医療用材料およびその製造方法
【課題】製造が容易であり、抗血小板剤を均一に含有させることができ、しかも、抗血小板剤の持続的な放出を可能にした医療用材料と、その製造方法とを提供すること。
【解決手段】本発明の医療用材料は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体に抗血小板剤を含有させたことを特徴とする。この医療用材料は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体を溶融状態で抗血小板剤と混合することにより、または、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体と、抗血小板剤とを溶媒に溶解して混合後、溶媒を除去することにより、製造される。
【解決手段】本発明の医療用材料は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体に抗血小板剤を含有させたことを特徴とする。この医療用材料は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体を溶融状態で抗血小板剤と混合することにより、または、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体と、抗血小板剤とを溶媒に溶解して混合後、溶媒を除去することにより、製造される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医療分野において、特に血液と直接接触する医療器具などを形成するための医療用材料およびその製造方法に関し、より詳しくは、直接血液に接しても血液凝固(血栓形成)を生じたり血小板の損失を起こしたりすることのない医療用材料およびその製造方法に関する。
【背景技術】
【0002】
医療分野においては、血液と直接接触する血液回路、バイパスチューブ、カテーテル等に使用する高分子材料の血栓形成が重要な問題になっている。そのため、優れた抗凝血性または抗血栓性を有する医療用材料の提供が望まれていた。
従来、医療用材料に抗血栓性を付与する方法としては、例えば(1)抗凝血剤であるヘパリンを高分子材料と複合化したり、あるいは(2)繊維素溶解酵素を高分子材料の表面に固定化するなどの方法が知られている(特許文献1〜4参照)。
【特許文献1】特開昭54−68097号公報
【特許文献2】特開昭56−136564号公報
【特許文献3】特開昭57−75655号公報
【特許文献4】特開昭57−14358号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、前記(1)の方法は、ヘパリンが熱に対して不安定であるために加工や製造上の制約が大きく、かつ材料中のヘパリン保持量が少ないため長期にわたる持続性が期待できないなどの問題がある。
また、前記(2)の方法は、加工法が表面コーティングでありかつ処理法も複雑であることや、熱によって線溶活性が損なわれやすいことから、製造上の制約が非常に大きく、さらに材料中の繊維素溶解酵素の絶対量が少なく持続性が期待できないなどの問題がある。
【0004】
さらに、これらの複合化、固定化に際して、リガンドあるいはスペーサーとして用いられている化学構造についても、人体に対する安全性が完全に解明されていないのが実状である。
一方、血栓を生じさせないように血液適合性に優れた材料の開発もなされている。例えば人工血管の分野では、米国ゴア社製のポリ四フッ化エチレンの延伸構造人工血管などが知られている。しかし、これらの材料で抗血栓性を発現させるためには、延伸により多孔構造とすることが不可欠であり、用途および製造方法の制約が大きくなる。
【0005】
また、ミクロ相分離構造を有するポリウレタンまたはポリウレタンウレアの医療用材料も知られているが、熱成形が困難であるため製造工程が複雑で製造上の制約が大きいうえに、ミクロ相分離構造が加工法によって大きく変化し、一定した抗血栓性が得られにくいなどの問題がある。
さらに、ポリウレタンやポリウレタンウレアに抗血小板剤を配合した医療用材料も提案されているが、熱成形が困難であるため製造工程が複雑で、製造上の制約が大きいという問題がある。
【0006】
他方、ミクロ相分離構造を有する(2−ヒドロキシエチルメタクリレート)−スチレン共重合体が抗血栓性を有していることが知られているが、機械的強度が小さいため、コーティング用材料に限定され、使用分野もごく一部に限られている。
さらに、ミクロ相分離構造を有するポリエステル、ポリアミドなどの熱可塑性ポリマーにメシル酸ナファモスタット、メシル酸ガベキサートなどのタンパク質分解酵素阻害剤を配合した医療用材料が提案されている(特開平6−23032号公報を参照)が、一般にこれらのタンパク質分解酵素阻害剤は水溶性が著しく大きく、材料表面近傍から急速に失われてしまうために、長期の持続的な抗血栓性を維持することが困難であり、実用的ではない。
【0007】
本発明の主たる目的は、上述の技術的課題を解決し、製造が容易であり、かつ抗血小板剤を均一に含有させることができ、しかも抗血小板剤の持続的な放出を可能にした医療用材料およびその製造方法を提供することである。
【課題を解決するための手段】
【0008】
本発明者らは、前記課題を解決すべく各種の薬剤と高分子材料との複合化について種々の検討を行った結果、抗血小板剤、特にシロスタゾール、ジピリダモール、アスピリン等を、特定のポリアミドブロック共重合体に均一でかつ安定した分散状態で含有させることが可能であり、しかも上記共重合体の種類、抗血小板剤の含有量、含有方法、上記共重合体への添加剤の配合処方などに依存して抗血小板剤の放出速度を任意に制御できるという新たな事実を見出し、本発明を完成するに至った。
【0009】
すなわち、本発明の医療用材料は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体に、抗血小板剤を含有させたことを特徴とするものである。
また、本発明の医療用材料の製造方法は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体を溶融状態で抗血小板剤と混合することを特徴とするものである。
【0010】
本発明の医療用材料の他の製造方法は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体と、抗血小板剤とを溶媒に溶解して混合した後、溶媒を除去することを特徴とするものである。
【発明の効果】
【0011】
本発明の医療用材料は、抗血小板剤を均一でかつ安定した分散状態で含有させることができる。また、かかる抗血小板剤を持続的にかつ有効な濃度で溶出させることができるため、高い抗凝血性および血小板の活性化による血小板の喪失防止作用を有するという効果がある。さらに、本発明の医療用材料の製造方法は、当該材料を簡単に製造できるという効果がある。
【発明を実施するための最良の形態】
【0012】
以下、本発明の医療用材料について詳細に説明する。
上記ポリアミドブロック共重合体には、ポリアミドとポリエーテルとのブロック共重合体や、ポリアミドとポリエステルとのブロック共重合体などがあり、いずれも本発明に使用することができる。なかでも、ポリエーテルとポリアミドとのブロック共重合体が生体内での安定性などの点から好適に使用できる。
【0013】
前者の具体的な例としては、ハードセグメントであるポリアミドとして、ナイロン6、ナイロン66、ナイロン610、ナイロン612、ナイロン11、ナイロン12等の1種または2種以上が、またソフトセグメントであるポリエーテルとして、ポリエチレングリコール、ポリプロピレングリコール、ポリテトラメチレングリコール等の1種または2種以上がそれぞれあげられ、それらを組み合わせて共重合させる。
【0014】
より具体的には、市販品として、東レ(株)の商品名「ペバックス」、宇部興産(株)の商品名「UBE−PAE」、ダイセルヒュルス社の商品名「ダイアミド−PAE」、テルモ(株)の「ポリエーテルナイロン610」等があげられる。
また、後者の具体的な例としては、ハードセグメントであるポリアミドとして、上記例示の群より選ばれる1種または2種以上が、ソフトセグメントであるポリエステルとして、ポリブチレンアジペート等から選ばれる1種または2種以上がそれぞれあげられ、それらを組み合わせて共重合させる。
【0015】
より具体的には、市販品として、エムスジャパン社の商品名「グリロンELX」、同社の商品名「グリルアミドELY」、三菱化成(株)の商品名「ノバミッドPAE」等があげられる。
さらに、本発明の医療用材料に用いるポリアミドブロック共重合体には、目的、用途に応じて種々の物性のものが使用できる。例えば、ハードセグメントとソフトセグメントの各鎖長や重合度、共重合体全体の重合度、ハードセグメントとソフトセグメントの含有比率などは、広範囲から適宜選択可能であり、なかでもショア硬度が80A〜75Dとなるように設定されたものが好適に使用できる。加えて、必要に応じてフタル酸ジ−2−エチルヘキシル、フタル酸ジ−2−デシル、トリメリル酸トリ−2−エチルヘキシル、ポリエチレングリコール等の可塑剤や各種の安定剤、二次可塑剤、滑剤などを添加配合することができる。
【0016】
これらのポリアミドブロック共重合体は、単独で用いてもよいし2種以上を混合あるいは積層して組み合わせることもでき、いずれも医療用具として必要な安全性および安定性を有することが既に確認されている。
本発明における抗血小板剤としては、例えばシロスタゾール、ジピリダモール、アスピリン、チクロピジン、ベラプロスト、インドメタシン、スルフィンピラゾン、サチグレル、d−インドブフェン、ダゾキシベン、フレグレレート、オザグレル、パーマグレル、ダズメグレル、ミダゾグレル、ダルトロバン、スロトロバン、バピプロスト、クロピドグレル、プロスタグランディンE1、イロプロスト、リマプロスト等があげられ、この他にも2−[4,5−ビス(4−メトキシフェニル)チアゾール−2−イル]ピロール−1−酢酸エチルエステル、2−メチル−3−(1,4,5,6−テトラヒドロニコチノイル)ピラゾロ[1,5−a]ピリジン、1−(シクロヘキシルメチル)−4−[4−(2,3−ジヒドロ−2−オキソ−1H−イミダゾ[4,5−b]キノリン−7−イルオキシ)−1−オキソブチル]ピペラジン、3−メチル−2−(3−ピリジニル)−1H−インドール−1−オクタン酸、(E)−7−フェニル−7−(3−ピリジル)−6−ヘプテン酸、(±)−6−(1−イミダゾリルメチル)−5,6,7,8−テトラヒドロナフタレン−2−カルボン酸、4−[α−ヒドロキシ−5−(1−イミダゾリル)−2−メチルベンジル]−3,5−ジメチル安息香酸、1−(2−カルボキシエチル)−2−メチル−3−(1H−イミダゾール−1−イルメチル)インドール、(E)−1−[3−(フェニルメトキシ)−1−オクテニル]−1H−イミダゾール、7−[2α,4α−(ジメチルメタノ)−6β−(2−シクロペンチル−2β−ヒドロキシアセタミド)−1α−シクロヘキシル]−5(Z)−ヘプタン酸、(E)−11−[2−(5,6−ジメチル−1−ベンズイミダゾリル)エチリデン]−6,11−ジヒドロジベンズ[b,e]オキセピン−2−カルボン酸、5−{(1R,6S,7S,8R)−8−ヒドロキシ−7−[(3S)−3−ヒドロキシ−4,4−ジメチル−1,6−ノナジイニル]−シス−ビシクロ[4,3,0]ノン−2−エン−3−イル}−3−オキサペンタン酸、5−{(1S,5S,6R,7R)−7−ヒドロキシ−6−[(E)−(S)−3−ヒドロキシ−1−オクテニル]ビシクロ[3,3,0]オクト−2−エン−3−イル}ペンタン酸メチルエステル、[1α,2α(Z),3β,4α]−(±)−7−{3−[(フェニルスルホニル)アミノ]−ビシクロ[2,2,1]ヘプト−2−イル}−5−ヘプテン酸、(−)−シス−3−アセトキシ−5−[2−(ジメチルアミノ)エチル]−2,3−ジヒドロ−8−メチル−2−(4−メチルフェニル)−1,5−ジベンゾチアゼピン−4−(5H)−オン等があげられる。また、これらは単独であるいは2種以上混合して使用することができる。上記例示のうち、シロスタゾール、ジピリダモール、ベラプロスト、サチグレル、アスピリンを用いるのが好ましく、なかでもシロスタゾールを用いるのが特に好ましい。
【0017】
本発明において、上記抗血小板剤の配合量は、ポリアミドブロック共重合体100重量部に対して0.01〜60重量部、好ましくは0.01〜45重量部、より好ましくは0.05〜10重量部、なかんづく0.1〜6重量部の範囲である。抗血小板剤の含有量が前記範囲を超える場合は成形性が悪くなり、たとえ成形できても物理的性質が低下して実用上問題が生じるおそれがある。一方、抗血小板剤の含有量が前記範囲を下回る場合は抗血小板剤放出制御が困難となり、凝血防止効果が低くなるなど、抗血小板剤を配合する効果がなくなるおそれがある。
【0018】
また、後述するように、抗血小板剤の配合量を前記範囲内で変化させることにより、抗血小板剤の放出量を制御することができる。
なお、一般に、抗血小板剤がポリアミドブロック共重合体中に均一に分散する量には上限があるが、この上限量までの範囲であれば、含有量が高いほど抗血小板剤の放出速度は速くなる。一方、上記上限量を超えて多量に抗血小板剤を含有させた場合、放出量はかえって低下するが、その分持続時間が延びることが期待される。また、一般に共重合体のソフトセグメントの比率が大きくなると抗血小板剤の溶出性は高まるが、均一に分散する量の上限は小さくなる傾向がある。従って、形成する医療用材料の種類、目的、用途などにあわせて、適切な抗血小板剤の含有量を決定するのが望ましい。
【0019】
本発明では、抗血小板剤を含有させたポリアミドブロック共重合体を、そのまま医療用材料の主要構成材料として使用してもよいし、他の材料に塗布(コーティング)あるいは含浸させて使用してもよい。
本発明の医療用材料は、例えば医療器具用材料として好適に使用できる。かかる医療器具としては、例えば血管カテーテル、カニューラ、モニタリングチューブ、人工腎臓、人工肺、人工心臓、体外循環用血液回路、人工腎臓用A−Vシャント、静脈内留置針、人工血管、人工心臓弁、血液の一時的バイパスチューブ、人工透析用血液回路、ステント、血液バッグ、血液成分分離装置のディスポーザブル回路、フィルム状もしくは中空状の透析膜などがあげられる。
【0020】
次に、本発明の医療用材料および本発明の医療用材料を用いた器具の製造方法を説明する。
代表的な製造方法には、溶液法と溶融法とがある。溶液法では、前記ポリアミドブロック共重合体と抗血小板剤とを溶媒に均一に溶解した後、溶媒を留去することにより、本発明の医療用材料が得られる。前記溶媒としては、例えばメタノール、クロロホルム、メタクレゾール、1,1,1,3,3,3−ヘキサフルオロ−2−プロパノールおよびこれらの2種以上の混合溶媒があげられる。このうち特に、メタノール、クロロホルム、1,1,1,3,3,3−ヘキサフルオロ−2−プロパノールなどは、それぞれ溶解性が高く留去し易い等の点で好ましい。
【0021】
使用するポリアミドブロック共重合体は、あらかじめソックスレー抽出などにより十分に洗浄し、不純物などを除去しておくのが好ましく、また、酸化分解をおこさない条件で十分に乾燥させて水分を除去しておくことも好ましい。
溶液法による医療用材料の成形は、前記各成分を溶媒に溶解した溶液をガラス板上に流延塗布したり、あるいは管状に押し出したり、他の構造物に塗布した後、溶媒を除去することにより行われる。これにより、医療用材料の用途に応じて、フィルム状、チューブ状などの所望の形状にしたり、あるいはコーティングを行うことが可能となる。
【0022】
前記溶媒の除去は、例えば風乾、減圧下での加熱乾燥、凝固液による相分離などにより行う。前記凝固液としては、使用するポリアミドブロック共重合体に対する貧溶媒、例えば水、エタノール、プロパノール、ブタノール等のアルコール類、アセトン等のケトン類等があげられる。この場合、共重合体の凝集物中から凝固液中に抗血小板剤が溶出することを極力避ける必要がある。従って、前記共重合体の貧溶媒に対する抗血小板剤の溶解力が大きい場合には、かかる溶解力を低減させる溶媒を凝固液に混合し、共重合体とこれに含まれる抗血小板剤とを同時に凝固させる方法を採用するのが好ましい。
【0023】
溶液法によりチューブ状の器具を成形する場合を具体的に説明すると、前記各成分を溶媒に溶解した溶液を適当な心棒表面に塗布し、乾燥させてチューブを成形した後、チューブを心棒から抜けばよい。また、他の方法として、前記溶液を心棒表面に塗布し、次いでこれを凝固液に浸積し、心棒の表面に前記ポリマーを凝固させてチューブ状に成形した後、チューブを心棒から抜いて乾燥する、あるいは前記溶液を凝固液中に中空状に押し出した後、乾燥するという方法があげられる。さらに、人工血管、血液回路、人工透析用血液回路などの既存の器具に、浸積法、減圧法、ガス圧送法、回転ドラム法などによりコーティングする方法でも製造可能である。
【0024】
また、溶液法によりフィルム状の材料を成形する場合には、例えばガラス板上に溶液を流延して溶剤を乾燥除去したり、溶液を織物、編物、不織布などに直接コーティングまたは含浸させて溶剤を乾燥除去した後、フィルム状に成形加工する方法などがあげられる。さらに、既存のフィルムに浸積法、噴霧法などによりコーティングすることによっても製造できる。また、上記の方法で得られたフィルムにさらにコーティングを施して多層フィルムとすることもできる。
【0025】
かかる溶液法において、成形品からの抗血小板剤の放出速度の制御は、前記ポリアミドブロック共重合体中の抗血小板剤の含有量や使用する抗血小板剤の種類、ポリアミドブロック共重合体の組成(各セグメントの構成成分と比率)、溶媒の除去方法(例えば、常圧もしくは減圧下での乾燥か、あるいは凝固液を使用して凝固させる方法か)などを変化させることによって行うことができる。また、可塑剤、安定剤、二次可塑剤、滑剤、紫外線吸収剤、耐熱安定剤などの添加剤の配合処方によっても放出速度を制御することが可能である。また、コーティングの場合は、コーティングを複数回繰り返し、各回ごとに共重合体の種類、薬剤の濃度・含有量、上記添加剤の含有量などの条件を変化させることにより、さらに細かい放出制御を行うことも可能である。特に、既存の器具にコーティングを行う場合であって、その器具が人工血管やステントなどの体内に長時間留置されるものの場合には、多層のコーティングを行い、内側の層の抗血小板剤含有量を高く、外側の層の抗血小板剤含有量を低くすることが好ましい。これにより、材料の物理的性質を維持したまま長期間の薬剤持続放出を可能とすることができる。
【0026】
上述の溶液法は、抗血小板剤のうち特に熱に不安定な薬剤を用いる場合に有用である。
一方、溶融法による場合は、前記ポリアミドブロック共重合体と抗血小板剤とを溶融状態で混合し、成形することにより本発明の医療用材料が得られる。
前記溶融は、抗血小板剤が分解せずにポリアミドブロック共重合体に均一に分散するようにしなければならない。そのため、抗血小板剤の分解温度以下の温度にて溶融するような適切なポリアミドブロック共重合体を選択して使用する。なお、必要に応じて、溶融、成形などの作業を無酸素雰囲気中で行えば、抗血小板剤やポリアミドブロック共重合体の酸化を防止できる。また、用いるポリアミドブロック共重合体中の水分を可能な限り除去しておくことが抗血小板剤や共重合体の安定性、成形品の寸法精度、外観などの点から好ましい。
【0027】
溶融成形には各種の成形法が使用可能であり、例えば押出成形によりチューブ状またはシート状の成形物を、また射出成形により複雑な構造の成形品をそれぞれ成形することができる。また、クロスヘッド等を用いることにより、金属線へのコーティングも可能である。
溶融成形における成形品からの抗血小板剤の放出制御についても、前記ポリアミドブロック共重合体中の抗血小板剤の含有量や使用する抗血小板剤の種類、ポリアミドブロック共重合体の種類などを変化させることによって行うことができる。また、溶液法と同様に可塑剤、安定剤、二次可塑剤、滑剤などの添加剤の配合処方によっても抗血小板剤の放出速度を制御することが可能である。さらに、多層(多色)成形を行い、各層(部分)で抗血小板剤の含有量や種類並びに共重合体の種類を変化させることにより、医療用材料として必要な物性を得るとともに、必要な部分のみでの抗凝血性の発現や、さらに細かい放出パターンの制御が可能である。
【0028】
本発明において、特に好ましい組み合わせとしては、抗血小板剤がシロスタゾールで、樹脂がポリエーテルポリアミド共重合体のものであり、シロスタゾールはポリエーテルポリアミドブロック共重合体への相溶性に優れているので、均一に混合することができる。
本発明材料のうち、チューブ状に成形したものは、例えば体外循環用血液回路、カテーテル、静脈内留置針、バイパスチューブ等として特に好適に使用される。また、多層ダイを用いて成形することにより、組成の異なる多層チューブを容易に製造することができる。
【0029】
なお、チューブ状に成形した本発明の医療用材料を開心術における体外循環回路に使用する場合、含有させる抗血小板剤としてシロスタゾール、ジピリダモール等を用いれば、抗凝血作用だけでなく血管拡張作用も発揮されるので、コントロールドショックによる末梢組織の循環不全を改善することができ、より好都合である。
また、フィルム状に成形した本発明の医療用材料は、血液バッグ等の素材として好適に使用可能である。なかでも、エチレン−酢酸ビニル共重合体やエチレン−α−オレフィン共重合体などのガス透過性の大きい素材を用いて多層化したフィルムは、血小板保存バッグとして特に好適である。
【0030】
さらに、押出成形により繊維状に、または射出成形によりコイル状もしくはジグザグ状などに成形した本発明の医療用材料は、そのままあるいは編み上げることにより、血管ステントとして好適に使用できる。この場合、抗血小板剤としてシロスタゾール等を用いれば、ステント表面での血栓形成を抑制するとともに血管内膜の過成長を抑制するので、血管の再閉塞防止には特に好ましい。また、クロスヘッドを用いて本発明の医療用材料を表面にコーティングしたステンレスあるいはタンタル製のワイヤから血管ステントを作成することも可能であり、上記と同様の効果を有するものが得られる。
【0031】
本発明の医療用材料を医療器具として用いる例は、上記記載の例に限定されるものではなく、例えば任意の形状に成形した本発明の医療用材料を、抗血小板作用を発揮させるための部材として医療器具内に設置するといった使用方法も可能である。また、既存の血小板保存バッグ中に、フィルム状、粒状などの形状に成形した本発明の医療用材料の小片を封入する方法、体外循環回路内の任意の位置に本発明の医療用材料の小片を固定する方法などをあげることができる。
【0032】
本発明の医療用材料は、上述のように抗血小板剤の種類や量および含有方法、ポリアミドブロック共重合体の種類、添加剤の処方などにより抗血小板剤の放出速度を制御することが可能であるが、成形する形状、特に表面積を変化させることによって放出速度を制御することもできる。
【実施例】
【0033】
以下、実施例を挙げて本発明を詳細に説明するが、本発明はこれらの実施例のみに限定されるものではない。
実施例1
ペバックス6333(東レ(株)の商品名、ポリアミドとポリエーテルとの共重合体)を小型粉砕機(井内盛栄堂製)で冷却粉砕し、粒子径が50〜125μmのものを採取した。この樹脂38gとシロスタゾール(大塚製薬(株)製)2gをドライブレンドし、小型混練押出機(CSI社製の商品名「CS−194A,MAXMIXING EXTRUDER」)により、窒素雰囲気下190℃で混練押出後、直ちに試験用卓上プレス(東洋精機社製)により190℃でプレスし、厚さ100μmの無色透明のフィルムを得た。
【0034】
実施例2
樹脂としてペバックス6333(前出)に代えてペバックス5533(東レ(株)の商品名;ポリアミドとポリエーテルとの共重合体)を用いた以外は実施例1と同様に操作を行い、厚さ100μmの無色透明のフィルムを得た。
実施例3
ペバックス4033(東レ(株))を小型粉砕機(井内盛栄堂製)で冷却粉砕し、粒子径が50〜125μmのものを採取した。さらに、この樹脂39.6gとシロスタゾール(大塚製薬(株)製)0.4gをドライブレンドし、小型混練押出機(CSI社製、前記と同じ)により、窒素雰囲気下190℃で混練押出後、直ちに試験用卓上プレス(東洋精機社製)により190℃でプレスし、厚さ100μmの無色透明のフィルムを得た。
【0035】
実施例4
樹脂としてペバックス4033(前出)に代えてUBE−PAE1200(宇部興産(株)の商品名、ポリアミドとポリエーテルとの共重合体)を用いた以外は実施例3と同様に操作を行い、厚さ100μmの無色透明のフィルムを得た。
実施例5(カテーテルの作製)
ペバックス5533(東レ(株))を小型粉砕機(井内盛栄堂製)で冷却粉砕し、粒子径が50〜125μmのものを採取した。このうち38gとシロスタゾール(大塚製薬(株)製)2gをドライブレンドし、小型混練押出機(CSI社製、前記と同じ)により、ストランドダイを用いて、窒素雰囲気下190℃で混練押出後、ペレタイズした。このものを、再び小型混練押出機(CSI社製、前記と同じ)により、チューブダイを用いて、窒素雰囲気下190℃で押出成形し、内径0.8mm、外径1.0mmのチューブを作製した。
【0036】
実施例6
ペバックス4033(東レ(株))398mgおよびシロスタゾール2mgを1,1,1,3,3,3−ヘキサフルオロ−2−プロパノール10mlに溶解し、ガラス板上に流延塗布した。これを室温で8時間乾燥し、さらに真空乾燥機により40℃で24時間乾燥して無色透明のフィルム(厚さ約50μm)を得た。
【0037】
実施例7(ステントの製造)
パルマッツ−シャッツ・ステント(米国、ジョンソン&ジョンソン社製)を、ペバックス6333−シロスタゾール溶液〔ペバックス6333(東レ(株))475mgおよびシロスタゾール25mgを1,1,1,3,3,3−ヘキサフルオロ−2−プロパノール50mlに溶解して作製、シロスタゾール含有量;5重量%〕に浸漬し、風乾後、再び浸漬し風乾した。この操作を繰り返し、厚さ約50μmのコーティング層(シロスタゾール含有量;50重量%)を作製した。このものを40℃で真空下72時間乾燥し、完全に溶媒を除去後、別途作製したペバックス6333−シロスタゾール溶液〔ペバックス6333(東レ(株))495mgおよびシロスタゾール5mgを1,1,1,3,3,3−ヘキサフルオロ−2−プロパノール100mlに溶解して作製〕に浸漬・風乾を繰り返し、先のコーティング層の上に厚さ10μmの第二のコーティング層(シロスタゾール含有量;1重量%)を作製した。
【0038】
実施例8
ペバックス6333(前出)を小型粉砕機(井内盛栄堂製)で、液体窒素を用いて冷却粉砕し、粒子径が50〜125μmのものを採取した。この樹脂39.92gとシロスタゾール(大塚製薬(株)製)0.08gをドライブレンドし、小型混練押出機(CSI社製、前記と同じ)により、窒素雰囲気下で190℃で混練押出後、直ちに試験用卓上プレス(東洋精機社製)により190℃でプレスし、厚さ100μmの無色透明のフィルムを得た。
【0039】
このフィルムは、実施例1〜4および6のフィルムに比べてシロスタゾールの含有量が少ないため、溶出速度が抑制されている。また、樹脂中でのシロスタゾールの分散安定性が優れており、長期にわたって保存可能または使用可能な医療用材料として有用である。
(溶出試験)
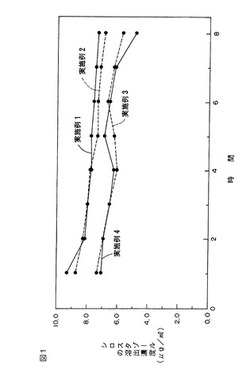
実施例1〜4で得たフィルム100mgをそれぞれ採取し、あらかじめ37℃に加温したpH7.4の生理食塩液10ml中に投入し、恒温振盪機で37℃にて振盪した。1時間振盪後、試験片を取り出し、別の37℃に加温したpH7.4の生理食塩液中に投入し、恒温振盪機で37℃にて1時間振盪した。以下、この操作を8時間まで繰り返し、各回での溶出液中のシロスタゾール濃度の変化を調べた。
【0040】
その結果、図1に示すように、実施例1〜4のいずれのフィルムからも、溶出初期から8時間後まで、有効濃度(1.1μg/ml)を上回るシロスタゾールの持続的な溶出が認められる。従って、実施例1〜4の各フィルムは高い抗凝血性を有していることがわかる。
本発明は、以上の記載に限定されるものではなく、特許請求の範囲に記載した事項の範囲において、種々の設計変更を施すことが可能である。
【図面の簡単な説明】
【0041】
【図1】実施例1〜4で得た各フィルムを用いて得た溶出薬物濃度の経時的変化を示すグラフである。
【技術分野】
【0001】
本発明は、医療分野において、特に血液と直接接触する医療器具などを形成するための医療用材料およびその製造方法に関し、より詳しくは、直接血液に接しても血液凝固(血栓形成)を生じたり血小板の損失を起こしたりすることのない医療用材料およびその製造方法に関する。
【背景技術】
【0002】
医療分野においては、血液と直接接触する血液回路、バイパスチューブ、カテーテル等に使用する高分子材料の血栓形成が重要な問題になっている。そのため、優れた抗凝血性または抗血栓性を有する医療用材料の提供が望まれていた。
従来、医療用材料に抗血栓性を付与する方法としては、例えば(1)抗凝血剤であるヘパリンを高分子材料と複合化したり、あるいは(2)繊維素溶解酵素を高分子材料の表面に固定化するなどの方法が知られている(特許文献1〜4参照)。
【特許文献1】特開昭54−68097号公報
【特許文献2】特開昭56−136564号公報
【特許文献3】特開昭57−75655号公報
【特許文献4】特開昭57−14358号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、前記(1)の方法は、ヘパリンが熱に対して不安定であるために加工や製造上の制約が大きく、かつ材料中のヘパリン保持量が少ないため長期にわたる持続性が期待できないなどの問題がある。
また、前記(2)の方法は、加工法が表面コーティングでありかつ処理法も複雑であることや、熱によって線溶活性が損なわれやすいことから、製造上の制約が非常に大きく、さらに材料中の繊維素溶解酵素の絶対量が少なく持続性が期待できないなどの問題がある。
【0004】
さらに、これらの複合化、固定化に際して、リガンドあるいはスペーサーとして用いられている化学構造についても、人体に対する安全性が完全に解明されていないのが実状である。
一方、血栓を生じさせないように血液適合性に優れた材料の開発もなされている。例えば人工血管の分野では、米国ゴア社製のポリ四フッ化エチレンの延伸構造人工血管などが知られている。しかし、これらの材料で抗血栓性を発現させるためには、延伸により多孔構造とすることが不可欠であり、用途および製造方法の制約が大きくなる。
【0005】
また、ミクロ相分離構造を有するポリウレタンまたはポリウレタンウレアの医療用材料も知られているが、熱成形が困難であるため製造工程が複雑で製造上の制約が大きいうえに、ミクロ相分離構造が加工法によって大きく変化し、一定した抗血栓性が得られにくいなどの問題がある。
さらに、ポリウレタンやポリウレタンウレアに抗血小板剤を配合した医療用材料も提案されているが、熱成形が困難であるため製造工程が複雑で、製造上の制約が大きいという問題がある。
【0006】
他方、ミクロ相分離構造を有する(2−ヒドロキシエチルメタクリレート)−スチレン共重合体が抗血栓性を有していることが知られているが、機械的強度が小さいため、コーティング用材料に限定され、使用分野もごく一部に限られている。
さらに、ミクロ相分離構造を有するポリエステル、ポリアミドなどの熱可塑性ポリマーにメシル酸ナファモスタット、メシル酸ガベキサートなどのタンパク質分解酵素阻害剤を配合した医療用材料が提案されている(特開平6−23032号公報を参照)が、一般にこれらのタンパク質分解酵素阻害剤は水溶性が著しく大きく、材料表面近傍から急速に失われてしまうために、長期の持続的な抗血栓性を維持することが困難であり、実用的ではない。
【0007】
本発明の主たる目的は、上述の技術的課題を解決し、製造が容易であり、かつ抗血小板剤を均一に含有させることができ、しかも抗血小板剤の持続的な放出を可能にした医療用材料およびその製造方法を提供することである。
【課題を解決するための手段】
【0008】
本発明者らは、前記課題を解決すべく各種の薬剤と高分子材料との複合化について種々の検討を行った結果、抗血小板剤、特にシロスタゾール、ジピリダモール、アスピリン等を、特定のポリアミドブロック共重合体に均一でかつ安定した分散状態で含有させることが可能であり、しかも上記共重合体の種類、抗血小板剤の含有量、含有方法、上記共重合体への添加剤の配合処方などに依存して抗血小板剤の放出速度を任意に制御できるという新たな事実を見出し、本発明を完成するに至った。
【0009】
すなわち、本発明の医療用材料は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体に、抗血小板剤を含有させたことを特徴とするものである。
また、本発明の医療用材料の製造方法は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体を溶融状態で抗血小板剤と混合することを特徴とするものである。
【0010】
本発明の医療用材料の他の製造方法は、ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体と、抗血小板剤とを溶媒に溶解して混合した後、溶媒を除去することを特徴とするものである。
【発明の効果】
【0011】
本発明の医療用材料は、抗血小板剤を均一でかつ安定した分散状態で含有させることができる。また、かかる抗血小板剤を持続的にかつ有効な濃度で溶出させることができるため、高い抗凝血性および血小板の活性化による血小板の喪失防止作用を有するという効果がある。さらに、本発明の医療用材料の製造方法は、当該材料を簡単に製造できるという効果がある。
【発明を実施するための最良の形態】
【0012】
以下、本発明の医療用材料について詳細に説明する。
上記ポリアミドブロック共重合体には、ポリアミドとポリエーテルとのブロック共重合体や、ポリアミドとポリエステルとのブロック共重合体などがあり、いずれも本発明に使用することができる。なかでも、ポリエーテルとポリアミドとのブロック共重合体が生体内での安定性などの点から好適に使用できる。
【0013】
前者の具体的な例としては、ハードセグメントであるポリアミドとして、ナイロン6、ナイロン66、ナイロン610、ナイロン612、ナイロン11、ナイロン12等の1種または2種以上が、またソフトセグメントであるポリエーテルとして、ポリエチレングリコール、ポリプロピレングリコール、ポリテトラメチレングリコール等の1種または2種以上がそれぞれあげられ、それらを組み合わせて共重合させる。
【0014】
より具体的には、市販品として、東レ(株)の商品名「ペバックス」、宇部興産(株)の商品名「UBE−PAE」、ダイセルヒュルス社の商品名「ダイアミド−PAE」、テルモ(株)の「ポリエーテルナイロン610」等があげられる。
また、後者の具体的な例としては、ハードセグメントであるポリアミドとして、上記例示の群より選ばれる1種または2種以上が、ソフトセグメントであるポリエステルとして、ポリブチレンアジペート等から選ばれる1種または2種以上がそれぞれあげられ、それらを組み合わせて共重合させる。
【0015】
より具体的には、市販品として、エムスジャパン社の商品名「グリロンELX」、同社の商品名「グリルアミドELY」、三菱化成(株)の商品名「ノバミッドPAE」等があげられる。
さらに、本発明の医療用材料に用いるポリアミドブロック共重合体には、目的、用途に応じて種々の物性のものが使用できる。例えば、ハードセグメントとソフトセグメントの各鎖長や重合度、共重合体全体の重合度、ハードセグメントとソフトセグメントの含有比率などは、広範囲から適宜選択可能であり、なかでもショア硬度が80A〜75Dとなるように設定されたものが好適に使用できる。加えて、必要に応じてフタル酸ジ−2−エチルヘキシル、フタル酸ジ−2−デシル、トリメリル酸トリ−2−エチルヘキシル、ポリエチレングリコール等の可塑剤や各種の安定剤、二次可塑剤、滑剤などを添加配合することができる。
【0016】
これらのポリアミドブロック共重合体は、単独で用いてもよいし2種以上を混合あるいは積層して組み合わせることもでき、いずれも医療用具として必要な安全性および安定性を有することが既に確認されている。
本発明における抗血小板剤としては、例えばシロスタゾール、ジピリダモール、アスピリン、チクロピジン、ベラプロスト、インドメタシン、スルフィンピラゾン、サチグレル、d−インドブフェン、ダゾキシベン、フレグレレート、オザグレル、パーマグレル、ダズメグレル、ミダゾグレル、ダルトロバン、スロトロバン、バピプロスト、クロピドグレル、プロスタグランディンE1、イロプロスト、リマプロスト等があげられ、この他にも2−[4,5−ビス(4−メトキシフェニル)チアゾール−2−イル]ピロール−1−酢酸エチルエステル、2−メチル−3−(1,4,5,6−テトラヒドロニコチノイル)ピラゾロ[1,5−a]ピリジン、1−(シクロヘキシルメチル)−4−[4−(2,3−ジヒドロ−2−オキソ−1H−イミダゾ[4,5−b]キノリン−7−イルオキシ)−1−オキソブチル]ピペラジン、3−メチル−2−(3−ピリジニル)−1H−インドール−1−オクタン酸、(E)−7−フェニル−7−(3−ピリジル)−6−ヘプテン酸、(±)−6−(1−イミダゾリルメチル)−5,6,7,8−テトラヒドロナフタレン−2−カルボン酸、4−[α−ヒドロキシ−5−(1−イミダゾリル)−2−メチルベンジル]−3,5−ジメチル安息香酸、1−(2−カルボキシエチル)−2−メチル−3−(1H−イミダゾール−1−イルメチル)インドール、(E)−1−[3−(フェニルメトキシ)−1−オクテニル]−1H−イミダゾール、7−[2α,4α−(ジメチルメタノ)−6β−(2−シクロペンチル−2β−ヒドロキシアセタミド)−1α−シクロヘキシル]−5(Z)−ヘプタン酸、(E)−11−[2−(5,6−ジメチル−1−ベンズイミダゾリル)エチリデン]−6,11−ジヒドロジベンズ[b,e]オキセピン−2−カルボン酸、5−{(1R,6S,7S,8R)−8−ヒドロキシ−7−[(3S)−3−ヒドロキシ−4,4−ジメチル−1,6−ノナジイニル]−シス−ビシクロ[4,3,0]ノン−2−エン−3−イル}−3−オキサペンタン酸、5−{(1S,5S,6R,7R)−7−ヒドロキシ−6−[(E)−(S)−3−ヒドロキシ−1−オクテニル]ビシクロ[3,3,0]オクト−2−エン−3−イル}ペンタン酸メチルエステル、[1α,2α(Z),3β,4α]−(±)−7−{3−[(フェニルスルホニル)アミノ]−ビシクロ[2,2,1]ヘプト−2−イル}−5−ヘプテン酸、(−)−シス−3−アセトキシ−5−[2−(ジメチルアミノ)エチル]−2,3−ジヒドロ−8−メチル−2−(4−メチルフェニル)−1,5−ジベンゾチアゼピン−4−(5H)−オン等があげられる。また、これらは単独であるいは2種以上混合して使用することができる。上記例示のうち、シロスタゾール、ジピリダモール、ベラプロスト、サチグレル、アスピリンを用いるのが好ましく、なかでもシロスタゾールを用いるのが特に好ましい。
【0017】
本発明において、上記抗血小板剤の配合量は、ポリアミドブロック共重合体100重量部に対して0.01〜60重量部、好ましくは0.01〜45重量部、より好ましくは0.05〜10重量部、なかんづく0.1〜6重量部の範囲である。抗血小板剤の含有量が前記範囲を超える場合は成形性が悪くなり、たとえ成形できても物理的性質が低下して実用上問題が生じるおそれがある。一方、抗血小板剤の含有量が前記範囲を下回る場合は抗血小板剤放出制御が困難となり、凝血防止効果が低くなるなど、抗血小板剤を配合する効果がなくなるおそれがある。
【0018】
また、後述するように、抗血小板剤の配合量を前記範囲内で変化させることにより、抗血小板剤の放出量を制御することができる。
なお、一般に、抗血小板剤がポリアミドブロック共重合体中に均一に分散する量には上限があるが、この上限量までの範囲であれば、含有量が高いほど抗血小板剤の放出速度は速くなる。一方、上記上限量を超えて多量に抗血小板剤を含有させた場合、放出量はかえって低下するが、その分持続時間が延びることが期待される。また、一般に共重合体のソフトセグメントの比率が大きくなると抗血小板剤の溶出性は高まるが、均一に分散する量の上限は小さくなる傾向がある。従って、形成する医療用材料の種類、目的、用途などにあわせて、適切な抗血小板剤の含有量を決定するのが望ましい。
【0019】
本発明では、抗血小板剤を含有させたポリアミドブロック共重合体を、そのまま医療用材料の主要構成材料として使用してもよいし、他の材料に塗布(コーティング)あるいは含浸させて使用してもよい。
本発明の医療用材料は、例えば医療器具用材料として好適に使用できる。かかる医療器具としては、例えば血管カテーテル、カニューラ、モニタリングチューブ、人工腎臓、人工肺、人工心臓、体外循環用血液回路、人工腎臓用A−Vシャント、静脈内留置針、人工血管、人工心臓弁、血液の一時的バイパスチューブ、人工透析用血液回路、ステント、血液バッグ、血液成分分離装置のディスポーザブル回路、フィルム状もしくは中空状の透析膜などがあげられる。
【0020】
次に、本発明の医療用材料および本発明の医療用材料を用いた器具の製造方法を説明する。
代表的な製造方法には、溶液法と溶融法とがある。溶液法では、前記ポリアミドブロック共重合体と抗血小板剤とを溶媒に均一に溶解した後、溶媒を留去することにより、本発明の医療用材料が得られる。前記溶媒としては、例えばメタノール、クロロホルム、メタクレゾール、1,1,1,3,3,3−ヘキサフルオロ−2−プロパノールおよびこれらの2種以上の混合溶媒があげられる。このうち特に、メタノール、クロロホルム、1,1,1,3,3,3−ヘキサフルオロ−2−プロパノールなどは、それぞれ溶解性が高く留去し易い等の点で好ましい。
【0021】
使用するポリアミドブロック共重合体は、あらかじめソックスレー抽出などにより十分に洗浄し、不純物などを除去しておくのが好ましく、また、酸化分解をおこさない条件で十分に乾燥させて水分を除去しておくことも好ましい。
溶液法による医療用材料の成形は、前記各成分を溶媒に溶解した溶液をガラス板上に流延塗布したり、あるいは管状に押し出したり、他の構造物に塗布した後、溶媒を除去することにより行われる。これにより、医療用材料の用途に応じて、フィルム状、チューブ状などの所望の形状にしたり、あるいはコーティングを行うことが可能となる。
【0022】
前記溶媒の除去は、例えば風乾、減圧下での加熱乾燥、凝固液による相分離などにより行う。前記凝固液としては、使用するポリアミドブロック共重合体に対する貧溶媒、例えば水、エタノール、プロパノール、ブタノール等のアルコール類、アセトン等のケトン類等があげられる。この場合、共重合体の凝集物中から凝固液中に抗血小板剤が溶出することを極力避ける必要がある。従って、前記共重合体の貧溶媒に対する抗血小板剤の溶解力が大きい場合には、かかる溶解力を低減させる溶媒を凝固液に混合し、共重合体とこれに含まれる抗血小板剤とを同時に凝固させる方法を採用するのが好ましい。
【0023】
溶液法によりチューブ状の器具を成形する場合を具体的に説明すると、前記各成分を溶媒に溶解した溶液を適当な心棒表面に塗布し、乾燥させてチューブを成形した後、チューブを心棒から抜けばよい。また、他の方法として、前記溶液を心棒表面に塗布し、次いでこれを凝固液に浸積し、心棒の表面に前記ポリマーを凝固させてチューブ状に成形した後、チューブを心棒から抜いて乾燥する、あるいは前記溶液を凝固液中に中空状に押し出した後、乾燥するという方法があげられる。さらに、人工血管、血液回路、人工透析用血液回路などの既存の器具に、浸積法、減圧法、ガス圧送法、回転ドラム法などによりコーティングする方法でも製造可能である。
【0024】
また、溶液法によりフィルム状の材料を成形する場合には、例えばガラス板上に溶液を流延して溶剤を乾燥除去したり、溶液を織物、編物、不織布などに直接コーティングまたは含浸させて溶剤を乾燥除去した後、フィルム状に成形加工する方法などがあげられる。さらに、既存のフィルムに浸積法、噴霧法などによりコーティングすることによっても製造できる。また、上記の方法で得られたフィルムにさらにコーティングを施して多層フィルムとすることもできる。
【0025】
かかる溶液法において、成形品からの抗血小板剤の放出速度の制御は、前記ポリアミドブロック共重合体中の抗血小板剤の含有量や使用する抗血小板剤の種類、ポリアミドブロック共重合体の組成(各セグメントの構成成分と比率)、溶媒の除去方法(例えば、常圧もしくは減圧下での乾燥か、あるいは凝固液を使用して凝固させる方法か)などを変化させることによって行うことができる。また、可塑剤、安定剤、二次可塑剤、滑剤、紫外線吸収剤、耐熱安定剤などの添加剤の配合処方によっても放出速度を制御することが可能である。また、コーティングの場合は、コーティングを複数回繰り返し、各回ごとに共重合体の種類、薬剤の濃度・含有量、上記添加剤の含有量などの条件を変化させることにより、さらに細かい放出制御を行うことも可能である。特に、既存の器具にコーティングを行う場合であって、その器具が人工血管やステントなどの体内に長時間留置されるものの場合には、多層のコーティングを行い、内側の層の抗血小板剤含有量を高く、外側の層の抗血小板剤含有量を低くすることが好ましい。これにより、材料の物理的性質を維持したまま長期間の薬剤持続放出を可能とすることができる。
【0026】
上述の溶液法は、抗血小板剤のうち特に熱に不安定な薬剤を用いる場合に有用である。
一方、溶融法による場合は、前記ポリアミドブロック共重合体と抗血小板剤とを溶融状態で混合し、成形することにより本発明の医療用材料が得られる。
前記溶融は、抗血小板剤が分解せずにポリアミドブロック共重合体に均一に分散するようにしなければならない。そのため、抗血小板剤の分解温度以下の温度にて溶融するような適切なポリアミドブロック共重合体を選択して使用する。なお、必要に応じて、溶融、成形などの作業を無酸素雰囲気中で行えば、抗血小板剤やポリアミドブロック共重合体の酸化を防止できる。また、用いるポリアミドブロック共重合体中の水分を可能な限り除去しておくことが抗血小板剤や共重合体の安定性、成形品の寸法精度、外観などの点から好ましい。
【0027】
溶融成形には各種の成形法が使用可能であり、例えば押出成形によりチューブ状またはシート状の成形物を、また射出成形により複雑な構造の成形品をそれぞれ成形することができる。また、クロスヘッド等を用いることにより、金属線へのコーティングも可能である。
溶融成形における成形品からの抗血小板剤の放出制御についても、前記ポリアミドブロック共重合体中の抗血小板剤の含有量や使用する抗血小板剤の種類、ポリアミドブロック共重合体の種類などを変化させることによって行うことができる。また、溶液法と同様に可塑剤、安定剤、二次可塑剤、滑剤などの添加剤の配合処方によっても抗血小板剤の放出速度を制御することが可能である。さらに、多層(多色)成形を行い、各層(部分)で抗血小板剤の含有量や種類並びに共重合体の種類を変化させることにより、医療用材料として必要な物性を得るとともに、必要な部分のみでの抗凝血性の発現や、さらに細かい放出パターンの制御が可能である。
【0028】
本発明において、特に好ましい組み合わせとしては、抗血小板剤がシロスタゾールで、樹脂がポリエーテルポリアミド共重合体のものであり、シロスタゾールはポリエーテルポリアミドブロック共重合体への相溶性に優れているので、均一に混合することができる。
本発明材料のうち、チューブ状に成形したものは、例えば体外循環用血液回路、カテーテル、静脈内留置針、バイパスチューブ等として特に好適に使用される。また、多層ダイを用いて成形することにより、組成の異なる多層チューブを容易に製造することができる。
【0029】
なお、チューブ状に成形した本発明の医療用材料を開心術における体外循環回路に使用する場合、含有させる抗血小板剤としてシロスタゾール、ジピリダモール等を用いれば、抗凝血作用だけでなく血管拡張作用も発揮されるので、コントロールドショックによる末梢組織の循環不全を改善することができ、より好都合である。
また、フィルム状に成形した本発明の医療用材料は、血液バッグ等の素材として好適に使用可能である。なかでも、エチレン−酢酸ビニル共重合体やエチレン−α−オレフィン共重合体などのガス透過性の大きい素材を用いて多層化したフィルムは、血小板保存バッグとして特に好適である。
【0030】
さらに、押出成形により繊維状に、または射出成形によりコイル状もしくはジグザグ状などに成形した本発明の医療用材料は、そのままあるいは編み上げることにより、血管ステントとして好適に使用できる。この場合、抗血小板剤としてシロスタゾール等を用いれば、ステント表面での血栓形成を抑制するとともに血管内膜の過成長を抑制するので、血管の再閉塞防止には特に好ましい。また、クロスヘッドを用いて本発明の医療用材料を表面にコーティングしたステンレスあるいはタンタル製のワイヤから血管ステントを作成することも可能であり、上記と同様の効果を有するものが得られる。
【0031】
本発明の医療用材料を医療器具として用いる例は、上記記載の例に限定されるものではなく、例えば任意の形状に成形した本発明の医療用材料を、抗血小板作用を発揮させるための部材として医療器具内に設置するといった使用方法も可能である。また、既存の血小板保存バッグ中に、フィルム状、粒状などの形状に成形した本発明の医療用材料の小片を封入する方法、体外循環回路内の任意の位置に本発明の医療用材料の小片を固定する方法などをあげることができる。
【0032】
本発明の医療用材料は、上述のように抗血小板剤の種類や量および含有方法、ポリアミドブロック共重合体の種類、添加剤の処方などにより抗血小板剤の放出速度を制御することが可能であるが、成形する形状、特に表面積を変化させることによって放出速度を制御することもできる。
【実施例】
【0033】
以下、実施例を挙げて本発明を詳細に説明するが、本発明はこれらの実施例のみに限定されるものではない。
実施例1
ペバックス6333(東レ(株)の商品名、ポリアミドとポリエーテルとの共重合体)を小型粉砕機(井内盛栄堂製)で冷却粉砕し、粒子径が50〜125μmのものを採取した。この樹脂38gとシロスタゾール(大塚製薬(株)製)2gをドライブレンドし、小型混練押出機(CSI社製の商品名「CS−194A,MAXMIXING EXTRUDER」)により、窒素雰囲気下190℃で混練押出後、直ちに試験用卓上プレス(東洋精機社製)により190℃でプレスし、厚さ100μmの無色透明のフィルムを得た。
【0034】
実施例2
樹脂としてペバックス6333(前出)に代えてペバックス5533(東レ(株)の商品名;ポリアミドとポリエーテルとの共重合体)を用いた以外は実施例1と同様に操作を行い、厚さ100μmの無色透明のフィルムを得た。
実施例3
ペバックス4033(東レ(株))を小型粉砕機(井内盛栄堂製)で冷却粉砕し、粒子径が50〜125μmのものを採取した。さらに、この樹脂39.6gとシロスタゾール(大塚製薬(株)製)0.4gをドライブレンドし、小型混練押出機(CSI社製、前記と同じ)により、窒素雰囲気下190℃で混練押出後、直ちに試験用卓上プレス(東洋精機社製)により190℃でプレスし、厚さ100μmの無色透明のフィルムを得た。
【0035】
実施例4
樹脂としてペバックス4033(前出)に代えてUBE−PAE1200(宇部興産(株)の商品名、ポリアミドとポリエーテルとの共重合体)を用いた以外は実施例3と同様に操作を行い、厚さ100μmの無色透明のフィルムを得た。
実施例5(カテーテルの作製)
ペバックス5533(東レ(株))を小型粉砕機(井内盛栄堂製)で冷却粉砕し、粒子径が50〜125μmのものを採取した。このうち38gとシロスタゾール(大塚製薬(株)製)2gをドライブレンドし、小型混練押出機(CSI社製、前記と同じ)により、ストランドダイを用いて、窒素雰囲気下190℃で混練押出後、ペレタイズした。このものを、再び小型混練押出機(CSI社製、前記と同じ)により、チューブダイを用いて、窒素雰囲気下190℃で押出成形し、内径0.8mm、外径1.0mmのチューブを作製した。
【0036】
実施例6
ペバックス4033(東レ(株))398mgおよびシロスタゾール2mgを1,1,1,3,3,3−ヘキサフルオロ−2−プロパノール10mlに溶解し、ガラス板上に流延塗布した。これを室温で8時間乾燥し、さらに真空乾燥機により40℃で24時間乾燥して無色透明のフィルム(厚さ約50μm)を得た。
【0037】
実施例7(ステントの製造)
パルマッツ−シャッツ・ステント(米国、ジョンソン&ジョンソン社製)を、ペバックス6333−シロスタゾール溶液〔ペバックス6333(東レ(株))475mgおよびシロスタゾール25mgを1,1,1,3,3,3−ヘキサフルオロ−2−プロパノール50mlに溶解して作製、シロスタゾール含有量;5重量%〕に浸漬し、風乾後、再び浸漬し風乾した。この操作を繰り返し、厚さ約50μmのコーティング層(シロスタゾール含有量;50重量%)を作製した。このものを40℃で真空下72時間乾燥し、完全に溶媒を除去後、別途作製したペバックス6333−シロスタゾール溶液〔ペバックス6333(東レ(株))495mgおよびシロスタゾール5mgを1,1,1,3,3,3−ヘキサフルオロ−2−プロパノール100mlに溶解して作製〕に浸漬・風乾を繰り返し、先のコーティング層の上に厚さ10μmの第二のコーティング層(シロスタゾール含有量;1重量%)を作製した。
【0038】
実施例8
ペバックス6333(前出)を小型粉砕機(井内盛栄堂製)で、液体窒素を用いて冷却粉砕し、粒子径が50〜125μmのものを採取した。この樹脂39.92gとシロスタゾール(大塚製薬(株)製)0.08gをドライブレンドし、小型混練押出機(CSI社製、前記と同じ)により、窒素雰囲気下で190℃で混練押出後、直ちに試験用卓上プレス(東洋精機社製)により190℃でプレスし、厚さ100μmの無色透明のフィルムを得た。
【0039】
このフィルムは、実施例1〜4および6のフィルムに比べてシロスタゾールの含有量が少ないため、溶出速度が抑制されている。また、樹脂中でのシロスタゾールの分散安定性が優れており、長期にわたって保存可能または使用可能な医療用材料として有用である。
(溶出試験)
実施例1〜4で得たフィルム100mgをそれぞれ採取し、あらかじめ37℃に加温したpH7.4の生理食塩液10ml中に投入し、恒温振盪機で37℃にて振盪した。1時間振盪後、試験片を取り出し、別の37℃に加温したpH7.4の生理食塩液中に投入し、恒温振盪機で37℃にて1時間振盪した。以下、この操作を8時間まで繰り返し、各回での溶出液中のシロスタゾール濃度の変化を調べた。
【0040】
その結果、図1に示すように、実施例1〜4のいずれのフィルムからも、溶出初期から8時間後まで、有効濃度(1.1μg/ml)を上回るシロスタゾールの持続的な溶出が認められる。従って、実施例1〜4の各フィルムは高い抗凝血性を有していることがわかる。
本発明は、以上の記載に限定されるものではなく、特許請求の範囲に記載した事項の範囲において、種々の設計変更を施すことが可能である。
【図面の簡単な説明】
【0041】
【図1】実施例1〜4で得た各フィルムを用いて得た溶出薬物濃度の経時的変化を示すグラフである。
【特許請求の範囲】
【請求項1】
ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体に、抗血小板剤を含有させたことを特徴とする医療用材料。
【請求項2】
ポリアミドブロック共重合体が、ポリアミドとポリエーテルとのブロック共重合体である請求項1記載の医療用材料。
【請求項3】
ポリアミドブロック共重合体が、ナイロン6、ナイロン66、ナイロン610、ナイロン612、ナイロン11およびナイロン12からなる群より選ばれるポリアミドと、ポリエチレングリコール、ポリプロピレングリコールおよびポリテトラメチレングリコールからなる群より選ばれるポリエーテルとのブロック共重合体である請求項2記載の医療用材料。
【請求項4】
ポリアミドブロック共重合体が、ポリアミドとポリエステルとのブロック共重合体である請求項1記載の医療用材料。
【請求項5】
抗血小板剤の含有量が、ポリアミドブロック共重合体100重量部に対し0.01〜60重量部である請求項1記載の医療用材料。
【請求項6】
抗血小板剤の含有量が、ポリアミドブロック共重合体100重量部に対し0.01〜45重量部である請求項5記載の医療用材料。
【請求項7】
抗血小板剤の含有量が、ポリアミドブロック共重合体100重量部に対し0.05〜10重量部である請求項6記載の医療用材料。
【請求項8】
抗血小板剤の含有量が、ポリアミドブロック共重合体100重量部に対し0.1〜6重量部である請求項7記載の医療用材料。
【請求項9】
抗血小板剤がシロスタゾール、ジピリダモール、ベラプロストおよびサチグレルからなる群より選ばれる少なくとも1種である請求項1〜8のいずれかに記載の医療用材料。
【請求項10】
抗血小板剤がシロスタゾールである請求項9記載の医療用材料。
【請求項11】
医療器具用材料である請求項1〜10のいずれかに記載の医療用材料。
【請求項12】
ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体を溶融状態で抗血小板剤と混合することを特徴とする医療用材料の製造方法。
【請求項13】
ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体と、抗血小板剤とを溶媒に溶解して混合した後、溶媒を除去することを特徴とする医療用材料の製造方法。
【請求項14】
ポリアミドブロック共重合体が、ポリアミドとポリエーテルとのブロック共重合体である請求項12または13記載の医療用材料の製造方法。
【請求項15】
ポリアミドブロック共重合体が、ナイロン6、ナイロン66、ナイロン610、ナイロン612、ナイロン11およびナイロン12からなる群より選ばれるポリアミドと、ポリエチレングリコール、ポリプロピレングリコールおよびポリテトラメチレングリコールからなる群より選ばれるポリエーテルとのブロック共重合体である請求項12または13記載の医療用材料の製造方法。
【請求項16】
抗血小板剤がシロスタゾール、ジピリダモール、ベラプロストおよびサチグレルからなる群より選ばれる少なくとも1種である請求項12〜15のいずれかに記載の医療用材料の製造方法。
【請求項17】
抗血小板剤がシロスタゾールである請求項12〜15のいずれかに記載の医療用材料の製造方法。
【請求項1】
ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体に、抗血小板剤を含有させたことを特徴とする医療用材料。
【請求項2】
ポリアミドブロック共重合体が、ポリアミドとポリエーテルとのブロック共重合体である請求項1記載の医療用材料。
【請求項3】
ポリアミドブロック共重合体が、ナイロン6、ナイロン66、ナイロン610、ナイロン612、ナイロン11およびナイロン12からなる群より選ばれるポリアミドと、ポリエチレングリコール、ポリプロピレングリコールおよびポリテトラメチレングリコールからなる群より選ばれるポリエーテルとのブロック共重合体である請求項2記載の医療用材料。
【請求項4】
ポリアミドブロック共重合体が、ポリアミドとポリエステルとのブロック共重合体である請求項1記載の医療用材料。
【請求項5】
抗血小板剤の含有量が、ポリアミドブロック共重合体100重量部に対し0.01〜60重量部である請求項1記載の医療用材料。
【請求項6】
抗血小板剤の含有量が、ポリアミドブロック共重合体100重量部に対し0.01〜45重量部である請求項5記載の医療用材料。
【請求項7】
抗血小板剤の含有量が、ポリアミドブロック共重合体100重量部に対し0.05〜10重量部である請求項6記載の医療用材料。
【請求項8】
抗血小板剤の含有量が、ポリアミドブロック共重合体100重量部に対し0.1〜6重量部である請求項7記載の医療用材料。
【請求項9】
抗血小板剤がシロスタゾール、ジピリダモール、ベラプロストおよびサチグレルからなる群より選ばれる少なくとも1種である請求項1〜8のいずれかに記載の医療用材料。
【請求項10】
抗血小板剤がシロスタゾールである請求項9記載の医療用材料。
【請求項11】
医療器具用材料である請求項1〜10のいずれかに記載の医療用材料。
【請求項12】
ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体を溶融状態で抗血小板剤と混合することを特徴とする医療用材料の製造方法。
【請求項13】
ハードセグメントとしてのポリアミドとソフトセグメントとからなるポリアミドブロック共重合体と、抗血小板剤とを溶媒に溶解して混合した後、溶媒を除去することを特徴とする医療用材料の製造方法。
【請求項14】
ポリアミドブロック共重合体が、ポリアミドとポリエーテルとのブロック共重合体である請求項12または13記載の医療用材料の製造方法。
【請求項15】
ポリアミドブロック共重合体が、ナイロン6、ナイロン66、ナイロン610、ナイロン612、ナイロン11およびナイロン12からなる群より選ばれるポリアミドと、ポリエチレングリコール、ポリプロピレングリコールおよびポリテトラメチレングリコールからなる群より選ばれるポリエーテルとのブロック共重合体である請求項12または13記載の医療用材料の製造方法。
【請求項16】
抗血小板剤がシロスタゾール、ジピリダモール、ベラプロストおよびサチグレルからなる群より選ばれる少なくとも1種である請求項12〜15のいずれかに記載の医療用材料の製造方法。
【請求項17】
抗血小板剤がシロスタゾールである請求項12〜15のいずれかに記載の医療用材料の製造方法。
【図1】




【公開番号】特開2007−236982(P2007−236982A)
【公開日】平成19年9月20日(2007.9.20)
【国際特許分類】
【出願番号】特願2007−166396(P2007−166396)
【出願日】平成19年6月25日(2007.6.25)
【分割の表示】特願平8−2573の分割
【原出願日】平成8年1月10日(1996.1.10)
【出願人】(000149435)株式会社大塚製薬工場 (154)
【出願人】(000206956)大塚製薬株式会社 (230)
【Fターム(参考)】
【公開日】平成19年9月20日(2007.9.20)
【国際特許分類】
【出願日】平成19年6月25日(2007.6.25)
【分割の表示】特願平8−2573の分割
【原出願日】平成8年1月10日(1996.1.10)
【出願人】(000149435)株式会社大塚製薬工場 (154)
【出願人】(000206956)大塚製薬株式会社 (230)
【Fターム(参考)】
[ Back to top ]

