医薬グレードの第二鉄有機化合物、その使用およびその製造方法
本発明は、より広範囲のpHにわたって可溶性であり、大きな活性表面積を有する、医薬グレードの第二鉄有機化合物(クエン酸第二鉄を含む)を開示する。設定された製造出荷時規格に一貫して従う医薬グレードのクエン酸第二鉄を作製するための製造および品質管理のプロセスもまた開示される。医薬グレードの第二鉄有機化合物は、高い血清リン酸塩レベルを特徴とする障害を治療するのに適している。
【発明の詳細な説明】
【技術分野】
【0001】
本願は、2005年8月19日出願の米国特許出願第60/709,511号、および2005年8月18日出願の米国特許出願第11/206,981号の優先権を主張するものであって;本願は2003年2月19日出願の米国特許出願第60/447,690号、および2003年4月15日出願の同第60/462,684号の利益を主張する2004年2月18日に出願され、2004年9月2日に国際公開番号WO2004/074444として公開されたPCT/US2004/004646の一部継続出願であり、これらの先行出願の全内容および開示は参照により本願に組み入れられる。
【0002】
本願を通じて、様々な刊行物が参照されるが、これらの刊行物の開示は、本発明が関連する技術の状況をさらに十分に説明するために、参照により本願にそのまま組み入れられる。
【0003】
技術分野
本発明は、医薬グレードの第二鉄(ferric)有機化合物(クエン酸第二鉄など)の製造および使用に関する。本明細書に記載の医薬グレードのクエン酸第二鉄の使用は、限定されるものではないが、ヒトおよび非ヒト被験体または患者における様々な障害を治療する方法を含む。
【背景技術】
【0004】
発明の背景
鉄化合物の利用
第二鉄含有化合物は数多くの障害の治療に有用であり、それらの障害には、限定されるものではないが、高リン酸血症(hyperphosphatemia)や代謝性アシドーシスが含まれる。Hsuら, "New Phosphate Binding Agents: Ferric Compounds", J Am Soc Nephrol, Vol. 10, Pages 1274-1280, 1999参照。これまでの研究や発明では、食事リン酸塩との結合に第二鉄化合物を利用することが報告されており、そのような第二鉄化合物は腎不全患者における高リン酸血症の治療に潜在的に有用である(米国特許第5,753,706号, 1998; 米国特許第6,903,235号, 2005; CN 1315174, 2001; Yang W. C, ら, Nephrol. Dial. Transplant 17: 265: 270 (2002))。血液中の上昇したリン酸塩量はクエン酸第二鉄などの化合物を投与することにより除去することができる。一旦溶液となると、第二鉄はリン酸と結合し、そのリン酸第二鉄化合物は胃腸管内で沈殿し、その結果、体内からの食事リン酸塩の有効な除去がもたらされる。また、クエン酸第二鉄から吸収されたクエン酸塩も、代謝性アシドーシス(腎不全患者に共通して認められる症状)を解消する重炭酸塩に変換されると考えられている。
【0005】
2004年2月18日に出願され、2004年9月2日に国際公開番号WO2004/074444として公開された国際出願番号PCT/US2004/004646は、第二鉄有機化合物(これまでに報告されている調製物よりも広い範囲のpHにわたって可溶性であり続け、大きな活性表面積を有するクエン酸第二鉄を含む)を製造する方法を開示している。しかしながら、医薬グレードのクエン酸第二鉄または第二鉄有機化合物の、設定された標準または規格のコンプライアンス(法令遵守)を確実にし、かつ/または確証するための品質管理/分析手段を含む商業的にスケールアップ可能な製造プロセスは、これまでに開示されていなかった。
【発明の開示】
【発明が解決しようとする課題】
【0006】
したがって、ヒトに用いる医薬グレードの第二鉄有機化合物またはクエン酸第二鉄を合成するためのスケールアップ可能なプロセスが必要である。このようなプロセスでは必要な医薬グレードの第二鉄有機化合物またはクエン酸第二鉄を常に作り出す必要がある。
【0007】
本発明は、クエン酸第二鉄の用量をさらに開示し、その用量は該化合物を必要とするヒトまたは非ヒト被験体または患者の治療を目的とするものである。異なる投与経路が検討されている。
【課題を解決するための手段】
【0008】
発明の概要
本発明のこれらの目的および他の目的に従って、本発明の概要を簡単に示す。次の概要では一部簡略化および省略がなされているが、この概要は本発明のいくつかの態様を強調し、かつ導入することを意図しており、その範囲を限定するものではない。当業者が本発明の概念を為しおよび利用し得るのに十分な好ましい例示的な実施形態の詳細な説明を後の節に記載する。
【0009】
本発明の一実施形態では、設定された製造出荷時規格(Manufacture Release Specification)に一貫して従う医薬グレードのクエン酸第二鉄を作製するための製造および品質管理のプロセス/分析を提供する。本発明の方法は、マルチキログラムバッチの医薬グレードのクエン酸第二鉄を生産するように適合させることができ、クエン酸第二鉄のさらなる生産力を提供するように容易にスケールアップすることができる。
【0010】
製造方法の例示的な一実施形態は、医薬グレードのクエン酸第二鉄を製造するための次の非限定的順序の工程により示すことができ、すなわち、該工程は、 (a)適量の塩化第二鉄六水和物を水に溶解して、塩化第二鉄六水和物溶液を作る工程;(b)適量のNaOHを水に溶解して、NaOH溶液を作る工程;(c)前記塩化第二鉄六水和物溶液とNaOH溶液とを混合して、Fe(OH)3沈殿物を含む溶液を作る工程;(d)Fe(OH)3沈殿物を含む前記溶液のpHを7.0より高く維持する工程;(e)前記Fe(OH)3沈殿物を分離する工程;(f)前記Fe(OH)3沈殿物を水で3回洗浄する工程;(g)前記Fe(OH)3沈殿物を水に懸濁する工程;(h)前記Fe(OH)3沈殿物にクエン酸を加えて、第二鉄-有機酸溶液を作る工程;(i)前記第二鉄-有機酸溶液を90〜100℃で30〜120分間攪拌および加熱する工程;(j)前記第二鉄-有機酸溶液中の固体を、クエン酸を加えることにより除去する工程;(k)前記第二鉄-有機酸溶液を30℃より低くなるまで冷却する工程;(l)前記第二鉄-有機酸溶液のpHを0.8〜1.5の間に維持する工程;(m)前記第二鉄-有機酸溶液を濾過して、濾液を得る工程;(n)アセトンと濾液とを混合して、クエン酸第二鉄を作る工程;(o)クエン酸第二鉄を分離する工程;(p)クエン酸第二鉄をアセトンで3回洗浄する工程;および(q)前記クエン酸第二鉄を乾燥する工程を含む。
【0011】
さらなる一実施形態では、医薬グレードのクエン酸第二鉄の大量生産スキームを提供し、そのスキームは、(a)適当な反応装置内で適量のNaOHと塩化第二鉄六水和物とを混合して、水酸化第二鉄沈殿物を含む水酸化第二鉄スラリーを作る工程;(b)前記水酸化第二鉄スラリーのpHを7.0より高く維持する工程;(c)加圧濾過を用いて前記水酸化第二鉄スラリーから前記水酸化第二鉄沈殿物を分離する工程;(d)前記水酸化第二鉄沈殿物を3回洗浄する工程;(e)前記水酸化第二鉄沈殿物中の%Clを5%未満に維持する工程;(f)加圧濾過を用いて前記洗浄した水酸化第二鉄沈殿物を分離する工程;(g)洗浄した水酸化第二鉄沈殿物とクエン酸を混合して、第二鉄有機酸溶液を作る工程;(h)前記第二鉄有機酸溶液の温度を80±5℃で2時間攪拌および維持する工程;(i)前記第二鉄有機酸溶液を60℃まで冷却する工程;(j)前記第二鉄有機酸溶液のpHを0.8〜1.5の間に、そして、前記第二鉄有機酸溶液中のFeの量を工程(a)で加えられたFeの≧85%に維持する工程;(k)加圧濾過を用いて前記第二鉄有機酸溶液を濾過して、濾液を得る工程;(l)前記濾液をアセトンと混合して、クエン酸第二鉄を得る工程;(m)加圧濾過を用いてクエン酸第二鉄を分離する工程;(n)前記クエン酸第二鉄をアセトンで洗浄する工程;(o)加圧濾過を用いて前記洗浄したクエン酸第二鉄を分離する工程;(p)前記洗浄したクエン酸第二鉄を流動床乾燥機で乾燥する工程;および(q)前記有機揮発性不純物を≦1000ppmアセトンに維持する工程を含む。
【0012】
さらなる一実施形態は、医薬グレードのクエン酸第二鉄の製造に有用であり得る様々な中間組成物を包含する。本明細書に包含される中間組成物としては、固体、液体、または多相混合物が含まれる。医薬グレードのクエン酸第二鉄を含む液体の中間組成物は、水性組成物または有機溶媒系組成物であり得る。多相組成物は、水相と有機相の両方を含み得る。
【0013】
さらなる一実施形態は、本明細書に開示される様々な中間組成物の保管、パッケージング、および使用のための方法を包含する。
【0014】
さらなる一実施形態では、医薬グレードのクエン酸第二鉄を含む医薬上有用な組成物を提供する。該医薬上有用な組成物は、被験体もしくはヒト患者に、有効量の該医薬グレードのクエン酸第二鉄を投与するのに適した、任意の医薬上許容されうる担体、補助剤、増量剤、または送達ビヒクルをさらに含む。
【0015】
前記医薬組成物のさらなる実施形態としては、限定されるものではないが、固体、液体、または半固体形態(例えばゲル、シロップ、チュアブル、もしくはペースト)が含まれる。本明細書に開示される医薬上有用な組成物を使用する方法の範囲内に、前記医薬組成物を投与する時期および様式だけでなく、前記医薬組成物の有効な用量もある。
【0016】
前記医薬組成物を使用する方法の限定されない例は、被験体またはヒト患者において、リン酸塩の上昇した血中レベルによって生じる障害、すなわち、高リン酸血症(hyperphosphateimia)を治療することを包含する。かかる障害は、限定されるものではないが、腎不全または腎不全の進行、軟組織の鉱物化(mineralization)、副甲状腺機能亢進症、ならびに他の合併症により示される。
【0017】
本発明により包含される一実施形態は、
(a)被験体または患者の血清リン酸塩レベルの低下を達成させるのに有効な量の医薬グレードの第二鉄有機化合物と、
(b)医薬上好適な担体と
を含み、該第二鉄有機化合物が表Aの製造出荷時規格における制限の少なくとも1つに適合している医薬組成物を含む。
【0018】
本明細書に記載される医薬組成物は、図1、2、3、または4により示される方法により製造され得る。これらの実施形態に加えて、関連した表B〜Fのいずれかの各出荷時規格に開示される少なくとも1つの制限を満たす材料で製造された組成物がある。
【0019】
さらなる一実施形態は、
(a)適量の塩化第二鉄六水和物を水に溶解して、塩化第二鉄六水和物溶液を作る工程;
(b)適量のNaOHを水に溶解して、NaOH溶液を作る工程;
(c)前記塩化第二鉄六水和物溶液とNaOH溶液とを混合して、Fe(OH)3沈殿物を含む溶液を作る工程;
(d)Fe(OH)3沈殿物を含む前記溶液のpHを7.0より高く維持する工程;
(e)前記Fe(OH)3沈殿物を分離する工程;
(f)前記Fe(OH)3沈殿物を水で3回洗浄する工程;
(g)前記Fe(OH)3沈殿物を水に懸濁する工程;
(h)前記Fe(OH)3沈殿物にクエン酸を加えて、第二鉄-有機酸溶液を作る工程;
(i)前記第二鉄-有機酸溶液を90〜100℃で30〜120分間攪拌および加熱する工程;
(j)前記第二鉄-有機酸溶液中の固体を、クエン酸を加えることにより除去する工程;
(k)前記第二鉄-有機酸溶液を30℃より低くなるまで冷却する工程;
(l)前記第二鉄-有機酸溶液のpHを0.8〜1.5の間に維持する工程;
(m)前記第二鉄-有機酸溶液を濾過して、濾液を得る工程;
(n)アセトンと濾液とを混合して、クエン酸第二鉄を作る工程;
(o)クエン酸第二鉄を分離する工程;
(p)クエン酸第二鉄をアセトンで3回洗浄する工程;
(q)前記クエン酸第二鉄を乾燥する工程;
を含む方法に従って製造された医薬グレードのクエン酸第二鉄の組成物を包含する。
【0020】
前記製造方法をスケールアップすることが有利である。よって、産業規模の方法は、
(a)適当な反応装置内で適量のNaOHと塩化第二鉄六水和物とを混合して、水酸化第二鉄沈殿物を含む水酸化第二鉄スラリーを作る工程;
(b)前記水酸化第二鉄スラリーのpHを7.0より高く維持する工程;
(c)加圧濾過を用いて前記水酸化第二鉄スラリーから前記水酸化第二鉄沈殿物を分離する工程;
(d)前記水酸化第二鉄沈殿物を3回洗浄する工程;
(e)前記水酸化第二鉄沈殿物中の%Clを5%未満に維持する工程;
(f)加圧濾過を用いて前記洗浄した水酸化第二鉄沈殿物を分離する工程;
(g)洗浄した水酸化第二鉄沈殿物とクエン酸を混合して、第二鉄有機酸溶液を作る工程;
(h)前記第二鉄有機酸溶液の温度を80±5℃で2時間攪拌および維持する工程;
(i)前記第二鉄有機酸溶液を60℃まで冷却する工程;
(j)前記第二鉄有機酸溶液のpHを0.8〜1.5の間に、そして、前記第二鉄有機酸溶液中のFeの量を工程(a)で加えられたFeの≧85%に維持する工程;
(k)加圧濾過を用いて前記第二鉄有機酸溶液を濾過して、濾液を得る工程;
(l)前記濾液をアセトンと混合して、クエン酸第二鉄を得る工程;
(m)加圧濾過を用いてクエン酸第二鉄を分離する工程;
(n)前記クエン酸第二鉄をアセトンで洗浄する工程;
(o)加圧濾過を用いて前記洗浄したクエン酸第二鉄を分離する工程;
(p)前記洗浄したクエン酸第二鉄を流動床乾燥機で乾燥する工程;および
(q)前記有機揮発性不純物を≦1000ppmアセトンに維持する工程;
を含み、前記クエン酸第二鉄が表Aの製造出荷時規格における制限の少なくとも1つに適合している、医薬グレードのクエン酸第二鉄の大量生産のための方法により具体化される。
【0021】
医薬グレードのクエン酸第二鉄を含む前記組成物は、高リン酸血症、または高血清リン酸塩レベルを特徴とする他の障害を治療するのに適している。よって、本発明は、様々な腎疾患、例えば、末期腎疾患(ESRD)、慢性腎疾患(CKD)、もしくは他の関連腎疾患を有する被験体もしくは患者、または透析、限定されるものではないが、血液透析を受けている被験体および患者を治療することを包含する。
【0022】
もう1つの実施形態では、医薬グレードのクエン酸第二鉄を含む前記組成物は、代謝性アシドーシスを有する被験体または患者を治療するのにも用いることができる。クエン酸塩の重炭酸塩への変換により改善され得る他の障害もまた、記載の本発明に包含される。
【0023】
前記医薬組成物を使用する方法の一実施形態は、慢性腎疾患を有するヒトまたは非ヒト被験体または患者を治療することを包含する。慢性腎疾患は、一般に5つの臨床病期(1〜5の番号がつけられている)が存在し、その病期1は重篤度が最も低く、病期5は重篤度が最も高い。初期段階、例えば、病期1および2では、透析は必要でない。慢性腎疾患が病期5に進行するにつれて、患者は週3回の透析治療が必要になる可能性がある。注目すべきは、慢性腎疾患のすべての病期で高いリン酸塩レベルが観察されることである。よって、本発明の一実施形態は、初期または中期慢性腎疾患を有する被験体または人を、より低い血清リン酸塩レベルを実現させるために、医薬グレードのクエン酸第二鉄を含む組成物で治療する方法である。
【0024】
本発明のさらなる一実施形態は、後期慢性腎疾患を有する、血液透析を受けているヒトまたは非ヒト被験体または患者を、医薬グレードのクエン酸第二鉄を含む組成物を投与することにより治療する方法を提供することである。血液透析は血清リン酸塩レベルを低下させるのに十分に有効ではないことが知られている。後期腎疾患を有する被験体またはヒトの治療は、その被験体またはヒトが現在血液透析治療を受けているかどうかに関わらず、適用できる。
【0025】
本発明のさらなる一実施形態は、慢性腎疾患を有する、腹膜透析を受けている被験体またはヒトを医薬グレードのクエン酸第二鉄を含有する、記載されている組成物で治療する方法である。腹膜透析は血清リン酸塩レベルを低下させるのに十分に有効ではないことが知られている。
【0026】
さらなる一実施形態は、軟組織の鉱物化、具体的に言えば、石灰化を阻害(抑制)あるいは脱石灰化するために前記医薬組成物を使用する方法である。高リン酸血症では、遊離カルシウムと結合して不溶性のリン酸カルシウムを形成する可能性が増すことにより、硬組織および軟組織でのリン酸カルシウム沈着の増加が起こり得る。よって、医薬グレードのクエン酸第二鉄を含む組成物の有効用量は、血清リン酸塩レベルを低下させ得、それに応じたリン酸カルシウム沈着の減少ももたらし得る。
【0027】
第二鉄イオンが胃腸管(the gastroinstestinal tract)の内腔でリン酸塩含有化合物と不溶性沈殿物を形成する一方、そのクエン酸塩成分は吸収され、カルシウムキレート剤として働くということは注目に値するものである。キレートされたカルシウムはリン酸カルシウムの形成に利用されないことから、医薬グレードのクエン酸第二鉄を投与することで、血清カルシウムとリン酸塩の両方の減少をもたらし得る。これはまた、血清カルシウム-リン酸塩生成物の減少現象としても表され得る。血清カルシウムとリン酸塩を減少させることで、リン酸カルシウム沈着が減少すると予想された。最終結果は、沈着したリン酸カルシウムの脱沈着、すなわち、可溶化または溶解ということになる。
【0028】
石灰化した軟組織、例えば、眼の強膜の脱灰(decalcifying)は、医薬グレードのクエン酸第二鉄を投与することにより行い得る。関連医療分野における通常の技術を有するヒトの間では、クエン酸第二鉄の投与を受けている腎疾患患者が眼の脱カルシウム沈着を示したということが知られている。よって、本発明の一実施形態は、軟組織(眼など)の脱灰に向けられる。
【0029】
腎石は、シュウ酸のカルシウム塩またはリン酸塩を含み、上述のものと似た機構により形成される。そのようなことから、医薬グレードのクエン酸第二鉄は、本発明のもう1つの実施形態では、腎石、すなわち、腎臓結石を、それらの溶解を促進することにより治療する方法を提供する。
【0030】
医薬グレードのクエン酸第二鉄を含む前記組成物は、2つ以上の機構により作用し得る。有望な限定されない作用機序は、胃腸管内でリン酸塩と結合して、不溶性のリン酸第二鉄沈殿物を形成する第二鉄イオンによって起こり得る。これは、次には、胃腸管からのリン酸塩およびリン酸塩含有化合物の取込みの減少をもたらし得る。
【0031】
このような機構を考えれば、医薬グレードのクエン酸第二鉄を含む組成物の経口経路による投与は、記載される本発明の方法に包含される。
【0032】
本発明は、被験体の軟組織の石灰化を脱石灰化、予防、または安定化する方法であって、該被験体に有効量のクエン酸第二鉄化合物を投与することを含む方法を提供する。
【0033】
本発明は、被験体の軟組織の石灰化を脱石灰化、予防、または安定化する方法であって、該被験体に有効量のクエン酸第二鉄化合物を投与することを含み、該クエン酸第二鉄化合物が図1〜4に示される方法により製造される方法をさらに提供する。
【0034】
本発明は、被験体の軟組織の石灰化を脱石灰化、予防、または安定化する方法であって、該被験体に有効量のクエン酸第二鉄化合物を投与することを含み、該クエン酸第二鉄化合物が下記の工程を含む方法により製造される方法を提供する。
【0035】
本発明の一実施形態は、クエン酸第二鉄のカプセル剤の場合、許容量1日当たり最高15gまで、そして、クエン酸第二鉄の錠剤の場合、許容量1日当たり30gを包含する。
【0036】
医薬グレードのクエン酸第二鉄を含む前記組成物は、様々な期間投与し得る。いくつかの実施形態では、医薬グレードのクエン酸第二鉄を含む前記組成物の許容性により、必要に応じて長期投与が可能である。
【発明を実施するための最良の形態】
【0037】
発明の詳細な説明
図面では、本発明の特定の実施形態を例示するが、技術思想を制限するものと解釈してはならず、または本発明を不必要にあいまいにすることを避けるために詳細に記載すべきである。従って、明細書および図面は、限定的な意味ではなく、むしろ例示的な意味で扱うべきである。
【0038】
本願を通じて、米国薬局方(the United Stats Pharmacopeia)(USP)を参照し、最新版のUSPであるUSP 28は参照により本願にそのまま組み入れられる。
【0039】
本発明は、医薬グレードのクエン酸第二鉄の製造方法であって、
(a)適量の塩化第二鉄六水和物を水に溶解して、塩化第二鉄六水和物溶液を作る工程;(b)適量のNaOHを水に溶解して、NaOH溶液を作る工程;(c)前記塩化第二鉄六水和物溶液とNaOH溶液とを混合して、Fe(OH)3沈殿物を含む溶液を作る工程;(d)Fe(OH)3沈殿物を含む前記溶液のpHを7.0より高く維持する工程;(e)前記Fe(OH)3沈殿物を分離する工程;(f)前記Fe(OH)3沈殿物を水で3回洗浄する工程;(g)前記Fe(OH)3沈殿物を水に懸濁する工程;(h)前記Fe(OH)3沈殿物にクエン酸を加えて、第二鉄-有機酸溶液を作る工程;(i)前記第二鉄-有機酸溶液を90〜100℃で30〜120分間攪拌および加熱する工程;(j)前記第二鉄-有機酸溶液中の固体を、クエン酸を加えることにより除去する工程;(k)前記第二鉄-有機酸溶液を30℃より低くなるまで冷却する工程;(1)前記第二鉄-有機酸溶液のpHを0.8〜1.5の間に維持する工程;(m)前記第二鉄-有機酸溶液を濾過して、濾液を得る工程;(n)アセトンと濾液とを混合して、クエン酸第二鉄を作る工程;(o)クエン酸第二鉄を分離する工程;(p)クエン酸第二鉄をアセトンで3回洗浄する工程;および(q)前記クエン酸第二鉄を乾燥する工程
を含む方法を提供する。
【0040】
本発明は、医薬グレードのクエン酸第二鉄のスケールアップ可能な生産または大規模生産のための方法であって、
(a)適当な反応装置内で適量のNaOHと塩化第二鉄六水和物とを混合して、水酸化第二鉄沈殿物を含む水酸化第二鉄スラリーを作る工程;(b)前記水酸化第二鉄スラリーのpHを7.0より高く維持する工程;(c)加圧濾過を用いて前記水酸化第二鉄スラリーから前記水酸化第二鉄沈殿物を分離する工程;(d)前記水酸化第二鉄沈殿物を3回洗浄する工程;(e)前記水酸化第二鉄沈殿物中の%Clを5%未満に維持する工程;(f)加圧濾過を用いて前記洗浄した水酸化第二鉄沈殿物を分離する工程;(g)洗浄した水酸化第二鉄沈殿物とクエン酸を混合して、第二鉄有機酸溶液を作る工程;(h)前記第二鉄有機酸溶液の温度を80±5℃で2時間攪拌および維持する工程;(i)前記第二鉄有機酸溶液を60℃まで冷却する工程;(j)前記第二鉄有機酸溶液のpHを0.8〜1.5の間に、そして、前記第二鉄有機酸溶液中のFeの量を工程(a)で加えられたFeの≧85%に維持する工程;(k)加圧濾過を用いて前記第二鉄有機酸溶液を濾過して、濾液を得る工程;(1)前記濾液をアセトンと混合して、クエン酸第二鉄を得る工程;(m)加圧濾過を用いてクエン酸第二鉄を分離する工程;(n)前記クエン酸第二鉄をアセトンで洗浄する工程;(o)加圧濾過を用いて前記洗浄したクエン酸第二鉄を分離する工程;(p)前記洗浄したクエン酸第二鉄を流動床乾燥機で乾燥する工程;および(q)前記有機揮発性不純物を≦1000ppmアセトンに維持する工程
を含む方法を提供する。
【0041】
一実施形態では、前記塩化第二鉄六水和物は、表Bに示される出荷時規格に適合しており;前記クエン酸は、表Fに示される出荷時規格に適合しており;前記水は、表Dに示される出荷時規格に適合しており;前記アセトンは、表Eに示される出荷時規格に適合しており;そして、前記水酸化ナトリウムは、表Cに示される出荷時規格に適合している。
【0042】
もう1つの実施形態では、前記クエン酸第二鉄は、流動床乾燥機を用いて乾燥されるか、または真空乾燥される。
【0043】
さらなる一実施形態では、上述の方法は、前記クエン酸第二鉄を、表Aに示される出荷時規格のコンプライアンス(法令遵守)について試験することをさらに含む。さらなる一実施形態では、前記試験は、クエン酸第二鉄およびクエン酸第二鉄一水和物の含有物純度分析;クエン酸の含量分析;検出可能なクエン酸第二鉄関連物質の含量分析;第二鉄イオンの含量分析;元素鉄不純物試験;第一鉄制限量試験;乾燥減量試験;水和試験(示差走査熱量測定法による水分含量);水和試験(カールフィッシャー滴定法による水分含量);微量または重金属試験(As、Ca、Cd、Cu、Fe、Hg、Na、Pb、Sr、Zn);シュウ酸制限量試験;第二鉄塩についての同定A試験;FTIRによる同定B試験;不溶性物質試験;アンモニウム制限量試験;塩化物制限量試験;硝酸塩制限量試験;酒石酸塩制限量試験;強熱残分試験;有機揮発性不純物試験;ならびに微生物、カビおよび酵母試験からなる群から選択される少なくとも1つの試験を実施することを含む。
【0044】
本発明は、上述の方法に従って製造された医薬グレードのクエン酸第二鉄を提供する。
【0045】
本発明は、高リン酸血症または代謝性アシドーシスを治療するための、上述の方法に従って製造された前記クエン酸第二鉄を含む組成物を提供する。
【0046】
本発明は、第二鉄有機化合物療法が奏功する障害を治療するための、上述の方法に従って製造された組成物を提供する。
【0047】
本発明は、NMR分光分析にかけると、図6に示されるようなピークが生じる、上述の方法に従って製造された医薬グレードのクエン酸第二鉄を提供する。
【0048】
本発明は、図8に示されるような溶解速度を有する、上述の方法に従って製造された医薬グレードのクエン酸第二鉄を提供する。
【0049】
本発明は、フーリエ変換赤外分光法(FTIR)によるスペクトル分析にかけると、図7に示されるようなスペクトルデータが生じる、上述の方法に従って製造された医薬グレードのクエン酸第二鉄を提供する。
【0050】
本発明は、高リン酸血症または代謝性アシドーシスを治療するための、上述のクエン酸第二鉄を含む組成物を提供する。
【0051】
本発明は、第二鉄有機化合物療法が奏功する障害を治療するための、上述の第二鉄酸を含む組成物を提供する。
【0052】
本発明は、図1〜4に示される工程を含むプロセスにより製造された医薬グレードのクエン酸第二鉄を提供する。
【0053】
本発明の医薬グレードのクエン酸第二鉄は、高リン酸血症、代謝性アシドーシス、または第二鉄有機化合物療法が奏功する障害に罹患している被験体の治療に有用である。一実施形態では、前記被験体はヒトである。
【0054】
また、本発明は、次の用途:
(a)高リン酸血症の治療;
(b)透析患者の死亡率の減少;
(c)代謝性アシドーシスの治療;
(d)リン酸カルシウム沈着の阻害;
(e)血清カルシウム-リン(リン酸塩)生成物([Ca]x[P])の減少
(f)血清カルシウムレベルの低下;
(g)軟組織の脱石灰化;および
(h)腎石溶解の支援
のうちの1以上の用途に有効な医薬グレードのクエン酸第二鉄を含む組成物の使用も提供する。
【0055】
前記使用は、カルシウムイオンおよびリン酸イオンの血清レベルを低下させることに少なくとも部分的に依存することをさらに包含し得る。
【0056】
上述の使用は、軟組織(血管または眼など)に適用し得る。
【0057】
上述の使用は、長期にわたって投与することにより行われ得る。
【0058】
本発明は、前記組成物が化学薬品グレードのクエン酸第二鉄を含有した場合と比べて、伴われる有害な胃腸管副作用がより少ない上述の使用の実現を可能にする。
【0059】
上述の使用によれば、本発明は、高血清リン酸塩レベルを特徴とする障害を治療するための方法であって、有効量の医薬グレードのクエン酸第二鉄を含む組成物を投与することを含む方法を提供する。
【0060】
本発明はまた、有効量の医薬グレードのクエン酸第二鉄が錠剤、粉末剤、懸濁液、エマルション、カプセル剤、ドロップ剤、顆粒剤、トローチ剤、丸剤、液剤、スピリット、またはシロップ剤の形態で投与される方法も提供する。
【0061】
本発明はまた、前記有効量の医薬グレードのクエン酸第二鉄が1日当たり2〜100g、好ましくは、1日当たり4〜60gである方法も提供する。
【0062】
いくつかの実施形態では、前記方法、1日の有効量2g、4g、6g、または8gを提供し得る。
【0063】
一般に、高リン酸血症は、慢性腎不全を有する患者および透析を受けている患者の間で高い有病率である。また、血清リンレベル、カルシウム-リン生成物(CaxP)レベル、および副甲状腺ホルモン(PTH)レベルの上昇は、腎疾患患者における血管、内臓、末梢血管、および軟組織の石灰化の発生増加の一因となるという証拠もある。
【0064】
このようなことから、請求する発明のさらなる新規特徴は、腎疾患患者または健常者における石灰化を予防または脱石灰化(reverse)することである。例えば、腎不全に伴って起こる可能性がある腎石の溶解である。
【0065】
リン(Phosphorous)は、CaxPに直接関与することにより血管の石灰化に悪影響を及ぼし、そして甲状腺機能亢進症の発症および進行には間接的に悪影響を及ぼす。血清カルシウムおよびリンは、通常の状況では準安定であり、これは、それらの濃度は自然沈降が起こるには十分でないということを意味する。しかしながら、一度石灰化プロセスが始まると、結晶の増加を支援するのにそれらの濃度は十分である。
【0066】
入手可能な証拠により、重症慢性腎不全を有する患者における基礎的血管疾患および構造的心疾患の有病率が高いことは裏付けられる。これらの構造的病変は、さらに、増加した血清リン、CaxP、およびPTH(1)にさらされる。
【0067】
血清リンおよびCaxP増加の一因となる可能性があると考えられる要因には、カルシウム含有リン結合剤の投与が含まれる。そのようなカルシウム含有リン結合剤、例えば、酢酸カルシウムは、多くの新しい血液透析(HD)患者や腹膜透析(PD)患者に処方されており、そのため、多量の外因性カルシウムが胃腸管に供給される。
【0068】
石灰化は、腎疾患患者だけにとどまらず、40歳を超えた人では誰でも起こり得る。米国における主な死亡原因は、急性心筋梗塞および卒中であるが、高コレステロール血症が原因となったこのカテゴリーでの死者はほんの15%であり、85%の原因は心室の石灰化である。
【0069】
血清リン、CaxP、およびPTHレベルの異常が血管、内臓、および/または軟組織の石灰化を引き起こし得ることは示されている。例えば、心筋、冠動脈、角膜の石灰化は、心筋虚血、心筋梗塞、心筋機能障害、鬱血性心不全、心弁不全症、および失明を含む数多くの臨床的に重大な合併症の発生をもたらす可能性がある。
【0070】
よって、多くの内科的障害を治療する手段として、血清リンを管理または低減する方法が必要である。この方法は、血清カルシウムレベルに悪影響を与えず、かつその患者において毒性のある副作用を引き起こさない、リン酸塩結合剤を投与することを含む。
【実施例】
【0071】
実施例では、本発明の実施形態(具体例)を例示することを目的としているが、本発明の範囲を制限することを意図するものではない。
【0072】
実施例1. 医薬グレードのクエン酸第二鉄の一般的な合成方法
本発明の医薬グレードのクエン酸第二鉄の一般的な合成方法を示す図1を参照しながら、この図でのフローチャートは、最終クエン酸第二鉄製品が、表Aに示される製造出荷時規格、または承認を受けているか、もしくはヒトに用いるのに適した医薬グレードのクエン酸第二鉄についての任意の設定された製造出荷時規格に確実に適合するようにするための、該合成プロセスの選択された段階における品質管理規準の実施を示す。他の品質管理規準または手順は、当業者ならば容易に理解でき、それらの手段または手順を用いて、または医薬グレードの該合成プロセスに組み込んで、最終製品の品質および純度を維持することができ、そして該合成プロセスの効率および収率を高めることができる。例えば、図1のQC10およびQC11参照。
【0073】
該合成プロセスに使用される品質管理規準の例は、(QC4)水酸化第二鉄スラリーのpHを7.0より高く維持すること;(QC5)水酸化第二鉄沈殿物中の%Clを5%未満に維持すること;(QC7)クエン酸を水酸化第二鉄沈殿物に加えた後に、混合物のpHを0.8〜1.5の間に、そして、混合物中のFeを、加えられたFe総量の≧85%に維持すること;および(QC9)乾燥段階中に、アセトンのレベルを≦1OOOppmに維持することを含む。
【0074】
一実施形態では、前記原材料、すなわち、塩化第二鉄、脱イオン水、クエン酸、アセトン、水酸化ナトリウムは、表B〜Fで提供されているものなどの出荷時規格に合格しなければならず、それらの原材料は合格して初めて該合成プロセスに用いることができる。図1、QC1〜QC3、QC6、およびQC8参照。
【0075】
実施例1A. 医薬グレードの第二鉄有機化合物の一般的な合成方法
本発明の医薬グレードの第二鉄有機化合物の一般的な合成方法を示す図10に関して、この図でのフローチャートは、最終クエン酸第二鉄製品が、承認を受けているか、もしくはヒトに用いるのに適した医薬グレードの第二鉄有機化合物についての設定された製造出荷時規格に確実に適合するようにするための、該合成プロセスの選択された段階における品質管理規準の実施を示す。他の品質管理規準または手順は、当業者ならば容易に理解でき、それらの規準または手順を用いて、または医薬グレードの該合成プロセスに組み込んで、最終製品の品質および純度を維持することができ、そして該合成プロセスの効率および収率を高めることができる。例えば、図10のQC10AおよびQC11A参照。
【0076】
前記合成プロセスに使用される品質管理規準の例は、(QC4A)水酸化第二鉄スラリーのpHを7.0より高く維持すること;(QC5A)水酸化第二鉄沈殿物中の%Clを5%未満に維持すること;(QC7A)有機酸を水酸化第二鉄沈殿物に加えた後に、混合物のpHを0.8〜1.5の間に、そして、混合物中のFeを、加えられたFe総量の≧85%に維持すること;および(QC9A)乾燥段階中に、有機溶媒のレベルを≦1000ppmに維持することを含む。
【0077】
一実施形態では、前記原材料、すなわち、第二鉄塩、脱イオン水、有機酸、有機溶媒、アルカリ金属水酸化物は、出荷時規格に合格しなければならず、それらの原材料は合格して初めて該合成プロセスに用いることができる。図1、QC1A〜QC3A、QC6A、およびQC8A参照。前記有機酸は、クエン酸、酢酸、イソクエン酸、コハク酸、フマル酸、酒石酸、または任意の他の好適な有機酸を含み得る。前記有機溶媒は、エタノール、メタノール、ブタノール、アセトン、イソプロピルアルコール、テトラヒドロフラン、または任意の他の好適な有機溶媒を含み得る。
【0078】
実施例2. 本発明の第二鉄有機化合物の溶解プロフィール
上述の方法により作り出された第二鉄有機化合物は、より広範囲のpHレベルにわたって、市販の第二鉄有機化合物より溶解度が高い。本発明の第二鉄有機化合物の溶解度のこのような増加は、本発明の第二鉄有機化合物の活性表面積が独特に著しく大きいことによるものと思われる。例えば、pH8.0では、本発明のクエン酸第二鉄の固有溶解速度は、市販のクエン酸第二鉄より3.08倍高い。表1参照。
【0079】
市販のクエン酸第二鉄の固有溶解速度を、本発明のクエン酸第二鉄と比較した。固有溶解速度は、一定表面積の条件下での純物質の溶解速度として定義される。製剤原料の溶解速度およびバイオアベイラビリティ(生物利用性)は、その物性、すなわち、結晶性、非晶性、多形、水和、溶媒和、粒径、および粒子表面積により影響を受ける。固有溶解速度の測定値は、これらの物性に依存し、一般に、一定温度、攪拌速度、およびpHを維持しながら、一定表面積の材料を適当な溶解媒質にさらすことにより決定される。固有溶解速度を表1に示している。
【表1】

【0080】
例えば、本発明のクエン酸第二鉄のBET活性表面積は、市販のクエン酸第二鉄より少なくとも16倍大きい。表2参照。
【0081】
活性表面積の分析はBET理論に基づいており、このBET理論は固体表面上および孔空間内へのガス吸着中の質量およびエネルギーの相互作用と相変化の現象を記載したものである。BET活性表面積測定では、ガスの単層の体積が決定され、それにより、吸着ガス分子の単層によって占められる面積を用いてサンプルの表面積を決定することが可能になる。表4は、本発明のクエン酸第二鉄の活性表面積と、市販のクエン酸第二鉄化合物の活性表面積との比較である。
【表2】

【0082】
実施例3. 障害の治療における本発明の第二鉄有機化合物の使用
上述の方法により作製された第二鉄有機化合物は、高リン酸血症、代謝性アシドーシス、および第二鉄有機化合物療法が奏功する任意の他の障害の治療において有用である。本発明の第二鉄有機化合物は市販の第二鉄有機化合物より溶解度が大きいため、より少ない量の本発明の第二鉄有機化合物を用いて、そのような障害に罹患している患者を効果的に治療することができる。
【0083】
水溶解度の向上は、第二鉄有機化合物療法が奏功する障害の治療における本発明の第二鉄有機化合物の使用に特に関わりがある。本発明の第二鉄有機化合物は溶解度が大きいことから、経口服用する場合にはより効果的であり、そのため、より低い用量で服用することができる。本発明の第二鉄有機化合物は、より広いpH範囲にわたって、市販の第二鉄有機化合物より溶解度が大きい。そのため、本発明の第二鉄有機化合物は、小腸で溶解することにより、より効果的であり得る。
【0084】
例えば、小腸内でアルカリ性条件をシミュレートする試験では、本発明のクエン酸第二鉄は、市販のクエン酸第二鉄より有利な溶解速度を示した。本発明のクエン酸第二鉄は、小腸でより溶解度が大きいことにより、より効果的であり得ることが示唆される。表1参照。結果として、患者は、副作用の発生率が低い、より低い用量の医薬を服用することができる。
【0085】
本発明の一実施形態では、本発明のクエン酸第二鉄は、生理学的条件下での水溶解速度が市販の形態のクエン酸第二鉄よりはるかに高く、そのため、本発明のクエン酸第二鉄は、クエン酸第二鉄の減量した用量での経口的有効使用により大きな改善を提供すると考えられる。クエン酸第二鉄の経口有効量を低減することで、本発明のクエン酸第二鉄では、市販のクエン酸第二鉄化合物に関連する潰瘍性胃腸管副作用の発生率が低くなると考えられる。加えて、本発明のクエン酸第二鉄の溶解速度の増大は、食事リン酸塩との結合に関する作用のより速やかな発現ももたらすと考えられる。
【0086】
本発明の第二鉄有機化合物は、経口投与可能な形態を含む数多くの形態で投与することができ、そのような形態は、本発明の第二鉄有機化合物単独、または医薬上許容される担体との組合せを含み得る。経口投与可能な形態には、限定されるものではないが、錠剤、粉末剤、懸濁液、エマルション、カプセル剤、顆粒剤、トローチ剤、丸剤、液剤、スピリット、またはシロップ剤が含まれる。この組成物は、第二鉄有機化合物療法が奏功する病気に罹患しているヒトまたは他の動物に投与することができる。
【0087】
実施例4. 医薬グレードのクエン酸第二鉄の作製方法
本発明では、ヒトに用いる活性医薬品成分として適した医薬グレードのクエン酸第二鉄を製造するための方法を記載している。クエン酸第二鉄製造フローチャートの概略は図1に示している。具体例では、下記手順を用いて医薬グレードのクエン酸第二鉄を作製した。図2も参照のこと。
【0088】
4.1. 塩化第二鉄溶液の調製
・1Lビーカーに塩化第二鉄六水和物550gを秤量する(CoA純度を補正する)。
【0089】
・その塩化第二鉄六水和物を4Lエルレンマイヤーフラスコに移す。
【0090】
・メスシリンダーを用いて脱イオン水1.1Lを量る。その脱イオン水の少量を用いて、ビーカーをすすぎ、その水を前記4Lエルレンマイヤーフラスコに移す。残りの水をそのエルレンマイヤーフラスコに移す。
【0091】
・完全に溶解するまで磁気攪拌子を用いて溶液を攪拌する。その溶液は暗黄色〜暗褐色である。
【0092】
4.2. 水酸化ナトリウム溶液の調製
・500mLビーカーに水酸化ナトリウム244gを秤量する(CoA純度を補正する)。
【0093】
・その水酸化ナトリウムを2Lエルレンマイヤーフラスコに移す。
【0094】
・メスシリンダーを用いて脱イオン水1.1Lを量る。その脱イオン水の少量を用いて、ビーカーをすすぎ、その水を4Lエルレンマイヤーフラスコに移す。残りの水をそのエルレンマイヤーフラスコにゆっくりと移す。
【0095】
・ヒュームフード内で、前記水を加えながら、攪拌子を用いてその溶液を攪拌し、完全に溶解するまで攪拌する。その溶液は無色透明である。
【0096】
・水浴を用いて溶液を30℃より低くなるまで冷却する。
【0097】
4.3. 水酸化第二鉄中間体の調製
・前記塩化第二鉄溶液中に磁気攪拌子を入れ、そのフラスコを水浴に入れる。攪拌プレート上に置き、その攪拌プレートを低速で開始する。
【0098】
・滴下漏斗を用いて前記水酸化ナトリウム溶液を前記塩化第二鉄溶液にゆっくりと(20ml/分未満の速度で)加え、水浴および水酸化ナトリウムの添加速度を用いて、その反応混合物の温度を40℃より低く制御する。
【0099】
・水浴を用いて褐色の粘性混合物を30℃より低くなるまで冷却し続ける。
【0100】
・最終pHは7を超えているはずであるが、もし7以下である場合には、適量の5M水酸化ナトリウム水溶液を用いて、そのpHを補正する。その最終pHを測定し、記録する。水酸化第二鉄の暗褐色沈殿物が形成される。
【0101】
・必要に応じて、冷水浴を用いて前記褐色粘性混合物を30℃より低くなるまで冷却し、その水酸化第二鉄懸濁液を1mmサイズのステンレス鋼フィルターで濾過して、大きな沈殿物を細かくする。
【0102】
・等量の水酸化第二鉄懸濁液を4つの500mL遠心容器に移す。遠心分離の前に電子はかりを用いて各遠心容器の重量を釣り合わせる。
【0103】
・その水酸化第二鉄懸濁液を1500rpm、25+5℃で5分間遠心分離する。その上清を廃棄する。
【0104】
・メスシリンダーを用いて脱イオン水2.5Lを量り、およそ1Lの水を用いて、前記遠心容器の水酸化第二鉄沈殿物を再懸濁する。
【0105】
・その水酸化第二鉄懸濁液を、ガラス漏斗上に1mmサイズのステンレス鋼フィルターを取り付けた4Lエルレンマイヤーフラスコに移す。残る1.5Lの脱イオン水を用いて、容器をすすぎ、ステンレス鋼フィルター上に残った沈殿物を洗浄する。
【0106】
・「等量の...移す。」から始まる工程を繰り返すことにより、その沈殿物をあと2回洗浄する。
【0107】
・3回目の洗浄の後、「等量の...移す。」から始まり、「その水酸化第二鉄懸濁液を...遠心分離する。」で終わる工程を繰り返すことにより、その沈殿物を回収する。
【0108】
・その沈殿物を脱イオン水150mLに再懸濁する。
【0109】
4.4. クエン酸第二鉄の調製
・前記水酸化第二鉄沈殿物を2Lエルレンマイヤーフラスコ内で機械的攪拌装置を用いて5分間ホモジナイズする。
【0110】
・500mLビーカーにクエン酸490gを秤量する(CoA純度を補正する)。
【0111】
・油浴に入れた2Lエルレンマイヤーフラスコに攪拌子を入れ、高速で攪拌する。
【0112】
・その水酸化第二鉄懸濁液にクエン酸を加える。
【0113】
・その溶液を30分間攪拌する。
【0114】
・その混合物を、その色が橙褐色から透明黒褐色に変わるまで(30〜120分間)または水酸化第二鉄沈殿物が溶解するまで、90〜100℃(油浴中)に加熱する。
【0115】
・1mLアリコートの反応混合物を6mLガラス試験管に取り、1500rpm、25+5℃で5分間遠心分離する。沈殿物が観察されなければ、次の工程に進む。いくらかの沈殿物が観察される場合には、その混合物にクエン酸10〜34gを加え、10〜30分間加熱を続ける。
【0116】
・その加熱を終わらせ、その混合物を30℃より低くなるまで冷却する。その反応混合物のpHを測定する;その反応混合物はpH0.8〜1.5であるはずである。
【0117】
・等量の反応混合物を4つの500mL遠心容器に移し、電子はかりを用いて各容器の重量を釣り合わせる。
【0118】
・その反応混合物を1500rpm、25±5℃で5分間遠心分離する。すべてのクエン酸第二鉄上清を清浄な4Lエルレンマイヤーフラスコに移し、プールする。
【0119】
・そのクエン酸第二鉄反応混合物のすべてに対して、前の2つの工程を繰り返す。
【0120】
・前記クエン酸第二鉄上清の半分を4Lエルレンマイヤーフラスコに入れ、磁気攪拌子を用いて高速で攪拌する。
【0121】
・アセトン3.5L(上清量の5倍として算出される正確な量のアセトン)をゆっくりと(20分かけて)加え、さらに10分攪拌する。ライトベージュ色の沈殿物が形成する。
【0122】
・その懸濁液を4つの500mL遠心容器に移し、電子はかりを用いて各容器の重量を釣り合わせる。
【0123】
・そのクエン酸第二鉄懸濁液を1500rpm、25+5℃で5分間遠心分離する。
【0124】
・すべてのクエン酸第二鉄沈殿物を清浄な4Lエルレンマイヤーフラスコに移し、プールする。
【0125】
・前記クエン酸第二鉄上清のさらに半分を用いて、前の4つの工程を繰り返す。
【0126】
・すべてのクエン酸第二鉄沈殿物をプールし、アセトン1.4Lを加え、5分間攪拌する。
【0127】
・その懸濁液を4つの500mL遠心容器に移し、電子はかりを用いて各容器の重量を釣り合わせる。
【0128】
・その懸濁液を1500rpm、25+5℃で5分間遠心分離する。
【0129】
・すべての懸濁液を遠心分離するまで、前の2つの工程を繰り返す。
【0130】
・すべてのクエン酸第二鉄沈殿物を清浄な4Lエルレンマイヤーフラスコに移し、プールする。
【0131】
・前の5つの工程をさらに2回を繰り返す(合計3回の洗浄)。
【0132】
・乾燥トレイにラベルを付け、秤量し、それらの重量を記録する。
【0133】
・前記クエン酸第二鉄沈殿物をその乾燥皿に載せ、周囲温度(25+5℃)で16時間乾燥する。
【0134】
・沈殿物が入った状態の乾燥トレイを真空炉に入れ、周囲温度(25+5℃)、真空下(約20mmHg)で8〜16時間乾燥させる(その材料が粉砕可能な状態になったと思われるまで)。
【0135】
・そのクエン酸第二鉄の粒径を磁器製の乳棒と乳鉢で小さくする。
【0136】
・そのクエン酸第二鉄粉末を真空炉に入れ、その材料が篩過可能な状態になったと思われるまで、周囲温度(25+5℃)、真空下(約20mmHg)で8〜24時間乾燥する。
【0137】
・そのクエン酸第二鉄の粒径を磁器製の乳棒と乳鉢で微細にする。そのクエン酸第二鉄粉末を、45メッシュサイズ(355μm)の篩を通して選別する。
【0138】
・そのクエン酸第二鉄粉末を乾燥トレイに移し、そのトレイを炉に入れて、25+5℃、真空下で、その材料が乾燥したと思われるまで乾燥させる(20〜48時間)。
【0139】
・予め秤量したプラスチック製琥珀色容器にその粉末を移す。
【0140】
・その容器にラベルを付け、周囲温度で光から守られた状態で保存する。
【0141】
実施例5. 医薬グレードのクエン酸第二鉄のスケールアップ可能な製造のための方法
本発明は、医薬グレードのクエン酸第二鉄のスケールアップ可能な製造を提供する。該クエン酸第二鉄製造法は、少なくとも125kgバッチの医薬グレードのクエン酸第二鉄を作り出すことができることが好ましい。クエン酸第二鉄製造の概略は図3に示している。クエン酸第二鉄合成の詳細は図4に示している。
【0142】
該スケールアップ可能な製造プロセスは、湿潤クエン酸第二鉄を乾燥するため、そして、有機揮発性不純物についての出荷時規格を達成するために流動床乾燥機をさらに使用する。医薬グレードのクエン酸第二鉄についての製造出荷時規格に関する表A参照。
【0143】
実施例6. 医薬グレードのクエン酸第二鉄
本発明は、以下で表Aに示される製造出荷時規格に適合している医薬グレードのクエン酸第二鉄を提供する。一貫した純度および品質の医薬グレードのクエン酸第二鉄は、本発明の製造プロセスを用いて調製することができる。クエン酸第二鉄製造および品質管理のプロセスの模式図に関する図1〜4参照。クエン酸第二鉄製造および品質管理のプロセスは、マルチキログラムバッチサイズを生産するように容易にスケールアップすることができ、また製造規模にスケールアップすることができる。
【表3】

【0144】

【0145】
実施例7. 原材料の出荷時検査規格
【表4】

【表5】

【表6】

【表7】

【表8】

【0146】
実施例8. 最終製品の製造出荷時検査方法
本発明の方法またはプロセスによって作製された最終クエン酸第二鉄製品が、表Aに示された設定された製造出荷時規格に確実に適合するようにするために、次の検査を実施する。この製造出荷時規格は、ヒトに用いる医薬グレードのクエン酸第二鉄の純度および安全性を高めるために、当業者ならば本発明の教示に従って容易に変更または修正し得る。
【0147】
(a)USP 25 <191> フェリシアン化カリウムを用いた重量測定法, p. 1918に基づく-クエン酸第二鉄における第一鉄の制限量(limit)
(b)USP 25, 硫酸第二鉄アッセイ, p. 728に基づく-クエン酸第二鉄における塩化物の制限量
(c)USP 25, 硫酸第二鉄アッセイ, p. 728に基づく-クエン酸第二鉄における酸不溶性物質の制限量
(d)USP 25, 硫酸第二鉄アッセイ, p. 728に基づく-クエン酸第二鉄における第二鉄の分析含量
(e)USP 25 <467>に基づく-GClFIDヘッドスペースによるクエン酸第二鉄サンプルにおけるアセトンの測定
(f)USP 25 <191>, 第二鉄塩;クエン酸塩, p. 1918に基づく-クエン酸第二鉄の同定
(g)USP 25 <621>, p. 1988-1995、<731>、<1086>, p. 2157-2159、<736>, p. 2029-2033に基づく-クエン酸第二鉄および関連物質のLCMS フローインジェクション定量およびプロフィール
(h)USP 25 <731> 乾燥減量
(i)USP 25 <921> 水分測定、方法Ia(直接滴定)
(j)Zn、Cu、Sr、Ca、Na、および全鉄についてのICP
(k)AsについてのGFAAS
(1)鉛およびカドミウムについてのICP-MS
(m)水銀についての低温蒸気/AA
(n)強熱残分
(o)微生物/カビおよび酵母
実施例9. 患者におけるin vivoでの医薬グレードのクエン酸第二鉄の使用方法および検査方法
A. 試験組成物の取り扱いおよび形態
クエン酸第二鉄は500mgカプセルで供給されるが、そのプラシーボは(活性薬剤を含有するものと区別ができない)同一に見えるカプセルで与える;このプラシーボカプセル剤は、ソルビトールと、活性カプセル剤の粉末の色と一致させるための着色剤を含む。このプラシーボカプセル剤のシェルは、活性カプセル剤のシェルと同一にする。
【0148】
保存
すべての試験薬供給品は、安定した状態で保存しなければならず、試験薬の容器に示されたそれらの使用期限を過ぎて使用してはならない。これらの試験薬は、遮光されたしっかり閉まる容器に管理された状態(15〜30℃;59〜86°F)で保存されるべきである。
【0149】
投薬量
最近の予備的研究では、末期腎疾患(ESRD)患者における血清PO4の減少について、クエン酸第二鉄(1日3g)と炭酸カルシウム(1日3g)を比較した。クエン酸第二鉄は血清P04の大幅な減少をもたらしたが、炭酸カルシウムほどの効果はなかった。この用量のクエン酸第二鉄で軽度の我慢できる胃腸管症状を伴った。
【0150】
図12および13に示されるように、医薬グレードのクエン酸第二鉄を用いた治療は、化学薬品グレードのクエン酸第二鉄よりも優れたいくつかの利点を与える。一般に、医薬グレードのクエン酸第二鉄は、化学薬品グレードのクエン酸第二鉄のものとほぼ同等の有効性を示す一方で、化学薬品グレードのクエン酸第二鉄よりも少ない有害な副作用でこの結果を実現する。
【0151】
また、図12は、医薬グレードのクエン酸第二鉄の投与に伴う有害な副作用がそのプラシーボに関するものと統計的には差はなかったということも示している。この安全性プロフィールの利点は、個々の患者が、副作用をあまり心配せずに、広範囲の用量にわたって漸増された医薬グレードのクエン酸第二鉄の投薬を受けることができるということである。このように、個々の患者の治療を、患者の特定のニーズや耐性に合うように合わせることができる。
【0152】
研究または治療のために選択されるクエン酸第二鉄の用量は1日当たりクエン酸第二鉄1〜30gであり得る。これは、ある程度、提供される製剤の性質に依存し得る。例えば、クエン酸第二鉄のカプセル剤は、1日用量約15g/日まで投与し得るが、一方、その錠剤形態は30g/日まで投与し得る。このように、本発明により包含される極めて広い範囲の投与計画が存在する。
【0153】
被験体の最適用量の滴定
本発明に関連して、用語「被験体」とは、ヒトまたは非ヒト動物のいずれかを指す。
【0154】
各被験体または群の最適用量は以下のとおり決定し得る。1日当たりおよそ1gまたは2gという用量は、単に例示的な開始用量として示しただけである。1日用量は、所望の結果が認められるまで必要に応じて増量してよい。
【0155】
本発明の意図は、使用される用量範囲を制限しないことである。そのため、投与される1日用量は、被験体に応じて、1日当たり30g、40g、50g、60g、70g、80g、90g、または100gと概算し得る。広範囲の用量の実施が医薬グレードのクエン酸第二鉄の安全性プロフィールにより可能となる。
【0156】
さらに、本発明の意図は、経口製剤としてのカプセル剤および錠剤に限定されないことである。様々な経口製剤が本発明での使用に適している可能性があることは当技術分野で公知である。
【0157】
投与計画の例示的具体例
投与計画の限定されない例を以下に示す。これは、クエン酸第二鉄の有効量を選択する方法、またはそれが提供される形態、またはその組成物の1日当たりの投与回数に関して本発明を限定するためのものではない。以下は、クエン酸第二鉄とプラシーボを、例えば、同一の外観を持つ500mgカプセル剤として投与する方法を単に例示するものである。すべての患者は、毎日三度の食事とともに毎度4つのカプセル剤を28日間(盲検法で)受ける。患者は、食事(朝食、昼食、および夕食)後10分間以内に試験薬を服用するように指示される。
【0158】
毎食時に服用するプラシーボカプセル剤の数と活性カプセル剤の数は以下のとおりである:
本研究のプラシーボアーム:
朝食時、プラシーボカプセル剤4つ
昼食時、プラシーボカプセル剤4つ
夕食時、プラシーボカプセル剤4つ
本研究のクエン酸第二鉄1日当たり2gアーム:
朝食時、クエン酸第二鉄カプセル剤1つとプラシーボカプセル剤3つ
昼食時、クエン酸第二鉄カプセル剤1つとプラシーボカプセル剤3つ
夕食時、クエン酸第二鉄カプセル剤2つとプラシーボカプセル剤2つ
クエン酸第二鉄1日当たり4gアーム:
朝食時、クエン酸第二鉄カプセル剤2つとプラシーボカプセル剤2つ
昼食時、クエン酸第二鉄カプセル剤3つとプラシーボカプセル剤1つ
夕食時、クエン酸第二鉄カプセル剤3つとプラシーボカプセル剤1つ
クエン酸第二鉄1日当たり6gアーム:
朝食時、クエン酸第二鉄カプセル剤4つ
昼食時、クエン酸第二鉄カプセル剤4つ
夕食時、クエン酸第二鉄カプセル剤4つ
B. 臨床スケジュールおよび評価
試験処置期間
各患者の試験への参加は最大8週間まで続く:スクリーニング期間(およそ1〜2週間)、ウォッシュアウト1〜2週間、および試験薬での処置4週間。
【0159】
スクリーニング訪問1(試験日の-30日〜-15日)
初回スクリーニング訪問時に次の調査を行う:
1. 病歴(併用薬など)。
【0160】
2. 人口統計データ。
【0161】
3. 身体診察(身長、体重、および生命徴候など)。
【0162】
4. 食事インタビュー(スクリーニング期間中、透析日1日、非透析日1日、および週末1日を含む3回、24時間想起法を用いて、食事によるカルシウムおよびリン摂取量を評価する)。注:食事インタビューは、ウォッシュアウト期間中に一部または全部を行ってもよい。
【0163】
5. 臨床検査による評価:
・血液学:全血球計算(CBC)(鑑別(differential)、血小板を含む)。
【0164】
・化学的性質:ナトリウム、カリウム、塩化物、重炭酸塩、血中尿素窒素(BUN)、クレアチニン、グルコース(任意)、アスパラギン酸トランスアミナーゼ(AST)、アラニントランスアミナーゼ(ALT)、アルカリ性ホスファターゼ(ALP)、総ビリルビン量、総タンパク質量、アルブミン、血清カルシウム、血清リン酸塩、マグネシウム
・総コレステロールレベルおよびLDLコレステロールレベル
・血清(妊娠の可能性がある女性に対して3-HCG
・鉄パネル:血清鉄、フェリチン、トランスフェリン飽和度、および総鉄結合能。
【0165】
6. 12-鉛 ECG。
【0166】
7. 患者には、ウォッシュアウト期間(試験日の-14日〜-1日)についての指示が与えられる:
a. すべてのリン酸塩結合剤を第-14日に中止する
b. いかなる鉄療法(経口または静脈内)も第-14日に中止する
c. 登録前に1ヶ月間継続してビタミンDまたはカルシトリオールを服用していた患者は、試験期間中は現在の服用量を維持するように指示を受ける
d. 患者は、食生活の変更、カルシウムまたはマグネシウムを含有する制酸剤(他の医薬)を避けるようにアドバイスを受ける。
【0167】
スクリーニング訪問2(試験日の-7+/-1日)
1. 臨床検査による評価:
血清PO4
注:第-7日の血清PO4が≧5.5mg/dLかつ≦10mg/dLであった患者を無作為化した後、2週間のウォッシュアウトを完了する。無作為化した日が自動的に第0日となる。
【0168】
注:第-7日のリン酸塩レベルが≧10mg/dLであった患者は、この試験から除外され、試験前の薬物治療を再開するよう指示を受ける。
【0169】
試験第0日(無作為化および投薬)
1. 身体診察(体重および生命徴候など)。
【0170】
2. 有害事象に関する問い合わせ。
【0171】
3. 併用薬に関する問い合わせ。
【0172】
4. 臨床検査によるベースライン評価:
・血清PO4
・血清Ca
・鉄パネル:血清鉄、フェリチン、トランスフェリン飽和パーセント、および総鉄結合能
注:臨床検査によるベースライン評価は、第0日の3日前まで行ってよい
5. PO4レベルが≧0.5mg/dLかつ≦10mg/dLであった患者を無作為化し、15日分の試験薬を調剤する。
【0173】
注:患者は、第0日における次の食事の完了後10分間以内に試験薬の服用を開始するよう指示を受けるものとする。
【0174】
試験の第14日(中間評価)
試験の第14+/-1日に次の検査を行う。
【0175】
1. 身体診察(体重および生命徴候を含む)。
【0176】
2. 有害事象に関する問い合わせ。
【0177】
3. 併用薬に関する問い合わせ。
【0178】
4. さらに15日分の試験薬を調剤する。返却されたすべてのカプセル剤を計数し、症例報告書に記録するものとする。
【0179】
5. 臨床検査による評価:
・血液学:CBC(鑑別、血小板を含む)。
【0180】
・化学的性質:ナトリウム、カリウム、塩化物、重炭酸塩、BUN、クレアチニン、グルコース(ランダム)、AST、ALT、ALP、総ビリルビン量、総タンパク質量、アルブミン、カルシウム、リン酸塩、マグネシウム。
【0181】
・鉄パネル:血清鉄、フェリチン、トランスフェリン飽和パーセント、および総鉄結合能。
【0182】
・総コレステロールレベルおよびLDLコレステロールレベル。
【0183】
注:第14日のリン酸塩レベルが>10mg/dLであった患者は、この試験から除外され、試験前の薬物治療を再開するよう指示を受ける。
【0184】
試験の第28日(試験評価の終了)
試験の第28+/-1日に、または早期終了日に、次の検査を行う。
【0185】
1. 身体診察(体重および生命徴候など)
2. 有害事象に関する問い合わせ。
【0186】
3. 併用薬に関する問い合わせ。
【0187】
4. 臨床検査による評価:
a. 血液学:CBC(鑑別、血小板を含む)
b. 化学的性質:ナトリウム、カリウム、塩化物、重炭酸塩、BUN、クレアチニン、グルコース(ランダム)、AST、ALT、ALP、総ビリルビン量、総タンパク質量、アルブミン、カルシウム、リン酸塩、マグネシウム。
【0188】
c. 総コレステロールレベルおよびLDLコレステロールレベル
d. 鉄パネル:血清鉄、フェリチン、トランスフェリン飽和パーセント、および総鉄結合能。
【0189】
5. 12-鉛 ECG
6. 患者は、この試験の終了後、試験前の薬物治療を再開するよう指示を受ける。
【0190】
C. データ管理および分析
GloboMaxは、一次データを管理、監視、および調整するセンターである。各被験体に関する症例報告書(CRF)を送る。被験体は、CRFに載っている氏名またはイニシャルでは識別されない。CRFは、臨床的部位で監視され、GloboMaxの試験モニターにより収集される。監査済みのCRFが電子データファイルを作成するために用いられる。
【0191】
3つの主要なカテゴリーの評価項目により、最初に対処を受けている生化学的および臨床的問題について検討する。さらなる生化学的および臨床的問題については、それらの問題が生じたときに対処する。よって、ここでの評価項目は、これらの試験、または将来の試験で収集される関連所見および測定結果全体を制限するものではない。
【0192】
主要評価項目(図9〜10参照)
・ベースラインからの第14日および第28日における血清PO4濃度の変化。
【0193】
副次的評価項目(図9〜10参照)
・ベースラインからの第14日および第28日における血清カルシウム濃度の変化。
【0194】
・ベースラインからの第14日および第28日における鉄、フェリチン、トランスフェリン飽和パーセント、および総鉄結合能の変化。
【0195】
・ベースラインからの第14日および第28日におけるCaPO4生成物の変化。
【0196】
医薬グレードのクエン酸第二鉄は、化学薬品グレードのクエン酸第二鉄と同様の有効性を示すことがさらに示される。図13参照。しかしながら、その安全性プロフィールは、医薬グレードのものによって、一般に、臨床上の有害作用の低減がもたらされるということを示している。図13参照。
【0197】
安全性評価項目(図11参照)
安全性は、有害事象(図11)、ならびに各調査訪問時の身体診察、生命徴候、および臨床検査の結果を記録することにより監視される。
【0198】
患者の安全性を保証するために、検査データに基づいた、この試験からの離脱についての具体的なルールも設けた。このような判定基準の限定されない例を、以下に示す。
【0199】
患者の血清リン酸塩レベルが≧10mg/dLまで増加した場合には、試験期間中のどの時点においても、その患者をこの試験から離脱させる。
【0200】
具体的な試験により、医薬グレードのクエン酸第二鉄が化学薬品グレードのクエン酸第二鉄と同様の有効性を有するということも分かった。(図13参照)。しかしながら、医薬グレードのものは、図12で示されるように、一般に、著しく、より望ましい安全性プロフィールを与える。これは、血清リン酸塩レベルの調節における重要な進歩であることを示している。
【図面の簡単な説明】
【0201】
図面では、本発明の特定の実施形態を例示するが、本発明の思想または範囲を限定するものと決して解釈してはならない。
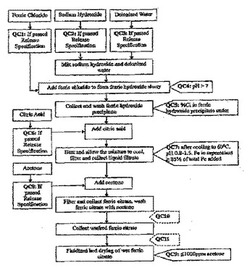
【図1】最終クエン酸第二鉄製品が、表Aに示される設定された製造出荷時規格に確実に適合するようにするための工程内品質管理規準を含む、医薬グレードのクエン酸第二鉄の一般的な合成方法の概要を示す模式図である。
【図2】本発明による医薬グレードクエン酸第二鉄作製方法の概要を示す模式図である。
【図3】本発明によるスケールアップ可能な医薬グレードクエン酸第二鉄製造および品質管理プロセスの概要を示す
【図4】本発明によるスケールアップ可能な医薬グレードクエン酸第二鉄製造および品質管理プロセスの模式図である。
【図5】本発明の医薬グレードクエン酸第二鉄の代表的なプロトンNMRスペクトルを示す。
【図6】本発明の医薬グレードクエン酸第二鉄の代表的なFTIRスペクトルを示す。
【図7】医薬グレードのクエン酸第二鉄と化学薬品グレードのクエン酸第二鉄のpH1.0および8.0における固有溶解速度の比較である。
【図8】最終第二鉄有機化合物が、設定された製造出荷時規格に確実に適合するようにするための工程内品質管理規準を含む、医薬グレードの第二鉄有機化合物の一般的な合成方法の概要を示す模式図である。
【図9】医薬グレードのクエン酸第二鉄の臨床結果のまとめである。
【図10】医薬グレードのクエン酸第二鉄の有効性データのまとめである。
【図11】臨床試験からの安全性データのまとめである。
【図12】化学薬品グレードのクエン酸第二鉄と医薬グレードのクエン酸第二鉄の安全性プロフィールの比較である。
【図13】化学薬品グレードのクエン酸第二鉄と医薬グレードのクエン酸第二鉄の有効性プロフィールの比較である。
【図14】患者の死亡率と高リン酸血症の関係の棒グラフを示す。
【技術分野】
【0001】
本願は、2005年8月19日出願の米国特許出願第60/709,511号、および2005年8月18日出願の米国特許出願第11/206,981号の優先権を主張するものであって;本願は2003年2月19日出願の米国特許出願第60/447,690号、および2003年4月15日出願の同第60/462,684号の利益を主張する2004年2月18日に出願され、2004年9月2日に国際公開番号WO2004/074444として公開されたPCT/US2004/004646の一部継続出願であり、これらの先行出願の全内容および開示は参照により本願に組み入れられる。
【0002】
本願を通じて、様々な刊行物が参照されるが、これらの刊行物の開示は、本発明が関連する技術の状況をさらに十分に説明するために、参照により本願にそのまま組み入れられる。
【0003】
技術分野
本発明は、医薬グレードの第二鉄(ferric)有機化合物(クエン酸第二鉄など)の製造および使用に関する。本明細書に記載の医薬グレードのクエン酸第二鉄の使用は、限定されるものではないが、ヒトおよび非ヒト被験体または患者における様々な障害を治療する方法を含む。
【背景技術】
【0004】
発明の背景
鉄化合物の利用
第二鉄含有化合物は数多くの障害の治療に有用であり、それらの障害には、限定されるものではないが、高リン酸血症(hyperphosphatemia)や代謝性アシドーシスが含まれる。Hsuら, "New Phosphate Binding Agents: Ferric Compounds", J Am Soc Nephrol, Vol. 10, Pages 1274-1280, 1999参照。これまでの研究や発明では、食事リン酸塩との結合に第二鉄化合物を利用することが報告されており、そのような第二鉄化合物は腎不全患者における高リン酸血症の治療に潜在的に有用である(米国特許第5,753,706号, 1998; 米国特許第6,903,235号, 2005; CN 1315174, 2001; Yang W. C, ら, Nephrol. Dial. Transplant 17: 265: 270 (2002))。血液中の上昇したリン酸塩量はクエン酸第二鉄などの化合物を投与することにより除去することができる。一旦溶液となると、第二鉄はリン酸と結合し、そのリン酸第二鉄化合物は胃腸管内で沈殿し、その結果、体内からの食事リン酸塩の有効な除去がもたらされる。また、クエン酸第二鉄から吸収されたクエン酸塩も、代謝性アシドーシス(腎不全患者に共通して認められる症状)を解消する重炭酸塩に変換されると考えられている。
【0005】
2004年2月18日に出願され、2004年9月2日に国際公開番号WO2004/074444として公開された国際出願番号PCT/US2004/004646は、第二鉄有機化合物(これまでに報告されている調製物よりも広い範囲のpHにわたって可溶性であり続け、大きな活性表面積を有するクエン酸第二鉄を含む)を製造する方法を開示している。しかしながら、医薬グレードのクエン酸第二鉄または第二鉄有機化合物の、設定された標準または規格のコンプライアンス(法令遵守)を確実にし、かつ/または確証するための品質管理/分析手段を含む商業的にスケールアップ可能な製造プロセスは、これまでに開示されていなかった。
【発明の開示】
【発明が解決しようとする課題】
【0006】
したがって、ヒトに用いる医薬グレードの第二鉄有機化合物またはクエン酸第二鉄を合成するためのスケールアップ可能なプロセスが必要である。このようなプロセスでは必要な医薬グレードの第二鉄有機化合物またはクエン酸第二鉄を常に作り出す必要がある。
【0007】
本発明は、クエン酸第二鉄の用量をさらに開示し、その用量は該化合物を必要とするヒトまたは非ヒト被験体または患者の治療を目的とするものである。異なる投与経路が検討されている。
【課題を解決するための手段】
【0008】
発明の概要
本発明のこれらの目的および他の目的に従って、本発明の概要を簡単に示す。次の概要では一部簡略化および省略がなされているが、この概要は本発明のいくつかの態様を強調し、かつ導入することを意図しており、その範囲を限定するものではない。当業者が本発明の概念を為しおよび利用し得るのに十分な好ましい例示的な実施形態の詳細な説明を後の節に記載する。
【0009】
本発明の一実施形態では、設定された製造出荷時規格(Manufacture Release Specification)に一貫して従う医薬グレードのクエン酸第二鉄を作製するための製造および品質管理のプロセス/分析を提供する。本発明の方法は、マルチキログラムバッチの医薬グレードのクエン酸第二鉄を生産するように適合させることができ、クエン酸第二鉄のさらなる生産力を提供するように容易にスケールアップすることができる。
【0010】
製造方法の例示的な一実施形態は、医薬グレードのクエン酸第二鉄を製造するための次の非限定的順序の工程により示すことができ、すなわち、該工程は、 (a)適量の塩化第二鉄六水和物を水に溶解して、塩化第二鉄六水和物溶液を作る工程;(b)適量のNaOHを水に溶解して、NaOH溶液を作る工程;(c)前記塩化第二鉄六水和物溶液とNaOH溶液とを混合して、Fe(OH)3沈殿物を含む溶液を作る工程;(d)Fe(OH)3沈殿物を含む前記溶液のpHを7.0より高く維持する工程;(e)前記Fe(OH)3沈殿物を分離する工程;(f)前記Fe(OH)3沈殿物を水で3回洗浄する工程;(g)前記Fe(OH)3沈殿物を水に懸濁する工程;(h)前記Fe(OH)3沈殿物にクエン酸を加えて、第二鉄-有機酸溶液を作る工程;(i)前記第二鉄-有機酸溶液を90〜100℃で30〜120分間攪拌および加熱する工程;(j)前記第二鉄-有機酸溶液中の固体を、クエン酸を加えることにより除去する工程;(k)前記第二鉄-有機酸溶液を30℃より低くなるまで冷却する工程;(l)前記第二鉄-有機酸溶液のpHを0.8〜1.5の間に維持する工程;(m)前記第二鉄-有機酸溶液を濾過して、濾液を得る工程;(n)アセトンと濾液とを混合して、クエン酸第二鉄を作る工程;(o)クエン酸第二鉄を分離する工程;(p)クエン酸第二鉄をアセトンで3回洗浄する工程;および(q)前記クエン酸第二鉄を乾燥する工程を含む。
【0011】
さらなる一実施形態では、医薬グレードのクエン酸第二鉄の大量生産スキームを提供し、そのスキームは、(a)適当な反応装置内で適量のNaOHと塩化第二鉄六水和物とを混合して、水酸化第二鉄沈殿物を含む水酸化第二鉄スラリーを作る工程;(b)前記水酸化第二鉄スラリーのpHを7.0より高く維持する工程;(c)加圧濾過を用いて前記水酸化第二鉄スラリーから前記水酸化第二鉄沈殿物を分離する工程;(d)前記水酸化第二鉄沈殿物を3回洗浄する工程;(e)前記水酸化第二鉄沈殿物中の%Clを5%未満に維持する工程;(f)加圧濾過を用いて前記洗浄した水酸化第二鉄沈殿物を分離する工程;(g)洗浄した水酸化第二鉄沈殿物とクエン酸を混合して、第二鉄有機酸溶液を作る工程;(h)前記第二鉄有機酸溶液の温度を80±5℃で2時間攪拌および維持する工程;(i)前記第二鉄有機酸溶液を60℃まで冷却する工程;(j)前記第二鉄有機酸溶液のpHを0.8〜1.5の間に、そして、前記第二鉄有機酸溶液中のFeの量を工程(a)で加えられたFeの≧85%に維持する工程;(k)加圧濾過を用いて前記第二鉄有機酸溶液を濾過して、濾液を得る工程;(l)前記濾液をアセトンと混合して、クエン酸第二鉄を得る工程;(m)加圧濾過を用いてクエン酸第二鉄を分離する工程;(n)前記クエン酸第二鉄をアセトンで洗浄する工程;(o)加圧濾過を用いて前記洗浄したクエン酸第二鉄を分離する工程;(p)前記洗浄したクエン酸第二鉄を流動床乾燥機で乾燥する工程;および(q)前記有機揮発性不純物を≦1000ppmアセトンに維持する工程を含む。
【0012】
さらなる一実施形態は、医薬グレードのクエン酸第二鉄の製造に有用であり得る様々な中間組成物を包含する。本明細書に包含される中間組成物としては、固体、液体、または多相混合物が含まれる。医薬グレードのクエン酸第二鉄を含む液体の中間組成物は、水性組成物または有機溶媒系組成物であり得る。多相組成物は、水相と有機相の両方を含み得る。
【0013】
さらなる一実施形態は、本明細書に開示される様々な中間組成物の保管、パッケージング、および使用のための方法を包含する。
【0014】
さらなる一実施形態では、医薬グレードのクエン酸第二鉄を含む医薬上有用な組成物を提供する。該医薬上有用な組成物は、被験体もしくはヒト患者に、有効量の該医薬グレードのクエン酸第二鉄を投与するのに適した、任意の医薬上許容されうる担体、補助剤、増量剤、または送達ビヒクルをさらに含む。
【0015】
前記医薬組成物のさらなる実施形態としては、限定されるものではないが、固体、液体、または半固体形態(例えばゲル、シロップ、チュアブル、もしくはペースト)が含まれる。本明細書に開示される医薬上有用な組成物を使用する方法の範囲内に、前記医薬組成物を投与する時期および様式だけでなく、前記医薬組成物の有効な用量もある。
【0016】
前記医薬組成物を使用する方法の限定されない例は、被験体またはヒト患者において、リン酸塩の上昇した血中レベルによって生じる障害、すなわち、高リン酸血症(hyperphosphateimia)を治療することを包含する。かかる障害は、限定されるものではないが、腎不全または腎不全の進行、軟組織の鉱物化(mineralization)、副甲状腺機能亢進症、ならびに他の合併症により示される。
【0017】
本発明により包含される一実施形態は、
(a)被験体または患者の血清リン酸塩レベルの低下を達成させるのに有効な量の医薬グレードの第二鉄有機化合物と、
(b)医薬上好適な担体と
を含み、該第二鉄有機化合物が表Aの製造出荷時規格における制限の少なくとも1つに適合している医薬組成物を含む。
【0018】
本明細書に記載される医薬組成物は、図1、2、3、または4により示される方法により製造され得る。これらの実施形態に加えて、関連した表B〜Fのいずれかの各出荷時規格に開示される少なくとも1つの制限を満たす材料で製造された組成物がある。
【0019】
さらなる一実施形態は、
(a)適量の塩化第二鉄六水和物を水に溶解して、塩化第二鉄六水和物溶液を作る工程;
(b)適量のNaOHを水に溶解して、NaOH溶液を作る工程;
(c)前記塩化第二鉄六水和物溶液とNaOH溶液とを混合して、Fe(OH)3沈殿物を含む溶液を作る工程;
(d)Fe(OH)3沈殿物を含む前記溶液のpHを7.0より高く維持する工程;
(e)前記Fe(OH)3沈殿物を分離する工程;
(f)前記Fe(OH)3沈殿物を水で3回洗浄する工程;
(g)前記Fe(OH)3沈殿物を水に懸濁する工程;
(h)前記Fe(OH)3沈殿物にクエン酸を加えて、第二鉄-有機酸溶液を作る工程;
(i)前記第二鉄-有機酸溶液を90〜100℃で30〜120分間攪拌および加熱する工程;
(j)前記第二鉄-有機酸溶液中の固体を、クエン酸を加えることにより除去する工程;
(k)前記第二鉄-有機酸溶液を30℃より低くなるまで冷却する工程;
(l)前記第二鉄-有機酸溶液のpHを0.8〜1.5の間に維持する工程;
(m)前記第二鉄-有機酸溶液を濾過して、濾液を得る工程;
(n)アセトンと濾液とを混合して、クエン酸第二鉄を作る工程;
(o)クエン酸第二鉄を分離する工程;
(p)クエン酸第二鉄をアセトンで3回洗浄する工程;
(q)前記クエン酸第二鉄を乾燥する工程;
を含む方法に従って製造された医薬グレードのクエン酸第二鉄の組成物を包含する。
【0020】
前記製造方法をスケールアップすることが有利である。よって、産業規模の方法は、
(a)適当な反応装置内で適量のNaOHと塩化第二鉄六水和物とを混合して、水酸化第二鉄沈殿物を含む水酸化第二鉄スラリーを作る工程;
(b)前記水酸化第二鉄スラリーのpHを7.0より高く維持する工程;
(c)加圧濾過を用いて前記水酸化第二鉄スラリーから前記水酸化第二鉄沈殿物を分離する工程;
(d)前記水酸化第二鉄沈殿物を3回洗浄する工程;
(e)前記水酸化第二鉄沈殿物中の%Clを5%未満に維持する工程;
(f)加圧濾過を用いて前記洗浄した水酸化第二鉄沈殿物を分離する工程;
(g)洗浄した水酸化第二鉄沈殿物とクエン酸を混合して、第二鉄有機酸溶液を作る工程;
(h)前記第二鉄有機酸溶液の温度を80±5℃で2時間攪拌および維持する工程;
(i)前記第二鉄有機酸溶液を60℃まで冷却する工程;
(j)前記第二鉄有機酸溶液のpHを0.8〜1.5の間に、そして、前記第二鉄有機酸溶液中のFeの量を工程(a)で加えられたFeの≧85%に維持する工程;
(k)加圧濾過を用いて前記第二鉄有機酸溶液を濾過して、濾液を得る工程;
(l)前記濾液をアセトンと混合して、クエン酸第二鉄を得る工程;
(m)加圧濾過を用いてクエン酸第二鉄を分離する工程;
(n)前記クエン酸第二鉄をアセトンで洗浄する工程;
(o)加圧濾過を用いて前記洗浄したクエン酸第二鉄を分離する工程;
(p)前記洗浄したクエン酸第二鉄を流動床乾燥機で乾燥する工程;および
(q)前記有機揮発性不純物を≦1000ppmアセトンに維持する工程;
を含み、前記クエン酸第二鉄が表Aの製造出荷時規格における制限の少なくとも1つに適合している、医薬グレードのクエン酸第二鉄の大量生産のための方法により具体化される。
【0021】
医薬グレードのクエン酸第二鉄を含む前記組成物は、高リン酸血症、または高血清リン酸塩レベルを特徴とする他の障害を治療するのに適している。よって、本発明は、様々な腎疾患、例えば、末期腎疾患(ESRD)、慢性腎疾患(CKD)、もしくは他の関連腎疾患を有する被験体もしくは患者、または透析、限定されるものではないが、血液透析を受けている被験体および患者を治療することを包含する。
【0022】
もう1つの実施形態では、医薬グレードのクエン酸第二鉄を含む前記組成物は、代謝性アシドーシスを有する被験体または患者を治療するのにも用いることができる。クエン酸塩の重炭酸塩への変換により改善され得る他の障害もまた、記載の本発明に包含される。
【0023】
前記医薬組成物を使用する方法の一実施形態は、慢性腎疾患を有するヒトまたは非ヒト被験体または患者を治療することを包含する。慢性腎疾患は、一般に5つの臨床病期(1〜5の番号がつけられている)が存在し、その病期1は重篤度が最も低く、病期5は重篤度が最も高い。初期段階、例えば、病期1および2では、透析は必要でない。慢性腎疾患が病期5に進行するにつれて、患者は週3回の透析治療が必要になる可能性がある。注目すべきは、慢性腎疾患のすべての病期で高いリン酸塩レベルが観察されることである。よって、本発明の一実施形態は、初期または中期慢性腎疾患を有する被験体または人を、より低い血清リン酸塩レベルを実現させるために、医薬グレードのクエン酸第二鉄を含む組成物で治療する方法である。
【0024】
本発明のさらなる一実施形態は、後期慢性腎疾患を有する、血液透析を受けているヒトまたは非ヒト被験体または患者を、医薬グレードのクエン酸第二鉄を含む組成物を投与することにより治療する方法を提供することである。血液透析は血清リン酸塩レベルを低下させるのに十分に有効ではないことが知られている。後期腎疾患を有する被験体またはヒトの治療は、その被験体またはヒトが現在血液透析治療を受けているかどうかに関わらず、適用できる。
【0025】
本発明のさらなる一実施形態は、慢性腎疾患を有する、腹膜透析を受けている被験体またはヒトを医薬グレードのクエン酸第二鉄を含有する、記載されている組成物で治療する方法である。腹膜透析は血清リン酸塩レベルを低下させるのに十分に有効ではないことが知られている。
【0026】
さらなる一実施形態は、軟組織の鉱物化、具体的に言えば、石灰化を阻害(抑制)あるいは脱石灰化するために前記医薬組成物を使用する方法である。高リン酸血症では、遊離カルシウムと結合して不溶性のリン酸カルシウムを形成する可能性が増すことにより、硬組織および軟組織でのリン酸カルシウム沈着の増加が起こり得る。よって、医薬グレードのクエン酸第二鉄を含む組成物の有効用量は、血清リン酸塩レベルを低下させ得、それに応じたリン酸カルシウム沈着の減少ももたらし得る。
【0027】
第二鉄イオンが胃腸管(the gastroinstestinal tract)の内腔でリン酸塩含有化合物と不溶性沈殿物を形成する一方、そのクエン酸塩成分は吸収され、カルシウムキレート剤として働くということは注目に値するものである。キレートされたカルシウムはリン酸カルシウムの形成に利用されないことから、医薬グレードのクエン酸第二鉄を投与することで、血清カルシウムとリン酸塩の両方の減少をもたらし得る。これはまた、血清カルシウム-リン酸塩生成物の減少現象としても表され得る。血清カルシウムとリン酸塩を減少させることで、リン酸カルシウム沈着が減少すると予想された。最終結果は、沈着したリン酸カルシウムの脱沈着、すなわち、可溶化または溶解ということになる。
【0028】
石灰化した軟組織、例えば、眼の強膜の脱灰(decalcifying)は、医薬グレードのクエン酸第二鉄を投与することにより行い得る。関連医療分野における通常の技術を有するヒトの間では、クエン酸第二鉄の投与を受けている腎疾患患者が眼の脱カルシウム沈着を示したということが知られている。よって、本発明の一実施形態は、軟組織(眼など)の脱灰に向けられる。
【0029】
腎石は、シュウ酸のカルシウム塩またはリン酸塩を含み、上述のものと似た機構により形成される。そのようなことから、医薬グレードのクエン酸第二鉄は、本発明のもう1つの実施形態では、腎石、すなわち、腎臓結石を、それらの溶解を促進することにより治療する方法を提供する。
【0030】
医薬グレードのクエン酸第二鉄を含む前記組成物は、2つ以上の機構により作用し得る。有望な限定されない作用機序は、胃腸管内でリン酸塩と結合して、不溶性のリン酸第二鉄沈殿物を形成する第二鉄イオンによって起こり得る。これは、次には、胃腸管からのリン酸塩およびリン酸塩含有化合物の取込みの減少をもたらし得る。
【0031】
このような機構を考えれば、医薬グレードのクエン酸第二鉄を含む組成物の経口経路による投与は、記載される本発明の方法に包含される。
【0032】
本発明は、被験体の軟組織の石灰化を脱石灰化、予防、または安定化する方法であって、該被験体に有効量のクエン酸第二鉄化合物を投与することを含む方法を提供する。
【0033】
本発明は、被験体の軟組織の石灰化を脱石灰化、予防、または安定化する方法であって、該被験体に有効量のクエン酸第二鉄化合物を投与することを含み、該クエン酸第二鉄化合物が図1〜4に示される方法により製造される方法をさらに提供する。
【0034】
本発明は、被験体の軟組織の石灰化を脱石灰化、予防、または安定化する方法であって、該被験体に有効量のクエン酸第二鉄化合物を投与することを含み、該クエン酸第二鉄化合物が下記の工程を含む方法により製造される方法を提供する。
【0035】
本発明の一実施形態は、クエン酸第二鉄のカプセル剤の場合、許容量1日当たり最高15gまで、そして、クエン酸第二鉄の錠剤の場合、許容量1日当たり30gを包含する。
【0036】
医薬グレードのクエン酸第二鉄を含む前記組成物は、様々な期間投与し得る。いくつかの実施形態では、医薬グレードのクエン酸第二鉄を含む前記組成物の許容性により、必要に応じて長期投与が可能である。
【発明を実施するための最良の形態】
【0037】
発明の詳細な説明
図面では、本発明の特定の実施形態を例示するが、技術思想を制限するものと解釈してはならず、または本発明を不必要にあいまいにすることを避けるために詳細に記載すべきである。従って、明細書および図面は、限定的な意味ではなく、むしろ例示的な意味で扱うべきである。
【0038】
本願を通じて、米国薬局方(the United Stats Pharmacopeia)(USP)を参照し、最新版のUSPであるUSP 28は参照により本願にそのまま組み入れられる。
【0039】
本発明は、医薬グレードのクエン酸第二鉄の製造方法であって、
(a)適量の塩化第二鉄六水和物を水に溶解して、塩化第二鉄六水和物溶液を作る工程;(b)適量のNaOHを水に溶解して、NaOH溶液を作る工程;(c)前記塩化第二鉄六水和物溶液とNaOH溶液とを混合して、Fe(OH)3沈殿物を含む溶液を作る工程;(d)Fe(OH)3沈殿物を含む前記溶液のpHを7.0より高く維持する工程;(e)前記Fe(OH)3沈殿物を分離する工程;(f)前記Fe(OH)3沈殿物を水で3回洗浄する工程;(g)前記Fe(OH)3沈殿物を水に懸濁する工程;(h)前記Fe(OH)3沈殿物にクエン酸を加えて、第二鉄-有機酸溶液を作る工程;(i)前記第二鉄-有機酸溶液を90〜100℃で30〜120分間攪拌および加熱する工程;(j)前記第二鉄-有機酸溶液中の固体を、クエン酸を加えることにより除去する工程;(k)前記第二鉄-有機酸溶液を30℃より低くなるまで冷却する工程;(1)前記第二鉄-有機酸溶液のpHを0.8〜1.5の間に維持する工程;(m)前記第二鉄-有機酸溶液を濾過して、濾液を得る工程;(n)アセトンと濾液とを混合して、クエン酸第二鉄を作る工程;(o)クエン酸第二鉄を分離する工程;(p)クエン酸第二鉄をアセトンで3回洗浄する工程;および(q)前記クエン酸第二鉄を乾燥する工程
を含む方法を提供する。
【0040】
本発明は、医薬グレードのクエン酸第二鉄のスケールアップ可能な生産または大規模生産のための方法であって、
(a)適当な反応装置内で適量のNaOHと塩化第二鉄六水和物とを混合して、水酸化第二鉄沈殿物を含む水酸化第二鉄スラリーを作る工程;(b)前記水酸化第二鉄スラリーのpHを7.0より高く維持する工程;(c)加圧濾過を用いて前記水酸化第二鉄スラリーから前記水酸化第二鉄沈殿物を分離する工程;(d)前記水酸化第二鉄沈殿物を3回洗浄する工程;(e)前記水酸化第二鉄沈殿物中の%Clを5%未満に維持する工程;(f)加圧濾過を用いて前記洗浄した水酸化第二鉄沈殿物を分離する工程;(g)洗浄した水酸化第二鉄沈殿物とクエン酸を混合して、第二鉄有機酸溶液を作る工程;(h)前記第二鉄有機酸溶液の温度を80±5℃で2時間攪拌および維持する工程;(i)前記第二鉄有機酸溶液を60℃まで冷却する工程;(j)前記第二鉄有機酸溶液のpHを0.8〜1.5の間に、そして、前記第二鉄有機酸溶液中のFeの量を工程(a)で加えられたFeの≧85%に維持する工程;(k)加圧濾過を用いて前記第二鉄有機酸溶液を濾過して、濾液を得る工程;(1)前記濾液をアセトンと混合して、クエン酸第二鉄を得る工程;(m)加圧濾過を用いてクエン酸第二鉄を分離する工程;(n)前記クエン酸第二鉄をアセトンで洗浄する工程;(o)加圧濾過を用いて前記洗浄したクエン酸第二鉄を分離する工程;(p)前記洗浄したクエン酸第二鉄を流動床乾燥機で乾燥する工程;および(q)前記有機揮発性不純物を≦1000ppmアセトンに維持する工程
を含む方法を提供する。
【0041】
一実施形態では、前記塩化第二鉄六水和物は、表Bに示される出荷時規格に適合しており;前記クエン酸は、表Fに示される出荷時規格に適合しており;前記水は、表Dに示される出荷時規格に適合しており;前記アセトンは、表Eに示される出荷時規格に適合しており;そして、前記水酸化ナトリウムは、表Cに示される出荷時規格に適合している。
【0042】
もう1つの実施形態では、前記クエン酸第二鉄は、流動床乾燥機を用いて乾燥されるか、または真空乾燥される。
【0043】
さらなる一実施形態では、上述の方法は、前記クエン酸第二鉄を、表Aに示される出荷時規格のコンプライアンス(法令遵守)について試験することをさらに含む。さらなる一実施形態では、前記試験は、クエン酸第二鉄およびクエン酸第二鉄一水和物の含有物純度分析;クエン酸の含量分析;検出可能なクエン酸第二鉄関連物質の含量分析;第二鉄イオンの含量分析;元素鉄不純物試験;第一鉄制限量試験;乾燥減量試験;水和試験(示差走査熱量測定法による水分含量);水和試験(カールフィッシャー滴定法による水分含量);微量または重金属試験(As、Ca、Cd、Cu、Fe、Hg、Na、Pb、Sr、Zn);シュウ酸制限量試験;第二鉄塩についての同定A試験;FTIRによる同定B試験;不溶性物質試験;アンモニウム制限量試験;塩化物制限量試験;硝酸塩制限量試験;酒石酸塩制限量試験;強熱残分試験;有機揮発性不純物試験;ならびに微生物、カビおよび酵母試験からなる群から選択される少なくとも1つの試験を実施することを含む。
【0044】
本発明は、上述の方法に従って製造された医薬グレードのクエン酸第二鉄を提供する。
【0045】
本発明は、高リン酸血症または代謝性アシドーシスを治療するための、上述の方法に従って製造された前記クエン酸第二鉄を含む組成物を提供する。
【0046】
本発明は、第二鉄有機化合物療法が奏功する障害を治療するための、上述の方法に従って製造された組成物を提供する。
【0047】
本発明は、NMR分光分析にかけると、図6に示されるようなピークが生じる、上述の方法に従って製造された医薬グレードのクエン酸第二鉄を提供する。
【0048】
本発明は、図8に示されるような溶解速度を有する、上述の方法に従って製造された医薬グレードのクエン酸第二鉄を提供する。
【0049】
本発明は、フーリエ変換赤外分光法(FTIR)によるスペクトル分析にかけると、図7に示されるようなスペクトルデータが生じる、上述の方法に従って製造された医薬グレードのクエン酸第二鉄を提供する。
【0050】
本発明は、高リン酸血症または代謝性アシドーシスを治療するための、上述のクエン酸第二鉄を含む組成物を提供する。
【0051】
本発明は、第二鉄有機化合物療法が奏功する障害を治療するための、上述の第二鉄酸を含む組成物を提供する。
【0052】
本発明は、図1〜4に示される工程を含むプロセスにより製造された医薬グレードのクエン酸第二鉄を提供する。
【0053】
本発明の医薬グレードのクエン酸第二鉄は、高リン酸血症、代謝性アシドーシス、または第二鉄有機化合物療法が奏功する障害に罹患している被験体の治療に有用である。一実施形態では、前記被験体はヒトである。
【0054】
また、本発明は、次の用途:
(a)高リン酸血症の治療;
(b)透析患者の死亡率の減少;
(c)代謝性アシドーシスの治療;
(d)リン酸カルシウム沈着の阻害;
(e)血清カルシウム-リン(リン酸塩)生成物([Ca]x[P])の減少
(f)血清カルシウムレベルの低下;
(g)軟組織の脱石灰化;および
(h)腎石溶解の支援
のうちの1以上の用途に有効な医薬グレードのクエン酸第二鉄を含む組成物の使用も提供する。
【0055】
前記使用は、カルシウムイオンおよびリン酸イオンの血清レベルを低下させることに少なくとも部分的に依存することをさらに包含し得る。
【0056】
上述の使用は、軟組織(血管または眼など)に適用し得る。
【0057】
上述の使用は、長期にわたって投与することにより行われ得る。
【0058】
本発明は、前記組成物が化学薬品グレードのクエン酸第二鉄を含有した場合と比べて、伴われる有害な胃腸管副作用がより少ない上述の使用の実現を可能にする。
【0059】
上述の使用によれば、本発明は、高血清リン酸塩レベルを特徴とする障害を治療するための方法であって、有効量の医薬グレードのクエン酸第二鉄を含む組成物を投与することを含む方法を提供する。
【0060】
本発明はまた、有効量の医薬グレードのクエン酸第二鉄が錠剤、粉末剤、懸濁液、エマルション、カプセル剤、ドロップ剤、顆粒剤、トローチ剤、丸剤、液剤、スピリット、またはシロップ剤の形態で投与される方法も提供する。
【0061】
本発明はまた、前記有効量の医薬グレードのクエン酸第二鉄が1日当たり2〜100g、好ましくは、1日当たり4〜60gである方法も提供する。
【0062】
いくつかの実施形態では、前記方法、1日の有効量2g、4g、6g、または8gを提供し得る。
【0063】
一般に、高リン酸血症は、慢性腎不全を有する患者および透析を受けている患者の間で高い有病率である。また、血清リンレベル、カルシウム-リン生成物(CaxP)レベル、および副甲状腺ホルモン(PTH)レベルの上昇は、腎疾患患者における血管、内臓、末梢血管、および軟組織の石灰化の発生増加の一因となるという証拠もある。
【0064】
このようなことから、請求する発明のさらなる新規特徴は、腎疾患患者または健常者における石灰化を予防または脱石灰化(reverse)することである。例えば、腎不全に伴って起こる可能性がある腎石の溶解である。
【0065】
リン(Phosphorous)は、CaxPに直接関与することにより血管の石灰化に悪影響を及ぼし、そして甲状腺機能亢進症の発症および進行には間接的に悪影響を及ぼす。血清カルシウムおよびリンは、通常の状況では準安定であり、これは、それらの濃度は自然沈降が起こるには十分でないということを意味する。しかしながら、一度石灰化プロセスが始まると、結晶の増加を支援するのにそれらの濃度は十分である。
【0066】
入手可能な証拠により、重症慢性腎不全を有する患者における基礎的血管疾患および構造的心疾患の有病率が高いことは裏付けられる。これらの構造的病変は、さらに、増加した血清リン、CaxP、およびPTH(1)にさらされる。
【0067】
血清リンおよびCaxP増加の一因となる可能性があると考えられる要因には、カルシウム含有リン結合剤の投与が含まれる。そのようなカルシウム含有リン結合剤、例えば、酢酸カルシウムは、多くの新しい血液透析(HD)患者や腹膜透析(PD)患者に処方されており、そのため、多量の外因性カルシウムが胃腸管に供給される。
【0068】
石灰化は、腎疾患患者だけにとどまらず、40歳を超えた人では誰でも起こり得る。米国における主な死亡原因は、急性心筋梗塞および卒中であるが、高コレステロール血症が原因となったこのカテゴリーでの死者はほんの15%であり、85%の原因は心室の石灰化である。
【0069】
血清リン、CaxP、およびPTHレベルの異常が血管、内臓、および/または軟組織の石灰化を引き起こし得ることは示されている。例えば、心筋、冠動脈、角膜の石灰化は、心筋虚血、心筋梗塞、心筋機能障害、鬱血性心不全、心弁不全症、および失明を含む数多くの臨床的に重大な合併症の発生をもたらす可能性がある。
【0070】
よって、多くの内科的障害を治療する手段として、血清リンを管理または低減する方法が必要である。この方法は、血清カルシウムレベルに悪影響を与えず、かつその患者において毒性のある副作用を引き起こさない、リン酸塩結合剤を投与することを含む。
【実施例】
【0071】
実施例では、本発明の実施形態(具体例)を例示することを目的としているが、本発明の範囲を制限することを意図するものではない。
【0072】
実施例1. 医薬グレードのクエン酸第二鉄の一般的な合成方法
本発明の医薬グレードのクエン酸第二鉄の一般的な合成方法を示す図1を参照しながら、この図でのフローチャートは、最終クエン酸第二鉄製品が、表Aに示される製造出荷時規格、または承認を受けているか、もしくはヒトに用いるのに適した医薬グレードのクエン酸第二鉄についての任意の設定された製造出荷時規格に確実に適合するようにするための、該合成プロセスの選択された段階における品質管理規準の実施を示す。他の品質管理規準または手順は、当業者ならば容易に理解でき、それらの手段または手順を用いて、または医薬グレードの該合成プロセスに組み込んで、最終製品の品質および純度を維持することができ、そして該合成プロセスの効率および収率を高めることができる。例えば、図1のQC10およびQC11参照。
【0073】
該合成プロセスに使用される品質管理規準の例は、(QC4)水酸化第二鉄スラリーのpHを7.0より高く維持すること;(QC5)水酸化第二鉄沈殿物中の%Clを5%未満に維持すること;(QC7)クエン酸を水酸化第二鉄沈殿物に加えた後に、混合物のpHを0.8〜1.5の間に、そして、混合物中のFeを、加えられたFe総量の≧85%に維持すること;および(QC9)乾燥段階中に、アセトンのレベルを≦1OOOppmに維持することを含む。
【0074】
一実施形態では、前記原材料、すなわち、塩化第二鉄、脱イオン水、クエン酸、アセトン、水酸化ナトリウムは、表B〜Fで提供されているものなどの出荷時規格に合格しなければならず、それらの原材料は合格して初めて該合成プロセスに用いることができる。図1、QC1〜QC3、QC6、およびQC8参照。
【0075】
実施例1A. 医薬グレードの第二鉄有機化合物の一般的な合成方法
本発明の医薬グレードの第二鉄有機化合物の一般的な合成方法を示す図10に関して、この図でのフローチャートは、最終クエン酸第二鉄製品が、承認を受けているか、もしくはヒトに用いるのに適した医薬グレードの第二鉄有機化合物についての設定された製造出荷時規格に確実に適合するようにするための、該合成プロセスの選択された段階における品質管理規準の実施を示す。他の品質管理規準または手順は、当業者ならば容易に理解でき、それらの規準または手順を用いて、または医薬グレードの該合成プロセスに組み込んで、最終製品の品質および純度を維持することができ、そして該合成プロセスの効率および収率を高めることができる。例えば、図10のQC10AおよびQC11A参照。
【0076】
前記合成プロセスに使用される品質管理規準の例は、(QC4A)水酸化第二鉄スラリーのpHを7.0より高く維持すること;(QC5A)水酸化第二鉄沈殿物中の%Clを5%未満に維持すること;(QC7A)有機酸を水酸化第二鉄沈殿物に加えた後に、混合物のpHを0.8〜1.5の間に、そして、混合物中のFeを、加えられたFe総量の≧85%に維持すること;および(QC9A)乾燥段階中に、有機溶媒のレベルを≦1000ppmに維持することを含む。
【0077】
一実施形態では、前記原材料、すなわち、第二鉄塩、脱イオン水、有機酸、有機溶媒、アルカリ金属水酸化物は、出荷時規格に合格しなければならず、それらの原材料は合格して初めて該合成プロセスに用いることができる。図1、QC1A〜QC3A、QC6A、およびQC8A参照。前記有機酸は、クエン酸、酢酸、イソクエン酸、コハク酸、フマル酸、酒石酸、または任意の他の好適な有機酸を含み得る。前記有機溶媒は、エタノール、メタノール、ブタノール、アセトン、イソプロピルアルコール、テトラヒドロフラン、または任意の他の好適な有機溶媒を含み得る。
【0078】
実施例2. 本発明の第二鉄有機化合物の溶解プロフィール
上述の方法により作り出された第二鉄有機化合物は、より広範囲のpHレベルにわたって、市販の第二鉄有機化合物より溶解度が高い。本発明の第二鉄有機化合物の溶解度のこのような増加は、本発明の第二鉄有機化合物の活性表面積が独特に著しく大きいことによるものと思われる。例えば、pH8.0では、本発明のクエン酸第二鉄の固有溶解速度は、市販のクエン酸第二鉄より3.08倍高い。表1参照。
【0079】
市販のクエン酸第二鉄の固有溶解速度を、本発明のクエン酸第二鉄と比較した。固有溶解速度は、一定表面積の条件下での純物質の溶解速度として定義される。製剤原料の溶解速度およびバイオアベイラビリティ(生物利用性)は、その物性、すなわち、結晶性、非晶性、多形、水和、溶媒和、粒径、および粒子表面積により影響を受ける。固有溶解速度の測定値は、これらの物性に依存し、一般に、一定温度、攪拌速度、およびpHを維持しながら、一定表面積の材料を適当な溶解媒質にさらすことにより決定される。固有溶解速度を表1に示している。
【表1】

【0080】
例えば、本発明のクエン酸第二鉄のBET活性表面積は、市販のクエン酸第二鉄より少なくとも16倍大きい。表2参照。
【0081】
活性表面積の分析はBET理論に基づいており、このBET理論は固体表面上および孔空間内へのガス吸着中の質量およびエネルギーの相互作用と相変化の現象を記載したものである。BET活性表面積測定では、ガスの単層の体積が決定され、それにより、吸着ガス分子の単層によって占められる面積を用いてサンプルの表面積を決定することが可能になる。表4は、本発明のクエン酸第二鉄の活性表面積と、市販のクエン酸第二鉄化合物の活性表面積との比較である。
【表2】

【0082】
実施例3. 障害の治療における本発明の第二鉄有機化合物の使用
上述の方法により作製された第二鉄有機化合物は、高リン酸血症、代謝性アシドーシス、および第二鉄有機化合物療法が奏功する任意の他の障害の治療において有用である。本発明の第二鉄有機化合物は市販の第二鉄有機化合物より溶解度が大きいため、より少ない量の本発明の第二鉄有機化合物を用いて、そのような障害に罹患している患者を効果的に治療することができる。
【0083】
水溶解度の向上は、第二鉄有機化合物療法が奏功する障害の治療における本発明の第二鉄有機化合物の使用に特に関わりがある。本発明の第二鉄有機化合物は溶解度が大きいことから、経口服用する場合にはより効果的であり、そのため、より低い用量で服用することができる。本発明の第二鉄有機化合物は、より広いpH範囲にわたって、市販の第二鉄有機化合物より溶解度が大きい。そのため、本発明の第二鉄有機化合物は、小腸で溶解することにより、より効果的であり得る。
【0084】
例えば、小腸内でアルカリ性条件をシミュレートする試験では、本発明のクエン酸第二鉄は、市販のクエン酸第二鉄より有利な溶解速度を示した。本発明のクエン酸第二鉄は、小腸でより溶解度が大きいことにより、より効果的であり得ることが示唆される。表1参照。結果として、患者は、副作用の発生率が低い、より低い用量の医薬を服用することができる。
【0085】
本発明の一実施形態では、本発明のクエン酸第二鉄は、生理学的条件下での水溶解速度が市販の形態のクエン酸第二鉄よりはるかに高く、そのため、本発明のクエン酸第二鉄は、クエン酸第二鉄の減量した用量での経口的有効使用により大きな改善を提供すると考えられる。クエン酸第二鉄の経口有効量を低減することで、本発明のクエン酸第二鉄では、市販のクエン酸第二鉄化合物に関連する潰瘍性胃腸管副作用の発生率が低くなると考えられる。加えて、本発明のクエン酸第二鉄の溶解速度の増大は、食事リン酸塩との結合に関する作用のより速やかな発現ももたらすと考えられる。
【0086】
本発明の第二鉄有機化合物は、経口投与可能な形態を含む数多くの形態で投与することができ、そのような形態は、本発明の第二鉄有機化合物単独、または医薬上許容される担体との組合せを含み得る。経口投与可能な形態には、限定されるものではないが、錠剤、粉末剤、懸濁液、エマルション、カプセル剤、顆粒剤、トローチ剤、丸剤、液剤、スピリット、またはシロップ剤が含まれる。この組成物は、第二鉄有機化合物療法が奏功する病気に罹患しているヒトまたは他の動物に投与することができる。
【0087】
実施例4. 医薬グレードのクエン酸第二鉄の作製方法
本発明では、ヒトに用いる活性医薬品成分として適した医薬グレードのクエン酸第二鉄を製造するための方法を記載している。クエン酸第二鉄製造フローチャートの概略は図1に示している。具体例では、下記手順を用いて医薬グレードのクエン酸第二鉄を作製した。図2も参照のこと。
【0088】
4.1. 塩化第二鉄溶液の調製
・1Lビーカーに塩化第二鉄六水和物550gを秤量する(CoA純度を補正する)。
【0089】
・その塩化第二鉄六水和物を4Lエルレンマイヤーフラスコに移す。
【0090】
・メスシリンダーを用いて脱イオン水1.1Lを量る。その脱イオン水の少量を用いて、ビーカーをすすぎ、その水を前記4Lエルレンマイヤーフラスコに移す。残りの水をそのエルレンマイヤーフラスコに移す。
【0091】
・完全に溶解するまで磁気攪拌子を用いて溶液を攪拌する。その溶液は暗黄色〜暗褐色である。
【0092】
4.2. 水酸化ナトリウム溶液の調製
・500mLビーカーに水酸化ナトリウム244gを秤量する(CoA純度を補正する)。
【0093】
・その水酸化ナトリウムを2Lエルレンマイヤーフラスコに移す。
【0094】
・メスシリンダーを用いて脱イオン水1.1Lを量る。その脱イオン水の少量を用いて、ビーカーをすすぎ、その水を4Lエルレンマイヤーフラスコに移す。残りの水をそのエルレンマイヤーフラスコにゆっくりと移す。
【0095】
・ヒュームフード内で、前記水を加えながら、攪拌子を用いてその溶液を攪拌し、完全に溶解するまで攪拌する。その溶液は無色透明である。
【0096】
・水浴を用いて溶液を30℃より低くなるまで冷却する。
【0097】
4.3. 水酸化第二鉄中間体の調製
・前記塩化第二鉄溶液中に磁気攪拌子を入れ、そのフラスコを水浴に入れる。攪拌プレート上に置き、その攪拌プレートを低速で開始する。
【0098】
・滴下漏斗を用いて前記水酸化ナトリウム溶液を前記塩化第二鉄溶液にゆっくりと(20ml/分未満の速度で)加え、水浴および水酸化ナトリウムの添加速度を用いて、その反応混合物の温度を40℃より低く制御する。
【0099】
・水浴を用いて褐色の粘性混合物を30℃より低くなるまで冷却し続ける。
【0100】
・最終pHは7を超えているはずであるが、もし7以下である場合には、適量の5M水酸化ナトリウム水溶液を用いて、そのpHを補正する。その最終pHを測定し、記録する。水酸化第二鉄の暗褐色沈殿物が形成される。
【0101】
・必要に応じて、冷水浴を用いて前記褐色粘性混合物を30℃より低くなるまで冷却し、その水酸化第二鉄懸濁液を1mmサイズのステンレス鋼フィルターで濾過して、大きな沈殿物を細かくする。
【0102】
・等量の水酸化第二鉄懸濁液を4つの500mL遠心容器に移す。遠心分離の前に電子はかりを用いて各遠心容器の重量を釣り合わせる。
【0103】
・その水酸化第二鉄懸濁液を1500rpm、25+5℃で5分間遠心分離する。その上清を廃棄する。
【0104】
・メスシリンダーを用いて脱イオン水2.5Lを量り、およそ1Lの水を用いて、前記遠心容器の水酸化第二鉄沈殿物を再懸濁する。
【0105】
・その水酸化第二鉄懸濁液を、ガラス漏斗上に1mmサイズのステンレス鋼フィルターを取り付けた4Lエルレンマイヤーフラスコに移す。残る1.5Lの脱イオン水を用いて、容器をすすぎ、ステンレス鋼フィルター上に残った沈殿物を洗浄する。
【0106】
・「等量の...移す。」から始まる工程を繰り返すことにより、その沈殿物をあと2回洗浄する。
【0107】
・3回目の洗浄の後、「等量の...移す。」から始まり、「その水酸化第二鉄懸濁液を...遠心分離する。」で終わる工程を繰り返すことにより、その沈殿物を回収する。
【0108】
・その沈殿物を脱イオン水150mLに再懸濁する。
【0109】
4.4. クエン酸第二鉄の調製
・前記水酸化第二鉄沈殿物を2Lエルレンマイヤーフラスコ内で機械的攪拌装置を用いて5分間ホモジナイズする。
【0110】
・500mLビーカーにクエン酸490gを秤量する(CoA純度を補正する)。
【0111】
・油浴に入れた2Lエルレンマイヤーフラスコに攪拌子を入れ、高速で攪拌する。
【0112】
・その水酸化第二鉄懸濁液にクエン酸を加える。
【0113】
・その溶液を30分間攪拌する。
【0114】
・その混合物を、その色が橙褐色から透明黒褐色に変わるまで(30〜120分間)または水酸化第二鉄沈殿物が溶解するまで、90〜100℃(油浴中)に加熱する。
【0115】
・1mLアリコートの反応混合物を6mLガラス試験管に取り、1500rpm、25+5℃で5分間遠心分離する。沈殿物が観察されなければ、次の工程に進む。いくらかの沈殿物が観察される場合には、その混合物にクエン酸10〜34gを加え、10〜30分間加熱を続ける。
【0116】
・その加熱を終わらせ、その混合物を30℃より低くなるまで冷却する。その反応混合物のpHを測定する;その反応混合物はpH0.8〜1.5であるはずである。
【0117】
・等量の反応混合物を4つの500mL遠心容器に移し、電子はかりを用いて各容器の重量を釣り合わせる。
【0118】
・その反応混合物を1500rpm、25±5℃で5分間遠心分離する。すべてのクエン酸第二鉄上清を清浄な4Lエルレンマイヤーフラスコに移し、プールする。
【0119】
・そのクエン酸第二鉄反応混合物のすべてに対して、前の2つの工程を繰り返す。
【0120】
・前記クエン酸第二鉄上清の半分を4Lエルレンマイヤーフラスコに入れ、磁気攪拌子を用いて高速で攪拌する。
【0121】
・アセトン3.5L(上清量の5倍として算出される正確な量のアセトン)をゆっくりと(20分かけて)加え、さらに10分攪拌する。ライトベージュ色の沈殿物が形成する。
【0122】
・その懸濁液を4つの500mL遠心容器に移し、電子はかりを用いて各容器の重量を釣り合わせる。
【0123】
・そのクエン酸第二鉄懸濁液を1500rpm、25+5℃で5分間遠心分離する。
【0124】
・すべてのクエン酸第二鉄沈殿物を清浄な4Lエルレンマイヤーフラスコに移し、プールする。
【0125】
・前記クエン酸第二鉄上清のさらに半分を用いて、前の4つの工程を繰り返す。
【0126】
・すべてのクエン酸第二鉄沈殿物をプールし、アセトン1.4Lを加え、5分間攪拌する。
【0127】
・その懸濁液を4つの500mL遠心容器に移し、電子はかりを用いて各容器の重量を釣り合わせる。
【0128】
・その懸濁液を1500rpm、25+5℃で5分間遠心分離する。
【0129】
・すべての懸濁液を遠心分離するまで、前の2つの工程を繰り返す。
【0130】
・すべてのクエン酸第二鉄沈殿物を清浄な4Lエルレンマイヤーフラスコに移し、プールする。
【0131】
・前の5つの工程をさらに2回を繰り返す(合計3回の洗浄)。
【0132】
・乾燥トレイにラベルを付け、秤量し、それらの重量を記録する。
【0133】
・前記クエン酸第二鉄沈殿物をその乾燥皿に載せ、周囲温度(25+5℃)で16時間乾燥する。
【0134】
・沈殿物が入った状態の乾燥トレイを真空炉に入れ、周囲温度(25+5℃)、真空下(約20mmHg)で8〜16時間乾燥させる(その材料が粉砕可能な状態になったと思われるまで)。
【0135】
・そのクエン酸第二鉄の粒径を磁器製の乳棒と乳鉢で小さくする。
【0136】
・そのクエン酸第二鉄粉末を真空炉に入れ、その材料が篩過可能な状態になったと思われるまで、周囲温度(25+5℃)、真空下(約20mmHg)で8〜24時間乾燥する。
【0137】
・そのクエン酸第二鉄の粒径を磁器製の乳棒と乳鉢で微細にする。そのクエン酸第二鉄粉末を、45メッシュサイズ(355μm)の篩を通して選別する。
【0138】
・そのクエン酸第二鉄粉末を乾燥トレイに移し、そのトレイを炉に入れて、25+5℃、真空下で、その材料が乾燥したと思われるまで乾燥させる(20〜48時間)。
【0139】
・予め秤量したプラスチック製琥珀色容器にその粉末を移す。
【0140】
・その容器にラベルを付け、周囲温度で光から守られた状態で保存する。
【0141】
実施例5. 医薬グレードのクエン酸第二鉄のスケールアップ可能な製造のための方法
本発明は、医薬グレードのクエン酸第二鉄のスケールアップ可能な製造を提供する。該クエン酸第二鉄製造法は、少なくとも125kgバッチの医薬グレードのクエン酸第二鉄を作り出すことができることが好ましい。クエン酸第二鉄製造の概略は図3に示している。クエン酸第二鉄合成の詳細は図4に示している。
【0142】
該スケールアップ可能な製造プロセスは、湿潤クエン酸第二鉄を乾燥するため、そして、有機揮発性不純物についての出荷時規格を達成するために流動床乾燥機をさらに使用する。医薬グレードのクエン酸第二鉄についての製造出荷時規格に関する表A参照。
【0143】
実施例6. 医薬グレードのクエン酸第二鉄
本発明は、以下で表Aに示される製造出荷時規格に適合している医薬グレードのクエン酸第二鉄を提供する。一貫した純度および品質の医薬グレードのクエン酸第二鉄は、本発明の製造プロセスを用いて調製することができる。クエン酸第二鉄製造および品質管理のプロセスの模式図に関する図1〜4参照。クエン酸第二鉄製造および品質管理のプロセスは、マルチキログラムバッチサイズを生産するように容易にスケールアップすることができ、また製造規模にスケールアップすることができる。
【表3】

【0144】

【0145】
実施例7. 原材料の出荷時検査規格
【表4】

【表5】

【表6】

【表7】

【表8】

【0146】
実施例8. 最終製品の製造出荷時検査方法
本発明の方法またはプロセスによって作製された最終クエン酸第二鉄製品が、表Aに示された設定された製造出荷時規格に確実に適合するようにするために、次の検査を実施する。この製造出荷時規格は、ヒトに用いる医薬グレードのクエン酸第二鉄の純度および安全性を高めるために、当業者ならば本発明の教示に従って容易に変更または修正し得る。
【0147】
(a)USP 25 <191> フェリシアン化カリウムを用いた重量測定法, p. 1918に基づく-クエン酸第二鉄における第一鉄の制限量(limit)
(b)USP 25, 硫酸第二鉄アッセイ, p. 728に基づく-クエン酸第二鉄における塩化物の制限量
(c)USP 25, 硫酸第二鉄アッセイ, p. 728に基づく-クエン酸第二鉄における酸不溶性物質の制限量
(d)USP 25, 硫酸第二鉄アッセイ, p. 728に基づく-クエン酸第二鉄における第二鉄の分析含量
(e)USP 25 <467>に基づく-GClFIDヘッドスペースによるクエン酸第二鉄サンプルにおけるアセトンの測定
(f)USP 25 <191>, 第二鉄塩;クエン酸塩, p. 1918に基づく-クエン酸第二鉄の同定
(g)USP 25 <621>, p. 1988-1995、<731>、<1086>, p. 2157-2159、<736>, p. 2029-2033に基づく-クエン酸第二鉄および関連物質のLCMS フローインジェクション定量およびプロフィール
(h)USP 25 <731> 乾燥減量
(i)USP 25 <921> 水分測定、方法Ia(直接滴定)
(j)Zn、Cu、Sr、Ca、Na、および全鉄についてのICP
(k)AsについてのGFAAS
(1)鉛およびカドミウムについてのICP-MS
(m)水銀についての低温蒸気/AA
(n)強熱残分
(o)微生物/カビおよび酵母
実施例9. 患者におけるin vivoでの医薬グレードのクエン酸第二鉄の使用方法および検査方法
A. 試験組成物の取り扱いおよび形態
クエン酸第二鉄は500mgカプセルで供給されるが、そのプラシーボは(活性薬剤を含有するものと区別ができない)同一に見えるカプセルで与える;このプラシーボカプセル剤は、ソルビトールと、活性カプセル剤の粉末の色と一致させるための着色剤を含む。このプラシーボカプセル剤のシェルは、活性カプセル剤のシェルと同一にする。
【0148】
保存
すべての試験薬供給品は、安定した状態で保存しなければならず、試験薬の容器に示されたそれらの使用期限を過ぎて使用してはならない。これらの試験薬は、遮光されたしっかり閉まる容器に管理された状態(15〜30℃;59〜86°F)で保存されるべきである。
【0149】
投薬量
最近の予備的研究では、末期腎疾患(ESRD)患者における血清PO4の減少について、クエン酸第二鉄(1日3g)と炭酸カルシウム(1日3g)を比較した。クエン酸第二鉄は血清P04の大幅な減少をもたらしたが、炭酸カルシウムほどの効果はなかった。この用量のクエン酸第二鉄で軽度の我慢できる胃腸管症状を伴った。
【0150】
図12および13に示されるように、医薬グレードのクエン酸第二鉄を用いた治療は、化学薬品グレードのクエン酸第二鉄よりも優れたいくつかの利点を与える。一般に、医薬グレードのクエン酸第二鉄は、化学薬品グレードのクエン酸第二鉄のものとほぼ同等の有効性を示す一方で、化学薬品グレードのクエン酸第二鉄よりも少ない有害な副作用でこの結果を実現する。
【0151】
また、図12は、医薬グレードのクエン酸第二鉄の投与に伴う有害な副作用がそのプラシーボに関するものと統計的には差はなかったということも示している。この安全性プロフィールの利点は、個々の患者が、副作用をあまり心配せずに、広範囲の用量にわたって漸増された医薬グレードのクエン酸第二鉄の投薬を受けることができるということである。このように、個々の患者の治療を、患者の特定のニーズや耐性に合うように合わせることができる。
【0152】
研究または治療のために選択されるクエン酸第二鉄の用量は1日当たりクエン酸第二鉄1〜30gであり得る。これは、ある程度、提供される製剤の性質に依存し得る。例えば、クエン酸第二鉄のカプセル剤は、1日用量約15g/日まで投与し得るが、一方、その錠剤形態は30g/日まで投与し得る。このように、本発明により包含される極めて広い範囲の投与計画が存在する。
【0153】
被験体の最適用量の滴定
本発明に関連して、用語「被験体」とは、ヒトまたは非ヒト動物のいずれかを指す。
【0154】
各被験体または群の最適用量は以下のとおり決定し得る。1日当たりおよそ1gまたは2gという用量は、単に例示的な開始用量として示しただけである。1日用量は、所望の結果が認められるまで必要に応じて増量してよい。
【0155】
本発明の意図は、使用される用量範囲を制限しないことである。そのため、投与される1日用量は、被験体に応じて、1日当たり30g、40g、50g、60g、70g、80g、90g、または100gと概算し得る。広範囲の用量の実施が医薬グレードのクエン酸第二鉄の安全性プロフィールにより可能となる。
【0156】
さらに、本発明の意図は、経口製剤としてのカプセル剤および錠剤に限定されないことである。様々な経口製剤が本発明での使用に適している可能性があることは当技術分野で公知である。
【0157】
投与計画の例示的具体例
投与計画の限定されない例を以下に示す。これは、クエン酸第二鉄の有効量を選択する方法、またはそれが提供される形態、またはその組成物の1日当たりの投与回数に関して本発明を限定するためのものではない。以下は、クエン酸第二鉄とプラシーボを、例えば、同一の外観を持つ500mgカプセル剤として投与する方法を単に例示するものである。すべての患者は、毎日三度の食事とともに毎度4つのカプセル剤を28日間(盲検法で)受ける。患者は、食事(朝食、昼食、および夕食)後10分間以内に試験薬を服用するように指示される。
【0158】
毎食時に服用するプラシーボカプセル剤の数と活性カプセル剤の数は以下のとおりである:
本研究のプラシーボアーム:
朝食時、プラシーボカプセル剤4つ
昼食時、プラシーボカプセル剤4つ
夕食時、プラシーボカプセル剤4つ
本研究のクエン酸第二鉄1日当たり2gアーム:
朝食時、クエン酸第二鉄カプセル剤1つとプラシーボカプセル剤3つ
昼食時、クエン酸第二鉄カプセル剤1つとプラシーボカプセル剤3つ
夕食時、クエン酸第二鉄カプセル剤2つとプラシーボカプセル剤2つ
クエン酸第二鉄1日当たり4gアーム:
朝食時、クエン酸第二鉄カプセル剤2つとプラシーボカプセル剤2つ
昼食時、クエン酸第二鉄カプセル剤3つとプラシーボカプセル剤1つ
夕食時、クエン酸第二鉄カプセル剤3つとプラシーボカプセル剤1つ
クエン酸第二鉄1日当たり6gアーム:
朝食時、クエン酸第二鉄カプセル剤4つ
昼食時、クエン酸第二鉄カプセル剤4つ
夕食時、クエン酸第二鉄カプセル剤4つ
B. 臨床スケジュールおよび評価
試験処置期間
各患者の試験への参加は最大8週間まで続く:スクリーニング期間(およそ1〜2週間)、ウォッシュアウト1〜2週間、および試験薬での処置4週間。
【0159】
スクリーニング訪問1(試験日の-30日〜-15日)
初回スクリーニング訪問時に次の調査を行う:
1. 病歴(併用薬など)。
【0160】
2. 人口統計データ。
【0161】
3. 身体診察(身長、体重、および生命徴候など)。
【0162】
4. 食事インタビュー(スクリーニング期間中、透析日1日、非透析日1日、および週末1日を含む3回、24時間想起法を用いて、食事によるカルシウムおよびリン摂取量を評価する)。注:食事インタビューは、ウォッシュアウト期間中に一部または全部を行ってもよい。
【0163】
5. 臨床検査による評価:
・血液学:全血球計算(CBC)(鑑別(differential)、血小板を含む)。
【0164】
・化学的性質:ナトリウム、カリウム、塩化物、重炭酸塩、血中尿素窒素(BUN)、クレアチニン、グルコース(任意)、アスパラギン酸トランスアミナーゼ(AST)、アラニントランスアミナーゼ(ALT)、アルカリ性ホスファターゼ(ALP)、総ビリルビン量、総タンパク質量、アルブミン、血清カルシウム、血清リン酸塩、マグネシウム
・総コレステロールレベルおよびLDLコレステロールレベル
・血清(妊娠の可能性がある女性に対して3-HCG
・鉄パネル:血清鉄、フェリチン、トランスフェリン飽和度、および総鉄結合能。
【0165】
6. 12-鉛 ECG。
【0166】
7. 患者には、ウォッシュアウト期間(試験日の-14日〜-1日)についての指示が与えられる:
a. すべてのリン酸塩結合剤を第-14日に中止する
b. いかなる鉄療法(経口または静脈内)も第-14日に中止する
c. 登録前に1ヶ月間継続してビタミンDまたはカルシトリオールを服用していた患者は、試験期間中は現在の服用量を維持するように指示を受ける
d. 患者は、食生活の変更、カルシウムまたはマグネシウムを含有する制酸剤(他の医薬)を避けるようにアドバイスを受ける。
【0167】
スクリーニング訪問2(試験日の-7+/-1日)
1. 臨床検査による評価:
血清PO4
注:第-7日の血清PO4が≧5.5mg/dLかつ≦10mg/dLであった患者を無作為化した後、2週間のウォッシュアウトを完了する。無作為化した日が自動的に第0日となる。
【0168】
注:第-7日のリン酸塩レベルが≧10mg/dLであった患者は、この試験から除外され、試験前の薬物治療を再開するよう指示を受ける。
【0169】
試験第0日(無作為化および投薬)
1. 身体診察(体重および生命徴候など)。
【0170】
2. 有害事象に関する問い合わせ。
【0171】
3. 併用薬に関する問い合わせ。
【0172】
4. 臨床検査によるベースライン評価:
・血清PO4
・血清Ca
・鉄パネル:血清鉄、フェリチン、トランスフェリン飽和パーセント、および総鉄結合能
注:臨床検査によるベースライン評価は、第0日の3日前まで行ってよい
5. PO4レベルが≧0.5mg/dLかつ≦10mg/dLであった患者を無作為化し、15日分の試験薬を調剤する。
【0173】
注:患者は、第0日における次の食事の完了後10分間以内に試験薬の服用を開始するよう指示を受けるものとする。
【0174】
試験の第14日(中間評価)
試験の第14+/-1日に次の検査を行う。
【0175】
1. 身体診察(体重および生命徴候を含む)。
【0176】
2. 有害事象に関する問い合わせ。
【0177】
3. 併用薬に関する問い合わせ。
【0178】
4. さらに15日分の試験薬を調剤する。返却されたすべてのカプセル剤を計数し、症例報告書に記録するものとする。
【0179】
5. 臨床検査による評価:
・血液学:CBC(鑑別、血小板を含む)。
【0180】
・化学的性質:ナトリウム、カリウム、塩化物、重炭酸塩、BUN、クレアチニン、グルコース(ランダム)、AST、ALT、ALP、総ビリルビン量、総タンパク質量、アルブミン、カルシウム、リン酸塩、マグネシウム。
【0181】
・鉄パネル:血清鉄、フェリチン、トランスフェリン飽和パーセント、および総鉄結合能。
【0182】
・総コレステロールレベルおよびLDLコレステロールレベル。
【0183】
注:第14日のリン酸塩レベルが>10mg/dLであった患者は、この試験から除外され、試験前の薬物治療を再開するよう指示を受ける。
【0184】
試験の第28日(試験評価の終了)
試験の第28+/-1日に、または早期終了日に、次の検査を行う。
【0185】
1. 身体診察(体重および生命徴候など)
2. 有害事象に関する問い合わせ。
【0186】
3. 併用薬に関する問い合わせ。
【0187】
4. 臨床検査による評価:
a. 血液学:CBC(鑑別、血小板を含む)
b. 化学的性質:ナトリウム、カリウム、塩化物、重炭酸塩、BUN、クレアチニン、グルコース(ランダム)、AST、ALT、ALP、総ビリルビン量、総タンパク質量、アルブミン、カルシウム、リン酸塩、マグネシウム。
【0188】
c. 総コレステロールレベルおよびLDLコレステロールレベル
d. 鉄パネル:血清鉄、フェリチン、トランスフェリン飽和パーセント、および総鉄結合能。
【0189】
5. 12-鉛 ECG
6. 患者は、この試験の終了後、試験前の薬物治療を再開するよう指示を受ける。
【0190】
C. データ管理および分析
GloboMaxは、一次データを管理、監視、および調整するセンターである。各被験体に関する症例報告書(CRF)を送る。被験体は、CRFに載っている氏名またはイニシャルでは識別されない。CRFは、臨床的部位で監視され、GloboMaxの試験モニターにより収集される。監査済みのCRFが電子データファイルを作成するために用いられる。
【0191】
3つの主要なカテゴリーの評価項目により、最初に対処を受けている生化学的および臨床的問題について検討する。さらなる生化学的および臨床的問題については、それらの問題が生じたときに対処する。よって、ここでの評価項目は、これらの試験、または将来の試験で収集される関連所見および測定結果全体を制限するものではない。
【0192】
主要評価項目(図9〜10参照)
・ベースラインからの第14日および第28日における血清PO4濃度の変化。
【0193】
副次的評価項目(図9〜10参照)
・ベースラインからの第14日および第28日における血清カルシウム濃度の変化。
【0194】
・ベースラインからの第14日および第28日における鉄、フェリチン、トランスフェリン飽和パーセント、および総鉄結合能の変化。
【0195】
・ベースラインからの第14日および第28日におけるCaPO4生成物の変化。
【0196】
医薬グレードのクエン酸第二鉄は、化学薬品グレードのクエン酸第二鉄と同様の有効性を示すことがさらに示される。図13参照。しかしながら、その安全性プロフィールは、医薬グレードのものによって、一般に、臨床上の有害作用の低減がもたらされるということを示している。図13参照。
【0197】
安全性評価項目(図11参照)
安全性は、有害事象(図11)、ならびに各調査訪問時の身体診察、生命徴候、および臨床検査の結果を記録することにより監視される。
【0198】
患者の安全性を保証するために、検査データに基づいた、この試験からの離脱についての具体的なルールも設けた。このような判定基準の限定されない例を、以下に示す。
【0199】
患者の血清リン酸塩レベルが≧10mg/dLまで増加した場合には、試験期間中のどの時点においても、その患者をこの試験から離脱させる。
【0200】
具体的な試験により、医薬グレードのクエン酸第二鉄が化学薬品グレードのクエン酸第二鉄と同様の有効性を有するということも分かった。(図13参照)。しかしながら、医薬グレードのものは、図12で示されるように、一般に、著しく、より望ましい安全性プロフィールを与える。これは、血清リン酸塩レベルの調節における重要な進歩であることを示している。
【図面の簡単な説明】
【0201】
図面では、本発明の特定の実施形態を例示するが、本発明の思想または範囲を限定するものと決して解釈してはならない。
【図1】最終クエン酸第二鉄製品が、表Aに示される設定された製造出荷時規格に確実に適合するようにするための工程内品質管理規準を含む、医薬グレードのクエン酸第二鉄の一般的な合成方法の概要を示す模式図である。
【図2】本発明による医薬グレードクエン酸第二鉄作製方法の概要を示す模式図である。
【図3】本発明によるスケールアップ可能な医薬グレードクエン酸第二鉄製造および品質管理プロセスの概要を示す
【図4】本発明によるスケールアップ可能な医薬グレードクエン酸第二鉄製造および品質管理プロセスの模式図である。
【図5】本発明の医薬グレードクエン酸第二鉄の代表的なプロトンNMRスペクトルを示す。
【図6】本発明の医薬グレードクエン酸第二鉄の代表的なFTIRスペクトルを示す。
【図7】医薬グレードのクエン酸第二鉄と化学薬品グレードのクエン酸第二鉄のpH1.0および8.0における固有溶解速度の比較である。
【図8】最終第二鉄有機化合物が、設定された製造出荷時規格に確実に適合するようにするための工程内品質管理規準を含む、医薬グレードの第二鉄有機化合物の一般的な合成方法の概要を示す模式図である。
【図9】医薬グレードのクエン酸第二鉄の臨床結果のまとめである。
【図10】医薬グレードのクエン酸第二鉄の有効性データのまとめである。
【図11】臨床試験からの安全性データのまとめである。
【図12】化学薬品グレードのクエン酸第二鉄と医薬グレードのクエン酸第二鉄の安全性プロフィールの比較である。
【図13】化学薬品グレードのクエン酸第二鉄と医薬グレードのクエン酸第二鉄の有効性プロフィールの比較である。
【図14】患者の死亡率と高リン酸血症の関係の棒グラフを示す。
【特許請求の範囲】
【請求項1】
高血清リン酸塩レベルを特徴とする障害を治療するのに有効な組成物であって、血清リン酸塩レベルを低下させるのに有効な量の医薬グレードのクエン酸第二鉄を含む、組成物。
【請求項2】
高血清リン酸塩レベルを特徴とする障害を治療するのに有効な組成物であって、医薬グレードのクエン酸第二鉄を含み、有害な副作用のより望ましいプロフィールを与える、組成物。
【請求項3】
前記有効量の医薬グレードのクエン酸第二鉄が1日当たり2〜30gである、請求項1〜2のいずれか一項に記載の組成物。
【請求項4】
医薬グレードのクエン酸第二鉄の前記有効量が、前記有効量の一部を1日2回以上経口投与することにより達成される、請求項1〜3のいずれか一項に記載の組成物。
【請求項5】
前記有効量の医薬グレードのクエン酸第二鉄が1日当たり4〜15gである、請求項1〜4のいずれか一項に記載の組成物。
【請求項6】
前記有効量の医薬グレードのクエン酸第二鉄が1日当たりおよそ4〜8gである、請求項1〜5のいずれか一項に記載の組成物。
【請求項7】
前記有効量の医薬グレードのクエン酸第二鉄が1日当たりおよそ2g、4g、または6gである、請求項1〜6のいずれか一項に記載の組成物。
【請求項8】
前記有効量が長期経口投与に適している、請求項1〜7のいずれか一項に記載の組成物。
【請求項9】
第二鉄イオンが胃腸管内で放出され、胃腸管内でリン酸塩含有化合物と接触する、請求項1〜8のいずれか一項に記載の組成物。
【請求項10】
第二鉄イオンと、前記接触したリン酸塩含有化合物とが結合して不溶形態となる、請求項9に記載の組成物。
【請求項11】
クエン酸塩が放出され、胃腸管内で吸収され得る、請求項1〜10のいずれか一項に記載の組成物。
【請求項12】
医薬グレードのクエン酸第二鉄がカプセル剤形態で投与される場合、1日に投与される医薬グレードのクエン酸第二鉄の前記量が、およそ15g、またはそれより少ない、請求項1または請求項2に記載の組成物。
【請求項13】
医薬グレードのクエン酸第二鉄が錠剤形態で投与される場合、1日に投与される医薬グレードのクエン酸第二鉄の前記量が、およそ30g、またはそれより少ない、請求項1または請求項2に記載の組成物。
【請求項14】
次の用途:
(a)高リン酸血症の治療;
(b)透析患者の死亡率の減少;
(c)代謝性アシドーシスの治療;
(d)リン酸カルシウム沈着の阻害;
(e)血清カルシウム-リン生成物([Ca]x[P])の減少
(f)血清カルシウムレベルの低下;
(g)軟組織の脱石灰化;および
(h)腎石溶解の支援
のうちの1以上の用途に有効な医薬グレードのクエン酸第二鉄を含む組成物の使用。
【請求項15】
前記使用が、カルシウムイオンおよびリン酸イオンの血清レベルを低下させることに少なくとも部分的に依存する、請求項13に記載の使用。
【請求項16】
前記軟組織が血管または眼である、請求項13または請求項14のいずれか一項に記載の使用。
【請求項17】
前記組成物が長期にわたって投与するのに有用である、請求項13〜15のいずれか一項に記載の使用。
【請求項18】
前記組成物が化学薬品グレードのクエン酸第二鉄を含有した場合と比べて、前記使用に伴われる胃腸有害副作用がより少ない、請求項13〜16のいずれか一項に記載の使用。
【請求項19】
高血清リン酸塩レベルを特徴とする障害を治療するための方法であって、有効量の医薬グレードのクエン酸第二鉄を含む組成物を投与することを含む、方法。
【請求項20】
前記障害が高リン酸血症である、請求項19に記載の方法。
【請求項21】
前記被験体または患者が透析療法、限定されるものではないが、血液透析により治療される、請求項20または請求項21に記載の方法。
【請求項22】
前記有効量が経口投与される、請求項20に記載の方法。
【請求項23】
前記有効量の一部が食事とともに投与される、請求項20に記載の方法。
【請求項24】
前記有効量が錠剤、粉末剤、懸濁液、エマルション、カプセル剤、ドロップ剤、顆粒剤、トローチ剤、丸剤、液剤、スピリット、またはシロップ剤の形態で投与される、請求項20に記載の方法。
【請求項25】
前記有効量が1日当たりおよそ2〜30gである、請求項20〜25のいずれか一項に記載の方法。
【請求項26】
前記有効量が1日当たりおよそ2、4または6gである、請求項20〜26のいずれか一項に記載の方法。
【請求項1】
高血清リン酸塩レベルを特徴とする障害を治療するのに有効な組成物であって、血清リン酸塩レベルを低下させるのに有効な量の医薬グレードのクエン酸第二鉄を含む、組成物。
【請求項2】
高血清リン酸塩レベルを特徴とする障害を治療するのに有効な組成物であって、医薬グレードのクエン酸第二鉄を含み、有害な副作用のより望ましいプロフィールを与える、組成物。
【請求項3】
前記有効量の医薬グレードのクエン酸第二鉄が1日当たり2〜30gである、請求項1〜2のいずれか一項に記載の組成物。
【請求項4】
医薬グレードのクエン酸第二鉄の前記有効量が、前記有効量の一部を1日2回以上経口投与することにより達成される、請求項1〜3のいずれか一項に記載の組成物。
【請求項5】
前記有効量の医薬グレードのクエン酸第二鉄が1日当たり4〜15gである、請求項1〜4のいずれか一項に記載の組成物。
【請求項6】
前記有効量の医薬グレードのクエン酸第二鉄が1日当たりおよそ4〜8gである、請求項1〜5のいずれか一項に記載の組成物。
【請求項7】
前記有効量の医薬グレードのクエン酸第二鉄が1日当たりおよそ2g、4g、または6gである、請求項1〜6のいずれか一項に記載の組成物。
【請求項8】
前記有効量が長期経口投与に適している、請求項1〜7のいずれか一項に記載の組成物。
【請求項9】
第二鉄イオンが胃腸管内で放出され、胃腸管内でリン酸塩含有化合物と接触する、請求項1〜8のいずれか一項に記載の組成物。
【請求項10】
第二鉄イオンと、前記接触したリン酸塩含有化合物とが結合して不溶形態となる、請求項9に記載の組成物。
【請求項11】
クエン酸塩が放出され、胃腸管内で吸収され得る、請求項1〜10のいずれか一項に記載の組成物。
【請求項12】
医薬グレードのクエン酸第二鉄がカプセル剤形態で投与される場合、1日に投与される医薬グレードのクエン酸第二鉄の前記量が、およそ15g、またはそれより少ない、請求項1または請求項2に記載の組成物。
【請求項13】
医薬グレードのクエン酸第二鉄が錠剤形態で投与される場合、1日に投与される医薬グレードのクエン酸第二鉄の前記量が、およそ30g、またはそれより少ない、請求項1または請求項2に記載の組成物。
【請求項14】
次の用途:
(a)高リン酸血症の治療;
(b)透析患者の死亡率の減少;
(c)代謝性アシドーシスの治療;
(d)リン酸カルシウム沈着の阻害;
(e)血清カルシウム-リン生成物([Ca]x[P])の減少
(f)血清カルシウムレベルの低下;
(g)軟組織の脱石灰化;および
(h)腎石溶解の支援
のうちの1以上の用途に有効な医薬グレードのクエン酸第二鉄を含む組成物の使用。
【請求項15】
前記使用が、カルシウムイオンおよびリン酸イオンの血清レベルを低下させることに少なくとも部分的に依存する、請求項13に記載の使用。
【請求項16】
前記軟組織が血管または眼である、請求項13または請求項14のいずれか一項に記載の使用。
【請求項17】
前記組成物が長期にわたって投与するのに有用である、請求項13〜15のいずれか一項に記載の使用。
【請求項18】
前記組成物が化学薬品グレードのクエン酸第二鉄を含有した場合と比べて、前記使用に伴われる胃腸有害副作用がより少ない、請求項13〜16のいずれか一項に記載の使用。
【請求項19】
高血清リン酸塩レベルを特徴とする障害を治療するための方法であって、有効量の医薬グレードのクエン酸第二鉄を含む組成物を投与することを含む、方法。
【請求項20】
前記障害が高リン酸血症である、請求項19に記載の方法。
【請求項21】
前記被験体または患者が透析療法、限定されるものではないが、血液透析により治療される、請求項20または請求項21に記載の方法。
【請求項22】
前記有効量が経口投与される、請求項20に記載の方法。
【請求項23】
前記有効量の一部が食事とともに投与される、請求項20に記載の方法。
【請求項24】
前記有効量が錠剤、粉末剤、懸濁液、エマルション、カプセル剤、ドロップ剤、顆粒剤、トローチ剤、丸剤、液剤、スピリット、またはシロップ剤の形態で投与される、請求項20に記載の方法。
【請求項25】
前記有効量が1日当たりおよそ2〜30gである、請求項20〜25のいずれか一項に記載の方法。
【請求項26】
前記有効量が1日当たりおよそ2、4または6gである、請求項20〜26のいずれか一項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公表番号】特表2009−504777(P2009−504777A)
【公表日】平成21年2月5日(2009.2.5)
【国際特許分類】
【出願番号】特願2008−527177(P2008−527177)
【出願日】平成18年8月18日(2006.8.18)
【国際出願番号】PCT/US2006/032385
【国際公開番号】WO2007/022435
【国際公開日】平成19年2月22日(2007.2.22)
【出願人】(505311733)グロボアジア エルエルシー (4)
【Fターム(参考)】
【公表日】平成21年2月5日(2009.2.5)
【国際特許分類】
【出願日】平成18年8月18日(2006.8.18)
【国際出願番号】PCT/US2006/032385
【国際公開番号】WO2007/022435
【国際公開日】平成19年2月22日(2007.2.22)
【出願人】(505311733)グロボアジア エルエルシー (4)
【Fターム(参考)】
[ Back to top ]

