医薬品製剤の安定性予測方法
【課題】医薬品製剤の安定性予測を、近赤外スペクトルを分析して精度高く行う。
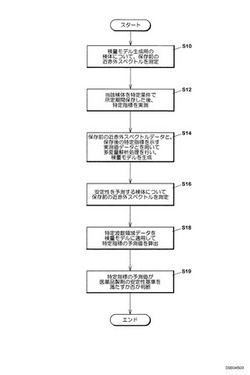
【解決手段】用意された検体について測定した保存前の近赤外スペクトルと(ステップS10)、特定条件で所定期間保存した後に実測した当該検体の特定指標と(ステップS12)、を用いて多変量解析を行うことにより、検量モデルを生成し(ステップS14)、安定性を予測しようとする医薬品製剤の近赤外スペクトルデータ(ステップS16)を検量モデルに適用することにより特定指標の予測値を算出する(ステップS18)。
【解決手段】用意された検体について測定した保存前の近赤外スペクトルと(ステップS10)、特定条件で所定期間保存した後に実測した当該検体の特定指標と(ステップS12)、を用いて多変量解析を行うことにより、検量モデルを生成し(ステップS14)、安定性を予測しようとする医薬品製剤の近赤外スペクトルデータ(ステップS16)を検量モデルに適用することにより特定指標の予測値を算出する(ステップS18)。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、近赤外スペクトルを用いた非破壊分析技術に関し、特に、医薬品製剤の安定性を予測するための技術に関する。
【背景技術】
【0002】
近年、非破壊分析による化学分析法として、対象物に近赤外光を照射して得られる近赤外スペクトルを用いた方法が注目されている(特許文献1〜4)。近赤外光は波長が可視光より長く、赤外光のうち波長の短い範囲の電磁波光であり、エネルギーの低い電磁波でありながら吸収が極めて小さく物質を透過しやすいという性質から、化学だけでなく、食品、農業などの幅広い分野における非破壊分析に利用されている。
【0003】
例えば、特許文献1、2には、リアルタイムで測定した近赤外スペクトルを利用して、生産プラントの運転制御を精度良く行うことが開示されている。特許文献3には、潤滑剤の近赤外スペクトルを測定しこれを所定の検量モデルに適用することで、未知潤滑剤の性状、性能などが推定できることが開示されている。特許文献4には、穀物サンプルに近赤外スペクトルを照射して穀物の内部品質などを評価することが開示されている。
【0004】
【特許文献1】特開2000−298512号公報
【0005】
【特許文献2】特表WO02/012969号公報
【0006】
【特許文献3】特開平11−194124号公報
【0007】
【特許文献4】特開平06−144264号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、特許文献1〜4のいずれにおいても近赤外分析による対象物の評価を行ってはいるが、これらはあくまで「スペクトル測定時点における対象物の評価」を行っているに過ぎず、経時的変化を考慮した予測を行うものは存在しなかった。
【0009】
一方、医薬品製剤の安定性は、一般的に保存により湿度、温度、光などの様々な環境要因に影響を受けやすい、あるいは品質、安全又は有効性に影響を与えるような対象によって評価する。しかし、バイアル全体に占める類縁物質量の割合で判定される場合(例えば、予め類縁物質の規格が設定されており、一定期間保存後の類縁物質量が規格を超えた製剤は安定性を満たさない不良品とされる等の基準がある。)、医薬品製剤について製造直後の類縁物質量自体は以降の安定性には直接的に関連していない場合があり、安定性予測が困難と考えられるような要因があった。
【0010】
図19は、ある医薬品製剤を製造した3ロットからそれぞれ実測した類縁物質量の初期値、および各ロットの製剤を一定条件で保存した後に実測した類縁物質量を比較した表である。図20は、図19に示す長期保存試験での保存期間と類縁物質量との関係を示すグラフである。
【0011】
図19、図20に示すように、製剤ロット2、3についてみると類縁物質量の初期値はほぼ同じであるが、長期保存試験の12箇月後においては類縁物質量(平均値、最大量及び範囲)の数値が異なっている。一方で、製剤ロット1、3についてみると類縁物質量の初期値は異なっているが、長期保存試験においては類縁物質量の数値が同等になっている。なお、図19に示す加速試験では製剤ロット2、3の類縁物質量がほぼ同じ値を示しているが、製剤ロット1のみが異なる高い値を示している。
【0012】
以上のように、製造直後の類縁物質量と、保存後の類縁物質量との間には関連性を見出すことができず安定性の予測は困難な場合があった。一方、医薬品製剤の安定性については法令等で基準が明確に定められており、医薬品製剤の保存後における安定性を、精度良く予測する有効な手段が求められていた。
【課題を解決するための手段】
【0013】
(1)この発明の安定性予測方法は、
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
前記特定指標値算出工程で得られた前記特定指標の予測値および医薬品製剤の安定性評価基準を比較することにより、検体が所定期間経過後における安定性を満たすか否かを判定する安定性判定工程、
を備えたことを特徴とすることを特徴とする。
【0014】
これにより、近赤外スペクトルを利用した非破壊検査で算出した特定指標を用いて、将来における医薬品製剤の安定性を精度良く予測することができる。
【0015】
(2)この発明の安定性予測方法は、
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とすることを特徴とする。
【0016】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、精度良く算出することができる。
【0017】
(3)この発明の安定性予測方法は、
前記特定指標値算出工程において前記検量モデルに適用される近赤外スペクトルの波数領域が、7500cm−1〜4400cm−1の範囲である、
ことを特徴とする。
【0018】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、汎用的、かつ、精度良く算出することができる。
【0019】
(4)この発明の安定性予測方法は、
前記特定指標値算出工程において前記検量モデルに適用される近赤外スペクトルの波数領域が、相関係数が高い波数領域を選定することにより決定される、
ことを特徴とする。
【0020】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、効果的、かつ、精度良く算出することができる。
【0021】
(5)この発明の安定性予測方法は、
前記医薬品製剤は、塩酸アムルビシン凍結乾燥製剤であり、
前記特定指標は、類縁物質である脱糖体の量である、
ことを特徴とする。
【0022】
これにより、将来における塩酸アムルビシン凍結乾燥製剤の安定性を予測するための指標である類縁物質量(脱糖体の量)を、近赤外スペクトルを利用した非破壊検査で、精度良く算出することができる。
【0023】
(6)この発明の医薬品製剤の生産方法は、
前記安定性予測方法を用いた医薬品製剤の製造方法であって、
前記安定性判定工程において、所定の安定性基準を満たさないと判定された検体については生産ラインから除外する、
ことを特徴とする。
【0024】
これにより、近赤外スペクトルを利用した非破壊検査で算出した特定指標を用いて、将来における医薬品製剤の安定性を精度良く予測し、安定性基準を満たさない医薬品を生産ラインから取り除くことができる。
【0025】
(7)この発明の安定性予測方法は、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより生成された検量モデルを記憶した記憶部、を備えたコンピュータを用いて医薬品製剤の安定性を予測するための安定性予測方法であって、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記記憶部に記憶された検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする。
【0026】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、精度良く算出することができる。
【0027】
(8)この発明の安定性予測方法は、
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと類似条件で(すなわち、同じ保存条件(温度、湿度)で、検量モデル生成工程における保存期間とは異なる期間)検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする。
【0028】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、精度良く算出することができる。
【0029】
なお、この実施形態において「保存前」とは、医薬品製剤を製造した直後であって、対象物に近赤外スペクトルに影響を与えるような化学的、物理的変化が生じるまでの状態を意味する。また「安定性」とは、温度、湿度、光などの様々な環境要因の影響の下で品質を維持する度合のことである。
【0030】
なお、この実施形態において「同一条件」とは、検量モデル生成用の試料と安定性を予測する対象となる試料の間で、保存期間及び保存条件(温度、湿度)が同じことをいい、「類似条件」とは、検量モデル生成用の試料と安定性を予測する対象となる試料の間で、保存条件(温度、湿度)が同じで保存期間が異なることをいう。
【発明を実施するための最良の形態】
【0031】
[安定性予測装置のハードウェア構成]
図1は、この発明の安定性予測方法を実行する安定性予測装置100のハードウェア構成を示す図である。図1に示すように、安定性予測装置100は、バイアル103に入った対象物(医薬品製剤の検体)の近赤外スペクトルを測定するための近赤外スペクトル測定手段102と、近赤外スペクトル測定手段102に接続された処理コンピュータ104とで構成されている。
【0032】
図1に示す近赤外スペクトル測定手段102は、処理コンピュータ104とデータ送受信が可能な分光光度計で、一般的に市販されているものを用いることができる。なお、近赤外スペクトルの測定方式としては、透過測定や拡散反射測定などが存在するが、液剤の場合は透過測定を行うことが好ましく、厚みのある固形製剤は拡散反射測定を行うことが好ましい。
【0033】
図1に示すように、処理コンピュータ104は、CPU10、RAM12、ディスプレイ14、ハードディスク16、キーボード/マウス18、通信回路20などを備えており、近赤外スペクトル測定手段102から受けた対象物の近赤外スペクトルデータに基づいて後述する種々の処理を行うための装置である。
【0034】
また、図1に示すように、ハードディスク16には安定性データ算出プログラム30および検量パラメータDB32が記憶されている。なお、安定性データ算出プログラム30などのハードディスク16へのインストールは、記録媒体(図示せず)に記録されたプログラムを読み出して行われる。
【0035】
安定性データ算出プログラム30としては、ケモメトリクス法に基づく検量モデル(検量式)の生成処理や、当該検量モデルを利用した安定性データの算出処理、検体が所定の安定性基準を満たすか否かを判断する処理などを行うための市販ソフトウェアを用いることができる。
【0036】
また、図1に示す検量パラメータDB32には、図2に示すような検量モデルを生成するための各パラメータが記憶される。図2に示すdata1(X1,X2,…Xk)は、所定の各波数(V1,V2,…Vk)における近赤外スペクトルの吸光度の値であり試料番号1〜Nのそれぞれについて近赤外スペクトル測定手段102で測定した値が記憶される。data2(M1,M2,…Mn)は各試料について保存後に実測された特定指標の実測値Mである。data3(W11,W21,…Wk1など)は各波数(V1,V2,…Vk)における重みを示す係数(ローディングスペクトルの数値)であり、data4(B0,B1,…Bn)は検量モデル(検量式)を構成する偏回帰係数である。なお、Bnのnには回帰に最適な主成分(後述する)の数が設定される。図2に示す各パラメータ項目の詳細や算出方法については、以下のフローチャートにおいて説明する。
【0037】
[安定性予測処理のフローチャート]
図1に示す安定性予測装置100のプログラム30が行う処理のフローチャートを、図3に示す。なお、本発明における安定性予測の対象は、医薬品製剤であり、特に後述の実施例1〜3においては、特に注射剤の塩酸アムルビシン凍結乾燥製剤を具体例として実験を行った。
【0038】
まず、近赤外スペクトル測定手段102に検量モデル生成用の検体が用意されると、作業者の操作入力に基づいて、用意された当該検体について保存前の近赤外スペクトルが測定される(ステップS10)。ここで測定された近赤外スペクトルデータdata1は、近赤外スペクトル測定手段102から処理コンピュータ104に送信され、予め設定された各波数(V1,V2,…Vk)に対応付けて吸光度X(図2のX11,X12,…X1kなど)の値がハードディスク16の検量パラメータDB32に記憶される。
【0039】
図4に、ステップS10において測定される近赤外スペクトルデータdata1の原スペクトルを示す。図4では、多数のバイアル103から測定された複数の近赤外スペクトルデータdata1を重ねて表示している。なお、適正な検量モデルを作成するためには、検量モデル生成用の検体は、1ロットでも可能であるが、複数のロットを用いることが好ましく、例えば3ロット以上を用いて作成することが好ましい。また、1ロットあたりの検体(バイアル)数も多いほうが好ましく、通常は5バイアル以上を用いることが好ましい。
【0040】
つぎに、当該検量モデル生成用の検体を特定条件で所定期間保存した後、当該検体の特定指標を実測し(つまり、従来分析法の測定を行い)、得た実測値M、data2(図2を参照)を各試料に対応づけて記憶する(ステップS12)。
【0041】
具体的には、ステップS12において保存前の近赤外スペクトルを測定した後、作業者が一旦検体を別の場所に移動させて所定の保存期間(第1時点から第2時点)で、かつ、特定の保存条件(例えば、温度40℃/75%RH)で保存する。その後、作業者が、特定指標を実測して得た実測値データをキーボード/マウス18を介して入力し、ハードディスク16の検量パラメータDB32に記憶する。ここで用いる特定指標の実測(従来分析法の測定)方法としては、例えば、類縁物質量にはHPLCなどを用いることができる。
【0042】
また、本発明における実測(従来分析法の測定)の対象となる特定指標としては、保存の時間的経過により変化し、品質の指標となる数値、つまり安定性評価の基準となる指標であればよい。上記特定指標の具体例は、例えば、類縁物質量であり、特に、医薬品製剤が塩酸アムルビシン凍結乾燥製剤の場合には、類縁物質の一つである脱糖体の量が好ましい。これら特定指標は、対象とする医薬品製剤毎に、適宜選定する必要がある。
【0043】
なお、上記検体バイアルの保存、保存後の実測、データ入力の一連または各工程を作業者が行わず機械的に自動で行うことも可能である。また、特定指標の実測(ステップS12)を前述の近赤外スペクトルの測定(ステップS10)と並行して、または前述の近赤外スペクトルの測定(ステップS10)より先に行うことも可能である。
【0044】
処理コンピュータ104の安定性データ算出プログラム30(図1)は、さらに、ステップS10で得た保存前の近赤外スペクトルデータdata1(図2)と、ステップS12で得た保存後の特定指標を示す実測値データdata2(図2)と、を用いて多変量解析を行うことにより、検量モデル(検量式)を生成してハードディスク16に記憶する(ステップS14)。
【0045】
検量モデルとは、測定した近赤外スペクトル間のわずかな違いを元にケモメトリクス法(多変量解析)で分析することで作成される近赤外スペクトルデータと測定成分の分析値との間の数学的関係式である。具体的には、近赤外分析で得られる近赤外スペクトルから医薬品製剤及び目的に応じて決められる分析領域の各波数V(V1,V2,…Vk)における吸光度データX(図2のX1,X2,…Xk)を選び、これらのデータと従来分析法の測定値M(図2のM1,M2,…MN)とを用いて多変量解析(例えば、PLS法によるデータ処理)を行うことにより得られる相関式(図2のパラメータdata3, data4で構成)であり、次式(β)で表される。
【0046】
Y=B0+B1*Z1+B2*Z2+・・・+Bn*Zn・・・(β)
ここで、目的変数Yは、予想しようとする値、すなわち類縁物質量である。偏回帰係数B(B0,B1,B2,…Bn、図2のdata4)は、説明変数Z(Z1,Z2,…Zn)にかけられる重みであり、実測値Mとの差(残差)の2乗和が最小になるように最小二乗法により求められる。
【0047】
また、説明変数Z(Z1,Z2,…Zn)は、主成分解析における第n主成分のZ値、Z=X1*W1+X2*W2+・・・+Xk*Wk、で表される(なお、X:近赤外スペクトルの吸光度、W:係数)。ここで、第一主成分の係数(W1,W2,…Wk)は、第一主成分として最もデータの分散の大きい方向(最も吸光度の差の大きい方向)に軸をとって、第1主成分をZ1=X1W11+X2W21+・・・+XkWk1として吸光度X(X1,X2,…Xk)の値を代入したときに、各試料(試料番号1〜N)について算出したZ11〜ZN1の値、[数1]の分散が最大となるような値を演算することで得られる。
【0048】
【数1】

【0049】
さらに、必要に応じて第n主成分まで各主成分における係数Wが求められ、ハードディスク16に記憶される。なお、図2に示す検量パラメータDB32には、第一主成分について算出した係数W(W11,W21,…Wk1)だけを示している。
【0050】
以上のステップS10〜ステップS14までが、保存前に測定した近赤外スペクトルデータと保存後に実測した実測値に基づいて、検量モデル(検量式)が生成されるまでの工程である。以降のステップでは、当該検量モデルに基づいて医薬品製剤の検体について安定性が予測されることになる。
【0051】
処理コンピュータ104のCPU10は、用意した安定性を予測しようとする医薬品製剤の検体について近赤外スペクトルを測定するように、近赤外スペクトル測定手段102を制御する(ステップS16)。これにより、処理コンピュータ104は当該近赤外スペクトルデータを受信し、各波数(V1,V2,…Vk)に対応付けた吸光度X’(X'1,X'2,…X'k)の値をハードディスク16に記憶する。
【0052】
処理コンピュータ104のCPU10は、さらに、ステップS16により得られた近赤外スペクトルを、ステップS14で生成した検量モデルに適用することにより、検量モデルと同一条件で検体を保存した後における前記特定指標の予測値M’を算出する(ステップS18)。具体的には、安定性を予測しようとする医薬品製剤の検体から測定した近赤外スペクトルデータの吸光度X’の値(X'1,X'2,…X'k)を検量モデル(前述の検量式(β))に代入してYの値を演算する。このYの値が特定指標の予測値M’となる。
【0053】
最後に、処理コンピュータ104のCPU10は、特定指標の予測値M’が安定性基準を満たすか否かを判断し(ステップS19)、その合否結果がディスプレイ14に表示されることになる。具体的には、作業者が入力したりハードディスク16に予め記憶された所定の安定性基準を示すデータを読み出して、特定指標の予測値M’が所定の基準値を超える場合には安定性を満たさないと判断し、所定の基準値内であれば安定性を満たすと判断する。なお、処理コンピュータ104はステップS18までの処理を行うこととし、ステップS18で算出した特定指標の予測値M’を見た作業者が当該判断を行うようにすることも可能である。
【0054】
以上のように、検量モデルを一旦生成すれば、予測しようとする対象物の近赤外スペクトルデータXを検量モデルに適用することで予測値Yが容易に算出され、将来における医薬品製剤の安定性予測を精度良く行うことができる。
【0055】
なお、一般に、近赤外光の波数領域は12500cm−1〜3600cm−1であるが、検量モデルの生成においては、その一部を評価に用いてもよく、特に、7500cm−1〜4400cm−1の範囲を選定すると汎用的でかつ精度が良いため、より好ましいと考えられる。これは、7500cm−1〜4400cm−1の範囲外では、比較的ノイズが大きいため省略する方が予測精度が向上するためと考えられる。また、以下に示すように、特定波数領域として2以上の特定波数領域を選定することも可能である。
【0056】
図6を用いて、分析する近赤外スペクトルの特定波数領域(分析領域)が異なる場合における相関性(相関係数)の差について説明する。図6は、20℃/60%RHで12箇月保存したある同一医薬品製剤の検体につき、近赤外スペクトルの分析領域を、7500cm−1〜4400cm−1、7200cm−1〜6900cm−1、5400cm−1〜4400cm−1、7200cm−1〜6900cm−1および7200cm−1〜6900cm−1(2つの波数領域)とした場合に、実験結果として得られる相関係数の違いを示す表である。
【0057】
図6に示すように、上記各波数領域から検量モデルを作成した結果、広範囲の分析領域7500cm−1〜4400cm−1で評価を行った場合に、相関係数Rが0.8606と最も高く、より高い相関性が得られることが確認された。図6に示すように、次に相関係数Rの値が高いのは5400cm−1〜4400cm−1であり、5400cm−1〜4400cm−1の波数領域に安定性予測に影響する因子が多く含まれていると考えられる。しかしながら、5400cm−1〜4400cm−1で特に寄与が大きかった波数ピーク(例えば図5A、Bに示す5240cm−1、5120cm−1)付近だけで同様の実験を行ってみたが、相関係数Rの値は0.5程度となり、上記広範囲の波数を分析した場合のような良い結果が得られないことが分かった。なお、図5Aは、図4に示す対象物の近赤外スペクトル(原スペクトル)を微分したデータ例を示す図であり、図5Bは、図5Aに対応するローディングスペクトルを示すグラフである。上記分析領域の選択は、図5Bに示すローディングスペクトルの絶対値が大きい部分を検量モデルの相関性に寄与する部分として抽出することにより行った。
【0058】
以上のように、より広い波数領域全体でスペクトルを評価すると良い結果が得られた理由は、波数領域を広くとることで、安定性に影響を及ぼす化学構造や不均一性等の物理化学的特徴など多くの情報を評価に用いることを可能としているためと考えられる。
【0059】
つぎに、図7を用いて、本発明において保存後でなく保存前(製造直後)に近赤外スペクトルを測定した理由を説明する。図7は、保存後に測定した近赤外スペクトルから予測される類縁物質量の相関性と、保存前(製造直後)に測定した近赤外スペクトルから予測される類縁物質量の相関性を示す表である。なお、図7には、同一の医薬品製剤(塩酸アムルビシン凍結乾燥製剤)について異なる3条件(実施例aは25℃/60%RHで6箇月、実施例aは25℃/60%RHで12箇月、実施例cは40℃/75%RHで6箇月)で保存した場合についての結果を示す。
【0060】
図7に示すように、保存後のスペクトルを測定し分析することにより予想される類縁物質量は保存前のスペクトルを測定した場合に比して相関係数が著しく低いという結果が得られた。これは、特に凍結乾燥製剤は不安定な製剤であるため、製造直後の近赤外スペクトルを測定することが望ましく、保存後に相関性が低くなるためと考えられる。また、化学構造や不均一性などの物理化学的特徴が製造直後の近赤外スペクトルには現れているが、保存後は水分増加や他の化学物質の増加といった要因によりそのような元々の状態が崩れてしまうためとも推測される。
【0061】
[実施例1]
実施例1は、塩酸アムルビシン凍結乾燥製剤(50mg製剤、3ロット)について、2ロットから検量モデルを生成し、残り1ロットの安定性を予測した場合を示す例である。
【0062】
凍結乾燥製剤の製造は、例えばWO2004/050098に記載の方法により行うことができる。すなわち、アムルビシンまたはその塩、L−システインまたはその塩、および必要に応じ賦型剤などを注射用蒸留水に溶解し、微量の塩基および/または酸でpH調整した後、無菌濾過した液をバイアル瓶に充填して凍結乾燥を施し粉末状態で製剤とするものである。注射剤はこの状態で保存が行われ、用時水に溶解されて投与に使用される。なお、アムルビシンはまたはその塩を含有する凍結乾燥製剤は、癌化学療法剤として、種々の癌疾患の治療に用いることができる。
【0063】
当該医薬品製剤の検量モデル用2ロット、計18個について、保存前に近赤外分光光度計により近赤外スペクトルを測定した。近赤外分析は、ブルカー・オプティクス株式会社製「近赤外分光光度計MPA」(商標)により、拡散反射測定で分析領域7500cm−1〜4400cm−1の範囲で実施し、得られた近赤外スペクトルについて一次微分処理及び正規化処理を行った。
【0064】
上記検体について、25℃/60%RHで6箇月保存し、従来分析法である液体クロマトグラフィーにより、類縁物質量の実測(従来分析法による脱糖体量の測定)を行った。3ロット用意したうちの2ロットを用いた。
【0065】
以上より、近赤外分析で得られた近赤外スペクトルと、液体クロマトグラフィー(HPLC)で得られた類縁物質量とを用いて、ブルカー・オプティクス株式会社製「OPUS分光ソフトウェア」(商標)によりPLS法で検量モデルを生成した。図8に、実施例1で生成した検量モデルによって描いた検量線および予測値と実測値をプロットしたものを示す。
【0066】
さらに、当該医薬品製剤の安定性未知の検体1ロット(用意した3ロットの残り)、計18個について、保存前に近赤外スペクトルを測定し、得られた近赤外スペクトルデータと上記で作成した検量モデルより、検体の「25℃/60%RH−6箇月」保存後の類縁物質量を予測した。得られた保存後類縁物質量、予測値を評価する目的で、上記安定性未知の検体について、「25℃/60%RH−6箇月」保存し、従来分析法であるHPLC(液体クロマトグラフィー)により、類縁物質量を測定し、類縁物質量と実測値を取得した。
【0067】
保存後における類縁物質量の予測値と実測値の結果及びその相関性をそれぞれ図9及び図10に示した。実験の結果、図10のように全体として相関性が高く(相関係数R=0.7459)、安定性予測が高精度で行われているという結果が得られた。
【0068】
[実施例2]
実施例1と同様にして、保存の期間を12箇月に変更して実施し、作成した検量モデルによって描いた検量線および予測値と実測値を評価したものを図11に、並びに保存後における類縁物質量の予測値と実測値の結果及びその相関性をそれぞれ図12及び図13に示した。
【0069】
図13に示すように、実施例2においても実施例1と同様、全体として相関性が高く(相関係数R=0.8668)、安定性予測が高精度で行われているという結果が得られた。
【0070】
[実施例3]
実施例1と同様にして、検量モデル用2ロット、計30個の検体を用い、保存の条件及び期間を「40℃/75%RH−1箇月」に変更して実施し、作成した検量モデルによって描いた検量線および予測値と実測値を評価したものを図14に、並びに保存後における類縁物質量の予測値と実測値の結果及びその相関性をそれぞれ図15及び図16に示した。
【0071】
図16に示すように、実施例3においても実施例1、2と同様、全体として相関性が高く(相関係数R=0.7443)、安定性予測が高精度で行われているという結果が得られた。
【0072】
[その他の実施形態]
なお、近赤外スペクトルの評価方法としては、原スペクトルのまま評価したり、ノイズなど不要なスペクトル変動を低減するために微分処理や正規化処理、平滑化などの前処理を行った後でケモメトリクス法による分析を行ってもよく、試料に応じて最適な処理方法を設定すればよいが、測定の再現性が良好でない場合や外部環境の影響を受けやすい場合は、微分処理や正規化処理を行うほうが好ましい。
【0073】
図5Aは、図4に示す近赤外スペクトルデータ(原スペクトル)を一次微分したデータ例を示す図であり、図5Bは、図5Aにおいて各波数が検量モデルへの寄与を示すローディングスペクトル(安定性データ算出プログラム30が部分最小2乗法により重みを付加)を示すグラフである。特に検量モデルの相関性に寄与すると考えられる波数領域を図5Bにおいて破線で示す。なお、各波数の近赤外スペクトルの吸光度X(図5A)とローディングスペクトルの数値、係数W(図5B)を掛け合わせて足した合計が前述のZ値である。
【0074】
なお、上記実施形態では、ケモメトリクス法として、部分最小二乗回帰分析法(PLS分析法(Partial least squares))を用いたが、主成分分析法(PCA法(Principal component analysis))、線形重回帰分析法(MLR分析法)、主成分回帰分析法(PCR法(Principal component regression))、フーリエ変換回帰分析法(FTR法(Fourier transform regression))、等を用いることもできる。
【0075】
なお、上記実施形態では、注射剤である塩酸アムルビシン凍結乾燥製剤を具体例として説明したが、安定性予測の対象となる医薬品製剤はこれに限られない。本発明の安定性予測の対象となる医薬品製剤としては、例えば、錠剤、カプセル剤、顆粒剤、丸剤、散剤、液剤、シロップ剤、トローチ剤、懸濁剤、乳剤、注射剤(凍結乾燥製剤、粉末充填製剤、注射用水性剤など)、坐剤、軟膏剤又は貼付剤等、通常用いられる種々の医薬品製剤を挙げることができる。好ましくは注射用製剤、特に好ましくは凍結乾燥製剤である。
【0076】
なお、上記実施形態では、実測(従来分析法の測定)の対象を類縁物質量としたが、本発明における実測(従来分析法の測定)の対象となる特定指標としては、保存の時間的経過により変化し、品質の指標となる数値、つまり安定性評価の基準となる指標であればよい。具体的には、例えば、類縁物質量の他、有効成分含量、水分量等が挙げられ、錠剤であれば溶出性、液剤であればpHなども挙げられる。これら特定指標は、対象とする医薬品製剤毎に、適宜選定する必要がある。
【0077】
なお、上記実施形態では、図3のステップS12における特定指標の実測(従来分析法の測定)方法としては、類縁物質量にはHPLC等を用いたがこれに限定されるものではない。また、その他、有効成分含量にはHPLC等を、水分量にはカールフィッシャー法等を、溶出性にはパドル法、回転バスケット法、フリースルーセル法等を、pHには水素電極法等を用いることができる。
【0078】
なお、上記実施形態では、保存条件を40℃/75%RH(図3のステップS12)等としたが、これに限定されるものではなく、30℃/65%RH、25℃/60%RH等が挙げられる。また、保存期間の例としては、1週間、2週間、1箇月、3箇月、6箇月、9箇月、12箇月、18箇月、24箇月、30箇月、36箇月等が挙げられる。また、これらの組み合わせとしては、40℃/75%RH−2週間や40℃/75%RH−1箇月、25℃/60%RH−6箇月や25℃/60%RH−12箇月が挙げられる。なお、このような保存の特定条件並びに保存の所定期間は、検体の性質に応じて適宜変動させることが好ましい。
【0079】
なお、上記実施形態では、実測した検体の保存期間と同一期間保存後の安定性(「同一条件」での保存後の安定性)を検量モデルを適用して予測したが、経時的変化のプロファイルが既知の場合、検量モデル生成時に実測する保存期間とは異なる期間保存後の安定性(「類似条件」での保存後の安定性)を予測するようにしてもよい。例えば、1つの検量モデル又は保存期間が異なる2つの検量モデルを基に(1)実施例1で得られる予測値に保存期間の比率を乗算する、(2)実施例1で得られる予測値と実施例2で得られる予測値とから補間することにより、実施例1の保存期間(6箇月)と実施例2の保存期間(12箇月)との間の任意の保存期間における安定性を予測する、(3)図19および図20に示されるような、異なる保存期間における特定指標の実測値間の関係より、単に比例関係ではない保存期間と特定指標の関係を推定し、その関係式から異なる保存期間の予測を行う、などの方法により、検量モデル生成時に実測する保存期間とは異なる期間を経過した後の安定性を予測することも可能である。
【0080】
なお、上記実施形態では、医薬品製剤の安定性を処理コンピュータ104によって予測することとしたが、かかる安定性予測方法を工場などにおける医薬品製剤の製造ラインで利用することも可能である。
【0081】
図17は、この発明の安定性予測方法を医薬品製剤の生産方法に適用した場合における安定性予測装置100のハードウェア構成を示す図である。安定性予測装置100は、図1に示すものと同様、すなわち対象物の近赤外スペクトルを測定するための近赤外スペクトル測定手段102と、近赤外スペクトル測定手段102に接続された処理コンピュータ104とで構成されているが、さらに製造ラインを制御するための製造ライン制御部106に接続されている点で相違する。なお、図17に示す近赤外スペクトル測定手段102は、製造ラインにおいて製造された医薬品製剤を入れた各バイアルの近赤外スペクトルが測定できるように配置される。
【0082】
また、図17に示すハードディスク16に記憶された安定性データ算出プログラム30は、ケモメトリクス法に基づく検量モデル(検量線)の生成処理や、検量モデルに基づいた安定性データの算出処理、検体が所定の安定性基準を満たすか否かを判断する処理だけでなく、さらに所定の安定性基準を満たさない場合には当該検体を除外する命令信号を製造ライン制御部106に対して送信する処理も行う点で相違する。
【0083】
図17に示す安定性予測装置100が行う処理のフローチャートを、図18に示す。なお、この実施形態では、検量モデルは既に生成されてハードディスク16に記憶されているものとする。
【0084】
図18に示すように、図3のステップS16と同様に、製造ライン制御部106の信号を受けた処理コンピュータ104のCPU10は、製造ラインの各検体について、近赤外スペクトル測定手段102を制御することにより、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを受信し、これをハードディスク16に記憶する(ステップS20)。
【0085】
処理コンピュータ104のCPU10は、ステップS16により得られた近赤外スペクトルデータを、ステップS14で生成した検量モデルに適用することより、検量モデルと同一条件で検体を保存した後における前記特定指標の予測値を算出する(ステップS22)。
【0086】
さらに、処理コンピュータ104のCPU10は、特定指標の予測値がハードディスク16に記憶された医薬品製剤の安定性基準を満たすか否か、例えば、類縁物質量の予測値が医薬品製剤の安定性基準である規格以内であるか否かを判定し(ステップS24)、当該規格を満たさないものについては(ステップS24のNo)、製造ラインから当該検体を削除するように製造ライン制御部106(例えば、バイアルを廃棄ラインに押し出すシリンダーを作動させるためのコンプレッサー、図示せず)を制御する(ステップS26)。
【0087】
処理コンピュータ104のCPU10は、安定性基準を満たすと判断した場合(ステップS24のYes)、次の検体が製造ラインに存在するか否かを判断し(例えば、図17のセンサー108により感知)、さらに、存在する場合には次の検体についてステップS20からの処理を繰り返す(ステップS28のYes)。一方、次の検体が存在しない場合には処理を終了する(ステップS28のNo)。
【図面の簡単な説明】
【0088】
【図1】この発明の安定性予測装置100のハードウェア構成を示す図である。
【図2】検量パラメータDB32に記憶されるパラメータの例を示す図である。
【図3】この発明の安定性予測装置100が行う処理のフローチャートである。
【図4】測定される近赤外スペクトルデータの原スペクトルを示す図である。
【図5】図5Aは、図4に示す対象物の近赤外スペクトル(原スペクトル)を微分したデータ例を示す図であり、図5Bは、図5Aに対応するローディングスペクトルを示すグラフである。
【図6】分析する特定波数領域(分析領域)が異なる場合における相関性の差を示す表である。
【図7】図7は、保存後に測定した近赤外スペクトルから予測される類縁物質量の相関性と、保存前(製造直後)に測定した近赤外スペクトルから予測される類縁物質量の相関性を示す表である。
【図8】実施例1において、検量モデル生成に用いた予測値および実測値のデータを評価し、検量線を描いた図である。
【図9】実施例1において、保存後における類縁物質量の予測値と実測値の結果を示す表である。
【図10】実施例1において、保存後における類縁物質量の予測値と実測値の相関性を示すグラフである。
【図11】実施例2において、検量モデル生成に用いた予測値および実測値のデータを評価し、検量線を描いた図である。
【図12】実施例2において、保存後における類縁物質量の予測値と実測値の結果を示す表である。
【図13】実施例2において、保存後における類縁物質量の予測値と実測値の相関性を示すグラフである。
【図14】実施例3において、検量モデル生成に用いた予測値および実測値のデータを評価し、検量線を描いた図である。
【図15】実施例3において、保存後における類縁物質量の予測値と実測値の結果を示す表である。
【図16】実施例3において、保存後における類縁物質量の予測値と実測値の相関性を示すグラフである。
【図17】この発明の安定性予測方法を医薬品製剤の生産方法に適用した場合における安定性予測装置100のハードウェア構成を示す図である。
【図18】図17に示す安定性予測装置100が行う処理のフローチャートを示す図である。
【図19】図19は、ある医薬品製剤を製造した3ロットからそれぞれ測定した類縁物質量の初期値、および各ロットの製剤を一定条件で保存した後の類縁物質量を比較した表である。
【図20】図19の長期保存試験における保存期間と類縁物質量との関係を示すグラフである。
【符号の説明】
【0089】
100・・・・安定性予測装置
102・・・・近赤外スペクトル測定手段
103・・・・検体バイアル
104・・・・処理コンピュータ
106・・・・製造ライン制御部
【技術分野】
【0001】
この発明は、近赤外スペクトルを用いた非破壊分析技術に関し、特に、医薬品製剤の安定性を予測するための技術に関する。
【背景技術】
【0002】
近年、非破壊分析による化学分析法として、対象物に近赤外光を照射して得られる近赤外スペクトルを用いた方法が注目されている(特許文献1〜4)。近赤外光は波長が可視光より長く、赤外光のうち波長の短い範囲の電磁波光であり、エネルギーの低い電磁波でありながら吸収が極めて小さく物質を透過しやすいという性質から、化学だけでなく、食品、農業などの幅広い分野における非破壊分析に利用されている。
【0003】
例えば、特許文献1、2には、リアルタイムで測定した近赤外スペクトルを利用して、生産プラントの運転制御を精度良く行うことが開示されている。特許文献3には、潤滑剤の近赤外スペクトルを測定しこれを所定の検量モデルに適用することで、未知潤滑剤の性状、性能などが推定できることが開示されている。特許文献4には、穀物サンプルに近赤外スペクトルを照射して穀物の内部品質などを評価することが開示されている。
【0004】
【特許文献1】特開2000−298512号公報
【0005】
【特許文献2】特表WO02/012969号公報
【0006】
【特許文献3】特開平11−194124号公報
【0007】
【特許文献4】特開平06−144264号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、特許文献1〜4のいずれにおいても近赤外分析による対象物の評価を行ってはいるが、これらはあくまで「スペクトル測定時点における対象物の評価」を行っているに過ぎず、経時的変化を考慮した予測を行うものは存在しなかった。
【0009】
一方、医薬品製剤の安定性は、一般的に保存により湿度、温度、光などの様々な環境要因に影響を受けやすい、あるいは品質、安全又は有効性に影響を与えるような対象によって評価する。しかし、バイアル全体に占める類縁物質量の割合で判定される場合(例えば、予め類縁物質の規格が設定されており、一定期間保存後の類縁物質量が規格を超えた製剤は安定性を満たさない不良品とされる等の基準がある。)、医薬品製剤について製造直後の類縁物質量自体は以降の安定性には直接的に関連していない場合があり、安定性予測が困難と考えられるような要因があった。
【0010】
図19は、ある医薬品製剤を製造した3ロットからそれぞれ実測した類縁物質量の初期値、および各ロットの製剤を一定条件で保存した後に実測した類縁物質量を比較した表である。図20は、図19に示す長期保存試験での保存期間と類縁物質量との関係を示すグラフである。
【0011】
図19、図20に示すように、製剤ロット2、3についてみると類縁物質量の初期値はほぼ同じであるが、長期保存試験の12箇月後においては類縁物質量(平均値、最大量及び範囲)の数値が異なっている。一方で、製剤ロット1、3についてみると類縁物質量の初期値は異なっているが、長期保存試験においては類縁物質量の数値が同等になっている。なお、図19に示す加速試験では製剤ロット2、3の類縁物質量がほぼ同じ値を示しているが、製剤ロット1のみが異なる高い値を示している。
【0012】
以上のように、製造直後の類縁物質量と、保存後の類縁物質量との間には関連性を見出すことができず安定性の予測は困難な場合があった。一方、医薬品製剤の安定性については法令等で基準が明確に定められており、医薬品製剤の保存後における安定性を、精度良く予測する有効な手段が求められていた。
【課題を解決するための手段】
【0013】
(1)この発明の安定性予測方法は、
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
前記特定指標値算出工程で得られた前記特定指標の予測値および医薬品製剤の安定性評価基準を比較することにより、検体が所定期間経過後における安定性を満たすか否かを判定する安定性判定工程、
を備えたことを特徴とすることを特徴とする。
【0014】
これにより、近赤外スペクトルを利用した非破壊検査で算出した特定指標を用いて、将来における医薬品製剤の安定性を精度良く予測することができる。
【0015】
(2)この発明の安定性予測方法は、
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とすることを特徴とする。
【0016】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、精度良く算出することができる。
【0017】
(3)この発明の安定性予測方法は、
前記特定指標値算出工程において前記検量モデルに適用される近赤外スペクトルの波数領域が、7500cm−1〜4400cm−1の範囲である、
ことを特徴とする。
【0018】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、汎用的、かつ、精度良く算出することができる。
【0019】
(4)この発明の安定性予測方法は、
前記特定指標値算出工程において前記検量モデルに適用される近赤外スペクトルの波数領域が、相関係数が高い波数領域を選定することにより決定される、
ことを特徴とする。
【0020】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、効果的、かつ、精度良く算出することができる。
【0021】
(5)この発明の安定性予測方法は、
前記医薬品製剤は、塩酸アムルビシン凍結乾燥製剤であり、
前記特定指標は、類縁物質である脱糖体の量である、
ことを特徴とする。
【0022】
これにより、将来における塩酸アムルビシン凍結乾燥製剤の安定性を予測するための指標である類縁物質量(脱糖体の量)を、近赤外スペクトルを利用した非破壊検査で、精度良く算出することができる。
【0023】
(6)この発明の医薬品製剤の生産方法は、
前記安定性予測方法を用いた医薬品製剤の製造方法であって、
前記安定性判定工程において、所定の安定性基準を満たさないと判定された検体については生産ラインから除外する、
ことを特徴とする。
【0024】
これにより、近赤外スペクトルを利用した非破壊検査で算出した特定指標を用いて、将来における医薬品製剤の安定性を精度良く予測し、安定性基準を満たさない医薬品を生産ラインから取り除くことができる。
【0025】
(7)この発明の安定性予測方法は、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより生成された検量モデルを記憶した記憶部、を備えたコンピュータを用いて医薬品製剤の安定性を予測するための安定性予測方法であって、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記記憶部に記憶された検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする。
【0026】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、精度良く算出することができる。
【0027】
(8)この発明の安定性予測方法は、
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと類似条件で(すなわち、同じ保存条件(温度、湿度)で、検量モデル生成工程における保存期間とは異なる期間)検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする。
【0028】
これにより、将来における医薬品製剤の安定性を予測するための指標を、近赤外スペクトルを利用した非破壊検査で、精度良く算出することができる。
【0029】
なお、この実施形態において「保存前」とは、医薬品製剤を製造した直後であって、対象物に近赤外スペクトルに影響を与えるような化学的、物理的変化が生じるまでの状態を意味する。また「安定性」とは、温度、湿度、光などの様々な環境要因の影響の下で品質を維持する度合のことである。
【0030】
なお、この実施形態において「同一条件」とは、検量モデル生成用の試料と安定性を予測する対象となる試料の間で、保存期間及び保存条件(温度、湿度)が同じことをいい、「類似条件」とは、検量モデル生成用の試料と安定性を予測する対象となる試料の間で、保存条件(温度、湿度)が同じで保存期間が異なることをいう。
【発明を実施するための最良の形態】
【0031】
[安定性予測装置のハードウェア構成]
図1は、この発明の安定性予測方法を実行する安定性予測装置100のハードウェア構成を示す図である。図1に示すように、安定性予測装置100は、バイアル103に入った対象物(医薬品製剤の検体)の近赤外スペクトルを測定するための近赤外スペクトル測定手段102と、近赤外スペクトル測定手段102に接続された処理コンピュータ104とで構成されている。
【0032】
図1に示す近赤外スペクトル測定手段102は、処理コンピュータ104とデータ送受信が可能な分光光度計で、一般的に市販されているものを用いることができる。なお、近赤外スペクトルの測定方式としては、透過測定や拡散反射測定などが存在するが、液剤の場合は透過測定を行うことが好ましく、厚みのある固形製剤は拡散反射測定を行うことが好ましい。
【0033】
図1に示すように、処理コンピュータ104は、CPU10、RAM12、ディスプレイ14、ハードディスク16、キーボード/マウス18、通信回路20などを備えており、近赤外スペクトル測定手段102から受けた対象物の近赤外スペクトルデータに基づいて後述する種々の処理を行うための装置である。
【0034】
また、図1に示すように、ハードディスク16には安定性データ算出プログラム30および検量パラメータDB32が記憶されている。なお、安定性データ算出プログラム30などのハードディスク16へのインストールは、記録媒体(図示せず)に記録されたプログラムを読み出して行われる。
【0035】
安定性データ算出プログラム30としては、ケモメトリクス法に基づく検量モデル(検量式)の生成処理や、当該検量モデルを利用した安定性データの算出処理、検体が所定の安定性基準を満たすか否かを判断する処理などを行うための市販ソフトウェアを用いることができる。
【0036】
また、図1に示す検量パラメータDB32には、図2に示すような検量モデルを生成するための各パラメータが記憶される。図2に示すdata1(X1,X2,…Xk)は、所定の各波数(V1,V2,…Vk)における近赤外スペクトルの吸光度の値であり試料番号1〜Nのそれぞれについて近赤外スペクトル測定手段102で測定した値が記憶される。data2(M1,M2,…Mn)は各試料について保存後に実測された特定指標の実測値Mである。data3(W11,W21,…Wk1など)は各波数(V1,V2,…Vk)における重みを示す係数(ローディングスペクトルの数値)であり、data4(B0,B1,…Bn)は検量モデル(検量式)を構成する偏回帰係数である。なお、Bnのnには回帰に最適な主成分(後述する)の数が設定される。図2に示す各パラメータ項目の詳細や算出方法については、以下のフローチャートにおいて説明する。
【0037】
[安定性予測処理のフローチャート]
図1に示す安定性予測装置100のプログラム30が行う処理のフローチャートを、図3に示す。なお、本発明における安定性予測の対象は、医薬品製剤であり、特に後述の実施例1〜3においては、特に注射剤の塩酸アムルビシン凍結乾燥製剤を具体例として実験を行った。
【0038】
まず、近赤外スペクトル測定手段102に検量モデル生成用の検体が用意されると、作業者の操作入力に基づいて、用意された当該検体について保存前の近赤外スペクトルが測定される(ステップS10)。ここで測定された近赤外スペクトルデータdata1は、近赤外スペクトル測定手段102から処理コンピュータ104に送信され、予め設定された各波数(V1,V2,…Vk)に対応付けて吸光度X(図2のX11,X12,…X1kなど)の値がハードディスク16の検量パラメータDB32に記憶される。
【0039】
図4に、ステップS10において測定される近赤外スペクトルデータdata1の原スペクトルを示す。図4では、多数のバイアル103から測定された複数の近赤外スペクトルデータdata1を重ねて表示している。なお、適正な検量モデルを作成するためには、検量モデル生成用の検体は、1ロットでも可能であるが、複数のロットを用いることが好ましく、例えば3ロット以上を用いて作成することが好ましい。また、1ロットあたりの検体(バイアル)数も多いほうが好ましく、通常は5バイアル以上を用いることが好ましい。
【0040】
つぎに、当該検量モデル生成用の検体を特定条件で所定期間保存した後、当該検体の特定指標を実測し(つまり、従来分析法の測定を行い)、得た実測値M、data2(図2を参照)を各試料に対応づけて記憶する(ステップS12)。
【0041】
具体的には、ステップS12において保存前の近赤外スペクトルを測定した後、作業者が一旦検体を別の場所に移動させて所定の保存期間(第1時点から第2時点)で、かつ、特定の保存条件(例えば、温度40℃/75%RH)で保存する。その後、作業者が、特定指標を実測して得た実測値データをキーボード/マウス18を介して入力し、ハードディスク16の検量パラメータDB32に記憶する。ここで用いる特定指標の実測(従来分析法の測定)方法としては、例えば、類縁物質量にはHPLCなどを用いることができる。
【0042】
また、本発明における実測(従来分析法の測定)の対象となる特定指標としては、保存の時間的経過により変化し、品質の指標となる数値、つまり安定性評価の基準となる指標であればよい。上記特定指標の具体例は、例えば、類縁物質量であり、特に、医薬品製剤が塩酸アムルビシン凍結乾燥製剤の場合には、類縁物質の一つである脱糖体の量が好ましい。これら特定指標は、対象とする医薬品製剤毎に、適宜選定する必要がある。
【0043】
なお、上記検体バイアルの保存、保存後の実測、データ入力の一連または各工程を作業者が行わず機械的に自動で行うことも可能である。また、特定指標の実測(ステップS12)を前述の近赤外スペクトルの測定(ステップS10)と並行して、または前述の近赤外スペクトルの測定(ステップS10)より先に行うことも可能である。
【0044】
処理コンピュータ104の安定性データ算出プログラム30(図1)は、さらに、ステップS10で得た保存前の近赤外スペクトルデータdata1(図2)と、ステップS12で得た保存後の特定指標を示す実測値データdata2(図2)と、を用いて多変量解析を行うことにより、検量モデル(検量式)を生成してハードディスク16に記憶する(ステップS14)。
【0045】
検量モデルとは、測定した近赤外スペクトル間のわずかな違いを元にケモメトリクス法(多変量解析)で分析することで作成される近赤外スペクトルデータと測定成分の分析値との間の数学的関係式である。具体的には、近赤外分析で得られる近赤外スペクトルから医薬品製剤及び目的に応じて決められる分析領域の各波数V(V1,V2,…Vk)における吸光度データX(図2のX1,X2,…Xk)を選び、これらのデータと従来分析法の測定値M(図2のM1,M2,…MN)とを用いて多変量解析(例えば、PLS法によるデータ処理)を行うことにより得られる相関式(図2のパラメータdata3, data4で構成)であり、次式(β)で表される。
【0046】
Y=B0+B1*Z1+B2*Z2+・・・+Bn*Zn・・・(β)
ここで、目的変数Yは、予想しようとする値、すなわち類縁物質量である。偏回帰係数B(B0,B1,B2,…Bn、図2のdata4)は、説明変数Z(Z1,Z2,…Zn)にかけられる重みであり、実測値Mとの差(残差)の2乗和が最小になるように最小二乗法により求められる。
【0047】
また、説明変数Z(Z1,Z2,…Zn)は、主成分解析における第n主成分のZ値、Z=X1*W1+X2*W2+・・・+Xk*Wk、で表される(なお、X:近赤外スペクトルの吸光度、W:係数)。ここで、第一主成分の係数(W1,W2,…Wk)は、第一主成分として最もデータの分散の大きい方向(最も吸光度の差の大きい方向)に軸をとって、第1主成分をZ1=X1W11+X2W21+・・・+XkWk1として吸光度X(X1,X2,…Xk)の値を代入したときに、各試料(試料番号1〜N)について算出したZ11〜ZN1の値、[数1]の分散が最大となるような値を演算することで得られる。
【0048】
【数1】

【0049】
さらに、必要に応じて第n主成分まで各主成分における係数Wが求められ、ハードディスク16に記憶される。なお、図2に示す検量パラメータDB32には、第一主成分について算出した係数W(W11,W21,…Wk1)だけを示している。
【0050】
以上のステップS10〜ステップS14までが、保存前に測定した近赤外スペクトルデータと保存後に実測した実測値に基づいて、検量モデル(検量式)が生成されるまでの工程である。以降のステップでは、当該検量モデルに基づいて医薬品製剤の検体について安定性が予測されることになる。
【0051】
処理コンピュータ104のCPU10は、用意した安定性を予測しようとする医薬品製剤の検体について近赤外スペクトルを測定するように、近赤外スペクトル測定手段102を制御する(ステップS16)。これにより、処理コンピュータ104は当該近赤外スペクトルデータを受信し、各波数(V1,V2,…Vk)に対応付けた吸光度X’(X'1,X'2,…X'k)の値をハードディスク16に記憶する。
【0052】
処理コンピュータ104のCPU10は、さらに、ステップS16により得られた近赤外スペクトルを、ステップS14で生成した検量モデルに適用することにより、検量モデルと同一条件で検体を保存した後における前記特定指標の予測値M’を算出する(ステップS18)。具体的には、安定性を予測しようとする医薬品製剤の検体から測定した近赤外スペクトルデータの吸光度X’の値(X'1,X'2,…X'k)を検量モデル(前述の検量式(β))に代入してYの値を演算する。このYの値が特定指標の予測値M’となる。
【0053】
最後に、処理コンピュータ104のCPU10は、特定指標の予測値M’が安定性基準を満たすか否かを判断し(ステップS19)、その合否結果がディスプレイ14に表示されることになる。具体的には、作業者が入力したりハードディスク16に予め記憶された所定の安定性基準を示すデータを読み出して、特定指標の予測値M’が所定の基準値を超える場合には安定性を満たさないと判断し、所定の基準値内であれば安定性を満たすと判断する。なお、処理コンピュータ104はステップS18までの処理を行うこととし、ステップS18で算出した特定指標の予測値M’を見た作業者が当該判断を行うようにすることも可能である。
【0054】
以上のように、検量モデルを一旦生成すれば、予測しようとする対象物の近赤外スペクトルデータXを検量モデルに適用することで予測値Yが容易に算出され、将来における医薬品製剤の安定性予測を精度良く行うことができる。
【0055】
なお、一般に、近赤外光の波数領域は12500cm−1〜3600cm−1であるが、検量モデルの生成においては、その一部を評価に用いてもよく、特に、7500cm−1〜4400cm−1の範囲を選定すると汎用的でかつ精度が良いため、より好ましいと考えられる。これは、7500cm−1〜4400cm−1の範囲外では、比較的ノイズが大きいため省略する方が予測精度が向上するためと考えられる。また、以下に示すように、特定波数領域として2以上の特定波数領域を選定することも可能である。
【0056】
図6を用いて、分析する近赤外スペクトルの特定波数領域(分析領域)が異なる場合における相関性(相関係数)の差について説明する。図6は、20℃/60%RHで12箇月保存したある同一医薬品製剤の検体につき、近赤外スペクトルの分析領域を、7500cm−1〜4400cm−1、7200cm−1〜6900cm−1、5400cm−1〜4400cm−1、7200cm−1〜6900cm−1および7200cm−1〜6900cm−1(2つの波数領域)とした場合に、実験結果として得られる相関係数の違いを示す表である。
【0057】
図6に示すように、上記各波数領域から検量モデルを作成した結果、広範囲の分析領域7500cm−1〜4400cm−1で評価を行った場合に、相関係数Rが0.8606と最も高く、より高い相関性が得られることが確認された。図6に示すように、次に相関係数Rの値が高いのは5400cm−1〜4400cm−1であり、5400cm−1〜4400cm−1の波数領域に安定性予測に影響する因子が多く含まれていると考えられる。しかしながら、5400cm−1〜4400cm−1で特に寄与が大きかった波数ピーク(例えば図5A、Bに示す5240cm−1、5120cm−1)付近だけで同様の実験を行ってみたが、相関係数Rの値は0.5程度となり、上記広範囲の波数を分析した場合のような良い結果が得られないことが分かった。なお、図5Aは、図4に示す対象物の近赤外スペクトル(原スペクトル)を微分したデータ例を示す図であり、図5Bは、図5Aに対応するローディングスペクトルを示すグラフである。上記分析領域の選択は、図5Bに示すローディングスペクトルの絶対値が大きい部分を検量モデルの相関性に寄与する部分として抽出することにより行った。
【0058】
以上のように、より広い波数領域全体でスペクトルを評価すると良い結果が得られた理由は、波数領域を広くとることで、安定性に影響を及ぼす化学構造や不均一性等の物理化学的特徴など多くの情報を評価に用いることを可能としているためと考えられる。
【0059】
つぎに、図7を用いて、本発明において保存後でなく保存前(製造直後)に近赤外スペクトルを測定した理由を説明する。図7は、保存後に測定した近赤外スペクトルから予測される類縁物質量の相関性と、保存前(製造直後)に測定した近赤外スペクトルから予測される類縁物質量の相関性を示す表である。なお、図7には、同一の医薬品製剤(塩酸アムルビシン凍結乾燥製剤)について異なる3条件(実施例aは25℃/60%RHで6箇月、実施例aは25℃/60%RHで12箇月、実施例cは40℃/75%RHで6箇月)で保存した場合についての結果を示す。
【0060】
図7に示すように、保存後のスペクトルを測定し分析することにより予想される類縁物質量は保存前のスペクトルを測定した場合に比して相関係数が著しく低いという結果が得られた。これは、特に凍結乾燥製剤は不安定な製剤であるため、製造直後の近赤外スペクトルを測定することが望ましく、保存後に相関性が低くなるためと考えられる。また、化学構造や不均一性などの物理化学的特徴が製造直後の近赤外スペクトルには現れているが、保存後は水分増加や他の化学物質の増加といった要因によりそのような元々の状態が崩れてしまうためとも推測される。
【0061】
[実施例1]
実施例1は、塩酸アムルビシン凍結乾燥製剤(50mg製剤、3ロット)について、2ロットから検量モデルを生成し、残り1ロットの安定性を予測した場合を示す例である。
【0062】
凍結乾燥製剤の製造は、例えばWO2004/050098に記載の方法により行うことができる。すなわち、アムルビシンまたはその塩、L−システインまたはその塩、および必要に応じ賦型剤などを注射用蒸留水に溶解し、微量の塩基および/または酸でpH調整した後、無菌濾過した液をバイアル瓶に充填して凍結乾燥を施し粉末状態で製剤とするものである。注射剤はこの状態で保存が行われ、用時水に溶解されて投与に使用される。なお、アムルビシンはまたはその塩を含有する凍結乾燥製剤は、癌化学療法剤として、種々の癌疾患の治療に用いることができる。
【0063】
当該医薬品製剤の検量モデル用2ロット、計18個について、保存前に近赤外分光光度計により近赤外スペクトルを測定した。近赤外分析は、ブルカー・オプティクス株式会社製「近赤外分光光度計MPA」(商標)により、拡散反射測定で分析領域7500cm−1〜4400cm−1の範囲で実施し、得られた近赤外スペクトルについて一次微分処理及び正規化処理を行った。
【0064】
上記検体について、25℃/60%RHで6箇月保存し、従来分析法である液体クロマトグラフィーにより、類縁物質量の実測(従来分析法による脱糖体量の測定)を行った。3ロット用意したうちの2ロットを用いた。
【0065】
以上より、近赤外分析で得られた近赤外スペクトルと、液体クロマトグラフィー(HPLC)で得られた類縁物質量とを用いて、ブルカー・オプティクス株式会社製「OPUS分光ソフトウェア」(商標)によりPLS法で検量モデルを生成した。図8に、実施例1で生成した検量モデルによって描いた検量線および予測値と実測値をプロットしたものを示す。
【0066】
さらに、当該医薬品製剤の安定性未知の検体1ロット(用意した3ロットの残り)、計18個について、保存前に近赤外スペクトルを測定し、得られた近赤外スペクトルデータと上記で作成した検量モデルより、検体の「25℃/60%RH−6箇月」保存後の類縁物質量を予測した。得られた保存後類縁物質量、予測値を評価する目的で、上記安定性未知の検体について、「25℃/60%RH−6箇月」保存し、従来分析法であるHPLC(液体クロマトグラフィー)により、類縁物質量を測定し、類縁物質量と実測値を取得した。
【0067】
保存後における類縁物質量の予測値と実測値の結果及びその相関性をそれぞれ図9及び図10に示した。実験の結果、図10のように全体として相関性が高く(相関係数R=0.7459)、安定性予測が高精度で行われているという結果が得られた。
【0068】
[実施例2]
実施例1と同様にして、保存の期間を12箇月に変更して実施し、作成した検量モデルによって描いた検量線および予測値と実測値を評価したものを図11に、並びに保存後における類縁物質量の予測値と実測値の結果及びその相関性をそれぞれ図12及び図13に示した。
【0069】
図13に示すように、実施例2においても実施例1と同様、全体として相関性が高く(相関係数R=0.8668)、安定性予測が高精度で行われているという結果が得られた。
【0070】
[実施例3]
実施例1と同様にして、検量モデル用2ロット、計30個の検体を用い、保存の条件及び期間を「40℃/75%RH−1箇月」に変更して実施し、作成した検量モデルによって描いた検量線および予測値と実測値を評価したものを図14に、並びに保存後における類縁物質量の予測値と実測値の結果及びその相関性をそれぞれ図15及び図16に示した。
【0071】
図16に示すように、実施例3においても実施例1、2と同様、全体として相関性が高く(相関係数R=0.7443)、安定性予測が高精度で行われているという結果が得られた。
【0072】
[その他の実施形態]
なお、近赤外スペクトルの評価方法としては、原スペクトルのまま評価したり、ノイズなど不要なスペクトル変動を低減するために微分処理や正規化処理、平滑化などの前処理を行った後でケモメトリクス法による分析を行ってもよく、試料に応じて最適な処理方法を設定すればよいが、測定の再現性が良好でない場合や外部環境の影響を受けやすい場合は、微分処理や正規化処理を行うほうが好ましい。
【0073】
図5Aは、図4に示す近赤外スペクトルデータ(原スペクトル)を一次微分したデータ例を示す図であり、図5Bは、図5Aにおいて各波数が検量モデルへの寄与を示すローディングスペクトル(安定性データ算出プログラム30が部分最小2乗法により重みを付加)を示すグラフである。特に検量モデルの相関性に寄与すると考えられる波数領域を図5Bにおいて破線で示す。なお、各波数の近赤外スペクトルの吸光度X(図5A)とローディングスペクトルの数値、係数W(図5B)を掛け合わせて足した合計が前述のZ値である。
【0074】
なお、上記実施形態では、ケモメトリクス法として、部分最小二乗回帰分析法(PLS分析法(Partial least squares))を用いたが、主成分分析法(PCA法(Principal component analysis))、線形重回帰分析法(MLR分析法)、主成分回帰分析法(PCR法(Principal component regression))、フーリエ変換回帰分析法(FTR法(Fourier transform regression))、等を用いることもできる。
【0075】
なお、上記実施形態では、注射剤である塩酸アムルビシン凍結乾燥製剤を具体例として説明したが、安定性予測の対象となる医薬品製剤はこれに限られない。本発明の安定性予測の対象となる医薬品製剤としては、例えば、錠剤、カプセル剤、顆粒剤、丸剤、散剤、液剤、シロップ剤、トローチ剤、懸濁剤、乳剤、注射剤(凍結乾燥製剤、粉末充填製剤、注射用水性剤など)、坐剤、軟膏剤又は貼付剤等、通常用いられる種々の医薬品製剤を挙げることができる。好ましくは注射用製剤、特に好ましくは凍結乾燥製剤である。
【0076】
なお、上記実施形態では、実測(従来分析法の測定)の対象を類縁物質量としたが、本発明における実測(従来分析法の測定)の対象となる特定指標としては、保存の時間的経過により変化し、品質の指標となる数値、つまり安定性評価の基準となる指標であればよい。具体的には、例えば、類縁物質量の他、有効成分含量、水分量等が挙げられ、錠剤であれば溶出性、液剤であればpHなども挙げられる。これら特定指標は、対象とする医薬品製剤毎に、適宜選定する必要がある。
【0077】
なお、上記実施形態では、図3のステップS12における特定指標の実測(従来分析法の測定)方法としては、類縁物質量にはHPLC等を用いたがこれに限定されるものではない。また、その他、有効成分含量にはHPLC等を、水分量にはカールフィッシャー法等を、溶出性にはパドル法、回転バスケット法、フリースルーセル法等を、pHには水素電極法等を用いることができる。
【0078】
なお、上記実施形態では、保存条件を40℃/75%RH(図3のステップS12)等としたが、これに限定されるものではなく、30℃/65%RH、25℃/60%RH等が挙げられる。また、保存期間の例としては、1週間、2週間、1箇月、3箇月、6箇月、9箇月、12箇月、18箇月、24箇月、30箇月、36箇月等が挙げられる。また、これらの組み合わせとしては、40℃/75%RH−2週間や40℃/75%RH−1箇月、25℃/60%RH−6箇月や25℃/60%RH−12箇月が挙げられる。なお、このような保存の特定条件並びに保存の所定期間は、検体の性質に応じて適宜変動させることが好ましい。
【0079】
なお、上記実施形態では、実測した検体の保存期間と同一期間保存後の安定性(「同一条件」での保存後の安定性)を検量モデルを適用して予測したが、経時的変化のプロファイルが既知の場合、検量モデル生成時に実測する保存期間とは異なる期間保存後の安定性(「類似条件」での保存後の安定性)を予測するようにしてもよい。例えば、1つの検量モデル又は保存期間が異なる2つの検量モデルを基に(1)実施例1で得られる予測値に保存期間の比率を乗算する、(2)実施例1で得られる予測値と実施例2で得られる予測値とから補間することにより、実施例1の保存期間(6箇月)と実施例2の保存期間(12箇月)との間の任意の保存期間における安定性を予測する、(3)図19および図20に示されるような、異なる保存期間における特定指標の実測値間の関係より、単に比例関係ではない保存期間と特定指標の関係を推定し、その関係式から異なる保存期間の予測を行う、などの方法により、検量モデル生成時に実測する保存期間とは異なる期間を経過した後の安定性を予測することも可能である。
【0080】
なお、上記実施形態では、医薬品製剤の安定性を処理コンピュータ104によって予測することとしたが、かかる安定性予測方法を工場などにおける医薬品製剤の製造ラインで利用することも可能である。
【0081】
図17は、この発明の安定性予測方法を医薬品製剤の生産方法に適用した場合における安定性予測装置100のハードウェア構成を示す図である。安定性予測装置100は、図1に示すものと同様、すなわち対象物の近赤外スペクトルを測定するための近赤外スペクトル測定手段102と、近赤外スペクトル測定手段102に接続された処理コンピュータ104とで構成されているが、さらに製造ラインを制御するための製造ライン制御部106に接続されている点で相違する。なお、図17に示す近赤外スペクトル測定手段102は、製造ラインにおいて製造された医薬品製剤を入れた各バイアルの近赤外スペクトルが測定できるように配置される。
【0082】
また、図17に示すハードディスク16に記憶された安定性データ算出プログラム30は、ケモメトリクス法に基づく検量モデル(検量線)の生成処理や、検量モデルに基づいた安定性データの算出処理、検体が所定の安定性基準を満たすか否かを判断する処理だけでなく、さらに所定の安定性基準を満たさない場合には当該検体を除外する命令信号を製造ライン制御部106に対して送信する処理も行う点で相違する。
【0083】
図17に示す安定性予測装置100が行う処理のフローチャートを、図18に示す。なお、この実施形態では、検量モデルは既に生成されてハードディスク16に記憶されているものとする。
【0084】
図18に示すように、図3のステップS16と同様に、製造ライン制御部106の信号を受けた処理コンピュータ104のCPU10は、製造ラインの各検体について、近赤外スペクトル測定手段102を制御することにより、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを受信し、これをハードディスク16に記憶する(ステップS20)。
【0085】
処理コンピュータ104のCPU10は、ステップS16により得られた近赤外スペクトルデータを、ステップS14で生成した検量モデルに適用することより、検量モデルと同一条件で検体を保存した後における前記特定指標の予測値を算出する(ステップS22)。
【0086】
さらに、処理コンピュータ104のCPU10は、特定指標の予測値がハードディスク16に記憶された医薬品製剤の安定性基準を満たすか否か、例えば、類縁物質量の予測値が医薬品製剤の安定性基準である規格以内であるか否かを判定し(ステップS24)、当該規格を満たさないものについては(ステップS24のNo)、製造ラインから当該検体を削除するように製造ライン制御部106(例えば、バイアルを廃棄ラインに押し出すシリンダーを作動させるためのコンプレッサー、図示せず)を制御する(ステップS26)。
【0087】
処理コンピュータ104のCPU10は、安定性基準を満たすと判断した場合(ステップS24のYes)、次の検体が製造ラインに存在するか否かを判断し(例えば、図17のセンサー108により感知)、さらに、存在する場合には次の検体についてステップS20からの処理を繰り返す(ステップS28のYes)。一方、次の検体が存在しない場合には処理を終了する(ステップS28のNo)。
【図面の簡単な説明】
【0088】
【図1】この発明の安定性予測装置100のハードウェア構成を示す図である。
【図2】検量パラメータDB32に記憶されるパラメータの例を示す図である。
【図3】この発明の安定性予測装置100が行う処理のフローチャートである。
【図4】測定される近赤外スペクトルデータの原スペクトルを示す図である。
【図5】図5Aは、図4に示す対象物の近赤外スペクトル(原スペクトル)を微分したデータ例を示す図であり、図5Bは、図5Aに対応するローディングスペクトルを示すグラフである。
【図6】分析する特定波数領域(分析領域)が異なる場合における相関性の差を示す表である。
【図7】図7は、保存後に測定した近赤外スペクトルから予測される類縁物質量の相関性と、保存前(製造直後)に測定した近赤外スペクトルから予測される類縁物質量の相関性を示す表である。
【図8】実施例1において、検量モデル生成に用いた予測値および実測値のデータを評価し、検量線を描いた図である。
【図9】実施例1において、保存後における類縁物質量の予測値と実測値の結果を示す表である。
【図10】実施例1において、保存後における類縁物質量の予測値と実測値の相関性を示すグラフである。
【図11】実施例2において、検量モデル生成に用いた予測値および実測値のデータを評価し、検量線を描いた図である。
【図12】実施例2において、保存後における類縁物質量の予測値と実測値の結果を示す表である。
【図13】実施例2において、保存後における類縁物質量の予測値と実測値の相関性を示すグラフである。
【図14】実施例3において、検量モデル生成に用いた予測値および実測値のデータを評価し、検量線を描いた図である。
【図15】実施例3において、保存後における類縁物質量の予測値と実測値の結果を示す表である。
【図16】実施例3において、保存後における類縁物質量の予測値と実測値の相関性を示すグラフである。
【図17】この発明の安定性予測方法を医薬品製剤の生産方法に適用した場合における安定性予測装置100のハードウェア構成を示す図である。
【図18】図17に示す安定性予測装置100が行う処理のフローチャートを示す図である。
【図19】図19は、ある医薬品製剤を製造した3ロットからそれぞれ測定した類縁物質量の初期値、および各ロットの製剤を一定条件で保存した後の類縁物質量を比較した表である。
【図20】図19の長期保存試験における保存期間と類縁物質量との関係を示すグラフである。
【符号の説明】
【0089】
100・・・・安定性予測装置
102・・・・近赤外スペクトル測定手段
103・・・・検体バイアル
104・・・・処理コンピュータ
106・・・・製造ライン制御部
【特許請求の範囲】
【請求項1】
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
前記特定指標値算出工程で得られた前記特定指標の予測値および医薬品製剤の安定性評価基準を比較することにより、検体が所定期間経過後における安定性を満たすか否かを判定する安定性判定工程、
を備えたことを特徴とする安定性予測方法。
【請求項2】
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする安定性予測方法。
【請求項3】
請求項1または請求項2の安定性予測方法において、
前記特定指標値算出工程において前記検量モデルに適用される近赤外スペクトルの波数領域が、7500cm−1〜4400cm−1の範囲である、
ことを特徴とする安定性予測方法。
【請求項4】
請求項1〜3の何れかの安定性予測方法において、
前記特定指標値算出工程において前記検量モデルに適用される近赤外スペクトルの波数領域が、相関係数が高い波数領域を選定することにより決定される、
ことを特徴とする安定性予測方法。
【請求項5】
請求項1〜4の何れかの安定性予測方法において、
前記医薬品製剤は、塩酸アムルビシン凍結乾燥製剤であり、
前記特定指標は、類縁物質である脱糖体の量である、
ことを特徴とする安定性予測方法。
【請求項6】
請求項1の安定性予測方法を用いた医薬品製剤の製造方法であって、
前記安定性判定工程において、所定の安定性基準を満たさないと判定された検体については生産ラインから除外する、
ことを特徴とする医薬品製剤の生産方法。
【請求項7】
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより生成された検量モデルを記憶した記憶部、を備えたコンピュータを用いて医薬品製剤の安定性を予測するための安定性予測方法であって、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記記憶部に記憶された検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする安定性予測方法。
【請求項8】
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする安定性予測方法。
【請求項9】
医薬品製剤の安定性を予測するための安定性データ算出プログラムであって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成処理、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定処理、
前記近赤外スペクトル測定処理により得られた近赤外スペクトルデータを、前記検量モデル生成処理で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出処理、
をコンピュータに実行させることを特徴とする安定性データ算出プログラム。
【請求項10】
医薬品製剤の近赤外スペクトルを測定する近赤外スペクトル測定手段を有し、医薬品製剤の安定性を予測するための安定性予測装置であって、
検量モデル生成用の検体について保存前に前記近赤外スペクトル測定手段で測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成手段、
安定性予測対象となる医薬品製剤の検体について保存前における近赤外スペクトルを前記近赤外スペクトル測定手段により測定して得られた近赤外スペクトルデータを、前記検量モデル生成手段で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出手段、
を備えたことを特徴とする安定性予測装置。
【請求項1】
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
前記特定指標値算出工程で得られた前記特定指標の予測値および医薬品製剤の安定性評価基準を比較することにより、検体が所定期間経過後における安定性を満たすか否かを判定する安定性判定工程、
を備えたことを特徴とする安定性予測方法。
【請求項2】
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする安定性予測方法。
【請求項3】
請求項1または請求項2の安定性予測方法において、
前記特定指標値算出工程において前記検量モデルに適用される近赤外スペクトルの波数領域が、7500cm−1〜4400cm−1の範囲である、
ことを特徴とする安定性予測方法。
【請求項4】
請求項1〜3の何れかの安定性予測方法において、
前記特定指標値算出工程において前記検量モデルに適用される近赤外スペクトルの波数領域が、相関係数が高い波数領域を選定することにより決定される、
ことを特徴とする安定性予測方法。
【請求項5】
請求項1〜4の何れかの安定性予測方法において、
前記医薬品製剤は、塩酸アムルビシン凍結乾燥製剤であり、
前記特定指標は、類縁物質である脱糖体の量である、
ことを特徴とする安定性予測方法。
【請求項6】
請求項1の安定性予測方法を用いた医薬品製剤の製造方法であって、
前記安定性判定工程において、所定の安定性基準を満たさないと判定された検体については生産ラインから除外する、
ことを特徴とする医薬品製剤の生産方法。
【請求項7】
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより生成された検量モデルを記憶した記憶部、を備えたコンピュータを用いて医薬品製剤の安定性を予測するための安定性予測方法であって、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記記憶部に記憶された検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする安定性予測方法。
【請求項8】
医薬品製剤の安定性を予測するための安定性予測方法であって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成工程、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定工程、
前記近赤外スペクトル測定工程により得られた近赤外スペクトルデータを、前記検量モデル生成工程で生成した前記検量モデルに適用することより、前記検量モデルと類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出工程、
を備えたことを特徴とする安定性予測方法。
【請求項9】
医薬品製剤の安定性を予測するための安定性データ算出プログラムであって、
検量モデル生成用の検体について保存前に測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成処理、
安定性予測対象となる医薬品製剤の検体について、保存前における近赤外スペクトルを測定して近赤外スペクトルデータを得る近赤外スペクトル測定処理、
前記近赤外スペクトル測定処理により得られた近赤外スペクトルデータを、前記検量モデル生成処理で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出処理、
をコンピュータに実行させることを特徴とする安定性データ算出プログラム。
【請求項10】
医薬品製剤の近赤外スペクトルを測定する近赤外スペクトル測定手段を有し、医薬品製剤の安定性を予測するための安定性予測装置であって、
検量モデル生成用の検体について保存前に前記近赤外スペクトル測定手段で測定した近赤外スペクトルデータと、当該検体を特定条件で所定期間保存した後に当該検体の特定指標を実測して得た実測値データと、を用いて多変量解析を行うことにより、予め検量モデルを生成する検量モデル生成手段、
安定性予測対象となる医薬品製剤の検体について保存前における近赤外スペクトルを前記近赤外スペクトル測定手段により測定して得られた近赤外スペクトルデータを、前記検量モデル生成手段で生成した前記検量モデルに適用することより、前記検量モデルと同一条件又は類似条件で検体を保存した後における前記特定指標の予測値を算出する特定指標値算出手段、
を備えたことを特徴とする安定性予測装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公開番号】特開2009−244112(P2009−244112A)
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願番号】特願2008−91234(P2008−91234)
【出願日】平成20年3月31日(2008.3.31)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【Fターム(参考)】
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願日】平成20年3月31日(2008.3.31)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【Fターム(参考)】
[ Back to top ]

