医薬組成物、その製造方法及び徐放性基材
【課題】
本発明は、高い抗酸化作用を有する医薬組成物、その製造方法及び徐放性基材の提供を課題とする。
【解決手段】
本発明は、薬物、キトサン及びペクチン酸を含む医薬組成物及びその製造方法を提供する。好ましくは、キトサンがペクチン酸と複合化してなる医薬組成物及びその製造方法を提供する。また、キトサン及びペクチン酸を含む徐放性基材を提供する。本発明は、キトサン単体又はペクチン酸単体の徐放性基材よりも徐放性に優れ、かつ、キトサン単体の徐放性基材よりも高い抗酸化作用を有する。
本発明は、高い抗酸化作用を有する医薬組成物、その製造方法及び徐放性基材の提供を課題とする。
【解決手段】
本発明は、薬物、キトサン及びペクチン酸を含む医薬組成物及びその製造方法を提供する。好ましくは、キトサンがペクチン酸と複合化してなる医薬組成物及びその製造方法を提供する。また、キトサン及びペクチン酸を含む徐放性基材を提供する。本発明は、キトサン単体又はペクチン酸単体の徐放性基材よりも徐放性に優れ、かつ、キトサン単体の徐放性基材よりも高い抗酸化作用を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医薬組成物、その製造方法及び徐放性基材に関する。
【背景技術】
【0002】
薬物を生体内分解型高分子重合物に分散させたタイプの徐放性製剤について様々な発明がなされている。例えば、特許文献1及び2では、主に黄体形成ホルモン放出ホルモンや甲状腺ホルモン放出ホルモンの徐放性基材として、分子量分布を制御した生体内分解型脂肪族ポリエステルを用いることを開示している。
【0003】
しかしながら、高い抗酸化作用を有する徐放性基材及び医薬組成物は未だに開示されていない。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第3200706号
【特許文献2】特許第3254449号
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、高い抗酸化作用を有する医薬組成物、その製造方法及び徐放性基材を提供を課題とする。
【課題を解決するための手段】
【0006】
本発明は、薬物、キトサン及びペクチン酸を含む医薬組成物及びその製造方法を提供する。また、キトサン及びペクチン酸を含む徐放性基材を提供する。
【発明の効果】
【0007】
本発明の医薬組成物及び徐放性基材は、高い抗酸化作用を有する。
【図面の簡単な説明】
【0008】
【図1】試験例1のDPPH radical消去能の結果を示す図である。
【図2】試験例1のABTS radical消去能の結果を示す図である。
【図3】試験例1のPAO(Potential Anti Oxidant kit)による抗酸化能測定の結果を示す図である。
【図4】試験例1のAAPH酸化による酸化HSAのカルボニル基生成抑制効果の検討の結果を示す図である。
【図5】実験例1の溶出試験の結果を示す図である。
【発明を実施するための形態】
【0009】
本発明の医薬組成物は、少なくとも薬物、キトサン及びペクチン酸を含む。そして、本発明において、キトサン及びペクチン酸は、薬物を徐放する基材(徐放性基材)である。
【0010】
本発明においては、薬物は、特に限定されるものではない。薬物の一例を挙げるとするならば、例えば、気管支拡張薬、向精神薬、抗不安薬、抗うつ薬、催眠鎮静薬、抗パーキンソン薬、アレルギー用薬、歯科口腔用薬、強心薬、解熱鎮痛消炎薬、抗ヒスタミン薬、鎮咳薬、制酸薬、生薬、降圧薬、抗生物質、抗菌剤、不整脈用薬、冠血管拡張薬、末梢血管拡張薬、高脂血症用薬、利胆薬、ホルモン薬、痛風治療薬、抗リウマチ薬、化学療法薬、糖尿病用薬、鎮吐薬、抗てんかん薬、交感神経興奮薬、骨粗鬆症用薬、抗悪性腫瘍薬、免疫抑制薬、泌尿器科用薬、胃腸薬、脳代謝改善薬、脳循環改善薬、呼吸促進薬、血管収縮薬、鎮暈薬、去痰薬、中枢神経作用用薬、潰瘍治療薬、胃粘膜修復薬及び鎮痛鎮痙薬などが挙げられる。
【0011】
また、上記薬物は、化合物名で例示すると、テオフィリン、テモカプリル塩酸塩、カベルゴリン、ベシル酸アムロジピン、オメプラゾール、ランソプラゾール、ファモチジン、ラフチジン、エカベトナトリウム、クエン酸モサプリド、レバミピド、ボグリボース、リスペリドン、イミダプリル塩酸塩、メロキシカム、ミルナシプラン塩酸塩、レボフロキサシン、クラリスロマイシン、サルポグレラート塩酸塩、トスフロキサシントシル酸塩、タムスロシン塩酸塩、ミゾリビン、タクロリムス水和物、フルボキサミンマレイン酸塩、グリメピリド、ラモセトロン塩酸塩、ニコランジル、ドネペジル塩酸塩、酒石酸ゾルピデム、ピオグリタゾン塩酸塩、アレンドロン酸ナトリウム水和物、リセドロン酸ナトリウム水和物、アトルバスタチンカルシウム水和物、フルバスタチンナトリウム、ロラタジン、ロサルタンカリウム、パロキセチン塩酸塩水和物、ラベプラゾールナトリウム、リバビリン、コハク酸スマトリプタン、ペロスピロン塩酸塩水和物、フマル酸クエチアピン、オロパタジン塩酸塩、フェキソフェナジン塩酸塩、エバスチン、セフジトレンピボキシル、塩酸セフカペンピボキシル、バルサルタン、ビカルタミド及びアカルボースなどが挙げられる。
【0012】
本発明において「キトサン」とは、直鎖型の多糖類であって、グルコサミンの1,4−重合物をいう。キトサンの分子式は(C6H11NO4)nであり、また、キトサンのCAS登録番号は、[9012−76−4]である。キトサンは、製造される医薬組成物が錠剤等に加工可能な程度の成形加工性があれば、その分子量等に限定されるものではない。
【0013】
また、本発明において「ペクチン酸」とは、ガラクツロン酸がα−1,4−結合したポリガラクツロン酸が主成分としてなり、当該ガラクツロン酸のカルボキシル基がメチルエステル化されていないものをいう。ペクチン酸は、ペクチン(ガラクツロン酸のカルボキシル基がメチルエステル化されているもの)とは区別される。このペクチン酸も、製造される医薬組成物が錠剤等に加工可能な程度の成形加工性があれば、その分子量等に限定されるものではない。
【0014】
以上に説明した薬物、キトサン及びペクチン酸は、単に混合することによって容易に本発明の医薬組成物を製造することができる。混合は、例えば、各成分を融解して混合する方法、各成分の溶液を調製して混合する方法、若しくは、薬物にキトサン及びペクチン酸を噴霧又はコーティングする方法等により実施することができるが、本発明はこれら混合方法により限定されるものではない。キトサン及びペクチン酸を混合することによりキトサンが有するカチオンとペクチン酸が有するアニオンによるイオン相互作用を形成する。このイオン相互作用の形成により、本発明の医薬組成物は、組成物として安定しており、かつ徐放性を有するものと考えられる。また、両高分子は共に抗酸化作用を有するために、薬物が酸化するおそれもなくなる。
【0015】
上記3成分の混合量の設計についても、特に限定されるものではない。例えば、薬物の絶対量に関しては、各薬物の1回の服用における投与量に応じて適宜設計されるものであるので、当業者によって適宜設計されるものである。また、薬物に対するキトサン及びペクチン酸(徐放性基材)の混合量も、1回の服用における薬物の投与量を考慮しながら、ヒトが服用可能な総量となるよう、当業者によって適宜設計されるものである。
【0016】
また、徐放性基材において、キトサンに対するペクチン酸との混合比も、製造される医薬組成物が錠剤等に加工可能な程度の成形加工性があり、好ましくはイオン相互作用が形成しやすい混合比であれば、必ずしも限定されるものではない。イオン相互作用が起こりやすくすることを考慮して、混合比の具体的数値を挙げるとするならば、その混合比は、7:3〜3:7、好ましくは5:5である。
【0017】
以上に説明した医薬組成物は、例えば、錠剤、カプセル剤、顆粒剤又は散剤等の剤型に応じて、当業者によりさらなる成形加工が可能である。
【0018】
また、上述のキトサン及びペクチン酸の組み合わせは、様々な薬物を担持するための徐放性基材として産業的に利用することも可能である。当該徐放性基材は、マイクロカプセル等の材料として使用できる。また、ステント等の医療機器の表面にコーティングして、当該医療機器に薬剤の徐放性を付与することもできる。
【実施例】
【0019】
以下に、本発明の実施例が説明される。本実施例は、本発明の一実施形態であり、本発明が実施例に記載された態様に限定されないことは言うまでもない。
【0020】
[試験例1]
キトサン及びペクチン酸の抗酸化作用について確認した。結論としては、ペクチン酸の方がキトサンよりも抗酸化作用が高いことを確認した。具体的な試験手法について以下に記載する。
【0021】
1.試薬
本試験例で用いる試薬の準備については以下に示す。尚、試薬、溶媒類はすべて市販特級品を使用し、溶媒としての水はイオン交換水またはミリQ水を使用した。
【0022】
(1)キトサン
キトサンは、以下のように調整した。キトサン粉末(キトサン8B、フナコシ株式会社製))2gに1%酢酸を加えて全量を200gとし、よく撹拌しながら溶かし、キトサン1%と酢酸1%の塩を得た。これらの塩の溶液はそれぞれスプレードライヤー(パルビスGB22)を用いて、入り口温度160℃、出口温度75℃、アスピレーターの乾燥空気量0.45m3/min、噴霧圧力1.0kg/cm2の条件下で噴霧乾燥し、その後噴霧乾燥品を採取した。
【0023】
(2)ペクチン酸
ペクチン酸は、和光純薬工業より購入した。
【0024】
(3)比較対象
キトサン及びペクチン酸の比較対象として、低分子アルギン酸(紀文フードケミファ)、高分子アルギン酸(紀文フードケミファ)、アスコルビン酸(和光純薬工業、以下VC)、及び、ヒト血清アルブミン(和光純薬工業;以下HSA)を準備した。
【0025】
2.抗酸化作用試験
抗酸化作用試験は、DPPH radical消去能、ABTS radical消去能、PAO(Potential Anti Oxidant kit)による抗酸化能測定、及び、AAPH酸化による酸化HSAのカルボニル基生成抑制効果により行った。詳細な実験手法については以下に示す。
【0026】
(1)DPPH radical消去能
DPPH radical消去能はSassaら(Biochem Biophys Acta. 1573, 84-92 (2002))の報告に準じて行った。DPPH溶液は、0.25 mM 1,1-diphenyl-2-picrylhydrazyl(DPPH)溶液(in EtOH)と50 mM 2-(N-morpholino)ethanesulfonic acid buffer(pH 7.4)溶液を2 : 1の割合で混合して調製した。DPPH溶液に各サンプル及びVCを濃度依存的に添加し、20分間インキュベート後にマイクロプレートリーダーで540 nmにおける吸光度を測定した。尚、この試験においては、HSAは比較対象としなかった。
【0027】
その結果を図1に示す。図1の結果から、VC>ペクチン酸>キトサン>低分子量及び高分子量アルギン酸の順で濃度依存的な抗酸化作用が確認された。
【0028】
(2)ABTS radical消去能
ABTS radical消去能はGebickiら(Nutrition. 22, 266-274 (2006))の報告に準じて行った。ABTS溶液は、2 mM 2,2’-azinobis (3-ethylbenzothiazoline-6-sulfonic acid(ABTS)溶液(in 2.45 mM Potassium Peroxodisulfate)を調製した。ABTS溶液に各サンプル及びVCを濃度依存的に添加し、24時間まで時間経時的に734 nmにおける吸光度を測定した。尚、この試験においては、HSAは比較対象としなかった。
【0029】
その結果を図2に示す。図2の結果は、DPPH radical消去能の結果(図1)と同様、ABTS radical消去能においても、VC>ペクチン酸>キトサン>低分子量アルギン酸及び高分子量アルギン酸の順で時間依存的な抗酸化作用が確認された。
【0030】
(3)PAO(Potential Anti Oxidant kit)による抗酸化能測定
PAO抗酸化能測定キットを用い、銅イオンの還元反応(Cu++からCu+への反応)を利用して行った。マイクロプレートにサンプル希釈液190μLと各サンプル10μLを加え、撹拌しCu++試薬を各ウェルに25μL分注し、室温にて3分間インキュベートし、反応停止液を加えた後、490nmにおける吸光度を測定した。尚、この試験においては、VC及びHSAは比較対象としなかった。
【0031】
その結果を図3に示す。PAO(Potential Anti Oxidant kit)による抗酸化能測定においても、ペクチン酸>キトサン>低分子量アルギン酸及び高分子量アルギン酸の順で抗酸化作用が確認され、DPPH radical消去能の結果(図1)及びABTS radical消去能(図2)の結果を支持するものであった。
【0032】
(4)AAPH酸化による酸化HSAのカルボニル基生成抑制効果の検討
各サンプル存在下、非存在下において酸化させたHSA溶液に10 mM 2,4-dinitrophenylhydrazine(DNPH)/ 2 N HClを添加し、1時間インキュベートした。その後、10 % トリクロロ酢酸を添加し、遠心分離して上清を除去した。10 mM HClを含むエタノール : 酢酸エチル=1 : 1でHSAを洗浄し、6 M 塩酸グアニジンで溶解した後、360 nmの吸光度を測定した。尚、この試験においては、HSAのみ比較対象とした。
【0033】
図4の結果からも、ペクチン酸及びキトサンの高い抗酸化作用が確認された。
【0034】
[実施例1]
テオフィリン200mg、キトサン100mg及びペクチン酸100mgを乳鉢中で混和し、医薬組成物を得た。その後、島津製IR打錠機を用いて100kg/cm2の打錠圧で圧縮打錠し、錠剤を得た。
【0035】
[比較例1]
テオフィリン200mg及びキトサン200mgを乳鉢中で混和し、医薬組成物を得た。その後、島津製IR打錠機を用いて100kg/cm2の打錠圧で圧縮打錠し、錠剤を得た。
【0036】
[比較例2]
テオフィリン200mg及びペクチン酸200mgを乳鉢中で混和し、医薬組成物を得た。その後、島津製IR打錠機を用いて100kg/cm2の打錠圧で圧縮打錠し、錠剤を得た
【0037】
実施例1、比較例1及び比較例2の錠剤の組成を表1に示す。
【0038】
【表1】

【0039】
[実験例1]
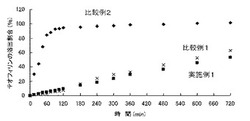
実施例1、比較例1及び比較例2の錠剤の溶出試験を行った。具体的には、これら錠剤を溶出試験機を用いて、回転バスケット法による溶出試験を37℃、100回転/minで行った。測定は、15分、30分、45分、60分、75分、90分、105分、120分、180分、240分、300分、360分、480分、600分及び720分の計15回行った。液はそれぞれ5mlずつ採取した。溶出試験で採取した溶出液は波長271nmでの吸光度を測定した。それぞれの時間におけるテオフィリンの溶出率を求めた。
【0040】
実験例1の結果を図5に示す。比較例2と参照すれば明らかなように、実施例1は本来であれば比較例1よりも徐放化されない(比較例1と比較例2の中間をとる)と予測されるはずであるが、予想外なことに実施例1の徐法性は比較例1よりも優れていた。さらに、試験例から明らかなように、ペクチン酸はキトサンよりも抗酸化性が高いことから、本発明の医薬組成物は、高い抗酸化作用を有する。
【産業上の利用可能性】
【0041】
各種抗酸化作用の検討より、キトサン及びペクチン酸が高い抗酸化作用を示した。また、これら2種について打錠によるテオフィリン含有錠剤を評価した結果、テオフィリン:キトサン:ペクチン酸=2:1:1の混合比において顕著な徐放化が確認され、徐放性基材として利用されているキトサン及びペクチン酸の抗酸化作用を有する徐放性基材としての有用性が示唆された。通常、胃潰瘍をはじめとした消化性潰瘍は、潰瘍部位においての炎症に伴うフリーラジカルの産生による潰瘍部位のさらなる悪化が懸念されている。今後、それぞれ抗酸化作用を持つキトサン-ペクチン酸高分子複合体を、胃潰瘍をはじめとした消化性潰瘍を誘発している患者に経口投与することにより、薬物の標的部位での作用に加え、高分子複合体の徐放化基材の抗酸化作用が期待される。すなわち、薬物の副作用による胃粘膜障害の保護は基より、フリーラジカル消去に伴う炎症部位の抑制効果も期待される。
【技術分野】
【0001】
本発明は、医薬組成物、その製造方法及び徐放性基材に関する。
【背景技術】
【0002】
薬物を生体内分解型高分子重合物に分散させたタイプの徐放性製剤について様々な発明がなされている。例えば、特許文献1及び2では、主に黄体形成ホルモン放出ホルモンや甲状腺ホルモン放出ホルモンの徐放性基材として、分子量分布を制御した生体内分解型脂肪族ポリエステルを用いることを開示している。
【0003】
しかしながら、高い抗酸化作用を有する徐放性基材及び医薬組成物は未だに開示されていない。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第3200706号
【特許文献2】特許第3254449号
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、高い抗酸化作用を有する医薬組成物、その製造方法及び徐放性基材を提供を課題とする。
【課題を解決するための手段】
【0006】
本発明は、薬物、キトサン及びペクチン酸を含む医薬組成物及びその製造方法を提供する。また、キトサン及びペクチン酸を含む徐放性基材を提供する。
【発明の効果】
【0007】
本発明の医薬組成物及び徐放性基材は、高い抗酸化作用を有する。
【図面の簡単な説明】
【0008】
【図1】試験例1のDPPH radical消去能の結果を示す図である。
【図2】試験例1のABTS radical消去能の結果を示す図である。
【図3】試験例1のPAO(Potential Anti Oxidant kit)による抗酸化能測定の結果を示す図である。
【図4】試験例1のAAPH酸化による酸化HSAのカルボニル基生成抑制効果の検討の結果を示す図である。
【図5】実験例1の溶出試験の結果を示す図である。
【発明を実施するための形態】
【0009】
本発明の医薬組成物は、少なくとも薬物、キトサン及びペクチン酸を含む。そして、本発明において、キトサン及びペクチン酸は、薬物を徐放する基材(徐放性基材)である。
【0010】
本発明においては、薬物は、特に限定されるものではない。薬物の一例を挙げるとするならば、例えば、気管支拡張薬、向精神薬、抗不安薬、抗うつ薬、催眠鎮静薬、抗パーキンソン薬、アレルギー用薬、歯科口腔用薬、強心薬、解熱鎮痛消炎薬、抗ヒスタミン薬、鎮咳薬、制酸薬、生薬、降圧薬、抗生物質、抗菌剤、不整脈用薬、冠血管拡張薬、末梢血管拡張薬、高脂血症用薬、利胆薬、ホルモン薬、痛風治療薬、抗リウマチ薬、化学療法薬、糖尿病用薬、鎮吐薬、抗てんかん薬、交感神経興奮薬、骨粗鬆症用薬、抗悪性腫瘍薬、免疫抑制薬、泌尿器科用薬、胃腸薬、脳代謝改善薬、脳循環改善薬、呼吸促進薬、血管収縮薬、鎮暈薬、去痰薬、中枢神経作用用薬、潰瘍治療薬、胃粘膜修復薬及び鎮痛鎮痙薬などが挙げられる。
【0011】
また、上記薬物は、化合物名で例示すると、テオフィリン、テモカプリル塩酸塩、カベルゴリン、ベシル酸アムロジピン、オメプラゾール、ランソプラゾール、ファモチジン、ラフチジン、エカベトナトリウム、クエン酸モサプリド、レバミピド、ボグリボース、リスペリドン、イミダプリル塩酸塩、メロキシカム、ミルナシプラン塩酸塩、レボフロキサシン、クラリスロマイシン、サルポグレラート塩酸塩、トスフロキサシントシル酸塩、タムスロシン塩酸塩、ミゾリビン、タクロリムス水和物、フルボキサミンマレイン酸塩、グリメピリド、ラモセトロン塩酸塩、ニコランジル、ドネペジル塩酸塩、酒石酸ゾルピデム、ピオグリタゾン塩酸塩、アレンドロン酸ナトリウム水和物、リセドロン酸ナトリウム水和物、アトルバスタチンカルシウム水和物、フルバスタチンナトリウム、ロラタジン、ロサルタンカリウム、パロキセチン塩酸塩水和物、ラベプラゾールナトリウム、リバビリン、コハク酸スマトリプタン、ペロスピロン塩酸塩水和物、フマル酸クエチアピン、オロパタジン塩酸塩、フェキソフェナジン塩酸塩、エバスチン、セフジトレンピボキシル、塩酸セフカペンピボキシル、バルサルタン、ビカルタミド及びアカルボースなどが挙げられる。
【0012】
本発明において「キトサン」とは、直鎖型の多糖類であって、グルコサミンの1,4−重合物をいう。キトサンの分子式は(C6H11NO4)nであり、また、キトサンのCAS登録番号は、[9012−76−4]である。キトサンは、製造される医薬組成物が錠剤等に加工可能な程度の成形加工性があれば、その分子量等に限定されるものではない。
【0013】
また、本発明において「ペクチン酸」とは、ガラクツロン酸がα−1,4−結合したポリガラクツロン酸が主成分としてなり、当該ガラクツロン酸のカルボキシル基がメチルエステル化されていないものをいう。ペクチン酸は、ペクチン(ガラクツロン酸のカルボキシル基がメチルエステル化されているもの)とは区別される。このペクチン酸も、製造される医薬組成物が錠剤等に加工可能な程度の成形加工性があれば、その分子量等に限定されるものではない。
【0014】
以上に説明した薬物、キトサン及びペクチン酸は、単に混合することによって容易に本発明の医薬組成物を製造することができる。混合は、例えば、各成分を融解して混合する方法、各成分の溶液を調製して混合する方法、若しくは、薬物にキトサン及びペクチン酸を噴霧又はコーティングする方法等により実施することができるが、本発明はこれら混合方法により限定されるものではない。キトサン及びペクチン酸を混合することによりキトサンが有するカチオンとペクチン酸が有するアニオンによるイオン相互作用を形成する。このイオン相互作用の形成により、本発明の医薬組成物は、組成物として安定しており、かつ徐放性を有するものと考えられる。また、両高分子は共に抗酸化作用を有するために、薬物が酸化するおそれもなくなる。
【0015】
上記3成分の混合量の設計についても、特に限定されるものではない。例えば、薬物の絶対量に関しては、各薬物の1回の服用における投与量に応じて適宜設計されるものであるので、当業者によって適宜設計されるものである。また、薬物に対するキトサン及びペクチン酸(徐放性基材)の混合量も、1回の服用における薬物の投与量を考慮しながら、ヒトが服用可能な総量となるよう、当業者によって適宜設計されるものである。
【0016】
また、徐放性基材において、キトサンに対するペクチン酸との混合比も、製造される医薬組成物が錠剤等に加工可能な程度の成形加工性があり、好ましくはイオン相互作用が形成しやすい混合比であれば、必ずしも限定されるものではない。イオン相互作用が起こりやすくすることを考慮して、混合比の具体的数値を挙げるとするならば、その混合比は、7:3〜3:7、好ましくは5:5である。
【0017】
以上に説明した医薬組成物は、例えば、錠剤、カプセル剤、顆粒剤又は散剤等の剤型に応じて、当業者によりさらなる成形加工が可能である。
【0018】
また、上述のキトサン及びペクチン酸の組み合わせは、様々な薬物を担持するための徐放性基材として産業的に利用することも可能である。当該徐放性基材は、マイクロカプセル等の材料として使用できる。また、ステント等の医療機器の表面にコーティングして、当該医療機器に薬剤の徐放性を付与することもできる。
【実施例】
【0019】
以下に、本発明の実施例が説明される。本実施例は、本発明の一実施形態であり、本発明が実施例に記載された態様に限定されないことは言うまでもない。
【0020】
[試験例1]
キトサン及びペクチン酸の抗酸化作用について確認した。結論としては、ペクチン酸の方がキトサンよりも抗酸化作用が高いことを確認した。具体的な試験手法について以下に記載する。
【0021】
1.試薬
本試験例で用いる試薬の準備については以下に示す。尚、試薬、溶媒類はすべて市販特級品を使用し、溶媒としての水はイオン交換水またはミリQ水を使用した。
【0022】
(1)キトサン
キトサンは、以下のように調整した。キトサン粉末(キトサン8B、フナコシ株式会社製))2gに1%酢酸を加えて全量を200gとし、よく撹拌しながら溶かし、キトサン1%と酢酸1%の塩を得た。これらの塩の溶液はそれぞれスプレードライヤー(パルビスGB22)を用いて、入り口温度160℃、出口温度75℃、アスピレーターの乾燥空気量0.45m3/min、噴霧圧力1.0kg/cm2の条件下で噴霧乾燥し、その後噴霧乾燥品を採取した。
【0023】
(2)ペクチン酸
ペクチン酸は、和光純薬工業より購入した。
【0024】
(3)比較対象
キトサン及びペクチン酸の比較対象として、低分子アルギン酸(紀文フードケミファ)、高分子アルギン酸(紀文フードケミファ)、アスコルビン酸(和光純薬工業、以下VC)、及び、ヒト血清アルブミン(和光純薬工業;以下HSA)を準備した。
【0025】
2.抗酸化作用試験
抗酸化作用試験は、DPPH radical消去能、ABTS radical消去能、PAO(Potential Anti Oxidant kit)による抗酸化能測定、及び、AAPH酸化による酸化HSAのカルボニル基生成抑制効果により行った。詳細な実験手法については以下に示す。
【0026】
(1)DPPH radical消去能
DPPH radical消去能はSassaら(Biochem Biophys Acta. 1573, 84-92 (2002))の報告に準じて行った。DPPH溶液は、0.25 mM 1,1-diphenyl-2-picrylhydrazyl(DPPH)溶液(in EtOH)と50 mM 2-(N-morpholino)ethanesulfonic acid buffer(pH 7.4)溶液を2 : 1の割合で混合して調製した。DPPH溶液に各サンプル及びVCを濃度依存的に添加し、20分間インキュベート後にマイクロプレートリーダーで540 nmにおける吸光度を測定した。尚、この試験においては、HSAは比較対象としなかった。
【0027】
その結果を図1に示す。図1の結果から、VC>ペクチン酸>キトサン>低分子量及び高分子量アルギン酸の順で濃度依存的な抗酸化作用が確認された。
【0028】
(2)ABTS radical消去能
ABTS radical消去能はGebickiら(Nutrition. 22, 266-274 (2006))の報告に準じて行った。ABTS溶液は、2 mM 2,2’-azinobis (3-ethylbenzothiazoline-6-sulfonic acid(ABTS)溶液(in 2.45 mM Potassium Peroxodisulfate)を調製した。ABTS溶液に各サンプル及びVCを濃度依存的に添加し、24時間まで時間経時的に734 nmにおける吸光度を測定した。尚、この試験においては、HSAは比較対象としなかった。
【0029】
その結果を図2に示す。図2の結果は、DPPH radical消去能の結果(図1)と同様、ABTS radical消去能においても、VC>ペクチン酸>キトサン>低分子量アルギン酸及び高分子量アルギン酸の順で時間依存的な抗酸化作用が確認された。
【0030】
(3)PAO(Potential Anti Oxidant kit)による抗酸化能測定
PAO抗酸化能測定キットを用い、銅イオンの還元反応(Cu++からCu+への反応)を利用して行った。マイクロプレートにサンプル希釈液190μLと各サンプル10μLを加え、撹拌しCu++試薬を各ウェルに25μL分注し、室温にて3分間インキュベートし、反応停止液を加えた後、490nmにおける吸光度を測定した。尚、この試験においては、VC及びHSAは比較対象としなかった。
【0031】
その結果を図3に示す。PAO(Potential Anti Oxidant kit)による抗酸化能測定においても、ペクチン酸>キトサン>低分子量アルギン酸及び高分子量アルギン酸の順で抗酸化作用が確認され、DPPH radical消去能の結果(図1)及びABTS radical消去能(図2)の結果を支持するものであった。
【0032】
(4)AAPH酸化による酸化HSAのカルボニル基生成抑制効果の検討
各サンプル存在下、非存在下において酸化させたHSA溶液に10 mM 2,4-dinitrophenylhydrazine(DNPH)/ 2 N HClを添加し、1時間インキュベートした。その後、10 % トリクロロ酢酸を添加し、遠心分離して上清を除去した。10 mM HClを含むエタノール : 酢酸エチル=1 : 1でHSAを洗浄し、6 M 塩酸グアニジンで溶解した後、360 nmの吸光度を測定した。尚、この試験においては、HSAのみ比較対象とした。
【0033】
図4の結果からも、ペクチン酸及びキトサンの高い抗酸化作用が確認された。
【0034】
[実施例1]
テオフィリン200mg、キトサン100mg及びペクチン酸100mgを乳鉢中で混和し、医薬組成物を得た。その後、島津製IR打錠機を用いて100kg/cm2の打錠圧で圧縮打錠し、錠剤を得た。
【0035】
[比較例1]
テオフィリン200mg及びキトサン200mgを乳鉢中で混和し、医薬組成物を得た。その後、島津製IR打錠機を用いて100kg/cm2の打錠圧で圧縮打錠し、錠剤を得た。
【0036】
[比較例2]
テオフィリン200mg及びペクチン酸200mgを乳鉢中で混和し、医薬組成物を得た。その後、島津製IR打錠機を用いて100kg/cm2の打錠圧で圧縮打錠し、錠剤を得た
【0037】
実施例1、比較例1及び比較例2の錠剤の組成を表1に示す。
【0038】
【表1】

【0039】
[実験例1]
実施例1、比較例1及び比較例2の錠剤の溶出試験を行った。具体的には、これら錠剤を溶出試験機を用いて、回転バスケット法による溶出試験を37℃、100回転/minで行った。測定は、15分、30分、45分、60分、75分、90分、105分、120分、180分、240分、300分、360分、480分、600分及び720分の計15回行った。液はそれぞれ5mlずつ採取した。溶出試験で採取した溶出液は波長271nmでの吸光度を測定した。それぞれの時間におけるテオフィリンの溶出率を求めた。
【0040】
実験例1の結果を図5に示す。比較例2と参照すれば明らかなように、実施例1は本来であれば比較例1よりも徐放化されない(比較例1と比較例2の中間をとる)と予測されるはずであるが、予想外なことに実施例1の徐法性は比較例1よりも優れていた。さらに、試験例から明らかなように、ペクチン酸はキトサンよりも抗酸化性が高いことから、本発明の医薬組成物は、高い抗酸化作用を有する。
【産業上の利用可能性】
【0041】
各種抗酸化作用の検討より、キトサン及びペクチン酸が高い抗酸化作用を示した。また、これら2種について打錠によるテオフィリン含有錠剤を評価した結果、テオフィリン:キトサン:ペクチン酸=2:1:1の混合比において顕著な徐放化が確認され、徐放性基材として利用されているキトサン及びペクチン酸の抗酸化作用を有する徐放性基材としての有用性が示唆された。通常、胃潰瘍をはじめとした消化性潰瘍は、潰瘍部位においての炎症に伴うフリーラジカルの産生による潰瘍部位のさらなる悪化が懸念されている。今後、それぞれ抗酸化作用を持つキトサン-ペクチン酸高分子複合体を、胃潰瘍をはじめとした消化性潰瘍を誘発している患者に経口投与することにより、薬物の標的部位での作用に加え、高分子複合体の徐放化基材の抗酸化作用が期待される。すなわち、薬物の副作用による胃粘膜障害の保護は基より、フリーラジカル消去に伴う炎症部位の抑制効果も期待される。
【特許請求の範囲】
【請求項1】
薬物、キトサン及びペクチン酸を含む医薬組成物。
【請求項2】
キトサンがペクチン酸と複合化してなる請求項1に記載の医薬組成物。
【請求項3】
薬物、キトサン及びペクチン酸を全て同時に混合して製造された請求項1に記載の医薬組成物。
【請求項4】
薬物、キトサン及びペクチン酸を混合する医薬組成物の製造方法。
【請求項5】
薬物、キトサン及びペクチン酸を全て同時に混合する請求項4に記載の医薬組成物の製造方法。
【請求項6】
キトサン及びペクチン酸を含む徐放性基材。
【請求項7】
キトサンがペクチン酸と複合化してなる請求項6に記載の徐放性基材。
【請求項1】
薬物、キトサン及びペクチン酸を含む医薬組成物。
【請求項2】
キトサンがペクチン酸と複合化してなる請求項1に記載の医薬組成物。
【請求項3】
薬物、キトサン及びペクチン酸を全て同時に混合して製造された請求項1に記載の医薬組成物。
【請求項4】
薬物、キトサン及びペクチン酸を混合する医薬組成物の製造方法。
【請求項5】
薬物、キトサン及びペクチン酸を全て同時に混合する請求項4に記載の医薬組成物の製造方法。
【請求項6】
キトサン及びペクチン酸を含む徐放性基材。
【請求項7】
キトサンがペクチン酸と複合化してなる請求項6に記載の徐放性基材。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−229036(P2010−229036A)
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願番号】特願2009−74905(P2009−74905)
【出願日】平成21年3月25日(2009.3.25)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年2月2日 インターネットアドレス「http://nenkai.pharm.or.jp/129/pc/ipdfview.asp?i=1430」に発表
【出願人】(000135036)ニプロ株式会社 (583)
【Fターム(参考)】
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願日】平成21年3月25日(2009.3.25)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年2月2日 インターネットアドレス「http://nenkai.pharm.or.jp/129/pc/ipdfview.asp?i=1430」に発表
【出願人】(000135036)ニプロ株式会社 (583)
【Fターム(参考)】
[ Back to top ]

