医薬組成物
【課題】本発明は、オキサゾール化合物の水に対する溶解性を著しく改善した医薬組成物を提供することを課題とする。
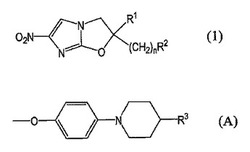
【解決手段】本発明の医薬組成物は、(I)一般式 (1)

[式中、R1は水素原子又はC1〜6アルキル基を示す。nは0〜6の整数を示す。R2は下記一般式(A)

(式中、R3は、フェノキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基の少なくとも1種が置換していてもよい)等を示す。)等を示す。]
で表されるオキサゾール化合物、その光学活性体又はその塩、並びに(II)ヒドロキシプロピルメチルセルロースフタレート及びヒドロキシプロピルメチルセルロースアセテートサクシネートからなる群より選ばれた少なくとも1種のセルロース化合物を含有する。
【解決手段】本発明の医薬組成物は、(I)一般式 (1)

[式中、R1は水素原子又はC1〜6アルキル基を示す。nは0〜6の整数を示す。R2は下記一般式(A)

(式中、R3は、フェノキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基の少なくとも1種が置換していてもよい)等を示す。)等を示す。]
で表されるオキサゾール化合物、その光学活性体又はその塩、並びに(II)ヒドロキシプロピルメチルセルロースフタレート及びヒドロキシプロピルメチルセルロースアセテートサクシネートからなる群より選ばれた少なくとも1種のセルロース化合物を含有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医薬組成物に関する。
【背景技術】
【0002】
下記一般式(1)で表される2,3−ジヒドロ−6−ニトロイミダゾ[2,1−b]オキサゾール化合物、それらの光学活性体及びそれらの薬理学的に許容される塩(以下これらを単に「オキサゾール化合物」という)は、結核菌、多剤耐性結核菌及び非定型抗酸菌に対して優れた殺菌作用を有していることが知られている(特許文献1及び特許文献2)。
【0003】
一般式(1):
【0004】
【化1】

【0005】
[式中、R1は水素原子又はC1〜6アルキル基を示す。nは0〜6の整数を示す。R2は下記一般式(A)〜(F)のいずれかの基を示す。
一般式(A)で表される基:
【0006】
【化2】

【0007】
(式中、R3は、下記(1)〜(6)のいずれかの基を示す。
(1)フェノキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(2)フェニルC1〜6アルコキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(3)基−NR4R5
(ここで、R4はC1〜6アルキル基を示し、R5はフェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。);
(4)フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(5)フェノキシC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(6)ベンゾフリルC1〜6アルキル基(ベンゾフラン環上には、ハロゲン原子、ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
一般式(B)で表される基:
【0008】
【化3】

【0009】
(式中、R6は、フェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(C)で表される基:
【0010】
【化4】

【0011】
(式中、R7は、フェニルC2〜10アルケニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)又はビフェニルC1〜6アルキル基(1個又は2個のフェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(D)で表される基:
【0012】
【化5】

【0013】
(式中、R8は、フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(E)で表される基:
【0014】
【化6】

【0015】
(式中、R8は前記に同じ。)
一般式(F)で表される基:
【0016】
【化7】

【0017】
(式中、R8は前記に同じ。)]
上記一般式(1)で表されるオキサゾール化合物又はその塩は、水に対する溶解性が低く、溶解性の改善が望まれている。
【特許文献1】日本特許公開2004−149527
【特許文献2】WO2005−042542
【発明の開示】
【発明が解決しようとする課題】
【0018】
本発明は、上記オキサゾール化合物の水に対する溶解性を改善した医薬組成物を提供することを課題とする。
【課題を解決するための手段】
【0019】
本発明者は、上記課題を解決するために種々の研究を重ねた結果、オキサゾール化合物に特定のセルロース化合物を配合することにより、オキサゾール化合物の水に対する溶解性を大幅に改善でき、所望の医薬組成物が得られることを見い出した。本発明は、このような知見に基づき完成されたものである。
【0020】
本発明は、下記項1〜15に示す医薬組成物を提供する。
項1.(I) 一般式 (1)
【0021】
【化8】

【0022】
[式中、R1は水素原子又はC1〜6アルキル基を示す。nは0〜6の整数を示す。R2は下記一般式(A)〜(F)のいずれかの基を示す。
一般式(A)で表される基:
【0023】
【化9】

【0024】
(式中、R3は、下記(1)〜(6)のいずれかの基を示す。
(1)フェノキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
(2)フェニルC1〜6アルコキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
(3)基−NR4R5
(ここで、R4はC1〜6アルキル基を示し、R5はフェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)を示す。);
(4)フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
(5)フェノキシC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
(6)ベンゾフリルC1〜6アルキル基(ベンゾフラン環上には、ハロゲン原子、ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
一般式(B)で表される基:
【0025】
【化10】

【0026】
(式中、R6は、フェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)を示す。)
一般式(C)で表される基:
【0027】
【化11】

【0028】
(式中、R7は、フェニルC2〜10アルケニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)又はビフェニルC1〜6アルキル基(1個又は2個のフェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)を示す。)
一般式(D)で表される基:
【0029】
【化12】

【0030】
(式中、R8は、フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)を示す。)
一般式(E)で表される基:
【0031】
【化13】

【0032】
(式中、R8は前記に同じ。)
一般式(F)で表される基:
【0033】
【化14】

【0034】
(式中、R8は前記に同じ。)]
で表される2,3−ジヒドロ−6−ニトロイミダゾ[2,1−b]オキサゾール化合物、それらの光学活性体及びそれらの薬理学的に許容される塩からなる群より選ばれた少なくとも1種のオキサゾール化合物、並びに
(II)ヒドロキシプロピルメチルセルロースフタレート及びヒドロキシプロピルメチルセルロースアセテートサクシネートからなる群より選ばれた少なくとも1種のセルロース化合物
を含有する医薬組成物。
項2.オキサゾール化合物が2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである上記項1に記載の医薬組成物。
項3.オキサゾール化合物が6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジルオキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである上記項1に記載の医薬組成物。
項4.オキサゾール化合物が2−メチル−6−ニトロ−2−(4−{4−[3−(4−トリフルオロメトキシフェニル)−2−プロペニル]ピペラジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである上記項1に記載の医薬組成物。
項5.オキサゾール化合物が2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメチルフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである上記項1に記載の医薬組成物。
項6.ビタミンEを更に含有する上記項1に記載の医薬組成物。
項7.ビタミンEがdl−α−トコフェロールである上記項6に記載の医薬組成物。
項8.ビタミンEを更に含有する上記項2に記載の医薬組成物。
項9.ビタミンEがdl−α−トコフェロールである上記項8に記載の医薬組成物。
項10.ビタミンEを更に含有する上記項3に記載の医薬組成物。
項11.ビタミンEがdl−α−トコフェロールである上記項10に記載の医薬組成物。
項12.ビタミンEを更に含有する上記項4に記載の医薬組成物。
項13.ビタミンEがdl−α−トコフェロールである上記項12に記載の医薬組成物。
項14.ビタミンEを更に含有する上記項4に記載の医薬組成物。
項15.ビタミンEがdl−α−トコフェロールである上記項14に記載の医薬組成物。
【0035】
本発明の医薬組成物に使用されるオキサゾール化合物は、上記一般式(1)で表される2,3−ジヒドロ−6−ニトロイミダゾ[2,1−b]オキサゾール化合物である。
【0036】
上記一般式(1)で表されるオキサゾール化合物には、以下の化合物が包含される。
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物A」という)
4−(2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール−2−イルメチル)ピペラジン−1−カルボン酸3−(4−トリフルオロメチルフェニル)−2−プロペニルエステル(以下「化合物B」という)
2−(4−{4−[N−(4−クロロフェニル)−N−メチル−アミノ]ピペリジン−1−イル}フェノキシメチル)−2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物C」という)
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物D」という)
2−{4−[4−(3,4−ジクロロベンジル)ピペリジン−1−イル]フェノキシメチル}−2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物E」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物F」という)
6−(2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール−2−イルメトキシ)−2−[4−(4−トリフルオロメトキシフェノキシ)ピペラジン−1−イル]ベンゾチアゾール(以下「化合物G」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジルオキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物H」という)
2−メチル−6−ニトロ−2−(4−{4−[2−(4−トリフルオロメトキシフェニル)エチル]ピペリジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物I」という)
2−{4−[4−(4−クロロフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物J」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物K」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物L」という)
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジルオキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物M」という)
2−メチル−6−ニトロ−2−(4−{4−[3−(4−トリフルオロメトキシフェニル)−2−プロペニル]ピペラジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物N」という)
2−{4−[4−(4−クロロフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物O」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメチルフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物P」という)
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメチルフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物Q」という)
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物R」という)
6−ニトロ−2−(4−{4−[3−(4−トリフルオロメトキシフェニル)プロピル]ピペリジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物S」という)
5−(2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール−2−イルメトキシ)−2−[4−(4−トリフルオロメトキシベンジル)ピペリジン−1−イル]−ピリジン(以下「化合物T」という)
2−メチル−6−ニトロ−2−{4−[4−(5−トリフルオロメチルベンゾフラン−2−イルメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物U」という)
6−(2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール−2−イルメトキシ)−2−[4−(4−トリフルオロメトキシベンジル)ピペリジン−1−イル]キノリン(以下「化合物V」という)
6−ニトロ−2−{4−[4−(4’−トリフルオロメチルビフェニル−4−イルメチル)ピペラジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物W」という)
本発明では、上記オキサゾール化合物、これらの光学活性体及びこれらの薬理学的に許容される塩からなる群より選ばれた少なくとも1種を使用するのが好ましい。
【0037】
オキサゾール化合物の光学活性体には、R体及びS体が含まれる。
【0038】
薬理学的に許容される塩としては、例えば、塩酸塩、クエン酸塩、コハク酸塩、フマル酸塩等が挙げられる。
【0039】
好ましいオキサゾール化合物は、化合物A、化合物H、化合物N、化合物Q、これらの光学活性体及びこれらの薬理学的に許容される塩からなる群より選ばれた少なくとも1種である。
【0040】
本発明の医薬組成物に使用されるセルロース化合物は、ヒドロキシプロピルメチルセルロースフタレート及びヒドロキシプロピルメチルセルロースアセテートサクシネートからなる群より選ばれた少なくとも1種である。これらのセルロース化合物を配合した場合に、オキサゾール化合物の水に対する溶解性を著しく向上させることができる。
【0041】
ヒドロキシプロピルメチルセルロースフタレートは、ヒドロキシプロピルセルロースにフタル酸がハーフエステル結合した高分子化合物である。ヒドロキシプロピルメチルセルロースフタレートは公知であり、例えば、信越化学工業(株)から商品名HP−55、HP−55S及びHP−50として市販されている。本発明では、これらの市販品をいずれも使用することができる。ヒドロキシプロピルメチルセルロースフタレートは、その水酸基がメトキシ基18〜24%、ヒドロキシプロポキシ基5〜10%、カルボキシベンゾイル基21〜35%で置換されている。
【0042】
ヒドロキシプロピルメチルセルロースアセテートサクシネートは、ヒドロキシプロピルセルロースに酢酸及びコハク酸がエステル結合した高分子化合物である。ヒドロキシプロピルメチルセルロースアセテートサクシネートは公知であり、例えば、信越化学工業(株)から商品名AS−L、AS−M及びAS−Hとして市販されている。本発明では、これらの市販品をいずれも使用することができる。ヒドロキシプロピルメチルセルロースアセテートサクシネートは、その水酸基がメトキシ基20〜26%、ヒドロキシプロポキシ基5〜10%、アセチル基5〜14%、サクシノイル基4〜18%で置換されている。
【0043】
上記セルロース化合物のうち、pH5〜5.5のマイクルバイン(McIlvaine)緩衝溶液に溶解するセルロース化合物が好ましい。このようなセルロース化合物には、HP−55、HP−55S、HP−50及びAS−Lが含まれる。
【0044】
上記セルロース化合物のうち、pH5のマイクルバイン緩衝溶液に溶解するセルロース化合物が特に好ましい。このようなセルロース化合物には、HP−50が含まれる。
【0045】
本発明の医薬組成物における(I)成分及び(II)成分の配合割合は、本発明の優れた効果を発現するためには、(I)成分1重量部に対して、(II)成分が通常約0.5重量部以上、好ましくは約1重量部以上、より好ましくは約1.5重量部以上である。本発明医薬組成物の投与形態を考慮すると、(I)成分1重量部に対して、(II)成分が通常約15重量部以下、好ましくは約10重量部以下、より好ましくは約5重量部以下、特に好ましくは約3重量部以下である。
【0046】
本発明の医薬組成物には、ビタミンEを更に配合することができる。
【0047】
ビタミンEには、例えば、d−α−トコフェロール、d−δ−トコフェロール、酢酸d−α−トコフェロール、コハク酸d−α−トコフェロール、dl−α−トコフェロール、酢酸dl−α−トコフェロール、コハク酸dl−α−トコフェロール、コハク酸dl−α−トコフェロールカルシウム、ニコチン酸dl−α−トコフェロール等の天然及び合成ビタミンE等が含まれる。好ましいビタミンEは、dl−α−トコフェロール、酢酸dl−α−トコフェロール、コハク酸dl−α−トコフェロール及びニコチン酸dl−α−トコフェロールであり、より好ましいビタミンEは、dl−α−トコフェロールである。
【0048】
本発明においては、ビタミンEを配合することが望ましい。ビタミンEを配合することにより医薬組成物の安定性を顕著に向上させることができる。ビタミンEと同様の抗酸化作用を有している化合物、例えば、ジブチルヒドロキシトルエン、ブチルヒドロキシアニソール、大豆レシチン、パルミチン酸アスコルビル、塩酸システイン、アスコルビン酸、クエン酸、エリソルビン酸、亜硝酸ナトリウム、亜硫酸ナトリウム、チオグリコール酸ナトリウム、チオリンゴ酸ナトリウム等をビタミンEの代わりに使用した場合には、医薬組成物の安定性を顕著に向上させることができない。これは、本発明者らが初めて見つけた事項である。
【0049】
これらのビタミンE、特にdl−α−トコフェロールを配合することにより、オキサゾール化合物の水に対する溶解性に悪影響を与えることなく、医薬組成物の安定性を顕著に向上させることができる。
【0050】
本発明の医薬組成物に配合されるビタミンEの量は、(I)成分1重量部に対して、通常0.001〜1重量部程度、好ましくは0.01〜0.8重量部程度、より好ましくは0.03〜0.5重量部程度である。
【0051】
本発明の医薬組成物には、pH非依存型水溶性高分子化合物(pH-independent water-soluble polymers)、可塑剤等の各種の補助成分を適宜配合することができる。
【0052】
pH非依存型水溶性高分子化合物としては、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ポリエチレングリコール、シクロデキストリン等が挙げられる。
【0053】
可塑剤としては、例えば、クエン酸トリエチル、グリセリン、グリセリン脂肪酸エステル、中鎖脂肪酸トリグリセライド、トリアセチン、ヒマシ油、プロピレングリコール、ポリソルベート等が挙げられる。
【0054】
本発明の医薬組成物は、賦形剤、崩壊剤、結合剤、流動化剤、滑沢剤、コーティング剤、着色剤、懸濁化剤、甘味剤、界面活性剤等の担体を適宜使用し、公知の方法に従って一般的な医薬製剤の形態とされる。医薬製剤の形態としては、例えば、粉剤、錠剤、丸剤、カプセル剤等が挙げられる。
【0055】
賦形剤しては、例えば、乳糖、無水乳糖、精製白糖、白糖、D−マンニトール、D−ソルビトール、キシリトール、エリスリトール、デキストリン、結晶セルロース、微結晶セルロース、トウモロコシデンプン、バレイショデンプン、無水リン酸水素カルシウム等が挙げられる。
【0056】
崩壊剤としては、例えば、カルボキシメチルスターチナトリウム、カルメロース、カルメロースカルシウム、カルメロースナトリウム、クロスカルメロースナトリウム、クロスポビドン、低置換度ヒドロキシプロピルセルロース、部分アルファ−化デンプン等が挙げられる。
【0057】
結合剤としては、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、アルファー化デンプン、シロップ、水あめ等が挙げられる。
【0058】
流動化剤としては、例えば、軽質無水ケイ酸、合成ケイ酸アルミニウム、含水二酸化ケイ素、ステアリン酸カルシウム、メタケイ酸アルミン酸マグネシウム、タルク等が挙げられる。
【0059】
滑沢剤としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、ケイ酸マグネシウム、酸化マグネシウム、タルク、硬化油、ショ糖脂肪酸エステル、フマル酸ステアリルナトリウム等が挙げられる。
【0060】
コーティング剤としては、例えば、ヒドロキシプロピルメチルセルロース、ポリビニルアルコール、ポリソリベート、マクロゴール、タルク等が挙げられる。
【0061】
着色剤としては、例えば、黄色三二酸化鉄、褐色酸化鉄、三二酸化鉄、酸化チタン、食用青色1号、食用赤色2号、食用赤色3号、食用黄色4号等が挙げられる。
【0062】
懸濁化剤としては、例えば、ポリソリベート、ポリエチレングリコール、アラビアゴム、グリセリン、ゼラチン等が挙げられる。
【0063】
甘味剤としては、例えば、アスパルテーム、サッカリン、サッカリンナトリウム、水アメ、果糖等が挙げられる。
【0064】
界面活性剤としては、例えば、ラウリル硫酸ナトリウム、ポリソリベート、ポリオキシエチレン硬化ヒマシ油等が挙げられる。
【0065】
カプセル剤は、公知の方法に従い、(I)成分、(II)成分等を上記例示した各種の担
体と混合して、ゼラチン、ヒドロキシプロピルメチルセルロース、ポリビニルアルコール等からなる硬質カプセル及びゼラチンをベースとした軟質カプセルに充填して調製される。
【発明の効果】
【0066】
本発明によれば、オキサゾール化合物にヒドロキシプロピルメチルセルロースフタレート及び/又はヒドロキシプロピルメチルセルロースアセテートサクシネートを配合することにより、オキサゾール化合物の水に対する溶解性を大幅に改善することができる。従って、オキサゾール化合物の水に対する溶解性を改善した医薬組成物を提供することができる。オキサゾール化合物及び上記セルロース化合物に更にビタミンEを配合することにより、医薬組成物の安定性を顕著に向上させることができる。
【発明を実施するための最良の形態】
【0067】
以下に実施例を掲げて、本発明をより一層明らかにする。
【0068】
製剤例1
化合物A 50mg
ヒドロキシプロピルメチルセルロースフタレート
(HP−50,信越化学工業製) 150mg
乳糖(スーパータブ HP−01,Lactose Company of NZ 製)100mg
結晶セルロース(セオラスPH301,旭化成工業製) 100mg
カルボキシメチルスターチナトリウム(プリモジェル,DMV 製) 40mg
カルメロースカルシウム(E.C.G.−505,五徳薬品製) 40mg
軽質無水珪酸(アドソリダー101,フロイント産業製) 6mg
ステアリン酸マグネシウム(太平化学産業製) 6mg
上記各成分が1錠中に含まれるように、錠剤を製造した。
【0069】
製剤例2
化合物A 50mg
ヒドロキシプロピルメチルセルロースフタレート
(HP−50,信越化学工業製) 150mg
軽質無水珪酸(アドソリダー101,フロイント産業製) 20mg
上記各成分が1カプセル中に含まれるように、カプセル剤を製造した。
【0070】
実施例1
化合物A(R体)1g及びヒドロキシプロピルメチルセルロースフタレート(HP−50、信越化学工業(株)製)3gを塩化メチレン−エタノール混合溶媒(塩化メチレン:エタノール=8:2重量比)100mlに溶解した。次いで混合物をスプレードライヤー(GS−310、ヤマト サイエンティフィック社製(Yamato Scientific Co., Ltd.))を用いて噴霧乾燥した。得られた噴霧乾燥物を、更に真空乾燥機(LCV−323、タバイエスペック社製(Tabai Espec Corp.))を用い60℃で12時間以上乾燥し、粉剤形態の本発明医薬組成物を製造した。
【0071】
実施例2
ヒドロキシプロピルメチルセルロースフタレートの代わりにヒドロキシプロピルメチルセルロースアセテートサクシネート(AS−L、信越化学工業(株)製)を用いる以外は実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0072】
比較例1
化合物A(R体)1gをジェットミル粉砕機(A−O,セイシン企業製)を用いて粉砕し、比較のための医薬組成物とした。
【0073】
比較例2
ヒドロキシプロピルメチルセルロースフタレートの代わりにヒドロキシプロピルセルロース(HPC−SL、日本曹達(株)製)を用いる以外は実施例1と同様にして、粉剤形態の医薬組成物を製造した。
【0074】
比較例3
ヒドロキシプロピルメチルセルロースフタレートの代わりにヒドロキシプロピルメチルセルロース(TC−5E、日本曹達(株)製)を用いる以外は実施例1と同様にして、粉剤形態の医薬組成物を製造した。
【0075】
試験例1
以下に示すようにして、実施例1〜2及び比較例1〜3で得られた医薬組成物の溶解性を調べた。
【0076】
まず、100mlのビーカーに0.3重量%ラウリル硫酸ナトリウム水溶液100mlを入れ、マグネットスターラーで撹拌した(回転数:500rpm)。別途、メノウ乳鉢に、上記各医薬組成物を化合物Aの量が5mgになるように量り取り、ビーカー中の試験液を数ml加えた。約1分間分散させた後、混合物をビーカー中に投入した。分散液投入から5分後、10分後及び20分後に、ビーカー中の液6mlをサンプリングし、この液を孔径0.5μm以下のメンブランフィルターで濾過した。初めの濾液2mlを除き、後の濾液4mlを試料溶液とした。
【0077】
各試料溶液について、層長10mmのセルを用いて、紫外可視吸光度測定法により、各液の波長(335nm)における吸光度を測定した。
【0078】
結果を図1に示す。
【0079】
図1から、実施例1及び実施例2で得られる医薬組成物は、水に対する溶解性が著しく改善されていることが分かる。
【0080】
実施例3
ヒドロキシプロピルメチルセルロースフタレート3gの代わりにヒドロキシプロピルメチルセルロースフタレート2gを用いる以外は実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0081】
実施例4
ヒドロキシプロピルメチルセルロースフタレート3gの代わりにヒドロキシプロピルメチルセルロースフタレート1.5gを用いる以外は実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0082】
実施例3及び実施例4で得られる医薬組成物についても、試験例1と同様にして水に対する溶解性を調べた結果、溶解性は実施例1で得られる医薬組成物のそれと同レベルであった。その結果、ヒドロキシプロピルメチルセルロースフタレートの配合量を、化合物A1gに対して1.5〜3gの範囲で変化させたいずれの場合においても、本発明の効果を発現できることが明らかになった。
【0083】
実施例5
化合物Q(R体)1g及びヒドロキシプロピルメチルセルロースフタレート(HP−50、信越化学工業(株)製)3gを塩化メチレン−エタノール混合溶媒(塩化メチレン:エタノール=8:2重量比)100mlに溶解した。次いで混合物をスプレードライヤー(GS−310、ヤマト サイエンティフィック社製(Yamato Scientific Co., Ltd.))を用いて噴霧乾燥した。得られた噴霧乾燥物を、更に真空乾燥機(LCV−323、タバイエスペック社製(Tabai Espec Corp.))を用い60℃で12時間以上乾燥し、粉剤形態の本発明医薬組成物を製造した。
【0084】
比較例4
化合物Q(R体)1gをジェットミル粉砕機(A−O,セイシン企業製)を用いて粉砕し、比較のための医薬組成物とした。
【0085】
比較例5
ヒドロキシプロピルメチルセルロースフタレートの代わりにヒドロキシプロピルセルロース(HPC−SL、日本曹達(株)製)を用いる以外は実施例5と同様にして、粉剤形態の医薬組成物を製造した。
【0086】
試験例2
試験例1と同様にして、実施例5、比較例4及び比較例5で得られた医薬組成物の溶解性を調べた。
【0087】
結果を図2に示す。
【0088】
図2から、実施例5で得られる医薬組成物は、水に対する溶解性が著しく改善されていることが分かる。
【0089】
実施例6
化合物A(R体)2g、ヒドロキシプロピルメチルセルロースフタレート(HP−50、信越化学工業(株)製)3g及びdl−α−トコフェロール(抗酸化剤、和光純薬工業(株)製)0.08gを塩化メチレン−エタノール混合溶媒(塩化メチレン:エタノール=8:2重量比)100mlに溶解した。次いで混合物をスプレードライヤー(GS−310、ヤマト サイエンティフィック社製(Yamato Scientific Co., Ltd.))を用いて噴霧乾燥した。得られた噴霧乾燥物を、更に真空乾燥機(LCV−323、タバイエスペック社製(Tabai Espec Corp.))を用い60℃で12時間以上乾燥し、粉剤形態の本発明医薬組成物を製造した。
【0090】
実施例7
dl−α−トコフェロールの代わりにジブチルヒドロキシトルエン(抗酸化剤)0.04gを用いる以外は実施例6と同様にして粉剤形態の本発明医薬組成物を製造した。
【0091】
実施例8
dl−α−トコフェロールの代わりにブチルヒドロキシアニソール(抗酸化剤)0.004gを用いる以外は実施例6と同様にして粉剤形態の本発明医薬組成物を製造した。
【0092】
実施例9
抗酸化剤を配合しない以外は実施例6と同様にして粉剤形態の本発明医薬組成物を製造した。
【0093】
試験例3
実施例6〜9で得られた医薬組成物を、40℃で1週間保存した後、各医薬組成物に含まれている化合物Aの純度を調べた。化合物Aの純度は、面積百分率で算出した。
【0094】
結果を次表に示す。
【0095】
【表1】

【0096】
表1から、dl−α−トコフェロールを配合することにより、化合物Aの安定性が格段に向上することがわかる。
【0097】
実施例10
化合物A(R体)の代わりに化合物B(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0098】
実施例11
化合物A(R体)の代わりに化合物C(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0099】
実施例12
化合物A(R体)の代わりに化合物D(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0100】
実施例13
化合物A(R体)の代わりに化合物G(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0101】
実施例14
化合物A(R体)の代わりに化合物H(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0102】
実施例15
化合物A(R体)の代わりに化合物N(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0103】
実施例16
化合物A(R体)の代わりに化合物T(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0104】
実施例17
化合物A(R体)の代わりに化合物U(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0105】
実施例18
化合物A(R体)の代わりに化合物V(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0106】
試験例3
試験例1と同様にして、実施例10〜18で得られた医薬組成物の溶解性を調べた。その結果、実施例10〜18で得られる各医薬組成物は、水に対する溶解性が著しく改善されていることが明らかになった。
【図面の簡単な説明】
【0107】
【図1】図1は、実施例1〜2及び比較例1〜3で得られた医薬組成物を含む溶液の吸光度と時間との関係を示すグラフである。
【図2】図2は、実施例5、比較例4及び比較例5で得られた医薬組成物を含む溶液の吸光度と時間との関係を示すグラフである。
【技術分野】
【0001】
本発明は、医薬組成物に関する。
【背景技術】
【0002】
下記一般式(1)で表される2,3−ジヒドロ−6−ニトロイミダゾ[2,1−b]オキサゾール化合物、それらの光学活性体及びそれらの薬理学的に許容される塩(以下これらを単に「オキサゾール化合物」という)は、結核菌、多剤耐性結核菌及び非定型抗酸菌に対して優れた殺菌作用を有していることが知られている(特許文献1及び特許文献2)。
【0003】
一般式(1):
【0004】
【化1】

【0005】
[式中、R1は水素原子又はC1〜6アルキル基を示す。nは0〜6の整数を示す。R2は下記一般式(A)〜(F)のいずれかの基を示す。
一般式(A)で表される基:
【0006】
【化2】

【0007】
(式中、R3は、下記(1)〜(6)のいずれかの基を示す。
(1)フェノキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(2)フェニルC1〜6アルコキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(3)基−NR4R5
(ここで、R4はC1〜6アルキル基を示し、R5はフェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。);
(4)フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(5)フェノキシC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(6)ベンゾフリルC1〜6アルキル基(ベンゾフラン環上には、ハロゲン原子、ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
一般式(B)で表される基:
【0008】
【化3】

【0009】
(式中、R6は、フェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(C)で表される基:
【0010】
【化4】

【0011】
(式中、R7は、フェニルC2〜10アルケニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)又はビフェニルC1〜6アルキル基(1個又は2個のフェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(D)で表される基:
【0012】
【化5】

【0013】
(式中、R8は、フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(E)で表される基:
【0014】
【化6】

【0015】
(式中、R8は前記に同じ。)
一般式(F)で表される基:
【0016】
【化7】

【0017】
(式中、R8は前記に同じ。)]
上記一般式(1)で表されるオキサゾール化合物又はその塩は、水に対する溶解性が低く、溶解性の改善が望まれている。
【特許文献1】日本特許公開2004−149527
【特許文献2】WO2005−042542
【発明の開示】
【発明が解決しようとする課題】
【0018】
本発明は、上記オキサゾール化合物の水に対する溶解性を改善した医薬組成物を提供することを課題とする。
【課題を解決するための手段】
【0019】
本発明者は、上記課題を解決するために種々の研究を重ねた結果、オキサゾール化合物に特定のセルロース化合物を配合することにより、オキサゾール化合物の水に対する溶解性を大幅に改善でき、所望の医薬組成物が得られることを見い出した。本発明は、このような知見に基づき完成されたものである。
【0020】
本発明は、下記項1〜15に示す医薬組成物を提供する。
項1.(I) 一般式 (1)
【0021】
【化8】

【0022】
[式中、R1は水素原子又はC1〜6アルキル基を示す。nは0〜6の整数を示す。R2は下記一般式(A)〜(F)のいずれかの基を示す。
一般式(A)で表される基:
【0023】
【化9】

【0024】
(式中、R3は、下記(1)〜(6)のいずれかの基を示す。
(1)フェノキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
(2)フェニルC1〜6アルコキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
(3)基−NR4R5
(ここで、R4はC1〜6アルキル基を示し、R5はフェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)を示す。);
(4)フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
(5)フェノキシC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
(6)ベンゾフリルC1〜6アルキル基(ベンゾフラン環上には、ハロゲン原子、ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい);
一般式(B)で表される基:
【0025】
【化10】

【0026】
(式中、R6は、フェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)を示す。)
一般式(C)で表される基:
【0027】
【化11】

【0028】
(式中、R7は、フェニルC2〜10アルケニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)又はビフェニルC1〜6アルキル基(1個又は2個のフェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)を示す。)
一般式(D)で表される基:
【0029】
【化12】

【0030】
(式中、R8は、フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上、好ましくは1〜3個置換していてもよい)を示す。)
一般式(E)で表される基:
【0031】
【化13】

【0032】
(式中、R8は前記に同じ。)
一般式(F)で表される基:
【0033】
【化14】

【0034】
(式中、R8は前記に同じ。)]
で表される2,3−ジヒドロ−6−ニトロイミダゾ[2,1−b]オキサゾール化合物、それらの光学活性体及びそれらの薬理学的に許容される塩からなる群より選ばれた少なくとも1種のオキサゾール化合物、並びに
(II)ヒドロキシプロピルメチルセルロースフタレート及びヒドロキシプロピルメチルセルロースアセテートサクシネートからなる群より選ばれた少なくとも1種のセルロース化合物
を含有する医薬組成物。
項2.オキサゾール化合物が2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである上記項1に記載の医薬組成物。
項3.オキサゾール化合物が6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジルオキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである上記項1に記載の医薬組成物。
項4.オキサゾール化合物が2−メチル−6−ニトロ−2−(4−{4−[3−(4−トリフルオロメトキシフェニル)−2−プロペニル]ピペラジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである上記項1に記載の医薬組成物。
項5.オキサゾール化合物が2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメチルフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである上記項1に記載の医薬組成物。
項6.ビタミンEを更に含有する上記項1に記載の医薬組成物。
項7.ビタミンEがdl−α−トコフェロールである上記項6に記載の医薬組成物。
項8.ビタミンEを更に含有する上記項2に記載の医薬組成物。
項9.ビタミンEがdl−α−トコフェロールである上記項8に記載の医薬組成物。
項10.ビタミンEを更に含有する上記項3に記載の医薬組成物。
項11.ビタミンEがdl−α−トコフェロールである上記項10に記載の医薬組成物。
項12.ビタミンEを更に含有する上記項4に記載の医薬組成物。
項13.ビタミンEがdl−α−トコフェロールである上記項12に記載の医薬組成物。
項14.ビタミンEを更に含有する上記項4に記載の医薬組成物。
項15.ビタミンEがdl−α−トコフェロールである上記項14に記載の医薬組成物。
【0035】
本発明の医薬組成物に使用されるオキサゾール化合物は、上記一般式(1)で表される2,3−ジヒドロ−6−ニトロイミダゾ[2,1−b]オキサゾール化合物である。
【0036】
上記一般式(1)で表されるオキサゾール化合物には、以下の化合物が包含される。
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物A」という)
4−(2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール−2−イルメチル)ピペラジン−1−カルボン酸3−(4−トリフルオロメチルフェニル)−2−プロペニルエステル(以下「化合物B」という)
2−(4−{4−[N−(4−クロロフェニル)−N−メチル−アミノ]ピペリジン−1−イル}フェノキシメチル)−2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物C」という)
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物D」という)
2−{4−[4−(3,4−ジクロロベンジル)ピペリジン−1−イル]フェノキシメチル}−2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物E」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物F」という)
6−(2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール−2−イルメトキシ)−2−[4−(4−トリフルオロメトキシフェノキシ)ピペラジン−1−イル]ベンゾチアゾール(以下「化合物G」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジルオキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物H」という)
2−メチル−6−ニトロ−2−(4−{4−[2−(4−トリフルオロメトキシフェニル)エチル]ピペリジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物I」という)
2−{4−[4−(4−クロロフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物J」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物K」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物L」という)
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジルオキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物M」という)
2−メチル−6−ニトロ−2−(4−{4−[3−(4−トリフルオロメトキシフェニル)−2−プロペニル]ピペラジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物N」という)
2−{4−[4−(4−クロロフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物O」という)
6−ニトロ−2−{4−[4−(4−トリフルオロメチルフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物P」という)
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメチルフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物Q」という)
2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物R」という)
6−ニトロ−2−(4−{4−[3−(4−トリフルオロメトキシフェニル)プロピル]ピペリジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物S」という)
5−(2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール−2−イルメトキシ)−2−[4−(4−トリフルオロメトキシベンジル)ピペリジン−1−イル]−ピリジン(以下「化合物T」という)
2−メチル−6−ニトロ−2−{4−[4−(5−トリフルオロメチルベンゾフラン−2−イルメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物U」という)
6−(2−メチル−6−ニトロ−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール−2−イルメトキシ)−2−[4−(4−トリフルオロメトキシベンジル)ピペリジン−1−イル]キノリン(以下「化合物V」という)
6−ニトロ−2−{4−[4−(4’−トリフルオロメチルビフェニル−4−イルメチル)ピペラジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾール(以下「化合物W」という)
本発明では、上記オキサゾール化合物、これらの光学活性体及びこれらの薬理学的に許容される塩からなる群より選ばれた少なくとも1種を使用するのが好ましい。
【0037】
オキサゾール化合物の光学活性体には、R体及びS体が含まれる。
【0038】
薬理学的に許容される塩としては、例えば、塩酸塩、クエン酸塩、コハク酸塩、フマル酸塩等が挙げられる。
【0039】
好ましいオキサゾール化合物は、化合物A、化合物H、化合物N、化合物Q、これらの光学活性体及びこれらの薬理学的に許容される塩からなる群より選ばれた少なくとも1種である。
【0040】
本発明の医薬組成物に使用されるセルロース化合物は、ヒドロキシプロピルメチルセルロースフタレート及びヒドロキシプロピルメチルセルロースアセテートサクシネートからなる群より選ばれた少なくとも1種である。これらのセルロース化合物を配合した場合に、オキサゾール化合物の水に対する溶解性を著しく向上させることができる。
【0041】
ヒドロキシプロピルメチルセルロースフタレートは、ヒドロキシプロピルセルロースにフタル酸がハーフエステル結合した高分子化合物である。ヒドロキシプロピルメチルセルロースフタレートは公知であり、例えば、信越化学工業(株)から商品名HP−55、HP−55S及びHP−50として市販されている。本発明では、これらの市販品をいずれも使用することができる。ヒドロキシプロピルメチルセルロースフタレートは、その水酸基がメトキシ基18〜24%、ヒドロキシプロポキシ基5〜10%、カルボキシベンゾイル基21〜35%で置換されている。
【0042】
ヒドロキシプロピルメチルセルロースアセテートサクシネートは、ヒドロキシプロピルセルロースに酢酸及びコハク酸がエステル結合した高分子化合物である。ヒドロキシプロピルメチルセルロースアセテートサクシネートは公知であり、例えば、信越化学工業(株)から商品名AS−L、AS−M及びAS−Hとして市販されている。本発明では、これらの市販品をいずれも使用することができる。ヒドロキシプロピルメチルセルロースアセテートサクシネートは、その水酸基がメトキシ基20〜26%、ヒドロキシプロポキシ基5〜10%、アセチル基5〜14%、サクシノイル基4〜18%で置換されている。
【0043】
上記セルロース化合物のうち、pH5〜5.5のマイクルバイン(McIlvaine)緩衝溶液に溶解するセルロース化合物が好ましい。このようなセルロース化合物には、HP−55、HP−55S、HP−50及びAS−Lが含まれる。
【0044】
上記セルロース化合物のうち、pH5のマイクルバイン緩衝溶液に溶解するセルロース化合物が特に好ましい。このようなセルロース化合物には、HP−50が含まれる。
【0045】
本発明の医薬組成物における(I)成分及び(II)成分の配合割合は、本発明の優れた効果を発現するためには、(I)成分1重量部に対して、(II)成分が通常約0.5重量部以上、好ましくは約1重量部以上、より好ましくは約1.5重量部以上である。本発明医薬組成物の投与形態を考慮すると、(I)成分1重量部に対して、(II)成分が通常約15重量部以下、好ましくは約10重量部以下、より好ましくは約5重量部以下、特に好ましくは約3重量部以下である。
【0046】
本発明の医薬組成物には、ビタミンEを更に配合することができる。
【0047】
ビタミンEには、例えば、d−α−トコフェロール、d−δ−トコフェロール、酢酸d−α−トコフェロール、コハク酸d−α−トコフェロール、dl−α−トコフェロール、酢酸dl−α−トコフェロール、コハク酸dl−α−トコフェロール、コハク酸dl−α−トコフェロールカルシウム、ニコチン酸dl−α−トコフェロール等の天然及び合成ビタミンE等が含まれる。好ましいビタミンEは、dl−α−トコフェロール、酢酸dl−α−トコフェロール、コハク酸dl−α−トコフェロール及びニコチン酸dl−α−トコフェロールであり、より好ましいビタミンEは、dl−α−トコフェロールである。
【0048】
本発明においては、ビタミンEを配合することが望ましい。ビタミンEを配合することにより医薬組成物の安定性を顕著に向上させることができる。ビタミンEと同様の抗酸化作用を有している化合物、例えば、ジブチルヒドロキシトルエン、ブチルヒドロキシアニソール、大豆レシチン、パルミチン酸アスコルビル、塩酸システイン、アスコルビン酸、クエン酸、エリソルビン酸、亜硝酸ナトリウム、亜硫酸ナトリウム、チオグリコール酸ナトリウム、チオリンゴ酸ナトリウム等をビタミンEの代わりに使用した場合には、医薬組成物の安定性を顕著に向上させることができない。これは、本発明者らが初めて見つけた事項である。
【0049】
これらのビタミンE、特にdl−α−トコフェロールを配合することにより、オキサゾール化合物の水に対する溶解性に悪影響を与えることなく、医薬組成物の安定性を顕著に向上させることができる。
【0050】
本発明の医薬組成物に配合されるビタミンEの量は、(I)成分1重量部に対して、通常0.001〜1重量部程度、好ましくは0.01〜0.8重量部程度、より好ましくは0.03〜0.5重量部程度である。
【0051】
本発明の医薬組成物には、pH非依存型水溶性高分子化合物(pH-independent water-soluble polymers)、可塑剤等の各種の補助成分を適宜配合することができる。
【0052】
pH非依存型水溶性高分子化合物としては、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ポリエチレングリコール、シクロデキストリン等が挙げられる。
【0053】
可塑剤としては、例えば、クエン酸トリエチル、グリセリン、グリセリン脂肪酸エステル、中鎖脂肪酸トリグリセライド、トリアセチン、ヒマシ油、プロピレングリコール、ポリソルベート等が挙げられる。
【0054】
本発明の医薬組成物は、賦形剤、崩壊剤、結合剤、流動化剤、滑沢剤、コーティング剤、着色剤、懸濁化剤、甘味剤、界面活性剤等の担体を適宜使用し、公知の方法に従って一般的な医薬製剤の形態とされる。医薬製剤の形態としては、例えば、粉剤、錠剤、丸剤、カプセル剤等が挙げられる。
【0055】
賦形剤しては、例えば、乳糖、無水乳糖、精製白糖、白糖、D−マンニトール、D−ソルビトール、キシリトール、エリスリトール、デキストリン、結晶セルロース、微結晶セルロース、トウモロコシデンプン、バレイショデンプン、無水リン酸水素カルシウム等が挙げられる。
【0056】
崩壊剤としては、例えば、カルボキシメチルスターチナトリウム、カルメロース、カルメロースカルシウム、カルメロースナトリウム、クロスカルメロースナトリウム、クロスポビドン、低置換度ヒドロキシプロピルセルロース、部分アルファ−化デンプン等が挙げられる。
【0057】
結合剤としては、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、アルファー化デンプン、シロップ、水あめ等が挙げられる。
【0058】
流動化剤としては、例えば、軽質無水ケイ酸、合成ケイ酸アルミニウム、含水二酸化ケイ素、ステアリン酸カルシウム、メタケイ酸アルミン酸マグネシウム、タルク等が挙げられる。
【0059】
滑沢剤としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、ケイ酸マグネシウム、酸化マグネシウム、タルク、硬化油、ショ糖脂肪酸エステル、フマル酸ステアリルナトリウム等が挙げられる。
【0060】
コーティング剤としては、例えば、ヒドロキシプロピルメチルセルロース、ポリビニルアルコール、ポリソリベート、マクロゴール、タルク等が挙げられる。
【0061】
着色剤としては、例えば、黄色三二酸化鉄、褐色酸化鉄、三二酸化鉄、酸化チタン、食用青色1号、食用赤色2号、食用赤色3号、食用黄色4号等が挙げられる。
【0062】
懸濁化剤としては、例えば、ポリソリベート、ポリエチレングリコール、アラビアゴム、グリセリン、ゼラチン等が挙げられる。
【0063】
甘味剤としては、例えば、アスパルテーム、サッカリン、サッカリンナトリウム、水アメ、果糖等が挙げられる。
【0064】
界面活性剤としては、例えば、ラウリル硫酸ナトリウム、ポリソリベート、ポリオキシエチレン硬化ヒマシ油等が挙げられる。
【0065】
カプセル剤は、公知の方法に従い、(I)成分、(II)成分等を上記例示した各種の担
体と混合して、ゼラチン、ヒドロキシプロピルメチルセルロース、ポリビニルアルコール等からなる硬質カプセル及びゼラチンをベースとした軟質カプセルに充填して調製される。
【発明の効果】
【0066】
本発明によれば、オキサゾール化合物にヒドロキシプロピルメチルセルロースフタレート及び/又はヒドロキシプロピルメチルセルロースアセテートサクシネートを配合することにより、オキサゾール化合物の水に対する溶解性を大幅に改善することができる。従って、オキサゾール化合物の水に対する溶解性を改善した医薬組成物を提供することができる。オキサゾール化合物及び上記セルロース化合物に更にビタミンEを配合することにより、医薬組成物の安定性を顕著に向上させることができる。
【発明を実施するための最良の形態】
【0067】
以下に実施例を掲げて、本発明をより一層明らかにする。
【0068】
製剤例1
化合物A 50mg
ヒドロキシプロピルメチルセルロースフタレート
(HP−50,信越化学工業製) 150mg
乳糖(スーパータブ HP−01,Lactose Company of NZ 製)100mg
結晶セルロース(セオラスPH301,旭化成工業製) 100mg
カルボキシメチルスターチナトリウム(プリモジェル,DMV 製) 40mg
カルメロースカルシウム(E.C.G.−505,五徳薬品製) 40mg
軽質無水珪酸(アドソリダー101,フロイント産業製) 6mg
ステアリン酸マグネシウム(太平化学産業製) 6mg
上記各成分が1錠中に含まれるように、錠剤を製造した。
【0069】
製剤例2
化合物A 50mg
ヒドロキシプロピルメチルセルロースフタレート
(HP−50,信越化学工業製) 150mg
軽質無水珪酸(アドソリダー101,フロイント産業製) 20mg
上記各成分が1カプセル中に含まれるように、カプセル剤を製造した。
【0070】
実施例1
化合物A(R体)1g及びヒドロキシプロピルメチルセルロースフタレート(HP−50、信越化学工業(株)製)3gを塩化メチレン−エタノール混合溶媒(塩化メチレン:エタノール=8:2重量比)100mlに溶解した。次いで混合物をスプレードライヤー(GS−310、ヤマト サイエンティフィック社製(Yamato Scientific Co., Ltd.))を用いて噴霧乾燥した。得られた噴霧乾燥物を、更に真空乾燥機(LCV−323、タバイエスペック社製(Tabai Espec Corp.))を用い60℃で12時間以上乾燥し、粉剤形態の本発明医薬組成物を製造した。
【0071】
実施例2
ヒドロキシプロピルメチルセルロースフタレートの代わりにヒドロキシプロピルメチルセルロースアセテートサクシネート(AS−L、信越化学工業(株)製)を用いる以外は実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0072】
比較例1
化合物A(R体)1gをジェットミル粉砕機(A−O,セイシン企業製)を用いて粉砕し、比較のための医薬組成物とした。
【0073】
比較例2
ヒドロキシプロピルメチルセルロースフタレートの代わりにヒドロキシプロピルセルロース(HPC−SL、日本曹達(株)製)を用いる以外は実施例1と同様にして、粉剤形態の医薬組成物を製造した。
【0074】
比較例3
ヒドロキシプロピルメチルセルロースフタレートの代わりにヒドロキシプロピルメチルセルロース(TC−5E、日本曹達(株)製)を用いる以外は実施例1と同様にして、粉剤形態の医薬組成物を製造した。
【0075】
試験例1
以下に示すようにして、実施例1〜2及び比較例1〜3で得られた医薬組成物の溶解性を調べた。
【0076】
まず、100mlのビーカーに0.3重量%ラウリル硫酸ナトリウム水溶液100mlを入れ、マグネットスターラーで撹拌した(回転数:500rpm)。別途、メノウ乳鉢に、上記各医薬組成物を化合物Aの量が5mgになるように量り取り、ビーカー中の試験液を数ml加えた。約1分間分散させた後、混合物をビーカー中に投入した。分散液投入から5分後、10分後及び20分後に、ビーカー中の液6mlをサンプリングし、この液を孔径0.5μm以下のメンブランフィルターで濾過した。初めの濾液2mlを除き、後の濾液4mlを試料溶液とした。
【0077】
各試料溶液について、層長10mmのセルを用いて、紫外可視吸光度測定法により、各液の波長(335nm)における吸光度を測定した。
【0078】
結果を図1に示す。
【0079】
図1から、実施例1及び実施例2で得られる医薬組成物は、水に対する溶解性が著しく改善されていることが分かる。
【0080】
実施例3
ヒドロキシプロピルメチルセルロースフタレート3gの代わりにヒドロキシプロピルメチルセルロースフタレート2gを用いる以外は実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0081】
実施例4
ヒドロキシプロピルメチルセルロースフタレート3gの代わりにヒドロキシプロピルメチルセルロースフタレート1.5gを用いる以外は実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0082】
実施例3及び実施例4で得られる医薬組成物についても、試験例1と同様にして水に対する溶解性を調べた結果、溶解性は実施例1で得られる医薬組成物のそれと同レベルであった。その結果、ヒドロキシプロピルメチルセルロースフタレートの配合量を、化合物A1gに対して1.5〜3gの範囲で変化させたいずれの場合においても、本発明の効果を発現できることが明らかになった。
【0083】
実施例5
化合物Q(R体)1g及びヒドロキシプロピルメチルセルロースフタレート(HP−50、信越化学工業(株)製)3gを塩化メチレン−エタノール混合溶媒(塩化メチレン:エタノール=8:2重量比)100mlに溶解した。次いで混合物をスプレードライヤー(GS−310、ヤマト サイエンティフィック社製(Yamato Scientific Co., Ltd.))を用いて噴霧乾燥した。得られた噴霧乾燥物を、更に真空乾燥機(LCV−323、タバイエスペック社製(Tabai Espec Corp.))を用い60℃で12時間以上乾燥し、粉剤形態の本発明医薬組成物を製造した。
【0084】
比較例4
化合物Q(R体)1gをジェットミル粉砕機(A−O,セイシン企業製)を用いて粉砕し、比較のための医薬組成物とした。
【0085】
比較例5
ヒドロキシプロピルメチルセルロースフタレートの代わりにヒドロキシプロピルセルロース(HPC−SL、日本曹達(株)製)を用いる以外は実施例5と同様にして、粉剤形態の医薬組成物を製造した。
【0086】
試験例2
試験例1と同様にして、実施例5、比較例4及び比較例5で得られた医薬組成物の溶解性を調べた。
【0087】
結果を図2に示す。
【0088】
図2から、実施例5で得られる医薬組成物は、水に対する溶解性が著しく改善されていることが分かる。
【0089】
実施例6
化合物A(R体)2g、ヒドロキシプロピルメチルセルロースフタレート(HP−50、信越化学工業(株)製)3g及びdl−α−トコフェロール(抗酸化剤、和光純薬工業(株)製)0.08gを塩化メチレン−エタノール混合溶媒(塩化メチレン:エタノール=8:2重量比)100mlに溶解した。次いで混合物をスプレードライヤー(GS−310、ヤマト サイエンティフィック社製(Yamato Scientific Co., Ltd.))を用いて噴霧乾燥した。得られた噴霧乾燥物を、更に真空乾燥機(LCV−323、タバイエスペック社製(Tabai Espec Corp.))を用い60℃で12時間以上乾燥し、粉剤形態の本発明医薬組成物を製造した。
【0090】
実施例7
dl−α−トコフェロールの代わりにジブチルヒドロキシトルエン(抗酸化剤)0.04gを用いる以外は実施例6と同様にして粉剤形態の本発明医薬組成物を製造した。
【0091】
実施例8
dl−α−トコフェロールの代わりにブチルヒドロキシアニソール(抗酸化剤)0.004gを用いる以外は実施例6と同様にして粉剤形態の本発明医薬組成物を製造した。
【0092】
実施例9
抗酸化剤を配合しない以外は実施例6と同様にして粉剤形態の本発明医薬組成物を製造した。
【0093】
試験例3
実施例6〜9で得られた医薬組成物を、40℃で1週間保存した後、各医薬組成物に含まれている化合物Aの純度を調べた。化合物Aの純度は、面積百分率で算出した。
【0094】
結果を次表に示す。
【0095】
【表1】

【0096】
表1から、dl−α−トコフェロールを配合することにより、化合物Aの安定性が格段に向上することがわかる。
【0097】
実施例10
化合物A(R体)の代わりに化合物B(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0098】
実施例11
化合物A(R体)の代わりに化合物C(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0099】
実施例12
化合物A(R体)の代わりに化合物D(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0100】
実施例13
化合物A(R体)の代わりに化合物G(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0101】
実施例14
化合物A(R体)の代わりに化合物H(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0102】
実施例15
化合物A(R体)の代わりに化合物N(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0103】
実施例16
化合物A(R体)の代わりに化合物T(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0104】
実施例17
化合物A(R体)の代わりに化合物U(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0105】
実施例18
化合物A(R体)の代わりに化合物V(R体)1gを使用する以外は、実施例1と同様にして、粉剤形態の本発明医薬組成物を製造した。
【0106】
試験例3
試験例1と同様にして、実施例10〜18で得られた医薬組成物の溶解性を調べた。その結果、実施例10〜18で得られる各医薬組成物は、水に対する溶解性が著しく改善されていることが明らかになった。
【図面の簡単な説明】
【0107】
【図1】図1は、実施例1〜2及び比較例1〜3で得られた医薬組成物を含む溶液の吸光度と時間との関係を示すグラフである。
【図2】図2は、実施例5、比較例4及び比較例5で得られた医薬組成物を含む溶液の吸光度と時間との関係を示すグラフである。
【特許請求の範囲】
【請求項1】
(I) 一般式 (1)
【化1】

[式中、R1は水素原子又はC1〜6アルキル基を示す。nは0〜6の整数を示す。R2は下記一般式(A)〜(F)のいずれかの基を示す。
一般式(A)で表される基:
【化2】

(式中、R3は、下記(1)〜(6)のいずれかの基を示す。
(1)フェノキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(2)フェニルC1〜6アルコキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(3)基−NR4R5
(ここで、R4はC1〜6アルキル基を示し、R5はフェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。);
(4)フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基の少なくとも1種が1個又は2個以上置換していてもよい);
(5)フェノキシC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(6)ベンゾフリルC1〜6アルキル基(ベンゾフラン環上には、ハロゲン原子、ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
一般式(B)で表される基:
【化3】

(式中、R6は、フェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(C)で表される基:
【化4】

(式中、R7は、フェニルC2〜10アルケニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)又はビフェニルC1〜6アルキル基(1個又は2個のフェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(D)で表される基:
【化5】

(式中、R8は、フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(E)で表される基:
【化6】

(式中、R8は前記に同じ。)
一般式(F)で表される基:
【化7】

(式中、R8は前記に同じ。)]
で表される2,3−ジヒドロ−6−ニトロイミダゾ[2,1−b]オキサゾール化合物、それらの光学活性体及びそれらの薬理学的に許容される塩からなる群より選ばれた少なくとも1種のオキサゾール化合物、並びに
(II)ヒドロキシプロピルメチルセルロースフタレート及びヒドロキシプロピルメチルセルロースアセテートサクシネートからなる群より選ばれた少なくとも1種のセルロース化合物
を含有する医薬組成物。
【請求項2】
オキサゾール化合物が2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである請求項1に記載の医薬組成物。
【請求項3】
オキサゾール化合物が6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジルオキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである請求項1に記載の医薬組成物。
【請求項4】
オキサゾール化合物が2−メチル−6−ニトロ−2−(4−{4−[3−(4−トリフルオロメトキシフェニル)−2−プロペニル]ピペラジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである請求項1に記載の医薬組成物。
【請求項5】
オキサゾール化合物が2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメチルフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである請求項1に記載の医薬組成物。
【請求項6】
ビタミンEを更に含有する請求項1に記載の医薬組成物。
【請求項7】
ビタミンEがdl−α−トコフェロールである請求項6に記載の医薬組成物。
【請求項8】
ビタミンEを更に含有する請求項2に記載の医薬組成物。
【請求項9】
ビタミンEがdl−α−トコフェロールである請求項8に記載の医薬組成物。
【請求項10】
ビタミンEを更に含有する請求項3に記載の医薬組成物。
【請求項11】
ビタミンEがdl−α−トコフェロールである請求項10に記載の医薬組成物。
【請求項12】
ビタミンEを更に含有する請求項4に記載の医薬組成物。
【請求項13】
ビタミンEがdl−α−トコフェロールである請求項12に記載の医薬組成物。
【請求項14】
ビタミンEを更に含有する請求項5に記載の医薬組成物。
【請求項15】
ビタミンEがdl−α−トコフェロールである請求項14に記載の医薬組成物。
【請求項1】
(I) 一般式 (1)
【化1】

[式中、R1は水素原子又はC1〜6アルキル基を示す。nは0〜6の整数を示す。R2は下記一般式(A)〜(F)のいずれかの基を示す。
一般式(A)で表される基:
【化2】

(式中、R3は、下記(1)〜(6)のいずれかの基を示す。
(1)フェノキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(2)フェニルC1〜6アルコキシ基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(3)基−NR4R5
(ここで、R4はC1〜6アルキル基を示し、R5はフェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。);
(4)フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基の少なくとも1種が1個又は2個以上置換していてもよい);
(5)フェノキシC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
(6)ベンゾフリルC1〜6アルキル基(ベンゾフラン環上には、ハロゲン原子、ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい);
一般式(B)で表される基:
【化3】

(式中、R6は、フェニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(C)で表される基:
【化4】

(式中、R7は、フェニルC2〜10アルケニル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)又はビフェニルC1〜6アルキル基(1個又は2個のフェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(D)で表される基:
【化5】

(式中、R8は、フェニルC1〜6アルキル基(フェニル環上には、ハロゲン原子;ハロゲン置換もしくは未置換のC1〜6アルキル基及びハロゲン置換もしくは未置換のC1〜6アルコキシ基からなる群より選ばれた基が1個又は2個以上置換していてもよい)を示す。)
一般式(E)で表される基:
【化6】

(式中、R8は前記に同じ。)
一般式(F)で表される基:
【化7】

(式中、R8は前記に同じ。)]
で表される2,3−ジヒドロ−6−ニトロイミダゾ[2,1−b]オキサゾール化合物、それらの光学活性体及びそれらの薬理学的に許容される塩からなる群より選ばれた少なくとも1種のオキサゾール化合物、並びに
(II)ヒドロキシプロピルメチルセルロースフタレート及びヒドロキシプロピルメチルセルロースアセテートサクシネートからなる群より選ばれた少なくとも1種のセルロース化合物
を含有する医薬組成物。
【請求項2】
オキサゾール化合物が2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメトキシフェノキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである請求項1に記載の医薬組成物。
【請求項3】
オキサゾール化合物が6−ニトロ−2−{4−[4−(4−トリフルオロメトキシベンジルオキシ)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである請求項1に記載の医薬組成物。
【請求項4】
オキサゾール化合物が2−メチル−6−ニトロ−2−(4−{4−[3−(4−トリフルオロメトキシフェニル)−2−プロペニル]ピペラジン−1−イル}フェノキシメチル)−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである請求項1に記載の医薬組成物。
【請求項5】
オキサゾール化合物が2−メチル−6−ニトロ−2−{4−[4−(4−トリフルオロメチルフェノキシメチル)ピペリジン−1−イル]フェノキシメチル}−2,3−ジヒドロイミダゾ[2,1−b]オキサゾールである請求項1に記載の医薬組成物。
【請求項6】
ビタミンEを更に含有する請求項1に記載の医薬組成物。
【請求項7】
ビタミンEがdl−α−トコフェロールである請求項6に記載の医薬組成物。
【請求項8】
ビタミンEを更に含有する請求項2に記載の医薬組成物。
【請求項9】
ビタミンEがdl−α−トコフェロールである請求項8に記載の医薬組成物。
【請求項10】
ビタミンEを更に含有する請求項3に記載の医薬組成物。
【請求項11】
ビタミンEがdl−α−トコフェロールである請求項10に記載の医薬組成物。
【請求項12】
ビタミンEを更に含有する請求項4に記載の医薬組成物。
【請求項13】
ビタミンEがdl−α−トコフェロールである請求項12に記載の医薬組成物。
【請求項14】
ビタミンEを更に含有する請求項5に記載の医薬組成物。
【請求項15】
ビタミンEがdl−α−トコフェロールである請求項14に記載の医薬組成物。
【図1】


【図2】




【図2】


【公表番号】特表2009−502736(P2009−502736A)
【公表日】平成21年1月29日(2009.1.29)
【国際特許分類】
【出願番号】特願2008−504290(P2008−504290)
【出願日】平成18年7月19日(2006.7.19)
【国際出願番号】PCT/JP2006/314708
【国際公開番号】WO2007/013477
【国際公開日】平成19年2月1日(2007.2.1)
【出願人】(000206956)大塚製薬株式会社 (230)
【Fターム(参考)】
【公表日】平成21年1月29日(2009.1.29)
【国際特許分類】
【出願日】平成18年7月19日(2006.7.19)
【国際出願番号】PCT/JP2006/314708
【国際公開番号】WO2007/013477
【国際公開日】平成19年2月1日(2007.2.1)
【出願人】(000206956)大塚製薬株式会社 (230)
【Fターム(参考)】
[ Back to top ]

