単核球分離管、単核球分離システム、単核球の分離方法、単核球、及び、体内投与用薬剤
【課題】簡易に単核球を分離できる単核球の単核球分離管を提供する。
【解決手段】遠心分離処理前には試料溶液が収納されると共に遠心分離処理後には低比重成分である単核球が位置する上チャンバ110と、遠心分離処理前には遠心分離媒体が収納されると共に遠心分離処理後には不要成分である高比重成分が位置する下チャンバ120と、上チャンバ110の下側開口と下チャンバ120の上側開口とを開閉自在に接続する三方活栓130と、上チャンバ110の上側開口を密栓する蓋140と、を備える
【解決手段】遠心分離処理前には試料溶液が収納されると共に遠心分離処理後には低比重成分である単核球が位置する上チャンバ110と、遠心分離処理前には遠心分離媒体が収納されると共に遠心分離処理後には不要成分である高比重成分が位置する下チャンバ120と、上チャンバ110の下側開口と下チャンバ120の上側開口とを開閉自在に接続する三方活栓130と、上チャンバ110の上側開口を密栓する蓋140と、を備える
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液等から簡単かつ純度良く単核球を分離することができる単核球の分離方法、単核球分離管、及び単核球分離システム、並びにその分離方法等により得られた単核球、及びその単核球を有効成分とする体内投与用薬剤に関する。
【背景技術】
【0002】
近年、幹細胞移植による心血管再生治療が虚血性心疾患に対する新しい治療法として期待されている。自己骨髄幹細胞や筋芽細胞等を用いる心血管再生治療は約10年前から臨床試験が開始され、骨髄幹細胞を含む骨髄単核球分画を用いた治療法は、心筋梗塞患者での有効性が二重盲検試験で明らかにされている。
【0003】
単核球を分離する最も一般的な技術としては、特許文献1や特許文献2に記載されているように、試験管の底にフィコール・パック(Ficoll-Paque、登録商標、ファルマシア・ファイン・ケミカルズ(Pharmacia Fine Chemicals)社製)を設置する遠心分離方法をあげることができる。この方法は、所定量のフィコール・パックを試験管底に設置する工程、血液試料をフィコール・パック上にピペットで移す工程、フィコール・パックの比重よりも大きい比重を有する血液成分が、フィコール・パックを通過するように遠心分離する工程、及び、フィコール・パックの上方に分離された単核球層をピペットで採取する工程からなる。
【0004】
また、単核球の分離には、細胞に細菌やウイルスが感染しないよう高度に無菌状態が保たれており、環境温度・室圧等の作業環境が厳密にコントロールされた閉鎖系設備が必要である。そのため特許文献3に記載されているようなCProC(Cell Processing Center=セルプロセッシングセンター)にて単核球の分離が行われる。
【0005】
CProCは、免疫細胞療法や再生医療、あるいは遺伝子治療等、細胞を利用した医療や研究を行うため施設であり、例えば細胞調製室、QC室、製品保管室、準備室、更衣室、監視室等から構成されており、細胞調製室には、安全キャビネット、細胞培養インキュベーターその他必要な機器が具備されており、環境清浄度は常にモニターされ監視室にてビデオモニターされる。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2010−504083号公報
【特許文献2】特表2007−509601号公報
【特許文献3】特開2009−065844号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかし、上述のフィコール・パックを試験管底に設置する単核球の分離は、血液試料をフィコール・パック上に移すとき、フィコール・パックとの界面を乱さないように血液試料を静かに重層しなければならず、更には、遠心分離後においては、フィコール・パックの上方に分離された単核球層をピペットで採取する際には、不要な成分をピペットにて採取しないように注意深く採取する必要があり、操作が煩雑であるという問題点を有する。
【0008】
また、CProCは、上述したように極めて高度かつ特殊な施設であり、しかも設置コストも非常に高価である問題点がある。そのため、CProCの設置は、心筋梗塞患者等に対する幹細胞治療の普及に対する大きな障壁となっており、一般病院でも使用可能な閉鎖系でかつ特殊な機械・設備や特別な知識・技能・訓練を必要としない単核球の分離システムが求められている。
【0009】
本発明はかかる問題点に鑑みてなされたものであって、極めて簡易に単核球を分離できる単核球分離管を提供することを目的とする。また、一般病院でも使用可能な簡易な閉鎖系の単核球分離システムを提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明においては、単核球分離管を上チャンバと下チャンバとを有して構成し、更に上チャンバと下チャンバとを連通状態又は非連通状態に切り換える活栓を設けたので、遠心分離前には下チャンバに遠心分離媒体を収納して活栓を閉じることにより、面倒な動作を要せずに上チャンバに試料溶液を導入でき、遠心分離後においては活栓を閉じることにより、不要成分の採取可能性を少なくして上チャンバから面倒な動作を要せずに単核球を採取することができる。ここで単核球とは、細胞内に核を1つ保有する有核細胞を指し、いわゆる単球、リンパ球及び未熟な幹細胞群を意味する。
【0011】
また、本発明においては、このような構成の単核球分離管と、単核球分離管に対して空気を出し入れするエアバッグと、試料溶液が収納される試料溶液バッグと、を閉鎖系状態にて接続させたので、極めて簡易に単核球分離システムを構成できる。
【0012】
具体的には、本発明の第1の観点に係る単核球分離管は、単核球を含む複数成分からなる試料溶液を、遠心分離媒体を用いて遠心分離処理することで、前記複数成分を比重の違いにより分離させ、低比重成分である単核球を採取するための単核球分離管であって、上側に配置されて前記試料溶液が導入される導入開口及び下側に配置された下側開口を有し、遠心分離処理前には前記試料溶液が収納されると共に遠心分離処理後には前記低比重成分である単核球が位置する上チャンバと、上側に上側開口が配置され下側が閉塞し、遠心分離処理前には前記遠心分離媒体が収納されると共に遠心分離処理後には不要成分である高比重成分が位置する下チャンバと、前記上チャンバの下側開口と前記下チャンバの上側開口とを、連通状態又は非連通状態に切り換える活栓と、前記上チャンバの前記導入開口を密栓する蓋と、を備えることを特徴とする。
【0013】
また、前記活栓は、第1、第2及び第3接続口を有する3個の流体通路を備えた三方活栓であり、第1接続口は前記上チャンバの下側開口に接続され、第2接続口は前記下チャンバの上側開口に接続され、遠心分離処理後に前記第1接続口及び前記第3接続口を連通させて、前記低比重成分である単核球を前記第3接続口から取り出すことが好ましい。
【0014】
また、前記遠心分離媒体は、ヨード造影剤を主成分とし、且つ、前記下チャンバに収納されていることが好ましい。
【0015】
また、前記ヨード造影剤は、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミドから選択される非イオン性水溶性ヨード造影剤であることが好ましい。
【0016】
また、本発明の第2の観点に係る単核球分離システムは、請求項1に記載の単核球分離管と、単核球を含む複数成分からなる試料溶液が収納される試料溶液バッグと、前記単核球分離管に対して空気を出し入れするエアバッグと、前記単核球分離管の蓋を貫通して、前記上チャンバと前記試料溶液バッグとを接続する第1チューブと、前記単核球分離管の蓋を貫通して、前記上チャンバと前記エアバッグとを接続する第2チューブと、を備えることを特徴とする。
【0017】
また、本発明の第3の観点に係る単核球分離システムは、請求項2乃至4の何れか1項に記載の単核球分離管と、単核球を含む複数成分からなる試料溶液が収納される試料溶液バッグと、前記単核球分離管に対して空気を出し入れするエアバッグと、分離された低比重成分である単核球を収納する単核球収納バッグと、前記単核球分離管の蓋を貫通して、前記上チャンバと前記試料溶液バッグとを接続する第1チューブと、前記単核球分離管の蓋を貫通して、前記上チャンバと前記エアバッグとを接続する第2チューブと、前記単核球収納バッグと前記三方活栓の第3接続口とを接続する第3チューブと、を備えることを特徴とする。
【0018】
また、本発明の第4の観点に係る遠心分離方法は、ヨード造影剤を遠心分離媒体の主成分とする比重遠心分離法により、単核球を含む複数成分からなる試料溶液から単核球を分離することを特徴とする。
【0019】
また、前記ヨード造影剤は、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミドから選択される非イオン性水溶性ヨード造影剤であることが好ましい。
【0020】
また、本発明の第5の観点に係る単核球は、請求項7又は8記載の単核球の分離方法により分離されたことを特徴とする。
【0021】
また、本発明の第6の観点に係る体内投与用薬剤は、請求項9記載の単核球を有効成分として含むことを特徴とする。
【0022】
また、前記体内投与用薬剤は、脳疾患治療、神経変性疾患治療、末梢血管疾患治療、心疾患治療、脳性麻痺治療、腎梗塞治療、認知症治療、慢性腎不全治療、又は、慢性心不全治療のいずれかに使用されることが好ましい。
【発明の効果】
【0023】
本発明によれば、遠心分離前に試料溶液を単核球分離管内に導入する際の操作及び遠心分離後に単核球を採取する操作を極めて簡易に行うことができ、そのため面倒な動作を行うこと無しに単核球を分離できる。また、この単核球分離管を使用して閉鎖系の単核球分離システムを構成するため、特殊な機械・設備や特別な知識・技能・訓練を必要とせず、一般病院でも使用できる。
【図面の簡単な説明】
【0024】
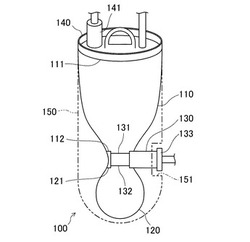
【図1】第1実施形態に係る単核球分離管の概略図である。
【図2】第2実施形態に係る単核球分離システムの概略図である。
【図3】試料溶液を単核球分離管の上チャンバに導入する状態を説明する図である。
【図4】三方活栓の第3接続口から単核球を採取する状態を説明する図である。
【図5】SCIDマウス脳虚血モデルにおける大脳皮質機能回復促進効果の測定結果である。
【図6】SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。
【図7】SCIDマウス脳虚血モデルにおける大脳皮質機能回復促進効果の測定結果である。
【図8】SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。
【図9】SCIDマウス脳虚血モデルにおける大脳皮質機能回復促進効果の測定結果である。
【図10】SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。
【発明を実施するための形態】
【0025】
以下、添付の図面を参照して本発明の実施形態について具体的に説明するが、当該実施形態は本発明の原理の理解を容易にするためのものであり、本発明の範囲は、下記の実施形態に限られるものではなく、当業者が以下の実施形態の構成を適宜置換した他の実施形態も、本発明の範囲に含まれる。
【0026】
(第1実施形態)
図1は本実施形態に係る単核球分離管100の概略図である。図1に示すように、単核球分離管100は、上端側に配置された導入開口111及び下端側に配置された下側開口112を有する筒体からなる上チャンバ110と、上端側に上側開口121が配置され下端側が閉塞した有底筒体からなる下チャンバ120と、第1接続口131、第2接続口132及び第3接続口133を有する3個の流体通路を備えた三方活栓130と、を備える。
【0027】
上チャンバ110の下側開口112及び下チャンバ120の上側開口121は、導入開口111よりも狭く構成されている。即ち、上チャンバ110と下チャンバ120との接続部分にはくびれ部が設けられており、そのくびれ部に三方活栓130が設けられている。
【0028】
三方活栓130は、第1接続口131、第2接続口132及び第3接続口133を外周上に備えるとともに、回転操作によりその第1〜第3接続口のうちの所定の接続口同士を連通させる流路切換部を備える。上チャンバ110の下側開口112と下チャンバ120の上側開口121とは、この流路切換部を回転させることにより開閉自在に液密に接続される。例えば、上チャンバ110の下側開口112と下チャンバ120の上側開口121とが連通状態の場合は、第1接続口131は上チャンバ110の下側開口112に接続され、第2接続口132は下チャンバ120の上側開口121に接続される。
【0029】
上チャンバ110及び下チャンバ120はケース150に覆われており、これにより各チャンバは外部衝撃から保護される。ケース150には切欠部151が設けられており、切欠部151からは第3接続口133が露出している。上チャンバ110の導入開口111は蓋140により密栓される。蓋140の上部には、試料溶液が導入される導入口141が設けられている。上チャンバ110及び下チャンバ120の材質は、遠心力に対しても変形しない自己保形性を備えた材料から構成されているならば特に限定されるものではないが、例えばポリプロピレン共重合体、ポリスチレン等により構成される。
【0030】
下チャンバ120には、ヨード造影剤を主成分とする遠心分離媒体が収納されている。ヨード造影剤は、ヨードを含有する造影剤であり、画像診断の際に画像にコントラストを付けたり特定の組織を強調して撮影するために患者に投与される医薬品である。ヨード造影剤を用いる理由は、赤血球・顆粒球と単核球とを分画できる比重の重い遠心分離媒体を用いる必要があること、かつ、後述するように、遠心分離により単核球分画が採取された後に遠心分離媒体を除去すること無しに体内投与が可能となるからである。
【0031】
ヨード造影剤は、水溶性ヨード造影剤であることが好ましく、特に非イオン性水溶性ヨード造影剤であることが好ましい。体内の細胞内や細胞膜には様々な陰イオンあるいは陽イオンの電荷を持つ物質があり、イオン性水溶性ヨード造影剤はそれに対して影響を与える可能性がありうるからである。非イオン性水溶性ヨード造影剤としては、特に限定されるものではないが、例えば、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミド等を用いることが可能である。
【0032】
下チャンバ120に収納される遠心分離媒体には、ヨード造影剤以外に、医療用生理食塩水や医療用蒸留水等を含有することが可能である。遠心分離媒体の比重は、赤血球・顆粒球と単核球とを分画できる比重であれば特に限定されるものではないが、室温(20℃〜25℃)において例えば1.066〜1.083g/mlであり、好ましくは1.073〜1.080g/ml、特に好ましくは1.077g/mlである。遠心分離媒体のpHは、分離される単核球に悪影響を与えないものであれば特に限定されるものではないが、例えば7.0〜7.8であり、好ましくは7.2〜7.6であり、特に好ましくは7.4である。遠心分離媒体の浸透圧は、分離される単核球に対して親和性を有するものであれば特に限定されるものではないが、例えば0.9〜1.1(医療用生理食塩水に対する比)であり、好ましくは1.0である。
【0033】
上チャンバ110の導入開口111から導入される試料溶液は、単核球を含む試料であれば特に限定されるものではないが、例えば骨髄液、血液、又は臍帯血を含むものが好ましい。試料溶液には、単核球を遠心分離しやすくするために、医療用生理食塩水を含有させることが可能である。
【0034】
上チャンバ110及び下チャンバ120の内容積は、遠心分離後の赤血球・顆粒球分画が下チャンバ120に位置し、単核球を含む分画が上チャンバ110に位置するものであれば特に限定されるものではなく、例えば、上チャンバ110の内容積:下チャンバ120の内容積を1:1〜2:1とすることが可能である。
【0035】
次に、上述の構成の単核球分離管100を用いる単核球の分離を説明する。上チャンバ110の内容積は例えば20mlとし、下チャンバ110の内容積は例えば10mlとする。遠心分離媒体は、例えば、医療用であるヨード造影剤に医療用生理食塩水と医療用蒸留水とを混和することにより作成される。そして例えば10mlの遠心分離媒体を下チャンバ120に配置し、三方活栓130の第1接続口131、第2接続口132及び第3接続口133をいずれも閉じる。
【0036】
次に、ヒト骨髄液原液を例えば10mlと、医療用生理食塩水を例えば10mlと混和することにより、20mlの試料溶液を調整する。そして注射器を用いて蓋140の導入口141から、三方活栓130の全ての接続口が閉じた状態にて試料溶液20mlを注入する。上チャンバ110と下チャンバ120との連通が閉じた状態にて試料溶液を入れるので、試料溶液と遠心分離媒体との界面の乱れを考慮することなく簡易な操作にて試料溶液の導入ができる。
【0037】
そして、三方活栓130の第3接続口133を閉鎖し、第1接続口131及び第2接続口132を連通させるようにして、所定条件の下で遠心分離を行い、遠心後には三方活栓130の第1接続口131、第2接続口132及び第3接続口133をいずれも閉じるようにする。
【0038】
遠心分離後は、下層の赤血球・顆粒球分画が約5ml、中間層の遠心分離媒体が10ml、上層の単核球を含む分画が約15mlである3層構造となるので、上チャンバ110には、単核球を含む分画が約15mlと遠心分離媒体が約5ml含まれ、下チャンバ120には、赤血球・顆粒球分画が約5mlと遠心分離媒体が約5ml含まれる。
【0039】
その後、蓋140の導入口141から注射器で採取することにより、単核球分画(骨髄幹細胞分画)を含み、かつ成熟顆粒球をほとんど含まない成分が採取される。なお、蓋140の導入口141から注射器で採取するのではなく、三方活栓130の第2接続口132を閉鎖し、第1接続口131及び第3接続口133を連通させるようにして、第3接続口133からチューブにより採取することも可能である。遠心分離後は、上チャンバ110には成熟顆粒球をほとんど含まない成分が位置し、かつ、上チャンバ110と下チャンバ120との連通が閉じた状態にて上チャンバ110から採取するので、不要な成分の採取を考慮することなく簡易な操作にて単核球を得ることができる。なお、取得された単核球分画には多少の遠心分離媒体が含有されているため、この含まれている遠心分離媒体を除去するために、遠心分離等による精製をその後に行うことも可能である。
【0040】
ここで、遠心分離媒体としてヨード造影剤を用いる場合にあっては、取得された単核球分画には多少のヨード造影剤が含有されていても、そのまま体内に移植することが可能である。単核球分画の分離に医薬品ではないフィコールによる比重遠心法を用いると、フィコールが含まれている状態にて体内に投与された場合、医療上の安全性に問題があるため、遠心分離後にフィコールを除去する必要がある。そのため、フィコールを除去するため更に2回以上の遠心分離による細胞精製が必要である。そしてフィコールの除去のため、遠心分離における幹細胞の回収効率が低下し細胞損失が発生する。しかしながら、遠心分離媒体としてヨード造影剤を用いる場合にあっては、取得された単核球分画には多少のヨード造影剤が含有されていても、そのまま体内に移植することが可能であり、遠心分離後の精製やこれに伴う細胞損失を防ぐことができるという極めて大きな利点を有する。
【0041】
なお、上述の実施形態においては、上チャンバ110と下チャンバ120とを接続する活栓は三方活栓130であったが、本発明の範囲はこのような実施形態に限定されるものではなく、上チャンバ110と下チャンバ120との接続を開閉する二方活栓として活栓を簡易に構成することも可能である。
【0042】
(第2実施形態)
上述の実施形態では単核球分離管100について説明をしたが、第2実施形態では第1実施形態の単核球分離管100を用いる閉鎖系の単核球分離システム900について説明をする。
【0043】
図2は、本実施形態に係る単核球分離システム900の概略図である。単核球分離システム900は、前述の構成の単核球分離管100と、試料溶液が収納される試料溶液バッグ210と、単核球分離管100に対して空気を出し入れするエアバッグ220と、分離された単核球を収納する単核球収納バッグ230とを備える。エアバッグ220は、所定体積に膨張可能な拡張能を有し、無塵無菌の空気が所定量入れられる。試料溶液バッグ210と単核球分離管100の上チャンバ110とは、第1チューブ310により接続されている。即ち、第1チューブ310の一方の端部は、試料溶液バッグ210の下端にある排出口211に接続しており、第1チューブ310の他方の端部は、上チャンバ110の上側開口を密栓する蓋140を貫通して上チャンバ110に接続している。また、エアバッグ220と単核球分離管100の上チャンバ110とは、第2チューブ320により接続されている。即ち、第2チューブ320の一方の端部は、エアバッグ220のエア排出口221に接続しており、第2チューブ320の他方の端部は、上チャンバ110の上側開口を密栓する蓋140を貫通して上チャンバ110に接続している。また、単核球収納バッグ230と三方活栓130の第3接続口133とは、第3チューブ330により接続されている。
【0044】
第1チューブ310の途中には、第1チューブ310の導通を開閉自在にする第1クランプ311が設けられている。また、第2チューブ320の途中には、第2チューブ320の導通を開閉自在にする第2クランプ321が設けられている。
【0045】
第1クランプ311と試料溶液バッグ210の下端にある排出口211との間には、フィルター312が設けられている。このフィルター312は、骨髄液を含む試料溶液を用いる場合に、試料溶液中に含まれている脂肪及び骨片を除去するためのものである。そのため、骨髄液ではなく血液を含む試料溶液の場合は、フィルター312は設ける必要はない。
【0046】
試料溶液バッグ210、エアバッグ220、単核球収納バッグ230、第1チューブ310、第2チューブ320、及び第3チューブ330は、これらの内部が細菌やウイルスに感染しないよう外界に対して無菌状態に保たれており、そのためこれらを構成する材質は特に限定されるものではないが、例えばポリ塩化ビニルやポリプロピレン等により構成される。
【0047】
次に、上述の構成の単核球分離システム900を用いる単核球の分離を説明する。
【0048】
試料溶液バッグ210には予め、例えば10mlの希釈用生理食塩水を収納する。また、遠心分離媒体は、ヨード造影剤、生理食塩水及び蒸留水を混和することにより作成し、これを単核球分離管100の下チャンバ120に予め例えば10ml配置する。エア用バックには、予め例えば10mlの無塵無菌空気を入れる。第1クランプ311及び第2クランプ321は閉の状態とする。
【0049】
次に、例えば10mlのヒト骨髄液の原液を試料溶液バッグ210に注入して、希釈用生理食塩水と良く混和し、試料溶液バッグ210内に20mlの試料溶液を準備する。
【0050】
図3は、試料溶液を単核球分離管100の上チャンバ110に導入する状態を説明する図である。図3に示すように、試料溶液バッグ210を点滴台350に懸架すると共に、単核球分離管100を図示しないチューブラックに立てる。この状態では単核球分離管100の三方活栓130の全ての接続口は閉じた状態とする。そして、第1クランプ312及び第2クランプ321を開放する。第2クランプ321を開放するのは上チャンバ110内の空気をエアバッグ220内に逃がすためである。試料溶液バッグ210内の全ての試料溶液が単核球分離管100の上チャンバ110に移動した後、第1クランプ311及び第2クランプ321を閉鎖する。その後は、空になった試料溶液バッグ210は不要であるため、第1チューブ310における第1クランプ311と蓋140との間の箇所にて、ヒートシーラーにより第1チューブ310を閉鎖して切断する。
【0051】
続いて、単核球分離管100の3方活栓130を試料溶液と遠心分離媒体とが接するように開放し、単核球分離管100と、単核球収納バッグ230及びエアバッグ220とを対側同士のバランスを保った状態にて、図示しない遠心機に懸架する。次いで遠心分離を行い、遠心後には三方活栓130の全ての接続口を閉じる。遠心分離後は、上チャンバ110には、単核球を含む分画が約15mlと遠心分離媒体が約5ml含まれ、下チャンバ120には、赤血球・顆粒球分画が約5mlと遠心分離媒体が約5ml含まれる。
【0052】
図4は、三方活栓130の第3接続口133から単核球を採取する状態を説明する図である。図4に示すように、懸架部を上段と下段とに有する点滴台360を用意し、単核球分離管100を上段の懸架部に懸架し、単核球収納バッグ230を下段の懸架部に懸架する。そして、三方活栓130の第2接続口132を閉鎖し、第1接続口131及び第3接続口133を連通させるようにして、第2クランプ321を開放する。ここで第2クランプ321を開放するのは、エアバッグ220内の空気を上チャンバ110内に押しやることにより、第3接続口133から単核球を含む分画を押し出すためである。このようにして全ての上チャンバ110にある単核球を含む分画を単核球収納バッグ230内に移動させる。その後は、単核球を含む分画を取り出した単核球分離管100は不要であるため、第3チューブ330の所定の箇所にてヒートシーラーにより閉鎖して切断する。その結果、単核球収納バッグ230内に、単核球分画を含み、かつ成熟顆粒球をほとんど含まない細胞液が得られる。
【0053】
なお、上述の実施形態では、上チャンバ110と下チャンバ120とを接続する活栓は三方活栓130であり、単核球を含む細胞液は単核球収納バッグ230に収納されたが、本発明の範囲はこのような実施形態に限定されるものではなく、上チャンバ110と下チャンバ120との接続を開閉する簡易な構成である二方活栓とすることも可能である。係る場合は、遠心分離後に、蓋140の上部の導入口141から注射器等により単核球を含む分画を取り出す。
【0054】
上述の第1実施形態に係る単核球分離管100及び第2実施形態に係る単核球分離システム900によれば、そのまま使用可能な血管再生剤として有用な単核球を含む細胞液を得ることができる。この細胞液は、単核球細胞(CD34+細胞)を約2〜5%程度の濃度(単核球細胞濃度107〜108個/ml程度)含有する幹細胞含有液である。この細胞液は、単核球回収率が約68〜85%と高いものであり、その生存率は約98%以上に及ぶ高いものである。また、この細胞液は、血管新生に不利と考えられる成熟顆粒球等が高効率に除去されており、成熟顆粒球除去率は約96%以上である。
【0055】
本実施形態に係る発明により得られる単核球を有効成分として含む体内投与用薬剤は、血管新生誘導剤として、脳血管疾患の治療に有効である。また例えば慢性閉塞性動脈硬化症や、ビュルガー病等の末梢血管疾患の治療に有効である。また、狭心症、心筋梗塞等の虚血性心疾患や腎梗塞、脳性麻痺の治療及び予防にも有効である。更に、この細胞液による血管新生作用により、全身の微小循環障害に伴う種々の病態、例えば認知症、慢性腎不全、慢性心不全等の治療及び予防にも有効である。
【0056】
上記の体内投与用薬剤は、通常の細胞移植用薬剤と同様に注入剤形態に調製され、特に限定されるものではないが例えば血管内、皮下、筋肉内、皮内投与等に投与される。また、心疾患患者、脳疾患患者等への適用に当たっては、血管カテーテル操作により、冠状動脈、心内膜側、脳動脈より投与することも可能である。投与量は、投与形態、投与経路、患者の疾患の程度等に応じて適宜決定することができる。一般には、成人一人一回当たりの投与量は、有効成分とする単核球の細胞量として例えば1×106〜1×108個/kg程度となる量を目安とすることができる。
【0057】
体内投与用薬剤の有効成分とする単核球は、自己又は血縁者由来であるのが好ましいが、特にこれに限定されるものではなく、骨髄バンク等に保管されている非血縁者由来とすることも可能である。
【0058】
また、骨髄は疾患発症後2〜10日の間に例えば腰の骨から採取し、その日のうちに骨髄単核球細胞を分離して注射することが好ましい。骨髄採取を発症後2〜10日としたのは、この時期に脳梗塞後に誘導される自己神経幹細胞が損傷部位に集まるからである。
【0059】
本実施形態に係る体内投与用薬剤によれば、例えば、骨髄中の幹細胞を注射して脳の血管を再生させ、組織の再生を促すことで脳梗塞による後遺症の治療が可能となる。
【実施例】
【0060】
(実施例1)
〈ヨード造影剤を用いた骨髄幹細胞の単離〉
実施例1では、ヨード造影剤としてイオヘキソールを使用し、単核球の分離を試みた。ヒト骨髄液の原液10mlに対して、10U/mlの医療用ヘパリンナトリウム(ノボ・ヘパリンナトリウム:持田製薬[注射用医薬品])を良く混合したものを分離原液として用いた。この骨髄液に医療用生理食塩水(大塚生食注:大塚製薬[注射用医薬品])を10ml加えることにより、試料溶液としての幹細胞分離用骨髄液を調整した。遠心分離媒体は、医療用造影剤(オムニパーク350:第一三共株式会社[注射用医薬品])を18.68ml、医療用生理食塩水(大塚生食注:大塚製薬[注射用医薬品])を51.76ml及び医療用蒸留水(大塚蒸留水:大塚製薬[注射用医薬品])を29.56ml混和することにより作成した。作成されたこの遠心分離媒体の比重は1.077、浸透圧(生理食塩液に対する比)は1.0、pHは7.4であった。
【0061】
10mlの遠心分離媒体の上に、液面を乱さないように緩徐に20mlの幹細胞分離用骨髄液を重層した。次いで、20℃において800gで20分間遠心分離を行うことにより、赤血球・顆粒球分画、比重遠心用分離薬剤層、単核球分画(骨髄幹細胞分画)、血小板・血漿分画の各分画に分離することができた。その後、単核球分画(骨髄幹細胞分画)を中心に6mlの骨髄幹細胞液を得た。
【0062】
上記の手法で得られた単核球を含む細胞液は、単核球回収率:約75%、単核球生存率:99%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約97%、所要時間29分であった。
【0063】
〈フィコールを用いた骨髄幹細胞の単離〉
一方、対照群として、遠心分離媒体としてフィコールを使用して単核球の分離を試みた。脳梗塞患者に対する自己骨髄幹細胞移植の臨床試験[臨床試験ID番号:日本UMIN000001133、米国NCT01028794]と同様に、遠心分離媒体としてフィコール[GEHealthcare社製:Ficoll-Paque PREMIUM]を用い、その他の条件は上述の〈ヨード造影剤を用いた骨髄幹細胞の単離〉と同様とした。単核球を含む細胞液の分離を行った後、生理食塩水と遠心機を用い、2度洗浄を行うことによりフィコールの除去を行った。
【0064】
上記の手法で得られた単核球を含む細胞液は、単核球回収率:約52%、単核球生存率:98%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約96%、所要時間75分であった。
【0065】
〈ヒドロキシルエチルデンプンを用いた骨髄幹細胞の単離〉
更に、対照群として、遠心分離媒体としてヒドロキシルエチルデンプンを使用し単核球の分離を試みた。ヒト骨髄液5mlをヘパリン混和の生理食塩水5mlと混和した。さらに、ヒドロキシルエチルデンプンを最終ヒドロキシルエチルデンプン濃度が1%となるように加え、得られた骨髄液を室温で40分間静置し、赤血球成分を沈降させ上清液を回収した。回収液を、濃縮機セルプロセッサーにセットし、脂肪分、骨片等の微小浮遊物を分離した。次いで、洗浄及び濃縮操作により、7mlの単核球を含む細胞液を得た。
【0066】
上記の手法で得られた単核球を含む細胞液は、単核球回収率:約70%、単核球生存率:98%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約52%、所要時間63分であった。
【0067】
(実施例2)
実施例2では、ヒト幹細胞治療薬の効果判定に有効なSCID(SevereCombined Immunodeficiency=重症免疫不全)マウス脳梗塞モデル(左中大脳動脈M1遠位部閉塞モデル)を用いて、実施例1で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。他の手法との比較検討のため、(i)本発明で分離された細胞液投与群(以下、幹細胞群)、(ii)フィコールによる分離された細胞群(以下、フィコール群)、(iii)ヒドロキシルエチルデンプンにより分離された細胞群(以下、デンプン群)、(iv)生理食塩水投与群(以下、生食群)を設定した。
【0068】
各群6匹の脳梗塞モデルマウスに対し、脳梗塞作成2日後に5x105個の細胞(あるいは生理食塩水)を尾静脈より投与し、各細胞投与群の脳神経機能回復促進効果の検証を行った。神経機能回復の評価項目に関しては、細胞投与30日後の大脳皮質神経機能をオープンフィールドテスト(暗条件に対する反応性)で評価し、統計解析は一元配置分散分析法(ポストホックとして生食群を対照としたDunnett法)を用いて行った。オープンフィールドテストの実験装置は、天井部のない立方体のオープンフィールドボックスであった。側面及び床面は厚さ3mmの透明アクリル版製で、内寸は、床部が40×40cm、高さが30cmであった。実験室は防音されており、オープンフィールドボックスには、赤外線センサー(7×7で、床から2cmと4.5cm)がついており、下のセンサーで移動活動量を、上のセンサーで立ち上がり反応を30分間検出し、コンピューターで記録した。マウスは夜行性であり暗条件にすると移動活動量及び立ち上がり反応が通常では増加するが、脳梗塞に起因する大脳皮質機能障害によりその暗条件への反応が減弱・消失する。本試験では、暗条件への反応性を評価することにより脳梗塞後の皮質機能の回復の程度の評価を行った。図5は、SCIDマウス脳虚血モデルにおける30分間の総活動量(移動活動量+立ち上がり反応)の暗条件に対する反応性(Responseto Darkness)の測定結果である。図5に示すように、生食群と比し、幹細胞群及びフィコール群では有意な機能回復促進が観察されたが、デンプン群では有意な治療効果が観察されなかった。なお有意確率は5%であった。
【0069】
(実施例3)
実施例3では、ヒト幹細胞治療薬の効果判定に有効なSCID(重症免疫不全)マウス下肢虚血モデル(左大腿動脈閉塞モデル)を用いて、実施例1で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。他の手法との比較検討のため、(i)本発明で分離された細胞液投与群(以下、幹細胞群)、(ii)フィコールによる分離された細胞群(以下、フィコール群)、(iii)ヒドロキシルエチルデンプンにより分離された細胞群(以下、デンプン群)、(iv)生理食塩水投与群(以下、生食群)を設定した。
【0070】
各群6匹の下肢虚血モデルマウスに対し、下肢虚血作成直後に計1x106個の細胞(あるいは生理食塩水)を3か所の大腿部筋肉内に投与し、下肢虚血モデル作成30日後の救肢促進効果の検証を行った。虚血レベルは、0点:正常、1点:軽度の変色、2点:中等度から重度の変色、3点:壊死、4点:離断のようにして評価を行った。統計解析はクラスカル・ワーリス検定を用いて行った。図6は、SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。図6に示すように、生食群と比し、幹細胞群、フィコール群、デンプン群でそれぞれ有意な救肢効果が観察されたが、デンプン群との比較においても、幹細胞群でさらに有意な治療効果が観察された。なお有意確率は5%であった。
【0071】
(実施例4)
〈単核球分離管による骨髄幹細胞の単離〉
遠心分離媒体は、医療用造影剤(オムニパーク350:第一三共株式会社[注射用医薬品])を16.68ml、医療用生理食塩水(大塚生食注:大塚製薬[注射用医薬品])を51.76ml及び医療用蒸留水(大塚蒸留水:大塚製薬[注射用医薬品])を29.56ml混和することにより作成した。作成された遠心分離媒体の比重は1.077、浸透圧(生理食塩液に対する比)は1.0、pHは7.4であった。そして単核球分離管は図1に示したものと同様の構成とし、約10mlの遠心分離媒体を単核球分離管100の下チャンバ120に配置した。
【0072】
次に、ヒト骨髄液の原液10mlに対して、10U/mlの医療用ヘパリンナトリウム(ノボ・ヘパリンナトリウム:持田製薬[注射用医薬品])を良く混合したものを分離原液として用いた。この骨髄液に医療用生理食塩水(大塚生食注:大塚製薬[注射用医薬品])を10ml加えることにより、試料溶液としての幹細胞分離用骨髄液を調整した。
【0073】
そして活栓を閉じた状態にし、注射器を用いて20mlの幹細胞分離用骨髄液を上チャンバ110に注入し、注入後に活栓を開放した。次いで、400gで40分間遠心分離を行い、遠心後に活栓を閉鎖した。その結果、下チャンバ120に赤血球・顆粒球分画及び遠心分離媒体、上チャンバ110には遠心分離媒体、単核球分画(骨髄幹細胞分画)及び血小板・血漿分画の2分画に分離することができた。上層を注射器で採取することにより、単核球分画(骨髄幹細胞分画)を含み、かつ成熟顆粒球をほとんど含まない単核球を含む細胞液を得た。
【0074】
上記の手法にて得られた単核球を含む細胞液は、単核球回収率:約80%、単核球生存率:99%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約96%の特性を有するものであった。
【0075】
上記の手法で得られた単核球を含む細胞液の細菌汚染、真菌汚染に関する検討を行った。即ち、10%牛胎児血清入り細胞培養液、CDLP寒天培地及びサブロー寒天培地に各1mlの骨髄幹細胞液を混和あるいは塗布し、37℃で30日間培養を行ったが、細胞及び真菌の増殖は全く観察されなかった。
【0076】
〈脳梗塞動物モデルでの治療効果〉
SCIDマウス脳梗塞モデル(左中大脳動脈M1遠位部閉塞モデル)を用いて、上記の〈単核球分離管による骨髄幹細胞の単離〉で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。(i)本発明で分離された細胞液投与群(幹細胞群)、及び(ii)生理食塩水投与群(生食群)を設定した。各群6匹の脳梗塞モデルマウスに対し、脳梗塞作成2日後に5x105個の細胞(あるいは生理食塩水)を尾静脈より投与し、それぞれ投与群の脳神経機能回復促進効果の検証を行った。神経機能回復の評価項目に関しては、細胞投与30日後の大脳皮質神経機能をオープンフィールドテストで評価し、統計解析はt検定を用いて行った。図7は、SCIDマウス脳虚血モデルにおける30分間の総活動量(移動活動量+立ち上がり反応)の暗条件に対する反応性の測定結果である。図7に示すように、生食群と比し、幹細胞群では有意な機能回復促進が観察された。なお有意確率は5%であった。
【0077】
〈下肢虚血動物モデルでの治療効果〉
SCIDマウス下肢虚血モデル(左大腿動脈閉塞モデル)を用いて、上記の〈単核球分離管による骨髄幹細胞の単離〉で得られた骨髄幹細胞液の治療薬剤としての効果の検討を行った。(i)本発明で分離された細胞液投与群(幹細胞群)、及び(ii)生理食塩水投与群(生食群)を設定した。各群6匹の下肢虚血モデルマウスに対し、下肢虚血作成直後に計1x106個の細胞(あるいは生理食塩水)を3か所の大腿部筋肉内に投与し、下肢虚血モデル作成30日後の救肢促進効果の検証を行った。虚血レベルは、0点:正常、1点:軽度の変色、2点:中等度から重度の変色、3点:壊死、4点:離断のようにして評価を行った。統計解析はマン・ホイットニ検定を用いて行った。図8は、SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。図8に示すように、生食群と比し、幹細胞群で有意な救肢効果が観察された。なお有意確率は5%であった。
【0078】
(実施例5)
〈単核球分離システムの準備〉
実施例5では、図2に示した単核球分離システムを用いて単核球の単離を試みた。試料溶液バッグ210には予め、10mlの希釈用生理食塩水(大塚生食注:大塚製薬)及び100単位のヘパリンナトリウム(ノボ・ヘパリンナトリウム)が収納された。また、遠心分離媒体として、造影剤(オムニパーク140:第一三共株式会社)を23.3ml、生理食塩水(大塚生食注:大塚製薬)を25.9ml及び蒸留水(大塚蒸留水:大塚製薬)を0.8ml混和することにより作成した。作成された遠心分離媒体の比重は1.077、浸透圧(生理食塩液に対する比)は1.0、pHは7.4であった。この約10mlの遠心分離媒体を単核球分離管100の下チャンバ120に予め配置した。エア用バック220には、予め約10mlの無塵無菌空気を入れるとともに、30ml以上の拡張能を持たせた。全てのクランプは閉の状態とした。
【0079】
〈単核球分離システムによる骨髄幹細胞の単離〉
次に、ヒト骨髄液の原液10mlを注射器により試料溶液バッグ210に注入して、良く混和した。そして図3に示したように、試料溶液バッグ210を点滴台350に懸架すると共に、単核球分離管100をチューブラックに立てた後、第1クランプ311及び第2クランプ321を開放した。全ての骨髄液が単核球分離管100に移動した後、第1クランプ311及び第2クランプ321を閉鎖し、ヒートシーラーにより第1チューブ310を閉鎖し、ヒートシーリングポイントの試料溶液バッグ210側で切断した。
【0080】
続いて、単核球分離管100の3方活栓130を試料溶液と遠心分離媒体とが接するように開放し、単核球分離管100と、単核球収納バッグ23及びエアバッグ220とを遠心機に懸架して、対側同士のバランスを取った。次いで、400gで40分間遠心分離を行い、遠心後に3方活栓130を閉鎖した。その結果、単核球分離管100の下チャンバ120には赤血球・顆粒球分画及び遠心分離媒体、上チャンバ110には遠心分離媒体、単核球分画(骨髄幹細胞分画)及び血小板・血漿分画の2分画に分離することができた。
【0081】
続いて、図4に示したように、単核球分離管100を点滴台に懸架し、エアバック220とのクランプを開放するとともに、第1接続口131及び第3接続口133を連通するように三方活栓を開放し、全ての上チャンバ110にある液体を単核球収納バッグ230内に移動させた。続いて、ヒートシーラーにより第3チューブ330を閉鎖して、ヒートシーリングポイントの単核球分離管100側で切断した。
【0082】
その結果、単核球収納バッグ230内に、単核球分画(骨髄幹細胞分画)を含み、かつ成熟顆粒球をほとんど含まない骨髄幹細胞液を得ることができた。
【0083】
上記の手法にて得られた単核球を含む細胞液は、単核球回収率:約69%、単核球生存率:99%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約96%の特性を有するものであった。
【0084】
上記の手法で得られた単核球を含む細胞液の細菌汚染、真菌汚染に関する検討を行った。即ち、10%牛胎児血清入り細胞培養液、CDLP寒天培地及びサブロー寒天培地に各1mlの細胞液を混和あるいは塗布し、37℃で30日間培養を行ったが、細胞及び真菌の増殖は全く観察されなかった。
【0085】
〈脳梗塞動物モデルでの治療効果〉
SCIDマウス脳梗塞モデル(左中大脳動脈M1遠位部閉塞モデル)を用いて、上記の〈単核球分離システムによる骨髄幹細胞の単離〉で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。(i)本発明で分離された細胞液投与群(幹細胞群)、及び(ii)生理食塩水投与群(生食群)を設定した。各群6匹の脳梗塞モデルマウスに対し、脳梗塞作成2日後に5x105個の細胞(あるいは生理食塩水)を尾静脈より投与し、それぞれ投与群の脳神経機能回復促進効果の検証を行った。神経機能回復の評価項目に関しては、細胞投与30日後の大脳皮質神経機能をオープンフィールドテストで評価し、統計解析はt検定を用いて行った。図9は、SCIDマウス脳虚血モデルにおける30分間の総活動量(移動活動量+立ち上がり反応)の暗条件に対する反応性の測定結果である。図9に示すように、生食群と比し、幹細胞群では有意な機能回復促進が観察された。なお有意確率は5%であった。
【0086】
〈下肢虚血動物モデルでの治療効果〉
SCIDマウス下肢虚血モデル(左大腿動脈閉塞モデル)を用いて、上記の〈単核球分離システムによる骨髄幹細胞の単離〉で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。(i)本発明で分離された細胞液投与群(幹細胞群)、及び(ii)生理食塩水投与群(生食群)を設定した。各群6匹の下肢虚血モデルマウスに対し、下肢虚血作成直後に計1x106個の細胞(あるいは生理食塩水)を3か所の大腿部筋肉内に投与し、下肢虚血モデル作成30日後の救肢促進効果の検証を行った。虚血レベルは、0点:正常、1点:軽度の変色、2点:中等度から重度の変色、3点:壊死、4点:離断のようにして評価を行った。統計解析はマン・ホイットニ検定を用いて行った。図10は、SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。図10に示すように、生食群と比し、幹細胞群で有意な救肢効果が観察された。なお有意確率は5%であった。
【産業上の利用可能性】
【0087】
本発明によれば単核球を簡易に分離することができ、この単核球により脳血管障害や末梢血管障害等の効果的な治療が可能となる。
【符号の説明】
【0088】
100:単核球分離管
110:上チャンバ
120:下チャンバ
130:三方活栓
131:第1接続口
132:第2接続口
133:第3接続口
140:蓋
150:ケース
210:試料溶液バッグ
220:エアバッグ
230:単核球収納バッグ
310:第1チューブ
311:第1クランプ
312:フィルター
320:第2チューブ
321:第2クランプ
330:第3チューブ
350,360:点滴台
900:単核球分離システム
【技術分野】
【0001】
本発明は、血液等から簡単かつ純度良く単核球を分離することができる単核球の分離方法、単核球分離管、及び単核球分離システム、並びにその分離方法等により得られた単核球、及びその単核球を有効成分とする体内投与用薬剤に関する。
【背景技術】
【0002】
近年、幹細胞移植による心血管再生治療が虚血性心疾患に対する新しい治療法として期待されている。自己骨髄幹細胞や筋芽細胞等を用いる心血管再生治療は約10年前から臨床試験が開始され、骨髄幹細胞を含む骨髄単核球分画を用いた治療法は、心筋梗塞患者での有効性が二重盲検試験で明らかにされている。
【0003】
単核球を分離する最も一般的な技術としては、特許文献1や特許文献2に記載されているように、試験管の底にフィコール・パック(Ficoll-Paque、登録商標、ファルマシア・ファイン・ケミカルズ(Pharmacia Fine Chemicals)社製)を設置する遠心分離方法をあげることができる。この方法は、所定量のフィコール・パックを試験管底に設置する工程、血液試料をフィコール・パック上にピペットで移す工程、フィコール・パックの比重よりも大きい比重を有する血液成分が、フィコール・パックを通過するように遠心分離する工程、及び、フィコール・パックの上方に分離された単核球層をピペットで採取する工程からなる。
【0004】
また、単核球の分離には、細胞に細菌やウイルスが感染しないよう高度に無菌状態が保たれており、環境温度・室圧等の作業環境が厳密にコントロールされた閉鎖系設備が必要である。そのため特許文献3に記載されているようなCProC(Cell Processing Center=セルプロセッシングセンター)にて単核球の分離が行われる。
【0005】
CProCは、免疫細胞療法や再生医療、あるいは遺伝子治療等、細胞を利用した医療や研究を行うため施設であり、例えば細胞調製室、QC室、製品保管室、準備室、更衣室、監視室等から構成されており、細胞調製室には、安全キャビネット、細胞培養インキュベーターその他必要な機器が具備されており、環境清浄度は常にモニターされ監視室にてビデオモニターされる。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2010−504083号公報
【特許文献2】特表2007−509601号公報
【特許文献3】特開2009−065844号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかし、上述のフィコール・パックを試験管底に設置する単核球の分離は、血液試料をフィコール・パック上に移すとき、フィコール・パックとの界面を乱さないように血液試料を静かに重層しなければならず、更には、遠心分離後においては、フィコール・パックの上方に分離された単核球層をピペットで採取する際には、不要な成分をピペットにて採取しないように注意深く採取する必要があり、操作が煩雑であるという問題点を有する。
【0008】
また、CProCは、上述したように極めて高度かつ特殊な施設であり、しかも設置コストも非常に高価である問題点がある。そのため、CProCの設置は、心筋梗塞患者等に対する幹細胞治療の普及に対する大きな障壁となっており、一般病院でも使用可能な閉鎖系でかつ特殊な機械・設備や特別な知識・技能・訓練を必要としない単核球の分離システムが求められている。
【0009】
本発明はかかる問題点に鑑みてなされたものであって、極めて簡易に単核球を分離できる単核球分離管を提供することを目的とする。また、一般病院でも使用可能な簡易な閉鎖系の単核球分離システムを提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明においては、単核球分離管を上チャンバと下チャンバとを有して構成し、更に上チャンバと下チャンバとを連通状態又は非連通状態に切り換える活栓を設けたので、遠心分離前には下チャンバに遠心分離媒体を収納して活栓を閉じることにより、面倒な動作を要せずに上チャンバに試料溶液を導入でき、遠心分離後においては活栓を閉じることにより、不要成分の採取可能性を少なくして上チャンバから面倒な動作を要せずに単核球を採取することができる。ここで単核球とは、細胞内に核を1つ保有する有核細胞を指し、いわゆる単球、リンパ球及び未熟な幹細胞群を意味する。
【0011】
また、本発明においては、このような構成の単核球分離管と、単核球分離管に対して空気を出し入れするエアバッグと、試料溶液が収納される試料溶液バッグと、を閉鎖系状態にて接続させたので、極めて簡易に単核球分離システムを構成できる。
【0012】
具体的には、本発明の第1の観点に係る単核球分離管は、単核球を含む複数成分からなる試料溶液を、遠心分離媒体を用いて遠心分離処理することで、前記複数成分を比重の違いにより分離させ、低比重成分である単核球を採取するための単核球分離管であって、上側に配置されて前記試料溶液が導入される導入開口及び下側に配置された下側開口を有し、遠心分離処理前には前記試料溶液が収納されると共に遠心分離処理後には前記低比重成分である単核球が位置する上チャンバと、上側に上側開口が配置され下側が閉塞し、遠心分離処理前には前記遠心分離媒体が収納されると共に遠心分離処理後には不要成分である高比重成分が位置する下チャンバと、前記上チャンバの下側開口と前記下チャンバの上側開口とを、連通状態又は非連通状態に切り換える活栓と、前記上チャンバの前記導入開口を密栓する蓋と、を備えることを特徴とする。
【0013】
また、前記活栓は、第1、第2及び第3接続口を有する3個の流体通路を備えた三方活栓であり、第1接続口は前記上チャンバの下側開口に接続され、第2接続口は前記下チャンバの上側開口に接続され、遠心分離処理後に前記第1接続口及び前記第3接続口を連通させて、前記低比重成分である単核球を前記第3接続口から取り出すことが好ましい。
【0014】
また、前記遠心分離媒体は、ヨード造影剤を主成分とし、且つ、前記下チャンバに収納されていることが好ましい。
【0015】
また、前記ヨード造影剤は、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミドから選択される非イオン性水溶性ヨード造影剤であることが好ましい。
【0016】
また、本発明の第2の観点に係る単核球分離システムは、請求項1に記載の単核球分離管と、単核球を含む複数成分からなる試料溶液が収納される試料溶液バッグと、前記単核球分離管に対して空気を出し入れするエアバッグと、前記単核球分離管の蓋を貫通して、前記上チャンバと前記試料溶液バッグとを接続する第1チューブと、前記単核球分離管の蓋を貫通して、前記上チャンバと前記エアバッグとを接続する第2チューブと、を備えることを特徴とする。
【0017】
また、本発明の第3の観点に係る単核球分離システムは、請求項2乃至4の何れか1項に記載の単核球分離管と、単核球を含む複数成分からなる試料溶液が収納される試料溶液バッグと、前記単核球分離管に対して空気を出し入れするエアバッグと、分離された低比重成分である単核球を収納する単核球収納バッグと、前記単核球分離管の蓋を貫通して、前記上チャンバと前記試料溶液バッグとを接続する第1チューブと、前記単核球分離管の蓋を貫通して、前記上チャンバと前記エアバッグとを接続する第2チューブと、前記単核球収納バッグと前記三方活栓の第3接続口とを接続する第3チューブと、を備えることを特徴とする。
【0018】
また、本発明の第4の観点に係る遠心分離方法は、ヨード造影剤を遠心分離媒体の主成分とする比重遠心分離法により、単核球を含む複数成分からなる試料溶液から単核球を分離することを特徴とする。
【0019】
また、前記ヨード造影剤は、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミドから選択される非イオン性水溶性ヨード造影剤であることが好ましい。
【0020】
また、本発明の第5の観点に係る単核球は、請求項7又は8記載の単核球の分離方法により分離されたことを特徴とする。
【0021】
また、本発明の第6の観点に係る体内投与用薬剤は、請求項9記載の単核球を有効成分として含むことを特徴とする。
【0022】
また、前記体内投与用薬剤は、脳疾患治療、神経変性疾患治療、末梢血管疾患治療、心疾患治療、脳性麻痺治療、腎梗塞治療、認知症治療、慢性腎不全治療、又は、慢性心不全治療のいずれかに使用されることが好ましい。
【発明の効果】
【0023】
本発明によれば、遠心分離前に試料溶液を単核球分離管内に導入する際の操作及び遠心分離後に単核球を採取する操作を極めて簡易に行うことができ、そのため面倒な動作を行うこと無しに単核球を分離できる。また、この単核球分離管を使用して閉鎖系の単核球分離システムを構成するため、特殊な機械・設備や特別な知識・技能・訓練を必要とせず、一般病院でも使用できる。
【図面の簡単な説明】
【0024】
【図1】第1実施形態に係る単核球分離管の概略図である。
【図2】第2実施形態に係る単核球分離システムの概略図である。
【図3】試料溶液を単核球分離管の上チャンバに導入する状態を説明する図である。
【図4】三方活栓の第3接続口から単核球を採取する状態を説明する図である。
【図5】SCIDマウス脳虚血モデルにおける大脳皮質機能回復促進効果の測定結果である。
【図6】SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。
【図7】SCIDマウス脳虚血モデルにおける大脳皮質機能回復促進効果の測定結果である。
【図8】SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。
【図9】SCIDマウス脳虚血モデルにおける大脳皮質機能回復促進効果の測定結果である。
【図10】SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。
【発明を実施するための形態】
【0025】
以下、添付の図面を参照して本発明の実施形態について具体的に説明するが、当該実施形態は本発明の原理の理解を容易にするためのものであり、本発明の範囲は、下記の実施形態に限られるものではなく、当業者が以下の実施形態の構成を適宜置換した他の実施形態も、本発明の範囲に含まれる。
【0026】
(第1実施形態)
図1は本実施形態に係る単核球分離管100の概略図である。図1に示すように、単核球分離管100は、上端側に配置された導入開口111及び下端側に配置された下側開口112を有する筒体からなる上チャンバ110と、上端側に上側開口121が配置され下端側が閉塞した有底筒体からなる下チャンバ120と、第1接続口131、第2接続口132及び第3接続口133を有する3個の流体通路を備えた三方活栓130と、を備える。
【0027】
上チャンバ110の下側開口112及び下チャンバ120の上側開口121は、導入開口111よりも狭く構成されている。即ち、上チャンバ110と下チャンバ120との接続部分にはくびれ部が設けられており、そのくびれ部に三方活栓130が設けられている。
【0028】
三方活栓130は、第1接続口131、第2接続口132及び第3接続口133を外周上に備えるとともに、回転操作によりその第1〜第3接続口のうちの所定の接続口同士を連通させる流路切換部を備える。上チャンバ110の下側開口112と下チャンバ120の上側開口121とは、この流路切換部を回転させることにより開閉自在に液密に接続される。例えば、上チャンバ110の下側開口112と下チャンバ120の上側開口121とが連通状態の場合は、第1接続口131は上チャンバ110の下側開口112に接続され、第2接続口132は下チャンバ120の上側開口121に接続される。
【0029】
上チャンバ110及び下チャンバ120はケース150に覆われており、これにより各チャンバは外部衝撃から保護される。ケース150には切欠部151が設けられており、切欠部151からは第3接続口133が露出している。上チャンバ110の導入開口111は蓋140により密栓される。蓋140の上部には、試料溶液が導入される導入口141が設けられている。上チャンバ110及び下チャンバ120の材質は、遠心力に対しても変形しない自己保形性を備えた材料から構成されているならば特に限定されるものではないが、例えばポリプロピレン共重合体、ポリスチレン等により構成される。
【0030】
下チャンバ120には、ヨード造影剤を主成分とする遠心分離媒体が収納されている。ヨード造影剤は、ヨードを含有する造影剤であり、画像診断の際に画像にコントラストを付けたり特定の組織を強調して撮影するために患者に投与される医薬品である。ヨード造影剤を用いる理由は、赤血球・顆粒球と単核球とを分画できる比重の重い遠心分離媒体を用いる必要があること、かつ、後述するように、遠心分離により単核球分画が採取された後に遠心分離媒体を除去すること無しに体内投与が可能となるからである。
【0031】
ヨード造影剤は、水溶性ヨード造影剤であることが好ましく、特に非イオン性水溶性ヨード造影剤であることが好ましい。体内の細胞内や細胞膜には様々な陰イオンあるいは陽イオンの電荷を持つ物質があり、イオン性水溶性ヨード造影剤はそれに対して影響を与える可能性がありうるからである。非イオン性水溶性ヨード造影剤としては、特に限定されるものではないが、例えば、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミド等を用いることが可能である。
【0032】
下チャンバ120に収納される遠心分離媒体には、ヨード造影剤以外に、医療用生理食塩水や医療用蒸留水等を含有することが可能である。遠心分離媒体の比重は、赤血球・顆粒球と単核球とを分画できる比重であれば特に限定されるものではないが、室温(20℃〜25℃)において例えば1.066〜1.083g/mlであり、好ましくは1.073〜1.080g/ml、特に好ましくは1.077g/mlである。遠心分離媒体のpHは、分離される単核球に悪影響を与えないものであれば特に限定されるものではないが、例えば7.0〜7.8であり、好ましくは7.2〜7.6であり、特に好ましくは7.4である。遠心分離媒体の浸透圧は、分離される単核球に対して親和性を有するものであれば特に限定されるものではないが、例えば0.9〜1.1(医療用生理食塩水に対する比)であり、好ましくは1.0である。
【0033】
上チャンバ110の導入開口111から導入される試料溶液は、単核球を含む試料であれば特に限定されるものではないが、例えば骨髄液、血液、又は臍帯血を含むものが好ましい。試料溶液には、単核球を遠心分離しやすくするために、医療用生理食塩水を含有させることが可能である。
【0034】
上チャンバ110及び下チャンバ120の内容積は、遠心分離後の赤血球・顆粒球分画が下チャンバ120に位置し、単核球を含む分画が上チャンバ110に位置するものであれば特に限定されるものではなく、例えば、上チャンバ110の内容積:下チャンバ120の内容積を1:1〜2:1とすることが可能である。
【0035】
次に、上述の構成の単核球分離管100を用いる単核球の分離を説明する。上チャンバ110の内容積は例えば20mlとし、下チャンバ110の内容積は例えば10mlとする。遠心分離媒体は、例えば、医療用であるヨード造影剤に医療用生理食塩水と医療用蒸留水とを混和することにより作成される。そして例えば10mlの遠心分離媒体を下チャンバ120に配置し、三方活栓130の第1接続口131、第2接続口132及び第3接続口133をいずれも閉じる。
【0036】
次に、ヒト骨髄液原液を例えば10mlと、医療用生理食塩水を例えば10mlと混和することにより、20mlの試料溶液を調整する。そして注射器を用いて蓋140の導入口141から、三方活栓130の全ての接続口が閉じた状態にて試料溶液20mlを注入する。上チャンバ110と下チャンバ120との連通が閉じた状態にて試料溶液を入れるので、試料溶液と遠心分離媒体との界面の乱れを考慮することなく簡易な操作にて試料溶液の導入ができる。
【0037】
そして、三方活栓130の第3接続口133を閉鎖し、第1接続口131及び第2接続口132を連通させるようにして、所定条件の下で遠心分離を行い、遠心後には三方活栓130の第1接続口131、第2接続口132及び第3接続口133をいずれも閉じるようにする。
【0038】
遠心分離後は、下層の赤血球・顆粒球分画が約5ml、中間層の遠心分離媒体が10ml、上層の単核球を含む分画が約15mlである3層構造となるので、上チャンバ110には、単核球を含む分画が約15mlと遠心分離媒体が約5ml含まれ、下チャンバ120には、赤血球・顆粒球分画が約5mlと遠心分離媒体が約5ml含まれる。
【0039】
その後、蓋140の導入口141から注射器で採取することにより、単核球分画(骨髄幹細胞分画)を含み、かつ成熟顆粒球をほとんど含まない成分が採取される。なお、蓋140の導入口141から注射器で採取するのではなく、三方活栓130の第2接続口132を閉鎖し、第1接続口131及び第3接続口133を連通させるようにして、第3接続口133からチューブにより採取することも可能である。遠心分離後は、上チャンバ110には成熟顆粒球をほとんど含まない成分が位置し、かつ、上チャンバ110と下チャンバ120との連通が閉じた状態にて上チャンバ110から採取するので、不要な成分の採取を考慮することなく簡易な操作にて単核球を得ることができる。なお、取得された単核球分画には多少の遠心分離媒体が含有されているため、この含まれている遠心分離媒体を除去するために、遠心分離等による精製をその後に行うことも可能である。
【0040】
ここで、遠心分離媒体としてヨード造影剤を用いる場合にあっては、取得された単核球分画には多少のヨード造影剤が含有されていても、そのまま体内に移植することが可能である。単核球分画の分離に医薬品ではないフィコールによる比重遠心法を用いると、フィコールが含まれている状態にて体内に投与された場合、医療上の安全性に問題があるため、遠心分離後にフィコールを除去する必要がある。そのため、フィコールを除去するため更に2回以上の遠心分離による細胞精製が必要である。そしてフィコールの除去のため、遠心分離における幹細胞の回収効率が低下し細胞損失が発生する。しかしながら、遠心分離媒体としてヨード造影剤を用いる場合にあっては、取得された単核球分画には多少のヨード造影剤が含有されていても、そのまま体内に移植することが可能であり、遠心分離後の精製やこれに伴う細胞損失を防ぐことができるという極めて大きな利点を有する。
【0041】
なお、上述の実施形態においては、上チャンバ110と下チャンバ120とを接続する活栓は三方活栓130であったが、本発明の範囲はこのような実施形態に限定されるものではなく、上チャンバ110と下チャンバ120との接続を開閉する二方活栓として活栓を簡易に構成することも可能である。
【0042】
(第2実施形態)
上述の実施形態では単核球分離管100について説明をしたが、第2実施形態では第1実施形態の単核球分離管100を用いる閉鎖系の単核球分離システム900について説明をする。
【0043】
図2は、本実施形態に係る単核球分離システム900の概略図である。単核球分離システム900は、前述の構成の単核球分離管100と、試料溶液が収納される試料溶液バッグ210と、単核球分離管100に対して空気を出し入れするエアバッグ220と、分離された単核球を収納する単核球収納バッグ230とを備える。エアバッグ220は、所定体積に膨張可能な拡張能を有し、無塵無菌の空気が所定量入れられる。試料溶液バッグ210と単核球分離管100の上チャンバ110とは、第1チューブ310により接続されている。即ち、第1チューブ310の一方の端部は、試料溶液バッグ210の下端にある排出口211に接続しており、第1チューブ310の他方の端部は、上チャンバ110の上側開口を密栓する蓋140を貫通して上チャンバ110に接続している。また、エアバッグ220と単核球分離管100の上チャンバ110とは、第2チューブ320により接続されている。即ち、第2チューブ320の一方の端部は、エアバッグ220のエア排出口221に接続しており、第2チューブ320の他方の端部は、上チャンバ110の上側開口を密栓する蓋140を貫通して上チャンバ110に接続している。また、単核球収納バッグ230と三方活栓130の第3接続口133とは、第3チューブ330により接続されている。
【0044】
第1チューブ310の途中には、第1チューブ310の導通を開閉自在にする第1クランプ311が設けられている。また、第2チューブ320の途中には、第2チューブ320の導通を開閉自在にする第2クランプ321が設けられている。
【0045】
第1クランプ311と試料溶液バッグ210の下端にある排出口211との間には、フィルター312が設けられている。このフィルター312は、骨髄液を含む試料溶液を用いる場合に、試料溶液中に含まれている脂肪及び骨片を除去するためのものである。そのため、骨髄液ではなく血液を含む試料溶液の場合は、フィルター312は設ける必要はない。
【0046】
試料溶液バッグ210、エアバッグ220、単核球収納バッグ230、第1チューブ310、第2チューブ320、及び第3チューブ330は、これらの内部が細菌やウイルスに感染しないよう外界に対して無菌状態に保たれており、そのためこれらを構成する材質は特に限定されるものではないが、例えばポリ塩化ビニルやポリプロピレン等により構成される。
【0047】
次に、上述の構成の単核球分離システム900を用いる単核球の分離を説明する。
【0048】
試料溶液バッグ210には予め、例えば10mlの希釈用生理食塩水を収納する。また、遠心分離媒体は、ヨード造影剤、生理食塩水及び蒸留水を混和することにより作成し、これを単核球分離管100の下チャンバ120に予め例えば10ml配置する。エア用バックには、予め例えば10mlの無塵無菌空気を入れる。第1クランプ311及び第2クランプ321は閉の状態とする。
【0049】
次に、例えば10mlのヒト骨髄液の原液を試料溶液バッグ210に注入して、希釈用生理食塩水と良く混和し、試料溶液バッグ210内に20mlの試料溶液を準備する。
【0050】
図3は、試料溶液を単核球分離管100の上チャンバ110に導入する状態を説明する図である。図3に示すように、試料溶液バッグ210を点滴台350に懸架すると共に、単核球分離管100を図示しないチューブラックに立てる。この状態では単核球分離管100の三方活栓130の全ての接続口は閉じた状態とする。そして、第1クランプ312及び第2クランプ321を開放する。第2クランプ321を開放するのは上チャンバ110内の空気をエアバッグ220内に逃がすためである。試料溶液バッグ210内の全ての試料溶液が単核球分離管100の上チャンバ110に移動した後、第1クランプ311及び第2クランプ321を閉鎖する。その後は、空になった試料溶液バッグ210は不要であるため、第1チューブ310における第1クランプ311と蓋140との間の箇所にて、ヒートシーラーにより第1チューブ310を閉鎖して切断する。
【0051】
続いて、単核球分離管100の3方活栓130を試料溶液と遠心分離媒体とが接するように開放し、単核球分離管100と、単核球収納バッグ230及びエアバッグ220とを対側同士のバランスを保った状態にて、図示しない遠心機に懸架する。次いで遠心分離を行い、遠心後には三方活栓130の全ての接続口を閉じる。遠心分離後は、上チャンバ110には、単核球を含む分画が約15mlと遠心分離媒体が約5ml含まれ、下チャンバ120には、赤血球・顆粒球分画が約5mlと遠心分離媒体が約5ml含まれる。
【0052】
図4は、三方活栓130の第3接続口133から単核球を採取する状態を説明する図である。図4に示すように、懸架部を上段と下段とに有する点滴台360を用意し、単核球分離管100を上段の懸架部に懸架し、単核球収納バッグ230を下段の懸架部に懸架する。そして、三方活栓130の第2接続口132を閉鎖し、第1接続口131及び第3接続口133を連通させるようにして、第2クランプ321を開放する。ここで第2クランプ321を開放するのは、エアバッグ220内の空気を上チャンバ110内に押しやることにより、第3接続口133から単核球を含む分画を押し出すためである。このようにして全ての上チャンバ110にある単核球を含む分画を単核球収納バッグ230内に移動させる。その後は、単核球を含む分画を取り出した単核球分離管100は不要であるため、第3チューブ330の所定の箇所にてヒートシーラーにより閉鎖して切断する。その結果、単核球収納バッグ230内に、単核球分画を含み、かつ成熟顆粒球をほとんど含まない細胞液が得られる。
【0053】
なお、上述の実施形態では、上チャンバ110と下チャンバ120とを接続する活栓は三方活栓130であり、単核球を含む細胞液は単核球収納バッグ230に収納されたが、本発明の範囲はこのような実施形態に限定されるものではなく、上チャンバ110と下チャンバ120との接続を開閉する簡易な構成である二方活栓とすることも可能である。係る場合は、遠心分離後に、蓋140の上部の導入口141から注射器等により単核球を含む分画を取り出す。
【0054】
上述の第1実施形態に係る単核球分離管100及び第2実施形態に係る単核球分離システム900によれば、そのまま使用可能な血管再生剤として有用な単核球を含む細胞液を得ることができる。この細胞液は、単核球細胞(CD34+細胞)を約2〜5%程度の濃度(単核球細胞濃度107〜108個/ml程度)含有する幹細胞含有液である。この細胞液は、単核球回収率が約68〜85%と高いものであり、その生存率は約98%以上に及ぶ高いものである。また、この細胞液は、血管新生に不利と考えられる成熟顆粒球等が高効率に除去されており、成熟顆粒球除去率は約96%以上である。
【0055】
本実施形態に係る発明により得られる単核球を有効成分として含む体内投与用薬剤は、血管新生誘導剤として、脳血管疾患の治療に有効である。また例えば慢性閉塞性動脈硬化症や、ビュルガー病等の末梢血管疾患の治療に有効である。また、狭心症、心筋梗塞等の虚血性心疾患や腎梗塞、脳性麻痺の治療及び予防にも有効である。更に、この細胞液による血管新生作用により、全身の微小循環障害に伴う種々の病態、例えば認知症、慢性腎不全、慢性心不全等の治療及び予防にも有効である。
【0056】
上記の体内投与用薬剤は、通常の細胞移植用薬剤と同様に注入剤形態に調製され、特に限定されるものではないが例えば血管内、皮下、筋肉内、皮内投与等に投与される。また、心疾患患者、脳疾患患者等への適用に当たっては、血管カテーテル操作により、冠状動脈、心内膜側、脳動脈より投与することも可能である。投与量は、投与形態、投与経路、患者の疾患の程度等に応じて適宜決定することができる。一般には、成人一人一回当たりの投与量は、有効成分とする単核球の細胞量として例えば1×106〜1×108個/kg程度となる量を目安とすることができる。
【0057】
体内投与用薬剤の有効成分とする単核球は、自己又は血縁者由来であるのが好ましいが、特にこれに限定されるものではなく、骨髄バンク等に保管されている非血縁者由来とすることも可能である。
【0058】
また、骨髄は疾患発症後2〜10日の間に例えば腰の骨から採取し、その日のうちに骨髄単核球細胞を分離して注射することが好ましい。骨髄採取を発症後2〜10日としたのは、この時期に脳梗塞後に誘導される自己神経幹細胞が損傷部位に集まるからである。
【0059】
本実施形態に係る体内投与用薬剤によれば、例えば、骨髄中の幹細胞を注射して脳の血管を再生させ、組織の再生を促すことで脳梗塞による後遺症の治療が可能となる。
【実施例】
【0060】
(実施例1)
〈ヨード造影剤を用いた骨髄幹細胞の単離〉
実施例1では、ヨード造影剤としてイオヘキソールを使用し、単核球の分離を試みた。ヒト骨髄液の原液10mlに対して、10U/mlの医療用ヘパリンナトリウム(ノボ・ヘパリンナトリウム:持田製薬[注射用医薬品])を良く混合したものを分離原液として用いた。この骨髄液に医療用生理食塩水(大塚生食注:大塚製薬[注射用医薬品])を10ml加えることにより、試料溶液としての幹細胞分離用骨髄液を調整した。遠心分離媒体は、医療用造影剤(オムニパーク350:第一三共株式会社[注射用医薬品])を18.68ml、医療用生理食塩水(大塚生食注:大塚製薬[注射用医薬品])を51.76ml及び医療用蒸留水(大塚蒸留水:大塚製薬[注射用医薬品])を29.56ml混和することにより作成した。作成されたこの遠心分離媒体の比重は1.077、浸透圧(生理食塩液に対する比)は1.0、pHは7.4であった。
【0061】
10mlの遠心分離媒体の上に、液面を乱さないように緩徐に20mlの幹細胞分離用骨髄液を重層した。次いで、20℃において800gで20分間遠心分離を行うことにより、赤血球・顆粒球分画、比重遠心用分離薬剤層、単核球分画(骨髄幹細胞分画)、血小板・血漿分画の各分画に分離することができた。その後、単核球分画(骨髄幹細胞分画)を中心に6mlの骨髄幹細胞液を得た。
【0062】
上記の手法で得られた単核球を含む細胞液は、単核球回収率:約75%、単核球生存率:99%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約97%、所要時間29分であった。
【0063】
〈フィコールを用いた骨髄幹細胞の単離〉
一方、対照群として、遠心分離媒体としてフィコールを使用して単核球の分離を試みた。脳梗塞患者に対する自己骨髄幹細胞移植の臨床試験[臨床試験ID番号:日本UMIN000001133、米国NCT01028794]と同様に、遠心分離媒体としてフィコール[GEHealthcare社製:Ficoll-Paque PREMIUM]を用い、その他の条件は上述の〈ヨード造影剤を用いた骨髄幹細胞の単離〉と同様とした。単核球を含む細胞液の分離を行った後、生理食塩水と遠心機を用い、2度洗浄を行うことによりフィコールの除去を行った。
【0064】
上記の手法で得られた単核球を含む細胞液は、単核球回収率:約52%、単核球生存率:98%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約96%、所要時間75分であった。
【0065】
〈ヒドロキシルエチルデンプンを用いた骨髄幹細胞の単離〉
更に、対照群として、遠心分離媒体としてヒドロキシルエチルデンプンを使用し単核球の分離を試みた。ヒト骨髄液5mlをヘパリン混和の生理食塩水5mlと混和した。さらに、ヒドロキシルエチルデンプンを最終ヒドロキシルエチルデンプン濃度が1%となるように加え、得られた骨髄液を室温で40分間静置し、赤血球成分を沈降させ上清液を回収した。回収液を、濃縮機セルプロセッサーにセットし、脂肪分、骨片等の微小浮遊物を分離した。次いで、洗浄及び濃縮操作により、7mlの単核球を含む細胞液を得た。
【0066】
上記の手法で得られた単核球を含む細胞液は、単核球回収率:約70%、単核球生存率:98%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約52%、所要時間63分であった。
【0067】
(実施例2)
実施例2では、ヒト幹細胞治療薬の効果判定に有効なSCID(SevereCombined Immunodeficiency=重症免疫不全)マウス脳梗塞モデル(左中大脳動脈M1遠位部閉塞モデル)を用いて、実施例1で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。他の手法との比較検討のため、(i)本発明で分離された細胞液投与群(以下、幹細胞群)、(ii)フィコールによる分離された細胞群(以下、フィコール群)、(iii)ヒドロキシルエチルデンプンにより分離された細胞群(以下、デンプン群)、(iv)生理食塩水投与群(以下、生食群)を設定した。
【0068】
各群6匹の脳梗塞モデルマウスに対し、脳梗塞作成2日後に5x105個の細胞(あるいは生理食塩水)を尾静脈より投与し、各細胞投与群の脳神経機能回復促進効果の検証を行った。神経機能回復の評価項目に関しては、細胞投与30日後の大脳皮質神経機能をオープンフィールドテスト(暗条件に対する反応性)で評価し、統計解析は一元配置分散分析法(ポストホックとして生食群を対照としたDunnett法)を用いて行った。オープンフィールドテストの実験装置は、天井部のない立方体のオープンフィールドボックスであった。側面及び床面は厚さ3mmの透明アクリル版製で、内寸は、床部が40×40cm、高さが30cmであった。実験室は防音されており、オープンフィールドボックスには、赤外線センサー(7×7で、床から2cmと4.5cm)がついており、下のセンサーで移動活動量を、上のセンサーで立ち上がり反応を30分間検出し、コンピューターで記録した。マウスは夜行性であり暗条件にすると移動活動量及び立ち上がり反応が通常では増加するが、脳梗塞に起因する大脳皮質機能障害によりその暗条件への反応が減弱・消失する。本試験では、暗条件への反応性を評価することにより脳梗塞後の皮質機能の回復の程度の評価を行った。図5は、SCIDマウス脳虚血モデルにおける30分間の総活動量(移動活動量+立ち上がり反応)の暗条件に対する反応性(Responseto Darkness)の測定結果である。図5に示すように、生食群と比し、幹細胞群及びフィコール群では有意な機能回復促進が観察されたが、デンプン群では有意な治療効果が観察されなかった。なお有意確率は5%であった。
【0069】
(実施例3)
実施例3では、ヒト幹細胞治療薬の効果判定に有効なSCID(重症免疫不全)マウス下肢虚血モデル(左大腿動脈閉塞モデル)を用いて、実施例1で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。他の手法との比較検討のため、(i)本発明で分離された細胞液投与群(以下、幹細胞群)、(ii)フィコールによる分離された細胞群(以下、フィコール群)、(iii)ヒドロキシルエチルデンプンにより分離された細胞群(以下、デンプン群)、(iv)生理食塩水投与群(以下、生食群)を設定した。
【0070】
各群6匹の下肢虚血モデルマウスに対し、下肢虚血作成直後に計1x106個の細胞(あるいは生理食塩水)を3か所の大腿部筋肉内に投与し、下肢虚血モデル作成30日後の救肢促進効果の検証を行った。虚血レベルは、0点:正常、1点:軽度の変色、2点:中等度から重度の変色、3点:壊死、4点:離断のようにして評価を行った。統計解析はクラスカル・ワーリス検定を用いて行った。図6は、SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。図6に示すように、生食群と比し、幹細胞群、フィコール群、デンプン群でそれぞれ有意な救肢効果が観察されたが、デンプン群との比較においても、幹細胞群でさらに有意な治療効果が観察された。なお有意確率は5%であった。
【0071】
(実施例4)
〈単核球分離管による骨髄幹細胞の単離〉
遠心分離媒体は、医療用造影剤(オムニパーク350:第一三共株式会社[注射用医薬品])を16.68ml、医療用生理食塩水(大塚生食注:大塚製薬[注射用医薬品])を51.76ml及び医療用蒸留水(大塚蒸留水:大塚製薬[注射用医薬品])を29.56ml混和することにより作成した。作成された遠心分離媒体の比重は1.077、浸透圧(生理食塩液に対する比)は1.0、pHは7.4であった。そして単核球分離管は図1に示したものと同様の構成とし、約10mlの遠心分離媒体を単核球分離管100の下チャンバ120に配置した。
【0072】
次に、ヒト骨髄液の原液10mlに対して、10U/mlの医療用ヘパリンナトリウム(ノボ・ヘパリンナトリウム:持田製薬[注射用医薬品])を良く混合したものを分離原液として用いた。この骨髄液に医療用生理食塩水(大塚生食注:大塚製薬[注射用医薬品])を10ml加えることにより、試料溶液としての幹細胞分離用骨髄液を調整した。
【0073】
そして活栓を閉じた状態にし、注射器を用いて20mlの幹細胞分離用骨髄液を上チャンバ110に注入し、注入後に活栓を開放した。次いで、400gで40分間遠心分離を行い、遠心後に活栓を閉鎖した。その結果、下チャンバ120に赤血球・顆粒球分画及び遠心分離媒体、上チャンバ110には遠心分離媒体、単核球分画(骨髄幹細胞分画)及び血小板・血漿分画の2分画に分離することができた。上層を注射器で採取することにより、単核球分画(骨髄幹細胞分画)を含み、かつ成熟顆粒球をほとんど含まない単核球を含む細胞液を得た。
【0074】
上記の手法にて得られた単核球を含む細胞液は、単核球回収率:約80%、単核球生存率:99%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約96%の特性を有するものであった。
【0075】
上記の手法で得られた単核球を含む細胞液の細菌汚染、真菌汚染に関する検討を行った。即ち、10%牛胎児血清入り細胞培養液、CDLP寒天培地及びサブロー寒天培地に各1mlの骨髄幹細胞液を混和あるいは塗布し、37℃で30日間培養を行ったが、細胞及び真菌の増殖は全く観察されなかった。
【0076】
〈脳梗塞動物モデルでの治療効果〉
SCIDマウス脳梗塞モデル(左中大脳動脈M1遠位部閉塞モデル)を用いて、上記の〈単核球分離管による骨髄幹細胞の単離〉で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。(i)本発明で分離された細胞液投与群(幹細胞群)、及び(ii)生理食塩水投与群(生食群)を設定した。各群6匹の脳梗塞モデルマウスに対し、脳梗塞作成2日後に5x105個の細胞(あるいは生理食塩水)を尾静脈より投与し、それぞれ投与群の脳神経機能回復促進効果の検証を行った。神経機能回復の評価項目に関しては、細胞投与30日後の大脳皮質神経機能をオープンフィールドテストで評価し、統計解析はt検定を用いて行った。図7は、SCIDマウス脳虚血モデルにおける30分間の総活動量(移動活動量+立ち上がり反応)の暗条件に対する反応性の測定結果である。図7に示すように、生食群と比し、幹細胞群では有意な機能回復促進が観察された。なお有意確率は5%であった。
【0077】
〈下肢虚血動物モデルでの治療効果〉
SCIDマウス下肢虚血モデル(左大腿動脈閉塞モデル)を用いて、上記の〈単核球分離管による骨髄幹細胞の単離〉で得られた骨髄幹細胞液の治療薬剤としての効果の検討を行った。(i)本発明で分離された細胞液投与群(幹細胞群)、及び(ii)生理食塩水投与群(生食群)を設定した。各群6匹の下肢虚血モデルマウスに対し、下肢虚血作成直後に計1x106個の細胞(あるいは生理食塩水)を3か所の大腿部筋肉内に投与し、下肢虚血モデル作成30日後の救肢促進効果の検証を行った。虚血レベルは、0点:正常、1点:軽度の変色、2点:中等度から重度の変色、3点:壊死、4点:離断のようにして評価を行った。統計解析はマン・ホイットニ検定を用いて行った。図8は、SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。図8に示すように、生食群と比し、幹細胞群で有意な救肢効果が観察された。なお有意確率は5%であった。
【0078】
(実施例5)
〈単核球分離システムの準備〉
実施例5では、図2に示した単核球分離システムを用いて単核球の単離を試みた。試料溶液バッグ210には予め、10mlの希釈用生理食塩水(大塚生食注:大塚製薬)及び100単位のヘパリンナトリウム(ノボ・ヘパリンナトリウム)が収納された。また、遠心分離媒体として、造影剤(オムニパーク140:第一三共株式会社)を23.3ml、生理食塩水(大塚生食注:大塚製薬)を25.9ml及び蒸留水(大塚蒸留水:大塚製薬)を0.8ml混和することにより作成した。作成された遠心分離媒体の比重は1.077、浸透圧(生理食塩液に対する比)は1.0、pHは7.4であった。この約10mlの遠心分離媒体を単核球分離管100の下チャンバ120に予め配置した。エア用バック220には、予め約10mlの無塵無菌空気を入れるとともに、30ml以上の拡張能を持たせた。全てのクランプは閉の状態とした。
【0079】
〈単核球分離システムによる骨髄幹細胞の単離〉
次に、ヒト骨髄液の原液10mlを注射器により試料溶液バッグ210に注入して、良く混和した。そして図3に示したように、試料溶液バッグ210を点滴台350に懸架すると共に、単核球分離管100をチューブラックに立てた後、第1クランプ311及び第2クランプ321を開放した。全ての骨髄液が単核球分離管100に移動した後、第1クランプ311及び第2クランプ321を閉鎖し、ヒートシーラーにより第1チューブ310を閉鎖し、ヒートシーリングポイントの試料溶液バッグ210側で切断した。
【0080】
続いて、単核球分離管100の3方活栓130を試料溶液と遠心分離媒体とが接するように開放し、単核球分離管100と、単核球収納バッグ23及びエアバッグ220とを遠心機に懸架して、対側同士のバランスを取った。次いで、400gで40分間遠心分離を行い、遠心後に3方活栓130を閉鎖した。その結果、単核球分離管100の下チャンバ120には赤血球・顆粒球分画及び遠心分離媒体、上チャンバ110には遠心分離媒体、単核球分画(骨髄幹細胞分画)及び血小板・血漿分画の2分画に分離することができた。
【0081】
続いて、図4に示したように、単核球分離管100を点滴台に懸架し、エアバック220とのクランプを開放するとともに、第1接続口131及び第3接続口133を連通するように三方活栓を開放し、全ての上チャンバ110にある液体を単核球収納バッグ230内に移動させた。続いて、ヒートシーラーにより第3チューブ330を閉鎖して、ヒートシーリングポイントの単核球分離管100側で切断した。
【0082】
その結果、単核球収納バッグ230内に、単核球分画(骨髄幹細胞分画)を含み、かつ成熟顆粒球をほとんど含まない骨髄幹細胞液を得ることができた。
【0083】
上記の手法にて得られた単核球を含む細胞液は、単核球回収率:約69%、単核球生存率:99%、CD34陽性細胞濃度:約3%、成熟顆粒球除去率:約96%の特性を有するものであった。
【0084】
上記の手法で得られた単核球を含む細胞液の細菌汚染、真菌汚染に関する検討を行った。即ち、10%牛胎児血清入り細胞培養液、CDLP寒天培地及びサブロー寒天培地に各1mlの細胞液を混和あるいは塗布し、37℃で30日間培養を行ったが、細胞及び真菌の増殖は全く観察されなかった。
【0085】
〈脳梗塞動物モデルでの治療効果〉
SCIDマウス脳梗塞モデル(左中大脳動脈M1遠位部閉塞モデル)を用いて、上記の〈単核球分離システムによる骨髄幹細胞の単離〉で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。(i)本発明で分離された細胞液投与群(幹細胞群)、及び(ii)生理食塩水投与群(生食群)を設定した。各群6匹の脳梗塞モデルマウスに対し、脳梗塞作成2日後に5x105個の細胞(あるいは生理食塩水)を尾静脈より投与し、それぞれ投与群の脳神経機能回復促進効果の検証を行った。神経機能回復の評価項目に関しては、細胞投与30日後の大脳皮質神経機能をオープンフィールドテストで評価し、統計解析はt検定を用いて行った。図9は、SCIDマウス脳虚血モデルにおける30分間の総活動量(移動活動量+立ち上がり反応)の暗条件に対する反応性の測定結果である。図9に示すように、生食群と比し、幹細胞群では有意な機能回復促進が観察された。なお有意確率は5%であった。
【0086】
〈下肢虚血動物モデルでの治療効果〉
SCIDマウス下肢虚血モデル(左大腿動脈閉塞モデル)を用いて、上記の〈単核球分離システムによる骨髄幹細胞の単離〉で得られた単核球を含む細胞液の治療薬剤としての効果の検討を行った。(i)本発明で分離された細胞液投与群(幹細胞群)、及び(ii)生理食塩水投与群(生食群)を設定した。各群6匹の下肢虚血モデルマウスに対し、下肢虚血作成直後に計1x106個の細胞(あるいは生理食塩水)を3か所の大腿部筋肉内に投与し、下肢虚血モデル作成30日後の救肢促進効果の検証を行った。虚血レベルは、0点:正常、1点:軽度の変色、2点:中等度から重度の変色、3点:壊死、4点:離断のようにして評価を行った。統計解析はマン・ホイットニ検定を用いて行った。図10は、SCIDマウス下肢虚血モデルにおける救肢効果の測定結果である。図10に示すように、生食群と比し、幹細胞群で有意な救肢効果が観察された。なお有意確率は5%であった。
【産業上の利用可能性】
【0087】
本発明によれば単核球を簡易に分離することができ、この単核球により脳血管障害や末梢血管障害等の効果的な治療が可能となる。
【符号の説明】
【0088】
100:単核球分離管
110:上チャンバ
120:下チャンバ
130:三方活栓
131:第1接続口
132:第2接続口
133:第3接続口
140:蓋
150:ケース
210:試料溶液バッグ
220:エアバッグ
230:単核球収納バッグ
310:第1チューブ
311:第1クランプ
312:フィルター
320:第2チューブ
321:第2クランプ
330:第3チューブ
350,360:点滴台
900:単核球分離システム
【特許請求の範囲】
【請求項1】
単核球を含む複数成分からなる試料溶液を、遠心分離媒体を用いて遠心分離処理することで、前記複数成分を比重の違いにより分離させ、低比重成分である単核球を採取するための単核球分離管であって、
上側に配置されて前記試料溶液が導入される導入開口及び下側に配置された下側開口を有し、遠心分離処理前には前記試料溶液が収納されると共に遠心分離処理後には前記低比重成分である単核球が位置する上チャンバと、
上側に上側開口が配置され下側が閉塞し、遠心分離処理前には前記遠心分離媒体が収納されると共に遠心分離処理後には不要成分である高比重成分が位置する下チャンバと、
前記上チャンバの下側開口と前記下チャンバの上側開口とを連通状態又は非連通状態に切り換える活栓と、
前記上チャンバの前記導入開口を密栓する蓋と、
を備えることを特徴とする単核球分離管。
【請求項2】
前記活栓は、第1、第2及び第3接続口を有する3個の流体通路を備えた三方活栓であり、
第1接続口は前記上チャンバの下側開口に接続され、
第2接続口は前記下チャンバの上側開口に接続され、
遠心分離処理後に三方活栓の前記第1接続口及び前記第3接続口を連通させて、前記低比重成分である単核球を前記第3接続口から取り出すことを特徴とする請求項1に記載の単核球分離管。
【請求項3】
前記遠心分離媒体は、ヨード造影剤を主成分とし、且つ、前記下チャンバに収納されていることを特徴とする請求項1又は2に記載の単核球分離管。
【請求項4】
前記ヨード造影剤は、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミドから選択される非イオン性水溶性ヨード造影剤であることを特徴とする請求項3記載の単核球分離管。
【請求項5】
請求項1に記載の単核球分離管と、
単核球を含む複数成分からなる試料溶液が収納される試料溶液バッグと、
前記単核球分離管に対して空気を出し入れするエアバッグと、
前記単核球分離管の蓋を貫通して、前記上チャンバと前記試料溶液バッグとを接続する第1チューブと、
前記単核球分離管の蓋を貫通して、前記上チャンバと前記エアバッグとを接続する第2チューブと、を備えることを特徴とする単核球分離システム。
【請求項6】
請求項2乃至4の何れか1項に記載の単核球分離管と、
単核球を含む複数成分からなる試料溶液が収納される試料溶液バッグと、
前記単核球分離管に対して空気を出し入れするエアバッグと、
分離された低比重成分である単核球を収納する単核球収納バッグと、
前記単核球分離管の蓋を貫通して、前記上チャンバと前記試料溶液バッグとを接続する第1チューブと、
前記単核球分離管の蓋を貫通して、前記上チャンバと前記エアバッグとを接続する第2チューブと、
前記単核球収納バッグと前記三方活栓の第3接続口とを接続する第3チューブと、を備えることを特徴とする単核球分離システム。
【請求項7】
ヨード造影剤を遠心分離媒体の主成分とする比重遠心分離法により、単核球を含む複数成分からなる試料溶液から単核球を分離する単核球の分離方法。
【請求項8】
前記ヨード造影剤は、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミドから選択される非イオン性水溶性ヨード造影剤である請求項7記載の単核球の分離方法。
【請求項9】
請求項7又は8記載の単核球の分離方法により分離された単核球。
【請求項10】
請求項9記載の単核球を有効成分として含む体内投与用薬剤。
【請求項11】
脳疾患治療、神経変性疾患治療、末梢血管疾患治療、心疾患治療、脳性麻痺治療、腎梗塞治療、認知症治療、慢性腎不全治療、又は、慢性心不全治療のいずれかに使用される請求項10記載の体内投与用薬剤。
【請求項1】
単核球を含む複数成分からなる試料溶液を、遠心分離媒体を用いて遠心分離処理することで、前記複数成分を比重の違いにより分離させ、低比重成分である単核球を採取するための単核球分離管であって、
上側に配置されて前記試料溶液が導入される導入開口及び下側に配置された下側開口を有し、遠心分離処理前には前記試料溶液が収納されると共に遠心分離処理後には前記低比重成分である単核球が位置する上チャンバと、
上側に上側開口が配置され下側が閉塞し、遠心分離処理前には前記遠心分離媒体が収納されると共に遠心分離処理後には不要成分である高比重成分が位置する下チャンバと、
前記上チャンバの下側開口と前記下チャンバの上側開口とを連通状態又は非連通状態に切り換える活栓と、
前記上チャンバの前記導入開口を密栓する蓋と、
を備えることを特徴とする単核球分離管。
【請求項2】
前記活栓は、第1、第2及び第3接続口を有する3個の流体通路を備えた三方活栓であり、
第1接続口は前記上チャンバの下側開口に接続され、
第2接続口は前記下チャンバの上側開口に接続され、
遠心分離処理後に三方活栓の前記第1接続口及び前記第3接続口を連通させて、前記低比重成分である単核球を前記第3接続口から取り出すことを特徴とする請求項1に記載の単核球分離管。
【請求項3】
前記遠心分離媒体は、ヨード造影剤を主成分とし、且つ、前記下チャンバに収納されていることを特徴とする請求項1又は2に記載の単核球分離管。
【請求項4】
前記ヨード造影剤は、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミドから選択される非イオン性水溶性ヨード造影剤であることを特徴とする請求項3記載の単核球分離管。
【請求項5】
請求項1に記載の単核球分離管と、
単核球を含む複数成分からなる試料溶液が収納される試料溶液バッグと、
前記単核球分離管に対して空気を出し入れするエアバッグと、
前記単核球分離管の蓋を貫通して、前記上チャンバと前記試料溶液バッグとを接続する第1チューブと、
前記単核球分離管の蓋を貫通して、前記上チャンバと前記エアバッグとを接続する第2チューブと、を備えることを特徴とする単核球分離システム。
【請求項6】
請求項2乃至4の何れか1項に記載の単核球分離管と、
単核球を含む複数成分からなる試料溶液が収納される試料溶液バッグと、
前記単核球分離管に対して空気を出し入れするエアバッグと、
分離された低比重成分である単核球を収納する単核球収納バッグと、
前記単核球分離管の蓋を貫通して、前記上チャンバと前記試料溶液バッグとを接続する第1チューブと、
前記単核球分離管の蓋を貫通して、前記上チャンバと前記エアバッグとを接続する第2チューブと、
前記単核球収納バッグと前記三方活栓の第3接続口とを接続する第3チューブと、を備えることを特徴とする単核球分離システム。
【請求項7】
ヨード造影剤を遠心分離媒体の主成分とする比重遠心分離法により、単核球を含む複数成分からなる試料溶液から単核球を分離する単核球の分離方法。
【請求項8】
前記ヨード造影剤は、イオヘキソール、イオパミドール、イオメプロール、イオキシラン、イオベルソール、又はイオプロミドから選択される非イオン性水溶性ヨード造影剤である請求項7記載の単核球の分離方法。
【請求項9】
請求項7又は8記載の単核球の分離方法により分離された単核球。
【請求項10】
請求項9記載の単核球を有効成分として含む体内投与用薬剤。
【請求項11】
脳疾患治療、神経変性疾患治療、末梢血管疾患治療、心疾患治療、脳性麻痺治療、腎梗塞治療、認知症治療、慢性腎不全治療、又は、慢性心不全治療のいずれかに使用される請求項10記載の体内投与用薬剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−34725(P2012−34725A)
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願番号】特願2010−175056(P2010−175056)
【出願日】平成22年8月4日(2010.8.4)
【出願人】(803000056)財団法人ヒューマンサイエンス振興財団 (341)
【Fターム(参考)】
【公開日】平成24年2月23日(2012.2.23)
【国際特許分類】
【出願日】平成22年8月4日(2010.8.4)
【出願人】(803000056)財団法人ヒューマンサイエンス振興財団 (341)
【Fターム(参考)】
[ Back to top ]

