単純ヘルペスウイルス複合サブユニットワクチンおよびその使用方法
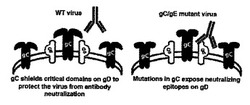
【課題】一次(初めての)感染を防止し、HSV−1およびHSV−2の再発を防止するための方法が、当技術分野において早急に必要である。
【解決手段】本発明は、gDタンパク質、gCタンパク質、およびgEタンパク質から選択される2つ以上の組換え単純ヘルペスウイルス(HSV)タンパク質を含有するワクチンと、対象にHSVに対するワクチン接種をして、それにより免疫回避を阻害し、HSV感染またはその症状もしくは兆候を治療、阻害、抑止、発生低減、および/または抑制する方法であって、本発明のワクチンを投与するステップを含む方法とを提供する。
【解決手段】本発明は、gDタンパク質、gCタンパク質、およびgEタンパク質から選択される2つ以上の組換え単純ヘルペスウイルス(HSV)タンパク質を含有するワクチンと、対象にHSVに対するワクチン接種をして、それにより免疫回避を阻害し、HSV感染またはその症状もしくは兆候を治療、阻害、抑止、発生低減、および/または抑制する方法であって、本発明のワクチンを投与するステップを含む方法とを提供する。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
ワクチンであって、
a.組換えHSV gDタンパク質またはその免疫原性フラグメントと、
b.組換えHSV gCタンパク質またはそのフラグメントであって、前記フラグメントは、そのC3b結合ドメイン、そのプロパージン干渉ドメイン、そのC5干渉ドメイン、または前記C3b結合ドメイン、プロパージン干渉ドメイン、もしくはC5干渉ドメインのフラグメントのいずれかを含む、組換えHSV gCタンパク質またはそのフラグメントと、
c.組換えHSV gEタンパク質またはそのフラグメントであって、前記フラグメントは、AA24−409またはそのフラグメントを含む、組換えHSV gEタンパク質またはそのフラグメントと、
d.アジュバントと
を含有することを特徴とするワクチン。
【請求項2】
前記アジュバントが、CpG含有ヌクレオチド分子、アルミニウム塩アジュバント、またはそれらの組み合わせを含むことを特徴とする請求項1に記載のワクチン。
【請求項3】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項1に記載のワクチン。
【請求項4】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、1用量当たり10〜250ナノグラムの量で存在することを特徴とする請求項1に記載のワクチン。
【請求項5】
前記組換えHSV gCタンパク質またはそのフラグメントが、1用量当たり0.5〜100マイクログラムの量で存在することを特徴とする請求項1に記載のワクチン。
【請求項6】
前記組換えHSV gEタンパク質またはそのフラグメントが、1用量当たり2〜100マイクログラムの量で存在することを特徴とする請求項1に記載のワクチン。
【請求項7】
前記組換えHSVタンパク質が、組換えHSV−1タンパク質であることを特徴とする請求項1に記載のワクチン。
【請求項8】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−2タンパク質をさらに含有することを特徴とする請求項7に記載のワクチン。
【請求項9】
前記組換えHSVタンパク質が、組換えHSV−2タンパク質であることを特徴とする請求項1に記載のワクチン。
【請求項10】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−1タンパク質をさらに含有することを特徴とする請求項9に記載のワクチン。
【請求項11】
対象における抗HSV免疫応答を誘発する方法であって、
前記対象に、請求項1に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項12】
前記対象に追加免疫ワクチン接種を実施するステップをさらに含み、
前記追加免疫ワクチン接種が、
(a)前記組換えHSV gDタンパク質またはその免疫原性フラグメントを含有し、
(b)組換えHSV gCタンパク質またはそのフラグメントを含有せず、
(c)前記組換えHSV gEタンパク質またはそのフラグメントを含有しない
ことを特徴とする請求項11に記載の方法。
【請求項13】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、前記追加免疫ワクチン接種において、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項12に記載の方法。
【請求項14】
対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
前記対象に、請求項1に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項15】
前記HSV感染が、HSV−1感染であることを特徴とする請求項14に記載の方法。
【請求項16】
前記HSV感染が、HSV−2感染であることを特徴とする請求項14に記載の方法。
【請求項17】
前記HSV感染が、一次HSV感染であることを特徴とする請求項14に記載の方法。
【請求項18】
前記HSV感染が、一次HSV感染後の発赤、再発、または口唇HSVであることを特徴とする請求項14に記載の方法。
【請求項19】
前記HSV感染が、HSV脳炎であることを特徴とする請求項14に記載の方法。
【請求項20】
前記HSV感染が、HSV新生児感染であることを特徴とする請求項14に記載の方法。
【請求項21】
前記対象が、HIVに感染していることを特徴とする請求項14に記載の方法。
【請求項22】
ワクチンであって、
a.組換えHSV gDタンパク質またはその免疫原性フラグメントと、
b.組換えHSV gCタンパク質またはそのフラグメントであって、前記フラグメントは、そのC3b結合ドメイン、そのプロパージン干渉ドメイン、そのC5干渉ドメイン、または前記C3b結合ドメイン、プロパージン干渉ドメイン、もしくはC5干渉ドメインのフラグメントのいずれかを含む、組換えHSV gCタンパク質またはそのフラグメントと、
c.アジュバントと
を含有し、
ヒト対象への前記ワクチンの投与が、前記組換えHSV gCタンパク質に対応するHSVタンパク質の免疫回避機能を遮断する抗HSV gC抗体を誘起することを特徴とするワクチン。
【請求項23】
前記アジュバントが、CpG含有ヌクレオチド分子、アルミニウム塩アジュバント、またはそれらの組み合わせを含むことを特徴とする請求項22に記載のワクチン。
【請求項24】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項22に記載のワクチン。
【請求項25】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、1用量当たり10〜250ngの量で存在することを特徴とする請求項22に記載のワクチン。
【請求項26】
前記組換えHSV gCタンパク質またはそのフラグメントが、1用量当たり0.5〜100マイクログラムの量で存在することを特徴とする請求項22に記載のワクチン。
【請求項27】
前記組換えHSVタンパク質が、組換えHSV−1タンパク質であることを特徴とする請求項22に記載のワクチン。
【請求項28】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−2タンパク質をさらに含有することを特徴とする請求項27に記載のワクチン。
【請求項29】
前記組換えHSVタンパク質が、組換えHSV−2タンパク質であることを特徴とする請求項22に記載のワクチン。
【請求項30】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−1タンパク質をさらに含有することを特徴とする請求項29に記載のワクチン。
【請求項31】
対象における抗HSV免疫応答を誘発する方法であって、
請求項22に記載のワクチンを前記対象に投与するステップを含むことを特徴とする方法。
【請求項32】
前記対象に追加免疫ワクチン接種を実施するステップをさらに含み、
前記追加免疫ワクチン接種が、
(a)前記組換えHSV gDタンパク質またはその免疫原性フラグメントを含有し、
(b)組換えHSV gCタンパク質またはそのフラグメントを含有しない
ことを特徴とする請求項31に記載の方法。
【請求項33】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、前記追加免疫ワクチン接種において、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項32に記載の方法。
【請求項34】
対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
前記対象に、請求項22に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項35】
前記HSV感染が、HSV−1感染であることを特徴とする請求項34に記載の方法。
【請求項36】
前記HSV感染が、HSV−2感染であることを特徴とする請求項34に記載の方法。
【請求項37】
前記HSV感染が、一次HSV感染であることを特徴とする請求項34に記載の方法。
【請求項38】
前記HSV感染が、一次HSV感染後の、発赤、再発、または口唇HSVであることを特徴とする請求項34に記載の方法。
【請求項39】
前記HSV感染が、HSV脳炎であることを特徴とする請求項34に記載の方法。
【請求項40】
前記HSV感染が、HSV新生児感染であることを特徴とする請求項34に記載の方法。
【請求項41】
前記対象が、HIVに感染していることを特徴とする請求項34に記載の方法。
【請求項42】
ワクチンであって、
a.組換えHSV gDタンパク質またはその免疫原性フラグメントと、
b.組換えHSV gEタンパク質またはそのフラグメントであって、前記フラグメントは、AA24−409またはそのフラグメントを含む、組換えHSV gEタンパク質またはそのフラグメントと、
c.アジュバントと
を含有し、
ヒト対象への前記ワクチンの投与が、前記組換えHSV gEタンパク質に対応するHSVタンパク質の免疫回避機能を遮断する抗HSV gE抗体を誘起することを特徴とするワクチン。
【請求項43】
前記アジュバントが、CpG含有ヌクレオチド分子、アルミニウム塩アジュバント、またはそれらの組み合わせを含むことを特徴とする請求項42に記載のワクチン。
【請求項44】
前記組換えHSV gDタンパク質またはそのフラグメントが、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項42に記載のワクチン。
【請求項45】
前記組換えHSV gDタンパク質またはそのフラグメントが、1用量当たり10〜250ナノグラムの量で存在することを特徴とする請求項42に記載のワクチン。
【請求項46】
前記組換えHSV gEタンパク質またはそのフラグメントが、1用量当たり2〜100マイクログラムの量で存在することを特徴とする請求項42に記載のワクチン。
【請求項47】
前記組換えHSVタンパク質が、組換えHSV−1タンパク質であることを特徴とする請求項42に記載のワクチン。
【請求項48】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−2タンパク質をさらに含有することを特徴とする請求項47に記載のワクチン。
【請求項49】
前記組換えHSVタンパク質が、組換えHSV−2タンパク質であることを特徴とする請求項42に記載のワクチン。
【請求項50】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−1タンパク質をさらに含有することを特徴とする請求項49に記載のワクチン。
【請求項51】
対象における抗HSV免疫応答を誘発する方法であって、
前記対象に、請求項42に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項52】
前記対象に追加免疫ワクチン接種を実施するステップをさらに含み、
前記追加免疫ワクチン接種が、
(a)前記組換えHSV gDタンパク質またはその免疫原性フラグメントを含有し、
(b)前記組換えHSV gEタンパク質またはそのフラグメントを含有しない
ことを特徴とする請求項51に記載の方法。
【請求項53】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、前記追加免疫ワクチン接種において、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項52に記載の方法。
【請求項54】
対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
前記対象に、請求項42に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項55】
前記HSV感染が、HSV−1感染であることを特徴とする請求項54に記載の方法。
【請求項56】
前記HSV感染が、HSV−2感染であることを特徴とする請求項54に記載の方法。
【請求項57】
前記HSV感染が、一次HSV感染であることを特徴とする請求項54に記載の方法。
【請求項58】
前記HSV感染が、一次HSV感染後の発赤、再発、または口唇HSVであることを特徴とする請求項54に記載の方法。
【請求項59】
前記HSV感染が、HSV脳炎であることを特徴とする請求項54に記載の方法。
【請求項60】
前記HSV感染が、HSV新生児感染であることを特徴とする請求項54に記載の方法。
【請求項61】
前記対象が、HIVに感染していることを特徴とする請求項54に記載の方法。
【請求項62】
ワクチンであって、
a.組換えHSV gCタンパク質またはそのフラグメントであって、前記フラグメントは、そのC3b結合ドメイン、そのプロパージン干渉ドメイン、そのC5干渉ドメイン、または前記C3b結合ドメイン、プロパージン干渉ドメイン、もしくはC5干渉ドメインのフラグメントのいずれかを含む、組換えHSV gCタンパク質またはそのフラグメントと、
b.組換えHSV gEタンパク質またはそのフラグメントであって、前記フラグメントは、AA24−409またはそのフラグメントを含む、組換えHSV gEタンパク質またはそのフラグメントと、
c.アジュバントと
を含有することを特徴とするワクチン。
【請求項63】
前記アジュバントが、CpG含有ヌクレオチド分子、アルミニウム塩アジュバント、またはそれらの組み合わせを含むことを特徴とする請求項62に記載のワクチン。
【請求項64】
前記組換えHSV gCタンパク質またはそのフラグメントが、1用量当たり0.5〜100マイクログラムの量で存在することを特徴とする請求項62に記載のワクチン。
【請求項65】
前記組換えHSV gEタンパク質またはそのフラグメントが、1用量当たり2〜100マイクログラムの量で存在することを特徴とする請求項62に記載のワクチン。
【請求項66】
前記組換えHSVタンパク質が、組換えHSV−1タンパク質であることを特徴とする請求項62に記載のワクチン。
【請求項67】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−2タンパク質をさらに含有することを特徴とする請求項66に記載のワクチン。
【請求項68】
前記組換えHSVタンパク質が、組換えHSV−2タンパク質であることを特徴とする請求項62に記載のワクチン。
【請求項69】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−1タンパク質をさらに含有することを特徴とする請求項64に記載のワクチン。
【請求項70】
対象における抗HSV免疫応答を誘発する方法であって、
前記対象に、請求項62に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項71】
前記対象に追加免疫ワクチン接種を実施するステップをさらに含み、
前記追加免疫ワクチン接種が、
(a)前記組換えHSV gDタンパク質またはその免疫原性フラグメントを含有し、
(b)前記組換えHSV gEタンパク質またはそのフラグメントを含有しない
ことを特徴とする請求項70に記載の方法。
【請求項72】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、前記追加免疫ワクチン接種において、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項71に記載の方法。
【請求項73】
対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
前記対象に、請求項62に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項74】
前記HSV感染が、HSV−1感染であることを特徴とする請求項73に記載の方法。
【請求項75】
前記HSV感染が、HSV−2感染であることを特徴とする請求項73に記載の方法。
【請求項76】
前記HSV感染が、一次HSV感染であることを特徴とする請求項73に記載の方法。
【請求項77】
前記HSV感染が、一次HSV感染後の発赤、再発、または口唇HSVであることを特徴とする請求項73に記載の方法。
【請求項78】
前記HSV感染が、HSV脳炎であることを特徴とする請求項73に記載の方法。
【請求項79】
前記HSV感染が、HSV新生児感染であることを特徴とする請求項73に記載の方法。
【請求項80】
前記対象が、HIVに感染していることを特徴とする請求項73に記載の方法。
【請求項81】
HIVに感染した対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
a.組換えHSV gCタンパク質またはそのフラグメントであって、前記フラグメントは、そのC3b結合ドメイン、そのプロパージン干渉ドメイン、そのC5干渉ドメイン、または前記C3b結合ドメイン、プロパージン干渉ドメイン、もしくはC5干渉ドメインのフラグメントのいずれかを含む、組換えHSV gCタンパク質またはそのフラグメントと、
b.組換えHSV gEタンパク質またはそのフラグメントであって、前記フラグメントは、AA24−409またはそのフラグメントを含む、組換えHSV gEタンパク質またはそのフラグメントと、
c.アジュバントと
を含有するワクチンを前記対象に投与するステップを含むことを特徴とする方法。
【請求項82】
前記HSV感染の発生低減が、HSV感染の再発の防止を含むことを特徴とする請求項79に記載の方法。
【請求項83】
前記HSV感染の抑制が、HSV感染の再発の重症度の軽減を含むことを特徴とする請求項79に記載の方法。
【請求項84】
前記HSV感染の発生低減が、HSV感染の再発の頻度の低減を含むことを特徴とする請求項79に記載の方法。
【請求項1】
ワクチンであって、
a.組換えHSV gDタンパク質またはその免疫原性フラグメントと、
b.組換えHSV gCタンパク質またはそのフラグメントであって、前記フラグメントは、そのC3b結合ドメイン、そのプロパージン干渉ドメイン、そのC5干渉ドメイン、または前記C3b結合ドメイン、プロパージン干渉ドメイン、もしくはC5干渉ドメインのフラグメントのいずれかを含む、組換えHSV gCタンパク質またはそのフラグメントと、
c.組換えHSV gEタンパク質またはそのフラグメントであって、前記フラグメントは、AA24−409またはそのフラグメントを含む、組換えHSV gEタンパク質またはそのフラグメントと、
d.アジュバントと
を含有することを特徴とするワクチン。
【請求項2】
前記アジュバントが、CpG含有ヌクレオチド分子、アルミニウム塩アジュバント、またはそれらの組み合わせを含むことを特徴とする請求項1に記載のワクチン。
【請求項3】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項1に記載のワクチン。
【請求項4】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、1用量当たり10〜250ナノグラムの量で存在することを特徴とする請求項1に記載のワクチン。
【請求項5】
前記組換えHSV gCタンパク質またはそのフラグメントが、1用量当たり0.5〜100マイクログラムの量で存在することを特徴とする請求項1に記載のワクチン。
【請求項6】
前記組換えHSV gEタンパク質またはそのフラグメントが、1用量当たり2〜100マイクログラムの量で存在することを特徴とする請求項1に記載のワクチン。
【請求項7】
前記組換えHSVタンパク質が、組換えHSV−1タンパク質であることを特徴とする請求項1に記載のワクチン。
【請求項8】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−2タンパク質をさらに含有することを特徴とする請求項7に記載のワクチン。
【請求項9】
前記組換えHSVタンパク質が、組換えHSV−2タンパク質であることを特徴とする請求項1に記載のワクチン。
【請求項10】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−1タンパク質をさらに含有することを特徴とする請求項9に記載のワクチン。
【請求項11】
対象における抗HSV免疫応答を誘発する方法であって、
前記対象に、請求項1に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項12】
前記対象に追加免疫ワクチン接種を実施するステップをさらに含み、
前記追加免疫ワクチン接種が、
(a)前記組換えHSV gDタンパク質またはその免疫原性フラグメントを含有し、
(b)組換えHSV gCタンパク質またはそのフラグメントを含有せず、
(c)前記組換えHSV gEタンパク質またはそのフラグメントを含有しない
ことを特徴とする請求項11に記載の方法。
【請求項13】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、前記追加免疫ワクチン接種において、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項12に記載の方法。
【請求項14】
対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
前記対象に、請求項1に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項15】
前記HSV感染が、HSV−1感染であることを特徴とする請求項14に記載の方法。
【請求項16】
前記HSV感染が、HSV−2感染であることを特徴とする請求項14に記載の方法。
【請求項17】
前記HSV感染が、一次HSV感染であることを特徴とする請求項14に記載の方法。
【請求項18】
前記HSV感染が、一次HSV感染後の発赤、再発、または口唇HSVであることを特徴とする請求項14に記載の方法。
【請求項19】
前記HSV感染が、HSV脳炎であることを特徴とする請求項14に記載の方法。
【請求項20】
前記HSV感染が、HSV新生児感染であることを特徴とする請求項14に記載の方法。
【請求項21】
前記対象が、HIVに感染していることを特徴とする請求項14に記載の方法。
【請求項22】
ワクチンであって、
a.組換えHSV gDタンパク質またはその免疫原性フラグメントと、
b.組換えHSV gCタンパク質またはそのフラグメントであって、前記フラグメントは、そのC3b結合ドメイン、そのプロパージン干渉ドメイン、そのC5干渉ドメイン、または前記C3b結合ドメイン、プロパージン干渉ドメイン、もしくはC5干渉ドメインのフラグメントのいずれかを含む、組換えHSV gCタンパク質またはそのフラグメントと、
c.アジュバントと
を含有し、
ヒト対象への前記ワクチンの投与が、前記組換えHSV gCタンパク質に対応するHSVタンパク質の免疫回避機能を遮断する抗HSV gC抗体を誘起することを特徴とするワクチン。
【請求項23】
前記アジュバントが、CpG含有ヌクレオチド分子、アルミニウム塩アジュバント、またはそれらの組み合わせを含むことを特徴とする請求項22に記載のワクチン。
【請求項24】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項22に記載のワクチン。
【請求項25】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、1用量当たり10〜250ngの量で存在することを特徴とする請求項22に記載のワクチン。
【請求項26】
前記組換えHSV gCタンパク質またはそのフラグメントが、1用量当たり0.5〜100マイクログラムの量で存在することを特徴とする請求項22に記載のワクチン。
【請求項27】
前記組換えHSVタンパク質が、組換えHSV−1タンパク質であることを特徴とする請求項22に記載のワクチン。
【請求項28】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−2タンパク質をさらに含有することを特徴とする請求項27に記載のワクチン。
【請求項29】
前記組換えHSVタンパク質が、組換えHSV−2タンパク質であることを特徴とする請求項22に記載のワクチン。
【請求項30】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−1タンパク質をさらに含有することを特徴とする請求項29に記載のワクチン。
【請求項31】
対象における抗HSV免疫応答を誘発する方法であって、
請求項22に記載のワクチンを前記対象に投与するステップを含むことを特徴とする方法。
【請求項32】
前記対象に追加免疫ワクチン接種を実施するステップをさらに含み、
前記追加免疫ワクチン接種が、
(a)前記組換えHSV gDタンパク質またはその免疫原性フラグメントを含有し、
(b)組換えHSV gCタンパク質またはそのフラグメントを含有しない
ことを特徴とする請求項31に記載の方法。
【請求項33】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、前記追加免疫ワクチン接種において、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項32に記載の方法。
【請求項34】
対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
前記対象に、請求項22に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項35】
前記HSV感染が、HSV−1感染であることを特徴とする請求項34に記載の方法。
【請求項36】
前記HSV感染が、HSV−2感染であることを特徴とする請求項34に記載の方法。
【請求項37】
前記HSV感染が、一次HSV感染であることを特徴とする請求項34に記載の方法。
【請求項38】
前記HSV感染が、一次HSV感染後の、発赤、再発、または口唇HSVであることを特徴とする請求項34に記載の方法。
【請求項39】
前記HSV感染が、HSV脳炎であることを特徴とする請求項34に記載の方法。
【請求項40】
前記HSV感染が、HSV新生児感染であることを特徴とする請求項34に記載の方法。
【請求項41】
前記対象が、HIVに感染していることを特徴とする請求項34に記載の方法。
【請求項42】
ワクチンであって、
a.組換えHSV gDタンパク質またはその免疫原性フラグメントと、
b.組換えHSV gEタンパク質またはそのフラグメントであって、前記フラグメントは、AA24−409またはそのフラグメントを含む、組換えHSV gEタンパク質またはそのフラグメントと、
c.アジュバントと
を含有し、
ヒト対象への前記ワクチンの投与が、前記組換えHSV gEタンパク質に対応するHSVタンパク質の免疫回避機能を遮断する抗HSV gE抗体を誘起することを特徴とするワクチン。
【請求項43】
前記アジュバントが、CpG含有ヌクレオチド分子、アルミニウム塩アジュバント、またはそれらの組み合わせを含むことを特徴とする請求項42に記載のワクチン。
【請求項44】
前記組換えHSV gDタンパク質またはそのフラグメントが、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項42に記載のワクチン。
【請求項45】
前記組換えHSV gDタンパク質またはそのフラグメントが、1用量当たり10〜250ナノグラムの量で存在することを特徴とする請求項42に記載のワクチン。
【請求項46】
前記組換えHSV gEタンパク質またはそのフラグメントが、1用量当たり2〜100マイクログラムの量で存在することを特徴とする請求項42に記載のワクチン。
【請求項47】
前記組換えHSVタンパク質が、組換えHSV−1タンパク質であることを特徴とする請求項42に記載のワクチン。
【請求項48】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−2タンパク質をさらに含有することを特徴とする請求項47に記載のワクチン。
【請求項49】
前記組換えHSVタンパク質が、組換えHSV−2タンパク質であることを特徴とする請求項42に記載のワクチン。
【請求項50】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−1タンパク質をさらに含有することを特徴とする請求項49に記載のワクチン。
【請求項51】
対象における抗HSV免疫応答を誘発する方法であって、
前記対象に、請求項42に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項52】
前記対象に追加免疫ワクチン接種を実施するステップをさらに含み、
前記追加免疫ワクチン接種が、
(a)前記組換えHSV gDタンパク質またはその免疫原性フラグメントを含有し、
(b)前記組換えHSV gEタンパク質またはそのフラグメントを含有しない
ことを特徴とする請求項51に記載の方法。
【請求項53】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、前記追加免疫ワクチン接種において、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項52に記載の方法。
【請求項54】
対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
前記対象に、請求項42に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項55】
前記HSV感染が、HSV−1感染であることを特徴とする請求項54に記載の方法。
【請求項56】
前記HSV感染が、HSV−2感染であることを特徴とする請求項54に記載の方法。
【請求項57】
前記HSV感染が、一次HSV感染であることを特徴とする請求項54に記載の方法。
【請求項58】
前記HSV感染が、一次HSV感染後の発赤、再発、または口唇HSVであることを特徴とする請求項54に記載の方法。
【請求項59】
前記HSV感染が、HSV脳炎であることを特徴とする請求項54に記載の方法。
【請求項60】
前記HSV感染が、HSV新生児感染であることを特徴とする請求項54に記載の方法。
【請求項61】
前記対象が、HIVに感染していることを特徴とする請求項54に記載の方法。
【請求項62】
ワクチンであって、
a.組換えHSV gCタンパク質またはそのフラグメントであって、前記フラグメントは、そのC3b結合ドメイン、そのプロパージン干渉ドメイン、そのC5干渉ドメイン、または前記C3b結合ドメイン、プロパージン干渉ドメイン、もしくはC5干渉ドメインのフラグメントのいずれかを含む、組換えHSV gCタンパク質またはそのフラグメントと、
b.組換えHSV gEタンパク質またはそのフラグメントであって、前記フラグメントは、AA24−409またはそのフラグメントを含む、組換えHSV gEタンパク質またはそのフラグメントと、
c.アジュバントと
を含有することを特徴とするワクチン。
【請求項63】
前記アジュバントが、CpG含有ヌクレオチド分子、アルミニウム塩アジュバント、またはそれらの組み合わせを含むことを特徴とする請求項62に記載のワクチン。
【請求項64】
前記組換えHSV gCタンパク質またはそのフラグメントが、1用量当たり0.5〜100マイクログラムの量で存在することを特徴とする請求項62に記載のワクチン。
【請求項65】
前記組換えHSV gEタンパク質またはそのフラグメントが、1用量当たり2〜100マイクログラムの量で存在することを特徴とする請求項62に記載のワクチン。
【請求項66】
前記組換えHSVタンパク質が、組換えHSV−1タンパク質であることを特徴とする請求項62に記載のワクチン。
【請求項67】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−2タンパク質をさらに含有することを特徴とする請求項66に記載のワクチン。
【請求項68】
前記組換えHSVタンパク質が、組換えHSV−2タンパク質であることを特徴とする請求項62に記載のワクチン。
【請求項69】
gD2タンパク質、gC2タンパク質、およびgE2タンパク質から選択される組換えHSV−1タンパク質をさらに含有することを特徴とする請求項64に記載のワクチン。
【請求項70】
対象における抗HSV免疫応答を誘発する方法であって、
前記対象に、請求項62に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項71】
前記対象に追加免疫ワクチン接種を実施するステップをさらに含み、
前記追加免疫ワクチン接種が、
(a)前記組換えHSV gDタンパク質またはその免疫原性フラグメントを含有し、
(b)前記組換えHSV gEタンパク質またはそのフラグメントを含有しない
ことを特徴とする請求項70に記載の方法。
【請求項72】
前記組換えHSV gDタンパク質またはその免疫原性フラグメントが、前記追加免疫ワクチン接種において、1用量当たり2〜10マイクログラムの量で存在することを特徴とする請求項71に記載の方法。
【請求項73】
対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
前記対象に、請求項62に記載のワクチンを投与するステップを含むことを特徴とする方法。
【請求項74】
前記HSV感染が、HSV−1感染であることを特徴とする請求項73に記載の方法。
【請求項75】
前記HSV感染が、HSV−2感染であることを特徴とする請求項73に記載の方法。
【請求項76】
前記HSV感染が、一次HSV感染であることを特徴とする請求項73に記載の方法。
【請求項77】
前記HSV感染が、一次HSV感染後の発赤、再発、または口唇HSVであることを特徴とする請求項73に記載の方法。
【請求項78】
前記HSV感染が、HSV脳炎であることを特徴とする請求項73に記載の方法。
【請求項79】
前記HSV感染が、HSV新生児感染であることを特徴とする請求項73に記載の方法。
【請求項80】
前記対象が、HIVに感染していることを特徴とする請求項73に記載の方法。
【請求項81】
HIVに感染した対象におけるHSV感染を治療、抑制、阻害、または発生低減する方法であって、
a.組換えHSV gCタンパク質またはそのフラグメントであって、前記フラグメントは、そのC3b結合ドメイン、そのプロパージン干渉ドメイン、そのC5干渉ドメイン、または前記C3b結合ドメイン、プロパージン干渉ドメイン、もしくはC5干渉ドメインのフラグメントのいずれかを含む、組換えHSV gCタンパク質またはそのフラグメントと、
b.組換えHSV gEタンパク質またはそのフラグメントであって、前記フラグメントは、AA24−409またはそのフラグメントを含む、組換えHSV gEタンパク質またはそのフラグメントと、
c.アジュバントと
を含有するワクチンを前記対象に投与するステップを含むことを特徴とする方法。
【請求項82】
前記HSV感染の発生低減が、HSV感染の再発の防止を含むことを特徴とする請求項79に記載の方法。
【請求項83】
前記HSV感染の抑制が、HSV感染の再発の重症度の軽減を含むことを特徴とする請求項79に記載の方法。
【請求項84】
前記HSV感染の発生低減が、HSV感染の再発の頻度の低減を含むことを特徴とする請求項79に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20A】


【図20B】


【図21A】


【図21B】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32A】


【図32B】


【図33】


【図34A】


【図34B】


【図35A】


【図35B】


【図36A】


【図36B】


【図36C】


【図36D】


【図37】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20A】


【図20B】


【図21A】


【図21B】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32A】


【図32B】


【図33】


【図34A】


【図34B】


【図35A】


【図35B】


【図36A】


【図36B】


【図36C】


【図36D】


【図37】


【公表番号】特表2010−514767(P2010−514767A)
【公表日】平成22年5月6日(2010.5.6)
【国際特許分類】
【出願番号】特願2009−544088(P2009−544088)
【出願日】平成19年12月27日(2007.12.27)
【国際出願番号】PCT/US2007/026352
【国際公開番号】WO2008/085486
【国際公開日】平成20年7月17日(2008.7.17)
【出願人】(500429103)ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア (102)
【Fターム(参考)】
【公表日】平成22年5月6日(2010.5.6)
【国際特許分類】
【出願日】平成19年12月27日(2007.12.27)
【国際出願番号】PCT/US2007/026352
【国際公開番号】WO2008/085486
【国際公開日】平成20年7月17日(2008.7.17)
【出願人】(500429103)ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア (102)
【Fターム(参考)】
[ Back to top ]

