卵巣明細胞腺癌におけるアネキシン4の発現を増強する遺伝子領域
【課題】明細胞腺癌におけるアネキシン4遺伝子の発現調節機構を解明し、新しい抗悪性腫瘍薬の開発に役立てることができるDNAを提供する。
【解決手段】以下の(a)又は(b)のDNA。(a)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域の全部又は一部のヌクレオチド配列と同一の配列からなるDNA、(b)(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズし、かつ(a)のDNAと同等の生物学的機能を有するDNA、組換えベクター、形質転換体、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質を探索する方法も提供される。
【解決手段】以下の(a)又は(b)のDNA。(a)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域の全部又は一部のヌクレオチド配列と同一の配列からなるDNA、(b)(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズし、かつ(a)のDNAと同等の生物学的機能を有するDNA、組換えベクター、形質転換体、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質を探索する方法も提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、卵巣明細胞腺癌に特異的に発現しているタンパク質であるアネキシン4の発現に重要な遺伝子領域とその応用に関する。
【背景技術】
【0002】
最近、我が国では、上皮性卵巣癌の中でも悪性度の高い明細胞癌の罹患率が上昇しつつある。
卵巣明細胞腺癌はそれ自体が予後不良因子とされ、初期段階であっても転移再発例が存在する。上皮性卵巣癌に対する標準的化学療法はタキサン製剤とプラチナ製剤であり、その代表的なものはパクリタキセルとカルボプラチンの併用療法である。
【0003】
上皮性卵巣癌は漿液性、粘液性、類内膜、明細胞腺癌などと組織型に富む癌である。中でも、明細胞腺癌は薬剤耐性が著しく高く、発見されるのが臨床病期初期であっても予後不良例が存在する。明細胞腺癌は現在、化学療法で主に使用されているプラチナ製剤やタキサン製剤に抵抗性であり、新しい抗悪性腫瘍薬の開発が求められている。
アネキシン4(ANX4)は、アネキシンファミリータンパク質の1つのホモログであり、腎癌明細胞癌で発現が上昇すること(非特許文献1)、過剰発現するとパクリタキセル抵抗性が上昇すること(非特許文献2)が知られている。
【0004】
【非特許文献1】Cancer Letters 209(2004) 111-118
【非特許文献2】British Journal of Cancer (2000)83(1), 83-88
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、明細胞腺癌におけるアネキシン4遺伝子の発現調節機構を解明し、新しい抗悪性腫瘍薬の開発に役立てることを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、まず、卵巣明細胞癌細胞が特異的に産生するタンパク質をプロテオミクス手法を用いて探索し、アネキシン4の発現量が明細胞癌細胞中にて著しく増加していることを見出した。アネキシン4は腎癌明細胞癌で発現が上昇すること、過剰発現するとパクリタキセル抵抗性が上昇することが知られているので、アネキシン4は卵巣明細胞癌の抗癌剤抵抗性においても重要な役割を果たしている可能性が考えられた。そこで、本発明者らは、明細胞腺癌におけるアネキシン4の発現を増強する遺伝子領域をアネキシン4遺伝子の5’-非翻訳領域中に見出し、本発明を完成させるに至った。
本発明の要旨は以下の通りである。
【0007】
(1)以下の(a)又は(b)のDNA。
(a)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域の全部又は一部のヌクレオチド配列と同一の配列からなるDNA
(b)(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズし、かつ(a)のDNAと同等の生物学的機能を有するDNA
(2)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域のヌクレオチド配列が配列番号1のヌクレオチド配列である(1)記載のDNA。
【0008】
(3)(a)のDNAが、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域の全部のヌクレオチド配列と同一の配列からなるDNAである(1)又は(2)記載のDNA。
(4)(a)のDNAが、アネキシン4遺伝子の転写開始点を+1としたときに、その下流+171から+190までの領域の全部のヌクレオチド配列と同一の配列からなるDNAである(1)又は(2)記載のDNA。
(5)(a)のDNAと同等の生物学的機能が、明細胞腺癌細胞においてアネキシン4遺伝子の転写を活性化することである(1)〜(4)のいずれかに記載のDNA。
【0009】
(6)明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子が結合できる部位を含む(1)〜(5)のいずれかに記載のDNA。
(7)明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子がNF−κBである(6)記載のDNA。
(8)明細胞腺癌が卵巣明細胞腺癌である(5)〜(7)のいずれかに記載のDNA。
(9)(1)〜(8)のいずれかに記載のDNAを含有する組換えベクター。
【0010】
(10)さらにレポーター遺伝子を含有する(9)記載の組換えベクター。
(11)レポーターがルシフェラーゼである(10)記載の組換えベクター。
(12)(9)〜(11)のいずれかに記載の組換えベクターを含む形質転換体。
(13)(10)又は(11)記載の組換えベクターを導入した宿主細胞である(12)記載の形質転換体。
(14)(13)記載の形質転換体を用いて、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質を探索する方法。
【0011】
(15)明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質が、明細胞腺癌に対する予防及び/又は治療効果を奏するものである(14)記載の方法。
(16)明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質が、細胞の抗癌剤感受性を上げることができるものである(14)記載の方法。
(17)(1)記載のDNAのヌクレオチド配列の全部又は一部及びその相補鎖からなる二本鎖核酸であって、アネキシン4遺伝子の転写を活性化する因子が結合できる前記二本鎖核酸。
【0012】
(18)(1)記載のDNAのヌクレオチド配列の一部が配列番号3のヌクレオチド配列である(17)記載の二本鎖核酸。
(19)(17)記載の二本鎖核酸を含有する組成物。
(20)試薬として使用される(19)記載の組成物。
(21)医薬として使用される(19)記載の組成物。
(22)アネキシン4が関与する疾患を予防及び/又は治療するための医薬として使用される(21)記載の組成物。
【0013】
(23)アネキシン4が関与する疾患が明細胞腺癌である(22)記載の組成物。
(24)明細胞腺癌が卵巣明細胞腺癌である(23)記載の組成物。
(25)細胞の抗癌剤感受性を上げることができる薬剤として使用される(19)記載の組成物。
【発明の効果】
【0014】
本発明により、明細胞癌におけるアネキシン4遺伝子の発現に重要なプロモーターおよびエンハンサーが転写開始点(+1)の上流-1534から下流+1010の領域に含まれていることが明らかとなった。この領域を利用して、アネキシン4が関与する疾患(例えば、卵巣や腎臓における明細胞腺癌)の予防及び/又は治療薬や細胞の抗癌剤感受性を上げる薬剤の探索を行うことができる。
【発明を実施するための最良の形態】
【0015】
以下、本発明の実施の形態についてより詳細に説明する。
本発明は、以下の(a)又は(b)のDNAを提供する。
【0016】
(a)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域の全部又は一部のヌクレオチド配列と同一の配列からなるDNA
(b)(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズし、かつ(a)のDNAと同等の生物学的機能を有するDNA
(a)のDNAについて、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域のヌクレオチド配列の一例を以下に示す。この配列は、卵巣明細胞腺癌細胞株OVISE及びOVTOKOに由来する。
【0017】
5’-cgtggctatgcacccggctaattatttatttattttttgttttcttttctttttttctttctttttcttttctttcttcctctttttttttttttttttttttagacaatgtctcactctgtcgcccaggctggcgtgcagtggcgcaatctcagcttactgagcctctgcctcccgggcttgggtgtttatcccacctcatccgactgaatagctgggactacaggcgcatgccaccacacccggctatatatatgttttttttttttttttttttgagatgggatttcaccacattggccaggcttatctcgaactcctgggctaaagtgatccacttgccctggcctcccaaagtgctgggattacaggcatgagccactgtgcccagccttaattttttaagttatcatatgcagataaaagaggcagaaccagttttagtatccaaatcagtctgatcctaaaacccgtgctctaaaccatattaaaccaccttttaaaattacatcttaatgaaataatttaatgttacctctccagctttaagggtgccattaaccacttagattttgatgtgtcggatggaaaacactccccaaacgggctattctctgttttttaaaaaaactgaatttgcctatagactcaacggattcattctgcaagcattcactacgtggcgaaatcggtgctgggcatgggtgcaaagacgacctagccctagttggtgtcttcaagaggctgcgtccagcaggggaagcagatatgaaaacacagaactattacaagggatgagcgccgcgccaagccgaacctgggagctacggacagtgtctaaactttagtcactcacaggagtacaaagatccggggctgctcctaactcctactccaaagctttcctggcctgctgggcgcacagggaagagggaagtgctggaaacttttgggaatgtgtgttttcatgtgaaagaggggaatgaaatgtatccttcagatttcactttctacttttccggccacgggctcggcacgacctgccgttgggagacgaacggtttcccgaggtggggggaagcgcggatttgccgcgggactccggcttggcgcggagctgggcgcggcaggcgcagggaggaactggcgaggtggcccgggctcggccctccgagggtgtggagcgcccgggaaacgggaccccaagaatccaactgctcccaccctgcgcggccaggagcggggctggcgatactggggacactgtccaatccgggcagggggcgaggccgggggaccgggcgggcctggggagcaggcacgtgtggagggcggacccgccgggggtcgaggcctgcctctccgagagctcctggcgcggccgtcccggcccggggccccaggtgcgcttcccctagagagggattttccggtctcgtgggcagaggaacaaccaggaacttgggctcagtctccaccccacagtggggcggatccgtcccggataagacccgctgtctggccctgagtagggTGTGACCTCCGCAGCCGCAGAGGAGGAGCGCAGCCCGGCCTCGgtacgaggggtaaaggggctccgggccgggggtcctgggctcagggaacggggagcgtggcccgggagcgtctcgcggggatgcccggctccgcgctgcaccccagagtgggtgctcgccgccggcttgcgggcaagcccgggcggccacagggtggagggggccagcgggccctggactcgctccgggtgggcgagagggaggcgagcgcggtgcttaaccgctggcaccatccaggacatccagggccgcttacacggctcaggacgcgggtcagagaccacggcagttatttattcagtccatgtgctaggctttgcatcaaaaagaaaggaccgagataatcttgcctgtagctaactcctcctaacacctcttacagtttactttttaattctttactccatttaagaaacttactcctttctcctagatccttaccactttcttaccttctcgtgtgtctaatgccctcggcacagtgcccggcacatcggagtctgattattatagggtccatgacttgagttggctggtggcgcagtctcagcattttgtcatgactttgaccagctggagactttggtgccaaggaggaaggcttctcaaccatttaccggcagaagtgacccccggggcaatgcaagtcttctgagctgacagagcagagtgggtcctgcataactcgtgctttacatggaactgggcatctgctctctcctgctgacagtgggaaggatagataaggtgtccctctccaagttatccattctcctgcccaccagtccatgacaccccaccacccccttccactccctactgtttgccctttaattttttgttttgttttgttttgagacgaggtctcactcctgtagcccaggctggagtgcagtggctggatacagttcactctgcctcccaggctcaggtgtttcacccacctcaacctcctgagtagctgaga-3’(配列番号1)
大文字はエキソン1bの領域を示す。その5’末端は、MCAS、OVISE、OVTOKO細胞のアネキシン4遺伝子5’-RACE産物の末端であり、これを転写開始点(+1)とした。下線部は+171〜+190領域を示す。
【0018】
(b)のDNAについて、(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズするDNAは、配列番号1のヌクレオチド配列からなるDNAに相補的なDNAの全部又は一部と少なくとも80%(好ましくは、少なくとも95%、より好ましくは、少なくとも98%)の同一性があるとよい。ハイブリダイゼーションはストリンジェントな条件下で行われる。核酸二本鎖又はハイブリッドの安定性は、融解温度Tm(プローブが標的DNAから解離する温度)で表される。この融解温度はストリンジェントな条件を定義するために用いられる。1%のミスマッチによりTmが1℃低下すると仮定すると、ハイブリダイゼーション反応の最終洗浄の温度を低くしなければならない。例えば、プローブと95%以上の同一性を有する配列を求める場合には、最終洗浄温度を5℃低くしなければならない。実際、1%のミスマッチにつき、0.5〜1.5℃の間でTmが変わることになる。ストリンジェントな条件の例としては、5x SSC/5x デンハルト溶液/1.0% SDS中68℃でハイブリダイズさせ、0.2x SSC/0.1%SDS中室温で洗浄することである。中程度にストリンジェントな条件の例としては、3x SSC中42℃で洗浄することである。塩濃度や温度は、プローブと標的核酸との同一性の最適なレベルを達成するために変更されうる。このような条件に関するさらなる指針として、Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, N.Y.; and Ausubel et al. (eds.), 1995, Current Protocols in Molecular Biology, (John Wiley & Sons. N.Y.) at Unit 2.10を参照されたい。
【0019】
(a)のDNAは、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域の全部のヌクレオチド配列と同一の配列からなるDNAであってもよい。
アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域のヌクレオチド配列の一例を以下に示す。
【0020】
5’-ggatccgtcccggataagacccgctgtctggcccTGAGTAGGGTGTGACCTCCGCAGCCGCAGAGGAGGAGCGCAGCCCGGCCTCGgtacgaggggtaaaggggctccgggccgggggtcctgggctcagggaacggggagcgtggcccgggagcgtctcgcggggatgcccggctccgcgctgcaccccagagtgggtgctcgccgccggcttgcgggcaagcccgggcggccacagggtggagggggccagcgggccctggactcgctccgggtgggcgagagggaggcgagcgcggtgcttaaccgctggcaccatccaggacatccagggccgcttacacggctcaggacgcgggtcagagaccacggcagttatttattcagtccatgtgctaggctttgcatcaaaaagaaaggaccgagataatcttgcctgtagctaactcctcctaacacctcttacagtttactttttaattctttactccatttaagaaacttactcctttctcctagatccttaccactttcttaccttctcgtgtgtctaatgccctcggcacagtgcccggcacatcgga-3’(配列番号2)
大文字はエキソン1bの領域を示す。その5’末端は、MCAS、OVISE、OVTOKO細胞のアネキシン4遺伝子5’-RACE産物の末端であり、これを転写開始点(+1)とした。下線部は+171〜+190領域を示す。
【0021】
(a)のDNAは、アネキシン4遺伝子の転写開始点を+1としたときに、その下流+171から+190までの領域の全部のヌクレオチド配列と同一の配列からなるDNAであってもよい。
アネキシン4遺伝子の転写開始点を+1としたときに、その下流+171から+190までの領域のヌクレオチド配列の一例を以下に示す。
【0022】
5’-tgcgggcaagcccgggcggc-3’(配列番号3)
配列番号3のヌクレオチド配列は、卵巣明細胞腺癌細胞株OVISE及びOVTOKOのアネキシン4遺伝子の第1イントロン内に存在する転写開始点(+1)の下流+171〜+190の領域の配列である。この配列の相補鎖には、転写因子NF−κBのコンセンサス配列gggRNNYYcc(配列番号4)に類似の配列を含んでいる。
【0023】
(a)のDNAと同等の生物学的機能としては、明細胞腺癌細胞においてアネキシン4遺伝子の転写を活性化することを挙げることができる。
本発明のDNAは、明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子が結合できる部位を含むとよい。明細胞腺癌としては、卵巣明細胞腺癌、腎明細胞腺癌などを例示することができるが、卵巣明細胞腺癌が好ましい。明細胞腺癌細胞としては、OVTOKO、OVISE、HAC2、RMG-I、RMG-II、KK、KOC-7c、HCH-1、SMOV-2、OVAS、OVMANA、OVSAYOなどを例示することができるが、OVTOKO、OVISEが好ましい。
【0024】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子は、明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化するものであればいかなるものであってもよいが、NF−κBファミリータンパク質(具体的には、RelA(p65)、RelB、c-Rel、p50(p105/NF−κB1)、p52(p100/NF−κB2))を例示することができる。この因子が結合できる否かは、ゲルシフトアッセイ(後述の実施例1を参照)により、調べることができる。
【0025】
本発明のDNAを含むレポーターベクターを利用すれば、アネキシン4の転写を制御できる物質を探索することができる。この場合、レポーターベクターに含まれる本発明のDNAは、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域を含むことが好ましい。
【0026】
また、本発明のDNAをプロモーターとして利用すれば、明細胞腺癌細胞/組織に特異的に目的の遺伝子を発現させることができるベクターを作成することができる。例えば、本発明のDNA配列をタンパク質遺伝子のコード領域の上流に連結したプラスミドを作成すれば、明細胞腺癌細胞/組織に特異的に目的のタンパク質(例えばp53などの抗腫瘍タンパク質や緑蛍光タンパク質(GFP)など)を発現させることができる。この場合、レポーターベクターに含まれる本発明のDNAは、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域を含むことが好ましく、その上流−1534から下流+1010までの領域を含むことがより好ましい。
【0027】
本発明は、本発明のDNAを含有する組換えベクターも提供する。
本発明のDNAを含有する組換えベクターは、公知の方法(例えば、Molecular Cloning2nd Edition, J. Sambrook et al., Cold Spring Harbor Lab. Press, 1989に記載の方法)により、本発明のDNAを適当な発現ベクターに挿入することにより得られる。
【0028】
発現ベクターとしては、大腸菌由来のプラスミド(例、pBR322,pBR325,pUC12,pUC13)、枯草菌由来のプラスミド(例、pUB110,pTP5,pC194)、酵母由来プラスミド(例、pSH19,pSH15)、λファージなどのバクテリオファージ、レトロウイルス,ワクシニアウイルスなどの動物ウイルス、バキュロウイルスなどの昆虫病原ウイルスなどを用いることができる。
【0029】
発現ベクターには、プロモーター、エンハンサー、スプライシングシグナル、ポリA付加シグナル、選択マーカー、SV40複製オリジンなどを付加してもよい。
また、発現ベクターは、融合タンパク質発現ベクターであってもよい。種々の融合タンパク質発現ベクターが市販されており、pGEXシリーズ(アマシャムファルマシアバイオテク社)、pET CBD Fusion System 34b-38b(Novagen社)、pET Dsb Fusion Systems 39b and 40b(Novagen社)、pET GST Fusion System 41 and 42(Novagen社)などを例示することができる。
【0030】
本発明の組換えベクターは、さらにレポーター遺伝子を含有してもよい。レポーターとしては、発光タンパク質(例えば、ルシフェラーゼなど)、蛍光タンパク質(例えば、GFP、YFP、CFP、BFP、Venusなど)などを例示することができるが、ルシフェラーゼが汎用されていて、便利である。レポーター遺伝子は、公知の塩基配列に基づいて、常法により調製することができる。また、レポーター遺伝子を含むベクター(例えば、プロメガ社のpGL3シリーズ、pGL4シリーズなど)が市販されているので、このようなレポーターベクターに本発明のDNAを組み込んでもよい。
【0031】
本発明のDNAを含有する組換えベクターを宿主に導入することにより、形質転換体を得ることができる。
宿主としては、細菌細胞(例えば、エシェリヒア属菌、バチルス属菌、枯草菌など)、真菌細胞(例えば、酵母、アスペルギルスなど)、昆虫細胞(例えば、S2細胞、Sf細胞など)、動物細胞(例えば、CHO細胞、COS細胞、HeLa細胞、C127細胞、3T3細胞、BHK細胞、HEK293細胞など)、植物細胞などを例示することができる。また、明細胞腺癌細胞(例えば、OVTOKO、OVISE、HAC2、RMG-I、RMG-II、KK、KOC-7c、HCH-1、SMOV-2、OVAS、OVMANA、OVSAYOなど)でもよい。
【0032】
組換えベクターを宿主に導入するには、Molecular Cloning2nd Edition, J. Sambrook et al., Cold Spring Harbor Lab. Press, 1989に記載の方法(例えば、リン酸カルシウム法、DEAE-デキストラン法、トランスフェクション法、マイクロインジェクション法、リポフェクション法、エレクロトポレーション法、形質導入法、スクレープローディング法、ショットガン法など)または感染により行うことができる。
本発明のDNAとレポーター遺伝子を含有する組換えベクターを導入した宿主細胞を用いて、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質を探索することができる。
【0033】
本発明の探索方法は、例えば、以下の工程を含む。
(a)本発明のDNAとレポーター遺伝子を含有する組換えベクターを導入した宿主細胞と被験物質とを接触させる工程、
(b)前記被験物質を接触させた細胞におけるレポーター遺伝子の発現量を調べ、被験物質を接触させない細胞における発現量と比較する工程、及び
(c)(b)の比較結果に基づいて、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる被験物質を選択する工程。
【0034】
被験物質は、いかなる物質であってもよく、タンパク質、ペプチド、ビタミン、ホルモン、多糖、オリゴ糖、単糖、低分子化合物、核酸(DNA、RNA、オリゴヌクレオチド、モノヌクレオチド等)、脂質、上記以外の天然化合物、合成化合物、植物抽出物、植物抽出物の分画物、それらの混合物などを挙げることができる。
被験物質と接触させる前に、本発明のDNAとレポーター遺伝子を含有する組換えベクターを宿主細胞に導入し、培養しておくとよい。宿主細胞としては、OVTOKO、OVISE、HAC2、RMG-I、RMG-II、KK、KOC-7c、HCH-1、SMOV-2、OVAS、OVMANA、OVSAYOを例示することができ、OVTOKO細胞が好ましい。
【0035】
本発明のDNAとレポーター遺伝子を含有する組換えベクターを導入した宿主細胞と被験物質とを接触させるには、例えば、本発明のDNAとレポーター遺伝子を含有する組換えベクターを導入した宿主細胞を培養している培地に被験物質を添加すればよい。被験物質の添加量は、被験物質や宿主細胞の種類などに応じて、適宜決定すればよい。
【0036】
被験物質を接触させた細胞におけるレポーター遺伝子の発現量は、レポーター遺伝子の種類に応じた方法で調べることができる。例えば、レポーターがルシフェラーゼの場合には、本発明のDNA(転写開始点上流、少なくとも-43から+541までを含む)を連結したルシフェラーゼベクターを培養細胞に導入し、24から48時間後にタンパク質を抽出し、基質であるATPとルシフェリンを加えることで起きる発光を測定することにより、発現量を調べることができる。同様の方法で、被験物質を接触させない細胞における発現量も調べ、被験物質を接触した場合の結果と接触しない場合の結果とを比較する。この比較結果の基づき、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる被験物質を選択する。例えば、レポーターの発現が上昇している場合、被験物質は明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を増加できると判定される。レポーターの発現が低下している場合、被験物質は明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を低下させると判定できる。明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を低下させる物質は、明細胞腺癌に対する予防及び/又は治療効果を奏すること、細胞の抗癌剤感受性を上げることが期待できる。
【0037】
また、本発明は、上記の(a)又は(b)のDNAのヌクレオチド配列の全部又は一部及びその相補鎖からなる二本鎖核酸であって、アネキシン4遺伝子の転写を活性化する因子が結合できる前記二本鎖核酸も提供する。(a)及び(b)のDNAは上記の通りである。上記の(a)又は(b)のDNAのヌクレオチド配列の全部又は一部としては、配列番号3のヌクレオチド配列が好ましい。配列番号3のヌクレオチド配列は、卵巣明細胞腺癌細胞株OVISE及びOVTOKOのアネキシン4遺伝子の第1イントロン内に存在する転写開始点(+1)の下流+171〜+190の領域の配列である。この配列の相補鎖には、転写因子NF−κBのコンセンサス配列gggRNNYYcc(配列番号4)に類似の配列を含んでいる。
【0038】
本発明の二本鎖核酸は、DNA、RNA、DNAとRNAのキメラ分子のいずれであってもよい。また、本発明の二本鎖核酸は、天然型核酸のみならず、修飾核酸(例えば、トリステル結合をもつ修飾核酸、メチルホスホネート結合をもつ修飾核酸、ホスホロチオエート結合をもつ修飾核酸、ホスホロジチオエート結合をもつ修飾核酸、ホスホロアミンデート結合をもつ修飾核酸などのリン酸結合部位を修飾した修飾核酸、α−アノマー型修飾核酸、ポリアミド核酸などの糖部を修飾した修飾核酸など)も含むものである。
【0039】
本発明の二本鎖核酸のヌクレオチド数は、10〜50個が適当であり、10〜20個が好ましい。
本発明の二本鎖核酸は、公知の化学合成法又は生化学的合成法で製造することができる。例えば、市販のDNA合成装置を用いて製造することができる。
【0040】
本発明の二本鎖核酸は、アネキシン4遺伝子の転写を活性化する因子のDNA上の結合部位と同じ配列を有すると考えられるので、本発明の二本鎖核酸が核内に存在すると、アネキシン4遺伝子の転写を活性化する因子が本発明の二本鎖核酸に結合し、本来のゲノムDNA上の結合部位への結合が競合的に阻害される。その結果、アネキシン4遺伝子の発現が抑制される。従って、本発明の二本鎖核酸は、アネキシン4遺伝子の発現を抑制するための試薬又は医薬として、利用することができる。本発明の二本鎖核酸を含む医薬は、アネキシン4が関与する種々の疾患(例えば、明細胞腺癌(腎明細胞腺癌、卵巣明細胞腺癌)の予防及び/治療に用いることができる。また、アネキシン4が過剰発現すると、細胞のパクリタキセル抵抗性が上昇することが報告されている(British Journal of Cancer (2000)83(1), 83-88)ので、本発明の二本鎖核酸を含む医薬は、抗癌剤の感受性を上げるために使用することができる。
【0041】
医薬として用いる場合には、本発明の二本鎖核酸は、局所的または全身的に生体に投与される。生体への投与は、生体内に核酸を導入できる方法であればいかなる投与法によってもよい。本発明の二本鎖核酸をそれ自体あるいは薬理学上許容される賦形剤、希釈剤などと混合し、錠剤、カプセル剤、顆粒剤、散剤又はシロップ剤などにより経口的に、あるいは、注射剤、坐剤、貼付剤又は外用剤などにより非経口的に投与することができる。
【0042】
これらの製剤は、賦形剤(例えば、乳糖、白糖、葡萄糖、マンニトールのような糖類;トウモロコシデンプン、バイレショデンプン、コムギデンプンのような澱粉;炭酸カルシムム、硫酸カルシウム、炭酸水素ナトリウム、塩化ナトリウムのような無機物;結晶セルロース;カンゾウ末、ゲンチアナ末のような植物末など)、滑沢剤(例えば、ステアリン酸マグネシウム;タルク;水素添加植物油;マクロゴール;シリコーン油など)、結合剤(例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、マクロゴール、前記賦形剤と同様の化合物など)、崩壊剤(例えば、架橋ポリビニルピロリドン、寒天、アルギン酸ナトリウムなど)、乳化剤(例えば、アラビアゴム、コレステロール、ステアリン酸ポリオキシル40、セスキオレイン酸ソルビタン、ポリソルベート80、ラウリル硫酸ナトリウム、薬用セッケンなど)、保存剤(例えば、安息香酸、安息香酸ナトリウム、パラオキシ安息香酸エステル、デヒドロ酢酸、ホウ酸、クロロブタノール、ベンジルアルコールなど)、矯味剤(例えば、乳糖、白糖、ブドウ糖、マンニトールなど)、矯臭剤(例えば、芳香性精油類など)などの添加剤を用いて周知の方法で製造される。
【0043】
注射剤の製剤形態をとる場合には、注射用水、ゴマ油、ダイズ油、トウモロコシ油などの溶剤、窒素、二酸化炭素などの不活性ガス、EDTA、チオグリコール酸などのキレート剤、アスコルビン酸などの抗酸化剤、塩化ベンザルコニウム、ベンジルアルコール、パラオキシ安息香酸エステル、クロロブタノールなどの保存剤、水素添加ヒマシ油、ポリソルベートなどの界面活性剤、ベンジルアルコール、クロロブタノールなどの無痛化剤、クエン酸、酢酸、リン酸のナトリウム塩、ホウ酸などの緩衝剤、CMC-Na、ポリビニルピロリドンなどの懸濁化剤などを使用するとよい。
【0044】
あるいはまた、一般の遺伝子導入法で用いられる製剤形態(例えば、センダイウイルス等を用いた膜融合リポソーム製剤、リポフェクトアミン等のカチオン性脂質を用いる製剤、レトロウイルスやアデノウイルス等のウイルス製剤など)をとってもよい。
投与は、疾患の種類、疾病の状態の重篤度、投与方法、患者の年齢や応答性などによるが、治療の有効性が認められるまで、あるいは疾病状態の軽減が達成されるまでの期間にわたり、適当な用量、投与方法、頻度で行えばよい。例えば、成人1回あたり、有効成分の量として、約1 μg〜100 mgの投与量で、1日1回〜数回、経口投与または静注する。
【実施例】
【0045】
以下、実施例に基づいて本発明を詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
〔実施例1〕
方法
卵巣癌細胞株:卵巣明細胞腺癌細胞株OVISEおよびOVTOKO、粘液性腺癌細胞株MCASはこれらの細胞株は横浜市立大学木原生物学研究所の安光英太郎准教授により分与された。これらの細胞株は10%ウシ胎児血清を含むRPMI培地中にて培養した。
【0046】
発現解析:OVISE,OVTOKO, MCAS細胞および漿液性、粘液性、明細胞の組織型を示す卵巣癌組織検体を対象に、アネキシン4(ANX4)タンパク質およびmRNAの発現量をウエスタンブロット法およびリアルタイムRT-PCR法を用いて解析した。抗ヒトANX4抗体はサンタクルズ社から購入した。
【0047】
5’-Rapid amplification cDNA ends法: OVISE,OVTOKO, MCAS細胞から抽出した全RNAを、ANX4-RTプライマー(5’-CATGGCATTGAATCCTGAAGCAGC-3’)(配列番号5)を用いて、パワースクリプト(クロンテック社)により逆転写を行った。得られたcDNAにターミナルデオキシトランスフェラーゼ(インビトロジェン社)を用いてポリC配列を付加し、それを鋳型として、オリゴdI-dGプライマーおよびANX4-R01プライマー(5’-CTCTTGTAGGCTGTCCTGATCTCCT-3’)(配列番号6)を用いてPCRを行い、ANX4遺伝子の5’非翻訳領域を増幅した。得られたDNA断片の塩基配列を解析して転写開始点(+1)を決定した。
【0048】
レポーターベクターの作成:市販のヒトゲノムDNA(ノバジェン社)を鋳型にして、ANX4遺伝子の転写開始点上流-1534から下流+1010までの領域を、ANX4-1534Fプライマー(5'-CGTGGCTATGCACCCGGCTAA-3')(配列番号7)とANX4+1010R-BglIIプライマー(5'-TGGAAGATCTTCTCAGCTACTCAGGAGGTTGAGGTGGGT-3'(配列番号8)、下線部はBglIIサイト)を用いて、KOD-plus-DNAポリメラーゼ(東洋紡績社)により増幅し、PCR産物をBglII切断後pGL3-basicルシフェラーゼベクター(プロメガ社)のマルチクローニングサイト(MCS)内のSmaIおよびBglIIサイトに挿入した。この挿入配列をもとにStuI(-181)サイトもしくBamHI(-43)サイトを用いて、-181もしくは-43の上流または下流を欠損させた。その他の様々な3’領域欠損体はPCR法を用いて作製した。センスプライマーとしてANX4遺伝子-43領域に相当するプライマー ANX4-43F(5'-GGATCCGTCCCGGATAAGACC-3')(配列番号9)を、アンチセンスプライマーとしてBglIIサイトを付加した各3’下流域に対応するプライマー(ANX4+27R-BglII; 5'-TGGAAGATCTTCCTCCTCTGCGGCTGCGGA-3'(配列番号10)、ANX4+150R-BglII; 5'-TGGAAGATCTTCTGGGGTGCAGCGCGGAGC-3'(配列番号11)、 ANX4+282R-BglII; 5'-TGGAAGATCTTCCTGGATGGTGCCAGCGGT-3'(配列番号12)、 ANX4+397R-BglII; 5'-TGCTAGATCTAGGCAAGATTATCTCGGTCC-3'(配列番号13)、 ANX4+541R-BglII; 5'-TGGAGATCTTCCGATGTGCCGGGCACTGTG-3'(配列番号14)、 下線部はBglIIサイト)を用いてPCRを行い、pGL3-basicベクターのSmaI/BglIIサイトに挿入した。+171-+190領域の欠損体を作成するためには、-43から+541までの領域を挿入したプラスミドを鋳型にしてPCR法を用いて作製した。センスプライマーはRV-primer3(pGL3-basicのMCSの上流に対応、プロメガ社)、アンチセンスプライマーにはANX4+170-R(5'-AGCCGGCGGCGAGCACCCAC-3')(配列番号15)を用いて、KOD-plus-DNAポリメラーゼによりpGL3-basicのMCS上流域を含むANX4遺伝子+170から-43までの断片を増幅し、KpnI(MCS内)切断を行った。またANX4-191-F(5'-CACAGGGTGGAGGGGGCCAG-3')(配列番号16)とGLprimer2(pGL3-basicのMCSの下流に対応、プロメガ)を用いてMCS下流域を含むANX4遺伝子+191から+541までの断片を増幅し、BglII(MCS内)で切断した。この2つの断片をT4ポリヌクレオチドキナーゼを用いて5’リン酸化を行った後、pGL3-basicベクターのKpnI/BglIIサイトに同時に導入した。同様に、ANX4-180-Rmut(5'-CTTGgCCGCAAGCCGGCGGCGAGCACCCAC-3')(配列番号17)およびANX4-181-Fmut(5'-CgtaGGCGGCCACAGGGTGGAGGGGGCCAG-3')(配列番号18)を用いてNF-κB認識配列の変異体を作成した。
【0049】
ルシフェラーゼアッセイ:OVISE、OVTOKOおよびMCAS細胞を24穴プレートに播種し24時間培養後、各ウェルの細胞に構築したプロモーターベクターと内部標準としてpSV-・・galactosidasae controlベクター(プロメガ社)をFuGENE HD試薬(ロシュ社)を用いて導入した。48時間培養後ルシフェラーゼ活性を測定し、β-ガラクトシダーゼ活性に対して補正を行った。
【0050】
ゲルシフトアッセイ:ゲルシフトアッセイに用いる二本鎖DNAプローブは、ANX4遺伝子のNF-kappa B認識配列を含む22塩基の合成オリゴヌクレオチドとその相補鎖をアニーリングさせることにより調製した。センス鎖の配列は5’-TTGCGGGCAAGCCCGGGCGGCC-3’(配列番号19)、その変異型の配列は 5’-TTGCGGcCAAGCgtaGGCGGCC-3’(小文字は変異導入箇所を示す)(配列番号20)である。作製した二本鎖オリゴヌクレオチドの5’末端をT4ポリヌクレオチドキナーゼを用いて[γ-32P]-ATPで標識した。MCAS、OVTOKOおよびOVISE細胞から抽出した核タンパク質と32P標識プローブを25℃で反応させ、5%アクリルアミドゲルで展開後、Typhoon 9400蛍光スキャナー(GEヘルスケア)にて解析した。比較対照として転写因子SP1の22塩基対コンセンサスオリゴヌクレオチド(プロメガ社)を使用した。
【0051】
結果および考察
異なる組織型を示す様々な卵巣腫瘍組織および細胞株におけるANX4の発現量をウエスタンブロット法により比較したところ、ANX4の発現量は明細胞腺癌細胞や組織中にて増加していることが認められた(図1上左と下)。さらにこれは、mRNAレベルにおいても同様の結果が得られた(図1上右)ことから、ANX4の発現は転写レベルで制御されていることが示唆された。そこで明細胞腺癌細胞におけるANX4の転写調節機構を解析するために、まず5’-rapid amplification cDNA ends法を用いてANX4遺伝子の5’非翻訳領域(図2)を調べたところ、上記3種の細胞株では同一の転写開始点が使用されていることが明らかになった。次に転写開始点(+1)の上流約1534 bpから下流 1010 bpまでの領域を用いてプロモーターアッセイを行った。その結果、MCASと比べて2種の明細胞腺癌細胞にて非常に高い転写活性を示した(図3)。さらにそこから転写開始点上流域を欠損させた場合は、明細胞腺癌細胞とMCAS細胞の転写活性の変化の比率は相対的に同じであったが、転写開始点下流域を欠損させた場合は、MCAS細胞では変化が見られないが、2種の明細胞腺癌細胞における転写活性は著しく減少した(図4)。第1イントロン内に存在する+171〜+190の領域には転写因子NF-κBの認識配列の類似配列が存在しており(図5)、本配列を欠損もしくは変異導入することで、CCA細胞では転写活性の著しい低下が認められたが、MCAS細胞では変化は見られなかった(図6)。ゲルシフトアッセイを行った結果、転写因子SP1の結合活性は3種の細胞間で大きな差は見られなかったが、本配列と結合する核内タンパク質は明細胞腺癌細胞にのみ活性化していることが明らかになった(図7)。したがってCCAにおけるANX4の発現には+171〜+190の領域が重要なエンハンサーとして機能していると考えられる。
【産業上の利用可能性】
【0052】
本発明により、明細胞癌におけるアネキシン4遺伝子の発現に重要なプロモーターおよびエンハンサーが転写開始点(+1)の上流-1534から下流+1010の領域に含まれていることが明らかとなった。この領域を挿入したレポーターベクターを用いて、アネキシン4の転写を制御できる物質を探索することができる。アネキシン4の転写を制御できる物質は、アネキシン4が関与する疾患、例えば、明細胞腺癌の予防及び/又は治療や細胞の抗癌剤感受性を上げる薬剤として利用できる。また、前記領域に含まれる二本鎖核酸は、転写因子阻害分子(デコイオリゴヌクレオチド)として利用すれば、アネキシン4の転写を抑制することができると考えられるので、アネキシン4が関与する疾患、例えば、明細胞腺癌の予防及び/又は治療や細胞の抗癌剤感受性を上げる薬剤としての効果が期待される。
【図面の簡単な説明】
【0053】
【図1】ANX4は卵巣明細胞腺癌で発現上昇している。ANX4のタンパク質およびmRNAの発現量を調べるためにウエスタンブロッティングとリアルタイムPCR解析を行った。その結果、タンパク質レベル、mRNAレベルともに、明細胞腺癌にANX4の発現上昇が確認された。また卵巣癌患者組織検体中のANX4発現量を調べたところ明細胞腺癌組織にのみANX4が高レベルに発現していることが認められた。
【図2】ANX4遺伝子の5’-非翻訳領域。ANX4遺伝子には2種類の開始エキソンがデータベース上に存在した。卵巣癌細胞株3種を用いて、5’-RACEを行ったところ、 3種の細胞からシングルバンドが検出された。DNAシークエンス解析からこのバンドはエキソン1b含有型cDNAであることが明らかになった。エキソン1b含有型 mRNAの発現量を調べるために、エキソン1bに対応するセンスプライマーとエキソン2に対応するアンチセンスプライマーを用いてRT-PCRを行った。
【図3】ANX4遺伝子の明細胞腺癌特異的な発現上昇には、転写開始点下流域が重要である。ANX4遺伝子の転写開始点上流-1534から下流+1010塩基までの領域をpGL3-basicベクターに連結し、その5’または3’領域の欠損させた様々な変異体を作成した。各々の作成したベクターと、内部標準としてβ-ガラクトシダーゼ発現ベクターと共に3種の卵巣癌細胞株に一過的に発現させて、ルシフェラーゼアッセイを行った。相対的なルシフェラーゼ活性を、pGL3-basicベクターの活性に対する比率で示した。
【図4】ANX4遺伝子の明細胞腺癌特異的な発現上昇には、転写開始点下流+150から+282の領域が重要である。ANX4遺伝子の転写開始点から上流-43から下流+1010までの領域における様々な3’領域欠損体とβ-ガラクトシダーゼ発現ベクターを3種の卵巣癌細胞株に共発現させ、ルシフェラーゼアッセイを行った。相対的なルシフェラーゼ活性を、pGL3-basicベクターの活性に対する比率で示した。
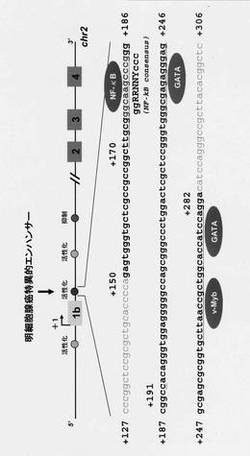
【図5】ANX4遺伝子の転写開始点下流+150から+282の領域の塩基配列。転写因子結合部位予測プログラムTFSEARCH(http://www.cbrc.jp/research/db/TFSEARCHJ.html)によって得られた結果を示す。+171〜+190領域には転写因子NF−κBの認識配列が存在した。
【図6】明細胞腺癌特異的なANX4遺伝子の発現には転写開始点下流+171から+190の領域に存在するNF−κBの認識配列が重要である。ANX4遺伝子の-43〜+541領域を挿入したベクターおよびその+171〜+190領域の欠損体とNF−κB認識配列の変異体を作成し、β-ガラクトシダーゼ発現ベクターと共に3種の卵巣癌細胞株に共発現させ、ルシフェラーゼアッセイを行った。各々の相対的な転写活性を、pGL3-basicベクターの活性に対する比率として示した。
【図7】ANX4遺伝子の+171〜+190領域に結合する転写因子は、明細胞腺癌細胞において活性化している。3種の卵巣癌細胞株から核タンパク質を抽出し、32P標識したDNAプローブと反応させた。プローブの100倍過剰量の非標識のオリゴヌクレオチド(wt)もしくはその変異型 (mut)を競合的に反応させることで、タンパク質のプローブに対する結合特異性を評価した。
【配列表フリーテキスト】
【0054】
<配列番号1>
配列番号1は、ヒトアネキシン4の転写開始点(+1)の上流-1534から+1010の領域のDNA配列を示す。
<配列番号2>
配列番号2は、ヒトアネキシン4の転写開始点(+1)の上流-43から+541の領域のDNA配列を示す。
<配列番号3>
配列番号3は、ヒトアネキシン4の転写開始点(+1)の下流+171〜+190の領域のDNA配列を示す。<配列番号4>
配列番号4は、転写因子NF−κBのコンセンサス配列を示す。
<配列番号5>
配列番号5は、ANX4-RTプライマーのDNA配列を示す。
<配列番号6>
配列番号6は、ANX4-R01プライマーのDNA配列を示す。
<配列番号7>
配列番号7は、ANX4-1534FプライマーのDNA配列を示す。
<配列番号8>
配列番号8は、ANX4+1010R-BglIIプライマーのDNA配列を示す。
<配列番号9>
配列番号9は、ANX4-43FプライマーのDNA配列を示す。
<配列番号10>
配列番号10は、ANX4+27R-BglIIプライマーのDNA配列を示す。
<配列番号11>
配列番号11は、ANX4+150R-BglIIプライマーのDNA配列を示す。
<配列番号12>
配列番号12は、ANX4+282R-BglIIプライマーのDNA配列を示す。
<配列番号13>
配列番号13は、ANX4+397R-BglIIプライマーのDNA配列を示す。
<配列番号14>
配列番号14は、ANX4+541R-BglIIプライマーのDNA配列を示す。
<配列番号15>
配列番号15は、ANX4+170-RプライマーのDNA配列を示す。
<配列番号16>
配列番号16は、ANX4-191-FプライマーのDNA配列を示す。
<配列番号17>
配列番号17は、ANX4-180-RmutプライマーのDNA配列を示す。
<配列番号18>
配列番号18は、ANX4-181-FmutプライマーのDNA配列を示す。
<配列番号19>
配列番号19は、ゲルシフトアッセイに用いた二本鎖DNAプローブのセンス鎖の配列を示す。
<配列番号20>
配列番号20は、ゲルシフトアッセイに用いた二本鎖DNAプローブのセンス鎖の変異型の配列を示す。
【技術分野】
【0001】
本発明は、卵巣明細胞腺癌に特異的に発現しているタンパク質であるアネキシン4の発現に重要な遺伝子領域とその応用に関する。
【背景技術】
【0002】
最近、我が国では、上皮性卵巣癌の中でも悪性度の高い明細胞癌の罹患率が上昇しつつある。
卵巣明細胞腺癌はそれ自体が予後不良因子とされ、初期段階であっても転移再発例が存在する。上皮性卵巣癌に対する標準的化学療法はタキサン製剤とプラチナ製剤であり、その代表的なものはパクリタキセルとカルボプラチンの併用療法である。
【0003】
上皮性卵巣癌は漿液性、粘液性、類内膜、明細胞腺癌などと組織型に富む癌である。中でも、明細胞腺癌は薬剤耐性が著しく高く、発見されるのが臨床病期初期であっても予後不良例が存在する。明細胞腺癌は現在、化学療法で主に使用されているプラチナ製剤やタキサン製剤に抵抗性であり、新しい抗悪性腫瘍薬の開発が求められている。
アネキシン4(ANX4)は、アネキシンファミリータンパク質の1つのホモログであり、腎癌明細胞癌で発現が上昇すること(非特許文献1)、過剰発現するとパクリタキセル抵抗性が上昇すること(非特許文献2)が知られている。
【0004】
【非特許文献1】Cancer Letters 209(2004) 111-118
【非特許文献2】British Journal of Cancer (2000)83(1), 83-88
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、明細胞腺癌におけるアネキシン4遺伝子の発現調節機構を解明し、新しい抗悪性腫瘍薬の開発に役立てることを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、まず、卵巣明細胞癌細胞が特異的に産生するタンパク質をプロテオミクス手法を用いて探索し、アネキシン4の発現量が明細胞癌細胞中にて著しく増加していることを見出した。アネキシン4は腎癌明細胞癌で発現が上昇すること、過剰発現するとパクリタキセル抵抗性が上昇することが知られているので、アネキシン4は卵巣明細胞癌の抗癌剤抵抗性においても重要な役割を果たしている可能性が考えられた。そこで、本発明者らは、明細胞腺癌におけるアネキシン4の発現を増強する遺伝子領域をアネキシン4遺伝子の5’-非翻訳領域中に見出し、本発明を完成させるに至った。
本発明の要旨は以下の通りである。
【0007】
(1)以下の(a)又は(b)のDNA。
(a)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域の全部又は一部のヌクレオチド配列と同一の配列からなるDNA
(b)(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズし、かつ(a)のDNAと同等の生物学的機能を有するDNA
(2)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域のヌクレオチド配列が配列番号1のヌクレオチド配列である(1)記載のDNA。
【0008】
(3)(a)のDNAが、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域の全部のヌクレオチド配列と同一の配列からなるDNAである(1)又は(2)記載のDNA。
(4)(a)のDNAが、アネキシン4遺伝子の転写開始点を+1としたときに、その下流+171から+190までの領域の全部のヌクレオチド配列と同一の配列からなるDNAである(1)又は(2)記載のDNA。
(5)(a)のDNAと同等の生物学的機能が、明細胞腺癌細胞においてアネキシン4遺伝子の転写を活性化することである(1)〜(4)のいずれかに記載のDNA。
【0009】
(6)明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子が結合できる部位を含む(1)〜(5)のいずれかに記載のDNA。
(7)明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子がNF−κBである(6)記載のDNA。
(8)明細胞腺癌が卵巣明細胞腺癌である(5)〜(7)のいずれかに記載のDNA。
(9)(1)〜(8)のいずれかに記載のDNAを含有する組換えベクター。
【0010】
(10)さらにレポーター遺伝子を含有する(9)記載の組換えベクター。
(11)レポーターがルシフェラーゼである(10)記載の組換えベクター。
(12)(9)〜(11)のいずれかに記載の組換えベクターを含む形質転換体。
(13)(10)又は(11)記載の組換えベクターを導入した宿主細胞である(12)記載の形質転換体。
(14)(13)記載の形質転換体を用いて、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質を探索する方法。
【0011】
(15)明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質が、明細胞腺癌に対する予防及び/又は治療効果を奏するものである(14)記載の方法。
(16)明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質が、細胞の抗癌剤感受性を上げることができるものである(14)記載の方法。
(17)(1)記載のDNAのヌクレオチド配列の全部又は一部及びその相補鎖からなる二本鎖核酸であって、アネキシン4遺伝子の転写を活性化する因子が結合できる前記二本鎖核酸。
【0012】
(18)(1)記載のDNAのヌクレオチド配列の一部が配列番号3のヌクレオチド配列である(17)記載の二本鎖核酸。
(19)(17)記載の二本鎖核酸を含有する組成物。
(20)試薬として使用される(19)記載の組成物。
(21)医薬として使用される(19)記載の組成物。
(22)アネキシン4が関与する疾患を予防及び/又は治療するための医薬として使用される(21)記載の組成物。
【0013】
(23)アネキシン4が関与する疾患が明細胞腺癌である(22)記載の組成物。
(24)明細胞腺癌が卵巣明細胞腺癌である(23)記載の組成物。
(25)細胞の抗癌剤感受性を上げることができる薬剤として使用される(19)記載の組成物。
【発明の効果】
【0014】
本発明により、明細胞癌におけるアネキシン4遺伝子の発現に重要なプロモーターおよびエンハンサーが転写開始点(+1)の上流-1534から下流+1010の領域に含まれていることが明らかとなった。この領域を利用して、アネキシン4が関与する疾患(例えば、卵巣や腎臓における明細胞腺癌)の予防及び/又は治療薬や細胞の抗癌剤感受性を上げる薬剤の探索を行うことができる。
【発明を実施するための最良の形態】
【0015】
以下、本発明の実施の形態についてより詳細に説明する。
本発明は、以下の(a)又は(b)のDNAを提供する。
【0016】
(a)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域の全部又は一部のヌクレオチド配列と同一の配列からなるDNA
(b)(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズし、かつ(a)のDNAと同等の生物学的機能を有するDNA
(a)のDNAについて、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域のヌクレオチド配列の一例を以下に示す。この配列は、卵巣明細胞腺癌細胞株OVISE及びOVTOKOに由来する。
【0017】
5’-cgtggctatgcacccggctaattatttatttattttttgttttcttttctttttttctttctttttcttttctttcttcctctttttttttttttttttttttagacaatgtctcactctgtcgcccaggctggcgtgcagtggcgcaatctcagcttactgagcctctgcctcccgggcttgggtgtttatcccacctcatccgactgaatagctgggactacaggcgcatgccaccacacccggctatatatatgttttttttttttttttttttgagatgggatttcaccacattggccaggcttatctcgaactcctgggctaaagtgatccacttgccctggcctcccaaagtgctgggattacaggcatgagccactgtgcccagccttaattttttaagttatcatatgcagataaaagaggcagaaccagttttagtatccaaatcagtctgatcctaaaacccgtgctctaaaccatattaaaccaccttttaaaattacatcttaatgaaataatttaatgttacctctccagctttaagggtgccattaaccacttagattttgatgtgtcggatggaaaacactccccaaacgggctattctctgttttttaaaaaaactgaatttgcctatagactcaacggattcattctgcaagcattcactacgtggcgaaatcggtgctgggcatgggtgcaaagacgacctagccctagttggtgtcttcaagaggctgcgtccagcaggggaagcagatatgaaaacacagaactattacaagggatgagcgccgcgccaagccgaacctgggagctacggacagtgtctaaactttagtcactcacaggagtacaaagatccggggctgctcctaactcctactccaaagctttcctggcctgctgggcgcacagggaagagggaagtgctggaaacttttgggaatgtgtgttttcatgtgaaagaggggaatgaaatgtatccttcagatttcactttctacttttccggccacgggctcggcacgacctgccgttgggagacgaacggtttcccgaggtggggggaagcgcggatttgccgcgggactccggcttggcgcggagctgggcgcggcaggcgcagggaggaactggcgaggtggcccgggctcggccctccgagggtgtggagcgcccgggaaacgggaccccaagaatccaactgctcccaccctgcgcggccaggagcggggctggcgatactggggacactgtccaatccgggcagggggcgaggccgggggaccgggcgggcctggggagcaggcacgtgtggagggcggacccgccgggggtcgaggcctgcctctccgagagctcctggcgcggccgtcccggcccggggccccaggtgcgcttcccctagagagggattttccggtctcgtgggcagaggaacaaccaggaacttgggctcagtctccaccccacagtggggcggatccgtcccggataagacccgctgtctggccctgagtagggTGTGACCTCCGCAGCCGCAGAGGAGGAGCGCAGCCCGGCCTCGgtacgaggggtaaaggggctccgggccgggggtcctgggctcagggaacggggagcgtggcccgggagcgtctcgcggggatgcccggctccgcgctgcaccccagagtgggtgctcgccgccggcttgcgggcaagcccgggcggccacagggtggagggggccagcgggccctggactcgctccgggtgggcgagagggaggcgagcgcggtgcttaaccgctggcaccatccaggacatccagggccgcttacacggctcaggacgcgggtcagagaccacggcagttatttattcagtccatgtgctaggctttgcatcaaaaagaaaggaccgagataatcttgcctgtagctaactcctcctaacacctcttacagtttactttttaattctttactccatttaagaaacttactcctttctcctagatccttaccactttcttaccttctcgtgtgtctaatgccctcggcacagtgcccggcacatcggagtctgattattatagggtccatgacttgagttggctggtggcgcagtctcagcattttgtcatgactttgaccagctggagactttggtgccaaggaggaaggcttctcaaccatttaccggcagaagtgacccccggggcaatgcaagtcttctgagctgacagagcagagtgggtcctgcataactcgtgctttacatggaactgggcatctgctctctcctgctgacagtgggaaggatagataaggtgtccctctccaagttatccattctcctgcccaccagtccatgacaccccaccacccccttccactccctactgtttgccctttaattttttgttttgttttgttttgagacgaggtctcactcctgtagcccaggctggagtgcagtggctggatacagttcactctgcctcccaggctcaggtgtttcacccacctcaacctcctgagtagctgaga-3’(配列番号1)
大文字はエキソン1bの領域を示す。その5’末端は、MCAS、OVISE、OVTOKO細胞のアネキシン4遺伝子5’-RACE産物の末端であり、これを転写開始点(+1)とした。下線部は+171〜+190領域を示す。
【0018】
(b)のDNAについて、(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズするDNAは、配列番号1のヌクレオチド配列からなるDNAに相補的なDNAの全部又は一部と少なくとも80%(好ましくは、少なくとも95%、より好ましくは、少なくとも98%)の同一性があるとよい。ハイブリダイゼーションはストリンジェントな条件下で行われる。核酸二本鎖又はハイブリッドの安定性は、融解温度Tm(プローブが標的DNAから解離する温度)で表される。この融解温度はストリンジェントな条件を定義するために用いられる。1%のミスマッチによりTmが1℃低下すると仮定すると、ハイブリダイゼーション反応の最終洗浄の温度を低くしなければならない。例えば、プローブと95%以上の同一性を有する配列を求める場合には、最終洗浄温度を5℃低くしなければならない。実際、1%のミスマッチにつき、0.5〜1.5℃の間でTmが変わることになる。ストリンジェントな条件の例としては、5x SSC/5x デンハルト溶液/1.0% SDS中68℃でハイブリダイズさせ、0.2x SSC/0.1%SDS中室温で洗浄することである。中程度にストリンジェントな条件の例としては、3x SSC中42℃で洗浄することである。塩濃度や温度は、プローブと標的核酸との同一性の最適なレベルを達成するために変更されうる。このような条件に関するさらなる指針として、Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, N.Y.; and Ausubel et al. (eds.), 1995, Current Protocols in Molecular Biology, (John Wiley & Sons. N.Y.) at Unit 2.10を参照されたい。
【0019】
(a)のDNAは、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域の全部のヌクレオチド配列と同一の配列からなるDNAであってもよい。
アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域のヌクレオチド配列の一例を以下に示す。
【0020】
5’-ggatccgtcccggataagacccgctgtctggcccTGAGTAGGGTGTGACCTCCGCAGCCGCAGAGGAGGAGCGCAGCCCGGCCTCGgtacgaggggtaaaggggctccgggccgggggtcctgggctcagggaacggggagcgtggcccgggagcgtctcgcggggatgcccggctccgcgctgcaccccagagtgggtgctcgccgccggcttgcgggcaagcccgggcggccacagggtggagggggccagcgggccctggactcgctccgggtgggcgagagggaggcgagcgcggtgcttaaccgctggcaccatccaggacatccagggccgcttacacggctcaggacgcgggtcagagaccacggcagttatttattcagtccatgtgctaggctttgcatcaaaaagaaaggaccgagataatcttgcctgtagctaactcctcctaacacctcttacagtttactttttaattctttactccatttaagaaacttactcctttctcctagatccttaccactttcttaccttctcgtgtgtctaatgccctcggcacagtgcccggcacatcgga-3’(配列番号2)
大文字はエキソン1bの領域を示す。その5’末端は、MCAS、OVISE、OVTOKO細胞のアネキシン4遺伝子5’-RACE産物の末端であり、これを転写開始点(+1)とした。下線部は+171〜+190領域を示す。
【0021】
(a)のDNAは、アネキシン4遺伝子の転写開始点を+1としたときに、その下流+171から+190までの領域の全部のヌクレオチド配列と同一の配列からなるDNAであってもよい。
アネキシン4遺伝子の転写開始点を+1としたときに、その下流+171から+190までの領域のヌクレオチド配列の一例を以下に示す。
【0022】
5’-tgcgggcaagcccgggcggc-3’(配列番号3)
配列番号3のヌクレオチド配列は、卵巣明細胞腺癌細胞株OVISE及びOVTOKOのアネキシン4遺伝子の第1イントロン内に存在する転写開始点(+1)の下流+171〜+190の領域の配列である。この配列の相補鎖には、転写因子NF−κBのコンセンサス配列gggRNNYYcc(配列番号4)に類似の配列を含んでいる。
【0023】
(a)のDNAと同等の生物学的機能としては、明細胞腺癌細胞においてアネキシン4遺伝子の転写を活性化することを挙げることができる。
本発明のDNAは、明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子が結合できる部位を含むとよい。明細胞腺癌としては、卵巣明細胞腺癌、腎明細胞腺癌などを例示することができるが、卵巣明細胞腺癌が好ましい。明細胞腺癌細胞としては、OVTOKO、OVISE、HAC2、RMG-I、RMG-II、KK、KOC-7c、HCH-1、SMOV-2、OVAS、OVMANA、OVSAYOなどを例示することができるが、OVTOKO、OVISEが好ましい。
【0024】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子は、明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化するものであればいかなるものであってもよいが、NF−κBファミリータンパク質(具体的には、RelA(p65)、RelB、c-Rel、p50(p105/NF−κB1)、p52(p100/NF−κB2))を例示することができる。この因子が結合できる否かは、ゲルシフトアッセイ(後述の実施例1を参照)により、調べることができる。
【0025】
本発明のDNAを含むレポーターベクターを利用すれば、アネキシン4の転写を制御できる物質を探索することができる。この場合、レポーターベクターに含まれる本発明のDNAは、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域を含むことが好ましい。
【0026】
また、本発明のDNAをプロモーターとして利用すれば、明細胞腺癌細胞/組織に特異的に目的の遺伝子を発現させることができるベクターを作成することができる。例えば、本発明のDNA配列をタンパク質遺伝子のコード領域の上流に連結したプラスミドを作成すれば、明細胞腺癌細胞/組織に特異的に目的のタンパク質(例えばp53などの抗腫瘍タンパク質や緑蛍光タンパク質(GFP)など)を発現させることができる。この場合、レポーターベクターに含まれる本発明のDNAは、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域を含むことが好ましく、その上流−1534から下流+1010までの領域を含むことがより好ましい。
【0027】
本発明は、本発明のDNAを含有する組換えベクターも提供する。
本発明のDNAを含有する組換えベクターは、公知の方法(例えば、Molecular Cloning2nd Edition, J. Sambrook et al., Cold Spring Harbor Lab. Press, 1989に記載の方法)により、本発明のDNAを適当な発現ベクターに挿入することにより得られる。
【0028】
発現ベクターとしては、大腸菌由来のプラスミド(例、pBR322,pBR325,pUC12,pUC13)、枯草菌由来のプラスミド(例、pUB110,pTP5,pC194)、酵母由来プラスミド(例、pSH19,pSH15)、λファージなどのバクテリオファージ、レトロウイルス,ワクシニアウイルスなどの動物ウイルス、バキュロウイルスなどの昆虫病原ウイルスなどを用いることができる。
【0029】
発現ベクターには、プロモーター、エンハンサー、スプライシングシグナル、ポリA付加シグナル、選択マーカー、SV40複製オリジンなどを付加してもよい。
また、発現ベクターは、融合タンパク質発現ベクターであってもよい。種々の融合タンパク質発現ベクターが市販されており、pGEXシリーズ(アマシャムファルマシアバイオテク社)、pET CBD Fusion System 34b-38b(Novagen社)、pET Dsb Fusion Systems 39b and 40b(Novagen社)、pET GST Fusion System 41 and 42(Novagen社)などを例示することができる。
【0030】
本発明の組換えベクターは、さらにレポーター遺伝子を含有してもよい。レポーターとしては、発光タンパク質(例えば、ルシフェラーゼなど)、蛍光タンパク質(例えば、GFP、YFP、CFP、BFP、Venusなど)などを例示することができるが、ルシフェラーゼが汎用されていて、便利である。レポーター遺伝子は、公知の塩基配列に基づいて、常法により調製することができる。また、レポーター遺伝子を含むベクター(例えば、プロメガ社のpGL3シリーズ、pGL4シリーズなど)が市販されているので、このようなレポーターベクターに本発明のDNAを組み込んでもよい。
【0031】
本発明のDNAを含有する組換えベクターを宿主に導入することにより、形質転換体を得ることができる。
宿主としては、細菌細胞(例えば、エシェリヒア属菌、バチルス属菌、枯草菌など)、真菌細胞(例えば、酵母、アスペルギルスなど)、昆虫細胞(例えば、S2細胞、Sf細胞など)、動物細胞(例えば、CHO細胞、COS細胞、HeLa細胞、C127細胞、3T3細胞、BHK細胞、HEK293細胞など)、植物細胞などを例示することができる。また、明細胞腺癌細胞(例えば、OVTOKO、OVISE、HAC2、RMG-I、RMG-II、KK、KOC-7c、HCH-1、SMOV-2、OVAS、OVMANA、OVSAYOなど)でもよい。
【0032】
組換えベクターを宿主に導入するには、Molecular Cloning2nd Edition, J. Sambrook et al., Cold Spring Harbor Lab. Press, 1989に記載の方法(例えば、リン酸カルシウム法、DEAE-デキストラン法、トランスフェクション法、マイクロインジェクション法、リポフェクション法、エレクロトポレーション法、形質導入法、スクレープローディング法、ショットガン法など)または感染により行うことができる。
本発明のDNAとレポーター遺伝子を含有する組換えベクターを導入した宿主細胞を用いて、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質を探索することができる。
【0033】
本発明の探索方法は、例えば、以下の工程を含む。
(a)本発明のDNAとレポーター遺伝子を含有する組換えベクターを導入した宿主細胞と被験物質とを接触させる工程、
(b)前記被験物質を接触させた細胞におけるレポーター遺伝子の発現量を調べ、被験物質を接触させない細胞における発現量と比較する工程、及び
(c)(b)の比較結果に基づいて、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる被験物質を選択する工程。
【0034】
被験物質は、いかなる物質であってもよく、タンパク質、ペプチド、ビタミン、ホルモン、多糖、オリゴ糖、単糖、低分子化合物、核酸(DNA、RNA、オリゴヌクレオチド、モノヌクレオチド等)、脂質、上記以外の天然化合物、合成化合物、植物抽出物、植物抽出物の分画物、それらの混合物などを挙げることができる。
被験物質と接触させる前に、本発明のDNAとレポーター遺伝子を含有する組換えベクターを宿主細胞に導入し、培養しておくとよい。宿主細胞としては、OVTOKO、OVISE、HAC2、RMG-I、RMG-II、KK、KOC-7c、HCH-1、SMOV-2、OVAS、OVMANA、OVSAYOを例示することができ、OVTOKO細胞が好ましい。
【0035】
本発明のDNAとレポーター遺伝子を含有する組換えベクターを導入した宿主細胞と被験物質とを接触させるには、例えば、本発明のDNAとレポーター遺伝子を含有する組換えベクターを導入した宿主細胞を培養している培地に被験物質を添加すればよい。被験物質の添加量は、被験物質や宿主細胞の種類などに応じて、適宜決定すればよい。
【0036】
被験物質を接触させた細胞におけるレポーター遺伝子の発現量は、レポーター遺伝子の種類に応じた方法で調べることができる。例えば、レポーターがルシフェラーゼの場合には、本発明のDNA(転写開始点上流、少なくとも-43から+541までを含む)を連結したルシフェラーゼベクターを培養細胞に導入し、24から48時間後にタンパク質を抽出し、基質であるATPとルシフェリンを加えることで起きる発光を測定することにより、発現量を調べることができる。同様の方法で、被験物質を接触させない細胞における発現量も調べ、被験物質を接触した場合の結果と接触しない場合の結果とを比較する。この比較結果の基づき、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる被験物質を選択する。例えば、レポーターの発現が上昇している場合、被験物質は明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を増加できると判定される。レポーターの発現が低下している場合、被験物質は明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を低下させると判定できる。明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を低下させる物質は、明細胞腺癌に対する予防及び/又は治療効果を奏すること、細胞の抗癌剤感受性を上げることが期待できる。
【0037】
また、本発明は、上記の(a)又は(b)のDNAのヌクレオチド配列の全部又は一部及びその相補鎖からなる二本鎖核酸であって、アネキシン4遺伝子の転写を活性化する因子が結合できる前記二本鎖核酸も提供する。(a)及び(b)のDNAは上記の通りである。上記の(a)又は(b)のDNAのヌクレオチド配列の全部又は一部としては、配列番号3のヌクレオチド配列が好ましい。配列番号3のヌクレオチド配列は、卵巣明細胞腺癌細胞株OVISE及びOVTOKOのアネキシン4遺伝子の第1イントロン内に存在する転写開始点(+1)の下流+171〜+190の領域の配列である。この配列の相補鎖には、転写因子NF−κBのコンセンサス配列gggRNNYYcc(配列番号4)に類似の配列を含んでいる。
【0038】
本発明の二本鎖核酸は、DNA、RNA、DNAとRNAのキメラ分子のいずれであってもよい。また、本発明の二本鎖核酸は、天然型核酸のみならず、修飾核酸(例えば、トリステル結合をもつ修飾核酸、メチルホスホネート結合をもつ修飾核酸、ホスホロチオエート結合をもつ修飾核酸、ホスホロジチオエート結合をもつ修飾核酸、ホスホロアミンデート結合をもつ修飾核酸などのリン酸結合部位を修飾した修飾核酸、α−アノマー型修飾核酸、ポリアミド核酸などの糖部を修飾した修飾核酸など)も含むものである。
【0039】
本発明の二本鎖核酸のヌクレオチド数は、10〜50個が適当であり、10〜20個が好ましい。
本発明の二本鎖核酸は、公知の化学合成法又は生化学的合成法で製造することができる。例えば、市販のDNA合成装置を用いて製造することができる。
【0040】
本発明の二本鎖核酸は、アネキシン4遺伝子の転写を活性化する因子のDNA上の結合部位と同じ配列を有すると考えられるので、本発明の二本鎖核酸が核内に存在すると、アネキシン4遺伝子の転写を活性化する因子が本発明の二本鎖核酸に結合し、本来のゲノムDNA上の結合部位への結合が競合的に阻害される。その結果、アネキシン4遺伝子の発現が抑制される。従って、本発明の二本鎖核酸は、アネキシン4遺伝子の発現を抑制するための試薬又は医薬として、利用することができる。本発明の二本鎖核酸を含む医薬は、アネキシン4が関与する種々の疾患(例えば、明細胞腺癌(腎明細胞腺癌、卵巣明細胞腺癌)の予防及び/治療に用いることができる。また、アネキシン4が過剰発現すると、細胞のパクリタキセル抵抗性が上昇することが報告されている(British Journal of Cancer (2000)83(1), 83-88)ので、本発明の二本鎖核酸を含む医薬は、抗癌剤の感受性を上げるために使用することができる。
【0041】
医薬として用いる場合には、本発明の二本鎖核酸は、局所的または全身的に生体に投与される。生体への投与は、生体内に核酸を導入できる方法であればいかなる投与法によってもよい。本発明の二本鎖核酸をそれ自体あるいは薬理学上許容される賦形剤、希釈剤などと混合し、錠剤、カプセル剤、顆粒剤、散剤又はシロップ剤などにより経口的に、あるいは、注射剤、坐剤、貼付剤又は外用剤などにより非経口的に投与することができる。
【0042】
これらの製剤は、賦形剤(例えば、乳糖、白糖、葡萄糖、マンニトールのような糖類;トウモロコシデンプン、バイレショデンプン、コムギデンプンのような澱粉;炭酸カルシムム、硫酸カルシウム、炭酸水素ナトリウム、塩化ナトリウムのような無機物;結晶セルロース;カンゾウ末、ゲンチアナ末のような植物末など)、滑沢剤(例えば、ステアリン酸マグネシウム;タルク;水素添加植物油;マクロゴール;シリコーン油など)、結合剤(例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、マクロゴール、前記賦形剤と同様の化合物など)、崩壊剤(例えば、架橋ポリビニルピロリドン、寒天、アルギン酸ナトリウムなど)、乳化剤(例えば、アラビアゴム、コレステロール、ステアリン酸ポリオキシル40、セスキオレイン酸ソルビタン、ポリソルベート80、ラウリル硫酸ナトリウム、薬用セッケンなど)、保存剤(例えば、安息香酸、安息香酸ナトリウム、パラオキシ安息香酸エステル、デヒドロ酢酸、ホウ酸、クロロブタノール、ベンジルアルコールなど)、矯味剤(例えば、乳糖、白糖、ブドウ糖、マンニトールなど)、矯臭剤(例えば、芳香性精油類など)などの添加剤を用いて周知の方法で製造される。
【0043】
注射剤の製剤形態をとる場合には、注射用水、ゴマ油、ダイズ油、トウモロコシ油などの溶剤、窒素、二酸化炭素などの不活性ガス、EDTA、チオグリコール酸などのキレート剤、アスコルビン酸などの抗酸化剤、塩化ベンザルコニウム、ベンジルアルコール、パラオキシ安息香酸エステル、クロロブタノールなどの保存剤、水素添加ヒマシ油、ポリソルベートなどの界面活性剤、ベンジルアルコール、クロロブタノールなどの無痛化剤、クエン酸、酢酸、リン酸のナトリウム塩、ホウ酸などの緩衝剤、CMC-Na、ポリビニルピロリドンなどの懸濁化剤などを使用するとよい。
【0044】
あるいはまた、一般の遺伝子導入法で用いられる製剤形態(例えば、センダイウイルス等を用いた膜融合リポソーム製剤、リポフェクトアミン等のカチオン性脂質を用いる製剤、レトロウイルスやアデノウイルス等のウイルス製剤など)をとってもよい。
投与は、疾患の種類、疾病の状態の重篤度、投与方法、患者の年齢や応答性などによるが、治療の有効性が認められるまで、あるいは疾病状態の軽減が達成されるまでの期間にわたり、適当な用量、投与方法、頻度で行えばよい。例えば、成人1回あたり、有効成分の量として、約1 μg〜100 mgの投与量で、1日1回〜数回、経口投与または静注する。
【実施例】
【0045】
以下、実施例に基づいて本発明を詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
〔実施例1〕
方法
卵巣癌細胞株:卵巣明細胞腺癌細胞株OVISEおよびOVTOKO、粘液性腺癌細胞株MCASはこれらの細胞株は横浜市立大学木原生物学研究所の安光英太郎准教授により分与された。これらの細胞株は10%ウシ胎児血清を含むRPMI培地中にて培養した。
【0046】
発現解析:OVISE,OVTOKO, MCAS細胞および漿液性、粘液性、明細胞の組織型を示す卵巣癌組織検体を対象に、アネキシン4(ANX4)タンパク質およびmRNAの発現量をウエスタンブロット法およびリアルタイムRT-PCR法を用いて解析した。抗ヒトANX4抗体はサンタクルズ社から購入した。
【0047】
5’-Rapid amplification cDNA ends法: OVISE,OVTOKO, MCAS細胞から抽出した全RNAを、ANX4-RTプライマー(5’-CATGGCATTGAATCCTGAAGCAGC-3’)(配列番号5)を用いて、パワースクリプト(クロンテック社)により逆転写を行った。得られたcDNAにターミナルデオキシトランスフェラーゼ(インビトロジェン社)を用いてポリC配列を付加し、それを鋳型として、オリゴdI-dGプライマーおよびANX4-R01プライマー(5’-CTCTTGTAGGCTGTCCTGATCTCCT-3’)(配列番号6)を用いてPCRを行い、ANX4遺伝子の5’非翻訳領域を増幅した。得られたDNA断片の塩基配列を解析して転写開始点(+1)を決定した。
【0048】
レポーターベクターの作成:市販のヒトゲノムDNA(ノバジェン社)を鋳型にして、ANX4遺伝子の転写開始点上流-1534から下流+1010までの領域を、ANX4-1534Fプライマー(5'-CGTGGCTATGCACCCGGCTAA-3')(配列番号7)とANX4+1010R-BglIIプライマー(5'-TGGAAGATCTTCTCAGCTACTCAGGAGGTTGAGGTGGGT-3'(配列番号8)、下線部はBglIIサイト)を用いて、KOD-plus-DNAポリメラーゼ(東洋紡績社)により増幅し、PCR産物をBglII切断後pGL3-basicルシフェラーゼベクター(プロメガ社)のマルチクローニングサイト(MCS)内のSmaIおよびBglIIサイトに挿入した。この挿入配列をもとにStuI(-181)サイトもしくBamHI(-43)サイトを用いて、-181もしくは-43の上流または下流を欠損させた。その他の様々な3’領域欠損体はPCR法を用いて作製した。センスプライマーとしてANX4遺伝子-43領域に相当するプライマー ANX4-43F(5'-GGATCCGTCCCGGATAAGACC-3')(配列番号9)を、アンチセンスプライマーとしてBglIIサイトを付加した各3’下流域に対応するプライマー(ANX4+27R-BglII; 5'-TGGAAGATCTTCCTCCTCTGCGGCTGCGGA-3'(配列番号10)、ANX4+150R-BglII; 5'-TGGAAGATCTTCTGGGGTGCAGCGCGGAGC-3'(配列番号11)、 ANX4+282R-BglII; 5'-TGGAAGATCTTCCTGGATGGTGCCAGCGGT-3'(配列番号12)、 ANX4+397R-BglII; 5'-TGCTAGATCTAGGCAAGATTATCTCGGTCC-3'(配列番号13)、 ANX4+541R-BglII; 5'-TGGAGATCTTCCGATGTGCCGGGCACTGTG-3'(配列番号14)、 下線部はBglIIサイト)を用いてPCRを行い、pGL3-basicベクターのSmaI/BglIIサイトに挿入した。+171-+190領域の欠損体を作成するためには、-43から+541までの領域を挿入したプラスミドを鋳型にしてPCR法を用いて作製した。センスプライマーはRV-primer3(pGL3-basicのMCSの上流に対応、プロメガ社)、アンチセンスプライマーにはANX4+170-R(5'-AGCCGGCGGCGAGCACCCAC-3')(配列番号15)を用いて、KOD-plus-DNAポリメラーゼによりpGL3-basicのMCS上流域を含むANX4遺伝子+170から-43までの断片を増幅し、KpnI(MCS内)切断を行った。またANX4-191-F(5'-CACAGGGTGGAGGGGGCCAG-3')(配列番号16)とGLprimer2(pGL3-basicのMCSの下流に対応、プロメガ)を用いてMCS下流域を含むANX4遺伝子+191から+541までの断片を増幅し、BglII(MCS内)で切断した。この2つの断片をT4ポリヌクレオチドキナーゼを用いて5’リン酸化を行った後、pGL3-basicベクターのKpnI/BglIIサイトに同時に導入した。同様に、ANX4-180-Rmut(5'-CTTGgCCGCAAGCCGGCGGCGAGCACCCAC-3')(配列番号17)およびANX4-181-Fmut(5'-CgtaGGCGGCCACAGGGTGGAGGGGGCCAG-3')(配列番号18)を用いてNF-κB認識配列の変異体を作成した。
【0049】
ルシフェラーゼアッセイ:OVISE、OVTOKOおよびMCAS細胞を24穴プレートに播種し24時間培養後、各ウェルの細胞に構築したプロモーターベクターと内部標準としてpSV-・・galactosidasae controlベクター(プロメガ社)をFuGENE HD試薬(ロシュ社)を用いて導入した。48時間培養後ルシフェラーゼ活性を測定し、β-ガラクトシダーゼ活性に対して補正を行った。
【0050】
ゲルシフトアッセイ:ゲルシフトアッセイに用いる二本鎖DNAプローブは、ANX4遺伝子のNF-kappa B認識配列を含む22塩基の合成オリゴヌクレオチドとその相補鎖をアニーリングさせることにより調製した。センス鎖の配列は5’-TTGCGGGCAAGCCCGGGCGGCC-3’(配列番号19)、その変異型の配列は 5’-TTGCGGcCAAGCgtaGGCGGCC-3’(小文字は変異導入箇所を示す)(配列番号20)である。作製した二本鎖オリゴヌクレオチドの5’末端をT4ポリヌクレオチドキナーゼを用いて[γ-32P]-ATPで標識した。MCAS、OVTOKOおよびOVISE細胞から抽出した核タンパク質と32P標識プローブを25℃で反応させ、5%アクリルアミドゲルで展開後、Typhoon 9400蛍光スキャナー(GEヘルスケア)にて解析した。比較対照として転写因子SP1の22塩基対コンセンサスオリゴヌクレオチド(プロメガ社)を使用した。
【0051】
結果および考察
異なる組織型を示す様々な卵巣腫瘍組織および細胞株におけるANX4の発現量をウエスタンブロット法により比較したところ、ANX4の発現量は明細胞腺癌細胞や組織中にて増加していることが認められた(図1上左と下)。さらにこれは、mRNAレベルにおいても同様の結果が得られた(図1上右)ことから、ANX4の発現は転写レベルで制御されていることが示唆された。そこで明細胞腺癌細胞におけるANX4の転写調節機構を解析するために、まず5’-rapid amplification cDNA ends法を用いてANX4遺伝子の5’非翻訳領域(図2)を調べたところ、上記3種の細胞株では同一の転写開始点が使用されていることが明らかになった。次に転写開始点(+1)の上流約1534 bpから下流 1010 bpまでの領域を用いてプロモーターアッセイを行った。その結果、MCASと比べて2種の明細胞腺癌細胞にて非常に高い転写活性を示した(図3)。さらにそこから転写開始点上流域を欠損させた場合は、明細胞腺癌細胞とMCAS細胞の転写活性の変化の比率は相対的に同じであったが、転写開始点下流域を欠損させた場合は、MCAS細胞では変化が見られないが、2種の明細胞腺癌細胞における転写活性は著しく減少した(図4)。第1イントロン内に存在する+171〜+190の領域には転写因子NF-κBの認識配列の類似配列が存在しており(図5)、本配列を欠損もしくは変異導入することで、CCA細胞では転写活性の著しい低下が認められたが、MCAS細胞では変化は見られなかった(図6)。ゲルシフトアッセイを行った結果、転写因子SP1の結合活性は3種の細胞間で大きな差は見られなかったが、本配列と結合する核内タンパク質は明細胞腺癌細胞にのみ活性化していることが明らかになった(図7)。したがってCCAにおけるANX4の発現には+171〜+190の領域が重要なエンハンサーとして機能していると考えられる。
【産業上の利用可能性】
【0052】
本発明により、明細胞癌におけるアネキシン4遺伝子の発現に重要なプロモーターおよびエンハンサーが転写開始点(+1)の上流-1534から下流+1010の領域に含まれていることが明らかとなった。この領域を挿入したレポーターベクターを用いて、アネキシン4の転写を制御できる物質を探索することができる。アネキシン4の転写を制御できる物質は、アネキシン4が関与する疾患、例えば、明細胞腺癌の予防及び/又は治療や細胞の抗癌剤感受性を上げる薬剤として利用できる。また、前記領域に含まれる二本鎖核酸は、転写因子阻害分子(デコイオリゴヌクレオチド)として利用すれば、アネキシン4の転写を抑制することができると考えられるので、アネキシン4が関与する疾患、例えば、明細胞腺癌の予防及び/又は治療や細胞の抗癌剤感受性を上げる薬剤としての効果が期待される。
【図面の簡単な説明】
【0053】
【図1】ANX4は卵巣明細胞腺癌で発現上昇している。ANX4のタンパク質およびmRNAの発現量を調べるためにウエスタンブロッティングとリアルタイムPCR解析を行った。その結果、タンパク質レベル、mRNAレベルともに、明細胞腺癌にANX4の発現上昇が確認された。また卵巣癌患者組織検体中のANX4発現量を調べたところ明細胞腺癌組織にのみANX4が高レベルに発現していることが認められた。
【図2】ANX4遺伝子の5’-非翻訳領域。ANX4遺伝子には2種類の開始エキソンがデータベース上に存在した。卵巣癌細胞株3種を用いて、5’-RACEを行ったところ、 3種の細胞からシングルバンドが検出された。DNAシークエンス解析からこのバンドはエキソン1b含有型cDNAであることが明らかになった。エキソン1b含有型 mRNAの発現量を調べるために、エキソン1bに対応するセンスプライマーとエキソン2に対応するアンチセンスプライマーを用いてRT-PCRを行った。
【図3】ANX4遺伝子の明細胞腺癌特異的な発現上昇には、転写開始点下流域が重要である。ANX4遺伝子の転写開始点上流-1534から下流+1010塩基までの領域をpGL3-basicベクターに連結し、その5’または3’領域の欠損させた様々な変異体を作成した。各々の作成したベクターと、内部標準としてβ-ガラクトシダーゼ発現ベクターと共に3種の卵巣癌細胞株に一過的に発現させて、ルシフェラーゼアッセイを行った。相対的なルシフェラーゼ活性を、pGL3-basicベクターの活性に対する比率で示した。
【図4】ANX4遺伝子の明細胞腺癌特異的な発現上昇には、転写開始点下流+150から+282の領域が重要である。ANX4遺伝子の転写開始点から上流-43から下流+1010までの領域における様々な3’領域欠損体とβ-ガラクトシダーゼ発現ベクターを3種の卵巣癌細胞株に共発現させ、ルシフェラーゼアッセイを行った。相対的なルシフェラーゼ活性を、pGL3-basicベクターの活性に対する比率で示した。
【図5】ANX4遺伝子の転写開始点下流+150から+282の領域の塩基配列。転写因子結合部位予測プログラムTFSEARCH(http://www.cbrc.jp/research/db/TFSEARCHJ.html)によって得られた結果を示す。+171〜+190領域には転写因子NF−κBの認識配列が存在した。
【図6】明細胞腺癌特異的なANX4遺伝子の発現には転写開始点下流+171から+190の領域に存在するNF−κBの認識配列が重要である。ANX4遺伝子の-43〜+541領域を挿入したベクターおよびその+171〜+190領域の欠損体とNF−κB認識配列の変異体を作成し、β-ガラクトシダーゼ発現ベクターと共に3種の卵巣癌細胞株に共発現させ、ルシフェラーゼアッセイを行った。各々の相対的な転写活性を、pGL3-basicベクターの活性に対する比率として示した。
【図7】ANX4遺伝子の+171〜+190領域に結合する転写因子は、明細胞腺癌細胞において活性化している。3種の卵巣癌細胞株から核タンパク質を抽出し、32P標識したDNAプローブと反応させた。プローブの100倍過剰量の非標識のオリゴヌクレオチド(wt)もしくはその変異型 (mut)を競合的に反応させることで、タンパク質のプローブに対する結合特異性を評価した。
【配列表フリーテキスト】
【0054】
<配列番号1>
配列番号1は、ヒトアネキシン4の転写開始点(+1)の上流-1534から+1010の領域のDNA配列を示す。
<配列番号2>
配列番号2は、ヒトアネキシン4の転写開始点(+1)の上流-43から+541の領域のDNA配列を示す。
<配列番号3>
配列番号3は、ヒトアネキシン4の転写開始点(+1)の下流+171〜+190の領域のDNA配列を示す。<配列番号4>
配列番号4は、転写因子NF−κBのコンセンサス配列を示す。
<配列番号5>
配列番号5は、ANX4-RTプライマーのDNA配列を示す。
<配列番号6>
配列番号6は、ANX4-R01プライマーのDNA配列を示す。
<配列番号7>
配列番号7は、ANX4-1534FプライマーのDNA配列を示す。
<配列番号8>
配列番号8は、ANX4+1010R-BglIIプライマーのDNA配列を示す。
<配列番号9>
配列番号9は、ANX4-43FプライマーのDNA配列を示す。
<配列番号10>
配列番号10は、ANX4+27R-BglIIプライマーのDNA配列を示す。
<配列番号11>
配列番号11は、ANX4+150R-BglIIプライマーのDNA配列を示す。
<配列番号12>
配列番号12は、ANX4+282R-BglIIプライマーのDNA配列を示す。
<配列番号13>
配列番号13は、ANX4+397R-BglIIプライマーのDNA配列を示す。
<配列番号14>
配列番号14は、ANX4+541R-BglIIプライマーのDNA配列を示す。
<配列番号15>
配列番号15は、ANX4+170-RプライマーのDNA配列を示す。
<配列番号16>
配列番号16は、ANX4-191-FプライマーのDNA配列を示す。
<配列番号17>
配列番号17は、ANX4-180-RmutプライマーのDNA配列を示す。
<配列番号18>
配列番号18は、ANX4-181-FmutプライマーのDNA配列を示す。
<配列番号19>
配列番号19は、ゲルシフトアッセイに用いた二本鎖DNAプローブのセンス鎖の配列を示す。
<配列番号20>
配列番号20は、ゲルシフトアッセイに用いた二本鎖DNAプローブのセンス鎖の変異型の配列を示す。
【特許請求の範囲】
【請求項1】
以下の(a)又は(b)のDNA。
(a)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域の全部又は一部のヌクレオチド配列と同一の配列からなるDNA
(b)(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズし、かつ(a)のDNAと同等の生物学的機能を有するDNA
【請求項2】
アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域のヌクレオチド配列が配列番号1のヌクレオチド配列である請求項1記載のDNA。
【請求項3】
(a)のDNAが、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域の全部のヌクレオチド配列と同一の配列からなるDNAである請求項1又は2記載のDNA。
【請求項4】
(a)のDNAが、アネキシン4遺伝子の転写開始点を+1としたときに、その下流+171から+190までの領域の全部のヌクレオチド配列と同一の配列からなるDNAである請求項1又は2記載のDNA。
【請求項5】
(a)のDNAと同等の生物学的機能が、明細胞腺癌細胞においてアネキシン4遺伝子の転写を活性化することである請求項1〜4のいずれかに記載のDNA。
【請求項6】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子が結合できる部位を含む請求項1〜5のいずれかに記載のDNA。
【請求項7】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子がNF−κBである請求項6記載のDNA。
【請求項8】
明細胞腺癌が卵巣明細胞腺癌である請求項5〜7のいずれかに記載のDNA。
【請求項9】
請求項1〜8のいずれかに記載のDNAを含有する組換えベクター。
【請求項10】
さらにレポーター遺伝子を含有する請求項9記載の組換えベクター。
【請求項11】
レポーターがルシフェラーゼである請求項10記載の組換えベクター。
【請求項12】
請求項9〜11のいずれかに記載の組換えベクターを含む形質転換体。
【請求項13】
請求項10又は11記載の組換えベクターを導入した宿主細胞である請求項12記載の形質転換体。
【請求項14】
請求項13記載の形質転換体を用いて、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質を探索する方法。
【請求項15】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質が、明細胞腺癌に対する予防及び/又は治療効果を奏するものである請求項14記載の方法。
【請求項16】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質が、細胞の抗癌剤感受性を上げることができるものである請求項14記載の方法。
【請求項17】
請求項1記載のDNAのヌクレオチド配列の全部又は一部及びその相補鎖からなる二本鎖核酸であって、アネキシン4遺伝子の転写を活性化する因子が結合できる前記二本鎖核酸。
【請求項18】
請求項1記載のDNAのヌクレオチド配列の一部が配列番号3のヌクレオチド配列である請求項17記載の二本鎖核酸。
【請求項19】
請求項17記載の二本鎖核酸を含有する組成物。
【請求項20】
試薬として使用される請求項19記載の組成物。
【請求項21】
医薬として使用される請求項19記載の組成物。
【請求項22】
アネキシン4が関与する疾患を予防及び/又は治療するための医薬として使用される請求項21記載の組成物。
【請求項23】
アネキシン4が関与する疾患が明細胞腺癌である請求項22記載の組成物。
【請求項24】
明細胞腺癌が卵巣明細胞腺癌である請求項23記載の組成物。
【請求項25】
細胞の抗癌剤感受性を上げることができる薬剤として使用される請求項19記載の組成物。
【請求項1】
以下の(a)又は(b)のDNA。
(a)アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域の全部又は一部のヌクレオチド配列と同一の配列からなるDNA
(b)(a)のDNAに相補的なDNAとストリンジェントな条件下でハイブリダイズし、かつ(a)のDNAと同等の生物学的機能を有するDNA
【請求項2】
アネキシン4遺伝子の転写開始点を+1としたときに、その上流−1534から下流+1010までの領域のヌクレオチド配列が配列番号1のヌクレオチド配列である請求項1記載のDNA。
【請求項3】
(a)のDNAが、アネキシン4遺伝子の転写開始点を+1としたときに、その上流−43から下流+541までの領域の全部のヌクレオチド配列と同一の配列からなるDNAである請求項1又は2記載のDNA。
【請求項4】
(a)のDNAが、アネキシン4遺伝子の転写開始点を+1としたときに、その下流+171から+190までの領域の全部のヌクレオチド配列と同一の配列からなるDNAである請求項1又は2記載のDNA。
【請求項5】
(a)のDNAと同等の生物学的機能が、明細胞腺癌細胞においてアネキシン4遺伝子の転写を活性化することである請求項1〜4のいずれかに記載のDNA。
【請求項6】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子が結合できる部位を含む請求項1〜5のいずれかに記載のDNA。
【請求項7】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写を活性化する因子がNF−κBである請求項6記載のDNA。
【請求項8】
明細胞腺癌が卵巣明細胞腺癌である請求項5〜7のいずれかに記載のDNA。
【請求項9】
請求項1〜8のいずれかに記載のDNAを含有する組換えベクター。
【請求項10】
さらにレポーター遺伝子を含有する請求項9記載の組換えベクター。
【請求項11】
レポーターがルシフェラーゼである請求項10記載の組換えベクター。
【請求項12】
請求項9〜11のいずれかに記載の組換えベクターを含む形質転換体。
【請求項13】
請求項10又は11記載の組換えベクターを導入した宿主細胞である請求項12記載の形質転換体。
【請求項14】
請求項13記載の形質転換体を用いて、明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質を探索する方法。
【請求項15】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質が、明細胞腺癌に対する予防及び/又は治療効果を奏するものである請求項14記載の方法。
【請求項16】
明細胞腺癌細胞におけるアネキシン4遺伝子の転写活性を制御できる物質が、細胞の抗癌剤感受性を上げることができるものである請求項14記載の方法。
【請求項17】
請求項1記載のDNAのヌクレオチド配列の全部又は一部及びその相補鎖からなる二本鎖核酸であって、アネキシン4遺伝子の転写を活性化する因子が結合できる前記二本鎖核酸。
【請求項18】
請求項1記載のDNAのヌクレオチド配列の一部が配列番号3のヌクレオチド配列である請求項17記載の二本鎖核酸。
【請求項19】
請求項17記載の二本鎖核酸を含有する組成物。
【請求項20】
試薬として使用される請求項19記載の組成物。
【請求項21】
医薬として使用される請求項19記載の組成物。
【請求項22】
アネキシン4が関与する疾患を予防及び/又は治療するための医薬として使用される請求項21記載の組成物。
【請求項23】
アネキシン4が関与する疾患が明細胞腺癌である請求項22記載の組成物。
【請求項24】
明細胞腺癌が卵巣明細胞腺癌である請求項23記載の組成物。
【請求項25】
細胞の抗癌剤感受性を上げることができる薬剤として使用される請求項19記載の組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2009−131162(P2009−131162A)
【公開日】平成21年6月18日(2009.6.18)
【国際特許分類】
【出願番号】特願2007−308256(P2007−308256)
【出願日】平成19年11月29日(2007.11.29)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度文部科学省都市エリア産学官連携促進事業新技術システムを用いた疾患細胞動態プロテオミクスの応用 産業活力再生特別措置法第30条の適用を受けるもの
【出願人】(505155528)公立大学法人横浜市立大学 (101)
【Fターム(参考)】
【公開日】平成21年6月18日(2009.6.18)
【国際特許分類】
【出願日】平成19年11月29日(2007.11.29)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度文部科学省都市エリア産学官連携促進事業新技術システムを用いた疾患細胞動態プロテオミクスの応用 産業活力再生特別措置法第30条の適用を受けるもの
【出願人】(505155528)公立大学法人横浜市立大学 (101)
【Fターム(参考)】
[ Back to top ]

