卵黄からのIgY精製方法
【課題】鳥類などの卵黄からの高精製度でのIgY精製方法を提供する。
【解決手段】卵黄溶液からIgYを分離精製するにあたり、脂質及びリポタンパク質を除去するための前処理工程として、卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程を設けることを特徴とする。さらに、硫酸アンモニウムを終濃度40%になるように加えて遠心し、二層分離させ、その上層部を回収し、当該上層部から高精製度でIgYを分離することができる。
【解決手段】卵黄溶液からIgYを分離精製するにあたり、脂質及びリポタンパク質を除去するための前処理工程として、卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程を設けることを特徴とする。さらに、硫酸アンモニウムを終濃度40%になるように加えて遠心し、二層分離させ、その上層部を回収し、当該上層部から高精製度でIgYを分離することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、鳥類、は虫類などの卵黄からIgYを精製する方法に関する。
【背景技術】
【0002】
生体防御機構の一つである抗体は通常、抗原を動物に免疫することにより作製され、その強い特異性から研究や臨床検査分野にて広く利用されている。IgYは鳥類、両生類、爬虫類などの血清中に含まれる抗体の一種であり、哺乳類の血清中に含まれるIgGと同様の機能を持ち、中でも鳥類の抗体多様性は、哺乳類の抗体にも劣らない。
鳥類IgYの優れた特徴としては、以下の点が挙げられる(非特許文献1)。
(1)哺乳動物とのホモロジーが低いため、これまで哺乳類のホストでは作製が難しかった抗体も作製できる可能性が高い。
(2)IgYはFcドメインを持たないため、細胞表面のFc受容体と結合せず、非特異的反応が起きない。
(3)哺乳類の補体系を活性化しない。
(4)哺乳類血中のリューマチ因子と結合しない。
(5)哺乳類IgGと交差反応がない。
(6)Protein A、Gと反応しないため、Protein A、Gを利用したELISA測定が可能である。
【0003】
また鳥類のIgY抗体は、親鳥が獲得免疫を子孫に伝えるための移行抗体であるため、選択的に卵黄に移行する。一般的な抗体(免疫グロブリン)の採取源である哺乳類の場合、抗体を得るためには、免疫動物の体液(主に血液)から回収するしかなく、大量に得るには免疫動物の負担が大きく、また採血操作は煩雑である。対して鳥類では、卵から高収量での抗体回収が可能であり、一旦親和性の高いIgYが作製されれば、卵から継続的かつ同ロットのIgYが回収できるというメリットがある。
【0004】
しかしながら、卵黄には多くの脂肪が含まれているので、その中から目的であるIgYのみを精製することは容易ではない。
高純度のIgYを得る方法として、ピロリン酸又はメタリン酸の金属塩を固定化材料とする吸着カラムを用いる方法が知られている(特許文献1)が、当該固定化相を作製するためには専用の高温設備が必要であり、煩雑で長時間を要し、簡便な方法とはいえない。
従来の卵黄からのIgY精製には、一般に長時間を要し、簡便な精製法の場合は、得られる精製度もそれほど高くはない(非特許文献2)。
卵黄からIgYを精製する際には、脂質及びリポタンパク質の除去が第一段階となる。脂質及びリポタンパク質の除去方法としては、有機溶媒、各種多糖類、ポリエチレングリコールを用いる方法が報告されている(特許文献2、非特許文献3〜5など)。しかし、有機溶媒を用いた場合には生体物質であるIgYが変性する可能性が高い(特許文献2)。
多糖類としてはデキストランサルフェートがよく使用され、「デキストランサルフェート法」とも呼ばれている(非特許文献4、6)が、デキストランサルフェートは非常に高価である。最も安価な除去方法として、「Akita法」と呼ばれる精製水により卵黄を希釈し除去する方法がある(非特許文献5)が、卵黄に対する必要な精製水の量が多いため、大量の卵黄を扱うには取扱いが煩雑で長時間を要する。
ポリエチレングリコールを使用する方法としては、溶液中のポリエチレングリコールの濃度が低い条件で脂質を除去し、その後さらにポリエチレングリコールを加えることで狭雑タンパク質を除去しIgYを精製するという方法が知られている(非特許文献6、7)が、この方法では精製度が高いものは得られない。
以上のことから、鳥類などの卵黄から簡便で安価に、かつ、高い精製度でIgY抗体を工業的レベルで高収量で得る方法の開発が望まれていた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平9−239203号公報
【特許文献2】特開2003−212898号公報
【非特許文献】
【0006】
【非特許文献3】Johan Stalberg et al. Upsala J Med Sci. 2001 106:99-110.
【非特許文献4】K.Y.Ko et al. Poultry Science 2007 86:400-407
【非特許文献1】Wei-Wei Zhang Drug Discovery tody 2003:
【非特許文献7】A. Michael et al. Indian J Sci Technol. 2010 3:468-474
【非特許文献2】F. Javier et al. J. Agric. Food Chem. 2010 58:187-193
【非特許文献5】E.M. Akita et al. J. Immuno. Methods. 1993 160:207-214
【非特許文献6】G.Bizhanov et al. Scand. J. Lab. Anim. Sci. 2004 31:121-130
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の課題は、鳥類など卵黄から、簡便かつ迅速に高精製度のIgY抗体を高収量で精製する手法に関するものである。
【課題を解決するための手段】
【0008】
本発明者等は、従来のIgY精製法を詳細に検討したところ、精製に要する時間が長くかかる欠点も、精製度が低いという欠点のいずれもIgYを特異的に分離するにプロセスに起因するのではないか、という推論をたて、分離プロセスについて鋭意研究を重ねた結果、従来のIgY精製法を飛躍的に改善する基本プロトコールを開発するに至った。
すなわち、本発明は、卵黄からのIgY精製に関する基本プロトコールに係るものであり、具体的には、卵黄成分を分離する薬剤を効率的に組み合わせる工程を加えることにより、IgYが高精度で分離されるだけでなく、より短時間に簡便な作業で高収量の精製が可能であるとの知見を得ることができた。そして、さらに研究を進め、分離物質として特にポリエチレングリコール(PEG)と硫酸アンモニウムを組み合わせた場合には、精製効率が、他の精製法と比較して全く予想外に飛躍的に高まることを見いだした。
以上の方法により、高精製度でIgYを高収量に精製可能であることを確認し、本発明を完成させた。
【0009】
本発明は以下のとおりである。
〔1〕 卵黄溶液からIgYを分離精製するにあたり、脂質及びリポタンパク質を除去するための前処理工程として、卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程を設けることを特徴とする、卵黄溶液からIgYを分離精製する方法。
〔2〕 前記ポリエチレングリコールとして、ポリエチレングリコール粉末をリン酸緩衝液に溶解して40〜60%のポリエチレングリコール溶液に調整したものを用いることを特徴とする、前記〔1〕に記載の方法。
〔3〕 卵黄溶液からIgYを分離精製する方法であって、下記の(1)及び(2)の工程を含む方法;
(1)卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程、
(2)硫酸アンモニウムを終濃度40%になるように加えて遠心し、二層分離させ、その上層部を回収する工程。
〔4〕
工程(1)で用いるポリエチレングリコールとして、ポリエチレングリコール粉末をリン酸緩衝液に溶解して40〜60%のポリエチレングリコール溶液に調整したものを用いることを特徴とする、請求項3に記載の方法。
【発明の効果】
【0010】
本発明のIgY精製法によれば、従来困難であった卵黄からの極めて高精製度IgY精製が簡便に行えるようになる。また、本法によれば、従来法と比較して、分離用の薬剤が少量ですみ、大量の水で希釈する必要もないため、最終的な精製物が高濃度で得られる。したがって、IgY抗体を極めて効率的、かつ短時間、安価に提供でき、これらを通じて医薬あるいは化粧品その他の分野において大いに貢献できる。
【図面の簡単な説明】
【0011】
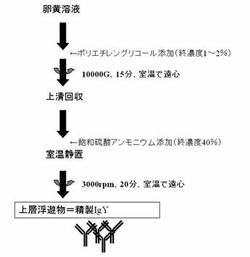
【図1】効率的IgY精製のプロトコール。
【図2】IgY精製の過程のSDSポアリクリルアミドゲル解析。 図中の記号は以下の通りである。(M:分子量マーカー)レーン1〜3:本発明1:ポリエチレングリコール(分子量6000)を添加し遠心した後の上清2:1に飽和硫酸アンモニウム液を添加し遠心した後の上層(精製IgY)3:1に飽和硫酸アンモニウム液を添加し遠心した後の下層レーン4,5:比較例(Akita法)4:蒸留水で懸濁し遠心した後の上清5:4に飽和硫酸アンモニウム液を添加し遠心した後の沈殿物(精製IgY)レーン6,7:比較例(デキストランサルフェート法)6:デキストラン硫酸を添加し遠心した後の上清7:6に飽和硫酸アンモニウム液を添加し遠心した後の沈殿物(精製IgY)
【図3】各種精製法によるIgYの収量、精製度の比較。(A)IgY回収量の比較(B)IgY精製度の比較
【発明を実施するための形態】
【0012】
1.本発明のIgY抗体の採取源と免疫法
本発明のIgY精製法は、ニワトリ、アヒル、ダチョウなどの鳥類のみならず爬虫類、両生類など、IgY抗体を産生する動物由来の卵黄からのIgY精製に適用できる。
鳥類の卵黄中には、親鳥が自然に獲得した免疫からの移行抗体としてのIgYをもともと大量に含んでいるため、特別な免疫を行わなくてもIgYを採取できる。細菌、ウイルスなど各種の抗原に対するIgYを大量に取得する目的であれば、当該特定抗原による免疫は必要となる。その場合、産卵する親鳥に対して注射または経口投与などにより人工的に1〜2週間ごとに数回過免疫することで、最初の免疫から約30〜45日後には、産卵された卵の卵黄中に特定抗原に対する抗体(IgY)が大量に産生される。
【0013】
2.本発明のIgY精製法
以下、本発明のIgY精製法を、典型的な鳥類卵黄であるニワトリ卵黄の場合について、具体的に説明する。
(1)ニワトリ卵黄溶液の調整
本発明において、「卵黄溶液」というとき、卵白及び卵黄表面の薄膜が除去され、かつ緩衝液を含み均一な状態の卵黄水溶液を指す。
例えば、ニワトリ卵から、卵白を可能な限り取り除き、卵黄のみを回収し、この卵黄に20mMリン酸バッファー(pH7.5)を加え、バッファー内で卵黄を包む薄膜を取り除き、攪拌子で均一な溶液になるまで攪拌する。
【0014】
(2)脂質及びリポタンパク質の除去方法
本発明における脂質及びリポタンパク質の除去方法は、卵黄溶液に、40〜60%ポリエチレングリコールを含有させたリン酸緩衝溶液を、ポリエチレングリコールの最終濃度が1〜2%、好ましくは1%になるように加え、均一溶液を得る。次いで、遠心分離後上清を回収する。加えるポリエチレングリコールの分子量は4000〜8000が好ましく、6000が最も望ましい。
具体的には、上記(1)で得られた卵黄溶液に、50%ポリエチレングリコール(分子量6000)を含む20mMリン酸バッファーをポリエチレングリコールの最終濃度が1〜2%になるように加え、20分間、常温(約25℃)で攪拌する。次いで、卵黄のポリエチレングリコール溶液を遠心分離して、上清を回収する。
【0015】
(3)精製IgYの回収
上記(2)で得られた上清に対し、飽和硫酸アンモニウム液を少量ずつ40%飽和溶液になるまで添加し攪拌後、室温で1時間静置する。静置後の溶液を遠心分離し、二層分離した溶液の上層部を最終精製IgYとして回収する。
このままでも極めて高い純度で得られているが、さらに高純度に精製する場合は、イオン交換体やゲルろ過などの周知の精製方法が適用でき、特に特定抗原に対する抗体を得たい場合は、アフィニティー精製法などを用いればよい。
以下に実施例を示し、本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
【実施例】
【0016】
(実施例1)卵黄溶液の調製
卵白を除去した卵黄をキムタオル上でゆっくりと転がし、卵黄表面上に残っている付着物を除去した後、卵黄をビーカーに入れ、卵黄重量を測定した卵黄(1個あたり約16g)。卵黄1個に対して4倍容量の20mM リン酸ナトリウムバッファー(pH7.5)を加え、ピンセットを使用して卵黄を包む薄膜を丁寧に取り除き、攪拌子を入れ、均一な溶液になるまで常温で攪拌し、1個分の卵黄16gを含有する80mLの卵黄溶液を得た。
【0017】
(実施例2)ポリエチレングリコールによる脂質・リポタンパク質の除去
得られた卵黄溶液80mLに対し、50%ポリエチレングリコール(分子量6000)液を終濃度1%になるように加え、20分間、常温で泡立たないよう攪拌し、攪拌した卵黄溶液約82mLを遠心分離(10000G、25分、室温)して、上清と沈殿物に分離させ上清部分を回収した(約70mL)。
【0018】
(実施例3)飽和硫酸アンモニウム液によるIgYの回収
回収した上清約70mLに、飽和硫酸アンモニウム液を少量ずつ40%飽和溶液になるまで添加し攪拌後、室温で1時間静置する。静置後の溶液を遠心分離(3000rpm、20分、室温)し、二層分離した上層部を精製IgYとして得た。卵1個の卵黄から得られたIgY量は116.2mg(回収率19.9%、精製度96%)であった。
【0019】
(比較例1)Akita法を用いたIgYの回収
比較として、脂質及びリポタンパク質の除去工程を、本発明のポリエチレングリコール処理(実施例2)に代えて、Akita法(非特許文献5)に従って大量の蒸留水処理を行った。
実施例1と同様の処理をした1個分の卵黄(約16g)に7倍容量の蒸留水を加え懸濁したのち、1晩静置したものを次の日遠心した。その上清を回収して、実施例3と同様の手法でアンモニウムサルフェートを添加し、1時間静置後の溶液を遠心し、沈殿物をIgY精製物(最終回収物)として回収した。
【0020】
(比較例2)デキストランサルフェート法を用いたIgYの回収
比較として、脂質及びリポタンパク質の除去工程を、本発明のポリエチレングリコール処理(実施例2)に代えて、デキストランサルフェート法(非特許文献4)に従ってデキストランサルフェート処理を行った。
実施例1と同様の処理をした1個分の卵黄(約16g)を3倍容量のTBS緩衝液{20mMトリス塩酸(pH7.5)、0.15M NaCl}で懸濁したのち、10%デキストランサルフェート溶液を1%濃度になるよう加え、さらに塩化カルシウム溶液を120mMになるよう加え攪拌後、1時間静置したものを遠心した。その上清を回収して、実施例3と同様の手法でアンモニウムサルフェートを添加し、1時間静置後の溶液を遠心し、沈殿物をIgY精製物(最終回収物)として回収した。
【0021】
(実施例4)IgYの回収量・純度の比較
得られたIgYの精製度を確認するため、SDSポリアクリルアミドゲル電気泳動を行った。まず、実施例3で調製したIgY 1μg分を等量のサンプルバッファー{0.125Mトリス塩酸バッファー(pH6.8)、10%メルカプトエタノール、4%SDS、20%グリセロール、0.01%ブロモフェノルブルー}と混合し、95℃、5分加熱処理した後、5〜20%SDSポリアクリルアミドグラジエントゲル{スーパーセップエース、Wako}にアプライし、20mA、80分の定電流で泳動した。泳動後のゲルを蒸留水に浸し30分洗浄した後、蒸留水を廃棄し、タンパク質染色液であるBio−Safe Coomacie {Bio−Rad社}を30ml加え1時間染色した。染色後、染色液を廃棄し、蒸留水を300ml加え、洗浄した。洗浄は、蒸留水を3回交換して2時間行った。また、回収したIgYはQuick Startプロテインアッセイ{Bio−Rad社}を用いて、キットに添付された説明書に従い求めた。
【0022】
電気泳動後、染色したゲルを図2に示す。
図2において、本発明における、ポリエチレングリコールを添加し遠心した後の上清(レーン1)、さらに飽和硫酸アンモニウム液を添加し遠心した後の上層(レーン2)及び下層(レーン3)の電気泳動を示す。また、比較例1(レーン4,5)及び比較例2(レーン6,7)で得られた分離物も同時に電気泳動した。各精製法におけるIgY精製物(最終回収物)は、卵黄 1/150,000個分から得られた最終産物に相当する。
【0023】
以上の結果、蒸留水のみで懸濁し遠心した上清(レーン番号4)よりも、ポリエチレングリコールを添加し遠心した上清(レーン番号1)のほうが狭雑タンパク質が除かれており、精製IgYも高精製であることが判る。また最終的に得られたIgYの量(矢印で示したバンド)は、各精製方法でほぼ同量であることが判る。
これらの各スポットを切り出してそれぞれの量を測定し、本発明と、上記各比較例を下記の(表1)としてまとめた。さらに、図3として(A)回収量、(B)精製度を図示した。
【0024】
【表1】

【0025】
これらの結果によると、回収量はAkita法を脂質及びリポタンパク質の除去のための前処理として用いた比較例1が最も高かったが、精製度は本発明の最終回収物には及ばない。本発明は、前処理として高価なデキストランサルフェートを用いるデキストランサルフェート法を用いた比較例2と同等程度の精製度が得られ、安価でかつ簡便に高精製度が得られることが確認できた。
【技術分野】
【0001】
本発明は、鳥類、は虫類などの卵黄からIgYを精製する方法に関する。
【背景技術】
【0002】
生体防御機構の一つである抗体は通常、抗原を動物に免疫することにより作製され、その強い特異性から研究や臨床検査分野にて広く利用されている。IgYは鳥類、両生類、爬虫類などの血清中に含まれる抗体の一種であり、哺乳類の血清中に含まれるIgGと同様の機能を持ち、中でも鳥類の抗体多様性は、哺乳類の抗体にも劣らない。
鳥類IgYの優れた特徴としては、以下の点が挙げられる(非特許文献1)。
(1)哺乳動物とのホモロジーが低いため、これまで哺乳類のホストでは作製が難しかった抗体も作製できる可能性が高い。
(2)IgYはFcドメインを持たないため、細胞表面のFc受容体と結合せず、非特異的反応が起きない。
(3)哺乳類の補体系を活性化しない。
(4)哺乳類血中のリューマチ因子と結合しない。
(5)哺乳類IgGと交差反応がない。
(6)Protein A、Gと反応しないため、Protein A、Gを利用したELISA測定が可能である。
【0003】
また鳥類のIgY抗体は、親鳥が獲得免疫を子孫に伝えるための移行抗体であるため、選択的に卵黄に移行する。一般的な抗体(免疫グロブリン)の採取源である哺乳類の場合、抗体を得るためには、免疫動物の体液(主に血液)から回収するしかなく、大量に得るには免疫動物の負担が大きく、また採血操作は煩雑である。対して鳥類では、卵から高収量での抗体回収が可能であり、一旦親和性の高いIgYが作製されれば、卵から継続的かつ同ロットのIgYが回収できるというメリットがある。
【0004】
しかしながら、卵黄には多くの脂肪が含まれているので、その中から目的であるIgYのみを精製することは容易ではない。
高純度のIgYを得る方法として、ピロリン酸又はメタリン酸の金属塩を固定化材料とする吸着カラムを用いる方法が知られている(特許文献1)が、当該固定化相を作製するためには専用の高温設備が必要であり、煩雑で長時間を要し、簡便な方法とはいえない。
従来の卵黄からのIgY精製には、一般に長時間を要し、簡便な精製法の場合は、得られる精製度もそれほど高くはない(非特許文献2)。
卵黄からIgYを精製する際には、脂質及びリポタンパク質の除去が第一段階となる。脂質及びリポタンパク質の除去方法としては、有機溶媒、各種多糖類、ポリエチレングリコールを用いる方法が報告されている(特許文献2、非特許文献3〜5など)。しかし、有機溶媒を用いた場合には生体物質であるIgYが変性する可能性が高い(特許文献2)。
多糖類としてはデキストランサルフェートがよく使用され、「デキストランサルフェート法」とも呼ばれている(非特許文献4、6)が、デキストランサルフェートは非常に高価である。最も安価な除去方法として、「Akita法」と呼ばれる精製水により卵黄を希釈し除去する方法がある(非特許文献5)が、卵黄に対する必要な精製水の量が多いため、大量の卵黄を扱うには取扱いが煩雑で長時間を要する。
ポリエチレングリコールを使用する方法としては、溶液中のポリエチレングリコールの濃度が低い条件で脂質を除去し、その後さらにポリエチレングリコールを加えることで狭雑タンパク質を除去しIgYを精製するという方法が知られている(非特許文献6、7)が、この方法では精製度が高いものは得られない。
以上のことから、鳥類などの卵黄から簡便で安価に、かつ、高い精製度でIgY抗体を工業的レベルで高収量で得る方法の開発が望まれていた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平9−239203号公報
【特許文献2】特開2003−212898号公報
【非特許文献】
【0006】
【非特許文献3】Johan Stalberg et al. Upsala J Med Sci. 2001 106:99-110.
【非特許文献4】K.Y.Ko et al. Poultry Science 2007 86:400-407
【非特許文献1】Wei-Wei Zhang Drug Discovery tody 2003:
【非特許文献7】A. Michael et al. Indian J Sci Technol. 2010 3:468-474
【非特許文献2】F. Javier et al. J. Agric. Food Chem. 2010 58:187-193
【非特許文献5】E.M. Akita et al. J. Immuno. Methods. 1993 160:207-214
【非特許文献6】G.Bizhanov et al. Scand. J. Lab. Anim. Sci. 2004 31:121-130
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の課題は、鳥類など卵黄から、簡便かつ迅速に高精製度のIgY抗体を高収量で精製する手法に関するものである。
【課題を解決するための手段】
【0008】
本発明者等は、従来のIgY精製法を詳細に検討したところ、精製に要する時間が長くかかる欠点も、精製度が低いという欠点のいずれもIgYを特異的に分離するにプロセスに起因するのではないか、という推論をたて、分離プロセスについて鋭意研究を重ねた結果、従来のIgY精製法を飛躍的に改善する基本プロトコールを開発するに至った。
すなわち、本発明は、卵黄からのIgY精製に関する基本プロトコールに係るものであり、具体的には、卵黄成分を分離する薬剤を効率的に組み合わせる工程を加えることにより、IgYが高精度で分離されるだけでなく、より短時間に簡便な作業で高収量の精製が可能であるとの知見を得ることができた。そして、さらに研究を進め、分離物質として特にポリエチレングリコール(PEG)と硫酸アンモニウムを組み合わせた場合には、精製効率が、他の精製法と比較して全く予想外に飛躍的に高まることを見いだした。
以上の方法により、高精製度でIgYを高収量に精製可能であることを確認し、本発明を完成させた。
【0009】
本発明は以下のとおりである。
〔1〕 卵黄溶液からIgYを分離精製するにあたり、脂質及びリポタンパク質を除去するための前処理工程として、卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程を設けることを特徴とする、卵黄溶液からIgYを分離精製する方法。
〔2〕 前記ポリエチレングリコールとして、ポリエチレングリコール粉末をリン酸緩衝液に溶解して40〜60%のポリエチレングリコール溶液に調整したものを用いることを特徴とする、前記〔1〕に記載の方法。
〔3〕 卵黄溶液からIgYを分離精製する方法であって、下記の(1)及び(2)の工程を含む方法;
(1)卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程、
(2)硫酸アンモニウムを終濃度40%になるように加えて遠心し、二層分離させ、その上層部を回収する工程。
〔4〕
工程(1)で用いるポリエチレングリコールとして、ポリエチレングリコール粉末をリン酸緩衝液に溶解して40〜60%のポリエチレングリコール溶液に調整したものを用いることを特徴とする、請求項3に記載の方法。
【発明の効果】
【0010】
本発明のIgY精製法によれば、従来困難であった卵黄からの極めて高精製度IgY精製が簡便に行えるようになる。また、本法によれば、従来法と比較して、分離用の薬剤が少量ですみ、大量の水で希釈する必要もないため、最終的な精製物が高濃度で得られる。したがって、IgY抗体を極めて効率的、かつ短時間、安価に提供でき、これらを通じて医薬あるいは化粧品その他の分野において大いに貢献できる。
【図面の簡単な説明】
【0011】
【図1】効率的IgY精製のプロトコール。
【図2】IgY精製の過程のSDSポアリクリルアミドゲル解析。 図中の記号は以下の通りである。(M:分子量マーカー)レーン1〜3:本発明1:ポリエチレングリコール(分子量6000)を添加し遠心した後の上清2:1に飽和硫酸アンモニウム液を添加し遠心した後の上層(精製IgY)3:1に飽和硫酸アンモニウム液を添加し遠心した後の下層レーン4,5:比較例(Akita法)4:蒸留水で懸濁し遠心した後の上清5:4に飽和硫酸アンモニウム液を添加し遠心した後の沈殿物(精製IgY)レーン6,7:比較例(デキストランサルフェート法)6:デキストラン硫酸を添加し遠心した後の上清7:6に飽和硫酸アンモニウム液を添加し遠心した後の沈殿物(精製IgY)
【図3】各種精製法によるIgYの収量、精製度の比較。(A)IgY回収量の比較(B)IgY精製度の比較
【発明を実施するための形態】
【0012】
1.本発明のIgY抗体の採取源と免疫法
本発明のIgY精製法は、ニワトリ、アヒル、ダチョウなどの鳥類のみならず爬虫類、両生類など、IgY抗体を産生する動物由来の卵黄からのIgY精製に適用できる。
鳥類の卵黄中には、親鳥が自然に獲得した免疫からの移行抗体としてのIgYをもともと大量に含んでいるため、特別な免疫を行わなくてもIgYを採取できる。細菌、ウイルスなど各種の抗原に対するIgYを大量に取得する目的であれば、当該特定抗原による免疫は必要となる。その場合、産卵する親鳥に対して注射または経口投与などにより人工的に1〜2週間ごとに数回過免疫することで、最初の免疫から約30〜45日後には、産卵された卵の卵黄中に特定抗原に対する抗体(IgY)が大量に産生される。
【0013】
2.本発明のIgY精製法
以下、本発明のIgY精製法を、典型的な鳥類卵黄であるニワトリ卵黄の場合について、具体的に説明する。
(1)ニワトリ卵黄溶液の調整
本発明において、「卵黄溶液」というとき、卵白及び卵黄表面の薄膜が除去され、かつ緩衝液を含み均一な状態の卵黄水溶液を指す。
例えば、ニワトリ卵から、卵白を可能な限り取り除き、卵黄のみを回収し、この卵黄に20mMリン酸バッファー(pH7.5)を加え、バッファー内で卵黄を包む薄膜を取り除き、攪拌子で均一な溶液になるまで攪拌する。
【0014】
(2)脂質及びリポタンパク質の除去方法
本発明における脂質及びリポタンパク質の除去方法は、卵黄溶液に、40〜60%ポリエチレングリコールを含有させたリン酸緩衝溶液を、ポリエチレングリコールの最終濃度が1〜2%、好ましくは1%になるように加え、均一溶液を得る。次いで、遠心分離後上清を回収する。加えるポリエチレングリコールの分子量は4000〜8000が好ましく、6000が最も望ましい。
具体的には、上記(1)で得られた卵黄溶液に、50%ポリエチレングリコール(分子量6000)を含む20mMリン酸バッファーをポリエチレングリコールの最終濃度が1〜2%になるように加え、20分間、常温(約25℃)で攪拌する。次いで、卵黄のポリエチレングリコール溶液を遠心分離して、上清を回収する。
【0015】
(3)精製IgYの回収
上記(2)で得られた上清に対し、飽和硫酸アンモニウム液を少量ずつ40%飽和溶液になるまで添加し攪拌後、室温で1時間静置する。静置後の溶液を遠心分離し、二層分離した溶液の上層部を最終精製IgYとして回収する。
このままでも極めて高い純度で得られているが、さらに高純度に精製する場合は、イオン交換体やゲルろ過などの周知の精製方法が適用でき、特に特定抗原に対する抗体を得たい場合は、アフィニティー精製法などを用いればよい。
以下に実施例を示し、本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
【実施例】
【0016】
(実施例1)卵黄溶液の調製
卵白を除去した卵黄をキムタオル上でゆっくりと転がし、卵黄表面上に残っている付着物を除去した後、卵黄をビーカーに入れ、卵黄重量を測定した卵黄(1個あたり約16g)。卵黄1個に対して4倍容量の20mM リン酸ナトリウムバッファー(pH7.5)を加え、ピンセットを使用して卵黄を包む薄膜を丁寧に取り除き、攪拌子を入れ、均一な溶液になるまで常温で攪拌し、1個分の卵黄16gを含有する80mLの卵黄溶液を得た。
【0017】
(実施例2)ポリエチレングリコールによる脂質・リポタンパク質の除去
得られた卵黄溶液80mLに対し、50%ポリエチレングリコール(分子量6000)液を終濃度1%になるように加え、20分間、常温で泡立たないよう攪拌し、攪拌した卵黄溶液約82mLを遠心分離(10000G、25分、室温)して、上清と沈殿物に分離させ上清部分を回収した(約70mL)。
【0018】
(実施例3)飽和硫酸アンモニウム液によるIgYの回収
回収した上清約70mLに、飽和硫酸アンモニウム液を少量ずつ40%飽和溶液になるまで添加し攪拌後、室温で1時間静置する。静置後の溶液を遠心分離(3000rpm、20分、室温)し、二層分離した上層部を精製IgYとして得た。卵1個の卵黄から得られたIgY量は116.2mg(回収率19.9%、精製度96%)であった。
【0019】
(比較例1)Akita法を用いたIgYの回収
比較として、脂質及びリポタンパク質の除去工程を、本発明のポリエチレングリコール処理(実施例2)に代えて、Akita法(非特許文献5)に従って大量の蒸留水処理を行った。
実施例1と同様の処理をした1個分の卵黄(約16g)に7倍容量の蒸留水を加え懸濁したのち、1晩静置したものを次の日遠心した。その上清を回収して、実施例3と同様の手法でアンモニウムサルフェートを添加し、1時間静置後の溶液を遠心し、沈殿物をIgY精製物(最終回収物)として回収した。
【0020】
(比較例2)デキストランサルフェート法を用いたIgYの回収
比較として、脂質及びリポタンパク質の除去工程を、本発明のポリエチレングリコール処理(実施例2)に代えて、デキストランサルフェート法(非特許文献4)に従ってデキストランサルフェート処理を行った。
実施例1と同様の処理をした1個分の卵黄(約16g)を3倍容量のTBS緩衝液{20mMトリス塩酸(pH7.5)、0.15M NaCl}で懸濁したのち、10%デキストランサルフェート溶液を1%濃度になるよう加え、さらに塩化カルシウム溶液を120mMになるよう加え攪拌後、1時間静置したものを遠心した。その上清を回収して、実施例3と同様の手法でアンモニウムサルフェートを添加し、1時間静置後の溶液を遠心し、沈殿物をIgY精製物(最終回収物)として回収した。
【0021】
(実施例4)IgYの回収量・純度の比較
得られたIgYの精製度を確認するため、SDSポリアクリルアミドゲル電気泳動を行った。まず、実施例3で調製したIgY 1μg分を等量のサンプルバッファー{0.125Mトリス塩酸バッファー(pH6.8)、10%メルカプトエタノール、4%SDS、20%グリセロール、0.01%ブロモフェノルブルー}と混合し、95℃、5分加熱処理した後、5〜20%SDSポリアクリルアミドグラジエントゲル{スーパーセップエース、Wako}にアプライし、20mA、80分の定電流で泳動した。泳動後のゲルを蒸留水に浸し30分洗浄した後、蒸留水を廃棄し、タンパク質染色液であるBio−Safe Coomacie {Bio−Rad社}を30ml加え1時間染色した。染色後、染色液を廃棄し、蒸留水を300ml加え、洗浄した。洗浄は、蒸留水を3回交換して2時間行った。また、回収したIgYはQuick Startプロテインアッセイ{Bio−Rad社}を用いて、キットに添付された説明書に従い求めた。
【0022】
電気泳動後、染色したゲルを図2に示す。
図2において、本発明における、ポリエチレングリコールを添加し遠心した後の上清(レーン1)、さらに飽和硫酸アンモニウム液を添加し遠心した後の上層(レーン2)及び下層(レーン3)の電気泳動を示す。また、比較例1(レーン4,5)及び比較例2(レーン6,7)で得られた分離物も同時に電気泳動した。各精製法におけるIgY精製物(最終回収物)は、卵黄 1/150,000個分から得られた最終産物に相当する。
【0023】
以上の結果、蒸留水のみで懸濁し遠心した上清(レーン番号4)よりも、ポリエチレングリコールを添加し遠心した上清(レーン番号1)のほうが狭雑タンパク質が除かれており、精製IgYも高精製であることが判る。また最終的に得られたIgYの量(矢印で示したバンド)は、各精製方法でほぼ同量であることが判る。
これらの各スポットを切り出してそれぞれの量を測定し、本発明と、上記各比較例を下記の(表1)としてまとめた。さらに、図3として(A)回収量、(B)精製度を図示した。
【0024】
【表1】

【0025】
これらの結果によると、回収量はAkita法を脂質及びリポタンパク質の除去のための前処理として用いた比較例1が最も高かったが、精製度は本発明の最終回収物には及ばない。本発明は、前処理として高価なデキストランサルフェートを用いるデキストランサルフェート法を用いた比較例2と同等程度の精製度が得られ、安価でかつ簡便に高精製度が得られることが確認できた。
【特許請求の範囲】
【請求項1】
卵黄溶液からIgYを分離精製するにあたり、脂質及びリポタンパク質を除去するための前処理工程として、卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程を設けることを特徴とする、卵黄溶液からIgYを分離精製する方法。
【請求項2】
前記ポリエチレングリコールとして、ポリエチレングリコール粉末をリン酸緩衝液に溶解して40〜60%のポリエチレングリコール溶液に調整したものを用いることを特徴とする、請求項1に記載の方法。
【請求項3】
卵黄溶液からIgYを分離精製する方法であって、下記の(1)及び(2)の工程を含む方法;
(1)卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程、
(2)硫酸アンモニウムを終濃度40%になるように加えて遠心し、二層分離させ、その上層部を回収する工程。
【請求項4】
工程(1)で用いるポリエチレングリコールとして、ポリエチレングリコール粉末をリン酸緩衝液に溶解して40〜60%のポリエチレングリコール溶液に調整したものを用いることを特徴とする、請求項3に記載の方法。
【請求項1】
卵黄溶液からIgYを分離精製するにあたり、脂質及びリポタンパク質を除去するための前処理工程として、卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程を設けることを特徴とする、卵黄溶液からIgYを分離精製する方法。
【請求項2】
前記ポリエチレングリコールとして、ポリエチレングリコール粉末をリン酸緩衝液に溶解して40〜60%のポリエチレングリコール溶液に調整したものを用いることを特徴とする、請求項1に記載の方法。
【請求項3】
卵黄溶液からIgYを分離精製する方法であって、下記の(1)及び(2)の工程を含む方法;
(1)卵黄溶液にポリエチレングリコールを終濃度1〜2%になるように添加して、遠心により上層部(上清部分)と沈殿部分に分離させ、その上層部を回収する工程、
(2)硫酸アンモニウムを終濃度40%になるように加えて遠心し、二層分離させ、その上層部を回収する工程。
【請求項4】
工程(1)で用いるポリエチレングリコールとして、ポリエチレングリコール粉末をリン酸緩衝液に溶解して40〜60%のポリエチレングリコール溶液に調整したものを用いることを特徴とする、請求項3に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−1689(P2013−1689A)
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願番号】特願2011−136140(P2011−136140)
【出願日】平成23年6月20日(2011.6.20)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願日】平成23年6月20日(2011.6.20)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

