原核細胞における免疫原性多糖体生成の生合成システム
本発明は、N-グリコシル化タンパク質を含有する、バイオコンジュゲートワクチンに関する。更に本発明は、還元末端にN-アセチルガラクトサミンを有するオリゴ糖又は多糖を合成するエピメラーゼをコードしている核酸を含む、組換え原核細胞生合成システムに関する。本発明は更に、還元末端にN-アセチルガラクトサミンを有するオリゴ糖又は多糖を含むN-グリコシル化タンパク質、並びにそのようなN-グリコシル化タンパク質を生成する発現システム及び方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の相互参照)
本出願は、2009年11月19日に出願され、その全体が引用により本明細書中に組み込まれている、米国特許仮出願第61/272,931号の米国特許法第119条(e)の下での利益を主張するものである。
【0002】
(発明の分野)
本発明は、ワクチン製造のための生合成システム及びタンパク質の使用に関する。加えて本発明は、還元末端に特定された単糖を持つオリゴ糖又は多糖の合成を開始するエピメラーゼを有する、組換え原核細胞生合成システムに関する。本発明は更に、発現システムにおいてグリカンで生成されたN-グリコシル化タンパク質、及び免疫原性グリカンを含む該N-グリコシル化タンパク質から製造されたバイオコンジュゲートワクチンに関し、且つN-グリコシル化タンパク質の製造方法を提供する。
【背景技術】
【0003】
(発明の背景)
糖タンパク質は、1個以上の共有結合された糖ポリマーを有するタンパク質である。N-結合型タンパク質のグリコシル化は、真核生物の小胞体において生じる本質的且つ保存されたプロセスである。それは、タンパク質フォールディング、オリゴマー化、安定性、品質管理、選別、並びに分泌タンパク質及び膜タンパク質の輸送にとって重要である(Helenius, A.及びAebi, M.の文献、(2004)、「小胞体におけるN-結合型グリカンの役割(Roles of N-linked glycans in the endoplasmic reticulum)」、Annu. Rev. Biochem. 73, 1019-1049)。
【0004】
タンパク質のグリコシル化は、タンパク質の免疫原性、安定性及び半減期への重大な影響を有する。加えてグリコシル化は、例えばタンパク質のグリコシル化された部分と相互作用する固相に結合されたレクチンリガンドによるアフィニティクロマトグラフィーなどの、クロマトグラフィーによるタンパク質の精製を補助することができる。従って、生物学的及び薬学的に有用なグリコシル化パターンを提供するために、真核細胞において組換えにより多くのグリコシル化タンパク質を生成する手法が確立されている。
【0005】
WO 2003/07467(Aebiら)は、細菌である食物媒介性病原体カンピロバクター・ジェジュニ(Campylobacter jejuni)が、そのタンパク質をN-グリコシル化することができ、このことはある種の古細菌を除いた公知の原核生物の中で独自の特徴であることを明らかにした。このグリコシル化に必要とされる機序は、いわゆるpgl遺伝子座にクラスター化されている12の遺伝子によりコードされている。N-グリコシル化の破壊は、C.ジェジュニの侵入及び病原性に影響を及ぼすが、しかし大抵の真核生物においては致命的ではない(Burda P.及びM. Aebiの文献、(1999)、「N-結合型グリコシル化のドリコール経路(The dolichol pathway of N-linked glycosylation)」、Biochem Biophys Acta, 1426(2):239-57)。大腸菌(E. coli)においてpgl遺伝子座及び受容体糖タンパク質を組換えにより同時に発現させることにより、C.ジェジュニタンパク質のN-グリコシル化を再構成することが可能である(Wackerらの文献、(2002)、「カンピロバクター・ジェジュニにおけるN-結合型グリコシル化及び大腸菌へのその機能転移(N-linked glycosylation in Campylobacter jejuni and its functional transfer into E. coli)」、Science, 298, 1790-1793)。
【0006】
N-グリカン類は、タンパク質内のコンセンサス配列に結合したグリカンを有する。タンパク質内の公知のN-グリコシル化コンセンサス配列は、原核生物において組換え標的タンパク質をN-グリコシル化することを可能にする。そのような生物は、グリカンをタンパク質のコンセンサス配列に転移する酵素であるオリゴサッカリルトランスフェラーゼ("OT";"OTase")、例えばC.ジェジュニのオリゴサッカリルトランスフェラーゼなどを含む。
【0007】
WO 2003/07467(Aebiら)は、(i)脂質キャリア上のオリゴ糖の構築のための特異的グリコシルトランスフェラーゼ、(ii)コンセンサス配列"N-X-S/T"を含む組換え標的タンパク質(式中、Xはプロリン以外の任意のアミノ酸である)、及び(iii)例えば、該オリゴ糖を標的タンパク質のコンセンサス配列に共有結合する、C.ジェジュニのオリゴサッカリルトランスフェラーゼなどのオリゴサッカリルトランスフェラーゼ:をコードしている核酸が導入された原核生物を教示している。前記原核生物は、特定のグリコシルトランスフェラーゼの種類により規定される特定の構造を持つN-グリカンを生成する。
【0008】
WO 2006/119987(Aebiら)は、タンパク質に加え、インビボで原核生物における効率的N-グリコシル化によりタンパク質を生成する手段及び方法を説明している。これは更に、該タンパク質の免疫原性、安定性、生物学的、予防的及び/又は治療的活性を改変するための、N-グリカンの組換えタンパク質への効率的導入、並びにその表面上に発明の組換えN-グリコシル化タンパク質を効率的にディスプレイする宿主細胞の条件を説明している。加えてこれは、以下のN-グリコシル化された最適化アミノ酸配列を1つ以上含む組換えN-グリコシル化タンパク質を説明しており:
D/E-X-N-Z-S/T (最適化コンセンサス配列)、
(式中、X及びZは、Pro以外の任意の天然アミノ酸であり得る)、且つ該N-グリコシル化された部分的アミノ酸配列の少なくとも1つが導入されている。この特定の部分的アミノ酸配列(最適化コンセンサス配列)のタンパク質への導入は、これらの導入された位置でオリゴサッカリルトランスフェラーゼにより効率的にN-グリコシル化されたタンパク質をもたらす。
【0009】
様々な多糖体の生合成が、細菌細胞において保存されている。多糖体は、規定された特異性を持つ様々なグリコシルトランスフェラーゼにより、細胞質膜で、共通の前駆体(活性化された糖ヌクレオチド)からキャリア脂質上に構築される。リポ多糖("LPS")は、例えば赤痢菌種、シュードモナス種、及び大腸菌(ExPEC、EHEC)などのグラム陰性菌においてのみ提供される。
【0010】
LPSの合成は、膜の細胞質側で、単糖がキャリア脂質ウンデカプレニルリン酸("Und-P-P")へ付加されることから始まる。抗原は、様々なグリコシルトランスフェラーゼにより活性化された糖ヌクレオチドから単糖が逐次付加されることにより作製され、その脂質-連結された多糖は、フリッパーゼにより膜を通じて反転される。この抗原-反復単位は、酵素反応により重合される。次にこの多糖は、LPSを形成するリガーゼWaaLによりリピドAへ転移され、LPSがその表面に輸送されるのに対し、莢膜多糖は、重合及び表面への輸送後、キャリア脂質から放出される。これらの多糖の生合成経路は、インビボにおけるLPSバイオコンジュゲートの生成、タンパク質キャリアへのペリプラズム内の多糖の捕獲を可能にする。
【0011】
そのように合成されたオリゴ糖又は多糖(すなわち、糖残基)及びタンパク質(すなわち、タンパク質キャリア)の複合体は、多くの細菌感染を防御するためのコンジュゲートワクチンとして使用することができる。コンジュゲートワクチンは、細菌感染を防御するためにうまく使用されている。多糖はT-細胞非依存性免疫原であるので、タンパク質キャリアに対する抗原性多糖の複合が、防御的記憶反応に必要とされる。多糖に加えタンパク質キャリアにおける反応基の活性化を用いる、様々な化学的方法により、多糖はタンパク質キャリアに複合されている。
【0012】
コンジュゲートワクチンは、小児に細菌感染に対する防御のために投与することができ、また成人に長期の持続免疫応答を提供することもできる。WO 2009/104074(Fernandezら)の作製体は、動物においてIgG応答を生じることがわかっている。ヒトにおける赤痢菌O-特異的多糖-タンパク質コンジュゲートワクチンに対するIgG応答は、ヒトにおける免疫防御に相関していることがわかっている(Passwell, J.H.らの文献、「イスラエルにおける成人での改良された赤痢菌O-特異的多糖-タンパク質コンジュゲートワクチンの安全性及び免疫原性(Safety and Immunogenicity of Improved Shigella O-Specific Polysaccharide-Protein Conjugate Vaccines in Adults in Israel)」、Infection and Immunity, 69(3):1351-1357 (2001年3月))。多糖(すなわち、糖残基)は、糖特異的である短期間の免疫応答を誘発すると考えられる。実際ヒトの免疫系は、O-抗原及び莢膜多糖などの、細菌の特異的多糖表面構造に対し強力な反応を生じる。しかし多糖に対する免疫応答はIgM依存型であるので、この免疫系は記憶を発生しない。多糖を運搬するタンパク質キャリアの免疫系は記憶を呈するので、この免疫系は、T-細胞依存型であり、且つ長期の防御を提供するIgG応答を誘発する。
【0013】
大腸菌O157は、溶血性尿毒症症候群の最近の全症例のおよそ2/3の原因である腸管出血性株であり、ヒトの健康上重大な懸念がある(Law, D.の文献、(2000) J. App. Microbiol., 88, 729-745;Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun., 66, 3545-3551)。
【0014】
大腸菌(Escherichia coli)O157株は、反復する四糖体単位(4-N-アセチルペロサミン→フコース→グルコース→GalNAc)(α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAc)を含むO-抗原を産生する(Perry, M. B.、MacLean, L.及びGriffith, D. W.の文献、(1986) Biochem. Cell Biol., 64, 21-28)。この四糖体は、ウンデカプレニルピロリン酸上で予め構築される。この大腸菌細胞エンベロープは、内側細胞質膜、圧負(stress-bearing)ペプチドグリカン層、並びにリン脂質の内側単層及び細菌LPSで構成された外側単層からなる非対称外膜を含む。LPSは、3つの構成成分、リピドAアンカー、3-デオキシ-D-マンノ-オクト-2-ウロソン酸-含有コア、及びO-抗原領域を含む(参照:Raetz, C. R. H.及びWhitfield, C.の文献、(2002) Annu. Rev. Biochem., 71, 635-700;Whitfield, C.の文献、(2006) Ann. Rev. Biochem. 75, 39-68;Samuel, G.及びReeves, P. R.の文献、(2003) Carbohydrate Research, 338, 2503-2519;及び、細菌LPSのO-抗原の構築に関する総説についてそれらの参考文献を参照されたい)。
【0015】
細菌LPSのO-抗原の構成成分は、単独の反復する単糖から構成されたホモポリマー、又は、3〜6の糖単位の10〜30の反復を含むヘテロポリマーのいずれかであることができる、巨大であり、極めて多様な多糖体である(Reeves, P. R.、Hobbs, M.、Valvano, M. A.、Skurnik, M.、Whitfield, C.、Coplin, D.、Kido, N.、Klena, J.、Maskell, D.、Raetz, C. R. H.、及びRick, P. D.の文献、(1996) Trends Microbiol., 4, 495-503)。従ってO-抗原は、その細菌の細胞表面の支配的な特徴であり、且つ毒性及び病原性の重要な決定因子を構成する(Law, D.の文献、(2000) J. App. Microbiol., 88, 729-745;Spears, K. J.、Roe, A. J.及びGally, D. L.の文献、(2006) FEMS Microbiol. Lett., 255, 187-202;Liu, B.、Knirel, Y. A.、Feng, L.、Perepelov, A. V.、Senchenkova, S. N.、Wang, Q.、Reeves, P. R.及びWang, Lの文献、(2008) FEMS Microbiol. Rev., 32, 627-653;Stenutz, R.、Weintraub, A.及びWidmalm, G.の文献、(2006) FEMS Microbiol. Rev., 30, 382-403)。独自のO-抗原構造に寄与した180よりも多い個別のO-血清型を有する大腸菌株が、同定されている(Stenutz, R.、Weintraub, A.及びWidmalm, G.の文献、(2006) FEMS Microbiol. Rev., 30, 382-403)。
【0016】
O-抗原反復単位は、ウンデカプレニルピロリン酸に結合された内側膜の細胞質ゾル面上に予め構築されている。脂質-結合された反復単位は、内側膜のペリプラズム表面へと横断して広がり(フリップ-フロップ)、外膜へ輸送され且つLPSに結合する前に重合される。ほとんどのヘテロポリマー性O-抗原反復単位は、それらの還元末端にN-アセチルグルコサミン("GlcNAc")又はN-アセチルガラクトサミン("GalNAc")のいずれかを有する。
【0017】
脂質中間体の生合成は、WecAにより触媒されたGlcNAc-P又はGalNAc-Pのそれらの各糖ヌクレオチド誘導体からウンデカプレニル一リン酸("Und-P")への転移により開始されると仮定されている(Samuel, G.及びReeves, P. R.の文献、(2003) Carbohydrate Research, 338, 2503-2519;Alexander, D. C.及びValvano, M. A.の文献、(1994) J. Bacteriol., 176, 7079-7084;Zhang, L.、Radziejewska-Lebrecht, J.、Krajewska-Pietrasik, D.、Tolvanen, P.及びSkurkik, M.の文献、(1997) Mol. Microbiol. 23, 63-76;Amor, P. A.及びWhitfield, C.の文献、(1997) Mol. Microbiol. 26 (145-161);Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun. 66, 3545-3551)。WecAのGlcNAc-ホスホトランスフェラーゼ活性の特性及び特異性は特徴付けられているが(Rush, J. S.、Rick, P. D.及びWaechter, C. J.の文献、(1997) Glycobiology, 7, 315-322)、WecAは、GalNAc-P-P-Undの合成を触媒するという結論は、遺伝子研究を基にしていた(Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun. 66, 3545-3551)。そのような初期の遺伝子研究は、脂質-結合された四糖体中間体の生合成は、WecAにより触媒されたGalNAc-PのUDP-GalNAcからUnd-Pへの酵素転移により開始されることを指摘した(Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun. 66, 3545-3551)。しかし、WecAはGalNAc-P供与体としてUDP-GalNAcを利用することを明らかにする直接の酵素学的証拠は存在しない。
【0018】
更に、大腸菌O55のgne及びgne1遺伝子は、UDP-GlcNAc 4-エピメラーゼをコードしていることが先に提唱された(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625;Guo, H.、Yi, W.、Li, L.及びWang, P. G.の文献、(2007) Biochem. Biophys. Res. Commun., 356, 604-609)。先の報告は、大腸菌O55由来(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625)、並びに大腸菌O86由来の(Guo, H.、Yi, W.、Li, L.及びWang, P. G.の文献、(2007) Biochem. Biophys. Res. Commun., 356, 604-609)、同じ遺伝子ファミリー内のZ3206遺伝子と100%同一である2つの遺伝子、各々、大腸菌O55 gne及び大腸菌O86 gne1を同定した。
【0019】
従って当業者は、Z3206遺伝子も、UDP-GlcNAc/UDP-GalNAcエピメラーゼをコードしていると考えるようになっている。
【発明の概要】
【0020】
(発明の簡単な概要)
現在驚くべきことに、大腸菌O157においてZ3206遺伝子によりコードされたエピメラーゼは、ウンデカプレニルピロリン酸上のN-アセチルガラクトサミン("GalNAc")を合成する反応を触媒し、このことはオリゴ糖又は多糖の形成を開始することが発見された。
【0021】
一態様において、本発明は、ウンデカプレニルピロリン酸上でGalNAcを合成するエピメラーゼを含む、多糖の全て又は一部を生成する組換え原核細胞生合成システムに関する。本発明は更に、還元末端にGalNAcを有する多糖の全て又は一部を合成するグリコシルトランスフェラーゼを含み、且つ更に還元末端にGalNAcを有する抗原性多糖の全て又は一部を合成するグリコシルトランスフェラーゼを含んでいる。
【0022】
別の態様において、本発明は、ウンデカプレニルピロリン酸上でGalNAcを生成するエピメラーゼに関し、且つ更なる態様において、本エピメラーゼは、Z3206遺伝子によりコードされている。
【0023】
追加の態様において、本発明は、オリゴサッカリルトランスフェラーゼをコードしているヌクレオチド配列;タンパク質キャリアをコードしているヌクレオチド配列;少なくとも1種の細菌由来の少なくとも1つのオリゴ糖又は多糖の遺伝子クラスターであり、ここで該多糖は、還元末端にGalNAcを含むもの;及び、エピメラーゼをコードしている核酸配列:を含む、N-グリコシル化タンパク質の生成のための発現システムに関する。
【0024】
より更なる態様において、本発明は、GlcNAc-P-P-UndをGalNAc-P-P-Undに変換するエピメラーゼをコードしているZ3206遺伝子を含む、組換え原核細胞生合成システムに関する。
【0025】
更に追加の態様において、本発明は、GlcNAc-P-P-UndをGalNAc-P-P-Undに変換するエピメラーゼをコードしている大腸菌O55 gne遺伝子又は大腸菌O86 gne1遺伝子を含む、組換え原核細胞生合成システムに関する。
【0026】
更に別の態様において、本発明は、少なくとも1つの導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZはプロリン以外の任意の天然のアミノ酸であり得る)、及び還元末端にN-アセチルガラクトサミンを有するグリカン:を含む、N-グリコシル化タンパク質に関する。
【0027】
より別の態様において、本発明は、少なくとも1つの導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZはプロリン以外の任意の天然のアミノ酸であり得る);還元末端にN-アセチルガラクトサミンを有する、免疫原性グリカン:を有するN-グリコシル化タンパク質;並びに、アジュバントを含有する、バイオコンジュゲートワクチンに関する。
【0028】
追加の態様において、本発明は、還元末端にGalNAcを含む少なくとも1種の細菌由来の少なくとも1つのオリゴ糖又は多糖を構築するグリコシルトランスフェラーゼ;タンパク質キャリア;オリゴサッカリルトランスフェラーゼ;及び、エピメラーゼ:をコードしている核酸を含む宿主細胞において、N-結合型グリコシル化タンパク質を生成する方法に関する。
【0029】
更なる態様において、本発明は、バイオコンジュゲートワクチンを調製するための生合成システム及びタンパク質の使用に関する。
【0030】
追加の態様において、本発明は、単糖、オリゴ糖及び多糖を生成する方法に関し、より更なる態様において、本発明は、抗原性グリカン及びN-グリコシル化タンパク質を生成する方法に関する。
【図面の簡単な説明】
【0031】
【図1】図1は、大腸菌O157由来の膜画分による、[3H]GlcNAc/GalNAc-P-P-Und合成の時間経過を示している。大腸菌O157株由来の膜画分は、UDP-[3H]GlcNAcと共に、37℃で指定された時間インキュベートした。[3H]脂質生成物を抽出し、[3H]GlcNAcの[3H]GlcNAc-P-P-Und(○)及び[3H]GalNAc-P-P-Und(●)への取り込みを、実施例2に記載のようにアッセイした。
【0032】
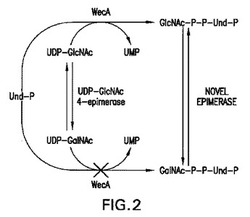
【図2】図2は、GlcNAc-P-P-UndからのGalNAc-P-P-Undの形成に関する提唱された生合成経路を示す。
【0033】
【図3】図3は、大腸菌O157株由来の膜画分により合成された[3H]GalNAc-P-P-Undの精製及び特徴決定を示す。大腸菌O157由来の膜画分は、UDP-[3H]GlcNAcと一緒にインキュベートし、且つ[3H]GalNAc脂質を、実施例3に記載のように精製した。図3Aは、DEAE-セルロース上での精製後の、ホウ酸含浸シリカゲルG(Quantum 1)上の[3H]HexNAc脂質の分取薄層クロマトグラムを示す。図3Bは、パネルAの分取プレートからの回収後の、ホウ酸含浸シリカゲルG(Baker Si250)上の精製された[3H]GalNAc-P-P-Undの薄層クロマトグラフィーを示す。図3Cは、図3Bで精製された[3H]GalNAc-P-P-Undの弱酸加水分解後に回収された[3H]-アミノ糖の、下降ペーパークロマトグラム(ホウ酸含浸ワットマン濾紙No.1)を示す。図3Dは、NaBH4による図3C由来の[3H]アミノ糖の還元により生成された[3H]HexNAc-アルジトールの下降ペーパークロマトグラム(ワットマンNo.3MM)を示す。
【0034】
【図4】図4は、pMLBAD:Z3206による形質転換後の大腸菌21546細胞及び大腸菌21546細胞の代謝標識を示す。大腸菌21546(図4A)及び大腸菌21546:pMLBAD/Z3206(図4B)は、[3H]GlcNAcにより37℃で5分間代謝標識した。[3H]GlcNAc/GalNAc-P-P-Undを抽出し、水溶性夾雑物を除去し、且つ実施例3に記載のようなホウ酸含浸シリカゲルプレート(Baker Si250)上の薄層クロマトグラフィーにより分離した。Bioscanクロマトスキャナーを用い、放射性脂質を検出した。GalNAc-P-P-Und及びGlcNAc-P-P-Undのクロマトグラフィー位置は、矢印で示した。
【0035】
【図5】図5は、大腸菌株由来の膜画分のUDP-[3H]GlcNAcと一緒のインキュベーションにより形成された[3H]GlcNAc/GalNAc-P-P-Undの薄層クロマトグラフィーを示す。大腸菌K12株(図5A)、O157株(図5B)、21546株(図5C)、及び21546:pMLBAD/Z3206株(図5D)由来の膜画分を、UDP-[3H]GlcNAcと一緒に、37℃で10分間インキュベーションし、且つ[3H]脂質生成物を抽出し、分配により水溶性夾雑物を除去し、実施例3に記載のようにホウ酸含浸シリカゲルプレート(Baker Si250)上の薄層クロマトグラフィーにより分離した。GalNAc-P-P-Und及びGlcNAc-P-P-Undのクロマトグラフィー位置は、矢印で示した。
【0036】
【図6】図6は、UMPと一緒のインキュベーションによるGlcNAc-Pの放出を示す。大腸菌21546:Z3206由来の膜画分を、GlcNAc-P-P-Undを酵素標識するために、UDP-[3H]GlcNAcと一緒に37℃で10分間プレインキュベーションし(図6A)、引き続き1mM UMPと一緒に、1分間(図6B)又は2分間(図6C)のいずれかの期間、2回目のインキュベーションした。指定されたインキュベーション期間の後、[3H]GlcNAc/GalNAc-P-P-Undを抽出し、実施例3に記載のようなホウ酸含浸シリカゲルプレート(Baker Si250)上の薄層クロマトグラフィーにより分離した。GalNAc-P-P-Und及びGlcNAc-P-P-Undのクロマトグラフィー位置は、矢印で示した。
【0037】
【図7】図7は、Z3206を発現している21546株由来の膜により触媒された、外因性[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの、関連する[3H]HexNAc-P-P-Und生成物への変換を示す。大腸菌21546株(図7B及び図7E)及び21546:pMLBAD/Z3206株(図7C及び図7F)由来の膜画分を、精製した[3H]GlcNAc-P-P-Und(図7A、図7B、及び図7C)又は[3H]GalNAc-P-P-Und(図7D、図7E、及び図7Fのパネル)(1%Triton X-100中に超音波処理により分散された)と一緒に、37℃で1分間インキュベートした。[3H]GlcNAc/GalNAc-P-P-Undを抽出し、ホウ酸含浸シリカゲルプレート(Baker Si250)上の薄層クロマトグラフィーにより分離し、実施例3に記載のようなBioscan AR2000ラディオクロマトスキャナーにより検出した。
【0038】
【図8】図8は、グリコシル化されない及びグリコシル化されたAcrAタンパク質のSDS-PAGE分析を示す。pMLBAD:Z3206(レーン1)、pMLBAD:gne(レーン2)又はベクター対照pMLBAD(レーン3)を補完したAcrA発現プラスミド及びpglオペロンΔgneを保持する大腸菌DH5α細胞から調製したペリプラズム抽出物を、10%SDS-PAGEにより分離し、ニトロセルロースメンブレンに移した。AcrA及びそのグリコシル化された形態は、抗AcrA抗血清により検出した。グリコシル化されないAcrA(AcrA)及びグリコシル化されたAcrA(gAcrA)に対応するバンドの位置を示した。
【0039】
【図9】図9は、Liu Bらの文献(「赤痢菌O-抗原の構造及び遺伝子(Structure and genetics of Shigella O antigens)」、FEMS Microbiology Review, 2008. 32: p.27)により同定された遺伝子を示す。
【0040】
【図10】図10は、S.フレックスネリ6 O抗原を合成するために必要とされる遺伝子を含むDNA領域を示すスキームである。
【0041】
【図11】図11は、大腸菌におけるS.フレックスネリ6のO抗原の発現を示す。LPSは、銀染色によるか、又はニトロセルロースメンブレンへの転移及びS.フレックスネリ6に対する抗体による検出のいずれかにより可視化した。
【0042】
【図12】図12は、O抗原のHPLCを示す。S.フレックスネリ−Z3206を含む大腸菌細胞(SCM3)、S.フレックスネリ+Z3206を含む大腸菌細胞(SCM3)、又は空の大腸菌(SCM3)細胞のLLO分析。
【0043】
【図13】図13は、EPA、pglB及びS.フレックスネリ6のO-抗原+/−Z3206を発現している大腸菌細胞由来のニッケル精製したタンパク質のウェスタンブロットを示す。
【発明を実施するための形態】
【0044】
(発明の詳細な説明)
本発明は、還元末端にN-アセチルガラクトサミンを有するオリゴ糖又は多糖を合成するエピメラーゼ、及びグリカンの還元末端にN-アセチルガラクトサミンを有するN-グリコシル化タンパク質:をコードしている核酸を含む、組換え原核細胞生合成システムを包含している。
【0045】
用語「部分的アミノ酸配列」は、「最適化コンセンサス配列」又は「コンセンサス配列」とも称される。最適化コンセンサス配列は、通常のコンセンサス配列"N-X-S/T"よりもはるかに効率的に、オリゴサッカリルトランスフェラーゼ("OST"、"OTase")によりN-グリコシル化される。
【0046】
概して、用語「組換えN-グリコシル化タンパク質」とは、該タンパク質をコードしている核酸を天然には含まない宿主細胞において生成される任意のポリペプチド又はオリゴペプチドをいう。本発明の状況において、この用語は、例えば、エシェリキア(Escherichia)種、カンピロバクター(Campylobacter)種、サルモネラ(Salmonella)種、シゲラ(Shigella)種、ヘリコバクター(Helicobacter)種、シュードモナス(Pseudomonas)種、バチルス(Bacillus)種などの原核宿主細胞において、並びに更なる実施態様においては、大腸菌、カンピロバクター・ジェジュニ、サルモネラ・ティフィムリウスなどにおいて、組換えにより生成されたタンパク質をいい、ここで該タンパク質をコードしている核酸は、該宿主細胞に導入されており、且つこのコードされたタンパク質は、OTaseにより、N-グリコシル化され、該転移酵素は該宿主細胞において天然に生じるか又は細胞へ組換えにより導入されている。
【0047】
アミノ酸に関する国際的に承認された1文字コードに従い、省略形D、E、N、S及びTは、各々、アスパラギン酸、グルタミン酸、アスパラギン、セリン、及びトレオニンを意味する。
【0048】
本発明のタンパク質は、タンパク質に導入され且つN-グリコシル化された最適化コンセンサス配列D/E-X-N-Z-S/Tを1つ以上含む。従って本発明のタンパク質は、同じく最適化コンセンサス配列を含むが追加の(導入された)最適化コンセンサス配列は全く含まない天然のC.ジェジュニのN-糖タンパク質とは異なる。
【0049】
最適化コンセンサス配列の導入は、1個以上のアミノ酸の付加、欠失及び/又は置換により達成することができる。最適化コンセンサス配列の導入を目的とした1個以上のアミノ酸の付加、欠失及び/又は置換は、化学合成戦略により達成することができ、これは本発明を考慮し、固相支持型化学ペプチド合成のように、当業者には周知であろう。あるいは、より大きいポリペプチドに好ましいことだが、本発明のタンパク質は、本発明に照らして当該技術分野において標準技術である組換え技術により調製することができる。
【0050】
本発明のタンパク質は、高い効率で且つ任意の宿主において生成され得るという利点を有する。本発明の一実施態様において、宿主は、カンピロバクター種に由来する、例えばC.ジェジュニに由来する機能性pglオペロンを含む。更なる実施態様において、本発明の実施のためのカンピロバクター種由来のオリゴサッカリルトランスフェラーゼは、カンピロバクター・コリ(Campylobacter coli)又はカンピロバクター・ラリ(Campylobacter lari)に由来している。本発明を考慮し、オリゴサッカリルトランスフェラーゼは、当業者には明らかであろう。例えば、オリゴサッカリルトランスフェラーゼは、Szymanski, C.M.及びWren, B.W.の文献「粘膜病原菌におけるタンパク質グリコシル化(Protein glycosylation in bacterial mucosal pathogens)」、Nat. Rev. Microbiol., 3:225-237 (2005)などの参考文献において明らかにされている。前記原核細胞宿主がカンピロバクター種、又は例えばC.ジェジュニである場合、機能性pglオペロンは天然に存在し得る。しかし、当該技術分野において先に明らかにされ、かつ前述のように、pglオペロンは、細胞に転移され、且つ該新規細胞の環境において機能性を維持する。
【0051】
用語「カンピロバクター種、好ましくはC.ジェジュニ由来の機能性のpglオペロン」とは、カンピロバクター種、例えばC.ジェジュニの機能性のオリゴサッカリルトランスフェラーゼ(OTase)、及び脂質キャリア上のオリゴ糖の構築が可能である1種以上の特異的グリコシルトランスフェラーゼをコードしている核酸のクラスターをいい、ここで該オリゴ糖は、OTaseにより、脂質キャリアから、1つ以上の最適化アミノ酸配列:D/E-X N-Z-S/Tを有する標的タンパク質へ転移され得ることを意味する。本発明の状況において用語「カンピロバクター種、好ましくはC.ジェジュニ由来の機能性のpglオペロン」は、必ずしも、単独の転写単位としてのオペロンをいうものではないことが理解されるべきである。この用語は、1つの宿主細胞における組換えタンパク質のN-グリコシル化のための機能性構成成分の存在のみを必要とする。これらの構成成分は、1つ以上の個別のmRNAとして転写されてもよく、且つ一緒に又は個別に調節されてもよい。例えばこの用語は、1つの宿主細胞においてゲノムDNA及びプラスミドに配置された機能性構成成分も包含している。効率化を目的として、一実施態様においては、機能性のpglオペロンの全ての構成成分が調節され、且つ同時に発現される。
【0052】
オリゴサッカリルトランスフェラーゼは、一部の実施態様においてはカンピロバクター種を起源とし、且つ別の実施態様においてはC.ジェジュニを起源とすることができる。追加の実施態様において、オリゴサッカリルトランスフェラーゼは、例えば、ウォリネラ(Wolinella)種及び真核生物など、オリゴサッカリルトランスフェラーゼを有することが当業者に公知である他の生物を起源とすることができる。
【0053】
脂質キャリア上にオリゴ糖を構築することが可能である1つ以上の特異的グリコシルトランスフェラーゼは、宿主細胞を起源とするか又は該宿主細胞へ組換えにより導入されることができ、その唯一の機能上の制限は、該グリコシルトランスフェラーゼにより構築されたオリゴ糖は、OTaseにより、脂質キャリアから1つ以上の最適化コンセンサス配列を有する標的タンパク質へ転移され得ることである。従って、特異的グリコシルトランスフェラーゼを天然に含み及び/又は該宿主に天然に存在する特異的グリコシルトランスフェラーゼを交換する宿主細胞の選択に加え、異種の特異的グリコシルトランスフェラーゼの導入は、当業者が、本発明のタンパク質において最適化N-グリコシル化コンセンサス部位に結合されたN-グリカンを変動することを可能にする。
【0054】
上記の結果として、本発明は、本発明のタンパク質上のN-グリカン-パターンの個別のデザインを提供する。従ってこれらのタンパク質は、生物学的、医薬的及び精製上の必要性に適するようにそれらのN-グリカンパターンを個別化することができる。
【0055】
本発明の実施態様において、前記タンパク質は、該N-グリコシル化された最適化アミノ酸配列を1つ、しかし同じく少なくとも2つ、少なくとも3つ又は少なくとも5つなど1つよりも多くも含むことができる。
【0056】
本発明のタンパク質内の1つ以上のN-グリコシル化された最適化アミノ酸配列の存在は、それらの免疫原性を高める上で、それらの安定性を増大する上で、それらの生物活性に影響を及ぼす上で、それらの生物学的半減期を延長する上で、及び/又はそれらの精製を簡略化する上で利点であり得る。
【0057】
本最適化コンセンサス配列は、X及びZの位置に、プロリン以外の任意のアミノ酸を含むことができる。用語「任意のアミノ酸」とは、OTaseにより最適化コンセンサス配列をN-グリコシル化させることが依然可能である、一般的な及び稀少な天然のアミノ酸に加え、合成のアミノ酸誘導体及び類似体を包含することを意味する。X及びZについて、天然の一般的な及び稀少なアミノ酸が好ましい。X及びZは、同じ又は異なることができる。
【0058】
本発明のタンパク質中の各最適化コンセンサス配列に関して、X及びZは異なってもよいことに留意されたい。
【0059】
OTaseによる転移のために脂質キャリア上にオリゴ糖を構築する場合、最適化コンセンサス配列に結合されたN-グリカンは、特異的グリコシルトランスフェラーゼ及びそれらの相互作用により決定されるであろう。本発明を考慮し、当業者は、所望の宿主細胞に存在する特異的グリコシルトランスフェラーゼの種類及び量を変動することにより、N-グリカンをデザインすることができるであろう。
【0060】
本明細書において使用される「単糖」とは、1個の糖残基をいう。「オリゴ糖及び多糖」とは、2個以上の糖残基をいう。本明細書において使用される用語「グリカン」とは、単糖、オリゴ糖又は多糖をいう。「N-グリカン」は、本明細書において、N-グリコシド結合を介してタンパク質内のアスパラギン残基のε-アミド窒素に連結された変動可能な組成の単糖、オリゴ糖又は多糖と定義される。ある実施態様において、OTaseにより転移されたN-グリカンは、グラム陰性菌又はグラム陽性菌の細胞質膜に存在するウンデカプレノールピロリン酸("Und-P-P")脂質-アンカー上に構築される。これらは、O抗原、O多糖及びペプチドグリカンの合成に関与している(Bugg, T. D.及びBrandish, P. E.の文献、(1994)、「ペプチドグリカンから糖タンパク質:脂質-連結されたオリゴ糖生合成の一般的特徴(From peptideglycan to glycoproteins : common features of lipid-linked oligosaccharide biosynthesis)」、FEMS Microbiol Lett, 119, 255-262;Valvano, M. A.の文献、(2003)、「O-特異的リポ多糖体の輸送(Export of O-specific lipopolysaccharide)」、Front Biosci, 8, s452-471)。
【0061】
脂質-連結された反復する四糖体(4-N-アセチルペロサミン→フコース→グルコース→GalNAc)の生合成は、WecAによるGalNAc-P-P-Undの形成により開始されるかどうかを決定するために、研究を行った。大腸菌K12株、O157株、及びPR4019株、WecA-過剰発現株由来の膜画分がUDP-[3H]GalNAcと一緒にインキュベートされる場合、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの酵素合成はどちらも検出されなかった。しかし、O157株由来の膜画分がUDP-[3H]GlcNAcと一緒にインキュベートされる場合、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの化学特性及びクロマトグラフィー特性を持つ2つの酵素標識された生成物が観察され、O157株は、GlcNAc-P-P-Und及びGalNAc-P-P-Undの相互変換を可能にするエピメラーゼを含むことを確認した。外因性[3H]GlcNAc-P-P-Undは、O157株由来の膜と一緒にインキュベートされる場合、[3H]GalNAc-P-P-Undへ変換されたことを示すことによっても、エピメラーゼの存在が確認された。O157株が[3H]GlcNAcにより代謝標識される場合、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの両方が検出された。大腸菌21546株のZ3206遺伝子による形質転換は、これらの細胞がインビボ及びインビトロにおいてGalNAc-P-P-Undを合成することを可能にした。このエピメラーゼ反応の可逆性は、O157株由来の膜が外因性[3H]GalNAc-P-P-Undと一緒にインキュベートされる場合、[3H]GlcNAc-P-P-Undが再形成(reform)されたことを示すことによって、明らかにされた。大腸菌におけるカンピロバクター・ジェジュニN-グリコシル化システムの発現においてZ3206はgne遺伝子の喪失を補完することができないことは、これがUDP-GlcNAc/UDP-GalNAcエピメラーゼとしては機能しないことを示した。これらの結果を基に、GalNAc-P-P-Undは、大腸菌O157におけるWecAによるGlcNAc-P-P-Undの形成後に、GlcNAc-P-P-Undエピメラーゼにより可逆的に合成されることが確認された。
【0062】
GalNAc-P-P-Und合成は、WecAによるよりもむしろ、いくつかのこれまで未知の機構により触媒されることを確認するために、大腸菌O157のO-抗原サブユニット構築の開始反応を調べた。本明細書に提示された証拠は、GalNAc-P-P-Undは、WecAにより触媒されたUDP-GalNAcからのGalNAc-P転移により合成されないが、しかし大腸菌O157のZ3206遺伝子によりコードされたエピメラーゼにより触媒されたGlcNAc-P-P-Undの4-OHの可逆的エピマー化により合成されることを示している。
【0063】
従って本発明は、GalNAc-P-P-Undの合成のための新規生合成経路に加え、重要な細菌細胞の表面構成成分の構築のための新規生合成経路を包含している。本発明の更なる実施態様は、抗微生物薬の新規標的としての細菌エピメラーゼを含む。
【0064】
大腸菌O157は、反復する四糖体構造(4-N-アセチルペロサミン→フコース→グルコース→3fGalNAc)を持つO-抗原を合成する。以前の遺伝子研究(Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun. 66, 3545-3551)とは対照的に、本明細書においては、脂質-連結された四糖体中間体の生合成は、WecAにより触媒されたUDP-GalNAcからUnd-PへのGalNAc-Pの酵素転移により開始されなかったことが示された。本明細書において説明され、ホモロジー検索により得られ、その後遺伝子、酵素及び代謝標識の実験の結果により確認された本発明は、WecAは、基質としてUDP-GalNAcを利用しないこと、しかしWecAは、O157株のZ3206遺伝子によりコードされたエピメラーゼによりその後GalNAc-P-P-Undへ可逆的に変換されるGlcNAc-P-P-Undの合成に必要であることを明らかにしている。
【0065】
本発明のZ3206遺伝子は、それらの還元末端にGalNAc残基を含む表面O-抗原反復単位を生成するいくつかの菌株に存在する遺伝子ファミリーに属する(表1)。Z3206遺伝子配列は、配列番号:1に示されている。先行する報告は、Z3206遺伝子と100%同一である、大腸菌O55由来(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625)及び大腸菌O86由来(Guo, H.、Yi, W.、Li, L.及びWang, P. G.の文献、(2007) Biochem. Biophys. Res. Comm., 356, 604-609)の2つの遺伝子、各々、大腸菌O55 gne及び大腸菌O86 gne1を報告している(表1)。大腸菌O55 gne遺伝子配列は配列番号:3として示され、大腸菌O86 gne1遺伝子配列は配列番号:5として示されている。
【表1】

【0066】
従って、本出願人らは、大腸菌O55 gne及び大腸菌O86 gne1は、各々、O55株及びO86株において、GlcNAc-P-P-UndのGalNAc-P-P-Undへの変換が可能であるエピメラーゼもコードしており、これらは還元末端にGalNAcを持つO-抗原反復単位をも生成することを結論づけた(表1)。
【0067】
本研究における2つの実験的アプローチは、Z3206タンパク質は、O157株におけるUDP-GlcNAcのUDP-GalNAcのへのエピマー化を触媒しないことを指摘している。第一に、O157株由来の膜が[3H]UDP-GalNAcと一緒にインキュベートされる場合、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undはどちらも検出されなかった(表3)。Z3206が、[3H]UDP-GalNAcの[3H]UDP-GlcNAcへの変換を触媒するならば、[3H]GlcNAc-P-P-Undが観察されるべきであることが予想される。第二に、本出願人らは、赤血球凝集素-タグ付きZ3206は、UDP-GalNAc-依存性C.ジェジュニN-グリコシル化リポーターシステムを補完することが不可能であることを示した(図8)。
【0068】
O55株由来の大腸菌O55 gne遺伝子(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625)も同じく、粗抽出物をUDP-GalNAcと一緒にインキュベートし、酸加水分解後のp-ジメチルアミノベンズアルデヒドとの反応性の増加を測定し、UDP-GlcNAcへの変換を間接的にアッセイすることにより、エピメラーゼ活性についてアッセイした。両方の研究において、本生成物の形成は、糖ヌクレオチド最終生成物の限定的特徴ではなく、p-ジメチルアミノベンズアルデヒドとの反応性の変化を基にした。90%純粋なポリヒスチジン-タグ付き大腸菌O86 gne1も同じく、組合せアッセイにおいてGne2と比べ、低レベルのUDP-グルコースエピメラーゼ活性を有することが示された。
【0069】
従って、本発明の実施態様は、GlcNAc-P-P-UndをGalNAc-P-P-Undへ変換する、Z3206遺伝子、大腸菌O55 gne遺伝子又は大腸菌O86 gne1遺伝子を含む、組換え原核細胞生合成システムに関する。
【0070】
追加の非還元末端GalNAcのためのグリコシル供与体として恐らくUDP-GalNAcを必要とする2個のGalNAc残基を含むO-抗原を合成する大腸菌O86は、O-抗原遺伝子クラスター内にgne2と称される追加のGlcNAc 4-エピメラーゼ遺伝子も有することは重要である(Guo, H.、Yi, W.、Li, L.及びWang, P. G.の文献、(2007) Biochem. Biophys. Res. Commun., 356, 604-609)。この追加のエピメラーゼ遺伝子は、コラン酸遺伝子クラスターのgalE遺伝子と高い相同性を有し、且つUDP-GalNAcを合成することが可能であるUDP-GlcNAc 4-エピメラーゼであるように考えられる。
【0071】
Z3206遺伝子は、GalNAcで始まる大腸菌O-血清型において高度に保存されるようである。最近の研究において、確立されたO-抗原反復単位構造を有する62種の大腸菌株が、大腸菌O157 Z3206遺伝子を特異的に検出するようにデザインされたヌクレオチドプライマーを使用するポリメラーゼ連鎖反応を基にした方法により、Z3206の発現についてスクリーニングされた(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625)。この研究において、Z3206は、GalNAcを含むことがわかっている22種の大腸菌株中16種において、及びGalNAcを欠く40種の菌株のわずかに4種において、検出された。更に、UDP-GlcNAc 4-エピメラーゼ活性を持つ代替エピメラーゼ(大腸菌O113のGalE遺伝子)を検出するようにデザインされたプライマーによる、22種のGalNAc-含有株の同様のスクリーニングは、この遺伝子を保持する菌株を検出せず、このことはZ3206は、大腸菌のO-抗原反復単位における還元末端GalNAcの存在に最も一般的に関連づけられたGlcNAc 4-エピメラーゼ遺伝子であることを示している。
【0072】
様々なウェブ-ベースのトポロジー予測アルゴリズムによるZ3206タンパク質配列の分析は、Z3206タンパク質は高度に疎水性ではないことを示している。大部分のトポロジー予測アルゴリズムは、Z3206は可溶性37kDaタンパク質であることを示しているが、TMPredは、1個の弱いN-末端膜貫通ヘリックスを予測した(Hofmann, K.及びStoffel, W.の文献、(1993) Biol. Chem. Hoppe-Seyler, 374, 166 (要約))。しかし赤血球凝集素-タグ付きZ3206を発現している大腸菌細胞由来の細胞画分のSDS-PAGE後のウェスタンブロットは、このタグ付きタンパク質は、それらの細胞の低張溶解後に、微粒子画分に会合されることを明確に示している。予備実験は、前記タンパク質は、膜画分の1M KClとのインキュベーション後に微粒子画分に会合され続けるが、0.1%Triton X-100とのインキュベーションにより活性型で可溶化されることを示している。
【0073】
大腸菌O157のZ3206は、NAD(P)結合ポケットと一致する、GXXGXXGモチーフ(Rossmanフォールド)(Allard, S. T. M.、Giraud, M. F.、及びNaismith, J. H.の文献、(2001) Cell. Mol. Life Sci. 58, 1650-1655)、並びにプロトン引き抜き及び供与に関与した、保存されたSX24YX3K配列(Field, R. A.及びNaismith, J. H.の文献、(2003) Biochemistry, 42, 7637-7647)を含むオキシド-レダクターゼの短鎖デヒドロゲナーゼ/レダクターゼファミリーと著しい配列相同性を有する。短鎖デヒドロゲナーゼ/レダクターゼファミリーの別のメンバーであるUDP-Glc 4-エピメラーゼの結晶構造を基にした分子モデリングは、ヒドリド引き抜き後、4-ケト中間体が、UDPのβリン酸の周りを回転し、ケト中間体の反対面を提示し、且つその反対面からのヒドリドの再挿入を可能にし、その結果4位の炭素におけるヒドロキシルの立体配置を反転することを示唆している。これらの保存された配列の存在は、Z3206は恐らく類似した機構を介し機能することを示唆している。図7に見られるように、本エピメラーゼ生成物の平衡分布は、GlcNAc-P-P-Undの形成を支持しているように見えるが、O-抗原反復単位の構築のためのGalNAc-P-P-Undの利用は、質量作用により、GalNAc-P-P-Undの方向にエピマー化反応を駆動するであろう。
【0074】
ポリイソプレノイド脂質中間体のグリコシル部分のエピマー化は、実際には広くは報告されていない。1つの先行する研究において、マイコバクテリアにおけるアラビノガラクタン生合成のアラビノシル供与体であるアラビノシル-P-デカプレノールを形成するリボシル-P-デカプレノールの2-エピマー化が報告された(Mikusova, K.、Huang, H.、Yagi, T.、Holsters, M.、Vereecke, D.、D'Haeze, W.、Scherman, M. S.、Brennan, P. J.、McNeil, M. R.、及びCrick, D. C.の文献、(2005) J. Bacteriol. 187, 8020-8025)。アラビノシル-P-デカプレノールは、2種のマイコバクテリアタンパク質Rv3790及びRv3791を必要とする、2工程酸化/還元反応を介して形成される。エピマー化は、NAD及びNADPの添加により若干刺激されるが、Rv3790もRv3791も、短鎖デヒドロゲナーゼ/レダクターゼファミリーの特徴であるRossmanフォールド又はSX24YXXXKモチーフのいずれも含まない(Allard, S. T. M.、Giraud, M.-F.及びNaismith, J. H.の文献、(2001) Cell. Mol. Life Sci. 58, 1650-1655;Field, R. A.及びNaismith, J. H.の文献、(2003) Biochemistry 42, 7637-7647)。
【0075】
まとめると、GlcNAc-P-P-Undのエピマー化によるGalNAc-P-P-Undの形成に関する新規生合成経路が説明されている。
【0076】
いくつかの抗生物質が、GlcNAc-P-P-Undの合成を阻害することが示されているが、それらはタンパク質N-グリコシル化経路を開始するドリコール-連結された中間体であるGlcNAc-P-P-ドリコールの合成も妨害するので、それらの有用性は限定されている。GlcNAc-P-P-ドリコールは、細菌の糖脂質中間体GlcNAc-P-P-Undの構造上関連した哺乳動物の対応物であるが、真核細胞においてはGlcNAc-P-P-ドリコールをGalNAc-P-P-ドリコールに変換する類似したエピマー化反応の証拠は存在しない。従ってこれは、還元末端にGalNAcを含む表面O-抗原が病理発生プロセスに関与している菌株において、細菌のエピメラーゼを阻害することによって、O-抗原合成が、潜在的に妨害される可能性を生じている。
【0077】
本発明の実施態様は、大腸菌O157において、GlcNAc-P-P-Und(N-アセチルグルコサミニルピロホスホリルウンデカプレノール)を、GalNAc-P-P-Und(N-アセチルガラクトサミニルピロホスホリルウンデカプレノール)に変換するエピメラーゼに関与している。なお更に本発明の例証的態様は、還元末端にGalNAcを有する脂質-結合した反復する四糖体の合成の開始に関与している。
【0078】
本発明の別の態様の基礎は、カンピロバクター・ジェジュニは、一般的N-連結されたタンパク質グリコシル化システムを含むことの発見を含む。C.ジェジュニの様々なタンパク質は、七糖類により修飾されることが示されている。この七糖類は、特異的グリコシルトランスフェラーゼにより触媒されたヌクレオチド活性化された単糖の段階的添加により、内側膜の細胞質側で、キャリア脂質ウンデカプレニルピロリン酸上に構築される。脂質-連結されたオリゴ糖は、次にフリッパーゼ、例えばPglKにより、ペリプラズム間隙へとフリップ-フロップする(横断して広がる)。N-連結されたタンパク質グリコシル化の最終工程において、オリゴサッカリルトランスフェラーゼ(例えば、PglB)は、キャリア脂質からコンセンサス配列D/E-X-N-Z-S/T内のアスパラギン(Asn)残基への、オリゴ糖の転移を触媒する(式中、X及びZは、Pro以外の任意の天然のアミノ酸であり得る)。七糖体に関するグリコシル化クラスターは、大腸菌へ巧く転移され、且つカンピロバクターのN-連結された糖タンパク質が生成されている。
【0079】
PglBは、脂質-連結された糖基質に対し厳密な特異性を有さないことが明らかにされた。ウンデカプレニルピロリン酸上に構築された抗原性多糖は、ペリプラズム内のPglBにより捕獲され、且つタンパク質キャリアへ転移される(Feldmanの文献、2005;Wacker, M.らの文献、「細菌及び真核生物のシステムの共通の転移機序を示唆する細菌オリゴサッカリルトランスフェラーゼの基質特異性(Substrate specificity of bacterial oligosaccharyltransferase suggests a common transfer mechanism for the bacterial and eukaryotic systems)、Proc Natl Acad Sci USA, 2006. 103(18): p.7088-93)。この酵素が還元末端にN-アセチル化されたヘキソサミンを含む場合、これはウンデカプレニルピロリン酸(UPP)連結されたオリゴ糖の多様なアレイも転移するであろう。pglBヌクレオチド配列及びPglBアミノ酸配列は、WO2009/104074に公開されている。
【0080】
従って本発明の一実施態様は、1つ以上の導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る);及び、還元末端に、N-アセチルガラクトサミンを有し、N-グリコシド結合により1以上の該導入されたコンセンサス配列の各々にN-連結されたオリゴ糖又は多糖:を含む、組換えN-グリコシル化タンパク質に関与している。
【0081】
更なる実施態様において、本発明は、ウンデカプレニルピロリン酸上にN-アセチルガラクトサミン("GalNAc")を合成するエピメラーゼを含む、多糖の全て又は一部を生成するための組換え原核細胞生合成システムに関する。更なる実施態様において、これらの多糖の全て又は一部は抗原性である。
【0082】
別の実施態様において、本発明は、ウンデカプレニルピロリン酸上でGalNAcを合成するエピメラーゼ;及び、還元末端にGalNAcを有する多糖を合成するグリコシルトランスフェラーゼ:を含む、組換え原核細胞生合成システムに関する。
【0083】
本発明の実施態様は、ウンデカプレニルピロリン酸上でGalNAcを合成するエピメラーゼ、及び、多糖を合成するグリコシルトランスフェラーゼ:を含む組換え原核細胞生合成システムを更に含み、ここで該多糖は、下記構造を有し:α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAc;且つ、ここでGalNAcは該多糖の還元末端に存在する。
【0084】
本組換え原核細胞生合成システムは、様々な起源の単糖、オリゴ糖又は多糖を生成することができる。本発明の実施態様は、様々な起源のオリゴ糖及び多糖に関する。そのようなオリゴ糖及び多糖は、原核細胞又は真核細胞を起源とすることができる。原核細胞起源のオリゴ糖又は多糖は、グラム陰性菌又はグラム陽性菌に由来してよい。本発明の一実施態様において、オリゴ糖又は多糖は、大腸菌に由来している。更なる本発明の態様において、該オリゴ糖又は多糖は、大腸菌O157に由来している。別の実施態様において、該オリゴ糖又は多糖は、下記構造を含む:α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAc。本発明の更なる実施態様において、オリゴ糖又は多糖は、シゲラ・フレックスネリに由来している。より更なる実施態様において、オリゴ糖又は多糖は、シゲラ・フレックスネリ6に由来している。より更なる態様において、該オリゴ糖又は多糖は、下記構造を含む。
【化1】

【0085】
本発明の実施態様は、様々な起源のタンパク質を更に含む。そのようなタンパク質は、原核生物及び真核生物について未変性のタンパク質を含む。タンパク質キャリアは、例えばAcrA、又はタンパク質グリコシル化のためのコンセンサス配列、すなわちD/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意のアミノ酸であり得る)(例えば、改変された外毒素緑膿菌(Pseudomonas aeruginosa)("EPA"))を含むように改変されたタンパク質キャリアであることができる。本発明の一実施態様において、タンパク質は、緑膿菌EPAである。
【0086】
本発明の更なる態様は、N-グリカンの還元末端にGalNAcを有する新規バイオコンジュゲートワクチンに関する。追加の本発明の実施態様は、ウンデカプレニルピロリン酸上にGalNAcを生成するエピメラーゼを含む組換え細菌細胞を使用する、そのようなバイオコンジュゲートワクチンを製造する新規アプローチに関与している。一実施態様において、バイオコンジュゲートワクチンは、細菌疾患を治療又は予防するために使用することができる。更なる実施態様において、バイオコンジュゲートワクチンは、癌又は他の疾患に関する治療的及び/又は予防的可能性を有し得る。
【0087】
典型的ヒトに関するワクチン接種用量は、約1〜25μg、好ましくは約1μg〜約10μg、最も好ましくは約10μgである。任意に、本発明のバイオコンジュゲートワクチンなどのワクチンは、アジュバントを含有する。
【0088】
追加の実施態様において、本発明は、オリゴサッカリルトランスフェラーゼをコードしているヌクレオチド配列;タンパク質キャリアをコードしているヌクレオチド配列;少なくとも1種の細菌由来の少なくとも1つの多糖の遺伝子クラスターであり、ここで多糖が還元末端にGalNAcを含むもの;及び、エピメラーゼをコードしている核酸配列:を含有する、少なくとも1種の細菌に対するバイオコンジュゲートワクチンを製造するための発現システムに関する。更なる実施態様において、多糖の遺伝子クラスターは、抗原性多糖をコードしている。
【0089】
なお更なる実施態様において、本発明は、オリゴサッカリルトランスフェラーゼをコードしているヌクレオチド配列;少なくとも1つの挿入されたコンセンサス配列D/E-X-N-Z-S/Tであり、ここでX及びZは、プロリン以外の任意の天然のアミノ酸であり得るものを含むタンパク質キャリアをコードしているヌクレオチド配列;少なくとも1種の細菌由来の少なくとも1つの多糖の遺伝子クラスターであり、ここで多糖が還元末端にGalNAcを含むもの;及び、Z3206遺伝子:を含有する、少なくとも1種の細菌に対するバイオコンジュゲートワクチンを製造するための発現システムに関する。更なる実施態様において、この多糖の遺伝子クラスターは、抗原性多糖をコードしている。
【0090】
更に別の実施態様において、本発明は、タンパク質キャリア;該タンパク質キャリアに連結された少なくとも1つの免疫原性多糖鎖であり、ここで該多糖が還元末端にGalNAcを有し、且つ更に該GalNAcがタンパク質キャリアに直接連結されているもの;及び、アジュバント:を含有する、バイオコンジュゲートワクチンに関する。
【0091】
更に追加の実施態様において、本発明は、少なくとも1つの挿入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る)を含むタンパク質キャリア;該タンパク質キャリアに連結された、少なくとも1種の細菌由来の少なくとも1つの免疫原性多糖であり、ここで少なくとも1つの免疫原性多糖が、タンパク質キャリアに直接連結されたGalNAcを還元末端に含むもの;及び、任意にアジュバント:を含有する、バイオコンジュゲートワクチンに関する。
【0092】
本発明の別の実施態様は、グリコシルトランスフェラーゼの使用を通じて、組換え生物において還元末端にGalNAcを有する多糖を構築する工程;該GalNAcを、該組換え生物における1種以上の標的タンパク質のアスパラギン残基へ連結する工程であって、ここで該1種以上の標的タンパク質が1つ以上のT-細胞エピトープを含む工程:を含む、バイオコンジュゲートワクチンの製造方法に関する。
【0093】
更なる実施態様において、本発明は、改変された原核生物を生じるために、原核生物へ標的タンパク質のN-グリコシル化を実行する代謝装置をコードしている遺伝情報を導入する工程であり;ここで1つ以上の組換え標的タンパク質の発現に必要とされる遺伝情報が、該原核生物に導入され;ここで大腸菌O157株エピメラーゼの発現に必要とされる遺伝情報が、該原核生物に導入され;並びに、ここで代謝装置は、脂質キャリア上の還元末端にGalNAcを有する多糖を構築する型のグリコシルトランスフェラーゼ、及びオリゴサッカリルトランスフェラーゼを含み、このオリゴサッカリルトランスフェラーゼは、多糖のGalNAcを標的タンパク質のアスパラギン残基に共有的に連結し、且つこの標的タンパク質は、少なくとも1つのT-細胞エピトープを含むものである工程;改変された原核生物の培養物を生じる工程;並びに、培養培地からグリコシル化タンパク質を得る工程:を含む、バイオコンジュゲートワクチンの製造方法に関する。
【0094】
本発明の更なる態様は、医薬組成物に関する。本発明の追加の態様は、本発明の少なくとも1つのN-グリコシル化タンパク質を含有する医薬組成物に関与している。本明細書の開示に照らして、タンパク質を含有する医薬品の調製は、当該技術分野において周知であろう。本発明のなお更なる態様は、GlcNAc-P-P-UndをGalNAc-P-P-Undへ変換するエピメラーゼを阻害する抗生物質を含有する医薬組成物に関する。好ましい実施態様において、本発明の医薬組成物は、医薬として許容し得る賦形剤、希釈剤及び/又はアジュバントを含有する。
【0095】
好適な賦形剤、希釈剤及び/又はアジュバントは、当該技術分野において周知である。賦形剤又は希釈剤は、活性成分の溶媒又は媒体として役立つ固体、半固体又は液体の物質であることができる。組成物調製の分野の当業者は、選択された製品の具体的特徴、治療される疾患又は状態、疾患又は状態の病期、及び他の関連状況に応じ適切な投与の形状及び様式を容易に選択することができる(「レミントン薬科学(Remington's Pharmaceutical Sciences)」、Mack Publishing Co. (1990))。医薬として許容し得る希釈剤又は賦形剤の割合及び性質は、選択された医薬活性化合物の溶解度及び化学特性、選択された投与経路、並びに標準の薬務により決定される。医薬品調製品は、経口、非経口又は局所使用に適合されることができ、且つ錠剤、カプセル剤、坐剤、液剤、懸濁剤などの形状で患者へ投与されることができる。本発明の医薬活性化合物は、それら自身が有効である一方、安定性、結晶化の簡便性、溶解度の上昇などの目的で、酸付加塩又は塩基付加塩などのそれらの医薬として許容し得る塩の形状で製剤され且つ投与されることができる。
【0096】
特定のヌクレオチド配列又はアミノ酸配列に留意する場合には、本発明は、留意された配列と同じ機能性を依然体現している相同配列を包含することは理解されるであろう。本発明の実施態様において、そのような配列は少なくとも85%相同である。別の実施態様において、そのような配列は少なくとも90%相同である。なお更なる実施態様において、そのような配列は少なくとも95%相同である。
【0097】
2つのヌクレオチド配列又はアミノ酸配列の間の同一性の割合の決定は、当業者に公知である。
【0098】
以下に列挙された配列において説明されたもののような、本明細書に記載された核酸配列は、単なる例証であり、これらの配列は様々な方法で組み合わせることができることは当業者には明らかであろう。
【0099】
本発明の追加の実施態様は、核酸の変異形を含む。核酸の変異形(例えば、コドン-最適化核酸)は、配列番号:1、配列番号:3、配列番号:5、配列番号:7、配列番号:9、配列番号:11、配列番号:13、配列番号:15、配列番号:17、配列番号:18、配列番号:19、配列番号:20、配列番号:21、配列番号:22、配列番号:23、配列番号:24、配列番号:27、配列番号:28又は配列番号:29と実質的に同一、すなわち、少なくとも80%同一、例えば、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は99.5%同一である。配列番号:1、配列番号:3、配列番号:5、配列番号:7、配列番号:9、配列番号:11、配列番号:13、配列番号:15、配列番号:17、配列番号:18、配列番号:19、配列番号:20、配列番号:21、配列番号:22、配列番号:23、配列番号:24、配列番号:27、配列番号:28又は配列番号:29を含む配列の核酸変異形は、配列番号:1、配列番号:3、配列番号:5、配列番号:7、配列番号:9、配列番号:11、配列番号:13、配列番号:15、配列番号:17、配列番号:18、配列番号:19、配列番号:20、配列番号:21、配列番号:22、配列番号:23、配列番号:24、配列番号:27、配列番号:28又は配列番号:29、若しくはそれらの一部を含む配列から、1個以上のヌクレオチド(例えば、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175又は200個のヌクレオチド)の置換、変異(variation)、修飾、交換、欠失及び/又は付加を伴う核酸を含む。
【0100】
例えば、本発明の実施態様において、そのような変異形は、GlcNAc-P-P-UndをGalNAc-P-P-Undへ変換するエピメラーゼをコードしている核酸であって、並びにi)例えば大腸菌などの宿主細胞において発現され、且つii)配列番号:1、配列番号:3、配列番号:5、配列番号:7若しくは配列番号:9、又はそれらの一部と実質的に同一である核酸を含む。
【0101】
本明細書に記載された核酸は、組換えDNA及び合成(例えば化学的に合成された)DNAを含む。核酸は、二本鎖又は一本鎖であることができる。一本鎖の核酸である場合、核酸はセンス鎖又はアンチセンス鎖であることができる。核酸は、オリゴヌクレオチド類似体又は誘導体を用いて合成することができる。
【0102】
本明細書に記載された核酸を含むプラスミドは、発現のために宿主細胞へと形質導入又は形質転換されることができる。形質導入及び形質転換の技術は、当業者に公知である。
【0103】
本明細書において言及された全ての刊行物は、それらの全体が引用により組み込まれている。本明細書において使用される用語「又は」は、適宜組み合わせることができる代替を意味し;すなわち、用語「又は」は、個別に列挙された代替の各々に加え、それらの組合せを含むと理解されるべきである。本明細書において使用されるように、文脈が別に明確に指摘しない限りは、単数形「1つ(a、an、及びthe)」などの単数の言及は、複数を含み、且つ複数の言及は単数を含む。
【0104】
本発明は、本発明の組成物及び方法に加え、その利用性を更に説明している下記実施例を参照し、更に規定される。当業者には、本発明の範囲内である組成物及び方法の両方の改変を実施することができることは明らかであろう。
【実施例】
【0105】
(実施例)
(細菌株及びプラスミド)−大腸菌PR4019株(Rush, J. S.、Rick, P. D.及びWaechter, C. J.の文献、(1997) Glycobiology, 7, 315-322)、及びPR21546株(Meier-Dieter, U.、Starman, R.、Barr, K.、Mayer, H.及びRick, P. D.の文献、(1990) J. Biol. Chem., 265, 13490-13497)は、Dr. Paul Rick(ベセスダ、MD)のご厚意により贈られ、並びに大腸菌O157:H45(Stephan, R.、Borel, N.、Zweifel, C.、Blanco, M.、及びBlanco, J.E.の文献、(2004) BMC Microbiol 4:10)は、Dr. Claudio Zweifel(チューリッヒ大学獣医学研究所)から贈答されたものであった。大腸菌DH5α(Invitrogen社)を、クローニング実験及びタンパク質グリコシル化分析のための宿主として使用した。使用したプラスミドを、表2に列挙した。
【表2】

【0106】
(材料)−[1,6-3H]GlcNAc(30Ci/mmol)、UDP-[1-3H]GlcNAc(20Ci/mmol)及びUDP-[6-3H]GalNAc(20Ci/mmol)は、American Radiolabeled Chemicals社(セントルイス、MO)から入手した。Quantum 1シリカゲルG薄層プレートは、Quantum Industries社(フェアフィールド、NJ)の製品であり、且つBaker Si250シリカゲルGプレートは、Mallinckrodt Chemical Works社により製造されている。酵母エキス及びバクトペプトンは、BD Biosciences社の製品であった。他の化学物質は全て、標準の商業的供給業者から入手した。トリメトプリム(50μg/ml)、クロラムフェニコール(20μg/ml)、アンピシリン(100μg/ml)、及びカナマイシン(50μg/ml)は、必要に応じ培地に添加した。
【0107】
(組換えプラスミドの作製)−大腸菌DH5α株を、DNAクローニング実験に使用し、作製されたプラスミドを、DNA配列決定により検証した。Z3206遺伝子を、大腸菌O157:H45から、オリゴヌクレオチドZ3206-Fw及びZ3206-RvHA
【化2】

;(制限部位には下線が付けられている)を用いるPCRにより、増幅した。PCR断片を、SmaI及びXbaIにより消化し、SmaI-XbaI切断されたpMLBADベクター(Lefebre, M. D.及びValvano M. A.の文献、(2002) Appl Environ Microbiol 68: 5956-5964)にライゲーションした。これは、C-末端に赤血球凝集素タグを持つZ3206をコードしているプラスミドpMLBAD:Z3206(配列番号:23)を生じた。
【0108】
gne遺伝子は、オリゴヌクレオチドgne-Fw及びgne-RV
【化3】

;(制限部位には下線が付けられている)により、カンピロバクター・ジェジュニpglクラスターをコードしているpACYCpgl(Wacker, M.、Linton, D.、Hitchen, P.G.、Nita-Lazar, M.、Haslam, S.M.、North, S.J.、Panico, M.、Morris, H.R.、Dell, A.、Wrenn, B.W.、Aebi, M.の文献、(2002) Science 298, 1790-1793)から増幅した。PCR産物を、NcoI及びXbaIで消化し、pMLBADの同じ部位にライゲーションし、C-末端に赤血球凝集素タグを持つGneをコードしているプラスミドpMLBAD:gne(配列番号:24)を生成した(表2)。
【0109】
(増殖条件、タンパク質発現及び免疫検出)−大腸菌株を、Luria-Bertani培地(1%酵母エキス、2%バクト-ペプトン、0.6%NaCl)において、37℃で激しく振盪しながら培養した。A600が0.05〜0.4となるまで増殖させた大腸菌細胞へ、最終濃度0.02〜0.2%(w/v)となるようアラビノースを添加することにより、アラビノース誘導性発現を実現した。同量のアラビノースを、誘導後5時間で再度添加し、インキュベーションを4〜15時間継続した。
【0110】
(分析手順)−タンパク質濃度は、Pierce Biotechnology社の公報「BCAタンパク質アッセイのための試料からの干渉物質の除去(Eliminate Interfering Substances from Samples for BCA Protein Assay)」に従い、デオキシコール酸及びトリクロロ酢酸による膜タンパク質の沈殿後、BCAタンパク質アッセイ(Pierce社)を使用し決定した。試料は、Packard社Tri-Carb 2100TR液体シンチレーションスペクトロメーターにおいて、1%SDS 0.5ml及びEconosafe Economical Biodegradable Counting Mixture(Research Products International社、マウントプロスペクト、IL)4mlの添加後、シンチレーションスペクトロメーターにより、放射能について分析した。
【0111】
(実施例1:GlcNAc-P-P-Und 4-エピメラーゼをコードしている大腸菌O157遺伝子の同定)
本出願人らは、本明細書において、GalNAc-P-P-Undが、これまで未知の4-エピメラーゼの作用により触媒されるGlcNAc-P-P-Undの4-OHのエピマー化により形成される新規生合成経路の驚くべき発見を記載する。この経路において、GlcNAc-P-P-Undは、WecAにより触媒されるUDP-GlcNAcからのGlcNAc-Pの転移により合成され、次にGlcNAc-P-P-Undは、GlcNAc-P-P-Und-4-エピメラーゼによりGalNAc-P-P-Undへエピマー化され、これはこれまで未知の経路である(図2)。
【0112】
GlcNAc-P-P-Und 4-エピメラーゼの候補をコードしている遺伝子は、DNAホモロジー検索により同定された。ホモロジー検索は、http://blast.ncbi.nlm.nih. gov/Blast.cgiにおいて認められる、米国国立医学図書館(NLM)データベースを用い行った。還元末端にGalNAcを有するO-抗原反復単位をコードしている様々な細菌のゲノム配列を検索した。還元末端にGalNAcを含む反復単位を持つ第一群、反復単位に末端GalNAcを欠いている第二群を比較し、可能性のあるエピメラーゼを同定した。これらの分類基準を用い、Z3206を、候補GlcNAc-P-P-Und 4-エピメラーゼとして同定した(表1)。
【0113】
GalNAcを含むO-抗原反復単位を有する大腸菌株に存在するGlcNAc 4-エピメラーゼ遺伝子は、表1に示されたように2つのホモロジー群に分けることができる。驚くべきことに、第一のホモロジー群(gne1を含む)は、O-抗原反復単位上の開始の糖としてのGalNAcの存在に明確に相関していることを発見した。更に驚くべきことに、第二群(gne2を含む)は、UDP-GlcエピメラーゼGalEと高度の類似性を示し、且つこれはGalNAcを持つO-抗原反復単位合成を開始しない大腸菌株において認められることを発見した。大腸菌O157におけるZ3206は、gne1と高度の相同性を持つ遺伝子であるが、これは候補GlcNAc-P-P-Und 4-エピメラーゼとして同定された。Z3206遺伝子はO-抗原クラスターのgalFとコラン酸クラスターに属するwcaMの間に存在するので、Z3206遺伝子のゲノム位置は、この経路における役割と一致している。
【0114】
実施例2〜11に説明された研究は、GalNAc-P-P-Undの形成を触媒するものとしてのGlcNAc 4-エピメラーゼ(大腸菌O157のZ3206)の同定を含む、前記発見を更に確認している。
【0115】
(実施例2:UDP-GalNAcは大腸菌WecA(GlcNAc-ホスホトランスフェラーゼ)の基質でない)
大腸菌WecAは、GalNAc-P-P-Undを形成するためのGalNAc-P供与体としてUDP-GalNAcを利用するかどうかを決定するために、GalNAc-P-P-Undの合成により恐らく開始される還元末端にGalNAcを持つ四糖体O-抗原反復単位を合成する大腸菌K12株、PR4019株、WecA-過剰発現株、及びO157株由来の膜画分を、UDP-[3H]GalNAcと一緒にインキュベートした。
【0116】
(大腸菌膜の調製)−細菌細胞を、1,000×gで10分間の遠心分離により収集し、氷冷したリン酸-緩衝食塩水中で1回、冷水で1回、及び10mMトリス-HCl(pH7.4)、0.25Mショ糖で1回洗浄した。これらの細胞を、0.2mg/mlリゾチームを含有する10mMトリス-HCl(pH7.4)、0.25Mショ糖、10mM EDTAの中に、密度〜200A600単位/mlとなるよう再懸濁し、30℃で30分間インキュベートした。細菌細胞を、1,000×gで10分間の遠心分離により回収し、40倍容量の氷冷した10mMトリス-HCl(pH7.4)中に迅速に再懸濁し、且つ氷上に放置した。10分後、細胞を、ぴったりはまったDounceホモジナイザーを用い15ストロークさせてホモジナイズし、0.1mMフッ化フェニルメチルスルホニル及びショ糖を補充し、最終濃度を0.25Mとした。破壊されていない細胞を、1,000×gで10分間の遠心分離により除去し、細胞エンベロープを、40,000×gで20分間の遠心分離により回収した。膜画分を、10mMトリス-HCl(pH7.4)、0.25Mショ糖、1mM EDTA中に再懸濁し、且つ40,000×gで再度沈降させ、同じ緩衝液中に、タンパク質濃度〜20mg/mlとなるよう再懸濁した。膜画分を、必要になるまで、-20℃で貯蔵した。
【0117】
(インビトロ大腸菌膜における[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの生合成のアッセイ)−GlcNAc-P-P-Und及びGalNAc-P-P-Undの合成のための反応混合物は、総容積0.05ml中に50mMトリス-HCl(pH8)、40mM MgCl2、5mMジチオスレイトール、5mM 5'AMP、大腸菌膜画分(50〜200μg膜タンパク質)、及び5μM UDP-[3H]GlcNAc/GalNAcのいずれか(500〜2500dpm/pmol)を含有した。37℃でインキュベーションした後、40倍容量のCHCl3/CH3OH(2:1)を添加することにより、反応を停止し、且つ[3H]HexNAc-P-P-ウンデカプレノールを含有する総脂質抽出物を、先に説明されたように調製した(Waechter, C. J.、Kennedy, J. L.及びHarford, J. B.の文献、(1976) Arch. Biochem. Biophys. 174, 726-737)。分配後、有機相を、窒素流下で乾燥し、CHCl3/CH3OH(2:1) 1ml中に再溶解し、且つアリコート(0.2ml)を取り出し、シンチレーションバイアル中で乾燥し、Packard社Tri-Carb 2100 TR液体シンチレーションスペクトロメーターにおいて液体シンチレーション分光法により放射能を分析した。[3H]GlcNAc-P-P-Und又は[3H]GalNAc-P-P-Undの合成の割合を決定するために、脂質抽出物を、窒素流下で乾燥し、少量のCHCl3/CH3OH(2:1)中に再溶解し、10cm×20cmのホウ酸含浸したBaker Si250シリカゲルプレート上にスポットし、且つこのプレートを、CHCl3、CH3OH、H2O、0.2Mホウ酸ナトリウム(65:25:2:2)で呈色した。個別の糖脂質を、Bioscan AR2000画像スキャン装置(Bioscan社、ワシントンD.C.)により検出した。各糖脂質の生合成の割合は、[3H]GlcNAc/GalNAc-P-P-Und中の放射能の総量に、個別の[3H]糖脂質の百分率を乗することにより、算出した。
【0118】
様々な大腸菌株(K12、PR4019及びO157)由来の膜画分を、UDP-[3H]GlcNAc又はUDP-[3H]GalNAcのいずれかと一緒にインキュベートし、[3H]GlcNAc/GalNAc-P-P-Undへの取り込みを、前述のように決定した。表3に認められるように、非標識の糖脂質が、UDP-[3H]GalNAcとのインキュベーション後に検出され、膜画分をUDP-[3H]GlcNAcと一緒にインキュベートした場合には、GlcNAc-P-P-Undのみが検出可能であった。
【表3】

【0119】
更に、PR4019株、WecA-過剰発現株由来の膜とのインキュベーションへの外因性Und-Pの添加も、O157細胞由来の細胞質ゾル画分の添加も、UDP-GalNAcからのGalNAc-P-P-Undの形成を生じなかった。これらの結果は、UDP-GalNAcは、WecAにとっての基質ではないことを明らかにし、且つGalNAc-P-P-Undは、別の機序により形成されることを示唆している。
【0120】
K12株由来の膜を、UDP-[3H]GlcNAcと一緒にインキュベートする場合、予想されたように[3H]GlcNAc-P-P-Undが合成された(Rush, J. S.、Rick, P. D.及びWaechter, C. J.の文献、(1997) Glycobiology, 7, 315-322)。しかし、O157株由来の膜を、[3H]GlcNAc-P-P-Undに加え、UDP-[3H]GlcNAcと一緒にインキュベートする場合、[3H]GalNAc-P-P-Undであることが示された第二の標識された脂質(下記参照)が認められた。これら2種の糖脂質の形成の時間経過を試験する場合、放射能の[3H]GlcNAc-P-P-Undへの取り込み(図1、○)は、より迅速に生じ、且つ前駆体-生成物の関係が同等である(図2)[3H]GalNAc-P-P-Undへの取り込み(図1、●)よりもより高度であった。
【0121】
大腸菌O157膜は、GalNAc-P-P-Undの合成のためのGalNAc-P供与体としてUDP-GalNAcを利用しないという知見は、図2に図示されたGalNAc-P-P-Undの形成に関する生合成経路を確認する一例である。このスキームにおいて、GlcNAc-P-P-Undは、WecAにより触媒された、UDP-GlcNAcからのGlcNAc-Pの転移により形成され、その後GlcNAc-P-P-Undは、これまで未知の4-エピメラーゼの作用によりエピマー化され、GalNAc-P-P-Undを生成する。
【0122】
(実施例3:大腸菌O157株由来の膜画分によりインビトロにおいて形成された[3H]GalNAc-P-P-Undの特徴決定)
GalNAc-P-P-Undとして図1において検出された追加のO157-特異的糖脂質生成物と同じく、これは弱アルカリメタノリシス(トルエン/メタノール1:3、0.1N KOH含有、0℃、60分間)に対して安定であり、CHCl3/CH3OH/H2O(10:10:3)中に平衡とされたDEAE-セルロースに保持され、且つ[3H]GlcNAc1-2-P-P-Dolについて先に報告されたように(Waechter, C. J.及びHarford, J. B.の文献、(1977) Arch. Biochem. Biophys. 181, 185-198)、20mM酢酸アンモニウムを含有するCHCl3/CH3OH/H2O(10:10:3)で溶離された。
【0123】
[3H]GalNAc-P-P-Undは、ホウ酸含浸シリカゲルG上の薄層クロマトグラフィーにより(Kean, E. L.の文献、(1966) J. Lipid Res. 7, 449-452)、[3H]GlcNAc-P-P-Undから明確に分離され、且つ図3A及び図3Bに示されたように、分取TLCにより精製された。
【0124】
(ホウ酸含浸薄層プレート及びワットマン濾紙No.1の調製)−シリカゲル薄層プレートは、Keanの文献(Kean, E. L.、(1966) J. Lipid Res. 7, 449-452)に説明されたように、これらのプレートを95%メタノールを溶媒とする2.5%Na2B4O7・10H2O中に短時間含浸することにより、ホウ酸ナトリウムで含浸した。ホウ酸含浸TLCプレートを、室温で一晩乾燥し、使用時までDrierite上の真空デシケーター内で貯蔵した。クロマトグラフィーの直前に、これらのプレートを、100℃に短時間(〜10-15分間)加熱することにより活性化した。ワットマン濾紙No.1の20cm×30cmシートを0.2MのNa2B4O7・10H2O中に浸漬することにより、ワットマン濾紙No.1をホウ酸ナトリウムで含浸した。Cardini及びLeloirの文献(Cardini, C. E.及びLeloir, L. F.、(1957) J. Biol. Chem. 225, 317-324)に記載されているように、ワットマン濾紙No.1シートを、ワットマン濾紙No.3MMの2枚のシートの間でしっかり圧迫し、室温で数日間かけて乾燥させた。
【0125】
(インビトロ反応において形成されたグリカン生成物の特徴決定)−個別の糖脂質([3H]GalNAc-P-P-Und及び[3H]GlcNAc-P-P-Und)のグリカンを、弱酸加水分解による放出後に、下降ペーパークロマトグラフィーにより特徴決定した。GlcNAc/GalNAc脂質は、コニカルスクリューキャップ付きチューブ内で窒素流下で乾燥し、0.01M HClの0.2ml中で、100℃で15分間加熱した。加水分解後、試料を、AG50WX8(H+)の0.4ml及びAG1X8(酢酸塩型)0.4mlを含む、0.8mlの混合床型イオン交換カラムに適用し、且つ水1.5mlで溶離した。溶離液を、窒素流れ下で乾燥し、少量のH2O(0.02ml)中に再溶解し、ホウ酸含浸ワットマン濾紙No.1の30cm細長片上にスポットし、且つ40〜50時間かけて、ブタノール/ピリジン/水(6:4:3)により下降モードで展開した。乾燥後、濾紙細長片を、1cmの帯状に切断し、シンチレーションスペクトロメーターにより放射能を分析した。GlcNAc及びGalNAc標準を、アニリン-ジフェニルアミン浸漬試薬を用いて検出した(Schwimmer, S.及びBenvenue, A.の文献、(1956) Science, 123, 543-544)。
【0126】
グリカン生成物は、先に説明されたような、弱酸加水分解後の、0.1M NaOHを溶媒とする0.1M NaBH4(最終容積0.1ml)による還元により、それらの対応するアルジトールへ変換された。室温で一晩インキュベーションした後、氷酢酸数滴により反応をクエンチし、且つ窒素流下で、酢酸1滴を含有するメタノールで数回乾燥した。アルジトールを水に溶解し、AG50WX8(H+)及びAG1X8(酢酸塩)の0.5mlカラム上の通過により脱塩し、窒素下で乾燥し、且つワットマン濾紙No.3MMの30cm細長片上にスポットした。ワットマンNo.3MM細長片を、酢酸エチル、ピリジン、0.1Mホウ酸(65:25:20)により下降モードで一晩展開し、乾燥し、1cmの帯状に切断し、シンチレーション分光法により放射能を分析した。GlcNAcitol及びGalNAcitol標準を、過ヨウ素酸-ベンジジン浸漬手法(Gordon, H. T.、Thornburg, W.及びWerum, L. N.の文献、(1956) Anal. Chem. 28, 849-855)の変法を用いて可視化した。これらの濾紙細長片を、アセトン、0.1M NaIO4(95:5)中に浸漬し、3分間風乾させ、その後アセトン/酢酸/H2O/o-トリジン(96:0.6:4.4:0.2g)中に浸漬した。cis-ジオールを含有するアルジトールは、青色のバックグラウンド上に黄色スポットとして染まった。
【0127】
(糖脂質の質量分析("MS"))−精製された糖脂質を、ABI Turbo Vエレクトロスプレーイオン給源を備えたABI/MDS Sciex 4000 Q-Trapハイブリッド三連四重極直列式イオントラップ型質量分析計を用いて分析した(ABI/MDS-Sciex社、トロント、カナダ)。簡単に述べると、試料を、経験的に決定されたイオン源設定で10μl/分で注入し、且つMS/MS(二次元での質量分光法)情報を、直列式イオントラップ様式での分子イオンのフラグメンテーションにより得た。
【0128】
糖脂質を、弱酸(0.01N HCl、100℃、15分間)で処理する場合、水溶性生成物を、ホウ酸含浸したワットマン濾紙No.1による下降ペーパークロマトグラフィー上での[3H]GalNAcとの同時クロマトグラフィーにかけた(図3C)。加えて、標識された糖が還元された場合、これは[3H]アルジトール、GalNAc-OHへ変換された(図3D)。更に、陰イオンMS分析は、m/z=1128の[M-H]-イオンを生じ、これはGalNAc-P-P-Undと予想され、且つMS/MS娘イオンスペクトルは、m/z=907に突出したイオンを示し、これはP-P-Undを含む糖脂質と予想された(Guan, Z.、Breazeale, S. D.及びRaetz, C. R.の文献、(2005) Anal. Biochem. 345, 336-339)。GalNAc-P-P-UndとしてO157株により形成された糖脂質生成物の同定は、外因性GlcNAc-P-P-Undからのその形成によっても裏付けられる(実施例7参照)。
【0129】
(実施例4:Z3206遺伝子を発現している大腸菌細胞における[3H]GlcNAcによる[3H]GalNAc-P-P-Und(インビボ)の代謝標識)
大腸菌O157 Z3206遺伝子の発現は、細胞にGalNAc-P-P-Und合成を可能にするかどうかを調べるために、Z3206遺伝子を発現している大腸菌株21546(Meier-Dieter, U.、Starman, R.、Barr, K.、Mayer, H.及びRick, P. D.の文献、(1990) J. Biol. Chem., 265, 13490-13497)を、[3H]GlcNAcで代謝的に標識し、且つ[3H]GlcNAc/GalNAc-P-P-Und形成について分析した。
【0130】
(細菌細胞の代謝標識)−大腸菌細胞を、Luria-Bertani培地において、37℃で激しく振盪しながら、A600が0.5〜1となるまで培養した。[3H]GlcNAcを、最終濃度1μCi/mlとなるよう添加し、インキュベーションを37℃で5分間継続した。放射標識の糖脂質への取り込みは、破砕した氷0.5gm/mlの添加により終結させ、培養物を完全に混合した。細菌細胞を、4000×gで10分間の遠心分離により回収し、上清を廃棄した。これらの細胞を、氷冷したリン酸-緩衝食塩水で2回洗浄し、(細胞ペレットの)10倍容量のメタノール中で激しくボルテックス混合することにより再懸濁し、プローブソニケーターにより全出力の40%で短時間超音波処理した。超音波処理後、20倍容量のクロロホルムを添加し、この抽出物を激しく混合し、且つ室温で15分間静置させた。不溶性物質を、遠心分離により沈降させ、ペレットを、少量のCHCl3/CH3OH(2:1)により2回再抽出した。その後一緒にした有機抽出液を、以下に説明したように処理した。
【0131】
(GlcNAc-P-P-Und及びGalNAc-P-P-Undの精製)−GlcNAc/GalNAc-P-P-Undを、CHCl3/CH3OH(2:1)により抽出し、別所に記載したように分配することにより水溶性物質を含まないようにした(Waechter, C. J.、Kennedy, J. L.及びHarford, J. B.の文献、(1976) Arch. Biochem. Biophys. 174, 726-737)。その後有機抽出液を、窒素流下で乾燥し、0.1N KOHを含有するトルエン/メタノール(1:3)中の0℃で60分間の脱アシル化により、バルクグリセロリン脂質を破壊した。この脱アシル化反応を、酢酸で中和し、4倍容量のCHCl3/CH3OH(2:1)により希釈し、且つ1/5倍容量の0.9%NaClにより洗浄した。有機(下側)相を、1/3倍容量のCHCl3、CH3OH、0.9%NaCl(3:48:47)で洗浄し、水相を廃棄した。有機相を、この有機相中に残留する水相を収容するのに十分量のメタノールで希釈し、CHCl3/CH3OH(2:1)により平衡としたDEAE-セルロースカラム(5ml)に装加した。このカラムを、20倍カラム容量のCHCl3/CH3OH/H2O(10:10:3)で洗浄し、その後20mM酢酸アンモニウムを含有するCHCl3/CH3OH/H2O(10:10:3)で溶離した。画分(2ml)を収集し、ホウ酸含浸シリカプレート上の薄層クロマトグラフィー(前記)による分離後、放射能、又はアニスアルデヒド噴霧試薬を使用するGlcNAc/GalNAc-P-P-Und(Dunphy, P. J.、Kerr, J. D.、Pennock, J. F.、Whittle, K. J.、及びFeeney, J.の文献、(1967) Biochim. Biophys. Acta 136, 136-147)のいずれかについてモニタリングした。
【0132】
UDP-ManNAcA合成の突然変異は、腸内細菌共通抗原の合成のためのGlcNAc-P-P-Undの利用の阻止を招くので、大腸菌21546株を、Z3206発現試験のための宿主として選択した。大腸菌21546は、大腸菌K12から誘導されるので、同様にこれもO-抗原反復を合成せず(Stevenson, G.、Neal, B.、Liu, D.、Hobbs, M.、Packer, N. H.、Batley, M.、Redmond, J. W.、Lindquist, L.及びReeves, P.の文献、(1994) J. Bacteriol., 176, 4144-4156)、その結果より大量のGlcNAc-P-P-Undが、GalNAc-P-P-Undへの変換のために蓄積する。菌株21546及びZ3206遺伝子を発現する形質転換体を、[3H]GlcNAcで標識し、これらの放射標識された脂質を、ホウ酸含浸シリカゲルプレート上の薄層クロマトグラフィーにより分析し、親株(図4A)は、わずかに1種の標識された脂質GlcNAc-P-P-Undを合成した。しかしZ3206遺伝子を発現している21546細胞は(図4B)、追加の標識された脂質も合成し、これはGalNAc-P-P-Undであることが示された。
【0133】
(実施例5:Z3206遺伝子を発現している大腸菌細胞由来の膜画分はインビトロにおいてGalNAc-P-P-Undを合成する)
大腸菌O157のZ3206遺伝子によりコードされたタンパク質が、GalNAc-P-P-Undの合成を触媒したことを裏付けるために、Z3206遺伝子を発現している大腸菌細胞由来の膜画分を、[3H]UDP-GlcNAcと一緒にインキュベートし、且つ[3H]糖脂質生成物を、図5に示したようにホウ酸含浸シリカゲルプレート上で薄層クロマトグラフィーにより分析した(クロマトグラフィー調製及び特徴決定の方法は実施例3に説明されている)。大腸菌K12又は宿主株大腸菌21546細胞由来の膜画分を、UDP-[3H]GlcNAcと一緒にインキュベートした場合、[3H]GlcNAc-P-P-Undのみ認められた(図5A及び図5C)。しかし、Z3206を発現している大腸菌O157及び大腸菌21546由来の膜画分は、GalNAc-P-P-Undも形成した(図5B及び図5D)。
【0134】
(実施例6:GlcNAc-P-P-Undの形成はUMPの存在下で逆転されるがGalNAc-P-P-Undは逆転されない)
GalNAc-P-P-UndはGlcNAc-P-P-Undから合成され、且つグリコシル供与体としてUDP-GalNAcを使用するWecAの作用によっては合成されないことの更なる証拠を提供するために、UMPによる内在性の予備標識された[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの放出の作用を試験した。WecAにより触媒されるGlcNAc-ホスホトランスフェラーゼ反応は、過剰なUMPの添加により自在に可逆性となり、UDP-GlcNAcを再合成し、且つUnd-Pを放出する。
【0135】
この実験において、Z3206を発現している大腸菌21546株由来の膜画分を、UDP-[3H]GlcNAcで10分間予備標識し、引き続き1mM UMPを添加し、残存する各標識された糖脂質の量を測定した。図6Aに図示された結果は、10分間の標識期間の終了時の、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの相対量を示している。1mM UMPと一緒の1分間のインキュベーション後、[3H]GlcNAc-P-P-Undのかなりの喪失が認められたのに対し、[3H]GalNAc-P-P-Undのピークは比較的変化がなかった(図6B)(クロマトグラフィー調製及び特徴決定の方法は実施例5に説明されている)。この知見は、表3の結果と一致しており、WecAは、UDP-GalNAcからGalNAc-P-P-UndへのGalNAc-Pの転移を触媒しないことを指摘している。UMPとの2分間のインキュベーション期間中(図6C)に、GlcNAc-P-P-Undの喪失は遅くなり、[3H]GalNAc-P-P-Undのピークのわずかな低下が存在することは注目に値し、これは[3H]GalNAc-P-P-Undは、エピメラーゼ反応の逆転により[3H]GlcNAc-P-P-Undプールと再度平衡となることを示唆している(実施例7参照)。
【0136】
(実施例7:Z3206を発現している大腸菌細胞由来の膜により触媒された外因性の精製された[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの相互変換)
GlcNAc-P-P-Und及びGalNAc-P-P-Undが、Z3260を発現している大腸菌細胞由来の膜画分により直接相互変換され得ることの直接の証拠を提供するために、精製された[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undを、外因性基質として試験した。
【0137】
精製された[3H]GlcNAc-P-P-Und/[3H]GalNAc-P-P-Undは、実施例4(細菌細胞の代謝標識並びにGlcNAc-P-P-Und及びGalNAc-P-P-Undの精製)のように調製した。[3H]HexNAc-P-P-ウンデカプレノール(2000 dpm/pmol、1%Triton X-100中に分散された、最終濃度0.1%)を、実施例2のインビトロにおける大腸菌膜中の[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Und生合成のアッセイのように大腸菌膜と一緒にインキュベートした。
【0138】
予備実験からは、エピメラーゼは、外因性[3H]GlcNAc-P-P-Undを、Triton X-100、CHAPS(3-[(3-コラミドプロピル)ジメチルアンモニオ]-1-プロパンスルホン酸)、Nonidet P-40、又はオクチルグルコシド中に分散された反応混合物に添加した場合に、活性化され、且つpH7〜8.5の範囲に最適pHを示したことが認められた。膜画分と一緒のインキュベーション前の精製された[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undのクロマトグラフィー移動度を、図7A及び図7Dに示している。図7B及び図7Eに示されるように、糖脂質は、大腸菌21546由来の膜画分と一緒のインキュベーションにより影響を受けなかった。しかし、精製された糖脂質のZ3206を発現している大腸菌21546由来の膜画分と一緒のインキュベーションは、外因性[3H]GlcNAc-P-P-Undの[3H]GalNAc-P-P-Undへの変換(図7C)及び[3H]GalNAc-P-P-Undの[3H]GlcNAc-P-P-Undへの変換(図7F)を触媒した。これらの結果は、GlcNAc-P-P-Und及びGalNAc-P-P-Undは、Z3206を発現している大腸菌株において酵素的に相互変換することができることを直接明らかにする。
【0139】
(実施例8:大腸菌Z3206はUDP-GlcNAc 4-エピメラーゼではない)
Z3206はUDP-GalNAcの形成を触媒することができるかどうかを決定するために、C.ジェジュニ由来のN-グリコシル化装置を、大腸菌において発現した。このリポーターシステムにおいて、標的タンパク質AcrAのグリコシル化は、機能的Gne UDP-Glc/UDP-GlcNAcエピメラーゼ(Bernatchez, S.、Szymanski, C.M.、Ishiyama, N.、Li, J.、Jarrell, H.C.、Lau, P.C.、Berghuis, A.M.、Young, N.M.、Wakarchuk, W.W.の文献、(2005) J. Biol. Chem. 280, 4792-4802)を含む、pgl遺伝子座の存在に左右された(Wacker, M.、Linton, D.、Hitchen, P.G.、 Nita-Lazar, M.、Haslam, S.M.、North, S.J.、Panico, M.、Morris, H.R.、Dell, A.、Wrenn, B.W.、Aebi, M.の文献、(2002) Science, 298, 1790-1793)。pglクラスターがgneの欠失を含む場合に、AcrAのグリコシル化が失われた(Linton, D.、 Dorrell, N.、Hitchen, P.G.、Amber, S.、Karlyshev, A.V.、Morris, H.R.、Dell, A.、Valvano, M.A.、Aebi, M.及びWren, B.W.の文献、(2005) Mol Microbiol. 55, 1695-1703)。pglオペロンΔgneの存在下でAcrA-グリコシル化を回復するZ3206の能力は、Gne(pMLBAD:gne)又はZ3206(pMLBAD:Z3206)のいずれかにより補完されたpgl遺伝子座ΔgneによりAcrA(pWA2)を発現することで、インビボにおいて調べた。
【0140】
総大腸菌細胞抽出物を、SDS負荷緩衝液100μl中に再懸濁された1 A600単位と等しい濃度で細胞を用いる免疫検出分析のために調製した(Laemmli, U.の文献、(1970) Nature, 227, 680-685)。10μlのアリコートを、10%SDS-PAGEの上に装加した。大腸菌細胞のペリプラズム抽出物を、リゾチーム処理により調製し(Feldman, M.F.、Wacker, M.、Hernandez, M.、Hitchen, P.G.、Marolda, C.L、Kowarik, M.、Morris, H.R.、Dell, A.、Valvano, M.A.、Aebi, M.の文献、(2005) Proc Natl Acad Sci USA, 102, 3016-3021)、且つ最終試料10μl(細胞の0.2 A600単位に相当)をSDS-PAGEにより分析した。ニトロセルロースメンブレンにブロットした後、試料を、特異的抗血清により免疫染色した(Aebi, M.、Gassenhuber, J.、Domdey, H.、及びte Heesen, S.の文献、(1996) Glycobiology, 6, 439-444)。抗-AcrA抗体(Wacker, M.、Linton, D.、Hitchen, P.G.、Nita-Lazar, M.、Haslam, S.M.、North, S.J.、Panico, M.、Morris, H.R.、Dell, A.、Wrenn, B.W.、Aebi, M.の文献、(2002) Science, 298, 1790-1793)を使用した。抗-ウサギIgG-HRP(Bio-Rad社)を、二次抗体として使用した。検出は、ECL(商標)ウェスタンブロッティング検出試薬(Amersham Biosciences社)により実行した。
【0141】
図8に示されたように、グリコシル化されたタンパク質は、グリコシル化されない形よりもより遅く移動し、これは、pgl遺伝子座Δgneを発現している細胞がGneにより補完された場合(レーン2)にのみ、形成された。Z3206は、リポーター糖タンパク質のグリコシル化を回復することができなかった(図8、レーン1)。従って、Z3206は、Gne依存性グリコシル化システムにおいてAcrAのグリコシル化を補完しない。Gne及び膜-会合されたZ3206の発現は、免疫検出により確認された。
【0142】
(実施例9:シゲラ・フレックスネリ6+/−Z3206 LPSの分析)
図9において、シゲラ・フレックスネリ6のO-抗原の生合成に必要ないくつかの遺伝子;ヌクレオチド糖前駆体の生合成のための酵素をコードしている遺伝子;グリコシルトランスフェラーゼをコードしている遺伝子;O抗原プロセッシングタンパク質をコードしている遺伝子;及び、O-アセチル化に寄与するタンパク質をコードしている遺伝子:が示された。O抗原の構造は、Dmitriev, B.A.らにより解明されている(Dmitriev, B.A.らの文献、「赤痢菌の菌体抗原(Somatic Antigens of Shigella)」、Eur J Biochem, 1979, 98: p.8;Liu Bらの文献、「赤痢菌O抗原の構造及び遺伝子(Structure and genetics of Shigella O antigens)」、FEMS Microbiology Review, 2008, 32: p.27)。
【0143】
シゲラ・フレックスネリ6のO-抗原の生合成に必要な全ての遺伝子を確定するために、ゲノムライブラリーを作製した。
【0144】
(シゲラ・フレックスネリ6ゲノムDNAのクローニング)−細菌からのDNA単離に関するプロトコールに従い、シゲラ・フレックスネリ6ゲノムDNAを、Macherey-Nagel NucleoSpin(登録商標)組織キットを用いて単離した。DNAは、5つのシゲラ・フレックスネリ6の各2mlの一晩培養物から単離し、最終溶離は、溶離緩衝液(5mMトリス/HCl、pH8.5)100μlで行った。溶離された画分をプールし、イソプロパノールにより沈殿し、且つ最終ペレットを、TE緩衝液52μl中に再懸濁し、その総容量に、CopyControl商標Fosmidライブラリー作製キット(EPICENTRE)により供されたプロトコールに従い、末端修復(end-repair)を施した。このキットのプロトコールに記載されているように、末端修復されたDNAは、1×TAE緩衝液で泳動する1%低融点アガロースゲル上で精製し、回収し、エタノールで沈殿させた。沈殿したDNAの再懸濁は、TE緩衝液7μl中で行い、そのDNA 0.15μlは、EPICENTREプロトコールに従いpCC1FOS(配列番号:27)にライゲーションさせた。このライゲーション生成物のファージへのパッケージングは、プロトコールに従い行い、且つパッケージされたファージは、ファージ希釈用緩衝液において1:1で希釈し、その10μlを、EPICENTREに記載されたように予め増殖したEPI300-T1細胞100μlの感染に使用した。細胞(110μl)を、1プレート当たりおよそ100コロニーで、6回播種し、その結果6つのプレートは、シゲラ・フレックスネリ6ゲノムライブラリー全体を含んだ。プレートを、コロニーブロティングにより呈色し、且つ陽性/陰性コロニーを、ウェスタンブロット及び銀染色した。
【0145】
(コロニーブロッティング)−コロニーブロットのために、ニトロセルロースメンブレンを、固形寒天プレート上に搭載し、取り外し、1×PBSTで3回洗浄し、同じ様式で処理した。このメンブレンを、最初に10%ミルクにより室温で1時間ブロックし、その後これを1%ミルク(PBST中)2ml中で、抗-VI型抗血清(一次抗体)と一緒に、室温で1時間インキュベーションした。PBST中で3回、各回10分間洗浄した後、メンブレンを、1%ミルク(PBST中)2ml中の二次抗体1:20000ペルオキシダーゼ複合したヤギ-抗-ウサギIgG(BioRad社)と、室温で更に1時間インキュベーションした。最後にPBSTで3回洗浄(各回10分間)した後、メンブレンを、SuperSignal(登録商標)West Dura Extended Duration Substrate Kit(Thermo Scientific社)により提供されるルミノールと過酸化物緩衝液の1:1混液により、UVP Chemi Doc Imaging Systemにおいて呈色した。
【0146】
S.フレックスネリ6ゲノムライブラリー生成後のS.フレックスネリ6抗血清と反応するクローンを、rmlBからwfbZに達するLiuらにより先に配列決定された領域(Liuらの文献、2008)のプライマーウォーキングにより配列決定した(図9)。プライマーrmlB_rev及びwfbZ_fwd(S.フレックスネリ−Z3206)は、rmlB及びwfbZとアニーリングさせ、且つそれぞれwcaM及びhisI/Fに達するまで(S.フレックスネリ+Z3206)の、クローンの挿入断片の配列決定に使用した(図10)。
【0147】
O抗原合成は、Z3206を欠いている(従って、und-GlcNAcのund-GalNAcへのエピマー化を妨害する)クローンにおいて維持されるかどうかを確立するために、2種のプラスミドを作製し(配列番号:28及び配列番号:29)(図10)、大腸菌細胞に形質転換し、且つ銀染色及びウェスタンブロットにより分析した。
【0148】
図11に示されるように、LPSは、大腸菌細胞+Z3206又は−Z3206において生成された。O抗原は、Z3206がなくとも生成され得るが、生成収量は低く、このことはエピメラーゼ(Z3206)を伴わない多糖生成の効率はより低いことを指摘している。
【0149】
(実施例10:S.フレックスネリ6+/−Z3206 LLOの分析)
(C18カラムクロマトグラフィーによるウンデカプレノール-PP-O抗原の精製)−S.フレックスネリ抗原+/−Z3206を発現している大腸菌細胞を、ペレット化し、0.9%NaCl 50mlで1回洗浄し、最終ペレットを、一晩凍結乾燥した。ペレットを、85〜95%メタノール30mlで1回洗浄し、10:10:3のクロロホルム-メタノール-水(v/v/v)で再抽出し、且つこの抽出物を、水の添加により2相ブライ/ダイアーシステムに変換し、最終比10:10:9(C:M:W)とした。相を遠心分離により分離し、上側水相を、メタノール10mlで馴化させ、且つ3:48:47(C:M:W) 10mlで平衡としたC18 Sep-Pakカートリッジ上に各々添加した。添加後、カートリッジを、3:48:47(C:M:W)10mlで洗浄し、10:10:3(C:M:W)5mlで溶離した。これらの添加物の20 OD試料を、流通させ(flow-through)、洗浄し、且つC18カラムの溶離物をEppendorf Concentrator Plusにおいて乾燥し、メタノール250μlで洗浄し、再蒸発させ、ddH2O 30μlで更に3回洗浄した。
【0150】
(糖脂質加水分解)−前記C18カラム洗浄液からの糖脂質試料を、乾燥試料をn-プロパノール:2Mトリフルオロ酢酸(1:1)2ml中に溶解し、50℃で15分間加熱し、N2下で蒸発乾固することにより、加水分解した。
【0151】
(2-アミノ安息香酸によるオリゴ糖標識及びHPLC)−標識はBiggeらの方法(Biggeの文献、1995)に従い実行し、且つグリカンクリーンアップを、Merryら(2002)により説明されたペーパーディスク法(Merrらの文献、2002)を用いて行った。2-アミノ安息香酸(2-AB)標識されたグリカンの分離を、Royleらの方法に従う(Royleの文献、2002)が3溶媒システムに変更したGlycoSep-N順相カラムを用いるHPLCにより行った。溶媒Aは、80%アセトニトロール中の10mMギ酸アンモニウム(pH4.4)であった。溶媒Bは、40%アセトニトリル中の30mMギ酸アンモニウム(pH4.4)であった。溶媒Cは、0.5%ギ酸であった。カラム温度は30℃であり、且つ2-AB標識されたグリカンは蛍光により検出した(λex=330nm、λem=420nm)。勾配条件は、流量0.4ml/分で160分間かけ100%Aから100%Bへの直線勾配、それに続く流量を1ml/分に増し、2分間かけ100%Bから100%Cへであった。カラムを、100%Cで5分間洗浄し、2分間かけて100%Aに戻し、100%Aを流量1ml/分で15分間流し、その後流量0.4ml/分で5分間に戻した。全ての試料は、水中に注入した。
【0152】
Z3206を持つ(配列番号:29)又は持たない(配列番号:28)S.フレックスネリO抗原を発現するプラスミドを、SCM3細胞に形質転換した(図10)。遅い溶離容量での追跡は、S.フレックスネリO抗原+/−Z3206を含む2つの試料の曲線の間の差を示している(図12)。この溶離パターンの差は、エピメラーゼ(Z3206)の存在に応じてGlcNAc又はGalNAcという還元末端に異なる単糖を保持する異なるオリゴ糖構造により説明することができる。
【0153】
(実施例11:S.フレックスネリ6+/−Z3206から生成されたバイオコンジュゲートの生成及び特徴決定によるpglB特異性の分析)
PglBは、還元末端にGlcNAc(S.フレックスネリ6のO-抗原)を有するオリゴ糖をキャリアタンパク質EPAに転移するかどうかを評価するために、EPA(配列番号:25)、PglB(配列番号:26)及びS.フレックスネリ6のO-抗原+/−Z3206(配列番号:29/配列番号:28)を発現している大腸菌細胞由来のニッケル精製した抽出物を、抗EPA抗体及び抗VI型抗体を用いるウェスタンブロットにより分析した。還元末端にGalNAcを有する及び有さないS.フレックスネリ6のO抗原を、PglBにより、EPAへ転移し、抗EPA及び抗VI抗血清により検出した(図13)。
【0154】
O抗原は、依然生成され且つ検出されたが、生成収量はより低く、このことはエピメラーゼを伴わない多糖生成の効率がより低いことを示している。
【0155】
本発明は、それらの実施態様を参照し具体的に示され且つ説明されているが、当業者は、請求項に包含された本発明の範囲を逸脱しない限りは、それらの形態及び詳細における様々な変更を行うことができることを理解するであろう。本発明の範囲内に収まるとして当業者に理解されるそのような様々な変更は、特に、還元末端にGalNAcを持つ大腸菌及びシゲラ・フレックスネリ由来のもの以外のグリカンを含むN-グリコシル化タンパク質及びバイオコンジュゲートを含んでいる。
【0156】
(配列表)
出願人:GlycoVaxyn AG
【0157】
表題:原核細胞における免疫原性多糖体生成の生合成システム
【0158】
配列番号の数:29
【0159】
配列番号:1−大腸菌O157 Z3206のヌクレオチド配列
【0160】
長さ:993
【0161】
種類:DNA
【0162】
生物:大腸菌O157
【0163】
配列:
【化4】

【0164】
配列番号:2−Z3206のアミノ酸配列
【0165】
長さ: 331
【0166】
種類:PRT
【0167】
生物:大腸菌O157
【0168】
配列:
【化5】

【0169】
配列番号:3−大腸菌O55 gneのヌクレオチド配列
【0170】
遺伝子座 AF461121_1 BCT 02-MAY-2002
【0171】
定義 (UDP-GlcNAc 4-エピメラーゼGne[大腸菌])
【0172】
寄託番号 AAL67550
【0173】
長さ: 993
【0174】
種類:DNA
【0175】
生物:大腸菌O55
【0176】
配列:
【化6】

【0177】
配列番号:4−大腸菌O55 UDP-GlcNAc 4-エピメラーゼGneのアミノ酸配列
【0178】
遺伝子座 AF461121_1
【0179】
定義 (UDP-GlcNAc 4-エピメラーゼGne[大腸菌])
【0180】
寄託番号 AAL67550
【0181】
長さ:331個のアミノ酸、線状
【0182】
種類:PRT
【0183】
生物:大腸菌O55
【0184】
配列:
【化7】

【0185】
配列番号:5−大腸菌O86 gne1のヌクレオチド配列
【0186】
遺伝子座 AAO37706 BCT 06-DEC-2005
【0187】
定義 UDP-GlcNAc C4-エピメラーゼ[大腸菌O86]
【0188】
寄託番号 AAO37706
【0189】
長さ:993
【0190】
種類:DNA
【0191】
生物:大腸菌O86
【0192】
配列:
【化8】

【0193】
配列番号:6−大腸菌O86 UDP-GlcNAc C4-エピメラーゼのアミノ酸配列
【0194】
遺伝子座 AAO37706
【0195】
定義 UDP-GlcNAc C4-エピメラーゼ[大腸菌O86]
【0196】
寄託番号 AAO37706
【0197】
長さ:331個のアミノ酸、線状
【0198】
種類:PRT
【0199】
生物:大腸菌O86
【0200】
配列:
【化9】

【0201】
配列番号:7−シゲラ・ボイディO18 gneのヌクレオチド配列
【0202】
遺伝子座 ACD09753 BCT 05-MAY-2008
【0203】
定義 UDP-N-アセチルグルコサミン4-エピメラーゼ[シゲラ・ボイディCDC 3083-94]
【0204】
寄託番号 ACD09753
【0205】
長さ: 993
【0206】
種類:DNA
【0207】
生物:シゲラ・ボイディO18
【0208】
配列:
【化10】

【0209】
配列番号:8−シゲラ・ボイディO18 UDP-N-アセチルグルコサミン4-エピメラーゼのアミノ酸配列
【0210】
遺伝子座 ACD09753
【0211】
定義 UDP-N-アセチルグルコサミン4-エピメラーゼ[シゲラ・ボイディCDC 3083-94]
【0212】
寄託番号 ACD09753
【0213】
長さ:331個のアミノ酸、線状
【0214】
種類:PRT
【0215】
生物:シゲラ・ボイディO18
【0216】
配列:
【化11】

【0217】
配列番号:9−サルモネラ・エンテリカO30 gneのヌクレオチド配列
【0218】
遺伝子座 AAV34516 BCT 25-OCT-2004
【0219】
定義 UDP-GlcNAc 4-エピメラーゼ[サルモネラ・エンテリカ亜種サラマエ血清型Greenside]
【0220】
寄託番号 AAV34516
【0221】
長さ: 993
【0222】
種類:DNA
【0223】
生物:サルモネラ・エンテリカO30
【0224】
配列:
【化12】

【0225】
配列番号:10−サルモネラ・エンテリカO30 UDP-GlcNAc 4-エピメラーゼのアミノ酸配列
【0226】
遺伝子座 AAV34516
【0227】
定義 UDP-GlcNAc 4-エピメラーゼ[サルモネラ・エンテリカ亜種サラマエ血清型Greenside]
【0228】
寄託番号 AAV34516
【0229】
長さ:331個のアミノ酸、線状
【0230】
種類:PRT
【0231】
生物:サルモネラ・エンテリカO30
【0232】
配列:
【化13】

【0233】
配列番号:11−C.ジェジュニgneのヌクレオチド配列
【0234】
遺伝子座 YP_002344524 BCT 14-SEP-2010
【0235】
定義 UDP-GlcNAc/Glc 4-エピメラーゼ[カンピロバクター・ジェジュニ亜種ジェジュニ
【0236】
寄託番号 YP_002344524
【0237】
長さ:987
【0238】
種類:DNA
【0239】
生物:C.ジェジュニ
【0240】
配列:
【化14】

【0241】
配列番号:12−C.ジェジュニUDP-GlcNAc/Glc 4-エピメラーゼのアミノ酸配列
【0242】
遺伝子座 YP_002344524
【0243】
定義 UDP-GlcNAc/Glc 4-エピメラーゼ[カンピロバクター・ジェジュニ亜種ジェジュニ
【0244】
寄託番号 YP_002344524
【0245】
長さ:328個のアミノ酸、線状
【0246】
種類:PRT
【0247】
生物:C.ジェジュニ
【0248】
配列:
【化15】

【0249】
配列番号:13−大腸菌K12 galEのヌクレオチド配列
【0250】
遺伝子座 AP_001390 BCT 30-APR-2010
【0251】
定義 UDP-ガラクトース-4-エピメラーゼ[大腸菌K-12株W3110亜株]
【0252】
寄託番号 AP_001390
【0253】
長さ:1,017
【0254】
種類:DNA
【0255】
生物:大腸菌K12
【0256】
配列:
【化16】

【0257】
配列番号:14−大腸菌K12 UDP-ガラクトース-4-エピメラーゼのアミノ酸配列
【0258】
遺伝子座 AP_001390
【0259】
定義 UDP-ガラクトース-4-エピメラーゼ [大腸菌K-12株W3110亜株]
【0260】
寄託番号 AP_001390
【0261】
長さ:338個のアミノ酸、線状
【0262】
種類:PRT
【0263】
生物:大腸菌K12
【0264】
配列:
【化17】

【0265】
配列番号:15−大腸菌O86 gne2のヌクレオチド配列
【0266】
遺伝子座 AAV85952 BCT 27-MAR-2005
【0267】
定義 Gne[大腸菌O86]
【0268】
寄託番号 AAV85952
【0269】
長さ:1,020
【0270】
種類:DNA
【0271】
生物:大腸菌O86
【0272】
配列:
【化18】

【0273】
配列番号:16−大腸菌O86 Gneのアミノ酸配列
【0274】
遺伝子座 AAV85952
【0275】
定義 Gne[大腸菌O86]
【0276】
寄託番号 AAV85952
【0277】
長さ:339個のアミノ酸(gne2)、線状
【0278】
種類:PRT
【0279】
生物:大腸菌O86
【0280】
配列:
【化19】

【0281】
配列番号:17−Z3206の末端をコードしている合成オリゴヌクレオチドZ3206-Fw(プライマー)のヌクレオチド配列;制限部位には下線をつけている
【0282】
長さ:30
【0283】
種類:DNA
【0284】
配列:
【化20】

【0285】
配列番号:18−赤血球凝集素タグ(HAタグ)をつけたZ3206の末端をコードしている合成オリゴヌクレオチドZ3206-RvHA(プライマー)のヌクレオチド配列;制限部位には下線をつけている
【0286】
長さ:60
【0287】
種類:DNA
【0288】
生物:
【0289】
配列:
【化21】

【0290】
配列番号:19−制限部位には下線をつけた、合成オリゴヌクレオチドgne-Fw(プライマー)のヌクレオチド配列
【0291】
長さ:29
【0292】
種類:DNA
【0293】
生物:
【0294】
配列:
【化22】

【0295】
配列番号:20−制限部位には下線をつけた、合成オリゴヌクレオチドgne-RV(プライマー)のヌクレオチド配列
【0296】
長さ:57
【0297】
種類:DNA
【0298】
生物:
【0299】
配列:
【化23】

【0300】
配列番号:21−NheI制限酵素のための制限部位を含むオリゴヌクレオチドのヌクレオチド配列
【0301】
長さ:11
【0302】
種類:DNA
【0303】
生物:
【0304】
配列:
【化24】

【0305】
配列番号:22−AscI制限酵素のための制限部位を含むオリゴヌクレオチドのヌクレオチド配列
【0306】
長さ:8
【0307】
種類:DNA
【0308】
生物:
【0309】
配列:
【化25】

【0310】
配列番号:23−C-末端赤血球凝集素タグを持つZ3206をコードしているプラスミドpMLBAD:Z3206(プラスミド内の大腸菌O157の挿入断片)のヌクレオチド配列
【0311】
定義 生成物のZ3206-pMLBAD*へのライゲーション
【0312】
特徴 位置/限定子
【0313】
CDS 2105..3098
/ラベル=Z3206
【0314】
CDS 3098..3127
/ラベル=HA
【0315】
長さ:7794 bp
【0316】
種類:DNA環状、未注釈型(UNA)
【0317】
配列:
【化26】








【0318】
配列番号:24−C-末端赤血球凝集素タグを持つGneをコードしているpMLBAD:gne(プラスミド内の大腸菌O157の挿入断片)のヌクレオチド配列
【0319】
遺伝子座 gne-pMLBAD
【0320】
定義 dig galEのpmlbad did(NcoI-XbaI)へのライゲーション
【0321】
特徴 位置/限定子
【0322】
CDS 2097..3080
/ラベル=galE
【0323】
CDS 3081..3107
/ラベル=HA
【0324】
領域 3108..3110
/ラベル=停止
【0325】
長さ:7776 bp
【0326】
種類:DNA環状、未注釈型(UNA)
【0327】
配列:
【化27】








【0328】
配列番号:25−シグナル配列を持つ修飾されたEPAのアミノ酸配列
【0329】
WO 2009/104074に開示(配列番号:6として)
【0330】
種類:PRT
【0331】
生物:人工
【0332】
/ノート="人工配列の説明:合成ポリペプチド"
【0333】
長さ:643
【0334】
配列:
【化28】




【0335】
配列番号:26−PglBのアミノ酸配列
【0336】
WO 2009/104074に開示(配列番号:2として)
【0337】
長さ:722
【0338】
種類:PRT
【0339】
生物:カンピロバクター・ジェジュニ
【0340】
配列:
【化29】





【0341】
配列番号:27−pCC1FOS空のプラスミドのヌクレオチド配列
【0342】
遺伝子座 MCSカセットを持つpCC1FOS
【0343】
特徴 位置/限定子
【0344】
領域 230..256
【0345】
/ラベル="pCC1/pEpiFOS fwd"
【0346】
領域 311..330
【0347】
/ラベル="T7プロモーター"
【0348】
領域相補体(504..529)
【0349】
/ラベル="pCC1pEpiFOS rv"
【0350】
CDS相補体(805..1464)
【0351】
/ラベル=cat
【0352】
CDS 1683..2030
【0353】
/ラベル=redF
【0354】
CDS 3425..4180
【0355】
/ラベル=repE
【0356】
CDS 4759..5934
【0357】
/ラベル=parA
【0358】
CDS 5934..6905
【0359】
/ラベル=parB
【0360】
起源
【0361】
長さ:8171 bp
【0362】
種類:DNA環状、未注釈型(UNA)
【0363】
生物:人工
【0364】
配列:
【化30】






【0365】
配列番号:28−pCC1FOSの切断(pFOS)及びZ3206を持たないシゲラ・フレックスネリ6 O-抗原のヌクレオチド配列
【0366】
遺伝子座 pFOSの切断及びO-抗原の切断(-Z3206)
【0367】
定義 NheI及びAscIで切断されたMCSカセットを持つ逆位pCC1FOSの、NheI及びAscIで切断されgalFNheI及びwzzAscIで増幅されたS.フレックスネリ6 O抗原クラスターへのライゲーション
【0368】
特徴 位置/限定子
【0369】
CDS 3..411
【0370】
/ラベル='galF
【0371】
CDS 784..1869
【0372】
/ラベル=rmlB
【0373】
CDS 1869..2768
【0374】
/ラベル=rmlD
【0375】
CDS 2826..3704
【0376】
/ラベル=rmlA
【0377】
CDS 3709..4266
【0378】
/ラベル=rmlC
【0379】
CDS 4263..5495
【0380】
/ラベル=wzx
【0381】
CDS 5551..6738
【0382】
/ラベル=wzy
【0383】
CDS 6755..7624
【0384】
/ラベル=wfbY
【0385】
CDS 7621..8454
【0386】
/ラベル=wfbZ
【0387】
CDS 8559..9965
【0388】
/ラベル=gnd
【0389】
CDS 10187..11380
【0390】
/ラベル=ugd
【0391】
CDS相補体(11446..12450)
【0392】
/ラベル=uge
【0393】
CDS 12802..12828
【0394】
/ラベル=wzz'
【0395】
領域相補体(12868..12887)
【0396】
/ラベル="T7プロモーター"
【0397】
領域相補体(12942..12968)
【0398】
/ラベル="pCC1/pEpiFOS fwd"
【0399】
CDS相補体(14460..15431)
【0400】
/ラベル=parB
【0401】
CDS相補体(15431..16606)
【0402】
/ラベル=parA
【0403】
CDS相補体(17185..17940)
【0404】
/ラベル=repE
【0405】
CDS相補体(19335..19682)
【0406】
/ラベル=redF
【0407】
CDS 19901..20560
【0408】
/ラベル=cat
【0409】
領域 20836..20861
【0410】
/ラベル="pCC1pEpiFOS rv"
【0411】
長さ:20982 bp
【0412】
種類:DNA環状、未注釈型(UNA)
【0413】
配列:
【化31】






















【0414】
配列番号:29−pCC1FOSの切断(pFOS)及びZ3206を持つシゲラ・フレックスネリ6 O-抗原のヌクレオチド配列
【0415】
遺伝子座 pFOSの切断及びO-抗原の切断(Z3206+)
【0416】
定義 NheI及びAscIで切断されZ3206Nhe及びwzzAscIで増幅された逆位S. フレックスネリ6 O-抗原クラスターの、NheI及びAscIで切断されたMCSカセットを持つpCC1FOSへのライゲーション
【0417】
特徴 位置/限定子
【0418】
CDS相補体 (370..396)
【0419】
/ラベル=wzz'
【0420】
CDS 748..1752
【0421】
/ラベル=uge
【0422】
CDS相補体(1818..3011)
【0423】
/ラベル=ugd
【0424】
CDS相補体(3233..4639)
【0425】
/ラベル=gnd
【0426】
CDS相補体(4744..5577)
【0427】
/ラベル=wfbZ
【0428】
CDS相補体(5574..6443)
【0429】
/ラベル=wfbY
【0430】
CDS相補体(6460..7647)
【0431】
/ラベル=wzy
【0432】
CDS相補体(7703..8935)
【0433】
/ラベル=wzx
【0434】
CDS相補体(8932..9489)
【0435】
/ラベル=rmlC
【0436】
CDS相補体(9494..10372)
【0437】
/ラベル=rmlA
【0438】
CDS相補体(10430..11329)
【0439】
/ラベル=rmlD
【0440】
CDS相補体(11329..12414)
【0441】
/ラベル=rmlB
【0442】
CDS相補体(12787..13680)
【0443】
/ラベル=galF
【0444】
CDS相補体(13912..14907)
【0445】
/ラベル=Z3206
【0446】
CDS相補体(15065..15097)
【0447】
/ラベル='wcaM
【0448】
CDS相補体(15525..16184)
【0449】
/ラベル=cat
【0450】
CDS 16403..16750
【0451】
/ラベル=redF
【0452】
CDS 18145..18900
【0453】
/ラベル=repE
【0454】
CDS 19479..20654
【0455】
/ラベル=parA
【0456】
CDS 20654..21625
【0457】
/ラベル=parB
【0458】
長さ:22887 bp
【0459】
種類:DNA環状、未注釈型(UNA)
【0460】
配列:
【化32】























【技術分野】
【0001】
(関連出願の相互参照)
本出願は、2009年11月19日に出願され、その全体が引用により本明細書中に組み込まれている、米国特許仮出願第61/272,931号の米国特許法第119条(e)の下での利益を主張するものである。
【0002】
(発明の分野)
本発明は、ワクチン製造のための生合成システム及びタンパク質の使用に関する。加えて本発明は、還元末端に特定された単糖を持つオリゴ糖又は多糖の合成を開始するエピメラーゼを有する、組換え原核細胞生合成システムに関する。本発明は更に、発現システムにおいてグリカンで生成されたN-グリコシル化タンパク質、及び免疫原性グリカンを含む該N-グリコシル化タンパク質から製造されたバイオコンジュゲートワクチンに関し、且つN-グリコシル化タンパク質の製造方法を提供する。
【背景技術】
【0003】
(発明の背景)
糖タンパク質は、1個以上の共有結合された糖ポリマーを有するタンパク質である。N-結合型タンパク質のグリコシル化は、真核生物の小胞体において生じる本質的且つ保存されたプロセスである。それは、タンパク質フォールディング、オリゴマー化、安定性、品質管理、選別、並びに分泌タンパク質及び膜タンパク質の輸送にとって重要である(Helenius, A.及びAebi, M.の文献、(2004)、「小胞体におけるN-結合型グリカンの役割(Roles of N-linked glycans in the endoplasmic reticulum)」、Annu. Rev. Biochem. 73, 1019-1049)。
【0004】
タンパク質のグリコシル化は、タンパク質の免疫原性、安定性及び半減期への重大な影響を有する。加えてグリコシル化は、例えばタンパク質のグリコシル化された部分と相互作用する固相に結合されたレクチンリガンドによるアフィニティクロマトグラフィーなどの、クロマトグラフィーによるタンパク質の精製を補助することができる。従って、生物学的及び薬学的に有用なグリコシル化パターンを提供するために、真核細胞において組換えにより多くのグリコシル化タンパク質を生成する手法が確立されている。
【0005】
WO 2003/07467(Aebiら)は、細菌である食物媒介性病原体カンピロバクター・ジェジュニ(Campylobacter jejuni)が、そのタンパク質をN-グリコシル化することができ、このことはある種の古細菌を除いた公知の原核生物の中で独自の特徴であることを明らかにした。このグリコシル化に必要とされる機序は、いわゆるpgl遺伝子座にクラスター化されている12の遺伝子によりコードされている。N-グリコシル化の破壊は、C.ジェジュニの侵入及び病原性に影響を及ぼすが、しかし大抵の真核生物においては致命的ではない(Burda P.及びM. Aebiの文献、(1999)、「N-結合型グリコシル化のドリコール経路(The dolichol pathway of N-linked glycosylation)」、Biochem Biophys Acta, 1426(2):239-57)。大腸菌(E. coli)においてpgl遺伝子座及び受容体糖タンパク質を組換えにより同時に発現させることにより、C.ジェジュニタンパク質のN-グリコシル化を再構成することが可能である(Wackerらの文献、(2002)、「カンピロバクター・ジェジュニにおけるN-結合型グリコシル化及び大腸菌へのその機能転移(N-linked glycosylation in Campylobacter jejuni and its functional transfer into E. coli)」、Science, 298, 1790-1793)。
【0006】
N-グリカン類は、タンパク質内のコンセンサス配列に結合したグリカンを有する。タンパク質内の公知のN-グリコシル化コンセンサス配列は、原核生物において組換え標的タンパク質をN-グリコシル化することを可能にする。そのような生物は、グリカンをタンパク質のコンセンサス配列に転移する酵素であるオリゴサッカリルトランスフェラーゼ("OT";"OTase")、例えばC.ジェジュニのオリゴサッカリルトランスフェラーゼなどを含む。
【0007】
WO 2003/07467(Aebiら)は、(i)脂質キャリア上のオリゴ糖の構築のための特異的グリコシルトランスフェラーゼ、(ii)コンセンサス配列"N-X-S/T"を含む組換え標的タンパク質(式中、Xはプロリン以外の任意のアミノ酸である)、及び(iii)例えば、該オリゴ糖を標的タンパク質のコンセンサス配列に共有結合する、C.ジェジュニのオリゴサッカリルトランスフェラーゼなどのオリゴサッカリルトランスフェラーゼ:をコードしている核酸が導入された原核生物を教示している。前記原核生物は、特定のグリコシルトランスフェラーゼの種類により規定される特定の構造を持つN-グリカンを生成する。
【0008】
WO 2006/119987(Aebiら)は、タンパク質に加え、インビボで原核生物における効率的N-グリコシル化によりタンパク質を生成する手段及び方法を説明している。これは更に、該タンパク質の免疫原性、安定性、生物学的、予防的及び/又は治療的活性を改変するための、N-グリカンの組換えタンパク質への効率的導入、並びにその表面上に発明の組換えN-グリコシル化タンパク質を効率的にディスプレイする宿主細胞の条件を説明している。加えてこれは、以下のN-グリコシル化された最適化アミノ酸配列を1つ以上含む組換えN-グリコシル化タンパク質を説明しており:
D/E-X-N-Z-S/T (最適化コンセンサス配列)、
(式中、X及びZは、Pro以外の任意の天然アミノ酸であり得る)、且つ該N-グリコシル化された部分的アミノ酸配列の少なくとも1つが導入されている。この特定の部分的アミノ酸配列(最適化コンセンサス配列)のタンパク質への導入は、これらの導入された位置でオリゴサッカリルトランスフェラーゼにより効率的にN-グリコシル化されたタンパク質をもたらす。
【0009】
様々な多糖体の生合成が、細菌細胞において保存されている。多糖体は、規定された特異性を持つ様々なグリコシルトランスフェラーゼにより、細胞質膜で、共通の前駆体(活性化された糖ヌクレオチド)からキャリア脂質上に構築される。リポ多糖("LPS")は、例えば赤痢菌種、シュードモナス種、及び大腸菌(ExPEC、EHEC)などのグラム陰性菌においてのみ提供される。
【0010】
LPSの合成は、膜の細胞質側で、単糖がキャリア脂質ウンデカプレニルリン酸("Und-P-P")へ付加されることから始まる。抗原は、様々なグリコシルトランスフェラーゼにより活性化された糖ヌクレオチドから単糖が逐次付加されることにより作製され、その脂質-連結された多糖は、フリッパーゼにより膜を通じて反転される。この抗原-反復単位は、酵素反応により重合される。次にこの多糖は、LPSを形成するリガーゼWaaLによりリピドAへ転移され、LPSがその表面に輸送されるのに対し、莢膜多糖は、重合及び表面への輸送後、キャリア脂質から放出される。これらの多糖の生合成経路は、インビボにおけるLPSバイオコンジュゲートの生成、タンパク質キャリアへのペリプラズム内の多糖の捕獲を可能にする。
【0011】
そのように合成されたオリゴ糖又は多糖(すなわち、糖残基)及びタンパク質(すなわち、タンパク質キャリア)の複合体は、多くの細菌感染を防御するためのコンジュゲートワクチンとして使用することができる。コンジュゲートワクチンは、細菌感染を防御するためにうまく使用されている。多糖はT-細胞非依存性免疫原であるので、タンパク質キャリアに対する抗原性多糖の複合が、防御的記憶反応に必要とされる。多糖に加えタンパク質キャリアにおける反応基の活性化を用いる、様々な化学的方法により、多糖はタンパク質キャリアに複合されている。
【0012】
コンジュゲートワクチンは、小児に細菌感染に対する防御のために投与することができ、また成人に長期の持続免疫応答を提供することもできる。WO 2009/104074(Fernandezら)の作製体は、動物においてIgG応答を生じることがわかっている。ヒトにおける赤痢菌O-特異的多糖-タンパク質コンジュゲートワクチンに対するIgG応答は、ヒトにおける免疫防御に相関していることがわかっている(Passwell, J.H.らの文献、「イスラエルにおける成人での改良された赤痢菌O-特異的多糖-タンパク質コンジュゲートワクチンの安全性及び免疫原性(Safety and Immunogenicity of Improved Shigella O-Specific Polysaccharide-Protein Conjugate Vaccines in Adults in Israel)」、Infection and Immunity, 69(3):1351-1357 (2001年3月))。多糖(すなわち、糖残基)は、糖特異的である短期間の免疫応答を誘発すると考えられる。実際ヒトの免疫系は、O-抗原及び莢膜多糖などの、細菌の特異的多糖表面構造に対し強力な反応を生じる。しかし多糖に対する免疫応答はIgM依存型であるので、この免疫系は記憶を発生しない。多糖を運搬するタンパク質キャリアの免疫系は記憶を呈するので、この免疫系は、T-細胞依存型であり、且つ長期の防御を提供するIgG応答を誘発する。
【0013】
大腸菌O157は、溶血性尿毒症症候群の最近の全症例のおよそ2/3の原因である腸管出血性株であり、ヒトの健康上重大な懸念がある(Law, D.の文献、(2000) J. App. Microbiol., 88, 729-745;Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun., 66, 3545-3551)。
【0014】
大腸菌(Escherichia coli)O157株は、反復する四糖体単位(4-N-アセチルペロサミン→フコース→グルコース→GalNAc)(α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAc)を含むO-抗原を産生する(Perry, M. B.、MacLean, L.及びGriffith, D. W.の文献、(1986) Biochem. Cell Biol., 64, 21-28)。この四糖体は、ウンデカプレニルピロリン酸上で予め構築される。この大腸菌細胞エンベロープは、内側細胞質膜、圧負(stress-bearing)ペプチドグリカン層、並びにリン脂質の内側単層及び細菌LPSで構成された外側単層からなる非対称外膜を含む。LPSは、3つの構成成分、リピドAアンカー、3-デオキシ-D-マンノ-オクト-2-ウロソン酸-含有コア、及びO-抗原領域を含む(参照:Raetz, C. R. H.及びWhitfield, C.の文献、(2002) Annu. Rev. Biochem., 71, 635-700;Whitfield, C.の文献、(2006) Ann. Rev. Biochem. 75, 39-68;Samuel, G.及びReeves, P. R.の文献、(2003) Carbohydrate Research, 338, 2503-2519;及び、細菌LPSのO-抗原の構築に関する総説についてそれらの参考文献を参照されたい)。
【0015】
細菌LPSのO-抗原の構成成分は、単独の反復する単糖から構成されたホモポリマー、又は、3〜6の糖単位の10〜30の反復を含むヘテロポリマーのいずれかであることができる、巨大であり、極めて多様な多糖体である(Reeves, P. R.、Hobbs, M.、Valvano, M. A.、Skurnik, M.、Whitfield, C.、Coplin, D.、Kido, N.、Klena, J.、Maskell, D.、Raetz, C. R. H.、及びRick, P. D.の文献、(1996) Trends Microbiol., 4, 495-503)。従ってO-抗原は、その細菌の細胞表面の支配的な特徴であり、且つ毒性及び病原性の重要な決定因子を構成する(Law, D.の文献、(2000) J. App. Microbiol., 88, 729-745;Spears, K. J.、Roe, A. J.及びGally, D. L.の文献、(2006) FEMS Microbiol. Lett., 255, 187-202;Liu, B.、Knirel, Y. A.、Feng, L.、Perepelov, A. V.、Senchenkova, S. N.、Wang, Q.、Reeves, P. R.及びWang, Lの文献、(2008) FEMS Microbiol. Rev., 32, 627-653;Stenutz, R.、Weintraub, A.及びWidmalm, G.の文献、(2006) FEMS Microbiol. Rev., 30, 382-403)。独自のO-抗原構造に寄与した180よりも多い個別のO-血清型を有する大腸菌株が、同定されている(Stenutz, R.、Weintraub, A.及びWidmalm, G.の文献、(2006) FEMS Microbiol. Rev., 30, 382-403)。
【0016】
O-抗原反復単位は、ウンデカプレニルピロリン酸に結合された内側膜の細胞質ゾル面上に予め構築されている。脂質-結合された反復単位は、内側膜のペリプラズム表面へと横断して広がり(フリップ-フロップ)、外膜へ輸送され且つLPSに結合する前に重合される。ほとんどのヘテロポリマー性O-抗原反復単位は、それらの還元末端にN-アセチルグルコサミン("GlcNAc")又はN-アセチルガラクトサミン("GalNAc")のいずれかを有する。
【0017】
脂質中間体の生合成は、WecAにより触媒されたGlcNAc-P又はGalNAc-Pのそれらの各糖ヌクレオチド誘導体からウンデカプレニル一リン酸("Und-P")への転移により開始されると仮定されている(Samuel, G.及びReeves, P. R.の文献、(2003) Carbohydrate Research, 338, 2503-2519;Alexander, D. C.及びValvano, M. A.の文献、(1994) J. Bacteriol., 176, 7079-7084;Zhang, L.、Radziejewska-Lebrecht, J.、Krajewska-Pietrasik, D.、Tolvanen, P.及びSkurkik, M.の文献、(1997) Mol. Microbiol. 23, 63-76;Amor, P. A.及びWhitfield, C.の文献、(1997) Mol. Microbiol. 26 (145-161);Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun. 66, 3545-3551)。WecAのGlcNAc-ホスホトランスフェラーゼ活性の特性及び特異性は特徴付けられているが(Rush, J. S.、Rick, P. D.及びWaechter, C. J.の文献、(1997) Glycobiology, 7, 315-322)、WecAは、GalNAc-P-P-Undの合成を触媒するという結論は、遺伝子研究を基にしていた(Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun. 66, 3545-3551)。そのような初期の遺伝子研究は、脂質-結合された四糖体中間体の生合成は、WecAにより触媒されたGalNAc-PのUDP-GalNAcからUnd-Pへの酵素転移により開始されることを指摘した(Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun. 66, 3545-3551)。しかし、WecAはGalNAc-P供与体としてUDP-GalNAcを利用することを明らかにする直接の酵素学的証拠は存在しない。
【0018】
更に、大腸菌O55のgne及びgne1遺伝子は、UDP-GlcNAc 4-エピメラーゼをコードしていることが先に提唱された(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625;Guo, H.、Yi, W.、Li, L.及びWang, P. G.の文献、(2007) Biochem. Biophys. Res. Commun., 356, 604-609)。先の報告は、大腸菌O55由来(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625)、並びに大腸菌O86由来の(Guo, H.、Yi, W.、Li, L.及びWang, P. G.の文献、(2007) Biochem. Biophys. Res. Commun., 356, 604-609)、同じ遺伝子ファミリー内のZ3206遺伝子と100%同一である2つの遺伝子、各々、大腸菌O55 gne及び大腸菌O86 gne1を同定した。
【0019】
従って当業者は、Z3206遺伝子も、UDP-GlcNAc/UDP-GalNAcエピメラーゼをコードしていると考えるようになっている。
【発明の概要】
【0020】
(発明の簡単な概要)
現在驚くべきことに、大腸菌O157においてZ3206遺伝子によりコードされたエピメラーゼは、ウンデカプレニルピロリン酸上のN-アセチルガラクトサミン("GalNAc")を合成する反応を触媒し、このことはオリゴ糖又は多糖の形成を開始することが発見された。
【0021】
一態様において、本発明は、ウンデカプレニルピロリン酸上でGalNAcを合成するエピメラーゼを含む、多糖の全て又は一部を生成する組換え原核細胞生合成システムに関する。本発明は更に、還元末端にGalNAcを有する多糖の全て又は一部を合成するグリコシルトランスフェラーゼを含み、且つ更に還元末端にGalNAcを有する抗原性多糖の全て又は一部を合成するグリコシルトランスフェラーゼを含んでいる。
【0022】
別の態様において、本発明は、ウンデカプレニルピロリン酸上でGalNAcを生成するエピメラーゼに関し、且つ更なる態様において、本エピメラーゼは、Z3206遺伝子によりコードされている。
【0023】
追加の態様において、本発明は、オリゴサッカリルトランスフェラーゼをコードしているヌクレオチド配列;タンパク質キャリアをコードしているヌクレオチド配列;少なくとも1種の細菌由来の少なくとも1つのオリゴ糖又は多糖の遺伝子クラスターであり、ここで該多糖は、還元末端にGalNAcを含むもの;及び、エピメラーゼをコードしている核酸配列:を含む、N-グリコシル化タンパク質の生成のための発現システムに関する。
【0024】
より更なる態様において、本発明は、GlcNAc-P-P-UndをGalNAc-P-P-Undに変換するエピメラーゼをコードしているZ3206遺伝子を含む、組換え原核細胞生合成システムに関する。
【0025】
更に追加の態様において、本発明は、GlcNAc-P-P-UndをGalNAc-P-P-Undに変換するエピメラーゼをコードしている大腸菌O55 gne遺伝子又は大腸菌O86 gne1遺伝子を含む、組換え原核細胞生合成システムに関する。
【0026】
更に別の態様において、本発明は、少なくとも1つの導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZはプロリン以外の任意の天然のアミノ酸であり得る)、及び還元末端にN-アセチルガラクトサミンを有するグリカン:を含む、N-グリコシル化タンパク質に関する。
【0027】
より別の態様において、本発明は、少なくとも1つの導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZはプロリン以外の任意の天然のアミノ酸であり得る);還元末端にN-アセチルガラクトサミンを有する、免疫原性グリカン:を有するN-グリコシル化タンパク質;並びに、アジュバントを含有する、バイオコンジュゲートワクチンに関する。
【0028】
追加の態様において、本発明は、還元末端にGalNAcを含む少なくとも1種の細菌由来の少なくとも1つのオリゴ糖又は多糖を構築するグリコシルトランスフェラーゼ;タンパク質キャリア;オリゴサッカリルトランスフェラーゼ;及び、エピメラーゼ:をコードしている核酸を含む宿主細胞において、N-結合型グリコシル化タンパク質を生成する方法に関する。
【0029】
更なる態様において、本発明は、バイオコンジュゲートワクチンを調製するための生合成システム及びタンパク質の使用に関する。
【0030】
追加の態様において、本発明は、単糖、オリゴ糖及び多糖を生成する方法に関し、より更なる態様において、本発明は、抗原性グリカン及びN-グリコシル化タンパク質を生成する方法に関する。
【図面の簡単な説明】
【0031】
【図1】図1は、大腸菌O157由来の膜画分による、[3H]GlcNAc/GalNAc-P-P-Und合成の時間経過を示している。大腸菌O157株由来の膜画分は、UDP-[3H]GlcNAcと共に、37℃で指定された時間インキュベートした。[3H]脂質生成物を抽出し、[3H]GlcNAcの[3H]GlcNAc-P-P-Und(○)及び[3H]GalNAc-P-P-Und(●)への取り込みを、実施例2に記載のようにアッセイした。
【0032】
【図2】図2は、GlcNAc-P-P-UndからのGalNAc-P-P-Undの形成に関する提唱された生合成経路を示す。
【0033】
【図3】図3は、大腸菌O157株由来の膜画分により合成された[3H]GalNAc-P-P-Undの精製及び特徴決定を示す。大腸菌O157由来の膜画分は、UDP-[3H]GlcNAcと一緒にインキュベートし、且つ[3H]GalNAc脂質を、実施例3に記載のように精製した。図3Aは、DEAE-セルロース上での精製後の、ホウ酸含浸シリカゲルG(Quantum 1)上の[3H]HexNAc脂質の分取薄層クロマトグラムを示す。図3Bは、パネルAの分取プレートからの回収後の、ホウ酸含浸シリカゲルG(Baker Si250)上の精製された[3H]GalNAc-P-P-Undの薄層クロマトグラフィーを示す。図3Cは、図3Bで精製された[3H]GalNAc-P-P-Undの弱酸加水分解後に回収された[3H]-アミノ糖の、下降ペーパークロマトグラム(ホウ酸含浸ワットマン濾紙No.1)を示す。図3Dは、NaBH4による図3C由来の[3H]アミノ糖の還元により生成された[3H]HexNAc-アルジトールの下降ペーパークロマトグラム(ワットマンNo.3MM)を示す。
【0034】
【図4】図4は、pMLBAD:Z3206による形質転換後の大腸菌21546細胞及び大腸菌21546細胞の代謝標識を示す。大腸菌21546(図4A)及び大腸菌21546:pMLBAD/Z3206(図4B)は、[3H]GlcNAcにより37℃で5分間代謝標識した。[3H]GlcNAc/GalNAc-P-P-Undを抽出し、水溶性夾雑物を除去し、且つ実施例3に記載のようなホウ酸含浸シリカゲルプレート(Baker Si250)上の薄層クロマトグラフィーにより分離した。Bioscanクロマトスキャナーを用い、放射性脂質を検出した。GalNAc-P-P-Und及びGlcNAc-P-P-Undのクロマトグラフィー位置は、矢印で示した。
【0035】
【図5】図5は、大腸菌株由来の膜画分のUDP-[3H]GlcNAcと一緒のインキュベーションにより形成された[3H]GlcNAc/GalNAc-P-P-Undの薄層クロマトグラフィーを示す。大腸菌K12株(図5A)、O157株(図5B)、21546株(図5C)、及び21546:pMLBAD/Z3206株(図5D)由来の膜画分を、UDP-[3H]GlcNAcと一緒に、37℃で10分間インキュベーションし、且つ[3H]脂質生成物を抽出し、分配により水溶性夾雑物を除去し、実施例3に記載のようにホウ酸含浸シリカゲルプレート(Baker Si250)上の薄層クロマトグラフィーにより分離した。GalNAc-P-P-Und及びGlcNAc-P-P-Undのクロマトグラフィー位置は、矢印で示した。
【0036】
【図6】図6は、UMPと一緒のインキュベーションによるGlcNAc-Pの放出を示す。大腸菌21546:Z3206由来の膜画分を、GlcNAc-P-P-Undを酵素標識するために、UDP-[3H]GlcNAcと一緒に37℃で10分間プレインキュベーションし(図6A)、引き続き1mM UMPと一緒に、1分間(図6B)又は2分間(図6C)のいずれかの期間、2回目のインキュベーションした。指定されたインキュベーション期間の後、[3H]GlcNAc/GalNAc-P-P-Undを抽出し、実施例3に記載のようなホウ酸含浸シリカゲルプレート(Baker Si250)上の薄層クロマトグラフィーにより分離した。GalNAc-P-P-Und及びGlcNAc-P-P-Undのクロマトグラフィー位置は、矢印で示した。
【0037】
【図7】図7は、Z3206を発現している21546株由来の膜により触媒された、外因性[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの、関連する[3H]HexNAc-P-P-Und生成物への変換を示す。大腸菌21546株(図7B及び図7E)及び21546:pMLBAD/Z3206株(図7C及び図7F)由来の膜画分を、精製した[3H]GlcNAc-P-P-Und(図7A、図7B、及び図7C)又は[3H]GalNAc-P-P-Und(図7D、図7E、及び図7Fのパネル)(1%Triton X-100中に超音波処理により分散された)と一緒に、37℃で1分間インキュベートした。[3H]GlcNAc/GalNAc-P-P-Undを抽出し、ホウ酸含浸シリカゲルプレート(Baker Si250)上の薄層クロマトグラフィーにより分離し、実施例3に記載のようなBioscan AR2000ラディオクロマトスキャナーにより検出した。
【0038】
【図8】図8は、グリコシル化されない及びグリコシル化されたAcrAタンパク質のSDS-PAGE分析を示す。pMLBAD:Z3206(レーン1)、pMLBAD:gne(レーン2)又はベクター対照pMLBAD(レーン3)を補完したAcrA発現プラスミド及びpglオペロンΔgneを保持する大腸菌DH5α細胞から調製したペリプラズム抽出物を、10%SDS-PAGEにより分離し、ニトロセルロースメンブレンに移した。AcrA及びそのグリコシル化された形態は、抗AcrA抗血清により検出した。グリコシル化されないAcrA(AcrA)及びグリコシル化されたAcrA(gAcrA)に対応するバンドの位置を示した。
【0039】
【図9】図9は、Liu Bらの文献(「赤痢菌O-抗原の構造及び遺伝子(Structure and genetics of Shigella O antigens)」、FEMS Microbiology Review, 2008. 32: p.27)により同定された遺伝子を示す。
【0040】
【図10】図10は、S.フレックスネリ6 O抗原を合成するために必要とされる遺伝子を含むDNA領域を示すスキームである。
【0041】
【図11】図11は、大腸菌におけるS.フレックスネリ6のO抗原の発現を示す。LPSは、銀染色によるか、又はニトロセルロースメンブレンへの転移及びS.フレックスネリ6に対する抗体による検出のいずれかにより可視化した。
【0042】
【図12】図12は、O抗原のHPLCを示す。S.フレックスネリ−Z3206を含む大腸菌細胞(SCM3)、S.フレックスネリ+Z3206を含む大腸菌細胞(SCM3)、又は空の大腸菌(SCM3)細胞のLLO分析。
【0043】
【図13】図13は、EPA、pglB及びS.フレックスネリ6のO-抗原+/−Z3206を発現している大腸菌細胞由来のニッケル精製したタンパク質のウェスタンブロットを示す。
【発明を実施するための形態】
【0044】
(発明の詳細な説明)
本発明は、還元末端にN-アセチルガラクトサミンを有するオリゴ糖又は多糖を合成するエピメラーゼ、及びグリカンの還元末端にN-アセチルガラクトサミンを有するN-グリコシル化タンパク質:をコードしている核酸を含む、組換え原核細胞生合成システムを包含している。
【0045】
用語「部分的アミノ酸配列」は、「最適化コンセンサス配列」又は「コンセンサス配列」とも称される。最適化コンセンサス配列は、通常のコンセンサス配列"N-X-S/T"よりもはるかに効率的に、オリゴサッカリルトランスフェラーゼ("OST"、"OTase")によりN-グリコシル化される。
【0046】
概して、用語「組換えN-グリコシル化タンパク質」とは、該タンパク質をコードしている核酸を天然には含まない宿主細胞において生成される任意のポリペプチド又はオリゴペプチドをいう。本発明の状況において、この用語は、例えば、エシェリキア(Escherichia)種、カンピロバクター(Campylobacter)種、サルモネラ(Salmonella)種、シゲラ(Shigella)種、ヘリコバクター(Helicobacter)種、シュードモナス(Pseudomonas)種、バチルス(Bacillus)種などの原核宿主細胞において、並びに更なる実施態様においては、大腸菌、カンピロバクター・ジェジュニ、サルモネラ・ティフィムリウスなどにおいて、組換えにより生成されたタンパク質をいい、ここで該タンパク質をコードしている核酸は、該宿主細胞に導入されており、且つこのコードされたタンパク質は、OTaseにより、N-グリコシル化され、該転移酵素は該宿主細胞において天然に生じるか又は細胞へ組換えにより導入されている。
【0047】
アミノ酸に関する国際的に承認された1文字コードに従い、省略形D、E、N、S及びTは、各々、アスパラギン酸、グルタミン酸、アスパラギン、セリン、及びトレオニンを意味する。
【0048】
本発明のタンパク質は、タンパク質に導入され且つN-グリコシル化された最適化コンセンサス配列D/E-X-N-Z-S/Tを1つ以上含む。従って本発明のタンパク質は、同じく最適化コンセンサス配列を含むが追加の(導入された)最適化コンセンサス配列は全く含まない天然のC.ジェジュニのN-糖タンパク質とは異なる。
【0049】
最適化コンセンサス配列の導入は、1個以上のアミノ酸の付加、欠失及び/又は置換により達成することができる。最適化コンセンサス配列の導入を目的とした1個以上のアミノ酸の付加、欠失及び/又は置換は、化学合成戦略により達成することができ、これは本発明を考慮し、固相支持型化学ペプチド合成のように、当業者には周知であろう。あるいは、より大きいポリペプチドに好ましいことだが、本発明のタンパク質は、本発明に照らして当該技術分野において標準技術である組換え技術により調製することができる。
【0050】
本発明のタンパク質は、高い効率で且つ任意の宿主において生成され得るという利点を有する。本発明の一実施態様において、宿主は、カンピロバクター種に由来する、例えばC.ジェジュニに由来する機能性pglオペロンを含む。更なる実施態様において、本発明の実施のためのカンピロバクター種由来のオリゴサッカリルトランスフェラーゼは、カンピロバクター・コリ(Campylobacter coli)又はカンピロバクター・ラリ(Campylobacter lari)に由来している。本発明を考慮し、オリゴサッカリルトランスフェラーゼは、当業者には明らかであろう。例えば、オリゴサッカリルトランスフェラーゼは、Szymanski, C.M.及びWren, B.W.の文献「粘膜病原菌におけるタンパク質グリコシル化(Protein glycosylation in bacterial mucosal pathogens)」、Nat. Rev. Microbiol., 3:225-237 (2005)などの参考文献において明らかにされている。前記原核細胞宿主がカンピロバクター種、又は例えばC.ジェジュニである場合、機能性pglオペロンは天然に存在し得る。しかし、当該技術分野において先に明らかにされ、かつ前述のように、pglオペロンは、細胞に転移され、且つ該新規細胞の環境において機能性を維持する。
【0051】
用語「カンピロバクター種、好ましくはC.ジェジュニ由来の機能性のpglオペロン」とは、カンピロバクター種、例えばC.ジェジュニの機能性のオリゴサッカリルトランスフェラーゼ(OTase)、及び脂質キャリア上のオリゴ糖の構築が可能である1種以上の特異的グリコシルトランスフェラーゼをコードしている核酸のクラスターをいい、ここで該オリゴ糖は、OTaseにより、脂質キャリアから、1つ以上の最適化アミノ酸配列:D/E-X N-Z-S/Tを有する標的タンパク質へ転移され得ることを意味する。本発明の状況において用語「カンピロバクター種、好ましくはC.ジェジュニ由来の機能性のpglオペロン」は、必ずしも、単独の転写単位としてのオペロンをいうものではないことが理解されるべきである。この用語は、1つの宿主細胞における組換えタンパク質のN-グリコシル化のための機能性構成成分の存在のみを必要とする。これらの構成成分は、1つ以上の個別のmRNAとして転写されてもよく、且つ一緒に又は個別に調節されてもよい。例えばこの用語は、1つの宿主細胞においてゲノムDNA及びプラスミドに配置された機能性構成成分も包含している。効率化を目的として、一実施態様においては、機能性のpglオペロンの全ての構成成分が調節され、且つ同時に発現される。
【0052】
オリゴサッカリルトランスフェラーゼは、一部の実施態様においてはカンピロバクター種を起源とし、且つ別の実施態様においてはC.ジェジュニを起源とすることができる。追加の実施態様において、オリゴサッカリルトランスフェラーゼは、例えば、ウォリネラ(Wolinella)種及び真核生物など、オリゴサッカリルトランスフェラーゼを有することが当業者に公知である他の生物を起源とすることができる。
【0053】
脂質キャリア上にオリゴ糖を構築することが可能である1つ以上の特異的グリコシルトランスフェラーゼは、宿主細胞を起源とするか又は該宿主細胞へ組換えにより導入されることができ、その唯一の機能上の制限は、該グリコシルトランスフェラーゼにより構築されたオリゴ糖は、OTaseにより、脂質キャリアから1つ以上の最適化コンセンサス配列を有する標的タンパク質へ転移され得ることである。従って、特異的グリコシルトランスフェラーゼを天然に含み及び/又は該宿主に天然に存在する特異的グリコシルトランスフェラーゼを交換する宿主細胞の選択に加え、異種の特異的グリコシルトランスフェラーゼの導入は、当業者が、本発明のタンパク質において最適化N-グリコシル化コンセンサス部位に結合されたN-グリカンを変動することを可能にする。
【0054】
上記の結果として、本発明は、本発明のタンパク質上のN-グリカン-パターンの個別のデザインを提供する。従ってこれらのタンパク質は、生物学的、医薬的及び精製上の必要性に適するようにそれらのN-グリカンパターンを個別化することができる。
【0055】
本発明の実施態様において、前記タンパク質は、該N-グリコシル化された最適化アミノ酸配列を1つ、しかし同じく少なくとも2つ、少なくとも3つ又は少なくとも5つなど1つよりも多くも含むことができる。
【0056】
本発明のタンパク質内の1つ以上のN-グリコシル化された最適化アミノ酸配列の存在は、それらの免疫原性を高める上で、それらの安定性を増大する上で、それらの生物活性に影響を及ぼす上で、それらの生物学的半減期を延長する上で、及び/又はそれらの精製を簡略化する上で利点であり得る。
【0057】
本最適化コンセンサス配列は、X及びZの位置に、プロリン以外の任意のアミノ酸を含むことができる。用語「任意のアミノ酸」とは、OTaseにより最適化コンセンサス配列をN-グリコシル化させることが依然可能である、一般的な及び稀少な天然のアミノ酸に加え、合成のアミノ酸誘導体及び類似体を包含することを意味する。X及びZについて、天然の一般的な及び稀少なアミノ酸が好ましい。X及びZは、同じ又は異なることができる。
【0058】
本発明のタンパク質中の各最適化コンセンサス配列に関して、X及びZは異なってもよいことに留意されたい。
【0059】
OTaseによる転移のために脂質キャリア上にオリゴ糖を構築する場合、最適化コンセンサス配列に結合されたN-グリカンは、特異的グリコシルトランスフェラーゼ及びそれらの相互作用により決定されるであろう。本発明を考慮し、当業者は、所望の宿主細胞に存在する特異的グリコシルトランスフェラーゼの種類及び量を変動することにより、N-グリカンをデザインすることができるであろう。
【0060】
本明細書において使用される「単糖」とは、1個の糖残基をいう。「オリゴ糖及び多糖」とは、2個以上の糖残基をいう。本明細書において使用される用語「グリカン」とは、単糖、オリゴ糖又は多糖をいう。「N-グリカン」は、本明細書において、N-グリコシド結合を介してタンパク質内のアスパラギン残基のε-アミド窒素に連結された変動可能な組成の単糖、オリゴ糖又は多糖と定義される。ある実施態様において、OTaseにより転移されたN-グリカンは、グラム陰性菌又はグラム陽性菌の細胞質膜に存在するウンデカプレノールピロリン酸("Und-P-P")脂質-アンカー上に構築される。これらは、O抗原、O多糖及びペプチドグリカンの合成に関与している(Bugg, T. D.及びBrandish, P. E.の文献、(1994)、「ペプチドグリカンから糖タンパク質:脂質-連結されたオリゴ糖生合成の一般的特徴(From peptideglycan to glycoproteins : common features of lipid-linked oligosaccharide biosynthesis)」、FEMS Microbiol Lett, 119, 255-262;Valvano, M. A.の文献、(2003)、「O-特異的リポ多糖体の輸送(Export of O-specific lipopolysaccharide)」、Front Biosci, 8, s452-471)。
【0061】
脂質-連結された反復する四糖体(4-N-アセチルペロサミン→フコース→グルコース→GalNAc)の生合成は、WecAによるGalNAc-P-P-Undの形成により開始されるかどうかを決定するために、研究を行った。大腸菌K12株、O157株、及びPR4019株、WecA-過剰発現株由来の膜画分がUDP-[3H]GalNAcと一緒にインキュベートされる場合、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの酵素合成はどちらも検出されなかった。しかし、O157株由来の膜画分がUDP-[3H]GlcNAcと一緒にインキュベートされる場合、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの化学特性及びクロマトグラフィー特性を持つ2つの酵素標識された生成物が観察され、O157株は、GlcNAc-P-P-Und及びGalNAc-P-P-Undの相互変換を可能にするエピメラーゼを含むことを確認した。外因性[3H]GlcNAc-P-P-Undは、O157株由来の膜と一緒にインキュベートされる場合、[3H]GalNAc-P-P-Undへ変換されたことを示すことによっても、エピメラーゼの存在が確認された。O157株が[3H]GlcNAcにより代謝標識される場合、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの両方が検出された。大腸菌21546株のZ3206遺伝子による形質転換は、これらの細胞がインビボ及びインビトロにおいてGalNAc-P-P-Undを合成することを可能にした。このエピメラーゼ反応の可逆性は、O157株由来の膜が外因性[3H]GalNAc-P-P-Undと一緒にインキュベートされる場合、[3H]GlcNAc-P-P-Undが再形成(reform)されたことを示すことによって、明らかにされた。大腸菌におけるカンピロバクター・ジェジュニN-グリコシル化システムの発現においてZ3206はgne遺伝子の喪失を補完することができないことは、これがUDP-GlcNAc/UDP-GalNAcエピメラーゼとしては機能しないことを示した。これらの結果を基に、GalNAc-P-P-Undは、大腸菌O157におけるWecAによるGlcNAc-P-P-Undの形成後に、GlcNAc-P-P-Undエピメラーゼにより可逆的に合成されることが確認された。
【0062】
GalNAc-P-P-Und合成は、WecAによるよりもむしろ、いくつかのこれまで未知の機構により触媒されることを確認するために、大腸菌O157のO-抗原サブユニット構築の開始反応を調べた。本明細書に提示された証拠は、GalNAc-P-P-Undは、WecAにより触媒されたUDP-GalNAcからのGalNAc-P転移により合成されないが、しかし大腸菌O157のZ3206遺伝子によりコードされたエピメラーゼにより触媒されたGlcNAc-P-P-Undの4-OHの可逆的エピマー化により合成されることを示している。
【0063】
従って本発明は、GalNAc-P-P-Undの合成のための新規生合成経路に加え、重要な細菌細胞の表面構成成分の構築のための新規生合成経路を包含している。本発明の更なる実施態様は、抗微生物薬の新規標的としての細菌エピメラーゼを含む。
【0064】
大腸菌O157は、反復する四糖体構造(4-N-アセチルペロサミン→フコース→グルコース→3fGalNAc)を持つO-抗原を合成する。以前の遺伝子研究(Wang, L.及びReeves, P. R.の文献、(1998) Infect. Immun. 66, 3545-3551)とは対照的に、本明細書においては、脂質-連結された四糖体中間体の生合成は、WecAにより触媒されたUDP-GalNAcからUnd-PへのGalNAc-Pの酵素転移により開始されなかったことが示された。本明細書において説明され、ホモロジー検索により得られ、その後遺伝子、酵素及び代謝標識の実験の結果により確認された本発明は、WecAは、基質としてUDP-GalNAcを利用しないこと、しかしWecAは、O157株のZ3206遺伝子によりコードされたエピメラーゼによりその後GalNAc-P-P-Undへ可逆的に変換されるGlcNAc-P-P-Undの合成に必要であることを明らかにしている。
【0065】
本発明のZ3206遺伝子は、それらの還元末端にGalNAc残基を含む表面O-抗原反復単位を生成するいくつかの菌株に存在する遺伝子ファミリーに属する(表1)。Z3206遺伝子配列は、配列番号:1に示されている。先行する報告は、Z3206遺伝子と100%同一である、大腸菌O55由来(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625)及び大腸菌O86由来(Guo, H.、Yi, W.、Li, L.及びWang, P. G.の文献、(2007) Biochem. Biophys. Res. Comm., 356, 604-609)の2つの遺伝子、各々、大腸菌O55 gne及び大腸菌O86 gne1を報告している(表1)。大腸菌O55 gne遺伝子配列は配列番号:3として示され、大腸菌O86 gne1遺伝子配列は配列番号:5として示されている。
【表1】

【0066】
従って、本出願人らは、大腸菌O55 gne及び大腸菌O86 gne1は、各々、O55株及びO86株において、GlcNAc-P-P-UndのGalNAc-P-P-Undへの変換が可能であるエピメラーゼもコードしており、これらは還元末端にGalNAcを持つO-抗原反復単位をも生成することを結論づけた(表1)。
【0067】
本研究における2つの実験的アプローチは、Z3206タンパク質は、O157株におけるUDP-GlcNAcのUDP-GalNAcのへのエピマー化を触媒しないことを指摘している。第一に、O157株由来の膜が[3H]UDP-GalNAcと一緒にインキュベートされる場合、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undはどちらも検出されなかった(表3)。Z3206が、[3H]UDP-GalNAcの[3H]UDP-GlcNAcへの変換を触媒するならば、[3H]GlcNAc-P-P-Undが観察されるべきであることが予想される。第二に、本出願人らは、赤血球凝集素-タグ付きZ3206は、UDP-GalNAc-依存性C.ジェジュニN-グリコシル化リポーターシステムを補完することが不可能であることを示した(図8)。
【0068】
O55株由来の大腸菌O55 gne遺伝子(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625)も同じく、粗抽出物をUDP-GalNAcと一緒にインキュベートし、酸加水分解後のp-ジメチルアミノベンズアルデヒドとの反応性の増加を測定し、UDP-GlcNAcへの変換を間接的にアッセイすることにより、エピメラーゼ活性についてアッセイした。両方の研究において、本生成物の形成は、糖ヌクレオチド最終生成物の限定的特徴ではなく、p-ジメチルアミノベンズアルデヒドとの反応性の変化を基にした。90%純粋なポリヒスチジン-タグ付き大腸菌O86 gne1も同じく、組合せアッセイにおいてGne2と比べ、低レベルのUDP-グルコースエピメラーゼ活性を有することが示された。
【0069】
従って、本発明の実施態様は、GlcNAc-P-P-UndをGalNAc-P-P-Undへ変換する、Z3206遺伝子、大腸菌O55 gne遺伝子又は大腸菌O86 gne1遺伝子を含む、組換え原核細胞生合成システムに関する。
【0070】
追加の非還元末端GalNAcのためのグリコシル供与体として恐らくUDP-GalNAcを必要とする2個のGalNAc残基を含むO-抗原を合成する大腸菌O86は、O-抗原遺伝子クラスター内にgne2と称される追加のGlcNAc 4-エピメラーゼ遺伝子も有することは重要である(Guo, H.、Yi, W.、Li, L.及びWang, P. G.の文献、(2007) Biochem. Biophys. Res. Commun., 356, 604-609)。この追加のエピメラーゼ遺伝子は、コラン酸遺伝子クラスターのgalE遺伝子と高い相同性を有し、且つUDP-GalNAcを合成することが可能であるUDP-GlcNAc 4-エピメラーゼであるように考えられる。
【0071】
Z3206遺伝子は、GalNAcで始まる大腸菌O-血清型において高度に保存されるようである。最近の研究において、確立されたO-抗原反復単位構造を有する62種の大腸菌株が、大腸菌O157 Z3206遺伝子を特異的に検出するようにデザインされたヌクレオチドプライマーを使用するポリメラーゼ連鎖反応を基にした方法により、Z3206の発現についてスクリーニングされた(Wang, L.、Huskic, S.、Cisterne, A.、Rothemund, D.及びReeves, P.R.の文献、(2002) J. Bacteriol. 184, 2620-2625)。この研究において、Z3206は、GalNAcを含むことがわかっている22種の大腸菌株中16種において、及びGalNAcを欠く40種の菌株のわずかに4種において、検出された。更に、UDP-GlcNAc 4-エピメラーゼ活性を持つ代替エピメラーゼ(大腸菌O113のGalE遺伝子)を検出するようにデザインされたプライマーによる、22種のGalNAc-含有株の同様のスクリーニングは、この遺伝子を保持する菌株を検出せず、このことはZ3206は、大腸菌のO-抗原反復単位における還元末端GalNAcの存在に最も一般的に関連づけられたGlcNAc 4-エピメラーゼ遺伝子であることを示している。
【0072】
様々なウェブ-ベースのトポロジー予測アルゴリズムによるZ3206タンパク質配列の分析は、Z3206タンパク質は高度に疎水性ではないことを示している。大部分のトポロジー予測アルゴリズムは、Z3206は可溶性37kDaタンパク質であることを示しているが、TMPredは、1個の弱いN-末端膜貫通ヘリックスを予測した(Hofmann, K.及びStoffel, W.の文献、(1993) Biol. Chem. Hoppe-Seyler, 374, 166 (要約))。しかし赤血球凝集素-タグ付きZ3206を発現している大腸菌細胞由来の細胞画分のSDS-PAGE後のウェスタンブロットは、このタグ付きタンパク質は、それらの細胞の低張溶解後に、微粒子画分に会合されることを明確に示している。予備実験は、前記タンパク質は、膜画分の1M KClとのインキュベーション後に微粒子画分に会合され続けるが、0.1%Triton X-100とのインキュベーションにより活性型で可溶化されることを示している。
【0073】
大腸菌O157のZ3206は、NAD(P)結合ポケットと一致する、GXXGXXGモチーフ(Rossmanフォールド)(Allard, S. T. M.、Giraud, M. F.、及びNaismith, J. H.の文献、(2001) Cell. Mol. Life Sci. 58, 1650-1655)、並びにプロトン引き抜き及び供与に関与した、保存されたSX24YX3K配列(Field, R. A.及びNaismith, J. H.の文献、(2003) Biochemistry, 42, 7637-7647)を含むオキシド-レダクターゼの短鎖デヒドロゲナーゼ/レダクターゼファミリーと著しい配列相同性を有する。短鎖デヒドロゲナーゼ/レダクターゼファミリーの別のメンバーであるUDP-Glc 4-エピメラーゼの結晶構造を基にした分子モデリングは、ヒドリド引き抜き後、4-ケト中間体が、UDPのβリン酸の周りを回転し、ケト中間体の反対面を提示し、且つその反対面からのヒドリドの再挿入を可能にし、その結果4位の炭素におけるヒドロキシルの立体配置を反転することを示唆している。これらの保存された配列の存在は、Z3206は恐らく類似した機構を介し機能することを示唆している。図7に見られるように、本エピメラーゼ生成物の平衡分布は、GlcNAc-P-P-Undの形成を支持しているように見えるが、O-抗原反復単位の構築のためのGalNAc-P-P-Undの利用は、質量作用により、GalNAc-P-P-Undの方向にエピマー化反応を駆動するであろう。
【0074】
ポリイソプレノイド脂質中間体のグリコシル部分のエピマー化は、実際には広くは報告されていない。1つの先行する研究において、マイコバクテリアにおけるアラビノガラクタン生合成のアラビノシル供与体であるアラビノシル-P-デカプレノールを形成するリボシル-P-デカプレノールの2-エピマー化が報告された(Mikusova, K.、Huang, H.、Yagi, T.、Holsters, M.、Vereecke, D.、D'Haeze, W.、Scherman, M. S.、Brennan, P. J.、McNeil, M. R.、及びCrick, D. C.の文献、(2005) J. Bacteriol. 187, 8020-8025)。アラビノシル-P-デカプレノールは、2種のマイコバクテリアタンパク質Rv3790及びRv3791を必要とする、2工程酸化/還元反応を介して形成される。エピマー化は、NAD及びNADPの添加により若干刺激されるが、Rv3790もRv3791も、短鎖デヒドロゲナーゼ/レダクターゼファミリーの特徴であるRossmanフォールド又はSX24YXXXKモチーフのいずれも含まない(Allard, S. T. M.、Giraud, M.-F.及びNaismith, J. H.の文献、(2001) Cell. Mol. Life Sci. 58, 1650-1655;Field, R. A.及びNaismith, J. H.の文献、(2003) Biochemistry 42, 7637-7647)。
【0075】
まとめると、GlcNAc-P-P-Undのエピマー化によるGalNAc-P-P-Undの形成に関する新規生合成経路が説明されている。
【0076】
いくつかの抗生物質が、GlcNAc-P-P-Undの合成を阻害することが示されているが、それらはタンパク質N-グリコシル化経路を開始するドリコール-連結された中間体であるGlcNAc-P-P-ドリコールの合成も妨害するので、それらの有用性は限定されている。GlcNAc-P-P-ドリコールは、細菌の糖脂質中間体GlcNAc-P-P-Undの構造上関連した哺乳動物の対応物であるが、真核細胞においてはGlcNAc-P-P-ドリコールをGalNAc-P-P-ドリコールに変換する類似したエピマー化反応の証拠は存在しない。従ってこれは、還元末端にGalNAcを含む表面O-抗原が病理発生プロセスに関与している菌株において、細菌のエピメラーゼを阻害することによって、O-抗原合成が、潜在的に妨害される可能性を生じている。
【0077】
本発明の実施態様は、大腸菌O157において、GlcNAc-P-P-Und(N-アセチルグルコサミニルピロホスホリルウンデカプレノール)を、GalNAc-P-P-Und(N-アセチルガラクトサミニルピロホスホリルウンデカプレノール)に変換するエピメラーゼに関与している。なお更に本発明の例証的態様は、還元末端にGalNAcを有する脂質-結合した反復する四糖体の合成の開始に関与している。
【0078】
本発明の別の態様の基礎は、カンピロバクター・ジェジュニは、一般的N-連結されたタンパク質グリコシル化システムを含むことの発見を含む。C.ジェジュニの様々なタンパク質は、七糖類により修飾されることが示されている。この七糖類は、特異的グリコシルトランスフェラーゼにより触媒されたヌクレオチド活性化された単糖の段階的添加により、内側膜の細胞質側で、キャリア脂質ウンデカプレニルピロリン酸上に構築される。脂質-連結されたオリゴ糖は、次にフリッパーゼ、例えばPglKにより、ペリプラズム間隙へとフリップ-フロップする(横断して広がる)。N-連結されたタンパク質グリコシル化の最終工程において、オリゴサッカリルトランスフェラーゼ(例えば、PglB)は、キャリア脂質からコンセンサス配列D/E-X-N-Z-S/T内のアスパラギン(Asn)残基への、オリゴ糖の転移を触媒する(式中、X及びZは、Pro以外の任意の天然のアミノ酸であり得る)。七糖体に関するグリコシル化クラスターは、大腸菌へ巧く転移され、且つカンピロバクターのN-連結された糖タンパク質が生成されている。
【0079】
PglBは、脂質-連結された糖基質に対し厳密な特異性を有さないことが明らかにされた。ウンデカプレニルピロリン酸上に構築された抗原性多糖は、ペリプラズム内のPglBにより捕獲され、且つタンパク質キャリアへ転移される(Feldmanの文献、2005;Wacker, M.らの文献、「細菌及び真核生物のシステムの共通の転移機序を示唆する細菌オリゴサッカリルトランスフェラーゼの基質特異性(Substrate specificity of bacterial oligosaccharyltransferase suggests a common transfer mechanism for the bacterial and eukaryotic systems)、Proc Natl Acad Sci USA, 2006. 103(18): p.7088-93)。この酵素が還元末端にN-アセチル化されたヘキソサミンを含む場合、これはウンデカプレニルピロリン酸(UPP)連結されたオリゴ糖の多様なアレイも転移するであろう。pglBヌクレオチド配列及びPglBアミノ酸配列は、WO2009/104074に公開されている。
【0080】
従って本発明の一実施態様は、1つ以上の導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る);及び、還元末端に、N-アセチルガラクトサミンを有し、N-グリコシド結合により1以上の該導入されたコンセンサス配列の各々にN-連結されたオリゴ糖又は多糖:を含む、組換えN-グリコシル化タンパク質に関与している。
【0081】
更なる実施態様において、本発明は、ウンデカプレニルピロリン酸上にN-アセチルガラクトサミン("GalNAc")を合成するエピメラーゼを含む、多糖の全て又は一部を生成するための組換え原核細胞生合成システムに関する。更なる実施態様において、これらの多糖の全て又は一部は抗原性である。
【0082】
別の実施態様において、本発明は、ウンデカプレニルピロリン酸上でGalNAcを合成するエピメラーゼ;及び、還元末端にGalNAcを有する多糖を合成するグリコシルトランスフェラーゼ:を含む、組換え原核細胞生合成システムに関する。
【0083】
本発明の実施態様は、ウンデカプレニルピロリン酸上でGalNAcを合成するエピメラーゼ、及び、多糖を合成するグリコシルトランスフェラーゼ:を含む組換え原核細胞生合成システムを更に含み、ここで該多糖は、下記構造を有し:α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAc;且つ、ここでGalNAcは該多糖の還元末端に存在する。
【0084】
本組換え原核細胞生合成システムは、様々な起源の単糖、オリゴ糖又は多糖を生成することができる。本発明の実施態様は、様々な起源のオリゴ糖及び多糖に関する。そのようなオリゴ糖及び多糖は、原核細胞又は真核細胞を起源とすることができる。原核細胞起源のオリゴ糖又は多糖は、グラム陰性菌又はグラム陽性菌に由来してよい。本発明の一実施態様において、オリゴ糖又は多糖は、大腸菌に由来している。更なる本発明の態様において、該オリゴ糖又は多糖は、大腸菌O157に由来している。別の実施態様において、該オリゴ糖又は多糖は、下記構造を含む:α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAc。本発明の更なる実施態様において、オリゴ糖又は多糖は、シゲラ・フレックスネリに由来している。より更なる実施態様において、オリゴ糖又は多糖は、シゲラ・フレックスネリ6に由来している。より更なる態様において、該オリゴ糖又は多糖は、下記構造を含む。
【化1】

【0085】
本発明の実施態様は、様々な起源のタンパク質を更に含む。そのようなタンパク質は、原核生物及び真核生物について未変性のタンパク質を含む。タンパク質キャリアは、例えばAcrA、又はタンパク質グリコシル化のためのコンセンサス配列、すなわちD/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意のアミノ酸であり得る)(例えば、改変された外毒素緑膿菌(Pseudomonas aeruginosa)("EPA"))を含むように改変されたタンパク質キャリアであることができる。本発明の一実施態様において、タンパク質は、緑膿菌EPAである。
【0086】
本発明の更なる態様は、N-グリカンの還元末端にGalNAcを有する新規バイオコンジュゲートワクチンに関する。追加の本発明の実施態様は、ウンデカプレニルピロリン酸上にGalNAcを生成するエピメラーゼを含む組換え細菌細胞を使用する、そのようなバイオコンジュゲートワクチンを製造する新規アプローチに関与している。一実施態様において、バイオコンジュゲートワクチンは、細菌疾患を治療又は予防するために使用することができる。更なる実施態様において、バイオコンジュゲートワクチンは、癌又は他の疾患に関する治療的及び/又は予防的可能性を有し得る。
【0087】
典型的ヒトに関するワクチン接種用量は、約1〜25μg、好ましくは約1μg〜約10μg、最も好ましくは約10μgである。任意に、本発明のバイオコンジュゲートワクチンなどのワクチンは、アジュバントを含有する。
【0088】
追加の実施態様において、本発明は、オリゴサッカリルトランスフェラーゼをコードしているヌクレオチド配列;タンパク質キャリアをコードしているヌクレオチド配列;少なくとも1種の細菌由来の少なくとも1つの多糖の遺伝子クラスターであり、ここで多糖が還元末端にGalNAcを含むもの;及び、エピメラーゼをコードしている核酸配列:を含有する、少なくとも1種の細菌に対するバイオコンジュゲートワクチンを製造するための発現システムに関する。更なる実施態様において、多糖の遺伝子クラスターは、抗原性多糖をコードしている。
【0089】
なお更なる実施態様において、本発明は、オリゴサッカリルトランスフェラーゼをコードしているヌクレオチド配列;少なくとも1つの挿入されたコンセンサス配列D/E-X-N-Z-S/Tであり、ここでX及びZは、プロリン以外の任意の天然のアミノ酸であり得るものを含むタンパク質キャリアをコードしているヌクレオチド配列;少なくとも1種の細菌由来の少なくとも1つの多糖の遺伝子クラスターであり、ここで多糖が還元末端にGalNAcを含むもの;及び、Z3206遺伝子:を含有する、少なくとも1種の細菌に対するバイオコンジュゲートワクチンを製造するための発現システムに関する。更なる実施態様において、この多糖の遺伝子クラスターは、抗原性多糖をコードしている。
【0090】
更に別の実施態様において、本発明は、タンパク質キャリア;該タンパク質キャリアに連結された少なくとも1つの免疫原性多糖鎖であり、ここで該多糖が還元末端にGalNAcを有し、且つ更に該GalNAcがタンパク質キャリアに直接連結されているもの;及び、アジュバント:を含有する、バイオコンジュゲートワクチンに関する。
【0091】
更に追加の実施態様において、本発明は、少なくとも1つの挿入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る)を含むタンパク質キャリア;該タンパク質キャリアに連結された、少なくとも1種の細菌由来の少なくとも1つの免疫原性多糖であり、ここで少なくとも1つの免疫原性多糖が、タンパク質キャリアに直接連結されたGalNAcを還元末端に含むもの;及び、任意にアジュバント:を含有する、バイオコンジュゲートワクチンに関する。
【0092】
本発明の別の実施態様は、グリコシルトランスフェラーゼの使用を通じて、組換え生物において還元末端にGalNAcを有する多糖を構築する工程;該GalNAcを、該組換え生物における1種以上の標的タンパク質のアスパラギン残基へ連結する工程であって、ここで該1種以上の標的タンパク質が1つ以上のT-細胞エピトープを含む工程:を含む、バイオコンジュゲートワクチンの製造方法に関する。
【0093】
更なる実施態様において、本発明は、改変された原核生物を生じるために、原核生物へ標的タンパク質のN-グリコシル化を実行する代謝装置をコードしている遺伝情報を導入する工程であり;ここで1つ以上の組換え標的タンパク質の発現に必要とされる遺伝情報が、該原核生物に導入され;ここで大腸菌O157株エピメラーゼの発現に必要とされる遺伝情報が、該原核生物に導入され;並びに、ここで代謝装置は、脂質キャリア上の還元末端にGalNAcを有する多糖を構築する型のグリコシルトランスフェラーゼ、及びオリゴサッカリルトランスフェラーゼを含み、このオリゴサッカリルトランスフェラーゼは、多糖のGalNAcを標的タンパク質のアスパラギン残基に共有的に連結し、且つこの標的タンパク質は、少なくとも1つのT-細胞エピトープを含むものである工程;改変された原核生物の培養物を生じる工程;並びに、培養培地からグリコシル化タンパク質を得る工程:を含む、バイオコンジュゲートワクチンの製造方法に関する。
【0094】
本発明の更なる態様は、医薬組成物に関する。本発明の追加の態様は、本発明の少なくとも1つのN-グリコシル化タンパク質を含有する医薬組成物に関与している。本明細書の開示に照らして、タンパク質を含有する医薬品の調製は、当該技術分野において周知であろう。本発明のなお更なる態様は、GlcNAc-P-P-UndをGalNAc-P-P-Undへ変換するエピメラーゼを阻害する抗生物質を含有する医薬組成物に関する。好ましい実施態様において、本発明の医薬組成物は、医薬として許容し得る賦形剤、希釈剤及び/又はアジュバントを含有する。
【0095】
好適な賦形剤、希釈剤及び/又はアジュバントは、当該技術分野において周知である。賦形剤又は希釈剤は、活性成分の溶媒又は媒体として役立つ固体、半固体又は液体の物質であることができる。組成物調製の分野の当業者は、選択された製品の具体的特徴、治療される疾患又は状態、疾患又は状態の病期、及び他の関連状況に応じ適切な投与の形状及び様式を容易に選択することができる(「レミントン薬科学(Remington's Pharmaceutical Sciences)」、Mack Publishing Co. (1990))。医薬として許容し得る希釈剤又は賦形剤の割合及び性質は、選択された医薬活性化合物の溶解度及び化学特性、選択された投与経路、並びに標準の薬務により決定される。医薬品調製品は、経口、非経口又は局所使用に適合されることができ、且つ錠剤、カプセル剤、坐剤、液剤、懸濁剤などの形状で患者へ投与されることができる。本発明の医薬活性化合物は、それら自身が有効である一方、安定性、結晶化の簡便性、溶解度の上昇などの目的で、酸付加塩又は塩基付加塩などのそれらの医薬として許容し得る塩の形状で製剤され且つ投与されることができる。
【0096】
特定のヌクレオチド配列又はアミノ酸配列に留意する場合には、本発明は、留意された配列と同じ機能性を依然体現している相同配列を包含することは理解されるであろう。本発明の実施態様において、そのような配列は少なくとも85%相同である。別の実施態様において、そのような配列は少なくとも90%相同である。なお更なる実施態様において、そのような配列は少なくとも95%相同である。
【0097】
2つのヌクレオチド配列又はアミノ酸配列の間の同一性の割合の決定は、当業者に公知である。
【0098】
以下に列挙された配列において説明されたもののような、本明細書に記載された核酸配列は、単なる例証であり、これらの配列は様々な方法で組み合わせることができることは当業者には明らかであろう。
【0099】
本発明の追加の実施態様は、核酸の変異形を含む。核酸の変異形(例えば、コドン-最適化核酸)は、配列番号:1、配列番号:3、配列番号:5、配列番号:7、配列番号:9、配列番号:11、配列番号:13、配列番号:15、配列番号:17、配列番号:18、配列番号:19、配列番号:20、配列番号:21、配列番号:22、配列番号:23、配列番号:24、配列番号:27、配列番号:28又は配列番号:29と実質的に同一、すなわち、少なくとも80%同一、例えば、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は99.5%同一である。配列番号:1、配列番号:3、配列番号:5、配列番号:7、配列番号:9、配列番号:11、配列番号:13、配列番号:15、配列番号:17、配列番号:18、配列番号:19、配列番号:20、配列番号:21、配列番号:22、配列番号:23、配列番号:24、配列番号:27、配列番号:28又は配列番号:29を含む配列の核酸変異形は、配列番号:1、配列番号:3、配列番号:5、配列番号:7、配列番号:9、配列番号:11、配列番号:13、配列番号:15、配列番号:17、配列番号:18、配列番号:19、配列番号:20、配列番号:21、配列番号:22、配列番号:23、配列番号:24、配列番号:27、配列番号:28又は配列番号:29、若しくはそれらの一部を含む配列から、1個以上のヌクレオチド(例えば、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175又は200個のヌクレオチド)の置換、変異(variation)、修飾、交換、欠失及び/又は付加を伴う核酸を含む。
【0100】
例えば、本発明の実施態様において、そのような変異形は、GlcNAc-P-P-UndをGalNAc-P-P-Undへ変換するエピメラーゼをコードしている核酸であって、並びにi)例えば大腸菌などの宿主細胞において発現され、且つii)配列番号:1、配列番号:3、配列番号:5、配列番号:7若しくは配列番号:9、又はそれらの一部と実質的に同一である核酸を含む。
【0101】
本明細書に記載された核酸は、組換えDNA及び合成(例えば化学的に合成された)DNAを含む。核酸は、二本鎖又は一本鎖であることができる。一本鎖の核酸である場合、核酸はセンス鎖又はアンチセンス鎖であることができる。核酸は、オリゴヌクレオチド類似体又は誘導体を用いて合成することができる。
【0102】
本明細書に記載された核酸を含むプラスミドは、発現のために宿主細胞へと形質導入又は形質転換されることができる。形質導入及び形質転換の技術は、当業者に公知である。
【0103】
本明細書において言及された全ての刊行物は、それらの全体が引用により組み込まれている。本明細書において使用される用語「又は」は、適宜組み合わせることができる代替を意味し;すなわち、用語「又は」は、個別に列挙された代替の各々に加え、それらの組合せを含むと理解されるべきである。本明細書において使用されるように、文脈が別に明確に指摘しない限りは、単数形「1つ(a、an、及びthe)」などの単数の言及は、複数を含み、且つ複数の言及は単数を含む。
【0104】
本発明は、本発明の組成物及び方法に加え、その利用性を更に説明している下記実施例を参照し、更に規定される。当業者には、本発明の範囲内である組成物及び方法の両方の改変を実施することができることは明らかであろう。
【実施例】
【0105】
(実施例)
(細菌株及びプラスミド)−大腸菌PR4019株(Rush, J. S.、Rick, P. D.及びWaechter, C. J.の文献、(1997) Glycobiology, 7, 315-322)、及びPR21546株(Meier-Dieter, U.、Starman, R.、Barr, K.、Mayer, H.及びRick, P. D.の文献、(1990) J. Biol. Chem., 265, 13490-13497)は、Dr. Paul Rick(ベセスダ、MD)のご厚意により贈られ、並びに大腸菌O157:H45(Stephan, R.、Borel, N.、Zweifel, C.、Blanco, M.、及びBlanco, J.E.の文献、(2004) BMC Microbiol 4:10)は、Dr. Claudio Zweifel(チューリッヒ大学獣医学研究所)から贈答されたものであった。大腸菌DH5α(Invitrogen社)を、クローニング実験及びタンパク質グリコシル化分析のための宿主として使用した。使用したプラスミドを、表2に列挙した。
【表2】

【0106】
(材料)−[1,6-3H]GlcNAc(30Ci/mmol)、UDP-[1-3H]GlcNAc(20Ci/mmol)及びUDP-[6-3H]GalNAc(20Ci/mmol)は、American Radiolabeled Chemicals社(セントルイス、MO)から入手した。Quantum 1シリカゲルG薄層プレートは、Quantum Industries社(フェアフィールド、NJ)の製品であり、且つBaker Si250シリカゲルGプレートは、Mallinckrodt Chemical Works社により製造されている。酵母エキス及びバクトペプトンは、BD Biosciences社の製品であった。他の化学物質は全て、標準の商業的供給業者から入手した。トリメトプリム(50μg/ml)、クロラムフェニコール(20μg/ml)、アンピシリン(100μg/ml)、及びカナマイシン(50μg/ml)は、必要に応じ培地に添加した。
【0107】
(組換えプラスミドの作製)−大腸菌DH5α株を、DNAクローニング実験に使用し、作製されたプラスミドを、DNA配列決定により検証した。Z3206遺伝子を、大腸菌O157:H45から、オリゴヌクレオチドZ3206-Fw及びZ3206-RvHA
【化2】

;(制限部位には下線が付けられている)を用いるPCRにより、増幅した。PCR断片を、SmaI及びXbaIにより消化し、SmaI-XbaI切断されたpMLBADベクター(Lefebre, M. D.及びValvano M. A.の文献、(2002) Appl Environ Microbiol 68: 5956-5964)にライゲーションした。これは、C-末端に赤血球凝集素タグを持つZ3206をコードしているプラスミドpMLBAD:Z3206(配列番号:23)を生じた。
【0108】
gne遺伝子は、オリゴヌクレオチドgne-Fw及びgne-RV
【化3】

;(制限部位には下線が付けられている)により、カンピロバクター・ジェジュニpglクラスターをコードしているpACYCpgl(Wacker, M.、Linton, D.、Hitchen, P.G.、Nita-Lazar, M.、Haslam, S.M.、North, S.J.、Panico, M.、Morris, H.R.、Dell, A.、Wrenn, B.W.、Aebi, M.の文献、(2002) Science 298, 1790-1793)から増幅した。PCR産物を、NcoI及びXbaIで消化し、pMLBADの同じ部位にライゲーションし、C-末端に赤血球凝集素タグを持つGneをコードしているプラスミドpMLBAD:gne(配列番号:24)を生成した(表2)。
【0109】
(増殖条件、タンパク質発現及び免疫検出)−大腸菌株を、Luria-Bertani培地(1%酵母エキス、2%バクト-ペプトン、0.6%NaCl)において、37℃で激しく振盪しながら培養した。A600が0.05〜0.4となるまで増殖させた大腸菌細胞へ、最終濃度0.02〜0.2%(w/v)となるようアラビノースを添加することにより、アラビノース誘導性発現を実現した。同量のアラビノースを、誘導後5時間で再度添加し、インキュベーションを4〜15時間継続した。
【0110】
(分析手順)−タンパク質濃度は、Pierce Biotechnology社の公報「BCAタンパク質アッセイのための試料からの干渉物質の除去(Eliminate Interfering Substances from Samples for BCA Protein Assay)」に従い、デオキシコール酸及びトリクロロ酢酸による膜タンパク質の沈殿後、BCAタンパク質アッセイ(Pierce社)を使用し決定した。試料は、Packard社Tri-Carb 2100TR液体シンチレーションスペクトロメーターにおいて、1%SDS 0.5ml及びEconosafe Economical Biodegradable Counting Mixture(Research Products International社、マウントプロスペクト、IL)4mlの添加後、シンチレーションスペクトロメーターにより、放射能について分析した。
【0111】
(実施例1:GlcNAc-P-P-Und 4-エピメラーゼをコードしている大腸菌O157遺伝子の同定)
本出願人らは、本明細書において、GalNAc-P-P-Undが、これまで未知の4-エピメラーゼの作用により触媒されるGlcNAc-P-P-Undの4-OHのエピマー化により形成される新規生合成経路の驚くべき発見を記載する。この経路において、GlcNAc-P-P-Undは、WecAにより触媒されるUDP-GlcNAcからのGlcNAc-Pの転移により合成され、次にGlcNAc-P-P-Undは、GlcNAc-P-P-Und-4-エピメラーゼによりGalNAc-P-P-Undへエピマー化され、これはこれまで未知の経路である(図2)。
【0112】
GlcNAc-P-P-Und 4-エピメラーゼの候補をコードしている遺伝子は、DNAホモロジー検索により同定された。ホモロジー検索は、http://blast.ncbi.nlm.nih. gov/Blast.cgiにおいて認められる、米国国立医学図書館(NLM)データベースを用い行った。還元末端にGalNAcを有するO-抗原反復単位をコードしている様々な細菌のゲノム配列を検索した。還元末端にGalNAcを含む反復単位を持つ第一群、反復単位に末端GalNAcを欠いている第二群を比較し、可能性のあるエピメラーゼを同定した。これらの分類基準を用い、Z3206を、候補GlcNAc-P-P-Und 4-エピメラーゼとして同定した(表1)。
【0113】
GalNAcを含むO-抗原反復単位を有する大腸菌株に存在するGlcNAc 4-エピメラーゼ遺伝子は、表1に示されたように2つのホモロジー群に分けることができる。驚くべきことに、第一のホモロジー群(gne1を含む)は、O-抗原反復単位上の開始の糖としてのGalNAcの存在に明確に相関していることを発見した。更に驚くべきことに、第二群(gne2を含む)は、UDP-GlcエピメラーゼGalEと高度の類似性を示し、且つこれはGalNAcを持つO-抗原反復単位合成を開始しない大腸菌株において認められることを発見した。大腸菌O157におけるZ3206は、gne1と高度の相同性を持つ遺伝子であるが、これは候補GlcNAc-P-P-Und 4-エピメラーゼとして同定された。Z3206遺伝子はO-抗原クラスターのgalFとコラン酸クラスターに属するwcaMの間に存在するので、Z3206遺伝子のゲノム位置は、この経路における役割と一致している。
【0114】
実施例2〜11に説明された研究は、GalNAc-P-P-Undの形成を触媒するものとしてのGlcNAc 4-エピメラーゼ(大腸菌O157のZ3206)の同定を含む、前記発見を更に確認している。
【0115】
(実施例2:UDP-GalNAcは大腸菌WecA(GlcNAc-ホスホトランスフェラーゼ)の基質でない)
大腸菌WecAは、GalNAc-P-P-Undを形成するためのGalNAc-P供与体としてUDP-GalNAcを利用するかどうかを決定するために、GalNAc-P-P-Undの合成により恐らく開始される還元末端にGalNAcを持つ四糖体O-抗原反復単位を合成する大腸菌K12株、PR4019株、WecA-過剰発現株、及びO157株由来の膜画分を、UDP-[3H]GalNAcと一緒にインキュベートした。
【0116】
(大腸菌膜の調製)−細菌細胞を、1,000×gで10分間の遠心分離により収集し、氷冷したリン酸-緩衝食塩水中で1回、冷水で1回、及び10mMトリス-HCl(pH7.4)、0.25Mショ糖で1回洗浄した。これらの細胞を、0.2mg/mlリゾチームを含有する10mMトリス-HCl(pH7.4)、0.25Mショ糖、10mM EDTAの中に、密度〜200A600単位/mlとなるよう再懸濁し、30℃で30分間インキュベートした。細菌細胞を、1,000×gで10分間の遠心分離により回収し、40倍容量の氷冷した10mMトリス-HCl(pH7.4)中に迅速に再懸濁し、且つ氷上に放置した。10分後、細胞を、ぴったりはまったDounceホモジナイザーを用い15ストロークさせてホモジナイズし、0.1mMフッ化フェニルメチルスルホニル及びショ糖を補充し、最終濃度を0.25Mとした。破壊されていない細胞を、1,000×gで10分間の遠心分離により除去し、細胞エンベロープを、40,000×gで20分間の遠心分離により回収した。膜画分を、10mMトリス-HCl(pH7.4)、0.25Mショ糖、1mM EDTA中に再懸濁し、且つ40,000×gで再度沈降させ、同じ緩衝液中に、タンパク質濃度〜20mg/mlとなるよう再懸濁した。膜画分を、必要になるまで、-20℃で貯蔵した。
【0117】
(インビトロ大腸菌膜における[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの生合成のアッセイ)−GlcNAc-P-P-Und及びGalNAc-P-P-Undの合成のための反応混合物は、総容積0.05ml中に50mMトリス-HCl(pH8)、40mM MgCl2、5mMジチオスレイトール、5mM 5'AMP、大腸菌膜画分(50〜200μg膜タンパク質)、及び5μM UDP-[3H]GlcNAc/GalNAcのいずれか(500〜2500dpm/pmol)を含有した。37℃でインキュベーションした後、40倍容量のCHCl3/CH3OH(2:1)を添加することにより、反応を停止し、且つ[3H]HexNAc-P-P-ウンデカプレノールを含有する総脂質抽出物を、先に説明されたように調製した(Waechter, C. J.、Kennedy, J. L.及びHarford, J. B.の文献、(1976) Arch. Biochem. Biophys. 174, 726-737)。分配後、有機相を、窒素流下で乾燥し、CHCl3/CH3OH(2:1) 1ml中に再溶解し、且つアリコート(0.2ml)を取り出し、シンチレーションバイアル中で乾燥し、Packard社Tri-Carb 2100 TR液体シンチレーションスペクトロメーターにおいて液体シンチレーション分光法により放射能を分析した。[3H]GlcNAc-P-P-Und又は[3H]GalNAc-P-P-Undの合成の割合を決定するために、脂質抽出物を、窒素流下で乾燥し、少量のCHCl3/CH3OH(2:1)中に再溶解し、10cm×20cmのホウ酸含浸したBaker Si250シリカゲルプレート上にスポットし、且つこのプレートを、CHCl3、CH3OH、H2O、0.2Mホウ酸ナトリウム(65:25:2:2)で呈色した。個別の糖脂質を、Bioscan AR2000画像スキャン装置(Bioscan社、ワシントンD.C.)により検出した。各糖脂質の生合成の割合は、[3H]GlcNAc/GalNAc-P-P-Und中の放射能の総量に、個別の[3H]糖脂質の百分率を乗することにより、算出した。
【0118】
様々な大腸菌株(K12、PR4019及びO157)由来の膜画分を、UDP-[3H]GlcNAc又はUDP-[3H]GalNAcのいずれかと一緒にインキュベートし、[3H]GlcNAc/GalNAc-P-P-Undへの取り込みを、前述のように決定した。表3に認められるように、非標識の糖脂質が、UDP-[3H]GalNAcとのインキュベーション後に検出され、膜画分をUDP-[3H]GlcNAcと一緒にインキュベートした場合には、GlcNAc-P-P-Undのみが検出可能であった。
【表3】

【0119】
更に、PR4019株、WecA-過剰発現株由来の膜とのインキュベーションへの外因性Und-Pの添加も、O157細胞由来の細胞質ゾル画分の添加も、UDP-GalNAcからのGalNAc-P-P-Undの形成を生じなかった。これらの結果は、UDP-GalNAcは、WecAにとっての基質ではないことを明らかにし、且つGalNAc-P-P-Undは、別の機序により形成されることを示唆している。
【0120】
K12株由来の膜を、UDP-[3H]GlcNAcと一緒にインキュベートする場合、予想されたように[3H]GlcNAc-P-P-Undが合成された(Rush, J. S.、Rick, P. D.及びWaechter, C. J.の文献、(1997) Glycobiology, 7, 315-322)。しかし、O157株由来の膜を、[3H]GlcNAc-P-P-Undに加え、UDP-[3H]GlcNAcと一緒にインキュベートする場合、[3H]GalNAc-P-P-Undであることが示された第二の標識された脂質(下記参照)が認められた。これら2種の糖脂質の形成の時間経過を試験する場合、放射能の[3H]GlcNAc-P-P-Undへの取り込み(図1、○)は、より迅速に生じ、且つ前駆体-生成物の関係が同等である(図2)[3H]GalNAc-P-P-Undへの取り込み(図1、●)よりもより高度であった。
【0121】
大腸菌O157膜は、GalNAc-P-P-Undの合成のためのGalNAc-P供与体としてUDP-GalNAcを利用しないという知見は、図2に図示されたGalNAc-P-P-Undの形成に関する生合成経路を確認する一例である。このスキームにおいて、GlcNAc-P-P-Undは、WecAにより触媒された、UDP-GlcNAcからのGlcNAc-Pの転移により形成され、その後GlcNAc-P-P-Undは、これまで未知の4-エピメラーゼの作用によりエピマー化され、GalNAc-P-P-Undを生成する。
【0122】
(実施例3:大腸菌O157株由来の膜画分によりインビトロにおいて形成された[3H]GalNAc-P-P-Undの特徴決定)
GalNAc-P-P-Undとして図1において検出された追加のO157-特異的糖脂質生成物と同じく、これは弱アルカリメタノリシス(トルエン/メタノール1:3、0.1N KOH含有、0℃、60分間)に対して安定であり、CHCl3/CH3OH/H2O(10:10:3)中に平衡とされたDEAE-セルロースに保持され、且つ[3H]GlcNAc1-2-P-P-Dolについて先に報告されたように(Waechter, C. J.及びHarford, J. B.の文献、(1977) Arch. Biochem. Biophys. 181, 185-198)、20mM酢酸アンモニウムを含有するCHCl3/CH3OH/H2O(10:10:3)で溶離された。
【0123】
[3H]GalNAc-P-P-Undは、ホウ酸含浸シリカゲルG上の薄層クロマトグラフィーにより(Kean, E. L.の文献、(1966) J. Lipid Res. 7, 449-452)、[3H]GlcNAc-P-P-Undから明確に分離され、且つ図3A及び図3Bに示されたように、分取TLCにより精製された。
【0124】
(ホウ酸含浸薄層プレート及びワットマン濾紙No.1の調製)−シリカゲル薄層プレートは、Keanの文献(Kean, E. L.、(1966) J. Lipid Res. 7, 449-452)に説明されたように、これらのプレートを95%メタノールを溶媒とする2.5%Na2B4O7・10H2O中に短時間含浸することにより、ホウ酸ナトリウムで含浸した。ホウ酸含浸TLCプレートを、室温で一晩乾燥し、使用時までDrierite上の真空デシケーター内で貯蔵した。クロマトグラフィーの直前に、これらのプレートを、100℃に短時間(〜10-15分間)加熱することにより活性化した。ワットマン濾紙No.1の20cm×30cmシートを0.2MのNa2B4O7・10H2O中に浸漬することにより、ワットマン濾紙No.1をホウ酸ナトリウムで含浸した。Cardini及びLeloirの文献(Cardini, C. E.及びLeloir, L. F.、(1957) J. Biol. Chem. 225, 317-324)に記載されているように、ワットマン濾紙No.1シートを、ワットマン濾紙No.3MMの2枚のシートの間でしっかり圧迫し、室温で数日間かけて乾燥させた。
【0125】
(インビトロ反応において形成されたグリカン生成物の特徴決定)−個別の糖脂質([3H]GalNAc-P-P-Und及び[3H]GlcNAc-P-P-Und)のグリカンを、弱酸加水分解による放出後に、下降ペーパークロマトグラフィーにより特徴決定した。GlcNAc/GalNAc脂質は、コニカルスクリューキャップ付きチューブ内で窒素流下で乾燥し、0.01M HClの0.2ml中で、100℃で15分間加熱した。加水分解後、試料を、AG50WX8(H+)の0.4ml及びAG1X8(酢酸塩型)0.4mlを含む、0.8mlの混合床型イオン交換カラムに適用し、且つ水1.5mlで溶離した。溶離液を、窒素流れ下で乾燥し、少量のH2O(0.02ml)中に再溶解し、ホウ酸含浸ワットマン濾紙No.1の30cm細長片上にスポットし、且つ40〜50時間かけて、ブタノール/ピリジン/水(6:4:3)により下降モードで展開した。乾燥後、濾紙細長片を、1cmの帯状に切断し、シンチレーションスペクトロメーターにより放射能を分析した。GlcNAc及びGalNAc標準を、アニリン-ジフェニルアミン浸漬試薬を用いて検出した(Schwimmer, S.及びBenvenue, A.の文献、(1956) Science, 123, 543-544)。
【0126】
グリカン生成物は、先に説明されたような、弱酸加水分解後の、0.1M NaOHを溶媒とする0.1M NaBH4(最終容積0.1ml)による還元により、それらの対応するアルジトールへ変換された。室温で一晩インキュベーションした後、氷酢酸数滴により反応をクエンチし、且つ窒素流下で、酢酸1滴を含有するメタノールで数回乾燥した。アルジトールを水に溶解し、AG50WX8(H+)及びAG1X8(酢酸塩)の0.5mlカラム上の通過により脱塩し、窒素下で乾燥し、且つワットマン濾紙No.3MMの30cm細長片上にスポットした。ワットマンNo.3MM細長片を、酢酸エチル、ピリジン、0.1Mホウ酸(65:25:20)により下降モードで一晩展開し、乾燥し、1cmの帯状に切断し、シンチレーション分光法により放射能を分析した。GlcNAcitol及びGalNAcitol標準を、過ヨウ素酸-ベンジジン浸漬手法(Gordon, H. T.、Thornburg, W.及びWerum, L. N.の文献、(1956) Anal. Chem. 28, 849-855)の変法を用いて可視化した。これらの濾紙細長片を、アセトン、0.1M NaIO4(95:5)中に浸漬し、3分間風乾させ、その後アセトン/酢酸/H2O/o-トリジン(96:0.6:4.4:0.2g)中に浸漬した。cis-ジオールを含有するアルジトールは、青色のバックグラウンド上に黄色スポットとして染まった。
【0127】
(糖脂質の質量分析("MS"))−精製された糖脂質を、ABI Turbo Vエレクトロスプレーイオン給源を備えたABI/MDS Sciex 4000 Q-Trapハイブリッド三連四重極直列式イオントラップ型質量分析計を用いて分析した(ABI/MDS-Sciex社、トロント、カナダ)。簡単に述べると、試料を、経験的に決定されたイオン源設定で10μl/分で注入し、且つMS/MS(二次元での質量分光法)情報を、直列式イオントラップ様式での分子イオンのフラグメンテーションにより得た。
【0128】
糖脂質を、弱酸(0.01N HCl、100℃、15分間)で処理する場合、水溶性生成物を、ホウ酸含浸したワットマン濾紙No.1による下降ペーパークロマトグラフィー上での[3H]GalNAcとの同時クロマトグラフィーにかけた(図3C)。加えて、標識された糖が還元された場合、これは[3H]アルジトール、GalNAc-OHへ変換された(図3D)。更に、陰イオンMS分析は、m/z=1128の[M-H]-イオンを生じ、これはGalNAc-P-P-Undと予想され、且つMS/MS娘イオンスペクトルは、m/z=907に突出したイオンを示し、これはP-P-Undを含む糖脂質と予想された(Guan, Z.、Breazeale, S. D.及びRaetz, C. R.の文献、(2005) Anal. Biochem. 345, 336-339)。GalNAc-P-P-UndとしてO157株により形成された糖脂質生成物の同定は、外因性GlcNAc-P-P-Undからのその形成によっても裏付けられる(実施例7参照)。
【0129】
(実施例4:Z3206遺伝子を発現している大腸菌細胞における[3H]GlcNAcによる[3H]GalNAc-P-P-Und(インビボ)の代謝標識)
大腸菌O157 Z3206遺伝子の発現は、細胞にGalNAc-P-P-Und合成を可能にするかどうかを調べるために、Z3206遺伝子を発現している大腸菌株21546(Meier-Dieter, U.、Starman, R.、Barr, K.、Mayer, H.及びRick, P. D.の文献、(1990) J. Biol. Chem., 265, 13490-13497)を、[3H]GlcNAcで代謝的に標識し、且つ[3H]GlcNAc/GalNAc-P-P-Und形成について分析した。
【0130】
(細菌細胞の代謝標識)−大腸菌細胞を、Luria-Bertani培地において、37℃で激しく振盪しながら、A600が0.5〜1となるまで培養した。[3H]GlcNAcを、最終濃度1μCi/mlとなるよう添加し、インキュベーションを37℃で5分間継続した。放射標識の糖脂質への取り込みは、破砕した氷0.5gm/mlの添加により終結させ、培養物を完全に混合した。細菌細胞を、4000×gで10分間の遠心分離により回収し、上清を廃棄した。これらの細胞を、氷冷したリン酸-緩衝食塩水で2回洗浄し、(細胞ペレットの)10倍容量のメタノール中で激しくボルテックス混合することにより再懸濁し、プローブソニケーターにより全出力の40%で短時間超音波処理した。超音波処理後、20倍容量のクロロホルムを添加し、この抽出物を激しく混合し、且つ室温で15分間静置させた。不溶性物質を、遠心分離により沈降させ、ペレットを、少量のCHCl3/CH3OH(2:1)により2回再抽出した。その後一緒にした有機抽出液を、以下に説明したように処理した。
【0131】
(GlcNAc-P-P-Und及びGalNAc-P-P-Undの精製)−GlcNAc/GalNAc-P-P-Undを、CHCl3/CH3OH(2:1)により抽出し、別所に記載したように分配することにより水溶性物質を含まないようにした(Waechter, C. J.、Kennedy, J. L.及びHarford, J. B.の文献、(1976) Arch. Biochem. Biophys. 174, 726-737)。その後有機抽出液を、窒素流下で乾燥し、0.1N KOHを含有するトルエン/メタノール(1:3)中の0℃で60分間の脱アシル化により、バルクグリセロリン脂質を破壊した。この脱アシル化反応を、酢酸で中和し、4倍容量のCHCl3/CH3OH(2:1)により希釈し、且つ1/5倍容量の0.9%NaClにより洗浄した。有機(下側)相を、1/3倍容量のCHCl3、CH3OH、0.9%NaCl(3:48:47)で洗浄し、水相を廃棄した。有機相を、この有機相中に残留する水相を収容するのに十分量のメタノールで希釈し、CHCl3/CH3OH(2:1)により平衡としたDEAE-セルロースカラム(5ml)に装加した。このカラムを、20倍カラム容量のCHCl3/CH3OH/H2O(10:10:3)で洗浄し、その後20mM酢酸アンモニウムを含有するCHCl3/CH3OH/H2O(10:10:3)で溶離した。画分(2ml)を収集し、ホウ酸含浸シリカプレート上の薄層クロマトグラフィー(前記)による分離後、放射能、又はアニスアルデヒド噴霧試薬を使用するGlcNAc/GalNAc-P-P-Und(Dunphy, P. J.、Kerr, J. D.、Pennock, J. F.、Whittle, K. J.、及びFeeney, J.の文献、(1967) Biochim. Biophys. Acta 136, 136-147)のいずれかについてモニタリングした。
【0132】
UDP-ManNAcA合成の突然変異は、腸内細菌共通抗原の合成のためのGlcNAc-P-P-Undの利用の阻止を招くので、大腸菌21546株を、Z3206発現試験のための宿主として選択した。大腸菌21546は、大腸菌K12から誘導されるので、同様にこれもO-抗原反復を合成せず(Stevenson, G.、Neal, B.、Liu, D.、Hobbs, M.、Packer, N. H.、Batley, M.、Redmond, J. W.、Lindquist, L.及びReeves, P.の文献、(1994) J. Bacteriol., 176, 4144-4156)、その結果より大量のGlcNAc-P-P-Undが、GalNAc-P-P-Undへの変換のために蓄積する。菌株21546及びZ3206遺伝子を発現する形質転換体を、[3H]GlcNAcで標識し、これらの放射標識された脂質を、ホウ酸含浸シリカゲルプレート上の薄層クロマトグラフィーにより分析し、親株(図4A)は、わずかに1種の標識された脂質GlcNAc-P-P-Undを合成した。しかしZ3206遺伝子を発現している21546細胞は(図4B)、追加の標識された脂質も合成し、これはGalNAc-P-P-Undであることが示された。
【0133】
(実施例5:Z3206遺伝子を発現している大腸菌細胞由来の膜画分はインビトロにおいてGalNAc-P-P-Undを合成する)
大腸菌O157のZ3206遺伝子によりコードされたタンパク質が、GalNAc-P-P-Undの合成を触媒したことを裏付けるために、Z3206遺伝子を発現している大腸菌細胞由来の膜画分を、[3H]UDP-GlcNAcと一緒にインキュベートし、且つ[3H]糖脂質生成物を、図5に示したようにホウ酸含浸シリカゲルプレート上で薄層クロマトグラフィーにより分析した(クロマトグラフィー調製及び特徴決定の方法は実施例3に説明されている)。大腸菌K12又は宿主株大腸菌21546細胞由来の膜画分を、UDP-[3H]GlcNAcと一緒にインキュベートした場合、[3H]GlcNAc-P-P-Undのみ認められた(図5A及び図5C)。しかし、Z3206を発現している大腸菌O157及び大腸菌21546由来の膜画分は、GalNAc-P-P-Undも形成した(図5B及び図5D)。
【0134】
(実施例6:GlcNAc-P-P-Undの形成はUMPの存在下で逆転されるがGalNAc-P-P-Undは逆転されない)
GalNAc-P-P-UndはGlcNAc-P-P-Undから合成され、且つグリコシル供与体としてUDP-GalNAcを使用するWecAの作用によっては合成されないことの更なる証拠を提供するために、UMPによる内在性の予備標識された[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの放出の作用を試験した。WecAにより触媒されるGlcNAc-ホスホトランスフェラーゼ反応は、過剰なUMPの添加により自在に可逆性となり、UDP-GlcNAcを再合成し、且つUnd-Pを放出する。
【0135】
この実験において、Z3206を発現している大腸菌21546株由来の膜画分を、UDP-[3H]GlcNAcで10分間予備標識し、引き続き1mM UMPを添加し、残存する各標識された糖脂質の量を測定した。図6Aに図示された結果は、10分間の標識期間の終了時の、[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの相対量を示している。1mM UMPと一緒の1分間のインキュベーション後、[3H]GlcNAc-P-P-Undのかなりの喪失が認められたのに対し、[3H]GalNAc-P-P-Undのピークは比較的変化がなかった(図6B)(クロマトグラフィー調製及び特徴決定の方法は実施例5に説明されている)。この知見は、表3の結果と一致しており、WecAは、UDP-GalNAcからGalNAc-P-P-UndへのGalNAc-Pの転移を触媒しないことを指摘している。UMPとの2分間のインキュベーション期間中(図6C)に、GlcNAc-P-P-Undの喪失は遅くなり、[3H]GalNAc-P-P-Undのピークのわずかな低下が存在することは注目に値し、これは[3H]GalNAc-P-P-Undは、エピメラーゼ反応の逆転により[3H]GlcNAc-P-P-Undプールと再度平衡となることを示唆している(実施例7参照)。
【0136】
(実施例7:Z3206を発現している大腸菌細胞由来の膜により触媒された外因性の精製された[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undの相互変換)
GlcNAc-P-P-Und及びGalNAc-P-P-Undが、Z3260を発現している大腸菌細胞由来の膜画分により直接相互変換され得ることの直接の証拠を提供するために、精製された[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undを、外因性基質として試験した。
【0137】
精製された[3H]GlcNAc-P-P-Und/[3H]GalNAc-P-P-Undは、実施例4(細菌細胞の代謝標識並びにGlcNAc-P-P-Und及びGalNAc-P-P-Undの精製)のように調製した。[3H]HexNAc-P-P-ウンデカプレノール(2000 dpm/pmol、1%Triton X-100中に分散された、最終濃度0.1%)を、実施例2のインビトロにおける大腸菌膜中の[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Und生合成のアッセイのように大腸菌膜と一緒にインキュベートした。
【0138】
予備実験からは、エピメラーゼは、外因性[3H]GlcNAc-P-P-Undを、Triton X-100、CHAPS(3-[(3-コラミドプロピル)ジメチルアンモニオ]-1-プロパンスルホン酸)、Nonidet P-40、又はオクチルグルコシド中に分散された反応混合物に添加した場合に、活性化され、且つpH7〜8.5の範囲に最適pHを示したことが認められた。膜画分と一緒のインキュベーション前の精製された[3H]GlcNAc-P-P-Und及び[3H]GalNAc-P-P-Undのクロマトグラフィー移動度を、図7A及び図7Dに示している。図7B及び図7Eに示されるように、糖脂質は、大腸菌21546由来の膜画分と一緒のインキュベーションにより影響を受けなかった。しかし、精製された糖脂質のZ3206を発現している大腸菌21546由来の膜画分と一緒のインキュベーションは、外因性[3H]GlcNAc-P-P-Undの[3H]GalNAc-P-P-Undへの変換(図7C)及び[3H]GalNAc-P-P-Undの[3H]GlcNAc-P-P-Undへの変換(図7F)を触媒した。これらの結果は、GlcNAc-P-P-Und及びGalNAc-P-P-Undは、Z3206を発現している大腸菌株において酵素的に相互変換することができることを直接明らかにする。
【0139】
(実施例8:大腸菌Z3206はUDP-GlcNAc 4-エピメラーゼではない)
Z3206はUDP-GalNAcの形成を触媒することができるかどうかを決定するために、C.ジェジュニ由来のN-グリコシル化装置を、大腸菌において発現した。このリポーターシステムにおいて、標的タンパク質AcrAのグリコシル化は、機能的Gne UDP-Glc/UDP-GlcNAcエピメラーゼ(Bernatchez, S.、Szymanski, C.M.、Ishiyama, N.、Li, J.、Jarrell, H.C.、Lau, P.C.、Berghuis, A.M.、Young, N.M.、Wakarchuk, W.W.の文献、(2005) J. Biol. Chem. 280, 4792-4802)を含む、pgl遺伝子座の存在に左右された(Wacker, M.、Linton, D.、Hitchen, P.G.、 Nita-Lazar, M.、Haslam, S.M.、North, S.J.、Panico, M.、Morris, H.R.、Dell, A.、Wrenn, B.W.、Aebi, M.の文献、(2002) Science, 298, 1790-1793)。pglクラスターがgneの欠失を含む場合に、AcrAのグリコシル化が失われた(Linton, D.、 Dorrell, N.、Hitchen, P.G.、Amber, S.、Karlyshev, A.V.、Morris, H.R.、Dell, A.、Valvano, M.A.、Aebi, M.及びWren, B.W.の文献、(2005) Mol Microbiol. 55, 1695-1703)。pglオペロンΔgneの存在下でAcrA-グリコシル化を回復するZ3206の能力は、Gne(pMLBAD:gne)又はZ3206(pMLBAD:Z3206)のいずれかにより補完されたpgl遺伝子座ΔgneによりAcrA(pWA2)を発現することで、インビボにおいて調べた。
【0140】
総大腸菌細胞抽出物を、SDS負荷緩衝液100μl中に再懸濁された1 A600単位と等しい濃度で細胞を用いる免疫検出分析のために調製した(Laemmli, U.の文献、(1970) Nature, 227, 680-685)。10μlのアリコートを、10%SDS-PAGEの上に装加した。大腸菌細胞のペリプラズム抽出物を、リゾチーム処理により調製し(Feldman, M.F.、Wacker, M.、Hernandez, M.、Hitchen, P.G.、Marolda, C.L、Kowarik, M.、Morris, H.R.、Dell, A.、Valvano, M.A.、Aebi, M.の文献、(2005) Proc Natl Acad Sci USA, 102, 3016-3021)、且つ最終試料10μl(細胞の0.2 A600単位に相当)をSDS-PAGEにより分析した。ニトロセルロースメンブレンにブロットした後、試料を、特異的抗血清により免疫染色した(Aebi, M.、Gassenhuber, J.、Domdey, H.、及びte Heesen, S.の文献、(1996) Glycobiology, 6, 439-444)。抗-AcrA抗体(Wacker, M.、Linton, D.、Hitchen, P.G.、Nita-Lazar, M.、Haslam, S.M.、North, S.J.、Panico, M.、Morris, H.R.、Dell, A.、Wrenn, B.W.、Aebi, M.の文献、(2002) Science, 298, 1790-1793)を使用した。抗-ウサギIgG-HRP(Bio-Rad社)を、二次抗体として使用した。検出は、ECL(商標)ウェスタンブロッティング検出試薬(Amersham Biosciences社)により実行した。
【0141】
図8に示されたように、グリコシル化されたタンパク質は、グリコシル化されない形よりもより遅く移動し、これは、pgl遺伝子座Δgneを発現している細胞がGneにより補完された場合(レーン2)にのみ、形成された。Z3206は、リポーター糖タンパク質のグリコシル化を回復することができなかった(図8、レーン1)。従って、Z3206は、Gne依存性グリコシル化システムにおいてAcrAのグリコシル化を補完しない。Gne及び膜-会合されたZ3206の発現は、免疫検出により確認された。
【0142】
(実施例9:シゲラ・フレックスネリ6+/−Z3206 LPSの分析)
図9において、シゲラ・フレックスネリ6のO-抗原の生合成に必要ないくつかの遺伝子;ヌクレオチド糖前駆体の生合成のための酵素をコードしている遺伝子;グリコシルトランスフェラーゼをコードしている遺伝子;O抗原プロセッシングタンパク質をコードしている遺伝子;及び、O-アセチル化に寄与するタンパク質をコードしている遺伝子:が示された。O抗原の構造は、Dmitriev, B.A.らにより解明されている(Dmitriev, B.A.らの文献、「赤痢菌の菌体抗原(Somatic Antigens of Shigella)」、Eur J Biochem, 1979, 98: p.8;Liu Bらの文献、「赤痢菌O抗原の構造及び遺伝子(Structure and genetics of Shigella O antigens)」、FEMS Microbiology Review, 2008, 32: p.27)。
【0143】
シゲラ・フレックスネリ6のO-抗原の生合成に必要な全ての遺伝子を確定するために、ゲノムライブラリーを作製した。
【0144】
(シゲラ・フレックスネリ6ゲノムDNAのクローニング)−細菌からのDNA単離に関するプロトコールに従い、シゲラ・フレックスネリ6ゲノムDNAを、Macherey-Nagel NucleoSpin(登録商標)組織キットを用いて単離した。DNAは、5つのシゲラ・フレックスネリ6の各2mlの一晩培養物から単離し、最終溶離は、溶離緩衝液(5mMトリス/HCl、pH8.5)100μlで行った。溶離された画分をプールし、イソプロパノールにより沈殿し、且つ最終ペレットを、TE緩衝液52μl中に再懸濁し、その総容量に、CopyControl商標Fosmidライブラリー作製キット(EPICENTRE)により供されたプロトコールに従い、末端修復(end-repair)を施した。このキットのプロトコールに記載されているように、末端修復されたDNAは、1×TAE緩衝液で泳動する1%低融点アガロースゲル上で精製し、回収し、エタノールで沈殿させた。沈殿したDNAの再懸濁は、TE緩衝液7μl中で行い、そのDNA 0.15μlは、EPICENTREプロトコールに従いpCC1FOS(配列番号:27)にライゲーションさせた。このライゲーション生成物のファージへのパッケージングは、プロトコールに従い行い、且つパッケージされたファージは、ファージ希釈用緩衝液において1:1で希釈し、その10μlを、EPICENTREに記載されたように予め増殖したEPI300-T1細胞100μlの感染に使用した。細胞(110μl)を、1プレート当たりおよそ100コロニーで、6回播種し、その結果6つのプレートは、シゲラ・フレックスネリ6ゲノムライブラリー全体を含んだ。プレートを、コロニーブロティングにより呈色し、且つ陽性/陰性コロニーを、ウェスタンブロット及び銀染色した。
【0145】
(コロニーブロッティング)−コロニーブロットのために、ニトロセルロースメンブレンを、固形寒天プレート上に搭載し、取り外し、1×PBSTで3回洗浄し、同じ様式で処理した。このメンブレンを、最初に10%ミルクにより室温で1時間ブロックし、その後これを1%ミルク(PBST中)2ml中で、抗-VI型抗血清(一次抗体)と一緒に、室温で1時間インキュベーションした。PBST中で3回、各回10分間洗浄した後、メンブレンを、1%ミルク(PBST中)2ml中の二次抗体1:20000ペルオキシダーゼ複合したヤギ-抗-ウサギIgG(BioRad社)と、室温で更に1時間インキュベーションした。最後にPBSTで3回洗浄(各回10分間)した後、メンブレンを、SuperSignal(登録商標)West Dura Extended Duration Substrate Kit(Thermo Scientific社)により提供されるルミノールと過酸化物緩衝液の1:1混液により、UVP Chemi Doc Imaging Systemにおいて呈色した。
【0146】
S.フレックスネリ6ゲノムライブラリー生成後のS.フレックスネリ6抗血清と反応するクローンを、rmlBからwfbZに達するLiuらにより先に配列決定された領域(Liuらの文献、2008)のプライマーウォーキングにより配列決定した(図9)。プライマーrmlB_rev及びwfbZ_fwd(S.フレックスネリ−Z3206)は、rmlB及びwfbZとアニーリングさせ、且つそれぞれwcaM及びhisI/Fに達するまで(S.フレックスネリ+Z3206)の、クローンの挿入断片の配列決定に使用した(図10)。
【0147】
O抗原合成は、Z3206を欠いている(従って、und-GlcNAcのund-GalNAcへのエピマー化を妨害する)クローンにおいて維持されるかどうかを確立するために、2種のプラスミドを作製し(配列番号:28及び配列番号:29)(図10)、大腸菌細胞に形質転換し、且つ銀染色及びウェスタンブロットにより分析した。
【0148】
図11に示されるように、LPSは、大腸菌細胞+Z3206又は−Z3206において生成された。O抗原は、Z3206がなくとも生成され得るが、生成収量は低く、このことはエピメラーゼ(Z3206)を伴わない多糖生成の効率はより低いことを指摘している。
【0149】
(実施例10:S.フレックスネリ6+/−Z3206 LLOの分析)
(C18カラムクロマトグラフィーによるウンデカプレノール-PP-O抗原の精製)−S.フレックスネリ抗原+/−Z3206を発現している大腸菌細胞を、ペレット化し、0.9%NaCl 50mlで1回洗浄し、最終ペレットを、一晩凍結乾燥した。ペレットを、85〜95%メタノール30mlで1回洗浄し、10:10:3のクロロホルム-メタノール-水(v/v/v)で再抽出し、且つこの抽出物を、水の添加により2相ブライ/ダイアーシステムに変換し、最終比10:10:9(C:M:W)とした。相を遠心分離により分離し、上側水相を、メタノール10mlで馴化させ、且つ3:48:47(C:M:W) 10mlで平衡としたC18 Sep-Pakカートリッジ上に各々添加した。添加後、カートリッジを、3:48:47(C:M:W)10mlで洗浄し、10:10:3(C:M:W)5mlで溶離した。これらの添加物の20 OD試料を、流通させ(flow-through)、洗浄し、且つC18カラムの溶離物をEppendorf Concentrator Plusにおいて乾燥し、メタノール250μlで洗浄し、再蒸発させ、ddH2O 30μlで更に3回洗浄した。
【0150】
(糖脂質加水分解)−前記C18カラム洗浄液からの糖脂質試料を、乾燥試料をn-プロパノール:2Mトリフルオロ酢酸(1:1)2ml中に溶解し、50℃で15分間加熱し、N2下で蒸発乾固することにより、加水分解した。
【0151】
(2-アミノ安息香酸によるオリゴ糖標識及びHPLC)−標識はBiggeらの方法(Biggeの文献、1995)に従い実行し、且つグリカンクリーンアップを、Merryら(2002)により説明されたペーパーディスク法(Merrらの文献、2002)を用いて行った。2-アミノ安息香酸(2-AB)標識されたグリカンの分離を、Royleらの方法に従う(Royleの文献、2002)が3溶媒システムに変更したGlycoSep-N順相カラムを用いるHPLCにより行った。溶媒Aは、80%アセトニトロール中の10mMギ酸アンモニウム(pH4.4)であった。溶媒Bは、40%アセトニトリル中の30mMギ酸アンモニウム(pH4.4)であった。溶媒Cは、0.5%ギ酸であった。カラム温度は30℃であり、且つ2-AB標識されたグリカンは蛍光により検出した(λex=330nm、λem=420nm)。勾配条件は、流量0.4ml/分で160分間かけ100%Aから100%Bへの直線勾配、それに続く流量を1ml/分に増し、2分間かけ100%Bから100%Cへであった。カラムを、100%Cで5分間洗浄し、2分間かけて100%Aに戻し、100%Aを流量1ml/分で15分間流し、その後流量0.4ml/分で5分間に戻した。全ての試料は、水中に注入した。
【0152】
Z3206を持つ(配列番号:29)又は持たない(配列番号:28)S.フレックスネリO抗原を発現するプラスミドを、SCM3細胞に形質転換した(図10)。遅い溶離容量での追跡は、S.フレックスネリO抗原+/−Z3206を含む2つの試料の曲線の間の差を示している(図12)。この溶離パターンの差は、エピメラーゼ(Z3206)の存在に応じてGlcNAc又はGalNAcという還元末端に異なる単糖を保持する異なるオリゴ糖構造により説明することができる。
【0153】
(実施例11:S.フレックスネリ6+/−Z3206から生成されたバイオコンジュゲートの生成及び特徴決定によるpglB特異性の分析)
PglBは、還元末端にGlcNAc(S.フレックスネリ6のO-抗原)を有するオリゴ糖をキャリアタンパク質EPAに転移するかどうかを評価するために、EPA(配列番号:25)、PglB(配列番号:26)及びS.フレックスネリ6のO-抗原+/−Z3206(配列番号:29/配列番号:28)を発現している大腸菌細胞由来のニッケル精製した抽出物を、抗EPA抗体及び抗VI型抗体を用いるウェスタンブロットにより分析した。還元末端にGalNAcを有する及び有さないS.フレックスネリ6のO抗原を、PglBにより、EPAへ転移し、抗EPA及び抗VI抗血清により検出した(図13)。
【0154】
O抗原は、依然生成され且つ検出されたが、生成収量はより低く、このことはエピメラーゼを伴わない多糖生成の効率がより低いことを示している。
【0155】
本発明は、それらの実施態様を参照し具体的に示され且つ説明されているが、当業者は、請求項に包含された本発明の範囲を逸脱しない限りは、それらの形態及び詳細における様々な変更を行うことができることを理解するであろう。本発明の範囲内に収まるとして当業者に理解されるそのような様々な変更は、特に、還元末端にGalNAcを持つ大腸菌及びシゲラ・フレックスネリ由来のもの以外のグリカンを含むN-グリコシル化タンパク質及びバイオコンジュゲートを含んでいる。
【0156】
(配列表)
出願人:GlycoVaxyn AG
【0157】
表題:原核細胞における免疫原性多糖体生成の生合成システム
【0158】
配列番号の数:29
【0159】
配列番号:1−大腸菌O157 Z3206のヌクレオチド配列
【0160】
長さ:993
【0161】
種類:DNA
【0162】
生物:大腸菌O157
【0163】
配列:
【化4】

【0164】
配列番号:2−Z3206のアミノ酸配列
【0165】
長さ: 331
【0166】
種類:PRT
【0167】
生物:大腸菌O157
【0168】
配列:
【化5】

【0169】
配列番号:3−大腸菌O55 gneのヌクレオチド配列
【0170】
遺伝子座 AF461121_1 BCT 02-MAY-2002
【0171】
定義 (UDP-GlcNAc 4-エピメラーゼGne[大腸菌])
【0172】
寄託番号 AAL67550
【0173】
長さ: 993
【0174】
種類:DNA
【0175】
生物:大腸菌O55
【0176】
配列:
【化6】

【0177】
配列番号:4−大腸菌O55 UDP-GlcNAc 4-エピメラーゼGneのアミノ酸配列
【0178】
遺伝子座 AF461121_1
【0179】
定義 (UDP-GlcNAc 4-エピメラーゼGne[大腸菌])
【0180】
寄託番号 AAL67550
【0181】
長さ:331個のアミノ酸、線状
【0182】
種類:PRT
【0183】
生物:大腸菌O55
【0184】
配列:
【化7】

【0185】
配列番号:5−大腸菌O86 gne1のヌクレオチド配列
【0186】
遺伝子座 AAO37706 BCT 06-DEC-2005
【0187】
定義 UDP-GlcNAc C4-エピメラーゼ[大腸菌O86]
【0188】
寄託番号 AAO37706
【0189】
長さ:993
【0190】
種類:DNA
【0191】
生物:大腸菌O86
【0192】
配列:
【化8】

【0193】
配列番号:6−大腸菌O86 UDP-GlcNAc C4-エピメラーゼのアミノ酸配列
【0194】
遺伝子座 AAO37706
【0195】
定義 UDP-GlcNAc C4-エピメラーゼ[大腸菌O86]
【0196】
寄託番号 AAO37706
【0197】
長さ:331個のアミノ酸、線状
【0198】
種類:PRT
【0199】
生物:大腸菌O86
【0200】
配列:
【化9】

【0201】
配列番号:7−シゲラ・ボイディO18 gneのヌクレオチド配列
【0202】
遺伝子座 ACD09753 BCT 05-MAY-2008
【0203】
定義 UDP-N-アセチルグルコサミン4-エピメラーゼ[シゲラ・ボイディCDC 3083-94]
【0204】
寄託番号 ACD09753
【0205】
長さ: 993
【0206】
種類:DNA
【0207】
生物:シゲラ・ボイディO18
【0208】
配列:
【化10】

【0209】
配列番号:8−シゲラ・ボイディO18 UDP-N-アセチルグルコサミン4-エピメラーゼのアミノ酸配列
【0210】
遺伝子座 ACD09753
【0211】
定義 UDP-N-アセチルグルコサミン4-エピメラーゼ[シゲラ・ボイディCDC 3083-94]
【0212】
寄託番号 ACD09753
【0213】
長さ:331個のアミノ酸、線状
【0214】
種類:PRT
【0215】
生物:シゲラ・ボイディO18
【0216】
配列:
【化11】

【0217】
配列番号:9−サルモネラ・エンテリカO30 gneのヌクレオチド配列
【0218】
遺伝子座 AAV34516 BCT 25-OCT-2004
【0219】
定義 UDP-GlcNAc 4-エピメラーゼ[サルモネラ・エンテリカ亜種サラマエ血清型Greenside]
【0220】
寄託番号 AAV34516
【0221】
長さ: 993
【0222】
種類:DNA
【0223】
生物:サルモネラ・エンテリカO30
【0224】
配列:
【化12】

【0225】
配列番号:10−サルモネラ・エンテリカO30 UDP-GlcNAc 4-エピメラーゼのアミノ酸配列
【0226】
遺伝子座 AAV34516
【0227】
定義 UDP-GlcNAc 4-エピメラーゼ[サルモネラ・エンテリカ亜種サラマエ血清型Greenside]
【0228】
寄託番号 AAV34516
【0229】
長さ:331個のアミノ酸、線状
【0230】
種類:PRT
【0231】
生物:サルモネラ・エンテリカO30
【0232】
配列:
【化13】

【0233】
配列番号:11−C.ジェジュニgneのヌクレオチド配列
【0234】
遺伝子座 YP_002344524 BCT 14-SEP-2010
【0235】
定義 UDP-GlcNAc/Glc 4-エピメラーゼ[カンピロバクター・ジェジュニ亜種ジェジュニ
【0236】
寄託番号 YP_002344524
【0237】
長さ:987
【0238】
種類:DNA
【0239】
生物:C.ジェジュニ
【0240】
配列:
【化14】

【0241】
配列番号:12−C.ジェジュニUDP-GlcNAc/Glc 4-エピメラーゼのアミノ酸配列
【0242】
遺伝子座 YP_002344524
【0243】
定義 UDP-GlcNAc/Glc 4-エピメラーゼ[カンピロバクター・ジェジュニ亜種ジェジュニ
【0244】
寄託番号 YP_002344524
【0245】
長さ:328個のアミノ酸、線状
【0246】
種類:PRT
【0247】
生物:C.ジェジュニ
【0248】
配列:
【化15】

【0249】
配列番号:13−大腸菌K12 galEのヌクレオチド配列
【0250】
遺伝子座 AP_001390 BCT 30-APR-2010
【0251】
定義 UDP-ガラクトース-4-エピメラーゼ[大腸菌K-12株W3110亜株]
【0252】
寄託番号 AP_001390
【0253】
長さ:1,017
【0254】
種類:DNA
【0255】
生物:大腸菌K12
【0256】
配列:
【化16】

【0257】
配列番号:14−大腸菌K12 UDP-ガラクトース-4-エピメラーゼのアミノ酸配列
【0258】
遺伝子座 AP_001390
【0259】
定義 UDP-ガラクトース-4-エピメラーゼ [大腸菌K-12株W3110亜株]
【0260】
寄託番号 AP_001390
【0261】
長さ:338個のアミノ酸、線状
【0262】
種類:PRT
【0263】
生物:大腸菌K12
【0264】
配列:
【化17】

【0265】
配列番号:15−大腸菌O86 gne2のヌクレオチド配列
【0266】
遺伝子座 AAV85952 BCT 27-MAR-2005
【0267】
定義 Gne[大腸菌O86]
【0268】
寄託番号 AAV85952
【0269】
長さ:1,020
【0270】
種類:DNA
【0271】
生物:大腸菌O86
【0272】
配列:
【化18】

【0273】
配列番号:16−大腸菌O86 Gneのアミノ酸配列
【0274】
遺伝子座 AAV85952
【0275】
定義 Gne[大腸菌O86]
【0276】
寄託番号 AAV85952
【0277】
長さ:339個のアミノ酸(gne2)、線状
【0278】
種類:PRT
【0279】
生物:大腸菌O86
【0280】
配列:
【化19】

【0281】
配列番号:17−Z3206の末端をコードしている合成オリゴヌクレオチドZ3206-Fw(プライマー)のヌクレオチド配列;制限部位には下線をつけている
【0282】
長さ:30
【0283】
種類:DNA
【0284】
配列:
【化20】

【0285】
配列番号:18−赤血球凝集素タグ(HAタグ)をつけたZ3206の末端をコードしている合成オリゴヌクレオチドZ3206-RvHA(プライマー)のヌクレオチド配列;制限部位には下線をつけている
【0286】
長さ:60
【0287】
種類:DNA
【0288】
生物:
【0289】
配列:
【化21】

【0290】
配列番号:19−制限部位には下線をつけた、合成オリゴヌクレオチドgne-Fw(プライマー)のヌクレオチド配列
【0291】
長さ:29
【0292】
種類:DNA
【0293】
生物:
【0294】
配列:
【化22】

【0295】
配列番号:20−制限部位には下線をつけた、合成オリゴヌクレオチドgne-RV(プライマー)のヌクレオチド配列
【0296】
長さ:57
【0297】
種類:DNA
【0298】
生物:
【0299】
配列:
【化23】

【0300】
配列番号:21−NheI制限酵素のための制限部位を含むオリゴヌクレオチドのヌクレオチド配列
【0301】
長さ:11
【0302】
種類:DNA
【0303】
生物:
【0304】
配列:
【化24】

【0305】
配列番号:22−AscI制限酵素のための制限部位を含むオリゴヌクレオチドのヌクレオチド配列
【0306】
長さ:8
【0307】
種類:DNA
【0308】
生物:
【0309】
配列:
【化25】

【0310】
配列番号:23−C-末端赤血球凝集素タグを持つZ3206をコードしているプラスミドpMLBAD:Z3206(プラスミド内の大腸菌O157の挿入断片)のヌクレオチド配列
【0311】
定義 生成物のZ3206-pMLBAD*へのライゲーション
【0312】
特徴 位置/限定子
【0313】
CDS 2105..3098
/ラベル=Z3206
【0314】
CDS 3098..3127
/ラベル=HA
【0315】
長さ:7794 bp
【0316】
種類:DNA環状、未注釈型(UNA)
【0317】
配列:
【化26】








【0318】
配列番号:24−C-末端赤血球凝集素タグを持つGneをコードしているpMLBAD:gne(プラスミド内の大腸菌O157の挿入断片)のヌクレオチド配列
【0319】
遺伝子座 gne-pMLBAD
【0320】
定義 dig galEのpmlbad did(NcoI-XbaI)へのライゲーション
【0321】
特徴 位置/限定子
【0322】
CDS 2097..3080
/ラベル=galE
【0323】
CDS 3081..3107
/ラベル=HA
【0324】
領域 3108..3110
/ラベル=停止
【0325】
長さ:7776 bp
【0326】
種類:DNA環状、未注釈型(UNA)
【0327】
配列:
【化27】








【0328】
配列番号:25−シグナル配列を持つ修飾されたEPAのアミノ酸配列
【0329】
WO 2009/104074に開示(配列番号:6として)
【0330】
種類:PRT
【0331】
生物:人工
【0332】
/ノート="人工配列の説明:合成ポリペプチド"
【0333】
長さ:643
【0334】
配列:
【化28】




【0335】
配列番号:26−PglBのアミノ酸配列
【0336】
WO 2009/104074に開示(配列番号:2として)
【0337】
長さ:722
【0338】
種類:PRT
【0339】
生物:カンピロバクター・ジェジュニ
【0340】
配列:
【化29】





【0341】
配列番号:27−pCC1FOS空のプラスミドのヌクレオチド配列
【0342】
遺伝子座 MCSカセットを持つpCC1FOS
【0343】
特徴 位置/限定子
【0344】
領域 230..256
【0345】
/ラベル="pCC1/pEpiFOS fwd"
【0346】
領域 311..330
【0347】
/ラベル="T7プロモーター"
【0348】
領域相補体(504..529)
【0349】
/ラベル="pCC1pEpiFOS rv"
【0350】
CDS相補体(805..1464)
【0351】
/ラベル=cat
【0352】
CDS 1683..2030
【0353】
/ラベル=redF
【0354】
CDS 3425..4180
【0355】
/ラベル=repE
【0356】
CDS 4759..5934
【0357】
/ラベル=parA
【0358】
CDS 5934..6905
【0359】
/ラベル=parB
【0360】
起源
【0361】
長さ:8171 bp
【0362】
種類:DNA環状、未注釈型(UNA)
【0363】
生物:人工
【0364】
配列:
【化30】






【0365】
配列番号:28−pCC1FOSの切断(pFOS)及びZ3206を持たないシゲラ・フレックスネリ6 O-抗原のヌクレオチド配列
【0366】
遺伝子座 pFOSの切断及びO-抗原の切断(-Z3206)
【0367】
定義 NheI及びAscIで切断されたMCSカセットを持つ逆位pCC1FOSの、NheI及びAscIで切断されgalFNheI及びwzzAscIで増幅されたS.フレックスネリ6 O抗原クラスターへのライゲーション
【0368】
特徴 位置/限定子
【0369】
CDS 3..411
【0370】
/ラベル='galF
【0371】
CDS 784..1869
【0372】
/ラベル=rmlB
【0373】
CDS 1869..2768
【0374】
/ラベル=rmlD
【0375】
CDS 2826..3704
【0376】
/ラベル=rmlA
【0377】
CDS 3709..4266
【0378】
/ラベル=rmlC
【0379】
CDS 4263..5495
【0380】
/ラベル=wzx
【0381】
CDS 5551..6738
【0382】
/ラベル=wzy
【0383】
CDS 6755..7624
【0384】
/ラベル=wfbY
【0385】
CDS 7621..8454
【0386】
/ラベル=wfbZ
【0387】
CDS 8559..9965
【0388】
/ラベル=gnd
【0389】
CDS 10187..11380
【0390】
/ラベル=ugd
【0391】
CDS相補体(11446..12450)
【0392】
/ラベル=uge
【0393】
CDS 12802..12828
【0394】
/ラベル=wzz'
【0395】
領域相補体(12868..12887)
【0396】
/ラベル="T7プロモーター"
【0397】
領域相補体(12942..12968)
【0398】
/ラベル="pCC1/pEpiFOS fwd"
【0399】
CDS相補体(14460..15431)
【0400】
/ラベル=parB
【0401】
CDS相補体(15431..16606)
【0402】
/ラベル=parA
【0403】
CDS相補体(17185..17940)
【0404】
/ラベル=repE
【0405】
CDS相補体(19335..19682)
【0406】
/ラベル=redF
【0407】
CDS 19901..20560
【0408】
/ラベル=cat
【0409】
領域 20836..20861
【0410】
/ラベル="pCC1pEpiFOS rv"
【0411】
長さ:20982 bp
【0412】
種類:DNA環状、未注釈型(UNA)
【0413】
配列:
【化31】






















【0414】
配列番号:29−pCC1FOSの切断(pFOS)及びZ3206を持つシゲラ・フレックスネリ6 O-抗原のヌクレオチド配列
【0415】
遺伝子座 pFOSの切断及びO-抗原の切断(Z3206+)
【0416】
定義 NheI及びAscIで切断されZ3206Nhe及びwzzAscIで増幅された逆位S. フレックスネリ6 O-抗原クラスターの、NheI及びAscIで切断されたMCSカセットを持つpCC1FOSへのライゲーション
【0417】
特徴 位置/限定子
【0418】
CDS相補体 (370..396)
【0419】
/ラベル=wzz'
【0420】
CDS 748..1752
【0421】
/ラベル=uge
【0422】
CDS相補体(1818..3011)
【0423】
/ラベル=ugd
【0424】
CDS相補体(3233..4639)
【0425】
/ラベル=gnd
【0426】
CDS相補体(4744..5577)
【0427】
/ラベル=wfbZ
【0428】
CDS相補体(5574..6443)
【0429】
/ラベル=wfbY
【0430】
CDS相補体(6460..7647)
【0431】
/ラベル=wzy
【0432】
CDS相補体(7703..8935)
【0433】
/ラベル=wzx
【0434】
CDS相補体(8932..9489)
【0435】
/ラベル=rmlC
【0436】
CDS相補体(9494..10372)
【0437】
/ラベル=rmlA
【0438】
CDS相補体(10430..11329)
【0439】
/ラベル=rmlD
【0440】
CDS相補体(11329..12414)
【0441】
/ラベル=rmlB
【0442】
CDS相補体(12787..13680)
【0443】
/ラベル=galF
【0444】
CDS相補体(13912..14907)
【0445】
/ラベル=Z3206
【0446】
CDS相補体(15065..15097)
【0447】
/ラベル='wcaM
【0448】
CDS相補体(15525..16184)
【0449】
/ラベル=cat
【0450】
CDS 16403..16750
【0451】
/ラベル=redF
【0452】
CDS 18145..18900
【0453】
/ラベル=repE
【0454】
CDS 19479..20654
【0455】
/ラベル=parA
【0456】
CDS 20654..21625
【0457】
/ラベル=parB
【0458】
長さ:22887 bp
【0459】
種類:DNA環状、未注釈型(UNA)
【0460】
配列:
【化32】























【特許請求の範囲】
【請求項1】
1つ以上の導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る);及び
還元末端に、N-グリコシド結合により少なくとも1つ以上の該導入されたコンセンサス配列に連結されたN-アセチルガラクトサミンを有するグリカンを含む、組換えN-グリコシル化タンパク質。
【請求項2】
前記タンパク質が、緑膿菌エキソタンパク質である、請求項1記載の組換えN-グリコシル化タンパク質。
【請求項3】
前記グリカンが、グラム陰性菌由来のオリゴ糖又は多糖を含む、請求項1記載の組換えN-グリコシル化タンパク質。
【請求項4】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリに由来する、請求項3記載の組換えN-グリコシル化タンパク質。
【請求項5】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリ6に由来する、請求項4記載の組換えN-グリコシル化タンパク質。
【請求項6】
前記グリカンが、下記構造を含むオリゴ糖又は多糖を含む、請求項1記載の組換えN-グリコシル化タンパク質:
【化1】

。
【請求項7】
前記オリゴ糖又は多糖が、大腸菌に由来する、請求項3記載の組換えN-グリコシル化タンパク質。
【請求項8】
前記オリゴ糖又は多糖が、大腸菌O157に由来する、請求項7記載の組換えN-グリコシル化タンパク質。
【請求項9】
前記グリカンが、構造α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAcを含むオリゴ糖又は多糖を含む、請求項1記載の組換えN-グリコシル化タンパク質。
【請求項10】
請求項1記載の組換えN-グリコシル化タンパク質及びアジュバントを含有する、バイオコンジュゲートワクチン。
【請求項11】
下記をコードしている核酸を含む、組換え原核細胞生合成システム:
ウンデカプレニルピロリン酸上でN-アセチルガラクトサミンを合成するエピメラーゼ;
脂質キャリア上でオリゴ糖又は多糖を構築するグリコシルトランスフェラーゼ;
オリゴサッカリルトランスフェラーゼ;及び
1つ以上の導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る)を含むタンパク質。
【請求項12】
前記エピメラーゼをコードしている核酸が、配列番号:1を含む、請求項11記載の組換え原核細胞生合成システム。
【請求項13】
前記オリゴサッカリルトランスフェラーゼが、カンピロバクター・ジェジュニに由来する、請求項11記載の組換え原核細胞生合成システム。
【請求項14】
前記タンパク質が、緑膿菌エキソタンパク質である、請求項11記載の組換え原核細胞生合成システム。
【請求項15】
前記オリゴ糖又は多糖が、グラム陰性菌に由来する、請求項11記載の組換え原核細胞生合成システム。
【請求項16】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリに由来する、請求項15記載の組換え原核細胞生合成システム。
【請求項17】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリ6に由来する、請求項16記載の組換え原核細胞生合成システム。
【請求項18】
前記オリゴ糖又は多糖が、下記構造を含む、請求項11記載の組換え原核細胞生合成システム:
【化2】

。
【請求項19】
前記オリゴ糖又は多糖が、大腸菌に由来する、請求項15記載の組換え原核細胞生合成システム。
【請求項20】
前記オリゴ糖又は多糖が、大腸菌O157に由来する、請求項19記載の組換え原核細胞生合成システム。
【請求項21】
前記オリゴ糖又は多糖が、構造α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAcを含む、請求項11記載の組換え原核細胞生合成システム。
【請求項22】
N結合型グリコシル化タンパク質を生成する方法であって:
a.)下記をコードしている核酸を、宿主生物へ導入する工程:
i.)ウンデカプレニルピロリン酸上でN-アセチルガラクトサミンを合成するエピメラーゼ;
ii.)脂質キャリア上でオリゴ糖又は多糖を構築するグリコシルトランスフェラーゼ;
iii.)オリゴサッカリルトランスフェラーゼ;及び
iv.)1つ以上の導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る)を含むタンパク質;並びに
b.)該宿主生物を、少なくとも1種のN-グリコシル化タンパク質が生成されるまで、培養する工程;を含む、前記方法。
【請求項23】
前記エピメラーゼをコードしている核酸が、配列番号:1を含む、請求項22記載の方法。
【請求項24】
前記オリゴサッカリルトランスフェラーゼが、カンピロバクター・ジェジュニに由来する、請求項22記載の方法。
【請求項25】
前記タンパク質が、緑膿菌エキソタンパク質である、請求項22記載の方法。
【請求項26】
前記オリゴ糖又は多糖が、グラム陰性菌に由来する、請求項22記載の方法。
【請求項27】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリに由来する、請求項26記載の方法。
【請求項28】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリ6に由来する、請求項27記載の方法。
【請求項29】
前記オリゴ糖又は多糖が、下記構造を有する、請求項22記載の方法:
【化3】

。
【請求項30】
前記オリゴ糖又は多糖が、大腸菌に由来する、請求項26記載の方法。
【請求項31】
前記オリゴ糖又は多糖が、大腸菌O157に由来する、請求項30記載の方法。
【請求項32】
前記オリゴ糖又は多糖が、構造α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAcを含む、請求項22記載の方法。
【請求項1】
1つ以上の導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る);及び
還元末端に、N-グリコシド結合により少なくとも1つ以上の該導入されたコンセンサス配列に連結されたN-アセチルガラクトサミンを有するグリカンを含む、組換えN-グリコシル化タンパク質。
【請求項2】
前記タンパク質が、緑膿菌エキソタンパク質である、請求項1記載の組換えN-グリコシル化タンパク質。
【請求項3】
前記グリカンが、グラム陰性菌由来のオリゴ糖又は多糖を含む、請求項1記載の組換えN-グリコシル化タンパク質。
【請求項4】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリに由来する、請求項3記載の組換えN-グリコシル化タンパク質。
【請求項5】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリ6に由来する、請求項4記載の組換えN-グリコシル化タンパク質。
【請求項6】
前記グリカンが、下記構造を含むオリゴ糖又は多糖を含む、請求項1記載の組換えN-グリコシル化タンパク質:
【化1】

。
【請求項7】
前記オリゴ糖又は多糖が、大腸菌に由来する、請求項3記載の組換えN-グリコシル化タンパク質。
【請求項8】
前記オリゴ糖又は多糖が、大腸菌O157に由来する、請求項7記載の組換えN-グリコシル化タンパク質。
【請求項9】
前記グリカンが、構造α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAcを含むオリゴ糖又は多糖を含む、請求項1記載の組換えN-グリコシル化タンパク質。
【請求項10】
請求項1記載の組換えN-グリコシル化タンパク質及びアジュバントを含有する、バイオコンジュゲートワクチン。
【請求項11】
下記をコードしている核酸を含む、組換え原核細胞生合成システム:
ウンデカプレニルピロリン酸上でN-アセチルガラクトサミンを合成するエピメラーゼ;
脂質キャリア上でオリゴ糖又は多糖を構築するグリコシルトランスフェラーゼ;
オリゴサッカリルトランスフェラーゼ;及び
1つ以上の導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る)を含むタンパク質。
【請求項12】
前記エピメラーゼをコードしている核酸が、配列番号:1を含む、請求項11記載の組換え原核細胞生合成システム。
【請求項13】
前記オリゴサッカリルトランスフェラーゼが、カンピロバクター・ジェジュニに由来する、請求項11記載の組換え原核細胞生合成システム。
【請求項14】
前記タンパク質が、緑膿菌エキソタンパク質である、請求項11記載の組換え原核細胞生合成システム。
【請求項15】
前記オリゴ糖又は多糖が、グラム陰性菌に由来する、請求項11記載の組換え原核細胞生合成システム。
【請求項16】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリに由来する、請求項15記載の組換え原核細胞生合成システム。
【請求項17】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリ6に由来する、請求項16記載の組換え原核細胞生合成システム。
【請求項18】
前記オリゴ糖又は多糖が、下記構造を含む、請求項11記載の組換え原核細胞生合成システム:
【化2】

。
【請求項19】
前記オリゴ糖又は多糖が、大腸菌に由来する、請求項15記載の組換え原核細胞生合成システム。
【請求項20】
前記オリゴ糖又は多糖が、大腸菌O157に由来する、請求項19記載の組換え原核細胞生合成システム。
【請求項21】
前記オリゴ糖又は多糖が、構造α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAcを含む、請求項11記載の組換え原核細胞生合成システム。
【請求項22】
N結合型グリコシル化タンパク質を生成する方法であって:
a.)下記をコードしている核酸を、宿主生物へ導入する工程:
i.)ウンデカプレニルピロリン酸上でN-アセチルガラクトサミンを合成するエピメラーゼ;
ii.)脂質キャリア上でオリゴ糖又は多糖を構築するグリコシルトランスフェラーゼ;
iii.)オリゴサッカリルトランスフェラーゼ;及び
iv.)1つ以上の導入されたコンセンサス配列D/E-X-N-Z-S/T(式中、X及びZは、プロリン以外の任意の天然のアミノ酸であり得る)を含むタンパク質;並びに
b.)該宿主生物を、少なくとも1種のN-グリコシル化タンパク質が生成されるまで、培養する工程;を含む、前記方法。
【請求項23】
前記エピメラーゼをコードしている核酸が、配列番号:1を含む、請求項22記載の方法。
【請求項24】
前記オリゴサッカリルトランスフェラーゼが、カンピロバクター・ジェジュニに由来する、請求項22記載の方法。
【請求項25】
前記タンパク質が、緑膿菌エキソタンパク質である、請求項22記載の方法。
【請求項26】
前記オリゴ糖又は多糖が、グラム陰性菌に由来する、請求項22記載の方法。
【請求項27】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリに由来する、請求項26記載の方法。
【請求項28】
前記オリゴ糖又は多糖が、シゲラ・フレックスネリ6に由来する、請求項27記載の方法。
【請求項29】
前記オリゴ糖又は多糖が、下記構造を有する、請求項22記載の方法:
【化3】

。
【請求項30】
前記オリゴ糖又は多糖が、大腸菌に由来する、請求項26記載の方法。
【請求項31】
前記オリゴ糖又は多糖が、大腸菌O157に由来する、請求項30記載の方法。
【請求項32】
前記オリゴ糖又は多糖が、構造α-D-PerNAc-α-L-Fuc-β-D-Glc-α-D-GalNAcを含む、請求項22記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7A−C】


【図7D−F】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7A−C】


【図7D−F】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公表番号】特表2013−511520(P2013−511520A)
【公表日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2012−539870(P2012−539870)
【出願日】平成22年11月16日(2010.11.16)
【国際出願番号】PCT/US2010/002980
【国際公開番号】WO2011/062615
【国際公開日】平成23年5月26日(2011.5.26)
【出願人】(510225155)グリコヴァキシン アーゲー (1)
【Fターム(参考)】
【公表日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成22年11月16日(2010.11.16)
【国際出願番号】PCT/US2010/002980
【国際公開番号】WO2011/062615
【国際公開日】平成23年5月26日(2011.5.26)
【出願人】(510225155)グリコヴァキシン アーゲー (1)
【Fターム(参考)】
[ Back to top ]

