反応性代謝物を同定するためのトラッピング化合物および方法
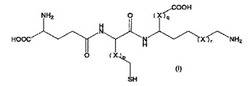
式(I)の化合物は、反応性代謝物を同定するのに有用である。

[式中、XはCH2であり、かつ、p、qおよびrはそれぞれ独立して0または1であるが、但し、pが0であり、qが0であり、かつ、rが1である化合物は除外されるものとする]

[式中、XはCH2であり、かつ、p、qおよびrはそれぞれ独立して0または1であるが、但し、pが0であり、qが0であり、かつ、rが1である化合物は除外されるものとする]
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、反応性代謝物を検出するための非同位体トラッピング化合物および方法、ならびに、薬物候補を同定する方法、に向けられたものである。より詳細には、この、反応性代謝物を検出するための非同位体トラッピング化合物および方法を利用して、「ソフト」な反応性代謝物および「ハード」な反応性代謝物、ならびに、さらには、アシルグルクロニド、を検出することができる。
【背景技術】
【0002】
患者の罹患率および死亡率の問題において、化合物の特定の毒性は、臨床開発においても上市後においても、依然として、安全性に対する深刻な懸念事項のままである。これらの特定の薬物有害事象は制限的使用につながり得り、また、市場からの撤退にさえつながり得り、このことは、結果的に、製薬会社に、より大きな負担をもたらす。有名な例として、トログリタゾンは、その上市後すぐに、予期せぬ毒性のために撤退した。
【0003】
特定の薬物有害事象は、通常、個々の感受性の度合いが高い場合に現れる、まれなケースである。さらに、これらの反応は、一般に、用量非依存的に起こる。現在、ヒトにおいて専ら起こるような反応を評価するのに使用可能な動物モデルは存在しない。したがって、これらの特定の薬物毒性は、前臨床試験において正確に評価することができず、また、臨床試験において認識できない場合が多い。
【0004】
現時点では、これらの特定の有害薬物反応のメカニズムはよく分かっていない。化学的に反応性の高い代謝物が特定の毒性に関係しているということを示唆する証拠が、特に肝毒性について、数多くある。特定の毒性に関連する数多くの化合物は、主にシトクロムP450酵素(CYP)によって、同様に、例えばペルオキシダーゼ、シクロオキシゲナーゼおよびミエロペルオキシダーゼなどの他の酸化酵素によって仲介される種々の代謝経路を介して、または、UDP−グルクロノシルトランスフェラーゼ(UGT)によって仲介される別の代謝経路を介して、反応性代謝物を生じる。これは、こうした毒性に関連する数多くの化合物が、まず、代謝活性化を受け、その結果、細胞タンパク質に共有結合する有毒性の反応性代謝物を生じる、と仮定したものである。これらの共有結合修飾されたタンパク質は、しばしば、抗原性であり、それ故に、免疫応答を刺激し、その結果、特定の薬物反応をもたらす。別の仮説では、反応性代謝物による細胞タンパク質の共有結合修飾がシグナル伝達カスケードと細胞の必須の機能とをブロックし、それにより、臨床上観察される致命的な結果が引き起こされる、と言われている。したがって、反応性代謝物を同定するための方法が深刻に必要とされている。
【0005】
酸化酵素により生じる化学的な化合物の反応性代謝物は、化学的な性質に基づく、「ソフト」な反応性代謝物および「ハード」な反応性代謝物という、2つのカテゴリーに特徴付けることができる。「ソフト」な反応性代謝物には、キノン、キノンイミン、イミノキノンメチド、エポキシド、アレーンオキシドおよびニトレニウムイオンを含み、かつ、例えばシステイン中のスルフヒドリル基などの「ソフト」な求核基と容易に反応する、求電子性代謝物の大多数が含まれる。一方、「ハード」な反応性代謝物は、最も一般的にはアルデヒドと考えられているが、これらは、例えばリシン、アルギニンといったアミン、および、核酸などの、「ハード」な求核基と優先的に反応する。それらの不安定性ゆえに、反応性代謝物の直接の検出および特徴付けは、非常に困難であることが立証されている。一般的に利用されているアプローチの1つは、これらの反応性代謝物を捕捉分子でトラップすることであり、これにより、その後の例えばタンデム質量分析などの公知の検出方法による特徴付けが可能な、安定した付加物が形成される。
【0006】
UGTにより生じる、反応性代謝物の別のカテゴリーは、アシルグルクロニドである。アシルグルクロニドは、本質的に反応性の化学種であり、分子内転位およびアノマー化、次いで、タンパク質との反応を経て、共有結合付加物を生じる。現在、ニュートラルロスタンデム質量分析を用いた、トラッピング剤を使用したアシルグルクロニドの検出システムに関する報告は存在しない。
【0007】
最近、Huebertらは、WO2008/042634A2の中で、安定同位体標識トラッピング化合物と質量分析とを用いる、反応性代謝物を検出するための方法を開示した。しかしながら、Huebertらは、単に、「安定同位体標識化合物」を用いる方法を開示しただけであり、例示した一実施形態のような、いかなる「非同位体標識化合物」も示さなかった。また、Huebertらにより開示された方法は、「ソフト」な反応性代謝物および「ハード」な反応性代謝物を検出することができるのみであり、例示したもののような、いかなる「アシルグルクロニド」も検出することはできない。
【0008】
他方で、本発明は、式(I)の非同位体化合物により、一度の実験での、「ソフト」な反応性代謝物および「ハード」な反応性代謝物、ならびに、さらにはアシルグルクロニドの検出のための新規の方法を与えることができるという特定の特徴を指し示している。
【発明の概要】
【0009】
本発明は、(「ソフト」な反応性代謝物および「ハード」な反応性代謝物ならびにアシルグルクロニドを含む)反応性代謝物を同定するための非同位体トラッピング化合物、すなわち、式(I)の化合物:
【化1】

に向けられたものである。
【0010】
本発明は、さらに、試験化合物の反応性代謝物を検出するための方法であって、
(a)試験化合物を、上記式(I)の化合物および薬物代謝酵素とともにインキュベートし、1種類以上の付加物を含む生成物混合物を得ること;ならびに
(b)工程(a)の付加物を検出すること、
を含む方法に向けられたものである。
【図面の簡単な説明】
【0011】
【図1A】ECOを用いて分析した場合の、ジクロフェナクについての、全イオンクロマトグラム(TIC;上段)、ならびに、129Da(中段)および147Da(下段)のニュートラルロススキャニングのTICを説明するものである。
【図1B】ECOを用いて分析した場合の、ジクロフェナク由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図1C】ECOを用いて分析した場合の、ジクロフェナク由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図2A】ECOを用いて分析した場合の、クロザピンについての、TIC(上段)、ならびに、129Da(中段)および147Da(下段)のニュートラルロススキャニングのTICを説明するものである。
【図2B】ECOを用いて分析した場合の、クロザピン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図3A】ECOを用いて分析した場合の、2−[2−チエニル]−フランについての、TIC(上段)、ならびに、129Da(中段)および147Da(下段)のニュートラルロススキャニングのTICを説明するものである。
【図3B】ECOを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図3C】ECOを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図3D】ECOを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図4A】ECOを用いて分析した場合の、ジクロフェナクアシルグルクロニドについての、TIC(上段)、ならびに、129Da(中段)および147Da(下段)のニュートラルロススキャニングのTICを説明するものである。
【図4B】ECOを用いて分析した場合の、ジクロフェナクアシルグルクロニド由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図5A】ECHKを用いて分析した場合の、ジクロフェナクについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図5B】ECHKを用いて分析した場合の、ジクロフェナク由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図5C】ECHKを用いて分析した場合の、ジクロフェナク由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図6A】ECHKを用いて分析した場合の、クロザピンについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図6B】ECHKを用いて分析した場合の、クロザピン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図7A】ECHKを用いて分析した場合の、2−[2−チエニル]−フランについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図7B】ECHKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図7C】ECHKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図7D】ECHKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図8A】ECHKを用いて分析した場合の、ジクロフェナクアシルグルクロニドについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図8B】ECHKを用いて分析した場合の、ジクロフェナクアシルグルクロニド由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図9A】EHCKを用いて分析した場合の、ジクロフェナクについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図9B】EHCKを用いて分析した場合の、ジクロフェナク由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図9C】EHCKを用いて分析した場合の、ジクロフェナク由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図10A】EHCKを用いて分析した場合の、クロザピンについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図10B】EHCKを用いて分析した場合の、クロザピン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図11A】EHCKを用いて分析した場合の、2−[2−チエニル]−フランについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図11B】EHCKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図11C】EHCKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図11D】EHCKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図12A】EHCKを用いて分析した場合の、ジクロフェナクアシルグルクロニドについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図12B】EHCKを用いて分析した場合の、ジクロフェナクアシルグルクロニド由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【発明を実施するための形態】
【0012】
本発明は、反応性代謝物に結合する能力を有する非同位体トラッピング化合物、すなわち、式(I)の化合物:
【化2】

に向けられたものであり、式中、
XはCH2であり、かつ、
p、qおよびrはそれぞれ独立して0または1であるが、
但し、pが0であり、qが0であり、かつ、rが1である化合物は除外されるものとする。
【0013】
式(I)の化合物はトリペプチド誘導体である。式(I)の化合物は、固相ペプチド合成により、保護アミノ酸(グルタミン酸、システイン/ホモシステイン、および、リシン/ホモリシン/オルニチン/β−リシン)から調製することができる。
【0014】
式(I)の化合物は、好ましくは、式(II)、(III)または(IV)の化合物:
【化3】

【化4】

【化5】

である。
【0015】
式(II)の化合物は、ECOと略記されるγ−グルタミルシステイニルオルニチンであり、式(III)の化合物は、ECHKと略記されるγ−グルタミルシステイニルホモリシンであり、また、式(IV)の化合物は、EHCKと略記されるγ−グルタミルホモシステイニルリシンである。
【0016】
式(I)〜(IV)の化合物は3つのキラル炭素を有しており、種々の立体異性体が存在する。式(I)〜(IV)の化合物はいずれの立体異性体であってもよく、またはその混合物であってもよい。好ましくは、式(I)〜(IV)の化合物は、ある特定の立体異性体のみを実質的に含む。より好ましくは、式(I)〜(IV)の化合物を構成するアミノ酸は、すべてL型であるか、または、すべてD型である。
【0017】
式(I)の化合物は2つの「トラッピングゾーン」を有し、これらは、それぞれ、「ハード」な反応性代謝物と「ソフト」な反応性代謝物とをトラップする。より詳細には、式(I)の化合物上のスルフヒドリル(−SH)基は、いわゆる「ソフト」な反応性代謝物と反応して、それらをトラップし、一方、式(I)の化合物上の−(X)r−CH2−NH2基は、いわゆる「ハード」な反応性代謝物と反応して、それらをトラップする。よって、式(I)の化合物は、「ハード」な反応性代謝物と「ソフト」な反応性代謝物の両方を同時にトラップする能力を有する。
【化6】

【0018】
特に断りのない限り、本明細書で用いられている「反応性代謝物」という語には、「ソフト」な反応性代謝物および「ハード」な反応性代謝物ならびにアシルグルクロニドが含まれるものとする。
【0019】
特に断りのない限り、本明細書で用いられている「ソフトな代謝物」という語は、例えばシステイン中のスルフヒドリル基および式(I)の化合物上の−SH基などの、「ソフト」な求核基と容易に反応する少なくとも1つの置換基を含む任意の求電子性代謝物を意味するものとする。そのような置換基の適切な例としては、キノン、キノンイミン、イミノキノンメチド、エポキシド、アレーンオキシド、および、ニトレニウムイオンなどが挙げられるが、これに限定されない。
【0020】
特に断りのない限り、本明細書で用いられている「ハードな代謝物」という語は、例えばリシン、アルギニンといったアミン、または、式(I)の化合物の−(X)r−CH2−NH2基などの、「ハード」な求核基と容易に反応する少なくとも1つの置換基を含む任意の求電子性代謝物を意味するものとする。そのような置換基の適切な例としては、アルデヒドなどが挙げられるが、これに限定されない。
【0021】
特に断りのない限り、本明細書で用いられている「アシルグルクロニド」という語は、例えばシステイン中のスルフヒドリル基、式(I)の化合物の−SH基、リシン、アルギニンといったアミン、または式(I)の化合物の−(X)r−CH2−NH2基などの、求核基と反応する任意の反応性代謝物を意味するものとする。そのような置換基の適切な例としては、1−O−β−アシルグルクロニドなどが挙げられるが、これに限定されない。
【0022】
反応性代謝物は、試験化合物に付随する数多くの有害事象、特に、深刻なおよび/または有毒性の有害事象、に関係していることから、試験化合物によって生じるすべての反応性代謝物を検出できることは非常に望ましいことである。試験化合物が反応性代謝物を生じるかどうかを、その試験化合物の、ヒトへの投与前に判定することは、さらに、非常に望ましい。
【0023】
当業者は、すべての試験化合物が反応性代謝物を生じるとは限らないということ、そして、さらには、すべての試験化合物が「ソフト」な反応性代謝物および「ハード」な反応性代謝物ならびにアシルグルクロニドを生じるとは限らないということを理解するであろう。反応性代謝物を生じない試験化合物もあるであろうし、「ハード」な反応性代謝物のみを生じる試験化合物もあるであろうし、「ソフト」な反応性代謝物のみを生じる試験化合物もあるであろうし、アシルグルクロニドのみを生じる試験化合物もあるであろうし、また、「ソフト」な反応性代謝物および「ハード」な反応性代謝物ならびにアシルグルクロニドを生じる試験化合物もあるであろう。よって、本発明のトラッピング化合物および方法は、試験化合物によって生じるあらゆるタイプの反応性代謝物を検出する。
【0024】
当業者は、本発明の方法は、反応性代謝物を同定することに向けられたものであると同時に、試験化合物が反応性代謝物を生じるかどうかを判定するプロセスをも包含している、ということをさらに理解するであろう。一実施形態においては、本発明は、有望な薬物候補(例えば、反応性代謝物を生じない試験化合物)を同定するための方法に向けられたものである。よって、本発明の方法には、(本明細書において、より詳細に記載されているような)インキュベーションにより、反応性代謝物、ひいては付加物がもたらされることがなく、かつ、129Daまたは147Daのニュートラルロススキャニングの全イオンスペクトルがピークを示さず、それにより、当該試験化合物が、検出可能ないかなる反応性代謝物も生じないということが指し示される、というプロセスが含まれる。
【0025】
「ソフト」な代謝物に対しては、グルタチオンは、「ソフト」な反応性代謝物を検出するためにミクロソームインキュベーションにおいて使用される最も一般的なトラッピング剤である。しかしながら、「ハード」な反応性代謝物およびアシルグルクロニドに対しては、グルタチオンは、そのトラッピング効率ゆえに、適切なトラッピング剤ではない。むしろ、「ハード」な反応性代謝物を検出するためには、代わりとなるトラッピング剤、例えばセミカルバジド、メトキシルアミンおよびα−アセチルリシンなど、が使用される。他方で、アシルグルクロニドを検出するためには、N−アセチルシステイン(NAC)が有用である。上記の理由から、これらは、「ハード」な反応性代謝物および「ソフト」な反応性代謝物ならびにアシルグルクロニドの検出のために、異なるトラッピング剤を用いた3つの別々の実験を必要とする。この状況であっても、本発明は、式(I)の非同位体標識化合物により、一度の実験での、「ソフト」な反応性代謝物および「ハード」な反応性代謝物、ならびに、さらにはアシルグルクロニドの検出のための新規の方法を与えることができるという特定の特徴を指し示している。
【0026】
特に断りのない限り、本明細書で用いられている「薬物代謝酵素」は、試験化合物を代謝することのできる、ヒトまたは動物組織由来の、好ましくはヒト、ラット、マウス、ハムスター、イヌ、サルまたはウサギ組織由来の、より好ましくはヒト、ラット、マウス、ハムスター、イヌ、サルまたはウサギの肝組織由来の、任意の酵素またはその混合物を意味するものとする。(例えば、Drug Metabolizing Enzymes, Edited by JaeS. Lee, R. Scott Obach and Michael B. Fisher, Marcel Dekker, lnc. (2003)を参照のこと。)適切な例としては、肝ミクロソーム、シトクロムP450酵素、または、シトクロムP450酵素の種々のアイソフォームの混合物、ペルオキシダーゼ、シクロオキシゲナーゼ、ミエロペルオキシダーゼ、UDP−グルクロノシルトランスフェラーゼ(UGT)等が挙げられるが、これに限定されない。好ましくは、薬物代謝酵素はヒト肝ミクロソームであり、より好ましくは、シトクロムP450酵素、組換え酵素およびUGTである。当業者は、試験化合物を、UGTおよびシトクロムP450酵素またはシトクロムP450酵素の種々のアイソフォームの混合物とともにインキュベートする場合には、このUGTおよびシトクロムP450酵素またはシトクロムP450の種々のアイソフォームの混合物は、ウリジン二リン酸グルクロン酸(UDPGA)およびNADPH補因子またはNADPH再生系と組み合わせてインキュベートされる、ということを理解するであろう。
【0027】
特に断りのない限り、本明細書で用いられている「試験化合物」という語は、反応性代謝物(単数または複数)の形成について試験される任意の化学物質を意味するものとする。好ましくは、試験化合物は、薬学的な作用物質またはその塩、エステルもしくはプロドラッグである。
【0028】
特に断りのない限り、本明細書で用いられている「薬物候補」という語は、反応性代謝物(単数または複数)を生じない任意の化学物質または試験化合物を意味するものとする。好ましくは、薬物候補は、薬学的な作用物質またはその塩、エステルもしくはプロドラッグである。
【0029】
別途指示がない限り、本明細書で用いられている「付加物」という語は、反応性代謝物の、式(I)の化合物との、任意の共有結合複合体を意味するものとする。
【0030】
本明細書、特にスキームおよび実施例、において用いられている略語は、以下の通りである:
APCI−MS/MS=大気圧化学イオン化タンデム質量分析
CYP=シトクロムP450酵素
UGT=UDP−グルクロノシルトランスフェラーゼ
Da=ダルトン
ESI−MS/MS=エレクトロスプレーイオン化タンデム質量分析
HPLC=高速液体クロマトグラフィー
MS=質量分析
NADPH=β−ニコチンアミドアデニンジヌクレオチドリン酸(還元型)
SPE=固相抽出
UDPGA=ウリジン二リン酸グルクロン酸
【0031】
本発明の一実施形態では、当該薬物代謝酵素は、ヒト肝ミクロソーム、シトクロムP450酵素、ペルオキシダーゼ、シクロオキシゲナーゼ、ミエロペルオキシダーゼおよびUGTからなる群より選択される。好ましくは、当該薬物代謝酵素はシトクロムP450酵素およびUGTである。
【0032】
一実施形態では、薬物代謝酵素、例えばS9、組換え酵素またはミクロソーム酵素など、を含有する細胞の任意の分画とともに試験化合物をインキュベートすることにより形成された反応性代謝物を検出するのに、本発明を適用する。一実施形態では、試験化合物が、ヒト対象内で(すなわち、この試験化合物のヒトへの投与後に)反応性代謝物を形成するかどうかを予測するのに本発明の方法を適用する。
【0033】
当業者は、「S9」という略語が、S9画分(ポストミトコンドリア上清画分)を指し、これはミクロソームとサイトゾルとの混合物である、とのことを理解するであろう。したがって、これは、P450酵素、フラビンモノオキシゲナーゼ、カルボキシルエステラーゼ、エポキシドヒドロラーゼ、UDP−グルクロノシルトランスフェラーゼ、スルホトランスフェラーゼ、メチルトランスフェラーゼ、アセチルトランスフェラーゼ、グルタチオンS−トランスフェラーゼおよび他の薬物代謝酵素などの、種々の第I相および第II相酵素を含有する。
【0034】
1種類以上のインキュベーション生成物(非反応性代謝物、反応性代謝物と式(I)の化合物との間で形成された付加物)を含有する生成物混合物は、好ましくは、公知の方法に従って、例えば遠心分離、SPE、蒸発または液−液抽出によって、精製し、濃縮して、生成物濃縮物を得る。次いで、この生成物濃縮物を、質量分析における使用に適した(すなわち、質量分析計への注入に適した)溶媒、例えば水中5%アセトニトリルおよび水中5%メタノールなど、に溶解させる。
【0035】
好ましくは、この生成物混合物は、公知の方法に従って、例えば液体クロマトグラフィー、HPLC、キャピラリー電気泳動、または他の分離技術によって、個々の付加物成分に分離する。次いで、ニュートラルロス質量スペクトルを、各付加物または付加物成分について測定する。ニュートラルロス質量スペクトルは、公知の方法に従って、任意のイオン化源を用いて、例えばAPCI−MS/MSおよびESI−MS/MSなどによって、好ましくはESI−MS/MSによって、測定してもよい。あるいは、分離および質量スペクトル測定は、例えばLC/MSなどのループシステムを用いて、1ステップで完了させてもよい。
【0036】
本発明の方法は、試験化合物が、一度の実験で、「ハード」な反応性代謝物および/もしくは「ソフト」な反応性代謝物ならびに/またはアシルグルクロニドを生じるかどうかを判定することが意図されたものである。当業者は、本発明の方法により「ハード」な反応性代謝物および「ソフト」な反応性代謝物の両方ならびにアシルグルクロニドが同時に検出されることとなるが、ある特定の試験化合物から、「ハード」な反応性代謝物、「ソフト」な反応性代謝物またはアシルグルクロニドのいずれかが形成されない場合には、この方法は、いずれかのタイプの反応性代謝物が形成されるかを検出するために行われることとなる、ということを理解するであろう。加えて、反応性代謝物が形成されない場合には、この方法により、129Daおよび147Daのニュートラルロススキャニングの全イオンスペクトルにピークがないことを示す質量スペクトルが作成され、それにより、その試験化合物が薬物候補として同定されることとなる。
【0037】
本発明は、さらに、薬物候補(すなわち、いかなる反応性代謝物も生じない試験化合物)を同定するための方法であって、
(a)試験化合物を、式(I)の非同位体標識化合物と薬物代謝酵素とを含む混合物とともにインキュベートして、生成物混合物を得ること;
(b)工程(a)において生じた生成物混合物のニュートラルロス質量スペクトルを測定すること;および
(c)ニュートラルロス質量スペクトルにおいてピークがないことを検出すること、
を含む方法に向けられたものである。
【0038】
以下の実施例は、本発明の理解を助けるために記載したものであり、添付の特許請求の範囲において記載されている本発明をなんらかの形で限定するようには意図されておらず、また、そのように解釈されるべきではない。
【実施例】
【0039】
実施例1:「ソフト」な反応性代謝物および「ハード」な反応性代謝物をトラップするための標準的な手順
【0040】
A.インキュベーション&化合物トラッピング:
【0041】
ここで記載するすべてのミクロソームインキュベーションは、37℃にて、ウォーターバス中またはヒートブロック上で行った。試験化合物を、0.1mMのEDTAを含む100mMのリン酸カリウム緩衝液(pH7.4)中のヒト肝ミクロソーム製剤(シトクロムP450酵素製剤)および式(I)の化合物と混合した。得られた混合物を、37℃で5分間、予め温めておいた。次いで、この反応混合物に、補因子−NADPHを(反応を開始させるために)添加して、最終体積を500μlにした。
【0042】
得られた反応混合物は、50μMの試験化合物、2mg/mlのミクロソームタンパク質、1mMの式(I)の化合物の混合物および3mMのNADPHを含有していた。
【0043】
15または60分のインキュベーション後、1000μlの50%メタノール/50%アセトニトリルの添加により反応を終結させた。得られた混合物を、10,000gで10分間、4℃にて遠心して沈殿タンパク質をペレットにし、上清を乾燥させた。得られた残渣を、50%メタノールで可溶化した。
【0044】
B.質量分析:
【0045】
MS分析は、LTQ Orbitrap FTMS(サーモフィッシャーサイエンティフィック社、ブレーメン、ドイツ)で行った。ESIイオン源は陽イオンモードで動作させた。全溶出液を、この質量分析計中へ、+5kVで噴霧し、この溶媒液滴の脱溶媒和を、350℃の加熱したキャピラリー温度によってさらに支援した。ニュートラルロススキャニングモードで収集される質量スペクトルは、m/z 200〜1100の範囲にわたり、分解能30000でスキャンすることによって得た。
【0046】
C.LC−MS/MS分析:
【0047】
反応性代謝物の完全プロファイリングのために、試料を、まず、オートサンプラーを備えたProminence LCシステム(島津製作所、京都、日本)を用いてクロマトグラフ分離に供し、溶出液を、ニュートラルロススキャニングモードで動作させたLTQ Orbitrap FTMSに導入した。クロマトグラフ分離には、L−カラムODS(オクタデシルシリル−シリカゲル;2.1×150mm、化学物質評価研究機構、東京、日本)を用いた。このクロマトグラフシステムでは、溶媒A(5mMの酢酸アンモニウム)と溶媒B(5mMの酢酸アンモニウムを含む95%アセトニトリル)との勾配として送達される二成分溶媒系が用いられた。初期勾配条件は95%A:5%Bを4分間であり、その後は、次の13分にわたって100%Bまでの流速0.25mL/分での直線勾配であった。当該溶媒組成は、その後、初期条件での再平衡化の前に、100%Bで8分間保持した。精製した試料の20μlずつに対してLC−MS/MS分析を行った。データ取得は、Xcaliber version 2.0ソフトウェア(サーモフィッシャーサイエンティフィック社、ブレーメン、ドイツ)を用いて行った。
【0048】
実施例2〜4:ソフトな反応性代謝物および/またはハードな反応性代謝物の検出
【0049】
上記実施例1に記載されている手順に従って、本発明の方法とECOとを適用することにより、129Daまたは147Daのニュートラルロススキャニングを用いて、「ソフト」な反応性代謝物および/または「ハード」な反応性代謝物を生じることが知られている試験化合物の反応性代謝物を検出した。
【0050】
実施例2:ECOによって分析したジクロフェナク
【0051】
「ソフト」な反応性代謝物を検出するべく、本方法およびECOの有用性を評価するための試験化合物として、ジクロフェナクを選択した。
【0052】
図1Aは、当該反応混合物について得た、全イオンクロマトグラム(TIC)、ならびに、129Daおよび147DaのニュートラルロススキャニングのTICを示している。147DaのニュートラルロススキャニングのTICにおいて、保持時間10.2分にて検出された最も強いピークは、m/z 640および674にてプロトン化イオンを示す、ジクロフェナクの反応性代謝物の、ECOとの2種類の付加物を含むものであった。この2種類の付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、それぞれ、図1Bおよび1Cに示した。
【0053】
本方法において検出された、ジクロフェナクの反応性代謝物の、ECOとの2種類の付加物の形成は、下記のスキームE1で概説する通りである。
【化7】

【0054】
実施例3:ECOによって分析したクロザピン
【0055】
「ソフト」な反応性代謝物を検出するべく、本方法およびECOの有用性を評価するための試験化合物として、クロザピンを選択した。
【0056】
図2Aは、当該反応混合物について得た、TIC、ならびに、129Daおよび147DaのニュートラルロススキャニングのTICを示している。147DaのニュートラルロススキャニングのTICにおいて、保持時間10.3分にて検出された最も強いピークは、m/z 689にてプロトン化イオンを示す、1種類の付加物を含むものであった。この付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、図2Bに示した。
【0057】
本方法において検出された、クロザピンの反応性代謝物の、ECOとの付加物の形成は、下記のスキームE2で概説する通りである。
【化8】

【0058】
実施例4:ECOによって分析した2−[2−チエニル]−フラン
【0059】
「ソフト」な反応性代謝物と「ハード」な反応性代謝物の両方を検出するべく、本方法およびECOの有用性を評価するための試験化合物として、2−[2−チエニル]−フランを選択した。
【0060】
図3Aは、当該反応混合物について得た、TIC、ならびに、129Daおよび147DaのニュートラルロススキャニングのTICを示している。3つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間10.2分、10.7分および11.0分にて検出された。10.2分における第一成分は、図3Bに示すように、フルスキャンスペクトルにおいて、m/z 513にてプロトン化イオンを示し、また、m/z 384にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。10.7分における第二成分は、図3Cに示すように、フルスキャンスペクトルにおいて、m/z 481にてプロトン化イオンを示し、また、m/z 352にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。11.0分における第三成分は、図3Dに示すように、フルスキャンスペクトルにおいて、m/z 495にてプロトン化イオンを示し、また、m/z 366にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0061】
本方法において検出された、2−[2−チエニル]−フランの反応性代謝物の、ECOとの3種類の付加物の形成は、下記のスキームE3で概説する通りである。
【化9】

【0062】
実施例5:アシルグルクロニドをトラップするための標準的な手順
【0063】
A.インキュベーション&化合物トラッピング:
【0064】
ここで記載するすべてのインキュベーションは、37℃にて、ウォーターバス中またはヒートブロック上で行った。ジクロフェナクアシルグルクロニドを、0.1mMのEDTAを含む100mMのリン酸カリウム緩衝液(pH7.4)中に添加した。得られた混合物を、37℃で5分間、予め温めておいた。次いで、この反応混合物に、式(I)の化合物を(反応を開始させるために)添加して、最終体積を500μlにした。
【0065】
得られた反応混合物は、100μMのジクロフェナクアシルグルクロニド、1mMの式(I)の化合物の混合物を含有していた。
【0066】
60分のインキュベーション後、氷上に置くことによりインキュベーションを停止させ、試料の20μlずつをLC/MS/MS分析に適用した。
【0067】
B.質量分析:
【0068】
MS分析は、LTQ Orbitrap FTMS(サーモフィッシャーサイエンティフィック社、ブレーメン、ドイツ)で行った。ESIイオン源は陽イオンモードで動作させた。全溶出液を、この質量分析計中へ、+5kVで噴霧し、この溶媒液滴の脱溶媒和を、350℃の加熱したキャピラリー温度によってさらに支援した。ニュートラルロススキャニングモードで収集される質量スペクトルは、m/z 200〜1100の範囲にわたり、分解能30000でスキャンすることによって得た。
【0069】
C.LC−MS/MS分析:
【0070】
反応性代謝物の完全プロファイリングのために、試料を、まず、オートサンプラーを備えたProminence LCシステム(島津製作所、京都、日本)を用いてクロマトグラフ分離に供し、溶出液を、ニュートラルロススキャニングモードで動作させたLTQ Orbitrap FTMSに導入した。クロマトグラフ分離には、L−カラムODS(2.1×150mm、化学物質評価研究機構、東京、日本)を用いた。このクロマトグラフシステムでは、溶媒A(5mMの酢酸アンモニウム)と溶媒B(5mMの酢酸アンモニウムを含む95%アセトニトリル)との勾配として送達される二成分溶媒系が用いられた。初期勾配条件は95%A:5%Bを4分間であり、その後は、次の13分にわたって100%Bまでの直線勾配であった。当該溶媒組成は、その後、初期条件での再平衡化の前に、100%Bで8分間保持した。精製した試料の20μlずつに対してLC−MS/MS分析を行った。データ取得は、Xcaliber version 2.0ソフトウェア(サーモフィッシャーサイエンティフィック社、ブレーメン、ドイツ)を用いて行った。
【0071】
実施例6:ECOによって分析したジクロフェナクアシルグルクロニド
【0072】
UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出するべく、本方法およびECOの有用性を評価するための試験化合物として、ジクロフェナクアシルグルクロニドを選択した。
【0073】
図4Aは、当該反応混合物について得た、TIC、ならびに、129Daおよび147DaのニュートラルロススキャニングのTICを示している。共通の強いピークが、129Daおよび147DaのニュートラルロススキャニングのTICにおいて、保持時間12.1分にて検出された。このピークは、図4Bに示すように、フルスキャンスペクトルにおいて、m/z 642にてプロトン化イオンを示し、また、m/z 495にてプロダクトイオンを示すが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0074】
本方法において検出された、ジクロフェナクアシルグルクロニドのECOとの付加物の形成は、下記のスキームE4で概説する通りである。
【化10】

【0075】
実施例7〜9:ソフトな反応性代謝物および/またはハードな反応性代謝物の検出
【0076】
上記実施例1に記載されている手順に従って、本発明の方法とECHKとを適用することにより、129Daのニュートラルロススキャニングを用いて、「ソフト」な反応性代謝物および/または「ハード」な反応性代謝物を生じることが知られている試験化合物の反応性代謝物を検出した。
実施例7:ECHKによって分析したジクロフェナク
【0077】
「ソフト」な反応性代謝物を検出するべく、本方法およびECHKの有用性を評価するための試験化合物として、ジクロフェナクを選択した。
【0078】
図5Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。129DaのニュートラルロススキャニングのTICにおいて、保持時間10.7分にて検出された最も強いピークは、m/z 668および702にてプロトン化イオンを示す、ジクロフェナクの反応性代謝物の、ECHKとの2種類の付加物を含むものであった。この2種類の付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、それぞれ、図5Bおよび5Cに示した。
【0079】
本方法において検出された、ジクロフェナクの反応性代謝物の、ECHKとの2種類の付加物の形成は、下記のスキームE5で概説する通りである。
【化11】

【0080】
実施例8:ECHKによって分析したクロザピン
【0081】
「ソフト」な反応性代謝物を検出するべく、本方法およびECHKの有用性を評価するための試験化合物として、クロザピンを選択した。
【0082】
図6Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。129DaのニュートラルロススキャニングのTICにおいて、保持時間11.1分にて検出された最も強いピークは、m/z 717にてプロトン化イオンを示す、1種類の付加物を含むものであった。この付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、図6Bに示した。
【0083】
本方法において検出された、クロザピンの反応性代謝物の、ECHKとの付加物の形成は、下記のスキームE6で概説する通りである。
【化12】

【0084】
実施例9:ECHKによって分析した2−[2−チエニル]−フラン
【0085】
「ソフト」な反応性代謝物と「ハード」な反応性代謝物の両方を検出するべく、本方法およびECHKの有用性を評価するための試験化合物として、2−[2−チエニル]−フランを選択した。
【0086】
図7Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。2つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間10.6分および11.9分にて検出された。10.6分における第一成分は、図7Bに示すように、フルスキャンスペクトルにおいて、m/z 541にてプロトン化イオンを示し、また、m/z 412にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。11.9分における第二成分は、2−[2−チエニル]−フランの反応性代謝物の、ECHKとの2種類の付加物を含むものであり、そして、図7Cおよび7Dに示すように、フルスキャンスペクトルにおいて、m/z 509および523にてプロトン化イオンを示し、また、m/z 380および394にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0087】
本方法において検出された、2−[2−チエニル]−フランの反応性代謝物の、ECHKとの3種類の付加物の形成は、下記のスキームE7で概説する通りである。
【化13】

【0088】
実施例10:ECHKによって分析したジクロフェナクアシルグルクロニド
【0089】
実施例5に記載されている手順に従って、本発明の方法とECHKとを適用することにより、UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出した。
【0090】
UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出するべく、本方法およびECHKの有用性を評価するための試験化合物として、ジクロフェナクアシルグルクロニドを選択した。
【0091】
図8Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。1つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間12.5分にて検出された。このピークは、図8Bに示すように、フルスキャンスペクトルにおいて、m/z 670にてプロトン化イオンを示し、また、m/z 541にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0092】
本方法において検出された、ジクロフェナクアシルグルクロニドのECHKとの付加物の形成は、下記のスキームE8で概説する通りである。
【化14】

【0093】
実施例11〜13:ソフトな反応性代謝物および/またはハードな反応性代謝物の検出
【0094】
上記実施例1に記載されている手順に従って、本発明の方法とEHCKとを適用することにより、129Daのニュートラルロススキャニングを用いて、「ソフト」な反応性代謝物および/または「ハード」な反応性代謝物を生じることが知られている試験化合物の反応性代謝物を検出した。
【0095】
実施例11:EHCKによって分析したジクロフェナク
【0096】
「ソフト」な反応性代謝物を検出するべく、本方法およびEHCKの有用性を評価するための試験化合物として、ジクロフェナクを選択した。
【0097】
図9Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。2つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間10.5分および10.8分にて検出された。10.5分および10.8分におけるこの2種類の成分は、m/z 668および702にてプロトン化イオンを示した。この2種類の付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、それぞれ、図9Bおよび9Cに示した。
【0098】
本方法において検出された、ジクロフェナクの反応性代謝物の、ECHKとの2種類の付加物の形成は、下記のスキームE9で概説する通りである。
【化15】

【0099】
実施例12:EHCKによって分析したクロザピン
【0100】
「ソフト」な反応性代謝物を検出するべく、本方法およびEHCKの有用性を評価するための試験化合物として、クロザピンを選択した。
【0101】
図10Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。129DaのニュートラルロススキャニングのTICにおいて、保持時間11.2分にて検出された最も強いピークは、m/z 717にてプロトン化イオンを示す、1種類の付加物を含むものであった。この付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、図10Bに示した。
【0102】
本方法において検出された、クロザピンの反応性代謝物の、EHCKとの付加物の形成は、下記のスキームE10で概説する通りである。
【化16】

【0103】
実施例13:EHCKによって分析した2−[2−チエニル]−フラン
【0104】
「ソフト」な反応性代謝物と「ハード」な反応性代謝物の両方を検出するべく、本方法およびEHCKの有用性を評価するための試験化合物として、2−[2−チエニル]−フランを選択した。
【0105】
図11Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。129DaのニュートラルロススキャニングのTICにおいて、保持時間12.0分にて検出されたピークは、m/z 509、541および523にてプロトン化イオンを示す、2−[2−チエニル]−フランの反応性代謝物の、EHCKとの3種類の付加物を含むものであった。この3種類の付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、それぞれ、図11B、11Cおよび11Dに示した。
【0106】
本方法において検出された、2−[2−チエニル]−フランの反応性代謝物の、EHCKとの3種類の付加物の形成は、下記のスキームE11で概説する通りである。
【化17】

【0107】
実施例14:EHCKによって分析したジクロフェナクアシルグルクロニド
【0108】
実施例5に記載されている手順に従って、本発明の方法とEHCKとを適用することにより、UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出した。
【0109】
UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出するべく、本方法およびEHCKの有用性を評価するための試験化合物として、ジクロフェナクアシルグルクロニドを選択した。
【0110】
図12Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。1つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間12.8分にて検出された。このピークは、図12Bに示すように、フルスキャンスペクトルにおいて、m/z 670にてプロトン化イオンを示し、また、m/z 541にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0111】
本方法において検出された、ジクロフェナクアシルグルクロニドのEHCKとの付加物の形成は、下記のスキームE12で概説する通りである。
【化18】

【技術分野】
【0001】
本発明は、反応性代謝物を検出するための非同位体トラッピング化合物および方法、ならびに、薬物候補を同定する方法、に向けられたものである。より詳細には、この、反応性代謝物を検出するための非同位体トラッピング化合物および方法を利用して、「ソフト」な反応性代謝物および「ハード」な反応性代謝物、ならびに、さらには、アシルグルクロニド、を検出することができる。
【背景技術】
【0002】
患者の罹患率および死亡率の問題において、化合物の特定の毒性は、臨床開発においても上市後においても、依然として、安全性に対する深刻な懸念事項のままである。これらの特定の薬物有害事象は制限的使用につながり得り、また、市場からの撤退にさえつながり得り、このことは、結果的に、製薬会社に、より大きな負担をもたらす。有名な例として、トログリタゾンは、その上市後すぐに、予期せぬ毒性のために撤退した。
【0003】
特定の薬物有害事象は、通常、個々の感受性の度合いが高い場合に現れる、まれなケースである。さらに、これらの反応は、一般に、用量非依存的に起こる。現在、ヒトにおいて専ら起こるような反応を評価するのに使用可能な動物モデルは存在しない。したがって、これらの特定の薬物毒性は、前臨床試験において正確に評価することができず、また、臨床試験において認識できない場合が多い。
【0004】
現時点では、これらの特定の有害薬物反応のメカニズムはよく分かっていない。化学的に反応性の高い代謝物が特定の毒性に関係しているということを示唆する証拠が、特に肝毒性について、数多くある。特定の毒性に関連する数多くの化合物は、主にシトクロムP450酵素(CYP)によって、同様に、例えばペルオキシダーゼ、シクロオキシゲナーゼおよびミエロペルオキシダーゼなどの他の酸化酵素によって仲介される種々の代謝経路を介して、または、UDP−グルクロノシルトランスフェラーゼ(UGT)によって仲介される別の代謝経路を介して、反応性代謝物を生じる。これは、こうした毒性に関連する数多くの化合物が、まず、代謝活性化を受け、その結果、細胞タンパク質に共有結合する有毒性の反応性代謝物を生じる、と仮定したものである。これらの共有結合修飾されたタンパク質は、しばしば、抗原性であり、それ故に、免疫応答を刺激し、その結果、特定の薬物反応をもたらす。別の仮説では、反応性代謝物による細胞タンパク質の共有結合修飾がシグナル伝達カスケードと細胞の必須の機能とをブロックし、それにより、臨床上観察される致命的な結果が引き起こされる、と言われている。したがって、反応性代謝物を同定するための方法が深刻に必要とされている。
【0005】
酸化酵素により生じる化学的な化合物の反応性代謝物は、化学的な性質に基づく、「ソフト」な反応性代謝物および「ハード」な反応性代謝物という、2つのカテゴリーに特徴付けることができる。「ソフト」な反応性代謝物には、キノン、キノンイミン、イミノキノンメチド、エポキシド、アレーンオキシドおよびニトレニウムイオンを含み、かつ、例えばシステイン中のスルフヒドリル基などの「ソフト」な求核基と容易に反応する、求電子性代謝物の大多数が含まれる。一方、「ハード」な反応性代謝物は、最も一般的にはアルデヒドと考えられているが、これらは、例えばリシン、アルギニンといったアミン、および、核酸などの、「ハード」な求核基と優先的に反応する。それらの不安定性ゆえに、反応性代謝物の直接の検出および特徴付けは、非常に困難であることが立証されている。一般的に利用されているアプローチの1つは、これらの反応性代謝物を捕捉分子でトラップすることであり、これにより、その後の例えばタンデム質量分析などの公知の検出方法による特徴付けが可能な、安定した付加物が形成される。
【0006】
UGTにより生じる、反応性代謝物の別のカテゴリーは、アシルグルクロニドである。アシルグルクロニドは、本質的に反応性の化学種であり、分子内転位およびアノマー化、次いで、タンパク質との反応を経て、共有結合付加物を生じる。現在、ニュートラルロスタンデム質量分析を用いた、トラッピング剤を使用したアシルグルクロニドの検出システムに関する報告は存在しない。
【0007】
最近、Huebertらは、WO2008/042634A2の中で、安定同位体標識トラッピング化合物と質量分析とを用いる、反応性代謝物を検出するための方法を開示した。しかしながら、Huebertらは、単に、「安定同位体標識化合物」を用いる方法を開示しただけであり、例示した一実施形態のような、いかなる「非同位体標識化合物」も示さなかった。また、Huebertらにより開示された方法は、「ソフト」な反応性代謝物および「ハード」な反応性代謝物を検出することができるのみであり、例示したもののような、いかなる「アシルグルクロニド」も検出することはできない。
【0008】
他方で、本発明は、式(I)の非同位体化合物により、一度の実験での、「ソフト」な反応性代謝物および「ハード」な反応性代謝物、ならびに、さらにはアシルグルクロニドの検出のための新規の方法を与えることができるという特定の特徴を指し示している。
【発明の概要】
【0009】
本発明は、(「ソフト」な反応性代謝物および「ハード」な反応性代謝物ならびにアシルグルクロニドを含む)反応性代謝物を同定するための非同位体トラッピング化合物、すなわち、式(I)の化合物:
【化1】

に向けられたものである。
【0010】
本発明は、さらに、試験化合物の反応性代謝物を検出するための方法であって、
(a)試験化合物を、上記式(I)の化合物および薬物代謝酵素とともにインキュベートし、1種類以上の付加物を含む生成物混合物を得ること;ならびに
(b)工程(a)の付加物を検出すること、
を含む方法に向けられたものである。
【図面の簡単な説明】
【0011】
【図1A】ECOを用いて分析した場合の、ジクロフェナクについての、全イオンクロマトグラム(TIC;上段)、ならびに、129Da(中段)および147Da(下段)のニュートラルロススキャニングのTICを説明するものである。
【図1B】ECOを用いて分析した場合の、ジクロフェナク由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図1C】ECOを用いて分析した場合の、ジクロフェナク由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図2A】ECOを用いて分析した場合の、クロザピンについての、TIC(上段)、ならびに、129Da(中段)および147Da(下段)のニュートラルロススキャニングのTICを説明するものである。
【図2B】ECOを用いて分析した場合の、クロザピン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図3A】ECOを用いて分析した場合の、2−[2−チエニル]−フランについての、TIC(上段)、ならびに、129Da(中段)および147Da(下段)のニュートラルロススキャニングのTICを説明するものである。
【図3B】ECOを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図3C】ECOを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図3D】ECOを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図4A】ECOを用いて分析した場合の、ジクロフェナクアシルグルクロニドについての、TIC(上段)、ならびに、129Da(中段)および147Da(下段)のニュートラルロススキャニングのTICを説明するものである。
【図4B】ECOを用いて分析した場合の、ジクロフェナクアシルグルクロニド由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図5A】ECHKを用いて分析した場合の、ジクロフェナクについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図5B】ECHKを用いて分析した場合の、ジクロフェナク由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図5C】ECHKを用いて分析した場合の、ジクロフェナク由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図6A】ECHKを用いて分析した場合の、クロザピンについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図6B】ECHKを用いて分析した場合の、クロザピン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図7A】ECHKを用いて分析した場合の、2−[2−チエニル]−フランについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図7B】ECHKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図7C】ECHKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図7D】ECHKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図8A】ECHKを用いて分析した場合の、ジクロフェナクアシルグルクロニドについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図8B】ECHKを用いて分析した場合の、ジクロフェナクアシルグルクロニド由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図9A】EHCKを用いて分析した場合の、ジクロフェナクについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図9B】EHCKを用いて分析した場合の、ジクロフェナク由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図9C】EHCKを用いて分析した場合の、ジクロフェナク由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図10A】EHCKを用いて分析した場合の、クロザピンについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図10B】EHCKを用いて分析した場合の、クロザピン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図11A】EHCKを用いて分析した場合の、2−[2−チエニル]−フランについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図11B】EHCKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図11C】EHCKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図11D】EHCKを用いて分析した場合の、2−[2−チエニル]−フラン由来の付加物IIIのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【図12A】EHCKを用いて分析した場合の、ジクロフェナクアシルグルクロニドについての、TIC(上段)、および、129DaのニュートラルロススキャニングのTIC(下段)を説明するものである。
【図12B】EHCKを用いて分析した場合の、ジクロフェナクアシルグルクロニド由来の付加物Iのフルスキャンスペクトル(上段)およびプロダクトイオンスペクトル(下段)を説明するものである。
【発明を実施するための形態】
【0012】
本発明は、反応性代謝物に結合する能力を有する非同位体トラッピング化合物、すなわち、式(I)の化合物:
【化2】

に向けられたものであり、式中、
XはCH2であり、かつ、
p、qおよびrはそれぞれ独立して0または1であるが、
但し、pが0であり、qが0であり、かつ、rが1である化合物は除外されるものとする。
【0013】
式(I)の化合物はトリペプチド誘導体である。式(I)の化合物は、固相ペプチド合成により、保護アミノ酸(グルタミン酸、システイン/ホモシステイン、および、リシン/ホモリシン/オルニチン/β−リシン)から調製することができる。
【0014】
式(I)の化合物は、好ましくは、式(II)、(III)または(IV)の化合物:
【化3】

【化4】

【化5】

である。
【0015】
式(II)の化合物は、ECOと略記されるγ−グルタミルシステイニルオルニチンであり、式(III)の化合物は、ECHKと略記されるγ−グルタミルシステイニルホモリシンであり、また、式(IV)の化合物は、EHCKと略記されるγ−グルタミルホモシステイニルリシンである。
【0016】
式(I)〜(IV)の化合物は3つのキラル炭素を有しており、種々の立体異性体が存在する。式(I)〜(IV)の化合物はいずれの立体異性体であってもよく、またはその混合物であってもよい。好ましくは、式(I)〜(IV)の化合物は、ある特定の立体異性体のみを実質的に含む。より好ましくは、式(I)〜(IV)の化合物を構成するアミノ酸は、すべてL型であるか、または、すべてD型である。
【0017】
式(I)の化合物は2つの「トラッピングゾーン」を有し、これらは、それぞれ、「ハード」な反応性代謝物と「ソフト」な反応性代謝物とをトラップする。より詳細には、式(I)の化合物上のスルフヒドリル(−SH)基は、いわゆる「ソフト」な反応性代謝物と反応して、それらをトラップし、一方、式(I)の化合物上の−(X)r−CH2−NH2基は、いわゆる「ハード」な反応性代謝物と反応して、それらをトラップする。よって、式(I)の化合物は、「ハード」な反応性代謝物と「ソフト」な反応性代謝物の両方を同時にトラップする能力を有する。
【化6】

【0018】
特に断りのない限り、本明細書で用いられている「反応性代謝物」という語には、「ソフト」な反応性代謝物および「ハード」な反応性代謝物ならびにアシルグルクロニドが含まれるものとする。
【0019】
特に断りのない限り、本明細書で用いられている「ソフトな代謝物」という語は、例えばシステイン中のスルフヒドリル基および式(I)の化合物上の−SH基などの、「ソフト」な求核基と容易に反応する少なくとも1つの置換基を含む任意の求電子性代謝物を意味するものとする。そのような置換基の適切な例としては、キノン、キノンイミン、イミノキノンメチド、エポキシド、アレーンオキシド、および、ニトレニウムイオンなどが挙げられるが、これに限定されない。
【0020】
特に断りのない限り、本明細書で用いられている「ハードな代謝物」という語は、例えばリシン、アルギニンといったアミン、または、式(I)の化合物の−(X)r−CH2−NH2基などの、「ハード」な求核基と容易に反応する少なくとも1つの置換基を含む任意の求電子性代謝物を意味するものとする。そのような置換基の適切な例としては、アルデヒドなどが挙げられるが、これに限定されない。
【0021】
特に断りのない限り、本明細書で用いられている「アシルグルクロニド」という語は、例えばシステイン中のスルフヒドリル基、式(I)の化合物の−SH基、リシン、アルギニンといったアミン、または式(I)の化合物の−(X)r−CH2−NH2基などの、求核基と反応する任意の反応性代謝物を意味するものとする。そのような置換基の適切な例としては、1−O−β−アシルグルクロニドなどが挙げられるが、これに限定されない。
【0022】
反応性代謝物は、試験化合物に付随する数多くの有害事象、特に、深刻なおよび/または有毒性の有害事象、に関係していることから、試験化合物によって生じるすべての反応性代謝物を検出できることは非常に望ましいことである。試験化合物が反応性代謝物を生じるかどうかを、その試験化合物の、ヒトへの投与前に判定することは、さらに、非常に望ましい。
【0023】
当業者は、すべての試験化合物が反応性代謝物を生じるとは限らないということ、そして、さらには、すべての試験化合物が「ソフト」な反応性代謝物および「ハード」な反応性代謝物ならびにアシルグルクロニドを生じるとは限らないということを理解するであろう。反応性代謝物を生じない試験化合物もあるであろうし、「ハード」な反応性代謝物のみを生じる試験化合物もあるであろうし、「ソフト」な反応性代謝物のみを生じる試験化合物もあるであろうし、アシルグルクロニドのみを生じる試験化合物もあるであろうし、また、「ソフト」な反応性代謝物および「ハード」な反応性代謝物ならびにアシルグルクロニドを生じる試験化合物もあるであろう。よって、本発明のトラッピング化合物および方法は、試験化合物によって生じるあらゆるタイプの反応性代謝物を検出する。
【0024】
当業者は、本発明の方法は、反応性代謝物を同定することに向けられたものであると同時に、試験化合物が反応性代謝物を生じるかどうかを判定するプロセスをも包含している、ということをさらに理解するであろう。一実施形態においては、本発明は、有望な薬物候補(例えば、反応性代謝物を生じない試験化合物)を同定するための方法に向けられたものである。よって、本発明の方法には、(本明細書において、より詳細に記載されているような)インキュベーションにより、反応性代謝物、ひいては付加物がもたらされることがなく、かつ、129Daまたは147Daのニュートラルロススキャニングの全イオンスペクトルがピークを示さず、それにより、当該試験化合物が、検出可能ないかなる反応性代謝物も生じないということが指し示される、というプロセスが含まれる。
【0025】
「ソフト」な代謝物に対しては、グルタチオンは、「ソフト」な反応性代謝物を検出するためにミクロソームインキュベーションにおいて使用される最も一般的なトラッピング剤である。しかしながら、「ハード」な反応性代謝物およびアシルグルクロニドに対しては、グルタチオンは、そのトラッピング効率ゆえに、適切なトラッピング剤ではない。むしろ、「ハード」な反応性代謝物を検出するためには、代わりとなるトラッピング剤、例えばセミカルバジド、メトキシルアミンおよびα−アセチルリシンなど、が使用される。他方で、アシルグルクロニドを検出するためには、N−アセチルシステイン(NAC)が有用である。上記の理由から、これらは、「ハード」な反応性代謝物および「ソフト」な反応性代謝物ならびにアシルグルクロニドの検出のために、異なるトラッピング剤を用いた3つの別々の実験を必要とする。この状況であっても、本発明は、式(I)の非同位体標識化合物により、一度の実験での、「ソフト」な反応性代謝物および「ハード」な反応性代謝物、ならびに、さらにはアシルグルクロニドの検出のための新規の方法を与えることができるという特定の特徴を指し示している。
【0026】
特に断りのない限り、本明細書で用いられている「薬物代謝酵素」は、試験化合物を代謝することのできる、ヒトまたは動物組織由来の、好ましくはヒト、ラット、マウス、ハムスター、イヌ、サルまたはウサギ組織由来の、より好ましくはヒト、ラット、マウス、ハムスター、イヌ、サルまたはウサギの肝組織由来の、任意の酵素またはその混合物を意味するものとする。(例えば、Drug Metabolizing Enzymes, Edited by JaeS. Lee, R. Scott Obach and Michael B. Fisher, Marcel Dekker, lnc. (2003)を参照のこと。)適切な例としては、肝ミクロソーム、シトクロムP450酵素、または、シトクロムP450酵素の種々のアイソフォームの混合物、ペルオキシダーゼ、シクロオキシゲナーゼ、ミエロペルオキシダーゼ、UDP−グルクロノシルトランスフェラーゼ(UGT)等が挙げられるが、これに限定されない。好ましくは、薬物代謝酵素はヒト肝ミクロソームであり、より好ましくは、シトクロムP450酵素、組換え酵素およびUGTである。当業者は、試験化合物を、UGTおよびシトクロムP450酵素またはシトクロムP450酵素の種々のアイソフォームの混合物とともにインキュベートする場合には、このUGTおよびシトクロムP450酵素またはシトクロムP450の種々のアイソフォームの混合物は、ウリジン二リン酸グルクロン酸(UDPGA)およびNADPH補因子またはNADPH再生系と組み合わせてインキュベートされる、ということを理解するであろう。
【0027】
特に断りのない限り、本明細書で用いられている「試験化合物」という語は、反応性代謝物(単数または複数)の形成について試験される任意の化学物質を意味するものとする。好ましくは、試験化合物は、薬学的な作用物質またはその塩、エステルもしくはプロドラッグである。
【0028】
特に断りのない限り、本明細書で用いられている「薬物候補」という語は、反応性代謝物(単数または複数)を生じない任意の化学物質または試験化合物を意味するものとする。好ましくは、薬物候補は、薬学的な作用物質またはその塩、エステルもしくはプロドラッグである。
【0029】
別途指示がない限り、本明細書で用いられている「付加物」という語は、反応性代謝物の、式(I)の化合物との、任意の共有結合複合体を意味するものとする。
【0030】
本明細書、特にスキームおよび実施例、において用いられている略語は、以下の通りである:
APCI−MS/MS=大気圧化学イオン化タンデム質量分析
CYP=シトクロムP450酵素
UGT=UDP−グルクロノシルトランスフェラーゼ
Da=ダルトン
ESI−MS/MS=エレクトロスプレーイオン化タンデム質量分析
HPLC=高速液体クロマトグラフィー
MS=質量分析
NADPH=β−ニコチンアミドアデニンジヌクレオチドリン酸(還元型)
SPE=固相抽出
UDPGA=ウリジン二リン酸グルクロン酸
【0031】
本発明の一実施形態では、当該薬物代謝酵素は、ヒト肝ミクロソーム、シトクロムP450酵素、ペルオキシダーゼ、シクロオキシゲナーゼ、ミエロペルオキシダーゼおよびUGTからなる群より選択される。好ましくは、当該薬物代謝酵素はシトクロムP450酵素およびUGTである。
【0032】
一実施形態では、薬物代謝酵素、例えばS9、組換え酵素またはミクロソーム酵素など、を含有する細胞の任意の分画とともに試験化合物をインキュベートすることにより形成された反応性代謝物を検出するのに、本発明を適用する。一実施形態では、試験化合物が、ヒト対象内で(すなわち、この試験化合物のヒトへの投与後に)反応性代謝物を形成するかどうかを予測するのに本発明の方法を適用する。
【0033】
当業者は、「S9」という略語が、S9画分(ポストミトコンドリア上清画分)を指し、これはミクロソームとサイトゾルとの混合物である、とのことを理解するであろう。したがって、これは、P450酵素、フラビンモノオキシゲナーゼ、カルボキシルエステラーゼ、エポキシドヒドロラーゼ、UDP−グルクロノシルトランスフェラーゼ、スルホトランスフェラーゼ、メチルトランスフェラーゼ、アセチルトランスフェラーゼ、グルタチオンS−トランスフェラーゼおよび他の薬物代謝酵素などの、種々の第I相および第II相酵素を含有する。
【0034】
1種類以上のインキュベーション生成物(非反応性代謝物、反応性代謝物と式(I)の化合物との間で形成された付加物)を含有する生成物混合物は、好ましくは、公知の方法に従って、例えば遠心分離、SPE、蒸発または液−液抽出によって、精製し、濃縮して、生成物濃縮物を得る。次いで、この生成物濃縮物を、質量分析における使用に適した(すなわち、質量分析計への注入に適した)溶媒、例えば水中5%アセトニトリルおよび水中5%メタノールなど、に溶解させる。
【0035】
好ましくは、この生成物混合物は、公知の方法に従って、例えば液体クロマトグラフィー、HPLC、キャピラリー電気泳動、または他の分離技術によって、個々の付加物成分に分離する。次いで、ニュートラルロス質量スペクトルを、各付加物または付加物成分について測定する。ニュートラルロス質量スペクトルは、公知の方法に従って、任意のイオン化源を用いて、例えばAPCI−MS/MSおよびESI−MS/MSなどによって、好ましくはESI−MS/MSによって、測定してもよい。あるいは、分離および質量スペクトル測定は、例えばLC/MSなどのループシステムを用いて、1ステップで完了させてもよい。
【0036】
本発明の方法は、試験化合物が、一度の実験で、「ハード」な反応性代謝物および/もしくは「ソフト」な反応性代謝物ならびに/またはアシルグルクロニドを生じるかどうかを判定することが意図されたものである。当業者は、本発明の方法により「ハード」な反応性代謝物および「ソフト」な反応性代謝物の両方ならびにアシルグルクロニドが同時に検出されることとなるが、ある特定の試験化合物から、「ハード」な反応性代謝物、「ソフト」な反応性代謝物またはアシルグルクロニドのいずれかが形成されない場合には、この方法は、いずれかのタイプの反応性代謝物が形成されるかを検出するために行われることとなる、ということを理解するであろう。加えて、反応性代謝物が形成されない場合には、この方法により、129Daおよび147Daのニュートラルロススキャニングの全イオンスペクトルにピークがないことを示す質量スペクトルが作成され、それにより、その試験化合物が薬物候補として同定されることとなる。
【0037】
本発明は、さらに、薬物候補(すなわち、いかなる反応性代謝物も生じない試験化合物)を同定するための方法であって、
(a)試験化合物を、式(I)の非同位体標識化合物と薬物代謝酵素とを含む混合物とともにインキュベートして、生成物混合物を得ること;
(b)工程(a)において生じた生成物混合物のニュートラルロス質量スペクトルを測定すること;および
(c)ニュートラルロス質量スペクトルにおいてピークがないことを検出すること、
を含む方法に向けられたものである。
【0038】
以下の実施例は、本発明の理解を助けるために記載したものであり、添付の特許請求の範囲において記載されている本発明をなんらかの形で限定するようには意図されておらず、また、そのように解釈されるべきではない。
【実施例】
【0039】
実施例1:「ソフト」な反応性代謝物および「ハード」な反応性代謝物をトラップするための標準的な手順
【0040】
A.インキュベーション&化合物トラッピング:
【0041】
ここで記載するすべてのミクロソームインキュベーションは、37℃にて、ウォーターバス中またはヒートブロック上で行った。試験化合物を、0.1mMのEDTAを含む100mMのリン酸カリウム緩衝液(pH7.4)中のヒト肝ミクロソーム製剤(シトクロムP450酵素製剤)および式(I)の化合物と混合した。得られた混合物を、37℃で5分間、予め温めておいた。次いで、この反応混合物に、補因子−NADPHを(反応を開始させるために)添加して、最終体積を500μlにした。
【0042】
得られた反応混合物は、50μMの試験化合物、2mg/mlのミクロソームタンパク質、1mMの式(I)の化合物の混合物および3mMのNADPHを含有していた。
【0043】
15または60分のインキュベーション後、1000μlの50%メタノール/50%アセトニトリルの添加により反応を終結させた。得られた混合物を、10,000gで10分間、4℃にて遠心して沈殿タンパク質をペレットにし、上清を乾燥させた。得られた残渣を、50%メタノールで可溶化した。
【0044】
B.質量分析:
【0045】
MS分析は、LTQ Orbitrap FTMS(サーモフィッシャーサイエンティフィック社、ブレーメン、ドイツ)で行った。ESIイオン源は陽イオンモードで動作させた。全溶出液を、この質量分析計中へ、+5kVで噴霧し、この溶媒液滴の脱溶媒和を、350℃の加熱したキャピラリー温度によってさらに支援した。ニュートラルロススキャニングモードで収集される質量スペクトルは、m/z 200〜1100の範囲にわたり、分解能30000でスキャンすることによって得た。
【0046】
C.LC−MS/MS分析:
【0047】
反応性代謝物の完全プロファイリングのために、試料を、まず、オートサンプラーを備えたProminence LCシステム(島津製作所、京都、日本)を用いてクロマトグラフ分離に供し、溶出液を、ニュートラルロススキャニングモードで動作させたLTQ Orbitrap FTMSに導入した。クロマトグラフ分離には、L−カラムODS(オクタデシルシリル−シリカゲル;2.1×150mm、化学物質評価研究機構、東京、日本)を用いた。このクロマトグラフシステムでは、溶媒A(5mMの酢酸アンモニウム)と溶媒B(5mMの酢酸アンモニウムを含む95%アセトニトリル)との勾配として送達される二成分溶媒系が用いられた。初期勾配条件は95%A:5%Bを4分間であり、その後は、次の13分にわたって100%Bまでの流速0.25mL/分での直線勾配であった。当該溶媒組成は、その後、初期条件での再平衡化の前に、100%Bで8分間保持した。精製した試料の20μlずつに対してLC−MS/MS分析を行った。データ取得は、Xcaliber version 2.0ソフトウェア(サーモフィッシャーサイエンティフィック社、ブレーメン、ドイツ)を用いて行った。
【0048】
実施例2〜4:ソフトな反応性代謝物および/またはハードな反応性代謝物の検出
【0049】
上記実施例1に記載されている手順に従って、本発明の方法とECOとを適用することにより、129Daまたは147Daのニュートラルロススキャニングを用いて、「ソフト」な反応性代謝物および/または「ハード」な反応性代謝物を生じることが知られている試験化合物の反応性代謝物を検出した。
【0050】
実施例2:ECOによって分析したジクロフェナク
【0051】
「ソフト」な反応性代謝物を検出するべく、本方法およびECOの有用性を評価するための試験化合物として、ジクロフェナクを選択した。
【0052】
図1Aは、当該反応混合物について得た、全イオンクロマトグラム(TIC)、ならびに、129Daおよび147DaのニュートラルロススキャニングのTICを示している。147DaのニュートラルロススキャニングのTICにおいて、保持時間10.2分にて検出された最も強いピークは、m/z 640および674にてプロトン化イオンを示す、ジクロフェナクの反応性代謝物の、ECOとの2種類の付加物を含むものであった。この2種類の付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、それぞれ、図1Bおよび1Cに示した。
【0053】
本方法において検出された、ジクロフェナクの反応性代謝物の、ECOとの2種類の付加物の形成は、下記のスキームE1で概説する通りである。
【化7】

【0054】
実施例3:ECOによって分析したクロザピン
【0055】
「ソフト」な反応性代謝物を検出するべく、本方法およびECOの有用性を評価するための試験化合物として、クロザピンを選択した。
【0056】
図2Aは、当該反応混合物について得た、TIC、ならびに、129Daおよび147DaのニュートラルロススキャニングのTICを示している。147DaのニュートラルロススキャニングのTICにおいて、保持時間10.3分にて検出された最も強いピークは、m/z 689にてプロトン化イオンを示す、1種類の付加物を含むものであった。この付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、図2Bに示した。
【0057】
本方法において検出された、クロザピンの反応性代謝物の、ECOとの付加物の形成は、下記のスキームE2で概説する通りである。
【化8】

【0058】
実施例4:ECOによって分析した2−[2−チエニル]−フラン
【0059】
「ソフト」な反応性代謝物と「ハード」な反応性代謝物の両方を検出するべく、本方法およびECOの有用性を評価するための試験化合物として、2−[2−チエニル]−フランを選択した。
【0060】
図3Aは、当該反応混合物について得た、TIC、ならびに、129Daおよび147DaのニュートラルロススキャニングのTICを示している。3つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間10.2分、10.7分および11.0分にて検出された。10.2分における第一成分は、図3Bに示すように、フルスキャンスペクトルにおいて、m/z 513にてプロトン化イオンを示し、また、m/z 384にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。10.7分における第二成分は、図3Cに示すように、フルスキャンスペクトルにおいて、m/z 481にてプロトン化イオンを示し、また、m/z 352にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。11.0分における第三成分は、図3Dに示すように、フルスキャンスペクトルにおいて、m/z 495にてプロトン化イオンを示し、また、m/z 366にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0061】
本方法において検出された、2−[2−チエニル]−フランの反応性代謝物の、ECOとの3種類の付加物の形成は、下記のスキームE3で概説する通りである。
【化9】

【0062】
実施例5:アシルグルクロニドをトラップするための標準的な手順
【0063】
A.インキュベーション&化合物トラッピング:
【0064】
ここで記載するすべてのインキュベーションは、37℃にて、ウォーターバス中またはヒートブロック上で行った。ジクロフェナクアシルグルクロニドを、0.1mMのEDTAを含む100mMのリン酸カリウム緩衝液(pH7.4)中に添加した。得られた混合物を、37℃で5分間、予め温めておいた。次いで、この反応混合物に、式(I)の化合物を(反応を開始させるために)添加して、最終体積を500μlにした。
【0065】
得られた反応混合物は、100μMのジクロフェナクアシルグルクロニド、1mMの式(I)の化合物の混合物を含有していた。
【0066】
60分のインキュベーション後、氷上に置くことによりインキュベーションを停止させ、試料の20μlずつをLC/MS/MS分析に適用した。
【0067】
B.質量分析:
【0068】
MS分析は、LTQ Orbitrap FTMS(サーモフィッシャーサイエンティフィック社、ブレーメン、ドイツ)で行った。ESIイオン源は陽イオンモードで動作させた。全溶出液を、この質量分析計中へ、+5kVで噴霧し、この溶媒液滴の脱溶媒和を、350℃の加熱したキャピラリー温度によってさらに支援した。ニュートラルロススキャニングモードで収集される質量スペクトルは、m/z 200〜1100の範囲にわたり、分解能30000でスキャンすることによって得た。
【0069】
C.LC−MS/MS分析:
【0070】
反応性代謝物の完全プロファイリングのために、試料を、まず、オートサンプラーを備えたProminence LCシステム(島津製作所、京都、日本)を用いてクロマトグラフ分離に供し、溶出液を、ニュートラルロススキャニングモードで動作させたLTQ Orbitrap FTMSに導入した。クロマトグラフ分離には、L−カラムODS(2.1×150mm、化学物質評価研究機構、東京、日本)を用いた。このクロマトグラフシステムでは、溶媒A(5mMの酢酸アンモニウム)と溶媒B(5mMの酢酸アンモニウムを含む95%アセトニトリル)との勾配として送達される二成分溶媒系が用いられた。初期勾配条件は95%A:5%Bを4分間であり、その後は、次の13分にわたって100%Bまでの直線勾配であった。当該溶媒組成は、その後、初期条件での再平衡化の前に、100%Bで8分間保持した。精製した試料の20μlずつに対してLC−MS/MS分析を行った。データ取得は、Xcaliber version 2.0ソフトウェア(サーモフィッシャーサイエンティフィック社、ブレーメン、ドイツ)を用いて行った。
【0071】
実施例6:ECOによって分析したジクロフェナクアシルグルクロニド
【0072】
UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出するべく、本方法およびECOの有用性を評価するための試験化合物として、ジクロフェナクアシルグルクロニドを選択した。
【0073】
図4Aは、当該反応混合物について得た、TIC、ならびに、129Daおよび147DaのニュートラルロススキャニングのTICを示している。共通の強いピークが、129Daおよび147DaのニュートラルロススキャニングのTICにおいて、保持時間12.1分にて検出された。このピークは、図4Bに示すように、フルスキャンスペクトルにおいて、m/z 642にてプロトン化イオンを示し、また、m/z 495にてプロダクトイオンを示すが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0074】
本方法において検出された、ジクロフェナクアシルグルクロニドのECOとの付加物の形成は、下記のスキームE4で概説する通りである。
【化10】

【0075】
実施例7〜9:ソフトな反応性代謝物および/またはハードな反応性代謝物の検出
【0076】
上記実施例1に記載されている手順に従って、本発明の方法とECHKとを適用することにより、129Daのニュートラルロススキャニングを用いて、「ソフト」な反応性代謝物および/または「ハード」な反応性代謝物を生じることが知られている試験化合物の反応性代謝物を検出した。
実施例7:ECHKによって分析したジクロフェナク
【0077】
「ソフト」な反応性代謝物を検出するべく、本方法およびECHKの有用性を評価するための試験化合物として、ジクロフェナクを選択した。
【0078】
図5Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。129DaのニュートラルロススキャニングのTICにおいて、保持時間10.7分にて検出された最も強いピークは、m/z 668および702にてプロトン化イオンを示す、ジクロフェナクの反応性代謝物の、ECHKとの2種類の付加物を含むものであった。この2種類の付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、それぞれ、図5Bおよび5Cに示した。
【0079】
本方法において検出された、ジクロフェナクの反応性代謝物の、ECHKとの2種類の付加物の形成は、下記のスキームE5で概説する通りである。
【化11】

【0080】
実施例8:ECHKによって分析したクロザピン
【0081】
「ソフト」な反応性代謝物を検出するべく、本方法およびECHKの有用性を評価するための試験化合物として、クロザピンを選択した。
【0082】
図6Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。129DaのニュートラルロススキャニングのTICにおいて、保持時間11.1分にて検出された最も強いピークは、m/z 717にてプロトン化イオンを示す、1種類の付加物を含むものであった。この付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、図6Bに示した。
【0083】
本方法において検出された、クロザピンの反応性代謝物の、ECHKとの付加物の形成は、下記のスキームE6で概説する通りである。
【化12】

【0084】
実施例9:ECHKによって分析した2−[2−チエニル]−フラン
【0085】
「ソフト」な反応性代謝物と「ハード」な反応性代謝物の両方を検出するべく、本方法およびECHKの有用性を評価するための試験化合物として、2−[2−チエニル]−フランを選択した。
【0086】
図7Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。2つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間10.6分および11.9分にて検出された。10.6分における第一成分は、図7Bに示すように、フルスキャンスペクトルにおいて、m/z 541にてプロトン化イオンを示し、また、m/z 412にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。11.9分における第二成分は、2−[2−チエニル]−フランの反応性代謝物の、ECHKとの2種類の付加物を含むものであり、そして、図7Cおよび7Dに示すように、フルスキャンスペクトルにおいて、m/z 509および523にてプロトン化イオンを示し、また、m/z 380および394にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0087】
本方法において検出された、2−[2−チエニル]−フランの反応性代謝物の、ECHKとの3種類の付加物の形成は、下記のスキームE7で概説する通りである。
【化13】

【0088】
実施例10:ECHKによって分析したジクロフェナクアシルグルクロニド
【0089】
実施例5に記載されている手順に従って、本発明の方法とECHKとを適用することにより、UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出した。
【0090】
UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出するべく、本方法およびECHKの有用性を評価するための試験化合物として、ジクロフェナクアシルグルクロニドを選択した。
【0091】
図8Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。1つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間12.5分にて検出された。このピークは、図8Bに示すように、フルスキャンスペクトルにおいて、m/z 670にてプロトン化イオンを示し、また、m/z 541にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0092】
本方法において検出された、ジクロフェナクアシルグルクロニドのECHKとの付加物の形成は、下記のスキームE8で概説する通りである。
【化14】

【0093】
実施例11〜13:ソフトな反応性代謝物および/またはハードな反応性代謝物の検出
【0094】
上記実施例1に記載されている手順に従って、本発明の方法とEHCKとを適用することにより、129Daのニュートラルロススキャニングを用いて、「ソフト」な反応性代謝物および/または「ハード」な反応性代謝物を生じることが知られている試験化合物の反応性代謝物を検出した。
【0095】
実施例11:EHCKによって分析したジクロフェナク
【0096】
「ソフト」な反応性代謝物を検出するべく、本方法およびEHCKの有用性を評価するための試験化合物として、ジクロフェナクを選択した。
【0097】
図9Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。2つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間10.5分および10.8分にて検出された。10.5分および10.8分におけるこの2種類の成分は、m/z 668および702にてプロトン化イオンを示した。この2種類の付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、それぞれ、図9Bおよび9Cに示した。
【0098】
本方法において検出された、ジクロフェナクの反応性代謝物の、ECHKとの2種類の付加物の形成は、下記のスキームE9で概説する通りである。
【化15】

【0099】
実施例12:EHCKによって分析したクロザピン
【0100】
「ソフト」な反応性代謝物を検出するべく、本方法およびEHCKの有用性を評価するための試験化合物として、クロザピンを選択した。
【0101】
図10Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。129DaのニュートラルロススキャニングのTICにおいて、保持時間11.2分にて検出された最も強いピークは、m/z 717にてプロトン化イオンを示す、1種類の付加物を含むものであった。この付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、図10Bに示した。
【0102】
本方法において検出された、クロザピンの反応性代謝物の、EHCKとの付加物の形成は、下記のスキームE10で概説する通りである。
【化16】

【0103】
実施例13:EHCKによって分析した2−[2−チエニル]−フラン
【0104】
「ソフト」な反応性代謝物と「ハード」な反応性代謝物の両方を検出するべく、本方法およびEHCKの有用性を評価するための試験化合物として、2−[2−チエニル]−フランを選択した。
【0105】
図11Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。129DaのニュートラルロススキャニングのTICにおいて、保持時間12.0分にて検出されたピークは、m/z 509、541および523にてプロトン化イオンを示す、2−[2−チエニル]−フランの反応性代謝物の、EHCKとの3種類の付加物を含むものであった。この3種類の付加物のフルスキャンスペクトルおよびプロダクトイオンスペクトルを、それぞれ、図11B、11Cおよび11Dに示した。
【0106】
本方法において検出された、2−[2−チエニル]−フランの反応性代謝物の、EHCKとの3種類の付加物の形成は、下記のスキームE11で概説する通りである。
【化17】

【0107】
実施例14:EHCKによって分析したジクロフェナクアシルグルクロニド
【0108】
実施例5に記載されている手順に従って、本発明の方法とEHCKとを適用することにより、UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出した。
【0109】
UDP−グルクロノシルトランスフェラーゼによって生じた反応性代謝物を検出するべく、本方法およびEHCKの有用性を評価するための試験化合物として、ジクロフェナクアシルグルクロニドを選択した。
【0110】
図12Aは、当該反応混合物について得た、TICおよび129DaのニュートラルロススキャニングのTICを示している。1つの強いピークが、129DaのニュートラルロススキャニングのTICにおいて、保持時間12.8分にて検出された。このピークは、図12Bに示すように、フルスキャンスペクトルにおいて、m/z 670にてプロトン化イオンを示し、また、m/z 541にてプロダクトイオンを示したが、これは、プロダクトイオンスペクトルにおいてピログルタミン酸部分の喪失を指し示すものであった。
【0111】
本方法において検出された、ジクロフェナクアシルグルクロニドのEHCKとの付加物の形成は、下記のスキームE12で概説する通りである。
【化18】

【特許請求の範囲】
【請求項1】
式(I)の化合物:
【化1】

[式中、
XはCH2であり、かつ
p、qおよびrはそれぞれ独立して0または1であるが、
但し、pが0であり、qが0であり、かつ、rが1である化合物は除外されるものとする]。
【請求項2】
式(II)の化合物:
【化2】

である、請求項1に記載の化合物。
【請求項3】
式(III)の化合物:
【化3】

である、請求項1に記載の化合物。
【請求項4】
式(IV)の化合物:
【化4】

である、請求項1に記載の化合物。
【請求項5】
試験化合物の反応性代謝物を検出するための方法であって、
(a)試験化合物を、式(I)の化合物:
【化5】

[式中、
XはCH2であり、かつ
p、qおよびrはそれぞれ独立して0または1であるが、
但し、pが0であり、qが0であり、かつ、rが1である化合物は除外されるものとする]、
および薬物代謝酵素とともにインキュベートし、1種類以上の付加物を含む生成物混合物を得ること;ならびに
(b)工程(a)の付加物を検出すること、
を含む方法。
【請求項6】
式(I)の化合物が、式(II)の化合物:
【化6】

、式(III)の化合物:
【化7】

または、式(IV)の化合物:
【化8】

である、請求項5に記載の方法。
【請求項7】
前記薬物代謝酵素が、ヒト、ラット、マウス、ハムスター、イヌ、サルまたはウサギ肝ミクロソームである、請求項5または6に記載の方法。
【請求項8】
前記薬物代謝酵素が、NADPH補因子と組み合わせたシトクロムP450酵素、または、NADPH再生系と組み合わせたシトクロムP450酵素である、請求項5または6に記載の方法。
【請求項9】
前記薬物代謝酵素が、ウリジン二リン酸グルクロン酸(UDPGA)補因子と組み合わせたUDP−グルクロノシルトランスフェラーゼである、請求項5または6に記載の方法。
【請求項10】
前記付加物が、ニュートラルロス質量スペクトルにおいて検出される、請求項5〜9のいずれか一項に記載の方法。
【請求項11】
前記ニュートラルロス質量スペクトルが、ESI−MS/MSまたはLS/MSを用いて測定される、請求項10に記載の方法。
【請求項1】
式(I)の化合物:
【化1】

[式中、
XはCH2であり、かつ
p、qおよびrはそれぞれ独立して0または1であるが、
但し、pが0であり、qが0であり、かつ、rが1である化合物は除外されるものとする]。
【請求項2】
式(II)の化合物:
【化2】

である、請求項1に記載の化合物。
【請求項3】
式(III)の化合物:
【化3】

である、請求項1に記載の化合物。
【請求項4】
式(IV)の化合物:
【化4】

である、請求項1に記載の化合物。
【請求項5】
試験化合物の反応性代謝物を検出するための方法であって、
(a)試験化合物を、式(I)の化合物:
【化5】

[式中、
XはCH2であり、かつ
p、qおよびrはそれぞれ独立して0または1であるが、
但し、pが0であり、qが0であり、かつ、rが1である化合物は除外されるものとする]、
および薬物代謝酵素とともにインキュベートし、1種類以上の付加物を含む生成物混合物を得ること;ならびに
(b)工程(a)の付加物を検出すること、
を含む方法。
【請求項6】
式(I)の化合物が、式(II)の化合物:
【化6】

、式(III)の化合物:
【化7】

または、式(IV)の化合物:
【化8】

である、請求項5に記載の方法。
【請求項7】
前記薬物代謝酵素が、ヒト、ラット、マウス、ハムスター、イヌ、サルまたはウサギ肝ミクロソームである、請求項5または6に記載の方法。
【請求項8】
前記薬物代謝酵素が、NADPH補因子と組み合わせたシトクロムP450酵素、または、NADPH再生系と組み合わせたシトクロムP450酵素である、請求項5または6に記載の方法。
【請求項9】
前記薬物代謝酵素が、ウリジン二リン酸グルクロン酸(UDPGA)補因子と組み合わせたUDP−グルクロノシルトランスフェラーゼである、請求項5または6に記載の方法。
【請求項10】
前記付加物が、ニュートラルロス質量スペクトルにおいて検出される、請求項5〜9のいずれか一項に記載の方法。
【請求項11】
前記ニュートラルロス質量スペクトルが、ESI−MS/MSまたはLS/MSを用いて測定される、請求項10に記載の方法。
【図1A】


【図1B】


【図1C】


【図2A】


【図2B】


【図3A】


【図3B】


【図3C】


【図3D】


【図4A】


【図4B】


【図5A】


【図5B】


【図5C】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図7D】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図10A】


【図10B】


【図11A】


【図11B】


【図11C】


【図11D】


【図12A】


【図12B】




【図1B】


【図1C】


【図2A】


【図2B】


【図3A】


【図3B】


【図3C】


【図3D】


【図4A】


【図4B】


【図5A】


【図5B】


【図5C】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図7D】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図10A】


【図10B】


【図11A】


【図11B】


【図11C】


【図11D】


【図12A】


【図12B】


【公表番号】特表2012−524709(P2012−524709A)
【公表日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2011−540251(P2011−540251)
【出願日】平成22年4月16日(2010.4.16)
【国際出願番号】PCT/JP2010/057192
【国際公開番号】WO2010/123085
【国際公開日】平成22年10月28日(2010.10.28)
【出願人】(506137147)エーザイ・アール・アンド・ディー・マネジメント株式会社 (215)
【Fターム(参考)】
【公表日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成22年4月16日(2010.4.16)
【国際出願番号】PCT/JP2010/057192
【国際公開番号】WO2010/123085
【国際公開日】平成22年10月28日(2010.10.28)
【出願人】(506137147)エーザイ・アール・アンド・ディー・マネジメント株式会社 (215)
【Fターム(参考)】
[ Back to top ]

