収率及び免疫原性を高めた組換えタンパク質発現系
宿主細胞における対象の組換えタンパク質の発現系であって、本質的に配列番号1のタンパク質形質導入ドメインをコードする核酸配列と、Hsp40Jドメインをコードする核酸配列と、対象のタンパク質をコードする核酸配列とから成る核酸断片を含む、発現系が提供される。核酸断片は、宿主細胞における対象の組換えタンパク質の発現に有用な宿主特異的な転写制御要素と翻訳制御要素とに操作可能に連結することができる。宿主細胞において収率を高めて対象の組換えタンパク質を製造する方法も提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、収率及び免疫原性を高めた組換えタンパク質の発現系に関する。
【背景技術】
【0002】
より多くの製品(例えば組換えタンパク質)のヒトでの使用が認可されているか、又は認可されようとしているために、治療上使用される生物製剤の効率的な製造に対する要求が着実に増している。昔から、そして今現在でも、細菌発酵プロセスがこれらの種類の分子を製造する主なツールである。プロセス最適化の主な目的は、出来る限り最も低いコストで要求される品質の製品を高収率で得ることであるが、これは多くの場合、特定の発現構築物又は発現系の特性に左右される。
【0003】
Jドメインの構造的特徴によって、Hsp40タンパク質と、それらのパートナーHsp70との間の相互作用の特異性が決定されることが報告されている(Hennessy et al., Protein Science (2005), 14:1697-1709;非特許文献1)。Jドメインは、主要な結合部位であり、またHsp40及びHsp40様タンパク質と、それらのパートナーHsp70との間の相互作用に必要な最小領域であると考えられている(Walsh et al., EMBO report (2004), 6:567-571;非特許文献2)。DNAワクチン系によるSV40ラージT抗原のJドメインと融合したペプチドによって、そのペプチドの抗原性を高めることができることが報告されている(Reimann and Schirmbeck, Immuno Rev. (2004), 199:54-67;非特許文献3)。Jドメインが、DnaKとDnaJ結合基質とを繋留し、それからDnaKがそのC末端ペプチド結合ドメインと結合することも知られている(Tilstra et al., Biochemical Society Transactions. (2007), 35:811-815;非特許文献4)。
【0004】
他方で、タンパク質形質導入ドメイン(PTD)は、従来のエンドサイトーシスと独立してはるかに大きい分子を細胞に運ぶことができる小ペプチドである。この特性によって、PTDは、研究目的でタンパク質及び他の分子を生細胞に運ぶのに理想的なツールとなる(Beerens et al, Current Gene Therapy (2003), 3(5):486-494;非特許文献5)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Hennessy et al., Protein Science (2005), 14:1697-1709
【非特許文献2】Walsh et al., EMBO report (2004), 6:567-571
【非特許文献3】Reimann and Schirmbeck, Immuno Rev. (2004), 199:54-67
【非特許文献4】Tilstra et al., Biochemical Society Transactions. (2007), 35:811-815
【非特許文献5】Beerens et al, Current Gene Therapy (2003), 3(5):486-494
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、組換えタンパク質の収率及び免疫原性を改善する発現系の開発において、PTDもHsp40Jドメインも示唆されていない。
【課題を解決するための手段】
【0007】
本発明によれば、宿主細胞における組換え標的タンパク質の発現系であって、本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含み、核酸セグメントが宿主細胞において、組換え標的タンパク質を発現するために、宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結する、発現系が提供される。
【0008】
さらに本発明によれば、上記の発現系を用いて、組換え標的タンパク質を発現する方法が提供される。本発明の方法は、
本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含む発現ベクターを構築すること(前記核酸セグメントが宿主細胞特異的な転写調節要素と翻訳調節要素とに操作可能に連結されている)、
前記発現ベクターで前記宿主細胞を形質転換すること、並びに
組換え標的タンパク質を宿主細胞から回収及び単離することを含む。
【0009】
したがって、本発明はまた、上述の発現系を用いることによって製造される組換えタンパク質を提供する。それによって、結果として、組換えタンパク質の免疫原性が高まる。
【0010】
本発明はまた、上記の組換えタンパク質を含むワクチンを提供し得る。
【0011】
本発明はまた、キメラタンパク質であって、
a.キメラタンパク質のN末端に、タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片を含有する第1のポリペプチジル断片と、
b.第1のポリペプチジル断片のC末端に、Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片を含有する第2のポリペプチジル断片と、
c.第2のポリペプチジル断片のC末端に、標的タンパク質又はポリペプチドを含有する第3のポリペプチジル断片とを含む、キメラタンパク質を提供する。
【0012】
本発明はまた、キメラ遺伝子であって、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、第1のDNA配列と翻訳フレームで連結した第2のDNA配列と、
c.標的タンパク質又はポリペプチドをコードする、第2のDNA配列と翻訳フレームで連結した第3のDNA配列とを含む、キメラ遺伝子を提供する。
【0013】
本発明は、さらに別のキメラ遺伝子であって、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、第1のDNA配列と翻訳フレームで連結した第2のDNA配列とを含む、さらに別のキメラ遺伝子を提供する。
【0014】
本発明のさらなる目的及び利点は一部、続く記載で示され、その記載から一部明らかになるか、又は本発明の実施によって理解され得る。本発明の目的及び利点は、添付の特許請求の範囲で特に指摘した要素及び組合せによって実現及び達成される。
【0015】
上述の概要と以下の詳細な説明との両方は例示的で且つ説明のためのものであるにすぎず、本発明を特許請求されるように制限するものではないことが理解される。
【0016】
本発明を説明する目的で、図面において本発明の好ましい実施形態を示す。しかしながら、本発明は、図示される実施形態に限定されないことを理解されたい。
【図面の簡単な説明】
【0017】
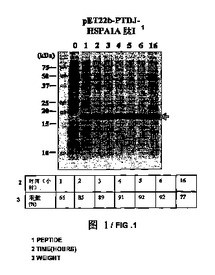
【図1】IPTGの存在下で増殖させた、pET22b−PTD−J−HSPA1AペプチドI構築物を含有する大腸菌ロゼッタ株(Rosetta)の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HSPA1AペプチドI、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、及び第9のレーン(16)、16時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI。
【図2】IPTGの存在下で増殖させた、pET22b−PTD−J−HSPA1AペプチドII構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HSPA1AペプチドII、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、及び第9のレーン(16)、16時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII。
【図3】IPTGの存在下で増殖させた、pET22b−PTD−J−HSPA1AペプチドIII構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HSPA1AペプチドIII、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、及び第9のレーン(16)、16時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII。
【図4】IPTGの存在下で増殖させた、pET22b−PTD−J−ニワトリIGF−I構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−ニワトリIGF−I、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、及び第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I。
【図5】IPTGの存在下で増殖させた、pET22b−PTD−J−HA RBD構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量25kDa及び37kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HA RBD、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HA RBD、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HA RBD、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HA RBD、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HA RBD、第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HA RBD、第9のレーン(7)、7時間後の誘導されたpET22b−PTD−J−HA RBD、及び第10のレーン(O/N)、16時間後の誘導されたpET22b−PTD−J−HA RBD。
【図6】IPTGの存在下で増殖させた、pET22b−PTD−J−HCVコア構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量25kDa及び37kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HCVコア、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HCVコア、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HCVコア、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HCVコア、第6のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HCVコア、第7のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HCVコア、及び第8のレーン(16)、16時間後の誘導されたpET22b−PTD−J−HCVコア。
【図7】IPTGの存在下で増殖させた、pET22b−PTD−J−HpNC構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HpNC、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HpNC、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HpNC、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HpNC、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HpNC、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HpNC、及び第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HpNC。
【図8】血清中、異なる濃度の組換えタンパク質、PTD−J1−好中球ペプチド−1(NP−1)、PTD−J1−コア及びPTD−J1を検出するためのドットブロット図である。
【発明を実施するための形態】
【0018】
概して本発明は、収率及び免疫原性を高めた、宿主細胞に導入して、組換え標的タンパク質を安定して且つ効率的に製造する発現系に関する。
【0019】
本明細書中で使用する場合、「組換えタンパク質」という用語は、組換え分子、及び通常組換え方法、化学的方法又は他の好適な方法によって、タンパク質形質導入ドメイン及びJドメインと共有結合(即ち融合)したタンパク質又はペプチド配列を意味する。必要に応じて、組換え分子は、ペプチドリンカー配列を介して1つ又は幾つかの部位で融合することができる。このペプチド配列は、宿主細胞誘発プロテアーゼによる切断のための部位を1つ又は複数含み得る。
【0020】
「ポリペプチド」は、好ましくはその大きさにかかわらず、本質的に20個の天然アミノ酸のいずれかから成る任意のポリマーを指す。「タンパク質」という用語は、比較的大きいタンパク質に対して用いられることが多いが、「ペプチド」は小ポリペプチドに対して用いられることが多く、この分野ではこれらの用語は重複して用いられることが多い。特に言及されない限り、「ポリペプチド」という用語は一般的にタンパク質、ポリペプチド及びペプチドを指す。
【0021】
本発明によれば、「免疫原性」という用語は、組換えタンパク質、例えば組換え抗原性タンパク質が免疫反応を引き起こす能力を指す。
【0022】
本発明によれば、宿主細胞における組換え標的タンパク質の発現系であって、本質的に配列番号1のタンパク質形質導入ドメイン(PTD)をコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含み、核酸セグメントが宿主細胞において、異種タンパク質を発現するために、宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結する、発現系が提供される。例として、PTDをコードするヌクレオチド配列は、配列番号2のヌクレオチド配列を含む。また、配列番号2のヌクレオチド配列は、配列番号5及び配列番号6のオリゴヌクレオチドを使用することによって合成され得る。配列番号5及び配列番号6のオリゴヌクレオチドは、その5’末端でリン酸化し得る。それからまた、オリゴヌクレオチドは、ベクターに挿入されると、ホスファターゼによって脱リン酸化され得る。別の例によれば、HSP40Jドメインは、亜型A、亜型B及び亜型CのHSP40Jドメインから成る群から選択され得る。例えば、亜型A、亜型B及び亜型CのHSP40Jドメインは、ヒトゲノムにおける41個のDnaJ/HSP40タンパク質中に含有されるJドメイン又はJ様ドメインであり得る(Qiu et al., Cell. Mol. Life Sci. 63: 2560-2570 (2006))。本発明の一具体例によれば、HSP40Jドメインは、配列番号4のヌクレオチド配列によってコードされた配列番号3のペプチドを含む。また、配列番号4のヌクレオチド配列は、配列番号7〜配列番号16のオリゴヌクレオチドを使用することによって合成され得る。また、標的タンパク質は、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、及びウイルスコアタンパク質を含み得るが、これらに限定されない。本発明の一例において、組換えタンパク質は、免疫付与された宿主において免疫原性を示す抗原性ポリペプチドである。別の例では、本発明は上記の発現系によって製造される組換えタンパク質を含むワクチンも提供する。
【0023】
本発明は、核酸配列、特に本発明の組換えタンパク質をコードするDNA配列を提供し得る。別の例では、DNA配列は、ファージ、ウイルス、プラスミド、ファージミド、コスミド、YAC又はエピソームのような染色体外の複製に適したベクターによって運ばれ得る。特に、所望の組換えタンパク質をコードするDNAベクターを使用して、本明細書中に記載の調製方法を容易にすると共に、有意量の組換えタンパク質を得ることができる。DNA配列は、適切なベクター、即ち挿入されるタンパク質コード配列の転写及び翻訳に必要な要素を含有するベクターに挿入することができる。タンパク質コード配列を発現するのに、種々の宿主ベクター系を利用してもよい。これらとしては、ウイルスを感染させた哺乳動物細胞系、ウイルスを感染させた昆虫細胞系、酵母ベクターを含有する酵母、又はバクテリオファージDNA、プラスミドDNA若しくはコスミドDNAで形質転換した細菌等の微生物が挙げられる。利用される宿主ベクター系に応じて、多くの好適な転写要素及び翻訳要素の1つが使用され得る。例えばベクターは、細菌T7プロモータ等のプロモータと、転写を調節する、lacオペレータ等の誘導性オペレータとを含有し得る。
【0024】
他のベクター及び構築物としては、染色体DNA配列、非染色体DNA配列及び合成DNA配列、例えばSV40の誘導体、細菌プラスミド、ファージDNA、バキュロウイルス、酵母プラスミド、酵母人工染色体(YAC)、プラスミドとファージDNAとの組合せに由来するベクター、プラスミドとウイルスDNAとの組合せに由来するシャトルベクター、ワクシニア、アデノウイルス、鶏痘ウイルス及び仮性狂犬病ウイルス等のウイルスDNAが挙げられる。しかしながら、任意の他のベクターは、対象の宿主細胞で複製可能で且つ生存可能であれば、核酸発現構築物の調製に使用してもよい。核酸配列は、単離及び任意の所望のベクターへのクローニングのために、多くの制限エンドヌクレアーゼ部位の横に位置し得る。組換えタンパク質のその後の精製を容易にするのに添加される、EE、6XHis、HA又はMYC等のタンパク質同定タグ又は精製タグも存在する。さらに、核酸発現構築物は、転写ターミネータも含有し得る。例えば、ベクターは、核酸配列の転写を終わらせるT7ターミネータを含有し得る。
【0025】
本発明の一具体例によれば、組換えタンパク質は、配列番号2のヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とを含む発現ベクターを使用することによって製造され得る。別の例では、発現ベクターは、配列番号2のヌクレオチド配列と、配列番号4のヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列と、発現ベクターにおいてヌクレオチド配列と操作可能に連結する、宿主特異的な転写調節要素及び翻訳調節要素とを含み得る。
【0026】
本発明の組換え分子を運ぶベクターは、標的細胞又はかかる細胞群に効果的に形質導入され得る。必要に応じて、様々な戦略の1つ又は組合せによって、形質導入の効率をモニタリング及び定量化してもよい。
【0027】
例えば、1つのアプローチは、細胞による組換えタンパク質の取り込みを測定するin vitroアッセイを伴う。アッセイには、例えば、放射性原子、蛍光タグ、リン光タグ又は発光タグ(例えばフルオレセイン、ローダミン、Cy3)による組換えタンパク質の検出可能な標識化と、その後の標識組換えタンパク質の取り込みの測定とが含まれる。代替的に、組換えタンパク質は、ホースラディッシュペルオキシダーゼ、β−ガラクトシダーゼ、クロラムフェニコールアセチルトランスフェラーゼ又はルシフェラーゼのような、検出可能なラベルを形成可能な酵素によって標識することができる。蛍光顕微鏡検査法又はオートラジオグラフィによる標準的な細胞分別器(例えばFACS)での標識細胞の定量化のような幾つかの従来方法によって、取り込みを測定することができる。
【0028】
概して上記で言及したように、宿主細胞は、所望の組換えタンパク質をコードする核酸を増殖するために調製目的で使用してもよい。このため、宿主細胞は、哺乳動物細胞のようなより高等な真核細胞であっても、若しくは酵母細胞のようなより低級の(lower)真核細胞であってもよく、又は宿主細胞は、細菌細胞のような原核細胞であってもよい。本発明による適切な宿主細胞の代表例としては、大腸菌、ストレプトミセス(Streptomyces)、ネズミチフス菌(Salmonella typhimurium)のような細菌細胞;酵母のような真菌細胞;ショウジョウバエS2及びスポドプテラ(Spodoptera)Sf9のような昆虫細胞;MDCK、Hep−2、CHO又はCOSのような動物細胞;ジャーカット細胞又は293細胞のようなヒト細胞;アデノウイルス;植物細胞、又は既にin vitro増殖に適応した、若しくはこのようにして新たに樹立した任意の他の細胞が挙げられるが、必ずしもこれらに限定されない。適切な宿主細胞の選択は、本明細書中の教示から当業者の範囲内であると見なされる。
【0029】
さらに、所望の組換えタンパク質をコードする核酸は、細胞をトランスフェクトするのに標準的な技法によって、宿主細胞に導入することができる。「トランスフェクト(transfecting)」又は「トランスフェクション(transfection)」は、核酸を宿主細胞に導入するための全ての従来技法を包含するように意図され、リン酸カルシウム共沈、DEAEデキストラン媒介トランスフェクション、リポフェクション、電気穿孔(electroporation)、顕微注入(microinjection)、ウイルス形質導入及び/又は融合(integration)が挙げられる。
【0030】
本発明は、対象の組換えタンパク質を単離する製造プロセスをさらに提供し得る。このプロセスでは、宿主細胞(例えば、酵母細胞、真菌細胞、昆虫細胞、細菌細胞又は動物細胞)(これに、調節配列と操作可能に連結した(liked)、対象のタンパク質をコードする核酸が導入されている)は、対象の組換えタンパク質をコードするヌクレオチド配列の転写を刺激するために、組換えタンパク質の存在下の培養培地中において生産規模で増殖し得る。その後、対象の組換えタンパク質は、採取された宿主細胞又は培養培地から単離され得る。培地又は採取された細胞から対象のタンパク質を単離するのに、標準的なタンパク質精製技法を使用してもよい。特に、精製技法を用いて、ローラーボトル、スピナーフラスコ、組織培養プレート、バイオリアクタ又は発酵槽を含む種々の装置(implementations)から大規模で(即ち少なくともミリグラム量で)所望の融合タンパク質を発現及び精製することができる。
【0031】
本発明の組換えタンパク質は、適切な組合せの既知の技法によって分離及び精製し得る。例えばこれらの方法としては、塩析及び溶媒析出のような溶解度を利用する方法、透析、限外濾過、ゲル濾過、及びSDS−ポリアクリルアミドゲル電気泳動のような分子量の違いを利用する方法、イオン交換カラムクロマトグラフィのような電荷の違いを利用する方法、親和性クロマトグラフィのような特異親和性を利用する方法、逆相高速液体クロマトグラフィのような疎水性の違いを利用する方法、並びに等電点電気泳動のような等電点の違いを利用する方法、Ni−NTAのような金属親和性カラムが挙げられる。
【0032】
したがって、別の例によれば、本発明は、宿主細胞において収率及び免疫原性を高めて組換え標的タンパク質を製造する方法を提供し得る。本方法は、
本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含む発現ベクターを構築すること(核酸セグメントが宿主細胞特異的な転写調節要素と翻訳調節要素とに操作可能に連結される)、
前記発現ベクターで前記宿主細胞を形質転換すること、並びに
組換え標的タンパク質を宿主細胞から回収及び単離することを含む。
【0033】
別の一例によれば、本方法は、生物を組換えタンパク質により免疫付与する工程をさらに含む。組換えタンパク質の抗原性は、試験膜上でブロットした組換えタンパク質のエピトープ(単数又は複数)と結合する標識抗体を使用して求められ得る。また、組換えタンパク質の免疫原性は、in vitroで抗原提示アッセイにおいて、並びにin vivoで抗体応答及び抗原性ポリペプチドによる皮下攻撃(challenge)に対する防御の誘導において他のポリペプチドと比較することができる。
【0034】
また本発明は、
a.キメラタンパク質のN末端に、タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片を含有する第1のポリペプチジル断片と、
b.第1のポリペプチジル断片のC末端に、Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片を含有する第2のポリペプチジル断片と、
c.第2のポリペプチジル断片のC末端に、標的タンパク質又はポリペプチドを含有する第3のポリペプチジル断片とを含む、キメラタンパク質を提供する。
【0035】
また本発明は、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、第1のDNA配列と翻訳フレームで連結した第2のDNA配列と、
c.標的タンパク質又はポリペプチドをコードする、第2のDNA配列と翻訳フレームで連結した第3のDNA配列とを含む、キメラ遺伝子を提供する。
【0036】
本発明は、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、第1のDNA配列と翻訳フレームで連結した第2のDNA配列とを含む、さらに別のキメラ遺伝子を提供する。
【0037】
本発明によれば、タンパク質形質導入ドメイン(PTD)をコードする第1のDNA配列は、配列番号1に記載のアミノ酸配列を含み、Jドメインをコードする第2のDNA配列は、配列番号3に記載のアミノ酸配列を含む。好ましくは、Jドメインはヒト熱ショックタンパク質40由来である。
【0038】
抗原性ポリペプチドは、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、ウイルスコアタンパク質又はそれらの組合せを含み得るが、必ずしもこれらに限定されない。例えば、宿主に対して免疫反応を誘起可能な他のタンパク質又はポリペプチドも、本発明に包含され得る。
【0039】
これより、本発明は、以下の具体的であるが、非限定的な実施例を参照してさらに詳細に説明される。
【実施例】
【0040】
実施例1:pET22b−PTD1−J1−Ag発現ベクターの構築
pET22bプラスミド(Novagen, Madison, Wis.)を用いて、配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、配列番号3のHsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とを含むpET22b−PTD−J1ベクターを作製した。ここで、核酸セグメントは、宿主細胞において組換え標的タンパク質を発現するために、宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結している。大腸菌に対するPTDの最適化コドンをコードするオリゴヌクレオチドは、以下の表Iに列挙される配列番号5及び配列番号6のプライマーを使用して化学合成した。NdeIとBamHIとで同時に消化したpET22bプラスミドに挿入するために、二本鎖形態にアニーリングする前、これらの2つのオリゴヌクレオチドの5’末端をポリヌクレオチドキナーゼでリン酸化し、ウシ腸アルカリホスファターゼ(CIAP)で脱リン酸化して、pET22b−PTD1を作製した。
【0041】
【表1】

【0042】
HSP40遺伝子のJドメインは、表IIに示される配列番号7〜配列番号16のオリゴヌクレオチドを使用したアセンブリPCRによって合成した。これらのオリゴヌクレオチドを、大腸菌に対する最適化コドンを増幅するために設計した。単一コロニーの選択及びDNAシークエンシングのために、PCR産物をpGEM−T Easyベクター(Promega)にクローン化した。正確なJドメインコードDNA配列を有するプラスミドをBamHIとEcoRIとで同時に消化し、pGEM−T Easyベクターから0.2kbの挿入DNA断片を取り除いた。それから、このDNA断片を、BamHI/EcoRIとCIAPとで処理したpET22b−PTD1ベクターに挿入し、pET22b−PTD1−J1発現ベクターを作製した。
【0043】
【表2】

【0044】
pET22b−PTD1−J1ベクターによって発現される、1つ又は複数の組換えポリペプチド又は抗原性(Ag)ポリペプチドは通常、大腸菌の最適化コドンを有するDNAに形質転換した。1つ又は複数の組換えポリペプチドコード領域もPCRで増幅した。以下の実施例におけるこれらのポリペプチドコードDNAは、都合よくpET22b−PTD1−J1ベクターに挿入されるように、EcoRI及びXhoI部位の横に位置していた。結果として、pET22b−PTD1−J1−Ag発現ベクターが構築された。
【0045】
アセンブリPCR
オリゴヌクレオチドセットを用いて、コドンが最適化されたcDNAを合成した。0.5μMのF1及びR1と、0.05μMのF2、F3、R3、R2等を、PCR反応混合液中で調整した。反応条件は、94℃で2分、その後94℃で20秒/40℃で40秒/72℃で20秒を20サイクル、及び72℃で5分の伸長であった。プラスミドDNA単離及びDNAシークエンシングのために、PCR産物をpGEM−T Easyにクローン化した。
【0046】
実施例2:PTD−J−Ag組換えタンパク質の発現
pET22b−PTD−J−Agベクターを大腸菌ロゼッタ株(Novagen)のコンピテントセルに形質転換した。1mMのIPTGを導入する前にOD600=0.3になるまで、アンピシリンとクロラムフェニコールとに耐性がある大腸菌コロニーをTYD培地(1L当たり10g トリプトン/20g 酵母エキス/5g NaCl/2g デキストロース、pH7.2)中で、培養及び増幅させた。細胞試料を列挙する時間割で回収した。
【0047】
0.3OD600単位での大腸菌の総タンパク試料を、30μLの2×SDS−PAGEローディングバッファー中に溶解した。5分間、水浴を沸騰させることによって処理した後、これらのタンパク質試料を、12.5%又は15%のSDS−PAGEで分離した。SDS−PAGEゲル上でクマシーブリリアントブルーR250染色を実施することによって、タンパク質のバンドを可視化した。
【0048】
実施例3:免疫付与
マウスを、TiterMAX Goldアジュバントで乳化したポリペプチド50μgにより皮下で免疫付与した。2週間ごとに追加免疫(Boosts)を実施した。マウスの血清を回収し、ポリペプチドに対する抗体を産生させた。
【0049】
ドットブロット法
段階希釈した組換えタンパク質又は合成ポリペプチドをPVDF膜上にスポットした(spotted)。5%脱脂乳のTBSN(25mMのトリスHCl、pH7.4/150mMのNaCl/0.02% Tween20)で1時間、膜をブロッキングした。TBSNで4回洗浄した後、一晩インキュベートするために1000倍に希釈したマウス抗血清中に膜を浸した。TBSNで4回洗浄することによって、結合されていない一次抗体(Ab)を取り除いた後、HRP結合ヤギ抗マウス二次Ab(2000倍希釈)を4時間適用した。製造業者の取扱説明書に記載されるように、化学発光キット(Pierce)によって、洗浄膜上でタンパク質の標識を実施した。
【0050】
実施例4:ヒトHSPA1AペプチドIの発現
アセンブリPCRで使用するオリゴヌクレオチドを表IIIに列挙した。これらのオリゴヌクレオチドを用いて、配列番号18(SSSTQASLEI DSLFEGIDFY TSITRARFEE LCSDLFRSTL EPVEKALRDA KLDKAQI)のHAPA1AペプチドIをコードする配列番号17のコドンが最適化されたcDNAを合成した。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターpET22b−PTD−Jに挿入した。
【0051】
【表3】

【0052】
実施例2に記載のように、組換えPTD−J−HSPA1AペプチドIをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HSPA1AペプチドI発現を定量化し、総タンパク質に対する組換えPTD−J−HSPA1AペプチドIの重量パーセントで表した。図1を参照すると、組換えPTD−J−HSPA1AペプチドIの重量パーセントは、最初の6時間で65%〜92%の範囲である。また、16時間後の組換えPTD−J−HSPA1AペプチドIの重量パーセントは77%であった。
【0053】
実施例5:ヒトHSPA1AペプチドIIの発現
アセンブリPCRで使用するオリゴヌクレオチドを表IVに列挙した。これらのオリゴヌクレオチドを用いて、配列番号26(NVTATDKSTG KANKITITND KGRLSKEEIE RMVQEAEKYK AEDEVQRERV SAKNALESYA F)のHAPA1AペプチドIIをコードする配列番号25のコドンが最適化されたcDNAを合成した。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0054】
【表4】

【0055】
実施例2に記載のように、組換えPTD−J−HSPA1AペプチドIIをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HSPA1AペプチドII発現を定量化し、総タンパク質に対する組換えPTD−J−HSPA1AペプチドIIの重量パーセントで表した。図2を参照すると、組換えPTD−J−HSPA1AペプチドIIの重量パーセントは、最初の6時間で27%〜54%の範囲である。また、16時間後の組換えPTD−J−HSPA1AペプチドIIの重量パーセントは10%であった。
【0056】
実施例6:ヒトHSPA1AペプチドIIIの発現
アセンブリPCRで使用するオリゴヌクレオチドを表Vに列挙した。これらのオリゴヌクレオチドを用いて、配列番号35(EDEGLKGKIS EADKKKVLDK CQEVISWLDA NTLAEKDEFE HKRKELEQVC NPIISGLYQG A)のHSPA1AペプチドIIIをコードする配列番号34のコドンが最適化されたcDNAを合成した。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0057】
【表5】

【0058】
実施例2に記載のように、組換えPTD−J−HSPA1AペプチドIIIをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HSPA1AペプチドIII発現を定量化し、総タンパク質に対する組換えPTD−J−HSPA1AペプチドIIIの重量パーセントで表した。図3を参照すると、組換えPTD−J−HSPA1AペプチドIIIの重量パーセントは、最初の5時間で10%〜33%の範囲である。
【0059】
実施例7:ニワトリIGF−Iの発現
アセンブリPCRで使用するオリゴヌクレオチドを表VIに列挙した。これらのオリゴヌクレオチドを用いて、配列番号44(GPETLCGAEL VDALQFVCGD RGFYFSKPTG YGSSSAALHH KGIVDECCFQ SCDLRRLEMY CAPIKPPKSA)のニワトリIGF−Iをコードする配列番号43のコドンが最適化されたcDNAを合成した。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0060】
【表6】

【0061】
実施例2に記載のように、組換えPTD−J−ニワトリIGF−Iをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−ニワトリIGF−I発現を定量化し、総タンパク質に対する組換えPTD−J−ニワトリIGF−Iの重量パーセントで表した。図4を参照すると、組換えPTD−J−ニワトリIGF−Iの重量パーセントは、最初の6時間で74%〜90%の範囲である。
【0062】
実施例8:トリインフルエンザウイルスHA(H5)受容体結合ドメイン(RBD)の発現
PCRに使用するプライマー対を表VIIに列挙した。これらのプライマーを用いて、配列番号53のHA−RBDをコードする配列番号52の天然ウイルスcDNAを合成した。cDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0063】
【表7】

【0064】
実施例2に記載のように、組換えPTD−J−HA RBDをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HA RBD発現を定量化し、総タンパク質に対する組換えPTD−J−HA RBDの重量パーセントで表した。図5を参照すると、組換えPTD−J−HA RBDの重量パーセントは、最初の7時間で12%〜38%の範囲である。また、16時間後の組換えPTD−J−HA RBDの重量パーセントは32%であった。
【0065】
実施例9:C型肝炎ウイルス(HCV)コアタンパク質の発現
PCRに使用するプライマー対を表VIIIに列挙した。これらのプライマーを用いて、配列番号57のHCVコアタンパク質をコードする配列番号56の天然ウイルスcDNAを合成した。cDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0066】
【表8】

【0067】
実施例2に記載のように、組換えPTD−J−HCVコアタンパク質をコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HCVコアタンパク質発現を定量化し、総タンパク質に対する組換えPTD−J−HCVコアタンパク質の重量パーセントで表した。図5を参照すると、組換えPTD−J−HCVコアタンパク質の重量パーセントは、最初の6時間で11%〜39%の範囲である。
【0068】
実施例10:HpNC免疫原性の増大
PCRに使用するプライマー組を表IXに列挙した。これらのプライマーを用いて、配列番号61のHpNCタンパク質をコードする配列番号60のヒトハプトグロビン融合ペプチドHpNCをコードするコドンが最適化されたcDNA配列を合成した。ヒトハプトグロビンα鎖の融合ペプチドHpNCは、ハプトグロビンの成熟分泌されたα1及びα2ペプチドに存在するN末端のDSGNDVTDIADDGペプチドと、リンカーGSGGのテトラペプチドと、未熟ハプトグロビンα鎖にしか存在しないC末端のRHYEGSTVPEKKTPKSペプチドとから成っていた。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターpET22b−PTD−Jに挿入した。
【0069】
【表9】

【0070】
実施例2に記載のように、組換えpET22b−PTD−J−HpNCをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HpNCタンパク質発現を定量化し、総タンパク質に対する組換えPTD−J−HpNCタンパク質の重量パーセントで表した。図7を参照すると、組換えPTD−J−HpNCタンパク質の重量パーセントは、最初の6時間で26%〜33%の範囲である。
【0071】
上記の実施例の結果から、最適化コドンを有するpET22b−PTD−J発現ベクターを使用することによって製造された組換えタンパク質の重量パーセントは、総タンパク質に対しておよそ90%であることが明らかになった。他方で、天然cDNAを使用した場合、総タンパク質中の組換えタンパク質の重量パーセントはおよそ40%になり得る。したがって、本発明の発現ベクターによって、収率が高まり、組換えタンパク質が製造される。
【0072】
実施例11:ウサギ好中球ペプチド−1(NP−1)の免疫原性の増大
NP−1(配列番号67)をコードするコドンが最適化されたcDNA配列を合成し、実施例1に記載の方法に従って構築した発現ベクターpET22b−PTD−Jに挿入した。実施例2に記載のように、組換えpET22b−PTD−J−NP−1をコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えNP−1(配列番号68)を大腸菌から回収及び単離した。
【0073】
実施例3に従って、組換えNP−1を皮下注射することによって、マウスを免疫付与し、組換えNP−1に対する抗体を産生させた。それから、マウスから血清を回収した。実施例3に記載のドットブロットアッセイを用いて、NP−1の抗原性を求めた。
【0074】
組換えNP−1を抗原に用いると、力価が高い血清が産生された。血清は、320pgの抗原を検出することができるが、PTD1−J1−コア組換えタンパク質と交差反応せず、このことは図8に示すように、血清が厳密にNP−1領域に強く且つ特異的に対応していたことを示している。
【0075】
当業者は、広範な本発明の概念を逸脱しなければ、上記の実施形態を変更することができることが認められる。したがって、本発明は、開示された特定の実施形態に限定されず、添付の特許請求の範囲によって規定されるような本発明の精神及び範囲内の変更形態を含むように意図されることが理解される。
【配列表フリーテキスト】
【0076】
配列番号1:ヒト免疫不全ウイルスTat PTD1
配列番号2:ヒト免疫不全ウイルスTat PTD1
配列番号3:HSP40Jドメイン(J1)
配列番号4:HSP40Jドメイン(J1)−コード配列
配列番号5:PTD1の合成の為のフォワードプライマーPTD1 f
配列番号6:PTD1の合成の為のフォワードプライマーPTD1 r
配列番号7:HSP40Jドメインの合成の為のフォワードプライマーJ1 nBF1
配列番号8:HSP40Jドメインの合成の為のフォワードプライマーnF2
配列番号9:HSP40Jドメインの合成の為のフォワードプライマーF3
配列番号10:HSP40Jドメインの合成の為のフォワードプライマーF4
配列番号11:HSP40Jドメインの合成の為のフォワードプライマーF5
配列番号12:HSP40Jドメインの合成の為のフォワードプライマーF6
配列番号13:HSP40Jドメインの合成の為のリバースプライマーEcoR1 R1
配列番号14:HSP40Jドメインの合成の為のリバースプライマーR2
配列番号15:HSP40Jドメインの合成の為のリバースプライマーR3
配列番号16:HSP40Jドメインの合成の為のリバースプライマーR4
配列番号17:ヒトHSPA1Aペプチド I−コード配列
配列番号18:ヒトHSPA1Aペプチド
配列番号19:HSPA1AペプチドIの合成の為のフォワードプライマーRI−I−f1
配列番号20:HSPA1AペプチドIの合成の為のフォワードプライマーI−f2
配列番号21:HSPA1AペプチドIの合成の為のフォワードプライマーI−f3
配列番号22:HSPA1AペプチドIの合成の為のリバースプライマーI−r3
配列番号23:HSPA1AペプチドIの合成の為のリバースプライマーI−r2
配列番号24:HSPA1AペプチドIの合成の為のリバースプライマーXho−I−r1
配列番号25:ヒトHSPA1Aペプチド II−コード配列
配列番号26:ヒトHSPA1Aペプチド II
配列番号27:HSPA1AペプチドIIの合成の為のフォワードプライマーRI−II−f1
配列番号28:HSPA1AペプチドIIの合成の為のフォワードプライマーII−f2
配列番号29:HSPA1AペプチドIIの合成の為のフォワードプライマーII−f3
配列番号30:HSPA1AペプチドIIの合成の為のフォワードプライマーII−f4
配列番号31:HSPA1AペプチドIIの合成の為のリバースプライマーII−r3
配列番号32:HSPA1AペプチドIIの合成の為のリバースプライマーII−r2
配列番号33:HSPA1AペプチドIIの合成の為のリバースプライマーXho−II−r1
配列番号34:ヒトHSPA1Aペプチド III−コード配列
配列番号35:ヒトHSPA1Aペプチド III
配列番号36:HSPA1AペプチドIIIの合成の為のフォワードプライマーRI−III−f1
配列番号37:HSPA1AペプチドIIIの合成の為のフォワードプライマーIII−f2
配列番号38:HSPA1AペプチドIIIの合成の為のフォワードプライマーIII−f3
配列番号39:HSPA1AペプチドIIIの合成の為のフォワードプライマーIII−f4
配列番号40:HSPA1AペプチドIIIの合成の為のリバースプライマーIII−r3
配列番号41:HSPA1AペプチドIIIの合成の為のリバースプライマーIII−r2
配列番号42:HSPA1AペプチドIIIの合成の為のリバースプライマーIII−r1
配列番号43:ニワトリIGF−1 コード配列
配列番号44:ニワトリIGF−1
配列番号45:cIGF−Iの合成の為のフォワードプライマーRI−F1
配列番号46:cIGF−Iの合成の為のフォワードプライマーF2
配列番号47:cIGF−Iの合成の為のフォワードプライマーF3
配列番号48:cIGF−Iの合成の為のフォワードプライマーF4
配列番号49:cIGF−Iの合成の為のフォワードプライマーF5
配列番号50:cIGF−Iの合成の為のリバースプライマーR2
配列番号51:cIGF−Iの合成の為のリバースプライマーXho−R1
配列番号52:トリインフルエンザHA(H5)RBD−コード配列
配列番号53:トリインフルエンザHA(H5)RBD
配列番号54:トリインフルエンザHA RBDの合成の為のフォワードプライマーRI HA−RBD f
配列番号55:トリインフルエンザHA RBDの合成の為のリバースプライマーXho HA−RBD r
配列番号56:C型肝炎ウイルスコアタンパク質−コード配列
配列番号57:C型肝炎ウイルスコアタンパク質
配列番号58:HCV−コアタンパク質の為のフォワードプライマーRI−コアf
配列番号59:HCV−コアタンパク質の為のリバースプライマーXho−コアr
配列番号60:ヒトハプトグロビン融合ポリペプチドHpNCをコードする融合遺伝子
配列番号61:ヒトハプトグロビン融合ポリペプチドHpNC
配列番号62:ヒトハプトグロビン融合ポリペプチドHpNCの為のフォワードプライマーRI−F1
配列番号63:ヒトハプトグロビン融合ポリペプチドHpNCの為のフォワードプライマーF2
配列番号64:ヒトハプトグロビン融合ポリペプチドHpNCの為のフォワードプライマーF3
配列番号65:ヒトハプトグロビン融合ポリペプチドHpNCの為のリバースプライマーR2
配列番号66:ヒトハプトグロビン融合ポリペプチドHpNCの為のリバースプライマーXho−R1
配列番号67:ウサギ好中球ペプチド−1(NP−1)をコードするcDNA
配列番号68:ウサギ好中球ペプチド−1(NP−1)
【技術分野】
【0001】
本発明は、収率及び免疫原性を高めた組換えタンパク質の発現系に関する。
【背景技術】
【0002】
より多くの製品(例えば組換えタンパク質)のヒトでの使用が認可されているか、又は認可されようとしているために、治療上使用される生物製剤の効率的な製造に対する要求が着実に増している。昔から、そして今現在でも、細菌発酵プロセスがこれらの種類の分子を製造する主なツールである。プロセス最適化の主な目的は、出来る限り最も低いコストで要求される品質の製品を高収率で得ることであるが、これは多くの場合、特定の発現構築物又は発現系の特性に左右される。
【0003】
Jドメインの構造的特徴によって、Hsp40タンパク質と、それらのパートナーHsp70との間の相互作用の特異性が決定されることが報告されている(Hennessy et al., Protein Science (2005), 14:1697-1709;非特許文献1)。Jドメインは、主要な結合部位であり、またHsp40及びHsp40様タンパク質と、それらのパートナーHsp70との間の相互作用に必要な最小領域であると考えられている(Walsh et al., EMBO report (2004), 6:567-571;非特許文献2)。DNAワクチン系によるSV40ラージT抗原のJドメインと融合したペプチドによって、そのペプチドの抗原性を高めることができることが報告されている(Reimann and Schirmbeck, Immuno Rev. (2004), 199:54-67;非特許文献3)。Jドメインが、DnaKとDnaJ結合基質とを繋留し、それからDnaKがそのC末端ペプチド結合ドメインと結合することも知られている(Tilstra et al., Biochemical Society Transactions. (2007), 35:811-815;非特許文献4)。
【0004】
他方で、タンパク質形質導入ドメイン(PTD)は、従来のエンドサイトーシスと独立してはるかに大きい分子を細胞に運ぶことができる小ペプチドである。この特性によって、PTDは、研究目的でタンパク質及び他の分子を生細胞に運ぶのに理想的なツールとなる(Beerens et al, Current Gene Therapy (2003), 3(5):486-494;非特許文献5)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Hennessy et al., Protein Science (2005), 14:1697-1709
【非特許文献2】Walsh et al., EMBO report (2004), 6:567-571
【非特許文献3】Reimann and Schirmbeck, Immuno Rev. (2004), 199:54-67
【非特許文献4】Tilstra et al., Biochemical Society Transactions. (2007), 35:811-815
【非特許文献5】Beerens et al, Current Gene Therapy (2003), 3(5):486-494
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、組換えタンパク質の収率及び免疫原性を改善する発現系の開発において、PTDもHsp40Jドメインも示唆されていない。
【課題を解決するための手段】
【0007】
本発明によれば、宿主細胞における組換え標的タンパク質の発現系であって、本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含み、核酸セグメントが宿主細胞において、組換え標的タンパク質を発現するために、宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結する、発現系が提供される。
【0008】
さらに本発明によれば、上記の発現系を用いて、組換え標的タンパク質を発現する方法が提供される。本発明の方法は、
本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含む発現ベクターを構築すること(前記核酸セグメントが宿主細胞特異的な転写調節要素と翻訳調節要素とに操作可能に連結されている)、
前記発現ベクターで前記宿主細胞を形質転換すること、並びに
組換え標的タンパク質を宿主細胞から回収及び単離することを含む。
【0009】
したがって、本発明はまた、上述の発現系を用いることによって製造される組換えタンパク質を提供する。それによって、結果として、組換えタンパク質の免疫原性が高まる。
【0010】
本発明はまた、上記の組換えタンパク質を含むワクチンを提供し得る。
【0011】
本発明はまた、キメラタンパク質であって、
a.キメラタンパク質のN末端に、タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片を含有する第1のポリペプチジル断片と、
b.第1のポリペプチジル断片のC末端に、Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片を含有する第2のポリペプチジル断片と、
c.第2のポリペプチジル断片のC末端に、標的タンパク質又はポリペプチドを含有する第3のポリペプチジル断片とを含む、キメラタンパク質を提供する。
【0012】
本発明はまた、キメラ遺伝子であって、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、第1のDNA配列と翻訳フレームで連結した第2のDNA配列と、
c.標的タンパク質又はポリペプチドをコードする、第2のDNA配列と翻訳フレームで連結した第3のDNA配列とを含む、キメラ遺伝子を提供する。
【0013】
本発明は、さらに別のキメラ遺伝子であって、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、第1のDNA配列と翻訳フレームで連結した第2のDNA配列とを含む、さらに別のキメラ遺伝子を提供する。
【0014】
本発明のさらなる目的及び利点は一部、続く記載で示され、その記載から一部明らかになるか、又は本発明の実施によって理解され得る。本発明の目的及び利点は、添付の特許請求の範囲で特に指摘した要素及び組合せによって実現及び達成される。
【0015】
上述の概要と以下の詳細な説明との両方は例示的で且つ説明のためのものであるにすぎず、本発明を特許請求されるように制限するものではないことが理解される。
【0016】
本発明を説明する目的で、図面において本発明の好ましい実施形態を示す。しかしながら、本発明は、図示される実施形態に限定されないことを理解されたい。
【図面の簡単な説明】
【0017】
【図1】IPTGの存在下で増殖させた、pET22b−PTD−J−HSPA1AペプチドI構築物を含有する大腸菌ロゼッタ株(Rosetta)の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HSPA1AペプチドI、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI、及び第9のレーン(16)、16時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドI。
【図2】IPTGの存在下で増殖させた、pET22b−PTD−J−HSPA1AペプチドII構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HSPA1AペプチドII、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII、及び第9のレーン(16)、16時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドII。
【図3】IPTGの存在下で増殖させた、pET22b−PTD−J−HSPA1AペプチドIII構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HSPA1AペプチドIII、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、及び第9のレーン(16)、16時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII。
【図4】IPTGの存在下で増殖させた、pET22b−PTD−J−ニワトリIGF−I構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−ニワトリIGF−I、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I、及び第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−ニワトリIGF−I。
【図5】IPTGの存在下で増殖させた、pET22b−PTD−J−HA RBD構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量25kDa及び37kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HA RBD、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HA RBD、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HSPA1AペプチドIII、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HA RBD、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HA RBD、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HA RBD、第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HA RBD、第9のレーン(7)、7時間後の誘導されたpET22b−PTD−J−HA RBD、及び第10のレーン(O/N)、16時間後の誘導されたpET22b−PTD−J−HA RBD。
【図6】IPTGの存在下で増殖させた、pET22b−PTD−J−HCVコア構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量25kDa及び37kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HCVコア、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HCVコア、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HCVコア、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HCVコア、第6のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HCVコア、第7のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HCVコア、及び第8のレーン(16)、16時間後の誘導されたpET22b−PTD−J−HCVコア。
【図7】IPTGの存在下で増殖させた、pET22b−PTD−J−HpNC構築物を含有する大腸菌ロゼッタ株の全細胞溶解物のクマシー(登録商標)ブルー染色SDS−PAGEを示す図である。第1のレーン、標準分子量マーカー(分子量15kDa及び20kDaに対応するバンドが示される)。第2のレーン(0)、誘導されていないpET22b−PTD−J−HpNC、第3のレーン(1)、1時間後の誘導されたpET22b−PTD−J−HpNC、第4のレーン(2)、2時間後の誘導されたpET22b−PTD−J−HpNC、第5のレーン(3)、3時間後の誘導されたpET22b−PTD−J−HpNC、第6のレーン(4)、4時間後の誘導されたpET22b−PTD−J−HpNC、第7のレーン(5)、5時間後の誘導されたpET22b−PTD−J−HpNC、及び第8のレーン(6)、6時間後の誘導されたpET22b−PTD−J−HpNC。
【図8】血清中、異なる濃度の組換えタンパク質、PTD−J1−好中球ペプチド−1(NP−1)、PTD−J1−コア及びPTD−J1を検出するためのドットブロット図である。
【発明を実施するための形態】
【0018】
概して本発明は、収率及び免疫原性を高めた、宿主細胞に導入して、組換え標的タンパク質を安定して且つ効率的に製造する発現系に関する。
【0019】
本明細書中で使用する場合、「組換えタンパク質」という用語は、組換え分子、及び通常組換え方法、化学的方法又は他の好適な方法によって、タンパク質形質導入ドメイン及びJドメインと共有結合(即ち融合)したタンパク質又はペプチド配列を意味する。必要に応じて、組換え分子は、ペプチドリンカー配列を介して1つ又は幾つかの部位で融合することができる。このペプチド配列は、宿主細胞誘発プロテアーゼによる切断のための部位を1つ又は複数含み得る。
【0020】
「ポリペプチド」は、好ましくはその大きさにかかわらず、本質的に20個の天然アミノ酸のいずれかから成る任意のポリマーを指す。「タンパク質」という用語は、比較的大きいタンパク質に対して用いられることが多いが、「ペプチド」は小ポリペプチドに対して用いられることが多く、この分野ではこれらの用語は重複して用いられることが多い。特に言及されない限り、「ポリペプチド」という用語は一般的にタンパク質、ポリペプチド及びペプチドを指す。
【0021】
本発明によれば、「免疫原性」という用語は、組換えタンパク質、例えば組換え抗原性タンパク質が免疫反応を引き起こす能力を指す。
【0022】
本発明によれば、宿主細胞における組換え標的タンパク質の発現系であって、本質的に配列番号1のタンパク質形質導入ドメイン(PTD)をコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含み、核酸セグメントが宿主細胞において、異種タンパク質を発現するために、宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結する、発現系が提供される。例として、PTDをコードするヌクレオチド配列は、配列番号2のヌクレオチド配列を含む。また、配列番号2のヌクレオチド配列は、配列番号5及び配列番号6のオリゴヌクレオチドを使用することによって合成され得る。配列番号5及び配列番号6のオリゴヌクレオチドは、その5’末端でリン酸化し得る。それからまた、オリゴヌクレオチドは、ベクターに挿入されると、ホスファターゼによって脱リン酸化され得る。別の例によれば、HSP40Jドメインは、亜型A、亜型B及び亜型CのHSP40Jドメインから成る群から選択され得る。例えば、亜型A、亜型B及び亜型CのHSP40Jドメインは、ヒトゲノムにおける41個のDnaJ/HSP40タンパク質中に含有されるJドメイン又はJ様ドメインであり得る(Qiu et al., Cell. Mol. Life Sci. 63: 2560-2570 (2006))。本発明の一具体例によれば、HSP40Jドメインは、配列番号4のヌクレオチド配列によってコードされた配列番号3のペプチドを含む。また、配列番号4のヌクレオチド配列は、配列番号7〜配列番号16のオリゴヌクレオチドを使用することによって合成され得る。また、標的タンパク質は、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、及びウイルスコアタンパク質を含み得るが、これらに限定されない。本発明の一例において、組換えタンパク質は、免疫付与された宿主において免疫原性を示す抗原性ポリペプチドである。別の例では、本発明は上記の発現系によって製造される組換えタンパク質を含むワクチンも提供する。
【0023】
本発明は、核酸配列、特に本発明の組換えタンパク質をコードするDNA配列を提供し得る。別の例では、DNA配列は、ファージ、ウイルス、プラスミド、ファージミド、コスミド、YAC又はエピソームのような染色体外の複製に適したベクターによって運ばれ得る。特に、所望の組換えタンパク質をコードするDNAベクターを使用して、本明細書中に記載の調製方法を容易にすると共に、有意量の組換えタンパク質を得ることができる。DNA配列は、適切なベクター、即ち挿入されるタンパク質コード配列の転写及び翻訳に必要な要素を含有するベクターに挿入することができる。タンパク質コード配列を発現するのに、種々の宿主ベクター系を利用してもよい。これらとしては、ウイルスを感染させた哺乳動物細胞系、ウイルスを感染させた昆虫細胞系、酵母ベクターを含有する酵母、又はバクテリオファージDNA、プラスミドDNA若しくはコスミドDNAで形質転換した細菌等の微生物が挙げられる。利用される宿主ベクター系に応じて、多くの好適な転写要素及び翻訳要素の1つが使用され得る。例えばベクターは、細菌T7プロモータ等のプロモータと、転写を調節する、lacオペレータ等の誘導性オペレータとを含有し得る。
【0024】
他のベクター及び構築物としては、染色体DNA配列、非染色体DNA配列及び合成DNA配列、例えばSV40の誘導体、細菌プラスミド、ファージDNA、バキュロウイルス、酵母プラスミド、酵母人工染色体(YAC)、プラスミドとファージDNAとの組合せに由来するベクター、プラスミドとウイルスDNAとの組合せに由来するシャトルベクター、ワクシニア、アデノウイルス、鶏痘ウイルス及び仮性狂犬病ウイルス等のウイルスDNAが挙げられる。しかしながら、任意の他のベクターは、対象の宿主細胞で複製可能で且つ生存可能であれば、核酸発現構築物の調製に使用してもよい。核酸配列は、単離及び任意の所望のベクターへのクローニングのために、多くの制限エンドヌクレアーゼ部位の横に位置し得る。組換えタンパク質のその後の精製を容易にするのに添加される、EE、6XHis、HA又はMYC等のタンパク質同定タグ又は精製タグも存在する。さらに、核酸発現構築物は、転写ターミネータも含有し得る。例えば、ベクターは、核酸配列の転写を終わらせるT7ターミネータを含有し得る。
【0025】
本発明の一具体例によれば、組換えタンパク質は、配列番号2のヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とを含む発現ベクターを使用することによって製造され得る。別の例では、発現ベクターは、配列番号2のヌクレオチド配列と、配列番号4のヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列と、発現ベクターにおいてヌクレオチド配列と操作可能に連結する、宿主特異的な転写調節要素及び翻訳調節要素とを含み得る。
【0026】
本発明の組換え分子を運ぶベクターは、標的細胞又はかかる細胞群に効果的に形質導入され得る。必要に応じて、様々な戦略の1つ又は組合せによって、形質導入の効率をモニタリング及び定量化してもよい。
【0027】
例えば、1つのアプローチは、細胞による組換えタンパク質の取り込みを測定するin vitroアッセイを伴う。アッセイには、例えば、放射性原子、蛍光タグ、リン光タグ又は発光タグ(例えばフルオレセイン、ローダミン、Cy3)による組換えタンパク質の検出可能な標識化と、その後の標識組換えタンパク質の取り込みの測定とが含まれる。代替的に、組換えタンパク質は、ホースラディッシュペルオキシダーゼ、β−ガラクトシダーゼ、クロラムフェニコールアセチルトランスフェラーゼ又はルシフェラーゼのような、検出可能なラベルを形成可能な酵素によって標識することができる。蛍光顕微鏡検査法又はオートラジオグラフィによる標準的な細胞分別器(例えばFACS)での標識細胞の定量化のような幾つかの従来方法によって、取り込みを測定することができる。
【0028】
概して上記で言及したように、宿主細胞は、所望の組換えタンパク質をコードする核酸を増殖するために調製目的で使用してもよい。このため、宿主細胞は、哺乳動物細胞のようなより高等な真核細胞であっても、若しくは酵母細胞のようなより低級の(lower)真核細胞であってもよく、又は宿主細胞は、細菌細胞のような原核細胞であってもよい。本発明による適切な宿主細胞の代表例としては、大腸菌、ストレプトミセス(Streptomyces)、ネズミチフス菌(Salmonella typhimurium)のような細菌細胞;酵母のような真菌細胞;ショウジョウバエS2及びスポドプテラ(Spodoptera)Sf9のような昆虫細胞;MDCK、Hep−2、CHO又はCOSのような動物細胞;ジャーカット細胞又は293細胞のようなヒト細胞;アデノウイルス;植物細胞、又は既にin vitro増殖に適応した、若しくはこのようにして新たに樹立した任意の他の細胞が挙げられるが、必ずしもこれらに限定されない。適切な宿主細胞の選択は、本明細書中の教示から当業者の範囲内であると見なされる。
【0029】
さらに、所望の組換えタンパク質をコードする核酸は、細胞をトランスフェクトするのに標準的な技法によって、宿主細胞に導入することができる。「トランスフェクト(transfecting)」又は「トランスフェクション(transfection)」は、核酸を宿主細胞に導入するための全ての従来技法を包含するように意図され、リン酸カルシウム共沈、DEAEデキストラン媒介トランスフェクション、リポフェクション、電気穿孔(electroporation)、顕微注入(microinjection)、ウイルス形質導入及び/又は融合(integration)が挙げられる。
【0030】
本発明は、対象の組換えタンパク質を単離する製造プロセスをさらに提供し得る。このプロセスでは、宿主細胞(例えば、酵母細胞、真菌細胞、昆虫細胞、細菌細胞又は動物細胞)(これに、調節配列と操作可能に連結した(liked)、対象のタンパク質をコードする核酸が導入されている)は、対象の組換えタンパク質をコードするヌクレオチド配列の転写を刺激するために、組換えタンパク質の存在下の培養培地中において生産規模で増殖し得る。その後、対象の組換えタンパク質は、採取された宿主細胞又は培養培地から単離され得る。培地又は採取された細胞から対象のタンパク質を単離するのに、標準的なタンパク質精製技法を使用してもよい。特に、精製技法を用いて、ローラーボトル、スピナーフラスコ、組織培養プレート、バイオリアクタ又は発酵槽を含む種々の装置(implementations)から大規模で(即ち少なくともミリグラム量で)所望の融合タンパク質を発現及び精製することができる。
【0031】
本発明の組換えタンパク質は、適切な組合せの既知の技法によって分離及び精製し得る。例えばこれらの方法としては、塩析及び溶媒析出のような溶解度を利用する方法、透析、限外濾過、ゲル濾過、及びSDS−ポリアクリルアミドゲル電気泳動のような分子量の違いを利用する方法、イオン交換カラムクロマトグラフィのような電荷の違いを利用する方法、親和性クロマトグラフィのような特異親和性を利用する方法、逆相高速液体クロマトグラフィのような疎水性の違いを利用する方法、並びに等電点電気泳動のような等電点の違いを利用する方法、Ni−NTAのような金属親和性カラムが挙げられる。
【0032】
したがって、別の例によれば、本発明は、宿主細胞において収率及び免疫原性を高めて組換え標的タンパク質を製造する方法を提供し得る。本方法は、
本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含む発現ベクターを構築すること(核酸セグメントが宿主細胞特異的な転写調節要素と翻訳調節要素とに操作可能に連結される)、
前記発現ベクターで前記宿主細胞を形質転換すること、並びに
組換え標的タンパク質を宿主細胞から回収及び単離することを含む。
【0033】
別の一例によれば、本方法は、生物を組換えタンパク質により免疫付与する工程をさらに含む。組換えタンパク質の抗原性は、試験膜上でブロットした組換えタンパク質のエピトープ(単数又は複数)と結合する標識抗体を使用して求められ得る。また、組換えタンパク質の免疫原性は、in vitroで抗原提示アッセイにおいて、並びにin vivoで抗体応答及び抗原性ポリペプチドによる皮下攻撃(challenge)に対する防御の誘導において他のポリペプチドと比較することができる。
【0034】
また本発明は、
a.キメラタンパク質のN末端に、タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片を含有する第1のポリペプチジル断片と、
b.第1のポリペプチジル断片のC末端に、Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片を含有する第2のポリペプチジル断片と、
c.第2のポリペプチジル断片のC末端に、標的タンパク質又はポリペプチドを含有する第3のポリペプチジル断片とを含む、キメラタンパク質を提供する。
【0035】
また本発明は、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、第1のDNA配列と翻訳フレームで連結した第2のDNA配列と、
c.標的タンパク質又はポリペプチドをコードする、第2のDNA配列と翻訳フレームで連結した第3のDNA配列とを含む、キメラ遺伝子を提供する。
【0036】
本発明は、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、第1のDNA配列と翻訳フレームで連結した第2のDNA配列とを含む、さらに別のキメラ遺伝子を提供する。
【0037】
本発明によれば、タンパク質形質導入ドメイン(PTD)をコードする第1のDNA配列は、配列番号1に記載のアミノ酸配列を含み、Jドメインをコードする第2のDNA配列は、配列番号3に記載のアミノ酸配列を含む。好ましくは、Jドメインはヒト熱ショックタンパク質40由来である。
【0038】
抗原性ポリペプチドは、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、ウイルスコアタンパク質又はそれらの組合せを含み得るが、必ずしもこれらに限定されない。例えば、宿主に対して免疫反応を誘起可能な他のタンパク質又はポリペプチドも、本発明に包含され得る。
【0039】
これより、本発明は、以下の具体的であるが、非限定的な実施例を参照してさらに詳細に説明される。
【実施例】
【0040】
実施例1:pET22b−PTD1−J1−Ag発現ベクターの構築
pET22bプラスミド(Novagen, Madison, Wis.)を用いて、配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、配列番号3のHsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とを含むpET22b−PTD−J1ベクターを作製した。ここで、核酸セグメントは、宿主細胞において組換え標的タンパク質を発現するために、宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結している。大腸菌に対するPTDの最適化コドンをコードするオリゴヌクレオチドは、以下の表Iに列挙される配列番号5及び配列番号6のプライマーを使用して化学合成した。NdeIとBamHIとで同時に消化したpET22bプラスミドに挿入するために、二本鎖形態にアニーリングする前、これらの2つのオリゴヌクレオチドの5’末端をポリヌクレオチドキナーゼでリン酸化し、ウシ腸アルカリホスファターゼ(CIAP)で脱リン酸化して、pET22b−PTD1を作製した。
【0041】
【表1】

【0042】
HSP40遺伝子のJドメインは、表IIに示される配列番号7〜配列番号16のオリゴヌクレオチドを使用したアセンブリPCRによって合成した。これらのオリゴヌクレオチドを、大腸菌に対する最適化コドンを増幅するために設計した。単一コロニーの選択及びDNAシークエンシングのために、PCR産物をpGEM−T Easyベクター(Promega)にクローン化した。正確なJドメインコードDNA配列を有するプラスミドをBamHIとEcoRIとで同時に消化し、pGEM−T Easyベクターから0.2kbの挿入DNA断片を取り除いた。それから、このDNA断片を、BamHI/EcoRIとCIAPとで処理したpET22b−PTD1ベクターに挿入し、pET22b−PTD1−J1発現ベクターを作製した。
【0043】
【表2】

【0044】
pET22b−PTD1−J1ベクターによって発現される、1つ又は複数の組換えポリペプチド又は抗原性(Ag)ポリペプチドは通常、大腸菌の最適化コドンを有するDNAに形質転換した。1つ又は複数の組換えポリペプチドコード領域もPCRで増幅した。以下の実施例におけるこれらのポリペプチドコードDNAは、都合よくpET22b−PTD1−J1ベクターに挿入されるように、EcoRI及びXhoI部位の横に位置していた。結果として、pET22b−PTD1−J1−Ag発現ベクターが構築された。
【0045】
アセンブリPCR
オリゴヌクレオチドセットを用いて、コドンが最適化されたcDNAを合成した。0.5μMのF1及びR1と、0.05μMのF2、F3、R3、R2等を、PCR反応混合液中で調整した。反応条件は、94℃で2分、その後94℃で20秒/40℃で40秒/72℃で20秒を20サイクル、及び72℃で5分の伸長であった。プラスミドDNA単離及びDNAシークエンシングのために、PCR産物をpGEM−T Easyにクローン化した。
【0046】
実施例2:PTD−J−Ag組換えタンパク質の発現
pET22b−PTD−J−Agベクターを大腸菌ロゼッタ株(Novagen)のコンピテントセルに形質転換した。1mMのIPTGを導入する前にOD600=0.3になるまで、アンピシリンとクロラムフェニコールとに耐性がある大腸菌コロニーをTYD培地(1L当たり10g トリプトン/20g 酵母エキス/5g NaCl/2g デキストロース、pH7.2)中で、培養及び増幅させた。細胞試料を列挙する時間割で回収した。
【0047】
0.3OD600単位での大腸菌の総タンパク試料を、30μLの2×SDS−PAGEローディングバッファー中に溶解した。5分間、水浴を沸騰させることによって処理した後、これらのタンパク質試料を、12.5%又は15%のSDS−PAGEで分離した。SDS−PAGEゲル上でクマシーブリリアントブルーR250染色を実施することによって、タンパク質のバンドを可視化した。
【0048】
実施例3:免疫付与
マウスを、TiterMAX Goldアジュバントで乳化したポリペプチド50μgにより皮下で免疫付与した。2週間ごとに追加免疫(Boosts)を実施した。マウスの血清を回収し、ポリペプチドに対する抗体を産生させた。
【0049】
ドットブロット法
段階希釈した組換えタンパク質又は合成ポリペプチドをPVDF膜上にスポットした(spotted)。5%脱脂乳のTBSN(25mMのトリスHCl、pH7.4/150mMのNaCl/0.02% Tween20)で1時間、膜をブロッキングした。TBSNで4回洗浄した後、一晩インキュベートするために1000倍に希釈したマウス抗血清中に膜を浸した。TBSNで4回洗浄することによって、結合されていない一次抗体(Ab)を取り除いた後、HRP結合ヤギ抗マウス二次Ab(2000倍希釈)を4時間適用した。製造業者の取扱説明書に記載されるように、化学発光キット(Pierce)によって、洗浄膜上でタンパク質の標識を実施した。
【0050】
実施例4:ヒトHSPA1AペプチドIの発現
アセンブリPCRで使用するオリゴヌクレオチドを表IIIに列挙した。これらのオリゴヌクレオチドを用いて、配列番号18(SSSTQASLEI DSLFEGIDFY TSITRARFEE LCSDLFRSTL EPVEKALRDA KLDKAQI)のHAPA1AペプチドIをコードする配列番号17のコドンが最適化されたcDNAを合成した。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターpET22b−PTD−Jに挿入した。
【0051】
【表3】

【0052】
実施例2に記載のように、組換えPTD−J−HSPA1AペプチドIをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HSPA1AペプチドI発現を定量化し、総タンパク質に対する組換えPTD−J−HSPA1AペプチドIの重量パーセントで表した。図1を参照すると、組換えPTD−J−HSPA1AペプチドIの重量パーセントは、最初の6時間で65%〜92%の範囲である。また、16時間後の組換えPTD−J−HSPA1AペプチドIの重量パーセントは77%であった。
【0053】
実施例5:ヒトHSPA1AペプチドIIの発現
アセンブリPCRで使用するオリゴヌクレオチドを表IVに列挙した。これらのオリゴヌクレオチドを用いて、配列番号26(NVTATDKSTG KANKITITND KGRLSKEEIE RMVQEAEKYK AEDEVQRERV SAKNALESYA F)のHAPA1AペプチドIIをコードする配列番号25のコドンが最適化されたcDNAを合成した。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0054】
【表4】

【0055】
実施例2に記載のように、組換えPTD−J−HSPA1AペプチドIIをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HSPA1AペプチドII発現を定量化し、総タンパク質に対する組換えPTD−J−HSPA1AペプチドIIの重量パーセントで表した。図2を参照すると、組換えPTD−J−HSPA1AペプチドIIの重量パーセントは、最初の6時間で27%〜54%の範囲である。また、16時間後の組換えPTD−J−HSPA1AペプチドIIの重量パーセントは10%であった。
【0056】
実施例6:ヒトHSPA1AペプチドIIIの発現
アセンブリPCRで使用するオリゴヌクレオチドを表Vに列挙した。これらのオリゴヌクレオチドを用いて、配列番号35(EDEGLKGKIS EADKKKVLDK CQEVISWLDA NTLAEKDEFE HKRKELEQVC NPIISGLYQG A)のHSPA1AペプチドIIIをコードする配列番号34のコドンが最適化されたcDNAを合成した。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0057】
【表5】

【0058】
実施例2に記載のように、組換えPTD−J−HSPA1AペプチドIIIをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HSPA1AペプチドIII発現を定量化し、総タンパク質に対する組換えPTD−J−HSPA1AペプチドIIIの重量パーセントで表した。図3を参照すると、組換えPTD−J−HSPA1AペプチドIIIの重量パーセントは、最初の5時間で10%〜33%の範囲である。
【0059】
実施例7:ニワトリIGF−Iの発現
アセンブリPCRで使用するオリゴヌクレオチドを表VIに列挙した。これらのオリゴヌクレオチドを用いて、配列番号44(GPETLCGAEL VDALQFVCGD RGFYFSKPTG YGSSSAALHH KGIVDECCFQ SCDLRRLEMY CAPIKPPKSA)のニワトリIGF−Iをコードする配列番号43のコドンが最適化されたcDNAを合成した。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0060】
【表6】

【0061】
実施例2に記載のように、組換えPTD−J−ニワトリIGF−Iをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−ニワトリIGF−I発現を定量化し、総タンパク質に対する組換えPTD−J−ニワトリIGF−Iの重量パーセントで表した。図4を参照すると、組換えPTD−J−ニワトリIGF−Iの重量パーセントは、最初の6時間で74%〜90%の範囲である。
【0062】
実施例8:トリインフルエンザウイルスHA(H5)受容体結合ドメイン(RBD)の発現
PCRに使用するプライマー対を表VIIに列挙した。これらのプライマーを用いて、配列番号53のHA−RBDをコードする配列番号52の天然ウイルスcDNAを合成した。cDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0063】
【表7】

【0064】
実施例2に記載のように、組換えPTD−J−HA RBDをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HA RBD発現を定量化し、総タンパク質に対する組換えPTD−J−HA RBDの重量パーセントで表した。図5を参照すると、組換えPTD−J−HA RBDの重量パーセントは、最初の7時間で12%〜38%の範囲である。また、16時間後の組換えPTD−J−HA RBDの重量パーセントは32%であった。
【0065】
実施例9:C型肝炎ウイルス(HCV)コアタンパク質の発現
PCRに使用するプライマー対を表VIIIに列挙した。これらのプライマーを用いて、配列番号57のHCVコアタンパク質をコードする配列番号56の天然ウイルスcDNAを合成した。cDNA配列を、実施例1に従って構築した発現ベクターに挿入した。
【0066】
【表8】

【0067】
実施例2に記載のように、組換えPTD−J−HCVコアタンパク質をコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HCVコアタンパク質発現を定量化し、総タンパク質に対する組換えPTD−J−HCVコアタンパク質の重量パーセントで表した。図5を参照すると、組換えPTD−J−HCVコアタンパク質の重量パーセントは、最初の6時間で11%〜39%の範囲である。
【0068】
実施例10:HpNC免疫原性の増大
PCRに使用するプライマー組を表IXに列挙した。これらのプライマーを用いて、配列番号61のHpNCタンパク質をコードする配列番号60のヒトハプトグロビン融合ペプチドHpNCをコードするコドンが最適化されたcDNA配列を合成した。ヒトハプトグロビンα鎖の融合ペプチドHpNCは、ハプトグロビンの成熟分泌されたα1及びα2ペプチドに存在するN末端のDSGNDVTDIADDGペプチドと、リンカーGSGGのテトラペプチドと、未熟ハプトグロビンα鎖にしか存在しないC末端のRHYEGSTVPEKKTPKSペプチドとから成っていた。コドンが最適化されたcDNA配列を、実施例1に従って構築した発現ベクターpET22b−PTD−Jに挿入した。
【0069】
【表9】

【0070】
実施例2に記載のように、組換えpET22b−PTD−J−HpNCをコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えPTD−J−HpNCタンパク質発現を定量化し、総タンパク質に対する組換えPTD−J−HpNCタンパク質の重量パーセントで表した。図7を参照すると、組換えPTD−J−HpNCタンパク質の重量パーセントは、最初の6時間で26%〜33%の範囲である。
【0071】
上記の実施例の結果から、最適化コドンを有するpET22b−PTD−J発現ベクターを使用することによって製造された組換えタンパク質の重量パーセントは、総タンパク質に対しておよそ90%であることが明らかになった。他方で、天然cDNAを使用した場合、総タンパク質中の組換えタンパク質の重量パーセントはおよそ40%になり得る。したがって、本発明の発現ベクターによって、収率が高まり、組換えタンパク質が製造される。
【0072】
実施例11:ウサギ好中球ペプチド−1(NP−1)の免疫原性の増大
NP−1(配列番号67)をコードするコドンが最適化されたcDNA配列を合成し、実施例1に記載の方法に従って構築した発現ベクターpET22b−PTD−Jに挿入した。実施例2に記載のように、組換えpET22b−PTD−J−NP−1をコードした核酸セグメントを有する発現ベクターを大腸菌に導入した。また、組換えNP−1(配列番号68)を大腸菌から回収及び単離した。
【0073】
実施例3に従って、組換えNP−1を皮下注射することによって、マウスを免疫付与し、組換えNP−1に対する抗体を産生させた。それから、マウスから血清を回収した。実施例3に記載のドットブロットアッセイを用いて、NP−1の抗原性を求めた。
【0074】
組換えNP−1を抗原に用いると、力価が高い血清が産生された。血清は、320pgの抗原を検出することができるが、PTD1−J1−コア組換えタンパク質と交差反応せず、このことは図8に示すように、血清が厳密にNP−1領域に強く且つ特異的に対応していたことを示している。
【0075】
当業者は、広範な本発明の概念を逸脱しなければ、上記の実施形態を変更することができることが認められる。したがって、本発明は、開示された特定の実施形態に限定されず、添付の特許請求の範囲によって規定されるような本発明の精神及び範囲内の変更形態を含むように意図されることが理解される。
【配列表フリーテキスト】
【0076】
配列番号1:ヒト免疫不全ウイルスTat PTD1
配列番号2:ヒト免疫不全ウイルスTat PTD1
配列番号3:HSP40Jドメイン(J1)
配列番号4:HSP40Jドメイン(J1)−コード配列
配列番号5:PTD1の合成の為のフォワードプライマーPTD1 f
配列番号6:PTD1の合成の為のフォワードプライマーPTD1 r
配列番号7:HSP40Jドメインの合成の為のフォワードプライマーJ1 nBF1
配列番号8:HSP40Jドメインの合成の為のフォワードプライマーnF2
配列番号9:HSP40Jドメインの合成の為のフォワードプライマーF3
配列番号10:HSP40Jドメインの合成の為のフォワードプライマーF4
配列番号11:HSP40Jドメインの合成の為のフォワードプライマーF5
配列番号12:HSP40Jドメインの合成の為のフォワードプライマーF6
配列番号13:HSP40Jドメインの合成の為のリバースプライマーEcoR1 R1
配列番号14:HSP40Jドメインの合成の為のリバースプライマーR2
配列番号15:HSP40Jドメインの合成の為のリバースプライマーR3
配列番号16:HSP40Jドメインの合成の為のリバースプライマーR4
配列番号17:ヒトHSPA1Aペプチド I−コード配列
配列番号18:ヒトHSPA1Aペプチド
配列番号19:HSPA1AペプチドIの合成の為のフォワードプライマーRI−I−f1
配列番号20:HSPA1AペプチドIの合成の為のフォワードプライマーI−f2
配列番号21:HSPA1AペプチドIの合成の為のフォワードプライマーI−f3
配列番号22:HSPA1AペプチドIの合成の為のリバースプライマーI−r3
配列番号23:HSPA1AペプチドIの合成の為のリバースプライマーI−r2
配列番号24:HSPA1AペプチドIの合成の為のリバースプライマーXho−I−r1
配列番号25:ヒトHSPA1Aペプチド II−コード配列
配列番号26:ヒトHSPA1Aペプチド II
配列番号27:HSPA1AペプチドIIの合成の為のフォワードプライマーRI−II−f1
配列番号28:HSPA1AペプチドIIの合成の為のフォワードプライマーII−f2
配列番号29:HSPA1AペプチドIIの合成の為のフォワードプライマーII−f3
配列番号30:HSPA1AペプチドIIの合成の為のフォワードプライマーII−f4
配列番号31:HSPA1AペプチドIIの合成の為のリバースプライマーII−r3
配列番号32:HSPA1AペプチドIIの合成の為のリバースプライマーII−r2
配列番号33:HSPA1AペプチドIIの合成の為のリバースプライマーXho−II−r1
配列番号34:ヒトHSPA1Aペプチド III−コード配列
配列番号35:ヒトHSPA1Aペプチド III
配列番号36:HSPA1AペプチドIIIの合成の為のフォワードプライマーRI−III−f1
配列番号37:HSPA1AペプチドIIIの合成の為のフォワードプライマーIII−f2
配列番号38:HSPA1AペプチドIIIの合成の為のフォワードプライマーIII−f3
配列番号39:HSPA1AペプチドIIIの合成の為のフォワードプライマーIII−f4
配列番号40:HSPA1AペプチドIIIの合成の為のリバースプライマーIII−r3
配列番号41:HSPA1AペプチドIIIの合成の為のリバースプライマーIII−r2
配列番号42:HSPA1AペプチドIIIの合成の為のリバースプライマーIII−r1
配列番号43:ニワトリIGF−1 コード配列
配列番号44:ニワトリIGF−1
配列番号45:cIGF−Iの合成の為のフォワードプライマーRI−F1
配列番号46:cIGF−Iの合成の為のフォワードプライマーF2
配列番号47:cIGF−Iの合成の為のフォワードプライマーF3
配列番号48:cIGF−Iの合成の為のフォワードプライマーF4
配列番号49:cIGF−Iの合成の為のフォワードプライマーF5
配列番号50:cIGF−Iの合成の為のリバースプライマーR2
配列番号51:cIGF−Iの合成の為のリバースプライマーXho−R1
配列番号52:トリインフルエンザHA(H5)RBD−コード配列
配列番号53:トリインフルエンザHA(H5)RBD
配列番号54:トリインフルエンザHA RBDの合成の為のフォワードプライマーRI HA−RBD f
配列番号55:トリインフルエンザHA RBDの合成の為のリバースプライマーXho HA−RBD r
配列番号56:C型肝炎ウイルスコアタンパク質−コード配列
配列番号57:C型肝炎ウイルスコアタンパク質
配列番号58:HCV−コアタンパク質の為のフォワードプライマーRI−コアf
配列番号59:HCV−コアタンパク質の為のリバースプライマーXho−コアr
配列番号60:ヒトハプトグロビン融合ポリペプチドHpNCをコードする融合遺伝子
配列番号61:ヒトハプトグロビン融合ポリペプチドHpNC
配列番号62:ヒトハプトグロビン融合ポリペプチドHpNCの為のフォワードプライマーRI−F1
配列番号63:ヒトハプトグロビン融合ポリペプチドHpNCの為のフォワードプライマーF2
配列番号64:ヒトハプトグロビン融合ポリペプチドHpNCの為のフォワードプライマーF3
配列番号65:ヒトハプトグロビン融合ポリペプチドHpNCの為のリバースプライマーR2
配列番号66:ヒトハプトグロビン融合ポリペプチドHpNCの為のリバースプライマーXho−R1
配列番号67:ウサギ好中球ペプチド−1(NP−1)をコードするcDNA
配列番号68:ウサギ好中球ペプチド−1(NP−1)
【特許請求の範囲】
【請求項1】
宿主細胞における組換え標的タンパク質の発現系であって、本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含み、該核酸セグメントが前記宿主細胞において、前記組換え標的タンパク質を発現するために、宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結されている、発現系。
【請求項2】
前記タンパク質形質導入ドメインをコードする前記ヌクレオチド配列が配列番号2のヌクレオチド配列を含む、請求項1に記載の発現系。
【請求項3】
前記配列番号2のヌクレオチド配列を、配列番号5及び配列番号6のオリゴヌクレオチドを使用することによって合成する、請求項2に記載の発現系。
【請求項4】
前記HSP40Jドメインが、亜型A、亜型B及び亜型CのHSP40Jドメインから成る群から選択される、請求項1に記載の発現系。
【請求項5】
前記HSP40Jドメインが配列番号3のペプチドを含む、請求項4に記載の発現系。
【請求項6】
前記HSP40Jドメインをコードする前記ヌクレオチド配列が配列番号4のヌクレオチド配列を含む、請求項5に記載の発現系。
【請求項7】
前記配列番号4のヌクレオチド配列を、配列番号7〜配列番号16のオリゴヌクレオチドを使用することによって合成する、請求項6に記載の発現系。
【請求項8】
前記宿主細胞が大腸菌を含む、請求項1に記載の発現系。
【請求項9】
前記標的タンパク質が、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、及びウイルスコアタンパク質の少なくとも1つを含む、請求項1に記載の発現系。
【請求項10】
請求項1に記載の発現系を用いて製造される組換えタンパク質。
【請求項11】
請求項10に記載の組換えタンパク質を含むワクチン。
【請求項12】
宿主細胞において収率を高めて組換え標的タンパク質を製造する方法であって、
本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含む発現ベクターを構築すること(該核酸セグメントが宿主細胞特異的な転写調節要素と翻訳調節要素とに操作可能に連結される)、
前記発現ベクターで前記宿主細胞を形質転換すること、並びに
前記組換え標的タンパク質を前記宿主細胞から回収及び単離することを含む、方法。
【請求項13】
前記タンパク質形質導入ドメインをコードする前記ヌクレオチド配列が配列番号2のヌクレオチド配列を含む、請求項12に記載の方法。
【請求項14】
前記配列番号2のヌクレオチド配列を、配列番号5及び配列番号6のオリゴヌクレオチドを使用することによって合成する、請求項13に記載の方法。
【請求項15】
前記HSP40Jドメインが、亜型A、亜型B及び亜型CのHSP40Jドメインから成る群から選択される、請求項12に記載の方法。
【請求項16】
前記HSP40Jドメインが配列番号3のペプチドを含む、請求項15に記載の方法。
【請求項17】
前記HSP40Jドメインをコードする前記ヌクレオチド配列が配列番号4のヌクレオチド配列を含む、請求項16に記載の方法。
【請求項18】
前記配列番号4のヌクレオチド配列を、配列番号7〜配列番号16のオリゴヌクレオチドを使用することによって合成する、請求項17に記載の方法。
【請求項19】
前記宿主細胞が大腸菌を含む、請求項12に記載の方法。
【請求項20】
前記標的タンパク質が、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、及びウイルスコアタンパク質の少なくとも1つを含む、請求項12に記載の方法。
【請求項21】
免疫原性を高めた組換え標的タンパク質を製造する方法であって、
本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含む発現ベクターを構築すること(該核酸セグメントが宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結される)、
前記発現ベクターで前記宿主細胞を形質転換すること、並びに
前記組換え標的タンパク質を前記宿主細胞から回収及び単離することを含む、方法。
【請求項22】
生物を前記組換えタンパク質により免疫付与することをさらに含む、請求項21に記載の方法。
【請求項23】
前記タンパク質形質導入ドメインをコードする前記ヌクレオチド配列が配列番号2のヌクレオチド配列を含む、請求項21に記載の方法。
【請求項24】
前記配列番号2のヌクレオチド配列を、配列番号5及び配列番号6のオリゴヌクレオチドを使用することによって合成する、請求項23に記載の方法。
【請求項25】
前記HSP40Jドメインが、亜型A、亜型B及び亜型CのHSP40Jドメインから成る群から選択される、請求項24に記載の方法。
【請求項26】
前記HSP40Jドメインが配列番号3のペプチドを含む、請求項25に記載の方法。
【請求項27】
前記HSP40Jドメインをコードする前記ヌクレオチド配列が配列番号4のヌクレオチド配列を含む、請求項26に記載の方法。
【請求項28】
前記配列番号4のヌクレオチド配列を、配列番号7〜配列番号16のオリゴヌクレオチドを使用することによって合成する、請求項27に記載の方法。
【請求項29】
前記宿主細胞が大腸菌を含む、請求項21に記載の方法。
【請求項30】
前記標的タンパク質が、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、及びウイルスコアタンパク質の少なくとも1つを含む、請求項21に記載の方法。
【請求項31】
キメラタンパク質であって、
a.前記キメラタンパク質のN末端に、タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片を含有する第1のポリペプチジル断片と、
b.前記第1のポリペプチジル断片のC末端に、Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片を含有する第2のポリペプチジル断片と、
c.前記第2のポリペプチジル断片のC末端に、標的タンパク質又はポリペプチドを含有する第3のポリペプチジル断片とを含む、キメラタンパク質。
【請求項32】
前記第1のポリペプチジル断片が配列番号1に記載のアミノ酸配列を含む、請求項31に記載のキメラタンパク質。
【請求項33】
前記第2のポリペプチジル断片が配列番号3に記載のアミノ酸配列を含む、請求項31に記載のキメラタンパク質。
【請求項34】
前記Jドメインがヒト熱ショックタンパク質40由来である、請求項31に記載のキメラタンパク質。
【請求項35】
キメラ遺伝子であって、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、前記第1のDNA配列と翻訳フレームで連結した第2のDNA配列と、
c.標的タンパク質又はポリペプチドをコードする、前記第2のDNA配列と翻訳フレームで連結した第3のDNA配列とを含む、キメラ遺伝子。
【請求項36】
タンパク質形質導入ドメイン(PTD)をコードする前記第1のDNA配列が配列番号1に記載のアミノ酸配列を含む、請求項35に記載のキメラ遺伝子。
【請求項37】
Jドメインをコードする前記第2のDNA配列が配列番号3に記載のアミノ酸配列を含む、請求項35に記載のキメラ遺伝子。
【請求項38】
タンパク質形質導入ドメイン(PTD)をコードする前記第1のDNA配列が配列番号1に記載のアミノ酸配列を含むと共に、Jドメインをコードする前記第2のDNA配列が配列番号3に記載のアミノ酸配列を含む、請求項35に記載のキメラ遺伝子。
【請求項39】
前記Jドメインがヒト熱ショックタンパク質40由来である、請求項35に記載のキメラ遺伝子。
【請求項40】
キメラ遺伝子であって、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、前記第1のDNA配列と翻訳フレームで連結した第2のDNA配列とを含む、キメラ遺伝子。
【請求項41】
タンパク質形質導入ドメイン(PTD)をコードする前記第1のDNA配列が配列番号1に記載のアミノ酸配列を含む、請求項40に記載のキメラ遺伝子。
【請求項42】
Jドメインをコードする前記第2のDNA配列が配列番号3に記載のアミノ酸配列を含む、請求項40に記載のキメラ遺伝子。
【請求項43】
タンパク質形質導入ドメイン(PTD)をコードする前記第1のDNA配列が配列番号1に記載のアミノ酸配列を含むと共に、Jドメインをコードする前記第2のDNA配列が配列番号3に記載のアミノ酸配列を含む、請求項40に記載のキメラ遺伝子。
【請求項44】
前記Jドメインがヒト熱ショックタンパク質40由来である、請求項40に記載のキメラ遺伝子。
【請求項1】
宿主細胞における組換え標的タンパク質の発現系であって、本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含み、該核酸セグメントが前記宿主細胞において、前記組換え標的タンパク質を発現するために、宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結されている、発現系。
【請求項2】
前記タンパク質形質導入ドメインをコードする前記ヌクレオチド配列が配列番号2のヌクレオチド配列を含む、請求項1に記載の発現系。
【請求項3】
前記配列番号2のヌクレオチド配列を、配列番号5及び配列番号6のオリゴヌクレオチドを使用することによって合成する、請求項2に記載の発現系。
【請求項4】
前記HSP40Jドメインが、亜型A、亜型B及び亜型CのHSP40Jドメインから成る群から選択される、請求項1に記載の発現系。
【請求項5】
前記HSP40Jドメインが配列番号3のペプチドを含む、請求項4に記載の発現系。
【請求項6】
前記HSP40Jドメインをコードする前記ヌクレオチド配列が配列番号4のヌクレオチド配列を含む、請求項5に記載の発現系。
【請求項7】
前記配列番号4のヌクレオチド配列を、配列番号7〜配列番号16のオリゴヌクレオチドを使用することによって合成する、請求項6に記載の発現系。
【請求項8】
前記宿主細胞が大腸菌を含む、請求項1に記載の発現系。
【請求項9】
前記標的タンパク質が、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、及びウイルスコアタンパク質の少なくとも1つを含む、請求項1に記載の発現系。
【請求項10】
請求項1に記載の発現系を用いて製造される組換えタンパク質。
【請求項11】
請求項10に記載の組換えタンパク質を含むワクチン。
【請求項12】
宿主細胞において収率を高めて組換え標的タンパク質を製造する方法であって、
本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含む発現ベクターを構築すること(該核酸セグメントが宿主細胞特異的な転写調節要素と翻訳調節要素とに操作可能に連結される)、
前記発現ベクターで前記宿主細胞を形質転換すること、並びに
前記組換え標的タンパク質を前記宿主細胞から回収及び単離することを含む、方法。
【請求項13】
前記タンパク質形質導入ドメインをコードする前記ヌクレオチド配列が配列番号2のヌクレオチド配列を含む、請求項12に記載の方法。
【請求項14】
前記配列番号2のヌクレオチド配列を、配列番号5及び配列番号6のオリゴヌクレオチドを使用することによって合成する、請求項13に記載の方法。
【請求項15】
前記HSP40Jドメインが、亜型A、亜型B及び亜型CのHSP40Jドメインから成る群から選択される、請求項12に記載の方法。
【請求項16】
前記HSP40Jドメインが配列番号3のペプチドを含む、請求項15に記載の方法。
【請求項17】
前記HSP40Jドメインをコードする前記ヌクレオチド配列が配列番号4のヌクレオチド配列を含む、請求項16に記載の方法。
【請求項18】
前記配列番号4のヌクレオチド配列を、配列番号7〜配列番号16のオリゴヌクレオチドを使用することによって合成する、請求項17に記載の方法。
【請求項19】
前記宿主細胞が大腸菌を含む、請求項12に記載の方法。
【請求項20】
前記標的タンパク質が、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、及びウイルスコアタンパク質の少なくとも1つを含む、請求項12に記載の方法。
【請求項21】
免疫原性を高めた組換え標的タンパク質を製造する方法であって、
本質的に配列番号1のタンパク質形質導入ドメインをコードするヌクレオチド配列と、Hsp40−Jドメインをコードするヌクレオチド配列と、標的タンパク質をコードするヌクレオチド配列とから成る核酸セグメントを含む発現ベクターを構築すること(該核酸セグメントが宿主特異的な転写調節要素と翻訳調節要素とに操作可能に連結される)、
前記発現ベクターで前記宿主細胞を形質転換すること、並びに
前記組換え標的タンパク質を前記宿主細胞から回収及び単離することを含む、方法。
【請求項22】
生物を前記組換えタンパク質により免疫付与することをさらに含む、請求項21に記載の方法。
【請求項23】
前記タンパク質形質導入ドメインをコードする前記ヌクレオチド配列が配列番号2のヌクレオチド配列を含む、請求項21に記載の方法。
【請求項24】
前記配列番号2のヌクレオチド配列を、配列番号5及び配列番号6のオリゴヌクレオチドを使用することによって合成する、請求項23に記載の方法。
【請求項25】
前記HSP40Jドメインが、亜型A、亜型B及び亜型CのHSP40Jドメインから成る群から選択される、請求項24に記載の方法。
【請求項26】
前記HSP40Jドメインが配列番号3のペプチドを含む、請求項25に記載の方法。
【請求項27】
前記HSP40Jドメインをコードする前記ヌクレオチド配列が配列番号4のヌクレオチド配列を含む、請求項26に記載の方法。
【請求項28】
前記配列番号4のヌクレオチド配列を、配列番号7〜配列番号16のオリゴヌクレオチドを使用することによって合成する、請求項27に記載の方法。
【請求項29】
前記宿主細胞が大腸菌を含む、請求項21に記載の方法。
【請求項30】
前記標的タンパク質が、HSPペプチド、成長因子、ウイルス受容体結合ドメイン、及びウイルスコアタンパク質の少なくとも1つを含む、請求項21に記載の方法。
【請求項31】
キメラタンパク質であって、
a.前記キメラタンパク質のN末端に、タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片を含有する第1のポリペプチジル断片と、
b.前記第1のポリペプチジル断片のC末端に、Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片を含有する第2のポリペプチジル断片と、
c.前記第2のポリペプチジル断片のC末端に、標的タンパク質又はポリペプチドを含有する第3のポリペプチジル断片とを含む、キメラタンパク質。
【請求項32】
前記第1のポリペプチジル断片が配列番号1に記載のアミノ酸配列を含む、請求項31に記載のキメラタンパク質。
【請求項33】
前記第2のポリペプチジル断片が配列番号3に記載のアミノ酸配列を含む、請求項31に記載のキメラタンパク質。
【請求項34】
前記Jドメインがヒト熱ショックタンパク質40由来である、請求項31に記載のキメラタンパク質。
【請求項35】
キメラ遺伝子であって、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、前記第1のDNA配列と翻訳フレームで連結した第2のDNA配列と、
c.標的タンパク質又はポリペプチドをコードする、前記第2のDNA配列と翻訳フレームで連結した第3のDNA配列とを含む、キメラ遺伝子。
【請求項36】
タンパク質形質導入ドメイン(PTD)をコードする前記第1のDNA配列が配列番号1に記載のアミノ酸配列を含む、請求項35に記載のキメラ遺伝子。
【請求項37】
Jドメインをコードする前記第2のDNA配列が配列番号3に記載のアミノ酸配列を含む、請求項35に記載のキメラ遺伝子。
【請求項38】
タンパク質形質導入ドメイン(PTD)をコードする前記第1のDNA配列が配列番号1に記載のアミノ酸配列を含むと共に、Jドメインをコードする前記第2のDNA配列が配列番号3に記載のアミノ酸配列を含む、請求項35に記載のキメラ遺伝子。
【請求項39】
前記Jドメインがヒト熱ショックタンパク質40由来である、請求項35に記載のキメラ遺伝子。
【請求項40】
キメラ遺伝子であって、
a.タンパク質形質導入ドメイン(PTD)又はHIV Tat PTD活性を有するその断片をコードする第1のDNA配列と、
b.Jドメイン又は熱ショックタンパク質70(Hsp70)非相互作用活性を有するその断片をコードする、前記第1のDNA配列と翻訳フレームで連結した第2のDNA配列とを含む、キメラ遺伝子。
【請求項41】
タンパク質形質導入ドメイン(PTD)をコードする前記第1のDNA配列が配列番号1に記載のアミノ酸配列を含む、請求項40に記載のキメラ遺伝子。
【請求項42】
Jドメインをコードする前記第2のDNA配列が配列番号3に記載のアミノ酸配列を含む、請求項40に記載のキメラ遺伝子。
【請求項43】
タンパク質形質導入ドメイン(PTD)をコードする前記第1のDNA配列が配列番号1に記載のアミノ酸配列を含むと共に、Jドメインをコードする前記第2のDNA配列が配列番号3に記載のアミノ酸配列を含む、請求項40に記載のキメラ遺伝子。
【請求項44】
前記Jドメインがヒト熱ショックタンパク質40由来である、請求項40に記載のキメラ遺伝子。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2010−526544(P2010−526544A)
【公表日】平成22年8月5日(2010.8.5)
【国際特許分類】
【出願番号】特願2010−507780(P2010−507780)
【出願日】平成20年5月15日(2008.5.15)
【国際出願番号】PCT/CN2008/000948
【国際公開番号】WO2008/138229
【国際公開日】平成20年11月20日(2008.11.20)
【出願人】(509316741)康泰生医科技股▲分▼有限公司 (1)
【出願人】(510046572)瑞林生物科技股▲分▼有限公司 (1)
【Fターム(参考)】
【公表日】平成22年8月5日(2010.8.5)
【国際特許分類】
【出願日】平成20年5月15日(2008.5.15)
【国際出願番号】PCT/CN2008/000948
【国際公開番号】WO2008/138229
【国際公開日】平成20年11月20日(2008.11.20)
【出願人】(509316741)康泰生医科技股▲分▼有限公司 (1)
【出願人】(510046572)瑞林生物科技股▲分▼有限公司 (1)
【Fターム(参考)】
[ Back to top ]

