受容体型チロシンホスファターゼPtprbを用いた受容体型チロシンキナーゼの活性抑制
【課題】本発明は、受容体型チロシンホスファターゼPtprbの基質分子となる受容体型チロシンキナーゼを明らかにし、Ptprbの新たな用途を創出することを課題とする。
【解決手段】プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターとして構成される。
【解決手段】プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターとして構成される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は受容体型チロシンホスファターゼPtprbの用途に関する。詳しくは、Ptprbの基質である受容体型チロシンキナーゼの活性抑制に有用な組換えベクター及びその用途、並びにPtprbの活性調節物質のスクリーニング法に関する。
【背景技術】
【0002】
タンパク質のチロシン残基のリン酸化が関与する情報伝達機構は、細胞増殖、細胞分化、細胞移動、恒常性維持や発がんなどに重要な役割を果たしている。チロシンリン酸化レベルは、リン酸化酵素であるプロテインチロシンキナーゼ(PTK)と、脱リン酸化酵素であるプロテインチロシンホスファターゼ(PTP)の活性のバランスによって決定される。PTKとPTPはともに細胞質型と受容体型に大別できる。受容体型PTP(RPTP)は哺乳類において21のメンバーが知られており、構造上の相同性から8つのサブファミリーに分けられる。一方、受容体型PTK(RPTK)は59のメンバーが知られており、20のサブファミリーに分類されている。RPTKは細胞外領域にリガンド分子が結合すると細胞内領域のチロシン残基を自己リン酸化し、活性化する。本発明者らの研究グループは、RPTPであるPtproがRPTKのEphを基質とし、その活性化を制御することを報告した(非特許文献1)。尚、Ptproが属するR3サブファミリーのメンバーPtprb(RB)に関連した特許出願を以下に示す(特許文献1)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特表2009−533337号公報
【非特許文献】
【0004】
【非特許文献1】Nature Neuroscience (2006) 9巻6号761-769
【発明の概要】
【発明が解決しようとする課題】
【0005】
RPTPは生体において重要な役割を果たしており、疾病の治療や創薬の標的として期待される。しかしながら、それぞれのRPTPがどのようなRPTKを基質とするかについて詳細は不明であり、RPTPの具体的な応用の可能性や用途は未知であった。そこで本発明は、特定のRPTPの基質を明らかにし、当該RPTPの新たな用途を創出することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、R3サブファミリーのメンバーPtprb(RB)に注目し、その基質となるRPTKの探索を行った。具体的には、Ptprbの細胞内領域に対して基質捕捉型変異体を作製し、それとRPTKの各サブファミリーの代表的な分子の細胞内領域との間の相互作用の有無について、哺乳類細胞ツーハイブリッド(mammalian two-hybryd)法を用いて網羅的に解析した。その結果、Ptprbとの相互作用を認めるRPTK、即ち、Ptprbの基質と考えられるRPTKを複数見出した。そこで、これらのRPTKが実際にPtprbの基質として機能していることを確認するために、これらのRPTKのいくつかを例にとり検討を進めた。具体的には、HEK293細胞を用いた共発現系による評価、PC12細胞の神経突起誘導系を用いた解析、及びC6グリオーマ細胞を用いた評価を行った(詳細は後述の実施例に示す)。その結果、同定に成功したRPTKがPtprbの基質として機能していることが裏付けられた。
【0007】
以上のように、本発明者らの検討の結果、Ptprbが特定のRPTKを基質として脱リン酸化し、それらの活性化を抑制することが明らかとなった。基質として同定されたRPTKは、細胞増殖、細胞移動、細胞分化、幹細胞の維持等に重要な役割を果たしており、その異常な活性亢進は様々な疾病の原因となる。従って、Ptprbの発現又は活性化は、これらの疾病に対する有効な治療手段となる。即ち、Ptprbを用いれば、その基質となるRPTKの活性抑制を介して、様々な疾病を治療可能となる。例えば、Ptprbの基質として同定されたRPTKの活性亢進を認めるがん細胞においてPtprbを強制発現させることは、当該がん細胞の増殖抑制に有効といえる。このように、Ptprbの基質が明らかになったことは、Ptprbを標的とした創薬の手段を提供できる点からも重要である。
【0008】
以下に示す本願発明は、主として上記の成果及び知見に基づく。
[1]プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクター。
[2]ポリA付加シグナル配列又はポリA配列を更に含む、[1]に記載の組換えベクター。
[3]前記Ptprb遺伝子が全長配列からなる、[1]又は[2]に記載の組換えベクター。
[4]前記Ptprb遺伝子が、配列番号1の配列からなる、[1]〜[3]のいずれか一項に記載の組換えベクター。
[5]前記Ptprb遺伝子として、Ptprbの細胞内領域をコードする配列を少なくとも含む、Ptprb遺伝子の一部が用いられる、[1]又は[2]に記載の組換えベクター。
[6]前記Ptprb遺伝子の一部が、シグナルペプチチド及びPtprbの膜貫通領域をコードする配列も含む、[5]に記載の組換えベクター。
[7]前記Ptprb遺伝子の一部が、配列番号3又は配列番号4の配列からなる、[5]に記載の組換えベクター。
[8]前記基質の異常発現又は異常な発現亢進が発症又は病態の進行の原因となる疾患の治療用である、[1]〜[7]のいずれか一項に記載の組換えベクター。
[9]前記疾患が、癌、癌に伴う血管新生又は自己免疫疾患である、[8]に記載の組換えベクター。
[10][1]〜[9]のいずれか一項に記載の組換えベクターと、薬学的に許容される媒体とを含む組成物。
[11]FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターを製造するための、Ptprb遺伝子の使用。
[12]プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターと、
薬学的に許容される媒体と、
を含む組成物を対象に投与するステップを含む、前記基質の異常発現又は異常な発現亢進が発症又は病態の進行の原因となる疾患の治療法。
【図面の簡単な説明】
【0009】
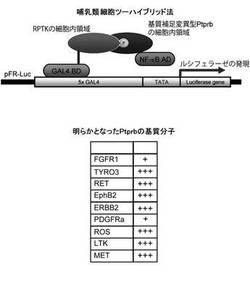
【図1】哺乳類細胞ツーハイブリッド法の概要(上)とPtprbと相互作用することが明らかになったRPTK(下)。表の中で+の数は相互作用の強さを表し、+の数が多いほど相互作用が強いことを表す。
【図2】ウエスタンブロットの結果。RPTKを発現する細胞の細胞抽出液を免疫沈降し、ウエスタンブロットに供した。
【図3】PC12 細胞にa)ベクターのみ(mock)、b)Ptprm (RM(WT))、c)Ptprb(RB(WT))またはd)不活性型のPtprb(RB(DA))を発現させ、basic FGFもしくはGDNF/GFRa1を作用させた。スケールバーは100μm。グラフは細胞体の2倍以上の長さの神経突起を有する細胞の割合を示す。Ptprbの発現により(RB)、長い神経突起を有する細胞の割合が半分以下になった。
【図4】ベクターのみ(mock)とPtprb発現プラスミド(RB)を導入したC6グリオーマ細胞(左)。スケールバーは250μm。右のグラフは、basic FGFを添加後それぞれの時間における1cm2当たりの細胞数を示す。
【図5】C6グリオーマ細胞の脳内移植実験によるPtprbの抗腫瘍活性の評価結果を示す図。上図は脳切片のヘマトキシリン・エオシン染色像であり、上図のうち左図はPtprbを発現していないグリオーマ、右図はPtprbを発現させたグリオーマを示す。スケールバー:0.5mm。下図は腫瘍の大きさを比較したグラフである。n=4。
【発明を実施するための形態】
【0010】
(組換えベクター)
本発明の第1の局面は組換えベクターに関する。本発明の組換えベクターは、Ptprbの基質の活性抑制に用いられる。組換えベクターの用途の詳細は後述する。
【0011】
用語「組換えベクター」とは、目的の遺伝子を標的細胞へ運搬するための運搬体(ベクター)であって、遺伝子工学的手法(遺伝子操作)によって構築されたものをいう。本発明ではPtprb遺伝子が目的の遺伝子である。従って、本発明の組換えベクターにはPtprb遺伝子が挿入されている。尚、説明の便宜上、Ptprb遺伝子を「挿入遺伝子」とも呼ぶ。
【0012】
Ptprb遺伝子を標的細胞に導入し、標的細胞内で発現させることが可能である限り、ベクターの種類は特に限定されない。ここでの「ベクター」にはウイルスベクター及び非ウイルスベクターが含まれる。ウイルスベクターを用いた遺伝子導入法は、ウイルスが細胞へと感染する現象を巧みに利用するものであり、高い遺伝子導入効率が得られる。ウイルスベクターとしてアデノウイルスベクター、アデノ随伴ウイルスベクター、レトロウイルスベクター、レンチウイルスベクター、ヘルペスウイルスベクター、センダイウイルスベクター(例えば、国際公開第97/16539号パンフレット、国際公開第02/000264号パンフレットを参照のこと)、サル免疫不全ウイルス(SIV)ベクター(例えば、国際公開第2002/101057号パンフレット;Nakajima T, Nakamaru K, Ido E, Terao K, Hayami M, Hasegawa M. Development of novel simian immunodeficiency virus vectors carrying a dual gene expression system. Hum Gene Ther 11, 1863-1874, 2000.;Ikeda Y, Goto Y, Yonemitsu Y, Miyazaki M, Sakamoto T, Ishibashi T, Ueda Y, Hasegawa M, Tobimatsu S, Sueishi K. Simian Immunodeficiency Virus-Based Lentiviral Vector For Retinal Gene Transfer: a preclinical safety study in adult rats. Gene Therapy 10: 1161-1169, 2003等を参照のこと)等が開発されている。
【0013】
非ウイルスベクターとしてリポソーム、正電荷型リポソーム(Felgner, P.L., Gadek, T.R., Holm, M. et al., Proc. Natl. Acad. Sci., 84:7413-7417, 1987)、HVJ(Hemagglutinating virus of Japan)-リポソーム(Dzau, V.J., Mann, M., Morishita, R. et al., Proc. Natl. Acad. Sci., 93:11421-11425, 1996、Kaneda, Y., Saeki, Y. & Morishita, R., Molecular Med. Today, 5:298-303, 1999)等が開発されている。本発明の組換えベクターをこのような非ウイルス性ベクターとして構築してもよい。
【0014】
アデノ随伴ウイルスベクター、レトロウイルスベクター、レンチウイルスベクターではベクターに組み込んだ外来遺伝子が宿主染色体へと組み込まれ、安定かつ長期的な発現が期待できる。レトロウイルスベクターの場合はウイルスゲノムの宿主染色体への組み込みには細胞の分裂が必要であることから非分裂細胞への遺伝子導入には適さない。一方、レンチウイルスベクターやアデノ随伴ウイルスベクターは非分裂細胞においても感染後に外来遺伝子の宿主染色体への組み込みが生ずる。従って、これらのベクターは非分裂細胞において安定かつ長期的に外来遺伝子を発現させるために有効である。
【0015】
センダイウイルスベクターは(1)毒性が低い、(2)導入遺伝子の発現効率が高い、(3)導入遺伝子の宿主染色体への組み込みが行われず安全性に優れる等、数多くの利点を有する。
【0016】
「サル免疫不全ウイルス(SIV)ベクター」とは、ウイルス粒子中の核酸分子のうち、ウイルスベクターとして機能に必須な配列がSIVゲノムに基づく配列であるベクターをいう(国際公開WO2006/090689、国際公開WO2006/090697、国際公開WO2007/049752)。「ウイルスベクターとしての機能に必須な配列」とは、5’側から順に、5’LTRのR領域、U5領域、パッケージングシグナル(φ)、RRE、3’LTRのプロモーター領域以外のU3領域、R領域の配列である。また、SIVベクターは、上述の定義に当てはまる限り、改変が施されていてもよく、例えば、「ウイルスベクターとしての機能に必須な配列」がSIV由来である限り、他にSIV由来の配列またはSIV以外の由来の配列を含んでいてもよい。好適に含まれ得る配列として、例えば、cPPT (central polypurine tract)、内部プロモーター(CMV)、内部プロモーター(CAG)、WPRE (woodchuck hepatitis virus posttranscriptional regulatory element)を挙げることができる。サル免疫不全ウイルスベクターは染色体組み込み型ベクターである。サル免疫不全ウイルスベクターは染色体に組み込まれても周囲の遺伝子を活性化することはなく、また二つの治療用遺伝子を同時にしかも所望の比率で発現させることができるという特徴がある。
【0017】
各ウイルスベクターは既報の方法に従い又は市販される専用のキットを用いて作製することができる。例えば、アデノウイルスベクターの作製はCOS-TPC法や完全長DNA導入法などで行うことができる。COS-TPC法は、目的のcDNA又は発現カセットを組み込んだ組換えコスミドと、親ウイルスDNA-末端タンパク質複合体(DNA-TPC)を293細胞に同時トランスフェクションし、293細胞内でおこる相同組換えを利用して組換えアデノウイルスを作製する方法である(Miyake,S., Makimura,M., Kanegae,Y., Harada,S., Takamori,K., Tokuda,C., and Saito,I. (1996) Proc. Natl. Acad. Sci. USA, 93, 1320.)。一方、完全長DNA導入法は、目的の遺伝子を挿入した組換えコスミドを制限消化処理した後、293細胞にトランスフェクションすることによって組換えアデノウイルスを作製する方法である(寺島美保、近藤小貴、鐘ヶ江裕美、斎藤泉(2003)実験医学 21(7)931.)。COS-TPC法はAdenovirus Expression Vector Kit (Dual Version)(タカラバイオ株式会社)、Adenovirus genome DNA-TPC(タカラバイオ株式会社)を利用して行うことができる。また、完全長DNA導入法は、Adenovirus Expression Vector Kit (Dual Version)(タカラバイオ株式会社)を利用して行うことができる。
【0018】
一方、レトロウイルスベクターは以下の手順で作製することができる。まず、ウイルスゲノムの両端に存在するLTR(Long Terminal Repeat)の間のパッケージングシグナル配列以外のウイルスゲノム(gag、pol、env遺伝子)を取り除き、そこへ目的の遺伝子を挿入する。このようにして構築したウイルスDNAを、gag、pol、env遺伝子を構成的に発現するパッケージング細胞に導入する。これによって、パッケージングシグナル配列をもつベクターRNAのみがウイルス粒子に組み込まれ、レトロウイルスベクターが産生される。
【0019】
アデノベクターを応用ないし改良したベクターとして、ファイバータンパク質の改変により特異性を向上させたもの(特異的感染ベクター)や目的遺伝子の発現効率向上が期待できるguttedベクター(ヘルパー依存性型ベクター)などが開発されている。本発明の組換えベクターをこのようなウイルスベクターとして構築してもよい。また、使用可能なベクターとしては、大腸菌、枯草菌、酵母等の由来のプラスミド、λファージ等のバクテリオファージなども例示することができる。
【0020】
本発明の組換えベクターは挿入遺伝子としてPtprb遺伝子を保持している。通常、治療対象の動物種に応じてPtprb遺伝子の種が選択される。例えば、ヒトが治療対象の場合、ヒトPtprb遺伝子を選択するとよい。Ptprb遺伝子の配列、その他の情報は公共のデータベースに登録されており容易に入手可能である。例えば、ヒトPtprb遺伝子はNCBI(National Center for Biotechnology Information)のデータベースにおいてGeneID: 5787で登録されている。ヒトPtprb遺伝子の配列(配列番号1)はACCESSION:NM_001109754(DEFINITION Homo sapiens protein tyrosine phosphatase, receptor type, B (PTPRB), transcript variant 1, mRNA.)で登録されており、ヒトPtprbのアミノ酸配列(配列番号2)はACCESSION: NP_01103224(DEFINITION receptor-type tyrosine-protein phosphatase beta isoform a [Homo sapiens])で登録されている。天然型遺伝子の他、核酸配列の一部の欠失、置換、挿入、付加などによって改変された遺伝子(但し、天然型遺伝子がコードするタンパク質と同等の機能を有するタンパク質をコードする必要がある)を用いることもできる。
【0021】
Ptprb遺伝子の配列は、本明細書又は添付の配列表が開示する配列情報を参考にし、標準的な遺伝子工学的手法、分子生物学的手法、生化学的手法などを用いることによって単離された状態に調製することができる。具体的には、適当な哺乳動物のゲノムDNAライブラリー又はcDNAライブラリー、或いは哺乳動物細胞抽出液から、Ptprb遺伝子に対して特異的にハイブリダイズ可能なオリゴヌクレオチドプローブ・プライマーを適宜利用して調製することができる。オリゴヌクレオチドプローブ・プライマーとしては、例えば、配列番号1に示す塩基配列に相補的なDNA又はその連続した一部が用いられる。オリゴヌクレオチドプローブ・プライマーは市販の自動化DNA合成装置などを用いて容易に合成することができる。尚、Ptprb遺伝子を調製するために用いるライブラリーの作製方法については、例えばMolecular Cloning, Third Edition, Cold Spring Harbor Laboratory Press, New Yorkが参考になる。
【0022】
Ptprb遺伝子の全長ではなく、その一部(部分配列)を用いることにしてもよい。ここで、Ptprbは膜貫通型タンパク質であり、細胞外領域、細胞内領域及び膜貫通領域からなる。Ptprbの基質である受容体型チロシンキナーゼに対する作用を担うドメイン(活性ドメイン)は細胞内領域に含まれる。そこで本発明の一態様では、少なくとも細胞内領域をコードする配列を含む部分Ptprb遺伝子を用いる。本発明で採用可能な部分Ptprb遺伝子の配列の具体例を配列番号3に示す。このように細胞外領域をコードする配列を除いた部分Ptprb遺伝子を用いる場合には、標的細胞内で発現したときに適切な輸送及び局在が達成され、その発現産物(部分RB)が膜結合型タンパク質である基質に対して効率的に作用するように、5'末端側にシグナルペプチド及び膜貫通領域をコードする配列を付加しておくとよい。シグナルペプチド及び膜貫通領域をコードする配列として、本来の配列(即ち、Ptprbのシグナルペプチドをコードする配列)の他、同等の機能を有する配列(例えば、RPTPファミリーに属するメンバーの配列やI型膜タンパク質の配列など)を用いることができる。尚、シグナルペプチド及び膜貫通領域をコードする配列が付加された部分Ptprb遺伝子(細胞内領域をコードする配列を含む)の例を配列番号4に示す。
【0023】
本発明の一態様では、配列番号2に示すアミノ酸配列からなるタンパク質と比較した場合にその機能は同等であるものの一部においてアミノ酸配列が相違するタンパク質(以下、「相同蛋白質」ともいう)をコードする核酸配列を用いて組換えベクターが構築される。このように本発明では、配列番号2のアミノ酸配列を有するタンパク質と機能面から実質的に同一と見なされる(換言すれば該アミノ酸配列と比較してPtprbタンパク質の機能に実質的に影響しない部分でのみ相違する)タンパク質をコードする核酸配列を用いて組換えベクターを構築してもよい。このような組換えベクターによれば、配列番号2のアミノ酸配列をコードする核酸配列が組み込まれた組換えベクターと同様に、標的細胞内で基質の活性を抑制するタンパク質を強制発現させることができる。
【0024】
ここで、「一部においてアミノ酸配列が相違する」とは、典型的には、アミノ酸配列を構成する1〜数個のアミノ酸の欠失、置換、若しくは1〜数個のアミノ酸の付加、挿入、又はこれらの組合せによりアミノ酸配列に変異(変化)が生じていることをいう。ここでのアミノ酸配列の相違は、基質の活性を抑制するという機能が保持される限り許容される。この条件を満たす限りアミノ酸配列が相違する位置は特に限定されず、また複数の位置で相違が生じていてもよい。ここでの複数とは例えば全アミノ酸の約30%未満に相当する数であり、好ましくは約20%未満に相当する数であり、さらに好ましくは約10%未満に相当する数であり、より一層好ましくは約5%未満に相当する数であり、最も好ましくは約1%未満に相当する数である。即ち相同的タンパク質は配列番号2のアミノ酸配列と例えば約70%以上、好ましくは約80%以上、さらに好ましくは約90%以上、より一層好ましくは約95%以上、最も好ましくは約99%以上の同一性を有する。
【0025】
好ましくは、保存的アミノ酸置換を非必須アミノ酸残基(基質の活性を抑制するという機能に関与しないアミノ酸残基)に生じさせることによって相同タンパク質を得る。ここでの「保存的アミノ酸置換」とは、あるアミノ酸残基を、同様の性質の側鎖を有するアミノ酸残基に置換することをいう。アミノ酸残基はその側鎖によって塩基性側鎖(例えばリシン、アルギニン、ヒスチジン)、酸性側鎖(例えばアスパラギン酸、グルタミン酸)、非荷電極性側鎖(例えばアスパラギン、グルタミン、セリン、スレオニン、チロシン、システイン)、非極性側鎖(例えばグリシン、アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン)、β分岐側鎖(例えばスレオニン、バリン、イソロイシン)、芳香族側鎖(例えばチロシン、フェニルアラニン、トリプトファン)のように、いくつかのファミリーに分類されている。保存的アミノ酸置換は好ましくは、同一のファミリー内のアミノ酸残基間の置換である。
【0026】
相同的タンパク質をコードする核酸配列を調製するにあたっては、チロシンホスファターゼ活性を有する領域(即ち細胞内領域)の改変を避けることが好ましい。
【0027】
ここで、二つのアミノ酸配列の同一性(%)は例えば以下の手順で決定することができる。まず、最適な比較ができるよう二つの配列を並べる(例えば、第一の配列にギャップを導入して第二の配列とのアライメントを最適化してもよい)。第一の配列の特定位置の分子(アミノ酸残基)が、第二の配列における対応する位置の分子と同じであるとき、その位置の分子が同一であるという。二つの配列の同一性は、その二つの配列に共通する同一位置の数の関数であり(すなわち、同一性(%)=同一位置の数/位置の総数 × 100)、好ましくは、アライメントの最適化に要したギャップの数およびサイズも考慮に入れる。
二つの配列の比較及び同一性の決定は数学的アルゴリズムを用いて実現可能である。配列の比較に利用可能な数学的アルゴリズムの具体例としては、KarlinおよびAltschul (1990) Proc. Natl. Acad. Sci. USA 87:2264-68に記載され、KarlinおよびAltschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-77において改変されたアルゴリズムがあるが、これに限定されることはない。このようなアルゴリズムは、Altschulら (1990) J. Mol. Biol. 215:403-10に記載のNBLASTプログラムおよびXBLASTプログラム(バージョン2.0)に組み込まれている。あるアミノ酸配列に相同的なアミノ酸配列を得るには例えば、XBLASTプログラムでscore = 50、wordlength = 3としてBLASTポリペプチド検索を行えばよい。比較のためのギャップアライメントを得るためには、Altschulら (1997) Amino Acids Research 25(17):3389-3402に記載のGapped BLASTが利用可能である。BLASTおよびGapped BLASTを利用する場合は、対応するプログラム(例えばXBLASTおよびNBLAST)のデフォルトパラメータを使用することができる。詳しくはhttp://www.ncbi.nlm.nih.govを参照されたい。配列の比較に利用可能な他の数学的アルゴリズムの例としては、MyersおよびMiller (1988) Comput Appl Biosci. 4:11-17に記載のアルゴリズムがある。このようなアルゴリズムは、例えばGENESTREAMネットワークサーバー(IGH Montpellier、フランス)またはISRECサーバーで利用可能なALIGNプログラムに組み込まれている。アミノ酸配列の比較にALIGNプログラムを利用する場合は例えば、PAM120残基質量表を使用し、ギャップ長ペナルティ=12、ギャップペナルティ=4とすることができる。二つのアミノ酸配列の同一性を、GCGソフトウェアパッケージのGAPプログラムを用いて、Blossom 62マトリックスまたはPAM250マトリックスを使用し、ギャップ加重=12、10、8、6、又は4、ギャップ長加重=2、3、又は4として決定することができる。
【0028】
本発明の組換えベクターには、標的細胞内での挿入遺伝子の発現を可能にすべくプロモーターが組み込まれている。挿入遺伝子は、プロモーターに作動可能に連結している。当該構成の組換えベクターではプロモーターの作用によって挿入遺伝子を標的細胞内で強制発現させることが可能となる。ここでの「プロモーターに作動可能に連結された」とは「プロモーターの制御下に配置された」と同義であり、通常、プロモーターの3'末端側に直接又は他の配列を介して挿入遺伝子が連結されることになる。
【0029】
プロモーターには、CMV-IE(サイトメガロウイルス初期遺伝子由来プロモーター)、SV40ori、レトロウイルスLTP、SRα、EF1α、βアクチンプロモーター等を使用可能である。アセチルコリンレセプタープロモーター、エノラーゼプロモーター、L7プロモーター、ネスチンプロモーター、アルブミンプロモーター、アルファフェトプロテインプロモーター、ケラチンプロモーター、インスリンプロモーター等、哺乳動物組織特異的プロモーターを使用してもよい。
【0030】
本発明の組換えベクター内にポリA付加シグナル配列又はポリA配列、エンハンサー配列、選択マーカー配列等を配置することもできる。ポリA付加シグナル配列又はポリA配列の使用によって、組換えベクターから生ずるmRNAの安定性が向上する。ポリA付加シグナル配列又はポリA配列は、下流側において挿入遺伝子に連結される。一方、エンハンサー配列の使用によって発現効率の向上が図られる。また、選択マーカー配列を含有する組換えベクターを使用すれば、選択マーカーを利用して組換えベクターの導入の有無(及びその程度)を確認することができる。
【0031】
尚、プロモーター、挿入遺伝子、エンハンサー配列(必要な場合)、選択マーカー配列(必要な場合)等の挿入操作等は標準的な組換えDNA技術(例えば、Molecular Cloning, Third Edition, 1.84, Cold Spring Harbor Laboratory Press, New Yorkを参照することができる)を用いて行うことができる。
【0032】
(組換えベクターの用途)
本発明の組換えベクターは、Ptprbの基質であることが明らかになった分子、即ち、FGFR1(fibroblast growth factor receptor 1)、TYRO3(TYRO3 protein tyrosine kinase 3)、RET(c-ret protooncogene)、EphB2(ephrin type-B receptor 2)、ERBB2(erythroblastic leukemia viral oncogene homolog 2)、PDGFRa(platelet-derived growth factor receptor, alpha polypeptide)、ROS(v-ros avian UR2 sarcoma virus oncogene homolog 1)、LTK(leukocyte tyrosine kinase)、MET(MNNG HOS transforming gene)の活性を抑制する目的に供される。換言すれば、本発明の組換えベクターを用いれば、標的細胞内における基質(一つ又は二つ以上)の活性を抑制する方法(以下、「本発明の活性抑制法」とも呼ぶ)を提供できる。また、本発明の組換えベクターは、Ptprb遺伝子を含む、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の脱リン酸化剤として用いることができる。尚、本発明において用語「抑制」は用語「阻害」と交換可能に使用される。
【0033】
本発明の活性抑制法では、本発明の組換えベクターが標的細胞に導入される。ここでの「標的細胞」は典型的には哺乳動物細胞である。即ち、ヒト又はサル、マウス、ラット等の非ヒト哺乳類の各種細胞、例えば、心筋細胞、平滑筋細胞、脂肪細胞、線維芽細胞、骨細胞、軟骨細胞、破骨細胞、実質細胞、表皮角化細胞(ケラチノサイト)、上皮細胞(皮膚表皮細胞、角膜上皮細胞、結膜上皮細胞、口腔粘膜上皮、毛包上皮細胞、口腔粘膜上皮細胞、気道粘膜上皮細胞、腸管粘膜上皮細胞など)、内皮細胞(角膜内皮細胞、血管内皮細胞など)、神経細胞、グリア細胞、脾細胞、膵臓β細胞、メサンギウム細胞、ランゲルハンス細胞、肝細胞、又はこれらの前駆細胞、或いは間葉系幹細胞(MSC)、胚性幹細胞(ES細胞)、胚性生殖細胞(EG細胞)、成体幹細胞、受精卵などを標的細胞にすることが可能である。HeLa細胞、CHO細胞、Vero細胞、HEK293細胞、HepG2細胞、COS-7細胞、NIH3T3細胞などの株化された細胞等を標的細胞にすることもできる。詳しくは後述するが、本発明の活性抑制法は特定の疾病の治療に有用であり、癌細胞、血管内皮細胞、リンパ系細胞等が好ましい標的細胞となる。
【0034】
単離された標的細胞、又は生物個体を構成した状態の標的細胞に対して本発明の組換えベクターが導入される。ここでの「単離された」とは、その本来の環境(例えば生体を構成した状態)から取り出された状態にあることをいう。従って通常は、単離された標的細胞は培養容器内又は保存容器内に存在し、それへのin vitroでの人為的操作が可能である。具体的には、生体から分離され、生体外で培養状態にある細胞(株化された細胞を含む)は、単離された標的細胞としての適格を有する。上記の意味において単離された状態にある限り、組織体を形成した状態であっても単離された細胞である。単離された標的細胞は生物個体より調製することができる。一方、独立行政法人理化学研究所バイオリソースセンター、独立行政法人 製品評価技術基盤機構、ATCC (American Type Culture Collection)、DSMZ(German Collection of Microorganisms and Cell Cultures)などより入手した細胞を、単離された標的細胞として使用することもできる。
【0035】
標的細胞への組換えベクターの導入は、標的細胞の種類、組換えベクターの構成などを考慮して、リン酸カルシウム共沈殿法、リポフェクション(Felgner, P.L. et al., Proc. Natl. Acad. Sci. U.S.A. 84,7413-7417(1984))、HVJリポソーム法、DEAEデキストラン法、エレクトロポーレーション(Potter,H. et al., Proc. Natl. Acad. Sci. U.S.A. 81, 7161-7165(1984))、マイクロインジェクション(Graessmann,M. & Graessmann,A., Proc. Natl. Acad. Sci. U.S.A. 73,366-370(1976))、遺伝子銃法、超音波遺伝子導入法等によって実施することができる。ウイルスベクターとして構築された組換えベクターを使用する場合には原則、感染によって標的細胞への導入が行われる。
【0036】
本発明の活性抑制法は、Ptprbの基質(FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK、MET、VEGFR1、VEGFR2、VEGFR3、TrkB、EGFR1、RON、ROR1、ROR2)の活性を抑制することに利用される。従って本発明の活性抑制法は、当該基質の異常な活性化又は異常な発現亢進が発症又は病態の進行の原因(副次的な原因であってもよい)となる疾患(標的疾病)の予防又は治療のため(即ち医療目的)の有効な手段といえる。このように本発明の活性抑制法は、特定の疾患に対する遺伝子治療(又はその一部)として利用され得る。
【0037】
ここで、Ptprbの基質の一つであるFGFR1は、発癌に関与する。また、FGFR1は癌に伴う血管新生に関与する。同様にRETは、多発性内分泌腫瘍症2型および甲状腺乳頭癌の発症に関与する。また、EphB2は、発癌に関与する。また、EphB2は癌に伴う血管新生に関与する。また、METは、固形腫瘍形成およびそれの転移に関与する。また、ERBB2は、発癌に関与する。また、PDGFRaは、癌に伴う血管新生に関与する。LTKは、自己免疫疾患に関与する。以上の事実を考慮すれば、本発明の活性抑制法が適用される標的疾患の例として、癌、血管新生、自己免疫疾患を挙げることができる。このように、本発明の活性抑制法は、癌、癌に伴う血管新生、自己免疫疾患等を罹患する対象(患者)に適用され得る。これらの疾患に罹患していると診断される前の患者(潜在的患者)に対して本発明の活性抑制法を適用することも可能である。換言すれば、予防的医療措置に本発明を利用することにしてもよい。
【0038】
ここで、遺伝子治療法には、遺伝子導入用の組換えベクターを直接患者体内へ投与する治療法(in vivo遺伝子治療法)と、治療対象から採取した細胞に対して体外で遺伝子導入した後、細胞を患者に投与する治療法(ex vivo治療法)がある。本発明の抑制法はいずれの治療法に対しても適用可能である。in vivo遺伝子治療法の場合における組換えベクターの投与経路は特に限定されず例えば局所接種、静脈内、皮内、皮下、筋肉内及び腹腔内などへの注入によって投与が実施される。これらの投与経路は互いに排他的なものではなく、任意に選択される二つ以上を併用することもできる(例えば、経口投与と同時に又は所定時間経過後に静脈注射等を行う等)。ここでの「治療対象」は特に限定されず、ヒト、及びヒト以外の哺乳動物(ペット動物、家畜、実験動物を含む。具体的には例えばマウス、ラット、モルモット、ハムスター、サル、ウシ、ブタ、ヤギ、ヒツジ、イヌ、ネコ、ニワトリ、ウズラ等である)を含む。好適には、本発明の抑制方法を利用した治療法の治療対象はヒトである。
【0039】
本発明の組換えベクターに、薬学的に許容可能な媒体を組み合わせることによって標的疾患治療用の組成物を構成することができる。「薬学的に許容可能な媒体」とは、組換えベクターの薬効(即ち標的疾患に対する治療効果)に実質的な影響を与えることなく組換えベクターの投与や保存等に関して利点ないし恩恵をもたらす物質をいう。「薬学的に許容可能な媒体」として、脱イオン水、超純水、生理食塩水、リン酸緩衝生理食塩水(PBS)、5%デキストロース水溶液等を例示できる。本発明の組成物に、懸濁剤、無痛化剤、安定剤(アルブミンやPrionex(登録商標、ペンタファームジャパン(株)製)等)、保存剤、防腐剤など、その他の成分を含有させてもよい。本発明の組成物を、凍結乾燥体として調製することもできる。
【0040】
本発明の組換えベクターがウイルスベクターの形態の場合、生体適合性のポリオル(例えばpoloxamer407など)を併用することが好ましい。ポリオルの使用によってウイルスベクターの形質導入率を10〜100倍に上昇させ得る(March et al., Human Gene Therapy 6:41-53, 1995)。従って、ポリオルを併用することにすればウイルスベクターの投与量を低く抑えることができる。尚、本発明の組成物の一成分としてポリオルを使用することにしても、本発明の組成物とは別にポリオル(又はそれを含む組成物)を調製することにしてもよい。後者の場合、本発明の組成物を投与するときにポリオル(又はそれを含む組成物)を併せて投与することになる。
【0041】
本発明の組換えベクターは全身投与又は局所投与によって対象に投与されるが、効率的な送達を達成し且つ副作用を低減するため、後者の投与方法を採用することが好ましい。例えば、腫瘍内への注入などの局所投与によって組換えベクターを送達すればよい。
【0042】
中でもウイルスベクターを使用する方法を採用することが好ましい。当該方法によれば、比較的簡便な操作によって効率的に標的細胞へ遺伝子導入することが可能である。従って、患者への負担を軽減しつつ治療効果の増大を図ることができる。
【0043】
本発明の組換えベクターは、治療上有効な量のPtprb遺伝子が標的細胞(例えばがん細胞)へ導入されるよう、その投与量が設定される。「治療上有効な量」とは、Ptprb遺伝子による治療効果(症状の改善、治癒など)をもたらすことが可能な量をいう。本発明の組換えベクターの投与量は一般に、組換えベクターの形態、投与経路、治療対象の症状、年齢、性別及び体重などによって異なるが、当業者であれば適宜適当な投与量を設定することが可能である。成人(体重約60kg)を対象として1回あたりに投与されるPtprb遺伝子の量が例えば40〜400μg、好ましくは200〜400μgとなるように、組換えベクターの投与量を設定するとよい。また、ウイルスベクターを利用して本発明の組換えベクターを構築した場合には、成人(体重約60kg)を対象として1回あたりに投与されるウイルスベクターの量が例えば2.0 x 108〜2.0 x 109CIU(cell-infectious units)/ml、好ましくは1.0 x 109〜2.0 x 109CIU/mlとなるように、組換えベクターの投与量を設定するとよい。投与スケジュールとしては例えば一日一回〜数回、二日に一回、或いは三日に一回などを採用できる。投与スケジュールの作成においては、対象(レシピエント)の症状、性別、年齢、病態などを考慮することができる。
【実施例】
【0044】
1.Ptprbの基質分子の探索
マウス由来Ptprbの基質捕捉変異体を用いて、哺乳類細胞ツーハイブリッド(Mammalian two-hybrid)法により、Ptprbが基質とする受容体型チロシンキナーゼのスクリーニングを行った。使用した基質捕捉変異体は、Ptprbの2088番目のアスパラギン酸をアラニンに置換したものであり、PTP活性中心側のシステイン残基と基質側のリン酸基間で共有結合が形成された状態で反応が停止することによりPTP−基質複合体が形成されるものである。スクリーニングは、Stratagene社のMammalian two-hybrid assay kitを使用して行った。様々な受容体型チロシンキナーゼの細胞内領域のcDNAをpCMV-BDベクターに挿入し、一方、Ptprbの細胞内領域の基質捕捉型変異体をコードするcDNAをpCMV-ADベクターに挿入した。株化細胞のCOS7細胞に、これらのプラスミドとルシフェラーゼをコードするレポータープラスミドを共導入し、24時間後にルシフェラーゼの発現を定量解析した。その結果、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTKおよびMetがPtprbの基質捕捉変異体との相互作用を示し、これらの受容体型チロシンキナーゼがPtprbの基質分子となることが明らかになった(図1)。
【0045】
2.Ptprbによる、FGFR1、TYRO3、RET及びEphB2の自己リン酸化抑制
FLAGタグあるいはMycタグを付加した、全長のマウス由来受容体型チロシンキナーゼ(RPTK)を発現するプラスミド(RPTK発現プラスミド)を構築するとともに、HAタグを付加したマウス由来Ptprb(全長配列)を発現するプラスミド(Ptprb発現プラスミド)を構築した。発現プラスミドの構築はpDisplayベクター(Life Technologies社製)を使用して行った。次いで、株化細胞のHEK293細胞に、構築したRPTK発現プラスミドを単独で、又はPtprb発現プラスミドと共に導入し、24時間後に細胞抽出液を調製した。抽出液について、抗FLAG抗体、抗Myc抗体、あるいは抗HA抗体を用いて免疫沈降を行った。これら免疫沈降物について抗リン酸化チロシン抗体を用いたウエスタンブロットを行ったところ、FGFR1、TYRO3、RETおよびEphB2のチロシンリン酸化レベルは、RPTKを単独で発現させた場合に比べて、Ptprbと共発現させた場合に顕著に低下した(図2)。
【0046】
3.リガンド刺激によるFGFR1及びRETの活性化の抑制
FGFR1およびRETを内在的に発現するPC12細胞を、それぞれのリガンド分子であるbasic FGF(50 ng/ml)(図3A)、あるいは、GDNF(25 ng/ml)およびGFRa1(300 ng/ml)(図3B)で刺激すると、神経突起の伸長が誘導される。まず、マウス由来Ptprb(全長配列)を発現するプラスミド、Ptprbと異なる受容体型チロシンホスファターゼであるマウス由来Ptprmの発現プラスミド、及びPtprbの不活性型変異体(RB(DA))の発現プラスミドを構築した。使用した不活性型変異体は、マウス由来Ptprbの2088番目のアスパラギン酸をアラニンに置換したものであり、Ptprb活性を有さない。なお、これらの発現プラスミドの構築はpDisplayベクター(Life Technologies社製)を使用して行った。次いで、PC12細胞に、コントロールプラスミド、構築したPtprm発現プラスミド、Ptprb発現プラスミド、あるいは不活性型Ptprb発現プラスミドをそれぞれ導入し、24時間後にbasic FGFもしくはGDNF/GFRa1を作用させた。さらに24時間後の突起伸長について解析したところ、コントロールプラスミド(mock)、Ptprm(RM(WT))、およびPtprbの不活性型変異体(RB(DA))では、長い神経突起の伸長が観察されたのに対して、野生型のPtprb(RB(WT))の発現により、FGFR1およびRETのリガンド刺激による神経突起伸長活性が顕著に抑制された。それぞれのプラスミドが導入された細胞の形態を示した(左)。
【0047】
4.FGF依存的な癌細胞の増殖の抑制
無血清下においてFGFに依存的に増殖することが知られているC6グリオーマ細胞(基質FGFR1の高発現を認める)を用いて、Ptprbによる癌細胞の増殖抑制効果について調べた。まず、上記2.で構築したものと同じPtprb発現プラスミド、又はコントロールプラスミドをC6グリオーマ細胞にそれぞれ導入し、次いで、50 ng/mlのbasic FGFを含む培地下で培養した。その後、C6グリオーマ細胞の増殖について調べたところ、コントロールプラスミド(mock)においては細胞増殖が観察されたのに対して、Ptprbを発現させた細胞では、細胞増殖が顕著に抑制された(図4)。培養0時間後と48時間後の、それぞれのプラスミドが導入された細胞を示した。
【0048】
5.生体内における癌細胞の増殖の抑制
テトラサイクリン発現調整システム(Tet-on system、Clontech社製)を用いて、マウス由来Ptprb遺伝子(全長配列)を含むPtprb発現ベクターを構築し、これをC6グリオーマ細胞に導入した。次いで、選択薬剤(G418とハイグロマイシン)を含む培地で2週間培養を行い、Ptprb発現ベクターを安定的に保持するクローンを得た。さらに、これらのクローン中からテトラサイクリンの誘導体であるdoxycyclineによりPtprbの発現誘導を確認できたC6グリオーマクローンを得た。
次いで、doxycyclineを1mg投与したラットと、doxycycline無投与のラットとを用意し、上記のC6グリオーマクローンを一定数(5 x105個)、それぞれのラット脳内に移植した。ラットを6日間飼育した後、脳切片を摘出し、その摘出した脳切片についてヘマトキシリン・エオシン染色を行い、腫瘍の大きさを比較した。その結果を図5に示す。尚、図5の上図において、矢頭で囲まれた領域が腫瘍を示している。図5に示すように、doxycyclineによりPtprbを発現させたラット(図5上の右)では、Ptprbを発現させなかったラット(図5上の左)に比べてグリオーマクローンの増殖が顕著に抑制された。また、腫瘍の大きさ(体積)を調べたところ、Ptprbを発現させたラットでは、Ptprbを発現させなかったラットの1/3と小さかった(図5下)。
【産業上の利用可能性】
【0049】
チロシンキナーゼ活性の異常亢進が原因の疾患が数多く知られている。例えば、がん細胞においては特定のチロシンキナーゼの活性が亢進していることが知られており、いくつかの癌治療にチロシンキナーゼ活性を抑制する低分子化合物が使用されている。本発明の組換えベクターは、タンパク質分子である受容体型チロシンホスファターゼを利用した治療を可能にするものであり、治療の選択肢を広げる。また、創薬の分野で活用されることが期待される。
【0050】
この発明は、上記発明の実施の形態及び実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。本明細書の中で明示した論文、公開特許公報、及び特許公報などの内容は、その全ての内容を援用によって引用することとする。
【技術分野】
【0001】
本発明は受容体型チロシンホスファターゼPtprbの用途に関する。詳しくは、Ptprbの基質である受容体型チロシンキナーゼの活性抑制に有用な組換えベクター及びその用途、並びにPtprbの活性調節物質のスクリーニング法に関する。
【背景技術】
【0002】
タンパク質のチロシン残基のリン酸化が関与する情報伝達機構は、細胞増殖、細胞分化、細胞移動、恒常性維持や発がんなどに重要な役割を果たしている。チロシンリン酸化レベルは、リン酸化酵素であるプロテインチロシンキナーゼ(PTK)と、脱リン酸化酵素であるプロテインチロシンホスファターゼ(PTP)の活性のバランスによって決定される。PTKとPTPはともに細胞質型と受容体型に大別できる。受容体型PTP(RPTP)は哺乳類において21のメンバーが知られており、構造上の相同性から8つのサブファミリーに分けられる。一方、受容体型PTK(RPTK)は59のメンバーが知られており、20のサブファミリーに分類されている。RPTKは細胞外領域にリガンド分子が結合すると細胞内領域のチロシン残基を自己リン酸化し、活性化する。本発明者らの研究グループは、RPTPであるPtproがRPTKのEphを基質とし、その活性化を制御することを報告した(非特許文献1)。尚、Ptproが属するR3サブファミリーのメンバーPtprb(RB)に関連した特許出願を以下に示す(特許文献1)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特表2009−533337号公報
【非特許文献】
【0004】
【非特許文献1】Nature Neuroscience (2006) 9巻6号761-769
【発明の概要】
【発明が解決しようとする課題】
【0005】
RPTPは生体において重要な役割を果たしており、疾病の治療や創薬の標的として期待される。しかしながら、それぞれのRPTPがどのようなRPTKを基質とするかについて詳細は不明であり、RPTPの具体的な応用の可能性や用途は未知であった。そこで本発明は、特定のRPTPの基質を明らかにし、当該RPTPの新たな用途を創出することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、R3サブファミリーのメンバーPtprb(RB)に注目し、その基質となるRPTKの探索を行った。具体的には、Ptprbの細胞内領域に対して基質捕捉型変異体を作製し、それとRPTKの各サブファミリーの代表的な分子の細胞内領域との間の相互作用の有無について、哺乳類細胞ツーハイブリッド(mammalian two-hybryd)法を用いて網羅的に解析した。その結果、Ptprbとの相互作用を認めるRPTK、即ち、Ptprbの基質と考えられるRPTKを複数見出した。そこで、これらのRPTKが実際にPtprbの基質として機能していることを確認するために、これらのRPTKのいくつかを例にとり検討を進めた。具体的には、HEK293細胞を用いた共発現系による評価、PC12細胞の神経突起誘導系を用いた解析、及びC6グリオーマ細胞を用いた評価を行った(詳細は後述の実施例に示す)。その結果、同定に成功したRPTKがPtprbの基質として機能していることが裏付けられた。
【0007】
以上のように、本発明者らの検討の結果、Ptprbが特定のRPTKを基質として脱リン酸化し、それらの活性化を抑制することが明らかとなった。基質として同定されたRPTKは、細胞増殖、細胞移動、細胞分化、幹細胞の維持等に重要な役割を果たしており、その異常な活性亢進は様々な疾病の原因となる。従って、Ptprbの発現又は活性化は、これらの疾病に対する有効な治療手段となる。即ち、Ptprbを用いれば、その基質となるRPTKの活性抑制を介して、様々な疾病を治療可能となる。例えば、Ptprbの基質として同定されたRPTKの活性亢進を認めるがん細胞においてPtprbを強制発現させることは、当該がん細胞の増殖抑制に有効といえる。このように、Ptprbの基質が明らかになったことは、Ptprbを標的とした創薬の手段を提供できる点からも重要である。
【0008】
以下に示す本願発明は、主として上記の成果及び知見に基づく。
[1]プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクター。
[2]ポリA付加シグナル配列又はポリA配列を更に含む、[1]に記載の組換えベクター。
[3]前記Ptprb遺伝子が全長配列からなる、[1]又は[2]に記載の組換えベクター。
[4]前記Ptprb遺伝子が、配列番号1の配列からなる、[1]〜[3]のいずれか一項に記載の組換えベクター。
[5]前記Ptprb遺伝子として、Ptprbの細胞内領域をコードする配列を少なくとも含む、Ptprb遺伝子の一部が用いられる、[1]又は[2]に記載の組換えベクター。
[6]前記Ptprb遺伝子の一部が、シグナルペプチチド及びPtprbの膜貫通領域をコードする配列も含む、[5]に記載の組換えベクター。
[7]前記Ptprb遺伝子の一部が、配列番号3又は配列番号4の配列からなる、[5]に記載の組換えベクター。
[8]前記基質の異常発現又は異常な発現亢進が発症又は病態の進行の原因となる疾患の治療用である、[1]〜[7]のいずれか一項に記載の組換えベクター。
[9]前記疾患が、癌、癌に伴う血管新生又は自己免疫疾患である、[8]に記載の組換えベクター。
[10][1]〜[9]のいずれか一項に記載の組換えベクターと、薬学的に許容される媒体とを含む組成物。
[11]FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターを製造するための、Ptprb遺伝子の使用。
[12]プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターと、
薬学的に許容される媒体と、
を含む組成物を対象に投与するステップを含む、前記基質の異常発現又は異常な発現亢進が発症又は病態の進行の原因となる疾患の治療法。
【図面の簡単な説明】
【0009】
【図1】哺乳類細胞ツーハイブリッド法の概要(上)とPtprbと相互作用することが明らかになったRPTK(下)。表の中で+の数は相互作用の強さを表し、+の数が多いほど相互作用が強いことを表す。
【図2】ウエスタンブロットの結果。RPTKを発現する細胞の細胞抽出液を免疫沈降し、ウエスタンブロットに供した。
【図3】PC12 細胞にa)ベクターのみ(mock)、b)Ptprm (RM(WT))、c)Ptprb(RB(WT))またはd)不活性型のPtprb(RB(DA))を発現させ、basic FGFもしくはGDNF/GFRa1を作用させた。スケールバーは100μm。グラフは細胞体の2倍以上の長さの神経突起を有する細胞の割合を示す。Ptprbの発現により(RB)、長い神経突起を有する細胞の割合が半分以下になった。
【図4】ベクターのみ(mock)とPtprb発現プラスミド(RB)を導入したC6グリオーマ細胞(左)。スケールバーは250μm。右のグラフは、basic FGFを添加後それぞれの時間における1cm2当たりの細胞数を示す。
【図5】C6グリオーマ細胞の脳内移植実験によるPtprbの抗腫瘍活性の評価結果を示す図。上図は脳切片のヘマトキシリン・エオシン染色像であり、上図のうち左図はPtprbを発現していないグリオーマ、右図はPtprbを発現させたグリオーマを示す。スケールバー:0.5mm。下図は腫瘍の大きさを比較したグラフである。n=4。
【発明を実施するための形態】
【0010】
(組換えベクター)
本発明の第1の局面は組換えベクターに関する。本発明の組換えベクターは、Ptprbの基質の活性抑制に用いられる。組換えベクターの用途の詳細は後述する。
【0011】
用語「組換えベクター」とは、目的の遺伝子を標的細胞へ運搬するための運搬体(ベクター)であって、遺伝子工学的手法(遺伝子操作)によって構築されたものをいう。本発明ではPtprb遺伝子が目的の遺伝子である。従って、本発明の組換えベクターにはPtprb遺伝子が挿入されている。尚、説明の便宜上、Ptprb遺伝子を「挿入遺伝子」とも呼ぶ。
【0012】
Ptprb遺伝子を標的細胞に導入し、標的細胞内で発現させることが可能である限り、ベクターの種類は特に限定されない。ここでの「ベクター」にはウイルスベクター及び非ウイルスベクターが含まれる。ウイルスベクターを用いた遺伝子導入法は、ウイルスが細胞へと感染する現象を巧みに利用するものであり、高い遺伝子導入効率が得られる。ウイルスベクターとしてアデノウイルスベクター、アデノ随伴ウイルスベクター、レトロウイルスベクター、レンチウイルスベクター、ヘルペスウイルスベクター、センダイウイルスベクター(例えば、国際公開第97/16539号パンフレット、国際公開第02/000264号パンフレットを参照のこと)、サル免疫不全ウイルス(SIV)ベクター(例えば、国際公開第2002/101057号パンフレット;Nakajima T, Nakamaru K, Ido E, Terao K, Hayami M, Hasegawa M. Development of novel simian immunodeficiency virus vectors carrying a dual gene expression system. Hum Gene Ther 11, 1863-1874, 2000.;Ikeda Y, Goto Y, Yonemitsu Y, Miyazaki M, Sakamoto T, Ishibashi T, Ueda Y, Hasegawa M, Tobimatsu S, Sueishi K. Simian Immunodeficiency Virus-Based Lentiviral Vector For Retinal Gene Transfer: a preclinical safety study in adult rats. Gene Therapy 10: 1161-1169, 2003等を参照のこと)等が開発されている。
【0013】
非ウイルスベクターとしてリポソーム、正電荷型リポソーム(Felgner, P.L., Gadek, T.R., Holm, M. et al., Proc. Natl. Acad. Sci., 84:7413-7417, 1987)、HVJ(Hemagglutinating virus of Japan)-リポソーム(Dzau, V.J., Mann, M., Morishita, R. et al., Proc. Natl. Acad. Sci., 93:11421-11425, 1996、Kaneda, Y., Saeki, Y. & Morishita, R., Molecular Med. Today, 5:298-303, 1999)等が開発されている。本発明の組換えベクターをこのような非ウイルス性ベクターとして構築してもよい。
【0014】
アデノ随伴ウイルスベクター、レトロウイルスベクター、レンチウイルスベクターではベクターに組み込んだ外来遺伝子が宿主染色体へと組み込まれ、安定かつ長期的な発現が期待できる。レトロウイルスベクターの場合はウイルスゲノムの宿主染色体への組み込みには細胞の分裂が必要であることから非分裂細胞への遺伝子導入には適さない。一方、レンチウイルスベクターやアデノ随伴ウイルスベクターは非分裂細胞においても感染後に外来遺伝子の宿主染色体への組み込みが生ずる。従って、これらのベクターは非分裂細胞において安定かつ長期的に外来遺伝子を発現させるために有効である。
【0015】
センダイウイルスベクターは(1)毒性が低い、(2)導入遺伝子の発現効率が高い、(3)導入遺伝子の宿主染色体への組み込みが行われず安全性に優れる等、数多くの利点を有する。
【0016】
「サル免疫不全ウイルス(SIV)ベクター」とは、ウイルス粒子中の核酸分子のうち、ウイルスベクターとして機能に必須な配列がSIVゲノムに基づく配列であるベクターをいう(国際公開WO2006/090689、国際公開WO2006/090697、国際公開WO2007/049752)。「ウイルスベクターとしての機能に必須な配列」とは、5’側から順に、5’LTRのR領域、U5領域、パッケージングシグナル(φ)、RRE、3’LTRのプロモーター領域以外のU3領域、R領域の配列である。また、SIVベクターは、上述の定義に当てはまる限り、改変が施されていてもよく、例えば、「ウイルスベクターとしての機能に必須な配列」がSIV由来である限り、他にSIV由来の配列またはSIV以外の由来の配列を含んでいてもよい。好適に含まれ得る配列として、例えば、cPPT (central polypurine tract)、内部プロモーター(CMV)、内部プロモーター(CAG)、WPRE (woodchuck hepatitis virus posttranscriptional regulatory element)を挙げることができる。サル免疫不全ウイルスベクターは染色体組み込み型ベクターである。サル免疫不全ウイルスベクターは染色体に組み込まれても周囲の遺伝子を活性化することはなく、また二つの治療用遺伝子を同時にしかも所望の比率で発現させることができるという特徴がある。
【0017】
各ウイルスベクターは既報の方法に従い又は市販される専用のキットを用いて作製することができる。例えば、アデノウイルスベクターの作製はCOS-TPC法や完全長DNA導入法などで行うことができる。COS-TPC法は、目的のcDNA又は発現カセットを組み込んだ組換えコスミドと、親ウイルスDNA-末端タンパク質複合体(DNA-TPC)を293細胞に同時トランスフェクションし、293細胞内でおこる相同組換えを利用して組換えアデノウイルスを作製する方法である(Miyake,S., Makimura,M., Kanegae,Y., Harada,S., Takamori,K., Tokuda,C., and Saito,I. (1996) Proc. Natl. Acad. Sci. USA, 93, 1320.)。一方、完全長DNA導入法は、目的の遺伝子を挿入した組換えコスミドを制限消化処理した後、293細胞にトランスフェクションすることによって組換えアデノウイルスを作製する方法である(寺島美保、近藤小貴、鐘ヶ江裕美、斎藤泉(2003)実験医学 21(7)931.)。COS-TPC法はAdenovirus Expression Vector Kit (Dual Version)(タカラバイオ株式会社)、Adenovirus genome DNA-TPC(タカラバイオ株式会社)を利用して行うことができる。また、完全長DNA導入法は、Adenovirus Expression Vector Kit (Dual Version)(タカラバイオ株式会社)を利用して行うことができる。
【0018】
一方、レトロウイルスベクターは以下の手順で作製することができる。まず、ウイルスゲノムの両端に存在するLTR(Long Terminal Repeat)の間のパッケージングシグナル配列以外のウイルスゲノム(gag、pol、env遺伝子)を取り除き、そこへ目的の遺伝子を挿入する。このようにして構築したウイルスDNAを、gag、pol、env遺伝子を構成的に発現するパッケージング細胞に導入する。これによって、パッケージングシグナル配列をもつベクターRNAのみがウイルス粒子に組み込まれ、レトロウイルスベクターが産生される。
【0019】
アデノベクターを応用ないし改良したベクターとして、ファイバータンパク質の改変により特異性を向上させたもの(特異的感染ベクター)や目的遺伝子の発現効率向上が期待できるguttedベクター(ヘルパー依存性型ベクター)などが開発されている。本発明の組換えベクターをこのようなウイルスベクターとして構築してもよい。また、使用可能なベクターとしては、大腸菌、枯草菌、酵母等の由来のプラスミド、λファージ等のバクテリオファージなども例示することができる。
【0020】
本発明の組換えベクターは挿入遺伝子としてPtprb遺伝子を保持している。通常、治療対象の動物種に応じてPtprb遺伝子の種が選択される。例えば、ヒトが治療対象の場合、ヒトPtprb遺伝子を選択するとよい。Ptprb遺伝子の配列、その他の情報は公共のデータベースに登録されており容易に入手可能である。例えば、ヒトPtprb遺伝子はNCBI(National Center for Biotechnology Information)のデータベースにおいてGeneID: 5787で登録されている。ヒトPtprb遺伝子の配列(配列番号1)はACCESSION:NM_001109754(DEFINITION Homo sapiens protein tyrosine phosphatase, receptor type, B (PTPRB), transcript variant 1, mRNA.)で登録されており、ヒトPtprbのアミノ酸配列(配列番号2)はACCESSION: NP_01103224(DEFINITION receptor-type tyrosine-protein phosphatase beta isoform a [Homo sapiens])で登録されている。天然型遺伝子の他、核酸配列の一部の欠失、置換、挿入、付加などによって改変された遺伝子(但し、天然型遺伝子がコードするタンパク質と同等の機能を有するタンパク質をコードする必要がある)を用いることもできる。
【0021】
Ptprb遺伝子の配列は、本明細書又は添付の配列表が開示する配列情報を参考にし、標準的な遺伝子工学的手法、分子生物学的手法、生化学的手法などを用いることによって単離された状態に調製することができる。具体的には、適当な哺乳動物のゲノムDNAライブラリー又はcDNAライブラリー、或いは哺乳動物細胞抽出液から、Ptprb遺伝子に対して特異的にハイブリダイズ可能なオリゴヌクレオチドプローブ・プライマーを適宜利用して調製することができる。オリゴヌクレオチドプローブ・プライマーとしては、例えば、配列番号1に示す塩基配列に相補的なDNA又はその連続した一部が用いられる。オリゴヌクレオチドプローブ・プライマーは市販の自動化DNA合成装置などを用いて容易に合成することができる。尚、Ptprb遺伝子を調製するために用いるライブラリーの作製方法については、例えばMolecular Cloning, Third Edition, Cold Spring Harbor Laboratory Press, New Yorkが参考になる。
【0022】
Ptprb遺伝子の全長ではなく、その一部(部分配列)を用いることにしてもよい。ここで、Ptprbは膜貫通型タンパク質であり、細胞外領域、細胞内領域及び膜貫通領域からなる。Ptprbの基質である受容体型チロシンキナーゼに対する作用を担うドメイン(活性ドメイン)は細胞内領域に含まれる。そこで本発明の一態様では、少なくとも細胞内領域をコードする配列を含む部分Ptprb遺伝子を用いる。本発明で採用可能な部分Ptprb遺伝子の配列の具体例を配列番号3に示す。このように細胞外領域をコードする配列を除いた部分Ptprb遺伝子を用いる場合には、標的細胞内で発現したときに適切な輸送及び局在が達成され、その発現産物(部分RB)が膜結合型タンパク質である基質に対して効率的に作用するように、5'末端側にシグナルペプチド及び膜貫通領域をコードする配列を付加しておくとよい。シグナルペプチド及び膜貫通領域をコードする配列として、本来の配列(即ち、Ptprbのシグナルペプチドをコードする配列)の他、同等の機能を有する配列(例えば、RPTPファミリーに属するメンバーの配列やI型膜タンパク質の配列など)を用いることができる。尚、シグナルペプチド及び膜貫通領域をコードする配列が付加された部分Ptprb遺伝子(細胞内領域をコードする配列を含む)の例を配列番号4に示す。
【0023】
本発明の一態様では、配列番号2に示すアミノ酸配列からなるタンパク質と比較した場合にその機能は同等であるものの一部においてアミノ酸配列が相違するタンパク質(以下、「相同蛋白質」ともいう)をコードする核酸配列を用いて組換えベクターが構築される。このように本発明では、配列番号2のアミノ酸配列を有するタンパク質と機能面から実質的に同一と見なされる(換言すれば該アミノ酸配列と比較してPtprbタンパク質の機能に実質的に影響しない部分でのみ相違する)タンパク質をコードする核酸配列を用いて組換えベクターを構築してもよい。このような組換えベクターによれば、配列番号2のアミノ酸配列をコードする核酸配列が組み込まれた組換えベクターと同様に、標的細胞内で基質の活性を抑制するタンパク質を強制発現させることができる。
【0024】
ここで、「一部においてアミノ酸配列が相違する」とは、典型的には、アミノ酸配列を構成する1〜数個のアミノ酸の欠失、置換、若しくは1〜数個のアミノ酸の付加、挿入、又はこれらの組合せによりアミノ酸配列に変異(変化)が生じていることをいう。ここでのアミノ酸配列の相違は、基質の活性を抑制するという機能が保持される限り許容される。この条件を満たす限りアミノ酸配列が相違する位置は特に限定されず、また複数の位置で相違が生じていてもよい。ここでの複数とは例えば全アミノ酸の約30%未満に相当する数であり、好ましくは約20%未満に相当する数であり、さらに好ましくは約10%未満に相当する数であり、より一層好ましくは約5%未満に相当する数であり、最も好ましくは約1%未満に相当する数である。即ち相同的タンパク質は配列番号2のアミノ酸配列と例えば約70%以上、好ましくは約80%以上、さらに好ましくは約90%以上、より一層好ましくは約95%以上、最も好ましくは約99%以上の同一性を有する。
【0025】
好ましくは、保存的アミノ酸置換を非必須アミノ酸残基(基質の活性を抑制するという機能に関与しないアミノ酸残基)に生じさせることによって相同タンパク質を得る。ここでの「保存的アミノ酸置換」とは、あるアミノ酸残基を、同様の性質の側鎖を有するアミノ酸残基に置換することをいう。アミノ酸残基はその側鎖によって塩基性側鎖(例えばリシン、アルギニン、ヒスチジン)、酸性側鎖(例えばアスパラギン酸、グルタミン酸)、非荷電極性側鎖(例えばアスパラギン、グルタミン、セリン、スレオニン、チロシン、システイン)、非極性側鎖(例えばグリシン、アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン)、β分岐側鎖(例えばスレオニン、バリン、イソロイシン)、芳香族側鎖(例えばチロシン、フェニルアラニン、トリプトファン)のように、いくつかのファミリーに分類されている。保存的アミノ酸置換は好ましくは、同一のファミリー内のアミノ酸残基間の置換である。
【0026】
相同的タンパク質をコードする核酸配列を調製するにあたっては、チロシンホスファターゼ活性を有する領域(即ち細胞内領域)の改変を避けることが好ましい。
【0027】
ここで、二つのアミノ酸配列の同一性(%)は例えば以下の手順で決定することができる。まず、最適な比較ができるよう二つの配列を並べる(例えば、第一の配列にギャップを導入して第二の配列とのアライメントを最適化してもよい)。第一の配列の特定位置の分子(アミノ酸残基)が、第二の配列における対応する位置の分子と同じであるとき、その位置の分子が同一であるという。二つの配列の同一性は、その二つの配列に共通する同一位置の数の関数であり(すなわち、同一性(%)=同一位置の数/位置の総数 × 100)、好ましくは、アライメントの最適化に要したギャップの数およびサイズも考慮に入れる。
二つの配列の比較及び同一性の決定は数学的アルゴリズムを用いて実現可能である。配列の比較に利用可能な数学的アルゴリズムの具体例としては、KarlinおよびAltschul (1990) Proc. Natl. Acad. Sci. USA 87:2264-68に記載され、KarlinおよびAltschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-77において改変されたアルゴリズムがあるが、これに限定されることはない。このようなアルゴリズムは、Altschulら (1990) J. Mol. Biol. 215:403-10に記載のNBLASTプログラムおよびXBLASTプログラム(バージョン2.0)に組み込まれている。あるアミノ酸配列に相同的なアミノ酸配列を得るには例えば、XBLASTプログラムでscore = 50、wordlength = 3としてBLASTポリペプチド検索を行えばよい。比較のためのギャップアライメントを得るためには、Altschulら (1997) Amino Acids Research 25(17):3389-3402に記載のGapped BLASTが利用可能である。BLASTおよびGapped BLASTを利用する場合は、対応するプログラム(例えばXBLASTおよびNBLAST)のデフォルトパラメータを使用することができる。詳しくはhttp://www.ncbi.nlm.nih.govを参照されたい。配列の比較に利用可能な他の数学的アルゴリズムの例としては、MyersおよびMiller (1988) Comput Appl Biosci. 4:11-17に記載のアルゴリズムがある。このようなアルゴリズムは、例えばGENESTREAMネットワークサーバー(IGH Montpellier、フランス)またはISRECサーバーで利用可能なALIGNプログラムに組み込まれている。アミノ酸配列の比較にALIGNプログラムを利用する場合は例えば、PAM120残基質量表を使用し、ギャップ長ペナルティ=12、ギャップペナルティ=4とすることができる。二つのアミノ酸配列の同一性を、GCGソフトウェアパッケージのGAPプログラムを用いて、Blossom 62マトリックスまたはPAM250マトリックスを使用し、ギャップ加重=12、10、8、6、又は4、ギャップ長加重=2、3、又は4として決定することができる。
【0028】
本発明の組換えベクターには、標的細胞内での挿入遺伝子の発現を可能にすべくプロモーターが組み込まれている。挿入遺伝子は、プロモーターに作動可能に連結している。当該構成の組換えベクターではプロモーターの作用によって挿入遺伝子を標的細胞内で強制発現させることが可能となる。ここでの「プロモーターに作動可能に連結された」とは「プロモーターの制御下に配置された」と同義であり、通常、プロモーターの3'末端側に直接又は他の配列を介して挿入遺伝子が連結されることになる。
【0029】
プロモーターには、CMV-IE(サイトメガロウイルス初期遺伝子由来プロモーター)、SV40ori、レトロウイルスLTP、SRα、EF1α、βアクチンプロモーター等を使用可能である。アセチルコリンレセプタープロモーター、エノラーゼプロモーター、L7プロモーター、ネスチンプロモーター、アルブミンプロモーター、アルファフェトプロテインプロモーター、ケラチンプロモーター、インスリンプロモーター等、哺乳動物組織特異的プロモーターを使用してもよい。
【0030】
本発明の組換えベクター内にポリA付加シグナル配列又はポリA配列、エンハンサー配列、選択マーカー配列等を配置することもできる。ポリA付加シグナル配列又はポリA配列の使用によって、組換えベクターから生ずるmRNAの安定性が向上する。ポリA付加シグナル配列又はポリA配列は、下流側において挿入遺伝子に連結される。一方、エンハンサー配列の使用によって発現効率の向上が図られる。また、選択マーカー配列を含有する組換えベクターを使用すれば、選択マーカーを利用して組換えベクターの導入の有無(及びその程度)を確認することができる。
【0031】
尚、プロモーター、挿入遺伝子、エンハンサー配列(必要な場合)、選択マーカー配列(必要な場合)等の挿入操作等は標準的な組換えDNA技術(例えば、Molecular Cloning, Third Edition, 1.84, Cold Spring Harbor Laboratory Press, New Yorkを参照することができる)を用いて行うことができる。
【0032】
(組換えベクターの用途)
本発明の組換えベクターは、Ptprbの基質であることが明らかになった分子、即ち、FGFR1(fibroblast growth factor receptor 1)、TYRO3(TYRO3 protein tyrosine kinase 3)、RET(c-ret protooncogene)、EphB2(ephrin type-B receptor 2)、ERBB2(erythroblastic leukemia viral oncogene homolog 2)、PDGFRa(platelet-derived growth factor receptor, alpha polypeptide)、ROS(v-ros avian UR2 sarcoma virus oncogene homolog 1)、LTK(leukocyte tyrosine kinase)、MET(MNNG HOS transforming gene)の活性を抑制する目的に供される。換言すれば、本発明の組換えベクターを用いれば、標的細胞内における基質(一つ又は二つ以上)の活性を抑制する方法(以下、「本発明の活性抑制法」とも呼ぶ)を提供できる。また、本発明の組換えベクターは、Ptprb遺伝子を含む、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の脱リン酸化剤として用いることができる。尚、本発明において用語「抑制」は用語「阻害」と交換可能に使用される。
【0033】
本発明の活性抑制法では、本発明の組換えベクターが標的細胞に導入される。ここでの「標的細胞」は典型的には哺乳動物細胞である。即ち、ヒト又はサル、マウス、ラット等の非ヒト哺乳類の各種細胞、例えば、心筋細胞、平滑筋細胞、脂肪細胞、線維芽細胞、骨細胞、軟骨細胞、破骨細胞、実質細胞、表皮角化細胞(ケラチノサイト)、上皮細胞(皮膚表皮細胞、角膜上皮細胞、結膜上皮細胞、口腔粘膜上皮、毛包上皮細胞、口腔粘膜上皮細胞、気道粘膜上皮細胞、腸管粘膜上皮細胞など)、内皮細胞(角膜内皮細胞、血管内皮細胞など)、神経細胞、グリア細胞、脾細胞、膵臓β細胞、メサンギウム細胞、ランゲルハンス細胞、肝細胞、又はこれらの前駆細胞、或いは間葉系幹細胞(MSC)、胚性幹細胞(ES細胞)、胚性生殖細胞(EG細胞)、成体幹細胞、受精卵などを標的細胞にすることが可能である。HeLa細胞、CHO細胞、Vero細胞、HEK293細胞、HepG2細胞、COS-7細胞、NIH3T3細胞などの株化された細胞等を標的細胞にすることもできる。詳しくは後述するが、本発明の活性抑制法は特定の疾病の治療に有用であり、癌細胞、血管内皮細胞、リンパ系細胞等が好ましい標的細胞となる。
【0034】
単離された標的細胞、又は生物個体を構成した状態の標的細胞に対して本発明の組換えベクターが導入される。ここでの「単離された」とは、その本来の環境(例えば生体を構成した状態)から取り出された状態にあることをいう。従って通常は、単離された標的細胞は培養容器内又は保存容器内に存在し、それへのin vitroでの人為的操作が可能である。具体的には、生体から分離され、生体外で培養状態にある細胞(株化された細胞を含む)は、単離された標的細胞としての適格を有する。上記の意味において単離された状態にある限り、組織体を形成した状態であっても単離された細胞である。単離された標的細胞は生物個体より調製することができる。一方、独立行政法人理化学研究所バイオリソースセンター、独立行政法人 製品評価技術基盤機構、ATCC (American Type Culture Collection)、DSMZ(German Collection of Microorganisms and Cell Cultures)などより入手した細胞を、単離された標的細胞として使用することもできる。
【0035】
標的細胞への組換えベクターの導入は、標的細胞の種類、組換えベクターの構成などを考慮して、リン酸カルシウム共沈殿法、リポフェクション(Felgner, P.L. et al., Proc. Natl. Acad. Sci. U.S.A. 84,7413-7417(1984))、HVJリポソーム法、DEAEデキストラン法、エレクトロポーレーション(Potter,H. et al., Proc. Natl. Acad. Sci. U.S.A. 81, 7161-7165(1984))、マイクロインジェクション(Graessmann,M. & Graessmann,A., Proc. Natl. Acad. Sci. U.S.A. 73,366-370(1976))、遺伝子銃法、超音波遺伝子導入法等によって実施することができる。ウイルスベクターとして構築された組換えベクターを使用する場合には原則、感染によって標的細胞への導入が行われる。
【0036】
本発明の活性抑制法は、Ptprbの基質(FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK、MET、VEGFR1、VEGFR2、VEGFR3、TrkB、EGFR1、RON、ROR1、ROR2)の活性を抑制することに利用される。従って本発明の活性抑制法は、当該基質の異常な活性化又は異常な発現亢進が発症又は病態の進行の原因(副次的な原因であってもよい)となる疾患(標的疾病)の予防又は治療のため(即ち医療目的)の有効な手段といえる。このように本発明の活性抑制法は、特定の疾患に対する遺伝子治療(又はその一部)として利用され得る。
【0037】
ここで、Ptprbの基質の一つであるFGFR1は、発癌に関与する。また、FGFR1は癌に伴う血管新生に関与する。同様にRETは、多発性内分泌腫瘍症2型および甲状腺乳頭癌の発症に関与する。また、EphB2は、発癌に関与する。また、EphB2は癌に伴う血管新生に関与する。また、METは、固形腫瘍形成およびそれの転移に関与する。また、ERBB2は、発癌に関与する。また、PDGFRaは、癌に伴う血管新生に関与する。LTKは、自己免疫疾患に関与する。以上の事実を考慮すれば、本発明の活性抑制法が適用される標的疾患の例として、癌、血管新生、自己免疫疾患を挙げることができる。このように、本発明の活性抑制法は、癌、癌に伴う血管新生、自己免疫疾患等を罹患する対象(患者)に適用され得る。これらの疾患に罹患していると診断される前の患者(潜在的患者)に対して本発明の活性抑制法を適用することも可能である。換言すれば、予防的医療措置に本発明を利用することにしてもよい。
【0038】
ここで、遺伝子治療法には、遺伝子導入用の組換えベクターを直接患者体内へ投与する治療法(in vivo遺伝子治療法)と、治療対象から採取した細胞に対して体外で遺伝子導入した後、細胞を患者に投与する治療法(ex vivo治療法)がある。本発明の抑制法はいずれの治療法に対しても適用可能である。in vivo遺伝子治療法の場合における組換えベクターの投与経路は特に限定されず例えば局所接種、静脈内、皮内、皮下、筋肉内及び腹腔内などへの注入によって投与が実施される。これらの投与経路は互いに排他的なものではなく、任意に選択される二つ以上を併用することもできる(例えば、経口投与と同時に又は所定時間経過後に静脈注射等を行う等)。ここでの「治療対象」は特に限定されず、ヒト、及びヒト以外の哺乳動物(ペット動物、家畜、実験動物を含む。具体的には例えばマウス、ラット、モルモット、ハムスター、サル、ウシ、ブタ、ヤギ、ヒツジ、イヌ、ネコ、ニワトリ、ウズラ等である)を含む。好適には、本発明の抑制方法を利用した治療法の治療対象はヒトである。
【0039】
本発明の組換えベクターに、薬学的に許容可能な媒体を組み合わせることによって標的疾患治療用の組成物を構成することができる。「薬学的に許容可能な媒体」とは、組換えベクターの薬効(即ち標的疾患に対する治療効果)に実質的な影響を与えることなく組換えベクターの投与や保存等に関して利点ないし恩恵をもたらす物質をいう。「薬学的に許容可能な媒体」として、脱イオン水、超純水、生理食塩水、リン酸緩衝生理食塩水(PBS)、5%デキストロース水溶液等を例示できる。本発明の組成物に、懸濁剤、無痛化剤、安定剤(アルブミンやPrionex(登録商標、ペンタファームジャパン(株)製)等)、保存剤、防腐剤など、その他の成分を含有させてもよい。本発明の組成物を、凍結乾燥体として調製することもできる。
【0040】
本発明の組換えベクターがウイルスベクターの形態の場合、生体適合性のポリオル(例えばpoloxamer407など)を併用することが好ましい。ポリオルの使用によってウイルスベクターの形質導入率を10〜100倍に上昇させ得る(March et al., Human Gene Therapy 6:41-53, 1995)。従って、ポリオルを併用することにすればウイルスベクターの投与量を低く抑えることができる。尚、本発明の組成物の一成分としてポリオルを使用することにしても、本発明の組成物とは別にポリオル(又はそれを含む組成物)を調製することにしてもよい。後者の場合、本発明の組成物を投与するときにポリオル(又はそれを含む組成物)を併せて投与することになる。
【0041】
本発明の組換えベクターは全身投与又は局所投与によって対象に投与されるが、効率的な送達を達成し且つ副作用を低減するため、後者の投与方法を採用することが好ましい。例えば、腫瘍内への注入などの局所投与によって組換えベクターを送達すればよい。
【0042】
中でもウイルスベクターを使用する方法を採用することが好ましい。当該方法によれば、比較的簡便な操作によって効率的に標的細胞へ遺伝子導入することが可能である。従って、患者への負担を軽減しつつ治療効果の増大を図ることができる。
【0043】
本発明の組換えベクターは、治療上有効な量のPtprb遺伝子が標的細胞(例えばがん細胞)へ導入されるよう、その投与量が設定される。「治療上有効な量」とは、Ptprb遺伝子による治療効果(症状の改善、治癒など)をもたらすことが可能な量をいう。本発明の組換えベクターの投与量は一般に、組換えベクターの形態、投与経路、治療対象の症状、年齢、性別及び体重などによって異なるが、当業者であれば適宜適当な投与量を設定することが可能である。成人(体重約60kg)を対象として1回あたりに投与されるPtprb遺伝子の量が例えば40〜400μg、好ましくは200〜400μgとなるように、組換えベクターの投与量を設定するとよい。また、ウイルスベクターを利用して本発明の組換えベクターを構築した場合には、成人(体重約60kg)を対象として1回あたりに投与されるウイルスベクターの量が例えば2.0 x 108〜2.0 x 109CIU(cell-infectious units)/ml、好ましくは1.0 x 109〜2.0 x 109CIU/mlとなるように、組換えベクターの投与量を設定するとよい。投与スケジュールとしては例えば一日一回〜数回、二日に一回、或いは三日に一回などを採用できる。投与スケジュールの作成においては、対象(レシピエント)の症状、性別、年齢、病態などを考慮することができる。
【実施例】
【0044】
1.Ptprbの基質分子の探索
マウス由来Ptprbの基質捕捉変異体を用いて、哺乳類細胞ツーハイブリッド(Mammalian two-hybrid)法により、Ptprbが基質とする受容体型チロシンキナーゼのスクリーニングを行った。使用した基質捕捉変異体は、Ptprbの2088番目のアスパラギン酸をアラニンに置換したものであり、PTP活性中心側のシステイン残基と基質側のリン酸基間で共有結合が形成された状態で反応が停止することによりPTP−基質複合体が形成されるものである。スクリーニングは、Stratagene社のMammalian two-hybrid assay kitを使用して行った。様々な受容体型チロシンキナーゼの細胞内領域のcDNAをpCMV-BDベクターに挿入し、一方、Ptprbの細胞内領域の基質捕捉型変異体をコードするcDNAをpCMV-ADベクターに挿入した。株化細胞のCOS7細胞に、これらのプラスミドとルシフェラーゼをコードするレポータープラスミドを共導入し、24時間後にルシフェラーゼの発現を定量解析した。その結果、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTKおよびMetがPtprbの基質捕捉変異体との相互作用を示し、これらの受容体型チロシンキナーゼがPtprbの基質分子となることが明らかになった(図1)。
【0045】
2.Ptprbによる、FGFR1、TYRO3、RET及びEphB2の自己リン酸化抑制
FLAGタグあるいはMycタグを付加した、全長のマウス由来受容体型チロシンキナーゼ(RPTK)を発現するプラスミド(RPTK発現プラスミド)を構築するとともに、HAタグを付加したマウス由来Ptprb(全長配列)を発現するプラスミド(Ptprb発現プラスミド)を構築した。発現プラスミドの構築はpDisplayベクター(Life Technologies社製)を使用して行った。次いで、株化細胞のHEK293細胞に、構築したRPTK発現プラスミドを単独で、又はPtprb発現プラスミドと共に導入し、24時間後に細胞抽出液を調製した。抽出液について、抗FLAG抗体、抗Myc抗体、あるいは抗HA抗体を用いて免疫沈降を行った。これら免疫沈降物について抗リン酸化チロシン抗体を用いたウエスタンブロットを行ったところ、FGFR1、TYRO3、RETおよびEphB2のチロシンリン酸化レベルは、RPTKを単独で発現させた場合に比べて、Ptprbと共発現させた場合に顕著に低下した(図2)。
【0046】
3.リガンド刺激によるFGFR1及びRETの活性化の抑制
FGFR1およびRETを内在的に発現するPC12細胞を、それぞれのリガンド分子であるbasic FGF(50 ng/ml)(図3A)、あるいは、GDNF(25 ng/ml)およびGFRa1(300 ng/ml)(図3B)で刺激すると、神経突起の伸長が誘導される。まず、マウス由来Ptprb(全長配列)を発現するプラスミド、Ptprbと異なる受容体型チロシンホスファターゼであるマウス由来Ptprmの発現プラスミド、及びPtprbの不活性型変異体(RB(DA))の発現プラスミドを構築した。使用した不活性型変異体は、マウス由来Ptprbの2088番目のアスパラギン酸をアラニンに置換したものであり、Ptprb活性を有さない。なお、これらの発現プラスミドの構築はpDisplayベクター(Life Technologies社製)を使用して行った。次いで、PC12細胞に、コントロールプラスミド、構築したPtprm発現プラスミド、Ptprb発現プラスミド、あるいは不活性型Ptprb発現プラスミドをそれぞれ導入し、24時間後にbasic FGFもしくはGDNF/GFRa1を作用させた。さらに24時間後の突起伸長について解析したところ、コントロールプラスミド(mock)、Ptprm(RM(WT))、およびPtprbの不活性型変異体(RB(DA))では、長い神経突起の伸長が観察されたのに対して、野生型のPtprb(RB(WT))の発現により、FGFR1およびRETのリガンド刺激による神経突起伸長活性が顕著に抑制された。それぞれのプラスミドが導入された細胞の形態を示した(左)。
【0047】
4.FGF依存的な癌細胞の増殖の抑制
無血清下においてFGFに依存的に増殖することが知られているC6グリオーマ細胞(基質FGFR1の高発現を認める)を用いて、Ptprbによる癌細胞の増殖抑制効果について調べた。まず、上記2.で構築したものと同じPtprb発現プラスミド、又はコントロールプラスミドをC6グリオーマ細胞にそれぞれ導入し、次いで、50 ng/mlのbasic FGFを含む培地下で培養した。その後、C6グリオーマ細胞の増殖について調べたところ、コントロールプラスミド(mock)においては細胞増殖が観察されたのに対して、Ptprbを発現させた細胞では、細胞増殖が顕著に抑制された(図4)。培養0時間後と48時間後の、それぞれのプラスミドが導入された細胞を示した。
【0048】
5.生体内における癌細胞の増殖の抑制
テトラサイクリン発現調整システム(Tet-on system、Clontech社製)を用いて、マウス由来Ptprb遺伝子(全長配列)を含むPtprb発現ベクターを構築し、これをC6グリオーマ細胞に導入した。次いで、選択薬剤(G418とハイグロマイシン)を含む培地で2週間培養を行い、Ptprb発現ベクターを安定的に保持するクローンを得た。さらに、これらのクローン中からテトラサイクリンの誘導体であるdoxycyclineによりPtprbの発現誘導を確認できたC6グリオーマクローンを得た。
次いで、doxycyclineを1mg投与したラットと、doxycycline無投与のラットとを用意し、上記のC6グリオーマクローンを一定数(5 x105個)、それぞれのラット脳内に移植した。ラットを6日間飼育した後、脳切片を摘出し、その摘出した脳切片についてヘマトキシリン・エオシン染色を行い、腫瘍の大きさを比較した。その結果を図5に示す。尚、図5の上図において、矢頭で囲まれた領域が腫瘍を示している。図5に示すように、doxycyclineによりPtprbを発現させたラット(図5上の右)では、Ptprbを発現させなかったラット(図5上の左)に比べてグリオーマクローンの増殖が顕著に抑制された。また、腫瘍の大きさ(体積)を調べたところ、Ptprbを発現させたラットでは、Ptprbを発現させなかったラットの1/3と小さかった(図5下)。
【産業上の利用可能性】
【0049】
チロシンキナーゼ活性の異常亢進が原因の疾患が数多く知られている。例えば、がん細胞においては特定のチロシンキナーゼの活性が亢進していることが知られており、いくつかの癌治療にチロシンキナーゼ活性を抑制する低分子化合物が使用されている。本発明の組換えベクターは、タンパク質分子である受容体型チロシンホスファターゼを利用した治療を可能にするものであり、治療の選択肢を広げる。また、創薬の分野で活用されることが期待される。
【0050】
この発明は、上記発明の実施の形態及び実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。本明細書の中で明示した論文、公開特許公報、及び特許公報などの内容は、その全ての内容を援用によって引用することとする。
【特許請求の範囲】
【請求項1】
プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクター。
【請求項2】
ポリA付加シグナル配列又はポリA配列を更に含む、請求項1に記載の組換えベクター。
【請求項3】
前記Ptprb遺伝子が全長配列からなる、請求項1又は2に記載の組換えベクター。
【請求項4】
前記Ptprb遺伝子が、配列番号1の配列からなる、請求項1〜3のいずれか一項に記載の組換えベクター。
【請求項5】
前記Ptprb遺伝子として、Ptprbの細胞内領域をコードする配列を少なくとも含む、Ptprb遺伝子の一部が用いられる、請求項1又は2に記載の組換えベクター。
【請求項6】
前記Ptprb遺伝子の一部が、シグナルペプチド及びPtprbの膜貫通領域をコードする配列も含む、請求項5に記載の組換えベクター。
【請求項7】
前記Ptprb遺伝子の一部が、配列番号3又は配列番号4の配列からなる、請求項5に記載の組換えベクター。
【請求項8】
前記基質の異常発現又は異常な発現亢進が発症又は病態の進行の原因となる疾患の治療用である、請求項1〜7のいずれか一項に記載の組換えベクター。
【請求項9】
前記疾患が、癌、癌に伴う血管新生又は自己免疫疾患である、請求項8に記載の組換えベクター。
【請求項10】
請求項1〜9のいずれか一項に記載の組換えベクターと、薬学的に許容される媒体とを含む組成物。
【請求項11】
FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターを製造するための、Ptprb遺伝子の使用。
【請求項12】
プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターと、
薬学的に許容される媒体と、
を含む組成物を対象に投与するステップを含む、前記基質の異常発現又は異常な発現亢進が発症又は病態の進行の原因となる疾患の治療法。
【請求項1】
プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクター。
【請求項2】
ポリA付加シグナル配列又はポリA配列を更に含む、請求項1に記載の組換えベクター。
【請求項3】
前記Ptprb遺伝子が全長配列からなる、請求項1又は2に記載の組換えベクター。
【請求項4】
前記Ptprb遺伝子が、配列番号1の配列からなる、請求項1〜3のいずれか一項に記載の組換えベクター。
【請求項5】
前記Ptprb遺伝子として、Ptprbの細胞内領域をコードする配列を少なくとも含む、Ptprb遺伝子の一部が用いられる、請求項1又は2に記載の組換えベクター。
【請求項6】
前記Ptprb遺伝子の一部が、シグナルペプチド及びPtprbの膜貫通領域をコードする配列も含む、請求項5に記載の組換えベクター。
【請求項7】
前記Ptprb遺伝子の一部が、配列番号3又は配列番号4の配列からなる、請求項5に記載の組換えベクター。
【請求項8】
前記基質の異常発現又は異常な発現亢進が発症又は病態の進行の原因となる疾患の治療用である、請求項1〜7のいずれか一項に記載の組換えベクター。
【請求項9】
前記疾患が、癌、癌に伴う血管新生又は自己免疫疾患である、請求項8に記載の組換えベクター。
【請求項10】
請求項1〜9のいずれか一項に記載の組換えベクターと、薬学的に許容される媒体とを含む組成物。
【請求項11】
FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターを製造するための、Ptprb遺伝子の使用。
【請求項12】
プロモーターと、該プロモーターに作動可能に連結したPtprb遺伝子を含み、FGFR1、TYRO3、RET、EphB2、ERBB2、PDGFRa、ROS、LTK及びMETからなる群より選択される基質の活性抑制用組換えベクターと、
薬学的に許容される媒体と、
を含む組成物を対象に投与するステップを含む、前記基質の異常発現又は異常な発現亢進が発症又は病態の進行の原因となる疾患の治療法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−51957(P2013−51957A)
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2012−171138(P2012−171138)
【出願日】平成24年8月1日(2012.8.1)
【出願人】(504261077)大学共同利用機関法人自然科学研究機構 (156)
【Fターム(参考)】
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成24年8月1日(2012.8.1)
【出願人】(504261077)大学共同利用機関法人自然科学研究機構 (156)
【Fターム(参考)】
[ Back to top ]

