受精卵培養装置、受精卵培養方法
【課題】受精卵のアレイ化またはアレイ化された受精卵の保持を良好に行うことができる受精卵培養デバイスおよび受精卵培養装置ならびに前記デバイスを用いた受精卵の培養方法を提供する。
【解決手段】哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、前記ケージ領域は、前記蛇行流路の下流側の側壁が切り欠かれて前記蛇行流路の下流方向に拡張している、または前記ケージ領域の底面に凹部が設けられている受精卵培養デバイス。
【解決手段】哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、前記ケージ領域は、前記蛇行流路の下流側の側壁が切り欠かれて前記蛇行流路の下流方向に拡張している、または前記ケージ領域の底面に凹部が設けられている受精卵培養デバイス。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、受精卵の培養に用いられる培養装置および該培養装置を用いた受精卵の培養方法に関する。
【背景技術】
【0002】
哺乳動物の受精卵の培養は、医療分野や家畜分野、最近では胚性幹細胞(ES細胞)の樹立などの様々なライフサイエンス分野において必要不可欠な基盤技術であり、その応用範囲も日増しに拡大の一途を辿っている。不妊治療や家畜繁殖などにおいて受精卵を母胎内に移植する過程では、確実な着床とその後の成長を期すため、一旦、体外で胚盤胞と呼ばれる段階まで培養し、状態の良い受精卵だけを選別して移植している。
従来、こうした受精卵の移植に際しては、洗浄、培養、選別等の操作が行われている。
受精卵の生体外培養は、通常、マイクロドロップレット法によって行われる。この方法は、シャーレ上に培養液の液滴を形成し、該液滴内に複数の受精卵を配置して培養を行う方法である。しかしマイクロドロップレット法は、高度な技術が必要であり、操作者の手技によって受精卵の質や発生率にばらつきが生じやすい問題がある。一例を挙げると、液滴内への受精卵の配置する際には、ガラスキャピラリーにマイクロピペットやマウスピースを接続し、吸気・排気のバランスによってキャピラリー内に受精卵を回収して新しい培地等の別の環境に移すといった操作が一般的に行われている。しかし受精卵は外乱に弱く、操作不良により胚盤胞への発生率の低下が生じやすい。そのため、上記のような方法は、行う者の手技の熟練度によって受精卵の質や胚盤胞への発生率にばらつきが生じるなど、定量性や再現性が低い問題がある。さらに、従来の技術では、受精卵を個別に管理し培養することが困難であるため、それぞれの受精卵の発生過程の評価が難しい。
そのため、熟練度によらず定量性や再現性の良好な受精卵の培養を行うために、自動化が期待されている。受精卵の培養の自動化のためには、複数の受精卵を、個別に品質管理しながら培養できること、および胚盤胞へと発生した受精卵のみの選択的回収が可能であること、を両立するシステムが要求されるが、このようなシステムは未だ実現されていない。
【0003】
一方、近年、微細加工技術を応用したμTAS(Micro Total Analysis System)分野で、細胞、細菌、生体分子などの微小なバイオ粒子を扱う研究が行われるようになっている。μTASでは、微細加工技術により形成したマイクロ流路内で微量流体操作を伴うマイクロシステムが実現されており、これまで多種多様のバイオ粒子の操作方法が提案されている。たとえば本願発明者らは、簡単な微量流体操作のみで、大量の微粒子を特定の部位に配置する、配置した状態で溶液を交換して薬物刺激を与える、配置した位置から流体に戻して他の部位に移動させる、といった微粒子操作が可能なマイクロ流路(ダイナミックマイクロアレイ)を設けたマイクロ流体デバイスについて研究している。たとえば特許文献1には、マイクロビーズを配列させる装置として、マイクロビーズが流されるとともに狭窄領域を有する直線状流路と、該直線状流路と順次交差する方形波形状の流路と、マイクロビーズが捕捉されていない空の狭窄領域がある場合はその空の狭窄領域でマイクロビーズを捕捉し、マイクロビーズが捕捉されている狭窄領域がある場合は該狭窄領域をバイパスしてマイクロビーズを下流に移動させるマイクロビーズ移動手段と、を具備する配列装置を開示している。
このダイナミックマイクロアレイにおいては、粒子が存在していない状態で液体を流した場合、直線状流路内の流れがメインストリームとなり、方形波形状流路内の流れはサブストリームとなるように設計されている。そのため、該ダイナミックマイクロアレイに液体とともに粒子を流すと、粒子は、主流路である直線状流路と方形波形状流路とが交差する位置(以下、交差路ということがある。)で直線状流路に流入し、粒子が通過しない幅で形成された狭窄部にせき止められる。粒子がせき止められると、次に流れてきた粒子は、迂回路である方形波形状流路に流入して下流側に移動し、次の交差路で、直線状流路に流入し、その下流側の狭窄部にせき止められる。このようにして、粒子が順次、交差路とその下流の狭窄部との間(ケージ領域)に捕捉され、アレイ化(配列化)される。そのため、該ダイナミックマイクロアレイを、1つのケージ領域に1つの粒子が捕捉されるように設計することで、各ケージ領域に捕捉された粒子を個別に管理することが可能である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2007−186456号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明者らは、特許文献1に記載するような、主流路と、該主流路と順次交差する蛇行流路とを備えるダイナミックマイクロアレイを設けたマイクロ流体デバイスを受精卵培養に適用してみた。その結果、該マイクロ流体デバイスには、受精卵の培養上、いくつかの問題があることを見出した。
その問題の一つは、1つのケージ領域に複数の受精卵が捕捉されてしまい、うまくアレイ化できないことである。つまり、受精卵を胚盤胞の状態まで培養するためには、ケージ領域の大きさを胚盤胞の大きさにあわせて設定する必要があるが、胚盤胞の大きさは、種別にもよるが初期の受精卵の1.3〜2倍程度である。そのため、初期の受精卵に比べてケージ領域が広すぎるため、受精卵がすでに捕捉されているケージ領域に、さらに別の受精卵が入ってしまう。1つのケージ領域に複数の受精卵が捕捉されてしまうと、個別管理ができなくなる。また、受精卵が連なって流れてくる場合、主流路と蛇行流路の交差路に受精卵が複数個引っかかることがあり、流路そのものを受精卵がふさいでしまう場合がある。
また、別の問題は、培養時に、捕捉した受精卵の位置を保持できない場合があることである。たとえば培養中に受精卵のケージ領域内での位置が変化したり、最悪、受精卵が胚盤胞まで発生する前にケージ領域からリリースされてしまうことがある。ケージ領域内での位置が変化すると、受精卵の個別観察が困難になる。
受精卵の培養を行う場合、受精卵が外乱に弱いため、特許文献1に記載されるようなマイクロビーズを配列する場合に比べて、流路内の液体の流量を少なくすることが望まれるが、低流量化すると上記リリース等の問題が生じやすくなる。
これらの問題は、受精卵培養の自動化への妨げとなるため、その改善が求められる。
本発明は、上記事情に鑑みてなされたものであって、受精卵のアレイ化またはアレイ化された受精卵の保持を良好に行うことができる受精卵培養デバイスおよび受精卵培養装置ならびに前記デバイスを用いた受精卵の培養方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
上記課題を解決する本発明は、以下の態様を有する。
[1]哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、
前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、
前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、
前記ケージ領域は、前記蛇行流路の下流側の側壁が切り欠かれて前記蛇行流路の下流方向に拡張している受精卵培養デバイス。
[2]哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、
前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、
前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、
前記ケージ領域の底面に凹部が設けられている受精卵培養デバイス。
[3]前記ケージ領域の底面に凹部が設けられている、[1]に記載の受精卵培養デバイス。
[4]前記ケージ領域の、前記蛇行流路の上流側の側壁と、前記蛇行流路の側壁とが略垂直に合流している、[1]に記載の受精卵培養デバイス。
[5]前記ケージ領域の、前記蛇行流路の上流側の側壁と、前記蛇行流路の側壁とが略垂直に合流している、[2]または[3]のいずれか一項に記載の受精卵培養デバイス。
[6][1]〜[5]のいずれか一項に記載の受精卵培養デバイスを備えた受精卵培養装置。
[7][1]〜[5]のいずれか一項に記載の受精卵培養デバイスを用いて哺乳動物の受精卵を培養する方法であって、
前記マイクロ流路構造に前記受精卵を培養液とともに流通させることにより前記ケージ領域に前記受精卵を配置する工程と、前記マイクロ流路構造に培養液を流通させながら前記受精卵を培養する工程と、を有する培養方法。
[8][2]、[3]または[5]に記載の受精卵デバイスを用いて哺乳動物の受精卵を培養する方法であって、
前記マイクロ流路構造に前記受精卵を培養液とともに流通させることにより前記ケージ領域に前記受精卵を配置する工程と、前記マイクロ流路構造に培養液を流通させずに前記受精卵を培養する工程と、を有する培養方法。
【発明の効果】
【0007】
本発明によれば、受精卵のアレイ化またはアレイ化された受精卵の保持を良好に行うことができる受精卵培養デバイスおよび受精卵培養装置ならびに前記デバイスを用いた受精卵の培養方法を提供できる。
【図面の簡単な説明】
【0008】
【図1】第一実施形態の受精卵培養デバイスが備えるマイクロ流路構造10の上面図である。
【図2】マイクロ流路構造10の部分拡大図である。
【図3】第二実施形態の受精卵培養デバイスが備えるマイクロ流路構造20の上面図である。
【図4】(a)はマイクロ流路構造20の部分拡大図であり、(b)は(a)中の位置X−X’における縦断面図である。
【図5】第三実施形態の受精卵培養デバイスが備えるマイクロ流路構造30の上面図である。
【図6】実施例1で得たマイクロ流体デバイスの写真である。
【図7】実施例2で得たマイクロ流体デバイスのマイクロ流路構造の写真である。
【図8】実施例3で得たマイクロ流体デバイスのマイクロ流路構造の写真である。
【図9】比較例1で得たマイクロ流体デバイスのマイクロ流路構造の写真である。
【図10】試験例1で、比較例1で得たマイクロ流体デバイスを用いて受精卵の配置操作を行った結果を示す写真である。
【図11】試験例1で、実施例1で得たマイクロ流体デバイスを用いて受精卵の配置操作を行った結果を示す写真である。
【図12】試験例1で、実施例3で得たマイクロ流体デバイスを用いて受精卵の配置操作を行った結果を示す写真である。
【図13】試験例1で、実施例2で得たマイクロ流体デバイスを用いて受精卵の配置操作を行った結果を示す写真である。
【発明を実施するための形態】
【0009】
本態様の受精卵培養デバイスを、添付の図面を用いて説明する。
<第一実施形態>
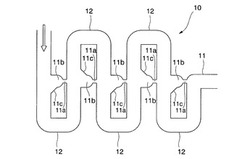
図1〜2に本発明の第一実施形態の受精卵培養デバイスが備えるマイクロ流路構造10を示す。図1は、本態様の受精卵培養デバイスが備えるマイクロ流路構造10の上面図であり、図2はその部分拡大図である。図1〜2中の矢印は、培養液の流通方向を示す。
マイクロ流路構造10は、直線状の主流路11と、主流路11と順次交差する方形波形状の蛇行流路12とを有する。
主流路11には、培養する受精卵が通過しない幅の狭窄部11aが複数設けられて、各狭窄部11aと、その上流で主流路11に交差する蛇行流路12との間(図2中の斜線部)が、受精卵を捕捉するケージ領域11bとされている。
ケージ領域11bは、蛇行流路12の下流側の側壁が切り欠かれて切り欠き11cが設けられることにより、蛇行流路12の下流方向に拡張している。以下、ケージ領域11bのうち、切り欠き11cによって幅が拡張している領域を拡張部11dという。
ケージ領域11b内の、拡張部11dよりも下流側の領域は、横断面が半円状(半円部11e)となっている。
ここで、「主流路」とは、受精卵が全く捕捉されていない状態で培養液を当該マイクロ流路構造内に流入させた際に、最も流量が多い流路を意味する。つまり、受精卵培養デバイス10において、主流路11の体積流量Q1と、蛇行流路12の体積流量Q2との比(Q1/Q2)は1超となっている。主流路11および蛇行流路12がQ1/Q2>1を満たすように設計されていることにより、受精卵培養デバイス10に受精卵を培養液とともに流通させた際に、空いているケージ領域11bに受精卵が導入される。
Q1/Q2は、1超5以下が好ましく、2以上4以下がより好ましい。Q1/Q2の値が1超以上、特に2以上であると、ケージ領域11bへの受精卵の配置が容易であり、Q1/Q2の値が5以下であると、1つのケージ領域11bに複数個の受精卵が捕捉されにくく、アレイ化を良好に行うことができる。
【0010】
主流路11の幅W1および高さ、蛇行流路12の幅W2および高さ、狭窄部11aの幅W3および長さW5、培養液の流通方向におけるケージ領域11b、拡張部11d、半円部11eそれぞれの長さW4、Wa、Wbは、それぞれ、上記Q1/Q2の値と、培養する受精卵に応じて設定される。
Q1/Q2の値は、狭窄部11aの幅W3、長さW5及び高さ、蛇行流路12の幅W2、長さ、高さ等のバランスによって定まる。
ここで、本発明の受精卵培養デバイスにより培養される受精卵は哺乳動物の受精卵であり、哺乳動物としては、ヒト、マウス、ウシ、ブタ等が挙げられる。哺乳動物の受精卵は、受精後、卵割により2細胞期、4細胞期、8細胞期と細胞数が増えていき、桑実胚を経て、胚盤胞へと発生する。胚盤胞は、栄養外胚葉とその内部にある内部細胞塊とから構成されるものであり、体外受精において、子宮内への移植は通常、4〜8細胞期から胚盤胞の段階で行われる。
受精直後の受精卵の大きさは、通常、ヒトは約130μm、マウスは約80μm、ウシやブタは約120〜130μmである。また、胚盤胞の段階の受精卵の大きさは、受精直後の受精卵の大きさの1.3〜2倍程度である。この倍率は、動物種によって異なり、たとえばマウスは約1.3倍、ウシは約2倍である。
したがって、主流路11の幅W1および高さ、蛇行流路12の幅W2および高さは、それぞれ、受精卵の導入、回収等を行うために、胚盤胞の大きさを基準として設定することが好ましい。具体的には、胚盤胞が移動可能な幅および高さであればよいが、胚盤胞の大きさ+5μm〜+50μmとすることが好ましい。
狭窄部11aの幅W3は、導入された受精卵をトラップするために、最小サイズ時の受精卵の大きさよりも狭くする必要がある。ここで「最小サイズ時の受精卵の大きさ」は、受精直後の受精卵と同等の大きさであり、受精直後から初期胚盤胞くらいまでは「最小サイズ時の受精卵の大きさ」である。一方、幅W3が狭すぎると、交差路から狭窄部方向への流れに対する抵抗が高くなり、蛇行流路12の流量が主流路の流量よりも多くなって、受精卵をうまく捕捉できないおそれがある。ただし幅W3を小さくしても、蛇行流路12の長さ)を長くすることで、交差路から蛇行流路12の下流方向への流れに対する抵抗を増加させ、Q1/Q2の値を維持あるいは大きくすることできるため、幅W3の下限は特に限定されない。ここで、蛇行流路12の長さとは、蛇行流路12が主流路11に交差する位置の1つと、その次に主流路11に交差する位置との間の流路中央の長さである。
狭窄部11aの長さW5は特に限定されないが、省流路スペースの点では短い方が好ましい。ただし長さW5は蛇行流路12の長さと相関し、長さW5が長くなると蛇行流路12の長さも長くなる。そのため、狭窄部11aの幅W3および長さW5の設定に際しては、Q1/Q2の値を考慮することが好ましい。
培養液の流通方向におけるケージ領域11bの長さW4は、受精卵を胚盤胞の段階まで発生させるために、胚盤胞の大きさを基準として設定することが好ましい。具体的には、受精卵が胚盤胞となるまでは受精卵全体がケージ領域11b内に収容される長さであればよいが、たとえば長さW4を、胚盤胞の大きさと同じ長さ又はそれよりもやや小さめに設計すると、長さW4と同じ大きさに達した胚盤胞が流れによって自動的にケージ領域11bから飛び出し、リリースされるようにすることができる。これらの観点から、胚盤胞の大きさ−10μm〜+50μmとすることが好ましい。また、培養液の流通方向における拡張部11dの長さWaは、胚盤胞の半径−5μm〜+25μmとすることが好ましい。また、培養液の流通方向における半円部11eの長さWbは、胚盤胞の半径−5μm〜+25μmとすることが好ましい。
【0011】
ケージ領域11cは、下流側が半円状の横断面を有する半円部11eとなっており、切り欠き11cは、その円弧の一端から、蛇行流路12の下流側の方向に切り込んだ形状を有する。
切り欠き11cの側壁と、蛇行流路12の側壁とがなす角度θbは、110〜160°が好ましく、120〜150°がより好ましい。
ケージ領域11cの切り欠き11cが設けられた側とは反対側の側壁、つまり蛇行流路12の上流側の側壁と、蛇行流路12の側壁とは、略垂直に合流している。ここで、略垂直とは、80〜100°の範囲内であることを意味する。ケージ領域11cの切り欠き11cとは反対側の側壁と、蛇行流路12の側壁とがなす角度θaは、80〜150°が好ましく、90〜120°がより好ましい。
【0012】
上記マイクロ流路構造10に受精卵を培養液とともに導入すると、受精卵がケージ領域11bに順次捕捉され、アレイ化される。つまり、ケージ領域11bが空いている(受精卵が捕捉されていない)場合、主流路11と蛇行流路12との交差路から狭窄部11a方向への流れに対する抵抗は、蛇行流路12の下流方向への流れに対する抵抗よりも低いため、主流路11の流量が蛇行流路12の流量よりも多くなる。そのため、培養液とともに導入した受精卵が、交差路から狭窄部11a方向に移動する。狭窄部11aは、培養液は通過するが受精卵は通過しない幅で形成されているため、狭窄部11aにより受精卵がトラップされ、ケージ領域11b内に受精卵が捕捉された状態となる。ケージ領域11b内に受精卵が捕捉された状態となると、その上流の交差路から狭窄部11a方向への流れに対する抵抗が大幅に上昇するため、蛇行流路12の流量が主流路11の流量よりも多くなる。従って、次に導入された受精卵は蛇行流路12沿いに移動し、受精卵が捕捉されたケージ領域11bを迂回して、次の空いているケージ領域11bに捕捉される。
前記特許文献1では、ケージ領域11bの側壁の両方が、蛇行流路12の側壁と垂直に合流した形状とされている(特許文献1の図5参照)。しかしこのような形状のケージ領域の場合、上述したように、1つのケージ領域に複数の受精卵が捕捉されやすい。本実施形態においては、切り欠き11cが設けられていることで、1つのケージ領域11bに1つの受精卵が捕捉された良好なアレイ化が可能である。これは、受精卵が捕捉されたケージ領域11bに別の受精卵が進入してきても、蛇行流路12の流れを受けたときに切り欠き11cに沿って押し流されやすくなるので、ケージ領域11b内に停滞することなくそのまま蛇行流路12へ流れるためと考えられる。
このように、本態様の受精卵培養デバイスによれば、受精卵を培養液とともにマイクロ流路構造10に順次導入するだけで、主流路11上に設けられた複数のケージ領域11bが上流側から順次受精卵で塞がれてゆき、結果として、受精卵を良好にアレイ化することができる。
本態様の受精卵培養デバイスによれば、1つのケージ領域に1つの受精卵が捕捉されたた良好なアレイを形成できるため、複数の受精卵を個別に品質管理しながら培養でき、受精卵の培養操作を自動化するうえで有用である。
【0013】
上記マイクロ流路構造10は、通常、板状の支持体の内部に設けられる。
支持体を構成する材料は特に限定されず、たとえば従来、マイクロ流路構造の形成に用いられている公知の材料のなかから目的に応じてから適宜選択できる。たとえばマイクロ流路構造10内の観察を外部から目視で行う場合、可視光を透過する透明材料が好ましい。透明材料として、たとえばポリジメチルシロキサン(以下、PDMSという)等のシリコーンゴム、アクリル、ポリスチレン等の各種樹脂材料やガラス、ゲル等が挙げられる。これらの中でも、安価で量産しやすい点から、ポリスチレン樹脂が好ましい。
透明材料以外では、シリコン、白金等の金属などが挙げられる。
本発明においては、受精卵の培養を行うことから、支持体を構成する材料が、受精卵に対して適合性を有する材料であることが好ましく、特に、デバイス外の大気中の酸素をマイクロ流路構造10内に供給できる点から、酸素透過性を有する材料(酸素透過性材料)が好ましい。酸素透過性材料としては、既知の任意の酸素透過性材料が使用可能であり、たとえば、酸素透過性コンタクトレンズなどに用いられている生体適合性の酸素透過性材料などを挙げることができる。特に、デバイス外部からマイクロ流路構造10内の培養細胞を観察できることから、酸素透過性を有する材料が、透明材料であることが好ましい。
生体適合性の酸素透過性材料として具体的には、シリコーンゴム、ゲル等が挙げられる。特に、生体適合性を有するとともに、透明性および酸素透過性を有し、さらに安価な材料であることから、PDMSが好ましい。
【0014】
支持体の内部にマイクロ流路構造10が形成されたデバイスは、たとえば以下の手順で製造できる。
まず、支持体の表面にマイクロ流路構造10が形成された構造体を作製する。該構造体は、従来、微小な流路構造を有するマイクロデバイスの製造に用いられている方法など、公知の微細加工法を利用して製造できる。該微細加工法としては、たとえばリソグラフィー法、エッチング法、切削、射出成型等が挙げられる。
リソグラフィー法を用いた製造方法の一例を挙げると、以下の工程(1)〜(5)を行うことにより、支持体の表面にマイクロ流路構造10が形成された構造体を作製できる。
(1)まず、基板上に、スピンコーティングによりフォトレジストを塗布してフォトレジスト層を形成する。
(2)フォトレジスト層に対し、マイクロ流路構造10に対応したパターンのマスクを介して露光し、現像することにより、フォトレジスト層をパターニングする。
(3)パターニングされたフォトレジスト層(鋳型)上に、UV硬化型または熱硬化型ポリマーのプレポリマーを塗布してプレポリマー層を形成する。
(4)プレポリマー層にUVを照射または加熱して硬化させてポリマー層とする。
(5)ポリマー層を剥離する。
このようにして得られたポリマー層(支持体)の表面には、フォトレジスト層のパターンが反転されたパターン(たとえばフォトレジスト層のパターンがラインパターンの場合はスペースパターン)で、フォトレジスト層の厚さと同じ高さ(深さ)のマイクロ流路構造10が形成されている。
このようにして得られた、支持体の表面にマイクロ流路構造10が形成された構造体に、貫通孔(マイクロ流路構造10の上流に培養液および/または受精卵を導入するためのポートとなる貫通孔、マイクロ流路構造10の下流から培養液および/または受精卵を導出するためのポートとなる貫通孔等)を形成する等の処理を行う。
支持体の内部にマイクロ流路構造10が形成されたデバイスは、たとえば、前記構造体の、マイクロ流路構造10が形成された面上に、板状の支持体(PDMSの平板やガラス板等)を接着することにより作製できる。また、前記支持体の表面にマイクロ流路構造10が形成された構造体と同様の手順で、支持体の表面に、マイクロ流路構造10のパターンが反転したパターンのマイクロ流路構造が形成された構造体を作製し、それら二つの構造体の、マイクロ流路構造が形成された面を位置合わせして貼り合わせることによっても作製できる。
【0015】
<第二実施形態>
図3〜4に本発明の第二実施形態の受精卵培養デバイスが備えるマイクロ流路構造20を示す。図3は、本態様の受精卵培養デバイスが備えるマイクロ流路構造20の上面図であり、図4(a)はその部分拡大図であり、図4(b)は図4(a)中の位置X−X’における縦断面図である。図3〜4中の矢印は、培養液の流通方向を示す。
マイクロ流路構造20は、直線状の主流路21と、主流路21と順次交差する方形波形状の蛇行流路22とを有する。
主流路21には、培養する受精卵が通過しない幅の狭窄部21aが複数設けられて、各狭窄部21aと、その上流で主流路21に交差する蛇行流路22との間(図4(a)中の斜線部)が、受精卵を捕捉するケージ領域21bとされている。
前記ケージ領域21bの底面には、円柱状のカップ構造(凹部)22cが設けられている。
【0016】
主流路21の幅および高さ、蛇行流路22の幅および高さ、狭窄部21aの幅および長さ、培養液の流通方向におけるケージ領域21bの長さは、それぞれ、前記第一実施形態における主流路11の幅W1および高さ、蛇行流路12の幅W2および高さ、狭窄部11aの幅W3および長さW5、培養液の流通方向におけるケージ領域11bの長さW4と同様にして設定される。
ケージ領域21cは、下流側が半円状の横断面を有しており、カップ構造21cは、ケージ領域21bの下流側末端、つまり狭窄部21aと接する位置に設けられている。
カップ構造21cの直径D1は、培養する受精卵の最小サイズ時の大きさの1.3〜2倍程度が好ましい。また、カップ構造21cの深さD2は、培養する受精卵の最小サイズ時の大きさの1/3〜1/2倍程度が好ましい。直径D1が小さすぎると、受精卵の発生をさまたげてしまうおそれがある。また、深さD2が小さすぎると、カップ構造21cを設ける効果が充分に得られないおそれがある。直径D1または深さD2が大きすぎると、配置の際に複数個の受精卵がケージ領域に入り込んでしまう上に、培養後に胚盤胞がカップ構造21c内にはまりこみ、回収が難しくなる。ただし、直径D1はW1以下の大きさでなければならない。
【0017】
上記マイクロ流路構造20に受精卵を培養液とともに導入すると、前記第一実施形態と同様、受精卵がケージ領域21bに順次捕捉され、アレイ化される。
前記特許文献1では、ケージ領域の底面は平滑である。しかしこのような形状のケージ部の場合、上述したように、培養時に、捕捉した受精卵の位置を保持できず、培養中に受精卵のケージ領域内での位置が変化したり、受精卵が胚盤胞まで発生する前にケージ領域からリリースされてしまうことがある。
受精卵の位置が変化する原因としてインキュベータ内圧の上昇が挙げられる。つまり、受精卵培養を行う際、環境中の二酸化炭素濃度や酸素濃度を受精卵の培養に適した条件とするためにマイクロ流体デバイスをインキュベータ内に収容し、炭酸ガスや窒素ガスを供給している。これによりインキュベータ内圧が上昇する。この内圧の上昇により、主流路で培養液の逆流が生じ、この流れによって受精卵が上流方向に移動してしまうと考えられる。
この逆流による位置の変化は、培養液の流量が多い場合はあまり問題にはならないが、低流量化するにつれて大きな問題となる。受精卵の培養を行う場合、受精卵が外乱に弱いため、発生率の向上のためには、特許文献1に記載されるようなマイクロビーズを配列する場合に比べて、流路内の液体の流量を少なくすることが望まれる。本実施形態においては、ケージ領域21bの底面にカップ構造21cが設けられていることで、低流量(たとえばマウス受精卵用の流路サイズの場合は0.1μL/分以下、ウシ受精卵用の流路サイズ(マウス受精卵用の流路サイズのほぼ倍)の場合は流量0.4μL/分以下)の場合でも、ケージ領域21bに捕捉された受精卵を、カップ構造21cの位置に安定に保持できる。したがって、本実施形態の受精卵培養デバイスは、胚盤胞に発生するまで受精卵を所定の位置に保持して品質管理を行うことができることから、受精卵の培養操作を自動化するうえで有用である。
【0018】
さらに、カップ構造21cが設けられていることで、以下の効果も得られる。
(1)オートクライン・パラクライン効果。
(2)溶存酸素濃度の保持。
(3)共培養の容易化。
上記のうち(1)について、受精卵は、受精後着床に至るまでに、各種の成長因子の影響を受けて発生が進行している。カップ構造21cが設けられていることによって、たとえば受精卵から放出される成長因子がそのままカップ構造21c内に留まり、ケージ領域21b内の成長因子の濃度が高くなる。そのため、より生体内に近い環境で培養でき、発生効率が向上する。
(2)について、たとえばカップ構造21cの底面に、酸素消費量により蛍光強度が変わる物質を付着させておき、培養を行う。その際、カップ構造21c部分の蛍光強度を測定することで、ケージ領域21b内の溶存酸素濃度が高感度で計測できる。この計測結果に応じて、マイクロ流路構造20に供給する培養液の溶存酸素濃度を調整することで、ケージ領域21b内の溶存酸素濃度を所望の濃度に維持できる。同時に受精卵の呼吸活性の計測も可能であり、その結果を受精卵の品質の指標とすることができる。
(3)について、カップ構造21cが設けられていることによって、その底面に、共培養のための支持細胞(feeder cell)を付着させることができる。カップ構造21cの底面に子宮内膜細胞等の支持細胞を付着させて受精卵の培養(共培養)を行うと、より生体内に近い環境で培養でき、発生効率が向上する。
ここで、「共培養」は、培養細胞(本発明の場合は受精卵)と、同種または異種の動物の体細胞とを同時に培養する方法を意味する。
哺乳動物の受精卵との共培養に用いられる支持細胞は、同種の哺乳動物の体細胞あるいは組織が好ましく、具体的には、繊維芽細胞(Fibroblast)、生殖器官由来細胞(子宮内膜細胞、卵管上皮細胞など)等が挙げられる。また、これらの細胞からなる組織であってもよい。これらの中でも、卵管上皮細胞が好ましい。
支持細胞のカップ構造21c底面への付着は、たとえば、受精卵を導入する前に、予め、マイクロ流路構造20内に支持細胞を含む培養液を導入し、そのまま閉鎖状態で培養することにより実施できる。カップ構造の底面に播種された支持細胞は、流れによる悪影響、たとえばせん断応力などを受けずに良好に培養できる。
【0019】
上記マイクロ流路構造20は、通常、前記第一実施形態におけるマイクロ流路構造10と同様、板状の支持体の内部に設けられる。
支持体の内部にマイクロ流路構造20が設けられたデバイスは、前記第一実施形態のデバイスと同様の手順で作製できる。
【0020】
<第三実施形態>
図5に本発明の第三実施形態の受精卵培養デバイスが備えるマイクロ流路構造30を示す。図5は、本態様の受精卵培養デバイスが備えるマイクロ流路構造30の上面図である。図5中の矢印は、培養液の流通方向を示す。
マイクロ流路構造30は、直線状の主流路31と、主流路31と順次交差する方形波形状の蛇行流路32とを有する。
主流路31には、培養する受精卵が通過しない幅の狭窄部31aが複数設けられて、各狭窄部31aと、その上流で主流路31に交差する蛇行流路32との間が、受精卵を捕捉するケージ領域31bとされている。
ケージ領域31bは、蛇行流路32の下流側の側壁が切り欠かれて切り欠き31cが設けられることにより、蛇行流路32の下流方向に拡張している。以下、ケージ領域31bのうち、切り欠き31cによって幅が拡張している領域を拡張部という。
ケージ領域31b内の、拡張部よりも下流側の領域は、横断面が半円状となっている。
また、ケージ領域31bの底面には、円柱状のカップ構造(凹部)31dが設けられている。
【0021】
本実施形態におけるマイクロ流路構造30は、さらにカップ構造31cが設けられている以外は、前記第一実施形態のマイクロ流路構造10と同様である。
カップ構造31dは、前記第二実施形態で説明したカップ構造21cと同様である。
したがって、本態様の受精卵培養デバイスによれば、受精卵を培養液とともにマイクロ流路構造30に順次導入するだけで、主流路31上に設けられた複数のケージ領域31bが上流側から順次受精卵で塞がれてゆき、結果として、受精卵を良好にアレイ化することができる。また、アレイ化された受精卵を、低流量下においても、ケージ領域31bのカップ構造31dの位置に安定に保持できる。そのため、本態様の受精卵培養デバイスは、受精卵の培養操作を自動化するうえで有用である。
さらに、前述した以下の効果も得られる。
(1)オートクライン・パラクライン効果。
(2)溶存酸素濃度の保持。
(3)共培養の容易化。
【0022】
上記マイクロ流路構造30は、通常、前記第一実施形態におけるマイクロ流路構造10と同様、板状の支持体の内部に設けられる。
支持体の内部にマイクロ流路構造30が設けられたデバイスは、前記第一実施形態のデバイスと同様の手順で作製できる。
【0023】
本発明の受精卵培養デバイスは上記実施形態に限定されるものではない。
たとえば第一実施形態〜第三実施形態では、主流路11、21、31として直線状のものを示し、蛇行流路12、22、32として、主流路に垂直に交差する方形波形状のものを示したが、本発明はこれに限定されず、主流路の流量が蛇行流路の流量よりも多くなる形状の流路構造であれば効果が得られる。したがって、主流路の流量が蛇行流路の流量よりも多くなる範囲内であれば、たとえば主流路を、曲線状、折線状等としてもよく、また、蛇行流路を、曲線状、折線状、のこぎり波形状、三角波形状、正弦波形状等としてもよい。主流路の流量が蛇行流路の流量よりも多くなる形状の流路構造を設計するには、流路の高さ、幅、長さによって決定される流路抵抗を、主流路より蛇行流路の方が高くなるように設定すればよい。
前記第一実施形態および第三実施形態では、切り欠き11c、31cが直線状である例を示したが、切り欠きが曲線状であってもよい。
前記第二実施形態および第三実施形態では、カップ構造21c、31dとして円柱状のものを示したが、半球状であってもよい。
第一実施形態〜第三実施形態では、ケージ領域11b、21b、31bとして、下流側の横断面形状が半円形状であるものを示したが、半円形状以外の形状、たとえば方形状、下流側に向かって幅狭となるテーパー形状等であってもよい。
【0024】
本発明の受精卵培養デバイスは、上述したように、受精卵の培養操作を自動化するうえで有用である。
本発明の受精卵培養装置は、本発明の受精卵培養デバイスと、送液手段と、受精卵観察手段と、インキュベータと、を備える。
受精卵を自動培養するための受精卵自動培養装置の一例として、受精卵培養デバイスと、シリンジポンプと、タイムラプス装置と、マルチガスインキュベータと、廃液タンクとを備えるものが挙げられる。該受精卵自動培養装置において、受精卵培養デバイスは、タイムラプス装置上に設置されている。受精卵培養デバイスのマイクロ流路構造の入口側ポートは送液用のシリンジポンプに、出口側ポートは廃液タンクにそれぞれ、シリコーンチューブによって接続されている。
このような受精卵自動培養装置においては、下記のようにして受精卵の配置、培養および回収が行われる。
まず、受精卵が、シリンジポンプを用いて培養液とともにマイクロ流路構造に導入し、流通させる。これにより、上述したように、受精卵が、マイクロ流路構造内の空いているケージ領域に捕捉される。この動作を繰り返すことによって、マイクロ流路構造内の複数のケージ領域に受精卵が配置(アレイ化)される。
受精卵としては、哺乳動物の受精卵であればよく、たとえばヒト、マウス、ウシ、ブタ等の受精卵が挙げられる。
受精卵を導入する前に、予め、共培養のための支持細胞を導入し、培養を行って、ケージ領域の底面等に支持細胞を付着させてもよい。
【0025】
次に、マイクロ流路構造内に配置された受精卵を培養する。
受精卵の培養は、マイクロ流路構造に培養液を流通させながら行うことが好ましい。この場合、供給する培養液の組成(栄養成分の種類や濃度、溶存酸素濃度等)を調整することによりケージ領域の組成を調節できる。ただし本発明はこれに限定されず、培養液を流通させずに培養を行ってもよい。拡張部や凹部を設けない従来のマイクロ流路構造を用いて受精卵の培養を行う場合、培養液を流通させずに培養を行うと、主流路において逆流が生じ、受精卵をケージ領域内の所定の位置に安定に保持できず、受精卵が胚盤胞に発生していない段階でケージ領域からリリースされてしまう。培養液をある程度高い流量で流せばリリースを防止できるが、胚盤胞への発生効率への悪影響が懸念される。これに対し、前記第二実施形態に示したような、ケージ領域の底面に凹部を設けた受精卵培養デバイスの場合、培養液を流通させなくても、受精卵をケージ領域内の所定の位置に安定に保持できる。
受精卵の培養を、マイクロ流路構造に培養液を流通させながら行う場合、マイクロ流路構造に供給する培養液の流量は、受精卵の胚盤胞への発生効率の点から、マウス受精卵用流路の場合、0.5μL/分以下が好ましく、0.2μL/分以下がより好ましい。該流量の下限は特に限定されないが、受精卵をケージ領域内の所定の位置に安定に保持できる点から、マウス受精卵用流路の場合、0.2μL/分以上が好ましく、0.5μL/分以上がより好ましい。該流量はシリンジポンプ等により制御できる。
使用する培養液の組成およびその他の培養条件(培養温度、培養時間等)は、培養する受精卵に応じて適宜設定できる。
受精卵の培養は、胚盤胞へと発生するまで行うことが好ましい。
培養中の受精卵の状態(発生段階等)は、タイムラプス装置により、ケージ領域毎に個別に観察できる。タイムラプス装置のステージは、XYZ軸をコンピュータによって自動制御可能であり、培養中の各ケージ領域内の受精卵を経時的に観察することができる。そのため、胚盤胞の形態学的評価だけでなく、発生の仕方を観察して評価し、質のよい受精卵だけをマイクロデバイスから回収することができる。質のよい受精卵を母胎に移植することで受胎率の向上が期待できる。
なお、ここではケージ領域毎の観察を、タイムラプス装置を用いて行う例を示したが、本発明はこれに限定されるものではなく、一般的な光学顕微鏡や動画撮影装置等を用いて行ってもよい。
【0026】
マイクロ流路構造内の受精卵の回収は、たとえば、回収対象の受精卵が捕捉されているケージ領域の下流の狭窄部に気泡を発生させる気泡発生手段を設け、該気泡発生手段により狭窄部に気泡を発生させることにより実施できる。気泡発生手段としては、電極、レーザー等が挙げられる。たとえばケージ領域の下流側の狭窄部に電極(白金電極等)を設置し、該電極に電圧を印可すると、気泡が発生、成長する。これによって、狭窄部からケージ領域方向に圧力がかかる。この圧力によって受精卵がケージ領域から押し出され、蛇行流路にリリースされる。リリースされた受精卵は、デバイスの出口側ポートから回収される。
【実施例】
【0027】
以下、実施例により本発明をより詳細に説明する。ただし本発明は本実施例に限定されるものではない。
<実施例1>
表面に、図1〜2に示す構成のマイクロ流路構造10を有するPDMS製のマイクロ流体デバイスを以下の手順で製造した。
(1)シリコン基板をピラナ−溶液(硫酸:過酸化水素水=2:1)とバッファードフッ酸(BHF)で洗浄した。
(2)ネガティブフォトレジストSU−8 2075(MicroChem社製)を、洗浄したシリコン基板上に、膜厚が120μmとなるようにスピンコートし、加熱して硬化(プリベイク処理)させた。
(3)流路形状が描画されているガラスフォトマスクでSU−8表面をマスキングし、UVを照射した。
(4)ポストベイク後、SU−8用現像液にシリコン基板ごと浸して現像した。この時、マスキングによってUVが照射されなかったところのSU−8が除去された。これによりマイクロ流路構造の凸型がシリコン基盤に製作できた。
(5)現像後、イソプロパノールと純水によってシリコン基板(以下,モールドマスタ)を洗浄した。
(6)PDMSをモールドマスタから離型しやすくするために、リアクティブイオンエッチング(RIE)装置を用いてモールドマスタ表面にトリフロロカーボンをコーティングした。
(7)未重合のPDMSと硬化剤を重量比10:1で撹拌し、適量をモールドマスタに流し込み、75度で2時間半加熱することで硬化させた。
(8)硬化したPDMSをモールドマスタから離型した。離型したPDMS(以下、PDMSチップ)の表面には凹構造が転写されていた。
(9)トレパンを用いてPDMSチップ流路の上流側(入口)ポート、下流側(出口)ポート、及び受精卵導入ポートに当たる部位に貫通孔をあけた。
(10)上記PDMSチップの流路構造面とPDMS製の平板、もしくはガラス板をRIE装置を用いた酸素プラズマボンディング法によって接合することで、上記マイクロ流路構造10を有するマイクロ流体デバイスが得られた。
得られたPDMS製のマイクロ流体デバイスにおけるマイクロ流路構造10の寸法は以下のとおりであった。
主流路11の幅W1=120μm、高さ=120μm。
蛇行流路12の幅W2=120μm、高さ=120μm、長さ1060μm。なお、蛇行流路12の長さは、上述したように、蛇行流路12が主流路11に交差する位置の1つと、その次に主流路11に交差する位置との間の流路中央の長さである。
狭窄部11aの幅W3=40μm、高さ=120μm、長さW5=30μm。
培養液の流通方向におけるケージ領域11bの長さW4=110μm、拡張部11dの長さWa=50μm、半円部11eの長さWb=60μm。
切り欠き11cの側壁と蛇行流路12の側壁とがなす角度θb=135°。
ケージ領域11cの切り欠き11cとは反対側の側壁と、蛇行流路12の側壁とがなす角度θa=90°。
また、このマイクロ流体デバイスをデジタルカメラにより撮影した。その写真を図6に示す。
【0028】
<実施例2>
表面に、図3〜4に示す構成のマイクロ流路構造20を有するPDMS製のマイクロ流体デバイスを、前記実施例1において基本的手順(2)〜(5)を2回行うことで製造した。具体的な手順は以下の通りである。
(1’)前記実施例1の手順(1)〜(5)によりマイクロ流路構造の凸型を製作した。
(2’)カップ構造を製作するために、前記実施例1の手順(2)に戻り、膜厚が40μmとなるようにSU−8 2050をスピンコートした。前記実施例1の手順(3)でカップ構造が描画されているガラスフォトマスクでSU−8表面をマスキングし、UVを照射した。この時、流路のケージ領域にカップ構造を製作するようにアライメント(位置合わせ)を行った。
(3’)以降は前記実施例1の(4)〜(10)と同様の手順でマイクロ流体デバイスを製作した。
得られたPDMS製のマイクロ流体デバイスにおけるマイクロ流路構造20の寸法は以下のとおりであった。
主流路21の幅W1=120μm、高さ=120μm。
蛇行流路22の幅W2=120μm、高さ=120μm、長さ1060μm。
狭窄部21aの幅W3=40μm、高さ=120μm、長さW5=30μm。
ケージ領域21bの長さW4=110μm。
ケージ領域21bの側壁と、蛇行流路12の側壁とがなす角度=90°。
カップ構造21cの直径D1=100μm、深さD2=40μm。
また、該PDMS製のマイクロ流体デバイスのマイクロ流路構造20の一部を倒立顕微鏡とデジタルカメラを用いて撮影した。その写真を図7に示す。
【0029】
<実施例3>
表面に図5に示す構成のマイクロ流路構造30を有するPDMS製のマイクロ流体デバイスを、前記実施例2においてガラスフォトマスクを、流路構造に切り欠きがあるデザインのものに変更した以外は同様の手順で製造した。
得られたPDMS製のマイクロ流体デバイスにおけるマイクロ流路構造30の寸法は以下のとおりであった。
主流路31の幅W1=120μm、高さ=120μm。
蛇行流路32の幅W2=120μm、高さ=120μm、長さ1060μm。
狭窄部31aの幅W3=40μm、高さ=120μm、長さW5=30μm。
ケージ領域31bの長さW4=110μm。
培養液の流通方向におけるケージ領域31bの長さW4=110μm、拡張部の長さWa=50μm、半円部の長さWb=60μm。
切り欠き31cの側壁と蛇行流路32の側壁とがなす角度θb=135°。
ケージ領域31cの切り欠き31cとは反対側の側壁と、蛇行流路32の側壁とがなす角度θa=90°。
カップ構造31dの直径D1=100μm、深さD2=40μm。
また、該PDMS製のマイクロ流体デバイスのマイクロ流路構造30の一部を倒立顕微鏡とデジタルカメラを用いて撮影した。その写真を図8に示す。
【0030】
<比較例1>
切り欠き11cを有さない以外はマイクロ流路構造10と同様の構成のマイクロ流路構造を表面に有するPDMS製のマイクロ流体デバイスを、用いるガラスフォトマスクを変更した以外は前記製造例1と同様の手順で製造した。
得られたPDMS製のマイクロ流体デバイスにおけるマイクロ流路構造の寸法は以下のとおりであった。
主流路11の幅W1=120μm、高さ=120μm。
蛇行流路12の幅W2=120μm、高さ=120μm、長さ1060μm。
狭窄部11aの幅W3=40μm、高さ=120μm、長さW5=30μm。
ケージ領域11bの長さW4=110μm。
ケージ領域11bの側壁と、蛇行流路12の側壁とがなす角度=90°。
また、該PDMS製のマイクロ流体デバイスのマイクロ流路構造部分を倒立顕微鏡とデジタルカメラを用いて撮影した。その写真を図9に示す。
【0031】
<試験例1>
実施例1〜3、比較例1で作製したマイクロ流体デバイスのマイクロ流路構造の入口側ポートを送液用のシリンジポンプに、出口側ポートを廃液タンクにそれぞれ、シリコーンチューブによって接続した。その後、該マイクロ流体デバイスを、タイムラプス装置上に設置した。
まず、シリンジポンプを用いて、マイクロ流路構造の入口側ポート側から、培養液を導入して、マイクロ流路構造内を培養液で満たした。次いで、受精卵導入ポート(入口側ポートの下流側すぐに設置されているポート。マイクロ流路構造よりも上流側。)からマウス受精卵を導入した。このとき、マイクロ流路構造内における受精卵の配置操作は、倒立顕微鏡とデジタルビデオカメラを用いて経時的に観察した。マウス受精卵は13週齢の雌BDF1と雄ICRを用い、Toyodaらが提案した体外受精手法によって用意したもので、導入時の直径は約80μmであった。培養液は、流量1.0μL/分にて送液した。
なお、各デバイスにおける、主流路および蛇行流路の体積流量比Q1/Q2は約2.5であった。
【0032】
その結果、比較例1で得たマイクロ流体デバイスを用いた例では、図10(a)に示すように、複数の受精卵が捕捉されたケージ領域が多数確認された。また、図10(b)に示すように、ケージ領域に引っかかってしまった受精卵が流路をふさいでしまうケースも確認された。
これに対し、実施例1、3で得たマイクロ流体デバイスを用いた例では、マイクロ流路構造のケージ領域に順次受精卵が捕捉されていった。また、各ケージ領域に捕捉された受精卵はそれぞれ1個であった。実施例1、3で得たマイクロ流体デバイスを用いた例で受精卵がケージ領域に捕捉されている状態をそれぞれ図11、12に示す。
実施例2で得たマイクロ流体デバイスを用いた例では、マイクロ流路構造のケージ領域に順次受精卵が捕捉されていった。しかし、図13に示すように、2〜3個の受精卵が捕捉されたケージ領域がわずかに存在していた。
【0033】
<試験例2>
カップ構造による受精卵保持位置の安定化効果を以下の手順で評価した。
上記試験例1において、受精卵の導入を開始した時点から72時間後まで、特定のケージ領域をタイプラプス装置によって定点観測し、捕捉された受精卵の位置の安定性を評価した。
その結果、比較例1のマイクロ流体デバイスを用いた例では、受精卵を導入(培養液を流量1.0μL/分で送液)してアレイ化した後、流量0.1μL/分で培養液を送液し続けたものの、実験開始した時点から72時間の間に幾度となくケージ領域からリリースされて戻ってくるという動作を繰り返し、最終的には、ケージ領域からほとんどの受精卵が消失していた。
これに対し、実施例2、3で得たマイクロ流体デバイスを用いた例では、受精卵を導入(培養液を流量1.0μL/分で送液)してアレイ化した後、流量0.1μL/分で培養液を送液し続けた場合はもちろん、培養液の送液を行わなく(流量0)とも、開始した時点から72時間後において、カップ構造の位置に受精卵が保持されていた。
【符号の説明】
【0034】
10…マイクロ流路構造、11…主流路、11a…狭窄部、11b…ケージ領域、11c…切り欠き、11d…拡張部、11e…半円部、12…蛇行流路、20…マイクロ流路構造、21…主流路、21a…狭窄部、21b…ケージ領域、21c…カップ構造(凹部)、22…蛇行流路、30…マイクロ流路構造、31…主流路、31a…狭窄部、31b…ケージ領域、31c…切り欠き、31d…カップ構造(凹部)、32…蛇行流路
【技術分野】
【0001】
本発明は、受精卵の培養に用いられる培養装置および該培養装置を用いた受精卵の培養方法に関する。
【背景技術】
【0002】
哺乳動物の受精卵の培養は、医療分野や家畜分野、最近では胚性幹細胞(ES細胞)の樹立などの様々なライフサイエンス分野において必要不可欠な基盤技術であり、その応用範囲も日増しに拡大の一途を辿っている。不妊治療や家畜繁殖などにおいて受精卵を母胎内に移植する過程では、確実な着床とその後の成長を期すため、一旦、体外で胚盤胞と呼ばれる段階まで培養し、状態の良い受精卵だけを選別して移植している。
従来、こうした受精卵の移植に際しては、洗浄、培養、選別等の操作が行われている。
受精卵の生体外培養は、通常、マイクロドロップレット法によって行われる。この方法は、シャーレ上に培養液の液滴を形成し、該液滴内に複数の受精卵を配置して培養を行う方法である。しかしマイクロドロップレット法は、高度な技術が必要であり、操作者の手技によって受精卵の質や発生率にばらつきが生じやすい問題がある。一例を挙げると、液滴内への受精卵の配置する際には、ガラスキャピラリーにマイクロピペットやマウスピースを接続し、吸気・排気のバランスによってキャピラリー内に受精卵を回収して新しい培地等の別の環境に移すといった操作が一般的に行われている。しかし受精卵は外乱に弱く、操作不良により胚盤胞への発生率の低下が生じやすい。そのため、上記のような方法は、行う者の手技の熟練度によって受精卵の質や胚盤胞への発生率にばらつきが生じるなど、定量性や再現性が低い問題がある。さらに、従来の技術では、受精卵を個別に管理し培養することが困難であるため、それぞれの受精卵の発生過程の評価が難しい。
そのため、熟練度によらず定量性や再現性の良好な受精卵の培養を行うために、自動化が期待されている。受精卵の培養の自動化のためには、複数の受精卵を、個別に品質管理しながら培養できること、および胚盤胞へと発生した受精卵のみの選択的回収が可能であること、を両立するシステムが要求されるが、このようなシステムは未だ実現されていない。
【0003】
一方、近年、微細加工技術を応用したμTAS(Micro Total Analysis System)分野で、細胞、細菌、生体分子などの微小なバイオ粒子を扱う研究が行われるようになっている。μTASでは、微細加工技術により形成したマイクロ流路内で微量流体操作を伴うマイクロシステムが実現されており、これまで多種多様のバイオ粒子の操作方法が提案されている。たとえば本願発明者らは、簡単な微量流体操作のみで、大量の微粒子を特定の部位に配置する、配置した状態で溶液を交換して薬物刺激を与える、配置した位置から流体に戻して他の部位に移動させる、といった微粒子操作が可能なマイクロ流路(ダイナミックマイクロアレイ)を設けたマイクロ流体デバイスについて研究している。たとえば特許文献1には、マイクロビーズを配列させる装置として、マイクロビーズが流されるとともに狭窄領域を有する直線状流路と、該直線状流路と順次交差する方形波形状の流路と、マイクロビーズが捕捉されていない空の狭窄領域がある場合はその空の狭窄領域でマイクロビーズを捕捉し、マイクロビーズが捕捉されている狭窄領域がある場合は該狭窄領域をバイパスしてマイクロビーズを下流に移動させるマイクロビーズ移動手段と、を具備する配列装置を開示している。
このダイナミックマイクロアレイにおいては、粒子が存在していない状態で液体を流した場合、直線状流路内の流れがメインストリームとなり、方形波形状流路内の流れはサブストリームとなるように設計されている。そのため、該ダイナミックマイクロアレイに液体とともに粒子を流すと、粒子は、主流路である直線状流路と方形波形状流路とが交差する位置(以下、交差路ということがある。)で直線状流路に流入し、粒子が通過しない幅で形成された狭窄部にせき止められる。粒子がせき止められると、次に流れてきた粒子は、迂回路である方形波形状流路に流入して下流側に移動し、次の交差路で、直線状流路に流入し、その下流側の狭窄部にせき止められる。このようにして、粒子が順次、交差路とその下流の狭窄部との間(ケージ領域)に捕捉され、アレイ化(配列化)される。そのため、該ダイナミックマイクロアレイを、1つのケージ領域に1つの粒子が捕捉されるように設計することで、各ケージ領域に捕捉された粒子を個別に管理することが可能である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2007−186456号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明者らは、特許文献1に記載するような、主流路と、該主流路と順次交差する蛇行流路とを備えるダイナミックマイクロアレイを設けたマイクロ流体デバイスを受精卵培養に適用してみた。その結果、該マイクロ流体デバイスには、受精卵の培養上、いくつかの問題があることを見出した。
その問題の一つは、1つのケージ領域に複数の受精卵が捕捉されてしまい、うまくアレイ化できないことである。つまり、受精卵を胚盤胞の状態まで培養するためには、ケージ領域の大きさを胚盤胞の大きさにあわせて設定する必要があるが、胚盤胞の大きさは、種別にもよるが初期の受精卵の1.3〜2倍程度である。そのため、初期の受精卵に比べてケージ領域が広すぎるため、受精卵がすでに捕捉されているケージ領域に、さらに別の受精卵が入ってしまう。1つのケージ領域に複数の受精卵が捕捉されてしまうと、個別管理ができなくなる。また、受精卵が連なって流れてくる場合、主流路と蛇行流路の交差路に受精卵が複数個引っかかることがあり、流路そのものを受精卵がふさいでしまう場合がある。
また、別の問題は、培養時に、捕捉した受精卵の位置を保持できない場合があることである。たとえば培養中に受精卵のケージ領域内での位置が変化したり、最悪、受精卵が胚盤胞まで発生する前にケージ領域からリリースされてしまうことがある。ケージ領域内での位置が変化すると、受精卵の個別観察が困難になる。
受精卵の培養を行う場合、受精卵が外乱に弱いため、特許文献1に記載されるようなマイクロビーズを配列する場合に比べて、流路内の液体の流量を少なくすることが望まれるが、低流量化すると上記リリース等の問題が生じやすくなる。
これらの問題は、受精卵培養の自動化への妨げとなるため、その改善が求められる。
本発明は、上記事情に鑑みてなされたものであって、受精卵のアレイ化またはアレイ化された受精卵の保持を良好に行うことができる受精卵培養デバイスおよび受精卵培養装置ならびに前記デバイスを用いた受精卵の培養方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
上記課題を解決する本発明は、以下の態様を有する。
[1]哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、
前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、
前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、
前記ケージ領域は、前記蛇行流路の下流側の側壁が切り欠かれて前記蛇行流路の下流方向に拡張している受精卵培養デバイス。
[2]哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、
前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、
前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、
前記ケージ領域の底面に凹部が設けられている受精卵培養デバイス。
[3]前記ケージ領域の底面に凹部が設けられている、[1]に記載の受精卵培養デバイス。
[4]前記ケージ領域の、前記蛇行流路の上流側の側壁と、前記蛇行流路の側壁とが略垂直に合流している、[1]に記載の受精卵培養デバイス。
[5]前記ケージ領域の、前記蛇行流路の上流側の側壁と、前記蛇行流路の側壁とが略垂直に合流している、[2]または[3]のいずれか一項に記載の受精卵培養デバイス。
[6][1]〜[5]のいずれか一項に記載の受精卵培養デバイスを備えた受精卵培養装置。
[7][1]〜[5]のいずれか一項に記載の受精卵培養デバイスを用いて哺乳動物の受精卵を培養する方法であって、
前記マイクロ流路構造に前記受精卵を培養液とともに流通させることにより前記ケージ領域に前記受精卵を配置する工程と、前記マイクロ流路構造に培養液を流通させながら前記受精卵を培養する工程と、を有する培養方法。
[8][2]、[3]または[5]に記載の受精卵デバイスを用いて哺乳動物の受精卵を培養する方法であって、
前記マイクロ流路構造に前記受精卵を培養液とともに流通させることにより前記ケージ領域に前記受精卵を配置する工程と、前記マイクロ流路構造に培養液を流通させずに前記受精卵を培養する工程と、を有する培養方法。
【発明の効果】
【0007】
本発明によれば、受精卵のアレイ化またはアレイ化された受精卵の保持を良好に行うことができる受精卵培養デバイスおよび受精卵培養装置ならびに前記デバイスを用いた受精卵の培養方法を提供できる。
【図面の簡単な説明】
【0008】
【図1】第一実施形態の受精卵培養デバイスが備えるマイクロ流路構造10の上面図である。
【図2】マイクロ流路構造10の部分拡大図である。
【図3】第二実施形態の受精卵培養デバイスが備えるマイクロ流路構造20の上面図である。
【図4】(a)はマイクロ流路構造20の部分拡大図であり、(b)は(a)中の位置X−X’における縦断面図である。
【図5】第三実施形態の受精卵培養デバイスが備えるマイクロ流路構造30の上面図である。
【図6】実施例1で得たマイクロ流体デバイスの写真である。
【図7】実施例2で得たマイクロ流体デバイスのマイクロ流路構造の写真である。
【図8】実施例3で得たマイクロ流体デバイスのマイクロ流路構造の写真である。
【図9】比較例1で得たマイクロ流体デバイスのマイクロ流路構造の写真である。
【図10】試験例1で、比較例1で得たマイクロ流体デバイスを用いて受精卵の配置操作を行った結果を示す写真である。
【図11】試験例1で、実施例1で得たマイクロ流体デバイスを用いて受精卵の配置操作を行った結果を示す写真である。
【図12】試験例1で、実施例3で得たマイクロ流体デバイスを用いて受精卵の配置操作を行った結果を示す写真である。
【図13】試験例1で、実施例2で得たマイクロ流体デバイスを用いて受精卵の配置操作を行った結果を示す写真である。
【発明を実施するための形態】
【0009】
本態様の受精卵培養デバイスを、添付の図面を用いて説明する。
<第一実施形態>
図1〜2に本発明の第一実施形態の受精卵培養デバイスが備えるマイクロ流路構造10を示す。図1は、本態様の受精卵培養デバイスが備えるマイクロ流路構造10の上面図であり、図2はその部分拡大図である。図1〜2中の矢印は、培養液の流通方向を示す。
マイクロ流路構造10は、直線状の主流路11と、主流路11と順次交差する方形波形状の蛇行流路12とを有する。
主流路11には、培養する受精卵が通過しない幅の狭窄部11aが複数設けられて、各狭窄部11aと、その上流で主流路11に交差する蛇行流路12との間(図2中の斜線部)が、受精卵を捕捉するケージ領域11bとされている。
ケージ領域11bは、蛇行流路12の下流側の側壁が切り欠かれて切り欠き11cが設けられることにより、蛇行流路12の下流方向に拡張している。以下、ケージ領域11bのうち、切り欠き11cによって幅が拡張している領域を拡張部11dという。
ケージ領域11b内の、拡張部11dよりも下流側の領域は、横断面が半円状(半円部11e)となっている。
ここで、「主流路」とは、受精卵が全く捕捉されていない状態で培養液を当該マイクロ流路構造内に流入させた際に、最も流量が多い流路を意味する。つまり、受精卵培養デバイス10において、主流路11の体積流量Q1と、蛇行流路12の体積流量Q2との比(Q1/Q2)は1超となっている。主流路11および蛇行流路12がQ1/Q2>1を満たすように設計されていることにより、受精卵培養デバイス10に受精卵を培養液とともに流通させた際に、空いているケージ領域11bに受精卵が導入される。
Q1/Q2は、1超5以下が好ましく、2以上4以下がより好ましい。Q1/Q2の値が1超以上、特に2以上であると、ケージ領域11bへの受精卵の配置が容易であり、Q1/Q2の値が5以下であると、1つのケージ領域11bに複数個の受精卵が捕捉されにくく、アレイ化を良好に行うことができる。
【0010】
主流路11の幅W1および高さ、蛇行流路12の幅W2および高さ、狭窄部11aの幅W3および長さW5、培養液の流通方向におけるケージ領域11b、拡張部11d、半円部11eそれぞれの長さW4、Wa、Wbは、それぞれ、上記Q1/Q2の値と、培養する受精卵に応じて設定される。
Q1/Q2の値は、狭窄部11aの幅W3、長さW5及び高さ、蛇行流路12の幅W2、長さ、高さ等のバランスによって定まる。
ここで、本発明の受精卵培養デバイスにより培養される受精卵は哺乳動物の受精卵であり、哺乳動物としては、ヒト、マウス、ウシ、ブタ等が挙げられる。哺乳動物の受精卵は、受精後、卵割により2細胞期、4細胞期、8細胞期と細胞数が増えていき、桑実胚を経て、胚盤胞へと発生する。胚盤胞は、栄養外胚葉とその内部にある内部細胞塊とから構成されるものであり、体外受精において、子宮内への移植は通常、4〜8細胞期から胚盤胞の段階で行われる。
受精直後の受精卵の大きさは、通常、ヒトは約130μm、マウスは約80μm、ウシやブタは約120〜130μmである。また、胚盤胞の段階の受精卵の大きさは、受精直後の受精卵の大きさの1.3〜2倍程度である。この倍率は、動物種によって異なり、たとえばマウスは約1.3倍、ウシは約2倍である。
したがって、主流路11の幅W1および高さ、蛇行流路12の幅W2および高さは、それぞれ、受精卵の導入、回収等を行うために、胚盤胞の大きさを基準として設定することが好ましい。具体的には、胚盤胞が移動可能な幅および高さであればよいが、胚盤胞の大きさ+5μm〜+50μmとすることが好ましい。
狭窄部11aの幅W3は、導入された受精卵をトラップするために、最小サイズ時の受精卵の大きさよりも狭くする必要がある。ここで「最小サイズ時の受精卵の大きさ」は、受精直後の受精卵と同等の大きさであり、受精直後から初期胚盤胞くらいまでは「最小サイズ時の受精卵の大きさ」である。一方、幅W3が狭すぎると、交差路から狭窄部方向への流れに対する抵抗が高くなり、蛇行流路12の流量が主流路の流量よりも多くなって、受精卵をうまく捕捉できないおそれがある。ただし幅W3を小さくしても、蛇行流路12の長さ)を長くすることで、交差路から蛇行流路12の下流方向への流れに対する抵抗を増加させ、Q1/Q2の値を維持あるいは大きくすることできるため、幅W3の下限は特に限定されない。ここで、蛇行流路12の長さとは、蛇行流路12が主流路11に交差する位置の1つと、その次に主流路11に交差する位置との間の流路中央の長さである。
狭窄部11aの長さW5は特に限定されないが、省流路スペースの点では短い方が好ましい。ただし長さW5は蛇行流路12の長さと相関し、長さW5が長くなると蛇行流路12の長さも長くなる。そのため、狭窄部11aの幅W3および長さW5の設定に際しては、Q1/Q2の値を考慮することが好ましい。
培養液の流通方向におけるケージ領域11bの長さW4は、受精卵を胚盤胞の段階まで発生させるために、胚盤胞の大きさを基準として設定することが好ましい。具体的には、受精卵が胚盤胞となるまでは受精卵全体がケージ領域11b内に収容される長さであればよいが、たとえば長さW4を、胚盤胞の大きさと同じ長さ又はそれよりもやや小さめに設計すると、長さW4と同じ大きさに達した胚盤胞が流れによって自動的にケージ領域11bから飛び出し、リリースされるようにすることができる。これらの観点から、胚盤胞の大きさ−10μm〜+50μmとすることが好ましい。また、培養液の流通方向における拡張部11dの長さWaは、胚盤胞の半径−5μm〜+25μmとすることが好ましい。また、培養液の流通方向における半円部11eの長さWbは、胚盤胞の半径−5μm〜+25μmとすることが好ましい。
【0011】
ケージ領域11cは、下流側が半円状の横断面を有する半円部11eとなっており、切り欠き11cは、その円弧の一端から、蛇行流路12の下流側の方向に切り込んだ形状を有する。
切り欠き11cの側壁と、蛇行流路12の側壁とがなす角度θbは、110〜160°が好ましく、120〜150°がより好ましい。
ケージ領域11cの切り欠き11cが設けられた側とは反対側の側壁、つまり蛇行流路12の上流側の側壁と、蛇行流路12の側壁とは、略垂直に合流している。ここで、略垂直とは、80〜100°の範囲内であることを意味する。ケージ領域11cの切り欠き11cとは反対側の側壁と、蛇行流路12の側壁とがなす角度θaは、80〜150°が好ましく、90〜120°がより好ましい。
【0012】
上記マイクロ流路構造10に受精卵を培養液とともに導入すると、受精卵がケージ領域11bに順次捕捉され、アレイ化される。つまり、ケージ領域11bが空いている(受精卵が捕捉されていない)場合、主流路11と蛇行流路12との交差路から狭窄部11a方向への流れに対する抵抗は、蛇行流路12の下流方向への流れに対する抵抗よりも低いため、主流路11の流量が蛇行流路12の流量よりも多くなる。そのため、培養液とともに導入した受精卵が、交差路から狭窄部11a方向に移動する。狭窄部11aは、培養液は通過するが受精卵は通過しない幅で形成されているため、狭窄部11aにより受精卵がトラップされ、ケージ領域11b内に受精卵が捕捉された状態となる。ケージ領域11b内に受精卵が捕捉された状態となると、その上流の交差路から狭窄部11a方向への流れに対する抵抗が大幅に上昇するため、蛇行流路12の流量が主流路11の流量よりも多くなる。従って、次に導入された受精卵は蛇行流路12沿いに移動し、受精卵が捕捉されたケージ領域11bを迂回して、次の空いているケージ領域11bに捕捉される。
前記特許文献1では、ケージ領域11bの側壁の両方が、蛇行流路12の側壁と垂直に合流した形状とされている(特許文献1の図5参照)。しかしこのような形状のケージ領域の場合、上述したように、1つのケージ領域に複数の受精卵が捕捉されやすい。本実施形態においては、切り欠き11cが設けられていることで、1つのケージ領域11bに1つの受精卵が捕捉された良好なアレイ化が可能である。これは、受精卵が捕捉されたケージ領域11bに別の受精卵が進入してきても、蛇行流路12の流れを受けたときに切り欠き11cに沿って押し流されやすくなるので、ケージ領域11b内に停滞することなくそのまま蛇行流路12へ流れるためと考えられる。
このように、本態様の受精卵培養デバイスによれば、受精卵を培養液とともにマイクロ流路構造10に順次導入するだけで、主流路11上に設けられた複数のケージ領域11bが上流側から順次受精卵で塞がれてゆき、結果として、受精卵を良好にアレイ化することができる。
本態様の受精卵培養デバイスによれば、1つのケージ領域に1つの受精卵が捕捉されたた良好なアレイを形成できるため、複数の受精卵を個別に品質管理しながら培養でき、受精卵の培養操作を自動化するうえで有用である。
【0013】
上記マイクロ流路構造10は、通常、板状の支持体の内部に設けられる。
支持体を構成する材料は特に限定されず、たとえば従来、マイクロ流路構造の形成に用いられている公知の材料のなかから目的に応じてから適宜選択できる。たとえばマイクロ流路構造10内の観察を外部から目視で行う場合、可視光を透過する透明材料が好ましい。透明材料として、たとえばポリジメチルシロキサン(以下、PDMSという)等のシリコーンゴム、アクリル、ポリスチレン等の各種樹脂材料やガラス、ゲル等が挙げられる。これらの中でも、安価で量産しやすい点から、ポリスチレン樹脂が好ましい。
透明材料以外では、シリコン、白金等の金属などが挙げられる。
本発明においては、受精卵の培養を行うことから、支持体を構成する材料が、受精卵に対して適合性を有する材料であることが好ましく、特に、デバイス外の大気中の酸素をマイクロ流路構造10内に供給できる点から、酸素透過性を有する材料(酸素透過性材料)が好ましい。酸素透過性材料としては、既知の任意の酸素透過性材料が使用可能であり、たとえば、酸素透過性コンタクトレンズなどに用いられている生体適合性の酸素透過性材料などを挙げることができる。特に、デバイス外部からマイクロ流路構造10内の培養細胞を観察できることから、酸素透過性を有する材料が、透明材料であることが好ましい。
生体適合性の酸素透過性材料として具体的には、シリコーンゴム、ゲル等が挙げられる。特に、生体適合性を有するとともに、透明性および酸素透過性を有し、さらに安価な材料であることから、PDMSが好ましい。
【0014】
支持体の内部にマイクロ流路構造10が形成されたデバイスは、たとえば以下の手順で製造できる。
まず、支持体の表面にマイクロ流路構造10が形成された構造体を作製する。該構造体は、従来、微小な流路構造を有するマイクロデバイスの製造に用いられている方法など、公知の微細加工法を利用して製造できる。該微細加工法としては、たとえばリソグラフィー法、エッチング法、切削、射出成型等が挙げられる。
リソグラフィー法を用いた製造方法の一例を挙げると、以下の工程(1)〜(5)を行うことにより、支持体の表面にマイクロ流路構造10が形成された構造体を作製できる。
(1)まず、基板上に、スピンコーティングによりフォトレジストを塗布してフォトレジスト層を形成する。
(2)フォトレジスト層に対し、マイクロ流路構造10に対応したパターンのマスクを介して露光し、現像することにより、フォトレジスト層をパターニングする。
(3)パターニングされたフォトレジスト層(鋳型)上に、UV硬化型または熱硬化型ポリマーのプレポリマーを塗布してプレポリマー層を形成する。
(4)プレポリマー層にUVを照射または加熱して硬化させてポリマー層とする。
(5)ポリマー層を剥離する。
このようにして得られたポリマー層(支持体)の表面には、フォトレジスト層のパターンが反転されたパターン(たとえばフォトレジスト層のパターンがラインパターンの場合はスペースパターン)で、フォトレジスト層の厚さと同じ高さ(深さ)のマイクロ流路構造10が形成されている。
このようにして得られた、支持体の表面にマイクロ流路構造10が形成された構造体に、貫通孔(マイクロ流路構造10の上流に培養液および/または受精卵を導入するためのポートとなる貫通孔、マイクロ流路構造10の下流から培養液および/または受精卵を導出するためのポートとなる貫通孔等)を形成する等の処理を行う。
支持体の内部にマイクロ流路構造10が形成されたデバイスは、たとえば、前記構造体の、マイクロ流路構造10が形成された面上に、板状の支持体(PDMSの平板やガラス板等)を接着することにより作製できる。また、前記支持体の表面にマイクロ流路構造10が形成された構造体と同様の手順で、支持体の表面に、マイクロ流路構造10のパターンが反転したパターンのマイクロ流路構造が形成された構造体を作製し、それら二つの構造体の、マイクロ流路構造が形成された面を位置合わせして貼り合わせることによっても作製できる。
【0015】
<第二実施形態>
図3〜4に本発明の第二実施形態の受精卵培養デバイスが備えるマイクロ流路構造20を示す。図3は、本態様の受精卵培養デバイスが備えるマイクロ流路構造20の上面図であり、図4(a)はその部分拡大図であり、図4(b)は図4(a)中の位置X−X’における縦断面図である。図3〜4中の矢印は、培養液の流通方向を示す。
マイクロ流路構造20は、直線状の主流路21と、主流路21と順次交差する方形波形状の蛇行流路22とを有する。
主流路21には、培養する受精卵が通過しない幅の狭窄部21aが複数設けられて、各狭窄部21aと、その上流で主流路21に交差する蛇行流路22との間(図4(a)中の斜線部)が、受精卵を捕捉するケージ領域21bとされている。
前記ケージ領域21bの底面には、円柱状のカップ構造(凹部)22cが設けられている。
【0016】
主流路21の幅および高さ、蛇行流路22の幅および高さ、狭窄部21aの幅および長さ、培養液の流通方向におけるケージ領域21bの長さは、それぞれ、前記第一実施形態における主流路11の幅W1および高さ、蛇行流路12の幅W2および高さ、狭窄部11aの幅W3および長さW5、培養液の流通方向におけるケージ領域11bの長さW4と同様にして設定される。
ケージ領域21cは、下流側が半円状の横断面を有しており、カップ構造21cは、ケージ領域21bの下流側末端、つまり狭窄部21aと接する位置に設けられている。
カップ構造21cの直径D1は、培養する受精卵の最小サイズ時の大きさの1.3〜2倍程度が好ましい。また、カップ構造21cの深さD2は、培養する受精卵の最小サイズ時の大きさの1/3〜1/2倍程度が好ましい。直径D1が小さすぎると、受精卵の発生をさまたげてしまうおそれがある。また、深さD2が小さすぎると、カップ構造21cを設ける効果が充分に得られないおそれがある。直径D1または深さD2が大きすぎると、配置の際に複数個の受精卵がケージ領域に入り込んでしまう上に、培養後に胚盤胞がカップ構造21c内にはまりこみ、回収が難しくなる。ただし、直径D1はW1以下の大きさでなければならない。
【0017】
上記マイクロ流路構造20に受精卵を培養液とともに導入すると、前記第一実施形態と同様、受精卵がケージ領域21bに順次捕捉され、アレイ化される。
前記特許文献1では、ケージ領域の底面は平滑である。しかしこのような形状のケージ部の場合、上述したように、培養時に、捕捉した受精卵の位置を保持できず、培養中に受精卵のケージ領域内での位置が変化したり、受精卵が胚盤胞まで発生する前にケージ領域からリリースされてしまうことがある。
受精卵の位置が変化する原因としてインキュベータ内圧の上昇が挙げられる。つまり、受精卵培養を行う際、環境中の二酸化炭素濃度や酸素濃度を受精卵の培養に適した条件とするためにマイクロ流体デバイスをインキュベータ内に収容し、炭酸ガスや窒素ガスを供給している。これによりインキュベータ内圧が上昇する。この内圧の上昇により、主流路で培養液の逆流が生じ、この流れによって受精卵が上流方向に移動してしまうと考えられる。
この逆流による位置の変化は、培養液の流量が多い場合はあまり問題にはならないが、低流量化するにつれて大きな問題となる。受精卵の培養を行う場合、受精卵が外乱に弱いため、発生率の向上のためには、特許文献1に記載されるようなマイクロビーズを配列する場合に比べて、流路内の液体の流量を少なくすることが望まれる。本実施形態においては、ケージ領域21bの底面にカップ構造21cが設けられていることで、低流量(たとえばマウス受精卵用の流路サイズの場合は0.1μL/分以下、ウシ受精卵用の流路サイズ(マウス受精卵用の流路サイズのほぼ倍)の場合は流量0.4μL/分以下)の場合でも、ケージ領域21bに捕捉された受精卵を、カップ構造21cの位置に安定に保持できる。したがって、本実施形態の受精卵培養デバイスは、胚盤胞に発生するまで受精卵を所定の位置に保持して品質管理を行うことができることから、受精卵の培養操作を自動化するうえで有用である。
【0018】
さらに、カップ構造21cが設けられていることで、以下の効果も得られる。
(1)オートクライン・パラクライン効果。
(2)溶存酸素濃度の保持。
(3)共培養の容易化。
上記のうち(1)について、受精卵は、受精後着床に至るまでに、各種の成長因子の影響を受けて発生が進行している。カップ構造21cが設けられていることによって、たとえば受精卵から放出される成長因子がそのままカップ構造21c内に留まり、ケージ領域21b内の成長因子の濃度が高くなる。そのため、より生体内に近い環境で培養でき、発生効率が向上する。
(2)について、たとえばカップ構造21cの底面に、酸素消費量により蛍光強度が変わる物質を付着させておき、培養を行う。その際、カップ構造21c部分の蛍光強度を測定することで、ケージ領域21b内の溶存酸素濃度が高感度で計測できる。この計測結果に応じて、マイクロ流路構造20に供給する培養液の溶存酸素濃度を調整することで、ケージ領域21b内の溶存酸素濃度を所望の濃度に維持できる。同時に受精卵の呼吸活性の計測も可能であり、その結果を受精卵の品質の指標とすることができる。
(3)について、カップ構造21cが設けられていることによって、その底面に、共培養のための支持細胞(feeder cell)を付着させることができる。カップ構造21cの底面に子宮内膜細胞等の支持細胞を付着させて受精卵の培養(共培養)を行うと、より生体内に近い環境で培養でき、発生効率が向上する。
ここで、「共培養」は、培養細胞(本発明の場合は受精卵)と、同種または異種の動物の体細胞とを同時に培養する方法を意味する。
哺乳動物の受精卵との共培養に用いられる支持細胞は、同種の哺乳動物の体細胞あるいは組織が好ましく、具体的には、繊維芽細胞(Fibroblast)、生殖器官由来細胞(子宮内膜細胞、卵管上皮細胞など)等が挙げられる。また、これらの細胞からなる組織であってもよい。これらの中でも、卵管上皮細胞が好ましい。
支持細胞のカップ構造21c底面への付着は、たとえば、受精卵を導入する前に、予め、マイクロ流路構造20内に支持細胞を含む培養液を導入し、そのまま閉鎖状態で培養することにより実施できる。カップ構造の底面に播種された支持細胞は、流れによる悪影響、たとえばせん断応力などを受けずに良好に培養できる。
【0019】
上記マイクロ流路構造20は、通常、前記第一実施形態におけるマイクロ流路構造10と同様、板状の支持体の内部に設けられる。
支持体の内部にマイクロ流路構造20が設けられたデバイスは、前記第一実施形態のデバイスと同様の手順で作製できる。
【0020】
<第三実施形態>
図5に本発明の第三実施形態の受精卵培養デバイスが備えるマイクロ流路構造30を示す。図5は、本態様の受精卵培養デバイスが備えるマイクロ流路構造30の上面図である。図5中の矢印は、培養液の流通方向を示す。
マイクロ流路構造30は、直線状の主流路31と、主流路31と順次交差する方形波形状の蛇行流路32とを有する。
主流路31には、培養する受精卵が通過しない幅の狭窄部31aが複数設けられて、各狭窄部31aと、その上流で主流路31に交差する蛇行流路32との間が、受精卵を捕捉するケージ領域31bとされている。
ケージ領域31bは、蛇行流路32の下流側の側壁が切り欠かれて切り欠き31cが設けられることにより、蛇行流路32の下流方向に拡張している。以下、ケージ領域31bのうち、切り欠き31cによって幅が拡張している領域を拡張部という。
ケージ領域31b内の、拡張部よりも下流側の領域は、横断面が半円状となっている。
また、ケージ領域31bの底面には、円柱状のカップ構造(凹部)31dが設けられている。
【0021】
本実施形態におけるマイクロ流路構造30は、さらにカップ構造31cが設けられている以外は、前記第一実施形態のマイクロ流路構造10と同様である。
カップ構造31dは、前記第二実施形態で説明したカップ構造21cと同様である。
したがって、本態様の受精卵培養デバイスによれば、受精卵を培養液とともにマイクロ流路構造30に順次導入するだけで、主流路31上に設けられた複数のケージ領域31bが上流側から順次受精卵で塞がれてゆき、結果として、受精卵を良好にアレイ化することができる。また、アレイ化された受精卵を、低流量下においても、ケージ領域31bのカップ構造31dの位置に安定に保持できる。そのため、本態様の受精卵培養デバイスは、受精卵の培養操作を自動化するうえで有用である。
さらに、前述した以下の効果も得られる。
(1)オートクライン・パラクライン効果。
(2)溶存酸素濃度の保持。
(3)共培養の容易化。
【0022】
上記マイクロ流路構造30は、通常、前記第一実施形態におけるマイクロ流路構造10と同様、板状の支持体の内部に設けられる。
支持体の内部にマイクロ流路構造30が設けられたデバイスは、前記第一実施形態のデバイスと同様の手順で作製できる。
【0023】
本発明の受精卵培養デバイスは上記実施形態に限定されるものではない。
たとえば第一実施形態〜第三実施形態では、主流路11、21、31として直線状のものを示し、蛇行流路12、22、32として、主流路に垂直に交差する方形波形状のものを示したが、本発明はこれに限定されず、主流路の流量が蛇行流路の流量よりも多くなる形状の流路構造であれば効果が得られる。したがって、主流路の流量が蛇行流路の流量よりも多くなる範囲内であれば、たとえば主流路を、曲線状、折線状等としてもよく、また、蛇行流路を、曲線状、折線状、のこぎり波形状、三角波形状、正弦波形状等としてもよい。主流路の流量が蛇行流路の流量よりも多くなる形状の流路構造を設計するには、流路の高さ、幅、長さによって決定される流路抵抗を、主流路より蛇行流路の方が高くなるように設定すればよい。
前記第一実施形態および第三実施形態では、切り欠き11c、31cが直線状である例を示したが、切り欠きが曲線状であってもよい。
前記第二実施形態および第三実施形態では、カップ構造21c、31dとして円柱状のものを示したが、半球状であってもよい。
第一実施形態〜第三実施形態では、ケージ領域11b、21b、31bとして、下流側の横断面形状が半円形状であるものを示したが、半円形状以外の形状、たとえば方形状、下流側に向かって幅狭となるテーパー形状等であってもよい。
【0024】
本発明の受精卵培養デバイスは、上述したように、受精卵の培養操作を自動化するうえで有用である。
本発明の受精卵培養装置は、本発明の受精卵培養デバイスと、送液手段と、受精卵観察手段と、インキュベータと、を備える。
受精卵を自動培養するための受精卵自動培養装置の一例として、受精卵培養デバイスと、シリンジポンプと、タイムラプス装置と、マルチガスインキュベータと、廃液タンクとを備えるものが挙げられる。該受精卵自動培養装置において、受精卵培養デバイスは、タイムラプス装置上に設置されている。受精卵培養デバイスのマイクロ流路構造の入口側ポートは送液用のシリンジポンプに、出口側ポートは廃液タンクにそれぞれ、シリコーンチューブによって接続されている。
このような受精卵自動培養装置においては、下記のようにして受精卵の配置、培養および回収が行われる。
まず、受精卵が、シリンジポンプを用いて培養液とともにマイクロ流路構造に導入し、流通させる。これにより、上述したように、受精卵が、マイクロ流路構造内の空いているケージ領域に捕捉される。この動作を繰り返すことによって、マイクロ流路構造内の複数のケージ領域に受精卵が配置(アレイ化)される。
受精卵としては、哺乳動物の受精卵であればよく、たとえばヒト、マウス、ウシ、ブタ等の受精卵が挙げられる。
受精卵を導入する前に、予め、共培養のための支持細胞を導入し、培養を行って、ケージ領域の底面等に支持細胞を付着させてもよい。
【0025】
次に、マイクロ流路構造内に配置された受精卵を培養する。
受精卵の培養は、マイクロ流路構造に培養液を流通させながら行うことが好ましい。この場合、供給する培養液の組成(栄養成分の種類や濃度、溶存酸素濃度等)を調整することによりケージ領域の組成を調節できる。ただし本発明はこれに限定されず、培養液を流通させずに培養を行ってもよい。拡張部や凹部を設けない従来のマイクロ流路構造を用いて受精卵の培養を行う場合、培養液を流通させずに培養を行うと、主流路において逆流が生じ、受精卵をケージ領域内の所定の位置に安定に保持できず、受精卵が胚盤胞に発生していない段階でケージ領域からリリースされてしまう。培養液をある程度高い流量で流せばリリースを防止できるが、胚盤胞への発生効率への悪影響が懸念される。これに対し、前記第二実施形態に示したような、ケージ領域の底面に凹部を設けた受精卵培養デバイスの場合、培養液を流通させなくても、受精卵をケージ領域内の所定の位置に安定に保持できる。
受精卵の培養を、マイクロ流路構造に培養液を流通させながら行う場合、マイクロ流路構造に供給する培養液の流量は、受精卵の胚盤胞への発生効率の点から、マウス受精卵用流路の場合、0.5μL/分以下が好ましく、0.2μL/分以下がより好ましい。該流量の下限は特に限定されないが、受精卵をケージ領域内の所定の位置に安定に保持できる点から、マウス受精卵用流路の場合、0.2μL/分以上が好ましく、0.5μL/分以上がより好ましい。該流量はシリンジポンプ等により制御できる。
使用する培養液の組成およびその他の培養条件(培養温度、培養時間等)は、培養する受精卵に応じて適宜設定できる。
受精卵の培養は、胚盤胞へと発生するまで行うことが好ましい。
培養中の受精卵の状態(発生段階等)は、タイムラプス装置により、ケージ領域毎に個別に観察できる。タイムラプス装置のステージは、XYZ軸をコンピュータによって自動制御可能であり、培養中の各ケージ領域内の受精卵を経時的に観察することができる。そのため、胚盤胞の形態学的評価だけでなく、発生の仕方を観察して評価し、質のよい受精卵だけをマイクロデバイスから回収することができる。質のよい受精卵を母胎に移植することで受胎率の向上が期待できる。
なお、ここではケージ領域毎の観察を、タイムラプス装置を用いて行う例を示したが、本発明はこれに限定されるものではなく、一般的な光学顕微鏡や動画撮影装置等を用いて行ってもよい。
【0026】
マイクロ流路構造内の受精卵の回収は、たとえば、回収対象の受精卵が捕捉されているケージ領域の下流の狭窄部に気泡を発生させる気泡発生手段を設け、該気泡発生手段により狭窄部に気泡を発生させることにより実施できる。気泡発生手段としては、電極、レーザー等が挙げられる。たとえばケージ領域の下流側の狭窄部に電極(白金電極等)を設置し、該電極に電圧を印可すると、気泡が発生、成長する。これによって、狭窄部からケージ領域方向に圧力がかかる。この圧力によって受精卵がケージ領域から押し出され、蛇行流路にリリースされる。リリースされた受精卵は、デバイスの出口側ポートから回収される。
【実施例】
【0027】
以下、実施例により本発明をより詳細に説明する。ただし本発明は本実施例に限定されるものではない。
<実施例1>
表面に、図1〜2に示す構成のマイクロ流路構造10を有するPDMS製のマイクロ流体デバイスを以下の手順で製造した。
(1)シリコン基板をピラナ−溶液(硫酸:過酸化水素水=2:1)とバッファードフッ酸(BHF)で洗浄した。
(2)ネガティブフォトレジストSU−8 2075(MicroChem社製)を、洗浄したシリコン基板上に、膜厚が120μmとなるようにスピンコートし、加熱して硬化(プリベイク処理)させた。
(3)流路形状が描画されているガラスフォトマスクでSU−8表面をマスキングし、UVを照射した。
(4)ポストベイク後、SU−8用現像液にシリコン基板ごと浸して現像した。この時、マスキングによってUVが照射されなかったところのSU−8が除去された。これによりマイクロ流路構造の凸型がシリコン基盤に製作できた。
(5)現像後、イソプロパノールと純水によってシリコン基板(以下,モールドマスタ)を洗浄した。
(6)PDMSをモールドマスタから離型しやすくするために、リアクティブイオンエッチング(RIE)装置を用いてモールドマスタ表面にトリフロロカーボンをコーティングした。
(7)未重合のPDMSと硬化剤を重量比10:1で撹拌し、適量をモールドマスタに流し込み、75度で2時間半加熱することで硬化させた。
(8)硬化したPDMSをモールドマスタから離型した。離型したPDMS(以下、PDMSチップ)の表面には凹構造が転写されていた。
(9)トレパンを用いてPDMSチップ流路の上流側(入口)ポート、下流側(出口)ポート、及び受精卵導入ポートに当たる部位に貫通孔をあけた。
(10)上記PDMSチップの流路構造面とPDMS製の平板、もしくはガラス板をRIE装置を用いた酸素プラズマボンディング法によって接合することで、上記マイクロ流路構造10を有するマイクロ流体デバイスが得られた。
得られたPDMS製のマイクロ流体デバイスにおけるマイクロ流路構造10の寸法は以下のとおりであった。
主流路11の幅W1=120μm、高さ=120μm。
蛇行流路12の幅W2=120μm、高さ=120μm、長さ1060μm。なお、蛇行流路12の長さは、上述したように、蛇行流路12が主流路11に交差する位置の1つと、その次に主流路11に交差する位置との間の流路中央の長さである。
狭窄部11aの幅W3=40μm、高さ=120μm、長さW5=30μm。
培養液の流通方向におけるケージ領域11bの長さW4=110μm、拡張部11dの長さWa=50μm、半円部11eの長さWb=60μm。
切り欠き11cの側壁と蛇行流路12の側壁とがなす角度θb=135°。
ケージ領域11cの切り欠き11cとは反対側の側壁と、蛇行流路12の側壁とがなす角度θa=90°。
また、このマイクロ流体デバイスをデジタルカメラにより撮影した。その写真を図6に示す。
【0028】
<実施例2>
表面に、図3〜4に示す構成のマイクロ流路構造20を有するPDMS製のマイクロ流体デバイスを、前記実施例1において基本的手順(2)〜(5)を2回行うことで製造した。具体的な手順は以下の通りである。
(1’)前記実施例1の手順(1)〜(5)によりマイクロ流路構造の凸型を製作した。
(2’)カップ構造を製作するために、前記実施例1の手順(2)に戻り、膜厚が40μmとなるようにSU−8 2050をスピンコートした。前記実施例1の手順(3)でカップ構造が描画されているガラスフォトマスクでSU−8表面をマスキングし、UVを照射した。この時、流路のケージ領域にカップ構造を製作するようにアライメント(位置合わせ)を行った。
(3’)以降は前記実施例1の(4)〜(10)と同様の手順でマイクロ流体デバイスを製作した。
得られたPDMS製のマイクロ流体デバイスにおけるマイクロ流路構造20の寸法は以下のとおりであった。
主流路21の幅W1=120μm、高さ=120μm。
蛇行流路22の幅W2=120μm、高さ=120μm、長さ1060μm。
狭窄部21aの幅W3=40μm、高さ=120μm、長さW5=30μm。
ケージ領域21bの長さW4=110μm。
ケージ領域21bの側壁と、蛇行流路12の側壁とがなす角度=90°。
カップ構造21cの直径D1=100μm、深さD2=40μm。
また、該PDMS製のマイクロ流体デバイスのマイクロ流路構造20の一部を倒立顕微鏡とデジタルカメラを用いて撮影した。その写真を図7に示す。
【0029】
<実施例3>
表面に図5に示す構成のマイクロ流路構造30を有するPDMS製のマイクロ流体デバイスを、前記実施例2においてガラスフォトマスクを、流路構造に切り欠きがあるデザインのものに変更した以外は同様の手順で製造した。
得られたPDMS製のマイクロ流体デバイスにおけるマイクロ流路構造30の寸法は以下のとおりであった。
主流路31の幅W1=120μm、高さ=120μm。
蛇行流路32の幅W2=120μm、高さ=120μm、長さ1060μm。
狭窄部31aの幅W3=40μm、高さ=120μm、長さW5=30μm。
ケージ領域31bの長さW4=110μm。
培養液の流通方向におけるケージ領域31bの長さW4=110μm、拡張部の長さWa=50μm、半円部の長さWb=60μm。
切り欠き31cの側壁と蛇行流路32の側壁とがなす角度θb=135°。
ケージ領域31cの切り欠き31cとは反対側の側壁と、蛇行流路32の側壁とがなす角度θa=90°。
カップ構造31dの直径D1=100μm、深さD2=40μm。
また、該PDMS製のマイクロ流体デバイスのマイクロ流路構造30の一部を倒立顕微鏡とデジタルカメラを用いて撮影した。その写真を図8に示す。
【0030】
<比較例1>
切り欠き11cを有さない以外はマイクロ流路構造10と同様の構成のマイクロ流路構造を表面に有するPDMS製のマイクロ流体デバイスを、用いるガラスフォトマスクを変更した以外は前記製造例1と同様の手順で製造した。
得られたPDMS製のマイクロ流体デバイスにおけるマイクロ流路構造の寸法は以下のとおりであった。
主流路11の幅W1=120μm、高さ=120μm。
蛇行流路12の幅W2=120μm、高さ=120μm、長さ1060μm。
狭窄部11aの幅W3=40μm、高さ=120μm、長さW5=30μm。
ケージ領域11bの長さW4=110μm。
ケージ領域11bの側壁と、蛇行流路12の側壁とがなす角度=90°。
また、該PDMS製のマイクロ流体デバイスのマイクロ流路構造部分を倒立顕微鏡とデジタルカメラを用いて撮影した。その写真を図9に示す。
【0031】
<試験例1>
実施例1〜3、比較例1で作製したマイクロ流体デバイスのマイクロ流路構造の入口側ポートを送液用のシリンジポンプに、出口側ポートを廃液タンクにそれぞれ、シリコーンチューブによって接続した。その後、該マイクロ流体デバイスを、タイムラプス装置上に設置した。
まず、シリンジポンプを用いて、マイクロ流路構造の入口側ポート側から、培養液を導入して、マイクロ流路構造内を培養液で満たした。次いで、受精卵導入ポート(入口側ポートの下流側すぐに設置されているポート。マイクロ流路構造よりも上流側。)からマウス受精卵を導入した。このとき、マイクロ流路構造内における受精卵の配置操作は、倒立顕微鏡とデジタルビデオカメラを用いて経時的に観察した。マウス受精卵は13週齢の雌BDF1と雄ICRを用い、Toyodaらが提案した体外受精手法によって用意したもので、導入時の直径は約80μmであった。培養液は、流量1.0μL/分にて送液した。
なお、各デバイスにおける、主流路および蛇行流路の体積流量比Q1/Q2は約2.5であった。
【0032】
その結果、比較例1で得たマイクロ流体デバイスを用いた例では、図10(a)に示すように、複数の受精卵が捕捉されたケージ領域が多数確認された。また、図10(b)に示すように、ケージ領域に引っかかってしまった受精卵が流路をふさいでしまうケースも確認された。
これに対し、実施例1、3で得たマイクロ流体デバイスを用いた例では、マイクロ流路構造のケージ領域に順次受精卵が捕捉されていった。また、各ケージ領域に捕捉された受精卵はそれぞれ1個であった。実施例1、3で得たマイクロ流体デバイスを用いた例で受精卵がケージ領域に捕捉されている状態をそれぞれ図11、12に示す。
実施例2で得たマイクロ流体デバイスを用いた例では、マイクロ流路構造のケージ領域に順次受精卵が捕捉されていった。しかし、図13に示すように、2〜3個の受精卵が捕捉されたケージ領域がわずかに存在していた。
【0033】
<試験例2>
カップ構造による受精卵保持位置の安定化効果を以下の手順で評価した。
上記試験例1において、受精卵の導入を開始した時点から72時間後まで、特定のケージ領域をタイプラプス装置によって定点観測し、捕捉された受精卵の位置の安定性を評価した。
その結果、比較例1のマイクロ流体デバイスを用いた例では、受精卵を導入(培養液を流量1.0μL/分で送液)してアレイ化した後、流量0.1μL/分で培養液を送液し続けたものの、実験開始した時点から72時間の間に幾度となくケージ領域からリリースされて戻ってくるという動作を繰り返し、最終的には、ケージ領域からほとんどの受精卵が消失していた。
これに対し、実施例2、3で得たマイクロ流体デバイスを用いた例では、受精卵を導入(培養液を流量1.0μL/分で送液)してアレイ化した後、流量0.1μL/分で培養液を送液し続けた場合はもちろん、培養液の送液を行わなく(流量0)とも、開始した時点から72時間後において、カップ構造の位置に受精卵が保持されていた。
【符号の説明】
【0034】
10…マイクロ流路構造、11…主流路、11a…狭窄部、11b…ケージ領域、11c…切り欠き、11d…拡張部、11e…半円部、12…蛇行流路、20…マイクロ流路構造、21…主流路、21a…狭窄部、21b…ケージ領域、21c…カップ構造(凹部)、22…蛇行流路、30…マイクロ流路構造、31…主流路、31a…狭窄部、31b…ケージ領域、31c…切り欠き、31d…カップ構造(凹部)、32…蛇行流路
【特許請求の範囲】
【請求項1】
哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、
前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、
前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、
前記ケージ領域は、前記蛇行流路の下流側の側壁が切り欠かれて前記蛇行流路の下流方向に拡張している受精卵培養デバイス。
【請求項2】
哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、
前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、
前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、
前記ケージ領域の底面に凹部が設けられている受精卵培養デバイス。
【請求項3】
前記ケージ領域の底面に凹部が設けられている、請求項1に記載の受精卵培養デバイス。
【請求項4】
前記ケージ領域の、前記蛇行流路の上流側の側壁と、前記蛇行流路の側壁とが略垂直に合流している、請求項1に記載の受精卵培養デバイス。
【請求項5】
前記ケージ領域の、前記蛇行流路の上流側の側壁と、前記蛇行流路の側壁とが略垂直に合流している、請求項2または3に記載の受精卵培養デバイス。
【請求項6】
請求項1〜5のいずれか一項に記載の受精卵培養デバイスを備えた受精卵培養装置。
【請求項7】
請求項1〜5のいずれか一項に記載の受精卵培養デバイスを用いて哺乳動物の受精卵を培養する方法であって、
前記マイクロ流路構造に前記受精卵を培養液とともに流通させることにより前記ケージ領域に前記受精卵を配置する工程と、前記マイクロ流路構造に培養液を流通させながら前記受精卵を培養する工程と、を有する培養方法。
【請求項8】
請求項2、3または5に記載の受精卵培養デバイスを用いて哺乳動物の受精卵を培養する方法であって、
前記マイクロ流路構造に前記受精卵を培養液とともに流通させることにより前記ケージ領域に前記受精卵を配置する工程と、前記マイクロ流路構造に培養液を流通させずに前記受精卵を培養する工程と、を有する培養方法。
【請求項1】
哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、
前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、
前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、
前記ケージ領域は、前記蛇行流路の下流側の側壁が切り欠かれて前記蛇行流路の下流方向に拡張している受精卵培養デバイス。
【請求項2】
哺乳動物の受精卵および培養液が流通するマイクロ流路構造を備え、
前記マイクロ流路構造は、主流路と、前記主流路と順次交差する蛇行流路とを有し、
前記主流路には、前記受精卵が通過しない幅の狭窄部が設けられて、前記狭窄部と、その上流で前記主流路に交差する蛇行流路との間が前記受精卵を捕捉するケージ領域とされており、
前記ケージ領域の底面に凹部が設けられている受精卵培養デバイス。
【請求項3】
前記ケージ領域の底面に凹部が設けられている、請求項1に記載の受精卵培養デバイス。
【請求項4】
前記ケージ領域の、前記蛇行流路の上流側の側壁と、前記蛇行流路の側壁とが略垂直に合流している、請求項1に記載の受精卵培養デバイス。
【請求項5】
前記ケージ領域の、前記蛇行流路の上流側の側壁と、前記蛇行流路の側壁とが略垂直に合流している、請求項2または3に記載の受精卵培養デバイス。
【請求項6】
請求項1〜5のいずれか一項に記載の受精卵培養デバイスを備えた受精卵培養装置。
【請求項7】
請求項1〜5のいずれか一項に記載の受精卵培養デバイスを用いて哺乳動物の受精卵を培養する方法であって、
前記マイクロ流路構造に前記受精卵を培養液とともに流通させることにより前記ケージ領域に前記受精卵を配置する工程と、前記マイクロ流路構造に培養液を流通させながら前記受精卵を培養する工程と、を有する培養方法。
【請求項8】
請求項2、3または5に記載の受精卵培養デバイスを用いて哺乳動物の受精卵を培養する方法であって、
前記マイクロ流路構造に前記受精卵を培養液とともに流通させることにより前記ケージ領域に前記受精卵を配置する工程と、前記マイクロ流路構造に培養液を流通させずに前記受精卵を培養する工程と、を有する培養方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2012−75391(P2012−75391A)
【公開日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願番号】特願2010−224131(P2010−224131)
【出願日】平成22年10月1日(2010.10.1)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19〜23年度、独立行政法人農業・食品産業技術総合研究機構、「家畜受精卵生体外育成用マイクロバイオリアクターシステムの開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(000002897)大日本印刷株式会社 (14,506)
【Fターム(参考)】
【公開日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願日】平成22年10月1日(2010.10.1)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19〜23年度、独立行政法人農業・食品産業技術総合研究機構、「家畜受精卵生体外育成用マイクロバイオリアクターシステムの開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(000002897)大日本印刷株式会社 (14,506)
【Fターム(参考)】
[ Back to top ]

