口腔ケア法及びシステム
本発明は、口のバイオフローラを評価する、および評価に従って塩基性アミノ酸を利用する適切な処置を提供する方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
[0001] この出願は2008年2月9日に出願された米国特許出願No.61/027,437の利益を主張し、2008年2月9日に出願された米国特許出願No.61/027,442、ならびに全て2008年2月8日に出願された米国特許出願No.61/027,432;61/027,431;61/027,420;および61/027,435の利益も主張し、その出願の内容を全て本明細書に援用する。
【0002】
[0002] 技術分野
[0003] この発明は、口の中の齲食原性細菌およびアルギニン分解(arginolytic)細菌の相対的なレベルを、例えば、塩基性アミノ酸を遊離または塩の型で含む組成物を用いる歯科ケア計画の一部として測定する方法に関する。
【背景技術】
【0003】
[0004] アルギニンおよび他の塩基性アミノ酸は口腔ケアにおける使用に関して提案されており、虫歯の形成および歯の過敏との戦いにおいて重要な利益を有すると考えられている。商業的に入手できるアルギニンに基づく練り歯磨きは、アルギニンおよび炭酸水素カルシウムを含むCaviStat(登録商標)を含むDenClude(登録商標)およびProClude(登録商標)である。
【0004】
[0005] 口の中のバイオフローラのタイプは、虫歯の発達において、および口の健康において一般に重要な役割を果たす。例えば、アルギニンの有益な作用における重要な因子は、アルギニンおよび他の塩基性アミノ酸が、齲食原性ではなく歯の上の、および口腔中での位置に関してS.ミュータンス(S. mutans)のような齲食原性細菌と競合する特定のタイプの細菌、例えばS.サングイス(S. sanguis)により代謝され得ることであると仮定されてきた。アルギニン分解細菌はアルギニンおよび他の塩基性アミノ酸を用いてアンモニアを生成することができ、それによりそれらの環境のpHを上昇させ、一方齲食原性細菌は糖を代謝して乳酸を生成し、それはプラークのpHを低下させ歯を脱灰させる傾向があり、最終的には虫歯につながる。
【0005】
[0006] 口の中のバイオフローラのタイプを監視する効率的な手段があれば、例えば最適な処置を決定するのに、および患者の処置の有効性を監視するのに有用であろう。
【発明の概要】
【発明が解決しようとする課題】
【0006】
[0007] 本発明は、口の中のバイオフローラを評価するための迅速かつ単純な方法を提供する。
【課題を解決するための手段】
【0007】
[0008] 第1態様において、本発明はプラークのアンモニア生成レベルを測定してアルギニン分解細菌の相対的な個体数を決定する。
[0009] 別の態様において、本発明はプラークの乳酸レベルを測定して齲食原性細菌の相対的な個体数を決定する。
【0008】
[0010] 別の態様において、本発明はポリメラーゼ連鎖反応(PCR)、例えば定量的リアルタイムPCRを用いて口の中の、例えばプラークまたは唾液中のバイオフローラを特性づける。
【0009】
[0011] 別の例において、本発明は逆転写酵素PCR(RT−PCR)を用いて口の中の、例えばプラークまたは唾液中のバイオフローラを特性づける。
[0012] 別の態様において、抗体プローブ、例えば蛍光抗体プローブを用いて口の中の、例えばプラークまたは唾液中のバイオフローラを特性づける。
【0010】
[0013] 例えば、本発明は少なくとも1種類の齲食原性細菌、例えばS.ミュータンスおよび少なくとも1種類のアルギニン分解細菌、例えばS.サングイスのレベルを定量する。
【0011】
[0014] 別の態様において、患者は前記の方法の1種類およびそれに従って定められた処置を用いて評価される。
[0015] 本発明の方法は、プラークの生態(ecology)における損傷を与える可能性のある変化を検出するために、および歯に対する検出可能なまたは重要な脱灰または損傷が存在する前の矯正的な処置を可能にするために特に有用である。
【0012】
[0016] 従って、本発明は口の健康を増進するための、例えば次のことのための方法を提供し:
a.齲食の形成を低減または抑制する、
b.歯の脱灰を低減または抑制し、再石灰化を促進する、
c.早期のエナメル質の病変の形成を処置、低減または抑制する、
d.歯の過敏性を低減する、
e.歯肉炎を低減または抑制する、
f.口の中の潰瘍または切り傷の治癒を促進する、
g.酸を産生する細菌のレベルを低減する、
h.アルギニン分解細菌の相対的なレベルを増大させる、
i.口腔中での微生物のバイオフィルムの形成を抑制する、
j.糖負荷の後のプラークのpHを少なくともpH5.5のレベルに上げる、および/または維持する、
k.プラークの蓄積を低減する、
l.口内乾燥を処置、緩和または低減する
m.歯を白くする、
n.例えば口の組織を経る全身感染の可能性を低減することにより、心血管の健康を含む全身の健康を増進する、
o.歯を齲食原性細菌およびそれらの作用に対して免疫化する、
p.歯および口腔を清潔にする、および/または
q.歯の酸食を低減する、
それは例えば前記の方法のいずれかを用いる、口腔のバイオフローラを測定すること、および必要であれば、有効量の塩基性アミノ酸、例えばアルギニンまたはその塩を含む口腔ケア製品を投与することを含む。
【0013】
[0017] 本発明はさらに、口腔のバイオフローラが、本発明に従う方法により測定される、高いレベルの齲食原性細菌および/または高いラクテートレベル、および/または低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成を含む対象において口の健康を増進するための医薬の製造のための、遊離または塩の型の塩基性アミノ酸の使用を提供する。
【0014】
[0018] 本発明はさらに、口腔を美容的に増進するための方法を提供し(ここでその美容的な増進は、例えば歯をより白くすることおよび/または口臭を低減することを含んでいてよい)、その方法は、本発明に従う方法を用いて口腔のバイオフローラを測定すること、およびもし必要であれば、高いレベルの齲食原性細菌および/または高いラクテートレベルの存在、および/または低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成の存在により、遊離または塩の型の塩基性アミノ酸を含む口腔ケア製品を投与することを含む。
【図面の簡単な説明】
【0015】
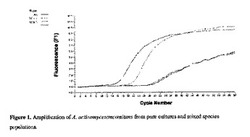
【図1】図1は、純粋培養物および混合集団からのA.アクチノミセテムコミタンスの増幅を示す。
【図2】図2は、生きた、および死んだA.アクチノミセテムコミタンスの混合物からのRNAの増幅を示す。
【図3】図3は、A.アクチノミセテムコミタンスの純粋および混合培養物から増幅された生成物の融解ピーク分析を示す。
【図4】図4は、標準曲線ならびに既知の濃度の生存している、および死んだA.アクチノミセテムコミタンスの増幅から生成された標準曲線の線形回帰を図説する。
【発明を実施するための形態】
【0016】
プラークの代謝−アンモニアの生成
[0019] 歯のプラークの、アルギニンをアンモニアに変換する能力は、アルギニン分解活性のマーカーである。特定の細菌が糖類を酸に変換できるのとちょうど同じように、特定の細菌はアルギニンをアンモニアに変換する能力を有している。アルギニン分解性の種の相対濃度を増大させることは、これらの細菌は酸性条件を好み齲食の危険性を増大させる齲食原性細菌の増殖にとって好ましくない条件を作り出すため、有益である。アルギニンの毎日の使用は、糖の頻繁な消費が酸を酸性する細菌に有利である条件を作り出すのと類似した方式で、アルギニン分解細菌に有利であるプラーク生態における変化を作り出すことが期待される。アンモニアは酸を中和することができる塩基であり、中性のプラークpHを維持するのを助ける。中性のpH条件は、非病原性細菌にとってより有利である。アンモニア生成の測定は、アルギニンをアンモニアに変換することができる全ての細菌からの寄与を測定する。これは、選ばれたアルギニン分解細菌の濃度を測定し代謝的に活性な(生きた)および不活性な(死んだ)細菌を識別しないリアルタイムPCR法(下記でさらに記述する)と対照的である。
【0017】
[0020] アンモニア検出キットは、アンモニアの生成を測定するために、例えばDiagnostic Chemicals Limited (Oxford, CT)から商業的に入手することができる。定量および決定の原理は、アンモニアがアルファ−ケトグルタル酸および還元型ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)と反応してL−グルタミンおよびNADPを形成することが知られていることである。その反応は、グルタミン酸デヒドロゲナーゼ(GLDH)により触媒される。NADPHの酸化による340nmの吸光度の減少は、アンモニア濃度に比例する。プラーク試料は、予め定められた処理プロトコルの後に集められる。一部の適用において、プラークは歯の固定装置(retainer)に取り付けられたエナメル質またはHAP標本から集められる。別の適用において、プラークは直接歯から集められる。
【0018】
乳酸レベルによるプラークの生態学(ecology)
[0021] ちょうどアンモニアレベルの測定がアルギニン分解細菌のレベルを測定するための代用品として役立つように、乳酸は齲食原性細菌のレベルを測定するための代用品として役立つ。対象は、朝の口腔清掃をせずに、および前の晩から節食または飲むことをせずに得られたプラークを有する。彼らは10%スクロース溶液で2分間ゆすぐ。8分後、歯の表面(複数)をひっかいてプラークを集める。プラーク試料を氷上で、予め重さを測定したチューブの中に集め、プラークの重量を決定する。分析には、氷で冷やした水を既知の量のプラーク試料に添加し、次いで試料を80度Cに5分間加熱して細菌を殺し、全ての酸を放出させた後、試料を氷水中でさらに5分間冷却することが含まれる。次いで試料を遠心分離し、上清を濾過する。ラクテート濃度を、キャピラリー電気泳動を用いて測定する。
【0019】
定量的リアルタイムPCRによるプラークの生態学
[0022] 定量的リアルタイムPCR(ポリメラーゼ連鎖反応)は、DNAを定量する非常に感度の高い手段である。DNAの量は存在する細菌の量に直接関係があるため、歯のプラークから単離した細菌のDNAを細菌の総レベルを定量するのに用いる。リアルタイムPCRは、政府組織、例えば疾病予防管理センター(Center for Disease Control)およびFDAに、非常に強力で高感度の技法として認められている。多くの口腔細菌の既知のゲノム配列を利用して、プローブを、口腔細菌または特定の細菌、例えばS.ミュータンスもしくはS.サングイスの総レベルを検出するように設計する。プラークまたは唾液の試料から単離したDNAをポリメラーゼ連鎖反応により増幅する。DNAの量は、PCR反応のそれぞれのサイクルと共に指数関数的に増大する。蛍光性の報告分子(report molecule)の使用により反応がリアルタイムで見守られるため、その技法は”リアルタイム”と呼ばれる。本発明の1態様において、報告分子としてSYBR Greenを用いる。この分子は、二本鎖DNAと連携すると強く蛍光を発する。定量は、蛍光の閾値を設定し、様々な濃度でのDNA標準を用いて、閾値に達するまでに必要なサイクル数を決定することにより達成される。より多くのDNAが存在すれば、閾値に達するまでにより少ないDNAサイクル数が必要である。市販のリアルタイムPCR器械は、多くの製造業者、例えばRoche Diagnosticsから入手することができる。
【0020】
[0023] プラークの試料を、既知の、および一定の表面積のエナメル質またはヒドロキシアパタイトの標本から集める。存在するDNAの量はどれだけ多くプラークを集めるかに直接関係するため、プラークの採集の標準化は決定的に重要である。その2種類の量は有意に相関があるため、プラークの質量をリアルタイムPCRにより測定する総細菌を標準化する手段として用いるのは不適切である。結果はmlあたりのμgDNAとして報告される。DNA濃度またはLn(DNA濃度)について統計学を実施することができる。総細菌に関して、対象および処理を要因として用いて、2要因ANOVAを実施する。もし違いが95%信頼度で検出されるなら、違いは有意であると考えられる。特定の細菌、例えばS.ミュータンスまたはS.サングイスに関して、総細菌を共変動として用いて2要因ANCOVAを行う。総細菌個体数と関係がある特定の細菌の総量は、プラーク生態の健康状態のより適切なマーカーである。
【0021】
[0024] 本発明の特定の態様において、S.ミュータンスを齲食原性に関するマーカーとして測定する。S.ミュータンスを選ぶのは、それが齲食の開始において関係している、十分に受け入れられている危険因子であるからである。他の酸を産生する細菌が齲食の過程に関わっている一方で、S.ミュータンスは齲食原性プロセスの開始および早いステージで特に重要な役割を果たしていることが知られている。本発明の1態様において、S.サングイスは高いレベルのアルギニン分解活性(アルギニンをアンモニアに変換する能力)を示すことが知られている細菌であるため、S.サングイスをより健康なプラーク生態への変化に関するマーカーとして選ぶ。
【0022】
RT−PCRによるプラークの生態学
[0025] 逆転写PCRは、試料中のRNA転写産物を測定する。RNAを単離し、逆転写酵素を用いて転写産物をcDNAに変換し、PCRを用いてcDNAを増幅する。RT−PCRの利点は、口腔細菌の検出のためのDNAに基づいた方法はそれらの種の生存度を決定できないことである。口腔細菌はバイオフィルム共同体(biofilm communities)において最も頻繁に見つけられるため、殺した後長い期間の間、死んだ細菌のDNAはバイオフィルムの構造の内部に保持され得る。他の方法、例えば蛍光に基づいた生存度アッセイ(Live Dead kit, Molecular Probes)は、生物が傷ついた膜を有しているか否かを検出することができるが、特定の種を直接検出することはない。
【0023】
[0026] 従って、逆転写リアルタイムPCRは、複合的な共同体の内部に存在する口腔細菌の特定の種の生菌を定量するための方法である。mRNAは比較的短い半減期を有しており、従って、最近活動している細菌を示す。我々は、伸長因子tufに対する種特異的なプライマーを開発した。この遺伝子は増殖期、培地または環境条件により有意に制御されず、それにより検出される細菌の数へのスプリアス効果(spurious effects)を最小限にする。アグリゲイティバクター・アクチノミセテムコミタンス(Aggregatibacter actinomycetemcomitans)を我々の試験生物として用いることで、わずか20%の存在する生物が生存可能であれば、生きた、およびEtOHで殺した細菌の混合された集団における生存度の差を検出することができる。加えて、その方法は、6種類までの異なる種の細菌を含む混合された種の集団中のA.アクチノミセテムコミタンスの存在の信頼できる同定を可能にする。計算された細菌の濃度は、同じ培養物に関するOD610に基づいて見積もられた値に密接に相関する(r=0.96、1%未満の差)。このアッセイは、口腔の複合的な環境の内部の特定の生物の生態を研究する手段である。さらなる遺伝子配列データが利用できるようになるにつれ、多種多様な口腔細菌に対してプライマーを開発することができる。
【0024】
蛍光抗体プローブによる細菌のレベル
[0027] 齲食診断キットを用いて、齲食原性タイプの細菌、例えばS.ミュータンスの、および/または非齲食原性タイプ、例えばS.サングイスに関する唾液中におけるレベルを、モノクローナル抗体の使用により検出する。用いる個別の抗体は細菌の種に特異的であり、抗体に結合した蛍光染料を有する。細菌のレベルは、放射された蛍光の量を測定することにより検出することができる。
【実施例】
【0025】
実施例1
総プラーク細菌レベルを測定するためのリアルタイムPCR
[0028] 対象における総プラーク細菌のレベル(マイクログラム細菌DNA/ml)を、異なる練り歯磨き配合物を用いて、上記の手順を用いて測定する:
【0026】
【表1】

【0027】
[0029] アルギニン−フッ化物配合物は、総細菌のプラーク重み(loads)、およびS.ミュータンスのプラーク重みを減少させ、一方でS.サングイス(アルギニン分解)の重みを増すのに有効である。
【0028】
実施例2−アンモニアの生成
[0030] アンモニアの生成を、異なる練り歯磨き配合物を用いる対象において、上記の方法を用いて測定する:
【0029】
【表2】

【0030】
[0031] アンモニアの生成は、アルギニンを含む配合物を用いる対象のプラークにおいて有意により高い。
実施例3−乳酸レベル
[0032] プラークの乳酸レベルを、対象において、上記のキャピラリー電気泳動を用いて測定し、スクロースの存在下でラクテートが有意に増加していることを示す。
【0031】
【表3】

【0032】
実施例4−リアルタイムPCR/RT−PCR
[0033] この発明は、細菌種のリアルタイムPCRでの検出の原理を、メッセンジャーRNA(mRNA)の細胞内の生物学的活性の指標としての使用と組み合わせる。細菌試料からのmRNAの精製の後、逆転写リアルタイムPCRを用いて単純な、または複合的な環境内の特定の細菌を検出および定量する。本発明は、そのプライマーの配列およびmRNA同定法およびその適用を含む。
【0033】
[0034] 生存細胞内のDNAの1つの機能は、タンパク質の合成のために遺伝暗号を指定することである。DNAはその対応するmRNA鎖の遺伝暗号を指定し、次いでそれが完成したタンパク質を組み立てるための指示として用いられる。DNAとは異なり、mRNAは非常に短い半減期(秒〜分)を有しており、生存しているか、または非常に最近殺されたかのいずれかである細胞にのみ存在する。DNAは細胞中に固定されたコピー数で存在する一方、mRNAレベルは細胞が存在する条件に応答して頻繁に変化する。様々なタンパク質の発現は、温度変化、成長培地、増殖期および他の環境条件に応答して上方または下方制御される可能性がある。従って、もし標的遺伝子を注意深く選ばないと、環境条件における変動が集団の生存度における変動であると誤って読み取られる可能性がある。この効果を避けるため、本発明は伸長因子tu、遺伝子tufを標的配列として用いる。異なる実験条件下においてtufの発現に変化がほとんどまたは全く観察されなかったため、この配列は以前にマーカーとして用いられてきた。
【0034】
[0035] リアルタイムPCRは、遺伝物質のポリメラーゼ連鎖反応(PCR)による増幅の裏の基礎的な化学を用い、それをそれぞれの増幅サイクルの後に存在する所与の遺伝子配列のコピー数を定量する機構としての蛍光標識のリアルタイム検出と結びつける。これらの方法のうちで最も単純なものは、二本鎖DNA(dsDNA)の中に特異的にインターカレートする蛍光プローブであるSYBR Green Iを用いる。SYBR Greenの蛍光の増大するレベルは、従って、dsDNAのより大きな濃度に相関する。この色素を、特定の遺伝子配列をプライマーとして用いる(primed using)PCR反応に含めると、蛍光の増加は標的遺伝子のコピー数の増加に一致する。その後、シグナルが予め決められた強度の閾値と交差するサイクル数は、出発物質中の遺伝子配列の濃度に相関し得る。
【0035】
[0036] リアルタイムPCRの技術の発達は、特定の生物学的種を速やかに、かつ高い程度の正確さで検出および定量することを可能にした。細菌種の定量のための、一般に用いられる方法は、16sリボソームサブユニットをコードするDNAの可変領域に対するプライマーの開発に頼っている。このサブユニットは細菌の複製にとって決定的に重要であり、従ってその配列は容易には変異しない。特定の種に特異的な16s rDNA配列の検出は、複合的な環境内の単一の細菌種の検出および計数を容易にすることができる。
【0036】
[0037] プライマーは、公に利用できるデータベース(国立生物工学情報センターおよびロスアラモス口腔病原体データベース)からのtuf遺伝子の配列に基づいて設計する。DNA Star LasergeneプログラムのMegAlignモジュールを用いて配列をアラインメントする。このアラインメントを用いて、種の特異性の見込みを最大にするために、相違がより大きい領域を選択する。プライマーの配列は、Roche Diagnostics LightCycler Probe Designソフトウェアから入手できる分析情報に基づいて選択する。この発明に含まれるプライマーには、既に設計し試験したプライマーだけでなく、口腔病原体におけるこの遺伝子領域に対する全てのプライマーが含まれる。
【0037】
[0038] 適切なRNA単離キットまたは他のRNA単離法を用いて、試料から総RNAを単離する。RNA単離のためのあらゆる好ましい方法を用いることができる。精製したRNAを、適切なDNase処理試薬で2回処理する。この工程は、RNA試料内のあらゆる混入しているDNAを分解し、偽陽性の獲得を防ぐ。単離したRNAを次いで逆転写して相補的DNA(cDNA)分子を生成する。得られたcDNAを増幅し、SYBR Greenを用いて検出する。完全なDNAの除去に関する質の管理として、逆転写の工程無しでリアルタイムPCR反応を行うことができる。逆転写反応無しで得られたPCR産物は、混入したDNAの結果であるに違いない。
【0038】
[0039] 既知の量の生菌を含む培養物から単離したRNA試料に対してリアルタイム逆転写PCR反応を実施することにより、標準曲線を生成する。それぞれの既知の試料に関する二次微分最大値をその細菌細胞の既知の濃度に対してプロットする。次いで未知の細菌試料から単離されたRNAの増幅曲線の二次微分最大値を標準曲線と比較して、試料集団内の生菌の濃度を決定することができる。このデータは、口腔環境の生態に対する抗菌物質および有効分子の作用の防止において、貴重な情報であろう。
【0039】
[0040] 次のプライマーペアは、アグリゲイティバクター(アクチノバチルス(Actinobacillus))・アクチノミセテムコミタンスからのtuf遺伝子の228塩基対の領域を増幅するために設計されている:
【0040】
【表4】

【0041】
表1.A.アクチノミセテムコミタンスのtufのmRNA発現の定量のために設計されたプライマーの特性。
[0041] これらのプライマーは、A.アクチノミセテムコミタンスの純粋培養物ならびに、A.アクチノミセテムコミタンスを含む、および含まない混合集団両方、の両方から単離されたRNAを増幅するのに用いられる。結果、特に蛍光(F1)およびサイクル数の間の関係を、図1のグラフに示す。図1において、”水”は陰性対照を表し、”Aa”
は純粋なA.アクチノミセテムコミタンスの培養物の陽性対照である。”混合物1”は、プレボテラ・インターメディア(Prevoltella intermedia)、ストレプトコッカス・ソブリナス(Streptococcus sobrinus)、ストレプトコッカス・オラリス(Streptococcus oralis)、およびアクチノミセス・ビスコーサス(Actinomyces viscosus)を含む集団から精製したものであり、従って、これらのプライマーを用いる増幅に関して陰性であるはずである。”混合物3”は、A.アクチノミセテムコミタンス、ポルフィロモナス・ジンジバリス(Porphyromonas gingivalis)、ストレプトコッカス・ゴルドニ(Streptococcus gordonii)、ストレプトコッカス・ミュータンス(Streptococcus mutans)、およびストレプトコッカス・サンギニス(Streptococcus sanquinis)を含む集団からのものであり、A.アクチノミセテムコミタンスの増幅に関して陽性であるはずである。
【0042】
[0042] このグラフは、A.アクチノミセテムコミタンスを含む混合物が陽性対照と類似の曲線で増幅される一方で、それを欠く混合物は水の対照と同じ増幅曲線に従うことを示し、これはこれらのプライマーがRNA種の混合物の内部からA.アクチノミセテムコミタンスを正確に検出することができることを示している。
【0043】
[0043] これらのプライマーの、A.アクチノミセテムコミタンスの生菌のみを正確に検出および定量する能力を、下記のようにして決定する。既知の濃度のA.アクチノミセテムコミタンス細胞を、80%エタノール中で15分間懸濁することにより殺す。次いで細菌を遠心分離によりペレットにし、新鮮なブレインハートインフュージョンブロス増殖培地中で再懸濁する。エタノールで殺した細菌を37℃で一夜培養し、増殖に関して試験し、生菌が残っていないことを確かめる。次いでエタノールで殺した細菌を生菌と定義された比率で混合し、逆転写、続いてリアルタイムPCRを実施する。これらの試料の増幅を図2に示し、それは生きた、および死んだA.アクチノミセテムコミタンスの混合物からのRNAの増幅を示す。
【0044】
[0044] この反応のための鋳型として用いられる集団の全てが同じ総数の生物を含んでいたという事実にも関わらず、より多くの生菌を含む試料においてより早い増幅が観察され、これはこのアッセイが生きた、および死んだ細菌両方の混合物内の生菌を検出することができることを示している。加えて、図3に示したこれらの試料の融解曲線は、全ての試料において単一の同じ生成物が増幅されていることを示し、それはアッセイの高い特異性を証明する。図3は、A.アクチノミセテムコミタンスの純粋および混合培養物から増幅された生成物の融解ピーク分析を示す。これらの曲線の重複は、全ての試料から単一の生成物が増幅されていることを示す。表2は、選択された標準曲線の試料中の生物の予想されたおよび計算された数の比較を示す。
【0045】
【表5】

【0046】
表2.選択された標準曲線の試料中の生物の予想されたおよび計算された数の比較。
[0045] 既知の濃度の、生存している、および殺した出発培養物に基づき、それぞれの集団中の生菌のおおよその数を計算し、それぞれの増幅曲線の二次微分最大値と共に用いて標準曲線を生成する。結果を図4に示し、それは標準曲線ならびに既知の濃度の生存している、および死んだA.アクチノミセテムコミタンスの増幅から生成された標準曲線の線形回帰を図説する。回帰直線のr2値は0.96である。
【0047】
[0046] 線形回帰直線のr2値は、回帰式の観察された値への適合の近さを示す。1.00により近いr2は、観察された値が回帰直線に密接に合うことを示す。上記の実施例に関して、標準曲線のr2値は0.96であり、これは、直線において観察される全ての変動の約96%は試料における実際の測定された変動によるものであり、この標準曲線は未知の集団中の生菌の濃度を計算するのに用いることができることを示す。
【0048】
[0047] 実際、1回の実験において、この標準曲線に基づいて計算した生菌の濃度は、RNAの単離の前に添加した実際の濃度と有意に異なっておらず、差は20%未満であった。これらのデータは、このアッセイが生物の複合的な集団内の特定の種の生菌を検出および定量する迅速、正確な手段であることを示している。これは、口腔の微生物の生態に対する処置の作用を分析するための強力な道具である可能性がある。
【技術分野】
【0001】
[0001] この出願は2008年2月9日に出願された米国特許出願No.61/027,437の利益を主張し、2008年2月9日に出願された米国特許出願No.61/027,442、ならびに全て2008年2月8日に出願された米国特許出願No.61/027,432;61/027,431;61/027,420;および61/027,435の利益も主張し、その出願の内容を全て本明細書に援用する。
【0002】
[0002] 技術分野
[0003] この発明は、口の中の齲食原性細菌およびアルギニン分解(arginolytic)細菌の相対的なレベルを、例えば、塩基性アミノ酸を遊離または塩の型で含む組成物を用いる歯科ケア計画の一部として測定する方法に関する。
【背景技術】
【0003】
[0004] アルギニンおよび他の塩基性アミノ酸は口腔ケアにおける使用に関して提案されており、虫歯の形成および歯の過敏との戦いにおいて重要な利益を有すると考えられている。商業的に入手できるアルギニンに基づく練り歯磨きは、アルギニンおよび炭酸水素カルシウムを含むCaviStat(登録商標)を含むDenClude(登録商標)およびProClude(登録商標)である。
【0004】
[0005] 口の中のバイオフローラのタイプは、虫歯の発達において、および口の健康において一般に重要な役割を果たす。例えば、アルギニンの有益な作用における重要な因子は、アルギニンおよび他の塩基性アミノ酸が、齲食原性ではなく歯の上の、および口腔中での位置に関してS.ミュータンス(S. mutans)のような齲食原性細菌と競合する特定のタイプの細菌、例えばS.サングイス(S. sanguis)により代謝され得ることであると仮定されてきた。アルギニン分解細菌はアルギニンおよび他の塩基性アミノ酸を用いてアンモニアを生成することができ、それによりそれらの環境のpHを上昇させ、一方齲食原性細菌は糖を代謝して乳酸を生成し、それはプラークのpHを低下させ歯を脱灰させる傾向があり、最終的には虫歯につながる。
【0005】
[0006] 口の中のバイオフローラのタイプを監視する効率的な手段があれば、例えば最適な処置を決定するのに、および患者の処置の有効性を監視するのに有用であろう。
【発明の概要】
【発明が解決しようとする課題】
【0006】
[0007] 本発明は、口の中のバイオフローラを評価するための迅速かつ単純な方法を提供する。
【課題を解決するための手段】
【0007】
[0008] 第1態様において、本発明はプラークのアンモニア生成レベルを測定してアルギニン分解細菌の相対的な個体数を決定する。
[0009] 別の態様において、本発明はプラークの乳酸レベルを測定して齲食原性細菌の相対的な個体数を決定する。
【0008】
[0010] 別の態様において、本発明はポリメラーゼ連鎖反応(PCR)、例えば定量的リアルタイムPCRを用いて口の中の、例えばプラークまたは唾液中のバイオフローラを特性づける。
【0009】
[0011] 別の例において、本発明は逆転写酵素PCR(RT−PCR)を用いて口の中の、例えばプラークまたは唾液中のバイオフローラを特性づける。
[0012] 別の態様において、抗体プローブ、例えば蛍光抗体プローブを用いて口の中の、例えばプラークまたは唾液中のバイオフローラを特性づける。
【0010】
[0013] 例えば、本発明は少なくとも1種類の齲食原性細菌、例えばS.ミュータンスおよび少なくとも1種類のアルギニン分解細菌、例えばS.サングイスのレベルを定量する。
【0011】
[0014] 別の態様において、患者は前記の方法の1種類およびそれに従って定められた処置を用いて評価される。
[0015] 本発明の方法は、プラークの生態(ecology)における損傷を与える可能性のある変化を検出するために、および歯に対する検出可能なまたは重要な脱灰または損傷が存在する前の矯正的な処置を可能にするために特に有用である。
【0012】
[0016] 従って、本発明は口の健康を増進するための、例えば次のことのための方法を提供し:
a.齲食の形成を低減または抑制する、
b.歯の脱灰を低減または抑制し、再石灰化を促進する、
c.早期のエナメル質の病変の形成を処置、低減または抑制する、
d.歯の過敏性を低減する、
e.歯肉炎を低減または抑制する、
f.口の中の潰瘍または切り傷の治癒を促進する、
g.酸を産生する細菌のレベルを低減する、
h.アルギニン分解細菌の相対的なレベルを増大させる、
i.口腔中での微生物のバイオフィルムの形成を抑制する、
j.糖負荷の後のプラークのpHを少なくともpH5.5のレベルに上げる、および/または維持する、
k.プラークの蓄積を低減する、
l.口内乾燥を処置、緩和または低減する
m.歯を白くする、
n.例えば口の組織を経る全身感染の可能性を低減することにより、心血管の健康を含む全身の健康を増進する、
o.歯を齲食原性細菌およびそれらの作用に対して免疫化する、
p.歯および口腔を清潔にする、および/または
q.歯の酸食を低減する、
それは例えば前記の方法のいずれかを用いる、口腔のバイオフローラを測定すること、および必要であれば、有効量の塩基性アミノ酸、例えばアルギニンまたはその塩を含む口腔ケア製品を投与することを含む。
【0013】
[0017] 本発明はさらに、口腔のバイオフローラが、本発明に従う方法により測定される、高いレベルの齲食原性細菌および/または高いラクテートレベル、および/または低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成を含む対象において口の健康を増進するための医薬の製造のための、遊離または塩の型の塩基性アミノ酸の使用を提供する。
【0014】
[0018] 本発明はさらに、口腔を美容的に増進するための方法を提供し(ここでその美容的な増進は、例えば歯をより白くすることおよび/または口臭を低減することを含んでいてよい)、その方法は、本発明に従う方法を用いて口腔のバイオフローラを測定すること、およびもし必要であれば、高いレベルの齲食原性細菌および/または高いラクテートレベルの存在、および/または低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成の存在により、遊離または塩の型の塩基性アミノ酸を含む口腔ケア製品を投与することを含む。
【図面の簡単な説明】
【0015】
【図1】図1は、純粋培養物および混合集団からのA.アクチノミセテムコミタンスの増幅を示す。
【図2】図2は、生きた、および死んだA.アクチノミセテムコミタンスの混合物からのRNAの増幅を示す。
【図3】図3は、A.アクチノミセテムコミタンスの純粋および混合培養物から増幅された生成物の融解ピーク分析を示す。
【図4】図4は、標準曲線ならびに既知の濃度の生存している、および死んだA.アクチノミセテムコミタンスの増幅から生成された標準曲線の線形回帰を図説する。
【発明を実施するための形態】
【0016】
プラークの代謝−アンモニアの生成
[0019] 歯のプラークの、アルギニンをアンモニアに変換する能力は、アルギニン分解活性のマーカーである。特定の細菌が糖類を酸に変換できるのとちょうど同じように、特定の細菌はアルギニンをアンモニアに変換する能力を有している。アルギニン分解性の種の相対濃度を増大させることは、これらの細菌は酸性条件を好み齲食の危険性を増大させる齲食原性細菌の増殖にとって好ましくない条件を作り出すため、有益である。アルギニンの毎日の使用は、糖の頻繁な消費が酸を酸性する細菌に有利である条件を作り出すのと類似した方式で、アルギニン分解細菌に有利であるプラーク生態における変化を作り出すことが期待される。アンモニアは酸を中和することができる塩基であり、中性のプラークpHを維持するのを助ける。中性のpH条件は、非病原性細菌にとってより有利である。アンモニア生成の測定は、アルギニンをアンモニアに変換することができる全ての細菌からの寄与を測定する。これは、選ばれたアルギニン分解細菌の濃度を測定し代謝的に活性な(生きた)および不活性な(死んだ)細菌を識別しないリアルタイムPCR法(下記でさらに記述する)と対照的である。
【0017】
[0020] アンモニア検出キットは、アンモニアの生成を測定するために、例えばDiagnostic Chemicals Limited (Oxford, CT)から商業的に入手することができる。定量および決定の原理は、アンモニアがアルファ−ケトグルタル酸および還元型ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)と反応してL−グルタミンおよびNADPを形成することが知られていることである。その反応は、グルタミン酸デヒドロゲナーゼ(GLDH)により触媒される。NADPHの酸化による340nmの吸光度の減少は、アンモニア濃度に比例する。プラーク試料は、予め定められた処理プロトコルの後に集められる。一部の適用において、プラークは歯の固定装置(retainer)に取り付けられたエナメル質またはHAP標本から集められる。別の適用において、プラークは直接歯から集められる。
【0018】
乳酸レベルによるプラークの生態学(ecology)
[0021] ちょうどアンモニアレベルの測定がアルギニン分解細菌のレベルを測定するための代用品として役立つように、乳酸は齲食原性細菌のレベルを測定するための代用品として役立つ。対象は、朝の口腔清掃をせずに、および前の晩から節食または飲むことをせずに得られたプラークを有する。彼らは10%スクロース溶液で2分間ゆすぐ。8分後、歯の表面(複数)をひっかいてプラークを集める。プラーク試料を氷上で、予め重さを測定したチューブの中に集め、プラークの重量を決定する。分析には、氷で冷やした水を既知の量のプラーク試料に添加し、次いで試料を80度Cに5分間加熱して細菌を殺し、全ての酸を放出させた後、試料を氷水中でさらに5分間冷却することが含まれる。次いで試料を遠心分離し、上清を濾過する。ラクテート濃度を、キャピラリー電気泳動を用いて測定する。
【0019】
定量的リアルタイムPCRによるプラークの生態学
[0022] 定量的リアルタイムPCR(ポリメラーゼ連鎖反応)は、DNAを定量する非常に感度の高い手段である。DNAの量は存在する細菌の量に直接関係があるため、歯のプラークから単離した細菌のDNAを細菌の総レベルを定量するのに用いる。リアルタイムPCRは、政府組織、例えば疾病予防管理センター(Center for Disease Control)およびFDAに、非常に強力で高感度の技法として認められている。多くの口腔細菌の既知のゲノム配列を利用して、プローブを、口腔細菌または特定の細菌、例えばS.ミュータンスもしくはS.サングイスの総レベルを検出するように設計する。プラークまたは唾液の試料から単離したDNAをポリメラーゼ連鎖反応により増幅する。DNAの量は、PCR反応のそれぞれのサイクルと共に指数関数的に増大する。蛍光性の報告分子(report molecule)の使用により反応がリアルタイムで見守られるため、その技法は”リアルタイム”と呼ばれる。本発明の1態様において、報告分子としてSYBR Greenを用いる。この分子は、二本鎖DNAと連携すると強く蛍光を発する。定量は、蛍光の閾値を設定し、様々な濃度でのDNA標準を用いて、閾値に達するまでに必要なサイクル数を決定することにより達成される。より多くのDNAが存在すれば、閾値に達するまでにより少ないDNAサイクル数が必要である。市販のリアルタイムPCR器械は、多くの製造業者、例えばRoche Diagnosticsから入手することができる。
【0020】
[0023] プラークの試料を、既知の、および一定の表面積のエナメル質またはヒドロキシアパタイトの標本から集める。存在するDNAの量はどれだけ多くプラークを集めるかに直接関係するため、プラークの採集の標準化は決定的に重要である。その2種類の量は有意に相関があるため、プラークの質量をリアルタイムPCRにより測定する総細菌を標準化する手段として用いるのは不適切である。結果はmlあたりのμgDNAとして報告される。DNA濃度またはLn(DNA濃度)について統計学を実施することができる。総細菌に関して、対象および処理を要因として用いて、2要因ANOVAを実施する。もし違いが95%信頼度で検出されるなら、違いは有意であると考えられる。特定の細菌、例えばS.ミュータンスまたはS.サングイスに関して、総細菌を共変動として用いて2要因ANCOVAを行う。総細菌個体数と関係がある特定の細菌の総量は、プラーク生態の健康状態のより適切なマーカーである。
【0021】
[0024] 本発明の特定の態様において、S.ミュータンスを齲食原性に関するマーカーとして測定する。S.ミュータンスを選ぶのは、それが齲食の開始において関係している、十分に受け入れられている危険因子であるからである。他の酸を産生する細菌が齲食の過程に関わっている一方で、S.ミュータンスは齲食原性プロセスの開始および早いステージで特に重要な役割を果たしていることが知られている。本発明の1態様において、S.サングイスは高いレベルのアルギニン分解活性(アルギニンをアンモニアに変換する能力)を示すことが知られている細菌であるため、S.サングイスをより健康なプラーク生態への変化に関するマーカーとして選ぶ。
【0022】
RT−PCRによるプラークの生態学
[0025] 逆転写PCRは、試料中のRNA転写産物を測定する。RNAを単離し、逆転写酵素を用いて転写産物をcDNAに変換し、PCRを用いてcDNAを増幅する。RT−PCRの利点は、口腔細菌の検出のためのDNAに基づいた方法はそれらの種の生存度を決定できないことである。口腔細菌はバイオフィルム共同体(biofilm communities)において最も頻繁に見つけられるため、殺した後長い期間の間、死んだ細菌のDNAはバイオフィルムの構造の内部に保持され得る。他の方法、例えば蛍光に基づいた生存度アッセイ(Live Dead kit, Molecular Probes)は、生物が傷ついた膜を有しているか否かを検出することができるが、特定の種を直接検出することはない。
【0023】
[0026] 従って、逆転写リアルタイムPCRは、複合的な共同体の内部に存在する口腔細菌の特定の種の生菌を定量するための方法である。mRNAは比較的短い半減期を有しており、従って、最近活動している細菌を示す。我々は、伸長因子tufに対する種特異的なプライマーを開発した。この遺伝子は増殖期、培地または環境条件により有意に制御されず、それにより検出される細菌の数へのスプリアス効果(spurious effects)を最小限にする。アグリゲイティバクター・アクチノミセテムコミタンス(Aggregatibacter actinomycetemcomitans)を我々の試験生物として用いることで、わずか20%の存在する生物が生存可能であれば、生きた、およびEtOHで殺した細菌の混合された集団における生存度の差を検出することができる。加えて、その方法は、6種類までの異なる種の細菌を含む混合された種の集団中のA.アクチノミセテムコミタンスの存在の信頼できる同定を可能にする。計算された細菌の濃度は、同じ培養物に関するOD610に基づいて見積もられた値に密接に相関する(r=0.96、1%未満の差)。このアッセイは、口腔の複合的な環境の内部の特定の生物の生態を研究する手段である。さらなる遺伝子配列データが利用できるようになるにつれ、多種多様な口腔細菌に対してプライマーを開発することができる。
【0024】
蛍光抗体プローブによる細菌のレベル
[0027] 齲食診断キットを用いて、齲食原性タイプの細菌、例えばS.ミュータンスの、および/または非齲食原性タイプ、例えばS.サングイスに関する唾液中におけるレベルを、モノクローナル抗体の使用により検出する。用いる個別の抗体は細菌の種に特異的であり、抗体に結合した蛍光染料を有する。細菌のレベルは、放射された蛍光の量を測定することにより検出することができる。
【実施例】
【0025】
実施例1
総プラーク細菌レベルを測定するためのリアルタイムPCR
[0028] 対象における総プラーク細菌のレベル(マイクログラム細菌DNA/ml)を、異なる練り歯磨き配合物を用いて、上記の手順を用いて測定する:
【0026】
【表1】

【0027】
[0029] アルギニン−フッ化物配合物は、総細菌のプラーク重み(loads)、およびS.ミュータンスのプラーク重みを減少させ、一方でS.サングイス(アルギニン分解)の重みを増すのに有効である。
【0028】
実施例2−アンモニアの生成
[0030] アンモニアの生成を、異なる練り歯磨き配合物を用いる対象において、上記の方法を用いて測定する:
【0029】
【表2】

【0030】
[0031] アンモニアの生成は、アルギニンを含む配合物を用いる対象のプラークにおいて有意により高い。
実施例3−乳酸レベル
[0032] プラークの乳酸レベルを、対象において、上記のキャピラリー電気泳動を用いて測定し、スクロースの存在下でラクテートが有意に増加していることを示す。
【0031】
【表3】

【0032】
実施例4−リアルタイムPCR/RT−PCR
[0033] この発明は、細菌種のリアルタイムPCRでの検出の原理を、メッセンジャーRNA(mRNA)の細胞内の生物学的活性の指標としての使用と組み合わせる。細菌試料からのmRNAの精製の後、逆転写リアルタイムPCRを用いて単純な、または複合的な環境内の特定の細菌を検出および定量する。本発明は、そのプライマーの配列およびmRNA同定法およびその適用を含む。
【0033】
[0034] 生存細胞内のDNAの1つの機能は、タンパク質の合成のために遺伝暗号を指定することである。DNAはその対応するmRNA鎖の遺伝暗号を指定し、次いでそれが完成したタンパク質を組み立てるための指示として用いられる。DNAとは異なり、mRNAは非常に短い半減期(秒〜分)を有しており、生存しているか、または非常に最近殺されたかのいずれかである細胞にのみ存在する。DNAは細胞中に固定されたコピー数で存在する一方、mRNAレベルは細胞が存在する条件に応答して頻繁に変化する。様々なタンパク質の発現は、温度変化、成長培地、増殖期および他の環境条件に応答して上方または下方制御される可能性がある。従って、もし標的遺伝子を注意深く選ばないと、環境条件における変動が集団の生存度における変動であると誤って読み取られる可能性がある。この効果を避けるため、本発明は伸長因子tu、遺伝子tufを標的配列として用いる。異なる実験条件下においてtufの発現に変化がほとんどまたは全く観察されなかったため、この配列は以前にマーカーとして用いられてきた。
【0034】
[0035] リアルタイムPCRは、遺伝物質のポリメラーゼ連鎖反応(PCR)による増幅の裏の基礎的な化学を用い、それをそれぞれの増幅サイクルの後に存在する所与の遺伝子配列のコピー数を定量する機構としての蛍光標識のリアルタイム検出と結びつける。これらの方法のうちで最も単純なものは、二本鎖DNA(dsDNA)の中に特異的にインターカレートする蛍光プローブであるSYBR Green Iを用いる。SYBR Greenの蛍光の増大するレベルは、従って、dsDNAのより大きな濃度に相関する。この色素を、特定の遺伝子配列をプライマーとして用いる(primed using)PCR反応に含めると、蛍光の増加は標的遺伝子のコピー数の増加に一致する。その後、シグナルが予め決められた強度の閾値と交差するサイクル数は、出発物質中の遺伝子配列の濃度に相関し得る。
【0035】
[0036] リアルタイムPCRの技術の発達は、特定の生物学的種を速やかに、かつ高い程度の正確さで検出および定量することを可能にした。細菌種の定量のための、一般に用いられる方法は、16sリボソームサブユニットをコードするDNAの可変領域に対するプライマーの開発に頼っている。このサブユニットは細菌の複製にとって決定的に重要であり、従ってその配列は容易には変異しない。特定の種に特異的な16s rDNA配列の検出は、複合的な環境内の単一の細菌種の検出および計数を容易にすることができる。
【0036】
[0037] プライマーは、公に利用できるデータベース(国立生物工学情報センターおよびロスアラモス口腔病原体データベース)からのtuf遺伝子の配列に基づいて設計する。DNA Star LasergeneプログラムのMegAlignモジュールを用いて配列をアラインメントする。このアラインメントを用いて、種の特異性の見込みを最大にするために、相違がより大きい領域を選択する。プライマーの配列は、Roche Diagnostics LightCycler Probe Designソフトウェアから入手できる分析情報に基づいて選択する。この発明に含まれるプライマーには、既に設計し試験したプライマーだけでなく、口腔病原体におけるこの遺伝子領域に対する全てのプライマーが含まれる。
【0037】
[0038] 適切なRNA単離キットまたは他のRNA単離法を用いて、試料から総RNAを単離する。RNA単離のためのあらゆる好ましい方法を用いることができる。精製したRNAを、適切なDNase処理試薬で2回処理する。この工程は、RNA試料内のあらゆる混入しているDNAを分解し、偽陽性の獲得を防ぐ。単離したRNAを次いで逆転写して相補的DNA(cDNA)分子を生成する。得られたcDNAを増幅し、SYBR Greenを用いて検出する。完全なDNAの除去に関する質の管理として、逆転写の工程無しでリアルタイムPCR反応を行うことができる。逆転写反応無しで得られたPCR産物は、混入したDNAの結果であるに違いない。
【0038】
[0039] 既知の量の生菌を含む培養物から単離したRNA試料に対してリアルタイム逆転写PCR反応を実施することにより、標準曲線を生成する。それぞれの既知の試料に関する二次微分最大値をその細菌細胞の既知の濃度に対してプロットする。次いで未知の細菌試料から単離されたRNAの増幅曲線の二次微分最大値を標準曲線と比較して、試料集団内の生菌の濃度を決定することができる。このデータは、口腔環境の生態に対する抗菌物質および有効分子の作用の防止において、貴重な情報であろう。
【0039】
[0040] 次のプライマーペアは、アグリゲイティバクター(アクチノバチルス(Actinobacillus))・アクチノミセテムコミタンスからのtuf遺伝子の228塩基対の領域を増幅するために設計されている:
【0040】
【表4】

【0041】
表1.A.アクチノミセテムコミタンスのtufのmRNA発現の定量のために設計されたプライマーの特性。
[0041] これらのプライマーは、A.アクチノミセテムコミタンスの純粋培養物ならびに、A.アクチノミセテムコミタンスを含む、および含まない混合集団両方、の両方から単離されたRNAを増幅するのに用いられる。結果、特に蛍光(F1)およびサイクル数の間の関係を、図1のグラフに示す。図1において、”水”は陰性対照を表し、”Aa”
は純粋なA.アクチノミセテムコミタンスの培養物の陽性対照である。”混合物1”は、プレボテラ・インターメディア(Prevoltella intermedia)、ストレプトコッカス・ソブリナス(Streptococcus sobrinus)、ストレプトコッカス・オラリス(Streptococcus oralis)、およびアクチノミセス・ビスコーサス(Actinomyces viscosus)を含む集団から精製したものであり、従って、これらのプライマーを用いる増幅に関して陰性であるはずである。”混合物3”は、A.アクチノミセテムコミタンス、ポルフィロモナス・ジンジバリス(Porphyromonas gingivalis)、ストレプトコッカス・ゴルドニ(Streptococcus gordonii)、ストレプトコッカス・ミュータンス(Streptococcus mutans)、およびストレプトコッカス・サンギニス(Streptococcus sanquinis)を含む集団からのものであり、A.アクチノミセテムコミタンスの増幅に関して陽性であるはずである。
【0042】
[0042] このグラフは、A.アクチノミセテムコミタンスを含む混合物が陽性対照と類似の曲線で増幅される一方で、それを欠く混合物は水の対照と同じ増幅曲線に従うことを示し、これはこれらのプライマーがRNA種の混合物の内部からA.アクチノミセテムコミタンスを正確に検出することができることを示している。
【0043】
[0043] これらのプライマーの、A.アクチノミセテムコミタンスの生菌のみを正確に検出および定量する能力を、下記のようにして決定する。既知の濃度のA.アクチノミセテムコミタンス細胞を、80%エタノール中で15分間懸濁することにより殺す。次いで細菌を遠心分離によりペレットにし、新鮮なブレインハートインフュージョンブロス増殖培地中で再懸濁する。エタノールで殺した細菌を37℃で一夜培養し、増殖に関して試験し、生菌が残っていないことを確かめる。次いでエタノールで殺した細菌を生菌と定義された比率で混合し、逆転写、続いてリアルタイムPCRを実施する。これらの試料の増幅を図2に示し、それは生きた、および死んだA.アクチノミセテムコミタンスの混合物からのRNAの増幅を示す。
【0044】
[0044] この反応のための鋳型として用いられる集団の全てが同じ総数の生物を含んでいたという事実にも関わらず、より多くの生菌を含む試料においてより早い増幅が観察され、これはこのアッセイが生きた、および死んだ細菌両方の混合物内の生菌を検出することができることを示している。加えて、図3に示したこれらの試料の融解曲線は、全ての試料において単一の同じ生成物が増幅されていることを示し、それはアッセイの高い特異性を証明する。図3は、A.アクチノミセテムコミタンスの純粋および混合培養物から増幅された生成物の融解ピーク分析を示す。これらの曲線の重複は、全ての試料から単一の生成物が増幅されていることを示す。表2は、選択された標準曲線の試料中の生物の予想されたおよび計算された数の比較を示す。
【0045】
【表5】

【0046】
表2.選択された標準曲線の試料中の生物の予想されたおよび計算された数の比較。
[0045] 既知の濃度の、生存している、および殺した出発培養物に基づき、それぞれの集団中の生菌のおおよその数を計算し、それぞれの増幅曲線の二次微分最大値と共に用いて標準曲線を生成する。結果を図4に示し、それは標準曲線ならびに既知の濃度の生存している、および死んだA.アクチノミセテムコミタンスの増幅から生成された標準曲線の線形回帰を図説する。回帰直線のr2値は0.96である。
【0047】
[0046] 線形回帰直線のr2値は、回帰式の観察された値への適合の近さを示す。1.00により近いr2は、観察された値が回帰直線に密接に合うことを示す。上記の実施例に関して、標準曲線のr2値は0.96であり、これは、直線において観察される全ての変動の約96%は試料における実際の測定された変動によるものであり、この標準曲線は未知の集団中の生菌の濃度を計算するのに用いることができることを示す。
【0048】
[0047] 実際、1回の実験において、この標準曲線に基づいて計算した生菌の濃度は、RNAの単離の前に添加した実際の濃度と有意に異なっておらず、差は20%未満であった。これらのデータは、このアッセイが生物の複合的な集団内の特定の種の生菌を検出および定量する迅速、正確な手段であることを示している。これは、口腔の微生物の生態に対する処置の作用を分析するための強力な道具である可能性がある。
【特許請求の範囲】
【請求項1】
アルギニン分解細菌のレベルを測定することを含む、口腔のバイオフローラを評価するための方法。
【請求項2】
齲食原性細菌の活性も測定する、請求項1に記載の方法。
【請求項3】
アルギニン分解細菌の活性を、プラークのアンモニアの生成レベルを測定することにより評価する、請求項1または2に記載の方法。
【請求項4】
齲食原性細菌の活性を、ラクテートの生成レベルを測定することにより評価する、請求項2または3に記載の方法。
【請求項5】
少なくとも1種類の齲食原性細菌および/または少なくとも1種類のアルギニン分解細菌のレベルを定量するために、定量的リアルタイムPCR、定量的RT−PCR、および/または蛍光抗体プローブを用いることを含む、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
アルギニン分解細菌がS.サングイスを含む、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
齲食原性細菌の活性も測定し、齲食原性細菌がS.ミュータンスを含む、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
歯に対する検出可能なまたは重要な脱灰または損傷が存在する前にプラークの生態における損傷を与える可能性のある変化を検出する、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
口の健康を増進するための、例えば次のことのための方法であって:
a.齲食の形成を低減または抑制する、
b.歯の脱灰を低減または抑制し、再石灰化を促進する、
c.早期のエナメル質の病変の形成を処置、低減または抑制する、
d.歯の過敏性を低減する、
e.歯肉炎を低減または抑制する、
f.口の中の潰瘍または切り傷の治癒を促進する、
g.酸を産生する細菌のレベルを低減する、
h.アルギニン分解細菌の相対的なレベルを増大させる、
i.口腔中での微生物のバイオフィルムの形成を抑制する、
j.糖負荷の後のプラークのpHを少なくともpH5.5のレベルに上げる、および/または維持する、
k.プラークの蓄積を低減する、
l.口内乾燥を処置、緩和または低減する
m.歯を白くする、
n.心血管の健康を含む全身の健康を増進する、
o.歯を齲食原性細菌に対して免疫化または保護する
p.歯および口腔を清潔にする、および/または
q.歯の酸食を低減する、
請求項1〜8のいずれか1項に記載の方法を用いる、口腔のバイオフローラを測定すること、および必要であれば、
高いレベルの齲食原性細菌および/または高いラクテートレベルの存在、および/または
低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成の存在、
により、有効量の塩基性アミノ酸またはその塩を含む口腔ケア製品を投与することを含む方法。
【請求項10】
塩基性アミノ酸がアルギニンまたはその塩である、請求項9に記載の方法。
【請求項11】
口腔のバイオフローラが、請求項1〜10のいずれか1項に記載の方法により測定される、高いレベルの齲食原性細菌および/または高いラクテートレベル、および/または低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成を含む対象において口の健康を増進するための医薬の製造のための、遊離または塩の型の塩基性アミノ酸の使用。
【請求項12】
口腔を美容的に増進するための方法であって、その方法が、請求項1〜10のいずれか1項に記載の方法を用いて口腔のバイオフローラを測定すること、および必要であれば、高いレベルの齲食原性細菌および/または高いラクテートレベルの存在、および/または低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成の存在により、遊離または塩の型の塩基性アミノ酸を含む口腔ケア製品を投与することを含む、前記方法。
【請求項1】
アルギニン分解細菌のレベルを測定することを含む、口腔のバイオフローラを評価するための方法。
【請求項2】
齲食原性細菌の活性も測定する、請求項1に記載の方法。
【請求項3】
アルギニン分解細菌の活性を、プラークのアンモニアの生成レベルを測定することにより評価する、請求項1または2に記載の方法。
【請求項4】
齲食原性細菌の活性を、ラクテートの生成レベルを測定することにより評価する、請求項2または3に記載の方法。
【請求項5】
少なくとも1種類の齲食原性細菌および/または少なくとも1種類のアルギニン分解細菌のレベルを定量するために、定量的リアルタイムPCR、定量的RT−PCR、および/または蛍光抗体プローブを用いることを含む、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
アルギニン分解細菌がS.サングイスを含む、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
齲食原性細菌の活性も測定し、齲食原性細菌がS.ミュータンスを含む、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
歯に対する検出可能なまたは重要な脱灰または損傷が存在する前にプラークの生態における損傷を与える可能性のある変化を検出する、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
口の健康を増進するための、例えば次のことのための方法であって:
a.齲食の形成を低減または抑制する、
b.歯の脱灰を低減または抑制し、再石灰化を促進する、
c.早期のエナメル質の病変の形成を処置、低減または抑制する、
d.歯の過敏性を低減する、
e.歯肉炎を低減または抑制する、
f.口の中の潰瘍または切り傷の治癒を促進する、
g.酸を産生する細菌のレベルを低減する、
h.アルギニン分解細菌の相対的なレベルを増大させる、
i.口腔中での微生物のバイオフィルムの形成を抑制する、
j.糖負荷の後のプラークのpHを少なくともpH5.5のレベルに上げる、および/または維持する、
k.プラークの蓄積を低減する、
l.口内乾燥を処置、緩和または低減する
m.歯を白くする、
n.心血管の健康を含む全身の健康を増進する、
o.歯を齲食原性細菌に対して免疫化または保護する
p.歯および口腔を清潔にする、および/または
q.歯の酸食を低減する、
請求項1〜8のいずれか1項に記載の方法を用いる、口腔のバイオフローラを測定すること、および必要であれば、
高いレベルの齲食原性細菌および/または高いラクテートレベルの存在、および/または
低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成の存在、
により、有効量の塩基性アミノ酸またはその塩を含む口腔ケア製品を投与することを含む方法。
【請求項10】
塩基性アミノ酸がアルギニンまたはその塩である、請求項9に記載の方法。
【請求項11】
口腔のバイオフローラが、請求項1〜10のいずれか1項に記載の方法により測定される、高いレベルの齲食原性細菌および/または高いラクテートレベル、および/または低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成を含む対象において口の健康を増進するための医薬の製造のための、遊離または塩の型の塩基性アミノ酸の使用。
【請求項12】
口腔を美容的に増進するための方法であって、その方法が、請求項1〜10のいずれか1項に記載の方法を用いて口腔のバイオフローラを測定すること、および必要であれば、高いレベルの齲食原性細菌および/または高いラクテートレベルの存在、および/または低いレベルのアルギニン分解細菌および/または低いレベルのプラークのアンモニア生成の存在により、遊離または塩の型の塩基性アミノ酸を含む口腔ケア製品を投与することを含む、前記方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2011−510683(P2011−510683A)
【公表日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願番号】特願2010−546013(P2010−546013)
【出願日】平成21年2月6日(2009.2.6)
【国際出願番号】PCT/US2009/033287
【国際公開番号】WO2009/100262
【国際公開日】平成21年8月13日(2009.8.13)
【出願人】(590002611)コルゲート・パーモリブ・カンパニー (147)
【氏名又は名称原語表記】COLGATE−PALMOLIVE COMPANY
【Fターム(参考)】
【公表日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願日】平成21年2月6日(2009.2.6)
【国際出願番号】PCT/US2009/033287
【国際公開番号】WO2009/100262
【国際公開日】平成21年8月13日(2009.8.13)
【出願人】(590002611)コルゲート・パーモリブ・カンパニー (147)
【氏名又は名称原語表記】COLGATE−PALMOLIVE COMPANY
【Fターム(参考)】
[ Back to top ]

