可溶性アニリン系導電性ポリマーの製造方法
【目的】 高い導電性を発現させると共に、いかなるpHを示す水又は有機溶剤に対してもすぐれた溶解性を示すと共にその塗布性を向上させた可溶性アニリン系導電性ポリマー及びその製造方法の提供。
【構成】 酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも1種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする重量平均分子量が10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【構成】 酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも1種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする重量平均分子量が10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【発明の詳細な説明】
【0001】
【産業上の利用分野】本発明は溶媒に可溶なアニリン系導電性ポリマー及びその製造方法に関する。該溶液はスプレー、ディップ等の簡便な手法で各種帯電防止用途に適応可能である。
【0002】
【従来の技術と課題】ドープされたポリアニリン(導電性ポリマー)は良く知られているが、ほとんど全ての溶剤に不溶であり、成形、加工に難点がある。また、アニリンを電解酸化重合する方法〔特開昭60−235831号公報、J.Polymer Sci.Polymer Chem. Ed.,26,1531(1988)〕は電極上にポリアニリンのフィルムを形成することが可能であるが、単離操作が煩雑になること及び大量合成が困難であるという問題がある。
【0003】また、近年ドープ剤を添加することなく導電性を発現するアルカリ可溶性のスルホン化ポリアニリンとその合成法及びカルボキシル化ポリアニリンとその合成法が提案されている。
【0004】例えば、スルホン化ポリアニリンの合成法としては、アニリンとm−アミノベンゼンスルホン酸を電気化学的に重合してスルホン化ポリアニリンを合成する方法(日本化学会誌,1985,1124、特開平02−166165号公報)、o−、m−、p−アミノベンゼンスルホン酸をそれぞれ単独で電気化学的に重合してスルホン化ポリアニリンを合成する方法〔日本化学会第64秋季年会 講演予稿集II 706(1992)〕、アニリンとo−、m−アミノベンゼンスルホン酸を化学的に重合してスルホン化ポリアニリンを合成する方法(特開平01−301714号公報)、アミノベンゼンスルホン酸系化合物又はアミノベンゼンスルホン酸系化合物及びアニリン系化合物を含む単量体を化学酸化重合する方法(特開平6−56987号公報)、化学的あるいは電気化学的に重合して得られたエメラルディンタイプの重合体(ポリアニリン)を濃硫酸でスルホン化する方法(特開昭58−210902)、無水硫酸/リン酸トリエチル錯体を用いてスルホン化する方法(特開昭61−197633号公報)、発煙硫酸でスルホン化する方法〔J. Am. Chem. Soc.,(1991)113, 2665〜2671、J. Am. Chem. Soc.,(1990)112,2800、WO91−06 887〕、ジフェニルアミン−4−スルホン酸(ナトリウム塩)を化学的に重合し、N−置換型のスルホン化ポリアニリン合成する方法〔Polymer,(1993)34,158〜162〕などが知られている。
【0005】アニリンとm−アミノベンゼンスルホン酸を電気化学的に重合してスルホン化ポリアニリンを合成する方法(日本化学会誌,1985,1124、特開平02−166165号公報)は、生成物が電極上に形成されるため、単離操作が煩雑になること及び大量合成が困難であるという問題がある。
【0006】また、日本化学会第64秋季年会講演予稿集II 706(1992)では、アミノベンゼンスルホン酸の電解酸化による可溶性導電性高分子の合成法が説明されているが、この方法も大量合成に適しているとは言い難い。また、ペルオキソ二硫酸アンモニウムを酸化剤としてアミノベンゼンスルホン酸を化学酸化重合を行った場合は生成物は得られなかったと記されている。また、J. Am. Chem. Soc.,(1991)113, 2665〜2671によるとo−,m−アミノベンゼンスルホン酸を化学的及び電気化学的に重合を試みたが成功しなかったと記されている。
【0007】また、特開平6−56987号公報では、アミノベンゼンスルホン酸系化合物またはアミノベンゼンスルホン酸系化合物およびアニリン系化合物を含む単量体を酸性、中性およびアルカリの何れの溶液でも、化学酸化重合することにより水に可溶性の導電性ポリマーが得られるとの記載がある。
【0008】しかし、本発明者らの検討では、フィルム形成するのに充分な分子量を有するポリマーを得るためには、塩基性化合物の存在下重合することが必須条件であり、酸性溶液および中性溶液ではフィルム形成するのに充分な分子量を有するポリマーを得ることができなかった。
【0009】特開平6−56987号公報の実施例においては、すべて硫酸酸性溶液中での重合であり、アルカリ性溶液中での重合に関する実施例はなく、また酸性水溶液中での重合に関する実施例においても、その分子量の記載もないため、どのような物性のポリマーが得られたか明らかでない。
【0010】更に本発明者らが酸化剤にペルオキソ二硫酸アンモニウムを用いて、プロトン酸を含む水溶液中および水溶液中での重合を試みたところ、水に可溶なポリマーは得られるが、低分子量のためフィルムを形成するような実用的なポリマーは得られなかった。
【0011】特開平01−301714号公報で記載されているアニリンとm−アミノベンゼンスルホン酸をペルオキソ二硫酸アンモニウムで化学的に重合する方法および特開平6−56987号公報で記載されているアニリンとm−アミノベンゼンスルホン酸を過マンガン酸カリウムで化学的に重合する方法を本発明者らが追試したところ、芳香環5個に約1個のスルホン基が導入されるのみであり、高い導電性を示すが中性および酸性の水には完全に不溶であり、アンモニアなどのアルカリ性水溶液にもほとんど不溶であった。また、特開昭61− 197633号公報の方法でスルホン化した場合も同公報7頁に記載されているとおり、スルホン化溶媒に対するポリアニリンの溶解性が充分でなく分散状態で反応させているため、芳香環5個に約1個のスルホン基しか導入されない。かくして得られるスルホン基導入割合の小さいスルホン化ポリアニリンは、導電性及び溶解性が充分でないという問題がある。
【0012】また、J. Am. Chem. Soc.,(1991)113,2665〜2671、J. Am.Chem. Soc.,(1990)112,2800によると、ポリアニリンを発煙硫酸でスルホン化した場合、芳香環2個に約1個のスルホン基が導入されると記されている。しかし、本方法でポリアニリンを充分にスルホン化しようとした場合、発煙硫酸に対するポリアニリンの溶解性が充分でないため、発煙硫酸が大過剰必要とされる。また、発煙硫酸にポリアニリンを添加する際もポリマーが固化し易いという問題がある。更に以上の方法で合成された重合物及びそのスルホン化物は、アンモニア及びアルキルアミン等の塩基を含む水溶液には溶解するが水単独には溶解しないという問題もある。
【0013】また、Polymer(1993)34,158〜162によると、ジフェニルアミン−4−スルホン酸(ナトリウム塩)を重合した場合、ベンゼンスルホン酸基がアニリン骨格に対して1個導入されたN位置換型のスルホン化ポリアニリンが得られ水単独にも溶解するが、重合物の単離に超遠心分離操作が必要であると記されている。本発明者らが追試したところ、高溶解性のため重合溶媒中からの重合物の取得収率は低いものであり、高速遠心分離操作を行わない場合、重合物を単離することはできなかった。また、N位置換型のため、上記に示したJ.Am. Chem. Soc.,(1991)113,2665〜2671の方法で合成した重合体に比べ導電性は低いものであった。
【0014】また例えば、カルボキシル化ポリアニリンの合成法としては、2−または3−カルボキシアニリンまたはその塩を酸化重合し、ついで塩基性物質で処理し、カルボキシル基が塩形で得られる製造法(特開平4−268331)が提案されているが、酸化剤の使用量が原料に対して2倍等量以上必要であり、導電性は低い値である。このことよりモノマーの反応性が低く低分子量のポリマーが生成していると考えられる。
【0015】また、メチルアントラニレート(アントラニル酸メチルエステル)をペルオキソ二硫酸アンモニウムの存在下で水性の酸性媒体中で重合後、ついでアルコール性水酸化カリウムによってメチルエステルをケン化する合成法(特開平5−226238)が提案されているが、反応が2段階となるため、操作が非常に煩雑である。
【0016】更に本発明者らが、2−カルボキシアニリンを酸化剤としてのペルオキソ二硫酸アンモニウムを用いて、プロトン酸を含む水溶液中での重合を試みたところ、生成物を得ることができなかった。また、本発明者らはアニリンと2−カルボキシアニリンを酸化剤にペルオキソ二硫酸アンモニウムを用いて、プロトン酸を含む水溶液中での重合を試みたところ、共重合体が得られたが溶解性、導電性も共に低いものであった。このことより得られた共重合体は2−カルボキシアニリンの共重合比率が低いものと考えられる。
【0017】従って、ポリマーにドープ剤を添加することなく導電性を発現させ、溶解性を向上させるためにはより多くのスルホン基またはカルボキシル基などの酸性基を主鎖の芳香環に導入する必要があるものと考えられる。
【0018】また、塗布による成膜等の成形性を考えた場合、特に親水性、疎水性いずれの基材にも塗布可能とするためには、水及び有機溶剤の両方に溶解性のあることが望まれる。ところが、ポリアニリンのスルホン化物は、アルカリ水に対する溶解性はあるが、中性から酸性を示す水溶液には不溶であり、また有機溶剤に対する溶解性が十分とはいえない。
【0019】これら諸々の問題を解決する方法として、本発明者らはアニリン、N−アルキルアニリン及びフェニレンジアミン類よりなる群から選ばれた少なくとも一種の化合物と、アミノベンゼンスルホン酸とを酸性溶媒中酸化剤を用いて共重合させ、更にスルホン化剤によりスルホン化することを特徴とするアニリン系共重合体スルホン化物の製造方法を提案(特開平5−178989号)した。しかし、該方法においても濃硫酸中でスルホン化する操作を必要とし、廃酸の処理が大きな問題として残る。
【0020】なお、以上の方法で合成された共重合体は何れも下式(2)の構造を持つと推定される。
【化2】

(式中、R11 、R12 、R13 およびR14 は、それぞれ水素およびスルホン基よりなる群から選ばれ、R′は水素又は炭素数1〜4のアルキル基よりなる群から選ばれ、スルホン基の割合はスルホン基が芳香環に対して40〜80%の含有量であり、xは0〜1の任意の数を表わし、nは重合度を示す2〜1500の数である。)
【0021】また、更に本発明者らは、アニリン、N−アルキルアニリン及びフェニレンジアミン類よりなる群から選ばれた少なくとも一種の化合物とアルコキシ基置換アミノベンゼンスルホン酸とを共重合させることにより、廃棄物を大量に発生させるスルホン化操作を省略することを特徴とするアニリン系共重合体の製造方法(特願平5−48540号)を提案した。しかし、該方法において得られる共重合体においても水単独には溶解しないという問題がある。
【0022】なお、以上の方法で合成された共重合体は何れも下式(3)の構造を持つと推定される。
【化3】

(式中、R15 、R16 、R17 、R18、R19 、R20 、R21 又はR22 は、それぞれ水素、アルコキシ基およびスルホン基よりなる群から選ばれ、スルホン基の割合はスルホン基が芳香環に対して25〜50%の含有量であり、同一芳香環にアルコキシ基およびスルホン基を含有しており、R′は水素又は炭素数1〜4のアルキル基よりなる群から選ばれ、xは、0〜1の任意の数を表し、nは重合度を示す2〜1500の数である。)
【0023】また、以上示した化学重合における重合溶媒は水またはプロトン酸を含む水溶液を用いている。たとえば、前記特開平1−163263号公報によると、酸化剤としてペルオキソ二硫酸アンモニウムを用いる場合、特にpKaが3以下のプロトン酸を含むことが好ましく、アニリンの重合における溶剤としてはアニリン、プロトン酸及び酸化剤が溶解し、且つ、酸化剤によって酸化されないものが用いられると記されている。また、前記特開平4−268331号の実施例3では、水100mlにアントラニル酸ナトリウム4gを溶解させ、過硫酸アンモニウム22.7gを水100mlに溶解し、これを上記アントラニル酸水溶液に添加して、酸化重合を行っており、この重合溶媒のpHもほぼ中性であり、モノマーの反応性の向上の観点から重合溶媒および酸化重合系を積極的にアルカリ性にすることは、重合系の性質から誰も考えもしなかったことである。
【0024】
【発明が解決しようとしている課題】本発明の目的は、高い導電性を発現させると共に、いかなるpHを示す水又は有機溶剤に対してもすぐれた溶解性を示すと共にその塗布性を向上させた可溶性アニリン系導電性ポリマーの製造方法を提供する点にある。
【0025】
【課題を解決するための手段】本発明者らは、高い導電性と溶解性を有するポリアニリンとして芳香環に対するスルホン基の導入割合の大きいスルホン化ポリアニリンおよびカルボキシル基の導入割合の大きいカルボキシル化ポリアニリンなどの酸性基の導入割合の大きい酸性基置換ポリアニリンの製法を鋭意検討した結果、モノマーとしてスルホン基置換アニリンまたはカルボキシル基置換アニリンなどの酸性基置換アニリンを、塩基性化合物を含む溶液中で、すなわちアルカリ性の重合溶媒中で酸化剤を用いて重合すると、おどろくべきことに反応性が特段に向上し、従来のスルホン基またはカルボキシル基を有するアニリン類は、それ単独では化学酸化重合しにくいう定説に反し、高分子量の重合体の製造が可能であることを見い出した。しかも、得られた導電性ポリマーは、高い導電性を示すと共に酸性〜アルカリ性の何れのpHの水溶液とくに単独の水にも溶解し、更にアルコールなどの有機溶剤にも優れた溶解性を示した。しかも、特開平4−268331号公報では、酸化重合後、塩基性物質で別途処理する工程が必ず必要であった。また、特開平6−56987号公報の記載では、アルカリ性で重合した場合、得られたポリマーを高導電性化するためにさらに酸処理する工程が必要であった。しかし、本発明ではこのような後処理工程がないから、製造工程が一工程短縮できる。
【0026】すなわち、本発明は、酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも一種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする可溶性アニリン系導電性ポリマーの製造法に関する。
【0027】前記酸性基置換アニリンは、一般式(1)
【化4】

(式中、R1,R2,R3,R4,R5は水素、炭素数1〜4の直鎖または分岐のアルキル基、酸性基、水酸基、ニトロ基およびハロゲンよりなる群から選ばれ、その少なくとも一つは酸性基を示す。また、ここで酸性基とはスルホン基またはカルボキシル基を示す)で示される酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも一つの化合物を表す。前記一般式(1)の化合物はアミノ基に対して酸性基がo位またはm位に結合しているものの方が得られるポリマーの導電性、溶解性などの性能が優れている。
【0028】前記酸性基置換アニリンとして最も代表的なものは、スルホン基置換アニリンまたはカルボキシル基置換アニリンである。好ましくはスルホン基置換アニリンであり、カルボキシル基置換アニリンに比べ導電性が高い傾向を示す。
【0029】スルホン基置換アニリンとして最も代表的なものは、アミノベンゼンスルホン酸類であり、具体的にはo−,m−,p−アミノベンゼンスルホン酸、アニリン−2,6−ジスルホン酸、アニリン−2,5−ジスルホン酸、アニリン−3,5−ジスルホン酸、アニリン−2,4−ジスルホン酸、アニリン−3,4−ジスルホン酸が好ましく用いられる。
【0030】その他のスルホン基置換アニリンとしては、メチルアミノベンゼンスルホン酸、エチルアミノベンゼンスルホン酸,n−プロピルアミノベンゼンスルホン酸、iso−プロピルアミノベンゼンスルホン酸、n−ブチルアミノベンゼンスルホン酸、sec−ブチルアミノベンゼンスルホン酸、t−ブチルアミノベンゼンスルホン酸などのアルキル基置換アミノベンゼンスルホン酸類、ヒドロキシ基置換アミノベンゼンスルホン酸類、ニトロ基置換アミノベンゼンスルホン酸類、フルオロアミノベンゼンスルホン酸、クロロアミノベンゼンスルホン酸、ブロムアミノベンゼンスルホン酸などのハロゲン基置換アミノベンゼンスルホン酸類などを挙げることができる。このなかではアルキル基置換アミノベンゼンスルホン酸類またはヒドロキシ基置換アミノベンゼンスルホン酸類が実用上もっとも好ましい。なお、これらのスルホン基置換アニリンはそれぞれ単独で用いても、また異性体を任意の割合で混合しても良い。
【0031】カルボキシル基置換アニリンとして最も代表的なものは、アミノベンゼンカルボン酸類であり、具体的にはo−,m−,p−アミノベンゼンカルボン酸、アニリン−2,6−ジカルボン酸、アニリン−2,5−ジカルボン酸、アニリン−3,5−ジカルボン酸、アニリン−2,4−ジカルボン酸、アニリン−3,4−ジカルボン酸が好ましく用いられる。
【0032】その他のカルボキシル基置換アニリンとしては、メチルアミノベンゼンカルボン酸、エチルアミノベンゼンカルボン酸,n−プロピルアミノベンゼンカルボン酸、iso−プロピルアミノベンゼンカルボン酸、n−ブチルアミノベンゼンカルボン酸、sec−ブチルアミノベンゼンカルボン酸、t−ブチルアミノベンゼンカルボン酸などのアルキル基置換アミノベンゼンカルボン酸類、ヒドロキシ基置換アミノベンゼンカルボン酸類、ニトロ基置換アミノベンゼンカルボン酸類、フルオロアミノベンゼンカルボン酸、クロロアミノベンゼンカルボン酸、ブロムアミノベンゼンカルボン酸などのハロゲン基置換アミノベンゼンカルボン酸類などを挙げることができる。このなかではアルキル基置換アミノベンゼンカルボン酸類またはヒドロキシ基置換アミノベンゼンカルボン酸類が実用上もっとも好ましい。これらのカルボキシル基置換アニリンはそれぞれ単独で用いても、また異性体を任意の割合で混合しても良い。
【0033】更に詳しく前記一般式(1)の酸性基置換アニリンの具体例としては、スルホン基置換アルキルアニリンカルボキシル基置換アルキルアニリンスルホン基置換ヒドロキシアニリンカルボキシル基置換ヒドロキシアニリンスルホン基置換ニトロアニリンカルボキシル基置換ニトロアニリンスルホン基置換フルオロアニリンカルボキシル基置換フルオロアニリンスルホン基置換クロロアニリンカルボキシル基置換クロロアニリンスルホン基置換ブロムアニリンおよびカルボキシル基置換ブロムアニリンなどを挙げることができ、これらの置換基の位置と組合わせの具体例を表1に示す。
【0034】
【表1】

ここで、A:スルホン基またはカルボキシル基、そのアルカリ金属塩、アンモニウム塩、置換アンモニウム塩かから選ばれた一つの基を示し、B:メチル基、エチル基、n−プロピル基、iso−プロピル基、n−ブチル基、sec−ブチル基、t−ブチル基などのアルキル基、ヒドロキシ基、ニトロ基、フルオロ基、クロロ基、ブロム基などのハロゲン基から選ばれた一つの基を示し、H:水素を示す。
【0035】これらモノマーにおけるアルカリ金属としては、リチウム、ナトリウム、カリウムなどが例示できる。
【0036】また、置換アンモニウムとしては、脂式アンモニウム類、環式飽和アンモニウム類、環式不飽和アンモニウム類などが挙げられる。
【0037】前記脂式アンモニウム類としては、下式(4)
【化5】

(式中R23 〜R26は、水素、炭素数1〜4のアルキル基、CH2OH、CH2CH2 OH よりなる群から独立して選ばれた基である。)で示される。たとえば、メチルアンモニウム、ジメチルアンモニウム、トリメチルアンモニウム、エチルアンモニウム、ジエチルアンモニウム、トリエチルアンモニウム、メチルエチルアンモニウム、ジエチルメチルアンモニウム、ジメチルエチルアンモニウム、プロピルアンモニウム、ジプロピルアンモニウム、イソプロピルアンモニウム、ジイソプロピルアンモニウム、ブチルアンモニウム、ジブチルアンモニウム、メチルプロピルアンモニウム、エチルプロピルアンモニウム、メチルイソプロピルアンモニウム、エチルイソプロピルアンモニウム、メチルブチルアンモニウム、エチルブチルアンモニウム、テトラメチルアンモニウム、テトラメチロールアンモニウム、テトラエチルアンモニウム、テトラn−ブチルアンモニウム、テトラsec−ブチルアンモニウム、テトラt−ブチルアンモニウムなどを例示することができる。なかでも、R23〜R26のうち1つが水素、他の3つが炭素数1〜4のアルキル基の場合が最も好ましく、ついでR23〜R26のうち2つが水素、他の2つが炭素数1〜4のアルキル基の場合が好ましい。
【0038】環式飽和アンモニウム類としては、ピペリジニウム、ピロリジニウム、モルホリニウム、ピペラジニウム及びこれらの骨格を有する誘導体などが例示される。
【0039】環式不飽和アンモニウム類としては、ピリジニウム、α−ピコリニウム、β−ピコリニウム、γ−ピコリニウム、キノリニウム、イソキノリニウム、ピロリニウム及びこれらの骨格を有する誘導体などが例示される。
【0040】次に、本発明で用いられる塩基性化合物(ロ)としては、前記酸性基置換アニリン類と塩を形成する化合物であればどのような化合物でも良いが、アンモニア、脂式アミン類、環式飽和アミン類、環式不飽和アミン類、無機塩基などが好ましく用いられる。とりわけ脂式アミン類、環式飽和アミン類、環式不飽和アミン類などが好ましい。
【0041】脂式アミン類としては、下記一般式(5)
【化6】

(式中、R27〜R29は、炭素数1〜4のアルキル基、CH2OHおよびCH2CH2OHよりなる群から独立して選ばれた基である。)で示される化合物、または一般式(6)
【化7】

(式中、R30〜R33はそれぞれ水素、炭素数1〜4のアルキル基、CH2OHおよびCH2CH2OHよりなる群から独立して選ばれた基である。)で示されるハイドロキサイド化合物を挙げることができる。
【0042】環式飽和アミン類としては、ピペリジン、ピロリジン、モルホリン、ピペラジン及びこれらの骨格を有する誘導体ならびにこれらのアンモニウムヒドロキシド化合物などが好ましく用いられる。
【0043】環式不飽和アミン類としては、ピリジン、α−ピコリン、β−ピコリン、γ−ピコリン、キノリン、イソキノリン、ピロリン及びこれらの骨格を有する誘導体ならびにこれらのアンモニウムヒドロキシド化合物などが好ましく用いられる。
【0044】無機塩基としては、水酸化ナトリウム、水酸化カリウム、水酸化リチウムなどの水酸化物の塩などが好ましく用いられるが、前記の脂式アミン類、環式飽和アミン類、環式不飽和アミン類に比べると得られるポリマーの導電性は劣る傾向にある。
【0045】これら塩基性化合物(ロ)の濃度は0.1mol/リットル以上、好ましくは0.1〜10.0mol/リットル、更に好ましくは0.2〜8.0mol/リットルの範囲で用いられる。この際、0.1mol/リットル以下の場合、得られるポリマーの収率が低下し、10.0mol/リットル以上の場合、導電性が低下する傾向を示す。前記塩基性化合物(ロ)は、それぞれ任意の割合で混合して用いることもできる。
【0046】前記酸性基置換アニリンなどの化合物(イ)と塩基性化合物(ロ)との重量比は(イ):(ロ)=1:100〜100:1、好ましくは10:90〜90:10が用いられる。ここで、塩基性化合物の割合が低いと反応性が低下し導電性も低下する。逆に割合が高い場合は得られるポリマー中の酸性基と塩基性化合物が塩を形成する割合が高くなり導電性が低下する傾向にある。
【0047】また、前記酸性基置換アニリンなどの化合物(イ)中の酸性基(ハ)と塩基性化合物(ロ)とのモル比は(ハ):(ロ)=1:100〜100:1、好ましくは1:0.25〜1:20、さらに好ましくは1:0.5〜1:15で用いることができる。ここで、塩基性化合物の割合が低いと反応性が低下し導電性も低下する。逆に割合が高い場合は得られるポリマー中の酸性基と塩基性化合物が塩を形成する割合が高くなり導電性が低下する傾向にある。
【0048】重合又は共重合は、これら塩基性化合物を含む溶液中、酸化剤で酸化重合することにより行う。溶媒は、水、メタノール、エタノール、イソプロパノール、アセトニトリル、メチルイソブチルケトン、メチルエチルケトン、ジメチルホルムアミド、ジメチルアセトアミド等が好ましく用いられる。
【0049】また、酸化剤は、標準電極電位が0.6V以上である酸化剤であれば特に限定されないが、ペルオキソ二硫酸、ペルオキソ二硫酸アンモニウム、ペルオキソ二硫酸ナトリウム及びペルオキソ二硫酸カリウムなどのペルオキソ二硫酸類、過酸化水素等が好ましく用いられ、モノマー1モルに対して0.1〜5モル、好ましくは0.5〜5モル用いられる。またこの際、触媒として鉄、銅などの遷移金属化合物を添加することも有効である。
【0050】反応温度は、マイナス15〜70℃の温度範囲で行うのが好ましく、更に好ましくはマイナス5〜60℃の範囲が適用される。ここで、マイナス15℃以下、又は70℃以上では、導電性が低下する傾向がある。
【0051】本発明によって製造されるポリマー中のスルホン基またはカルボキシル基における水素は、水素、アルカリ金属、アンモニウム及び置換アンモニウムよりなる群から独立して選ばれた基であること、即ちこれらの基が単独ではなく混合した状態でも得ることができる。
【0052】具体的には、水酸化ナトリウム存在下で重合された場合、単離されたポリマー中のスルホン基またはカルボキシル基における水素は、ほとんどがナトリウムに置換された状態になっている。
【0053】同様に、ポリマー中のスルホン基またはカルボキシル基における水素は、アンモニア存在下重合した場合、大部分はアンモニウムであり、トリメチルアミン存在下重合した場合、大部分はトリメチルアンモニウムであり、キノリン存在下重合した場合、大部分はキノリニウムで得られる。
【0054】また、塩基性化合物を混合して用いた場合は、これらの混合した状態で得られる。具体的には、水酸化ナトリウムとアンモニア存在下重合された場合、単離されたポリマー中のスルホン基またはカルボキシル基における水素は、ナトリウムとアンモニウムの両方が存在した状態で得られる。また、得られたポリマーを水酸化ナトリウムとアンモニアの両方が存在する溶液で処理した場合も同様にポリマー中のスルホン基またはカルボキシル基における水素は、ナトリウムとアンモニウムの両方が存在した状態で得られる。
【0055】以上に記した酸性基の一部が塩を形成しているポリマーは、酸性溶液中で処理するとその塩が水素に置換されたポリマーにすることができる。
【0056】酸性溶液としては塩酸、硫酸、p−トルエンスルホン酸、硝酸などを挙げることができる。ただし、十分に酸置換を行っても、全てが水素で置換されたものを得ることは難しい。
【0057】しかし、本発明の製造法では、得られるポリマーは重合溶媒中より析出してくるので塩を形成する割合は低いため、特に酸性溶液中で処理する必要はなく、高導電性の実用的なポリマーを製造することができる。
【0058】かくして得られたすべての芳香環にスルホン基またはカルボキシ基を含有する可溶性アニリン系導電性ポリマーの重量平均分子量は約10,000〜3,240,000、好ましくは20,000以上、さらに好ましくは50,000〜3,240,000である。このポリマーは更にスルホン化操作を施すことなく、単なる水、アンモニア及びアルキルアミン等の塩基又は酢酸アンモニウム、シュウ酸アンモニウム等の塩基及び塩基性塩を含む水、塩酸及び硫酸等の酸を含む水又はメチルアルコール、エチルアルコール、イソプロピルアルコール等の溶媒又はそれらの混合物に溶解することができる。
【0059】溶解性を詳しく説明すると、本発明における可溶性アニリン系導電性ポリマーは、0.1モル/リットルのアンモニア水などのアルカリ水溶液に1重量%以上溶解し、0.1モル/リットルの硫酸水溶液などの酸性水溶液に1重量%以上溶解し、単独の水などの中性水溶液に1重量%以上溶解し、さらに0.1モル/リットルのアンモニアアルコール溶液などの有機溶剤に1重量%以上溶解するという性質を有している。
【0060】なお、以上の方法で合成された重合体または共重合体は何れも下式(4)の構造を持つと推定される。
【化8】

(式中、Aはスルホン基、カルボキシル基、そのアルカリ金属塩、アンモニウム塩、置換アンモニウム塩から選ばれた一つの基であり、Bは水素、メチル基、エチル基,n−プロピル基,iso−プロピル基,n−ブチル基,sec−ブチル基、t−ブチル基などのアルキル基、ヒドロキシ基、ニトロ基、フルオロ基、クロロ基、ブロム基などのハロゲン基から選ばれた一つの基を示す。xは0〜1の任意の数を示し、nは重合度を示し、10〜5,000の数である)
【0061】
【実施例】以下実施例を挙げて説明する。なお、IRスペクトルはパーキンエルマー製(モデル1600)の装置を用いて測定した。分子量分布及び分子量の測定には、N,N−ジメチルホルムアミド用のGPCカラムを用いて、GPC測定(ポリスチレン換算)を行った。カラムは、N,N−ジメチルホルムアミド用のものを3種類連結して用いた。また、溶離液には0.01モル/リットルトリエチルアミンと0.1モル/リットル臭化リチウムのN,N−ジメチルホルムアミド溶液を用いた。導電性は、導電率の測定には4端子法、表面抵抗の測定には2端子法を用いた。
【0062】実施例1o−アミノベンゼンスルホン酸100mmolを25℃で4モル/リットルのアンモニア水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末12gを得た。このものの体積抵抗値は12.0Ωcmであった。
【0063】前記重合体3重量部を0.2モル/リットルの硫酸水溶液100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布し、100℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値2.5×107 Ω/□のフィルムが得られた。
【0064】測定の結果、数平均分子量150,000、重量平均分子量190,000、Z平均分子量210,000、分散度MW/MN1.5、MZ/MW1.3であった。
【0065】水、0.1モル/リットルの硫酸水溶液又は0.1モル/リットルのアンモニア水10mlにポリマーを少量ずつ加えて溶解しなくなったところで濾過し、溶解量を求めたところ、実施例1にて合成した導電性ポリマーの溶解性は、 水 230mg/ml 0.1モル/リットルの硫酸水溶液 225mg/ml 0.1モル/リットルのアンモニア水 200mg/mlであった。
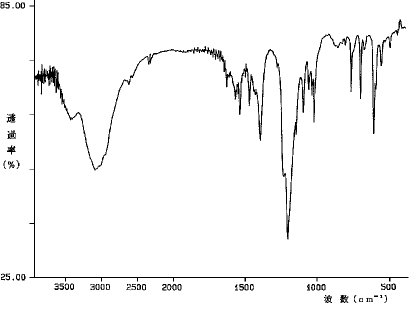
【0066】図1は、実施例1にて合成した導電性ポリマーのIRスペクトルを示す。IRスペクトルの帰属は次のとおりである。
スルホン基:1120,1020cm-1付近の吸収スルホン基のアンモニウム塩:1400cm-1付近の吸収ポリマーの骨格:1500cm-1付近の吸収
【0067】実施例23ーメチルー6ーアミノベンゼンスルホン酸100mmolを4℃で4モル/リットルのトリメチルアミン水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で6時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末10gを得た。
【0068】この重合体を1モル/リットルp−トルエンスルホン酸(PTS)のアセトン溶液中で1時間撹拌し濾別洗浄後、乾燥しスルホン基がフリーの重合体の粉末18gを得た。このものの体積抵抗値は12.5Ωcmであった。
【0069】前記重合体1重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。該組成物のpHは約3.5であったことより、ポリマー中のスルホン酸基の約80%以上がフリーの状態であると推定される。このようにして得られた溶液をガラス基板上にキャスト法により塗布し、100℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値5.0×106 Ω/□のフィルムが得られた。
【0070】実施例32−カルボキシルアニリン(アントラニル酸)100mmolを4℃で4モル/リットルのキノリン水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末11gを得た。このものの体積抵抗値は45Ωcmであった。
【0071】前記重合体3重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。該組成物のpHは約6.0であったことより、ポリマー中のカルボキシル基の約20%以上が塩を形成していると推定される。
【0072】このようにして得られた溶液を、PETフィルム上にスピンコート法により塗布し、80℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値3.0×107 Ω/□のフィルムが得られた。
【0073】実施例43−ヒドロキシアントラニル酸100mmolを25℃で3モル/リットルの2−メチルピリジン(α−ピコリン)水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末11gを得た。このものの体積抵抗値は37Ωcmであった。
【0074】前記重合体3重量部を水/イソプロピルアルコール(7/3)100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布し、120℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値7.0×106Ω/□のフィルムが得られた。
【0075】実施例54ーニトロアントラニル酸100mmolを10℃で4モル/リットルのトリエタノールアミン水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末9.5gを得た。このものの体積抵抗値は50Ωcmであった。
【0076】前記重合体3重量部を水溶性ポリエステル樹脂「アラスター300」{荒川化学工業(株)製}100重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液を深度35μmのグラビアコーターによりPETフィルム上に塗布し、70℃で乾燥させた。膜厚0.5μm表面の平滑な表面抵抗値1.5×107 Ω/□のフィルムが得られた。
【0077】実施例6m−ニトロアニリンスルホン酸100mmolを25℃で4モル/リットルのピぺリジン水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末6gを得た。このものの体積抵抗値は15Ωcmであった。
【0078】前記重合体2重量部を0.2モル/リットルのアンモニア水100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液を、PETフィルム上にスピンコート法により塗布し、80℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値1.0×107 Ω/□のフィルムが得られた。
【0079】実施例72−クロロ−5−アミノベンゼンスルホン酸100mmolを4℃で3モル/リットルの水酸化ナトリウム水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃、6時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末6gを得た。このものの体積抵抗値は20Ωcmであった。この重合体を1モル/リットルのp−トルエンスルホン酸(PTS)のアセトン溶液中で1時間撹拌し、濾別洗浄後、乾燥しスルホン酸基がフリーの重合体粉末4gを得た。
【0080】前記重合体3重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。該組成物の粘度は4.7cp(25℃)であった。この粘度はウベローヂ粘度計を用いて測定した。該組成物のpHは約3.8であったことより、ポリマー中のスルホン酸基の約80%以上がフリーの状態であることが推定される。このようにして得られた溶液をガラス基板上にスピンコート法により塗布し、80℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値8.5×106 Ω/□のフィルムが得られた。
【0081】比較例1o−アミノベンゼンスルホン酸100mmolを4℃で水に撹拌懸濁させ、ペルオキソ二硫酸アンモニウム100mmolの水を滴下した。滴下終了後25℃、12時間更に撹拌したのち、反応液を減圧留去し濃縮物を単離洗浄後、乾燥し粉末6gを得た。このものの体積抵抗値は>106 Ωcmであった。
【0082】前記粉末3重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液を、PETフィルム上にスピンコート法により塗布したが膜は形成されなかった。
【0083】比較例22ーカルボキシルアニリン(アントラニル酸)100mmolを25℃で1モル/リットルの硫酸水溶液に撹拌懸濁させ、ペルオキソ二硫酸アンモニウム100mmolの1モル/リットルの硫酸水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応液を減圧留去し、濃縮物を単離洗浄後乾燥し、粉末3gを得た。このものの体積抵抗値は>106 Ωcmであった。
【0084】前記粉末3重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布したが、膜は形成されなかった。
【0085】比較例3アニリン系導電性ポリマーとして、スルホン化ポリアニリンを概知の方法〔J.Am.Chem.Soc.,(1991),113,2665−2666〕に従って合成した。なお、得られたスルホン基の含有量は芳香環に対して52%であった。
【0086】前記スルホン化ポリアニリン3重量部を0.2モル/リットル硫酸水溶液100重量部に室温混合し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布したが、0.2モル/リットルの硫酸水溶液にスルホン化ポリアニリンは不溶であったため膜は形成されなかった。
【0087】比較例3(従来法)にて合成した導電性ポリマーの溶解性は、 水 0mg/ml 0.1モル/リットルの硫酸水溶液 0mg/ml 0.1モル/リットルのアンモニア水 50mg/mlであった。
【0088】比較例4p−アミノベンゼンスルホン酸100mmolとアニリン40mmolを4℃で1モル/リットルの硫酸水溶液に撹拌懸濁させ、ペルオキソ二硫酸アンモニウム100mmolの1モル/リットルの硫酸水溶液を滴下した。滴下終了後25℃、12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末4.3gを得た。このものの体積抵抗値は15Ωcmであった。
【0089】前記アニリン系導電性ポリマー3重量部を水100重量部に室温で混合し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布したが、このポリマーは水に不溶であったため膜は形成されなかった。
【0090】比較例4にて合成した導電性ポリマーの溶解性は、水 0mg/ml0.1モル/リットルの硫酸水溶液 0mg/ml0.1モル/リットルのアンモニア水 3mg/mlであった。
【0091】以下に実施態様項を列挙する。
(1)酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも1種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする重量平均分子量が10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(2)一般式(1)
【化9】

(式中、R1,R2,R3,R4,R5は水素、炭素数1〜4の直鎖または分岐のアルキル基、酸性基、水酸基、ニトロ基およびハロゲンよりなる群から選ばれ、その少なくとも一つは酸性基を示す。また、ここで酸性基とはスルホン基またはカルボキシル基を示す)で示される酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも一種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする前項(1)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(3)前記化合物(イ)中の酸性基(ハ)と塩基性化合物(ロ)とを(ハ):(ロ)の当量比が1:100〜100:1であることを特徴とする前項(1)または(2)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(4)前記酸性基置換アニリンがスルホン基置換アルキルアニリンカルボキシル基置換アルキルアニリンスルホン基置換ヒドロキシアニリンカルボキシル基置換ヒドロキシアニリンスルホン基置換ニトロアニリンカルボキシル基置換ニトロアニリンスルホン基置換フルオロアニリンカルボキシル基置換フルオロアニリンスルホン基置換クロロアニリンカルボキシル基置換クロロアニリンスルホン基置換ブロムアニリンおよびカルボキシル基置換ブロムアニリンよりなる群から選らばれたものである前項(1)、(2)または(3)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(5)前記酸性基置換アニリンのアルカリ金属塩が、前項(4)のリチウム塩、ナトリウム塩またはカリウム塩である前項(1)、(2)または(3)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(6)前記酸性基置換アニリンの置換アンモニウム塩が前項(4)の脂式アンモニウム塩、環式飽和アンモニウム塩、環式不飽和アンモニウム塩である前項(1)、(2)または(3)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(7)前記脂式アンモニウム塩が、下式
【化10】

(式中R23 〜R26は、水素、炭素数1〜4のアルキル基、CH2OH、CH2CH2 OH よりなる群から独立して選ばれた基である。)で示される化合物の塩である前項(6)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(8)前記環式飽和アンモニウム塩が、ピペリジニウム、ピロリジニウム、モルホリニウム、ピペラジニウム及びこれらの骨格を有する誘導体よりなる群から選らばれた化合物の塩である前項(6)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(9)前記環式不飽和アンモニウム塩が、ピリジニウム、α−ピコリニウム、β−ピコリニウム、γ−ピコリニウム、キノリニウム、イソキノリニウム、ピロリニウム及びこれらの骨格を有する誘導体よりなる群から選らばれた化合物の塩である前項(6)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(10)前記塩基性化合物(ロ)が、アンモニア、脂式アミン類、環式飽和アミン類、環式不飽和アミン類、無機塩基よりなる群から選らばれたものである前項(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)または(9)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(11)前記脂式アミン類が下記一般式(5)
【化11】

(式中、R27〜R29は、炭素数1〜4のアルキル基、CH2OHおよびCH2CH2OHよりなる群から独立して選ばれた基である。)で示される化合物、または一般式(6)
【化12】

(式中、R30〜R33はそれぞれ水素、炭素数1〜4のアルキル基、CH2OHおよびCH2CH2OHよりなる群から独立して選ばれた基である。)で示されるハイドロキサイド化合物である前項(10)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(12)前記環式飽和アミン類が、ピペリジン、ピロリジン、モルホリン、ピペラジン及びこれらの骨格を有する誘導体ならびにこれらのアンモニウムヒドロキシド化合物よりなる群から選らばれたものである前項(10)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(13)前記不飽和アミン類が、ピリジン、α−ピコリン、β−ピコリン、γ−ピコリン、キノリン、イソキノリン、ピロリン及びこれらの骨格を有する誘導体ならびにこれらのアンモニウムヒドロキシド化合物よりなる群から選らばれたものである前項(10)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(14)前記無機塩基が、水酸化ナトリウム、水酸化カリウム、水酸化リチウムよりなる群から選らばれたものである前項(10)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(15)前記塩基性化合物(ロ)の濃度が0.1〜10.0モル/リットルである前項(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)、(9)、(10)、(11)、(12)、(13)または(14)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(16)前記(イ)と(ロ)の重量比が1:100〜100:1、好ましくは10:90〜90:10である前項(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)、(9)、(10)、(11)、(12)、(13)、(14)または(15)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(17)前記(イ)中の酸性基(ハ)と塩基性化合物(ロ)とのモル比が1:100〜100:1、好ましくは1:0.25〜1:20、さらに好ましくは1:0.5〜1:15である前項(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)、(9)、(10)、(11)、(12)、(13)、(14)、(15)または(16)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【0092】
【効果】本発明は、従来スルホン基またはカルボキシル基などの酸性基を有するアニリン類は、単独では化学酸化重合はしにくいとされていた固定観念を打破する新規重合法を開発し、ベンゼン核のすべてにスルホン基又はカルボキシル基を持たせることにより、高い導電性とともに、アルカリ性、中性(とくに単なる水)、酸性のすべてのpHをもつ水溶液およびアルコールなどの有機溶剤に対して優れた溶解性を示す新規な高分子量のポリアニリン系ポリマーの製造法を提供することができた。また、得られたポリマーは、従来法により得られた酸性基置換アニリン類の重合体に較べて高分子量であるため、実用性のあるフィルムを形成することができた。
【図面の簡単な説明】
【図1】実施例1にて合成した導電性ポリマーのIRスペクトルを示す。
【0001】
【産業上の利用分野】本発明は溶媒に可溶なアニリン系導電性ポリマー及びその製造方法に関する。該溶液はスプレー、ディップ等の簡便な手法で各種帯電防止用途に適応可能である。
【0002】
【従来の技術と課題】ドープされたポリアニリン(導電性ポリマー)は良く知られているが、ほとんど全ての溶剤に不溶であり、成形、加工に難点がある。また、アニリンを電解酸化重合する方法〔特開昭60−235831号公報、J.Polymer Sci.Polymer Chem. Ed.,26,1531(1988)〕は電極上にポリアニリンのフィルムを形成することが可能であるが、単離操作が煩雑になること及び大量合成が困難であるという問題がある。
【0003】また、近年ドープ剤を添加することなく導電性を発現するアルカリ可溶性のスルホン化ポリアニリンとその合成法及びカルボキシル化ポリアニリンとその合成法が提案されている。
【0004】例えば、スルホン化ポリアニリンの合成法としては、アニリンとm−アミノベンゼンスルホン酸を電気化学的に重合してスルホン化ポリアニリンを合成する方法(日本化学会誌,1985,1124、特開平02−166165号公報)、o−、m−、p−アミノベンゼンスルホン酸をそれぞれ単独で電気化学的に重合してスルホン化ポリアニリンを合成する方法〔日本化学会第64秋季年会 講演予稿集II 706(1992)〕、アニリンとo−、m−アミノベンゼンスルホン酸を化学的に重合してスルホン化ポリアニリンを合成する方法(特開平01−301714号公報)、アミノベンゼンスルホン酸系化合物又はアミノベンゼンスルホン酸系化合物及びアニリン系化合物を含む単量体を化学酸化重合する方法(特開平6−56987号公報)、化学的あるいは電気化学的に重合して得られたエメラルディンタイプの重合体(ポリアニリン)を濃硫酸でスルホン化する方法(特開昭58−210902)、無水硫酸/リン酸トリエチル錯体を用いてスルホン化する方法(特開昭61−197633号公報)、発煙硫酸でスルホン化する方法〔J. Am. Chem. Soc.,(1991)113, 2665〜2671、J. Am. Chem. Soc.,(1990)112,2800、WO91−06 887〕、ジフェニルアミン−4−スルホン酸(ナトリウム塩)を化学的に重合し、N−置換型のスルホン化ポリアニリン合成する方法〔Polymer,(1993)34,158〜162〕などが知られている。
【0005】アニリンとm−アミノベンゼンスルホン酸を電気化学的に重合してスルホン化ポリアニリンを合成する方法(日本化学会誌,1985,1124、特開平02−166165号公報)は、生成物が電極上に形成されるため、単離操作が煩雑になること及び大量合成が困難であるという問題がある。
【0006】また、日本化学会第64秋季年会講演予稿集II 706(1992)では、アミノベンゼンスルホン酸の電解酸化による可溶性導電性高分子の合成法が説明されているが、この方法も大量合成に適しているとは言い難い。また、ペルオキソ二硫酸アンモニウムを酸化剤としてアミノベンゼンスルホン酸を化学酸化重合を行った場合は生成物は得られなかったと記されている。また、J. Am. Chem. Soc.,(1991)113, 2665〜2671によるとo−,m−アミノベンゼンスルホン酸を化学的及び電気化学的に重合を試みたが成功しなかったと記されている。
【0007】また、特開平6−56987号公報では、アミノベンゼンスルホン酸系化合物またはアミノベンゼンスルホン酸系化合物およびアニリン系化合物を含む単量体を酸性、中性およびアルカリの何れの溶液でも、化学酸化重合することにより水に可溶性の導電性ポリマーが得られるとの記載がある。
【0008】しかし、本発明者らの検討では、フィルム形成するのに充分な分子量を有するポリマーを得るためには、塩基性化合物の存在下重合することが必須条件であり、酸性溶液および中性溶液ではフィルム形成するのに充分な分子量を有するポリマーを得ることができなかった。
【0009】特開平6−56987号公報の実施例においては、すべて硫酸酸性溶液中での重合であり、アルカリ性溶液中での重合に関する実施例はなく、また酸性水溶液中での重合に関する実施例においても、その分子量の記載もないため、どのような物性のポリマーが得られたか明らかでない。
【0010】更に本発明者らが酸化剤にペルオキソ二硫酸アンモニウムを用いて、プロトン酸を含む水溶液中および水溶液中での重合を試みたところ、水に可溶なポリマーは得られるが、低分子量のためフィルムを形成するような実用的なポリマーは得られなかった。
【0011】特開平01−301714号公報で記載されているアニリンとm−アミノベンゼンスルホン酸をペルオキソ二硫酸アンモニウムで化学的に重合する方法および特開平6−56987号公報で記載されているアニリンとm−アミノベンゼンスルホン酸を過マンガン酸カリウムで化学的に重合する方法を本発明者らが追試したところ、芳香環5個に約1個のスルホン基が導入されるのみであり、高い導電性を示すが中性および酸性の水には完全に不溶であり、アンモニアなどのアルカリ性水溶液にもほとんど不溶であった。また、特開昭61− 197633号公報の方法でスルホン化した場合も同公報7頁に記載されているとおり、スルホン化溶媒に対するポリアニリンの溶解性が充分でなく分散状態で反応させているため、芳香環5個に約1個のスルホン基しか導入されない。かくして得られるスルホン基導入割合の小さいスルホン化ポリアニリンは、導電性及び溶解性が充分でないという問題がある。
【0012】また、J. Am. Chem. Soc.,(1991)113,2665〜2671、J. Am.Chem. Soc.,(1990)112,2800によると、ポリアニリンを発煙硫酸でスルホン化した場合、芳香環2個に約1個のスルホン基が導入されると記されている。しかし、本方法でポリアニリンを充分にスルホン化しようとした場合、発煙硫酸に対するポリアニリンの溶解性が充分でないため、発煙硫酸が大過剰必要とされる。また、発煙硫酸にポリアニリンを添加する際もポリマーが固化し易いという問題がある。更に以上の方法で合成された重合物及びそのスルホン化物は、アンモニア及びアルキルアミン等の塩基を含む水溶液には溶解するが水単独には溶解しないという問題もある。
【0013】また、Polymer(1993)34,158〜162によると、ジフェニルアミン−4−スルホン酸(ナトリウム塩)を重合した場合、ベンゼンスルホン酸基がアニリン骨格に対して1個導入されたN位置換型のスルホン化ポリアニリンが得られ水単独にも溶解するが、重合物の単離に超遠心分離操作が必要であると記されている。本発明者らが追試したところ、高溶解性のため重合溶媒中からの重合物の取得収率は低いものであり、高速遠心分離操作を行わない場合、重合物を単離することはできなかった。また、N位置換型のため、上記に示したJ.Am. Chem. Soc.,(1991)113,2665〜2671の方法で合成した重合体に比べ導電性は低いものであった。
【0014】また例えば、カルボキシル化ポリアニリンの合成法としては、2−または3−カルボキシアニリンまたはその塩を酸化重合し、ついで塩基性物質で処理し、カルボキシル基が塩形で得られる製造法(特開平4−268331)が提案されているが、酸化剤の使用量が原料に対して2倍等量以上必要であり、導電性は低い値である。このことよりモノマーの反応性が低く低分子量のポリマーが生成していると考えられる。
【0015】また、メチルアントラニレート(アントラニル酸メチルエステル)をペルオキソ二硫酸アンモニウムの存在下で水性の酸性媒体中で重合後、ついでアルコール性水酸化カリウムによってメチルエステルをケン化する合成法(特開平5−226238)が提案されているが、反応が2段階となるため、操作が非常に煩雑である。
【0016】更に本発明者らが、2−カルボキシアニリンを酸化剤としてのペルオキソ二硫酸アンモニウムを用いて、プロトン酸を含む水溶液中での重合を試みたところ、生成物を得ることができなかった。また、本発明者らはアニリンと2−カルボキシアニリンを酸化剤にペルオキソ二硫酸アンモニウムを用いて、プロトン酸を含む水溶液中での重合を試みたところ、共重合体が得られたが溶解性、導電性も共に低いものであった。このことより得られた共重合体は2−カルボキシアニリンの共重合比率が低いものと考えられる。
【0017】従って、ポリマーにドープ剤を添加することなく導電性を発現させ、溶解性を向上させるためにはより多くのスルホン基またはカルボキシル基などの酸性基を主鎖の芳香環に導入する必要があるものと考えられる。
【0018】また、塗布による成膜等の成形性を考えた場合、特に親水性、疎水性いずれの基材にも塗布可能とするためには、水及び有機溶剤の両方に溶解性のあることが望まれる。ところが、ポリアニリンのスルホン化物は、アルカリ水に対する溶解性はあるが、中性から酸性を示す水溶液には不溶であり、また有機溶剤に対する溶解性が十分とはいえない。
【0019】これら諸々の問題を解決する方法として、本発明者らはアニリン、N−アルキルアニリン及びフェニレンジアミン類よりなる群から選ばれた少なくとも一種の化合物と、アミノベンゼンスルホン酸とを酸性溶媒中酸化剤を用いて共重合させ、更にスルホン化剤によりスルホン化することを特徴とするアニリン系共重合体スルホン化物の製造方法を提案(特開平5−178989号)した。しかし、該方法においても濃硫酸中でスルホン化する操作を必要とし、廃酸の処理が大きな問題として残る。
【0020】なお、以上の方法で合成された共重合体は何れも下式(2)の構造を持つと推定される。
【化2】

(式中、R11 、R12 、R13 およびR14 は、それぞれ水素およびスルホン基よりなる群から選ばれ、R′は水素又は炭素数1〜4のアルキル基よりなる群から選ばれ、スルホン基の割合はスルホン基が芳香環に対して40〜80%の含有量であり、xは0〜1の任意の数を表わし、nは重合度を示す2〜1500の数である。)
【0021】また、更に本発明者らは、アニリン、N−アルキルアニリン及びフェニレンジアミン類よりなる群から選ばれた少なくとも一種の化合物とアルコキシ基置換アミノベンゼンスルホン酸とを共重合させることにより、廃棄物を大量に発生させるスルホン化操作を省略することを特徴とするアニリン系共重合体の製造方法(特願平5−48540号)を提案した。しかし、該方法において得られる共重合体においても水単独には溶解しないという問題がある。
【0022】なお、以上の方法で合成された共重合体は何れも下式(3)の構造を持つと推定される。
【化3】

(式中、R15 、R16 、R17 、R18、R19 、R20 、R21 又はR22 は、それぞれ水素、アルコキシ基およびスルホン基よりなる群から選ばれ、スルホン基の割合はスルホン基が芳香環に対して25〜50%の含有量であり、同一芳香環にアルコキシ基およびスルホン基を含有しており、R′は水素又は炭素数1〜4のアルキル基よりなる群から選ばれ、xは、0〜1の任意の数を表し、nは重合度を示す2〜1500の数である。)
【0023】また、以上示した化学重合における重合溶媒は水またはプロトン酸を含む水溶液を用いている。たとえば、前記特開平1−163263号公報によると、酸化剤としてペルオキソ二硫酸アンモニウムを用いる場合、特にpKaが3以下のプロトン酸を含むことが好ましく、アニリンの重合における溶剤としてはアニリン、プロトン酸及び酸化剤が溶解し、且つ、酸化剤によって酸化されないものが用いられると記されている。また、前記特開平4−268331号の実施例3では、水100mlにアントラニル酸ナトリウム4gを溶解させ、過硫酸アンモニウム22.7gを水100mlに溶解し、これを上記アントラニル酸水溶液に添加して、酸化重合を行っており、この重合溶媒のpHもほぼ中性であり、モノマーの反応性の向上の観点から重合溶媒および酸化重合系を積極的にアルカリ性にすることは、重合系の性質から誰も考えもしなかったことである。
【0024】
【発明が解決しようとしている課題】本発明の目的は、高い導電性を発現させると共に、いかなるpHを示す水又は有機溶剤に対してもすぐれた溶解性を示すと共にその塗布性を向上させた可溶性アニリン系導電性ポリマーの製造方法を提供する点にある。
【0025】
【課題を解決するための手段】本発明者らは、高い導電性と溶解性を有するポリアニリンとして芳香環に対するスルホン基の導入割合の大きいスルホン化ポリアニリンおよびカルボキシル基の導入割合の大きいカルボキシル化ポリアニリンなどの酸性基の導入割合の大きい酸性基置換ポリアニリンの製法を鋭意検討した結果、モノマーとしてスルホン基置換アニリンまたはカルボキシル基置換アニリンなどの酸性基置換アニリンを、塩基性化合物を含む溶液中で、すなわちアルカリ性の重合溶媒中で酸化剤を用いて重合すると、おどろくべきことに反応性が特段に向上し、従来のスルホン基またはカルボキシル基を有するアニリン類は、それ単独では化学酸化重合しにくいう定説に反し、高分子量の重合体の製造が可能であることを見い出した。しかも、得られた導電性ポリマーは、高い導電性を示すと共に酸性〜アルカリ性の何れのpHの水溶液とくに単独の水にも溶解し、更にアルコールなどの有機溶剤にも優れた溶解性を示した。しかも、特開平4−268331号公報では、酸化重合後、塩基性物質で別途処理する工程が必ず必要であった。また、特開平6−56987号公報の記載では、アルカリ性で重合した場合、得られたポリマーを高導電性化するためにさらに酸処理する工程が必要であった。しかし、本発明ではこのような後処理工程がないから、製造工程が一工程短縮できる。
【0026】すなわち、本発明は、酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも一種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする可溶性アニリン系導電性ポリマーの製造法に関する。
【0027】前記酸性基置換アニリンは、一般式(1)
【化4】

(式中、R1,R2,R3,R4,R5は水素、炭素数1〜4の直鎖または分岐のアルキル基、酸性基、水酸基、ニトロ基およびハロゲンよりなる群から選ばれ、その少なくとも一つは酸性基を示す。また、ここで酸性基とはスルホン基またはカルボキシル基を示す)で示される酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも一つの化合物を表す。前記一般式(1)の化合物はアミノ基に対して酸性基がo位またはm位に結合しているものの方が得られるポリマーの導電性、溶解性などの性能が優れている。
【0028】前記酸性基置換アニリンとして最も代表的なものは、スルホン基置換アニリンまたはカルボキシル基置換アニリンである。好ましくはスルホン基置換アニリンであり、カルボキシル基置換アニリンに比べ導電性が高い傾向を示す。
【0029】スルホン基置換アニリンとして最も代表的なものは、アミノベンゼンスルホン酸類であり、具体的にはo−,m−,p−アミノベンゼンスルホン酸、アニリン−2,6−ジスルホン酸、アニリン−2,5−ジスルホン酸、アニリン−3,5−ジスルホン酸、アニリン−2,4−ジスルホン酸、アニリン−3,4−ジスルホン酸が好ましく用いられる。
【0030】その他のスルホン基置換アニリンとしては、メチルアミノベンゼンスルホン酸、エチルアミノベンゼンスルホン酸,n−プロピルアミノベンゼンスルホン酸、iso−プロピルアミノベンゼンスルホン酸、n−ブチルアミノベンゼンスルホン酸、sec−ブチルアミノベンゼンスルホン酸、t−ブチルアミノベンゼンスルホン酸などのアルキル基置換アミノベンゼンスルホン酸類、ヒドロキシ基置換アミノベンゼンスルホン酸類、ニトロ基置換アミノベンゼンスルホン酸類、フルオロアミノベンゼンスルホン酸、クロロアミノベンゼンスルホン酸、ブロムアミノベンゼンスルホン酸などのハロゲン基置換アミノベンゼンスルホン酸類などを挙げることができる。このなかではアルキル基置換アミノベンゼンスルホン酸類またはヒドロキシ基置換アミノベンゼンスルホン酸類が実用上もっとも好ましい。なお、これらのスルホン基置換アニリンはそれぞれ単独で用いても、また異性体を任意の割合で混合しても良い。
【0031】カルボキシル基置換アニリンとして最も代表的なものは、アミノベンゼンカルボン酸類であり、具体的にはo−,m−,p−アミノベンゼンカルボン酸、アニリン−2,6−ジカルボン酸、アニリン−2,5−ジカルボン酸、アニリン−3,5−ジカルボン酸、アニリン−2,4−ジカルボン酸、アニリン−3,4−ジカルボン酸が好ましく用いられる。
【0032】その他のカルボキシル基置換アニリンとしては、メチルアミノベンゼンカルボン酸、エチルアミノベンゼンカルボン酸,n−プロピルアミノベンゼンカルボン酸、iso−プロピルアミノベンゼンカルボン酸、n−ブチルアミノベンゼンカルボン酸、sec−ブチルアミノベンゼンカルボン酸、t−ブチルアミノベンゼンカルボン酸などのアルキル基置換アミノベンゼンカルボン酸類、ヒドロキシ基置換アミノベンゼンカルボン酸類、ニトロ基置換アミノベンゼンカルボン酸類、フルオロアミノベンゼンカルボン酸、クロロアミノベンゼンカルボン酸、ブロムアミノベンゼンカルボン酸などのハロゲン基置換アミノベンゼンカルボン酸類などを挙げることができる。このなかではアルキル基置換アミノベンゼンカルボン酸類またはヒドロキシ基置換アミノベンゼンカルボン酸類が実用上もっとも好ましい。これらのカルボキシル基置換アニリンはそれぞれ単独で用いても、また異性体を任意の割合で混合しても良い。
【0033】更に詳しく前記一般式(1)の酸性基置換アニリンの具体例としては、スルホン基置換アルキルアニリンカルボキシル基置換アルキルアニリンスルホン基置換ヒドロキシアニリンカルボキシル基置換ヒドロキシアニリンスルホン基置換ニトロアニリンカルボキシル基置換ニトロアニリンスルホン基置換フルオロアニリンカルボキシル基置換フルオロアニリンスルホン基置換クロロアニリンカルボキシル基置換クロロアニリンスルホン基置換ブロムアニリンおよびカルボキシル基置換ブロムアニリンなどを挙げることができ、これらの置換基の位置と組合わせの具体例を表1に示す。
【0034】
【表1】

ここで、A:スルホン基またはカルボキシル基、そのアルカリ金属塩、アンモニウム塩、置換アンモニウム塩かから選ばれた一つの基を示し、B:メチル基、エチル基、n−プロピル基、iso−プロピル基、n−ブチル基、sec−ブチル基、t−ブチル基などのアルキル基、ヒドロキシ基、ニトロ基、フルオロ基、クロロ基、ブロム基などのハロゲン基から選ばれた一つの基を示し、H:水素を示す。
【0035】これらモノマーにおけるアルカリ金属としては、リチウム、ナトリウム、カリウムなどが例示できる。
【0036】また、置換アンモニウムとしては、脂式アンモニウム類、環式飽和アンモニウム類、環式不飽和アンモニウム類などが挙げられる。
【0037】前記脂式アンモニウム類としては、下式(4)
【化5】

(式中R23 〜R26は、水素、炭素数1〜4のアルキル基、CH2OH、CH2CH2 OH よりなる群から独立して選ばれた基である。)で示される。たとえば、メチルアンモニウム、ジメチルアンモニウム、トリメチルアンモニウム、エチルアンモニウム、ジエチルアンモニウム、トリエチルアンモニウム、メチルエチルアンモニウム、ジエチルメチルアンモニウム、ジメチルエチルアンモニウム、プロピルアンモニウム、ジプロピルアンモニウム、イソプロピルアンモニウム、ジイソプロピルアンモニウム、ブチルアンモニウム、ジブチルアンモニウム、メチルプロピルアンモニウム、エチルプロピルアンモニウム、メチルイソプロピルアンモニウム、エチルイソプロピルアンモニウム、メチルブチルアンモニウム、エチルブチルアンモニウム、テトラメチルアンモニウム、テトラメチロールアンモニウム、テトラエチルアンモニウム、テトラn−ブチルアンモニウム、テトラsec−ブチルアンモニウム、テトラt−ブチルアンモニウムなどを例示することができる。なかでも、R23〜R26のうち1つが水素、他の3つが炭素数1〜4のアルキル基の場合が最も好ましく、ついでR23〜R26のうち2つが水素、他の2つが炭素数1〜4のアルキル基の場合が好ましい。
【0038】環式飽和アンモニウム類としては、ピペリジニウム、ピロリジニウム、モルホリニウム、ピペラジニウム及びこれらの骨格を有する誘導体などが例示される。
【0039】環式不飽和アンモニウム類としては、ピリジニウム、α−ピコリニウム、β−ピコリニウム、γ−ピコリニウム、キノリニウム、イソキノリニウム、ピロリニウム及びこれらの骨格を有する誘導体などが例示される。
【0040】次に、本発明で用いられる塩基性化合物(ロ)としては、前記酸性基置換アニリン類と塩を形成する化合物であればどのような化合物でも良いが、アンモニア、脂式アミン類、環式飽和アミン類、環式不飽和アミン類、無機塩基などが好ましく用いられる。とりわけ脂式アミン類、環式飽和アミン類、環式不飽和アミン類などが好ましい。
【0041】脂式アミン類としては、下記一般式(5)
【化6】

(式中、R27〜R29は、炭素数1〜4のアルキル基、CH2OHおよびCH2CH2OHよりなる群から独立して選ばれた基である。)で示される化合物、または一般式(6)
【化7】

(式中、R30〜R33はそれぞれ水素、炭素数1〜4のアルキル基、CH2OHおよびCH2CH2OHよりなる群から独立して選ばれた基である。)で示されるハイドロキサイド化合物を挙げることができる。
【0042】環式飽和アミン類としては、ピペリジン、ピロリジン、モルホリン、ピペラジン及びこれらの骨格を有する誘導体ならびにこれらのアンモニウムヒドロキシド化合物などが好ましく用いられる。
【0043】環式不飽和アミン類としては、ピリジン、α−ピコリン、β−ピコリン、γ−ピコリン、キノリン、イソキノリン、ピロリン及びこれらの骨格を有する誘導体ならびにこれらのアンモニウムヒドロキシド化合物などが好ましく用いられる。
【0044】無機塩基としては、水酸化ナトリウム、水酸化カリウム、水酸化リチウムなどの水酸化物の塩などが好ましく用いられるが、前記の脂式アミン類、環式飽和アミン類、環式不飽和アミン類に比べると得られるポリマーの導電性は劣る傾向にある。
【0045】これら塩基性化合物(ロ)の濃度は0.1mol/リットル以上、好ましくは0.1〜10.0mol/リットル、更に好ましくは0.2〜8.0mol/リットルの範囲で用いられる。この際、0.1mol/リットル以下の場合、得られるポリマーの収率が低下し、10.0mol/リットル以上の場合、導電性が低下する傾向を示す。前記塩基性化合物(ロ)は、それぞれ任意の割合で混合して用いることもできる。
【0046】前記酸性基置換アニリンなどの化合物(イ)と塩基性化合物(ロ)との重量比は(イ):(ロ)=1:100〜100:1、好ましくは10:90〜90:10が用いられる。ここで、塩基性化合物の割合が低いと反応性が低下し導電性も低下する。逆に割合が高い場合は得られるポリマー中の酸性基と塩基性化合物が塩を形成する割合が高くなり導電性が低下する傾向にある。
【0047】また、前記酸性基置換アニリンなどの化合物(イ)中の酸性基(ハ)と塩基性化合物(ロ)とのモル比は(ハ):(ロ)=1:100〜100:1、好ましくは1:0.25〜1:20、さらに好ましくは1:0.5〜1:15で用いることができる。ここで、塩基性化合物の割合が低いと反応性が低下し導電性も低下する。逆に割合が高い場合は得られるポリマー中の酸性基と塩基性化合物が塩を形成する割合が高くなり導電性が低下する傾向にある。
【0048】重合又は共重合は、これら塩基性化合物を含む溶液中、酸化剤で酸化重合することにより行う。溶媒は、水、メタノール、エタノール、イソプロパノール、アセトニトリル、メチルイソブチルケトン、メチルエチルケトン、ジメチルホルムアミド、ジメチルアセトアミド等が好ましく用いられる。
【0049】また、酸化剤は、標準電極電位が0.6V以上である酸化剤であれば特に限定されないが、ペルオキソ二硫酸、ペルオキソ二硫酸アンモニウム、ペルオキソ二硫酸ナトリウム及びペルオキソ二硫酸カリウムなどのペルオキソ二硫酸類、過酸化水素等が好ましく用いられ、モノマー1モルに対して0.1〜5モル、好ましくは0.5〜5モル用いられる。またこの際、触媒として鉄、銅などの遷移金属化合物を添加することも有効である。
【0050】反応温度は、マイナス15〜70℃の温度範囲で行うのが好ましく、更に好ましくはマイナス5〜60℃の範囲が適用される。ここで、マイナス15℃以下、又は70℃以上では、導電性が低下する傾向がある。
【0051】本発明によって製造されるポリマー中のスルホン基またはカルボキシル基における水素は、水素、アルカリ金属、アンモニウム及び置換アンモニウムよりなる群から独立して選ばれた基であること、即ちこれらの基が単独ではなく混合した状態でも得ることができる。
【0052】具体的には、水酸化ナトリウム存在下で重合された場合、単離されたポリマー中のスルホン基またはカルボキシル基における水素は、ほとんどがナトリウムに置換された状態になっている。
【0053】同様に、ポリマー中のスルホン基またはカルボキシル基における水素は、アンモニア存在下重合した場合、大部分はアンモニウムであり、トリメチルアミン存在下重合した場合、大部分はトリメチルアンモニウムであり、キノリン存在下重合した場合、大部分はキノリニウムで得られる。
【0054】また、塩基性化合物を混合して用いた場合は、これらの混合した状態で得られる。具体的には、水酸化ナトリウムとアンモニア存在下重合された場合、単離されたポリマー中のスルホン基またはカルボキシル基における水素は、ナトリウムとアンモニウムの両方が存在した状態で得られる。また、得られたポリマーを水酸化ナトリウムとアンモニアの両方が存在する溶液で処理した場合も同様にポリマー中のスルホン基またはカルボキシル基における水素は、ナトリウムとアンモニウムの両方が存在した状態で得られる。
【0055】以上に記した酸性基の一部が塩を形成しているポリマーは、酸性溶液中で処理するとその塩が水素に置換されたポリマーにすることができる。
【0056】酸性溶液としては塩酸、硫酸、p−トルエンスルホン酸、硝酸などを挙げることができる。ただし、十分に酸置換を行っても、全てが水素で置換されたものを得ることは難しい。
【0057】しかし、本発明の製造法では、得られるポリマーは重合溶媒中より析出してくるので塩を形成する割合は低いため、特に酸性溶液中で処理する必要はなく、高導電性の実用的なポリマーを製造することができる。
【0058】かくして得られたすべての芳香環にスルホン基またはカルボキシ基を含有する可溶性アニリン系導電性ポリマーの重量平均分子量は約10,000〜3,240,000、好ましくは20,000以上、さらに好ましくは50,000〜3,240,000である。このポリマーは更にスルホン化操作を施すことなく、単なる水、アンモニア及びアルキルアミン等の塩基又は酢酸アンモニウム、シュウ酸アンモニウム等の塩基及び塩基性塩を含む水、塩酸及び硫酸等の酸を含む水又はメチルアルコール、エチルアルコール、イソプロピルアルコール等の溶媒又はそれらの混合物に溶解することができる。
【0059】溶解性を詳しく説明すると、本発明における可溶性アニリン系導電性ポリマーは、0.1モル/リットルのアンモニア水などのアルカリ水溶液に1重量%以上溶解し、0.1モル/リットルの硫酸水溶液などの酸性水溶液に1重量%以上溶解し、単独の水などの中性水溶液に1重量%以上溶解し、さらに0.1モル/リットルのアンモニアアルコール溶液などの有機溶剤に1重量%以上溶解するという性質を有している。
【0060】なお、以上の方法で合成された重合体または共重合体は何れも下式(4)の構造を持つと推定される。
【化8】

(式中、Aはスルホン基、カルボキシル基、そのアルカリ金属塩、アンモニウム塩、置換アンモニウム塩から選ばれた一つの基であり、Bは水素、メチル基、エチル基,n−プロピル基,iso−プロピル基,n−ブチル基,sec−ブチル基、t−ブチル基などのアルキル基、ヒドロキシ基、ニトロ基、フルオロ基、クロロ基、ブロム基などのハロゲン基から選ばれた一つの基を示す。xは0〜1の任意の数を示し、nは重合度を示し、10〜5,000の数である)
【0061】
【実施例】以下実施例を挙げて説明する。なお、IRスペクトルはパーキンエルマー製(モデル1600)の装置を用いて測定した。分子量分布及び分子量の測定には、N,N−ジメチルホルムアミド用のGPCカラムを用いて、GPC測定(ポリスチレン換算)を行った。カラムは、N,N−ジメチルホルムアミド用のものを3種類連結して用いた。また、溶離液には0.01モル/リットルトリエチルアミンと0.1モル/リットル臭化リチウムのN,N−ジメチルホルムアミド溶液を用いた。導電性は、導電率の測定には4端子法、表面抵抗の測定には2端子法を用いた。
【0062】実施例1o−アミノベンゼンスルホン酸100mmolを25℃で4モル/リットルのアンモニア水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末12gを得た。このものの体積抵抗値は12.0Ωcmであった。
【0063】前記重合体3重量部を0.2モル/リットルの硫酸水溶液100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布し、100℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値2.5×107 Ω/□のフィルムが得られた。
【0064】測定の結果、数平均分子量150,000、重量平均分子量190,000、Z平均分子量210,000、分散度MW/MN1.5、MZ/MW1.3であった。
【0065】水、0.1モル/リットルの硫酸水溶液又は0.1モル/リットルのアンモニア水10mlにポリマーを少量ずつ加えて溶解しなくなったところで濾過し、溶解量を求めたところ、実施例1にて合成した導電性ポリマーの溶解性は、 水 230mg/ml 0.1モル/リットルの硫酸水溶液 225mg/ml 0.1モル/リットルのアンモニア水 200mg/mlであった。
【0066】図1は、実施例1にて合成した導電性ポリマーのIRスペクトルを示す。IRスペクトルの帰属は次のとおりである。
スルホン基:1120,1020cm-1付近の吸収スルホン基のアンモニウム塩:1400cm-1付近の吸収ポリマーの骨格:1500cm-1付近の吸収
【0067】実施例23ーメチルー6ーアミノベンゼンスルホン酸100mmolを4℃で4モル/リットルのトリメチルアミン水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で6時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末10gを得た。
【0068】この重合体を1モル/リットルp−トルエンスルホン酸(PTS)のアセトン溶液中で1時間撹拌し濾別洗浄後、乾燥しスルホン基がフリーの重合体の粉末18gを得た。このものの体積抵抗値は12.5Ωcmであった。
【0069】前記重合体1重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。該組成物のpHは約3.5であったことより、ポリマー中のスルホン酸基の約80%以上がフリーの状態であると推定される。このようにして得られた溶液をガラス基板上にキャスト法により塗布し、100℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値5.0×106 Ω/□のフィルムが得られた。
【0070】実施例32−カルボキシルアニリン(アントラニル酸)100mmolを4℃で4モル/リットルのキノリン水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末11gを得た。このものの体積抵抗値は45Ωcmであった。
【0071】前記重合体3重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。該組成物のpHは約6.0であったことより、ポリマー中のカルボキシル基の約20%以上が塩を形成していると推定される。
【0072】このようにして得られた溶液を、PETフィルム上にスピンコート法により塗布し、80℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値3.0×107 Ω/□のフィルムが得られた。
【0073】実施例43−ヒドロキシアントラニル酸100mmolを25℃で3モル/リットルの2−メチルピリジン(α−ピコリン)水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末11gを得た。このものの体積抵抗値は37Ωcmであった。
【0074】前記重合体3重量部を水/イソプロピルアルコール(7/3)100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布し、120℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値7.0×106Ω/□のフィルムが得られた。
【0075】実施例54ーニトロアントラニル酸100mmolを10℃で4モル/リットルのトリエタノールアミン水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末9.5gを得た。このものの体積抵抗値は50Ωcmであった。
【0076】前記重合体3重量部を水溶性ポリエステル樹脂「アラスター300」{荒川化学工業(株)製}100重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液を深度35μmのグラビアコーターによりPETフィルム上に塗布し、70℃で乾燥させた。膜厚0.5μm表面の平滑な表面抵抗値1.5×107 Ω/□のフィルムが得られた。
【0077】実施例6m−ニトロアニリンスルホン酸100mmolを25℃で4モル/リットルのピぺリジン水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末6gを得た。このものの体積抵抗値は15Ωcmであった。
【0078】前記重合体2重量部を0.2モル/リットルのアンモニア水100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液を、PETフィルム上にスピンコート法により塗布し、80℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値1.0×107 Ω/□のフィルムが得られた。
【0079】実施例72−クロロ−5−アミノベンゼンスルホン酸100mmolを4℃で3モル/リットルの水酸化ナトリウム水溶液に撹拌溶解し、ペルオキソ二硫酸アンモニウム100mmolの水溶液を滴下した。滴下終了後25℃、6時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末6gを得た。このものの体積抵抗値は20Ωcmであった。この重合体を1モル/リットルのp−トルエンスルホン酸(PTS)のアセトン溶液中で1時間撹拌し、濾別洗浄後、乾燥しスルホン酸基がフリーの重合体粉末4gを得た。
【0080】前記重合体3重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。該組成物の粘度は4.7cp(25℃)であった。この粘度はウベローヂ粘度計を用いて測定した。該組成物のpHは約3.8であったことより、ポリマー中のスルホン酸基の約80%以上がフリーの状態であることが推定される。このようにして得られた溶液をガラス基板上にスピンコート法により塗布し、80℃で乾燥させた。膜厚0.1μm表面の平滑な表面抵抗値8.5×106 Ω/□のフィルムが得られた。
【0081】比較例1o−アミノベンゼンスルホン酸100mmolを4℃で水に撹拌懸濁させ、ペルオキソ二硫酸アンモニウム100mmolの水を滴下した。滴下終了後25℃、12時間更に撹拌したのち、反応液を減圧留去し濃縮物を単離洗浄後、乾燥し粉末6gを得た。このものの体積抵抗値は>106 Ωcmであった。
【0082】前記粉末3重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液を、PETフィルム上にスピンコート法により塗布したが膜は形成されなかった。
【0083】比較例22ーカルボキシルアニリン(アントラニル酸)100mmolを25℃で1モル/リットルの硫酸水溶液に撹拌懸濁させ、ペルオキソ二硫酸アンモニウム100mmolの1モル/リットルの硫酸水溶液を滴下した。滴下終了後25℃で12時間更に撹拌したのち、反応液を減圧留去し、濃縮物を単離洗浄後乾燥し、粉末3gを得た。このものの体積抵抗値は>106 Ωcmであった。
【0084】前記粉末3重量部を水100重量部に室温で撹拌溶解し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布したが、膜は形成されなかった。
【0085】比較例3アニリン系導電性ポリマーとして、スルホン化ポリアニリンを概知の方法〔J.Am.Chem.Soc.,(1991),113,2665−2666〕に従って合成した。なお、得られたスルホン基の含有量は芳香環に対して52%であった。
【0086】前記スルホン化ポリアニリン3重量部を0.2モル/リットル硫酸水溶液100重量部に室温混合し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布したが、0.2モル/リットルの硫酸水溶液にスルホン化ポリアニリンは不溶であったため膜は形成されなかった。
【0087】比較例3(従来法)にて合成した導電性ポリマーの溶解性は、 水 0mg/ml 0.1モル/リットルの硫酸水溶液 0mg/ml 0.1モル/リットルのアンモニア水 50mg/mlであった。
【0088】比較例4p−アミノベンゼンスルホン酸100mmolとアニリン40mmolを4℃で1モル/リットルの硫酸水溶液に撹拌懸濁させ、ペルオキソ二硫酸アンモニウム100mmolの1モル/リットルの硫酸水溶液を滴下した。滴下終了後25℃、12時間更に撹拌したのち、反応生成物を濾別洗浄後乾燥し、重合体粉末4.3gを得た。このものの体積抵抗値は15Ωcmであった。
【0089】前記アニリン系導電性ポリマー3重量部を水100重量部に室温で混合し導電性組成物を調製した。このようにして得られた溶液をガラス基板上にスピンコート法により塗布したが、このポリマーは水に不溶であったため膜は形成されなかった。
【0090】比較例4にて合成した導電性ポリマーの溶解性は、水 0mg/ml0.1モル/リットルの硫酸水溶液 0mg/ml0.1モル/リットルのアンモニア水 3mg/mlであった。
【0091】以下に実施態様項を列挙する。
(1)酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも1種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする重量平均分子量が10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(2)一般式(1)
【化9】

(式中、R1,R2,R3,R4,R5は水素、炭素数1〜4の直鎖または分岐のアルキル基、酸性基、水酸基、ニトロ基およびハロゲンよりなる群から選ばれ、その少なくとも一つは酸性基を示す。また、ここで酸性基とはスルホン基またはカルボキシル基を示す)で示される酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも一種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする前項(1)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(3)前記化合物(イ)中の酸性基(ハ)と塩基性化合物(ロ)とを(ハ):(ロ)の当量比が1:100〜100:1であることを特徴とする前項(1)または(2)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(4)前記酸性基置換アニリンがスルホン基置換アルキルアニリンカルボキシル基置換アルキルアニリンスルホン基置換ヒドロキシアニリンカルボキシル基置換ヒドロキシアニリンスルホン基置換ニトロアニリンカルボキシル基置換ニトロアニリンスルホン基置換フルオロアニリンカルボキシル基置換フルオロアニリンスルホン基置換クロロアニリンカルボキシル基置換クロロアニリンスルホン基置換ブロムアニリンおよびカルボキシル基置換ブロムアニリンよりなる群から選らばれたものである前項(1)、(2)または(3)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(5)前記酸性基置換アニリンのアルカリ金属塩が、前項(4)のリチウム塩、ナトリウム塩またはカリウム塩である前項(1)、(2)または(3)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(6)前記酸性基置換アニリンの置換アンモニウム塩が前項(4)の脂式アンモニウム塩、環式飽和アンモニウム塩、環式不飽和アンモニウム塩である前項(1)、(2)または(3)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(7)前記脂式アンモニウム塩が、下式
【化10】

(式中R23 〜R26は、水素、炭素数1〜4のアルキル基、CH2OH、CH2CH2 OH よりなる群から独立して選ばれた基である。)で示される化合物の塩である前項(6)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(8)前記環式飽和アンモニウム塩が、ピペリジニウム、ピロリジニウム、モルホリニウム、ピペラジニウム及びこれらの骨格を有する誘導体よりなる群から選らばれた化合物の塩である前項(6)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(9)前記環式不飽和アンモニウム塩が、ピリジニウム、α−ピコリニウム、β−ピコリニウム、γ−ピコリニウム、キノリニウム、イソキノリニウム、ピロリニウム及びこれらの骨格を有する誘導体よりなる群から選らばれた化合物の塩である前項(6)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(10)前記塩基性化合物(ロ)が、アンモニア、脂式アミン類、環式飽和アミン類、環式不飽和アミン類、無機塩基よりなる群から選らばれたものである前項(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)または(9)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(11)前記脂式アミン類が下記一般式(5)
【化11】

(式中、R27〜R29は、炭素数1〜4のアルキル基、CH2OHおよびCH2CH2OHよりなる群から独立して選ばれた基である。)で示される化合物、または一般式(6)
【化12】

(式中、R30〜R33はそれぞれ水素、炭素数1〜4のアルキル基、CH2OHおよびCH2CH2OHよりなる群から独立して選ばれた基である。)で示されるハイドロキサイド化合物である前項(10)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(12)前記環式飽和アミン類が、ピペリジン、ピロリジン、モルホリン、ピペラジン及びこれらの骨格を有する誘導体ならびにこれらのアンモニウムヒドロキシド化合物よりなる群から選らばれたものである前項(10)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(13)前記不飽和アミン類が、ピリジン、α−ピコリン、β−ピコリン、γ−ピコリン、キノリン、イソキノリン、ピロリン及びこれらの骨格を有する誘導体ならびにこれらのアンモニウムヒドロキシド化合物よりなる群から選らばれたものである前項(10)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(14)前記無機塩基が、水酸化ナトリウム、水酸化カリウム、水酸化リチウムよりなる群から選らばれたものである前項(10)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(15)前記塩基性化合物(ロ)の濃度が0.1〜10.0モル/リットルである前項(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)、(9)、(10)、(11)、(12)、(13)または(14)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(16)前記(イ)と(ロ)の重量比が1:100〜100:1、好ましくは10:90〜90:10である前項(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)、(9)、(10)、(11)、(12)、(13)、(14)または(15)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
(17)前記(イ)中の酸性基(ハ)と塩基性化合物(ロ)とのモル比が1:100〜100:1、好ましくは1:0.25〜1:20、さらに好ましくは1:0.5〜1:15である前項(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)、(9)、(10)、(11)、(12)、(13)、(14)、(15)または(16)記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【0092】
【効果】本発明は、従来スルホン基またはカルボキシル基などの酸性基を有するアニリン類は、単独では化学酸化重合はしにくいとされていた固定観念を打破する新規重合法を開発し、ベンゼン核のすべてにスルホン基又はカルボキシル基を持たせることにより、高い導電性とともに、アルカリ性、中性(とくに単なる水)、酸性のすべてのpHをもつ水溶液およびアルコールなどの有機溶剤に対して優れた溶解性を示す新規な高分子量のポリアニリン系ポリマーの製造法を提供することができた。また、得られたポリマーは、従来法により得られた酸性基置換アニリン類の重合体に較べて高分子量であるため、実用性のあるフィルムを形成することができた。
【図面の簡単な説明】
【図1】実施例1にて合成した導電性ポリマーのIRスペクトルを示す。
【特許請求の範囲】
【請求項1】 酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも1種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする重量平均分子量が10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【請求項2】 一般式(1)
【化1】

(式中、R1,R2,R3,R4,R5は水素、炭素数1〜4の直鎖または分岐のアルキル基、酸性基、水酸基、ニトロ基およびハロゲンよりなる群から選ばれ、その少なくとも一つは酸性基を示す。また、ここで酸性基とはスルホン基またはカルボキシル基を示す)で示される酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも一種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする請求項1記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【請求項3】 前記化合物(イ)中の酸性基(ハ)と塩基性化合物(ロ)とを(ハ):(ロ)の当量比が1:100〜100:1であることを特徴とする請求項1または2記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【請求項1】 酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも1種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする重量平均分子量が10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【請求項2】 一般式(1)
【化1】

(式中、R1,R2,R3,R4,R5は水素、炭素数1〜4の直鎖または分岐のアルキル基、酸性基、水酸基、ニトロ基およびハロゲンよりなる群から選ばれ、その少なくとも一つは酸性基を示す。また、ここで酸性基とはスルホン基またはカルボキシル基を示す)で示される酸性基置換アニリン、そのアルカリ金属塩、アンモニウム塩および置換アンモニウム塩のうち少なくとも一種の化合物(イ)を、塩基性化合物(ロ)を含む溶液中で酸化剤により重合させることを特徴とする請求項1記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【請求項3】 前記化合物(イ)中の酸性基(ハ)と塩基性化合物(ロ)とを(ハ):(ロ)の当量比が1:100〜100:1であることを特徴とする請求項1または2記載の重量平均分子量10,000〜3,240,000である可溶性アニリン系導電性ポリマーの製造方法。
【図1】




【公開番号】特開平7−324132
【公開日】平成7年(1995)12月12日
【国際特許分類】
【出願番号】特願平6−183882
【出願日】平成6年(1994)7月13日
【出願人】(000003953)日東化学工業株式会社 (11)
【公開日】平成7年(1995)12月12日
【国際特許分類】
【出願日】平成6年(1994)7月13日
【出願人】(000003953)日東化学工業株式会社 (11)
[ Back to top ]

