可溶性インターロイキン−2受容体の測定方法及び測定用試薬
【課題】 簡便で、かつ、高感度な試料中の、可溶性インターロイキン−2受容体(sIL−2R)の測定方法を提供する。
【解決手段】 以下の工程を含むことを特徴とする、試料中のsIL−2Rの測定方法。
(1)試料を濃縮することなく、試料中のsIL−2Rを、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応させる工程;
(2)sIL−2Rに結合する第2抗体若しくはそのフラグメントを、水性媒体中で、工程(1)で生成した免疫複合体を固定化する磁性粒子と反応させる工程;
(3)工程(2)後の反応混合物中の磁性粒子を磁力により集めて、磁力により集められた磁性粒子とそれ以外の反応液とを分離する工程;及び、
(4)工程(3)で分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定する工程。
【解決手段】 以下の工程を含むことを特徴とする、試料中のsIL−2Rの測定方法。
(1)試料を濃縮することなく、試料中のsIL−2Rを、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応させる工程;
(2)sIL−2Rに結合する第2抗体若しくはそのフラグメントを、水性媒体中で、工程(1)で生成した免疫複合体を固定化する磁性粒子と反応させる工程;
(3)工程(2)後の反応混合物中の磁性粒子を磁力により集めて、磁力により集められた磁性粒子とそれ以外の反応液とを分離する工程;及び、
(4)工程(3)で分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定する工程。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、可溶性インターロイキン−2受容体の測定方法、及び、可溶性インターロイキン−2受容体の測定用試薬に関する。
【背景技術】
【0002】
インターロイキン−2受容体(以下、IL−2Rと記す)はα鎖、β鎖、γ鎖から構成されているが、α鎖の一部が細胞上から遊離した可溶性インターロイキン−2受容体(以下、sIL−2Rと記す)が血中に存在することが知られている(特許文献1、非特許文献1参照)。sIL−2Rは活性化T細胞、B細胞によって産生されるために、生体の免疫防御機構の活性化、T細胞系及びB細胞系などの活性化に伴い血中のsIL−2Rが上昇することが報告されている。血清中のsIL−2R濃度は、慢性関節リウマチ、全身性エリテマトーデス(SLE)などの自己免疫疾患や、ウイルス性肝炎、後天性免疫不全症候群(AIDS)などのウイルス感染症の患者で高値を示し、体内の活性化リンパ球量の指標の1つとなることが報告されている(非特許文献2参照)。また腫瘍細胞がsIL−2Rを産生し、成人T細胞白血病(ATL)や非ホジキンリンパ腫の進行と血清中のsIL−2R濃度の変動が良く相関することが知られている(非特許文献3、非特許文献4参照)。このようにsIL−2Rに関して、様々な免疫系の疾患や病態との関連が報告されており、なかでも造血疾患の有望な血液中のマーカーと認識されている。血清中のsIL−2R濃度は成人T細胞白血病においては病態モニタリングの指標など、非ホジキンリンパ腫においては治療効果の判定、寛解後のモニタリング、再発の早期発見の指標などとして臨床的に有効活用されている。
【0003】
白血病、ATL、非ホジキンリンパ腫等の血液疾患の有効な治療法の1つに、造血幹細胞移植がある。造血幹細胞移植を行う前には、患者の生体内に残存する腫瘍細胞を根絶させ、かつ、移植されたドナーの幹細胞が拒絶されないように患者の免疫担当細胞を根絶させる必要があるため、前処置として大量の抗がん剤投与や放射線照射を行う。造血幹細胞移植後の問題として、患者の生体内の腫瘍細胞が残存していたことによる再発、患者の免疫担当細胞が残存しドナーの幹細胞を攻撃する拒絶反応、移植されたドナーの幹細胞が患者組織を攻撃する移植片対宿反応病(GVHD)がある。再発、拒絶反応及びGVHDが起こる際に、血清中のsIL−2Rが上昇することが知られている。造血幹細胞移植後の患者は生命の危険に晒されており、患者の生命の危険を回避するためには、患者への迅速な処置が必要である。そのためには、造血幹細胞移植後のsIL−2Rの微量の変化を的確に捉えることができる高感度なsIL−2Rの測定方法が必要である。
【0004】
血清又は血漿中のsIL−2R定量用試薬としては、「セルフリーIL−2Rメデックス」(協和メデックス社製)、「シーメンス・イムライズIL−2R II」(シーメンス社製)等があり、臨床の現場で使用されている。これらの試薬を用いて血清又は血漿等の試料中に微量に存在するsIL−2Rを測定するには、試料をそのまま用いた測定は測定感度の観点から困難であり、試料の濃縮操作を行わなければならない。従って、簡便で、かつ、高感度な試料中のsIL−2Rの測定方法の開発が望まれていた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開昭62−70761号公報
【非特許文献】
【0006】
【非特許文献1】The Journal of Immunology, vol.135, No.5, p.3172〜3177 (1985).
【非特許文献2】Clinical immunology and immunopathology, vol.50, No.3, p.321〜332 (1989).
【非特許文献3】臨床病理,vol.42, No.8, p.834-842 (1994).
【非特許文献4】臨床検査,vol.35, No.1, p.87-91 (1991).
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、簡便で、かつ、高感度な試料中のsIL−2Rの測定方法及び測定用試薬を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決すべく鋭意検討した結果、磁性粒子を担体として用いるサンドイッチ法により、試料の濃縮操作を行うことなく、高感度にsIL−2Rを測定できることを見出し、本発明を完成した。すなわち、本発明は、以下の[1]〜[9]に関する。
【0009】
[1] 試料中のsIL−2Rの測定方法であって、以下の工程を含むことを特徴とする方法。
(1)試料を濃縮することなく、試料中のsIL−2Rを、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応させる工程;
(2)sIL−2Rに結合する第2抗体若しくはそのフラグメントを、水性媒体中で、工程(1)で生成したsIL−2Rに結合する第1抗体若しくはそのフラグメントとsIL−2Rの免疫複合体が固定化された磁性粒子と反応させる工程;
(3)工程(2)後の反応混合物中の磁性粒子を磁力により集めて、磁力により集められた磁性粒子とそれ以外の反応溶液とを分離する工程;及び、
(4)工程(3)で分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定する工程。
[2] 工程(1)と工程(2)とが同時に行われる、[1]記載の方法。
[3] 工程(1)及び/又は工程(2)が、塩類共存下に行われる[1]又は[2]記載の方法。
[4] 工程(1)及び/又は工程(2)が、ポリエチレングリコール誘導体共存下に行われる[1]〜[3]のいずれかに記載の方法。
[5] ポリエチレングリコール誘導体が、ポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル又はポリオキシエチレンソルビタン脂肪酸エステルである[4]記載の方法。
【0010】
[6] 磁性粒子、可溶性インターロイキン−2受容体(以下、sIL−2Rと記す)に結合する第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有することを特徴とする、試料中のsIL−2R測定用試薬。
[7] さらに塩類を含有することを特徴とする、[6]記載の試薬。
[8] さらにポリエチレングリコール誘導体を含有することを特徴とする、[6]又は[7]記載の試薬。
[9] ポリエチレングリコール誘導体が、ポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル又はポリオキシエチレンソルビタン脂肪酸エステルである[8]記載の試薬。
【発明の効果】
【0011】
本発明により、簡便で、かつ、高感度な試料中のsIL−2Rの測定方法及び測定用試薬が提供される。
【図面の簡単な説明】
【0012】
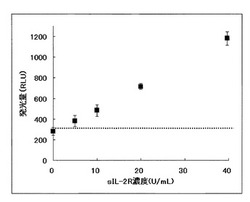
【図1】実施例1のsIL−2Rの測定方法による試料中のsIL−2Rの測定の結果を表すグラフであり、試料中のsIL−2R濃度と発光量との関係を表すグラフである。破線は、ブランク+2SDの発光量を表す。
【図2】実施例2のsIL−2Rの測定方法による試料中のsIL−2Rの測定の結果を表すグラフであり、試料中のsIL−2R濃度と発光量との関係を表すグラフである。破線は、ブランク+2SDの発光量を表す。
【図3】プレートを使用する比較例のsIL−2Rの測定方法による試料中のsIL−2Rの測定の結果を表すグラフであり、試料中のsIL−2R濃度と発光量との関係を表すグラフである。破線は、ブランク+2SDの発光量を表す。
【発明を実施するための形態】
【0013】
(測定方法)
本発明の試料中のsIL−2Rの測定方法は、磁性粒子を担体として用いる、サンドイッチ法による試料中のsIL−2Rの免疫測定法であり、試料を濃縮することなく測定に供するものである。
【0014】
本発明のsIL−2Rの測定方法は、以下の工程を含むことを特徴とする方法である。
(1)試料を濃縮することなく、試料中のsIL−2Rを、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応させる工程;
(2)sIL−2Rに結合する第2抗体若しくはそのフラグメントを、水性媒体中で、工程(1)で生成したsIL−2Rに結合する第1抗体若しくはそのフラグメントとsIL−2Rの免疫複合体が固定化された磁性粒子と反応させる工程;
(3)工程(2)後の反応混合物中の磁性粒子を磁力により集めて、磁力により集められた磁性粒子とそれ以外の反応溶液とを分離する工程;及び、
(4)工程(3)で分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定する工程。
【0015】
上記(1)の工程において、試料中のsIL−2Rは、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応する。sIL−2Rに結合する第1抗体若しくはそのフラグメントは予め磁性粒子に固定化されていてもよいが、反応の過程でsIL−2Rに結合する第1抗体若しくはそのフラグメントを磁性粒子に固定化されてもよい。
【0016】
sIL−2Rに結合する第1抗体若しくはそのフラグメントの磁性粒子への固定は、物理吸着による固定、リンカーを介する固定、アビジン類(アビジン、ストレプトアビジン、ニュートラアビジン等)−ビオチン等の2つの親和性物質間の相互作用を利用した固定等が挙げられる。
【0017】
反応の過程でsIL−2Rに結合する第1抗体若しくはそのフラグメントを磁性粒子に固定化させる方法としては、例えばアビジン類が固定化された磁性粒子と、sIL−2Rに結合する第1抗体若しくはそのフラグメントにビオチンが結合したビオチン結合第1抗体若しくはそのフラグメントとを反応させて、sIL−2Rに結合する第1抗体若しくはそのフラグメントを磁性粒子に固定化させる方法、ビオチンが固定化された磁性粒子と、sIL−2Rに結合する第1抗体若しくはそのフラグメントにアビジン類が結合したアビジン類結合第1抗体若しくはそのフラグメントとを反応させて、sIL−2Rに結合する第1抗体若しくはそのフラグメントを磁性粒子に固定化させる方法等が挙げられる。
【0018】
反応溶液中の磁性粒子の濃度は、本発明のsIL−2Rの測定を可能とする濃度であれば特に限定はなく、通常、0.1〜10mg/mLである。反応温度は、本発明のsIL−2Rの測定を可能とする温度であれば特に限定はなく、通常、0〜50℃であり、4〜45℃が好ましく、20〜40℃が特に好ましい。反応時間は、本発明のsIL−2Rの測定を可能とする時間であれば特に限定はなく、通常、5分間〜1時間であり、5〜20分間が好ましい。
【0019】
工程(1)において、磁性粒子上に、sIL−2Rに結合する第1抗体若しくはそのフラグメントと、sIL−2Rとからなる免疫複合体が形成される。
【0020】
磁性粒子に固定化されるsIL−2Rに結合する第1抗体若しくはそのフラグメントの量は、本発明のsIL−2Rの測定を可能とする量であれば特に制限はなく、通常、0.1〜10mg/mLの磁性粒子の懸濁液に、抗体の重量換算で0.1〜10μg/mLの濃度になるように第1抗体若しくはそのフラグメントを添加し、放置することにより磁性粒子に固定される量である。磁性粒子への第1抗体若しくはそのフラグメントの固定は、例えば磁性粒子懸濁液に、sIL−2Rに結合する第1抗体若しくはそのフラグメントを添加し、37℃で5分間〜1時間反応させることにより行うことができる。
【0021】
次いで、工程(2)において、工程(1)で生成した免疫複合体(磁性粒子に固定化された免疫複合体で、sIL−2Rに結合する第1抗体若しくはそのフラグメントと、sIL−2Rとからなる免疫複合体)と、sIL−2Rに結合する第2抗体若しくはそのフラグメントとが水性媒体中で反応し、磁性粒子上に、sIL−2Rに結合する第1抗体若しくはそのフラグメント、sIL−2R、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントからなる免疫複合体が生成される。
【0022】
工程(1)と工程(2)とは順次行われてよいが、同時に行われてもよい。工程(1)と工程(2)を同時に行う場合には、試料中のsIL−2Rを、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントと反応させる。工程(1)と工程(2)を同時に行う場合も、前述の通り、sIL−2Rに結合する第1抗体若しくはそのフラグメントは予め磁性粒子に固定化されていても、反応の過程で磁性粒子に固定化されてもよく、sIL−2Rに結合する第1抗体若しくはそのフラグメントの磁性粒子への固定は前述の方法で行うことができる。
【0023】
また、工程(1)と工程(2)の間に、磁性粒子の洗浄工程を設定してもよい。工程(1)の反応混合物から、免疫複合体(sIL−2Rに結合する第1抗体若しくはそのフラグメントと、sIL−2Rとからなる免疫複合体)が固定化された磁性粒子を磁力により集め、磁性粒子以外の反応溶液を除去し、磁性粒子が残った反応容器に洗浄液を添加し、磁性粒子を洗浄する。磁性粒子を洗浄した後、磁力により磁性粒子を集めて反応容器に残った洗浄液を除去し、残った磁性粒子を工程(2)に供する。尚、磁性粒子の洗浄において、磁力により集められた磁性粒子以外の反応溶液の除去と、洗浄液の反応容器への添加は同時に行ってもよい。また、洗浄液を工程(1)の反応溶液に添加し、得られる混合物から磁性粒子以外の溶液を除去してもよい。洗浄液としては、本発明のsIL−2Rの測定を可能とする洗浄液であれば特に制限はなく、例えば後述の水性媒体、後述の水性媒体に界面活性剤が添加されてなる水性媒体等が挙げられる。界面活性剤としては、例えばツイーン(Tween)20等の非イオン性界面活性剤等が挙げられる。
【0024】
次いで、工程(3)において、反応後の磁性粒子(sIL−2Rに結合する第1抗体若しくはそのフラグメント、sIL−2R、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントからなる免疫複合体がその上に形成された磁性粒子)は磁力によって集められ、磁力により集められた磁性粒子は、それ以外の溶液と分離される。反応後の磁性粒子を集めるための磁力は、本発明のsIL−2Rの測定を可能とする磁力であれば特に制限はない。磁力により集められた磁性粒子と、それ以外の反応溶液との分離は、本発明のsIL−2Rの測定を可能とする分離であれば特に制限はない。
【0025】
また、本発明のsIL−2Rの測定方法においては、反応後の磁性粒子を洗浄する工程を含んでいてもよい。磁性粒子の洗浄は、工程(3)の後に行うこともできるが、工程(3)と同時に行うこともできる。工程(3)の後に反応後の磁性粒子を洗浄する場合には、反応溶液から磁性粒子を磁力により分離し、磁性粒子以外の溶液を除去し、磁性粒子が残った反応容器に洗浄液を添加し、磁性粒子を洗浄する。工程(3)と同時に磁性粒子を洗浄する場合には、反応容器に洗浄液を添加すると同時に、反応容器から、磁性粒子以外の溶液を除去し、磁性粒子を洗浄する。反応後の磁性粒子の洗浄に用いられる洗浄液は、本発明の測定を可能とする洗浄液であれば特に制限はなく、例えば前述の洗浄液等が挙げられる。
【0026】
次いで、工程(4)において、工程(3)により分離された磁性粒子上の第2抗体若しくはそのフラグメントの量を以下の方法を用いて測定することにより、試料中のsIL−2R濃度が決定される。
【0027】
(1)第2抗体若しくはそのフラグメントが標識化されていない場合
第2抗体若しくはそのフラグメントに結合する第3抗体若しくはそのフラグメントに標識が結合した標識化第3抗体若しくはそのフラグメントを、磁性粒子(第1抗体若しくはそのフラグメント、sIL−2R、及び、第2抗体若しくはそのフラグメントからなる免疫複合体が固定化されている磁性粒子)上の、第2抗体若しくはそのフラグメントと反応させて、磁性粒子上に、第1抗体若しくはそのフラグメント、sIL−2R、第2抗体若しくはそのフラグメント、及び、第3抗体若しくはそのフラグメントからなる免疫複合体を形成させ、該免疫複合体中の標識を後述の方法により測定することにより、分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定することができる。第2抗体若しくはそのフラグメントに結合する第3抗体若しくはそのフラグメントとしては、例えば第2抗体のFc領域に結合する抗体若しくはそのフラグメント等が挙げられる。
【0028】
(2)第2抗体若しくはそのフラグメントが標識化されている場合
磁性粒子上に形成された免疫複合体(第1抗体若しくはそのフラグメント、sIL−2R、及び、標識化第2抗体若しくはそのフラグメントからなる免疫複合体)中の標識を測定することにより、分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定することができる。標識としては、例えば酵素、蛍光物質、発光物質等が挙げられる。
【0029】
・標識として酵素を用いる場合
酵素としては、例えばアルカリホスファターゼ、ペルオキシダーゼ、β−D−ガラクトシダーゼ、β−グルクロニダーゼ、ルシフェラーゼ等が挙げられ、アルカリホスファターゼが好ましい。免疫複合体中の酵素の酵素活性を測定することによって、免疫複合体中の第2抗体若しくはそのフラグメントを測定することができる。免疫複合体中の酵素の酵素活性は、例えば酵素の基質を当該酵素と反応させ、生成した物質を測定することにより測定することができる。
【0030】
アルカリホスファターゼ活性の測定方法としては、例えばアルカリホスファターゼをその基質と反応させ、生成した発光の発光強度を発光強度計等で測定する方法等が挙げられる。アルカリホスファターゼの基質としては、例えば3−(2'−スピロアダマンタン)−4−メトキシ−4−(3'−ホスホリルオキシ)フェニル−1,2−ジオキセタン・二ナトリウム塩(AMPPD)、2−クロロ−5−{4−メトキシスピロ[1,2−ジオキセタン−3,2'−(5'−クロロ)トリシクロ[3.3.1.13,7]カン]−4−イル}フェニルホスフェート・二ナトリウム塩(CDP−StarTM)、3−{4−メトキシスピロ[1,2−ジオキセタン−3,2'−(5'−クロロ)トリシクロ[3.3.1.13,7]デカン]−4−イル}フェニルホスフェート・二ナトリウム塩(CSPDTM)、[10−メチル−9(10H)−アクリジニルイデン]フェノキシメチルリン酸・二ナトリウム塩(LumigenTM APS−5)、9−(4−クロロフェニルチオホスホリルオキシメチリデン)−10−メチルアクリダン・二ナトリウム塩等が挙げられる。
【0031】
ペルオキシダーゼ活性の測定方法としては、例えば次の方法等が挙げられる。
(i)ペルオキシダーゼを、その基質である過酸化水素、及び、蛍光物質(例えば、4−ヒドロキシフェニル酢酸、3−(4−ヒドロキシフェニル)プロピオン酸、クマリン等)と反応させ、生成した蛍光の強度を蛍光光度計等で測定する方法。
(ii)ペルオキシダーゼを、その基質である過酸化水素、及び、発光物質(例えば、ルミノール化合物、ルシゲニン化合物等)と反応させ、生成した発光の強度を発光光度計等で測定する方法。
【0032】
β−D−ガラクトシダーゼ活性の測定方法としては、例えばβ−D−ガラクトシダーゼをその基質と反応させ、生成物の蛍光強度、発光強度等を測定する方法等が挙げられる。生成物の蛍光強度は、蛍光光度計等で測定することができる。生成物の発光強度は、発光強度計等で測定することができる。β−D−ガラクトシダーゼの基質としては、例えば4−メチルウンベリフェリル−β−D−ガラクトピラノシド、ガラクトン−プラス[Galacton-Plus、アプライドバイオシステムズ(Applied Biosystems)社製]又はその類似化合物等が挙げられる。
【0033】
β−グルクロニダーゼ活性の測定方法としては、例えばβ−グルクロニダーゼをその基質と反応させ、生成物の蛍光強度等を測定する方法等が挙げられる。生成物の蛍光強度は、蛍光光度計等で測定することができる。β−グルクロニダーゼの基質としては、例えばTokyoGreenTM−βGluU(積水メディカル社製)等が挙げられる。
【0034】
ルシフェラーゼ活性の測定方法としては、例えば例えばルシフェラーゼをその基質と反応させ、生成物の発光強度等を測定する方法等が挙げられる。生成物の発光強度は、発光光度計等で測定することができる。ルシフェラーゼの基質としては、例えばルシフェリン、セレンテラジン等が挙げられる。
【0035】
・標識として蛍光物質を用いる場合
蛍光物質としては、例えばFITC(フルオレッセイン イソチオシアナート)、RITC(ローダミンB−イソチオシアナート)、quantum dot(Science, 281, 2016-2018, 1998)、フィコエリスリン等のフィコビリ蛋白質、GFP(Green fluorescent Protein)、RFP(Red fluorescent Protein)、YFP(Yellow fluorescent Protein)、BFP(Blue fluorescent Protein)等が挙げられる。免疫複合体中の蛍光物質の蛍光強度を測定することによって、免疫複合体中の第2抗体若しくはそのフラグメントを測定することができる。
【0036】
・標識として発光物質を用いる場合
発光物質としては、例えばアクリジニウムおよびその誘導体、ルテニウム錯体化合物、ロフィン等が挙げられる。免疫複合体中の発光物質の発光強度を測定することによって、免疫複合体中の第2抗体若しくはそのフラグメントを測定することができる。
【0037】
上記(1)及び(2)のいずれの場合にも、標識が予め第2抗体に直接結合しているか、間接的に結合しているかに関わらず、分離された磁性粒子上の第2抗体若しくはそのフラグメントの量は、標識の量に置換されて測定される。
【0038】
測定された、第2抗体若しくはそのフラグメントの量からの、検体として用いた試料中のsIL−2R濃度の決定は、次の様な方法で行うことができる。すなわち、既知濃度のsIL−2Rを用いて測定を行い、sIL−2Rの濃度と測定値(標識由来の情報量)との関係を表す検量線を作成し、次いで、実際の検体である試料を用いて測定を行い、得られた測定値を予め作成した検量線に照らし合わせて、検体として用いた試料中のsIL−2R濃度を決定する。
【0039】
尚、工程(1)、工程(2)のいずれか、又は、両方の工程において、塩類を共存させてもよい。また、工程(1)、工程(2)のいずれか、又は、両方の工程において、ポリオキシエチレングリコール誘導体を共存させてもよい。更に、工程(1)、工程(2)のいずれか、又は、両方の工程において、塩類とポリオキシエチレングリコールの両方を共存させてもよい。
【0040】
塩類としては、本発明のsIL−2Rの測定を可能とする塩類であれば特に制限はなく、例えば塩化リチウム、塩化ナトリウム、塩化カリウム、塩化カルシウム、塩化マグネシウム、塩化アンモニウム、臭化リチウム、臭化ナトリウム、臭化カリウム、臭化カルシウム、臭化マグネシウム、臭化アンモニウム等が挙げられ、塩化ナトリウムが好ましい。塩類の反応中の濃度は、本発明の測定方法を可能とする濃度であれば特に制限はなく、例えば40〜400mmol/Lであり、70〜250mmol/Lが好ましい。
【0041】
ポリエチレングリコール誘導体としては、本発明のsIL−2Rの測定を可能とするポリエチレングリコール誘導体であれば特に制限はなく、例えばポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル、ポリオキシエチレンソルビタン脂肪酸エステル等が挙げられるが、ポリエチレングリコールが好ましい。ポリエチレングリコールの平均分子量としては、例えば2,000〜26,000であり、6,000〜20,000が好ましい。ポリエチレングリコールの反応溶液中の濃度は、本発明のsIL−2Rの測定を可能とする濃度であれば特に制限はなく、例えば0.5〜10%(w/v)であり、1〜6%(w/v)が好ましい。
【0042】
ポリオキシエチレンアルキルフェニルエーテルにおけるアルキルとしては、例えばオクチル、ノニル等が挙げられる。ポリオキシエチレンアルキルフェニルエーテルの反応溶液中の濃度は、本発明のsIL−2Rの測定を可能とする濃度であれば特に制限はなく、例えば0.5〜10%(w/v)であり、1〜6%(w/v)が好ましい。ポリオキシエチレンアルキルフェニルエーテルの市販品としては、例えばトリトンX−100、トリトンX−405、トリトンX−705(以上、日本油脂社製)等が挙げられる。
【0043】
ポリオキシエチレンソルビタン脂肪酸エステルとしては、例えばポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノパルミテート等が挙げられ、ポリオキシエチレンソルビタンモノラウレートが好ましい。ポリオキシエチレンソルビタン脂肪酸エステルの反応溶液中の濃度は、本発明のsIL−2Rの測定を可能とする濃度であれば特に制限はなく、例えば0.5〜10%(w/v)であり、1〜6%(w/v)が好ましい。ポリオキシエチレンソルビタン脂肪酸エステルの市販品としては、例えばツイーン20(シグマ社製)等が挙げられる。
【0044】
また、工程(1)及び工程(2)においては、金属イオン、糖類、防腐剤、蛋白質、蛋白質安定化剤等を共存させることができる。金属イオンとしては、例えばマグネシウムイオン、マンガンイオン、亜鉛イオン等が挙げられる。糖類としては、例えばマンニトール、ソルビトール等が挙げられる。防腐剤としては、例えばアジ化ナトリウム、抗生物質(ストレプトマイシン、ペニシリン、ゲンタマイシン等)、バイオエース、プロクリン300、プロキセル(Proxel)GXL等が挙げられる。蛋白質としては、例えばウシ血清アルブミン(BSA)、ウシ胎児血清(FBS)、カゼイン、ブロックエース(大日本製薬社製)等が挙げられる。蛋白質安定化剤としては、例えばペルオキシダーゼ安定化緩衝液[Peroxidase Stabilizing Buffer、ダコサイトメーション(DakoCytomation)社製]等が挙げられる。
【0045】
(試料)
本発明における試料としては、本発明のsIL−2Rの測定を可能とする試料であれば特に制限はなく、例えば全血、血漿、血清、髄液、唾液、羊水、尿、汗、膵液等が挙げられるが、全血、血漿、血清等が好ましい。
【0046】
(水性媒体)
本発明において使用される水性媒体としては、本発明のsIL−2Rの測定を可能とする水性媒体であれば特に制限はなく、例えば脱イオン水、蒸留水、緩衝液等があげられ、緩衝液が好ましい。緩衝液の調製に使用される緩衝剤としては、緩衝能を有するものならば特に限定されないが、pH1〜11の例えば乳酸緩衝剤、クエン酸緩衝剤、酢酸緩衝剤、コハク酸緩衝剤、フタル酸緩衝剤、リン酸緩衝剤、トリエタノールアミン緩衝剤、ジエタノールアミン緩衝剤、リジン緩衝剤、バルビツール緩衝剤、イミダゾール緩衝剤、リンゴ酸緩衝剤、シュウ酸緩衝剤、グリシン緩衝剤、ホウ酸緩衝剤、炭酸緩衝剤、グリシン緩衝剤、グッド緩衝剤等があげられる。
【0047】
グッド緩衝剤としては、例えば2−モルホリノエタンスルホン酸(MES)緩衝剤、ビス(2−ヒドロキシエチル)イミノトリス(ヒドロキシメチル)メタン(Bis−Tris)緩衝剤、トリス(ヒドロキシメチル)アミノメタン(Tris)緩衝剤、N−(2−アセトアミド)イミノ二酢酸(ADA)緩衝剤、ピペラジン−N,N’−ビス(2−エタンスルホン酸)(PIPES)緩衝剤、2−[N−(2−アセトアミド)アミノ]エタンスルホン酸(ACES)緩衝剤、3−モルホリノ−2−ヒドロキシプロパンスルホン酸(MOPSO)緩衝剤、2−[N,N−ビス(2−ヒドロキシエチル)アミノ]エタンスルホン酸(BES)緩衝剤、3−モルホリノプロパンスルホン酸(MOPS)緩衝剤、2−{N−[トリス(ヒドロキシメチル)メチル]アミノ}エタンスルホン酸(TES)緩衝剤、N−(2−ヒドロキシエチル)−N’−(2−スルホエチル)ピペラジン(HEPES)緩衝剤、3−[N,N−ビス(2−ヒドロキシエチル)アミノ]−2−ヒドロキシプロパンスルホン酸(DIPSO)緩衝剤、2−ヒドロキシ−3−{[N−トリス(ヒドロキシメチル)メチル]アミノ}プロパンスルホン酸(TAPSO)緩衝剤、ピペラジン−N,N’−ビス(2−ヒドロキシプロパン−3−スルホン酸)(POPSO)緩衝剤、N−(2−ヒドロキシエチル)−N’−(2−ヒドロキシ−3−スルホプロピル)ピペラジン(HEPPSO)緩衝剤、N−(2−ヒドロキシエチル)−N’−(3−スルホプロピル)ピペラジン(EPPS)緩衝剤、[N−トリス(ヒドロキシメチル)メチルグリシン](Tricine)緩衝剤、[N,N−ビス(2−ヒドロキシエチル)グリシン](Bicine)緩衝剤、3−[N−トリス(ヒドロキシメチル)メチル]アミノプロパンスルホン酸(TAPS)緩衝剤、2−(N−シクロヘキシルアミノ)エタンスルホン酸(CHES)緩衝剤、3−(N−シクロヘキシルアミノ)−2−ヒドロキシプロパンスルホン酸(CAPSO)緩衝剤、3−(N−シクロヘキシルアミノ)プロパンスルホン酸(CAPS)緩衝剤等が挙げられる。
【0048】
(磁性粒子)
本発明における磁性粒子としては、本発明のsIL−2Rの測定を可能とする磁性粒子であれば特に限定はなく、例えばフェライトで被覆したラテックス、フェライトで被覆したポリマー粒子等が挙げられる。また、抗体の結合を容易にするために、ビオチンと結合する性質を有するアビジン、ニュートラアビジン又はストレプトアビジンを表面に固定化した磁性粒子も使用することができる。磁性粒子の粒径は、特に限定されないが、例えば1μm〜6μmであり、好ましくは1μm〜3μmである。本発明における磁性粒子としては、市販の磁性粒子を用いることができる。市販の磁性粒子としては、例えばDynabeads MyOne Streptavidin T1(ダイナル社製)、Estapor(メルク社製)、 Sera-Mag Magnetic Streptavidin Particles(サーモサイエンティフィック社製)、MAGNOTEX-SA(JSR社製)等が挙げられる。
【0049】
(抗体)
本発明におけるsIL−2Rに結合する抗体(第1抗体及び第2抗体)は、本発明のsIL−2Rの測定を可能とする抗体であれば特に制限はなく、ポリクローナル抗体、モノクローナル抗体のいずれも使用できるが、モノクローナル抗体が好ましい。また、本発明においては、全長の抗体のみならず、抗体フラグメントを用いることもできる。抗体フラグメントとしては、例えば、抗体をパパイン処理により得られるFab、ペプシン処理により得られるF(ab')2、ペプシン処理−還元処理により得られるFab'等のFc部分を除去した抗体フラグメント等が挙げられる。磁性粒子として、アビジン、ニュートラアビジン又はストレプトアビジンがその表面に固定化された磁性粒子を用いる場合には、第1抗体にビオチンが結合したビオチン結合第1抗体を用いる。
【0050】
本発明において使用される第1抗体と第2抗体は共に、sIL−2Rに結合する。それぞれの抗体が認識するsIL−2Rの部位は同じであっても、異なっていてもよいが、異なっていることが好ましい。
【0051】
本発明において使用される抗体は、sIL−2Rそのもの、又は、sIL−2R中のエピトープに相当するペプチドを抗原として用いて通常の方法により取得することができるが、市販品としても入手可能である。sIL−2Rに結合する抗体としては、例えばモノクローナル抗体AM92.3(ピアース社製)、モノクローナル抗体7G7/B6(ピアース社製)等が挙げられる。
【0052】
また、本発明のsIL−2Rの測定方法及び測定用試薬において、sIL−2Rに結合する抗体の代わりに、sIL−2Rに結合するアプタマー等の、抗体以外の物質を用いることもできる。
【0053】
(測定用試薬)
本発明の試料中のsIL−2R測定用試薬は、本発明の試料中のsIL−2Rの測定方法に使用され得る。本発明の測定用試薬は、磁性粒子、sIL−2Rに結合する第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有する。sIL−2Rに結合する第1抗体若しくはそのフラグメントは、磁性粒子に固定化されていても、固定化されていなくてもよい。
【0054】
sIL−2Rに結合する第1抗体若しくはそのフラグメントが磁性粒子に固定化されている場合、本発明の測定用試薬は、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有する。
【0055】
sIL−2Rに結合する第1抗体若しくはそのフラグメントが磁性粒子に固定化されていない場合、本発明の測定用試薬は、相互作用する2つの親和性物質のうちの片方が固定化された磁性粒子、相互作用する2つの親和性物質のうちのもう一方が結合した第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有する。相互作用する2つの親和性物質の組み合わせとしては、例えばアビジン、ストレプトアビジン、ニュートラアビジン等のアビジン類と、ビオチンとの組み合わせ等が挙げられる。本発明の測定用試薬の1態様としては、例えばアビジン類が固定化された磁性粒子、sIL−2Rに結合する第1抗体若しくはそのフラグメントにビオチンが結合したビオチン結合第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有する測定用試薬が挙げられる。
【0056】
本発明の測定用試薬には、塩類、ポリエチレングリコール誘導体のいずれか又は両方が含まれていてよい。本発明の測定用試薬に使用される塩類、ポリエチレングリコール誘導体としては、例えば前述の塩類、ポリエチレングリコール誘導体が挙げられる。
【0057】
本発明の測定用試薬の形状は、本発明の測定方法を可能とする形状であれば特に制限はなく、例えば液状や凍結乾燥状態等の形状が挙げられる。凍結乾燥状態の試薬を使用する場合には、測定前に前述の水性媒体等で溶解して測定に供される。また、本発明の測定用試薬は、キットの形態で保存、流通されてもよい。キットとしては、2試薬系、3試薬系等の形態が挙げられるが、キットを構成する各試薬中の構成要素は、当業者が適宜選択することができる。
【0058】
本発明の測定用試薬において使用される磁性粒子、sIL−2Rに結合する第1抗体若しくはそのフラグメント、sIL−2Rに結合する第2抗体若しくはそのフラグメント、塩類、ポリオキシエチレングリコール誘導体としては、例えばそれぞれ前述の磁性粒子、sIL−2Rに結合する第1抗体若しくはそのフラグメント、sIL−2Rに結合する第2抗体若しくはそのフラグメント、塩類、ポリオキシエチレングリコール誘導体等が挙げられる。また、本発明の測定用試薬には、必要に応じて、それぞれ前述の水性媒体、標識酵素の基質、金属イオン、糖類、防腐剤、蛋白質、蛋白質安定化剤等を含有させてもよい。
【0059】
以下、実施例により本発明を詳細に説明するが、これらは本発明の範囲を何ら限定するものではない。尚、以下の実施例においては、次のメーカーの試薬類を使用した。
【0060】
BSA(シグマ社製)、塩化ナトリウム(和光純薬工業社製)、分子量20,000のポリオキシエチレングリコール(シグマ社製)、アジ化ナトリウム(和光純薬工業社製)、MES(和光純薬工業社製)、ストレプトアビジン結合磁性粒子(ダイナル社製)、NHS−ビオチン(ピアース社製)、アルカリホスファターゼ(ロシュ・ダイアグノスティックス社製)、イミノチオラン(ピアース社製)、EMCS(マレイミド化試薬;同仁化学研究所社製)、MOPS(和光純薬工業社製)、Tween20(シグマ社製)、発光基質液(ルミジェン社製)。
【実施例1】
【0061】
(1)材料及び測定方法
(測定対象試料)
健常人より得た血清(sIL−2R濃度が390U/mLの血清)をPBS[リン酸緩衝化生理食塩水(0.15mol/L 塩化ナトリウムを含有する10mmol/L リン酸緩衝液、pH7.2)]にて10倍、20倍、40倍、80倍、160倍に希釈したもの、及びPBSそのものを測定対象試料に用いた。
【0062】
(磁性粒子懸濁液)
磁性粒子として、ストレプトアビジンが結合した市販の磁性粒子(Dynabeads MyOne Streptavidin T1ダイナル社製)を用いて、以下の組成からなる磁性粒子懸濁液を調製した。
【0063】
MES(pH7.0) 50mmol/L
ストレプトアビジン結合磁性粒子 0.75mg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
ポリエチレングリコール(分子量20,000) 4%
【0064】
(ビオチン結合抗sIL−2R抗体とビオチン結合抗sIL−2R抗体溶液)
第1抗体として、抗sIL−2Rモノクローナル抗体AM92.3(ピアース社製)を用いて、当該抗体とNHS−ビオチンとを混合し、37℃で1時間反応させ、反応後の混合物をセファデックスG−25カラム(アマシャム・バイオサイエンス社製)に供して未反応のNHS−ビオチンを除去し、ビオチン結合抗sIL−2Rモノクローナル抗体を調製した。得られたビオチン結合抗sIL−2Rモノクローナル抗体を用いて、以下の組成からなるビオチン結合抗sIL−2R抗体溶液を調製した。
【0065】
MES(pH7.0) 50mmol/L
抗sIL−2Rモノクローナル抗体 1.2μg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
ポリエチレングリコール(分子量20,000) 4%
【0066】
(アルカリホスファターゼ標識抗sIL−2R抗体とアルカリホスファターゼ標識抗sIL−2R抗体溶液)
第2抗体フラグメントとして、抗sIL−2Rモノクローナル抗体7G7/B6(ピアース社製)をペプシンで消化した後、移動相として0.1mol/Lリン酸緩衝液(pH7.4)を用いてG3000SWカラム(東ソー社製;口径:21.5mm;長さ:60cm)を用いたHPLCシステム(日立製作所社製)でF(ab’)2を分離した。得られたF(ab’)2とアルカリホスファターゼとを以下の手順により、マレイミド法によって結合させた。
【0067】
イミノチオランを用いて、該F(ab’)2をスルフヒドリル化し、反応混合物をセファデックスG−25カラム(アマシャム・バイオサイエンス社製)に供して未反応のイミノチオランを除去し、スルフヒドリル化F(ab’)2を得た。
一方、マレイミド化試薬EMCSを用いて、アルカリホスファターゼをマレイミド化し、反応混合物をセファデックスG−25カラム(アマシャム・バイオサイエンス社製)に供して未反応のEMSCを除去し、マレイミド化アルカリホスファターゼを得た。
【0068】
調製したスルフヒドリル化F(ab’)2とマレイミド化アルカリホスファターゼとを混合し、アルカリホスファターゼ標識F(ab’)2を作製した。得られたアルカリホスファターゼ標識F(ab’)2を用いて、以下の組成からなるアルカリホスファターゼ標識抗sIL−2R抗体溶液を調製した。
【0069】
MES(pH7.0) 50mmol/L
アルカリホスファターゼ標識F(ab’)2 1.2μg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
ポリエチレングリコール(分子量20,000) 4%
【0070】
(2)試料中のsIL−2Rの測定
上記(1)で調製した測定対象試料10μLに、(1)で調製した磁性粒子懸濁液、ビオチン結合抗sIL−2R抗体溶液、及び、アルカリホスファターゼ標識抗sIL−2R抗体溶液を各30μL加えて攪拌し、37℃で20分間反応させた。磁性粒子を磁力で集めて、磁性粒子以外の反応溶液を除去すると共に、洗浄液[0.1%ツイーン20を含有する50mmol/L MOPS緩衝液(pH7.0)]で磁性粒子を5回洗浄した。その後、9−(4−クロロフェニルチオホスホリルオキシメチリデン)−10−メチルアクリダン・二ナトリウム塩を主成分とする発光基質液を100μL加えて攪拌し、生じた発光量(RLU)を測定した。測定結果を図1に示す。
【0071】
測定系として測定可能な最小濃度を規定する方法として、平均値と標準偏差を用いて統計学的に評価する方法がある。具体的には、0U/mL試料を5重測定した際の平均値+2倍の標準偏差(+2SD)よりも、(1)で調製した試料を5重測定した際の平均値−2倍の標準偏差(−2SD)が高いRLUとなれば、その試料を検出できる濃度として規定できる。
【0072】
sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDは83RLU(図1の破線)であった。sIL−2R濃度が2.4U/mLである試料を測定した際の発光量の平均−2SDは80RLUであり、sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDよりも低い値であったことから、2.4U/mLのsIL−2Rは測定できないことを確認した。一方、sIL−2R濃度が5U/mLである試料を測定した際の発光量の平均−2SDは122RLUであり、0U/mL試料を測定した際の発光量の平均+2SDよりも高い値であったことから、5U/mLのsIL−2Rを測定できることを確認した。また、図1に示したように、sIL−2Rが5U/mL以上の濃度では濃度依存的な吸光度の増加が見られた。
【0073】
以上の結果から、磁性粒子を用いる本発明の測定方法において、最小測定感度は5U/mLであった。
【実施例2】
【0074】
以下の測定対象試料、並びに、以下の組成からなる磁性粒子懸濁液、ビオチン結合抗sIL−2R抗体溶液、及び、アルカリホスファターゼ標識抗sIL−2R抗体溶液を用いる以外は実施例1と同様の方法により、sIL−2R測定における最小測定感度を検証した。
【0075】
(測定対象試料)
健常人より得た血清(sIL−2R濃度が390U/mLの血清)をPBS[リン酸緩衝化生理食塩水(0.15mol/L 塩化ナトリウムを含有する10mmol/L リン酸緩衝液、pH7.2)]にて10倍、20倍、40倍、80倍に希釈したもの、及び、PBSそのものを測定対象試料に用いた。
【0076】
(磁性粒子懸濁液)
MES(pH6.5) 50mmol/L
ストレプトアビジン結合磁性粒子 0.2mg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
【0077】
(ビオチン結合抗sIL−2R抗体溶液)
MES(pH6.5) 50mmol/L
抗sIL−2Rモノクローナル抗体 3μg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
【0078】
(アルカリホスファターゼ標識抗sIL−2R抗体溶液)
MES(pH7.0) 50mmol/L
アルカリホスファターゼ標識F(ab’)2 1.2μg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
【0079】
sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDは317RLU(図2の破線)であった。sIL−2R濃度が5U/mLである試料を測定した際の発光量の平均−2SDは327RLUであり、sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDよりも高い値であったことから、5U/mLのsIL−2Rを測定できることを確認した。また、図2に示したように、sIL−2Rが5U/mL以上の濃度では濃度依存的な吸光度の増加が見られた。
【0080】
以上の結果から、磁性粒子を用いる本発明の測定方法において、最小測定感度は5U/mLU/mLであった。
【0081】
[比較例]
(1)材料
(測定対象試料)
健常人より得た血清(sIL−2R濃度が390U/mLの血清)を、1%BSAを含むPBS[リン酸緩衝化生理食塩水(0.15mol/L 塩化ナトリウムを含有する10mmol/L リン酸緩衝液、pH7.2)]にて50U/mL、25U/mL、12.5U/mL、6.3U/mLと希釈したもの、及び1%BSAを含むPBS(0U/mL)そのものを測定対象試料に用いた。
【0082】
(抗sIL−2R抗体固相化96穴プレートの作製)
抗sIL−2Rモノクローナル抗体AM92.3(ピアース社製)をPBSで希釈してAM92.3のPBS溶液(10mg/mL)を調製し、96穴マイクロタイタープレート[Nunc フルオロヌンクモジュール(サーモフィッシャーサイエンティフィック社)]の各ウェルに100μL添加し、固相化した。その後、ブロッキング液(1%BSA、0.05%Tween20を含有する10mmol/Lリン酸緩衝液)でブロッキングしたものを抗体固相化プレートとした。
【0083】
(アルカリホスファターゼ標識抗sIL−2R抗体溶液)
実施例1で作製したアルカリホスファターゼ標識F(ab’)2を用いて、以下の組成からなるアルカリホスファターゼ標識抗sIL−2R抗体溶液を調製した。
【0084】
MES(pH6.5) 50mmol/L
アルカリホスファターゼ標識F(ab’)2 20ng/mL
BSA 0.2%
【0085】
(2)試料中のsIL−2Rの測定
上記(1)で調製した抗sIL−2R抗体固相化96穴プレートに、(1)で調製した測定対象試料を100μLずつ添加して室温で1時間静置した。洗浄液(150mmol/L塩化ナトリウム、0.05%Tween20を含有する10mmol/Lリン酸緩衝液)で各ウェルを洗浄後、(1)で調製したアルカリホスファターゼ標識抗sIL−2R抗体溶液を100μLずつ加えて攪拌し、室温で1時間静置した。洗浄液で洗浄後、9−(4−クロロフェニルチオホスホリルオキシメチリデン)−10−メチルアクリダン・二ナトリウム塩を主成分とする発光基質液を100μL加えて攪拌し、生じた発光の量を測定した。測定結果を図3に示す。実施例1と同様に、測定系として検出可能な濃度を統計学的に評価した。
【0086】
sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDは153RLUであった。sIL−2R濃度が6.3U/mLである試料を測定した際の発光量の平均−2SDは147RLUであり、0U/mL試料を測定した際の発光量の平均+2SDよりも低い値であったことから、6.3U/mLのsIL−2R濃度は測定できないことを確認した。一方、sIL−2R濃度が12.5U/mLである試料を測定した際の発光量の平均−2SDは211RLUで、sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDよりも高い値であったことから、12.5U/mLのIL−2Rを測定できることを確認した。また、図3に示したように、sIL−2Rが12.5U/mL以上の濃度では、濃度依存的な吸光度の増加が見られた。
【0087】
以上の結果より、プレート法におけるsIL−2Rの最小測定感度は12.5U/mLであった。実施例1及び2より、磁性粒子を用いる測定においては、最小測定感度は5U/mLであることから、磁性粒子を用いる本発明の方法はプレート法よりも高感度にsIL−2Rを測定でき、sIL−2R濃度が5U/mLである試料においても、試料を濃縮することなく、sIL−2Rを測定できることが明らかとなった。
【産業上の利用可能性】
【0088】
本発明により、骨髄移植後の処置判断等に有効な、試料中のsIL−2Rの簡便で、かつ、高感度な測定方法、及び、測定用試薬が提供される。
【技術分野】
【0001】
本発明は、可溶性インターロイキン−2受容体の測定方法、及び、可溶性インターロイキン−2受容体の測定用試薬に関する。
【背景技術】
【0002】
インターロイキン−2受容体(以下、IL−2Rと記す)はα鎖、β鎖、γ鎖から構成されているが、α鎖の一部が細胞上から遊離した可溶性インターロイキン−2受容体(以下、sIL−2Rと記す)が血中に存在することが知られている(特許文献1、非特許文献1参照)。sIL−2Rは活性化T細胞、B細胞によって産生されるために、生体の免疫防御機構の活性化、T細胞系及びB細胞系などの活性化に伴い血中のsIL−2Rが上昇することが報告されている。血清中のsIL−2R濃度は、慢性関節リウマチ、全身性エリテマトーデス(SLE)などの自己免疫疾患や、ウイルス性肝炎、後天性免疫不全症候群(AIDS)などのウイルス感染症の患者で高値を示し、体内の活性化リンパ球量の指標の1つとなることが報告されている(非特許文献2参照)。また腫瘍細胞がsIL−2Rを産生し、成人T細胞白血病(ATL)や非ホジキンリンパ腫の進行と血清中のsIL−2R濃度の変動が良く相関することが知られている(非特許文献3、非特許文献4参照)。このようにsIL−2Rに関して、様々な免疫系の疾患や病態との関連が報告されており、なかでも造血疾患の有望な血液中のマーカーと認識されている。血清中のsIL−2R濃度は成人T細胞白血病においては病態モニタリングの指標など、非ホジキンリンパ腫においては治療効果の判定、寛解後のモニタリング、再発の早期発見の指標などとして臨床的に有効活用されている。
【0003】
白血病、ATL、非ホジキンリンパ腫等の血液疾患の有効な治療法の1つに、造血幹細胞移植がある。造血幹細胞移植を行う前には、患者の生体内に残存する腫瘍細胞を根絶させ、かつ、移植されたドナーの幹細胞が拒絶されないように患者の免疫担当細胞を根絶させる必要があるため、前処置として大量の抗がん剤投与や放射線照射を行う。造血幹細胞移植後の問題として、患者の生体内の腫瘍細胞が残存していたことによる再発、患者の免疫担当細胞が残存しドナーの幹細胞を攻撃する拒絶反応、移植されたドナーの幹細胞が患者組織を攻撃する移植片対宿反応病(GVHD)がある。再発、拒絶反応及びGVHDが起こる際に、血清中のsIL−2Rが上昇することが知られている。造血幹細胞移植後の患者は生命の危険に晒されており、患者の生命の危険を回避するためには、患者への迅速な処置が必要である。そのためには、造血幹細胞移植後のsIL−2Rの微量の変化を的確に捉えることができる高感度なsIL−2Rの測定方法が必要である。
【0004】
血清又は血漿中のsIL−2R定量用試薬としては、「セルフリーIL−2Rメデックス」(協和メデックス社製)、「シーメンス・イムライズIL−2R II」(シーメンス社製)等があり、臨床の現場で使用されている。これらの試薬を用いて血清又は血漿等の試料中に微量に存在するsIL−2Rを測定するには、試料をそのまま用いた測定は測定感度の観点から困難であり、試料の濃縮操作を行わなければならない。従って、簡便で、かつ、高感度な試料中のsIL−2Rの測定方法の開発が望まれていた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開昭62−70761号公報
【非特許文献】
【0006】
【非特許文献1】The Journal of Immunology, vol.135, No.5, p.3172〜3177 (1985).
【非特許文献2】Clinical immunology and immunopathology, vol.50, No.3, p.321〜332 (1989).
【非特許文献3】臨床病理,vol.42, No.8, p.834-842 (1994).
【非特許文献4】臨床検査,vol.35, No.1, p.87-91 (1991).
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、簡便で、かつ、高感度な試料中のsIL−2Rの測定方法及び測定用試薬を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決すべく鋭意検討した結果、磁性粒子を担体として用いるサンドイッチ法により、試料の濃縮操作を行うことなく、高感度にsIL−2Rを測定できることを見出し、本発明を完成した。すなわち、本発明は、以下の[1]〜[9]に関する。
【0009】
[1] 試料中のsIL−2Rの測定方法であって、以下の工程を含むことを特徴とする方法。
(1)試料を濃縮することなく、試料中のsIL−2Rを、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応させる工程;
(2)sIL−2Rに結合する第2抗体若しくはそのフラグメントを、水性媒体中で、工程(1)で生成したsIL−2Rに結合する第1抗体若しくはそのフラグメントとsIL−2Rの免疫複合体が固定化された磁性粒子と反応させる工程;
(3)工程(2)後の反応混合物中の磁性粒子を磁力により集めて、磁力により集められた磁性粒子とそれ以外の反応溶液とを分離する工程;及び、
(4)工程(3)で分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定する工程。
[2] 工程(1)と工程(2)とが同時に行われる、[1]記載の方法。
[3] 工程(1)及び/又は工程(2)が、塩類共存下に行われる[1]又は[2]記載の方法。
[4] 工程(1)及び/又は工程(2)が、ポリエチレングリコール誘導体共存下に行われる[1]〜[3]のいずれかに記載の方法。
[5] ポリエチレングリコール誘導体が、ポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル又はポリオキシエチレンソルビタン脂肪酸エステルである[4]記載の方法。
【0010】
[6] 磁性粒子、可溶性インターロイキン−2受容体(以下、sIL−2Rと記す)に結合する第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有することを特徴とする、試料中のsIL−2R測定用試薬。
[7] さらに塩類を含有することを特徴とする、[6]記載の試薬。
[8] さらにポリエチレングリコール誘導体を含有することを特徴とする、[6]又は[7]記載の試薬。
[9] ポリエチレングリコール誘導体が、ポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル又はポリオキシエチレンソルビタン脂肪酸エステルである[8]記載の試薬。
【発明の効果】
【0011】
本発明により、簡便で、かつ、高感度な試料中のsIL−2Rの測定方法及び測定用試薬が提供される。
【図面の簡単な説明】
【0012】
【図1】実施例1のsIL−2Rの測定方法による試料中のsIL−2Rの測定の結果を表すグラフであり、試料中のsIL−2R濃度と発光量との関係を表すグラフである。破線は、ブランク+2SDの発光量を表す。
【図2】実施例2のsIL−2Rの測定方法による試料中のsIL−2Rの測定の結果を表すグラフであり、試料中のsIL−2R濃度と発光量との関係を表すグラフである。破線は、ブランク+2SDの発光量を表す。
【図3】プレートを使用する比較例のsIL−2Rの測定方法による試料中のsIL−2Rの測定の結果を表すグラフであり、試料中のsIL−2R濃度と発光量との関係を表すグラフである。破線は、ブランク+2SDの発光量を表す。
【発明を実施するための形態】
【0013】
(測定方法)
本発明の試料中のsIL−2Rの測定方法は、磁性粒子を担体として用いる、サンドイッチ法による試料中のsIL−2Rの免疫測定法であり、試料を濃縮することなく測定に供するものである。
【0014】
本発明のsIL−2Rの測定方法は、以下の工程を含むことを特徴とする方法である。
(1)試料を濃縮することなく、試料中のsIL−2Rを、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応させる工程;
(2)sIL−2Rに結合する第2抗体若しくはそのフラグメントを、水性媒体中で、工程(1)で生成したsIL−2Rに結合する第1抗体若しくはそのフラグメントとsIL−2Rの免疫複合体が固定化された磁性粒子と反応させる工程;
(3)工程(2)後の反応混合物中の磁性粒子を磁力により集めて、磁力により集められた磁性粒子とそれ以外の反応溶液とを分離する工程;及び、
(4)工程(3)で分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定する工程。
【0015】
上記(1)の工程において、試料中のsIL−2Rは、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応する。sIL−2Rに結合する第1抗体若しくはそのフラグメントは予め磁性粒子に固定化されていてもよいが、反応の過程でsIL−2Rに結合する第1抗体若しくはそのフラグメントを磁性粒子に固定化されてもよい。
【0016】
sIL−2Rに結合する第1抗体若しくはそのフラグメントの磁性粒子への固定は、物理吸着による固定、リンカーを介する固定、アビジン類(アビジン、ストレプトアビジン、ニュートラアビジン等)−ビオチン等の2つの親和性物質間の相互作用を利用した固定等が挙げられる。
【0017】
反応の過程でsIL−2Rに結合する第1抗体若しくはそのフラグメントを磁性粒子に固定化させる方法としては、例えばアビジン類が固定化された磁性粒子と、sIL−2Rに結合する第1抗体若しくはそのフラグメントにビオチンが結合したビオチン結合第1抗体若しくはそのフラグメントとを反応させて、sIL−2Rに結合する第1抗体若しくはそのフラグメントを磁性粒子に固定化させる方法、ビオチンが固定化された磁性粒子と、sIL−2Rに結合する第1抗体若しくはそのフラグメントにアビジン類が結合したアビジン類結合第1抗体若しくはそのフラグメントとを反応させて、sIL−2Rに結合する第1抗体若しくはそのフラグメントを磁性粒子に固定化させる方法等が挙げられる。
【0018】
反応溶液中の磁性粒子の濃度は、本発明のsIL−2Rの測定を可能とする濃度であれば特に限定はなく、通常、0.1〜10mg/mLである。反応温度は、本発明のsIL−2Rの測定を可能とする温度であれば特に限定はなく、通常、0〜50℃であり、4〜45℃が好ましく、20〜40℃が特に好ましい。反応時間は、本発明のsIL−2Rの測定を可能とする時間であれば特に限定はなく、通常、5分間〜1時間であり、5〜20分間が好ましい。
【0019】
工程(1)において、磁性粒子上に、sIL−2Rに結合する第1抗体若しくはそのフラグメントと、sIL−2Rとからなる免疫複合体が形成される。
【0020】
磁性粒子に固定化されるsIL−2Rに結合する第1抗体若しくはそのフラグメントの量は、本発明のsIL−2Rの測定を可能とする量であれば特に制限はなく、通常、0.1〜10mg/mLの磁性粒子の懸濁液に、抗体の重量換算で0.1〜10μg/mLの濃度になるように第1抗体若しくはそのフラグメントを添加し、放置することにより磁性粒子に固定される量である。磁性粒子への第1抗体若しくはそのフラグメントの固定は、例えば磁性粒子懸濁液に、sIL−2Rに結合する第1抗体若しくはそのフラグメントを添加し、37℃で5分間〜1時間反応させることにより行うことができる。
【0021】
次いで、工程(2)において、工程(1)で生成した免疫複合体(磁性粒子に固定化された免疫複合体で、sIL−2Rに結合する第1抗体若しくはそのフラグメントと、sIL−2Rとからなる免疫複合体)と、sIL−2Rに結合する第2抗体若しくはそのフラグメントとが水性媒体中で反応し、磁性粒子上に、sIL−2Rに結合する第1抗体若しくはそのフラグメント、sIL−2R、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントからなる免疫複合体が生成される。
【0022】
工程(1)と工程(2)とは順次行われてよいが、同時に行われてもよい。工程(1)と工程(2)を同時に行う場合には、試料中のsIL−2Rを、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントと反応させる。工程(1)と工程(2)を同時に行う場合も、前述の通り、sIL−2Rに結合する第1抗体若しくはそのフラグメントは予め磁性粒子に固定化されていても、反応の過程で磁性粒子に固定化されてもよく、sIL−2Rに結合する第1抗体若しくはそのフラグメントの磁性粒子への固定は前述の方法で行うことができる。
【0023】
また、工程(1)と工程(2)の間に、磁性粒子の洗浄工程を設定してもよい。工程(1)の反応混合物から、免疫複合体(sIL−2Rに結合する第1抗体若しくはそのフラグメントと、sIL−2Rとからなる免疫複合体)が固定化された磁性粒子を磁力により集め、磁性粒子以外の反応溶液を除去し、磁性粒子が残った反応容器に洗浄液を添加し、磁性粒子を洗浄する。磁性粒子を洗浄した後、磁力により磁性粒子を集めて反応容器に残った洗浄液を除去し、残った磁性粒子を工程(2)に供する。尚、磁性粒子の洗浄において、磁力により集められた磁性粒子以外の反応溶液の除去と、洗浄液の反応容器への添加は同時に行ってもよい。また、洗浄液を工程(1)の反応溶液に添加し、得られる混合物から磁性粒子以外の溶液を除去してもよい。洗浄液としては、本発明のsIL−2Rの測定を可能とする洗浄液であれば特に制限はなく、例えば後述の水性媒体、後述の水性媒体に界面活性剤が添加されてなる水性媒体等が挙げられる。界面活性剤としては、例えばツイーン(Tween)20等の非イオン性界面活性剤等が挙げられる。
【0024】
次いで、工程(3)において、反応後の磁性粒子(sIL−2Rに結合する第1抗体若しくはそのフラグメント、sIL−2R、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントからなる免疫複合体がその上に形成された磁性粒子)は磁力によって集められ、磁力により集められた磁性粒子は、それ以外の溶液と分離される。反応後の磁性粒子を集めるための磁力は、本発明のsIL−2Rの測定を可能とする磁力であれば特に制限はない。磁力により集められた磁性粒子と、それ以外の反応溶液との分離は、本発明のsIL−2Rの測定を可能とする分離であれば特に制限はない。
【0025】
また、本発明のsIL−2Rの測定方法においては、反応後の磁性粒子を洗浄する工程を含んでいてもよい。磁性粒子の洗浄は、工程(3)の後に行うこともできるが、工程(3)と同時に行うこともできる。工程(3)の後に反応後の磁性粒子を洗浄する場合には、反応溶液から磁性粒子を磁力により分離し、磁性粒子以外の溶液を除去し、磁性粒子が残った反応容器に洗浄液を添加し、磁性粒子を洗浄する。工程(3)と同時に磁性粒子を洗浄する場合には、反応容器に洗浄液を添加すると同時に、反応容器から、磁性粒子以外の溶液を除去し、磁性粒子を洗浄する。反応後の磁性粒子の洗浄に用いられる洗浄液は、本発明の測定を可能とする洗浄液であれば特に制限はなく、例えば前述の洗浄液等が挙げられる。
【0026】
次いで、工程(4)において、工程(3)により分離された磁性粒子上の第2抗体若しくはそのフラグメントの量を以下の方法を用いて測定することにより、試料中のsIL−2R濃度が決定される。
【0027】
(1)第2抗体若しくはそのフラグメントが標識化されていない場合
第2抗体若しくはそのフラグメントに結合する第3抗体若しくはそのフラグメントに標識が結合した標識化第3抗体若しくはそのフラグメントを、磁性粒子(第1抗体若しくはそのフラグメント、sIL−2R、及び、第2抗体若しくはそのフラグメントからなる免疫複合体が固定化されている磁性粒子)上の、第2抗体若しくはそのフラグメントと反応させて、磁性粒子上に、第1抗体若しくはそのフラグメント、sIL−2R、第2抗体若しくはそのフラグメント、及び、第3抗体若しくはそのフラグメントからなる免疫複合体を形成させ、該免疫複合体中の標識を後述の方法により測定することにより、分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定することができる。第2抗体若しくはそのフラグメントに結合する第3抗体若しくはそのフラグメントとしては、例えば第2抗体のFc領域に結合する抗体若しくはそのフラグメント等が挙げられる。
【0028】
(2)第2抗体若しくはそのフラグメントが標識化されている場合
磁性粒子上に形成された免疫複合体(第1抗体若しくはそのフラグメント、sIL−2R、及び、標識化第2抗体若しくはそのフラグメントからなる免疫複合体)中の標識を測定することにより、分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定することができる。標識としては、例えば酵素、蛍光物質、発光物質等が挙げられる。
【0029】
・標識として酵素を用いる場合
酵素としては、例えばアルカリホスファターゼ、ペルオキシダーゼ、β−D−ガラクトシダーゼ、β−グルクロニダーゼ、ルシフェラーゼ等が挙げられ、アルカリホスファターゼが好ましい。免疫複合体中の酵素の酵素活性を測定することによって、免疫複合体中の第2抗体若しくはそのフラグメントを測定することができる。免疫複合体中の酵素の酵素活性は、例えば酵素の基質を当該酵素と反応させ、生成した物質を測定することにより測定することができる。
【0030】
アルカリホスファターゼ活性の測定方法としては、例えばアルカリホスファターゼをその基質と反応させ、生成した発光の発光強度を発光強度計等で測定する方法等が挙げられる。アルカリホスファターゼの基質としては、例えば3−(2'−スピロアダマンタン)−4−メトキシ−4−(3'−ホスホリルオキシ)フェニル−1,2−ジオキセタン・二ナトリウム塩(AMPPD)、2−クロロ−5−{4−メトキシスピロ[1,2−ジオキセタン−3,2'−(5'−クロロ)トリシクロ[3.3.1.13,7]カン]−4−イル}フェニルホスフェート・二ナトリウム塩(CDP−StarTM)、3−{4−メトキシスピロ[1,2−ジオキセタン−3,2'−(5'−クロロ)トリシクロ[3.3.1.13,7]デカン]−4−イル}フェニルホスフェート・二ナトリウム塩(CSPDTM)、[10−メチル−9(10H)−アクリジニルイデン]フェノキシメチルリン酸・二ナトリウム塩(LumigenTM APS−5)、9−(4−クロロフェニルチオホスホリルオキシメチリデン)−10−メチルアクリダン・二ナトリウム塩等が挙げられる。
【0031】
ペルオキシダーゼ活性の測定方法としては、例えば次の方法等が挙げられる。
(i)ペルオキシダーゼを、その基質である過酸化水素、及び、蛍光物質(例えば、4−ヒドロキシフェニル酢酸、3−(4−ヒドロキシフェニル)プロピオン酸、クマリン等)と反応させ、生成した蛍光の強度を蛍光光度計等で測定する方法。
(ii)ペルオキシダーゼを、その基質である過酸化水素、及び、発光物質(例えば、ルミノール化合物、ルシゲニン化合物等)と反応させ、生成した発光の強度を発光光度計等で測定する方法。
【0032】
β−D−ガラクトシダーゼ活性の測定方法としては、例えばβ−D−ガラクトシダーゼをその基質と反応させ、生成物の蛍光強度、発光強度等を測定する方法等が挙げられる。生成物の蛍光強度は、蛍光光度計等で測定することができる。生成物の発光強度は、発光強度計等で測定することができる。β−D−ガラクトシダーゼの基質としては、例えば4−メチルウンベリフェリル−β−D−ガラクトピラノシド、ガラクトン−プラス[Galacton-Plus、アプライドバイオシステムズ(Applied Biosystems)社製]又はその類似化合物等が挙げられる。
【0033】
β−グルクロニダーゼ活性の測定方法としては、例えばβ−グルクロニダーゼをその基質と反応させ、生成物の蛍光強度等を測定する方法等が挙げられる。生成物の蛍光強度は、蛍光光度計等で測定することができる。β−グルクロニダーゼの基質としては、例えばTokyoGreenTM−βGluU(積水メディカル社製)等が挙げられる。
【0034】
ルシフェラーゼ活性の測定方法としては、例えば例えばルシフェラーゼをその基質と反応させ、生成物の発光強度等を測定する方法等が挙げられる。生成物の発光強度は、発光光度計等で測定することができる。ルシフェラーゼの基質としては、例えばルシフェリン、セレンテラジン等が挙げられる。
【0035】
・標識として蛍光物質を用いる場合
蛍光物質としては、例えばFITC(フルオレッセイン イソチオシアナート)、RITC(ローダミンB−イソチオシアナート)、quantum dot(Science, 281, 2016-2018, 1998)、フィコエリスリン等のフィコビリ蛋白質、GFP(Green fluorescent Protein)、RFP(Red fluorescent Protein)、YFP(Yellow fluorescent Protein)、BFP(Blue fluorescent Protein)等が挙げられる。免疫複合体中の蛍光物質の蛍光強度を測定することによって、免疫複合体中の第2抗体若しくはそのフラグメントを測定することができる。
【0036】
・標識として発光物質を用いる場合
発光物質としては、例えばアクリジニウムおよびその誘導体、ルテニウム錯体化合物、ロフィン等が挙げられる。免疫複合体中の発光物質の発光強度を測定することによって、免疫複合体中の第2抗体若しくはそのフラグメントを測定することができる。
【0037】
上記(1)及び(2)のいずれの場合にも、標識が予め第2抗体に直接結合しているか、間接的に結合しているかに関わらず、分離された磁性粒子上の第2抗体若しくはそのフラグメントの量は、標識の量に置換されて測定される。
【0038】
測定された、第2抗体若しくはそのフラグメントの量からの、検体として用いた試料中のsIL−2R濃度の決定は、次の様な方法で行うことができる。すなわち、既知濃度のsIL−2Rを用いて測定を行い、sIL−2Rの濃度と測定値(標識由来の情報量)との関係を表す検量線を作成し、次いで、実際の検体である試料を用いて測定を行い、得られた測定値を予め作成した検量線に照らし合わせて、検体として用いた試料中のsIL−2R濃度を決定する。
【0039】
尚、工程(1)、工程(2)のいずれか、又は、両方の工程において、塩類を共存させてもよい。また、工程(1)、工程(2)のいずれか、又は、両方の工程において、ポリオキシエチレングリコール誘導体を共存させてもよい。更に、工程(1)、工程(2)のいずれか、又は、両方の工程において、塩類とポリオキシエチレングリコールの両方を共存させてもよい。
【0040】
塩類としては、本発明のsIL−2Rの測定を可能とする塩類であれば特に制限はなく、例えば塩化リチウム、塩化ナトリウム、塩化カリウム、塩化カルシウム、塩化マグネシウム、塩化アンモニウム、臭化リチウム、臭化ナトリウム、臭化カリウム、臭化カルシウム、臭化マグネシウム、臭化アンモニウム等が挙げられ、塩化ナトリウムが好ましい。塩類の反応中の濃度は、本発明の測定方法を可能とする濃度であれば特に制限はなく、例えば40〜400mmol/Lであり、70〜250mmol/Lが好ましい。
【0041】
ポリエチレングリコール誘導体としては、本発明のsIL−2Rの測定を可能とするポリエチレングリコール誘導体であれば特に制限はなく、例えばポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル、ポリオキシエチレンソルビタン脂肪酸エステル等が挙げられるが、ポリエチレングリコールが好ましい。ポリエチレングリコールの平均分子量としては、例えば2,000〜26,000であり、6,000〜20,000が好ましい。ポリエチレングリコールの反応溶液中の濃度は、本発明のsIL−2Rの測定を可能とする濃度であれば特に制限はなく、例えば0.5〜10%(w/v)であり、1〜6%(w/v)が好ましい。
【0042】
ポリオキシエチレンアルキルフェニルエーテルにおけるアルキルとしては、例えばオクチル、ノニル等が挙げられる。ポリオキシエチレンアルキルフェニルエーテルの反応溶液中の濃度は、本発明のsIL−2Rの測定を可能とする濃度であれば特に制限はなく、例えば0.5〜10%(w/v)であり、1〜6%(w/v)が好ましい。ポリオキシエチレンアルキルフェニルエーテルの市販品としては、例えばトリトンX−100、トリトンX−405、トリトンX−705(以上、日本油脂社製)等が挙げられる。
【0043】
ポリオキシエチレンソルビタン脂肪酸エステルとしては、例えばポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノパルミテート等が挙げられ、ポリオキシエチレンソルビタンモノラウレートが好ましい。ポリオキシエチレンソルビタン脂肪酸エステルの反応溶液中の濃度は、本発明のsIL−2Rの測定を可能とする濃度であれば特に制限はなく、例えば0.5〜10%(w/v)であり、1〜6%(w/v)が好ましい。ポリオキシエチレンソルビタン脂肪酸エステルの市販品としては、例えばツイーン20(シグマ社製)等が挙げられる。
【0044】
また、工程(1)及び工程(2)においては、金属イオン、糖類、防腐剤、蛋白質、蛋白質安定化剤等を共存させることができる。金属イオンとしては、例えばマグネシウムイオン、マンガンイオン、亜鉛イオン等が挙げられる。糖類としては、例えばマンニトール、ソルビトール等が挙げられる。防腐剤としては、例えばアジ化ナトリウム、抗生物質(ストレプトマイシン、ペニシリン、ゲンタマイシン等)、バイオエース、プロクリン300、プロキセル(Proxel)GXL等が挙げられる。蛋白質としては、例えばウシ血清アルブミン(BSA)、ウシ胎児血清(FBS)、カゼイン、ブロックエース(大日本製薬社製)等が挙げられる。蛋白質安定化剤としては、例えばペルオキシダーゼ安定化緩衝液[Peroxidase Stabilizing Buffer、ダコサイトメーション(DakoCytomation)社製]等が挙げられる。
【0045】
(試料)
本発明における試料としては、本発明のsIL−2Rの測定を可能とする試料であれば特に制限はなく、例えば全血、血漿、血清、髄液、唾液、羊水、尿、汗、膵液等が挙げられるが、全血、血漿、血清等が好ましい。
【0046】
(水性媒体)
本発明において使用される水性媒体としては、本発明のsIL−2Rの測定を可能とする水性媒体であれば特に制限はなく、例えば脱イオン水、蒸留水、緩衝液等があげられ、緩衝液が好ましい。緩衝液の調製に使用される緩衝剤としては、緩衝能を有するものならば特に限定されないが、pH1〜11の例えば乳酸緩衝剤、クエン酸緩衝剤、酢酸緩衝剤、コハク酸緩衝剤、フタル酸緩衝剤、リン酸緩衝剤、トリエタノールアミン緩衝剤、ジエタノールアミン緩衝剤、リジン緩衝剤、バルビツール緩衝剤、イミダゾール緩衝剤、リンゴ酸緩衝剤、シュウ酸緩衝剤、グリシン緩衝剤、ホウ酸緩衝剤、炭酸緩衝剤、グリシン緩衝剤、グッド緩衝剤等があげられる。
【0047】
グッド緩衝剤としては、例えば2−モルホリノエタンスルホン酸(MES)緩衝剤、ビス(2−ヒドロキシエチル)イミノトリス(ヒドロキシメチル)メタン(Bis−Tris)緩衝剤、トリス(ヒドロキシメチル)アミノメタン(Tris)緩衝剤、N−(2−アセトアミド)イミノ二酢酸(ADA)緩衝剤、ピペラジン−N,N’−ビス(2−エタンスルホン酸)(PIPES)緩衝剤、2−[N−(2−アセトアミド)アミノ]エタンスルホン酸(ACES)緩衝剤、3−モルホリノ−2−ヒドロキシプロパンスルホン酸(MOPSO)緩衝剤、2−[N,N−ビス(2−ヒドロキシエチル)アミノ]エタンスルホン酸(BES)緩衝剤、3−モルホリノプロパンスルホン酸(MOPS)緩衝剤、2−{N−[トリス(ヒドロキシメチル)メチル]アミノ}エタンスルホン酸(TES)緩衝剤、N−(2−ヒドロキシエチル)−N’−(2−スルホエチル)ピペラジン(HEPES)緩衝剤、3−[N,N−ビス(2−ヒドロキシエチル)アミノ]−2−ヒドロキシプロパンスルホン酸(DIPSO)緩衝剤、2−ヒドロキシ−3−{[N−トリス(ヒドロキシメチル)メチル]アミノ}プロパンスルホン酸(TAPSO)緩衝剤、ピペラジン−N,N’−ビス(2−ヒドロキシプロパン−3−スルホン酸)(POPSO)緩衝剤、N−(2−ヒドロキシエチル)−N’−(2−ヒドロキシ−3−スルホプロピル)ピペラジン(HEPPSO)緩衝剤、N−(2−ヒドロキシエチル)−N’−(3−スルホプロピル)ピペラジン(EPPS)緩衝剤、[N−トリス(ヒドロキシメチル)メチルグリシン](Tricine)緩衝剤、[N,N−ビス(2−ヒドロキシエチル)グリシン](Bicine)緩衝剤、3−[N−トリス(ヒドロキシメチル)メチル]アミノプロパンスルホン酸(TAPS)緩衝剤、2−(N−シクロヘキシルアミノ)エタンスルホン酸(CHES)緩衝剤、3−(N−シクロヘキシルアミノ)−2−ヒドロキシプロパンスルホン酸(CAPSO)緩衝剤、3−(N−シクロヘキシルアミノ)プロパンスルホン酸(CAPS)緩衝剤等が挙げられる。
【0048】
(磁性粒子)
本発明における磁性粒子としては、本発明のsIL−2Rの測定を可能とする磁性粒子であれば特に限定はなく、例えばフェライトで被覆したラテックス、フェライトで被覆したポリマー粒子等が挙げられる。また、抗体の結合を容易にするために、ビオチンと結合する性質を有するアビジン、ニュートラアビジン又はストレプトアビジンを表面に固定化した磁性粒子も使用することができる。磁性粒子の粒径は、特に限定されないが、例えば1μm〜6μmであり、好ましくは1μm〜3μmである。本発明における磁性粒子としては、市販の磁性粒子を用いることができる。市販の磁性粒子としては、例えばDynabeads MyOne Streptavidin T1(ダイナル社製)、Estapor(メルク社製)、 Sera-Mag Magnetic Streptavidin Particles(サーモサイエンティフィック社製)、MAGNOTEX-SA(JSR社製)等が挙げられる。
【0049】
(抗体)
本発明におけるsIL−2Rに結合する抗体(第1抗体及び第2抗体)は、本発明のsIL−2Rの測定を可能とする抗体であれば特に制限はなく、ポリクローナル抗体、モノクローナル抗体のいずれも使用できるが、モノクローナル抗体が好ましい。また、本発明においては、全長の抗体のみならず、抗体フラグメントを用いることもできる。抗体フラグメントとしては、例えば、抗体をパパイン処理により得られるFab、ペプシン処理により得られるF(ab')2、ペプシン処理−還元処理により得られるFab'等のFc部分を除去した抗体フラグメント等が挙げられる。磁性粒子として、アビジン、ニュートラアビジン又はストレプトアビジンがその表面に固定化された磁性粒子を用いる場合には、第1抗体にビオチンが結合したビオチン結合第1抗体を用いる。
【0050】
本発明において使用される第1抗体と第2抗体は共に、sIL−2Rに結合する。それぞれの抗体が認識するsIL−2Rの部位は同じであっても、異なっていてもよいが、異なっていることが好ましい。
【0051】
本発明において使用される抗体は、sIL−2Rそのもの、又は、sIL−2R中のエピトープに相当するペプチドを抗原として用いて通常の方法により取得することができるが、市販品としても入手可能である。sIL−2Rに結合する抗体としては、例えばモノクローナル抗体AM92.3(ピアース社製)、モノクローナル抗体7G7/B6(ピアース社製)等が挙げられる。
【0052】
また、本発明のsIL−2Rの測定方法及び測定用試薬において、sIL−2Rに結合する抗体の代わりに、sIL−2Rに結合するアプタマー等の、抗体以外の物質を用いることもできる。
【0053】
(測定用試薬)
本発明の試料中のsIL−2R測定用試薬は、本発明の試料中のsIL−2Rの測定方法に使用され得る。本発明の測定用試薬は、磁性粒子、sIL−2Rに結合する第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有する。sIL−2Rに結合する第1抗体若しくはそのフラグメントは、磁性粒子に固定化されていても、固定化されていなくてもよい。
【0054】
sIL−2Rに結合する第1抗体若しくはそのフラグメントが磁性粒子に固定化されている場合、本発明の測定用試薬は、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有する。
【0055】
sIL−2Rに結合する第1抗体若しくはそのフラグメントが磁性粒子に固定化されていない場合、本発明の測定用試薬は、相互作用する2つの親和性物質のうちの片方が固定化された磁性粒子、相互作用する2つの親和性物質のうちのもう一方が結合した第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有する。相互作用する2つの親和性物質の組み合わせとしては、例えばアビジン、ストレプトアビジン、ニュートラアビジン等のアビジン類と、ビオチンとの組み合わせ等が挙げられる。本発明の測定用試薬の1態様としては、例えばアビジン類が固定化された磁性粒子、sIL−2Rに結合する第1抗体若しくはそのフラグメントにビオチンが結合したビオチン結合第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有する測定用試薬が挙げられる。
【0056】
本発明の測定用試薬には、塩類、ポリエチレングリコール誘導体のいずれか又は両方が含まれていてよい。本発明の測定用試薬に使用される塩類、ポリエチレングリコール誘導体としては、例えば前述の塩類、ポリエチレングリコール誘導体が挙げられる。
【0057】
本発明の測定用試薬の形状は、本発明の測定方法を可能とする形状であれば特に制限はなく、例えば液状や凍結乾燥状態等の形状が挙げられる。凍結乾燥状態の試薬を使用する場合には、測定前に前述の水性媒体等で溶解して測定に供される。また、本発明の測定用試薬は、キットの形態で保存、流通されてもよい。キットとしては、2試薬系、3試薬系等の形態が挙げられるが、キットを構成する各試薬中の構成要素は、当業者が適宜選択することができる。
【0058】
本発明の測定用試薬において使用される磁性粒子、sIL−2Rに結合する第1抗体若しくはそのフラグメント、sIL−2Rに結合する第2抗体若しくはそのフラグメント、塩類、ポリオキシエチレングリコール誘導体としては、例えばそれぞれ前述の磁性粒子、sIL−2Rに結合する第1抗体若しくはそのフラグメント、sIL−2Rに結合する第2抗体若しくはそのフラグメント、塩類、ポリオキシエチレングリコール誘導体等が挙げられる。また、本発明の測定用試薬には、必要に応じて、それぞれ前述の水性媒体、標識酵素の基質、金属イオン、糖類、防腐剤、蛋白質、蛋白質安定化剤等を含有させてもよい。
【0059】
以下、実施例により本発明を詳細に説明するが、これらは本発明の範囲を何ら限定するものではない。尚、以下の実施例においては、次のメーカーの試薬類を使用した。
【0060】
BSA(シグマ社製)、塩化ナトリウム(和光純薬工業社製)、分子量20,000のポリオキシエチレングリコール(シグマ社製)、アジ化ナトリウム(和光純薬工業社製)、MES(和光純薬工業社製)、ストレプトアビジン結合磁性粒子(ダイナル社製)、NHS−ビオチン(ピアース社製)、アルカリホスファターゼ(ロシュ・ダイアグノスティックス社製)、イミノチオラン(ピアース社製)、EMCS(マレイミド化試薬;同仁化学研究所社製)、MOPS(和光純薬工業社製)、Tween20(シグマ社製)、発光基質液(ルミジェン社製)。
【実施例1】
【0061】
(1)材料及び測定方法
(測定対象試料)
健常人より得た血清(sIL−2R濃度が390U/mLの血清)をPBS[リン酸緩衝化生理食塩水(0.15mol/L 塩化ナトリウムを含有する10mmol/L リン酸緩衝液、pH7.2)]にて10倍、20倍、40倍、80倍、160倍に希釈したもの、及びPBSそのものを測定対象試料に用いた。
【0062】
(磁性粒子懸濁液)
磁性粒子として、ストレプトアビジンが結合した市販の磁性粒子(Dynabeads MyOne Streptavidin T1ダイナル社製)を用いて、以下の組成からなる磁性粒子懸濁液を調製した。
【0063】
MES(pH7.0) 50mmol/L
ストレプトアビジン結合磁性粒子 0.75mg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
ポリエチレングリコール(分子量20,000) 4%
【0064】
(ビオチン結合抗sIL−2R抗体とビオチン結合抗sIL−2R抗体溶液)
第1抗体として、抗sIL−2Rモノクローナル抗体AM92.3(ピアース社製)を用いて、当該抗体とNHS−ビオチンとを混合し、37℃で1時間反応させ、反応後の混合物をセファデックスG−25カラム(アマシャム・バイオサイエンス社製)に供して未反応のNHS−ビオチンを除去し、ビオチン結合抗sIL−2Rモノクローナル抗体を調製した。得られたビオチン結合抗sIL−2Rモノクローナル抗体を用いて、以下の組成からなるビオチン結合抗sIL−2R抗体溶液を調製した。
【0065】
MES(pH7.0) 50mmol/L
抗sIL−2Rモノクローナル抗体 1.2μg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
ポリエチレングリコール(分子量20,000) 4%
【0066】
(アルカリホスファターゼ標識抗sIL−2R抗体とアルカリホスファターゼ標識抗sIL−2R抗体溶液)
第2抗体フラグメントとして、抗sIL−2Rモノクローナル抗体7G7/B6(ピアース社製)をペプシンで消化した後、移動相として0.1mol/Lリン酸緩衝液(pH7.4)を用いてG3000SWカラム(東ソー社製;口径:21.5mm;長さ:60cm)を用いたHPLCシステム(日立製作所社製)でF(ab’)2を分離した。得られたF(ab’)2とアルカリホスファターゼとを以下の手順により、マレイミド法によって結合させた。
【0067】
イミノチオランを用いて、該F(ab’)2をスルフヒドリル化し、反応混合物をセファデックスG−25カラム(アマシャム・バイオサイエンス社製)に供して未反応のイミノチオランを除去し、スルフヒドリル化F(ab’)2を得た。
一方、マレイミド化試薬EMCSを用いて、アルカリホスファターゼをマレイミド化し、反応混合物をセファデックスG−25カラム(アマシャム・バイオサイエンス社製)に供して未反応のEMSCを除去し、マレイミド化アルカリホスファターゼを得た。
【0068】
調製したスルフヒドリル化F(ab’)2とマレイミド化アルカリホスファターゼとを混合し、アルカリホスファターゼ標識F(ab’)2を作製した。得られたアルカリホスファターゼ標識F(ab’)2を用いて、以下の組成からなるアルカリホスファターゼ標識抗sIL−2R抗体溶液を調製した。
【0069】
MES(pH7.0) 50mmol/L
アルカリホスファターゼ標識F(ab’)2 1.2μg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
ポリエチレングリコール(分子量20,000) 4%
【0070】
(2)試料中のsIL−2Rの測定
上記(1)で調製した測定対象試料10μLに、(1)で調製した磁性粒子懸濁液、ビオチン結合抗sIL−2R抗体溶液、及び、アルカリホスファターゼ標識抗sIL−2R抗体溶液を各30μL加えて攪拌し、37℃で20分間反応させた。磁性粒子を磁力で集めて、磁性粒子以外の反応溶液を除去すると共に、洗浄液[0.1%ツイーン20を含有する50mmol/L MOPS緩衝液(pH7.0)]で磁性粒子を5回洗浄した。その後、9−(4−クロロフェニルチオホスホリルオキシメチリデン)−10−メチルアクリダン・二ナトリウム塩を主成分とする発光基質液を100μL加えて攪拌し、生じた発光量(RLU)を測定した。測定結果を図1に示す。
【0071】
測定系として測定可能な最小濃度を規定する方法として、平均値と標準偏差を用いて統計学的に評価する方法がある。具体的には、0U/mL試料を5重測定した際の平均値+2倍の標準偏差(+2SD)よりも、(1)で調製した試料を5重測定した際の平均値−2倍の標準偏差(−2SD)が高いRLUとなれば、その試料を検出できる濃度として規定できる。
【0072】
sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDは83RLU(図1の破線)であった。sIL−2R濃度が2.4U/mLである試料を測定した際の発光量の平均−2SDは80RLUであり、sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDよりも低い値であったことから、2.4U/mLのsIL−2Rは測定できないことを確認した。一方、sIL−2R濃度が5U/mLである試料を測定した際の発光量の平均−2SDは122RLUであり、0U/mL試料を測定した際の発光量の平均+2SDよりも高い値であったことから、5U/mLのsIL−2Rを測定できることを確認した。また、図1に示したように、sIL−2Rが5U/mL以上の濃度では濃度依存的な吸光度の増加が見られた。
【0073】
以上の結果から、磁性粒子を用いる本発明の測定方法において、最小測定感度は5U/mLであった。
【実施例2】
【0074】
以下の測定対象試料、並びに、以下の組成からなる磁性粒子懸濁液、ビオチン結合抗sIL−2R抗体溶液、及び、アルカリホスファターゼ標識抗sIL−2R抗体溶液を用いる以外は実施例1と同様の方法により、sIL−2R測定における最小測定感度を検証した。
【0075】
(測定対象試料)
健常人より得た血清(sIL−2R濃度が390U/mLの血清)をPBS[リン酸緩衝化生理食塩水(0.15mol/L 塩化ナトリウムを含有する10mmol/L リン酸緩衝液、pH7.2)]にて10倍、20倍、40倍、80倍に希釈したもの、及び、PBSそのものを測定対象試料に用いた。
【0076】
(磁性粒子懸濁液)
MES(pH6.5) 50mmol/L
ストレプトアビジン結合磁性粒子 0.2mg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
【0077】
(ビオチン結合抗sIL−2R抗体溶液)
MES(pH6.5) 50mmol/L
抗sIL−2Rモノクローナル抗体 3μg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
【0078】
(アルカリホスファターゼ標識抗sIL−2R抗体溶液)
MES(pH7.0) 50mmol/L
アルカリホスファターゼ標識F(ab’)2 1.2μg/mL
BSA 1%
塩化ナトリウム 0.15mol/L
【0079】
sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDは317RLU(図2の破線)であった。sIL−2R濃度が5U/mLである試料を測定した際の発光量の平均−2SDは327RLUであり、sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDよりも高い値であったことから、5U/mLのsIL−2Rを測定できることを確認した。また、図2に示したように、sIL−2Rが5U/mL以上の濃度では濃度依存的な吸光度の増加が見られた。
【0080】
以上の結果から、磁性粒子を用いる本発明の測定方法において、最小測定感度は5U/mLU/mLであった。
【0081】
[比較例]
(1)材料
(測定対象試料)
健常人より得た血清(sIL−2R濃度が390U/mLの血清)を、1%BSAを含むPBS[リン酸緩衝化生理食塩水(0.15mol/L 塩化ナトリウムを含有する10mmol/L リン酸緩衝液、pH7.2)]にて50U/mL、25U/mL、12.5U/mL、6.3U/mLと希釈したもの、及び1%BSAを含むPBS(0U/mL)そのものを測定対象試料に用いた。
【0082】
(抗sIL−2R抗体固相化96穴プレートの作製)
抗sIL−2Rモノクローナル抗体AM92.3(ピアース社製)をPBSで希釈してAM92.3のPBS溶液(10mg/mL)を調製し、96穴マイクロタイタープレート[Nunc フルオロヌンクモジュール(サーモフィッシャーサイエンティフィック社)]の各ウェルに100μL添加し、固相化した。その後、ブロッキング液(1%BSA、0.05%Tween20を含有する10mmol/Lリン酸緩衝液)でブロッキングしたものを抗体固相化プレートとした。
【0083】
(アルカリホスファターゼ標識抗sIL−2R抗体溶液)
実施例1で作製したアルカリホスファターゼ標識F(ab’)2を用いて、以下の組成からなるアルカリホスファターゼ標識抗sIL−2R抗体溶液を調製した。
【0084】
MES(pH6.5) 50mmol/L
アルカリホスファターゼ標識F(ab’)2 20ng/mL
BSA 0.2%
【0085】
(2)試料中のsIL−2Rの測定
上記(1)で調製した抗sIL−2R抗体固相化96穴プレートに、(1)で調製した測定対象試料を100μLずつ添加して室温で1時間静置した。洗浄液(150mmol/L塩化ナトリウム、0.05%Tween20を含有する10mmol/Lリン酸緩衝液)で各ウェルを洗浄後、(1)で調製したアルカリホスファターゼ標識抗sIL−2R抗体溶液を100μLずつ加えて攪拌し、室温で1時間静置した。洗浄液で洗浄後、9−(4−クロロフェニルチオホスホリルオキシメチリデン)−10−メチルアクリダン・二ナトリウム塩を主成分とする発光基質液を100μL加えて攪拌し、生じた発光の量を測定した。測定結果を図3に示す。実施例1と同様に、測定系として検出可能な濃度を統計学的に評価した。
【0086】
sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDは153RLUであった。sIL−2R濃度が6.3U/mLである試料を測定した際の発光量の平均−2SDは147RLUであり、0U/mL試料を測定した際の発光量の平均+2SDよりも低い値であったことから、6.3U/mLのsIL−2R濃度は測定できないことを確認した。一方、sIL−2R濃度が12.5U/mLである試料を測定した際の発光量の平均−2SDは211RLUで、sIL−2R濃度が0U/mLである試料を測定した際の発光量の平均+2SDよりも高い値であったことから、12.5U/mLのIL−2Rを測定できることを確認した。また、図3に示したように、sIL−2Rが12.5U/mL以上の濃度では、濃度依存的な吸光度の増加が見られた。
【0087】
以上の結果より、プレート法におけるsIL−2Rの最小測定感度は12.5U/mLであった。実施例1及び2より、磁性粒子を用いる測定においては、最小測定感度は5U/mLであることから、磁性粒子を用いる本発明の方法はプレート法よりも高感度にsIL−2Rを測定でき、sIL−2R濃度が5U/mLである試料においても、試料を濃縮することなく、sIL−2Rを測定できることが明らかとなった。
【産業上の利用可能性】
【0088】
本発明により、骨髄移植後の処置判断等に有効な、試料中のsIL−2Rの簡便で、かつ、高感度な測定方法、及び、測定用試薬が提供される。
【特許請求の範囲】
【請求項1】
試料中の可溶性インターロイキン−2受容体(以下、sIL−2Rと記す)の測定方法であって、以下の工程を含むことを特徴とする方法。
(1)試料を濃縮することなく、試料中のsIL−2Rを、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応させる工程;
(2)sIL−2Rに結合する第2抗体若しくはそのフラグメントを、水性媒体中で、工程(1)で生成したsIL−2Rに結合する第1抗体若しくはそのフラグメントとsIL−2Rの免疫複合体が固定化された磁性粒子と反応させる工程;
(3)工程(2)後の反応混合物中の磁性粒子を磁力により集めて、磁力により集められた磁性粒子とそれ以外の反応液とを分離する工程;及び、
(4)工程(3)で分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定する工程。
【請求項2】
工程(1)と工程(2)とが同時に行われる、請求項1記載の方法。
【請求項3】
工程(1)及び/又は工程(2)が、塩類共存下に行われる請求項1又は2記載の方法。
【請求項4】
工程(1)及び/又は工程(2)が、ポリエチレングリコール誘導体共存下に行われる請求項1〜3のいずれかに記載の方法。
【請求項5】
ポリエチレングリコール誘導体が、ポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル又はポリオキシエチレンソルビタン脂肪酸エステルである請求項4記載の方法。
【請求項6】
磁性粒子、可溶性インターロイキン−2受容体(以下、sIL−2Rと記す)に結合する第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有することを特徴とする、試料中のsIL−2R測定用試薬。
【請求項7】
さらに塩類を含有することを特徴とする、請求項6記載の試薬。
【請求項8】
さらにポリエチレングリコール誘導体を含有することを特徴とする、請求項6又は7記載の試薬。
【請求項9】
ポリエチレングリコール誘導体が、ポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル又はポリオキシエチレンソルビタン脂肪酸エステルである請求項8記載の試薬。
【請求項1】
試料中の可溶性インターロイキン−2受容体(以下、sIL−2Rと記す)の測定方法であって、以下の工程を含むことを特徴とする方法。
(1)試料を濃縮することなく、試料中のsIL−2Rを、水性媒体中で、sIL−2Rに結合する第1抗体若しくはそのフラグメントが固定化された磁性粒子と反応させる工程;
(2)sIL−2Rに結合する第2抗体若しくはそのフラグメントを、水性媒体中で、工程(1)で生成したsIL−2Rに結合する第1抗体若しくはそのフラグメントとsIL−2Rの免疫複合体が固定化された磁性粒子と反応させる工程;
(3)工程(2)後の反応混合物中の磁性粒子を磁力により集めて、磁力により集められた磁性粒子とそれ以外の反応液とを分離する工程;及び、
(4)工程(3)で分離された磁性粒子上の第2抗体若しくはそのフラグメントを測定する工程。
【請求項2】
工程(1)と工程(2)とが同時に行われる、請求項1記載の方法。
【請求項3】
工程(1)及び/又は工程(2)が、塩類共存下に行われる請求項1又は2記載の方法。
【請求項4】
工程(1)及び/又は工程(2)が、ポリエチレングリコール誘導体共存下に行われる請求項1〜3のいずれかに記載の方法。
【請求項5】
ポリエチレングリコール誘導体が、ポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル又はポリオキシエチレンソルビタン脂肪酸エステルである請求項4記載の方法。
【請求項6】
磁性粒子、可溶性インターロイキン−2受容体(以下、sIL−2Rと記す)に結合する第1抗体若しくはそのフラグメント、及び、sIL−2Rに結合する第2抗体若しくはそのフラグメントを含有することを特徴とする、試料中のsIL−2R測定用試薬。
【請求項7】
さらに塩類を含有することを特徴とする、請求項6記載の試薬。
【請求項8】
さらにポリエチレングリコール誘導体を含有することを特徴とする、請求項6又は7記載の試薬。
【請求項9】
ポリエチレングリコール誘導体が、ポリエチレングリコール、ポリオキシエチレンアルキルフェニルエーテル又はポリオキシエチレンソルビタン脂肪酸エステルである請求項8記載の試薬。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−7782(P2011−7782A)
【公開日】平成23年1月13日(2011.1.13)
【国際特許分類】
【出願番号】特願2010−116977(P2010−116977)
【出願日】平成22年5月21日(2010.5.21)
【出願人】(000162478)協和メデックス株式会社 (42)
【公開日】平成23年1月13日(2011.1.13)
【国際特許分類】
【出願日】平成22年5月21日(2010.5.21)
【出願人】(000162478)協和メデックス株式会社 (42)
[ Back to top ]

