可視光応答型光触媒皮膜の製造方法及びそれらを用いた殺菌方法
【課題】触媒活性を低下させることなく製膜を行うことが可能で、可視光の照射下で高い抗菌活性を有する可視光応答型光触媒皮膜の製造方法及び可視光応答型光触媒皮膜を用いた殺菌方法を提供する。
【解決手段】可視光応答型光触媒皮膜10は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を、高速フレーム溶射法又はコールドスプレー法を用いて基材12の表面に成膜することにより形成され、衛生部材の抗菌性皮膜、又は種子等の殺菌方法に用いることができる。
【解決手段】可視光応答型光触媒皮膜10は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を、高速フレーム溶射法又はコールドスプレー法を用いて基材12の表面に成膜することにより形成され、衛生部材の抗菌性皮膜、又は種子等の殺菌方法に用いることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、可視光応答型光触媒皮膜とその製造方法及びそれらを用いた殺菌方法に係り、更に詳細には、可視光の照射下で高い抗菌活性を有する可視光応答型光触媒皮膜の製造方法、並びに可視光応答型光触媒皮膜を用いた殺菌方法に関する。
【背景技術】
【0002】
高齢化社会の進展により、免疫力の低下した高齢者の全人口に占める割合が増加傾向にある。それに伴い、院内感染や食中毒の予防の観点から、医療現場や食品生産及び加工現場における衛生管理の強化が喫緊の課題となっている。このような社会的背景を受けて、様々な抗菌加工製品が開発されており、近年、抗菌加工への光触媒機能の利用が特に注目を集めている。
特に二酸化チタンを用いた光触媒は、安価で、化学的安定性に優れ、かつ高い触媒活性を有し、その強力な有機物分解活性により、細菌の菌体と同時に、グラム陰性菌の細胞壁外膜成分であるエンドトキシンや細菌が産生する毒素(病原性大腸菌の産生するベロ毒素等)等の有害物質を併せて分解することができ、しかも光触媒自体は人体に無害であるという利点を有している。そのため、食品容器、布帛、建材等の抗菌加工に二酸化チタン光触媒が広く用いられている(例えば、特許文献1及び2参照)。
【0003】
しかし、二酸化チタンは紫外線照射下でしか光触媒活性を発現しないため、紫外線成分を殆ど含まない室内光の下では十分な触媒活性を発現することができない。そこで、窒素、炭素、硫黄等の原子を結晶格子中にドープした二酸化チタンが、可視光照射下で光触媒活性を発現する光触媒として提案されている。特に硫黄ドープ二酸化チタンは、可視領域における吸光係数が高く、可視光で高い触媒活性を有している(例えば、特許文献3参照)。
一方、基質の表面に二酸化チタン光触媒皮膜を形成するための種々の方法が提案されている。二酸化チタン光触媒皮膜の形成方法の例としては、ゾル−ゲル法(例えば、非特許文献1参照)等の溶液法、及びスパッタリング法、イオンクラスタービーム法、CVD(化学蒸着)法、溶射法(例えば、特許文献4参照)等の乾式法が挙げられる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2007−51263号公報
【特許文献2】特開2006−346651号公報
【特許文献3】特開2004−143032号公報
【特許文献4】特開2006−51439号公報
【非特許文献】
【0005】
【非特許文献1】古南 博、大谷 文章著、「電気化学」、電気化学会、1998年、第66巻、p.996
【発明の概要】
【発明が解決しようとする課題】
【0006】
前記従来の光触媒皮膜の形成方法のうち、溶射法は、高価な真空機器を必要としない、多様な基材の表面に密着強度に優れた光触媒被膜を形成することができる、大面積の被膜の形成にも適用可能である等の多くの利点を有している。しかしながら、一般の溶射法では、溶射材料への入熱を確保するために溶射温度が700℃以上になるが、このような高温下では、可視光応答型光触媒において二酸化チタンにドープされている原子が消失してしまう(例えば、硫黄原子の場合、600℃以上に加熱すると一部が消失し、800℃以上に加熱すると完全に消失することが知られている)。そのため、従来の高速フレーム溶射法は、そのままでは可視光応答型光触媒被膜の形成に適用できないという課題があった。
また、仮に、窒素、炭素、硫黄等の原子を結晶格子中にドープした二酸化チタンを使用して、可視光応答型光触媒被膜を形成したとしても、その殺菌効果を更に向上させるには限界があった。
【0007】
本発明はかかる事情に鑑みてなされたもので、触媒活性を低下させることなく成膜を行うことが可能で、可視光の照射下で高い抗菌活性を有する可視光応答型光触媒皮膜の製造方法並びに可視光応答型光触媒皮膜を用いた殺菌方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
前記目的に沿う第1の発明に係る可視光応答型光触媒皮膜は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射法又はコールドスプレー法を用いて基材の表面に成膜している。
前記目的に沿う第2の発明に係る可視光応答型光触媒皮膜は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射温度が300〜700℃の溶射法を用いて基材の表面に成膜している。
ここで、溶射温度を300〜700℃とすることにより、溶射材料(混合物)への十分な入熱を確保しつつ、溶射材料の温度を600℃以下に保つことができる。そのため、可視光応答型光触媒において二酸化チタンにドープされている原子の消失が抑制され、高い可視光応答性を保持することができると共に、抗菌性を有する金属との相乗効果により、抗菌活性を向上させることができる。
【0009】
第1、第2の発明に係る可視光応答型光触媒皮膜において、前記溶射法がフレーム温度300〜700℃の高速フレーム溶射法であることが好ましい。なお、「フレーム温度」とは、溶射ガン先端から200mmの位置で測定した温度をいう。
この場合において、前記基材の融点が300〜700℃であることが好ましい。
【0010】
第3の発明に係る可視光応答型光触媒皮膜において、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射温度が50〜300℃のコールドスプレー法を用いて基材の表面に成膜している。
ここで、溶射温度が50〜300℃のコールドスプレー法を用いることにより、溶射材料(混合物)への十分な入熱を確保しつつ、溶射材料の温度を600℃以下に保つことができる。そのため、可視光応答型光触媒において二酸化チタンにドープされている原子の消失が抑制され、高い可視光応答性を保持することができる。
【0011】
第1〜第3の発明に係る可視光応答型光触媒皮膜において、前記抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であることが好ましい。
なお、本発明において「銀系の金属」とは、銀及び銀合金(例えば、銀を50質量%以上、更には80質量%以上含む合金)のいずれかを意味する。同様に、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属とは、それぞれ、それらの金属の単体又は合金(例えば、その金属を50質量%以上、更には80質量%以上含む合金)を意味する。
【0012】
第4の発明に係る可視光応答型光触媒皮膜の製造方法は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、高速フレーム溶射法又はコールドスプレー法を用いて基材の表面に成膜する工程を有する。
【0013】
第5の発明に係る可視光応答型光触媒皮膜の製造方法は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、フレーム温度300〜700℃の高速フレーム溶射法を用いて基材の表面に成膜する工程を有する。
【0014】
第6の発明に係る可視光応答型光触媒皮膜の製造方法は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射温度50〜300℃のコールドスプレー法を用いて基材の表面に成膜する工程を有する。
【0015】
第4〜第6の発明に係る可視光応答型光触媒皮膜の製造方法において、前記抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であることが好ましい。
【0016】
第4〜第6の発明に係る可視光応答型光触媒皮膜の製造方法において、前記混合物を、水及び有機溶媒のいずれか一方又は双方を含む分散媒中に分散したスラリーを霧化した霧状粒子を溶射フレーム中に投入してもよい。
例えば、可視光応答型光触媒の微粒子及び抗菌性を有する金属の微粒子を分散媒中に分散したスラリーを霧化した霧状粒子を高速溶射フレーム中に投入することにより、分散媒の蒸発潜熱を利用して従来の高速フレーム溶射よりも低いフレーム温度での溶射が可能になる。
【0017】
第4〜第6の発明に係る可視光応答型光触媒皮膜の製造方法において、前記スラリー中の前記可視光応答型光触媒の濃度が1〜30質量%であることが好ましい。
スラリー中の可視光応答型光触媒の濃度を上記範囲内とすることにより、スラリーの分散性及び流動性が保たれ、スラリー供給装置の目詰まり等を起こすことなく、ムラのない可視光応答型光触媒皮膜を形成することができる。
【0018】
第4〜第6の発明に係る可視光応答型光触媒皮膜の製造方法において、前記スラリー中の前記抗菌性を有する金属の濃度が1〜30質量%であることが好ましい。
【0019】
第7の発明に係る殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び殺菌対象物と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行う。
【0020】
第8の発明に係る殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して該水溶液中の殺菌対象物に近接配置し、該可視光応答型光触媒皮膜に可視光を照射して、前記抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行う。
【0021】
第7及び第8の発明に係る殺菌方法において、前記抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であることが好ましい。
【0022】
第9の発明に係る殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、殺菌対象物に接触又は近接配置させ、該可視光応答型光触媒皮膜に可視光を照射して、光触媒反応の作用により殺菌を行う。
【0023】
第10の発明に係る植物の種子の殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び植物の種子と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行う。
【0024】
第11の発明に係る植物の種子の殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して該水溶液中の植物の種子に近接配置し、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行う。
【0025】
第10及び第11の発明に係る植物の種子の殺菌方法において、前記抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であってもよい。
【0026】
第12の発明に係る水溶液の殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、大腸菌又は黄色ぶどう球菌を含む水溶液と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、光触媒反応により前記水溶液の殺菌を行う。
【0027】
第12の発明に係る水溶液の殺菌方法において、前記可視光の発光源として、600ルックス以上の蛍光灯を使用することが好ましい。
第12の発明に係る水溶液の殺菌方法において、前記蛍光灯の照射時間は60分以上であることが好ましい。
【0028】
第13の発明に係る殺菌装置は、第7〜第9の発明に係る殺菌方法を用いた殺菌装置である。
【発明の効果】
【0029】
請求項1〜6記載の可視光応答型光触媒皮膜においては、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒と、抗菌性を有する金属とを含む。そのため、可視光の吸光係数が高く、紫外光を殆ど含まない室内光の下でも高い抗菌活性を示すと共に、抗菌性を有する金属との相乗効果により抗菌活性が向上している。
また、可視光応答型光触媒皮膜は溶射法又はコールドスプレー法を用いて形成されるので、高価な真空機器等を用いることなく、様々な材質及び面積の基材の表面上に、均一で強固な皮膜を安価かつ簡便に形成することができる。
【0030】
特に、請求項3記載の可視光応答型光触媒皮膜においては、その形成に用いられる溶射法が高速フレーム溶射法であるので、可視光応答型光触媒と抗菌性を有する金属の微粒子は、1000m/s以上の高速で基材上に噴射される。そのため、成膜された可視光応答型光触媒皮膜は高い密着強度を有し、耐久性に優れ、長寿命である。
また、フレーム温度が300〜700℃であるので、二酸化チタン結晶格子中にドープされた窒素、炭素、及び硫黄原子が溶射中に消失するのを抑制できる。そのため、得られた皮膜は、高い可視光応答性を保持している。
【0031】
請求項4記載の可視光応答型光触媒皮膜においては、基材が300〜700℃に融点を有するので、高速フレーム溶射による可視光応答型光触媒皮膜の形成の際に基材の表面への融着が起こる。従って、皮膜の接着強度を更に向上することができる。
【0032】
請求項6記載の可視光応答型光触媒皮膜においては、抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であるので、高い抗菌性を有する。
【0033】
請求項7〜13記載の可視光応答型光触媒皮膜の製造方法においては、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、高速フレーム溶射法又はコールドスプレー法を用いて基材の表面に成膜するので、高価な真空機器等を用いることなく、様々な材質及び面積の基材の表面上に、均一で強固な皮膜を安価かつ簡便に形成することができる。また、高速フレーム溶射法は、可視光応答型光触媒と抗菌性を有する金属の微粒子が、1000m/s以上の高速で基材上に噴射されるため、成膜された可視光応答型光触媒皮膜は高い密着強度を有し、耐久性に優れ、長寿命である。
【0034】
特に、請求項8記載の可視光応答型光触媒皮膜の製造方法においては、フレーム温度が300〜700℃の範囲内であるので、二酸化チタン結晶格子中にドープされた窒素、炭素、及び硫黄原子が溶射中に消失するのを抑制できる。そのため、得られた皮膜は、高い可視光応答性を保持している。
【0035】
請求項10記載の可視光応答型光触媒皮膜の製造方法においては、抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であるので、得られる可視光応答型光触媒皮膜は高い抗菌性を有する。
【0036】
請求項11記載の可視光応答型光触媒皮膜の製造方法においては、混合物の微粒子を水及び有機溶媒のいずれか一方又は双方の分散媒中に分散したスラリーを霧化した霧状粒子を溶射フレーム中に投入しているので、分散媒の蒸発潜熱を利用して従来の高速フレーム溶射よりも低いフレーム温度での溶射が可能になる。そのため、可視光応答型光触媒において二酸化チタン結晶格子中にドープした原子が溶射により消失するのを抑制でき、可視光応答性が保たれた可視光応答型光触媒皮膜を製造することができる。
【0037】
請求項12記載の可視光応答型光触媒皮膜の製造方法においては、スラリー中の可視光応答型光触媒の濃度が1〜30質量%であるので、光触媒活性発現のために十分な膜厚を有し、剥離強度が高く、かつムラのない可視光応答型光触媒皮膜を高い効率で形成することができる。
【0038】
請求項13記載の可視光応答型光触媒皮膜の製造方法においては、抗菌性を有する金属の含有量がスラリーの1〜30質量%であるので、高い抗菌活性と光触媒活性とを併せ持つ。
【0039】
請求項14及びこれに従属する請求項16記載の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び殺菌対象物と接触させ、可視光応答型光触媒皮膜に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌(微生物の数を激減させる)効率、更には滅菌(微生物を完全に死滅させる)効果を有する。
【0040】
請求項15及びこれに従属する請求項16記載の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して水溶液中の殺菌対象物に近接配置し、可視光応答型光触媒皮膜に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有する。
【0041】
特に、請求項16記載の殺菌方法においては、抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であるので、可視光応答型光触媒皮膜との相乗効果により特に高い抗菌活性を有する。
【0042】
請求項17記載の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、殺菌対象物に接触又は近接配置させ、可視光応答型光触媒皮膜に可視光を照射して、光触媒反応の作用により殺菌を行うので、光触媒反応を単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有する。
【0043】
請求項18及びこれに従属する請求項20記載の植物の種子の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び植物の種子と接触させ、可視光応答型光触媒皮膜に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有すると共に、種子の発芽率が殺菌により低下しない。
【0044】
請求項19及びこれに従属する請求項20記載の植物の種子の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して水溶液中の植物の種子に近接配置し、可視光応答型光触媒皮膜に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有すると共に、種子の発芽率が殺菌により低下しない。
【0045】
特に、請求項20記載の植物の種子の殺菌方法においては、抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であるので、殺菌後の種子の発芽率を保持しつつ、可視光応答型光触媒皮膜との相乗効果により特に高い抗菌活性を有する。
【0046】
請求項21〜23記載の水溶液の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、大腸菌又は黄色ぶどう球菌を含む水溶液と接触させ、可視光応答型光触媒皮膜に可視光を照射して、光触媒反応により水溶液の殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有する。
【0047】
特に、請求項22記載の水溶液の殺菌方法においては、可視光の発光源として、600ルックス以上の蛍光灯を使用するので、殺菌効率、更には滅菌効果を、更に高めることができる。
請求項23記載の水溶液の殺菌方法においては、蛍光灯の照射時間は60分以上であるので、殺菌効率、更には滅菌効果を、更に高めることができる。
【図面の簡単な説明】
【0048】
【図1】本発明の第1の実施の形態に係る可視光応答型光触媒皮膜の製造方法の説明図である。
【図2】同可視光応答型光触媒皮膜の製造方法で使用される原料供給装置の説明図である。
【図3】(A)は同可視光応答型光触媒皮膜の製造方法で使用される霧化ノズルの説明図、(B)は霧化ノズルの内部構造を示す説明図である。
【図4】同可視光応答型光触媒皮膜の製造方法で使用される高速溶射装置の説明図である。
【図5】(A)は本発明の第2の実施の形態に係る殺菌方法の説明図、(B)は他の殺菌方法の説明図である。
【図6】TiO2、Cu、S−TiO2、及びS−TiO2+Cu溶射皮膜の光触媒抗菌活性を示すグラフである。
【図7】カイワレダイコン種子の殺菌処理後の大腸菌数、発芽率及び発芽後の全長を示すグラフである。
【図8】大腸菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図9】明条件での大腸菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図10】暗条件での大腸菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図11】明条件での黄色ブドウ球菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図12】暗条件での黄色ブドウ球菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図13】室内の明るさでの大腸菌に対する殺菌効果の説明図である。
【図14】室内の明るさでの黄色ブドウ球菌に対する殺菌効果の説明図である。
【図15】金属の違いによる大腸菌に対する抗菌効果の説明図である。
【図16】金属の違いによる黄色ブドウ球菌に対する抗菌効果の説明図である。
【図17】大腸菌に対する塩素の抗菌効果の説明図である。
【図18】黄色ブドウ球菌に対する塩素の抗菌効果の説明図である。
【発明を実施するための形態】
【0049】
続いて、添付した図面を参照しつつ、本発明を具体化した実施の形態につき説明し、本発明の理解に供する。
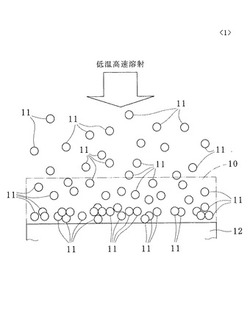
図1に示すように、本発明の第1の実施の形態に係る可視光応答型光触媒皮膜の製造方法によって成膜された可視光応答型光触媒皮膜の一例である硫黄ドープ二酸化チタン皮膜10は、二酸化チタンの結晶格子中に硫黄原子がドープされた硫黄ドープ二酸化チタン(可視光応答型光触媒の一例)の微粒子と銅(抗菌性を有する金属の一例)の微粒子とを含む混合物を原料として用いて形成されている。
硫黄ドープ二酸化チタンの微粒子と銅の微粒子とを有する混合物を分散媒の一例である水中に分散したスラリーを霧化した霧状粒子11を溶射フレーム29(図4参照)中に投入し、フレーム温度(溶射温度)300〜700℃で高速フレーム溶射する(溶射法の一例である高速フレーム溶射法を用いる)ことにより基材12の表面に硫黄ドープ二酸化チタン皮膜10が形成される。
【0050】
なお、基材12としては、例えば、コンクリート、セラミックスタイルガラス、金属繊維、ガラス繊維、活性炭素繊維、セラミックス繊維、プラスチック、金属等が挙げられる。基材12として用いられる金属繊維、ガラス繊維、活性炭素繊維、及びセラミックス繊維は、布帛状であってもよく、不織布状であってもよい。
基材12として金属を用いる場合には、高速フレーム溶射による硫黄ドープ二酸化チタン皮膜10の形成時に、溶射皮膜からの入熱により表面の一部が融解又は軟化して融着が起こり、硫黄ドープ二酸化チタン皮膜10の接着強度が向上する。そのため、融点が300〜700℃である金属材料が好ましい。このような金属材料の具体例としては、アルミニウム(660.4℃)及び亜鉛(419.5℃)が挙げられる。或いは、これらの金属を表面にめっきしためっき鋼板等でもよく、アルミニウム亜鉛の合金がめっきされたガルバリウム鋼板等でもよい。また、アルミニウムの表面は厚さ数μm〜数十μmのアルマイト処理がされていてもよい。
基材12の形状及び大きさに特に制限はなく、装置や建造物等の構造体を構成するものであってもよい。ただし、光触媒機能を発揮するためには、基材12は構造体の表面に位置することが好ましい。
【0051】
硫黄ドープ二酸化チタン皮膜10を構成する硫黄ドープ二酸化チタンは、二酸化チタン結晶格子中のTi4+が4価の硫黄陽イオン(S4+)に置換された構造を有している。このように、Ti4+の一部をS4+で置換することにより、価電子帯上端のエネルギー準位が上昇してバンドギャップが狭くなるので、吸収端が可視光領域にシフトし、可視光応答性が発現すると考えられている。
【0052】
硫黄ドープ二酸化チタンは、公知の方法を用いて製造することができる。製造方法の一例としては、チオ尿素等の硫黄源を混合したチタンアルコキシドを原料とするゾル−ゲル法が挙げられる。
【0053】
スラリーを高速フレーム溶射して基材12の表面に硫黄ドープ二酸化チタン皮膜10を形成する際のフレーム温度は、300〜700℃、好ましくは400〜700℃、より好ましくは400〜600℃である。フレーム温度が700℃を超えると、硫黄ドープ二酸化チタン微粒子への入熱量が大きくなりすぎてドープした硫黄原子が完全に消失し、可視光応答特性が失われてしまう。また、フレーム温度が300℃を下回ると硫黄ドープ二酸化チタン及び金属銅の微粒子への入熱が不十分となるため、十分な膜厚及び剥離強度を有する硫黄ドープ二酸化チタン皮膜10の成膜が困難となる。
【0054】
なお、高速フレーム溶射の代わりに、従来公知のコールドスプレー法を用いてもよい。この場合、溶射温度を50〜300℃、好ましくは、100〜250℃、より好ましくは100〜200℃にする。ここで、300℃とは、コールドスプレー法の上限温度であり、一方温度が50℃を下回ると硫黄ドープ二酸化チタン及び金属銅の微粒子への入熱が不十分となるため、十分な膜厚及び剥離強度を有する硫黄ドープ二酸化チタン皮膜10の成膜が困難となる。
【0055】
上述したとおり、硫黄の消失を抑制及び防止するために、硫黄ドープ二酸化チタン皮膜10の作製の際には、フレーム温度700℃以下で高速フレーム溶射を行う必要がある。そのため、原料として使用する硫黄ドープ二酸化チタン及び金属銅の微粒子は、スラリー状の混合物として水と共に、撹拌機能を備え、窒素ボンベ22aからの高圧窒素ガスで加圧された加圧器22とスラリーポンプ23とを含む原料供給装置(図2参照)を用いて溶射フレームまで搬送する。
原料粉である硫黄ドープ二酸化チタン微粒子、金属銅微粒子、及び水を容器21に投入し、撹拌することによりスラリーを調製する。
【0056】
スラリー中の硫黄ドープ二酸化チタン微粒子の量は、1〜30質量%であり、好ましくは3〜15質量%であり、より好ましくは5質量%〜10質量%である。スラリー中の硫黄ドープ二酸化チタン微粒子の量が30質量%を上回ると、高速フレーム溶射後の冷却時における硫黄ドープ二酸化チタン皮膜10と基材12との熱膨張率の違いに起因して硫黄ドープ二酸化チタン皮膜10の内部に応力が発生し、亀裂を生じる原因となる。また、スラリー中の硫黄ドープ二酸化チタン微粒子の量が1質量%を下回ると、得られる硫黄ドープ二酸化チタン皮膜10の膜厚が小さくなりすぎ、十分な光触媒活性が発現しなくなる。
硫黄ドープ二酸化チタン微粒子の直径は、例えば、0.5〜10μmであり、好ましくは1〜5μmである。硫黄ドープ二酸化チタン微粒子の直径が10μmを上回ると分散性が低下し、0.5μmを下回ると、微粒子の運動エネルギーが低下するため製膜が困難になる。
【0057】
金属銅微粒子の添加量は、スラリーの1〜30質量%であることが好ましく、3〜30質量%であることが更に好ましく、5〜10質量%であることがより好ましい。金属銅微粒子の添加量が30質量%を上回ると、沈殿や偏析によりスラリー中での分散性が低下する。また、金属銅微粒子の添加量が1質量%を下回ると、十分な抗菌活性が発現しなくなる。
また、金属銅微粒子の直径は、例えば、0.5〜10μmであり、好ましくは5μmである。金属銅微粒子の直径が10μmを上回ると沈降や偏析が起こりやすくなり、0.5μmを下回ると、二次凝集が起こりやすくなる。
なお、硫黄ドープ二酸化チタン微粒子及び金属銅微粒子の直径は、動的光散乱法等の公知の方法を用いて測定される。
【0058】
なお、硫黄ドープ二酸化チタン微粒子及び金属銅微粒子のスラリー中への分散性を向上させるために、撹拌の代わりに、あるいは撹拌と同時に超音波照射を行ってもよい。
また、ノニオン系又はアニオン系の界面活性剤を分散剤として混合物に添加してもよい。好ましい界面活性剤としては、例えば、ポリカルボン酸系高分子界面活性剤等のアニオン系高分子界面活性剤が挙げられる。界面活性剤の添加量は、硫黄ドープ二酸化チタン微粒子及び金属銅微粒子の0.5〜3質量%程度が好ましい。
更に、分散媒として水の代わりにアルコール(有機溶液の一例)を使用することも可能であり、また水とアルコールとの混合液を使用することも可能である。
【0059】
このようにして得られたスラリーを、撹拌機能を備えた加圧器22に投入した後、スラリーポンプ23により所定量ずつ、図3(A)、(B)に示す霧化ノズル24へ搬送する。
この霧化ノズル24は、ほぼ円筒状となったものであり、一方側には圧搾空気が吹き込まれる空気流入口25が設けられ、他方側には霧化した霧状粒子を噴出する排出口26が設けられ、側部にはスラリーが流入するスラリー流入口27が設けられている。
この霧化ノズル24内部の霧化室28内に、スラリー流入口27を介して流入したスラリーを供給すると共に、この混合液に対し空気流入口25を介して流入した圧搾空気を吹き付け、混合液を霧状にする。霧状粒子11は、排出口26から排出され、溶射フレーム(火炎)29を形成する溶射装置30の溶射原料入口(図4参照)へ供給される。このように、溶射装置30への搬送過程、即ち溶射フレーム29への投入前にスラリーを霧化することで、原料微粒子である硫黄ドープ二酸化チタン微粒子及び金属銅微粒子の凝集を抑制、更には防止して、溶射フレーム29まで所定量ずつ安定に供給し、霧状粒子11を溶射できる。また、原料微粒子と共に供給された水の蒸発潜熱により、溶射フレーム29の温度を300〜700℃の低温に保つことができる。
【0060】
霧状粒子11の溶射において、基材12の表面に硫黄ドープ二酸化チタン皮膜10を形成するためには、低温度の高速溶射を行う必要があり、その装置として、例えば、特開2005−68457号公報に記載された溶射温度可変型の高速溶射装置(以下、単に溶射装置ともいう)30を使用することができる。
図4に示すように、溶射装置30は、高圧燃焼支援ガス(O2+空気)及びガス燃料によって形成された高速の溶射フレーム29と共に、溶射原料(霧化ノズル24から排出された霧状粒子11)を基材12に対して噴出して皮膜10を形成する溶射ガン(溶射ガンバレル)31を備えている。
【0061】
溶射ガン31の上流側には、所定の混合比率に調整された高圧の酸素ガス及び空気を予め混合して高圧の燃焼支援ガスを製造する混合手段(例えば、スタティックミキサ)32が設けられ、酸素ガス量に対する燃料量又は燃料量に対する酸素ガス量を増減させて、溶射フレーム29の温度を可変可能に調整できるものである。この溶射装置30を使用し、溶射原料を形成された溶射フレーム29中に投入するので、噴出される溶射原料の溶射速度を超音速に維持しながら、フレーム温度の制御を行うことが可能となる。
【0062】
なお、混合手段32によって酸素ガスと空気とを予め混合し、この燃焼支援ガスを溶射ガン31へ供給するので、酸素ガス量に対する燃料量を減少させて、溶射フレーム29の温度を低温に調整した場合に、空気の混合量、溶射ガン31の燃焼圧力、及び溶射原料の溶射速度の低下を制御して、基材12上に形成した皮膜10の酸化を抑制できる。また、酸素ガス及び空気を混合手段32によってほぼ均一な状態に混合し、この燃焼支援ガスを溶射ガン31へ供給して溶射フレーム29を形成するので、混合の不均一に起因する溶射フレーム29の揺らぎ等の発生を抑制、更には防止できる。
【0063】
このようにして得られた硫黄ドープ二酸化チタン皮膜10は、可視光の照射下で高い光触媒活性を示す。なお、硫黄ドープ二酸化チタン皮膜10の厚みは、1〜100μm(好ましくは、1〜10μm)である。
使用することができる可視光源は特に制限されないが、硫黄ドープ二酸化チタンが高い吸光係数を有する500nmの発光強度が高いものが好ましい。可視光源の具体例としては、蛍光灯、白熱電球、ハロゲンランプ、白色、青色、緑色等のLED(発光ダイオード)、半導体レーザー、エレクトロルミネッセンス光源等や、太陽光(自然光)が挙げられる。
【0064】
硫黄ドープ二酸化チタン皮膜10は、紫外線強度の低い室内光の下でも光触媒活性を有しているので、紫外線ランプを用いた殺菌灯や消毒剤等を用いることなく、可視光の照射下で、その表面での有害微生物の増殖を抑制することができる。従って、硫黄ドープ二酸化チタン皮膜10は、抗菌性を要求される各種衛生部材の抗菌性皮膜として用いることができる。
硫黄ドープ二酸化チタン皮膜10が形成される衛生部材には、抗菌性を必要とする什器類並びに建材に用いられる部材があり、家庭用、業務用を問わず、任意の材質の什器類、建材等が挙げられる。
【0065】
衛生部材が用いられる家庭用の什器類の一例としては、浴槽、流し台、洗面台及び便器等の衛生陶器、台所用品、洗面用品、浴室用品、洗濯用品、電話機、家電用リモートコントローラ等が挙げられる。
また、衛生部材が用いられる家庭用の建材の一例としては、タイル、壁紙等の屋内用建材等が挙げられる。
衛生部材が用いられる業務用の什器類の一例としては、医療用設備で用いられる寝台、診断及び手術用機器及び器具、福祉施設等で用いられる浴槽、流し台、洗面台及び便器等の衛生陶器、台所用品、洗面用品、浴室用品、洗濯用品、電話機、家電用リモートコントローラ等食品製造装置、業務用厨房設備、公共交通機関、公共施設及び福祉施設等の手すり、座席その他の内装用品等が挙げられる。
また、衛生部材が用いられる業務用施設の建材の一例としては、医療用施設、食品製造現場、公共交通機関、公共施設及び福祉施設等の内装用品等が挙げられる。
【0066】
本発明の第2の実施の形態に係る殺菌方法は、硫黄ドープ二酸化チタン皮膜10を、抗菌性を有する水溶液及び殺菌対象物と接触させ、硫黄ドープ二酸化チタン皮膜10に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌、更には滅菌を行う。ここで、殺菌とは、微生物の数を激減させることを意味し、滅菌とは、微生物を完全に死滅させることを意味する。
殺菌対象物に特に限定はなく、抗菌性を有する水溶液に接触させることが可能な任意の物体に本方法を適用することができる。硫黄ドープ二酸化チタン皮膜10が形成された衛生部材そのものの殺菌に、本殺菌方法を適用してもよい。
殺菌の対象となる微生物についても特に限定されず、例えば、グラム陽性菌、グラム陰性菌等の細菌類、真菌類等が挙げられる。
【0067】
病原性大腸菌O−157等の感染による食中毒の発生防止のため、野菜等の植物の種子に対する殺菌に対しても本殺菌方法を適用することができる。菌体だけでなく、食中毒の原因となるベロ毒素等も、硫黄ドープ二酸化チタン皮膜10の光触媒作用によって併せて分解することができるため、食中毒の発生をより確実に抑制できる。更に、次亜塩素酸ナトリウム等の発芽率や発芽後の成長率に悪影響を及ぼすおそれがある殺菌剤の使用を抑制できるので、殺菌処理後の発芽率や成長率を損なうことが少ないという利点も有している。
殺菌の対象となる種子に特に制限はないが、一例として、カイワレダイコン、モヤシ等の、水耕栽培により栽培される野菜の種子が挙げられる。
【0068】
抗菌性を有する水溶液について特に制限はなく、それぞれの殺菌対象物に対して通常用いられる任意の抗菌物質を含む水溶液を用いることができるが、硫黄ドープ二酸化チタン皮膜10との相乗効果により殺菌活性が向上する抗菌物質を含む水溶液を用いることが好ましく、ビワ種子抽出物水溶液が最も好ましい。ビワ種子抽出物の濃度は、10〜500mg/mLであり、好ましくは50〜250mg/mL、より好ましくは100〜200mg/mLである。ビワ種子抽出物の濃度が10mg/mLを下回ると十分な殺菌活性が得られず、500mg/mLを上回ると、発芽後のカイワレダイコンの全長が短くなる等の成長阻害作用が見られるようになる。
【0069】
上記した硫黄ドープ二酸化チタン皮膜10を、抗菌性を有する水溶液及び殺菌対象物である種子と接触させる方法の具体例としては、図5(A)がある。
図5(A)に示すように、深さが浅い容器40(例えば、シャーレ)内の底に硫黄ドープ二酸化チタン皮膜10を配置し、その表面に種子41を配置する。そして、容器40内に抗菌性を有する水溶液42を供給し、この水溶液42中に、硫黄ドープ二酸化チタン皮膜10と種子を浸漬させる。
これにより、容器40の上方に配置された光源43から、硫黄ドープ二酸化チタン皮膜10に可視光を照射して、水溶液42及び光触媒反応の作用により、殺菌、更には滅菌を行うことができる。なお、ここでは、二酸化チタン皮膜10、容器40、水溶液42、及び光源43が、殺菌装置を構成する。
【0070】
なお、硫黄ドープ二酸化チタン皮膜10は、図5(B)に示すように、種子41に近接配置してもよい。即ち、容器44の内側面に硫黄ドープ二酸化チタン皮膜10を取付け、種子41が入った抗菌性を有する水溶液42を、硫黄ドープ二酸化チタン皮膜10が浸漬するまで容器44内に供給する。
これにより、容器44の上方に配置された光源43から、硫黄ドープ二酸化チタン皮膜10に可視光を照射して、水溶液42及び光触媒反応の作用により、殺菌、更には滅菌を行うことができる。なお、ここでは、二酸化チタン皮膜10、容器44、水溶液42、及び光源43が、殺菌装置を構成する。
以上の方法では、硫黄ドープ二酸化チタン皮膜10を使用するに際し、抗菌性を有する水溶液42を用いているが、この水溶液42を使用することなく、殺菌対象物に接触又は近接配置させても、本発明の作用効果は得られる。この場合、水溶液42を除いたものが殺菌装置を構成する。
【実施例】
【0071】
次に、本発明の作用効果を確認するために行った実施例について説明する。ここで、図6はTiO2、Cu、S−TiO2、及びS−TiO2−Cu溶射皮膜の光触媒抗菌活性を示すグラフ、図7はカイワレダイコン種子の殺菌処理後の大腸菌数、発芽率及び発芽後の全長を示すグラフ、図8は大腸菌に対するS−TiO2+Cuの抗菌効果の説明図、図9は明条件での大腸菌に対するS−TiO2+Cuの抗菌効果の説明図、図10は暗条件での大腸菌に対するS−TiO2+Cuの抗菌効果の説明図、図11は明条件での黄色ブドウ球菌に対するS−TiO2+Cuの抗菌効果の説明図、図12は暗条件での黄色ブドウ球菌に対するS−TiO2+Cuの抗菌効果の説明図、図13は室内の明るさでの大腸菌に対する殺菌効果の説明図、図14は室内の明るさでの黄色ブドウ球菌に対する殺菌効果の説明図、図15は金属の違いによる大腸菌に対する抗菌効果の説明図、図16は金属の違いによる黄色ブドウ球菌に対する抗菌効果の説明図、図17は大腸菌に対する塩素の抗菌効果の説明図、図18は黄色ブドウ球菌に対する塩素の抗菌効果の説明図である。
【0072】
(1)硫黄ドープ二酸化チタンの製造
チオ尿素とチタンテトライソプロポキシド(Ti(OiPr)4)とをエタノール中で混合した。得られた溶液を減圧濃縮すると、スラリー状の混合物が得られた。これを室温で乾燥し、得られた粉末を空気中400〜600℃で焼成することにより、黄色粉末状の硫黄ドープ二酸化チタン(以下「S−TiO2」という)を得た。
【0073】
(2)スラリーの製造
原料微粒子10質量部、水90質量部、及びポリカルボン酸型高分子界面活性剤(花王製ポイズ532A)0.1質量部を混合し、超音波照射器で超音波照射を行い、均一なスラリーを得た。
スラリーの製造に用いた原料微粒子を表1に示す。
【0074】
【表1】

【0075】
(3)溶射皮膜の形成
上記(2)で得られたスラリーを、スラリーポンプを介して一定流量で霧化装置(霧化ノズル)に供給した。霧化装置に圧縮空気と高圧窒素ガスの混合ガスを供給してアトマイズした。このようにして得られたアトマイズ粉(霧状粒子)を溶射装置に供給し、フレーム温度600℃で、アルミニウム試験片(15mm×70mm×6mmt、20mm×20mm×6mmt、又は55mm×55mm×6mmt)の表面に高速フレーム溶射し、溶射皮膜を形成した。溶射皮膜を形成後、試験片をアセトンで洗浄し風乾した。
以下、表1のNo.X(Xは、1〜10の整数)に示す原料微粒子を用いて形成された溶射皮膜を、表1の番号を用いて「溶射皮膜No.X」と略称する。
【0076】
(4)可視光の照射による2−プロパノールの分解試験
光触媒活性の評価に広く用いられているメチレンブルーは、可視光(波長664nm)の照射により分解することが知られているので、可視光領域に吸収を有しない2−プロパノールを用いて、溶射皮膜No.1〜7による光触媒分解試験を行った。
2−プロパノールは、下記の反応式に示す光触媒酸化を受けてアセトンを生じる。
CH3CH(OH)CH3 → CH3COCH3+2(H)
【0077】
2−プロパノールの50mol/Lアセトニトリル溶液5mLを7本の石英ガラス製の試験管に取り、それぞれ溶射皮膜No.1〜7を形成した試験片(15mm×70mm×6mmt)を浸漬し、紫外線又は可視光用ロングパスフィルタ(カットオフ波長250nm、350nm、390nm、420nmの4種類のものを使用した)を取付けたXeランプで照射(1〜3時間)を行った。照射後、各試験管から溶液を採取し、ガスクロマトグラフィを用いてアセトン濃度を定量した。アセトン濃度の定量には、予め作成した検量線を使用した。
結果は、下記の表2に示すとおりである。なお、「N.D.」は、アセトン濃度がガスクロマトグラフィ法による検出限界以下であったことを示す。
【0078】
【表2】

【0079】
他の原子をドープしていないTiO2を原料とする溶射皮膜No.1は、可視光応答性を示さないことが確認された。また、可視光応答性を有するとの報告がなされているWO3を原料とした溶射皮膜No.2は、それ単独では可視光応答性、紫外光応答性のいずれをも示さず、TiO2と複合化した触媒皮膜No.3及びNo.4のいずれについても可視光応答性は確認されなかった。
S−TiO2を原料とする溶射皮膜No.5及びS−TiO2とWO3とを複合化した溶射皮膜No.6については、両者とも可視光の照射により光触媒活性を示すことが確認された。なお、溶射皮膜No.6の方が高い光触媒活性を示したのは、WO3との複合化による溶射被膜の厚膜化が原因であると考えられる。
窒素ドープTiO2を原料とする溶射皮膜No.7は、可視光の照射により光触媒活性を示さなかったが、溶射時の熱によって不活性化したと考えられる。
【0080】
(5)S−TiO2溶射皮膜の光触媒抗菌活性の検討
検定菌として、Escherichia Coli IFO 3972(以下「E.Coli」と略称する)を使用した。1L三角フラスコにニュートリエント・ブロス培地(NB培地)250mLを取り、オートクレーブ処理(121℃、20分)により滅菌した後、E.Coliを接種し、37℃で24時間振とう培養した。培養液を遠心分離(4200rpm、10分間)して上清を除去した後、滅菌水を添加して、細菌濃度約1.0×106CFU(コロニー形成単位)/mLのE.Coli懸濁液を調製した。溶射皮膜No.5、No.8、及びNo.9が形成されたアルミニウム試験片、(20mm×20mm×6mmt)及びブランクとして溶射皮膜が形成されていない同一サイズのアルミニウム板を用意し、紫外線を3時間照射して滅菌した。
滅菌したシャーレ(直径30mm)に、滅菌した試験片及びブランクをそれぞれ取り、E.Coli懸濁液各3mLを加えた。これらのシャーレに蓋をし、蛍光灯照射下(照度1200lux)30℃で放置した。照射開始から24時間経過後に、コロニーカウント法により残存細菌数を計測した。
結果は、下記の表3に示すとおりである。
【0081】
【表3】

【0082】
ブランクと溶射皮膜No.5との比較より、S−TiO2溶射皮膜は、可視光の照射によりE.Coliの生菌数を大きく減少させる効果があることがわかる。更に、これらの結果と溶射皮膜No.8及びNo.9との比較より、S−TiO2に銅を配合した溶射皮膜において、抗菌活性は更に向上することがわかる。
【0083】
(6)TiO2、Cu、S−TiO2、及びS−TiO2−Cu溶射皮膜の光触媒抗菌活性の検討
(5)と同様の方法により、細菌濃度約1.0×106CFU(コロニー形成単位)/mLのE.Coli懸濁液を調製した。
溶射皮膜No.1、No.5、No.9、及びNo.10が形成されたアルミニウム試験片、(55mm×55mm×6mmt)及びブランクとして溶射皮膜が形成されていない同一サイズのアルミニウム板を用意し、紫外線を3時間照射して滅菌した。
滅菌したシャーレ(直径30mm)に、滅菌した試験片及びブランクをそれぞれ取り、E.Coli懸濁液各30mLを加えた。これらのシャーレに蓋をし、蛍光灯照射下(照度1700lux)30℃で放置した。照射開始から5分、10分、30分、及び60分経過後に、コロニーカウント法により残存細菌数を計測した。
結果は、図6に示すとおりである。
【0084】
溶射皮膜No.1とNo.5との比較より、照射開始から1時間程度の短時間では、TiO2溶射皮膜の抗菌活性とS−TiO2溶射皮膜の抗菌活性との間には顕著な差は見られなかった。溶射皮膜No.10の観測結果から、銅を単独で溶射した溶射皮膜は高い抗菌活性を示し、60分後にはE.Coliの生菌数が観測限界以下となった。
溶射皮膜No.9の観測結果から、S−TiO2に銅を配合した溶射皮膜において、光触媒活性との相乗効果により抗菌活性は更に向上し、5分後にはE.Coliの生菌が観測されなくなるほど強力な抗菌活性を示すことがわかる。
【0085】
(7)カイワレダイコン種子の殺菌試験
(5)と同様の方法により、細菌濃度約1.0×107CFU(コロニー形成単位)/mLのE.Coli懸濁液を調製した。カイワレダイコンの種子を、E.Coli懸濁液200mLに5分間浸漬後種子を取り出し、40℃の乾燥機で、浸漬前の含水量になるまで乾燥したものを接種種子として使用した。
抗菌性を有する水溶液として、次亜塩素酸ナトリウム水溶液(500〜5000ppm)、及び殺菌作用を有することが知られているビワ種子抽出物水溶液(2006年6月に収穫した長崎県産茂木ビワの種子を水洗後、破砕機により微粉末化し、滅菌水中25℃で24時間抽出した)(50〜300mg/mL)を調製した。
抗菌性を有する水溶液又は滅菌水(ブランク)は、同一のものを2検体ずつ調製し、一方には溶射皮膜No.9が形成された試験片を入れた。接種種子を加えた後、蛍光灯で照射(照度950lux)しながら12時間放置した。接種種子を取り出し、滅菌水20mL中、22±1℃の暗所で4日間培養後、E.Coliの生菌数、発芽率及び発芽したカイワレダイコンの全長を測定した。
結果は、表4に示すとおりである。
【0086】
【表4】

【0087】
なお、表中「N.D.」は検出限界以下であったことを表す。
濃度100mg/mLのビワ種子抽出物水溶液及び溶射皮膜No.9が形成された試験片をそれぞれ単独で用いた場合(エントリー2、3)には、12時間の処理時間では十分に生菌数を減少させることができなかった。
しかし、溶射皮膜No.9が形成された試験片の存在下で抗菌性を有する水溶液としてビワ種子抽出物水溶液を用いた場合(エントリー4)は、生菌数が検出限界以下に低下していたにもかかわらず、高い発芽率(90%)を示すと共に、発芽後のカイワレダイコンの成長にも殆ど影響が見られなかった。このことから、ビワ種子抽出物水溶液を可視光応答型光触媒と組み合わせて使用することにより、カイワレダイコンの発芽や成長に悪影響を及ぼすことなく、相乗効果により殺菌効率を大きく向上させていることがわかる。
なお、表4には示していないが、抗菌性を有する水溶液として次亜塩素酸ナトリウム水溶液を使用した試料については、溶射皮膜No.9の存否に関わりなく、生菌数の減少が見られたものの、エントリー4では観測されなかった、発芽率やカイワレダイコンの全長の低下も併せて観測された。
【0088】
滅菌水又は抗菌性を有する水溶液(次亜塩素酸ナトリウム水溶液(500〜5000ppm)及びビワ種子抽出物水溶液(50〜300mg/mL))に分散させたカイワレダイコンの接種種子に、溶射皮膜No.9の存在下又は非存在下で光照射(照度950lux、30分間〜12時間)を行った後、接種種子を取り出し、滅菌水20mL中、22±1℃の暗所で4日間培養後、E.Coliの生菌数、発芽率及び発芽したカイワレダイコンの全長を測定した。結果を図7に示す。なお、図7において、大腸菌数が検出限界以下であった場合のデータ点については、log CFU/mL=0の位置に表示している。
溶射皮膜No.9の非存在下で次亜塩素酸ナトリウム水溶液を用いて殺菌処理を行った場合、発芽率が60%以下に低下してしまうことが確認された。次亜塩素酸ナトリウム濃度を低下させたり、処理時間を短縮することにより発芽率の改善を試みたところ、殺菌効果が失われる程濃度を低下させたにもかかわらず発芽率については改善が見られなかった。
溶射皮膜No.9の非存在下でビワ種子抽出物水溶液を用いて殺菌処理を行った場合、ビワ種子抽出物の濃度が150mg/mLである場合に(図7中の点a)、大腸菌数が最低(検出限界以下)となり、発芽率の顕著な低下が見られないものの、発芽後のカイワレダイコンの全長は、約2.5cmと短くなった。
【0089】
溶射皮膜No.9の存在下でビワ種子抽出物水溶液(濃度100mg/mL)を用いて殺菌処理を行ったところ、12時間光照射を行うことにより、大腸菌数は検出限界以下となった。更に、ほぼ100%近い発芽率が得られると共に、発芽後のカイワレダイコンの全長も5cm以上と良好であった(図7中の点b)。
これらの結果より、カイワレダイコンの種子の殺菌には、S−TiO2+Cu皮膜を、ビワ種子抽出物水溶液及びカイワレダイコンの種子と接触させ、可視光を照射して、ビワ種子抽出物の抗菌活性及びS−TiO2+Cuの光触媒活性の相乗効果を利用して殺菌を行うのが最も好ましいことがわかる。
【0090】
(8)他の抗菌評価試験
(8−1)培養法
検定菌として、Escherichia Coli IFO 3972(以下、大腸菌という)と、Staphylococcus Aureus IFO 12732(以下、黄色ブドウ球菌という)を使用した。1L三角フラスコにNB培地250mLを取り、オートクレーブ処理(121℃、20分)により滅菌した後、大腸菌と黄色ブドウ球菌を接種し、これを30℃、70rpmで24時間振とう培養した。この培養液を遠心分離(4200rpm、20分間)して上清を除去した後、滅菌水を添加して、細菌濃度約1.0×106CFU(コロニー形成単位)/mLの大腸菌と黄色ブドウ球菌の各懸濁液(水溶液)を調製した。
【0091】
(8−2)抗菌活性測定法
各種試験片をアセトン洗浄し、紫外線UVで12時間照射して、微生物を排除した。そして、滅菌したシャーレ(直径90mm)に、上記滅菌した試験片及びブランク(原液)をそれぞれ取り、各懸濁液を30mLずつ加えた。これらのシャーレに蓋をし、設定温度を30℃とした明条件と暗条件の各環境下で、測定開始から5分、10分、30分、60分、120分、180分の経過時間ごとに、コロニーカウント法により残存細菌数を経時的に計測した。
【0092】
(8−3)試験結果
(8−3−1)S−TiO2とCu併用の抗菌効果(大腸菌)の検討
試験片に、S−TiO2+Cu、S−TiO2、及びTiO2を使用し、検定菌に大腸菌を使用した。これを、設定温度が30℃の明条件(蛍光灯・照度950lux)の環境下に配置し、残存細菌数を経時的に計測した。この結果を、図8に示す。
図8から明らかなように、試験片に硫黄をドープしたTiO2を使用した場合の抗菌効果は、試験片との接触時間が180分程度で、大腸菌の減少量が4オーダー(1万分の1、以下同様)程度であった。一方、試験片にS−TiO2+Cuを使用した場合の抗菌効果は、試験片との接触時間がわずか5分程度で、大腸菌を6オーダー(100万分の1、以下同様)まで、急激に減少できることを確認できた。
【0093】
(8−3−2)Cu存在比の違いによる抗菌効果(大腸菌)の検討
試験片に、表面のCu存在比が1質量%〜20質量%となるように調整したS−TiO2+Cuを使用し、検定菌に大腸菌を使用した。
図9に示すように、設定温度が30℃の明条件(蛍光灯・照度950lux)の環境下では、S−TiO2中のCu存在比が4質量%、5質量%、7質量%の試験片は、試験片との接触時間が5分程度で、大腸菌の減少量が6オーダー程度であった。なお、図9において、Cu存在比が4質量%(×)と7質量%(△)は、5質量%(■)と同様の挙動を示している。また、10質量%の試験片は、試験片との接触時間が10分程度で、大腸菌の減少量が6オーダー程度であった。なお、S−TiO2中のCu存在比が12質量%以上の試験片と3質量%以下の試験片では、抗菌機能性の低下が認められた。
一方、暗条件では、図10に示すように、全く抗菌効果が認められなかった。
【0094】
(8−3−3)S−TiO2とCu併用の抗菌効果(黄色ブドウ球菌)の検討
上記した大腸菌はグラム陰性菌であり、細胞壁が10nm程度と薄いのが特徴である。これに対して、グラム陽性菌はペプチドグリカン層に覆われ、細胞壁が厚い構造をとっていることから、このような検定菌として黄色ブドウ球菌を用い、同様に抗菌効果を調べた。
図11に示すように、S−TiO2中のCu存在比が4質量%、7質量%、10質量%の試験片は、試験片との接触時間が5分程度で、黄色ブドウ球菌の減少量が6オーダー程度であった。なお、図11において、Cu存在比が4質量%(×)と7質量%(△)は、10質量%(▲)と同様の挙動を示している。また、5質量%の試験片は、試験片との接触時間が10分程度で、黄色ブドウ球菌の減少量が6オーダー程度であった。なお、S−TiO2中のCu存在比が12質量%以上の試験片と3質量%以下の試験片では、抗菌機能性の低下が認められた。
一方、暗条件では、図12に示すように、全く抗菌効果が認められなかった。
【0095】
(8−3−4)照度の違いによる抗菌効果の検討
検定菌に大腸菌と黄色ブドウ球菌をそれぞれ用い、蛍光灯で照度1700luxと650(600〜700)luxにおける抗菌効果を調べた。この大腸菌の結果を図13に、黄色ブドウ球菌の結果を図14に、それぞれ示す。
図13、図14から明らかなように、光強度が650luxに低下したときでも、試験片との接触時間が60分以上であれば、大腸菌と黄色ブドウ球菌のいずれも、その減少量が6オーダー程度の抗菌効果があることを確認できた。
従って、照度が600ルックス以上の蛍光灯を可視光の発光源として使用する場合、その照射時間を60分以上とすることで、十分な抗菌効果が得られる。
【0096】
(8−3−5)添加金属の違いによる抗菌効果の検討
銅以外にも、抗菌効果のあることで知られている銀やニッケルを、同じくS−TiO2に10質量%加えて、抗菌効果の比較を行った。大腸菌の結果を図15に、黄色ブドウ球菌の結果を図16に、それぞれ示す。なお、図15、図16は、それぞれ設定温度が30℃の明条件(蛍光灯・照度950lux)と暗条件の各環境下で試験を行った結果である。
図15、図16から明らかなように、明条件において、S−TiO2に銀又はニッケルを混合した場合、銅の結果(5分で6オーダー)には、はるかに及ばない結果であったが、試験片との接触時間が120分程度で、その減少量が6オーダー程度の抗菌効果が認められた。
一方、暗条件では、いずれの場合も抗菌効果が認められなかった。
【0097】
(9)塩素による抗菌評価試験
一般的に利用されている塩素の殺菌効果の結果を、図17、図18にそれぞれ示す。なお、図17は、検定菌として大腸菌を使用した場合の結果であり、図18は検定菌として黄色ブドウ球菌を使用した場合の結果である。
この試験は、前記した本願発明のS−TiO2とCu併用の抗菌効果と同様の結果、即ち、5分程度で生菌数を0にするために、塩素濃度をどの程度まで上昇させる必要があるのかを検討したものである。このため、図17、図18においては、塩素濃度を、0mg/L、0.05mg/L、0.1mg/L、0.2mg/L、0.4mg/L、及び0.8mg/Lにそれぞれ調整した場合の生菌数を検討した。
【0098】
図17から明らかなように、検定菌として大腸菌を使用した場合、本願発明と同程度の抗菌効果を得るには、塩素濃度を0.4mg/L以上とする必要があることが分かった。
また、図18から明らかなように、検定菌として黄色ブドウ球菌を使用した場合、本願発明と同程度の抗菌効果を得るには、塩素濃度を0.8mg/L以上とする必要があることが分かった。
なお、通常の水道水では、塩素濃度が0.2mg/L程度であることから、本願発明と同程度の抗菌効果を得るには、塩素濃度を非常に高める必要があることが分かった。
以上のことから、本願発明の可視光応答型光触媒皮膜は、従来法と比較して殺菌効果を非常に高めることができることを確認できた。
【0099】
本発明は、前記した実施の形態に限定されるものではなく、本発明の要旨を変更しない範囲での変更は可能であり、例えば、前記したそれぞれの実施の形態や変形例の一部又は全部を組み合わせて本発明の可視光応答型光触媒皮膜とその製造方法及びそれらを用いた殺菌方法並びに殺菌装置を構成する場合も本発明の権利範囲に含まれる。
例えば、前記実施の形態の可視光応答型光触媒皮膜において、可視光応答型光触媒として硫黄ドープ二酸化チタンを用いたが、窒素原子又は炭素原子をドープした二酸化チタン等の他の材料を用いてもよい。
また、前記実施の形態に係る可視光応答型光触媒皮膜の製造方法においては高速溶射フレーム法を用いたが、可視光応答型光触媒と抗菌性を有する金属とを含むエアロゾル状の微粒子を、一定の温度で基材に噴射するのにコールドスプレー法を用いてもよい。コールドスプレー法においては、原料微粒子をより低温下(例えば、200℃)で、ある一定速度(例えば、500m/秒)の高速で基材に噴射することにより製膜を行う方法である。原料微粒子への入熱量が少ないので、二酸化チタン結晶格子にドープした原子の消失を抑制できる。
【0100】
なお、前記実施の形態の可視光応答型光触媒皮膜において、抗菌性を有する金属の微粒子として銅の微粒子を用いたが、銅合金、銀又は銀合金、亜鉛又は亜鉛合金、アルミニウム又はアルミニウム合金、ニッケル又はニッケル合金、コバルト又はコバルト合金、鉄又は鉄合金のいずれかの微粒子を用いてもよい。これらの金属の微粒子は単独で用いてもよく、任意の2以上を任意の割合で混合して用いてもよい。
これらの金属のうち、比較的融点の低い亜鉛(419.5℃)、アルミニウム(660.4℃)、銀(961℃)、及び銅(1083℃)は、可視光応答型溶射皮膜のバインダーとしても作用するので、その機械的強度及び耐剥離強度を向上させる効果も有している。
【符号の説明】
【0101】
10:硫黄ドープ二酸化チタン皮膜、11:霧状粒子、12:基材、21:容器、22:加圧器、22a:窒素ボンベ、23:スラリーポンプ、24:霧化ノズル、25:空気流入口、26:排出口、27:スラリー流入口、28:霧化室、29:溶射フレーム、30:溶射装置、31:溶射ガン、32:混合手段、40:容器、41:種子、42:水溶液、43:光源、44:容器
【技術分野】
【0001】
本発明は、可視光応答型光触媒皮膜とその製造方法及びそれらを用いた殺菌方法に係り、更に詳細には、可視光の照射下で高い抗菌活性を有する可視光応答型光触媒皮膜の製造方法、並びに可視光応答型光触媒皮膜を用いた殺菌方法に関する。
【背景技術】
【0002】
高齢化社会の進展により、免疫力の低下した高齢者の全人口に占める割合が増加傾向にある。それに伴い、院内感染や食中毒の予防の観点から、医療現場や食品生産及び加工現場における衛生管理の強化が喫緊の課題となっている。このような社会的背景を受けて、様々な抗菌加工製品が開発されており、近年、抗菌加工への光触媒機能の利用が特に注目を集めている。
特に二酸化チタンを用いた光触媒は、安価で、化学的安定性に優れ、かつ高い触媒活性を有し、その強力な有機物分解活性により、細菌の菌体と同時に、グラム陰性菌の細胞壁外膜成分であるエンドトキシンや細菌が産生する毒素(病原性大腸菌の産生するベロ毒素等)等の有害物質を併せて分解することができ、しかも光触媒自体は人体に無害であるという利点を有している。そのため、食品容器、布帛、建材等の抗菌加工に二酸化チタン光触媒が広く用いられている(例えば、特許文献1及び2参照)。
【0003】
しかし、二酸化チタンは紫外線照射下でしか光触媒活性を発現しないため、紫外線成分を殆ど含まない室内光の下では十分な触媒活性を発現することができない。そこで、窒素、炭素、硫黄等の原子を結晶格子中にドープした二酸化チタンが、可視光照射下で光触媒活性を発現する光触媒として提案されている。特に硫黄ドープ二酸化チタンは、可視領域における吸光係数が高く、可視光で高い触媒活性を有している(例えば、特許文献3参照)。
一方、基質の表面に二酸化チタン光触媒皮膜を形成するための種々の方法が提案されている。二酸化チタン光触媒皮膜の形成方法の例としては、ゾル−ゲル法(例えば、非特許文献1参照)等の溶液法、及びスパッタリング法、イオンクラスタービーム法、CVD(化学蒸着)法、溶射法(例えば、特許文献4参照)等の乾式法が挙げられる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2007−51263号公報
【特許文献2】特開2006−346651号公報
【特許文献3】特開2004−143032号公報
【特許文献4】特開2006−51439号公報
【非特許文献】
【0005】
【非特許文献1】古南 博、大谷 文章著、「電気化学」、電気化学会、1998年、第66巻、p.996
【発明の概要】
【発明が解決しようとする課題】
【0006】
前記従来の光触媒皮膜の形成方法のうち、溶射法は、高価な真空機器を必要としない、多様な基材の表面に密着強度に優れた光触媒被膜を形成することができる、大面積の被膜の形成にも適用可能である等の多くの利点を有している。しかしながら、一般の溶射法では、溶射材料への入熱を確保するために溶射温度が700℃以上になるが、このような高温下では、可視光応答型光触媒において二酸化チタンにドープされている原子が消失してしまう(例えば、硫黄原子の場合、600℃以上に加熱すると一部が消失し、800℃以上に加熱すると完全に消失することが知られている)。そのため、従来の高速フレーム溶射法は、そのままでは可視光応答型光触媒被膜の形成に適用できないという課題があった。
また、仮に、窒素、炭素、硫黄等の原子を結晶格子中にドープした二酸化チタンを使用して、可視光応答型光触媒被膜を形成したとしても、その殺菌効果を更に向上させるには限界があった。
【0007】
本発明はかかる事情に鑑みてなされたもので、触媒活性を低下させることなく成膜を行うことが可能で、可視光の照射下で高い抗菌活性を有する可視光応答型光触媒皮膜の製造方法並びに可視光応答型光触媒皮膜を用いた殺菌方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
前記目的に沿う第1の発明に係る可視光応答型光触媒皮膜は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射法又はコールドスプレー法を用いて基材の表面に成膜している。
前記目的に沿う第2の発明に係る可視光応答型光触媒皮膜は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射温度が300〜700℃の溶射法を用いて基材の表面に成膜している。
ここで、溶射温度を300〜700℃とすることにより、溶射材料(混合物)への十分な入熱を確保しつつ、溶射材料の温度を600℃以下に保つことができる。そのため、可視光応答型光触媒において二酸化チタンにドープされている原子の消失が抑制され、高い可視光応答性を保持することができると共に、抗菌性を有する金属との相乗効果により、抗菌活性を向上させることができる。
【0009】
第1、第2の発明に係る可視光応答型光触媒皮膜において、前記溶射法がフレーム温度300〜700℃の高速フレーム溶射法であることが好ましい。なお、「フレーム温度」とは、溶射ガン先端から200mmの位置で測定した温度をいう。
この場合において、前記基材の融点が300〜700℃であることが好ましい。
【0010】
第3の発明に係る可視光応答型光触媒皮膜において、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射温度が50〜300℃のコールドスプレー法を用いて基材の表面に成膜している。
ここで、溶射温度が50〜300℃のコールドスプレー法を用いることにより、溶射材料(混合物)への十分な入熱を確保しつつ、溶射材料の温度を600℃以下に保つことができる。そのため、可視光応答型光触媒において二酸化チタンにドープされている原子の消失が抑制され、高い可視光応答性を保持することができる。
【0011】
第1〜第3の発明に係る可視光応答型光触媒皮膜において、前記抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であることが好ましい。
なお、本発明において「銀系の金属」とは、銀及び銀合金(例えば、銀を50質量%以上、更には80質量%以上含む合金)のいずれかを意味する。同様に、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属とは、それぞれ、それらの金属の単体又は合金(例えば、その金属を50質量%以上、更には80質量%以上含む合金)を意味する。
【0012】
第4の発明に係る可視光応答型光触媒皮膜の製造方法は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、高速フレーム溶射法又はコールドスプレー法を用いて基材の表面に成膜する工程を有する。
【0013】
第5の発明に係る可視光応答型光触媒皮膜の製造方法は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、フレーム温度300〜700℃の高速フレーム溶射法を用いて基材の表面に成膜する工程を有する。
【0014】
第6の発明に係る可視光応答型光触媒皮膜の製造方法は、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射温度50〜300℃のコールドスプレー法を用いて基材の表面に成膜する工程を有する。
【0015】
第4〜第6の発明に係る可視光応答型光触媒皮膜の製造方法において、前記抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であることが好ましい。
【0016】
第4〜第6の発明に係る可視光応答型光触媒皮膜の製造方法において、前記混合物を、水及び有機溶媒のいずれか一方又は双方を含む分散媒中に分散したスラリーを霧化した霧状粒子を溶射フレーム中に投入してもよい。
例えば、可視光応答型光触媒の微粒子及び抗菌性を有する金属の微粒子を分散媒中に分散したスラリーを霧化した霧状粒子を高速溶射フレーム中に投入することにより、分散媒の蒸発潜熱を利用して従来の高速フレーム溶射よりも低いフレーム温度での溶射が可能になる。
【0017】
第4〜第6の発明に係る可視光応答型光触媒皮膜の製造方法において、前記スラリー中の前記可視光応答型光触媒の濃度が1〜30質量%であることが好ましい。
スラリー中の可視光応答型光触媒の濃度を上記範囲内とすることにより、スラリーの分散性及び流動性が保たれ、スラリー供給装置の目詰まり等を起こすことなく、ムラのない可視光応答型光触媒皮膜を形成することができる。
【0018】
第4〜第6の発明に係る可視光応答型光触媒皮膜の製造方法において、前記スラリー中の前記抗菌性を有する金属の濃度が1〜30質量%であることが好ましい。
【0019】
第7の発明に係る殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び殺菌対象物と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行う。
【0020】
第8の発明に係る殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して該水溶液中の殺菌対象物に近接配置し、該可視光応答型光触媒皮膜に可視光を照射して、前記抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行う。
【0021】
第7及び第8の発明に係る殺菌方法において、前記抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であることが好ましい。
【0022】
第9の発明に係る殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、殺菌対象物に接触又は近接配置させ、該可視光応答型光触媒皮膜に可視光を照射して、光触媒反応の作用により殺菌を行う。
【0023】
第10の発明に係る植物の種子の殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び植物の種子と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行う。
【0024】
第11の発明に係る植物の種子の殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して該水溶液中の植物の種子に近接配置し、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行う。
【0025】
第10及び第11の発明に係る植物の種子の殺菌方法において、前記抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であってもよい。
【0026】
第12の発明に係る水溶液の殺菌方法は、第1〜第3の発明に係る可視光応答型光触媒皮膜を、大腸菌又は黄色ぶどう球菌を含む水溶液と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、光触媒反応により前記水溶液の殺菌を行う。
【0027】
第12の発明に係る水溶液の殺菌方法において、前記可視光の発光源として、600ルックス以上の蛍光灯を使用することが好ましい。
第12の発明に係る水溶液の殺菌方法において、前記蛍光灯の照射時間は60分以上であることが好ましい。
【0028】
第13の発明に係る殺菌装置は、第7〜第9の発明に係る殺菌方法を用いた殺菌装置である。
【発明の効果】
【0029】
請求項1〜6記載の可視光応答型光触媒皮膜においては、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒と、抗菌性を有する金属とを含む。そのため、可視光の吸光係数が高く、紫外光を殆ど含まない室内光の下でも高い抗菌活性を示すと共に、抗菌性を有する金属との相乗効果により抗菌活性が向上している。
また、可視光応答型光触媒皮膜は溶射法又はコールドスプレー法を用いて形成されるので、高価な真空機器等を用いることなく、様々な材質及び面積の基材の表面上に、均一で強固な皮膜を安価かつ簡便に形成することができる。
【0030】
特に、請求項3記載の可視光応答型光触媒皮膜においては、その形成に用いられる溶射法が高速フレーム溶射法であるので、可視光応答型光触媒と抗菌性を有する金属の微粒子は、1000m/s以上の高速で基材上に噴射される。そのため、成膜された可視光応答型光触媒皮膜は高い密着強度を有し、耐久性に優れ、長寿命である。
また、フレーム温度が300〜700℃であるので、二酸化チタン結晶格子中にドープされた窒素、炭素、及び硫黄原子が溶射中に消失するのを抑制できる。そのため、得られた皮膜は、高い可視光応答性を保持している。
【0031】
請求項4記載の可視光応答型光触媒皮膜においては、基材が300〜700℃に融点を有するので、高速フレーム溶射による可視光応答型光触媒皮膜の形成の際に基材の表面への融着が起こる。従って、皮膜の接着強度を更に向上することができる。
【0032】
請求項6記載の可視光応答型光触媒皮膜においては、抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であるので、高い抗菌性を有する。
【0033】
請求項7〜13記載の可視光応答型光触媒皮膜の製造方法においては、窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、高速フレーム溶射法又はコールドスプレー法を用いて基材の表面に成膜するので、高価な真空機器等を用いることなく、様々な材質及び面積の基材の表面上に、均一で強固な皮膜を安価かつ簡便に形成することができる。また、高速フレーム溶射法は、可視光応答型光触媒と抗菌性を有する金属の微粒子が、1000m/s以上の高速で基材上に噴射されるため、成膜された可視光応答型光触媒皮膜は高い密着強度を有し、耐久性に優れ、長寿命である。
【0034】
特に、請求項8記載の可視光応答型光触媒皮膜の製造方法においては、フレーム温度が300〜700℃の範囲内であるので、二酸化チタン結晶格子中にドープされた窒素、炭素、及び硫黄原子が溶射中に消失するのを抑制できる。そのため、得られた皮膜は、高い可視光応答性を保持している。
【0035】
請求項10記載の可視光応答型光触媒皮膜の製造方法においては、抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であるので、得られる可視光応答型光触媒皮膜は高い抗菌性を有する。
【0036】
請求項11記載の可視光応答型光触媒皮膜の製造方法においては、混合物の微粒子を水及び有機溶媒のいずれか一方又は双方の分散媒中に分散したスラリーを霧化した霧状粒子を溶射フレーム中に投入しているので、分散媒の蒸発潜熱を利用して従来の高速フレーム溶射よりも低いフレーム温度での溶射が可能になる。そのため、可視光応答型光触媒において二酸化チタン結晶格子中にドープした原子が溶射により消失するのを抑制でき、可視光応答性が保たれた可視光応答型光触媒皮膜を製造することができる。
【0037】
請求項12記載の可視光応答型光触媒皮膜の製造方法においては、スラリー中の可視光応答型光触媒の濃度が1〜30質量%であるので、光触媒活性発現のために十分な膜厚を有し、剥離強度が高く、かつムラのない可視光応答型光触媒皮膜を高い効率で形成することができる。
【0038】
請求項13記載の可視光応答型光触媒皮膜の製造方法においては、抗菌性を有する金属の含有量がスラリーの1〜30質量%であるので、高い抗菌活性と光触媒活性とを併せ持つ。
【0039】
請求項14及びこれに従属する請求項16記載の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び殺菌対象物と接触させ、可視光応答型光触媒皮膜に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌(微生物の数を激減させる)効率、更には滅菌(微生物を完全に死滅させる)効果を有する。
【0040】
請求項15及びこれに従属する請求項16記載の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して水溶液中の殺菌対象物に近接配置し、可視光応答型光触媒皮膜に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有する。
【0041】
特に、請求項16記載の殺菌方法においては、抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であるので、可視光応答型光触媒皮膜との相乗効果により特に高い抗菌活性を有する。
【0042】
請求項17記載の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、殺菌対象物に接触又は近接配置させ、可視光応答型光触媒皮膜に可視光を照射して、光触媒反応の作用により殺菌を行うので、光触媒反応を単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有する。
【0043】
請求項18及びこれに従属する請求項20記載の植物の種子の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び植物の種子と接触させ、可視光応答型光触媒皮膜に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有すると共に、種子の発芽率が殺菌により低下しない。
【0044】
請求項19及びこれに従属する請求項20記載の植物の種子の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して水溶液中の植物の種子に近接配置し、可視光応答型光触媒皮膜に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有すると共に、種子の発芽率が殺菌により低下しない。
【0045】
特に、請求項20記載の植物の種子の殺菌方法においては、抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であるので、殺菌後の種子の発芽率を保持しつつ、可視光応答型光触媒皮膜との相乗効果により特に高い抗菌活性を有する。
【0046】
請求項21〜23記載の水溶液の殺菌方法においては、請求項1〜6記載の可視光応答型光触媒皮膜を、大腸菌又は黄色ぶどう球菌を含む水溶液と接触させ、可視光応答型光触媒皮膜に可視光を照射して、光触媒反応により水溶液の殺菌を行うので、抗菌剤及び光触媒反応をそれぞれ単独で用いた場合に比べて高い殺菌効率、更には滅菌効果を有する。
【0047】
特に、請求項22記載の水溶液の殺菌方法においては、可視光の発光源として、600ルックス以上の蛍光灯を使用するので、殺菌効率、更には滅菌効果を、更に高めることができる。
請求項23記載の水溶液の殺菌方法においては、蛍光灯の照射時間は60分以上であるので、殺菌効率、更には滅菌効果を、更に高めることができる。
【図面の簡単な説明】
【0048】
【図1】本発明の第1の実施の形態に係る可視光応答型光触媒皮膜の製造方法の説明図である。
【図2】同可視光応答型光触媒皮膜の製造方法で使用される原料供給装置の説明図である。
【図3】(A)は同可視光応答型光触媒皮膜の製造方法で使用される霧化ノズルの説明図、(B)は霧化ノズルの内部構造を示す説明図である。
【図4】同可視光応答型光触媒皮膜の製造方法で使用される高速溶射装置の説明図である。
【図5】(A)は本発明の第2の実施の形態に係る殺菌方法の説明図、(B)は他の殺菌方法の説明図である。
【図6】TiO2、Cu、S−TiO2、及びS−TiO2+Cu溶射皮膜の光触媒抗菌活性を示すグラフである。
【図7】カイワレダイコン種子の殺菌処理後の大腸菌数、発芽率及び発芽後の全長を示すグラフである。
【図8】大腸菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図9】明条件での大腸菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図10】暗条件での大腸菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図11】明条件での黄色ブドウ球菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図12】暗条件での黄色ブドウ球菌に対するS−TiO2+Cuの抗菌効果の説明図である。
【図13】室内の明るさでの大腸菌に対する殺菌効果の説明図である。
【図14】室内の明るさでの黄色ブドウ球菌に対する殺菌効果の説明図である。
【図15】金属の違いによる大腸菌に対する抗菌効果の説明図である。
【図16】金属の違いによる黄色ブドウ球菌に対する抗菌効果の説明図である。
【図17】大腸菌に対する塩素の抗菌効果の説明図である。
【図18】黄色ブドウ球菌に対する塩素の抗菌効果の説明図である。
【発明を実施するための形態】
【0049】
続いて、添付した図面を参照しつつ、本発明を具体化した実施の形態につき説明し、本発明の理解に供する。
図1に示すように、本発明の第1の実施の形態に係る可視光応答型光触媒皮膜の製造方法によって成膜された可視光応答型光触媒皮膜の一例である硫黄ドープ二酸化チタン皮膜10は、二酸化チタンの結晶格子中に硫黄原子がドープされた硫黄ドープ二酸化チタン(可視光応答型光触媒の一例)の微粒子と銅(抗菌性を有する金属の一例)の微粒子とを含む混合物を原料として用いて形成されている。
硫黄ドープ二酸化チタンの微粒子と銅の微粒子とを有する混合物を分散媒の一例である水中に分散したスラリーを霧化した霧状粒子11を溶射フレーム29(図4参照)中に投入し、フレーム温度(溶射温度)300〜700℃で高速フレーム溶射する(溶射法の一例である高速フレーム溶射法を用いる)ことにより基材12の表面に硫黄ドープ二酸化チタン皮膜10が形成される。
【0050】
なお、基材12としては、例えば、コンクリート、セラミックスタイルガラス、金属繊維、ガラス繊維、活性炭素繊維、セラミックス繊維、プラスチック、金属等が挙げられる。基材12として用いられる金属繊維、ガラス繊維、活性炭素繊維、及びセラミックス繊維は、布帛状であってもよく、不織布状であってもよい。
基材12として金属を用いる場合には、高速フレーム溶射による硫黄ドープ二酸化チタン皮膜10の形成時に、溶射皮膜からの入熱により表面の一部が融解又は軟化して融着が起こり、硫黄ドープ二酸化チタン皮膜10の接着強度が向上する。そのため、融点が300〜700℃である金属材料が好ましい。このような金属材料の具体例としては、アルミニウム(660.4℃)及び亜鉛(419.5℃)が挙げられる。或いは、これらの金属を表面にめっきしためっき鋼板等でもよく、アルミニウム亜鉛の合金がめっきされたガルバリウム鋼板等でもよい。また、アルミニウムの表面は厚さ数μm〜数十μmのアルマイト処理がされていてもよい。
基材12の形状及び大きさに特に制限はなく、装置や建造物等の構造体を構成するものであってもよい。ただし、光触媒機能を発揮するためには、基材12は構造体の表面に位置することが好ましい。
【0051】
硫黄ドープ二酸化チタン皮膜10を構成する硫黄ドープ二酸化チタンは、二酸化チタン結晶格子中のTi4+が4価の硫黄陽イオン(S4+)に置換された構造を有している。このように、Ti4+の一部をS4+で置換することにより、価電子帯上端のエネルギー準位が上昇してバンドギャップが狭くなるので、吸収端が可視光領域にシフトし、可視光応答性が発現すると考えられている。
【0052】
硫黄ドープ二酸化チタンは、公知の方法を用いて製造することができる。製造方法の一例としては、チオ尿素等の硫黄源を混合したチタンアルコキシドを原料とするゾル−ゲル法が挙げられる。
【0053】
スラリーを高速フレーム溶射して基材12の表面に硫黄ドープ二酸化チタン皮膜10を形成する際のフレーム温度は、300〜700℃、好ましくは400〜700℃、より好ましくは400〜600℃である。フレーム温度が700℃を超えると、硫黄ドープ二酸化チタン微粒子への入熱量が大きくなりすぎてドープした硫黄原子が完全に消失し、可視光応答特性が失われてしまう。また、フレーム温度が300℃を下回ると硫黄ドープ二酸化チタン及び金属銅の微粒子への入熱が不十分となるため、十分な膜厚及び剥離強度を有する硫黄ドープ二酸化チタン皮膜10の成膜が困難となる。
【0054】
なお、高速フレーム溶射の代わりに、従来公知のコールドスプレー法を用いてもよい。この場合、溶射温度を50〜300℃、好ましくは、100〜250℃、より好ましくは100〜200℃にする。ここで、300℃とは、コールドスプレー法の上限温度であり、一方温度が50℃を下回ると硫黄ドープ二酸化チタン及び金属銅の微粒子への入熱が不十分となるため、十分な膜厚及び剥離強度を有する硫黄ドープ二酸化チタン皮膜10の成膜が困難となる。
【0055】
上述したとおり、硫黄の消失を抑制及び防止するために、硫黄ドープ二酸化チタン皮膜10の作製の際には、フレーム温度700℃以下で高速フレーム溶射を行う必要がある。そのため、原料として使用する硫黄ドープ二酸化チタン及び金属銅の微粒子は、スラリー状の混合物として水と共に、撹拌機能を備え、窒素ボンベ22aからの高圧窒素ガスで加圧された加圧器22とスラリーポンプ23とを含む原料供給装置(図2参照)を用いて溶射フレームまで搬送する。
原料粉である硫黄ドープ二酸化チタン微粒子、金属銅微粒子、及び水を容器21に投入し、撹拌することによりスラリーを調製する。
【0056】
スラリー中の硫黄ドープ二酸化チタン微粒子の量は、1〜30質量%であり、好ましくは3〜15質量%であり、より好ましくは5質量%〜10質量%である。スラリー中の硫黄ドープ二酸化チタン微粒子の量が30質量%を上回ると、高速フレーム溶射後の冷却時における硫黄ドープ二酸化チタン皮膜10と基材12との熱膨張率の違いに起因して硫黄ドープ二酸化チタン皮膜10の内部に応力が発生し、亀裂を生じる原因となる。また、スラリー中の硫黄ドープ二酸化チタン微粒子の量が1質量%を下回ると、得られる硫黄ドープ二酸化チタン皮膜10の膜厚が小さくなりすぎ、十分な光触媒活性が発現しなくなる。
硫黄ドープ二酸化チタン微粒子の直径は、例えば、0.5〜10μmであり、好ましくは1〜5μmである。硫黄ドープ二酸化チタン微粒子の直径が10μmを上回ると分散性が低下し、0.5μmを下回ると、微粒子の運動エネルギーが低下するため製膜が困難になる。
【0057】
金属銅微粒子の添加量は、スラリーの1〜30質量%であることが好ましく、3〜30質量%であることが更に好ましく、5〜10質量%であることがより好ましい。金属銅微粒子の添加量が30質量%を上回ると、沈殿や偏析によりスラリー中での分散性が低下する。また、金属銅微粒子の添加量が1質量%を下回ると、十分な抗菌活性が発現しなくなる。
また、金属銅微粒子の直径は、例えば、0.5〜10μmであり、好ましくは5μmである。金属銅微粒子の直径が10μmを上回ると沈降や偏析が起こりやすくなり、0.5μmを下回ると、二次凝集が起こりやすくなる。
なお、硫黄ドープ二酸化チタン微粒子及び金属銅微粒子の直径は、動的光散乱法等の公知の方法を用いて測定される。
【0058】
なお、硫黄ドープ二酸化チタン微粒子及び金属銅微粒子のスラリー中への分散性を向上させるために、撹拌の代わりに、あるいは撹拌と同時に超音波照射を行ってもよい。
また、ノニオン系又はアニオン系の界面活性剤を分散剤として混合物に添加してもよい。好ましい界面活性剤としては、例えば、ポリカルボン酸系高分子界面活性剤等のアニオン系高分子界面活性剤が挙げられる。界面活性剤の添加量は、硫黄ドープ二酸化チタン微粒子及び金属銅微粒子の0.5〜3質量%程度が好ましい。
更に、分散媒として水の代わりにアルコール(有機溶液の一例)を使用することも可能であり、また水とアルコールとの混合液を使用することも可能である。
【0059】
このようにして得られたスラリーを、撹拌機能を備えた加圧器22に投入した後、スラリーポンプ23により所定量ずつ、図3(A)、(B)に示す霧化ノズル24へ搬送する。
この霧化ノズル24は、ほぼ円筒状となったものであり、一方側には圧搾空気が吹き込まれる空気流入口25が設けられ、他方側には霧化した霧状粒子を噴出する排出口26が設けられ、側部にはスラリーが流入するスラリー流入口27が設けられている。
この霧化ノズル24内部の霧化室28内に、スラリー流入口27を介して流入したスラリーを供給すると共に、この混合液に対し空気流入口25を介して流入した圧搾空気を吹き付け、混合液を霧状にする。霧状粒子11は、排出口26から排出され、溶射フレーム(火炎)29を形成する溶射装置30の溶射原料入口(図4参照)へ供給される。このように、溶射装置30への搬送過程、即ち溶射フレーム29への投入前にスラリーを霧化することで、原料微粒子である硫黄ドープ二酸化チタン微粒子及び金属銅微粒子の凝集を抑制、更には防止して、溶射フレーム29まで所定量ずつ安定に供給し、霧状粒子11を溶射できる。また、原料微粒子と共に供給された水の蒸発潜熱により、溶射フレーム29の温度を300〜700℃の低温に保つことができる。
【0060】
霧状粒子11の溶射において、基材12の表面に硫黄ドープ二酸化チタン皮膜10を形成するためには、低温度の高速溶射を行う必要があり、その装置として、例えば、特開2005−68457号公報に記載された溶射温度可変型の高速溶射装置(以下、単に溶射装置ともいう)30を使用することができる。
図4に示すように、溶射装置30は、高圧燃焼支援ガス(O2+空気)及びガス燃料によって形成された高速の溶射フレーム29と共に、溶射原料(霧化ノズル24から排出された霧状粒子11)を基材12に対して噴出して皮膜10を形成する溶射ガン(溶射ガンバレル)31を備えている。
【0061】
溶射ガン31の上流側には、所定の混合比率に調整された高圧の酸素ガス及び空気を予め混合して高圧の燃焼支援ガスを製造する混合手段(例えば、スタティックミキサ)32が設けられ、酸素ガス量に対する燃料量又は燃料量に対する酸素ガス量を増減させて、溶射フレーム29の温度を可変可能に調整できるものである。この溶射装置30を使用し、溶射原料を形成された溶射フレーム29中に投入するので、噴出される溶射原料の溶射速度を超音速に維持しながら、フレーム温度の制御を行うことが可能となる。
【0062】
なお、混合手段32によって酸素ガスと空気とを予め混合し、この燃焼支援ガスを溶射ガン31へ供給するので、酸素ガス量に対する燃料量を減少させて、溶射フレーム29の温度を低温に調整した場合に、空気の混合量、溶射ガン31の燃焼圧力、及び溶射原料の溶射速度の低下を制御して、基材12上に形成した皮膜10の酸化を抑制できる。また、酸素ガス及び空気を混合手段32によってほぼ均一な状態に混合し、この燃焼支援ガスを溶射ガン31へ供給して溶射フレーム29を形成するので、混合の不均一に起因する溶射フレーム29の揺らぎ等の発生を抑制、更には防止できる。
【0063】
このようにして得られた硫黄ドープ二酸化チタン皮膜10は、可視光の照射下で高い光触媒活性を示す。なお、硫黄ドープ二酸化チタン皮膜10の厚みは、1〜100μm(好ましくは、1〜10μm)である。
使用することができる可視光源は特に制限されないが、硫黄ドープ二酸化チタンが高い吸光係数を有する500nmの発光強度が高いものが好ましい。可視光源の具体例としては、蛍光灯、白熱電球、ハロゲンランプ、白色、青色、緑色等のLED(発光ダイオード)、半導体レーザー、エレクトロルミネッセンス光源等や、太陽光(自然光)が挙げられる。
【0064】
硫黄ドープ二酸化チタン皮膜10は、紫外線強度の低い室内光の下でも光触媒活性を有しているので、紫外線ランプを用いた殺菌灯や消毒剤等を用いることなく、可視光の照射下で、その表面での有害微生物の増殖を抑制することができる。従って、硫黄ドープ二酸化チタン皮膜10は、抗菌性を要求される各種衛生部材の抗菌性皮膜として用いることができる。
硫黄ドープ二酸化チタン皮膜10が形成される衛生部材には、抗菌性を必要とする什器類並びに建材に用いられる部材があり、家庭用、業務用を問わず、任意の材質の什器類、建材等が挙げられる。
【0065】
衛生部材が用いられる家庭用の什器類の一例としては、浴槽、流し台、洗面台及び便器等の衛生陶器、台所用品、洗面用品、浴室用品、洗濯用品、電話機、家電用リモートコントローラ等が挙げられる。
また、衛生部材が用いられる家庭用の建材の一例としては、タイル、壁紙等の屋内用建材等が挙げられる。
衛生部材が用いられる業務用の什器類の一例としては、医療用設備で用いられる寝台、診断及び手術用機器及び器具、福祉施設等で用いられる浴槽、流し台、洗面台及び便器等の衛生陶器、台所用品、洗面用品、浴室用品、洗濯用品、電話機、家電用リモートコントローラ等食品製造装置、業務用厨房設備、公共交通機関、公共施設及び福祉施設等の手すり、座席その他の内装用品等が挙げられる。
また、衛生部材が用いられる業務用施設の建材の一例としては、医療用施設、食品製造現場、公共交通機関、公共施設及び福祉施設等の内装用品等が挙げられる。
【0066】
本発明の第2の実施の形態に係る殺菌方法は、硫黄ドープ二酸化チタン皮膜10を、抗菌性を有する水溶液及び殺菌対象物と接触させ、硫黄ドープ二酸化チタン皮膜10に可視光を照射して、抗菌性を有する水溶液及び光触媒反応の作用により殺菌、更には滅菌を行う。ここで、殺菌とは、微生物の数を激減させることを意味し、滅菌とは、微生物を完全に死滅させることを意味する。
殺菌対象物に特に限定はなく、抗菌性を有する水溶液に接触させることが可能な任意の物体に本方法を適用することができる。硫黄ドープ二酸化チタン皮膜10が形成された衛生部材そのものの殺菌に、本殺菌方法を適用してもよい。
殺菌の対象となる微生物についても特に限定されず、例えば、グラム陽性菌、グラム陰性菌等の細菌類、真菌類等が挙げられる。
【0067】
病原性大腸菌O−157等の感染による食中毒の発生防止のため、野菜等の植物の種子に対する殺菌に対しても本殺菌方法を適用することができる。菌体だけでなく、食中毒の原因となるベロ毒素等も、硫黄ドープ二酸化チタン皮膜10の光触媒作用によって併せて分解することができるため、食中毒の発生をより確実に抑制できる。更に、次亜塩素酸ナトリウム等の発芽率や発芽後の成長率に悪影響を及ぼすおそれがある殺菌剤の使用を抑制できるので、殺菌処理後の発芽率や成長率を損なうことが少ないという利点も有している。
殺菌の対象となる種子に特に制限はないが、一例として、カイワレダイコン、モヤシ等の、水耕栽培により栽培される野菜の種子が挙げられる。
【0068】
抗菌性を有する水溶液について特に制限はなく、それぞれの殺菌対象物に対して通常用いられる任意の抗菌物質を含む水溶液を用いることができるが、硫黄ドープ二酸化チタン皮膜10との相乗効果により殺菌活性が向上する抗菌物質を含む水溶液を用いることが好ましく、ビワ種子抽出物水溶液が最も好ましい。ビワ種子抽出物の濃度は、10〜500mg/mLであり、好ましくは50〜250mg/mL、より好ましくは100〜200mg/mLである。ビワ種子抽出物の濃度が10mg/mLを下回ると十分な殺菌活性が得られず、500mg/mLを上回ると、発芽後のカイワレダイコンの全長が短くなる等の成長阻害作用が見られるようになる。
【0069】
上記した硫黄ドープ二酸化チタン皮膜10を、抗菌性を有する水溶液及び殺菌対象物である種子と接触させる方法の具体例としては、図5(A)がある。
図5(A)に示すように、深さが浅い容器40(例えば、シャーレ)内の底に硫黄ドープ二酸化チタン皮膜10を配置し、その表面に種子41を配置する。そして、容器40内に抗菌性を有する水溶液42を供給し、この水溶液42中に、硫黄ドープ二酸化チタン皮膜10と種子を浸漬させる。
これにより、容器40の上方に配置された光源43から、硫黄ドープ二酸化チタン皮膜10に可視光を照射して、水溶液42及び光触媒反応の作用により、殺菌、更には滅菌を行うことができる。なお、ここでは、二酸化チタン皮膜10、容器40、水溶液42、及び光源43が、殺菌装置を構成する。
【0070】
なお、硫黄ドープ二酸化チタン皮膜10は、図5(B)に示すように、種子41に近接配置してもよい。即ち、容器44の内側面に硫黄ドープ二酸化チタン皮膜10を取付け、種子41が入った抗菌性を有する水溶液42を、硫黄ドープ二酸化チタン皮膜10が浸漬するまで容器44内に供給する。
これにより、容器44の上方に配置された光源43から、硫黄ドープ二酸化チタン皮膜10に可視光を照射して、水溶液42及び光触媒反応の作用により、殺菌、更には滅菌を行うことができる。なお、ここでは、二酸化チタン皮膜10、容器44、水溶液42、及び光源43が、殺菌装置を構成する。
以上の方法では、硫黄ドープ二酸化チタン皮膜10を使用するに際し、抗菌性を有する水溶液42を用いているが、この水溶液42を使用することなく、殺菌対象物に接触又は近接配置させても、本発明の作用効果は得られる。この場合、水溶液42を除いたものが殺菌装置を構成する。
【実施例】
【0071】
次に、本発明の作用効果を確認するために行った実施例について説明する。ここで、図6はTiO2、Cu、S−TiO2、及びS−TiO2−Cu溶射皮膜の光触媒抗菌活性を示すグラフ、図7はカイワレダイコン種子の殺菌処理後の大腸菌数、発芽率及び発芽後の全長を示すグラフ、図8は大腸菌に対するS−TiO2+Cuの抗菌効果の説明図、図9は明条件での大腸菌に対するS−TiO2+Cuの抗菌効果の説明図、図10は暗条件での大腸菌に対するS−TiO2+Cuの抗菌効果の説明図、図11は明条件での黄色ブドウ球菌に対するS−TiO2+Cuの抗菌効果の説明図、図12は暗条件での黄色ブドウ球菌に対するS−TiO2+Cuの抗菌効果の説明図、図13は室内の明るさでの大腸菌に対する殺菌効果の説明図、図14は室内の明るさでの黄色ブドウ球菌に対する殺菌効果の説明図、図15は金属の違いによる大腸菌に対する抗菌効果の説明図、図16は金属の違いによる黄色ブドウ球菌に対する抗菌効果の説明図、図17は大腸菌に対する塩素の抗菌効果の説明図、図18は黄色ブドウ球菌に対する塩素の抗菌効果の説明図である。
【0072】
(1)硫黄ドープ二酸化チタンの製造
チオ尿素とチタンテトライソプロポキシド(Ti(OiPr)4)とをエタノール中で混合した。得られた溶液を減圧濃縮すると、スラリー状の混合物が得られた。これを室温で乾燥し、得られた粉末を空気中400〜600℃で焼成することにより、黄色粉末状の硫黄ドープ二酸化チタン(以下「S−TiO2」という)を得た。
【0073】
(2)スラリーの製造
原料微粒子10質量部、水90質量部、及びポリカルボン酸型高分子界面活性剤(花王製ポイズ532A)0.1質量部を混合し、超音波照射器で超音波照射を行い、均一なスラリーを得た。
スラリーの製造に用いた原料微粒子を表1に示す。
【0074】
【表1】

【0075】
(3)溶射皮膜の形成
上記(2)で得られたスラリーを、スラリーポンプを介して一定流量で霧化装置(霧化ノズル)に供給した。霧化装置に圧縮空気と高圧窒素ガスの混合ガスを供給してアトマイズした。このようにして得られたアトマイズ粉(霧状粒子)を溶射装置に供給し、フレーム温度600℃で、アルミニウム試験片(15mm×70mm×6mmt、20mm×20mm×6mmt、又は55mm×55mm×6mmt)の表面に高速フレーム溶射し、溶射皮膜を形成した。溶射皮膜を形成後、試験片をアセトンで洗浄し風乾した。
以下、表1のNo.X(Xは、1〜10の整数)に示す原料微粒子を用いて形成された溶射皮膜を、表1の番号を用いて「溶射皮膜No.X」と略称する。
【0076】
(4)可視光の照射による2−プロパノールの分解試験
光触媒活性の評価に広く用いられているメチレンブルーは、可視光(波長664nm)の照射により分解することが知られているので、可視光領域に吸収を有しない2−プロパノールを用いて、溶射皮膜No.1〜7による光触媒分解試験を行った。
2−プロパノールは、下記の反応式に示す光触媒酸化を受けてアセトンを生じる。
CH3CH(OH)CH3 → CH3COCH3+2(H)
【0077】
2−プロパノールの50mol/Lアセトニトリル溶液5mLを7本の石英ガラス製の試験管に取り、それぞれ溶射皮膜No.1〜7を形成した試験片(15mm×70mm×6mmt)を浸漬し、紫外線又は可視光用ロングパスフィルタ(カットオフ波長250nm、350nm、390nm、420nmの4種類のものを使用した)を取付けたXeランプで照射(1〜3時間)を行った。照射後、各試験管から溶液を採取し、ガスクロマトグラフィを用いてアセトン濃度を定量した。アセトン濃度の定量には、予め作成した検量線を使用した。
結果は、下記の表2に示すとおりである。なお、「N.D.」は、アセトン濃度がガスクロマトグラフィ法による検出限界以下であったことを示す。
【0078】
【表2】

【0079】
他の原子をドープしていないTiO2を原料とする溶射皮膜No.1は、可視光応答性を示さないことが確認された。また、可視光応答性を有するとの報告がなされているWO3を原料とした溶射皮膜No.2は、それ単独では可視光応答性、紫外光応答性のいずれをも示さず、TiO2と複合化した触媒皮膜No.3及びNo.4のいずれについても可視光応答性は確認されなかった。
S−TiO2を原料とする溶射皮膜No.5及びS−TiO2とWO3とを複合化した溶射皮膜No.6については、両者とも可視光の照射により光触媒活性を示すことが確認された。なお、溶射皮膜No.6の方が高い光触媒活性を示したのは、WO3との複合化による溶射被膜の厚膜化が原因であると考えられる。
窒素ドープTiO2を原料とする溶射皮膜No.7は、可視光の照射により光触媒活性を示さなかったが、溶射時の熱によって不活性化したと考えられる。
【0080】
(5)S−TiO2溶射皮膜の光触媒抗菌活性の検討
検定菌として、Escherichia Coli IFO 3972(以下「E.Coli」と略称する)を使用した。1L三角フラスコにニュートリエント・ブロス培地(NB培地)250mLを取り、オートクレーブ処理(121℃、20分)により滅菌した後、E.Coliを接種し、37℃で24時間振とう培養した。培養液を遠心分離(4200rpm、10分間)して上清を除去した後、滅菌水を添加して、細菌濃度約1.0×106CFU(コロニー形成単位)/mLのE.Coli懸濁液を調製した。溶射皮膜No.5、No.8、及びNo.9が形成されたアルミニウム試験片、(20mm×20mm×6mmt)及びブランクとして溶射皮膜が形成されていない同一サイズのアルミニウム板を用意し、紫外線を3時間照射して滅菌した。
滅菌したシャーレ(直径30mm)に、滅菌した試験片及びブランクをそれぞれ取り、E.Coli懸濁液各3mLを加えた。これらのシャーレに蓋をし、蛍光灯照射下(照度1200lux)30℃で放置した。照射開始から24時間経過後に、コロニーカウント法により残存細菌数を計測した。
結果は、下記の表3に示すとおりである。
【0081】
【表3】

【0082】
ブランクと溶射皮膜No.5との比較より、S−TiO2溶射皮膜は、可視光の照射によりE.Coliの生菌数を大きく減少させる効果があることがわかる。更に、これらの結果と溶射皮膜No.8及びNo.9との比較より、S−TiO2に銅を配合した溶射皮膜において、抗菌活性は更に向上することがわかる。
【0083】
(6)TiO2、Cu、S−TiO2、及びS−TiO2−Cu溶射皮膜の光触媒抗菌活性の検討
(5)と同様の方法により、細菌濃度約1.0×106CFU(コロニー形成単位)/mLのE.Coli懸濁液を調製した。
溶射皮膜No.1、No.5、No.9、及びNo.10が形成されたアルミニウム試験片、(55mm×55mm×6mmt)及びブランクとして溶射皮膜が形成されていない同一サイズのアルミニウム板を用意し、紫外線を3時間照射して滅菌した。
滅菌したシャーレ(直径30mm)に、滅菌した試験片及びブランクをそれぞれ取り、E.Coli懸濁液各30mLを加えた。これらのシャーレに蓋をし、蛍光灯照射下(照度1700lux)30℃で放置した。照射開始から5分、10分、30分、及び60分経過後に、コロニーカウント法により残存細菌数を計測した。
結果は、図6に示すとおりである。
【0084】
溶射皮膜No.1とNo.5との比較より、照射開始から1時間程度の短時間では、TiO2溶射皮膜の抗菌活性とS−TiO2溶射皮膜の抗菌活性との間には顕著な差は見られなかった。溶射皮膜No.10の観測結果から、銅を単独で溶射した溶射皮膜は高い抗菌活性を示し、60分後にはE.Coliの生菌数が観測限界以下となった。
溶射皮膜No.9の観測結果から、S−TiO2に銅を配合した溶射皮膜において、光触媒活性との相乗効果により抗菌活性は更に向上し、5分後にはE.Coliの生菌が観測されなくなるほど強力な抗菌活性を示すことがわかる。
【0085】
(7)カイワレダイコン種子の殺菌試験
(5)と同様の方法により、細菌濃度約1.0×107CFU(コロニー形成単位)/mLのE.Coli懸濁液を調製した。カイワレダイコンの種子を、E.Coli懸濁液200mLに5分間浸漬後種子を取り出し、40℃の乾燥機で、浸漬前の含水量になるまで乾燥したものを接種種子として使用した。
抗菌性を有する水溶液として、次亜塩素酸ナトリウム水溶液(500〜5000ppm)、及び殺菌作用を有することが知られているビワ種子抽出物水溶液(2006年6月に収穫した長崎県産茂木ビワの種子を水洗後、破砕機により微粉末化し、滅菌水中25℃で24時間抽出した)(50〜300mg/mL)を調製した。
抗菌性を有する水溶液又は滅菌水(ブランク)は、同一のものを2検体ずつ調製し、一方には溶射皮膜No.9が形成された試験片を入れた。接種種子を加えた後、蛍光灯で照射(照度950lux)しながら12時間放置した。接種種子を取り出し、滅菌水20mL中、22±1℃の暗所で4日間培養後、E.Coliの生菌数、発芽率及び発芽したカイワレダイコンの全長を測定した。
結果は、表4に示すとおりである。
【0086】
【表4】

【0087】
なお、表中「N.D.」は検出限界以下であったことを表す。
濃度100mg/mLのビワ種子抽出物水溶液及び溶射皮膜No.9が形成された試験片をそれぞれ単独で用いた場合(エントリー2、3)には、12時間の処理時間では十分に生菌数を減少させることができなかった。
しかし、溶射皮膜No.9が形成された試験片の存在下で抗菌性を有する水溶液としてビワ種子抽出物水溶液を用いた場合(エントリー4)は、生菌数が検出限界以下に低下していたにもかかわらず、高い発芽率(90%)を示すと共に、発芽後のカイワレダイコンの成長にも殆ど影響が見られなかった。このことから、ビワ種子抽出物水溶液を可視光応答型光触媒と組み合わせて使用することにより、カイワレダイコンの発芽や成長に悪影響を及ぼすことなく、相乗効果により殺菌効率を大きく向上させていることがわかる。
なお、表4には示していないが、抗菌性を有する水溶液として次亜塩素酸ナトリウム水溶液を使用した試料については、溶射皮膜No.9の存否に関わりなく、生菌数の減少が見られたものの、エントリー4では観測されなかった、発芽率やカイワレダイコンの全長の低下も併せて観測された。
【0088】
滅菌水又は抗菌性を有する水溶液(次亜塩素酸ナトリウム水溶液(500〜5000ppm)及びビワ種子抽出物水溶液(50〜300mg/mL))に分散させたカイワレダイコンの接種種子に、溶射皮膜No.9の存在下又は非存在下で光照射(照度950lux、30分間〜12時間)を行った後、接種種子を取り出し、滅菌水20mL中、22±1℃の暗所で4日間培養後、E.Coliの生菌数、発芽率及び発芽したカイワレダイコンの全長を測定した。結果を図7に示す。なお、図7において、大腸菌数が検出限界以下であった場合のデータ点については、log CFU/mL=0の位置に表示している。
溶射皮膜No.9の非存在下で次亜塩素酸ナトリウム水溶液を用いて殺菌処理を行った場合、発芽率が60%以下に低下してしまうことが確認された。次亜塩素酸ナトリウム濃度を低下させたり、処理時間を短縮することにより発芽率の改善を試みたところ、殺菌効果が失われる程濃度を低下させたにもかかわらず発芽率については改善が見られなかった。
溶射皮膜No.9の非存在下でビワ種子抽出物水溶液を用いて殺菌処理を行った場合、ビワ種子抽出物の濃度が150mg/mLである場合に(図7中の点a)、大腸菌数が最低(検出限界以下)となり、発芽率の顕著な低下が見られないものの、発芽後のカイワレダイコンの全長は、約2.5cmと短くなった。
【0089】
溶射皮膜No.9の存在下でビワ種子抽出物水溶液(濃度100mg/mL)を用いて殺菌処理を行ったところ、12時間光照射を行うことにより、大腸菌数は検出限界以下となった。更に、ほぼ100%近い発芽率が得られると共に、発芽後のカイワレダイコンの全長も5cm以上と良好であった(図7中の点b)。
これらの結果より、カイワレダイコンの種子の殺菌には、S−TiO2+Cu皮膜を、ビワ種子抽出物水溶液及びカイワレダイコンの種子と接触させ、可視光を照射して、ビワ種子抽出物の抗菌活性及びS−TiO2+Cuの光触媒活性の相乗効果を利用して殺菌を行うのが最も好ましいことがわかる。
【0090】
(8)他の抗菌評価試験
(8−1)培養法
検定菌として、Escherichia Coli IFO 3972(以下、大腸菌という)と、Staphylococcus Aureus IFO 12732(以下、黄色ブドウ球菌という)を使用した。1L三角フラスコにNB培地250mLを取り、オートクレーブ処理(121℃、20分)により滅菌した後、大腸菌と黄色ブドウ球菌を接種し、これを30℃、70rpmで24時間振とう培養した。この培養液を遠心分離(4200rpm、20分間)して上清を除去した後、滅菌水を添加して、細菌濃度約1.0×106CFU(コロニー形成単位)/mLの大腸菌と黄色ブドウ球菌の各懸濁液(水溶液)を調製した。
【0091】
(8−2)抗菌活性測定法
各種試験片をアセトン洗浄し、紫外線UVで12時間照射して、微生物を排除した。そして、滅菌したシャーレ(直径90mm)に、上記滅菌した試験片及びブランク(原液)をそれぞれ取り、各懸濁液を30mLずつ加えた。これらのシャーレに蓋をし、設定温度を30℃とした明条件と暗条件の各環境下で、測定開始から5分、10分、30分、60分、120分、180分の経過時間ごとに、コロニーカウント法により残存細菌数を経時的に計測した。
【0092】
(8−3)試験結果
(8−3−1)S−TiO2とCu併用の抗菌効果(大腸菌)の検討
試験片に、S−TiO2+Cu、S−TiO2、及びTiO2を使用し、検定菌に大腸菌を使用した。これを、設定温度が30℃の明条件(蛍光灯・照度950lux)の環境下に配置し、残存細菌数を経時的に計測した。この結果を、図8に示す。
図8から明らかなように、試験片に硫黄をドープしたTiO2を使用した場合の抗菌効果は、試験片との接触時間が180分程度で、大腸菌の減少量が4オーダー(1万分の1、以下同様)程度であった。一方、試験片にS−TiO2+Cuを使用した場合の抗菌効果は、試験片との接触時間がわずか5分程度で、大腸菌を6オーダー(100万分の1、以下同様)まで、急激に減少できることを確認できた。
【0093】
(8−3−2)Cu存在比の違いによる抗菌効果(大腸菌)の検討
試験片に、表面のCu存在比が1質量%〜20質量%となるように調整したS−TiO2+Cuを使用し、検定菌に大腸菌を使用した。
図9に示すように、設定温度が30℃の明条件(蛍光灯・照度950lux)の環境下では、S−TiO2中のCu存在比が4質量%、5質量%、7質量%の試験片は、試験片との接触時間が5分程度で、大腸菌の減少量が6オーダー程度であった。なお、図9において、Cu存在比が4質量%(×)と7質量%(△)は、5質量%(■)と同様の挙動を示している。また、10質量%の試験片は、試験片との接触時間が10分程度で、大腸菌の減少量が6オーダー程度であった。なお、S−TiO2中のCu存在比が12質量%以上の試験片と3質量%以下の試験片では、抗菌機能性の低下が認められた。
一方、暗条件では、図10に示すように、全く抗菌効果が認められなかった。
【0094】
(8−3−3)S−TiO2とCu併用の抗菌効果(黄色ブドウ球菌)の検討
上記した大腸菌はグラム陰性菌であり、細胞壁が10nm程度と薄いのが特徴である。これに対して、グラム陽性菌はペプチドグリカン層に覆われ、細胞壁が厚い構造をとっていることから、このような検定菌として黄色ブドウ球菌を用い、同様に抗菌効果を調べた。
図11に示すように、S−TiO2中のCu存在比が4質量%、7質量%、10質量%の試験片は、試験片との接触時間が5分程度で、黄色ブドウ球菌の減少量が6オーダー程度であった。なお、図11において、Cu存在比が4質量%(×)と7質量%(△)は、10質量%(▲)と同様の挙動を示している。また、5質量%の試験片は、試験片との接触時間が10分程度で、黄色ブドウ球菌の減少量が6オーダー程度であった。なお、S−TiO2中のCu存在比が12質量%以上の試験片と3質量%以下の試験片では、抗菌機能性の低下が認められた。
一方、暗条件では、図12に示すように、全く抗菌効果が認められなかった。
【0095】
(8−3−4)照度の違いによる抗菌効果の検討
検定菌に大腸菌と黄色ブドウ球菌をそれぞれ用い、蛍光灯で照度1700luxと650(600〜700)luxにおける抗菌効果を調べた。この大腸菌の結果を図13に、黄色ブドウ球菌の結果を図14に、それぞれ示す。
図13、図14から明らかなように、光強度が650luxに低下したときでも、試験片との接触時間が60分以上であれば、大腸菌と黄色ブドウ球菌のいずれも、その減少量が6オーダー程度の抗菌効果があることを確認できた。
従って、照度が600ルックス以上の蛍光灯を可視光の発光源として使用する場合、その照射時間を60分以上とすることで、十分な抗菌効果が得られる。
【0096】
(8−3−5)添加金属の違いによる抗菌効果の検討
銅以外にも、抗菌効果のあることで知られている銀やニッケルを、同じくS−TiO2に10質量%加えて、抗菌効果の比較を行った。大腸菌の結果を図15に、黄色ブドウ球菌の結果を図16に、それぞれ示す。なお、図15、図16は、それぞれ設定温度が30℃の明条件(蛍光灯・照度950lux)と暗条件の各環境下で試験を行った結果である。
図15、図16から明らかなように、明条件において、S−TiO2に銀又はニッケルを混合した場合、銅の結果(5分で6オーダー)には、はるかに及ばない結果であったが、試験片との接触時間が120分程度で、その減少量が6オーダー程度の抗菌効果が認められた。
一方、暗条件では、いずれの場合も抗菌効果が認められなかった。
【0097】
(9)塩素による抗菌評価試験
一般的に利用されている塩素の殺菌効果の結果を、図17、図18にそれぞれ示す。なお、図17は、検定菌として大腸菌を使用した場合の結果であり、図18は検定菌として黄色ブドウ球菌を使用した場合の結果である。
この試験は、前記した本願発明のS−TiO2とCu併用の抗菌効果と同様の結果、即ち、5分程度で生菌数を0にするために、塩素濃度をどの程度まで上昇させる必要があるのかを検討したものである。このため、図17、図18においては、塩素濃度を、0mg/L、0.05mg/L、0.1mg/L、0.2mg/L、0.4mg/L、及び0.8mg/Lにそれぞれ調整した場合の生菌数を検討した。
【0098】
図17から明らかなように、検定菌として大腸菌を使用した場合、本願発明と同程度の抗菌効果を得るには、塩素濃度を0.4mg/L以上とする必要があることが分かった。
また、図18から明らかなように、検定菌として黄色ブドウ球菌を使用した場合、本願発明と同程度の抗菌効果を得るには、塩素濃度を0.8mg/L以上とする必要があることが分かった。
なお、通常の水道水では、塩素濃度が0.2mg/L程度であることから、本願発明と同程度の抗菌効果を得るには、塩素濃度を非常に高める必要があることが分かった。
以上のことから、本願発明の可視光応答型光触媒皮膜は、従来法と比較して殺菌効果を非常に高めることができることを確認できた。
【0099】
本発明は、前記した実施の形態に限定されるものではなく、本発明の要旨を変更しない範囲での変更は可能であり、例えば、前記したそれぞれの実施の形態や変形例の一部又は全部を組み合わせて本発明の可視光応答型光触媒皮膜とその製造方法及びそれらを用いた殺菌方法並びに殺菌装置を構成する場合も本発明の権利範囲に含まれる。
例えば、前記実施の形態の可視光応答型光触媒皮膜において、可視光応答型光触媒として硫黄ドープ二酸化チタンを用いたが、窒素原子又は炭素原子をドープした二酸化チタン等の他の材料を用いてもよい。
また、前記実施の形態に係る可視光応答型光触媒皮膜の製造方法においては高速溶射フレーム法を用いたが、可視光応答型光触媒と抗菌性を有する金属とを含むエアロゾル状の微粒子を、一定の温度で基材に噴射するのにコールドスプレー法を用いてもよい。コールドスプレー法においては、原料微粒子をより低温下(例えば、200℃)で、ある一定速度(例えば、500m/秒)の高速で基材に噴射することにより製膜を行う方法である。原料微粒子への入熱量が少ないので、二酸化チタン結晶格子にドープした原子の消失を抑制できる。
【0100】
なお、前記実施の形態の可視光応答型光触媒皮膜において、抗菌性を有する金属の微粒子として銅の微粒子を用いたが、銅合金、銀又は銀合金、亜鉛又は亜鉛合金、アルミニウム又はアルミニウム合金、ニッケル又はニッケル合金、コバルト又はコバルト合金、鉄又は鉄合金のいずれかの微粒子を用いてもよい。これらの金属の微粒子は単独で用いてもよく、任意の2以上を任意の割合で混合して用いてもよい。
これらの金属のうち、比較的融点の低い亜鉛(419.5℃)、アルミニウム(660.4℃)、銀(961℃)、及び銅(1083℃)は、可視光応答型溶射皮膜のバインダーとしても作用するので、その機械的強度及び耐剥離強度を向上させる効果も有している。
【符号の説明】
【0101】
10:硫黄ドープ二酸化チタン皮膜、11:霧状粒子、12:基材、21:容器、22:加圧器、22a:窒素ボンベ、23:スラリーポンプ、24:霧化ノズル、25:空気流入口、26:排出口、27:スラリー流入口、28:霧化室、29:溶射フレーム、30:溶射装置、31:溶射ガン、32:混合手段、40:容器、41:種子、42:水溶液、43:光源、44:容器
【特許請求の範囲】
【請求項1】
窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、高速フレーム溶射法又はコールドスプレー法を用いて基材の表面に成膜する工程を有することを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項2】
窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、フレーム温度300〜700℃の高速フレーム溶射法を用いて基材の表面に成膜する工程を有することを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項3】
窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射温度50〜300℃のコールドスプレー法を用いて基材の表面に成膜する工程を有することを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項4】
請求項1〜3のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法において、前記抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であることを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項5】
請求項1〜4のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法において、前記混合物を、水及び有機溶媒のいずれか一方又は双方を含む分散媒中に分散したスラリーを霧化した霧状粒子を溶射フレーム中に投入することを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項6】
請求項5記載の可視光応答型光触媒皮膜の製造方法において、前記スラリー中の前記可視光応答型光触媒の濃度が1〜30質量%であることを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項7】
請求項5又は6記載の可視光応答型光触媒皮膜の製造方法において、前記スラリー中の前記抗菌性を有する金属の濃度が1〜30質量%であることを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項8】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び殺菌対象物と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うことを特徴とする殺菌方法。
【請求項9】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して該水溶液中の殺菌対象物に近接配置し、該可視光応答型光触媒皮膜に可視光を照射して、前記抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うことを特徴とする殺菌方法。
【請求項10】
請求項8又は9記載の殺菌方法において、前記抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であることを特徴とする殺菌方法。
【請求項11】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、殺菌対象物に接触又は近接配置させ、該可視光応答型光触媒皮膜に可視光を照射して、光触媒反応の作用により殺菌を行うことを特徴とする殺菌方法。
【請求項12】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び植物の種子と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うことを特徴とする植物の種子の殺菌方法。
【請求項13】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して該水溶液中の植物の種子に近接配置し、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うことを特徴とする植物の種子の殺菌方法。
【請求項14】
請求項12又は13記載の植物の種子の殺菌方法において、前記抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であることを特徴とする植物の種子の殺菌方法。
【請求項15】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、大腸菌又は黄色ぶどう球菌を含む水溶液と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、光触媒反応により前記水溶液の殺菌を行うことを特徴とする水溶液の殺菌方法。
【請求項16】
請求項15記載の水溶液の殺菌方法において、前記可視光の発光源として、600ルックス以上の蛍光灯を使用することを特徴とする水溶液の殺菌方法。
【請求項17】
請求項16記載の水溶液の殺菌方法において、前記蛍光灯の照射時間は60分以上であることを特徴とする水溶液の殺菌方法。
【請求項1】
窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、高速フレーム溶射法又はコールドスプレー法を用いて基材の表面に成膜する工程を有することを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項2】
窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、フレーム温度300〜700℃の高速フレーム溶射法を用いて基材の表面に成膜する工程を有することを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項3】
窒素、炭素、及び硫黄原子のいずれか1又は複数を結晶格子中にドープした二酸化チタンを含む可視光応答型光触媒の微粒子と、抗菌性を有する金属の微粒子とを含む混合物を原料として、溶射温度50〜300℃のコールドスプレー法を用いて基材の表面に成膜する工程を有することを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項4】
請求項1〜3のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法において、前記抗菌性を有する金属が、銀系、銅系、亜鉛系、アルミニウム系、ニッケル系、コバルト系、及び鉄系の金属からなる群より選択される1又は複数の金属であることを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項5】
請求項1〜4のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法において、前記混合物を、水及び有機溶媒のいずれか一方又は双方を含む分散媒中に分散したスラリーを霧化した霧状粒子を溶射フレーム中に投入することを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項6】
請求項5記載の可視光応答型光触媒皮膜の製造方法において、前記スラリー中の前記可視光応答型光触媒の濃度が1〜30質量%であることを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項7】
請求項5又は6記載の可視光応答型光触媒皮膜の製造方法において、前記スラリー中の前記抗菌性を有する金属の濃度が1〜30質量%であることを特徴とする可視光応答型光触媒皮膜の製造方法。
【請求項8】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び殺菌対象物と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うことを特徴とする殺菌方法。
【請求項9】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して該水溶液中の殺菌対象物に近接配置し、該可視光応答型光触媒皮膜に可視光を照射して、前記抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うことを特徴とする殺菌方法。
【請求項10】
請求項8又は9記載の殺菌方法において、前記抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であることを特徴とする殺菌方法。
【請求項11】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、殺菌対象物に接触又は近接配置させ、該可視光応答型光触媒皮膜に可視光を照射して、光触媒反応の作用により殺菌を行うことを特徴とする殺菌方法。
【請求項12】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、抗菌性を有する水溶液及び植物の種子と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うことを特徴とする植物の種子の殺菌方法。
【請求項13】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、抗菌性を有する水溶液中に浸漬して該水溶液中の植物の種子に近接配置し、該可視光応答型光触媒皮膜に可視光を照射して、該抗菌性を有する水溶液及び光触媒反応の作用により殺菌を行うことを特徴とする植物の種子の殺菌方法。
【請求項14】
請求項12又は13記載の植物の種子の殺菌方法において、前記抗菌性を有する水溶液が10〜500mg/mLのビワ種子抽出物水溶液であることを特徴とする植物の種子の殺菌方法。
【請求項15】
請求項1〜7のいずれか1項に記載の可視光応答型光触媒皮膜の製造方法によって製造された可視光応答型光触媒皮膜を、大腸菌又は黄色ぶどう球菌を含む水溶液と接触させ、該可視光応答型光触媒皮膜に可視光を照射して、光触媒反応により前記水溶液の殺菌を行うことを特徴とする水溶液の殺菌方法。
【請求項16】
請求項15記載の水溶液の殺菌方法において、前記可視光の発光源として、600ルックス以上の蛍光灯を使用することを特徴とする水溶液の殺菌方法。
【請求項17】
請求項16記載の水溶液の殺菌方法において、前記蛍光灯の照射時間は60分以上であることを特徴とする水溶液の殺菌方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【公開番号】特開2012−139690(P2012−139690A)
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願番号】特願2012−104823(P2012−104823)
【出願日】平成24年5月1日(2012.5.1)
【分割の表示】特願2008−208069(P2008−208069)の分割
【原出願日】平成20年8月12日(2008.8.12)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【出願人】(802000031)公益財団法人北九州産業学術推進機構 (187)
【出願人】(591209280)株式会社フジコー (25)
【Fターム(参考)】
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願日】平成24年5月1日(2012.5.1)
【分割の表示】特願2008−208069(P2008−208069)の分割
【原出願日】平成20年8月12日(2008.8.12)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【出願人】(802000031)公益財団法人北九州産業学術推進機構 (187)
【出願人】(591209280)株式会社フジコー (25)
【Fターム(参考)】
[ Back to top ]

