合成抗体または抗体断片による、ヒト免疫不全ウイルス感染の治療のための方法および組成物
【解決課題】対象内のHIV感染の治療のための方法および組成物に関する。
【解決手段】抗HIV抗体または抗体断片等の、HIV抗原に対する標的となる分子を含み、前記抗HIV抗体または断片は、ドキソルビシン等の様々な細胞毒性薬と合成させることができる。好適には、抗体または断片はP4/D10である。また、診断用薬剤と合成された抗HIV抗体または断片を用いて、対象内のHIV感染の画像化、検知、または診断の方法。さらに、治療薬に合成された担体の分子の投与前、少なくとも1つのHIV抗原の結合部位と、少なくとも1つの担体の分子の結合部位とを有する二重特異性抗体を投与することができる。
【解決手段】抗HIV抗体または抗体断片等の、HIV抗原に対する標的となる分子を含み、前記抗HIV抗体または断片は、ドキソルビシン等の様々な細胞毒性薬と合成させることができる。好適には、抗体または断片はP4/D10である。また、診断用薬剤と合成された抗HIV抗体または断片を用いて、対象内のHIV感染の画像化、検知、または診断の方法。さらに、治療薬に合成された担体の分子の投与前、少なくとも1つのHIV抗原の結合部位と、少なくとも1つの担体の分子の結合部位とを有する二重特異性抗体を投与することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、感染対象のヒト免疫不全ウィルス(HIV)を治療し、さらに好適な実施形態においては排除するための、方法および組成物に関する。
本発明は、その全内容が本明細書に参照として組み込まれている、2006年5月15日に出願された、仮出願シリアル番号第60/800,342号に対し、35 C.F.R.§119(e)において、その利益を請求する。
【背景技術】
【0002】
本発明は、感染対象のヒト免疫不全ウィルス(HIV)を治療し、さらに好適な実施形態においては処置するための、方法および組成物に関する。特定の実施形態では、組成物および方法は、例えば、HIVエンベロープ抗原の、HIV抗原に対する抗体または抗体断片等の標的となる分子に関する。さらなる特定の実施形態において、抗体または抗体断片は、ドキソルビシン等の化学療法薬を含むがこれに限定されない、治療薬、診断薬、ウイルス静止剤および/または細胞毒性薬等の1つ以上の薬剤と併用することができる。別の実施形態において、HIV抗原のための1つ以上の結合部位および細胞毒性、ウイルス静止性またはその他の治療用薬剤および/または診断用薬剤が結合可能な担体分子のための親和性を有する1つ以上の結合部位と共に、二重特異性または複数特異性抗体あるいはその断片を利用することができる。
【0003】
抗レトロウィルス治療(ART)によるヒト免疫不全ウイルス―1(HIV―1)の治療における有望な進歩にもかかわらず、末梢血およびリンパ節の分析によって、治療が終了して何年も自然に活発化することがある潜在的なプロウィルスが存在する静止T細胞の持続的貯蔵庫の存在が文書で発表されている(Berger et al、Proc Natl Acad Sci U S 1998、95:11511―11513;Blankson et al、Annu Rev Med 2002,53:557―593)。
【0004】
結合抗体および中和抗体は、遊離型ウイルスの細胞受容体への結合を防ぐことができ、これらはウイルス表面に結合でき、また補体を介した遊離型ビリオンのvirolysis(Parren et al.、AIDS 1999、13[Suppl A]:S137―162)を誘発できる。抗体はさらに、NK細胞を、感染した標的細胞と結合することにより、抗体依存の細胞の細胞毒性(ADCC)によって、感染した細胞の根絶に仲介的な働きをすることができる(Broliden et al、J Virol 1990、64:936―940)。しかし、抗ウイルスの抗体のみをHIVに感染した患者の免疫療法の一部に利用することが、その当初の目的をかなえるものではない(Hinkula et al.、J Acquir Immune Defic Syndr 1994、7:940―951;Trkola et al.、Nat Med 2005、11:615―622)。
【0005】
様々なウイルスのまたは細胞の成分を、HIV感染細胞に対する治療薬剤の抗体送達の標的として使用するための試みがなされている(Davey et al.、J Infect Dis 1994、170:1180―1188;Pincus et al.、J Immunol 2003、170:2236―2241;Ramachandran et al.、J Infect Dis 1994、170:1009―1013;Saavedra―Lozano et al.、Proc Natl Acad Sci USA2004、101:2494―2499)。同様の抗毒素が、癌患者に有効であることが証明されている(WuおよびSenter、Nat Biotechnol 2005、23:1137―1146)。しかし、HIV感染した細胞の治療のためのより有用な方法および組成物に対するニーズが存在している。
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、HIV感染細胞を阻害、抑制、検出、同定、位置特定、および/または排除するための方法および組成物を提供することにより、当分野の未解決のニーズを実現する。
【課題を解決するための手段】
【0007】
特定の実施形態において、組成物および/または方法は、HIV抗原に対して標的となる分子に関する場合がある。こうした標的となる分子は、ペプチド、抗体、ヒト化抗体、キメラ抗体、ヒト抗体または任意のこうした抗体、および/または抗体の類似体の断片を含むことができるが、これに限定されない。特定の実施形態において、標的の分子は、例えば「裸の」抗体または抗体断片等、非共役にすることができる。別の実施形態において、標的の分子は、1つ以上の治療用および/または診断用薬剤に共役することができる。こうした薬剤は、薬物、プロ薬物、ウイルス静止剤、毒素、酵素、オリゴヌクレオチド、放射性同位体、放射性核種、免疫賦活剤、サイトカイン、ラベル、蛍光ラベル、発光ラベル、常磁性ラベル、MRIラベル、ミセル、リポゾーム、ナノ粒子、またはその組み合わせを含むが、これに限定されない。特定の実施形態において、共役の抗HIV抗体または断片を、HIV感染が判断されているまたは感染が疑われている患者に対して、生体内に投与する。こうした投与により、患者の細胞のHIV感染をブロックまたは予防し、患者内のHIV感染細胞を低減または排除し、および/またはその他の公知の抗レトロウィルスの療法よりも以前におよび/または同時に治療された患者内のHIV感染した細胞の残留病巣を低減または排除することができる。
【0008】
別の実施形態は、HIV、SIV、その他のレトロウィルスに感染した対象等の対象を治療するための方法および/または組成物に関する。対象には、ヒト、動物、ネコ、イヌ、ウシ、ヒツジ、ヤギ、ウマ、および哺乳類が含まれるが、これに限定されない。方法および組成物には、対象に投与される1つ以上の裸または共役の標的の分子を含むことができる。好適な実施形態において、標的の分子は、キメラの、ヒト化またはヒト抗体または断片の任意のバリエーションを含む、抗体または抗体断片である。投与は、経口、経鼻、口腔、吸入、直腸、経膣、または局所等の、当分野で公知の任意の経路にすることができる。または、投与は、同所、皮内、皮下、筋肉内、腹腔内、動脈内、髄腔内または静脈内にすることができる。
【0009】
当業者には、共役または非共役の、1つ以上のHIVの標的の分子は、単体で、またはアジドチミジン、その他のヌクレオシド/ヌクレオチド逆転写酵素阻害薬、非核酸逆転写酵素阻害薬、HIVタンパク質分解酵素阻害剤および/または融合阻害薬等の、HIV感染のためのその他の公知の治療と共に、投与することができることが理解されよう。特定の実施形態において、共役HIV標的の分子は、HAART(高活性抗レトロウィルス療法)と共に使用することができる。多くの抗HIV治療薬が当分野において公知であり、エファビレンツ、ジドブジン、テノホビル、ラミブジン、エムトリシタビン、ディダノシン、アバカビル、スタブジン、ネビラピン、ロピナビル、リトナビル、アタザナビル、ホスアンプレナビル、インディナビル、ネルフィナビル、サクイナビルを、単体または組み合わせたものを含むがこれに限定されない、任意のこうした公知の薬剤を使用することができる。
【0010】
いくつかの実施形態において、抗HIV抗体または断片は、ハプテンまたは担体分子等の、HIV抗原の少なくとも1つの結合部位および第2の標的の第2の結合部位を有する二重特異性または複数特異性抗体複合体の一部として、投与することができる。別の実施形態において、抗HIV抗体または断片は、共有して結合する、または抗体、抗体断片、モノクローナル抗体、Fc断片、Fc結合タンパク質または抗体結合タンパク質を有する融合タンパク質として提供することができる。
様々な実施形態において、抗HIV抗体または断片は、共有架橋試薬の使用等、当分野で公知の方法によって、様々な部分に、共有でまたは非共有で接続することができる。カルボジイミド、ビスイミデート、スベリン酸のN―ヒドロキシスクシニミドエステル、ジメチル―3,3’―ジチオ―ビスプロピオンイミデート、アジドグリオキサール、l,5―ジフルオロ―2,4―(ジニトロベンゼン)等の多くのこうした薬剤、およびタンパク質および/またはペプチドに使用する公知のその他の架橋剤を使用できる。
【0011】
別の実施形態において、抗HIV抗体または断片は、診断および/または画像化の標的のために付加物として使用できる。例えば、抗HIV抗体または断片は、任意の公知の造影剤または検知剤と共にタグを付けたり、またはELISA等の公知のメソドロジを使って検知することができる。抗HIV抗体または断片は、残留HIV感染を検知するために、例えば、組織部分の免疫組織化学法により、生体外で使用することができる。または、抗HIV抗体または断片を、HIV感染組織の生体内の検知のため、対象に投与することができる。こうした組成物および方法は、HIV感染の存在を検知および/または診断するために、治療後の残留HIV感染を監視するために、および/または抗HIV療法の有効性を監視するために、使用することができる。
【0012】
以下の図面は、本発明の一部を形成するものであり、本発明の特定の実施形態の特定の態様をさらに説明するために含まれている。この実施形態は、本明細書に記載されている詳細な説明と共に、1つ以上のこれらの図面を参照することで、より良く理解される。
【0013】
特許、特許出願、記事、書籍、および学術論文を含むがこれに限定されない、本発明で言及されている文書全体、または文書の一部が、本明細書によって、その全体を参照として明示的に組み込まれている。
【0014】
定義
本明細書において、「1つの(a)」または「1つの(an)」は、項目が1つではなく、1つ以上のという意味になり得る。
【0015】
本明細書において、「および」と「または」という用語は、接続または選言的に意味するために使用され得る。すなわち両用語は、特に説明されているのでない限り、「および/または」に相当するものとして理解すべきである。
【0016】
本明細書において、「約」は、ある数のプラスまたはマイナス10パーセント以内を意味する。例えば、「約100」は、90および110の間の任意の数を意味する。
【0017】
「抗体」は、本明細書で記載されているように、完全な長さの(すなわち、自然に生ずる、または通常の免疫グロブリン遺伝子の断片の組み換え過程によって形成される)免疫グロブリン分子(例:IgG抗体)または免疫学的に活性化された(すなわち、特異的に結合する)部分または抗体断片のような免疫グロブリン分子の類似体を指す。
【0018】
「抗体断片」は、F(ab)2、F(ab’)2、Fab、Fv、sFv等の抗体の一部である。構造に関係なく、抗体断片は、操作されていない抗体によって認識される同じ抗原と結合する。「抗体断片」という用語は、複合体を形成するために特定の抗原に結合することによって抗体様の働きをする、任意の合成または遺伝子的に操作されたタンパク質をさらに含む。例えば、抗体断片は、重鎖および軽鎖の可変領域で成る「Fv」断片、軽いおよび重い可変領域がペプチドのリンカー(「scFvタンパク質」)で接続されている遺伝子組み換え一本鎖ポリペプチド分子、および超可変領域に類似したアミノ酸残基で成る最小認識(CDR)単位等の、可変領域で成る分離断片を含む。
【0019】
「治療薬剤」とは、病気の治療に有効である原子、分子、または化合物である。治療薬の例には、抗体、抗体断片、薬物、ウイルス静止剤、毒素、酵素、ヌクレアーゼ、ホルモン、免疫賦活剤、アンチセンスオリゴヌクレオチド、低分子干渉RN(siRNA)、キレート剤、ボロン化合物、感光剤、着色料、および放射性同位体が含まれる。その他の例示的な治療薬および使用法は、それぞれ本明細書に参照として組み込まれている、米国特許出願文書第20050002945号、第20040018557号、第20030148409号、および第20050014207号に開示されている。
【0020】
「中和抗体」または「中和抗体断片」は、本明細書では、感染性因子(ウィルス等の)と反応する抗体または断片を指すために用いられており、伝染力および/または毒性を無効化および阻害する。
【0021】
「診断薬剤」とは、病気の診断に有用な原子、分子または化合物である。有用な診断薬には、放射性同位体、着色料(ビオチン―ストレプトアビジン複合体等の)、造影剤、蛍光化合物または分子および(例:常磁性イオン)磁気共鳴画像化(MRI)のための造影剤を含むが、これに限定されない。
【0022】
「免疫抱合体」は、原子、分子、またはより高次の構造(例:担体、治療薬、または診断薬を有する)を有する結合分子(例:抗体成分)の共役である。
【0023】
「裸抗体」とは、任意のその他の薬剤に共役されていない抗体である。
【0024】
「担体」とは、標的細胞へのこうした薬剤の送達を促進するための治療用または診断用薬剤に関連付けることができる原子、分子またはより高次の構造である。担体は、脂質(例:より高次の構造を形成することができる両親和性脂質)、多糖類(デキストラン等)、タンパク質、ペプチド、ペプチド類似物質、ペプチド誘導体またはミセル、リポゾーム、またはナノ粒子等のその他のより高次の構造を含むことができる。特定の実施形態において、担体は、例えばタンパク質またはペプチド内の自然発生的なL―アミノ酸にD―アミノ酸を置き換えることによって、タンパク質分解のまたはその他の酵素の分解が起きにくいように設計することができる。
【0025】
本明細書において、「抗体融合タンパク質」という用語は、同一または異なる特異性を有する2つ以上の同一または異なるscFvまたは抗体断片がリンクされている、遺伝子組み換えで生成される抗原結合分子を指す。融合タンパク質の価数は、単一の抗原またはエピトープに対して融合タンパク質が有する結合アームまたは部位の数、すなわち、一価、二価、三価または多価を示す。抗体融合タンパク質の価の高さは、抗原に対する結合において複数の相互作用を利用できる、つまり、抗原に対する結合の親和力が強いことを示す。特異性は、抗体融合タンパク質が結合可能な抗原またはエピトープの数、すなわち、単一特異性、二重特異性、三重特異性、複数特異性を示す。これらの定義を用いると、自然抗体(例:IgG)は2つの結合アームを有するため二価であるが、1つのエピトープに結合されるため単一特異性である。単一特異的、多価の融合タンパク質はエピトープの1つよりも多い結合部位を有するが、1つのこうしたエピトープに結合するにすぎない、例えば二重抗体は、同じ抗原に反作用を示す2つの結合部位を有する。融合タンパク質は、単一の抗体成分、多価または異なる抗体成分の複数特異性の組み合わせ、または複数の同じ抗体成分複製を含むことができる。融合タンパク質はさらに、抗体または抗体断片および治療薬を含むことができる。こうした融合タンパク質に適した治療薬の例には、免疫賦活剤(「抗体―免疫賦活剤融合タンパク質」)および毒素(「抗体―毒素融合タンパク質」)が含まれる。1つの好適な毒素にはリボヌクレアーゼ(RNase)、好適には遺伝子組み換えRNaseが含まれる。
【0026】
「二重特異性抗体」とは、異なる構造の2つの標的に対して同時に結合することができる抗体である。この二重特異性抗体および二重特異性抗体断片は、例えば、HIVエンベロープタンパク質に特異的に結合する少なくとも1つのアーム、および治療のまたは診断薬を伝達する標的にすることが可能な共役に特異的に結合する少なくとも1つのその他のアームを有する。
【0027】
本明細書に記載されている抗体または免疫抱合体の生成、または組成物は、投与量が生理的に意義がある場合に「治療有効量」で投与されると言われている。その存在により服用者の哺乳類の生理機能に検知可能な変化が表れる場合、薬剤は生理的な意義を持つ。特に、その存在によって、HIV感染細胞が低減、阻害、または排除される、または非感染細胞のHIV感染が低減、阻害または排除される場合、抗HIV抗体調剤は生理的な意義を持つ。
【0028】
その投与が服用した患者に耐えられる場合、組成物は「薬剤的に容認可能な担体」であると言われる。無菌リン酸緩衝生理食塩水は、薬剤的に容認可能な担体の一例である。その他の適した担体が、当業者に公知である。例えば、REMINGTON‘S PHARMACEUTICAL SCIENCES、19th Ed.(Mack Publishing Co.1995)、およびGoodman and Gilman’s THE PHARMACOLOGICAL BASIS OF THERAPEUTICS(Goodman et al,Eds.Macmillan Publishing Co.,New York,1980 and 2001 editions)を参照されたい。
【0029】
用いられている略称は以下の通りである。
ABS、150mMの塩化ナトリウムを含有する酢酸ナトリウム緩衝液
ADCC、抗体依存の細胞の細胞毒性
DTT、ジチオスレイトール
ELISA、酵素結合免疫吸着剤アッセイ
ART、抗レトロウィルス療法
HIV、ヒト免疫不全ウイルス
Mab、モノクローナル抗体
MuLV、マウス白血病ウイルス
PBMC、末梢血単核細胞
TCID50、50%組織培養感染量
【0030】
抗体
様々な実施形態は、HIVの1つ以上の抗原またはエピトープに対する抗体リガンドに関する。好適な実施形態において、抗原またはエピトープは、HIVエンベロープタンパク質等のHIV感染した細胞の表面に露曝しているものである。様々な抗体を基にした構造および断片を作成および使用する技術が、当分野で公知である。抗体を作成および特性化する手段がさらに、当分野で公知である(例:Harlowe and Lane,1988,Antibodies:A Laboratory Manual,Cold Spring Harbor Laboratoryを参照)。使用する抗体はさらに幅広い様々な公知の提供元から市販されているものを入手可能である。例えば、様々な抗体分泌ハイブリドーマ系が、American Type Culture Collection(ATCC、Manassas、VA)から市販されている。
【0031】
モノクローナル抗体
好適な実施形態はP4/D10抗体の使用に関するものにすることができるが、その他の抗HIV抗体を入手、作成および/または使用することができる。HIVに対する様々な抗体が報告されており、特定の実施形態において、任意のこうした公知の抗HIV抗体を利用することができる。例えば、それぞれ本明細書に参照として組み込まれている、4E10(Rosa et al、Immunity 2:163―73、2005)、2F5(Bryson et al、Protein and Peptide Letters、8:413―18、2001)、3D6(Ruker et al.、Ann.NY Acad.Sci.646:212―19、1991)、C37(Cao et al.、DNAおよびCell Biology、12:836―41、2004)、IACY、1F58、IGGGC(Berry et al.、Proteins、45:281―82、2001)、2G12(Armbruster et al.、J.Antimicrob.Chemother.54:915―20、2004)である。別の実施形態において、モノクローナル抗体は、米国特許第4,196,265号に例示されているもの等の、公知の技術の利用によって、容易に産生することができる。典型的には、この技術には、選択した免疫原組成物への適した動物の免疫付与が含まれる。マウスおよびラット等のげっ歯類の細胞が好適である。マウスはより好適であり、これは最も日常的に使用されており、概して、より高い割合の安定した融合が得られるため、BALB/cマウスが最も好適である。
【0032】
免疫付与後、抗体を生成することのできる体細胞、詳細にはBリンパ球(B細胞)が、Mab生成プロトコルで使用されるように選択される。これらの細胞は、生検を行った脾臓、扁桃腺またはリンパ節、または末梢血サンプルから入手可能である。多くの場合、一群の動物が免疫付与され、最も高い抗体力価を有する動物の脾臓は除去され、脾臓のリンパ球が、注射器によって、脾臓を均質化することで入手される。典型的には、免疫付与されたマウスの脾臓は、約5×107から2×108のリンパ球を含む。
【0033】
免疫付与された動物からの抗体生成Bリンパ球は、次に、不滅の骨髄腫細胞の細胞と、概して、同じ種の1つを、免疫付与された動物として融合される。ハイブリドーマ生成融合手順において使用するために適している骨髄腫細胞系は、好適には、非抗体産生であり、高い融合効率および、所望の融合細胞(ハイブリドーマ)のみの成長を支持する特定の選択培地における成長ができない、酵素欠乏を有する。
【0034】
当業者に公知であるように、多くの骨髄腫細胞の任意の1つを使用することができる。例えば、免疫付与された動物はマウスにすることができ、P3―X63/Ag8、P3―X63―Ag8.653、NSl/l.Ag 4 1、Sp210―Agl4、FO、NSO/U、MPC―1l、MPC11―X45―GTG 1.7およびS194/5XX0 Bulを使用することができ、ラットには、R210.RCY3、Y3―Ag 1.2.3、IR983Fおよび4B210およびU―266、GM1500―GRG2、LICR―LON―HMy2を使用することができ、UC729―6は、細胞融合との結合に全て有用である。
【0035】
抗体産生の脾臓またはリンパ節細胞および骨髄腫細胞のハイブリッドを生成する方法には、通常、2:1の比率で体細胞と骨髄腫細胞を混在させているが、細胞膜の融合を促進する薬剤(化学的または電気的)が存在する場合にそれぞれ、比率は、約20:1から約1:1に変化させることができる。Sendaiウイルスを使用した融合方法、および37%(v/v)PEG等のポリエチレングリコール(PEG)を使用した融合方法について記載されている。また、電気的に誘導される融合方法の使用も適切である。
【0036】
融合手順は、通常、約1×10−6から1×10−8の低い周波数において実行可能なハイブリッドを産生する。しかし、実現可能な融合ハイブリッドは、選択培地に培養されることによって、親の非融合細胞(特に、通常無限に分裂を続ける非融合の骨髄腫細胞)と区別されているため、これによって問題は生じない。選択培地は、一般的に、組織の培地のヌクレオチドの新規の合成物質をブロックする薬剤を含むものである。例示的な薬剤は、アミノプテリン、メトトレキサート、およびアザセリンである。アミノプテリンおよびメトトレキサートは、プリンおよびピリミジンの双方の新規の合成物質をブロックし、一方で、アザセリンはプリン合成物質のみをブロックする。アミノプテリンまたはメトトレキサートが使用される場合、培地は、ヌクレオチド(HAT培地)のソースとしてヒポキサンチンおよびチミジンで強化される。アザセリンを使用している場合、培地はヒポキサンチンで強化される。
【0037】
好適な選択培地はHATである。ヌクレオチドのサルベージ経路を操作することのできる細胞のみが、HAT培地において生存することができる。骨髄腫細胞は、サルベージ経路の主要な酵素、例えばヒポキサンチンホスホリボシル転移酵素(HPRT)において欠陥があり、生存することができない。B細胞はこの経路を操作することができるが、培地における寿命は限られており、一般的に、2週間以内で死滅してしまう。従って、選択培地において生存する細胞は、骨髄腫およびB細胞から形成されるハイブリッドのみである。
【0038】
この培養により、特定のハイブリドーマが選択されたハイブリドーマの個体数が得られる。典型的には、ハイブリドーマの選択は、所望の反応度のために個々のクローン上清を試験した後(約2、3週間後)、マイクロタイタープレートにおける1回の希釈によって、細胞を培養することで実行される。アッセイは、ラジオイミュノアッセイ、酵素免疫アッセイ、細胞毒性アッセイ、血小板アッセイ、ドット免疫結合アッセイ等、高感度、単純かつ素早くすべきである。
【0039】
次に選択されたハイブリドーマは、連続的に希釈し、個々の抗体産生細胞系に複製され、こうして複製はMabsを提供するために無限に増殖することが可能である。細胞系は、2つの基本的な方法でMabを産生するために利用することができる。ハイブリドーマのサンプルを、(多くの場合、腹腔に)本来の融合のために体および骨髄腫細胞を提供するために使用された種類の組織適合の動物に注入することができる。注入された動物は、融合された細胞雑種によって産生されるモノクローナル抗体に特異な腫瘍の分泌を発現させる。血清または腹水等の動物の体液は、次に、高い濃度のMabsを提供するために液体を出すことができる。個々の細胞系はさらに生体内で培養され、こうして、高い濃度で容易に入手することができる培地へと、Mabsが自然に分泌される。各手段によって産生されたMabsは、好適には、HPLCまたは親和性クロマトグラフィー等のろ過、遠心分離、および様々なクロマトグラフ法を用いて、さらに純化することができる。
【0040】
抗体断片の産生
請求された方法および/または組成物のいくつかの実施形態は、抗体断片に関する場合がある。こうした抗体断片は、従来の方法による抗体全体のペプシンまたはパパインによる消化によって得られる。例えば、抗体断片は、F(ab’)2と示される5S断片を提供するためにペプシンによって抗体の酵素の分裂によって産生することができる。この断片は、さらにチオール還元剤、また、任意に、3.5SFab’一価断片を産生するために、ジスルフィド結合の分裂によって生じたスルフヒドリル基の保護基を使って、分裂させることができる。または、ペプシンを用いた酵素の分裂によって、2つの一価Fab断片およびFc断片が産生される。抗体断片を産生するための例示的な方法が、米国特許番号第4,036,945号、米国特許番号第4,331,647号、Nisonoff et al、1960、Arch.Biochem.Biophys.、89:230;Porter、1959、Biochem.J.、73:119;Edelman et al.、1967、METHODS IN ENZYMOLOGY、422ページ(Academic Press)、およびColigan et al.(eds.)、1991、CURRENT PROTOCOLS IN IMMUNOLOGY(John Wiley & Sons)に開示されている。
【0041】
無傷の抗体によって認識される抗原へと断片が結合される限り、一価軽鎖―重鎖の断片を形成するための重鎖の分断等の、抗体を切断するその他の方法、さらに断片またはその他の酵素の分断、化学または遺伝子技術を、さらに使用することができる。例えば、Fv断片はVHおよびVL鎖の関連を含む。この関連は、Inbar et al.,1972,Proc.Nat’l.Acad.Sci.USA、69:2659に記載されているように、非共有にすることができる。または、可変鎖を、分子間ジスルフィド結合によってリンクする、またはグルタルアルデヒド等化学的に架橋することができる。Sandhu,1992,Crit.Rev.Biotech.,12:437を参照されたい。
【0042】
好適には、Fv断片は、ペプチドリンカーによって接続されるVHおよびVL鎖を含む。これらの単一の鎖の抗原結合タンパク質(sFv)は、オリゴヌクレオチドリンカー配列によって接続されるDNA配列塩コーディングVHおよびVL領域を含む構造的遺伝子を構築することによって生成される。構造的遺伝子は、大腸菌等の宿主細胞にそれ以降導入される発現ベクターに挿入される。遺伝子組み換え宿主細胞は、2つのV領域を架橋するリンカーペプチドによって、単一のポリペプチド鎖を合成する。sFvsを産生する方法が当分野で公知である。Whitlow et al.、1991、Methods:A Companion to Methods in Enzymology 2:97;Bird et al.、1988、Science、242:423;米国特許番号第4,946,778号;Pack et al.、1993、Bio/Technology、11:1271、およびSandhu、1992、Crit.Rev.Biotech.、12:437を参照されたい。
【0043】
その他の形態の抗体断片は、補体決定領域(CDR)のためのペプチドコーディングである。CDRペプチド(「最小認識単位」)は、対象の抗体の遺伝子塩コーディングCDRを構築することで得られる。こうした遺伝子を、例えば、抗体産生細胞のRNAから可変領域を合成するためのポリメラーゼ鎖反応を使用することによって、生成することができる。Larrick et al.、1991、Methods:A Companion to Methods in Enzymology 2:106;Ritter et al.(eds.)、1995、MONOCLONAL ANTIBODIES: PRODUCTION、ENGINEERING AND CLINICAL APPLICATION、166―179ページ(Cambridge University Press);Birch et al.、(eds.)、1995、MONOCLONAL ANTIBODIES: PRINCIPLES AND APPLICATIONS、137―185ページ(Wiley―Liss、Inc.)を参照されたい。
【0044】
キメラおよびヒト化抗体
キメラ抗体は、例えば、ヒト抗体の可変領域を、例えば、マウスの抗体の相補性決定領域(CDR)を含む、マウスの抗体の可変領域によって置き換えた、遺伝子組み換えタンパク質である。キメラ抗体は、対象に投与される場合に、免疫原性の減少、および安定性の向上がもたらされる。キメラ抗体を構成するための方法が、当分野で公知である(例:Leung et al.,1994,Hybridoma 13:469)。
【0045】
キメラモノクローナル抗体を、マウスのCDRをマウスの免疫グロブリンの重軽可変鎖からヒト抗体の対応する可変領域へと移動させることによってヒト化することができる。キメラモノクローナル抗体のマウスのフレームワーク領域(FR)はさらに、ヒトのFR配列で置き換えられる。ヒト化モノクローナルの安定性および抗原特異性を保存するために、1つ以上のヒトのFR残基を、マウスの相当する残基で置き換えることができる。ヒト化モノクローナル抗体は、対象の療法的な治療に利用することができる。標的のためのヒト化抗体の親和性は、さらに、CDR配列(WO0029584A1)の選択された修正によって向上させることができる。ヒト化モノクローナル抗体の産生のための技術が、当分野で公知である。(例:Jones et al.、1986、Nature、321:522;Riechmann et al.、Nature、1988、332:323;Verhoeyen et al.、1988、Science、239:1534;Carter et al.、1992、Proc.Nat‘l Acad.Sci.USA、89:4285;Sandhu、Crit.Rev.Biotech.、1992、12:437;Tempest et al.、1991、Biotechnology 9:266;Singer et al.、J.Immun.、1993、150:2844.を参照。)
【0046】
別の実施形態は、ヒト以外の霊長類の抗体に関することができる。例えば、Goldenberg et al.、WO 91/11465(1991)、およびLosman et al.、Int.J.Cancer 46: 310(1990)において、ヒヒの治療的に有用な抗体を生成するための一般的な技術が示されている。
【0047】
ヒト抗体
別の実施形態において、抗体はヒトのモノクローナル抗体にすることができる。こうした抗体は、抗原的な問題に対して特異的なヒト抗体を賛成するために操作されている遺伝子組み換えマウスから得ることができる。この技術において、ヒトの重鎖および軽鎖の遺伝子座のエレメントが、内生の重鎖および軽鎖の遺伝座の標的の崩壊を含む、胚幹細胞系に由来するマウスのストレインに導入される。遺伝子組み換えマウスは、ヒトの抗原に特異的なヒト抗体を合成することができ、マウスを、ヒト抗体分泌ハイブリドーマを産生するために用いることができる。遺伝子組み換えマウスからヒト抗体を得るための方法が、Green et al.、Nature Genet 7:13(1994)、Lonberg et al.、Nature 368:856(1994)、およびTaylor et al.、Int.Immun.6:579(1994)に記載されている。
【0048】
組み合わせ法またはヒト免疫グロブリン遺伝座によって変形された遺伝子組み換え動物を用いて、ヒト抗体を完全に産生する方法が、当分野で公知である(例:それぞれ本明細書に参照として組み込まれている、Mancini et al.、2004、New Microbiol.27:315―28、Conrad and Scheller、2005、Comb.Chem.High Throughput Screen。8:117―26、Brekke and Loset、2003、Curr.Opin.PHamacol.3:544―50)。こうした完全なヒト抗体は、キメラまたはヒト抗体よりも副作用が少なく、また、本質的に内生のヒトの交代として生体内で機能すると考えられている。特定の実施形態において、請求される方法および手順は、こうした技術によって産生されるヒトの交代を利用することができる。
【0049】
ある別の実施形態において、ファージ提示技術を、ヒト抗体を生成するために使用できる(例:本明細書に参照として組み込まれている、Dantas―Barbosa et al、2005、Genet.Mol.Res.4:126―40)。ヒト抗体を、通常のヒト、またはHIV感染またはAIDS等の特定の病状を抱えるヒトから生成することができる。病気の個人からヒト抗体を生成する利点は、循環抗体の範囲を病気に関連する抗原に対する抗体へとバイアスすることができる、ということである。
【0050】
この方法論の1つの非制限的な例において、Dantas―Barbosa et al.(2005)は、骨肉種患者から、ヒトのFab抗体断片のファージ提示ライブラリを生成した。概して、循環血リンパ球(Id.)から全RNAが得られた。遺伝子組み換えFabは、μ、γおよびκ鎖抗体の範囲からクローン化され、ファージ提示ライブラリ(Id.)に挿入された。RNAは、cDNAに変換され、重鎖および軽鎖の免疫グロブリン配列に対する特異的なプライマーを用いて、Fab cDNAライブラリを作成する(本明細書に参照として組み込まれている、Marks et al.、1991、J.Mol.Biol.222:581―97)。ライブラリ構築は、Andris―Widhopf et al.によって行われた。(本明細書に参照として組み込まれている、2000,In:Phage Display Laboratory Manual,Barbas et al.(eds),1st edition,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY 9.1から9.22ページ)最終的なFab断片は、制限エンドヌクレアーゼによって消化され、ファージ提示ライブラリを作成するためにバクテリオファージゲノムに挿入された。こうしたライブラリは、バイオパニング等の標準的なファージ提示方法によってスクリーニングすることができる。当業者は、この技術は例示的であるにすぎないこと、また、ファージ提示によってヒト抗体または抗体断片を作成およびスクリーニングするための任意の公知の方法を利用できることが理解されよう。
【0051】
別の実施形態において、ヒト抗体を産生するために遺伝子的に操作された遺伝子組み換え動物を使って、上記で述べた標準的な免疫付与プロトコルを使った任意の免疫原の標的に対する抗体を生成することができる。こうした系統の非制限的な例は、Abgenix(Fremont,CA)によるXenoMouse(登録商標)(例:Green et al.,1999,J.Immunol.Methods 231:11―23)である。XenoMouse(登録商標)および同様の動物において、マウスの抗体遺伝子は不活性化され、機能的ヒト抗体遺伝子で置き換えられているが、マウスの免疫系のその他の部分は操作されていない。
【0052】
XenoMouse(登録商標)は、付属遺伝子および調節塩基配列に沿って大部分の可変領域配列を含む、ヒトIgHおよびIgkappa遺伝子座の部分を含有する、生殖細胞で構成されたYAC(酵母人工染色体)によって変換された。ヒトの可変領域の範囲を使用して、公知の技術によるハイブリドーマに処理可能な抗体産生B細胞を生成することができる。標的抗原によって免疫を付与されたXeno Mouse(登録商標)は、上述した標準的な技術によって得られるおよび/または生成することができる通常の免疫反応によって、ヒト抗体を生成する。それぞれ、様々な分類の抗体を産生することができる、XenoMouse(登録商標)の様々なストレインが利用可能である。こうしたヒト抗体は、化学的な架橋のまたはその他の公知の方法論によって、他の分子に結合可能である。通常のヒト抗体の薬物動態的な性質を保持しつつも治療の可能性を有するよう、遺伝子組み換えにより産生されたヒト抗体が示されている(Green et al.,1999)。当業者は、請求される組成物および方法はXenoMouse(登録商標)系の使用に制限されず、ヒト抗体を生成するために遺伝子的に操作された任意の遺伝子組み換え動物を利用することができることを、理解されるであろう。
【0053】
中和抗体
特定の実施形態において、HIVの感染力および/または毒性を壊滅または阻害することができる中和抗体またはその断片が好適である。様々なHIV中和抗体が当分野で公知であり、P4/D10、2G12(例:Joos et al.、Antimicrob Agents Chemother 2006、50:1773―79)、4E10(Joos et al.、2006)、2F5(Joos et al.、2006)、bl2(例:Wu et al.、J Virol 2006、80:2585)、X5(Moulard et al.、Proc Natl Acad Sci 2002、99:6913―18)または任意のその組み合わせを含むがこれに限定されない、これらの任意の公知の抗体またはその断片を使用できる。複数特異性抗体または断片が使用される場合、当業者は、同じまたは異なるHIVエピトープに結合される複数の抗体または断片を組み合わせることができることを理解されるであろう。HIVエンベロープタンパク質(gpl20)および/またはgp41に対する抗体は好適であるが、当業者は、HIV感染した細胞を標的にする抗体またはその断片を発現させるためにその他のHIV標的抗原を利用できることが理解されよう。一部の場合では、T細胞抗原(例:CD4、CCR5および/またはCXCR4)と組み合わせられた1つ以上のHIV抗原に結合する抗体または断片を利用できる。
【0054】
融合タンパク質
様々な実施形態が、融合タンパク質に関する。これらの分子は、一般的に、第2のポリペプチドまたはタンパク質の全てまたは一部へと、NまたはC末端でリンクされる、ペプチドの全てのまたは重要な部分を有する。例えば、融合は、異種宿主のタンパク質の遺伝子組み換え発現を可能にするため、その他の種からのリーダー配列を利用することができる。別の有用な融合には、ペプチドまたはタンパク質毒性または酵素等の治療用薬剤への、抗体または断片等の免疫学的に活性化した領域の結合が含まれる。しかし、その他の有用な形態の融合には、FLAGエピトープ等の、生成のために使用する部分の結合を含むことができる(Prickett et al、1989、Biotechniques 7:580―589、Castrucci et al、1992、J Virol 66:4647―4653)。融合タンパク質を生成する方法が当業者に公知である。例えば、二官能価の架橋試薬を使った化学的結合、完全融合タンパク質の新規の合成、または操作されていない融合タンパク質の発現後の、第1のタンパク質またはペプチドをエンコーディングするDNA配列の第2のペプチドまたはタンパク質をエンコーディングするDNA配列への結合によって、こうしたタンパク質を生成することができる。
【0055】
二重特異性抗体
特定の実施形態において、二重特異性または複数特異性抗体または断片を利用可能である。こうした抗体または断片は、例えば、治療用のおよび/または診断用の薬、サイトカイン、細胞表面受容体またはその他の抗原に共役された担体分子に対して、HIVに関連する抗原の少なくとも1つの結合部位および少なくとも1つのその他の結合部位を含む。
【0056】
一般的に、遺伝子組み換えDNA技術によって生成された抗体の別々のVHおよびVL領域は、結合能力を有するダイマー(遺伝子組み換えFv断片)を形成するために、互いに対になることができる(米国特許番号第4,642,334号)。しかし、こうした、非共有で関連する分子は、任意の実用的な利用を得るための生理的な条件下において十分に安定していない。同族のVHおよびVL領域を、結合作用を有する単一の―鎖Fv(scFv)を形成するために、適切な組成物および長さ(通常、12よりも多いアミノ酸残基で成る)のペプチドリンカーによって結合することができる。scFvsの生成方法は、米国特許番号第4,946,778号および米国特許番号第5,132,405号に開示されている。ペプチドリンカーの長さを12アミノ酸残基未満に縮小することにより、同じ鎖上のVHおよびVLの領域の対が予防され、別の鎖において相補的な領域を有するVHおよびVLの領域の対が強制されることになり、こうして、機能的多重結合体が形成される。3から12のアミノ酸残基の間のリンカーによって結合されるVHおよびVLの領域のポリペプチド鎖によって、圧倒的多数のダイマーが形成される(二重抗体といわれる)。0および2のアミノ酸残基の間にリンカーがある場合、トリマー(三重抗体といわれる)およびテトラマー(四重抗体といわれる)が好適であるが、オリゴマー化の正確なパターンは、組成物、および、リンカー長さに加えて、V領域(VH―リンカー―VLまたはVL―リンカー―VH)の方向に依存しているようである。
【0057】
複数の価数を有する単一特異的二重抗体、三重抗体、および四重抗体を、5アミノ酸残基またはそれ未満を含むペプチドリンカーを使用して得た。それぞれscFvが短いペプチドリンカーによって接続されている1つの抗体から、その他の抗体のVL領域へのVH領域を構成している、本明細書中では2つの異なるscFvsのダイマーである二重特異性二重抗体は、さらに、VH1―リンカー―VL2を含むあるシストロン遺伝子組み換え遺伝子構造においてシストロン発現ベクターを、また、VH2―リンカー―VL1を含む第2の遺伝子組み換え遺伝子構造において他のシストロン発現ベクターを含むジシストロン発現ベクターを使って、生成されている(Holliger、et al.Proc Natl Acad Sci USA.1993;90:6444―6448;Atwell、et al.Mol Immunol.1996;33:1301―1302;Holliger、et al.Nature Biotechnol.1997;15:632―631;Helfrich、et al.Int.J Cancer.1998;76:232―239;Kipriyanov、et al.Int J Cancer.1998;77:763―772;Holliger、et al.Cancer Res.1999;59:2909―2916)。
【0058】
より最近になって、二重の特異性を有する四価タンデム二重抗体(tandabと呼ばれる)も報告されている(Cochlovius,et al.Cancer Res.2000;60:4336−4341)。二重特異性tandabは、自己関連において2つの異なる特異性のそれぞれについて、2つの可能性のある結合部位の形成に役立つような向きにリンクされた2つの異なる抗体(VH1、VL1、VH2、VL2)の4つの可変領域をそれぞれが含む、2つの同一のポリペプチドのダイマーである。
【0059】
リンカー長さを変更することによる、多価および複数特異性のscFvベースの薬剤の製造方法が、米国特許番号第5,844,094号、米国特許番号第5,837,242号、および第WO98/44001号に開示されている。1つは少なくとも2つの抗体からのVH領域を含み、もう一方は対応するVL領域を含む、2つのポリペプチド鎖を構成することによる、多価および複数特異性のscFvベースの薬剤の製造方法が、米国特許番号第5,989,830号および米国特許番号第6,239,259号に開示されている。CHlのc末端およびFVのCLは、それぞれ同じまたは異なるモノクローナル抗体に由来するscFvに融合される、遺伝子組み換えにより生成された二重特異性または三重特異性の抗体が、米国特許番号第6,809,185号に開示されている。
【0060】
二重特異性および複数特異性抗体の構築および利用のための方法が、例えば、2004年11月2日に出願された、その全文が本明細書に参照として組み込まれている、米国特許出願文書番号第20050002945号に開示されている。二重特異性抗体および抗体断片を生成するために様々な遺伝子組み換え方法を使用することができる。例えば、遺伝子組み換えした家畜のミルクにおいて二重特異性抗体および抗体断片を生成することができる。(例:それぞれ本明細書に参照として組み込まれている、Colman、A.、Biochem.Soc.Symp.、63:141―147、1998、米国特許番号第5,827,690号を参照。)それぞれ、DNA断片のコーディングが免疫グロブリン重鎖および軽鎖の対となっている、2つのDNA構成が生成される。その断片は、哺乳類の上皮細胞に優先的に発現するプロモーター配列を含む発現ベクターにクローン化される。例には、ウサギ、ウシおよびヒツジのカゼインの遺伝子、ウシのアルファラクトグロブリン遺伝子、ヒツジのベータラクトグロブリン遺伝子、およびマウスのホエイ酸タンパク質遺伝子からのプロモーターが含まれるが、これに限定されない。好適には、挿入された断片は、哺乳類に特異的な遺伝子の同族ゲノム配列によって、その3’の側面に位置する。これにより、ポリアデニル化部位および転写安定化配列がもたらされる。この発現カセットは、受精した哺乳類の卵子の前核に注入され、こうして、受精したメスの子宮に移植され、妊娠させられる。誕生後、その子孫は、Southern分析によって、両トランス遺伝子の存在をスクリーニングされる。抗体が存在するようにするには、重鎖および軽鎖遺伝子の双方を同じ細胞において同時に発現させる必要がある。遺伝子組み換えしたメスからのミルクは、当分野で公知の標準的な免疫論理方法を用いて、抗体または抗体断片の存在および機能性について分析される。抗体は、当分野で公知の標準的な方法を用いて、ミルクから精製することができる。
【0061】
事前標的
二重特異性抗体で使用するためのある戦略に、二重特異性抗体が投与された後でエフェクター分子を対象に投与する事前標的の方法論が含まれる。HIV抗原の結合部位および1つ以上のエフェクター分子に共役される担体の結合部位を含む二重特異性抗体は、病変組織の位置を特定し、病変組織へのエフェクターの局所化の特異性を増大させる(米国特許出願第20050002945号)。エフェクター分子を、二重特異性抗体よりもずっと素早く循環からクリアにすることができるため、エフェクター分子が病変標的抗体に直接リンクしている場合よりも、事前標的の戦略が使用されている場合に通常の組織は、エフェクター分子に対する曝露を少なくすることができる。
【0062】
事前標的の方法が、検知薬または治療薬の標的バックグラウンド比率を向上させるために開発されている。事前標的のおよびビオチン/アビジンのアプローチの例が、例えば、その全てが本明細書に参照として組み込まれている、Goodwin et al、米国特許番号第4,863,713号、Goodwin et al.、J.Nucl.Med.29:226、1988、Hnatowich et al.、J.Nucl.Med.28:1294、1987、Oehr et al.、J.Nucl.Med.29:728、1988、Klibanov et al.、J.Nucl.Med.29:1951、1988、Sinitsyn et al.、J.Nucl.Med.30:66、1989、Kalofonos et al.、J.Nucl.Med.31:1791、1990、Schechter et al.、Int.J.Cancer 48:167、1991、Paganelli et al.、Cancer Res.51:5960、1991、Paganelli et al.、Nucl.Med.Commun.12:211、1991、米国特許番号第5,256,395号、Stickney et al、Cancer Res.51:6650、1991、Yuan et al.、Cancer Res.51:3119、1991、米国特許番号第6,077,499号、米国シリアル番号第09/597,580号、米国シリアル番号第10/361,026号、米国シリアル番号第09/337,756号、米国シリアル番号第09/823,746号、米国シリアル番号第10/116,116号、米国シリアル番号第09/382,186号、米国シリアル番号第10/150,654号、米国特許番号第6,090,381号、米国特許番号第6,472,511号、米国シリアル番号第10/114,315号、米国仮出願番号第60/386,411号、米国仮出願番号第60/345,641号、米国仮出願番号第60/3328,835号、¥米国仮出願番号第60/426,379号、米国シリアル番号第09/823,746号、米国シリアル番号第09/337,756、および米国仮出願番号第60/342,103号に記載されている。
【0063】
特定の実施形態において、病変組織の治療および/または画像化において、例えば、それぞれ本明細書に参照として組み込まれている、米国特許第6,126,916号、第6,077,499号、第6,010,680号、第5,776,095号、第5,776,094号、第5,776,093号、第5,772,981号、第5,753,206号、第5,746,996号、第5,697,902号、第5,328,679号、第5,128,119号、第5,101,827号および第4,735,210号に記載された方法の使用において、二重特異性抗体および標的可能な構成を使用することができる。さらなる方法が、1999年6月22日に出願された、米国出願シリアル第09/337,756号、および2001年4月3日に出願された、米国出願シリアル第09/823,746号に記載されている。
【0064】
ドックおよびロック(DNL)
特定の実施形態において、二重特異性の抗体または断片、または抗体または断片の共役を、公知の技術を用いて、ドックおよびロック(DNL)として組み立てることができる。DNL技術のさらなる詳細は、それぞれ、全文が本明細書に参照として組み込まれている、2005年3月24日に出願された米国特許出願シリアル第11/389,358号、2006年3月28日に出願された第11/391,584号、2006年6月29日に出願された第11/478,021号、2007年6月21日に出願された第11/633,729号、および2006年11月6日に出願された米国仮特許出願シリアル第60/864,530号に説明されている。
【0065】
要約すると、DNL技術は、例えば、c―AMP依存のタンパク質キナーゼA、および、PKAのRサブユニットとの関連を媒介する様々なA―キナーゼ固着タンパク質(AKAP)内で見られる固着領域の標準的サブユニットの、ダイマー化およびドッキング領域(DDD)等の2つ以上の相補配列間の標的の結合を含む。しかし、当業者には、その他のダイマー化およびドック領域および固着領域が公知であり、任意のこうした公知の領域を、請求される対象事項の範囲内で利用できることが理解されよう。その他の例示的な4らせんバンドルタイプのDDD領域を、p53、DCoH(プテリン4アルファカルビノラミン脱水酵素/肝細胞核因子1アルファ(TCFl)のダイマー化共因子)およびHNF―I(肝細胞核因子1)から得ることができる。利用が可能なその他のAD配列が、全文が本明細書に参照として組み込まれている、特許出願シリアル番号第US20003/0232420A1号に記載されている。
【0066】
これらの相補結合対は、決定された特異性および活性の治療用または診断用の複合物を形成する、抗体または抗体断片等の様々な機能的ユニットに、または治療用または診断用の薬に対して、共有結合することができる。当業者は、例えばADまたはDDDの配列を、公知の結合特異性と共にFab、Fab’、IgG、scFcまたはその他の抗体または断片を含む融合タンパク質に組み込むことにより、こうした複合体を形成できる複数の方法が存在することを理解されるであろう。例えば、二重特異性複合体を、ADおよびDDD配列を2つの異なる標的抗原に特異な抗体または断片に組み込むことで、形成することができる。または、DDDまたはADの部分に結合する抗体または断片を、相補的なADまたはDDDの部分に結合する、ホルモン、酵素、リボヌクレアーゼ、オンコナーゼまたはその他の薬剤等の治療用タンパク質またはペプチドと組み合わせることができる。多くのこうした可能性のある複合体が、上記の患者の応用例において記載されており、任意のこうした公知の複合体を利用することができる。
【0067】
抗HIV抗体への、治療薬または診断薬の共役
様々な実施形態において、治療薬を、HIV感染細胞の送達のために、抗HIV抗体、断片またはその他の標的となる分子に共役することができる。使用する治療薬には、アピリジン、アザリビン、アナストロゾール、アザシチジン、ブレオマイシン、ボルテゾミブ、ブリオスタチン−1、ブスルファン、カリケアマイシン、カンプトセシン、10―ヒドロキシカプリン酸、カルムスチン、セレブレックス、クロラムブシル、シスプラチン、イリノテカン(CPT―11)、SN―38、カルボプラチン、クラドリビン、シクロホスファミド、シタラビン、ダカルバジン、ドセタキセル、ダクチノマイシン、ダウノマイシングルクノニド、ダウノルビシン、ドキソルビシン、2―ピロリノドキソルビシン(pyrrolinodoxorubicine)(2P−DOX)、シアノ―モルホリノドキソルビシン、ドキソルビシングルクロニド、エピルビシングルクロニド、エストラムスチン、エトポシド、エトポシドグルクノニド、リン酸エトポシド、フロクスウリジン(FUdR)、3’,5’―O―ジオレオイル−FudR(FUdR−dO)、フルダラビン、フルタミド、フルオロウラシル、フルオキシメステロン、ゲムシタビン、ヒドロキシウレア、イダルビシン、イホスファミド、L−アスパラギナーゼ、ロイコボリン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、6−メルカプトプリン、メトトレキサート、ミトキサントロン、ミトラマイシン、マイトマイシン、ミトタン、フェニル酪酸塩、プロカルバジン、ペントスタチン、PSI―341、セムスチン、ストレプトゾシン、タキサン、チオグアニン、チオテパ、テニポシド、トポテカン、ウラシルマスタード、ベルケイド、ビンブラスチン、ビノレルビン、ビンクリスチン、リシン、アブリン、リボヌクレアーゼ、オンコナーゼ、rapLRl、DNase I、ブドウ球菌性エンテロトキシン−A、ヤマゴボウ抗ウイルス性タンパク質、ゲロニン、ジフテリアトキシン、シュードモナスエクソトキシン、シュードモナスエンドトキシン、アンチセンスオリゴヌクレオチド、干渉RNAまたはその組み合わせを含むことができる。
【0068】
さらなる部分を、本明細書に記載されているHIV標的の分子に共役にすることができる。例えば、薬物、毒素、放射線化合物、酵素、ホルモン、細胞毒性タンパク質、キレート、サイトカイン、およびその他の機能薬剤を、HIV標的の分子に対して共役にすることができる。共役は、例えば、その側鎖においてアミン基、カルボキシル基、チオール基またはヒドロキシル基を含むアミノ酸残基へ共有結合によるものにすることができる。例えば、ジイソシアネート、ジイソチオシアネート、ビス(ヒドロキシスクシニミド)エステル、カルボジイミド、マレイミド―ヒドロキシスクシニミドエステル、グルタルアルデヒド等の、様々な従来のリンカーをこの目的のために使用できる。HIV標的の分子への薬剤の共役は、好適には、非組み換え構造に比較して、結合活性または特異性に大きな影響を及ぼさない。さらに、細胞毒性および/またはウイルス静止剤は、まずはポリマー担体に結合することができ、次にHIV標的の分子に共役する。この方法については、本明細書に参照として組み込まれている、Ryser et al、Proc.Natl.Acad.Sci.USA、75:3867―3870、1978、米国第4,699,784号および米国第4,046,722号を参照されたい。
【0069】
本明細書に記載されている共役は、抗体を脂質、炭水化物、タンパク質、放射性核種、またはその他の原子および分子にリンクさせるための公知の方法によって、生成することができる。例えば、本明細書に記載されているHIV標的の分子は、共有で、非共有で、またはその他の方法で、治療用のまたは診断用の薬を組み込むことができる共役を形成するために、本明細書に記載されている1つ以上の担体(例:脂質、ポリマー、リポゾーム、ミセル、またはナノ粒子)にリンクさせることができる。または、任意の本明細書に記載されているHIV標的の分子は、本明細書に記載されている1つ以上の治療用のまたは診断用の薬と直接共役にすることができる。
【0070】
例えば、HIV標的の分子は、131Iで標識化することができ、また、脂質に共役し、生じた共役でリポゾームが形成されるようにすることができる。リポゾームは、1つ以上の治療の(例:FUdR―dO等の薬)または診断の薬を組み込むことができる。リポゾームおよびミセルの形成は当分野で公知である。例:Wrobel and Collins、Biochimica et BiopHysica Acta(1995)、1235:296―304;Lundberg et al、J.Pharm.Pharmacol.(1999)、51:1099―1105;Lundberg et al.、Int.J.PHarm.(2000)、205:101―108;Lundberg、J.Pharm.Sci.(1994)、83:72―75;Xu et al.、Molec.Cancer Ther.(2002)、1:337―346;Torchilin et al.、Proc.Nat’l.Acad.Sci.、U.S.A.(2003)、100:6039―6044;U.S.5,565,215;U.S.6,379,698、およびU.S.2003/0082154を参照されたい。
【0071】
薬物の送達または画像化に有用な、ポリマー、シリカ、または金属から形成されるナノ粒子またはナノカプセルについても、記載されている。例:West et al、Applications of Nanotechnology to Biotechnology(2000)、11:215―217、U.S.5,620,708、U.S.5,702,727、およびU.S.6,530,944を参照されたい。治療のまたは診断薬のための標的の担体を形成するための、リポゾームへの抗体または結合分子の共役が説明されている。例:Bendas、Biodrugs(2001)、15:215―224、Xu et al.、Mol.Cancer Ther(2002)、1:337―346;Torchilin et al.、Proc.Nat’l.Acad.Sci.U.S.(2003)、100:6039―6044、Bally、et al.、J.Liposome Res.(1998)、8:299―335、Lundberg、Int.J.Pharm.(1994)、109:73―81、Lundberg、J.Pharm.Pharmacol.(1997)、49:16―21;Lundberg、Anti−cancer Drug Design(1998)、13:453―461を参照されたい。さらに、1999年6月9日に出願された、米国番号第6,306,393号、米国シリアル番号第10/350,096号、米国シリアル番号第09/590,284号、および米国シリアル番号第60/138,284号を参照されたい。これらの全ての参照は本明細書に参照として組み込まれている。
【0072】
幅広い様々な診断用のおよび治療用の薬は、HIV標的の分子の共役を形成するために有利に利用することができるか、またはHIV標的の分子における認識部位に結合するハプテンにリンクさせることができる。診断用薬剤には、放射性同位体、MRIに使用する造影剤または超音波画像化のための造影剤、および蛍光化合物を含むことができる。多くの適切な画像化剤が、タンパク質またはペプチドへの結合のための方法として、当分野で公知である(共に本明細書に参照として組み込まれている、例:米国特許第5,021,236号および第4,472,509号を参照)。特定の結合方法には、例えば、有機キレート剤タンパク質またはペプチドに結合したこうしたDTPを使用する金属キレート複合体の使用を含む(米国特許第4,472,509号)。
【0073】
HIV標的の分子に放射性金属または常磁性イオンを取り込むためには、放射性金属または常磁性イオンを結合するためのキレート基の複数の複製が結合している担体で、これと最初に反応することが必要になる場合がある。こうした担体は、この目的で有用であることが公知の、エチレンジアミン四酢酸(EDTA)、ジエチレントリアミン五酢酸(DTPA)、ポルフィリン、ポリアミド、クラウンエーテル、ビス―チオセミカルバゾン、ポリオキシム等の、ポリリシン、多糖類、またはキレート基を結合可能なペンダント基を有する誘導体化あるいは誘導体化可能なポリマー物質にすることができる。キレートを含有する担体は、免疫反応の凝集および損失を最小限にするように、標準的な化学的方法を使用して、HIV標的分子に結合される。
【0074】
こうした共役の生成のために適用可能な、その他の、より変わった方法および試薬が、その全体が参照として本明細書に組み込まれている、米国第4,824,659号に開示されている。特に、有用な金属とキレートの組み合わせには、60から4,000keVの一般的なエネルギー範囲で診断用の同位元素と共に使用される、2―ベンジル―DTPおよびそのモノメチルおよびシクロヘキシル類似体が含まれる。いくつかの有用な診断的な核種には、18F、52Fe、62Cu、64Cu、67Cu、67Ga、68Ga、86Y、89Zr、94Tc、94mTc、99mTc、または111Inを含むことができる。本明細書に記載されているHIV標的の分子および担体と共に使用する場合、マンガン、鉄およびガドリニウム等の非放射性金属と複合された同じキレートが、MRIで有用である。NOTA、DOTA、およびTETA等の大環状のキレートが、様々な金属および放射能金属と共に、特にそれぞれ、ガリウム、イットリウムおよび銅の放射性核種と共に使用される。こうした金属とキレートの複合体は、対象となる金属の輪の大きさに合わせて調整されることによって、非常に安定させることができる。223Raを複合させるための大環状のポリエーテル等のその他の輪タイプのキレートを使用できる。
【0075】
治療薬は、例えば、ビンカアルカロイド、アントラサイクリン、エピポドフィロトキシン、タキサン、代謝拮抗物質、アルキル化剤、抗生物質、Cox―2阻害物質、抗有糸分裂剤、抗血管由来およびアポトーシス誘導剤等の化学的治療薬、特にドキソルビシン、メトトレキサート、タクソール、CPT―1l、カンプトテシン、ならびにこれらのおよびその他の細胞毒性薬の分類のその他のものが含まれる。その他の細胞毒性薬には、ナイトロジェンマスタード、アルキルスルフォン酸塩、ニトロソウレア、トリアジン、葉酸類似体、ピリミジン類似体、プリン類似体、プラチナ配位錯体等が含まれる。適した細胞毒性薬は、REMINGTON‘S PHARMACEUTICAL SCIENCES、19th Ed.(Mack Publishing Co.1995)、およびGOODMAN AND GILMAN’S THE PHARMACOLOGICAL BASIS OF THERAPEUTICS、7th Ed.(MacMillan Publishing Co.1985)、およびこれらの文書の改訂版に記載されている。実験的薬剤等のその他の適した細胞毒性薬が当業者に公知であり、当分野で公知の方法を用いて、本明細書に記載されたHIV標的の分子に共役することができる。
【0076】
その他の治療薬分類は、α粒子(212Pb、212Bi、213Bi、211At、223Ra、225Ac等)、β粒子(32P、33P、47Sc、67Cu、67Ga、89Sr、90Y、111AA g、125I、131I、142Pr、153Sm、161Tb、166Ho、166Dy、177Lu、186Re、188Re,189Re等)またはオーガー電子(111In、125I、67Ga、191Os、193mPt、195mPt、195mHg等)を発する放射性核種から成る。HIV標的の分子は、診断用薬について説明しているように、方法を使って上記の1つ以上の放射性核種で標識化することができる。
【0077】
特定の実施形態において、使用する治療薬は、1つ以上のアグリゾーム阻害物質を含むことができる。アグリゾームは、異常な折りたたみ構造のタンパク質に対して形成すると考えられている大きな細胞間複合体である(例:Heath et al.、J.Cell Biol.153:449―55、2001、Johnston et al、J.Cell Biol.143:1883―98、1998、Wileman、Science 312:875―78、2006を参照)。より最近では、アグリゾームはウイルスの粒子(Heath et al.、2001、Wileman、2006)の組み立てにおいて働くことができることが示唆されている。従って、アグリゾーム阻害物質は、HIVまたはその他のウイルスに感染した細胞からの新たな感染性ウイルスの粒子の形成をブロックまたは阻害するよう機能する。様々なアグリゾーム阻害物質は、ALLN、ノコダゾール、コルヒチンおよびビンブラスチン(Johnston et al.、1998)、その他の微小管阻害物質(GerdesおよびKatsanis、Hum.Molec.Genet.14:R291―300、2005)、ボルテゾミブ(Velcade)(Catley et al.、Blood 108:3441―49、2006)、tubacin、ヒストン脱アセチル化酵素阻害物質(Corcoran et al.、Curr.Biol.14:488―92、2004)等が公知であり、任意のこうした公知のアグリゾームは阻害するか、または使用することができる。
【0078】
様々な実施形態において、1つ以上の免疫賦活剤を、患者への投与のために抗HIV抗体または断片へ共役することができるか、または、患者に同時投与することができる。本明細書において、「免疫賦活剤」という用語は、インターロイキン、コロニー刺激因子、インターフェロン(例:インターフェロンα、βおよびγ)等のサイトカイン、幹細胞成長因子、リンパ毒素および造血因子、「Sl因子」と呼ばれる幹細胞成長因子を含む。適した免疫賦活剤の部分の例には、IL―2、IL―6、IL―10、IL―12、IL―18、IL―21、インターフェロン―ガンマ、TNF―アルファ等が含まれる。
【0079】
「サイトカイン」という用語は、細胞間媒介物質としてその他の細胞上で作用する1つの細胞集団によって放出されるタンパク質またはペプチドを指す遺伝子用語である。本明細書で幅広く用いられているように、サイトカインの例には、リンフォカイン、モノカイン、成長因子および従来のポリペプチドホルモンが含まれる。サイトカインには、ヒトの成長ホルモン、N―メチオニルのヒトの成長ホルモン、およびウシの成長ホルモン等の成長ホルモン、副甲状腺ホルモン、チロキシン、インシュリン、プロインシュリン、レラキシン、プロレラキシン、卵胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、および黄体形成ホルモン(LH)等の糖タンパク質ホルモン、肝臓成長因子、プロスタグランジン、繊維芽細胞成長因子、プロラクチン、胎盤性ラクトゲン、OBタンパク質、腫瘍壊死因子―αおよび―β、ミューラー阻害物質、マウスのゴナドトロピン関連ペプチド、インヒビン、アクティビン、血管内皮性成長因子、インテグリン;トロンボポイエチン(TPO)、NGF―β等の神経成長因子、血小板成長因子、TGF―αおよびTGF―β等の変換成長因子(TGF)、インシュリン様成長因子―Iおよび―II、エリスロポエチン(EPO)、骨誘導因子、インターフェロン―α、インターフェロン―β、インターフェロン―γ等のインターフェロン、マクロファージ―CSF(M―CSF)、顆粒球―マクロファージ―CSF(GM―CSF)、顆粒球―CSF(G―CSF等のコロニー刺激因子(CSF)、IL―1、IL―lα、IL―2、IL―3、IL―4、IL―5、IL―6、IL―7、IL―8、IL―9、IL―10、IL―1l、IL―12;IL―13、IL―14、IL―15、IL―16、IL―17、IL―18、IL―21、LIF、G―CSF、GM―CSF、M―CSF、EPO、キット―配位子またはFLT―3等のインターロイキン(IL)、アンギオスタチン、トロンボスポンジン、エンドスタチン、腫瘍壊死因子およびLT等が含まれる。本明細書において、サイトカインという用語には、自然源からのまたは遺伝子組み換え細胞培養によるタンパク質および元の配列のサイトカインの生物学的に活性な同等物が含まれる。
【0080】
ケモカインは、一般的に、免疫エフェクター細胞をケモカイン発現部位に編成するために、化学的誘引物質として働く。治療部位に対する他の免疫系構成要素の編成を強化するために、例えば、サイトカイン遺伝子と組み合わせて、特定のケモカイン遺伝子を発現させることが有利である場合がある。ケモカインは、RANTES、MCAF、MIP1アルファ、MIP1ベータ、およびIP10を含むが、これに限定されない。当業者は、特定のサイトカインはさらに、化学的誘引物質の効果を有し、ケモカインという用語で分類することもできることを理解されよう。同様に、免疫賦活剤およびサイトカインは、各員において重複する。
【0081】
検知可能なラベル(例:蛍光分子)、またはウイルス静止性および/または細胞毒性薬、(例:放射性ヨウ素)を含む適したペプチドは、共有で、非共有で、またはHIV標的の分子と関連するようにすることができる。例えば、感光剤または着色剤をHIV標的の分子に組み込むことにより、治療的に有用な共役を得ることができる。適切な光を病巣に当てることによって病巣を検知および治療するため、フルオロクロム等の蛍光組成物、およびその他の色原体、または可視光に反応するポルフィリン等の着色料が使用されている。治療において、これは、光線照射、光線療法、または光線力学療法と呼ばれている。Jori et al.(eds.)、PHOTODYNAMIC THERAPY OF TUMORS AND OTHER DISEASES(Libreria Progetto 1985)、van den Bergh、Chem.Britain(1986)、22:430を参照されたい。さらに、モノクローナル抗体は、光線療法を実行するための光活性化した着色料と結合されている。Mew et al.、J.Immunol.(1983),130:1473、idem.、Cancer Res.(1985)、45:4380;Oseroff et al.、Proc.Natl.Acad.Sci.US(1986)、83:8744、idem.、Photochem.Photobiol.(1987)、46:83、Hasan et al.、Prog.Clin.Biol.Res.(1989)、288:471、Tatsuta et al.、Lasers Surg.Med.(1989)、9:422;Pelegrin et al.、Cancer(1991)、67:2529を参照されたい。
【0082】
アプタマー
別の実施形態において、開示された組成物および方法は、アプタマー等の、抗体または抗体断片に対する別の形態の結合分子を利用することができる。アプタマーは典型的には、選択された標的分子に抗体様の結合親和性および特異性を提供する3次元構造を適用可能な合成オリゴヌクレオチドである。アプタマーの結合特徴を構成および決定する方法が分野で公知である。例えば、こうした技術は、本明細書に参照として組み込まれている、米国特許第5,582,981号、第5,595,877号および第5,637,459号に記載されている。
【0083】
アプタマーは、合成、遺伝子組み換え、および精製方法を含む任意の公知の方法で作成することができ、単体で、同じ標的に特定のその他のリガンドと共に、使用することができる。一般的に、特異的な結合を有効にするために、少なくとも約3のヌクレオチド、好適には少なくとも5のヌクレオチドが必要である。10、20、30または40のヌクレオチドのアプタマーが好適であるが、10塩基よりも短い配列のアプタマーが適している場合がある。
【0084】
アプタマーは結合特異性を与える配列を含む必要があるが、側面領域に延伸することができる、またそうでない場合には被膜することができる。好適な実施形態において、アプタマーの結合配列はプライマー結合配列によって挟むことができ、これは、PCRまたはその他の増幅技術によるアプタマーの増幅に役立つ。さらなる実施形態において、側面配列には、基質へのアプタマーの固定化を強化させるための部分を優先的に認識または結合する特異的な配列を含むことができる。
【0085】
アプタマーは、従来のDNAまたはRNA分子として、分離、配列、および/または増殖または合成することができる。または、対象のアプタマーは組み換えを行ったオリゴマーを含むことができる。通常、アプタマー内に存在する任意のヒドロキシル基は、ホスホン酸基、リン酸基によって置換したり、標準的な保護基で保護したり、またはその他のヌクレオチドへのさらなる結合を生成するよう活性化されたり、あるいは固体支持に共役するようにすることができる。1つ以上のリン酸ジエステル結合を、P(O)S、P(O)NR2、P(O)R、P(O)OR’、CO、またはCNR2で置換したP(O)O等の別の結合基で置換することができる、ここでRはHまたはアルキル(1―20C)およびR’はアルキル(1―20C)であり、さらに、この基はOまたはSによって隣接するヌクレオチドに結合可能である。オリゴマーの全ての結合を同一にする必要はない。
【0086】
それぞれ参照として組み込まれている、例えば米国特許番号第5,475,096号および米国特許番号第5,270,163号等の、特定の対象となる標的に結合するアプタマーの生成およびスクリーニングの方法が公知である。技術には概して、候補アプタマーの混合および結合の段階的な反復、非結合アプタマーからの分離、および増殖からの選択を含む。最も高い親和性のアプタマーに相当する少数の配列のみ(恐らくはアプタマーの1つの分子のみ)が混合物内に存在するため、混合物内のアプタマーの高い容量(約5―50%)が、分離時においても保持されるよう、分割基準を設定することが一般的に望ましい。各サイクルによって、標的のための高い親和性を有するアプタマーが濃縮される。高い親和力および標的に対する特異性を持って結合する、3から6つの選択および増殖のサイクルの繰り返しを用いることができる。アプタマーは、当分野で公知の標準的な核酸標識化技術によって治療薬に共役することができる。
【0087】
アビマー
特定の実施形態において、開示されている組成物または方法は、1つ以上のアビマー配列を利用することができる。アビマーは、様々な標的分子に対する親和性および特異性において抗体と類似した結合タンパク質の一種類である。これは、生体内のエキソンシャッフリングおよびファージ提示法によって、ヒトの細胞外受容体領域から成長する。(Silverman et al.、2005、Nat. Biotechnol. 23:1493―94;Silverman et al.、2006、Nat. Biotechnol。 24:220。)生成された複数領域タンパク質は、単一エピトープ結合タンパク質と比較して高い親和力(場合によってはサブナノモル)および特異性を示すことができる、複数の結合領域を含むことができる。(Id.)様々な実施形態において、アビマーは、本明細書に記載されている標準的なタンパク質架橋または標識化の技術を用いた、請求されている方法および組成物で使用する治療薬に結合することができる。例えば、それぞれ、例のセクションが本明細書に参照として組み込まれている、米国特許出願文書番号第20040175756号、第20050048512号、第20050053973号、第20050089932号および第20050221384号において、アビマーの構築および利用の方法に関するさらなる詳細が開示されている。
【0088】
処方および投与
その共役を含む、HIV標的の分子はさらに、1つ以上の薬剤的に適した賦形剤、1つ以上のさらなる構成要素、またはこれらのいくつかの組み合わせを含む組成物を得るように編成できるこれらは薬剤的に有用な用量を生成するために公知の方法によって行うことができ、これにより、活性構成要素(すなわち、HIV標的の分子または共役)は、1つ以上の薬剤的に適した賦形剤と共に混合物中に混合される。無菌リン酸緩衝生理食塩水は、薬剤的に適した賦形剤の一例である。その他の適した賦形剤が当業者に公知である。例:Ansel et al.、PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS、5th Edition(Lea & Febiger 1990) and Gennaro(ed.)、REMINGTON‘S PHARMACEUTICAL SCIENCES、18th Edition(Mack Publishing Company 1990)、およびその改訂版を参照されたい。
【0089】
本明細書に記載の組成物のある投与経路は、非経口注入である。非経口投与において、その組成物は、薬剤的に容認可能な溶液、懸濁液またはエマルジョン等の注入可能な形態の単位用量で、賦形剤に関連して、編成される。こうした賦形剤は、本質的に、非毒性および非治療的であるこうした賦形剤の例は、生理食塩水、Ringerの溶液、デキストロース溶液、およびHankの溶液である。揮発性油、オレイン酸エチル等の非水性の賦形剤も使用できる。好適な賦形剤は、生理食塩水に5パーセントのデキストロースを混合したものである。賦形剤は、緩衝液および保存剤を含む、等張性および化学的安定性を向上させる物質等の、少量の添加物を含むことができる。経口投与を含む、その他の投与方法も検討されている。
【0090】
HIV標的分子を含む編成された組成物を、例えば、ボーラス注入または継続的注入による静脈内投与のために使用できる。注入のための組成物は、防腐剤を加え、アンプルまたは複数用量容器において、単位用量形態で示すことができる。油性または水性の賦形剤における懸濁液、溶液またはエマルジョンの形態を取ることもでき、懸濁化剤、安定剤および/または分散剤等の形成用の薬剤を含むことができる。あるいは、使用前に無菌の発熱物質なしの水等の適切な賦形剤によって、組成物は、構成のために粉状にすることができる。
【0091】
組成物は、溶液で投与することができる。溶液のpHは、pH5から9.5の範囲に、好適にはpH6.5から7.5の範囲にするべきである。溶液の編成は、リン酸、トリス(ヒドロキシメチル)アミノメタン―HClまたはクエン酸等の適切な薬剤的に容認可能な緩衝液を有する溶液にするべきである。緩衝液濃度は1から100mMの範囲にするべきである。編成された溶液はさらに、濃度50から150mMの塩化ナトリウムまたは塩化カリウム等の塩を含有することもできる。グリセロール、アルブミン、グロブリン、浄化剤、ゼラチン、プロタミンまたはプロタミン塩をさらに含有することができる。編成された組成物の全身への投与は、ヒト化の形態の抗体をHIV標的の分子のテンプレートとして使用する場合、典型的には、2日または3日ごとに、または1週間に1回行われる。または、毎日の投与が有用である。通常、投与は、筋肉内注入または血管内注入によるものである。
【0092】
組成物は、哺乳類の皮下に、またはその他の非経口経路によって、投与することができる。さらに、投与は、継続注入または一回のみまたは複数回のボーラス注入にすることができる。抗体または免疫抱合体に有効な方法を、本明細書に記載の組成物に適用することができる。一般的に、投与する免疫抱合体、融合タンパク質、またはヒトの裸抗体の用量は、患者の年齢、体重、身長、性別、一般的な健康状態および過去の病歴等の因子によって変動する。状況によってはよりの低用量または高用量も投与可能であるが、典型的に、1回の静脈内注入として、1mg/kgから20mg/kgの範囲の活性材料の用量を被験者に与えることが望ましい。この用量を、例えば、4週から10週間にわたって週一回、好適には8週間にわたって週一回、およびより好適には、4週間にわたって週一回等、必要に応じて繰り返すことができる。さらに、数ヶ月間にわたって一週間おき等の、より低い頻度で与えることもできる。用量は、用量およびスケジュールの適切な調節を行って、様々な非経口の経路で与えることができる。
【0093】
免疫抱合体または抗体の作用の期間を制御するために使用される薬剤の方法を、本明細書に記載されている形成された組成物に適用することができる。注入制御による生成は、複合体への生体適合性のあるポリマーの使用によって行うことができ、または、例えば、ポリ(エチレン―共―ビニルアセテート)の基質およびステアリン酸ダイマーポリ無水物コポリマーおよびセバシン酸の基質等の、免疫抱合体または裸抗体を吸収する。Sherwood et al.、Bio/Technology(1992)、10:1446を参照されたい。こうした基質からの免疫抱合体または抗体の注入速度は、免疫抱合体または抗体の分子重量、免疫抱合体の量、基質内の抗体、および分散粒子の大きさに依存する。上記のSaltzman et al.、Biophys.J(1989)、55:163;Sherwood et al.を参照されたい。その他の固体用量の形態が、Ansel et al.、PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS、5th Edition(Lea & Febiger 1990)、およびGennaro(ed.)、REMINGTON’S PHARMACEUTICAL SCIENCES、18th Edition (Mack Publishing Company 1990)およびその改訂版に記載されている。
【0094】
治療のために、治療有効量の組成物を哺乳類に投与する。非ヒトの動物の対象もさらに検討されるが、本明細書に開示されている治療用および診断用の方法に適した対象は通常ヒトである。
【0095】
肺への局所的送達を行うために、組成物を噴霧器によって投与することができる。水性の噴霧器または非水分の(例:過フッ化炭化水素噴射)懸濁液のいずれかを使用することができる。ソニック噴霧器は、好適には、剪断する組成物におけるHIV標的分子の曝露を最小限にするためにエアロゾルを作成するために使用され、これによって、活性の低下および消失がもたらされる可能性がある。
【0096】
放射性核種にリンクされているHIV標的分子は、治療に有効な場合がある。対象において1つ以上の感染部位にHIV標的の分子が配置されたと判断された後で、標識化された組成物のより高用量、一般的に、それぞれ70kgの患者の体重を基にした、131Iの各用量につき20mCiから150mCi、90Yの各用量につき5mCiから30mCi、または186Reの各用量につき5mCiから20mCiが注入される。注入は静脈内、動脈内、リンパ内、髄腔内、または腔内(すなわち、非経口)にすることができ、繰り返すことができる。複数の、分割された用量を投与すると、通常の組織の曝露においてそれに伴う増加に通常、影響せずに、より高い中毒量を提供できるため、いくつかの療法に有利である場合がある。
【0097】
また別の実施形態では、抗HIV抗体または断片を、IgGlのFc(例3―7を参照)等の特定のタンパク質に共役することにより、経口または吸入投与のために操作することができる。ペプチドFc共役の生成および利用の方法が、それぞれ本明細書に参照として組み込まれている、例えば、Low et al.(2005、Hum.Reprod.20:1805―13)およびDumont et al.(2005、J.Aerosol.Med.18:294―303)に開示されている。Low et al.(2005)は、CHO細胞における遺伝子組み換え発現を使った、一本鎖におけるIgGlのFc領域へのFSHのアルファおよびベータのサブユニットまたはヘテロダイマーの形態の共役を開示している。Fc共役されたペプチドは、新生児のFc受容体が媒介となる伝達系によって、肺または腸の上皮細胞を通って吸収された。Fcで共役されたペプチドは、本来のペプチドと比較して、生体内の安定性および吸収性が向上した。さらに、ヘテロダイマー共役は、一本鎖の形態よりも活性が高いことが観察された。エリスロポエチン等のより大きいタンパク質は、さらに、Fc共役(Dumont et al.、2005)を使って、吸入によって有効に送達することができる。
【0098】
治療および診断への利用:事前標的を含まない応用例
HIV標的の分子にリンクされている、放射性および非放射性診断薬の利用が検討されてきた。適した非放射性診断薬とは、磁気共鳴画像装置(MRI)で使用されるもの、コンピュータ断層撮影(CT)または超音波で使用されるものである。MRI用薬剤には、例えば、2―ベンジル―DTPAの適したキレートと複合されているマンガン、鉄およびガドリニウムおよびそのモノメチルおよびシクロヘキシル類似体等の非放射性金属が含まれる。その全てが参照として組み込まれている、2001年10月10日に出願された、米国シリアル第09/921,290号を参照されたい。
【0099】
HIV標的の分子は、診断用の画像化に有用な放射性同位体によって標識化することができる。適した放射性同位体は、60から4,000KeVのエネルギー範囲のもの、またはより詳細には、18F、52Fe、62Cu、64Cu、67Cu、67Ga、68Ga、86Y、89Zr 94mTc、94Tc、99mTc、45Ti、111In、123I、124I、125I、131I、154−158Gd、177Lu、32P、188Re等またはその組み合わせを含むことができる。例:米国特許出願「Labeling Targeting Agents with Gallium―68”―Inventors G.L.Griffiths and W.J.McBride」、および、画像化の目的のための18F、68Ga、94mTc等の陽電子エミッタを開示する米国仮出願番号第60/342,104号(本明細書に参照として組み込まれている)を参照されたい。例えば、単一光子発射のコンピュータ断層撮影(SPECT)または陽電子発射断層撮影(PET)によって、検知を行うことができる。
【0100】
別の実施形態において、HIV標的の分子は、β―エミッタ(32P、33P、47Sc、67Cu、67Ga、89Sr、90Y、111Ag、125I、131I、142Pr、153Sm、161Tb、166Ho、166Dy、177Lu、186Re、188Re、189Re等)、オーガー電子エミッタ(111In、125I、67Ga、191Os、193mPt、195mPt、195mHg等)、α―エミッタ(212Pb、212Bi、213Bi、211At、223Ra、225Ac等)、またはその組み合わせを含む、HIV感染した細胞を壊滅させるために有用な1つ以上の放射性同位元素でラベルすることができる。
【0101】
HIV標的の分子を、クロム(III)、マンガン(II)、鉄(III)、鉄(II)、コバルト(II)、ニッケル(II)、銅(II)、ネオジム(III)、サマリウム(III)、イッテルビウム(III)、ガドリニウム(III)、バナジウム(II)、テルビウム(III)、ジスプロシウム(III)、ホルミウム(III)、エルビウム(III)で成る群から選択された金属の複合体を含むことができる、1つ以上の画像処理剤にリンクさせることによって、MRIに使用することができる。同様に、HIV標的の分子は、現在市販されている1つ以上の画像処理剤に結合させることによって超音波画像化に使用することができる。米国特許番号第6,331,175号は、MRI技術およびMRI造影剤に対する共役された抗体の生成について記載しており、その全てが参照として組み込まれている。
【0102】
毒素等の機能タンパク質は、いくつかの方法で、HIV標的の分子に存在することができる。例えば、機能タンパク質は、標準的な分子生物学的技術を使って、融合タンパク質として、抗HIV抗体または断片に直接結合することができる。または、機能タンパク質は、公知の化学的架橋法によって、抗HIV抗体または断片に共有で共役することができる。これに関して使用される毒素には、リシン、アブリン、リボヌクレアーゼ(RNase)、DNase I、ブドウ球菌エンテロトキシン―A、ヤマゴボウ抗ウイルスのタンパク質、ゲロニン、ジフテリア毒素、シュードモナス 外毒素、およびシュードモナス内毒素が含まれる。(それぞれ本明細書に参照として組み込まれている、例:Pastan et al.、Cell(1986)、47:641、Goldenberg、CA―Cancer Journal for Clinicians(1994)、44:43、Sharkey and Goldenberg、CA Cancer J.Clin.56:226(2006)を参照)。本明細書の利用に適したさらなる毒素は、当業者に公知であり、その全てが参照として組み込まれている、米国第6,077,499号に開示されている。対象となるその他の機能タンパク質には、様々なサイトカイン、酵素、および蛍光タンパク質が含まれる。
【0103】
治療および診断への利用:事前標的を含む応用例
事前標的は、通常の組織、特に、骨髄への望ましくない毒の一因となっている、本来は、直接抗体を標的にする遅い血クリアランスを解決するために開発された、複数ステップのプロセスである。事前標的では、放射性核種またはその他の治療薬が、血から数分以内にクリアされる小型の複合物に接続される。標的抗体に加えて、小型の放射能で標識化された化合物を認識することができる事前標的をまず投与し、後で、事前標的剤が血から十分にクリアになると、放射能で標識化された化合物が投与される。
【0104】
対象において病気または不調を治療または診断するための事前標的の方法は、(1)上述したように、二重特異性のHIV標的分子を対象に投与し、ここでは、少なくとも1つの抗原結合部位がHIVマーカーに向けられており、その他の抗原結合部位は二価ハプテンを含む価標的可能な構造に向けられており、(2)任意に対象に対してクリア組成物を投与し、組成物が循環から結合構造をクリアさせるようにし、(3)二価ハプテンを含む標的可能な構成を対象に投与し、この構成はさらに、1つ以上のキレートのまたは化学結合した治療薬または診断薬を含むことにより、提供される。様々なクリア剤および方法が当分野で公知であり、その他の薬剤と合成することができるHIV標的抗体(単糖結合抗体等)に対して、タグまたはラベル(例:単糖)のHIV標的抗体または結合によって合成される抗イディオタイプ抗体等を事前標的するために使用できる。クリア方法へのアビジン―ビオチンの結合相互作用の利用が、さらに当分野で公知である。
【0105】
さらに、抗体依存の酵素プロ薬物療法(ADEPT)の方法も、by(1)上記のようにHIV標的の分子を患者に投与し、構造にはプロ薬物を活性化できる共有で結合された酵素を含み、(2)対象に対しクリア組成物を任意に投与し、組成物によって循環から結合構造をクリアするようにし、(3)患者にプロ薬物を投与することによって、提供される。
【0106】
IMP411標的可能構造
好適な実施形態において、標的とできる構造は1つ以上のヒスタミン―スクシニル―グリシン(HSG)の部分を含むことができ、抗原結合部位は、679抗体または断片等の、HSG結合抗体または断片に関連付けることができる(本明細書に参照として組み込まれている、例:米国特許番号第6,962,702を参照)。標的とできる構造は、公知の事前標的の技術(例:米国特許番号第6,962,702号)を用いて、任意の公知の診断用のおよび/または治療薬に共役にすることができる。2つのHSG部分を含む、IMP411として公知の、例示的な標的とできる構成は、DOTA―D―Cys(3―SP―Gly―20―O―SN38)―D―Ala―D―Lys(HSG)―D―Tyr―D―Lys(HSG)―NH2の式を有する。上記の式に示されているように、IMP411は、例えば、SN38化学療法薬にリンクすることができる。または、その他の治療用のまたは診断薬は、同じペプチド基幹に組み込む、または共役にすることができる。
【0107】
さらなる利用
特定の実施形態において、HIV標的の分子は、例えば、それぞれ本明細書に参照として組み込まれている、米国特許第6,126,916号、第6,077,499号、第6,010,680号、第5,776,095号、第5,776,094号、第5,776,093号、第5,772,981号、第5,753,206号、第5,746,996号、第5,697,902号、第5,328,679号、第5,128,119号、第5,101,827号、および第4,735,210号に記載されている方法を用いて、HIV感染した組織の治療および/または画像化に使用できる。さらなる方法が、1999年、6月22日に出願された米国出願シリアル第09/337,756号および2001年4月3日に出願された米国出願シリアル第09/823,746号に記載されている。こうした画像化は、Goldenberg et al.、「Antibody Pretargeted Advances Cancer Radioimmunodetection and Radiotherapy」(J.Clin.Oncol.、2006 24:823―34)に記載されているように、HIV標的の分子の直接のラベリング、または事前標的画像化方法によって実施することができ、さらに、それぞれ本明細書に参照として組み込まれている、米国特許文書第20050002945号、第20040018557号、第20030148409号、および第20050014207号を参照されたい。
【0108】
いくつかの実施形態において、本明細書で開示および請求されているHIV標的の分子を、放射性核種療法または放射線免疫療法に使用することができる(それぞれ本明細書に参照として組み込まれている、例:Govindan et al.、2005、Technology in Cancer Research & Treatment、4:375―91;Sharkey and Goldenberg、2005、J.Nucl.Med.46:115S―127S;Goldenberg et al.、2006、J.Clin.Oncol.24:823―34を参照)。
【0109】
別の実施形態では、放射線感受性増強物質を、裸のまたは共役されたHIV標的分子、抗体、または断片と組み合わせて使用することができる。例えば、放射線感受性増強物質を、放射線で標識化されたHIV標的分子と組み合わせて使用することができる。放射線感受性増強物質を追加すると、放射線で標識化されたHIV標的分子のみによる治療と比較して、効能を向上させることができる。放射線感受性増強物質は、本明細書に参照として組み込まれている、D.M.Goldenberg(ed.),CANCER THERAPY WITH RADIOLABELED ANTIBODIES, CRC Press(1995)に記載されている。
【0110】
任意の請求される方法で使用されるHIV標的分子は、サイトカインおよび免疫変調成分に関連付けるまたはこれと共に投与することができる。これらのサイトカインおよび免疫変調成分は、少なくとも、アルファ、ベータ、ガンマのインターフェロンとコロニー刺激因子とを含む。しかし、IL―I、IL―2、IL―3、IL―6、IL―10、IL―12、IL―18、TNF―α、幹細胞成長因子、リンパ毒素、エリスロポエチン、トロンボポイエチン、G―CSF、GM―CSF、Sl因子またはその組み合わせ等の、その他の免疫変調成分が公知であり、これを使用することができる。
【0111】
別の実施形態は、有効量のHIV標的の分子および標的可能な構造を投与することによる、対象内のHIV感染組織の血管内識別のための方法に関する。HIV標的の分子は、HIV抗原に特異的に結合する少なくとも1つのABS、および、標的可能な構造に特異的に結合する少なくとも1つのABSを含む。
【0112】
キット
いくつかの実施形態は、請求された方法を実施するためのキットに関する。キットには、HIV標的分子を含めることができる。標的の分子は、上記の任意の薬剤で標識化することができる。さらに、標的の分子はラベルを取り除くことができるが、キットは、ラベル標的の分子に対する試薬への標識化を含むことができる。試薬の標識化は、含まれる場合には、ラベルおよび架橋剤を含むことができる。キットはさらに、HIV抗原に特異な少なくとも1つの抗体、および担体に特異な少なくとも1つの抗体を含むHIV標的の分子を含むことができる。キットは、任意に、HIV標的の分子を循環から取り除くためのクリア組成物を含むことができる。
【0113】
キットの構成要素は一括して包装するか、または2つ以上の別々の容器に分けることができる。いくつかの実施形態において、容器は、再構成に適した組成物の無菌、凍結乾燥した構成を含むバイアルとすることができる。キットはさらに、その他の試薬の再構成および/または希釈に適した1つ以上の緩衝液を含むことができる。使用することのできるその他の容器には、袋、トレイ、箱、管等が含まれるが、これに限定されない。キットの構成要素は、容器内において無菌状態で包装および保持することができる。含むことができるその他の構成要素は、その利用のためのキットの使用者への説明書である。
【0114】
病変組織の検査、診断、および画像化方法
生体内診断
抗HIV抗体または断片は、生体内診断に利用されている。標識Mabを用いた画像診断法は、周知である。例えば、抗HIV抗体は、免疫シンチグラフィー技術で、ガンマ線放射性同位体で標識化され、患者に導入される。ガンマカメラが、ガンマ線放射性同位体の位置および分布の検知に使用される。例えば、Srivastava (ed.), RADIOLABELED MONOCLONAL ANTIBODIES FOR IMAGING AND THERAPY(Plenum Press 1988)、Chase, “Medical Applications of Radioisotopes,” in REMINGTON’S PHARMACEUTICAL SCIENCES, 18th Edition, Gennaro et al. (eds.), pp. 624−652 (Mack Publishing Co., 1990)、およびBrown, “Clinical Use of Monoclonal Antibodies,” in BIOTECHNOLOGY AND PHARMACY 227−49, Pezzuto et al. (eds.) (Chapman & Hall 1993)を参照されたい。511keVのエネルギー等の、フッ素−18(18F)、ガリウム−68(68Ga)、およびヨウ素−124(124I)等の陽電子放出核種(PETアイソトープ)の使用もまた好ましい。このような画像化は、Goldenberg et al., 2006, J. Clin. Oncol. 24:823−34で述べられているように、抗HIV抗体または断片の直接標識により、または事前標的画像化法により、行われることが可能であり、また米国特許公報第20050002945号、第20040018557号、第20030148409号、および第20050014207号も参照されたく、それぞれは参照として本明細書に組み込まれる。
【0115】
画像診断のために、放射性同位体は、媒介官能基を使用して直接または間接的のいずれかで、抗HIV抗体または断片に結合されてよい。有用な媒介官能基には、エチレンジアミン4酢酸およびジエチレントリアミン5酢酸等のキレート剤が挙げられる。例えば、上記のShih et al.、および米国特許第5,057,313号を参照されたい。
【0116】
患者に投与される放射線量は、検知および正確な測定を可能にする、最小限の半減期、最小限の体内での保持、および最小限のアイソトープ量の、最良の組み合わせのための、アイソトープ選択を通して、可能な限り低いレベルに維持される。抗HIV抗体に結合することができ、かつ画像診断に適した放射性同位体の例には、99mTcおよび111Inが挙げられる。
【0117】
また抗HIV抗体またはその断片は、生体内診断のために、常磁性イオンおよび多種の放射線造影剤でも標識化され得る。磁気共鳴映像法に特に有用な造影剤は、ガドリニウム、マンガン、ジスプロシウム、ランタン、または鉄イオンを含む。追加物質には、クロム、銅、コバルト、ニッケル、レニウム、ユウロピウム、テルビウム、ホルミウム、またはネオジムが挙げられる。また抗HIV抗体またはその断片は、超音波造影/強化剤に合成することも可能である。例えば、超音波造影剤の1つには、ヒト化抗HIVIgGまたはその断片を含む、リポソームがある。また、超音波造影剤には、ガスが充填されたリポソームが好ましい。
【0118】
好適な実施形態では、二重特異性抗体が、造影剤に合成され得る。例えば、二重特異性抗体は、超音波画像診断で使用するための、1つ以上の画像増強剤を含んでよい。好適な実施形態では、造影剤は、リポソームである。好ましくは、リポソームは、リポソームの外表面に共有結合した、二価DTPAペプチドを含む。さらに好ましいのは、リポソームがガスで充填されていることである。
【0119】
画像化剤および放射性同位体
特定の実施形態では、請求の範囲に記載のペプチドまたはタンパク質は、多種の罹病器官、組織、細胞種類の画像化および診断に有用である、画像化剤に付着されてよい。多くの適した画像化剤が、タンパク質またはペプチドへのそれらの付着方法同様、技術的に既知である(例えば、米国特許第5,021,236号および第4,472,509号を参照されたく、共に参照として本明細書に組み込まれる)。特定の付着方法は、例えば、タンパク質またはペプチドに付着されたDTPAのような、有機キレート剤を用いる、金属キレート錯体の使用を伴う(米国特許第4,472,509号)。またタンパク質またはペプチドは、グルタルアルデヒドまたは過ヨウ素酸塩等の共役剤の存在下で酵素と反応させてもよい。フルオレセインマーカーとの合成物は、これらの共役剤の存在下で、またはイソチオシアネートとの反応により、調製される。
【0120】
画像化剤として潜在的に有用である常磁性イオンの非限定的な例には、クロム(III)、マンガン(II)、鉄(III)、鉄(II)、コバルト(II)、ニッケル(II)、銅(II)、ネオジム(III)、サマリウム(III)、イッテルビウム(III)、ガドリニウム(III)、バナジウム(II)、テルビウム(III)、ジスプロシウム(III)、ホルミウム(III)、およびエルビウム(III)を含み、ガドリニウムが特に好ましい。X線画像化等の他の状況で有用なイオンには、ランタン(III)、金(III)、鉛(II)および特にビスマス(III)が挙げられるが、これらに限定されない。
【0121】
画像化剤または治療薬として潜在的に有用な放射性同位体には、アスタチン211、14炭素、51クロム、36塩素、57コバルト、58コバルト、銅62、銅64、銅67、152Eu、フッ素18、ガリウム67、ガリウム68、3水素、ヨウ素123、ヨウ素124、ヨウ素125、ヨウ素131、インジウム111、52鉄、59鉄、32リン、33リン、レニウム186、レニウム188、Sc47、75セレン、銀111、35硫黄、テクニシウム94m、テクニシウム99m、イットリウム86、およびイットリウム90が挙げられる。125I、しばしば特定の実施形態での使用に好ましく、テクニシウム99mおよびインジウム111もまた、その低エネルギーおよび長期の検知に対する適合性のため、しばしば好ましい。
【0122】
放射活性物質で標識したタンパク質またはペプチドは、当該技術分野において周知の方法により産生されてよい。例えばそれらは、ヨウ化ナトリウムもしくはカリウム、および次亜塩素酸ナトリウム等の化学的酸化剤、またはラクトペルオキシダーゼ等の酵素による酸化剤との接触により、ヨウ素化され得る。タンパク質またはペプチドは、例えば、過テクネチウム酸をスズ溶液で還元し、還元したテクニシウムをセファデックスのカラム上でキレートし、そしてペプチドをこのカラムに適用する、配位子交換工程により、または、例えば、過テクネチウム酸、SNCl2等の還元剤、ナトリウム−カリウムフタル酸エステル溶液等の緩衝溶液、およびペプチドを培養する直接標識技術により、テクニシウム99mで標識化されてよい。金属イオンとして存在する放射性同位体を、ペプチドに結合するためにしばしば使用される媒介官能基には、ジエチレントリアミン5酢酸(DTPA)、DOTA、NOTA、ポルフィリンキレート剤、およびエチレンジアミン四酢酸(EDTA)が挙げられる。同様に使用を検討されるものには、ローダミン、フルオレセインイソチオシアネート、およびレノグラフィン(renographin)を含む蛍光標識がある。
【0123】
特定の実施形態では、抗HIV抗体または断片は、発色性基質と接触すると着色産物を生成する、第2の結合配位子または酵素(酵素タグ)に連結されてよい。好適な酵素の例には、ウレアーゼ、アルカリ性ホスファターゼ、(セイヨウワサビ)過酸化水素、およびブドウ糖酸化酵素が挙げられる。好ましい第2の結合配位子は、ビオチンおよびアビジンまたはストレプトアビジン化合物である。このような標識の使用は当業者には周知であり、例えば米国特許第3,817,837号、第3,850,752号、第3,939,350号、第3,996,345号、第4,277,437号、第4,275,149号、および第4,366,241号に記載され、それぞれ参照として本明細書に組み込まれる。これらの蛍光標識は、生体外での使用に好適であるが、生体内の適用、特に内視鏡によるまたは血管内の検知手順においてもまた実用的であり得る。
【0124】
別の実施形態では、抗HIV抗体または断片は、蛍光マーカーでタグ付けされてよい。感光ラベルの非限定的な例には、Alexa350、Alexa430、AMCA、アミノアクリジン、BODIPY630/650、BODIPY650/665、BODIPY―FL、BODIPY―R6G、BODIPY―TMR、BODIPY―TRX、5―カルボキシ―4’,5’−ジクロロ−2’,7’−ジメトキシフルオレセイン、5―カルボキシ―2’,4’,5’,7’―テトラクロルエチレン、5―カルボキシフルオレセイン、5―カルボキシローダミン、6―カルボキシローダミン、6―カルボキシテトラメチルアミノ、Cascade Blue、Cy2、Cy3、Cy5,6―FAM、塩化ダンシル、フルオレセイン、HEX、6−JOE、NBD(7―ニトロベンズ―2―オクサ―l,3―ジアゾール)、Oregon Green488、Oregon Green500、Oregon Green514、Pacific Blue、フタル酸、テレフタル酸塩、イソフタル酸、クレシルファストバイオレット、クレシルブルーバイオレット、ブリリアントクレシルブルー、パラアミノ安息香酸、エリトロシン、フタロシアニン、アゾメチン、シアニン、キサンチン、スクニシルフルオレセイン、希土類金属クリプタート、ユーロピウムトリスビピリジンジアミン、ユーロピウムクリプタートまたはキレート、ジアミン、ジシアン、La Jolla青色色素、アロフィコシアニン、アロフィコシアニンB、フィコシアニンC、フィコシアニンR、チアミン、フィコエリトロシアニン(phycoerythrocyanin)、フィコエリトリンR、REG、Rhodamine Green、ローダミンイソチオシアネート、Rhodamine Red、ROX、TAMRA、TET、TRIT(テトラメチルローダミンイソチオール)、テトラメチルローダミン、およびTexas Redを含む。これらおよび他の発光ラベルは、Molecular Probes(Eugene,OR)等の商業的供給源から入手されてよい。
【0125】
有用な化学発光法による標識化合物には、ルミノール、イソルミノール、芳香族アクリジニウムエステル、イミダゾール、アクリジニウム塩、およびシュウ酸エステル、またはルシフェリン、ルシフェラーゼ、およびエクオリン等の生物発光化合物を挙げることができる。
【0126】
様々な実施形態で、有用なラベルは、金属ナノ粒子を含んでよい。ナノ粒子の調製方法は既知である。(例えば、米国特許第6,054,495号、第6,127,120号、第6,149,868号、Lee and Meisel,J.Phys.Chem.86:3391−3395,1982を参照されたい。)ナノ粒子もまた、商業的供給源(例えば、Nanoprobes Inc.,Yaphank,NY;Polysciences,Inc.,Warrington,PA)から入手されてよい。修飾ナノ粒子は、Nanoprobes,Inc.(Yaphank,NY)からのNanogold(登録商標)ナノ粒子等が、市販されている。タンパク質またはペプチドへの合成に有用な官能性ナノ粒子は、市販のものが入手されてよい。
【0127】
架橋剤
いくつかの実施形態では、抗HIV抗体もしくは断片または他のHIV標的分子が、同一二価、異種二価および/または光活性化することが可能な架橋試薬等、当該技術分野において既知である様々な架橋試薬を使用して標識化されてよい。そのような試薬の非限定的な例には、ビスイミデート(bisimidate)、l,5−ジフルオロ−2,4−(ジニトロベンゼン)、スベリン酸のN−ヒドロキシサクシンイミドエステル、酒石酸ジサクシンイミジル、ジメチル−3,3’−ジチオ−ビスプロピオンイミデート(bispropionimidate)、N−サクシンイミジル−3−(2−ピリジルジチオ)プロピオン酸塩、4−(ブロモアミノエチル)−2−ニトロフェニルアジド、および4−アジドグリオキサールが挙げられる。典型的な実施形態では、DCCDまたはEDC等のカルボジイミド架橋剤は、酸性残基をアミノまたは他の基に架橋するために使用されてよい。このような試薬は、蛍光標識等の多種のラベルを付着するよう修正されてよい。
【0128】
二官能性架橋試薬は、様々な目的に広く使用されている。2つの同一官能基を運ぶ同一二価試薬は、同一および異なる巨大分子または巨大分子のサブユニット間の架橋、およびポリペプチド配位子のそれら固有の結合部位への連結の誘発に、非常に効率的であることが判明した。異種二価試薬は、2つの異なる官能基を含有する。架橋は、2つの異なる官能基の微分反応性を利用して、選択的および連続的の双方で制御され得る。二価の架橋試薬は、例えば、アミノ、スルフヒドリル、グアニジノ、インドール、カルボキシル特定基等の、それらの官能基の特異性にしたがって分類され得る。これらの中で、遊離アミノ基を対象とした試薬は、市販されていること、合成の容易さ、それらが適用される反応条件の緩やかさから、特によく知られている。異種二価架橋試薬の大半は、第1級アミン反応基およびチオール反応基を含む。
【0129】
別の実施形態では、異種二価架橋試薬および架橋試薬の使用方法が記載されている(米国特許第5,889,155号、参照として本明細書に組み込まれる)。架橋試薬は、求核ヒドラジド残基を求電子マレイミド残基と組み合わせ、一例では、アルデヒドから遊離チオールへの共役を可能にする。架橋試薬は、様々な官能基の架橋用に修正され得る。
【発明を実施するための最良の形態】
【0130】
以下の実施例は、本発明の好適な実施形態を明示するために含まれる。以下の実施例で開示される技術は、本発明の実施に際し、上手く機能すると見出された技術を表しており、従って、その実施のための好適な態様を成すと考慮され得ることが、当業者には認識されるはずである。しかしながら、当業者は、本開示を踏まえて、開示される具体的な実施形態に、多くの変更を加えることが可能であり、それにもかかわらず、本発明の精神および範囲から逸脱することなく、同等または類似した結果が得られることを認識すべきである。
【実施例1】
【0131】
合成抗HIV抗体を使用した、生体外および生体内のHIV感染の阻害
概要
HIV−1に対する免疫抱合体の有効性を実証するため、HIVのエンベロープ抗原に対するマウスモノクローナル抗体(Mab)(P4/D10)は、従来の抗癌剤、ドキソルビシンと合成され、感染性ウイルスおよび感染細胞に対して、生体外および生体内の双方で試験された。P4/D10抗体は、遊離ウイルス(中和)またはHIV感染細胞(阻害)で培養され、得られた感染は、p24捕捉酵素免疫測定法で測定された。HIV−1/MuLVマウス攻撃モデルで、生体内の感染を阻害する接合能が測定された。
【0132】
ドキソルビシン合成されたP4/D10は、HIV−lIIIBを中和し、感染したジャーカット細胞における生体外の細胞間伝播およびHIV複製を排除した。またそれは、遊離抗体に必要とされるものより8倍低い濃度で、HIV−1IΠB/MuLVでの攻撃からマウスを防御し、一方、遊離型薬物または不適切な合成対照には、影響は観察されなかった。
【0133】
これらの結果は、ドキソルビシンが、P4/D10抗体によりHIV感染細胞に集中され、HIV排除に有意に(p=0.0001)寄与したことを実証している。同一組成物および方法が、ART(抗レトロウイルス療法)による治療を受ける患者における、残留する抗原発現T細胞の根絶に役立つ。
【0134】
本研究において、我々は、ドキソルビシン、アントラサイクリン系抗癌剤を、患者における既知の薬理学、毒物学、および抗腫瘍活性を用いて、HIV−1の外側エンベロープgpl20(第3可変ループ部位)に対して発達した、中和およびADCC媒介モノクローナル抗体(Mab)に、合成した。
【0135】
ドキソルビシンに合成されたP4/D10抗体は、非感染細胞間、およびマウスモデルにおける、HIV−1感染細胞排除の有効性について、HIV−1/MuLV(マウス白血病ウイルス)感染同系細胞を腹腔から除去し、生体外で試験された。抗gpl20抗体であるP4/D10は、HIV−1ウイルスを中和し、ADCCを媒介する(Broliden et al,1990)。またそれは、末期のHIV−1感染者に対する第1相臨床試験において、非合成型でも使用され、HIV抗原を長期間減少させた(Hinkula et al.,1994)。本研究は、同様にドキソルビシンと合成された、遊離Mab、遊離型薬物および不適切な抗体hRS7(Stein et al.,IntJ Cancer 1993,55:938−946)、およびhLLl Griffiths et al.,Clin Cancer Res 2003,9:6567−6571;Sapra et al.,Clin Cancer Res 2005,11:5257−5264)と比較して、臨床HIVモデルにおいて、P4/D10の組み合わせを薬物合成型で詳細に調べた最初のものである。
【0136】
材料および方法
抗体および薬物合成。ドキソルビシンの、IgGlκ抗gpl20抗体P4/D10(Broliden et al.,1990)および対照抗体との合成は、マレイミド基との、二官能性のドキソルビシンヒドラゾン誘導体の調製と同様、Griffithsら(2003)に従って行った。簡潔に、最終濃度約9mg/mlの、抗体P4/D10、hLLl(ヒト化抗CD74)、およびhRS7(ヒト化抗EGP−1)は、該抗体に対して38倍モル過剰の還元体に相当する、約2.2mMの最終DTT濃度を用い、5mMのEDTAを含む、PBS(pH7.5)中のDTT(ジチオスレイトール)で軽度に還元した。溶液を、37℃で40分間培養した。還元されたMabを、150mMのNaClおよび2mMのEDTA(pH5.3)を含有する、50mMの酢酸ナトリウム緩衝液中で、セファデックスのスピンカラムG50/80上で、した。抗体上で生成されたチオール基数は、エルマン法で測定した。合成には、6.5mg/mlで軽度に還元された抗体を、二官能性ドキソルビシンと混合した。培養物を、氷上で15分間保ち、0.1Mの酢酸ナトリウム(pH6.5)中で、スピンカラムG50/80上で精製し、次いで、同一の緩衝液で平衡化された、Bio−Beads SM2(Bio−Rad,Hercules,CA)のショートカラムを通過させた。産生物を、吸光度の測定により、ドキソルビシン/Mab置換率を分析した。サイズ排除HPLC分析を、BioSil250分析カラムで行った。
【0137】
HIV感染患者からの、IgGのGMP製造ロット(HIVIgG)(Guay et al.AIDS 2002,16:1391−1400)を、陽性対照として、またHIV陰性の個人からの血清が陰性対照として、使用した。遊離ドキソルビシン、およびドキソルビシンと同様に合成された抗癌ヒト化Mab、LLlおよびRS7を、合成P4/D10抗体の対照として含めた。
【0138】
HIV−1中和アッセイ。ドキソルビシンP4/D10、非標識P4/D10、HIV免疫グロブリン(HIVIgG)、およびHIV陰性血清を、HIV−1分離株、HIV−1IIIB(LAI)と混合した、37℃で1時間培養し、50,000ジャーカットT細胞/ウェルを加えた。1時間培養後、細胞を培地で洗浄し、新しい完全な培地を加えた(200μl/ウェル)。7日間の培養後、産生されたp24の量を、p24捕捉ELISA(酵素免疫測定法)で測定し、HIV−1p24産生の阻害割合を計算した。
【0139】
生体外HIV−1阻害ジャーカットT細胞を、5〜10×106細胞を100×TCID50のHIV−lIIIBと混合し、37℃で1時間培養して、HlV−lIIIBと感染させた。細胞を培地で洗浄し、37℃で培養した。2日おきに、培地を変え、上清のp24産生を確認した。細胞の100%近くが感染した際、異なる割合のHIV−lIIIB感染細胞を、非感染細胞と混合した。細胞は、抗体、血清、または遊離ドキソルビシンの連続希釈で、100〜0.00001μg/mlに処理された。37℃で7日間培養した後、HIV−1p24阻害を測定し、0.1〜10μg/mlのドキソルビシン−P4/D10、非合成P4/D10、および0.05〜0.5mg/mlのHIV陰性血清で予め処理された細胞からの上を採取し、未使用のジャーカットT細胞に移し、培養開始後3、7、10、12、および15日目に、感染性HIVが同定されるかどうかを、p24ELISAで試験した。
【0140】
HIV−1/MuLV攻撃モデル。ヒトT細胞株、CEM−IBを、遺伝子的に統合されたMuLVゲノムと共に、HIV−1ΠIBに感染させ、HIV−1ゲノムおよびMuLVエンベロープでの擬似ウイルスの産生に至った(Adang et al,PNAS USA 1999,96:12749−753;Hinkula et al.,Cells Tissues Organs 2004,177:169−184)。これらのウイルスの上清を、HLA−A201遺伝子導入のC57Bl/6xDBA Fl Kb/dマウスからの脾細胞を感染させるために使用した。同系マウスを、腹腔内で、HIV−1IΠB/MuLV感染脾細胞で攻撃し、合成抗体、遊離抗体、または遊離ドキソルビシンを腹腔内に直ちに与えた。攻撃の10日後、マウスを致死させ、腹膜細胞が採取した。腹膜細胞を、ペレット化し、1×106のHIV感受性ジャーカットT細胞または24ウェルプレートで成長させたヒトPBMCに加えた。これらの二次培養から、上清を除去し、未使用の培地を3〜4日毎に加えた。感染性HIV上清中で回収された感染性HIV量を、p24ELISAで3週間測定した。
【0141】
統計的分析。抗gpl20Mabおよび対照抗体の生体内HIV−1中和能を比較するために、スチューデントt検定およびノンパラメトリックのクラスカル・ワーリス検定を使用した。異なる抗体で処理された群間の統計比較を、ノンパラメトリックの、マン・ホイットニーのU検定およびクラスカル・ワーリス検定を使用して行った。<0.05の確率値が得られた時、差異は有意であるとみなされた。ノンパラメトリックの一元配置分散分析検定を、GraphPad Prismの4.0a版(GraphPad Software,San Diego,CA)を使用して行い、試験群間のHIV−1分離およびp24抗原の陽性率の比較に使用した。
【0142】
結果
軽度の還元により、それぞれの抗体上に生成されたチオール基の数は、最終的に精製された合成物中のドキソルビシン/Mab置換率と同様、8.8(P4/D10、hRS7)〜9.4(hLLl)に及び、IgG当たり約9薬物分子の比率が出た。高圧液体クロマトグラフィー分析は、該合成物および天然Mabが、ゼロから最少の凝集と共に、類似した保持時間を持つことを示した(データ示さず)。
【0143】
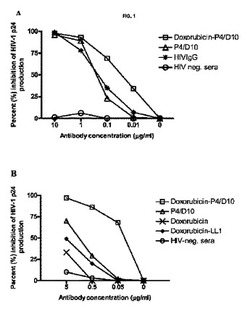
ドキソルビシン合成P4/D10Mabと、非合成P4/D10MabまたはHIVIgG抗体のいずれかとの間には、遊離HIV−1ウイルスのHIV−1中和能における有意な差異は示され得なかった(図IA)。しかしながら、全ての抗HIV−1特定抗体は、HIV−1IΠBの中和において、陰性の対照血清よりも有意に優れていた(p=0.001)。
【0144】
3%HIV−1IΠB感染ジャーカッタ細胞が、97%非感染細胞と混合されると、ドキソルビシン−P4/D10は、遊離P4/D10、ドキソルビシン合成対照抗体、hLLl、または0.5もしくは0.05μg/ml濃度の遊離ドキソルビシンよりも、HIV−1感染の細胞間伝播の有意に(p=0.002)強力な阻害を媒介した(図1B)。感染および非感染細胞の他の全ての濃度で、類似した結果が見られた。感染の細胞間伝播が、中和剤としてのドキソルビシン−P4/D10で得られた効果よりさらに強く阻害されたように思われることが、特に興味を引いた。また、これらの細胞培養物から非感染ジャーカッタ細胞へ上清を移した後は、p24の産生は検知されなかったため、高用量のドキソルビシン−P4/D10で処理された培養物には、感染ウイルスは発見され得なかった(データ示さず)。ドキソルビシン−P4/D10と非合成P4/D10との間の効果における有意な差異は、遊離HIV−1ウイルスの中和についての結果からは、予測され得なかった(図1A)。
【0145】
ドキソルビシン−P4/D10抗体の有効性を生体内で試験するために、マウスは腹腔内に、合成物とともに、同系のHIV/MuLV感染細胞を与えられた。腹膜細胞を、10日後に採取し、感染HIVは、過去の研究(Hinkula et al, 2004)と同様、全ての対照で実証された。ドキソルビシン−P4/D10抗体は、HIV−1感染一次リンパ細胞での攻撃から、完全にマウスを防御した(p=0.0001)(図2)。100μgのドキソルビシン−P4/D10抗体での攻撃および処理後、腹膜細胞から感染HIVは回収されなかった。マウスが100μgの非合成P4/D10抗体で処理された場合は、全てp24産生に陽性であった。用量が8倍の、1マウス当たり800μgまで非合成P4/D10を増加された場合のみ、抗体のみによる完全な防御が見られた。用量100〜200μgでは、いずれのドキソルビシン合成対照抗体(hLLlまたはhRS7)も防御をもたらさず、用量100〜400μgの遊離ドキソルビシンでももたらさなかった。
【0146】
考察
前述の結果は、HIV−1のエンベロープを対象とした、抗体の総合的なウイルス阻害特性が、ドキソルビシンへの共役により有意に増幅され得たことを示す。ドキソルビシン−P4/D10は、生体外で、また実験的な生体内攻撃モデルで、HIV−1感染細胞を根絶することができた。非合成P4/D10Mabの、HIV−1感染標的細胞に対するADCC媒介能は、HIV−1の中和と同様(Broliden et al.,1990;Hinkula et al.,1994)無毒な方法で、薬物免疫抱合体としての有効性を増進する可能性がある。
【0147】
同様にドキソルビシンと合成された抗癌の抗−CD74Mab、LLlは、非常に低い容量で、生体外および非ホジキンリンパ腫または多発性骨髄腫のヒト異種移植モデルで、顕著な活性を示した(Griffiths et al,2003;Sapra et al,2005)。これらの研究は、サルにおける毒物学同様、非常に高用量の免疫抱合体のみが、骨髄抑制の証拠であるという結果になったが、ドキソルビシンに関連した心毒性は観察されなかったと示している(Sapra et al.,2005)。ウイルス脱出を避けるため、HIVの接触しやすいエピトープの、保存および可変部位の両方を対象とした抗体は、共に試験されるべきである(Trkola et al.,2005;Ferrantelli et al.,J Infect Dis 2004,189:2167−2173)。
【0148】
過去の生体外研究では、緑膿菌外毒素A(PE40)に合成されたHIV−1特有の免疫抱合体が、HIV−1感染細胞を除去した(Pincus et al.,2003;Ashorn et al.,Proc Natl Acad Sci USA 1990,87:8889−8893)。しかしながら臨床試験において、CD4細胞に共役したPE40は、免疫原性および肝細胞毒性であることが判明した(Davey et al.,1994;Ramachandran et al.,1994)。従って、副作用がほとんど、または全く無い、ドキソルビシン−Mab合成物の有効性を示す本結果は、驚くべき、予期せぬものである。高ウイルス量の非ART治療患者において高濃度で存在する、PE40−CD4の毒性は、遊離gpl20との有毒な複合体の形成により説明され得る(Berger et al.,1998)。高ウイルス量に関連する潜在的な毒性問題を避けるため、好ましくは、HIVエンベロープ特有エピトープを標的とする分子は、ART中、HIV感染の初期、またはさらにHIV感染に既知または潜在的な暴露後間もなく等、ウイルス負荷が低い周囲環境で使用されるべきである。例えば、HIVで汚染された、または潜在的に汚染された、血液または他の流体に針刺し事故で暴露された医療従事者は、本開示方法による合成抗体での治療が可能である。ドキソルビシンP4/D10合成体の抗細胞活性の結果、ARTによる治療を受ける患者への薬物合成物の追加は、抗原運搬細胞および遊離ビリオンを根絶することができ、従ってさらにウイルス量を減少させる。当業者は、請求の範囲に記載の組成物および方法は、P4/D10のドキソルビシン合成物に限られず、むしろP4/D10に、または既知の他の抗HIV抗体に合成された、既知の他の細胞毒性薬を利用することができることを理解するであろう。
【0149】
他の実施形態では、非特異的毒性を避けるため、抗体照準法および毒物の送達は、分離される、二重特異抗体および他の事前標的戦略,が使用され得る(Wu et al.,2005)。本戦略は、癌の前臨床および臨床試験双方において、期待できる結果を示した(Forero et al.,Blood 2004,104:227−236;Rossi et al.,Clin Cancer Res 2005,11:7122s−7129s)。人を対象とした生体内使用については、繰り返される臨床用途の、ヒト抗体またはヒト化された形の抗体が好ましい。
【実施例2】
【0150】
ART後のHIV感染患者の治療
47歳男性患者は、HIVに対して血清反応陽性であると判断された。該患者のCD4数は、200/mm3未満であった。該患者は、非核酸系逆転写酵素阻害物質ネビラピンの標準療法による治療を受けた。CD4細胞数は、300/mm3まで改善したが、該患者は依然としてHIVに対して血清反応陽性であった。該患者は、ヒト化ドキソルビシン−P4/D10抗体による治療を受けた。該患者のCD4数は、350/mm3超過まで改善し、該患者は、もはやHIVに対して血清反応陽性ではなくなった。1年後、該患者は、無症状のままであり、検出可能なHIV感染は存在しない。
【実施例3】
【0151】
針刺し事故後の医療従事者の治療
30歳の臨床看護師は、HIV陽性血液の付着した針刺し事故に遭った。1時間以内に、該対象は、ヒト化ドキソルビシン−P4/D10抗体による治療を受けた。1年後、該対象にHIV感染の兆候は見られない。
【実施例4】
【0152】
その他の細胞毒素および/または抗体による治療
28歳男性患者は、HIVに対して血清反応陽性であると判断された。該患者のCD4数は、200/mm3未満であった。該患者は、非核酸系逆転写酵素阻害物質ネビラピンの標準療法による治療を受けた。CD4細胞数は、300/mm3まで改善したが、該患者は依然としてHIVに対して血清反応陽性であった。該患者は、ヒト化4E10Fab−734scFvを含み、米国特許第7,052,872号(参照として組み込まれる)に開示される方法を使用して調製された二重特異性抗体による治療を受けた。注入後、遊離二重特異性抗体を循環から除去するために、24時間の培養を行い、続いて標的ペプチドIMP−156(Id.)に合成された5−フルオロウラシルを注入した。該患者のCD4数は、350/mm3超過まで改善し、該患者は、もはやHIVに対して血清反応陽性ではなくなった。1年後、該患者は、無症状のままであり、検出可能なHIV感染は存在しない。
【実施例5】
【0153】
IMP411による事前標的
35歳男性患者は、HIVに対して血清反応陽性であると判断された。該患者のCD4数は、180/mm3未満であった。該患者は、非核酸系逆転写酵素阻害物質ネビラピンの標準療法による治療を受けた。CD4細胞数は、250/mm3まで改善したが、該患者は依然としてHIVに対して血清反応陽性であった。該患者は、参照として本明細書に組み込まれる、米国特許出願シリアル番号第11/389,358号、第11/391,584号、第11/478,021号、および第11/633,729号に開示される方法を使用するDNL技術によって調製された、抗gpl20 P4/D10 IgGl x Fab−679を含む二重特異性抗による治療を受けた。注入後、遊離二重特異性抗体を循環から除去するために、24時間の培養を行い、続いて標的としているペプチドIMP−411に合成されたSN38を注入した。該患者のCD4数は、325/mm3超過まで改善し、該患者は、もはやHIVに対して血清反応陽性ではなくなった。1年後、該患者は、無症状のままであり、検出可能なHIV感染は存在しない。
【実施例6】
【0154】
抗HIV抗体のヒト化
HIVエンベロープタンパク質に対するマウスモノクローナル抗体のVLおよびVH部位を符号化するcDNAは、分離され、組み換えによって、それぞれ別個に、カッパおよびIgG1定常部位をそれぞれ符号化する遺伝子を含む、ヒト抗体の哺乳類発現ベクターにサブクローニングされる。これら2つの組み換えDNAを有する哺乳類細胞の同時トランスフェクションは、親マウスMabと同一の結合および治療特性を有するヒト化Mabの発現を生じる。
【0155】
VKおよびVH DNAのCDRは、組み換えによって、ヒトVKおよびVH部位の骨格(FR)配列にそれぞれ連結され、それらは結果として、哺乳類細胞を発現するために、ヒトカッパおよびIgG1定常部位にそれぞれ連結される。一般に、本明細書で記載されるように、「キメラ」MabはマウスVKおよびVH部位を、それぞれヒト定常軽鎖および重鎖に結合するか、またはサブクローニングすることによって形成され、一方、「ヒト化」Mabは、キメラMab内のマウス骨格(FR)配列を、対応するヒトFR配列で置換することによって、さらに誘導体化される。以下に記載されるように、ヒト化Mabは、ヒトFRアミノ酸、特にCDRアミノ酸残基に接触している、または近いFR残基の1つ以上を、対応するマウスFRアミノ酸で置換することによって、さらに最適化されてもよい。
【0156】
様々な実施形態では、コンピュータモデリングによって、抗体可変領域をモデル化することができる(例えば、本明細書に参照として組み込まれる、Dion,「Humanization of Monoclonal Antibodies:Molecular Approaches and Applications」in Goldenberg et al.eds.,Cancer Therapy With Radiolabeled Antibodies,Ch.19,CRC Press,Boca Raton,FIa.,1994を参照)。一般に、Mabの3D構造は、相同性、好ましくは以下の、置換されるマウスFR配列と高い(75%を上回る、好ましくは85%を上回る、より好ましくは90%を上回る、より好ましくは95%を上回る)相同性を示すヒトFR配列の指標によって、最良の形でモデル化される。CαとCβとの間のねじれ角を維持するために、可能な限り、側基の置換を行うべきである。エネルギー最小化は、収束法を使用する、AMBER力場(Weiner et al,J.Amer.Chem.Soc.106:765,1984)によって達成されてもよい。軽および重可変鎖を最初にモデル化することによって、決定的に重要となる可能性のあるFR−CDR相互作用を判断することができる。従って、それぞれのCDR内の半径が4.5オングストローム内のすべての原子内のすべてのマウスFR残基を特定し、ヒト化抗体の最終設計モデル内に保持することができる。
【0157】
一度VKおよびVH領域の配列が設計されると、CDR移植は、長い合成DNAオリゴヌクレオチドをテンプレートとして使用し、短いオリゴヌクレオチドをPCR反応におけるプライマーとして使用する遺伝子合成によって、達成され得る。多くの場合、VKまたはVH領域を符号化するDNAは、おそよ350bp長となる。コドン縮重の利点を利用することによって、符号化されたアミノ酸を変更することなく、V遺伝子DNA配列の中央の近くの部位に、固有の制限部位を容易に導入できる可能性がある。制限部位の上流および下流が約150bpである、2つの長い非重複単鎖DNAオリゴヌクレオチドを、自動DNAオリゴヌクレオチド合成装置(Cyclone Plus DNA Synthesizer,Milligen−Biosearch)で生成することができる。全長DNAオリゴヌクレオチドの産出率が低いと予想される場合、PCR反応における2組のフランキングプライマーによって、それらを増幅することができる。
【0158】
プライマーは、配列サブクローニングを促進するために必要な制限部位で設計することができる。オリゴAおよびオリゴBのプライマーは、オリゴAおよびBの結果として生じるPCR生成物が、それぞれ、制限部位で枠内に結合され、VH領域を符号化する、全長DNA配列(約350bp)を形成できるように、制限部位に重複配列を含むべきである。
【0159】
オリゴAおよびBに対するPCR生成物の連結反応、およびそれらの適切な足場(staging)ベクターの制限部位へのサブクローニングは、単一3断片連結反応ステップで完了され得る。正しい配列の足場(staging)ベクターへのサブクローニングは、最初に、制限消化分析によって分析され、続いてSanger et al,Proc.Natl.Acad.Sci.USA 74:5463(1977)による、配列反応配列反応によって確認され得る。
【0160】
Igプロモーター、リーダー配列、およびVH配列を含む制限断片を、足場(staging)ベクターから切除し、ヒトIgG定常部位のゲノム配列、Igエンハンサー、gpt選択マーカーを含み、最終発現ベクターを形成する、pSVgpt系ベクター内の対応する部位にサブクローニングすることができる。VK配列の構成に、同様な方法を採用することができる。
【0161】
Igプロモーター、リーダー配列、および抗HIV VK配列を含むDNA配列を、適切なエンドヌクレアーゼで処理することによって、足場(staging)ベクターから切除することができ、pSVhyg系ベクター、ヒトカッパ鎖定常部位のゲノム配列を含むpKh、ハイグロマイシン選択マーカー、Ig、およびカッパエンハンサーの対応する部位にサブクローニングし、最終発現ベクターを形成することができる。
【0162】
ヒト化は、結果として抗体親和力が減少またはさらには損失する場合があることから、元の親和力を回復するために、さらなる修正が必要となる場合がある(例えば、参照として組み込まれる、Tempest et al,Bio/Technology 9:266(1991);Verhoeyen et al,Science 239:1534(1988)を参照)。一般に、キメラ抗HIVのMabを調製するために、DNA生成物およびプライマーを使用する、PCRクローニングによって、抗HIVのMabのVHおよびVK鎖を得ることができる。Orlandi et al.(Proc.Natl.Acad.Sci.,USA,1989,86:3833)、およびLeung et al.(BioTechniques,1993,15:286)。上記に記載されるように、VK PCRプライマーを、pBR327系足場(staging)ベクター(VKpBR)にサブクローニングしてもよい。VH PCR生成物を、類似するpブルースクリプト系足場(staging)ベクター(VHpBS)にサブクローニングしてもよい。プロモーターおよびシグナルペプチド配列に加え、VKおよびVH配列を含む断片を、適切な制限エンドヌクレアーゼを使用して、足場(staging)ベクターから切除することができる。従来通り、VK断片(約600bp)を、哺乳類発現ベクター(例えば、pKh)にサブクローニングすることができる。PKhは、ヒトカッパ定常部位のゲノム配列、Igエンハンサー、カッパエンハンサー、およびハイグロマイシン耐性遺伝子を含む、pSVhyg系発現ベクターである。同様に、約800bpのVH断片を、ヒトIgGl定常部位のゲノム配列、Igエンハンサー、およびキサンチングアニンホスホリボシルトランスフェラーゼ(gpt)遺伝子を運ぶ、pSVgpt系発現ベクターであるpGlgにサブクローニングすることができる。2つのプラスミドは、エレクトロポレーションによって、Sp2/O−−Agl4細胞等の哺乳類発現細胞にトランスフェクションされ、ハイグロマイシン耐性のために選択されてもよい。選択後に生存するコロニーを拡大し、ELISA法によって、上清のキメラ抗HIV Mabの生成を監視する。トランスフェクション効率が約1〜10×106の細胞が望ましい。本システムでは、抗体発現レベル0.10〜2.5μg/mlを期待できる。
【0163】
RNA分離、cDNA合成、および増幅を、以下のように行うことができる。約107個の細胞を使用し、参照として組み込まれる、Sambrook et al.(Molecular Cloning:A Laboratory Manual,Second ed.,Cold Spring Harbor Press,1989)に従い、抗HIVハイブリドーマ細胞株からトータル細胞RNAを調製することができる。Superscript preamplification system(Gibco/BRL.,Gaithersburg,MD)を使用する等によって、従来通り、トータルRNAから第1の鎖cDNAを逆転写することができる。簡潔に、反応量20μlにおいて、10X合成緩衝液[200mMのTris−HCl(pH8.4)、500mMのKCl、25mMのMgCl2、1mg/mlのBSA]が2μl、10mMのdNTPミックスが1μl、0.1MのDTTが2μl、および200ユニットのSuperScrip逆転写酵素が存在する下で、50ngのランダムプライマーを5μgのRNAにアニールすることができる。伸長ステップは、最初に、室温で10分間進行され、続いて42℃で50分間の培養が行われる。反応混合物を90℃で5分間加熱することによって、反応を終了させることができる。
【0164】
キメラまたはヒト抗HIV MabのVKおよびVH配列は、参照として組み込まれる、Orlandi et al,(Proc.Natl.Acad.Sci.,USA,86:3833(1989))に記載されるように、PCRによって増幅することができる。VK配列は、プライマーCK3BHおよびVK5−3(参照として組み込まれる、Leung et al.,BioTechniques,15:286(1993))を使用して増幅されてもよく、一方、VH配列は、マウスIgGのCHl部位、およびVHIBACK(Orlandi et al.,1989)をアニールするプライマーCHlBを使用して、増幅することができる。第1の鎖cDNA生成物を10μl、10XのPCR緩衝液[500mMのKCl、100mMのTris−HCl(pH8.3)、15mMのMgC12、および0.01%(w/v)のゼラチン](Perkin Elmer Cetus,Norwalk,Conn.)を9μl、含むPCR反応混合物に、30サイクルのPCRを行うことができる。それぞれのPCRサイクルは、好ましくは、94℃で1分間の変性、50℃で1.5分間のアニーリング、および72°Cで1.5分間の重合からなる。増幅されたVKおよびVH断片を、2%のアガローズ(BioRad,Richmond,Calif)で精製することができる。
VKのためのPCR生成物を、Igプロモーター、シグナルペプチド配列、およびVK PCR生成物の枠内連結反応を促進するために適宜な制限部位を含む、pBR327系足場(staging)ベクターVKpBR等の足場(staging)ベクターにサブクローニングすることができる。VHに対するPCR生成物を、ブルースクリプト系VHpBS等の類似の足場(staging)ベクターにサブクローニングすることができる。個別のPCR生成物を含む個々のクローンは、例えば、参照として組み込まれる、Sanger et al.,Proc.Natl.Acad.Sci.,USA,74:5463(1977)の方法によって、配列されてもよい。
【0165】
適切な細胞、例えば、骨髄腫Sp2/O−−Agl4、ハイグロマイシン耐性のために選択されるコロニー、および、例えば、ELISAアッセイによってキメラまたはヒト化抗HIV抗体の生成が監視される上清に、2つのプラスミドを同時トランスフェクションすることができる。
【0166】
抗体分泌クローンのトランスフェクションおよびアッセイは、以下のように実行することができる。参照として組み込まれる、Co et al.,J.Immunol,148:1149(1992)による、エレクトロポレーション(BioRad,Richmond,Calif.)による、5×106SP2/O骨髄腫細胞のトランスフェクションに、約10μgの軽鎖発現ベクターおよび20μgの重鎖発現ベクターを使用することができる。トランスフェクションに続き、完全HSFM培地(GIBCO,Gaithersburg,Md.)内の96ウェルマイクロタイタープレート内で、37°C、5%のCO2で、細胞を成長させてもよい。選択プロセスは、ハイグロマイシンの最終濃度500μg/mlでハイグロマイシン選択培地(Calbiochem,San Diego,Calif.)を添加することによって、2日後に開始することができる。典型的にコロニーは、エレクトロポレーション後、2〜3週間で出現する。次いで、さらなる分析のために、培養物を拡大することができる。
【0167】
キメラまたはヒト化重鎖の分泌に陽性のトランスフェクトーマクローンは、ELISAアッセイによって特定することができる。簡潔に、トランスフェクトーマ培養からの上清試料(100μl)を、ヤギ抗ヒト(GAH)−IgG,F(ab’)2断片特異抗体(Jackson ImmunoResearch,West Grove,Pa.)でプレコートされたELISAマイクロタイタープレートに3回に分けて添加する。プレートを、室温で1時間培養する。洗浄緩衝液(0.05%のポリソルベート20を含むPBS)で3回洗浄することによって、非結合タンパク質を除去する。ホースラディッシュペルオキシダーゼ(HRP)共役GAH−IgG、Fc断片特異抗体(Jackson ImmunoResearch,West Grove,PA)を、ウェル(104倍に希釈し、最終濃度1.0μg/mlまで非共役抗体を追加した、100μlの抗体ストック)に添加する。1時間の培養に続き、典型的には3回、プレートを洗浄する。反応溶液[100μl、PBS中、167μgのオルトフェニレンジアミン(OPD)(Sigma,St.Louis,MO)、0.025%の過酸化水素を含む]を、ウェルに添加する。暗所に30分間置くことによって、色が発現する。50μlの4NHCl溶液をそれぞれのウェルに添加することによって、反応を停止し、自動ELISAリーダー(Bio−Tek instruments,Winooski,Vt.)で490nmでの吸光度を測定する。次いで結合キメラ抗体は、不適切なキメラ抗体標準(Scotgen,Ltd.,Edinburg,Scotlandから入手可能)と関連して判断される。
【0168】
抗体は、以下のように、細胞培養培地から分離される。トランスフェクトーマ培養液を無血清培地に適合させる。キメラ抗体を生成するために、HSFMを使用し、500mlの培養液として、ローラーボトル内で細胞を成長させる。培養液を遠心分離し、0.2ミクロンの薄膜を通して、上清を濾過する。流速1ml/minでタンパク質Aカラム(1×3cm)に濾過した培地を通す。次いで約10カラム容量のPBSで樹脂を洗浄し、10mMのEDTAを含む0.1Mのグリシン緩衝液(pH3.5)で、カラムからタンパク質A結合抗体を溶出する。1.0mlのフラクションが、3MのTris(pH8.6)を10μl含むチューブに回収され、タンパク質濃度が280/260nmでの吸光度から測定される。ピークフラクションをプールし、PBSを透析し、例えば、Centricon30(Amicon,Beverly,MA)で抗体を凝縮する。抗体濃度は、ELISAで測定し、従来のように、PBSを使用して、その濃度を約1mg/mlに調整する。防腐剤として、0.01%(w/v)のアジ化ナトリウムを適宜試料に添加する。
【0169】
このように単離されたマウス、キメラ、およびヒト化抗体の比較結合親和力は、直接ラジオイムノアッセイによって、測定することができる。キメラおよびヒト化抗HIV抗体は、マウスMabと同一の結合特異性および親和力を有すると判断される。
【0170】
本明細書で開示され、主張されるすべての組成物および方法は、本開示を考慮し、過度の実験を行うことなく作製および実施することができる。組成物および方法は、好ましい実施形態の点から説明されているが、本発明の概念、精神、および範囲を逸脱することなく、本明細書に記載される組成物および方法、ならびに方法のステップまたはステップの順序に変形が適用されてもよいことが、当業者には明らかである。より具体的には、同一または類似の結果が達成される間、化学的および生理的に関連する特定の薬剤が、本明細書に記載される薬剤と置き換えられてもよい。当業者に明らかなすべてのそのような置換えおよび修正は、添付の請求の範囲で定義される、本発明の精神、範囲、および概念内であると見なされる。
【図面の簡単な説明】
【0171】
【図1A】HIV−1IIIB HIV感染の生体内中和。HIV―1IIIBを有する異なる濃度の免疫グロブリンを培養し、HIVに感染しやすいジャーカットT細胞のウイルス感染を分析することで、免疫グロブリンの中和能力を試験した。10μg/mlのドキソルビシンとP4/D10および非ラベルのP4/D10の双方により、HIV陰性血清(p=0.001)よりも大幅に良好に、HIV―1IIIBを中和した。
【図1B】HIV−1IIIB 生体外におけるHIV感染の細胞間伝播の阻害。免疫グロブリンがHIV―1感染ジャーカットT細胞の細胞間の拡散を制限することができるかどうかを試験するため、0.2%、1%、3%、および5%感染の、および99.8%、99%、97%、および95%非感染の細胞の割合で混合した。異なる濃度の免疫グロブリンによる、HIV―1IIIB感染した3%のジャーカットT細胞および97%の未感染細胞の処理後のHIV―1 p24の産生を示す。結果を、培養7日後のp24産生の阻害%にて示す。ドキソルビシン―P4/D10では、未ラベルのP4/D10、対照抗体ドキソルビシン―LLl、遊離型ドキソルビシンおよび濃度0.5または0.05μg/ml(p=0.002)のHIV陰性血清と比較して、HIV―1p24の生成における阻害効果が大幅に上昇した。
【図2】生体内におけるHIV―1/MuLV感染に対する保護。マウス(6―12/群)について、HIV―1/MuLV感染した脾細胞によって腹腔内にて調査され、モノクローナル抗体(Mab)または遊離型ドキソルビシンによって直ちに処置された。非共役P4/D10Mabが、マウス当たり100―800μg遊離型ドキソルビシン100―400μgおよび非関連ドキソルビシン―hRS7100―200μgで滴定された。その他全ての治療が、マウス当たり100μgで与えられた。調査から10日後、腹膜細胞を回収し、HIVに感染しやすいジャーカットT細胞と共に混合された。これらの細胞培養におけるHIVp24の産生が、18日間で3、4日ごとに計測された。100μgのMabまたは遊離型ドキソルビシンによる処置後のp24陽性細胞培養によるマウスのパーセントを示す。100μgのドキソルビシン―P4/D10で処理したマウスからの細胞のみが、その他の全ての群とは大幅に異なり(p=0.0001)、感染性HIVを含んでいなかった。
【技術分野】
【0001】
本発明は、感染対象のヒト免疫不全ウィルス(HIV)を治療し、さらに好適な実施形態においては排除するための、方法および組成物に関する。
本発明は、その全内容が本明細書に参照として組み込まれている、2006年5月15日に出願された、仮出願シリアル番号第60/800,342号に対し、35 C.F.R.§119(e)において、その利益を請求する。
【背景技術】
【0002】
本発明は、感染対象のヒト免疫不全ウィルス(HIV)を治療し、さらに好適な実施形態においては処置するための、方法および組成物に関する。特定の実施形態では、組成物および方法は、例えば、HIVエンベロープ抗原の、HIV抗原に対する抗体または抗体断片等の標的となる分子に関する。さらなる特定の実施形態において、抗体または抗体断片は、ドキソルビシン等の化学療法薬を含むがこれに限定されない、治療薬、診断薬、ウイルス静止剤および/または細胞毒性薬等の1つ以上の薬剤と併用することができる。別の実施形態において、HIV抗原のための1つ以上の結合部位および細胞毒性、ウイルス静止性またはその他の治療用薬剤および/または診断用薬剤が結合可能な担体分子のための親和性を有する1つ以上の結合部位と共に、二重特異性または複数特異性抗体あるいはその断片を利用することができる。
【0003】
抗レトロウィルス治療(ART)によるヒト免疫不全ウイルス―1(HIV―1)の治療における有望な進歩にもかかわらず、末梢血およびリンパ節の分析によって、治療が終了して何年も自然に活発化することがある潜在的なプロウィルスが存在する静止T細胞の持続的貯蔵庫の存在が文書で発表されている(Berger et al、Proc Natl Acad Sci U S 1998、95:11511―11513;Blankson et al、Annu Rev Med 2002,53:557―593)。
【0004】
結合抗体および中和抗体は、遊離型ウイルスの細胞受容体への結合を防ぐことができ、これらはウイルス表面に結合でき、また補体を介した遊離型ビリオンのvirolysis(Parren et al.、AIDS 1999、13[Suppl A]:S137―162)を誘発できる。抗体はさらに、NK細胞を、感染した標的細胞と結合することにより、抗体依存の細胞の細胞毒性(ADCC)によって、感染した細胞の根絶に仲介的な働きをすることができる(Broliden et al、J Virol 1990、64:936―940)。しかし、抗ウイルスの抗体のみをHIVに感染した患者の免疫療法の一部に利用することが、その当初の目的をかなえるものではない(Hinkula et al.、J Acquir Immune Defic Syndr 1994、7:940―951;Trkola et al.、Nat Med 2005、11:615―622)。
【0005】
様々なウイルスのまたは細胞の成分を、HIV感染細胞に対する治療薬剤の抗体送達の標的として使用するための試みがなされている(Davey et al.、J Infect Dis 1994、170:1180―1188;Pincus et al.、J Immunol 2003、170:2236―2241;Ramachandran et al.、J Infect Dis 1994、170:1009―1013;Saavedra―Lozano et al.、Proc Natl Acad Sci USA2004、101:2494―2499)。同様の抗毒素が、癌患者に有効であることが証明されている(WuおよびSenter、Nat Biotechnol 2005、23:1137―1146)。しかし、HIV感染した細胞の治療のためのより有用な方法および組成物に対するニーズが存在している。
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、HIV感染細胞を阻害、抑制、検出、同定、位置特定、および/または排除するための方法および組成物を提供することにより、当分野の未解決のニーズを実現する。
【課題を解決するための手段】
【0007】
特定の実施形態において、組成物および/または方法は、HIV抗原に対して標的となる分子に関する場合がある。こうした標的となる分子は、ペプチド、抗体、ヒト化抗体、キメラ抗体、ヒト抗体または任意のこうした抗体、および/または抗体の類似体の断片を含むことができるが、これに限定されない。特定の実施形態において、標的の分子は、例えば「裸の」抗体または抗体断片等、非共役にすることができる。別の実施形態において、標的の分子は、1つ以上の治療用および/または診断用薬剤に共役することができる。こうした薬剤は、薬物、プロ薬物、ウイルス静止剤、毒素、酵素、オリゴヌクレオチド、放射性同位体、放射性核種、免疫賦活剤、サイトカイン、ラベル、蛍光ラベル、発光ラベル、常磁性ラベル、MRIラベル、ミセル、リポゾーム、ナノ粒子、またはその組み合わせを含むが、これに限定されない。特定の実施形態において、共役の抗HIV抗体または断片を、HIV感染が判断されているまたは感染が疑われている患者に対して、生体内に投与する。こうした投与により、患者の細胞のHIV感染をブロックまたは予防し、患者内のHIV感染細胞を低減または排除し、および/またはその他の公知の抗レトロウィルスの療法よりも以前におよび/または同時に治療された患者内のHIV感染した細胞の残留病巣を低減または排除することができる。
【0008】
別の実施形態は、HIV、SIV、その他のレトロウィルスに感染した対象等の対象を治療するための方法および/または組成物に関する。対象には、ヒト、動物、ネコ、イヌ、ウシ、ヒツジ、ヤギ、ウマ、および哺乳類が含まれるが、これに限定されない。方法および組成物には、対象に投与される1つ以上の裸または共役の標的の分子を含むことができる。好適な実施形態において、標的の分子は、キメラの、ヒト化またはヒト抗体または断片の任意のバリエーションを含む、抗体または抗体断片である。投与は、経口、経鼻、口腔、吸入、直腸、経膣、または局所等の、当分野で公知の任意の経路にすることができる。または、投与は、同所、皮内、皮下、筋肉内、腹腔内、動脈内、髄腔内または静脈内にすることができる。
【0009】
当業者には、共役または非共役の、1つ以上のHIVの標的の分子は、単体で、またはアジドチミジン、その他のヌクレオシド/ヌクレオチド逆転写酵素阻害薬、非核酸逆転写酵素阻害薬、HIVタンパク質分解酵素阻害剤および/または融合阻害薬等の、HIV感染のためのその他の公知の治療と共に、投与することができることが理解されよう。特定の実施形態において、共役HIV標的の分子は、HAART(高活性抗レトロウィルス療法)と共に使用することができる。多くの抗HIV治療薬が当分野において公知であり、エファビレンツ、ジドブジン、テノホビル、ラミブジン、エムトリシタビン、ディダノシン、アバカビル、スタブジン、ネビラピン、ロピナビル、リトナビル、アタザナビル、ホスアンプレナビル、インディナビル、ネルフィナビル、サクイナビルを、単体または組み合わせたものを含むがこれに限定されない、任意のこうした公知の薬剤を使用することができる。
【0010】
いくつかの実施形態において、抗HIV抗体または断片は、ハプテンまたは担体分子等の、HIV抗原の少なくとも1つの結合部位および第2の標的の第2の結合部位を有する二重特異性または複数特異性抗体複合体の一部として、投与することができる。別の実施形態において、抗HIV抗体または断片は、共有して結合する、または抗体、抗体断片、モノクローナル抗体、Fc断片、Fc結合タンパク質または抗体結合タンパク質を有する融合タンパク質として提供することができる。
様々な実施形態において、抗HIV抗体または断片は、共有架橋試薬の使用等、当分野で公知の方法によって、様々な部分に、共有でまたは非共有で接続することができる。カルボジイミド、ビスイミデート、スベリン酸のN―ヒドロキシスクシニミドエステル、ジメチル―3,3’―ジチオ―ビスプロピオンイミデート、アジドグリオキサール、l,5―ジフルオロ―2,4―(ジニトロベンゼン)等の多くのこうした薬剤、およびタンパク質および/またはペプチドに使用する公知のその他の架橋剤を使用できる。
【0011】
別の実施形態において、抗HIV抗体または断片は、診断および/または画像化の標的のために付加物として使用できる。例えば、抗HIV抗体または断片は、任意の公知の造影剤または検知剤と共にタグを付けたり、またはELISA等の公知のメソドロジを使って検知することができる。抗HIV抗体または断片は、残留HIV感染を検知するために、例えば、組織部分の免疫組織化学法により、生体外で使用することができる。または、抗HIV抗体または断片を、HIV感染組織の生体内の検知のため、対象に投与することができる。こうした組成物および方法は、HIV感染の存在を検知および/または診断するために、治療後の残留HIV感染を監視するために、および/または抗HIV療法の有効性を監視するために、使用することができる。
【0012】
以下の図面は、本発明の一部を形成するものであり、本発明の特定の実施形態の特定の態様をさらに説明するために含まれている。この実施形態は、本明細書に記載されている詳細な説明と共に、1つ以上のこれらの図面を参照することで、より良く理解される。
【0013】
特許、特許出願、記事、書籍、および学術論文を含むがこれに限定されない、本発明で言及されている文書全体、または文書の一部が、本明細書によって、その全体を参照として明示的に組み込まれている。
【0014】
定義
本明細書において、「1つの(a)」または「1つの(an)」は、項目が1つではなく、1つ以上のという意味になり得る。
【0015】
本明細書において、「および」と「または」という用語は、接続または選言的に意味するために使用され得る。すなわち両用語は、特に説明されているのでない限り、「および/または」に相当するものとして理解すべきである。
【0016】
本明細書において、「約」は、ある数のプラスまたはマイナス10パーセント以内を意味する。例えば、「約100」は、90および110の間の任意の数を意味する。
【0017】
「抗体」は、本明細書で記載されているように、完全な長さの(すなわち、自然に生ずる、または通常の免疫グロブリン遺伝子の断片の組み換え過程によって形成される)免疫グロブリン分子(例:IgG抗体)または免疫学的に活性化された(すなわち、特異的に結合する)部分または抗体断片のような免疫グロブリン分子の類似体を指す。
【0018】
「抗体断片」は、F(ab)2、F(ab’)2、Fab、Fv、sFv等の抗体の一部である。構造に関係なく、抗体断片は、操作されていない抗体によって認識される同じ抗原と結合する。「抗体断片」という用語は、複合体を形成するために特定の抗原に結合することによって抗体様の働きをする、任意の合成または遺伝子的に操作されたタンパク質をさらに含む。例えば、抗体断片は、重鎖および軽鎖の可変領域で成る「Fv」断片、軽いおよび重い可変領域がペプチドのリンカー(「scFvタンパク質」)で接続されている遺伝子組み換え一本鎖ポリペプチド分子、および超可変領域に類似したアミノ酸残基で成る最小認識(CDR)単位等の、可変領域で成る分離断片を含む。
【0019】
「治療薬剤」とは、病気の治療に有効である原子、分子、または化合物である。治療薬の例には、抗体、抗体断片、薬物、ウイルス静止剤、毒素、酵素、ヌクレアーゼ、ホルモン、免疫賦活剤、アンチセンスオリゴヌクレオチド、低分子干渉RN(siRNA)、キレート剤、ボロン化合物、感光剤、着色料、および放射性同位体が含まれる。その他の例示的な治療薬および使用法は、それぞれ本明細書に参照として組み込まれている、米国特許出願文書第20050002945号、第20040018557号、第20030148409号、および第20050014207号に開示されている。
【0020】
「中和抗体」または「中和抗体断片」は、本明細書では、感染性因子(ウィルス等の)と反応する抗体または断片を指すために用いられており、伝染力および/または毒性を無効化および阻害する。
【0021】
「診断薬剤」とは、病気の診断に有用な原子、分子または化合物である。有用な診断薬には、放射性同位体、着色料(ビオチン―ストレプトアビジン複合体等の)、造影剤、蛍光化合物または分子および(例:常磁性イオン)磁気共鳴画像化(MRI)のための造影剤を含むが、これに限定されない。
【0022】
「免疫抱合体」は、原子、分子、またはより高次の構造(例:担体、治療薬、または診断薬を有する)を有する結合分子(例:抗体成分)の共役である。
【0023】
「裸抗体」とは、任意のその他の薬剤に共役されていない抗体である。
【0024】
「担体」とは、標的細胞へのこうした薬剤の送達を促進するための治療用または診断用薬剤に関連付けることができる原子、分子またはより高次の構造である。担体は、脂質(例:より高次の構造を形成することができる両親和性脂質)、多糖類(デキストラン等)、タンパク質、ペプチド、ペプチド類似物質、ペプチド誘導体またはミセル、リポゾーム、またはナノ粒子等のその他のより高次の構造を含むことができる。特定の実施形態において、担体は、例えばタンパク質またはペプチド内の自然発生的なL―アミノ酸にD―アミノ酸を置き換えることによって、タンパク質分解のまたはその他の酵素の分解が起きにくいように設計することができる。
【0025】
本明細書において、「抗体融合タンパク質」という用語は、同一または異なる特異性を有する2つ以上の同一または異なるscFvまたは抗体断片がリンクされている、遺伝子組み換えで生成される抗原結合分子を指す。融合タンパク質の価数は、単一の抗原またはエピトープに対して融合タンパク質が有する結合アームまたは部位の数、すなわち、一価、二価、三価または多価を示す。抗体融合タンパク質の価の高さは、抗原に対する結合において複数の相互作用を利用できる、つまり、抗原に対する結合の親和力が強いことを示す。特異性は、抗体融合タンパク質が結合可能な抗原またはエピトープの数、すなわち、単一特異性、二重特異性、三重特異性、複数特異性を示す。これらの定義を用いると、自然抗体(例:IgG)は2つの結合アームを有するため二価であるが、1つのエピトープに結合されるため単一特異性である。単一特異的、多価の融合タンパク質はエピトープの1つよりも多い結合部位を有するが、1つのこうしたエピトープに結合するにすぎない、例えば二重抗体は、同じ抗原に反作用を示す2つの結合部位を有する。融合タンパク質は、単一の抗体成分、多価または異なる抗体成分の複数特異性の組み合わせ、または複数の同じ抗体成分複製を含むことができる。融合タンパク質はさらに、抗体または抗体断片および治療薬を含むことができる。こうした融合タンパク質に適した治療薬の例には、免疫賦活剤(「抗体―免疫賦活剤融合タンパク質」)および毒素(「抗体―毒素融合タンパク質」)が含まれる。1つの好適な毒素にはリボヌクレアーゼ(RNase)、好適には遺伝子組み換えRNaseが含まれる。
【0026】
「二重特異性抗体」とは、異なる構造の2つの標的に対して同時に結合することができる抗体である。この二重特異性抗体および二重特異性抗体断片は、例えば、HIVエンベロープタンパク質に特異的に結合する少なくとも1つのアーム、および治療のまたは診断薬を伝達する標的にすることが可能な共役に特異的に結合する少なくとも1つのその他のアームを有する。
【0027】
本明細書に記載されている抗体または免疫抱合体の生成、または組成物は、投与量が生理的に意義がある場合に「治療有効量」で投与されると言われている。その存在により服用者の哺乳類の生理機能に検知可能な変化が表れる場合、薬剤は生理的な意義を持つ。特に、その存在によって、HIV感染細胞が低減、阻害、または排除される、または非感染細胞のHIV感染が低減、阻害または排除される場合、抗HIV抗体調剤は生理的な意義を持つ。
【0028】
その投与が服用した患者に耐えられる場合、組成物は「薬剤的に容認可能な担体」であると言われる。無菌リン酸緩衝生理食塩水は、薬剤的に容認可能な担体の一例である。その他の適した担体が、当業者に公知である。例えば、REMINGTON‘S PHARMACEUTICAL SCIENCES、19th Ed.(Mack Publishing Co.1995)、およびGoodman and Gilman’s THE PHARMACOLOGICAL BASIS OF THERAPEUTICS(Goodman et al,Eds.Macmillan Publishing Co.,New York,1980 and 2001 editions)を参照されたい。
【0029】
用いられている略称は以下の通りである。
ABS、150mMの塩化ナトリウムを含有する酢酸ナトリウム緩衝液
ADCC、抗体依存の細胞の細胞毒性
DTT、ジチオスレイトール
ELISA、酵素結合免疫吸着剤アッセイ
ART、抗レトロウィルス療法
HIV、ヒト免疫不全ウイルス
Mab、モノクローナル抗体
MuLV、マウス白血病ウイルス
PBMC、末梢血単核細胞
TCID50、50%組織培養感染量
【0030】
抗体
様々な実施形態は、HIVの1つ以上の抗原またはエピトープに対する抗体リガンドに関する。好適な実施形態において、抗原またはエピトープは、HIVエンベロープタンパク質等のHIV感染した細胞の表面に露曝しているものである。様々な抗体を基にした構造および断片を作成および使用する技術が、当分野で公知である。抗体を作成および特性化する手段がさらに、当分野で公知である(例:Harlowe and Lane,1988,Antibodies:A Laboratory Manual,Cold Spring Harbor Laboratoryを参照)。使用する抗体はさらに幅広い様々な公知の提供元から市販されているものを入手可能である。例えば、様々な抗体分泌ハイブリドーマ系が、American Type Culture Collection(ATCC、Manassas、VA)から市販されている。
【0031】
モノクローナル抗体
好適な実施形態はP4/D10抗体の使用に関するものにすることができるが、その他の抗HIV抗体を入手、作成および/または使用することができる。HIVに対する様々な抗体が報告されており、特定の実施形態において、任意のこうした公知の抗HIV抗体を利用することができる。例えば、それぞれ本明細書に参照として組み込まれている、4E10(Rosa et al、Immunity 2:163―73、2005)、2F5(Bryson et al、Protein and Peptide Letters、8:413―18、2001)、3D6(Ruker et al.、Ann.NY Acad.Sci.646:212―19、1991)、C37(Cao et al.、DNAおよびCell Biology、12:836―41、2004)、IACY、1F58、IGGGC(Berry et al.、Proteins、45:281―82、2001)、2G12(Armbruster et al.、J.Antimicrob.Chemother.54:915―20、2004)である。別の実施形態において、モノクローナル抗体は、米国特許第4,196,265号に例示されているもの等の、公知の技術の利用によって、容易に産生することができる。典型的には、この技術には、選択した免疫原組成物への適した動物の免疫付与が含まれる。マウスおよびラット等のげっ歯類の細胞が好適である。マウスはより好適であり、これは最も日常的に使用されており、概して、より高い割合の安定した融合が得られるため、BALB/cマウスが最も好適である。
【0032】
免疫付与後、抗体を生成することのできる体細胞、詳細にはBリンパ球(B細胞)が、Mab生成プロトコルで使用されるように選択される。これらの細胞は、生検を行った脾臓、扁桃腺またはリンパ節、または末梢血サンプルから入手可能である。多くの場合、一群の動物が免疫付与され、最も高い抗体力価を有する動物の脾臓は除去され、脾臓のリンパ球が、注射器によって、脾臓を均質化することで入手される。典型的には、免疫付与されたマウスの脾臓は、約5×107から2×108のリンパ球を含む。
【0033】
免疫付与された動物からの抗体生成Bリンパ球は、次に、不滅の骨髄腫細胞の細胞と、概して、同じ種の1つを、免疫付与された動物として融合される。ハイブリドーマ生成融合手順において使用するために適している骨髄腫細胞系は、好適には、非抗体産生であり、高い融合効率および、所望の融合細胞(ハイブリドーマ)のみの成長を支持する特定の選択培地における成長ができない、酵素欠乏を有する。
【0034】
当業者に公知であるように、多くの骨髄腫細胞の任意の1つを使用することができる。例えば、免疫付与された動物はマウスにすることができ、P3―X63/Ag8、P3―X63―Ag8.653、NSl/l.Ag 4 1、Sp210―Agl4、FO、NSO/U、MPC―1l、MPC11―X45―GTG 1.7およびS194/5XX0 Bulを使用することができ、ラットには、R210.RCY3、Y3―Ag 1.2.3、IR983Fおよび4B210およびU―266、GM1500―GRG2、LICR―LON―HMy2を使用することができ、UC729―6は、細胞融合との結合に全て有用である。
【0035】
抗体産生の脾臓またはリンパ節細胞および骨髄腫細胞のハイブリッドを生成する方法には、通常、2:1の比率で体細胞と骨髄腫細胞を混在させているが、細胞膜の融合を促進する薬剤(化学的または電気的)が存在する場合にそれぞれ、比率は、約20:1から約1:1に変化させることができる。Sendaiウイルスを使用した融合方法、および37%(v/v)PEG等のポリエチレングリコール(PEG)を使用した融合方法について記載されている。また、電気的に誘導される融合方法の使用も適切である。
【0036】
融合手順は、通常、約1×10−6から1×10−8の低い周波数において実行可能なハイブリッドを産生する。しかし、実現可能な融合ハイブリッドは、選択培地に培養されることによって、親の非融合細胞(特に、通常無限に分裂を続ける非融合の骨髄腫細胞)と区別されているため、これによって問題は生じない。選択培地は、一般的に、組織の培地のヌクレオチドの新規の合成物質をブロックする薬剤を含むものである。例示的な薬剤は、アミノプテリン、メトトレキサート、およびアザセリンである。アミノプテリンおよびメトトレキサートは、プリンおよびピリミジンの双方の新規の合成物質をブロックし、一方で、アザセリンはプリン合成物質のみをブロックする。アミノプテリンまたはメトトレキサートが使用される場合、培地は、ヌクレオチド(HAT培地)のソースとしてヒポキサンチンおよびチミジンで強化される。アザセリンを使用している場合、培地はヒポキサンチンで強化される。
【0037】
好適な選択培地はHATである。ヌクレオチドのサルベージ経路を操作することのできる細胞のみが、HAT培地において生存することができる。骨髄腫細胞は、サルベージ経路の主要な酵素、例えばヒポキサンチンホスホリボシル転移酵素(HPRT)において欠陥があり、生存することができない。B細胞はこの経路を操作することができるが、培地における寿命は限られており、一般的に、2週間以内で死滅してしまう。従って、選択培地において生存する細胞は、骨髄腫およびB細胞から形成されるハイブリッドのみである。
【0038】
この培養により、特定のハイブリドーマが選択されたハイブリドーマの個体数が得られる。典型的には、ハイブリドーマの選択は、所望の反応度のために個々のクローン上清を試験した後(約2、3週間後)、マイクロタイタープレートにおける1回の希釈によって、細胞を培養することで実行される。アッセイは、ラジオイミュノアッセイ、酵素免疫アッセイ、細胞毒性アッセイ、血小板アッセイ、ドット免疫結合アッセイ等、高感度、単純かつ素早くすべきである。
【0039】
次に選択されたハイブリドーマは、連続的に希釈し、個々の抗体産生細胞系に複製され、こうして複製はMabsを提供するために無限に増殖することが可能である。細胞系は、2つの基本的な方法でMabを産生するために利用することができる。ハイブリドーマのサンプルを、(多くの場合、腹腔に)本来の融合のために体および骨髄腫細胞を提供するために使用された種類の組織適合の動物に注入することができる。注入された動物は、融合された細胞雑種によって産生されるモノクローナル抗体に特異な腫瘍の分泌を発現させる。血清または腹水等の動物の体液は、次に、高い濃度のMabsを提供するために液体を出すことができる。個々の細胞系はさらに生体内で培養され、こうして、高い濃度で容易に入手することができる培地へと、Mabsが自然に分泌される。各手段によって産生されたMabsは、好適には、HPLCまたは親和性クロマトグラフィー等のろ過、遠心分離、および様々なクロマトグラフ法を用いて、さらに純化することができる。
【0040】
抗体断片の産生
請求された方法および/または組成物のいくつかの実施形態は、抗体断片に関する場合がある。こうした抗体断片は、従来の方法による抗体全体のペプシンまたはパパインによる消化によって得られる。例えば、抗体断片は、F(ab’)2と示される5S断片を提供するためにペプシンによって抗体の酵素の分裂によって産生することができる。この断片は、さらにチオール還元剤、また、任意に、3.5SFab’一価断片を産生するために、ジスルフィド結合の分裂によって生じたスルフヒドリル基の保護基を使って、分裂させることができる。または、ペプシンを用いた酵素の分裂によって、2つの一価Fab断片およびFc断片が産生される。抗体断片を産生するための例示的な方法が、米国特許番号第4,036,945号、米国特許番号第4,331,647号、Nisonoff et al、1960、Arch.Biochem.Biophys.、89:230;Porter、1959、Biochem.J.、73:119;Edelman et al.、1967、METHODS IN ENZYMOLOGY、422ページ(Academic Press)、およびColigan et al.(eds.)、1991、CURRENT PROTOCOLS IN IMMUNOLOGY(John Wiley & Sons)に開示されている。
【0041】
無傷の抗体によって認識される抗原へと断片が結合される限り、一価軽鎖―重鎖の断片を形成するための重鎖の分断等の、抗体を切断するその他の方法、さらに断片またはその他の酵素の分断、化学または遺伝子技術を、さらに使用することができる。例えば、Fv断片はVHおよびVL鎖の関連を含む。この関連は、Inbar et al.,1972,Proc.Nat’l.Acad.Sci.USA、69:2659に記載されているように、非共有にすることができる。または、可変鎖を、分子間ジスルフィド結合によってリンクする、またはグルタルアルデヒド等化学的に架橋することができる。Sandhu,1992,Crit.Rev.Biotech.,12:437を参照されたい。
【0042】
好適には、Fv断片は、ペプチドリンカーによって接続されるVHおよびVL鎖を含む。これらの単一の鎖の抗原結合タンパク質(sFv)は、オリゴヌクレオチドリンカー配列によって接続されるDNA配列塩コーディングVHおよびVL領域を含む構造的遺伝子を構築することによって生成される。構造的遺伝子は、大腸菌等の宿主細胞にそれ以降導入される発現ベクターに挿入される。遺伝子組み換え宿主細胞は、2つのV領域を架橋するリンカーペプチドによって、単一のポリペプチド鎖を合成する。sFvsを産生する方法が当分野で公知である。Whitlow et al.、1991、Methods:A Companion to Methods in Enzymology 2:97;Bird et al.、1988、Science、242:423;米国特許番号第4,946,778号;Pack et al.、1993、Bio/Technology、11:1271、およびSandhu、1992、Crit.Rev.Biotech.、12:437を参照されたい。
【0043】
その他の形態の抗体断片は、補体決定領域(CDR)のためのペプチドコーディングである。CDRペプチド(「最小認識単位」)は、対象の抗体の遺伝子塩コーディングCDRを構築することで得られる。こうした遺伝子を、例えば、抗体産生細胞のRNAから可変領域を合成するためのポリメラーゼ鎖反応を使用することによって、生成することができる。Larrick et al.、1991、Methods:A Companion to Methods in Enzymology 2:106;Ritter et al.(eds.)、1995、MONOCLONAL ANTIBODIES: PRODUCTION、ENGINEERING AND CLINICAL APPLICATION、166―179ページ(Cambridge University Press);Birch et al.、(eds.)、1995、MONOCLONAL ANTIBODIES: PRINCIPLES AND APPLICATIONS、137―185ページ(Wiley―Liss、Inc.)を参照されたい。
【0044】
キメラおよびヒト化抗体
キメラ抗体は、例えば、ヒト抗体の可変領域を、例えば、マウスの抗体の相補性決定領域(CDR)を含む、マウスの抗体の可変領域によって置き換えた、遺伝子組み換えタンパク質である。キメラ抗体は、対象に投与される場合に、免疫原性の減少、および安定性の向上がもたらされる。キメラ抗体を構成するための方法が、当分野で公知である(例:Leung et al.,1994,Hybridoma 13:469)。
【0045】
キメラモノクローナル抗体を、マウスのCDRをマウスの免疫グロブリンの重軽可変鎖からヒト抗体の対応する可変領域へと移動させることによってヒト化することができる。キメラモノクローナル抗体のマウスのフレームワーク領域(FR)はさらに、ヒトのFR配列で置き換えられる。ヒト化モノクローナルの安定性および抗原特異性を保存するために、1つ以上のヒトのFR残基を、マウスの相当する残基で置き換えることができる。ヒト化モノクローナル抗体は、対象の療法的な治療に利用することができる。標的のためのヒト化抗体の親和性は、さらに、CDR配列(WO0029584A1)の選択された修正によって向上させることができる。ヒト化モノクローナル抗体の産生のための技術が、当分野で公知である。(例:Jones et al.、1986、Nature、321:522;Riechmann et al.、Nature、1988、332:323;Verhoeyen et al.、1988、Science、239:1534;Carter et al.、1992、Proc.Nat‘l Acad.Sci.USA、89:4285;Sandhu、Crit.Rev.Biotech.、1992、12:437;Tempest et al.、1991、Biotechnology 9:266;Singer et al.、J.Immun.、1993、150:2844.を参照。)
【0046】
別の実施形態は、ヒト以外の霊長類の抗体に関することができる。例えば、Goldenberg et al.、WO 91/11465(1991)、およびLosman et al.、Int.J.Cancer 46: 310(1990)において、ヒヒの治療的に有用な抗体を生成するための一般的な技術が示されている。
【0047】
ヒト抗体
別の実施形態において、抗体はヒトのモノクローナル抗体にすることができる。こうした抗体は、抗原的な問題に対して特異的なヒト抗体を賛成するために操作されている遺伝子組み換えマウスから得ることができる。この技術において、ヒトの重鎖および軽鎖の遺伝子座のエレメントが、内生の重鎖および軽鎖の遺伝座の標的の崩壊を含む、胚幹細胞系に由来するマウスのストレインに導入される。遺伝子組み換えマウスは、ヒトの抗原に特異的なヒト抗体を合成することができ、マウスを、ヒト抗体分泌ハイブリドーマを産生するために用いることができる。遺伝子組み換えマウスからヒト抗体を得るための方法が、Green et al.、Nature Genet 7:13(1994)、Lonberg et al.、Nature 368:856(1994)、およびTaylor et al.、Int.Immun.6:579(1994)に記載されている。
【0048】
組み合わせ法またはヒト免疫グロブリン遺伝座によって変形された遺伝子組み換え動物を用いて、ヒト抗体を完全に産生する方法が、当分野で公知である(例:それぞれ本明細書に参照として組み込まれている、Mancini et al.、2004、New Microbiol.27:315―28、Conrad and Scheller、2005、Comb.Chem.High Throughput Screen。8:117―26、Brekke and Loset、2003、Curr.Opin.PHamacol.3:544―50)。こうした完全なヒト抗体は、キメラまたはヒト抗体よりも副作用が少なく、また、本質的に内生のヒトの交代として生体内で機能すると考えられている。特定の実施形態において、請求される方法および手順は、こうした技術によって産生されるヒトの交代を利用することができる。
【0049】
ある別の実施形態において、ファージ提示技術を、ヒト抗体を生成するために使用できる(例:本明細書に参照として組み込まれている、Dantas―Barbosa et al、2005、Genet.Mol.Res.4:126―40)。ヒト抗体を、通常のヒト、またはHIV感染またはAIDS等の特定の病状を抱えるヒトから生成することができる。病気の個人からヒト抗体を生成する利点は、循環抗体の範囲を病気に関連する抗原に対する抗体へとバイアスすることができる、ということである。
【0050】
この方法論の1つの非制限的な例において、Dantas―Barbosa et al.(2005)は、骨肉種患者から、ヒトのFab抗体断片のファージ提示ライブラリを生成した。概して、循環血リンパ球(Id.)から全RNAが得られた。遺伝子組み換えFabは、μ、γおよびκ鎖抗体の範囲からクローン化され、ファージ提示ライブラリ(Id.)に挿入された。RNAは、cDNAに変換され、重鎖および軽鎖の免疫グロブリン配列に対する特異的なプライマーを用いて、Fab cDNAライブラリを作成する(本明細書に参照として組み込まれている、Marks et al.、1991、J.Mol.Biol.222:581―97)。ライブラリ構築は、Andris―Widhopf et al.によって行われた。(本明細書に参照として組み込まれている、2000,In:Phage Display Laboratory Manual,Barbas et al.(eds),1st edition,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY 9.1から9.22ページ)最終的なFab断片は、制限エンドヌクレアーゼによって消化され、ファージ提示ライブラリを作成するためにバクテリオファージゲノムに挿入された。こうしたライブラリは、バイオパニング等の標準的なファージ提示方法によってスクリーニングすることができる。当業者は、この技術は例示的であるにすぎないこと、また、ファージ提示によってヒト抗体または抗体断片を作成およびスクリーニングするための任意の公知の方法を利用できることが理解されよう。
【0051】
別の実施形態において、ヒト抗体を産生するために遺伝子的に操作された遺伝子組み換え動物を使って、上記で述べた標準的な免疫付与プロトコルを使った任意の免疫原の標的に対する抗体を生成することができる。こうした系統の非制限的な例は、Abgenix(Fremont,CA)によるXenoMouse(登録商標)(例:Green et al.,1999,J.Immunol.Methods 231:11―23)である。XenoMouse(登録商標)および同様の動物において、マウスの抗体遺伝子は不活性化され、機能的ヒト抗体遺伝子で置き換えられているが、マウスの免疫系のその他の部分は操作されていない。
【0052】
XenoMouse(登録商標)は、付属遺伝子および調節塩基配列に沿って大部分の可変領域配列を含む、ヒトIgHおよびIgkappa遺伝子座の部分を含有する、生殖細胞で構成されたYAC(酵母人工染色体)によって変換された。ヒトの可変領域の範囲を使用して、公知の技術によるハイブリドーマに処理可能な抗体産生B細胞を生成することができる。標的抗原によって免疫を付与されたXeno Mouse(登録商標)は、上述した標準的な技術によって得られるおよび/または生成することができる通常の免疫反応によって、ヒト抗体を生成する。それぞれ、様々な分類の抗体を産生することができる、XenoMouse(登録商標)の様々なストレインが利用可能である。こうしたヒト抗体は、化学的な架橋のまたはその他の公知の方法論によって、他の分子に結合可能である。通常のヒト抗体の薬物動態的な性質を保持しつつも治療の可能性を有するよう、遺伝子組み換えにより産生されたヒト抗体が示されている(Green et al.,1999)。当業者は、請求される組成物および方法はXenoMouse(登録商標)系の使用に制限されず、ヒト抗体を生成するために遺伝子的に操作された任意の遺伝子組み換え動物を利用することができることを、理解されるであろう。
【0053】
中和抗体
特定の実施形態において、HIVの感染力および/または毒性を壊滅または阻害することができる中和抗体またはその断片が好適である。様々なHIV中和抗体が当分野で公知であり、P4/D10、2G12(例:Joos et al.、Antimicrob Agents Chemother 2006、50:1773―79)、4E10(Joos et al.、2006)、2F5(Joos et al.、2006)、bl2(例:Wu et al.、J Virol 2006、80:2585)、X5(Moulard et al.、Proc Natl Acad Sci 2002、99:6913―18)または任意のその組み合わせを含むがこれに限定されない、これらの任意の公知の抗体またはその断片を使用できる。複数特異性抗体または断片が使用される場合、当業者は、同じまたは異なるHIVエピトープに結合される複数の抗体または断片を組み合わせることができることを理解されるであろう。HIVエンベロープタンパク質(gpl20)および/またはgp41に対する抗体は好適であるが、当業者は、HIV感染した細胞を標的にする抗体またはその断片を発現させるためにその他のHIV標的抗原を利用できることが理解されよう。一部の場合では、T細胞抗原(例:CD4、CCR5および/またはCXCR4)と組み合わせられた1つ以上のHIV抗原に結合する抗体または断片を利用できる。
【0054】
融合タンパク質
様々な実施形態が、融合タンパク質に関する。これらの分子は、一般的に、第2のポリペプチドまたはタンパク質の全てまたは一部へと、NまたはC末端でリンクされる、ペプチドの全てのまたは重要な部分を有する。例えば、融合は、異種宿主のタンパク質の遺伝子組み換え発現を可能にするため、その他の種からのリーダー配列を利用することができる。別の有用な融合には、ペプチドまたはタンパク質毒性または酵素等の治療用薬剤への、抗体または断片等の免疫学的に活性化した領域の結合が含まれる。しかし、その他の有用な形態の融合には、FLAGエピトープ等の、生成のために使用する部分の結合を含むことができる(Prickett et al、1989、Biotechniques 7:580―589、Castrucci et al、1992、J Virol 66:4647―4653)。融合タンパク質を生成する方法が当業者に公知である。例えば、二官能価の架橋試薬を使った化学的結合、完全融合タンパク質の新規の合成、または操作されていない融合タンパク質の発現後の、第1のタンパク質またはペプチドをエンコーディングするDNA配列の第2のペプチドまたはタンパク質をエンコーディングするDNA配列への結合によって、こうしたタンパク質を生成することができる。
【0055】
二重特異性抗体
特定の実施形態において、二重特異性または複数特異性抗体または断片を利用可能である。こうした抗体または断片は、例えば、治療用のおよび/または診断用の薬、サイトカイン、細胞表面受容体またはその他の抗原に共役された担体分子に対して、HIVに関連する抗原の少なくとも1つの結合部位および少なくとも1つのその他の結合部位を含む。
【0056】
一般的に、遺伝子組み換えDNA技術によって生成された抗体の別々のVHおよびVL領域は、結合能力を有するダイマー(遺伝子組み換えFv断片)を形成するために、互いに対になることができる(米国特許番号第4,642,334号)。しかし、こうした、非共有で関連する分子は、任意の実用的な利用を得るための生理的な条件下において十分に安定していない。同族のVHおよびVL領域を、結合作用を有する単一の―鎖Fv(scFv)を形成するために、適切な組成物および長さ(通常、12よりも多いアミノ酸残基で成る)のペプチドリンカーによって結合することができる。scFvsの生成方法は、米国特許番号第4,946,778号および米国特許番号第5,132,405号に開示されている。ペプチドリンカーの長さを12アミノ酸残基未満に縮小することにより、同じ鎖上のVHおよびVLの領域の対が予防され、別の鎖において相補的な領域を有するVHおよびVLの領域の対が強制されることになり、こうして、機能的多重結合体が形成される。3から12のアミノ酸残基の間のリンカーによって結合されるVHおよびVLの領域のポリペプチド鎖によって、圧倒的多数のダイマーが形成される(二重抗体といわれる)。0および2のアミノ酸残基の間にリンカーがある場合、トリマー(三重抗体といわれる)およびテトラマー(四重抗体といわれる)が好適であるが、オリゴマー化の正確なパターンは、組成物、および、リンカー長さに加えて、V領域(VH―リンカー―VLまたはVL―リンカー―VH)の方向に依存しているようである。
【0057】
複数の価数を有する単一特異的二重抗体、三重抗体、および四重抗体を、5アミノ酸残基またはそれ未満を含むペプチドリンカーを使用して得た。それぞれscFvが短いペプチドリンカーによって接続されている1つの抗体から、その他の抗体のVL領域へのVH領域を構成している、本明細書中では2つの異なるscFvsのダイマーである二重特異性二重抗体は、さらに、VH1―リンカー―VL2を含むあるシストロン遺伝子組み換え遺伝子構造においてシストロン発現ベクターを、また、VH2―リンカー―VL1を含む第2の遺伝子組み換え遺伝子構造において他のシストロン発現ベクターを含むジシストロン発現ベクターを使って、生成されている(Holliger、et al.Proc Natl Acad Sci USA.1993;90:6444―6448;Atwell、et al.Mol Immunol.1996;33:1301―1302;Holliger、et al.Nature Biotechnol.1997;15:632―631;Helfrich、et al.Int.J Cancer.1998;76:232―239;Kipriyanov、et al.Int J Cancer.1998;77:763―772;Holliger、et al.Cancer Res.1999;59:2909―2916)。
【0058】
より最近になって、二重の特異性を有する四価タンデム二重抗体(tandabと呼ばれる)も報告されている(Cochlovius,et al.Cancer Res.2000;60:4336−4341)。二重特異性tandabは、自己関連において2つの異なる特異性のそれぞれについて、2つの可能性のある結合部位の形成に役立つような向きにリンクされた2つの異なる抗体(VH1、VL1、VH2、VL2)の4つの可変領域をそれぞれが含む、2つの同一のポリペプチドのダイマーである。
【0059】
リンカー長さを変更することによる、多価および複数特異性のscFvベースの薬剤の製造方法が、米国特許番号第5,844,094号、米国特許番号第5,837,242号、および第WO98/44001号に開示されている。1つは少なくとも2つの抗体からのVH領域を含み、もう一方は対応するVL領域を含む、2つのポリペプチド鎖を構成することによる、多価および複数特異性のscFvベースの薬剤の製造方法が、米国特許番号第5,989,830号および米国特許番号第6,239,259号に開示されている。CHlのc末端およびFVのCLは、それぞれ同じまたは異なるモノクローナル抗体に由来するscFvに融合される、遺伝子組み換えにより生成された二重特異性または三重特異性の抗体が、米国特許番号第6,809,185号に開示されている。
【0060】
二重特異性および複数特異性抗体の構築および利用のための方法が、例えば、2004年11月2日に出願された、その全文が本明細書に参照として組み込まれている、米国特許出願文書番号第20050002945号に開示されている。二重特異性抗体および抗体断片を生成するために様々な遺伝子組み換え方法を使用することができる。例えば、遺伝子組み換えした家畜のミルクにおいて二重特異性抗体および抗体断片を生成することができる。(例:それぞれ本明細書に参照として組み込まれている、Colman、A.、Biochem.Soc.Symp.、63:141―147、1998、米国特許番号第5,827,690号を参照。)それぞれ、DNA断片のコーディングが免疫グロブリン重鎖および軽鎖の対となっている、2つのDNA構成が生成される。その断片は、哺乳類の上皮細胞に優先的に発現するプロモーター配列を含む発現ベクターにクローン化される。例には、ウサギ、ウシおよびヒツジのカゼインの遺伝子、ウシのアルファラクトグロブリン遺伝子、ヒツジのベータラクトグロブリン遺伝子、およびマウスのホエイ酸タンパク質遺伝子からのプロモーターが含まれるが、これに限定されない。好適には、挿入された断片は、哺乳類に特異的な遺伝子の同族ゲノム配列によって、その3’の側面に位置する。これにより、ポリアデニル化部位および転写安定化配列がもたらされる。この発現カセットは、受精した哺乳類の卵子の前核に注入され、こうして、受精したメスの子宮に移植され、妊娠させられる。誕生後、その子孫は、Southern分析によって、両トランス遺伝子の存在をスクリーニングされる。抗体が存在するようにするには、重鎖および軽鎖遺伝子の双方を同じ細胞において同時に発現させる必要がある。遺伝子組み換えしたメスからのミルクは、当分野で公知の標準的な免疫論理方法を用いて、抗体または抗体断片の存在および機能性について分析される。抗体は、当分野で公知の標準的な方法を用いて、ミルクから精製することができる。
【0061】
事前標的
二重特異性抗体で使用するためのある戦略に、二重特異性抗体が投与された後でエフェクター分子を対象に投与する事前標的の方法論が含まれる。HIV抗原の結合部位および1つ以上のエフェクター分子に共役される担体の結合部位を含む二重特異性抗体は、病変組織の位置を特定し、病変組織へのエフェクターの局所化の特異性を増大させる(米国特許出願第20050002945号)。エフェクター分子を、二重特異性抗体よりもずっと素早く循環からクリアにすることができるため、エフェクター分子が病変標的抗体に直接リンクしている場合よりも、事前標的の戦略が使用されている場合に通常の組織は、エフェクター分子に対する曝露を少なくすることができる。
【0062】
事前標的の方法が、検知薬または治療薬の標的バックグラウンド比率を向上させるために開発されている。事前標的のおよびビオチン/アビジンのアプローチの例が、例えば、その全てが本明細書に参照として組み込まれている、Goodwin et al、米国特許番号第4,863,713号、Goodwin et al.、J.Nucl.Med.29:226、1988、Hnatowich et al.、J.Nucl.Med.28:1294、1987、Oehr et al.、J.Nucl.Med.29:728、1988、Klibanov et al.、J.Nucl.Med.29:1951、1988、Sinitsyn et al.、J.Nucl.Med.30:66、1989、Kalofonos et al.、J.Nucl.Med.31:1791、1990、Schechter et al.、Int.J.Cancer 48:167、1991、Paganelli et al.、Cancer Res.51:5960、1991、Paganelli et al.、Nucl.Med.Commun.12:211、1991、米国特許番号第5,256,395号、Stickney et al、Cancer Res.51:6650、1991、Yuan et al.、Cancer Res.51:3119、1991、米国特許番号第6,077,499号、米国シリアル番号第09/597,580号、米国シリアル番号第10/361,026号、米国シリアル番号第09/337,756号、米国シリアル番号第09/823,746号、米国シリアル番号第10/116,116号、米国シリアル番号第09/382,186号、米国シリアル番号第10/150,654号、米国特許番号第6,090,381号、米国特許番号第6,472,511号、米国シリアル番号第10/114,315号、米国仮出願番号第60/386,411号、米国仮出願番号第60/345,641号、米国仮出願番号第60/3328,835号、¥米国仮出願番号第60/426,379号、米国シリアル番号第09/823,746号、米国シリアル番号第09/337,756、および米国仮出願番号第60/342,103号に記載されている。
【0063】
特定の実施形態において、病変組織の治療および/または画像化において、例えば、それぞれ本明細書に参照として組み込まれている、米国特許第6,126,916号、第6,077,499号、第6,010,680号、第5,776,095号、第5,776,094号、第5,776,093号、第5,772,981号、第5,753,206号、第5,746,996号、第5,697,902号、第5,328,679号、第5,128,119号、第5,101,827号および第4,735,210号に記載された方法の使用において、二重特異性抗体および標的可能な構成を使用することができる。さらなる方法が、1999年6月22日に出願された、米国出願シリアル第09/337,756号、および2001年4月3日に出願された、米国出願シリアル第09/823,746号に記載されている。
【0064】
ドックおよびロック(DNL)
特定の実施形態において、二重特異性の抗体または断片、または抗体または断片の共役を、公知の技術を用いて、ドックおよびロック(DNL)として組み立てることができる。DNL技術のさらなる詳細は、それぞれ、全文が本明細書に参照として組み込まれている、2005年3月24日に出願された米国特許出願シリアル第11/389,358号、2006年3月28日に出願された第11/391,584号、2006年6月29日に出願された第11/478,021号、2007年6月21日に出願された第11/633,729号、および2006年11月6日に出願された米国仮特許出願シリアル第60/864,530号に説明されている。
【0065】
要約すると、DNL技術は、例えば、c―AMP依存のタンパク質キナーゼA、および、PKAのRサブユニットとの関連を媒介する様々なA―キナーゼ固着タンパク質(AKAP)内で見られる固着領域の標準的サブユニットの、ダイマー化およびドッキング領域(DDD)等の2つ以上の相補配列間の標的の結合を含む。しかし、当業者には、その他のダイマー化およびドック領域および固着領域が公知であり、任意のこうした公知の領域を、請求される対象事項の範囲内で利用できることが理解されよう。その他の例示的な4らせんバンドルタイプのDDD領域を、p53、DCoH(プテリン4アルファカルビノラミン脱水酵素/肝細胞核因子1アルファ(TCFl)のダイマー化共因子)およびHNF―I(肝細胞核因子1)から得ることができる。利用が可能なその他のAD配列が、全文が本明細書に参照として組み込まれている、特許出願シリアル番号第US20003/0232420A1号に記載されている。
【0066】
これらの相補結合対は、決定された特異性および活性の治療用または診断用の複合物を形成する、抗体または抗体断片等の様々な機能的ユニットに、または治療用または診断用の薬に対して、共有結合することができる。当業者は、例えばADまたはDDDの配列を、公知の結合特異性と共にFab、Fab’、IgG、scFcまたはその他の抗体または断片を含む融合タンパク質に組み込むことにより、こうした複合体を形成できる複数の方法が存在することを理解されるであろう。例えば、二重特異性複合体を、ADおよびDDD配列を2つの異なる標的抗原に特異な抗体または断片に組み込むことで、形成することができる。または、DDDまたはADの部分に結合する抗体または断片を、相補的なADまたはDDDの部分に結合する、ホルモン、酵素、リボヌクレアーゼ、オンコナーゼまたはその他の薬剤等の治療用タンパク質またはペプチドと組み合わせることができる。多くのこうした可能性のある複合体が、上記の患者の応用例において記載されており、任意のこうした公知の複合体を利用することができる。
【0067】
抗HIV抗体への、治療薬または診断薬の共役
様々な実施形態において、治療薬を、HIV感染細胞の送達のために、抗HIV抗体、断片またはその他の標的となる分子に共役することができる。使用する治療薬には、アピリジン、アザリビン、アナストロゾール、アザシチジン、ブレオマイシン、ボルテゾミブ、ブリオスタチン−1、ブスルファン、カリケアマイシン、カンプトセシン、10―ヒドロキシカプリン酸、カルムスチン、セレブレックス、クロラムブシル、シスプラチン、イリノテカン(CPT―11)、SN―38、カルボプラチン、クラドリビン、シクロホスファミド、シタラビン、ダカルバジン、ドセタキセル、ダクチノマイシン、ダウノマイシングルクノニド、ダウノルビシン、ドキソルビシン、2―ピロリノドキソルビシン(pyrrolinodoxorubicine)(2P−DOX)、シアノ―モルホリノドキソルビシン、ドキソルビシングルクロニド、エピルビシングルクロニド、エストラムスチン、エトポシド、エトポシドグルクノニド、リン酸エトポシド、フロクスウリジン(FUdR)、3’,5’―O―ジオレオイル−FudR(FUdR−dO)、フルダラビン、フルタミド、フルオロウラシル、フルオキシメステロン、ゲムシタビン、ヒドロキシウレア、イダルビシン、イホスファミド、L−アスパラギナーゼ、ロイコボリン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、6−メルカプトプリン、メトトレキサート、ミトキサントロン、ミトラマイシン、マイトマイシン、ミトタン、フェニル酪酸塩、プロカルバジン、ペントスタチン、PSI―341、セムスチン、ストレプトゾシン、タキサン、チオグアニン、チオテパ、テニポシド、トポテカン、ウラシルマスタード、ベルケイド、ビンブラスチン、ビノレルビン、ビンクリスチン、リシン、アブリン、リボヌクレアーゼ、オンコナーゼ、rapLRl、DNase I、ブドウ球菌性エンテロトキシン−A、ヤマゴボウ抗ウイルス性タンパク質、ゲロニン、ジフテリアトキシン、シュードモナスエクソトキシン、シュードモナスエンドトキシン、アンチセンスオリゴヌクレオチド、干渉RNAまたはその組み合わせを含むことができる。
【0068】
さらなる部分を、本明細書に記載されているHIV標的の分子に共役にすることができる。例えば、薬物、毒素、放射線化合物、酵素、ホルモン、細胞毒性タンパク質、キレート、サイトカイン、およびその他の機能薬剤を、HIV標的の分子に対して共役にすることができる。共役は、例えば、その側鎖においてアミン基、カルボキシル基、チオール基またはヒドロキシル基を含むアミノ酸残基へ共有結合によるものにすることができる。例えば、ジイソシアネート、ジイソチオシアネート、ビス(ヒドロキシスクシニミド)エステル、カルボジイミド、マレイミド―ヒドロキシスクシニミドエステル、グルタルアルデヒド等の、様々な従来のリンカーをこの目的のために使用できる。HIV標的の分子への薬剤の共役は、好適には、非組み換え構造に比較して、結合活性または特異性に大きな影響を及ぼさない。さらに、細胞毒性および/またはウイルス静止剤は、まずはポリマー担体に結合することができ、次にHIV標的の分子に共役する。この方法については、本明細書に参照として組み込まれている、Ryser et al、Proc.Natl.Acad.Sci.USA、75:3867―3870、1978、米国第4,699,784号および米国第4,046,722号を参照されたい。
【0069】
本明細書に記載されている共役は、抗体を脂質、炭水化物、タンパク質、放射性核種、またはその他の原子および分子にリンクさせるための公知の方法によって、生成することができる。例えば、本明細書に記載されているHIV標的の分子は、共有で、非共有で、またはその他の方法で、治療用のまたは診断用の薬を組み込むことができる共役を形成するために、本明細書に記載されている1つ以上の担体(例:脂質、ポリマー、リポゾーム、ミセル、またはナノ粒子)にリンクさせることができる。または、任意の本明細書に記載されているHIV標的の分子は、本明細書に記載されている1つ以上の治療用のまたは診断用の薬と直接共役にすることができる。
【0070】
例えば、HIV標的の分子は、131Iで標識化することができ、また、脂質に共役し、生じた共役でリポゾームが形成されるようにすることができる。リポゾームは、1つ以上の治療の(例:FUdR―dO等の薬)または診断の薬を組み込むことができる。リポゾームおよびミセルの形成は当分野で公知である。例:Wrobel and Collins、Biochimica et BiopHysica Acta(1995)、1235:296―304;Lundberg et al、J.Pharm.Pharmacol.(1999)、51:1099―1105;Lundberg et al.、Int.J.PHarm.(2000)、205:101―108;Lundberg、J.Pharm.Sci.(1994)、83:72―75;Xu et al.、Molec.Cancer Ther.(2002)、1:337―346;Torchilin et al.、Proc.Nat’l.Acad.Sci.、U.S.A.(2003)、100:6039―6044;U.S.5,565,215;U.S.6,379,698、およびU.S.2003/0082154を参照されたい。
【0071】
薬物の送達または画像化に有用な、ポリマー、シリカ、または金属から形成されるナノ粒子またはナノカプセルについても、記載されている。例:West et al、Applications of Nanotechnology to Biotechnology(2000)、11:215―217、U.S.5,620,708、U.S.5,702,727、およびU.S.6,530,944を参照されたい。治療のまたは診断薬のための標的の担体を形成するための、リポゾームへの抗体または結合分子の共役が説明されている。例:Bendas、Biodrugs(2001)、15:215―224、Xu et al.、Mol.Cancer Ther(2002)、1:337―346;Torchilin et al.、Proc.Nat’l.Acad.Sci.U.S.(2003)、100:6039―6044、Bally、et al.、J.Liposome Res.(1998)、8:299―335、Lundberg、Int.J.Pharm.(1994)、109:73―81、Lundberg、J.Pharm.Pharmacol.(1997)、49:16―21;Lundberg、Anti−cancer Drug Design(1998)、13:453―461を参照されたい。さらに、1999年6月9日に出願された、米国番号第6,306,393号、米国シリアル番号第10/350,096号、米国シリアル番号第09/590,284号、および米国シリアル番号第60/138,284号を参照されたい。これらの全ての参照は本明細書に参照として組み込まれている。
【0072】
幅広い様々な診断用のおよび治療用の薬は、HIV標的の分子の共役を形成するために有利に利用することができるか、またはHIV標的の分子における認識部位に結合するハプテンにリンクさせることができる。診断用薬剤には、放射性同位体、MRIに使用する造影剤または超音波画像化のための造影剤、および蛍光化合物を含むことができる。多くの適切な画像化剤が、タンパク質またはペプチドへの結合のための方法として、当分野で公知である(共に本明細書に参照として組み込まれている、例:米国特許第5,021,236号および第4,472,509号を参照)。特定の結合方法には、例えば、有機キレート剤タンパク質またはペプチドに結合したこうしたDTPを使用する金属キレート複合体の使用を含む(米国特許第4,472,509号)。
【0073】
HIV標的の分子に放射性金属または常磁性イオンを取り込むためには、放射性金属または常磁性イオンを結合するためのキレート基の複数の複製が結合している担体で、これと最初に反応することが必要になる場合がある。こうした担体は、この目的で有用であることが公知の、エチレンジアミン四酢酸(EDTA)、ジエチレントリアミン五酢酸(DTPA)、ポルフィリン、ポリアミド、クラウンエーテル、ビス―チオセミカルバゾン、ポリオキシム等の、ポリリシン、多糖類、またはキレート基を結合可能なペンダント基を有する誘導体化あるいは誘導体化可能なポリマー物質にすることができる。キレートを含有する担体は、免疫反応の凝集および損失を最小限にするように、標準的な化学的方法を使用して、HIV標的分子に結合される。
【0074】
こうした共役の生成のために適用可能な、その他の、より変わった方法および試薬が、その全体が参照として本明細書に組み込まれている、米国第4,824,659号に開示されている。特に、有用な金属とキレートの組み合わせには、60から4,000keVの一般的なエネルギー範囲で診断用の同位元素と共に使用される、2―ベンジル―DTPおよびそのモノメチルおよびシクロヘキシル類似体が含まれる。いくつかの有用な診断的な核種には、18F、52Fe、62Cu、64Cu、67Cu、67Ga、68Ga、86Y、89Zr、94Tc、94mTc、99mTc、または111Inを含むことができる。本明細書に記載されているHIV標的の分子および担体と共に使用する場合、マンガン、鉄およびガドリニウム等の非放射性金属と複合された同じキレートが、MRIで有用である。NOTA、DOTA、およびTETA等の大環状のキレートが、様々な金属および放射能金属と共に、特にそれぞれ、ガリウム、イットリウムおよび銅の放射性核種と共に使用される。こうした金属とキレートの複合体は、対象となる金属の輪の大きさに合わせて調整されることによって、非常に安定させることができる。223Raを複合させるための大環状のポリエーテル等のその他の輪タイプのキレートを使用できる。
【0075】
治療薬は、例えば、ビンカアルカロイド、アントラサイクリン、エピポドフィロトキシン、タキサン、代謝拮抗物質、アルキル化剤、抗生物質、Cox―2阻害物質、抗有糸分裂剤、抗血管由来およびアポトーシス誘導剤等の化学的治療薬、特にドキソルビシン、メトトレキサート、タクソール、CPT―1l、カンプトテシン、ならびにこれらのおよびその他の細胞毒性薬の分類のその他のものが含まれる。その他の細胞毒性薬には、ナイトロジェンマスタード、アルキルスルフォン酸塩、ニトロソウレア、トリアジン、葉酸類似体、ピリミジン類似体、プリン類似体、プラチナ配位錯体等が含まれる。適した細胞毒性薬は、REMINGTON‘S PHARMACEUTICAL SCIENCES、19th Ed.(Mack Publishing Co.1995)、およびGOODMAN AND GILMAN’S THE PHARMACOLOGICAL BASIS OF THERAPEUTICS、7th Ed.(MacMillan Publishing Co.1985)、およびこれらの文書の改訂版に記載されている。実験的薬剤等のその他の適した細胞毒性薬が当業者に公知であり、当分野で公知の方法を用いて、本明細書に記載されたHIV標的の分子に共役することができる。
【0076】
その他の治療薬分類は、α粒子(212Pb、212Bi、213Bi、211At、223Ra、225Ac等)、β粒子(32P、33P、47Sc、67Cu、67Ga、89Sr、90Y、111AA g、125I、131I、142Pr、153Sm、161Tb、166Ho、166Dy、177Lu、186Re、188Re,189Re等)またはオーガー電子(111In、125I、67Ga、191Os、193mPt、195mPt、195mHg等)を発する放射性核種から成る。HIV標的の分子は、診断用薬について説明しているように、方法を使って上記の1つ以上の放射性核種で標識化することができる。
【0077】
特定の実施形態において、使用する治療薬は、1つ以上のアグリゾーム阻害物質を含むことができる。アグリゾームは、異常な折りたたみ構造のタンパク質に対して形成すると考えられている大きな細胞間複合体である(例:Heath et al.、J.Cell Biol.153:449―55、2001、Johnston et al、J.Cell Biol.143:1883―98、1998、Wileman、Science 312:875―78、2006を参照)。より最近では、アグリゾームはウイルスの粒子(Heath et al.、2001、Wileman、2006)の組み立てにおいて働くことができることが示唆されている。従って、アグリゾーム阻害物質は、HIVまたはその他のウイルスに感染した細胞からの新たな感染性ウイルスの粒子の形成をブロックまたは阻害するよう機能する。様々なアグリゾーム阻害物質は、ALLN、ノコダゾール、コルヒチンおよびビンブラスチン(Johnston et al.、1998)、その他の微小管阻害物質(GerdesおよびKatsanis、Hum.Molec.Genet.14:R291―300、2005)、ボルテゾミブ(Velcade)(Catley et al.、Blood 108:3441―49、2006)、tubacin、ヒストン脱アセチル化酵素阻害物質(Corcoran et al.、Curr.Biol.14:488―92、2004)等が公知であり、任意のこうした公知のアグリゾームは阻害するか、または使用することができる。
【0078】
様々な実施形態において、1つ以上の免疫賦活剤を、患者への投与のために抗HIV抗体または断片へ共役することができるか、または、患者に同時投与することができる。本明細書において、「免疫賦活剤」という用語は、インターロイキン、コロニー刺激因子、インターフェロン(例:インターフェロンα、βおよびγ)等のサイトカイン、幹細胞成長因子、リンパ毒素および造血因子、「Sl因子」と呼ばれる幹細胞成長因子を含む。適した免疫賦活剤の部分の例には、IL―2、IL―6、IL―10、IL―12、IL―18、IL―21、インターフェロン―ガンマ、TNF―アルファ等が含まれる。
【0079】
「サイトカイン」という用語は、細胞間媒介物質としてその他の細胞上で作用する1つの細胞集団によって放出されるタンパク質またはペプチドを指す遺伝子用語である。本明細書で幅広く用いられているように、サイトカインの例には、リンフォカイン、モノカイン、成長因子および従来のポリペプチドホルモンが含まれる。サイトカインには、ヒトの成長ホルモン、N―メチオニルのヒトの成長ホルモン、およびウシの成長ホルモン等の成長ホルモン、副甲状腺ホルモン、チロキシン、インシュリン、プロインシュリン、レラキシン、プロレラキシン、卵胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、および黄体形成ホルモン(LH)等の糖タンパク質ホルモン、肝臓成長因子、プロスタグランジン、繊維芽細胞成長因子、プロラクチン、胎盤性ラクトゲン、OBタンパク質、腫瘍壊死因子―αおよび―β、ミューラー阻害物質、マウスのゴナドトロピン関連ペプチド、インヒビン、アクティビン、血管内皮性成長因子、インテグリン;トロンボポイエチン(TPO)、NGF―β等の神経成長因子、血小板成長因子、TGF―αおよびTGF―β等の変換成長因子(TGF)、インシュリン様成長因子―Iおよび―II、エリスロポエチン(EPO)、骨誘導因子、インターフェロン―α、インターフェロン―β、インターフェロン―γ等のインターフェロン、マクロファージ―CSF(M―CSF)、顆粒球―マクロファージ―CSF(GM―CSF)、顆粒球―CSF(G―CSF等のコロニー刺激因子(CSF)、IL―1、IL―lα、IL―2、IL―3、IL―4、IL―5、IL―6、IL―7、IL―8、IL―9、IL―10、IL―1l、IL―12;IL―13、IL―14、IL―15、IL―16、IL―17、IL―18、IL―21、LIF、G―CSF、GM―CSF、M―CSF、EPO、キット―配位子またはFLT―3等のインターロイキン(IL)、アンギオスタチン、トロンボスポンジン、エンドスタチン、腫瘍壊死因子およびLT等が含まれる。本明細書において、サイトカインという用語には、自然源からのまたは遺伝子組み換え細胞培養によるタンパク質および元の配列のサイトカインの生物学的に活性な同等物が含まれる。
【0080】
ケモカインは、一般的に、免疫エフェクター細胞をケモカイン発現部位に編成するために、化学的誘引物質として働く。治療部位に対する他の免疫系構成要素の編成を強化するために、例えば、サイトカイン遺伝子と組み合わせて、特定のケモカイン遺伝子を発現させることが有利である場合がある。ケモカインは、RANTES、MCAF、MIP1アルファ、MIP1ベータ、およびIP10を含むが、これに限定されない。当業者は、特定のサイトカインはさらに、化学的誘引物質の効果を有し、ケモカインという用語で分類することもできることを理解されよう。同様に、免疫賦活剤およびサイトカインは、各員において重複する。
【0081】
検知可能なラベル(例:蛍光分子)、またはウイルス静止性および/または細胞毒性薬、(例:放射性ヨウ素)を含む適したペプチドは、共有で、非共有で、またはHIV標的の分子と関連するようにすることができる。例えば、感光剤または着色剤をHIV標的の分子に組み込むことにより、治療的に有用な共役を得ることができる。適切な光を病巣に当てることによって病巣を検知および治療するため、フルオロクロム等の蛍光組成物、およびその他の色原体、または可視光に反応するポルフィリン等の着色料が使用されている。治療において、これは、光線照射、光線療法、または光線力学療法と呼ばれている。Jori et al.(eds.)、PHOTODYNAMIC THERAPY OF TUMORS AND OTHER DISEASES(Libreria Progetto 1985)、van den Bergh、Chem.Britain(1986)、22:430を参照されたい。さらに、モノクローナル抗体は、光線療法を実行するための光活性化した着色料と結合されている。Mew et al.、J.Immunol.(1983),130:1473、idem.、Cancer Res.(1985)、45:4380;Oseroff et al.、Proc.Natl.Acad.Sci.US(1986)、83:8744、idem.、Photochem.Photobiol.(1987)、46:83、Hasan et al.、Prog.Clin.Biol.Res.(1989)、288:471、Tatsuta et al.、Lasers Surg.Med.(1989)、9:422;Pelegrin et al.、Cancer(1991)、67:2529を参照されたい。
【0082】
アプタマー
別の実施形態において、開示された組成物および方法は、アプタマー等の、抗体または抗体断片に対する別の形態の結合分子を利用することができる。アプタマーは典型的には、選択された標的分子に抗体様の結合親和性および特異性を提供する3次元構造を適用可能な合成オリゴヌクレオチドである。アプタマーの結合特徴を構成および決定する方法が分野で公知である。例えば、こうした技術は、本明細書に参照として組み込まれている、米国特許第5,582,981号、第5,595,877号および第5,637,459号に記載されている。
【0083】
アプタマーは、合成、遺伝子組み換え、および精製方法を含む任意の公知の方法で作成することができ、単体で、同じ標的に特定のその他のリガンドと共に、使用することができる。一般的に、特異的な結合を有効にするために、少なくとも約3のヌクレオチド、好適には少なくとも5のヌクレオチドが必要である。10、20、30または40のヌクレオチドのアプタマーが好適であるが、10塩基よりも短い配列のアプタマーが適している場合がある。
【0084】
アプタマーは結合特異性を与える配列を含む必要があるが、側面領域に延伸することができる、またそうでない場合には被膜することができる。好適な実施形態において、アプタマーの結合配列はプライマー結合配列によって挟むことができ、これは、PCRまたはその他の増幅技術によるアプタマーの増幅に役立つ。さらなる実施形態において、側面配列には、基質へのアプタマーの固定化を強化させるための部分を優先的に認識または結合する特異的な配列を含むことができる。
【0085】
アプタマーは、従来のDNAまたはRNA分子として、分離、配列、および/または増殖または合成することができる。または、対象のアプタマーは組み換えを行ったオリゴマーを含むことができる。通常、アプタマー内に存在する任意のヒドロキシル基は、ホスホン酸基、リン酸基によって置換したり、標準的な保護基で保護したり、またはその他のヌクレオチドへのさらなる結合を生成するよう活性化されたり、あるいは固体支持に共役するようにすることができる。1つ以上のリン酸ジエステル結合を、P(O)S、P(O)NR2、P(O)R、P(O)OR’、CO、またはCNR2で置換したP(O)O等の別の結合基で置換することができる、ここでRはHまたはアルキル(1―20C)およびR’はアルキル(1―20C)であり、さらに、この基はOまたはSによって隣接するヌクレオチドに結合可能である。オリゴマーの全ての結合を同一にする必要はない。
【0086】
それぞれ参照として組み込まれている、例えば米国特許番号第5,475,096号および米国特許番号第5,270,163号等の、特定の対象となる標的に結合するアプタマーの生成およびスクリーニングの方法が公知である。技術には概して、候補アプタマーの混合および結合の段階的な反復、非結合アプタマーからの分離、および増殖からの選択を含む。最も高い親和性のアプタマーに相当する少数の配列のみ(恐らくはアプタマーの1つの分子のみ)が混合物内に存在するため、混合物内のアプタマーの高い容量(約5―50%)が、分離時においても保持されるよう、分割基準を設定することが一般的に望ましい。各サイクルによって、標的のための高い親和性を有するアプタマーが濃縮される。高い親和力および標的に対する特異性を持って結合する、3から6つの選択および増殖のサイクルの繰り返しを用いることができる。アプタマーは、当分野で公知の標準的な核酸標識化技術によって治療薬に共役することができる。
【0087】
アビマー
特定の実施形態において、開示されている組成物または方法は、1つ以上のアビマー配列を利用することができる。アビマーは、様々な標的分子に対する親和性および特異性において抗体と類似した結合タンパク質の一種類である。これは、生体内のエキソンシャッフリングおよびファージ提示法によって、ヒトの細胞外受容体領域から成長する。(Silverman et al.、2005、Nat. Biotechnol. 23:1493―94;Silverman et al.、2006、Nat. Biotechnol。 24:220。)生成された複数領域タンパク質は、単一エピトープ結合タンパク質と比較して高い親和力(場合によってはサブナノモル)および特異性を示すことができる、複数の結合領域を含むことができる。(Id.)様々な実施形態において、アビマーは、本明細書に記載されている標準的なタンパク質架橋または標識化の技術を用いた、請求されている方法および組成物で使用する治療薬に結合することができる。例えば、それぞれ、例のセクションが本明細書に参照として組み込まれている、米国特許出願文書番号第20040175756号、第20050048512号、第20050053973号、第20050089932号および第20050221384号において、アビマーの構築および利用の方法に関するさらなる詳細が開示されている。
【0088】
処方および投与
その共役を含む、HIV標的の分子はさらに、1つ以上の薬剤的に適した賦形剤、1つ以上のさらなる構成要素、またはこれらのいくつかの組み合わせを含む組成物を得るように編成できるこれらは薬剤的に有用な用量を生成するために公知の方法によって行うことができ、これにより、活性構成要素(すなわち、HIV標的の分子または共役)は、1つ以上の薬剤的に適した賦形剤と共に混合物中に混合される。無菌リン酸緩衝生理食塩水は、薬剤的に適した賦形剤の一例である。その他の適した賦形剤が当業者に公知である。例:Ansel et al.、PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS、5th Edition(Lea & Febiger 1990) and Gennaro(ed.)、REMINGTON‘S PHARMACEUTICAL SCIENCES、18th Edition(Mack Publishing Company 1990)、およびその改訂版を参照されたい。
【0089】
本明細書に記載の組成物のある投与経路は、非経口注入である。非経口投与において、その組成物は、薬剤的に容認可能な溶液、懸濁液またはエマルジョン等の注入可能な形態の単位用量で、賦形剤に関連して、編成される。こうした賦形剤は、本質的に、非毒性および非治療的であるこうした賦形剤の例は、生理食塩水、Ringerの溶液、デキストロース溶液、およびHankの溶液である。揮発性油、オレイン酸エチル等の非水性の賦形剤も使用できる。好適な賦形剤は、生理食塩水に5パーセントのデキストロースを混合したものである。賦形剤は、緩衝液および保存剤を含む、等張性および化学的安定性を向上させる物質等の、少量の添加物を含むことができる。経口投与を含む、その他の投与方法も検討されている。
【0090】
HIV標的分子を含む編成された組成物を、例えば、ボーラス注入または継続的注入による静脈内投与のために使用できる。注入のための組成物は、防腐剤を加え、アンプルまたは複数用量容器において、単位用量形態で示すことができる。油性または水性の賦形剤における懸濁液、溶液またはエマルジョンの形態を取ることもでき、懸濁化剤、安定剤および/または分散剤等の形成用の薬剤を含むことができる。あるいは、使用前に無菌の発熱物質なしの水等の適切な賦形剤によって、組成物は、構成のために粉状にすることができる。
【0091】
組成物は、溶液で投与することができる。溶液のpHは、pH5から9.5の範囲に、好適にはpH6.5から7.5の範囲にするべきである。溶液の編成は、リン酸、トリス(ヒドロキシメチル)アミノメタン―HClまたはクエン酸等の適切な薬剤的に容認可能な緩衝液を有する溶液にするべきである。緩衝液濃度は1から100mMの範囲にするべきである。編成された溶液はさらに、濃度50から150mMの塩化ナトリウムまたは塩化カリウム等の塩を含有することもできる。グリセロール、アルブミン、グロブリン、浄化剤、ゼラチン、プロタミンまたはプロタミン塩をさらに含有することができる。編成された組成物の全身への投与は、ヒト化の形態の抗体をHIV標的の分子のテンプレートとして使用する場合、典型的には、2日または3日ごとに、または1週間に1回行われる。または、毎日の投与が有用である。通常、投与は、筋肉内注入または血管内注入によるものである。
【0092】
組成物は、哺乳類の皮下に、またはその他の非経口経路によって、投与することができる。さらに、投与は、継続注入または一回のみまたは複数回のボーラス注入にすることができる。抗体または免疫抱合体に有効な方法を、本明細書に記載の組成物に適用することができる。一般的に、投与する免疫抱合体、融合タンパク質、またはヒトの裸抗体の用量は、患者の年齢、体重、身長、性別、一般的な健康状態および過去の病歴等の因子によって変動する。状況によってはよりの低用量または高用量も投与可能であるが、典型的に、1回の静脈内注入として、1mg/kgから20mg/kgの範囲の活性材料の用量を被験者に与えることが望ましい。この用量を、例えば、4週から10週間にわたって週一回、好適には8週間にわたって週一回、およびより好適には、4週間にわたって週一回等、必要に応じて繰り返すことができる。さらに、数ヶ月間にわたって一週間おき等の、より低い頻度で与えることもできる。用量は、用量およびスケジュールの適切な調節を行って、様々な非経口の経路で与えることができる。
【0093】
免疫抱合体または抗体の作用の期間を制御するために使用される薬剤の方法を、本明細書に記載されている形成された組成物に適用することができる。注入制御による生成は、複合体への生体適合性のあるポリマーの使用によって行うことができ、または、例えば、ポリ(エチレン―共―ビニルアセテート)の基質およびステアリン酸ダイマーポリ無水物コポリマーおよびセバシン酸の基質等の、免疫抱合体または裸抗体を吸収する。Sherwood et al.、Bio/Technology(1992)、10:1446を参照されたい。こうした基質からの免疫抱合体または抗体の注入速度は、免疫抱合体または抗体の分子重量、免疫抱合体の量、基質内の抗体、および分散粒子の大きさに依存する。上記のSaltzman et al.、Biophys.J(1989)、55:163;Sherwood et al.を参照されたい。その他の固体用量の形態が、Ansel et al.、PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS、5th Edition(Lea & Febiger 1990)、およびGennaro(ed.)、REMINGTON’S PHARMACEUTICAL SCIENCES、18th Edition (Mack Publishing Company 1990)およびその改訂版に記載されている。
【0094】
治療のために、治療有効量の組成物を哺乳類に投与する。非ヒトの動物の対象もさらに検討されるが、本明細書に開示されている治療用および診断用の方法に適した対象は通常ヒトである。
【0095】
肺への局所的送達を行うために、組成物を噴霧器によって投与することができる。水性の噴霧器または非水分の(例:過フッ化炭化水素噴射)懸濁液のいずれかを使用することができる。ソニック噴霧器は、好適には、剪断する組成物におけるHIV標的分子の曝露を最小限にするためにエアロゾルを作成するために使用され、これによって、活性の低下および消失がもたらされる可能性がある。
【0096】
放射性核種にリンクされているHIV標的分子は、治療に有効な場合がある。対象において1つ以上の感染部位にHIV標的の分子が配置されたと判断された後で、標識化された組成物のより高用量、一般的に、それぞれ70kgの患者の体重を基にした、131Iの各用量につき20mCiから150mCi、90Yの各用量につき5mCiから30mCi、または186Reの各用量につき5mCiから20mCiが注入される。注入は静脈内、動脈内、リンパ内、髄腔内、または腔内(すなわち、非経口)にすることができ、繰り返すことができる。複数の、分割された用量を投与すると、通常の組織の曝露においてそれに伴う増加に通常、影響せずに、より高い中毒量を提供できるため、いくつかの療法に有利である場合がある。
【0097】
また別の実施形態では、抗HIV抗体または断片を、IgGlのFc(例3―7を参照)等の特定のタンパク質に共役することにより、経口または吸入投与のために操作することができる。ペプチドFc共役の生成および利用の方法が、それぞれ本明細書に参照として組み込まれている、例えば、Low et al.(2005、Hum.Reprod.20:1805―13)およびDumont et al.(2005、J.Aerosol.Med.18:294―303)に開示されている。Low et al.(2005)は、CHO細胞における遺伝子組み換え発現を使った、一本鎖におけるIgGlのFc領域へのFSHのアルファおよびベータのサブユニットまたはヘテロダイマーの形態の共役を開示している。Fc共役されたペプチドは、新生児のFc受容体が媒介となる伝達系によって、肺または腸の上皮細胞を通って吸収された。Fcで共役されたペプチドは、本来のペプチドと比較して、生体内の安定性および吸収性が向上した。さらに、ヘテロダイマー共役は、一本鎖の形態よりも活性が高いことが観察された。エリスロポエチン等のより大きいタンパク質は、さらに、Fc共役(Dumont et al.、2005)を使って、吸入によって有効に送達することができる。
【0098】
治療および診断への利用:事前標的を含まない応用例
HIV標的の分子にリンクされている、放射性および非放射性診断薬の利用が検討されてきた。適した非放射性診断薬とは、磁気共鳴画像装置(MRI)で使用されるもの、コンピュータ断層撮影(CT)または超音波で使用されるものである。MRI用薬剤には、例えば、2―ベンジル―DTPAの適したキレートと複合されているマンガン、鉄およびガドリニウムおよびそのモノメチルおよびシクロヘキシル類似体等の非放射性金属が含まれる。その全てが参照として組み込まれている、2001年10月10日に出願された、米国シリアル第09/921,290号を参照されたい。
【0099】
HIV標的の分子は、診断用の画像化に有用な放射性同位体によって標識化することができる。適した放射性同位体は、60から4,000KeVのエネルギー範囲のもの、またはより詳細には、18F、52Fe、62Cu、64Cu、67Cu、67Ga、68Ga、86Y、89Zr 94mTc、94Tc、99mTc、45Ti、111In、123I、124I、125I、131I、154−158Gd、177Lu、32P、188Re等またはその組み合わせを含むことができる。例:米国特許出願「Labeling Targeting Agents with Gallium―68”―Inventors G.L.Griffiths and W.J.McBride」、および、画像化の目的のための18F、68Ga、94mTc等の陽電子エミッタを開示する米国仮出願番号第60/342,104号(本明細書に参照として組み込まれている)を参照されたい。例えば、単一光子発射のコンピュータ断層撮影(SPECT)または陽電子発射断層撮影(PET)によって、検知を行うことができる。
【0100】
別の実施形態において、HIV標的の分子は、β―エミッタ(32P、33P、47Sc、67Cu、67Ga、89Sr、90Y、111Ag、125I、131I、142Pr、153Sm、161Tb、166Ho、166Dy、177Lu、186Re、188Re、189Re等)、オーガー電子エミッタ(111In、125I、67Ga、191Os、193mPt、195mPt、195mHg等)、α―エミッタ(212Pb、212Bi、213Bi、211At、223Ra、225Ac等)、またはその組み合わせを含む、HIV感染した細胞を壊滅させるために有用な1つ以上の放射性同位元素でラベルすることができる。
【0101】
HIV標的の分子を、クロム(III)、マンガン(II)、鉄(III)、鉄(II)、コバルト(II)、ニッケル(II)、銅(II)、ネオジム(III)、サマリウム(III)、イッテルビウム(III)、ガドリニウム(III)、バナジウム(II)、テルビウム(III)、ジスプロシウム(III)、ホルミウム(III)、エルビウム(III)で成る群から選択された金属の複合体を含むことができる、1つ以上の画像処理剤にリンクさせることによって、MRIに使用することができる。同様に、HIV標的の分子は、現在市販されている1つ以上の画像処理剤に結合させることによって超音波画像化に使用することができる。米国特許番号第6,331,175号は、MRI技術およびMRI造影剤に対する共役された抗体の生成について記載しており、その全てが参照として組み込まれている。
【0102】
毒素等の機能タンパク質は、いくつかの方法で、HIV標的の分子に存在することができる。例えば、機能タンパク質は、標準的な分子生物学的技術を使って、融合タンパク質として、抗HIV抗体または断片に直接結合することができる。または、機能タンパク質は、公知の化学的架橋法によって、抗HIV抗体または断片に共有で共役することができる。これに関して使用される毒素には、リシン、アブリン、リボヌクレアーゼ(RNase)、DNase I、ブドウ球菌エンテロトキシン―A、ヤマゴボウ抗ウイルスのタンパク質、ゲロニン、ジフテリア毒素、シュードモナス 外毒素、およびシュードモナス内毒素が含まれる。(それぞれ本明細書に参照として組み込まれている、例:Pastan et al.、Cell(1986)、47:641、Goldenberg、CA―Cancer Journal for Clinicians(1994)、44:43、Sharkey and Goldenberg、CA Cancer J.Clin.56:226(2006)を参照)。本明細書の利用に適したさらなる毒素は、当業者に公知であり、その全てが参照として組み込まれている、米国第6,077,499号に開示されている。対象となるその他の機能タンパク質には、様々なサイトカイン、酵素、および蛍光タンパク質が含まれる。
【0103】
治療および診断への利用:事前標的を含む応用例
事前標的は、通常の組織、特に、骨髄への望ましくない毒の一因となっている、本来は、直接抗体を標的にする遅い血クリアランスを解決するために開発された、複数ステップのプロセスである。事前標的では、放射性核種またはその他の治療薬が、血から数分以内にクリアされる小型の複合物に接続される。標的抗体に加えて、小型の放射能で標識化された化合物を認識することができる事前標的をまず投与し、後で、事前標的剤が血から十分にクリアになると、放射能で標識化された化合物が投与される。
【0104】
対象において病気または不調を治療または診断するための事前標的の方法は、(1)上述したように、二重特異性のHIV標的分子を対象に投与し、ここでは、少なくとも1つの抗原結合部位がHIVマーカーに向けられており、その他の抗原結合部位は二価ハプテンを含む価標的可能な構造に向けられており、(2)任意に対象に対してクリア組成物を投与し、組成物が循環から結合構造をクリアさせるようにし、(3)二価ハプテンを含む標的可能な構成を対象に投与し、この構成はさらに、1つ以上のキレートのまたは化学結合した治療薬または診断薬を含むことにより、提供される。様々なクリア剤および方法が当分野で公知であり、その他の薬剤と合成することができるHIV標的抗体(単糖結合抗体等)に対して、タグまたはラベル(例:単糖)のHIV標的抗体または結合によって合成される抗イディオタイプ抗体等を事前標的するために使用できる。クリア方法へのアビジン―ビオチンの結合相互作用の利用が、さらに当分野で公知である。
【0105】
さらに、抗体依存の酵素プロ薬物療法(ADEPT)の方法も、by(1)上記のようにHIV標的の分子を患者に投与し、構造にはプロ薬物を活性化できる共有で結合された酵素を含み、(2)対象に対しクリア組成物を任意に投与し、組成物によって循環から結合構造をクリアするようにし、(3)患者にプロ薬物を投与することによって、提供される。
【0106】
IMP411標的可能構造
好適な実施形態において、標的とできる構造は1つ以上のヒスタミン―スクシニル―グリシン(HSG)の部分を含むことができ、抗原結合部位は、679抗体または断片等の、HSG結合抗体または断片に関連付けることができる(本明細書に参照として組み込まれている、例:米国特許番号第6,962,702を参照)。標的とできる構造は、公知の事前標的の技術(例:米国特許番号第6,962,702号)を用いて、任意の公知の診断用のおよび/または治療薬に共役にすることができる。2つのHSG部分を含む、IMP411として公知の、例示的な標的とできる構成は、DOTA―D―Cys(3―SP―Gly―20―O―SN38)―D―Ala―D―Lys(HSG)―D―Tyr―D―Lys(HSG)―NH2の式を有する。上記の式に示されているように、IMP411は、例えば、SN38化学療法薬にリンクすることができる。または、その他の治療用のまたは診断薬は、同じペプチド基幹に組み込む、または共役にすることができる。
【0107】
さらなる利用
特定の実施形態において、HIV標的の分子は、例えば、それぞれ本明細書に参照として組み込まれている、米国特許第6,126,916号、第6,077,499号、第6,010,680号、第5,776,095号、第5,776,094号、第5,776,093号、第5,772,981号、第5,753,206号、第5,746,996号、第5,697,902号、第5,328,679号、第5,128,119号、第5,101,827号、および第4,735,210号に記載されている方法を用いて、HIV感染した組織の治療および/または画像化に使用できる。さらなる方法が、1999年、6月22日に出願された米国出願シリアル第09/337,756号および2001年4月3日に出願された米国出願シリアル第09/823,746号に記載されている。こうした画像化は、Goldenberg et al.、「Antibody Pretargeted Advances Cancer Radioimmunodetection and Radiotherapy」(J.Clin.Oncol.、2006 24:823―34)に記載されているように、HIV標的の分子の直接のラベリング、または事前標的画像化方法によって実施することができ、さらに、それぞれ本明細書に参照として組み込まれている、米国特許文書第20050002945号、第20040018557号、第20030148409号、および第20050014207号を参照されたい。
【0108】
いくつかの実施形態において、本明細書で開示および請求されているHIV標的の分子を、放射性核種療法または放射線免疫療法に使用することができる(それぞれ本明細書に参照として組み込まれている、例:Govindan et al.、2005、Technology in Cancer Research & Treatment、4:375―91;Sharkey and Goldenberg、2005、J.Nucl.Med.46:115S―127S;Goldenberg et al.、2006、J.Clin.Oncol.24:823―34を参照)。
【0109】
別の実施形態では、放射線感受性増強物質を、裸のまたは共役されたHIV標的分子、抗体、または断片と組み合わせて使用することができる。例えば、放射線感受性増強物質を、放射線で標識化されたHIV標的分子と組み合わせて使用することができる。放射線感受性増強物質を追加すると、放射線で標識化されたHIV標的分子のみによる治療と比較して、効能を向上させることができる。放射線感受性増強物質は、本明細書に参照として組み込まれている、D.M.Goldenberg(ed.),CANCER THERAPY WITH RADIOLABELED ANTIBODIES, CRC Press(1995)に記載されている。
【0110】
任意の請求される方法で使用されるHIV標的分子は、サイトカインおよび免疫変調成分に関連付けるまたはこれと共に投与することができる。これらのサイトカインおよび免疫変調成分は、少なくとも、アルファ、ベータ、ガンマのインターフェロンとコロニー刺激因子とを含む。しかし、IL―I、IL―2、IL―3、IL―6、IL―10、IL―12、IL―18、TNF―α、幹細胞成長因子、リンパ毒素、エリスロポエチン、トロンボポイエチン、G―CSF、GM―CSF、Sl因子またはその組み合わせ等の、その他の免疫変調成分が公知であり、これを使用することができる。
【0111】
別の実施形態は、有効量のHIV標的の分子および標的可能な構造を投与することによる、対象内のHIV感染組織の血管内識別のための方法に関する。HIV標的の分子は、HIV抗原に特異的に結合する少なくとも1つのABS、および、標的可能な構造に特異的に結合する少なくとも1つのABSを含む。
【0112】
キット
いくつかの実施形態は、請求された方法を実施するためのキットに関する。キットには、HIV標的分子を含めることができる。標的の分子は、上記の任意の薬剤で標識化することができる。さらに、標的の分子はラベルを取り除くことができるが、キットは、ラベル標的の分子に対する試薬への標識化を含むことができる。試薬の標識化は、含まれる場合には、ラベルおよび架橋剤を含むことができる。キットはさらに、HIV抗原に特異な少なくとも1つの抗体、および担体に特異な少なくとも1つの抗体を含むHIV標的の分子を含むことができる。キットは、任意に、HIV標的の分子を循環から取り除くためのクリア組成物を含むことができる。
【0113】
キットの構成要素は一括して包装するか、または2つ以上の別々の容器に分けることができる。いくつかの実施形態において、容器は、再構成に適した組成物の無菌、凍結乾燥した構成を含むバイアルとすることができる。キットはさらに、その他の試薬の再構成および/または希釈に適した1つ以上の緩衝液を含むことができる。使用することのできるその他の容器には、袋、トレイ、箱、管等が含まれるが、これに限定されない。キットの構成要素は、容器内において無菌状態で包装および保持することができる。含むことができるその他の構成要素は、その利用のためのキットの使用者への説明書である。
【0114】
病変組織の検査、診断、および画像化方法
生体内診断
抗HIV抗体または断片は、生体内診断に利用されている。標識Mabを用いた画像診断法は、周知である。例えば、抗HIV抗体は、免疫シンチグラフィー技術で、ガンマ線放射性同位体で標識化され、患者に導入される。ガンマカメラが、ガンマ線放射性同位体の位置および分布の検知に使用される。例えば、Srivastava (ed.), RADIOLABELED MONOCLONAL ANTIBODIES FOR IMAGING AND THERAPY(Plenum Press 1988)、Chase, “Medical Applications of Radioisotopes,” in REMINGTON’S PHARMACEUTICAL SCIENCES, 18th Edition, Gennaro et al. (eds.), pp. 624−652 (Mack Publishing Co., 1990)、およびBrown, “Clinical Use of Monoclonal Antibodies,” in BIOTECHNOLOGY AND PHARMACY 227−49, Pezzuto et al. (eds.) (Chapman & Hall 1993)を参照されたい。511keVのエネルギー等の、フッ素−18(18F)、ガリウム−68(68Ga)、およびヨウ素−124(124I)等の陽電子放出核種(PETアイソトープ)の使用もまた好ましい。このような画像化は、Goldenberg et al., 2006, J. Clin. Oncol. 24:823−34で述べられているように、抗HIV抗体または断片の直接標識により、または事前標的画像化法により、行われることが可能であり、また米国特許公報第20050002945号、第20040018557号、第20030148409号、および第20050014207号も参照されたく、それぞれは参照として本明細書に組み込まれる。
【0115】
画像診断のために、放射性同位体は、媒介官能基を使用して直接または間接的のいずれかで、抗HIV抗体または断片に結合されてよい。有用な媒介官能基には、エチレンジアミン4酢酸およびジエチレントリアミン5酢酸等のキレート剤が挙げられる。例えば、上記のShih et al.、および米国特許第5,057,313号を参照されたい。
【0116】
患者に投与される放射線量は、検知および正確な測定を可能にする、最小限の半減期、最小限の体内での保持、および最小限のアイソトープ量の、最良の組み合わせのための、アイソトープ選択を通して、可能な限り低いレベルに維持される。抗HIV抗体に結合することができ、かつ画像診断に適した放射性同位体の例には、99mTcおよび111Inが挙げられる。
【0117】
また抗HIV抗体またはその断片は、生体内診断のために、常磁性イオンおよび多種の放射線造影剤でも標識化され得る。磁気共鳴映像法に特に有用な造影剤は、ガドリニウム、マンガン、ジスプロシウム、ランタン、または鉄イオンを含む。追加物質には、クロム、銅、コバルト、ニッケル、レニウム、ユウロピウム、テルビウム、ホルミウム、またはネオジムが挙げられる。また抗HIV抗体またはその断片は、超音波造影/強化剤に合成することも可能である。例えば、超音波造影剤の1つには、ヒト化抗HIVIgGまたはその断片を含む、リポソームがある。また、超音波造影剤には、ガスが充填されたリポソームが好ましい。
【0118】
好適な実施形態では、二重特異性抗体が、造影剤に合成され得る。例えば、二重特異性抗体は、超音波画像診断で使用するための、1つ以上の画像増強剤を含んでよい。好適な実施形態では、造影剤は、リポソームである。好ましくは、リポソームは、リポソームの外表面に共有結合した、二価DTPAペプチドを含む。さらに好ましいのは、リポソームがガスで充填されていることである。
【0119】
画像化剤および放射性同位体
特定の実施形態では、請求の範囲に記載のペプチドまたはタンパク質は、多種の罹病器官、組織、細胞種類の画像化および診断に有用である、画像化剤に付着されてよい。多くの適した画像化剤が、タンパク質またはペプチドへのそれらの付着方法同様、技術的に既知である(例えば、米国特許第5,021,236号および第4,472,509号を参照されたく、共に参照として本明細書に組み込まれる)。特定の付着方法は、例えば、タンパク質またはペプチドに付着されたDTPAのような、有機キレート剤を用いる、金属キレート錯体の使用を伴う(米国特許第4,472,509号)。またタンパク質またはペプチドは、グルタルアルデヒドまたは過ヨウ素酸塩等の共役剤の存在下で酵素と反応させてもよい。フルオレセインマーカーとの合成物は、これらの共役剤の存在下で、またはイソチオシアネートとの反応により、調製される。
【0120】
画像化剤として潜在的に有用である常磁性イオンの非限定的な例には、クロム(III)、マンガン(II)、鉄(III)、鉄(II)、コバルト(II)、ニッケル(II)、銅(II)、ネオジム(III)、サマリウム(III)、イッテルビウム(III)、ガドリニウム(III)、バナジウム(II)、テルビウム(III)、ジスプロシウム(III)、ホルミウム(III)、およびエルビウム(III)を含み、ガドリニウムが特に好ましい。X線画像化等の他の状況で有用なイオンには、ランタン(III)、金(III)、鉛(II)および特にビスマス(III)が挙げられるが、これらに限定されない。
【0121】
画像化剤または治療薬として潜在的に有用な放射性同位体には、アスタチン211、14炭素、51クロム、36塩素、57コバルト、58コバルト、銅62、銅64、銅67、152Eu、フッ素18、ガリウム67、ガリウム68、3水素、ヨウ素123、ヨウ素124、ヨウ素125、ヨウ素131、インジウム111、52鉄、59鉄、32リン、33リン、レニウム186、レニウム188、Sc47、75セレン、銀111、35硫黄、テクニシウム94m、テクニシウム99m、イットリウム86、およびイットリウム90が挙げられる。125I、しばしば特定の実施形態での使用に好ましく、テクニシウム99mおよびインジウム111もまた、その低エネルギーおよび長期の検知に対する適合性のため、しばしば好ましい。
【0122】
放射活性物質で標識したタンパク質またはペプチドは、当該技術分野において周知の方法により産生されてよい。例えばそれらは、ヨウ化ナトリウムもしくはカリウム、および次亜塩素酸ナトリウム等の化学的酸化剤、またはラクトペルオキシダーゼ等の酵素による酸化剤との接触により、ヨウ素化され得る。タンパク質またはペプチドは、例えば、過テクネチウム酸をスズ溶液で還元し、還元したテクニシウムをセファデックスのカラム上でキレートし、そしてペプチドをこのカラムに適用する、配位子交換工程により、または、例えば、過テクネチウム酸、SNCl2等の還元剤、ナトリウム−カリウムフタル酸エステル溶液等の緩衝溶液、およびペプチドを培養する直接標識技術により、テクニシウム99mで標識化されてよい。金属イオンとして存在する放射性同位体を、ペプチドに結合するためにしばしば使用される媒介官能基には、ジエチレントリアミン5酢酸(DTPA)、DOTA、NOTA、ポルフィリンキレート剤、およびエチレンジアミン四酢酸(EDTA)が挙げられる。同様に使用を検討されるものには、ローダミン、フルオレセインイソチオシアネート、およびレノグラフィン(renographin)を含む蛍光標識がある。
【0123】
特定の実施形態では、抗HIV抗体または断片は、発色性基質と接触すると着色産物を生成する、第2の結合配位子または酵素(酵素タグ)に連結されてよい。好適な酵素の例には、ウレアーゼ、アルカリ性ホスファターゼ、(セイヨウワサビ)過酸化水素、およびブドウ糖酸化酵素が挙げられる。好ましい第2の結合配位子は、ビオチンおよびアビジンまたはストレプトアビジン化合物である。このような標識の使用は当業者には周知であり、例えば米国特許第3,817,837号、第3,850,752号、第3,939,350号、第3,996,345号、第4,277,437号、第4,275,149号、および第4,366,241号に記載され、それぞれ参照として本明細書に組み込まれる。これらの蛍光標識は、生体外での使用に好適であるが、生体内の適用、特に内視鏡によるまたは血管内の検知手順においてもまた実用的であり得る。
【0124】
別の実施形態では、抗HIV抗体または断片は、蛍光マーカーでタグ付けされてよい。感光ラベルの非限定的な例には、Alexa350、Alexa430、AMCA、アミノアクリジン、BODIPY630/650、BODIPY650/665、BODIPY―FL、BODIPY―R6G、BODIPY―TMR、BODIPY―TRX、5―カルボキシ―4’,5’−ジクロロ−2’,7’−ジメトキシフルオレセイン、5―カルボキシ―2’,4’,5’,7’―テトラクロルエチレン、5―カルボキシフルオレセイン、5―カルボキシローダミン、6―カルボキシローダミン、6―カルボキシテトラメチルアミノ、Cascade Blue、Cy2、Cy3、Cy5,6―FAM、塩化ダンシル、フルオレセイン、HEX、6−JOE、NBD(7―ニトロベンズ―2―オクサ―l,3―ジアゾール)、Oregon Green488、Oregon Green500、Oregon Green514、Pacific Blue、フタル酸、テレフタル酸塩、イソフタル酸、クレシルファストバイオレット、クレシルブルーバイオレット、ブリリアントクレシルブルー、パラアミノ安息香酸、エリトロシン、フタロシアニン、アゾメチン、シアニン、キサンチン、スクニシルフルオレセイン、希土類金属クリプタート、ユーロピウムトリスビピリジンジアミン、ユーロピウムクリプタートまたはキレート、ジアミン、ジシアン、La Jolla青色色素、アロフィコシアニン、アロフィコシアニンB、フィコシアニンC、フィコシアニンR、チアミン、フィコエリトロシアニン(phycoerythrocyanin)、フィコエリトリンR、REG、Rhodamine Green、ローダミンイソチオシアネート、Rhodamine Red、ROX、TAMRA、TET、TRIT(テトラメチルローダミンイソチオール)、テトラメチルローダミン、およびTexas Redを含む。これらおよび他の発光ラベルは、Molecular Probes(Eugene,OR)等の商業的供給源から入手されてよい。
【0125】
有用な化学発光法による標識化合物には、ルミノール、イソルミノール、芳香族アクリジニウムエステル、イミダゾール、アクリジニウム塩、およびシュウ酸エステル、またはルシフェリン、ルシフェラーゼ、およびエクオリン等の生物発光化合物を挙げることができる。
【0126】
様々な実施形態で、有用なラベルは、金属ナノ粒子を含んでよい。ナノ粒子の調製方法は既知である。(例えば、米国特許第6,054,495号、第6,127,120号、第6,149,868号、Lee and Meisel,J.Phys.Chem.86:3391−3395,1982を参照されたい。)ナノ粒子もまた、商業的供給源(例えば、Nanoprobes Inc.,Yaphank,NY;Polysciences,Inc.,Warrington,PA)から入手されてよい。修飾ナノ粒子は、Nanoprobes,Inc.(Yaphank,NY)からのNanogold(登録商標)ナノ粒子等が、市販されている。タンパク質またはペプチドへの合成に有用な官能性ナノ粒子は、市販のものが入手されてよい。
【0127】
架橋剤
いくつかの実施形態では、抗HIV抗体もしくは断片または他のHIV標的分子が、同一二価、異種二価および/または光活性化することが可能な架橋試薬等、当該技術分野において既知である様々な架橋試薬を使用して標識化されてよい。そのような試薬の非限定的な例には、ビスイミデート(bisimidate)、l,5−ジフルオロ−2,4−(ジニトロベンゼン)、スベリン酸のN−ヒドロキシサクシンイミドエステル、酒石酸ジサクシンイミジル、ジメチル−3,3’−ジチオ−ビスプロピオンイミデート(bispropionimidate)、N−サクシンイミジル−3−(2−ピリジルジチオ)プロピオン酸塩、4−(ブロモアミノエチル)−2−ニトロフェニルアジド、および4−アジドグリオキサールが挙げられる。典型的な実施形態では、DCCDまたはEDC等のカルボジイミド架橋剤は、酸性残基をアミノまたは他の基に架橋するために使用されてよい。このような試薬は、蛍光標識等の多種のラベルを付着するよう修正されてよい。
【0128】
二官能性架橋試薬は、様々な目的に広く使用されている。2つの同一官能基を運ぶ同一二価試薬は、同一および異なる巨大分子または巨大分子のサブユニット間の架橋、およびポリペプチド配位子のそれら固有の結合部位への連結の誘発に、非常に効率的であることが判明した。異種二価試薬は、2つの異なる官能基を含有する。架橋は、2つの異なる官能基の微分反応性を利用して、選択的および連続的の双方で制御され得る。二価の架橋試薬は、例えば、アミノ、スルフヒドリル、グアニジノ、インドール、カルボキシル特定基等の、それらの官能基の特異性にしたがって分類され得る。これらの中で、遊離アミノ基を対象とした試薬は、市販されていること、合成の容易さ、それらが適用される反応条件の緩やかさから、特によく知られている。異種二価架橋試薬の大半は、第1級アミン反応基およびチオール反応基を含む。
【0129】
別の実施形態では、異種二価架橋試薬および架橋試薬の使用方法が記載されている(米国特許第5,889,155号、参照として本明細書に組み込まれる)。架橋試薬は、求核ヒドラジド残基を求電子マレイミド残基と組み合わせ、一例では、アルデヒドから遊離チオールへの共役を可能にする。架橋試薬は、様々な官能基の架橋用に修正され得る。
【発明を実施するための最良の形態】
【0130】
以下の実施例は、本発明の好適な実施形態を明示するために含まれる。以下の実施例で開示される技術は、本発明の実施に際し、上手く機能すると見出された技術を表しており、従って、その実施のための好適な態様を成すと考慮され得ることが、当業者には認識されるはずである。しかしながら、当業者は、本開示を踏まえて、開示される具体的な実施形態に、多くの変更を加えることが可能であり、それにもかかわらず、本発明の精神および範囲から逸脱することなく、同等または類似した結果が得られることを認識すべきである。
【実施例1】
【0131】
合成抗HIV抗体を使用した、生体外および生体内のHIV感染の阻害
概要
HIV−1に対する免疫抱合体の有効性を実証するため、HIVのエンベロープ抗原に対するマウスモノクローナル抗体(Mab)(P4/D10)は、従来の抗癌剤、ドキソルビシンと合成され、感染性ウイルスおよび感染細胞に対して、生体外および生体内の双方で試験された。P4/D10抗体は、遊離ウイルス(中和)またはHIV感染細胞(阻害)で培養され、得られた感染は、p24捕捉酵素免疫測定法で測定された。HIV−1/MuLVマウス攻撃モデルで、生体内の感染を阻害する接合能が測定された。
【0132】
ドキソルビシン合成されたP4/D10は、HIV−lIIIBを中和し、感染したジャーカット細胞における生体外の細胞間伝播およびHIV複製を排除した。またそれは、遊離抗体に必要とされるものより8倍低い濃度で、HIV−1IΠB/MuLVでの攻撃からマウスを防御し、一方、遊離型薬物または不適切な合成対照には、影響は観察されなかった。
【0133】
これらの結果は、ドキソルビシンが、P4/D10抗体によりHIV感染細胞に集中され、HIV排除に有意に(p=0.0001)寄与したことを実証している。同一組成物および方法が、ART(抗レトロウイルス療法)による治療を受ける患者における、残留する抗原発現T細胞の根絶に役立つ。
【0134】
本研究において、我々は、ドキソルビシン、アントラサイクリン系抗癌剤を、患者における既知の薬理学、毒物学、および抗腫瘍活性を用いて、HIV−1の外側エンベロープgpl20(第3可変ループ部位)に対して発達した、中和およびADCC媒介モノクローナル抗体(Mab)に、合成した。
【0135】
ドキソルビシンに合成されたP4/D10抗体は、非感染細胞間、およびマウスモデルにおける、HIV−1感染細胞排除の有効性について、HIV−1/MuLV(マウス白血病ウイルス)感染同系細胞を腹腔から除去し、生体外で試験された。抗gpl20抗体であるP4/D10は、HIV−1ウイルスを中和し、ADCCを媒介する(Broliden et al,1990)。またそれは、末期のHIV−1感染者に対する第1相臨床試験において、非合成型でも使用され、HIV抗原を長期間減少させた(Hinkula et al.,1994)。本研究は、同様にドキソルビシンと合成された、遊離Mab、遊離型薬物および不適切な抗体hRS7(Stein et al.,IntJ Cancer 1993,55:938−946)、およびhLLl Griffiths et al.,Clin Cancer Res 2003,9:6567−6571;Sapra et al.,Clin Cancer Res 2005,11:5257−5264)と比較して、臨床HIVモデルにおいて、P4/D10の組み合わせを薬物合成型で詳細に調べた最初のものである。
【0136】
材料および方法
抗体および薬物合成。ドキソルビシンの、IgGlκ抗gpl20抗体P4/D10(Broliden et al.,1990)および対照抗体との合成は、マレイミド基との、二官能性のドキソルビシンヒドラゾン誘導体の調製と同様、Griffithsら(2003)に従って行った。簡潔に、最終濃度約9mg/mlの、抗体P4/D10、hLLl(ヒト化抗CD74)、およびhRS7(ヒト化抗EGP−1)は、該抗体に対して38倍モル過剰の還元体に相当する、約2.2mMの最終DTT濃度を用い、5mMのEDTAを含む、PBS(pH7.5)中のDTT(ジチオスレイトール)で軽度に還元した。溶液を、37℃で40分間培養した。還元されたMabを、150mMのNaClおよび2mMのEDTA(pH5.3)を含有する、50mMの酢酸ナトリウム緩衝液中で、セファデックスのスピンカラムG50/80上で、した。抗体上で生成されたチオール基数は、エルマン法で測定した。合成には、6.5mg/mlで軽度に還元された抗体を、二官能性ドキソルビシンと混合した。培養物を、氷上で15分間保ち、0.1Mの酢酸ナトリウム(pH6.5)中で、スピンカラムG50/80上で精製し、次いで、同一の緩衝液で平衡化された、Bio−Beads SM2(Bio−Rad,Hercules,CA)のショートカラムを通過させた。産生物を、吸光度の測定により、ドキソルビシン/Mab置換率を分析した。サイズ排除HPLC分析を、BioSil250分析カラムで行った。
【0137】
HIV感染患者からの、IgGのGMP製造ロット(HIVIgG)(Guay et al.AIDS 2002,16:1391−1400)を、陽性対照として、またHIV陰性の個人からの血清が陰性対照として、使用した。遊離ドキソルビシン、およびドキソルビシンと同様に合成された抗癌ヒト化Mab、LLlおよびRS7を、合成P4/D10抗体の対照として含めた。
【0138】
HIV−1中和アッセイ。ドキソルビシンP4/D10、非標識P4/D10、HIV免疫グロブリン(HIVIgG)、およびHIV陰性血清を、HIV−1分離株、HIV−1IIIB(LAI)と混合した、37℃で1時間培養し、50,000ジャーカットT細胞/ウェルを加えた。1時間培養後、細胞を培地で洗浄し、新しい完全な培地を加えた(200μl/ウェル)。7日間の培養後、産生されたp24の量を、p24捕捉ELISA(酵素免疫測定法)で測定し、HIV−1p24産生の阻害割合を計算した。
【0139】
生体外HIV−1阻害ジャーカットT細胞を、5〜10×106細胞を100×TCID50のHIV−lIIIBと混合し、37℃で1時間培養して、HlV−lIIIBと感染させた。細胞を培地で洗浄し、37℃で培養した。2日おきに、培地を変え、上清のp24産生を確認した。細胞の100%近くが感染した際、異なる割合のHIV−lIIIB感染細胞を、非感染細胞と混合した。細胞は、抗体、血清、または遊離ドキソルビシンの連続希釈で、100〜0.00001μg/mlに処理された。37℃で7日間培養した後、HIV−1p24阻害を測定し、0.1〜10μg/mlのドキソルビシン−P4/D10、非合成P4/D10、および0.05〜0.5mg/mlのHIV陰性血清で予め処理された細胞からの上を採取し、未使用のジャーカットT細胞に移し、培養開始後3、7、10、12、および15日目に、感染性HIVが同定されるかどうかを、p24ELISAで試験した。
【0140】
HIV−1/MuLV攻撃モデル。ヒトT細胞株、CEM−IBを、遺伝子的に統合されたMuLVゲノムと共に、HIV−1ΠIBに感染させ、HIV−1ゲノムおよびMuLVエンベロープでの擬似ウイルスの産生に至った(Adang et al,PNAS USA 1999,96:12749−753;Hinkula et al.,Cells Tissues Organs 2004,177:169−184)。これらのウイルスの上清を、HLA−A201遺伝子導入のC57Bl/6xDBA Fl Kb/dマウスからの脾細胞を感染させるために使用した。同系マウスを、腹腔内で、HIV−1IΠB/MuLV感染脾細胞で攻撃し、合成抗体、遊離抗体、または遊離ドキソルビシンを腹腔内に直ちに与えた。攻撃の10日後、マウスを致死させ、腹膜細胞が採取した。腹膜細胞を、ペレット化し、1×106のHIV感受性ジャーカットT細胞または24ウェルプレートで成長させたヒトPBMCに加えた。これらの二次培養から、上清を除去し、未使用の培地を3〜4日毎に加えた。感染性HIV上清中で回収された感染性HIV量を、p24ELISAで3週間測定した。
【0141】
統計的分析。抗gpl20Mabおよび対照抗体の生体内HIV−1中和能を比較するために、スチューデントt検定およびノンパラメトリックのクラスカル・ワーリス検定を使用した。異なる抗体で処理された群間の統計比較を、ノンパラメトリックの、マン・ホイットニーのU検定およびクラスカル・ワーリス検定を使用して行った。<0.05の確率値が得られた時、差異は有意であるとみなされた。ノンパラメトリックの一元配置分散分析検定を、GraphPad Prismの4.0a版(GraphPad Software,San Diego,CA)を使用して行い、試験群間のHIV−1分離およびp24抗原の陽性率の比較に使用した。
【0142】
結果
軽度の還元により、それぞれの抗体上に生成されたチオール基の数は、最終的に精製された合成物中のドキソルビシン/Mab置換率と同様、8.8(P4/D10、hRS7)〜9.4(hLLl)に及び、IgG当たり約9薬物分子の比率が出た。高圧液体クロマトグラフィー分析は、該合成物および天然Mabが、ゼロから最少の凝集と共に、類似した保持時間を持つことを示した(データ示さず)。
【0143】
ドキソルビシン合成P4/D10Mabと、非合成P4/D10MabまたはHIVIgG抗体のいずれかとの間には、遊離HIV−1ウイルスのHIV−1中和能における有意な差異は示され得なかった(図IA)。しかしながら、全ての抗HIV−1特定抗体は、HIV−1IΠBの中和において、陰性の対照血清よりも有意に優れていた(p=0.001)。
【0144】
3%HIV−1IΠB感染ジャーカッタ細胞が、97%非感染細胞と混合されると、ドキソルビシン−P4/D10は、遊離P4/D10、ドキソルビシン合成対照抗体、hLLl、または0.5もしくは0.05μg/ml濃度の遊離ドキソルビシンよりも、HIV−1感染の細胞間伝播の有意に(p=0.002)強力な阻害を媒介した(図1B)。感染および非感染細胞の他の全ての濃度で、類似した結果が見られた。感染の細胞間伝播が、中和剤としてのドキソルビシン−P4/D10で得られた効果よりさらに強く阻害されたように思われることが、特に興味を引いた。また、これらの細胞培養物から非感染ジャーカッタ細胞へ上清を移した後は、p24の産生は検知されなかったため、高用量のドキソルビシン−P4/D10で処理された培養物には、感染ウイルスは発見され得なかった(データ示さず)。ドキソルビシン−P4/D10と非合成P4/D10との間の効果における有意な差異は、遊離HIV−1ウイルスの中和についての結果からは、予測され得なかった(図1A)。
【0145】
ドキソルビシン−P4/D10抗体の有効性を生体内で試験するために、マウスは腹腔内に、合成物とともに、同系のHIV/MuLV感染細胞を与えられた。腹膜細胞を、10日後に採取し、感染HIVは、過去の研究(Hinkula et al, 2004)と同様、全ての対照で実証された。ドキソルビシン−P4/D10抗体は、HIV−1感染一次リンパ細胞での攻撃から、完全にマウスを防御した(p=0.0001)(図2)。100μgのドキソルビシン−P4/D10抗体での攻撃および処理後、腹膜細胞から感染HIVは回収されなかった。マウスが100μgの非合成P4/D10抗体で処理された場合は、全てp24産生に陽性であった。用量が8倍の、1マウス当たり800μgまで非合成P4/D10を増加された場合のみ、抗体のみによる完全な防御が見られた。用量100〜200μgでは、いずれのドキソルビシン合成対照抗体(hLLlまたはhRS7)も防御をもたらさず、用量100〜400μgの遊離ドキソルビシンでももたらさなかった。
【0146】
考察
前述の結果は、HIV−1のエンベロープを対象とした、抗体の総合的なウイルス阻害特性が、ドキソルビシンへの共役により有意に増幅され得たことを示す。ドキソルビシン−P4/D10は、生体外で、また実験的な生体内攻撃モデルで、HIV−1感染細胞を根絶することができた。非合成P4/D10Mabの、HIV−1感染標的細胞に対するADCC媒介能は、HIV−1の中和と同様(Broliden et al.,1990;Hinkula et al.,1994)無毒な方法で、薬物免疫抱合体としての有効性を増進する可能性がある。
【0147】
同様にドキソルビシンと合成された抗癌の抗−CD74Mab、LLlは、非常に低い容量で、生体外および非ホジキンリンパ腫または多発性骨髄腫のヒト異種移植モデルで、顕著な活性を示した(Griffiths et al,2003;Sapra et al,2005)。これらの研究は、サルにおける毒物学同様、非常に高用量の免疫抱合体のみが、骨髄抑制の証拠であるという結果になったが、ドキソルビシンに関連した心毒性は観察されなかったと示している(Sapra et al.,2005)。ウイルス脱出を避けるため、HIVの接触しやすいエピトープの、保存および可変部位の両方を対象とした抗体は、共に試験されるべきである(Trkola et al.,2005;Ferrantelli et al.,J Infect Dis 2004,189:2167−2173)。
【0148】
過去の生体外研究では、緑膿菌外毒素A(PE40)に合成されたHIV−1特有の免疫抱合体が、HIV−1感染細胞を除去した(Pincus et al.,2003;Ashorn et al.,Proc Natl Acad Sci USA 1990,87:8889−8893)。しかしながら臨床試験において、CD4細胞に共役したPE40は、免疫原性および肝細胞毒性であることが判明した(Davey et al.,1994;Ramachandran et al.,1994)。従って、副作用がほとんど、または全く無い、ドキソルビシン−Mab合成物の有効性を示す本結果は、驚くべき、予期せぬものである。高ウイルス量の非ART治療患者において高濃度で存在する、PE40−CD4の毒性は、遊離gpl20との有毒な複合体の形成により説明され得る(Berger et al.,1998)。高ウイルス量に関連する潜在的な毒性問題を避けるため、好ましくは、HIVエンベロープ特有エピトープを標的とする分子は、ART中、HIV感染の初期、またはさらにHIV感染に既知または潜在的な暴露後間もなく等、ウイルス負荷が低い周囲環境で使用されるべきである。例えば、HIVで汚染された、または潜在的に汚染された、血液または他の流体に針刺し事故で暴露された医療従事者は、本開示方法による合成抗体での治療が可能である。ドキソルビシンP4/D10合成体の抗細胞活性の結果、ARTによる治療を受ける患者への薬物合成物の追加は、抗原運搬細胞および遊離ビリオンを根絶することができ、従ってさらにウイルス量を減少させる。当業者は、請求の範囲に記載の組成物および方法は、P4/D10のドキソルビシン合成物に限られず、むしろP4/D10に、または既知の他の抗HIV抗体に合成された、既知の他の細胞毒性薬を利用することができることを理解するであろう。
【0149】
他の実施形態では、非特異的毒性を避けるため、抗体照準法および毒物の送達は、分離される、二重特異抗体および他の事前標的戦略,が使用され得る(Wu et al.,2005)。本戦略は、癌の前臨床および臨床試験双方において、期待できる結果を示した(Forero et al.,Blood 2004,104:227−236;Rossi et al.,Clin Cancer Res 2005,11:7122s−7129s)。人を対象とした生体内使用については、繰り返される臨床用途の、ヒト抗体またはヒト化された形の抗体が好ましい。
【実施例2】
【0150】
ART後のHIV感染患者の治療
47歳男性患者は、HIVに対して血清反応陽性であると判断された。該患者のCD4数は、200/mm3未満であった。該患者は、非核酸系逆転写酵素阻害物質ネビラピンの標準療法による治療を受けた。CD4細胞数は、300/mm3まで改善したが、該患者は依然としてHIVに対して血清反応陽性であった。該患者は、ヒト化ドキソルビシン−P4/D10抗体による治療を受けた。該患者のCD4数は、350/mm3超過まで改善し、該患者は、もはやHIVに対して血清反応陽性ではなくなった。1年後、該患者は、無症状のままであり、検出可能なHIV感染は存在しない。
【実施例3】
【0151】
針刺し事故後の医療従事者の治療
30歳の臨床看護師は、HIV陽性血液の付着した針刺し事故に遭った。1時間以内に、該対象は、ヒト化ドキソルビシン−P4/D10抗体による治療を受けた。1年後、該対象にHIV感染の兆候は見られない。
【実施例4】
【0152】
その他の細胞毒素および/または抗体による治療
28歳男性患者は、HIVに対して血清反応陽性であると判断された。該患者のCD4数は、200/mm3未満であった。該患者は、非核酸系逆転写酵素阻害物質ネビラピンの標準療法による治療を受けた。CD4細胞数は、300/mm3まで改善したが、該患者は依然としてHIVに対して血清反応陽性であった。該患者は、ヒト化4E10Fab−734scFvを含み、米国特許第7,052,872号(参照として組み込まれる)に開示される方法を使用して調製された二重特異性抗体による治療を受けた。注入後、遊離二重特異性抗体を循環から除去するために、24時間の培養を行い、続いて標的ペプチドIMP−156(Id.)に合成された5−フルオロウラシルを注入した。該患者のCD4数は、350/mm3超過まで改善し、該患者は、もはやHIVに対して血清反応陽性ではなくなった。1年後、該患者は、無症状のままであり、検出可能なHIV感染は存在しない。
【実施例5】
【0153】
IMP411による事前標的
35歳男性患者は、HIVに対して血清反応陽性であると判断された。該患者のCD4数は、180/mm3未満であった。該患者は、非核酸系逆転写酵素阻害物質ネビラピンの標準療法による治療を受けた。CD4細胞数は、250/mm3まで改善したが、該患者は依然としてHIVに対して血清反応陽性であった。該患者は、参照として本明細書に組み込まれる、米国特許出願シリアル番号第11/389,358号、第11/391,584号、第11/478,021号、および第11/633,729号に開示される方法を使用するDNL技術によって調製された、抗gpl20 P4/D10 IgGl x Fab−679を含む二重特異性抗による治療を受けた。注入後、遊離二重特異性抗体を循環から除去するために、24時間の培養を行い、続いて標的としているペプチドIMP−411に合成されたSN38を注入した。該患者のCD4数は、325/mm3超過まで改善し、該患者は、もはやHIVに対して血清反応陽性ではなくなった。1年後、該患者は、無症状のままであり、検出可能なHIV感染は存在しない。
【実施例6】
【0154】
抗HIV抗体のヒト化
HIVエンベロープタンパク質に対するマウスモノクローナル抗体のVLおよびVH部位を符号化するcDNAは、分離され、組み換えによって、それぞれ別個に、カッパおよびIgG1定常部位をそれぞれ符号化する遺伝子を含む、ヒト抗体の哺乳類発現ベクターにサブクローニングされる。これら2つの組み換えDNAを有する哺乳類細胞の同時トランスフェクションは、親マウスMabと同一の結合および治療特性を有するヒト化Mabの発現を生じる。
【0155】
VKおよびVH DNAのCDRは、組み換えによって、ヒトVKおよびVH部位の骨格(FR)配列にそれぞれ連結され、それらは結果として、哺乳類細胞を発現するために、ヒトカッパおよびIgG1定常部位にそれぞれ連結される。一般に、本明細書で記載されるように、「キメラ」MabはマウスVKおよびVH部位を、それぞれヒト定常軽鎖および重鎖に結合するか、またはサブクローニングすることによって形成され、一方、「ヒト化」Mabは、キメラMab内のマウス骨格(FR)配列を、対応するヒトFR配列で置換することによって、さらに誘導体化される。以下に記載されるように、ヒト化Mabは、ヒトFRアミノ酸、特にCDRアミノ酸残基に接触している、または近いFR残基の1つ以上を、対応するマウスFRアミノ酸で置換することによって、さらに最適化されてもよい。
【0156】
様々な実施形態では、コンピュータモデリングによって、抗体可変領域をモデル化することができる(例えば、本明細書に参照として組み込まれる、Dion,「Humanization of Monoclonal Antibodies:Molecular Approaches and Applications」in Goldenberg et al.eds.,Cancer Therapy With Radiolabeled Antibodies,Ch.19,CRC Press,Boca Raton,FIa.,1994を参照)。一般に、Mabの3D構造は、相同性、好ましくは以下の、置換されるマウスFR配列と高い(75%を上回る、好ましくは85%を上回る、より好ましくは90%を上回る、より好ましくは95%を上回る)相同性を示すヒトFR配列の指標によって、最良の形でモデル化される。CαとCβとの間のねじれ角を維持するために、可能な限り、側基の置換を行うべきである。エネルギー最小化は、収束法を使用する、AMBER力場(Weiner et al,J.Amer.Chem.Soc.106:765,1984)によって達成されてもよい。軽および重可変鎖を最初にモデル化することによって、決定的に重要となる可能性のあるFR−CDR相互作用を判断することができる。従って、それぞれのCDR内の半径が4.5オングストローム内のすべての原子内のすべてのマウスFR残基を特定し、ヒト化抗体の最終設計モデル内に保持することができる。
【0157】
一度VKおよびVH領域の配列が設計されると、CDR移植は、長い合成DNAオリゴヌクレオチドをテンプレートとして使用し、短いオリゴヌクレオチドをPCR反応におけるプライマーとして使用する遺伝子合成によって、達成され得る。多くの場合、VKまたはVH領域を符号化するDNAは、おそよ350bp長となる。コドン縮重の利点を利用することによって、符号化されたアミノ酸を変更することなく、V遺伝子DNA配列の中央の近くの部位に、固有の制限部位を容易に導入できる可能性がある。制限部位の上流および下流が約150bpである、2つの長い非重複単鎖DNAオリゴヌクレオチドを、自動DNAオリゴヌクレオチド合成装置(Cyclone Plus DNA Synthesizer,Milligen−Biosearch)で生成することができる。全長DNAオリゴヌクレオチドの産出率が低いと予想される場合、PCR反応における2組のフランキングプライマーによって、それらを増幅することができる。
【0158】
プライマーは、配列サブクローニングを促進するために必要な制限部位で設計することができる。オリゴAおよびオリゴBのプライマーは、オリゴAおよびBの結果として生じるPCR生成物が、それぞれ、制限部位で枠内に結合され、VH領域を符号化する、全長DNA配列(約350bp)を形成できるように、制限部位に重複配列を含むべきである。
【0159】
オリゴAおよびBに対するPCR生成物の連結反応、およびそれらの適切な足場(staging)ベクターの制限部位へのサブクローニングは、単一3断片連結反応ステップで完了され得る。正しい配列の足場(staging)ベクターへのサブクローニングは、最初に、制限消化分析によって分析され、続いてSanger et al,Proc.Natl.Acad.Sci.USA 74:5463(1977)による、配列反応配列反応によって確認され得る。
【0160】
Igプロモーター、リーダー配列、およびVH配列を含む制限断片を、足場(staging)ベクターから切除し、ヒトIgG定常部位のゲノム配列、Igエンハンサー、gpt選択マーカーを含み、最終発現ベクターを形成する、pSVgpt系ベクター内の対応する部位にサブクローニングすることができる。VK配列の構成に、同様な方法を採用することができる。
【0161】
Igプロモーター、リーダー配列、および抗HIV VK配列を含むDNA配列を、適切なエンドヌクレアーゼで処理することによって、足場(staging)ベクターから切除することができ、pSVhyg系ベクター、ヒトカッパ鎖定常部位のゲノム配列を含むpKh、ハイグロマイシン選択マーカー、Ig、およびカッパエンハンサーの対応する部位にサブクローニングし、最終発現ベクターを形成することができる。
【0162】
ヒト化は、結果として抗体親和力が減少またはさらには損失する場合があることから、元の親和力を回復するために、さらなる修正が必要となる場合がある(例えば、参照として組み込まれる、Tempest et al,Bio/Technology 9:266(1991);Verhoeyen et al,Science 239:1534(1988)を参照)。一般に、キメラ抗HIVのMabを調製するために、DNA生成物およびプライマーを使用する、PCRクローニングによって、抗HIVのMabのVHおよびVK鎖を得ることができる。Orlandi et al.(Proc.Natl.Acad.Sci.,USA,1989,86:3833)、およびLeung et al.(BioTechniques,1993,15:286)。上記に記載されるように、VK PCRプライマーを、pBR327系足場(staging)ベクター(VKpBR)にサブクローニングしてもよい。VH PCR生成物を、類似するpブルースクリプト系足場(staging)ベクター(VHpBS)にサブクローニングしてもよい。プロモーターおよびシグナルペプチド配列に加え、VKおよびVH配列を含む断片を、適切な制限エンドヌクレアーゼを使用して、足場(staging)ベクターから切除することができる。従来通り、VK断片(約600bp)を、哺乳類発現ベクター(例えば、pKh)にサブクローニングすることができる。PKhは、ヒトカッパ定常部位のゲノム配列、Igエンハンサー、カッパエンハンサー、およびハイグロマイシン耐性遺伝子を含む、pSVhyg系発現ベクターである。同様に、約800bpのVH断片を、ヒトIgGl定常部位のゲノム配列、Igエンハンサー、およびキサンチングアニンホスホリボシルトランスフェラーゼ(gpt)遺伝子を運ぶ、pSVgpt系発現ベクターであるpGlgにサブクローニングすることができる。2つのプラスミドは、エレクトロポレーションによって、Sp2/O−−Agl4細胞等の哺乳類発現細胞にトランスフェクションされ、ハイグロマイシン耐性のために選択されてもよい。選択後に生存するコロニーを拡大し、ELISA法によって、上清のキメラ抗HIV Mabの生成を監視する。トランスフェクション効率が約1〜10×106の細胞が望ましい。本システムでは、抗体発現レベル0.10〜2.5μg/mlを期待できる。
【0163】
RNA分離、cDNA合成、および増幅を、以下のように行うことができる。約107個の細胞を使用し、参照として組み込まれる、Sambrook et al.(Molecular Cloning:A Laboratory Manual,Second ed.,Cold Spring Harbor Press,1989)に従い、抗HIVハイブリドーマ細胞株からトータル細胞RNAを調製することができる。Superscript preamplification system(Gibco/BRL.,Gaithersburg,MD)を使用する等によって、従来通り、トータルRNAから第1の鎖cDNAを逆転写することができる。簡潔に、反応量20μlにおいて、10X合成緩衝液[200mMのTris−HCl(pH8.4)、500mMのKCl、25mMのMgCl2、1mg/mlのBSA]が2μl、10mMのdNTPミックスが1μl、0.1MのDTTが2μl、および200ユニットのSuperScrip逆転写酵素が存在する下で、50ngのランダムプライマーを5μgのRNAにアニールすることができる。伸長ステップは、最初に、室温で10分間進行され、続いて42℃で50分間の培養が行われる。反応混合物を90℃で5分間加熱することによって、反応を終了させることができる。
【0164】
キメラまたはヒト抗HIV MabのVKおよびVH配列は、参照として組み込まれる、Orlandi et al,(Proc.Natl.Acad.Sci.,USA,86:3833(1989))に記載されるように、PCRによって増幅することができる。VK配列は、プライマーCK3BHおよびVK5−3(参照として組み込まれる、Leung et al.,BioTechniques,15:286(1993))を使用して増幅されてもよく、一方、VH配列は、マウスIgGのCHl部位、およびVHIBACK(Orlandi et al.,1989)をアニールするプライマーCHlBを使用して、増幅することができる。第1の鎖cDNA生成物を10μl、10XのPCR緩衝液[500mMのKCl、100mMのTris−HCl(pH8.3)、15mMのMgC12、および0.01%(w/v)のゼラチン](Perkin Elmer Cetus,Norwalk,Conn.)を9μl、含むPCR反応混合物に、30サイクルのPCRを行うことができる。それぞれのPCRサイクルは、好ましくは、94℃で1分間の変性、50℃で1.5分間のアニーリング、および72°Cで1.5分間の重合からなる。増幅されたVKおよびVH断片を、2%のアガローズ(BioRad,Richmond,Calif)で精製することができる。
VKのためのPCR生成物を、Igプロモーター、シグナルペプチド配列、およびVK PCR生成物の枠内連結反応を促進するために適宜な制限部位を含む、pBR327系足場(staging)ベクターVKpBR等の足場(staging)ベクターにサブクローニングすることができる。VHに対するPCR生成物を、ブルースクリプト系VHpBS等の類似の足場(staging)ベクターにサブクローニングすることができる。個別のPCR生成物を含む個々のクローンは、例えば、参照として組み込まれる、Sanger et al.,Proc.Natl.Acad.Sci.,USA,74:5463(1977)の方法によって、配列されてもよい。
【0165】
適切な細胞、例えば、骨髄腫Sp2/O−−Agl4、ハイグロマイシン耐性のために選択されるコロニー、および、例えば、ELISAアッセイによってキメラまたはヒト化抗HIV抗体の生成が監視される上清に、2つのプラスミドを同時トランスフェクションすることができる。
【0166】
抗体分泌クローンのトランスフェクションおよびアッセイは、以下のように実行することができる。参照として組み込まれる、Co et al.,J.Immunol,148:1149(1992)による、エレクトロポレーション(BioRad,Richmond,Calif.)による、5×106SP2/O骨髄腫細胞のトランスフェクションに、約10μgの軽鎖発現ベクターおよび20μgの重鎖発現ベクターを使用することができる。トランスフェクションに続き、完全HSFM培地(GIBCO,Gaithersburg,Md.)内の96ウェルマイクロタイタープレート内で、37°C、5%のCO2で、細胞を成長させてもよい。選択プロセスは、ハイグロマイシンの最終濃度500μg/mlでハイグロマイシン選択培地(Calbiochem,San Diego,Calif.)を添加することによって、2日後に開始することができる。典型的にコロニーは、エレクトロポレーション後、2〜3週間で出現する。次いで、さらなる分析のために、培養物を拡大することができる。
【0167】
キメラまたはヒト化重鎖の分泌に陽性のトランスフェクトーマクローンは、ELISAアッセイによって特定することができる。簡潔に、トランスフェクトーマ培養からの上清試料(100μl)を、ヤギ抗ヒト(GAH)−IgG,F(ab’)2断片特異抗体(Jackson ImmunoResearch,West Grove,Pa.)でプレコートされたELISAマイクロタイタープレートに3回に分けて添加する。プレートを、室温で1時間培養する。洗浄緩衝液(0.05%のポリソルベート20を含むPBS)で3回洗浄することによって、非結合タンパク質を除去する。ホースラディッシュペルオキシダーゼ(HRP)共役GAH−IgG、Fc断片特異抗体(Jackson ImmunoResearch,West Grove,PA)を、ウェル(104倍に希釈し、最終濃度1.0μg/mlまで非共役抗体を追加した、100μlの抗体ストック)に添加する。1時間の培養に続き、典型的には3回、プレートを洗浄する。反応溶液[100μl、PBS中、167μgのオルトフェニレンジアミン(OPD)(Sigma,St.Louis,MO)、0.025%の過酸化水素を含む]を、ウェルに添加する。暗所に30分間置くことによって、色が発現する。50μlの4NHCl溶液をそれぞれのウェルに添加することによって、反応を停止し、自動ELISAリーダー(Bio−Tek instruments,Winooski,Vt.)で490nmでの吸光度を測定する。次いで結合キメラ抗体は、不適切なキメラ抗体標準(Scotgen,Ltd.,Edinburg,Scotlandから入手可能)と関連して判断される。
【0168】
抗体は、以下のように、細胞培養培地から分離される。トランスフェクトーマ培養液を無血清培地に適合させる。キメラ抗体を生成するために、HSFMを使用し、500mlの培養液として、ローラーボトル内で細胞を成長させる。培養液を遠心分離し、0.2ミクロンの薄膜を通して、上清を濾過する。流速1ml/minでタンパク質Aカラム(1×3cm)に濾過した培地を通す。次いで約10カラム容量のPBSで樹脂を洗浄し、10mMのEDTAを含む0.1Mのグリシン緩衝液(pH3.5)で、カラムからタンパク質A結合抗体を溶出する。1.0mlのフラクションが、3MのTris(pH8.6)を10μl含むチューブに回収され、タンパク質濃度が280/260nmでの吸光度から測定される。ピークフラクションをプールし、PBSを透析し、例えば、Centricon30(Amicon,Beverly,MA)で抗体を凝縮する。抗体濃度は、ELISAで測定し、従来のように、PBSを使用して、その濃度を約1mg/mlに調整する。防腐剤として、0.01%(w/v)のアジ化ナトリウムを適宜試料に添加する。
【0169】
このように単離されたマウス、キメラ、およびヒト化抗体の比較結合親和力は、直接ラジオイムノアッセイによって、測定することができる。キメラおよびヒト化抗HIV抗体は、マウスMabと同一の結合特異性および親和力を有すると判断される。
【0170】
本明細書で開示され、主張されるすべての組成物および方法は、本開示を考慮し、過度の実験を行うことなく作製および実施することができる。組成物および方法は、好ましい実施形態の点から説明されているが、本発明の概念、精神、および範囲を逸脱することなく、本明細書に記載される組成物および方法、ならびに方法のステップまたはステップの順序に変形が適用されてもよいことが、当業者には明らかである。より具体的には、同一または類似の結果が達成される間、化学的および生理的に関連する特定の薬剤が、本明細書に記載される薬剤と置き換えられてもよい。当業者に明らかなすべてのそのような置換えおよび修正は、添付の請求の範囲で定義される、本発明の精神、範囲、および概念内であると見なされる。
【図面の簡単な説明】
【0171】
【図1A】HIV−1IIIB HIV感染の生体内中和。HIV―1IIIBを有する異なる濃度の免疫グロブリンを培養し、HIVに感染しやすいジャーカットT細胞のウイルス感染を分析することで、免疫グロブリンの中和能力を試験した。10μg/mlのドキソルビシンとP4/D10および非ラベルのP4/D10の双方により、HIV陰性血清(p=0.001)よりも大幅に良好に、HIV―1IIIBを中和した。
【図1B】HIV−1IIIB 生体外におけるHIV感染の細胞間伝播の阻害。免疫グロブリンがHIV―1感染ジャーカットT細胞の細胞間の拡散を制限することができるかどうかを試験するため、0.2%、1%、3%、および5%感染の、および99.8%、99%、97%、および95%非感染の細胞の割合で混合した。異なる濃度の免疫グロブリンによる、HIV―1IIIB感染した3%のジャーカットT細胞および97%の未感染細胞の処理後のHIV―1 p24の産生を示す。結果を、培養7日後のp24産生の阻害%にて示す。ドキソルビシン―P4/D10では、未ラベルのP4/D10、対照抗体ドキソルビシン―LLl、遊離型ドキソルビシンおよび濃度0.5または0.05μg/ml(p=0.002)のHIV陰性血清と比較して、HIV―1p24の生成における阻害効果が大幅に上昇した。
【図2】生体内におけるHIV―1/MuLV感染に対する保護。マウス(6―12/群)について、HIV―1/MuLV感染した脾細胞によって腹腔内にて調査され、モノクローナル抗体(Mab)または遊離型ドキソルビシンによって直ちに処置された。非共役P4/D10Mabが、マウス当たり100―800μg遊離型ドキソルビシン100―400μgおよび非関連ドキソルビシン―hRS7100―200μgで滴定された。その他全ての治療が、マウス当たり100μgで与えられた。調査から10日後、腹膜細胞を回収し、HIVに感染しやすいジャーカットT細胞と共に混合された。これらの細胞培養におけるHIVp24の産生が、18日間で3、4日ごとに計測された。100μgのMabまたは遊離型ドキソルビシンによる処置後のp24陽性細胞培養によるマウスのパーセントを示す。100μgのドキソルビシン―P4/D10で処理したマウスからの細胞のみが、その他の全ての群とは大幅に異なり(p=0.0001)、感染性HIVを含んでいなかった。
【特許請求の範囲】
【請求項1】
HIV表面エンベロープの抗原に対して、治療薬に合成された抗体またはその断片を対象に投与するステップを含む、前記対象のHIV感染を治療する方法であって、前記合成された抗体または断片への曝露は、HIV感染を減少、根絶、または予防するために、または生体内においてHIVが未感染の細胞へ細胞間感染するのを予防するために有効である、方法。
【請求項2】
前記治療薬は、細胞毒性薬、ウイルス静止剤、毒素、放射性同位体、オリゴヌクレオチド、免疫賦活剤、サイトカイン、ケモカイン、低分子干渉RNA(siRNA)または酵素である、請求項1に記載の方法。
【請求項3】
前記治療薬はドキソルビシンである、請求項1に記載の方法。
【請求項4】
前記合成抗体または断片はドキソルビシン―P4/D10である、請求項3に記載の方法。
【請求項5】
前記抗体または断片はP4/D10である、請求項1に記載の方法。
【請求項6】
前記対象はヒト対象である、請求項1に記載の方法。
【請求項7】
前記抗体または断片は、キメラの、ヒト化した、またはヒト抗体あるいは断片である、請求項6に記載の方法。
【請求項8】
前記合成抗体または断片は、認識されているまたは潜在的なHIV感染の後で前記対象に投与される、請求項7に記載の方法。
【請求項9】
認識されているまたは潜在的な感染から、前記対象への合成抗体または断片の投与の間の期間は、1時間未満、1時間から5時間、12時間未満、1日未満、2日未満、1週間未満または1ヶ月未満である、請求項8に記載の方法。
【請求項10】
前記合成抗体または断片の投与は、前記対象におけるHIV感染をブロックするために有効である、請求項8に記載の方法。
【請求項11】
前記合成抗体または断片は、前記対象が抗レトロウィルス療法(ART)によって治療された後で前記対象に投与される、請求項6に記載の方法。
【請求項12】
前記治療薬は、アピリジン、アザリビン、アナストロゾール、アザシチジン、ブレオマイシン、ボルテゾミブ、ブリオスタチン−1、ブスルファン、カリケアマイシン、カンプトセシン、10ヒドロキシカプリン酸、カルムスチン、セレブレックス、クロラムブシル、シスプラチン、イリノテカン(CPT―11)、SN―38、カルボプラチン、クラドリビン、シクロホスファミド、シタラビン、ダカルバジン、ドセタキセル、ダクチノマイシン、ダウノマイシングルクノニド、ダウノルビシン、ドキソルビシン、2―ピロリノドキソルビシン(pyrrolinodoxorubicine)(2P−DOX)、シアノ―モルホリノドキソルビシン、ドキソルビシングルクロニド、エピルビシングルクロニド、エストラムスチン、エトポシド、エトポシドグルクノニド、リン酸エトポシド、フロクスウリジン(FUdR)、3’,5’―O―ジオレオイル−FudR(FUdR−dO)、フルダラビン、フルタミド、フルオロウラシル、ゲムシタビン、ヒドロキシウレア、イダルビシン、イホスファミド、L−アスパラギナーゼ、ロイコボリン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、6−メルカプトプリン、メトトレキサート、ミトキサントロン、ミトラマイシン、マイトマイシン、ミトタン、フェニル酪酸塩、プロカルバジン、パクリタキセル、ペントスタチン、PSI―341、セムスチン、ストレプトゾシン、タモキシフェン、タキサン、タクソール、サリドマイド、チオグアニン、チオテパ、テニポシド、トポテカン、ウラシルマスタード、ベルケイド、ビンブラスチン、酒石酸ビノレルビン、ビンクリスチン、リシン、アブリン、リボヌクレアーゼ、オンコナーゼ、rapLRl、DNase I、ブドウ球菌性エンテロトキシン−A、ヤマゴボウ抗ウイルス性タンパク質、ゲロニン、ジフテリアトキシン、シュードモナスエクソトキシン、シュードモナスエンドトキシン、アンチセンスオリゴヌクレオチド、干渉RNA、siRNA、アグリゾーム阻害物質またはその組み合わせである、請求項2に記載の方法。
【請求項13】
前記放射性同位体は、225Ac、211At、212Bi、213Bi、14C、51Cr、36Cl、45Ti、57Co、58Co、62Cu、64Cu、67Cu、166Dy、152Eu、18F、67Ga、68Ga、195mHg、166Ho、3H、111In、123I、124I、125I、1311、52Fe、59Fe 177Lu、191Os、212Pb、32P、33P、142Pr、195mPt、223Ra、186Re、188Re、189Re、47Sc、75Se111Ag、153Sm、89Sr、35S、161Tb、94mTc、99mTc、86Y、90Yおよび89Zrから成る群から選択される、請求項2に記載の方法。
【請求項14】
前記抗体または断片は、二重特異性抗体、二重特異性抗体断片、scFv、Fab、Fab’、F(ab)2、F(ab’)2、Fv、sFv、scFv、scFv−Fc統合、一本鎖抗体、二重抗体、三重抗体または四重抗体である、請求項1に記載の方法。
【請求項15】
前記ARTはHAART(高活性抗レトロウィルス療法)である、請求項1に記載の方法。
【請求項16】
前記抗レトロウィルス療法は、エファビレンツ、ジドブジン、テノホビル、ラミブジン、エムトリシタビン、ディダノシン、アバカビル、スタブジン、ネビラピン、ロピナビル、リトナビル、アタザナビル、ホスアンプレナビル、インディナビル、ネルフィナビル、サクイナビル、またはその組み合わせによる治療を含む、請求項11に記載の方法。
【請求項17】
前記抗体または断片は、中和抗体または断片である、請求項1に記載の方法。
【請求項18】
前記免疫賦活剤は、サイトカイン、幹細胞成長因子、リンホトキシン、造血因子、インターロイキン、コロニー刺激因子、インターフェロン、インターフェロン−α、インターフェロン−β、インターフェロン―γ、「Sl因子」IL−2、IL−6、IL−10、IL−12、IL−18、IL−21およびTNF−αと呼ばれる幹細胞成長因子から成る群から選択される、請求項2に記載の方法。
【請求項19】
前記サイトカインは、リンフォカイン、モノカイン、成長因子、ヒト成長ホルモン、N−メチオニルヒト成長ホルモン、ウシ成長ホルモン、副甲状腺ホルモン、サイロキシン、インシュリン、プロインシュリン、レラキシン、プロレラキシン、卵胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、黄体形成ホルモン(LH)、肝成長因子、プロスタグランジン、繊維芽細胞成長因子、プロラクチン、胎盤性ラクトゲン、OBタンパク質、腫瘍壊死因子―ex、腫瘍壊死因子―β、ミューラー阻害物質、マウスゴナドトロピン関連ペプチド、インヒビン、アクティビン、血管内皮性成長因子、インテグリン、トロンボポイエチン(TPO)、NGF−β、血小板成長因子、変換成長因子(TGF)、TGF−α、TGF−β、インシュリン様成長因子―Iおよび−II、エリスロポエチン(EPO)、骨誘導因子、インターフェロン―α、インターフェロン―β、インターフェロン―γ、コロニー刺激因子、マクロファージ―CSF(M−CSF)、顆粒球―マクロファージ―CSF(GM−CSF)、顆粒球―CSF(G−CSF)、IL−I、IL−lα、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、IL−13、IL−14、IL−15、IL−16、IL−17、IL−18、IL−21、LIF、キット―配位子、FLT―3、アンギオスタチン、トロンボスポンジン、エンドスタチン、腫瘍壊死因子およびLTで成る群から選択される、請求項18に記載の方法。
【請求項20】
前記ケモカインは、RANTES、MCAF、MlPl―アルファ、MIPl―ベータおよびIP―10で成る群から選択される、請求項2に記載の方法。
【請求項21】
前記投与は、経口、経鼻、口腔、吸入、直腸、経膣、局所、同所、皮内、皮下、筋肉内、腹腔内、動脈内、髄腔内、または静脈内である、請求項1に記載の方法。
【請求項22】
前記放射性同位体は、アルファエミッタまたはオーガー電子エミッタである、請求項2に記載の方法。
【請求項23】
前記アルファエミッタは、212Pb、212Bi、213Bi、211At、223Raまたは225Ac、あるいは、前記オーガー電子エミッタは111In、125I、67Ga、191Os、193mPt、195mPtまたは195mHgである、請求項22に記載の方法。
【請求項24】
対象におけるHIV感染を画像化、検知、または診断するための方法であって、
a)前記対象に対して、HIV表面エンベロープ抗原に対する画像化剤に合成された抗体または抗体断片を投与するステップと、
b)HIV感染した細胞に結合された、合成抗体または断片の存在を検知するステップであって、前記合成抗体または断片の前記HIV感染した細胞への結合が、前記対象におけるHIV感染の存在の画像化、診断、または検知に有効である、ステップとを含む、方法。
【請求項25】
前記画像化剤は、放射性同位体、酵素、感光ラベル、造影剤、超音波ラベル、または常磁性ラベルである、請求項24に記載の方法。
【請求項26】
前記画像化剤は、クロム(III)、マンガン(II)、鉄(III)、鉄(II)、コバルト(II)、ニッケル(II)、銅(II)、ネオジム(III)、サマリウム(III)、イッテルビウム(III)、ガドリニウム(III)、バナジウム(II)、テルビウム(III)、ジスプロシウム(III)、ホルミウム(III)、エルビウム(III)、ランタン(III)、金(III)、鉛(II)およびビスマス(III)から成る群から選択される、請求項25に記載の方法。
【請求項27】
前記画像化剤は、18F、52Fe、62Cu、64Cu、67Cu、67Ga、68Ga、86Y、89Zr94mTc、94Tc、99mTc、45Ti、111In、123I、124I、125I、131I、154−158Gd、177Lu、32Pまたは188Reである、請求項25に記載の方法。
【請求項28】
前記画像化剤は、Alexa350、Alexa430、AMCA、アミノアクリジン、BODIPY630/650、BODIPY650/665、BODIPY―FL、BODIPY―R6G、BODIPY―TMR、BODIPY―TRX、5―カルボキシ―4’,5’―ジクロロ―2’,7’−ジメトキシフルオレセイン、5―カルボキシ―2’,4’,5’,7’―テトラクロルエチレン、5―カルボキシフルオレセイン、5―カルボキシローダミン、6―カルボキシローダミン、6―カルボキシテトラメチルアミノ、Cascade Blue、Cy2、Cy3、Cy5、6―FAM、塩化ダンシル、フルオレセイン、HEX、6−JOE、NBD(7―ニトロベンズ―2―オクサ―l,3―ジアゾール)、Oregon Green488、Oregon Green500、Oregon Green514、Pacific Blue、フタル酸、テレフタル酸塩、イソフタル酸、クレシルファストバイオレット、クレシルブルーバイオレット、ブリリアントクレシルブルー、パラアミノ安息香酸、エリトロシン、フタロシアニン、アゾメチン、シアニン、キサンチン、スクニシルフルオレセイン、希土類金属クリプタート、ユーロピウムトリスビピリジンジアミン、ユーロピウムクリプタートまたはキレート、ジアミン、ジシアン、La Jolla青色色素、アロフィコシアニン、アロフィコシアニンB、フィコシアニンC、フィコシアニンR、チアミン、フィコエリトロシアニン(phycoerythrocyanin)、フィコエリトリンR、REG、Rhodamine Green、ローダミンイソチオシアネート、Rhodamine Red、ROX、TAMRA、TET、TRIT(テトラメチルローダミンイソチオール)、テトラメチルローダミン、またはTexas Redである、請求項25に記載の方法。
【請求項29】
対象におけるHIV感染を治療するための方法であって、
a)前記対象に対して、二重特異抗体またはその抗体断片を投与するステップであって、前記二重特異抗体は、HIV表面エンベロープの抗原に特異な1つ以上の結合部位と担体の1つ以上の結合部位とを含む、ステップと、
b)任意に、前記対象にクリア剤を投与するステップと、
c)前記対象に対して、治療薬に合成された担体を投与するステップであって、前記担体の前記投与は HIV感染を減少、根絶、または予防するために、または前記対象内においてHIVが未感染の細胞へ細胞間感染するのを予防するために有効である、ステップとを含む、方法。
【請求項30】
前記治療薬は、細胞毒性薬、ウイルス静止剤、毒素、放射性同位体、オリゴヌクレオチド、低分子干渉RNA(siRNA)または酵素である、請求項29に記載の方法。
【請求項31】
前記治療薬はドキソルビシンである、請求項30に記載の方法。
【請求項32】
前記対象はヒト対象である、請求項29に記載の方法。
【請求項33】
前記抗体または断片は、キメラの、ヒト化した、またはヒト抗体または断片である、請求項32に記載の方法。
【請求項34】
前記抗体または断片、オプションのクリア剤および担体は、前記対象が抗レトロウィルス療法によって治療された後で、前記対象に投与される、請求項33に記載の方法。
【請求項35】
前記治療薬は、アピリジン、アザリビン、アナストロゾール、アザシチジン、ブレオマイシン、ボルテゾミブ、ブリオスタチン−1、ブスルファン、カリケアマイシン、カンプトセシン、10ヒドロキシカプリン酸、カルムスチン、セレブレックス、クロラムブシル、シスプラチン、イリノテカン(CPT―11)、SN―38、カルボプラチン、クラドリビン、シクロホスファミド、シタラビン、ダカルバジン、ドセタキセル、ダクチノマイシン、ダウノマイシングルクノニド、ダウノルビシン、ドキソルビシン、2―ピロリノドキソルビシン(pyrrolinodoxorubicine)(2P−DOX)、シアノ―モルホリノドキソルビシン、ドキソルビシングルクロニド、エピルビシングルクロニド、エストラムスチン、エトポシド、エトポシドグルクノニド、リン酸エトポシド、フロクスウリジン(FUdR)、3’,5’―O―ジオレオイル−FudR(FUdR−dO)、フルダラビン、フルタミド、フルオロウラシル、ゲムシタビン、ヒドロキシウレア、イダルビシン、イホスファミド、L―アスパラギナーゼ、ロイコボリン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、6―メルカプトプリン、メトトレキサート、ミトキサントロン、ミトラマイシン、マイトマイシン、ミトタン、フェニル酪酸塩、プロカルバジン、パクリタキセル、ペントスタチン、PSI−341、セムスチン、ストレプトゾシン、タモキシフェン、タキサン、タクソール、サリドマイド、チオグアニン、チオテパ、テニポシド、トポテカン、ウラシルマスタード、ベルケイド、ビンブラスチン、酒石酸ビノレルビン、ビンクリスチン、リシン、アブリン、リボヌクレアーゼ、オンコナーゼ、rapLRl、DNase I、ブドウ球菌性エンテロトキシン−A、ヤマゴボウ抗ウイルス性タンパク質、ゲロニン、ジフテリアトキシン、シュードモナスエクソトキシン、シュードモナスエンドトキシン、アンチセンスオリゴヌクレオチド、干渉RNA、siRNA、アグリゾーム阻害物質またはその組み合わせである、請求項29に記載の方法。
【請求項36】
前記放射性同位体は、225Ac、211At、212Bi、213Bi、14C、51Cr、36Cl、45Ti、57Co、58Co、62Cu、64Cu、67Cu、166Dy、152Eu、18F、67Ga、68Ga、195mHg、166Ho、3H、111In、123I、124I、125I、1311、52Fe、59Fe 177Lu、191Os、212Pb、32P、33P、142Pr、195mPt、223Ra、186Re、188Re、189Re、47Sc、75Se111Ag、153Sm、89Sr、35S、161Tb、94mTc、99mTc、86Y、90Yおよび89Zrから成る群から選択される、請求項30に記載の方法。
【請求項37】
前記二重特異性抗体または二重特異性抗体断片は、少なくとも1つのscFv、Fab、Fab’、F(ab)2、F(ab’)2、Fv、sFv、scFv―Fc統合、一本鎖抗体、二重抗体、三重抗体または四重抗体を含む、請求項29に記載の方法。
【請求項38】
前記二重特異性抗体または断片は、少なくとも1つのP4/D10抗体または断片を含む、請求項29に記載の方法。
【請求項39】
前記担体は1つ以上のHSG(ヒスタミン―スクシニル―グリシン)部分を含み、前記二重特異性抗体または断片はHSGに結合される、請求項29に記載の方法。
【請求項40】
前記二重特異性抗体または断片は、HSGに結合される1つ以上の679抗体または抗体断片を含む、請求項29に記載の方法。
【請求項41】
前記担体は、DOTA−D−Cys(3−SP−Gly−20−O−SN38)−D−Ala−D−Lys(HSG)−D−Tyr−D−Lys(HSG)−NH2(IMP−411)である、請求項40に記載の方法。
【請求項42】
前記二重特異性抗体または断片は、ドックアンドロック(DNL)構造を含む、請求項29に記載の方法。
【請求項43】
治療薬に合成された抗HIV抗体またはその断片を含む組成物であって、前記合成された抗体またはその断片は、HIV感染を減少、根絶、または予防するために、または対象に投与された場合に、HIVが未感染の細胞へ細胞間感染するのを予防するために有効である、組成物。
【請求項44】
前記対象はヒト対象である、請求項43に記載の組成物。
【請求項45】
前記合成抗体または断片は、キメラの、ヒト化した、またはヒト抗体あるいは断片である、請求項43に記載の組成物。
【請求項46】
前記抗体または断片はP4/D10である、請求項43に記載の組成物。
【請求項47】
前記合成抗体または抗体の断片はドキソルビシンP4/D10である、請求項46に記載の組成物。
【請求項48】
前記抗体または断片は、アピリジン、アザリビン、アナストロゾール、アザシチジン、ブレオマイシン、ボルテゾミブ、ブリオスタチン―1、ブスルファン、カリケアマイシン、カンプトセシン、10ヒドロキシカプリン酸、カルムスチン、セレブレックス、クロラムブシル、シスプラチン、イリノテカン(CPT―11)、SN―38、カルボプラチン、クラドリビン、シクロホスファミド、シタラビン、ダカルバジン、ドセタキセル、ダクチノマイシン、ダウノマイシングルクノニド、ダウノルビシン、ドキソルビシン、2―ピロリノドキソルビシン(pyrrolinodoxorubicine)(2P−DOX)、シアノ―モルホリノドキソルビシン、ドキソルビシングルクロニド、エピルビシングルクロニド、エストラムスチン、エトポシド、エトポシドグルクノニド、リン酸エトポシド、フロクスウリジン(FUdR)、3’,5’―O―ジオレオイル−FudR(FUdR−dO)、フルダラビン、フルタミド、フルオロウラシル、ゲムシタビン、ヒドロキシウレア、イダルビシン、イホスファミド、L―アスパラギナーゼ、ロイコボリン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、6―メルカプトプリン、メトトレキサート、ミトキサントロン、ミトラマイシン、マイトマイシン、ミトタン、フェニル酪酸塩、プロカルバジン、パクリタキセル、ペントスタチン、PSI−341、セムスチン、ストレプトゾシン、タモキシフェン、タキサン、タクソール、サリドマイド、チオグアニン、チオテパ、テニポシド、トポテカン、ウラシルマスタード、ベルケイド、ビンブラスチン、酒石酸ビノレルビン、ビンクリスチン、リシン、アブリン、リボヌクレアーゼ、オンコナーゼ、rapLRl、DNase I、ブドウ球菌性エンテロトキシン−A、ヤマゴボウ抗ウイルス性タンパク質、ゲロニン、ジフテリアトキシン、シュードモナスエクソトキシン、シュードモナスエンドトキシン、アンチセンスオリゴヌクレオチド、干渉RNA、siRNA、アグリゾーム阻害物質またはその組み合わせに合成されている、請求項43に記載の組成物。
【請求項49】
前記抗体または断片は、212Pb、212Bi、213Bi、211At、223Ra、225Ac、32P、33P、47Sc、67Cu、67Ga、89Sr、90Y、111Ag、125I、131I、142Pr、153Sm、161Tb、166Ho、166Dy、177Lu、186Re、188Re、189Re、111In、125I、67Ga、191Os、193mPt、195mPtまたは195mHgに合成されている、請求項43に記載の組成物。
【請求項50】
前記抗体または断片は、二重特異性抗体、二重特異性抗体断片、scFv、Fab、Fab’、F(ab)2、F(ab’)2、Fv、sFv、scFv、scFv−Fc統合、一本鎖抗体、二重抗体、三重抗体または四重抗体である、請求項43に記載の組成物。
【請求項51】
前記抗体または断片は、中和抗体である、請求項43に記載の組成物。
【請求項52】
各抗体または断片はHIV表面エンベロープ抗原に結合されている、前記対象に対して2つまたは3つの前記抗体または断片を投与するステップをさらに含む、請求項1に記載の方法。
【請求項53】
前記2つまたは3つの抗体または断片は、同じ前記HIV表面エンベロープ抗原に結合されている、請求項52に記載の方法。
【請求項54】
前記2つまたは3つの抗体または断片は、異なるHIV表面エンベロープ抗原に結合されている、請求項52に記載の方法。
【請求項55】
前記2つまたは3つの抗体または断片は、HIVのアクセス可能なエピトープの不可変、および可変部分に結合されている、請求項52に記載の方法。
【請求項56】
前記抗体または抗体の断片は、4E10、2F5、3D6、C37、1ACY、1F58、1GGGC、2G12およびX5で成る群から選択される、請求項1に記載の方法。
【請求項57】
前記抗体または断片は、キメラの、ヒト化した、またはヒト抗体または断片である、請求項56に記載の方法。
【請求項1】
HIV表面エンベロープの抗原に対して、治療薬に合成された抗体またはその断片を対象に投与するステップを含む、前記対象のHIV感染を治療する方法であって、前記合成された抗体または断片への曝露は、HIV感染を減少、根絶、または予防するために、または生体内においてHIVが未感染の細胞へ細胞間感染するのを予防するために有効である、方法。
【請求項2】
前記治療薬は、細胞毒性薬、ウイルス静止剤、毒素、放射性同位体、オリゴヌクレオチド、免疫賦活剤、サイトカイン、ケモカイン、低分子干渉RNA(siRNA)または酵素である、請求項1に記載の方法。
【請求項3】
前記治療薬はドキソルビシンである、請求項1に記載の方法。
【請求項4】
前記合成抗体または断片はドキソルビシン―P4/D10である、請求項3に記載の方法。
【請求項5】
前記抗体または断片はP4/D10である、請求項1に記載の方法。
【請求項6】
前記対象はヒト対象である、請求項1に記載の方法。
【請求項7】
前記抗体または断片は、キメラの、ヒト化した、またはヒト抗体あるいは断片である、請求項6に記載の方法。
【請求項8】
前記合成抗体または断片は、認識されているまたは潜在的なHIV感染の後で前記対象に投与される、請求項7に記載の方法。
【請求項9】
認識されているまたは潜在的な感染から、前記対象への合成抗体または断片の投与の間の期間は、1時間未満、1時間から5時間、12時間未満、1日未満、2日未満、1週間未満または1ヶ月未満である、請求項8に記載の方法。
【請求項10】
前記合成抗体または断片の投与は、前記対象におけるHIV感染をブロックするために有効である、請求項8に記載の方法。
【請求項11】
前記合成抗体または断片は、前記対象が抗レトロウィルス療法(ART)によって治療された後で前記対象に投与される、請求項6に記載の方法。
【請求項12】
前記治療薬は、アピリジン、アザリビン、アナストロゾール、アザシチジン、ブレオマイシン、ボルテゾミブ、ブリオスタチン−1、ブスルファン、カリケアマイシン、カンプトセシン、10ヒドロキシカプリン酸、カルムスチン、セレブレックス、クロラムブシル、シスプラチン、イリノテカン(CPT―11)、SN―38、カルボプラチン、クラドリビン、シクロホスファミド、シタラビン、ダカルバジン、ドセタキセル、ダクチノマイシン、ダウノマイシングルクノニド、ダウノルビシン、ドキソルビシン、2―ピロリノドキソルビシン(pyrrolinodoxorubicine)(2P−DOX)、シアノ―モルホリノドキソルビシン、ドキソルビシングルクロニド、エピルビシングルクロニド、エストラムスチン、エトポシド、エトポシドグルクノニド、リン酸エトポシド、フロクスウリジン(FUdR)、3’,5’―O―ジオレオイル−FudR(FUdR−dO)、フルダラビン、フルタミド、フルオロウラシル、ゲムシタビン、ヒドロキシウレア、イダルビシン、イホスファミド、L−アスパラギナーゼ、ロイコボリン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、6−メルカプトプリン、メトトレキサート、ミトキサントロン、ミトラマイシン、マイトマイシン、ミトタン、フェニル酪酸塩、プロカルバジン、パクリタキセル、ペントスタチン、PSI―341、セムスチン、ストレプトゾシン、タモキシフェン、タキサン、タクソール、サリドマイド、チオグアニン、チオテパ、テニポシド、トポテカン、ウラシルマスタード、ベルケイド、ビンブラスチン、酒石酸ビノレルビン、ビンクリスチン、リシン、アブリン、リボヌクレアーゼ、オンコナーゼ、rapLRl、DNase I、ブドウ球菌性エンテロトキシン−A、ヤマゴボウ抗ウイルス性タンパク質、ゲロニン、ジフテリアトキシン、シュードモナスエクソトキシン、シュードモナスエンドトキシン、アンチセンスオリゴヌクレオチド、干渉RNA、siRNA、アグリゾーム阻害物質またはその組み合わせである、請求項2に記載の方法。
【請求項13】
前記放射性同位体は、225Ac、211At、212Bi、213Bi、14C、51Cr、36Cl、45Ti、57Co、58Co、62Cu、64Cu、67Cu、166Dy、152Eu、18F、67Ga、68Ga、195mHg、166Ho、3H、111In、123I、124I、125I、1311、52Fe、59Fe 177Lu、191Os、212Pb、32P、33P、142Pr、195mPt、223Ra、186Re、188Re、189Re、47Sc、75Se111Ag、153Sm、89Sr、35S、161Tb、94mTc、99mTc、86Y、90Yおよび89Zrから成る群から選択される、請求項2に記載の方法。
【請求項14】
前記抗体または断片は、二重特異性抗体、二重特異性抗体断片、scFv、Fab、Fab’、F(ab)2、F(ab’)2、Fv、sFv、scFv、scFv−Fc統合、一本鎖抗体、二重抗体、三重抗体または四重抗体である、請求項1に記載の方法。
【請求項15】
前記ARTはHAART(高活性抗レトロウィルス療法)である、請求項1に記載の方法。
【請求項16】
前記抗レトロウィルス療法は、エファビレンツ、ジドブジン、テノホビル、ラミブジン、エムトリシタビン、ディダノシン、アバカビル、スタブジン、ネビラピン、ロピナビル、リトナビル、アタザナビル、ホスアンプレナビル、インディナビル、ネルフィナビル、サクイナビル、またはその組み合わせによる治療を含む、請求項11に記載の方法。
【請求項17】
前記抗体または断片は、中和抗体または断片である、請求項1に記載の方法。
【請求項18】
前記免疫賦活剤は、サイトカイン、幹細胞成長因子、リンホトキシン、造血因子、インターロイキン、コロニー刺激因子、インターフェロン、インターフェロン−α、インターフェロン−β、インターフェロン―γ、「Sl因子」IL−2、IL−6、IL−10、IL−12、IL−18、IL−21およびTNF−αと呼ばれる幹細胞成長因子から成る群から選択される、請求項2に記載の方法。
【請求項19】
前記サイトカインは、リンフォカイン、モノカイン、成長因子、ヒト成長ホルモン、N−メチオニルヒト成長ホルモン、ウシ成長ホルモン、副甲状腺ホルモン、サイロキシン、インシュリン、プロインシュリン、レラキシン、プロレラキシン、卵胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、黄体形成ホルモン(LH)、肝成長因子、プロスタグランジン、繊維芽細胞成長因子、プロラクチン、胎盤性ラクトゲン、OBタンパク質、腫瘍壊死因子―ex、腫瘍壊死因子―β、ミューラー阻害物質、マウスゴナドトロピン関連ペプチド、インヒビン、アクティビン、血管内皮性成長因子、インテグリン、トロンボポイエチン(TPO)、NGF−β、血小板成長因子、変換成長因子(TGF)、TGF−α、TGF−β、インシュリン様成長因子―Iおよび−II、エリスロポエチン(EPO)、骨誘導因子、インターフェロン―α、インターフェロン―β、インターフェロン―γ、コロニー刺激因子、マクロファージ―CSF(M−CSF)、顆粒球―マクロファージ―CSF(GM−CSF)、顆粒球―CSF(G−CSF)、IL−I、IL−lα、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、IL−13、IL−14、IL−15、IL−16、IL−17、IL−18、IL−21、LIF、キット―配位子、FLT―3、アンギオスタチン、トロンボスポンジン、エンドスタチン、腫瘍壊死因子およびLTで成る群から選択される、請求項18に記載の方法。
【請求項20】
前記ケモカインは、RANTES、MCAF、MlPl―アルファ、MIPl―ベータおよびIP―10で成る群から選択される、請求項2に記載の方法。
【請求項21】
前記投与は、経口、経鼻、口腔、吸入、直腸、経膣、局所、同所、皮内、皮下、筋肉内、腹腔内、動脈内、髄腔内、または静脈内である、請求項1に記載の方法。
【請求項22】
前記放射性同位体は、アルファエミッタまたはオーガー電子エミッタである、請求項2に記載の方法。
【請求項23】
前記アルファエミッタは、212Pb、212Bi、213Bi、211At、223Raまたは225Ac、あるいは、前記オーガー電子エミッタは111In、125I、67Ga、191Os、193mPt、195mPtまたは195mHgである、請求項22に記載の方法。
【請求項24】
対象におけるHIV感染を画像化、検知、または診断するための方法であって、
a)前記対象に対して、HIV表面エンベロープ抗原に対する画像化剤に合成された抗体または抗体断片を投与するステップと、
b)HIV感染した細胞に結合された、合成抗体または断片の存在を検知するステップであって、前記合成抗体または断片の前記HIV感染した細胞への結合が、前記対象におけるHIV感染の存在の画像化、診断、または検知に有効である、ステップとを含む、方法。
【請求項25】
前記画像化剤は、放射性同位体、酵素、感光ラベル、造影剤、超音波ラベル、または常磁性ラベルである、請求項24に記載の方法。
【請求項26】
前記画像化剤は、クロム(III)、マンガン(II)、鉄(III)、鉄(II)、コバルト(II)、ニッケル(II)、銅(II)、ネオジム(III)、サマリウム(III)、イッテルビウム(III)、ガドリニウム(III)、バナジウム(II)、テルビウム(III)、ジスプロシウム(III)、ホルミウム(III)、エルビウム(III)、ランタン(III)、金(III)、鉛(II)およびビスマス(III)から成る群から選択される、請求項25に記載の方法。
【請求項27】
前記画像化剤は、18F、52Fe、62Cu、64Cu、67Cu、67Ga、68Ga、86Y、89Zr94mTc、94Tc、99mTc、45Ti、111In、123I、124I、125I、131I、154−158Gd、177Lu、32Pまたは188Reである、請求項25に記載の方法。
【請求項28】
前記画像化剤は、Alexa350、Alexa430、AMCA、アミノアクリジン、BODIPY630/650、BODIPY650/665、BODIPY―FL、BODIPY―R6G、BODIPY―TMR、BODIPY―TRX、5―カルボキシ―4’,5’―ジクロロ―2’,7’−ジメトキシフルオレセイン、5―カルボキシ―2’,4’,5’,7’―テトラクロルエチレン、5―カルボキシフルオレセイン、5―カルボキシローダミン、6―カルボキシローダミン、6―カルボキシテトラメチルアミノ、Cascade Blue、Cy2、Cy3、Cy5、6―FAM、塩化ダンシル、フルオレセイン、HEX、6−JOE、NBD(7―ニトロベンズ―2―オクサ―l,3―ジアゾール)、Oregon Green488、Oregon Green500、Oregon Green514、Pacific Blue、フタル酸、テレフタル酸塩、イソフタル酸、クレシルファストバイオレット、クレシルブルーバイオレット、ブリリアントクレシルブルー、パラアミノ安息香酸、エリトロシン、フタロシアニン、アゾメチン、シアニン、キサンチン、スクニシルフルオレセイン、希土類金属クリプタート、ユーロピウムトリスビピリジンジアミン、ユーロピウムクリプタートまたはキレート、ジアミン、ジシアン、La Jolla青色色素、アロフィコシアニン、アロフィコシアニンB、フィコシアニンC、フィコシアニンR、チアミン、フィコエリトロシアニン(phycoerythrocyanin)、フィコエリトリンR、REG、Rhodamine Green、ローダミンイソチオシアネート、Rhodamine Red、ROX、TAMRA、TET、TRIT(テトラメチルローダミンイソチオール)、テトラメチルローダミン、またはTexas Redである、請求項25に記載の方法。
【請求項29】
対象におけるHIV感染を治療するための方法であって、
a)前記対象に対して、二重特異抗体またはその抗体断片を投与するステップであって、前記二重特異抗体は、HIV表面エンベロープの抗原に特異な1つ以上の結合部位と担体の1つ以上の結合部位とを含む、ステップと、
b)任意に、前記対象にクリア剤を投与するステップと、
c)前記対象に対して、治療薬に合成された担体を投与するステップであって、前記担体の前記投与は HIV感染を減少、根絶、または予防するために、または前記対象内においてHIVが未感染の細胞へ細胞間感染するのを予防するために有効である、ステップとを含む、方法。
【請求項30】
前記治療薬は、細胞毒性薬、ウイルス静止剤、毒素、放射性同位体、オリゴヌクレオチド、低分子干渉RNA(siRNA)または酵素である、請求項29に記載の方法。
【請求項31】
前記治療薬はドキソルビシンである、請求項30に記載の方法。
【請求項32】
前記対象はヒト対象である、請求項29に記載の方法。
【請求項33】
前記抗体または断片は、キメラの、ヒト化した、またはヒト抗体または断片である、請求項32に記載の方法。
【請求項34】
前記抗体または断片、オプションのクリア剤および担体は、前記対象が抗レトロウィルス療法によって治療された後で、前記対象に投与される、請求項33に記載の方法。
【請求項35】
前記治療薬は、アピリジン、アザリビン、アナストロゾール、アザシチジン、ブレオマイシン、ボルテゾミブ、ブリオスタチン−1、ブスルファン、カリケアマイシン、カンプトセシン、10ヒドロキシカプリン酸、カルムスチン、セレブレックス、クロラムブシル、シスプラチン、イリノテカン(CPT―11)、SN―38、カルボプラチン、クラドリビン、シクロホスファミド、シタラビン、ダカルバジン、ドセタキセル、ダクチノマイシン、ダウノマイシングルクノニド、ダウノルビシン、ドキソルビシン、2―ピロリノドキソルビシン(pyrrolinodoxorubicine)(2P−DOX)、シアノ―モルホリノドキソルビシン、ドキソルビシングルクロニド、エピルビシングルクロニド、エストラムスチン、エトポシド、エトポシドグルクノニド、リン酸エトポシド、フロクスウリジン(FUdR)、3’,5’―O―ジオレオイル−FudR(FUdR−dO)、フルダラビン、フルタミド、フルオロウラシル、ゲムシタビン、ヒドロキシウレア、イダルビシン、イホスファミド、L―アスパラギナーゼ、ロイコボリン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、6―メルカプトプリン、メトトレキサート、ミトキサントロン、ミトラマイシン、マイトマイシン、ミトタン、フェニル酪酸塩、プロカルバジン、パクリタキセル、ペントスタチン、PSI−341、セムスチン、ストレプトゾシン、タモキシフェン、タキサン、タクソール、サリドマイド、チオグアニン、チオテパ、テニポシド、トポテカン、ウラシルマスタード、ベルケイド、ビンブラスチン、酒石酸ビノレルビン、ビンクリスチン、リシン、アブリン、リボヌクレアーゼ、オンコナーゼ、rapLRl、DNase I、ブドウ球菌性エンテロトキシン−A、ヤマゴボウ抗ウイルス性タンパク質、ゲロニン、ジフテリアトキシン、シュードモナスエクソトキシン、シュードモナスエンドトキシン、アンチセンスオリゴヌクレオチド、干渉RNA、siRNA、アグリゾーム阻害物質またはその組み合わせである、請求項29に記載の方法。
【請求項36】
前記放射性同位体は、225Ac、211At、212Bi、213Bi、14C、51Cr、36Cl、45Ti、57Co、58Co、62Cu、64Cu、67Cu、166Dy、152Eu、18F、67Ga、68Ga、195mHg、166Ho、3H、111In、123I、124I、125I、1311、52Fe、59Fe 177Lu、191Os、212Pb、32P、33P、142Pr、195mPt、223Ra、186Re、188Re、189Re、47Sc、75Se111Ag、153Sm、89Sr、35S、161Tb、94mTc、99mTc、86Y、90Yおよび89Zrから成る群から選択される、請求項30に記載の方法。
【請求項37】
前記二重特異性抗体または二重特異性抗体断片は、少なくとも1つのscFv、Fab、Fab’、F(ab)2、F(ab’)2、Fv、sFv、scFv―Fc統合、一本鎖抗体、二重抗体、三重抗体または四重抗体を含む、請求項29に記載の方法。
【請求項38】
前記二重特異性抗体または断片は、少なくとも1つのP4/D10抗体または断片を含む、請求項29に記載の方法。
【請求項39】
前記担体は1つ以上のHSG(ヒスタミン―スクシニル―グリシン)部分を含み、前記二重特異性抗体または断片はHSGに結合される、請求項29に記載の方法。
【請求項40】
前記二重特異性抗体または断片は、HSGに結合される1つ以上の679抗体または抗体断片を含む、請求項29に記載の方法。
【請求項41】
前記担体は、DOTA−D−Cys(3−SP−Gly−20−O−SN38)−D−Ala−D−Lys(HSG)−D−Tyr−D−Lys(HSG)−NH2(IMP−411)である、請求項40に記載の方法。
【請求項42】
前記二重特異性抗体または断片は、ドックアンドロック(DNL)構造を含む、請求項29に記載の方法。
【請求項43】
治療薬に合成された抗HIV抗体またはその断片を含む組成物であって、前記合成された抗体またはその断片は、HIV感染を減少、根絶、または予防するために、または対象に投与された場合に、HIVが未感染の細胞へ細胞間感染するのを予防するために有効である、組成物。
【請求項44】
前記対象はヒト対象である、請求項43に記載の組成物。
【請求項45】
前記合成抗体または断片は、キメラの、ヒト化した、またはヒト抗体あるいは断片である、請求項43に記載の組成物。
【請求項46】
前記抗体または断片はP4/D10である、請求項43に記載の組成物。
【請求項47】
前記合成抗体または抗体の断片はドキソルビシンP4/D10である、請求項46に記載の組成物。
【請求項48】
前記抗体または断片は、アピリジン、アザリビン、アナストロゾール、アザシチジン、ブレオマイシン、ボルテゾミブ、ブリオスタチン―1、ブスルファン、カリケアマイシン、カンプトセシン、10ヒドロキシカプリン酸、カルムスチン、セレブレックス、クロラムブシル、シスプラチン、イリノテカン(CPT―11)、SN―38、カルボプラチン、クラドリビン、シクロホスファミド、シタラビン、ダカルバジン、ドセタキセル、ダクチノマイシン、ダウノマイシングルクノニド、ダウノルビシン、ドキソルビシン、2―ピロリノドキソルビシン(pyrrolinodoxorubicine)(2P−DOX)、シアノ―モルホリノドキソルビシン、ドキソルビシングルクロニド、エピルビシングルクロニド、エストラムスチン、エトポシド、エトポシドグルクノニド、リン酸エトポシド、フロクスウリジン(FUdR)、3’,5’―O―ジオレオイル−FudR(FUdR−dO)、フルダラビン、フルタミド、フルオロウラシル、ゲムシタビン、ヒドロキシウレア、イダルビシン、イホスファミド、L―アスパラギナーゼ、ロイコボリン、ロムスチン、メクロレタミン、メルファラン、メルカプトプリン、6―メルカプトプリン、メトトレキサート、ミトキサントロン、ミトラマイシン、マイトマイシン、ミトタン、フェニル酪酸塩、プロカルバジン、パクリタキセル、ペントスタチン、PSI−341、セムスチン、ストレプトゾシン、タモキシフェン、タキサン、タクソール、サリドマイド、チオグアニン、チオテパ、テニポシド、トポテカン、ウラシルマスタード、ベルケイド、ビンブラスチン、酒石酸ビノレルビン、ビンクリスチン、リシン、アブリン、リボヌクレアーゼ、オンコナーゼ、rapLRl、DNase I、ブドウ球菌性エンテロトキシン−A、ヤマゴボウ抗ウイルス性タンパク質、ゲロニン、ジフテリアトキシン、シュードモナスエクソトキシン、シュードモナスエンドトキシン、アンチセンスオリゴヌクレオチド、干渉RNA、siRNA、アグリゾーム阻害物質またはその組み合わせに合成されている、請求項43に記載の組成物。
【請求項49】
前記抗体または断片は、212Pb、212Bi、213Bi、211At、223Ra、225Ac、32P、33P、47Sc、67Cu、67Ga、89Sr、90Y、111Ag、125I、131I、142Pr、153Sm、161Tb、166Ho、166Dy、177Lu、186Re、188Re、189Re、111In、125I、67Ga、191Os、193mPt、195mPtまたは195mHgに合成されている、請求項43に記載の組成物。
【請求項50】
前記抗体または断片は、二重特異性抗体、二重特異性抗体断片、scFv、Fab、Fab’、F(ab)2、F(ab’)2、Fv、sFv、scFv、scFv−Fc統合、一本鎖抗体、二重抗体、三重抗体または四重抗体である、請求項43に記載の組成物。
【請求項51】
前記抗体または断片は、中和抗体である、請求項43に記載の組成物。
【請求項52】
各抗体または断片はHIV表面エンベロープ抗原に結合されている、前記対象に対して2つまたは3つの前記抗体または断片を投与するステップをさらに含む、請求項1に記載の方法。
【請求項53】
前記2つまたは3つの抗体または断片は、同じ前記HIV表面エンベロープ抗原に結合されている、請求項52に記載の方法。
【請求項54】
前記2つまたは3つの抗体または断片は、異なるHIV表面エンベロープ抗原に結合されている、請求項52に記載の方法。
【請求項55】
前記2つまたは3つの抗体または断片は、HIVのアクセス可能なエピトープの不可変、および可変部分に結合されている、請求項52に記載の方法。
【請求項56】
前記抗体または抗体の断片は、4E10、2F5、3D6、C37、1ACY、1F58、1GGGC、2G12およびX5で成る群から選択される、請求項1に記載の方法。
【請求項57】
前記抗体または断片は、キメラの、ヒト化した、またはヒト抗体または断片である、請求項56に記載の方法。
【図1A】


【図1B】


【図2】




【図1B】


【図2】


【公表番号】特表2009−538284(P2009−538284A)
【公表日】平成21年11月5日(2009.11.5)
【国際特許分類】
【出願番号】特願2009−511157(P2009−511157)
【出願日】平成19年5月8日(2007.5.8)
【国際出願番号】PCT/US2007/068449
【国際公開番号】WO2007/134037
【国際公開日】平成19年11月22日(2007.11.22)
【出願人】(508250648)イムノメディックス,インク. (2)
【Fターム(参考)】
【公表日】平成21年11月5日(2009.11.5)
【国際特許分類】
【出願日】平成19年5月8日(2007.5.8)
【国際出願番号】PCT/US2007/068449
【国際公開番号】WO2007/134037
【国際公開日】平成19年11月22日(2007.11.22)
【出願人】(508250648)イムノメディックス,インク. (2)
【Fターム(参考)】
[ Back to top ]

