合成画像の作成及び分析によって細胞サンプルを分析する方法
【課題】複数の成分を含む複数の細胞抽出物サンプルの比較方法を提供する。
【解決手段】2以上の群の細胞から2以上の細胞抽出物のサンプルを各々を適合マーカーセットの別々のものに暴露して、マーカーを細胞抽出物に結合させて細胞抽出物を標識する。次いでサンプルを混合して混合物を形成し、混合物を電気泳動して細胞抽出物中の成分を分離する。個々のマーカーの検出によって、電気泳動した混合物の2以上の電子画像が得られるが、各々の画像は他のものとは異なるマーカーの検出によって表示される。得られた2以上の電子画像の1つの合成電子画像(Ires)を作成し、合成電子画像を分析してスポット分析領域を同定する。2以上の電子画像の各々で同定したスポット分析領域を適用して、領域を評価して細胞抽出物の成分を表すスポットを検出する。
【解決手段】2以上の群の細胞から2以上の細胞抽出物のサンプルを各々を適合マーカーセットの別々のものに暴露して、マーカーを細胞抽出物に結合させて細胞抽出物を標識する。次いでサンプルを混合して混合物を形成し、混合物を電気泳動して細胞抽出物中の成分を分離する。個々のマーカーの検出によって、電気泳動した混合物の2以上の電子画像が得られるが、各々の画像は他のものとは異なるマーカーの検出によって表示される。得られた2以上の電子画像の1つの合成電子画像(Ires)を作成し、合成電子画像を分析してスポット分析領域を同定する。2以上の電子画像の各々で同定したスポット分析領域を適用して、領域を評価して細胞抽出物の成分を表すスポットを検出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞及び細胞抽出物のタンパク質組成における差異を検出するため細胞抽出物の多数のサンプルを比較する方法に関し、特に、そのような差異を検出するため適合標識試薬対を利用する方法に関する。細胞抽出物の発現サンプルは、本出願で概説される分析方法に従い得るサンプルであれば何でもよい。
【背景技術】
【0002】
本発明は、細胞及び細胞抽出物のタンパク質組成における差異を検出するため細胞抽出物の多数のサンプルを比較する方法に関し、特に、そのような差異を検出するため適合標識試薬対を利用する方法に関する。細胞抽出物の発現サンプルは、本出願で概説される分析方法に従い得るサンプルであれば何でもよい。
【0003】
細胞生物学の様々な側面を研究する研究者は、細胞構造、機能及び発達における差異を検出しモニターする種々のツールを利用する。細胞研究の中心的部分は、種々の細胞タイプ間や、発達及び状況の段階の間の、タンパク質組成での差異や類似性の研究である。正常細胞と癌細胞との間、又は野生型と変異細胞との間の、タンパク質組成の差異の判定は、例えば、有益な情報源たり得、有益な診断ツールたり得る。
【0004】
タンパク質の混合物は、変性条件下でのポリアクリルアミドゲル電気泳動によって、質量の差によって、個々の成分に分離させることができる。1次元及び2次元ゲル電気泳動は、タンパク質を研究するための標準ツールとなっている。シリンダ又はスラブによる1次元SDS(ドデシル硫酸ナトリウム)電気泳動は、テストされるサンプル内に存在する主要タンパク質のみ明らかにする。2次元ポリアクリルアミドゲル電気泳動(2D PAGE)は、1次元での等電点電気泳動によるつまり電荷による分離と2次元での大きさによる分離によってタンパク質を分離するのであるが、分離のためのより鋭敏な方法であり、サンプル内のタンパク質の殆どが分離される。
【0005】
タンパク質は、1次元ゲル又は2次元ゲルで、帯状又はスポット状で、夫々移動する。分離したタンパク質は、様々な方法で可視化される。タンパク質特性色素による着色、タンパク質媒介銀沈殿、放射能標識タンパク質のオートラジオグラフィ検出、及び、蛍光化合物の共有結合などである。後者の方法は、これまでは、2D PAGEの等電点電気泳動ステップの後にようやく実施され得たものである。電気泳動の直後に、合成ゲルパターンは、目、即ち写真により、若しくは、電子画像捕捉、例えば冷却された電荷結合素子(CCD)又はレーザベース画像検出器を利用して、可視化し得る。従来技術の方法によって、様々な細胞又は細胞発達の様々な段階からのタンパク質サンプルを比較するために、各々のサンプルは、1次元ゲル又は分離2次元ゲルの分離レーンを移動する。視覚試験又は電子画像、例えば、デジタル化された1次元又は2次元ゲルの計算機援用画像分析によって、比較される。しかしながら、どの2つのゲルも同一ではなくゲルはpH勾配や均一性で夫々異なるので、分離ゲルの中の各々のサンプルは、厳密な正確さをもって準備されなければならない。
【0006】
分離ゲルを動かすことによる欠点は、“Difference gel electrophoresis using matched multiple dyes”という名称の国際公開第96/33406号に開示されるプロセスにより一部克服されている。該発明は、本明細書にその全体が組み込まれるものである。この公知のプロセスによると、例えば種々の細胞から抽出されるタンパク質の多数サンプルの間の差異は、そのようなタンパク質の各々のサンプルを、適合発光色素セットの内の異なる色素で、標識することで検出される。適合色素は、吸収及び/又は、様々な波長の様々な色発光を生成する発光光以外は、概略同じイオン及びpH特性を有する。さらに、色素は大きさにおいて同一であるべきである。かように標識されるサンプルは、その後混合され、単一のゲル上で同時に電気泳動される。各々のサンプルに共通するタンパク質は、同じ位置に共に動かされる。異なるタンパク質は、ゲル上の異なる位置に単独で移動して異なる色を発光し、どの最初のサンプルが、最初のサンプル又はサンプル群と異なる1つ又は複数のタンパク質を備えるかを、明確にする。
【0007】
ゲルは、2つ(又はそれ以上)の波長の発光スキャナ、発光マイクロスコープ、又は発光を検出する公知の手段によって、分析し得る。光電子増倍管若しくはCCDカメラ、白色光源若しくは所与の波長の光源、2つの電子画像を備えるレーザスキャニングシステムのような電子検出システムは、標識の種々のスペクトル特性を適応させる種々の公知のフィルタセットを利用する湿性ゲルから構成される。第1の色素の波長で放射される光以外の全ての光をフィルタするのに適切な第1のフィルタを利用する第1の色素の発光を、一方の画像は示し、第2の色素の波長で放射される光以外の全ての光をフィルタするのに適切な第2のフィルタを利用する第2の色素の発光を、もう一方の画像は示す。露光は、約数ミリ秒から500秒である。各々の画像は、画素強度値の格子状アレイとみなし得る。
【0008】
異なるスポットを同定するため第2の画像から第1の画像を差し引くか、又は、画像が分割されて両方の画像に共通しないスポットのみ残す、市販のソフトウエアパッケージによって、このように得られた画像は続いて国際公開第96/33406号に従って分析される。画像を差し引く際には、類似のスポットは互いにキャンセルし、異なるもののみ残る。比率分析では、類似のスポットは一つの値を示す。差異があると、一つ又は数個の場合より、大きい値となる。
【0009】
国際公開第96/33406号から知り得る方法での上記の分析ステップは、時として非常に時間がかかる。
【0010】
国際公開第96/33406号に開示される技術に従って得られる電子画像に適用される従来からの2次元ゲル分析法も、利用可能である。この技術によると、各々の電子画像は、スポットを検出するために、個別に分析される。2つの画像からの対応するスポットは、マッチングされ、対照され、さらに分析される。
【0011】
電子画像を分析する際に従来法を利用すると、幾つかの欠点が明確になり得る。
【0012】
一つの欠点は、スポットがミスマッチする、即ち、2つの画像で対応すると想定されるスポットがそうではない、というリスクである。その理由は、電子画像の検出は低すぎる感度によってなされること、即ち、同じスポットは正確には両方の画像では検出されないということである。
【0013】
もう一つの欠点は、更なる分析、例えば、2つのスポット間の差異発現の計算には不正確さがあるということである。これは、スポットに係るパラメータが2つの画像で全く同じようには計算されないためである。例えば、スポットを示す体積は、2つの画像での異なる境界を持つ分析領域の積分により決定される。上記に簡潔に記載したマッチング手順は、誰が相互作用ステップを実施するかに依存して結果が変動する単調な相互作用プロセスでもある。
【0014】
本発明の目的は、電気泳動混合物から得られる電子画像を評価するための、より時間のかからない方法を得ることである。本発明の別の目的は、細胞抽出物の成分に対応するスポットが検出される電子画像の分析において高度な正確性を得ることである。
【0015】
本発明のもう一つの目的は、測定を実施するためにセットされることが求められるパラメータが数個のみである点において、ユーザフレンドリである方法を得ることである。このことは、ユーザ間の測定結果の変動が限定されることに繋がる。
【0016】
本発明の更なる目的は、本発明に従って測定を実施する際に高度な自動化を達成することである。
【0017】
そしてさらにもう一つの本発明の目的は、上記方法を利用して得られる結果が高い信頼性を持つと考えられる、ということである。
【発明の概要】
【課題を解決するための手段】
【0018】
上述の目的は、添付の請求項に示される、特徴的なステップを有する方法による本発明によって、達成される。
【0019】
好適な実施形態は、従属する請求項に示される。
【0020】
本発明に係る方法における大きな利点は、全く同じスポット分析領域が、各々の電子画像の全く同じ位置で利用され適応されるので、細胞抽出物を示す電子画像の評価が高い正確性をもって実施し得る、ということである。その概念それ自身は、ミスマッチが生じない、即ち、異なる画像での対応するスポット間の差異発現がより高い正確度をもって確実に判定できるようになる。
【0021】
スポット分析領域はスポットがあると推定される領域を指摘するので、非常に微弱なスポットであっても検出し得る。
【0022】
さらに、スポット分析領域でスポットが見つけられないならば、分析装置の中の感度に関する内部パラメータが自動的に調整し得る。
【0023】
本発明の好適な実施形態によると、合成電子画像が得られる前に、整列するステップが実施される。
【0024】
本発明の原理を明確に示すために、電気泳動プロセスに関して記述されている。しかしながら、本発明は、pH(電荷)及びサイズ以外の分離パラメータを利用する、1次元又は2次元の差異分析法であればどれにおいても、等しく利用可能である。これら方法のうちには、「高圧液体クロマトグラフィ(hplc)」と「細胞標識」がある。
【0025】
従来技術によって実施される対応する分析と比較して、本発明に係る方法によって実施される分析がいかに時間消費が少ないかを示すため、次の例が挙げられる。サンプルの20ゲルの一群では、一人が古い技術を利用して分析すると約1ヶ月かかる。本発明に係る方法を利用すると、対応する分析は1日以内で終了し得る。
【図面の簡単な説明】
【0026】
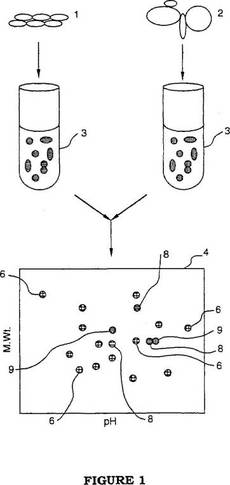
【図1】先行技術に係るプロセスの概略図である。
【図2】本発明に係る方法を示すフロー図である。
【図3】本発明に係る方法の重要ステップを示すフロー図である。
【図4A】2つの電子画像での多数の画素強度値の2次元表現を示す。
【図4B】類似度を示す多数の画素強度値の2次元表現を示す。
【図5】本発明に係る方法を示すデータディスプレイを示す。
【発明を実施するための形態】
【0027】
図2は、本発明に係る方法を示すフロー図を示す。フロー図で示される異なるステップを、全図面を参照しつつ以下で説明する。
【0028】
説明全体において、本発明を示す例では、分離ステップは電気泳動によって実施されるのが好ましい。しかしながら、本発明は、他のどんな分離法でも等しく適用可能である。
【0029】
準備及び混合ステップ
本発明の好適な実施形態では、本発明のプロセスは、セットにおける各々の色素がイオン及びpH特性、タンパク質との共有結合のための化学反応性の点で他のものとほぼ等しいが、異なる波長で蛍光発光し検分時には異なる色の発光を示す、色素の適合セットを利用する。色素は、分子量において略等しいことが好ましいが、必ずしもその必要はない。色素の適合セットの内部の各々の色素は、各々の細胞抽出物サンプルが色素セットの異なる色素で標識されるように、細胞抽出物の種々のサンプルのセットの別々のものでタンパク質を標識するのに利用される。標識後、抽出物は、1次元若しくは2次元電気泳動によって、同じゲル内で混合され電気泳動される。
【0030】
以下のプロセスは、単純化のため、本発明に従って分析される2つのみの異なる細胞抽出物を示す。しかしながら、プロセスはより多数の細胞抽出物にも適用できる。
【0031】
図1の概略図を参照すると、第1の細胞抽出物が、第1の細胞群1から公知の技術により準備され、プロピルシアニン(3)−NHSなどの色素の適合対の第1の色素で、標識される。第2の細胞抽出物が、第2の細胞群2から公知の技術により準備され、メチルシアニン(5)−NHSなどの色素の適合対の第2の色素で、標識される。シアニン(3)及び(5)の準備の構成及び方法は、上述の国際公開第96/33406号に記載されている。細胞抽出物混合物を標識するために、反応性の色素とタンパク質抽出物は、反応性の色素と、抽出物の中のタンパク質上の潜在的な付着つまり結合部位との間に、共有結合が形成し得る程の時間、試験管3のような適切な容器でインキュベートされる。その時間は、温度に依存するが、略15分から30分である。温度の範囲は、略、0℃から25℃である。色素とタンパク質との反応は、タンパク質分子上の利用可能な結合部位の十分なパーセントが、色素に共有結合して結合した後、消滅されてもよい。適切な公知の消滅剤なら何が利用されてもよい。
【0032】
第1と第2の細胞群(1、2)は、タンパク質組成を比較即ち対照し得る細胞の2つのセットであるならば何でもよい。例えば、第1の細胞群は、野生型即ち正常のものでよく、第2の細胞群は、同一種からの変異種細胞であってもよい。一方で、第1の細胞群は正常のもので、第2の群は同一固体の癌細胞であってもよい。発達の異なる段階や細胞サイクルの異なるフェーズにおける同一固体の細胞も、利用し得る。
【0033】
異なる種からの同じタイプの細胞間のタンパク質組成の差異も、本発明のプロセスによる研究課題たり得る。さらに、本発明のプロセスは、種々の刺激即ち薬に細胞がいかに反応するかをモニターするのに、利用し得る。タンパク質変動により発現するような細胞行動を改め、「翻訳後変異(PTM)」のようなタンパク質に対する変異を含む、全てのイベントは、高精度の2D PAGEシステムに対する要求や費用が無くとも、検出し得る。当業者であれば、比較のためのタンパク質は、血清、尿、髄液、細菌、哺乳類、又は、植物などのような、生物体体液からも誘導し得ることは、認識されるところである。
【0034】
本発明の好適な実施形態は、細胞抽出物が蛍光発光色素により標識される例により示されるが、本発明は、他の同定用標識により標識される細胞抽出物を分析する場合にも、同様に適用可能である。国際公開第98/235950号は、多数の他の標識を開示する。例えば、適切な放射性核種(例えば、トリチウム、硫黄放射性核種、炭素放射性核種)による代謝標識、適切な放射性核種(例えば、放射性ヨウ素)による化学即ち酵素標識などである。安定的な天然同位体を利用することも可能である。このように標識タンパク質は、利用されている標識(ラベル)を検出し得る検出手段により画像化される。例えば、濃度計又は分光器の利用によるものや、若しくは放射能の検出によるものである。
【0035】
電気泳動ステップ
標識サンプルは混合され、図1に示すように、測定アリコートとして一つのゲル4に加えられ、それから好ましくは2D PAGEに付される。1次元SDS電気泳動は、2D PAGEの代わりに、利用し得る。1次元及び2次元電気泳動を実施するための手順は、当業者には公知である。
【0036】
2つの細胞群が共有するタンパク質は、符合スポット6を形成する。夫々の群からの同一のタンパク質の蛍光発光強度は、大部分のタンパク質に対しては、理論上同じものである。2つの細胞群が共有しないタンパク質8、9は、独立して移動する。従って、唯一の、即ち一つの群に対して異なる相対濃度を備えるタンパク質は、異なる蛍光発光強度を有する。
【0037】
国際公開第96/33406号に従い、公知の技術に関連して上述されるように、ゲルは、2つの波長蛍光発光スキャナ、蛍光発光マイクロスコープ、又は、蛍光発光を検出する公知の手段であれば何ででも、分析し得る。2つの電子画像は、異なるスペクトル特性に適応する異なる公知のフィルタセットを利用する湿性ゲルで形成される。各々の電子画像は、画素強度値の格子状アレイと想定されることが可能である。即ち、画素強度値p1,・・・pNを備える電子画像I1と、画素強度値p’1,・・・p’Nを備える電子画像I2である。
【0038】
整列ステップ
合成電子画像が形成される前に、本発明の好適な実施形態では、整列ステップが実施される。このステップは、任意のものであり、必要と目される場合のみ実施される。
【0039】
2つの異なる細胞サンプルの電気泳動が同じゲル内で実施されよって異なるゲルの間でのミスマッチは回避されようとも、合成電子画像を形成する前に整列ステップを実施することが必要であると、しばしば考えられる。その理由は、細胞抽出物上へのラベルとして、利用されるマーカー、例えば発光マーカーは、ある条件下では細胞抽出物の分子のある特性、例えば大きさに影響し得る、ということである。整列ステップの目的は、対応する画素強度値、即ち同じスポット(例えば同じタンパク質)を示す画素強度が、合成画像で一致することを保証することである。
【0040】
2つの電子画像の画素強度値は、一つの画像上のパターンが他の画像上の対応するパターンと一致するかどうかをチェックするため、従来からの画像分析法を利用して相互に比較される。2つの画像の所定の限定領域での強度値を比較する際に、例えば、相互相関関数を利用することは、このことを実施する明確な方法である。相互相関関数は、2つの画像間の整列の程度を示すスコア値を提示する。
【0041】
この最初の比較を行うと、電子画像は相互に整列する結果となってしまうことがあり、このとき整列は不必要である。
【0042】
画像が受容し得る程度にまで整列しない場合には、幾つかの様々な整列サブステップ:
電子画像を互いに整列させるサブステップ、
線型変換を適用するサブステップ、
より複雑な拡大関数を適用するサブステップ
を実施してもよい。即ち、。
【0043】
各々のサブステップは単独で使用してもよいし、他の1以上のステップと併用してもよい。整列は、2次元で実施し得る。電子画像は、整列ステップの間、継続して相互に比較される。
【0044】
結合ステップ
本発明に係る方法の良好な全体結果を得るために、当然ながら仮定されるべきことは、(勿論、タンパク質に影響する変動がサンプル間で生じていないときにのみ)2つの電子画像の中の同じ位置の画素強度値が各々の細胞サンプルの同じスポットを実際に表現する程に、電子画像間の整列が良好である、ということである。2つの整列された電子画像は図3、ステップIに見られる。図に示されるように、それらは、スポットの1つが他の画像では見えないという点で、わずかに異なる。
【0045】
一つの合成電子画像(Ires)は、電子画像I1とI2とからの対応する画素強度値p1,・・・pN及びp’1,・・・p’Nを結合することによって、得られた2つの電子画像で形成される。図3のステップIIに進む。画素強度値を結合する一つの単純な方法は、対応する画素強度値の和を形成すること、例えばp1res=(p1+p’1)/2とすることである。
【0046】
合成強度値を計算する別の方法は、以下の通りである。
【0047】
【数1】

より一般的で複雑な関数も、もちろん、合成強度値を計算する際に利用し得る。例えば、近傍の強度値を斟酌するとか、画素強度値の全体の、又は部分集合の、平均値を斟酌するなど、である。このように得られる合成電子画像Iresは、合成画素強度値p1res・・・pNresの格子状アレイを含む。
【0048】
合成画像の分析
合成画像は、続いてスポット分析領域を同定するために分析される。所与の基準に従って画素値をスポット分析領域にグループ分けするために画素値によって示される画像を分析する別の方法は、当業者には公知である。利用可能な一つの種類のアルゴリズムが、イー・バテンズ(E.Battens)その他による“A new segmentation and modeling algorithm for electrophoresis gels”(Electrophoresis 1997,18,pp.793−798)に、記載されている。
【0049】
利用可能な別の種類のアルゴリズムは、いわゆる縁検出を基にするものであり、よく知られたパターン検出アルゴリズムである。
【0050】
本発明の好適な実施形態によると、合成画像内で同定されるべき複数のスポット分析領域は、所定の値、例えば800にセットされている。スコアが適切なスポット特性値のセットを基礎にしているような所定のスコア関数に従って、800の上位のスポット分析領域が抽出されるという点において、その値は、感度のレベルとみなし得る。スポット分析領域の数は、本発明の好適な実施形態では、スポット分析領域が同定される場合に設定されるべき唯一のパラメータであることが好ましい。
【0051】
スポット分析領域の分析
スポット分析領域を電子画像に適用する前に、スポット分析領域を分析することが時々必要になる。その理由は、分析領域は真実のタンパク質スポットを表し、予想不能なアーチファクト、例えばほこりやちりの結果ではないことを保証するためである。ある領域が真実のタンパク質スポットを示していないことがスポット分析領域の分析で示唆されたら、更なる方法ステップからその領域を排除することを可能にするために、その領域をアーチファクトに標識する。更なる分析で必要と見なされるならば、アーチファクトと標識される領域は依然利用可能である。
【0052】
真実のタンパク質スポットと同定するために利用し得る数多くの基準が存在する。それらのうち、スポット分析領域のサイズと、領域の輪郭の程度が例えば(3次元オブジェクトをフィルタするための公知の方法である)ラプラスフィルタリング法(Laplace−filtration method)を用いて判定されるスポット分析領域の3次元トポグラフィとを、挙げることができる。例えば、真実のタンパク質スポットのはるかに滑らかな曲線形態に比べてちり粒子ははるかに不規則で狭い縁を有するという点で、ちり粒子は同定される。
【0053】
明白なアウトライアが除去された全スポットの部分集合に対する、対応する「中間」特性に関する、同定された真実のタンパク質スポット特性の正規化が、実施される。正規化された特性に関してスポットを標識するために、限界が判定される。
【0054】
真実のタンパク質スポットを同定する別の方法は、人工の神経系ネットワークを利用することであり、その人工の神経系ネットワークは、学習プロセスの間に、上述の正規化特性を与えられるときに真実のタンパク質スポットを同定する方法を「学習する」。上記の分析及びフィルタは、ちり濾過ステップと考えられ得る。
【0055】
電子画像上にスポット分析領域を適用する
このようにして得られたスポット分析領域を、続いて、この例では画像I1とI2である電子画像に適用する。図3のステップIVである。両方の画像に同じスポット分析領域を適用することが重要である。結合するステップの前に画像が整列(整列、拡大等)されたのなら、更なる分析において利用されるのは勿論整列された電子画像である。図4は、両方の画像で同じ領域を利用して得られる大きな利点を示す。
【0056】
図4では、画像I1、I2夫々の1行のアレイに沿った複数の画素強度値の2次元表示を示す。これらの画像を分析する一つの方法は、図において、強度値のピーク値により示される曲線の下と、所与のベースレベル(B)と、x1とx2との間との、領域を決定することである。曲線の最大値は画像間で異なるが、画像I2からの寄与分が重要である。特に、画像I2での曲線により表されるスポットが、従来技術に係る技術を利用すると殆ど検出されないほど微弱である場合はそうである。
【0057】
画像を分析するとき、スポット分析領域でのいわゆる3次元マップの体積が、図5の「3次元スポットビュー」に示されるように、判定される。3次元マップは、電気泳動にかけられた細胞サンプルの電子画像の画素強度値の3次元表示である。
【0058】
類似度の判定
本発明の好適な実施の形態によると、2つ(又はそれ以上)の画像での対応するスポット分析領域の間の類似度が、判定される。発現類似によって、ここでは、3次元曲線形態に関する、対応するスポット分析領域間の類似性を意味する。さらにこのことを示すと、図4Bに、2つの電子画像に適用される2つの異なるスポット分析領域の表示が示される。原理を示すために1行の画素強度値により表されるスポット分析領域の2次元スライスの2次元表示を、図4Bは示すに過ぎないことが、観察されなければならない。類似度を判定するときには、スポット分析領域の全ての画素強度値に関して、3次元で適用される。
【0059】
左の曲線は、類似度の低い2つの画像からのスポット分析領域を示す。即ち、曲線は互いに類似していない。このスポット分析領域の分析に関して、更なる分析に影響し得る不確実性が存在することを示すものと、このことは解釈し得る。この不確実性は、時としてさらに分析されなければならず、分析領域の画素強度値により示されるタンパク質の同定に関連し得る。即ち、タンパク質の翻訳後変異や電気泳動に関する正体不明の問題に関連し得る。
【0060】
右の曲線は、類似度の高い2つの画像からのスポット分析領域を示す。即ち、曲線は互いに類似している。この場合、高い類似度が判定されたことにより、分析領域の画素強度値により示されるタンパク質の同定が判定され更なる分析が高程度の正確性をもって実施し得ることが、保証される。
【0061】
曲線形態の間における上述の類似度を判定する方法は、他に数多くある。
【0062】
本発明の好適な実施形態では、類似度を示す値を決定するために、当業者には公知である所謂「ピアソン相関法(Pearson Correlation Method)」が利用される。他のより一般的な方法も、利用し得る。
【0063】
そのうちでは、画素強度値とスポット分析領域のサイズとに関して正規化を実施し、対応する画素強度値の間の差異の平方値を決定する、というものが挙げられ得る。
【0064】
類似度は、3次元曲線形態の規模の程度に因るのではなく、図4Bに示されるように、曲線形態の類似度に因る。
【0065】
このステップの結果として、類似度の測定がなされ、例えば、1に近似する計測値は類似の高い程度を示し、1より小さい値は類似の低い程度を示す。
【0066】
上述されたように高い程度の正確性を備える類似度を判定すると仮定するならば、スポット分析領域は、上記に概説されたステップに従って判定されればよい。
差異発現を判定する
確立された技術である、対応する検出スポットを比較するため細胞サンプルの検出スポットを示す画像分析法に従って、検出スポットの所定のパラメータの間のいわゆる差異発現DEが、実施される。差異発現とは、以下のように定義される。
【0067】
【数2】

BquantityとAquantityとは、夫々、例えば、上記に示すような各々のスポット分析領域の内部の体積として、決定される。
【0068】
DEは、画像の間におけるスポットの変動を示す。DEが1に近ければ、変動は生じていない、という結論になる。
【0069】
電子画像対の差異発現が、計算されて、図5の「スポット選択」に示すようにヒストグラム内に設定し得る。タンパク質の大部分が2つの画像の間で変動していないという状況では、全てのスポットが略同じDEを備え、大部分のスポットが同一のDEに近いヒストグラム曲線となる。理想的な状況、即ち、2つのサンプルが夫々のサンプル内に全く同じ数のタンパク質を有するという状況では、タンパク質において変動が無いときは、DEは理論上1である。しかしながら、多くの因子により、画素強度値の系統的な偏差により、ヒストグラム曲線の最大幅の点は、1からずれる。
【0070】
系統的なエラーに関して訂正されるヒストグラム曲線は、多くの異なる方法で与えられ得る。差異発現のセットは、DEの中間値によって正規化し得る。正規化されたDEのセットは、続いて正規化されたヒストグラム曲線を設定するのに利用し得る。別の方法は、ヒストグラム曲線の最大幅の点を同定し対応するDEを1と定義することである。
【0071】
訂正されたヒストグラム曲線で1とは異なるDEによって示されるスポットは、従って容易に同定され得、さらに分析し得る。
【0072】
図5のヒストグラムのデータディスプレイに見られるように、過小発現スポット若しくは過大発現スポットを標識するために、限界値が利用し得る。スポットのうちの所定のパーセントを、過小又は過大発現とみなせるように、これら限界値を選択することができる。更なる分析を実施するために、ガウス曲線も利用されてヒストグラム曲線に対応するように調整されてもよい。
【0073】
データディスプレイ
図5は、本発明に係る方法を表すデータディスプレイを示す。見てのとおり、ディスプレイは4つの異なるビューに分割される。「画像ビュー」、「スポット選択」、「3次元スポットビュー」及び「結果表」である。例えば、画像ビュー上でスポット対が選択されたら(ポイントされたら)同時に3次元スポットビューで示され、スポット選択ビュー内の「差異発現ヒストグラム」と結果表にマークされるように、これらビューはすべてリンクしている。結果表に特定のスポット対を選択しそれらが同時に他のビュー内で強調されるというのも、もちろん可能である。
【0074】
触れられる価値のある、データディスプレイのスポット選択ビューの一つの特徴は、垂直軸で利用されるパラメータを変更できることである。従って、水平軸上には差異発現を示し、例えば垂直軸には領域や、体積や、類似度などを示すスポット選択ビューで、特定のスポット対を選ぶことができる。この特徴は、特に大部分のスポット対と異なる差異発現を備えるスポット対を分析する際に、効果的である。従って、特定のスポット対をより正確に分析するために、異なる上記のパラメータの値を容易に入手することが、可能である。
【0075】
上述のように、本発明に係る方法の全てのステップ又は一部のステップは、例えば、1次元電気泳動のような、1次元分離法で利用可能である。
【0076】
上述の全てのステップは、多くの異なるサンプルからの分析データをロードする能力を備える完全な自動プロセスで実施され得、これらのデータ全てに関する同時分析をなし得る。
【0077】
本発明は、上述の好適な実施形態に限定されない。種々の代替策、変更、及び等価物が、利用可能である。従って、上記の実施形態は、添付の請求項により定義される本発明の範囲を、限定するものと捉えられるべきではない。
【技術分野】
【0001】
本発明は、細胞及び細胞抽出物のタンパク質組成における差異を検出するため細胞抽出物の多数のサンプルを比較する方法に関し、特に、そのような差異を検出するため適合標識試薬対を利用する方法に関する。細胞抽出物の発現サンプルは、本出願で概説される分析方法に従い得るサンプルであれば何でもよい。
【背景技術】
【0002】
本発明は、細胞及び細胞抽出物のタンパク質組成における差異を検出するため細胞抽出物の多数のサンプルを比較する方法に関し、特に、そのような差異を検出するため適合標識試薬対を利用する方法に関する。細胞抽出物の発現サンプルは、本出願で概説される分析方法に従い得るサンプルであれば何でもよい。
【0003】
細胞生物学の様々な側面を研究する研究者は、細胞構造、機能及び発達における差異を検出しモニターする種々のツールを利用する。細胞研究の中心的部分は、種々の細胞タイプ間や、発達及び状況の段階の間の、タンパク質組成での差異や類似性の研究である。正常細胞と癌細胞との間、又は野生型と変異細胞との間の、タンパク質組成の差異の判定は、例えば、有益な情報源たり得、有益な診断ツールたり得る。
【0004】
タンパク質の混合物は、変性条件下でのポリアクリルアミドゲル電気泳動によって、質量の差によって、個々の成分に分離させることができる。1次元及び2次元ゲル電気泳動は、タンパク質を研究するための標準ツールとなっている。シリンダ又はスラブによる1次元SDS(ドデシル硫酸ナトリウム)電気泳動は、テストされるサンプル内に存在する主要タンパク質のみ明らかにする。2次元ポリアクリルアミドゲル電気泳動(2D PAGE)は、1次元での等電点電気泳動によるつまり電荷による分離と2次元での大きさによる分離によってタンパク質を分離するのであるが、分離のためのより鋭敏な方法であり、サンプル内のタンパク質の殆どが分離される。
【0005】
タンパク質は、1次元ゲル又は2次元ゲルで、帯状又はスポット状で、夫々移動する。分離したタンパク質は、様々な方法で可視化される。タンパク質特性色素による着色、タンパク質媒介銀沈殿、放射能標識タンパク質のオートラジオグラフィ検出、及び、蛍光化合物の共有結合などである。後者の方法は、これまでは、2D PAGEの等電点電気泳動ステップの後にようやく実施され得たものである。電気泳動の直後に、合成ゲルパターンは、目、即ち写真により、若しくは、電子画像捕捉、例えば冷却された電荷結合素子(CCD)又はレーザベース画像検出器を利用して、可視化し得る。従来技術の方法によって、様々な細胞又は細胞発達の様々な段階からのタンパク質サンプルを比較するために、各々のサンプルは、1次元ゲル又は分離2次元ゲルの分離レーンを移動する。視覚試験又は電子画像、例えば、デジタル化された1次元又は2次元ゲルの計算機援用画像分析によって、比較される。しかしながら、どの2つのゲルも同一ではなくゲルはpH勾配や均一性で夫々異なるので、分離ゲルの中の各々のサンプルは、厳密な正確さをもって準備されなければならない。
【0006】
分離ゲルを動かすことによる欠点は、“Difference gel electrophoresis using matched multiple dyes”という名称の国際公開第96/33406号に開示されるプロセスにより一部克服されている。該発明は、本明細書にその全体が組み込まれるものである。この公知のプロセスによると、例えば種々の細胞から抽出されるタンパク質の多数サンプルの間の差異は、そのようなタンパク質の各々のサンプルを、適合発光色素セットの内の異なる色素で、標識することで検出される。適合色素は、吸収及び/又は、様々な波長の様々な色発光を生成する発光光以外は、概略同じイオン及びpH特性を有する。さらに、色素は大きさにおいて同一であるべきである。かように標識されるサンプルは、その後混合され、単一のゲル上で同時に電気泳動される。各々のサンプルに共通するタンパク質は、同じ位置に共に動かされる。異なるタンパク質は、ゲル上の異なる位置に単独で移動して異なる色を発光し、どの最初のサンプルが、最初のサンプル又はサンプル群と異なる1つ又は複数のタンパク質を備えるかを、明確にする。
【0007】
ゲルは、2つ(又はそれ以上)の波長の発光スキャナ、発光マイクロスコープ、又は発光を検出する公知の手段によって、分析し得る。光電子増倍管若しくはCCDカメラ、白色光源若しくは所与の波長の光源、2つの電子画像を備えるレーザスキャニングシステムのような電子検出システムは、標識の種々のスペクトル特性を適応させる種々の公知のフィルタセットを利用する湿性ゲルから構成される。第1の色素の波長で放射される光以外の全ての光をフィルタするのに適切な第1のフィルタを利用する第1の色素の発光を、一方の画像は示し、第2の色素の波長で放射される光以外の全ての光をフィルタするのに適切な第2のフィルタを利用する第2の色素の発光を、もう一方の画像は示す。露光は、約数ミリ秒から500秒である。各々の画像は、画素強度値の格子状アレイとみなし得る。
【0008】
異なるスポットを同定するため第2の画像から第1の画像を差し引くか、又は、画像が分割されて両方の画像に共通しないスポットのみ残す、市販のソフトウエアパッケージによって、このように得られた画像は続いて国際公開第96/33406号に従って分析される。画像を差し引く際には、類似のスポットは互いにキャンセルし、異なるもののみ残る。比率分析では、類似のスポットは一つの値を示す。差異があると、一つ又は数個の場合より、大きい値となる。
【0009】
国際公開第96/33406号から知り得る方法での上記の分析ステップは、時として非常に時間がかかる。
【0010】
国際公開第96/33406号に開示される技術に従って得られる電子画像に適用される従来からの2次元ゲル分析法も、利用可能である。この技術によると、各々の電子画像は、スポットを検出するために、個別に分析される。2つの画像からの対応するスポットは、マッチングされ、対照され、さらに分析される。
【0011】
電子画像を分析する際に従来法を利用すると、幾つかの欠点が明確になり得る。
【0012】
一つの欠点は、スポットがミスマッチする、即ち、2つの画像で対応すると想定されるスポットがそうではない、というリスクである。その理由は、電子画像の検出は低すぎる感度によってなされること、即ち、同じスポットは正確には両方の画像では検出されないということである。
【0013】
もう一つの欠点は、更なる分析、例えば、2つのスポット間の差異発現の計算には不正確さがあるということである。これは、スポットに係るパラメータが2つの画像で全く同じようには計算されないためである。例えば、スポットを示す体積は、2つの画像での異なる境界を持つ分析領域の積分により決定される。上記に簡潔に記載したマッチング手順は、誰が相互作用ステップを実施するかに依存して結果が変動する単調な相互作用プロセスでもある。
【0014】
本発明の目的は、電気泳動混合物から得られる電子画像を評価するための、より時間のかからない方法を得ることである。本発明の別の目的は、細胞抽出物の成分に対応するスポットが検出される電子画像の分析において高度な正確性を得ることである。
【0015】
本発明のもう一つの目的は、測定を実施するためにセットされることが求められるパラメータが数個のみである点において、ユーザフレンドリである方法を得ることである。このことは、ユーザ間の測定結果の変動が限定されることに繋がる。
【0016】
本発明の更なる目的は、本発明に従って測定を実施する際に高度な自動化を達成することである。
【0017】
そしてさらにもう一つの本発明の目的は、上記方法を利用して得られる結果が高い信頼性を持つと考えられる、ということである。
【発明の概要】
【課題を解決するための手段】
【0018】
上述の目的は、添付の請求項に示される、特徴的なステップを有する方法による本発明によって、達成される。
【0019】
好適な実施形態は、従属する請求項に示される。
【0020】
本発明に係る方法における大きな利点は、全く同じスポット分析領域が、各々の電子画像の全く同じ位置で利用され適応されるので、細胞抽出物を示す電子画像の評価が高い正確性をもって実施し得る、ということである。その概念それ自身は、ミスマッチが生じない、即ち、異なる画像での対応するスポット間の差異発現がより高い正確度をもって確実に判定できるようになる。
【0021】
スポット分析領域はスポットがあると推定される領域を指摘するので、非常に微弱なスポットであっても検出し得る。
【0022】
さらに、スポット分析領域でスポットが見つけられないならば、分析装置の中の感度に関する内部パラメータが自動的に調整し得る。
【0023】
本発明の好適な実施形態によると、合成電子画像が得られる前に、整列するステップが実施される。
【0024】
本発明の原理を明確に示すために、電気泳動プロセスに関して記述されている。しかしながら、本発明は、pH(電荷)及びサイズ以外の分離パラメータを利用する、1次元又は2次元の差異分析法であればどれにおいても、等しく利用可能である。これら方法のうちには、「高圧液体クロマトグラフィ(hplc)」と「細胞標識」がある。
【0025】
従来技術によって実施される対応する分析と比較して、本発明に係る方法によって実施される分析がいかに時間消費が少ないかを示すため、次の例が挙げられる。サンプルの20ゲルの一群では、一人が古い技術を利用して分析すると約1ヶ月かかる。本発明に係る方法を利用すると、対応する分析は1日以内で終了し得る。
【図面の簡単な説明】
【0026】
【図1】先行技術に係るプロセスの概略図である。
【図2】本発明に係る方法を示すフロー図である。
【図3】本発明に係る方法の重要ステップを示すフロー図である。
【図4A】2つの電子画像での多数の画素強度値の2次元表現を示す。
【図4B】類似度を示す多数の画素強度値の2次元表現を示す。
【図5】本発明に係る方法を示すデータディスプレイを示す。
【発明を実施するための形態】
【0027】
図2は、本発明に係る方法を示すフロー図を示す。フロー図で示される異なるステップを、全図面を参照しつつ以下で説明する。
【0028】
説明全体において、本発明を示す例では、分離ステップは電気泳動によって実施されるのが好ましい。しかしながら、本発明は、他のどんな分離法でも等しく適用可能である。
【0029】
準備及び混合ステップ
本発明の好適な実施形態では、本発明のプロセスは、セットにおける各々の色素がイオン及びpH特性、タンパク質との共有結合のための化学反応性の点で他のものとほぼ等しいが、異なる波長で蛍光発光し検分時には異なる色の発光を示す、色素の適合セットを利用する。色素は、分子量において略等しいことが好ましいが、必ずしもその必要はない。色素の適合セットの内部の各々の色素は、各々の細胞抽出物サンプルが色素セットの異なる色素で標識されるように、細胞抽出物の種々のサンプルのセットの別々のものでタンパク質を標識するのに利用される。標識後、抽出物は、1次元若しくは2次元電気泳動によって、同じゲル内で混合され電気泳動される。
【0030】
以下のプロセスは、単純化のため、本発明に従って分析される2つのみの異なる細胞抽出物を示す。しかしながら、プロセスはより多数の細胞抽出物にも適用できる。
【0031】
図1の概略図を参照すると、第1の細胞抽出物が、第1の細胞群1から公知の技術により準備され、プロピルシアニン(3)−NHSなどの色素の適合対の第1の色素で、標識される。第2の細胞抽出物が、第2の細胞群2から公知の技術により準備され、メチルシアニン(5)−NHSなどの色素の適合対の第2の色素で、標識される。シアニン(3)及び(5)の準備の構成及び方法は、上述の国際公開第96/33406号に記載されている。細胞抽出物混合物を標識するために、反応性の色素とタンパク質抽出物は、反応性の色素と、抽出物の中のタンパク質上の潜在的な付着つまり結合部位との間に、共有結合が形成し得る程の時間、試験管3のような適切な容器でインキュベートされる。その時間は、温度に依存するが、略15分から30分である。温度の範囲は、略、0℃から25℃である。色素とタンパク質との反応は、タンパク質分子上の利用可能な結合部位の十分なパーセントが、色素に共有結合して結合した後、消滅されてもよい。適切な公知の消滅剤なら何が利用されてもよい。
【0032】
第1と第2の細胞群(1、2)は、タンパク質組成を比較即ち対照し得る細胞の2つのセットであるならば何でもよい。例えば、第1の細胞群は、野生型即ち正常のものでよく、第2の細胞群は、同一種からの変異種細胞であってもよい。一方で、第1の細胞群は正常のもので、第2の群は同一固体の癌細胞であってもよい。発達の異なる段階や細胞サイクルの異なるフェーズにおける同一固体の細胞も、利用し得る。
【0033】
異なる種からの同じタイプの細胞間のタンパク質組成の差異も、本発明のプロセスによる研究課題たり得る。さらに、本発明のプロセスは、種々の刺激即ち薬に細胞がいかに反応するかをモニターするのに、利用し得る。タンパク質変動により発現するような細胞行動を改め、「翻訳後変異(PTM)」のようなタンパク質に対する変異を含む、全てのイベントは、高精度の2D PAGEシステムに対する要求や費用が無くとも、検出し得る。当業者であれば、比較のためのタンパク質は、血清、尿、髄液、細菌、哺乳類、又は、植物などのような、生物体体液からも誘導し得ることは、認識されるところである。
【0034】
本発明の好適な実施形態は、細胞抽出物が蛍光発光色素により標識される例により示されるが、本発明は、他の同定用標識により標識される細胞抽出物を分析する場合にも、同様に適用可能である。国際公開第98/235950号は、多数の他の標識を開示する。例えば、適切な放射性核種(例えば、トリチウム、硫黄放射性核種、炭素放射性核種)による代謝標識、適切な放射性核種(例えば、放射性ヨウ素)による化学即ち酵素標識などである。安定的な天然同位体を利用することも可能である。このように標識タンパク質は、利用されている標識(ラベル)を検出し得る検出手段により画像化される。例えば、濃度計又は分光器の利用によるものや、若しくは放射能の検出によるものである。
【0035】
電気泳動ステップ
標識サンプルは混合され、図1に示すように、測定アリコートとして一つのゲル4に加えられ、それから好ましくは2D PAGEに付される。1次元SDS電気泳動は、2D PAGEの代わりに、利用し得る。1次元及び2次元電気泳動を実施するための手順は、当業者には公知である。
【0036】
2つの細胞群が共有するタンパク質は、符合スポット6を形成する。夫々の群からの同一のタンパク質の蛍光発光強度は、大部分のタンパク質に対しては、理論上同じものである。2つの細胞群が共有しないタンパク質8、9は、独立して移動する。従って、唯一の、即ち一つの群に対して異なる相対濃度を備えるタンパク質は、異なる蛍光発光強度を有する。
【0037】
国際公開第96/33406号に従い、公知の技術に関連して上述されるように、ゲルは、2つの波長蛍光発光スキャナ、蛍光発光マイクロスコープ、又は、蛍光発光を検出する公知の手段であれば何ででも、分析し得る。2つの電子画像は、異なるスペクトル特性に適応する異なる公知のフィルタセットを利用する湿性ゲルで形成される。各々の電子画像は、画素強度値の格子状アレイと想定されることが可能である。即ち、画素強度値p1,・・・pNを備える電子画像I1と、画素強度値p’1,・・・p’Nを備える電子画像I2である。
【0038】
整列ステップ
合成電子画像が形成される前に、本発明の好適な実施形態では、整列ステップが実施される。このステップは、任意のものであり、必要と目される場合のみ実施される。
【0039】
2つの異なる細胞サンプルの電気泳動が同じゲル内で実施されよって異なるゲルの間でのミスマッチは回避されようとも、合成電子画像を形成する前に整列ステップを実施することが必要であると、しばしば考えられる。その理由は、細胞抽出物上へのラベルとして、利用されるマーカー、例えば発光マーカーは、ある条件下では細胞抽出物の分子のある特性、例えば大きさに影響し得る、ということである。整列ステップの目的は、対応する画素強度値、即ち同じスポット(例えば同じタンパク質)を示す画素強度が、合成画像で一致することを保証することである。
【0040】
2つの電子画像の画素強度値は、一つの画像上のパターンが他の画像上の対応するパターンと一致するかどうかをチェックするため、従来からの画像分析法を利用して相互に比較される。2つの画像の所定の限定領域での強度値を比較する際に、例えば、相互相関関数を利用することは、このことを実施する明確な方法である。相互相関関数は、2つの画像間の整列の程度を示すスコア値を提示する。
【0041】
この最初の比較を行うと、電子画像は相互に整列する結果となってしまうことがあり、このとき整列は不必要である。
【0042】
画像が受容し得る程度にまで整列しない場合には、幾つかの様々な整列サブステップ:
電子画像を互いに整列させるサブステップ、
線型変換を適用するサブステップ、
より複雑な拡大関数を適用するサブステップ
を実施してもよい。即ち、。
【0043】
各々のサブステップは単独で使用してもよいし、他の1以上のステップと併用してもよい。整列は、2次元で実施し得る。電子画像は、整列ステップの間、継続して相互に比較される。
【0044】
結合ステップ
本発明に係る方法の良好な全体結果を得るために、当然ながら仮定されるべきことは、(勿論、タンパク質に影響する変動がサンプル間で生じていないときにのみ)2つの電子画像の中の同じ位置の画素強度値が各々の細胞サンプルの同じスポットを実際に表現する程に、電子画像間の整列が良好である、ということである。2つの整列された電子画像は図3、ステップIに見られる。図に示されるように、それらは、スポットの1つが他の画像では見えないという点で、わずかに異なる。
【0045】
一つの合成電子画像(Ires)は、電子画像I1とI2とからの対応する画素強度値p1,・・・pN及びp’1,・・・p’Nを結合することによって、得られた2つの電子画像で形成される。図3のステップIIに進む。画素強度値を結合する一つの単純な方法は、対応する画素強度値の和を形成すること、例えばp1res=(p1+p’1)/2とすることである。
【0046】
合成強度値を計算する別の方法は、以下の通りである。
【0047】
【数1】

より一般的で複雑な関数も、もちろん、合成強度値を計算する際に利用し得る。例えば、近傍の強度値を斟酌するとか、画素強度値の全体の、又は部分集合の、平均値を斟酌するなど、である。このように得られる合成電子画像Iresは、合成画素強度値p1res・・・pNresの格子状アレイを含む。
【0048】
合成画像の分析
合成画像は、続いてスポット分析領域を同定するために分析される。所与の基準に従って画素値をスポット分析領域にグループ分けするために画素値によって示される画像を分析する別の方法は、当業者には公知である。利用可能な一つの種類のアルゴリズムが、イー・バテンズ(E.Battens)その他による“A new segmentation and modeling algorithm for electrophoresis gels”(Electrophoresis 1997,18,pp.793−798)に、記載されている。
【0049】
利用可能な別の種類のアルゴリズムは、いわゆる縁検出を基にするものであり、よく知られたパターン検出アルゴリズムである。
【0050】
本発明の好適な実施形態によると、合成画像内で同定されるべき複数のスポット分析領域は、所定の値、例えば800にセットされている。スコアが適切なスポット特性値のセットを基礎にしているような所定のスコア関数に従って、800の上位のスポット分析領域が抽出されるという点において、その値は、感度のレベルとみなし得る。スポット分析領域の数は、本発明の好適な実施形態では、スポット分析領域が同定される場合に設定されるべき唯一のパラメータであることが好ましい。
【0051】
スポット分析領域の分析
スポット分析領域を電子画像に適用する前に、スポット分析領域を分析することが時々必要になる。その理由は、分析領域は真実のタンパク質スポットを表し、予想不能なアーチファクト、例えばほこりやちりの結果ではないことを保証するためである。ある領域が真実のタンパク質スポットを示していないことがスポット分析領域の分析で示唆されたら、更なる方法ステップからその領域を排除することを可能にするために、その領域をアーチファクトに標識する。更なる分析で必要と見なされるならば、アーチファクトと標識される領域は依然利用可能である。
【0052】
真実のタンパク質スポットと同定するために利用し得る数多くの基準が存在する。それらのうち、スポット分析領域のサイズと、領域の輪郭の程度が例えば(3次元オブジェクトをフィルタするための公知の方法である)ラプラスフィルタリング法(Laplace−filtration method)を用いて判定されるスポット分析領域の3次元トポグラフィとを、挙げることができる。例えば、真実のタンパク質スポットのはるかに滑らかな曲線形態に比べてちり粒子ははるかに不規則で狭い縁を有するという点で、ちり粒子は同定される。
【0053】
明白なアウトライアが除去された全スポットの部分集合に対する、対応する「中間」特性に関する、同定された真実のタンパク質スポット特性の正規化が、実施される。正規化された特性に関してスポットを標識するために、限界が判定される。
【0054】
真実のタンパク質スポットを同定する別の方法は、人工の神経系ネットワークを利用することであり、その人工の神経系ネットワークは、学習プロセスの間に、上述の正規化特性を与えられるときに真実のタンパク質スポットを同定する方法を「学習する」。上記の分析及びフィルタは、ちり濾過ステップと考えられ得る。
【0055】
電子画像上にスポット分析領域を適用する
このようにして得られたスポット分析領域を、続いて、この例では画像I1とI2である電子画像に適用する。図3のステップIVである。両方の画像に同じスポット分析領域を適用することが重要である。結合するステップの前に画像が整列(整列、拡大等)されたのなら、更なる分析において利用されるのは勿論整列された電子画像である。図4は、両方の画像で同じ領域を利用して得られる大きな利点を示す。
【0056】
図4では、画像I1、I2夫々の1行のアレイに沿った複数の画素強度値の2次元表示を示す。これらの画像を分析する一つの方法は、図において、強度値のピーク値により示される曲線の下と、所与のベースレベル(B)と、x1とx2との間との、領域を決定することである。曲線の最大値は画像間で異なるが、画像I2からの寄与分が重要である。特に、画像I2での曲線により表されるスポットが、従来技術に係る技術を利用すると殆ど検出されないほど微弱である場合はそうである。
【0057】
画像を分析するとき、スポット分析領域でのいわゆる3次元マップの体積が、図5の「3次元スポットビュー」に示されるように、判定される。3次元マップは、電気泳動にかけられた細胞サンプルの電子画像の画素強度値の3次元表示である。
【0058】
類似度の判定
本発明の好適な実施の形態によると、2つ(又はそれ以上)の画像での対応するスポット分析領域の間の類似度が、判定される。発現類似によって、ここでは、3次元曲線形態に関する、対応するスポット分析領域間の類似性を意味する。さらにこのことを示すと、図4Bに、2つの電子画像に適用される2つの異なるスポット分析領域の表示が示される。原理を示すために1行の画素強度値により表されるスポット分析領域の2次元スライスの2次元表示を、図4Bは示すに過ぎないことが、観察されなければならない。類似度を判定するときには、スポット分析領域の全ての画素強度値に関して、3次元で適用される。
【0059】
左の曲線は、類似度の低い2つの画像からのスポット分析領域を示す。即ち、曲線は互いに類似していない。このスポット分析領域の分析に関して、更なる分析に影響し得る不確実性が存在することを示すものと、このことは解釈し得る。この不確実性は、時としてさらに分析されなければならず、分析領域の画素強度値により示されるタンパク質の同定に関連し得る。即ち、タンパク質の翻訳後変異や電気泳動に関する正体不明の問題に関連し得る。
【0060】
右の曲線は、類似度の高い2つの画像からのスポット分析領域を示す。即ち、曲線は互いに類似している。この場合、高い類似度が判定されたことにより、分析領域の画素強度値により示されるタンパク質の同定が判定され更なる分析が高程度の正確性をもって実施し得ることが、保証される。
【0061】
曲線形態の間における上述の類似度を判定する方法は、他に数多くある。
【0062】
本発明の好適な実施形態では、類似度を示す値を決定するために、当業者には公知である所謂「ピアソン相関法(Pearson Correlation Method)」が利用される。他のより一般的な方法も、利用し得る。
【0063】
そのうちでは、画素強度値とスポット分析領域のサイズとに関して正規化を実施し、対応する画素強度値の間の差異の平方値を決定する、というものが挙げられ得る。
【0064】
類似度は、3次元曲線形態の規模の程度に因るのではなく、図4Bに示されるように、曲線形態の類似度に因る。
【0065】
このステップの結果として、類似度の測定がなされ、例えば、1に近似する計測値は類似の高い程度を示し、1より小さい値は類似の低い程度を示す。
【0066】
上述されたように高い程度の正確性を備える類似度を判定すると仮定するならば、スポット分析領域は、上記に概説されたステップに従って判定されればよい。
差異発現を判定する
確立された技術である、対応する検出スポットを比較するため細胞サンプルの検出スポットを示す画像分析法に従って、検出スポットの所定のパラメータの間のいわゆる差異発現DEが、実施される。差異発現とは、以下のように定義される。
【0067】
【数2】

BquantityとAquantityとは、夫々、例えば、上記に示すような各々のスポット分析領域の内部の体積として、決定される。
【0068】
DEは、画像の間におけるスポットの変動を示す。DEが1に近ければ、変動は生じていない、という結論になる。
【0069】
電子画像対の差異発現が、計算されて、図5の「スポット選択」に示すようにヒストグラム内に設定し得る。タンパク質の大部分が2つの画像の間で変動していないという状況では、全てのスポットが略同じDEを備え、大部分のスポットが同一のDEに近いヒストグラム曲線となる。理想的な状況、即ち、2つのサンプルが夫々のサンプル内に全く同じ数のタンパク質を有するという状況では、タンパク質において変動が無いときは、DEは理論上1である。しかしながら、多くの因子により、画素強度値の系統的な偏差により、ヒストグラム曲線の最大幅の点は、1からずれる。
【0070】
系統的なエラーに関して訂正されるヒストグラム曲線は、多くの異なる方法で与えられ得る。差異発現のセットは、DEの中間値によって正規化し得る。正規化されたDEのセットは、続いて正規化されたヒストグラム曲線を設定するのに利用し得る。別の方法は、ヒストグラム曲線の最大幅の点を同定し対応するDEを1と定義することである。
【0071】
訂正されたヒストグラム曲線で1とは異なるDEによって示されるスポットは、従って容易に同定され得、さらに分析し得る。
【0072】
図5のヒストグラムのデータディスプレイに見られるように、過小発現スポット若しくは過大発現スポットを標識するために、限界値が利用し得る。スポットのうちの所定のパーセントを、過小又は過大発現とみなせるように、これら限界値を選択することができる。更なる分析を実施するために、ガウス曲線も利用されてヒストグラム曲線に対応するように調整されてもよい。
【0073】
データディスプレイ
図5は、本発明に係る方法を表すデータディスプレイを示す。見てのとおり、ディスプレイは4つの異なるビューに分割される。「画像ビュー」、「スポット選択」、「3次元スポットビュー」及び「結果表」である。例えば、画像ビュー上でスポット対が選択されたら(ポイントされたら)同時に3次元スポットビューで示され、スポット選択ビュー内の「差異発現ヒストグラム」と結果表にマークされるように、これらビューはすべてリンクしている。結果表に特定のスポット対を選択しそれらが同時に他のビュー内で強調されるというのも、もちろん可能である。
【0074】
触れられる価値のある、データディスプレイのスポット選択ビューの一つの特徴は、垂直軸で利用されるパラメータを変更できることである。従って、水平軸上には差異発現を示し、例えば垂直軸には領域や、体積や、類似度などを示すスポット選択ビューで、特定のスポット対を選ぶことができる。この特徴は、特に大部分のスポット対と異なる差異発現を備えるスポット対を分析する際に、効果的である。従って、特定のスポット対をより正確に分析するために、異なる上記のパラメータの値を容易に入手することが、可能である。
【0075】
上述のように、本発明に係る方法の全てのステップ又は一部のステップは、例えば、1次元電気泳動のような、1次元分離法で利用可能である。
【0076】
上述の全てのステップは、多くの異なるサンプルからの分析データをロードする能力を備える完全な自動プロセスで実施され得、これらのデータ全てに関する同時分析をなし得る。
【0077】
本発明は、上述の好適な実施形態に限定されない。種々の代替策、変更、及び等価物が、利用可能である。従って、上記の実施形態は、添付の請求項により定義される本発明の範囲を、限定するものと捉えられるべきではない。
【特許請求の範囲】
【請求項1】
複数の成分を含む複数の細胞抽出物サンプルを比較する方法であって、当該方法が、
2以上の群の細胞から2以上の細胞抽出物のサンプルを準備するステップと、
上記細胞抽出物のサンプルの各々を適合マーカーセットの別々のものに暴露して、マーカーを細胞抽出物に結合させて細胞抽出物を標識するステップであって、上記マーカーセットの各々のマーカーが、細胞抽出物に結合させることができて上記セットの他のすべてのマーカーから個別に検出できるものである、ステップと、
上記標識細胞抽出物のサンプルを混合して混合物を形成するステップと、
上記混合物を分離して細胞抽出物中の成分を分離するステップと、
個々のマーカーの検出によって、分離した混合物の2以上の電子画像であって、各々の画像が他のものとは異なるマーカーの検出によって表示される、2以上の電子画像を得るステップと
を含んでおり、当該方法が、
得られた2以上の電子画像から1つの合成電子画像(Ires)を作成するステップと、
合成電子画像を分析してスポット分析領域を同定するステップと、
上記2以上の電子画像の各々で上記の同定したスポット分析領域を適用して、上記領域を評価して上記細胞抽出物の成分を表すスポットを検出するステップと
をさらに含んでいることを特徴とする、方法。
【請求項2】
上記分離ステップが電気泳動によって実施される、請求項1記載の方法。
【請求項3】
上記マーカーセットが、色素を細胞抽出物に共有結合して細胞抽出物を標識する発光色素セットであり、上記色素セットの各色素が、細胞抽出物に共有結合させることができて、上記色素セットの他のすべての色素と略同じイオン及びpH特性を有するが、上記色素セットの他のすべての色素とは実質的に異なる波長の光を発光して異なる色の光を呈する、請求項2記載の方法。
【請求項4】
2つの電子画像に適用された対応するスポット分析領域で画素強度値間の類似度を判定するステップをさらに含む、請求項1乃至請求項3のいずれか1項記載の方法。
【請求項5】
上記類似度がピアソン相関法で判定される、請求項4記載の方法。
【請求項6】
合成画像で同定されるスポット分析領域の数が所定の値に設定される、請求項1乃至請求項5のいずれか1項記載の方法。
【請求項7】
上記スポット分析領域が、上記領域の3次元トポグラフィに関する所定の基準に従って上記領域を類別するためのフィルタリングステップに付される、請求項1乃至請求項6のいずれか1項記載の方法。
【請求項8】
対応する検出スポットの所定のパラメータ間の差異発現(DE)を作成することによって、対応する検出スポットを比較するステップをさらに含む、請求項1乃至請求項7のいずれか1項記載の方法。
【請求項9】
差異発現を正規化してヒストグラムとして表す、請求項8記載の方法。
【請求項10】
対応スポットの過小発現及び過大発現を表す所定の限界値をヒストグラムに設定する、請求項9記載の方法。
【請求項11】
得られた2以上の電子画像から1つの合成電子画像(Ires)を作成するステップが、対応する画素強度値(p1,・・・,pN;p’1,・・・,p’N)を所定の関数に従って結合することによって達成される、請求項1乃至請求項10のいずれか1項記載の方法。
【請求項12】
上記関数が、対応する画素強度値の和(p1res=(p1+p’1)/2)である、請求項11記載の方法。
【請求項13】
上記関数に従い各々の合成画素強度値が以下の通り決定される、請求項11記載の方法。
【数1】

【請求項14】
合成電子画像(Ires)を作成する前に、対応するスポットが一致するように電子画像を整列させる整列ステップが実施される、請求項1乃至請求項13のいずれか1項記載の方法。
【請求項15】
上記整列ステップが、
2以上の電子画像を互いに整列させるサブステップ、
線型変換を適用するサブステップ、
拡大関数を適用するサブステップ
のいずれか又はそれらの組合せを含む、請求項14記載の方法。
【請求項16】
当該方法が、所定の数の所定の可変ビューを含むユーザインタフェースディスプレイによって制御され、所定の可変ビューがすべて同時に利用可能であり、所定の可変ビューの各々が、実施される様々なステップを図式的に又は数値で表示し、上記表示が、スポット又はスポット分析領域の図式的又は数的オブジェクトを含んでいて、対応するオブジェクトが別々のビューで互いにリンクしている、請求項1乃至請求項15のいずれか1項記載の方法。
【請求項1】
複数の成分を含む複数の細胞抽出物サンプルを比較する方法であって、当該方法が、
2以上の群の細胞から2以上の細胞抽出物のサンプルを準備するステップと、
上記細胞抽出物のサンプルの各々を適合マーカーセットの別々のものに暴露して、マーカーを細胞抽出物に結合させて細胞抽出物を標識するステップであって、上記マーカーセットの各々のマーカーが、細胞抽出物に結合させることができて上記セットの他のすべてのマーカーから個別に検出できるものである、ステップと、
上記標識細胞抽出物のサンプルを混合して混合物を形成するステップと、
上記混合物を分離して細胞抽出物中の成分を分離するステップと、
個々のマーカーの検出によって、分離した混合物の2以上の電子画像であって、各々の画像が他のものとは異なるマーカーの検出によって表示される、2以上の電子画像を得るステップと
を含んでおり、当該方法が、
得られた2以上の電子画像から1つの合成電子画像(Ires)を作成するステップと、
合成電子画像を分析してスポット分析領域を同定するステップと、
上記2以上の電子画像の各々で上記の同定したスポット分析領域を適用して、上記領域を評価して上記細胞抽出物の成分を表すスポットを検出するステップと
をさらに含んでいることを特徴とする、方法。
【請求項2】
上記分離ステップが電気泳動によって実施される、請求項1記載の方法。
【請求項3】
上記マーカーセットが、色素を細胞抽出物に共有結合して細胞抽出物を標識する発光色素セットであり、上記色素セットの各色素が、細胞抽出物に共有結合させることができて、上記色素セットの他のすべての色素と略同じイオン及びpH特性を有するが、上記色素セットの他のすべての色素とは実質的に異なる波長の光を発光して異なる色の光を呈する、請求項2記載の方法。
【請求項4】
2つの電子画像に適用された対応するスポット分析領域で画素強度値間の類似度を判定するステップをさらに含む、請求項1乃至請求項3のいずれか1項記載の方法。
【請求項5】
上記類似度がピアソン相関法で判定される、請求項4記載の方法。
【請求項6】
合成画像で同定されるスポット分析領域の数が所定の値に設定される、請求項1乃至請求項5のいずれか1項記載の方法。
【請求項7】
上記スポット分析領域が、上記領域の3次元トポグラフィに関する所定の基準に従って上記領域を類別するためのフィルタリングステップに付される、請求項1乃至請求項6のいずれか1項記載の方法。
【請求項8】
対応する検出スポットの所定のパラメータ間の差異発現(DE)を作成することによって、対応する検出スポットを比較するステップをさらに含む、請求項1乃至請求項7のいずれか1項記載の方法。
【請求項9】
差異発現を正規化してヒストグラムとして表す、請求項8記載の方法。
【請求項10】
対応スポットの過小発現及び過大発現を表す所定の限界値をヒストグラムに設定する、請求項9記載の方法。
【請求項11】
得られた2以上の電子画像から1つの合成電子画像(Ires)を作成するステップが、対応する画素強度値(p1,・・・,pN;p’1,・・・,p’N)を所定の関数に従って結合することによって達成される、請求項1乃至請求項10のいずれか1項記載の方法。
【請求項12】
上記関数が、対応する画素強度値の和(p1res=(p1+p’1)/2)である、請求項11記載の方法。
【請求項13】
上記関数に従い各々の合成画素強度値が以下の通り決定される、請求項11記載の方法。
【数1】

【請求項14】
合成電子画像(Ires)を作成する前に、対応するスポットが一致するように電子画像を整列させる整列ステップが実施される、請求項1乃至請求項13のいずれか1項記載の方法。
【請求項15】
上記整列ステップが、
2以上の電子画像を互いに整列させるサブステップ、
線型変換を適用するサブステップ、
拡大関数を適用するサブステップ
のいずれか又はそれらの組合せを含む、請求項14記載の方法。
【請求項16】
当該方法が、所定の数の所定の可変ビューを含むユーザインタフェースディスプレイによって制御され、所定の可変ビューがすべて同時に利用可能であり、所定の可変ビューの各々が、実施される様々なステップを図式的に又は数値で表示し、上記表示が、スポット又はスポット分析領域の図式的又は数的オブジェクトを含んでいて、対応するオブジェクトが別々のビューで互いにリンクしている、請求項1乃至請求項15のいずれか1項記載の方法。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図5】




【図2】


【図3】


【図4A】


【図4B】


【図5】


【公開番号】特開2013−33052(P2013−33052A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−198280(P2012−198280)
【出願日】平成24年9月10日(2012.9.10)
【分割の表示】特願2001−535179(P2001−535179)の分割
【原出願日】平成12年10月31日(2000.10.31)
【出願人】(597064713)ジーイー・ヘルスケア・バイオサイエンス・アクチボラグ (109)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2012−198280(P2012−198280)
【出願日】平成24年9月10日(2012.9.10)
【分割の表示】特願2001−535179(P2001−535179)の分割
【原出願日】平成12年10月31日(2000.10.31)
【出願人】(597064713)ジーイー・ヘルスケア・バイオサイエンス・アクチボラグ (109)
【Fターム(参考)】
[ Back to top ]

