同位体標識化内部標準物質を用いる定量方法、該定量方法を実行する解析システムおよび該解析のためのプログラム
【課題】代謝的に標識することができない、組織、生体液、細胞、細胞器官又はタンパク質複合体などのサンプル中の、1若しくは複数の生体分子を精度よく定量する、さらには、絶対定量する。質量分析スペクトルの定量的解析を可能とする解析システムおよび解析方法を提供する。前記定量的解析方法をコンピュータに実行させるプログラムを提供する。
【解決手段】予め同位体標識された生体分子を調製し、各サンプルに加えて、質量分析装置で測定する。また、あらかじめ調製した同位体標識された生体分子を定量しておくことにより、生体分子の網羅的な絶対定量をも可能である。また、生体分子の質量分析法において、同位体標識法とともに、質量分析スペクトルに波形分離処理を施すことにより、より高精度な生体分子発現の定量的解析が可能である。
【解決手段】予め同位体標識された生体分子を調製し、各サンプルに加えて、質量分析装置で測定する。また、あらかじめ調製した同位体標識された生体分子を定量しておくことにより、生体分子の網羅的な絶対定量をも可能である。また、生体分子の質量分析法において、同位体標識法とともに、質量分析スペクトルに波形分離処理を施すことにより、より高精度な生体分子発現の定量的解析が可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、サンプルに添加し、質量分析計で測定することにより、サンプル中の1又は複数の生体分子を定量する方法に関する。
【0002】
さらに、本発明は生体分子の定量的解析方法に係り、より詳細には、本発明は、同位体標識化生体分子を利用した解析方法および該解析のためのプログラムに関する。
【背景技術】
【0003】
ゲノムとは、その生物の全ての遺伝子と遺伝子間領域を含む、一つの細胞に含まれる全DNAのことであり、我々が知る生命はゲノムによって決められている。現在、既にヒトの塩基配列が読み終わり、遺伝子の数も予測されつつある。しかし、生命現象を解明するためには、塩基配列情報だけでは不充分であり、実際に大腸菌、酵母、線虫、ショウジョウバエなど全ゲノムが明らかになったが、これらモデル生物の全ての遺伝子機能が明らかになったわけではない。
【0004】
プロテオミクスはポスト・ゲノム時代の重要な項目の一つであるが、この技術が遺伝子の機能解析を行う上で注目を集めつつある。現在のプロテオーム技術、つまり質量分析装置とデータベース、そしてそれらを結ぶ検索エンジンによってタンパク質同定が飛躍的に容易になったことによって、特定のタンパク質混合物(例えば、あるタンパク質複合体)を網羅的に同定できるようになった(たとえば、非特許文献1−4参照)。しかしながら、タンパク質を同定するだけでは、あるいは構成成分を明らかにするだけでは、機能解析としては不十分である。なぜなら、プロテオームは動的なものであり、その時々あるいは場所によって発現状態が変化している。よって個々のタンパク質の変動解析を行ってこそ、プロテオミクスの利点が活かされる筈である。そこで、DNAチップにおけるDifferential Displayと同様に、プロテオームにおいてもタンパク質レベルでのDifferential Displayを作製し、個々のタンパク質レベルの変化を捉える種々の試みが行われている。
【0005】
プロテオーム解析の手段として二次元電気泳動が汎用されているが、このようなゲル上で染色されたタンパク質のスポットを比べる方法では、比較すべき二つの試料に存在する個々のタンパク質の存在量を正確に比較することは極めて難しい。なぜなら、
1;細胞からの抽出の再現性や細胞分画・粗精製など前処理操作による再現性
2;二次元電気泳動などタンパク質の分離における再現性
3;ゲル染色の再現性
などに課題があり、さらに
4;一つのスポット・バンドに複数のタンパク質が混在している場合は個々のタンパク質に対する定量性は失われる。
よって現状では、ゲル染色によるパターン比較では発現量が10-100倍以上と劇的な変化をする場合を除き、微小な変化を捉えることは難しい。
【0006】
また、このように劇的な変化を検知したとしても、ゲル上のスポットを比較するだけでは、そのスポットが対応するタンパク質が不明のままであり、ゲルから目的のスポットを切り出し質量分析装置によってタンパク質の同定作業を行うことになる。
【0007】
質量分析装置による分析において、イオン化率の再現性が悪いため、定量的データを得るためには、必ず内部標準物質による補正が必要である。また、質量分析装置で分析するまでの前処理操作(抽出や誘導体化、分離など)により、実験ごとに定量値を非常に変動させる。そこで、目的の低分子物質又はタンパク質等を安定同位体で標識した内部標準物質を、サンプルに予め添加することで、これらの全ての補正が可能になり、定量精度が飛躍的に向上している。薬物、脂質およびタンパク質などにおいて、安定同位体元素で標識した内部標準物質を用いて、定量分析が行われている(たとえば、非特許文献5−10参照)。
【0008】
上記の薬物や脂質のような低分子物質およびタンパク質の質量分析装置による定量は、あくまでも目的とする物質が既知の場合に適用できる。一方、プロテオミクスでは未知かつ多数の目的物質を測定する必要がある。このため、近年、比較すべきサンプルに含まれるタンパク質全てを標識することにより、質量分析装置を使った定量的プロテオームが可能になってきている。現在報告されている手法(たとえば、非特許文献11参照)を大きく分けると、以下の3通りに分類することが出来る(図1参照)。
【0009】
In vivo標識法
安定同位体と質量分析装置を組み合わせた定量的プロテオームとして、小田らの15Nで酵母のタンパク質を標識する方法がある(たとえば、特許文献1および非特許文献12−13参照)。比較する2種類の細胞を、それぞれ同位体標識アミノ酸を含む培地と同位体標識アミノ酸を含まない培地で培養し、培養された細胞を混合した後、タンパク質の抽出および分画をして、質量分析装置で分析し、同位体標識されたタンパク質と同位体標識されてないタンパク質とのピーク強度を比較する。この方法では、分析における回収率の誤差があったとしても、細胞間の相違を定量的に知ることができ、また、スペクトルデータによりタンパク質の同定を同時に行うことが出来る。
【0010】
しかしながら、このin vivo標識法は、培養細胞であるならば原理的に全ての細胞に応用可能であるが、実際には培養条件を変えることで細胞の成長速度が大きく変わるなど、安定同位体を含む培地での培養は困難なことが多い。つまり、培養条件に影響を受けないような限られた細胞でしか実施できない。さらに、動物や人などの組織は、容易に培養することができず、この方法によって測定することはできない。
【0011】
消化前のIn vitro標識法
そこで、組織中のタンパク質を網羅的に定量する方法として、以下の方法が見出された。すなわち、比較する2種類のサンプルに対し、それぞれ同位体標識したシステイン残基反応試薬と同位体標識していないシステイン残基反応試薬を加えることによりサンプル中に含まれるタンパク質のシステイン残基を標識し、カラムによってタンパク質を精製し、質量分析装置で分析し、ペアのピークの強度を比較することでタンパク質定量が可能になった(たとえば、非特許文献14−19参照)。しかしながら、この方法では、システイン残基を含まないタンパク質は定量できず、また、精製など前処理段階での実験ごとに定量値が変動することの補正はできない。
【0012】
消化後・消化中のin vitro標識法
システイン残基を含まないタンパク質や精製の操作性を向上した方法がいくつか報告されている。比較する2種類のサンプルに含まれるタンパク質を酵素消化して得られたペプチド断片のC末、N末、グルタミン酸残基、アスパラギン酸残基などを、同位体標識した分子と同位体標識していない分子でそれぞれ標識し、質量分析装置で分析し、ペアのピークの強度を比較することでタンパク質定量が可能になった(たとえば、非特許文献20−23参照)。
【0013】
しかしながら、これらの方法では、サンプルに含まれるタンパク質の消化、分画、精製など前処理段階での実験ごとに定量値が変動することの補正はできない。
【0014】
上述したように、現在の定量的プロテオーム解析法は、in vivo標識法とin vitro標識法に大別できる。前者は、標識が簡単であり、高い再現性データが期待できるが、組織、生体液、細胞器官、タンパク質複合体、安定同位体を含む培地中で生育できない細胞などがサンプルの場合には、それらに含まれる安定同位体を取り込まないタンパク質には適応できない。後者は、あらゆるサンプルに応用できるが、標識するまでのサンプルの破砕、抽出、消化、分画、精製など前処理段階での実験ごとに定量値が変動することの補正はできない。また、標識反応自体が簡単でない場合が多く実験者の経験の差が出やすい。
【0015】
これまでの定量的プロテオーム解析法は、内部標準物質と被検体とを直接比較していたため、測定のたびにサンプル調製を行う必要があった。また、3個以上のサンプルの比較を行うには単純ではなく、それだけ精度も低下していた。さらに、測定対象が変わると標識すべき内部標準物質も変わるため、その都度、標識についての条件検討を行う必要があり、また、実験間の比較もできなかった。
【0016】
さらには、これまでの定量的プロテオーム解析法は、内部標準物質と被検体とを直接比較しており、測定対象が変わると標識すべき内部標準物質も変える必要があった。一方、内部標準物質の生体分子を定量することは容易ではなく、したがって、絶対定量をすることが非常に困難であった。
【0017】
これまで報告されている定量的プロテオーム解析法のうち絶対定量する方法としては、AQUA法がある(たとえば、特許文献2参照)。これは、合成ペプチドの一部に安定同位体を組込み、目的のタンパク質との比を求める方法である。しかし、この方法では、実験ごとに常に同位体標識した合成ペプチドを用意し、さらに、実験毎に定量する必要があるため、網羅的に定量するのは困難である。また、目的タンパク質の精製過程における回収率の影響や、一般的に30-50%と言われているゲル内消化効率の影響も受け、正確に定量することは困難である。
【0018】
一方で、ポストゲノム時代をむかえて、生体内の生体分子として重要であるタンパク質を分離同定し、さらに定量することが、ますます重要になってきている。特に、病気の診断・治療技術の研究開発には、多数のタンパク質の機能を解明することが必要である。
【0019】
従来、細胞が発現するタンパク質のプロテオーム解析には、二次元電気泳動が用いられていた。ここで、用語「プロテオーム解析」とは、遺伝子情報と細胞内で複雑に相互作用している多様なタンパク質との関係を明らかにする解析のこという(たとえば、非特許文献24参照)。つまり、プロテオーム解析は、細胞を構成するすべてのタンパク質を網羅的に解析する手法をいう。
【0020】
前述の二次元電気泳動では、発現したタンパク質をゲル展開し、対象とするタンパク質に対応したスポットの切り出しにより、その種類を総合的に同定することを可能にするものである。このため、二次元電気泳動はプロテオーム解析における有用な定性的解析手段である。
【0021】
しかし、展開されるタンパク質の量が僅少であり、分析時の回収率に誤差が生じ易いことに起因して、二次元電気泳動ではタンパク質の定量的解析には不向きであることが指摘されている。
【0022】
他方、もう一つの重要なタンパク質の解析技術として、質量分析法が利用されている。本方法は質量分析装置を用いたタンパク質やペプチドの正確な質量を分析する方法である。この質量分析装置は、一般には、タンパク質及びペプチドをイオン化する装置と、その質量に応じて分離する質量分離部を備え、該質量を分析する質量分析計とから構成されている。そして、質量分析計とタンパク質のデータベース、及びそれらを結ぶ検索システムによって、今日ではタンパク質の同定は飛躍的に容易になったといえる。そのため、特定のタンパク群(たとえば、ある複合体を形成するタンパク群)を網羅的に同定することが可能である。
【0023】
しかし、質量分析法によってタンパク質を同定する、あるいは構成成分を明らかにするだけでは、タンパク質の機能解析としては不十分である。なぜなら、プロテオームによる機能解析では、病態との比較や、薬物あるいはリガンドによる刺激、それに標的遺伝子のノックアウトや過剰発現などの影響による個々のタンパク質の変動解析、つまりは、タンパク質の発現量が比較可能である定量的データが必要になる。
【0024】
かかる背景のもと、質量分析装置を用いて、同位体標識を利用した定量的解析が試みられている(たとえば、非特許文献25参照)。
【先行技術文献】
【非特許文献】
【0025】
【非特許文献1】「ネイチャージェネティクス (Nature Genetics)」第20巻、1998年9月、p. 46−50
【非特許文献2】「ジャーナル・オブ・セル・バイオロジー (Journal of Cell Biology)」第141巻、第4号、1998年5月18日、p. 967−977
【非特許文献3】「カレント・オピニオン・イン・セル・バイオロジー (Current Opinion in Cell Biology)」第15巻、第2号、2003年4月、p. 199−205
【非特許文献4】「カレント・オピニオン・イン・ケミカル・バイオロジー (Current Opinion in Chemical Biology)」第7巻、第1号、2003年2月、p. 21−27
【非特許文献5】「サージェリー・トゥデイ(Surgery Today)」第23巻、第3号、1993年、p. 228−233
【非特許文献6】「ラピッド・コミュニケーションズ・イン・マス・スペクトロメトリー (Rapid Communications in Mass Spectrometry)」第8巻、第5号、1994年、p. 377−380
【非特許文献7】「ジャーナル・オブ・クロマトグラフィー・エー (Journal of Chromatography A)」第694巻、第1号、1995年5月、p. 209−218
【非特許文献8】「アナリティカル・バイオケミストリー (Analytical Biochemistry)」第231巻、第1号、1995年10月、p. 141−150
【非特許文献9】「ジャーナル・オブ・クロマトグラフィー・ビー (Journal of Chromatography B)」第729巻、第1−2号、1999年6月、p. 147−155
【非特許文献10】「プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンスイズ・オブ・ザ・ユナイテッド・ステイツ・オブ・アメリカ (Proceedings of the National Academy of Sciences of the United States of America)」第100巻、第12号、2003年6月、p. 6940−6945
【非特許文献11】「カレント・オピニオン・イン・ケミカル・バイオロジー (Current Opinion in Chemical Biology)」第7巻、第1号、2003年2月、p. 70−77
【非特許文献12】「プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンスイズ・オブ・ザ・ユナイテッド・ステイツ・オブ・アメリカ (Proceedings of the National Academy of Sciences of the United States of America)」第96巻、第12号、1999年6月、p. 6591−6596
【非特許文献13】「メソッズ (Methods)」第29巻、第2号、2003年2月、p. 124−130
【非特許文献14】「ネイチャー・バイオテクノロジー (Nature Biotechnology)」第17巻、第10号、1999年10月、p. 994−999
【非特許文献15】「アナリティカル・ケミストリー (Analytical Chemistry)」第70巻、第24号、1998年12月、p. 5150−5158
【非特許文献16】「ラピッド・コミュニケーションズ・イン・マス・スペクトロメトリー (Rapid Communications in Mass Spectrometry)」第16巻、第15号、2002年、p. 1416−1424
【非特許文献17】「ジャーナル・オブ・ジ・アメリカン・ソサエティ・マス・スペクトロメトリー (J Am Soc Mass Spectrum)」第12巻、第12号、2001年12月、p. 1238−1246
【非特許文献18】「ネイチャー・バイオテクノロジー (Nature Biotechnology)」第19巻、第10号、2001年10月、p. 946−951
【非特許文献19】「モレキュラー・アンド・セルラー・プロテオミクス (Molecular and Cellular Proteomics)」 第1巻、第1号、2002年1月、p. 19−29
【非特許文献20】「アナリティカル・ケミストリー (Analytical Chemistry)」第73巻、第13号、2001年7月、p. 2836−2842
【非特許文献21】「ラピッド・コミュニケーションズ・イン・マス・スペクトロメトリー (Rapid Communications in Mass Spectrometry)」第15巻、第14号、2001年、p. 1214−1221
【非特許文献22】「ネイチャー・バイオテクノロジー (Nature Biotechnology)」第20巻、第2号、2002年2月、p. 163−170
【非特許文献23】「ネイチャー・バイオテクノロジー (Nature Biotechnology)」第20巻、第5号、2002年5月、p. 512−515
【非特許文献24】Karn, P. Science 270, pp. 369-370, 1995
【非特許文献25】「プロテオーム解析法」羊土社 2000年7月10日発行 pp. 111-122
【特許文献】
【0026】
【特許文献1】USP 6391649
【特許文献2】WO2003 016861
【発明の概要】
【発明が解決しようとする課題】
【0027】
本発明は、このような状況に鑑みてなされたものであり、その解決しようとする課題は、代謝的に標識することができないサンプル(例えば、組織、生体液、細胞、細胞器官、タンパク質複合体など)中の1又は複数の生体分子を精度よく定量すること、さらには、絶対定量することにある。
【0028】
また、同位体標識を利用した解析において、一つの質量分析スペクトルピークに対して、複数の異なる生体分子からの質量スペクトルが寄与している場合もあり、生体分子の定量的解析を困難にしている。そこで、本発明は、質量分析スペクトルに対して複数の異なる生体分子からの質量分析スペクトルが寄与している場合であっても、質量分析スペクトルの定量的解析を可能とする解析システムおよび解析方法を提供することである。さらに、本発明では、かかる生体分子に関する定量的解析と機能情報を付加させる、解析システムおよび解析方法を提供する。
【0029】
さらにまた、前記定量的解析方法をコンピュータに実行させるプログラムを提供することである。
【課題を解決するための手段】
【0030】
本発明者らは、上記課題を解決するため、鋭意検討を重ねた結果、生体分子に対する質量分析法において、あらかじめ同位体標識された生体分子を調製し、各サンプルに加えて質量分析装置で測定することにより、代謝的に標識することができないサンプル(例えば、組織、生体液、細胞、細胞器官、タンパク質複合体など)中の1又は複数の生体分子を精度よく定量することを見出した。また、あらかじめ調製した同位体標識された生体分子を定量しておくことにより、生体分子の網羅的な絶対定量をも可能であることを見出し、本発明を完成するに至った。また、生体分子の質量分析法において、同位体標識法とともに、質量分析スペクトルに波形分離処理を施すことにより、より高精度な生体分子発現の定量的解析が可能であることを見出し、本発明を完成するに至った。
【0031】
すなわち、本発明の第一の態様では、
[1] サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、加えることを特徴とする質量分析計によるサンプル中の生体分子を定量する方法、
[2]サンプル中の1又は複数の生体分子を定量する方法であって、
同位体標識された生体分子の前駆体を加えて培養し、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、サンプルに添加する工程と、
当該各サンプルから生体分子を抽出し分画する工程と、
当該分画した各生体分子を質量分析装置により分析する工程と、
質量分析の情報から当該生体分子を同定する工程と、
各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を含む、生体分子を定量する方法、
[3] 各サンプル間の該ピーク強度比を比較し、生体分子を相対定量する、前記[1]または[2]のいずれか一に記載の方法、
[4] 代謝的に同位体標識された生体分子である内部標準物質中の、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が既知量である、前記[1]ないし[3]のいずれか一に記載の方法、
[5] 定量が絶対定量である、前記[1]ないし[4]のいずれか一に記載の方法、
[6] サンプル中の1または複数の生体分子を定量する方法であって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、添加する工程と、
(2)当該サンプル中の各生体分子を質量分析する工程と、
(3)質量分析の情報から当該生体分子を同定する工程と、
(4)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を含む、サンプル中の1または複数の生体分子を定量する方法、
[7] サンプルから生体分子を抽出し分画する工程をさらに含む、前記[6]に記載の方法、
[8] 同位体標識された生体分子の前駆体を加えて培養し、生体分子を代謝的に同位体標識する工程をさらに含む、前記[6]または[7]に記載の方法、
[9] 複数のサンプルについて行い、各サンプル間の各生体分子のピーク強度比を比較する工程をさらに含む、前記[6]ないし[8]のいずれか一に記載の方法、
[10] サンプル中の1または複数の生体分子を絶対定量する方法であって、
代謝的に同位体標識された生体分子である内部標準物質中の生体分子、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が、既知量である、[6]ないし[9]のいずれか一に記載の方法、
[11] 代謝的に同位体標識された生体分子である内部標準物質中の生体分子を、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を、絶対定量する工程をさらに含む、前記[6]ないし[10]のいずれか一に記載の方法、
[12] 前記[11]に記載の工程が、
(a)同位体非標識の合成ペプチドを、代謝的に同位体標識された生体分子である内部標準物質、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞に添加する工程と、
(b)当該代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞から生体分子を抽出し分画する工程と、
(c)当該分画した各生体分子を質量分析する工程と、
(d)質量分析の情報から当該生体分子を同定する工程と、
(e)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を絶対定量する工程と、
を含む、前記[11]に記載の方法、
[13] サンプルが、代謝的に標識できないサンプルである、前記[1]ないし[12]のいずれか一に記載の方法、
[14] サンプルが、細胞培養によって標識できないサンプルである、前記[1]ないし[13]のいずれか一に記載の方法、
[15] 生体分子がタンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、前記[1]ないし[14]のいずれか一に記載の方法、
[16] 生体分子がタンパク質である、前記[1]ないし[15]のいずれか一に記載の方法、
[17] 生体分子がタンパク質であって、当該タンパク質を抽出し分画し、タンパク質を消化する工程をさらに含む、前記[1]ないし[16]のいずれか一に記載の方法、
[18] サンプルが、組織、生体液、細胞、細胞器官およびタンパク質複合体からなる群から選択されるいずれかのサンプルである、前記[1]ないし[17]のいずれか一に記載の方法、
[19] 同位体が、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[1]ないし[18]のいずれか一に記載の方法、
[20] 同位体が、13Cである、前記[1]ないし[19]のいずれか一に記載の方法、
[21] 前記[1]ないし[20]のいずれか一に記載の方法に用いられる代謝的に同位体標識された生体分子である内部標準物質、
[22] 前記[1]ないし[20]のいずれか一に記載の方法に用いられる代謝的に同位体標識された生体分子である内部標準物質を含む細胞、
[23] 代謝的に同位体標識された生体分子である内部標準物質を含有する、前記[1]ないし[20]のいずれか一に記載の方法のための試薬、
[24] 代謝的に同位体標識された生体分子である内部標準物質を含む細胞を含有する、前記[1]ないし[20]のいずれか一に記載の方法のための試薬、
[25] 代謝的に同位体標識された生体分子である内部標準物質の、[1]ないし[20]のいずれか一に記載の方法のための使用、
[26] 代謝的に同位体標識された生体分子である内部標準物質を含む細胞の、前記[1]ないし[20]のいずれか一に記載の方法のための使用、
[27] 質量分析装置において得られた、サンプル中の1または複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1又は複数の生体分子の定量をさせるためのプログラムであって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加し、当該各サンプル中の各生体分子を質量分析装置により分析し、質量分析装置から分析結果を受ける工程と、
(2)質量分析の分析結果から当該生体分子を同定する工程と、
(3)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、を実行させるプログラム、
[28] 質量分析装置において得られた、サンプル中の1または複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1又は複数の生体分子の定量をさせるためのプログラムであって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加し、当該各サンプルから生体分子を抽出し分画し、当該分画した各生体分子を質量分析装置により分析し、質量分析装置から分析結果を受ける工程と、
(2)質量分析の分析結果から当該生体分子を同定する工程と、
(3)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、を実行させるプログラム、
[29] 複数のサンプルについて行い、各サンプル間の各生体分子のピーク強度比を比較する工程をさらに実行させる、前記[27]または[28]に記載のプログラム、
[30] サンプル中の1又は複数の生体分子の絶対定量をするためのプログラムであって、代謝的に同位体標識された生体分子である内部標準物質中の、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が既知量である、前記[27]ないし[29]のいずれか一に記載のプログラム等を提供する。
【0032】
また、本発明の第二の態様では、[31] 第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子との質量分析に関するデータの解析システムであって、前記第一および第二の生体分子の質量分析を実行する質量分析装置と、前記質量分析装置から、前記生体分子の質量分析に関するデータを受けるデータ入出部を有する制御部と、を備え、前記制御部は、生体分子の構成成分の配列が決定された前記生体分子に対する第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子に対する第二のm/zの値とを決定するとともに、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析装置にて得られた質量分析に関するデータから抽出する処理部と、前記処理部から前記第一および第二のm/zの値における時間に対する質量分析スペクトル(マスクロマトグラム)を受け、前記時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する波形処理部と、を備える解析システムを提供する。かかる構成によれば、固有の生体分子に由来する質量分析スペクトルを入手でき、より定量的な解析を可能とする。
【0033】
本発明の好ましい態様では、前記[31]に記載の解析システムにおいて、[32] 前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される。かかる構成によれば、同位体非標識と同位体標識の構成成分を含む生体分子の発現変化を、一方の生体分子に着目しながら追跡可能となる。
【0034】
本発明の好ましい態様では、前記[31]または [32]に解析システムにおいて、[33] 前記制御部は、前記波形分離処理部からの波形分離処理により得られた固有の生体分子に由来する波形の面積を算出し、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、前記第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する演算部を、さらに備える。かかる構成によれば、一方のタンパク質との対比により、タンパク質の発現の定量的解析が可能となる。
【0035】
本発明の好ましい態様では、前記[31]ないし[33]のうち何れか一に記載の解析システムにおいて、[34] 前記制御部は、波形分離後、前記生体分子の構成成分の配列毎に分類し、前記配列を生体分子の機能情報を有するデータベースに照合し、その照合結果から、前記配列と機能とを関連付けてグループ化する情報付加部を、さらに備える。かかる構成によれば、波形分離された生体分子の構成成分の配列と機能情報とを関連付けることが可能となる。
【0036】
本発明の好ましい態様では、前記[31]ないし[34]のうち何れか一に記載の解析システムにいて、[35] 前記制御部は、生体分子の構成成分の配列から生体分子を特定し、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする演算部を、さらに備える。かかる構成によれば、生体分子の構成成分の代表的な定量値を求めることができ、後述するデータベースとの照合により機能情報との関連付けをすることができる。
【0037】
本発明の好ましい態様では、前記[31]ないし[35]のうち何れか一に記載の解析システムにおいて、[36] 前記制御部は、生体分子の構成成分の配列を、生体分子の機能情報を有するデータベースに照合し、当該生体分子の機能情報を取得する情報付加部を、さらに備える。かかる構成によれば、構成成分の代表的定量値と機能情報との関連性に関する知見を得ることができる。
【0038】
本発明の好ましい態様では、前記[31]ないし[36]のうち何れか一に記載の解析システムにおいて、[37] 前記第一および第二の生体分子の質量分析を実行する際、内部標準物質の存在下で質量分析を実行し、前記波形処理部は、前記内部標準物質のm/zの値における時間に対する質量分析スペクトル(マスクロマトグラム)を受けて、前記内部標準物質に固有の波形を得るために、さらに波形分離処理を行い、前記演算部は、前記波形処理部からの内部標準物質に固有の波形面積を算出するとともに、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を、さらに算出する。かかる構成によれば、内部標準物質中の生体分子が既知量である場合には、絶対定量が可能となる。
【0039】
また、本発明の第三の態様では、[38] 第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータの解析システムであって、前記第一および第二の生体分子並びに同位体標識された生体分子の質量分析を実行する質量分析装置と、前記質量分析装置から、前記生体分子の質量分析に関するデータを受けるデータ入出部を有する制御部と、を備え、前記制御部は、生体分子の構成成分の配列が決定された前記生体分子に対する第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記同位体標識された生体分子に対する内部標準物質のm/zの値とを決定するとともに、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析装置にて得られた質量分析に関するデータから抽出する処理部と、前記処理部から前記第一および第二並びに内部標準物質のm/zの値における時間に対する質量分析スペクトル(マスクロマトグラム)を受け、前記時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する波形処理部と、を備える解析システムを提供する。かかる構成によれば、生体分子が同位体非標識であっても、同位体標識された内部標準物質との比較において、その生体分子に固有の生体分子に由来する質量分析スペクトルを入手でき、より定量的な解析を可能とする。
【0040】
本発明の好ましい態様では、前記[38]に記載の解析システムにおいて、[39] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される。
【0041】
本発明の好ましい態様では、前記[38]または[39]に記載の解析システムにおいて、前記制御部は、前記波形分離処理部からの波形分離処理により得られた固有の生体分子に由来する波形の面積を算出し、前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する演算部を、さらに備える。
【0042】
本発明の好ましい態様では、前記[38]ないし[40]のうち何れか一に記載の解析システムにおいて、[41] 前記制御部は、波形分離後、前記生体分子の構成成分の配列毎に分類し、前記配列を生体分子の機能情報を有するデータベースに照合し、その照合結果から、前記配列と機能とを関連付けてグループ化する情報付加部を、さらに備える。
【0043】
本発明の好ましい態様では、前記[38]ないし[41]のうち何れか一に記載の解析システムにおいて、[42] 前記制御部は、生体分子の構成成分の配列から生体分子を特定し、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする演算部を、さらに備える。
【0044】
本発明の好ましい態様では、前記[38]ないし[42]のうち何れか一に記載の解析システムにおいて、[43] 前記制御部は、生体分子の構成成分の配列を、生体分子の機能情報を有するデータベースに照合し、当該生体分子の機能情報を取得する情報付加部を、さらに備える。
【0045】
本発明の好ましい態様では、前記[31]ないし[43]のうち何れか一に記載の解析システムにおいて、[44] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である。
【0046】
本発明の好ましい態様では、前記[31]ないし[44]のうち何れか一に記載の解析システムにおいて、[45] 前記構成成分の配列の決定は、MS/MS処理により行われる。
【0047】
本発明の好ましい態様では、前記[45]に記載の解析システムにおいて、[46] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により、前記構成成分の配列の決定が行われる。
【0048】
本発明の好ましい態様では、前記[31]ないし[46]のうち何れか一に記載の解析システムにおいて、[47] 前記生体分子は、経時的にサンプルから分離された生体分子である。
【0049】
本発明の好ましい態様では、前記[31]ないし[47]のうち何れか一に記載の解析システムであって、[48] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である。
【0050】
また、本発明の第四の態様では、[49] 第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子の質量分析に関するデータの解析方法であって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一及び第二の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を含む、解析方法、
[50] 前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体成分の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される、前記[49]に記載の解析方法、
[51] 前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、をさらに備える、前記[49]または[50]に記載の解析方法、
[52] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに含む、前記[49]ないし[51]のうち何れか一に記載の解析方法、
[53] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに含む、前記[49]ないし[52]のいずれか一に記載の解析方法、
[54] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに含む、前記[49]ないし[53]のいずれか一に記載の解析方法、
[55] 前記第一および第二の生体分子とともに、内部標準物質のm/zの値の決定する工程と、内部標準物質の時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを抽出する工程と、前記内部標準物質の時間に対する質量分析スペクトル(マスクロマトグラム)の波形分離処理する工程と、前記内部標準物質に固有の波形の面積を算出する工程とを実行し、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を、算出する工程を、さらに含む、前記[49]ないし[54]のうち何れか一に記載の解析方法、
[56] 第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータの解析方法であって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一および第二並びに内部標準物質の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を含む、解析方法、
[57] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、前記[56]に記載の解析方法、
[58] 前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する工程と、をさらに備える、前記[56]または[57]に記載の解析方法、
[59] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに含む、前記[56]ないし[58]のうち何れか一に記載の解析方法、
[60] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに含む、前記[56]ないし[59]のいずれか一に記載の解析方法、
[61] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに含む、前記[56]ないし[60]のいずれか一に記載の解析方法、
[62] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[49]ないし[61]のうち何れか一に記載の解析方法、
[63] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[49]ないし[62]のうち何れか一に記載の解析方法、
[64] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[63]に記載の解析方法、
[65] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[49]ないし[64]のうち何れか一に記載の解析方法、
[66] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、前記[49]ないし[65]のうち何れか一に記載の解析方法等を提供する。
【0051】
さらに、本発明の第五の態様では、[67] 質量分析装置において得られた、第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子の質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、前記質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一および第二の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を実行させるプログラム、
[68] 前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行させる、前記[67]に記載のプログラム、
[69] 前記波形分離処理により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、をさらに実行させる、前記[67]または[68]に記載のプログラム、
[70] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに実行させる、前記[67]ないし69のうち何れか一に記載のプログラム、
[71] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに実行させる、前記[67]ないし[70]のいずれか一に記載のプログラム、
[72] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに含む、前記[67]ないし[71]のいずれか一に記載のプログラム、
[73] 前記質量分析装置において、前記第一および第二の生体分子とともに、内部標準物質の質量分析に関するデータを得て、前記質量分析に関するデータから、前記内部標準物質の時間に対する質量分析スペクトル(マスクロマトグラム)を抽出するとともに、前記内部標準物質の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理し、前記波形分離処理により得られた内部標準物質に固有の波形面積を算出し、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)に比を算出する工程を、さらに実行させる、前記[67]ないし[72]のうち何れか一に記載のプログラム、
[74] 第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一および第二並びに内部標準物質の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を実行するプログラム、
[75] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、前記[74]に記載のプログラム。
[76] 前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する工程と、をさらに実行させる、前記[74]または[75]に記載のプログラム、
[77] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに実行させる、前記[74]ないし[76]のうち何れか一に記載のプログラム、
[78] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに実行させる、前記[74]ないし[77]のいずれか一に記載のプログラム、
[79] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに含む、前記[74]ないし[78]のいずれか一に記載のプログラム、
[80] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[69]ないし[90]のうち何れか一に記載のプログラム、
[81] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[69]ないし[80]のうち何れか一に記載のプログラム、
[82] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[81]に記載のプログラム、
[83] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[67]ないし[82]のうち何れか一に記載のプログラム、
[84] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、前記[67]ないし[83]のうち何れか一に記載のプログラム等を提供する。
【0052】
さらに、本発明の第六の態様では、[85] 第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質の質量分析に関するデータの解析方法であって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、得られた配列データをもとに、生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程とを含む解析方法、
[86] 前記決定工程の後、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を、前記質量分析に関するデータから抽出する工程と、さらに含む前記[85]に記載の解析方法と、
[87] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、前記[85]または[86]に記載の解析方法、
[88] 前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二のピークの値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質のピークの値とから、(前記第一のピーク)/(前記内部標準物質に固有のピーク)の比、および/または、(前記第二のピーク)/(前記内部標準物質に固有のピーク)の比を算出する工程とをさらに備える、前記[85]なしひ[87]のうち何れか一に記載の解析方法、
[89] 前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに含む、前記[85]ないし[88]のうち何れか一に記載の解析方法、
[90] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに含む、前記[85]ないし[89]のいずれか一に記載の解析方法、
[91] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[85]ないし[90]のいずれか一に記載の解析方法、
[92] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[85]ないし[91]のうち何れか一に記載の解析方法、
[93] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[92]に記載の解析方法、
[94] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[85]ないし[93]のうち何れか一に記載の解析方法、
[95] 前記生体分子は、タンパク質、脂質、糖鎖もしくは核酸またはこれらの組み合わせである、前記[85]ないし[94]のうち何れか一に記載の解析方法、および、
[96] 質量分析装置において得られた、第一および第二の生体分子と、当該第一および第二の生体分子に対して同位体標識された生体分子である内部標準物質との質量分析に関するデータを受けるコンピュータに、前記データの解析をするためのプログラムであって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、得られた配列データをもとに、生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、を実行させるプログラム、
[97] 前記決定工程の後、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を、前記質量分析に関するデータから抽出する工程と、をさらに実行させる前記[96]に記載のプログラム、
[98] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、前記[96]または[97]に記載のプログラム、
[99] 前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二のピークの値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質のピークの値とから、(前記第一のピーク)/(前記内部標準物質に固有のピーク)の比、および/または、(前記第二のピーク)/(前記内部標準物質に固有のピーク)の比を算出する工程と、をさらに実行させる、前記[96]ないし[98]のうち何れか一に記載のプログラム、
[100] 前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、前記[96]ないし[99]のうち何れか一に記載のプログラム、
[101] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに実行させる、前記[96]ないし[100]の何れか一に記載のプログラム、
[102] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[96]ないし[101]のうち何れか一に記載のプログラム、
[103] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[96]ないし[102]のうち何れか一に記載のプログラム、
[104] 前記構成成分の配列の決定は、MS/MS処理により得られた生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[103]に記載のプログラム、
[105] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[96]ないし[104]のうち何れか一に記載のプログラム、
[106] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせであるからなる群から選択されるいずれかの分子である、前記[96]ないし[105]のうち何れか一に記載のプログラム等を提供する。
【0053】
さらに、本発明の第七の態様では、[107] 質量分析装置において得られた、サンプル中の1または複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1または複数の生体分子の定量をさせるためのプログラムであって、質量分析装置にて測定された生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一および第二の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を実行させるプログラム、
[108] 前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行させる、前記[107]に記載のプログラム、
[109] 前記波形分離処理により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、をさらに実行させる、前記[107]または[108]に記載のプログラム、
[110] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに実行させる、前記[107]ないし[109]のうち何れか一に記載のプログラム、
[111] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに実行させる前記[107]ないし[110]の何れか一に記載のプログラム、
[112] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに実行させる、前記[107]ないし[111]の何れか一に記載のプログラム、
[113] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[107]ないし[112]のうち何れか一に記載のプログラム、
[114] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[107]ないし[113]のうち何れか一に記載のプログラム、
[115] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[112]に記載のプログラム、
[116] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[107]ないし[115]のうち何れか一に記載のプログラム、
[117] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、前記[107]ないし[116]のうち何れか一に記載のプログラム等を提供する。
【発明の効果】
【0054】
本発明により、代謝的に標識することができないサンプル(例えば、組織、生体液、細胞、細胞器官、タンパク質複合体など)中の1若しくは複数の生体分子を精度よく定量することが可能となった。
【0055】
すなわち、従来のin vivo標識法では、培養条件に影響を受けないような限られた細胞でしか実施できなかったが、本発明では、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞をサンプルに加えるため、培養できる細胞に限られることなく、代謝的に標識することができないサンプル(例えば、組織、生体液、細胞、細胞器官、タンパク質複合体など)中の1若しくは複数の生体分子を定量することが可能となった。
【0056】
また、従来のin vitro標識法では、サンプルの破砕、抽出、消化、分画、精製など前処理段階での実験ごとに定量値が変動することの補正はできなかったが、本発明では、サンプルの破砕、抽出、消化、分画、精製などを行う前に代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加えるため、サンプル中の1若しくは複数の生体分子を精度よく定量することが可能となった。
【0057】
本発明により、3個以上のサンプル間の比較が容易になった。すなわち、これまでの定量的プロテオーム解析法は、内部標準物質と被検体とを直接比較していたため、測定のたびにサンプル調製を行う必要があった。さらに、測定対象が変わると標識すべき内部標準物質も変わるため、その都度、標識についての条件検討を行う必要があり、また、実験間の比較もできなかったが、本発明では、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を保存し、適宜、用いることにより、実験間のデータ比較、例えばある実験データに対し、一定期間経過後(例えば、1ヶ月後、1年後等)に比較データを得て解析することが可能となる。さらには、使用した代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を譲渡又は貸し渡しすることにより、今まで不可能であった研究者間のデータ比較が可能となる。
【0058】
本発明により、あらかじめ代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子の濃度を算出しておくことにより、生体分子の絶対定量が可能となった。代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、譲渡又は貸し渡しすることにより、研究者間のデータ共有化が可能となる。また、1度代謝的に同位体標識された生体分子である内部標準物質もしくは代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子の絶対量を求めておけば、実験ごとに定量する必要がなく、その後各種実験に応用できる。
【0059】
さらにまた、本発明による解析装置および解析方法によれば、固有の生体分子に由来する質量分析スペクトルを得ることができ、生体内の細胞で時々刻々変化する生体分子の発現量を定量的に解析することが可能となる。また、本発明によるプログラムにより、前記解析方法を、コンピュータに実現させることができる。くわえて、かかる定量的解析結果を、NCBInr等のデータベースと照合することにより、定量的解析結果に機能情報を付加させることもできる。
【0060】
従来の方法(AQUA法)では、サンプルに対して、合成ペプチドを添加するため、分画、抽出、精製、消化(特にゲル内消化)の過程におけるタンパク質の回収率の低さにより、精度のよい定量値が得られなかった。一方、本発明の方法では、サンプルに対して、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加するため、分画、抽出、精製、消化(特にゲル内消化)の過程におけるタンパク質の回収率の影響を受けず、精度よく再現性の高い定量値を得ることが可能となった。
【0061】
また、従来の方法では、サンプルに対して、合成ペプチドを添加するため、定量できるペプチドは、合成ペプチドと同一の配列を有するペプチドのみである。そのため、当該ペプチドの測定結果の誤差により、タンパク質の定量値が大きく影響を受けることとなる。一方、本発明の方法では、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を定量しておき、サンプルに対して、当該代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加するため、定量できるペプチドは、合成ペプチドと同一の配列を有するペプチドのみならず、当該ペプチドが構成していたタンパク質由来のその他のペプチドについても定量することができる。そのため、一つのタンパク質に対し、複数のペプチドによって定量するため、個々のペプチドの測定結果の誤差により、タンパク質の定量値が大きく影響を受けることがなく、精度よく再現性の高い定量値を得ることが可能となった。
【0062】
さらには、ペプチド合成機は、10倍過剰量の試薬を用い、しかも合成スケールがマイクログラムからミリグラム単位となる。そのため、同位体標識されたペプチドの合成は、非常に高価となり、従来の方法で網羅的な定量することはコストの面で難しい。一方、本発明の方法では、生体分子の同位体標識は、細胞培養によって行うので、ごく微量でも効率がよく生成することができる。また、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を定量するための合成ペプチドは、同位体を必要としない通常のペプチド合成で対応できるので、網羅的な定量方法として適している。
【図面の簡単な説明】
【0063】
【図1】従来技術による定量法を表したものを示す。
【図2】本発明による定量法を表したものを示す。
【図3】本発明による生体分子の定量的解析方法の概略的な全体スキームを示す。
【図4】本発明による同位体標識を利用する測定サンプル調製の一の態様のスキームを示す。
【図5】質量分析後、本発明による解析方法のスキームを示す。
【図6】典型的な質量分析装置にて得られる質量分析スペクトルを示す。
【図7】単一のm/zの値におけるマスクロマトグラムに対して、複数のピークが重なっている一例のスペクトルを示す。
【図8】図7に示したスペクトルを、本発明にて用いた波形分離処理により分離された波形スペクトルを示す。
【図9】本発明が適用される解析システムの構成の機能ブロック図の一例を示す。
【図10】本発明に係る解析方法を実行するプログラムを、概念的に表すフローチャートである。
【図11】本発明に用いる制御部の詳細な構成を示す機能ブロック図である。
【図12】本発明の第一の態様における方法を実行するためのプログラムの工程図を示す。
【図13】本発明で用いる外部データベースを利用した機能情報の取得に関するスキームを示す。
【図14】本発明における波形分離後のペプチドのマスクロマトグラムの結果に基づき、機能情報の付加を行う方法を実行するための工程図を示す。
【図15】図15は、波形分離をせずに、ペプチドの質量分析スペクトルの結果に基づき、機能情報の付加を行う方法を実行するための工程図を示す。
【図16】cMDHについて、野生型マウス脳由来および代謝的に同位体標識された生体分子である内部標準物質由来の質量分析スペクトルを示す。
【図17】cMDHについて、野生型マウス脳由来および代謝的に同位体標識された生体分子である内部標準物質由来の質量分析スペクトルの比における用量依存性を表したものを示す。
【図18】cMDHについて、質量分析による野生型マウス脳由来および代謝的に同位体標識された生体分子である内部標準物質由来の発現量における理論上の比と実際に測定した比とをプロットしたものを示す。
【図19】protein phosphatase 2aおよびmyotrophinについて、野生型マウス脳(Wild)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトル、ならびにADAM22遺伝子欠損マウス脳(K/O)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルを示す。
【図20】protein phosphatase PP2Aおよびheat shock protein 1について、野生型マウス脳(Wild)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルならびにADAM22遺伝子欠損マウス脳(K/O)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルを示す。
【図21】glyceraldehyde-3-phosphate dehydrogenaseおよびADP-ribosylation factorについて、野生型マウス脳(Wild)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルならびにADAM22遺伝子欠損マウス脳(K/O)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルを示す。
【図22】cofilinおよびtubulin-betaについて、野生型マウス脳(Wild)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルならびにADAM22遺伝子欠損マウス脳(K/O)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルを示す。
【図23】時間、つまり、特定の連続したスキャン番号における質量分析スペクトルを示す図である。図中におけるLとは、同位体標識されていないロイシンを含むタンパク質に由来するピークを指す。
【図24】中心を644.7とする、644.2〜645.2の幅でのm/z値におけるスキャン番号975〜1005でのマスクロマトグラムを示す図である。
【図25】中心を646.7とする、646.2〜647.2の幅でのm/z値における、スキャン番号975〜1005でのマスクロマトグラムを示す図である。図中におけるHとは、同位体標識されたロイシンを含むタンパク質に由来するピークを指す。
【図26】本発明による波形分離処理の結果を示す。図26中の(A)は、図19に示すLで表示されるマスクロマトグラムの波形分離処理の結果を示し、一方で、図26中の(B)は、図19に示すHで表示されるマスクロマトグラムの波形分離処理の結果を示す。
【図27】代謝的に同位体標識された生体分子である内部標準物質由来のピークに対する野生型マウス脳(Wild)由来およびADAM22遺伝子欠損マウス脳(K/O)由来のピーク強度比を算出するにあたって、同位体標識された生体分子である内部標準物質由来の同一配列のピークを用いた場合および別の配列のピークを用いた場合において、野生型マウス脳(Wild)由来およびADAM22遺伝子欠損マウス脳(K/O)由来のピーク強度比の比較した結果を示す。
【図28】本発明の一の実施例において着目した波形分離後の配列と、その配列の定量値を示す図である。
【図29】本発明の一の実施例において、NCBInrデータベースのHomoSapiensにてパターン検索を行った結果、各配列に対して同定されたタンパクのGiNoの一覧を示す図である。
【図30】本発明において、波形分離後の質量分析データを、データベースを利用して解析した結果の一例を示す図である。
【発明を実施するための形態】
【0064】
以下に本発明の実施の形態について、図面を参照しつつ詳細に説明する。以下の実施形態は、本発明を説明するための例示であり、本発明をこの実施形態にのみ限定する趣旨ではない。本発明はその要旨を逸脱しない限り、さまざまな形態で実施することができる。なお、本明細書において引用した文献、公開公報、特許公報その他の特許文献は、参照として本明細書に組み込むものとする。
【0065】
本発明において用いる用語「サンプル」とは、生体分子を含む測定対象物を示し、好ましくは、組織、生体液、細胞、細胞器官又はタンパク質複合体を指す。組織としては、例えば、脳、脳の各部位(例えば、嗅球、扁桃核、大脳基底球、海馬、視床、視床下部、大脳皮質、延髄、小脳)、脊髄、下垂体、胃、膵臓、腎臓、肝臓、生殖腺、甲状腺、胆嚢、骨髄、副腎、皮膚、筋肉、肺、十二指腸、小腸、大腸、血管、心臓、胸腺、脾臓、顎下腺、耳下腺、舌下腺、末梢血、前立腺、睾丸、卵巣、胎盤、子宮、骨、関節、骨格筋などがあげられる。生体液としては、例えば、血液(血漿、血清を含む)、尿、糞、唾液、涙液、浸潤液(腹水、組織液を含む)などがあげられる。細胞としては、例えば、肝細胞、脾細胞、神経細胞、グリア細胞、膵臓β細胞、骨髄細胞、メサンギウム細胞、ランゲルハンス細胞、表皮細胞、上皮細胞、杯細胞、内皮細胞、平滑筋細胞、線維芽細胞、線維細胞、筋細胞、脂肪細胞、免疫細胞(例えば、マクロファージ、T細胞、B細胞、ナチュラルキラー細胞、肥満細胞、好中球、好酸球、好塩基球、単球)、巨核球、滑膜細胞、軟骨細胞、骨細胞、骨芽細胞、破骨細胞、乳腺細胞、間質細胞もしくはこれらの前駆細胞、幹細胞、癌細胞などがあげられる。細胞器官としては、例えば、核、細胞小器官(核小体、核膜、細胞膜、ミトコンドリア、リソソーム、リボソーム、ペルオキシソーム、小胞体(粗面小胞体、滑面小胞体、筋小胞体など)、ゴルジ体、微小管、中心体、アクチンフィラメントなど)、サイトゾル、シナプス、基底膜、細胞間接着装置などがあげられる。タンパク質複合体とは、二以上のタンパク質が物理的に結合している状態のものをいう。ここにあげたものは具体例であって、これらに限定されるものではない。
【0066】
本発明において用いる用語「生体分子」とは、タンパク質、脂質、糖鎖又は核酸若しくはこれらの組み合わせを指し、好ましくはタンパク質である。また、生体分子には、生理的な修飾を受けているもの(例えば、リン酸化タンパク質等)も含まれることは言うまでもない。
【0067】
本発明において用いる用語「タンパク質」とは、2以上のアミノ酸がペプチド結合によって結合したペプチドを含む。
【0068】
本発明において用いる用語「代謝的に同位体標識された生体分子」とは、同位体標識された当該生体分子の前駆体を加えることにより、代謝的に標識された生体分子を指す。上記「代謝的に」とは、酵素反応などを介した生理的条件を示し、好ましくは培養細胞における代謝反応である。
【0069】
本発明において用いる用語「前駆体」とは、生体分子の構成成分になりうる分子を指す。前駆体は、生体分子がタンパク質の場合には、好ましくはアミノ酸、より好ましくは必須アミノ酸、例えば、ロイシン、イソロイシン、トリプトファン、メチオニン、リジン、フェニルアラニン、バリン、スレオニン、特に好ましくはロイシンであり、生体分子が脂質の場合には、例えばスフィンゴ脂質であればセリンが好ましく、糖の場合には、グルコースが好ましく、核酸の場合には、アスパラギン酸、グルタミン、グリシンからプリンヌクレオチドが生合成されるためこれらが好ましいが、これらに限定されるものではない。つまり、前駆体は、生体分子に取り込まれるものであれば、その種類は限定されない。
【0070】
本発明において用いる用語「内部標準物質」とは、質量分析装置にて測定物質を定量するときに、主として実験ごとに定量値が変動することを補正するため、サンプル中に一定量を加えられる物質をいう。
【0071】
本発明において用いる用語「代謝的に同位体標識された生体分子である内部標準物質」とは、代謝的に同位体標識された生体分子を1又は複数含んだ内部標準物質をいう。
【0072】
本発明において用いる用語「代謝的に同位体標識された生体分子である内部標準物質を含む細胞」とは、代謝的に同位体標識された生体分子を1又は複数含んだ内部標準物質を含む細胞をいう。
【0073】
本発明において用いる用語「定量」とは、絶対定量及び相対定量を広く含むものである。本発明において用いる用語「絶対定量」とは測定結果を量又は濃度として得ることを目的とする定量方法であり、「相対定量」とは絶対定量以外の定量方法を指す。
【0074】
本発明において用いる用語「代謝的に標識できないサンプル」とは、代謝的に標識できるサンプル以外のサンプルを指す。代謝的に標識できるサンプルとは、培養することによる同位体標識された当該生体分子の前駆体の影響を受けることなく代謝的に標識できるサンプルをいう。「代謝的に標識できないサンプル」には、たとえば、培養することによる同位体標識された当該生体分子の前駆体の影響を受けつつ代謝的に標識できるサンプル及び生体への投与、組織培養、その他の方法により標識できるサンプルが含まれるものとする。
【0075】
本発明において用いる用語「細胞培養によって標識できないサンプル」とは、細胞を培養することができないサンプルを指す。つまり、細胞培養をできず、生体への投与、組織培養、その他の細胞培養以外の方法により標識できるサンプルは、「細胞培養によって標識できないサンプル」に含まれるものとする。例えば、組織、生体液、細胞器官又はタンパク質複合体があげられる。
【0076】
(本発明の第一の実施態様)
本発明は、代謝的に同位体標識された生体分子である内部標準物質、代謝的に同位体標識された生体分子である内部標準物質を含む細胞、および前記内部標準物質を含有する試薬と前記内部標準物質を含む細胞を含有する試薬等を提供する。
【0077】
以下では、特に、代謝的に同位体標識された生体分子である内部標準物質および代謝的に同位体標識された生体分子である内部標準物質を含む細胞の作製方法を記載する。
【0078】
代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、測定対象となるサンプルと同じ種の、好ましくは同じ組織由来の、特に好ましくは同位体を含む培地中で生育が容易な細胞であるが、これに限定されるものではない。選択された細胞を、同位体標識された当該生体分子の前駆体としての構成成分を含む培地で培養することによって、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を作製することができる。培養条件はどのようなものであってもよく、液体培地あるいは固体培地に該生細胞を培養するのに好適な条件を選択すればよい。例えば、動物細胞を選択した場合には、DMEM、MEM、RPMI1640、IMDM等の培地を用い、必要に応じウシ胎児血清(FCS)等の血清、アミノ酸、グルコース、ペニシリン又はストレプトマイシンなどを添加することができ、pH約6〜8、30〜40℃において15〜200時間前後の培養を行うことができる。その他必要に応じ途中で培地の交換を行ったり、通気及び攪拌を行ったりすることができる。
【0079】
同位体は、放射性同位体を適用することもできるが、安定同位体を用いることが好ましい。安定同位体には、好ましくは2H、13C、15N、17O、18O、33P又は34S若しくはこれらの組み合わせ、特に好ましくは13Cを用いるが、これに限定されるものではない。つまり、本発明の同位体は、細胞に取り込まれ、生体分子を標識しうるものであれば、その種類は限定されない。具体例としては、同位体標識された生体分子の前駆体として、13C標識(13C×6個)ロイシン(Cambridge Isotope Labs (CIL)社製、L-Leucine U-13C6, CLM‐2262)が挙げられる。
【0080】
上述のようにして得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、そのまま用いることができるが、破砕しておくことも可能である。破砕する方法は、ダウンス型テフロンR・ホモジナイザー、ポリトロン、ワーリング・ブレンダー、ポッター型ガラス・ホモジナイザー、超音波破砕装置、細胞溶解液(例えば、PIERCE社のM-PER: cat no. 78501, T-PER: cat no. 78510など)を用いる方法又は凍結融解法があげられ、好ましくは細胞溶解液を用いる方法である。必要に応じて、タンパク質を定量しておくことができる。このようにして、代謝的に同位体標識された生体分子である内部標準物質を作製することができる。これらの代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、適当な条件、好ましくは−20℃以下、特に好ましくは−80℃以下で保存することができる。
【0081】
本発明は、サンプルに、代謝的に同位体標識された生体分子である内部標準物質又は当該生体分子である内部標準物質を含む細胞を加えることを特徴とする質量分析計によるサンプル中の生体分子の定量方法を提供する。
【0082】
この定量方法は、サンプルに、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加える工程と、各サンプルから生体分子を抽出、分画等する工程と、質量分析装置で測定する工程と、質量分析装置で得られた結果から各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程とからなる。
【0083】
また、本発明に係るプログラムは、後述するように、本発明による定量または解析方法の各工程をコンピュータ上で実行させる。本発明に係るプログラムは、CD−ROM、磁気ディスク、半導体メモリなどの各種記録媒体を通じてコンピュータにインストールまたはダウンロードすることが可能である。
【0084】
以下に、詳細について記載する。
<質量分析による測定サンプルの調製方法>
各サンプルに、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞、好ましくは一定量の代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加える。
【0085】
続いて、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加えたサンプルを破砕し、生体分子、好ましくはタンパク質を抽出後、分画することができる。これを分画したサンプルとする。破砕・抽出する方法は、ダウンス型テフロンR・ホモジナイザー、ポリトロン、ワーリング・ブレンダー、ポッター型ガラス・ホモジナイザー、超音波破砕装置、細胞溶解液(例えばピアス社のM-PER: cat no. 78501, T-PER: cat no. 78510など)を用いる方法又は凍結融解法があげられ、好ましくはダウンス型テフロンR・ホモジナイザー、ポッター型ガラス・ホモジナイザーを用いる方法である。分画する方法は、分画遠心法やショ糖密度勾配遠心法などがあげられ、好ましくはショ糖密度勾配遠心法である。
【0086】
次に、必要に応じて、分画したサンプルを精製することができる。これを精製したサンプルとする。精製する方法は、群特異的アフィニティーカラム精製、カチオン交換クロマトグラフィー、アニオン交換クロマトグラフィー、逆相クロマトグラフィーを利用する方法、免疫沈降法、硫安沈殿法、有機溶媒による沈殿法、限外ろ過法、ゲルろ過法、透析法などがあげられ、好ましくは群特異的アフィニティーカラム精製である。破砕・抽出、分画、精製の各操作は、これらに限定されるものではなく、当業者における技術常識により、適当なものを選択し、また、組み合わせればよい。
【0087】
その後、必要に応じて、精製したサンプルを分離および消化を行うことができる。これを分離したサンプルおよび消化したサンプルとする。分離方法は、二次元電気泳動、SDS PAGE、各種クロマトグラフィー(例えば、アフィニティークロマトグラフィー、逆相クロマトグラフィー、アニオン交換クロマトグラフィー、カチオン交換クロマトグラフィーなど)等が考えられるが、これに限定されるものではなく、適当なものを選択すればよい。消化方法には、酵素消化、化学分解等があげられ、好ましくは酵素消化であるが、これに限定されるものではなく、適当なものを選択すればよい。酵素消化に用いる酵素としては、トリプシン、キモトリプシン、Lys-C, Asp-N, Glu-Cなどがあげられ、好ましくはトリプシンである。
【0088】
こうして得られた分画したサンプル、精製したサンプル、分離したサンプル又は消化したサンプルは、高速液体クロマトグラフィー(HPLC)により分離することができる。これをHPLCにより分離されたサンプルとする。HPLCに用いるカラムは、当業者における技術常識により、適当なものを選択すればよく、好ましくはアニオン交換カラム又はカチオン交換カラムである。HPLCの諸条件(流速、検出器、移動相など)は、当業者における技術常識により、適宜選択できる。
【0089】
<質量分析装置による測定サンプルの測定方法>
次に、上記の操作により得られた測定サンプル(分画したサンプル、精製したサンプル、分離したサンプル、消化したサンプル又はHPLCにより分離されたサンプルを意味する)を質量分析装置で測定する。質量分析装置は、ガスクロマトグラフと結合された質量分析装置であるガスクロマトグラフィーマススペクトロメトリー(GC/MS)や液体クロマトグラフと結合された装置である液体クロマトグラフィーマススペクトロメトリー(LC/MS)等の汎用の装置を用いて行うことができる。質量分析装置におけるイオン化方法は、各装置に応じて適宜選択できる。例えば、MALDI(マトリックス支援レーザー脱離イオン化法)、ESI(エレクトロスプレーイオン化法)、EI(電子イオン化法)、CI(化学イオン化法)、APCI(大気圧化学イオン化法)、FAB(高速原子衝撃法)、LD、FD、SIMS、TSP等があげられ、好ましくはMALDI又はESIである。アナライザーは、各装置に応じて適宜選択できる。例えば、TOF(飛行時間型)、イオントラップ、二重収束型、四重極型、フーリエ変換型等の汎用の装置を用いて行うことができる。質量分析の装置及び方法は、ここにあげたものに限定されるものではなく、当業者において質量分析に通常使用されるものを適宜選択すればよい。
【0090】
<生体分子の同定方法>
質量分析による測定の結果得られたデータを用いて、生体分子、好ましくはタンパク質を同定することができる。得られたデータを市販のソフトフェア、例えば、SonarMSMS(Genomic solution社)およびデータベース、例えば、NCBInr(http://www.ncbi.nlm.nih.gov/)、IPI、Sport等のデータベースを使用することにより解析し、サンプル中のタンパク質の自動同定が可能である。質量分析による測定データを用いて、タンパク質を同定することは当業者にとって容易である(Nat Genet. 1998: 20, 46-50; J Cell Biol. 1998: 141, 967-977; J Cell Biol. 2000: 148, 635-651; Nature. 2002: 415, 141-147; Nature. 2002: 415, 180-183; Curr Opin Cell Biol. 2003: 15, 199-205; Curr Opin Cell Biol. 2003: 7, 21-27)。
【0091】
<生体分子の標識ピークと非標識ピークとの強度比を求めて比較する方法>
本発明において、「生体分子の標識ピーク」とは、質量分析の測定結果から得られるm/zの値に対する質量分析スペクトル(以下、単に「質量分析スペクトル」という。)および/または時間に対する質量分析スペクトル(以下、「マスクロマトグラム」と称する場合がある)において、代謝的に同位体標識された生体分子に由来するシグナル強度又はその総和(通常面積で表されることは当業者であれば理解できる)をいう(以下、単に標識ピークと称する場合がある)。
【0092】
本発明において、「生体分子の非標識ピーク」とは、質量分析スペクトルおよび/またはマスクロマトグラムにおいて、代謝的に同位体標識されていない生体分子に由来するシグナル強度又はその総和をいう(以下、単に非標識ピークと称する場合がある)。
【0093】
質量分析による測定の結果得られたデータを用いて、各生体分子について、代謝的に同位体標識された生体分子である内部標準物質由来の標識ピークとサンプル由来の非標識ピークの強度比を求めて、サンプル間で該ピーク強度比の値を比較することにより、サンプル間の生体分子を相対定量することができる。代謝的に同位体標識された生体分子は、サンプル由来の生体分子に比べ、同位体標識されている分子量の分、分子量が大きくなり質量分析においてペアのピークとして観測される(図2参照)。同位体標識されている生体分子の分子量は、同定されたタンパク質、脂質、糖鎖又は核酸配列から計算によって求めることができる。
【0094】
より具体的には、例えば、サンプルAおよびサンプルBに含まれる生体分子量を比較する場合、サンプルAにおける各生体分子の非標識ピークを該生体分子に対応する内部標準物質の標識ピークで除することによって、該生体分子における非標識ピーク/標識ピーク(ピーク強度比A)を求める。一方、サンプルBにおける各生体分子の非標識ピークを該生体分子に対応する内部標準物質の標識ピークで除することによって、該生体分子における非標識ピーク/標識ピーク(ピーク強度比B)を求める。次に、ピーク強度比Aとピーク強度比Bとを比較することで、サンプルAおよびサンプルBにおける生体分子を相対的に定量することができる。
【0095】
なお、サンプル中では存在していて、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞には存在していない生体分子(例えば、タンパク質等)が存在することがある。この場合には、質量分析装置で測定した際に、近傍の内部標準物質由来のピーク、好ましくはLC/MSならクロマトグラフィーでの溶出時間が近いピーク、MALDI-MSなら分子量が近いピークを対象としてピーク強度比を求めて、サンプル間で該ピーク強度比を比較することによって定量することができる。したがって、サンプル中のすべての生体分子(例えば、タンパク質)を測定することが可能である。
【0096】
より具体的には、サンプルAおよびサンプルBにおける生体分子Xを比較する場合、内部標準物質に生体分子Xが存在せず、近傍に生体分子Yが存在することがある。ここで、近傍とは、内部標準物質由来のピークで、かつ、LC/MSならクロマトグラフィーでの溶出時間が近いピーク、MALDI-MSなら分子量が近いピークである。この場合には、サンプルAにおける生体分子Xの非標識ピークを生体分子Yに対応する内部標準物質の標識ピークで除することによって、生体分子Xにおける非標識ピーク/生体分子Yにおける標識ピーク(ピーク強度比C)を求める。一方、サンプルBにおける生体分子Xの非標識ピークを生体分子Yに対応する内部標準物質の標識ピークで除することによって、生体分子Xにおける非標識ピーク/生体分子Yにおける標識ピーク(ピーク強度比D)を求める。次に、ピーク強度比Cとピーク強度比Dとを比較することで、サンプルAおよびサンプルBにおける生体分子を相対的に定量することができる。近傍の生体分子を複数選択することによって、測定の精度を上げることができる。
【0097】
本発明によって、質量分析に用いた1又は複数の生体分子、好ましくはタンパク質の絶対定量が可能となる。また、これに伴い、1又は複数の生体分子が既知量である代謝的に同位体標識された生体分子である内部標準物質及び1又は複数の生体分子が既知量である代謝的に同位体標識された生体分子である内部標準物質を含む細胞が提供される。
【0098】
つまり、既知量の各々の生体分子標品、好ましくはタンパク質標品を使って、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する生体分子量、好ましくはタンパク質の絶対量を求めておくことで、目的のサンプルに含まれる生体分子、好ましくはタンパク質の絶対定量が可能である。したがって、これまでの定量的プロテオーム解析ではできなかった絶対定量が可能となる。このようにして同位体標識された生体分子の絶対量を求めておけば、その後、各種実験に当該同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を使用できるため、実験ごとに定量を行うことを余儀なくされていた従来の方法に比べて非常に有用である。
【0099】
以下に、詳細について記載する。
<代謝的に同位体標識された生体分子である、内部標準物質に含まれる生体分子の定量方法>
代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する生体分子の絶対量は、既知量の生体分子標品を用いて質量分析装置で測定することにより絶対量を求めることができる。
【0100】
より具体的には、例えば、化学合成した既知量の生体分子を、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に添加し、必要に応じて、上述の方法により、破砕、抽出、分画、精製を行う。次に、質量分析装置で測定し、化学合成した生体分子由来のピークと標識ピークとを比較することにより、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する当該生体分子の絶対量が求められる。
【0101】
生体分子がタンパク質である場合には、上記の方法に加え、SDS-PAGE、EIA、ELISA、RIA、ウェスタンブロット、フローサイトメトリーにより測定できる。これらは例示であり、これに限定されるものではなく、当業者にとって最適と考えられる方法を用いることができる。
【0102】
より具体的には、一定量の代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、適当な条件下、好ましくは上述の測定サンプルの調製方法と同じ条件下で破砕し、タンパク質を抽出する。この抽出液中の目的のタンパク質をSDS-PAGE、EIA、ELISA、RIA、ウェスタンブロットなどの方法で測定することにより、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する当該生体分子の絶対量が求められる。
【0103】
また、生体分子が酵素などの活性を有するものであれば、その生体分子固有の比活性(タンパク質量あたりの活性の強さ)が求められている。物質固有の比活性は、報告されている活性を用いてもよく、測定して求めてもよい。したがって、前述の抽出液中のタンパク質の持つ活性を測定することにより、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する当該生体分子の絶対量が求められる。
【0104】
なお、本発明において定量の対象は、タンパク質に限ったものではなく、細胞が培地の栄養分を使って作り出す全ての物質、例えば、脂質、糖鎖又は核酸などに対して定量および同定を目的とした分析に応用可能である。
【0105】
なお、生体分子の標識ピークと非標識ピークとの強度比を求めて比較する方法、および代謝的に同位体標識された生体分子である内部標準物質に含まれる生体分子の定量方法を実行するための、本発明に係るプログラムについて後述する。
【0106】
(本発明の第二の実施態様)
図3は、本発明の第二の実施態様による生体分子の一例としてのタンパク質の定量的解析方法の概略的な全体スキームを示す。図3に示すように、まず、測定サンプル調製を行い、その後、質量分析装置を用いて質量分析を行う。次いで、本発明による定量的解析方法を実行する。
【0107】
図3の工程S11に示す測定サンプル調製には、サンプルを同位体標識する工程と、各サンプルから生体分子を抽出、分画等する工程とからなる。サンプルを同位体標識する方法には、同位体標識されたアミノ酸を含む培地で培養する方法、in vitroにおいて化学的または酵素的に同位体標識する方法などがある。
【0108】
同位体標識されたアミノ酸を含む培地で培養する方法は、同位体標識されたアミノ酸を含まない環境で育成および/または培養された同位体非標識細胞に、同位体標識アミノ酸の添加により生合成されるタンパク質が、同位体標識アミノ酸を代謝的に取り込み、同位体標識アミノ酸を有する同位体標識タンパク質を作出する工程を含む。
【0109】
同位体標識されたアミノ酸を含む培地で培養する方法は、培養条件はどのようなものであってもよく、液体培地あるいは固体培地に、該細胞を培養するのに好適な条件を設定すればよい。たとえば、前述の本発明の第一の態様にて説明した方法に準じて行うことができ、動物細胞を選択した場合には、DMEM、MEM、RPMI1640、IMDM等の培地を用い、必要に応じて、ウシ胎児血清(FCS)等の血清、アミノ酸、グルコース、ペニシリン又はストレプトマイシンなどを添加することができ、pH約6〜8、30〜40℃において、15〜200時間前後の培養を行う。その他、必要に応じて、培地を途中で交換したり、通気及び攪拌を行ったりすることができる。このようにして得られた同位体標識されたタンパク質を含む細胞は、そのまま用いることもできるが、破砕して利用することも可能である。破砕する方法は、ダウンス型テフロン・ホモジナイザー、ポリトロン、ワーリング・ブレンダー、ポッター型ガラス・ホモジナイザー、超音波破砕装置、細胞溶解液(たとえば、ピアス社のM-PER:cat no. 78501, T-PER: cat no.78510など)を用いる方法又は凍結融解法が挙げられ、好ましくは細胞溶解液を用いる方法である。
【0110】
また、本発明の第二の実施態様において、同位体標識されたタンパク質は、in vitroにおいても調製することができる。たとえば、タンパク質中のシステイン残基を同位体標識されたアルキル化試薬を用いてアルキル化することにより、同位体標識することができる(「ラピッド・コミュケーションズ・イン・マス・スペクトルメトリー(Rapid Communications in Mass Spectroscopy)」第16巻、第15号、2002年、pp.1416-1424参照)。さらに、タンパク質中のシステイン残基を同位体標識されたビオチン化試薬を用いてビオチン化することにより、同位体標識することもできる。これを、さらに、アビジンカラムを用いて、標識されたタンパク質のみを精製することが可能である(「ネイチャー・バイオテクノロジー(Nature Biotechnology)」第17巻、第10号、1999年10月、pp.994-999)。
【0111】
さらにまた、タンパク質を消化して得られたペプチド断片のC末、N末、グルタミン酸残基、アスパラギン酸残基などを同位体標識した分子で標識することができる。具体的には、タンパク質を酵素で消化する際に、緩衝液中に18Oで標識された水を加える。消化酵素としては、キモトリプシン、トリプシン、Asp-N、Lys-C、Glu-Cを用いることができる。キモトリプシン、Asp-Nを用いたときには、加水分解後のペプチドのC末側に18Oが一つ、トリプシン、Lys-C、Glu-Cを用いたときには、加水分解後のペプチドのC末のカルボン酸の酸素原子が二つとも18Oになることが知られている。
【0112】
くわえて、タンパク質を消化して得られたペプチド断片のC末、グルタミン酸残基、アスパラギン酸残基のカルボン酸をメチルエステルにする方法が知られており(Goodlett DR, Keller A, Watts JD, Newitt R, Yi EC, Purvine S, Eng JK, von Haller P, Aebersold, Koller E. Differential stable isotope labeling of peptides for quantitation and de nove sequence derivation. Rapid Commun mass Spectrom. 2001:15, pp.1214-1221参照)、同位体標識されたメタノールを用いてメチル化することにより、同位体標識することも可能である。
【0113】
また、タンパク質を消化して得られるペプチド断片のN末をニコチン酸誘導体化する方法(Munchbach M, Quadroni M, Miotto G, James P. Quantitation and facilitated de novo sequencing of proteins by isotropic N-terminal labeling of peptides with a fragmentation-directing moiety. Anal. Chem. 2000:72, pp.4047-4057参照)や、アセチル化する方法(Ji. J. Chakraborty A, Geng M, Zhang X, Amini A, Bina M, Regnier F. Strategy for quantitative and quantitative analysis in proteomics based on signature peptides. J Chromatogr B Biomed Sci Appl. 2000:745, pp.197-210参照)が知られている。そのため、これらの同位体標識された試薬を用いることにより、同位体標識することもできる。
【0114】
なお、同位体標識されたタンパク質または同位体標識されたタンパク質を含む細胞は、適当な条件、好ましくは−20℃以下、特に好ましくは−80℃以下で保存することができる。そして、このようにして得られた同位体標識されたタンパク質は、後述する解析において内部標準物質としても用いることができる。
【0115】
本発明で用いる同位体標識アミノ酸は、放射性同位体を適用することもできるが、放射性を有さない安定同位体が、取り扱いが容易であることから、特に好ましい。安定同位体には、以下に限定されるものではないが、2H、13C、15N、17O、18O、33P若しくは34S又はこれらの組み合わせが挙げられ、好ましくは13Cである。本発明に利用される同位体は、細胞に取り込まれ、タンパク質を標識し得るものであれば、その種類は特に限定されない。具体的には、同位体標識タンパク質の前駆体として、13C標識(13Cx6個)ロイシン(Cambridge Isotope Labs(CIL)社製、L-Leucine U-13C6, CLM-2262)を挙げることができる。
【0116】
図4は、本発明による同位体標識を利用する測定サンプル調製について、本発明の第二の態様の一つの態様のスキームを示す。測定対象のサンプルのうち、一方を同位体標識されたタンパク質を含むサンプル1、他方を同位体標識されていないタンパク質を含むサンプル2を準備する。そして、サンプル1およびサンプル2を混合する。
【0117】
次いで、混合後のサンプルを破砕し、タンパク質を抽出する。そして、必要に応じて、前述のサンプルを精製することができる。精製方法は、群特異的アフィニティーカラム精製、カチオン交換クロマトグラフィー、アニオン交換クロマトグラフィー、逆相クロマトグラフィーを利用する方法、免疫沈澱法、硫安沈殿法、有機溶媒により沈殿法、限界ろ過法、透析法などが挙げられる。
【0118】
その後、さらに必要に応じて、各種分離や消化を行うことができる。分離方法には、以下に限定されるものではないが、二次元電気泳動、SDA PAGE、各種クロマトグラフィー(たとえば、アフィニティークロマトグラフィー、逆相クロマトグラフィー、アニオン交換フロマトグラフィー、カチオン交換クロマトグラフィーなど)等が考えられる。消化方法には、以下に限定されるものではないが、酵素消化、化学分解等が挙げられる。酵素消化に用いる酵素としては、たとえば、トリプシン、キモトリプシン、Lys-C、Asp-N、Glu-C等が挙げられる。
【0119】
このようにして得られたサンプル生成物をそのまま測定することもできるが、HPLCにより分離することもできる。HPLCに用いるカラムには、以下に限定されるものではないが、アニオン交換カラム又はカチオン交換カラム等が挙げられる。HPLCの諸条件(流速、検出器、移動相)は、当業者には容易に理解され、適宜選択できる。
【0120】
前述のように調製されたサンプルを、図3に示す工程S12にて質量分析を行う。この質量分析は、ガスクロマトグラフと結合された質量分析装置であるガスクロマトグラフィーマススペクトロメトリー(GC/MS)や液体クロマトグラフと結合された質量分析装置である液体クロマトグラフィーマススペクトロメトリー(LC/MS)等の汎用の装置を利用することができる。質量分析におけるイオン化方法は、前述の本発明の第一の態様で説明したように、各装置に応じて適宜選択できる。たとえば、MALDI、ESI、EI、CI、APCI、FAB、LD、FD、SIMS、TSP等が挙げられる。アナライザーには、各装置に応じて適宜選択できる。たとえば、TOF、イオントラップ、二重収束型、四重極型、フーリエ変換型等の汎用の装置を用いて行うことができる。
【0121】
質量分析による測定の結果から得られたデータを用いて、タンパク質を同定することができる。得られたデータを市販のソフトウエア、たとえば、SonarMSMS(Genomic solution社)及びデータベース、たとえば、NCBInr(hhtp://www.ncbi.nlm.nih.gov/)、IPI、Sport等のデータベースを使用することによりタンパク質の自動同定が可能である。質量分析による測定データを用いて、タンパク質を同定することは、当業者には容易に理解できる(たとえば、Nat Genet. 1998:20, 45-50; J Cell Biol. 1998: 141, 967-977; J Cell Biol. 200: 148, 635-651; Nature, 2002: 415, 141-147; Nature. 2002: 415, 180-183; Curr Opin Cell Biol. 2003: 15, 199-205; Curr Opin Cell Biol. 2003: 7, 21-27)。
【0122】
本発明に係る解析方法では、概略的には、質量分析による測定の結果から得られたデータを用いて、各タンパク質についての内部標準物質となる同位体標識タンパク質由来ピークと、サンプル中のタンパク質由来ピークの強度比や、より詳細には、固有のタンパク質に由来する波形分離したマスクロマトグラムを求めて、サンプル間でこれらのピーク強度比の値や、波形面積を比較することにより、図3の工程S13に示すサンプル中のタンパク質の定量的解析を可能とする。たとえば、本発明による第一の実施態様で説明したように、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加える工程と、各サンプルから生体分子を抽出、分画等する工程を、図3に示す工程S13にて行う。次いで、前記生体分子を質量分析装置で測定する(図3の工程S12参照)。その後、図3の工程S13に示す定量的解析にて、前記質量分析装置で得られた結果を取得し、各生体分子の標識ピークと非標識ピークとを選択した上で各ピークの強度比を求めて、当該生体分子を定量するができる。
【0123】
図5は、質量分析装置における質量分析後に、本発明に係る定量的解析方法のスキームを示す。図5に示すように、本発明による定量的解析方法は、被解析対象の質量分析スペクトルのMS/MS処理によるアミノ酸配列の決定(工程S111)、前記質量分析スペクトル(第一のm/z)の決定工程(工程S112)、前記アミノ酸配列が決定されたタンパク質の第一のm/zの値から、前記タンパク質に対して同位体標識された同位体標識タンパク質の第二のm/zの値の算出(工程S113)、前記第一及び第二のm/zの値における時間に対する質量分析スペクトル(以下、「マスクロマトグラム」と称する場合もあある。)の抽出(工程S114)、前記第一及び第二のm/zの値に対応する各タンパク質のマスクロマトグラムに対する波形分離(工程S115)、前記波形分離処理により得られた固有のタンパク質由来による波形面積の算出(工程S116)、前記第一のm/zに対応する第一の波形面積の値と、前記第二のm/zに対応する第二の波形面積の値とから、(前記第二の波形面積)/(前記第一の波形面積)の比の算出(工程S117)を、含む。以下、各工程を詳述することにより、本発明に係る定量的解析方法を説明する。
【0124】
なお、前記解析方法は、同位体非標識タンパク質の質量分析スペクトルから、対応する同位体標識されたタンパク質の質量分析スペクトルを求める方法に基づいて説明したが、先に、解析対象として同位体標識タンパク質の質量分析スペクトルを決定した後で、対応する同位体非標識タンパク質の質量分析スペクトルを求める方法でも、本発明に係る解析方法は実施可能であることは、当業者には容易に理解できる。
【0125】
図6は、典型的な質量分析装置にて得られるスペクトルを示す。得られるスペクトルの種類には、任意の時間軸点から、m/zに対する強度軸を示すスペクトル(m/zに対する質量分析スペクトル)や、検出された全イオン量を、各時間に対する強度で示すスペクトル(時間に対する質量分析スペクトル(以下、「マスクロマトグラム」と称する場合もある。)がある。
【0126】
図5に示す工程S111では、MS/MS処理から得られた質量分析スペクトルにより、アミノ酸配列を決定する(工程S111)。その後、解析対象とするタンパク質の第一のm/zの値を定める(工程S112)。
【0127】
前述したMS/MS処理とは、複数の質量分離部を用い、1つ目の質量分離部(以下、「MS1」という。)のイオン化室で生成したイオン種のうちの一つを前駆イオンとして選択し、2つ目の質量分離部(MS2)で、その前駆イオンの分解によって生じる生成イオンを検出する処理法である。そして、生成イオンのm/zの値からアミノ酸配列の解析を行うものであり、当業者には、MS/MS処理によりアミノ酸配列を決定する手法は容易に理解される(たとえば、「ポストゲノム・マススペクトロメトリー」 1993年、pp 39-72 丹羽利充編 化学同人 参照)。このMS/MS処理によるアミノ酸配列の決定は、インターネットを介してNCBInr (hhtp://www.ncbi.nlm.nih.gov/)データベースとの照合により実行することが可能である。
【0128】
その後、前記アミノ酸配列が決定されたタンパク質の第一のm/zの値から、そのタンパク質に対応する同位体標識タンパク質の第二のm/zを求める。これは、図3に示す工程S11にてサンプル調製する際、同位体標識させるアミノ酸として、安定同位体が既知である試薬、たとえば、13C標識(13Cx6個)ロイシンを利用して細胞を培養させれば、第一のm/zの値と第二のm/zの値の差は、12Cと13Cの6個分であり、その差が6である。そして、タンパク質の電荷の値から、工程S113にて第二のm/zの値を算出することができる。
【0129】
前記第一のm/z及び前記第二のm/zの値における、時間に対する質量分析スペクトル(以下、それぞれ、「時間に対する第一の質量分析スペクトル(以下、「第一のマスクロマトグラム」と称する場合がある。)」という、「時間に対する第二の質量分析スペクトル(以下、「第二のマスクロマトグラム」と称する場合がある。)」という)を、質量分析装置にて得られた質量分析スペクトルから抽出する(工程S114)。
【0130】
ところで、細胞中には複数のタンパク質が存在しており、その多くのタンパク質を一度に質量分析すると、一つのマスクロマトグラムであっても、異なるタンパク質のピークが重なる現象が観測される。図7は、単一のm/zの値において、複数のピークが重なっている一例のマスクロマトグラムを示す。
【0131】
かかる現象により、細胞中のタンパク質の発現量の定量的解析を困難にしている。そこで、本発明では、前示の第一のマスクロマトグラム及び第二のマスクロマトグラムに対して、波形分離処理を行い(工程S115)、固有のタンパク質由来のマスクロマトグラムに分離する。
【0132】
本発明で用いる波形分離処理とは、複雑な波形に対する曲線適合法を基本とする合成的分離法である。これは、最初に各ピーク成分が特定の解析関数で表現できると仮定する。この仮定に基づき、いくつかのピーク関数を生成・合成し、各ピーク関数に含まれるパラメータを調整して観測波形との偏差を最小化する。偏差の最小点におけるパラメータより、各ピーク波形を分解・分離することにより行う。なお、本発明による波形分離処理に利用される波形パラメータには、ピークの個数、各ピークの形、ピーク位置、ピーク高さ、ベースラインの形等が挙げられる。
【0133】
図8は、図7に示したマスクロマトグラムを、本発明による波形分離処理により分離したマスクロマトグラムを示す。本発明では、たとえば、ガウシアン関数とローレンツ関数とを利用して波形分離することができる。図8から明らかなように、実線で示される、実際に測定されたマスクロマトグラムは、本発明による波形分離処理により、点線等で表されるマスクロマトグラムにより5分割される。
【0134】
図8に示す波形分離処理を、同位体非標識タンパク質とそれに対応する同位体標識タンパク質とで実行する。このようにして得られたマスクロマトグラムは、固有のタンパク質に由来するマスクロマトグラムである。そして、そのマスクロマトグラムの面積を、前記同位体非標識タンパク質及び同位体標識タンパク質のそれぞれについて算出し、それぞれを、第一の波形面積及び第二の波形面積とする(工程S116)。次いで、工程S117にて、(第二の波形面積)/(第一の波形面積)の比を求め、タンパク質変動の定量的解析に利用できる。これは、常に、同位体標識されたタンパク質との比較を行うことで、定量的解析を可能にするものである。
【0135】
次に、本発明による定量的解析方法に係るプログラムを、コンピュータにて実行させる解析システムについて説明する。図9は、本発明が適用される解析システム10の構成の機能ブロック図の一例を示す。なお、図9では、前記構成のうち、本発明に関係する部分のみを概念的に示し、マイクロコンピュータから構成される。
【0136】
本発明に係る解析システム10は、概略的には、質量分析装置20にて得られた質量分析データを解析する解析装置部30と、アミノ酸配列決定用の外部分析プログラム等を提供する外部装置部40とを、ネットワーク50を介して通信可能に接続して構成される。なお、図9に示すネットワーク50は、解析装置部30と外部装置部40とを相互に接続する機能を有し、たとえば、インターネット等である。
【0137】
本発明にて用いられる質量分析装置20は、特に限定されるものではなく、市販の質量分析装置であればよい。そして、前記質量分析装置20は、それ自体に該装置にて測定して得られた結果を保存するデータ保存部25を備えていてもよい。また、本発明に用いられる質量分析装置20は、それ自体に装置を制御する制御部や入出力部を備えるものであってもよい。
【0138】
図9に示す外部装置部40は、ネットワークを介して、質量分析データを解析する解析装置部30と相互に接続され、利用者に対してアミノ酸配列情報等に関する外部データベースやホモロジー検索等の外部分析プログラムを実行するウェッブサイトを提供する機能を具有する。
【0139】
ここで、外部装置部40は、WEBサーバやASPサーバ等として構成してもよく、そのハードウェア構成は、一般に市販されるワークステーション、パーソナルコンピュータ等の情報処理装置及びその付属装置により構成してもよい。また、外部装置部40の各機能は、外部装置部のハードウェア構成中のCPU、ディスク装置、メモリ装置、入力装置、出力装置、通信制御装置等およびそれらを制御するプログラム等により実現される。
【0140】
本発明では前記外部装置部としてNCBInr等のデータベースを利用することができる。
【0141】
図9に示す解析装置部30は、概略的には、質量分析装置20の全体を統括的に制御するCPU等の制御部60、通信回線等に接続されるルータ等の通信装置(不図示)に接続される通信制御インターフェース部70、質量分析装置20、およびディスプレイやプリンター等の出力装置90に接続される入出力制御インターフェース部80、および各種のデータベースを格納する記憶部100を備えて構成される。各部は任意の通信路を介して通信可能に接続される。さらに、本発明による解析装置部30は、ルータ等の通信装置及び専用線等の有線又は無線の通信回線を介して、ネットワークに通信可能に接続されている。
【0142】
記憶部100に格納される各種のデータベース(質量分析データやアミノ酸配列データベース等)は、固定ディスク装置等のストレージ手段であり、ファイルやデータ等を格納する。
【0143】
前記記憶部100の各構成要素のうち、質量分析データベースは、質量分析装置20にて得られたデータベースである。また、アミノ酸配列データベースは、質量分析装置にて得られた質量分析スペクトルの解析結果としてのアミノ酸配列データベースや、インターネットを経由してアクセス可能な外部のアミノ酸配列データベースであってもよい。さらに、これらのデータベースをコピーしたり、オリジナルの配列情報を格納したり、さらに独自の識別番号を付与し作成したインハウスデータベースであってもよい。
【0144】
制御部60は、本発明に係る解析方法を実行するプログラムを格納し、前記解析装置部30を、ひいては解析システム10の全体を制御する装置である。前記制御部60は、OS(operating system)等の制御プログラム、各種の処理手順等を規定したプログラム、および所要データを格納するための内部メモリ(不図示)を有し、これらのプログラム等により、種々の処理を実行するための情報処理を行う。なお、本発明に係る解析方法を実行するプログラムは、前記記憶部100に格納されていてもよい。
【0145】
図10は、本発明に係る解析方法を実行する一のプログラムを、概念的に表すフローチャートである。工程S200にて、制御部60は、質量分析装置20にて得られた質量分析データを取得する。そして、取得した質量分析データを記憶部100に保存するが、その際に、後述する解析の便宜のため、データ検索を容易にするように、各質量分析データに、スキャン番号等の識別番号を付与する(工程S201)。次に、図5の工程S111にて説明したのと同様に、通信制御インターフェース部を介したインターネット50を通じて、外部のデータベース、たとえば、NCBInrデータベースと照合させながら、MS/MS処理により、制御部60にてアミノ酸配列を決定することができる(工程S202)。前記質量分析データの中から、解析対象とする質量分析スペクトルを決定する(工程S203参照)。その際、前述のように決定した質量分析スペクトルのm/zを定め、これを第一のm/zとする。この第一のm/zの値は、同位体非標識タンパク質の質量分析スペクトル、または同位体標識タンパク質の質量分析スペクトルであってもよい。かかる決定は、前述のスキャン番号から容易に行うことができる。
【0146】
工程S204にて、前記アミノ酸配列が決定されたタンパク質の第一のm/zの値から、そのタンパク質に対応する同位体標識タンパク質の第二のm/zの値を求める。この決定工程は、図3の工程S11にて予め培養させる際に利用した同位体標識のアミノ酸に含まれる同位体原子の数と、前記第一のm/zに対応するタンパク質の電荷から容易に決定することができる。決定した第二のm/zの値から、その値のマスクロマトグラムを、記憶部100に格納された質量分析データから抽出する(工程S205参照)。
【0147】
次いで、第一のm/z及び第二のm/zの値における第一のマスクロマトグラムおよび第二のマスクロマトグラムに対して、図7及び図8にて説明したように、工程S206にて波形分離処理を行う。本処理により、固有のタンパク質に由来するマスクロマトグラムを分離し、記憶部100に格納する。このようにして得られたマスクロマトグラムの波形面積として、第一の波形面積及び第二の波形面積を算出し(工程S207)、工程S208にて、(第二の波形面積)/(第一の波形面積)の比を求める。
【0148】
その後、必要に応じ、前記比の値を、ディスプレイ若しくはプリンター等の出力装置90に表示若しくは印字することができる。
【0149】
図10に示す一連の工程を、同位体標識タンパク質に起因する質量分析スペクトルと比較しながら行うため、サンプル内のタンパク質発現量の変化を、定量的に解析することが可能となる。また、必要に応じて、解析対象とする別の質量分析スペクトルに対して、図10に示す一連の工程を繰り返し実行することも可能である。たとえば、正常な細胞由来のタンパク質との比較から、遺伝子欠損した細胞由来のタンパク質の発現パターンの相違を観測することも可能である。
【0150】
さらに、図10では、同位体非標識された生体分子と同位体標識された生体分子にて説明したが、同位体標識された生体分子に代えて、同位体標識された内部標準物質である生体分子を利用することもでき、その場合、図10の工程SS208に示す波形面積比は、(生体分子の波形面積)/(内部標準物質に固有の波形面積)の比として算出される。
【0151】
図11は、本発明に用いる制御部60の詳細な構成を示す機能ブロック図である。前述のように、図10で説明した本発明に係る解析方法を実行するための制御部80は、質量分析装置20にて得られた質量分析データを、入力制御インターフェース部80を通じて、制御部80のデータ入出力部にて入手する。外部のデータベース、たとえば、NCBInrデータベースと照合させながら、MS/MS処理により、入手したタンパク質の質量分析データについてのアミノ酸配列を、制御部60の処理部にて決定する。解析対象としての質量分析スペクトルを、質量分析装置20、または制御部80と接続された不図示の入力手段からの信号に基づき決定する。ここで、前記入力手段としては、たとえば、制御部に接続されたキーボードやマウス等が挙げられる。
【0152】
前記決定により第一のm/zの値が決まり、制御部60の処理部にて第二のm/zの値を決定する。第二のm/zの値の決定は、図5の工程S113により行うことができる。なお、第一のm/zの値と第二のm/zの値のタンパク質は、アミノ酸の同位体非標識と、同じアミノ酸が同位体標識されたタンパク質の関係にある。
【0153】
このように決定された第一及び第二のm/zの値におけるマスクロマトグラムを、データ入出力部を介して、記憶部100の質量分析データベースや、質量分析装置20から、処理部にて入手する。入手した第一および第二のm/zの値におけるマスクロマトグラムを、図5の工程S115や図10の工程S206にて説明したように、処理部にて波形分離処理する。かかる波形分離処理により、m/zの値におけるマスクロマトグラムの結果からだけでは、一見、単一のタンパク質のピークと観測されたものであっても、固有のタンパク質に由来するマスクロマトグラムに分離することが可能となる(図8参照)。
【0154】
次いで、固有のタンパク質に由来するマスクロマトグラムに分離されたデータを、波形処理部から演算部へ送り、前記演算部にて分離された波形面積の算出と、同位体非標識と同位体標識されたタンパク質において、対応する固有のタンパク質に由来するマスクロマトグラム間の波形面積比の算出と、を実行する。
【0155】
このように、本発明に係る解析方法によれば、同位体非標識と同位体標識のアミノ酸を含むタンパク質において、固有のタンパク質に由来する波形分離されたマスクロマトグラム間の比較により、定量的解析を可能とする。
【0156】
次に、代謝的に同位体標識されたタンパク質である内部標準物質または代謝的に同位体標識されたタンパク質である内部標準物質を含む細胞を利用した解析方法について説明する。
【0157】
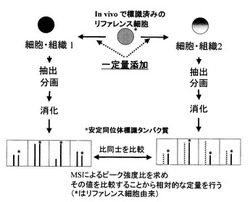
本発明の第一の実施態様において説明したように、各サンプルに、予め、代謝的に同位体標識されたタンパク質である内部標準物質または代謝的に同位体標識されたタンパク質である内部標準物質を含む細胞を加え、各サンプルからのタンパク質を抽出、分画等し、質量分析装置に測定する。その後、図5、図9〜図11にて説明したように、波形分離処理を伴う、本発明による解析方法を行うことにより、生体分子の定量的解析を可能とする。なお、かかる解析方法は、サンプルが培養できない場合、サンプルが培養できても、継代培養により影響を受ける場合、サンプルを同時期、同研究所で準備できない場合に、有用な方法である。さらに、前記内部標準物質中のタンパク質が既知量であるならば、絶対定量を可能とする。
【0158】
ここで、本発明の第一の実施態様における、生体分子の標識ピークと非標識ピークとの強度比を求めて比較する方法を実行するプログラムについて説明する。図12は、本発明の第一の態様における強度比を求め、比較するためのプログラムの工程図を示す。図12に示す工程S300にて、質量分析装置20にて測定された各種測定サンプルの質量分析データを、本発明に係る解析システム10の解析装置部30にて取得する。前述のとおり、測定サンプルの調製方法に調製された、分画したサンプル、精製サンプル、分離サンプル、消化したサンプル又はHPLCにより分離されたサンプルを含むものである。ここでは、特に、代謝的に同位体標識されていない生体分子と、同位体非標識の生体分子を対象とする。
【0159】
次いで、工程S301にて、前記質量分析スペクトルの測定結果に関するデータを、解析装置部30の通信制御IF部70を介して、外部のデータベース、たとえば、NCBInrデータベースと照合させながら、MS/MS処理により、入手した質量分析に関するデータ、具体的には、同位体標識および同位体非標識のタンパク質の同定、つまりはアミノ酸配列を制御部60の処理部にて同定する。その後、対象とする同位体標識ピークと同位体非標識ピークとを特定する(工程S302参照)。
【0160】
以上の結果に基づき、工程S303に示すように、制御部60にて、ペプチドのアミノ酸配列が同定された分子における、同位体標識ピークと同位体非標識ピークのピーク強度比を算出する。以上の操作を、各サンプルから得られた複数のペプチドについて実行することにより、異なるペプチド間で、ピーク強度比の比較することができる。
【0161】
さらに、同位体標識された生体分子が既知量である場合には、図12に示す工程を実行すると、本発明では、生体分子を絶対定量するプログラムを提供することができる。
【0162】
ところで、波形分離されたマスクロマトグラムに関して、実際に測定され、波形分離されたマスクロマトグラムは、元来、解析対象であるサンプルを二次元電気泳動等により分離されたタンパク質を質量分析したものである。そのサンプル調製の際、ゲル上のタンパク質スポットのバンドを切断し、容器に回収する。次いで、当該容器内のゲルを、トリプシン等の酵素で消化してペプチドに断片を回収して、質量分析を行う。
【0163】
このように回収されたペプチドは、切断されたタンパク質スポットに由来するバンドから誘導されるものであるが、当該バンド自体が単一のタンパク質を含有するものではなく、同じタンパク質でも、サンプル処理過程でペプチドが切断され得ることにより、複数のバンドに存在していることが通例である。そのため、前述のように波形分離されたマスクロマトグラムであっても、同一のペプチドは複数の波形分離されたマスクロマトグラムとして測定される。よって、同一のペプチドであっても、(同位体非標識ペプチドのピーク)/(同位体標識ペプチドのピーク)の比や(同位体非標識ペプチドの波形面積)/(同位体標識ペプチドの波形面積)の比の値(以下、これらを総称して「定量値」という。)は、質量分析したピーク毎に異なり、複数の値が存在することになる。
【0164】
そこで、波形分離されたマスクロマトグラムの結果から、1又は複数のペプチドに着目して、当該ペプチドが構成するタンパク質が同定されるか否かを検討することができる。たとえば、前記質量分析スペクトルの結果を、タンパク質の機能情報を有するLocusLink等のデータベースと照合して、タンパク質の機能情報を得ることができる。ここでLocusLinkには、NCBInr、IPI、Sport等の複数のデータベースにおけるキー情報から「Locus ID」という共通のキーへのリンク情報およびタンパク質の機能情報が提供されている。そこで、ペプチド配列から、NCBInr、IPI、Sport等のデータベースを使用して、各データベースにおけるキー情報を得る。次に、LocusLinkを使用して、キー情報からLocus IDを得ることができる。そして、当該Locus IDから、タンパク質の機能情報を得ることができる。例えば、ペプチド配列から、NCBInr等のデータベースを使用して、「GiNo」というキー情報を得る。次に、LocusLinkを使用して、GiNoからLocus IDを得る。そして、当該Locus IDから、タンパク質の機能情報を得ることができる。
【0165】
図13は、本発明で用いる、外部データベースを利用した機能情報の取得に関するスキームを示す。図13に示すように、波形分離後のペプチド毎に分類した上で、タンパク質の機能情報を有するデータベース、たとえば、NCBInr、IPI、Sport等へアクセスする。特に、NCBI-BLASTを利用して配列パターンを照合する。得られた配列パターンからNCBInrのキー情報であるGiNoを取得し、詳細な機能情報を有するデータベースであるLocusLinkへ接続し、GiNoからLocus IDを取得する。その後、同一のLocus IDを有するものをグループ化するとともに、かかるIDからGene Symbol、Gene Ontology(biological process)、Gene Ontology (cellular component)、Gene Ontology(molecular function)、代表定量値の情報を入手することができる。なお、波形分離前の工程は、図5および図10に示した工程と同様である。
【0166】
さらに、前述のグループ化されたGene Symbolから各ペプチドが構成していたタンパク質の情報も取得でき、複数のペプチドにおける測定値からタンパク質の定量値を算出することが可能となる。これにより、かかるタンパク質の定量値と生物学的情報との関連付けが実現される。なお、ペプチドの定量値の場合、単にその平均の定量値を算出することもできるが、その場合、ペプチドの定量値の極大値および極小値の影響を受けやすい。一方で、タンパク質の定量値を算出するにあたり、グループ化された機能タンパク質にて標準偏差を求め、その標準偏差の範囲内のデータのみで再度平均を求めてそのタンパク質の定量値とすれば、ペプチドの定量値よりも、タンパク質の定量値とその生物学的情報との関係性に意義があるものとなる。
【0167】
前述の定量値と機能情報との付加の操作は、図11に示した情報付加部により、外部のデータベースを利用して行うことができる。なお、質量分析データに関する処理は、図9に示した手段等により、波形分離までの情報処理工程と同様である。
【0168】
図14は、本発明において、波形分離後(工程S400)、決定されたペプチドの配列の結果に基づき、機能情報の付加を行う方法を実行するための工程図を示す。工程S401にて、選択したペプチドの配列ごとに分類し、その後の解析の対象とするペプチド配列を特定する。次いで、図9に示すように、通信制御インターフェースを介して、外部のデータベースへ、機能情報を取得するためにアクセスする。ここで、外部のデータベースの具体例としては、NCBInr(hhtp://www.ncbi.nlm.nih.gov/)、IPI、Sport等のデータベースを挙げることができる。そして、かかるデータベースから、配列パターンを検索し、GiNo等の情報を取得する。その後、工程S402において、ペプチドのGiNo等の情報から、当該ペプチドが構成していたタンパク質に関する情報の有無を検査する。タンパク質の情報を有する場合には、かかる情報を共有する配列としてグループ化する。このグループ化されたタンパク質における定量値を算出する(工程S403参照)。さらに、この情報には、図14に示すように、Gene Symbol、GO(biological process)、GO(cellular component) GO(molecular function)等の機能情報を入手することもできる。なお、前述の定量値の平均値を求め、当該ペプチドの代表定量値を算出することは、図9および図11に示す制御部60の演算部にて行うことができる。
【0169】
このようにして、決定されたペプチドの配列の結果から、ペプチドが構成していたタンパク質を検出し、そのタンパク質の定量値と機能情報、具体的には、Gene Ontology情報との関連を付けることができる。これは、タンパク質の定量値と生物学的データとの関連性を示唆するものである。
【0170】
また、本発明では、MS/MS処理から得られた質量分析スペクトルにより、ペプチドを構成するアミノ酸配列を決定したのち、波形分離処理を施さずに、前述のタンパク質の機能情報を有するデータベース(NCBInr等)へアクセスし、ペプチドの定量値と生物学的データとの関連性を見出すこともできる。これは、アミノ酸配列の決定されたペプチドの質量分析スペクトル自体を波形分離する必要がない場合にも、適用できる。
【0171】
図15は、波形分離をせずに、同位体標識された生体分子である内部標準物質存在下でのペプチドの質量分析スペクトルの結果、具体的にはアミノ配列の結果に基づき、機能情報の付加を行う方法を実行するための工程図を示す。図15に示す工程S500〜S502までは、図10に示す工程S200〜S205と共通するため、その説明は省略する。本発明の好ましい態様では、工程S503にて第一および第二、並びに内部標準物質のm/zにおけるマスクロマトグラムを抽出する。工程S502後、工程S504にて、図9に示す通信制御インターフェースを介して、外部のデータベースへ機能情報を取得するためにアクセスする。前述のように、外部のデータベースとしては、NCBInr(hhtp://www.ncbi.nlm.nih.gov/)、IPI、Sport等のデータベースを挙げることができる。かかるデータベースから、ペプチドの配列パターンを検索し、GiNo等の情報を取得する。この後、工程505にて、ペプチドのGiNo等の情報から、そのペプチドは構成していたタンパク質の関する情報の有無を検索する、タンパク質の情報を有する場合には、そのタンパク質情報から、Gene Symbol、GO(biological process)、GO(cellular component)、GO(molecular function)、代表定量値等の機能情報と関連させることができる。なお、図15に示す工程図では、図10の工程S209にて実行した、同位体非標識のペプチドと同位体標識のペプチドの波形面積の比を求める工程を記載していない。しかし、工程S502にて配列決定された同位体標識および同位体非標識のペプチドにおいて、各々のペプチドの波形面積を求め、(同位体非標識ペプチドの波形面積)/(同位体標識ペプチドの波形面積)の比を算出し、工程S504およびS505を実行することにより、機能情報と関連させることもできる。なお、波形面積の比だけでなく、ピーク強度比を用いても、同様に、機能情報と関連させることもできる。
【実施例】
【0172】
以下に、具体的な例をもって本発明を示すが、本発明はこれに限られるものではない。
[実施例1]
代謝的に同位体標識された生体分子である内部標準物質を含む細胞を調製するため、以下の操作を行った。
マウス神経芽細胞種Neuro2Aを培養した。培地には、10%牛胎児血清(MOREGATE社、BATCH 32300102)、100U/ml ペニシリンG、100μg/mlストレプトマイシン(GIBCO社、15140-122)を含むRPMI-1640(Sigma社、R−7130)を用いた。RPMI-1640としては、L-グルタミン、L-リジン、L-メチオニン、L-ロイシン、炭酸水素ナトリウムを含まない粉末培地を選択し、当該培地に欠損した成分を加えて調製(L-グルタミン(Sigma社製、G-8540)、L-リジン(Sigma社製、L-9037)、L-メチオニン(Sigma社製、M-5308)、炭酸水素ナトリウム(和光純薬、191-01305)をそれぞれ0.3g/L、0.04g/L、0.015g/L、2g/Lを加え、さらに、安定同位体で標識されたL-ロイシン(Cambridge Isotope Laboratories社、CLM-2262)を0.05g/L加えた)した。このようにして調製した培地を用いて、5%CO2下37℃で培養した。この培養によって得られた細胞を、代謝的に同位体標識された生体分子である内部標準物質を含む細胞として以下の実験に用いた(実施例2−7)。
【0173】
代謝的に同位体標識された生体分子である内部標準物質を含む細胞におけるタンパク質量を測定するために以下の操作を行った。
代謝的に同位体標識された生体分子である内部標準物質を含む細胞1.9x107個を細胞溶解液M-PER(PIERCE社、78501)1mLで可溶化し、遠心分離により不溶性画分を除去して可溶性画分を調製した。この可溶性画分に含まれるタンパク質量をタンパク質定量試薬Micro BCA(PIERCE社、23235)を用いて定量した。その結果、6.2mg/mLであった。
【0174】
[実施例2]
再現性を確認するために、以下の実験を行った。
<測定サンプルの調製>
サンプルとして、野生型マウス(C57BL/6)およびADAM22遺伝子を欠損させたマウスを複数用意し、それぞれの全脳を摘出し凍結保存した。脳湿重量あたりのタンパク質量を測定するため、そのうちの1個の脳湿重量を測定し、さらにプロテアーゼインヒビター(コンプリートTM(ロシュ・ダイアグノスティックス株式会社、製品番号 1 697 498)をサンプルからの抽出液50 mLあたり2錠になるように溶解した)を含む10mMHEPES-(pH7.4)-1mMDTT-1mMMgCl2-1mMNaF-1mM vanadate中でホモジナイズし、100,000xg1時間の遠心分離により可溶性画分を調製した。この可溶性画分のタンパク質量を測定したところ、脳湿重量1gあたりタンパク質量39.4mgとなった。
【0175】
被検体とする脳を解凍して脳湿重量を測定し、上述の脳湿重量あたりのタンパク量から、被検体のタンパク質量を推定した。そして、実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞をタンパク質量が等しくなるような細胞数(12.1x107個)加えて、テフロンRホモジナイザーでホモジナイズし、500xg 5分間の遠心分離により未破壊の細胞、核などを除去した。次にその上清を100,000xg 1時間の遠心分離することにより可溶性画分を調製した。
【0176】
<サンプルの抽出、分画、精製、消化>
サンプル中のあるタンパク質が定量できることを確認するために、cytosolic malate dehydrogenase(cMDH)と親和性を持つことが知られているE7070(J. Med. Chem. 42, 3789-99, 1999)を固定化したアフィニティーマトリックス(Anal. Chem. 75, 2159-2165, 2003)を使用して、以下の操作を行った。可溶性画分0.1mLを0.9mLのPBSで希釈し、E7070を固定化したアフィニティーマトリックス0.1mLと混合して反応させた後に遠心分離で上清を除去した。沈殿したアフィニティーマトリックスをPBS、1MNaClで洗浄した後、吸着したタンパク質を、PBS-10mM NADH溶液(NADHは、Sigma社、N-8129)で溶出することによりcMDHを回収した。回収した画分を限外ろ過で濃縮してSDS PAGE(ATTO社製、e-PAGEL、E-T520L)にかけて精製し、cMDHに相当するバンドを切り出してトリプシン(Promega社製, Cat. No. V5111)でゲル内消化(Rapid Comm Mass Spectrom., 15, 1416-1421, 2001: Rapid Comm Mass Spectrom., 17, 1071-1078, 2003)し消化したサンプルを得た。
【0177】
<消化したサンプルの測定>
消化したサンプルをMALDI-MS(ABI4700, Applied Biosystems社製:alpha-cyano-4-hydroxyl cinnamicacid (CHCA)をマトリクスとしてDry-droplet法でサンプルと共結晶化した)で測定した。得られた結果を基に、フラグメントの同定、ピーク強度比の算出(付属のソフトウエアにピーク面積を計算させて、強度比を計算)を行った。具体的な計算は、以下のように行った。
【0178】
野生型マウス(Wild)およびADAM22遺伝子ノックアウトマウス(KO)におけるcMDHについて、野生型マウスにおけるcMDH由来の非標識ピーク(例えば、m/z = 1750のとき、非標識ピーク=12405.31)を内部標準物質におけるcMDH由来の標識ピーク(m/z = 1762のとき(ロイシンを2つ含むため分子量は12増加する)、標識ピーク = 5373.19)で除することによって、cMDHにおける非標識ピーク/標識ピーク(12405.31/5373.19 = 2.308743)を求めた。次に、同じく野生型マウスにおけるcMDH由来の非標識ピーク(例えば、m/z = 1770のとき、非標識ピーク = 4533.977)を内部標準物質におけるcMDH由来の標識ピーク(m/z = 1776のとき(ロイシンを1つ含むため分子量は6増加する)、標識ピーク = 3156.617)で除することによって、cMDHにおける非標識ピーク/標識ピーク(4533.977/3156.617 = 1.436341)を求めた。さらに、同じく野生型マウスにおけるcMDH由来の非標識ピークm/z = 1392, 1039についても同様に非標識ピーク/標識ピークの比を求め、それぞれ2.435703, 1.750933と算出した。次に、このそれぞれのピーク強度比2.308743, 1.436341, 2.435703, 1.750933の平均値1.98293を求め、これを野生型マウスにおけるcMDH由来のピーク強度比とした。
【0179】
一方、ADAM22遺伝子ノックアウトマウスにおけるcMDHの非標識ピーク(非標識ピーク = 13011.03)を内部標準物質におけるcMDH由来の標識ピーク(標識ピーク= 6035.838)で除することによって、該生体分子における非標識ピーク/標識ピーク(13011.03/6035.838 = 2.155629)を求めた。同様に非標識ピーク/標識ピークの比を求め、それぞれ2.056147, 2.340332, 2.090195と算出した。次に、このそれぞれのピーク強度比2.155629, 2.056147, 2.340332, 2.090195の平均値2.160576を求め、これをADAM22遺伝子欠損マウスにおけるcMDH由来のピーク強度比とした。
【0180】
次に、野生型マウスにおけるピーク強度比(2.308743)とADAM22遺伝子ノックアウトマウスにおけるピーク強度比(2.160576)とを比較し、比0.917778を得た。
この操作を5回繰り返し、実験間の測定値の変動を検討した。
その結果、アフィニティー精製と言う実験間の測定値の変動が大きいステップを経ているにも関わらず、CV値4.1%という再現性の良い結果を得ることが出来た。(図16および表1)
【0181】
【表1】

[表1] cMDHについて、野生型マウス脳およびADAM22遺伝子欠損マウス脳における代謝的に同位体標識された生体分子である内部標準物質とのピーク強度比ならびに内部標準物質に対する野生型マウス脳のピーク強度比とADAM22遺伝子欠損マウス脳のピーク強度比との比較における再現性(n=5)を表している。
【0182】
[実施例3]
目的物質の量の変化に応じて質量分析スペクトル上のピーク強度比が比例的に変化することを確認するために以下の実験を行った。
<測定サンプルの調製>
サンプルとして、野生型マウス(C57B6)の全脳を摘出し凍結保存した。脳湿重量を測定し、プロテアーゼインヒビター(コンプリートTM(ロシュ・ダイアグノスティックス株式会社、製品番号 1 697 498)をサンプルからの抽出液50mLあたり2錠になるように溶解した)を含む10mM HEPES-(pH7.4)-1mM DTT-1mM MgCl2-1mM NaF-1mM vanadate中でホモジナイズし、100,000xg 1時間の遠心分離により可溶性画分を調製した。可溶性画分のタンパク質濃度が3.7mg/mLになるように調製した。
【0183】
実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞1.9x107個を細胞溶解液M-PER(PIERCE社、78501)1mLで可溶化し、遠心分離により不溶性画分を除去して、代謝的に同位体標識された生体分子である内部標準物質を調製した。代謝的に同位体標識された生体分子である内部標準物質を上記可溶性画分に対し、1:3、1:1、3:1、10:1の割合で混合して、サンプルの可溶性画分とした(0.2mLずつ)。
【0184】
<測定サンプルの抽出、分画、精製、消化>
サンプル中のあるタンパク質が定量できることを確認するために、cytosolic malate dehydrogenase(cMDH)と親和性を持つことが知られているE7070(J. Med. Chem. 42, 3789-99, 1999)を固定化したアフィニティーマトリックス(Anal. Chem. 75, 2159-2165, 2003)を使用して、以下の操作を行った。サンプルの可溶性画分0.1mLを0.9mLのPBSで希釈し、E7070を固定化したアフィニティーマトリックス0.1mLと混合して反応させた後に遠心分離で上清を除去した。沈殿したアフィニティーマトリックスをPBS、1MNaClで洗浄した後、吸着したタンパク質を、PBS-10mM NADH溶液(NADHは、Sigma社、N-8129)で溶出することによりcMDHを回収した。回収した画分を限外ろ過で濃縮してSDS PAGE(ATTO社製、e-PAGEL、E-T520L)にかけて精製し、cMDHに相当するバンドを切り出してトリプシン(Promega社製, Cat. No. V5111)でゲル内消化(Rapid Comm Mass Spectrom., 15, 1416-1421, 2001: Rapid Comm Mass Spectrom., 17, 1071-1078, 2003)し、消化したサンプルを得た。
【0185】
<測定サンプルの測定>
消化したサンプルをMALDI-MS(ABI4700, Applied Biosystems社製:alpha-cyano-4-hydroxyl cinnamicacid (CHCA)をマトリクスとしてDry-droplet法でサンプルと共結晶化した)で測定した。得られた結果を基に、でフラグメントの同定、ピーク強度比の算出(付属のソフトウエアにピーク面積を計算させて、強度比を計算)を行った。その結果、ピーク強度比はサンプル量に比例した直線となり(R2=0.97)、非常に精度良く定量することが可能であった(図17および18)。
【0186】
[実施例4]
動物組織由来のサンプル間の比較において、本法が適用できることを確認するために以下の実験を行った。
<測定サンプルの調製>
可溶性画分のタンパク質濃度が3.7mg/mLになるように調製した。
サンプルとして、野生型マウス(C57B6)およびADAM22遺伝子を欠損させたマウス(系統、ブリーダー)を用意して、それぞれの全脳を摘出し凍結保存した。次に、脳を解凍して脳湿重量を測定し、実施例1で得た脳湿重量あたりのタンパク質量から、サンプル中のタンパク質量を算出した。そして、実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞をタンパク質量が等しくなるような細胞数加えて、テフロンRホモジナイザーにてホモジナイズし、500xg 5分間の遠心分離により未破壊の細胞、核などを除去した。次に、その上清を100,000xg 1時間の遠心分離することにより可溶性画分を調製した。タンパク質量を測定したところ、野生型マウス由来のタンパク質は3.02mg/mL、ADAM22遺伝子を欠損させたマウス由来のタンパク質は3.12mg/mLであった。これを分画したサンプルとした。
【0187】
続いて、各分画したサンプルにつき2mLずつ(1mLチューブ2本ずつ)につき以下の操作を行った。尿素(Bio-Rad社Cat. No. 161-0731)を加えて8Mとし、1mLあたり3mgのディチオスレイトール(和光純薬Cat.No. 045-08974: DTT)を加えた0.5M Tris緩衝液(pH8.3, Sigma社製)500μLを各分画したサンプルに加え、37度で3時間インキュベーションすることでタンパク質中のシステイン残基を還元した。その後、尿素を加えて8Mとし、8mgのアクリルアミド(Bio-Rad社製Cat. No. 161-0107)を加えた0.5M Tris緩衝液(pH8.3) 500μLを、各分画したサンプル加えて室温で3時間インキュベーションしてシステイン残基をアルキル化した。そこに8mgのDTTを加えることで過剰のアクリルアミドを失活させた。分子量1万カットのSnakeSkin(ピアス社、Cat. No.68100)を使い、1000倍量の10mMの炭酸水素アンモニウム緩衝液により、4℃にて、1昼夜透析することにより還元アルキル化試薬を除去し、当該分画したサンプルを野生型マウス由来のタンパク質、ADAM22遺伝子を欠損させたマウス由来のタンパク質それぞれ2本ずつのチューブに分け、SpeedVacにて凍結乾燥した。この各分画したサンプルを8Mの尿素を含む0.2%ベータ・オクチルグルコシド水溶液200μLで再溶解し、50mMの炭酸水素アンモニウムで5倍に希釈し、計1mLとした。タンパク質量0.3mgに対して100μLのトリプシン(プロメガ社製、Cat. No. V5111)を加えて37℃にて24時間消化を行った。ここで消化したサンプルを得た。この各消化したサンプル(野生型マウス由来のタンパク質、ADAM22遺伝子を欠損させたマウス由来のタンパク質)を各1本ずつアニオン交換カラム(Mini-Q PC 3.2/3: Amersham Biosciences Cat. No. 17-0686-01)およびカチオン交換カラム(Mini-S PC 3.2/3: Amersham Biosciences Cat. No. 17-0687-01)にアプライし、1分ごとに分取を行った。アニオン交換カラムの場合には、消化したサンプルに50μLのアンモニア水と0.5mLの超純水を加えて2万Gで1分間遠心し、上清をアニオン交換カラムに注入した。一方、カチオン交換カラムの場合には、消化したサンプルに50μLのギ酸と0.5mLの超純水を加えて2万Gで1分間遠心して上清をカチオン交換カラムに注入した。HPLC条件は、流速が毎分0.2mL、UV検出波長が235nm & 280nm、カチオン交換カラムの場合には、移動相Aが25mMのギ酸に5%アセトニトリル、移動相Bが1Mのギ酸アンモニウムでpH3.5、5%アセトニトリルとした。アニオン交換の場合には、移動相Aが25mMのアンモニアに5%アセトニトリル、移動相Bが1Mの酢酸アンモニウムでpH8.6に5%アセトニトリルとした。グラディエントは、最初5分間が100%移動相Aで、その後40分かけて移動相濃度を直線的に40%まで増加させ、その後15分間で移動相Bを100%として5分間流した。カラムから溶出してくる各フラクションを、TFAを加えることにより酸性とし、あらかじめアセトニトリルで洗浄後0.l%TFA水でコンディショニングしておいたZipTipC18 (ミリポア社製Cat. No. ZTC18S960)にアプライした。続いて、5%アセトニトリルを含む0.1%TFA 水20μLで3回洗浄し、5μLの70%アセトニトリルを含む0.1%TFA水で溶出することにより脱塩した。ここで、HPLCにより分離したサンプルを得た。
【0188】
次に、このHPLCにより分離したサンプルを95μLの0.1%TFA水で希釈してLC(C18column)/MS (ThermoFinnigan LCQ) で測定を行った。このときの条件は、HPLC側としてはMichrom BioResources Inc社のMagic C18カラム0.2x150mm(Cat. No. 902-61261-00)に移動相Aとして5%アセトニトリルと0.01%TFAを含む0.2%酢酸水、移動相Bとして95%アセトニトリルと0.01%TFAを含む0.2%酢酸水を用いて、最初の1分間は100%移動相Aとして、その後35分間で移動相Bを直線的に40%とし、その後0.1分間で移動相Bを100%にして7分間維持、その後移動相Aを100%として14分後に次のサンプルを注入した。装置には島津製作所のLC-10AシリーズのROMをミクロ対応として、また、ミキシングチャンバーとしては付属の島津製作所製を外してバルコ社のTコネクターを採用した。流速としてはFlow-splitting方式を採用し、カラムには約毎分1−2μLの流速となるように調整した。サンプルをCTC社のオートサンプラーPALによって50μL注入し、サンプルを一度インジェクターのサンプルループに組みこんだペプチド用キャピラリートラップカラム(Michrom BioResource社Cat.No.004-25109-32)で濃縮した後に分析カラムに送り込んだ。質量分析装置は、ThermoFinnigan社のLCQ DuoにAMR社に特注した、シーズガスを使用しない、そしてXYZステージによってスプレー位置を任意に調整できる低流速対応のサブナノスプレイヤーを装着し、かつ、スプレーにはメタルニードル(GLサイエンス社製(カタログ番号7820-59001)をC18カラムに直接つないで使用した。ESI電圧としては2.6kVを印加した。測定は、Data DependentモードでDynamic ExclusionのRepeatを1とした。なお、スキャン回数を稼ぐためにZoom Scanモードを外したいわゆるダブルプレーモードで測定した。
【0189】
得られたデータについては、SonarMSMS (Genomic solution社)およびNCBInrデータベース用いてタンパク質の自動同定を行った。このとき、安定同位体で標識したロイシン(ロイシン1つにつき分子量6の増加)でもNCBInrに対して検索できるように、プログラムの一部を改変した。定量はロイシンを含むペプチドのピークで行うため、SonarMSMSにより同定されたペプチドのうち、ロイシンを含むペプチドのみ選び出し、かつ、そのペプチドピークの溶出位置(HPLCでの保持時間=質量分析でのスキャン番号)を特定するためにLCQ Duoの付属ソフトであるLCQ#dta.exeファイルからスキャン情報を自動で選び出すソフトウエアを構築した。そして、そのスキャン番号の情報から、そのスキャン番号の質量分析スペクトルを抜き出し、天然型ロイシンペプチドのピークと同位体ペプチドのピークについて、MS/MSを測定した際の親イオンの情報(m/z値)とそのペプチド内に何個のロイシンがあるか、そして電荷は何個かをSonarMSMSでの検索結果から求めて、ペアとなるピークを探し、そのピーク強度比を自動計算した。このように構築した、本発明に係る解析ソフトウエアを用いてタンパク質の同定およびピーク強度比の算出を行った。また、サンプル中に存在し、かつ、質量分析により同定されていて、代謝的に同位体標識された生体分子である内部標準物質に存在しないタンパク質については、そのペプチドが同定された質量分析スペクトルと同じ又は近いScan番号に存在する、代謝的に同位体標識された生体分子である内部標準物質由来のペプチドピークとのピーク強度比を求めた。続いて野生型マウスの全脳とADAM22遺伝子を欠損させたマウスの全脳との間で可溶性画分に含まれるタンパク質量について、先に求めたピーク強度比を比較することで算出した。
【0190】
図19〜図22は、本発明による実施例5にて得られたタンパク質の同定結果を示す。
その結果、複数の生体分子(例えば、protein phosphatase 2a, myotrophin, heat shock protein 1, protein phosphatase PP2A, glyceraldehyde-3-phosphate dehydrogenase, ADP-ribosylation factor, cofilin, tubulin-beta等)が同定され、後述するように、網羅的に相対定量することができた。
【0191】
図23ないし26は、前述のタンパク質の同定結果に基づき、本発明による波形分離処理を施した、固有なタンパク質に由来する波形面積の比の結果を示す。
ロイシンを含むタンパク質を例として、本発明に係るプロテオーム解析について説明する。図19に示す、protein phosphatase 2aに由来するタンパク質の質量分析結果より、m/z値が644.7の同位体標識されていないロイシンを含むタンパク質に由来するピークに着目した(図19中にてLで示される)。なお、本ピークがロイシンに由来するものであることは、前述のMS/MS処理から判明している。つまり、前述の説明にて、図10に示す工程S200〜S203は、既に実行されている。
【0192】
図23は、時間、つまり、特定の連続したスキャン番号における質量分析スペクトルを示す図である。図23に示す結果から、644.7であるm/z値がスキャン2で極大をむかえ、その後、減衰していることが、ピークの高さの変動から分かる。
【0193】
図24は、図23に示すスキャン番号を、必要な数だけ連続してつなぎ合わせた結果のマスクロマトグラムを示す。具体的には、図24は、中心を644.7として(m/z値:644.2〜645.2)、スキャン番号975〜1005までの質量分析スペクトルをつなぎ合わせて作成したマスクロマトグラムを示す。
【0194】
以上の操作は、前述の解析ソフトにより、必要なスキャン情報を呼び出して実行することは可能であることは、当業者には容易に理解できる。
【0195】
次に、同位体標識されたロイシンを含むタンパク質に由来するピークに着目した。この場合、同位体標識されたロイシンは、非標識のタンパク質よりも6/zだけ分子量が大きい。ここで、zとは、タンパク質が有する電荷のことである。図19に示す質量分析スペクトルの結果から、図10の工程S204にて、電荷が3であるprotein phosphatase 2aの同位体標識されたロイシンに由来する質量分析スペクトルのm/z値が、644.7 + 6/3 = 646.7の質量分析スペクトルのピークに着目し、実測された質量分析スペクトルから抽出した(図10の工程205)。なお、図19中において、同位体標識されたロイシンを含むタンパク質に由来する質量分析スペクトルをHで表示する。
【0196】
図25は、図23に示すスキャン番号を、必要な数だけ連続してつなぎ合わせた結果のマスクロマトグラムを示す。具体的には、図24は、中心を646.7として(m/z値:646.2〜647.2)、スキャン番号975〜1005までの質量分析スペクトルをつなぎ合わせて作成したマスクロマトグラムを示す。
【0197】
通常、特定のm/z値におけるマスクロマトグラムは、単一のロイシンを含むタンパク質に由来するものであるならば、単一のピークが観測されるはずである。しかしながら、図24および図25に示す結果から、複数のピークが観測された。
【0198】
そこで、本発明において、固有のタンパク質に由来するマスクロマトグラムを得るために、図24および図25で得られた質量分析スペクトルの波形分離処理を、図10の工程S206にて、以下のように行った。すなわち、ガウシアン関数とローレンツ関数とを組み合わせて曲線適合法により、波形分離処理を実行した。
【0199】
図26は、本発明による波形分離処理の結果を示す。図26中の(A)は、図19に示す野生型マウス脳(Wild)由来のprotein phosphatase 2aのLで表示されるマスクロマトグラムの波形分離処理の結果であり、一方、図26中の(B)は、図19に示す野生型マウス脳(Wild)由来の同位体標識されたprotein phosphatase 2aのHで表示されるマスクロマトグラムの波形分離処理の結果である。実測されたL及びHのマスクロマトグラムは、各々、5つの固有のタンパク質に由来するマスクロマトグラムの重ね合わせであることが判明した。
【0200】
図26(A)に示す波形分離後の波形1ないし波形5において、各波形の面積を、積分により算出することができる。同様に、図26(B)においても、波形分離後の波形6ないし波形10において、各波形の面積を、積分により算出することができる(図10の工程S207)。
【0201】
必要に応じて、以上の説明から得られた解析結果を、図9に示す記録部100に保存をすることができる。このように算出した波形面積を、同位体標識したアミノ酸を含むタンパク質由来の波形と、同位体非標識のアミノ酸を含むタンパク質由来の波形との比を観測することにより、細胞中で発現されている、アミノ酸配列を同定した特定のタンパク質の経時変化を、同位体標識されたアミノ酸を含むタンパク質との比から、定量的に追跡することが可能となる。
【0202】
図27は、本発明の解析方法により得られた結果を示す図である。図27では、代謝的に同位体標識された生体分子である内部標準物質由来のピークに対する野生型マウス脳(Wild)由来およびADAM22遺伝子欠損マウス脳(K/O)由来のピーク強度比を算出するにあたって、代謝的に同位体標識された生体分子である内部標準物質由来の同一配列のピークを用いた場合および別の配列のピークを用いた場合において、野生型マウス脳(Wild)由来およびADAM22遺伝子欠損マウス脳(K/O)由来のピーク強度比の比較したものを示す。
絶対定量ができることを確認するために以下の実験を行った。
【0203】
[実施例5]代謝的に同位体標識された生体分子である内部標準物質を含む細胞中のHSP60の定量(ELISAで定量した例)
代謝的に同位体標識された生体分子である内部標準物質を含む細胞中のHSP60の定量は、Hsp60 ELISA Kit(Stressgen社、EKS-600)を用いて行った。実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞をPBS(Sigma社、D-8537)で洗浄し、細胞3.75x107個をHsp60 ELISA Kitに添付されている溶解液3mLで溶解して、その遠心上清を可溶性画分とした。以下、定量操作はHsp60 ELISA Kitの説明書にしたがって行った。その結果、可溶性画分中のHSP60濃度は480ng/mLと求められた。よって、代謝的に同位体標識された生体分子である内部標準物質を含む細胞3.75x107個には1440ngのHSP60が存在することが算出された。
【0204】
この値を元に、野生型マウス脳中のHSP60の定量を行った。脳1gから抽出されたタンパク質量は39.4mgであり、同タンパク質量の代謝的に同位体標識された生体分子である内部標準物質を含む細胞(12.1x107個)を加えたので(実施例2)、サンプルに加えた代謝的に同位体標識された生体分子である内部標準物質中のHSP60量としては、12.1x107個×1440 ng/3.75x107個 = 4636ngとなる。一方、質量分析における野生型マウス脳由来のHSP60(配列LPDGVAVLK)と代謝的に同位体標識された生体分子である内部標準物質由来のHSP60のピーク強度比は、6.8であった。よって、野生型マウス脳1 gあたり4636ng×6.8 = 約32μgのHSP60が存在したことが算出された。
【0205】
したがって、この代謝的に同位体標識された生体分子である内部標準物質を含む細胞を用いることによって、質量分析による測定において、絶対定量を行うことができることが明らかになった。
【0206】
[実施例6]代謝的に同位体標識された生体分子である内部標準物質を含む細胞中のcMDHの定量(精製酵素標品の比活性を指標にした例)
実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞1.9x107個をM-PER(Pierce社、78501)1mLにて溶解しその遠心上清を可溶性画分とした。
【0207】
<標準物質の調製>
標準物質として用いるcMDHは、以下のようにして調製した。ヒトcMDH遺伝子をクローニングし、そのN末端側にFLAGタグを挿入したものを、バキュロウイルスベクターに組み込んだ。そして、そのベクターを持つバキュロウイルスを、Sf9細胞に感染させて培養した。培養した細胞を遠心分離で回収し、その沈殿を-80℃で凍結後再融解し、25mLのPBSで懸濁させてcMDHを抽出した。抽出後、不溶性画分を遠心分離により除去し、その上清を粗抽出液とした。cMDHの精製は、Anti FLAG M2 Agarose(Sigma社、A-2220)1.5mLに粗抽出液をアプライし、10mLのPBSで洗浄した後に、5mLのFLAG PEPTIDE(Sigma社、F-3290)溶液(0.1mg/mL in PBS)で溶出した。溶出主画分のタンパク質濃度は、0.4mg/mLであった。この画分を標準cMDH標品として定量に用いた。
【0208】
<比活性の測定>
cMDH活性の測定は、以下の反応用溶液にcMDH溶液1μLを加え、NADHに由来する340nmの吸光度の減少を、分光光度計(アマシャムバイオサイエンス社、Ultrospec 4300 pro)を用いて経時的に測定し、1分間あたりの吸光度の減少をcMDH活性とした。その結果、cMDH濃度0.02mg/mLの溶液1μLを用いたときの吸光度の減少が0.068/分、可溶性画分1μLを用いたときの吸光度の減少が0.057/分であった。
反応用緩衝液 10mM Tris-HCl(pH7.4)-0.15M NaCl 0.98mL
オキザロ酢酸(和光純薬、Lot.SEH1972)10mM水溶液 0.01mL
NADH(Sigma社、Lot.102K701)10mM水溶液 0.01mL
反応用溶液 1 mL
この測定結果から、以下のように、野生型マウス脳中のcMDH濃度を定量した。
可溶性画分中のタンパク質量は6.2mg/mLである(実施例1)。また、可溶性画分中の溶液に対するcMDH濃度は0.057/0.068 x 0.02mg/mL = 0.0167mg/mLである。よって、可溶性画分中のタンパク質量に対するcMDH濃度は、0.0167/6.2 = 0.0027mg/mg、と算出される。
【0209】
また、質量分析による測定(実施例)における野生型マウス脳由来のcMDHと代謝的に同位体標識された生体分子である内部標準物質由来のcMDHとのピーク強度比は約2.0であった(表1Wild)。よって、野生型マウス脳由来の可溶性画分中のタンパク質量に対するcMDH濃度は、0.0027 x 2 = 0.0054mg/mgとなる。また、野生型マウス脳1gあたり39.4mgのタンパク質を含んでいる(実施例2)。したがって、野生型マウス脳1gあたり39.4 x 0.0054 = 0.21mgのcMDHが存在したことを算出できた。
【0210】
したがって、この代謝的に同位体標識された生体分子である内部標準物質を含む細胞を用いることによって、質量分析による測定において、絶対定量を行うことができることが明らかになった。
【0211】
[実施例7]生体分子の絶対定量(合成ペプチドを用いた例)
実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞1.9x107個を、M-PER(Pierce社、78501)1mLで溶解しその遠心上清を可溶性画分とした。
<合成ペプチドの調製>
以下に掲げる5種類の合成ペプチドは、ペプチド研究所株式会社(大阪)に依頼し標品を得た。SQIHDIVLVGGSTR(heat shock 70kDa protein 8 isoform1), HFSVEGQLEFR (heat shock protein 90-beta), HLIPAANTGESK(14-3-3 epsilon), SYELPDGQVITIGNER (mutant beta-actin (beta'-actin), ELEAELEDER(Myosin heavy chain, nonmuscle type B)。これら合成ペプチド各2pmolを先の可溶性画分に添加した。可溶性画分(990ng/mL)と合成ペプチド(91nmol/mL)の混合溶液3mLをLC/MSMS(アプライド社製QSTAR PULSAR i)により測定した。測定条件は以下の通りである。
【0212】
<LC条件>
オートサンプラー:HTS-PAL(CTC Analytica社製)
ポンプおよびコントローラー:LC-10Avp 2台(高圧グラジエントシステム),SCL-10Avp(島津製作所製)
フロースプリッター:3方ティー(GLサイエンス社製)に抵抗管(内径25μm長さ150mmのフューズドシリカキャピラリー、GLサイエンス社製)をつけたもの。
カラム:エレクトロスプレー用ニードル(New Objective社製、内径0.1mm, 長さ150mm,先端径8μm、導電物質被覆なし)に逆相系充填剤(ReproSil-Pur 120 C18-AQ, 3μm Dr.Maisch社製)をスラリー充填したもの。
移動相:(A) 0.5%酢酸水溶液、(B) 0.5%酢酸水溶液,80%アセトニトリル
流速:0.06mL/min(ポンプ出力値)、250nL/min(スプリット後)
グラジエント溶出条件:
【0213】
【表2】

測定時間:110分
質量分析条件:
ESIインターフェース:nanoelectrospray用(プロタナ社製)
MS スキャン:350-1400 amu, 1.0秒
MSMS スキャン:1回のMSスキャンにつき最大4回, 85-1400 amu, 各1.5秒
測定時間: 110分
スプレー電圧: 2400V
【0214】
ペプチド配列の同定は、MS/MSスペクトルをデータベース検索エンジンMascot(MatrixScience, London)に出力して行った。タンパク質データベースにはNCBIタンパク質データベース(http://www4.ncbi.nlm.nih.gov/)を用いた。定量は質量分析スペクトル上のピーク強度比を用いて行った。可溶性画分中の代謝的に同位体標識された生体分子は、ロイシンが安定同位体13Cx6個で標識されているため、添加した合成ペプチド由来のピークと質量分析スペクトル上において、容易に区別できる。
【0215】
また、ピーク強度比から計算した値を基に、可溶性画分中に存在していた各タンパク質の絶対量について表3に示した(右端wt%:可溶性画分中に含まれている割合)
【0216】
【表3】

[表3] 代謝的に同位体標識された生体分子である内部標準物質に発現していた各タンパク質の絶対量について測定結果を表す。
【0217】
一方、実施例4に示したように、野生型マウス脳由来のタンパク質と代謝的に同位体標識された生体分子である内部標準物質由来の当該タンパク質とのピーク強度比が求められる。そして、野生型マウス脳と代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、それぞれタンパク質量が同じになるように混ぜて測定している(実施例4)。また、マウス脳1gあたりのタンパク質量は、39.4mgである(実施例2)。よって、マウス脳1gに含まれている絶対量は表4のように算出することができた。
【0218】
したがって、この代謝的に同位体標識された生体分子である内部標準物質を含む細胞を用いることによって、質量分析による測定において、絶対定量を行うことができることが明らかになった。
【0219】
【表4】

[表4] 野生型マウス脳およびADAM22遺伝子欠損マウス脳中の各タンパク質の絶対量について測定結果を表す。
【0220】
以上のように、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の各タンパク質について絶対定量しておくことによって、網羅的に生体分子を絶対定量することができた。
【0221】
次に、実施例4にて得られた波形分離後の質量分析スペクトルに関するデータ、特に、定量値の値と、機能情報との関連付けについて説明する。
[実施例8]
まず、実施例4で例示したように、波形分離後の一つ又は複数の配列に着目した。図28は、本発明の一の実施例において着目した波形分離後の配列と、その配列の定量値を示す図である。具体的には、本実施例では、(1)ALVLELCCNDESGEDVEVPYVR、
(2)KPLLESGTLGTK、(3)NFPNAIEHTLQWAR、(4)YFLVGAGAIGCELLK、の4つの配列に着目した。また、図28に示す定量値は、かかる配列毎の値を表す。なお、同位体標識は、安定同位体で標識されたL-Leucineを用いて行われた。図28に示すように、配列:NFPNAIEHTLQWAR および配列:YFLVGAGAIGCELLKには、同一のペプチドに対して複数の定量値が算出されている。
【0222】
図28に示すペプチド配列に基づき、外部データベース、具体的には、NCBInrデータベースへ照合し、かかるデータベースにて、HomoSapiensにてパターン検索を実行した。その結果、検索対象である各配列に対して同定タンパクのGiNoが得られた(図29参照)。検索対象とした全ての配列において、(1)giI23510340IrefINP#695012.1I、
(2)giI35830IembICAA40296.1I、(3)giI24485IembICAA37078.1Iが同定された。この3つのGiNoに対して、LocusLinkにて検索すると、LocusID = 7317に集約された。このLocusIDに対して、図30に示す結果が得られた。
【0223】
一方、LocusID = 7317のタンパク質について、L-Leucineにて同位体標識された場合の、(LocusID = 7317のタンパク質の波形面積)/(同位体標識されたLocusID = 7317の波形面積)の定量値は、1.10726332649であった。この値は、図28に示す各ペプチド配列にて得られた値とは相違するが、タンパク質の定量値として採用し、各タンパク質毎に、この定量値を用いれば、機能が公知のタンパク質と定量値の関連付けをすることができる。なお、本発明では、質量分析のために、予めサンプルを酵素等で消化させ分解しているため、実際にタンパク質自体の質量分析スペクトルは測定されていない。しかし、タンパク質自体の質量分析スペクトルが測定されたと仮定した場合、タンパク質の定量値と生物学的機能との関連性を示唆する情報を提供することができる。
【0224】
[実施例9]
<合成ペプチドの調製>
以下に掲げる114種類の合成ペプチドのうち、8種類はペプチド研究所株式会社(大阪)から入手した。残り106種類(少なくとも1つのLeu, ひとつのTyrを含むもの)は、島津PSSM-8ペプチド合成機を用いて自家合成した。合成法および切り出し法は装置に付属のF-moc用プロトコールに従った。以下に示すHPLC条件で分画した後、目的画分の質量数をMSで確認した。さらに目的画分をHPLC-UV(280nm)で分析し、主ピークのピーク面積とTyrのモル吸光係数より溶液濃度を算出した。
【0225】
<分取HPLC条件>
LC システム(オートサンプラー、ポンプ、UV検出器、フラクションコレクター、コントローラー):LC10Avp(島津製作所製)
カラム:YMC-Pack Pro C18 (10mm径、150mm長)
移動相:(A) 0.1%トリフルオロ酢酸水溶液、(B)アセトニトリル
流速:4mL/min
検出器波長:220 nm
グラジエント溶出条件:
【表5】

測定時間:20分
【0226】
<分析HPLC条件>
流速、カラム径、検出器波長以外上記と同じ。
カラム:YMC-Pack Pro C18 (4.6mm径、150mm長)
流速:1mL/min
検出器波長:280 nm
【0227】
こうして得られた合成ペプチド各2 pmolを先の可溶性画分に添加した。可溶性画分(990 ng/mL)と合成ペプチド(91 nmol/mL)の混合溶液3 mLをLC/MSMS (アプライド社製QSTAR PULSAR i)により測定した。さらに、合成ペプチド含量を5倍および5分の1にした混合溶液を調製し、同様に測定した。測定条件は以下の通りである。
【0228】
【表6】

【0229】
測定時間:110分
MS条件:
ESIインターフェース:nanoelectrospray用(プロタナ社製)
MS スキャン: 350-1400 amu, 1.0 秒
MSMS スキャン: 1回のMSスキャンにつき最大4回, 85-1400 amu, 各1.5秒
測定時間: 110分
スプレー電圧: 2400V
【0230】
ペプチド配列の同定は、MS/MSスペクトルをデータベース検索エンジンMascot(Matrix Science, London)に出力して行った。タンパク質データベースにはSwissProtタンパク質データベース(http://kr.expasy.org/sprot/)を用いた。定量は質量分析スペクトル上のピーク強度比を用いて行った。可溶性画分中の代謝的に同位体標識された生体分子は、ロイシンが安定同位体13Cx6個で標識されているため、添加した合成ペプチド由来のピークと質量分析スペクトル上において、容易に区別できる。
【0231】
また、ピーク強度比から計算した値を基に、可溶性画分中に存在していた各タンパク質の絶対量について表4に示した(右端Conc in neuro2a:neuro2a可溶性画分タンパク質1mg当たりに含まれている割合)。
【0232】
【表7】

【表8】

【表9】

【表10】

【表11】

[表7から表11] 代謝的に同位体標識された生体分子である内部標準物質に発現していた各タンパク質の絶対量について測定結果を表す。
【0233】
一方、実施例4に示したように、野生型およびADAM22ノックアウトマウス脳由来のタンパク質と代謝的に同位体標識された生体分子である内部標準物質由来の当該タンパク質とのピーク強度比が求められる。そして、マウス脳と代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、それぞれタンパク質量が同じになるように混ぜて測定しており、重量混合比は既知である(実施例4)。よって、マウス脳1mgに含まれている絶対量は表8のように算出することができた。したがって、この代謝的に同位体標識された生体分子である内部標準物質を含む細胞を用いることによって、MSによる測定において、絶対定量を行うことができることが明らかになった。
【0234】
【表12】

【表13】

【表14】

【表15】

【表16】

[表12から表16] 野生型マウス脳およびADAM22遺伝子欠損マウス脳中の各タンパク質の絶対量について測定結果を表す。
【0235】
以上のように、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の各タンパク質について絶対定量しておくことによって、網羅的に生体分子を絶対定量することができた。
【産業上の利用可能性】
【0236】
本発明により、代謝的に標識することができないサンプルを含む、組織、生体液、細胞、細胞器官、タンパク質複合体などのサンプル中の1若しくは複数の生体分子を精度よく定量することが可能となった。
【0237】
すなわち、従来のin vivo標識法では、培養条件に影響を受けないような限られた細胞でしか実施できなかったが、本発明では、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞をサンプルに加えるため、培養できる細胞に限られることなく、代謝的に標識することができないサンプルを含む、組織、生体液、細胞、細胞器官、タンパク質複合体などのサンプル中の1若しくは複数の生体分子を定量することが可能となった。
【0238】
また、従来のin vitro標識法では、サンプルの消化、分画、精製など前処理段階での実験ごとに定量値が変動することの補正はできなかったが、本発明では、サンプルの消化、分画、精製などを行う前に代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加えるため、サンプル中の1若しくは複数の生体分子を精度よく定量することが可能となった。
【0239】
本発明により、3個以上のサンプル間の比較が容易になった。すなわち、これまでの定量的プロテオーム解析法は、内部標準物質と被検体とを直接比較していたため、測定のたびにサンプル調製を行う必要があった。さらに、測定対象が変わると標識すべき内部標準物質も変わるため、その都度、標識についての条件検討を行う必要があり、また、実験間の比較もできなかったが、本発明では、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を保存し、適宜、用いることにより、実験間のデータ比較、例えばある実験データに対し、一定期間経過後(例えば、1ヶ月後、1年後等)に比較データを得て解析することが可能となる。さらには、使用した代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を譲渡又は貸し渡しすることにより、今まで不可能であった研究者間のデータ比較が可能となる。
【0240】
本発明により、あらかじめ代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子の濃度を算出しておくことにより、生体分子の絶対定量が可能となった。代謝的に同位体標識された生体分子である内部標準物質、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を譲渡又は貸し渡しすることにより、研究者間のデータ共有化が可能となる。
【0241】
さらに、本発明による解析装置および解析方法によれば、固有の生体分子に由来する質量分析スペクトルを得ることができ、生体内の細胞で時々刻々変化する生体分子の発現量を定量的に解析することが可能となる。さらにまた、本発明によるプログラムにより、前記解析方法を、コンピュータに実現させることができる。
【0242】
くわえて、本発明によれば、タンパク質における(同位体非標識のタンパク質)/(同位体標識されたタンパク質)という定量値と機能情報とを関連付けることが可能となる。
【0243】
従来の方法(AQUA法)では、サンプルに対して、合成ペプチドを添加するため、分画、抽出、精製、消化(特にゲル内消化)の過程におけるタンパク質の回収率の低さにより、精度のよい定量値が得られなかった。一方、本発明の方法では、サンプルに対して、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加するため、分画、抽出、精製、消化(特にゲル内消化)の過程におけるタンパク質の回収率の影響を受けず、精度よく再現性の高い定量値を得ることが可能となった。
【0244】
また、従来の方法では、サンプルに対して、合成ペプチドを添加するため、定量できるペプチドは、合成ペプチドと同一の配列を有するペプチドのみである。そのため、当該ペプチドの測定結果の誤差により、タンパク質の定量値が大きく影響を受けることとなる。一方、本発明の方法では、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を定量しておき、サンプルに対して、当該代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加するため、定量できるペプチドは、合成ペプチドと同一の配列を有するペプチドのみならず、当該ペプチドが構成していたタンパク質由来のその他のペプチドについても定量することができる。そのため、一つのタンパク質に対し、複数のペプチドによって定量するため、個々のペプチドの測定結果の誤差により、タンパク質の定量値が大きく影響を受けることがなく、精度よく再現性の高い定量値を得ることが可能となった。
【0245】
さらには、ペプチド合成機は、10倍過剰量の試薬を用い、しかも合成スケールがマイクログラムからミリグラム単位となる。そのため、同位体標識されたペプチドの合成は、非常に高価となり、従来の方法で網羅的な定量することはコストの面で難しい。一方、本発明の方法では、生体分子の同位体標識は、細胞培養によって行うので、ごく微量でも効率がよく生成することができる。また、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を定量するための合成ペプチドは、同位体を必要としない通常のペプチド合成で対応できるので、網羅的な定量方法として適している。
【技術分野】
【0001】
本発明は、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、サンプルに添加し、質量分析計で測定することにより、サンプル中の1又は複数の生体分子を定量する方法に関する。
【0002】
さらに、本発明は生体分子の定量的解析方法に係り、より詳細には、本発明は、同位体標識化生体分子を利用した解析方法および該解析のためのプログラムに関する。
【背景技術】
【0003】
ゲノムとは、その生物の全ての遺伝子と遺伝子間領域を含む、一つの細胞に含まれる全DNAのことであり、我々が知る生命はゲノムによって決められている。現在、既にヒトの塩基配列が読み終わり、遺伝子の数も予測されつつある。しかし、生命現象を解明するためには、塩基配列情報だけでは不充分であり、実際に大腸菌、酵母、線虫、ショウジョウバエなど全ゲノムが明らかになったが、これらモデル生物の全ての遺伝子機能が明らかになったわけではない。
【0004】
プロテオミクスはポスト・ゲノム時代の重要な項目の一つであるが、この技術が遺伝子の機能解析を行う上で注目を集めつつある。現在のプロテオーム技術、つまり質量分析装置とデータベース、そしてそれらを結ぶ検索エンジンによってタンパク質同定が飛躍的に容易になったことによって、特定のタンパク質混合物(例えば、あるタンパク質複合体)を網羅的に同定できるようになった(たとえば、非特許文献1−4参照)。しかしながら、タンパク質を同定するだけでは、あるいは構成成分を明らかにするだけでは、機能解析としては不十分である。なぜなら、プロテオームは動的なものであり、その時々あるいは場所によって発現状態が変化している。よって個々のタンパク質の変動解析を行ってこそ、プロテオミクスの利点が活かされる筈である。そこで、DNAチップにおけるDifferential Displayと同様に、プロテオームにおいてもタンパク質レベルでのDifferential Displayを作製し、個々のタンパク質レベルの変化を捉える種々の試みが行われている。
【0005】
プロテオーム解析の手段として二次元電気泳動が汎用されているが、このようなゲル上で染色されたタンパク質のスポットを比べる方法では、比較すべき二つの試料に存在する個々のタンパク質の存在量を正確に比較することは極めて難しい。なぜなら、
1;細胞からの抽出の再現性や細胞分画・粗精製など前処理操作による再現性
2;二次元電気泳動などタンパク質の分離における再現性
3;ゲル染色の再現性
などに課題があり、さらに
4;一つのスポット・バンドに複数のタンパク質が混在している場合は個々のタンパク質に対する定量性は失われる。
よって現状では、ゲル染色によるパターン比較では発現量が10-100倍以上と劇的な変化をする場合を除き、微小な変化を捉えることは難しい。
【0006】
また、このように劇的な変化を検知したとしても、ゲル上のスポットを比較するだけでは、そのスポットが対応するタンパク質が不明のままであり、ゲルから目的のスポットを切り出し質量分析装置によってタンパク質の同定作業を行うことになる。
【0007】
質量分析装置による分析において、イオン化率の再現性が悪いため、定量的データを得るためには、必ず内部標準物質による補正が必要である。また、質量分析装置で分析するまでの前処理操作(抽出や誘導体化、分離など)により、実験ごとに定量値を非常に変動させる。そこで、目的の低分子物質又はタンパク質等を安定同位体で標識した内部標準物質を、サンプルに予め添加することで、これらの全ての補正が可能になり、定量精度が飛躍的に向上している。薬物、脂質およびタンパク質などにおいて、安定同位体元素で標識した内部標準物質を用いて、定量分析が行われている(たとえば、非特許文献5−10参照)。
【0008】
上記の薬物や脂質のような低分子物質およびタンパク質の質量分析装置による定量は、あくまでも目的とする物質が既知の場合に適用できる。一方、プロテオミクスでは未知かつ多数の目的物質を測定する必要がある。このため、近年、比較すべきサンプルに含まれるタンパク質全てを標識することにより、質量分析装置を使った定量的プロテオームが可能になってきている。現在報告されている手法(たとえば、非特許文献11参照)を大きく分けると、以下の3通りに分類することが出来る(図1参照)。
【0009】
In vivo標識法
安定同位体と質量分析装置を組み合わせた定量的プロテオームとして、小田らの15Nで酵母のタンパク質を標識する方法がある(たとえば、特許文献1および非特許文献12−13参照)。比較する2種類の細胞を、それぞれ同位体標識アミノ酸を含む培地と同位体標識アミノ酸を含まない培地で培養し、培養された細胞を混合した後、タンパク質の抽出および分画をして、質量分析装置で分析し、同位体標識されたタンパク質と同位体標識されてないタンパク質とのピーク強度を比較する。この方法では、分析における回収率の誤差があったとしても、細胞間の相違を定量的に知ることができ、また、スペクトルデータによりタンパク質の同定を同時に行うことが出来る。
【0010】
しかしながら、このin vivo標識法は、培養細胞であるならば原理的に全ての細胞に応用可能であるが、実際には培養条件を変えることで細胞の成長速度が大きく変わるなど、安定同位体を含む培地での培養は困難なことが多い。つまり、培養条件に影響を受けないような限られた細胞でしか実施できない。さらに、動物や人などの組織は、容易に培養することができず、この方法によって測定することはできない。
【0011】
消化前のIn vitro標識法
そこで、組織中のタンパク質を網羅的に定量する方法として、以下の方法が見出された。すなわち、比較する2種類のサンプルに対し、それぞれ同位体標識したシステイン残基反応試薬と同位体標識していないシステイン残基反応試薬を加えることによりサンプル中に含まれるタンパク質のシステイン残基を標識し、カラムによってタンパク質を精製し、質量分析装置で分析し、ペアのピークの強度を比較することでタンパク質定量が可能になった(たとえば、非特許文献14−19参照)。しかしながら、この方法では、システイン残基を含まないタンパク質は定量できず、また、精製など前処理段階での実験ごとに定量値が変動することの補正はできない。
【0012】
消化後・消化中のin vitro標識法
システイン残基を含まないタンパク質や精製の操作性を向上した方法がいくつか報告されている。比較する2種類のサンプルに含まれるタンパク質を酵素消化して得られたペプチド断片のC末、N末、グルタミン酸残基、アスパラギン酸残基などを、同位体標識した分子と同位体標識していない分子でそれぞれ標識し、質量分析装置で分析し、ペアのピークの強度を比較することでタンパク質定量が可能になった(たとえば、非特許文献20−23参照)。
【0013】
しかしながら、これらの方法では、サンプルに含まれるタンパク質の消化、分画、精製など前処理段階での実験ごとに定量値が変動することの補正はできない。
【0014】
上述したように、現在の定量的プロテオーム解析法は、in vivo標識法とin vitro標識法に大別できる。前者は、標識が簡単であり、高い再現性データが期待できるが、組織、生体液、細胞器官、タンパク質複合体、安定同位体を含む培地中で生育できない細胞などがサンプルの場合には、それらに含まれる安定同位体を取り込まないタンパク質には適応できない。後者は、あらゆるサンプルに応用できるが、標識するまでのサンプルの破砕、抽出、消化、分画、精製など前処理段階での実験ごとに定量値が変動することの補正はできない。また、標識反応自体が簡単でない場合が多く実験者の経験の差が出やすい。
【0015】
これまでの定量的プロテオーム解析法は、内部標準物質と被検体とを直接比較していたため、測定のたびにサンプル調製を行う必要があった。また、3個以上のサンプルの比較を行うには単純ではなく、それだけ精度も低下していた。さらに、測定対象が変わると標識すべき内部標準物質も変わるため、その都度、標識についての条件検討を行う必要があり、また、実験間の比較もできなかった。
【0016】
さらには、これまでの定量的プロテオーム解析法は、内部標準物質と被検体とを直接比較しており、測定対象が変わると標識すべき内部標準物質も変える必要があった。一方、内部標準物質の生体分子を定量することは容易ではなく、したがって、絶対定量をすることが非常に困難であった。
【0017】
これまで報告されている定量的プロテオーム解析法のうち絶対定量する方法としては、AQUA法がある(たとえば、特許文献2参照)。これは、合成ペプチドの一部に安定同位体を組込み、目的のタンパク質との比を求める方法である。しかし、この方法では、実験ごとに常に同位体標識した合成ペプチドを用意し、さらに、実験毎に定量する必要があるため、網羅的に定量するのは困難である。また、目的タンパク質の精製過程における回収率の影響や、一般的に30-50%と言われているゲル内消化効率の影響も受け、正確に定量することは困難である。
【0018】
一方で、ポストゲノム時代をむかえて、生体内の生体分子として重要であるタンパク質を分離同定し、さらに定量することが、ますます重要になってきている。特に、病気の診断・治療技術の研究開発には、多数のタンパク質の機能を解明することが必要である。
【0019】
従来、細胞が発現するタンパク質のプロテオーム解析には、二次元電気泳動が用いられていた。ここで、用語「プロテオーム解析」とは、遺伝子情報と細胞内で複雑に相互作用している多様なタンパク質との関係を明らかにする解析のこという(たとえば、非特許文献24参照)。つまり、プロテオーム解析は、細胞を構成するすべてのタンパク質を網羅的に解析する手法をいう。
【0020】
前述の二次元電気泳動では、発現したタンパク質をゲル展開し、対象とするタンパク質に対応したスポットの切り出しにより、その種類を総合的に同定することを可能にするものである。このため、二次元電気泳動はプロテオーム解析における有用な定性的解析手段である。
【0021】
しかし、展開されるタンパク質の量が僅少であり、分析時の回収率に誤差が生じ易いことに起因して、二次元電気泳動ではタンパク質の定量的解析には不向きであることが指摘されている。
【0022】
他方、もう一つの重要なタンパク質の解析技術として、質量分析法が利用されている。本方法は質量分析装置を用いたタンパク質やペプチドの正確な質量を分析する方法である。この質量分析装置は、一般には、タンパク質及びペプチドをイオン化する装置と、その質量に応じて分離する質量分離部を備え、該質量を分析する質量分析計とから構成されている。そして、質量分析計とタンパク質のデータベース、及びそれらを結ぶ検索システムによって、今日ではタンパク質の同定は飛躍的に容易になったといえる。そのため、特定のタンパク群(たとえば、ある複合体を形成するタンパク群)を網羅的に同定することが可能である。
【0023】
しかし、質量分析法によってタンパク質を同定する、あるいは構成成分を明らかにするだけでは、タンパク質の機能解析としては不十分である。なぜなら、プロテオームによる機能解析では、病態との比較や、薬物あるいはリガンドによる刺激、それに標的遺伝子のノックアウトや過剰発現などの影響による個々のタンパク質の変動解析、つまりは、タンパク質の発現量が比較可能である定量的データが必要になる。
【0024】
かかる背景のもと、質量分析装置を用いて、同位体標識を利用した定量的解析が試みられている(たとえば、非特許文献25参照)。
【先行技術文献】
【非特許文献】
【0025】
【非特許文献1】「ネイチャージェネティクス (Nature Genetics)」第20巻、1998年9月、p. 46−50
【非特許文献2】「ジャーナル・オブ・セル・バイオロジー (Journal of Cell Biology)」第141巻、第4号、1998年5月18日、p. 967−977
【非特許文献3】「カレント・オピニオン・イン・セル・バイオロジー (Current Opinion in Cell Biology)」第15巻、第2号、2003年4月、p. 199−205
【非特許文献4】「カレント・オピニオン・イン・ケミカル・バイオロジー (Current Opinion in Chemical Biology)」第7巻、第1号、2003年2月、p. 21−27
【非特許文献5】「サージェリー・トゥデイ(Surgery Today)」第23巻、第3号、1993年、p. 228−233
【非特許文献6】「ラピッド・コミュニケーションズ・イン・マス・スペクトロメトリー (Rapid Communications in Mass Spectrometry)」第8巻、第5号、1994年、p. 377−380
【非特許文献7】「ジャーナル・オブ・クロマトグラフィー・エー (Journal of Chromatography A)」第694巻、第1号、1995年5月、p. 209−218
【非特許文献8】「アナリティカル・バイオケミストリー (Analytical Biochemistry)」第231巻、第1号、1995年10月、p. 141−150
【非特許文献9】「ジャーナル・オブ・クロマトグラフィー・ビー (Journal of Chromatography B)」第729巻、第1−2号、1999年6月、p. 147−155
【非特許文献10】「プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンスイズ・オブ・ザ・ユナイテッド・ステイツ・オブ・アメリカ (Proceedings of the National Academy of Sciences of the United States of America)」第100巻、第12号、2003年6月、p. 6940−6945
【非特許文献11】「カレント・オピニオン・イン・ケミカル・バイオロジー (Current Opinion in Chemical Biology)」第7巻、第1号、2003年2月、p. 70−77
【非特許文献12】「プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンスイズ・オブ・ザ・ユナイテッド・ステイツ・オブ・アメリカ (Proceedings of the National Academy of Sciences of the United States of America)」第96巻、第12号、1999年6月、p. 6591−6596
【非特許文献13】「メソッズ (Methods)」第29巻、第2号、2003年2月、p. 124−130
【非特許文献14】「ネイチャー・バイオテクノロジー (Nature Biotechnology)」第17巻、第10号、1999年10月、p. 994−999
【非特許文献15】「アナリティカル・ケミストリー (Analytical Chemistry)」第70巻、第24号、1998年12月、p. 5150−5158
【非特許文献16】「ラピッド・コミュニケーションズ・イン・マス・スペクトロメトリー (Rapid Communications in Mass Spectrometry)」第16巻、第15号、2002年、p. 1416−1424
【非特許文献17】「ジャーナル・オブ・ジ・アメリカン・ソサエティ・マス・スペクトロメトリー (J Am Soc Mass Spectrum)」第12巻、第12号、2001年12月、p. 1238−1246
【非特許文献18】「ネイチャー・バイオテクノロジー (Nature Biotechnology)」第19巻、第10号、2001年10月、p. 946−951
【非特許文献19】「モレキュラー・アンド・セルラー・プロテオミクス (Molecular and Cellular Proteomics)」 第1巻、第1号、2002年1月、p. 19−29
【非特許文献20】「アナリティカル・ケミストリー (Analytical Chemistry)」第73巻、第13号、2001年7月、p. 2836−2842
【非特許文献21】「ラピッド・コミュニケーションズ・イン・マス・スペクトロメトリー (Rapid Communications in Mass Spectrometry)」第15巻、第14号、2001年、p. 1214−1221
【非特許文献22】「ネイチャー・バイオテクノロジー (Nature Biotechnology)」第20巻、第2号、2002年2月、p. 163−170
【非特許文献23】「ネイチャー・バイオテクノロジー (Nature Biotechnology)」第20巻、第5号、2002年5月、p. 512−515
【非特許文献24】Karn, P. Science 270, pp. 369-370, 1995
【非特許文献25】「プロテオーム解析法」羊土社 2000年7月10日発行 pp. 111-122
【特許文献】
【0026】
【特許文献1】USP 6391649
【特許文献2】WO2003 016861
【発明の概要】
【発明が解決しようとする課題】
【0027】
本発明は、このような状況に鑑みてなされたものであり、その解決しようとする課題は、代謝的に標識することができないサンプル(例えば、組織、生体液、細胞、細胞器官、タンパク質複合体など)中の1又は複数の生体分子を精度よく定量すること、さらには、絶対定量することにある。
【0028】
また、同位体標識を利用した解析において、一つの質量分析スペクトルピークに対して、複数の異なる生体分子からの質量スペクトルが寄与している場合もあり、生体分子の定量的解析を困難にしている。そこで、本発明は、質量分析スペクトルに対して複数の異なる生体分子からの質量分析スペクトルが寄与している場合であっても、質量分析スペクトルの定量的解析を可能とする解析システムおよび解析方法を提供することである。さらに、本発明では、かかる生体分子に関する定量的解析と機能情報を付加させる、解析システムおよび解析方法を提供する。
【0029】
さらにまた、前記定量的解析方法をコンピュータに実行させるプログラムを提供することである。
【課題を解決するための手段】
【0030】
本発明者らは、上記課題を解決するため、鋭意検討を重ねた結果、生体分子に対する質量分析法において、あらかじめ同位体標識された生体分子を調製し、各サンプルに加えて質量分析装置で測定することにより、代謝的に標識することができないサンプル(例えば、組織、生体液、細胞、細胞器官、タンパク質複合体など)中の1又は複数の生体分子を精度よく定量することを見出した。また、あらかじめ調製した同位体標識された生体分子を定量しておくことにより、生体分子の網羅的な絶対定量をも可能であることを見出し、本発明を完成するに至った。また、生体分子の質量分析法において、同位体標識法とともに、質量分析スペクトルに波形分離処理を施すことにより、より高精度な生体分子発現の定量的解析が可能であることを見出し、本発明を完成するに至った。
【0031】
すなわち、本発明の第一の態様では、
[1] サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、加えることを特徴とする質量分析計によるサンプル中の生体分子を定量する方法、
[2]サンプル中の1又は複数の生体分子を定量する方法であって、
同位体標識された生体分子の前駆体を加えて培養し、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、サンプルに添加する工程と、
当該各サンプルから生体分子を抽出し分画する工程と、
当該分画した各生体分子を質量分析装置により分析する工程と、
質量分析の情報から当該生体分子を同定する工程と、
各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を含む、生体分子を定量する方法、
[3] 各サンプル間の該ピーク強度比を比較し、生体分子を相対定量する、前記[1]または[2]のいずれか一に記載の方法、
[4] 代謝的に同位体標識された生体分子である内部標準物質中の、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が既知量である、前記[1]ないし[3]のいずれか一に記載の方法、
[5] 定量が絶対定量である、前記[1]ないし[4]のいずれか一に記載の方法、
[6] サンプル中の1または複数の生体分子を定量する方法であって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、添加する工程と、
(2)当該サンプル中の各生体分子を質量分析する工程と、
(3)質量分析の情報から当該生体分子を同定する工程と、
(4)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を含む、サンプル中の1または複数の生体分子を定量する方法、
[7] サンプルから生体分子を抽出し分画する工程をさらに含む、前記[6]に記載の方法、
[8] 同位体標識された生体分子の前駆体を加えて培養し、生体分子を代謝的に同位体標識する工程をさらに含む、前記[6]または[7]に記載の方法、
[9] 複数のサンプルについて行い、各サンプル間の各生体分子のピーク強度比を比較する工程をさらに含む、前記[6]ないし[8]のいずれか一に記載の方法、
[10] サンプル中の1または複数の生体分子を絶対定量する方法であって、
代謝的に同位体標識された生体分子である内部標準物質中の生体分子、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が、既知量である、[6]ないし[9]のいずれか一に記載の方法、
[11] 代謝的に同位体標識された生体分子である内部標準物質中の生体分子を、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を、絶対定量する工程をさらに含む、前記[6]ないし[10]のいずれか一に記載の方法、
[12] 前記[11]に記載の工程が、
(a)同位体非標識の合成ペプチドを、代謝的に同位体標識された生体分子である内部標準物質、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞に添加する工程と、
(b)当該代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞から生体分子を抽出し分画する工程と、
(c)当該分画した各生体分子を質量分析する工程と、
(d)質量分析の情報から当該生体分子を同定する工程と、
(e)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を絶対定量する工程と、
を含む、前記[11]に記載の方法、
[13] サンプルが、代謝的に標識できないサンプルである、前記[1]ないし[12]のいずれか一に記載の方法、
[14] サンプルが、細胞培養によって標識できないサンプルである、前記[1]ないし[13]のいずれか一に記載の方法、
[15] 生体分子がタンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、前記[1]ないし[14]のいずれか一に記載の方法、
[16] 生体分子がタンパク質である、前記[1]ないし[15]のいずれか一に記載の方法、
[17] 生体分子がタンパク質であって、当該タンパク質を抽出し分画し、タンパク質を消化する工程をさらに含む、前記[1]ないし[16]のいずれか一に記載の方法、
[18] サンプルが、組織、生体液、細胞、細胞器官およびタンパク質複合体からなる群から選択されるいずれかのサンプルである、前記[1]ないし[17]のいずれか一に記載の方法、
[19] 同位体が、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[1]ないし[18]のいずれか一に記載の方法、
[20] 同位体が、13Cである、前記[1]ないし[19]のいずれか一に記載の方法、
[21] 前記[1]ないし[20]のいずれか一に記載の方法に用いられる代謝的に同位体標識された生体分子である内部標準物質、
[22] 前記[1]ないし[20]のいずれか一に記載の方法に用いられる代謝的に同位体標識された生体分子である内部標準物質を含む細胞、
[23] 代謝的に同位体標識された生体分子である内部標準物質を含有する、前記[1]ないし[20]のいずれか一に記載の方法のための試薬、
[24] 代謝的に同位体標識された生体分子である内部標準物質を含む細胞を含有する、前記[1]ないし[20]のいずれか一に記載の方法のための試薬、
[25] 代謝的に同位体標識された生体分子である内部標準物質の、[1]ないし[20]のいずれか一に記載の方法のための使用、
[26] 代謝的に同位体標識された生体分子である内部標準物質を含む細胞の、前記[1]ないし[20]のいずれか一に記載の方法のための使用、
[27] 質量分析装置において得られた、サンプル中の1または複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1又は複数の生体分子の定量をさせるためのプログラムであって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加し、当該各サンプル中の各生体分子を質量分析装置により分析し、質量分析装置から分析結果を受ける工程と、
(2)質量分析の分析結果から当該生体分子を同定する工程と、
(3)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、を実行させるプログラム、
[28] 質量分析装置において得られた、サンプル中の1または複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1又は複数の生体分子の定量をさせるためのプログラムであって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加し、当該各サンプルから生体分子を抽出し分画し、当該分画した各生体分子を質量分析装置により分析し、質量分析装置から分析結果を受ける工程と、
(2)質量分析の分析結果から当該生体分子を同定する工程と、
(3)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、を実行させるプログラム、
[29] 複数のサンプルについて行い、各サンプル間の各生体分子のピーク強度比を比較する工程をさらに実行させる、前記[27]または[28]に記載のプログラム、
[30] サンプル中の1又は複数の生体分子の絶対定量をするためのプログラムであって、代謝的に同位体標識された生体分子である内部標準物質中の、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が既知量である、前記[27]ないし[29]のいずれか一に記載のプログラム等を提供する。
【0032】
また、本発明の第二の態様では、[31] 第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子との質量分析に関するデータの解析システムであって、前記第一および第二の生体分子の質量分析を実行する質量分析装置と、前記質量分析装置から、前記生体分子の質量分析に関するデータを受けるデータ入出部を有する制御部と、を備え、前記制御部は、生体分子の構成成分の配列が決定された前記生体分子に対する第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子に対する第二のm/zの値とを決定するとともに、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析装置にて得られた質量分析に関するデータから抽出する処理部と、前記処理部から前記第一および第二のm/zの値における時間に対する質量分析スペクトル(マスクロマトグラム)を受け、前記時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する波形処理部と、を備える解析システムを提供する。かかる構成によれば、固有の生体分子に由来する質量分析スペクトルを入手でき、より定量的な解析を可能とする。
【0033】
本発明の好ましい態様では、前記[31]に記載の解析システムにおいて、[32] 前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される。かかる構成によれば、同位体非標識と同位体標識の構成成分を含む生体分子の発現変化を、一方の生体分子に着目しながら追跡可能となる。
【0034】
本発明の好ましい態様では、前記[31]または [32]に解析システムにおいて、[33] 前記制御部は、前記波形分離処理部からの波形分離処理により得られた固有の生体分子に由来する波形の面積を算出し、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、前記第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する演算部を、さらに備える。かかる構成によれば、一方のタンパク質との対比により、タンパク質の発現の定量的解析が可能となる。
【0035】
本発明の好ましい態様では、前記[31]ないし[33]のうち何れか一に記載の解析システムにおいて、[34] 前記制御部は、波形分離後、前記生体分子の構成成分の配列毎に分類し、前記配列を生体分子の機能情報を有するデータベースに照合し、その照合結果から、前記配列と機能とを関連付けてグループ化する情報付加部を、さらに備える。かかる構成によれば、波形分離された生体分子の構成成分の配列と機能情報とを関連付けることが可能となる。
【0036】
本発明の好ましい態様では、前記[31]ないし[34]のうち何れか一に記載の解析システムにいて、[35] 前記制御部は、生体分子の構成成分の配列から生体分子を特定し、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする演算部を、さらに備える。かかる構成によれば、生体分子の構成成分の代表的な定量値を求めることができ、後述するデータベースとの照合により機能情報との関連付けをすることができる。
【0037】
本発明の好ましい態様では、前記[31]ないし[35]のうち何れか一に記載の解析システムにおいて、[36] 前記制御部は、生体分子の構成成分の配列を、生体分子の機能情報を有するデータベースに照合し、当該生体分子の機能情報を取得する情報付加部を、さらに備える。かかる構成によれば、構成成分の代表的定量値と機能情報との関連性に関する知見を得ることができる。
【0038】
本発明の好ましい態様では、前記[31]ないし[36]のうち何れか一に記載の解析システムにおいて、[37] 前記第一および第二の生体分子の質量分析を実行する際、内部標準物質の存在下で質量分析を実行し、前記波形処理部は、前記内部標準物質のm/zの値における時間に対する質量分析スペクトル(マスクロマトグラム)を受けて、前記内部標準物質に固有の波形を得るために、さらに波形分離処理を行い、前記演算部は、前記波形処理部からの内部標準物質に固有の波形面積を算出するとともに、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を、さらに算出する。かかる構成によれば、内部標準物質中の生体分子が既知量である場合には、絶対定量が可能となる。
【0039】
また、本発明の第三の態様では、[38] 第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータの解析システムであって、前記第一および第二の生体分子並びに同位体標識された生体分子の質量分析を実行する質量分析装置と、前記質量分析装置から、前記生体分子の質量分析に関するデータを受けるデータ入出部を有する制御部と、を備え、前記制御部は、生体分子の構成成分の配列が決定された前記生体分子に対する第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記同位体標識された生体分子に対する内部標準物質のm/zの値とを決定するとともに、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析装置にて得られた質量分析に関するデータから抽出する処理部と、前記処理部から前記第一および第二並びに内部標準物質のm/zの値における時間に対する質量分析スペクトル(マスクロマトグラム)を受け、前記時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する波形処理部と、を備える解析システムを提供する。かかる構成によれば、生体分子が同位体非標識であっても、同位体標識された内部標準物質との比較において、その生体分子に固有の生体分子に由来する質量分析スペクトルを入手でき、より定量的な解析を可能とする。
【0040】
本発明の好ましい態様では、前記[38]に記載の解析システムにおいて、[39] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される。
【0041】
本発明の好ましい態様では、前記[38]または[39]に記載の解析システムにおいて、前記制御部は、前記波形分離処理部からの波形分離処理により得られた固有の生体分子に由来する波形の面積を算出し、前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する演算部を、さらに備える。
【0042】
本発明の好ましい態様では、前記[38]ないし[40]のうち何れか一に記載の解析システムにおいて、[41] 前記制御部は、波形分離後、前記生体分子の構成成分の配列毎に分類し、前記配列を生体分子の機能情報を有するデータベースに照合し、その照合結果から、前記配列と機能とを関連付けてグループ化する情報付加部を、さらに備える。
【0043】
本発明の好ましい態様では、前記[38]ないし[41]のうち何れか一に記載の解析システムにおいて、[42] 前記制御部は、生体分子の構成成分の配列から生体分子を特定し、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする演算部を、さらに備える。
【0044】
本発明の好ましい態様では、前記[38]ないし[42]のうち何れか一に記載の解析システムにおいて、[43] 前記制御部は、生体分子の構成成分の配列を、生体分子の機能情報を有するデータベースに照合し、当該生体分子の機能情報を取得する情報付加部を、さらに備える。
【0045】
本発明の好ましい態様では、前記[31]ないし[43]のうち何れか一に記載の解析システムにおいて、[44] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である。
【0046】
本発明の好ましい態様では、前記[31]ないし[44]のうち何れか一に記載の解析システムにおいて、[45] 前記構成成分の配列の決定は、MS/MS処理により行われる。
【0047】
本発明の好ましい態様では、前記[45]に記載の解析システムにおいて、[46] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により、前記構成成分の配列の決定が行われる。
【0048】
本発明の好ましい態様では、前記[31]ないし[46]のうち何れか一に記載の解析システムにおいて、[47] 前記生体分子は、経時的にサンプルから分離された生体分子である。
【0049】
本発明の好ましい態様では、前記[31]ないし[47]のうち何れか一に記載の解析システムであって、[48] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である。
【0050】
また、本発明の第四の態様では、[49] 第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子の質量分析に関するデータの解析方法であって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一及び第二の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を含む、解析方法、
[50] 前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体成分の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される、前記[49]に記載の解析方法、
[51] 前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、をさらに備える、前記[49]または[50]に記載の解析方法、
[52] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに含む、前記[49]ないし[51]のうち何れか一に記載の解析方法、
[53] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに含む、前記[49]ないし[52]のいずれか一に記載の解析方法、
[54] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに含む、前記[49]ないし[53]のいずれか一に記載の解析方法、
[55] 前記第一および第二の生体分子とともに、内部標準物質のm/zの値の決定する工程と、内部標準物質の時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを抽出する工程と、前記内部標準物質の時間に対する質量分析スペクトル(マスクロマトグラム)の波形分離処理する工程と、前記内部標準物質に固有の波形の面積を算出する工程とを実行し、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を、算出する工程を、さらに含む、前記[49]ないし[54]のうち何れか一に記載の解析方法、
[56] 第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータの解析方法であって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一および第二並びに内部標準物質の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を含む、解析方法、
[57] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、前記[56]に記載の解析方法、
[58] 前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する工程と、をさらに備える、前記[56]または[57]に記載の解析方法、
[59] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに含む、前記[56]ないし[58]のうち何れか一に記載の解析方法、
[60] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに含む、前記[56]ないし[59]のいずれか一に記載の解析方法、
[61] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに含む、前記[56]ないし[60]のいずれか一に記載の解析方法、
[62] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[49]ないし[61]のうち何れか一に記載の解析方法、
[63] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[49]ないし[62]のうち何れか一に記載の解析方法、
[64] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[63]に記載の解析方法、
[65] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[49]ないし[64]のうち何れか一に記載の解析方法、
[66] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、前記[49]ないし[65]のうち何れか一に記載の解析方法等を提供する。
【0051】
さらに、本発明の第五の態様では、[67] 質量分析装置において得られた、第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子の質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、前記質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一および第二の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を実行させるプログラム、
[68] 前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行させる、前記[67]に記載のプログラム、
[69] 前記波形分離処理により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、をさらに実行させる、前記[67]または[68]に記載のプログラム、
[70] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに実行させる、前記[67]ないし69のうち何れか一に記載のプログラム、
[71] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに実行させる、前記[67]ないし[70]のいずれか一に記載のプログラム、
[72] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに含む、前記[67]ないし[71]のいずれか一に記載のプログラム、
[73] 前記質量分析装置において、前記第一および第二の生体分子とともに、内部標準物質の質量分析に関するデータを得て、前記質量分析に関するデータから、前記内部標準物質の時間に対する質量分析スペクトル(マスクロマトグラム)を抽出するとともに、前記内部標準物質の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理し、前記波形分離処理により得られた内部標準物質に固有の波形面積を算出し、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)に比を算出する工程を、さらに実行させる、前記[67]ないし[72]のうち何れか一に記載のプログラム、
[74] 第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一および第二並びに内部標準物質の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を実行するプログラム、
[75] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、前記[74]に記載のプログラム。
[76] 前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する工程と、をさらに実行させる、前記[74]または[75]に記載のプログラム、
[77] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに実行させる、前記[74]ないし[76]のうち何れか一に記載のプログラム、
[78] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに実行させる、前記[74]ないし[77]のいずれか一に記載のプログラム、
[79] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに含む、前記[74]ないし[78]のいずれか一に記載のプログラム、
[80] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[69]ないし[90]のうち何れか一に記載のプログラム、
[81] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[69]ないし[80]のうち何れか一に記載のプログラム、
[82] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[81]に記載のプログラム、
[83] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[67]ないし[82]のうち何れか一に記載のプログラム、
[84] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、前記[67]ないし[83]のうち何れか一に記載のプログラム等を提供する。
【0052】
さらに、本発明の第六の態様では、[85] 第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質の質量分析に関するデータの解析方法であって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、得られた配列データをもとに、生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程とを含む解析方法、
[86] 前記決定工程の後、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を、前記質量分析に関するデータから抽出する工程と、さらに含む前記[85]に記載の解析方法と、
[87] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、前記[85]または[86]に記載の解析方法、
[88] 前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二のピークの値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質のピークの値とから、(前記第一のピーク)/(前記内部標準物質に固有のピーク)の比、および/または、(前記第二のピーク)/(前記内部標準物質に固有のピーク)の比を算出する工程とをさらに備える、前記[85]なしひ[87]のうち何れか一に記載の解析方法、
[89] 前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに含む、前記[85]ないし[88]のうち何れか一に記載の解析方法、
[90] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに含む、前記[85]ないし[89]のいずれか一に記載の解析方法、
[91] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[85]ないし[90]のいずれか一に記載の解析方法、
[92] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[85]ないし[91]のうち何れか一に記載の解析方法、
[93] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[92]に記載の解析方法、
[94] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[85]ないし[93]のうち何れか一に記載の解析方法、
[95] 前記生体分子は、タンパク質、脂質、糖鎖もしくは核酸またはこれらの組み合わせである、前記[85]ないし[94]のうち何れか一に記載の解析方法、および、
[96] 質量分析装置において得られた、第一および第二の生体分子と、当該第一および第二の生体分子に対して同位体標識された生体分子である内部標準物質との質量分析に関するデータを受けるコンピュータに、前記データの解析をするためのプログラムであって、質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、得られた配列データをもとに、生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、を実行させるプログラム、
[97] 前記決定工程の後、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を、前記質量分析に関するデータから抽出する工程と、をさらに実行させる前記[96]に記載のプログラム、
[98] 前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、前記[96]または[97]に記載のプログラム、
[99] 前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二のピークの値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質のピークの値とから、(前記第一のピーク)/(前記内部標準物質に固有のピーク)の比、および/または、(前記第二のピーク)/(前記内部標準物質に固有のピーク)の比を算出する工程と、をさらに実行させる、前記[96]ないし[98]のうち何れか一に記載のプログラム、
[100] 前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、前記[96]ないし[99]のうち何れか一に記載のプログラム、
[101] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに実行させる、前記[96]ないし[100]の何れか一に記載のプログラム、
[102] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[96]ないし[101]のうち何れか一に記載のプログラム、
[103] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[96]ないし[102]のうち何れか一に記載のプログラム、
[104] 前記構成成分の配列の決定は、MS/MS処理により得られた生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[103]に記載のプログラム、
[105] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[96]ないし[104]のうち何れか一に記載のプログラム、
[106] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせであるからなる群から選択されるいずれかの分子である、前記[96]ないし[105]のうち何れか一に記載のプログラム等を提供する。
【0053】
さらに、本発明の第七の態様では、[107] 質量分析装置において得られた、サンプル中の1または複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1または複数の生体分子の定量をさせるためのプログラムであって、質量分析装置にて測定された生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよび時間に対する質量分析スペクトル(マスクロマトグラム)を含むデータを、前記質量分析に関するデータから抽出する工程と、前記第一および第二の生体分子の時間に対する質量分析スペクトル(マスクロマトグラム)を波形分離処理する工程と、を実行させるプログラム、
[108] 前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行させる、前記[107]に記載のプログラム、
[109] 前記波形分離処理により得られた固有の生体分子に由来する波形の面積を算出する工程と、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、をさらに実行させる、前記[107]または[108]に記載のプログラム、
[110] 前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、前記配列を生体分子の機能情報を有するデータベースに照合する工程と、前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、をさらに実行させる、前記[107]ないし[109]のうち何れか一に記載のプログラム、
[111] 生体分子の構成成分の配列から生体分子を特定する工程と、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、をさらに実行させる前記[107]ないし[110]の何れか一に記載のプログラム、
[112] 生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、をさらに実行させる、前記[107]ないし[111]の何れか一に記載のプログラム、
[113] 前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、前記[107]ないし[112]のうち何れか一に記載のプログラム、
[114] 前記構成成分の配列の決定は、MS/MS処理により行われる、前記[107]ないし[113]のうち何れか一に記載のプログラム、
[115] 前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、前記[112]に記載のプログラム、
[116] 前記生体分子は、経時的にサンプルから分離された生体分子である、前記[107]ないし[115]のうち何れか一に記載のプログラム、
[117] 前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、前記[107]ないし[116]のうち何れか一に記載のプログラム等を提供する。
【発明の効果】
【0054】
本発明により、代謝的に標識することができないサンプル(例えば、組織、生体液、細胞、細胞器官、タンパク質複合体など)中の1若しくは複数の生体分子を精度よく定量することが可能となった。
【0055】
すなわち、従来のin vivo標識法では、培養条件に影響を受けないような限られた細胞でしか実施できなかったが、本発明では、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞をサンプルに加えるため、培養できる細胞に限られることなく、代謝的に標識することができないサンプル(例えば、組織、生体液、細胞、細胞器官、タンパク質複合体など)中の1若しくは複数の生体分子を定量することが可能となった。
【0056】
また、従来のin vitro標識法では、サンプルの破砕、抽出、消化、分画、精製など前処理段階での実験ごとに定量値が変動することの補正はできなかったが、本発明では、サンプルの破砕、抽出、消化、分画、精製などを行う前に代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加えるため、サンプル中の1若しくは複数の生体分子を精度よく定量することが可能となった。
【0057】
本発明により、3個以上のサンプル間の比較が容易になった。すなわち、これまでの定量的プロテオーム解析法は、内部標準物質と被検体とを直接比較していたため、測定のたびにサンプル調製を行う必要があった。さらに、測定対象が変わると標識すべき内部標準物質も変わるため、その都度、標識についての条件検討を行う必要があり、また、実験間の比較もできなかったが、本発明では、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を保存し、適宜、用いることにより、実験間のデータ比較、例えばある実験データに対し、一定期間経過後(例えば、1ヶ月後、1年後等)に比較データを得て解析することが可能となる。さらには、使用した代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を譲渡又は貸し渡しすることにより、今まで不可能であった研究者間のデータ比較が可能となる。
【0058】
本発明により、あらかじめ代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子の濃度を算出しておくことにより、生体分子の絶対定量が可能となった。代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、譲渡又は貸し渡しすることにより、研究者間のデータ共有化が可能となる。また、1度代謝的に同位体標識された生体分子である内部標準物質もしくは代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子の絶対量を求めておけば、実験ごとに定量する必要がなく、その後各種実験に応用できる。
【0059】
さらにまた、本発明による解析装置および解析方法によれば、固有の生体分子に由来する質量分析スペクトルを得ることができ、生体内の細胞で時々刻々変化する生体分子の発現量を定量的に解析することが可能となる。また、本発明によるプログラムにより、前記解析方法を、コンピュータに実現させることができる。くわえて、かかる定量的解析結果を、NCBInr等のデータベースと照合することにより、定量的解析結果に機能情報を付加させることもできる。
【0060】
従来の方法(AQUA法)では、サンプルに対して、合成ペプチドを添加するため、分画、抽出、精製、消化(特にゲル内消化)の過程におけるタンパク質の回収率の低さにより、精度のよい定量値が得られなかった。一方、本発明の方法では、サンプルに対して、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加するため、分画、抽出、精製、消化(特にゲル内消化)の過程におけるタンパク質の回収率の影響を受けず、精度よく再現性の高い定量値を得ることが可能となった。
【0061】
また、従来の方法では、サンプルに対して、合成ペプチドを添加するため、定量できるペプチドは、合成ペプチドと同一の配列を有するペプチドのみである。そのため、当該ペプチドの測定結果の誤差により、タンパク質の定量値が大きく影響を受けることとなる。一方、本発明の方法では、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を定量しておき、サンプルに対して、当該代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加するため、定量できるペプチドは、合成ペプチドと同一の配列を有するペプチドのみならず、当該ペプチドが構成していたタンパク質由来のその他のペプチドについても定量することができる。そのため、一つのタンパク質に対し、複数のペプチドによって定量するため、個々のペプチドの測定結果の誤差により、タンパク質の定量値が大きく影響を受けることがなく、精度よく再現性の高い定量値を得ることが可能となった。
【0062】
さらには、ペプチド合成機は、10倍過剰量の試薬を用い、しかも合成スケールがマイクログラムからミリグラム単位となる。そのため、同位体標識されたペプチドの合成は、非常に高価となり、従来の方法で網羅的な定量することはコストの面で難しい。一方、本発明の方法では、生体分子の同位体標識は、細胞培養によって行うので、ごく微量でも効率がよく生成することができる。また、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を定量するための合成ペプチドは、同位体を必要としない通常のペプチド合成で対応できるので、網羅的な定量方法として適している。
【図面の簡単な説明】
【0063】
【図1】従来技術による定量法を表したものを示す。
【図2】本発明による定量法を表したものを示す。
【図3】本発明による生体分子の定量的解析方法の概略的な全体スキームを示す。
【図4】本発明による同位体標識を利用する測定サンプル調製の一の態様のスキームを示す。
【図5】質量分析後、本発明による解析方法のスキームを示す。
【図6】典型的な質量分析装置にて得られる質量分析スペクトルを示す。
【図7】単一のm/zの値におけるマスクロマトグラムに対して、複数のピークが重なっている一例のスペクトルを示す。
【図8】図7に示したスペクトルを、本発明にて用いた波形分離処理により分離された波形スペクトルを示す。
【図9】本発明が適用される解析システムの構成の機能ブロック図の一例を示す。
【図10】本発明に係る解析方法を実行するプログラムを、概念的に表すフローチャートである。
【図11】本発明に用いる制御部の詳細な構成を示す機能ブロック図である。
【図12】本発明の第一の態様における方法を実行するためのプログラムの工程図を示す。
【図13】本発明で用いる外部データベースを利用した機能情報の取得に関するスキームを示す。
【図14】本発明における波形分離後のペプチドのマスクロマトグラムの結果に基づき、機能情報の付加を行う方法を実行するための工程図を示す。
【図15】図15は、波形分離をせずに、ペプチドの質量分析スペクトルの結果に基づき、機能情報の付加を行う方法を実行するための工程図を示す。
【図16】cMDHについて、野生型マウス脳由来および代謝的に同位体標識された生体分子である内部標準物質由来の質量分析スペクトルを示す。
【図17】cMDHについて、野生型マウス脳由来および代謝的に同位体標識された生体分子である内部標準物質由来の質量分析スペクトルの比における用量依存性を表したものを示す。
【図18】cMDHについて、質量分析による野生型マウス脳由来および代謝的に同位体標識された生体分子である内部標準物質由来の発現量における理論上の比と実際に測定した比とをプロットしたものを示す。
【図19】protein phosphatase 2aおよびmyotrophinについて、野生型マウス脳(Wild)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトル、ならびにADAM22遺伝子欠損マウス脳(K/O)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルを示す。
【図20】protein phosphatase PP2Aおよびheat shock protein 1について、野生型マウス脳(Wild)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルならびにADAM22遺伝子欠損マウス脳(K/O)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルを示す。
【図21】glyceraldehyde-3-phosphate dehydrogenaseおよびADP-ribosylation factorについて、野生型マウス脳(Wild)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルならびにADAM22遺伝子欠損マウス脳(K/O)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルを示す。
【図22】cofilinおよびtubulin-betaについて、野生型マウス脳(Wild)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルならびにADAM22遺伝子欠損マウス脳(K/O)由来(L)および代謝的に同位体標識された生体分子である内部標準物質由来(H)の質量分析スペクトルを示す。
【図23】時間、つまり、特定の連続したスキャン番号における質量分析スペクトルを示す図である。図中におけるLとは、同位体標識されていないロイシンを含むタンパク質に由来するピークを指す。
【図24】中心を644.7とする、644.2〜645.2の幅でのm/z値におけるスキャン番号975〜1005でのマスクロマトグラムを示す図である。
【図25】中心を646.7とする、646.2〜647.2の幅でのm/z値における、スキャン番号975〜1005でのマスクロマトグラムを示す図である。図中におけるHとは、同位体標識されたロイシンを含むタンパク質に由来するピークを指す。
【図26】本発明による波形分離処理の結果を示す。図26中の(A)は、図19に示すLで表示されるマスクロマトグラムの波形分離処理の結果を示し、一方で、図26中の(B)は、図19に示すHで表示されるマスクロマトグラムの波形分離処理の結果を示す。
【図27】代謝的に同位体標識された生体分子である内部標準物質由来のピークに対する野生型マウス脳(Wild)由来およびADAM22遺伝子欠損マウス脳(K/O)由来のピーク強度比を算出するにあたって、同位体標識された生体分子である内部標準物質由来の同一配列のピークを用いた場合および別の配列のピークを用いた場合において、野生型マウス脳(Wild)由来およびADAM22遺伝子欠損マウス脳(K/O)由来のピーク強度比の比較した結果を示す。
【図28】本発明の一の実施例において着目した波形分離後の配列と、その配列の定量値を示す図である。
【図29】本発明の一の実施例において、NCBInrデータベースのHomoSapiensにてパターン検索を行った結果、各配列に対して同定されたタンパクのGiNoの一覧を示す図である。
【図30】本発明において、波形分離後の質量分析データを、データベースを利用して解析した結果の一例を示す図である。
【発明を実施するための形態】
【0064】
以下に本発明の実施の形態について、図面を参照しつつ詳細に説明する。以下の実施形態は、本発明を説明するための例示であり、本発明をこの実施形態にのみ限定する趣旨ではない。本発明はその要旨を逸脱しない限り、さまざまな形態で実施することができる。なお、本明細書において引用した文献、公開公報、特許公報その他の特許文献は、参照として本明細書に組み込むものとする。
【0065】
本発明において用いる用語「サンプル」とは、生体分子を含む測定対象物を示し、好ましくは、組織、生体液、細胞、細胞器官又はタンパク質複合体を指す。組織としては、例えば、脳、脳の各部位(例えば、嗅球、扁桃核、大脳基底球、海馬、視床、視床下部、大脳皮質、延髄、小脳)、脊髄、下垂体、胃、膵臓、腎臓、肝臓、生殖腺、甲状腺、胆嚢、骨髄、副腎、皮膚、筋肉、肺、十二指腸、小腸、大腸、血管、心臓、胸腺、脾臓、顎下腺、耳下腺、舌下腺、末梢血、前立腺、睾丸、卵巣、胎盤、子宮、骨、関節、骨格筋などがあげられる。生体液としては、例えば、血液(血漿、血清を含む)、尿、糞、唾液、涙液、浸潤液(腹水、組織液を含む)などがあげられる。細胞としては、例えば、肝細胞、脾細胞、神経細胞、グリア細胞、膵臓β細胞、骨髄細胞、メサンギウム細胞、ランゲルハンス細胞、表皮細胞、上皮細胞、杯細胞、内皮細胞、平滑筋細胞、線維芽細胞、線維細胞、筋細胞、脂肪細胞、免疫細胞(例えば、マクロファージ、T細胞、B細胞、ナチュラルキラー細胞、肥満細胞、好中球、好酸球、好塩基球、単球)、巨核球、滑膜細胞、軟骨細胞、骨細胞、骨芽細胞、破骨細胞、乳腺細胞、間質細胞もしくはこれらの前駆細胞、幹細胞、癌細胞などがあげられる。細胞器官としては、例えば、核、細胞小器官(核小体、核膜、細胞膜、ミトコンドリア、リソソーム、リボソーム、ペルオキシソーム、小胞体(粗面小胞体、滑面小胞体、筋小胞体など)、ゴルジ体、微小管、中心体、アクチンフィラメントなど)、サイトゾル、シナプス、基底膜、細胞間接着装置などがあげられる。タンパク質複合体とは、二以上のタンパク質が物理的に結合している状態のものをいう。ここにあげたものは具体例であって、これらに限定されるものではない。
【0066】
本発明において用いる用語「生体分子」とは、タンパク質、脂質、糖鎖又は核酸若しくはこれらの組み合わせを指し、好ましくはタンパク質である。また、生体分子には、生理的な修飾を受けているもの(例えば、リン酸化タンパク質等)も含まれることは言うまでもない。
【0067】
本発明において用いる用語「タンパク質」とは、2以上のアミノ酸がペプチド結合によって結合したペプチドを含む。
【0068】
本発明において用いる用語「代謝的に同位体標識された生体分子」とは、同位体標識された当該生体分子の前駆体を加えることにより、代謝的に標識された生体分子を指す。上記「代謝的に」とは、酵素反応などを介した生理的条件を示し、好ましくは培養細胞における代謝反応である。
【0069】
本発明において用いる用語「前駆体」とは、生体分子の構成成分になりうる分子を指す。前駆体は、生体分子がタンパク質の場合には、好ましくはアミノ酸、より好ましくは必須アミノ酸、例えば、ロイシン、イソロイシン、トリプトファン、メチオニン、リジン、フェニルアラニン、バリン、スレオニン、特に好ましくはロイシンであり、生体分子が脂質の場合には、例えばスフィンゴ脂質であればセリンが好ましく、糖の場合には、グルコースが好ましく、核酸の場合には、アスパラギン酸、グルタミン、グリシンからプリンヌクレオチドが生合成されるためこれらが好ましいが、これらに限定されるものではない。つまり、前駆体は、生体分子に取り込まれるものであれば、その種類は限定されない。
【0070】
本発明において用いる用語「内部標準物質」とは、質量分析装置にて測定物質を定量するときに、主として実験ごとに定量値が変動することを補正するため、サンプル中に一定量を加えられる物質をいう。
【0071】
本発明において用いる用語「代謝的に同位体標識された生体分子である内部標準物質」とは、代謝的に同位体標識された生体分子を1又は複数含んだ内部標準物質をいう。
【0072】
本発明において用いる用語「代謝的に同位体標識された生体分子である内部標準物質を含む細胞」とは、代謝的に同位体標識された生体分子を1又は複数含んだ内部標準物質を含む細胞をいう。
【0073】
本発明において用いる用語「定量」とは、絶対定量及び相対定量を広く含むものである。本発明において用いる用語「絶対定量」とは測定結果を量又は濃度として得ることを目的とする定量方法であり、「相対定量」とは絶対定量以外の定量方法を指す。
【0074】
本発明において用いる用語「代謝的に標識できないサンプル」とは、代謝的に標識できるサンプル以外のサンプルを指す。代謝的に標識できるサンプルとは、培養することによる同位体標識された当該生体分子の前駆体の影響を受けることなく代謝的に標識できるサンプルをいう。「代謝的に標識できないサンプル」には、たとえば、培養することによる同位体標識された当該生体分子の前駆体の影響を受けつつ代謝的に標識できるサンプル及び生体への投与、組織培養、その他の方法により標識できるサンプルが含まれるものとする。
【0075】
本発明において用いる用語「細胞培養によって標識できないサンプル」とは、細胞を培養することができないサンプルを指す。つまり、細胞培養をできず、生体への投与、組織培養、その他の細胞培養以外の方法により標識できるサンプルは、「細胞培養によって標識できないサンプル」に含まれるものとする。例えば、組織、生体液、細胞器官又はタンパク質複合体があげられる。
【0076】
(本発明の第一の実施態様)
本発明は、代謝的に同位体標識された生体分子である内部標準物質、代謝的に同位体標識された生体分子である内部標準物質を含む細胞、および前記内部標準物質を含有する試薬と前記内部標準物質を含む細胞を含有する試薬等を提供する。
【0077】
以下では、特に、代謝的に同位体標識された生体分子である内部標準物質および代謝的に同位体標識された生体分子である内部標準物質を含む細胞の作製方法を記載する。
【0078】
代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、測定対象となるサンプルと同じ種の、好ましくは同じ組織由来の、特に好ましくは同位体を含む培地中で生育が容易な細胞であるが、これに限定されるものではない。選択された細胞を、同位体標識された当該生体分子の前駆体としての構成成分を含む培地で培養することによって、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を作製することができる。培養条件はどのようなものであってもよく、液体培地あるいは固体培地に該生細胞を培養するのに好適な条件を選択すればよい。例えば、動物細胞を選択した場合には、DMEM、MEM、RPMI1640、IMDM等の培地を用い、必要に応じウシ胎児血清(FCS)等の血清、アミノ酸、グルコース、ペニシリン又はストレプトマイシンなどを添加することができ、pH約6〜8、30〜40℃において15〜200時間前後の培養を行うことができる。その他必要に応じ途中で培地の交換を行ったり、通気及び攪拌を行ったりすることができる。
【0079】
同位体は、放射性同位体を適用することもできるが、安定同位体を用いることが好ましい。安定同位体には、好ましくは2H、13C、15N、17O、18O、33P又は34S若しくはこれらの組み合わせ、特に好ましくは13Cを用いるが、これに限定されるものではない。つまり、本発明の同位体は、細胞に取り込まれ、生体分子を標識しうるものであれば、その種類は限定されない。具体例としては、同位体標識された生体分子の前駆体として、13C標識(13C×6個)ロイシン(Cambridge Isotope Labs (CIL)社製、L-Leucine U-13C6, CLM‐2262)が挙げられる。
【0080】
上述のようにして得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、そのまま用いることができるが、破砕しておくことも可能である。破砕する方法は、ダウンス型テフロンR・ホモジナイザー、ポリトロン、ワーリング・ブレンダー、ポッター型ガラス・ホモジナイザー、超音波破砕装置、細胞溶解液(例えば、PIERCE社のM-PER: cat no. 78501, T-PER: cat no. 78510など)を用いる方法又は凍結融解法があげられ、好ましくは細胞溶解液を用いる方法である。必要に応じて、タンパク質を定量しておくことができる。このようにして、代謝的に同位体標識された生体分子である内部標準物質を作製することができる。これらの代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、適当な条件、好ましくは−20℃以下、特に好ましくは−80℃以下で保存することができる。
【0081】
本発明は、サンプルに、代謝的に同位体標識された生体分子である内部標準物質又は当該生体分子である内部標準物質を含む細胞を加えることを特徴とする質量分析計によるサンプル中の生体分子の定量方法を提供する。
【0082】
この定量方法は、サンプルに、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加える工程と、各サンプルから生体分子を抽出、分画等する工程と、質量分析装置で測定する工程と、質量分析装置で得られた結果から各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程とからなる。
【0083】
また、本発明に係るプログラムは、後述するように、本発明による定量または解析方法の各工程をコンピュータ上で実行させる。本発明に係るプログラムは、CD−ROM、磁気ディスク、半導体メモリなどの各種記録媒体を通じてコンピュータにインストールまたはダウンロードすることが可能である。
【0084】
以下に、詳細について記載する。
<質量分析による測定サンプルの調製方法>
各サンプルに、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞、好ましくは一定量の代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加える。
【0085】
続いて、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加えたサンプルを破砕し、生体分子、好ましくはタンパク質を抽出後、分画することができる。これを分画したサンプルとする。破砕・抽出する方法は、ダウンス型テフロンR・ホモジナイザー、ポリトロン、ワーリング・ブレンダー、ポッター型ガラス・ホモジナイザー、超音波破砕装置、細胞溶解液(例えばピアス社のM-PER: cat no. 78501, T-PER: cat no. 78510など)を用いる方法又は凍結融解法があげられ、好ましくはダウンス型テフロンR・ホモジナイザー、ポッター型ガラス・ホモジナイザーを用いる方法である。分画する方法は、分画遠心法やショ糖密度勾配遠心法などがあげられ、好ましくはショ糖密度勾配遠心法である。
【0086】
次に、必要に応じて、分画したサンプルを精製することができる。これを精製したサンプルとする。精製する方法は、群特異的アフィニティーカラム精製、カチオン交換クロマトグラフィー、アニオン交換クロマトグラフィー、逆相クロマトグラフィーを利用する方法、免疫沈降法、硫安沈殿法、有機溶媒による沈殿法、限外ろ過法、ゲルろ過法、透析法などがあげられ、好ましくは群特異的アフィニティーカラム精製である。破砕・抽出、分画、精製の各操作は、これらに限定されるものではなく、当業者における技術常識により、適当なものを選択し、また、組み合わせればよい。
【0087】
その後、必要に応じて、精製したサンプルを分離および消化を行うことができる。これを分離したサンプルおよび消化したサンプルとする。分離方法は、二次元電気泳動、SDS PAGE、各種クロマトグラフィー(例えば、アフィニティークロマトグラフィー、逆相クロマトグラフィー、アニオン交換クロマトグラフィー、カチオン交換クロマトグラフィーなど)等が考えられるが、これに限定されるものではなく、適当なものを選択すればよい。消化方法には、酵素消化、化学分解等があげられ、好ましくは酵素消化であるが、これに限定されるものではなく、適当なものを選択すればよい。酵素消化に用いる酵素としては、トリプシン、キモトリプシン、Lys-C, Asp-N, Glu-Cなどがあげられ、好ましくはトリプシンである。
【0088】
こうして得られた分画したサンプル、精製したサンプル、分離したサンプル又は消化したサンプルは、高速液体クロマトグラフィー(HPLC)により分離することができる。これをHPLCにより分離されたサンプルとする。HPLCに用いるカラムは、当業者における技術常識により、適当なものを選択すればよく、好ましくはアニオン交換カラム又はカチオン交換カラムである。HPLCの諸条件(流速、検出器、移動相など)は、当業者における技術常識により、適宜選択できる。
【0089】
<質量分析装置による測定サンプルの測定方法>
次に、上記の操作により得られた測定サンプル(分画したサンプル、精製したサンプル、分離したサンプル、消化したサンプル又はHPLCにより分離されたサンプルを意味する)を質量分析装置で測定する。質量分析装置は、ガスクロマトグラフと結合された質量分析装置であるガスクロマトグラフィーマススペクトロメトリー(GC/MS)や液体クロマトグラフと結合された装置である液体クロマトグラフィーマススペクトロメトリー(LC/MS)等の汎用の装置を用いて行うことができる。質量分析装置におけるイオン化方法は、各装置に応じて適宜選択できる。例えば、MALDI(マトリックス支援レーザー脱離イオン化法)、ESI(エレクトロスプレーイオン化法)、EI(電子イオン化法)、CI(化学イオン化法)、APCI(大気圧化学イオン化法)、FAB(高速原子衝撃法)、LD、FD、SIMS、TSP等があげられ、好ましくはMALDI又はESIである。アナライザーは、各装置に応じて適宜選択できる。例えば、TOF(飛行時間型)、イオントラップ、二重収束型、四重極型、フーリエ変換型等の汎用の装置を用いて行うことができる。質量分析の装置及び方法は、ここにあげたものに限定されるものではなく、当業者において質量分析に通常使用されるものを適宜選択すればよい。
【0090】
<生体分子の同定方法>
質量分析による測定の結果得られたデータを用いて、生体分子、好ましくはタンパク質を同定することができる。得られたデータを市販のソフトフェア、例えば、SonarMSMS(Genomic solution社)およびデータベース、例えば、NCBInr(http://www.ncbi.nlm.nih.gov/)、IPI、Sport等のデータベースを使用することにより解析し、サンプル中のタンパク質の自動同定が可能である。質量分析による測定データを用いて、タンパク質を同定することは当業者にとって容易である(Nat Genet. 1998: 20, 46-50; J Cell Biol. 1998: 141, 967-977; J Cell Biol. 2000: 148, 635-651; Nature. 2002: 415, 141-147; Nature. 2002: 415, 180-183; Curr Opin Cell Biol. 2003: 15, 199-205; Curr Opin Cell Biol. 2003: 7, 21-27)。
【0091】
<生体分子の標識ピークと非標識ピークとの強度比を求めて比較する方法>
本発明において、「生体分子の標識ピーク」とは、質量分析の測定結果から得られるm/zの値に対する質量分析スペクトル(以下、単に「質量分析スペクトル」という。)および/または時間に対する質量分析スペクトル(以下、「マスクロマトグラム」と称する場合がある)において、代謝的に同位体標識された生体分子に由来するシグナル強度又はその総和(通常面積で表されることは当業者であれば理解できる)をいう(以下、単に標識ピークと称する場合がある)。
【0092】
本発明において、「生体分子の非標識ピーク」とは、質量分析スペクトルおよび/またはマスクロマトグラムにおいて、代謝的に同位体標識されていない生体分子に由来するシグナル強度又はその総和をいう(以下、単に非標識ピークと称する場合がある)。
【0093】
質量分析による測定の結果得られたデータを用いて、各生体分子について、代謝的に同位体標識された生体分子である内部標準物質由来の標識ピークとサンプル由来の非標識ピークの強度比を求めて、サンプル間で該ピーク強度比の値を比較することにより、サンプル間の生体分子を相対定量することができる。代謝的に同位体標識された生体分子は、サンプル由来の生体分子に比べ、同位体標識されている分子量の分、分子量が大きくなり質量分析においてペアのピークとして観測される(図2参照)。同位体標識されている生体分子の分子量は、同定されたタンパク質、脂質、糖鎖又は核酸配列から計算によって求めることができる。
【0094】
より具体的には、例えば、サンプルAおよびサンプルBに含まれる生体分子量を比較する場合、サンプルAにおける各生体分子の非標識ピークを該生体分子に対応する内部標準物質の標識ピークで除することによって、該生体分子における非標識ピーク/標識ピーク(ピーク強度比A)を求める。一方、サンプルBにおける各生体分子の非標識ピークを該生体分子に対応する内部標準物質の標識ピークで除することによって、該生体分子における非標識ピーク/標識ピーク(ピーク強度比B)を求める。次に、ピーク強度比Aとピーク強度比Bとを比較することで、サンプルAおよびサンプルBにおける生体分子を相対的に定量することができる。
【0095】
なお、サンプル中では存在していて、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞には存在していない生体分子(例えば、タンパク質等)が存在することがある。この場合には、質量分析装置で測定した際に、近傍の内部標準物質由来のピーク、好ましくはLC/MSならクロマトグラフィーでの溶出時間が近いピーク、MALDI-MSなら分子量が近いピークを対象としてピーク強度比を求めて、サンプル間で該ピーク強度比を比較することによって定量することができる。したがって、サンプル中のすべての生体分子(例えば、タンパク質)を測定することが可能である。
【0096】
より具体的には、サンプルAおよびサンプルBにおける生体分子Xを比較する場合、内部標準物質に生体分子Xが存在せず、近傍に生体分子Yが存在することがある。ここで、近傍とは、内部標準物質由来のピークで、かつ、LC/MSならクロマトグラフィーでの溶出時間が近いピーク、MALDI-MSなら分子量が近いピークである。この場合には、サンプルAにおける生体分子Xの非標識ピークを生体分子Yに対応する内部標準物質の標識ピークで除することによって、生体分子Xにおける非標識ピーク/生体分子Yにおける標識ピーク(ピーク強度比C)を求める。一方、サンプルBにおける生体分子Xの非標識ピークを生体分子Yに対応する内部標準物質の標識ピークで除することによって、生体分子Xにおける非標識ピーク/生体分子Yにおける標識ピーク(ピーク強度比D)を求める。次に、ピーク強度比Cとピーク強度比Dとを比較することで、サンプルAおよびサンプルBにおける生体分子を相対的に定量することができる。近傍の生体分子を複数選択することによって、測定の精度を上げることができる。
【0097】
本発明によって、質量分析に用いた1又は複数の生体分子、好ましくはタンパク質の絶対定量が可能となる。また、これに伴い、1又は複数の生体分子が既知量である代謝的に同位体標識された生体分子である内部標準物質及び1又は複数の生体分子が既知量である代謝的に同位体標識された生体分子である内部標準物質を含む細胞が提供される。
【0098】
つまり、既知量の各々の生体分子標品、好ましくはタンパク質標品を使って、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する生体分子量、好ましくはタンパク質の絶対量を求めておくことで、目的のサンプルに含まれる生体分子、好ましくはタンパク質の絶対定量が可能である。したがって、これまでの定量的プロテオーム解析ではできなかった絶対定量が可能となる。このようにして同位体標識された生体分子の絶対量を求めておけば、その後、各種実験に当該同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を使用できるため、実験ごとに定量を行うことを余儀なくされていた従来の方法に比べて非常に有用である。
【0099】
以下に、詳細について記載する。
<代謝的に同位体標識された生体分子である、内部標準物質に含まれる生体分子の定量方法>
代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する生体分子の絶対量は、既知量の生体分子標品を用いて質量分析装置で測定することにより絶対量を求めることができる。
【0100】
より具体的には、例えば、化学合成した既知量の生体分子を、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に添加し、必要に応じて、上述の方法により、破砕、抽出、分画、精製を行う。次に、質量分析装置で測定し、化学合成した生体分子由来のピークと標識ピークとを比較することにより、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する当該生体分子の絶対量が求められる。
【0101】
生体分子がタンパク質である場合には、上記の方法に加え、SDS-PAGE、EIA、ELISA、RIA、ウェスタンブロット、フローサイトメトリーにより測定できる。これらは例示であり、これに限定されるものではなく、当業者にとって最適と考えられる方法を用いることができる。
【0102】
より具体的には、一定量の代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、適当な条件下、好ましくは上述の測定サンプルの調製方法と同じ条件下で破砕し、タンパク質を抽出する。この抽出液中の目的のタンパク質をSDS-PAGE、EIA、ELISA、RIA、ウェスタンブロットなどの方法で測定することにより、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する当該生体分子の絶対量が求められる。
【0103】
また、生体分子が酵素などの活性を有するものであれば、その生体分子固有の比活性(タンパク質量あたりの活性の強さ)が求められている。物質固有の比活性は、報告されている活性を用いてもよく、測定して求めてもよい。したがって、前述の抽出液中のタンパク質の持つ活性を測定することにより、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞に存在する当該生体分子の絶対量が求められる。
【0104】
なお、本発明において定量の対象は、タンパク質に限ったものではなく、細胞が培地の栄養分を使って作り出す全ての物質、例えば、脂質、糖鎖又は核酸などに対して定量および同定を目的とした分析に応用可能である。
【0105】
なお、生体分子の標識ピークと非標識ピークとの強度比を求めて比較する方法、および代謝的に同位体標識された生体分子である内部標準物質に含まれる生体分子の定量方法を実行するための、本発明に係るプログラムについて後述する。
【0106】
(本発明の第二の実施態様)
図3は、本発明の第二の実施態様による生体分子の一例としてのタンパク質の定量的解析方法の概略的な全体スキームを示す。図3に示すように、まず、測定サンプル調製を行い、その後、質量分析装置を用いて質量分析を行う。次いで、本発明による定量的解析方法を実行する。
【0107】
図3の工程S11に示す測定サンプル調製には、サンプルを同位体標識する工程と、各サンプルから生体分子を抽出、分画等する工程とからなる。サンプルを同位体標識する方法には、同位体標識されたアミノ酸を含む培地で培養する方法、in vitroにおいて化学的または酵素的に同位体標識する方法などがある。
【0108】
同位体標識されたアミノ酸を含む培地で培養する方法は、同位体標識されたアミノ酸を含まない環境で育成および/または培養された同位体非標識細胞に、同位体標識アミノ酸の添加により生合成されるタンパク質が、同位体標識アミノ酸を代謝的に取り込み、同位体標識アミノ酸を有する同位体標識タンパク質を作出する工程を含む。
【0109】
同位体標識されたアミノ酸を含む培地で培養する方法は、培養条件はどのようなものであってもよく、液体培地あるいは固体培地に、該細胞を培養するのに好適な条件を設定すればよい。たとえば、前述の本発明の第一の態様にて説明した方法に準じて行うことができ、動物細胞を選択した場合には、DMEM、MEM、RPMI1640、IMDM等の培地を用い、必要に応じて、ウシ胎児血清(FCS)等の血清、アミノ酸、グルコース、ペニシリン又はストレプトマイシンなどを添加することができ、pH約6〜8、30〜40℃において、15〜200時間前後の培養を行う。その他、必要に応じて、培地を途中で交換したり、通気及び攪拌を行ったりすることができる。このようにして得られた同位体標識されたタンパク質を含む細胞は、そのまま用いることもできるが、破砕して利用することも可能である。破砕する方法は、ダウンス型テフロン・ホモジナイザー、ポリトロン、ワーリング・ブレンダー、ポッター型ガラス・ホモジナイザー、超音波破砕装置、細胞溶解液(たとえば、ピアス社のM-PER:cat no. 78501, T-PER: cat no.78510など)を用いる方法又は凍結融解法が挙げられ、好ましくは細胞溶解液を用いる方法である。
【0110】
また、本発明の第二の実施態様において、同位体標識されたタンパク質は、in vitroにおいても調製することができる。たとえば、タンパク質中のシステイン残基を同位体標識されたアルキル化試薬を用いてアルキル化することにより、同位体標識することができる(「ラピッド・コミュケーションズ・イン・マス・スペクトルメトリー(Rapid Communications in Mass Spectroscopy)」第16巻、第15号、2002年、pp.1416-1424参照)。さらに、タンパク質中のシステイン残基を同位体標識されたビオチン化試薬を用いてビオチン化することにより、同位体標識することもできる。これを、さらに、アビジンカラムを用いて、標識されたタンパク質のみを精製することが可能である(「ネイチャー・バイオテクノロジー(Nature Biotechnology)」第17巻、第10号、1999年10月、pp.994-999)。
【0111】
さらにまた、タンパク質を消化して得られたペプチド断片のC末、N末、グルタミン酸残基、アスパラギン酸残基などを同位体標識した分子で標識することができる。具体的には、タンパク質を酵素で消化する際に、緩衝液中に18Oで標識された水を加える。消化酵素としては、キモトリプシン、トリプシン、Asp-N、Lys-C、Glu-Cを用いることができる。キモトリプシン、Asp-Nを用いたときには、加水分解後のペプチドのC末側に18Oが一つ、トリプシン、Lys-C、Glu-Cを用いたときには、加水分解後のペプチドのC末のカルボン酸の酸素原子が二つとも18Oになることが知られている。
【0112】
くわえて、タンパク質を消化して得られたペプチド断片のC末、グルタミン酸残基、アスパラギン酸残基のカルボン酸をメチルエステルにする方法が知られており(Goodlett DR, Keller A, Watts JD, Newitt R, Yi EC, Purvine S, Eng JK, von Haller P, Aebersold, Koller E. Differential stable isotope labeling of peptides for quantitation and de nove sequence derivation. Rapid Commun mass Spectrom. 2001:15, pp.1214-1221参照)、同位体標識されたメタノールを用いてメチル化することにより、同位体標識することも可能である。
【0113】
また、タンパク質を消化して得られるペプチド断片のN末をニコチン酸誘導体化する方法(Munchbach M, Quadroni M, Miotto G, James P. Quantitation and facilitated de novo sequencing of proteins by isotropic N-terminal labeling of peptides with a fragmentation-directing moiety. Anal. Chem. 2000:72, pp.4047-4057参照)や、アセチル化する方法(Ji. J. Chakraborty A, Geng M, Zhang X, Amini A, Bina M, Regnier F. Strategy for quantitative and quantitative analysis in proteomics based on signature peptides. J Chromatogr B Biomed Sci Appl. 2000:745, pp.197-210参照)が知られている。そのため、これらの同位体標識された試薬を用いることにより、同位体標識することもできる。
【0114】
なお、同位体標識されたタンパク質または同位体標識されたタンパク質を含む細胞は、適当な条件、好ましくは−20℃以下、特に好ましくは−80℃以下で保存することができる。そして、このようにして得られた同位体標識されたタンパク質は、後述する解析において内部標準物質としても用いることができる。
【0115】
本発明で用いる同位体標識アミノ酸は、放射性同位体を適用することもできるが、放射性を有さない安定同位体が、取り扱いが容易であることから、特に好ましい。安定同位体には、以下に限定されるものではないが、2H、13C、15N、17O、18O、33P若しくは34S又はこれらの組み合わせが挙げられ、好ましくは13Cである。本発明に利用される同位体は、細胞に取り込まれ、タンパク質を標識し得るものであれば、その種類は特に限定されない。具体的には、同位体標識タンパク質の前駆体として、13C標識(13Cx6個)ロイシン(Cambridge Isotope Labs(CIL)社製、L-Leucine U-13C6, CLM-2262)を挙げることができる。
【0116】
図4は、本発明による同位体標識を利用する測定サンプル調製について、本発明の第二の態様の一つの態様のスキームを示す。測定対象のサンプルのうち、一方を同位体標識されたタンパク質を含むサンプル1、他方を同位体標識されていないタンパク質を含むサンプル2を準備する。そして、サンプル1およびサンプル2を混合する。
【0117】
次いで、混合後のサンプルを破砕し、タンパク質を抽出する。そして、必要に応じて、前述のサンプルを精製することができる。精製方法は、群特異的アフィニティーカラム精製、カチオン交換クロマトグラフィー、アニオン交換クロマトグラフィー、逆相クロマトグラフィーを利用する方法、免疫沈澱法、硫安沈殿法、有機溶媒により沈殿法、限界ろ過法、透析法などが挙げられる。
【0118】
その後、さらに必要に応じて、各種分離や消化を行うことができる。分離方法には、以下に限定されるものではないが、二次元電気泳動、SDA PAGE、各種クロマトグラフィー(たとえば、アフィニティークロマトグラフィー、逆相クロマトグラフィー、アニオン交換フロマトグラフィー、カチオン交換クロマトグラフィーなど)等が考えられる。消化方法には、以下に限定されるものではないが、酵素消化、化学分解等が挙げられる。酵素消化に用いる酵素としては、たとえば、トリプシン、キモトリプシン、Lys-C、Asp-N、Glu-C等が挙げられる。
【0119】
このようにして得られたサンプル生成物をそのまま測定することもできるが、HPLCにより分離することもできる。HPLCに用いるカラムには、以下に限定されるものではないが、アニオン交換カラム又はカチオン交換カラム等が挙げられる。HPLCの諸条件(流速、検出器、移動相)は、当業者には容易に理解され、適宜選択できる。
【0120】
前述のように調製されたサンプルを、図3に示す工程S12にて質量分析を行う。この質量分析は、ガスクロマトグラフと結合された質量分析装置であるガスクロマトグラフィーマススペクトロメトリー(GC/MS)や液体クロマトグラフと結合された質量分析装置である液体クロマトグラフィーマススペクトロメトリー(LC/MS)等の汎用の装置を利用することができる。質量分析におけるイオン化方法は、前述の本発明の第一の態様で説明したように、各装置に応じて適宜選択できる。たとえば、MALDI、ESI、EI、CI、APCI、FAB、LD、FD、SIMS、TSP等が挙げられる。アナライザーには、各装置に応じて適宜選択できる。たとえば、TOF、イオントラップ、二重収束型、四重極型、フーリエ変換型等の汎用の装置を用いて行うことができる。
【0121】
質量分析による測定の結果から得られたデータを用いて、タンパク質を同定することができる。得られたデータを市販のソフトウエア、たとえば、SonarMSMS(Genomic solution社)及びデータベース、たとえば、NCBInr(hhtp://www.ncbi.nlm.nih.gov/)、IPI、Sport等のデータベースを使用することによりタンパク質の自動同定が可能である。質量分析による測定データを用いて、タンパク質を同定することは、当業者には容易に理解できる(たとえば、Nat Genet. 1998:20, 45-50; J Cell Biol. 1998: 141, 967-977; J Cell Biol. 200: 148, 635-651; Nature, 2002: 415, 141-147; Nature. 2002: 415, 180-183; Curr Opin Cell Biol. 2003: 15, 199-205; Curr Opin Cell Biol. 2003: 7, 21-27)。
【0122】
本発明に係る解析方法では、概略的には、質量分析による測定の結果から得られたデータを用いて、各タンパク質についての内部標準物質となる同位体標識タンパク質由来ピークと、サンプル中のタンパク質由来ピークの強度比や、より詳細には、固有のタンパク質に由来する波形分離したマスクロマトグラムを求めて、サンプル間でこれらのピーク強度比の値や、波形面積を比較することにより、図3の工程S13に示すサンプル中のタンパク質の定量的解析を可能とする。たとえば、本発明による第一の実施態様で説明したように、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加える工程と、各サンプルから生体分子を抽出、分画等する工程を、図3に示す工程S13にて行う。次いで、前記生体分子を質量分析装置で測定する(図3の工程S12参照)。その後、図3の工程S13に示す定量的解析にて、前記質量分析装置で得られた結果を取得し、各生体分子の標識ピークと非標識ピークとを選択した上で各ピークの強度比を求めて、当該生体分子を定量するができる。
【0123】
図5は、質量分析装置における質量分析後に、本発明に係る定量的解析方法のスキームを示す。図5に示すように、本発明による定量的解析方法は、被解析対象の質量分析スペクトルのMS/MS処理によるアミノ酸配列の決定(工程S111)、前記質量分析スペクトル(第一のm/z)の決定工程(工程S112)、前記アミノ酸配列が決定されたタンパク質の第一のm/zの値から、前記タンパク質に対して同位体標識された同位体標識タンパク質の第二のm/zの値の算出(工程S113)、前記第一及び第二のm/zの値における時間に対する質量分析スペクトル(以下、「マスクロマトグラム」と称する場合もあある。)の抽出(工程S114)、前記第一及び第二のm/zの値に対応する各タンパク質のマスクロマトグラムに対する波形分離(工程S115)、前記波形分離処理により得られた固有のタンパク質由来による波形面積の算出(工程S116)、前記第一のm/zに対応する第一の波形面積の値と、前記第二のm/zに対応する第二の波形面積の値とから、(前記第二の波形面積)/(前記第一の波形面積)の比の算出(工程S117)を、含む。以下、各工程を詳述することにより、本発明に係る定量的解析方法を説明する。
【0124】
なお、前記解析方法は、同位体非標識タンパク質の質量分析スペクトルから、対応する同位体標識されたタンパク質の質量分析スペクトルを求める方法に基づいて説明したが、先に、解析対象として同位体標識タンパク質の質量分析スペクトルを決定した後で、対応する同位体非標識タンパク質の質量分析スペクトルを求める方法でも、本発明に係る解析方法は実施可能であることは、当業者には容易に理解できる。
【0125】
図6は、典型的な質量分析装置にて得られるスペクトルを示す。得られるスペクトルの種類には、任意の時間軸点から、m/zに対する強度軸を示すスペクトル(m/zに対する質量分析スペクトル)や、検出された全イオン量を、各時間に対する強度で示すスペクトル(時間に対する質量分析スペクトル(以下、「マスクロマトグラム」と称する場合もある。)がある。
【0126】
図5に示す工程S111では、MS/MS処理から得られた質量分析スペクトルにより、アミノ酸配列を決定する(工程S111)。その後、解析対象とするタンパク質の第一のm/zの値を定める(工程S112)。
【0127】
前述したMS/MS処理とは、複数の質量分離部を用い、1つ目の質量分離部(以下、「MS1」という。)のイオン化室で生成したイオン種のうちの一つを前駆イオンとして選択し、2つ目の質量分離部(MS2)で、その前駆イオンの分解によって生じる生成イオンを検出する処理法である。そして、生成イオンのm/zの値からアミノ酸配列の解析を行うものであり、当業者には、MS/MS処理によりアミノ酸配列を決定する手法は容易に理解される(たとえば、「ポストゲノム・マススペクトロメトリー」 1993年、pp 39-72 丹羽利充編 化学同人 参照)。このMS/MS処理によるアミノ酸配列の決定は、インターネットを介してNCBInr (hhtp://www.ncbi.nlm.nih.gov/)データベースとの照合により実行することが可能である。
【0128】
その後、前記アミノ酸配列が決定されたタンパク質の第一のm/zの値から、そのタンパク質に対応する同位体標識タンパク質の第二のm/zを求める。これは、図3に示す工程S11にてサンプル調製する際、同位体標識させるアミノ酸として、安定同位体が既知である試薬、たとえば、13C標識(13Cx6個)ロイシンを利用して細胞を培養させれば、第一のm/zの値と第二のm/zの値の差は、12Cと13Cの6個分であり、その差が6である。そして、タンパク質の電荷の値から、工程S113にて第二のm/zの値を算出することができる。
【0129】
前記第一のm/z及び前記第二のm/zの値における、時間に対する質量分析スペクトル(以下、それぞれ、「時間に対する第一の質量分析スペクトル(以下、「第一のマスクロマトグラム」と称する場合がある。)」という、「時間に対する第二の質量分析スペクトル(以下、「第二のマスクロマトグラム」と称する場合がある。)」という)を、質量分析装置にて得られた質量分析スペクトルから抽出する(工程S114)。
【0130】
ところで、細胞中には複数のタンパク質が存在しており、その多くのタンパク質を一度に質量分析すると、一つのマスクロマトグラムであっても、異なるタンパク質のピークが重なる現象が観測される。図7は、単一のm/zの値において、複数のピークが重なっている一例のマスクロマトグラムを示す。
【0131】
かかる現象により、細胞中のタンパク質の発現量の定量的解析を困難にしている。そこで、本発明では、前示の第一のマスクロマトグラム及び第二のマスクロマトグラムに対して、波形分離処理を行い(工程S115)、固有のタンパク質由来のマスクロマトグラムに分離する。
【0132】
本発明で用いる波形分離処理とは、複雑な波形に対する曲線適合法を基本とする合成的分離法である。これは、最初に各ピーク成分が特定の解析関数で表現できると仮定する。この仮定に基づき、いくつかのピーク関数を生成・合成し、各ピーク関数に含まれるパラメータを調整して観測波形との偏差を最小化する。偏差の最小点におけるパラメータより、各ピーク波形を分解・分離することにより行う。なお、本発明による波形分離処理に利用される波形パラメータには、ピークの個数、各ピークの形、ピーク位置、ピーク高さ、ベースラインの形等が挙げられる。
【0133】
図8は、図7に示したマスクロマトグラムを、本発明による波形分離処理により分離したマスクロマトグラムを示す。本発明では、たとえば、ガウシアン関数とローレンツ関数とを利用して波形分離することができる。図8から明らかなように、実線で示される、実際に測定されたマスクロマトグラムは、本発明による波形分離処理により、点線等で表されるマスクロマトグラムにより5分割される。
【0134】
図8に示す波形分離処理を、同位体非標識タンパク質とそれに対応する同位体標識タンパク質とで実行する。このようにして得られたマスクロマトグラムは、固有のタンパク質に由来するマスクロマトグラムである。そして、そのマスクロマトグラムの面積を、前記同位体非標識タンパク質及び同位体標識タンパク質のそれぞれについて算出し、それぞれを、第一の波形面積及び第二の波形面積とする(工程S116)。次いで、工程S117にて、(第二の波形面積)/(第一の波形面積)の比を求め、タンパク質変動の定量的解析に利用できる。これは、常に、同位体標識されたタンパク質との比較を行うことで、定量的解析を可能にするものである。
【0135】
次に、本発明による定量的解析方法に係るプログラムを、コンピュータにて実行させる解析システムについて説明する。図9は、本発明が適用される解析システム10の構成の機能ブロック図の一例を示す。なお、図9では、前記構成のうち、本発明に関係する部分のみを概念的に示し、マイクロコンピュータから構成される。
【0136】
本発明に係る解析システム10は、概略的には、質量分析装置20にて得られた質量分析データを解析する解析装置部30と、アミノ酸配列決定用の外部分析プログラム等を提供する外部装置部40とを、ネットワーク50を介して通信可能に接続して構成される。なお、図9に示すネットワーク50は、解析装置部30と外部装置部40とを相互に接続する機能を有し、たとえば、インターネット等である。
【0137】
本発明にて用いられる質量分析装置20は、特に限定されるものではなく、市販の質量分析装置であればよい。そして、前記質量分析装置20は、それ自体に該装置にて測定して得られた結果を保存するデータ保存部25を備えていてもよい。また、本発明に用いられる質量分析装置20は、それ自体に装置を制御する制御部や入出力部を備えるものであってもよい。
【0138】
図9に示す外部装置部40は、ネットワークを介して、質量分析データを解析する解析装置部30と相互に接続され、利用者に対してアミノ酸配列情報等に関する外部データベースやホモロジー検索等の外部分析プログラムを実行するウェッブサイトを提供する機能を具有する。
【0139】
ここで、外部装置部40は、WEBサーバやASPサーバ等として構成してもよく、そのハードウェア構成は、一般に市販されるワークステーション、パーソナルコンピュータ等の情報処理装置及びその付属装置により構成してもよい。また、外部装置部40の各機能は、外部装置部のハードウェア構成中のCPU、ディスク装置、メモリ装置、入力装置、出力装置、通信制御装置等およびそれらを制御するプログラム等により実現される。
【0140】
本発明では前記外部装置部としてNCBInr等のデータベースを利用することができる。
【0141】
図9に示す解析装置部30は、概略的には、質量分析装置20の全体を統括的に制御するCPU等の制御部60、通信回線等に接続されるルータ等の通信装置(不図示)に接続される通信制御インターフェース部70、質量分析装置20、およびディスプレイやプリンター等の出力装置90に接続される入出力制御インターフェース部80、および各種のデータベースを格納する記憶部100を備えて構成される。各部は任意の通信路を介して通信可能に接続される。さらに、本発明による解析装置部30は、ルータ等の通信装置及び専用線等の有線又は無線の通信回線を介して、ネットワークに通信可能に接続されている。
【0142】
記憶部100に格納される各種のデータベース(質量分析データやアミノ酸配列データベース等)は、固定ディスク装置等のストレージ手段であり、ファイルやデータ等を格納する。
【0143】
前記記憶部100の各構成要素のうち、質量分析データベースは、質量分析装置20にて得られたデータベースである。また、アミノ酸配列データベースは、質量分析装置にて得られた質量分析スペクトルの解析結果としてのアミノ酸配列データベースや、インターネットを経由してアクセス可能な外部のアミノ酸配列データベースであってもよい。さらに、これらのデータベースをコピーしたり、オリジナルの配列情報を格納したり、さらに独自の識別番号を付与し作成したインハウスデータベースであってもよい。
【0144】
制御部60は、本発明に係る解析方法を実行するプログラムを格納し、前記解析装置部30を、ひいては解析システム10の全体を制御する装置である。前記制御部60は、OS(operating system)等の制御プログラム、各種の処理手順等を規定したプログラム、および所要データを格納するための内部メモリ(不図示)を有し、これらのプログラム等により、種々の処理を実行するための情報処理を行う。なお、本発明に係る解析方法を実行するプログラムは、前記記憶部100に格納されていてもよい。
【0145】
図10は、本発明に係る解析方法を実行する一のプログラムを、概念的に表すフローチャートである。工程S200にて、制御部60は、質量分析装置20にて得られた質量分析データを取得する。そして、取得した質量分析データを記憶部100に保存するが、その際に、後述する解析の便宜のため、データ検索を容易にするように、各質量分析データに、スキャン番号等の識別番号を付与する(工程S201)。次に、図5の工程S111にて説明したのと同様に、通信制御インターフェース部を介したインターネット50を通じて、外部のデータベース、たとえば、NCBInrデータベースと照合させながら、MS/MS処理により、制御部60にてアミノ酸配列を決定することができる(工程S202)。前記質量分析データの中から、解析対象とする質量分析スペクトルを決定する(工程S203参照)。その際、前述のように決定した質量分析スペクトルのm/zを定め、これを第一のm/zとする。この第一のm/zの値は、同位体非標識タンパク質の質量分析スペクトル、または同位体標識タンパク質の質量分析スペクトルであってもよい。かかる決定は、前述のスキャン番号から容易に行うことができる。
【0146】
工程S204にて、前記アミノ酸配列が決定されたタンパク質の第一のm/zの値から、そのタンパク質に対応する同位体標識タンパク質の第二のm/zの値を求める。この決定工程は、図3の工程S11にて予め培養させる際に利用した同位体標識のアミノ酸に含まれる同位体原子の数と、前記第一のm/zに対応するタンパク質の電荷から容易に決定することができる。決定した第二のm/zの値から、その値のマスクロマトグラムを、記憶部100に格納された質量分析データから抽出する(工程S205参照)。
【0147】
次いで、第一のm/z及び第二のm/zの値における第一のマスクロマトグラムおよび第二のマスクロマトグラムに対して、図7及び図8にて説明したように、工程S206にて波形分離処理を行う。本処理により、固有のタンパク質に由来するマスクロマトグラムを分離し、記憶部100に格納する。このようにして得られたマスクロマトグラムの波形面積として、第一の波形面積及び第二の波形面積を算出し(工程S207)、工程S208にて、(第二の波形面積)/(第一の波形面積)の比を求める。
【0148】
その後、必要に応じ、前記比の値を、ディスプレイ若しくはプリンター等の出力装置90に表示若しくは印字することができる。
【0149】
図10に示す一連の工程を、同位体標識タンパク質に起因する質量分析スペクトルと比較しながら行うため、サンプル内のタンパク質発現量の変化を、定量的に解析することが可能となる。また、必要に応じて、解析対象とする別の質量分析スペクトルに対して、図10に示す一連の工程を繰り返し実行することも可能である。たとえば、正常な細胞由来のタンパク質との比較から、遺伝子欠損した細胞由来のタンパク質の発現パターンの相違を観測することも可能である。
【0150】
さらに、図10では、同位体非標識された生体分子と同位体標識された生体分子にて説明したが、同位体標識された生体分子に代えて、同位体標識された内部標準物質である生体分子を利用することもでき、その場合、図10の工程SS208に示す波形面積比は、(生体分子の波形面積)/(内部標準物質に固有の波形面積)の比として算出される。
【0151】
図11は、本発明に用いる制御部60の詳細な構成を示す機能ブロック図である。前述のように、図10で説明した本発明に係る解析方法を実行するための制御部80は、質量分析装置20にて得られた質量分析データを、入力制御インターフェース部80を通じて、制御部80のデータ入出力部にて入手する。外部のデータベース、たとえば、NCBInrデータベースと照合させながら、MS/MS処理により、入手したタンパク質の質量分析データについてのアミノ酸配列を、制御部60の処理部にて決定する。解析対象としての質量分析スペクトルを、質量分析装置20、または制御部80と接続された不図示の入力手段からの信号に基づき決定する。ここで、前記入力手段としては、たとえば、制御部に接続されたキーボードやマウス等が挙げられる。
【0152】
前記決定により第一のm/zの値が決まり、制御部60の処理部にて第二のm/zの値を決定する。第二のm/zの値の決定は、図5の工程S113により行うことができる。なお、第一のm/zの値と第二のm/zの値のタンパク質は、アミノ酸の同位体非標識と、同じアミノ酸が同位体標識されたタンパク質の関係にある。
【0153】
このように決定された第一及び第二のm/zの値におけるマスクロマトグラムを、データ入出力部を介して、記憶部100の質量分析データベースや、質量分析装置20から、処理部にて入手する。入手した第一および第二のm/zの値におけるマスクロマトグラムを、図5の工程S115や図10の工程S206にて説明したように、処理部にて波形分離処理する。かかる波形分離処理により、m/zの値におけるマスクロマトグラムの結果からだけでは、一見、単一のタンパク質のピークと観測されたものであっても、固有のタンパク質に由来するマスクロマトグラムに分離することが可能となる(図8参照)。
【0154】
次いで、固有のタンパク質に由来するマスクロマトグラムに分離されたデータを、波形処理部から演算部へ送り、前記演算部にて分離された波形面積の算出と、同位体非標識と同位体標識されたタンパク質において、対応する固有のタンパク質に由来するマスクロマトグラム間の波形面積比の算出と、を実行する。
【0155】
このように、本発明に係る解析方法によれば、同位体非標識と同位体標識のアミノ酸を含むタンパク質において、固有のタンパク質に由来する波形分離されたマスクロマトグラム間の比較により、定量的解析を可能とする。
【0156】
次に、代謝的に同位体標識されたタンパク質である内部標準物質または代謝的に同位体標識されたタンパク質である内部標準物質を含む細胞を利用した解析方法について説明する。
【0157】
本発明の第一の実施態様において説明したように、各サンプルに、予め、代謝的に同位体標識されたタンパク質である内部標準物質または代謝的に同位体標識されたタンパク質である内部標準物質を含む細胞を加え、各サンプルからのタンパク質を抽出、分画等し、質量分析装置に測定する。その後、図5、図9〜図11にて説明したように、波形分離処理を伴う、本発明による解析方法を行うことにより、生体分子の定量的解析を可能とする。なお、かかる解析方法は、サンプルが培養できない場合、サンプルが培養できても、継代培養により影響を受ける場合、サンプルを同時期、同研究所で準備できない場合に、有用な方法である。さらに、前記内部標準物質中のタンパク質が既知量であるならば、絶対定量を可能とする。
【0158】
ここで、本発明の第一の実施態様における、生体分子の標識ピークと非標識ピークとの強度比を求めて比較する方法を実行するプログラムについて説明する。図12は、本発明の第一の態様における強度比を求め、比較するためのプログラムの工程図を示す。図12に示す工程S300にて、質量分析装置20にて測定された各種測定サンプルの質量分析データを、本発明に係る解析システム10の解析装置部30にて取得する。前述のとおり、測定サンプルの調製方法に調製された、分画したサンプル、精製サンプル、分離サンプル、消化したサンプル又はHPLCにより分離されたサンプルを含むものである。ここでは、特に、代謝的に同位体標識されていない生体分子と、同位体非標識の生体分子を対象とする。
【0159】
次いで、工程S301にて、前記質量分析スペクトルの測定結果に関するデータを、解析装置部30の通信制御IF部70を介して、外部のデータベース、たとえば、NCBInrデータベースと照合させながら、MS/MS処理により、入手した質量分析に関するデータ、具体的には、同位体標識および同位体非標識のタンパク質の同定、つまりはアミノ酸配列を制御部60の処理部にて同定する。その後、対象とする同位体標識ピークと同位体非標識ピークとを特定する(工程S302参照)。
【0160】
以上の結果に基づき、工程S303に示すように、制御部60にて、ペプチドのアミノ酸配列が同定された分子における、同位体標識ピークと同位体非標識ピークのピーク強度比を算出する。以上の操作を、各サンプルから得られた複数のペプチドについて実行することにより、異なるペプチド間で、ピーク強度比の比較することができる。
【0161】
さらに、同位体標識された生体分子が既知量である場合には、図12に示す工程を実行すると、本発明では、生体分子を絶対定量するプログラムを提供することができる。
【0162】
ところで、波形分離されたマスクロマトグラムに関して、実際に測定され、波形分離されたマスクロマトグラムは、元来、解析対象であるサンプルを二次元電気泳動等により分離されたタンパク質を質量分析したものである。そのサンプル調製の際、ゲル上のタンパク質スポットのバンドを切断し、容器に回収する。次いで、当該容器内のゲルを、トリプシン等の酵素で消化してペプチドに断片を回収して、質量分析を行う。
【0163】
このように回収されたペプチドは、切断されたタンパク質スポットに由来するバンドから誘導されるものであるが、当該バンド自体が単一のタンパク質を含有するものではなく、同じタンパク質でも、サンプル処理過程でペプチドが切断され得ることにより、複数のバンドに存在していることが通例である。そのため、前述のように波形分離されたマスクロマトグラムであっても、同一のペプチドは複数の波形分離されたマスクロマトグラムとして測定される。よって、同一のペプチドであっても、(同位体非標識ペプチドのピーク)/(同位体標識ペプチドのピーク)の比や(同位体非標識ペプチドの波形面積)/(同位体標識ペプチドの波形面積)の比の値(以下、これらを総称して「定量値」という。)は、質量分析したピーク毎に異なり、複数の値が存在することになる。
【0164】
そこで、波形分離されたマスクロマトグラムの結果から、1又は複数のペプチドに着目して、当該ペプチドが構成するタンパク質が同定されるか否かを検討することができる。たとえば、前記質量分析スペクトルの結果を、タンパク質の機能情報を有するLocusLink等のデータベースと照合して、タンパク質の機能情報を得ることができる。ここでLocusLinkには、NCBInr、IPI、Sport等の複数のデータベースにおけるキー情報から「Locus ID」という共通のキーへのリンク情報およびタンパク質の機能情報が提供されている。そこで、ペプチド配列から、NCBInr、IPI、Sport等のデータベースを使用して、各データベースにおけるキー情報を得る。次に、LocusLinkを使用して、キー情報からLocus IDを得ることができる。そして、当該Locus IDから、タンパク質の機能情報を得ることができる。例えば、ペプチド配列から、NCBInr等のデータベースを使用して、「GiNo」というキー情報を得る。次に、LocusLinkを使用して、GiNoからLocus IDを得る。そして、当該Locus IDから、タンパク質の機能情報を得ることができる。
【0165】
図13は、本発明で用いる、外部データベースを利用した機能情報の取得に関するスキームを示す。図13に示すように、波形分離後のペプチド毎に分類した上で、タンパク質の機能情報を有するデータベース、たとえば、NCBInr、IPI、Sport等へアクセスする。特に、NCBI-BLASTを利用して配列パターンを照合する。得られた配列パターンからNCBInrのキー情報であるGiNoを取得し、詳細な機能情報を有するデータベースであるLocusLinkへ接続し、GiNoからLocus IDを取得する。その後、同一のLocus IDを有するものをグループ化するとともに、かかるIDからGene Symbol、Gene Ontology(biological process)、Gene Ontology (cellular component)、Gene Ontology(molecular function)、代表定量値の情報を入手することができる。なお、波形分離前の工程は、図5および図10に示した工程と同様である。
【0166】
さらに、前述のグループ化されたGene Symbolから各ペプチドが構成していたタンパク質の情報も取得でき、複数のペプチドにおける測定値からタンパク質の定量値を算出することが可能となる。これにより、かかるタンパク質の定量値と生物学的情報との関連付けが実現される。なお、ペプチドの定量値の場合、単にその平均の定量値を算出することもできるが、その場合、ペプチドの定量値の極大値および極小値の影響を受けやすい。一方で、タンパク質の定量値を算出するにあたり、グループ化された機能タンパク質にて標準偏差を求め、その標準偏差の範囲内のデータのみで再度平均を求めてそのタンパク質の定量値とすれば、ペプチドの定量値よりも、タンパク質の定量値とその生物学的情報との関係性に意義があるものとなる。
【0167】
前述の定量値と機能情報との付加の操作は、図11に示した情報付加部により、外部のデータベースを利用して行うことができる。なお、質量分析データに関する処理は、図9に示した手段等により、波形分離までの情報処理工程と同様である。
【0168】
図14は、本発明において、波形分離後(工程S400)、決定されたペプチドの配列の結果に基づき、機能情報の付加を行う方法を実行するための工程図を示す。工程S401にて、選択したペプチドの配列ごとに分類し、その後の解析の対象とするペプチド配列を特定する。次いで、図9に示すように、通信制御インターフェースを介して、外部のデータベースへ、機能情報を取得するためにアクセスする。ここで、外部のデータベースの具体例としては、NCBInr(hhtp://www.ncbi.nlm.nih.gov/)、IPI、Sport等のデータベースを挙げることができる。そして、かかるデータベースから、配列パターンを検索し、GiNo等の情報を取得する。その後、工程S402において、ペプチドのGiNo等の情報から、当該ペプチドが構成していたタンパク質に関する情報の有無を検査する。タンパク質の情報を有する場合には、かかる情報を共有する配列としてグループ化する。このグループ化されたタンパク質における定量値を算出する(工程S403参照)。さらに、この情報には、図14に示すように、Gene Symbol、GO(biological process)、GO(cellular component) GO(molecular function)等の機能情報を入手することもできる。なお、前述の定量値の平均値を求め、当該ペプチドの代表定量値を算出することは、図9および図11に示す制御部60の演算部にて行うことができる。
【0169】
このようにして、決定されたペプチドの配列の結果から、ペプチドが構成していたタンパク質を検出し、そのタンパク質の定量値と機能情報、具体的には、Gene Ontology情報との関連を付けることができる。これは、タンパク質の定量値と生物学的データとの関連性を示唆するものである。
【0170】
また、本発明では、MS/MS処理から得られた質量分析スペクトルにより、ペプチドを構成するアミノ酸配列を決定したのち、波形分離処理を施さずに、前述のタンパク質の機能情報を有するデータベース(NCBInr等)へアクセスし、ペプチドの定量値と生物学的データとの関連性を見出すこともできる。これは、アミノ酸配列の決定されたペプチドの質量分析スペクトル自体を波形分離する必要がない場合にも、適用できる。
【0171】
図15は、波形分離をせずに、同位体標識された生体分子である内部標準物質存在下でのペプチドの質量分析スペクトルの結果、具体的にはアミノ配列の結果に基づき、機能情報の付加を行う方法を実行するための工程図を示す。図15に示す工程S500〜S502までは、図10に示す工程S200〜S205と共通するため、その説明は省略する。本発明の好ましい態様では、工程S503にて第一および第二、並びに内部標準物質のm/zにおけるマスクロマトグラムを抽出する。工程S502後、工程S504にて、図9に示す通信制御インターフェースを介して、外部のデータベースへ機能情報を取得するためにアクセスする。前述のように、外部のデータベースとしては、NCBInr(hhtp://www.ncbi.nlm.nih.gov/)、IPI、Sport等のデータベースを挙げることができる。かかるデータベースから、ペプチドの配列パターンを検索し、GiNo等の情報を取得する。この後、工程505にて、ペプチドのGiNo等の情報から、そのペプチドは構成していたタンパク質の関する情報の有無を検索する、タンパク質の情報を有する場合には、そのタンパク質情報から、Gene Symbol、GO(biological process)、GO(cellular component)、GO(molecular function)、代表定量値等の機能情報と関連させることができる。なお、図15に示す工程図では、図10の工程S209にて実行した、同位体非標識のペプチドと同位体標識のペプチドの波形面積の比を求める工程を記載していない。しかし、工程S502にて配列決定された同位体標識および同位体非標識のペプチドにおいて、各々のペプチドの波形面積を求め、(同位体非標識ペプチドの波形面積)/(同位体標識ペプチドの波形面積)の比を算出し、工程S504およびS505を実行することにより、機能情報と関連させることもできる。なお、波形面積の比だけでなく、ピーク強度比を用いても、同様に、機能情報と関連させることもできる。
【実施例】
【0172】
以下に、具体的な例をもって本発明を示すが、本発明はこれに限られるものではない。
[実施例1]
代謝的に同位体標識された生体分子である内部標準物質を含む細胞を調製するため、以下の操作を行った。
マウス神経芽細胞種Neuro2Aを培養した。培地には、10%牛胎児血清(MOREGATE社、BATCH 32300102)、100U/ml ペニシリンG、100μg/mlストレプトマイシン(GIBCO社、15140-122)を含むRPMI-1640(Sigma社、R−7130)を用いた。RPMI-1640としては、L-グルタミン、L-リジン、L-メチオニン、L-ロイシン、炭酸水素ナトリウムを含まない粉末培地を選択し、当該培地に欠損した成分を加えて調製(L-グルタミン(Sigma社製、G-8540)、L-リジン(Sigma社製、L-9037)、L-メチオニン(Sigma社製、M-5308)、炭酸水素ナトリウム(和光純薬、191-01305)をそれぞれ0.3g/L、0.04g/L、0.015g/L、2g/Lを加え、さらに、安定同位体で標識されたL-ロイシン(Cambridge Isotope Laboratories社、CLM-2262)を0.05g/L加えた)した。このようにして調製した培地を用いて、5%CO2下37℃で培養した。この培養によって得られた細胞を、代謝的に同位体標識された生体分子である内部標準物質を含む細胞として以下の実験に用いた(実施例2−7)。
【0173】
代謝的に同位体標識された生体分子である内部標準物質を含む細胞におけるタンパク質量を測定するために以下の操作を行った。
代謝的に同位体標識された生体分子である内部標準物質を含む細胞1.9x107個を細胞溶解液M-PER(PIERCE社、78501)1mLで可溶化し、遠心分離により不溶性画分を除去して可溶性画分を調製した。この可溶性画分に含まれるタンパク質量をタンパク質定量試薬Micro BCA(PIERCE社、23235)を用いて定量した。その結果、6.2mg/mLであった。
【0174】
[実施例2]
再現性を確認するために、以下の実験を行った。
<測定サンプルの調製>
サンプルとして、野生型マウス(C57BL/6)およびADAM22遺伝子を欠損させたマウスを複数用意し、それぞれの全脳を摘出し凍結保存した。脳湿重量あたりのタンパク質量を測定するため、そのうちの1個の脳湿重量を測定し、さらにプロテアーゼインヒビター(コンプリートTM(ロシュ・ダイアグノスティックス株式会社、製品番号 1 697 498)をサンプルからの抽出液50 mLあたり2錠になるように溶解した)を含む10mMHEPES-(pH7.4)-1mMDTT-1mMMgCl2-1mMNaF-1mM vanadate中でホモジナイズし、100,000xg1時間の遠心分離により可溶性画分を調製した。この可溶性画分のタンパク質量を測定したところ、脳湿重量1gあたりタンパク質量39.4mgとなった。
【0175】
被検体とする脳を解凍して脳湿重量を測定し、上述の脳湿重量あたりのタンパク量から、被検体のタンパク質量を推定した。そして、実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞をタンパク質量が等しくなるような細胞数(12.1x107個)加えて、テフロンRホモジナイザーでホモジナイズし、500xg 5分間の遠心分離により未破壊の細胞、核などを除去した。次にその上清を100,000xg 1時間の遠心分離することにより可溶性画分を調製した。
【0176】
<サンプルの抽出、分画、精製、消化>
サンプル中のあるタンパク質が定量できることを確認するために、cytosolic malate dehydrogenase(cMDH)と親和性を持つことが知られているE7070(J. Med. Chem. 42, 3789-99, 1999)を固定化したアフィニティーマトリックス(Anal. Chem. 75, 2159-2165, 2003)を使用して、以下の操作を行った。可溶性画分0.1mLを0.9mLのPBSで希釈し、E7070を固定化したアフィニティーマトリックス0.1mLと混合して反応させた後に遠心分離で上清を除去した。沈殿したアフィニティーマトリックスをPBS、1MNaClで洗浄した後、吸着したタンパク質を、PBS-10mM NADH溶液(NADHは、Sigma社、N-8129)で溶出することによりcMDHを回収した。回収した画分を限外ろ過で濃縮してSDS PAGE(ATTO社製、e-PAGEL、E-T520L)にかけて精製し、cMDHに相当するバンドを切り出してトリプシン(Promega社製, Cat. No. V5111)でゲル内消化(Rapid Comm Mass Spectrom., 15, 1416-1421, 2001: Rapid Comm Mass Spectrom., 17, 1071-1078, 2003)し消化したサンプルを得た。
【0177】
<消化したサンプルの測定>
消化したサンプルをMALDI-MS(ABI4700, Applied Biosystems社製:alpha-cyano-4-hydroxyl cinnamicacid (CHCA)をマトリクスとしてDry-droplet法でサンプルと共結晶化した)で測定した。得られた結果を基に、フラグメントの同定、ピーク強度比の算出(付属のソフトウエアにピーク面積を計算させて、強度比を計算)を行った。具体的な計算は、以下のように行った。
【0178】
野生型マウス(Wild)およびADAM22遺伝子ノックアウトマウス(KO)におけるcMDHについて、野生型マウスにおけるcMDH由来の非標識ピーク(例えば、m/z = 1750のとき、非標識ピーク=12405.31)を内部標準物質におけるcMDH由来の標識ピーク(m/z = 1762のとき(ロイシンを2つ含むため分子量は12増加する)、標識ピーク = 5373.19)で除することによって、cMDHにおける非標識ピーク/標識ピーク(12405.31/5373.19 = 2.308743)を求めた。次に、同じく野生型マウスにおけるcMDH由来の非標識ピーク(例えば、m/z = 1770のとき、非標識ピーク = 4533.977)を内部標準物質におけるcMDH由来の標識ピーク(m/z = 1776のとき(ロイシンを1つ含むため分子量は6増加する)、標識ピーク = 3156.617)で除することによって、cMDHにおける非標識ピーク/標識ピーク(4533.977/3156.617 = 1.436341)を求めた。さらに、同じく野生型マウスにおけるcMDH由来の非標識ピークm/z = 1392, 1039についても同様に非標識ピーク/標識ピークの比を求め、それぞれ2.435703, 1.750933と算出した。次に、このそれぞれのピーク強度比2.308743, 1.436341, 2.435703, 1.750933の平均値1.98293を求め、これを野生型マウスにおけるcMDH由来のピーク強度比とした。
【0179】
一方、ADAM22遺伝子ノックアウトマウスにおけるcMDHの非標識ピーク(非標識ピーク = 13011.03)を内部標準物質におけるcMDH由来の標識ピーク(標識ピーク= 6035.838)で除することによって、該生体分子における非標識ピーク/標識ピーク(13011.03/6035.838 = 2.155629)を求めた。同様に非標識ピーク/標識ピークの比を求め、それぞれ2.056147, 2.340332, 2.090195と算出した。次に、このそれぞれのピーク強度比2.155629, 2.056147, 2.340332, 2.090195の平均値2.160576を求め、これをADAM22遺伝子欠損マウスにおけるcMDH由来のピーク強度比とした。
【0180】
次に、野生型マウスにおけるピーク強度比(2.308743)とADAM22遺伝子ノックアウトマウスにおけるピーク強度比(2.160576)とを比較し、比0.917778を得た。
この操作を5回繰り返し、実験間の測定値の変動を検討した。
その結果、アフィニティー精製と言う実験間の測定値の変動が大きいステップを経ているにも関わらず、CV値4.1%という再現性の良い結果を得ることが出来た。(図16および表1)
【0181】
【表1】

[表1] cMDHについて、野生型マウス脳およびADAM22遺伝子欠損マウス脳における代謝的に同位体標識された生体分子である内部標準物質とのピーク強度比ならびに内部標準物質に対する野生型マウス脳のピーク強度比とADAM22遺伝子欠損マウス脳のピーク強度比との比較における再現性(n=5)を表している。
【0182】
[実施例3]
目的物質の量の変化に応じて質量分析スペクトル上のピーク強度比が比例的に変化することを確認するために以下の実験を行った。
<測定サンプルの調製>
サンプルとして、野生型マウス(C57B6)の全脳を摘出し凍結保存した。脳湿重量を測定し、プロテアーゼインヒビター(コンプリートTM(ロシュ・ダイアグノスティックス株式会社、製品番号 1 697 498)をサンプルからの抽出液50mLあたり2錠になるように溶解した)を含む10mM HEPES-(pH7.4)-1mM DTT-1mM MgCl2-1mM NaF-1mM vanadate中でホモジナイズし、100,000xg 1時間の遠心分離により可溶性画分を調製した。可溶性画分のタンパク質濃度が3.7mg/mLになるように調製した。
【0183】
実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞1.9x107個を細胞溶解液M-PER(PIERCE社、78501)1mLで可溶化し、遠心分離により不溶性画分を除去して、代謝的に同位体標識された生体分子である内部標準物質を調製した。代謝的に同位体標識された生体分子である内部標準物質を上記可溶性画分に対し、1:3、1:1、3:1、10:1の割合で混合して、サンプルの可溶性画分とした(0.2mLずつ)。
【0184】
<測定サンプルの抽出、分画、精製、消化>
サンプル中のあるタンパク質が定量できることを確認するために、cytosolic malate dehydrogenase(cMDH)と親和性を持つことが知られているE7070(J. Med. Chem. 42, 3789-99, 1999)を固定化したアフィニティーマトリックス(Anal. Chem. 75, 2159-2165, 2003)を使用して、以下の操作を行った。サンプルの可溶性画分0.1mLを0.9mLのPBSで希釈し、E7070を固定化したアフィニティーマトリックス0.1mLと混合して反応させた後に遠心分離で上清を除去した。沈殿したアフィニティーマトリックスをPBS、1MNaClで洗浄した後、吸着したタンパク質を、PBS-10mM NADH溶液(NADHは、Sigma社、N-8129)で溶出することによりcMDHを回収した。回収した画分を限外ろ過で濃縮してSDS PAGE(ATTO社製、e-PAGEL、E-T520L)にかけて精製し、cMDHに相当するバンドを切り出してトリプシン(Promega社製, Cat. No. V5111)でゲル内消化(Rapid Comm Mass Spectrom., 15, 1416-1421, 2001: Rapid Comm Mass Spectrom., 17, 1071-1078, 2003)し、消化したサンプルを得た。
【0185】
<測定サンプルの測定>
消化したサンプルをMALDI-MS(ABI4700, Applied Biosystems社製:alpha-cyano-4-hydroxyl cinnamicacid (CHCA)をマトリクスとしてDry-droplet法でサンプルと共結晶化した)で測定した。得られた結果を基に、でフラグメントの同定、ピーク強度比の算出(付属のソフトウエアにピーク面積を計算させて、強度比を計算)を行った。その結果、ピーク強度比はサンプル量に比例した直線となり(R2=0.97)、非常に精度良く定量することが可能であった(図17および18)。
【0186】
[実施例4]
動物組織由来のサンプル間の比較において、本法が適用できることを確認するために以下の実験を行った。
<測定サンプルの調製>
可溶性画分のタンパク質濃度が3.7mg/mLになるように調製した。
サンプルとして、野生型マウス(C57B6)およびADAM22遺伝子を欠損させたマウス(系統、ブリーダー)を用意して、それぞれの全脳を摘出し凍結保存した。次に、脳を解凍して脳湿重量を測定し、実施例1で得た脳湿重量あたりのタンパク質量から、サンプル中のタンパク質量を算出した。そして、実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞をタンパク質量が等しくなるような細胞数加えて、テフロンRホモジナイザーにてホモジナイズし、500xg 5分間の遠心分離により未破壊の細胞、核などを除去した。次に、その上清を100,000xg 1時間の遠心分離することにより可溶性画分を調製した。タンパク質量を測定したところ、野生型マウス由来のタンパク質は3.02mg/mL、ADAM22遺伝子を欠損させたマウス由来のタンパク質は3.12mg/mLであった。これを分画したサンプルとした。
【0187】
続いて、各分画したサンプルにつき2mLずつ(1mLチューブ2本ずつ)につき以下の操作を行った。尿素(Bio-Rad社Cat. No. 161-0731)を加えて8Mとし、1mLあたり3mgのディチオスレイトール(和光純薬Cat.No. 045-08974: DTT)を加えた0.5M Tris緩衝液(pH8.3, Sigma社製)500μLを各分画したサンプルに加え、37度で3時間インキュベーションすることでタンパク質中のシステイン残基を還元した。その後、尿素を加えて8Mとし、8mgのアクリルアミド(Bio-Rad社製Cat. No. 161-0107)を加えた0.5M Tris緩衝液(pH8.3) 500μLを、各分画したサンプル加えて室温で3時間インキュベーションしてシステイン残基をアルキル化した。そこに8mgのDTTを加えることで過剰のアクリルアミドを失活させた。分子量1万カットのSnakeSkin(ピアス社、Cat. No.68100)を使い、1000倍量の10mMの炭酸水素アンモニウム緩衝液により、4℃にて、1昼夜透析することにより還元アルキル化試薬を除去し、当該分画したサンプルを野生型マウス由来のタンパク質、ADAM22遺伝子を欠損させたマウス由来のタンパク質それぞれ2本ずつのチューブに分け、SpeedVacにて凍結乾燥した。この各分画したサンプルを8Mの尿素を含む0.2%ベータ・オクチルグルコシド水溶液200μLで再溶解し、50mMの炭酸水素アンモニウムで5倍に希釈し、計1mLとした。タンパク質量0.3mgに対して100μLのトリプシン(プロメガ社製、Cat. No. V5111)を加えて37℃にて24時間消化を行った。ここで消化したサンプルを得た。この各消化したサンプル(野生型マウス由来のタンパク質、ADAM22遺伝子を欠損させたマウス由来のタンパク質)を各1本ずつアニオン交換カラム(Mini-Q PC 3.2/3: Amersham Biosciences Cat. No. 17-0686-01)およびカチオン交換カラム(Mini-S PC 3.2/3: Amersham Biosciences Cat. No. 17-0687-01)にアプライし、1分ごとに分取を行った。アニオン交換カラムの場合には、消化したサンプルに50μLのアンモニア水と0.5mLの超純水を加えて2万Gで1分間遠心し、上清をアニオン交換カラムに注入した。一方、カチオン交換カラムの場合には、消化したサンプルに50μLのギ酸と0.5mLの超純水を加えて2万Gで1分間遠心して上清をカチオン交換カラムに注入した。HPLC条件は、流速が毎分0.2mL、UV検出波長が235nm & 280nm、カチオン交換カラムの場合には、移動相Aが25mMのギ酸に5%アセトニトリル、移動相Bが1Mのギ酸アンモニウムでpH3.5、5%アセトニトリルとした。アニオン交換の場合には、移動相Aが25mMのアンモニアに5%アセトニトリル、移動相Bが1Mの酢酸アンモニウムでpH8.6に5%アセトニトリルとした。グラディエントは、最初5分間が100%移動相Aで、その後40分かけて移動相濃度を直線的に40%まで増加させ、その後15分間で移動相Bを100%として5分間流した。カラムから溶出してくる各フラクションを、TFAを加えることにより酸性とし、あらかじめアセトニトリルで洗浄後0.l%TFA水でコンディショニングしておいたZipTipC18 (ミリポア社製Cat. No. ZTC18S960)にアプライした。続いて、5%アセトニトリルを含む0.1%TFA 水20μLで3回洗浄し、5μLの70%アセトニトリルを含む0.1%TFA水で溶出することにより脱塩した。ここで、HPLCにより分離したサンプルを得た。
【0188】
次に、このHPLCにより分離したサンプルを95μLの0.1%TFA水で希釈してLC(C18column)/MS (ThermoFinnigan LCQ) で測定を行った。このときの条件は、HPLC側としてはMichrom BioResources Inc社のMagic C18カラム0.2x150mm(Cat. No. 902-61261-00)に移動相Aとして5%アセトニトリルと0.01%TFAを含む0.2%酢酸水、移動相Bとして95%アセトニトリルと0.01%TFAを含む0.2%酢酸水を用いて、最初の1分間は100%移動相Aとして、その後35分間で移動相Bを直線的に40%とし、その後0.1分間で移動相Bを100%にして7分間維持、その後移動相Aを100%として14分後に次のサンプルを注入した。装置には島津製作所のLC-10AシリーズのROMをミクロ対応として、また、ミキシングチャンバーとしては付属の島津製作所製を外してバルコ社のTコネクターを採用した。流速としてはFlow-splitting方式を採用し、カラムには約毎分1−2μLの流速となるように調整した。サンプルをCTC社のオートサンプラーPALによって50μL注入し、サンプルを一度インジェクターのサンプルループに組みこんだペプチド用キャピラリートラップカラム(Michrom BioResource社Cat.No.004-25109-32)で濃縮した後に分析カラムに送り込んだ。質量分析装置は、ThermoFinnigan社のLCQ DuoにAMR社に特注した、シーズガスを使用しない、そしてXYZステージによってスプレー位置を任意に調整できる低流速対応のサブナノスプレイヤーを装着し、かつ、スプレーにはメタルニードル(GLサイエンス社製(カタログ番号7820-59001)をC18カラムに直接つないで使用した。ESI電圧としては2.6kVを印加した。測定は、Data DependentモードでDynamic ExclusionのRepeatを1とした。なお、スキャン回数を稼ぐためにZoom Scanモードを外したいわゆるダブルプレーモードで測定した。
【0189】
得られたデータについては、SonarMSMS (Genomic solution社)およびNCBInrデータベース用いてタンパク質の自動同定を行った。このとき、安定同位体で標識したロイシン(ロイシン1つにつき分子量6の増加)でもNCBInrに対して検索できるように、プログラムの一部を改変した。定量はロイシンを含むペプチドのピークで行うため、SonarMSMSにより同定されたペプチドのうち、ロイシンを含むペプチドのみ選び出し、かつ、そのペプチドピークの溶出位置(HPLCでの保持時間=質量分析でのスキャン番号)を特定するためにLCQ Duoの付属ソフトであるLCQ#dta.exeファイルからスキャン情報を自動で選び出すソフトウエアを構築した。そして、そのスキャン番号の情報から、そのスキャン番号の質量分析スペクトルを抜き出し、天然型ロイシンペプチドのピークと同位体ペプチドのピークについて、MS/MSを測定した際の親イオンの情報(m/z値)とそのペプチド内に何個のロイシンがあるか、そして電荷は何個かをSonarMSMSでの検索結果から求めて、ペアとなるピークを探し、そのピーク強度比を自動計算した。このように構築した、本発明に係る解析ソフトウエアを用いてタンパク質の同定およびピーク強度比の算出を行った。また、サンプル中に存在し、かつ、質量分析により同定されていて、代謝的に同位体標識された生体分子である内部標準物質に存在しないタンパク質については、そのペプチドが同定された質量分析スペクトルと同じ又は近いScan番号に存在する、代謝的に同位体標識された生体分子である内部標準物質由来のペプチドピークとのピーク強度比を求めた。続いて野生型マウスの全脳とADAM22遺伝子を欠損させたマウスの全脳との間で可溶性画分に含まれるタンパク質量について、先に求めたピーク強度比を比較することで算出した。
【0190】
図19〜図22は、本発明による実施例5にて得られたタンパク質の同定結果を示す。
その結果、複数の生体分子(例えば、protein phosphatase 2a, myotrophin, heat shock protein 1, protein phosphatase PP2A, glyceraldehyde-3-phosphate dehydrogenase, ADP-ribosylation factor, cofilin, tubulin-beta等)が同定され、後述するように、網羅的に相対定量することができた。
【0191】
図23ないし26は、前述のタンパク質の同定結果に基づき、本発明による波形分離処理を施した、固有なタンパク質に由来する波形面積の比の結果を示す。
ロイシンを含むタンパク質を例として、本発明に係るプロテオーム解析について説明する。図19に示す、protein phosphatase 2aに由来するタンパク質の質量分析結果より、m/z値が644.7の同位体標識されていないロイシンを含むタンパク質に由来するピークに着目した(図19中にてLで示される)。なお、本ピークがロイシンに由来するものであることは、前述のMS/MS処理から判明している。つまり、前述の説明にて、図10に示す工程S200〜S203は、既に実行されている。
【0192】
図23は、時間、つまり、特定の連続したスキャン番号における質量分析スペクトルを示す図である。図23に示す結果から、644.7であるm/z値がスキャン2で極大をむかえ、その後、減衰していることが、ピークの高さの変動から分かる。
【0193】
図24は、図23に示すスキャン番号を、必要な数だけ連続してつなぎ合わせた結果のマスクロマトグラムを示す。具体的には、図24は、中心を644.7として(m/z値:644.2〜645.2)、スキャン番号975〜1005までの質量分析スペクトルをつなぎ合わせて作成したマスクロマトグラムを示す。
【0194】
以上の操作は、前述の解析ソフトにより、必要なスキャン情報を呼び出して実行することは可能であることは、当業者には容易に理解できる。
【0195】
次に、同位体標識されたロイシンを含むタンパク質に由来するピークに着目した。この場合、同位体標識されたロイシンは、非標識のタンパク質よりも6/zだけ分子量が大きい。ここで、zとは、タンパク質が有する電荷のことである。図19に示す質量分析スペクトルの結果から、図10の工程S204にて、電荷が3であるprotein phosphatase 2aの同位体標識されたロイシンに由来する質量分析スペクトルのm/z値が、644.7 + 6/3 = 646.7の質量分析スペクトルのピークに着目し、実測された質量分析スペクトルから抽出した(図10の工程205)。なお、図19中において、同位体標識されたロイシンを含むタンパク質に由来する質量分析スペクトルをHで表示する。
【0196】
図25は、図23に示すスキャン番号を、必要な数だけ連続してつなぎ合わせた結果のマスクロマトグラムを示す。具体的には、図24は、中心を646.7として(m/z値:646.2〜647.2)、スキャン番号975〜1005までの質量分析スペクトルをつなぎ合わせて作成したマスクロマトグラムを示す。
【0197】
通常、特定のm/z値におけるマスクロマトグラムは、単一のロイシンを含むタンパク質に由来するものであるならば、単一のピークが観測されるはずである。しかしながら、図24および図25に示す結果から、複数のピークが観測された。
【0198】
そこで、本発明において、固有のタンパク質に由来するマスクロマトグラムを得るために、図24および図25で得られた質量分析スペクトルの波形分離処理を、図10の工程S206にて、以下のように行った。すなわち、ガウシアン関数とローレンツ関数とを組み合わせて曲線適合法により、波形分離処理を実行した。
【0199】
図26は、本発明による波形分離処理の結果を示す。図26中の(A)は、図19に示す野生型マウス脳(Wild)由来のprotein phosphatase 2aのLで表示されるマスクロマトグラムの波形分離処理の結果であり、一方、図26中の(B)は、図19に示す野生型マウス脳(Wild)由来の同位体標識されたprotein phosphatase 2aのHで表示されるマスクロマトグラムの波形分離処理の結果である。実測されたL及びHのマスクロマトグラムは、各々、5つの固有のタンパク質に由来するマスクロマトグラムの重ね合わせであることが判明した。
【0200】
図26(A)に示す波形分離後の波形1ないし波形5において、各波形の面積を、積分により算出することができる。同様に、図26(B)においても、波形分離後の波形6ないし波形10において、各波形の面積を、積分により算出することができる(図10の工程S207)。
【0201】
必要に応じて、以上の説明から得られた解析結果を、図9に示す記録部100に保存をすることができる。このように算出した波形面積を、同位体標識したアミノ酸を含むタンパク質由来の波形と、同位体非標識のアミノ酸を含むタンパク質由来の波形との比を観測することにより、細胞中で発現されている、アミノ酸配列を同定した特定のタンパク質の経時変化を、同位体標識されたアミノ酸を含むタンパク質との比から、定量的に追跡することが可能となる。
【0202】
図27は、本発明の解析方法により得られた結果を示す図である。図27では、代謝的に同位体標識された生体分子である内部標準物質由来のピークに対する野生型マウス脳(Wild)由来およびADAM22遺伝子欠損マウス脳(K/O)由来のピーク強度比を算出するにあたって、代謝的に同位体標識された生体分子である内部標準物質由来の同一配列のピークを用いた場合および別の配列のピークを用いた場合において、野生型マウス脳(Wild)由来およびADAM22遺伝子欠損マウス脳(K/O)由来のピーク強度比の比較したものを示す。
絶対定量ができることを確認するために以下の実験を行った。
【0203】
[実施例5]代謝的に同位体標識された生体分子である内部標準物質を含む細胞中のHSP60の定量(ELISAで定量した例)
代謝的に同位体標識された生体分子である内部標準物質を含む細胞中のHSP60の定量は、Hsp60 ELISA Kit(Stressgen社、EKS-600)を用いて行った。実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞をPBS(Sigma社、D-8537)で洗浄し、細胞3.75x107個をHsp60 ELISA Kitに添付されている溶解液3mLで溶解して、その遠心上清を可溶性画分とした。以下、定量操作はHsp60 ELISA Kitの説明書にしたがって行った。その結果、可溶性画分中のHSP60濃度は480ng/mLと求められた。よって、代謝的に同位体標識された生体分子である内部標準物質を含む細胞3.75x107個には1440ngのHSP60が存在することが算出された。
【0204】
この値を元に、野生型マウス脳中のHSP60の定量を行った。脳1gから抽出されたタンパク質量は39.4mgであり、同タンパク質量の代謝的に同位体標識された生体分子である内部標準物質を含む細胞(12.1x107個)を加えたので(実施例2)、サンプルに加えた代謝的に同位体標識された生体分子である内部標準物質中のHSP60量としては、12.1x107個×1440 ng/3.75x107個 = 4636ngとなる。一方、質量分析における野生型マウス脳由来のHSP60(配列LPDGVAVLK)と代謝的に同位体標識された生体分子である内部標準物質由来のHSP60のピーク強度比は、6.8であった。よって、野生型マウス脳1 gあたり4636ng×6.8 = 約32μgのHSP60が存在したことが算出された。
【0205】
したがって、この代謝的に同位体標識された生体分子である内部標準物質を含む細胞を用いることによって、質量分析による測定において、絶対定量を行うことができることが明らかになった。
【0206】
[実施例6]代謝的に同位体標識された生体分子である内部標準物質を含む細胞中のcMDHの定量(精製酵素標品の比活性を指標にした例)
実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞1.9x107個をM-PER(Pierce社、78501)1mLにて溶解しその遠心上清を可溶性画分とした。
【0207】
<標準物質の調製>
標準物質として用いるcMDHは、以下のようにして調製した。ヒトcMDH遺伝子をクローニングし、そのN末端側にFLAGタグを挿入したものを、バキュロウイルスベクターに組み込んだ。そして、そのベクターを持つバキュロウイルスを、Sf9細胞に感染させて培養した。培養した細胞を遠心分離で回収し、その沈殿を-80℃で凍結後再融解し、25mLのPBSで懸濁させてcMDHを抽出した。抽出後、不溶性画分を遠心分離により除去し、その上清を粗抽出液とした。cMDHの精製は、Anti FLAG M2 Agarose(Sigma社、A-2220)1.5mLに粗抽出液をアプライし、10mLのPBSで洗浄した後に、5mLのFLAG PEPTIDE(Sigma社、F-3290)溶液(0.1mg/mL in PBS)で溶出した。溶出主画分のタンパク質濃度は、0.4mg/mLであった。この画分を標準cMDH標品として定量に用いた。
【0208】
<比活性の測定>
cMDH活性の測定は、以下の反応用溶液にcMDH溶液1μLを加え、NADHに由来する340nmの吸光度の減少を、分光光度計(アマシャムバイオサイエンス社、Ultrospec 4300 pro)を用いて経時的に測定し、1分間あたりの吸光度の減少をcMDH活性とした。その結果、cMDH濃度0.02mg/mLの溶液1μLを用いたときの吸光度の減少が0.068/分、可溶性画分1μLを用いたときの吸光度の減少が0.057/分であった。
反応用緩衝液 10mM Tris-HCl(pH7.4)-0.15M NaCl 0.98mL
オキザロ酢酸(和光純薬、Lot.SEH1972)10mM水溶液 0.01mL
NADH(Sigma社、Lot.102K701)10mM水溶液 0.01mL
反応用溶液 1 mL
この測定結果から、以下のように、野生型マウス脳中のcMDH濃度を定量した。
可溶性画分中のタンパク質量は6.2mg/mLである(実施例1)。また、可溶性画分中の溶液に対するcMDH濃度は0.057/0.068 x 0.02mg/mL = 0.0167mg/mLである。よって、可溶性画分中のタンパク質量に対するcMDH濃度は、0.0167/6.2 = 0.0027mg/mg、と算出される。
【0209】
また、質量分析による測定(実施例)における野生型マウス脳由来のcMDHと代謝的に同位体標識された生体分子である内部標準物質由来のcMDHとのピーク強度比は約2.0であった(表1Wild)。よって、野生型マウス脳由来の可溶性画分中のタンパク質量に対するcMDH濃度は、0.0027 x 2 = 0.0054mg/mgとなる。また、野生型マウス脳1gあたり39.4mgのタンパク質を含んでいる(実施例2)。したがって、野生型マウス脳1gあたり39.4 x 0.0054 = 0.21mgのcMDHが存在したことを算出できた。
【0210】
したがって、この代謝的に同位体標識された生体分子である内部標準物質を含む細胞を用いることによって、質量分析による測定において、絶対定量を行うことができることが明らかになった。
【0211】
[実施例7]生体分子の絶対定量(合成ペプチドを用いた例)
実施例1で得られた代謝的に同位体標識された生体分子である内部標準物質を含む細胞1.9x107個を、M-PER(Pierce社、78501)1mLで溶解しその遠心上清を可溶性画分とした。
<合成ペプチドの調製>
以下に掲げる5種類の合成ペプチドは、ペプチド研究所株式会社(大阪)に依頼し標品を得た。SQIHDIVLVGGSTR(heat shock 70kDa protein 8 isoform1), HFSVEGQLEFR (heat shock protein 90-beta), HLIPAANTGESK(14-3-3 epsilon), SYELPDGQVITIGNER (mutant beta-actin (beta'-actin), ELEAELEDER(Myosin heavy chain, nonmuscle type B)。これら合成ペプチド各2pmolを先の可溶性画分に添加した。可溶性画分(990ng/mL)と合成ペプチド(91nmol/mL)の混合溶液3mLをLC/MSMS(アプライド社製QSTAR PULSAR i)により測定した。測定条件は以下の通りである。
【0212】
<LC条件>
オートサンプラー:HTS-PAL(CTC Analytica社製)
ポンプおよびコントローラー:LC-10Avp 2台(高圧グラジエントシステム),SCL-10Avp(島津製作所製)
フロースプリッター:3方ティー(GLサイエンス社製)に抵抗管(内径25μm長さ150mmのフューズドシリカキャピラリー、GLサイエンス社製)をつけたもの。
カラム:エレクトロスプレー用ニードル(New Objective社製、内径0.1mm, 長さ150mm,先端径8μm、導電物質被覆なし)に逆相系充填剤(ReproSil-Pur 120 C18-AQ, 3μm Dr.Maisch社製)をスラリー充填したもの。
移動相:(A) 0.5%酢酸水溶液、(B) 0.5%酢酸水溶液,80%アセトニトリル
流速:0.06mL/min(ポンプ出力値)、250nL/min(スプリット後)
グラジエント溶出条件:
【0213】
【表2】

測定時間:110分
質量分析条件:
ESIインターフェース:nanoelectrospray用(プロタナ社製)
MS スキャン:350-1400 amu, 1.0秒
MSMS スキャン:1回のMSスキャンにつき最大4回, 85-1400 amu, 各1.5秒
測定時間: 110分
スプレー電圧: 2400V
【0214】
ペプチド配列の同定は、MS/MSスペクトルをデータベース検索エンジンMascot(MatrixScience, London)に出力して行った。タンパク質データベースにはNCBIタンパク質データベース(http://www4.ncbi.nlm.nih.gov/)を用いた。定量は質量分析スペクトル上のピーク強度比を用いて行った。可溶性画分中の代謝的に同位体標識された生体分子は、ロイシンが安定同位体13Cx6個で標識されているため、添加した合成ペプチド由来のピークと質量分析スペクトル上において、容易に区別できる。
【0215】
また、ピーク強度比から計算した値を基に、可溶性画分中に存在していた各タンパク質の絶対量について表3に示した(右端wt%:可溶性画分中に含まれている割合)
【0216】
【表3】

[表3] 代謝的に同位体標識された生体分子である内部標準物質に発現していた各タンパク質の絶対量について測定結果を表す。
【0217】
一方、実施例4に示したように、野生型マウス脳由来のタンパク質と代謝的に同位体標識された生体分子である内部標準物質由来の当該タンパク質とのピーク強度比が求められる。そして、野生型マウス脳と代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、それぞれタンパク質量が同じになるように混ぜて測定している(実施例4)。また、マウス脳1gあたりのタンパク質量は、39.4mgである(実施例2)。よって、マウス脳1gに含まれている絶対量は表4のように算出することができた。
【0218】
したがって、この代謝的に同位体標識された生体分子である内部標準物質を含む細胞を用いることによって、質量分析による測定において、絶対定量を行うことができることが明らかになった。
【0219】
【表4】

[表4] 野生型マウス脳およびADAM22遺伝子欠損マウス脳中の各タンパク質の絶対量について測定結果を表す。
【0220】
以上のように、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の各タンパク質について絶対定量しておくことによって、網羅的に生体分子を絶対定量することができた。
【0221】
次に、実施例4にて得られた波形分離後の質量分析スペクトルに関するデータ、特に、定量値の値と、機能情報との関連付けについて説明する。
[実施例8]
まず、実施例4で例示したように、波形分離後の一つ又は複数の配列に着目した。図28は、本発明の一の実施例において着目した波形分離後の配列と、その配列の定量値を示す図である。具体的には、本実施例では、(1)ALVLELCCNDESGEDVEVPYVR、
(2)KPLLESGTLGTK、(3)NFPNAIEHTLQWAR、(4)YFLVGAGAIGCELLK、の4つの配列に着目した。また、図28に示す定量値は、かかる配列毎の値を表す。なお、同位体標識は、安定同位体で標識されたL-Leucineを用いて行われた。図28に示すように、配列:NFPNAIEHTLQWAR および配列:YFLVGAGAIGCELLKには、同一のペプチドに対して複数の定量値が算出されている。
【0222】
図28に示すペプチド配列に基づき、外部データベース、具体的には、NCBInrデータベースへ照合し、かかるデータベースにて、HomoSapiensにてパターン検索を実行した。その結果、検索対象である各配列に対して同定タンパクのGiNoが得られた(図29参照)。検索対象とした全ての配列において、(1)giI23510340IrefINP#695012.1I、
(2)giI35830IembICAA40296.1I、(3)giI24485IembICAA37078.1Iが同定された。この3つのGiNoに対して、LocusLinkにて検索すると、LocusID = 7317に集約された。このLocusIDに対して、図30に示す結果が得られた。
【0223】
一方、LocusID = 7317のタンパク質について、L-Leucineにて同位体標識された場合の、(LocusID = 7317のタンパク質の波形面積)/(同位体標識されたLocusID = 7317の波形面積)の定量値は、1.10726332649であった。この値は、図28に示す各ペプチド配列にて得られた値とは相違するが、タンパク質の定量値として採用し、各タンパク質毎に、この定量値を用いれば、機能が公知のタンパク質と定量値の関連付けをすることができる。なお、本発明では、質量分析のために、予めサンプルを酵素等で消化させ分解しているため、実際にタンパク質自体の質量分析スペクトルは測定されていない。しかし、タンパク質自体の質量分析スペクトルが測定されたと仮定した場合、タンパク質の定量値と生物学的機能との関連性を示唆する情報を提供することができる。
【0224】
[実施例9]
<合成ペプチドの調製>
以下に掲げる114種類の合成ペプチドのうち、8種類はペプチド研究所株式会社(大阪)から入手した。残り106種類(少なくとも1つのLeu, ひとつのTyrを含むもの)は、島津PSSM-8ペプチド合成機を用いて自家合成した。合成法および切り出し法は装置に付属のF-moc用プロトコールに従った。以下に示すHPLC条件で分画した後、目的画分の質量数をMSで確認した。さらに目的画分をHPLC-UV(280nm)で分析し、主ピークのピーク面積とTyrのモル吸光係数より溶液濃度を算出した。
【0225】
<分取HPLC条件>
LC システム(オートサンプラー、ポンプ、UV検出器、フラクションコレクター、コントローラー):LC10Avp(島津製作所製)
カラム:YMC-Pack Pro C18 (10mm径、150mm長)
移動相:(A) 0.1%トリフルオロ酢酸水溶液、(B)アセトニトリル
流速:4mL/min
検出器波長:220 nm
グラジエント溶出条件:
【表5】

測定時間:20分
【0226】
<分析HPLC条件>
流速、カラム径、検出器波長以外上記と同じ。
カラム:YMC-Pack Pro C18 (4.6mm径、150mm長)
流速:1mL/min
検出器波長:280 nm
【0227】
こうして得られた合成ペプチド各2 pmolを先の可溶性画分に添加した。可溶性画分(990 ng/mL)と合成ペプチド(91 nmol/mL)の混合溶液3 mLをLC/MSMS (アプライド社製QSTAR PULSAR i)により測定した。さらに、合成ペプチド含量を5倍および5分の1にした混合溶液を調製し、同様に測定した。測定条件は以下の通りである。
【0228】
【表6】

【0229】
測定時間:110分
MS条件:
ESIインターフェース:nanoelectrospray用(プロタナ社製)
MS スキャン: 350-1400 amu, 1.0 秒
MSMS スキャン: 1回のMSスキャンにつき最大4回, 85-1400 amu, 各1.5秒
測定時間: 110分
スプレー電圧: 2400V
【0230】
ペプチド配列の同定は、MS/MSスペクトルをデータベース検索エンジンMascot(Matrix Science, London)に出力して行った。タンパク質データベースにはSwissProtタンパク質データベース(http://kr.expasy.org/sprot/)を用いた。定量は質量分析スペクトル上のピーク強度比を用いて行った。可溶性画分中の代謝的に同位体標識された生体分子は、ロイシンが安定同位体13Cx6個で標識されているため、添加した合成ペプチド由来のピークと質量分析スペクトル上において、容易に区別できる。
【0231】
また、ピーク強度比から計算した値を基に、可溶性画分中に存在していた各タンパク質の絶対量について表4に示した(右端Conc in neuro2a:neuro2a可溶性画分タンパク質1mg当たりに含まれている割合)。
【0232】
【表7】

【表8】

【表9】

【表10】

【表11】

[表7から表11] 代謝的に同位体標識された生体分子である内部標準物質に発現していた各タンパク質の絶対量について測定結果を表す。
【0233】
一方、実施例4に示したように、野生型およびADAM22ノックアウトマウス脳由来のタンパク質と代謝的に同位体標識された生体分子である内部標準物質由来の当該タンパク質とのピーク強度比が求められる。そして、マウス脳と代謝的に同位体標識された生体分子である内部標準物質を含む細胞は、それぞれタンパク質量が同じになるように混ぜて測定しており、重量混合比は既知である(実施例4)。よって、マウス脳1mgに含まれている絶対量は表8のように算出することができた。したがって、この代謝的に同位体標識された生体分子である内部標準物質を含む細胞を用いることによって、MSによる測定において、絶対定量を行うことができることが明らかになった。
【0234】
【表12】

【表13】

【表14】

【表15】

【表16】

[表12から表16] 野生型マウス脳およびADAM22遺伝子欠損マウス脳中の各タンパク質の絶対量について測定結果を表す。
【0235】
以上のように、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の各タンパク質について絶対定量しておくことによって、網羅的に生体分子を絶対定量することができた。
【産業上の利用可能性】
【0236】
本発明により、代謝的に標識することができないサンプルを含む、組織、生体液、細胞、細胞器官、タンパク質複合体などのサンプル中の1若しくは複数の生体分子を精度よく定量することが可能となった。
【0237】
すなわち、従来のin vivo標識法では、培養条件に影響を受けないような限られた細胞でしか実施できなかったが、本発明では、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞をサンプルに加えるため、培養できる細胞に限られることなく、代謝的に標識することができないサンプルを含む、組織、生体液、細胞、細胞器官、タンパク質複合体などのサンプル中の1若しくは複数の生体分子を定量することが可能となった。
【0238】
また、従来のin vitro標識法では、サンプルの消化、分画、精製など前処理段階での実験ごとに定量値が変動することの補正はできなかったが、本発明では、サンプルの消化、分画、精製などを行う前に代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を加えるため、サンプル中の1若しくは複数の生体分子を精度よく定量することが可能となった。
【0239】
本発明により、3個以上のサンプル間の比較が容易になった。すなわち、これまでの定量的プロテオーム解析法は、内部標準物質と被検体とを直接比較していたため、測定のたびにサンプル調製を行う必要があった。さらに、測定対象が変わると標識すべき内部標準物質も変わるため、その都度、標識についての条件検討を行う必要があり、また、実験間の比較もできなかったが、本発明では、代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を保存し、適宜、用いることにより、実験間のデータ比較、例えばある実験データに対し、一定期間経過後(例えば、1ヶ月後、1年後等)に比較データを得て解析することが可能となる。さらには、使用した代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を譲渡又は貸し渡しすることにより、今まで不可能であった研究者間のデータ比較が可能となる。
【0240】
本発明により、あらかじめ代謝的に同位体標識された生体分子である内部標準物質又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子の濃度を算出しておくことにより、生体分子の絶対定量が可能となった。代謝的に同位体標識された生体分子である内部標準物質、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を譲渡又は貸し渡しすることにより、研究者間のデータ共有化が可能となる。
【0241】
さらに、本発明による解析装置および解析方法によれば、固有の生体分子に由来する質量分析スペクトルを得ることができ、生体内の細胞で時々刻々変化する生体分子の発現量を定量的に解析することが可能となる。さらにまた、本発明によるプログラムにより、前記解析方法を、コンピュータに実現させることができる。
【0242】
くわえて、本発明によれば、タンパク質における(同位体非標識のタンパク質)/(同位体標識されたタンパク質)という定量値と機能情報とを関連付けることが可能となる。
【0243】
従来の方法(AQUA法)では、サンプルに対して、合成ペプチドを添加するため、分画、抽出、精製、消化(特にゲル内消化)の過程におけるタンパク質の回収率の低さにより、精度のよい定量値が得られなかった。一方、本発明の方法では、サンプルに対して、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加するため、分画、抽出、精製、消化(特にゲル内消化)の過程におけるタンパク質の回収率の影響を受けず、精度よく再現性の高い定量値を得ることが可能となった。
【0244】
また、従来の方法では、サンプルに対して、合成ペプチドを添加するため、定量できるペプチドは、合成ペプチドと同一の配列を有するペプチドのみである。そのため、当該ペプチドの測定結果の誤差により、タンパク質の定量値が大きく影響を受けることとなる。一方、本発明の方法では、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を定量しておき、サンプルに対して、当該代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加するため、定量できるペプチドは、合成ペプチドと同一の配列を有するペプチドのみならず、当該ペプチドが構成していたタンパク質由来のその他のペプチドについても定量することができる。そのため、一つのタンパク質に対し、複数のペプチドによって定量するため、個々のペプチドの測定結果の誤差により、タンパク質の定量値が大きく影響を受けることがなく、精度よく再現性の高い定量値を得ることが可能となった。
【0245】
さらには、ペプチド合成機は、10倍過剰量の試薬を用い、しかも合成スケールがマイクログラムからミリグラム単位となる。そのため、同位体標識されたペプチドの合成は、非常に高価となり、従来の方法で網羅的な定量することはコストの面で難しい。一方、本発明の方法では、生体分子の同位体標識は、細胞培養によって行うので、ごく微量でも効率がよく生成することができる。また、代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を定量するための合成ペプチドは、同位体を必要としない通常のペプチド合成で対応できるので、網羅的な定量方法として適している。
【特許請求の範囲】
【請求項1】
サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、加えることを特徴とする質量分析計によるサンプル中の生体分子を定量する方法。
【請求項2】
サンプル中の1又は複数の生体分子を定量する方法であって、
同位体標識された生体分子の前駆体を加えて培養し、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、サンプルに添加する工程と、
当該各サンプルから生体分子を抽出し分画する工程と、
当該分画した各生体分子を質量分析装置により分析する工程と、
質量分析の情報から当該生体分子を同定する工程と、
各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を含む、生体分子を定量する方法。
【請求項3】
各サンプル間の該ピーク強度比を比較し、生体分子を相対定量する、請求項1または2に記載の方法。
【請求項4】
代謝的に同位体標識された生体分子である内部標準物質中の、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が既知量である、請求項1ないし3のいずれか一項に記載の方法。
【請求項5】
定量が絶対定量である、請求項1ないし4のいずれか一項に記載の方法。
【請求項6】
サンプル中の1または複数の生体分子を定量する方法であって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、添加する工程と、
(2)当該サンプル中の各生体分子を質量分析する工程と、
(3)質量分析の情報から当該生体分子を同定する工程と、
(4)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を含む、サンプル中の1または複数の生体分子を定量する方法。
【請求項7】
サンプルから生体分子を抽出し分画する工程をさらに含む、請求項6に記載の方法。
【請求項8】
同位体標識された生体分子の前駆体を加えて培養し、生体分子を代謝的に同位体標識する工程をさらに含む、請求項6または7に記載の方法。
【請求項9】
複数のサンプルについて行い、各サンプル間の各生体分子のピーク強度比を比較する工程をさらに含む、請求項6ないし8のいずれか一項に記載の方法。
【請求項10】
サンプル中の1または複数の生体分子を絶対定量する方法であって、
代謝的に同位体標識された生体分子である内部標準物質中の生体分子、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が、既知量である、請求項6ないし9のいずれか一項に記載の方法。
【請求項11】
代謝的に同位体標識された生体分子である内部標準物質中の生体分子を、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を、絶対定量する工程をさらに含む、請求項6ないし10のいずれか一項に記載の方法。
【請求項12】
請求項11に記載の工程が、
(a)同位体非標識の合成ペプチドを、代謝的に同位体標識された生体分子である内部標準物質、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞に添加する工程と、
(b)当該代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞から生体分子を抽出し分画する工程と、
(c)当該分画した各生体分子を質量分析する工程と、
(d)質量分析の情報から当該生体分子を同定する工程と、
(e)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を絶対定量する工程と、
を含む、請求項11に記載の方法。
【請求項13】
サンプルが、代謝的に標識できないサンプルである、請求項1ないし12のいずれか一項に記載の方法。
【請求項14】
サンプルが、細胞培養によって標識できないサンプルである、請求項1ないし13のいずれか一項に記載の方法。
【請求項15】
生体分子がタンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項1ないし14のいずれか一項に記載の方法。
【請求項16】
生体分子がタンパク質である、請求項1ないし15のいずれか一項に記載の方法。
【請求項17】
生体分子がタンパク質であって、当該タンパク質を抽出し分画し、タンパク質を消化する工程をさらに含む、請求項1ないし16のいずれか一項に記載の方法。
【請求項18】
サンプルが、組織、生体液、細胞、細胞器官およびタンパク質複合体からなる群から選択されるいずれかのサンプルである、請求項1ないし17のいずれか一項に記載の方法。
【請求項19】
同位体が、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項1ないし18のいずれか一項に記載の方法。
【請求項20】
同位体が、13Cである、請求項1ないし19のいずれか一項に記載の方法。
【請求項21】
請求項1ないし20のいずれか一項に記載の方法に用いられる代謝的に同位体標識された生体分子である内部標準物質。
【請求項22】
請求項1ないし20のいずれか一項に記載の方法に用いられる代謝的に同位体標識された生体分子である内部標準物質を含む細胞。
【請求項23】
代謝的に同位体標識された生体分子である内部標準物質を含有する、請求項1ないし20のいずれか一項に記載の方法のための試薬。
【請求項24】
代謝的に同位体標識された生体分子である内部標準物質を含む細胞を含有する、請求項1ないし20のいずれか一項に記載の方法のための試薬。
【請求項25】
代謝的に同位体標識された生体分子である内部標準物質の、請求項1ないし20のいずれか一項に記載の方法のための使用。
【請求項26】
代謝的に同位体標識された生体分子である内部標準物質を含む細胞の、請求項1ないし20のいずれか一項に記載の方法のための使用。
【請求項27】
質量分析装置おいて得られた、サンプル中の1又は複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1又は複数の生体分子の定量をさせるためのプログラムであって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加し、当該各サンプル中の各生体分子を質量分析装置により分析し、質量分析装置から分析結果を受ける工程と、
(2)質量分析の分析結果から当該生体分子を同定する工程と、
(3)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を実行させるプログラム。
【請求項28】
質量分析装置において得られた、サンプル中の1又は複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1又は複数の生体分子の定量をさせるためのプログラムであって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は、代謝的に同位体標識された生体分である内部標準物質を含む細胞を添加し、当該各サンプルから生体分子を抽出し分画し、当該分画した各生体分子を質量分析装置により分析し、質量分析装置から分析結果を受ける工程と、
(2)質量分析の分析結果から当該生体分子を同定する工程と、
(3)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を実行させるプログラム。
【請求項29】
複数のサンプルについて行い、各サンプル間の各生体分子のピーク強度比を比較する工程をさらに実行させる、請求項27または28に記載のプログラム。
【請求項30】
サンプル中の1又は複数の生体分子の絶対定量をするためのプログラムであって、
代謝的に同位体標識された生体分子である内部標準物質中の、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が既知量である、請求項27ないし29のいずれか一項に記載のプログラム。
【請求項31】
第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子との質量分析に関するデータの解析システムであって、
前記第一および第二の生体分子の質量分析を実行する質量分析装置と、
前記質量分析装置から、前記生体分子の質量分析に関するデータを受けるデータ入出部を有する制御部と、を備え、
前記制御部は、生体分子の構成成分の配列が決定された前記生体分子に対する第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子に対する第二のm/zの値とを決定するとともに、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析装置にて得られた質量分析に関するデータから抽出する処理部と、
前記処理部から前記第一および第二のm/zの値におけるマスクロマトグラムを受け、前記時間軸に対する質量分析スペクトルを波形分離処理する波形処理部と、を備える、解析システム。
【請求項32】
前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される、請求項31に記載の解析システム。
【請求項33】
前記制御部は、前記波形分離処理部からの波形分離処理により得られた固有の生体分子に由来する波形の面積を算出し、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、前記第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する演算部を、さらに備える、請求項31又は32に記載の解析システム。
【請求項34】
前記制御部は、波形分離後、前記生体分子の構成成分の配列毎に分類し、前記配列を生体分子の機能情報を有するデータベースに照合し、その照合結果から、前記配列と機能とを関連付けてグループ化する情報付加部を、さらに備える、請求項31ないし33のうち何れか一項に記載の解析システム。
【請求項35】
前記制御部は、生体分子の構成成分の配列から生体分子を特定し、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする演算部を、さらに備える、請求項31ないし34のいずれか一項に記載の解析システム。
【請求項36】
前記制御部は、生体分子の構成成分の配列を、生体分子の機能情報を有するデータベースに照合し、当該生体分子の機能情報を取得する情報付加部を、さらに備える、請求項31ないし35のいずれか一項に記載の解析システム。
【請求項37】
前記第一および第二の生体分子の質量分析を実行する際、内部標準物質の存在下で質量分析を実行し、
前記波形処理部は、前記内部標準物質のm/zの値におけるマスクロマトグラムを受けて、前記内部標準物質に固有の波形を得るために、さらに波形分離処理を行い、
前記演算部は、前記波形処理部からの内部標準物質に固有の波形面積を算出するとともに、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を、さらに算出する、請求項31ないし36のうち何れか一項に記載の解析システム。
【請求項38】
第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータの解析システムであって、
前記第一および第二の生体分子並びに同位体標識された生体分子の質量分析を実行する質量分析装置と、
前記質量分析装置から、前記生体分子の質量分析に関するデータを受けるデータ入出部を有する制御部と、を備え、
前記制御部は、生体分子の構成成分の配列が決定された前記生体分子に対する第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記同位体標識された生体分子に対する内部標準物質のm/zの値とを決定するとともに、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析装置にて得られた質量分析に関するデータから抽出する処理部と、
前記処理部から前記第一および第二並びに内部標準物質のm/zの値におけるマスクロマトグラムを受け、前記マスクロマトグラムを波形分離処理する波形処理部と、を備える、解析システム。
【請求項39】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項38に記載の解析システム。
【請求項40】
前記制御部は、前記波形分離処理部からの波形分離処理により得られた固有の生体分子に由来する波形の面積を算出し、前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する演算部を、さらに備える、請求項38又は39に記載の解析システム。
【請求項41】
前記制御部は、波形分離後、前記生体分子の構成成分の配列毎に分類し、前記配列を生体分子の機能情報を有するデータベースに照合し、その照合結果から、前記配列と機能とを関連付けてグループ化する情報付加部を、さらに備える、請求項38ないし40のうち何れか一項に記載の解析システム。
【請求項42】
前記制御部は、生体分子の構成成分の配列から生体分子を特定し、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする演算部を、さらに備える、請求項38ないし41のいずれか一項に記載の解析システム。
【請求項43】
前記制御部は、生体分子の構成成分の配列を、生体分子の機能情報を有するデータベースに照合し、当該生体分子の機能情報を取得する情報付加部を、さらに備える、請求項38ないし42のいずれか一項に記載の解析システム。
【請求項44】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項31ないし43のうち何れか一項に記載の解析システム。
【請求項45】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項31ないし44のうち何れか一項に記載の解析システム。
【請求項46】
前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により、前記構成成分の配列の決定が行われる、請求項45に記載の解析システム。
【請求項47】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項31ないし46のうち何れか一項に記載の解析システム。
【請求項48】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項31ないし47のうち何れか一項に記載の解析システム。
【請求項49】
第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子の質量分析に関するデータの解析方法であって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、
前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一及び第二の生体分子のマスクロマトグラムを波形分離処理する工程と、
を含む、解析方法。
【請求項50】
前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体成分の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される、請求項49に記載の解析方法。
【請求項51】
前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、
をさらに備える、請求項49又は50に記載の解析方法。
【請求項52】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに含む、請求項49ないし51のうち何れか一項に記載の解析方法。
【請求項53】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに含む、請求項49ないし52のいずれか一項に記載の解析方法。
【請求項54】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに含む、請求項49ないし53のいずれか一項に記載の解析方法。
【請求項55】
前記第一および第二の生体分子とともに、内部標準物質のm/zの値の決定する工程と、内部標準物質のマスクロマトグラムを含むデータを抽出する工程と、前記内部標準物質のマスクロマトグラムの波形分離処理する工程と、前記内部標準物質に固有の波形の面積を算出する工程とを実行し、
(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を、算出する工程を、さらに含む、請求項49ないし54のうち何れか一項に記載の解析方法。
【請求項56】
第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータの解析方法であって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、
前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一および第二並びに内部標準物質の生体分子のマスクロマトグラムを波形分離処理する工程と、
を含む、解析方法。
【請求項57】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項56に記載の解析方法。
【請求項58】
前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する工程と、
をさらに備える、請求項56又は57に記載の解析方法。
【請求項59】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに含む、請求項56ないし58のうち何れか一項に記載の解析方法。
【請求項60】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに含む、請求項56ないし59のいずれか一項に記載の解析方法。
【請求項61】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに含む、請求項56ないし58のいずれか一項に記載の解析方法。
【請求項62】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項49ないし61のうち何れか一項に記載の解析方法。
【請求項63】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項49ないし62のうち何れか一項に記載の解析方法。
【請求項64】
前記構成成分の配列の決定は、MS/MS処理により得られるデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項63に記載の解析方法。
【請求項65】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項49ないし64のうち何れか一項に記載の解析方法。
【請求項66】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項49ないし65のうち何れか一項に記載の解析方法。
【請求項67】
質量分析装置において得られた、第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子の質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、
前記質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、
前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一および第二の生体分子のマスクロマトグラムを波形分離処理する工程と、
を実行させるプログラム。
【請求項68】
前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行させる、請求項67に記載のプログラム。
【請求項69】
前記波形分離処理により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、
をさらに実行させる、請求項67又は68に記載のプログラム。
【請求項70】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、請求項67ないし69のうち何れか一項に記載のプログラム。
【請求項71】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに実行させる、請求項67ないし70のいずれか一項に記載のプログラム。
【請求項72】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに含む、請求項67ないし71のいずれか一項に記載のプログラム。
【請求項73】
前記質量分析装置において、前記第一および第二の生体分子とともに、内部標準物質の質量分析に関するデータを得て、
前記質量分析に関するデータから、前記内部標準物質のマスクロマトグラムを抽出するとともに、前記内部標準物質のマスクロマトグラムを波形分離処理し、
前記波形分離処理により得られた内部標準物質に固有の波形面積を算出し、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)に比を算出する工程を、さらに実行させる、請求項67ないし72のうち何れか一項に記載のプログラム。
【請求項74】
第一および第二の生体分子と、当該第一および第二の生体分子に対して同位体標識された生体分子である内部標準物質との質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、
前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一および第二並びに内部標準物質の生体分子のマスクロマトグラムを波形分離処理する工程と、
を実行させるプログラム。
【請求項75】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項74に記載のプログラム。
【請求項76】
前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する工程と、
をさらに実行させる、請求項74又は75に記載のプログラム。
【請求項77】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、請求項74ないし76のうち何れか一項に記載のプログラム。
【請求項78】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらにさせる、請求項74ないし77のいずれか一項に記載のプログラム。
【請求項79】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに含む、請求項74ないし78のいずれか一項に記載のプログラム。
【請求項80】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項67ないし79のうち何れか一項に記載のプログラム。
【請求項81】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項67ないし80のうち何れか一項に記載のプログラム。
【請求項82】
前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項81に記載のプログラム。
【請求項83】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項67ないし82のうち何れか一項に記載のプログラム。
【請求項84】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項67ないし83のうち何れか一項に記載のプログラム。
【請求項85】
第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質の質量分析に関するデータの解析方法であって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、
得られたデータをもとに、生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
を含む解析方法。
【請求項86】
前記決定工程の後、
前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを、前記質量分析に関するデータから抽出する工程と、
をさらに含む解析方法。
【請求項87】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項85または86に記載の解析方法。
【請求項88】
前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二のピークの値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質のピークの値とから、(前記第一のピーク)/(前記内部標準物質に固有のピーク)の比、および/または、(前記第二のピーク)/(前記内部標準物質に固有のピーク)の比を算出する工程と、
をさらに備える、請求項85ないし87のうち何れか一項に記載の解析方法。
【請求項89】
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに含む、請求項85ないし88のうち何れか一項に記載の解析方法。
【請求項90】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに含む、請求項85ないし89のいずれか一項に記載の解析方法。
【請求項91】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項85ないし90のいずれか一項に記載の解析方法。
【請求項92】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項85ないし91のうち何れか一項に記載の解析方法。
【請求項93】
前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項92に記載の解析方法。
【請求項94】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項85ないし93のうち何れか一項に記載の解析方法。
【請求項95】
前記生体分子は、タンパク質、脂質、糖鎖もしくは核酸またはこれらの組み合わせである、請求項85ないし94のうち何れか一項に記載の解析方法。
【請求項96】
質量分析装置において得られた、第一および第二の生体分子と、当該第一および第二の生体分子に対して同位体標識された生体分子である内部標準物質との質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、
得られたデータをもとに、生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
を実行させるプログラム。
【請求項97】
前記決定工程の後、
前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを、前記質量分析に関するデータから抽出する工程と、
をさらに実行させる請求項96に記載のプログラム。
【請求項98】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項96または97に記載のプログラム。
【請求項99】
前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二のピークの値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質のピークの値とから、(前記第一のピーク)/(前記内部標準物質に固有のピーク)の比、および/または、(前記第二のピーク)/(前記内部標準物質に固有のピーク)の比を算出する工程と、
をさらに実行させる、請求項96ないし98のうち何れか一項に記載のプログラム。
【請求項100】
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、請求項96ないし99のうち何れか一項に記載のプログラム。
【請求項101】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに実行させる、請求項96ないし100のいずれか一項に記載のプログラム。
【請求項102】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項96ないし101のうち何れか一項に記載のプログラム。
【請求項103】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項96ないし102のうち何れか一項に記載のプログラム。
【請求項104】
前記構成成分の配列決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項103に記載のプログラム。
【請求項105】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項96ないし104のうち何れか一項に記載のプログラム。
【請求項106】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせであるからなる群から選択されるいずれかの分子である、請求項96ないし105のうち何れか一項に記載のプログラム。
【請求項107】
質量分析装置において得られた、サンプル中の1または複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1または複数の生体分子の定量をさせるためのプログラムであって、
質量分析装置にて測定された生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、
前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一および第二の生体分子のマスクロマトグラムを波形分離処理する工程と、
を実行させるプログラム。
【請求項108】
前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される、請求項107に記載のプログラム。
【請求項109】
前記波形分離処理により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、
をさらに実行させる、請求項107又は108に記載のプログラム。
【請求項110】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、請求項107ないし109のうち何れか一項に記載のプログラム。
【請求項111】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに実行させる、請求項107ないし110のいずれか一項に記載のプログラム。
【請求項112】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに実行させる、請求項107ないし111のいずれか一項に記載のプログラム。
【請求項113】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項107ないし112のうち何れか一項に記載のプログラム。
【請求項114】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項107ないし113のうち何れか一項に記載のプログラム。
【請求項115】
前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項114に記載のプログラム。
【請求項116】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項107ないし115のうち何れか一項に記載のプログラム。
【請求項117】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項107ないし116のうち何れか一項に記載のプログラム。
【請求項1】
サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、加えることを特徴とする質量分析計によるサンプル中の生体分子を定量する方法。
【請求項2】
サンプル中の1又は複数の生体分子を定量する方法であって、
同位体標識された生体分子の前駆体を加えて培養し、代謝的に同位体標識された生体分子である内部標準物質を、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、サンプルに添加する工程と、
当該各サンプルから生体分子を抽出し分画する工程と、
当該分画した各生体分子を質量分析装置により分析する工程と、
質量分析の情報から当該生体分子を同定する工程と、
各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を含む、生体分子を定量する方法。
【請求項3】
各サンプル間の該ピーク強度比を比較し、生体分子を相対定量する、請求項1または2に記載の方法。
【請求項4】
代謝的に同位体標識された生体分子である内部標準物質中の、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が既知量である、請求項1ないし3のいずれか一項に記載の方法。
【請求項5】
定量が絶対定量である、請求項1ないし4のいずれか一項に記載の方法。
【請求項6】
サンプル中の1または複数の生体分子を定量する方法であって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を、添加する工程と、
(2)当該サンプル中の各生体分子を質量分析する工程と、
(3)質量分析の情報から当該生体分子を同定する工程と、
(4)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を含む、サンプル中の1または複数の生体分子を定量する方法。
【請求項7】
サンプルから生体分子を抽出し分画する工程をさらに含む、請求項6に記載の方法。
【請求項8】
同位体標識された生体分子の前駆体を加えて培養し、生体分子を代謝的に同位体標識する工程をさらに含む、請求項6または7に記載の方法。
【請求項9】
複数のサンプルについて行い、各サンプル間の各生体分子のピーク強度比を比較する工程をさらに含む、請求項6ないし8のいずれか一項に記載の方法。
【請求項10】
サンプル中の1または複数の生体分子を絶対定量する方法であって、
代謝的に同位体標識された生体分子である内部標準物質中の生体分子、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が、既知量である、請求項6ないし9のいずれか一項に記載の方法。
【請求項11】
代謝的に同位体標識された生体分子である内部標準物質中の生体分子を、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子を、絶対定量する工程をさらに含む、請求項6ないし10のいずれか一項に記載の方法。
【請求項12】
請求項11に記載の工程が、
(a)同位体非標識の合成ペプチドを、代謝的に同位体標識された生体分子である内部標準物質、または、代謝的に同位体標識された生体分子である内部標準物質を含む細胞に添加する工程と、
(b)当該代謝的に同位体標識された生体分子である内部標準物質または代謝的に同位体標識された生体分子である内部標準物質を含む細胞から生体分子を抽出し分画する工程と、
(c)当該分画した各生体分子を質量分析する工程と、
(d)質量分析の情報から当該生体分子を同定する工程と、
(e)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を絶対定量する工程と、
を含む、請求項11に記載の方法。
【請求項13】
サンプルが、代謝的に標識できないサンプルである、請求項1ないし12のいずれか一項に記載の方法。
【請求項14】
サンプルが、細胞培養によって標識できないサンプルである、請求項1ないし13のいずれか一項に記載の方法。
【請求項15】
生体分子がタンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項1ないし14のいずれか一項に記載の方法。
【請求項16】
生体分子がタンパク質である、請求項1ないし15のいずれか一項に記載の方法。
【請求項17】
生体分子がタンパク質であって、当該タンパク質を抽出し分画し、タンパク質を消化する工程をさらに含む、請求項1ないし16のいずれか一項に記載の方法。
【請求項18】
サンプルが、組織、生体液、細胞、細胞器官およびタンパク質複合体からなる群から選択されるいずれかのサンプルである、請求項1ないし17のいずれか一項に記載の方法。
【請求項19】
同位体が、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項1ないし18のいずれか一項に記載の方法。
【請求項20】
同位体が、13Cである、請求項1ないし19のいずれか一項に記載の方法。
【請求項21】
請求項1ないし20のいずれか一項に記載の方法に用いられる代謝的に同位体標識された生体分子である内部標準物質。
【請求項22】
請求項1ないし20のいずれか一項に記載の方法に用いられる代謝的に同位体標識された生体分子である内部標準物質を含む細胞。
【請求項23】
代謝的に同位体標識された生体分子である内部標準物質を含有する、請求項1ないし20のいずれか一項に記載の方法のための試薬。
【請求項24】
代謝的に同位体標識された生体分子である内部標準物質を含む細胞を含有する、請求項1ないし20のいずれか一項に記載の方法のための試薬。
【請求項25】
代謝的に同位体標識された生体分子である内部標準物質の、請求項1ないし20のいずれか一項に記載の方法のための使用。
【請求項26】
代謝的に同位体標識された生体分子である内部標準物質を含む細胞の、請求項1ないし20のいずれか一項に記載の方法のための使用。
【請求項27】
質量分析装置おいて得られた、サンプル中の1又は複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1又は複数の生体分子の定量をさせるためのプログラムであって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は、代謝的に同位体標識された生体分子である内部標準物質を含む細胞を添加し、当該各サンプル中の各生体分子を質量分析装置により分析し、質量分析装置から分析結果を受ける工程と、
(2)質量分析の分析結果から当該生体分子を同定する工程と、
(3)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を実行させるプログラム。
【請求項28】
質量分析装置において得られた、サンプル中の1又は複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1又は複数の生体分子の定量をさせるためのプログラムであって、
(1)サンプルに、代謝的に同位体標識された生体分子である内部標準物質を、又は、代謝的に同位体標識された生体分である内部標準物質を含む細胞を添加し、当該各サンプルから生体分子を抽出し分画し、当該分画した各生体分子を質量分析装置により分析し、質量分析装置から分析結果を受ける工程と、
(2)質量分析の分析結果から当該生体分子を同定する工程と、
(3)各生体分子の標識ピークと非標識ピークとの強度比を求めて、当該生体分子を定量する工程と、
を実行させるプログラム。
【請求項29】
複数のサンプルについて行い、各サンプル間の各生体分子のピーク強度比を比較する工程をさらに実行させる、請求項27または28に記載のプログラム。
【請求項30】
サンプル中の1又は複数の生体分子の絶対定量をするためのプログラムであって、
代謝的に同位体標識された生体分子である内部標準物質中の、又は代謝的に同位体標識された生体分子である内部標準物質を含む細胞中の生体分子が既知量である、請求項27ないし29のいずれか一項に記載のプログラム。
【請求項31】
第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子との質量分析に関するデータの解析システムであって、
前記第一および第二の生体分子の質量分析を実行する質量分析装置と、
前記質量分析装置から、前記生体分子の質量分析に関するデータを受けるデータ入出部を有する制御部と、を備え、
前記制御部は、生体分子の構成成分の配列が決定された前記生体分子に対する第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子に対する第二のm/zの値とを決定するとともに、前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析装置にて得られた質量分析に関するデータから抽出する処理部と、
前記処理部から前記第一および第二のm/zの値におけるマスクロマトグラムを受け、前記時間軸に対する質量分析スペクトルを波形分離処理する波形処理部と、を備える、解析システム。
【請求項32】
前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される、請求項31に記載の解析システム。
【請求項33】
前記制御部は、前記波形分離処理部からの波形分離処理により得られた固有の生体分子に由来する波形の面積を算出し、前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、前記第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する演算部を、さらに備える、請求項31又は32に記載の解析システム。
【請求項34】
前記制御部は、波形分離後、前記生体分子の構成成分の配列毎に分類し、前記配列を生体分子の機能情報を有するデータベースに照合し、その照合結果から、前記配列と機能とを関連付けてグループ化する情報付加部を、さらに備える、請求項31ないし33のうち何れか一項に記載の解析システム。
【請求項35】
前記制御部は、生体分子の構成成分の配列から生体分子を特定し、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする演算部を、さらに備える、請求項31ないし34のいずれか一項に記載の解析システム。
【請求項36】
前記制御部は、生体分子の構成成分の配列を、生体分子の機能情報を有するデータベースに照合し、当該生体分子の機能情報を取得する情報付加部を、さらに備える、請求項31ないし35のいずれか一項に記載の解析システム。
【請求項37】
前記第一および第二の生体分子の質量分析を実行する際、内部標準物質の存在下で質量分析を実行し、
前記波形処理部は、前記内部標準物質のm/zの値におけるマスクロマトグラムを受けて、前記内部標準物質に固有の波形を得るために、さらに波形分離処理を行い、
前記演算部は、前記波形処理部からの内部標準物質に固有の波形面積を算出するとともに、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を、さらに算出する、請求項31ないし36のうち何れか一項に記載の解析システム。
【請求項38】
第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータの解析システムであって、
前記第一および第二の生体分子並びに同位体標識された生体分子の質量分析を実行する質量分析装置と、
前記質量分析装置から、前記生体分子の質量分析に関するデータを受けるデータ入出部を有する制御部と、を備え、
前記制御部は、生体分子の構成成分の配列が決定された前記生体分子に対する第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記同位体標識された生体分子に対する内部標準物質のm/zの値とを決定するとともに、前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析装置にて得られた質量分析に関するデータから抽出する処理部と、
前記処理部から前記第一および第二並びに内部標準物質のm/zの値におけるマスクロマトグラムを受け、前記マスクロマトグラムを波形分離処理する波形処理部と、を備える、解析システム。
【請求項39】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項38に記載の解析システム。
【請求項40】
前記制御部は、前記波形分離処理部からの波形分離処理により得られた固有の生体分子に由来する波形の面積を算出し、前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する演算部を、さらに備える、請求項38又は39に記載の解析システム。
【請求項41】
前記制御部は、波形分離後、前記生体分子の構成成分の配列毎に分類し、前記配列を生体分子の機能情報を有するデータベースに照合し、その照合結果から、前記配列と機能とを関連付けてグループ化する情報付加部を、さらに備える、請求項38ないし40のうち何れか一項に記載の解析システム。
【請求項42】
前記制御部は、生体分子の構成成分の配列から生体分子を特定し、生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする演算部を、さらに備える、請求項38ないし41のいずれか一項に記載の解析システム。
【請求項43】
前記制御部は、生体分子の構成成分の配列を、生体分子の機能情報を有するデータベースに照合し、当該生体分子の機能情報を取得する情報付加部を、さらに備える、請求項38ないし42のいずれか一項に記載の解析システム。
【請求項44】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項31ないし43のうち何れか一項に記載の解析システム。
【請求項45】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項31ないし44のうち何れか一項に記載の解析システム。
【請求項46】
前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により、前記構成成分の配列の決定が行われる、請求項45に記載の解析システム。
【請求項47】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項31ないし46のうち何れか一項に記載の解析システム。
【請求項48】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項31ないし47のうち何れか一項に記載の解析システム。
【請求項49】
第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子の質量分析に関するデータの解析方法であって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、
前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一及び第二の生体分子のマスクロマトグラムを波形分離処理する工程と、
を含む、解析方法。
【請求項50】
前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体成分の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される、請求項49に記載の解析方法。
【請求項51】
前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、
をさらに備える、請求項49又は50に記載の解析方法。
【請求項52】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに含む、請求項49ないし51のうち何れか一項に記載の解析方法。
【請求項53】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに含む、請求項49ないし52のいずれか一項に記載の解析方法。
【請求項54】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに含む、請求項49ないし53のいずれか一項に記載の解析方法。
【請求項55】
前記第一および第二の生体分子とともに、内部標準物質のm/zの値の決定する工程と、内部標準物質のマスクロマトグラムを含むデータを抽出する工程と、前記内部標準物質のマスクロマトグラムの波形分離処理する工程と、前記内部標準物質に固有の波形の面積を算出する工程とを実行し、
(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を、算出する工程を、さらに含む、請求項49ないし54のうち何れか一項に記載の解析方法。
【請求項56】
第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質との質量分析に関するデータの解析方法であって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、
前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一および第二並びに内部標準物質の生体分子のマスクロマトグラムを波形分離処理する工程と、
を含む、解析方法。
【請求項57】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項56に記載の解析方法。
【請求項58】
前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する工程と、
をさらに備える、請求項56又は57に記載の解析方法。
【請求項59】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに含む、請求項56ないし58のうち何れか一項に記載の解析方法。
【請求項60】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに含む、請求項56ないし59のいずれか一項に記載の解析方法。
【請求項61】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに含む、請求項56ないし58のいずれか一項に記載の解析方法。
【請求項62】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pおよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項49ないし61のうち何れか一項に記載の解析方法。
【請求項63】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項49ないし62のうち何れか一項に記載の解析方法。
【請求項64】
前記構成成分の配列の決定は、MS/MS処理により得られるデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項63に記載の解析方法。
【請求項65】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項49ないし64のうち何れか一項に記載の解析方法。
【請求項66】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項49ないし65のうち何れか一項に記載の解析方法。
【請求項67】
質量分析装置において得られた、第一の生体分子と、前記第一の生体分子に対して同位体標識された第二の生体分子の質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、
前記質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、
前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一および第二の生体分子のマスクロマトグラムを波形分離処理する工程と、
を実行させるプログラム。
【請求項68】
前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行させる、請求項67に記載のプログラム。
【請求項69】
前記波形分離処理により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、
をさらに実行させる、請求項67又は68に記載のプログラム。
【請求項70】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、請求項67ないし69のうち何れか一項に記載のプログラム。
【請求項71】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに実行させる、請求項67ないし70のいずれか一項に記載のプログラム。
【請求項72】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに含む、請求項67ないし71のいずれか一項に記載のプログラム。
【請求項73】
前記質量分析装置において、前記第一および第二の生体分子とともに、内部標準物質の質量分析に関するデータを得て、
前記質量分析に関するデータから、前記内部標準物質のマスクロマトグラムを抽出するとともに、前記内部標準物質のマスクロマトグラムを波形分離処理し、
前記波形分離処理により得られた内部標準物質に固有の波形面積を算出し、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)に比を算出する工程を、さらに実行させる、請求項67ないし72のうち何れか一項に記載のプログラム。
【請求項74】
第一および第二の生体分子と、当該第一および第二の生体分子に対して同位体標識された生体分子である内部標準物質との質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、
前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一および第二並びに内部標準物質の生体分子のマスクロマトグラムを波形分離処理する工程と、
を実行させるプログラム。
【請求項75】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項74に記載のプログラム。
【請求項76】
前記波形分離処理工程により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二の波形面積の値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質の波形面積の値とから、(前記第一の波形面積)/(前記内部標準物質に固有の波形面積)の比、および/または、(前記第二の波形面積)/(前記内部標準物質に固有の波形面積)の比を算出する工程と、
をさらに実行させる、請求項74又は75に記載のプログラム。
【請求項77】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、請求項74ないし76のうち何れか一項に記載のプログラム。
【請求項78】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらにさせる、請求項74ないし77のいずれか一項に記載のプログラム。
【請求項79】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに含む、請求項74ないし78のいずれか一項に記載のプログラム。
【請求項80】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項67ないし79のうち何れか一項に記載のプログラム。
【請求項81】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項67ないし80のうち何れか一項に記載のプログラム。
【請求項82】
前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項81に記載のプログラム。
【請求項83】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項67ないし82のうち何れか一項に記載のプログラム。
【請求項84】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項67ないし83のうち何れか一項に記載のプログラム。
【請求項85】
第一および第二の生体分子に対して、同位体標識された生体分子である内部標準物質の質量分析に関するデータの解析方法であって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、
得られたデータをもとに、生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
を含む解析方法。
【請求項86】
前記決定工程の後、
前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを、前記質量分析に関するデータから抽出する工程と、
をさらに含む解析方法。
【請求項87】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項85または86に記載の解析方法。
【請求項88】
前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二のピークの値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質のピークの値とから、(前記第一のピーク)/(前記内部標準物質に固有のピーク)の比、および/または、(前記第二のピーク)/(前記内部標準物質に固有のピーク)の比を算出する工程と、
をさらに備える、請求項85ないし87のうち何れか一項に記載の解析方法。
【請求項89】
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに含む、請求項85ないし88のうち何れか一項に記載の解析方法。
【請求項90】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに含む、請求項85ないし89のいずれか一項に記載の解析方法。
【請求項91】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項85ないし90のいずれか一項に記載の解析方法。
【請求項92】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項85ないし91のうち何れか一項に記載の解析方法。
【請求項93】
前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項92に記載の解析方法。
【請求項94】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項85ないし93のうち何れか一項に記載の解析方法。
【請求項95】
前記生体分子は、タンパク質、脂質、糖鎖もしくは核酸またはこれらの組み合わせである、請求項85ないし94のうち何れか一項に記載の解析方法。
【請求項96】
質量分析装置において得られた、第一および第二の生体分子と、当該第一および第二の生体分子に対して同位体標識された生体分子である内部標準物質との質量分析に関するデータを受けるコンピュータに、前記データの解析をさせるためのプログラムであって、
質量分析装置にて測定された前記生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値と、生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する工程と、
得られたデータをもとに、生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
を実行させるプログラム。
【請求項97】
前記決定工程の後、
前記第一および第二並びに内部標準物質のm/zの値から、前記第一および第二の生体分子並びに前記内部標準物質の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを、前記質量分析に関するデータから抽出する工程と、
をさらに実行させる請求項96に記載のプログラム。
【請求項98】
前記第一および第二並びに内部標準物質のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一および第二の生体分子の第一および第二のm/zの値から、前記第一および第二の生体分子の同位体非標識の構成成分の個数と前記第一および第二の生体分子の電荷の情報に基づいて、前記内部標準物質の生体分子の内部標準物質のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記内部標準物質の生体分子の内部標準物質のm/zの値から、前記内部標準物質の生体分子の同位体標識された構成成分の個数と前記内部標準物質の生体分子の電荷の情報に基づいて、前記第一および第二の生体分子の第一および第二のm/zの値を決定することにより実行される、請求項96または97に記載のプログラム。
【請求項99】
前記第一および第二のm/zの値における固有の生体分子に由来する第一および第二のピークの値と、前記内部標準物質のm/zの値における固有の生体分子に由来する内部標準物質のピークの値とから、(前記第一のピーク)/(前記内部標準物質に固有のピーク)の比、および/または、(前記第二のピーク)/(前記内部標準物質に固有のピーク)の比を算出する工程と、
をさらに実行させる、請求項96ないし98のうち何れか一項に記載のプログラム。
【請求項100】
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、請求項96ないし99のうち何れか一項に記載のプログラム。
【請求項101】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに実行させる、請求項96ないし100のいずれか一項に記載のプログラム。
【請求項102】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項96ないし101のうち何れか一項に記載のプログラム。
【請求項103】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項96ないし102のうち何れか一項に記載のプログラム。
【請求項104】
前記構成成分の配列決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項103に記載のプログラム。
【請求項105】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項96ないし104のうち何れか一項に記載のプログラム。
【請求項106】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせであるからなる群から選択されるいずれかの分子である、請求項96ないし105のうち何れか一項に記載のプログラム。
【請求項107】
質量分析装置において得られた、サンプル中の1または複数の生体分子の質量分析に関するデータを受けるコンピュータに、前記サンプル中の1または複数の生体分子の定量をさせるためのプログラムであって、
質量分析装置にて測定された生体分子の質量分析に関するデータのうち、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値と、生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値を決定する工程と、
前記第一および第二のm/zの値から、前記第一の生体分子および前記第二の生体分子のm/zの値に対する質量分析スペクトルおよびマスクロマトグラムを含むデータを、前記質量分析に関するデータから抽出する工程と、
前記第一および第二の生体分子のマスクロマトグラムを波形分離処理する工程と、
を実行させるプログラム。
【請求項108】
前記第一および第二のm/zの値の決定は、生体分子の構成成分の配列が決定された前記第一の生体分子の第一のm/zの値から、前記第一の生体分子の同位体非標識の構成成分の個数と前記第一の生体分子の電荷の情報に基づいて、前記第二の生体分子の第二のm/zの値を決定する、または生体分子の構成成分の配列が決定された前記第二の生体分子の第二のm/zの値から、前記第二の生体分子の同位体標識された構成成分の個数と前記第二の生体分子の電荷の情報に基づいて、前記第一の生体分子の第一のm/zの値を決定することにより実行される、請求項107に記載のプログラム。
【請求項109】
前記波形分離処理により得られた固有の生体分子に由来する波形の面積を算出する工程と、
前記第一のm/zの値における固有の生体分子に由来する第一の波形面積の値と、第二のm/zの値における固有の生体分子に由来する第二の波形面積の値とから、(前記第一の波形面積)/(前記第二の波形面積)の比を算出する工程と、
をさらに実行させる、請求項107又は108に記載のプログラム。
【請求項110】
前記波形分離後、前記生体分子の構成成分の配列毎に分類する工程と、
前記配列を生体分子の機能情報を有するデータベースに照合する工程と、
前記照合結果から、前記配列と機能とを関連付けてグループ化する工程と、
をさらに実行させる、請求項107ないし109のうち何れか一項に記載のプログラム。
【請求項111】
生体分子の構成成分の配列から生体分子を特定する工程と、
生体分子を構成する各生体分子の構成成分の定量値から平均値を求めて、生体分子の代表定量値とする工程と、
をさらに実行させる、請求項107ないし110のいずれか一項に記載のプログラム。
【請求項112】
生体分子の構成成分の配列を生体分子の機能情報を有するデータベースに照合して、当該生体分子の機能情報を取得する工程と、
をさらに実行させる、請求項107ないし111のいずれか一項に記載のプログラム。
【請求項113】
前記同位体標識に用いられる同位体は、2H、13C、15N、17O、18O、33Pよび34S並びにこれらの組み合わせからなる群から選択されるいずれかの同位体である、請求項107ないし112のうち何れか一項に記載のプログラム。
【請求項114】
前記構成成分の配列の決定は、MS/MS処理により行われる、請求項107ないし113のうち何れか一項に記載のプログラム。
【請求項115】
前記構成成分の配列の決定は、MS/MS処理により得られたデータと生体分子に関するデータベースとの照合により構成成分の配列の決定が行われる、請求項114に記載のプログラム。
【請求項116】
前記生体分子は、経時的にサンプルから分離された生体分子である、請求項107ないし115のうち何れか一項に記載のプログラム。
【請求項117】
前記生体分子は、タンパク質、脂質、糖鎖および核酸並びにこれらの組み合わせからなる群から選択されるいずれかの分子である、請求項107ないし116のうち何れか一項に記載のプログラム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【公開番号】特開2010−210641(P2010−210641A)
【公開日】平成22年9月24日(2010.9.24)
【国際特許分類】
【出願番号】特願2010−122476(P2010−122476)
【出願日】平成22年5月28日(2010.5.28)
【分割の表示】特願2005−515684(P2005−515684)の分割
【原出願日】平成16年11月22日(2004.11.22)
【出願人】(506137147)エーザイ・アール・アンド・ディー・マネジメント株式会社 (215)
【出願人】(500021664)三井情報株式会社 (3)
【Fターム(参考)】
【公開日】平成22年9月24日(2010.9.24)
【国際特許分類】
【出願日】平成22年5月28日(2010.5.28)
【分割の表示】特願2005−515684(P2005−515684)の分割
【原出願日】平成16年11月22日(2004.11.22)
【出願人】(506137147)エーザイ・アール・アンド・ディー・マネジメント株式会社 (215)
【出願人】(500021664)三井情報株式会社 (3)
【Fターム(参考)】
[ Back to top ]

