吸収性骨疾患の予防・治療剤
【課題】吸収性骨疾患の予防剤または治療剤、骨形成促進剤、またはがんの骨転移抑制剤を提供する。
【解決手段】下記式(1)の化合物を有効成分とする。

上記化合物が、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科植物から選択された少なくとも1種類の植物から得られたポリフェノール抽出物である。
【解決手段】下記式(1)の化合物を有効成分とする。

上記化合物が、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科植物から選択された少なくとも1種類の植物から得られたポリフェノール抽出物である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、骨粗鬆症、歯周病、関節リウマチなどの吸収性骨疾患の予防剤または治療剤、骨形成促進剤、及びがんの骨転移抑制剤に関する。また、有効成分は、特にツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から得られるポリフェノール抽出物を主とするものに関する。
【背景技術】
【0002】
骨も新陳代謝を繰り返し、骨形成と骨吸収とのバランスの上に構造と骨量とが維持されている。しかし、加齢またはその他の原因によって、骨形成と骨吸収との間のバランスが崩れると、種々の骨疾患を発症する。例えば、骨吸収が骨形成を上回ると、骨粗鬆症、歯周病、関節リウマチ、悪性高カルシウム血症、または骨ページェット病などの骨量減少症となる。
骨粗鬆症は、骨がスカスカになって脆弱になる病気で、日常生活程度の負荷でも骨折を引き起こす。老人の骨折は寝たきりに繋がり、QOLを著しく低下させ、経済的負担も重く、その予防剤・治療剤の開発が望まれている。
歯周病は、歯肉や歯を支える歯槽骨などが破壊される病気で、歯牙を喪失する主要因となっている。成人の85%が罹患していると言われており、糖尿病や心疾患などとも関連が示唆されている。
骨吸収が骨形成を上回ることで生じる骨量減少症は、吸収性骨疾患と呼ばれ、破骨細胞が骨組織を破壊することに起因する。したがって、これらの疾患の治療・予防には骨吸収を抑制する薬剤が使われている。
骨吸収を抑制する薬剤の第一選択薬としてビスフォスフォネートが知られている。この薬剤は、破骨細胞に作用して骨吸収を強く抑制するが、骨形成細胞である骨芽細胞の増殖も同時に抑制してしまうものが存在する(非特許文献1)ため、結果として骨質を悪くするなどの問題点が指摘されている。そこで、骨吸収を抑えるとともに、骨形成を促進するような薬剤の開発が望まれている。
【0003】
また、破骨細胞はがんの骨転移にも関与することが知られている(非特許文献2〜4)。がん細胞は、破骨細胞の働きを活性化させることで骨を破壊し、そこに定着していく。骨が破壊されると、骨のなかに含まれている細胞増殖因子が放出されて、がん細胞の増殖能力が強まり、破骨細胞をさらに活性化して、転移巣を広げていく。がん細胞の骨転移は、病巣の悪化ともに強い疼痛を伴うことが多く、骨折を起こすこともあり、患者のQOLを低下させ、闘病意欲をそぐことにもなるので、積極的な治療が望まれている。実際に、がん治療では、がんの骨転移を抑制する目的でビスフォスフォネートなどの骨吸収抑制剤が使われている。
また、ポリフェノール成分の一つであるデルフィニジンについては、制がん作用が知られている(特許文献1)。しかしながら、この作用は、がん細胞の増殖抑制効果を確認したものであり、がんの骨転移抑制作用を調べたデータについては、知られていなかった。
【0004】
骨の主たる構成成分は、有機質であるコラーゲン線維と、無機質であるリン酸カルシウム塩とであり、この両者が結びつくことによって、張力および圧力に強い骨が形成される。特に、リン酸カルシウム塩は全骨重量の70%を占める。骨粗鬆症のような吸収性骨疾患においては、リン酸カルシウム塩が骨から血液中に溶出して高カルシウム血症を伴いつつ、骨からリン酸カルシウム塩が失われる。
従来には、吸収性骨疾患の予防にはカルシウムを維持する方法が、治療にはカルシウムを補う方法が採用されていた。そのための薬剤として、活性型ビタミンD3製剤、またはカルシウム製剤等が用いられてきた。また、骨からの脱灰を抑制するために、エストロゲン製剤およびカルシトニン製剤のようなホルモン剤が用いられてきた。これらの薬剤は、疼痛軽減、病状の進行防止等には効果が認められるものの、その効果は満足のいくものではなかった。このため、経口摂取が可能であり、安全性の高いものが開発されていた(特許文献2〜5)。これらのうち、特許文献2には、バラ科、ツバキ科、またはクワ科植物から抽出されたポリフェノール画分が開示されている。
しかしながら、植物には多くの科が存在しており、それら全ての科について、吸収性骨疾患に効果のあるポリフェノールが評価されているわけではない。
【特許文献1】特開2002−322055号公報
【特許文献2】特開平6−183985号公報
【特許文献3】特開平6−183958号公報
【特許文献4】特開平7−291858号公報
【特許文献5】特開平7−291857号公報
【特許文献6】特開2005−312402号公報
【非特許文献1】日本再生歯科医学会誌2巻3号182‐191(2005)
【非特許文献2】Tomoko Okada et al: Bone marrow metastatic myeloma cells promote osteoclastogenesis through RANKL on endothelial cells. Clin. Exp. Metastasis, 20, 639-646(2003)
【非特許文献3】Tomoko Okada et al: Osteoclast induction by bone marrow metastatic myeloma cells was mediated by M-CSF production from endothelial cells. Proc. 96th annual meeting of American Association for Cancer Research, 46, 1105(2005)
【非特許文献4】Tomoko Okada et al: Establishment of highly metastatic murine breast cancer cell line to bone marrow, UICC World Cancer Congress 2006, 19, 476(2006)
【非特許文献5】禹 済泰、「破骨細胞の骨吸収調節機構及び骨粗鬆症治療薬開発」、生物機能開発研究所紀要2:69−74(2002)
【非特許文献6】佐伯行彦、「関節リウマチの破骨細胞活性化亢進(とくに細胞融合による多角巨細胞化)の分子機構の解明に関する研究」、厚生労働科学研究費補助金(免疫アレルギー疾患予防・治療研究事業)関節リウマチ・骨粗鬆症患者の疫学、病態解明と治療法開発に関する研究分担研究報告書、p34−36
【非特許文献7】Patricia Collin-Osdoby et al, RANKL-Mediated Osteoclast Formation from Murine RAW 264.7 Cells, Methods in Molecular Medicine, Vol.80, p153-166
【非特許文献8】Alice Wattel et al, Flavonoid Quercetin Decreses Osteoclastic Differentiation Induced by RANKL via a Mechanism Involving NFkB and AP-1, Journal of Cellular Biochemistry, 92, 285-295 (2004)
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、上記した事情に鑑みてなされたものであり、その目的は、吸収性骨疾患の予防剤または治療剤、骨形成促進剤、及びがんの骨転移抑制剤であって、特にツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から得られるポリフェノール抽出物を有効成分とするものを提供することである。
【課題を解決するための手段】
【0006】
上述のように、骨量は骨形成と骨吸収とのバランスの上に維持されている。このうち、骨吸収は主として破骨細胞が分化誘導されることによって行われるものである。このため、破骨細胞の分化抑制効果を示す物質は、吸収性骨疾患の予防剤または治療剤として使用することができる(特許文献6、非特許文献5〜8)。この知見に基づき、本発明者は鋭意検討の結果、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から得られたポリフェノール抽出物が、吸収性骨疾患を予防または治療することを見出し、基本的には本発明を完成するに至った。
【0007】
こうして、上記目的を達成するための発明に係る吸収性骨疾患の予防及び/または治療剤は、下記化合物を含有することを特徴とする。
【化1】

但し、式(1)において、R1は、水素、水酸基、またはメトキシ基を意味し、R2は、水素、または配糖体を意味し、R3は、水素、または配糖体を意味する。なお、R2またはR3が、配糖体の場合には、糖のC1において、式(1)の化合物と結合することが好ましい。
【0008】
上記化合物には、強力な骨吸収抑制効果が認められたことから、吸収性骨疾患を予防または治療することができる。
また、本発明者らは、驚くべきことに、式(1)に示す化合物が、骨形成促進作用、及び骨吸収を抑制してがんの骨転移抑制作用を示すことを見いだした。
こうして、上記目的を達成するための発明に係る骨形成促進剤及びがんの骨転移抑制剤は、式(1)の化合物を含有することを特徴とする。
【0009】
上記発明においては、式(1)において、R1が水酸基であり、R2及びR3が水素であるデルフィニジン、R1がメトキシ基であり、R2及びR3が水素であるペチュニジン、R1が水素であり、R2及びR3が水素であるシアニジン、R1が水酸基であり、R2が配糖体であり、R3が水素または配糖体であるデルフィニジン配糖体、R1がメトキシ基であり、R2が配糖体であり、R3が水素または配糖体であるペチュニジン配糖体、R1が水素であり、R2が配糖体であり、R3が水素または配糖体であるシアニジン配糖体、から選択される一つであることであることが好ましい。
本発明においては、式(1)に示す化合物を主成分として含有する物質が体内で生じるものを含有するアントシアニンであれば、同様の効果を奏することができる。このため、式(1)のR2またはR3については、種々の配糖体が含まれる。ここで、配糖体とは、少なくとも一分子の糖(例えば、アラビノース、グルコース、またはガラクトース)を主成分とする分子を意味する。具体的には、デルフィニジンまたはペチュニジンの場合には、R2がアラビノース、グルコース、またはガラクトースのうちの一つの糖であり、R3が水素であるもの、または図1、図2に示すように、R2がグルコース・ラムノース・グルコースなどを含む配糖体であり、R3がグルコースであるもの(例えば、http://www.h.chiba-u.jp/florista/monotoricho/ando-iro/petunia-iro.htmを参照)などが含まれる。
式(1)に示すポリフェノール化合物は、デルフィニジン、デルフィニジン配糖体、ペチュニジン、ペチュニジン配糖体、シアニジン、シアニジン配糖体等として知られているが、これらの化合物が、骨吸収抑制作用を示し、骨粗鬆症等の吸収性骨疾患に有効であるとの知見は、従来には認められない。また、骨形成の促進作用、及び骨吸収の抑制作用を通じてがんの骨転移抑制に関与する知見もない。
【0010】
式(1)に示す化合物は、公知の方法により合成されたものを用いてもよく、後述のようにツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物からの天然物を用いても良い。
天然物を用いる場合は、必ずしも純品にまで精製する必要はなく、本発明の効果を損なわない範囲で、抽出物、粗精製物、種々の混合物等を用いることができる。また、上記化合物は、単独で用いても良く、その他の成分を混合したものを用いることもできる。
本発明において吸収性骨疾患とは、骨吸収の異常亢進に伴う疾患を意味しており、例えば、骨粗鬆症、歯周病、関節リウマチ、悪性高カルシウム血症、または骨ページェット病などが含まれる。
【0011】
本発明の吸収性骨疾患の予防・治療剤、及び骨形成促進剤、がんの骨転移抑制剤を製造するには、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から、常法に従ってポリフェノール抽出物を抽出する。この抽出物は、そのままで、或いは適当な加工(例えば凍結乾燥、再抽出、更なる精製、他の物質を添加して混合など)を施すことによって、投与することができる。また、式(1)の化合物を有効成分とし、常法に従って公知の医薬品用担体と組合わせて製剤化することもできる。本発明の有効成分は常法に従って種々の剤型での投与が可能である。例えば経口投与剤としては、液剤、カプセル剤、錠剤、顆粒剤、細粒剤、菓子錠剤(トローチ、飴類)、シロップ剤、ドライシロップ剤、ガム等が例示でき、非経口投与剤としては、歯磨剤、洗口剤の他、注射剤、坐薬、膣坐薬等の坐剤、経鼻投与剤、喉スプレー等の噴霧剤、塗布剤(軟膏、クリーム)、貼付剤、経皮吸収性テープ、入浴剤等の経皮吸収剤が例示できる。また、本発明の有効成分を通常の飲食物中に添加して、日常的に摂取することもできる。そのような飲食物の種類には特に制限はない。しかしながら、本発明の有効成分には特有の風味があるため、例えばドリンク剤等の飲料や、キャンディー等の甘味の強い食品に、食品本来の味を損なわない範囲、例えば0.01質量%〜10質量%の範囲で添加することが好ましい。
【0012】
本発明の有効成分を経口投与する場合には、有効成分の合計として、通常成人1日当たり0.1mg/kg〜100mg/kg、好ましくは10mg/kg〜50mg/kgを適宜に(例えば、1回〜3回)分けて投与する。本発明の有効成分を飲食物等に添加して日常的に摂取する場合には、経口投与の場合の投与量に準ずる。なお、投与量は、年齢、症状等に応じて、適宜増減することができる。
また、本発明の有効成分を非経口的に投与する場合には、有効成分の血中濃度を勘案して、経口投与の場合の1/5〜1/10程度の投与量とすることができる。つまり、有効成分の合計として、通常成人1日当たり0.01mg/kg〜10mg/kg、好ましくは1.0mg/kg〜3.0mg/kgを適宜に(例えば、1回〜3回)分けて投与する。なお、投与量は、年齢、症状等により適宜増減することができる。
本発明の有効成分には、現在のところ、特に毒性は認められない。
【0013】
本発明において、上記化合物は、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科植物から得られたポリフェノール抽出物を有効成分とすることが好ましい。
ツツジ科(Ericaceae)とは、被子植物の科のひとつであり、約100属1350種が含まれる。ツツジ科に含まれる属としては、アセビ属(Pieris)、イソツツジ属(Ledum)、イワナシ属(Epigaea)、イワナンテン属(Leucothoe)、イワヒゲ属(Cassiope)、ウラシマツツジ属(Arctous)、エリカ属(Erica)、カルーナ属(Calluna)、カルミア属(Kalmia)、シラタマノキ属(Gaultheria)、スノキ属(Vaccinium)、チシマツガザクラ属(Bryanthus)、ツガザクラ属(Phyllodoce)、ツツジ属(Rhododendron)、ドウダンツツジ属(Enkianthus)、ネジキ属(Lyonia)、ヒメシャクナゲ属(Andromeda)、ミネズオウ属(Loiseleuria)、ヤチツツジ属(Chamaedaphne)、ヨウラクツツジ属(Menziesia)などが例示される。本発明においては、いずれの属を用いることもできる。
【0014】
スグリ科(Grossulariaceae)とは、双子葉植物に属する科の一つである。スグリ科に含まれる属としては、スグリ属(Ribes)がある。本発明においては、いずれの属を用いることもできる。
ナス科(Solanaceae)とは、双子葉植物綱キク亜綱ナス目の科の一つであり、約90属を含む大きな群である。ナスやトマトなど多くの有用植物を含む。ナス科に含まれる属としては、ナス属(Solanum:ナス Solanum melongena 、ジャガイモ Solanum tuberosum 、イヌホオズキ Solanum nigrum L. 、アメリカイヌホオズキ Solanum americanum 、ペピーノ Solanum muricatum Aiton 、トマト Solanum lycopersicum(Lycopersicon esculentum) 、タマサンゴ(リュウノタマ、フユサンゴ) Solanum pseudocapsicum 、ツノナス Solanum mammosum 、ワルナスビ Solanum carolinense を含む)、トウガラシ属(Capsicum:トウガラシ(ピーマン、パプリカ)Capsicum annuum 、ロコト Capsicum pubescens 、ウルピカ Capsicum cardenasii 、アヒ・アマリージョ Capsicum baccatum 、ハバネロ Capsicum chinense 、キダチトウガラシ Capsicum frutescens を含む)、タバコ属(Nicotiana:タバコ Nicotiana spp. を含む)、チョウセンアサガオ属(Datura:チョウセンアサガオ Datura metel 、アメリカチョウセンアサガオ Datura meteloides 、シロバナヨウシュチョウセンアサガオ Datura stramonium を含む)、キダチチョウセンアサガオ属(Brugmansia:キダチチョウセンアサガオ Brugmansia suaveolens 、コダチチョウセンアサガオ Brugmansia arborea を含む)、ホオズキ属(Physalis:ホオズキ Physalis alkekengi var. franchetii 、オオブドウホオズキ(トマティージョ, Tomatillo)Physalis ixocarpa を含む)、イガホオズキ属(Physaliastrum:イガホオズキ P. japonicum を含む)、ペチュニア属(Petunia:ペチュニア、サフィニア Petunia x hybrida を含む)、ハシリドコロ属(Scopolia:ハシリドコロ Scopolia japonica を含む)、ヒヨス属(Hyoscyamus:ヒヨス Hyoscyamus niger を含む)、ベラドンナ属(Atropa:ベラドンナ Atoropa belladonna L. を含む)、マンドラゴラ属(コイナス属)(Mandragora:マンドレイク Mandragora officinarun を含む)、クコ属(Lycium:クコ Lycium rhombifolium(L. chinense)を含む)、カリブラコア属(ミリオンベル を含む)などがある。本発明においては、いずれの属を用いることもできる。
【0015】
ヒルガオ科(Convolvulaceae)とは、双子葉植物の科で、ヒルガオ、アサガオ、サツマイモなどを含む。約50属1200種からなり、熱帯・亜熱帯を中心に世界的に分布する。ヒルガオ科に含まれる属としては、ヒルガオ属(Calystegia)、セイヨウヒルガオ属(Convolvulus)、アオイゴケ属(Dichondra)、ホルトカズラ属(Erycibe)、アサガオガラクサ属(Evolvulus)、サツマイモ属(Ipomoea)、ルコウソウ属(Quamoclit)、オオバハマアサガオ属(Stictocardia)などがある。本発明においては、いずれの属を用いることもできる。
ブドウ科(Vitaceae)とは、双子葉植物の一つの科であり、ブドウ、ヤマブドウ、ノブドウ、ツタや、雑草のヤブガラシなどを含む。いずれもつる性の木本または草本で、巻きひげまたは吸盤を持ち、約15属700種が世界の熱帯から温帯に分布する。ブドウ科に含まれる属としては、アカレオスペルマ属(Acareosperma)、アムペロシスス属(Ampelocissus)、ノブドウ属(Ampelopsis:ノブドウ、カガミグサなどを含む)、ヤブガラシ属(Cayratia:ヤブガラシなどを含む)、シスス属(Cissus)、クレマチシスス属(Clematicissus)、シフォステマ属(Cyphostemma)、ノチョシスス属(Nothocissus)、ツタ属(Parthenocissus)、プテリサンセス属(Pterisanthes)、プテロシスス属(Pterocissus)、ロイシスス属(Rhoicissus)、ミツバカズラ属(Tetrastigma)、ブドウ属(Vitis:ブドウ、ヤマブドウ、エビヅルなどを含む)、ユア属(Yua)などがある。本発明においては、いずれの属を用いることもできる。
ショウガ科(Zingiberaceae)とは、単子葉植物の一つである。ショウガ科に含まれる属としては、ショウガ属(Zyngiber)ウコン属(Curcuma)、ハナミョウガ属(Alpinia)などがある。本発明においては、いずれの属を用いることもできる。
スイカズラ科(Caprifoliaceae)とは、双子葉植物に属する科の一つである。スイカズラ科に含まれる属としては、スイカズラ属(Lonicera)、ツキヌキソウ属(Triosteum)、タニウツギ属(Weigela)、ツクバネウツギ属(Abelia)、イワツクバネウツギ属(Zabelia)、ショウキウツギ属(Kolkwitzia)、リンネソウ属(Linnaea)などがある。本発明においては、いずれの属を用いることもできる。
【発明の効果】
【0016】
本発明によれば、新規な構造を持つ吸収性骨疾患の予防剤または治療剤、骨形成促進剤、及びがんの骨転移抑制剤を提供することができる。この化合物は、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科の植物から得られたポリフェノール抽出物として得ることができる。
【発明を実施するための最良の形態】
【0017】
次に、本発明の実施形態について、図表を参照しつつ説明するが、本発明の技術的範囲は、これらの実施形態によって限定されるものではなく、発明の要旨を変更することなく様々な形態で実施することができる。また、本発明の技術的範囲は、均等の範囲にまで及ぶものである。
<試験例1> 破骨細胞の分化抑制試験
破骨細胞は、造血系の幹細胞に由来し、単球・マクロファージ系の前駆細胞から分化する多核の巨細胞であり、正常な骨組織の発達・リモデリングに関与している。また、この細胞は、骨粗鬆症における骨量減少、慢性関節リウマチやにおける骨関節破壊、歯周病における歯槽骨破壊などにおいても重要な役割を果たしている。破骨細胞分化因子(receptor activator of NF-kB ligand:RANKL)は、骨芽細胞上に発現する膜結合型のサイトカインであり、TNFスーパーファミリーに属している。RANKLが、破骨細胞前駆細胞の受容体(RANK)に結合すると、破骨細胞前駆細胞が破骨細胞へと分化誘導される。破骨細胞への分化を阻害することにより、吸収性骨疾患を予防または治療できる可能性があることから、RANK-RANKLの結合を阻害するための創薬開発が行われている。
【0018】
上記点に鑑み、ツツジ科、スグリ科、ヒルガオ科、又はスイカズラ科由来の植物から得られたポリフェノール抽出物が、破骨細胞前駆細胞から破骨細胞への分化を抑制するか否かを確認するための試験を行った。
破骨細胞前駆細胞として、マウスマクロファージ細胞株RAW264.7を用いた。
【0019】
次に、上記破骨細胞前駆細胞を96ウェルプレート1ウエルあたり4,000個播種し、37℃、5日間培養した。このとき培地としてa-MEMを用い、培養液には100ng/mLのRANKLを添加した。ウエルを3群に分け、ブリーベリーアントシアニン(ツツジ科スキノ属:100μg/mL)、ムラサキ芋アントシアニン(ヒルガオ科サツマイモ属:100μg/mL)、またはアントシアニンなし(コントロール:Non-treatment)のものを用意した。ブルーベリーアントシアニンは、タマ生化学(株)より購入したブルーベリーエキスを用いた。このブルーベリーアントシアニンは、ビルベリー(bilberry:ツツジ科スキノ属)から調製されたものである。ビルベリーは、ブルーベリーの仲間である。また、ムラサキ芋アントシアニンは(独)農業・食品産業技術総合研究機構 九州沖縄農業研究センターがムラサキ芋より分離精製したものを用いた。
培養後に、各ウエル中の細胞について、酒石酸抵抗性酸性ホスファターゼ(TRAP)の活性を測定した。
【0020】
結果を図3に示した。コントロール(Non-treatment)では、破骨細胞前駆細胞が破骨細胞に分化したことを示す紫色の発色が認められ、多核化した大型の破骨細胞への分化が確認された。また、ムラサキ芋アントシアニン(ヒルガオ科サツマイモ属)については、僅かに発色を減少させる効果が認められ、大型の破骨細胞が減少した。これに比べて、ブルーベリーアントシアニン(ツツジ科スキノ属)は、紫色の発色を大幅に減少させ、多核化した破骨細胞が認められなかった。このことから、ブルーベリーアントシアニンには、破骨細胞への分化誘導を抑制する効果があることがわかった。
ブルーベリー(ツツジ科)、ムラサキ芋(ヒルガオ科)については、破骨細胞の分化抑制効果は知られていなかった。
【0021】
<試験例2> 破骨細胞の分化抑制試験
次に、ブルーベリー(ツツジ科スノキ属)、カシス(スグリ科スグリ属)、及びハスカップ(スイカズラ科スイカズラ属)から得られたアントシアニンについて、破骨細胞の分化抑制効果が認められるか否かを確認する試験を行った。
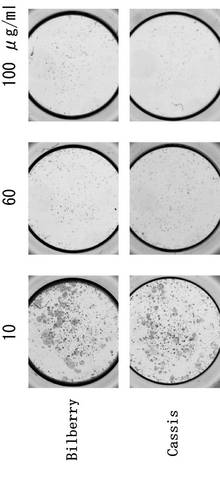
ブルーベリーアントシアニンは、試験例1と同じものを用いた。カシスアントシアニンは、タマ生化学(株)より購入したものを用いた。またハスカップアントシアニンは日本新薬(株)よりハスカップパウダーHBを購入して試験に供した。
試験例1と同様の試験系において、ブリーベリーアントシアニン、カシスアントシアニン、及びハスカップアントシアニンのそれぞれについて、10μg/mL、60μg/mL、及び100μg/mLの3種類の濃度を用意した。
【0022】
結果を図4及び図5に示した。ブルーベリー及びカシスのアントシアニンについては、強力な破骨細胞の分化抑制効果が認められた。特に、60μg/mL以上の濃度では、破骨細胞の分化抑制はほぼ完全に抑制された。また、ハスカップのアントシアニンについては、ブルーベリーとカシス程には強くないものの、破骨細胞の分化抑制効果が認められた。
ブルーベリー(ツツジ科)、カシス(スグリ科)、及びハスカップ(スイカズラ科)については、破骨細胞の分化抑制効果は知られていなかった。
【0023】
<試験例3> 破骨細胞の分化抑制効果を示すアントシアニンの同定
次に、ブルーベリーまたはカシスに含まれるアントシアニンのそれぞれについて、破骨細胞の分化抑制効果の有無を評価する試験を行った。ブルーベリーには、シアニジン誘導体(式(1)において、R1が水素であり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)、デルフィニジン誘導体(式(1)において、R1が水酸基であり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)、マルビジン誘導体(式(1)において、R1がメトキシ基であり、R1に対してメタ位の水酸基がメトキシ基に代わり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)、ペオニジン誘導体(式(1)において、R1がメトキシ基であり、R1に対してメタ位の水酸基が水素に代わり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)、及びペチュニジン誘導体(式(1)において、R1がメトキシ基であり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)の5種類のアントシアニンが含まれている。また、カシスには、上記5種類のうちデルフィニジン誘導体とシアニジン誘導体が含まれている。そこで、上記5種類のアントシアニンのそれぞれについて、破骨細胞の分化抑制効果を調べた。
【0024】
試験例1と同様の試験系において、シアニジン誘導体としてシアニジン(ChromaDex社製)、デルフィニジン誘導体としてデルフィニジン(ChromaDex社製)、マルビジン誘導体としてマルビジン(ChromaDex社製)、ペオニジン誘導体としてペオニジン(ChromaDex社製)、ペチュニジン誘導体としてペチュニジン(ChromaDex社製)のそれぞれについて、10μg/mL、20μg/mL、30μg/mL、及び40μg/mLの4種類の濃度を用意した。
【0025】
結果を図6及び図7に示した。デルフィニジンでは10μg/mL以上の濃度において、ペチュニジンでは20μg/mL以上の濃度において、シアニジンでは40μg/mL以上の濃度において、それぞれ破骨細胞の分化抑制効果が認められた。
なお、図には示さないが、賦形剤として供試物中に含まれるデキストリンには、破骨細胞の分化抑制効果は認められなかった。
【0026】
<試験例4> ペチュニジンが有する破骨細胞の分化抑制効果に関する検討
次に、ペチュニジンが有する破骨細胞の分化抑制効果をペオニジンと比較した。試験例1と同様の試験系において、ペオニジン(ChromaDex社製)、またはペチュニジン(ChromaDex社製)を10μg/mL含有する培地中で破骨細胞の分化抑制効果を調べた。
結果を図8及び図9に示した。破骨細胞の分化抑制率(1−(薬物添加時の破骨細胞数/コントロールの破骨細胞数))は、ペオニジンでは、16%(コントロールに比して16%増加)であったのに対し、ペチュニジンでは、86%(コントロールに比して14%)であった。
【0027】
<試験例5> クロマニンが有する破骨細胞の分化抑制効果に関する検討
次に、クロマニン(シアニジン配糖体:C3G)が有する破骨細胞の分化抑制効果を検討した。クロマニンは、九州沖縄農業研究センターより提供されたものを用いた。試験例1と同様の試験系において、クロマニン誘導体としてクロマニンを、0.25μg/mL、0.5μg/mL、1μg/mL、2.5μg/mL、5μg/mL、10μg/mL、20μg/mL、及び30μg/mLの濃度で用意した。
結果を図10に示した。シアニジンは図6に示したように40μg/mL以上の濃度において破骨細胞の分化抑制効果が認められたが、その配糖体であるクロマニンはさらに強く、0.25μg/mL以上の濃度において破骨細胞の分化抑制効果が認められた。
【0028】
試験例1〜5の結果から、ツツジ科のブルーベリー(ビルベリー)、スグリ科のカシス、及びスイカズラ科のハスカップ、ヒルガオ科のムラサキ芋に含まれるアントシアニンに強力な破骨細胞の分化抑制効果があること示唆され、これらはデルフィニジン、ペチュニジン、シアニジンを基本骨格とするアントシアニンによるものであることが明らかとなり、特にデルフィニジン、ペチュニジンに強い作用を示すことがわかった。
【0029】
従来より、バラ科、ツバキ科、またはクワ科植物から抽出されたポリフェノール抽出物には、吸収性骨疾患に有用な効果があることが知られている(特許文献2)。また、この作用本体は、3,4,5−トリヒドロキシフェニル基を有する化合物であることが知られている(特許文献3)。上記文献の試験系は、PTHrp(1-34)により惹起された培養新生マウス仔頭蓋冠からのカルシウムおよび無機リン遊離を抑制する効果を確認するものであり、実際の破骨細胞の分化抑制を確認したものではない。また、本発明者の検討によれば、3,4,5−トリヒドロキシフェニル基を有するエピガロカテキンには、破骨細胞の分化抑制効果は認められなかった(データは示さない)。
一方、本願では、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科植物から得られたポリフェノール抽出物が、破骨細胞の分化抑制効果を有すること、及びその作用本体が、デルフィニジン、ペチュニジンであることを見出した。本願の化合物は、3位及び4位にヒドロキシ基を有し、5位にヒドロキシ基またはメトキシ基を有しているもの(デルフィニジン、及びペチュニジン)であるか、3位及び4位にヒドロキシ基を有するものである。これらの知見は、従来には知られていなかった。
【0030】
<試験例6> デルフィニジン及びペチュニジンが有する骨形成促進効果に関する検討
次に、デルフィニジン及びペチュニジンが有する骨形成促進効果を検討した。デルフィニジン及びペチュニジンは、ChromaDex社のものを用いた。
マウス(C57BL/6系マウス、5週齢・雌、3匹/群)に、5mg/kgまたは10mg/kgのデルフィニジンまたはペチュニジンを1日1回、経口投与した。投与開始から3日目に、RANKLを腹腔投与(500μg/kg×2回)し、骨吸収を誘発し、骨粗鬆症モデルマウスとした。
その後、11日間に渡って、5mg/kgまたは10mg/kgのデルフィニジンまたはペチュニジンを経口投与した後、屠殺した。屠殺後のマウスから骨組織を採取し、骨密度及び骨芽細胞数を測定した。コントロールとして、何の薬剤も投与していないマウスを用いた。
【0031】
結果を図11及び図12に示した。RANKLを投与した骨粗鬆症モデルマウスでは、コントロールに比べると、骨芽細胞数(N.Ob/BS)は約55%に、新生骨量(OV/TV)は約26%に減少した。
一方、デルフィニジンを投与した骨粗鬆症モデルマウスでは、コントロールに比べると、骨芽細胞数は約115%に、新生骨量は約118%に上昇した。これらの値は、RANKLを投与した骨粗鬆症モデルマウスに比べると、それぞれ約210%、及び約449%であった。
また、ペチュニジンを投与した骨粗鬆症モデルマウスでは、コントロールに比べると、骨芽細胞数は約129%に、新生骨量は約115%に上昇した。これらの値は、RANKLを投与した骨粗鬆症モデルマウスに比べると、それぞれ約236%、及び約435%であった。
【0032】
このように、デルフィニジン及びペチュニジンを投与した骨粗鬆症モデルマウスでは、骨芽細胞数及び新生骨量が、コントロール値を上回り、骨形成が活発に行われることが明らかとなった。また、本実施形態の物質は、骨吸収を抑制することから、がんの骨転移抑制剤としても用いることができる。
このように本実施形態によれば、吸収性骨疾患の予防剤または治療剤、骨形成促進剤、及びがんの骨転移抑制剤であって、特にツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から得られるポリフェノール抽出物を有効成分とするものを提供できた。
【図面の簡単な説明】
【0033】
【図1】デルフィニジン配糖体の構造式である。
【図2】ペチュニジン配糖体の構造式である。
【図3】ムラサキ芋アントシアニンとブルーベリーアントシアニンの破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図4】ブルーベリーとカシスから抽出したポリフェノール抽出物の破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図5】ハスカップから抽出したポリフェノール抽出物の破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図6】ブルーベリーに含まれるアントシアニンの破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図7】ブルーベリーに含まれるアントシアニンの破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図8】ペチュニジンが有する破骨細胞の分化抑制効果を確認する試験結果を示すグラフである。
【図9】ペチュニジンが有する破骨細胞の分化抑制効果を確認する試験結果を示すグラフである。
【図10】クロマニンが有する破骨細胞の分化抑制効果を確認する試験結果を示すグラフである。
【図11】RANKLを投与した骨粗鬆症モデルマウスにデルフィニジンを投与したときの骨芽細胞数(N.Ob/BS)及び新生骨量(OV/TV)を測定した結果を示すグラフである。(A)は骨芽細胞数を、(B)は新生骨量を示す。データは、左からコントロール群、RANKL投与モデルマウス群、及びデルフィニジン投与群を示している。また、データは、平均値±S.D.(n=3)で示した。
【図12】RANKLを投与した骨粗鬆症モデルマウスにペチュニジンを投与したときの骨芽細胞数(N.Ob/BS)及び新生骨量(OV/TV)を測定した結果を示すグラフである。(A)は骨芽細胞数を、(B)は新生骨量を示す。データは、左からコントロール群、RANKL投与モデルマウス群、及びペチュニジン投与群を示している。また、データは、平均値±S.D.(n=3)で示した。
【技術分野】
【0001】
本発明は、骨粗鬆症、歯周病、関節リウマチなどの吸収性骨疾患の予防剤または治療剤、骨形成促進剤、及びがんの骨転移抑制剤に関する。また、有効成分は、特にツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から得られるポリフェノール抽出物を主とするものに関する。
【背景技術】
【0002】
骨も新陳代謝を繰り返し、骨形成と骨吸収とのバランスの上に構造と骨量とが維持されている。しかし、加齢またはその他の原因によって、骨形成と骨吸収との間のバランスが崩れると、種々の骨疾患を発症する。例えば、骨吸収が骨形成を上回ると、骨粗鬆症、歯周病、関節リウマチ、悪性高カルシウム血症、または骨ページェット病などの骨量減少症となる。
骨粗鬆症は、骨がスカスカになって脆弱になる病気で、日常生活程度の負荷でも骨折を引き起こす。老人の骨折は寝たきりに繋がり、QOLを著しく低下させ、経済的負担も重く、その予防剤・治療剤の開発が望まれている。
歯周病は、歯肉や歯を支える歯槽骨などが破壊される病気で、歯牙を喪失する主要因となっている。成人の85%が罹患していると言われており、糖尿病や心疾患などとも関連が示唆されている。
骨吸収が骨形成を上回ることで生じる骨量減少症は、吸収性骨疾患と呼ばれ、破骨細胞が骨組織を破壊することに起因する。したがって、これらの疾患の治療・予防には骨吸収を抑制する薬剤が使われている。
骨吸収を抑制する薬剤の第一選択薬としてビスフォスフォネートが知られている。この薬剤は、破骨細胞に作用して骨吸収を強く抑制するが、骨形成細胞である骨芽細胞の増殖も同時に抑制してしまうものが存在する(非特許文献1)ため、結果として骨質を悪くするなどの問題点が指摘されている。そこで、骨吸収を抑えるとともに、骨形成を促進するような薬剤の開発が望まれている。
【0003】
また、破骨細胞はがんの骨転移にも関与することが知られている(非特許文献2〜4)。がん細胞は、破骨細胞の働きを活性化させることで骨を破壊し、そこに定着していく。骨が破壊されると、骨のなかに含まれている細胞増殖因子が放出されて、がん細胞の増殖能力が強まり、破骨細胞をさらに活性化して、転移巣を広げていく。がん細胞の骨転移は、病巣の悪化ともに強い疼痛を伴うことが多く、骨折を起こすこともあり、患者のQOLを低下させ、闘病意欲をそぐことにもなるので、積極的な治療が望まれている。実際に、がん治療では、がんの骨転移を抑制する目的でビスフォスフォネートなどの骨吸収抑制剤が使われている。
また、ポリフェノール成分の一つであるデルフィニジンについては、制がん作用が知られている(特許文献1)。しかしながら、この作用は、がん細胞の増殖抑制効果を確認したものであり、がんの骨転移抑制作用を調べたデータについては、知られていなかった。
【0004】
骨の主たる構成成分は、有機質であるコラーゲン線維と、無機質であるリン酸カルシウム塩とであり、この両者が結びつくことによって、張力および圧力に強い骨が形成される。特に、リン酸カルシウム塩は全骨重量の70%を占める。骨粗鬆症のような吸収性骨疾患においては、リン酸カルシウム塩が骨から血液中に溶出して高カルシウム血症を伴いつつ、骨からリン酸カルシウム塩が失われる。
従来には、吸収性骨疾患の予防にはカルシウムを維持する方法が、治療にはカルシウムを補う方法が採用されていた。そのための薬剤として、活性型ビタミンD3製剤、またはカルシウム製剤等が用いられてきた。また、骨からの脱灰を抑制するために、エストロゲン製剤およびカルシトニン製剤のようなホルモン剤が用いられてきた。これらの薬剤は、疼痛軽減、病状の進行防止等には効果が認められるものの、その効果は満足のいくものではなかった。このため、経口摂取が可能であり、安全性の高いものが開発されていた(特許文献2〜5)。これらのうち、特許文献2には、バラ科、ツバキ科、またはクワ科植物から抽出されたポリフェノール画分が開示されている。
しかしながら、植物には多くの科が存在しており、それら全ての科について、吸収性骨疾患に効果のあるポリフェノールが評価されているわけではない。
【特許文献1】特開2002−322055号公報
【特許文献2】特開平6−183985号公報
【特許文献3】特開平6−183958号公報
【特許文献4】特開平7−291858号公報
【特許文献5】特開平7−291857号公報
【特許文献6】特開2005−312402号公報
【非特許文献1】日本再生歯科医学会誌2巻3号182‐191(2005)
【非特許文献2】Tomoko Okada et al: Bone marrow metastatic myeloma cells promote osteoclastogenesis through RANKL on endothelial cells. Clin. Exp. Metastasis, 20, 639-646(2003)
【非特許文献3】Tomoko Okada et al: Osteoclast induction by bone marrow metastatic myeloma cells was mediated by M-CSF production from endothelial cells. Proc. 96th annual meeting of American Association for Cancer Research, 46, 1105(2005)
【非特許文献4】Tomoko Okada et al: Establishment of highly metastatic murine breast cancer cell line to bone marrow, UICC World Cancer Congress 2006, 19, 476(2006)
【非特許文献5】禹 済泰、「破骨細胞の骨吸収調節機構及び骨粗鬆症治療薬開発」、生物機能開発研究所紀要2:69−74(2002)
【非特許文献6】佐伯行彦、「関節リウマチの破骨細胞活性化亢進(とくに細胞融合による多角巨細胞化)の分子機構の解明に関する研究」、厚生労働科学研究費補助金(免疫アレルギー疾患予防・治療研究事業)関節リウマチ・骨粗鬆症患者の疫学、病態解明と治療法開発に関する研究分担研究報告書、p34−36
【非特許文献7】Patricia Collin-Osdoby et al, RANKL-Mediated Osteoclast Formation from Murine RAW 264.7 Cells, Methods in Molecular Medicine, Vol.80, p153-166
【非特許文献8】Alice Wattel et al, Flavonoid Quercetin Decreses Osteoclastic Differentiation Induced by RANKL via a Mechanism Involving NFkB and AP-1, Journal of Cellular Biochemistry, 92, 285-295 (2004)
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、上記した事情に鑑みてなされたものであり、その目的は、吸収性骨疾患の予防剤または治療剤、骨形成促進剤、及びがんの骨転移抑制剤であって、特にツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から得られるポリフェノール抽出物を有効成分とするものを提供することである。
【課題を解決するための手段】
【0006】
上述のように、骨量は骨形成と骨吸収とのバランスの上に維持されている。このうち、骨吸収は主として破骨細胞が分化誘導されることによって行われるものである。このため、破骨細胞の分化抑制効果を示す物質は、吸収性骨疾患の予防剤または治療剤として使用することができる(特許文献6、非特許文献5〜8)。この知見に基づき、本発明者は鋭意検討の結果、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から得られたポリフェノール抽出物が、吸収性骨疾患を予防または治療することを見出し、基本的には本発明を完成するに至った。
【0007】
こうして、上記目的を達成するための発明に係る吸収性骨疾患の予防及び/または治療剤は、下記化合物を含有することを特徴とする。
【化1】

但し、式(1)において、R1は、水素、水酸基、またはメトキシ基を意味し、R2は、水素、または配糖体を意味し、R3は、水素、または配糖体を意味する。なお、R2またはR3が、配糖体の場合には、糖のC1において、式(1)の化合物と結合することが好ましい。
【0008】
上記化合物には、強力な骨吸収抑制効果が認められたことから、吸収性骨疾患を予防または治療することができる。
また、本発明者らは、驚くべきことに、式(1)に示す化合物が、骨形成促進作用、及び骨吸収を抑制してがんの骨転移抑制作用を示すことを見いだした。
こうして、上記目的を達成するための発明に係る骨形成促進剤及びがんの骨転移抑制剤は、式(1)の化合物を含有することを特徴とする。
【0009】
上記発明においては、式(1)において、R1が水酸基であり、R2及びR3が水素であるデルフィニジン、R1がメトキシ基であり、R2及びR3が水素であるペチュニジン、R1が水素であり、R2及びR3が水素であるシアニジン、R1が水酸基であり、R2が配糖体であり、R3が水素または配糖体であるデルフィニジン配糖体、R1がメトキシ基であり、R2が配糖体であり、R3が水素または配糖体であるペチュニジン配糖体、R1が水素であり、R2が配糖体であり、R3が水素または配糖体であるシアニジン配糖体、から選択される一つであることであることが好ましい。
本発明においては、式(1)に示す化合物を主成分として含有する物質が体内で生じるものを含有するアントシアニンであれば、同様の効果を奏することができる。このため、式(1)のR2またはR3については、種々の配糖体が含まれる。ここで、配糖体とは、少なくとも一分子の糖(例えば、アラビノース、グルコース、またはガラクトース)を主成分とする分子を意味する。具体的には、デルフィニジンまたはペチュニジンの場合には、R2がアラビノース、グルコース、またはガラクトースのうちの一つの糖であり、R3が水素であるもの、または図1、図2に示すように、R2がグルコース・ラムノース・グルコースなどを含む配糖体であり、R3がグルコースであるもの(例えば、http://www.h.chiba-u.jp/florista/monotoricho/ando-iro/petunia-iro.htmを参照)などが含まれる。
式(1)に示すポリフェノール化合物は、デルフィニジン、デルフィニジン配糖体、ペチュニジン、ペチュニジン配糖体、シアニジン、シアニジン配糖体等として知られているが、これらの化合物が、骨吸収抑制作用を示し、骨粗鬆症等の吸収性骨疾患に有効であるとの知見は、従来には認められない。また、骨形成の促進作用、及び骨吸収の抑制作用を通じてがんの骨転移抑制に関与する知見もない。
【0010】
式(1)に示す化合物は、公知の方法により合成されたものを用いてもよく、後述のようにツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物からの天然物を用いても良い。
天然物を用いる場合は、必ずしも純品にまで精製する必要はなく、本発明の効果を損なわない範囲で、抽出物、粗精製物、種々の混合物等を用いることができる。また、上記化合物は、単独で用いても良く、その他の成分を混合したものを用いることもできる。
本発明において吸収性骨疾患とは、骨吸収の異常亢進に伴う疾患を意味しており、例えば、骨粗鬆症、歯周病、関節リウマチ、悪性高カルシウム血症、または骨ページェット病などが含まれる。
【0011】
本発明の吸収性骨疾患の予防・治療剤、及び骨形成促進剤、がんの骨転移抑制剤を製造するには、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から、常法に従ってポリフェノール抽出物を抽出する。この抽出物は、そのままで、或いは適当な加工(例えば凍結乾燥、再抽出、更なる精製、他の物質を添加して混合など)を施すことによって、投与することができる。また、式(1)の化合物を有効成分とし、常法に従って公知の医薬品用担体と組合わせて製剤化することもできる。本発明の有効成分は常法に従って種々の剤型での投与が可能である。例えば経口投与剤としては、液剤、カプセル剤、錠剤、顆粒剤、細粒剤、菓子錠剤(トローチ、飴類)、シロップ剤、ドライシロップ剤、ガム等が例示でき、非経口投与剤としては、歯磨剤、洗口剤の他、注射剤、坐薬、膣坐薬等の坐剤、経鼻投与剤、喉スプレー等の噴霧剤、塗布剤(軟膏、クリーム)、貼付剤、経皮吸収性テープ、入浴剤等の経皮吸収剤が例示できる。また、本発明の有効成分を通常の飲食物中に添加して、日常的に摂取することもできる。そのような飲食物の種類には特に制限はない。しかしながら、本発明の有効成分には特有の風味があるため、例えばドリンク剤等の飲料や、キャンディー等の甘味の強い食品に、食品本来の味を損なわない範囲、例えば0.01質量%〜10質量%の範囲で添加することが好ましい。
【0012】
本発明の有効成分を経口投与する場合には、有効成分の合計として、通常成人1日当たり0.1mg/kg〜100mg/kg、好ましくは10mg/kg〜50mg/kgを適宜に(例えば、1回〜3回)分けて投与する。本発明の有効成分を飲食物等に添加して日常的に摂取する場合には、経口投与の場合の投与量に準ずる。なお、投与量は、年齢、症状等に応じて、適宜増減することができる。
また、本発明の有効成分を非経口的に投与する場合には、有効成分の血中濃度を勘案して、経口投与の場合の1/5〜1/10程度の投与量とすることができる。つまり、有効成分の合計として、通常成人1日当たり0.01mg/kg〜10mg/kg、好ましくは1.0mg/kg〜3.0mg/kgを適宜に(例えば、1回〜3回)分けて投与する。なお、投与量は、年齢、症状等により適宜増減することができる。
本発明の有効成分には、現在のところ、特に毒性は認められない。
【0013】
本発明において、上記化合物は、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科植物から得られたポリフェノール抽出物を有効成分とすることが好ましい。
ツツジ科(Ericaceae)とは、被子植物の科のひとつであり、約100属1350種が含まれる。ツツジ科に含まれる属としては、アセビ属(Pieris)、イソツツジ属(Ledum)、イワナシ属(Epigaea)、イワナンテン属(Leucothoe)、イワヒゲ属(Cassiope)、ウラシマツツジ属(Arctous)、エリカ属(Erica)、カルーナ属(Calluna)、カルミア属(Kalmia)、シラタマノキ属(Gaultheria)、スノキ属(Vaccinium)、チシマツガザクラ属(Bryanthus)、ツガザクラ属(Phyllodoce)、ツツジ属(Rhododendron)、ドウダンツツジ属(Enkianthus)、ネジキ属(Lyonia)、ヒメシャクナゲ属(Andromeda)、ミネズオウ属(Loiseleuria)、ヤチツツジ属(Chamaedaphne)、ヨウラクツツジ属(Menziesia)などが例示される。本発明においては、いずれの属を用いることもできる。
【0014】
スグリ科(Grossulariaceae)とは、双子葉植物に属する科の一つである。スグリ科に含まれる属としては、スグリ属(Ribes)がある。本発明においては、いずれの属を用いることもできる。
ナス科(Solanaceae)とは、双子葉植物綱キク亜綱ナス目の科の一つであり、約90属を含む大きな群である。ナスやトマトなど多くの有用植物を含む。ナス科に含まれる属としては、ナス属(Solanum:ナス Solanum melongena 、ジャガイモ Solanum tuberosum 、イヌホオズキ Solanum nigrum L. 、アメリカイヌホオズキ Solanum americanum 、ペピーノ Solanum muricatum Aiton 、トマト Solanum lycopersicum(Lycopersicon esculentum) 、タマサンゴ(リュウノタマ、フユサンゴ) Solanum pseudocapsicum 、ツノナス Solanum mammosum 、ワルナスビ Solanum carolinense を含む)、トウガラシ属(Capsicum:トウガラシ(ピーマン、パプリカ)Capsicum annuum 、ロコト Capsicum pubescens 、ウルピカ Capsicum cardenasii 、アヒ・アマリージョ Capsicum baccatum 、ハバネロ Capsicum chinense 、キダチトウガラシ Capsicum frutescens を含む)、タバコ属(Nicotiana:タバコ Nicotiana spp. を含む)、チョウセンアサガオ属(Datura:チョウセンアサガオ Datura metel 、アメリカチョウセンアサガオ Datura meteloides 、シロバナヨウシュチョウセンアサガオ Datura stramonium を含む)、キダチチョウセンアサガオ属(Brugmansia:キダチチョウセンアサガオ Brugmansia suaveolens 、コダチチョウセンアサガオ Brugmansia arborea を含む)、ホオズキ属(Physalis:ホオズキ Physalis alkekengi var. franchetii 、オオブドウホオズキ(トマティージョ, Tomatillo)Physalis ixocarpa を含む)、イガホオズキ属(Physaliastrum:イガホオズキ P. japonicum を含む)、ペチュニア属(Petunia:ペチュニア、サフィニア Petunia x hybrida を含む)、ハシリドコロ属(Scopolia:ハシリドコロ Scopolia japonica を含む)、ヒヨス属(Hyoscyamus:ヒヨス Hyoscyamus niger を含む)、ベラドンナ属(Atropa:ベラドンナ Atoropa belladonna L. を含む)、マンドラゴラ属(コイナス属)(Mandragora:マンドレイク Mandragora officinarun を含む)、クコ属(Lycium:クコ Lycium rhombifolium(L. chinense)を含む)、カリブラコア属(ミリオンベル を含む)などがある。本発明においては、いずれの属を用いることもできる。
【0015】
ヒルガオ科(Convolvulaceae)とは、双子葉植物の科で、ヒルガオ、アサガオ、サツマイモなどを含む。約50属1200種からなり、熱帯・亜熱帯を中心に世界的に分布する。ヒルガオ科に含まれる属としては、ヒルガオ属(Calystegia)、セイヨウヒルガオ属(Convolvulus)、アオイゴケ属(Dichondra)、ホルトカズラ属(Erycibe)、アサガオガラクサ属(Evolvulus)、サツマイモ属(Ipomoea)、ルコウソウ属(Quamoclit)、オオバハマアサガオ属(Stictocardia)などがある。本発明においては、いずれの属を用いることもできる。
ブドウ科(Vitaceae)とは、双子葉植物の一つの科であり、ブドウ、ヤマブドウ、ノブドウ、ツタや、雑草のヤブガラシなどを含む。いずれもつる性の木本または草本で、巻きひげまたは吸盤を持ち、約15属700種が世界の熱帯から温帯に分布する。ブドウ科に含まれる属としては、アカレオスペルマ属(Acareosperma)、アムペロシスス属(Ampelocissus)、ノブドウ属(Ampelopsis:ノブドウ、カガミグサなどを含む)、ヤブガラシ属(Cayratia:ヤブガラシなどを含む)、シスス属(Cissus)、クレマチシスス属(Clematicissus)、シフォステマ属(Cyphostemma)、ノチョシスス属(Nothocissus)、ツタ属(Parthenocissus)、プテリサンセス属(Pterisanthes)、プテロシスス属(Pterocissus)、ロイシスス属(Rhoicissus)、ミツバカズラ属(Tetrastigma)、ブドウ属(Vitis:ブドウ、ヤマブドウ、エビヅルなどを含む)、ユア属(Yua)などがある。本発明においては、いずれの属を用いることもできる。
ショウガ科(Zingiberaceae)とは、単子葉植物の一つである。ショウガ科に含まれる属としては、ショウガ属(Zyngiber)ウコン属(Curcuma)、ハナミョウガ属(Alpinia)などがある。本発明においては、いずれの属を用いることもできる。
スイカズラ科(Caprifoliaceae)とは、双子葉植物に属する科の一つである。スイカズラ科に含まれる属としては、スイカズラ属(Lonicera)、ツキヌキソウ属(Triosteum)、タニウツギ属(Weigela)、ツクバネウツギ属(Abelia)、イワツクバネウツギ属(Zabelia)、ショウキウツギ属(Kolkwitzia)、リンネソウ属(Linnaea)などがある。本発明においては、いずれの属を用いることもできる。
【発明の効果】
【0016】
本発明によれば、新規な構造を持つ吸収性骨疾患の予防剤または治療剤、骨形成促進剤、及びがんの骨転移抑制剤を提供することができる。この化合物は、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科の植物から得られたポリフェノール抽出物として得ることができる。
【発明を実施するための最良の形態】
【0017】
次に、本発明の実施形態について、図表を参照しつつ説明するが、本発明の技術的範囲は、これらの実施形態によって限定されるものではなく、発明の要旨を変更することなく様々な形態で実施することができる。また、本発明の技術的範囲は、均等の範囲にまで及ぶものである。
<試験例1> 破骨細胞の分化抑制試験
破骨細胞は、造血系の幹細胞に由来し、単球・マクロファージ系の前駆細胞から分化する多核の巨細胞であり、正常な骨組織の発達・リモデリングに関与している。また、この細胞は、骨粗鬆症における骨量減少、慢性関節リウマチやにおける骨関節破壊、歯周病における歯槽骨破壊などにおいても重要な役割を果たしている。破骨細胞分化因子(receptor activator of NF-kB ligand:RANKL)は、骨芽細胞上に発現する膜結合型のサイトカインであり、TNFスーパーファミリーに属している。RANKLが、破骨細胞前駆細胞の受容体(RANK)に結合すると、破骨細胞前駆細胞が破骨細胞へと分化誘導される。破骨細胞への分化を阻害することにより、吸収性骨疾患を予防または治療できる可能性があることから、RANK-RANKLの結合を阻害するための創薬開発が行われている。
【0018】
上記点に鑑み、ツツジ科、スグリ科、ヒルガオ科、又はスイカズラ科由来の植物から得られたポリフェノール抽出物が、破骨細胞前駆細胞から破骨細胞への分化を抑制するか否かを確認するための試験を行った。
破骨細胞前駆細胞として、マウスマクロファージ細胞株RAW264.7を用いた。
【0019】
次に、上記破骨細胞前駆細胞を96ウェルプレート1ウエルあたり4,000個播種し、37℃、5日間培養した。このとき培地としてa-MEMを用い、培養液には100ng/mLのRANKLを添加した。ウエルを3群に分け、ブリーベリーアントシアニン(ツツジ科スキノ属:100μg/mL)、ムラサキ芋アントシアニン(ヒルガオ科サツマイモ属:100μg/mL)、またはアントシアニンなし(コントロール:Non-treatment)のものを用意した。ブルーベリーアントシアニンは、タマ生化学(株)より購入したブルーベリーエキスを用いた。このブルーベリーアントシアニンは、ビルベリー(bilberry:ツツジ科スキノ属)から調製されたものである。ビルベリーは、ブルーベリーの仲間である。また、ムラサキ芋アントシアニンは(独)農業・食品産業技術総合研究機構 九州沖縄農業研究センターがムラサキ芋より分離精製したものを用いた。
培養後に、各ウエル中の細胞について、酒石酸抵抗性酸性ホスファターゼ(TRAP)の活性を測定した。
【0020】
結果を図3に示した。コントロール(Non-treatment)では、破骨細胞前駆細胞が破骨細胞に分化したことを示す紫色の発色が認められ、多核化した大型の破骨細胞への分化が確認された。また、ムラサキ芋アントシアニン(ヒルガオ科サツマイモ属)については、僅かに発色を減少させる効果が認められ、大型の破骨細胞が減少した。これに比べて、ブルーベリーアントシアニン(ツツジ科スキノ属)は、紫色の発色を大幅に減少させ、多核化した破骨細胞が認められなかった。このことから、ブルーベリーアントシアニンには、破骨細胞への分化誘導を抑制する効果があることがわかった。
ブルーベリー(ツツジ科)、ムラサキ芋(ヒルガオ科)については、破骨細胞の分化抑制効果は知られていなかった。
【0021】
<試験例2> 破骨細胞の分化抑制試験
次に、ブルーベリー(ツツジ科スノキ属)、カシス(スグリ科スグリ属)、及びハスカップ(スイカズラ科スイカズラ属)から得られたアントシアニンについて、破骨細胞の分化抑制効果が認められるか否かを確認する試験を行った。
ブルーベリーアントシアニンは、試験例1と同じものを用いた。カシスアントシアニンは、タマ生化学(株)より購入したものを用いた。またハスカップアントシアニンは日本新薬(株)よりハスカップパウダーHBを購入して試験に供した。
試験例1と同様の試験系において、ブリーベリーアントシアニン、カシスアントシアニン、及びハスカップアントシアニンのそれぞれについて、10μg/mL、60μg/mL、及び100μg/mLの3種類の濃度を用意した。
【0022】
結果を図4及び図5に示した。ブルーベリー及びカシスのアントシアニンについては、強力な破骨細胞の分化抑制効果が認められた。特に、60μg/mL以上の濃度では、破骨細胞の分化抑制はほぼ完全に抑制された。また、ハスカップのアントシアニンについては、ブルーベリーとカシス程には強くないものの、破骨細胞の分化抑制効果が認められた。
ブルーベリー(ツツジ科)、カシス(スグリ科)、及びハスカップ(スイカズラ科)については、破骨細胞の分化抑制効果は知られていなかった。
【0023】
<試験例3> 破骨細胞の分化抑制効果を示すアントシアニンの同定
次に、ブルーベリーまたはカシスに含まれるアントシアニンのそれぞれについて、破骨細胞の分化抑制効果の有無を評価する試験を行った。ブルーベリーには、シアニジン誘導体(式(1)において、R1が水素であり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)、デルフィニジン誘導体(式(1)において、R1が水酸基であり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)、マルビジン誘導体(式(1)において、R1がメトキシ基であり、R1に対してメタ位の水酸基がメトキシ基に代わり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)、ペオニジン誘導体(式(1)において、R1がメトキシ基であり、R1に対してメタ位の水酸基が水素に代わり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)、及びペチュニジン誘導体(式(1)において、R1がメトキシ基であり、R2が水素あるいは配糖体、R3が水素あるいは配糖体であるもの)の5種類のアントシアニンが含まれている。また、カシスには、上記5種類のうちデルフィニジン誘導体とシアニジン誘導体が含まれている。そこで、上記5種類のアントシアニンのそれぞれについて、破骨細胞の分化抑制効果を調べた。
【0024】
試験例1と同様の試験系において、シアニジン誘導体としてシアニジン(ChromaDex社製)、デルフィニジン誘導体としてデルフィニジン(ChromaDex社製)、マルビジン誘導体としてマルビジン(ChromaDex社製)、ペオニジン誘導体としてペオニジン(ChromaDex社製)、ペチュニジン誘導体としてペチュニジン(ChromaDex社製)のそれぞれについて、10μg/mL、20μg/mL、30μg/mL、及び40μg/mLの4種類の濃度を用意した。
【0025】
結果を図6及び図7に示した。デルフィニジンでは10μg/mL以上の濃度において、ペチュニジンでは20μg/mL以上の濃度において、シアニジンでは40μg/mL以上の濃度において、それぞれ破骨細胞の分化抑制効果が認められた。
なお、図には示さないが、賦形剤として供試物中に含まれるデキストリンには、破骨細胞の分化抑制効果は認められなかった。
【0026】
<試験例4> ペチュニジンが有する破骨細胞の分化抑制効果に関する検討
次に、ペチュニジンが有する破骨細胞の分化抑制効果をペオニジンと比較した。試験例1と同様の試験系において、ペオニジン(ChromaDex社製)、またはペチュニジン(ChromaDex社製)を10μg/mL含有する培地中で破骨細胞の分化抑制効果を調べた。
結果を図8及び図9に示した。破骨細胞の分化抑制率(1−(薬物添加時の破骨細胞数/コントロールの破骨細胞数))は、ペオニジンでは、16%(コントロールに比して16%増加)であったのに対し、ペチュニジンでは、86%(コントロールに比して14%)であった。
【0027】
<試験例5> クロマニンが有する破骨細胞の分化抑制効果に関する検討
次に、クロマニン(シアニジン配糖体:C3G)が有する破骨細胞の分化抑制効果を検討した。クロマニンは、九州沖縄農業研究センターより提供されたものを用いた。試験例1と同様の試験系において、クロマニン誘導体としてクロマニンを、0.25μg/mL、0.5μg/mL、1μg/mL、2.5μg/mL、5μg/mL、10μg/mL、20μg/mL、及び30μg/mLの濃度で用意した。
結果を図10に示した。シアニジンは図6に示したように40μg/mL以上の濃度において破骨細胞の分化抑制効果が認められたが、その配糖体であるクロマニンはさらに強く、0.25μg/mL以上の濃度において破骨細胞の分化抑制効果が認められた。
【0028】
試験例1〜5の結果から、ツツジ科のブルーベリー(ビルベリー)、スグリ科のカシス、及びスイカズラ科のハスカップ、ヒルガオ科のムラサキ芋に含まれるアントシアニンに強力な破骨細胞の分化抑制効果があること示唆され、これらはデルフィニジン、ペチュニジン、シアニジンを基本骨格とするアントシアニンによるものであることが明らかとなり、特にデルフィニジン、ペチュニジンに強い作用を示すことがわかった。
【0029】
従来より、バラ科、ツバキ科、またはクワ科植物から抽出されたポリフェノール抽出物には、吸収性骨疾患に有用な効果があることが知られている(特許文献2)。また、この作用本体は、3,4,5−トリヒドロキシフェニル基を有する化合物であることが知られている(特許文献3)。上記文献の試験系は、PTHrp(1-34)により惹起された培養新生マウス仔頭蓋冠からのカルシウムおよび無機リン遊離を抑制する効果を確認するものであり、実際の破骨細胞の分化抑制を確認したものではない。また、本発明者の検討によれば、3,4,5−トリヒドロキシフェニル基を有するエピガロカテキンには、破骨細胞の分化抑制効果は認められなかった(データは示さない)。
一方、本願では、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科植物から得られたポリフェノール抽出物が、破骨細胞の分化抑制効果を有すること、及びその作用本体が、デルフィニジン、ペチュニジンであることを見出した。本願の化合物は、3位及び4位にヒドロキシ基を有し、5位にヒドロキシ基またはメトキシ基を有しているもの(デルフィニジン、及びペチュニジン)であるか、3位及び4位にヒドロキシ基を有するものである。これらの知見は、従来には知られていなかった。
【0030】
<試験例6> デルフィニジン及びペチュニジンが有する骨形成促進効果に関する検討
次に、デルフィニジン及びペチュニジンが有する骨形成促進効果を検討した。デルフィニジン及びペチュニジンは、ChromaDex社のものを用いた。
マウス(C57BL/6系マウス、5週齢・雌、3匹/群)に、5mg/kgまたは10mg/kgのデルフィニジンまたはペチュニジンを1日1回、経口投与した。投与開始から3日目に、RANKLを腹腔投与(500μg/kg×2回)し、骨吸収を誘発し、骨粗鬆症モデルマウスとした。
その後、11日間に渡って、5mg/kgまたは10mg/kgのデルフィニジンまたはペチュニジンを経口投与した後、屠殺した。屠殺後のマウスから骨組織を採取し、骨密度及び骨芽細胞数を測定した。コントロールとして、何の薬剤も投与していないマウスを用いた。
【0031】
結果を図11及び図12に示した。RANKLを投与した骨粗鬆症モデルマウスでは、コントロールに比べると、骨芽細胞数(N.Ob/BS)は約55%に、新生骨量(OV/TV)は約26%に減少した。
一方、デルフィニジンを投与した骨粗鬆症モデルマウスでは、コントロールに比べると、骨芽細胞数は約115%に、新生骨量は約118%に上昇した。これらの値は、RANKLを投与した骨粗鬆症モデルマウスに比べると、それぞれ約210%、及び約449%であった。
また、ペチュニジンを投与した骨粗鬆症モデルマウスでは、コントロールに比べると、骨芽細胞数は約129%に、新生骨量は約115%に上昇した。これらの値は、RANKLを投与した骨粗鬆症モデルマウスに比べると、それぞれ約236%、及び約435%であった。
【0032】
このように、デルフィニジン及びペチュニジンを投与した骨粗鬆症モデルマウスでは、骨芽細胞数及び新生骨量が、コントロール値を上回り、骨形成が活発に行われることが明らかとなった。また、本実施形態の物質は、骨吸収を抑制することから、がんの骨転移抑制剤としても用いることができる。
このように本実施形態によれば、吸収性骨疾患の予防剤または治療剤、骨形成促進剤、及びがんの骨転移抑制剤であって、特にツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科由来の植物から得られるポリフェノール抽出物を有効成分とするものを提供できた。
【図面の簡単な説明】
【0033】
【図1】デルフィニジン配糖体の構造式である。
【図2】ペチュニジン配糖体の構造式である。
【図3】ムラサキ芋アントシアニンとブルーベリーアントシアニンの破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図4】ブルーベリーとカシスから抽出したポリフェノール抽出物の破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図5】ハスカップから抽出したポリフェノール抽出物の破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図6】ブルーベリーに含まれるアントシアニンの破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図7】ブルーベリーに含まれるアントシアニンの破骨細胞の分化抑制効果を確認する試験結果を示す写真図である。
【図8】ペチュニジンが有する破骨細胞の分化抑制効果を確認する試験結果を示すグラフである。
【図9】ペチュニジンが有する破骨細胞の分化抑制効果を確認する試験結果を示すグラフである。
【図10】クロマニンが有する破骨細胞の分化抑制効果を確認する試験結果を示すグラフである。
【図11】RANKLを投与した骨粗鬆症モデルマウスにデルフィニジンを投与したときの骨芽細胞数(N.Ob/BS)及び新生骨量(OV/TV)を測定した結果を示すグラフである。(A)は骨芽細胞数を、(B)は新生骨量を示す。データは、左からコントロール群、RANKL投与モデルマウス群、及びデルフィニジン投与群を示している。また、データは、平均値±S.D.(n=3)で示した。
【図12】RANKLを投与した骨粗鬆症モデルマウスにペチュニジンを投与したときの骨芽細胞数(N.Ob/BS)及び新生骨量(OV/TV)を測定した結果を示すグラフである。(A)は骨芽細胞数を、(B)は新生骨量を示す。データは、左からコントロール群、RANKL投与モデルマウス群、及びペチュニジン投与群を示している。また、データは、平均値±S.D.(n=3)で示した。
【特許請求の範囲】
【請求項1】
下記式(1)の化合物を有効成分とする吸収性骨疾患の予防及び/または治療剤。
【化1】

但し、式(1)において、R1は、水素、水酸基、またはメトキシ基を意味し、R2は、水素、または配糖体を意味し、R3は、水素、または配糖体を意味する。
【請求項2】
上記化合物が、式(1)において、R1が水酸基であり、R2及びR3が水素であるデルフィニジン、R1がメトキシ基であり、R2及びR3が水素であるペチュニジン、R1が水素であり、R2及びR3が水素であるシアニジン、R1が水酸基であり、R2が配糖体であり、R3が水素または配糖体であるデルフィニジン配糖体、R1がメトキシ基であり、R2が配糖体であり、R3が水素または配糖体であるペチュニジン配糖体、R1が水素であり、R2が配糖体であり、R3が水素または配糖体であるシアニジン配糖体、から選択される一つであることを特徴とする請求項1に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項3】
上記化合物が、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科植物から選択された少なくとも1種類の植物から得られたポリフェノール抽出物に含有されることを特徴とする請求項1または2に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項4】
ツツジ科植物が、ブルーベリーであることを特徴とする請求項3に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項5】
スグリ科植物が、カシスであることを特徴とする請求項3に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項6】
スイカズラ科植物が、ハスカップであることを特徴とする請求項3に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項7】
ヒルガオ科植物が、ムラサキ芋であることを特徴とする請求項3に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項8】
吸収性骨疾患が、骨粗鬆症、歯周病、関節リウマチ、悪性高カルシウム血症、または骨ページェット病、であることを特徴とする請求項1〜5のいずれか一つに記載の吸収性骨疾患の予防及び/または治療剤。
【請求項9】
請求項1〜7に記載の吸収性骨疾患の予防及び/または治療剤を含有することを特徴とするがんの骨転移抑制剤。
【請求項10】
下記式(1)の化合物を有効成分とする骨形成促進剤。
【化1】

但し、式(1)において、R1は、水素、水酸基、またはメトキシ基を意味し、R2は、水素、または配糖体を意味し、R3は、水素、または配糖体を意味する。
【請求項1】
下記式(1)の化合物を有効成分とする吸収性骨疾患の予防及び/または治療剤。
【化1】

但し、式(1)において、R1は、水素、水酸基、またはメトキシ基を意味し、R2は、水素、または配糖体を意味し、R3は、水素、または配糖体を意味する。
【請求項2】
上記化合物が、式(1)において、R1が水酸基であり、R2及びR3が水素であるデルフィニジン、R1がメトキシ基であり、R2及びR3が水素であるペチュニジン、R1が水素であり、R2及びR3が水素であるシアニジン、R1が水酸基であり、R2が配糖体であり、R3が水素または配糖体であるデルフィニジン配糖体、R1がメトキシ基であり、R2が配糖体であり、R3が水素または配糖体であるペチュニジン配糖体、R1が水素であり、R2が配糖体であり、R3が水素または配糖体であるシアニジン配糖体、から選択される一つであることを特徴とする請求項1に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項3】
上記化合物が、ツツジ科、スグリ科、ナス科、ヒルガオ科、ブドウ科、ショウガ科、またはスイカズラ科植物から選択された少なくとも1種類の植物から得られたポリフェノール抽出物に含有されることを特徴とする請求項1または2に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項4】
ツツジ科植物が、ブルーベリーであることを特徴とする請求項3に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項5】
スグリ科植物が、カシスであることを特徴とする請求項3に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項6】
スイカズラ科植物が、ハスカップであることを特徴とする請求項3に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項7】
ヒルガオ科植物が、ムラサキ芋であることを特徴とする請求項3に記載の吸収性骨疾患の予防及び/または治療剤。
【請求項8】
吸収性骨疾患が、骨粗鬆症、歯周病、関節リウマチ、悪性高カルシウム血症、または骨ページェット病、であることを特徴とする請求項1〜5のいずれか一つに記載の吸収性骨疾患の予防及び/または治療剤。
【請求項9】
請求項1〜7に記載の吸収性骨疾患の予防及び/または治療剤を含有することを特徴とするがんの骨転移抑制剤。
【請求項10】
下記式(1)の化合物を有効成分とする骨形成促進剤。
【化1】

但し、式(1)において、R1は、水素、水酸基、またはメトキシ基を意味し、R2は、水素、または配糖体を意味し、R3は、水素、または配糖体を意味する。
【図1】


【図2】


【図9】


【図11】


【図12】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図10】




【図2】


【図9】


【図11】


【図12】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図10】


【公開番号】特開2009−167174(P2009−167174A)
【公開日】平成21年7月30日(2009.7.30)
【国際特許分類】
【出願番号】特願2008−319206(P2008−319206)
【出願日】平成20年12月16日(2008.12.16)
【出願人】(399087433)日本製薬工業株式会社 (4)
【Fターム(参考)】
【公開日】平成21年7月30日(2009.7.30)
【国際特許分類】
【出願日】平成20年12月16日(2008.12.16)
【出願人】(399087433)日本製薬工業株式会社 (4)
【Fターム(参考)】
[ Back to top ]

