呼気凝縮液中のリポ多糖体を利用するグラム陰性菌性肺炎の診断
【課題】 被験者から採取された呼気凝縮液中のリポ多糖体の有無に基づいて、被験者がグラム陰性細菌性肺炎であるか否かを決定するための方法を提供すること。
【解決手段】 空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法であって、(a)空気呼吸する脊椎動物被験体から採取された呼気凝縮液中のリポ多糖体の濃度を測定する工程と、(b)前記呼気凝縮液中のリポ多糖体の前記測定濃度に基づいて、前記被験体が肺内グラム陰性細菌感染症であるか否かを決定する工程とを含む方法。
【解決手段】 空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法であって、(a)空気呼吸する脊椎動物被験体から採取された呼気凝縮液中のリポ多糖体の濃度を測定する工程と、(b)前記呼気凝縮液中のリポ多糖体の前記測定濃度に基づいて、前記被験体が肺内グラム陰性細菌感染症であるか否かを決定する工程とを含む方法。
【発明の詳細な説明】
【技術分野】
【0001】
本願は、2004年6月7日出願の米国特許仮出願第60/577641号の特典を主張し、かつその優先権を主張し、その内容全体を参照によって本明細書に援用する。
【0002】
本願はまた、2002年12月20日出願の米国特許仮出願第60/434916号および2003年2月14日出願の米国特許仮出願第60/447581号の特典を主張する2003年12月19日出願の米国特許出願第10/742721号の一部継続出願でもある。上記出願の各々の内容全体を参照によって本明細書に援用する。
【0003】
さらに、本願は、2003年2月14日出願の米国特許仮出願第60/447581号の特典を主張する2004年2月13日出願の米国特許出願第10/778477号の一部継続出願である。上記出願の各々の内容全体を同様に参照によって本明細書に援用する。
【0004】
本発明は、一般的にグラム陰性細菌性肺炎を診断するための方法および装置に関し、さらに詳しくは、呼気凝縮液中のリポ多糖体の存在を検出することによるグラム陰性細菌性肺炎の診断に関する。
【背景技術】
【0005】
肺炎は、かなりの罹病率および死亡率を持つ一般的な病気の代表である。肺炎は、米国における感染症による死亡原因の第1位であり、よくある死亡原因の第6位である。National Hospital Ambulatory Medical Care Survey(全国病院外来医療調査)は、2001年に148万人の救急診療部外来が肺炎の診断に関係したことを明らかにした。National Hospital Discharge Survey(全国病院退院調査)は、1998年に132万人の患者が肺炎を治療した後に退院したことを明らかにした。
【0006】
肺炎は、ウィルス、クラミジア、マイコプラズマ、原虫、菌類、および細菌を含め、多種類の微生物の肺感染が原因となり得る。肺炎の疑いがある患者に対して、感染因子を特定することが抗菌治療の選択を決定付けるので、臨床医は感染の正確な原因を突き止める義務がある。西洋社会における最も一般的な原因は細菌性肺炎であり、細菌性肺炎が疑われる場合、臨床医は一般的に細菌性肺炎の原因をグラム陽性、グラム陰性、または嫌気性に分類しようとする。
【0007】
特に、グラム陰性肺感染は侵攻的であり、高い合併症率および死亡率に結びつくので、臨床医はグラム陰性細菌感染の有無を確認するように動機付けられる。細菌のグラム陰性の特徴は、当業者にはよく理解されている染色手順後の細菌の色に関連する。グラム陰性細菌性肺炎を含め、グラム陰性細菌感染は、他の種類の細菌感染の治療とは異なる特定の抗菌治療を必要とし、メディケアのような第三者支払者からの高水準の財政償還を正当化する。
【0008】
現在の臨床実務では、肺炎は臨床、検査、および放射線画像の情報を結集することによって診断される。一般的に、患者の訴え、患者のバイタルサイン、末梢白血球数、および胸部放射線撮影の結果のような特徴が、肺炎の有無を決定するために使用される。これらのデータ源が典型的なパターンと一致したとき、合理的な臨床的確信を持って診断を下すことができ、細菌培養の結果が出る前に抗菌治療を開始することができる。グラム陰性感染症の抗生物質治療を開始するために、非特異的な臨床データがしばしば使用されるが、一般的実務では、グラム陰性菌性肺炎の最終的診断にはグラム陰性細菌性肺感染症のより特異的な証拠が必要であるとされる。
【0009】
この目的のために、下気道から喀出された痰に直ちにグラム染色を実行することができ、顕微鏡分析によりグラム陰性感染を示唆する形態および色を持つ細菌を明らかにすることができる。しかし、肺炎のヒトから有用な痰試料を得ることが難しいことはよく知られている。肺炎と一致する臨床パターンを有する患者からの血液試料培養物がグラム陰性細菌を成長させる場合、これはグラム陰性菌性肺炎の特異的な指標となる。残念ながら、たいていの場合、グラム陰性菌性肺炎の患者の血液は無菌である。
【0010】
さらに、患者の血液は、エンドトキシン分子について化学アッセイを用いてエンドトキシン濃度を検査することができる。しかし、エンドトキシン濃度は、より一般的な敗血症症候群の原因または重篤度のいずれについても不正確な予測因子であることが分かっている。血中のエンドトキシン濃度は、短時間の間に大幅に変動することがある。さらに、肝疾患、多発性外傷、高血圧症、および血液悪性腫瘍を含め、特定の疾病状態は、臨床的に重大な感染症が無くても、エンドトキシン濃度の慢性的な上昇に関係する。循環エンドトキシン濃度で肺炎のグラム陰性病因を予測することができるか否かについては研究されていない。
【0011】
グラム陰性肺炎感染を診断する高感度の特異的方法は、気管支肺胞洗浄を実行し、洗浄液で細菌培養を実行することである。別の方法は、気管支肺胞洗浄液試料中のリポ多糖体成分について化学的に分析することである。この方法を使用する研究者らは、高濃度のリポ多糖体が気管支肺胞液の培養中のグラム陰性細菌の同時成長に関連付けられることを発見した。この方法の完全な記述は、Flanagan,P.G.、Jackson,S.K.、Findlay,G.の「Diagnosis of Gram negative, ventilator associated pneumonia by assaying endotoxin in bronchial lavage fluid」、J.Clin.Pathol.2001,54:107〜110、およびPugin,J.、Auckenthaler,R.、およびDelaspre,O.の「Rapid Diagnosis of Gram−negative pneumonia by assay of endotoxin in bronchoalveolar lavage fluid」、Thorax 1992,47:547〜549に見ることができる。どちらの方法も、特殊内視鏡装置および下位専門分野の専門知識が必要であり、かつそれらが比較的侵襲性で不快な処置であるという欠点を有する。さらに、公知の培養方法は結果を得るまでに少なくとも24時間を要する。したがって、患者は有効な抗生物質治療を受けるまで、少なくとも24時間待つことがある。
【0012】
グラム陰性細菌の細胞壁はエンドトキシンを含む。エンドトキシンは細胞溶解で細菌から放出される有毒物質である。エンドトキシンは熱を誘発するその能力が最初に認識されたが、今は広範囲の生物活性を持つことが知られている。溶菌により、リポ多糖体およびタンパク質および脂質の凝集体から構成されるエンドトキシンが、細菌から周囲の培地に放出される。エンドトキシンは主にリポ多糖体(「LPS」)と、様々な量のタンパク質および脂質から構成される。細菌エンドトキシンに通常起因する生物活性のほとんど全てが、単離された化学的に純粋なリポ多糖体でも誘発させることができるので、用語「エンドトキシン」および「リポ多糖体」は互換的に使用される。
【0013】
病原性の観点から、リポ多糖体の存在はグラム陰性感染の最も重要な影響の1つである。したがって、患者の体液中のリポ多糖体の検出はグラム陰性細菌感染の指標である。さらに詳しくは、患者の体液中のリポ多糖体の存在は、グラム陰性菌性肺炎の重要な潜在的指標である。
【0014】
本発明は、呼気の凝縮液に由来する液体に対しリポ多糖体の分析を実行することによるグラム陰性細菌性肺炎の診断における、上述した臨床上の欠点を克服する。本明細書に記載する新規の装置および方法を使用して、呼気凝縮液は、自発呼吸する被験者からマウスピース、フェイスマスク、もしくは他の同様の手段を介して、または機械的人工呼吸器の助けを借りて呼吸する被験者から機械的人工呼吸器の呼気配管への接続を介して、得ることができる。本発明の追加の利点は、肺炎のようなグラム陰性細菌感染症を診断する時間が、他の診断方法の場合に要する時間より短いことである。
【0015】
呼気凝縮液を採取するための代替的装置も公知である。これらの装置として、Gastonらの米国特許第6033368号および第6419634号、Huntらの米国特許第6585661号、Baddourの米国特許出願第10/257912号、およびWinselらの欧州特許0759169号に開示されているものが挙げられ、これら全部の内容全体を参照によって本明細書に援用する。加えて、Klineの米国特許出願第10/742721号および第10/778477号すなわち2つの同一出願人に譲渡された非仮特許出願は、呼気を採取するための装置を開示しており、それらの内容を参照によって本明細書に援用する。
【0016】
呼気凝縮液は、2001年にKharitinovらによって概説された通り、多くの肺疾患のマーカとして役立つことのできる多くの分子を含むことが知られている(Biomarkers 7(1):1〜32,2002)。しかし、グラム陰性菌性肺炎または他のグラム陰性細菌感染症を診断する目的のために呼気凝縮液中のリポ多糖体を測定するという概念は、これまで開示されていない。
【発明の概要】
【0017】
本発明は、被験者から採取された呼気凝縮液中のリポ多糖体の有無に基づいて、被験者がグラム陰性細菌性肺炎であるか否かを決定するための方法を含む。本発明はさらに、自発呼吸する被験者および人工呼吸する被験者の両方から呼気凝縮液を採取するために利用される採取装置、ならびに採取された呼気凝縮液中にリポ多糖体が存在するか否かを決定するために利用される装置を含む。
【0018】
広義には、本発明は、1態様では、空気呼吸する脊椎動物被験体から呼気凝縮液を採取し、採取された呼気凝縮液中のリポ多糖体の濃度を測定し、かつ呼気凝縮液中のリポ多糖体の測定された濃度に基づいて被験体が肺内グラム陰性細菌感染症であるか否かを決定することを含む、空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染を診断し監視するための方法である。
【0019】
この態様の特徴には、肺内グラム陰性細菌感染症は肺炎であり、肺内グラム陰性細菌感染症は気管支炎であり、該方法は被験体が肺内グラム陰性細菌感染症であるという陽性判定に応えて抗生物質治療を選択することをさらに含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は哺乳類被験体から呼気凝縮液を採取することを含み、該方法は抗生物質治療に対する哺乳類被験体の反応を監視することをさらに含み、該方法は肺内グラム陰性細菌の特定の菌株を特定することをさらに含み、特定するとは、リポ多糖体分子のO‐単糖類部の決定に基づいて肺内グラム陰性細菌の特定の菌株を特定することを含み、リポ多糖体の濃度の測定は、リムルス変形細胞溶解物分析を用いてリポ多糖体の濃度を測定することを含み、少なくとも約0.20エンドトキシン単位/mL(EU/mL)のリポ多糖体の測定濃度はグラム陰性細菌感染の存在を示し、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取が、自発呼吸する被験体からの呼気凝縮液の採取を含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取が人工呼吸する被験体から呼気凝縮液を採取することを含み、かつ空気呼吸する脊椎動物被験体からの呼気凝縮液の採取が、凝縮を促進するために約32°F以下の温度に冷却することのできる内壁を有する室を備えた呼気凝縮液採取装置を利用することを含む。
【0020】
本発明は、別の態様では、空気呼吸する脊椎動物被験体から呼気凝縮液を採取し、反応試薬が内部に配置された反応室を用意し、採取された呼気凝縮液の少なくとも一部分を反応室に送り込み、採取された呼気凝縮液の少なくとも一部分が反応室に送り込まれたときに発生する物理的変化に基づいて、被験体が肺内グラム陰性細菌感染症であるか否かを決定することを含み、前記物理的変化が呼気凝縮液中のリポ多糖体の存在によって引き起こされる、空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法である。
【0021】
この態様の特徴では、反応試薬はリムルス変形細胞溶解物、発色基質、および/または蛍光基質を含み、反応試薬は呼気凝縮液の少なくとも一部分の送り込みによる発熱反応を通して熱を放出する化学物質を含み、物理的変化はゲルの形成であり、該方法は反応室における色の変化を標準に視覚的に突き合わせることをさらに含み、前記標準は増加する色相強度のカラーパッチの印刷帯片を含み、各カラーパッチはリポ多糖体の増加する濃度にそれぞれ対応し、1ミリリットル当たり0.2エンドトキシン単位の濃度に対応する色相強度は肺内グラム陰性細菌感染の存在を示し、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は自発呼吸する被験体から呼気凝縮液を採取することを含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は機械的人工呼吸する被験体から呼気凝縮液を採取することを含み、空気呼吸する脊椎動物被験体からの呼気凝縮する液の採取は、凝縮を促進するために温度を約32°F以下に冷却することのできる内壁を有する室を備えた呼気凝縮液採取装置を利用することを含み、呼気凝縮液の少なくとも一部分の送り込みは、呼気凝縮液の少なくとも一部分を皮下注射針を介して反応室内に注入することを含む。
【0022】
本発明は、別の態様では、空気呼吸する脊椎動物被験体から呼気凝縮液を採取し、内部表面を持つ反応室を用意し、その反応室はその中に配置されたリポ多糖体と結合する物質を有し、採取された呼気凝縮液の少なくとも一部分を反応室に送り込み、反応室を緩衝液で洗浄し、反応試薬を反応室に送り込み、採取された呼気凝縮液の少なくとも一部分が反応室に送り込まれたときに生じる物理的変化に基づいて被験体が肺内グラム陰性細菌感染症であるか否かを決定することを含み、前記物理的変化が呼気凝縮液中のリポ多糖体の存在によって引き起こされる、空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染を診断し監視するための方法である。
【0023】
この態様の特徴では、反応試薬は発色基質および/または蛍光基質を含み、結合剤は特定種のリポ多糖体と結合する抗体であり、抗体は反応室の表面の内部に配置され、結合剤は不溶性ポリマーである。結合剤は反応室内に配置された基質表面に埋め込まれ、該方法は反応室における色の変化を標準に視覚的に突き合わせることをさらに含み、前記標準は増加する色相強度のカラーパッチの印刷帯片を含み、各カラーパッチはリポ多糖体の増加する濃度にそれぞれ対応し、1ミリリットル当たり0.2エンドトキシン単位の濃度に対応する色相強度は肺内グラム陰性細菌感染の存在を示し、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は自発呼吸する被験体から呼気凝縮液を採取することを含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は人工呼吸する被験体から呼気凝縮液を採取することを含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は、凝縮を促進するために温度を約32°F以下に冷却することのできる内壁を有する室を備えた呼気凝縮液採取装置を利用することを含み、呼気凝縮液の少なくとも一部分の送り込みは、呼気凝縮液の少なくとも一部分を皮下注射針を介して反応室内に注入することを含む。
【0024】
本発明は、別の態様では、空気呼吸する脊椎動物被験体から細管を有する採取装置で呼気凝縮液を採取し、リポ多糖体に暴露されるとゲル化を引き起こす酵素を含浸させた繊維プラグを細管内に挿入し、採取された呼気凝縮液試料の少なくとも一部分を細管に導入して繊維プラグを湿潤させ、細管内で発生するゲル化の量に基づいて被験者が肺内グラム陰性細菌感染症であるか否かを決定することを含み、前記ゲル化が呼気凝縮液中のリポ多糖体の存在によって引き起こされる、空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染を診断し監視するための方法である。
【0025】
この態様の特徴では、繊維プラグはリムルス変形細胞溶解物由来の酵素を含浸し、該方法は採取装置内に配置されたシリンジを用意することをさらに含み、前記シリンジは液圧を測定するためにその片側に配置されたマノメータを有し、細管はシリンジの端部に配置された皮下注射針である。
【0026】
本発明は、別の態様では、被験者の呼吸を促進するための機械的人工呼吸回路、その人工呼吸回路は被験者の呼気を取り除くための導管として働く呼気流管を含み、内部を有する中央室であって、凝縮を促進するために約32°F以下の温度に冷却することができ、中央室の内部および呼気流管と流体連通するように中央室の一端に配置された呼気入力アセンブリであって、それによって呼気流管と中央室とを接続する呼気入力アセンブリと、中央室の内部と流体連通するように中央室の他端に配置された出口アセンブリと、中央室から呼気凝縮液を採取するために出口アセンブリに接続された真空装置とを備える、機械的人工呼吸回路の助けを借りて呼吸する被験者から呼気凝縮液を採取するための装置である。
【0027】
本発明は、別の態様では、内部ならびに第1および第2の対向端を有する中央室と、中央室の内部と流体連通する呼気入力アセンブリと、中央室の内部と流体連通する出口アセンブリとを含み、前記出口アセンブリが細管を含み、前記細管がその中に配置された繊維プラグを有し、リポ多糖体に暴露されるとゲル化を引き起こす反応試薬を前記プラグに含浸させて成る.呼気凝縮液採取装置である。
【0028】
この態様の特徴では、プラグはリムルス変形細胞溶解物に由来する酵素を含浸させた繊維基質であり、該装置は、ピストンおよびハンドルを有するプランジャアセンブリをさらに含み、ピストンは中央室の内部に摺動自在に配置され、ハンドルはピストンを中央室内で移動することができるように中央室の第1端から延び、それによって採取された呼気凝縮液が細管内に配置された繊維プラグと接触することができる。
【0029】
本発明は、別の態様では、反応室と、呼気凝縮液を反応室内に送り込むための送り込みポートと、呼気凝縮液中に存在するリポ多糖体と反応する反応試薬と、反応室内の物理的変化の視覚的な検出を可能にする目視部とを含む、呼気凝縮液中のリポ多糖体の濃度を測定するための反応室アセンブリである。
【0030】
この態様の特徴では、送り込みポートは、呼気凝縮液の送り込みのために皮下注射針を穿刺することのできる再封可能な蓋である。目視部は透明な壁である。反応室は内部表面をさらに含み、リポ多糖体固定剤は反応室の内部表面の少なくとも一部分に結合され、リポ多糖体固定剤はモノクローナル抗体、ポリクローナル抗体、ポリミキシン抗生剤、リポ多糖体結合タンパク質、およびカブトガニ抗リポ多糖体因子から構成される群から選択され、反応室は反応室内に配置された化学物質をさらに含み、該化学物質は水和反応により熱を放出し、それによって化学物質の水和により、15〜30分間、34〜43℃の範囲の温度が達成され、化学物質は半透性基質中の塩であり、化学物質は結晶形態の塩であり、化学物質はチオ硫酸ナトリウム五水和物である。
【0031】
本発明は、別の態様では、筺体と、筺体内に配置された検査モジュールであって、ユーザ始動化学反応を利用して呼気凝縮液中のリポ多糖体の存在を検出する前記検査モジュールと、筺体内に検査モジュールに隣接して配置された陽性対照モジュールであって、リポ多糖体の存在について確実な陽性結果を示すためにその内部に配置されたリポ多糖体を有する、検査モジュールとの比較用の前記陽性対照モジュールとを含む、呼気凝縮液中のリポ多糖体の存在を検出するための検査キットカートリッジである。
【0032】
この態様の特徴では、筺体内に配置された化学物質は制御された発熱反応をもたらし、それにより34℃から43℃の間の温度が15〜30分の期間達成され、化学物質はチオ硫酸ナトリウム五水和物であり、検査キットの各モジュールは再封可能な注入ポートと、反応ウェルと、反応ウェルと注入ポートとの間の流体接続部と、流体接続部に配置された第1の一方向弁と、反応ウェルの出口を提供する出口管と、出口管に配置された第2の一方向弁とを含み、各反応ウェルは物理的変化の視覚的決定を可能にするように適応された透明なカバーを含み、各反応ウェルは不溶性高分子リポ多糖体結合基質を含み、陽性対照モジュールの反応ウェルは適切な種のグラム陰性細菌に由来するリポ多糖体を含み、検査キットカートリッジは反応室から再構成される発色基質をさらに含み、検査キットカートリッジは徐々に増加する色相強度のカラーパッチを有するカラーストリップをさらに含み、各カラーパッチは所定の範囲のエンドトキシン単位に対応して、反応ウェルの色変化との視覚的な比較を可能にし、筺体はポリマーから形成され、ポリマーはプラスチックである。
【0033】
本発明の適用可能なさらなる領域は、下述する詳細な説明から明らかになるであろう。詳細な説明および特定の実施例は、本発明の好適な実施形態を示すものであるが、単に説明を目的とするにすぎず、本発明の範囲を限定するつもりはないことを理解されたい。
本発明のさらなる特徴、実施形態、および利点は、図面に関連する以下の詳細な説明から明らかになるであろう。
【図面の簡単な説明】
【0034】
【図1】リポ多糖体の基本構造の略図である。
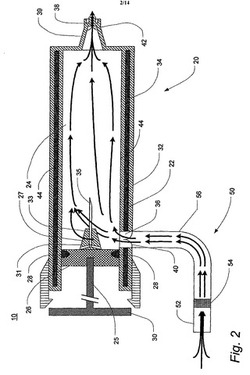
【図2】本発明の第1の好適な実施形態に係る呼気凝縮液採取装置の側面断面図である。
【図3】図3Aはプランジャアセンブリが部分的に押し下げられた位置にある状態の図2の呼気凝縮液採取装置の部分側面断面略図である。図3Bはプランジャアセンブリが完全に押し下げられた位置にある状態の図2の呼気凝縮液採取装置の部分側面断面略図である。
【図4】本発明の第2の好適な実施形態に係る呼気凝縮液採取装置の部分側面断面図である。
【図5】本発明の第3の好適な実施形態に係る呼気凝縮液採取装置の側面断面図である。
【図6】本発明の好適な実施形態の代替的人工呼吸システムの略図である。
【図7】図2、4、および5の採取装置と共に使用するのに適した反応室装置の側面断面略図である。
【図8】図7の反応室装置の上面図である。
【図9】第1の代替的反応室装置の側面斜視図である。
【図10A−B】図9の第1の代替的反応室装置の部分側面断面図である。
【図10C−D】図9の第1の代替的反応室装置の部分側面断面図である。
【図11】第2の代替的反応室装置を組み込んだ検査キットの斜視図である。
【図12】図11の検査モジュールの線12−12に沿って切った側面断面図である。
【図13】図11の陽性対照モジュールの線13−13に沿って切った側面断面図である。
【図14】本発明の第4の好適な実施形態に係る呼気凝縮液採取装置の部分側面断面図である。
【図15】図14の針の拡大部分側面断面図である。
【図16】3つの試験群の各々における患者の測定エンドトキシン濃度を示す散布図である。
【発明を実施するための形態】
【0035】
本発明の方法は、呼気凝縮液を利用して、LPSが呼気凝縮液中に存在するか否かを決定し、かくして被験者が肺内グラム陰性細菌感染症であるか否かを決定する。本願はグラム陰性細菌性肺炎を診断することに向けられる。しかし、当業者は、本発明が有効であるどんなグラム陰性細菌感染症でも検出するために利用できることを理解されるであろう。グラム陰性細菌感染症と診断された患者は、診断がグラム陰性菌性肺炎であろうと、別のグラム陰性細菌感染症であろうと関係なく、同じ抗菌治療で処置される。本明細書に記載するLPSを検出するための方法論はリムルス変形細胞溶解物アッセイであるが、本発明ではELISAアッセイおよびウサギのパイロジェン試験を含むが、それらに限らない、LPSの存在を検出するためのどんな方法論でも利用できることを、当業者は理解されるであろう。
【0036】
肺内LPS含有量は、呼気凝縮液試料を提供する被験者の肺の健康状態に基づいて変動することがあり得る。一般的に、少なくとも約0.2EU/mLの呼気凝縮液中のLPSの濃度は、臨床検査陽性閾値に対応し、肺内のグラム陰性細菌感染の存在を示す。EUはエンドトキシン単位である。細菌の種類間で変化するリポ多糖体の可変作用強度のため標準化することのできない典型的な質量濃度とは異なり、EUは標準化することができるので、USDAは、エンドトキシンの濃度をエンドトキシン単位で報告することを勧告している。エンドトキシン単位は、未知の試料に含まれるLPS反応性の量を指す。この反応性の量は、既知の量のLPS作用性を有する大腸菌のFDA承認菌株から導出された標準曲線からの補間によって決定される。
【0037】
呼気凝縮液を採取するために使用する装置は、自然に発生するLPSによる「背景」水準のLPSを含むことが可能である。この背景濃度を明らかにするために、LPSが含まれない水を装置に注入することによって、呼気採取に使用される装置で「模擬」標準を実行することができる。次いで、明らかになった水試料中のLPS濃度値が明らかになった呼気凝縮液試料中のLPS濃度値から除算して、システムの背景「ノイズ」を除去する。LPSの背景濃度は、採取に使用される装置によって変化する。
【0038】
呼気凝縮液採取装置、つまり下述する本明細書で、さらに詳細にその幾つかの実施例では、グラム陰性細菌性肺炎と同義の症状を呈する患者から、感染症を示す量のLPS含有量の検出のために、呼気凝縮液を採取するために使用することができる。
【0039】
ここで、図面に関して、幾つかの図を通して同様の数字は同様の構成要素を表わしている図面を参照しながら、本発明の好適な実施形態について次に説明する。好適な実施形態の以下の説明は、本来、単なる例証であって、本発明、その用途、または使用を制限する意図は全く無い。
【0040】
図1は、リポ多糖体の基本構造の略図である。この構造は全てのグラム陰性細菌の細胞壁に見られる。リポ多糖体(エンドトキシンともいう)は重さ約10Kdの複合糖脂質である。リポ多糖体の基本構造は3つの比較的よく定義された領域を含み、全てのグラム陰性細菌で同様である。これらの領域はO−抗原部、コア多糖類、および脂質Aである。O−抗原部は各々が2〜6個の単糖類を有する反復多糖類単位から構成される。O−抗原部はグラム陰性種の間でかなり異なり、したがって、特異的モノクローナル抗体の結合に基づいて、個々の細菌種のマーカとして役立つことができる。コアはO−抗原部と脂質Aとの間に存在し、グルコース、N−アセチルグルコースアミン、およびガラクトースのような代表的な糖質を有する分枝多糖類である。O−抗原部とは異なり、コア領域全体にわたって微小な変化があるだけであり、脂質Aに近接する内部コア領域の構造は高度に保存される。LPS分子の最も高度に保存される部分は、長鎖脂肪酸が結合された脂質A、二リン酸化二糖体である。分子の脂質A部分は事実上全ての真核細胞組織で毒性を持つ。ヒトでは、これはサイトカインの誘導、発熱、白血球増加症、白血球の漸増および活性化、血管の損傷、血管拡張、血管内凝固、および組織の損傷を含む。
【0041】
LPSを検出し定量化する1つの受け入れられた方法は、カブトガニ(リムルスポリフェムス(limulus polyphemus))からの変形細胞の水性抽出液に対するLPSの毒性作用を利用する。本願で使用する用語「変形細胞」とは血球を指す。一般的に、リムルス変形細胞溶解物(「LAL」)アッセイとして一般的に知られるこの方法は、米国特許第4322217号、第5310657号、および第5702882号に記載されている。他の認められた方法として、生体外ウサギパイロジェンアッセイおよびヒトパイロジェンアッセイが挙げられ、それらは当業者には周知であるので、ここでは詳述しない。
【0042】
簡単に要約すると、LALはLPSで培養されたときに凝固ゲルを形成し、それは少量のLPSの検出を可能にする。さらに詳しくは、LALアッセイでは、LPSは、変形細胞に含まれる因子Cとして一般的に知られる酵素を活性化する。活性化された因子Cは次に、因子Bの特定部位を加水分解することによって因子Bを活性化する。活性化された因子Bはプロクロッティング(proclotting)酵素を活性化して、それを凝固酵素に変換する。凝固酵素は次いでコアグローゲン(凝固タンパク質、分子量:19723)を特定部位(つまりArg8−Thr19およびArg46−Gly47)で開裂し、混合物のゲル化を引き起こす。加えて、凝固酵素が機能することを可能にする6.5と7.4との間のpHを維持するために、カルシウム塩、マグネシウム塩、およびリン酸塩のような補因子、またはヒドロキシメチル(「TRIS」)アミノメタン緩衝液のような他の有機化合物が存在しなければならない。
【0043】
LALアッセイで凝固ゲルの形成に基づいてLPSを検出するために、様々な技術が利用されてきた。一部の技術には、単純にゲルの形成を待ってLPSの存在を決定するエンドポイントアッセイなどもある。他にはより複雑であり、比濁時間分析法を使用して、LALアッセイにおける凝固が発生するにつれて増加する濁度を測定する。
【0044】
ゲルの形成を正確に決定することに関連する問題点を克服するために、発色基質または蛍光基質を使用する代替的分析方法論を使用してLPSが検出されてきた。この代替的方法論は、合成基質のアミド結合を加水分解する、上記のカスケード反応で形成された凝固酵素に依存する。合成基質は、凝固酵素によって加水分解されたときに遊離するマーカ分子または化合物に共有結合することができる。遊離したマーカは次いで比色法または分光光度法によって検出することができ、かくしてLPSの存在が示される。合成基質の例として、t−ブトキシカルボニル−ロイシル−グリシル−アルギニン−パラニトロアニリド(N−t−Boc−Leu−Gly−Arg−pNA)、N−t−Boc−Val−Leu−Gly−Arg−pNA(配列番号:1)、ベンジルオキシカルボニル−ロイシル−グリシル−アルギニン−パラニトロアニリド(Z−Leu−Gly−Arg−pNA)、Boc−Ile−Glu−Gly−Arg−pNA(配列番号:2)、Boc−Val−Ser−Gly−Arg−pNA(配列番号:3)、またはBoc−Ser−Gly−Arg−pNAを挙げることができるが、これらに限定されない。これらは全てパラニトロアニリンを遊離し、それは反応混合物を黄色にする。発色アッセイの特別な例として、Lingの米国特許第6645724号およびTamuraらの米国特許第5702882号に記載されている。
【0045】
また、カブトガニから酵素を得るのではなく、組換えバイオ技術によって生体外凝固カスケードに必要な酵素を合成することも可能である。そのような合成酵素は、発色法を使用して、未知の溶液中のLPSを検出し定量化するために使用することができる。
【0046】
LPSを捕獲し検出する他の代替的方法も公知である。LPS結合剤、例えば不溶性マトリクスポリマーの形のポリミキシン抗生剤または樹脂は、LPSを固定し、その後上述した比濁法、発色法、または蛍光発生法のいずれかによってLPSを検出するように、支持体に結合することができる。加えて、LPSはLPSに対し高い親和性を持つ任意の個数の抗体によって固定することができる。抗体はY字状構造を有し、2つの基本的ユニットを含む。第1のユニットはフラグメント−抗原結合部(「Fab」)であり、それは抗原に、この状況ではLPSに結合する。第2のユニットはフラグメント結晶化部分(「Fc」)である。Fcユニットは抗体を固定面に結合するハンドルとして機能することができる。潜在的に有用な抗体として、ポリクローナルまたはモノクローナル抗体、例えば脂質A反応性モノクローナル抗体(「HA−IA」)およびマウスの抗エンドトキシン免疫グロブリンM(「E5」)、リポ多糖体結合タンパク質(「LBP」)および関連タンパク質、殺菌性/浸透性増加タンパク質(「BPI」)、ならびにリムルスの抗LPS因子(「LALF」)が挙げられるが、それらに限定されない。
【0047】
酵素結合免疫測定技術を利用する方法も公知であり、選択された様々なマトリクス結合抗体を使用して、特定のエンドトキシンおよび特定の細菌の種類を捕獲し検出することができる。検出することのできる細菌からのエンドトキシンの例として、エシェリキア、ボルデテラ、ブランハメラ、サルモネラ、ヘモフィルス、クレブシエラ、プロテウス、エンテロバクタ、シュードモナス、パスツレラ、アシネトバクタ、クラミジア、およびナイセリア、ならびに一般的にそのLPSが選択された抗体に結合することのできる任意の細菌が挙げられるが、それらに限定されない。
【0048】
さらに、β−1,3グルカン類(β−D−グルカン類)の存在もまた上述の凝固カスケードを活性化させることができることが認識されている。この偽陽性効果を制限するために特定の処置を講じることができることを、当業者は理解されるであろう。
【0049】
本発明は、自発呼吸する被験者または機械的人工呼吸処置を受けている患者からの呼気凝縮液(「EBC」)の迅速な(例えば30分未満)非侵襲性採取に続いて、LPSの濃度についての凝縮液の1段階定量分析または半定量分析を可能にするように設計された、幾つかの採取装置を含む。自発呼吸する被験者では、呼気凝縮液は一般的に口唇によって保持されるマウスピースを介して採取される。しかし、重度の呼吸困難な患者では、試料は、呼気ガスおよびエアロゾルを下述するような凝縮室内に迂回させながら、酸素の送り込みを可能にする気密性のぴったり嵌合する顔マスクを患者に装着することによって採取することができる。
【0050】
一般的に、呼気凝縮液採取装置は各々、呼気の凝縮を可能にするように32°F未満の温度に冷却することのできる、無菌のLPSを含まない内壁を有する採取室を備える。これらの呼気凝縮液採取装置は使い捨てであり、かつ軽量であることが好ましい。各装置は同軸室を含み、外部からまたは内部吸熱反応を介して冷却することのできる冷却剤を介在する領域に含む。そのような呼気凝縮液採取装置については、発明者および譲受人が本願と共通する上記の米国特許出願第10/742721号および第10/778477号に概説されている。しかし、本明細書に記載しかつ例証する装置は、どの先行技術の装置にも含まれない追加の新規かつ有用な特徴を有する。
【0051】
図2は、本発明の好適な実施形態に係る呼気凝縮液採取装置10の側面断面略図である。この構成は、協力的なヒトに使用するのに特に適している。呼気凝縮液採取装置10は二重壁のシリンジ20および呼気入力アセンブリ50を備える。シリンジ20の内壁22は、ピストン26と、ゴムガスケット28と、シリンジ20の一端から延びるハンドル30とを備えるプランジャアセンブリ25が中に装着される、円筒状の中央室24を画定する。外壁32は、内壁22および外壁32の間に狭い空間が形成されるように、内壁22の周囲に配設される。製造中に、内壁22および外壁32の間の空間には冷却材34のジャケットを充填することができ、次いで外壁32は漏れを防止するために内壁22に封着することができる。好適な実施形態では、冷却材34として水を使用することができるが、ポリエチレングリコール(「PEG」)等のような他の材料も同様に使用することができることは明瞭である。
【0052】
シリンジ20は、入口36と、出口38と、1対の一方向弁40、42とをさらに備える。中央室24を通る呼気の単一方向のみの通過を促進するために、第1弁40は入口36に隣接して配置することのできる吸込み弁であり、第2弁42は出口38に隣接して配置することのできる出口弁である。中央室24内に採取された物質をピストン26によって出口38から押し出すことができるようにするために、出口38はプランジャハンドル30の反対側の端に配置することが好ましい。出口38は、ニップル状のノズル39の端部に配置することができる。ノズル39はまた、その遠端にルアーロックの雌部のような取付具をも備えることができる。そのような取付具は、ノズル39に保護カバーまたは他の付属品を取り付けることを可能にする。弁40、42は様々な図に単に模式的に示したが、それらは例えば、プラスチックまたは別の変形可能なポリマーから形成された2つまたは3つの自己密閉リーフを含むことができる。そのような弁の設計は、当業者には明らかであろう。
【0053】
ピストン26は、プランジャアセンブリ25が完全に押し下げられたとき、ノズル39内にしっくり嵌合するのに適した寸法および形状の先端または突起27を備える。先端27は、先端27の基部の周囲に配設されかつ皮下注射針のような針35がその中に配設される中空の中心シャフトまたはコンジット33に接続する、複数の放射状コンジット31を備える。放射状コンジット31および中心コンジット33は約1mmから2mmの間の直径であることが好ましく、針35の外径は、中央コンジット33内にしっくり嵌合するために、同様に約1mmから2mmの間の直径であることが好ましい。
【0054】
さらに、ピストン26はシリンジ20の一端を埋め、反対側の端に出口38が配設されるので、入口36はシリンジ20の側部の内壁および外壁22,32の両方を貫通するように構成されることが好ましい。中央室24を通過する呼気と内壁22の内面44との間で最大の相互作用を引き起こすために、入口36はできるだけピストン26の近くに配設することが好ましいが、これらの構成要素の他の配置構成も、本発明の範囲から逸脱することなく、同様に可能であることは明らかであろう。
【0055】
呼気入力アセンブリ50はマウスピース52と、フィルタ54と、呼気をマウスピース52からシリンジ20の入口36へ誘導するために必要ないずれかの配管56とを備える。マウスピース52は、患者の口の領域と快適に接触することができるように、適切なサイズおよび形状である。唾液および他の液体または最小限の大きさの固形物がそこを通過してシリンジ20内に送られるのを防止するために、穿孔および連続貫入を有するポリマー材を含むフィルタ54を、マウスピース52とシリンジ入口36との間の配管56内に配設することができる。呼気入力アセンブリ50を通過する空気が上昇移動するように、呼気入力アセンブリ50をシリンジ20の下に配設することによって、唾液が中央室24に到達することをさらに防止することができる。この配置構成で、唾液および他の液体または固形物に対する重力の作用は、そのような物質は代わりに配管56内に集まり易くなるので、それが中央室24内に送られることを防止するのに役立つ。
【0056】
配管56は、マウスピース52と、または配管56の他の部分と、下述する動作のようなプランジャアセンブリ25の動作との間の干渉を回避するように構成することが好ましい。さらに好ましくは、マウスピース52はシリンジ20およびその中のプランジャアセンブリ25と略平行に配向され、換言すると、マウスピース52はシリンジ20によって画定される主軸に平行に配向される。この配向で、プランジャアセンブリ25の動作に対する干渉を生じることなく、患者から呼気を受け取ることができ、患者が装置10を使用するときにシリンジ20の内部に形成される凝縮液は、出口38に向かって下向きに排出され易い。
【0057】
患者または付添人によって容易に保持され、かつ患者がその呼吸パターンを変化させることを必要としないように、充分に小型で軽量である装置10を使用して、比較的短時間に充分な量の凝縮液を採取することができるように装置10の寸法を選択する。壁22、32および装置10の他の構造は、白金硬化シリコンのような、タンパク質に結合する傾向の無い材料から構成することが好ましい。他の適切な材料としてガラス、プラスチック、ポリエチレン、ポリカーボネート、もしくはポリビニルポリマーまたは他の合成ポリマーが挙げられるが、それらに限定されない。プランジャアセンブリ25は同様に非タンパク質結合剤から構成することが好ましいが、プラスチック、ビニル、ポリエチレン、ゴム、白金硬化シリコン、またはフッ素含有ポリマーをはじめ、それらに限らず、任意の適切な不活性材料から構成することができる。加えて、フッ素含有ポリマーであり、デラウェア州ウィルミントンの企業E.I.Du Pont De Nemours and Companyが所有する登録商標であるTEFLON(登録商標)を使用することができる。好適な実施形態では、シリンジ20は、長さが10cmから20cmの間、直径が2cmから5cmの間である。冷却材ジャケット34の厚さは1mmから10mmの間とすることができ、単回使用から圧出される試料容積は100μLから1000μLの間であることが好ましいが、わずか25μLの試料から有用な結果を得ることが可能であることもある。
【0058】
プランジャアセンブリ25は、前述した皮下注射針35または同様の構造を含めることにより、先願に開示されたプランジャアセンブリに比べて改善されている。この改善は、幾つかの実施例を下述する特殊化された反応室装置内への凝縮液の無菌送達を促進する。針35はピストン先端27の中心コンジット33に中心配置され、針35の内部は、以下で明らかになる目的のために、先端27の放射状コンジット31と流体連通する状態に構成される。
【0059】
動作時、約0°Fまで温度を低下させかくしてシリンジ20の内壁および外壁22,32の間に含まれる冷却材34のジャケットを冷凍させることのできる、従来の家庭用または商業用フリーザのような冷凍装置に、1つ以上のシリンジ20が最初に貯蔵される。患者を検査するとき、単一のシリンジ20が最初にフリーザから引き出される。呼気入力アセンブリ50またはマウスピース52は装置10の残部とは別個に貯蔵され、次いで装置10は使用のために、様々な構成要素を一体に結合することによって組み立てられる。次に、患者はマウスピース52をその患者の口領域に密閉するように配置し、マウスピース52内に呼気を吐く。呼気は配管56を通して、入口36を介して中央室24内へ誘導される。吸込み弁40は正圧によって開かれるが、そのような圧力が無ければ、それ中央室24内の空気が入口36を通して逸出するのを防止する。次いで呼気は、取込み端とは反対側の中央室24の端の出口38から針35を介して排出する。出口弁42は、弁42のシリンダ側に正圧が存在するときだけ、空気を中央室24から外に通すことを可能にし、そのような圧力が無いときには、弁42は周囲空気が出口38を介して中央室24に入り込むのを防止する。
【0060】
患者が装置10を通して呼気を吐くと、呼気中の湿分が中央室24の内部表面44上に凝縮し始める。冷却材34およびシリンジ24の低下された温度のため、凝縮液は内部表面44に即座に凍結することができる。ノズル39および針35の直径は、患者の呼息に抵抗を生じるぐらい充分小さい。直径は好ましくは、各呼息が完了するのに約5秒を要するようになるまで、または最高で約5cmの水圧の抵抗がもたらされるまで、呼気の割合を低下させるように選択することができる。ノズル39は代替的に、呼息に対する抵抗を変動させるダイヤルを有する終末呼気正圧弁(「PEEP」弁)を装着することができることを、当業者は理解されるであろう。PEEP弁は、カリフォルニア州ランチョコードバのLife Assist Incから市販されている。この改善は、呼気が中央室24の内部表面44と平衡するまでの時間の量を増加させる。
【0061】
患者が装置10を通して呼気を吐き続けると、装置10の内壁22と外壁32との間の空間に配置された冷凍冷却材34が溶融し始める。中央室24を包囲する冷却材ジャケット34の組成、容積、および厚さは、患者による約10〜15回の呼息後に冷却材34が溶解し始めるように較正することが好ましい。所望の回数の呼息後に冷却材34が溶解または解凍すると、凝縮液は同様に溶解し始めることができる。凝縮液が溶解すると、プランジャアセンブリ25を押し込んで、採取された凝縮液試料を出口38から圧出させることができる。
【0062】
図3Aおよび3Bはそれぞれ、プランジャアセンブリ25が部分的に押し下げられた位置および完全に押し下げられた位置にある状態の図2の呼気凝縮液採取装置10の部分側面断面略図である。プランジャアセンブリ25が押し下げられると、針35は出口38から押し出される。一方、ピストン26と出口38との間の空間の容積は収縮するので、凝縮液は放射状コンジット31を通して中央導管33に押し込まれ、そこから皮下注射針35内へ押し込まれる。次いで凝縮液は、適切な反応室装置内に排出する準備ができている。反応室装置の幾つかの実施例については、図7〜13に関連して下述する。排出は、プランジャアセンブリ25を完全に押し下げることによって促進することができる。プランジャアセンブリ25のハンドル30を捕捉し、それによってプランジャアセンブリ25が完全に押し下げられたことをユーザに示すために、シリンジ20の反対側の端にクリップアセンブリを設けることができる。最後に、EBCが採取され、本明細書で下述する検査手順に従って針35を介して排出されると、装置10全体を従来の廃棄物処理手順に従って処分することができる。
【0063】
図4は、本発明の第2の好適な実施形態に係る呼気凝縮液採取装置60の部分側面断面図である。第1の実施形態と同様に、この呼気凝縮液採取装置60は、中央室24と、プランジャアセンブリ65と、ゴムガスケット28と、ハンドル30とを備える二重壁シリンジ62、および呼気入力アセンブリ(図示せず)を備える。中央室24およびその様々な構成要素を含むシリンジ62の本体は、幾つかの重要な例外を除き、第1シリンジ20のそれと同様である。最初に、第1実施形態の出口38は、シリンジ62の内壁22および外壁32をその遠端付近で貫通する直径が約1mmのブリードポート68に置き換えられる。プランジャアセンブリが押し下げられるがEBCを保持しているとき、ブリードポート68は、空気が中央室24から抜けることを可能にする。また、プランジャアセンブリ65は、ピストン66の正面にニップル状の先端またはそこから延びる針を含まない。しかし、ピストン66の正面はわずかな円錐形を有し、中央室24の端部はそれに対応する形状を有する。一緒に、この形状構成は、採取された凝縮液をより効率的に出口38に誘導することができる。しかし、前の装置10のニップル状先端27および図4の装置に開示された円錐形状は相互に排他的ではなく、すなわち、図2のニップル状の先端27に図4の円錐形状を結合することによって、円錐形状を図2の装置に容易に組み込むことができることは明らかであろう。
【0064】
第1装置10および第2装置60の間の別の相違としては、第2装置が、皮下注射針35を取り付けることのできるねじ付きノズル61を備えることである。針35は第1装置10の針35と同様であるが、それはプランジャアセンブリ65に装着されるのではなく、ノズル61に固定される。針35の内部は中央室24の内部に連通接続される。針35は、ねじ付きノズル61からのカバー69の簡単な接続および取外しを促進するねじ付き取付具を有する、着脱自在のプラスチックカバー69によって保護することができる。シリンジ62に取り付けられたとき、カバー69は、下述する目的のために比較的気密性の封止をもたらすことが好ましい。
【0065】
この第2装置60の使用は第1装置10のそれと幾分同様であるが、被験者が針35を通して呼吸することができるようになる前に、カバー69は取り外さなければならない。しかし、上述した改善により、この装置60は第1装置10より、凝縮液の較正された量の凝縮液を送り込むのによく適応させることができる。最小限の量の凝縮液が採取されたことを確実にするために充分な回数の呼吸を被験者が装置60を通して行った後、カバー69をシリンジ62の端部に戻すことができ、プランジャアセンブリ65を慎重に押し下げることができる。カバー69はガスまたは液体が針35を通過することを効果的に防止するが、従来設計のブリードポート68は、ピストン66の正面が較正線78を通過するまで、空気および過剰な凝縮液の排出を可能にする。EBCが環境に逸出することを防止するために、希望するならば綿ボールまたは他の吸収性材料、および希望するならば適切な支持構造をブリードポート68の上に配置することができる。ブリードポート68を上向きに配向して装置60を保持することによって、ほとんどまたは全ての空気を中央室24から除去することができ、較正線78によって測定される通り、較正量の凝縮液がその中に残る。図4に示す通り、シリンジ62は、その中に含まれる液体を見易くするために、較正線78の領域に単壁設計を使用することができる。好ましくは、シリンジ62は250〜500μLの間の量を採取するように較正される。次いで、カバー69を再び取り外すことができ、この較正量を針35によって適切な反応室装置に送り込むことができる。
【0066】
図5は、本発明の第3の好適な実施形態に係る呼気凝縮液採取装置80の側面断面略図である。呼気を気道成分および肺胞成分に分画し、肺胞に由来する呼気の部分からだけ凝縮を発生させることが有利であるかもしれない。この区分化工程は下気道肺感染症を気管支炎と区別するのに役立つかもしれない。上記のKlineの米国特許出願第10/778477号に記載されている通り、肺胞呼気凝縮液の採取のための装置は、例えば呼気の二酸化炭素の部分圧力の上昇によって作動するゲーティングメカニズムを組み込むことができる。図5に示された呼気凝縮液採取装置80は、その装置の好適な実施形態または匹敵する装置で使用するのに適した装置の例である。図5の装置80は、第1装置10の呼気入力アセンブリ50が除去されて、米国特許出願第10/778477号に開示された装置に含まれるような筺体内に装置80を挿入することができることを除いては、図2の装置10と同様である。当業者には明らかであるように、ゲーティングメカニズムからの流体連通を促進するため、または他の目的のために、図5に示すように、凝縮プロセス中に空気流の方向を反転させることもできる。この場合、出口36および入口38、ならびにそれらのそれぞれの一方向弁81、83のそれぞれの位置は、ここで、図2の装置10に対して反転される。
【0067】
本明細書には図示されていないが、空気流の反転は図4に示された装置60にも適用することができる。しかし、たとえ空気流の方向が反転しても、図3Aおよび3Bまたは図4のいずれかに関して記載するように、凝縮液は依然として皮下注射針35を介して反応室装置内へ送り込むことができる。
【0068】
先行する実施形態では、それぞれの装置10、60、80は自発呼吸する被験者からEBCを採取するように設計され、被験者はマウスピースまたは顔マスク(図示せず)を介して、図2または図5に模式的に示したもののような適切な入口に流れを方向付ける配管内に呼気を吐く。本発明を機械的人工呼吸を受けている患者からの採取を可能にするように適応させることも有利であろう。たいていの病院では、ヒトは、しばしば酸素に混入され、過剰水蒸気で加湿された加圧空気に対して換気される。この過剰水蒸気は、呼吸サイクル中に呼気を患者の肺から離すように方向付ける流出配管内に、凝縮を蓄積させる。呼吸療法士が、呼息回路のほとんどの垂下部に容量約20〜100mLの小さいシリンダを取り付け、この凝縮液を捕集することは標準的な慣行である。本発明を利用して、人工呼吸を受ける患者のグラム陰性細菌性肺感染症を診断するために、捕集された凝縮液の一定量をLPS含有量について分析することができる。最も単純な実施形態では、薬剤の送達に使用される型の市販のシリンジ(例えばインシュリンシリンジ)を使用して、人工呼吸回路の呼息管路の凝縮液タンクにある凝縮液の設定量(例えば100〜200マイクロリットル)を抜き取ることができ、この量を下述する実施例の反応室装置内に注入することができる。
【0069】
図6は、本発明の好適な実施形態を実現する代替的人工呼吸システムの略図である。一例として図5の装置80を使用すると、人工呼吸を受ける患者からの採取は、装置80の出口36に真空システム92を追加し、YまたはT継手94を、ノズル39の端部の前述したルアーロック接続具に接続することによって促進することができる。YまたはT継手94は、患者96から従来の人工呼吸器98までの流出経路の途中で管路に接続される。流出経路は2つのポリエチレン管102、104を含み、最初の管は、従来の気管内挿入管100または他の患者インタフェースからYまたはT継手94の入口に接続され、第2の管はYまたはT継手94の出口と、人工呼吸器110の流出トラックに通常設けられるようなポートとの間に接続される。第3のポリエチレン管106は、人口呼吸器110の流入トラックから気管内挿入管100に接続される。各ポリエチレン管102、104、106は内径が約10〜30mm、長さが1メートル以上である。総じて、そのような装置は、充分な量のEBCが採取されるまで、真空システム92が採取装置80を通して呼気の連続側流試料を抜き取ることを可能にする。真空システム92のポンプによる吸引速度は約100mL/分に設定することができる。
【0070】
図7および8はそれぞれ、図2、4、および5の採取装置10、60、80と使用するのに適した1つの反応室アセンブリ120の側面断面略図および上面図である。反応室アセンブリ120は、EBC中に存在するLPSの量を検出して定量するように設計されている。アセンブリ120は、注入用の薬剤を貯蔵するために一般的に使用される無菌アンプルの一般的形状構成に似ている。アセンブリ120は、反応室、および分光光度計キュベットの両方として機能することができ、試料中のLPSの濃度に比例する可視光の透過百分率を測定する。アセンブリ120は真空密閉され、反応室122およびプラグ124、保持リング126、ならびに保護キャップ128を含む。反応室122はガラスまたは別の透明な材料から作られることが好ましいが、下述する選択される色または光の変化または現象がそこを通して容易に見ることができるならば、代替的に準透明な(半透明な、または他の不透明でない)材料から作ることができる。反応室122は約0.5〜1.0mLの容積を持つことが好ましい。図示する通り、反応室122は円形であるが、反応室122は同様に方形とすることができ、あるいは分光光度計内への挿入を容易にする別の幾何学的形状を持つことができ、あるいは既存の市販の実験室用分析システムに「改造設置」することができるように変形することができることは理解されるであろう。反応室122は、上述した凝縮液採取装置10、80のものと同様のねじ付き雄型ルアーロック接続具132をさらに含む。言うまでもなく、図4に開示されたような装置60を利用する場合には、ルアーロック接続具132は必要ないかもしれない。
【0071】
反応室122内部の密閉された無菌で発熱物質を含まない環境を維持するために、好ましくはゴムから形成されるプラグ124を反応室122の頂部に配置することができる。プラグ124は保持リング126によって反応室122に保持され、該保持リングは好ましくはアルミニウムから作られ、プラグ124の送り込みポート130を介して反応室122内に呼気凝縮液を送り込むことを可能にする開口を中心に有する。好適な実施形態では、送り込みポート130は、皮下注射針で穿刺することのできる再封可能な蓋である。好ましくはプラスチックから形成される保護キャップ128は、保持リング126およびプラグ124の損傷または汚れを防止するために、アセンブリ120の頂部に一時的に取り付けられる。
【0072】
使用時に、無菌反応室アセンブリ120は貯蔵所から取り出され、開示された装置10、60、80の1つ(または別の同等の装置)を用いてEBC試料が採取される。反応室アセンブリ120の保護キャップ128が取り外され、次いで、それぞれの皮下注射針35をプラグ124の送り込みポート130に挿入することによって、比較的正確な量のEBC試料が反応室122に送込まれる。設けられている場合にはそれぞれのルアーロック接続具を係合させて、装置10、60、80を反応室アセンブリ120に効果的に固定することができる。次いで、充分な量のEBCがアセンブリ120に送り込まれるまで、プランジャアセンブリ25を押し下げることができる。必要な量を示すために較正線134を反応室122に付けることができるが、量が採取装置60で事前に較正されている場合には、そのような線134は必要ないかもしれない。エンドトキシン分析物の正確な測定に必要な、充分な量のEBCを抜き取るために、組立中に、反応室122は真空下で密閉される。
【0073】
反応室122は、因子C、因子B、プロクロッティング酵素、および発色基質の事前指定された乾燥塊136を、水和により約7.4のpHを維持するためにカルシウムおよびマグネシウムの塩、ならびにリン酸塩、または他の有機化合物、例えばTRISアミノメタン緩衝液と共に含む。これらの酵素の量および活性は、所定の量のEBCで臨床関連範囲のLPSの検出が可能となるように、事前較正される。量は、約37℃で15〜30分の反応時間で測定したときに、非希釈EBCで0〜約10EU/mLの範囲のLPSの濃度に比例して対応する、0〜1.00までの範囲の線形光学濃度読み値を反応から生じさせるように較正される。反応の温度は少なくとも約34℃に保持されることが好ましい。反応の温度は少なくとも約37℃に保持されることがさらに好ましい。
【0074】
発色基質は、約43℃までの温度に、活性を失うことなく耐えることができる。したがって、反応室は、制御された発熱反応によって、約43℃まで加熱することができる。少なくとも15分間、好ましくは25分間、34〜43℃の均等な培養をもたらすために、発熱反応を制御することが好ましい。したがって、下述の通り、発熱水和反応の速度を制御する処置を講じる必要がある。
【0075】
そのような発熱反応は、水和により熱を放出する塩を反応室内に配置することによって開始することができる。そのような塩の一例として、チオ硫酸ナトリウム五水和物が挙げられるが、それに限定されない。塩を反応室内に配置すると、採取された凝縮液の導入により、発熱反応を開始することができる。短い加熱期間内に即時の完全な水和を促進する、粉末の塩を使用することが好ましい。例えば、塩は制御された水和により34〜43℃の反応温度を少なくとも15分間発生させることのできる、半透性マトリクスまたは結晶形態とすることができる。あるいは、塩は反応室を取り囲むユーザ開始加熱ジャケットに配置することができる。この実施形態では、反応室は可撓性ポリマーから構成される二重壁ジャケット内に挿入することができる。ジャケットは、水和により熱を放出することのできる乾燥塩、および2本の指で圧搾することによって容易に破断することのできる水のアンプル(2〜5mL)を含むことができる。水のアンプルを破断させる行為により塩の水和が開始され、発熱反応を引き起こし、かくして反応室は約43℃に約15〜30分間加熱され、その時点で色強度および対応するエンドトキシン活性を、下述する通り、定量化することができる。
【0076】
予備データから、約0.20EU/mL(約0.20の較正線形光学濃度読み値)を越えるLPSの濃度は、肺のグラム陰性細菌感染の存在を示す臨床検査陽性閾値に対応することが示唆される。好適な実施形態では、発色基質は、凝固酵素によって開裂されて約405nmのピーク吸光度を持つ反応溶液に黄色を放つ、パラアミノアニリドのような色素にコンジュゲートされたペプチドとすることができる。他の発色基質と代替することができること、および異なる等吸収点で検出することのできる代替物に他の色素マーカをコンジュゲートさせることができることは、容易に理解されるであろう。加えて、マーカ分子は励起蛍光の特性を含む化合物とすることができ、それにより分子は、単色光の入射ビームによる刺激に応答して狭い波長間隔内の光を放出する。LPSの存在を検出するためのマーカとして、様々な発色基質および蛍光基質を使用できることを、当業者は理解されるであろう。
【0077】
あるいは、ウェルの側部にマトリックス結合された抗体を使用してLPSを捕獲するように反応室アセンブリを設計することができる。図9は、第1の代替的反応室アセンブリ140の斜視図である。この代替的実施形態では、アセンブリ140は、酵素結合免疫測定技術を使用する縦型マイクロタイタウェルとして機能し、種特異的LPS分子154の検出が可能であるという利点を有する。キュベットとして機能することのできるアセンブリ140は、室142と、プラグ144と、保持リングまたは他の構造体146とを含むことができる。以下で明らかにする目的のために、窓143は室142の壁の少なくとも一部分に形成される。前の装置120のリング126と同様に、リング146は、プラグ144の中心に注入目標領域150を露出させる開口を含む。
【0078】
図10A〜10Dは、図9の第1の代替的反応室アセンブリ140の部分概略部分側面断面図である。各抗体152のFc部は、従来の技術を用いて、アセンブリ140の窓143にコンジュゲートまたは結合する。したがって、各抗体152のFab部はアセンブリ140の中心に向かって配向され、LPS154のO多糖体部がよりよく捕獲される。EBC試料の導入後、室142は次いで、アルブミン含有緩衝液(図示せず)で洗浄して、非特定的物質を除去することができる。次いで、LPSを含まない水(図示せず)を加えることによって、所定量の前述したような発色基質156を含む別個のアンプルが再構成され、発色試薬試料がシリンジによって抜き取られ、図10Cに示すように、反応室142に注入される。発色基質156はLPS154と反応し、それによって色素158を放出する。約15〜30分後に、幾つかの方法の1つによって光学濃度を読み取ることができる。本発明の好適な実施形態に使用するのに適した1つの発色基質156はパラニトロアニリドを組み込み、それは放出されたときに約405〜410nmで検出することができる。
【0079】
O抗原に特異的な免疫原性を持つ抗体ではなく、LPSを捕獲するために、LPSのいずれかの部分に対し特異的な高い親和性を持つ他の分子を反応室の壁に結合させることができることを、当業者は理解するであろう。これらの分子としてHA‐1AおよびE5、リポ多糖体結合タンパク質(「LPB」)、殺菌性/浸透性増加タンパク質(「BPI」)、リムルス抗リポ多糖体因子(「LALF」)、またはポリミキシン抗生剤が挙げられるが、それらに限定されない。
【0080】
LPS濃度を定量化するために、多数の実施形態を利用することができる。1つの実施形態では、カラーストリップとの視覚的比較を用いて、半定量的決定を行うことができる。カラーストリップは、最も明るい陰影を最左端に配置し、最も暗い陰影を最右端に配置し、陰影強度を徐々に上げながら左右方向に表示される1つの色のパッチを有する標準物差に似ている。各陰影パッチは、陰影強度の増加がEU反応度の増加を表わすようにした、特定範囲のエンドトキシン単位(EU)の反応度と関連する。観察者は、反応室アセンブリ120、140の内容物の陰影をカラーストリップのパッチと比較するために、周囲光の中でプラスチックまたは紙のカラーストリップの隣に透明な反応室アセンブリ120、140を保持することができる。観察者は次いで、反応室内に観察される色の陰影強度と最もよく合致するカラーパッチを選択することができる。陽性反応は、約0.20EU/mLに対応するかあるいは追加検査から決定された、特定の色陰影閾値によって示される。
【0081】
より正確な定量化は、上述の通り培養後の反応室を受け入れるように構成された、小型の特殊設計された単一ビーム光分光光度計により得ることができる。分光光度計は、試料を37°Fに加温するために反応室の挿入により活性化される、加熱コイルを含むことができる。分光光度計は代替的に、25分間の培養後に測定光学濃度を表示または印刷することができる。
【0082】
図11は、分光光度計を使用することなく視覚的に読み取ることのできる単回使用のカートリッジにEBCを送り出すことを可能にする、第2の代替的反応室装置を組み込んだ検査キット200の斜視図である。検査キット200は筺体202内に配置された検査モジュール203および陽性対照モジュール223を含む、2つのモジュール203、223を有する。図12は、図11の検査モジュール203の線12−12に沿って切った側面断面図である。検査モジュール203はポート204を含む。ポート204は好ましくは約100マイクロリットルの容積を有し、乾燥塊が水和により約7.4のpHを維持しかつ水性試薬を形成することを可能にする、EDTA、カルシウムおよびマグネシウムの塩、ならびにリン酸塩、または他の有機化合物と共に、因子C、因子B、プロクロッティング酵素、および発色基質の乾燥塊136を含む。
【0083】
図11では、反応室208、検査マトリクス212、1対の微小管214、216、1対の一方向弁218、220、および出口222をさらに示す。反応室208は少なくとも約250マイクロリットルの容積を有することが好ましい。ポート204および反応室208は第1微小管214によって接続される一方、反応室208は第2微小管216によって出口222に接続される。当業者は、微小管214が1つ以上の微小管を含むことができることを理解されるであろう。ポート204から反応室208を介して出口222までの一方向の流体連通を促進するために、弁218、220は第1および第2微小管214、216にそれぞれ配置される。微小管214が複数の微小管を含む場合、複数の微小管に対応するために、2つ以上の弁218、220が必要になるかもしれない。カートリッジの頂部には、一連の徐々に暗くなる色パッチが配置され、各々の徐々に暗くなる色パッチがエンドトキシン活性の徐々に増大する間隔に対応するように構成された、事前印刷カラーストリップ221がある。
【0084】
反応室208は、LPSの存在を示す色の変化がないかマトリクス212を観察できるように、透明な材料210で被覆される。反応室208内に配置されたマトリクス212は、受入れ、発色基質によって染色される不溶性ポリマーまたは他の材料から形成された表面である。適切な材料として、セルロース、アガロース、メタクリレート、ポリスチレン、ポリフェニル、ポリナフチル、ポリベンジル、ナイロン、絹、または他の繊維等から生じたポリマーが挙げられるがそれらに限定されない。マトリクス212は吸収性であるが、密に織られるので、流体が重力および毛管作用によって微小管216を通して、移動するまで、流体が反応室208内に浮遊し続けることを可能にする。利点として、マトリクス212は本質的にLPS自体を結合することができ、あるいはHA−1AおよびE5、LPB、BPI、LALF、またはポリミキシン抗生剤のようなLPS結合分子の1つを共有結合もしくは他の方法で結合することができる。したがって、マトリクス212は、未知の試料中のエンドトキシンの濃度に比例して色強度を発現させる。事前印刷カラーストリップ221との視覚的比較により、上述の通り、エンドトキシン濃度の半定量的決定が可能になる。
【0085】
検査キット200の内部は、チオ硫酸ナトリウム五水和物と、検査キット200の圧搾により破断する水の密閉アンプルとを含むこともできる。水のアンプルを破断する作用により、チオ硫酸ナトリウムの水和を開始すると、発熱反応を引き起こし、かくして検査キット200全体が約25分間約43℃に加熱される。発熱反応のための材料は検査キット200内に配置されるが、それらは、試料が導入されかつ何らかのLPS関連化学反応が発生する検査キット200内の全ての領域から分離される。
【0086】
動作時に、装置10、60、80により採取された凝縮液を、前述した乾燥塊136を含む反応室204内に注入することによって、反応が開始される。少なくとも約0.35mLの凝縮液を反応室204内に注入することが好ましい。凝縮液を注入する動作は、反応室204および微小管214における凝縮液および乾燥塊136の混合作用を引き起こし、それによってLAL反応が開始される。注入によって誘発される圧力差が毛管作用の力と結合されることにより、反応混合物は微小管214内を経て反応室208内に流入し、34〜43℃の温度で発色基質反応が続く間、そこに留まる。エンドトキシンはマトリクス212に結合されるので、発色基質から加水分解された着色分子は、凝縮液中のエンドトキシンの活性に比例する色相強度にマトリクス212を染色し、色変化は定量化のためにカラーストリップ221と視覚的に比較することができる。
【0087】
図13は、図11の陽性対照モジュール223の線13−13に沿って切った側面断面図である。陽性対照モジュール223はポート224と、反応室228と、検査マトリクス232と、ここで244で表わされる乾燥塊136と結合されたある量の乾燥LPSと、1対の微小管234、236と、1対の一方向弁238、240と、出口242とを含む。ポート224および反応室228は第1微小管234によって接続され、反応室228は第2微小管236によって出口242に接続される。ポート224から反応室228を介して出口242まで一方向の流体連通が可能となるように、弁238、240が第1および第2微小管234、236にそれぞれ配置される。図示する通り、LPS244はポート224に配置されているが、LPS244は代替的にまたは追加的に、第1微小管234内または検査マトリクス232上に配置することができることは理解されるであろう。
【0088】
第2の代替的反応室装置も次のように使用することができる。EBC試料を前述の呼気凝縮液採取装置10、60、80の1つから検査モジュールポート204内に注入し、そこから第1の検査モジュール微小管214を介して検査モジュール反応室208内へ向けることができる。好適な実施形態では、EBC試料の量は約0.35mLである。試料の量は、マトリクス212を含むウェル208が満杯になるように較正し、かくしてマトリクス212を液体で被覆させ、LPSのマトリクス212との結合を開始することが好ましい。過剰なEBCは第2検査モジュール微小管216を通して流出することができる。一方向弁218は周囲空気からのLPSの侵入を防止する。吸収性材料を216に配置することができ、外部流体漏出を防止する。
【0089】
約60秒とすることのできる比較的正確な予め定められた時間後に、検査モジュール203および陽性対照モジュール223を各々、ある量の滅菌(エンドトキシンを含まない)水で洗浄することができる。好適な実施形態では、各モジュール203、223に注入される滅菌水の量は約0.25mLである。水はそれぞれの反応室208、228を通過し、それぞれの第2微小管216、236を介してそれぞれの出口222、242から排出させられる。
【0090】
次に、LPSを含まない水は、図7および8の反応室装置120のようなアンプルに添加され、水和により約7.4のpHを維持し、水性試薬を形成するためのEDTA、カルシウムおよびマグネシウムの塩、ならびにリン酸塩、または他の有機化合物と共に、因子C、因子B、プロクロッティング酵素、および発色基質の乾燥塊136を含む、図7および8の反応室装置120のようなアンプルに添加される。ひとたび試薬が再構成されると、それはインシュリンを送達し、結核検査抗原を提供するために一般的に使用されるようなシリンジ(しばしば「TBシリンジ」と呼ばれる)(図示せず)を使用して抜き取り、検査モジュールポート204および陽性対照モジュールポート224の両方に注入することができる。検査キット200は次いで、23℃で所定の時間、例えば10分間放置して発色させ、次いで検査ウェル208に色またはパターンの変化がないか、視覚的に検査することができる。陽性対照モジュール223は、発色基質酵素系の活性を確実にするために含まれる。
【0091】
さらなる代替例では、参照によってその内容全体を本明細書に援用するNeemanらの米国特許第4370413号(’413特許)に記載されるように、細管内で凝固カスケードのゲル形成を可能にすることによって、EBC中のLPSの割合を測定することができる。図14は、本発明の第4の好適な実施形態に係る呼気凝縮液採取装置260の部分側面断面図である。この装置260は、それが二重壁22、32と、中央室24と、ピストン26、ゴムガスケット28、およびハンドル30付きのプランジャアセンブリ65と、呼気入力アセンブリ(図示せず)と、出口68と、ねじ付きノズル61と、着脱自在のプラスチックカバー69とを有するシリンジ262を含むという点では、図4のそれと同様である。これらの構成要素の各々は、シリンジ262が出口68との流体連通状態でシリンジの側部から延びるマノメータ265をさらに含むことを除き、図4の装置60のそれらと一般的に同様である。加えて、各装置60、260は針35、275を含むが、この第4実施形態の針275は、その中でEBCがLALアッセイ試薬と接触する細管として働く。したがって、針275は、図15に示すように、LPSがEBC中に存在する場合にゲル化するためのLALアッセイ試薬を予備充填された、乾燥した不溶性かつ不活性の繊維基質270により塞栓される。
【0092】
プラグ270がEBCで湿潤するまでプランジャアセンブリ65を押し下げることによって、反応を開始することができる。流出針275におけるゲル化の量は、EBC中のLPSの量に比例する。指定時間後に、プランジャアセンブリ65を再び強制的に押し下げ、マノメータ265を用いて中央室24内の押出し圧力を測定することができる。押出し圧力はEBC中のLPS濃度に比例する。
【0093】
先行する全実施形態において、試料を75℃に加熱すること、アルキルグルコシドまたはベータ1,4グルコシド結合を持つ分子を添加することをはじめ、βグルカン(因子G)との反応を防止する化学物質または方法を含めることによって、反応の特定性を向上することができることを理解されたい。
【0094】
ひとたびグラム陰性細菌感染が診断されると、抗生物質治療を開始することができる。本発明の方法は、抗生物質治療の有効性を監視するために利用することができることを、当業者は理解されるであろう。有効な抗生物質治療は、細胞膜の破裂を伴う細菌の死滅および遊離したLPSの肺胞上皮液中への放出の増加のため、吐き出された呼気凝縮液中のLPS濃度の初期増加を引き起こすかもしれないことを当業者は予測することができる。この濃度の上昇は、抗生物質の投与後最初の24〜72時間に予想される。さらに、有効な抗生物質治療は最終的に、抗生物質の投与後の続く3〜10日間に吐き出された呼気凝縮液中のLPSの濃度の低下をもたらすことを予想することができる。したがって、連続的なLPS測定を使用して治療の有効性を監視することを推量することができる。呼気中のLPS含有量の初期増加が示されず、あるいはその後の数日間の呼気中のLPS含有量の低下が示されないことは、治療に対するグラム陰性細菌の耐性を示唆することができる。
【0095】
比較的容易に無痛かつ迅速にグラム陰性細菌感染症を診断するための方法および装置を提供するので、本発明は有利である。本願は、呼気凝縮液中のLPSの濃度を測定することによって、グラム陰性細菌性肺炎を診断することを対象にする。しかし本発明は、敗血症をはじめ、それに限らず、どんな肺内グラム陰性細菌感染症の診断にも利用することができる。グラム陰性細菌感染症は同一抗生物質治療法により治療することができ、したがって、どのグラム陰性細菌感染症の診断でも、そのような感染症にかかった被験者にとって有利であることを、当業者は理解されるであろう。さらに、本発明を利用して、感染症を引き起こしたグラム陰性細菌の特定菌種を、この情報が有益である状況で、特定することができる。
【0096】
実施例
【0097】
実施例1
【0098】
起きて、協力的な、自発呼吸のできる患者がグラム陰性細菌性肺炎であるか否かを診断するために、そのような患者からの呼気凝縮液試料中のLPSを以下の手順に従って検出した。
【0099】
処置のための被験者は、次の手順に従って選択した。被験者(各群毎にN=8)は、次の3つの基準、すなわち1)肺炎の診断、2)1日10本を越える煙草を積極的に喫煙する健康な患者、および3)健康な非喫煙者に基づいて募集した。肺炎と診断された被験者を獲得するために、有色痰を生じる咳、101°Fを超える計測発熱、1立方マイクロリットル当たり12000を越える末梢白血球総数によって立証される白血球増加症、および胸部放射線写真における湿潤物の存在を含む標準的な治療背景で診断された被験者を選択した。被験者の排除基準として、抗菌剤薬物治療の使用、呼気採取を不可能にする急性疾患もしくは解剖学的異常所見、および/または肺結核の疑いが挙げられる。
【0100】
採取した呼気試料に利用された呼気凝縮装置は次に記述する通りである。装置は、高さ約50cmの変性ガラスフラスコに取り付けられた長さ1メートルのポリビニル管(内径15mm)から構成された。ガラスフラスコは特別に設計された着脱自在のガラス栓を頂部に有していたが、それ以外は標準的な実験室用のメス(フロレンス)フラスコと同様の外見であった。ガラス栓は2つの出口を有し、1つは上方に突出し90度に屈曲したガラス管の挿入用であり、もう1つは乾燥した呼気を周囲空気中に排出させることができた。ガラス管の一端をガラス管にしっくり嵌合するポリビニル管に接続した。ガラス管の他端は、フラスコのガラス球の内部に約25cm突き出した。ガラスフラスコ全体を、エタノール中のドライアイスの冷却スラリ中に沈めた。
【0101】
以下の手順で呼気凝縮液を採取した。被験者にポリビニル管を保持させ、ポリビニル管の反対側の端に取り付けられたカモノハシ形のマウスピース内に呼気を吐き出させた。被験者の呼気は、ポリビニル管を通してフラスコの凝縮室内に送られ、そこでフラスコの冷却された内側が、被験者の呼気水蒸気およびエアロゾル化された液滴を凝縮され冷凍させた。被験者に深呼吸を約30回行うように要求し、それにより約1〜3mLの試料が得られた。
【0102】
被験者から呼気試料を採取する前に、外部のエンドトキシンまたはベータグルカン分子による試料の汚染を低減するために、複数の処置を講じた。全ての構成要素は、使用中に220℃で最低4時間高圧滅菌することにより、かつエンドトキシンを除去するように設計された市販の洗浄液を使用することにより滅菌した。ポリビニル管は高圧滅菌の前に無菌箔で包んだ。無菌箔は、試料採取中、付けたままにしておいたが、ポリビニル管を取り外す前に取り外した。技術者は全ての構成要素を取り扱うのに無菌手袋を使用した。しかし、ポリビニル管の末端部6cmは、無菌手袋を着用していない被験者が把持することができた。凝縮液を溶解させた後、それを発熱物質を含まないピペット先端で凝縮室から吸引し、層状フード下で発熱物質を含まないクライオチューブに移した。背景エンドトキシンについて検査するために、次の手順に従ってガラス器および配管の「模擬」標準を実行した。2ミリリットルのエンドトキシンを含まない水(ミズーリ州セントルイスのSigma Chemical)を洗浄され高圧蒸気滅菌された凝縮室に注入し、撹拌し、次いで吸引して、凝縮液試料と同様の方法で貯蔵した。凝縮液試料および模擬標準用の水を−57℃で分析まで貯蔵した。
【0103】
エンドトキシンの存在を以下の手順に従って検出した。製造者の仕様書(米国マサチューセッツ州ファルマスのAssociates of Cape Cod、パイロクロムアッセイ)に従って、発色リムルスアッセイを用いて、非希釈溶解凝縮液について分析を実施した。反応は96ウェルマイクロタイタプレート(Associates of Cape Cod、パイロクロムマイクロタイタプレート)で、37℃で30分間行なわれ、マイクロタイタプレート分光光度計で405nmの色の変化が読み出された。1バッチ中に全ての試料が実行された。アッセイエンドトキシン標準を用いて標準曲線が達成され、R=0.997で直線状であった。
【0104】
図16は、3つの試験群の各々における患者について測定されたエンドトキシン濃度を示す散布図である。正常者、喫煙者、および肺炎患者の平均(±SD)エンドトキシン濃度はそれぞれ0.096±0.050、0.091±0.040、および0.234±0.130EU/mLであった。グラフは、0.20EU/mLがグラム陰性菌性肺炎の被験者とグラム陰性菌性肺炎でない被験者とを区別する有用な限界点であるかもしれないことを示唆している。
【0105】
肺炎であり0.20EU/mL未満の試験値を持つ2人の被験者を「A」および「B」と標識した。従来の臨床試験で、これらの被験者がグラム陰性細菌性肺炎でないことを確認した。患者Aは血液培養の結果、連鎖球菌肺炎が陽性であり、それが患者の肺炎の細菌性原因であると臨床的に推定された。患者Bは、血液培養が陰性であり、分析用の他の標本は提出されず、インフルエンザ(ウィルス性)肺炎が臨床的に疑われた。
【0106】
模擬標準からの水試料の2つは、0.10および0.14EU/mL(平均は0.12EU/mL)の値であった。したがって、0.12EU/mLはシステムの背景「ノイズ」であるとみなされ、この値を、未補正試料で決定された0.20EU/mLの限界値から減算した。この分析を用いて、0.08EU/mLより上の値を含む呼気凝縮液の試料は異常検査結果とみなされる。別の実験室で異なる凝縮装置を使用した場合、この背景補正値は異なるかもしれないことを理解されたい。
【0107】
実施例2
【0108】
人工呼吸器の助けを借りて呼吸している被験者がグラム陰性細菌性肺炎であるか否かを診断するために、そのような被験者からの呼気凝縮液試料で、次の手順に従ってLPSを検出した。
【0109】
6人の被験者が試験に参加した。人工呼吸を受けている被験者のうちの4人は肺炎の臨床的証拠を示し、抗生物質治療により処置されていた。人工呼吸を受けている被験者のうちの2人は肺炎の臨床的証拠を示さず、対照として使用された。
【0110】
以下の手順に従って呼気凝縮液試料を得た。人工呼吸システムの気管内挿入管に取り付けられた流出配管に蓄積された呼気凝縮液から分析物を得た。分析物は目視検査で透明かつ非混濁状態に見えた。
【0111】
エンドトキシンの存在を以下の手順に従って検出した。製造者の仕様書(米国マサチューセッツ州ファルマスのAssociates of Cape Cod、パイロクロムアッセイ)に従って、発色リムルスアッセイを用いて、非希釈および希釈凝縮液に分析を実施した。希釈はエンドトキシンを含まない水中に1:10、1:100、および1:1000の希釈を含んだ。反応は96ウェルマイクロタイタプレート(Associates of Cape Cod、パイロクロムマイクロタイタプレート)で、37℃で30分間行なわれ、マイクロタイタプレート分光光度計で405nmの色の変化が読み出された。1バッチ中に全ての試料が実行された。アッセイの検出の上限は0.25EU/mLであった。
【0112】
分析の結果は次の通りである。6つの試料は全て、非希釈試料では検出範囲より上であった(つまり0.25EU/mLより高かった)。肺炎の被験者の全ての1:10の希釈試料における平均エンドトキシン濃度は、線形検出の限度より上であったが、肺炎でない2人の人工呼吸患者の1:10の希釈液の平均エンドトキシン濃度は0.05EU/mLより低かった。これらのデータは、人工呼吸回路の流出配管中の目視検査で透明かつ非混濁状態に見える凝縮液の試料中の濃度が0.25EU/mLより高い場合、グラム陰性菌性肺炎が陽性になる気管支肺胞洗浄試料の存在が予測されることを示唆している。
【0113】
実施例3
【0114】
呼気凝縮液中のLPSを以下の手順に従って検出した。以下の手順に従って呼気凝縮液試料を採取するために、市販の容積1リットルのガラスフラスコを用意した。ガラスを3時間にわたって400℃に加熱し、その表面にLPSが含まれないようにした。患者が管内に呼気を吐き出したときに、患者の呼気がガラスフラスコを通過して出口から流出するように、滅菌された内径11mmの可撓性ポリビニル管をフラスコの枝部分に流体連通状態に配設した。フラスコ中の呼気凝縮液の捕獲を促進するために、フラスコを冷却材としてのドライアイスおよびエタノールスラリ混合物中に部分的に沈めた。エアルゾル化した唾液の捕獲を防止するために、管およびフラスコは、凝縮フラスコが患者の高さより上に維持されるように配設した。
【0115】
呼気を以下の手順に従って採取した。変動する健康状態の8人の被験者がフラスコに接続された管内に呼吸した。各被験者は、呼吸を追跡するためにハンドカウンタを用いてフラスコ内に100回深呼吸をした。この方法から11±4mLに等しい平均量の凝縮液が得られた。
【0116】
以下の手順に従って、市販の発色性LALアッセイ(マサチューセッツ州Cape Cod)を使用して、呼気凝縮液中のLPSを検出した。各被験者の凝縮液試料から、二つ組の50μL分注物を標準96ウェルELISAプレートの2つのウェルに移した。発色LALアッセイに必要な試薬を添加し、試薬を37℃で30分間培養した。市販のプレートウェル読取装置で405nmの光学濃度が読み出された。FDA承認情報源から得られた既知の量のLPSを使用して、標準曲線と比較することによって濃度を決定した。
【0117】
次の結果が得られた。4人の正常な志願者は全員100pg/mL未満のLPS濃度を持つことが明らかになったが、2人の他の点では健康な喫煙者は200pg/mL未満の濃度を持つことが明らかになった。臨床的に肺炎の2人の喫煙者は、800pg/mLを越えるEBC LPS濃度を持つことが明らかになった。この実験から、EBC試料のLPS含有量は、試料を提供する被験者の肺の健康に基づいて変動し得ることが結論付けられた。これらのデータはまた、健康な被験者の口腔細菌叢からの汚染無しにEBCを試料採取することができることも示唆している。
【0118】
上記の情報に基づいて、本発明に幅広い実用性および用途が考えられることは、当業者には容易に理解される。本発明の本質または範囲から逸脱することなく、本明細書に具体的に記述した以外の本発明の多くの実施形態および適応例が、多くの変形、変化、および同等の構成と同様に、本発明およびその上記の説明から明らかであり、合理的に示唆される。したがって、本発明を本明細書ではその好適な実施形態に関連して記載したが、この開示は本発明の単なる例証および例示であって、本発明の完全かつ実施を可能にする開示を提供する目的のために行ったにすぎないことを理解されたい。上記の開示は、本発明を限定したり、あるいはそのような他の実施形態、適応例、変形、変化、または同等の構成を排除することを意図したものではない。本発明は、本明細書に添付する請求項およびそれらの同等物によってのみ限定される。本明細書で特定の用語を使用したが、それらは限定のためではなく、一般的かつ説明的な意味で使用されているにすぎない。
【技術分野】
【0001】
本願は、2004年6月7日出願の米国特許仮出願第60/577641号の特典を主張し、かつその優先権を主張し、その内容全体を参照によって本明細書に援用する。
【0002】
本願はまた、2002年12月20日出願の米国特許仮出願第60/434916号および2003年2月14日出願の米国特許仮出願第60/447581号の特典を主張する2003年12月19日出願の米国特許出願第10/742721号の一部継続出願でもある。上記出願の各々の内容全体を参照によって本明細書に援用する。
【0003】
さらに、本願は、2003年2月14日出願の米国特許仮出願第60/447581号の特典を主張する2004年2月13日出願の米国特許出願第10/778477号の一部継続出願である。上記出願の各々の内容全体を同様に参照によって本明細書に援用する。
【0004】
本発明は、一般的にグラム陰性細菌性肺炎を診断するための方法および装置に関し、さらに詳しくは、呼気凝縮液中のリポ多糖体の存在を検出することによるグラム陰性細菌性肺炎の診断に関する。
【背景技術】
【0005】
肺炎は、かなりの罹病率および死亡率を持つ一般的な病気の代表である。肺炎は、米国における感染症による死亡原因の第1位であり、よくある死亡原因の第6位である。National Hospital Ambulatory Medical Care Survey(全国病院外来医療調査)は、2001年に148万人の救急診療部外来が肺炎の診断に関係したことを明らかにした。National Hospital Discharge Survey(全国病院退院調査)は、1998年に132万人の患者が肺炎を治療した後に退院したことを明らかにした。
【0006】
肺炎は、ウィルス、クラミジア、マイコプラズマ、原虫、菌類、および細菌を含め、多種類の微生物の肺感染が原因となり得る。肺炎の疑いがある患者に対して、感染因子を特定することが抗菌治療の選択を決定付けるので、臨床医は感染の正確な原因を突き止める義務がある。西洋社会における最も一般的な原因は細菌性肺炎であり、細菌性肺炎が疑われる場合、臨床医は一般的に細菌性肺炎の原因をグラム陽性、グラム陰性、または嫌気性に分類しようとする。
【0007】
特に、グラム陰性肺感染は侵攻的であり、高い合併症率および死亡率に結びつくので、臨床医はグラム陰性細菌感染の有無を確認するように動機付けられる。細菌のグラム陰性の特徴は、当業者にはよく理解されている染色手順後の細菌の色に関連する。グラム陰性細菌性肺炎を含め、グラム陰性細菌感染は、他の種類の細菌感染の治療とは異なる特定の抗菌治療を必要とし、メディケアのような第三者支払者からの高水準の財政償還を正当化する。
【0008】
現在の臨床実務では、肺炎は臨床、検査、および放射線画像の情報を結集することによって診断される。一般的に、患者の訴え、患者のバイタルサイン、末梢白血球数、および胸部放射線撮影の結果のような特徴が、肺炎の有無を決定するために使用される。これらのデータ源が典型的なパターンと一致したとき、合理的な臨床的確信を持って診断を下すことができ、細菌培養の結果が出る前に抗菌治療を開始することができる。グラム陰性感染症の抗生物質治療を開始するために、非特異的な臨床データがしばしば使用されるが、一般的実務では、グラム陰性菌性肺炎の最終的診断にはグラム陰性細菌性肺感染症のより特異的な証拠が必要であるとされる。
【0009】
この目的のために、下気道から喀出された痰に直ちにグラム染色を実行することができ、顕微鏡分析によりグラム陰性感染を示唆する形態および色を持つ細菌を明らかにすることができる。しかし、肺炎のヒトから有用な痰試料を得ることが難しいことはよく知られている。肺炎と一致する臨床パターンを有する患者からの血液試料培養物がグラム陰性細菌を成長させる場合、これはグラム陰性菌性肺炎の特異的な指標となる。残念ながら、たいていの場合、グラム陰性菌性肺炎の患者の血液は無菌である。
【0010】
さらに、患者の血液は、エンドトキシン分子について化学アッセイを用いてエンドトキシン濃度を検査することができる。しかし、エンドトキシン濃度は、より一般的な敗血症症候群の原因または重篤度のいずれについても不正確な予測因子であることが分かっている。血中のエンドトキシン濃度は、短時間の間に大幅に変動することがある。さらに、肝疾患、多発性外傷、高血圧症、および血液悪性腫瘍を含め、特定の疾病状態は、臨床的に重大な感染症が無くても、エンドトキシン濃度の慢性的な上昇に関係する。循環エンドトキシン濃度で肺炎のグラム陰性病因を予測することができるか否かについては研究されていない。
【0011】
グラム陰性肺炎感染を診断する高感度の特異的方法は、気管支肺胞洗浄を実行し、洗浄液で細菌培養を実行することである。別の方法は、気管支肺胞洗浄液試料中のリポ多糖体成分について化学的に分析することである。この方法を使用する研究者らは、高濃度のリポ多糖体が気管支肺胞液の培養中のグラム陰性細菌の同時成長に関連付けられることを発見した。この方法の完全な記述は、Flanagan,P.G.、Jackson,S.K.、Findlay,G.の「Diagnosis of Gram negative, ventilator associated pneumonia by assaying endotoxin in bronchial lavage fluid」、J.Clin.Pathol.2001,54:107〜110、およびPugin,J.、Auckenthaler,R.、およびDelaspre,O.の「Rapid Diagnosis of Gram−negative pneumonia by assay of endotoxin in bronchoalveolar lavage fluid」、Thorax 1992,47:547〜549に見ることができる。どちらの方法も、特殊内視鏡装置および下位専門分野の専門知識が必要であり、かつそれらが比較的侵襲性で不快な処置であるという欠点を有する。さらに、公知の培養方法は結果を得るまでに少なくとも24時間を要する。したがって、患者は有効な抗生物質治療を受けるまで、少なくとも24時間待つことがある。
【0012】
グラム陰性細菌の細胞壁はエンドトキシンを含む。エンドトキシンは細胞溶解で細菌から放出される有毒物質である。エンドトキシンは熱を誘発するその能力が最初に認識されたが、今は広範囲の生物活性を持つことが知られている。溶菌により、リポ多糖体およびタンパク質および脂質の凝集体から構成されるエンドトキシンが、細菌から周囲の培地に放出される。エンドトキシンは主にリポ多糖体(「LPS」)と、様々な量のタンパク質および脂質から構成される。細菌エンドトキシンに通常起因する生物活性のほとんど全てが、単離された化学的に純粋なリポ多糖体でも誘発させることができるので、用語「エンドトキシン」および「リポ多糖体」は互換的に使用される。
【0013】
病原性の観点から、リポ多糖体の存在はグラム陰性感染の最も重要な影響の1つである。したがって、患者の体液中のリポ多糖体の検出はグラム陰性細菌感染の指標である。さらに詳しくは、患者の体液中のリポ多糖体の存在は、グラム陰性菌性肺炎の重要な潜在的指標である。
【0014】
本発明は、呼気の凝縮液に由来する液体に対しリポ多糖体の分析を実行することによるグラム陰性細菌性肺炎の診断における、上述した臨床上の欠点を克服する。本明細書に記載する新規の装置および方法を使用して、呼気凝縮液は、自発呼吸する被験者からマウスピース、フェイスマスク、もしくは他の同様の手段を介して、または機械的人工呼吸器の助けを借りて呼吸する被験者から機械的人工呼吸器の呼気配管への接続を介して、得ることができる。本発明の追加の利点は、肺炎のようなグラム陰性細菌感染症を診断する時間が、他の診断方法の場合に要する時間より短いことである。
【0015】
呼気凝縮液を採取するための代替的装置も公知である。これらの装置として、Gastonらの米国特許第6033368号および第6419634号、Huntらの米国特許第6585661号、Baddourの米国特許出願第10/257912号、およびWinselらの欧州特許0759169号に開示されているものが挙げられ、これら全部の内容全体を参照によって本明細書に援用する。加えて、Klineの米国特許出願第10/742721号および第10/778477号すなわち2つの同一出願人に譲渡された非仮特許出願は、呼気を採取するための装置を開示しており、それらの内容を参照によって本明細書に援用する。
【0016】
呼気凝縮液は、2001年にKharitinovらによって概説された通り、多くの肺疾患のマーカとして役立つことのできる多くの分子を含むことが知られている(Biomarkers 7(1):1〜32,2002)。しかし、グラム陰性菌性肺炎または他のグラム陰性細菌感染症を診断する目的のために呼気凝縮液中のリポ多糖体を測定するという概念は、これまで開示されていない。
【発明の概要】
【0017】
本発明は、被験者から採取された呼気凝縮液中のリポ多糖体の有無に基づいて、被験者がグラム陰性細菌性肺炎であるか否かを決定するための方法を含む。本発明はさらに、自発呼吸する被験者および人工呼吸する被験者の両方から呼気凝縮液を採取するために利用される採取装置、ならびに採取された呼気凝縮液中にリポ多糖体が存在するか否かを決定するために利用される装置を含む。
【0018】
広義には、本発明は、1態様では、空気呼吸する脊椎動物被験体から呼気凝縮液を採取し、採取された呼気凝縮液中のリポ多糖体の濃度を測定し、かつ呼気凝縮液中のリポ多糖体の測定された濃度に基づいて被験体が肺内グラム陰性細菌感染症であるか否かを決定することを含む、空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染を診断し監視するための方法である。
【0019】
この態様の特徴には、肺内グラム陰性細菌感染症は肺炎であり、肺内グラム陰性細菌感染症は気管支炎であり、該方法は被験体が肺内グラム陰性細菌感染症であるという陽性判定に応えて抗生物質治療を選択することをさらに含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は哺乳類被験体から呼気凝縮液を採取することを含み、該方法は抗生物質治療に対する哺乳類被験体の反応を監視することをさらに含み、該方法は肺内グラム陰性細菌の特定の菌株を特定することをさらに含み、特定するとは、リポ多糖体分子のO‐単糖類部の決定に基づいて肺内グラム陰性細菌の特定の菌株を特定することを含み、リポ多糖体の濃度の測定は、リムルス変形細胞溶解物分析を用いてリポ多糖体の濃度を測定することを含み、少なくとも約0.20エンドトキシン単位/mL(EU/mL)のリポ多糖体の測定濃度はグラム陰性細菌感染の存在を示し、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取が、自発呼吸する被験体からの呼気凝縮液の採取を含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取が人工呼吸する被験体から呼気凝縮液を採取することを含み、かつ空気呼吸する脊椎動物被験体からの呼気凝縮液の採取が、凝縮を促進するために約32°F以下の温度に冷却することのできる内壁を有する室を備えた呼気凝縮液採取装置を利用することを含む。
【0020】
本発明は、別の態様では、空気呼吸する脊椎動物被験体から呼気凝縮液を採取し、反応試薬が内部に配置された反応室を用意し、採取された呼気凝縮液の少なくとも一部分を反応室に送り込み、採取された呼気凝縮液の少なくとも一部分が反応室に送り込まれたときに発生する物理的変化に基づいて、被験体が肺内グラム陰性細菌感染症であるか否かを決定することを含み、前記物理的変化が呼気凝縮液中のリポ多糖体の存在によって引き起こされる、空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法である。
【0021】
この態様の特徴では、反応試薬はリムルス変形細胞溶解物、発色基質、および/または蛍光基質を含み、反応試薬は呼気凝縮液の少なくとも一部分の送り込みによる発熱反応を通して熱を放出する化学物質を含み、物理的変化はゲルの形成であり、該方法は反応室における色の変化を標準に視覚的に突き合わせることをさらに含み、前記標準は増加する色相強度のカラーパッチの印刷帯片を含み、各カラーパッチはリポ多糖体の増加する濃度にそれぞれ対応し、1ミリリットル当たり0.2エンドトキシン単位の濃度に対応する色相強度は肺内グラム陰性細菌感染の存在を示し、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は自発呼吸する被験体から呼気凝縮液を採取することを含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は機械的人工呼吸する被験体から呼気凝縮液を採取することを含み、空気呼吸する脊椎動物被験体からの呼気凝縮する液の採取は、凝縮を促進するために温度を約32°F以下に冷却することのできる内壁を有する室を備えた呼気凝縮液採取装置を利用することを含み、呼気凝縮液の少なくとも一部分の送り込みは、呼気凝縮液の少なくとも一部分を皮下注射針を介して反応室内に注入することを含む。
【0022】
本発明は、別の態様では、空気呼吸する脊椎動物被験体から呼気凝縮液を採取し、内部表面を持つ反応室を用意し、その反応室はその中に配置されたリポ多糖体と結合する物質を有し、採取された呼気凝縮液の少なくとも一部分を反応室に送り込み、反応室を緩衝液で洗浄し、反応試薬を反応室に送り込み、採取された呼気凝縮液の少なくとも一部分が反応室に送り込まれたときに生じる物理的変化に基づいて被験体が肺内グラム陰性細菌感染症であるか否かを決定することを含み、前記物理的変化が呼気凝縮液中のリポ多糖体の存在によって引き起こされる、空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染を診断し監視するための方法である。
【0023】
この態様の特徴では、反応試薬は発色基質および/または蛍光基質を含み、結合剤は特定種のリポ多糖体と結合する抗体であり、抗体は反応室の表面の内部に配置され、結合剤は不溶性ポリマーである。結合剤は反応室内に配置された基質表面に埋め込まれ、該方法は反応室における色の変化を標準に視覚的に突き合わせることをさらに含み、前記標準は増加する色相強度のカラーパッチの印刷帯片を含み、各カラーパッチはリポ多糖体の増加する濃度にそれぞれ対応し、1ミリリットル当たり0.2エンドトキシン単位の濃度に対応する色相強度は肺内グラム陰性細菌感染の存在を示し、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は自発呼吸する被験体から呼気凝縮液を採取することを含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は人工呼吸する被験体から呼気凝縮液を採取することを含み、空気呼吸する脊椎動物被験体からの呼気凝縮液の採取は、凝縮を促進するために温度を約32°F以下に冷却することのできる内壁を有する室を備えた呼気凝縮液採取装置を利用することを含み、呼気凝縮液の少なくとも一部分の送り込みは、呼気凝縮液の少なくとも一部分を皮下注射針を介して反応室内に注入することを含む。
【0024】
本発明は、別の態様では、空気呼吸する脊椎動物被験体から細管を有する採取装置で呼気凝縮液を採取し、リポ多糖体に暴露されるとゲル化を引き起こす酵素を含浸させた繊維プラグを細管内に挿入し、採取された呼気凝縮液試料の少なくとも一部分を細管に導入して繊維プラグを湿潤させ、細管内で発生するゲル化の量に基づいて被験者が肺内グラム陰性細菌感染症であるか否かを決定することを含み、前記ゲル化が呼気凝縮液中のリポ多糖体の存在によって引き起こされる、空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染を診断し監視するための方法である。
【0025】
この態様の特徴では、繊維プラグはリムルス変形細胞溶解物由来の酵素を含浸し、該方法は採取装置内に配置されたシリンジを用意することをさらに含み、前記シリンジは液圧を測定するためにその片側に配置されたマノメータを有し、細管はシリンジの端部に配置された皮下注射針である。
【0026】
本発明は、別の態様では、被験者の呼吸を促進するための機械的人工呼吸回路、その人工呼吸回路は被験者の呼気を取り除くための導管として働く呼気流管を含み、内部を有する中央室であって、凝縮を促進するために約32°F以下の温度に冷却することができ、中央室の内部および呼気流管と流体連通するように中央室の一端に配置された呼気入力アセンブリであって、それによって呼気流管と中央室とを接続する呼気入力アセンブリと、中央室の内部と流体連通するように中央室の他端に配置された出口アセンブリと、中央室から呼気凝縮液を採取するために出口アセンブリに接続された真空装置とを備える、機械的人工呼吸回路の助けを借りて呼吸する被験者から呼気凝縮液を採取するための装置である。
【0027】
本発明は、別の態様では、内部ならびに第1および第2の対向端を有する中央室と、中央室の内部と流体連通する呼気入力アセンブリと、中央室の内部と流体連通する出口アセンブリとを含み、前記出口アセンブリが細管を含み、前記細管がその中に配置された繊維プラグを有し、リポ多糖体に暴露されるとゲル化を引き起こす反応試薬を前記プラグに含浸させて成る.呼気凝縮液採取装置である。
【0028】
この態様の特徴では、プラグはリムルス変形細胞溶解物に由来する酵素を含浸させた繊維基質であり、該装置は、ピストンおよびハンドルを有するプランジャアセンブリをさらに含み、ピストンは中央室の内部に摺動自在に配置され、ハンドルはピストンを中央室内で移動することができるように中央室の第1端から延び、それによって採取された呼気凝縮液が細管内に配置された繊維プラグと接触することができる。
【0029】
本発明は、別の態様では、反応室と、呼気凝縮液を反応室内に送り込むための送り込みポートと、呼気凝縮液中に存在するリポ多糖体と反応する反応試薬と、反応室内の物理的変化の視覚的な検出を可能にする目視部とを含む、呼気凝縮液中のリポ多糖体の濃度を測定するための反応室アセンブリである。
【0030】
この態様の特徴では、送り込みポートは、呼気凝縮液の送り込みのために皮下注射針を穿刺することのできる再封可能な蓋である。目視部は透明な壁である。反応室は内部表面をさらに含み、リポ多糖体固定剤は反応室の内部表面の少なくとも一部分に結合され、リポ多糖体固定剤はモノクローナル抗体、ポリクローナル抗体、ポリミキシン抗生剤、リポ多糖体結合タンパク質、およびカブトガニ抗リポ多糖体因子から構成される群から選択され、反応室は反応室内に配置された化学物質をさらに含み、該化学物質は水和反応により熱を放出し、それによって化学物質の水和により、15〜30分間、34〜43℃の範囲の温度が達成され、化学物質は半透性基質中の塩であり、化学物質は結晶形態の塩であり、化学物質はチオ硫酸ナトリウム五水和物である。
【0031】
本発明は、別の態様では、筺体と、筺体内に配置された検査モジュールであって、ユーザ始動化学反応を利用して呼気凝縮液中のリポ多糖体の存在を検出する前記検査モジュールと、筺体内に検査モジュールに隣接して配置された陽性対照モジュールであって、リポ多糖体の存在について確実な陽性結果を示すためにその内部に配置されたリポ多糖体を有する、検査モジュールとの比較用の前記陽性対照モジュールとを含む、呼気凝縮液中のリポ多糖体の存在を検出するための検査キットカートリッジである。
【0032】
この態様の特徴では、筺体内に配置された化学物質は制御された発熱反応をもたらし、それにより34℃から43℃の間の温度が15〜30分の期間達成され、化学物質はチオ硫酸ナトリウム五水和物であり、検査キットの各モジュールは再封可能な注入ポートと、反応ウェルと、反応ウェルと注入ポートとの間の流体接続部と、流体接続部に配置された第1の一方向弁と、反応ウェルの出口を提供する出口管と、出口管に配置された第2の一方向弁とを含み、各反応ウェルは物理的変化の視覚的決定を可能にするように適応された透明なカバーを含み、各反応ウェルは不溶性高分子リポ多糖体結合基質を含み、陽性対照モジュールの反応ウェルは適切な種のグラム陰性細菌に由来するリポ多糖体を含み、検査キットカートリッジは反応室から再構成される発色基質をさらに含み、検査キットカートリッジは徐々に増加する色相強度のカラーパッチを有するカラーストリップをさらに含み、各カラーパッチは所定の範囲のエンドトキシン単位に対応して、反応ウェルの色変化との視覚的な比較を可能にし、筺体はポリマーから形成され、ポリマーはプラスチックである。
【0033】
本発明の適用可能なさらなる領域は、下述する詳細な説明から明らかになるであろう。詳細な説明および特定の実施例は、本発明の好適な実施形態を示すものであるが、単に説明を目的とするにすぎず、本発明の範囲を限定するつもりはないことを理解されたい。
本発明のさらなる特徴、実施形態、および利点は、図面に関連する以下の詳細な説明から明らかになるであろう。
【図面の簡単な説明】
【0034】
【図1】リポ多糖体の基本構造の略図である。
【図2】本発明の第1の好適な実施形態に係る呼気凝縮液採取装置の側面断面図である。
【図3】図3Aはプランジャアセンブリが部分的に押し下げられた位置にある状態の図2の呼気凝縮液採取装置の部分側面断面略図である。図3Bはプランジャアセンブリが完全に押し下げられた位置にある状態の図2の呼気凝縮液採取装置の部分側面断面略図である。
【図4】本発明の第2の好適な実施形態に係る呼気凝縮液採取装置の部分側面断面図である。
【図5】本発明の第3の好適な実施形態に係る呼気凝縮液採取装置の側面断面図である。
【図6】本発明の好適な実施形態の代替的人工呼吸システムの略図である。
【図7】図2、4、および5の採取装置と共に使用するのに適した反応室装置の側面断面略図である。
【図8】図7の反応室装置の上面図である。
【図9】第1の代替的反応室装置の側面斜視図である。
【図10A−B】図9の第1の代替的反応室装置の部分側面断面図である。
【図10C−D】図9の第1の代替的反応室装置の部分側面断面図である。
【図11】第2の代替的反応室装置を組み込んだ検査キットの斜視図である。
【図12】図11の検査モジュールの線12−12に沿って切った側面断面図である。
【図13】図11の陽性対照モジュールの線13−13に沿って切った側面断面図である。
【図14】本発明の第4の好適な実施形態に係る呼気凝縮液採取装置の部分側面断面図である。
【図15】図14の針の拡大部分側面断面図である。
【図16】3つの試験群の各々における患者の測定エンドトキシン濃度を示す散布図である。
【発明を実施するための形態】
【0035】
本発明の方法は、呼気凝縮液を利用して、LPSが呼気凝縮液中に存在するか否かを決定し、かくして被験者が肺内グラム陰性細菌感染症であるか否かを決定する。本願はグラム陰性細菌性肺炎を診断することに向けられる。しかし、当業者は、本発明が有効であるどんなグラム陰性細菌感染症でも検出するために利用できることを理解されるであろう。グラム陰性細菌感染症と診断された患者は、診断がグラム陰性菌性肺炎であろうと、別のグラム陰性細菌感染症であろうと関係なく、同じ抗菌治療で処置される。本明細書に記載するLPSを検出するための方法論はリムルス変形細胞溶解物アッセイであるが、本発明ではELISAアッセイおよびウサギのパイロジェン試験を含むが、それらに限らない、LPSの存在を検出するためのどんな方法論でも利用できることを、当業者は理解されるであろう。
【0036】
肺内LPS含有量は、呼気凝縮液試料を提供する被験者の肺の健康状態に基づいて変動することがあり得る。一般的に、少なくとも約0.2EU/mLの呼気凝縮液中のLPSの濃度は、臨床検査陽性閾値に対応し、肺内のグラム陰性細菌感染の存在を示す。EUはエンドトキシン単位である。細菌の種類間で変化するリポ多糖体の可変作用強度のため標準化することのできない典型的な質量濃度とは異なり、EUは標準化することができるので、USDAは、エンドトキシンの濃度をエンドトキシン単位で報告することを勧告している。エンドトキシン単位は、未知の試料に含まれるLPS反応性の量を指す。この反応性の量は、既知の量のLPS作用性を有する大腸菌のFDA承認菌株から導出された標準曲線からの補間によって決定される。
【0037】
呼気凝縮液を採取するために使用する装置は、自然に発生するLPSによる「背景」水準のLPSを含むことが可能である。この背景濃度を明らかにするために、LPSが含まれない水を装置に注入することによって、呼気採取に使用される装置で「模擬」標準を実行することができる。次いで、明らかになった水試料中のLPS濃度値が明らかになった呼気凝縮液試料中のLPS濃度値から除算して、システムの背景「ノイズ」を除去する。LPSの背景濃度は、採取に使用される装置によって変化する。
【0038】
呼気凝縮液採取装置、つまり下述する本明細書で、さらに詳細にその幾つかの実施例では、グラム陰性細菌性肺炎と同義の症状を呈する患者から、感染症を示す量のLPS含有量の検出のために、呼気凝縮液を採取するために使用することができる。
【0039】
ここで、図面に関して、幾つかの図を通して同様の数字は同様の構成要素を表わしている図面を参照しながら、本発明の好適な実施形態について次に説明する。好適な実施形態の以下の説明は、本来、単なる例証であって、本発明、その用途、または使用を制限する意図は全く無い。
【0040】
図1は、リポ多糖体の基本構造の略図である。この構造は全てのグラム陰性細菌の細胞壁に見られる。リポ多糖体(エンドトキシンともいう)は重さ約10Kdの複合糖脂質である。リポ多糖体の基本構造は3つの比較的よく定義された領域を含み、全てのグラム陰性細菌で同様である。これらの領域はO−抗原部、コア多糖類、および脂質Aである。O−抗原部は各々が2〜6個の単糖類を有する反復多糖類単位から構成される。O−抗原部はグラム陰性種の間でかなり異なり、したがって、特異的モノクローナル抗体の結合に基づいて、個々の細菌種のマーカとして役立つことができる。コアはO−抗原部と脂質Aとの間に存在し、グルコース、N−アセチルグルコースアミン、およびガラクトースのような代表的な糖質を有する分枝多糖類である。O−抗原部とは異なり、コア領域全体にわたって微小な変化があるだけであり、脂質Aに近接する内部コア領域の構造は高度に保存される。LPS分子の最も高度に保存される部分は、長鎖脂肪酸が結合された脂質A、二リン酸化二糖体である。分子の脂質A部分は事実上全ての真核細胞組織で毒性を持つ。ヒトでは、これはサイトカインの誘導、発熱、白血球増加症、白血球の漸増および活性化、血管の損傷、血管拡張、血管内凝固、および組織の損傷を含む。
【0041】
LPSを検出し定量化する1つの受け入れられた方法は、カブトガニ(リムルスポリフェムス(limulus polyphemus))からの変形細胞の水性抽出液に対するLPSの毒性作用を利用する。本願で使用する用語「変形細胞」とは血球を指す。一般的に、リムルス変形細胞溶解物(「LAL」)アッセイとして一般的に知られるこの方法は、米国特許第4322217号、第5310657号、および第5702882号に記載されている。他の認められた方法として、生体外ウサギパイロジェンアッセイおよびヒトパイロジェンアッセイが挙げられ、それらは当業者には周知であるので、ここでは詳述しない。
【0042】
簡単に要約すると、LALはLPSで培養されたときに凝固ゲルを形成し、それは少量のLPSの検出を可能にする。さらに詳しくは、LALアッセイでは、LPSは、変形細胞に含まれる因子Cとして一般的に知られる酵素を活性化する。活性化された因子Cは次に、因子Bの特定部位を加水分解することによって因子Bを活性化する。活性化された因子Bはプロクロッティング(proclotting)酵素を活性化して、それを凝固酵素に変換する。凝固酵素は次いでコアグローゲン(凝固タンパク質、分子量:19723)を特定部位(つまりArg8−Thr19およびArg46−Gly47)で開裂し、混合物のゲル化を引き起こす。加えて、凝固酵素が機能することを可能にする6.5と7.4との間のpHを維持するために、カルシウム塩、マグネシウム塩、およびリン酸塩のような補因子、またはヒドロキシメチル(「TRIS」)アミノメタン緩衝液のような他の有機化合物が存在しなければならない。
【0043】
LALアッセイで凝固ゲルの形成に基づいてLPSを検出するために、様々な技術が利用されてきた。一部の技術には、単純にゲルの形成を待ってLPSの存在を決定するエンドポイントアッセイなどもある。他にはより複雑であり、比濁時間分析法を使用して、LALアッセイにおける凝固が発生するにつれて増加する濁度を測定する。
【0044】
ゲルの形成を正確に決定することに関連する問題点を克服するために、発色基質または蛍光基質を使用する代替的分析方法論を使用してLPSが検出されてきた。この代替的方法論は、合成基質のアミド結合を加水分解する、上記のカスケード反応で形成された凝固酵素に依存する。合成基質は、凝固酵素によって加水分解されたときに遊離するマーカ分子または化合物に共有結合することができる。遊離したマーカは次いで比色法または分光光度法によって検出することができ、かくしてLPSの存在が示される。合成基質の例として、t−ブトキシカルボニル−ロイシル−グリシル−アルギニン−パラニトロアニリド(N−t−Boc−Leu−Gly−Arg−pNA)、N−t−Boc−Val−Leu−Gly−Arg−pNA(配列番号:1)、ベンジルオキシカルボニル−ロイシル−グリシル−アルギニン−パラニトロアニリド(Z−Leu−Gly−Arg−pNA)、Boc−Ile−Glu−Gly−Arg−pNA(配列番号:2)、Boc−Val−Ser−Gly−Arg−pNA(配列番号:3)、またはBoc−Ser−Gly−Arg−pNAを挙げることができるが、これらに限定されない。これらは全てパラニトロアニリンを遊離し、それは反応混合物を黄色にする。発色アッセイの特別な例として、Lingの米国特許第6645724号およびTamuraらの米国特許第5702882号に記載されている。
【0045】
また、カブトガニから酵素を得るのではなく、組換えバイオ技術によって生体外凝固カスケードに必要な酵素を合成することも可能である。そのような合成酵素は、発色法を使用して、未知の溶液中のLPSを検出し定量化するために使用することができる。
【0046】
LPSを捕獲し検出する他の代替的方法も公知である。LPS結合剤、例えば不溶性マトリクスポリマーの形のポリミキシン抗生剤または樹脂は、LPSを固定し、その後上述した比濁法、発色法、または蛍光発生法のいずれかによってLPSを検出するように、支持体に結合することができる。加えて、LPSはLPSに対し高い親和性を持つ任意の個数の抗体によって固定することができる。抗体はY字状構造を有し、2つの基本的ユニットを含む。第1のユニットはフラグメント−抗原結合部(「Fab」)であり、それは抗原に、この状況ではLPSに結合する。第2のユニットはフラグメント結晶化部分(「Fc」)である。Fcユニットは抗体を固定面に結合するハンドルとして機能することができる。潜在的に有用な抗体として、ポリクローナルまたはモノクローナル抗体、例えば脂質A反応性モノクローナル抗体(「HA−IA」)およびマウスの抗エンドトキシン免疫グロブリンM(「E5」)、リポ多糖体結合タンパク質(「LBP」)および関連タンパク質、殺菌性/浸透性増加タンパク質(「BPI」)、ならびにリムルスの抗LPS因子(「LALF」)が挙げられるが、それらに限定されない。
【0047】
酵素結合免疫測定技術を利用する方法も公知であり、選択された様々なマトリクス結合抗体を使用して、特定のエンドトキシンおよび特定の細菌の種類を捕獲し検出することができる。検出することのできる細菌からのエンドトキシンの例として、エシェリキア、ボルデテラ、ブランハメラ、サルモネラ、ヘモフィルス、クレブシエラ、プロテウス、エンテロバクタ、シュードモナス、パスツレラ、アシネトバクタ、クラミジア、およびナイセリア、ならびに一般的にそのLPSが選択された抗体に結合することのできる任意の細菌が挙げられるが、それらに限定されない。
【0048】
さらに、β−1,3グルカン類(β−D−グルカン類)の存在もまた上述の凝固カスケードを活性化させることができることが認識されている。この偽陽性効果を制限するために特定の処置を講じることができることを、当業者は理解されるであろう。
【0049】
本発明は、自発呼吸する被験者または機械的人工呼吸処置を受けている患者からの呼気凝縮液(「EBC」)の迅速な(例えば30分未満)非侵襲性採取に続いて、LPSの濃度についての凝縮液の1段階定量分析または半定量分析を可能にするように設計された、幾つかの採取装置を含む。自発呼吸する被験者では、呼気凝縮液は一般的に口唇によって保持されるマウスピースを介して採取される。しかし、重度の呼吸困難な患者では、試料は、呼気ガスおよびエアロゾルを下述するような凝縮室内に迂回させながら、酸素の送り込みを可能にする気密性のぴったり嵌合する顔マスクを患者に装着することによって採取することができる。
【0050】
一般的に、呼気凝縮液採取装置は各々、呼気の凝縮を可能にするように32°F未満の温度に冷却することのできる、無菌のLPSを含まない内壁を有する採取室を備える。これらの呼気凝縮液採取装置は使い捨てであり、かつ軽量であることが好ましい。各装置は同軸室を含み、外部からまたは内部吸熱反応を介して冷却することのできる冷却剤を介在する領域に含む。そのような呼気凝縮液採取装置については、発明者および譲受人が本願と共通する上記の米国特許出願第10/742721号および第10/778477号に概説されている。しかし、本明細書に記載しかつ例証する装置は、どの先行技術の装置にも含まれない追加の新規かつ有用な特徴を有する。
【0051】
図2は、本発明の好適な実施形態に係る呼気凝縮液採取装置10の側面断面略図である。この構成は、協力的なヒトに使用するのに特に適している。呼気凝縮液採取装置10は二重壁のシリンジ20および呼気入力アセンブリ50を備える。シリンジ20の内壁22は、ピストン26と、ゴムガスケット28と、シリンジ20の一端から延びるハンドル30とを備えるプランジャアセンブリ25が中に装着される、円筒状の中央室24を画定する。外壁32は、内壁22および外壁32の間に狭い空間が形成されるように、内壁22の周囲に配設される。製造中に、内壁22および外壁32の間の空間には冷却材34のジャケットを充填することができ、次いで外壁32は漏れを防止するために内壁22に封着することができる。好適な実施形態では、冷却材34として水を使用することができるが、ポリエチレングリコール(「PEG」)等のような他の材料も同様に使用することができることは明瞭である。
【0052】
シリンジ20は、入口36と、出口38と、1対の一方向弁40、42とをさらに備える。中央室24を通る呼気の単一方向のみの通過を促進するために、第1弁40は入口36に隣接して配置することのできる吸込み弁であり、第2弁42は出口38に隣接して配置することのできる出口弁である。中央室24内に採取された物質をピストン26によって出口38から押し出すことができるようにするために、出口38はプランジャハンドル30の反対側の端に配置することが好ましい。出口38は、ニップル状のノズル39の端部に配置することができる。ノズル39はまた、その遠端にルアーロックの雌部のような取付具をも備えることができる。そのような取付具は、ノズル39に保護カバーまたは他の付属品を取り付けることを可能にする。弁40、42は様々な図に単に模式的に示したが、それらは例えば、プラスチックまたは別の変形可能なポリマーから形成された2つまたは3つの自己密閉リーフを含むことができる。そのような弁の設計は、当業者には明らかであろう。
【0053】
ピストン26は、プランジャアセンブリ25が完全に押し下げられたとき、ノズル39内にしっくり嵌合するのに適した寸法および形状の先端または突起27を備える。先端27は、先端27の基部の周囲に配設されかつ皮下注射針のような針35がその中に配設される中空の中心シャフトまたはコンジット33に接続する、複数の放射状コンジット31を備える。放射状コンジット31および中心コンジット33は約1mmから2mmの間の直径であることが好ましく、針35の外径は、中央コンジット33内にしっくり嵌合するために、同様に約1mmから2mmの間の直径であることが好ましい。
【0054】
さらに、ピストン26はシリンジ20の一端を埋め、反対側の端に出口38が配設されるので、入口36はシリンジ20の側部の内壁および外壁22,32の両方を貫通するように構成されることが好ましい。中央室24を通過する呼気と内壁22の内面44との間で最大の相互作用を引き起こすために、入口36はできるだけピストン26の近くに配設することが好ましいが、これらの構成要素の他の配置構成も、本発明の範囲から逸脱することなく、同様に可能であることは明らかであろう。
【0055】
呼気入力アセンブリ50はマウスピース52と、フィルタ54と、呼気をマウスピース52からシリンジ20の入口36へ誘導するために必要ないずれかの配管56とを備える。マウスピース52は、患者の口の領域と快適に接触することができるように、適切なサイズおよび形状である。唾液および他の液体または最小限の大きさの固形物がそこを通過してシリンジ20内に送られるのを防止するために、穿孔および連続貫入を有するポリマー材を含むフィルタ54を、マウスピース52とシリンジ入口36との間の配管56内に配設することができる。呼気入力アセンブリ50を通過する空気が上昇移動するように、呼気入力アセンブリ50をシリンジ20の下に配設することによって、唾液が中央室24に到達することをさらに防止することができる。この配置構成で、唾液および他の液体または固形物に対する重力の作用は、そのような物質は代わりに配管56内に集まり易くなるので、それが中央室24内に送られることを防止するのに役立つ。
【0056】
配管56は、マウスピース52と、または配管56の他の部分と、下述する動作のようなプランジャアセンブリ25の動作との間の干渉を回避するように構成することが好ましい。さらに好ましくは、マウスピース52はシリンジ20およびその中のプランジャアセンブリ25と略平行に配向され、換言すると、マウスピース52はシリンジ20によって画定される主軸に平行に配向される。この配向で、プランジャアセンブリ25の動作に対する干渉を生じることなく、患者から呼気を受け取ることができ、患者が装置10を使用するときにシリンジ20の内部に形成される凝縮液は、出口38に向かって下向きに排出され易い。
【0057】
患者または付添人によって容易に保持され、かつ患者がその呼吸パターンを変化させることを必要としないように、充分に小型で軽量である装置10を使用して、比較的短時間に充分な量の凝縮液を採取することができるように装置10の寸法を選択する。壁22、32および装置10の他の構造は、白金硬化シリコンのような、タンパク質に結合する傾向の無い材料から構成することが好ましい。他の適切な材料としてガラス、プラスチック、ポリエチレン、ポリカーボネート、もしくはポリビニルポリマーまたは他の合成ポリマーが挙げられるが、それらに限定されない。プランジャアセンブリ25は同様に非タンパク質結合剤から構成することが好ましいが、プラスチック、ビニル、ポリエチレン、ゴム、白金硬化シリコン、またはフッ素含有ポリマーをはじめ、それらに限らず、任意の適切な不活性材料から構成することができる。加えて、フッ素含有ポリマーであり、デラウェア州ウィルミントンの企業E.I.Du Pont De Nemours and Companyが所有する登録商標であるTEFLON(登録商標)を使用することができる。好適な実施形態では、シリンジ20は、長さが10cmから20cmの間、直径が2cmから5cmの間である。冷却材ジャケット34の厚さは1mmから10mmの間とすることができ、単回使用から圧出される試料容積は100μLから1000μLの間であることが好ましいが、わずか25μLの試料から有用な結果を得ることが可能であることもある。
【0058】
プランジャアセンブリ25は、前述した皮下注射針35または同様の構造を含めることにより、先願に開示されたプランジャアセンブリに比べて改善されている。この改善は、幾つかの実施例を下述する特殊化された反応室装置内への凝縮液の無菌送達を促進する。針35はピストン先端27の中心コンジット33に中心配置され、針35の内部は、以下で明らかになる目的のために、先端27の放射状コンジット31と流体連通する状態に構成される。
【0059】
動作時、約0°Fまで温度を低下させかくしてシリンジ20の内壁および外壁22,32の間に含まれる冷却材34のジャケットを冷凍させることのできる、従来の家庭用または商業用フリーザのような冷凍装置に、1つ以上のシリンジ20が最初に貯蔵される。患者を検査するとき、単一のシリンジ20が最初にフリーザから引き出される。呼気入力アセンブリ50またはマウスピース52は装置10の残部とは別個に貯蔵され、次いで装置10は使用のために、様々な構成要素を一体に結合することによって組み立てられる。次に、患者はマウスピース52をその患者の口領域に密閉するように配置し、マウスピース52内に呼気を吐く。呼気は配管56を通して、入口36を介して中央室24内へ誘導される。吸込み弁40は正圧によって開かれるが、そのような圧力が無ければ、それ中央室24内の空気が入口36を通して逸出するのを防止する。次いで呼気は、取込み端とは反対側の中央室24の端の出口38から針35を介して排出する。出口弁42は、弁42のシリンダ側に正圧が存在するときだけ、空気を中央室24から外に通すことを可能にし、そのような圧力が無いときには、弁42は周囲空気が出口38を介して中央室24に入り込むのを防止する。
【0060】
患者が装置10を通して呼気を吐くと、呼気中の湿分が中央室24の内部表面44上に凝縮し始める。冷却材34およびシリンジ24の低下された温度のため、凝縮液は内部表面44に即座に凍結することができる。ノズル39および針35の直径は、患者の呼息に抵抗を生じるぐらい充分小さい。直径は好ましくは、各呼息が完了するのに約5秒を要するようになるまで、または最高で約5cmの水圧の抵抗がもたらされるまで、呼気の割合を低下させるように選択することができる。ノズル39は代替的に、呼息に対する抵抗を変動させるダイヤルを有する終末呼気正圧弁(「PEEP」弁)を装着することができることを、当業者は理解されるであろう。PEEP弁は、カリフォルニア州ランチョコードバのLife Assist Incから市販されている。この改善は、呼気が中央室24の内部表面44と平衡するまでの時間の量を増加させる。
【0061】
患者が装置10を通して呼気を吐き続けると、装置10の内壁22と外壁32との間の空間に配置された冷凍冷却材34が溶融し始める。中央室24を包囲する冷却材ジャケット34の組成、容積、および厚さは、患者による約10〜15回の呼息後に冷却材34が溶解し始めるように較正することが好ましい。所望の回数の呼息後に冷却材34が溶解または解凍すると、凝縮液は同様に溶解し始めることができる。凝縮液が溶解すると、プランジャアセンブリ25を押し込んで、採取された凝縮液試料を出口38から圧出させることができる。
【0062】
図3Aおよび3Bはそれぞれ、プランジャアセンブリ25が部分的に押し下げられた位置および完全に押し下げられた位置にある状態の図2の呼気凝縮液採取装置10の部分側面断面略図である。プランジャアセンブリ25が押し下げられると、針35は出口38から押し出される。一方、ピストン26と出口38との間の空間の容積は収縮するので、凝縮液は放射状コンジット31を通して中央導管33に押し込まれ、そこから皮下注射針35内へ押し込まれる。次いで凝縮液は、適切な反応室装置内に排出する準備ができている。反応室装置の幾つかの実施例については、図7〜13に関連して下述する。排出は、プランジャアセンブリ25を完全に押し下げることによって促進することができる。プランジャアセンブリ25のハンドル30を捕捉し、それによってプランジャアセンブリ25が完全に押し下げられたことをユーザに示すために、シリンジ20の反対側の端にクリップアセンブリを設けることができる。最後に、EBCが採取され、本明細書で下述する検査手順に従って針35を介して排出されると、装置10全体を従来の廃棄物処理手順に従って処分することができる。
【0063】
図4は、本発明の第2の好適な実施形態に係る呼気凝縮液採取装置60の部分側面断面図である。第1の実施形態と同様に、この呼気凝縮液採取装置60は、中央室24と、プランジャアセンブリ65と、ゴムガスケット28と、ハンドル30とを備える二重壁シリンジ62、および呼気入力アセンブリ(図示せず)を備える。中央室24およびその様々な構成要素を含むシリンジ62の本体は、幾つかの重要な例外を除き、第1シリンジ20のそれと同様である。最初に、第1実施形態の出口38は、シリンジ62の内壁22および外壁32をその遠端付近で貫通する直径が約1mmのブリードポート68に置き換えられる。プランジャアセンブリが押し下げられるがEBCを保持しているとき、ブリードポート68は、空気が中央室24から抜けることを可能にする。また、プランジャアセンブリ65は、ピストン66の正面にニップル状の先端またはそこから延びる針を含まない。しかし、ピストン66の正面はわずかな円錐形を有し、中央室24の端部はそれに対応する形状を有する。一緒に、この形状構成は、採取された凝縮液をより効率的に出口38に誘導することができる。しかし、前の装置10のニップル状先端27および図4の装置に開示された円錐形状は相互に排他的ではなく、すなわち、図2のニップル状の先端27に図4の円錐形状を結合することによって、円錐形状を図2の装置に容易に組み込むことができることは明らかであろう。
【0064】
第1装置10および第2装置60の間の別の相違としては、第2装置が、皮下注射針35を取り付けることのできるねじ付きノズル61を備えることである。針35は第1装置10の針35と同様であるが、それはプランジャアセンブリ65に装着されるのではなく、ノズル61に固定される。針35の内部は中央室24の内部に連通接続される。針35は、ねじ付きノズル61からのカバー69の簡単な接続および取外しを促進するねじ付き取付具を有する、着脱自在のプラスチックカバー69によって保護することができる。シリンジ62に取り付けられたとき、カバー69は、下述する目的のために比較的気密性の封止をもたらすことが好ましい。
【0065】
この第2装置60の使用は第1装置10のそれと幾分同様であるが、被験者が針35を通して呼吸することができるようになる前に、カバー69は取り外さなければならない。しかし、上述した改善により、この装置60は第1装置10より、凝縮液の較正された量の凝縮液を送り込むのによく適応させることができる。最小限の量の凝縮液が採取されたことを確実にするために充分な回数の呼吸を被験者が装置60を通して行った後、カバー69をシリンジ62の端部に戻すことができ、プランジャアセンブリ65を慎重に押し下げることができる。カバー69はガスまたは液体が針35を通過することを効果的に防止するが、従来設計のブリードポート68は、ピストン66の正面が較正線78を通過するまで、空気および過剰な凝縮液の排出を可能にする。EBCが環境に逸出することを防止するために、希望するならば綿ボールまたは他の吸収性材料、および希望するならば適切な支持構造をブリードポート68の上に配置することができる。ブリードポート68を上向きに配向して装置60を保持することによって、ほとんどまたは全ての空気を中央室24から除去することができ、較正線78によって測定される通り、較正量の凝縮液がその中に残る。図4に示す通り、シリンジ62は、その中に含まれる液体を見易くするために、較正線78の領域に単壁設計を使用することができる。好ましくは、シリンジ62は250〜500μLの間の量を採取するように較正される。次いで、カバー69を再び取り外すことができ、この較正量を針35によって適切な反応室装置に送り込むことができる。
【0066】
図5は、本発明の第3の好適な実施形態に係る呼気凝縮液採取装置80の側面断面略図である。呼気を気道成分および肺胞成分に分画し、肺胞に由来する呼気の部分からだけ凝縮を発生させることが有利であるかもしれない。この区分化工程は下気道肺感染症を気管支炎と区別するのに役立つかもしれない。上記のKlineの米国特許出願第10/778477号に記載されている通り、肺胞呼気凝縮液の採取のための装置は、例えば呼気の二酸化炭素の部分圧力の上昇によって作動するゲーティングメカニズムを組み込むことができる。図5に示された呼気凝縮液採取装置80は、その装置の好適な実施形態または匹敵する装置で使用するのに適した装置の例である。図5の装置80は、第1装置10の呼気入力アセンブリ50が除去されて、米国特許出願第10/778477号に開示された装置に含まれるような筺体内に装置80を挿入することができることを除いては、図2の装置10と同様である。当業者には明らかであるように、ゲーティングメカニズムからの流体連通を促進するため、または他の目的のために、図5に示すように、凝縮プロセス中に空気流の方向を反転させることもできる。この場合、出口36および入口38、ならびにそれらのそれぞれの一方向弁81、83のそれぞれの位置は、ここで、図2の装置10に対して反転される。
【0067】
本明細書には図示されていないが、空気流の反転は図4に示された装置60にも適用することができる。しかし、たとえ空気流の方向が反転しても、図3Aおよび3Bまたは図4のいずれかに関して記載するように、凝縮液は依然として皮下注射針35を介して反応室装置内へ送り込むことができる。
【0068】
先行する実施形態では、それぞれの装置10、60、80は自発呼吸する被験者からEBCを採取するように設計され、被験者はマウスピースまたは顔マスク(図示せず)を介して、図2または図5に模式的に示したもののような適切な入口に流れを方向付ける配管内に呼気を吐く。本発明を機械的人工呼吸を受けている患者からの採取を可能にするように適応させることも有利であろう。たいていの病院では、ヒトは、しばしば酸素に混入され、過剰水蒸気で加湿された加圧空気に対して換気される。この過剰水蒸気は、呼吸サイクル中に呼気を患者の肺から離すように方向付ける流出配管内に、凝縮を蓄積させる。呼吸療法士が、呼息回路のほとんどの垂下部に容量約20〜100mLの小さいシリンダを取り付け、この凝縮液を捕集することは標準的な慣行である。本発明を利用して、人工呼吸を受ける患者のグラム陰性細菌性肺感染症を診断するために、捕集された凝縮液の一定量をLPS含有量について分析することができる。最も単純な実施形態では、薬剤の送達に使用される型の市販のシリンジ(例えばインシュリンシリンジ)を使用して、人工呼吸回路の呼息管路の凝縮液タンクにある凝縮液の設定量(例えば100〜200マイクロリットル)を抜き取ることができ、この量を下述する実施例の反応室装置内に注入することができる。
【0069】
図6は、本発明の好適な実施形態を実現する代替的人工呼吸システムの略図である。一例として図5の装置80を使用すると、人工呼吸を受ける患者からの採取は、装置80の出口36に真空システム92を追加し、YまたはT継手94を、ノズル39の端部の前述したルアーロック接続具に接続することによって促進することができる。YまたはT継手94は、患者96から従来の人工呼吸器98までの流出経路の途中で管路に接続される。流出経路は2つのポリエチレン管102、104を含み、最初の管は、従来の気管内挿入管100または他の患者インタフェースからYまたはT継手94の入口に接続され、第2の管はYまたはT継手94の出口と、人工呼吸器110の流出トラックに通常設けられるようなポートとの間に接続される。第3のポリエチレン管106は、人口呼吸器110の流入トラックから気管内挿入管100に接続される。各ポリエチレン管102、104、106は内径が約10〜30mm、長さが1メートル以上である。総じて、そのような装置は、充分な量のEBCが採取されるまで、真空システム92が採取装置80を通して呼気の連続側流試料を抜き取ることを可能にする。真空システム92のポンプによる吸引速度は約100mL/分に設定することができる。
【0070】
図7および8はそれぞれ、図2、4、および5の採取装置10、60、80と使用するのに適した1つの反応室アセンブリ120の側面断面略図および上面図である。反応室アセンブリ120は、EBC中に存在するLPSの量を検出して定量するように設計されている。アセンブリ120は、注入用の薬剤を貯蔵するために一般的に使用される無菌アンプルの一般的形状構成に似ている。アセンブリ120は、反応室、および分光光度計キュベットの両方として機能することができ、試料中のLPSの濃度に比例する可視光の透過百分率を測定する。アセンブリ120は真空密閉され、反応室122およびプラグ124、保持リング126、ならびに保護キャップ128を含む。反応室122はガラスまたは別の透明な材料から作られることが好ましいが、下述する選択される色または光の変化または現象がそこを通して容易に見ることができるならば、代替的に準透明な(半透明な、または他の不透明でない)材料から作ることができる。反応室122は約0.5〜1.0mLの容積を持つことが好ましい。図示する通り、反応室122は円形であるが、反応室122は同様に方形とすることができ、あるいは分光光度計内への挿入を容易にする別の幾何学的形状を持つことができ、あるいは既存の市販の実験室用分析システムに「改造設置」することができるように変形することができることは理解されるであろう。反応室122は、上述した凝縮液採取装置10、80のものと同様のねじ付き雄型ルアーロック接続具132をさらに含む。言うまでもなく、図4に開示されたような装置60を利用する場合には、ルアーロック接続具132は必要ないかもしれない。
【0071】
反応室122内部の密閉された無菌で発熱物質を含まない環境を維持するために、好ましくはゴムから形成されるプラグ124を反応室122の頂部に配置することができる。プラグ124は保持リング126によって反応室122に保持され、該保持リングは好ましくはアルミニウムから作られ、プラグ124の送り込みポート130を介して反応室122内に呼気凝縮液を送り込むことを可能にする開口を中心に有する。好適な実施形態では、送り込みポート130は、皮下注射針で穿刺することのできる再封可能な蓋である。好ましくはプラスチックから形成される保護キャップ128は、保持リング126およびプラグ124の損傷または汚れを防止するために、アセンブリ120の頂部に一時的に取り付けられる。
【0072】
使用時に、無菌反応室アセンブリ120は貯蔵所から取り出され、開示された装置10、60、80の1つ(または別の同等の装置)を用いてEBC試料が採取される。反応室アセンブリ120の保護キャップ128が取り外され、次いで、それぞれの皮下注射針35をプラグ124の送り込みポート130に挿入することによって、比較的正確な量のEBC試料が反応室122に送込まれる。設けられている場合にはそれぞれのルアーロック接続具を係合させて、装置10、60、80を反応室アセンブリ120に効果的に固定することができる。次いで、充分な量のEBCがアセンブリ120に送り込まれるまで、プランジャアセンブリ25を押し下げることができる。必要な量を示すために較正線134を反応室122に付けることができるが、量が採取装置60で事前に較正されている場合には、そのような線134は必要ないかもしれない。エンドトキシン分析物の正確な測定に必要な、充分な量のEBCを抜き取るために、組立中に、反応室122は真空下で密閉される。
【0073】
反応室122は、因子C、因子B、プロクロッティング酵素、および発色基質の事前指定された乾燥塊136を、水和により約7.4のpHを維持するためにカルシウムおよびマグネシウムの塩、ならびにリン酸塩、または他の有機化合物、例えばTRISアミノメタン緩衝液と共に含む。これらの酵素の量および活性は、所定の量のEBCで臨床関連範囲のLPSの検出が可能となるように、事前較正される。量は、約37℃で15〜30分の反応時間で測定したときに、非希釈EBCで0〜約10EU/mLの範囲のLPSの濃度に比例して対応する、0〜1.00までの範囲の線形光学濃度読み値を反応から生じさせるように較正される。反応の温度は少なくとも約34℃に保持されることが好ましい。反応の温度は少なくとも約37℃に保持されることがさらに好ましい。
【0074】
発色基質は、約43℃までの温度に、活性を失うことなく耐えることができる。したがって、反応室は、制御された発熱反応によって、約43℃まで加熱することができる。少なくとも15分間、好ましくは25分間、34〜43℃の均等な培養をもたらすために、発熱反応を制御することが好ましい。したがって、下述の通り、発熱水和反応の速度を制御する処置を講じる必要がある。
【0075】
そのような発熱反応は、水和により熱を放出する塩を反応室内に配置することによって開始することができる。そのような塩の一例として、チオ硫酸ナトリウム五水和物が挙げられるが、それに限定されない。塩を反応室内に配置すると、採取された凝縮液の導入により、発熱反応を開始することができる。短い加熱期間内に即時の完全な水和を促進する、粉末の塩を使用することが好ましい。例えば、塩は制御された水和により34〜43℃の反応温度を少なくとも15分間発生させることのできる、半透性マトリクスまたは結晶形態とすることができる。あるいは、塩は反応室を取り囲むユーザ開始加熱ジャケットに配置することができる。この実施形態では、反応室は可撓性ポリマーから構成される二重壁ジャケット内に挿入することができる。ジャケットは、水和により熱を放出することのできる乾燥塩、および2本の指で圧搾することによって容易に破断することのできる水のアンプル(2〜5mL)を含むことができる。水のアンプルを破断させる行為により塩の水和が開始され、発熱反応を引き起こし、かくして反応室は約43℃に約15〜30分間加熱され、その時点で色強度および対応するエンドトキシン活性を、下述する通り、定量化することができる。
【0076】
予備データから、約0.20EU/mL(約0.20の較正線形光学濃度読み値)を越えるLPSの濃度は、肺のグラム陰性細菌感染の存在を示す臨床検査陽性閾値に対応することが示唆される。好適な実施形態では、発色基質は、凝固酵素によって開裂されて約405nmのピーク吸光度を持つ反応溶液に黄色を放つ、パラアミノアニリドのような色素にコンジュゲートされたペプチドとすることができる。他の発色基質と代替することができること、および異なる等吸収点で検出することのできる代替物に他の色素マーカをコンジュゲートさせることができることは、容易に理解されるであろう。加えて、マーカ分子は励起蛍光の特性を含む化合物とすることができ、それにより分子は、単色光の入射ビームによる刺激に応答して狭い波長間隔内の光を放出する。LPSの存在を検出するためのマーカとして、様々な発色基質および蛍光基質を使用できることを、当業者は理解されるであろう。
【0077】
あるいは、ウェルの側部にマトリックス結合された抗体を使用してLPSを捕獲するように反応室アセンブリを設計することができる。図9は、第1の代替的反応室アセンブリ140の斜視図である。この代替的実施形態では、アセンブリ140は、酵素結合免疫測定技術を使用する縦型マイクロタイタウェルとして機能し、種特異的LPS分子154の検出が可能であるという利点を有する。キュベットとして機能することのできるアセンブリ140は、室142と、プラグ144と、保持リングまたは他の構造体146とを含むことができる。以下で明らかにする目的のために、窓143は室142の壁の少なくとも一部分に形成される。前の装置120のリング126と同様に、リング146は、プラグ144の中心に注入目標領域150を露出させる開口を含む。
【0078】
図10A〜10Dは、図9の第1の代替的反応室アセンブリ140の部分概略部分側面断面図である。各抗体152のFc部は、従来の技術を用いて、アセンブリ140の窓143にコンジュゲートまたは結合する。したがって、各抗体152のFab部はアセンブリ140の中心に向かって配向され、LPS154のO多糖体部がよりよく捕獲される。EBC試料の導入後、室142は次いで、アルブミン含有緩衝液(図示せず)で洗浄して、非特定的物質を除去することができる。次いで、LPSを含まない水(図示せず)を加えることによって、所定量の前述したような発色基質156を含む別個のアンプルが再構成され、発色試薬試料がシリンジによって抜き取られ、図10Cに示すように、反応室142に注入される。発色基質156はLPS154と反応し、それによって色素158を放出する。約15〜30分後に、幾つかの方法の1つによって光学濃度を読み取ることができる。本発明の好適な実施形態に使用するのに適した1つの発色基質156はパラニトロアニリドを組み込み、それは放出されたときに約405〜410nmで検出することができる。
【0079】
O抗原に特異的な免疫原性を持つ抗体ではなく、LPSを捕獲するために、LPSのいずれかの部分に対し特異的な高い親和性を持つ他の分子を反応室の壁に結合させることができることを、当業者は理解するであろう。これらの分子としてHA‐1AおよびE5、リポ多糖体結合タンパク質(「LPB」)、殺菌性/浸透性増加タンパク質(「BPI」)、リムルス抗リポ多糖体因子(「LALF」)、またはポリミキシン抗生剤が挙げられるが、それらに限定されない。
【0080】
LPS濃度を定量化するために、多数の実施形態を利用することができる。1つの実施形態では、カラーストリップとの視覚的比較を用いて、半定量的決定を行うことができる。カラーストリップは、最も明るい陰影を最左端に配置し、最も暗い陰影を最右端に配置し、陰影強度を徐々に上げながら左右方向に表示される1つの色のパッチを有する標準物差に似ている。各陰影パッチは、陰影強度の増加がEU反応度の増加を表わすようにした、特定範囲のエンドトキシン単位(EU)の反応度と関連する。観察者は、反応室アセンブリ120、140の内容物の陰影をカラーストリップのパッチと比較するために、周囲光の中でプラスチックまたは紙のカラーストリップの隣に透明な反応室アセンブリ120、140を保持することができる。観察者は次いで、反応室内に観察される色の陰影強度と最もよく合致するカラーパッチを選択することができる。陽性反応は、約0.20EU/mLに対応するかあるいは追加検査から決定された、特定の色陰影閾値によって示される。
【0081】
より正確な定量化は、上述の通り培養後の反応室を受け入れるように構成された、小型の特殊設計された単一ビーム光分光光度計により得ることができる。分光光度計は、試料を37°Fに加温するために反応室の挿入により活性化される、加熱コイルを含むことができる。分光光度計は代替的に、25分間の培養後に測定光学濃度を表示または印刷することができる。
【0082】
図11は、分光光度計を使用することなく視覚的に読み取ることのできる単回使用のカートリッジにEBCを送り出すことを可能にする、第2の代替的反応室装置を組み込んだ検査キット200の斜視図である。検査キット200は筺体202内に配置された検査モジュール203および陽性対照モジュール223を含む、2つのモジュール203、223を有する。図12は、図11の検査モジュール203の線12−12に沿って切った側面断面図である。検査モジュール203はポート204を含む。ポート204は好ましくは約100マイクロリットルの容積を有し、乾燥塊が水和により約7.4のpHを維持しかつ水性試薬を形成することを可能にする、EDTA、カルシウムおよびマグネシウムの塩、ならびにリン酸塩、または他の有機化合物と共に、因子C、因子B、プロクロッティング酵素、および発色基質の乾燥塊136を含む。
【0083】
図11では、反応室208、検査マトリクス212、1対の微小管214、216、1対の一方向弁218、220、および出口222をさらに示す。反応室208は少なくとも約250マイクロリットルの容積を有することが好ましい。ポート204および反応室208は第1微小管214によって接続される一方、反応室208は第2微小管216によって出口222に接続される。当業者は、微小管214が1つ以上の微小管を含むことができることを理解されるであろう。ポート204から反応室208を介して出口222までの一方向の流体連通を促進するために、弁218、220は第1および第2微小管214、216にそれぞれ配置される。微小管214が複数の微小管を含む場合、複数の微小管に対応するために、2つ以上の弁218、220が必要になるかもしれない。カートリッジの頂部には、一連の徐々に暗くなる色パッチが配置され、各々の徐々に暗くなる色パッチがエンドトキシン活性の徐々に増大する間隔に対応するように構成された、事前印刷カラーストリップ221がある。
【0084】
反応室208は、LPSの存在を示す色の変化がないかマトリクス212を観察できるように、透明な材料210で被覆される。反応室208内に配置されたマトリクス212は、受入れ、発色基質によって染色される不溶性ポリマーまたは他の材料から形成された表面である。適切な材料として、セルロース、アガロース、メタクリレート、ポリスチレン、ポリフェニル、ポリナフチル、ポリベンジル、ナイロン、絹、または他の繊維等から生じたポリマーが挙げられるがそれらに限定されない。マトリクス212は吸収性であるが、密に織られるので、流体が重力および毛管作用によって微小管216を通して、移動するまで、流体が反応室208内に浮遊し続けることを可能にする。利点として、マトリクス212は本質的にLPS自体を結合することができ、あるいはHA−1AおよびE5、LPB、BPI、LALF、またはポリミキシン抗生剤のようなLPS結合分子の1つを共有結合もしくは他の方法で結合することができる。したがって、マトリクス212は、未知の試料中のエンドトキシンの濃度に比例して色強度を発現させる。事前印刷カラーストリップ221との視覚的比較により、上述の通り、エンドトキシン濃度の半定量的決定が可能になる。
【0085】
検査キット200の内部は、チオ硫酸ナトリウム五水和物と、検査キット200の圧搾により破断する水の密閉アンプルとを含むこともできる。水のアンプルを破断する作用により、チオ硫酸ナトリウムの水和を開始すると、発熱反応を引き起こし、かくして検査キット200全体が約25分間約43℃に加熱される。発熱反応のための材料は検査キット200内に配置されるが、それらは、試料が導入されかつ何らかのLPS関連化学反応が発生する検査キット200内の全ての領域から分離される。
【0086】
動作時に、装置10、60、80により採取された凝縮液を、前述した乾燥塊136を含む反応室204内に注入することによって、反応が開始される。少なくとも約0.35mLの凝縮液を反応室204内に注入することが好ましい。凝縮液を注入する動作は、反応室204および微小管214における凝縮液および乾燥塊136の混合作用を引き起こし、それによってLAL反応が開始される。注入によって誘発される圧力差が毛管作用の力と結合されることにより、反応混合物は微小管214内を経て反応室208内に流入し、34〜43℃の温度で発色基質反応が続く間、そこに留まる。エンドトキシンはマトリクス212に結合されるので、発色基質から加水分解された着色分子は、凝縮液中のエンドトキシンの活性に比例する色相強度にマトリクス212を染色し、色変化は定量化のためにカラーストリップ221と視覚的に比較することができる。
【0087】
図13は、図11の陽性対照モジュール223の線13−13に沿って切った側面断面図である。陽性対照モジュール223はポート224と、反応室228と、検査マトリクス232と、ここで244で表わされる乾燥塊136と結合されたある量の乾燥LPSと、1対の微小管234、236と、1対の一方向弁238、240と、出口242とを含む。ポート224および反応室228は第1微小管234によって接続され、反応室228は第2微小管236によって出口242に接続される。ポート224から反応室228を介して出口242まで一方向の流体連通が可能となるように、弁238、240が第1および第2微小管234、236にそれぞれ配置される。図示する通り、LPS244はポート224に配置されているが、LPS244は代替的にまたは追加的に、第1微小管234内または検査マトリクス232上に配置することができることは理解されるであろう。
【0088】
第2の代替的反応室装置も次のように使用することができる。EBC試料を前述の呼気凝縮液採取装置10、60、80の1つから検査モジュールポート204内に注入し、そこから第1の検査モジュール微小管214を介して検査モジュール反応室208内へ向けることができる。好適な実施形態では、EBC試料の量は約0.35mLである。試料の量は、マトリクス212を含むウェル208が満杯になるように較正し、かくしてマトリクス212を液体で被覆させ、LPSのマトリクス212との結合を開始することが好ましい。過剰なEBCは第2検査モジュール微小管216を通して流出することができる。一方向弁218は周囲空気からのLPSの侵入を防止する。吸収性材料を216に配置することができ、外部流体漏出を防止する。
【0089】
約60秒とすることのできる比較的正確な予め定められた時間後に、検査モジュール203および陽性対照モジュール223を各々、ある量の滅菌(エンドトキシンを含まない)水で洗浄することができる。好適な実施形態では、各モジュール203、223に注入される滅菌水の量は約0.25mLである。水はそれぞれの反応室208、228を通過し、それぞれの第2微小管216、236を介してそれぞれの出口222、242から排出させられる。
【0090】
次に、LPSを含まない水は、図7および8の反応室装置120のようなアンプルに添加され、水和により約7.4のpHを維持し、水性試薬を形成するためのEDTA、カルシウムおよびマグネシウムの塩、ならびにリン酸塩、または他の有機化合物と共に、因子C、因子B、プロクロッティング酵素、および発色基質の乾燥塊136を含む、図7および8の反応室装置120のようなアンプルに添加される。ひとたび試薬が再構成されると、それはインシュリンを送達し、結核検査抗原を提供するために一般的に使用されるようなシリンジ(しばしば「TBシリンジ」と呼ばれる)(図示せず)を使用して抜き取り、検査モジュールポート204および陽性対照モジュールポート224の両方に注入することができる。検査キット200は次いで、23℃で所定の時間、例えば10分間放置して発色させ、次いで検査ウェル208に色またはパターンの変化がないか、視覚的に検査することができる。陽性対照モジュール223は、発色基質酵素系の活性を確実にするために含まれる。
【0091】
さらなる代替例では、参照によってその内容全体を本明細書に援用するNeemanらの米国特許第4370413号(’413特許)に記載されるように、細管内で凝固カスケードのゲル形成を可能にすることによって、EBC中のLPSの割合を測定することができる。図14は、本発明の第4の好適な実施形態に係る呼気凝縮液採取装置260の部分側面断面図である。この装置260は、それが二重壁22、32と、中央室24と、ピストン26、ゴムガスケット28、およびハンドル30付きのプランジャアセンブリ65と、呼気入力アセンブリ(図示せず)と、出口68と、ねじ付きノズル61と、着脱自在のプラスチックカバー69とを有するシリンジ262を含むという点では、図4のそれと同様である。これらの構成要素の各々は、シリンジ262が出口68との流体連通状態でシリンジの側部から延びるマノメータ265をさらに含むことを除き、図4の装置60のそれらと一般的に同様である。加えて、各装置60、260は針35、275を含むが、この第4実施形態の針275は、その中でEBCがLALアッセイ試薬と接触する細管として働く。したがって、針275は、図15に示すように、LPSがEBC中に存在する場合にゲル化するためのLALアッセイ試薬を予備充填された、乾燥した不溶性かつ不活性の繊維基質270により塞栓される。
【0092】
プラグ270がEBCで湿潤するまでプランジャアセンブリ65を押し下げることによって、反応を開始することができる。流出針275におけるゲル化の量は、EBC中のLPSの量に比例する。指定時間後に、プランジャアセンブリ65を再び強制的に押し下げ、マノメータ265を用いて中央室24内の押出し圧力を測定することができる。押出し圧力はEBC中のLPS濃度に比例する。
【0093】
先行する全実施形態において、試料を75℃に加熱すること、アルキルグルコシドまたはベータ1,4グルコシド結合を持つ分子を添加することをはじめ、βグルカン(因子G)との反応を防止する化学物質または方法を含めることによって、反応の特定性を向上することができることを理解されたい。
【0094】
ひとたびグラム陰性細菌感染が診断されると、抗生物質治療を開始することができる。本発明の方法は、抗生物質治療の有効性を監視するために利用することができることを、当業者は理解されるであろう。有効な抗生物質治療は、細胞膜の破裂を伴う細菌の死滅および遊離したLPSの肺胞上皮液中への放出の増加のため、吐き出された呼気凝縮液中のLPS濃度の初期増加を引き起こすかもしれないことを当業者は予測することができる。この濃度の上昇は、抗生物質の投与後最初の24〜72時間に予想される。さらに、有効な抗生物質治療は最終的に、抗生物質の投与後の続く3〜10日間に吐き出された呼気凝縮液中のLPSの濃度の低下をもたらすことを予想することができる。したがって、連続的なLPS測定を使用して治療の有効性を監視することを推量することができる。呼気中のLPS含有量の初期増加が示されず、あるいはその後の数日間の呼気中のLPS含有量の低下が示されないことは、治療に対するグラム陰性細菌の耐性を示唆することができる。
【0095】
比較的容易に無痛かつ迅速にグラム陰性細菌感染症を診断するための方法および装置を提供するので、本発明は有利である。本願は、呼気凝縮液中のLPSの濃度を測定することによって、グラム陰性細菌性肺炎を診断することを対象にする。しかし本発明は、敗血症をはじめ、それに限らず、どんな肺内グラム陰性細菌感染症の診断にも利用することができる。グラム陰性細菌感染症は同一抗生物質治療法により治療することができ、したがって、どのグラム陰性細菌感染症の診断でも、そのような感染症にかかった被験者にとって有利であることを、当業者は理解されるであろう。さらに、本発明を利用して、感染症を引き起こしたグラム陰性細菌の特定菌種を、この情報が有益である状況で、特定することができる。
【0096】
実施例
【0097】
実施例1
【0098】
起きて、協力的な、自発呼吸のできる患者がグラム陰性細菌性肺炎であるか否かを診断するために、そのような患者からの呼気凝縮液試料中のLPSを以下の手順に従って検出した。
【0099】
処置のための被験者は、次の手順に従って選択した。被験者(各群毎にN=8)は、次の3つの基準、すなわち1)肺炎の診断、2)1日10本を越える煙草を積極的に喫煙する健康な患者、および3)健康な非喫煙者に基づいて募集した。肺炎と診断された被験者を獲得するために、有色痰を生じる咳、101°Fを超える計測発熱、1立方マイクロリットル当たり12000を越える末梢白血球総数によって立証される白血球増加症、および胸部放射線写真における湿潤物の存在を含む標準的な治療背景で診断された被験者を選択した。被験者の排除基準として、抗菌剤薬物治療の使用、呼気採取を不可能にする急性疾患もしくは解剖学的異常所見、および/または肺結核の疑いが挙げられる。
【0100】
採取した呼気試料に利用された呼気凝縮装置は次に記述する通りである。装置は、高さ約50cmの変性ガラスフラスコに取り付けられた長さ1メートルのポリビニル管(内径15mm)から構成された。ガラスフラスコは特別に設計された着脱自在のガラス栓を頂部に有していたが、それ以外は標準的な実験室用のメス(フロレンス)フラスコと同様の外見であった。ガラス栓は2つの出口を有し、1つは上方に突出し90度に屈曲したガラス管の挿入用であり、もう1つは乾燥した呼気を周囲空気中に排出させることができた。ガラス管の一端をガラス管にしっくり嵌合するポリビニル管に接続した。ガラス管の他端は、フラスコのガラス球の内部に約25cm突き出した。ガラスフラスコ全体を、エタノール中のドライアイスの冷却スラリ中に沈めた。
【0101】
以下の手順で呼気凝縮液を採取した。被験者にポリビニル管を保持させ、ポリビニル管の反対側の端に取り付けられたカモノハシ形のマウスピース内に呼気を吐き出させた。被験者の呼気は、ポリビニル管を通してフラスコの凝縮室内に送られ、そこでフラスコの冷却された内側が、被験者の呼気水蒸気およびエアロゾル化された液滴を凝縮され冷凍させた。被験者に深呼吸を約30回行うように要求し、それにより約1〜3mLの試料が得られた。
【0102】
被験者から呼気試料を採取する前に、外部のエンドトキシンまたはベータグルカン分子による試料の汚染を低減するために、複数の処置を講じた。全ての構成要素は、使用中に220℃で最低4時間高圧滅菌することにより、かつエンドトキシンを除去するように設計された市販の洗浄液を使用することにより滅菌した。ポリビニル管は高圧滅菌の前に無菌箔で包んだ。無菌箔は、試料採取中、付けたままにしておいたが、ポリビニル管を取り外す前に取り外した。技術者は全ての構成要素を取り扱うのに無菌手袋を使用した。しかし、ポリビニル管の末端部6cmは、無菌手袋を着用していない被験者が把持することができた。凝縮液を溶解させた後、それを発熱物質を含まないピペット先端で凝縮室から吸引し、層状フード下で発熱物質を含まないクライオチューブに移した。背景エンドトキシンについて検査するために、次の手順に従ってガラス器および配管の「模擬」標準を実行した。2ミリリットルのエンドトキシンを含まない水(ミズーリ州セントルイスのSigma Chemical)を洗浄され高圧蒸気滅菌された凝縮室に注入し、撹拌し、次いで吸引して、凝縮液試料と同様の方法で貯蔵した。凝縮液試料および模擬標準用の水を−57℃で分析まで貯蔵した。
【0103】
エンドトキシンの存在を以下の手順に従って検出した。製造者の仕様書(米国マサチューセッツ州ファルマスのAssociates of Cape Cod、パイロクロムアッセイ)に従って、発色リムルスアッセイを用いて、非希釈溶解凝縮液について分析を実施した。反応は96ウェルマイクロタイタプレート(Associates of Cape Cod、パイロクロムマイクロタイタプレート)で、37℃で30分間行なわれ、マイクロタイタプレート分光光度計で405nmの色の変化が読み出された。1バッチ中に全ての試料が実行された。アッセイエンドトキシン標準を用いて標準曲線が達成され、R=0.997で直線状であった。
【0104】
図16は、3つの試験群の各々における患者について測定されたエンドトキシン濃度を示す散布図である。正常者、喫煙者、および肺炎患者の平均(±SD)エンドトキシン濃度はそれぞれ0.096±0.050、0.091±0.040、および0.234±0.130EU/mLであった。グラフは、0.20EU/mLがグラム陰性菌性肺炎の被験者とグラム陰性菌性肺炎でない被験者とを区別する有用な限界点であるかもしれないことを示唆している。
【0105】
肺炎であり0.20EU/mL未満の試験値を持つ2人の被験者を「A」および「B」と標識した。従来の臨床試験で、これらの被験者がグラム陰性細菌性肺炎でないことを確認した。患者Aは血液培養の結果、連鎖球菌肺炎が陽性であり、それが患者の肺炎の細菌性原因であると臨床的に推定された。患者Bは、血液培養が陰性であり、分析用の他の標本は提出されず、インフルエンザ(ウィルス性)肺炎が臨床的に疑われた。
【0106】
模擬標準からの水試料の2つは、0.10および0.14EU/mL(平均は0.12EU/mL)の値であった。したがって、0.12EU/mLはシステムの背景「ノイズ」であるとみなされ、この値を、未補正試料で決定された0.20EU/mLの限界値から減算した。この分析を用いて、0.08EU/mLより上の値を含む呼気凝縮液の試料は異常検査結果とみなされる。別の実験室で異なる凝縮装置を使用した場合、この背景補正値は異なるかもしれないことを理解されたい。
【0107】
実施例2
【0108】
人工呼吸器の助けを借りて呼吸している被験者がグラム陰性細菌性肺炎であるか否かを診断するために、そのような被験者からの呼気凝縮液試料で、次の手順に従ってLPSを検出した。
【0109】
6人の被験者が試験に参加した。人工呼吸を受けている被験者のうちの4人は肺炎の臨床的証拠を示し、抗生物質治療により処置されていた。人工呼吸を受けている被験者のうちの2人は肺炎の臨床的証拠を示さず、対照として使用された。
【0110】
以下の手順に従って呼気凝縮液試料を得た。人工呼吸システムの気管内挿入管に取り付けられた流出配管に蓄積された呼気凝縮液から分析物を得た。分析物は目視検査で透明かつ非混濁状態に見えた。
【0111】
エンドトキシンの存在を以下の手順に従って検出した。製造者の仕様書(米国マサチューセッツ州ファルマスのAssociates of Cape Cod、パイロクロムアッセイ)に従って、発色リムルスアッセイを用いて、非希釈および希釈凝縮液に分析を実施した。希釈はエンドトキシンを含まない水中に1:10、1:100、および1:1000の希釈を含んだ。反応は96ウェルマイクロタイタプレート(Associates of Cape Cod、パイロクロムマイクロタイタプレート)で、37℃で30分間行なわれ、マイクロタイタプレート分光光度計で405nmの色の変化が読み出された。1バッチ中に全ての試料が実行された。アッセイの検出の上限は0.25EU/mLであった。
【0112】
分析の結果は次の通りである。6つの試料は全て、非希釈試料では検出範囲より上であった(つまり0.25EU/mLより高かった)。肺炎の被験者の全ての1:10の希釈試料における平均エンドトキシン濃度は、線形検出の限度より上であったが、肺炎でない2人の人工呼吸患者の1:10の希釈液の平均エンドトキシン濃度は0.05EU/mLより低かった。これらのデータは、人工呼吸回路の流出配管中の目視検査で透明かつ非混濁状態に見える凝縮液の試料中の濃度が0.25EU/mLより高い場合、グラム陰性菌性肺炎が陽性になる気管支肺胞洗浄試料の存在が予測されることを示唆している。
【0113】
実施例3
【0114】
呼気凝縮液中のLPSを以下の手順に従って検出した。以下の手順に従って呼気凝縮液試料を採取するために、市販の容積1リットルのガラスフラスコを用意した。ガラスを3時間にわたって400℃に加熱し、その表面にLPSが含まれないようにした。患者が管内に呼気を吐き出したときに、患者の呼気がガラスフラスコを通過して出口から流出するように、滅菌された内径11mmの可撓性ポリビニル管をフラスコの枝部分に流体連通状態に配設した。フラスコ中の呼気凝縮液の捕獲を促進するために、フラスコを冷却材としてのドライアイスおよびエタノールスラリ混合物中に部分的に沈めた。エアルゾル化した唾液の捕獲を防止するために、管およびフラスコは、凝縮フラスコが患者の高さより上に維持されるように配設した。
【0115】
呼気を以下の手順に従って採取した。変動する健康状態の8人の被験者がフラスコに接続された管内に呼吸した。各被験者は、呼吸を追跡するためにハンドカウンタを用いてフラスコ内に100回深呼吸をした。この方法から11±4mLに等しい平均量の凝縮液が得られた。
【0116】
以下の手順に従って、市販の発色性LALアッセイ(マサチューセッツ州Cape Cod)を使用して、呼気凝縮液中のLPSを検出した。各被験者の凝縮液試料から、二つ組の50μL分注物を標準96ウェルELISAプレートの2つのウェルに移した。発色LALアッセイに必要な試薬を添加し、試薬を37℃で30分間培養した。市販のプレートウェル読取装置で405nmの光学濃度が読み出された。FDA承認情報源から得られた既知の量のLPSを使用して、標準曲線と比較することによって濃度を決定した。
【0117】
次の結果が得られた。4人の正常な志願者は全員100pg/mL未満のLPS濃度を持つことが明らかになったが、2人の他の点では健康な喫煙者は200pg/mL未満の濃度を持つことが明らかになった。臨床的に肺炎の2人の喫煙者は、800pg/mLを越えるEBC LPS濃度を持つことが明らかになった。この実験から、EBC試料のLPS含有量は、試料を提供する被験者の肺の健康に基づいて変動し得ることが結論付けられた。これらのデータはまた、健康な被験者の口腔細菌叢からの汚染無しにEBCを試料採取することができることも示唆している。
【0118】
上記の情報に基づいて、本発明に幅広い実用性および用途が考えられることは、当業者には容易に理解される。本発明の本質または範囲から逸脱することなく、本明細書に具体的に記述した以外の本発明の多くの実施形態および適応例が、多くの変形、変化、および同等の構成と同様に、本発明およびその上記の説明から明らかであり、合理的に示唆される。したがって、本発明を本明細書ではその好適な実施形態に関連して記載したが、この開示は本発明の単なる例証および例示であって、本発明の完全かつ実施を可能にする開示を提供する目的のために行ったにすぎないことを理解されたい。上記の開示は、本発明を限定したり、あるいはそのような他の実施形態、適応例、変形、変化、または同等の構成を排除することを意図したものではない。本発明は、本明細書に添付する請求項およびそれらの同等物によってのみ限定される。本明細書で特定の用語を使用したが、それらは限定のためではなく、一般的かつ説明的な意味で使用されているにすぎない。
【特許請求の範囲】
【請求項1】
空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法であって、
(a)空気呼吸する脊椎動物被験体から採取された呼気凝縮液中のリポ多糖体の濃度を測定する工程と、
(b)前記呼気凝縮液中のリポ多糖体の前記測定濃度に基づいて、前記被験体が肺内グラム陰性細菌感染症であるか否かを決定する工程と、
を含む方法。
【請求項2】
前記肺内グラム陰性細菌感染症が肺炎である、請求項1に記載の方法。
【請求項3】
前記肺内グラム陰性細菌感染症が気管支炎である、請求項1に記載の方法。
【請求項4】
前記被験体が肺内グラム陰性細菌感染症であるという陽性判定に応えて、抗生物質治療を選択する工程をさらに含む、請求項1に記載の方法。
【請求項5】
前記空気呼吸する脊椎動物被験体が、哺乳類被験体であり、前記方法が抗生物質治療に対する前記哺乳類被験体の反応を監視する工程をさらに含む、請求項1に記載の方法。
【請求項6】
肺内グラム陰性細菌の特定菌株を特定する工程をさらに含む、請求項1に記載の方法。
【請求項7】
特定する工程が、リポ多糖体分子のO‐単糖類部の決定に基づいて、肺内グラム陰性細菌の特定の菌株を特定することを含む、請求項6に記載の方法。
【請求項8】
リポ多糖体の濃度を測定する工程が、リムルス変形細胞溶解物アッセイを用いてリポ多糖体の濃度を測定する工程を含む、請求項1に記載の方法。
【請求項9】
少なくとも0.20EU/mLのリポ多糖体の測定濃度がグラム陰性細菌感染症の存在を示す、請求項1に記載の方法。
【請求項10】
前記空気呼吸する脊椎動物被験体が、自発呼吸する被験体である、請求項1に記載の方法。
【請求項11】
前記空気呼吸する脊椎動物被験体が、機械的人工呼吸を受ける被験体である、請求項1に記載の方法。
【請求項12】
空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法であって、
(a)反応試薬が内部に配置された反応室を用意する工程と、
(b)空気呼吸する脊椎動物被験体から採取された呼気凝縮液の少なくとも一部分を前記反応室に送り込む工程と、
(c)前記採取された呼気凝縮液の少なくとも一部分が前記反応室に送り込まれたときに発生する物理的変化に基づいて、前記被験体が肺内グラム陰性細菌感染症であるか否かを決定する工程であって、前記物理的変化が前記呼気凝縮液中のリポ多糖体の存在によって引き起こされる工程と、
を含む方法。
【請求項13】
前記反応試薬がリムルス変形細胞溶解物を含む、請求項12に記載の方法。
【請求項14】
前記反応試薬が発色基質を含む、請求項12に記載の方法。
【請求項15】
前記反応試薬が蛍光基質を含む、請求項12に記載の方法。
【請求項16】
前記反応試薬が、前記呼気凝縮液の少なくとも一部分の送り込みによる発熱反応を通して熱を放出する化学物質を含む、請求項12に記載の方法。
【請求項17】
前記物理的変化がゲルの形成である、請求項12に記載の方法。
【請求項18】
前記反応室の色変化を標準に視覚的に突き合わせる工程をさらに含み、前記標準が増加する色相強度のカラーパッチの印刷帯片を含み、各カラーパッチがリポ多糖体の増加する濃度にそれぞれ対応する、請求項12に記載の方法。
【請求項19】
1ミリリットル当たり少なくとも0.2エンドトキシン単位の濃度に対応する色相強度が、肺内グラム陰性細菌感染症の存在を示す、請求項18に記載の方法。
【請求項20】
前記空気呼吸する脊椎動物被験体が、自発呼吸する被験体である、請求項12に記載の方法。
【請求項21】
前記空気呼吸する脊椎動物被験体が、機械的人工呼吸を受ける被験体である、請求項12に記載の方法。
【請求項22】
前記呼気凝縮液の少なくとも一部分を送り込む工程が、皮下注射針を介して前記呼気凝縮液の少なくとも一部分を前記反応室に注入する工程を含む、請求項12に記載の方法。
【請求項23】
空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法であって、
(a)内部表面を有する反応室であって、その中に配置されたリポ多糖体と結合する材料を有する反応室を用意する工程と、
(b)空気呼吸する脊椎動物被験体から採取された呼気凝縮液の少なくとも一部分を前記反応室に送り込む工程と、
(c)前記反応室を緩衝液で洗浄する工程と、
(d)反応試剤を前記反応室に送り込む工程と、
(e)前記採取された呼気凝縮液の少なくとも一部分が前記反応室に送り込まれたときに発生する物理的変化に基づいて、前記被験体が肺内グラム陰性細菌感染症であるか否かを決定する工程であって、前記物理的変化が前記呼気凝縮液中のリポ多糖体の存在によって引き起こされる工程と、
を含む方法。
【請求項24】
前記反応試薬が発色基質を含む、請求項23に記載の方法。
【請求項25】
前記反応試薬が蛍光基質を含む、請求項23に記載の方法。
【請求項26】
結合材料がリポ多糖体の特定の種に結合する抗体である、請求項23に記載の方法。
【請求項27】
抗体が反応室の内部表面に配置されている、請求項26に記載の方法。
【請求項28】
結合材料が不溶性ポリマーである、請求項23に記載の方法。
【請求項29】
結合材料が反応室内に配置されたマトリクス表面に埋め込まれている、請求項23に記載の方法。
【請求項30】
前記反応室の色変化を標準に視覚的に突き合わせる工程をさらに含み、前記標準が増加する色相強度のカラーパッチの印刷帯片を含み、各カラーパッチがリポ多糖体の増加する濃度にそれぞれ対応する、請求項23に記載の方法。
【請求項31】
1ミリリットル当たり少なくとも0.2エンドトキシン単位の濃度に対応する色相強度が、肺内グラム陰性細菌感染症の存在を示す、請求項23に記載の方法。
【請求項32】
前記空気呼吸する脊椎動物被験体が、自発呼吸する被験体である、請求項23に記載の方法。
【請求項33】
前記空気呼吸する脊椎動物被験体が、機械的人工呼吸を受ける被験体である、請求項23に記載の方法。
【請求項34】
前記呼気凝縮液の少なくとも一部分を送り込む工程が、皮下注射針を介して前記呼気凝縮液の少なくとも一部分を前記反応室に注入する工程を含む、請求項23に記載の方法。
【請求項35】
空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染を診断し監視するための方法であって、
(a)リポ多糖体に暴露されるとゲル化を引き起こす酵素を含浸させた繊維プラグを採取装置の細管内に挿入する工程と、
(b)空気呼吸する脊椎動物被験体から前記採取装置で採取された呼気凝縮液試料の少なくとも一部分を細管に導入して繊維プラグを湿潤させる工程と、
(c)細管内で発生するゲル化の量に基づいて被験者が肺内グラム陰性細菌感染症であるか否かを決定する工程であって、前記ゲル化が呼気凝縮液中のリポ多糖体の存在によって引き起こされる工程と、
を含む方法。
【請求項36】
リポ多糖体の濃度を決定することが、
(a)予め決められた時間期間の後で繊維プラグを放出するのに必要な液圧を測定する工程と、
(b)測定された液圧に基づいて、リポ多糖体の濃度を決定する工程と、
を含む、請求項35に記載の方法。
【請求項37】
繊維プラグが、リムルス変形細胞溶解物由来の酵素を含浸される、請求項35に記載の方法。
【請求項38】
採取装置内に配置されたシリンジを用意する工程をさらに含み、前記シリンジは液圧を測定するためにその片側に配置されたマノメータを有する、請求項35に記載の方法。
【請求項39】
細管がシリンジの端部に配置された皮下注射針である、請求項38に記載の方法。
【請求項1】
空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法であって、
(a)空気呼吸する脊椎動物被験体から採取された呼気凝縮液中のリポ多糖体の濃度を測定する工程と、
(b)前記呼気凝縮液中のリポ多糖体の前記測定濃度に基づいて、前記被験体が肺内グラム陰性細菌感染症であるか否かを決定する工程と、
を含む方法。
【請求項2】
前記肺内グラム陰性細菌感染症が肺炎である、請求項1に記載の方法。
【請求項3】
前記肺内グラム陰性細菌感染症が気管支炎である、請求項1に記載の方法。
【請求項4】
前記被験体が肺内グラム陰性細菌感染症であるという陽性判定に応えて、抗生物質治療を選択する工程をさらに含む、請求項1に記載の方法。
【請求項5】
前記空気呼吸する脊椎動物被験体が、哺乳類被験体であり、前記方法が抗生物質治療に対する前記哺乳類被験体の反応を監視する工程をさらに含む、請求項1に記載の方法。
【請求項6】
肺内グラム陰性細菌の特定菌株を特定する工程をさらに含む、請求項1に記載の方法。
【請求項7】
特定する工程が、リポ多糖体分子のO‐単糖類部の決定に基づいて、肺内グラム陰性細菌の特定の菌株を特定することを含む、請求項6に記載の方法。
【請求項8】
リポ多糖体の濃度を測定する工程が、リムルス変形細胞溶解物アッセイを用いてリポ多糖体の濃度を測定する工程を含む、請求項1に記載の方法。
【請求項9】
少なくとも0.20EU/mLのリポ多糖体の測定濃度がグラム陰性細菌感染症の存在を示す、請求項1に記載の方法。
【請求項10】
前記空気呼吸する脊椎動物被験体が、自発呼吸する被験体である、請求項1に記載の方法。
【請求項11】
前記空気呼吸する脊椎動物被験体が、機械的人工呼吸を受ける被験体である、請求項1に記載の方法。
【請求項12】
空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法であって、
(a)反応試薬が内部に配置された反応室を用意する工程と、
(b)空気呼吸する脊椎動物被験体から採取された呼気凝縮液の少なくとも一部分を前記反応室に送り込む工程と、
(c)前記採取された呼気凝縮液の少なくとも一部分が前記反応室に送り込まれたときに発生する物理的変化に基づいて、前記被験体が肺内グラム陰性細菌感染症であるか否かを決定する工程であって、前記物理的変化が前記呼気凝縮液中のリポ多糖体の存在によって引き起こされる工程と、
を含む方法。
【請求項13】
前記反応試薬がリムルス変形細胞溶解物を含む、請求項12に記載の方法。
【請求項14】
前記反応試薬が発色基質を含む、請求項12に記載の方法。
【請求項15】
前記反応試薬が蛍光基質を含む、請求項12に記載の方法。
【請求項16】
前記反応試薬が、前記呼気凝縮液の少なくとも一部分の送り込みによる発熱反応を通して熱を放出する化学物質を含む、請求項12に記載の方法。
【請求項17】
前記物理的変化がゲルの形成である、請求項12に記載の方法。
【請求項18】
前記反応室の色変化を標準に視覚的に突き合わせる工程をさらに含み、前記標準が増加する色相強度のカラーパッチの印刷帯片を含み、各カラーパッチがリポ多糖体の増加する濃度にそれぞれ対応する、請求項12に記載の方法。
【請求項19】
1ミリリットル当たり少なくとも0.2エンドトキシン単位の濃度に対応する色相強度が、肺内グラム陰性細菌感染症の存在を示す、請求項18に記載の方法。
【請求項20】
前記空気呼吸する脊椎動物被験体が、自発呼吸する被験体である、請求項12に記載の方法。
【請求項21】
前記空気呼吸する脊椎動物被験体が、機械的人工呼吸を受ける被験体である、請求項12に記載の方法。
【請求項22】
前記呼気凝縮液の少なくとも一部分を送り込む工程が、皮下注射針を介して前記呼気凝縮液の少なくとも一部分を前記反応室に注入する工程を含む、請求項12に記載の方法。
【請求項23】
空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染症を診断し監視するための方法であって、
(a)内部表面を有する反応室であって、その中に配置されたリポ多糖体と結合する材料を有する反応室を用意する工程と、
(b)空気呼吸する脊椎動物被験体から採取された呼気凝縮液の少なくとも一部分を前記反応室に送り込む工程と、
(c)前記反応室を緩衝液で洗浄する工程と、
(d)反応試剤を前記反応室に送り込む工程と、
(e)前記採取された呼気凝縮液の少なくとも一部分が前記反応室に送り込まれたときに発生する物理的変化に基づいて、前記被験体が肺内グラム陰性細菌感染症であるか否かを決定する工程であって、前記物理的変化が前記呼気凝縮液中のリポ多糖体の存在によって引き起こされる工程と、
を含む方法。
【請求項24】
前記反応試薬が発色基質を含む、請求項23に記載の方法。
【請求項25】
前記反応試薬が蛍光基質を含む、請求項23に記載の方法。
【請求項26】
結合材料がリポ多糖体の特定の種に結合する抗体である、請求項23に記載の方法。
【請求項27】
抗体が反応室の内部表面に配置されている、請求項26に記載の方法。
【請求項28】
結合材料が不溶性ポリマーである、請求項23に記載の方法。
【請求項29】
結合材料が反応室内に配置されたマトリクス表面に埋め込まれている、請求項23に記載の方法。
【請求項30】
前記反応室の色変化を標準に視覚的に突き合わせる工程をさらに含み、前記標準が増加する色相強度のカラーパッチの印刷帯片を含み、各カラーパッチがリポ多糖体の増加する濃度にそれぞれ対応する、請求項23に記載の方法。
【請求項31】
1ミリリットル当たり少なくとも0.2エンドトキシン単位の濃度に対応する色相強度が、肺内グラム陰性細菌感染症の存在を示す、請求項23に記載の方法。
【請求項32】
前記空気呼吸する脊椎動物被験体が、自発呼吸する被験体である、請求項23に記載の方法。
【請求項33】
前記空気呼吸する脊椎動物被験体が、機械的人工呼吸を受ける被験体である、請求項23に記載の方法。
【請求項34】
前記呼気凝縮液の少なくとも一部分を送り込む工程が、皮下注射針を介して前記呼気凝縮液の少なくとも一部分を前記反応室に注入する工程を含む、請求項23に記載の方法。
【請求項35】
空気呼吸する脊椎動物被験体の肺内グラム陰性細菌感染を診断し監視するための方法であって、
(a)リポ多糖体に暴露されるとゲル化を引き起こす酵素を含浸させた繊維プラグを採取装置の細管内に挿入する工程と、
(b)空気呼吸する脊椎動物被験体から前記採取装置で採取された呼気凝縮液試料の少なくとも一部分を細管に導入して繊維プラグを湿潤させる工程と、
(c)細管内で発生するゲル化の量に基づいて被験者が肺内グラム陰性細菌感染症であるか否かを決定する工程であって、前記ゲル化が呼気凝縮液中のリポ多糖体の存在によって引き起こされる工程と、
を含む方法。
【請求項36】
リポ多糖体の濃度を決定することが、
(a)予め決められた時間期間の後で繊維プラグを放出するのに必要な液圧を測定する工程と、
(b)測定された液圧に基づいて、リポ多糖体の濃度を決定する工程と、
を含む、請求項35に記載の方法。
【請求項37】
繊維プラグが、リムルス変形細胞溶解物由来の酵素を含浸される、請求項35に記載の方法。
【請求項38】
採取装置内に配置されたシリンジを用意する工程をさらに含み、前記シリンジは液圧を測定するためにその片側に配置されたマノメータを有する、請求項35に記載の方法。
【請求項39】
細管がシリンジの端部に配置された皮下注射針である、請求項38に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A−B】


【図10C−D】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A−B】


【図10C−D】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2009−186487(P2009−186487A)
【公開日】平成21年8月20日(2009.8.20)
【国際特許分類】
【出願番号】特願2009−118170(P2009−118170)
【出願日】平成21年5月15日(2009.5.15)
【分割の表示】特願2007−527565(P2007−527565)の分割
【原出願日】平成17年5月24日(2005.5.24)
【出願人】(505233608)ザ シャーロット‐メクレンバーグ ホスピタル オーソリティ (3)
【Fターム(参考)】
【公開日】平成21年8月20日(2009.8.20)
【国際特許分類】
【出願日】平成21年5月15日(2009.5.15)
【分割の表示】特願2007−527565(P2007−527565)の分割
【原出願日】平成17年5月24日(2005.5.24)
【出願人】(505233608)ザ シャーロット‐メクレンバーグ ホスピタル オーソリティ (3)
【Fターム(参考)】
[ Back to top ]

