呼気採取システム
【課題】無侵襲、無麻酔、無拘束、常圧でストレスを与えず、生理的条件に近い状態で動物からの経時的呼気採取を可能とし、しかも簡易で汎用性の高い、呼気採取システムを提供する。
【解決手段】動物に13C-標識体を投与した後、動物の体躯より大きな動物収納容器に入れることにより動物を無麻酔、無拘束、常圧の状態におくことを可能とし、ストレスを極力かけない状態での呼気採取を実現した。また排出された呼気は、動物収納容器に収納された動物の体躯以下に設けた呼気採取口より、呼気移送装置を用いて試験期間中一定速度で継続的に移送させ、呼気貯留容器に捕集する。また、呼気移送装置に複数ラインの呼気移送を可能とするヘッドを装着し、ライン毎に動物収納容器および呼気貯留容器を装着すれば同時に多数の個体から呼気を採取することも可能である。
【解決手段】動物に13C-標識体を投与した後、動物の体躯より大きな動物収納容器に入れることにより動物を無麻酔、無拘束、常圧の状態におくことを可能とし、ストレスを極力かけない状態での呼気採取を実現した。また排出された呼気は、動物収納容器に収納された動物の体躯以下に設けた呼気採取口より、呼気移送装置を用いて試験期間中一定速度で継続的に移送させ、呼気貯留容器に捕集する。また、呼気移送装置に複数ラインの呼気移送を可能とするヘッドを装着し、ライン毎に動物収納容器および呼気貯留容器を装着すれば同時に多数の個体から呼気を採取することも可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、動物の生理機能等を評価する上で有用な呼気採取システムに関する。
【背景技術】
【0002】
医薬品や機能性食品、保健機能食品、栄養食品、病者用食品等の効果、消化吸収代謝能、安全性等の評価を行う手段の1つとして、in vivo試験で動物の生理機能を評価する方法が用いられていた。従来、in vivo試験方法の1つとして、評価用検体投与後に各時点で採血または屠殺を行い、評価用検体またはその変化体の血中濃度や臓器中濃度を測定する方法が用いられていた。しかし、採血の場合は動物への侵襲、屠殺の場合は個体間のバラツキが問題であり、一時点での評価は可能であるが経時的な同一動物での変動を測定するには問題があった。また、採血などの侵襲に起因するストレスにより生理機能が正確に評価できない欠点も有する。そこで、代謝能力や胃腸状態などの生理機能、口腔や胃腸等腔内に棲息する菌の状態などを、より生理的条件に近い状態で定量測定する技術が求められていた。
【0003】
近年、炭素元素を含む各種基質の炭素原子を13Cに置換した化合物(以降、13C-標識体ともいう)を生物に投与し、生体や棲息菌の生理作用によって生じた13CO2量の経時的変化を呼気中に排泄される13CO2の濃度変化として観察することで、生体の生理機能の定量化を図る試みがなされている。これまでに、ヒトを対象として尿素の13C-標識体を用いたHelicobacter pyloriの検出(非特許文献1:J Pediatr,145(1), pp.112-114 (2004))、グルコースの13C-標識体を用いたインシュリン感受性の評価(非特許文献2:Diabetes Care,27(2), pp.441-447 (2004))、オクタン酸の13C-標識体を用いた胃排出能の評価(非特許文献3:Diabetes Obes Metab,6(4), pp.264-270 (2004),非特許文献4:Rapid Commun Mass Spectrom,18(10), pp.1003-1007 (2004))、フェニルアラニンの13C-標識体を用いた肝臓での代謝能評価(非特許文献5:J Chromatogr B Analyt Technol Biomed Life Sci,806(1),pp. 5-10 (2004))、ロイシンの13C-標識体を用いた蛋白消化能評価(非特許文献6:J Nutr,134(4), pp.806-810 (2004))、Benzoyl-L-tyrosyl-alanineの13C-標識体を用いた膵外分泌機能(非特許文献7:消化器科、39(2)、pp.174-177 (2004))などの呼気テストが知られており、医療や研究の分野において用いられている。
また、標識体ではないが、呼気中の水素やメタンを指標にした呼気テストも知られており、医療や研究の分野において用いられている。
【0004】
一方、ラットやマウス等の動物を用いた呼気テストもいくつか報告されているが、呼気量が少ない上に安定的に呼気を採取するのが困難であった。そのために、例えば麻酔下の呼気採取や(非特許文献8:日薬理誌,120(1),pp.101-106 (2002))、ガラス容器の中に無麻酔の動物を入れ、呼気を採取する時に換気を停止し、動物にストレスがかった状態での呼気採取(非特許文献9:Clin Exp Pharmacol Physiol,27(9), 671-675 (2000))が行われていた。他の例として、コンピュータ制御された気密容器に無麻酔の動物を入れ自動的に呼気を採取する方法も報告されているが、呼気採取時に換気を停止するために動物にストレスがかかりやすく、またコンピュータ制御の切り替えバルブやオートサンプラー等の高価な機器を必要とする上に、同時に呼気を採取することもできない。ここではさらに呼気非採取時にCO2を含まない合成空気で換気を行っているため、低CO2環境による動物の血圧低下が懸念される(非特許文献10:Neurogastroenterol Motil,14(3), 287-293 (2002))。一方、麻酔下においては呼吸抑制が起こり、またストレスをかけることにより胃排出の遅延が起こるため、いずれも生理機能を正しく反映できる方法とは言えない(非特許文献11:J Physiol,1556(Pt 1), pp.221-234 (2004))。
【0005】
また、同時に多数の個体を対象に試験する場合には、多数の個体から同時平行で呼気を採取し、採取した呼気を安定的に保持する必要がある。これまでに動物を収納した容器からシリンジで呼気を吸引する方法や、容器から真空チューブに呼気を採取する方法等が報告されている(非特許文献10〜11)。臨床においては逆止弁の付いた呼気貯留容器へ呼気を吹き込み、呼気を貯留する方法も用いられている(非特許文献1〜6)。この方法は呼気採取貯留容器以外に特別の器具や機器を用いることなく呼気を採取、保持できる点にすぐれているが、動物への応用例は報告されていない。
【0006】
採取した呼気中の13CO2の濃度変化を測定する方法については、これまでガスマススペクトロメーター等の分析機器を用いた例が報告されている(非特許文献9)。しかし、上記に示す分析機器などの装置は高価であり、操作も熟練が必要であるため汎用性に乏しい点が問題であった。近年では、赤外分光分析装置と上記の呼気貯留容器を組み合わせた、より簡便な測定法が用いられており、臨床などで応用されている(非特許文献1〜6)。この測定法では、呼気貯留容器を赤外分光分析装置に接続するだけで自動的に呼気中の13CO2の濃度変化を測定することができるが、動物への応用例は報告されていない。そこで、呼気の吹き込みによる呼気採取が困難な測定対象動物であっても、ストレスの少ない生理的条件に近い状態で安定して呼気を採取、貯留し、測定に供することができる、簡便な呼気採取システムが望まれていた。
【0007】
【特許文献1】特開平06−245703号公報
【非特許文献1】Levine A, Shevah O, Miloh T, Wine E, Niv Y, Bujanover Y, Avni Y, Shirin H、Validation of a novel real time 13C urea breath test for rapid evaluation of Helicobacter pylori in children and adolescents.、J Pediatr、145(1)、pp. 112-114 (2004)
【非特許文献2】Lewanczuk RZ, Paty BW, Toth EL、Comparison of the [13C]glucose breath test to the hyperinsulinemic-euglycemic clamp when determining insulin resistance.、Diabetes Care、27(2)、pp.441-447 (2004)
【非特許文献3】Jackson SJ, Leahy FE, McGowan AA, Bluck LJ, Coward WA, Jebb SA、Delayed gastric emptying in the obese: an assessment using the non-invasive 13C-octanoic acid breath test.、Diabetes Obes Metab、6(4)、pp.264-270 (2004)
【非特許文献4】Jackson SJ, Bluck LJ, Coward WA、Use of isotopically labeled octanoic acid to assess the effect of meal size on gastric emptying.、Rapid Commun Mass Spectrum、18(10)、pp.1003-1007 (2004)
【非特許文献5】Wada M、Measurement of hepatic phenylalanine metabolism in children using the [13C]-phenylalanine breath test and gas chromatography-mass spectrometry.、J Chromatogr B Analyt Technol Biomed Life Sci、806(1)、pp.5-10 (2004)
【非特許文献6】Geboes KP, Bammens B, Luypaerts A, Malheiros R, Buyse J, Evenepoel P, Rutgeerts P, Verbeke K.、Validation of a new test meal for a protein digestion breath test in humans.、J Nutr、134(4)、pp. 806-810 (2004)
【非特許文献7】石井敬基,河野匡,伊藤あすか,高山忠利,山本寛,藤本康雄,浅井聡、13C−ジペプチド(Benzoyl-L-tyrosyl-[1-13C]alanine)呼気テストによる簡易膵外分泌機能検査法、消化器科、39(2)、pp.174-177 (2004)
【非特許文献8】石井敬基,石川紘一,浅井聰、ラット肝切除モデルを用いた 13C標識アミノ酸投与後,呼気中13CO2連続測定による肝機能評価、日薬理誌、120(1)、pp.101-106 (2002)
【非特許文献9】Symonds EL, Butler RN, Omari TI、Assessment of gastric emptying in the mouse using the [13C]-octanoic acid breath test.、Clin Exp Pharmacol Physiol、27(9)、pp.671-675 (2000)
【非特許文献10】Schoonjans R, Van Vlem B, Van Heddeghem N, Vandamme W, Vanholder R, Lameire N, Lefebvre R, De Vos M、The 13C-octanoic acid breath test: validation of a new noninvasive method of measuring gastric emptying in rats.、Neurogastroenterol Motil、14(3)、pp.287-293 (2002)
【非特許文献11】Martinez V, Wang L, Rivier J, Grigoriadis D, Tache Y、Central CRF, urocortins and stress increase colonic transit via CRF1 receptors while activation of CRF2 receptors delays gastric transit in mice.、J Physiol、1556(Pt 1)、pp.221-234 (2004)
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明の解決しようとする課題は、動物に与えるストレスが少ない状態において、動物呼気を経時的に採取することを可能とし、さらに簡易で汎用性の高い、呼気採取システムおよび該システムを用いた生理機能評価方法を提供することである。
【課題を解決するための手段】
【0009】
すなわち、本発明は上記課題を解決するためになされたものであって、本発明者らは鋭意検討の結果、動物に13C-標識体または未標識体を投与した後、あるいは通常の状態で、動物の体躯より大きな収納容器に入れることにより動物を無麻酔、無拘束、常圧の状態におくことを可能とし、さらに試験期間中一定速度で呼気を継続的に移送して換気速度を一定に保つことで、麻酔、拘束、換気速度の変動等に起因するストレスを極力かけない状態での呼気採取を実現した。また排出された呼気は、収納容器に収納された動物の体躯以下に設けた呼気採取口より、呼気移送装置を用いて移送させ、呼気貯留容器に捕集する。こうすることで、高価なコンピュータシステムを用いたチャンバーシステムを用いなくても呼気採取を可能とし、しかも採取した呼気を安定的に貯留することができる。また、呼気移送装置に複数ラインの呼気移送を可能とするヘッドを装着し、ライン毎に動物収納容器および呼気貯留容器を装着するだけで同時に多数の個体から呼気を採取することも可能である。
【0010】
採取した呼気中の13CO2 の変化量は、例えばUBiT-IR300(大塚製薬株式会社)等の市販の呼気測定装置で測定することができる。この場合、測定にあたっては呼気採取容器をノズルに差し込むだけで自動的に測定が行われ、ガスクロマトグラフィーやガスマススペクトロメーターなどの操作を必要としない。しかも、1検体当たりの測定時間はUBiT-IR300の場合約5.5分とガスクロマトグラフィー等の分析機器に比べてきわめて短く、また例えば専用オートサンプラー UBiT-AS10(大塚製薬株式会社)を装着すると、最大10検体の呼気採取容器を装着することができ、これらを自動的に順次測定することも可能である。また、未標識体についても、例えば水素やメタンの場合、Breath Gas Analyzer TGA-2000H(TERAMECS)などの汎用の機器を用いて測定することができる。
【0011】
すなわち、本発明は
[1] 呼気採取口および空気採り入れ口を有し、空気採り入れ口が開放されていることを特徴とする、動物収納容器、
[2] 動物の体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設けたこと特徴とする、前記[1]に記載の動物収納容器、
[3] 動物の体躯以上に呼気採取口を設け、動物体躯以下かつ呼気採取口よりも下部に空気採り入れ口を設けたこと特徴とする、前記[1]に記載の動物収納容器、
[4] 前記[1]〜[3]のいずれか1つに記載の動物収納容器、および呼気貯留容器、呼気移送装置を含む、呼気採取システム、
[5] 呼気貯留容器が呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなく保持できることを特徴とする、前記[4]に記載の呼気採取システム、
[6] 呼気移送装置が呼気を一定速度で移送するものであることを特徴とする、前記[4]に記載の呼気採取システム、
[7] 動物収納容器が収納した動物の体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設けたこと特徴し、呼気貯留容器が呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなく保持できることを特徴し、呼気移送装置が呼気を一定速度で移送するものであることを特徴とする、前記[4]に記載の呼気採取システム、
[8] 前記[4]〜[6]のいずれか1つに記載の呼気採取システムを用いた呼気採取方法、
[9] 前記[4]〜[6]のいずれか1つに記載の呼気採取システムを用いた、生理機能の評価方法、
[10] 生理機能が胃排出能、肝機能、脂質代謝および膵外分泌機能からなる群のうちすくなくとも1つである、前記[9]に記載の方法、
[11] 生理機能を評価するための、前記[4]〜[6]のいずれか1つに記載の呼気採取システムの使用、
[12] 生理機能が胃排出能、肝機能、脂質代謝および膵外分泌機能からなる群のうちすくなくとも1つである、前記[11]に記載の呼気採取システムの使用、
を提供するものである、
【発明の効果】
【0012】
in vivo試験において、動物に麻酔、拘束、換気速度の変動等に起因するストレスを与えず、同じ個体の生理機能(臓器機能、栄養成分の代謝能、腸内細菌の状態等)を無侵襲のまま生理的条件に近い状態にて経時的に測定することができる。しかも、操作性にすぐれ、複数個体において同時に呼気の採取、貯留が簡便に行える。さらに安価に呼気採取システムを組むことができる。さらに、採取した呼気は、市販の呼気測定装置でも測定することができる。したがって、本発明の呼気採取システムは、分析技術を有しない者であっても測定が可能で、操作性、汎用性にすぐれた呼気テストシステムまたは生理機能の評価方法を提供できる。本発明により、動物の生理機能のみならず、医薬品や機能性食品、保健機能食品、栄養食品、病者用食品等の効果、消化吸収代謝能等の評価も、より適正で簡便で安価に行うことが可能となる。
【発明を実施するための最良の形態】
【0013】
従来、in vivo試験において動物の生理機能を経時的に測定するためには、経時的採血などの侵襲や屠殺による方法、あるいは麻酔、拘束、換気速度の変動等に起因するストレスを伴った呼気採取システムによる呼気テストが用いられていた。また、従来の呼気採取システムは高価な機器や技術を要し、また複数個体から同時に呼気採取する装置として十分とは言えなかった。
【0014】
動物の呼気を採取する方法として、麻酔下で呼気を採取する方法が報告されているが麻酔の影響により呼吸が抑制されるため、この場合も呼気テストの結果が左右される。そこで、動物収納容器としては、ある程度自由に動くことのできるスペースを確保したものを用いることにし、無麻酔、無拘束を可能にした。動物収納容器の大きさは動物の体躯の大きさ、呼吸速度等によって異なるため、特に限定されないが、例えば約200gのラットを対象とした場合に容積2Lの動物収納容器を用いることができる。例えば炭酸ガスなどのように、空気よりも重い気体を採取の目的とする場合、体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設ける。また、例えば水素、メタンやアンモニアのような空気よりも軽い気体を採取の目的とする場合、体躯以上に呼気採取口を設け、動物体躯以下かつ呼気採取口よりも下部に空気採り入れ口を設ける。呼気採取口は、例えば動物収納容器に穿孔して設けることができる。また、空気採り入れ口をふさがない程度の太さのチューブを空気採り入れ口から通し入れ、動物の体躯以下にその開口部の一端を設置してこれを呼気採取口とし、他端を動物収納容器外に設ける方式を用いても、動物の体躯以上にその開口部の一端を設置してこれを呼気採取口とし、他端を動物収納容器外に設ける方式を用いてもよい。あるいは、呼気採取口をふさがない程度の太さのチューブを呼気採取口から通し入れ、動物の体躯以下にその開口部の一端を設置してこれを空気採り入れ口とし、他端を動物収納容器外に設ける方式を用いても、動物の体躯以上にその開口部の一端を設置してこれを空気採り入れ口とし、他端を動物収納容器外に設ける方式を用いてもよい。呼気採取口は、動物から目的とする気体を含む呼気を採取できるのであれば上記の例に限らず他の形態であってもかまわない。動物収納容器の色は透明、半透明、不透明の各種色を用いることができるが、一般状態の観察が可能である無彩色透明であるのが好ましい。動物収納容器の一例として、デシケーターを挙げることができる。さらにその使い方の一例を挙げると、デシケーター内に中敷きを敷きその上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分からから呼気が漏れないようにふたを固定する。呼気は動物の体躯以下に設けた呼気採取口から移送する方法を用いる。動物収納容器およびその使用方法は上記の例に限らず、無麻酔・無拘束で動物の収納が可能で、常圧で継続的に呼気を採取できるのであれば他の容器や使用方法であってもかまわない。
【0015】
排出された呼気は、呼気移送装置を用い一定速度で継続的に移送させ呼気貯留容器に捕集することで、コンピュータ制御された高価なチャンバーを用いなくても呼気を採取することが可能になった。
【0016】
呼気の移送方法としては、ガラスコンテナーや気密容器の中にラットを入れ、呼気を採取する時に一旦換気を停止する方法が報告されている。しかし、換気を停止することでストレスがかかり、その影響で呼気テストの結果が左右されることが容易に推察される。そのため、呼気移送装置としては、呼気を一定の速度で継続的に移送できるものが望ましい。例えばペリスタホンプ、インフュージョンポンプ、プランジャーポンプ、ダイヤフラムポンプ等を挙げることができるが、これらに限定されず、呼気を一定の速度で継続的に移送できるのであれば、他の装置であってもかまわない。呼気移送方式は、動物収納容器の呼気採取口から呼気を吸引する方式、動物収納容器の空気採り入れ口から呼気を押し出す方式等のいずれの方式であってもよい。また、呼気移送装置に複数ラインの呼気移送を可能とするヘッド(図1の、同時採取用ポンプヘッドに相当する)を装着し、ライン毎に動物収納容器および呼気貯留容器を装着するだけで同時に多数の個体から呼気を採取することも可能である。
【0017】
呼気移送の速度は、動物収納容器の大きさ、動物の体躯の大きさ、測定対象、測定目的、13C-標識体や未標識体の投与量、呼気排出速度などによって異なり、特に限定されないが、動物にストレスを与えず、適切に呼気を採取できる範囲あればよい。あえて挙げるなら、例えば体重約200gのラットを対象とし、容積2Lの動物収納容器を使用する場合、50〜400ml/min、好ましくは75〜300ml/min、さらに好ましくは100〜200ml/minの速度で呼気を移送することができる。
【0018】
動物へのストレスを最小限にするため、試験期間中は呼気の採取時も非採取時も呼気移送装置を同じ流速で稼働させ、換気速度を一定とする。呼気を採取しない時(非採取時)は、動物収納容器内の呼気が動物収納容器外の試験環境に混入しないよう、呼気採取口からの呼気を他の容器に回収あるいは試験環境外へ排気するのが望ましい。
【0019】
また、呼気貯留容器としては、呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなくまたは少なく保持できるものを用いる。例えば呼気捕集専用の呼気採取用バッグ、UBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)を挙げることができる。呼気採取中および呼気採取後の呼気が逆流せず、容器構造を通じて中の呼気が外気と交換することがなくまたは少なく保持できるのであれば、前記容器に限らず、ビニールバッグなど、他の素材や形態の容器であってもかまわない。
【0020】
動物収納容器、呼気移送装置、呼気貯留容器の間は、呼気が漏出しない方式によって接続する。各々を直に接続しても、間にチューブ、配管などを介して接続してもよい。この時用いるチューブ、配管等は構造や素材を通じて中の呼気が外気と交換することがなくまたは少なく保持できるものを用いる。
【0021】
例えば、呼気中の13CO2は、赤外分光分析装置、ガスクロマトグラフィー、GC-MS等の機器を用いて測定できるが、上記の例に限らず、呼気中の13CO2量を測定できるのであれば他の方式であってもよい。例えば市販の赤外分光分析装置であるUBiT-IR300(大塚製薬株式会社)を用いることができる。UBiT-IR300は、13CO2と12CO2の赤外線吸収波長の差を利用して呼気中の存在比(13CO2/12CO2)を測定する。さらに自然な存在比を有する基準用呼気ガスの測定値との差を求め、変化量(以降、Δ13CO2ともいう)を算出する。測定可能なCO2濃度範囲は0.5%以上、CO2濃度1%以上のサンプルを10回測定した時の測定精度は±0.3‰以内である。測定にあたっては呼気採取容器をノズルに差し込むだけで自動的に測定が行われ、ガスクロマトグラフィーやガスマススペクトロメーターなどの操作を必要としない。しかも、1検体当たりの測定時間はUBiT-IR300の場合約5.5分とガスクロマトグラフィー等の分析機器に比べてきわめて短い。これまで測定にはガスクロマトグラフィーやガスマススペクトロメーターなどを用いており、装置自体が高価であり、また、操作にある程度の熟練を必要とする。しかし、本発明の呼気採取システムとUBiT-IR300を組み合わせた場合は、測定にあたって呼気採取バッグをノズルに差し込むだけでΔ13CO2が自動的に測定され、測定のための熟練は必要ない。また例えば専用オートサンプラー UBiT-AS10(大塚製薬株式会社)を装着すると、最大10検体の呼気採取容器を装着することができ、これらを自動的に順次測定することも可能である。したがって、分析技術を有しない者であっても測定が可能であり、より汎用性の高い方法ということができる。
また、未標識体についても、赤外分光分析装置、ガスクロマトグラフィー、GC-MS等の機器を用いて測定できるが、これらの例に限らず、例えば水素やメタンの場合、Breath Gas Analyzer TGA-2000H(TERAMECS)などの汎用の機器を用いて測定することができる。
【0022】
呼気中13CO2の測定が可能であれば、各種13C-標識体を投与することにより、動物の脳、胃、腸、肝臓、膵臓などの臓器機能、栄養成分や薬物の消化吸収代謝能などの生理機能を評価することができる。または、未標識体を投与後、あるいは特に基質を投与しない状態でも、呼気中の未標識の気体を測定することで生理機能を評価することもできる。
【0023】
本発明の呼気採取システムを用いた、生理機能の評価方法については、(1)酢酸の13C-標識体を用いた胃排出速度の評価(実施例2〜5)、(2)アミノピリンの13C-標識体を用いた肝機能の評価(実施例6)、(3)オレイン酸の酢酸の13C-標識体を用いた脂質代謝の評価(実施例7)、(4)Benzoyl-L-tyrosyl-[1-13C]alanineを用いた膵外分泌の評価(実施例8〜9)において有効である事が実証されている。
評価が可能な生理機能の例としては、他にも、酢酸やオクタン酸の13C-標識体を用いた胃排出能や胃運動性、でんぷんの13C-標識体を用いた膵臓の機能、グルコースの13C-標識体を用いたインシュリン感受性、アミノピリンやフェニルアラニンの13C-標識体を用いた肝臓の代謝能、ロイシン等の13C-標識体を用いた蛋白消化能(J Nutr 134, 806-810 (2004))、中性脂肪等の13C-標識体を用いた脂肪消化吸収能、スクロース、マルトース、等の13C-標識体を用いた糖消化吸収能、Benzoyl-L-tyrosyl-[1-13C]alanineを用いた膵外分泌機能などを挙げることができるが、これらの例に限定されるものではない。また、口腔や胃腸管腔に棲息する微生物の検出も可能である。例えば尿素の13C-標識体を用いたHelicobacter pyloriの検出などを挙げることができるが、他の微生物の検出であってもかまわない。
Bacterial Overgrowthは、小腸通過時間の延長によって、腸内細菌(例えば上部小腸細菌叢など)が異常に増殖し、炭水化物の吸収不良に類似した症状を呈する。グルコースやラクツロースなどの糖を投与し、呼気中の水素あるいはメタンを本発明の呼気採取システムで採取して測定し、この現象を評価することもできる。
【0024】
本発明の呼気採取システムは、上述の用途以外に、動物の生理機能等を評価するために未標識体または他の元素を標識したものの呼気中排泄物を採取する手段として用いることもできる。例えば、腸内細菌の異常増殖を測定するために呼気中の水素やメタンの増加を観察
【0025】
本発明の呼気採取システムまたは該システムを用いた生理機能の評価方法を用いることにより、医薬品、医薬部外品、機能性食品、保健機能食品、栄養食品、病者用食品等の効果、消化吸収代謝能、安全性等を評価することができる。さらに、腸内細菌叢の異常増殖を評価することもできる。また、本発明は薬物や栄養成分等の体内動態を評価するために薬物や栄養成分またはそれらの代謝産物が呼気中に排泄されたものを採取する手段として用いることもできる。このとき採取の対象とするものは未標識体、13C-標識体、他の元素を標識したもののいずれであってもよい。
【0026】
評価対象の動物としては、ラット、マウス、モルモット、ハムスター、スナネズミ等のげっ歯類、ウサギ、イヌ、ネコ、フェレット、ブタ、サル、ヒト等の哺乳動物、ニワトリ、ウズラ等の鳥類、カエル、イモリ、サンショウウオ等の両生類、は虫類、魚類、昆虫等を対象とすることができる。さらに、植物や微生物にも応用することができる。
【実施例】
【0027】
以下、本発明について実施例を挙げて説明するが、本発明はこれにより限定されるものではない。
【0028】
[実施例1](呼気移送速度の違いによる呼気中の13CO2排泄量への影響)
(1) 材料および方法
[動物実験]
体重約200gのSD系雄性ラットを一晩絶食した。但し、水は自由に摂取とした。ラットに13C標識した酢酸(以降、13C-酢酸ともいう)を経腸栄養剤ラコール(大塚製薬株式会社)に混ぜ経口投与する。13C-酢酸の用量は16mg/kg、ラコール-13C-酢酸混合液投与容量は2.5ml/kgとした。ラコール-13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度75、150、300ml/minでそれぞれ吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点でそれぞれの呼気移送速度に応じて3.0(呼気移送速度75ml/min)、1.5(呼気移送速度150ml/min)、0.75(呼気移送速度300ml/min)分間の呼気を採取した。ラコールは経腸栄養剤であり、たんぱく質4.38g/100ml、脂質2.23g/100ml、糖質15.62g/100mlを含有する。
【0029】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度75、150、300ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)。
【0030】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、最高Δ13CO2排泄量(以降、Cmaxともいう)、最高Δ13CO2排泄発現時間(以降、Tmaxともいう)を表示する。さらにラコール-13C-酢酸混合液投与から0〜120分のΔ13CO2測定値-時間曲線下面積(以降、AUCともいう)台形面積法にて算出した。また、呼気吸引中におけるラットの状態も併せて観察した。
【0031】
(3)結果および考察
経時的なΔ13CO2測定値を図2、Cmax、Tmax、AUCを表1に示す。各時点においてΔ13CO2測定値に有意な差は認められなかった。Cmaxは吸引速度が増加するにしたがって増加したが、吸引速度間で有意差はなかった。また、TmaxやAUCについても吸引速度間で有意差はなかった。動物の状態を観察すると、吸引速度が75ml/minではラットが軽度の酸欠状態になった。一方、吸引速度が300ml/minでは換気速度が高いためラットに風が当たり、ラットにややストレスを与える傾向がみられた。したがって、吸引速度は150ml/minが適当であると判断した。
【0032】
【表1】

【0033】
表1は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4(吸引速度75ml/minおよび150ml/min)、n=3(吸引速度300ml/min))を示す。
【0034】
[実施例2](経腸栄養剤投与による胃排出遅延効果)
[動物実験]
体重約200gのSD系雄性ラットを一晩絶食した。但し、水は自由に摂取とした。ラットに13C-酢酸を蒸留水または経腸栄養剤ラコール(大塚製薬株式会社)に混ぜ経口投与する。13C-酢酸の用量は16mg/kg、13C-酢酸混合液投与容量は2.5ml/kgとした。13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。ラコールは経腸栄養剤であり、たんぱく質4.38g/100ml、脂質2.23g/100ml、糖質15.62g/100mlを含有する。
【0035】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0036】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらに13C-酢酸混合液投与から0〜120分のAUCを台形面積法にて算出した。
【0037】
(3)結果および考察
経時的なΔ13CO2測定値を図3、Cmax、Tmax、AUCを表2に示す。図3、表2から明らかなように、蒸留水に比較してラコールを投与すると胃排出は遅延した。これはラコールが経腸栄養剤であり、胃排出遅延が起きたためである。蛋白や脂肪を含む食品によって胃排出遅延が起きることはよく知られた知見であり、今回得られた結果と一致していた。このことは、本発明を用いた呼気テストシステムにより胃排出機能の評価が十分可能であることを示す結果と考えられる。
【0038】
【表2】

【0039】
表2は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4)を示す。**:蒸留水に対して有意(p<0.01、Student's t-test)。
【0040】
[実施例3](呼気中Δ13CO2排泄量に対する経腸栄養剤投与容量の影響)
(1) 材料および方法
[動物実験]
体重約200gのSD系雄性ラット(n=4(投与容量1.25, 2.5, 5.0ml/kgの群)、n=3(投与容量10ml/kgの群))を一晩絶食する。但し、水は自由に摂取とした。ラットに13C-酢酸を経腸栄養剤ラコールに各種濃度にて混合し経口投与する。13C-酢酸の用量は一定の16mg/kgとしたまま、ラコール-13C-酢酸混合液の投与容量を1.25, 2.5, 5.0 および10ml/kgとした。ラコール-13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0041】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0042】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにラコール-13C-酢酸混合液投与から0〜120分のAUCを台形面積法にて算出した。
【0043】
(3)結果および考察
経時的なΔ13CO2測定値を図4、Cmax、Tmax、AUCを表3に示す。図4から明らかなように投与容量に比例してΔ13CO2排出量は増加した。また、CmaxおよびAUCも容量に依存して増加した。Tmaxは容量に依存して遅延した。中でも、投与容量10ml/kgの群では明らかなΔ13CO2測定値のピークが認められなかったことから、望ましい投与容量は1.25〜5.0ml/kgであると考えられた。
【0044】
【表3】

【0045】
表3は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4(投与容量1.25, 2.5, 5.0ml/kg)、n=3(投与容量10ml/kg))を示す。
【0046】
[実施例4](呼気中Δ13CO2排泄量に対する13C-酢酸の投与用量の影響)
(1)材料および方法
[動物実験]
体重約200gのSD系雄性ラットを一晩絶食する。但し、水は自由に摂取とした。ラットに13C-酢酸を経腸栄養剤ラコールに各種濃度にて混合し経口投与する。13C-酢酸の用量は8, 16 および32mg/kgとしラコール-13C-酢酸混合液の投与容量は一定の2.5ml/kgとした。ラコール-13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0047】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0048】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにラコール-13C-酢酸混合液投与から0〜120分のAUCを台形面積法にて算出した。
【0049】
(3)結果および考察
経時的なΔ13CO2測定値を図5、Cmax、Tmax、AUCを表4に示す。図5から明らかなように13C-酢酸の用量に比例してΔ13CO2排出量は増加した。また、表4からもCmaxおよびAUCも用量に依存して増加した。但し、Tmaxは用量の増加により遅延した。
【0050】
【表4】

【0051】
表4は、ラコール-13C-酢酸混合液の投与容量を一定とし、13C-酢酸の用量を変えた場合の呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4)を示す。
【0052】
[実施例5](胃運動亢進薬の投与用量依存的な胃排出促進効果)
(1) 材料および方法
[動物実験]
体重約200gのSD系雄性ラットを一晩絶食する。但し、水は自由に摂取とした。胃運動亢進薬であるメトクロプラミドを1%アラビアゴムに懸濁して経口投与した。メトクロプラミド投与群には、メトクロプラミドの用量は0mg/kg(対照群)、0.3mg/kg、1.0、3.0mg/kgとし、投与容量は一定の5ml/kgで経口投与した。対照群には1%アラビアゴムを5ml/kgを経口投与した。メトクロプラミド投与30分後、13C-酢酸を経腸栄養剤ラコール混合し経口投与した。13C-酢酸の用量は16mg/kgとしラコール-13C-酢酸混合液の投与容量は2.5ml/kgとした。ラコール-13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0053】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0054】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20を13CO2 UBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにラコール-13C-酢酸混合液投与から0〜120分のAUCを台形面積法にて算出した。
【0055】
(3)結果および考察
経時的なΔ13CO2測定値を図6、Cmax、Tmax、AUCを表5に示す。図6から明らかなようにメトクロプラミドを投与することによりTmaxは有意に早くなり、Cmaxも有意に増加した。但し、AUCには影響しなかった。したがって、本発明を用いた呼気テストシステムは明らかに胃運動を評価できる簡便な方法であることが示された。
【0056】
【表5】

【0057】
表5は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4(メトクロプラミド用量0mg/kg,0.3mg/kg,1.0mg/kg)、n=3(メトクロプラミド用量3.0mg/kg))を示す。*:p<0.05(vs.対照群、Student's t-test)、**:p<0.01(vs.対照群、Student's t-test)。
【0058】
[実施例6](エタノールとLPS併用投与により誘導されるアルコール性肝障害モデルでの検討)
(1)材料および方法
[動物実験]
7週齢Sprague-Dawley系雌性ラット(日本SLC)の体重を基に群分けし、陰性群、対照群、LPS低用量群、LPS中用量群およびLPS高用量群の5群を設けた。匹数は陰性群に4匹、その他の群は3匹とした。群構成を表6に示す。非絶食状態にて、対照群、LPS低用量群、LPS中用量群およびLPS高用量群に50V/V%エタノールを10ml/kg経口投与し、陰性群には同容量の蒸留水を経口投与した(Time 0)。エタノールまたは蒸留水投与の6時間後(Time 6)にリポポリサッカライド(E.coli055:B5由来、Sigma-Aldrich Co.、以降LPSともいう)を投与した。この時、LPS低用量群には0.54mg/kg、LPS中用量群には1.66 mg/kg、LPS高用量群には5.0mg/kgの用量にてLPSを静脈内投与し(投与容量はいずれも2ml/kg)、陰性群、対照群には同容量の生理食塩水を静脈内投与した。LPS投与20時間後(Time 26)に20mg/kgの用量にて13C標識したアミノピリン(以降、13C-アミノピリンともいう)を経口投与し(投与容量はいずれも10ml/kg)、その直後、個体毎にラットをデシケーターに入れ、投与後10分から90分まで10分毎に、90分以降は30分毎に240分まで経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。13C-アミノピリン投与から240分 (Time 30)経過後に剖検を行い、腹部大動脈より全採血を行った。
【0059】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0060】
【表6】

【0061】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらに13C-アミノピリン投与から0〜240分のAUCを台形面積法にて算出した。
【0062】
さらに、採取した血液から血漿と血清を分離し、血漿のプロトロンビン時間、血清のGPT、アルブミン、蛋白分画を測定した。
【0063】
(3)結果および考察
経時的なΔ13CO2測定値を図7、Cmax、Tmax、AUCを表7に示す。今回、エタノールと共存下に、LPSによる3段階の肝障害をラットに作製し、13C-アミノピリン代謝能をみたところ、LPS中用量群およびLPS高用量群は対照群と比較して各時点のΔ13CO2測定値が有意に低下した。また、CmaxおよびAUCもLPS投与用量依存的に減少し、LPS中用量群およびLPS高用量群では対照群と比較して有意な低下がみられた。また、いずれの値においても陰性と対照群の間に有意差はみられなかった。
【0064】
【表7】

【0065】
表7は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準偏差(n=4(陰性群)、n=3(対照群、LPS低用量群、LPS中用量群、LPS高用量群))を示す。*:p<0.05(vs.対照群、Scheffeの多重比較検定)
【0066】
血液生化学検査の結果を表8に示す。血清GPTは、陰性群と対照群、あるいは対照群とLPS低用量群、LPS中用量群およびLPS高用量群の比較において、有意差はみられなかった。しかし、LPS投与用量に相関して血清GPTが増加する傾向がみられた。また、LPS中用量群およびLPS高用量群においては血清蛋白分画のアルブミン分画の有意な低値、α1分画の有意な高値、α2分画の増加傾向も認められた。β蛋白分画、γ蛋白分画には群間に変化がなかった。
【0067】
【表8】

【0068】
表8は、血清GPT、血清アルブミン(Albumin)、血清蛋白分画、血漿プロトロンビン時間(PT時間)を示す表である。平均値±標準偏差(n=4(陰性群)、n=3(対照群、LPS低用量群、LPS中用量群、LPS高用量群))を示す。#:p< 0.05(vs.陰性群、Student's t-test)、*:p<0.05(vs.対照群、Scheffeの多重比較検定)、**:p<0.01(vs.対照群、Scheffeの多重比較検定)。
【0069】
アミノピリンは肝ミクロソームにおけるチトクロームP-450系を介する薬物代謝能をみていることから、慢性肝疾患患者にアミノピリン呼気テストを施行すると正常人に比してΔ13CO2の排出量が有意に低下し、その肝障害の重症度に応じて低下することが知られている。また、血清アルブミンおよび血清蛋白のアルブミン分画は肝生合成低下等が原因となって減少する(金井泉、臨床検査法堤要、金原出版、pp.413(1985))。これに対し、肝細胞逸脱酵素であるGOT、GPTを指標とした肝障害モデルにおいては、GPTが数千に上るほど重度の肝障害を作成する系が知られている。今回、エタノール共存下にLPSの投与したところ、LPSを1.66 mg/kgまたは5.0mg/kgを投与した群において13C-アミノピリンに由来するΔ13CO2の排出量およびアルブミン分画が有意に減少した。また、この時の蛋白分画の変化(アルブミン分画の減少とα1およびα2分画の増加)は急性炎症を示唆するものであった。一方、これらのLPS投与量において、肝細胞破壊の指標であるGPTの有意な増大を認めることはなかった。
【0070】
これらの結果から、当実験系は大幅な肝細胞破壊に至らない程度の傷害による肝代謝能低下でも評価することを可能とした。したがって、その予防/治療効果を経時観察する上でも、本発明を用いた呼気テストシステムは感度が良く有用であることが示された。
【0071】
[実施例7](13C-オレイン酸の用量による呼気中のΔ13CO2排泄量への影響。)
(1)材料および方法
[動物実験]
7週齢Sprague-Dawley系雌性ラット(日本SLC)の体重を基に群分けし、13C-オレイン酸低用量群、13C-オレイン酸中用量群および13C-オレイン酸高用量群の3群を設けた。匹数はいずれの群も2匹とした。1晩絶食の後、13C-オレイン酸低用量群には26mg/kg、13C-オレイン酸中用量群には77mg/kg、13C-オレイン酸高用量群には230mg/kgの13C-オレイン酸を、13C-オレイン酸混合オリーブ油5ml/kgとして経口投与した。その直後、個体毎にラットをデシケーターに入れ、30分毎に8時間まで経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0072】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0073】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらに13C-オレイン酸混合オリーブ油投与から0〜480分のAUCを台形面積法にて算出した。
【0074】
(3)結果および考察
経時的な13CO2測定値を図8、Cmax、Tmax、AUCを表9に示す。図8から明らかなように13C-オレイン酸の用量に比例してΔ13CO2排出量は増加した。また、CmaxおよびAUCも用量に依存して増加した。但し、Tmaxは用量によらず大きな変動はみられなかった。脂肪酸の一つであるオレイン酸において、Δ13CO2排出量に13C-オレイン酸用量依存性がみられたことから、ラットの脂質代謝検討に本発明を用いた呼気テストシステムは有用であることが示された。
【0075】
【表9】

【0076】
表9は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。個体毎の値および平均値(n=2)を示す。
【0077】
[実施例8] (糖尿病モデル動物における膵外分泌機能の評価)
膵外分泌機能検査にはBT-BAPA(N-benzoyl-L-tyrosyl-paminobenzoic acid)、PFD test、pancreolaury test、糞便中chymotrypsin testが知られている。しかし、検査の結果が出るまでに時間を要するなど、簡易的ではない。近年、安定同位体である13Cを用いた呼気テストによる生理機能評価が広く行われるようになり、石井ら(消化器科39; 174-177, 2004)はBenzoyl-L-tyrosyl-[1-13C]alanine(以下、Bz-Tyr-[1-13C]Alaともいう)を用いて臨床で膵外分泌機能を呼気テストにより評価している。そこで、本発明の方法を用いてin vivoにおいて膵外分泌機能が評価できるか検討を行った。また、糖尿病患者において、膵膵外分泌機能が低下することから(Keller I and Layer P、Gut、54 suppl VI、vi19-vi20(2005))、同時に、糖尿病ラットについても測定し膵外分泌機能が的確に評価できるかどうかも併せて検討した。
(1)材料および方法
[動物実験]
7週齢Fisher 344系雄性ラット(日本SLC)を、体重を基に群分けして、アロキサン投与群、対照群の2群を設けた。いずれの群も4匹とした。アロキサン投与群にはアロキサン40mg/kgを静脈内投与して糖尿病を惹起した。アロキサン静脈内投与の3日後からアロキサン投与群、対照群とも一夜絶食し、アロキサン静脈内投与の4日後に実験に用いた。Bz-Tyr-[1-13C]Alaは8mg/mlになるように注射用水に溶解した。1匹あたり20mg/kg(容量2.5ml/kg)になるようにBz-Tyr-[1-13C]Alaを経口投与し、その直後個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的に呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0078】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0079】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにBz-Tyr-[1-13C]Ala投与から0〜120分のAUC(以降、AUC120ともいう)を台形面積法にて算出した。
【0080】
(3)結果および考察
経時的な13CO2測定値を図9、Cmax、Tmax、AUC120を表10に示す。図9から明らかなように、対照群のΔ13CO2排出量は経時的に増加し、20分で最大値を示し、その値(Cmax)は72.1±6.9 ‰であり、以降、経時的に低下した。AUC120は4589±253 ‰・minであった。一方、アロキサン投与群のΔ13CO2排出量も経時的に増加し、20分で最大値を示し、その値(Cmax)は59.5±4.9 ‰であり、以降、経時的に低下した。また、AUC120は3699±369 ‰・minであったが、Cmax、および、AUC120は対照群に比較して明らかに低い値であった。
以上の結果から基質であるBz-Tyr-[1-13C]Alaが膵液中のプロテアーゼにより分解後、アラニンが十二指腸から吸収されて肝臓で代謝され呼気中に13CO2となり排泄されることが明らかになった。また、膵機能低下動物である糖尿病ラットでは呼気中への13CO2排泄量が正常ラットに比較して顕著に低下していたことから、本法により的確に膵外分泌機能を評価できていることが確認できた。
【0081】
【表10】

【0082】
表10は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4)を示す。
【0083】
[実施例9] (加齢ラットにおける膵外分泌機能の評価)
加齢により、膵臓機能が低下することが知られている(Laugier R et al、Digestion、50(3-4)、pp.202-11(1991)、石橋忠明ら、日本老年医学会雑誌、28(5)、pp.599-605(1991))。本発明の方法を用いた膵外分泌機能の評価方法を用い、in vivoにおいて膵外分泌機能の低下が的確に評価できるか検討した。
(1)材料および方法
[動物実験]
6週齢Fisher 344系雄性ラット(日本SLC)を4匹(6週齢群)と、加齢ラットとして30週齢Fisher 344系雄性ラット(日本SLC)を4匹(30週齢群)を用いて試験を行った。6週齢群、30週齢群とも一夜絶食して実験に用いた。Bz-Tyr-[1-13C]Alaは8mg/mlになるように注射用水に溶解した。1匹あたり4.0mg(容量0.5ml/body)になるようにBz-Tyr-[1-13C]Alaを経口投与し、その直後個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的に呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0084】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0085】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにBz-Tyr-[1-13C]Ala投与から0〜120分のAUC(以降、AUC120ともいう)を台形面積法にて算出した。
【0086】
(3)結果および考察
経時的な13CO2測定値を図10、Cmax、Tmax、AUC120を表11に示す。図10から明らかなように、6週齢群のΔ13CO2排出量は経時的に増加し、20分で最大値を示し、その値(Cmax)は72.1±4.9 ‰であり、以降、経時的に低下した。AUC120は4280±219 ‰・minであった。一方、30週齢群のΔ13CO2排出量も経時的に増加し、20分で最大値を示し、その値(Cmax)は29.8±1.1 ‰であったが、6週齢群と比較して有意に(p<0.01)低値であった。その後、Δ13CO2排出量は経時的に低下した。AUC120は3699±369 ‰・minと、6週齢群と比較して有意に(p<0.01)低値であった。Tmaxについては、週齢の違いによる有意な差は認められなかった。いずれの時点においても、Δ13CO2排出量は、30週齢群は6週齢群と比較して有意に低値を示した。
以上の結果から、本発明の呼気採取システムを用いることにより、動物実験でも加齢により膵分泌機能が低下する現象を観察できることが明らかになり、その有用性が示された。
【0087】
【表11】

【0088】
表10は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4)を示す。**:p<0.01(vs. 6週齢群、Student's t-test)。
【産業上の利用可能性】
【0089】
本発明の呼気採取システムは、分析技術を有しない者であっても測定が可能で、操作性、汎用性にすぐれた呼気テストシステムを構成できる。本発明により、動物の生理機能のみならず、医薬品や機能性食品、保健機能食品、栄養食品、病者用食品等の効果、消化吸収代謝能、安全性等の評価も、より適正でかつ簡便で安価に行うことが可能となる。
【図面の簡単な説明】
【0090】
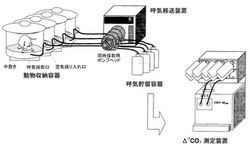
【図1】本発明の呼気採取システムの概略図である。図中、本発明の呼気採取システムは、動物収納容器、呼気貯留容器、呼気移送装置を含む構成となっている。この図では、本発明の呼気採取システムにて4個体の呼気を同時に採取し、さらにΔ13CO2測定装置にて呼気を測定する様子を示す。
【図2】呼気移送速度の違いによる呼気中のΔ13CO2排泄量への影響。13C-酢酸をラコールに溶解した場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4(吸引速度75ml/minおよび150ml/min)、n=3(吸引速度300ml/min))を示す。
【図3】経腸栄養剤投与による胃排出遅延効果。13C-酢酸を蒸留水に溶解した場合とラコールに溶解した場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4)を示す。*:p<0.05(vs.蒸留水投与群、Student's t-test)、**: p<0.01(vs.蒸留水投与群、Student's t-test)。
【図4】呼気中Δ13CO2排泄量に対する経腸栄養剤投与容量の影響。13C-酢酸の用量を一定とし、ラコール-13C-酢酸混合液の投与容量を変えた場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4(投与容量1.25, 2.5, 5.0ml/kg)、n=3(投与容量10ml/kg))を示す。
【図5】呼気中Δ13CO2排泄量に対する13C-酢酸の投与用量の影響。ラコール-13C-酢酸混合液の投与容量を一定とし、13C-酢酸の用量を変えた場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4)を示す。
【図6】胃運動亢進薬の投与用量依存的な胃排出促進効果。メトクロプラミドを前投与した場合の呼気中の呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4(メトクロプラミド用量0mg/kg,0.3mg/kg,1.0mg/kg)、n=3(メトクロプラミド用量3.0mg/kg))を示す。*:p<0.05(vs.対照群、Student's t-test)、**:p<0.01(vs.対照群、Student's t-test)。
【図7】エタノール共存下における、LPSの投与量依存的な肝障害惹起効果。LPS投与量を変えた場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準偏差(n=4(陰性群)、n=3(対照群、LPS低用量群、LPS中用量群、LPS高用量群))を示す。*:p<0.05(vs.対照群、Scheffeの多重比較検定)、**:p<0.01(vs.対照群、Scheffeの多重比較検定) 。
【図8】13C-オレイン酸の用量による呼気中のΔ13CO2排泄量への影響。13Cオレイン酸投与量を変えた場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値(n=2)を示す。
【図9】アロキサン誘発糖尿病による呼気中のΔ13CO2排泄量への影響。Bz-Tyr-[1-13C]Ala投与後の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準偏差(n=4)を示す。
【図10】加齢による呼気中のΔ13CO2排泄量への影響。Bz-Tyr-[1-13C]Ala投与後の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準偏差(n=4)を示す。*:p<0.05(vs. 6週齢群、Student's t-test)、**:p<0.01(vs. 6週齢群、Student's t-test)、#:p<0.001(vs.6週齢群、Student's t-test)。
【技術分野】
【0001】
本発明は、動物の生理機能等を評価する上で有用な呼気採取システムに関する。
【背景技術】
【0002】
医薬品や機能性食品、保健機能食品、栄養食品、病者用食品等の効果、消化吸収代謝能、安全性等の評価を行う手段の1つとして、in vivo試験で動物の生理機能を評価する方法が用いられていた。従来、in vivo試験方法の1つとして、評価用検体投与後に各時点で採血または屠殺を行い、評価用検体またはその変化体の血中濃度や臓器中濃度を測定する方法が用いられていた。しかし、採血の場合は動物への侵襲、屠殺の場合は個体間のバラツキが問題であり、一時点での評価は可能であるが経時的な同一動物での変動を測定するには問題があった。また、採血などの侵襲に起因するストレスにより生理機能が正確に評価できない欠点も有する。そこで、代謝能力や胃腸状態などの生理機能、口腔や胃腸等腔内に棲息する菌の状態などを、より生理的条件に近い状態で定量測定する技術が求められていた。
【0003】
近年、炭素元素を含む各種基質の炭素原子を13Cに置換した化合物(以降、13C-標識体ともいう)を生物に投与し、生体や棲息菌の生理作用によって生じた13CO2量の経時的変化を呼気中に排泄される13CO2の濃度変化として観察することで、生体の生理機能の定量化を図る試みがなされている。これまでに、ヒトを対象として尿素の13C-標識体を用いたHelicobacter pyloriの検出(非特許文献1:J Pediatr,145(1), pp.112-114 (2004))、グルコースの13C-標識体を用いたインシュリン感受性の評価(非特許文献2:Diabetes Care,27(2), pp.441-447 (2004))、オクタン酸の13C-標識体を用いた胃排出能の評価(非特許文献3:Diabetes Obes Metab,6(4), pp.264-270 (2004),非特許文献4:Rapid Commun Mass Spectrom,18(10), pp.1003-1007 (2004))、フェニルアラニンの13C-標識体を用いた肝臓での代謝能評価(非特許文献5:J Chromatogr B Analyt Technol Biomed Life Sci,806(1),pp. 5-10 (2004))、ロイシンの13C-標識体を用いた蛋白消化能評価(非特許文献6:J Nutr,134(4), pp.806-810 (2004))、Benzoyl-L-tyrosyl-alanineの13C-標識体を用いた膵外分泌機能(非特許文献7:消化器科、39(2)、pp.174-177 (2004))などの呼気テストが知られており、医療や研究の分野において用いられている。
また、標識体ではないが、呼気中の水素やメタンを指標にした呼気テストも知られており、医療や研究の分野において用いられている。
【0004】
一方、ラットやマウス等の動物を用いた呼気テストもいくつか報告されているが、呼気量が少ない上に安定的に呼気を採取するのが困難であった。そのために、例えば麻酔下の呼気採取や(非特許文献8:日薬理誌,120(1),pp.101-106 (2002))、ガラス容器の中に無麻酔の動物を入れ、呼気を採取する時に換気を停止し、動物にストレスがかった状態での呼気採取(非特許文献9:Clin Exp Pharmacol Physiol,27(9), 671-675 (2000))が行われていた。他の例として、コンピュータ制御された気密容器に無麻酔の動物を入れ自動的に呼気を採取する方法も報告されているが、呼気採取時に換気を停止するために動物にストレスがかかりやすく、またコンピュータ制御の切り替えバルブやオートサンプラー等の高価な機器を必要とする上に、同時に呼気を採取することもできない。ここではさらに呼気非採取時にCO2を含まない合成空気で換気を行っているため、低CO2環境による動物の血圧低下が懸念される(非特許文献10:Neurogastroenterol Motil,14(3), 287-293 (2002))。一方、麻酔下においては呼吸抑制が起こり、またストレスをかけることにより胃排出の遅延が起こるため、いずれも生理機能を正しく反映できる方法とは言えない(非特許文献11:J Physiol,1556(Pt 1), pp.221-234 (2004))。
【0005】
また、同時に多数の個体を対象に試験する場合には、多数の個体から同時平行で呼気を採取し、採取した呼気を安定的に保持する必要がある。これまでに動物を収納した容器からシリンジで呼気を吸引する方法や、容器から真空チューブに呼気を採取する方法等が報告されている(非特許文献10〜11)。臨床においては逆止弁の付いた呼気貯留容器へ呼気を吹き込み、呼気を貯留する方法も用いられている(非特許文献1〜6)。この方法は呼気採取貯留容器以外に特別の器具や機器を用いることなく呼気を採取、保持できる点にすぐれているが、動物への応用例は報告されていない。
【0006】
採取した呼気中の13CO2の濃度変化を測定する方法については、これまでガスマススペクトロメーター等の分析機器を用いた例が報告されている(非特許文献9)。しかし、上記に示す分析機器などの装置は高価であり、操作も熟練が必要であるため汎用性に乏しい点が問題であった。近年では、赤外分光分析装置と上記の呼気貯留容器を組み合わせた、より簡便な測定法が用いられており、臨床などで応用されている(非特許文献1〜6)。この測定法では、呼気貯留容器を赤外分光分析装置に接続するだけで自動的に呼気中の13CO2の濃度変化を測定することができるが、動物への応用例は報告されていない。そこで、呼気の吹き込みによる呼気採取が困難な測定対象動物であっても、ストレスの少ない生理的条件に近い状態で安定して呼気を採取、貯留し、測定に供することができる、簡便な呼気採取システムが望まれていた。
【0007】
【特許文献1】特開平06−245703号公報
【非特許文献1】Levine A, Shevah O, Miloh T, Wine E, Niv Y, Bujanover Y, Avni Y, Shirin H、Validation of a novel real time 13C urea breath test for rapid evaluation of Helicobacter pylori in children and adolescents.、J Pediatr、145(1)、pp. 112-114 (2004)
【非特許文献2】Lewanczuk RZ, Paty BW, Toth EL、Comparison of the [13C]glucose breath test to the hyperinsulinemic-euglycemic clamp when determining insulin resistance.、Diabetes Care、27(2)、pp.441-447 (2004)
【非特許文献3】Jackson SJ, Leahy FE, McGowan AA, Bluck LJ, Coward WA, Jebb SA、Delayed gastric emptying in the obese: an assessment using the non-invasive 13C-octanoic acid breath test.、Diabetes Obes Metab、6(4)、pp.264-270 (2004)
【非特許文献4】Jackson SJ, Bluck LJ, Coward WA、Use of isotopically labeled octanoic acid to assess the effect of meal size on gastric emptying.、Rapid Commun Mass Spectrum、18(10)、pp.1003-1007 (2004)
【非特許文献5】Wada M、Measurement of hepatic phenylalanine metabolism in children using the [13C]-phenylalanine breath test and gas chromatography-mass spectrometry.、J Chromatogr B Analyt Technol Biomed Life Sci、806(1)、pp.5-10 (2004)
【非特許文献6】Geboes KP, Bammens B, Luypaerts A, Malheiros R, Buyse J, Evenepoel P, Rutgeerts P, Verbeke K.、Validation of a new test meal for a protein digestion breath test in humans.、J Nutr、134(4)、pp. 806-810 (2004)
【非特許文献7】石井敬基,河野匡,伊藤あすか,高山忠利,山本寛,藤本康雄,浅井聡、13C−ジペプチド(Benzoyl-L-tyrosyl-[1-13C]alanine)呼気テストによる簡易膵外分泌機能検査法、消化器科、39(2)、pp.174-177 (2004)
【非特許文献8】石井敬基,石川紘一,浅井聰、ラット肝切除モデルを用いた 13C標識アミノ酸投与後,呼気中13CO2連続測定による肝機能評価、日薬理誌、120(1)、pp.101-106 (2002)
【非特許文献9】Symonds EL, Butler RN, Omari TI、Assessment of gastric emptying in the mouse using the [13C]-octanoic acid breath test.、Clin Exp Pharmacol Physiol、27(9)、pp.671-675 (2000)
【非特許文献10】Schoonjans R, Van Vlem B, Van Heddeghem N, Vandamme W, Vanholder R, Lameire N, Lefebvre R, De Vos M、The 13C-octanoic acid breath test: validation of a new noninvasive method of measuring gastric emptying in rats.、Neurogastroenterol Motil、14(3)、pp.287-293 (2002)
【非特許文献11】Martinez V, Wang L, Rivier J, Grigoriadis D, Tache Y、Central CRF, urocortins and stress increase colonic transit via CRF1 receptors while activation of CRF2 receptors delays gastric transit in mice.、J Physiol、1556(Pt 1)、pp.221-234 (2004)
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明の解決しようとする課題は、動物に与えるストレスが少ない状態において、動物呼気を経時的に採取することを可能とし、さらに簡易で汎用性の高い、呼気採取システムおよび該システムを用いた生理機能評価方法を提供することである。
【課題を解決するための手段】
【0009】
すなわち、本発明は上記課題を解決するためになされたものであって、本発明者らは鋭意検討の結果、動物に13C-標識体または未標識体を投与した後、あるいは通常の状態で、動物の体躯より大きな収納容器に入れることにより動物を無麻酔、無拘束、常圧の状態におくことを可能とし、さらに試験期間中一定速度で呼気を継続的に移送して換気速度を一定に保つことで、麻酔、拘束、換気速度の変動等に起因するストレスを極力かけない状態での呼気採取を実現した。また排出された呼気は、収納容器に収納された動物の体躯以下に設けた呼気採取口より、呼気移送装置を用いて移送させ、呼気貯留容器に捕集する。こうすることで、高価なコンピュータシステムを用いたチャンバーシステムを用いなくても呼気採取を可能とし、しかも採取した呼気を安定的に貯留することができる。また、呼気移送装置に複数ラインの呼気移送を可能とするヘッドを装着し、ライン毎に動物収納容器および呼気貯留容器を装着するだけで同時に多数の個体から呼気を採取することも可能である。
【0010】
採取した呼気中の13CO2 の変化量は、例えばUBiT-IR300(大塚製薬株式会社)等の市販の呼気測定装置で測定することができる。この場合、測定にあたっては呼気採取容器をノズルに差し込むだけで自動的に測定が行われ、ガスクロマトグラフィーやガスマススペクトロメーターなどの操作を必要としない。しかも、1検体当たりの測定時間はUBiT-IR300の場合約5.5分とガスクロマトグラフィー等の分析機器に比べてきわめて短く、また例えば専用オートサンプラー UBiT-AS10(大塚製薬株式会社)を装着すると、最大10検体の呼気採取容器を装着することができ、これらを自動的に順次測定することも可能である。また、未標識体についても、例えば水素やメタンの場合、Breath Gas Analyzer TGA-2000H(TERAMECS)などの汎用の機器を用いて測定することができる。
【0011】
すなわち、本発明は
[1] 呼気採取口および空気採り入れ口を有し、空気採り入れ口が開放されていることを特徴とする、動物収納容器、
[2] 動物の体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設けたこと特徴とする、前記[1]に記載の動物収納容器、
[3] 動物の体躯以上に呼気採取口を設け、動物体躯以下かつ呼気採取口よりも下部に空気採り入れ口を設けたこと特徴とする、前記[1]に記載の動物収納容器、
[4] 前記[1]〜[3]のいずれか1つに記載の動物収納容器、および呼気貯留容器、呼気移送装置を含む、呼気採取システム、
[5] 呼気貯留容器が呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなく保持できることを特徴とする、前記[4]に記載の呼気採取システム、
[6] 呼気移送装置が呼気を一定速度で移送するものであることを特徴とする、前記[4]に記載の呼気採取システム、
[7] 動物収納容器が収納した動物の体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設けたこと特徴し、呼気貯留容器が呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなく保持できることを特徴し、呼気移送装置が呼気を一定速度で移送するものであることを特徴とする、前記[4]に記載の呼気採取システム、
[8] 前記[4]〜[6]のいずれか1つに記載の呼気採取システムを用いた呼気採取方法、
[9] 前記[4]〜[6]のいずれか1つに記載の呼気採取システムを用いた、生理機能の評価方法、
[10] 生理機能が胃排出能、肝機能、脂質代謝および膵外分泌機能からなる群のうちすくなくとも1つである、前記[9]に記載の方法、
[11] 生理機能を評価するための、前記[4]〜[6]のいずれか1つに記載の呼気採取システムの使用、
[12] 生理機能が胃排出能、肝機能、脂質代謝および膵外分泌機能からなる群のうちすくなくとも1つである、前記[11]に記載の呼気採取システムの使用、
を提供するものである、
【発明の効果】
【0012】
in vivo試験において、動物に麻酔、拘束、換気速度の変動等に起因するストレスを与えず、同じ個体の生理機能(臓器機能、栄養成分の代謝能、腸内細菌の状態等)を無侵襲のまま生理的条件に近い状態にて経時的に測定することができる。しかも、操作性にすぐれ、複数個体において同時に呼気の採取、貯留が簡便に行える。さらに安価に呼気採取システムを組むことができる。さらに、採取した呼気は、市販の呼気測定装置でも測定することができる。したがって、本発明の呼気採取システムは、分析技術を有しない者であっても測定が可能で、操作性、汎用性にすぐれた呼気テストシステムまたは生理機能の評価方法を提供できる。本発明により、動物の生理機能のみならず、医薬品や機能性食品、保健機能食品、栄養食品、病者用食品等の効果、消化吸収代謝能等の評価も、より適正で簡便で安価に行うことが可能となる。
【発明を実施するための最良の形態】
【0013】
従来、in vivo試験において動物の生理機能を経時的に測定するためには、経時的採血などの侵襲や屠殺による方法、あるいは麻酔、拘束、換気速度の変動等に起因するストレスを伴った呼気採取システムによる呼気テストが用いられていた。また、従来の呼気採取システムは高価な機器や技術を要し、また複数個体から同時に呼気採取する装置として十分とは言えなかった。
【0014】
動物の呼気を採取する方法として、麻酔下で呼気を採取する方法が報告されているが麻酔の影響により呼吸が抑制されるため、この場合も呼気テストの結果が左右される。そこで、動物収納容器としては、ある程度自由に動くことのできるスペースを確保したものを用いることにし、無麻酔、無拘束を可能にした。動物収納容器の大きさは動物の体躯の大きさ、呼吸速度等によって異なるため、特に限定されないが、例えば約200gのラットを対象とした場合に容積2Lの動物収納容器を用いることができる。例えば炭酸ガスなどのように、空気よりも重い気体を採取の目的とする場合、体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設ける。また、例えば水素、メタンやアンモニアのような空気よりも軽い気体を採取の目的とする場合、体躯以上に呼気採取口を設け、動物体躯以下かつ呼気採取口よりも下部に空気採り入れ口を設ける。呼気採取口は、例えば動物収納容器に穿孔して設けることができる。また、空気採り入れ口をふさがない程度の太さのチューブを空気採り入れ口から通し入れ、動物の体躯以下にその開口部の一端を設置してこれを呼気採取口とし、他端を動物収納容器外に設ける方式を用いても、動物の体躯以上にその開口部の一端を設置してこれを呼気採取口とし、他端を動物収納容器外に設ける方式を用いてもよい。あるいは、呼気採取口をふさがない程度の太さのチューブを呼気採取口から通し入れ、動物の体躯以下にその開口部の一端を設置してこれを空気採り入れ口とし、他端を動物収納容器外に設ける方式を用いても、動物の体躯以上にその開口部の一端を設置してこれを空気採り入れ口とし、他端を動物収納容器外に設ける方式を用いてもよい。呼気採取口は、動物から目的とする気体を含む呼気を採取できるのであれば上記の例に限らず他の形態であってもかまわない。動物収納容器の色は透明、半透明、不透明の各種色を用いることができるが、一般状態の観察が可能である無彩色透明であるのが好ましい。動物収納容器の一例として、デシケーターを挙げることができる。さらにその使い方の一例を挙げると、デシケーター内に中敷きを敷きその上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分からから呼気が漏れないようにふたを固定する。呼気は動物の体躯以下に設けた呼気採取口から移送する方法を用いる。動物収納容器およびその使用方法は上記の例に限らず、無麻酔・無拘束で動物の収納が可能で、常圧で継続的に呼気を採取できるのであれば他の容器や使用方法であってもかまわない。
【0015】
排出された呼気は、呼気移送装置を用い一定速度で継続的に移送させ呼気貯留容器に捕集することで、コンピュータ制御された高価なチャンバーを用いなくても呼気を採取することが可能になった。
【0016】
呼気の移送方法としては、ガラスコンテナーや気密容器の中にラットを入れ、呼気を採取する時に一旦換気を停止する方法が報告されている。しかし、換気を停止することでストレスがかかり、その影響で呼気テストの結果が左右されることが容易に推察される。そのため、呼気移送装置としては、呼気を一定の速度で継続的に移送できるものが望ましい。例えばペリスタホンプ、インフュージョンポンプ、プランジャーポンプ、ダイヤフラムポンプ等を挙げることができるが、これらに限定されず、呼気を一定の速度で継続的に移送できるのであれば、他の装置であってもかまわない。呼気移送方式は、動物収納容器の呼気採取口から呼気を吸引する方式、動物収納容器の空気採り入れ口から呼気を押し出す方式等のいずれの方式であってもよい。また、呼気移送装置に複数ラインの呼気移送を可能とするヘッド(図1の、同時採取用ポンプヘッドに相当する)を装着し、ライン毎に動物収納容器および呼気貯留容器を装着するだけで同時に多数の個体から呼気を採取することも可能である。
【0017】
呼気移送の速度は、動物収納容器の大きさ、動物の体躯の大きさ、測定対象、測定目的、13C-標識体や未標識体の投与量、呼気排出速度などによって異なり、特に限定されないが、動物にストレスを与えず、適切に呼気を採取できる範囲あればよい。あえて挙げるなら、例えば体重約200gのラットを対象とし、容積2Lの動物収納容器を使用する場合、50〜400ml/min、好ましくは75〜300ml/min、さらに好ましくは100〜200ml/minの速度で呼気を移送することができる。
【0018】
動物へのストレスを最小限にするため、試験期間中は呼気の採取時も非採取時も呼気移送装置を同じ流速で稼働させ、換気速度を一定とする。呼気を採取しない時(非採取時)は、動物収納容器内の呼気が動物収納容器外の試験環境に混入しないよう、呼気採取口からの呼気を他の容器に回収あるいは試験環境外へ排気するのが望ましい。
【0019】
また、呼気貯留容器としては、呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなくまたは少なく保持できるものを用いる。例えば呼気捕集専用の呼気採取用バッグ、UBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)を挙げることができる。呼気採取中および呼気採取後の呼気が逆流せず、容器構造を通じて中の呼気が外気と交換することがなくまたは少なく保持できるのであれば、前記容器に限らず、ビニールバッグなど、他の素材や形態の容器であってもかまわない。
【0020】
動物収納容器、呼気移送装置、呼気貯留容器の間は、呼気が漏出しない方式によって接続する。各々を直に接続しても、間にチューブ、配管などを介して接続してもよい。この時用いるチューブ、配管等は構造や素材を通じて中の呼気が外気と交換することがなくまたは少なく保持できるものを用いる。
【0021】
例えば、呼気中の13CO2は、赤外分光分析装置、ガスクロマトグラフィー、GC-MS等の機器を用いて測定できるが、上記の例に限らず、呼気中の13CO2量を測定できるのであれば他の方式であってもよい。例えば市販の赤外分光分析装置であるUBiT-IR300(大塚製薬株式会社)を用いることができる。UBiT-IR300は、13CO2と12CO2の赤外線吸収波長の差を利用して呼気中の存在比(13CO2/12CO2)を測定する。さらに自然な存在比を有する基準用呼気ガスの測定値との差を求め、変化量(以降、Δ13CO2ともいう)を算出する。測定可能なCO2濃度範囲は0.5%以上、CO2濃度1%以上のサンプルを10回測定した時の測定精度は±0.3‰以内である。測定にあたっては呼気採取容器をノズルに差し込むだけで自動的に測定が行われ、ガスクロマトグラフィーやガスマススペクトロメーターなどの操作を必要としない。しかも、1検体当たりの測定時間はUBiT-IR300の場合約5.5分とガスクロマトグラフィー等の分析機器に比べてきわめて短い。これまで測定にはガスクロマトグラフィーやガスマススペクトロメーターなどを用いており、装置自体が高価であり、また、操作にある程度の熟練を必要とする。しかし、本発明の呼気採取システムとUBiT-IR300を組み合わせた場合は、測定にあたって呼気採取バッグをノズルに差し込むだけでΔ13CO2が自動的に測定され、測定のための熟練は必要ない。また例えば専用オートサンプラー UBiT-AS10(大塚製薬株式会社)を装着すると、最大10検体の呼気採取容器を装着することができ、これらを自動的に順次測定することも可能である。したがって、分析技術を有しない者であっても測定が可能であり、より汎用性の高い方法ということができる。
また、未標識体についても、赤外分光分析装置、ガスクロマトグラフィー、GC-MS等の機器を用いて測定できるが、これらの例に限らず、例えば水素やメタンの場合、Breath Gas Analyzer TGA-2000H(TERAMECS)などの汎用の機器を用いて測定することができる。
【0022】
呼気中13CO2の測定が可能であれば、各種13C-標識体を投与することにより、動物の脳、胃、腸、肝臓、膵臓などの臓器機能、栄養成分や薬物の消化吸収代謝能などの生理機能を評価することができる。または、未標識体を投与後、あるいは特に基質を投与しない状態でも、呼気中の未標識の気体を測定することで生理機能を評価することもできる。
【0023】
本発明の呼気採取システムを用いた、生理機能の評価方法については、(1)酢酸の13C-標識体を用いた胃排出速度の評価(実施例2〜5)、(2)アミノピリンの13C-標識体を用いた肝機能の評価(実施例6)、(3)オレイン酸の酢酸の13C-標識体を用いた脂質代謝の評価(実施例7)、(4)Benzoyl-L-tyrosyl-[1-13C]alanineを用いた膵外分泌の評価(実施例8〜9)において有効である事が実証されている。
評価が可能な生理機能の例としては、他にも、酢酸やオクタン酸の13C-標識体を用いた胃排出能や胃運動性、でんぷんの13C-標識体を用いた膵臓の機能、グルコースの13C-標識体を用いたインシュリン感受性、アミノピリンやフェニルアラニンの13C-標識体を用いた肝臓の代謝能、ロイシン等の13C-標識体を用いた蛋白消化能(J Nutr 134, 806-810 (2004))、中性脂肪等の13C-標識体を用いた脂肪消化吸収能、スクロース、マルトース、等の13C-標識体を用いた糖消化吸収能、Benzoyl-L-tyrosyl-[1-13C]alanineを用いた膵外分泌機能などを挙げることができるが、これらの例に限定されるものではない。また、口腔や胃腸管腔に棲息する微生物の検出も可能である。例えば尿素の13C-標識体を用いたHelicobacter pyloriの検出などを挙げることができるが、他の微生物の検出であってもかまわない。
Bacterial Overgrowthは、小腸通過時間の延長によって、腸内細菌(例えば上部小腸細菌叢など)が異常に増殖し、炭水化物の吸収不良に類似した症状を呈する。グルコースやラクツロースなどの糖を投与し、呼気中の水素あるいはメタンを本発明の呼気採取システムで採取して測定し、この現象を評価することもできる。
【0024】
本発明の呼気採取システムは、上述の用途以外に、動物の生理機能等を評価するために未標識体または他の元素を標識したものの呼気中排泄物を採取する手段として用いることもできる。例えば、腸内細菌の異常増殖を測定するために呼気中の水素やメタンの増加を観察
【0025】
本発明の呼気採取システムまたは該システムを用いた生理機能の評価方法を用いることにより、医薬品、医薬部外品、機能性食品、保健機能食品、栄養食品、病者用食品等の効果、消化吸収代謝能、安全性等を評価することができる。さらに、腸内細菌叢の異常増殖を評価することもできる。また、本発明は薬物や栄養成分等の体内動態を評価するために薬物や栄養成分またはそれらの代謝産物が呼気中に排泄されたものを採取する手段として用いることもできる。このとき採取の対象とするものは未標識体、13C-標識体、他の元素を標識したもののいずれであってもよい。
【0026】
評価対象の動物としては、ラット、マウス、モルモット、ハムスター、スナネズミ等のげっ歯類、ウサギ、イヌ、ネコ、フェレット、ブタ、サル、ヒト等の哺乳動物、ニワトリ、ウズラ等の鳥類、カエル、イモリ、サンショウウオ等の両生類、は虫類、魚類、昆虫等を対象とすることができる。さらに、植物や微生物にも応用することができる。
【実施例】
【0027】
以下、本発明について実施例を挙げて説明するが、本発明はこれにより限定されるものではない。
【0028】
[実施例1](呼気移送速度の違いによる呼気中の13CO2排泄量への影響)
(1) 材料および方法
[動物実験]
体重約200gのSD系雄性ラットを一晩絶食した。但し、水は自由に摂取とした。ラットに13C標識した酢酸(以降、13C-酢酸ともいう)を経腸栄養剤ラコール(大塚製薬株式会社)に混ぜ経口投与する。13C-酢酸の用量は16mg/kg、ラコール-13C-酢酸混合液投与容量は2.5ml/kgとした。ラコール-13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度75、150、300ml/minでそれぞれ吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点でそれぞれの呼気移送速度に応じて3.0(呼気移送速度75ml/min)、1.5(呼気移送速度150ml/min)、0.75(呼気移送速度300ml/min)分間の呼気を採取した。ラコールは経腸栄養剤であり、たんぱく質4.38g/100ml、脂質2.23g/100ml、糖質15.62g/100mlを含有する。
【0029】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度75、150、300ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)。
【0030】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、最高Δ13CO2排泄量(以降、Cmaxともいう)、最高Δ13CO2排泄発現時間(以降、Tmaxともいう)を表示する。さらにラコール-13C-酢酸混合液投与から0〜120分のΔ13CO2測定値-時間曲線下面積(以降、AUCともいう)台形面積法にて算出した。また、呼気吸引中におけるラットの状態も併せて観察した。
【0031】
(3)結果および考察
経時的なΔ13CO2測定値を図2、Cmax、Tmax、AUCを表1に示す。各時点においてΔ13CO2測定値に有意な差は認められなかった。Cmaxは吸引速度が増加するにしたがって増加したが、吸引速度間で有意差はなかった。また、TmaxやAUCについても吸引速度間で有意差はなかった。動物の状態を観察すると、吸引速度が75ml/minではラットが軽度の酸欠状態になった。一方、吸引速度が300ml/minでは換気速度が高いためラットに風が当たり、ラットにややストレスを与える傾向がみられた。したがって、吸引速度は150ml/minが適当であると判断した。
【0032】
【表1】

【0033】
表1は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4(吸引速度75ml/minおよび150ml/min)、n=3(吸引速度300ml/min))を示す。
【0034】
[実施例2](経腸栄養剤投与による胃排出遅延効果)
[動物実験]
体重約200gのSD系雄性ラットを一晩絶食した。但し、水は自由に摂取とした。ラットに13C-酢酸を蒸留水または経腸栄養剤ラコール(大塚製薬株式会社)に混ぜ経口投与する。13C-酢酸の用量は16mg/kg、13C-酢酸混合液投与容量は2.5ml/kgとした。13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。ラコールは経腸栄養剤であり、たんぱく質4.38g/100ml、脂質2.23g/100ml、糖質15.62g/100mlを含有する。
【0035】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0036】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらに13C-酢酸混合液投与から0〜120分のAUCを台形面積法にて算出した。
【0037】
(3)結果および考察
経時的なΔ13CO2測定値を図3、Cmax、Tmax、AUCを表2に示す。図3、表2から明らかなように、蒸留水に比較してラコールを投与すると胃排出は遅延した。これはラコールが経腸栄養剤であり、胃排出遅延が起きたためである。蛋白や脂肪を含む食品によって胃排出遅延が起きることはよく知られた知見であり、今回得られた結果と一致していた。このことは、本発明を用いた呼気テストシステムにより胃排出機能の評価が十分可能であることを示す結果と考えられる。
【0038】
【表2】

【0039】
表2は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4)を示す。**:蒸留水に対して有意(p<0.01、Student's t-test)。
【0040】
[実施例3](呼気中Δ13CO2排泄量に対する経腸栄養剤投与容量の影響)
(1) 材料および方法
[動物実験]
体重約200gのSD系雄性ラット(n=4(投与容量1.25, 2.5, 5.0ml/kgの群)、n=3(投与容量10ml/kgの群))を一晩絶食する。但し、水は自由に摂取とした。ラットに13C-酢酸を経腸栄養剤ラコールに各種濃度にて混合し経口投与する。13C-酢酸の用量は一定の16mg/kgとしたまま、ラコール-13C-酢酸混合液の投与容量を1.25, 2.5, 5.0 および10ml/kgとした。ラコール-13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0041】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0042】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにラコール-13C-酢酸混合液投与から0〜120分のAUCを台形面積法にて算出した。
【0043】
(3)結果および考察
経時的なΔ13CO2測定値を図4、Cmax、Tmax、AUCを表3に示す。図4から明らかなように投与容量に比例してΔ13CO2排出量は増加した。また、CmaxおよびAUCも容量に依存して増加した。Tmaxは容量に依存して遅延した。中でも、投与容量10ml/kgの群では明らかなΔ13CO2測定値のピークが認められなかったことから、望ましい投与容量は1.25〜5.0ml/kgであると考えられた。
【0044】
【表3】

【0045】
表3は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4(投与容量1.25, 2.5, 5.0ml/kg)、n=3(投与容量10ml/kg))を示す。
【0046】
[実施例4](呼気中Δ13CO2排泄量に対する13C-酢酸の投与用量の影響)
(1)材料および方法
[動物実験]
体重約200gのSD系雄性ラットを一晩絶食する。但し、水は自由に摂取とした。ラットに13C-酢酸を経腸栄養剤ラコールに各種濃度にて混合し経口投与する。13C-酢酸の用量は8, 16 および32mg/kgとしラコール-13C-酢酸混合液の投与容量は一定の2.5ml/kgとした。ラコール-13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0047】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0048】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにラコール-13C-酢酸混合液投与から0〜120分のAUCを台形面積法にて算出した。
【0049】
(3)結果および考察
経時的なΔ13CO2測定値を図5、Cmax、Tmax、AUCを表4に示す。図5から明らかなように13C-酢酸の用量に比例してΔ13CO2排出量は増加した。また、表4からもCmaxおよびAUCも用量に依存して増加した。但し、Tmaxは用量の増加により遅延した。
【0050】
【表4】

【0051】
表4は、ラコール-13C-酢酸混合液の投与容量を一定とし、13C-酢酸の用量を変えた場合の呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4)を示す。
【0052】
[実施例5](胃運動亢進薬の投与用量依存的な胃排出促進効果)
(1) 材料および方法
[動物実験]
体重約200gのSD系雄性ラットを一晩絶食する。但し、水は自由に摂取とした。胃運動亢進薬であるメトクロプラミドを1%アラビアゴムに懸濁して経口投与した。メトクロプラミド投与群には、メトクロプラミドの用量は0mg/kg(対照群)、0.3mg/kg、1.0、3.0mg/kgとし、投与容量は一定の5ml/kgで経口投与した。対照群には1%アラビアゴムを5ml/kgを経口投与した。メトクロプラミド投与30分後、13C-酢酸を経腸栄養剤ラコール混合し経口投与した。13C-酢酸の用量は16mg/kgとしラコール-13C-酢酸混合液の投与容量は2.5ml/kgとした。ラコール-13C-酢酸混合液投与直後、個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0053】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0054】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20を13CO2 UBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにラコール-13C-酢酸混合液投与から0〜120分のAUCを台形面積法にて算出した。
【0055】
(3)結果および考察
経時的なΔ13CO2測定値を図6、Cmax、Tmax、AUCを表5に示す。図6から明らかなようにメトクロプラミドを投与することによりTmaxは有意に早くなり、Cmaxも有意に増加した。但し、AUCには影響しなかった。したがって、本発明を用いた呼気テストシステムは明らかに胃運動を評価できる簡便な方法であることが示された。
【0056】
【表5】

【0057】
表5は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4(メトクロプラミド用量0mg/kg,0.3mg/kg,1.0mg/kg)、n=3(メトクロプラミド用量3.0mg/kg))を示す。*:p<0.05(vs.対照群、Student's t-test)、**:p<0.01(vs.対照群、Student's t-test)。
【0058】
[実施例6](エタノールとLPS併用投与により誘導されるアルコール性肝障害モデルでの検討)
(1)材料および方法
[動物実験]
7週齢Sprague-Dawley系雌性ラット(日本SLC)の体重を基に群分けし、陰性群、対照群、LPS低用量群、LPS中用量群およびLPS高用量群の5群を設けた。匹数は陰性群に4匹、その他の群は3匹とした。群構成を表6に示す。非絶食状態にて、対照群、LPS低用量群、LPS中用量群およびLPS高用量群に50V/V%エタノールを10ml/kg経口投与し、陰性群には同容量の蒸留水を経口投与した(Time 0)。エタノールまたは蒸留水投与の6時間後(Time 6)にリポポリサッカライド(E.coli055:B5由来、Sigma-Aldrich Co.、以降LPSともいう)を投与した。この時、LPS低用量群には0.54mg/kg、LPS中用量群には1.66 mg/kg、LPS高用量群には5.0mg/kgの用量にてLPSを静脈内投与し(投与容量はいずれも2ml/kg)、陰性群、対照群には同容量の生理食塩水を静脈内投与した。LPS投与20時間後(Time 26)に20mg/kgの用量にて13C標識したアミノピリン(以降、13C-アミノピリンともいう)を経口投与し(投与容量はいずれも10ml/kg)、その直後、個体毎にラットをデシケーターに入れ、投与後10分から90分まで10分毎に、90分以降は30分毎に240分まで経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。13C-アミノピリン投与から240分 (Time 30)経過後に剖検を行い、腹部大動脈より全採血を行った。
【0059】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0060】
【表6】

【0061】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらに13C-アミノピリン投与から0〜240分のAUCを台形面積法にて算出した。
【0062】
さらに、採取した血液から血漿と血清を分離し、血漿のプロトロンビン時間、血清のGPT、アルブミン、蛋白分画を測定した。
【0063】
(3)結果および考察
経時的なΔ13CO2測定値を図7、Cmax、Tmax、AUCを表7に示す。今回、エタノールと共存下に、LPSによる3段階の肝障害をラットに作製し、13C-アミノピリン代謝能をみたところ、LPS中用量群およびLPS高用量群は対照群と比較して各時点のΔ13CO2測定値が有意に低下した。また、CmaxおよびAUCもLPS投与用量依存的に減少し、LPS中用量群およびLPS高用量群では対照群と比較して有意な低下がみられた。また、いずれの値においても陰性と対照群の間に有意差はみられなかった。
【0064】
【表7】

【0065】
表7は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準偏差(n=4(陰性群)、n=3(対照群、LPS低用量群、LPS中用量群、LPS高用量群))を示す。*:p<0.05(vs.対照群、Scheffeの多重比較検定)
【0066】
血液生化学検査の結果を表8に示す。血清GPTは、陰性群と対照群、あるいは対照群とLPS低用量群、LPS中用量群およびLPS高用量群の比較において、有意差はみられなかった。しかし、LPS投与用量に相関して血清GPTが増加する傾向がみられた。また、LPS中用量群およびLPS高用量群においては血清蛋白分画のアルブミン分画の有意な低値、α1分画の有意な高値、α2分画の増加傾向も認められた。β蛋白分画、γ蛋白分画には群間に変化がなかった。
【0067】
【表8】

【0068】
表8は、血清GPT、血清アルブミン(Albumin)、血清蛋白分画、血漿プロトロンビン時間(PT時間)を示す表である。平均値±標準偏差(n=4(陰性群)、n=3(対照群、LPS低用量群、LPS中用量群、LPS高用量群))を示す。#:p< 0.05(vs.陰性群、Student's t-test)、*:p<0.05(vs.対照群、Scheffeの多重比較検定)、**:p<0.01(vs.対照群、Scheffeの多重比較検定)。
【0069】
アミノピリンは肝ミクロソームにおけるチトクロームP-450系を介する薬物代謝能をみていることから、慢性肝疾患患者にアミノピリン呼気テストを施行すると正常人に比してΔ13CO2の排出量が有意に低下し、その肝障害の重症度に応じて低下することが知られている。また、血清アルブミンおよび血清蛋白のアルブミン分画は肝生合成低下等が原因となって減少する(金井泉、臨床検査法堤要、金原出版、pp.413(1985))。これに対し、肝細胞逸脱酵素であるGOT、GPTを指標とした肝障害モデルにおいては、GPTが数千に上るほど重度の肝障害を作成する系が知られている。今回、エタノール共存下にLPSの投与したところ、LPSを1.66 mg/kgまたは5.0mg/kgを投与した群において13C-アミノピリンに由来するΔ13CO2の排出量およびアルブミン分画が有意に減少した。また、この時の蛋白分画の変化(アルブミン分画の減少とα1およびα2分画の増加)は急性炎症を示唆するものであった。一方、これらのLPS投与量において、肝細胞破壊の指標であるGPTの有意な増大を認めることはなかった。
【0070】
これらの結果から、当実験系は大幅な肝細胞破壊に至らない程度の傷害による肝代謝能低下でも評価することを可能とした。したがって、その予防/治療効果を経時観察する上でも、本発明を用いた呼気テストシステムは感度が良く有用であることが示された。
【0071】
[実施例7](13C-オレイン酸の用量による呼気中のΔ13CO2排泄量への影響。)
(1)材料および方法
[動物実験]
7週齢Sprague-Dawley系雌性ラット(日本SLC)の体重を基に群分けし、13C-オレイン酸低用量群、13C-オレイン酸中用量群および13C-オレイン酸高用量群の3群を設けた。匹数はいずれの群も2匹とした。1晩絶食の後、13C-オレイン酸低用量群には26mg/kg、13C-オレイン酸中用量群には77mg/kg、13C-オレイン酸高用量群には230mg/kgの13C-オレイン酸を、13C-オレイン酸混合オリーブ油5ml/kgとして経口投与した。その直後、個体毎にラットをデシケーターに入れ、30分毎に8時間まで経時的な呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0072】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0073】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらに13C-オレイン酸混合オリーブ油投与から0〜480分のAUCを台形面積法にて算出した。
【0074】
(3)結果および考察
経時的な13CO2測定値を図8、Cmax、Tmax、AUCを表9に示す。図8から明らかなように13C-オレイン酸の用量に比例してΔ13CO2排出量は増加した。また、CmaxおよびAUCも用量に依存して増加した。但し、Tmaxは用量によらず大きな変動はみられなかった。脂肪酸の一つであるオレイン酸において、Δ13CO2排出量に13C-オレイン酸用量依存性がみられたことから、ラットの脂質代謝検討に本発明を用いた呼気テストシステムは有用であることが示された。
【0075】
【表9】

【0076】
表9は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。個体毎の値および平均値(n=2)を示す。
【0077】
[実施例8] (糖尿病モデル動物における膵外分泌機能の評価)
膵外分泌機能検査にはBT-BAPA(N-benzoyl-L-tyrosyl-paminobenzoic acid)、PFD test、pancreolaury test、糞便中chymotrypsin testが知られている。しかし、検査の結果が出るまでに時間を要するなど、簡易的ではない。近年、安定同位体である13Cを用いた呼気テストによる生理機能評価が広く行われるようになり、石井ら(消化器科39; 174-177, 2004)はBenzoyl-L-tyrosyl-[1-13C]alanine(以下、Bz-Tyr-[1-13C]Alaともいう)を用いて臨床で膵外分泌機能を呼気テストにより評価している。そこで、本発明の方法を用いてin vivoにおいて膵外分泌機能が評価できるか検討を行った。また、糖尿病患者において、膵膵外分泌機能が低下することから(Keller I and Layer P、Gut、54 suppl VI、vi19-vi20(2005))、同時に、糖尿病ラットについても測定し膵外分泌機能が的確に評価できるかどうかも併せて検討した。
(1)材料および方法
[動物実験]
7週齢Fisher 344系雄性ラット(日本SLC)を、体重を基に群分けして、アロキサン投与群、対照群の2群を設けた。いずれの群も4匹とした。アロキサン投与群にはアロキサン40mg/kgを静脈内投与して糖尿病を惹起した。アロキサン静脈内投与の3日後からアロキサン投与群、対照群とも一夜絶食し、アロキサン静脈内投与の4日後に実験に用いた。Bz-Tyr-[1-13C]Alaは8mg/mlになるように注射用水に溶解した。1匹あたり20mg/kg(容量2.5ml/kg)になるようにBz-Tyr-[1-13C]Alaを経口投与し、その直後個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的に呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0078】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0079】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにBz-Tyr-[1-13C]Ala投与から0〜120分のAUC(以降、AUC120ともいう)を台形面積法にて算出した。
【0080】
(3)結果および考察
経時的な13CO2測定値を図9、Cmax、Tmax、AUC120を表10に示す。図9から明らかなように、対照群のΔ13CO2排出量は経時的に増加し、20分で最大値を示し、その値(Cmax)は72.1±6.9 ‰であり、以降、経時的に低下した。AUC120は4589±253 ‰・minであった。一方、アロキサン投与群のΔ13CO2排出量も経時的に増加し、20分で最大値を示し、その値(Cmax)は59.5±4.9 ‰であり、以降、経時的に低下した。また、AUC120は3699±369 ‰・minであったが、Cmax、および、AUC120は対照群に比較して明らかに低い値であった。
以上の結果から基質であるBz-Tyr-[1-13C]Alaが膵液中のプロテアーゼにより分解後、アラニンが十二指腸から吸収されて肝臓で代謝され呼気中に13CO2となり排泄されることが明らかになった。また、膵機能低下動物である糖尿病ラットでは呼気中への13CO2排泄量が正常ラットに比較して顕著に低下していたことから、本法により的確に膵外分泌機能を評価できていることが確認できた。
【0081】
【表10】

【0082】
表10は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4)を示す。
【0083】
[実施例9] (加齢ラットにおける膵外分泌機能の評価)
加齢により、膵臓機能が低下することが知られている(Laugier R et al、Digestion、50(3-4)、pp.202-11(1991)、石橋忠明ら、日本老年医学会雑誌、28(5)、pp.599-605(1991))。本発明の方法を用いた膵外分泌機能の評価方法を用い、in vivoにおいて膵外分泌機能の低下が的確に評価できるか検討した。
(1)材料および方法
[動物実験]
6週齢Fisher 344系雄性ラット(日本SLC)を4匹(6週齢群)と、加齢ラットとして30週齢Fisher 344系雄性ラット(日本SLC)を4匹(30週齢群)を用いて試験を行った。6週齢群、30週齢群とも一夜絶食して実験に用いた。Bz-Tyr-[1-13C]Alaは8mg/mlになるように注射用水に溶解した。1匹あたり4.0mg(容量0.5ml/body)になるようにBz-Tyr-[1-13C]Alaを経口投与し、その直後個体毎にラットをデシケーターに入れ、投与後5分から70分まで5分毎に、70分以降は投与後90分、120分に経時的に呼気採取を行った。デシケーター内に排泄された呼気を速度150ml/minで吸引してUBiT・POCone専用呼気採取バッグ20(大塚製薬株式会社)に呼気を採取した。具体的には以下に示す方法で呼気採取を行い、各時点で1.5分間の呼気を採取した。
【0084】
[呼気採取装置]
容積2Lのデシケーター内に数ミリメートルの小孔を多数有する板状の中敷きを敷き、その上にラットを乗せ、ふたを閉め、呼気採取口または空気採り入れ口以外の部分から呼気が漏れないようにふたを固定した。デシケーターの側面開口部(空気採り入れ口)よりシリコンチューブを通し、チューブ開口部の一端をデシケーター底面に固定して呼気採取口とした。シリコンチューブは空気採り入れ口より径の小さいものを用いる。呼気は中敷きの下に設けた呼気採取口から移送することになる。チューブ開口部の他端はUBiT・POCone専用呼気採取バッグ20に接続し、デシケーターとUBiT・POCone専用呼気採取バッグ20の間にペリスタポンプ(Master Flex L/S; Cole-Parmer Instrument Company)を接続し、デシケーター内に排泄された呼気を一定速度150ml/minでそれぞれ継続的に吸引してUBiT・POCone専用呼気採取バッグ20に採取した(図1)
【0085】
(2)評価
呼気を採取したUBiT・POCone専用呼気採取バッグ20をUBiT-IR300に接続したUBiT-IR300専用オートサンプラー UBiT-AS10(大塚製薬株式会社)へ接続し、混合ガス(O2:95%、CO2:5%)を対照として呼気中のΔ13CO2を測定した。評価は個体毎に経時的なΔ13CO2測定値、Cmax、Tmaxを表示する。さらにBz-Tyr-[1-13C]Ala投与から0〜120分のAUC(以降、AUC120ともいう)を台形面積法にて算出した。
【0086】
(3)結果および考察
経時的な13CO2測定値を図10、Cmax、Tmax、AUC120を表11に示す。図10から明らかなように、6週齢群のΔ13CO2排出量は経時的に増加し、20分で最大値を示し、その値(Cmax)は72.1±4.9 ‰であり、以降、経時的に低下した。AUC120は4280±219 ‰・minであった。一方、30週齢群のΔ13CO2排出量も経時的に増加し、20分で最大値を示し、その値(Cmax)は29.8±1.1 ‰であったが、6週齢群と比較して有意に(p<0.01)低値であった。その後、Δ13CO2排出量は経時的に低下した。AUC120は3699±369 ‰・minと、6週齢群と比較して有意に(p<0.01)低値であった。Tmaxについては、週齢の違いによる有意な差は認められなかった。いずれの時点においても、Δ13CO2排出量は、30週齢群は6週齢群と比較して有意に低値を示した。
以上の結果から、本発明の呼気採取システムを用いることにより、動物実験でも加齢により膵分泌機能が低下する現象を観察できることが明らかになり、その有用性が示された。
【0087】
【表11】

【0088】
表10は、呼気中のΔ13CO2排泄量のTmax、CmaxおよびAUCを示す表である。平均値±標準誤差(n=4)を示す。**:p<0.01(vs. 6週齢群、Student's t-test)。
【産業上の利用可能性】
【0089】
本発明の呼気採取システムは、分析技術を有しない者であっても測定が可能で、操作性、汎用性にすぐれた呼気テストシステムを構成できる。本発明により、動物の生理機能のみならず、医薬品や機能性食品、保健機能食品、栄養食品、病者用食品等の効果、消化吸収代謝能、安全性等の評価も、より適正でかつ簡便で安価に行うことが可能となる。
【図面の簡単な説明】
【0090】
【図1】本発明の呼気採取システムの概略図である。図中、本発明の呼気採取システムは、動物収納容器、呼気貯留容器、呼気移送装置を含む構成となっている。この図では、本発明の呼気採取システムにて4個体の呼気を同時に採取し、さらにΔ13CO2測定装置にて呼気を測定する様子を示す。
【図2】呼気移送速度の違いによる呼気中のΔ13CO2排泄量への影響。13C-酢酸をラコールに溶解した場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4(吸引速度75ml/minおよび150ml/min)、n=3(吸引速度300ml/min))を示す。
【図3】経腸栄養剤投与による胃排出遅延効果。13C-酢酸を蒸留水に溶解した場合とラコールに溶解した場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4)を示す。*:p<0.05(vs.蒸留水投与群、Student's t-test)、**: p<0.01(vs.蒸留水投与群、Student's t-test)。
【図4】呼気中Δ13CO2排泄量に対する経腸栄養剤投与容量の影響。13C-酢酸の用量を一定とし、ラコール-13C-酢酸混合液の投与容量を変えた場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4(投与容量1.25, 2.5, 5.0ml/kg)、n=3(投与容量10ml/kg))を示す。
【図5】呼気中Δ13CO2排泄量に対する13C-酢酸の投与用量の影響。ラコール-13C-酢酸混合液の投与容量を一定とし、13C-酢酸の用量を変えた場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4)を示す。
【図6】胃運動亢進薬の投与用量依存的な胃排出促進効果。メトクロプラミドを前投与した場合の呼気中の呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準誤差(n=4(メトクロプラミド用量0mg/kg,0.3mg/kg,1.0mg/kg)、n=3(メトクロプラミド用量3.0mg/kg))を示す。*:p<0.05(vs.対照群、Student's t-test)、**:p<0.01(vs.対照群、Student's t-test)。
【図7】エタノール共存下における、LPSの投与量依存的な肝障害惹起効果。LPS投与量を変えた場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準偏差(n=4(陰性群)、n=3(対照群、LPS低用量群、LPS中用量群、LPS高用量群))を示す。*:p<0.05(vs.対照群、Scheffeの多重比較検定)、**:p<0.01(vs.対照群、Scheffeの多重比較検定) 。
【図8】13C-オレイン酸の用量による呼気中のΔ13CO2排泄量への影響。13Cオレイン酸投与量を変えた場合の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値(n=2)を示す。
【図9】アロキサン誘発糖尿病による呼気中のΔ13CO2排泄量への影響。Bz-Tyr-[1-13C]Ala投与後の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準偏差(n=4)を示す。
【図10】加齢による呼気中のΔ13CO2排泄量への影響。Bz-Tyr-[1-13C]Ala投与後の、呼気中13CO2濃度の変化(Δ13CO2)を示すグラフである。平均値±標準偏差(n=4)を示す。*:p<0.05(vs. 6週齢群、Student's t-test)、**:p<0.01(vs. 6週齢群、Student's t-test)、#:p<0.001(vs.6週齢群、Student's t-test)。
【特許請求の範囲】
【請求項1】
呼気採取口および空気採り入れ口を有し、空気採り入れ口が開放されていることを特徴とする、動物収納容器。
【請求項2】
動物の体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設けたこと特徴とする、請求項1に記載の動物収納容器。
【請求項3】
動物の体躯以上に呼気採取口を設け、動物体躯以下かつ呼気採取口よりも下部に空気採り入れ口を設けたこと特徴とする、請求項1に記載の動物収納容器。
【請求項4】
請求項1〜3のいずれか1項に記載の動物収納容器、および呼気貯留容器、呼気移送装置を含む、呼気採取システム。
【請求項5】
呼気貯留容器が呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなく保持できることを特徴とする、請求項4に記載の呼気採取システム。
【請求項6】
呼気移送装置が呼気を一定速度で移送するものであることを特徴とする、請求項4に記載の呼気採取システム。
【請求項7】
動物収納容器が収納した動物の体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設けたこと特徴し、呼気貯留容器が呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなく保持できることを特徴し、呼気移送装置が呼気を一定速度で移送するものであることを特徴とする、請求項4に記載の呼気採取システム。
【請求項8】
請求項4〜6のいずれか1項に記載の呼気採取システムを用いた呼気採取方法。
【請求項9】
請求項4〜6のいずれか1項に記載の呼気採取システムを用いた、生理機能の評価方法。
【請求項10】
生理機能が胃排出能、肝機能、脂質代謝および膵外分泌機能からなる群のうちすくなくとも1つである、請求項9に記載の方法。
【請求項11】
生理機能を評価するための、請求項4〜6のいずれか1項に記載の呼気採取システムの使用。
【請求項12】
生理機能が胃排出能、肝機能、脂質代謝および膵外分泌機能からなる群のうちすくなくとも1つである、請求項11に記載の呼気採取システムの使用。
【請求項1】
呼気採取口および空気採り入れ口を有し、空気採り入れ口が開放されていることを特徴とする、動物収納容器。
【請求項2】
動物の体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設けたこと特徴とする、請求項1に記載の動物収納容器。
【請求項3】
動物の体躯以上に呼気採取口を設け、動物体躯以下かつ呼気採取口よりも下部に空気採り入れ口を設けたこと特徴とする、請求項1に記載の動物収納容器。
【請求項4】
請求項1〜3のいずれか1項に記載の動物収納容器、および呼気貯留容器、呼気移送装置を含む、呼気採取システム。
【請求項5】
呼気貯留容器が呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなく保持できることを特徴とする、請求項4に記載の呼気採取システム。
【請求項6】
呼気移送装置が呼気を一定速度で移送するものであることを特徴とする、請求項4に記載の呼気採取システム。
【請求項7】
動物収納容器が収納した動物の体躯以下に呼気採取口を設け、動物体躯以上かつ呼気採取口よりも上部に空気採り入れ口を設けたこと特徴し、呼気貯留容器が呼気採取中および呼気採取後の呼気が逆流せず、容器構造や容器素材を通じて中の呼気が外気と交換することがなく保持できることを特徴し、呼気移送装置が呼気を一定速度で移送するものであることを特徴とする、請求項4に記載の呼気採取システム。
【請求項8】
請求項4〜6のいずれか1項に記載の呼気採取システムを用いた呼気採取方法。
【請求項9】
請求項4〜6のいずれか1項に記載の呼気採取システムを用いた、生理機能の評価方法。
【請求項10】
生理機能が胃排出能、肝機能、脂質代謝および膵外分泌機能からなる群のうちすくなくとも1つである、請求項9に記載の方法。
【請求項11】
生理機能を評価するための、請求項4〜6のいずれか1項に記載の呼気採取システムの使用。
【請求項12】
生理機能が胃排出能、肝機能、脂質代謝および膵外分泌機能からなる群のうちすくなくとも1つである、請求項11に記載の呼気採取システムの使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2006−267098(P2006−267098A)
【公開日】平成18年10月5日(2006.10.5)
【国際特許分類】
【出願番号】特願2006−54067(P2006−54067)
【出願日】平成18年2月28日(2006.2.28)
【出願人】(000006138)明治乳業株式会社 (265)
【Fターム(参考)】
【公開日】平成18年10月5日(2006.10.5)
【国際特許分類】
【出願日】平成18年2月28日(2006.2.28)
【出願人】(000006138)明治乳業株式会社 (265)
【Fターム(参考)】
[ Back to top ]

