哺乳動物疾患の治療におけるエンドキシフェンの方法および組成物
本発明は、エンドキシフェンを含有する組成物、エンドキシフェンの製剤およびリポソーム、そのような薬剤および製剤の調製法、およびそのような薬剤および製剤の、精神および神経変性疾患、感染症、妊娠障害、骨粗鬆症、骨関節炎、および/または心血管疾患を有するまたはその危険性がある対象の治療のための使用を提供する。具体的には、本発明は、そのような障害またはその素因に対する治療で使用されるエンドキシフェンを含む組成物、そのような障害を治療するための薬剤の製造における使用、およびそのような治療におけるそのような組成物の使用を含む方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2006年11月21日に出願された米国特許仮出願第60/860,420号および2006年11月22日に出願された同第60/860,788号の優先権を主張する、2007年11月21日に出願された国際出願PCT/US07/85443の§371国内段階出願である、2009年5月15日に出願された米国特許出願第12/515,261号の一部継続出願である、2009年5月21日に出願された米国特許出願第12/470,219号の優先権を主張する。これらのそれぞれは参照により本明細書に組み込まれる。
【背景技術】
【0002】
本発明は、哺乳動物疾患の治療におけるエンドキシフェンの使用に関する。本発明はまた、エンドキシフェンのリポソームと、複合体、小胞、乳濁液、ミセルおよび混合ミセルなどの他の製剤、調製の方法、ならびに例えば、ヒトおよび動物の乳房疾患の治療における使用に関する。本発明は特に、エンドキシフェン脂質複合体を含む組成物、調製の方法、および乳房疾患、特に良性および悪性乳房疾患の、疾患の後退を高めて、乳癌を発症する患者の危険性を減少させる治療のためのこれらの使用に関する。本発明はさらに、精神および神経変性疾患の治療におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。詳細には、さらに本発明は、双極性疾患、統合失調症、多発性硬化症(MS)、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症(ALS)およびてんかんの治療におけるエンドキシフェンを含む組成物の使用に関する。またさらに本発明は、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染などの感染症の治療におけるエンドキシフェンおよびエンドキシフェンを含む組成物;ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染;骨粗鬆症および心血管疾患に関する。さらに本発明は、不妊治療および療法におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。またさらに本発明は、エンドキシフェンを調製する方法、およびヒトおよび動物の疾患の治療における、本発明の方法によって調製されたエンドキシフェンの使用に関する。
【0003】
毎年、米国において210,000人を超える女性が乳癌になる。米国において女性8人中の1人は生涯の間に乳癌になるであろう。乳癌の約70パーセントは、エストロゲンによって刺激され、多くは、乳房組織におけるエストロゲンの作用を阻止するように設計された薬物であるタモキシフェンで治療される。
【0004】
タモキシフェンは、乳癌の長期かつ低用量療法用に処方される抗エストロゲン剤である。これは、すべての段階のホルモン受容体陽性の乳癌の内分泌治療に対して30年を超えて広く使用されている(1、2)。また、タモキシフェンは乳癌の予防にも認可されている(3)。女性において、タモキシフェンに関連する有害事象のうちの1つはのぼせである。のぼせの危険性は、タモキシフェンを服用しない女性と比べて、服用する女性の間で2〜3倍高い(4、5)。選択的セロトニン再取り込み阻害薬(Selective serotonin−reuptake inhibitor:SSRI)抗鬱薬は、のぼせを治療するために処方される。しかし、パロキセチンおよびフルオキセチンなどのある種のSSRIは、タモキシフェンを含む多くの薬物の代謝に重要な酵素であるシトクロムP450(CYP)2D6を阻害することが知られている(5、6)。さらに、その発現および機能に影響を与えるCYP2D6遺伝的多型によって、タモキシフェン代謝において個人間および人種間のばらつきが大きい(7)。それにより、CYP2D6を阻害する薬物の共処方が、タモキシフェン有効性を損なう可能性があるという幅広い認識によって、タモキシフェン代謝および効果の理解が臨床診療を変えた。
【0005】
双極性障害は、障害を受けた者の間での自殺の多大な危険性と関連する慢性の精神病である(8)。リチウムおよびバルプロエートは、双極性障害において気分安定薬として広く用いられているが、しかし、患者の一部はこれらの薬剤に反応しない、または、部分的にしか反応しない(8)。したがって、より迅速、より強力で、より特異的な作用様式およびより少ない副作用の新規の治療剤の開発が必要とされる。
【0006】
タモキシフェンは選択的エストロゲン受容体修飾剤(SERM)である。最近の研究は、精神疾患(例えば双極性障害、統合失調症)におけるエストロゲン/SERMの治療の役割および神経変性の症状(例えば多発性硬化症、パーキンソン病、アルツハイマー病および卒中)における神経保護作用を強く支持する。躁病のラットモデル(9)、および双極性患者での2つの治験(10、11)において。これはプロテインキナーゼC(PKC)の作用の減衰に起因すると示唆される(YesiloglujへのWO2008/048194)。タモキシフェンの使用は、分裂情動性障害(12)の患者の躁病の症候において改善を示し、またタモキシフェンのいくつかの神経保護作用が立証されている(13、14)。さらに、タモキシフェンは、例えば、シナプスの密度を増加させること、および神経突起成長を刺激することによる神経組織栄養の作用を有し得るという証拠がある(13)。しかし、上の議論で述べたように、タモキシフェンを用いる治療の有効性は、他の薬物によってまたは薬物の代謝を中断させる突然変異によって損われることがある。
【0007】
有害な全身性副作用が低減された、治療にSERMを用いる方法に対して、強い必要性が存在する。さらに、乳癌、双極性障害、感染症(例えば、細菌、菌類、リーシュマニア属など)などの疾患を治療、予防し、他の薬物との相互作用が低減され、主要な薬物を代謝する酵素をコードする遺伝子の変異を含む患者遺伝子への感度が低減された、方法および組成物に対する必要性がある
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Furr,B.J.,and V.C.Jordan.1984.The pharmacology and clinical uses of tamoxifen.Pharmacol Ther 25:127−205.
【非特許文献2】Osborne,C.K.1998.Tamoxifen in the treatment of breast cancer.N Engl J Med 339:1609−1618.
【非特許文献3】Fisher,B.,J.P.Costantino,D.L.Wickerham,C.K.Redmond,M.Kavanah,W.M.Cronin,V.Vogel,A.Robidoux,N.Dimitrov,J.Atkins,M.Daly,S.Wieand,E.Tan−Chiu,L.Ford,and N.Wolmark.1998.Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P−1 Study.J Natl Cancer Inst 90:1371−1388.
【非特許文献4】Stearns,V.,L.Ullmer,J.F.Lopez,Y.Smith,C.Isaacs,and D.Hayes.2002.Hot flushes.Lancet 360:1851−1861.
【非特許文献5】Stearns,V.,M.D.Johnson,J.M.Rae,A.Morocho,A.Novielli,P.Bhargava,D.F.Hayes,Z.Desta,and D.A.Flockhart.2003.Active tamoxifen metabolite plasma concentrations after coadministration of tamoxifen and the selective serotonin reuptake inhibitor paroxetine.J Natl Cancer Inst 95:1758−1764.
【非特許文献6】Otton,S.V.,S.E.Ball,S.W.Cheung,T.Inaba,R.L.Rudolph,and E.M.Sellers.1996.Venlafaxine oxidation in vitro is catalysed by CYP2D6.Br J Clin Pharmacol 41:149−156.
【非特許文献7】Bijl,M.J.,L.E.Visser,A.Hofman,A.G.Vulto,T.van Gelder,B.H.Stricker,and R.H.van Schaik.2008.Influence of the CYP2D6*4 polymorphism on dose,switching and discontinuation of antidepressants.Br J Clin Pharmacol 65:558−564.
【非特許文献8】Manji,H.K.,and R.H.Lenox.2000.The nature of bipolar disorder.J Clin Psychiatry 61 Supp 13:42−57.
【非特許文献9】Einat,H.,P.Yuan,S.T.Szabo,S.Dogra,and H.K.Manji.2007.Protein kinase C inhibition by tamoxifen antagonizes manic−like behavior in rats: implications for the development of novel therapeutics for bipolar disorder.Neuropsychobiology 55:123−131.
【非特許文献10】Yildiz,A.,S.Guleryuz,D.P.Ankerst,D.Ongur,and P.F.Renshaw.2008.Protein kinase C inhibition in the treatment of mania: a double−blind,placebo−controlled trial of tamoxifen.Arch Gen Psychiatry 65:255−263.
【非特許文献11】Zarate,C.A.,Jr.,J.B.Singh,P.J.Carlson,J.Quiroz,L.Jolkovsky,D.A.Luckenbaugh,and H.K.Manji.2007.Efficacy of a protein kinase C inhibitor (tamoxifen) in the treatment of acute mania: a pilot study.Bipolar Disord 9:561−570.
【非特許文献12】Kulkarni,J.,C.Gurvich,H.Gilbert,F.Mehmedbegovic,L.Mu,N.Marston,E.Gavrilidis,and A.de Castella.2008.Hormone modulation: a novel therapeutic approach for women with severe mental illness.Aust N Z J Psychiatry 42:83−88.
【非特許文献13】Dhandapani,K.M.,and D.W.Brann.2002.Protective effects of estrogen and selective estrogen receptor modulators in the brain.Biol Reprod 67:1379−1385.
【非特許文献14】O’Neill,K.,S.Chen,and R.D.Brinton.2004.Impact of the selective estrogen receptor modulator,raloxifene,on neuronal survival and outgrowth following toxic insults associated with aging and Alzheimer’s disease.Exp Neurol 185:63−80.
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、抗癌剤および精神および神経変性の症状の治療用の薬剤などの活性薬剤の合成および使用のための方法および組成物を提供する。本発明は、詳しくは癌の治療または予防に関係する用途において、精神および神経変性疾患の治療および予防において、不妊療法において、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染、ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染などの感染の治療において、また骨粗鬆症および心血管疾患において、エンドキシフェンの製剤および使用と関係する方法および組成物に関する。さらに本発明は、そのような症状を治療するための、薬剤の製造でのこれらの組成物の使用を提供する。
【0010】
本発明の組成物は、精神および神経変性疾患を治療するために使用することができる。例えば、本発明の組成物は双極性障害または躁病の障害と診断された患者に投与することができる。本発明の組成物によって治療可能な精神および神経変性疾患の例は、双極性障害、アルツハイマー病、パーキンソン病、多発性硬化症疾患、てんかんなどを含むが、これらに限定されない。本発明の組成物はさらに、不妊療法において、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染などの感染症;ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染の治療において、ならびに骨粗鬆症および心血管疾患において使用することができる。
【0011】
エンドキシフェン(4−ヒドロキシN−デスメチルタモキシフェン)は、乳癌の治療のための市販薬物タモキシフェンの活性代謝物である。タモキシフェンは、シトクロムP450(CYP)酵素CYP3A4およびCYP2D6によって広範囲に代謝され、4−ヒドロキシタモキシフェンおよび4−ヒドロキシ−N−デスメチルタモキシフェン(エンドキシフェン)(図3)を含む活性代謝物になる。シトクロムP450(CYP)酵素による代謝的活性化を必要とし、その作用が遺伝的多型および薬物間相互作用による阻害のために変動する母化合物のタモキシフェンの使用と比較して、例えば、癌ならびに精神および神経変性疾患のための治療剤としてエンドキシフェンを使用することは、著しい利点を有する。
【課題を解決するための手段】
【0012】
いくつかの実施形態において、本発明は、治療上活性な量のエンドキシフェンを含む組成物を調製し、組成物を投与することを含む、疾患を治療する方法を提供する。いくつかの実施形態において、エンドキシフェンは遊離塩基または塩の形態である。いくつかの好ましい実施形態において、エンドキシフェンは、クエン酸塩、酢酸塩、ギ酸塩、スルホン酸塩、シュウ酸塩、コハク酸塩、酒石酸塩(tartarate)、トリフルオロ酢酸塩、メタンスルホン酸塩、リン酸塩、硫酸塩、塩化物、臭化物、ヨウ化物および乳酸塩からなる塩の群から選択される塩の形態をしている。好ましい実施形態において、塩はクエン酸塩の形態をしている。いくつかのいくつかの実施形態において、エンドキシフェンは主に、E異性体、Z異性体ならびにEおよびZ異性体の混合物からなる群から選択される形態をしている。
【0013】
いくつかの実施形態において、本方法は抗癌性または精神医学の治療薬および少なくとも1種の脂質を含む複合体を調製することを含む。いくつかの実施形態において、薬物はエンドキシフェンである。いくつかの実施形態において、本発明の化合物は脂質と複合体を形成しない。いくつかの実施形態において、化合物は、遊離塩基の形態をしているか、または塩の形態をしている。
【0014】
いくつかの実施形態において、本発明は、構造:
【化1】

【0015】
を有する式5の化合物を酸と反応させること、および式5の化合物の酸との反応の後、化合物をメチルアミンと反応させることを含む、エンドキシフェンを調製する方法を提供する。
【0016】
いくつかの実施形態において、式5の化合物は式4
【化2】

【0017】
の化合物を式3
【化3】

【0018】
の化合物と反応させることにより調製される。
【0019】
いくつかの実施形態において、式3の化合物は式1
【化4】

【0020】
の化合物を式2
【化5】

【0021】
の化合物と反応させることにより調製される。
【0022】
いくつかの実施形態において、本発明は、エンドキシフェンを結晶化するステップ、および/またはクロマトグラフィーで前記エンドキシフェンを処理し、E異性体もしくはZ異性体またはEおよびZ異性体の混合物を主に含む、エンドキシフェンの精製調製物を製造するステップを含む、上記のエンドキシフェンを精製する方法を提供する。
【0023】
上記のように、いくつかの実施形態において、本発明は、少なくとも1種の脂質を含むエンドキシフェン調製物を提供する。好ましい実施形態において、この少なくとも1種の脂質は、卵ホスファチジルコリン(EPC)、卵ホスファチジルグリセロール(EPG)、大豆ホスファチジルコリン(SPC)、水素化大豆ホスファチジルコリン(HSPC)、ジミリストイルホスファチジルコリン(DMPC)、ジミリストイルホスファチジルグリセロール(DMPG)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルグリセロール(disteroylphosphatidylglycerol)(DSPG)、ジパルミトイルホスファチジルグリセロール(DMPG)、コレステロール(Chol)、硫酸コレステリルおよびその塩(CS)、ヘミコハク酸コレステリルおよびその塩(Chems)、リン酸コレステリルおよびその塩(CP)、コレステリルホスホコリンおよび他のヒドロキシコレステロールまたはアミノコレステロール誘導体、コハク酸コレステリル、オレイン酸コレステリル、コレステロールのポリエチレングリコール誘導体(コレステロール−PEG)、コプロスタノール、コレスタノール、コレスタン、コール酸、コルチゾール、コルチコステロン、ヒドロコルチゾン、およびカルシフェロール、Eググルステロン,Zググルステロン、EおよびZググルステロンの混合物、モノグリセリド、ジグリセリド、トリグリセリド、ガラクトリピド、マンノトリピド、ガラクトレシチンからなる群から選択される炭水化物系脂質、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラソステロール、カンペステロール、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール(phosphatdylinositol)、ホスファチジン酸、ならびにジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロールおよびジオレオイルホスファチジルグリセロールのペグ化誘導体からなる群から選択される。
【0024】
いくつかの実施形態において、本発明による組成物は、エンドキシフェン、コレステロールおよび/またはコレステロール誘導体、および1種または複数のリン脂質を含む。いくつかの好ましい実施形態において、本組成物はコレステロール誘導体を含み、コレステロール誘導体は硫酸コレステリルである。いくつかの実施形態において、リン脂質の少なくとも1種は水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンである。
【0025】
本発明の方法および組成物のいくつかの実施形態においては、本組成物は、粉末、溶液、乳濁液、ミセル、リポソーム、脂質粒子、ゲル、およびペーストの形態からなる群から選択される形態を含む。いくつかの好ましい実施形態において、複合体を含む組成物の調製は、凍結乾燥形態の前記複合体の調製を含む。いくつかの実施形態において、凍結乾燥形態の複合体の調製は、凍結保護物質の使用を含み、前記凍結保護物質は、トレハロース、マルトース、ラクトース、スクロース、グルコース、およびデキストランからなる群から選択される1種または複数の糖を含む。いくつかの実施形態において、本組成物は、腸溶被覆材料を場合によって含む錠剤または充填カプセル剤を含む。
【0026】
本発明の治療方法のいくつかの実施形態において、疾患は、癌または発癌物質によって引き起こされ、一方、いくつかの実施形態においては、疾患は良性乳房疾患である。
【0027】
いくつかの実施形態において、投与は前記組成物を前記対象へ経口、静脈内、皮下、経皮、非経口、腹腔内、直腸、膣、および/または局所の送達を含む。
【0028】
いくつかの実施形態において、本組成物は、少なくとも1種の飽和または不飽和脂肪酸エステルを含む浸透促進剤を含む。
【0029】
いくつかの実施形態において、エンドキシフェンを含む組成物は、含水アルコールゲル、含水アルコール溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤またはオイル中で製剤化される。
【0030】
いくつかの実施形態において、エンドキシフェンを含む組成物は、浸透促進剤、水性ビヒクル、アルコールビヒクルおよびゲル化剤を含有する含水アルコール組成物中で製剤化される。
【0031】
いくつかの実施形態において、含水アルコール組成物は中和剤を含む。
【0032】
いくつかの実施形態において、含水アルコール組成物は、約0.01重量%から0.20重量%のエンドキシフェン、約0.1重量%から2.0重量%、好ましくは0.5重量%から2.0重量%のミリスチン酸イソプロピル、約50.0重量%から80.0重量%、好ましくは約60.0重量%から75.0重量%のアルコール、約20.0重量%から60.0重量%、好ましくは25.0重量%から50.0重量%の水性ビヒクル、および約1.0重量%から10.0重量%、好ましくは約0.5重量%から5.0重量%のゲル化剤を含む。いくつかの実施形態において、成分の百分比は本組成物重量に対する重量である。
【0033】
いくつかの実施形態において、アルコールはエタノールまたはイソプロパノールであり、無水形態で構成される。
【0034】
いくつかの実施形態において、水性ビヒクルはリン酸緩衝液である。
【0035】
いくつかの実施形態において、ゲル化剤は、ポリアクリル酸、ヒドロキシプロピルセルロースおよびヒドロキシプロピルセルロース以外のセルロース誘導体からなる群から選択される。
【0036】
いくつかの実施形態において、含水アルコール組成物は、中和剤をさらに含み、前記中和剤は、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、アミノメチルプロパノール、アルギニン、トロラミン、およびトロメタミンからなる群から選択され、約1:1から約4:1の中和剤/ゲル化剤の比率で存在する。
【0037】
いくつかの実施形態において、本発明は、上記の組成物のいずれかを準備すること、および組成物を送達し組成物を細胞に曝露することを含む、エンドキシフェンを送達する方法を提供する。
【0038】
いくつかの実施形態において、この細胞はインビボである。
【0039】
本発明のいくつかの実施形態において、宿主は哺乳動物である。
【0040】
本発明はまた、上記の組成物のいずれかを哺乳動物に投与することを含む、哺乳動物におけるホルモン依存性乳癌を阻止する方法も提供する。
【0041】
本発明は、上記組成物のいずれかを、前記哺乳動物(例えば、ヒト)に投与することを含む、哺乳動物の癌を阻止する方法をさらに提供し、前記癌は、哺乳動物の肺癌、大腸癌、乳癌、白血病、腎癌、メラノーマ、中枢神経系の癌、および前立腺癌を含むがこれらに限定されない。
【0042】
本発明は、遊離塩基であるかまたは塩の形態であるエンドキシフェン、および少なくとも1種の脂質を含む治療有効量の複合体を含む組成物をさらに提供する。
【0043】
いくつかの実施形態において、エンドキシフェンを含む組成物は、含水アルコールゲル、含水アルコール溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤またはオイル中で製剤化される。
【0044】
いくつかの実施形態において、エンドキシフェンを含む組成物は、浸透促進剤、水性ビヒクル、アルコール性ビヒクルおよびゲル化剤を含有する含水アルコール組成物中で製剤化される。
【0045】
いくつかの実施形態において、含水アルコール組成物は中和剤を含む。
【0046】
いくつかの実施形態において、含水アルコール組成物は、約0.01重量%から0.20重量%のエンドキシフェン、約0.1重量%から2.0重量%、好ましくは0.5重量%から2.0重量%のミリスチン酸イソプロピル、約50.0重量%から80.0重量%、好ましくは約60.0重量%から75.0重量%のアルコール、約20.0重量%から60.0重量%、好ましくは25.0重量%から50.0重量%の水性ビヒクル、および約1.0重量%から10.0重量%、好ましくは約0.5重量%から5.0重量%のゲル化剤を含む。いくつかの実施形態において、成分の百分比は、組成物の重量に対する重量である。
【0047】
いくつかの実施形態において、本発明は、エンドキシフェンの治療有効量を含む医薬調製物を投与することを含む、対象の症状(例えば、癌または精神医学または神経変性の症状)を治療または予防する方法を提供する。
【0048】
エンドキシフェン組成物の精神医学および神経変性の療法のための使用は、特定の疾患または投与経路に限定されない。いくつかの好ましい実施形態において、本発明は双極性障害を治療する方法および組成物を提供し、一方、他の実施形態において、本発明は、多発性硬化症、統合失調症、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症およびてんかんを治療する方法および組成物を提供する。
【0049】
いくつかの実施形態において、本発明の医薬調製物は第2の治療剤をさらに含む。いくつかの好ましい実施形態において、第2の治療剤は症状の治療のための公知の治療剤である。例えば、いくつかの実施形態において、第2の治療剤は、双極性障害、躁病の障害または鬱病の治療のための公知の治療剤、例えば、リチウム、選択的セロトニン再取り込み阻害薬、セロトニンおよびノルエピネフリン再取り込み阻害薬、ドパミン再取り込み阻害薬、四環系抗鬱薬、再取り込み阻害薬の組み合わせ、受容体遮断薬、三環系抗鬱薬およびモノアミン酸化酵素阻害薬である。いくつかの実施形態において、精神医学または神経変性の症状の治療のための公知の治療剤は、シタロプラム、エスシタロプラム、フルオキセチン、パロキセチン、セルトラリン、デュロキセチン、ベンラファキシン、ブプロピオン、ミルタザピン、トラドゾン、tefazodone、マプロチリン、アミトリプチリン、アモキサピン、デシプラミン、ドキセピン、イミプラミン、ノルトリプチリン、プロトリプチリン、トリミプラミン、フェネルジン、トラニルシプロミン、イソカルボキサジドおよびselegilinからなる群から選択される。
【0050】
第2の治療剤がエンドキシフェンを含む組成物と共投与されるいくつかの実施形態において、第2の治療薬は、ベンゾジアゼピン、ベータ遮断薬および非ベンゾジアゼピン催眠薬などの不安の治療のための公知の治療剤である。いくつかの好ましい実施形態において、不安の治療のための治療薬は、ジアゼパム、ニトラゼパム、アルプラゾラム、ブロマゼパム、クロルジアゼポキシド、クロラゼプ酸、ロラゼパム、オキサゼパム、フルニトラゼパム、フルラゼパム、ロプラゾラム、ロルメタゼパムおよびテマゼパム、ブスピロン、メプロバメート、zalepon、ゾルピデム、ゾピクロン、抱水クロラール、トリクロホス、clomethizoleおよびメプロバメートからなる群から選択される。
【0051】
本発明の特定の実施形態は、発明の概要および下記の発明を実施するための形態に記載されている。本発明は上記の組成物および方法に限定されない。本発明は、具体的実施形態と関連させて記載されるが、請求される本発明は、そのような具体的実施形態に不当に限定されるものではなく、また、本明細書に記載される、または当業者により本開示を考慮して理解される上記の組成物および方法の変型例は、本発明の範囲内に包含されることを理解すべきである。
【図面の簡単な説明】
【0052】
【図1】化合物Iの図示である。
【図2】化合物3、5およびIの合成の実施形態の図示である。
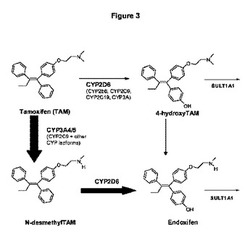
【図3】タモキシフェンのエンドキシフェン(4−ヒドロキシ−N−デスメチルタモキシフェン)への代謝の概略図である。
【図4】PKC経路の略図である。
【図5】エンドキシフェンおよびタモキシフェンによるPKC活性の阻害を比較するグラフである。
【発明を実施するための形態】
【0053】
定義
本明細書で使用される「宿主」、「対象」および「患者」という用語は、研究、分析、試験、診断または治療されるヒトおよび非ヒト動物(例えば、イヌ、ネコ、雌ウシ、ウマ、ヒツジ、家禽、魚、甲殻類など)を指すがこれらに限定されない、任意の動物を指す。本明細書で使用される「宿主」、「対象」および「患者」という用語は、特に明記しない限り、同じ意味で使用される。
【0054】
本明細書で使用される「癌の危険性がある対象」という用語は、例えば、事前の既往歴、遺伝データなどによって、癌を発症する危険性があると特定された対象を指す。
【0055】
本明細書で使用される「抗癌薬」という用語は、癌を治療または予防するために使用される薬剤を指す。そのような薬剤は、小分子、薬物、抗体、医薬品などを含むが、これらに限定されない。
【0056】
本明細書で使用される「鬱病を有する対象」または「鬱病を示す徴候または症候または病状を見せる対象」または「鬱病を示す徴候または症候または病状を見せると疑われている対象」という用語は、公知の鬱病の徴候、症候および病状に基づいた鬱病を有するまたは多分有するものとして識別される対象を指す。
【0057】
本明細書で使用される「鬱病を示す病状を見せる危険性がある対象」および「鬱病の危険性がある対象」という用語は、鬱病の発症の危険性があると識別された対象を指す。
【0058】
本明細書で使用される「双極性障害を有する対象」または「双極性障害を示す徴候または症候または病状を見せる対象」または「双極性障害を示す徴候または症候または病状を見せると疑われる対象」という用語は、公知の鬱病の徴候、症候および病状に基づいた双極性障害を有するまたは多分有するものとして識別される対象を指す。
【0059】
本明細書において「双極性障害を示す病状を見せる危険性がある対象」および「双極性障害の危険性がある対象」という用語は、双極性障害を発症する危険性があると識別された対象を指す。
【0060】
本明細書で使用される「抗鬱薬」という用語は、鬱病を治療または予防するために使用される薬剤を指す。そのような薬剤は、小分子、薬物、抗体、医薬品などを包含するが、これらに限定されない。
【0061】
本明細書で使用される「抗不安薬」は、不安を治療または予防するために使用される薬剤を指す。そのような薬剤は、小分子、薬物、抗体、医薬品などを包含するが、これらに限定されない。
【0062】
本明細書で使用される「不安を有する対象」または「不安を示す徴候または症候または病状を見せる対象」または「不安を示す徴候または症候または病状を見せると疑われる対象」という用語は、公知の不安の徴候、症候および病状に基づいた不安を有するまたは多分有するものとして識別される対象を指す。
【0063】
本明細書で使用される「不安を示す病状を見せる危険性がある対象」および「不安の危険性がある対象」という用語は、不安を発症する危険性があると識別された対象を指す。
【0064】
本明細書で使用される「認知機能」という用語は、一般に、思考する、推論する、集中する、または記憶する能力を指す。したがって、用語「認知機能の低下」は、思考する、推論する、集中する、または記憶する能力の不足の劣化を指す。
【0065】
本明細書で使用される「有効量」という用語は、選択された効果を与える、例えば、有益なまたは所望の結果を達成するのに十分な活性組成物(例えば脂質または他の製剤中の成分として提供される医薬化合物または組成物)の量を指す。例えば、PKC阻害薬の有効量は、例えば、PKC活性の低下に関連するインビボ効果についての観察によって、またはインビトロアッセイの使用によって判断されるような、PKC活性を低下させるのに十分な阻害薬の量である。有効量は1回または複数の投与、適用または用量で投与することができ、特定の製剤または投与経路に限定されるようには意図されない。
【0066】
薬剤、組成物、または化合物に関して使用される「活性な」または「医薬的に活性な」という用語は、本明細書において使用される場合、投与または適用により、有益な、所望の、または期待される結果をもたらす薬剤を指す。投与は、1回または複数の投与、適用、または用量であってよく、特定の製剤または投与経路に限定されることは意図しない。この用語は、活性のいずれの特定レベルにも限定されない。
【0067】
「薬剤」および「化合物」という用語は、本明細書において同義的に使用され、属性の特徴を有する任意の原子、分子、混合物、またはより複雑な組成物を指す。例えば、「活性薬剤」または「活性化合物」は、投与または適用により、有益な、所望の、または期待される結果をもたらす、任意の原子、分子、調合物、混合物などを指す。
【0068】
本明細書で使用される「治療する」という用語は、特定の障害、疾患、損傷または症状に関連する症候を予防、治癒、または軽減/予防するための、投与療法を含む。
【0069】
本明細書で使用される「治療」という用語または文法的均等物は、疾患または症状(例えば癌、双極性障害、パーキンソン病、感染症、骨粗鬆症、不妊障害など)の症候の改善および/もしくは回復、または疾患の発生の危険性の減少を包含する。本発明の選別法で使用される時に、疾患に関連する何らかのパラメーターに改善をもたらす化合物は、それによって、治療用化合物として特定することができる。「治療」という用語は、治療処置および予防または防止対策の両方を指す。例えば、本発明の組成物および方法での治療から利益を享受し得る者は、疾患および/または障害(例えば、癌、精神もしくは神経変性疾患、またはこれらの症状と一致する症候もしくは病状)をすでに有する者、ならびに疾患および/または障害が(例えば、本発明の予防治療を用いて)予防される者を含む。
【0070】
本明細書で使用される「疾患の危険性がある」という用語は、特定の疾患にかかる素因のある対象(例えば、ヒト)を指す。この素因は、遺伝的(例えば、遺伝性障害などの疾患にかかる特定の遺伝的傾向)であり得るか、または他の因子(例えば、年齢、体重、環境条件、環境に存在する有害な化合物への曝露など)に起因し得る。したがって、本発明は、任意の特定の危険性に限定されることを意図するものではなく、本発明は、任意の特定の疾患に限定されることを意図するものでもない。
【0071】
本明細書で使用される「疾患に罹患する」という用語は、特定の疾患にかかる対象(例えば、ヒト)を指す。本発明は、何らかの特定の徴候もしくは症候、または疾患に限定されることを意図するものではない。したがって、本発明は、あらゆる範囲の疾患(例えば、無症状の徴候から完全に症状を呈する疾患)にかかる対象を包含することが意図され、対象は、特定の疾患に関連する、少なくともいくらかの徴候(例えば徴候および症候)を呈する。
【0072】
本明細書で使用される「疾患」および「病的症状」という用語は、通常の機能の性能を妨害もしくは変更する、生きている動物またはその器官もしくは組織のいずれかの通常の状態の何らかの悪化に関連し、環境因子(心的外傷、身体的外傷、栄養障害、工業災害、または気候など)、特定の感染因子(虫、細菌、またはウイルスなど)、生物の固有の欠陥(種々の遺伝子異常など)、またはこれらのおよび他の要因の組み合わせに対する反応であり得る、状態、徴候、および/または症候を説明するために、同義的に使用される。
【0073】
本明細書で使用される「投与」という用語は、薬物、プロドラッグ、もしくは他の活性薬剤、または治療処置(例えば本発明の組成物)を、生理系(例えば対象またはインビボ、インビトロ、もしくはエキソビボの細胞、組織、および器官)に与える行為を指す。人体への投与の例示的な経路は、眼(眼科)、口(経口)、皮膚(経皮)、鼻(経鼻)、肺(吸入)、直腸、膣、口腔粘膜(口腔)、耳、注射(例えば静脈、皮下、腫瘍内、腹腔内など)などを介してよい。投与は、1回または複数の投与、適用または用量でよく、特定の投与経路に限定されることは意図しない。
【0074】
本明細書で使用される「共投与」という用語は、対象への少なくとも2種の薬剤(例えば異なる活性化合物を含有する、2種の別個の脂質組成物)または療法の投与を指す。例えば、いくつかの実施形態において、エンドキシフェンは、第2の治療薬、例えば疾患または症状(例えば鬱病)の治療用の公知の治療薬と共投与されてもよい。いくつかの実施形態において、2種以上の薬剤または療法の共投与は同時的である。他の実施形態において、第1の薬剤/療法は第2の薬剤/療法以前に投与される。当業者は、使用される様々な薬剤または療法の製剤および/または投与経路は変動してもよいことを理解する。共投与のための適切な用量は、当業者によって容易に求めることができる。いくつかの実施形態において、薬剤または療法が共投与される場合、各々の薬剤または療法は、単独投与のために適切である量より低用量で投与される。したがって、共投与は、薬剤または療法の共投与が潜在的に有害な(例えば、有毒な)薬剤の必要な用量を低下させる実施形態において特に望ましい。
【0075】
「公知の治療」化合物または薬剤は、(例えば、動物試行またはヒトへの投与の過去の経験によって)治療に特定の治療効果を有すると示された治療化合物を含む。しかし、公知の治療化合物は、疾患(例えば双極性障害、鬱病または不安)の治療または予防における特定のレベルの有効性を有する化合物に限定されない。公知の双極性障害治療剤の例は、炭酸リチウムおよびクエン酸リチウムの一般的名称の下に入手可能な塩(例えばESKALITH、LITHOBID、LITHANE、LITHONATE、LITHOTABS、CIBALITH−S)を包含するリチウムおよびバルプロエートまたはバルプロ酸(DEPAKOTE)、ラモトリジン(LAMICTAL)、カルバマゼピン(TEGRETOL)およびオキスカルバゼピン(TRILEPTAL)などの抗痙攣薬を含むが、これらに限定されない。本発明の方法においてエンドキシフェンと組み合わせて使用される他の化合物の例はまた、ガバペンチン(NEUROTONIN)およびトピラマート(TOPAMAX)を含む。使用される公知の抗鬱治療剤は、選択的セロトニン再取り込み阻害剤(SSRI、例えばシタロプラム(CELEXA)、エスシタロプラム(LEXAPRO)、フルオキセチン(PROZAC,PROZACWEEKLY)、パロキセチン(PAXIL,PAXILCR)、セルトラリン(ZOLOFT);セロトニンおよびノルエピネフリンの再取り込み阻害薬(SNRI、例えばデュロキセチン(CYMBALTA)およびベンラファキシン(EFFEXOR、EFFEXORXR);ノルエピネフリンおよびドパミンの再取り込み阻害薬(NDRI、例えばブプロピオン(WELLBUTRIN、WELLBUTRIN SR、WELLBUTRINXL);四環系抗鬱薬(例えばミルタザピン(REMERON、REMERONSOLTAB));再取り込み阻害薬および受容体遮断薬の組み合わせ(例えばトラドゾン、tefazodone、マプロチリン);三環系抗鬱薬(TCA、例えばアミトリプチリン、アモキサピン、デシプラミン(NORPRAMIN)、ドキセピン(SINEQUAN)、イミプラミン(TOFRANIL)、ノルトリプチリン(PAMELOR)、プロトリプチリン(VIVACTIL)、トリミプラミン(SURMONTIL));モノアミン酸化酵素阻害薬(MAOI、例えばフェネルジン(NARDIL)、トラニルシプロミン(PARNATE)、イソカルボキサジド(MARPLAN)、セレギリン(EMSAM))を含むが、これらに限定されない。公知の抗不安治療剤の例は、ベンゾジアゼピン(例えばジアゼパム(VALIUM)、ニトラゼパム(MOGADON)、アルプラゾラム(XANAX)、ブロマゼパム(LEXOTAN)、クロルジアゼポキシド(LIBRIUM)、クロラゼプ酸(TRANXENE)、ロラゼパム(ATIVAN)、オキサゼパム、フルニトラゼパム(ROHYPNOL)、フルラゼパム(DALMANE)、ロプラゾラム、ロルメタゼパム、およびテマゼパム);非ベンゾジアゼピン剤(例えばブスピロン(BUSPAR)、ベータ遮断薬およびメプロバメート(EQUAGESIC));および非ベンゾジアゼピン催眠薬(例えばzalepon(SONATA)、ゾルピデム(STILLNOCT)、ゾピクロン(ZIMOVANE)、抱水クロラール、トリクロホスおよびclomethizole、アリピプラゾール(ABILIFY)、フマル酸クエチアピン(SEROQUEL)、オランザピン(ZYPREXA)、ジプラシドン(GEODON)などを含むが、これらに限定されない。
【0076】
本明細書で使用される「有毒」という用語は、毒物の投与前の同一細胞または組織と比較して、対象、細胞または組織に対する何らかの悪影響または有害な影響を指す。
【0077】
本明細書で使用される「薬学的に精製された」という用語は、薬学的使用のための調製物の十分な純度または品質の組成物を指す。
【0078】
本明細書で使用される「精製された」という用語は、除去した成分に対する精製された成分の比が、出発組成物においてよりも大きくなるように、少なくとも1つの他の成分(例えば、出発組成物からの別の成分(例えば、植物もしくは動物組織、環境試料など)、混入物、合成前駆体、または副生物など)を除去するための出発組成物の処理を指す。
【0079】
本明細書において使用される、「医薬組成物」という用語は、組成物を、特にインビボ、インビトロ、またはエキソビボの診断または治療の使用に適するようにする、活性薬剤(例えば活性医薬化合物)と、不活性または活性の担体(例えばリン脂質)との組み合わせを指す。
【0080】
本明細書において使用される、「薬学的に許容される」または「薬理学的に許容される」という用語は、対象に投与された場合、薬害反応、例えば毒性、アレルギー、または免疫学的反応を実質的に発生しない組成物を指す。
【0081】
本明細書において使用される「局所的に」という用語は、本発明の組成物の、皮膚の表面、ならびに粘膜細胞および組織(例えば歯槽、口腔、舌、咀嚼器官、または鼻粘膜、ならびに管腔器官もしくは体腔の内側を覆う他の組織および細胞)への適用を指す。
【0082】
本明細書で使用される「薬学的に許容される担体」という用語は、リン酸緩衝食塩水溶液、水、乳濁液(例えば油/水型または水/油型乳濁液など)、および様々な種類の湿潤剤、あらゆる溶媒、分散媒、コーティング、ラウリル硫酸ナトリウム、等張剤および吸収遅延剤、崩壊剤(disintigrants)(例えばジャガイモ澱粉または澱粉グリコール酸ナトリウム)などを含む、標準的な医薬担体のうちのいずれかを指すが、これらに限定されない。本組成物は、安定剤および保存料もまた含むことができる。担体、安定剤、およびアジュバントの例については、例えばMartin,Remington’s Pharmaceutical Sciences,15th Ed.,MackPubl.Co.,Easton,Pa.(1975)を参照。これは参照により本明細書に組み込まれる。さらに、特定の実施形態において、本発明の組成物は、園芸または農業での使用に製剤化してもよい。そのような製剤には、浸漬液、噴霧剤、種子粉衣、茎部注入、噴霧剤、およびミストを含む。
【0083】
本明細書で使用される「薬学的に許容される塩」という用語は、標的対象(例えば哺乳動物の対象、および/またはインビボもしくはエキソビボの細胞、組織もしくは器官)において生理学的に耐性のある、本発明の化合物の(例えば酸または塩基との反応により得られる)いずれかの塩を指す。本発明の化合物の「塩」は、無機または有機の酸および塩基から得ることができる。酸の例には、塩酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、エタンスルホン酸、ギ酸、安息香酸、マロン酸、スルホン酸、ナフタレン−2−スルホン酸、ベンゼンスルホン酸などが含まれるが、これらに限定されない。シュウ酸などの他の酸は、それ自体では薬学的に許容されないが、本発明の化合物およびそれらの薬学的に許容される酸付加塩を得る際、中間体として有用な、塩の調製に用いることができる。
【0084】
塩基の例には、アルカリ金属(例えばナトリウム)水酸化物、アルカリ土類金属(例えばマグネシウム)水酸化物、アンモニア、および式NW4+の化合物(式中、WがC1−4アルキルである)などが含まれるが、これらに限定されない。
【0085】
塩の例には、酢酸塩、アジピン酸塩、アルギン酸塩、アスパラギン酸塩、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、クエン酸塩、樟脳酸塩、樟脳スルホン酸塩、シクロペンタンプロピオン酸塩、ジグルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、フルコヘプタン酸塩(flucoheptanoate)、グリセロリン酸塩、ヘミ硫酸塩、ヘプタン酸塩、ヘキサン酸塩、塩化物、臭化物、ヨウ化物、2−ヒドロキシエタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、2−ナフタレンスルホン酸塩、ニコチン酸塩、シュウ酸塩、パルモン酸塩(palmoate)、ペクチン酸塩、過硫酸塩、フェニルプロピオン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、コハク酸塩、酒石酸塩、チオシアン酸塩、トシル酸塩、ウンデカン酸塩などが含まれるが、これらに限定されない。塩の他の例は、Na+、NH4+およびNW4+(式中、WはC1−4アルキル基)などの適切な陽イオンと化合した、本発明の化合物の陰イオンを含む。治療での使用のために、本発明の化合物の塩は、薬学的に許容されるとして企図される。しかしながら、薬学的に許容されない酸および塩基の塩もまた、例えば、薬学的に許容される化合物の調製または精製において使用され得る。
【0086】
治療での使用のために、本発明の化合物の塩は、薬学的に許容されると企図される。しかしながら、また、薬学的に許容されない酸および塩基の塩は、薬学的に許容される化合物の調製または精製において使用することができる。
【0087】
物質または組成物に関して使用される「含水アルコール」という用語は、本明細書において使用される場合、前記物質または組成物が水およびアルコールの両方を含むことを示す。
【0088】
本明細書で使用される「ゲル化剤」という用語は、流体(例えば、水または緩衝溶液などの水性流体)中に溶解、懸濁または分散される時に、ゼラチン状半固体(例えば、潤滑剤ゲル)を形成する組成物を指す。ゲル化剤の例は、ヒドロキシエチルセルロース、ヒドロキシメチルセルロース、ヒドロキシプロピルグアー、メチルセルロース、エチルセルロース、ヒドロキシプロピルセルロース、カルボキシルメチルセルロースナトリウム、カルボマー、アルギン酸、ゼラチン、およびポロキサマーを含むが、これらに限定されない。
【0089】
組成物に関して使用される「乾燥」という用語は、本明細書において使用される場合、化学反応をもはや補助しないレベルまで、溶剤成分または成分を除去することを指す。この用語はまた、乾燥された組成物に関して使用される(例えば、乾燥調製物または乾燥組成物)。当業者であれば、組成物が、例えば、凍結乾燥後に、残留溶剤もしくは水分含量を有しながら「乾燥」することができ、または乾燥工程の完了後に、例えば、大気から吸湿的に水分を吸収し得ることを理解する。「乾燥」という用語は、吸湿性の吸収による水分含量の増加を伴う組成物を包含する。
【0090】
本明細書で使用される「保護剤」という用語は、活性薬剤が特定の条件(例えば、乾燥、凍結)に曝露される時に、活性薬剤(例えば、抗癌薬または精神もしくは神経変性疾患薬)の活性または完全性を保護する組成物または化合物を指す。いくつかの実施形態において、保護剤は、凍結工程時に活性薬剤を保護する(すなわち、これは「凍結防止剤」である)。保護剤の例は、脱脂乳固形分、トレハロース、グリセロール、ベタイン、スクロース、グルコース、ラクトース、デキストラン、ポリエチレングリコール、ソルビトール、マンニトール、ポリビニルプロピレン、グルタミン酸カリウム、グルタミン酸一ナトリウム、Tween20界面活性剤、Tween80界面活性剤、およびアミノ酸塩酸塩を含むが、これらに限定されない。
【0091】
本明細書で使用される「賦形剤」という用語は、活性成分の調製物に添加される不活性成分(すなわち、薬学的に活性でない)を指す。本明細書に記述するゲル化剤および保護剤は、一般に「賦形剤」と呼ぶことができる。
【0092】
本明細書で使用される「キット」という用語は、材料を送達するための任意の送達系を指す。キナーゼ活性または阻害アッセイの文脈において、そのような送達系は、ある位置から別の位置への、反応試薬および/または補助材料(例えば、緩衝液、アッセイを行うための指示書など)の貯蔵、運搬、または送達を可能にする系を含む。例えば、キットは、関連反応試薬および/または補助材料を含有する1つまたは複数の筐体(例えば、箱)を含む。本明細書で使用される「区分化キット」という用語は、それぞれが全キット要素の下位区分を含有する2つ以上の別々の容器を備える送達系を指す。容器は、対象レシピエントに一緒にまたは別々に送達されてもよい。例えば、第1の容器は、アッセイに使用するための薬剤を含有することができ、第2の容器は、試験化合物との比較基準を含有する。「区分化キット」という用語は、Federal Food,Drug,and Cosmetic Act(連邦食品医薬品化粧品法)の520(e)条によって規制されているAnalyte Specific Reagent(ASR)を含有するキットを包含することが意図されるが、これらに限定されない。事実、それぞれが全キット要素の下位区分を含有する2つ以上の別々の容器を備える任意の送達系は、「区分化キット」という用語に含まれる。対照的に、「組み合わせキット」は、単一容器中(例えば、所望の要素のそれぞれを収容する単一の箱中)に、反応アッセイのすべての要素を含有する送達系を指す。「キット」という用語は、区分化キットおよび組み合わせキットの両方を含む。
【0093】
発明の詳細な説明
本発明は、エンドキシフェンを含有する組成物の医療での使用を提供する。さらに本発明は、精神および神経変性疾患の治療におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。詳細には、本発明は、双極性疾患、統合失調症、多発性硬化症(MS)、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症(ALS)およびてんかんの治療におけるエンドキシフェンを含む組成物の使用に関する。さらに本発明は、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染などの感染;ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染;骨粗鬆症および心血管疾患の治療におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。本発明は、さらになお、不妊治療および療法におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。またさらに本発明は、エンドキシフェンを調製する方法、およびヒトおよび動物の疾患の治療における、本発明の方法によって調製されたエンドキシフェンの使用に関する。
【0094】
エンドキシフェンは、タモキシフェンのCYP3A4媒介N−脱メチル反応およびCYP2D6媒介のヒドロキシル化を介して産生される(例えば、図3参照)。上で論じたように、パロキセチンを阻害する薬物とのタモキシフェンの共投与が、エンドキシフェンの血漿中濃度を減少させることは周知である(5)。さらに、CYP3A4またはCYP2D6の基質になり得る任意の薬物(例えばSSRI)は、たとえそれらが薬物を代謝する酵素の阻害薬でなくても、エンドキシフェンの血中濃度を低下させる可能性があり(5)、それにより、タモキシフェンの治療有用性を減少させる。したがって、そのような薬物間相互作用を回避するため、それらを一緒に与えるべきではないと助言される。
【0095】
近年、エンドキシフェンは、乳癌細胞において抗エストロゲン性であり、タモキシフェンよりも強力であることが分かっている。タモキシフェンで治療される患者において、エンドキシフェンは、ヒト血漿中で、4−OH−タモキシフェン(1ng/mL)よりも高い濃度(12.4ng/mL)で存在する。エンドキシフェンにより影響を受ける過半の遺伝子は、エストロゲン調節遺伝子である(15、16)。例えば、エンドキシフェンをタモキシフェンの代わりに使用することにより、CYP2D6に依存するいくつかの代謝段階が回避される。
【0096】
本発明者らは、エンドキシフェンがPKCを阻害し、それにより精神および神経変性疾患の治療に、例えば双極性障害の治療に使用されることを見出した。本発明はいずれの特定の様式または作用機序に限定されないが、観察された効果は、リチウムおよびバルプロエート(双極性障害に最も一般に用いられている治療)がPKC活性の減衰を介して治療効果を提供すると知られる観察と矛盾しない。
【0097】
精神および神経変性疾患におけるエンドキシフェンの使用
エンドキシフェン(4−ヒドロキシN−デスメチルタモキシフェン)は、乳癌の治療のための市販薬物タモキシフェンの活性代謝物である。タモキシフェンは、シトクロムP450(CYP)酵素CYP3A4およびCYP2D6によって広範囲に代謝され、4−ヒドロキシタモキシフェンおよび4−ヒドロキシ−N−デスメチルタモキシフェン(エンドキシフェン)(図1)を含む活性代謝物になる。本発明者らは、双極性障害、統合失調症ならびに多発性硬化症、パーキンソン病、アルツハイマー病、ハンティングトン病、筋萎縮性側索硬化症およびてんかんにおける神経保護の役割にエンドキシフェンが有益な効果を有すると仮定する。精神および神経変性疾患のための治療剤としてエンドキシフェンを使用することは、シトクロムP450(CYP)酵素による代謝的活性化を必要とし、その作用が遺伝的多型および薬物間相互作用による阻害のために変動する母化合物のタモキシフェンより著しい利点を有する。
【0098】
精神疾患
双極性障害
双極性障害は、障害を受けた者の間での自殺の多大な危険性と関連する慢性の精神病である(8)。リチウムおよびバルプロエートは、双極性障害において気分安定薬として広く用いられているが、しかし、患者の一部はこれらの薬剤に反応しない、または、部分的にしか反応しない(8)。したがって、より迅速、より強力で、より特異的な作用様式およびより少ない副作用の新規の治療剤の開発が必要とされる。
【0099】
疾患病態生理学の正確な機序が明らかでないにもかかわらず、プロテインキナーゼC(PKC)シグナル経路の役割も双極性障害に関係している(17)。PKCは、シナプス前部および後部の神経伝達の両方を調節する際に主要な役割を果たす。したがって、脳において細胞シグナルの変化を引き起こすPKC活性の変動は、情緒不安定(運動、認知および心理学的挙動における変動などの)をもたらす。動物の研究データは、過剰なPKC活性化が行動の調節を混乱させることがあり、動揺、判断力低下、衝動および無秩序な思考障害(これらのすべては双極性障害の患者の特徴である(9、17))などのような機能障害の一因と恐らくなることを示唆している。これらの基礎医学的調査結果は、脳内のPKCシグナルが気分安定剤の極めて妥当な標的を表すことを強く示唆している(17)。最も広く用いられている、リチウムおよびバルプロエートなどの気分安定薬はまた、直接にまたはPKC基質ミリストイル化アラニンリッチCキナーゼ基質(MARCKS)へのその作用を介してPKC活性を軽減することによって(17)、薬物療法の作用を与えることが知られている(図4)。
【0100】
タモキシフェンは、末梢的に投与することができ、ヒトに認可された、立証され容易に評価できる中枢神経系(CNS)PKC阻害活性を有する唯一の化合物である。ラットでの最近の調査において、タモキシフェンはアンフェタミンに誘発された躁病の挙動を低減した(9)。これらの結果は、PKCシグナルが双極性障害の病態生理学および治療に重要な役割を果たすことができる可能性を支持する。これらの調査結果は、障害のためのさらなる特定の薬物を開発する試みにとって、新規の方法を提供するので、直接的な臨床上の意味合いを有する。予備的な二重盲検の比較臨床試験では、偽薬でよりもタモキシフェンで大きい抗躁病効果を示した(18)。より新しくは、2つのグループが、二重盲検偽薬比較試験において、PKC阻害薬タモキシフェンが抗躁病性を示し十分な耐性があることを確証した(10、11)。これらの調査結果は、タモキシフェンおよびその代謝物質(可能性のある抗躁病または気分安定剤としてのエンドキシフェンなどの)の開発を促進する。
【0101】
統合失調症
統合失調症は、妄想、幻覚、偏執病および精神病などの挿話的症候を特徴とした精神病であり、情動の平坦化、注意力低下、引きこもりおよび認知障害などの持続的な症候を含んでもよい(19)。疫学的および臨床上の証拠は、統合失調症の発病および悪化へのエストロゲンの影響を示唆している。早期の調査は男性と女性の統合失調症の発病率はほぼ同等であると示唆したが、より最近の調査は、疾病発生率が男性においてより高いことを示す(20)。
【0102】
エストロゲンは女性において保護因子として働き、統合失調症の発病年齢は、男性より女性で著しく遅く、40〜45歳以降の女性においてより大きく遅い第2の発症ピークがある。さらに、精神機能障害のレベルは月経周期の相に応じて変動する(21)。統合失調症の女性において、月経周期中にエストロゲンレベルが低いとき、再発率はより高く、エストロゲンレベルが高い場合には、再発は低い(22)。統合失調症の女性のより高い再発率も、分娩後の間(低エストロゲン)観察され、一方、妊娠(高エストロゲン)中には再発は低い。他方では、統合失調症の男性は、女性より、発症年齢が低く、早期に入院し、典型的な様相および劣った予後を示す。
【0103】
統合失調症における外因性エストロゲンの精神治療効果を支持する証拠は、経皮的な補給エストラジオールを受けた統合失調症の更年期前の女性において、補給ラロキシフェン(SERM)を受けた統合失調症の閉経後の女性において、およびタモキシフェンを受けた躁病期の統合失調感情障害の女性において、ホルモン調節を調査する3つの二重盲検無作為化比較臨床試験の調査結果によって得られた(12)。その結果、統合失調症の更年期前の女性において補給エストラジオールは精神病の症候の改善に関連し;統合失調症の閉経後の女性において、補給ラロキシフェンは認知機能の改善に関連し;統合失調感情障害の女性において、補給タモキシフェンは躁病の症候の改善に関連した。これらの調査結果は、タモキシフェンなどのSERMを含む補給ホルモン調節が統合失調症用の性別特殊療法の有望な領域であることを示唆する。
【0104】
神経変性
多発性硬化症
多発性硬化症(MS)は、免疫系が、ミエリン塩基性タンパク質またはプロテオリピドタンパク質などのミエリンの成分に対する不適当な反応を起こす、CNSの自己免疫疾患である。これは、CNSの炎症およびミエリン損傷を特徴とする。自己反応性CD4+T−ヘルパ−1(Th1)細胞およびそれらの産生物(例えば、腫瘍壊死因子−α(TNF−α)、インターフェロン−γ(IFN−γ)、および、メタロプロテアーゼ)は、免疫病理の多くを媒介し、ミエリン鞘の破壊、および続いて神経機能障害をもたらす(23)。
【0105】
他の自己免疫疾患と同様に、男性(24)と比較して、MSの発病率は女性においてより高く(2から3倍)、これはホルモンの影響に起因すると考えられる。MSにおいてエストロゲンの疾患を調節する作用は広範囲に述べられている(25)。MSの患者および動物疾患モデルの両方において、エストロゲンの保護効果はよく立証されている。これらの調査結果は、疾患プロセスの保護効果が少なくとも一部はエストロゲンによる免疫応答の調節に起因し得ることを示唆している。しかし、ステロイドエストロゲンに関連する危険性および副作用は、長期のMS療法の有用性を限定するおそれがある。
【0106】
選択的エストロゲン受容体修飾剤は、いくつかの組織でエストロゲン作動薬として振る舞うが、他の組織においては不活性であるかまたはエストロゲン拮抗薬のように振る舞うので、代替治療薬戦略を提供することができよう(26)。例えば、ラロキシフェン(骨粗鬆症の治療に認可されたSERM)は骨中でエストロゲンとして振る舞うが、乳房組織、および子宮(27)中ではエストロゲン拮抗薬として働く。さらに最近の研究において、マウス中のミエリン特異免疫およびEAEを調節する、タモキシフェンおよびラロキシフェンの能力が研究された。タモキシフェンおよびラロキシフェンのどちらも、ミエリン抗原特異的T細胞の増殖を阻害した。しかし、タモキシフェンはこの点に関してより効果的であった。これらの調査結果は、タモキシフェンまたは関連するSERMは、MSなどのCNSの炎症性自己免疫障害の治療において使用することができる可能性のある薬剤であるという考えを支持する(28)。
【0107】
アルツハイマー病
アルツハイマー病は、最も一般的な神経変性障害の1つで、高齢者の認知症の最も一般的な形である。エストロゲンは、アルツハイマー病の予防において保護的役割を有すると思われる。エストロゲンは、β−アミロイド斑形成の阻害、コリン作動活性の刺激、酸化ストレス関連の細胞損傷の減少および血管危険性からの保護を含むいくつかの神経保護作用を、老化する脳に与えることができる。閉経後のホルモン補充療法は、認知症になる危険性をおよそ30%減少させる。同様に、骨粗鬆症のためのラロキシフェンを受けている患者は、軽度認知障害の危険性を33%減少させ、アルツハイマー病を発症する相対危険度を半減させ、老化関連神経変性障害(29)の予防におけるSERMの役割を示唆している。インビトロのニューロンモデル系でのタモキシフェン(およびその代謝物質、4−ヒドロキシタモキシフェン)の研究は、この薬剤が脳において部分作動薬として働き、閉経後に何らかの神経保護の有用性を提供し得ることを示唆している(14)。
【0108】
パーキンソン病
パーキンソン病(PD)は、ドパミン(30)の枯渇をもたらす中脳の黒質においてドパミン作動性ニューロンの選択的な損失を特徴としたもう一つの一般的な変性障害である。正常なドパミン伝達は、薬物(レボドパまたはドパミン作動薬)の投与によって回復することができる。長期投与の後、最終的に運動機能変動および運動障害を含む有害な運動合併症が現われる。プロテインキナーゼCは、レボドパ関連の運動変化の発症を加速し得る(31)。タモキシフェンはPKC拮抗薬として働くことができ、ラットおよびヒト以外の霊長動物において長期レボドパ療法の有益な応答が短縮するのを逆転させる(32)。同様に、パーキンソン病のサルへのタモキシフェンのレボドパとの共投与は、レボドパ誘発運動障害を著しく(61%)減じた(32)。
【0109】
PKC経由のその作用に加えて、タモキシフェンには神経保護機能を包含する複数の代謝効果がある(33)。タモキシフェンもドパミン放出を刺激すると示された。全体として、この証拠は、タモキシフェンがPDの長期レボドパ投与で見られる、望まれない運動不全の阻止に役割を有し、また、ことによると神経変性障害の化学的予防における役割を有し得ることを示唆する。
【0110】
本発明は、式Iのエンドキシフェンを、例えば、哺乳動物の宿主に送達するための組成物および方法を提供する。本発明のいくつかの実施形態において、エンドキシフェンはE異性体であり、他の実施形態において、Z異性体であるが、さらに他の実施形態においては、E異性体およびZ異性体の混合物である。
【化6】

【0111】
本発明の例は、エンドキシフェン、エンドキシフェンの類似体およびエンドキシフェンの誘導体を含み、エンドキシフェン、タモキシフェンおよび4−ヒドロキシタモキシフェンを含むが、これらに限定されない。また、本発明は、パクリタキセル、ドセタキセル、メルファラン、クロルメチン、extramustinephosphate、ウラムスチン、イホスファミド、マンノムスチン、トリホスファミド、ストレプトゾトシン、ミトブロニトール、ミトキサントロン、メトトレキサート、フルオロウラシル、シタラビン、テガフル、イドキシド、タキソール、パクリタキセル、ダウノマイシン、ダウノルビシン、ブレオマイシン、アンホテリシン、カルボプラチン、シスプラチン、BCNU、ビンクリスチン、カンプトセシン、SN−38、ドキソルビシン、およびエトポシドなどの他の抗腫瘍薬とともに使用される。また、bicautamide、エキセメスタン、ホルメスタン、レトロゾール、アナストラゾールおよびこれらの類似体などの癌治療において使用されるステロイド系および非ステロイド系阻害薬も含む。
【0112】
式Iのエンドキシフェンは、本発明の治療に使用するための任意の所望の方法によって調製することができるが、いくつかの実施形態においては、本発明は、エンドキシフェンを調製するための特定の方法を提供する。本発明の1つの好ましい方法を図2に示す。この方法において、4−ブロモフェノール1を、酸(例えば、硫酸など)の存在下において、3,4−ジヒドロピラン2と反応させて、化合物3を得る。次いで、化合物3を、適切な無水溶剤(例えば、テトラヒドロフランなど)中でマグネシウム削り屑と反応させる。これに続いて、1−[4−(2−クロロエトキシ)フェニル]−2−フェニル−1−ブタノン4と反応させて化合物5を得、適切な溶剤(例えば、メタノールなど)中、酸の存在下で脱水/脱保護して化合物6を得る。適切な溶剤(例えば、イソプロパノールなど)中で得られた化合物6をメチルアミンと反応させて、エンドキシフェンIを得る。
【0113】
本発明のいくつかの実施形態において、エンドキシフェンのEおよびZ異性体の混合物を分離して、エンドキシフェンのEおよびZ異性体の精製調製物を生成することができる。本発明におけるエンドキシフェンのEおよびZ異性体の分離は、例えば、結晶化、液体カラムクロマトグラフィ(LC)、または高圧液体カラムクロマトグラフィ(HPLC)による精製によって行うことができる。
【0114】
エンドキシフェンのEおよびZ異性体の分離のために本発明において用いることができる適切な溶剤は、ヘキサン、ヘプタンなど、ベンゼン、トルエン、酢酸エチル、アセトニトリル;塩化メチレン、クロロホルム、1,2−ジクロロメタンなどの塩素化溶剤;ケトン、例えば、アセトン、2−ブタノンなど;ジエチルエーテル、ジイソプロピルエーテル、メチルブチルエーテル、およびテトラヒドロフランなどのエーテル;メタノール、エチルアルコール、およびイソプロピルアルコールなどのアルコール;ならびに水などを含むが、これらに限定されない。結晶化のための溶剤は、単一溶剤として、またはヘキサン−酢酸エチル、クロロホルム−アセトン、クロロホルム−メタノール、ジクロロメタン−メタノールなどの溶剤の混合物として使用することができる。本発明において2種の溶剤の混合物を使用する場合、1つの溶剤の別の溶剤に対する比率の例は、例えば、9:1から1:9など(例えば、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9など)の範囲内である。しかし、本発明において使用するための混合物は、これらの比率、または2種の溶剤のみを含む混合物に限定されない。
【0115】
本発明によるエンドキシフェンの調製に使用される溶剤は、テトラヒドロフラン、ジクロロメタン、クロロホルム、1,2−ジクロロエタン、アセトニトリル、N,N’−ジメチルホルムアミド、ジメチルスルホキシド、トルエン、ピリジン、メタノール、エタノール、イソプロパノール、アセトン、2−ブタノン、ヘキサン、ヘプタン、ペンタン、酢酸エチルなどを含むが、これらに限定されない。
【0116】
本発明によるエンドキシフェンの調製に使用される酸は、硫酸、塩酸、酢酸、トリフルオロ酢酸、リン酸、p−トルエンスルホン酸、メタンスルホン酸、硝酸などを含むが、これらに限定されない。
【0117】
本発明の中間体および最終生成物は、ヘキサン ペンタン、ヘプタン、酢酸エチル、塩化メチレン、クロロホルム、メタノール、アセトンなどの単一の一般的有機溶剤またはその混合物を使用して、カラムクロマトグラフィで精製することができる。
【0118】
上記のように、本発明の中間体および最終生成物は、いくつかの実施形態においては、結晶化によって精製することができる。中間体および生成物の結晶化において使用される溶剤は、ペンタン、ヘキサン、ヘプタンなどの炭化水素;ベンゼン、トルエン、酢酸エチル、アセトニトリル;塩化メチレン、クロロホルム、1,2−ジクロロメタンなどの塩素化溶剤;ケトン、例えば、アセトン、2−ブタノンなど;ジエチルエーテル、ジイソプロピルエーテル、メチルブチルエーテル、テトラヒドロフランなどのエーテル;メタノール、エチルアルコール、イソプロピルアルコールなどのアルコールなどを含むが、これらに限定されない。結晶化のための溶剤は、単一溶剤としてまたは溶剤の混合物として使用することができる。例示的な混合物は、例えば、ヘキサン−酢酸エチル、クロロホルム−アセトン、クロロホルム−メタノール、ジクロロメタン−メタノールなどを含む。本発明において2種の溶剤の混合物を使用する場合、1つの溶剤の別の溶剤に対する比率の例は、例えば、9:1から1:9など(例えば、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9など)の範囲内である。しかし、本発明において使用するための混合物は、これらの比率、または2種の溶剤のみを含む混合物に限定されない。
【0119】
本発明の一目的は、少なくとも90%純度または少なくとも95%純度または少なくとも98%純度または少なくとも99%純度または少なくとも100%純度などの、少なくとも80%純度を有するEエンドキシフェンまたはZエンドキシフェンを提供することである。
【0120】
本発明の別の目的は、例えば、水性酸中などに可溶化されたエンドキシフェンを提供することである。エンドキシフェンを可溶化するための適切な酸は、ギ酸、酢酸、プロピオン酸、酪酸、トリフルオロ酢酸、乳酸、酒石酸、シュウ酸、マロン酸、コハク酸などを含むが、これらに限定されない。エンドキシフェンを含む酸性溶液のpHは、適切な塩基または緩衝液で調節することができる。塩基および緩衝液の例は、水酸化ナトリウム、酢酸ナトリウム、乳酸ナトリウム、コハク酸ナトリウム、一リン酸ナトリウム、二リン酸ナトリウム、三リン酸ナトリウム、シュウ酸ナトリウム、酒石酸ナトリウム、水酸化アンモニウム、酢酸アンモニウムなどを含むが、これらに限定されない。いくつかの実施形態においては、エンドキシフェンを可溶化するために共溶剤を使用することもできる。共溶剤の例は、エタノール、イソプロパノール、Tween20およびポリソルベートなどの界面活性剤などを含むが、これらに限定されない。
【0121】
特定の好ましい実施形態において、本発明によるエンドキシフェンを含有する組成物のpHは、約4.0から約8.0、好ましくは約5.0から約8.0、最も好ましくは約5.5から約7.5の間である。
【0122】
いくつかの実施形態において、本発明は、エンドキシフェンまたはエンドキシフェン−脂質複合体を、哺乳動物の宿主に送達するための組成物および方法に関する。任意の適切な量のエンドキシフェンを複合体形成に使用することができる。適切な量のエンドキシフェンは、本発明の複合体に安定して取り込むことができる量である。
【0123】
いくつかの実施形態において、本発明の組成物は、複合体が、望ましくは脂質または脂質の混合物を含有する、エンドキシフェンを有する脂質複合体を含む。複合体は、他の形態を除外することなく、例えば、ミセル、小胞またはエマルションの形態であってよい。本発明のミセルは、単量体、二量体、重合体または混合ミセルの形態であってよい。ミセルおよびエマルションを含む複合体は、主に、50nm〜20ミクロンの寸法範囲内、好ましくは50nm〜5ミクロンの寸法範囲内にある。複合体において、活性薬剤は、共有結合、疎水結合、静電結合、水素結合、または他の結合によって脂質に結合することができ、薬物が、脂質構造の内部に単に封入された場合にも、結合しているとみなされる。
【0124】
エンドキシフェン−脂質複合体は、例えば、コレステロールもしくはコレステロール誘導体またはコレステロールとコレステロール誘導体との混合物を含有することができる。本発明において使用されるコレステロール誘導体は、ヘミコハク酸コレステリル、コハク酸コレステリル、オレイン酸コレステリル、リノール酸コレステリル、エイコサペンタエン酸コレステリル、リノレン酸コレステリル、アラキドン酸コレステリル、パルミチン酸コレステリル、ステアリン酸コレステリル、ミリスチン酸コレステリル、コレステロールのポリエチレングリコール誘導体(コレステロール−PEG)、水溶性コレステロール(例えば、コレステロールメチル−β−シクロデキストリン)、コプロスタノール、コレスタノール、またはコレスタン、コール酸、コルチゾール、コルチコステロンもしくはヒドロコルチゾンならびに7−デヒドロコレステロールを含む。
【0125】
いくつかの好ましい実施形態において、組成物はまた、α−,β−,γ−トコフェロール、ビタミンE、カルシフェロール、ヘミコハク酸α−トコフェロール(THS)などのα−,β−,γ−トコフェロールの有機酸誘導体、コハク酸α−トコフェロールおよび/またはこれらの混合物も含む。
【0126】
他のいくつかの好ましい実施形態において、本発明のエンドキシフェン−脂質複合体はステロールを含有する。本発明において使用されるステロールは、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラソステロール、カンペステロールおよび/またはこれらの混合物を含む。
【0127】
また、本発明の組成物は、遊離脂肪酸および/またはその塩もしくはエステルとのエンドキシフェン複合体も含む。好ましい脂肪酸は約C2からC34までの範囲の炭素鎖長を有するものであり、好ましくは約C4から約C24の間で、とりわけ、テトラ酸(C4:0)、ペンタン酸(C5:0)、ヘキサン酸(C6:0)、ヘプタン酸(C7:0)、オクタン酸(C8:0)、ノナン酸(C9:0)、デカン酸(C10:0)、ウンデカン酸(C11:0)、ドデカン酸(C12:0)、トリデカン酸(C13:0)、テトラデカン(ミリスチン)酸(C14:0)、ペンタデカン酸(C15:0)、ヘキサデカン(パルミチン)酸(C16:0)、ヘプタデカン酸(C17:0)、オクタデカン(ステアリン)酸(C18:0)、ノナデカン酸(C19:0)、エイコサン(アラキジン)酸(C2O:0)、ヘンエイコサン酸(C21:0)、ドコサン(ベヘン)酸(C22:0)、トリコサン酸(C23:0)、テトラコサン酸(C24:0)、10−ウンデセン酸(C11:1)、11−ドデセン酸(C12:1)、12−トリデセン酸(C13:1)、ミリストレイン酸(C14:1)、10−ペンタデセン酸(C15:1)、パルミトレイン酸(C16:1)、オレイン酸(C18:1)、リノール酸(C18:2)、リノレン酸(C18:3)、エイコセン酸(C20:1)、エイコサジエン酸(C20:2)、エイコサトリエン酸(C20:3)、アラキドン酸(cis−5,8,11,14−エイコサテトラエン酸)、およびcis−5,8,11,14,17−エイコサペンタエン酸を含む。また、他の脂肪酸を組成物中に用いることもできる。そのようなものの例は、エタン(または酢)酸、プロパン(またはプロピオン)酸、ブタン(または酪)酸、ヘキサコサン(またはセロチン)酸、オクタコサン(またはモンタン)酸、トリアコンタン(またはメリシン)酸、ドトリアコンタン(またはラッセル)酸、テトラトリアコンタン(またはゲダ)酸、ペンタトリアコンタン(またはセロプラスチン)酸等の飽和脂肪酸、trans−2−ブテン(またはクロトン)酸、cis−2−ブテン(またはイソクロトン)酸、2−ヘキセン(またはイソヒドロソルビン)酸、4−デカン(またはオブツケイ)酸、9−デカン(またはカプロレイン)酸、4−ドデセン(またはリンデン)酸、5−ドデセン(またはデンチセチン)酸、9−ドデセン(またはラウロレイン)酸、4−テトラデセン(またはツズ)酸、5−テトラデセン(またはフィゼテリン)酸、6−オクタデセン(またはペトロセレン)酸、trans−9−オクタデセン(またはエライジン)酸、trans−11−オクタデセン(またはバクセン)酸、9−エイコセン(またはガドレイン)酸、11−エイコセン(またはゴンド)酸、11−ドコセン(またはセトレン)酸、13−ドコセン(またはエルカ)酸、15−テトラコセン(またはネルボン)酸、17−ヘキサコセン(またはキシメン)酸、21−トリアコンテン(またはルメキン)酸等のモノエテン不飽和脂肪酸、2,4−ペンタジエン(またはβ−ビニルアクリル)酸、2,4−ヘキサジエン(またはソルビン)酸、2,4−デカジエン(またはスチルリン)酸、2,4−ドデカジエン酸、9,12−ヘキサデカジエン酸、cis−9,cis−12−オクタデカジエン(またはα−リノール)酸、trans−9,trans−12−オクタデカジエン(またはリノールエライジン)酸、trans−10,trans−12−オクタデカジエン酸、11,14−エイコサジエン酸、13,16−ドコサジエン酸、17,20−ヘキサコサジエン酸等のジエン不飽和脂肪酸、6,10,14−ヘキサデカトリエン(またはヒラゴニン)酸、7,10,13−ヘキサデカトリエン酸、cis−6,cis−9−cis−12−オクタデカトリエン(またはγ−リノール)酸、trans−8,trans−10−trans−12−オクタデカトリエン(またはβ−カレンジン)酸、cis−8,trans−10−cis−12−オクタデカトリエン酸、cis−9,cis−12−cis−15−オクタデカトリエン(またはα−リノレン)酸、trans−9,trans−12−trans−15−オクタデカトリエン(またはα−リノレンエライジン)酸、cis−9,trans−11−trans−13−オクタデカトリエン(またはα−エレオステアリン)酸、trans−9,trans−11−trans−13−オクタデカトリエン(またはβ−エレオステアリン)酸、cis−9,trans−11−cis−13−オクタデカトリエン(またはプニカ)酸、5,8,11−エイコサトリエン酸、8,11,14−エイコサトリエン酸等のトリエン不飽和脂肪酸、4,8,11,14−ヘキサデカテトラエン酸、6,9,12,15−ヘキサデカテトラエン酸、4,8,12,15−オクタデカテトラエン(またはモロクチン)酸、6,9,12,15−オクタデカテトラエン酸、9,11,13,15−オクタデカテトラエン(またはα−またはβ−パリナリン)酸、9,12,15,18−オクタデカテトラエン酸、4,8,12,16−エイコサテトラエン酸、6,10,14,18−エイコサテトラエン酸、4,7,10,13−ドコサテトラエン酸、7,10,13,16−ドコサテトラエン酸、8,12,16,19−ドコサテトラエン酸等のテトラエン不飽和脂肪酸、4,8,12,15,18−エイコサペンタエン(またはティムノドン)酸、4,7,10,13,16−ドコサペンタエン酸、4,8,12,15,19−ドコサペンタエン(またはクルパノドン)酸、7,10,13,16,19−ドコサペンタエン、4,7,10,13,16,19−ドコサヘキサエン酸、4,8,12,15,18,21−テトラコサヘキサエン(またはニシン)酸等のペンタおよびヘキサエン不飽和脂肪酸、3−メチルブタン(またはイソ吉草)酸、8−メチルドデカン酸、10−メチルウンデカン(またはイソラウリン)酸、11−メチルドデカン(またはイソウンデシル)酸、12−メチルトリデカン(またはイソミリスチン)酸、13−メチルテトラデカン(またはイソペンタデシル)酸、14−メチルペンタデカン(またはイソパルミチン)酸、15−メチルヘキサデカン、10−メチルヘプタデカン酸,16−メチルヘプタデカン(またはイソステアリン)酸、18−メチルノナデカン(またはイソアラキジン)酸、20−メチルヘンエイコサン(またはイソベヘン)酸、22−メチルトリコサン(またはイソリグノセリン)酸、24−メチルペンタコサン(またはイソセロチン)酸、26−メチルヘプタコサン(またはイソモナトニック)酸、2,4,6−トリメチルオクタコサン(またはマイコセランまたはマイコセロシン)酸、2−メチル−cis−2−ブテン(アンゲリカ)酸、2−メチル−trans−2−ブテン(またはチグリン)酸、4−メチル−3−ペンテン(またはピロテレブ)酸の分枝鎖脂肪酸等を含む。
【0128】
いくつかの好ましい実施形態において、エンドキシフェン−脂質複合体はリン脂質を含有する。任意の適切なリン脂質またはリン脂質の混合物を使用することができる。例えば、リン脂質は、天然源から得るか、化学的に合成することができる。適切なリン脂質は、別々にまたは組み合わせて使用される、ホスファチジルエタノールアミン(PE)、ホスファチジルグリセロール(PG)、ホスファチジルセリン(PS)、ホスファチジルコリン(PC)、ホスファチジルイノシトール(PI)、ホスファチジン酸(PA)、スフィンゴミエリンなどを含むが、これらに限定されない。ホスファチジルグリセロールは、短鎖または長鎖を有し、飽和または不飽和であり、例えばジミリストイルホスファチジルグリセロール、ジオレオイルホスファチジルグリセロール、ジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジアラキドノイルホスファチジルグリセロール、短鎖ホスファチジルグリセロール(C6−C8)、およびこれらの混合物などである。ホスファチジルコリンの例は、ジミリストイルホスファチジルコリン、ジステアロイルホスファチジルコリン、ジパルミトイルホスファチジルコリン、ジオレオイルホスファチジルコリン、ジアラキドノイルホスファチジルコリン、卵ホスファチジルコリン、大豆ホスファチジルコリンまたは水素化大豆ホスファチジルコリンを含み、これらの混合物を使用してもよい。
【0129】
一態様によれば、本発明は、エンドキシフェンならびにモノ、ジおよびトリグリセリドの誘導体を含む組成物を提供する。グリセリドの例は、1−オレオイル−グリセロール(モノオレイン)および1,2−ジオクタノイル−sn−グリセロールを含む。
【0130】
本発明の別の態様は、ホスファチジルエタノールアミン、好ましくはジオレオイルホスファチジルエタノールアミン、ホスファチジルチオエタノール、N−ビオチニルホスファチジルエタノールアミンおよびホスファチジルエチレングリコールを含むがこれらに限定されない、官能性リン脂質とのエンドキシフェンの複合体の形成を提供する。
【0131】
本発明の別の態様は、炭水化物系脂質とのエンドキシフェンの複合体の形成を提供する。炭水化物系脂質の例は、ガラクトリピド、マンノリピド、ガラクトレシチンなどを含むが、これらに限定されない。
【0132】
他の好ましい実施形態において、エンドキシフェン−脂質複合体は、ステロールを含む。本発明において使用されるステロールは、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール,ラソステロール、カンペステロールおよび/またはこれらの混合物を含むが、これらに限定されない。
【0133】
本発明の別の態様は、ググリピドおよび任意の適切なリン脂質とのエンドキシフェンの複合体の形成を提供する。ググリピド、またはググルは、ムクルミルラの木に由来する天然物質である。ムクルミルラは、粘着性樹脂を生成し、加工されてググリピドが得られる。この抽出物は、関節炎および肥満症を治療するために、アーユルヴェーダ医学において何千年もの間使用されてきた。ググリピドは、通常少なくとも2.5%の量で存在する、ZおよびEググルステロンなどのステロール化合物の源である(10)。ZおよびEググルステロンは、化学的に合成することができ、したがって、これらのステロンの純粋形態を有することが必要とされる製剤において使用することができる。例えば、どちらも参照により本願明細書に組み込まれる2006年11月6日に出願された米国特許出願第60/856,952号、および2007年11月6日に出願されたPCT/US07/83832号を参照。
【0134】
本発明のさらに別の態様は、ペグ化リン脂質などのリン脂質誘導体とのエンドキシフェンの複合体の形成を提供する。本発明において使用されるペグ化脂質の例は、ジステアロイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、ジオレオイルホスファチジルグリセロールなどのポリエチレングリコール(ペグ化、PEG)誘導体を含むが、これらに限定されない。
【0135】
他の態様において、エンドキシフェンおよびポリエチレングリコール(PEG)ならびに1種または複数の脂質を含む組成物を提供する。
【0136】
さらに他の態様によれば、本発明は、1種または複数の脂質とのエンドキシフェン複合体を含む組成物を提供する。例として、エンドキシフェン、コレステロールまたはコレステロール誘導体および1種または複数のリン脂質を含む組成物が挙げられるが、これらに限定されない。組成物の他の例は、エンドキシフェン、β−シトステロール、および1種または複数のリン脂質を含む。いくつかの好ましい実施形態において、本発明の組成物は、エンドキシフェン、および水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンを含む。
【0137】
「ポリエチレングリコール(PEG)」という用語は、低級アルキレンオキシド、特に、ポリマー分子の少なくとも一端にエステル化可能なヒドロキシル基を有するエチレンオキシド(ポリエチレングリコール)のポリマー、ならびにエステル化可能なカルボキシ基を有するそのようなポリマーの誘導体を含む。200〜20,000の範囲の平均分子量のポリエチレングリコールが好ましく、500〜2000の範囲の平均分子量を有するものが、特に好ましい。
【0138】
本発明の別の態様は、炭水化物系脂質とのエンドキシフェンの複合体の形成を提供する。炭水化物系脂質の例は、ガラクトリピド、マンノリピド、ガラクトレシチンなどを含むが、これらに限定されない。
【0139】
本発明の組成物のいくつかの実施形態において、エンドキシフェン、好ましくは1mg/mLから約20mg/mLの間、または1mg/mLから10mg/mLの間、より好ましくは1mg/mLから5mg/mLの間などの約0.5mg/mLから約25mg/mLの濃度の水中のエンドキシフェンを含む複合体が形成される。
【0140】
いくつかの実施形態において、本発明の組成物は、総脂質の約2.5%から約90%、好ましくは、総脂質の重量の約2.5から約50%、またはより好ましくは、総脂質の重量の約10%から約50%を含有する。
【0141】
特定の実施形態において、本発明の組成物は、好ましくは、1:1から1:20モル比の間、または1:1から1:30モル比の間、または1:1から1:40モル比の間、または1:1から1:50モル比の間、1:1から1:60モル比の間、1:1から1:70モル比の間、1:1から1:80モル比の間、および1:90モル比などの1:1から1:100のモル比の間で、エンドキシフェンおよび脂質を含有する。
【0142】
本明細書に挙げた比率、例えば、組成物中の成分のモル比は、一例として提供され、本発明を正確な増分比、例えば、組成物中の成分の整数比に限定するものではない。例えば、約1:10から1:90の比率の範囲は、1:11、1:25、1:89などのみならず、約1:10から1:90(例えば、1:53.637)の、またはその間の、任意の比率を含むが、これらに限定されない。
【0143】
特定の実施形態において、本発明の組成物は、好ましくは、エンドキシフェンならびに水素化大豆ホスファチジルコリン、または大豆ホスファチジルコリン、およびコレステロールもしくはコレステロール誘導体を含有する。そのような組成物は、好ましくは約1:1から1:5モル比で、より好ましくは約1:1モル比から約1:2モル比で、エンドキシフェンおよびコレステロールまたはコレステロール誘導体を含む。
【0144】
本発明のさらに別の態様は、ペグ化リン脂質などのリン脂質誘導体とのエンドキシフェンの複合体を形成することである。例としては、ジステアロイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、ジオレオイルホスファチジルグリセロールなどのポリエチレングリコール(PEG)誘導体が挙げられるが、これらに限定されない。
【0145】
いくつかの好ましい実施形態において、水素化大豆ホスファチジルコリンまたはホスファチジルコリンを含有する組成物中の、エンドキシフェンと水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンとのモル比は、約1:10から1:90の間、例えば、約1:10から1:80、または1:10から1:70、または1:10から1:60、または1:10から1:50、または1:10から1:40および1:10から1:30の間である。特に好ましい実施形態において、エンドキフェンと水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンとのモル比は、1:10から1:60の間である。
いくつかの実施形態において、本発明の組成物は、好ましくは、1:1から1:20比の間、または1:1から1:30比の間、または1:1から1:40比の間、または1:1から1:50比の間、または1:1から1:60比の間、または1:1から1:70比の間、および1:1から1:80比の間、あるいは1:1から1:90比の間などの1:1から1:100比の間の重量に対する重量比を有する、エンドキシフェンおよび総脂質を含有する。
【0146】
いくつかの実施形態において、本発明の方法は、例えば水などの水溶液中で、エンドキシフェンおよび脂質を一緒に可溶化する、または懸濁することを含む。エンドキシフェン−脂質複合体溶液は、複合体の粒度分布を制御するために、適切なフィルターに通して濾過することができる。
【0147】
いくつかの実施形態において、本方法は、水中で脂質を一緒に混合し、次いで、エンドキシフェンの添加を含んでもよい。エンドキシフェン−脂質複合体溶液は、複合体の粒度分布を制御するために、適切なフィルターに通して濾過することができる。
【0148】
いくつかの実施形態においては、本方法はまた、クロロホルムもしくはエタノールまたは任意の他の医薬的に許容される溶剤などの有機溶剤中で、エンドキシフェンおよび脂質を混合し、溶剤を蒸発させて、脂質相または脂質膜を形成することも含む。次いで、脂質相を水または水溶液で水和する。水溶液の例は、0.9%塩化ナトリウム、デキストロース、スクロースなどの糖を含有する溶液を含むが、これらに限定されない。水和した溶液は、複合体の粒度分布を制御するために、適切なフィルターに通して濾過することができる。
【0149】
いくつかの実施形態において、本方法は、有機溶剤中で脂質を混合し、溶剤を蒸発させて、脂質相または脂質膜を形成することを含む。次いで、脂質相を、エンドキシフェンを含有する水溶液で水和する。水溶液は、エンドキシフェンに加えて、塩化ナトリウムまたはデキストロース、スクロースなどの糖をさらに含有してよい。水和した溶液は、複合体の粒度分布を制御するために、適切なフィルターに通して濾過することができる。
【0150】
他の実施形態において、本発明の方法は、結果として生じる本発明の組成物が、エンドキシフェン、および1種または複数の脂質を含有するように、任意の順序で、かつ任意の適切な溶剤中で、エンドキシフェンと1種または複数の脂質を混合することを含む。
【0151】
いくつかの実施形態においては、本発明の調製方法は、30〜100℃、好ましくは30〜80℃の間、より好ましくは30〜60℃の間の範囲の温度で、エンドキシフェン、および脂質を含む組成物を加熱することを含む。
【0152】
いくつかの実施形態において、本発明の組成物のpHは、約3から約11の範囲であるが、pH3.5から約8の間が好ましく、pH4.0からpH7.5の間が特に好ましい。
【0153】
特定のpHを有する水溶液は、適した緩衝液を含む水から調製することができる。好ましい緩衝剤は、リン酸二水素ナトリウムおよびリン酸水素二ナトリウム、リン酸ナトリウム、コハク酸二ナトリウムの混合物を含むが、これらに限定されない。本発明において使用される他の緩衝液は、炭酸ナトリウム、重炭酸ナトリウム、水酸化ナトリウム、酢酸アンモニウム、クエン酸ナトリウム、トリス(ヒドロキシ−メチル)アミノエタン、安息香酸ナトリウムなどを含む。
【0154】
エンドキシフェンおよび水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンを含有する組成物中の、エンドキシフェンと水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンとのモル比は、1:10から1:80の間、または1:10から1:80、または1:10から1:60、または1:10から1:50、または1:10から1:40および1:10から1:30などの1:10から1:90の間である。好ましい実施形態において、エンドキシフェンと水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンとのモル比は、1:5から1:60の間である。
【0155】
上記のように、組成物は、濾過して、濾液から所望の寸法範囲の複合体粒径を得ることができる。本発明において使用されるフィルターは、濾液から所望の寸法範囲の複合体を得るために使用することができるものを含む。例えば、複合体を形成して、その後、各粒子が約5ミクロン以下の直径を有する複合体を得るために、5ミクロンフィルターを用いて濾過することができる。代替として、1μm、500nm、200nm、100nmまたは他のフィルターを、約1μm、500nm、200nm、100nmの直径または任意の適切な寸法範囲をそれぞれ有する複合体を得るために、使用することができる。
【0156】
所望される場合、エンドキシフェン−脂質複合体は、例えば、蒸発または凍結乾燥によって乾燥することができる。本発明の特定の実施形態において、エンドキシフェン−脂質複合体は、糖などの1種または複数の凍結防止剤とともに凍結乾燥することができる。好ましい実施形態において、糖は、トレハロース、マルトース、ラクトース、スクロース、グルコース、およびデキストランを含むが、これらに限定されない。特に好ましい実施形態において、トレハロースおよび/またはスクロースが使用される。凍結乾燥は、減圧下で行われ、エンドキシフェン脂質調製の事前の凍結の有無にかかわらずに行うことができる。所望される場合、複合体は、水、生理食塩水、デキストロースおよび緩衝液を含む、任意の所望の溶剤中に再懸濁することができる。
【0157】
本発明の組成物を用いて使用される医薬調製物は、錠剤、カプセル剤、丸剤、糖衣錠、坐剤、液剤、懸濁剤、乳剤、軟膏剤、およびゲル剤を含むが、これらに限定されない。経口投与のための、エンドキシフェンまたはエンドキシフェン脂質複合体の好ましい形態は、錠剤、カプセル剤、トローチ剤、散剤、シロップ剤、水溶液、懸濁剤などを含む。局所適用および坐剤のための、エンドキシフェンまたはエンドキシフェン−脂質複合体の好ましい形態は、ゲル剤、オイルおよび乳剤を含み、例えば、ポリエチレングリコール、ある種の脂肪、およびエステル、高含量の多価不飽和脂肪酸ならびにこれらの誘導体を含む組成物の適切な水溶性または水不溶性賦形剤の添加によって形成される。誘導体は、モノ、ジおよびトリグリセリドならびにこれらの脂肪族エステル(例えば、魚油、植物油など)、またはこれらの物質の混合物を含む。適切な賦形剤は、薬物複合体が、治療での使用を可能にするよう十分安定したものである。
【0158】
所望される場合、エンドキシフェンまたはエンドキシフェン−脂質複合体を含有する組成物は、それを胃酸から保護するために、腸溶被覆カプセル内に被包することができる。「腸溶」という用語は、小腸を指し、および腸溶被覆は、それが小腸に到達する前の薬物の放出を防ぐ。腸溶被覆の多くは、酸性pHで安定であるが、より高いpHで急速に分解する表面を存在させることによって機能する。エンドキシフェンまたはエンドキシフェン−脂質複合体を含有する組成物が充填されたカプセルの腸溶被覆は、当分野で既知の方法で行うことができる。
【0159】
本発明のエンドキシフェン−脂質複合体は、様々な寸法であってよく、または実質的に均一な寸法であってよい。例えば、複合体は、約1mm以下の平均直径を有することができ、より好ましくはミクロンまたはサブミクロンの範囲にある。いくつかの好ましい実施形態において、複合体は、0.2μm以下または0.1μm以下などの約5μm以下の平均直径を有する。
【0160】
また、本発明で概説される技術は、任意の他の水不溶性薬物のために使用することができる。本発明の方法および組成物は、2006年10月10日に出願された米国特許出願第60/850,446号、2007年10月10日に出願されたPCT出願第PCT/US07/80984号、2006年11月6日に出願された米国特許出願第60/856,952号、2007年11月6日に出願されたPCT出願第PCT/US07/83832号に開示される方法および組成物と併せて使用され、これらのすべては、参照によりこれら全体が本願明細書に組み込まれる。
【0161】
本発明の組成物は、乳癌および乳房関連疾患を治療するために用いることができる。例えば、本発明の組成物は、良性乳房疾患と診断された患者に投与することができる。本明細書で使用される「良性乳房疾患」という用語は、乳房組織内の様々な非悪性異常を指す。異常は、本来、増殖性または非増殖性であってもよい。本発明の組成物によって治療可能な例示的な良性乳房疾患は、腺症、嚢胞、管拡張症、線維腺腫、線維症、過形成、化生および他の線維嚢胞性変化を含む。それらの有病率に起因して「変化」または「症状」と称されるこれらの各疾患は、明確な組織学的および臨床的特徴を有する。
【0162】
「腺症」は胸の全身性腺疾患を指す。これは、典型的に、通常より多くの腺を含む胸小葉の拡大を伴う。「硬化性腺症」または「線維性腺症」において、拡大した小葉は、瘢痕様の線維組織によって変形する。
【0163】
「嚢胞」は、流体または半固体物質が充填された異常嚢である。胸内の嚢胞は、小葉構造から発生する胸上皮細胞に覆われている。これらは胸腺内部の過剰流体として始まるが、周囲の乳房組織に伸展する割合までに成長し、痛みを生じ得る。「線維嚢胞性」は、顕著な量の線維性結合組織によって取り囲まれる、またはその内部にある嚢胞性病変である。
【0164】
「管拡張症」は、脂質および細胞残屑による乳管の拡張を指す。管の破裂は、顆粒球および血漿細胞による浸潤を誘発する。
「線維腺腫」は腺上皮に由来し、増殖性線維芽細胞および結合組織の顕著な間質を含有する良性腫瘍を指す。
【0165】
「線維症」は、単に、胸の線維組織の突出物を指す。
【0166】
「過形成」とは、腫瘍形成がなく、細胞の幾つかの層が基底膜の内側を覆う細胞の過成長を指す。過形成は乳房組織の大部分を増大させる。「上皮過形成」では、乳管および小葉の内側を覆う細胞が関与しており、「管過形成」および「小葉過形成」という用語につながる。組織学的決定に基づいて、過形成は、「通常」または「非定型」と特徴付けることができる。
【0167】
「化生」は、1つの種類の分化した組織が、別の種類の分化した組織に形質転換する現象を指す。化生は、環境変化に起因することが多く、細胞がより変化に耐えることを可能にする。
【0168】
本発明の組成物は、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染などの感染;ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染;骨粗鬆症および心血管疾患を治療するために使用することができる。本発明の組成物は不妊治療および療法にさらに使用することができる。
【0169】
本発明の組成物は、任意の剤形で、活性化合物エンドキシフェンを、インビボの乳房エストロゲン受容体に送達する任意の系を介して投与することができる。いくつかの実施形態において、本発明の組成物は、例えば、角質層、表皮および真皮層を介して、薬物を患者の皮膚の表面から微小循環に送達するなどの、「経皮投与」によって送達される。これは、一般に、濃度勾配に沿って拡散することによって達成される。拡散は、細胞内浸透(細胞を通して)、細胞間浸透(細胞間)、経付属器的(transappendageal)浸透(毛包、汗腺、および皮脂腺を通じて)、または上記の任意の組み合わせを介して生じ得る。
【0170】
本発明のエンドキシフェン組成物の経皮投与は、これが、全身性の薬物曝露および体全体にわたってエストロゲン受容体を非特異的に活性化させることによる危険性を減少させるために、有利な場合がある。これは、エンドキシフェンの局所適用では、主として局所組織に吸収されるためである。エンドキシフェンを含有する本発明の組成物が、乳房に経皮的に適用される場合、その中の多くのエストロゲン受容体に恐らくは起因して、高い濃度が乳房組織内に蓄積する。エンドキシフェンの組成物は、あらゆる皮膚表面、好ましくは、一方または両方の乳房に適用することができる。投与される日用量は、エンドキシフェンの吸収係数、所望される乳房組織中濃度、および超過すべきではない血漿中濃度に基づいて初回に推定することができる。初回量は、個人応答に応じて、各患者で最適化することができる。
【0171】
経皮投与は、様々な方法で達成することができる。例えば、(i)ある量の製剤を、皮膚の特定の領域に適用する場合に、軟膏剤、乳剤、ゲル剤、ローション剤、クリーム剤などを形成するために、エンドキシフェンの組成物を、適切な医薬担体、および場合によって、浸透促進剤と混合する、(ii)当分野において既知の技術に従って、エンドキシフェンの組成物を、パッチまたは経皮送達系に取り込むなどである。
【0172】
経皮薬物投与の有効性は、薬物濃度、適用の表面積、回数および持続時間、皮膚温度、皮膚の水分量、以前の照射、薬物の物理化学的特性、および製剤と皮膚との間の薬物の分配などの多くの因子に依存する。いくつかの実施形態において、例えば、経皮的有効性を増強させるために、組成物または複合体は、その物理化学的特性を可逆的に変化させて角質層の抵抗を減少させることによって、共溶剤の役割を果たす角質層内の水和を変化させること、または細胞内空間における脂質もしくはタンパク質の組織化を変化させることによって、経皮吸収を向上させる浸透促進剤を含む。そのような促進剤は、アルコール、アセトン、ジメチルスルホキシド(DMSO)、ポリエチレングリコール、プロピレングリコール、脂肪酸および脂肪アルコールならびにこれらの誘導体、ヒドロキシル酸、ピロリドン、尿素、植物油、精油、ならびにこれらの混合物などの有機溶剤を含むが、これらに限定されない。化学的促進剤に加えて、物理的方法で経皮吸収を増強させることができる。例えば、密封包帯は、皮膚の水和を誘発する。他の物理的方法は、イオン導入および超音波導入を含み、これは、それらの寸法およびイオン特性のために吸収されにくい薬物の吸収を増強させるために、それぞれ電場および高周波数超音波を使用する(12〜13)。医薬分野に携わる者は、経皮送達のための正しい有効な投与量を実現する種々の因子および方法を容易に操作することができる。
【0173】
経皮投与のために、エンドキシフェンを含有する本発明の製剤または組成物は、軟膏剤、乳剤(ローション剤)、クリーム剤、ゲル剤、散剤、オイルまたは同様の製剤の形態で送達することができる。いくつかの実施形態において、製剤は、大豆油,からし油、扁桃油、オリーブ油、ラッカセイ油,ピーナッツ油、杏仁油、ラッカセイ油、ヒマシ油、菜種油などの植物油、動物性脂肪、DMSO、ラノリンリポイド、リン脂質、パラフィン類などの炭化水素、ワセリン、ワックス、レシチン,界面活性剤乳化剤、カロチン、アルコール、グリセロール、グリセロールエーテル、グリセリン、グリコール、グリコールエーテル、ポリエチレングリコール、ポリプロピレングリコール、不揮発性脂肪アルコール、酸、エステル、揮発性アルコール化合物、タルク、尿素、セルロース誘導体、着色剤、抗酸化剤および保存料などを含むがこれらに限定されない、賦形剤添加物を含む。
【0174】
いくつかの実施形態において、エンドキシフェンを含有する本発明の製剤または組成物は、経皮パッチとして送達することができる。パッチは、(i)溶液不浸透性裏当て箔、(ii)空洞を有する層状要素、(iii)微多孔または半透膜、(iv)自己接着層、および(v)場合によって、除去可能な裏当て膜を含んでよい。空洞を有する層状要素は、裏当て箔および膜によって形成することができる。代替として、パッチは、(i)溶液不浸透性裏当て箔、(ii)貯蔵器としての開放気孔発泡体、閉鎖気孔発泡体、組織様層または繊維織物様層、(iii)自己接着層、および(iv)場合によって、除去可能な裏当て膜を含んでよい。
【0175】
いくつかの好ましい実施形態において、エンドキシフェンを含有する本発明の組成物は、含水アルコールゲル剤中で製剤化され、エンドキシフェンの量は、ゲル剤100グラム当たり0.001001から1.0グラムまで変動し、最も好ましくはゲル剤100グラム当たり0.01から0.20グラムの範囲内であってよい。
【0176】
他の実施形態において、本発明の組成物は、浸透促進剤として1種または複数の脂肪酸エステルを含む。脂肪酸エステル浸透促進剤の非常に好ましい例の1つは、ミリスチン酸イソプロピルである。ミリスチン酸イソプロピルをゲル剤中で使用する場合、量は、例えば、ゲル剤100グラム当たり0.11から5.0グラムまで、好ましくはゲル剤100グラム当たり0.5から2.0グラムまでの範囲であってよい。
【0177】
もう一つの好ましい実施形態において、エンドキシフェンを含有する本発明の組成物はまた、アルコール性ビヒクルなどの1種または複数の非水性ビヒクルを含有し得る。非水性ビヒクルの例は、酢酸エチル、エタノール、およびイソプロパノール、好ましくはエタノールおよびイソプロパノールを含む。これらの非水性ビヒクルは、使用される活性薬剤エンドキシフェンおよび任意の他の浸透促進剤の両方を溶解するために有用であり得る。また、これらは、好ましくは、皮膚と接触すると急速に蒸発できるように、低沸点を有し、好ましくは、大気圧で100℃未満である。特に、エタノールは、皮膚との接触後に急速に蒸発することによって、エンドキシフェンの経皮吸収に効果的に寄与し得る。ゲル製剤中の無水非水性ビヒクルの量は、35重量%から99重量%までの範囲、好ましくは50%から85%の間、より好ましくは60%から75%の間である。
【0178】
別の好ましい実施形態において、本発明の組成物または製剤は、親水性分子の可溶化を可能にし、皮膚の加湿を促進する水性ビヒクルを含む。水性ビヒクルはまた、pHを調節することができる。水性ビヒクルは、リン酸緩衝溶液(例えば、リン酸水素二ナトリウムまたはリン酸二水素ナトリウム)を含むリン酸緩衝溶液、クエン酸緩衝溶液(例えば、クエン酸ナトリウムまたはクエン酸カリウム)および精製水を含む、アルカリ化および塩基性緩衝溶液を含む。水性ビヒクルの量は、好ましく、医薬組成物の0.1重量%から65重量%の間、より好ましくは15%から50%の間、さらにより好ましくは25%から40%の間の範囲である。
【0179】
他の実施形態において、本発明の組成物は、組成物または製剤の粘性を増大させるために、または可溶化剤として機能するように、1種または複数のゲル化剤を含む。これは、ゲル化剤の性質に応じて、製剤の0.1重量%から20重量%の間、好ましくは0.5%から10%の間、より好ましくは0.5%から5%の間を構成し得る。ゲル化剤は、カルボマー、セルロース誘導体、ポロキサマーおよびポロキサミンであってよい。好ましいゲル化剤は、キトサン、デキストラン、ペクチン、天然ゴム、およびエチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、カルボキシメチルセルロース(CMC)などのセルロース誘導体である。最も好ましいゲル化剤はヒドロキシプロピルセルロースである。
【0180】
本発明の組成物は、上記のようなゲル化剤、特に事前に中和されていないアクリルポリマーを含んでもよく、また中和剤も含み得る。中和剤/ゲル化剤の比率は、10:1から0.1:1の間、好ましくは7:1から0.5:1の間、より好ましくは4:1から1:1の間で変化する。ポリマーの存在下における中和剤は、ビヒクルに可溶である塩を形成すべきである。また、中和剤は、電荷の中和およびポリマー塩の形成時に、ポリマー鎖の最適な膨潤を可能にすべきである。中和剤は、水酸化アンモニウム、水酸化カリウム、水酸化ナトリウム、アミノメチルプロパノール、トロラミン、およびトロメタミンを含む。当業者は、組成物または製剤において使用するゲル化剤の種類に従って、中和剤を選択するであろう。しかし、セルロース誘導体をゲル化剤として使用する時は、中和剤は必要とされない。
【0181】
いくつかの実施形態において、本発明の組成物は、他の疾患を治療するために用いられ、薬物は、喘息治療薬、抗不整脈薬、抗真菌薬、降圧剤、抗癌薬、抗生物質、抗糖尿病薬、抗ヒスタミン薬、抗寄生虫薬、抗ウイルス薬,強心配糖体、ホルモン、免疫療法、抗低血圧薬、ステロイド、鎮静剤および鎮痛薬、精神安定薬、ワクチン、ならびに細胞表面受容体遮断薬からなる群の、誘導体化により、親油性化合物または親油性にされた化合物から選択される。
【0182】
本発明について記載する文脈における(特に以下の特許請求の範囲の文脈で)、「a」、および「an」、および「the」という用語、および類似の指示対象の使用は、本明細書において別途指示されるか、文脈により明らかに矛盾しない限り、単数および複数の両方を対象とすると解釈されるべきである。「〜を含む(含有する)」、「〜を含む」、「〜を有する」、および「〜を含有する(含む)」という用語は、別途指摘のない限り、限定のない用語(すなわち、「〜を含むが、これらに限定されない」を意味する)として、解釈されるものとする。本明細書において提供される、あらゆる例、または例を示す言葉(例えば「〜など」)の使用は、単に、本発明の理解をより容易にすることが意図され、別途言及のない限り、本発明の範囲に制限を課すことはない。本明細書における、いかなる言葉遣いも、いずれかの非言及要素を、本発明の実施に必須であることを示していると、解釈されるべきではない。
【0183】
本発明を実施するための、本発明者らが知る最良の様式を含む、本発明の好ましい実施形態が記載される。これらの好ましい実施形態の変形物は、そのような変形物を適切に利用する当業者には明白であり、本発明者らは、本発明を、本明細書に具体的に記載されたのとは別の方法で、実施することを意図する。したがって、本発明は、適用法令により許可される、本明細書に添付される特許請求の範囲に示される内容のすべての変形物および均等物を含む。さらに、上記要素の、そのすべての可能な変形物の形態でのあらゆる組み合わせは、本明細書において別途指示されるか、文脈により明らかに矛盾しない限り、本発明により包含される。
【実施例】
【0184】
以下の実施例は、本発明をさらに例証するものであり、決してその範囲を限定すると解釈されるべきではない。
【0185】
実施例1
化合物3の合成
【化7】

【0186】
4−ブロモフェノールブルー(1、1kg)および3,4−ジヒドロ−2H−ピラン(2、1.5L)を、丸底フラスコ内で一緒に混合し、0℃まで冷却した。濃硫酸(1mL)を室温より低い温度に維持しながら滴下した。溶液を室温で1時間撹拌した。反応溶液をヘキサンで希釈し、水(1L)、続いて5%重炭酸ナトリウム溶液(1L)で洗浄した。有機層を硫酸ナトリウムで乾燥し、濾過して、50〜55℃で真空中で蒸発させ、油(1.55Kg)を得た。ヘキサン(300mL)を油に添加し、摩砕して、白色固体3を得た。懸濁液は0℃まで冷却して、30分間撹拌し、次に濾過して、冷ヘキサン(100mL)で洗浄し、乾燥した。収量1.32Kg。
【0187】
実施例2
化合物5の合成
【化8】

【0188】
削り屑状マグネシウム(115g)を、無水テトラヒドロフラン(1L)を含有する10Lの4つ口丸底フラスコに添加した。混合物を55℃まで加熱した。ヨウ素チップ(約5)を1ロットで、続いて臭化エチル(5mL)を添加した。化合物3(1.1kg)をTHF(2L)に溶解した。200mLのこの溶液を、Mg−THF懸濁液中に1度に添加した。反応は30分後に始まり、還流が始まった。化合物3の残りの溶液は、1.5時間にわたって還流温度を維持しながら滴下した。反応混合物は、2時間さらに還流し、室温まで冷却した。THF(1.5L)中(2−クロロエトキシフェニル)フェニルブタノン(4、870g)を、30〜35℃の間の温度を維持しながら1時間にわたって滴下した。反応混合物を4時間さらに還流し、室温まで冷却した。反応混合物を氷冷の50%塩酸(3L)に注いだ。有機層を分離し、水層をTHF(3x500mL)で抽出した。有機層を合わせ、硫酸ナトリウム上で乾燥し、濾過して濃縮し、オイルとして5を得た。これはさらに精製することなく、次の段階に使用した。収量1.57kg。
【0189】
実施例3
化合物6の合成
【化9】

【0190】
化合物(5、1.57kg)をメタノール(6L)に溶解し、濃塩酸(1.57kg)を添加した。溶液を5時間還流させた。メタノールを真空中で除去し、ジクロロメタン(5L)を添加した。有機層を分離した。水層をジクロロメタン(2x500mL)で抽出した。有機層を合わせ、水(2L)、5%NaHCO3水溶液(2L)、水(2L)で洗浄して、硫酸ナトリウムで乾燥した。木炭を添加して、濾過した。溶剤を減圧下で除去し、オイル(1.38kg)を得た。オイルを激しく撹拌しながらヘキサン(5L)で摩砕し、固形生成物として6を得、これを濾過して乾燥した。収量1.07kg。
【0191】
実施例4
化合物Iの合成
【化10】

【0192】
イソプロパノール(500mL)中の化合物6(50g)の溶液に、モノメチルアミン(300mL)を添加し、70〜75℃の温度を維持しながら24時間加熱した。反応の完了は、TLC(トルエン:トリエチルアミン、7:3)によってモニターした。溶剤を真空中で除去した。水(500mL)を残渣に添加し、ジイソプロピルエーテル(DIPE、500mL)で抽出した。有機層を分離し、水層をDIPE(200mL)で逆抽出した。有機層を合わせて、水(500mL)、5%重炭酸ナトリウム(500mL)水溶液で洗浄し、硫酸ナトリウム上で乾燥して、濾過した。溶剤を真空中で除去し、粘着性残渣を得た。酢酸エチル(50mL)を添加し、加熱し、残渣を完全に溶解した。溶液を室温まで冷却し、ヘキサン(50mL)を添加して12時間撹拌した。固体を濾過して、冷酢酸エチル−ヘキサン(1:1、10mL)混合物で洗浄した。生成物Iは、高真空下で一晩乾燥した。収量25g。
【0193】
実施例5
エンドキシフェン溶液
0.2%氷酢酸(10mL)中でエンドキシフェン(10.3mg)を可溶化することによって、エンドキシフェン溶液(1mg/mL)を調製した。溶液のpH(約5.75)は、1N水酸化ナトリウム(300μL)で調節した。
【0194】
実施例6
エンドキシフェン溶液
2%氷酢酸(8.6mL)中でエンドキシフェン(100mg)を可溶化することによって、エンドキシフェン溶液(5mg/mL)を調製した。溶液は、5%デキストロース(10.97mL)で希釈した。溶液のpH(約5.56)は、5N水酸化ナトリウム(430μL)で調節した。
【0195】
実施例7
エンドキシフェン複合体
エンドキシフェン、硫酸コレステリルおよび大豆レシチンの懸濁液を、水中で成分を一緒に混合し、例えば、高圧ホモジナイザーを使用して、均質化することによって生成する。結果として生じる懸濁液を、0.2μmフィルターに通して濾過し、次いで、7.5%スクロース溶液と混合し、バイアル中またはバルク中のいずれかで凍結乾燥することができる。結果として生じる複合体の粒径は、標準的な手順を使用して、例えば、Nicomp粒子測定器380を使用して決定する。
【0196】
実施例8
エンドキシフェン複合体
エンドキシフェンおよび大豆レシチンの懸濁液を、水中で成分を一緒に混合し、例えば、高圧ホモジナイザーを使用して、均質化することによって生成する。結果として生じる懸濁液は、0.2μmフィルターに通して濾過し、次いで7.5%スクロース溶液と混合し、バイアル中またはバルク中のいずれかで凍結乾燥することができる。粒径は、標準的な手順を使用して、例えば、Nicomp粒子測定器380を使用して決定する。
【0197】
実施例9
毒性試験
エンドキシフェンは、実施例6に従って製剤化し、雄性Balb/cマウスにおいて毒性を試験した。100mg/kgまたは50mg/kgでの単回試験量を、マウスに静脈内投与した。すべてのマウスは100mg/kg用量レベルで死亡したのに対して、すべての動物は50mg/kg用量レベルで生存し、有意な体重減少はなかった。また、マウスは、エンドキシフェンを含まないビヒクル対照を用いた対照群においても生存した。25mg/kgの用量を3日間連続的に投与して反復投与毒性試験を行い、75mg/kg用量蓄積した。この群の動物はすべて生き残った。合計数あたりの生存マウス数として、結果を下表に報告する。
【表1】

【0198】
実施例10
エンドキシフェンは、様々な腫瘍細胞に対して抗増殖活性を示す
エンドキシフェンを、非小細胞肺癌、乳癌、前立腺癌、メラノーマ癌、卵巣癌、CNS癌、腎癌および大腸癌からの種々の癌細胞株に対する抗増殖活性について試験した。細胞は、エンドキシフェン(10nMから10μM)と共に数日間(3〜6)インキュベートし、増殖の阻害を、SRBまたはMTT染色法で測定した。その結果、エンドキシフェンの存在下において、10から100%の範囲の有意な細胞の増殖阻害を示した。種々の腫瘍細胞内における増殖阻害または細胞死滅のエンドキシフェンの誘発は、ヒトの癌の治療でのエンドキシフェンの有用性を示す。
【0199】
実施例11
エンドキシフェンはエストラジオール依存性の乳房腫瘍成長を阻害する
タモキシフェンは、エストラジオール依存性の乳癌異種移植片増殖に拮抗することが知られている(34)。経口剤形中のエンドキシフェン塩基およびエンドキシフェン−クエン酸塩を、エストラジオール依存性のMCF−7異種移植片増殖の阻害に関して同様に試験することができる。動物実験のために、4から6週齢および体重20から24gの雌性ヌードマウス(Bom:NMRI−nu/nu)を、異種移植片実験ごとに標準プロトコルに従って使用する。そのような手順の例は、以下の通りである。
【0200】
エストラジオールで処置した卵巣摘出の胸腺欠損ヌードマウスにおいて確立した元の腫瘍からの移植可能な腫瘍の継代によってMCF−7異種移植片を発生させる(35)。
【0201】
無作為に繁殖させた雌性胸腺欠損マウスを、両側的に卵巣摘出し、腫瘍材料の埋め込み前に、2週間回復させる。MCF−7腫瘍断片(寸法1x1x1mm3)の皮下(s.c.)移植を、麻酔下で行う。腫瘍の直径は、カリパス様機械計器を使用して、例えば週1回など、定期的に測定し、腫瘍体積(V)を、経験式V=(長さx幅2)/2に従って計算する。各群の体積中間値を、初回の腫瘍体積に対して規格化し、相対的な腫瘍体積が得られる。すべての実験において、担腫瘍マウスは、エストラジオール補給[吉草酸エストラジオール(E2D)、0.5mg/kg、週1回、筋肉内(i.m.)]を受ける。この補給は、ヒトの状態(卵胞期に応じて25〜600pg/mL)に相当する血清E2(25〜984pg/mL)の生理的濃度をもたらす。
【0202】
物質:物質、E2D、タモキシフェンおよびエンドキシフェンを使用する。
【0203】
治療法:MCF−7移植動物はすべて、週に1回E2D(0.5mg/kg)注射を受ける。4週後、ホルモン補給腫瘍が、直径で約0.7〜0.8cm(180〜250mm3)に成長した時に、マウスを、それぞれ5〜10匹のマウスの4つの治療群にランダム化する。5〜10匹のマウスを、E2D単独についての基線対照として屠殺する。
【0204】
治療群は、次の通りである。(i)E2D補給(0.5mg/kg週1回、筋肉内)、(ii)E2D補給(0.5mg/kg週1回、筋肉内)に加えてタモキシフェン、1日当たり(0.5mg〜2mg)/マウス、強制経口により週5回、(iii)E2D補給(0.5mg/kg週1回、筋肉内)に加えてエンドキシフェン、1日当たり(0.5mg〜2mg)/マウス、強制経口により週5回、(iv)E2D補給の中止。
【0205】
この乳癌腫瘍モデルにおける腫瘍増殖の阻害は、ヒトの乳癌治療における治療効果を示す(34)。
【0206】
実施例12
エンドキシフェンはエストロゲンの子宮肥大作用を最小化させる
タモキシフェンは、動物およびインビトロモデルにおいて強力な抗エストロゲン作用を有する非ステロイド薬であることが知られている。この薬理学的特性は、乳房組織内のエストロゲン受容体をめぐってエストロゲンと競合し、子宮、腟および卵巣へのエストロゲンの刺激作用を阻害する薬物の能力に関連する(36)。
【0207】
エンドキシフェン(0.1mg〜2mg)を、エストラジオールの子宮肥大作用の減少を判断するために、28日間にわたり1日1回経口投与する。およそ50日齢および体重19〜20gの雌性BALB/cマウスを入取し(例えば、Charles−River,Inc.から)、温度(23±1℃)および光(12時間の光/1日)でケージごとに4匹から5匹を収容する。萎縮変化をマウスにおいて観察する。ビヒクル対照、タモキシフェンおよびエンドキシフェンなどの3つの群がある。動物(5〜10匹のマウス)を、各群に無作為に割り当てる。タモキシフェンまたはエンドキシフェンの強制経口による用量(例えば、0.1mg〜2mg)での、無傷のマウスの毎日の処置は、子宮および腟体重の進行性阻害を導くことが予期される。
【0208】
そのような結果は、エンドキシフェンが、タモキシフェンよりもエストロゲンの子宮肥大作用をより良好に最小化させること、およびエンドキシフェンが、有効な抗エストロゲンとして使用されることを示すであろう。また、エストロゲンによって刺激される子宮体重増加のエンドキシフェン遮断を、未成熟ラットにおいて実証することができる。上記の作用を示すエンドキシフェン調製物は、乳癌の治療、子宮内膜症、平滑筋腫および良性乳房疾患などの他のエストロゲン感受性状態の治療、ならびに男性および女性における他のエストロゲン応答性状態の治療における用途がある。
【0209】
実施例13
増殖性乳癌細胞におけるKi−67抗原発現の、エンドキシフェンによる減少
Ki−67は、核非ヒストンタンパク質である。この抗原は、静止細胞内に存在せず、増殖性細胞内に発現し、バイオマーカーとして使用される(37,38)。経口または注射可能な形態において、エンドキシフェン塩基またはエンドキシフェン−クエン酸塩を、異種移植片乳癌腫瘍モデル(例えば、上記のような)に、ならびに乳癌患者に与える。Ki−67の免疫化学的定量は、患者からのならびに実施例11に記述した担腫瘍マウスからの乳癌組織に由来する腫瘍細胞で行う。MIB−1、またはDAKO,Carpenteria,CAなどの商業的供給源から入手可能な同様の抗体を、抗原の免疫化学的局在化のために使用する。動物および/または乳癌患者におけるKi−67抗原発現の減少は、乳癌の治療におけるエンドキシフェンの適用性を実証する。
【0210】
実施例14
エンドキシフェンは乳癌のIGF−1レベルを低下させる
タモキシフェンが、ヒトについて血中インスリン様成長因子I(IGF−1)のレベルを低下させることが知られている。IGF−1は、代替バイオマーカーとして使用されており、乳癌患者の治療におけるタモキシフェンの有効性を予測する(39)。本発明のエンドキシフェン調製物の作用を試験するために、エンドキシフェン塩基またはエンドキシフェン−クエン酸塩を、乳癌腫瘍を有する実験動物に経口で投与するか、または注入する。対照におけるIGF−1レベルの濃度および異種移植した乳房腫瘍を、既存のアッセイ(例えば、Diagnostics Systems Laboratories,London,UKまたはDAKO,Carpenteria,CAからのELISAキット)でモニターする。エンドキシフェンは、1週間に5日、1日当たり0.5mg〜2mgを強制経口投与する。IGF−1レベルの低下および腫瘍増殖減少は、乳癌に対する代替マーカーとしてのIGF−1の有用性を示唆する。
【0211】
実施例15
エンドキシフェンはビカルタミド誘発の女性化乳房および乳房痛の発生を予防する
ビカルタミド(CasodexR)は、男性における前立腺癌を治療するために使用される。IGF−1が、前立腺癌の促進および進行に関与し得るという根拠が増加している。また、タモキシフェンなどの抗エストロゲン薬が、IGF−1レベルを低下させ、前立腺癌患者におけるbiculatamide誘発の女性化乳房を予防することも知られている(40)。エンドキシフェンは、タモキシフェン抗エストロゲンの活性代謝物であるため、biculatamideとともに、移植のためのエンドキシフェン含有シラスティック持続放出カプセルまたは経口量のエンドキシフェン(1mg〜10mg/日)は、biclutamide誘発の女性化乳房および乳房痛の発生を予防することが期待される。
【0212】
実施例16
インビトロでのエンドキシフェンによるPKCの阻害
エンドキシフェンPKC阻害活性を試験するためにPKCキナーゼ活性アッセイキット(Assay Designs,Ann Arbor,MI)を用いた。0.025、0.05、0.1、または、0.2mMエンドキシフェンをPKC10ng/ウェルを含有する反応混合物に使用した。同一濃度のタモキシフェンを陽性対照として使用した。エンドキシフェンは濃度に応じてPKC活性を阻害した。PKC阻害百分率は、エンドキシフェン濃度0.025〜0.2mMの間で、それぞれ、12から80の間の範囲であった。それに比べて、タモキシフェンは、試験したところ、0.1および0.2mMで、それぞれ、35および25%のPKC阻害であり、タモキシフェン(0.025および0.05mM)のより低い濃度ではPKC阻害は無視でき、タモキシフェンはそれほど強力でないPKC阻害薬であることが分かった。図5は、0.2mMでエンドキシフェンおよびタモキシフェン誘発されたPKC阻害を示す。この検討は、エンドキシフェンがタモキシフェンより少なくとも4倍強力なPKC阻害薬であることを実証し、躁病の障害における役割を示唆する。
【0213】
実施例17
エンドキシフェンの安全性を2種のげっ歯類で評価した。エンドキシフェンの亜慢性毒性の検討をマウスおよびラットで行った。その結果、28日間毎日のマウスへの最大8mg/kgまたはラットへの最大4mg/kgのエンドキシフェンの経口投与によって、死亡を起こさなかった。全体の病理学検査では、処置群と関係する異常は現れず、動物は毒性の臨床症状がなかった。
【0214】
実施例18
ラットにおいて行った比較薬物動態試験は、その経口投与されたエンドキシフェン(10mg/kg)はタモキシフェンの同一用量(10mg/kg)投与後のエンドキシフェン濃度と比較して、10倍高いエンドキシフェン血漿中濃度を示した。
【0215】
下記のリストおよびその他本明細書に記載したものを含む、本明細書に記載した刊行物、特許出願、および特許を含むすべての参考文献は、各参考文献が、それぞれ参照によって個別かつ明確に組み込まれることが示され、本明細書にその全体が記述されるのと同様に、参照することにより組み込まれる。
【0216】
参考文献
1. Furr,B.J.,and V.C.Jordan.1984.The pharmacology and clinical uses of tamoxifen.Pharmacol Ther 25:127−205.
2. Osborne,C.K.1998.Tamoxifen in the treatment of breast cancer.N Engl J Med 339:1609−1618.
3. Fisher,B.,J.P.Costantino,D.L.Wickerham,C.K.Redmond,M.Kavanah,W.M.Cronin,V.Vogel,A.Robidoux,N.Dimitrov,J.Atkins,M.Daly,S.Wieand,E.Tan−Chiu,L.Ford,and N.Wolmark.1998.Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P−1 Study.J Natl Cancer Inst 90:1371−1388.
4. Stearns,V.,L.Ullmer,J.F.Lopez,Y.Smith,C.Isaacs,and D.Hayes.2002.Hot flushes.Lancet 360:1851−1861.
5. Stearns,V.,M.D.Johnson,J.M.Rae,A.Morocho,A.Novielli,P.Bhargava,D.F.Hayes,Z.Desta,and D.A.Flockhart.2003.Active tamoxifen metabolite plasma concentrations after coadministration of tamoxifen and the selective serotonin reuptake inhibitor paroxetine.J Natl Cancer Inst 95:1758−1764.
6. Otton,S.V.,S.E.Ball,S.W.Cheung,T.Inaba,R.L.Rudolph,and E.M.Sellers.1996.Venlafaxine oxidation in vitro is catalysed by CYP2D6.Br J Clin Pharmacol 41:149−156.
7. Bijl,M.J.,L.E.Visser,A.Hofman,A.G.Vulto,T.van Gelder,B.H.Stricker,and R.H.van Schaik.2008.Influence of the CYP2D6*4 polymorphism on dose,switching and discontinuation of antidepressants.Br J Clin Pharmacol 65:558−564.
8. Manji,H.K.,and R.H.Lenox.2000.The nature of bipolar disorder.J Clin Psychiatry 61 Supp 13:42−57.
9. Einat,H.,P.Yuan,S.T.Szabo,S.Dogra,and H.K.Manji.2007.Protein kinase C inhibition by tamoxifen antagonizes manic−like behavior in rats: implications for the development of novel therapeutics for bipolar disorder.Neuropsychobiology 55:123−131.
10. Yildiz,A.,S.Guleryuz,D.P.Ankerst,D.Ongur,and P.F.Renshaw.2008.Protein kinase C inhibition in the treatment of mania: a double−blind,placebo−controlled trial of tamoxifen.Arch Gen Psychiatry 65:255−263.
11. Zarate,C.A.,Jr.,J.B.Singh,P.J.Carlson,J.Quiroz,L.Jolkovsky,D.A.Luckenbaugh,and H.K.Manji.2007.Efficacy of a protein kinase C inhibitor (tamoxifen) in the treatment of acute mania: a pilot study.Bipolar Disord 9:561−570.
12. Kulkarni,J.,C.Gurvich,H.Gilbert,F.Mehmedbegovic,L.Mu,N.Marston,E.Gavrilidis,and A.de Castella.2008.Hormone modulation: a novel therapeutic approach for women with severe mental illness.Aust N Z J Psychiatry 42:83−88.
13. Dhandapani,K.M.,and D.W.Brann.2002.Protective effects of estrogen and selective estrogen receptor modulators in the brain.Biol Reprod 67:1379−1385.
14. O’Neill,K.,S.Chen,and R.D.Brinton.2004.Impact of the selective estrogen receptor modulator,raloxifene,on neuronal survival and outgrowth following toxic insults associated with aging and Alzheimer’s disease.Exp Neurol 185:63−80.
15. Lim,Y.C.,Z.Desta,D.A.Flockhart,and T.C.Skaar.2005.Endoxifen (4−hydroxy−N−desmethyl−tamoxifen) has anti−estrogenic effects in breast cancer cells with potency similar to 4−hydroxy−tamoxifen.Cancer Chemother Pharmacol 55:471−478.
16. Lim,Y.C.,L.Li,Z.Desta,Q.Zhao,J.M.Rae,D.A.Flockhart,and T.C.Skaar.2006.Endoxifen,a secondary metabolite of tamoxifen,and 4−OH−tamoxifen induce similar changes in global gene expression patterns in MCF−7 breast cancer cells.J Pharmacol Exp Ther 318:503−512.
17. DiazGranados,N.,and C.A.Zarate,Jr.2008.A review of the preclinical and clinical evidence for protein kinase C as a target for drug development for bipolar disorder.Curr Psychiatry Rep 10:510−519.
18. Kulkarni,J.,K.A.Garland,A.Scaffidi,B.Headey,R.Anderson,A.de Castella,P.Fitzgerald,and S.R.Davis.2006.A pilot study of hormone modulation as a new treatment for mania in women with bipolar affective disorder.Psychoneuroendocrinology 31:543−547.
19. Lindamer,L.A.,J.B.Lohr,M.J.Harris,and D.V.Jeste.1997.Gender,estrogen,and schizophrenia.Psychopharmacol Bull 33:221−228.
20. Salem,J.E.,and A.M.Kring.1998.The role of gender differences in the reduction of etiologic heterogeneity in schizophrenia.Clin Psychol Rev 18:795−819.
21. Hendrick,V.,L.L.Altshuler,and V.K.Burt.1996.Course of psychiatric disorders across the menstrual cycle.Harv Rev Psychiatry 4:200−207.
22. Chang,S.S.,and D.C.Renshaw.1986.Psychosis and pregnancy.Compr Ther 12:36−41.
23. Steinman,L.2001.Multiple sclerosis: a two−stage disease.Nat Immunol 2:762−764.
24. Whitacre,C.C.2001.Sex differences in autoimmune disease.Nat Immunol 2:777−780.
25. El−Etr,M.,S.Vukusic,L.Gignoux,F.Durand−Dubief,I.Achiti,E.E.Baulieu,and C.Confavreux.2005.Steroid hormones in multiple sclerosis.J Neurol Sci 233:49−54.
26. Riggs,B.L.,and L.C.Hartmann.2003.Selective estrogen−receptor modulators −− mechanisms of action and application to clinical practice.N Engl J Med 348:618−629.
27. Shang,Y.,and M.Brown.2002.Molecular determinants for the tissue specificity of SERMs.Science 295:2465−2468.
28. Bebo,B.F.,Jr.,B.Dehghani,S.Foster,A.Kurniawan,F.J.Lopez,and L.S.Sherman.2009.Treatment with selective estrogen receptor modulators regulates myelin specific T−cells and suppresses experimental autoimmune encephalomyelitis.Glia 57:777−790.
29. Yaffe,K.,K.Krueger,S.R.Cummings,T.Blackwell,V.W.Henderson,S.Sarkar,K.Ensrud,and D.Grady.2005.Effect of raloxifene on prevention of dementia and cognitive impairment in older women: the Multiple Outcomes of Raloxifene Evaluation (MORE) randomized trial.Am J Psychiatry 162:683−690.
30. Hornykiewicz,O.1998.Biochemical aspects of Parkinson’s disease.Neurology 51:S2−9.
31. Oh,J.D.,A.I.Geller,G.Zhang,and T.N.Chase.2003.Gene transfer of constitutively active protein kinase C into striatal neurons accelerates onset of levodopa−induced motor response alterations in parkinsonian rats.Brain Res 971:18−30.
32. Smith,C.P.,J.D.Oh,F.Bibbiani,M.A.Collins,I.Avila,and T.N.Chase.2007.Tamoxifen effect on L−DOPA induced response complications in parkinsonian rats and primates.Neuropharmacology 52:515−526.
33. O’Neill,K.,S.Chen,and R.Diaz Brinton.2004.Impact of the selective estrogen receptor modulator,tamoxifen,on neuronal outgrowth and survival following toxic insults associated with aging and Alzheimer’s disease.Exp Neurol 188:268−278.
34. Johnston,S.R.,I.M.Boeddinghaus,S.Riddler,B.P.Haynes,I.R.Hardcastle,M.Rowlands,R.Grimshaw,M.Jarman,and M.Dowsett.1999.Idoxifene antagonizes estradiol−dependent MCF−7 breast cancer xenograft growth through sustained induction of apoptosis.Cancer Res 59:3646−3651.
35. Iino,Y.,D.M.Wolf,S.M.Langan−Fahey,D.A.Johnson,M.Ricchio,M.E.Thompson,and V.C.Jordan.1991.Reversible control of oestradiol−stimulated growth of MCF−7 tumours by tamoxifen in the athymic mouse.Br J Cancer 64:1019−1024.
36. Suh,N.,A.L.Glasebrook,A.D.Palkowitz,H.U.Bryant,L.L.Burris,J.J.Starling,H.L.Pearce,C.Williams,C.Peer,Y.Wang,and M.B.Sporn.2001.Arzoxifene,a new selective estrogen receptor modulator for chemoprevention of experimental breast cancer.Cancer Res 61:8412−8415.
37. Assersohn,L.,J.Salter,T.J.Powles,R.A’Hern,A.Makris,R.K.Gregory,J.Chang,and M.Dowsett.2003.Studies of the potential utility of Ki67 as a predictive molecular marker of clinical response in primary breast cancer.Breast Cancer Res Treat 82:113−123.
38. Kenny,F.S.,P.C.Willsher,J.M.Gee,R.Nicholson,S.E.Pinder,I.O.Ellis,and J.F.Robertson.2001.Change in expression of ER,bcl−2 and MIB1 on primary tamoxifen and relation to response in ER positive breast cancer.Breast Cancer Res Treat 65:135−144.
39. Nahta,R.,G.N.Hortobagyi,and F.J.Esteva.2003.Growth factor receptors in breast cancer: potential for therapeutic intervention.Oncologist 8:5−17.
40. Saltzstein,D.,P.Sieber,T.Morris,and J.Gallo.2005.Prevention and management of bicalutamide−induced gynecomastia and breast pain: randomized endocrinologic and clinical studies with tamoxifen and anastrozole.Prostate Cancer Prostatic Dis 8:75−83.
【技術分野】
【0001】
本出願は、2006年11月21日に出願された米国特許仮出願第60/860,420号および2006年11月22日に出願された同第60/860,788号の優先権を主張する、2007年11月21日に出願された国際出願PCT/US07/85443の§371国内段階出願である、2009年5月15日に出願された米国特許出願第12/515,261号の一部継続出願である、2009年5月21日に出願された米国特許出願第12/470,219号の優先権を主張する。これらのそれぞれは参照により本明細書に組み込まれる。
【背景技術】
【0002】
本発明は、哺乳動物疾患の治療におけるエンドキシフェンの使用に関する。本発明はまた、エンドキシフェンのリポソームと、複合体、小胞、乳濁液、ミセルおよび混合ミセルなどの他の製剤、調製の方法、ならびに例えば、ヒトおよび動物の乳房疾患の治療における使用に関する。本発明は特に、エンドキシフェン脂質複合体を含む組成物、調製の方法、および乳房疾患、特に良性および悪性乳房疾患の、疾患の後退を高めて、乳癌を発症する患者の危険性を減少させる治療のためのこれらの使用に関する。本発明はさらに、精神および神経変性疾患の治療におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。詳細には、さらに本発明は、双極性疾患、統合失調症、多発性硬化症(MS)、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症(ALS)およびてんかんの治療におけるエンドキシフェンを含む組成物の使用に関する。またさらに本発明は、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染などの感染症の治療におけるエンドキシフェンおよびエンドキシフェンを含む組成物;ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染;骨粗鬆症および心血管疾患に関する。さらに本発明は、不妊治療および療法におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。またさらに本発明は、エンドキシフェンを調製する方法、およびヒトおよび動物の疾患の治療における、本発明の方法によって調製されたエンドキシフェンの使用に関する。
【0003】
毎年、米国において210,000人を超える女性が乳癌になる。米国において女性8人中の1人は生涯の間に乳癌になるであろう。乳癌の約70パーセントは、エストロゲンによって刺激され、多くは、乳房組織におけるエストロゲンの作用を阻止するように設計された薬物であるタモキシフェンで治療される。
【0004】
タモキシフェンは、乳癌の長期かつ低用量療法用に処方される抗エストロゲン剤である。これは、すべての段階のホルモン受容体陽性の乳癌の内分泌治療に対して30年を超えて広く使用されている(1、2)。また、タモキシフェンは乳癌の予防にも認可されている(3)。女性において、タモキシフェンに関連する有害事象のうちの1つはのぼせである。のぼせの危険性は、タモキシフェンを服用しない女性と比べて、服用する女性の間で2〜3倍高い(4、5)。選択的セロトニン再取り込み阻害薬(Selective serotonin−reuptake inhibitor:SSRI)抗鬱薬は、のぼせを治療するために処方される。しかし、パロキセチンおよびフルオキセチンなどのある種のSSRIは、タモキシフェンを含む多くの薬物の代謝に重要な酵素であるシトクロムP450(CYP)2D6を阻害することが知られている(5、6)。さらに、その発現および機能に影響を与えるCYP2D6遺伝的多型によって、タモキシフェン代謝において個人間および人種間のばらつきが大きい(7)。それにより、CYP2D6を阻害する薬物の共処方が、タモキシフェン有効性を損なう可能性があるという幅広い認識によって、タモキシフェン代謝および効果の理解が臨床診療を変えた。
【0005】
双極性障害は、障害を受けた者の間での自殺の多大な危険性と関連する慢性の精神病である(8)。リチウムおよびバルプロエートは、双極性障害において気分安定薬として広く用いられているが、しかし、患者の一部はこれらの薬剤に反応しない、または、部分的にしか反応しない(8)。したがって、より迅速、より強力で、より特異的な作用様式およびより少ない副作用の新規の治療剤の開発が必要とされる。
【0006】
タモキシフェンは選択的エストロゲン受容体修飾剤(SERM)である。最近の研究は、精神疾患(例えば双極性障害、統合失調症)におけるエストロゲン/SERMの治療の役割および神経変性の症状(例えば多発性硬化症、パーキンソン病、アルツハイマー病および卒中)における神経保護作用を強く支持する。躁病のラットモデル(9)、および双極性患者での2つの治験(10、11)において。これはプロテインキナーゼC(PKC)の作用の減衰に起因すると示唆される(YesiloglujへのWO2008/048194)。タモキシフェンの使用は、分裂情動性障害(12)の患者の躁病の症候において改善を示し、またタモキシフェンのいくつかの神経保護作用が立証されている(13、14)。さらに、タモキシフェンは、例えば、シナプスの密度を増加させること、および神経突起成長を刺激することによる神経組織栄養の作用を有し得るという証拠がある(13)。しかし、上の議論で述べたように、タモキシフェンを用いる治療の有効性は、他の薬物によってまたは薬物の代謝を中断させる突然変異によって損われることがある。
【0007】
有害な全身性副作用が低減された、治療にSERMを用いる方法に対して、強い必要性が存在する。さらに、乳癌、双極性障害、感染症(例えば、細菌、菌類、リーシュマニア属など)などの疾患を治療、予防し、他の薬物との相互作用が低減され、主要な薬物を代謝する酵素をコードする遺伝子の変異を含む患者遺伝子への感度が低減された、方法および組成物に対する必要性がある
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Furr,B.J.,and V.C.Jordan.1984.The pharmacology and clinical uses of tamoxifen.Pharmacol Ther 25:127−205.
【非特許文献2】Osborne,C.K.1998.Tamoxifen in the treatment of breast cancer.N Engl J Med 339:1609−1618.
【非特許文献3】Fisher,B.,J.P.Costantino,D.L.Wickerham,C.K.Redmond,M.Kavanah,W.M.Cronin,V.Vogel,A.Robidoux,N.Dimitrov,J.Atkins,M.Daly,S.Wieand,E.Tan−Chiu,L.Ford,and N.Wolmark.1998.Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P−1 Study.J Natl Cancer Inst 90:1371−1388.
【非特許文献4】Stearns,V.,L.Ullmer,J.F.Lopez,Y.Smith,C.Isaacs,and D.Hayes.2002.Hot flushes.Lancet 360:1851−1861.
【非特許文献5】Stearns,V.,M.D.Johnson,J.M.Rae,A.Morocho,A.Novielli,P.Bhargava,D.F.Hayes,Z.Desta,and D.A.Flockhart.2003.Active tamoxifen metabolite plasma concentrations after coadministration of tamoxifen and the selective serotonin reuptake inhibitor paroxetine.J Natl Cancer Inst 95:1758−1764.
【非特許文献6】Otton,S.V.,S.E.Ball,S.W.Cheung,T.Inaba,R.L.Rudolph,and E.M.Sellers.1996.Venlafaxine oxidation in vitro is catalysed by CYP2D6.Br J Clin Pharmacol 41:149−156.
【非特許文献7】Bijl,M.J.,L.E.Visser,A.Hofman,A.G.Vulto,T.van Gelder,B.H.Stricker,and R.H.van Schaik.2008.Influence of the CYP2D6*4 polymorphism on dose,switching and discontinuation of antidepressants.Br J Clin Pharmacol 65:558−564.
【非特許文献8】Manji,H.K.,and R.H.Lenox.2000.The nature of bipolar disorder.J Clin Psychiatry 61 Supp 13:42−57.
【非特許文献9】Einat,H.,P.Yuan,S.T.Szabo,S.Dogra,and H.K.Manji.2007.Protein kinase C inhibition by tamoxifen antagonizes manic−like behavior in rats: implications for the development of novel therapeutics for bipolar disorder.Neuropsychobiology 55:123−131.
【非特許文献10】Yildiz,A.,S.Guleryuz,D.P.Ankerst,D.Ongur,and P.F.Renshaw.2008.Protein kinase C inhibition in the treatment of mania: a double−blind,placebo−controlled trial of tamoxifen.Arch Gen Psychiatry 65:255−263.
【非特許文献11】Zarate,C.A.,Jr.,J.B.Singh,P.J.Carlson,J.Quiroz,L.Jolkovsky,D.A.Luckenbaugh,and H.K.Manji.2007.Efficacy of a protein kinase C inhibitor (tamoxifen) in the treatment of acute mania: a pilot study.Bipolar Disord 9:561−570.
【非特許文献12】Kulkarni,J.,C.Gurvich,H.Gilbert,F.Mehmedbegovic,L.Mu,N.Marston,E.Gavrilidis,and A.de Castella.2008.Hormone modulation: a novel therapeutic approach for women with severe mental illness.Aust N Z J Psychiatry 42:83−88.
【非特許文献13】Dhandapani,K.M.,and D.W.Brann.2002.Protective effects of estrogen and selective estrogen receptor modulators in the brain.Biol Reprod 67:1379−1385.
【非特許文献14】O’Neill,K.,S.Chen,and R.D.Brinton.2004.Impact of the selective estrogen receptor modulator,raloxifene,on neuronal survival and outgrowth following toxic insults associated with aging and Alzheimer’s disease.Exp Neurol 185:63−80.
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、抗癌剤および精神および神経変性の症状の治療用の薬剤などの活性薬剤の合成および使用のための方法および組成物を提供する。本発明は、詳しくは癌の治療または予防に関係する用途において、精神および神経変性疾患の治療および予防において、不妊療法において、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染、ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染などの感染の治療において、また骨粗鬆症および心血管疾患において、エンドキシフェンの製剤および使用と関係する方法および組成物に関する。さらに本発明は、そのような症状を治療するための、薬剤の製造でのこれらの組成物の使用を提供する。
【0010】
本発明の組成物は、精神および神経変性疾患を治療するために使用することができる。例えば、本発明の組成物は双極性障害または躁病の障害と診断された患者に投与することができる。本発明の組成物によって治療可能な精神および神経変性疾患の例は、双極性障害、アルツハイマー病、パーキンソン病、多発性硬化症疾患、てんかんなどを含むが、これらに限定されない。本発明の組成物はさらに、不妊療法において、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染などの感染症;ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染の治療において、ならびに骨粗鬆症および心血管疾患において使用することができる。
【0011】
エンドキシフェン(4−ヒドロキシN−デスメチルタモキシフェン)は、乳癌の治療のための市販薬物タモキシフェンの活性代謝物である。タモキシフェンは、シトクロムP450(CYP)酵素CYP3A4およびCYP2D6によって広範囲に代謝され、4−ヒドロキシタモキシフェンおよび4−ヒドロキシ−N−デスメチルタモキシフェン(エンドキシフェン)(図3)を含む活性代謝物になる。シトクロムP450(CYP)酵素による代謝的活性化を必要とし、その作用が遺伝的多型および薬物間相互作用による阻害のために変動する母化合物のタモキシフェンの使用と比較して、例えば、癌ならびに精神および神経変性疾患のための治療剤としてエンドキシフェンを使用することは、著しい利点を有する。
【課題を解決するための手段】
【0012】
いくつかの実施形態において、本発明は、治療上活性な量のエンドキシフェンを含む組成物を調製し、組成物を投与することを含む、疾患を治療する方法を提供する。いくつかの実施形態において、エンドキシフェンは遊離塩基または塩の形態である。いくつかの好ましい実施形態において、エンドキシフェンは、クエン酸塩、酢酸塩、ギ酸塩、スルホン酸塩、シュウ酸塩、コハク酸塩、酒石酸塩(tartarate)、トリフルオロ酢酸塩、メタンスルホン酸塩、リン酸塩、硫酸塩、塩化物、臭化物、ヨウ化物および乳酸塩からなる塩の群から選択される塩の形態をしている。好ましい実施形態において、塩はクエン酸塩の形態をしている。いくつかのいくつかの実施形態において、エンドキシフェンは主に、E異性体、Z異性体ならびにEおよびZ異性体の混合物からなる群から選択される形態をしている。
【0013】
いくつかの実施形態において、本方法は抗癌性または精神医学の治療薬および少なくとも1種の脂質を含む複合体を調製することを含む。いくつかの実施形態において、薬物はエンドキシフェンである。いくつかの実施形態において、本発明の化合物は脂質と複合体を形成しない。いくつかの実施形態において、化合物は、遊離塩基の形態をしているか、または塩の形態をしている。
【0014】
いくつかの実施形態において、本発明は、構造:
【化1】

【0015】
を有する式5の化合物を酸と反応させること、および式5の化合物の酸との反応の後、化合物をメチルアミンと反応させることを含む、エンドキシフェンを調製する方法を提供する。
【0016】
いくつかの実施形態において、式5の化合物は式4
【化2】

【0017】
の化合物を式3
【化3】

【0018】
の化合物と反応させることにより調製される。
【0019】
いくつかの実施形態において、式3の化合物は式1
【化4】

【0020】
の化合物を式2
【化5】

【0021】
の化合物と反応させることにより調製される。
【0022】
いくつかの実施形態において、本発明は、エンドキシフェンを結晶化するステップ、および/またはクロマトグラフィーで前記エンドキシフェンを処理し、E異性体もしくはZ異性体またはEおよびZ異性体の混合物を主に含む、エンドキシフェンの精製調製物を製造するステップを含む、上記のエンドキシフェンを精製する方法を提供する。
【0023】
上記のように、いくつかの実施形態において、本発明は、少なくとも1種の脂質を含むエンドキシフェン調製物を提供する。好ましい実施形態において、この少なくとも1種の脂質は、卵ホスファチジルコリン(EPC)、卵ホスファチジルグリセロール(EPG)、大豆ホスファチジルコリン(SPC)、水素化大豆ホスファチジルコリン(HSPC)、ジミリストイルホスファチジルコリン(DMPC)、ジミリストイルホスファチジルグリセロール(DMPG)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルグリセロール(disteroylphosphatidylglycerol)(DSPG)、ジパルミトイルホスファチジルグリセロール(DMPG)、コレステロール(Chol)、硫酸コレステリルおよびその塩(CS)、ヘミコハク酸コレステリルおよびその塩(Chems)、リン酸コレステリルおよびその塩(CP)、コレステリルホスホコリンおよび他のヒドロキシコレステロールまたはアミノコレステロール誘導体、コハク酸コレステリル、オレイン酸コレステリル、コレステロールのポリエチレングリコール誘導体(コレステロール−PEG)、コプロスタノール、コレスタノール、コレスタン、コール酸、コルチゾール、コルチコステロン、ヒドロコルチゾン、およびカルシフェロール、Eググルステロン,Zググルステロン、EおよびZググルステロンの混合物、モノグリセリド、ジグリセリド、トリグリセリド、ガラクトリピド、マンノトリピド、ガラクトレシチンからなる群から選択される炭水化物系脂質、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラソステロール、カンペステロール、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール(phosphatdylinositol)、ホスファチジン酸、ならびにジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロールおよびジオレオイルホスファチジルグリセロールのペグ化誘導体からなる群から選択される。
【0024】
いくつかの実施形態において、本発明による組成物は、エンドキシフェン、コレステロールおよび/またはコレステロール誘導体、および1種または複数のリン脂質を含む。いくつかの好ましい実施形態において、本組成物はコレステロール誘導体を含み、コレステロール誘導体は硫酸コレステリルである。いくつかの実施形態において、リン脂質の少なくとも1種は水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンである。
【0025】
本発明の方法および組成物のいくつかの実施形態においては、本組成物は、粉末、溶液、乳濁液、ミセル、リポソーム、脂質粒子、ゲル、およびペーストの形態からなる群から選択される形態を含む。いくつかの好ましい実施形態において、複合体を含む組成物の調製は、凍結乾燥形態の前記複合体の調製を含む。いくつかの実施形態において、凍結乾燥形態の複合体の調製は、凍結保護物質の使用を含み、前記凍結保護物質は、トレハロース、マルトース、ラクトース、スクロース、グルコース、およびデキストランからなる群から選択される1種または複数の糖を含む。いくつかの実施形態において、本組成物は、腸溶被覆材料を場合によって含む錠剤または充填カプセル剤を含む。
【0026】
本発明の治療方法のいくつかの実施形態において、疾患は、癌または発癌物質によって引き起こされ、一方、いくつかの実施形態においては、疾患は良性乳房疾患である。
【0027】
いくつかの実施形態において、投与は前記組成物を前記対象へ経口、静脈内、皮下、経皮、非経口、腹腔内、直腸、膣、および/または局所の送達を含む。
【0028】
いくつかの実施形態において、本組成物は、少なくとも1種の飽和または不飽和脂肪酸エステルを含む浸透促進剤を含む。
【0029】
いくつかの実施形態において、エンドキシフェンを含む組成物は、含水アルコールゲル、含水アルコール溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤またはオイル中で製剤化される。
【0030】
いくつかの実施形態において、エンドキシフェンを含む組成物は、浸透促進剤、水性ビヒクル、アルコールビヒクルおよびゲル化剤を含有する含水アルコール組成物中で製剤化される。
【0031】
いくつかの実施形態において、含水アルコール組成物は中和剤を含む。
【0032】
いくつかの実施形態において、含水アルコール組成物は、約0.01重量%から0.20重量%のエンドキシフェン、約0.1重量%から2.0重量%、好ましくは0.5重量%から2.0重量%のミリスチン酸イソプロピル、約50.0重量%から80.0重量%、好ましくは約60.0重量%から75.0重量%のアルコール、約20.0重量%から60.0重量%、好ましくは25.0重量%から50.0重量%の水性ビヒクル、および約1.0重量%から10.0重量%、好ましくは約0.5重量%から5.0重量%のゲル化剤を含む。いくつかの実施形態において、成分の百分比は本組成物重量に対する重量である。
【0033】
いくつかの実施形態において、アルコールはエタノールまたはイソプロパノールであり、無水形態で構成される。
【0034】
いくつかの実施形態において、水性ビヒクルはリン酸緩衝液である。
【0035】
いくつかの実施形態において、ゲル化剤は、ポリアクリル酸、ヒドロキシプロピルセルロースおよびヒドロキシプロピルセルロース以外のセルロース誘導体からなる群から選択される。
【0036】
いくつかの実施形態において、含水アルコール組成物は、中和剤をさらに含み、前記中和剤は、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、アミノメチルプロパノール、アルギニン、トロラミン、およびトロメタミンからなる群から選択され、約1:1から約4:1の中和剤/ゲル化剤の比率で存在する。
【0037】
いくつかの実施形態において、本発明は、上記の組成物のいずれかを準備すること、および組成物を送達し組成物を細胞に曝露することを含む、エンドキシフェンを送達する方法を提供する。
【0038】
いくつかの実施形態において、この細胞はインビボである。
【0039】
本発明のいくつかの実施形態において、宿主は哺乳動物である。
【0040】
本発明はまた、上記の組成物のいずれかを哺乳動物に投与することを含む、哺乳動物におけるホルモン依存性乳癌を阻止する方法も提供する。
【0041】
本発明は、上記組成物のいずれかを、前記哺乳動物(例えば、ヒト)に投与することを含む、哺乳動物の癌を阻止する方法をさらに提供し、前記癌は、哺乳動物の肺癌、大腸癌、乳癌、白血病、腎癌、メラノーマ、中枢神経系の癌、および前立腺癌を含むがこれらに限定されない。
【0042】
本発明は、遊離塩基であるかまたは塩の形態であるエンドキシフェン、および少なくとも1種の脂質を含む治療有効量の複合体を含む組成物をさらに提供する。
【0043】
いくつかの実施形態において、エンドキシフェンを含む組成物は、含水アルコールゲル、含水アルコール溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤またはオイル中で製剤化される。
【0044】
いくつかの実施形態において、エンドキシフェンを含む組成物は、浸透促進剤、水性ビヒクル、アルコール性ビヒクルおよびゲル化剤を含有する含水アルコール組成物中で製剤化される。
【0045】
いくつかの実施形態において、含水アルコール組成物は中和剤を含む。
【0046】
いくつかの実施形態において、含水アルコール組成物は、約0.01重量%から0.20重量%のエンドキシフェン、約0.1重量%から2.0重量%、好ましくは0.5重量%から2.0重量%のミリスチン酸イソプロピル、約50.0重量%から80.0重量%、好ましくは約60.0重量%から75.0重量%のアルコール、約20.0重量%から60.0重量%、好ましくは25.0重量%から50.0重量%の水性ビヒクル、および約1.0重量%から10.0重量%、好ましくは約0.5重量%から5.0重量%のゲル化剤を含む。いくつかの実施形態において、成分の百分比は、組成物の重量に対する重量である。
【0047】
いくつかの実施形態において、本発明は、エンドキシフェンの治療有効量を含む医薬調製物を投与することを含む、対象の症状(例えば、癌または精神医学または神経変性の症状)を治療または予防する方法を提供する。
【0048】
エンドキシフェン組成物の精神医学および神経変性の療法のための使用は、特定の疾患または投与経路に限定されない。いくつかの好ましい実施形態において、本発明は双極性障害を治療する方法および組成物を提供し、一方、他の実施形態において、本発明は、多発性硬化症、統合失調症、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症およびてんかんを治療する方法および組成物を提供する。
【0049】
いくつかの実施形態において、本発明の医薬調製物は第2の治療剤をさらに含む。いくつかの好ましい実施形態において、第2の治療剤は症状の治療のための公知の治療剤である。例えば、いくつかの実施形態において、第2の治療剤は、双極性障害、躁病の障害または鬱病の治療のための公知の治療剤、例えば、リチウム、選択的セロトニン再取り込み阻害薬、セロトニンおよびノルエピネフリン再取り込み阻害薬、ドパミン再取り込み阻害薬、四環系抗鬱薬、再取り込み阻害薬の組み合わせ、受容体遮断薬、三環系抗鬱薬およびモノアミン酸化酵素阻害薬である。いくつかの実施形態において、精神医学または神経変性の症状の治療のための公知の治療剤は、シタロプラム、エスシタロプラム、フルオキセチン、パロキセチン、セルトラリン、デュロキセチン、ベンラファキシン、ブプロピオン、ミルタザピン、トラドゾン、tefazodone、マプロチリン、アミトリプチリン、アモキサピン、デシプラミン、ドキセピン、イミプラミン、ノルトリプチリン、プロトリプチリン、トリミプラミン、フェネルジン、トラニルシプロミン、イソカルボキサジドおよびselegilinからなる群から選択される。
【0050】
第2の治療剤がエンドキシフェンを含む組成物と共投与されるいくつかの実施形態において、第2の治療薬は、ベンゾジアゼピン、ベータ遮断薬および非ベンゾジアゼピン催眠薬などの不安の治療のための公知の治療剤である。いくつかの好ましい実施形態において、不安の治療のための治療薬は、ジアゼパム、ニトラゼパム、アルプラゾラム、ブロマゼパム、クロルジアゼポキシド、クロラゼプ酸、ロラゼパム、オキサゼパム、フルニトラゼパム、フルラゼパム、ロプラゾラム、ロルメタゼパムおよびテマゼパム、ブスピロン、メプロバメート、zalepon、ゾルピデム、ゾピクロン、抱水クロラール、トリクロホス、clomethizoleおよびメプロバメートからなる群から選択される。
【0051】
本発明の特定の実施形態は、発明の概要および下記の発明を実施するための形態に記載されている。本発明は上記の組成物および方法に限定されない。本発明は、具体的実施形態と関連させて記載されるが、請求される本発明は、そのような具体的実施形態に不当に限定されるものではなく、また、本明細書に記載される、または当業者により本開示を考慮して理解される上記の組成物および方法の変型例は、本発明の範囲内に包含されることを理解すべきである。
【図面の簡単な説明】
【0052】
【図1】化合物Iの図示である。
【図2】化合物3、5およびIの合成の実施形態の図示である。
【図3】タモキシフェンのエンドキシフェン(4−ヒドロキシ−N−デスメチルタモキシフェン)への代謝の概略図である。
【図4】PKC経路の略図である。
【図5】エンドキシフェンおよびタモキシフェンによるPKC活性の阻害を比較するグラフである。
【発明を実施するための形態】
【0053】
定義
本明細書で使用される「宿主」、「対象」および「患者」という用語は、研究、分析、試験、診断または治療されるヒトおよび非ヒト動物(例えば、イヌ、ネコ、雌ウシ、ウマ、ヒツジ、家禽、魚、甲殻類など)を指すがこれらに限定されない、任意の動物を指す。本明細書で使用される「宿主」、「対象」および「患者」という用語は、特に明記しない限り、同じ意味で使用される。
【0054】
本明細書で使用される「癌の危険性がある対象」という用語は、例えば、事前の既往歴、遺伝データなどによって、癌を発症する危険性があると特定された対象を指す。
【0055】
本明細書で使用される「抗癌薬」という用語は、癌を治療または予防するために使用される薬剤を指す。そのような薬剤は、小分子、薬物、抗体、医薬品などを含むが、これらに限定されない。
【0056】
本明細書で使用される「鬱病を有する対象」または「鬱病を示す徴候または症候または病状を見せる対象」または「鬱病を示す徴候または症候または病状を見せると疑われている対象」という用語は、公知の鬱病の徴候、症候および病状に基づいた鬱病を有するまたは多分有するものとして識別される対象を指す。
【0057】
本明細書で使用される「鬱病を示す病状を見せる危険性がある対象」および「鬱病の危険性がある対象」という用語は、鬱病の発症の危険性があると識別された対象を指す。
【0058】
本明細書で使用される「双極性障害を有する対象」または「双極性障害を示す徴候または症候または病状を見せる対象」または「双極性障害を示す徴候または症候または病状を見せると疑われる対象」という用語は、公知の鬱病の徴候、症候および病状に基づいた双極性障害を有するまたは多分有するものとして識別される対象を指す。
【0059】
本明細書において「双極性障害を示す病状を見せる危険性がある対象」および「双極性障害の危険性がある対象」という用語は、双極性障害を発症する危険性があると識別された対象を指す。
【0060】
本明細書で使用される「抗鬱薬」という用語は、鬱病を治療または予防するために使用される薬剤を指す。そのような薬剤は、小分子、薬物、抗体、医薬品などを包含するが、これらに限定されない。
【0061】
本明細書で使用される「抗不安薬」は、不安を治療または予防するために使用される薬剤を指す。そのような薬剤は、小分子、薬物、抗体、医薬品などを包含するが、これらに限定されない。
【0062】
本明細書で使用される「不安を有する対象」または「不安を示す徴候または症候または病状を見せる対象」または「不安を示す徴候または症候または病状を見せると疑われる対象」という用語は、公知の不安の徴候、症候および病状に基づいた不安を有するまたは多分有するものとして識別される対象を指す。
【0063】
本明細書で使用される「不安を示す病状を見せる危険性がある対象」および「不安の危険性がある対象」という用語は、不安を発症する危険性があると識別された対象を指す。
【0064】
本明細書で使用される「認知機能」という用語は、一般に、思考する、推論する、集中する、または記憶する能力を指す。したがって、用語「認知機能の低下」は、思考する、推論する、集中する、または記憶する能力の不足の劣化を指す。
【0065】
本明細書で使用される「有効量」という用語は、選択された効果を与える、例えば、有益なまたは所望の結果を達成するのに十分な活性組成物(例えば脂質または他の製剤中の成分として提供される医薬化合物または組成物)の量を指す。例えば、PKC阻害薬の有効量は、例えば、PKC活性の低下に関連するインビボ効果についての観察によって、またはインビトロアッセイの使用によって判断されるような、PKC活性を低下させるのに十分な阻害薬の量である。有効量は1回または複数の投与、適用または用量で投与することができ、特定の製剤または投与経路に限定されるようには意図されない。
【0066】
薬剤、組成物、または化合物に関して使用される「活性な」または「医薬的に活性な」という用語は、本明細書において使用される場合、投与または適用により、有益な、所望の、または期待される結果をもたらす薬剤を指す。投与は、1回または複数の投与、適用、または用量であってよく、特定の製剤または投与経路に限定されることは意図しない。この用語は、活性のいずれの特定レベルにも限定されない。
【0067】
「薬剤」および「化合物」という用語は、本明細書において同義的に使用され、属性の特徴を有する任意の原子、分子、混合物、またはより複雑な組成物を指す。例えば、「活性薬剤」または「活性化合物」は、投与または適用により、有益な、所望の、または期待される結果をもたらす、任意の原子、分子、調合物、混合物などを指す。
【0068】
本明細書で使用される「治療する」という用語は、特定の障害、疾患、損傷または症状に関連する症候を予防、治癒、または軽減/予防するための、投与療法を含む。
【0069】
本明細書で使用される「治療」という用語または文法的均等物は、疾患または症状(例えば癌、双極性障害、パーキンソン病、感染症、骨粗鬆症、不妊障害など)の症候の改善および/もしくは回復、または疾患の発生の危険性の減少を包含する。本発明の選別法で使用される時に、疾患に関連する何らかのパラメーターに改善をもたらす化合物は、それによって、治療用化合物として特定することができる。「治療」という用語は、治療処置および予防または防止対策の両方を指す。例えば、本発明の組成物および方法での治療から利益を享受し得る者は、疾患および/または障害(例えば、癌、精神もしくは神経変性疾患、またはこれらの症状と一致する症候もしくは病状)をすでに有する者、ならびに疾患および/または障害が(例えば、本発明の予防治療を用いて)予防される者を含む。
【0070】
本明細書で使用される「疾患の危険性がある」という用語は、特定の疾患にかかる素因のある対象(例えば、ヒト)を指す。この素因は、遺伝的(例えば、遺伝性障害などの疾患にかかる特定の遺伝的傾向)であり得るか、または他の因子(例えば、年齢、体重、環境条件、環境に存在する有害な化合物への曝露など)に起因し得る。したがって、本発明は、任意の特定の危険性に限定されることを意図するものではなく、本発明は、任意の特定の疾患に限定されることを意図するものでもない。
【0071】
本明細書で使用される「疾患に罹患する」という用語は、特定の疾患にかかる対象(例えば、ヒト)を指す。本発明は、何らかの特定の徴候もしくは症候、または疾患に限定されることを意図するものではない。したがって、本発明は、あらゆる範囲の疾患(例えば、無症状の徴候から完全に症状を呈する疾患)にかかる対象を包含することが意図され、対象は、特定の疾患に関連する、少なくともいくらかの徴候(例えば徴候および症候)を呈する。
【0072】
本明細書で使用される「疾患」および「病的症状」という用語は、通常の機能の性能を妨害もしくは変更する、生きている動物またはその器官もしくは組織のいずれかの通常の状態の何らかの悪化に関連し、環境因子(心的外傷、身体的外傷、栄養障害、工業災害、または気候など)、特定の感染因子(虫、細菌、またはウイルスなど)、生物の固有の欠陥(種々の遺伝子異常など)、またはこれらのおよび他の要因の組み合わせに対する反応であり得る、状態、徴候、および/または症候を説明するために、同義的に使用される。
【0073】
本明細書で使用される「投与」という用語は、薬物、プロドラッグ、もしくは他の活性薬剤、または治療処置(例えば本発明の組成物)を、生理系(例えば対象またはインビボ、インビトロ、もしくはエキソビボの細胞、組織、および器官)に与える行為を指す。人体への投与の例示的な経路は、眼(眼科)、口(経口)、皮膚(経皮)、鼻(経鼻)、肺(吸入)、直腸、膣、口腔粘膜(口腔)、耳、注射(例えば静脈、皮下、腫瘍内、腹腔内など)などを介してよい。投与は、1回または複数の投与、適用または用量でよく、特定の投与経路に限定されることは意図しない。
【0074】
本明細書で使用される「共投与」という用語は、対象への少なくとも2種の薬剤(例えば異なる活性化合物を含有する、2種の別個の脂質組成物)または療法の投与を指す。例えば、いくつかの実施形態において、エンドキシフェンは、第2の治療薬、例えば疾患または症状(例えば鬱病)の治療用の公知の治療薬と共投与されてもよい。いくつかの実施形態において、2種以上の薬剤または療法の共投与は同時的である。他の実施形態において、第1の薬剤/療法は第2の薬剤/療法以前に投与される。当業者は、使用される様々な薬剤または療法の製剤および/または投与経路は変動してもよいことを理解する。共投与のための適切な用量は、当業者によって容易に求めることができる。いくつかの実施形態において、薬剤または療法が共投与される場合、各々の薬剤または療法は、単独投与のために適切である量より低用量で投与される。したがって、共投与は、薬剤または療法の共投与が潜在的に有害な(例えば、有毒な)薬剤の必要な用量を低下させる実施形態において特に望ましい。
【0075】
「公知の治療」化合物または薬剤は、(例えば、動物試行またはヒトへの投与の過去の経験によって)治療に特定の治療効果を有すると示された治療化合物を含む。しかし、公知の治療化合物は、疾患(例えば双極性障害、鬱病または不安)の治療または予防における特定のレベルの有効性を有する化合物に限定されない。公知の双極性障害治療剤の例は、炭酸リチウムおよびクエン酸リチウムの一般的名称の下に入手可能な塩(例えばESKALITH、LITHOBID、LITHANE、LITHONATE、LITHOTABS、CIBALITH−S)を包含するリチウムおよびバルプロエートまたはバルプロ酸(DEPAKOTE)、ラモトリジン(LAMICTAL)、カルバマゼピン(TEGRETOL)およびオキスカルバゼピン(TRILEPTAL)などの抗痙攣薬を含むが、これらに限定されない。本発明の方法においてエンドキシフェンと組み合わせて使用される他の化合物の例はまた、ガバペンチン(NEUROTONIN)およびトピラマート(TOPAMAX)を含む。使用される公知の抗鬱治療剤は、選択的セロトニン再取り込み阻害剤(SSRI、例えばシタロプラム(CELEXA)、エスシタロプラム(LEXAPRO)、フルオキセチン(PROZAC,PROZACWEEKLY)、パロキセチン(PAXIL,PAXILCR)、セルトラリン(ZOLOFT);セロトニンおよびノルエピネフリンの再取り込み阻害薬(SNRI、例えばデュロキセチン(CYMBALTA)およびベンラファキシン(EFFEXOR、EFFEXORXR);ノルエピネフリンおよびドパミンの再取り込み阻害薬(NDRI、例えばブプロピオン(WELLBUTRIN、WELLBUTRIN SR、WELLBUTRINXL);四環系抗鬱薬(例えばミルタザピン(REMERON、REMERONSOLTAB));再取り込み阻害薬および受容体遮断薬の組み合わせ(例えばトラドゾン、tefazodone、マプロチリン);三環系抗鬱薬(TCA、例えばアミトリプチリン、アモキサピン、デシプラミン(NORPRAMIN)、ドキセピン(SINEQUAN)、イミプラミン(TOFRANIL)、ノルトリプチリン(PAMELOR)、プロトリプチリン(VIVACTIL)、トリミプラミン(SURMONTIL));モノアミン酸化酵素阻害薬(MAOI、例えばフェネルジン(NARDIL)、トラニルシプロミン(PARNATE)、イソカルボキサジド(MARPLAN)、セレギリン(EMSAM))を含むが、これらに限定されない。公知の抗不安治療剤の例は、ベンゾジアゼピン(例えばジアゼパム(VALIUM)、ニトラゼパム(MOGADON)、アルプラゾラム(XANAX)、ブロマゼパム(LEXOTAN)、クロルジアゼポキシド(LIBRIUM)、クロラゼプ酸(TRANXENE)、ロラゼパム(ATIVAN)、オキサゼパム、フルニトラゼパム(ROHYPNOL)、フルラゼパム(DALMANE)、ロプラゾラム、ロルメタゼパム、およびテマゼパム);非ベンゾジアゼピン剤(例えばブスピロン(BUSPAR)、ベータ遮断薬およびメプロバメート(EQUAGESIC));および非ベンゾジアゼピン催眠薬(例えばzalepon(SONATA)、ゾルピデム(STILLNOCT)、ゾピクロン(ZIMOVANE)、抱水クロラール、トリクロホスおよびclomethizole、アリピプラゾール(ABILIFY)、フマル酸クエチアピン(SEROQUEL)、オランザピン(ZYPREXA)、ジプラシドン(GEODON)などを含むが、これらに限定されない。
【0076】
本明細書で使用される「有毒」という用語は、毒物の投与前の同一細胞または組織と比較して、対象、細胞または組織に対する何らかの悪影響または有害な影響を指す。
【0077】
本明細書で使用される「薬学的に精製された」という用語は、薬学的使用のための調製物の十分な純度または品質の組成物を指す。
【0078】
本明細書で使用される「精製された」という用語は、除去した成分に対する精製された成分の比が、出発組成物においてよりも大きくなるように、少なくとも1つの他の成分(例えば、出発組成物からの別の成分(例えば、植物もしくは動物組織、環境試料など)、混入物、合成前駆体、または副生物など)を除去するための出発組成物の処理を指す。
【0079】
本明細書において使用される、「医薬組成物」という用語は、組成物を、特にインビボ、インビトロ、またはエキソビボの診断または治療の使用に適するようにする、活性薬剤(例えば活性医薬化合物)と、不活性または活性の担体(例えばリン脂質)との組み合わせを指す。
【0080】
本明細書において使用される、「薬学的に許容される」または「薬理学的に許容される」という用語は、対象に投与された場合、薬害反応、例えば毒性、アレルギー、または免疫学的反応を実質的に発生しない組成物を指す。
【0081】
本明細書において使用される「局所的に」という用語は、本発明の組成物の、皮膚の表面、ならびに粘膜細胞および組織(例えば歯槽、口腔、舌、咀嚼器官、または鼻粘膜、ならびに管腔器官もしくは体腔の内側を覆う他の組織および細胞)への適用を指す。
【0082】
本明細書で使用される「薬学的に許容される担体」という用語は、リン酸緩衝食塩水溶液、水、乳濁液(例えば油/水型または水/油型乳濁液など)、および様々な種類の湿潤剤、あらゆる溶媒、分散媒、コーティング、ラウリル硫酸ナトリウム、等張剤および吸収遅延剤、崩壊剤(disintigrants)(例えばジャガイモ澱粉または澱粉グリコール酸ナトリウム)などを含む、標準的な医薬担体のうちのいずれかを指すが、これらに限定されない。本組成物は、安定剤および保存料もまた含むことができる。担体、安定剤、およびアジュバントの例については、例えばMartin,Remington’s Pharmaceutical Sciences,15th Ed.,MackPubl.Co.,Easton,Pa.(1975)を参照。これは参照により本明細書に組み込まれる。さらに、特定の実施形態において、本発明の組成物は、園芸または農業での使用に製剤化してもよい。そのような製剤には、浸漬液、噴霧剤、種子粉衣、茎部注入、噴霧剤、およびミストを含む。
【0083】
本明細書で使用される「薬学的に許容される塩」という用語は、標的対象(例えば哺乳動物の対象、および/またはインビボもしくはエキソビボの細胞、組織もしくは器官)において生理学的に耐性のある、本発明の化合物の(例えば酸または塩基との反応により得られる)いずれかの塩を指す。本発明の化合物の「塩」は、無機または有機の酸および塩基から得ることができる。酸の例には、塩酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、エタンスルホン酸、ギ酸、安息香酸、マロン酸、スルホン酸、ナフタレン−2−スルホン酸、ベンゼンスルホン酸などが含まれるが、これらに限定されない。シュウ酸などの他の酸は、それ自体では薬学的に許容されないが、本発明の化合物およびそれらの薬学的に許容される酸付加塩を得る際、中間体として有用な、塩の調製に用いることができる。
【0084】
塩基の例には、アルカリ金属(例えばナトリウム)水酸化物、アルカリ土類金属(例えばマグネシウム)水酸化物、アンモニア、および式NW4+の化合物(式中、WがC1−4アルキルである)などが含まれるが、これらに限定されない。
【0085】
塩の例には、酢酸塩、アジピン酸塩、アルギン酸塩、アスパラギン酸塩、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、クエン酸塩、樟脳酸塩、樟脳スルホン酸塩、シクロペンタンプロピオン酸塩、ジグルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、フルコヘプタン酸塩(flucoheptanoate)、グリセロリン酸塩、ヘミ硫酸塩、ヘプタン酸塩、ヘキサン酸塩、塩化物、臭化物、ヨウ化物、2−ヒドロキシエタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、2−ナフタレンスルホン酸塩、ニコチン酸塩、シュウ酸塩、パルモン酸塩(palmoate)、ペクチン酸塩、過硫酸塩、フェニルプロピオン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、コハク酸塩、酒石酸塩、チオシアン酸塩、トシル酸塩、ウンデカン酸塩などが含まれるが、これらに限定されない。塩の他の例は、Na+、NH4+およびNW4+(式中、WはC1−4アルキル基)などの適切な陽イオンと化合した、本発明の化合物の陰イオンを含む。治療での使用のために、本発明の化合物の塩は、薬学的に許容されるとして企図される。しかしながら、薬学的に許容されない酸および塩基の塩もまた、例えば、薬学的に許容される化合物の調製または精製において使用され得る。
【0086】
治療での使用のために、本発明の化合物の塩は、薬学的に許容されると企図される。しかしながら、また、薬学的に許容されない酸および塩基の塩は、薬学的に許容される化合物の調製または精製において使用することができる。
【0087】
物質または組成物に関して使用される「含水アルコール」という用語は、本明細書において使用される場合、前記物質または組成物が水およびアルコールの両方を含むことを示す。
【0088】
本明細書で使用される「ゲル化剤」という用語は、流体(例えば、水または緩衝溶液などの水性流体)中に溶解、懸濁または分散される時に、ゼラチン状半固体(例えば、潤滑剤ゲル)を形成する組成物を指す。ゲル化剤の例は、ヒドロキシエチルセルロース、ヒドロキシメチルセルロース、ヒドロキシプロピルグアー、メチルセルロース、エチルセルロース、ヒドロキシプロピルセルロース、カルボキシルメチルセルロースナトリウム、カルボマー、アルギン酸、ゼラチン、およびポロキサマーを含むが、これらに限定されない。
【0089】
組成物に関して使用される「乾燥」という用語は、本明細書において使用される場合、化学反応をもはや補助しないレベルまで、溶剤成分または成分を除去することを指す。この用語はまた、乾燥された組成物に関して使用される(例えば、乾燥調製物または乾燥組成物)。当業者であれば、組成物が、例えば、凍結乾燥後に、残留溶剤もしくは水分含量を有しながら「乾燥」することができ、または乾燥工程の完了後に、例えば、大気から吸湿的に水分を吸収し得ることを理解する。「乾燥」という用語は、吸湿性の吸収による水分含量の増加を伴う組成物を包含する。
【0090】
本明細書で使用される「保護剤」という用語は、活性薬剤が特定の条件(例えば、乾燥、凍結)に曝露される時に、活性薬剤(例えば、抗癌薬または精神もしくは神経変性疾患薬)の活性または完全性を保護する組成物または化合物を指す。いくつかの実施形態において、保護剤は、凍結工程時に活性薬剤を保護する(すなわち、これは「凍結防止剤」である)。保護剤の例は、脱脂乳固形分、トレハロース、グリセロール、ベタイン、スクロース、グルコース、ラクトース、デキストラン、ポリエチレングリコール、ソルビトール、マンニトール、ポリビニルプロピレン、グルタミン酸カリウム、グルタミン酸一ナトリウム、Tween20界面活性剤、Tween80界面活性剤、およびアミノ酸塩酸塩を含むが、これらに限定されない。
【0091】
本明細書で使用される「賦形剤」という用語は、活性成分の調製物に添加される不活性成分(すなわち、薬学的に活性でない)を指す。本明細書に記述するゲル化剤および保護剤は、一般に「賦形剤」と呼ぶことができる。
【0092】
本明細書で使用される「キット」という用語は、材料を送達するための任意の送達系を指す。キナーゼ活性または阻害アッセイの文脈において、そのような送達系は、ある位置から別の位置への、反応試薬および/または補助材料(例えば、緩衝液、アッセイを行うための指示書など)の貯蔵、運搬、または送達を可能にする系を含む。例えば、キットは、関連反応試薬および/または補助材料を含有する1つまたは複数の筐体(例えば、箱)を含む。本明細書で使用される「区分化キット」という用語は、それぞれが全キット要素の下位区分を含有する2つ以上の別々の容器を備える送達系を指す。容器は、対象レシピエントに一緒にまたは別々に送達されてもよい。例えば、第1の容器は、アッセイに使用するための薬剤を含有することができ、第2の容器は、試験化合物との比較基準を含有する。「区分化キット」という用語は、Federal Food,Drug,and Cosmetic Act(連邦食品医薬品化粧品法)の520(e)条によって規制されているAnalyte Specific Reagent(ASR)を含有するキットを包含することが意図されるが、これらに限定されない。事実、それぞれが全キット要素の下位区分を含有する2つ以上の別々の容器を備える任意の送達系は、「区分化キット」という用語に含まれる。対照的に、「組み合わせキット」は、単一容器中(例えば、所望の要素のそれぞれを収容する単一の箱中)に、反応アッセイのすべての要素を含有する送達系を指す。「キット」という用語は、区分化キットおよび組み合わせキットの両方を含む。
【0093】
発明の詳細な説明
本発明は、エンドキシフェンを含有する組成物の医療での使用を提供する。さらに本発明は、精神および神経変性疾患の治療におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。詳細には、本発明は、双極性疾患、統合失調症、多発性硬化症(MS)、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症(ALS)およびてんかんの治療におけるエンドキシフェンを含む組成物の使用に関する。さらに本発明は、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染などの感染;ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染;骨粗鬆症および心血管疾患の治療におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。本発明は、さらになお、不妊治療および療法におけるエンドキシフェンおよびエンドキシフェンを含む組成物に関する。またさらに本発明は、エンドキシフェンを調製する方法、およびヒトおよび動物の疾患の治療における、本発明の方法によって調製されたエンドキシフェンの使用に関する。
【0094】
エンドキシフェンは、タモキシフェンのCYP3A4媒介N−脱メチル反応およびCYP2D6媒介のヒドロキシル化を介して産生される(例えば、図3参照)。上で論じたように、パロキセチンを阻害する薬物とのタモキシフェンの共投与が、エンドキシフェンの血漿中濃度を減少させることは周知である(5)。さらに、CYP3A4またはCYP2D6の基質になり得る任意の薬物(例えばSSRI)は、たとえそれらが薬物を代謝する酵素の阻害薬でなくても、エンドキシフェンの血中濃度を低下させる可能性があり(5)、それにより、タモキシフェンの治療有用性を減少させる。したがって、そのような薬物間相互作用を回避するため、それらを一緒に与えるべきではないと助言される。
【0095】
近年、エンドキシフェンは、乳癌細胞において抗エストロゲン性であり、タモキシフェンよりも強力であることが分かっている。タモキシフェンで治療される患者において、エンドキシフェンは、ヒト血漿中で、4−OH−タモキシフェン(1ng/mL)よりも高い濃度(12.4ng/mL)で存在する。エンドキシフェンにより影響を受ける過半の遺伝子は、エストロゲン調節遺伝子である(15、16)。例えば、エンドキシフェンをタモキシフェンの代わりに使用することにより、CYP2D6に依存するいくつかの代謝段階が回避される。
【0096】
本発明者らは、エンドキシフェンがPKCを阻害し、それにより精神および神経変性疾患の治療に、例えば双極性障害の治療に使用されることを見出した。本発明はいずれの特定の様式または作用機序に限定されないが、観察された効果は、リチウムおよびバルプロエート(双極性障害に最も一般に用いられている治療)がPKC活性の減衰を介して治療効果を提供すると知られる観察と矛盾しない。
【0097】
精神および神経変性疾患におけるエンドキシフェンの使用
エンドキシフェン(4−ヒドロキシN−デスメチルタモキシフェン)は、乳癌の治療のための市販薬物タモキシフェンの活性代謝物である。タモキシフェンは、シトクロムP450(CYP)酵素CYP3A4およびCYP2D6によって広範囲に代謝され、4−ヒドロキシタモキシフェンおよび4−ヒドロキシ−N−デスメチルタモキシフェン(エンドキシフェン)(図1)を含む活性代謝物になる。本発明者らは、双極性障害、統合失調症ならびに多発性硬化症、パーキンソン病、アルツハイマー病、ハンティングトン病、筋萎縮性側索硬化症およびてんかんにおける神経保護の役割にエンドキシフェンが有益な効果を有すると仮定する。精神および神経変性疾患のための治療剤としてエンドキシフェンを使用することは、シトクロムP450(CYP)酵素による代謝的活性化を必要とし、その作用が遺伝的多型および薬物間相互作用による阻害のために変動する母化合物のタモキシフェンより著しい利点を有する。
【0098】
精神疾患
双極性障害
双極性障害は、障害を受けた者の間での自殺の多大な危険性と関連する慢性の精神病である(8)。リチウムおよびバルプロエートは、双極性障害において気分安定薬として広く用いられているが、しかし、患者の一部はこれらの薬剤に反応しない、または、部分的にしか反応しない(8)。したがって、より迅速、より強力で、より特異的な作用様式およびより少ない副作用の新規の治療剤の開発が必要とされる。
【0099】
疾患病態生理学の正確な機序が明らかでないにもかかわらず、プロテインキナーゼC(PKC)シグナル経路の役割も双極性障害に関係している(17)。PKCは、シナプス前部および後部の神経伝達の両方を調節する際に主要な役割を果たす。したがって、脳において細胞シグナルの変化を引き起こすPKC活性の変動は、情緒不安定(運動、認知および心理学的挙動における変動などの)をもたらす。動物の研究データは、過剰なPKC活性化が行動の調節を混乱させることがあり、動揺、判断力低下、衝動および無秩序な思考障害(これらのすべては双極性障害の患者の特徴である(9、17))などのような機能障害の一因と恐らくなることを示唆している。これらの基礎医学的調査結果は、脳内のPKCシグナルが気分安定剤の極めて妥当な標的を表すことを強く示唆している(17)。最も広く用いられている、リチウムおよびバルプロエートなどの気分安定薬はまた、直接にまたはPKC基質ミリストイル化アラニンリッチCキナーゼ基質(MARCKS)へのその作用を介してPKC活性を軽減することによって(17)、薬物療法の作用を与えることが知られている(図4)。
【0100】
タモキシフェンは、末梢的に投与することができ、ヒトに認可された、立証され容易に評価できる中枢神経系(CNS)PKC阻害活性を有する唯一の化合物である。ラットでの最近の調査において、タモキシフェンはアンフェタミンに誘発された躁病の挙動を低減した(9)。これらの結果は、PKCシグナルが双極性障害の病態生理学および治療に重要な役割を果たすことができる可能性を支持する。これらの調査結果は、障害のためのさらなる特定の薬物を開発する試みにとって、新規の方法を提供するので、直接的な臨床上の意味合いを有する。予備的な二重盲検の比較臨床試験では、偽薬でよりもタモキシフェンで大きい抗躁病効果を示した(18)。より新しくは、2つのグループが、二重盲検偽薬比較試験において、PKC阻害薬タモキシフェンが抗躁病性を示し十分な耐性があることを確証した(10、11)。これらの調査結果は、タモキシフェンおよびその代謝物質(可能性のある抗躁病または気分安定剤としてのエンドキシフェンなどの)の開発を促進する。
【0101】
統合失調症
統合失調症は、妄想、幻覚、偏執病および精神病などの挿話的症候を特徴とした精神病であり、情動の平坦化、注意力低下、引きこもりおよび認知障害などの持続的な症候を含んでもよい(19)。疫学的および臨床上の証拠は、統合失調症の発病および悪化へのエストロゲンの影響を示唆している。早期の調査は男性と女性の統合失調症の発病率はほぼ同等であると示唆したが、より最近の調査は、疾病発生率が男性においてより高いことを示す(20)。
【0102】
エストロゲンは女性において保護因子として働き、統合失調症の発病年齢は、男性より女性で著しく遅く、40〜45歳以降の女性においてより大きく遅い第2の発症ピークがある。さらに、精神機能障害のレベルは月経周期の相に応じて変動する(21)。統合失調症の女性において、月経周期中にエストロゲンレベルが低いとき、再発率はより高く、エストロゲンレベルが高い場合には、再発は低い(22)。統合失調症の女性のより高い再発率も、分娩後の間(低エストロゲン)観察され、一方、妊娠(高エストロゲン)中には再発は低い。他方では、統合失調症の男性は、女性より、発症年齢が低く、早期に入院し、典型的な様相および劣った予後を示す。
【0103】
統合失調症における外因性エストロゲンの精神治療効果を支持する証拠は、経皮的な補給エストラジオールを受けた統合失調症の更年期前の女性において、補給ラロキシフェン(SERM)を受けた統合失調症の閉経後の女性において、およびタモキシフェンを受けた躁病期の統合失調感情障害の女性において、ホルモン調節を調査する3つの二重盲検無作為化比較臨床試験の調査結果によって得られた(12)。その結果、統合失調症の更年期前の女性において補給エストラジオールは精神病の症候の改善に関連し;統合失調症の閉経後の女性において、補給ラロキシフェンは認知機能の改善に関連し;統合失調感情障害の女性において、補給タモキシフェンは躁病の症候の改善に関連した。これらの調査結果は、タモキシフェンなどのSERMを含む補給ホルモン調節が統合失調症用の性別特殊療法の有望な領域であることを示唆する。
【0104】
神経変性
多発性硬化症
多発性硬化症(MS)は、免疫系が、ミエリン塩基性タンパク質またはプロテオリピドタンパク質などのミエリンの成分に対する不適当な反応を起こす、CNSの自己免疫疾患である。これは、CNSの炎症およびミエリン損傷を特徴とする。自己反応性CD4+T−ヘルパ−1(Th1)細胞およびそれらの産生物(例えば、腫瘍壊死因子−α(TNF−α)、インターフェロン−γ(IFN−γ)、および、メタロプロテアーゼ)は、免疫病理の多くを媒介し、ミエリン鞘の破壊、および続いて神経機能障害をもたらす(23)。
【0105】
他の自己免疫疾患と同様に、男性(24)と比較して、MSの発病率は女性においてより高く(2から3倍)、これはホルモンの影響に起因すると考えられる。MSにおいてエストロゲンの疾患を調節する作用は広範囲に述べられている(25)。MSの患者および動物疾患モデルの両方において、エストロゲンの保護効果はよく立証されている。これらの調査結果は、疾患プロセスの保護効果が少なくとも一部はエストロゲンによる免疫応答の調節に起因し得ることを示唆している。しかし、ステロイドエストロゲンに関連する危険性および副作用は、長期のMS療法の有用性を限定するおそれがある。
【0106】
選択的エストロゲン受容体修飾剤は、いくつかの組織でエストロゲン作動薬として振る舞うが、他の組織においては不活性であるかまたはエストロゲン拮抗薬のように振る舞うので、代替治療薬戦略を提供することができよう(26)。例えば、ラロキシフェン(骨粗鬆症の治療に認可されたSERM)は骨中でエストロゲンとして振る舞うが、乳房組織、および子宮(27)中ではエストロゲン拮抗薬として働く。さらに最近の研究において、マウス中のミエリン特異免疫およびEAEを調節する、タモキシフェンおよびラロキシフェンの能力が研究された。タモキシフェンおよびラロキシフェンのどちらも、ミエリン抗原特異的T細胞の増殖を阻害した。しかし、タモキシフェンはこの点に関してより効果的であった。これらの調査結果は、タモキシフェンまたは関連するSERMは、MSなどのCNSの炎症性自己免疫障害の治療において使用することができる可能性のある薬剤であるという考えを支持する(28)。
【0107】
アルツハイマー病
アルツハイマー病は、最も一般的な神経変性障害の1つで、高齢者の認知症の最も一般的な形である。エストロゲンは、アルツハイマー病の予防において保護的役割を有すると思われる。エストロゲンは、β−アミロイド斑形成の阻害、コリン作動活性の刺激、酸化ストレス関連の細胞損傷の減少および血管危険性からの保護を含むいくつかの神経保護作用を、老化する脳に与えることができる。閉経後のホルモン補充療法は、認知症になる危険性をおよそ30%減少させる。同様に、骨粗鬆症のためのラロキシフェンを受けている患者は、軽度認知障害の危険性を33%減少させ、アルツハイマー病を発症する相対危険度を半減させ、老化関連神経変性障害(29)の予防におけるSERMの役割を示唆している。インビトロのニューロンモデル系でのタモキシフェン(およびその代謝物質、4−ヒドロキシタモキシフェン)の研究は、この薬剤が脳において部分作動薬として働き、閉経後に何らかの神経保護の有用性を提供し得ることを示唆している(14)。
【0108】
パーキンソン病
パーキンソン病(PD)は、ドパミン(30)の枯渇をもたらす中脳の黒質においてドパミン作動性ニューロンの選択的な損失を特徴としたもう一つの一般的な変性障害である。正常なドパミン伝達は、薬物(レボドパまたはドパミン作動薬)の投与によって回復することができる。長期投与の後、最終的に運動機能変動および運動障害を含む有害な運動合併症が現われる。プロテインキナーゼCは、レボドパ関連の運動変化の発症を加速し得る(31)。タモキシフェンはPKC拮抗薬として働くことができ、ラットおよびヒト以外の霊長動物において長期レボドパ療法の有益な応答が短縮するのを逆転させる(32)。同様に、パーキンソン病のサルへのタモキシフェンのレボドパとの共投与は、レボドパ誘発運動障害を著しく(61%)減じた(32)。
【0109】
PKC経由のその作用に加えて、タモキシフェンには神経保護機能を包含する複数の代謝効果がある(33)。タモキシフェンもドパミン放出を刺激すると示された。全体として、この証拠は、タモキシフェンがPDの長期レボドパ投与で見られる、望まれない運動不全の阻止に役割を有し、また、ことによると神経変性障害の化学的予防における役割を有し得ることを示唆する。
【0110】
本発明は、式Iのエンドキシフェンを、例えば、哺乳動物の宿主に送達するための組成物および方法を提供する。本発明のいくつかの実施形態において、エンドキシフェンはE異性体であり、他の実施形態において、Z異性体であるが、さらに他の実施形態においては、E異性体およびZ異性体の混合物である。
【化6】

【0111】
本発明の例は、エンドキシフェン、エンドキシフェンの類似体およびエンドキシフェンの誘導体を含み、エンドキシフェン、タモキシフェンおよび4−ヒドロキシタモキシフェンを含むが、これらに限定されない。また、本発明は、パクリタキセル、ドセタキセル、メルファラン、クロルメチン、extramustinephosphate、ウラムスチン、イホスファミド、マンノムスチン、トリホスファミド、ストレプトゾトシン、ミトブロニトール、ミトキサントロン、メトトレキサート、フルオロウラシル、シタラビン、テガフル、イドキシド、タキソール、パクリタキセル、ダウノマイシン、ダウノルビシン、ブレオマイシン、アンホテリシン、カルボプラチン、シスプラチン、BCNU、ビンクリスチン、カンプトセシン、SN−38、ドキソルビシン、およびエトポシドなどの他の抗腫瘍薬とともに使用される。また、bicautamide、エキセメスタン、ホルメスタン、レトロゾール、アナストラゾールおよびこれらの類似体などの癌治療において使用されるステロイド系および非ステロイド系阻害薬も含む。
【0112】
式Iのエンドキシフェンは、本発明の治療に使用するための任意の所望の方法によって調製することができるが、いくつかの実施形態においては、本発明は、エンドキシフェンを調製するための特定の方法を提供する。本発明の1つの好ましい方法を図2に示す。この方法において、4−ブロモフェノール1を、酸(例えば、硫酸など)の存在下において、3,4−ジヒドロピラン2と反応させて、化合物3を得る。次いで、化合物3を、適切な無水溶剤(例えば、テトラヒドロフランなど)中でマグネシウム削り屑と反応させる。これに続いて、1−[4−(2−クロロエトキシ)フェニル]−2−フェニル−1−ブタノン4と反応させて化合物5を得、適切な溶剤(例えば、メタノールなど)中、酸の存在下で脱水/脱保護して化合物6を得る。適切な溶剤(例えば、イソプロパノールなど)中で得られた化合物6をメチルアミンと反応させて、エンドキシフェンIを得る。
【0113】
本発明のいくつかの実施形態において、エンドキシフェンのEおよびZ異性体の混合物を分離して、エンドキシフェンのEおよびZ異性体の精製調製物を生成することができる。本発明におけるエンドキシフェンのEおよびZ異性体の分離は、例えば、結晶化、液体カラムクロマトグラフィ(LC)、または高圧液体カラムクロマトグラフィ(HPLC)による精製によって行うことができる。
【0114】
エンドキシフェンのEおよびZ異性体の分離のために本発明において用いることができる適切な溶剤は、ヘキサン、ヘプタンなど、ベンゼン、トルエン、酢酸エチル、アセトニトリル;塩化メチレン、クロロホルム、1,2−ジクロロメタンなどの塩素化溶剤;ケトン、例えば、アセトン、2−ブタノンなど;ジエチルエーテル、ジイソプロピルエーテル、メチルブチルエーテル、およびテトラヒドロフランなどのエーテル;メタノール、エチルアルコール、およびイソプロピルアルコールなどのアルコール;ならびに水などを含むが、これらに限定されない。結晶化のための溶剤は、単一溶剤として、またはヘキサン−酢酸エチル、クロロホルム−アセトン、クロロホルム−メタノール、ジクロロメタン−メタノールなどの溶剤の混合物として使用することができる。本発明において2種の溶剤の混合物を使用する場合、1つの溶剤の別の溶剤に対する比率の例は、例えば、9:1から1:9など(例えば、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9など)の範囲内である。しかし、本発明において使用するための混合物は、これらの比率、または2種の溶剤のみを含む混合物に限定されない。
【0115】
本発明によるエンドキシフェンの調製に使用される溶剤は、テトラヒドロフラン、ジクロロメタン、クロロホルム、1,2−ジクロロエタン、アセトニトリル、N,N’−ジメチルホルムアミド、ジメチルスルホキシド、トルエン、ピリジン、メタノール、エタノール、イソプロパノール、アセトン、2−ブタノン、ヘキサン、ヘプタン、ペンタン、酢酸エチルなどを含むが、これらに限定されない。
【0116】
本発明によるエンドキシフェンの調製に使用される酸は、硫酸、塩酸、酢酸、トリフルオロ酢酸、リン酸、p−トルエンスルホン酸、メタンスルホン酸、硝酸などを含むが、これらに限定されない。
【0117】
本発明の中間体および最終生成物は、ヘキサン ペンタン、ヘプタン、酢酸エチル、塩化メチレン、クロロホルム、メタノール、アセトンなどの単一の一般的有機溶剤またはその混合物を使用して、カラムクロマトグラフィで精製することができる。
【0118】
上記のように、本発明の中間体および最終生成物は、いくつかの実施形態においては、結晶化によって精製することができる。中間体および生成物の結晶化において使用される溶剤は、ペンタン、ヘキサン、ヘプタンなどの炭化水素;ベンゼン、トルエン、酢酸エチル、アセトニトリル;塩化メチレン、クロロホルム、1,2−ジクロロメタンなどの塩素化溶剤;ケトン、例えば、アセトン、2−ブタノンなど;ジエチルエーテル、ジイソプロピルエーテル、メチルブチルエーテル、テトラヒドロフランなどのエーテル;メタノール、エチルアルコール、イソプロピルアルコールなどのアルコールなどを含むが、これらに限定されない。結晶化のための溶剤は、単一溶剤としてまたは溶剤の混合物として使用することができる。例示的な混合物は、例えば、ヘキサン−酢酸エチル、クロロホルム−アセトン、クロロホルム−メタノール、ジクロロメタン−メタノールなどを含む。本発明において2種の溶剤の混合物を使用する場合、1つの溶剤の別の溶剤に対する比率の例は、例えば、9:1から1:9など(例えば、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9など)の範囲内である。しかし、本発明において使用するための混合物は、これらの比率、または2種の溶剤のみを含む混合物に限定されない。
【0119】
本発明の一目的は、少なくとも90%純度または少なくとも95%純度または少なくとも98%純度または少なくとも99%純度または少なくとも100%純度などの、少なくとも80%純度を有するEエンドキシフェンまたはZエンドキシフェンを提供することである。
【0120】
本発明の別の目的は、例えば、水性酸中などに可溶化されたエンドキシフェンを提供することである。エンドキシフェンを可溶化するための適切な酸は、ギ酸、酢酸、プロピオン酸、酪酸、トリフルオロ酢酸、乳酸、酒石酸、シュウ酸、マロン酸、コハク酸などを含むが、これらに限定されない。エンドキシフェンを含む酸性溶液のpHは、適切な塩基または緩衝液で調節することができる。塩基および緩衝液の例は、水酸化ナトリウム、酢酸ナトリウム、乳酸ナトリウム、コハク酸ナトリウム、一リン酸ナトリウム、二リン酸ナトリウム、三リン酸ナトリウム、シュウ酸ナトリウム、酒石酸ナトリウム、水酸化アンモニウム、酢酸アンモニウムなどを含むが、これらに限定されない。いくつかの実施形態においては、エンドキシフェンを可溶化するために共溶剤を使用することもできる。共溶剤の例は、エタノール、イソプロパノール、Tween20およびポリソルベートなどの界面活性剤などを含むが、これらに限定されない。
【0121】
特定の好ましい実施形態において、本発明によるエンドキシフェンを含有する組成物のpHは、約4.0から約8.0、好ましくは約5.0から約8.0、最も好ましくは約5.5から約7.5の間である。
【0122】
いくつかの実施形態において、本発明は、エンドキシフェンまたはエンドキシフェン−脂質複合体を、哺乳動物の宿主に送達するための組成物および方法に関する。任意の適切な量のエンドキシフェンを複合体形成に使用することができる。適切な量のエンドキシフェンは、本発明の複合体に安定して取り込むことができる量である。
【0123】
いくつかの実施形態において、本発明の組成物は、複合体が、望ましくは脂質または脂質の混合物を含有する、エンドキシフェンを有する脂質複合体を含む。複合体は、他の形態を除外することなく、例えば、ミセル、小胞またはエマルションの形態であってよい。本発明のミセルは、単量体、二量体、重合体または混合ミセルの形態であってよい。ミセルおよびエマルションを含む複合体は、主に、50nm〜20ミクロンの寸法範囲内、好ましくは50nm〜5ミクロンの寸法範囲内にある。複合体において、活性薬剤は、共有結合、疎水結合、静電結合、水素結合、または他の結合によって脂質に結合することができ、薬物が、脂質構造の内部に単に封入された場合にも、結合しているとみなされる。
【0124】
エンドキシフェン−脂質複合体は、例えば、コレステロールもしくはコレステロール誘導体またはコレステロールとコレステロール誘導体との混合物を含有することができる。本発明において使用されるコレステロール誘導体は、ヘミコハク酸コレステリル、コハク酸コレステリル、オレイン酸コレステリル、リノール酸コレステリル、エイコサペンタエン酸コレステリル、リノレン酸コレステリル、アラキドン酸コレステリル、パルミチン酸コレステリル、ステアリン酸コレステリル、ミリスチン酸コレステリル、コレステロールのポリエチレングリコール誘導体(コレステロール−PEG)、水溶性コレステロール(例えば、コレステロールメチル−β−シクロデキストリン)、コプロスタノール、コレスタノール、またはコレスタン、コール酸、コルチゾール、コルチコステロンもしくはヒドロコルチゾンならびに7−デヒドロコレステロールを含む。
【0125】
いくつかの好ましい実施形態において、組成物はまた、α−,β−,γ−トコフェロール、ビタミンE、カルシフェロール、ヘミコハク酸α−トコフェロール(THS)などのα−,β−,γ−トコフェロールの有機酸誘導体、コハク酸α−トコフェロールおよび/またはこれらの混合物も含む。
【0126】
他のいくつかの好ましい実施形態において、本発明のエンドキシフェン−脂質複合体はステロールを含有する。本発明において使用されるステロールは、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラソステロール、カンペステロールおよび/またはこれらの混合物を含む。
【0127】
また、本発明の組成物は、遊離脂肪酸および/またはその塩もしくはエステルとのエンドキシフェン複合体も含む。好ましい脂肪酸は約C2からC34までの範囲の炭素鎖長を有するものであり、好ましくは約C4から約C24の間で、とりわけ、テトラ酸(C4:0)、ペンタン酸(C5:0)、ヘキサン酸(C6:0)、ヘプタン酸(C7:0)、オクタン酸(C8:0)、ノナン酸(C9:0)、デカン酸(C10:0)、ウンデカン酸(C11:0)、ドデカン酸(C12:0)、トリデカン酸(C13:0)、テトラデカン(ミリスチン)酸(C14:0)、ペンタデカン酸(C15:0)、ヘキサデカン(パルミチン)酸(C16:0)、ヘプタデカン酸(C17:0)、オクタデカン(ステアリン)酸(C18:0)、ノナデカン酸(C19:0)、エイコサン(アラキジン)酸(C2O:0)、ヘンエイコサン酸(C21:0)、ドコサン(ベヘン)酸(C22:0)、トリコサン酸(C23:0)、テトラコサン酸(C24:0)、10−ウンデセン酸(C11:1)、11−ドデセン酸(C12:1)、12−トリデセン酸(C13:1)、ミリストレイン酸(C14:1)、10−ペンタデセン酸(C15:1)、パルミトレイン酸(C16:1)、オレイン酸(C18:1)、リノール酸(C18:2)、リノレン酸(C18:3)、エイコセン酸(C20:1)、エイコサジエン酸(C20:2)、エイコサトリエン酸(C20:3)、アラキドン酸(cis−5,8,11,14−エイコサテトラエン酸)、およびcis−5,8,11,14,17−エイコサペンタエン酸を含む。また、他の脂肪酸を組成物中に用いることもできる。そのようなものの例は、エタン(または酢)酸、プロパン(またはプロピオン)酸、ブタン(または酪)酸、ヘキサコサン(またはセロチン)酸、オクタコサン(またはモンタン)酸、トリアコンタン(またはメリシン)酸、ドトリアコンタン(またはラッセル)酸、テトラトリアコンタン(またはゲダ)酸、ペンタトリアコンタン(またはセロプラスチン)酸等の飽和脂肪酸、trans−2−ブテン(またはクロトン)酸、cis−2−ブテン(またはイソクロトン)酸、2−ヘキセン(またはイソヒドロソルビン)酸、4−デカン(またはオブツケイ)酸、9−デカン(またはカプロレイン)酸、4−ドデセン(またはリンデン)酸、5−ドデセン(またはデンチセチン)酸、9−ドデセン(またはラウロレイン)酸、4−テトラデセン(またはツズ)酸、5−テトラデセン(またはフィゼテリン)酸、6−オクタデセン(またはペトロセレン)酸、trans−9−オクタデセン(またはエライジン)酸、trans−11−オクタデセン(またはバクセン)酸、9−エイコセン(またはガドレイン)酸、11−エイコセン(またはゴンド)酸、11−ドコセン(またはセトレン)酸、13−ドコセン(またはエルカ)酸、15−テトラコセン(またはネルボン)酸、17−ヘキサコセン(またはキシメン)酸、21−トリアコンテン(またはルメキン)酸等のモノエテン不飽和脂肪酸、2,4−ペンタジエン(またはβ−ビニルアクリル)酸、2,4−ヘキサジエン(またはソルビン)酸、2,4−デカジエン(またはスチルリン)酸、2,4−ドデカジエン酸、9,12−ヘキサデカジエン酸、cis−9,cis−12−オクタデカジエン(またはα−リノール)酸、trans−9,trans−12−オクタデカジエン(またはリノールエライジン)酸、trans−10,trans−12−オクタデカジエン酸、11,14−エイコサジエン酸、13,16−ドコサジエン酸、17,20−ヘキサコサジエン酸等のジエン不飽和脂肪酸、6,10,14−ヘキサデカトリエン(またはヒラゴニン)酸、7,10,13−ヘキサデカトリエン酸、cis−6,cis−9−cis−12−オクタデカトリエン(またはγ−リノール)酸、trans−8,trans−10−trans−12−オクタデカトリエン(またはβ−カレンジン)酸、cis−8,trans−10−cis−12−オクタデカトリエン酸、cis−9,cis−12−cis−15−オクタデカトリエン(またはα−リノレン)酸、trans−9,trans−12−trans−15−オクタデカトリエン(またはα−リノレンエライジン)酸、cis−9,trans−11−trans−13−オクタデカトリエン(またはα−エレオステアリン)酸、trans−9,trans−11−trans−13−オクタデカトリエン(またはβ−エレオステアリン)酸、cis−9,trans−11−cis−13−オクタデカトリエン(またはプニカ)酸、5,8,11−エイコサトリエン酸、8,11,14−エイコサトリエン酸等のトリエン不飽和脂肪酸、4,8,11,14−ヘキサデカテトラエン酸、6,9,12,15−ヘキサデカテトラエン酸、4,8,12,15−オクタデカテトラエン(またはモロクチン)酸、6,9,12,15−オクタデカテトラエン酸、9,11,13,15−オクタデカテトラエン(またはα−またはβ−パリナリン)酸、9,12,15,18−オクタデカテトラエン酸、4,8,12,16−エイコサテトラエン酸、6,10,14,18−エイコサテトラエン酸、4,7,10,13−ドコサテトラエン酸、7,10,13,16−ドコサテトラエン酸、8,12,16,19−ドコサテトラエン酸等のテトラエン不飽和脂肪酸、4,8,12,15,18−エイコサペンタエン(またはティムノドン)酸、4,7,10,13,16−ドコサペンタエン酸、4,8,12,15,19−ドコサペンタエン(またはクルパノドン)酸、7,10,13,16,19−ドコサペンタエン、4,7,10,13,16,19−ドコサヘキサエン酸、4,8,12,15,18,21−テトラコサヘキサエン(またはニシン)酸等のペンタおよびヘキサエン不飽和脂肪酸、3−メチルブタン(またはイソ吉草)酸、8−メチルドデカン酸、10−メチルウンデカン(またはイソラウリン)酸、11−メチルドデカン(またはイソウンデシル)酸、12−メチルトリデカン(またはイソミリスチン)酸、13−メチルテトラデカン(またはイソペンタデシル)酸、14−メチルペンタデカン(またはイソパルミチン)酸、15−メチルヘキサデカン、10−メチルヘプタデカン酸,16−メチルヘプタデカン(またはイソステアリン)酸、18−メチルノナデカン(またはイソアラキジン)酸、20−メチルヘンエイコサン(またはイソベヘン)酸、22−メチルトリコサン(またはイソリグノセリン)酸、24−メチルペンタコサン(またはイソセロチン)酸、26−メチルヘプタコサン(またはイソモナトニック)酸、2,4,6−トリメチルオクタコサン(またはマイコセランまたはマイコセロシン)酸、2−メチル−cis−2−ブテン(アンゲリカ)酸、2−メチル−trans−2−ブテン(またはチグリン)酸、4−メチル−3−ペンテン(またはピロテレブ)酸の分枝鎖脂肪酸等を含む。
【0128】
いくつかの好ましい実施形態において、エンドキシフェン−脂質複合体はリン脂質を含有する。任意の適切なリン脂質またはリン脂質の混合物を使用することができる。例えば、リン脂質は、天然源から得るか、化学的に合成することができる。適切なリン脂質は、別々にまたは組み合わせて使用される、ホスファチジルエタノールアミン(PE)、ホスファチジルグリセロール(PG)、ホスファチジルセリン(PS)、ホスファチジルコリン(PC)、ホスファチジルイノシトール(PI)、ホスファチジン酸(PA)、スフィンゴミエリンなどを含むが、これらに限定されない。ホスファチジルグリセロールは、短鎖または長鎖を有し、飽和または不飽和であり、例えばジミリストイルホスファチジルグリセロール、ジオレオイルホスファチジルグリセロール、ジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジアラキドノイルホスファチジルグリセロール、短鎖ホスファチジルグリセロール(C6−C8)、およびこれらの混合物などである。ホスファチジルコリンの例は、ジミリストイルホスファチジルコリン、ジステアロイルホスファチジルコリン、ジパルミトイルホスファチジルコリン、ジオレオイルホスファチジルコリン、ジアラキドノイルホスファチジルコリン、卵ホスファチジルコリン、大豆ホスファチジルコリンまたは水素化大豆ホスファチジルコリンを含み、これらの混合物を使用してもよい。
【0129】
一態様によれば、本発明は、エンドキシフェンならびにモノ、ジおよびトリグリセリドの誘導体を含む組成物を提供する。グリセリドの例は、1−オレオイル−グリセロール(モノオレイン)および1,2−ジオクタノイル−sn−グリセロールを含む。
【0130】
本発明の別の態様は、ホスファチジルエタノールアミン、好ましくはジオレオイルホスファチジルエタノールアミン、ホスファチジルチオエタノール、N−ビオチニルホスファチジルエタノールアミンおよびホスファチジルエチレングリコールを含むがこれらに限定されない、官能性リン脂質とのエンドキシフェンの複合体の形成を提供する。
【0131】
本発明の別の態様は、炭水化物系脂質とのエンドキシフェンの複合体の形成を提供する。炭水化物系脂質の例は、ガラクトリピド、マンノリピド、ガラクトレシチンなどを含むが、これらに限定されない。
【0132】
他の好ましい実施形態において、エンドキシフェン−脂質複合体は、ステロールを含む。本発明において使用されるステロールは、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール,ラソステロール、カンペステロールおよび/またはこれらの混合物を含むが、これらに限定されない。
【0133】
本発明の別の態様は、ググリピドおよび任意の適切なリン脂質とのエンドキシフェンの複合体の形成を提供する。ググリピド、またはググルは、ムクルミルラの木に由来する天然物質である。ムクルミルラは、粘着性樹脂を生成し、加工されてググリピドが得られる。この抽出物は、関節炎および肥満症を治療するために、アーユルヴェーダ医学において何千年もの間使用されてきた。ググリピドは、通常少なくとも2.5%の量で存在する、ZおよびEググルステロンなどのステロール化合物の源である(10)。ZおよびEググルステロンは、化学的に合成することができ、したがって、これらのステロンの純粋形態を有することが必要とされる製剤において使用することができる。例えば、どちらも参照により本願明細書に組み込まれる2006年11月6日に出願された米国特許出願第60/856,952号、および2007年11月6日に出願されたPCT/US07/83832号を参照。
【0134】
本発明のさらに別の態様は、ペグ化リン脂質などのリン脂質誘導体とのエンドキシフェンの複合体の形成を提供する。本発明において使用されるペグ化脂質の例は、ジステアロイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、ジオレオイルホスファチジルグリセロールなどのポリエチレングリコール(ペグ化、PEG)誘導体を含むが、これらに限定されない。
【0135】
他の態様において、エンドキシフェンおよびポリエチレングリコール(PEG)ならびに1種または複数の脂質を含む組成物を提供する。
【0136】
さらに他の態様によれば、本発明は、1種または複数の脂質とのエンドキシフェン複合体を含む組成物を提供する。例として、エンドキシフェン、コレステロールまたはコレステロール誘導体および1種または複数のリン脂質を含む組成物が挙げられるが、これらに限定されない。組成物の他の例は、エンドキシフェン、β−シトステロール、および1種または複数のリン脂質を含む。いくつかの好ましい実施形態において、本発明の組成物は、エンドキシフェン、および水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンを含む。
【0137】
「ポリエチレングリコール(PEG)」という用語は、低級アルキレンオキシド、特に、ポリマー分子の少なくとも一端にエステル化可能なヒドロキシル基を有するエチレンオキシド(ポリエチレングリコール)のポリマー、ならびにエステル化可能なカルボキシ基を有するそのようなポリマーの誘導体を含む。200〜20,000の範囲の平均分子量のポリエチレングリコールが好ましく、500〜2000の範囲の平均分子量を有するものが、特に好ましい。
【0138】
本発明の別の態様は、炭水化物系脂質とのエンドキシフェンの複合体の形成を提供する。炭水化物系脂質の例は、ガラクトリピド、マンノリピド、ガラクトレシチンなどを含むが、これらに限定されない。
【0139】
本発明の組成物のいくつかの実施形態において、エンドキシフェン、好ましくは1mg/mLから約20mg/mLの間、または1mg/mLから10mg/mLの間、より好ましくは1mg/mLから5mg/mLの間などの約0.5mg/mLから約25mg/mLの濃度の水中のエンドキシフェンを含む複合体が形成される。
【0140】
いくつかの実施形態において、本発明の組成物は、総脂質の約2.5%から約90%、好ましくは、総脂質の重量の約2.5から約50%、またはより好ましくは、総脂質の重量の約10%から約50%を含有する。
【0141】
特定の実施形態において、本発明の組成物は、好ましくは、1:1から1:20モル比の間、または1:1から1:30モル比の間、または1:1から1:40モル比の間、または1:1から1:50モル比の間、1:1から1:60モル比の間、1:1から1:70モル比の間、1:1から1:80モル比の間、および1:90モル比などの1:1から1:100のモル比の間で、エンドキシフェンおよび脂質を含有する。
【0142】
本明細書に挙げた比率、例えば、組成物中の成分のモル比は、一例として提供され、本発明を正確な増分比、例えば、組成物中の成分の整数比に限定するものではない。例えば、約1:10から1:90の比率の範囲は、1:11、1:25、1:89などのみならず、約1:10から1:90(例えば、1:53.637)の、またはその間の、任意の比率を含むが、これらに限定されない。
【0143】
特定の実施形態において、本発明の組成物は、好ましくは、エンドキシフェンならびに水素化大豆ホスファチジルコリン、または大豆ホスファチジルコリン、およびコレステロールもしくはコレステロール誘導体を含有する。そのような組成物は、好ましくは約1:1から1:5モル比で、より好ましくは約1:1モル比から約1:2モル比で、エンドキシフェンおよびコレステロールまたはコレステロール誘導体を含む。
【0144】
本発明のさらに別の態様は、ペグ化リン脂質などのリン脂質誘導体とのエンドキシフェンの複合体を形成することである。例としては、ジステアロイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、ジオレオイルホスファチジルグリセロールなどのポリエチレングリコール(PEG)誘導体が挙げられるが、これらに限定されない。
【0145】
いくつかの好ましい実施形態において、水素化大豆ホスファチジルコリンまたはホスファチジルコリンを含有する組成物中の、エンドキシフェンと水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンとのモル比は、約1:10から1:90の間、例えば、約1:10から1:80、または1:10から1:70、または1:10から1:60、または1:10から1:50、または1:10から1:40および1:10から1:30の間である。特に好ましい実施形態において、エンドキフェンと水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンとのモル比は、1:10から1:60の間である。
いくつかの実施形態において、本発明の組成物は、好ましくは、1:1から1:20比の間、または1:1から1:30比の間、または1:1から1:40比の間、または1:1から1:50比の間、または1:1から1:60比の間、または1:1から1:70比の間、および1:1から1:80比の間、あるいは1:1から1:90比の間などの1:1から1:100比の間の重量に対する重量比を有する、エンドキシフェンおよび総脂質を含有する。
【0146】
いくつかの実施形態において、本発明の方法は、例えば水などの水溶液中で、エンドキシフェンおよび脂質を一緒に可溶化する、または懸濁することを含む。エンドキシフェン−脂質複合体溶液は、複合体の粒度分布を制御するために、適切なフィルターに通して濾過することができる。
【0147】
いくつかの実施形態において、本方法は、水中で脂質を一緒に混合し、次いで、エンドキシフェンの添加を含んでもよい。エンドキシフェン−脂質複合体溶液は、複合体の粒度分布を制御するために、適切なフィルターに通して濾過することができる。
【0148】
いくつかの実施形態においては、本方法はまた、クロロホルムもしくはエタノールまたは任意の他の医薬的に許容される溶剤などの有機溶剤中で、エンドキシフェンおよび脂質を混合し、溶剤を蒸発させて、脂質相または脂質膜を形成することも含む。次いで、脂質相を水または水溶液で水和する。水溶液の例は、0.9%塩化ナトリウム、デキストロース、スクロースなどの糖を含有する溶液を含むが、これらに限定されない。水和した溶液は、複合体の粒度分布を制御するために、適切なフィルターに通して濾過することができる。
【0149】
いくつかの実施形態において、本方法は、有機溶剤中で脂質を混合し、溶剤を蒸発させて、脂質相または脂質膜を形成することを含む。次いで、脂質相を、エンドキシフェンを含有する水溶液で水和する。水溶液は、エンドキシフェンに加えて、塩化ナトリウムまたはデキストロース、スクロースなどの糖をさらに含有してよい。水和した溶液は、複合体の粒度分布を制御するために、適切なフィルターに通して濾過することができる。
【0150】
他の実施形態において、本発明の方法は、結果として生じる本発明の組成物が、エンドキシフェン、および1種または複数の脂質を含有するように、任意の順序で、かつ任意の適切な溶剤中で、エンドキシフェンと1種または複数の脂質を混合することを含む。
【0151】
いくつかの実施形態においては、本発明の調製方法は、30〜100℃、好ましくは30〜80℃の間、より好ましくは30〜60℃の間の範囲の温度で、エンドキシフェン、および脂質を含む組成物を加熱することを含む。
【0152】
いくつかの実施形態において、本発明の組成物のpHは、約3から約11の範囲であるが、pH3.5から約8の間が好ましく、pH4.0からpH7.5の間が特に好ましい。
【0153】
特定のpHを有する水溶液は、適した緩衝液を含む水から調製することができる。好ましい緩衝剤は、リン酸二水素ナトリウムおよびリン酸水素二ナトリウム、リン酸ナトリウム、コハク酸二ナトリウムの混合物を含むが、これらに限定されない。本発明において使用される他の緩衝液は、炭酸ナトリウム、重炭酸ナトリウム、水酸化ナトリウム、酢酸アンモニウム、クエン酸ナトリウム、トリス(ヒドロキシ−メチル)アミノエタン、安息香酸ナトリウムなどを含む。
【0154】
エンドキシフェンおよび水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンを含有する組成物中の、エンドキシフェンと水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンとのモル比は、1:10から1:80の間、または1:10から1:80、または1:10から1:60、または1:10から1:50、または1:10から1:40および1:10から1:30などの1:10から1:90の間である。好ましい実施形態において、エンドキシフェンと水素化大豆ホスファチジルコリンまたは大豆ホスファチジルコリンとのモル比は、1:5から1:60の間である。
【0155】
上記のように、組成物は、濾過して、濾液から所望の寸法範囲の複合体粒径を得ることができる。本発明において使用されるフィルターは、濾液から所望の寸法範囲の複合体を得るために使用することができるものを含む。例えば、複合体を形成して、その後、各粒子が約5ミクロン以下の直径を有する複合体を得るために、5ミクロンフィルターを用いて濾過することができる。代替として、1μm、500nm、200nm、100nmまたは他のフィルターを、約1μm、500nm、200nm、100nmの直径または任意の適切な寸法範囲をそれぞれ有する複合体を得るために、使用することができる。
【0156】
所望される場合、エンドキシフェン−脂質複合体は、例えば、蒸発または凍結乾燥によって乾燥することができる。本発明の特定の実施形態において、エンドキシフェン−脂質複合体は、糖などの1種または複数の凍結防止剤とともに凍結乾燥することができる。好ましい実施形態において、糖は、トレハロース、マルトース、ラクトース、スクロース、グルコース、およびデキストランを含むが、これらに限定されない。特に好ましい実施形態において、トレハロースおよび/またはスクロースが使用される。凍結乾燥は、減圧下で行われ、エンドキシフェン脂質調製の事前の凍結の有無にかかわらずに行うことができる。所望される場合、複合体は、水、生理食塩水、デキストロースおよび緩衝液を含む、任意の所望の溶剤中に再懸濁することができる。
【0157】
本発明の組成物を用いて使用される医薬調製物は、錠剤、カプセル剤、丸剤、糖衣錠、坐剤、液剤、懸濁剤、乳剤、軟膏剤、およびゲル剤を含むが、これらに限定されない。経口投与のための、エンドキシフェンまたはエンドキシフェン脂質複合体の好ましい形態は、錠剤、カプセル剤、トローチ剤、散剤、シロップ剤、水溶液、懸濁剤などを含む。局所適用および坐剤のための、エンドキシフェンまたはエンドキシフェン−脂質複合体の好ましい形態は、ゲル剤、オイルおよび乳剤を含み、例えば、ポリエチレングリコール、ある種の脂肪、およびエステル、高含量の多価不飽和脂肪酸ならびにこれらの誘導体を含む組成物の適切な水溶性または水不溶性賦形剤の添加によって形成される。誘導体は、モノ、ジおよびトリグリセリドならびにこれらの脂肪族エステル(例えば、魚油、植物油など)、またはこれらの物質の混合物を含む。適切な賦形剤は、薬物複合体が、治療での使用を可能にするよう十分安定したものである。
【0158】
所望される場合、エンドキシフェンまたはエンドキシフェン−脂質複合体を含有する組成物は、それを胃酸から保護するために、腸溶被覆カプセル内に被包することができる。「腸溶」という用語は、小腸を指し、および腸溶被覆は、それが小腸に到達する前の薬物の放出を防ぐ。腸溶被覆の多くは、酸性pHで安定であるが、より高いpHで急速に分解する表面を存在させることによって機能する。エンドキシフェンまたはエンドキシフェン−脂質複合体を含有する組成物が充填されたカプセルの腸溶被覆は、当分野で既知の方法で行うことができる。
【0159】
本発明のエンドキシフェン−脂質複合体は、様々な寸法であってよく、または実質的に均一な寸法であってよい。例えば、複合体は、約1mm以下の平均直径を有することができ、より好ましくはミクロンまたはサブミクロンの範囲にある。いくつかの好ましい実施形態において、複合体は、0.2μm以下または0.1μm以下などの約5μm以下の平均直径を有する。
【0160】
また、本発明で概説される技術は、任意の他の水不溶性薬物のために使用することができる。本発明の方法および組成物は、2006年10月10日に出願された米国特許出願第60/850,446号、2007年10月10日に出願されたPCT出願第PCT/US07/80984号、2006年11月6日に出願された米国特許出願第60/856,952号、2007年11月6日に出願されたPCT出願第PCT/US07/83832号に開示される方法および組成物と併せて使用され、これらのすべては、参照によりこれら全体が本願明細書に組み込まれる。
【0161】
本発明の組成物は、乳癌および乳房関連疾患を治療するために用いることができる。例えば、本発明の組成物は、良性乳房疾患と診断された患者に投与することができる。本明細書で使用される「良性乳房疾患」という用語は、乳房組織内の様々な非悪性異常を指す。異常は、本来、増殖性または非増殖性であってもよい。本発明の組成物によって治療可能な例示的な良性乳房疾患は、腺症、嚢胞、管拡張症、線維腺腫、線維症、過形成、化生および他の線維嚢胞性変化を含む。それらの有病率に起因して「変化」または「症状」と称されるこれらの各疾患は、明確な組織学的および臨床的特徴を有する。
【0162】
「腺症」は胸の全身性腺疾患を指す。これは、典型的に、通常より多くの腺を含む胸小葉の拡大を伴う。「硬化性腺症」または「線維性腺症」において、拡大した小葉は、瘢痕様の線維組織によって変形する。
【0163】
「嚢胞」は、流体または半固体物質が充填された異常嚢である。胸内の嚢胞は、小葉構造から発生する胸上皮細胞に覆われている。これらは胸腺内部の過剰流体として始まるが、周囲の乳房組織に伸展する割合までに成長し、痛みを生じ得る。「線維嚢胞性」は、顕著な量の線維性結合組織によって取り囲まれる、またはその内部にある嚢胞性病変である。
【0164】
「管拡張症」は、脂質および細胞残屑による乳管の拡張を指す。管の破裂は、顆粒球および血漿細胞による浸潤を誘発する。
「線維腺腫」は腺上皮に由来し、増殖性線維芽細胞および結合組織の顕著な間質を含有する良性腫瘍を指す。
【0165】
「線維症」は、単に、胸の線維組織の突出物を指す。
【0166】
「過形成」とは、腫瘍形成がなく、細胞の幾つかの層が基底膜の内側を覆う細胞の過成長を指す。過形成は乳房組織の大部分を増大させる。「上皮過形成」では、乳管および小葉の内側を覆う細胞が関与しており、「管過形成」および「小葉過形成」という用語につながる。組織学的決定に基づいて、過形成は、「通常」または「非定型」と特徴付けることができる。
【0167】
「化生」は、1つの種類の分化した組織が、別の種類の分化した組織に形質転換する現象を指す。化生は、環境変化に起因することが多く、細胞がより変化に耐えることを可能にする。
【0168】
本発明の組成物は、真菌感染、細菌感染、皮膚リーシュマニア症、内臓リーシュマニア症などのリーシュマニア感染などの感染;ヒト免疫不全ウイルス(HIV)、単純性疱疹ウイルス(HSV−1およびHSV−2)、肝炎ウイルス(A、BおよびC)およびサイトメガロウイルス(CMV)などのウイルス感染;骨粗鬆症および心血管疾患を治療するために使用することができる。本発明の組成物は不妊治療および療法にさらに使用することができる。
【0169】
本発明の組成物は、任意の剤形で、活性化合物エンドキシフェンを、インビボの乳房エストロゲン受容体に送達する任意の系を介して投与することができる。いくつかの実施形態において、本発明の組成物は、例えば、角質層、表皮および真皮層を介して、薬物を患者の皮膚の表面から微小循環に送達するなどの、「経皮投与」によって送達される。これは、一般に、濃度勾配に沿って拡散することによって達成される。拡散は、細胞内浸透(細胞を通して)、細胞間浸透(細胞間)、経付属器的(transappendageal)浸透(毛包、汗腺、および皮脂腺を通じて)、または上記の任意の組み合わせを介して生じ得る。
【0170】
本発明のエンドキシフェン組成物の経皮投与は、これが、全身性の薬物曝露および体全体にわたってエストロゲン受容体を非特異的に活性化させることによる危険性を減少させるために、有利な場合がある。これは、エンドキシフェンの局所適用では、主として局所組織に吸収されるためである。エンドキシフェンを含有する本発明の組成物が、乳房に経皮的に適用される場合、その中の多くのエストロゲン受容体に恐らくは起因して、高い濃度が乳房組織内に蓄積する。エンドキシフェンの組成物は、あらゆる皮膚表面、好ましくは、一方または両方の乳房に適用することができる。投与される日用量は、エンドキシフェンの吸収係数、所望される乳房組織中濃度、および超過すべきではない血漿中濃度に基づいて初回に推定することができる。初回量は、個人応答に応じて、各患者で最適化することができる。
【0171】
経皮投与は、様々な方法で達成することができる。例えば、(i)ある量の製剤を、皮膚の特定の領域に適用する場合に、軟膏剤、乳剤、ゲル剤、ローション剤、クリーム剤などを形成するために、エンドキシフェンの組成物を、適切な医薬担体、および場合によって、浸透促進剤と混合する、(ii)当分野において既知の技術に従って、エンドキシフェンの組成物を、パッチまたは経皮送達系に取り込むなどである。
【0172】
経皮薬物投与の有効性は、薬物濃度、適用の表面積、回数および持続時間、皮膚温度、皮膚の水分量、以前の照射、薬物の物理化学的特性、および製剤と皮膚との間の薬物の分配などの多くの因子に依存する。いくつかの実施形態において、例えば、経皮的有効性を増強させるために、組成物または複合体は、その物理化学的特性を可逆的に変化させて角質層の抵抗を減少させることによって、共溶剤の役割を果たす角質層内の水和を変化させること、または細胞内空間における脂質もしくはタンパク質の組織化を変化させることによって、経皮吸収を向上させる浸透促進剤を含む。そのような促進剤は、アルコール、アセトン、ジメチルスルホキシド(DMSO)、ポリエチレングリコール、プロピレングリコール、脂肪酸および脂肪アルコールならびにこれらの誘導体、ヒドロキシル酸、ピロリドン、尿素、植物油、精油、ならびにこれらの混合物などの有機溶剤を含むが、これらに限定されない。化学的促進剤に加えて、物理的方法で経皮吸収を増強させることができる。例えば、密封包帯は、皮膚の水和を誘発する。他の物理的方法は、イオン導入および超音波導入を含み、これは、それらの寸法およびイオン特性のために吸収されにくい薬物の吸収を増強させるために、それぞれ電場および高周波数超音波を使用する(12〜13)。医薬分野に携わる者は、経皮送達のための正しい有効な投与量を実現する種々の因子および方法を容易に操作することができる。
【0173】
経皮投与のために、エンドキシフェンを含有する本発明の製剤または組成物は、軟膏剤、乳剤(ローション剤)、クリーム剤、ゲル剤、散剤、オイルまたは同様の製剤の形態で送達することができる。いくつかの実施形態において、製剤は、大豆油,からし油、扁桃油、オリーブ油、ラッカセイ油,ピーナッツ油、杏仁油、ラッカセイ油、ヒマシ油、菜種油などの植物油、動物性脂肪、DMSO、ラノリンリポイド、リン脂質、パラフィン類などの炭化水素、ワセリン、ワックス、レシチン,界面活性剤乳化剤、カロチン、アルコール、グリセロール、グリセロールエーテル、グリセリン、グリコール、グリコールエーテル、ポリエチレングリコール、ポリプロピレングリコール、不揮発性脂肪アルコール、酸、エステル、揮発性アルコール化合物、タルク、尿素、セルロース誘導体、着色剤、抗酸化剤および保存料などを含むがこれらに限定されない、賦形剤添加物を含む。
【0174】
いくつかの実施形態において、エンドキシフェンを含有する本発明の製剤または組成物は、経皮パッチとして送達することができる。パッチは、(i)溶液不浸透性裏当て箔、(ii)空洞を有する層状要素、(iii)微多孔または半透膜、(iv)自己接着層、および(v)場合によって、除去可能な裏当て膜を含んでよい。空洞を有する層状要素は、裏当て箔および膜によって形成することができる。代替として、パッチは、(i)溶液不浸透性裏当て箔、(ii)貯蔵器としての開放気孔発泡体、閉鎖気孔発泡体、組織様層または繊維織物様層、(iii)自己接着層、および(iv)場合によって、除去可能な裏当て膜を含んでよい。
【0175】
いくつかの好ましい実施形態において、エンドキシフェンを含有する本発明の組成物は、含水アルコールゲル剤中で製剤化され、エンドキシフェンの量は、ゲル剤100グラム当たり0.001001から1.0グラムまで変動し、最も好ましくはゲル剤100グラム当たり0.01から0.20グラムの範囲内であってよい。
【0176】
他の実施形態において、本発明の組成物は、浸透促進剤として1種または複数の脂肪酸エステルを含む。脂肪酸エステル浸透促進剤の非常に好ましい例の1つは、ミリスチン酸イソプロピルである。ミリスチン酸イソプロピルをゲル剤中で使用する場合、量は、例えば、ゲル剤100グラム当たり0.11から5.0グラムまで、好ましくはゲル剤100グラム当たり0.5から2.0グラムまでの範囲であってよい。
【0177】
もう一つの好ましい実施形態において、エンドキシフェンを含有する本発明の組成物はまた、アルコール性ビヒクルなどの1種または複数の非水性ビヒクルを含有し得る。非水性ビヒクルの例は、酢酸エチル、エタノール、およびイソプロパノール、好ましくはエタノールおよびイソプロパノールを含む。これらの非水性ビヒクルは、使用される活性薬剤エンドキシフェンおよび任意の他の浸透促進剤の両方を溶解するために有用であり得る。また、これらは、好ましくは、皮膚と接触すると急速に蒸発できるように、低沸点を有し、好ましくは、大気圧で100℃未満である。特に、エタノールは、皮膚との接触後に急速に蒸発することによって、エンドキシフェンの経皮吸収に効果的に寄与し得る。ゲル製剤中の無水非水性ビヒクルの量は、35重量%から99重量%までの範囲、好ましくは50%から85%の間、より好ましくは60%から75%の間である。
【0178】
別の好ましい実施形態において、本発明の組成物または製剤は、親水性分子の可溶化を可能にし、皮膚の加湿を促進する水性ビヒクルを含む。水性ビヒクルはまた、pHを調節することができる。水性ビヒクルは、リン酸緩衝溶液(例えば、リン酸水素二ナトリウムまたはリン酸二水素ナトリウム)を含むリン酸緩衝溶液、クエン酸緩衝溶液(例えば、クエン酸ナトリウムまたはクエン酸カリウム)および精製水を含む、アルカリ化および塩基性緩衝溶液を含む。水性ビヒクルの量は、好ましく、医薬組成物の0.1重量%から65重量%の間、より好ましくは15%から50%の間、さらにより好ましくは25%から40%の間の範囲である。
【0179】
他の実施形態において、本発明の組成物は、組成物または製剤の粘性を増大させるために、または可溶化剤として機能するように、1種または複数のゲル化剤を含む。これは、ゲル化剤の性質に応じて、製剤の0.1重量%から20重量%の間、好ましくは0.5%から10%の間、より好ましくは0.5%から5%の間を構成し得る。ゲル化剤は、カルボマー、セルロース誘導体、ポロキサマーおよびポロキサミンであってよい。好ましいゲル化剤は、キトサン、デキストラン、ペクチン、天然ゴム、およびエチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、カルボキシメチルセルロース(CMC)などのセルロース誘導体である。最も好ましいゲル化剤はヒドロキシプロピルセルロースである。
【0180】
本発明の組成物は、上記のようなゲル化剤、特に事前に中和されていないアクリルポリマーを含んでもよく、また中和剤も含み得る。中和剤/ゲル化剤の比率は、10:1から0.1:1の間、好ましくは7:1から0.5:1の間、より好ましくは4:1から1:1の間で変化する。ポリマーの存在下における中和剤は、ビヒクルに可溶である塩を形成すべきである。また、中和剤は、電荷の中和およびポリマー塩の形成時に、ポリマー鎖の最適な膨潤を可能にすべきである。中和剤は、水酸化アンモニウム、水酸化カリウム、水酸化ナトリウム、アミノメチルプロパノール、トロラミン、およびトロメタミンを含む。当業者は、組成物または製剤において使用するゲル化剤の種類に従って、中和剤を選択するであろう。しかし、セルロース誘導体をゲル化剤として使用する時は、中和剤は必要とされない。
【0181】
いくつかの実施形態において、本発明の組成物は、他の疾患を治療するために用いられ、薬物は、喘息治療薬、抗不整脈薬、抗真菌薬、降圧剤、抗癌薬、抗生物質、抗糖尿病薬、抗ヒスタミン薬、抗寄生虫薬、抗ウイルス薬,強心配糖体、ホルモン、免疫療法、抗低血圧薬、ステロイド、鎮静剤および鎮痛薬、精神安定薬、ワクチン、ならびに細胞表面受容体遮断薬からなる群の、誘導体化により、親油性化合物または親油性にされた化合物から選択される。
【0182】
本発明について記載する文脈における(特に以下の特許請求の範囲の文脈で)、「a」、および「an」、および「the」という用語、および類似の指示対象の使用は、本明細書において別途指示されるか、文脈により明らかに矛盾しない限り、単数および複数の両方を対象とすると解釈されるべきである。「〜を含む(含有する)」、「〜を含む」、「〜を有する」、および「〜を含有する(含む)」という用語は、別途指摘のない限り、限定のない用語(すなわち、「〜を含むが、これらに限定されない」を意味する)として、解釈されるものとする。本明細書において提供される、あらゆる例、または例を示す言葉(例えば「〜など」)の使用は、単に、本発明の理解をより容易にすることが意図され、別途言及のない限り、本発明の範囲に制限を課すことはない。本明細書における、いかなる言葉遣いも、いずれかの非言及要素を、本発明の実施に必須であることを示していると、解釈されるべきではない。
【0183】
本発明を実施するための、本発明者らが知る最良の様式を含む、本発明の好ましい実施形態が記載される。これらの好ましい実施形態の変形物は、そのような変形物を適切に利用する当業者には明白であり、本発明者らは、本発明を、本明細書に具体的に記載されたのとは別の方法で、実施することを意図する。したがって、本発明は、適用法令により許可される、本明細書に添付される特許請求の範囲に示される内容のすべての変形物および均等物を含む。さらに、上記要素の、そのすべての可能な変形物の形態でのあらゆる組み合わせは、本明細書において別途指示されるか、文脈により明らかに矛盾しない限り、本発明により包含される。
【実施例】
【0184】
以下の実施例は、本発明をさらに例証するものであり、決してその範囲を限定すると解釈されるべきではない。
【0185】
実施例1
化合物3の合成
【化7】

【0186】
4−ブロモフェノールブルー(1、1kg)および3,4−ジヒドロ−2H−ピラン(2、1.5L)を、丸底フラスコ内で一緒に混合し、0℃まで冷却した。濃硫酸(1mL)を室温より低い温度に維持しながら滴下した。溶液を室温で1時間撹拌した。反応溶液をヘキサンで希釈し、水(1L)、続いて5%重炭酸ナトリウム溶液(1L)で洗浄した。有機層を硫酸ナトリウムで乾燥し、濾過して、50〜55℃で真空中で蒸発させ、油(1.55Kg)を得た。ヘキサン(300mL)を油に添加し、摩砕して、白色固体3を得た。懸濁液は0℃まで冷却して、30分間撹拌し、次に濾過して、冷ヘキサン(100mL)で洗浄し、乾燥した。収量1.32Kg。
【0187】
実施例2
化合物5の合成
【化8】

【0188】
削り屑状マグネシウム(115g)を、無水テトラヒドロフラン(1L)を含有する10Lの4つ口丸底フラスコに添加した。混合物を55℃まで加熱した。ヨウ素チップ(約5)を1ロットで、続いて臭化エチル(5mL)を添加した。化合物3(1.1kg)をTHF(2L)に溶解した。200mLのこの溶液を、Mg−THF懸濁液中に1度に添加した。反応は30分後に始まり、還流が始まった。化合物3の残りの溶液は、1.5時間にわたって還流温度を維持しながら滴下した。反応混合物は、2時間さらに還流し、室温まで冷却した。THF(1.5L)中(2−クロロエトキシフェニル)フェニルブタノン(4、870g)を、30〜35℃の間の温度を維持しながら1時間にわたって滴下した。反応混合物を4時間さらに還流し、室温まで冷却した。反応混合物を氷冷の50%塩酸(3L)に注いだ。有機層を分離し、水層をTHF(3x500mL)で抽出した。有機層を合わせ、硫酸ナトリウム上で乾燥し、濾過して濃縮し、オイルとして5を得た。これはさらに精製することなく、次の段階に使用した。収量1.57kg。
【0189】
実施例3
化合物6の合成
【化9】

【0190】
化合物(5、1.57kg)をメタノール(6L)に溶解し、濃塩酸(1.57kg)を添加した。溶液を5時間還流させた。メタノールを真空中で除去し、ジクロロメタン(5L)を添加した。有機層を分離した。水層をジクロロメタン(2x500mL)で抽出した。有機層を合わせ、水(2L)、5%NaHCO3水溶液(2L)、水(2L)で洗浄して、硫酸ナトリウムで乾燥した。木炭を添加して、濾過した。溶剤を減圧下で除去し、オイル(1.38kg)を得た。オイルを激しく撹拌しながらヘキサン(5L)で摩砕し、固形生成物として6を得、これを濾過して乾燥した。収量1.07kg。
【0191】
実施例4
化合物Iの合成
【化10】

【0192】
イソプロパノール(500mL)中の化合物6(50g)の溶液に、モノメチルアミン(300mL)を添加し、70〜75℃の温度を維持しながら24時間加熱した。反応の完了は、TLC(トルエン:トリエチルアミン、7:3)によってモニターした。溶剤を真空中で除去した。水(500mL)を残渣に添加し、ジイソプロピルエーテル(DIPE、500mL)で抽出した。有機層を分離し、水層をDIPE(200mL)で逆抽出した。有機層を合わせて、水(500mL)、5%重炭酸ナトリウム(500mL)水溶液で洗浄し、硫酸ナトリウム上で乾燥して、濾過した。溶剤を真空中で除去し、粘着性残渣を得た。酢酸エチル(50mL)を添加し、加熱し、残渣を完全に溶解した。溶液を室温まで冷却し、ヘキサン(50mL)を添加して12時間撹拌した。固体を濾過して、冷酢酸エチル−ヘキサン(1:1、10mL)混合物で洗浄した。生成物Iは、高真空下で一晩乾燥した。収量25g。
【0193】
実施例5
エンドキシフェン溶液
0.2%氷酢酸(10mL)中でエンドキシフェン(10.3mg)を可溶化することによって、エンドキシフェン溶液(1mg/mL)を調製した。溶液のpH(約5.75)は、1N水酸化ナトリウム(300μL)で調節した。
【0194】
実施例6
エンドキシフェン溶液
2%氷酢酸(8.6mL)中でエンドキシフェン(100mg)を可溶化することによって、エンドキシフェン溶液(5mg/mL)を調製した。溶液は、5%デキストロース(10.97mL)で希釈した。溶液のpH(約5.56)は、5N水酸化ナトリウム(430μL)で調節した。
【0195】
実施例7
エンドキシフェン複合体
エンドキシフェン、硫酸コレステリルおよび大豆レシチンの懸濁液を、水中で成分を一緒に混合し、例えば、高圧ホモジナイザーを使用して、均質化することによって生成する。結果として生じる懸濁液を、0.2μmフィルターに通して濾過し、次いで、7.5%スクロース溶液と混合し、バイアル中またはバルク中のいずれかで凍結乾燥することができる。結果として生じる複合体の粒径は、標準的な手順を使用して、例えば、Nicomp粒子測定器380を使用して決定する。
【0196】
実施例8
エンドキシフェン複合体
エンドキシフェンおよび大豆レシチンの懸濁液を、水中で成分を一緒に混合し、例えば、高圧ホモジナイザーを使用して、均質化することによって生成する。結果として生じる懸濁液は、0.2μmフィルターに通して濾過し、次いで7.5%スクロース溶液と混合し、バイアル中またはバルク中のいずれかで凍結乾燥することができる。粒径は、標準的な手順を使用して、例えば、Nicomp粒子測定器380を使用して決定する。
【0197】
実施例9
毒性試験
エンドキシフェンは、実施例6に従って製剤化し、雄性Balb/cマウスにおいて毒性を試験した。100mg/kgまたは50mg/kgでの単回試験量を、マウスに静脈内投与した。すべてのマウスは100mg/kg用量レベルで死亡したのに対して、すべての動物は50mg/kg用量レベルで生存し、有意な体重減少はなかった。また、マウスは、エンドキシフェンを含まないビヒクル対照を用いた対照群においても生存した。25mg/kgの用量を3日間連続的に投与して反復投与毒性試験を行い、75mg/kg用量蓄積した。この群の動物はすべて生き残った。合計数あたりの生存マウス数として、結果を下表に報告する。
【表1】

【0198】
実施例10
エンドキシフェンは、様々な腫瘍細胞に対して抗増殖活性を示す
エンドキシフェンを、非小細胞肺癌、乳癌、前立腺癌、メラノーマ癌、卵巣癌、CNS癌、腎癌および大腸癌からの種々の癌細胞株に対する抗増殖活性について試験した。細胞は、エンドキシフェン(10nMから10μM)と共に数日間(3〜6)インキュベートし、増殖の阻害を、SRBまたはMTT染色法で測定した。その結果、エンドキシフェンの存在下において、10から100%の範囲の有意な細胞の増殖阻害を示した。種々の腫瘍細胞内における増殖阻害または細胞死滅のエンドキシフェンの誘発は、ヒトの癌の治療でのエンドキシフェンの有用性を示す。
【0199】
実施例11
エンドキシフェンはエストラジオール依存性の乳房腫瘍成長を阻害する
タモキシフェンは、エストラジオール依存性の乳癌異種移植片増殖に拮抗することが知られている(34)。経口剤形中のエンドキシフェン塩基およびエンドキシフェン−クエン酸塩を、エストラジオール依存性のMCF−7異種移植片増殖の阻害に関して同様に試験することができる。動物実験のために、4から6週齢および体重20から24gの雌性ヌードマウス(Bom:NMRI−nu/nu)を、異種移植片実験ごとに標準プロトコルに従って使用する。そのような手順の例は、以下の通りである。
【0200】
エストラジオールで処置した卵巣摘出の胸腺欠損ヌードマウスにおいて確立した元の腫瘍からの移植可能な腫瘍の継代によってMCF−7異種移植片を発生させる(35)。
【0201】
無作為に繁殖させた雌性胸腺欠損マウスを、両側的に卵巣摘出し、腫瘍材料の埋め込み前に、2週間回復させる。MCF−7腫瘍断片(寸法1x1x1mm3)の皮下(s.c.)移植を、麻酔下で行う。腫瘍の直径は、カリパス様機械計器を使用して、例えば週1回など、定期的に測定し、腫瘍体積(V)を、経験式V=(長さx幅2)/2に従って計算する。各群の体積中間値を、初回の腫瘍体積に対して規格化し、相対的な腫瘍体積が得られる。すべての実験において、担腫瘍マウスは、エストラジオール補給[吉草酸エストラジオール(E2D)、0.5mg/kg、週1回、筋肉内(i.m.)]を受ける。この補給は、ヒトの状態(卵胞期に応じて25〜600pg/mL)に相当する血清E2(25〜984pg/mL)の生理的濃度をもたらす。
【0202】
物質:物質、E2D、タモキシフェンおよびエンドキシフェンを使用する。
【0203】
治療法:MCF−7移植動物はすべて、週に1回E2D(0.5mg/kg)注射を受ける。4週後、ホルモン補給腫瘍が、直径で約0.7〜0.8cm(180〜250mm3)に成長した時に、マウスを、それぞれ5〜10匹のマウスの4つの治療群にランダム化する。5〜10匹のマウスを、E2D単独についての基線対照として屠殺する。
【0204】
治療群は、次の通りである。(i)E2D補給(0.5mg/kg週1回、筋肉内)、(ii)E2D補給(0.5mg/kg週1回、筋肉内)に加えてタモキシフェン、1日当たり(0.5mg〜2mg)/マウス、強制経口により週5回、(iii)E2D補給(0.5mg/kg週1回、筋肉内)に加えてエンドキシフェン、1日当たり(0.5mg〜2mg)/マウス、強制経口により週5回、(iv)E2D補給の中止。
【0205】
この乳癌腫瘍モデルにおける腫瘍増殖の阻害は、ヒトの乳癌治療における治療効果を示す(34)。
【0206】
実施例12
エンドキシフェンはエストロゲンの子宮肥大作用を最小化させる
タモキシフェンは、動物およびインビトロモデルにおいて強力な抗エストロゲン作用を有する非ステロイド薬であることが知られている。この薬理学的特性は、乳房組織内のエストロゲン受容体をめぐってエストロゲンと競合し、子宮、腟および卵巣へのエストロゲンの刺激作用を阻害する薬物の能力に関連する(36)。
【0207】
エンドキシフェン(0.1mg〜2mg)を、エストラジオールの子宮肥大作用の減少を判断するために、28日間にわたり1日1回経口投与する。およそ50日齢および体重19〜20gの雌性BALB/cマウスを入取し(例えば、Charles−River,Inc.から)、温度(23±1℃)および光(12時間の光/1日)でケージごとに4匹から5匹を収容する。萎縮変化をマウスにおいて観察する。ビヒクル対照、タモキシフェンおよびエンドキシフェンなどの3つの群がある。動物(5〜10匹のマウス)を、各群に無作為に割り当てる。タモキシフェンまたはエンドキシフェンの強制経口による用量(例えば、0.1mg〜2mg)での、無傷のマウスの毎日の処置は、子宮および腟体重の進行性阻害を導くことが予期される。
【0208】
そのような結果は、エンドキシフェンが、タモキシフェンよりもエストロゲンの子宮肥大作用をより良好に最小化させること、およびエンドキシフェンが、有効な抗エストロゲンとして使用されることを示すであろう。また、エストロゲンによって刺激される子宮体重増加のエンドキシフェン遮断を、未成熟ラットにおいて実証することができる。上記の作用を示すエンドキシフェン調製物は、乳癌の治療、子宮内膜症、平滑筋腫および良性乳房疾患などの他のエストロゲン感受性状態の治療、ならびに男性および女性における他のエストロゲン応答性状態の治療における用途がある。
【0209】
実施例13
増殖性乳癌細胞におけるKi−67抗原発現の、エンドキシフェンによる減少
Ki−67は、核非ヒストンタンパク質である。この抗原は、静止細胞内に存在せず、増殖性細胞内に発現し、バイオマーカーとして使用される(37,38)。経口または注射可能な形態において、エンドキシフェン塩基またはエンドキシフェン−クエン酸塩を、異種移植片乳癌腫瘍モデル(例えば、上記のような)に、ならびに乳癌患者に与える。Ki−67の免疫化学的定量は、患者からのならびに実施例11に記述した担腫瘍マウスからの乳癌組織に由来する腫瘍細胞で行う。MIB−1、またはDAKO,Carpenteria,CAなどの商業的供給源から入手可能な同様の抗体を、抗原の免疫化学的局在化のために使用する。動物および/または乳癌患者におけるKi−67抗原発現の減少は、乳癌の治療におけるエンドキシフェンの適用性を実証する。
【0210】
実施例14
エンドキシフェンは乳癌のIGF−1レベルを低下させる
タモキシフェンが、ヒトについて血中インスリン様成長因子I(IGF−1)のレベルを低下させることが知られている。IGF−1は、代替バイオマーカーとして使用されており、乳癌患者の治療におけるタモキシフェンの有効性を予測する(39)。本発明のエンドキシフェン調製物の作用を試験するために、エンドキシフェン塩基またはエンドキシフェン−クエン酸塩を、乳癌腫瘍を有する実験動物に経口で投与するか、または注入する。対照におけるIGF−1レベルの濃度および異種移植した乳房腫瘍を、既存のアッセイ(例えば、Diagnostics Systems Laboratories,London,UKまたはDAKO,Carpenteria,CAからのELISAキット)でモニターする。エンドキシフェンは、1週間に5日、1日当たり0.5mg〜2mgを強制経口投与する。IGF−1レベルの低下および腫瘍増殖減少は、乳癌に対する代替マーカーとしてのIGF−1の有用性を示唆する。
【0211】
実施例15
エンドキシフェンはビカルタミド誘発の女性化乳房および乳房痛の発生を予防する
ビカルタミド(CasodexR)は、男性における前立腺癌を治療するために使用される。IGF−1が、前立腺癌の促進および進行に関与し得るという根拠が増加している。また、タモキシフェンなどの抗エストロゲン薬が、IGF−1レベルを低下させ、前立腺癌患者におけるbiculatamide誘発の女性化乳房を予防することも知られている(40)。エンドキシフェンは、タモキシフェン抗エストロゲンの活性代謝物であるため、biculatamideとともに、移植のためのエンドキシフェン含有シラスティック持続放出カプセルまたは経口量のエンドキシフェン(1mg〜10mg/日)は、biclutamide誘発の女性化乳房および乳房痛の発生を予防することが期待される。
【0212】
実施例16
インビトロでのエンドキシフェンによるPKCの阻害
エンドキシフェンPKC阻害活性を試験するためにPKCキナーゼ活性アッセイキット(Assay Designs,Ann Arbor,MI)を用いた。0.025、0.05、0.1、または、0.2mMエンドキシフェンをPKC10ng/ウェルを含有する反応混合物に使用した。同一濃度のタモキシフェンを陽性対照として使用した。エンドキシフェンは濃度に応じてPKC活性を阻害した。PKC阻害百分率は、エンドキシフェン濃度0.025〜0.2mMの間で、それぞれ、12から80の間の範囲であった。それに比べて、タモキシフェンは、試験したところ、0.1および0.2mMで、それぞれ、35および25%のPKC阻害であり、タモキシフェン(0.025および0.05mM)のより低い濃度ではPKC阻害は無視でき、タモキシフェンはそれほど強力でないPKC阻害薬であることが分かった。図5は、0.2mMでエンドキシフェンおよびタモキシフェン誘発されたPKC阻害を示す。この検討は、エンドキシフェンがタモキシフェンより少なくとも4倍強力なPKC阻害薬であることを実証し、躁病の障害における役割を示唆する。
【0213】
実施例17
エンドキシフェンの安全性を2種のげっ歯類で評価した。エンドキシフェンの亜慢性毒性の検討をマウスおよびラットで行った。その結果、28日間毎日のマウスへの最大8mg/kgまたはラットへの最大4mg/kgのエンドキシフェンの経口投与によって、死亡を起こさなかった。全体の病理学検査では、処置群と関係する異常は現れず、動物は毒性の臨床症状がなかった。
【0214】
実施例18
ラットにおいて行った比較薬物動態試験は、その経口投与されたエンドキシフェン(10mg/kg)はタモキシフェンの同一用量(10mg/kg)投与後のエンドキシフェン濃度と比較して、10倍高いエンドキシフェン血漿中濃度を示した。
【0215】
下記のリストおよびその他本明細書に記載したものを含む、本明細書に記載した刊行物、特許出願、および特許を含むすべての参考文献は、各参考文献が、それぞれ参照によって個別かつ明確に組み込まれることが示され、本明細書にその全体が記述されるのと同様に、参照することにより組み込まれる。
【0216】
参考文献
1. Furr,B.J.,and V.C.Jordan.1984.The pharmacology and clinical uses of tamoxifen.Pharmacol Ther 25:127−205.
2. Osborne,C.K.1998.Tamoxifen in the treatment of breast cancer.N Engl J Med 339:1609−1618.
3. Fisher,B.,J.P.Costantino,D.L.Wickerham,C.K.Redmond,M.Kavanah,W.M.Cronin,V.Vogel,A.Robidoux,N.Dimitrov,J.Atkins,M.Daly,S.Wieand,E.Tan−Chiu,L.Ford,and N.Wolmark.1998.Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P−1 Study.J Natl Cancer Inst 90:1371−1388.
4. Stearns,V.,L.Ullmer,J.F.Lopez,Y.Smith,C.Isaacs,and D.Hayes.2002.Hot flushes.Lancet 360:1851−1861.
5. Stearns,V.,M.D.Johnson,J.M.Rae,A.Morocho,A.Novielli,P.Bhargava,D.F.Hayes,Z.Desta,and D.A.Flockhart.2003.Active tamoxifen metabolite plasma concentrations after coadministration of tamoxifen and the selective serotonin reuptake inhibitor paroxetine.J Natl Cancer Inst 95:1758−1764.
6. Otton,S.V.,S.E.Ball,S.W.Cheung,T.Inaba,R.L.Rudolph,and E.M.Sellers.1996.Venlafaxine oxidation in vitro is catalysed by CYP2D6.Br J Clin Pharmacol 41:149−156.
7. Bijl,M.J.,L.E.Visser,A.Hofman,A.G.Vulto,T.van Gelder,B.H.Stricker,and R.H.van Schaik.2008.Influence of the CYP2D6*4 polymorphism on dose,switching and discontinuation of antidepressants.Br J Clin Pharmacol 65:558−564.
8. Manji,H.K.,and R.H.Lenox.2000.The nature of bipolar disorder.J Clin Psychiatry 61 Supp 13:42−57.
9. Einat,H.,P.Yuan,S.T.Szabo,S.Dogra,and H.K.Manji.2007.Protein kinase C inhibition by tamoxifen antagonizes manic−like behavior in rats: implications for the development of novel therapeutics for bipolar disorder.Neuropsychobiology 55:123−131.
10. Yildiz,A.,S.Guleryuz,D.P.Ankerst,D.Ongur,and P.F.Renshaw.2008.Protein kinase C inhibition in the treatment of mania: a double−blind,placebo−controlled trial of tamoxifen.Arch Gen Psychiatry 65:255−263.
11. Zarate,C.A.,Jr.,J.B.Singh,P.J.Carlson,J.Quiroz,L.Jolkovsky,D.A.Luckenbaugh,and H.K.Manji.2007.Efficacy of a protein kinase C inhibitor (tamoxifen) in the treatment of acute mania: a pilot study.Bipolar Disord 9:561−570.
12. Kulkarni,J.,C.Gurvich,H.Gilbert,F.Mehmedbegovic,L.Mu,N.Marston,E.Gavrilidis,and A.de Castella.2008.Hormone modulation: a novel therapeutic approach for women with severe mental illness.Aust N Z J Psychiatry 42:83−88.
13. Dhandapani,K.M.,and D.W.Brann.2002.Protective effects of estrogen and selective estrogen receptor modulators in the brain.Biol Reprod 67:1379−1385.
14. O’Neill,K.,S.Chen,and R.D.Brinton.2004.Impact of the selective estrogen receptor modulator,raloxifene,on neuronal survival and outgrowth following toxic insults associated with aging and Alzheimer’s disease.Exp Neurol 185:63−80.
15. Lim,Y.C.,Z.Desta,D.A.Flockhart,and T.C.Skaar.2005.Endoxifen (4−hydroxy−N−desmethyl−tamoxifen) has anti−estrogenic effects in breast cancer cells with potency similar to 4−hydroxy−tamoxifen.Cancer Chemother Pharmacol 55:471−478.
16. Lim,Y.C.,L.Li,Z.Desta,Q.Zhao,J.M.Rae,D.A.Flockhart,and T.C.Skaar.2006.Endoxifen,a secondary metabolite of tamoxifen,and 4−OH−tamoxifen induce similar changes in global gene expression patterns in MCF−7 breast cancer cells.J Pharmacol Exp Ther 318:503−512.
17. DiazGranados,N.,and C.A.Zarate,Jr.2008.A review of the preclinical and clinical evidence for protein kinase C as a target for drug development for bipolar disorder.Curr Psychiatry Rep 10:510−519.
18. Kulkarni,J.,K.A.Garland,A.Scaffidi,B.Headey,R.Anderson,A.de Castella,P.Fitzgerald,and S.R.Davis.2006.A pilot study of hormone modulation as a new treatment for mania in women with bipolar affective disorder.Psychoneuroendocrinology 31:543−547.
19. Lindamer,L.A.,J.B.Lohr,M.J.Harris,and D.V.Jeste.1997.Gender,estrogen,and schizophrenia.Psychopharmacol Bull 33:221−228.
20. Salem,J.E.,and A.M.Kring.1998.The role of gender differences in the reduction of etiologic heterogeneity in schizophrenia.Clin Psychol Rev 18:795−819.
21. Hendrick,V.,L.L.Altshuler,and V.K.Burt.1996.Course of psychiatric disorders across the menstrual cycle.Harv Rev Psychiatry 4:200−207.
22. Chang,S.S.,and D.C.Renshaw.1986.Psychosis and pregnancy.Compr Ther 12:36−41.
23. Steinman,L.2001.Multiple sclerosis: a two−stage disease.Nat Immunol 2:762−764.
24. Whitacre,C.C.2001.Sex differences in autoimmune disease.Nat Immunol 2:777−780.
25. El−Etr,M.,S.Vukusic,L.Gignoux,F.Durand−Dubief,I.Achiti,E.E.Baulieu,and C.Confavreux.2005.Steroid hormones in multiple sclerosis.J Neurol Sci 233:49−54.
26. Riggs,B.L.,and L.C.Hartmann.2003.Selective estrogen−receptor modulators −− mechanisms of action and application to clinical practice.N Engl J Med 348:618−629.
27. Shang,Y.,and M.Brown.2002.Molecular determinants for the tissue specificity of SERMs.Science 295:2465−2468.
28. Bebo,B.F.,Jr.,B.Dehghani,S.Foster,A.Kurniawan,F.J.Lopez,and L.S.Sherman.2009.Treatment with selective estrogen receptor modulators regulates myelin specific T−cells and suppresses experimental autoimmune encephalomyelitis.Glia 57:777−790.
29. Yaffe,K.,K.Krueger,S.R.Cummings,T.Blackwell,V.W.Henderson,S.Sarkar,K.Ensrud,and D.Grady.2005.Effect of raloxifene on prevention of dementia and cognitive impairment in older women: the Multiple Outcomes of Raloxifene Evaluation (MORE) randomized trial.Am J Psychiatry 162:683−690.
30. Hornykiewicz,O.1998.Biochemical aspects of Parkinson’s disease.Neurology 51:S2−9.
31. Oh,J.D.,A.I.Geller,G.Zhang,and T.N.Chase.2003.Gene transfer of constitutively active protein kinase C into striatal neurons accelerates onset of levodopa−induced motor response alterations in parkinsonian rats.Brain Res 971:18−30.
32. Smith,C.P.,J.D.Oh,F.Bibbiani,M.A.Collins,I.Avila,and T.N.Chase.2007.Tamoxifen effect on L−DOPA induced response complications in parkinsonian rats and primates.Neuropharmacology 52:515−526.
33. O’Neill,K.,S.Chen,and R.Diaz Brinton.2004.Impact of the selective estrogen receptor modulator,tamoxifen,on neuronal outgrowth and survival following toxic insults associated with aging and Alzheimer’s disease.Exp Neurol 188:268−278.
34. Johnston,S.R.,I.M.Boeddinghaus,S.Riddler,B.P.Haynes,I.R.Hardcastle,M.Rowlands,R.Grimshaw,M.Jarman,and M.Dowsett.1999.Idoxifene antagonizes estradiol−dependent MCF−7 breast cancer xenograft growth through sustained induction of apoptosis.Cancer Res 59:3646−3651.
35. Iino,Y.,D.M.Wolf,S.M.Langan−Fahey,D.A.Johnson,M.Ricchio,M.E.Thompson,and V.C.Jordan.1991.Reversible control of oestradiol−stimulated growth of MCF−7 tumours by tamoxifen in the athymic mouse.Br J Cancer 64:1019−1024.
36. Suh,N.,A.L.Glasebrook,A.D.Palkowitz,H.U.Bryant,L.L.Burris,J.J.Starling,H.L.Pearce,C.Williams,C.Peer,Y.Wang,and M.B.Sporn.2001.Arzoxifene,a new selective estrogen receptor modulator for chemoprevention of experimental breast cancer.Cancer Res 61:8412−8415.
37. Assersohn,L.,J.Salter,T.J.Powles,R.A’Hern,A.Makris,R.K.Gregory,J.Chang,and M.Dowsett.2003.Studies of the potential utility of Ki67 as a predictive molecular marker of clinical response in primary breast cancer.Breast Cancer Res Treat 82:113−123.
38. Kenny,F.S.,P.C.Willsher,J.M.Gee,R.Nicholson,S.E.Pinder,I.O.Ellis,and J.F.Robertson.2001.Change in expression of ER,bcl−2 and MIB1 on primary tamoxifen and relation to response in ER positive breast cancer.Breast Cancer Res Treat 65:135−144.
39. Nahta,R.,G.N.Hortobagyi,and F.J.Esteva.2003.Growth factor receptors in breast cancer: potential for therapeutic intervention.Oncologist 8:5−17.
40. Saltzstein,D.,P.Sieber,T.Morris,and J.Gallo.2005.Prevention and management of bicalutamide−induced gynecomastia and breast pain: randomized endocrinologic and clinical studies with tamoxifen and anastrozole.Prostate Cancer Prostatic Dis 8:75−83.
【特許請求の範囲】
【請求項1】
対象の神経変性障害または精神障害の治療としての、エンドキシフェンまたはその薬学的に許容される塩を含む組成物の使用。
【請求項2】
対象の神経変性障害または精神障害に対する素因の治療としての、エンドキシフェンまたはその薬学的に許容される塩を含む組成物の使用。
【請求項3】
精神障害が双極性障害である、請求項1または請求項2に記載の使用。
【請求項4】
神経変性障害が、多発性硬化症、統合失調症、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症およびてんかんからなる群から選択される、請求項1または請求項2に記載の使用。
【請求項5】
前記エンドキシフェンを含む組成物が、含水アルコール性ゲル、含水アルコール性溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤、錠剤、カプセル剤、腸溶被覆カプセル剤、腸溶被覆錠、トローチまたはオイル中で製剤化される、請求項1または請求項2に記載の使用。
【請求項6】
前記エンドキシフェンを含む組成物が、浸透促進剤、水性ビヒクル、アルコール性ビヒクルおよびゲル化剤を含有する含水アルコール性組成物中で製剤化される、請求項1または請求項2に記載の使用。
【請求項7】
前記含水アルコール性組成物が中和剤を含み、前記中和剤が、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、アミノメチルプロパノール、アルギニン、トロラミンおよびトロメタミンからなる群から選択され、前記中和剤が約1:1から約4:1の中和剤/ゲル化剤の比で存在する、請求項6に記載の使用。
【請求項8】
前記含水アルコール性組成物が、
(i)約0.01から0.20重量%のエンドキシフェン
(ii)約0.1から2.0重量%、好ましくは約0.5から2.0重量%のミリスチン酸イソプロピル
(iii)約50.0から80.0重量%、好ましくは約60.0から75.0重量%のアルコール
(iv)約20.0から60.0重量%、好ましくは約25.0から50.0重量%の水性ビヒクル、および
(v)約1.0から10.0重量%、好ましくは約0.5から5.0重量%のゲル化剤
を含み、成分の百分比は組成物の重量に対する重量である、請求項7に記載の使用。
【請求項9】
前記組成物におけるエンドキシフェンが主に、Z異性体、E異性体、ならびにZ異性体およびE異性体の混合物からなる群から選択される形態である、請求項1または請求項2に記載の使用。
【請求項10】
前記エンドキシフェンが、クエン酸塩、酢酸塩、ギ酸塩、シュウ酸塩、コハク酸塩、酒石酸塩、トリフルオロ酢酸塩、メタンスルホン酸塩、リン酸塩、硫酸塩、塩化物、臭化物、ヨウ化物、乳酸塩、およびギ酸塩からなる塩の群から選択される塩の形態である、請求項1または請求項2に記載の使用。
【請求項11】
前記エンドキシフェンを含む組成物が、卵ホスファチジルコリン(EPC)、卵ホスファチジルグリセロール(EPG)、大豆ホスファチジルコリン(SPC)、水素化大豆ホスファチジルコリン(HSPC)、ジミリストイルホスファチジルコリン(DMPC)、ジミリストイルホスファチジルグリセロール(DMPG)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルグリセロール(DSPG)、ジパルミトイルホスファチジルグリセロール(DMPG)、コレステロール(Chol)、硫酸コレステリルおよびその塩(CS)、ヘミコハク酸コレステリルおよびその塩(Chems)、リン酸コレステリルおよびその塩(CP)、コレステリルホスホコリンおよび他のヒドロキシコレステロール、または、アミノコレステロール誘導体、コハク酸コレステリル、オレイン酸コレステリル、コレステロール(コレステロール−PEG)、コプロスタノール、コレスタノール、コレスタン、コール酸、コルチゾール、コルチコステロン、ヒドロコルチゾン、およびカルシフェロールのポリエチレングリコール誘導体、Eググルステロン、Zググルステロン、EおよびZググルステロンの混合物、モノグリセリド、ジグリセリド、トリグリセリド、ガラクトリピド、マンノリピド、ガラクトレシチン、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラトステロール、カンペステロール、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジン酸からなる群から選択される炭水化物系脂質、およびジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、およびジオレオイルホスファチジルグリセロールのペグ化誘導体からなる群から選択される脂質の少なくとも1種を含む、請求項1または請求項2に記載の使用。
【請求項12】
エンドキシフェンを含む前記組成物が、粉末、溶液、乳濁液、ミセル、リポソーム、脂質粒子、ゲル、ペースト形態、凍結乾燥形態、および錠剤または充填されたカプセルからなる群から選択される形態を含み、前記錠剤または充填されたカプセルが、場合によって腸溶被覆材料を含む、請求項1または請求項2に記載の使用。
【請求項13】
前記組成物が凍結防止剤を含む凍結乾燥形態にあり、前記凍結防止剤が、トレハロース、マルトース、ラクトース、スクロース、グルコースおよびデキストランからなる群から選択される1種または複数の糖を含む、請求項1または請求項2に記載の使用。
【請求項14】
エンドキシフェンまたはその薬学的に許容される塩を含む組成物の、感染症を含む症状の対象の治療としての使用。
【請求項15】
前記感染症が、細菌感染症、真菌感染症、ウイルス感染症およびリーシュマニア感染症からなる群から選択される、請求項14に記載の使用。
【請求項16】
エンドキシフェンまたはその薬学的に許容される塩を含む組成物の、骨粗鬆症および心血管疾患からなる群から選択される症状の患者の治療としての使用。
【請求項17】
エンドキシフェンまたはその薬学的に許容される塩を含む組成物の、対象の不妊治療としての使用。
【請求項18】
前記エンドキシフェンを含む組成物が、含水アルコール性ゲル、含水アルコール性溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤、錠剤、カプセル剤、腸溶被覆カプセル剤、腸溶被覆錠、トローチまたはオイル中で製剤化される、請求項14から17の一項に記載の使用。
【請求項19】
前記エンドキシフェンを含む組成物が、浸透促進剤、水性ビヒクル、アルコール性ビヒクルおよびゲル化剤を含有する含水アルコール性組成物中で製剤化される、請求項14から17の一項に記載の使用。
【請求項20】
前記含水アルコール性組成物が中和剤を含み、前記中和剤が、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、アミノメチルプロパノール、アルギニン、トロラミンおよびトロメタミンからなる群から選択され、前記中和剤が中和剤/ゲル化剤約1:1から約4:1の比で存在する、請求項19に記載の使用。
【請求項21】
前記含水アルコール性組成物が、
(i)約0.01重量%から0.20重量%のエンドキシフェン
(ii)約0.1重量%から2.0重量%、好ましくは約0.5重量%から2.0重量%のミリスチン酸イソプロピル
(iii)約50.0重量%から80.0重量%、好ましくは約60.0重量%から75.0重量%のアルコール
(iv)約20.0重量%から60.0重量%、好ましくは約25.0重量%から50.0重量%の水性ビヒクル、および
(v)約1.0重量%から10.0重量%、好ましくは約0.5重量%から5.0重量%のゲル化剤
を含み、成分の百分比が組成物重量に対する重量である、請求項19に記載の使用。
【請求項22】
前記組成物中において、エンドキシフェンが主に、Z異性体、E異性体ならびにZ異性体およびE異性体の混合物からなる群から選択される形態である、請求項14から17の一項に記載の使用。
【請求項23】
前記エンドキシフェンが、クエン酸塩、酢酸塩、ギ酸塩、シュウ酸塩、コハク酸塩、酒石酸塩、トリフルオロ酢酸塩、メタンスルホン酸塩、リン酸塩、硫酸塩、塩化物、臭化物、ヨウ化物、乳酸塩およびギ酸塩からなる塩の群から選択される塩の形態である、請求項14から17の一項に記載の使用。
【請求項24】
前記エンドキシフェンを含む組成物が、卵ホスファチジルコリン(EPC)、卵ホスファチジルグリセロール(EPG)、大豆ホスファチジルコリン(SPC)、水素化大豆ホスファチジルコリン(HSPC)、ジミリストイルホスファチジルコリン(DMPC)、ジミリストイルホスファチジルグリセロール(DMPG)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルグリセロール(DSPG)、ジパルミトイルホスファチジルグリセロール(DMPG)、コレステロール(Chol)、硫酸コレステリルおよびその塩(CS)、ヘミコハク酸コレステリルおよびその塩(Chems)、リン酸コレステリルおよびその塩(CP)、コレステリルホスホコリンおよび他のヒドロキシコレステロールまたは、アミノコレステロール誘導体、コハク酸コレステリル、オレイン酸コレステリル、コレステロール(コレステロール−PEG)、コプロスタノール、コレスタノール、コレスタン、コール酸、コルチゾール、コルチコステロン、ヒドロコルチゾン、およびカルシフェロールのポリエチレングリコール誘導体、Eググルステロン、Zググルステロン、EおよびZググルステロンの混合物、モノグリセリド、ジグリセリド、トリグリセリド、ガラクトリピド、マンノリピド、ガラクトレシチン、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラトステロール、カンペステロール、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジン酸からなる群から選択される炭水化物系脂質、およびジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、およびジオレオイルホスファチジルグリセロールのペグ化誘導体からなる群から選択される脂質の少なくとも1種を含む、請求項14から17の一項に記載の使用。
【請求項25】
前記エンドキシフェンを含む組成物が、粉末、溶液、乳濁剤、ミセル、リポソーム、脂質粒子、ゲル、ペースト形態、凍結乾燥形態、および錠剤または充填されたカプセルからなる群から選択される形態を含み、前記錠剤または充填されたカプセルが、場合によって腸溶被覆材料を含む、請求項14から17の一項に記載の使用。
【請求項26】
前記組成物が凍結防止剤を含む凍結乾燥形態にあり、前記凍結防止剤が、トレハロース、マルトース、ラクトース、スクロース、グルコースおよびデキストランからなる群から選択される1種または複数の糖を含む、請求項14から17の一項に記載の使用。
【請求項27】
対象の神経変性障害または精神障害の治療として使用される、エンドキシフェンを含む化合物またはその薬学的に許容される塩。
【請求項28】
対象の神経変性障害または精神障害に対する素因の治療として使用される、エンドキシフェンを含む化合物またはその薬学的に許容される塩。
【請求項29】
精神疾患が双極性障害である、請求項27または請求項28に記載の化合物。
【請求項30】
神経変性障害が、多発性硬化症、統合失調症、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症およびてんかんからなる群から選択される、請求項27または請求項28に記載の化合物。
【請求項31】
対象の感染症の治療に使用される、エンドキシフェンを含む化合物またはその薬学的に許容される塩。
【請求項32】
前記感染症が、細菌感染症、真菌感染症、リーシュマニア感染症およびウイルス感染症からなる群から選択される、請求項31に記載の化合物。
【請求項33】
患者の骨粗鬆症、骨関節炎、心血管疾患および不妊治療において使用される、エンドキシフェンを含む化合物またはその薬学的に許容される塩。
【請求項34】
前記エンドキシフェンを含む化合物が、含水アルコール性ゲル、含水アルコール性溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤、錠剤、カプセル、腸溶被覆カプセル、腸溶被覆錠、トローチまたはオイル中で製剤化される、請求項27から33のいずれかに記載の化合物。
【請求項35】
前記エンドキシフェンを含む組成物が、浸透促進剤、水性ビヒクル、アルコール性ビヒクルおよびゲル化剤を含有する含水アルコール性組成物中で製剤化される、請求項27から33のいずれかに記載の化合物。
【請求項36】
前記含水アルコール性組成物が中和剤を含み、前記中和剤が、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、アミノメチルプロパノール、アルギニン、トロラミンおよびトロメタミンからなる群から選択され、前記中和剤が中和剤/ゲル化剤約1:1から約4:1の比で存在する、請求項27から33のいずれかに記載の化合物。
【請求項37】
前記含水アルコール性組成物が、
(i)約0.01重量%から0.20重量%のエンドキシフェン
(ii)約0.1重量%から2.0重量%、好ましくは約0.5重量%から2.0重量%のミリスチン酸イソプロピル
(iii)約50.0重量%から80.0重量%、好ましくは約60.0重量%から75.0重量%のアルコール
(iv)約20.0重量%から60.0重量%、好ましくは約25.0重量%から50.0重量%の水性ビヒクル、および
(v)約1.0重量%から10.0重量%、好ましくは約0.5重量%から5.0重量%のゲル化剤
を含み、成分の百分比が組成物の重量に対する重量である、請求項36に記載の化合物。
【請求項38】
前記組成物におけるエンドキシフェンが主に、Z異性体、E異性体、ならびにZ異性体およびE異性体の混合物からなる群から選択される形態である、請求項27から33のいずれかに記載の化合物。
【請求項39】
前記エンドキシフェンが、クエン酸塩、酢酸塩、ギ酸塩、シュウ酸塩、コハク酸塩、酒石酸塩、トリフルオロ酢酸塩、メタンスルホン酸塩、リン酸塩、硫酸塩、塩化物、臭化物、ヨウ化物、乳酸塩、およびギ酸塩からなる塩の群から選択される塩の形態である、請求項27から33のいずれかに記載の化合物。
【請求項40】
前記エンドキシフェンを含む組成物が、卵ホスファチジルコリン(EPC)、卵ホスファチジルグリセロール(EPG)、大豆ホスファチジルコリン(SPC)、水素化大豆ホスファチジルコリン(HSPC)、ジミリストイルホスファチジルコリン(DMPC)、ジミリストイルホスファチジルグリセロール(DMPG)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルグリセロール(DSPG)、ジパルミトイルホスファチジルグリセロール(DMPG)、コレステロール(Chol)、硫酸コレステリルおよびその塩(CS)、ヘミコハク酸コレステリルおよびその塩(Chems)、リン酸コレステリルおよびその塩(CP)、コレステリルホスホコリンおよび他のヒドロキシコレステロールまたはアミノコレステロール誘導体、コハク酸コレステリル、オレイン酸コレステリル、コレステロール(コレステロール−PEG)、コプロスタノール、コレスタノール、コレスタン、コール酸、コルチゾール、コルチコステロン、ヒドロコルチゾン、およびカルシフェロールのポリエチレングリコール誘導体、Eググルステロン、Zググルステロン、EおよびZググルステロンの混合物、モノグリセリド、ジグリセリド、トリグリセリド、ガラクトリピド、マンノリピド、ガラクトレシチン、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラトステロール、カンペステロール、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジン酸からなる群から選択される炭水化物系脂質、およびジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、およびジオレオイルホスファチジルグリセロールのペグ化誘導体からなる群から選択される脂質の少なくとも1種を含む、請求項27から33に記載の化合物。
【請求項41】
前記エンドキシフェンを含む組成物が、粉末、溶液、エマルジョン、ミセル、リポソーム、脂質粒子、ゲル、ペースト形態、凍結乾燥形態、および錠剤または充填されたカプセルからなる群から選択される形態を含み、前記錠剤または充填されたカプセルが、場合により腸溶被覆材料を含む、請求項27から33のいずれかに記載の化合物。
【請求項42】
前記組成物が凍結防止剤を含む凍結乾燥形態であり、前記凍結防止剤が、トレハロース、マルトース、ラクトース、スクロース、グルコースおよびデキストランからなる群から選択される1種または複数の糖を含む、請求項27から33のいずれかに記載の化合物。
【請求項43】
対象の神経変性障害または精神障害の治療として使用される薬剤の製造における、エンドキシフェンを含む化合物またはその薬学的に許容される塩の使用。
【請求項44】
対象の感染症の治療として使用される薬剤の製造における、エンドキシフェンを含む化合物またはその薬学的に許容される塩の使用。
【請求項45】
骨粗鬆症、骨関節炎、心血管疾患および不妊症からなる群から選択される症状の治療として使用される薬剤の製造における、エンドキシフェンを含む化合物またはその薬学的に許容される塩の使用。
【請求項46】
前記化合物が請求項34から42のいずれか一項に記載の化合物である、請求項43から45のいずれか一項に記載の使用。
【請求項47】
a)神経変性障害または精神障害の有無またはその素因について対象を評価すること
b)請求項27から29および請求項34から42のいずれかの化合物を投与すること
c)神経変性障害または精神障害に関して前記対象を評価すること
を含む方法。
【請求項48】
a)感染症の有無について対象を評価すること
b)請求項31から32および請求項34から42のいずれかの化合物を投与すること
c)感染症に関して前記対象を評価すること
を含む方法。
【請求項49】
a)骨粗鬆症、骨関節炎、心血管疾患および不妊症からなる群から選択される症状の有無またはその素因について対象を評価すること
b)請求項33から42のいずれかの化合物を投与すること
c)骨粗鬆症、骨関節炎、心血管疾患または不妊症について前記対象を評価すること
を含む方法。
【請求項1】
対象の神経変性障害または精神障害の治療としての、エンドキシフェンまたはその薬学的に許容される塩を含む組成物の使用。
【請求項2】
対象の神経変性障害または精神障害に対する素因の治療としての、エンドキシフェンまたはその薬学的に許容される塩を含む組成物の使用。
【請求項3】
精神障害が双極性障害である、請求項1または請求項2に記載の使用。
【請求項4】
神経変性障害が、多発性硬化症、統合失調症、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症およびてんかんからなる群から選択される、請求項1または請求項2に記載の使用。
【請求項5】
前記エンドキシフェンを含む組成物が、含水アルコール性ゲル、含水アルコール性溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤、錠剤、カプセル剤、腸溶被覆カプセル剤、腸溶被覆錠、トローチまたはオイル中で製剤化される、請求項1または請求項2に記載の使用。
【請求項6】
前記エンドキシフェンを含む組成物が、浸透促進剤、水性ビヒクル、アルコール性ビヒクルおよびゲル化剤を含有する含水アルコール性組成物中で製剤化される、請求項1または請求項2に記載の使用。
【請求項7】
前記含水アルコール性組成物が中和剤を含み、前記中和剤が、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、アミノメチルプロパノール、アルギニン、トロラミンおよびトロメタミンからなる群から選択され、前記中和剤が約1:1から約4:1の中和剤/ゲル化剤の比で存在する、請求項6に記載の使用。
【請求項8】
前記含水アルコール性組成物が、
(i)約0.01から0.20重量%のエンドキシフェン
(ii)約0.1から2.0重量%、好ましくは約0.5から2.0重量%のミリスチン酸イソプロピル
(iii)約50.0から80.0重量%、好ましくは約60.0から75.0重量%のアルコール
(iv)約20.0から60.0重量%、好ましくは約25.0から50.0重量%の水性ビヒクル、および
(v)約1.0から10.0重量%、好ましくは約0.5から5.0重量%のゲル化剤
を含み、成分の百分比は組成物の重量に対する重量である、請求項7に記載の使用。
【請求項9】
前記組成物におけるエンドキシフェンが主に、Z異性体、E異性体、ならびにZ異性体およびE異性体の混合物からなる群から選択される形態である、請求項1または請求項2に記載の使用。
【請求項10】
前記エンドキシフェンが、クエン酸塩、酢酸塩、ギ酸塩、シュウ酸塩、コハク酸塩、酒石酸塩、トリフルオロ酢酸塩、メタンスルホン酸塩、リン酸塩、硫酸塩、塩化物、臭化物、ヨウ化物、乳酸塩、およびギ酸塩からなる塩の群から選択される塩の形態である、請求項1または請求項2に記載の使用。
【請求項11】
前記エンドキシフェンを含む組成物が、卵ホスファチジルコリン(EPC)、卵ホスファチジルグリセロール(EPG)、大豆ホスファチジルコリン(SPC)、水素化大豆ホスファチジルコリン(HSPC)、ジミリストイルホスファチジルコリン(DMPC)、ジミリストイルホスファチジルグリセロール(DMPG)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルグリセロール(DSPG)、ジパルミトイルホスファチジルグリセロール(DMPG)、コレステロール(Chol)、硫酸コレステリルおよびその塩(CS)、ヘミコハク酸コレステリルおよびその塩(Chems)、リン酸コレステリルおよびその塩(CP)、コレステリルホスホコリンおよび他のヒドロキシコレステロール、または、アミノコレステロール誘導体、コハク酸コレステリル、オレイン酸コレステリル、コレステロール(コレステロール−PEG)、コプロスタノール、コレスタノール、コレスタン、コール酸、コルチゾール、コルチコステロン、ヒドロコルチゾン、およびカルシフェロールのポリエチレングリコール誘導体、Eググルステロン、Zググルステロン、EおよびZググルステロンの混合物、モノグリセリド、ジグリセリド、トリグリセリド、ガラクトリピド、マンノリピド、ガラクトレシチン、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラトステロール、カンペステロール、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジン酸からなる群から選択される炭水化物系脂質、およびジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、およびジオレオイルホスファチジルグリセロールのペグ化誘導体からなる群から選択される脂質の少なくとも1種を含む、請求項1または請求項2に記載の使用。
【請求項12】
エンドキシフェンを含む前記組成物が、粉末、溶液、乳濁液、ミセル、リポソーム、脂質粒子、ゲル、ペースト形態、凍結乾燥形態、および錠剤または充填されたカプセルからなる群から選択される形態を含み、前記錠剤または充填されたカプセルが、場合によって腸溶被覆材料を含む、請求項1または請求項2に記載の使用。
【請求項13】
前記組成物が凍結防止剤を含む凍結乾燥形態にあり、前記凍結防止剤が、トレハロース、マルトース、ラクトース、スクロース、グルコースおよびデキストランからなる群から選択される1種または複数の糖を含む、請求項1または請求項2に記載の使用。
【請求項14】
エンドキシフェンまたはその薬学的に許容される塩を含む組成物の、感染症を含む症状の対象の治療としての使用。
【請求項15】
前記感染症が、細菌感染症、真菌感染症、ウイルス感染症およびリーシュマニア感染症からなる群から選択される、請求項14に記載の使用。
【請求項16】
エンドキシフェンまたはその薬学的に許容される塩を含む組成物の、骨粗鬆症および心血管疾患からなる群から選択される症状の患者の治療としての使用。
【請求項17】
エンドキシフェンまたはその薬学的に許容される塩を含む組成物の、対象の不妊治療としての使用。
【請求項18】
前記エンドキシフェンを含む組成物が、含水アルコール性ゲル、含水アルコール性溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤、錠剤、カプセル剤、腸溶被覆カプセル剤、腸溶被覆錠、トローチまたはオイル中で製剤化される、請求項14から17の一項に記載の使用。
【請求項19】
前記エンドキシフェンを含む組成物が、浸透促進剤、水性ビヒクル、アルコール性ビヒクルおよびゲル化剤を含有する含水アルコール性組成物中で製剤化される、請求項14から17の一項に記載の使用。
【請求項20】
前記含水アルコール性組成物が中和剤を含み、前記中和剤が、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、アミノメチルプロパノール、アルギニン、トロラミンおよびトロメタミンからなる群から選択され、前記中和剤が中和剤/ゲル化剤約1:1から約4:1の比で存在する、請求項19に記載の使用。
【請求項21】
前記含水アルコール性組成物が、
(i)約0.01重量%から0.20重量%のエンドキシフェン
(ii)約0.1重量%から2.0重量%、好ましくは約0.5重量%から2.0重量%のミリスチン酸イソプロピル
(iii)約50.0重量%から80.0重量%、好ましくは約60.0重量%から75.0重量%のアルコール
(iv)約20.0重量%から60.0重量%、好ましくは約25.0重量%から50.0重量%の水性ビヒクル、および
(v)約1.0重量%から10.0重量%、好ましくは約0.5重量%から5.0重量%のゲル化剤
を含み、成分の百分比が組成物重量に対する重量である、請求項19に記載の使用。
【請求項22】
前記組成物中において、エンドキシフェンが主に、Z異性体、E異性体ならびにZ異性体およびE異性体の混合物からなる群から選択される形態である、請求項14から17の一項に記載の使用。
【請求項23】
前記エンドキシフェンが、クエン酸塩、酢酸塩、ギ酸塩、シュウ酸塩、コハク酸塩、酒石酸塩、トリフルオロ酢酸塩、メタンスルホン酸塩、リン酸塩、硫酸塩、塩化物、臭化物、ヨウ化物、乳酸塩およびギ酸塩からなる塩の群から選択される塩の形態である、請求項14から17の一項に記載の使用。
【請求項24】
前記エンドキシフェンを含む組成物が、卵ホスファチジルコリン(EPC)、卵ホスファチジルグリセロール(EPG)、大豆ホスファチジルコリン(SPC)、水素化大豆ホスファチジルコリン(HSPC)、ジミリストイルホスファチジルコリン(DMPC)、ジミリストイルホスファチジルグリセロール(DMPG)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルグリセロール(DSPG)、ジパルミトイルホスファチジルグリセロール(DMPG)、コレステロール(Chol)、硫酸コレステリルおよびその塩(CS)、ヘミコハク酸コレステリルおよびその塩(Chems)、リン酸コレステリルおよびその塩(CP)、コレステリルホスホコリンおよび他のヒドロキシコレステロールまたは、アミノコレステロール誘導体、コハク酸コレステリル、オレイン酸コレステリル、コレステロール(コレステロール−PEG)、コプロスタノール、コレスタノール、コレスタン、コール酸、コルチゾール、コルチコステロン、ヒドロコルチゾン、およびカルシフェロールのポリエチレングリコール誘導体、Eググルステロン、Zググルステロン、EおよびZググルステロンの混合物、モノグリセリド、ジグリセリド、トリグリセリド、ガラクトリピド、マンノリピド、ガラクトレシチン、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラトステロール、カンペステロール、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジン酸からなる群から選択される炭水化物系脂質、およびジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、およびジオレオイルホスファチジルグリセロールのペグ化誘導体からなる群から選択される脂質の少なくとも1種を含む、請求項14から17の一項に記載の使用。
【請求項25】
前記エンドキシフェンを含む組成物が、粉末、溶液、乳濁剤、ミセル、リポソーム、脂質粒子、ゲル、ペースト形態、凍結乾燥形態、および錠剤または充填されたカプセルからなる群から選択される形態を含み、前記錠剤または充填されたカプセルが、場合によって腸溶被覆材料を含む、請求項14から17の一項に記載の使用。
【請求項26】
前記組成物が凍結防止剤を含む凍結乾燥形態にあり、前記凍結防止剤が、トレハロース、マルトース、ラクトース、スクロース、グルコースおよびデキストランからなる群から選択される1種または複数の糖を含む、請求項14から17の一項に記載の使用。
【請求項27】
対象の神経変性障害または精神障害の治療として使用される、エンドキシフェンを含む化合物またはその薬学的に許容される塩。
【請求項28】
対象の神経変性障害または精神障害に対する素因の治療として使用される、エンドキシフェンを含む化合物またはその薬学的に許容される塩。
【請求項29】
精神疾患が双極性障害である、請求項27または請求項28に記載の化合物。
【請求項30】
神経変性障害が、多発性硬化症、統合失調症、アルツハイマー病、パーキンソン病、ハンティングトン病、筋萎縮性側索硬化症およびてんかんからなる群から選択される、請求項27または請求項28に記載の化合物。
【請求項31】
対象の感染症の治療に使用される、エンドキシフェンを含む化合物またはその薬学的に許容される塩。
【請求項32】
前記感染症が、細菌感染症、真菌感染症、リーシュマニア感染症およびウイルス感染症からなる群から選択される、請求項31に記載の化合物。
【請求項33】
患者の骨粗鬆症、骨関節炎、心血管疾患および不妊治療において使用される、エンドキシフェンを含む化合物またはその薬学的に許容される塩。
【請求項34】
前記エンドキシフェンを含む化合物が、含水アルコール性ゲル、含水アルコール性溶液、パッチ、クリーム剤、乳剤、ローション剤、軟膏剤、散剤、錠剤、カプセル、腸溶被覆カプセル、腸溶被覆錠、トローチまたはオイル中で製剤化される、請求項27から33のいずれかに記載の化合物。
【請求項35】
前記エンドキシフェンを含む組成物が、浸透促進剤、水性ビヒクル、アルコール性ビヒクルおよびゲル化剤を含有する含水アルコール性組成物中で製剤化される、請求項27から33のいずれかに記載の化合物。
【請求項36】
前記含水アルコール性組成物が中和剤を含み、前記中和剤が、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、アミノメチルプロパノール、アルギニン、トロラミンおよびトロメタミンからなる群から選択され、前記中和剤が中和剤/ゲル化剤約1:1から約4:1の比で存在する、請求項27から33のいずれかに記載の化合物。
【請求項37】
前記含水アルコール性組成物が、
(i)約0.01重量%から0.20重量%のエンドキシフェン
(ii)約0.1重量%から2.0重量%、好ましくは約0.5重量%から2.0重量%のミリスチン酸イソプロピル
(iii)約50.0重量%から80.0重量%、好ましくは約60.0重量%から75.0重量%のアルコール
(iv)約20.0重量%から60.0重量%、好ましくは約25.0重量%から50.0重量%の水性ビヒクル、および
(v)約1.0重量%から10.0重量%、好ましくは約0.5重量%から5.0重量%のゲル化剤
を含み、成分の百分比が組成物の重量に対する重量である、請求項36に記載の化合物。
【請求項38】
前記組成物におけるエンドキシフェンが主に、Z異性体、E異性体、ならびにZ異性体およびE異性体の混合物からなる群から選択される形態である、請求項27から33のいずれかに記載の化合物。
【請求項39】
前記エンドキシフェンが、クエン酸塩、酢酸塩、ギ酸塩、シュウ酸塩、コハク酸塩、酒石酸塩、トリフルオロ酢酸塩、メタンスルホン酸塩、リン酸塩、硫酸塩、塩化物、臭化物、ヨウ化物、乳酸塩、およびギ酸塩からなる塩の群から選択される塩の形態である、請求項27から33のいずれかに記載の化合物。
【請求項40】
前記エンドキシフェンを含む組成物が、卵ホスファチジルコリン(EPC)、卵ホスファチジルグリセロール(EPG)、大豆ホスファチジルコリン(SPC)、水素化大豆ホスファチジルコリン(HSPC)、ジミリストイルホスファチジルコリン(DMPC)、ジミリストイルホスファチジルグリセロール(DMPG)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルグリセロール(DSPG)、ジパルミトイルホスファチジルグリセロール(DMPG)、コレステロール(Chol)、硫酸コレステリルおよびその塩(CS)、ヘミコハク酸コレステリルおよびその塩(Chems)、リン酸コレステリルおよびその塩(CP)、コレステリルホスホコリンおよび他のヒドロキシコレステロールまたはアミノコレステロール誘導体、コハク酸コレステリル、オレイン酸コレステリル、コレステロール(コレステロール−PEG)、コプロスタノール、コレスタノール、コレスタン、コール酸、コルチゾール、コルチコステロン、ヒドロコルチゾン、およびカルシフェロールのポリエチレングリコール誘導体、Eググルステロン、Zググルステロン、EおよびZググルステロンの混合物、モノグリセリド、ジグリセリド、トリグリセリド、ガラクトリピド、マンノリピド、ガラクトレシチン、β−シトステロール、スチグマステロール、スチグマスタノール、ラノステロール、α−スピナステロール、ラトステロール、カンペステロール、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジン酸からなる群から選択される炭水化物系脂質、およびジステアロイルホスファチジルグリセロール、ジパルミトイルホスファチジルグリセロール、ジミリストイルホスファチジルグリセロール、およびジオレオイルホスファチジルグリセロールのペグ化誘導体からなる群から選択される脂質の少なくとも1種を含む、請求項27から33に記載の化合物。
【請求項41】
前記エンドキシフェンを含む組成物が、粉末、溶液、エマルジョン、ミセル、リポソーム、脂質粒子、ゲル、ペースト形態、凍結乾燥形態、および錠剤または充填されたカプセルからなる群から選択される形態を含み、前記錠剤または充填されたカプセルが、場合により腸溶被覆材料を含む、請求項27から33のいずれかに記載の化合物。
【請求項42】
前記組成物が凍結防止剤を含む凍結乾燥形態であり、前記凍結防止剤が、トレハロース、マルトース、ラクトース、スクロース、グルコースおよびデキストランからなる群から選択される1種または複数の糖を含む、請求項27から33のいずれかに記載の化合物。
【請求項43】
対象の神経変性障害または精神障害の治療として使用される薬剤の製造における、エンドキシフェンを含む化合物またはその薬学的に許容される塩の使用。
【請求項44】
対象の感染症の治療として使用される薬剤の製造における、エンドキシフェンを含む化合物またはその薬学的に許容される塩の使用。
【請求項45】
骨粗鬆症、骨関節炎、心血管疾患および不妊症からなる群から選択される症状の治療として使用される薬剤の製造における、エンドキシフェンを含む化合物またはその薬学的に許容される塩の使用。
【請求項46】
前記化合物が請求項34から42のいずれか一項に記載の化合物である、請求項43から45のいずれか一項に記載の使用。
【請求項47】
a)神経変性障害または精神障害の有無またはその素因について対象を評価すること
b)請求項27から29および請求項34から42のいずれかの化合物を投与すること
c)神経変性障害または精神障害に関して前記対象を評価すること
を含む方法。
【請求項48】
a)感染症の有無について対象を評価すること
b)請求項31から32および請求項34から42のいずれかの化合物を投与すること
c)感染症に関して前記対象を評価すること
を含む方法。
【請求項49】
a)骨粗鬆症、骨関節炎、心血管疾患および不妊症からなる群から選択される症状の有無またはその素因について対象を評価すること
b)請求項33から42のいずれかの化合物を投与すること
c)骨粗鬆症、骨関節炎、心血管疾患または不妊症について前記対象を評価すること
を含む方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公表番号】特表2012−527484(P2012−527484A)
【公表日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願番号】特願2012−512075(P2012−512075)
【出願日】平成22年5月21日(2010.5.21)
【国際出願番号】PCT/US2010/035852
【国際公開番号】WO2010/135703
【国際公開日】平成22年11月25日(2010.11.25)
【出願人】(509103303)ジャイナ ファーマシューティカルズ,インコーポレーテッド (5)
【Fターム(参考)】
【公表日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願日】平成22年5月21日(2010.5.21)
【国際出願番号】PCT/US2010/035852
【国際公開番号】WO2010/135703
【国際公開日】平成22年11月25日(2010.11.25)
【出願人】(509103303)ジャイナ ファーマシューティカルズ,インコーポレーテッド (5)
【Fターム(参考)】
[ Back to top ]

