哺乳類における免疫応答誘導組成物および方法、ならびに短鎖干渉RNAなどのオリゴヌクレオチド剤に対する免疫応答の回避方法
【課題】哺乳類における免疫応答を刺激する方法を提供する。
【解決手段】 本発明は、IFN産生を刺激することにより免疫応答を調節するオリゴヌクレオチド剤、および該剤を哺乳類の治療的処置に用いる方法を提供する。
【解決手段】 本発明は、IFN産生を刺激することにより免疫応答を調節するオリゴヌクレオチド剤、および該剤を哺乳類の治療的処置に用いる方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、対象における免疫応答を誘導することのできる配列特異的オリゴリボヌクレオチド剤を提供することによる、免疫治療および創薬の分野、ならびにRNAi剤に対する配列特異的免疫応答の回避方法に関する。
【背景技術】
【0002】
(関連出願)
本願は、参照によりその全体を本願に組み込む、2004年12月9日に提出された米国仮出願番号第60/634,849号明細書に利益を請求する。
【0003】
(背景)
二本鎖RNA分子(dsRNA)は、RNA干渉(RNAi)として知られる高度に保存された調節機構によって、遺伝子発現をブロックすることができる。すなわち、RNAIIIDicer酵素は、dsRNAを、約22ヌクレオチドの小さい干渉RNA(短鎖干渉RNAまたはsiRNAとも呼ばれる)に処理する。siRNAの一方の鎖(「アンチセンス鎖」)は、RNAによって誘導されるサイレンシング複合体RISCによってアンチセンス鎖の配列と少なくとも部分的に相補的なヌクレオチド配列を含むメッセンジャーRNA(mRNA)の切断を誘導するガイド配列としてはたらく。アンチセンス鎖は、このプロセスにおいては切断されないか、いずれにせよ分解されず、アンチセンス鎖を含んだRISCは引き続き、さらなるmRNAの切断に影響を及ぼすことができる。
【0004】
転写後二本鎖RNA依存性遺伝子サイレンシングのプロセスは、一般的にRNA干渉(RNAi)と呼ばれている(非特許文献1〜3)。真核生物は、ウィルスなどの侵襲してくる外来遺伝子要素から自己のゲノムを守るためにRNAiを利用していると提案されてきた。ウィルス複製中の二本鎖RNAの形成は、望まれない遺伝子活性に対するシグナルとして細胞によって解釈される(非特許文献4、5)。DicerRNaseIIIは、二本鎖RNAを明確なサイズと構造を持った小さい二本鎖RNA断片、すなわち短鎖干渉RNA(siRNA)に迅速に処理して、該短鎖干渉RNAが、侵襲遺伝子の一本鎖mRNAの配列特異的分解を支援する(非特許文献6〜9)。このようなsiRNA二本鎖は、2〜3ヌクレオチドの3’突出端を有するとともに、5’リン酸および自由3’ヒドロキシ末端を含む(非特許文献10)。合成siRNA二本鎖の細胞送達またはプラスミドもしくはウィルスベクターによるsiRNAの導入は、現在では、導入された二本鎖RNAと配列が相同な細胞遺伝子の活性を妨害するために広く用いられている。
【0005】
siRNAがどのようにして哺乳類の系と相互作用しているかを理解することが、この遺伝子サイレンシング技術に磨きをかけ、遺伝子特異的治療剤を開発するために重要である(非特許文献11)。長い二本鎖RNAの認識について、2つの異なる検出モード、すなわち、セリンスレオニンキナーゼPKR(非特許文献12〜14)およびTLR3(非特許文献15)が知られている。PKRは細胞質内に局在しているが、TLR3はエンドゾーム内に存在している(非特許文献16)。TLR3は、病原体特異的分子を検出するために進化してきたToll様受容体ファミリーのメンバーである(非特許文献17)。
【0006】
PKRは、2つの二本鎖RNA結合ドメインを有し、その一方は、二本鎖RNAに対する高い親和性を有し、他方は相当に低い親和性しか示さない。PKRによって媒介される反応の完全な活性化には、二本鎖RNAが両ドメインに同時に結合することが必要であり(これは、長い二本鎖RNA、たとえば長さが50〜80ヌクレオチド対を超える二本鎖
RNAによって容易化されるようである)、また二量化を必要とするようである(非特許文献18、19)。50ヌクレオチド対未満の二本鎖RNAを含む二本鎖RNAの濃度が高いと、または二本鎖RNA結合部位に対する他のリガンド(たとえばAlu RNA)の濃度が高いと、PKRの活性化が阻害される。初期の研究から、siRNA二本鎖は、脊椎動物細胞における一般的な二本鎖RNAによって誘導される非特異的効果をバイパスするのに十分に短いことが証明されている。(非特許文献20)。しかしながら、複数のより最近の文献では、インターフェロン経路、特にPKRの活性化に関与する遺伝子を含む短い二本鎖RNAの導入によって、長い二本鎖RNAの効果と同等とまではいかないにせよ、数多くの遺伝子が様々に調節されることが示されている(非特許文献21〜29)。どの遺伝子がアップレギュレートまたはダウンレギュレートされるかは、少なくとも部分的にはsiRNA配列特異的と考えられ、この調節の基礎をなす機構(または機構群)はまだ解明されていない。
【0007】
ウィルス感染を認識するために免疫系によって利用されるウィルス核酸の第2の特徴的性質はウィルスDNA中に見られるCpGモチーフであり、CpGモチーフはTLR9を介して検出される(非特許文献30〜31)。CpGモチーフは、特定の隣接塩基を有したメチル化されていないCGジヌクレオチドである。脊椎動物においてはCpGモチーフの頻度は抑制されており、これにより脊椎動物免疫系が、CpGモチーフなどに基づいて微生物DNAを検出できるようになっている(非特許文献32〜34)。TLR3と同様に、TLR9はエンドゾームに局在しており、ここで、TLR9はCpGモチーフに直接結合する(非特許文献35)。
【0008】
長い二本鎖RNAおよびCpG DNAに加えて、2つの最近の文献により、ウィルス核酸が認識される第3の機構が示唆されている。これらの研究は、一本鎖RNA(ssRNA)ウィルスのssRNAがTLR7(マウスおよびヒト)およびTLR8(ヒトのみ)を介して検出されることを実証している(非特許文献36、37)。グアニンアナログは、TLR7およびTLR8に対する特異的リガンドとして初期に同定されていた(非特許文献38、39)。TLR9(CpGDNAに対する受容体)(非特許文献35)と同様に、TLR7およびTLR8は、エンドゾーム膜に局在している。
【0009】
ウィルス核酸の検出は、I型IFN(IFN−αおよびIFN−β)の生産につながる。ヒトにおけるI型IFNの主たる生産者は、プラズマサイトイド樹状細胞(インターフェロン産生細胞、IPCとも呼ばれる)である。プラズマサイトイド樹状細胞(PDC)は、樹状細胞の高度に特化したサブセットであり、ウィルス感染に対する見張り(センチネル)として機能すると考えられ、ウィルス感染のあいだの大量のI型IFNに関与する(非特許文献40)。PDCが、ウィルス感染を検出するための核酸系分子を優先的に使用するという証拠も増えてきている。ヒトおよびマウスPDCのTLR発現は、TLR7およびTLR9に限られている(非特許文献41〜43)。
【0010】
非特許文献44〜46および32は、細菌および合成のオリゴデオキシリボヌクレオチド中の特定の配列コンテクストにCpGジヌクレオチドが存在すること(CpG DNA)が、脊椎動物の生来の免疫応答、T細胞およびB細胞を活性化することが知られていることを教示している。
【0011】
非特許文献47〜50は、CpGDNAによる免疫細胞の活性化が、IFN,ガンマ、IL−12、TNF−α、およびIL−6を含む複数のサイトカインの分泌と、共刺激性表面分子の刺激発現を誘導していると教示している。
【0012】
前掲の非特許文献32および非特許文献51〜54は、CpGジヌクレオチドの存在および該ジヌクレオチドに隣接する配列が、DNAの免疫刺激活性を決定するのに重要な役
割を果たすこと、パリンドロームまたは非パリンドロームの6量体配列中のCpGジヌクレオチド(P1.P2CGP3P4)が免疫刺激に必要とされること、およびさらに、PuPuCGPyPyおよびPuTCGモチーフが、それぞれマウスおよびヒト免疫系を最適に活性化することを教示している。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】タシュル、ティー(Tuschl,T.) Chembiochem 2,239〜45(2001)
【非特許文献2】ザモア、ピーディー(Zamore,P.D.) Science 296,1265〜9(2002)
【非特許文献3】ハノン、ジージェイ(Hannon,GJ.) Nature 418,244〜51(2002))
【非特許文献4】アールキスト、ピー(Ahlquist,P.) Science 296,1270〜3(2002)
【非特許文献5】プラスターク、アールエイチ(Plasterk,R.H.) Science 296,1263〜5(2002)
【非特許文献6】エルバシャー、エスエム(Elbashir,S.M.)ら Nature 411,494〜8(2001)
【非特許文献7】エルバシャー、エスエム(Elbashir,SM.)ら Genes Dev 15,188〜200(2001)
【非特許文献8】ハモンド、エスエム(Hammond,S.M.)ら Nature 404,293〜6(2000)
【非特許文献9】ザモア、ピーディー(Zamore,P.D.)ら Cell 101,25〜33(2000)
【非特許文献10】エルバシャー、エスエム(Elbashir,S.M.)ら Embo J 20,6877〜88(2001)
【非特許文献11】タシュル、ティー(Tuschl,T.)ら Mol Interv 2,158〜67(2002)
【非特許文献12】ウィリアムズ、ビーアール(Williams,B.R.) Sci Signal Transduction Knowledge Enviroment 89,RE2(2001)
【非特許文献13】ミュルス、イーエフ(Meurs,E.F.)ら Virol 66,5805〜14(1992)
【非特許文献14】カッツェ、エムジー(Katze,M.G.)ら Mol Cell Biol 11,5497〜505(1991)
【非特許文献15】アレキソポーロー、エル(Alexopoulou,L.)ら Nature 413,732〜8(2001)
【非特許文献16】マツモト、エム(Matsumoto,M.)ら、J Immunol 171,3154〜62(2003)
【非特許文献17】タケダ、ケイ(Takeda,K.)ら Annu Rev Immunol 21,335〜76(2003)
【非特許文献18】マンヘ、エル(Manche,L.)ら,Mol Cell Biol,12,5238〜48(1992)
【非特許文献19】ウィリアムズ、ビージー(Williams,B.G.) Oncogene,18,6112〜20(1999)
【非特許文献20】ビトコ、ブイ(Bitko,V.)ら BMC Microbiol,1,34(2001)
【非特許文献21】ジャクソン、エイアール(Jackson,A.L.)およびリンスレー、ピーエス(Linsley,P.S.) Trends Genet,20,521〜4(2004)
【非特許文献22】ジャクソン、エイアール(Jackson,A.L.)ら、Nat Biotechnol,21,635〜7(2003)
【非特許文献23】モス、イージー(Moss,E.G.)およびテイラー、ジェイエム(Taylor,J.M.) Nat Cell Biol,5,771〜2(2003)
【非特許文献24】ブリッジ、エイジェイ(Bridge,A.J.)ら、Nat Genet,34,263〜4(2003)
【非特許文献25】スレズ、シーエイ(Sledz,C.A.)ら、Nat Cell Biol,5,834〜9(2003)
【非特許文献26】ヘイデル、ジェイディー(Heidel,J.D.)ら、Nat Biotechnol,22,1579〜81(2004)
【非特許文献27】キム、ディーエイチ(Kim,D.H.)ら,Nat Biotechnol,22,321〜5(2004)
【非特許文献28】ツェン、エックス(Zheng,X.)およびベビラッカ、ピーシー(Bevilacqua,P.C.)、RNA,10,1934〜45(2004)
【非特許文献29】ペバナード、エス(Pebernard,S.)およびイッゴ、アール(Iggo,R.)、Differentiation,72,103〜11(2004)
【非特許文献30】ランド、ジェイ(Lund,J.)ら J Exp Med 198,513〜520(2003)
【非特許文献31】クルグ、エイ(Krug,A.)ら Blood 103,1433〜7(2004)
【非特許文献32】クリーグ、エイエム(Krieg,A.M.)ら Nature 374,546〜9(1995)
【非特許文献33】バウア、エス(Bauer,S.)ら Proc Natl Acad Sci USA 98,9237〜42(2001)
【非特許文献34】ワグナー、エイチ(Wagner,H.) Curr Opin Microbiol 5,62〜9(2002)
【非特許文献35】ラッツ、イー(Latz,E.)ら Nat Immunol 5,190〜8(2004)
【非特許文献36】ディーボルト、エスエス(Diebold,S.S.)、Science 303,1529〜31(2004)
【非特許文献37】ハイル、エフ(Heil,F.)ら Science 303,1526〜9(2004)
【非特許文献38】リ、ジェイ(Lee,J.)ら Proc Natl Acad Sci USA 100,6646〜51(2003)
【非特許文献39】ハイル、エフ(Heil,F.)ら Eur J Immunol 33,2987〜97(2003)
【非特許文献40】アセリン‐パトゥエル、シー(Asselin−Paturel,C.)ら Nat Immunol 2,1144〜50(2001)
【非特許文献41】クルグ、エイ(Krug,A.)ら Eur J Immunol 31,3026〜37(2001)
【非特許文献42】ホルヌング、ブイ(Hornung,V.)ら J Immunol 168,4531〜7(2002)
【非特許文献43】エドワーズ、エイディー(Edwards,A.D.)ら Eur J Immunol 33,827〜33(2003)
【非特許文献44】トクナガ(Tokunaga)ら、J.Natl.Cancer Inst.72:955〜962(1984)
【非特許文献45】メシナ(Messina)ら、J.Immunol.147:1759〜1764(1991)
【非特許文献46】サトウ(Sato)ら,Science 273:352〜354(1996)
【非特許文献47】ヤマモト(Yamamoto)ら,Jpn.J.Cancer Res.79:866〜873(1988)
【非特許文献48】ハルパーン(Halpern)ら,Cell Immunol.,167:72〜78(1996)
【非特許文献49】クリンマン(Klinman)ら,Proc.Natl.Acad.Sci.U.S.A.93:2879〜2883(1996)
【非特許文献50】ツァオ(Zhao)ら,Antisense Nucleic Acid Drug Dev.7:495〜502(1997)
【非特許文献51】ヤマモト(Yamamoto)ら,J.Immunol.148;4072〜4076(1992)
【非特許文献52】トクナガ(Tokunaga)ら,Microbiol.Immunol.36:55〜66(1992)
【非特許文献53】リャン(Liang)ら,J.Clin.Invest.98:1119〜1129(1996)
【非特許文献54】ハートマン(Hartmann)ら,J.Immunol.164:1617〜1624(2000)
【発明の概要】
【発明が解決しようとする課題】
【0014】
上記の発見は、オリゴヌクレオチドが免疫刺激剤として有用であることを示すが、そのような用途に伴ういくつかの問題もいまだに存在している。たとえば、長いオリゴヌクレオチドは作製費用が高く、隣接配列の種特異性が任意の所与のオリゴヌクレオチドの有用性の幅を限定してしまう。したがって、より安価な免疫刺激剤、好ましくは種を超えて有効な免疫刺激剤が必要されるとともに、さらに別の配列特異的モチーフを同定することが必要とされている。
【課題を解決するための手段】
【0015】
本発明は、少なくとも部分的には、一本鎖または二本鎖RNA分子内の特定の配列モチーフが特にプラズマサイトイド樹状細胞(PDC)などのTLR7を発現する細胞におけるIFN誘導を介した免疫応答の刺激に有効であるという発見に基づいている。この発見に基づいて、本発明は、哺乳類におけるIFN産生を刺激するために使用することのできる免疫刺激性オリゴヌクレオチド剤、ならびに、望まれる免疫応答を誘導するため、または望ましくない免疫応答の誘導を回避するために、一本鎖アンチセンス剤および二本鎖iRNA剤を選択的に設計する方法を提供する。
【0016】
本発明は、免疫刺激剤として一本鎖または二本鎖オリゴヌクレオチドを含む治療用組成物、ならびに、そのような組成物の免疫治療用途での使用方法も提供する。本発明は具体的には、限定はされないが、たとえば、成人および小児ならびに家畜に対する適用において、がん、自己免疫疾患、ぜんそく、呼吸器系アレルギー、食品アレルギー、および細菌、寄生虫、およびウィルス感染の治療などの免疫治療用途に用いられる免疫応答を高めるための方法および組成物を提供する。本発明は、そのような化合物の製造方法も提供する。さらに、本発明の化合物は、DNAワクチン、抗体およびアレルゲンと組み合わせるアジュバントとして、および他の免疫刺激剤、化学治療剤、iRNA剤および/またはアンチセンスオリゴヌクレオチドと組み合わせるアジュバントとして有用である。
【0017】
本発明のオリゴヌクレオチド剤は、ヌクレオチド配列
5’−GUCCUUCAA−3’(配列番号:1)
を含むか、該配列で構成されるか、または本質的に該配列で構成される。
【0018】
他の実施形態において、オリゴヌクレオチドは、配列番号:1由来の、好ましくは当該配列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列、たとえば、5’−GUCC−3’(配列番号:2)、5’−GUCCU−3’(配列番号:3)、5’−GUCCUU−3’(配列番号:4)、5’−GUCCUUC−3’(配列番号:5)、または5’−GUCCUUCA−3’(配列番号:6)を含むか、該配列で構成されるか、または、本質的に該配列で構成される。
【0019】
すなわち、1つの態様において、本発明は、哺乳類における免疫応答を刺激する方法であって、前記哺乳類に、配列番号:1由来の、好ましくは当該配列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含むか、該配列で構成されるか、または、本質的に該配列で構成されるオリゴヌクレオチド剤を投与する工程を含む方法を提供する。前記オリゴヌクレオチド剤は、配列番号:1、または配列番号:1の配列から1以下または2以下のヌクレオチドだけが異なる配列を含むか、該配列で構成されるか、または、本質的に該配列で構成されてもよい。前記配列は、配列番号:2、配列番号:3、配列番号:4、配列番号:5、および配列番号:6からなる群より選択されてもよい。オリゴヌクレオチドは、iRNA剤であってもよいし、または一本鎖RNA剤であってもよい。
【0020】
第2の態様において、本発明は、哺乳類において免疫応答の刺激を回避するためのオリゴヌクレオチド剤の製造方法であって、潜在薬剤プールから、配列番号:1由来の、好ましくは当該配列の5’末端から4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含む、または配列番号:1から1以下または2以下のヌクレオチドしか違わない配列を含む任意の剤を除去する工程を含む方法を提供する。オリゴヌクレオチドは、iRNA剤であってもよいし、または一本鎖RNA剤であってもよい。
【0021】
第3の態様において、本発明は、配列番号:1由来の、好ましくは当該配列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含むか、該配列で構成されるか、または、本質的に該配列で構成される単離オリゴヌクレオチド剤を提供する。該オリゴヌクレオチド剤は、配列番号:1、または配列番号:1の配列から1以下または2以下のヌクレオチドだけが異なる配列を含むか、該配列で構成されるか、または、本質的に該配列で構成されてもよい。前記配列は、配列番号:2、配列番号:3、配列番号:4、配列番号:5、および配列番号:6からなる群より選択されてもよい。オリゴヌクレオチドは、iRNA剤であってもよいし、または一本鎖RNA剤であってもよい。少なくとも1つの2’−フルオロ修飾ヌクレオチドをさらに含んでいてもよく、該2’−フルオロ修飾ヌクレオチドは、配列番号:1由来の4つ以上の連続したヌクレオチドを含む配列の一部ではない。オリゴヌクレオチド剤がiRNA剤の場合には、表8の遺伝子のいずれかに対して特異的(たとえば、一方の鎖は少なくとも部分的に該遺伝子に相補的)なものであればよい。
【0022】
第4の態様において、本発明は、哺乳類における免疫応答を誘導するオリゴヌクレオチド剤の製造方法であって、潜在薬剤プールに、配列番号:1の4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドを含む、または配列番号:1から1以下または2以下のヌクレオチドしか違わない配列を含む任意の剤を添加する工程を含む方法を提供する。オリゴヌクレオチドは、iRNA剤であってもよいし、または一本鎖RNA剤であってもよい。
【0023】
第5の態様において、本発明は、哺乳類において遺伝子の発現の阻害と、免疫応答の誘導とを同時に行う方法であって、前記哺乳類に、配列番号:1由来の、好ましくは当該配
列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列、または、配列番号:1の配列から1以下または2以下のヌクレオチドだけが異なる配列を含むiRNA剤を投与する工程を含む方法を提供する。前記配列は、配列番号:2、配列番号:3、配列番号:4、配列番号:5、および配列番号:6からなる群より選択されてよい。前記遺伝子は、表8の遺伝子のうちの任意のものであってよい。
【0024】
第6の態様において、本発明は、iRNA剤の評価方法であって、
a.候補iRNA剤を提供することと、
b.候補iRNA剤を検査して、配列番号:1、または、配列番号:1から1または2ヌクレオチドしか違わない配列を含むかどうかを判定することと
を含む方法を提供する。
【0025】
前記方法は、iRNA剤を修飾して、配列番号:1の配列、または配列番号:1から1または2ヌクレオチドしか違わない配列を除去することをさらに含んでもよい。
第7の態様において、本発明は、本発明のオリゴヌクレオチドと、薬学的に許容される担体とを含む薬学的組成物を提供する。前記薬学的組成物はワクチンであってもよい。
【0026】
第8の態様において、本発明は、哺乳類における免疫応答の刺激を回避するオリゴヌクレオチド剤の製造方法であって、前記オリゴヌクレオチドは、配列番号:1由来の4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含み、前記方法は、オリゴヌクレオチド剤を、該オリゴヌクレオチド剤が少なくとも2つ、または少なくとも4つの2’−O−メチル修飾ヌクレオチドを含むように提供することを含む方法を提供する。2’−O−メチル修飾ヌクレオチドのうちの少なくとも1つ、または少なくとも2つが、配列番号:1からの4以上連続したヌクレオチドの配列の一部であってよい。
【図面の簡単な説明】
【0027】
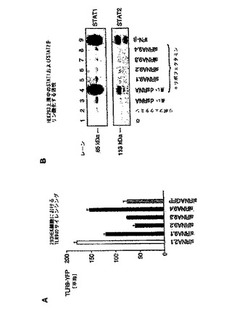
【図1】HEK293細胞において、siRNAを用いて、標的非特異的なI型IFN媒介性のSTATlまたはSTAT2リン酸化活性を誘導せずに、TLR9発現を阻害することができることを示す図。 HEK293細胞(50.000/ウェル)を、様々なRNA分子およびリポフェクタミンとともにインキュベートした。 A:C末端YFPタグを有するヒトTLR9の構築物を発現するHEK293細胞を、ヒトTLR9mRNAの種々の領域と相補的な4つのsiRNAでトランスフェクトした。GFPmRNAおよびTLR2(図面中では、siRNA2.1と表す)mRNAを標的とするsiRNAを用いたトランスフェクションを陽性および陰性対照とした。20時間目に、YFPタグ発現の平均蛍光強度をフローサイトメトリーによって解析した。結果を平均値±SEM(n=3)として示す。 B:HEK293細胞を、単独でインキュベートしたもの(レーン1)、リポフェクタミンとともにインキュベートしたもの(レーン2)、500塩基対長の二本鎖RNAとともにインキュベートしたもの(10μg/mL、レーン3)、または500塩基対長の二本鎖RNAと複合化したリポフェクタミンでトランスフェクトしたもの(レーン4)、ヒトTLR9mRNAを標的とする4つの異なるsiRNAと複合化したリポフェクタミンでトランスフェクトしたもの(TLR9.1,TLR9.2,TLR9.3およびTLR9.4;レーン5〜8;TLR9.1,TLR9.2,TLR9.3およびTLR9.4は、図面ではそれぞれsiRNA9.1,siRNA9.2,siRNA9.3、およびsiRNA9.4と表されている)。24時間後、上清を回収し、BL41細胞(1条件あたり細胞1×106個)に加えた。組換えIFN−β(100U/mL)を加えたものを、陽性対照とした(レーン9)。30分後、BL41細胞を溶菌し、SDS−pageにかけて、STATlおよびSTAT2のリン酸化を調べた。上清は4連実験から回収した。3回のうちの1つの代表的な実験を示す。
【図2A】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 A:PDCを、200ngの4つの異なるsiRNA(TLR9.1、TLR9.2、TLR9.3およびTLR9.4)でトランスフェクトした。TLR9−リガンドであるCpG−A(ODN2216、灰色バー)を、IFN−α誘導に関する陽性対照とした。結果は、11名の個別ドナーからの平均IFN−α産生±SEMで示されている(TLR9.1対TLR9.2に対してはp<0.0001、TLR9.1対TLR9.3に対してはp<0.0001、TLR9.3対TLR9.1に対してはp<0.0001、およびTLR9.3対TLR9.4に対してはp<0.001)。
【図2B】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 B:TLR9.1、TLR9.2、TLR9.3またはTLR9.4の量を減少させて(200ng、100ng、50ng、25ng)PDCをトランスフェクトした。結果は、3名の個別ドナーからの平均IFN−α産生±SEMを示す。
【図2C】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 C:PDCを、siRNA9.2二本鎖または対応するセンス鎖およびアンチセンス鎖のいずれかによってトランスフェクトした。10名の個別ドナーからの結果をまとめ、平均値±SEMで示した。
【図2D】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 D(左パネル):siRNA9.2センス鎖のFITC修飾物、または対応するアニールしたsiRNA二本鎖を、266μg/mLのRNAseの存在下、または非存在下でインキュベートした。3時間後、4μLのこの調製物を、未処理の試料を対照として含めて3%アガロースゲルで解析した。 D(右パネル):次に、siRNA精製カラムを介して試料を精製してRNaseを除去し、3μLのこの調製物をPDCにトランスフェクトした。36時間後、IFN−α産生をELISAによって評価した。2つの代表的な実験の一方からのデータを示す。
【図2E】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 E:siRNA二本鎖9.2を自己安定化する一本鎖ヘアピン型としたもの(表2を参照)を、siRNA9.2二本鎖と比較したもの。2つの独立した実験からのデータを平均±SEMで表している。
【図3】RNA9.2センス鎖3’末端の9塩基の配列が、免疫刺激活性に関与していることを示す図。 PDCを種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 A:TLR9.2のセンス鎖(RNA9.2s、元の配列については「n」で示す)およびRNA9.2sにフルオレセインタグを付加したもの(5’Fまたは3’F)でPDCをトランスフェクトした。*はp<0.05を示す。 B:TLR9.2のセンス鎖、19量体ポリAオリゴヌクレオチド、5’末端から数えて塩基番号8〜12がアデノシンに置換された一連のRNA9.2s(L8A〜L12A)、3’末端から数えて9塩基対(推定モチーフ)以内にある1つ、2つ、3つまたは6つの塩基が(推定9量体モチーフに混乱をきたすために)アデノシンまたはウリジンで置換された一連のRNA9.2s誘導体、または2つのRNA9.2s短縮物(いずれもRNA9.2sの3’末端の推定9量体モチーフを含む16量体または12量体)ならびに配列内に推定9量体モチーフを2回含む19量体RNAオリゴヌクレオチド(DR)でPDCをトランスフェクトした。使用したすべての配列の詳細については表2に示す。4名の個別ドナーからの結果を平均値±SEMとして示す。
【図4】siRNATLR9.2のセンス鎖およびアンチセンス鎖のLNA修飾から、siRNAのIFN−α誘導およびサイレンシングが2つの独立した活性であることが明らかになったことを示す図。 PDCを種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 A:TLR9.2のセンス鎖(RNA9.2s)とその5’末端および3’末端にLNA修飾を有する、または有しない誘導体(n、5’LNA、3’LNA、5’3’LNA)を比較したもの(表2を参照)。 B:siRNA9.2のセンスおよびアンチセンス鎖を様々にLNA修飾したものを二本鎖にアニールし、PDCにトランスフェクトした。36時間後、上清中のIFN−α産生を測定した(黒色バー)。5名の個別ドナーからの結果を平均値±SEMで示す。さらに、C末端YFPタグを有するヒトTLR9の構築物を安定に発現しているHEK293細胞を、同じタイプのsiRNA9.2誘導体でトランスフェクトした。GFP、TLR2またはTLR4のmRNAを標的とするsiRNA二本鎖によるトランスフェクションを対照とした。トランスフェクションから20時間後、YFPタグ発現の平均蛍光強度をフローサイトメトリーによって解析した(白抜きバー)。データは、siRNA2.1を100%、非修飾siRNA9.2を0%としたときのTLR9発現の割合(%)で示している。結果は、平均値±SEM(n=3)で示されている。
【図5A】マウスin vivoにおけるsiRNAによる全身免疫応答の配列依存性誘導を示す図。 A:マウス骨髄培養物(129Sv)を、siRNA TLR9.2の二本鎖、センス鎖もしくはアンチセンス鎖または19量体ポリ(A)オリゴヌクレオチドをポリカチオン性ペプチドと複合化したもので刺激した。ODN1826(6μg/mL)およびR848(1H−イミダゾ(4,5−c)キノリン−1−エタノール(エトキシメチル)−α;0.5μg/mL)を陽性対照とした。36時間後、上清を回収し、IFN−α産生をELISAによって評価した。データは、マウス3個体の骨髄培養物をプールしたものの3連実験の平均値±SEMとして示す。
【図5B】マウスin vivoにおけるsiRNAによる全身免疫応答の配列依存性誘導を示す図。 B:5μgのsiRNA TLR2.1、TLR9.2、または一本鎖TLR9.2a(センス鎖)またはTLR9.2as(アンチセンス鎖)をDOTAPと複合体化し、静脈注射によって129Svマウス(1群につき3個体)に投与した。RNAを含まないDOTAPを対照として含めた。7時間後、血清を回収し、IFN−α産生をELISAによって評価した。データは平均値±SEMとして示す。
【図5C】マウスin vivoにおけるsiRNAによる全身免疫応答の配列依存性誘導を示す図。 C:注射から41時間後、脾臓細胞を単離し、抗CD3、抗CD8、抗CD11bおよび抗CD11c抗体を用いて、脾臓細胞中のCD8+T細胞およびMDCを同定した。CD69またはCD86発現を、適当なアイソタイプの対照抗体を用いて評定した。1群につき3個体のマウスからの結果を平均値±SEMとして示す。
【図5D】マウスin vivoにおけるsiRNAによる全身免疫応答の配列依存性誘導を示す図。 D:DOTAPと複合化した、または複合体化していないsiRNA TLR9.2、CpG ODN1826(いずれも5μg)またはHBSを、静脈注射によって129P2/OlaHsdマウス(1群につき3個体)に投与した。18時間後、血清を回収し、IFN−α産生をELISAによって評価した(左パネル)。さらに、注射から41時間後に、脾臓MDC上でのCD86発現を分析した(右パネル)。データは平均値±SEMとして示す。
【図6A】siRNA認識にはTLR7が必要であることを示す図。 A:野生型(黒色バー)またはTLR7−/−(白抜きバー)のC57BL/6マウスからの骨髄培養物を、siRNA TLR9.2とともに、TLR9.2のセンス鎖またはアンチセンス鎖とともに、またはポリカチオン性ペプチドと複合化した19量体ポリ(A)オリゴヌクレオチドとともにインキュベートした。CpG ODN1826(TLR9)およびロキソリビン(TLR7)をそれぞれ6μg/mLまたは0.5μg/mLの濃度で使用した。刺激から36時間後、上清を回収し、IFN−α産生をELISAによって評定した。データは、2個体のマウスからプールした骨髄培養物の3連実験の平均値±SEMとして示す。
【図6B】siRNA認識にはTLR7が必要であることを示す図。 B:5μgのsiRNA TLR9.2をDOTAPと複合体化し、野生型(黒色バー)またはTLR7−/−(白抜きバー)のC57BL/6マウスのいずれかに静脈注射した。1群につき2匹のマウスを用いた。7および18時間後、血清を回収し、IFN−α産生をELISAによって評定した。
【図6C】siRNA認識にはTLR7が必要であることを示す図。 C:注射から41時間後、脾臓細胞を単離した。抗CD3および抗CD8抗体を用いることにより、脾臓細胞中のCD8+およびCD4+T細胞を同定した。適当なアイソタイプの対照抗体を用いてCD69発現を評定した(灰色バー)。CD8+T細胞に対する1つの代表的なヒストグラムを示す。PDC(CD11c+,CD11b−およびB220++)および骨髄樹状細胞(MDC:CD11c++,CD11b++およびB220−)上でのCD69またはCD86の発現を分析した。CD69およびCD86の発現は平均値±SEMとして示されている。
【発明を実施するための形態】
【0028】
本発明は少なくとも部分的には、一本鎖または二本鎖RNA分子内の特定の配列モチーフが、とりわけTLR7を発現している細胞、たとえばプラズマサイトイド樹状細胞(PDC)などにおいて、IFN誘導を介した免疫応答を刺激するのに有効であるという発見に基づくものである。この発見に基づいて、本発明は、哺乳類においてIFN産生を刺激するために用いることのできる免疫刺激性オリゴヌクレオチド剤、ならびに一本鎖アンチセンス剤および二本鎖iRNA剤を選択的に設計して、所望の免疫応答を誘導するか、不要な免疫応答の誘導を回避するようにする方法も提供する。
【0029】
具体的には、本発明は、免疫刺激剤として一本鎖または二本鎖オリゴヌクレオチドを含む治療用組成物、ならびに、かかる組成物を免疫治療用途に用いる方法を提供する。本発明は具体的には、限定はされないが、成人および小児ならびに家畜への適用における、がん、自己免疫疾患、ぜんそく、呼吸アレルギー、食品アレルギー、および、細菌、寄生虫およびウィルス感染の治療などの免疫治療用途に用いられる免疫応答を強化するための方法および組成物を提供する。本発明はさらに、そのような化合物の製造方法をさらに提供する。さらに、本発明の化合物は、DNAワクチン、抗体、およびアレルゲンと組み合わせるアジュバントとして、および他の免疫刺激剤、化学療法剤、iRNA剤および/またはアンチセンスオリゴヌクレオチドと組み合わせるアジュバントとしても有用である。
【0030】
本発明は、ヌクレオチド配列
5’−GUCCUUCAA−3’(配列番号:1)
を含むか、該配列で構成されるか、または、本質的に該配列で構成されるオリゴヌクレオチド剤を提供する。
【0031】
他の実施形態において、オリゴヌクレオチド剤は、配列番号:1由来の、好ましくは当該配列の5’末端から、4以上、5以上、6以上、7以上または8以上の連続したヌクレオチドの配列、たとえば、5’−GUCC−3’(配列番号:2)、5’−GUCCU−3’(配列番号:3)、5’−GUCCUU−3’(配列番号:4)、5’−GUCCUUC−3’(配列番号:5)、または5’−GUCCUUCA−3’(配列番号:6)を含むか、該配列で構成されるか、または、本質的に該配列で構成される。
【0032】
本明細書において、オリゴヌクレオチド剤は、同剤において他のヌクレオチドを含まない場合には、配列番号:1で構成されると表現する。本明細書において、オリゴヌクレオチド剤は、1、2、3または4以下の他のヌクレオチドしか同剤に含まない場合には、本質的に配列番号:1で構成されると表現する。本明細書において、オリゴヌクレオチド剤は、同剤に他のヌクレオチドを含む場合には、配列番号:1を含むと表現する。好ましくは、このような剤は、同剤が二本鎖構造からならない場合には、21以下の他のヌクレオチド、より好ましくは約15〜約10以下の他のヌクレオチドしか該剤に含まない。二本鎖構造を含むオリゴヌクレオチド剤、たとえばiRNA剤は、配列番号:1を含む鎖の中に、21、15または10以下の他のヌクレオチドを含み、好ましくは、配列番号:1を含まない方の鎖の中に、30、24または19以下のヌクレオチドを含む。
【0033】
本明細書において、「オリゴヌクレオチド」という用語は、複数の連結されたヌクレオシド単位で形成されるポリヌクレオチドのことをいう。このようなオリゴヌクレオチドは、ゲノムDNAまたはcDNAを含む既存の核酸供給源から得ることができるが、好ましくは合成法によって作成される。好ましい実施形態において、各ヌクレオシド単位は、複素環塩基と、ペントフラノシル、トレハロース、アラビノース、2’−デオキシ−2’−置換アラビノース、2’−O−置換アラビノースまたはヘキソース糖基とを含む。ヌクレオシド残基は、任意の様々な既知のヌクレオシド間結合によって互いに連結することができる。そのようなヌクレオシド間結合としては、限定はされないが、ホスホジエステル、ホスホロチオエート、ホスホロジチオエート、アルキルホスホネート、アルキルホスホノチオエート、ホスホトリエステル、ホスホラミデート、シロキサン、カーボネート、カルボアルコキシ、アセトアミデート、カルバメート、モルホリノ、ボラノ、チオエーテル、架橋ホスホラミデート、架橋メチレンホスホネート、架橋ホスホロチオエート、およびスルフォンヌクレオシド間結合が挙げられる。「オリゴヌクレオチド」という用語は、1つ以上の立体特異的ヌクレオシド間結合(たとえば、(Rp)−または(Sp)−ホスホロチオエート、アルキルホスホネート、またはホスホトリエステル結合)を有するポリヌクレオシドも包含する。
【0034】
本発明のオリゴヌクレオチドは、配列番号:1を含むか、配列番号:1で構成されるか、または、本質的に配列番号:1で構成されるのであれば、天然のヌクレオシド、修飾ヌクレオシドまたはその混合物を含んでいてもよい。本明細書において、「修飾ヌクレオシド」とは、修飾複素環塩基、修飾糖部分、またはその組み合わせを含むヌクレオシドのことである。いくつかの実施形態において、修飾ヌクレオシドは、本明細書に記載するように、非天然のピリミジンまたはプリンヌクレオシドである。いくつかの実施形態において、修飾ヌクレオシドは、2’−置換リボヌクレオシド、アラビノヌクレオシドまたは2’−デオキシ−2’−置換−アラビノシドである。
【0035】
本明細書において、「2’−置換リボヌクレオシド」または「2’−置換アラビノシド」という用語には、ペントース部分の2’位のヒドロキシル基が置換されて、2’−置換または2’−O−置換リボヌクレオシドが生じた、リボヌクレオシドまたはアラビノヌクレオシドが含まれる。好ましくは、このような置換は1〜6個の飽和または不飽和炭素原子を含む低級アルキル基による置換、または6〜10個の炭素原子を有したアリール基による置換であり、このようなアルキルまたはアリール基は、非置換のものであってもよいし、たとえばハロ、ヒドロキシ、トリフルオロメチル、シアノ、ニトロ、アシル、アシルオキシ、アルコキシ、カルボキシル、カルボアルコキシ、またはアミノ基などによって置換されていてもよい。2’−O−置換リボヌクレオシドまたは2’−O−置換−アラビノシドの例としては、限定はされないが、たとえば、2’−O−メチルリボヌクレオシドまたは2’−O−メチルアラビノシドおよび2’−O−メトキシエチルリボヌクレオシド、または2’−O−メトキシエチルアラビノシドが挙げられる。
【0036】
「2’−置換リボヌクレオシド」または「2’−置換アラビノシド」という用語は、2’−ヒドロキシル基が1〜6個の飽和または不飽和炭素原子を含む低級アルキル基によって、あるいはアミノまたはハロ基によって置換されている、リボヌクレオシドまたはアラビノヌクレオシドも含む。このような2’−置換リボヌクレオシドまたは2’−置換アラビノシドの例としては、限定はされないが、たとえば、2’−アミノ、2’−フルオロ、2’−アリル、および2’−プロパルギルリボヌクレオシドまたはアラビノシドが挙げられる。
【0037】
「オリゴヌクレオチド」という用語には、ハイブリッドおよびキメラオリゴヌクレオチドも含まれる。「キメラオリゴヌクレオチド」とは、2種以上のヌクレオシド間結合を有するオリゴヌクレオチドのことである。キメラオリゴヌクレオチドの1つの好ましい実施形態は、ホスホロチオエート、ホスホジエステルまたはホスホロジチオエート領域と、アルキルホスホネートまたはアルキルホスホノチオエート結合などの非イオン結合とを含むキメラオリゴヌクレオチドである(たとえば、ペダーソン(Pederson)らの米国特許第5,635,377号および同第5,366,878号明細書を参照のこと)。
【0038】
「ハイブリッドオリゴヌクレオチド」は、2種以上のヌクレオシドを有するオリゴヌクレオチドである。このようなハイブリッドオリゴヌクレオチドの1つの好ましい実施形態は、リボヌクレオチドまたは2’−置換リボヌクレオチド領域と、デオキシリボヌクレオチド領域とを含む(たとえば、メテレフ(Metelev)およびアグラバル(Agrawal)の米国特許第5,652,355号、同第6,346,614号および同第6,143,881号を参照のこと)。
【0039】
本明細書における「免疫刺激」剤、または「免疫応答を刺激する」剤とは、細胞内でin vitroにて、または生物体内でin vivoにて、生物病原体に対する天然の防御の一部であると一般的に理解されている反応、たとえば免疫系を刺激する剤のことをいう。このような反応としては、限定はされないが、たとえば、抗体またはサイトカイン、たとえばインターフェロン、たとえばインターフェロンα(IFN−α)の産生が挙げられる。
【0040】
別の実施形態において、本発明は、たとえば、上記の免疫調節性オリゴヌクレオチドまたはオリゴヌクレオチド剤と、該オリゴヌクレオチド剤の利用可能な5’末端以外の位置に連結された抗原とを含んでなる、免疫調節性オリゴヌクレオチド複合体およびオリゴヌクレオチド剤複合体を提供する。いくつかの実施形態において、非ヌクレオチドリンカーは、オリゴヌクレオチドに連結された抗原を含む。いくつかの他の実施形態において、抗原は、オリゴヌクレオチドの3’末端以外の位置に連結される。いくつかの実施形態において、抗原は、ワクチン効果を生じる。他のオリゴヌクレオチド剤複合体については以下にさらに説明する。
【0041】
オリゴヌクレオチド剤が抗原と複合体化される場合には、抗原は好ましくは、病原体に関連する抗原、がんに関連する抗原、自己免疫疾患に関連する抗原、および、限定はされないがたとえば家畜の疾患または小児疾患などの他の疾患に関連する抗原からなる群より選択される。本明細書において、「と関連する」という用語は、その抗原が当該病原体、がん、自己免疫疾患、食品アレルギー、呼吸器系アレルギー、ぜんそく、または他の疾患が存在するときには存在するが、当該病原体、がん、自己免疫疾患、食品アレルギー、呼吸器系アレルギー、ぜんそく、または他の疾患が存在しないときには存在しないか、少ない量でしか存在しないことを意味する。
【0042】
免疫調節性オリゴヌクレオチドまたはオリゴヌクレオチド剤は抗原に共有結合されてい
るか、いずれにせよ抗原に機能的に結合されている。本明細書において「機能的に結合されている」という場合、オリゴヌクレオチド剤と抗原の両方の活性を維持するあらゆる結合をさす。このような機能的な結合の非限定的な例としては、同一のリポソームその他の同様の輸送ビヒクルまたは薬剤の一部であることが含まれる。オリゴヌクレオチド剤が抗原と共有結合している実施形態において、このような共有結合は、免疫調節性オリゴヌクレオチドの利用可能な5’末端以外のオリゴヌクレオチド剤上の任意の位置にあるのが好ましい。たとえば、抗原は、ヌクレオシド間結合に付加してもよいし、非ヌクレオチドリンカーに付加してもよい。あるいは、抗原自体が非ヌクレオチドリンカーであってもよい。
【0043】
ある好ましい実施形態において、オリゴヌクレオチドまたはオリゴヌクレオチド剤はiRNA剤、たとえばアンチセンス剤またはsiRNA剤である。その意味で、本明細書において用いるオリゴヌクレオチドまたはオリゴヌクレオチド剤は、たとえばヒトなどの哺乳類の血清中において、または哺乳類、特にヒトの細胞の細胞質においてみられるようなある条件下で互いにハイブリダイズするなどの直接結合によってのみ本質的に生じる、2以上、好ましくは2つのオリゴヌクレオチド分子で構成される複合体をも意味する。以後、オリゴヌクレオチド剤であるためには、該複合体を形成する2以上の該オリゴヌクレオチド分子のうちの少なくとも1つが、配列番号:1を含むか、該配列で構成されるか、または、本質的に該配列で構成される。
【0044】
本明細書中で用いるiRNA剤とは、アンチセンス剤またはsiRNA剤などの、標的遺伝子の発現を特異的に妨害することのできる剤のことである。典型的には、iRNA剤は、標的遺伝子によってコードされるmRNAの一部と相補的なオリゴヌクレオチド配列を含む。該iRNA剤は、任意のメカニズム、たとえば、mRNAの翻訳をブロックしたり、たとえばRNA干渉のメカニズムを介してmRNAの分解を開始させたり、またはたとえばDNAメチル化を介して遺伝子の転写をブロックすることによって、標的遺伝子の発現を妨害する。
【0045】
iRNA剤の設計
本発明はさらに、アンチセンス剤またはsiRNA剤などのiRNA剤を、炎症反応を誘導するか、炎症反応の誘導を回避するように、設計/選択する方法も提供する。具体的には、本方法は、IFN/炎症反応が望まれる場合には、配列番号:1、またはその断片をアンチセンス剤またはsiRNA剤などのオリゴヌクレオチド剤に含める工程を含み、あるいは炎症反応が望まれない場合には、上記配列を剤の中に含めない工程を含む。
【0046】
したがって、本発明は、とりわけ、少なくとも15、16、17、18、19、20、21または23ヌクレオチドの配列を含む、アンチセンス鎖と、任意選択でセンス鎖とを含むiRNA剤を提供し、IFN産生が望まれる場合には、アンチセンスおよび任意選択のセンス鎖の配列のうちの少なくとも一方は配列番号:1からなり、IFN産生を避ける場合には、アンチセンス鎖と任意選択のセンス鎖のいずれも上記配列を含まない。
【0047】
iRNA剤のアンチセンス鎖は、15、16、17、18、19、25、29、40または50ヌクレオチド以上の長さを有するものとする。また、50、40または30ヌクレオチド以下の長さのものとする。好ましい範囲は、長さが15〜30、17〜25、19〜23および19〜21ヌクレオチドである。
【0048】
iRNA剤のセンス鎖がある場合には、該センス鎖は、15、16、17、18、19、25、29、40または50ヌクレオチド以上の長さを有するものとする。また、50、40または30ヌクレオチド以下の長さのものとする。好ましい範囲は、長さが15〜30、17〜25、19〜23および19〜21ヌクレオチドである。
【0049】
iRNA剤に二本鎖部分がある場合、該二本鎖部分は、15、16、17、18、19、20、21、22、23、24、25、29、40または50以上のヌクレオチド対の長さを有するものとする。その長さは50、40または30ヌクレオチド対以下でなければならない。好ましい範囲は、15〜30、17〜25、19〜23、および19〜21ヌクレオチド対の長さである。
【0050】
本発明によるiRNA剤を設計する際には、最初に、配列番号:1からの4以上、5以上、6以上、7以上、または8以上の連続ヌクレオチドと相補的(アンチセンスオリゴヌクレオチドおよびsiRNAアンチセンス鎖において用いるため)または同一(siRNAセンス鎖において用いるため)である標的遺伝子のmRNA配列中の領域を同定することが有益である。次いでiRNA剤を、この領域に相補的または同一の配列と、標的遺伝子発現阻害活性を与えるようにいくつかの適切な追加のヌクレオチドとを含むように選ぶことができる。ここで配列番号:1は、iRNA剤内のたとえば3’または5’末端領域などのどこの場所に含まれていてもよく、または、iRNA剤のセンス鎖またはアンチセンス鎖のいずれかのどこの場所に含まれていてもよい。
【0051】
しかしながら、そのmRNAが配列番号:1と完全に相補的または同一の領域を含まない特定の遺伝子を阻害することが望まれる場合には、標的遺伝子mRNAに対するミスマッチを含むiRNA剤を用いてもよい。ミスマッチは、たとえばsiRNAのいずれかの鎖の末端領域において最も許容されうるため、ミスマッチはこれらの末端領域に導入するのが最もよい。たとえば、siRNAのセンス鎖の最も3’末端側または最も5’末端側の4,5,6,7,8または9ヌクレオチド、またはアンチセンス鎖の最も3’末端側の4,5,6,7,8または9ヌクレオチドを配列番号:1から選んでもよく、この場合、1以下、2以下、または3以下のヌクレオチドが標的mRNAに対してミスマッチを示し、残りのヌクレオチドは、標的mRNAに対して完全に一致するか相補的になるように選ばれる。しかしながら、アンチセンス鎖の(5’から3’に向けて数えて)2〜9位にあるヌクレオチドは、標的mRNAの認識にとって重要であると考えられている(ヘイリー、ビー(Haley,B.),およびザモア、ピーディー(Zamore,P.D.),Nat Struct Mol Biol,11,599〜606(2004))。したがって、この領域(「シード領域」ともよばれることもある)では、標的mRNAとの完全な相補配列が存在することが好ましい。
【0052】
このような実施形態において、前記標的遺伝子は本質的に、上述のような完全に一致した、または部分的にミスマッチのあるiRNA剤の設計を可能にする任意の遺伝子配列であってよい。この遺伝子は、たとえば、ヒト遺伝子など、哺乳類の遺伝子であってよい。たとえば、限定するものではないが、このような遺伝子は、オンコジーン、免疫応答に関与する遺伝子、代謝に関与する遺伝子、または成長因子、転写因子、もしくは受容体をコードする遺伝子であってよい。表7は、ヒトmRNA配列データベースのBLAST検索によって得られた、配列番号:1と同一または相補的な配列を含むことからこの様式で阻害可能な例示的な遺伝子転写物の名前を示した非限定的なリストを含む。あるいは、標的遺伝子は、動物、好ましくは哺乳類、より好ましくはヒトに対して病原性のある生物、たとえば細菌またはウィルスに由来するものであってもよい。
【0053】
iRNA剤化学
本明細書で検討するiRNA剤には、非修飾RNAとともに、たとえば効力を高めるために修飾されたRNAや、ヌクレオシド代用物のポリマーも含まれる。非修飾RNAは、核酸の成分、すなわち、糖、塩基、およびリン酸部分が、天然に生じるものと、好ましくはヒトの体において天然に生じるものと同じまたは実質的に同じ分子のことをいう。従来技術では、希少または特殊であるが天然に発生するRNAを修飾RNAと呼んできた。た
とえば、リンバッハ(Limbach)ら.,(1994)Nucleic Acids
Res.22:2183〜2196を参照のこと。修飾RNAと呼ばれることも多いこのような希少または特殊なRNA(明らかにこれらは典型的に転写後修飾の結果によるものである)は、本明細書中では非修飾RNAの用語の範囲内であるとする。本明細書中で用いる修飾RNAとは、核酸の成分、すなわち、糖、塩基、およびリン酸部分のうちの1つまたはそれ以上が、天然に生じるものとは異なる、好ましくはヒトの体内で生じるものとは異なる分子のことをいう。それらは、修飾「RNA」と呼ばれるが、勿論、修飾のためにもはやRNAではない分子をも含む。ヌクレオシド代用物は、リボホスフェート骨格が非リボホスフェート構築物に置き換わっている分子であり、該構築物は、ハイブリダイゼーションがリボホスフェート骨格、たとえば非荷電のリボホスフェート骨格類似物の場合に見られるものとほぼ同じとなるように、塩基を正しい空間的関係に存在できるようにする。上記のそれぞれの例について下記で検討する。
【0054】
ヌクレアーゼ耐性の増強
ヌクレアーゼ耐性および/または標的mRNAへの結合親和性を高めるために、オリゴヌクレオチド剤は、たとえば、2’修飾リボース単位および/またはホスホロチオエート結合を含んでいてもよく、たとえば2’ヒドロキシル基(OH)を、複数の異なる「オキシ」または「デオキシ」置換基で修飾または置換してもよい。
【0055】
「オキシ」−2’ヒドロキシル基修飾の例としては、アルコキシまたはアリールオキシ(OR、たとえば、R=H,アルキル、シクロアルキル、アリール、アラルキル、ヘテロアリールまたは糖);ポリエチレングリコール(PEG)、O(CH2CH2O)nCH2CH2OR;2’ヒドロキシが、たとえばメチレン架橋によって、同じリボース糖の4’炭素に複合化した「ロックト」核酸(LNA);O−AMINEおよびアミノアルコキシ、O(CH2)nAMlNE、(たとえば、AMINE=NH2;アルキルアミノ、ジアルキルアミノ、ヘテロサイクリルアミノ、アリールアミノ、ジアリールアミノ、ヘテロアリールアミノ、またはジヘテロアリールアミノ、エチレンジアミン、ポリアミノ)が挙げられる。注目すべきは、メトキシエチル基(MOE)(OCH2CH2OCH3、PEG誘導体)のみを含むオリゴヌクレオチドは、堅牢なホスホロチオエート修飾によって修飾されたものに匹敵するヌクレアーゼ安定性を示す。
【0056】
「デオキシ」修飾は、水素(すなわち、部分的に二本鎖のRNAの突出部分に特に関係のあるデオキシリボース糖);ハロ(たとえば、フルオロ);アミノ(たとえば、NH2;アルキルアミノ、ジアルキルアミノ、ヘテロサイクリル、アリールアミノ、ジアリールアミノ、ヘテロアリールアミノ、ジヘテロアリールアミノ、またはアミノ酸);NH(CH2CH2NH)nCH2CH2−AMINE(AMINE=NH2;アルキルアミノ、ジアルキルアミノ、ヘテロサイクリルアミノ、アリールアミノ、ジアリールアミノ、ヘテロアリールアミノ、またはジヘテロアリールアミノ)、−NHC(O)R(R=アルキル、シクロアルキル、アリール、アラルキル、ヘテロアリールまたは糖)、シアノ;メルカプト;アルキル−チオ−アルキル;チオアルコキシ;および任意選択でたとえばアミノ官能性に置換されていてもよいアルキル、シクロアルキル、アリール、アルケニル、およびアルキニルを含む。
【0057】
好ましい置換基は、2’−メトキシエチル、2’−OCH3、2’−O−アリル、2’−C−アリル、および2’−フルオロである。
ヌクレアーゼ耐性を最大化するために、2’修飾を、1つまたはそれ以上のホスフェートリンカー修飾(たとえば、ホスホロチオエート)と組み合わせて用いてもよい。
【0058】
オリゴヌクレオチド骨格内にフラノース糖を含めることによっても、エンドヌクレアーゼによる切断を低減することができる。オリゴヌクレオチド剤は、3’カチオン基を含め
ることによって、または3’末端のヌクレオシドを3’−3’結合で反転させることによって、さらに修飾することもできる。別の代替例において、3’末端を、アミノアルキル基、たとえば、3’C5−アミノアルキルdTでブロックすることもできる。他の3’複合体が、3’−5’エキソヌクレアーゼによる切断を阻害することもできる。理論に束縛されるものではないが、ナプロキセンまたはイブプロフェンなどの3’複合体は、エキソヌクレアーゼがオリゴヌクレオチドの3’末端に結合するのを立体的に阻害することにより、該エキソヌクレアーゼによる切断を阻害することができる。小さいアルキル鎖、アリール基、または複素環複合体または修飾糖(D−リボース、デオキシリボース、グルコースなど)も3’−5’エキソヌクレアーゼを阻害することができる。
【0059】
同様に、5’複合体は、5’−3’エキソヌクレアーゼによる切断を阻害することができる。理論に束縛されるものではないが、ナプロキセンまたはイブプロフェンなどの5’複合体は、エキソヌクレアーゼがオリゴヌクレオチドの5’末端に結合するのを立体的に阻害することにより、該エキソヌクレアーゼによる切断を阻害することができる。小さいアルキル鎖、アリール基、または複素環複合体または修飾糖(D−リボース、デオキシリボース、グルコースなど)も3’−5’エキソヌクレアーゼを阻害することができる。
【0060】
テザードリガンド
オリゴヌクレオチド剤の特性は、その薬理学的特性も含めて、リガンド、たとえばテザードリガンド(繋留リガンド)などの導入によって影響を与えたり、調整したりすることができる。テザードリガンドを含むオリゴヌクレオチド剤は、本明細書においては複合体または生物複合体ともよぶこともある。
【0061】
たとえばリガンドなどの幅広い実体をオリゴヌクレオチド剤に、たとえばリガンド複合化モノマーサブユニットの担体に繋留することができる。その例を、リガンド複合化モノマーサブユニットに関して下記に記載するが、これは好適な例にすぎず、実体をオリゴヌクレオチド剤の他の地点に連結することもできる。
【0062】
好ましい部分は、担体に、好ましくは共有結合によって、直接または間接的に介在テザーを介して連結されたリガンドである。好ましい実施形態において、リガンドは、介在テザーを介して担体に付加されている。リガンドまたはテザードリガンドは、リガンド複合化モノマーが成長中の鎖に組み込まれる場合には、リガンド複合化モノマー上に存在していてもよい。一部の実施形態では、「前駆体」リガンド複合化モノマーサブユニットを成長中の鎖に組み込んだ後に、リガンドを「前駆体」リガンド複合化モノマーサブユニットに組み込むとよい。たとえば、アミノ末端テザー、たとえばTAP−(CH2)nNH2を有するモノマーを、成長中のセンス鎖またはアンチセンス鎖に組み込むことができる。次の操作において、すなわち前駆体モノマーサブユニットを鎖に組み込んだ後に、続いて求電子基、たとえばペンタフルオロフェニルエステルまたはアルデヒド基を有するリガンドを、該リガンドの求電子基と前駆体リガンド複合化モノマーサブユニットテザーの求核基とを連結することによって、前駆体リガンド複合化モノマーに付加することができる。
【0063】
好ましい実施形態において、リガンドはそれが組み込まれるオリゴヌクレオチド剤の分布、標的または寿命を変える。好ましい実施形態において、リガンドは、選択された標的、たとえば分子、細胞または細胞種、コンパートメント、たとえば細胞または器官のコンパートメント、組織、器官、または体の部位に対して、たとえば当該リガンドが存在しないものと比べて高い親和性を提供する。
【0064】
好ましいリガンドは、輸送特性、ハイブリダイゼーション特性、および特異性を向上させることができ、得られる天然または修飾オリゴリボヌクレオチド、または、本明細書に記載のモノマーの任意の組み合わせを含む高分子、および/または天然または修飾リボヌ
クレオチドのヌクレアーゼ耐性を向上させることもできる。
【0065】
リガンドは一般的に、たとえば取り込みを高めるための治療用改質剤;たとえば分布をモニタするための診断用化合物またはレポーター基;架橋剤;ヌクレアーゼ耐性を付与する部分;および天然または通常のものとは異なる核酸塩基を含んでいてもよい。一般例としては、脂溶性分子、脂質、レクチン、ステロイド(たとえば、ウバオール、ヘシゲニン(hecigenin)、ジオスゲニン)、テルペン(たとえば、トリテルペン、たとえばサルササポゲニン、フリーデリン、エピフリーデラノール誘導化リトコール酸)、ビタミン、炭水化物(たとえば、デキストラン、プルラン、キチン、キトサン、イヌリン、シクロデキストリンまたはヒアルロン酸)、タンパク質、タンパク質結合物質、インテグリンを標的とする分子、ポリカチオン、ペプチド、ポリアミン、およびペプチド疑似物質が挙げられる。
【0066】
リガンドは、天然に存在する分子または組換えもしくは合成分子、たとえば、合成ポリマー、たとえば合成ポリアミノ酸であってよい。ポリアミノ酸の例としては、ポリリシン(PLL)、ポリL−アスパラギン酸、ポリL−グルタミン酸、スチレン−無水マレイン酸コポリマー、ポリ(L−ラクチド−コ−グリコライド)コポリマー、ジビニルエーテル−無水マレイン酸コポリマー、N−(2−ヒドロキシプロピル)メタクリルアミドコポリマー(HMPA)、ポリエチレングリコール(PEG)、ポリビニルアルコール(PVA)、ポリウレタン、ポリ(2−エチルアクリル酸)、N−イソプロピルアクリルアミドポリマー、またはポリホスファジンが挙げられる。ポリアミンの例としては、ポリエチレンイミン、ポリリシン(PLL)、スペルミン、スペルミジン、ポリアミン、疑似ペプチド−ポリアミン、ペプチド疑似物−ポリアミン、デンドリマーポリアミン、アルギニン、アミジン、プロタミン、カチオン部分、たとえば、カチオン脂質、カチオンプロフィリン、ポリアミンの第4級塩、またはαヘリックスペプチドが挙げられる。
【0067】
リガンドは、標的化基、たとえば、細胞または組織を標的とする物質、たとえば、チロトロピン、メラノトロピン、サーファクタントプロテインA、ムチン炭水化物、グリコシル化ポリアミノ酸、トランスフェリン、ビスホスフォネート、ポリグルタメート、ポリアルパルテート、またはRGDペプチドもしくはRGDペプチド疑似物を含んでいてもよい。
【0068】
リガンドは、タンパク質、たとえば糖タンパク質、リポタンパク質、例えば低密度リポタンパク質(LDL)、またはアルブミン、たとえばヒト血清アルブミン(HSA)、またはペプチド、たとえば、共リガンドに対する特異的親和性を有する分子、または抗体、たとえば、がん細胞、内皮細胞、もしくは骨細胞などの特定の細胞種に結合する抗体であってよい。リガンドは、ホルモンおよびホルモン受容体を含んでいてもよい。それらは、非ペプチド性のもの、たとえば補因子、多価ラクトース、多価ガラクトース、N−アセチル−ガラクトサミン、N−アセチル−グルコサミン、多価マンノース、または多価フコースを含んでいてもよい。リガンドは、たとえば、リポ多糖、p38MAPキナーゼの活性化剤、またはNF−κBの活性化剤であってもよい。
【0069】
リガンドは、物質、たとえば薬剤であって、たとえば細胞の細胞骨格を崩壊させることにより、たとえば、細胞の微小管、マイクロフィラメント、および/または中間径フィラメントを崩壊させることにより、細胞へのオリゴヌクレオチド剤の取り込みを高めることのできる薬剤であってもよい。この薬剤は、たとえば、タキソン、ビンクリスチン、ビンブラスチン、サイトカラシン、ノコダゾール、ジャプラキノリド(japlakinolide)、ラトランクリンA、ファロイジン、スウィンホライドA、インダノシン、またはミオセルビンなどであってよい。
【0070】
一実施形態において、リガンドは脂質または脂質系分子である。このような脂質または脂質系分子は、血清タンパク質、たとえば、ヒト血清アルブミン(HSA)に結合することが好ましい。HSA結合リガンドは、標的組織、たとえば肝臓実質細胞を含む肝臓組織への複合体の分布を可能にする。HSAに結合しうる他の分子もリガンドとして用いることができる。たとえば、ネプロキシンまたはアスピリンを用いることができる。脂質または脂質系リガンドは、(a)複合体の分解に対する耐性を増大させる、(b)標的細胞または標的膜への標的化または輸送を増大させる、および/または(c)たとえばHSAなどの血清タンパク質への結合を調節するために用いることができる。
【0071】
脂質系リガンドは、標的組織への複合体の結合を調節、たとえば制御するために用いることができる。たとえば、HSAに比較的強く結合する脂質または脂質系リガンドは、腎臓を標的としにくく、したがって、体から除去されにくい。HSAに比較的弱く結合する脂質または脂質系リガンドは、複合体の標的を腎臓とするために用いることができる。
【0072】
別の実施形態において、リガンドは、例えば増殖中の細胞などの標的細胞によって取り込まれる部分、例えばビタミンまたは栄養素である。これらは、悪性型または非悪性型のたとえばがん細胞などの望ましくない細胞増殖を特徴とする疾患を治療するために特に有用である。ビタミンの例としては、ビタミンA、E、およびKが挙げられる。他のビタミンの例としては、Bビタミン類、たとえば、葉酸、B12、リボフラビン、ビオチン、ピリドキサルまたはがん細胞によって取り込まれる他のビタミンまたは栄養素が挙げられる。
【0073】
別の実施形態において、リガンドは細胞透過剤であり、好ましくはヘリックス細胞透過剤である。好ましくは、同剤は両親媒性である。剤としては、たとえば、tatまたはアンテナペディアなどのペプチドが挙げられる。剤がペプチドであれば、ペプチジル疑似物、インバートマー、非ペプチドまたは疑似ペプチド結合、およびD−アミノ酸の使用も含めて修飾することができる。ヘリックス剤は、好ましくは脂溶性相および疎油性相を有する好ましくはαヘリックス剤である。
【0074】
好ましいリガンドは、本発明の剤に、細胞に結合する能力、好ましくは、問題の病状と最も関連する特定の種類の細胞に結合する能力を与える。たとえば、アシアロ糖タンパク質受容体(ASGPr)(ウー(Wu)およびウー(Wu)、1987,J.Biol.Chem.262,4429〜4432)は、幹細胞に独特のものであり、分枝状ガラクトース末端糖タンパク質、たとえばアシアロオロソムコイド(ASOR)と結合する。他の例では、葉酸受容体は多くのがん細胞において過剰発現される。このような糖タンパク質、合成糖複合体、または葉酸塩の受容体への結合は、オリゴサッカライド鎖の分枝の程度に強く依存する親和性で起こり、たとえば、トリアンテナ型構造は、バイアンテナ型またはモノアンテナ型鎖よりも大きな親和性で結合する(ベツィンガー(Baenziger)およびフィーテ(Fiete)、1980,Cell,22,611〜620;コノリー(Connolly)ら、1982,J.Biol.Chem.,257,939〜945)。リ(Lee)およびリ(Lee)、1987,Glycoconjugate
J.,4,317〜328では、この高い特異性を、ガラクトースに比べて高い受容体親和性を有するN−アセチル−D−ガラクトサミンを炭水化物部分として使用することによって得ている。この「クラスタリング効果」は、マンノシル末端糖タンパク質または糖複合体の結合および取り込みについても記載されている(ポンパイポム(Ponpipom)ら、1981,J.Med.Chem.,24,1388〜1395)。ガラクトース、ガラクトサミン、または葉酸塩に基づく複合体を用いて外来化合物を細胞膜を通して輸送することにより、たとえば、肝疾患、肝臓がん、または他のがんの治療に対するターゲッティド(標的を定めた)送達手法を提供することができる。生物複合体を用いることにより、治療に必要な治療用化合物の必要用量を低減することもできる。さらに、治療上
の生物利用性、薬力学、および薬物動態パラメータを、本発明の核酸生物複合体を使用することによって調節することができる。このような生物複合体の非限定的な例が、バルギース(Vargeese)らの米国特許出願番号第10/201,394号(2001年8月13日出願);およびマトゥーリック‐アダミック(Matulic−Adamic)らの米国特許出願番号第60/362,016号(2002年3月6日出願)に記載されている。
【0075】
5’リン酸修飾
他の実施形態において、オリゴヌクレオチド剤は、5’リン酸化されているか、または5’末端にホスホリルアナログを含む。アンチセンス鎖の5’リン酸修飾には、RISC媒介性遺伝子サイレンシングに適合するものが挙げられる。適切な修飾には、5’−モノホスフェート((HO)2(O)P−O−5’);5’二リン酸((HO)2(O)P−O−P(HO)(O)−O−5’);5’三リン酸((HO)2(O)P−O−(HO)(O)P−O−P(HO)(O)−O−5’);5’グアノシンキャップ(7−メチル化または非メチル化)(7m−G−O−5’−(HO)(O)P−O−(HO)(O)P−O−P(HO)(O)−O−5’);5’アデノシンキャップ(Appp)、および修飾または非修飾のヌクレオチドキャップ構造がある。他の適切な5’リン酸修飾は当業者に周知である。
【0076】
製剤
本明細書において記載するオリゴヌクレオチド剤は、対象への投与、好ましくは、限定はされないが静脈内、筋肉内、腹腔内、直腸、皮内、皮下、または、経皮投与などの、たとえば非経口または経口投与などの全身投与用として、または、組織、たとえば肺や鼻腔(呼吸組織)などへのたとえば吸入または経鼻投与、肝臓、腎臓、脾臓、脳、脊髄、目、皮膚、腸、粘膜、胎盤、または当該オリゴヌクレオチド剤の効果に対する好適な標的である他の任意の組織または器官への標的を定めた送達用として、製剤することができる。
【0077】
説明を容易にするために、本セクションにおける製剤、組成物、および方法は、主に非修飾オリゴヌクレオチド剤に関して説明する。しかしながら、これらの製剤、組成物、および方法は、他のオリゴヌクレオチド剤、たとえば修飾オリゴヌクレオチド剤を用いても実施することができ、そのような実施も本発明に含まれることは当然のことである。
【0078】
製剤されたオリゴヌクレオチド剤組成物は、様々な形態をとりうる。いくつかの例において、組成物は少なくとも部分的に結晶、均一な結晶および/または無水物(たとえば、水分が80,50,30,20または10%未満)である。別の例において、オリゴヌクレオチド剤は水性相にあり、たとえば、水を含む溶液状態であり、この形態が非経口投与には好ましい。
【0079】
水性相または結晶組成物は、輸送ビヒクル、たとえばリポソーム(特に水性相に対して)または粒子(たとえば、結晶組成物に対して適切であるような微粒子)内に組み込んでもよい。一般に、オリゴヌクレオチド剤組成物は、対象とする投与方法に適合するような様式で調合される。
【0080】
オリゴヌクレオチド剤製剤は、別の剤、たとえば別の治療剤または前記オリゴヌクレオチド剤を安定化させる剤、たとえば、オリゴヌクレオチド剤と複合体を形成するタンパク質と組み合わせて調合してもよい。さらに他の剤としては、キレート剤、たとえばEDTA(たとえば、Mg2+などの二価カチオンを除去するため)、塩、ヌクレアーゼ阻害剤(たとえば、RNAsinなどの広い特異性のヌクレアーゼ阻害剤)などが挙げられる。
【0081】
一実施形態において、オリゴヌクレオチド剤製剤は、別のオリゴヌクレオチド剤、たと
えば、標的遺伝子に関してRNAiを媒介することのできるsiRNA剤を含む。そのような用途では、本発明のオリゴヌクレオチド剤により、標的遺伝子は細胞内で崩壊するとともに、該細胞は刺激されてIFNを産生する。このような同時治療は、がんおよびウィルス感染などの疾患の治療において重要である。
【0082】
核酸分子の送達方法は、アクタール(Akhtar)ら、1992、Trends Cell Bio.,2,139;「アンチセンスオリゴヌクレオチド治療のための送達戦略(Delivery Strategies for Antisense Oligonucleotide Therapeutics)」、アクタール(Akhtar)編、1995、マウレル(Maurer)ら、1999、Mol.Membr.Biol.,16,129〜140;ホフランド(Hofland)およびヒュアン(Huang)、1999、Handb.Exp.Pharmacol.,137,165〜192;およびリ(Lee)ら,2000、ACS Symp.Ser.,752,184〜192に記載されており、これらのすべての文献は参照により本願に組み入れる。バイゲルマン(Beigelman)ら、米国特許第6,395,713号、およびサリバン(Sullivan)ら、国際公開公報第94/02595号パンフレットは、さらに、核酸分子のための一般的な送達方法を記載している。これらのプロトコールは、事実上あらゆる核酸分子の送達のために利用することができる。核酸分子は、限定はされないが、イオントフォレシスによるリポソームへのカプセル化、他のビヒクルたとえば生分解性ポリマー、ハイドロゲル、シクロデキストリン(たとえば、ゴンザレス(Gonzalez)ら、1999、Bioconjugate Chem.,10,1068〜1074;ワン(Wang)ら、国際公開公報第03/47518号および同第03/46185号パンフレット)、ポリ(乳酸−グリコール酸共重合体)(PLGA)およびPLCAミクロスフェア(たとえば、米国特許第6,447,796号、および米国特許出願公開番号第2002130430号を参照)、生分解性ナノカプセル、および生体接着性ミクロスフェアへの組み込みによって、またはタンパク様ベクター(オヘア(O’Hare)およびノーマンド(Normand)、国際公開公報第00/53722号パンフレット)によってなど、当業者に周知の様々な方法によって投与することができる。あるいは、核酸/ビヒクルの組み合わせは、直接注射によって、または注入ポンプを用いることによって局所的に送達される。本発明の核酸分子の直接注射は、皮下、筋肉内、皮内にかかわらず、標準的な針とシリンジの方法を用いて、またはコンリー(Conry)ら、1999、Clin.Cancer Res.,5,2330〜2337およびバリー(Barry)ら、国際公開公報第99/31262号パンフレットに記載されるような無針技術によって行うことができる。
【0083】
別の実施形態において、本発明の核酸分子は、ポリエチレンイミンおよびその誘導体、たとえば、ポリエチレンイミン−ポリエチレングリコール−N−アセチルガラクトサミン(PEI−PEG−GAL)やポリエチレンイミン−ポリエチレングリコール−トリ−N−アセチルガラクトサミン(PEI−PEG−トリGAL)誘導体とともに製剤化または複合体形成してもよい。一実施形態において、本発明の核酸分子は、参照によりその全体を本願に組み込む米国特許出願公開番号第20030077829号に記載されているように製剤する。
【0084】
一実施形態において、本発明のオリゴヌクレオチド剤は、参照により図面も含めたその全体を本願に組み込む米国特許出願公開番号第20010007666号に記載されるような膜破壊剤と複合化される。別の実施形態において、膜破壊剤およびオリゴヌクレオチド剤は、カチオン脂質またはヘルパー脂質分子、たとえば、参照により図面も含めたその全体を本願に組み込む米国特許第6,235,310号に記載されるような脂質とも複合化される。
【0085】
一実施形態において、本発明のオリゴヌクレオチド剤は、図面を含めた全体を参照により本願に組み込む米国特許出願公報番号2003077829号明細書および国際公開公報第00/03683号および同第02/087541号パンフレットに記載されるような送達系と複合化される。
【0086】
一実施形態において、本発明の核酸分子は、肺送達、たとえば、吸入装置もしくはネブライザーによって投与されるエアロゾルまたはスプレー乾燥製剤の吸入などによって、肺送達を介して投与され、核酸分子を迅速に関連する肺組織に局所的に取り込ませる。微粉化核酸組成物の呼吸用乾燥粒子を含む固体粒状組成物は、乾燥または凍結乾燥した核酸組成物を粉砕して、その微粉化組成物を、たとえば400メッシュスクリーンに通して、大きな凝集体を分割もしくは分離することによって調製することができる。本発明の核酸組成物を含む固体粒状組成物は、任意選択で、エアロゾルならびに他の治療用化合物の作成を容易にするためにはたらく分散剤を含んでいてもよい。適切な分散剤はラクトースであり、1対1の重量比などの任意の適切な比率で核酸化合物と混合することができる。
【0087】
本発明の核酸組成物を含む液体粒子のエアロゾルは、ネブライザーを用いるなど任意の手段によって発生させることができる(たとえば、米国特許第4,501,729号を参照)。ネブライザーは市販の装置であり、有効成分の溶液または懸濁液を、典型的には空気または酸素などの圧縮ガスを狭いベンチュリを通して加速するか、あるいは超音波攪拌によって、治療用エアロゾルミストに変えるものである。ネブライザーにおいて用いるのに適した製剤は、液体担体中に、有効成分を、製剤の40%(w/w)まで、好ましくは20%(w/w)未満の量で含む。担体は典型的には水または希釈水性アルコール溶液であり、好ましくはたとえば塩化ナトリウムまたは他の適切な塩などを加えることにより体液と等張にしたものである。任意選択の添加物としては、製剤が無菌的に調製されない場合には保存剤、たとえば、メチルヒドロキシベンゾエート、抗酸化剤、着香剤、揮発油、緩衝剤、および乳化剤、ならびに他の調合界面活性剤が挙げられる。有効組成物と界面活性剤とを含む固体粒子のエアロゾルも同様に、任意の固体粒状エアロゾル発生器を用いて発生させることができる。固体粒状治療薬を対象に投与するためのエアロゾル発生器は、上述のように吸入可能な粒子を発生し、所定量の治療組成物を含む一定体積のエアロゾルをヒトへの投与に適した速度で発生させる。固体粒状エアロゾル発生器の説明的な例として、吸入器がある。吸入による投与に適した製剤は、吸入器によって送達可能な細かく砕いた粉末を含む。吸入器において、粉末、たとえば、本明細書において記載する治療を行うのに有効な一定量の粉末は、典型的にはゼラチンまたはプラスチックからなるカプセルまたはカートリッジに含まれ、該カプセルまたはカートリッジはin situにおいて穿刺または開口され、吸入時に装置を通って吸引される空気によって、または手動ポンプによって、粉末が送達される。吸入器において用いられる粉末は、有効成分だけで構成されるか、有効成分と、適切な粉末希釈剤、たとえばラクトースと、任意選択の界面活性剤とからなる粉末混成物のいずれかである。有効成分は典型的には、製剤の0.1〜100(w/w)である。第2の説明的なエアロゾル発生器は、定量吸入器からなる。定量吸入器は、典型的には液化推進剤中に有効成分の懸濁物または溶液製剤を含む加圧エアロゾルディスペンサである。使用中にはこれらの装置は、定体積を送達するようにしたバルブを介して製剤を放出し、有効成分を含んだ微細粒状スプレーを発生する。適切な推進剤としては、ある種のクロロフルオロカーボン化合物、たとえば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、およびその混合物が挙げられる。製剤は、さらに、1つ以上の共溶媒、たとえば、エタノール、乳化剤および他の製剤界面活性剤、たとえばオレイン酸または三オレイン酸ソルビタン、抗酸化剤および適切な着香剤を含んでいてもよい。肺送達のための他の方法は、たとえば、米国特許出願番号第20040037780号、および米国特許第6,592,904号、同第6,582,728号、同第6,565,885号に記載されている。
【0088】
一実施形態において、本発明の核酸分子は、中枢神経系(CNS)または末梢神経系(PNS)に投与される。実験から、ニューロンによる核酸の有効なin vivoでの取り込みが証明された。神経細胞への核酸の局所投与の例として、ソマー(Sommer)ら、1998、Antisense Nuc.Acid Drug Dev.,8,75は、c−fosに対する15量体のホスホロチオエートアンチセンス核酸分子を、脳へのマイクロインジェクションによりラットに投与する研究について述べている。テトラメチルローダミン−イソチオシアネート(TRITC)またはフルオレセインイソチオシアネート(FITC)で標識されたアンチセンス分子は、注入後30分の間に専らニューロンによって取り込まれた。広範な細胞質染色および核染色がこれらの細胞において見られた。神経細胞への核酸の全身投与の例としては、エパ(Epa)ら、2000、Antisense Nuc.Acid Drug Dev.,10,469は、神経系に分化したPC12細胞においてp75ニューロトロピン受容体を標的とするためにβ−シクロデキストリン−アダマンタン−オリゴヌクレオチド複合体を使用した、マウスでのin vivo研究について述べている。2週間にわたる腹腔内投与に続いて、p75ニューロトロピン受容体アンチセンスの顕著な取り込みが、後根神経節(DRG)細胞において観察された。さらに、p75の際だった一貫したダウンレギュレーションが、DRGニューロンにおいて観察された。核酸の標的をニューロンに定めるためのさらなるアプローチが、ブローダス(Broaddus)ら、1998、J.Neurosurg.,88(4),734;カーレ(Karle)ら、1997、Eur.J.Pharmocol.,340(2/3),153;バナイ(Bannai)ら、1998、Brain Research,784(1,2),304;ラジャクマー(Rajakumar)ら、1997、Synapse,26(3),199;ウー‐ポン(Wu−pong)ら、1999、BioPharm,12(1),32;バナイ(Bannai)ら、1998、Brain Res.Protoc,3(1),83;シマトフ(Simantov)ら、1996、Neuroscience,74(1),39に記載されている。したがって、本発明の核酸分子は、CNSおよび/またはPNSにおいて細胞に送達され取り込まれやすい。
【0089】
CNSへの本発明の核酸分子の送達は、様々な異なる戦略によって提供される。使用しうるCNS送達に対する伝統的なアプローチとしては、限定はされないが、髄腔内および脳室内投与、カテーテルおよびポンプの移植、障害または損傷の部位における直接注入または潅流、脳動脈系への注入、または血液−脳関門の化学的または浸透性開口によるものが挙げられる。他のアプローチとしては、たとえば複合体および生分解性ポリマーの使用を介した、様々な輸送システムおよび担体システムの使用が挙げられる。さらに、たとえばカプリット(Kaplitt)らの米国特許第6,180,613号およびデビッドソン(Davidson)の国際公開公報第04/013280号パンフレットに記載されるような遺伝子治療アプローチを用いて、CNSにおいて核酸分子を発現させることができる。
【0090】
一実施形態において、本発明の送達系は、たとえば、水性または非水性ゲル、クリーム、多重エマルジョン、ミクロエマルジョン、リポソーム、軟膏、水性および非水性溶液、ローション、エアロゾル、ハイドロカーボン基剤および粉末を含み、また賦形剤、たとえば、可溶化剤、透過促進剤(たとえば、脂肪酸、脂肪酸エステル、脂肪アルコール、およびアミノ酸)、および親水性ポリマー(たとえば、ポリカルボフィルおよびポリビニルピロリドン)を含んでいてもよい。一実施形態において、薬学的に許容される担体はリポソームまたは経皮増強剤である。本発明において使用しうるリポソームの例は次の通り、すなわち(1)CellFectin(R)、カチオン脂質N,NI,NII,NIII−テトラメチル−N,NI,NII,NIII−−テトラパルミット−y−スペルミンおよびジオレオイルホスファチジルエタノールアミン(DOPE)の1:1.5(M/M)リポソーム製剤(ギブコ・ビーアールエル(GIBCO BRL));(2)Cytofe
ctin GSV(R)、カチオン脂質およびDOPEの2:1(M/M)リポソーム製剤(グレン・リサーチ(Glen Research));(3)DOTAP(N−[1−(2,3−ジオレオイルオキシ)−N,N,N−トリメチルアンモニウムメチルスルフェート)(ベーリンガー・マンハイム(Boehringer Manheim));および(4)Lipofectamine(TM)、ポリカチオン脂質DOSPAおよび中性脂質DOPEの3:1(M/M)リポソーム製剤(ギブコ・ビーアールエル)。
【0091】
一実施形態において、本発明の送達系は、パッチ剤、錠剤、坐剤、腟坐薬、ゲル剤、およびクリーム剤を含み、可溶化剤および増強剤などの賦形剤(たとえば、ポリエチレングリコール、胆汁酸塩およびアミノ酸)、および他のビヒクル(たとえば、ポリエチレングリコール、脂肪酸エステルおよび誘導体、および親水性ポリマー、たとえばヒドロキシプロピルメチルセルロースおよびヒアルロン酸)を含有していてもよい。
【0092】
一実施形態において、本発明のオリゴヌクレオチド剤は、ポリエチレンイミン(たとえば、直鎖または分枝状PEI)および/またはポリエチレンイミン誘導体、たとえばガラクトースPEI、コレステロールPEI,抗体誘導化PEI、およびそれらのポリエチレングリコールPEI(PEG−PEI)誘導体などのグラフトPEIとともに製剤または複合体形成される(たとえば、参照により本願に組み込む以下の文献、すなわちオグリス(Ogris)ら,2001,AAPA PharmSci,3,1〜11;ファーガソン(Furgeson)ら,2003,Bioconjugate Chem.,14,840〜847;クナス(Kunath)ら,2002,Phramaceutical
Research,19,810〜817;チョイ(Choi)ら,2001,Bull.Korean Chem.Soc,22,46〜52;ベッティンガー(Bettinger)ら,1999,Bioconjugate Chem.,10,558〜561;ピーターソン(Peterson)ら,2002,Bioconjugate Chem.,13,845〜854;エルバシャー(Erbacher)ら,1999,Journal of Gene Medicine Preprint,1,1〜18;ゴドベイ(Godbey)ら,1999.,PNAS USA,96,5177〜5181;ゴドベイ(Godbey)ら,1999,Journal of Controlled Release,60,149〜160;ディーボルド(Diebold)ら,1999,Journal of Biological Chemistry,274,19087〜19094;トマス(Thomas)およびクリバノフ(Klibanov),2002,PNAS USA,99,14640〜14645;およびサガラ(Sagara),米国特許第6,586,524号を参照のこと)。
【0093】
したがって、本発明は、記載の化合物の薬学的に許容される製剤をも含む。これらの製剤は、上記化合物の塩、たとえば酸付加塩、たとえば、塩酸、シュウ酸、酢酸およびベンゼンスルホン酸の塩を含む。
【0094】
本発明は、ポリ(エチレングリコール)脂質を含む表面修飾リポソーム(PEG修飾、または長期循環リポソームまたはステルスリポソーム)を含む組成物も特徴とする。これらの製剤は、標的組織における薬物の蓄積を増加させるための方法も提供する。この部類の薬物担体は、オプソニン化および単核性食細胞系(MPSまたはRES)による排除に耐えることにより、より長い血液循環時間を可能にするとともに、カプセルに封入された薬物に対する組織の曝露を増強する(ラシック(Lasic)ら、Chem.Rev.1995,95,2601〜2627;イシワタ(Ishiwata)ら,Chem.Pharm.Bull.1995,43,1005〜1011)。このようなリポソームは、おそらくは血管新生が生じた標的組織における遊出と取り込みにより、腫瘍内に選択的に蓄積することが示されている(ラシック(Lasic)ら,Science 1995,267,1275〜1276;オク(Oku)ら,1995,Biochim.Biop
hys.Acta,1238,86〜90)。長期間循環リポソームは、特にMPSの組織内に蓄積することが知られている従来のカチオン性リポソームと比べて、DNAおよびRNAの薬物動態および薬力学を増強する。(リウ(Liu)ら,J.Biol.Chem.1995,42,24864〜24870;チョイ(Choi)ら,国際公開公報第96/10391号パンフレット;アンセル(Ansell)ら,国際公開公報第96/10390号パンフレット;ホランド(Holland)ら,国際公開公報第96/10392号パンフレット)。長期間循環リポソームは、代謝的に活発なMPS組織、たとえば肝臓や脾臓などにおける蓄積を回避できることから、カチオン性リポソームに比べて、薬物をヌクレアーゼ分解から大きく保護するようである。
【0095】
IFN産生を介した免疫応答の調節方法
本発明は、さらに、脊椎動物における免疫応答を調節するための方法を提供する。本方法は、脊椎動物に、本発明の免疫刺激性オリゴヌクレオチドを投与する工程を含む。
【0096】
本明細書において、用語「脊椎動物」には、限定はされないが、魚類、鳥類、または哺乳類が含まれる。本明細書において、「哺乳類」には、限定はされないが、ラット、マウス、ネコ、イヌ、ウマ、ウシ、乳牛、ブタ、ウサギ、ヒト以外の霊長類、およびヒトが含まれる。
【0097】
明細書において、「免疫応答を調節する」とは、B細胞誘導、T細胞誘導、サイトカイン誘導、ナチュラルキラー細胞誘導、特異的細胞表面マーカー発現、ケモカイン誘導および、たとえば樹状細胞、単球およびマクロファージなどの抗原提示細胞の活性化のうちの一つ以上の増大または活性化を引き起こすことを意味する。とりわけ、このような免疫応答には、PDCなどのTLR7タンパク質を発現する細胞におけるIFNの産生を伴う。
【0098】
本発明は、IFN産生を誘導することによって改善可能な疾患を有した脊椎動物の治療方法も提供する。本発明の本実施形態による方法は、脊椎動物に本発明のオリゴヌクレオチド剤、たとえば、配列番号:1で構成されるか、本質的に該配列で構成されるか、または該配列を含む剤を投与することを含む。そのような用途において、本発明のオリゴヌクレオチド剤は、脊椎動物におけるIFN産生を刺激して、その状態を直接治療するか、他の治療を増強するために用いられる。IFN産生の選択的活性化が望まれる場合には、よく認知された臨床設定が存在する。
【0099】
別の実施形態において、本発明は、疾患または疾病を有する患者を治療的に処置する方法も提供し、該方法は、患者に、本発明による免疫調節性オリゴヌクレオチド、免疫調節性オリゴヌクレオチド複合体、オリゴヌクレオチド剤またはオリゴヌクレオチド剤複合体を投与することを含む。様々な実施形態において、治療される疾患または疾病は、がん、自己免疫疾患、気道炎症、炎症性疾患、アレルギー、ぜんそく、または病原体によって引き起こされる疾病である。病原体としては、細菌、寄生虫、真菌、ウィルス、ウィロイド、およびプリオンが挙げられる。投与は本明細書中に別途記載してあるようにして実施する。
【0100】
本明細書において、「アレルギー」という用語には、限定はされないが、食品アレルギーと呼吸器系アレルギーとが含まれる。「気道炎症」という用語には、限定はされないが、ぜんそくが含まれる。
【0101】
本明細書において、「自己免疫疾患」という用語は、「自己」のタンパク質が免疫系によって攻撃を受ける疾患のことをいう。このような用語には、自己免疫ぜんそくが含まれる。
【0102】
本発明のいずれの方法においても、免疫調節性オリゴヌクレオチド、免疫調節性オリゴヌクレオチド複合体、オリゴヌクレオチド剤またはオリゴヌクレオチド剤複合体は、疾病または状態を治療するために有用な、該オリゴヌクレオチド剤の免疫刺激効果を減退させることのない他の任意の剤と組み合わせて投与してもよい。たとえば、がんの治療において、免疫調節性オリゴヌクレオチド、免疫調節性オリゴヌクレオチド複合体、オリゴヌクレオチド剤またはオリゴヌクレオチド剤複合体は、化学治療化合物と組み合わせて投与してもよいものとする。
【0103】
細胞の増殖性疾患および/または分化不全の例としては、がん、たとえば、癌腫、肉腫、転移性疾患、または造血系新生物疾患、たとえば白血病などが挙げられる。転移性腫瘍は、限定はされないが、前立腺、結腸、肺、乳房および肝臓を起源とするものを含む多数の原発性腫瘍から発生しうる。本明細書において、「がん」「過剰増殖性」および「新生物の」という用語は、自律的に増殖する能力を有する細胞のことをいい、すなわち、急速に増殖する細胞増殖によって特徴づけられる異常な状況または状態のことをいう。これらの用語は、組織病理学上のタイプまたは侵襲性のステージに関係なく、あらゆるタイプのがん性増殖または発がんプロセス、転移性組織または悪性形質転換細胞、組織、または器官を含むことを意味する。増殖性疾患は、たとえば、脊髄、リンパ球、または赤血球系統、またはそれらの前駆細胞から発生する、造血系起源の増生/新生細胞を伴う疾患を含む造血系新生物疾患も含む。
【0104】
本発明の薬学的組成物は、様々な造血系疾患を治療するために用いることができる。造血系の疾患または疾病の例としては、限定はされないが、自己免疫疾患(たとえば、糖尿病、関節炎(リウマチ性関節炎、若年性関節リウマチ、変形性関節症、乾癬性関節炎を含む)、多発性硬化症、脳脊髄炎、重症筋無力症、全身性紅斑性狼瘡、自己免疫甲状腺炎、皮膚炎(アトピー性皮膚炎および湿疹様皮膚炎を含む)、乾癬、シューグレン症候群、クローン病、アフター性潰瘍、虹彩炎、結膜炎、角結膜炎、潰瘍性大腸炎、ぜんそく、アレルギー性ぜんそく、皮膚エリテマトーデス、強皮症、膣炎、直腸炎、薬物発疹、ハンセン病逆転反応、らい性結節性紅斑、自己免疫性ブドウ膜炎、アレルギー性脳髄膜炎、急性壊死性出血性脳障害、突発性両側性進行性感音難聴、喪失、再生不良性貧血、赤芽球貧血、突発性血小板減少症、多発性軟骨炎、ヴェーゲナー肉芽腫症、慢性活動性肝炎、スティーブンス・ジョンソン症候群、突発性スプルー、扁平苔癬、グレーブス病、サルコイドーシス、原発性胆汁性肝硬変、後部ブドウ膜炎、および間質肺線維症)、移植片対宿主病、移植症例、およびアレルギーが挙げられる。
【0105】
別の実施形態において、本発明は、限定はされないが、C型肝炎、B型肝炎、単純ヘルペスウィルス(HSV),HΓV−AIDS、ポリオウィルス、および天然痘ウィルスを含むウィルス疾患を治療するための方法に関する。(+)鎖RNAウィルスの例としては、限定はされないが、ピコルナウィルス、カリシウィルス、ノダウィルス、コロナウィルス、アルテリウィルス、フラビウィルス、およびトガウィルスが挙げられる。ピコルナウィルスの例としては、エンテロウィルス(ポリオウィルス1)、リノウィルス(ヒトリノウィルス1A)、ヘパトウィルス(A型肝炎ウィルス)、カルディオウィルス(脳心筋炎ウィルス)、アフト・ウィルス属(口蹄疫ウィルスO)、およびパレコウィルス(ヒトエコウィルス22)が挙げられる。カリシウィルスの例としては、ベシクロウィルス(ブタ水疱性発疹ウィルス)、ラゴウィルス(ウサギ出血性疾患ウィルス)、「ノーウォーク様ウィルス」(ノーウォークウィルス)、「サッポロ様ウィルス」(サッポロウィルス)、および、「E型肝炎様ウィルス」(E型肝炎ウィルス)が挙げられる。ベータノダウィルス(ストライプジャック(striped jack)神経壊死ウィルス)が代表的なノダウィルスである。コロナウィルスには、コロナウィルス(鳥類伝染性気管支炎ウィルス)およびトロウィルス(ベルネウィルス)が含まれる。アルテリウィルス(ウマ動脈炎ウィルス)は、代表的なアルテリウィルスである。トガウィルスには、アルファウィルス(
シンドビスウィルス)と、ルビウィルス(ルベラウィルス)が含まれる。最後に、フラビウィルスは、フラビウィルス(黄熱ウィルス)とペストウィルス(ウシ下痢ウィルス)、およびヘパチウィルス(C型肝炎ウィルス)を含む。ある好ましい実施形態において、ウィルスはヘパチウィルス、C型肝炎ウィルスである。
【0106】
薬学的組成物
一実施形態において、本発明は、前セクションにおいて記載したようなオリゴヌクレオチド剤と、以下に示すような薬学的に許容される担体とを含有する薬学的組成物にも関する。該オリゴヌクレオチド剤を含む薬学的組成物は、IFN産生によって改善可能な疾患の治療に有用である。本発明の本形態において、本発明のオリゴヌクレオチド剤は、後述のように調製される。本発明の薬学的組成物は、IFN産生を誘導するのに十分な用量で投与される。薬学的組成物はiRNA剤からなり、用量は、標的遺伝子の発現または活性を阻害するのに十分な量である。本発明のオリゴヌクレオチド剤を含有する組成物は、驚くほど低用量での投与が可能である。IFN産生を誘導するには、また応用できる場合には、標的遺伝子の発現または活性を阻害または完全に抑制するためには、一日あたり体重1kgにつき5mgの最大用量のオリゴヌクレオチド剤で十分である。
【0107】
治療用途のための許容される担体または希釈剤は、製薬分野においてはよく知られており、たとえば、参照により本願に組み入れる「Remington’s Pharmaceutical Sciences」、Mack Publishing Co.(A.R.Gennaro編、1985)に記載されている。たとえば、防腐剤、安定剤、染料および着香料が提供されてもよい。これらには、安息香酸ナトリウム、ソルビン酸、およびp−ヒドロキシ安息香酸のエステルが含まれる。さらに、抗酸化剤および懸濁化剤を用いてもよい。
【0108】
一般に、オリゴヌクレオチド剤の適切な用量は、1日につき受容者の体重1kgあたり0.001〜500ミリグラムの範囲(たとえば、1kgあたり約1μgから1kgあたり約500mg、1kgあたり約100μgから1kgあたり約100mg、1kgあたり約1mgから1kgあたり約75mg、1kgあたり約10μgから1kgあたり約50mg、または1kgあたり約1μgから1kgあたり約50μg)である。薬学的組成物は、1日につき1回投与してもよいし、オリゴヌクレオチド剤は、1日のあいだに2回、3回、4回、5回、6回またはそれ以上の回数に分けて適当な間隔で投与してもよい。その場合、各分回用量に含まれるオリゴヌクレオチド剤は、1日の総用量を達成するために対応して少なくなるはずである。用量単位は、数日間の期間にわたってオリゴヌクレオチド剤を徐放させる従来の徐放製剤を例えば用いて、数日間にわたって送達するように構成することもできる。徐放製剤は、当該技術分野において周知である。この実施形態において、用量単位は、1日用量の相応の複数倍を含んでいる。
【0109】
当業者であれば、ある特定の要因が対象を有効に治療するのに必要な用量およびタイミングに影響を与えうること、該要因は例えば、限定はされないが、感染または疾病の重症度、以前の治療、対象の全体的な健康および/または年齢、および他の疾病の存在などであることを認識しているであろう。さらに、治療上有効な量の組成物による対象の治療は、1回の治療であっても、一連の複数回の治療であってもよい。本発明によって含意される個々のオリゴヌクレオチド剤についての有効用量およびin vivo半減期の評価は、従来の方法論を用いて、または本明細書中に別途記載する適切な動物モデルを用いたin vivo試験に基づいて行うことができる。
【0110】
本発明によって含意される薬学的組成物は、限定はされないが、経口または非経口経路、例えば静脈内、筋肉内、腹腔内、皮下、経皮、気道(エアロゾル)、眼内、直腸内、膣内および局所(例えば口腔内および舌下)投与を含む、当該技術分野において知られる任
意の手段によって投与することができる。好ましい実施形態において、薬学的組成物は、静脈内または腹腔内注入または注射によって投与される。薬学的組成物は、実質内、髄腔内投与してもよいし、および/または定位注射によって投与してもよい。
【0111】
経口投与については、本発明において有用なオリゴヌクレオチド剤は、一般的に錠剤またはカプセル剤の形態で、粉末または顆粒として、または水性溶液または懸濁液として提供される。経口使用のためのカプセルは、有効成分が固体希釈剤と混合される硬ゼラチンカプセルと、有効成分が水または油、例えばピーナツ油、流動パラフィンまたはオリーブ油などと混合される軟ゼラチンカプセルとを含む。
【0112】
筋肉内、腹腔内、皮下、および静脈内使用に対しては、本発明の薬学的組成物は、一般的に、適当なpHおよび等張性に緩衝された無菌の水性溶液または懸濁液として提供される。適切な水性ビヒクルには、リンガー(Ringer)溶液および等張塩化ナトリウムが含まれる。ある好ましい実施形態において、担体は専ら水性バッファのみからなる。本文中において「専ら〜のみ」とは、標的遺伝子またはウィルスを有する細胞中のオリゴヌクレオチド剤の取り込みに影響を与えるか、これを媒介する可能性のある補助剤またはカプセル化物質が全く存在しないことを意味する。このような物質としては、たとえば、ミセル構造、たとえば以下に示すようなリポソームまたはカプシドが挙げられる。オリゴヌクレオチド剤を細胞培養物内に導入するには、マイクロインジェクション、リポフェクション、ウィルス、ウィロイド、カプシド、カプソイド、または他の補助剤が必要であるが、驚くべきことに、これらの方法および物質はin vivoにおけるオリゴヌクレオチド剤の取り込みには必要とされない。本発明のオリゴヌクレオチド剤は、オリゴヌクレオチド剤の細胞内への取り込みを媒介する補助剤の使用を必要としないという点で特に有用であるが、それはこれらの補助剤の多くが毒性であるか、有害な副作用を伴うためである。本発明による水性懸濁剤は、セルロース誘導体、アルギン酸ナトリウム、ポリビニルピロリドンおよびトラガカントガム、およびレシチンなどの湿潤剤を含んでいてもよい。水性懸濁液のための適切な防腐剤には、エチルおよびn−プロピルp−ヒドロキシベンゾエートが含まれる。
【0113】
本発明の核酸分子は、たとえば薬物の直腸投与のために、坐剤の形態で投与することもできる。これらの組成物は、薬物を、常温では固体であるが直腸温度においては液体となるため直腸内で溶けて薬物を放出する適当な非刺激性賦形剤と混合することによって、調製することができる。このような材料としては、ココアバターおよびポリエチレングリコールが含まれる。
【0114】
薬学的組成物は、オリゴヌクレオチド剤を体からの迅速な排除から保護するための、カプセル化製剤、たとえば、移植物およびミクロカプセル化送達系を含む、放出制御製剤を含んでいてもよい。生分解性、生体適合性ポリマー、たとえばエチレン酢酸ビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、およびポリ乳酸などを用いてもよい。このような製剤の調製方法は、当業者にとっては明白である。材料もアルツァ・コーポレーション(Alza Corporation)およびノバ・ファーマシューティカルズ・インコーポレイテッド(Nova Pharmaceuticals,Inc.)から市販されているものを入手することができる。リポソーム懸濁液(ウィルス抗原に対するモノクローナル抗体によって感染細胞を標的とするリポソームを含む)もまた、薬学的に許容される担体として使用できる。これらは、たとえば、参照により本願に組み入れる米国特許第4,522,811号;国際公開公報第91/06309号パンフレット;および欧州特許公報EP−A−43075号に記載されるような、当業者に周知の方法によって調製することができる。
【0115】
本発明による好ましい薬学的組成物は、ワクチンである。ワクチンは、本発明のオリゴ
ヌクレオチド以外に抗原を含んでいなければならない。この抗原が、ワクチン接種した個体の防御/免疫反応を高める潜在性は、該抗原を本発明のオリゴヌクレオチドと組み合わせることによって、特に該オリゴヌクレオチドの免疫刺激活性により、強力に向上する。
【0116】
ワクチンは、種々の異なる抗原を含んでいてもよい。抗原の例としては、不活化されたウィルスまたは細菌、真菌、原虫などの死生物全体、あるいはがん細胞が挙げられる。抗原は、これらの生物/組織、タンパク質、またはそれらの最も単純な形のペプチドの、サブフラクションからなるものであってよい。抗原は、グリコシル化タンパク質またはペプチドの形態で免疫系によって認識されてもよいし、多糖または脂質であるか、多糖または脂質を含むものであってよい。たとえば、細胞傷害性T細胞(CTL)は、主要組織適合抗原(MHC)と複合化した、通常は8〜11アミノ酸長の短いペプチドの形態の抗原を認識するので、短いペプチドを使用してもよい(ラメンシー(Rammensee)ら,Immunogenetics,41,178〜228(1995))。B細胞は15アミノ酸程度からのより長いペプチドを認識する(ハロウ(Harrow)ら,Cold Spring Harbor:Cold Spring Harbor Laboratory,(1988))。T細胞エピトープとは対照的に、B細胞抗原の三次元構造も、抗体による認識にとって重要であるのかもしれない。持続的な抗原特異的免疫応答を得るために、必要な免疫系のすべての細胞を含む免疫カスケードをトリガーするためには、アジュバントが助けとなる。主としてアジュバントはいわゆる抗原提示細胞(APC)に作用するが、それらの作用様式において制限されていない。抗原提示細胞は通常は、最初に抗原と遭遇してから、免疫エフェクタに対してプロセシング済みまたは非修飾の抗原の提示を行う。中間種の細胞が関与してもよい。適切な特異性を有したエフェクタ細胞だけが、生産性免疫反応において活性化される。アジュバントもまた局所的に抗原および同時注射された他の因子を保持しうる。さらにアジュバントは他の免疫細胞に対する化学誘引物質として作用することもあるし、免疫系の刺激剤として局所的および/または全身的に作用する場合もある。
【0117】
本発明の組成物において用いる抗原はさほど重要でない。好ましくは、ウィルスまたは細菌病原体に由来する、または真菌または寄生虫に由来するタンパク質またはペプチドをこのような抗原(たとえば、誘導体化した抗原またはグリコシル化もしくは脂質化した抗原または多糖または脂質を含む)として用いる。抗原の別の好ましい供給源は、腫瘍抗原である。好ましい病原体は、ヒト免疫不全ウィルス(HIV)、A型およびB型肝炎ウィルス、C型肝炎ウィルス(HCV)、ラウス肉腫ウィルス(RSV)、エプスタインバーウィルス(EBV)、インフルエンザウィルス、ロタウィルス、スタフィロコッカス・アウレウス、クラミジア・ニューモニア、クラミジア・トラコマティス、ミコバクテリウム・ツベルクロシス、ストレプトコッカス・ニューモニア、バチルス・アントラシス、ビブリオ・コレラエ、プラスモディウム属生物種(プラズモディウム・ファルシパルム、プラズモディウム・ヴィバックスなど)、アスペルギルス属生物種またはカンジダ・アルビカンスより選択される。抗原は、がん細胞によって発現される分子(腫瘍抗原)であってもよい。誘導体化のプロセスは、病原体/がん細胞から特定のタンパク質を精製すること、病原体の不活化、ならびにそのようなタンパク質の化学的誘導体化または安定化を含みうる。同様に、腫瘍抗原(がんワクチン)または自己免疫抗原を本発明による薬学的組成物において用いてもよい。そのような組成物を用いて、腫瘍ワクチン接種または自己免疫疾患に対する治療を行うことができる。
【0118】
ペプチド抗原の場合、ペプチドミミトープ/アゴニスト/スーパーアゴニスト/アンタゴニストまたは免疫学的特性に影響を与えることなくある部位が変更されたペプチド、または非ペプチドミミトープ/アゴニスト/スーパーアゴニスト/アンタゴニスト(総説としてスパルビア(Sparbier)およびバルデン(Walden),Curr Opin Immunol,11,214〜218(1999))の使用が本発明に含まれる
。ペプチド抗原は、該ペプチド抗原のカルボキシ末端またはアミノ末端のいずれかに、ポリカチオン性化合物または免疫刺激性化合物との相互作用を容易にする延長部を有していてもよい。自己免疫疾患の治療のためには、ペプチドアンタゴニストを適用してもよい。抗原提示と、抗原提示細胞への抗原の標的化を高める分子を含むように、抗原を誘導体化してもよい。
【0119】
オリゴヌクレオチド剤の毒性および治療効力は、例えばLD50(集団の50%致死用量)およびED50(集団の50%において治療上有効な用量)を決定するための、細胞培養物または実験動物における標準的な薬学的手順によって判定することができる。毒性と治療効果との間の用量比が治療指標であり、比LD50/ED50で表すことができる。高い治療指標を示すオリゴヌクレオチド剤が好ましい。
【0120】
細胞培養アッセイおよび動物実験から得られたデータを用いて、ヒトにおいて使用する用量の範囲を策定することができる。本発明の組成物の用量は、好ましくは、毒性が殆どまたは全く無いED50を含む血中濃度の範囲にある。用量は、採用する剤形および利用する投与経路に応じてこの範囲内で変えることができる。本発明の方法において用いられる任意のオリゴヌクレオチド剤において、治療上有効な用量は、最初に細胞培養アッセイから推定することができる。用量を、細胞培養において決定されるIC50(すなわち、兆候の最大阻害の半分の阻害を達成する試験オリゴヌクレオチド剤の濃度)を含む、オリゴヌクレオチド剤またはIFNの循環血漿中濃度を達成するように、または必要に応じてiRNA剤の標的配列のポリペプチド生成物の循環血漿中濃度を達成するように(たとえば、ポリペプチド濃度の減少を達成)、動物モデルにおいて策定してもよい。このような情報を用いて、ヒトにおける有用な用量をより正確に決定することができる。血漿中の濃度は、たとえば、高速液体クロマトグラフィーによって測定することができる。
【0121】
上述のように個別または複数として投与することに加えて、本発明に関するオリゴヌクレオチド剤は、ウィルス感染および疾患を治療するのに有効な他の既知の剤と組み合わせて投与することもできる。いずれの場合も、投与を行う医師は、当該技術分野において周知であるかまたは本明細書に記載するような、標準的な有効性の尺度を用いて観察された結果に基づいて、オリゴヌクレオチド剤投与の量とタイミングを調整することができる。
【0122】
本発明の数々の実施形態について記載してきた。しかしながら、本発明の精神と範囲から逸脱しない限りにおいて様々な変更を行ってよいことが理解できるであろう。他の実施形態は特許請求の範囲に記載されている。
【実施例1】
【0123】
プラズマサイトイド樹状細胞の単離
PBMCは、健康な個体の全血液からフィコール・ハイパック(Ficoll−Hypaque)密度勾配遠心分離(ドイツ連邦共和国ベルリン所在のバイオクロム(Biochrom))により得た。PDCは、ミルテニル・バイオテク(Miltenyi Biotec)製のBDCA−4樹状細胞単離キットを用いてMACSによって単離した。すなわち、PDCを、コロイド状常磁性マイクロビーズを連結した抗BDCA−4抗体で標識し、磁気分離カラム(LSカラム;ミルテニル・バイオテク)に1回通した。単離したPDC(lineage陰性、MHC−II陽性,およびCD123陽性細胞)の純度は、75%〜100%であった。混入細胞は主としてT細胞であった。トリパンブルー排除法で判定した生存率は、95%を超えていた。
【0124】
細胞培養 単離したPDCを96ウェル平底プレート中にて、10ng/mLのIL−3(ドイツ連邦共和国ヴィースバーデン所在のR&Dシステムズ)を添加した150μLのOPTIMEM(R)(ドイツ連邦共和国カールスルーエ所在のインビトロジェン(I
nvitroge))中、5×104細胞の濃度で培養した。C末端黄色蛍光タンパク質(YFP)タグを有したヒトTLR9遺伝子を含む構築物で安定的にトランスフェクトされたHEK293細胞は、ディ.ゴレンボック氏(D.Golenbock)(米国マサチューセッツ州ワーチェスター(Worcester))の好意により提供されたものである。HEK293細胞は、10%(v/v)ウシ胎仔血清(米国メリーランド州ウォーカーズビル(Walkersville)所在のバイオウィッテイカー(BioWhittaker))、1.5mMのL−グルタミン、100U/mlペニシリン、および100μg/mLストレプトマイシン(すべてドイツ連邦共和国ミュンヘン所在のシグマ・アルドリッチ(Sigma−Aldrich)より入手)を添加したRPMI1640培養培地(バイオクロム)中で培養した。EBV陰性のバーキットリンパ腫細胞株BL41は、10%(v/v)ウシ胎仔血清(バイオクロム)、2mMのL−グルタミン、0.1mg/mL ペニシリン/ストレプトマイシンおよび1%の1mMピルベート(すべてオーストリア国リンツ所在のPAAより入手)を添加したRPMI1640(PAA)中で増殖させた。細胞は37℃および5%CO2においてインキュベートした。
【0125】
In Vitroでの細胞の刺激、トランスフェクションおよびエレクトロポーレション
CpG ODNは、コリー・ファーマシューティカル・グループ(Coley Pharmaceutical Group)(米国マサチューセッツ州ウェルスレイ(Wellesley))から供給されたものである(下線を付けた文字:該塩基の3’ホスホロチオエート結合;太字:CpGジヌクレオチド):
【0126】
【化1】

【0127】
R848はインビボゲン(Invivogen)(フランス国トゥールーズ所在)より購入した。R848およびODN2216は、それぞれ最終濃度500ng/mLおよび3μg/mLで添加した。siRNA配列(表1を参照)はダーマコン(Dharmacon)(米国コロラド州ラファイエット所在)によって合成およびアニールされたものである。siRNAをリポフェクタミン2000(ドイツ連邦共和国カールスルーエ所在のインビトロジェン)を用いてトランスフェクトした。特に示さない限り、200ngの核酸を25μLのOPTIMEM(R)と混合した。別のチューブにおいて、0.5μLのリポフェクタミンを25μLのOPTIMEMに加え、室温で5分間インキュベートした。複合体形成のために、両溶液を混合し、室温でさらに20分間インキュベートし、96ウェルプレートにおいて細胞(100μL)に加えた(最終容量150μL)。トランスフェクション溶液中の細胞はさらなる洗浄を行うことなく、37℃でインキュベートした。
【0128】
エレクトロポーレションのために、250,000PDCを、siRNA(2.5μg/mL)含有または非含有の400μLの「等浸透圧エレクトロポーレション−バッファ」(ドイツ連邦共和国ハンブルク所在のエッペンドルフ(Eppendorf))に再懸濁し、100Vで50μ秒間の1回のパルスを行った(Multiporator(R)、エッペンドルフ)。5分後、800μLの完全培地を加え、細胞を24ウェルの平底ウェルでさらに36時間インキュベートした。
【0129】
マウス実験
in vivo刺激については、129P2/OlaHsdマウスまたは129Svマウスを麻酔して、1,2−ジオレイルオキシ−3−トリメチルアンモニウムプロパン(DOTAP)複合体形成(30μLのDOTAP(ベーリンガー・マンハイム)を170μLのHepes緩衝生理食塩水(HBS)中の5μgの核酸と混合した)を事前に行った、または行っていない、5μgのCpG ODN1826またはsiRNA TLR9.2を含む200μLを後眼窩静脈に静脈注射した。対照のマウスにはHBS単独(対照)またはHBSおよびDOTAP(DOTAP)のいずれかを与えた。全血液試料は、注射から7時間、18時間、または24時間のいずれかにおいて、テールクリッピングによって得た。血清は37℃で30分間凝固させてから遠心分離することによって全血液より調製した。
【0130】
サイトカインの検出
IFN−α全体は14の異なる異性体からなるので、ELISAによって測定されるIFN−αの量は、これらの異性体の検出に用いた抗体の特異性に依存し、従ってELISAが異なれば同一でなくなる。この実験には、ベンダー・メドシステムズ(Bender
MedSystems(オーストリア国グラーツ(Graz)所在)のIFN−αキット(検出範囲8〜500pg/mL)を使用した。このELISAは、IFN−α異性体の殆どを検出するが、IFN−BおよびIFN−Fは検出しない。ヒトTNF−αELISA(検出範囲8〜500pg/mL)およびヒトIL−6ELISA(検出範囲5〜300pg/mL)は、ビーディー・ファルミンゲン(BD PharMingen(ドイツ連邦共和国ハイデルベルク所在))から得た。マウスIFN−αは、ピービーエル・バイオメディカル・ラボラトリーズ(PBL Biomedical Laboratories(米国ピスカタウェイ所在))製のマウスIFN−αELISAキットを用いて判定した。すべてのELISA手順は、製造業者の推奨に従って行った。
【0131】
フローサイトメトリー
フローサイトメトリーデータは、2つのレーザ(波長488nmおよび635nmで励起)を備えたビーディー・バイオサイエンシズ(BD Biosciences)(ドイツ連邦共和国ハイデルベルク所在))のFACSCalibur(商標)で得た。概して、細胞は示した特定の抗体および適当なアイソタイプ対照を用いて、4℃で20分間染色した。ヒトPDCは、抗CD123PEおよび抗MHCIIPerCPによるポジティブ染色、および抗lineageFITCによるネガティブ染色によって同定した。共刺激分子の発現は、抗CD86APCを用いて判定した(すべてビーディー・ファルミンゲン)。PDCの生き残りについては、刺激から36時間後に細胞を回収し、吸引体積50μLあたりの生きている細胞の絶対数をフローサイトメトリーによって判定した。PDCの生存率は、TO−PRO−3ヨウ素(米国オレゴン州ユージーン所在のモレキュラー・プローブス(Molecular Probes))に対してネガティブの染色、および形態学に基づくライブゲート(live gate)によって判定した。マウスMDCの表現型(CD11c++,CD11b++およびB220−)およびPDCの表現型(CD11c+,CD11b−およびB220++)の解析のために、新鮮な単離脾臓細胞を抗CD86FITC、抗CD45R/B220PE、抗CD11bPerCPおよび抗CD11cAPC(すべてビーディー・ファルミンゲン)で染色した。脾臓NK細胞およびT細胞の活性化は、抗pan−NK FITC陽性細胞(NK細胞)および抗CD3APC陽性細胞(T細胞)上で抗CD69PEによって判定した(すべてビーディー・ファルミンゲン)。データは、CellQuest(商標)(ビーディー・バイオサイエンシズ)またはFlowJo(R)ソフトウェア(バージョン2.5.1;米国カリフォルニア州スタンフォード所在のツリー・スター(Tree Star))を用いて解析した。
【0132】
ウェスタンブロット分析
細胞はリン酸緩衝食塩水(PBS)中で1回洗浄し、計数し、ラエムリ(Laemmli)サンプルバッファ(106細胞/50μL)中への再懸濁と10秒間の超音波処理により溶菌した。この試料をSDSポリアクリルアミドゲル(10%)上で分離し、ニトロセルロース膜(Hybond−ECL(商標)、アマシャム(Amersham))上に写し取った。写し取りに続いて、膜をポンソーレッド中で染色し、等量のタンパク質がロードされていたことを確認した。次に、膜をTBST(トリス10mM,pH8.0,NaCl 30mM,0.1%Tween)中で5分間洗浄し、TBST−MLK(5%乾燥スキムミルクを添加したTBST)中で30分間インキュベートした。水で2回リンスした後、TBST−MLK中の特異抗体(1:1000)を加え4℃で1時間または一晩処理した。水で2回リンスし、TBSTによる5分間の洗浄を3回行った後、セイヨウワサビペルオキシダーゼと複合化された二次抗体(TBS−MLK中1:3000)を加えて1.5時間処理し、水で3回リンスし、TBST中で5分間の洗浄を3回行い、水で5回リンスした。バンドは、ECLフィルム(アマシャム)上で、供給業者の方法(アマシャム)に従った強化化学発光によって可視化した。以下のタンパク質に対する抗体:ホスホ(チロシン701)−STATl(米国マサチューセッツ州ビバリー所在のニューイングランド・バイオラボ(New−England Biolabs))およびホスホ(チロシン689)−STAT2(米国マサチューセッツ州ウォルサム所在のアップステート(Upstate))を用いた。
【0133】
統計学的解析
データは、平均±SEMとして表す。差の統計学的有意性は、対応のある両側スチューデントt検定によって判定した。差は、p<0.05である場合に統計学的に有意であるとみなした。統計学的解析は、StatView(R)4.51ソフトウェア(米国カリフォルニア州カラバサス所在のアバカス・コンセプツ・インコーポレイテッド(Abacus Concepts Inc.))を用いて行った。
【0134】
特異的siRNAによって媒介されるHEK293細胞におけるTLR9発現の阻害
プラズマサイトイド樹状細胞(PDC)は、CpGモチーフの重要なセンサとして同定されてきた。siRNAを用いてPDCにおけるTLR9を選択的に阻害することにより、ウィルスおよび種々のCpGモチーフ含有オリゴデオキシヌクレオチド(CpG ODN)の認識におけるTLR9の関与について解析することが可能となる。本発明者らは、C末端黄色蛍光タンパク質(YFP)タグを有したヒトTLR9遺伝子を含む構築物で安定的にトランスフェクトされたHEK293細胞株における、siRNA媒介性のTLR9のダウンレギュレーションを確立した。ヒトTLR9mRNAを標的とする4つのsiRNA分子(TLR9.1,TLR9.2,TLR9.3,TLR9.4)を設計した(表1)。標準BLAST検索によって、これらのsiRNA標的配列が、他のヒト遺伝子といかなる相同性も有しないことを確認した。ヒトTLR2mRNAを標的とするsiRNAを陰性対照として用いて、TLR9構築物のC末端YFPタグを標的とする以前に確立されたsiRNAを阻害の陽性対照として用いた(表1を参照)。接着性のHEK293細胞を、96ウェルプレート中でリポフェクタミンを用いて200ngのsiRNAでトランスフェクトした。20時間、30時間、および54時間後、HEK293細胞をハーベストし、フローサイトメトリーによってYFP蛍光強度を定量することによりTLR9の発現を評定した。分析した3つの時点のすべてにおいて、調べた4つのTLR9特異的siRNAのうちの2つ(TLR9.2およびTLR9.3)が、阻害の陽性対照として用いた抗YFPsiRNAと同範囲の、強力なTLR9−YFP融合タンパク質発現の阻害を示した(20時間後のTLR9発現を図1Aに示す;30時間後:TLR2.1:151±10;TLR9.1:71±10;TLR9.2:43±2;TLR9.3:48±2;TLR9.4:119±5;GFP:37±3;54時間後:TLR2.1:167±8,TLR9.1:65±4;TLR9.2:32±1;TLR9.3:34±2;TLR9.4:110±7;GFP:24±1)。
【0135】
HEK293細胞中の標的遺伝子のダウンレギュレーションが、標的特異的ではないI型IFNの誘導に関係している可能性を除外するために、HEK293細胞の上清について、I型IFN活性を分析した。BL41細胞におけるSTATlおよびSTAT2リン酸化の誘導を、I型IFNの高感度の尺度として用いた。4つの異なる抗TLR9siRNAであるTLR9.1、TLR9.2、TLR9.3、TLR9.4でトランスフェクトしたHEK293細胞の上清には、I型IFN活性は全く検出されなかった(図1B)。予想どおり、リポフェクタミンと複合化した500塩基対の長さの二本鎖RNA(リポフェクタミンは含まない)は、陽性対照の組換えIFN−βを用いた場合と同様のSTATlおよびSTAT2リン酸化活性を誘導した(図1B)。これらの結果は、2つの抗TLR9siRNA、TLR9.2およびTLR9.3が、HEK293細胞におけるTLR9発現の特異的ダウンレギュレーションを可能にすること、およびこの細胞株において、siRNAによるトランスフェクションが標的非特異的な効果としてI型IFNを誘導するのではないことを実証した。
【0136】
プラズマサイトイド樹状細胞におけるsiRNAによるIFN−αの配列依存性の強力な誘導
次に、HEK293細胞におけるTLR9発現を阻害した抗TLR9siRNAが、TLR9リガンドによる刺激に対してPDSを脱感作するかどうかを調べた。PDCは、ヒト免疫系におけるI型IFNの主な生産者であるので、二本鎖(ds)RNAをPDCにおける選択的標的タンパク質阻害に用いると、PDCにおけるタンパク質阻害は、二本鎖RNAに媒介される標的非特異的なI型IFN誘導によって複雑になると考えられる。この可能性を調べるために、ヒト末梢血からのPDCを、いずれも細胞質送達のためにリポフェクタミンと複合化した二本鎖RNAのプロトタイプ刺激剤であるポリ(I:C)、または500塩基対(bp)長の二本鎖RNA分子のいずれかとともにインキュベートした。TLR9リガンドであるCpG−A ODN2216(クルグ、エイ((Krug,A.)ら Eur J Immunol 31,2154〜63(2001))およびTLR7リガンドであるR848を陽性対照とした。陽性対照のCpG−A ODN2216およびR848が、活発なIFN−α応答を示したのに対し、どちらの二本鎖RNA分子もPDCにおけるIFN−αの誘導能を欠いていることがわかった。これらの結果は、二本鎖RNAが、PDCにおける標的遺伝子の選択的ノックダウンに有用であることを示唆している。
【0137】
驚くべきことに、4つの抗TLR9siRNAの200ngでのトランスフェクションでは、PDCにおけるIFN−α産生の一貫性のあるパターンが誘導された(図2A)。TLR9.2およびTLR9.3は、TLR9.1およびTLR9.4と比べて、PDCにおいて有意に多いIFN−α産生を誘導した(図2A)。TLR9.1およびTLR9.4によるインターフェロン誘導の程度の低さ(図2Aを参照)にRNAの分解が関与していることを除外するために、4つすべての配列の減少量を比較した。25ng(12.5nM)において、2つの配列TLR9.2およびTLR9.3は、200ng(100nM)のTLR9.1より依然として高いレベルのIFN−αを誘導することから(図2B)、PDCにおけるIFN−αの誘導における4つの抗TLR9siRNAの活性の違いが確認された。TLR9.1およびTLR9.2の異なるIFN−α誘導活性は、siRNAがエレクトロポーレションによってPDCのサイトゾルへ送達される際にも観察されたことから、リポフェクタミンとsiRNAとの複合体形成はsiRNAによるIFN−α誘導には必要なく、むしろsiRNA分子そのものが有効成分のようであることが示された。B細胞または骨髄樹状細胞においては、siRNAによるIFN−α誘導は全く見られなかった(データ示さず)。
【0138】
注目すべきは、調べた4つの抗TLR9siRNAのうち、HEK293細胞における
TLR9発現をダウンレギュレートする最も高い活性を有する2つが、PDCにおけるIFN−αを誘導する最も強力な配列でもあったことである(図1Aと図2Aを比較)。ありそうもないことではあるが、標的非特異的な免疫刺激効果ではなく、標的特異的効果(TLR9の阻害)が、PDCにおけるIFN−α誘導に関与しているのかもしれない。この可能性を排除するために、PDCにおいて発現されるmRNA(TLR9)、PDCにおいて発現されないmRNA(TLR2,TLR3,TLR4,表1を参照)を標的とするsiRNAのパネルを比較した。これらのsiRNAがIFN−αを誘導する効力には有意な違いが見られたが、IFN−αの誘導効力と、PDC中の標的mRNAの有無との間に相関関係は見つからなかった(ODN 2216:xADD VALUE±SEM;IFN−α誘導の低い順に:TLR4.1:491±59;TLR9.1:500±88;TLR9.4:760±131;TLR4.2:1208±267;TLR3.2:1219±204;TLR2.1:1535±235;TLR3.1:2503±552;TLR9.3:3592±283;TLR9.2:4845±621:n=6)。調製品質の違いまたは混入物がsiRNAのIFN−α誘導活性の違いに寄与する可能性は、種々の市販供給源のsiRNA配列を用いて同じ結果が得られたことから排除された(データ示さず)。これらのデータは、siRNAによるPDCにおけるIFN−αの誘導が配列依存性であり、標的mRNAの有無とは関係がないことを示すものである。
【0139】
IFN−α誘導性RNA配列の同定
グアノシンおよびウリジンに富む一本鎖RNAがPDCにおけるIFN−αを誘導することが報告されている。グアノシンおよびウリジンモノマーの混合物もまた、免疫刺激活性を示した。したがって、我々の研究におけるsiRNAのグアノシンおよびウリジン含量の違いが、siRNAのPDCにおけるIFN−α誘導能力の差をもたらしているのではないかとの仮説をたてた。siRNAは二本鎖であるので、19量体のsiRNA中のグアノシンおよびウリジンの総含量は、常に19である。調べたsiRNA内のウリジンの数は、9から11の範囲であり、ウリジンの数とIFN−α誘導活性との間には何ら相関関係は無かった(表1を参照)。免疫活性siRNAは、様々なグアノシンおよびウリジン含量の特異的一本鎖(センスまたはアンチセンス)を含みうる。しかしながら、グアノシンとウリジンの合計数は、活性siRNA(TLR9.2およびTLR9.3)の一本鎖において、またより低い活性を有するsiRNA(TLR9.1,TLR9.4,TLR2.1,TLR4.1,TLR4.2,TLR3.1,TLR3.2)の一本鎖においても、7〜12の範囲であり、さらに、グアノシンに対するウリジンの比は、免疫学的活性とは関連がなかった(表1を参照)。したがって、単にグアノシンおよびウリジンの含量ではなく、特定の配列がTLR9.2およびTLR9.3の免疫学的活性に関与していると思われる。
【0140】
この免疫刺激配列を同定するために、TLR9.2の2本の一本鎖(センスおよびアンチセンス)のIFN−α誘導活性を、二本鎖の活性と比較した。TLR9.2のセンス鎖は、二本鎖と比べてPDCにおいてIFN−αを同等の強さで誘導したが、TLR9.2のアンチセンス鎖は、弱い活性しか示さなかった(図2C、左パネル)。ポリ(U)またはポリ(A)一本鎖RNAおよびポリ(U:A)二本鎖RNAによるIFN−α誘導は、TLR9.2siRNAのセンス鎖に比べて低く(RNA9.2s:4962±797;ポリ(U):574±165;ポリ(A):244±120;ポリ(U:A):111±53;n=7;ポリ(A)については、図3Bの左から二番目のバーも参照のこと)、このことは、TLR9.2のセンス鎖がPDCによって認識される特異的免疫刺激モチーフを含んでいるという概念をさらに支持するものである。
【0141】
siRNAは、センスおよびアンチセンス鎖のアニーリングによって生成されるので、TLR9.2siRNAの免疫刺激活性は、siRNA調製物中の非結合のセンス鎖によるものであり、二本鎖によるものではないかもしれない。この可能性を排除するために、
TLR9.2のセンス鎖と二本鎖を一本鎖RNAseに曝露した。予想どおり、センス鎖はRNAse処理によって完全に分解され(図2D、左パネル)、免疫活性が失われた(図2D、右パネル)。これに対して、二本鎖は、RNAse処理による影響は受けず、IFN−αの誘導活性は維持されていた(図2D)。siRNA調製物に混入した一本鎖RNAの寄与をさらに排除するために、二本鎖領域に完全なTLR9.2siRNAの二本鎖が含まれたエネルギー的に安定なヘアピン(ミクロRNAと同様)を形成する一本鎖RNAを設計した(表2)。このヘアピンは、TLR9.2siRNA二本鎖と同様にIFN−αを誘導する活性をもつことが判った(図2E)。これらのデータは、siRNAの免疫刺激活性が、siRNA調製物中の一本鎖混入物を除去することでは防げないこと、また免疫刺激がヘアピン型RNAの干渉(すなわちミクロRNA)にも関係することを実証するものである。
【0142】
TLR9.2およびTLR9.3の配列は、13塩基の重複を示している(表1を参照)。どちらのsiRNAもPDCにおけるIFN−αの強力な誘導剤であるので、IFNα誘導に関与する配列モチーフがこのTLR9.2とTLR9.3との重複領域に存在するとの仮説をたてた。このように、免疫刺激モチーフの局在化から、TLR9.2のセンス鎖の3’末端にある13塩基に着目した。この仮説は、FITC分子を3’末端に連結し、5’末端には連結しない場合に、センス鎖の活性が低下したことから支持された(図3A、5’Fを3’Fと比較のこと)。ポリ(A)には免疫学的活性が欠如していることから(図3A)、モチーフを絞り混むために、TLR9.2のセンス鎖内の塩基をAに置換することができた。TLR9.2のセンス鎖の3’末端の13塩基内に免疫刺激モチーフが局在することと矛盾することなく、3’末端の8塩基を置換すると(R8A,Rは右を表す)、センス鎖の免疫学的活性が無効となり、5’末端の8塩基を置換しても(L8A,Lは左を表す)センス鎖の免疫学的活性は無効とはならなかった(図3B)。5’末端からAの数をさらに増加させることにより(L8AからL12A)、部位11が3’末端のモチーフに必須であることが同定され、TLR9.2センス鎖の3’末端の9塩基(5’GUCCUUCAA3’,配列番号:1)がTLR9.2センス鎖の免疫刺激活性に関与していることが示唆される。この9量体配列における塩基の交換数を増加していくと、TLR9.2センス鎖の免疫学的活性が徐々に低下し、9量体配列のうちの6塩基を交換した場合に活性は完全に損失した(図3B;R8A)。IFNα誘導に必要なRNAの最小の長さは19塩基の範囲内にあることが判ったが、これは、前記9量体配列を含む12量体および16量体はいずれもはるかに低い活性しか示さなかったためである(図3B)。一方、19量体RNAオリゴヌクレオチド中に9量体配列を2度配置することにより(DRとよぶ)、1つの免疫刺激性9量体配列しか含まないTLR9.2のセンス鎖(nとよぶ、図3B)と比べて免疫学的活性はさらに増加する。
【0143】
siRNAの免疫刺激活性およびサイレンシング活性についての検討
上記の研究によれば、TLR9.2の免疫刺激活性はセンス鎖内に局在し、サイレンシング活性は二本鎖のアンチセンス鎖に局在する。TLR9.2の一本鎖RNA鎖の両方を適当に修飾して、サイレンシング活性から免疫刺激性を分離しても、またその逆を行うようにしてもよい。siRNAの標的阻害に関する特性を変更するために、骨格の修飾であるロックト核酸(LNA)が用いられてきた。本発明者らは、センス鎖およびアンチセンス鎖のLNA修飾を用いて、サイレンシングだけでなくsiRNAの免疫学的活性をも調節できるかどうかに興味を持った。最初に、TLR9.2のセンス鎖の免疫学的活性に対する5’および3’LNAの影響を調べた(表2を参照)。FITC分子を5’または3’末端に連結した場合(図3Aを参照)と矛盾することなく、5’末端ではなく3’末端におけるLNA修飾により、センス鎖がIFNαを誘導する活性が強く阻害された(図4A)。次に、異なるLNA修飾を有する(5’末端、3’末端、または5’および3’末端のLNA)、またはLNA修飾を有しないセンスおよびアンチセンス鎖をアニーリングして、全部で16の異なるTLR9.2siRNA誘導体を作成した。この一連のTLR
9.2二本鎖がPDCにおけるIFNαを誘導する活性について評定した(図4B,黒色バー)。センス鎖単独の場合(図4A)と同様に、センス鎖の3’末端または3’末端と5’末端の両方にLNA修飾を有する二本鎖は、IFNα誘導活性を強く阻害したが、センス鎖の5’末端におけるLNA修飾では、大きな活性変化は見られなかった(図4B)。アンチセンス鎖のLNA修飾は、非修飾センス鎖を含むsiRNAの免疫刺激性に影響を与えることはなかった(図4B)。
【0144】
次に、TLR9.2siRNAのサイレンシング活性に対するLNA修飾の影響を調べた。IFNα誘導の場合と異なり、センス鎖のLNA修飾は、TLR9.2siRNAのサイレンシング活性にほとんど影響を及ぼさなかった(図4B、白抜きバー)。これに対し、アンチセンス鎖のLNA修飾は、TLR9.2siRNAのサイレンシング活性に強く影響を及ぼした。アンチセンス鎖の3’末端のLNA修飾は、アンチセンス鎖の5’末端のLNA修飾よりもサイレンシング活性に与える影響がより小さかった。サイレンシング活性は、3’および5’末端の両方をLNAによって修飾した場合に、完全に失われた。これらのデータを合わせると、センスおよびアンチセンス鎖の異なる領域にLNA修飾を導入することによりsiRNAの2つの機能的活性を分離することが可能であり、siRNAの免疫刺激成分を最小限にしながらサイレンシング活性を維持することもできるし(たとえば:センス鎖の3’末端にLNA);siRNAのサイレンシング活性を無効にしながら免疫刺激活性を維持することもできる(すなわち、アンチセンス鎖の3’および5’末端にLNA)ことがわかる。
【0145】
免疫刺激性のsiRNAは、in vivoでマウスの全身性免疫反応を誘導する
siRNAのin vivoでの全身作用を検討するために、最初にマウスの系においてsiRNA配列のin vitro免疫刺激活性について調べた。ヒトの系と同様に、TLR9.2の二本鎖およびセンス鎖がIFNαを誘導する一方、TLR9.2のアンチセンス鎖ははるかに活性が低く、ポリ(A)は活性を持たないことが判った(図5A)。
【0146】
次に、TLR9.2二本鎖、TLR9.2センス鎖、およびTLR9.2アンチセンス鎖の免疫学的活性をin vivoにおいて評価した。この分析には、ヒトの系においてTLR9.2よりも活性の低かったsiRNAとしてTLR2.1を含めた。129Svマウスへの静脈注射の7時間後に、マウス血清中のIFN−αの濃度を測定した(図5B)。さらに、脾臓における免疫細胞サブセットの活性化を、43時間後にフローサイトメトリーによって評価した(図5C)。in vitroデータと矛盾することなく、TLR9.2二本鎖およびTLR9.2センス鎖は、IFN−αの全身レベルを誘導し、CD4およびCD8 T細胞および骨髄樹状細胞を活性化する最も高い活性を示した(図5C)。カチオン性リポソーム(DOTAP)またはsiRNA単独のいずれかでは免疫学的活性は観察されなかった(図5D)。同時に上記の結果は、in vivoにおけるsiRNAの投与が、血液および脾臓のいずれにおいても検出可能な全身性免疫反応を誘引すること、ならびにマウスにおける免疫学的活性がヒトの系におけるものと同じ配列依存性を示すことを実証するものである。
【0147】
siRNAの免疫認識はTLR7を必要とする
マウスとヒトにおいてsiRNAの配列依存性免疫認識が保存されていることから、関係する受容体を同定するためにノックアウトマウスを使用することができた。TLR7およびTLR9は、PDCにおいて発現され(FIX REFERENCE{Krug,2001#5;Hornung,2002#37})、IFN−α産生と関係することが知られているTLRファミリーの唯一のメンバーである。これまでのところ、TLR7を介して特異的に検出されるRNA配列モチーフは同定されていない。本発明者らは、TLR7がTLR9.2siRNAに含まれる免疫刺激配列モチーフの認識に関与しているという仮説をたてた。実際に本発明者らは、in vitroにおけるTLR9.2二本鎖お
よびTLR9.2センス鎖による、また確立されたTLR7リガンド(ロキソリビン)によるIFN−α誘導が、TLR7欠失マウス由来の骨髄細胞には存在しないことを発見した(図6A)。対照的に、TLR9リガンドであるCpG ODN1826によるIFN−α誘導は、TLR7欠失マウス由来の骨髄細胞においては減少しなかった(図6A)。
【0148】
in vitroでは検出不可能な、siRNAの免疫認識のさらなるin vivoメカニズムが存在するかもしれない。そのようなものとして、TLR9.2siRNAをTLR7欠失マウスおよび野生型の対照マウスに静脈注射した。野生型マウスとは対照的に、TLR7欠失マウスは、7時間および24時間後の血清中に検出可能なIFN−αは全くみられなかった(図6B)。さらに、TLR7欠失マウスの脾臓細胞においては、CD4T細胞、CD8T細胞、骨髄樹状細胞およびPDCの活性化は全く見られなかったが、野生型マウスにおいては4つすべての細胞サブセットに強い活性化が見られた(図6C)。これらのデータを合わせると、TLR7がTLR9.2siRNAの免疫認識のために必要とされていることがわかる。
【0149】
考察
RNA干渉技術における最も顕著な進歩の一つとして、二本鎖RNA分子の長さを22塩基対まで減らすことにより、標的mRNAの配列特異的ダウンレギュレーションを維持しながら、PKRによって媒介される非特異的I型IFN誘導を回避できるということがある。この概念どおり、本発明者らは、IFN応答を伴わないヒトHEK293細胞株におけるsiRNA媒介性の配列特異的なTLR9ダウンレギュレーションを実証することができた。しかしながら、この方法を初代プラズマサイトイド樹状細胞(PDC)に適用しようとしたところ、以前に提案された長さ依存性の二本鎖RNA認識が逆転しているようであり、500塩基対長の二本鎖RNA分子またはポリ(I:C)(長い二本鎖RNAの模倣物)によるPDCのトランスフェクションでは、IFN−αが誘導できず、調べたsiRNA配列のいくつかが活発なIFN−α反応を示すという驚くべき観察結果を得た。
【0150】
強力なIFN−α誘導活性を有した2つのsiRNAの重複配列に基づいて、9塩基(5’GUCCUUCAA3’,配列番号:1)で構成される免疫刺激性の一本鎖RNA配列を同定することができた。免疫刺激性siRNAの両鎖の異なる領域の化学的骨格修飾により、免疫刺激とRNAサイレンシングを、2つの独立した機能的活性として分けることができた。siRNAによるIFN−α誘導に関する同じタイプの配列特異性が、マウスにおいても見られた。in vitroの免疫刺激活性およびin vivoの全身性免疫反応はTLR7欠失マウスにおいては無効になったことから、siRNAの配列特異的免疫認識は、TLR7によって媒介されることが実証された。
【0151】
本発明者らの結果は、siRNAの免疫刺激活性が、不完全なアニーリング処理後のsiRNA調製物に残された一本鎖RNA分子によって媒介されるのではないという証拠を与えるものである。すなわち、i)siRNA調製物を一本鎖RNAseで処理しても、siRNAの免疫学的活性に影響はないが、対応する免疫刺激性一本鎖RNAの活性は損なわれた。ii)免疫刺激性siRNAの完全な二本鎖を含む、エネルギー的に安定なヘアピンを自然に形成するように設計された一本鎖RNAオリゴヌクレオチド(ミクロRNAの形態)は、免疫刺激性siRNAと同等の活性を有していた。これらのデータから、siRNAの認識に関与する認識メカニズムによって、RNA二本鎖の内の一本鎖RNAモチーフの検出が可能になっていることが確認された。
【0152】
siRNAおよびTLR9リガンド(CpG DNA)の認識に関して、siRNAと微生物DNAのいずれも最初は二本鎖(ウィルスまたは細菌のDNAゲノムは通常は二本鎖)であるにもかかわらず、免疫刺激配列モチーフの検出は一本鎖レベルにおいて行われ
るということは興味深い。これまで、ヘリカーゼ活性が認識プロセスの一部であるかどうかについての情報はなかった。RNAおよびDNAのいずれに対しても、対応するタイプの免疫反応を誘起するために、適当な配列モチーフを含む合成一本鎖オリゴヌクレオチドを用いることができる。免疫刺激性RNAオリゴヌクレオチドの最短の長さは、約19塩基であった。同様に、活性TLR9リガンドになるためには、6量体CpGモチーフは、より長いオリゴヌクレオチドの一部でなければならない(ハートマン、ジー(Hartmann,G.)ら、J Immunol 2000,164:944〜53)。ポリA RNAは免疫学的活性を全く示さないので、9量体の刺激配列を含むRNAオリゴヌクレオチドを、19量体の長さにまで延長するためにポリAの添加を利用することができた。19量体RNAオリゴヌクレオチド中に2つの刺激性9量体配列を挿入することによって、免疫刺激活性がさらに増大した。同様に、ポリ(C)DNA(ホスホロチオエート修飾を有するものも有しないものも)は免疫刺激活性を欠如していることから、ポリ(C)は、以前の研究においてオリゴデスオキシヌクレオチドを含んだCpGモチーフの延長のために用いられていた(ハートマン、ジー(Hartmann,G.)ら J Immunol 2000,164:944〜53)。
【0153】
水疱性口内炎ウィルスやインフルエンザウィルスなどのある種の一本鎖RNAウィルスは、TLR7を介して免疫細胞によって認識されることが報告されているが(ランド(Lund)ら、Proc.Natl.Acad.Sci.USA 2004,101:5598〜603;ハイル(Heil)ら、Science 2004,303:1526〜9;ディーボルト(Diebold)ら、Science 2004,303:1526〜9)、ウィルスRNAの認識に関与する特定の配列モチーフはこれまで同定されていない。その代わりに、ポリ(U)が活性であることが報告されており、ウィルスRNAにおいてはGUが豊富な配列が免疫認識に関与し、さらにモノマーのGおよびUの混合物が免疫刺激性であることが提案されている。後者は、RNA分解産物の関与している可能性を示すものである。本研究におけるRNA分子の免疫刺激活性がGU含量によるものではないという証拠がいくつかある。最初に、当然のことながら、二本鎖RNAのGおよびUの総数は、二本鎖の長さと常に一致する(すなわち、19量体二本鎖のGU数は、常に19である)。第2に、siRNAの2つの一本鎖の一方または他方において、GまたはUの数、またはG対Uの比が大きくなっても、siRNAの免疫学的活性には関係しなかった。第3に、免疫刺激性一本鎖RNAにおけるGの数を増加すると、免疫学活性は強化されるよりもむしろ減少した。そして、第4に、本研究において記載する免疫刺激性RNA配列を含むRNAオリゴヌクレオチドと比べて、ポリ(U)は弱かった。
【0154】
本発明者らの結果は、PDCによるsiRNAの免疫認識が、配列依存性かつGU含量非依存性であり、本研究において記載された配列がいくつかの異なる免疫刺激性RNA配列モチーフの1つであるかもしれないことを明確に実証するものである。本研究の配列の最適化と、さらなる配列の同定は、最も強力な免疫刺激性RNAモチーフを同定するための幅広い配列スクリーニングの課題となるであろう。
【0155】
少なくとも本研究において記載するRNA配列については、siRNAの認識はマウスとヒトとの間で保存されているようである。DOTAPに複合化した免疫刺激性siRNAを静脈注射したところ、血清中のIFN−αならびにT細胞、PDCおよび骨髄樹状細胞の活性化を含む強い全身免疫反応が観察された。免疫活性化のレベルは、TLR9リガンドであるCpGの場合と同じ範囲にあった。siRNAによる骨髄樹状細胞およびT細胞のin vivo活性化は、すでにヒトの系において実証されているように(クルグ、エイ(Krug,A.)ら J Immunol 170,3468〜77(2003),ローテンファッサー、エス(Rothenfusser,S.)ら、Blood 103,2162〜9(2004),ローテンファッサー、エス(Rothenfusser,S.)ら、Eur J Immunol 31,3525〜34(2001))、IF
N−αによって媒介される二次的効果によるものであるかもしれない。結果として、カチオン性脂質と複合化したsiRNAは、CpGと同様に、ウィルス(ディトマー、ユー(Dittmer,U.)&オルブリッチ、エイ・アール(Olbrich,A.R.)、Curr Opin Microbiol 6,472〜7(2003))および細菌感染(ワグナー、エイチ(Wagner,H.)、Springer Semin Immunopathol 22,147〜52(2000))および腫瘍(ヘッケルスミラー、ケイ(Heckelsmiller,K.)ら、Eur J Immunol 32,3235〜45(2002)、ヘッケルスミラー、ケイ(Heckelsmiller,K.)ら、J Immunol 169,3892〜9(2002)、ワイナー、ジー・ジェイ(Weiner,G.J.)、Curr Top Microbiol Immunol 247,157〜70(2000))に対して、強力な治療活性を示すかもしれない。B型肝炎のマウスモデルにおいてウィルスの複製と転写を阻害するためにsiRNAがうまく用いられたことは興味深い(クライン、シー(Klein,C.)ら、Gastroenterology 125,9〜18(2003)、デビッドソン、ビー・エル(Davidson,B.L.)、N Engl J Med 349,2357〜9(2003))。IFN−αはB型肝炎治療の中心となるものであるから、PDCに由来するIFN−αがsiRNAの治療効果に寄与しているかもしれない。
【0156】
本研究において、in vitroおよびin vivoの両方においてsiRNAによって誘導される免疫反応は、完全にTLR7の存在に依存していた。しかしながら、HEK293細胞などの多くの細胞株においてTLR7は発現されず、したがって、TLR7を介したsiRNAの免疫認識は期待されない。このことは、siRNAでトランスフェクトしたHEK293細胞の上清が、長い二本鎖RNA分子によるトランスフェクションとは対照的に、STATlまたはSTAT2リン酸化活性の欠如によって証明されるようにI型IFN反応を示さないという我々のin vitroでの観察に矛盾しない。これらの結果は、in vitroのTLR7欠損細胞株において、21塩基対の短い二本鎖RNA(siRNA)が免疫刺激活性を欠き、標的遺伝子の配列特異的ダウンレギュレーションについては有用であるという概念と一致する。
【0157】
この概念に反する報告として、siRNAの細胞株へのトランスフェクションが、PKR依存性のI型IFN媒介性のSTAT経路の活性化をもたらし、IFNによって刺激される遺伝子のアップレギュレーションにつながることを示唆したものがある(スレズ、シー・エイ(Sledz,C.A.)ら、Nat Cell Biol 5,834〜9(2003))。さらに、siRNAは、HEK293細胞などの細胞株において発現されるTLR3を介してI型IFN反応を誘導することが報告されている(カリコ、ケイ(Kariko,K.)ら、J Immunol 172,6545〜9(2004),カリコ、ケイ(Kariko,K.)ら、Cells Tissues Organs 177,132〜8(2004))。しかしながら、本研究におけるTLR7欠損マウスでのsiRNAの免疫刺激活性の完全な損失は、PKRおよびTLR3が、天然の免疫系によってsiRNAを検出する主たるメカニズムを示すものではないという証拠を提供する。このことは、siRNAの免疫学的活性がTRIF欠損マウスでは影響されないという我々の最近の知見(データ示さず)によって支持される。TRIFは、TLR3シグナル伝達に必要なアダプタ分子である。TRIF欠損マウスにおけるsiRNAの免疫学的活性の欠如は、ホーベ(Hoebe)および共同研究者(ホーベ、ケイ(Hoebe,K.)ら、Nat Immunol 4,1223〜9(2003))によって提案された、代替のTLR3およびTRIF非依存性の長い二本鎖RNA(ポリ[I:C])認識の経路が、siRNAの免疫認識に関与していないことも示す。
【0158】
siRNAによって誘導されるI型IFN産生による、タンパク質発現の標的非特異的ダウンレギュレーションは、RNA干渉技術における大きな問題である。siRNAのサ
イレンシング活性からI型IFN誘導特性を分離する方法によって、siRNAの用途は進化するであろう。本研究において、siRNA TLR9.2は、サイレンシング活性と免疫刺激活性とがsiRNAの2つの無関係の機能的特性であることを実証するための優れたモデルであることが判った。IFN−α誘導に関与するRNA配列がアンチセンス鎖上ではなくセンス鎖上に見つかったので、両機能的活性の解離が可能であった。siRNA TLR9.2のセンス鎖またはアンチセンス鎖上のある領域に選択された骨格修飾(ロックト核酸;LNAによるもの)を施すことにより、サイレンシング活性は維持されているが免疫刺激活性が無効になった、またはその逆の、siRNA TLR9.2誘導体を作成することができた。これにより、siRNAの機能的特性は、免疫刺激および/または標的mRNAのサイレンシングを好むように変更できることが実証された。明らかに、mRNAサイレンシングに対するその効果に加えて、ある種のsiRNAは、その潜在的免疫刺激特性ゆえに、とくに該siRNAが抗感染または抗腫瘍治療薬としての使用に関する場合には、さらなる治療的可能性を有しうる。本研究において用いた刺激性配列は、PDCにおいて見られた最大刺激(刺激:CpG−A ODN2216)の約30%のIFN−α誘導を起こした。この刺激性配列が最適であるとは思えないが、このRNA配列によるin vivoでの結果は、免疫刺激性siRNA分子のさらなる開発に対する潜在性を浮き彫りにするものである。
【実施例2】
【0159】
免疫刺激を調節するための修飾オリゴヌクレオチドの合成
(a)RNA,2’−O−メチル修飾、2’−デオキシ−2’−フルオロ修飾、およびチオエート修飾を施したオリゴヌクレオチド
RNA分子は、394ABI合成機で、製造業者によって記載された標準サイクルを用い、下記に記載するように数箇所の待ち工程に改変を加えて合成した。固体支持体は、多孔性ガラス(CPG;500Å、米国ペンシルベニア州アストン所在のプライム・シンセシス・インコーポレイテッド(Prime Synthesis,Inc.))とした。モノマーは、ピアス・ヌクレイック・アシド・テクノロジーズ(Pierce Nucleic Acid Technologies)(米国ウィスコンシン州ミルウォーキー所在のピアス・ミルウォーキー・エルエルシー(Pierce Milwaukee LLC))から入手した標準的な保護基を有するRNAホスホルアミダイトまたは2’−O−メチル(2’−OMe)RNAホスホルアミダイトであって、特に述べない限り、CH3CN中に0.15Mの濃度で使用した。具体的には、RNAホスホルアミダイトは、5’−O−ジメトキシトリチル−N6−ベンゾイル−2’−O−tブチルジメチルシリル−アデノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N2−イソブチリル−2’−O−tブチルジメチルシリル−グアノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N4−アセチル−2’−O−tブチルジメチルシリル−シチジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−2’−O−tブチルジメチルシリル−ウリジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N6−ベンゾイル−2’−O−メチル−アデノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N2−イソブチリル−2’−O−メチル−グアノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N4−アセチル−2’−O−メチル−シチジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、および5’−O−ジメトキシトリチル−2’−O−メチル−ウリジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイトであった。2’−デオキシ−2’−フルオロ(2’−F)ホスホルアミダイト、5’−O−ジメトキシトリチル−N4−アセチル−2’−デオキシ−2’−フルオロ−シチジン−3’−O−N,N’−ジイソ
プロピル−2−シアノエチル−ホスホルアミダイトおよび5’−O−ジメトキシトリチル−2’−デオキシ−2’−フルオロ−ウリジン−3’−O−N,N’−ジイソプロピル−2−シアノエチル−ホスホルアミダイトは、プロメガ・コーポレイション(Promega Corp.(米国ウィスコンシン州マディソン所在))より購入した。5’−O−ジメトキシトリチル−N6−ベンゾイル−2’−デオキシ−2’−フルオロ−アデノシン−3’−O−N,N’−ジイソプロピル−2−シアノエチル−ホスホルアミダイトおよび5’−O−ジメトキシトリチル−N2−イソブチリル−2’−デオキシ−2’−フルオロ−グアノシン−3’−O−N,N’−ジイソプロピル−2−シアノエチル−ホスホルアミダイトは、文献プロトコールに従って合成した(引用)。すべてのモノマーに対してカップリング時間は10分間とした。他の試薬の詳細は以下の通りである;アクチベータ,5−エチルチオテトラゾール(0.25M、米国VIスターリング所在のグレン・リサーチ(Glen Research));CapA,5%無水酢酸/THF/ピリジン(米国VIスターリング所在のグレン・リサーチ);CapB:10%N−メチルイミダゾール/THF(米国VIスターリング所在のグレン・リサーチ);PO酸化には0.02M I2/THF/H2O(米国VIスターリング所在のグレン・リサーチ)を用いた。PS酸化には、Beaucage試薬(英国グラスゴー所在のクルアケム・リミテッド(Chruachem Ltd))のアセトニトリル溶液(1%)を使用した。トリチル基は、合成機において、3%TCA/ジクロロメタン(米国VIスターリング所在のグレン・リサーチ)によって除去した。
【0160】
(b)LNA結合を有するオリゴヌクレオチドの合成
RNA分子は、394ABI合成機で、製造業者によって記載された標準サイクルを用い、下記に記載するように数箇所の待ち工程に改変を加えて合成した。固体支持体は、rA CPG(2マイクロモル、520Å、米国ペンシルベニア州アストン所在のプライム・シンセシス・インコーポレイテッド、バッチ番号CPG60N11RASN)、rU CPG(G311103がこれ、米国ペンシルベニア州アストン所在のプライム・シンセシス・インコーポレイテッド、バッチ番号も同様か)、LocA(2マイクロモル、米国コロラド州ボルダー所在のプロリゴ・エルエルシー(Proligo LLC)、40.0マイクロモル/g、バッチ番号225401)、またはLocT(2マイクロモル、米国コロラド州ボルダー所在のプロリゴ・エルエルシー、39.0マイクロモル/g、バッチ番号224597)とした。Locは、LNA構築ブロックを表す。モノマーは、RNAホスホルアミダイト(ピアス・ヌクレイック・アシド・テクノロジーズ、ピアス・ミルウォーキー・エルエルシー(Pierce Nucleic Acid Technologies,Pierce Milwaukee LLC)、米国ウィスコンシン州ミルウォーキー所在)またはLNAホスホルアミダイトLocABz(米国コロラド州ボルダー所在のプロリゴ・エルエルシー、カタログ番号223917),5’DMTCELoc5meCBz(米国コロラド州ボルダー所在のプロリゴ・エルエルシー、カタログ番号223816),5’DMTCELoc5meGiBu(米国コロラド州ボルダー所在のプロリゴ・エルエルシー、カタログ番号223817),5’DMTCELocT(米国コロラド州ボルダー所在のプロリゴ・エルエルシー、カタログ番号22818)とした。特に注記のない限り、すべて標準的な保護基を有し、CH3CN中0.15Mの濃度で使用した。具体的には、RNAホスホルアミダイトは、5’−O−ジメトキシトリチル−N6−ベンゾイル−2’−O−tブチルジメチルシリル−アデノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト(バッチ番号FG0082)、5’−O−ジメトキシトリチル−N2−イソブチリル−2’−O−tブチルジメチルシリル−グアノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト(バッチ番号FE0031)、5’−O−ジメトキシトリチル−N4−アセチル−2’−O−tブチルジメチルシリル−シチジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト(バッチ番号FF0046)、および5’−O−ジメトキシトリチル−2’−O−tブチルジメチルシリル−ウリジン−3’−O
−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト(バッチ番号FF0036)とした。LNAホスホルアミダイトは、5’−O−ジメトキシトリチル−N6−ベンゾイル−アデノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)LNAホスホルアミダイト、5’−O−ジメトキシトリチル−N2−イソブチリル−グアノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)LNAホスホルアミダイト、5’−O−ジメトキシトリチル−N4−アセチル−5−メチル−シチジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)LNAホスホルアミダイト、および5’−O−ジメトキシトリチル−5−メチル−チミジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)LNAホスホルアミダイトとした。
【0161】
すべてのモノマーに対してカップリング時間は10分間とした。他の試薬の詳細は以下の通りである:アクチベータ、5−エチルチオテトラゾール(0.25M、米国VIスターリング所在のグレン・リサーチ);CapA、5%無水酢酸/THF/ピリジン(米国VIスターリング所在のグレン・リサーチ);およびCapB、10%N−メチルイミダゾール/THF(米国VIスターリング所在のグレン・リサーチ);PO酸化には0.02M I2/THF/H2O(米国VIスターリング所在のグレン・リサーチ)を用いた。トリチル基は、合成機において、3%TCA/ジクロロメタン(米国VIスターリング所在のグレン・リサーチ)によって除去した。
【0162】
脱保護
合成の完了後、多孔性ガラス(CPG)をネジ蓋付無菌微量遠心チューブに移した。オリゴヌクレオチドを切断し、同時に、塩基およびリン酸基を1.0mLのエタノール性アンモニアの混合物(1:3)中、55℃で5時間かけて脱保護した。遠心チューブを氷上で短時間冷却し、溶液を5mLの遠心チューブに移した。固体支持体を、50%CH3CN水溶液0.25mLを用いて3回洗浄し、洗浄液は元の溶液に加えた。遠心チューブを−80℃で15分間冷却し、溶液を凍結乾燥器中で乾燥させた。
【0163】
得られた白色の残渣は、200μLのトリエチルアミントリヒドロフルオリド中に再懸濁し、65℃で1.5時間加熱して、2’位にあるTBDMS基を除去した。次にオリゴヌクレオチドを乾燥メタノール(400μL)中で沈殿させた。液体を注意深く除去したところ、チューブの底にペレットが得られた。残ったメタノールを高速真空遠心機中で除去して、粗RNAを白色のふわふわした物質として得た。
【0164】
精製
試料を1mLのRNaseを含まない水に溶解し、260nmで定量した。粗オリゴヌクレオチドは、変性ゲル電気泳動(20%アクリルアミド、6M尿素)によって精製した。精製したオリゴヌクレオチドは、セファデックスG25M(米国ニュージャージー州ピスカタウェイ所在のアマシャム・バイオサイエンシズ・コーポレイション(Amersham Biosciences Corp))を用いて脱塩した。
【0165】
表3〜6は、合成された、記載のように修飾したオリゴヌクレオチドの配列を示したものである。
活性の測定
修飾オリゴヌクレオチドを、実施例1において上記したようにPDCとともにインキュベートし、IFN−α産生を測定した。表7は、末端チミジン以外はTLR9.2sと同じ塩基配列を有するが、1および2位、1、2、18および19位、1〜4および16〜19位、ならびに16〜19位に2’−フルオロまたは2’−O−メチル修飾を含むか、または完全にホスホロチオエートで置換された骨格を含むオリゴヌクレオチドについて得られた結果を、それぞれ、TLR9.2sについて測定されたIFN−α産生に対する%で表して示すものである。2’−フルオロ修飾は一般にこれらのオリゴヌクレオチドの免
疫刺激性活性への影響は少ないのに対し、2’−O−メチル修飾はこの活性をほぼ完全に無効にすることが明らかである。2’−フルオロ修飾に関しては、5’−GUCCUUCAA−3’(配列番号:1)モチーフから最も遠い5’末端のヌクレオチドのみを修飾すると、影響は最小限であるが、両端の4ヌクレオチドを修飾するとオリゴヌクレオチドの免疫刺激活性を著しく減退させた。ホスホロチオエートは、IFN−α誘導活性を穏やかに減退させた。
【0166】
したがって、たとえばヌクレアーゼによる分解から保護するために、本発明の免疫刺激性オリゴヌクレオチドを修飾することが望ましいようであれば、2’−フルオロ修飾を導入することにより、また好ましくは2’−フルオロ修飾を配列番号:1のヌクレオチドが非修飾のままであるように導入することによって達成することができる。しかしながら、配列番号:1を含むオリゴヌクレオチド、またはヌクレオチド配列番号:1由来の4以上、5以上、6以上、7以上または8以上の連続したヌクレオチド、たとえば、5’−GUCC−3’(配列番号:2),5’−GUCCU−3’(配列番号:3),5’−GUCCUU−3’(配列番号:4),5’−GUCCUUC−3’(配列番号:5),または5’−GUCCUUCA−3’(配列番号:6)を含むオリゴヌクレオチドを作成し、免疫刺激活性は回避することが望ましい場合、2’−O−メチル修飾を導入することにより、また好ましくは、2’−O−メチル修飾を、配列番号:1のヌクレオチドが修飾されるように導入することにより、達成することができる。
【0167】
【表1】

【0168】
【表2】

【0169】
【表3】

【0170】
【表4】

【0171】
【表5】

【0172】
【表6】

【0173】
表3〜6において、鎖は5’から3’の方向に示した。dTは2’−デオキシチミジンを示し、前に小文字の「s」が付いたものは5’−ホスホロチオエート基を表す。ロックト核酸は、後ろに「L」を付けて示した。前に小文字の「d」が付いたものはデオキシ残基を示す。前に「o」が付いたものは2’−O−メチル修飾ヌクレオチドを表す。前に「f」が付いたものは2’−フルオロヌクレオチドを示す。「T」は5−メチル−ウリジン
を表し、「mC5」は5−メチル−シチジンを表す。フルオロ修飾セットの配列のうち6つが「dT」突出部で終わっているのは、リボフルオロヌクレオシドを含む適切なCPGがこの時点では入手できなかったからである。これらは、2793、2794、2795、2797、2798、および2799である。「Extn coeff.e260*10−3」は、波長260nmにおけるオリゴヌクレオチドのモル吸光係数を(1000×l/(mol×cm)で割ったものである。
【0174】
【表7】

【0175】
【表8】

【0176】

【0177】

【技術分野】
【0001】
本発明は、対象における免疫応答を誘導することのできる配列特異的オリゴリボヌクレオチド剤を提供することによる、免疫治療および創薬の分野、ならびにRNAi剤に対する配列特異的免疫応答の回避方法に関する。
【背景技術】
【0002】
(関連出願)
本願は、参照によりその全体を本願に組み込む、2004年12月9日に提出された米国仮出願番号第60/634,849号明細書に利益を請求する。
【0003】
(背景)
二本鎖RNA分子(dsRNA)は、RNA干渉(RNAi)として知られる高度に保存された調節機構によって、遺伝子発現をブロックすることができる。すなわち、RNAIIIDicer酵素は、dsRNAを、約22ヌクレオチドの小さい干渉RNA(短鎖干渉RNAまたはsiRNAとも呼ばれる)に処理する。siRNAの一方の鎖(「アンチセンス鎖」)は、RNAによって誘導されるサイレンシング複合体RISCによってアンチセンス鎖の配列と少なくとも部分的に相補的なヌクレオチド配列を含むメッセンジャーRNA(mRNA)の切断を誘導するガイド配列としてはたらく。アンチセンス鎖は、このプロセスにおいては切断されないか、いずれにせよ分解されず、アンチセンス鎖を含んだRISCは引き続き、さらなるmRNAの切断に影響を及ぼすことができる。
【0004】
転写後二本鎖RNA依存性遺伝子サイレンシングのプロセスは、一般的にRNA干渉(RNAi)と呼ばれている(非特許文献1〜3)。真核生物は、ウィルスなどの侵襲してくる外来遺伝子要素から自己のゲノムを守るためにRNAiを利用していると提案されてきた。ウィルス複製中の二本鎖RNAの形成は、望まれない遺伝子活性に対するシグナルとして細胞によって解釈される(非特許文献4、5)。DicerRNaseIIIは、二本鎖RNAを明確なサイズと構造を持った小さい二本鎖RNA断片、すなわち短鎖干渉RNA(siRNA)に迅速に処理して、該短鎖干渉RNAが、侵襲遺伝子の一本鎖mRNAの配列特異的分解を支援する(非特許文献6〜9)。このようなsiRNA二本鎖は、2〜3ヌクレオチドの3’突出端を有するとともに、5’リン酸および自由3’ヒドロキシ末端を含む(非特許文献10)。合成siRNA二本鎖の細胞送達またはプラスミドもしくはウィルスベクターによるsiRNAの導入は、現在では、導入された二本鎖RNAと配列が相同な細胞遺伝子の活性を妨害するために広く用いられている。
【0005】
siRNAがどのようにして哺乳類の系と相互作用しているかを理解することが、この遺伝子サイレンシング技術に磨きをかけ、遺伝子特異的治療剤を開発するために重要である(非特許文献11)。長い二本鎖RNAの認識について、2つの異なる検出モード、すなわち、セリンスレオニンキナーゼPKR(非特許文献12〜14)およびTLR3(非特許文献15)が知られている。PKRは細胞質内に局在しているが、TLR3はエンドゾーム内に存在している(非特許文献16)。TLR3は、病原体特異的分子を検出するために進化してきたToll様受容体ファミリーのメンバーである(非特許文献17)。
【0006】
PKRは、2つの二本鎖RNA結合ドメインを有し、その一方は、二本鎖RNAに対する高い親和性を有し、他方は相当に低い親和性しか示さない。PKRによって媒介される反応の完全な活性化には、二本鎖RNAが両ドメインに同時に結合することが必要であり(これは、長い二本鎖RNA、たとえば長さが50〜80ヌクレオチド対を超える二本鎖
RNAによって容易化されるようである)、また二量化を必要とするようである(非特許文献18、19)。50ヌクレオチド対未満の二本鎖RNAを含む二本鎖RNAの濃度が高いと、または二本鎖RNA結合部位に対する他のリガンド(たとえばAlu RNA)の濃度が高いと、PKRの活性化が阻害される。初期の研究から、siRNA二本鎖は、脊椎動物細胞における一般的な二本鎖RNAによって誘導される非特異的効果をバイパスするのに十分に短いことが証明されている。(非特許文献20)。しかしながら、複数のより最近の文献では、インターフェロン経路、特にPKRの活性化に関与する遺伝子を含む短い二本鎖RNAの導入によって、長い二本鎖RNAの効果と同等とまではいかないにせよ、数多くの遺伝子が様々に調節されることが示されている(非特許文献21〜29)。どの遺伝子がアップレギュレートまたはダウンレギュレートされるかは、少なくとも部分的にはsiRNA配列特異的と考えられ、この調節の基礎をなす機構(または機構群)はまだ解明されていない。
【0007】
ウィルス感染を認識するために免疫系によって利用されるウィルス核酸の第2の特徴的性質はウィルスDNA中に見られるCpGモチーフであり、CpGモチーフはTLR9を介して検出される(非特許文献30〜31)。CpGモチーフは、特定の隣接塩基を有したメチル化されていないCGジヌクレオチドである。脊椎動物においてはCpGモチーフの頻度は抑制されており、これにより脊椎動物免疫系が、CpGモチーフなどに基づいて微生物DNAを検出できるようになっている(非特許文献32〜34)。TLR3と同様に、TLR9はエンドゾームに局在しており、ここで、TLR9はCpGモチーフに直接結合する(非特許文献35)。
【0008】
長い二本鎖RNAおよびCpG DNAに加えて、2つの最近の文献により、ウィルス核酸が認識される第3の機構が示唆されている。これらの研究は、一本鎖RNA(ssRNA)ウィルスのssRNAがTLR7(マウスおよびヒト)およびTLR8(ヒトのみ)を介して検出されることを実証している(非特許文献36、37)。グアニンアナログは、TLR7およびTLR8に対する特異的リガンドとして初期に同定されていた(非特許文献38、39)。TLR9(CpGDNAに対する受容体)(非特許文献35)と同様に、TLR7およびTLR8は、エンドゾーム膜に局在している。
【0009】
ウィルス核酸の検出は、I型IFN(IFN−αおよびIFN−β)の生産につながる。ヒトにおけるI型IFNの主たる生産者は、プラズマサイトイド樹状細胞(インターフェロン産生細胞、IPCとも呼ばれる)である。プラズマサイトイド樹状細胞(PDC)は、樹状細胞の高度に特化したサブセットであり、ウィルス感染に対する見張り(センチネル)として機能すると考えられ、ウィルス感染のあいだの大量のI型IFNに関与する(非特許文献40)。PDCが、ウィルス感染を検出するための核酸系分子を優先的に使用するという証拠も増えてきている。ヒトおよびマウスPDCのTLR発現は、TLR7およびTLR9に限られている(非特許文献41〜43)。
【0010】
非特許文献44〜46および32は、細菌および合成のオリゴデオキシリボヌクレオチド中の特定の配列コンテクストにCpGジヌクレオチドが存在すること(CpG DNA)が、脊椎動物の生来の免疫応答、T細胞およびB細胞を活性化することが知られていることを教示している。
【0011】
非特許文献47〜50は、CpGDNAによる免疫細胞の活性化が、IFN,ガンマ、IL−12、TNF−α、およびIL−6を含む複数のサイトカインの分泌と、共刺激性表面分子の刺激発現を誘導していると教示している。
【0012】
前掲の非特許文献32および非特許文献51〜54は、CpGジヌクレオチドの存在および該ジヌクレオチドに隣接する配列が、DNAの免疫刺激活性を決定するのに重要な役
割を果たすこと、パリンドロームまたは非パリンドロームの6量体配列中のCpGジヌクレオチド(P1.P2CGP3P4)が免疫刺激に必要とされること、およびさらに、PuPuCGPyPyおよびPuTCGモチーフが、それぞれマウスおよびヒト免疫系を最適に活性化することを教示している。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】タシュル、ティー(Tuschl,T.) Chembiochem 2,239〜45(2001)
【非特許文献2】ザモア、ピーディー(Zamore,P.D.) Science 296,1265〜9(2002)
【非特許文献3】ハノン、ジージェイ(Hannon,GJ.) Nature 418,244〜51(2002))
【非特許文献4】アールキスト、ピー(Ahlquist,P.) Science 296,1270〜3(2002)
【非特許文献5】プラスターク、アールエイチ(Plasterk,R.H.) Science 296,1263〜5(2002)
【非特許文献6】エルバシャー、エスエム(Elbashir,S.M.)ら Nature 411,494〜8(2001)
【非特許文献7】エルバシャー、エスエム(Elbashir,SM.)ら Genes Dev 15,188〜200(2001)
【非特許文献8】ハモンド、エスエム(Hammond,S.M.)ら Nature 404,293〜6(2000)
【非特許文献9】ザモア、ピーディー(Zamore,P.D.)ら Cell 101,25〜33(2000)
【非特許文献10】エルバシャー、エスエム(Elbashir,S.M.)ら Embo J 20,6877〜88(2001)
【非特許文献11】タシュル、ティー(Tuschl,T.)ら Mol Interv 2,158〜67(2002)
【非特許文献12】ウィリアムズ、ビーアール(Williams,B.R.) Sci Signal Transduction Knowledge Enviroment 89,RE2(2001)
【非特許文献13】ミュルス、イーエフ(Meurs,E.F.)ら Virol 66,5805〜14(1992)
【非特許文献14】カッツェ、エムジー(Katze,M.G.)ら Mol Cell Biol 11,5497〜505(1991)
【非特許文献15】アレキソポーロー、エル(Alexopoulou,L.)ら Nature 413,732〜8(2001)
【非特許文献16】マツモト、エム(Matsumoto,M.)ら、J Immunol 171,3154〜62(2003)
【非特許文献17】タケダ、ケイ(Takeda,K.)ら Annu Rev Immunol 21,335〜76(2003)
【非特許文献18】マンヘ、エル(Manche,L.)ら,Mol Cell Biol,12,5238〜48(1992)
【非特許文献19】ウィリアムズ、ビージー(Williams,B.G.) Oncogene,18,6112〜20(1999)
【非特許文献20】ビトコ、ブイ(Bitko,V.)ら BMC Microbiol,1,34(2001)
【非特許文献21】ジャクソン、エイアール(Jackson,A.L.)およびリンスレー、ピーエス(Linsley,P.S.) Trends Genet,20,521〜4(2004)
【非特許文献22】ジャクソン、エイアール(Jackson,A.L.)ら、Nat Biotechnol,21,635〜7(2003)
【非特許文献23】モス、イージー(Moss,E.G.)およびテイラー、ジェイエム(Taylor,J.M.) Nat Cell Biol,5,771〜2(2003)
【非特許文献24】ブリッジ、エイジェイ(Bridge,A.J.)ら、Nat Genet,34,263〜4(2003)
【非特許文献25】スレズ、シーエイ(Sledz,C.A.)ら、Nat Cell Biol,5,834〜9(2003)
【非特許文献26】ヘイデル、ジェイディー(Heidel,J.D.)ら、Nat Biotechnol,22,1579〜81(2004)
【非特許文献27】キム、ディーエイチ(Kim,D.H.)ら,Nat Biotechnol,22,321〜5(2004)
【非特許文献28】ツェン、エックス(Zheng,X.)およびベビラッカ、ピーシー(Bevilacqua,P.C.)、RNA,10,1934〜45(2004)
【非特許文献29】ペバナード、エス(Pebernard,S.)およびイッゴ、アール(Iggo,R.)、Differentiation,72,103〜11(2004)
【非特許文献30】ランド、ジェイ(Lund,J.)ら J Exp Med 198,513〜520(2003)
【非特許文献31】クルグ、エイ(Krug,A.)ら Blood 103,1433〜7(2004)
【非特許文献32】クリーグ、エイエム(Krieg,A.M.)ら Nature 374,546〜9(1995)
【非特許文献33】バウア、エス(Bauer,S.)ら Proc Natl Acad Sci USA 98,9237〜42(2001)
【非特許文献34】ワグナー、エイチ(Wagner,H.) Curr Opin Microbiol 5,62〜9(2002)
【非特許文献35】ラッツ、イー(Latz,E.)ら Nat Immunol 5,190〜8(2004)
【非特許文献36】ディーボルト、エスエス(Diebold,S.S.)、Science 303,1529〜31(2004)
【非特許文献37】ハイル、エフ(Heil,F.)ら Science 303,1526〜9(2004)
【非特許文献38】リ、ジェイ(Lee,J.)ら Proc Natl Acad Sci USA 100,6646〜51(2003)
【非特許文献39】ハイル、エフ(Heil,F.)ら Eur J Immunol 33,2987〜97(2003)
【非特許文献40】アセリン‐パトゥエル、シー(Asselin−Paturel,C.)ら Nat Immunol 2,1144〜50(2001)
【非特許文献41】クルグ、エイ(Krug,A.)ら Eur J Immunol 31,3026〜37(2001)
【非特許文献42】ホルヌング、ブイ(Hornung,V.)ら J Immunol 168,4531〜7(2002)
【非特許文献43】エドワーズ、エイディー(Edwards,A.D.)ら Eur J Immunol 33,827〜33(2003)
【非特許文献44】トクナガ(Tokunaga)ら、J.Natl.Cancer Inst.72:955〜962(1984)
【非特許文献45】メシナ(Messina)ら、J.Immunol.147:1759〜1764(1991)
【非特許文献46】サトウ(Sato)ら,Science 273:352〜354(1996)
【非特許文献47】ヤマモト(Yamamoto)ら,Jpn.J.Cancer Res.79:866〜873(1988)
【非特許文献48】ハルパーン(Halpern)ら,Cell Immunol.,167:72〜78(1996)
【非特許文献49】クリンマン(Klinman)ら,Proc.Natl.Acad.Sci.U.S.A.93:2879〜2883(1996)
【非特許文献50】ツァオ(Zhao)ら,Antisense Nucleic Acid Drug Dev.7:495〜502(1997)
【非特許文献51】ヤマモト(Yamamoto)ら,J.Immunol.148;4072〜4076(1992)
【非特許文献52】トクナガ(Tokunaga)ら,Microbiol.Immunol.36:55〜66(1992)
【非特許文献53】リャン(Liang)ら,J.Clin.Invest.98:1119〜1129(1996)
【非特許文献54】ハートマン(Hartmann)ら,J.Immunol.164:1617〜1624(2000)
【発明の概要】
【発明が解決しようとする課題】
【0014】
上記の発見は、オリゴヌクレオチドが免疫刺激剤として有用であることを示すが、そのような用途に伴ういくつかの問題もいまだに存在している。たとえば、長いオリゴヌクレオチドは作製費用が高く、隣接配列の種特異性が任意の所与のオリゴヌクレオチドの有用性の幅を限定してしまう。したがって、より安価な免疫刺激剤、好ましくは種を超えて有効な免疫刺激剤が必要されるとともに、さらに別の配列特異的モチーフを同定することが必要とされている。
【課題を解決するための手段】
【0015】
本発明は、少なくとも部分的には、一本鎖または二本鎖RNA分子内の特定の配列モチーフが特にプラズマサイトイド樹状細胞(PDC)などのTLR7を発現する細胞におけるIFN誘導を介した免疫応答の刺激に有効であるという発見に基づいている。この発見に基づいて、本発明は、哺乳類におけるIFN産生を刺激するために使用することのできる免疫刺激性オリゴヌクレオチド剤、ならびに、望まれる免疫応答を誘導するため、または望ましくない免疫応答の誘導を回避するために、一本鎖アンチセンス剤および二本鎖iRNA剤を選択的に設計する方法を提供する。
【0016】
本発明は、免疫刺激剤として一本鎖または二本鎖オリゴヌクレオチドを含む治療用組成物、ならびに、そのような組成物の免疫治療用途での使用方法も提供する。本発明は具体的には、限定はされないが、たとえば、成人および小児ならびに家畜に対する適用において、がん、自己免疫疾患、ぜんそく、呼吸器系アレルギー、食品アレルギー、および細菌、寄生虫、およびウィルス感染の治療などの免疫治療用途に用いられる免疫応答を高めるための方法および組成物を提供する。本発明は、そのような化合物の製造方法も提供する。さらに、本発明の化合物は、DNAワクチン、抗体およびアレルゲンと組み合わせるアジュバントとして、および他の免疫刺激剤、化学治療剤、iRNA剤および/またはアンチセンスオリゴヌクレオチドと組み合わせるアジュバントとして有用である。
【0017】
本発明のオリゴヌクレオチド剤は、ヌクレオチド配列
5’−GUCCUUCAA−3’(配列番号:1)
を含むか、該配列で構成されるか、または本質的に該配列で構成される。
【0018】
他の実施形態において、オリゴヌクレオチドは、配列番号:1由来の、好ましくは当該配列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列、たとえば、5’−GUCC−3’(配列番号:2)、5’−GUCCU−3’(配列番号:3)、5’−GUCCUU−3’(配列番号:4)、5’−GUCCUUC−3’(配列番号:5)、または5’−GUCCUUCA−3’(配列番号:6)を含むか、該配列で構成されるか、または、本質的に該配列で構成される。
【0019】
すなわち、1つの態様において、本発明は、哺乳類における免疫応答を刺激する方法であって、前記哺乳類に、配列番号:1由来の、好ましくは当該配列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含むか、該配列で構成されるか、または、本質的に該配列で構成されるオリゴヌクレオチド剤を投与する工程を含む方法を提供する。前記オリゴヌクレオチド剤は、配列番号:1、または配列番号:1の配列から1以下または2以下のヌクレオチドだけが異なる配列を含むか、該配列で構成されるか、または、本質的に該配列で構成されてもよい。前記配列は、配列番号:2、配列番号:3、配列番号:4、配列番号:5、および配列番号:6からなる群より選択されてもよい。オリゴヌクレオチドは、iRNA剤であってもよいし、または一本鎖RNA剤であってもよい。
【0020】
第2の態様において、本発明は、哺乳類において免疫応答の刺激を回避するためのオリゴヌクレオチド剤の製造方法であって、潜在薬剤プールから、配列番号:1由来の、好ましくは当該配列の5’末端から4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含む、または配列番号:1から1以下または2以下のヌクレオチドしか違わない配列を含む任意の剤を除去する工程を含む方法を提供する。オリゴヌクレオチドは、iRNA剤であってもよいし、または一本鎖RNA剤であってもよい。
【0021】
第3の態様において、本発明は、配列番号:1由来の、好ましくは当該配列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含むか、該配列で構成されるか、または、本質的に該配列で構成される単離オリゴヌクレオチド剤を提供する。該オリゴヌクレオチド剤は、配列番号:1、または配列番号:1の配列から1以下または2以下のヌクレオチドだけが異なる配列を含むか、該配列で構成されるか、または、本質的に該配列で構成されてもよい。前記配列は、配列番号:2、配列番号:3、配列番号:4、配列番号:5、および配列番号:6からなる群より選択されてもよい。オリゴヌクレオチドは、iRNA剤であってもよいし、または一本鎖RNA剤であってもよい。少なくとも1つの2’−フルオロ修飾ヌクレオチドをさらに含んでいてもよく、該2’−フルオロ修飾ヌクレオチドは、配列番号:1由来の4つ以上の連続したヌクレオチドを含む配列の一部ではない。オリゴヌクレオチド剤がiRNA剤の場合には、表8の遺伝子のいずれかに対して特異的(たとえば、一方の鎖は少なくとも部分的に該遺伝子に相補的)なものであればよい。
【0022】
第4の態様において、本発明は、哺乳類における免疫応答を誘導するオリゴヌクレオチド剤の製造方法であって、潜在薬剤プールに、配列番号:1の4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドを含む、または配列番号:1から1以下または2以下のヌクレオチドしか違わない配列を含む任意の剤を添加する工程を含む方法を提供する。オリゴヌクレオチドは、iRNA剤であってもよいし、または一本鎖RNA剤であってもよい。
【0023】
第5の態様において、本発明は、哺乳類において遺伝子の発現の阻害と、免疫応答の誘導とを同時に行う方法であって、前記哺乳類に、配列番号:1由来の、好ましくは当該配
列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列、または、配列番号:1の配列から1以下または2以下のヌクレオチドだけが異なる配列を含むiRNA剤を投与する工程を含む方法を提供する。前記配列は、配列番号:2、配列番号:3、配列番号:4、配列番号:5、および配列番号:6からなる群より選択されてよい。前記遺伝子は、表8の遺伝子のうちの任意のものであってよい。
【0024】
第6の態様において、本発明は、iRNA剤の評価方法であって、
a.候補iRNA剤を提供することと、
b.候補iRNA剤を検査して、配列番号:1、または、配列番号:1から1または2ヌクレオチドしか違わない配列を含むかどうかを判定することと
を含む方法を提供する。
【0025】
前記方法は、iRNA剤を修飾して、配列番号:1の配列、または配列番号:1から1または2ヌクレオチドしか違わない配列を除去することをさらに含んでもよい。
第7の態様において、本発明は、本発明のオリゴヌクレオチドと、薬学的に許容される担体とを含む薬学的組成物を提供する。前記薬学的組成物はワクチンであってもよい。
【0026】
第8の態様において、本発明は、哺乳類における免疫応答の刺激を回避するオリゴヌクレオチド剤の製造方法であって、前記オリゴヌクレオチドは、配列番号:1由来の4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含み、前記方法は、オリゴヌクレオチド剤を、該オリゴヌクレオチド剤が少なくとも2つ、または少なくとも4つの2’−O−メチル修飾ヌクレオチドを含むように提供することを含む方法を提供する。2’−O−メチル修飾ヌクレオチドのうちの少なくとも1つ、または少なくとも2つが、配列番号:1からの4以上連続したヌクレオチドの配列の一部であってよい。
【図面の簡単な説明】
【0027】
【図1】HEK293細胞において、siRNAを用いて、標的非特異的なI型IFN媒介性のSTATlまたはSTAT2リン酸化活性を誘導せずに、TLR9発現を阻害することができることを示す図。 HEK293細胞(50.000/ウェル)を、様々なRNA分子およびリポフェクタミンとともにインキュベートした。 A:C末端YFPタグを有するヒトTLR9の構築物を発現するHEK293細胞を、ヒトTLR9mRNAの種々の領域と相補的な4つのsiRNAでトランスフェクトした。GFPmRNAおよびTLR2(図面中では、siRNA2.1と表す)mRNAを標的とするsiRNAを用いたトランスフェクションを陽性および陰性対照とした。20時間目に、YFPタグ発現の平均蛍光強度をフローサイトメトリーによって解析した。結果を平均値±SEM(n=3)として示す。 B:HEK293細胞を、単独でインキュベートしたもの(レーン1)、リポフェクタミンとともにインキュベートしたもの(レーン2)、500塩基対長の二本鎖RNAとともにインキュベートしたもの(10μg/mL、レーン3)、または500塩基対長の二本鎖RNAと複合化したリポフェクタミンでトランスフェクトしたもの(レーン4)、ヒトTLR9mRNAを標的とする4つの異なるsiRNAと複合化したリポフェクタミンでトランスフェクトしたもの(TLR9.1,TLR9.2,TLR9.3およびTLR9.4;レーン5〜8;TLR9.1,TLR9.2,TLR9.3およびTLR9.4は、図面ではそれぞれsiRNA9.1,siRNA9.2,siRNA9.3、およびsiRNA9.4と表されている)。24時間後、上清を回収し、BL41細胞(1条件あたり細胞1×106個)に加えた。組換えIFN−β(100U/mL)を加えたものを、陽性対照とした(レーン9)。30分後、BL41細胞を溶菌し、SDS−pageにかけて、STATlおよびSTAT2のリン酸化を調べた。上清は4連実験から回収した。3回のうちの1つの代表的な実験を示す。
【図2A】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 A:PDCを、200ngの4つの異なるsiRNA(TLR9.1、TLR9.2、TLR9.3およびTLR9.4)でトランスフェクトした。TLR9−リガンドであるCpG−A(ODN2216、灰色バー)を、IFN−α誘導に関する陽性対照とした。結果は、11名の個別ドナーからの平均IFN−α産生±SEMで示されている(TLR9.1対TLR9.2に対してはp<0.0001、TLR9.1対TLR9.3に対してはp<0.0001、TLR9.3対TLR9.1に対してはp<0.0001、およびTLR9.3対TLR9.4に対してはp<0.001)。
【図2B】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 B:TLR9.1、TLR9.2、TLR9.3またはTLR9.4の量を減少させて(200ng、100ng、50ng、25ng)PDCをトランスフェクトした。結果は、3名の個別ドナーからの平均IFN−α産生±SEMを示す。
【図2C】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 C:PDCを、siRNA9.2二本鎖または対応するセンス鎖およびアンチセンス鎖のいずれかによってトランスフェクトした。10名の個別ドナーからの結果をまとめ、平均値±SEMで示した。
【図2D】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 D(左パネル):siRNA9.2センス鎖のFITC修飾物、または対応するアニールしたsiRNA二本鎖を、266μg/mLのRNAseの存在下、または非存在下でインキュベートした。3時間後、4μLのこの調製物を、未処理の試料を対照として含めて3%アガロースゲルで解析した。 D(右パネル):次に、siRNA精製カラムを介して試料を精製してRNaseを除去し、3μLのこの調製物をPDCにトランスフェクトした。36時間後、IFN−α産生をELISAによって評価した。2つの代表的な実験の一方からのデータを示す。
【図2E】siRNAによるプラズマサイトイド樹状細胞におけるIFN−αの配列依存性誘導は、一本鎖レベルでのモチーフ認識に基づいていることを示す図。 PDC(50.000/ウェル)を、リポフェクタミン(0.5μL)を用いて種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 E:siRNA二本鎖9.2を自己安定化する一本鎖ヘアピン型としたもの(表2を参照)を、siRNA9.2二本鎖と比較したもの。2つの独立した実験からのデータを平均±SEMで表している。
【図3】RNA9.2センス鎖3’末端の9塩基の配列が、免疫刺激活性に関与していることを示す図。 PDCを種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 A:TLR9.2のセンス鎖(RNA9.2s、元の配列については「n」で示す)およびRNA9.2sにフルオレセインタグを付加したもの(5’Fまたは3’F)でPDCをトランスフェクトした。*はp<0.05を示す。 B:TLR9.2のセンス鎖、19量体ポリAオリゴヌクレオチド、5’末端から数えて塩基番号8〜12がアデノシンに置換された一連のRNA9.2s(L8A〜L12A)、3’末端から数えて9塩基対(推定モチーフ)以内にある1つ、2つ、3つまたは6つの塩基が(推定9量体モチーフに混乱をきたすために)アデノシンまたはウリジンで置換された一連のRNA9.2s誘導体、または2つのRNA9.2s短縮物(いずれもRNA9.2sの3’末端の推定9量体モチーフを含む16量体または12量体)ならびに配列内に推定9量体モチーフを2回含む19量体RNAオリゴヌクレオチド(DR)でPDCをトランスフェクトした。使用したすべての配列の詳細については表2に示す。4名の個別ドナーからの結果を平均値±SEMとして示す。
【図4】siRNATLR9.2のセンス鎖およびアンチセンス鎖のLNA修飾から、siRNAのIFN−α誘導およびサイレンシングが2つの独立した活性であることが明らかになったことを示す図。 PDCを種々のRNAオリゴヌクレオチドでトランスフェクトした。36時間後、上清中のIFN−α産生を測定した。 A:TLR9.2のセンス鎖(RNA9.2s)とその5’末端および3’末端にLNA修飾を有する、または有しない誘導体(n、5’LNA、3’LNA、5’3’LNA)を比較したもの(表2を参照)。 B:siRNA9.2のセンスおよびアンチセンス鎖を様々にLNA修飾したものを二本鎖にアニールし、PDCにトランスフェクトした。36時間後、上清中のIFN−α産生を測定した(黒色バー)。5名の個別ドナーからの結果を平均値±SEMで示す。さらに、C末端YFPタグを有するヒトTLR9の構築物を安定に発現しているHEK293細胞を、同じタイプのsiRNA9.2誘導体でトランスフェクトした。GFP、TLR2またはTLR4のmRNAを標的とするsiRNA二本鎖によるトランスフェクションを対照とした。トランスフェクションから20時間後、YFPタグ発現の平均蛍光強度をフローサイトメトリーによって解析した(白抜きバー)。データは、siRNA2.1を100%、非修飾siRNA9.2を0%としたときのTLR9発現の割合(%)で示している。結果は、平均値±SEM(n=3)で示されている。
【図5A】マウスin vivoにおけるsiRNAによる全身免疫応答の配列依存性誘導を示す図。 A:マウス骨髄培養物(129Sv)を、siRNA TLR9.2の二本鎖、センス鎖もしくはアンチセンス鎖または19量体ポリ(A)オリゴヌクレオチドをポリカチオン性ペプチドと複合化したもので刺激した。ODN1826(6μg/mL)およびR848(1H−イミダゾ(4,5−c)キノリン−1−エタノール(エトキシメチル)−α;0.5μg/mL)を陽性対照とした。36時間後、上清を回収し、IFN−α産生をELISAによって評価した。データは、マウス3個体の骨髄培養物をプールしたものの3連実験の平均値±SEMとして示す。
【図5B】マウスin vivoにおけるsiRNAによる全身免疫応答の配列依存性誘導を示す図。 B:5μgのsiRNA TLR2.1、TLR9.2、または一本鎖TLR9.2a(センス鎖)またはTLR9.2as(アンチセンス鎖)をDOTAPと複合体化し、静脈注射によって129Svマウス(1群につき3個体)に投与した。RNAを含まないDOTAPを対照として含めた。7時間後、血清を回収し、IFN−α産生をELISAによって評価した。データは平均値±SEMとして示す。
【図5C】マウスin vivoにおけるsiRNAによる全身免疫応答の配列依存性誘導を示す図。 C:注射から41時間後、脾臓細胞を単離し、抗CD3、抗CD8、抗CD11bおよび抗CD11c抗体を用いて、脾臓細胞中のCD8+T細胞およびMDCを同定した。CD69またはCD86発現を、適当なアイソタイプの対照抗体を用いて評定した。1群につき3個体のマウスからの結果を平均値±SEMとして示す。
【図5D】マウスin vivoにおけるsiRNAによる全身免疫応答の配列依存性誘導を示す図。 D:DOTAPと複合化した、または複合体化していないsiRNA TLR9.2、CpG ODN1826(いずれも5μg)またはHBSを、静脈注射によって129P2/OlaHsdマウス(1群につき3個体)に投与した。18時間後、血清を回収し、IFN−α産生をELISAによって評価した(左パネル)。さらに、注射から41時間後に、脾臓MDC上でのCD86発現を分析した(右パネル)。データは平均値±SEMとして示す。
【図6A】siRNA認識にはTLR7が必要であることを示す図。 A:野生型(黒色バー)またはTLR7−/−(白抜きバー)のC57BL/6マウスからの骨髄培養物を、siRNA TLR9.2とともに、TLR9.2のセンス鎖またはアンチセンス鎖とともに、またはポリカチオン性ペプチドと複合化した19量体ポリ(A)オリゴヌクレオチドとともにインキュベートした。CpG ODN1826(TLR9)およびロキソリビン(TLR7)をそれぞれ6μg/mLまたは0.5μg/mLの濃度で使用した。刺激から36時間後、上清を回収し、IFN−α産生をELISAによって評定した。データは、2個体のマウスからプールした骨髄培養物の3連実験の平均値±SEMとして示す。
【図6B】siRNA認識にはTLR7が必要であることを示す図。 B:5μgのsiRNA TLR9.2をDOTAPと複合体化し、野生型(黒色バー)またはTLR7−/−(白抜きバー)のC57BL/6マウスのいずれかに静脈注射した。1群につき2匹のマウスを用いた。7および18時間後、血清を回収し、IFN−α産生をELISAによって評定した。
【図6C】siRNA認識にはTLR7が必要であることを示す図。 C:注射から41時間後、脾臓細胞を単離した。抗CD3および抗CD8抗体を用いることにより、脾臓細胞中のCD8+およびCD4+T細胞を同定した。適当なアイソタイプの対照抗体を用いてCD69発現を評定した(灰色バー)。CD8+T細胞に対する1つの代表的なヒストグラムを示す。PDC(CD11c+,CD11b−およびB220++)および骨髄樹状細胞(MDC:CD11c++,CD11b++およびB220−)上でのCD69またはCD86の発現を分析した。CD69およびCD86の発現は平均値±SEMとして示されている。
【発明を実施するための形態】
【0028】
本発明は少なくとも部分的には、一本鎖または二本鎖RNA分子内の特定の配列モチーフが、とりわけTLR7を発現している細胞、たとえばプラズマサイトイド樹状細胞(PDC)などにおいて、IFN誘導を介した免疫応答を刺激するのに有効であるという発見に基づくものである。この発見に基づいて、本発明は、哺乳類においてIFN産生を刺激するために用いることのできる免疫刺激性オリゴヌクレオチド剤、ならびに一本鎖アンチセンス剤および二本鎖iRNA剤を選択的に設計して、所望の免疫応答を誘導するか、不要な免疫応答の誘導を回避するようにする方法も提供する。
【0029】
具体的には、本発明は、免疫刺激剤として一本鎖または二本鎖オリゴヌクレオチドを含む治療用組成物、ならびに、かかる組成物を免疫治療用途に用いる方法を提供する。本発明は具体的には、限定はされないが、成人および小児ならびに家畜への適用における、がん、自己免疫疾患、ぜんそく、呼吸アレルギー、食品アレルギー、および、細菌、寄生虫およびウィルス感染の治療などの免疫治療用途に用いられる免疫応答を強化するための方法および組成物を提供する。本発明はさらに、そのような化合物の製造方法をさらに提供する。さらに、本発明の化合物は、DNAワクチン、抗体、およびアレルゲンと組み合わせるアジュバントとして、および他の免疫刺激剤、化学療法剤、iRNA剤および/またはアンチセンスオリゴヌクレオチドと組み合わせるアジュバントとしても有用である。
【0030】
本発明は、ヌクレオチド配列
5’−GUCCUUCAA−3’(配列番号:1)
を含むか、該配列で構成されるか、または、本質的に該配列で構成されるオリゴヌクレオチド剤を提供する。
【0031】
他の実施形態において、オリゴヌクレオチド剤は、配列番号:1由来の、好ましくは当該配列の5’末端から、4以上、5以上、6以上、7以上または8以上の連続したヌクレオチドの配列、たとえば、5’−GUCC−3’(配列番号:2)、5’−GUCCU−3’(配列番号:3)、5’−GUCCUU−3’(配列番号:4)、5’−GUCCUUC−3’(配列番号:5)、または5’−GUCCUUCA−3’(配列番号:6)を含むか、該配列で構成されるか、または、本質的に該配列で構成される。
【0032】
本明細書において、オリゴヌクレオチド剤は、同剤において他のヌクレオチドを含まない場合には、配列番号:1で構成されると表現する。本明細書において、オリゴヌクレオチド剤は、1、2、3または4以下の他のヌクレオチドしか同剤に含まない場合には、本質的に配列番号:1で構成されると表現する。本明細書において、オリゴヌクレオチド剤は、同剤に他のヌクレオチドを含む場合には、配列番号:1を含むと表現する。好ましくは、このような剤は、同剤が二本鎖構造からならない場合には、21以下の他のヌクレオチド、より好ましくは約15〜約10以下の他のヌクレオチドしか該剤に含まない。二本鎖構造を含むオリゴヌクレオチド剤、たとえばiRNA剤は、配列番号:1を含む鎖の中に、21、15または10以下の他のヌクレオチドを含み、好ましくは、配列番号:1を含まない方の鎖の中に、30、24または19以下のヌクレオチドを含む。
【0033】
本明細書において、「オリゴヌクレオチド」という用語は、複数の連結されたヌクレオシド単位で形成されるポリヌクレオチドのことをいう。このようなオリゴヌクレオチドは、ゲノムDNAまたはcDNAを含む既存の核酸供給源から得ることができるが、好ましくは合成法によって作成される。好ましい実施形態において、各ヌクレオシド単位は、複素環塩基と、ペントフラノシル、トレハロース、アラビノース、2’−デオキシ−2’−置換アラビノース、2’−O−置換アラビノースまたはヘキソース糖基とを含む。ヌクレオシド残基は、任意の様々な既知のヌクレオシド間結合によって互いに連結することができる。そのようなヌクレオシド間結合としては、限定はされないが、ホスホジエステル、ホスホロチオエート、ホスホロジチオエート、アルキルホスホネート、アルキルホスホノチオエート、ホスホトリエステル、ホスホラミデート、シロキサン、カーボネート、カルボアルコキシ、アセトアミデート、カルバメート、モルホリノ、ボラノ、チオエーテル、架橋ホスホラミデート、架橋メチレンホスホネート、架橋ホスホロチオエート、およびスルフォンヌクレオシド間結合が挙げられる。「オリゴヌクレオチド」という用語は、1つ以上の立体特異的ヌクレオシド間結合(たとえば、(Rp)−または(Sp)−ホスホロチオエート、アルキルホスホネート、またはホスホトリエステル結合)を有するポリヌクレオシドも包含する。
【0034】
本発明のオリゴヌクレオチドは、配列番号:1を含むか、配列番号:1で構成されるか、または、本質的に配列番号:1で構成されるのであれば、天然のヌクレオシド、修飾ヌクレオシドまたはその混合物を含んでいてもよい。本明細書において、「修飾ヌクレオシド」とは、修飾複素環塩基、修飾糖部分、またはその組み合わせを含むヌクレオシドのことである。いくつかの実施形態において、修飾ヌクレオシドは、本明細書に記載するように、非天然のピリミジンまたはプリンヌクレオシドである。いくつかの実施形態において、修飾ヌクレオシドは、2’−置換リボヌクレオシド、アラビノヌクレオシドまたは2’−デオキシ−2’−置換−アラビノシドである。
【0035】
本明細書において、「2’−置換リボヌクレオシド」または「2’−置換アラビノシド」という用語には、ペントース部分の2’位のヒドロキシル基が置換されて、2’−置換または2’−O−置換リボヌクレオシドが生じた、リボヌクレオシドまたはアラビノヌクレオシドが含まれる。好ましくは、このような置換は1〜6個の飽和または不飽和炭素原子を含む低級アルキル基による置換、または6〜10個の炭素原子を有したアリール基による置換であり、このようなアルキルまたはアリール基は、非置換のものであってもよいし、たとえばハロ、ヒドロキシ、トリフルオロメチル、シアノ、ニトロ、アシル、アシルオキシ、アルコキシ、カルボキシル、カルボアルコキシ、またはアミノ基などによって置換されていてもよい。2’−O−置換リボヌクレオシドまたは2’−O−置換−アラビノシドの例としては、限定はされないが、たとえば、2’−O−メチルリボヌクレオシドまたは2’−O−メチルアラビノシドおよび2’−O−メトキシエチルリボヌクレオシド、または2’−O−メトキシエチルアラビノシドが挙げられる。
【0036】
「2’−置換リボヌクレオシド」または「2’−置換アラビノシド」という用語は、2’−ヒドロキシル基が1〜6個の飽和または不飽和炭素原子を含む低級アルキル基によって、あるいはアミノまたはハロ基によって置換されている、リボヌクレオシドまたはアラビノヌクレオシドも含む。このような2’−置換リボヌクレオシドまたは2’−置換アラビノシドの例としては、限定はされないが、たとえば、2’−アミノ、2’−フルオロ、2’−アリル、および2’−プロパルギルリボヌクレオシドまたはアラビノシドが挙げられる。
【0037】
「オリゴヌクレオチド」という用語には、ハイブリッドおよびキメラオリゴヌクレオチドも含まれる。「キメラオリゴヌクレオチド」とは、2種以上のヌクレオシド間結合を有するオリゴヌクレオチドのことである。キメラオリゴヌクレオチドの1つの好ましい実施形態は、ホスホロチオエート、ホスホジエステルまたはホスホロジチオエート領域と、アルキルホスホネートまたはアルキルホスホノチオエート結合などの非イオン結合とを含むキメラオリゴヌクレオチドである(たとえば、ペダーソン(Pederson)らの米国特許第5,635,377号および同第5,366,878号明細書を参照のこと)。
【0038】
「ハイブリッドオリゴヌクレオチド」は、2種以上のヌクレオシドを有するオリゴヌクレオチドである。このようなハイブリッドオリゴヌクレオチドの1つの好ましい実施形態は、リボヌクレオチドまたは2’−置換リボヌクレオチド領域と、デオキシリボヌクレオチド領域とを含む(たとえば、メテレフ(Metelev)およびアグラバル(Agrawal)の米国特許第5,652,355号、同第6,346,614号および同第6,143,881号を参照のこと)。
【0039】
本明細書における「免疫刺激」剤、または「免疫応答を刺激する」剤とは、細胞内でin vitroにて、または生物体内でin vivoにて、生物病原体に対する天然の防御の一部であると一般的に理解されている反応、たとえば免疫系を刺激する剤のことをいう。このような反応としては、限定はされないが、たとえば、抗体またはサイトカイン、たとえばインターフェロン、たとえばインターフェロンα(IFN−α)の産生が挙げられる。
【0040】
別の実施形態において、本発明は、たとえば、上記の免疫調節性オリゴヌクレオチドまたはオリゴヌクレオチド剤と、該オリゴヌクレオチド剤の利用可能な5’末端以外の位置に連結された抗原とを含んでなる、免疫調節性オリゴヌクレオチド複合体およびオリゴヌクレオチド剤複合体を提供する。いくつかの実施形態において、非ヌクレオチドリンカーは、オリゴヌクレオチドに連結された抗原を含む。いくつかの他の実施形態において、抗原は、オリゴヌクレオチドの3’末端以外の位置に連結される。いくつかの実施形態において、抗原は、ワクチン効果を生じる。他のオリゴヌクレオチド剤複合体については以下にさらに説明する。
【0041】
オリゴヌクレオチド剤が抗原と複合体化される場合には、抗原は好ましくは、病原体に関連する抗原、がんに関連する抗原、自己免疫疾患に関連する抗原、および、限定はされないがたとえば家畜の疾患または小児疾患などの他の疾患に関連する抗原からなる群より選択される。本明細書において、「と関連する」という用語は、その抗原が当該病原体、がん、自己免疫疾患、食品アレルギー、呼吸器系アレルギー、ぜんそく、または他の疾患が存在するときには存在するが、当該病原体、がん、自己免疫疾患、食品アレルギー、呼吸器系アレルギー、ぜんそく、または他の疾患が存在しないときには存在しないか、少ない量でしか存在しないことを意味する。
【0042】
免疫調節性オリゴヌクレオチドまたはオリゴヌクレオチド剤は抗原に共有結合されてい
るか、いずれにせよ抗原に機能的に結合されている。本明細書において「機能的に結合されている」という場合、オリゴヌクレオチド剤と抗原の両方の活性を維持するあらゆる結合をさす。このような機能的な結合の非限定的な例としては、同一のリポソームその他の同様の輸送ビヒクルまたは薬剤の一部であることが含まれる。オリゴヌクレオチド剤が抗原と共有結合している実施形態において、このような共有結合は、免疫調節性オリゴヌクレオチドの利用可能な5’末端以外のオリゴヌクレオチド剤上の任意の位置にあるのが好ましい。たとえば、抗原は、ヌクレオシド間結合に付加してもよいし、非ヌクレオチドリンカーに付加してもよい。あるいは、抗原自体が非ヌクレオチドリンカーであってもよい。
【0043】
ある好ましい実施形態において、オリゴヌクレオチドまたはオリゴヌクレオチド剤はiRNA剤、たとえばアンチセンス剤またはsiRNA剤である。その意味で、本明細書において用いるオリゴヌクレオチドまたはオリゴヌクレオチド剤は、たとえばヒトなどの哺乳類の血清中において、または哺乳類、特にヒトの細胞の細胞質においてみられるようなある条件下で互いにハイブリダイズするなどの直接結合によってのみ本質的に生じる、2以上、好ましくは2つのオリゴヌクレオチド分子で構成される複合体をも意味する。以後、オリゴヌクレオチド剤であるためには、該複合体を形成する2以上の該オリゴヌクレオチド分子のうちの少なくとも1つが、配列番号:1を含むか、該配列で構成されるか、または、本質的に該配列で構成される。
【0044】
本明細書中で用いるiRNA剤とは、アンチセンス剤またはsiRNA剤などの、標的遺伝子の発現を特異的に妨害することのできる剤のことである。典型的には、iRNA剤は、標的遺伝子によってコードされるmRNAの一部と相補的なオリゴヌクレオチド配列を含む。該iRNA剤は、任意のメカニズム、たとえば、mRNAの翻訳をブロックしたり、たとえばRNA干渉のメカニズムを介してmRNAの分解を開始させたり、またはたとえばDNAメチル化を介して遺伝子の転写をブロックすることによって、標的遺伝子の発現を妨害する。
【0045】
iRNA剤の設計
本発明はさらに、アンチセンス剤またはsiRNA剤などのiRNA剤を、炎症反応を誘導するか、炎症反応の誘導を回避するように、設計/選択する方法も提供する。具体的には、本方法は、IFN/炎症反応が望まれる場合には、配列番号:1、またはその断片をアンチセンス剤またはsiRNA剤などのオリゴヌクレオチド剤に含める工程を含み、あるいは炎症反応が望まれない場合には、上記配列を剤の中に含めない工程を含む。
【0046】
したがって、本発明は、とりわけ、少なくとも15、16、17、18、19、20、21または23ヌクレオチドの配列を含む、アンチセンス鎖と、任意選択でセンス鎖とを含むiRNA剤を提供し、IFN産生が望まれる場合には、アンチセンスおよび任意選択のセンス鎖の配列のうちの少なくとも一方は配列番号:1からなり、IFN産生を避ける場合には、アンチセンス鎖と任意選択のセンス鎖のいずれも上記配列を含まない。
【0047】
iRNA剤のアンチセンス鎖は、15、16、17、18、19、25、29、40または50ヌクレオチド以上の長さを有するものとする。また、50、40または30ヌクレオチド以下の長さのものとする。好ましい範囲は、長さが15〜30、17〜25、19〜23および19〜21ヌクレオチドである。
【0048】
iRNA剤のセンス鎖がある場合には、該センス鎖は、15、16、17、18、19、25、29、40または50ヌクレオチド以上の長さを有するものとする。また、50、40または30ヌクレオチド以下の長さのものとする。好ましい範囲は、長さが15〜30、17〜25、19〜23および19〜21ヌクレオチドである。
【0049】
iRNA剤に二本鎖部分がある場合、該二本鎖部分は、15、16、17、18、19、20、21、22、23、24、25、29、40または50以上のヌクレオチド対の長さを有するものとする。その長さは50、40または30ヌクレオチド対以下でなければならない。好ましい範囲は、15〜30、17〜25、19〜23、および19〜21ヌクレオチド対の長さである。
【0050】
本発明によるiRNA剤を設計する際には、最初に、配列番号:1からの4以上、5以上、6以上、7以上、または8以上の連続ヌクレオチドと相補的(アンチセンスオリゴヌクレオチドおよびsiRNAアンチセンス鎖において用いるため)または同一(siRNAセンス鎖において用いるため)である標的遺伝子のmRNA配列中の領域を同定することが有益である。次いでiRNA剤を、この領域に相補的または同一の配列と、標的遺伝子発現阻害活性を与えるようにいくつかの適切な追加のヌクレオチドとを含むように選ぶことができる。ここで配列番号:1は、iRNA剤内のたとえば3’または5’末端領域などのどこの場所に含まれていてもよく、または、iRNA剤のセンス鎖またはアンチセンス鎖のいずれかのどこの場所に含まれていてもよい。
【0051】
しかしながら、そのmRNAが配列番号:1と完全に相補的または同一の領域を含まない特定の遺伝子を阻害することが望まれる場合には、標的遺伝子mRNAに対するミスマッチを含むiRNA剤を用いてもよい。ミスマッチは、たとえばsiRNAのいずれかの鎖の末端領域において最も許容されうるため、ミスマッチはこれらの末端領域に導入するのが最もよい。たとえば、siRNAのセンス鎖の最も3’末端側または最も5’末端側の4,5,6,7,8または9ヌクレオチド、またはアンチセンス鎖の最も3’末端側の4,5,6,7,8または9ヌクレオチドを配列番号:1から選んでもよく、この場合、1以下、2以下、または3以下のヌクレオチドが標的mRNAに対してミスマッチを示し、残りのヌクレオチドは、標的mRNAに対して完全に一致するか相補的になるように選ばれる。しかしながら、アンチセンス鎖の(5’から3’に向けて数えて)2〜9位にあるヌクレオチドは、標的mRNAの認識にとって重要であると考えられている(ヘイリー、ビー(Haley,B.),およびザモア、ピーディー(Zamore,P.D.),Nat Struct Mol Biol,11,599〜606(2004))。したがって、この領域(「シード領域」ともよばれることもある)では、標的mRNAとの完全な相補配列が存在することが好ましい。
【0052】
このような実施形態において、前記標的遺伝子は本質的に、上述のような完全に一致した、または部分的にミスマッチのあるiRNA剤の設計を可能にする任意の遺伝子配列であってよい。この遺伝子は、たとえば、ヒト遺伝子など、哺乳類の遺伝子であってよい。たとえば、限定するものではないが、このような遺伝子は、オンコジーン、免疫応答に関与する遺伝子、代謝に関与する遺伝子、または成長因子、転写因子、もしくは受容体をコードする遺伝子であってよい。表7は、ヒトmRNA配列データベースのBLAST検索によって得られた、配列番号:1と同一または相補的な配列を含むことからこの様式で阻害可能な例示的な遺伝子転写物の名前を示した非限定的なリストを含む。あるいは、標的遺伝子は、動物、好ましくは哺乳類、より好ましくはヒトに対して病原性のある生物、たとえば細菌またはウィルスに由来するものであってもよい。
【0053】
iRNA剤化学
本明細書で検討するiRNA剤には、非修飾RNAとともに、たとえば効力を高めるために修飾されたRNAや、ヌクレオシド代用物のポリマーも含まれる。非修飾RNAは、核酸の成分、すなわち、糖、塩基、およびリン酸部分が、天然に生じるものと、好ましくはヒトの体において天然に生じるものと同じまたは実質的に同じ分子のことをいう。従来技術では、希少または特殊であるが天然に発生するRNAを修飾RNAと呼んできた。た
とえば、リンバッハ(Limbach)ら.,(1994)Nucleic Acids
Res.22:2183〜2196を参照のこと。修飾RNAと呼ばれることも多いこのような希少または特殊なRNA(明らかにこれらは典型的に転写後修飾の結果によるものである)は、本明細書中では非修飾RNAの用語の範囲内であるとする。本明細書中で用いる修飾RNAとは、核酸の成分、すなわち、糖、塩基、およびリン酸部分のうちの1つまたはそれ以上が、天然に生じるものとは異なる、好ましくはヒトの体内で生じるものとは異なる分子のことをいう。それらは、修飾「RNA」と呼ばれるが、勿論、修飾のためにもはやRNAではない分子をも含む。ヌクレオシド代用物は、リボホスフェート骨格が非リボホスフェート構築物に置き換わっている分子であり、該構築物は、ハイブリダイゼーションがリボホスフェート骨格、たとえば非荷電のリボホスフェート骨格類似物の場合に見られるものとほぼ同じとなるように、塩基を正しい空間的関係に存在できるようにする。上記のそれぞれの例について下記で検討する。
【0054】
ヌクレアーゼ耐性の増強
ヌクレアーゼ耐性および/または標的mRNAへの結合親和性を高めるために、オリゴヌクレオチド剤は、たとえば、2’修飾リボース単位および/またはホスホロチオエート結合を含んでいてもよく、たとえば2’ヒドロキシル基(OH)を、複数の異なる「オキシ」または「デオキシ」置換基で修飾または置換してもよい。
【0055】
「オキシ」−2’ヒドロキシル基修飾の例としては、アルコキシまたはアリールオキシ(OR、たとえば、R=H,アルキル、シクロアルキル、アリール、アラルキル、ヘテロアリールまたは糖);ポリエチレングリコール(PEG)、O(CH2CH2O)nCH2CH2OR;2’ヒドロキシが、たとえばメチレン架橋によって、同じリボース糖の4’炭素に複合化した「ロックト」核酸(LNA);O−AMINEおよびアミノアルコキシ、O(CH2)nAMlNE、(たとえば、AMINE=NH2;アルキルアミノ、ジアルキルアミノ、ヘテロサイクリルアミノ、アリールアミノ、ジアリールアミノ、ヘテロアリールアミノ、またはジヘテロアリールアミノ、エチレンジアミン、ポリアミノ)が挙げられる。注目すべきは、メトキシエチル基(MOE)(OCH2CH2OCH3、PEG誘導体)のみを含むオリゴヌクレオチドは、堅牢なホスホロチオエート修飾によって修飾されたものに匹敵するヌクレアーゼ安定性を示す。
【0056】
「デオキシ」修飾は、水素(すなわち、部分的に二本鎖のRNAの突出部分に特に関係のあるデオキシリボース糖);ハロ(たとえば、フルオロ);アミノ(たとえば、NH2;アルキルアミノ、ジアルキルアミノ、ヘテロサイクリル、アリールアミノ、ジアリールアミノ、ヘテロアリールアミノ、ジヘテロアリールアミノ、またはアミノ酸);NH(CH2CH2NH)nCH2CH2−AMINE(AMINE=NH2;アルキルアミノ、ジアルキルアミノ、ヘテロサイクリルアミノ、アリールアミノ、ジアリールアミノ、ヘテロアリールアミノ、またはジヘテロアリールアミノ)、−NHC(O)R(R=アルキル、シクロアルキル、アリール、アラルキル、ヘテロアリールまたは糖)、シアノ;メルカプト;アルキル−チオ−アルキル;チオアルコキシ;および任意選択でたとえばアミノ官能性に置換されていてもよいアルキル、シクロアルキル、アリール、アルケニル、およびアルキニルを含む。
【0057】
好ましい置換基は、2’−メトキシエチル、2’−OCH3、2’−O−アリル、2’−C−アリル、および2’−フルオロである。
ヌクレアーゼ耐性を最大化するために、2’修飾を、1つまたはそれ以上のホスフェートリンカー修飾(たとえば、ホスホロチオエート)と組み合わせて用いてもよい。
【0058】
オリゴヌクレオチド骨格内にフラノース糖を含めることによっても、エンドヌクレアーゼによる切断を低減することができる。オリゴヌクレオチド剤は、3’カチオン基を含め
ることによって、または3’末端のヌクレオシドを3’−3’結合で反転させることによって、さらに修飾することもできる。別の代替例において、3’末端を、アミノアルキル基、たとえば、3’C5−アミノアルキルdTでブロックすることもできる。他の3’複合体が、3’−5’エキソヌクレアーゼによる切断を阻害することもできる。理論に束縛されるものではないが、ナプロキセンまたはイブプロフェンなどの3’複合体は、エキソヌクレアーゼがオリゴヌクレオチドの3’末端に結合するのを立体的に阻害することにより、該エキソヌクレアーゼによる切断を阻害することができる。小さいアルキル鎖、アリール基、または複素環複合体または修飾糖(D−リボース、デオキシリボース、グルコースなど)も3’−5’エキソヌクレアーゼを阻害することができる。
【0059】
同様に、5’複合体は、5’−3’エキソヌクレアーゼによる切断を阻害することができる。理論に束縛されるものではないが、ナプロキセンまたはイブプロフェンなどの5’複合体は、エキソヌクレアーゼがオリゴヌクレオチドの5’末端に結合するのを立体的に阻害することにより、該エキソヌクレアーゼによる切断を阻害することができる。小さいアルキル鎖、アリール基、または複素環複合体または修飾糖(D−リボース、デオキシリボース、グルコースなど)も3’−5’エキソヌクレアーゼを阻害することができる。
【0060】
テザードリガンド
オリゴヌクレオチド剤の特性は、その薬理学的特性も含めて、リガンド、たとえばテザードリガンド(繋留リガンド)などの導入によって影響を与えたり、調整したりすることができる。テザードリガンドを含むオリゴヌクレオチド剤は、本明細書においては複合体または生物複合体ともよぶこともある。
【0061】
たとえばリガンドなどの幅広い実体をオリゴヌクレオチド剤に、たとえばリガンド複合化モノマーサブユニットの担体に繋留することができる。その例を、リガンド複合化モノマーサブユニットに関して下記に記載するが、これは好適な例にすぎず、実体をオリゴヌクレオチド剤の他の地点に連結することもできる。
【0062】
好ましい部分は、担体に、好ましくは共有結合によって、直接または間接的に介在テザーを介して連結されたリガンドである。好ましい実施形態において、リガンドは、介在テザーを介して担体に付加されている。リガンドまたはテザードリガンドは、リガンド複合化モノマーが成長中の鎖に組み込まれる場合には、リガンド複合化モノマー上に存在していてもよい。一部の実施形態では、「前駆体」リガンド複合化モノマーサブユニットを成長中の鎖に組み込んだ後に、リガンドを「前駆体」リガンド複合化モノマーサブユニットに組み込むとよい。たとえば、アミノ末端テザー、たとえばTAP−(CH2)nNH2を有するモノマーを、成長中のセンス鎖またはアンチセンス鎖に組み込むことができる。次の操作において、すなわち前駆体モノマーサブユニットを鎖に組み込んだ後に、続いて求電子基、たとえばペンタフルオロフェニルエステルまたはアルデヒド基を有するリガンドを、該リガンドの求電子基と前駆体リガンド複合化モノマーサブユニットテザーの求核基とを連結することによって、前駆体リガンド複合化モノマーに付加することができる。
【0063】
好ましい実施形態において、リガンドはそれが組み込まれるオリゴヌクレオチド剤の分布、標的または寿命を変える。好ましい実施形態において、リガンドは、選択された標的、たとえば分子、細胞または細胞種、コンパートメント、たとえば細胞または器官のコンパートメント、組織、器官、または体の部位に対して、たとえば当該リガンドが存在しないものと比べて高い親和性を提供する。
【0064】
好ましいリガンドは、輸送特性、ハイブリダイゼーション特性、および特異性を向上させることができ、得られる天然または修飾オリゴリボヌクレオチド、または、本明細書に記載のモノマーの任意の組み合わせを含む高分子、および/または天然または修飾リボヌ
クレオチドのヌクレアーゼ耐性を向上させることもできる。
【0065】
リガンドは一般的に、たとえば取り込みを高めるための治療用改質剤;たとえば分布をモニタするための診断用化合物またはレポーター基;架橋剤;ヌクレアーゼ耐性を付与する部分;および天然または通常のものとは異なる核酸塩基を含んでいてもよい。一般例としては、脂溶性分子、脂質、レクチン、ステロイド(たとえば、ウバオール、ヘシゲニン(hecigenin)、ジオスゲニン)、テルペン(たとえば、トリテルペン、たとえばサルササポゲニン、フリーデリン、エピフリーデラノール誘導化リトコール酸)、ビタミン、炭水化物(たとえば、デキストラン、プルラン、キチン、キトサン、イヌリン、シクロデキストリンまたはヒアルロン酸)、タンパク質、タンパク質結合物質、インテグリンを標的とする分子、ポリカチオン、ペプチド、ポリアミン、およびペプチド疑似物質が挙げられる。
【0066】
リガンドは、天然に存在する分子または組換えもしくは合成分子、たとえば、合成ポリマー、たとえば合成ポリアミノ酸であってよい。ポリアミノ酸の例としては、ポリリシン(PLL)、ポリL−アスパラギン酸、ポリL−グルタミン酸、スチレン−無水マレイン酸コポリマー、ポリ(L−ラクチド−コ−グリコライド)コポリマー、ジビニルエーテル−無水マレイン酸コポリマー、N−(2−ヒドロキシプロピル)メタクリルアミドコポリマー(HMPA)、ポリエチレングリコール(PEG)、ポリビニルアルコール(PVA)、ポリウレタン、ポリ(2−エチルアクリル酸)、N−イソプロピルアクリルアミドポリマー、またはポリホスファジンが挙げられる。ポリアミンの例としては、ポリエチレンイミン、ポリリシン(PLL)、スペルミン、スペルミジン、ポリアミン、疑似ペプチド−ポリアミン、ペプチド疑似物−ポリアミン、デンドリマーポリアミン、アルギニン、アミジン、プロタミン、カチオン部分、たとえば、カチオン脂質、カチオンプロフィリン、ポリアミンの第4級塩、またはαヘリックスペプチドが挙げられる。
【0067】
リガンドは、標的化基、たとえば、細胞または組織を標的とする物質、たとえば、チロトロピン、メラノトロピン、サーファクタントプロテインA、ムチン炭水化物、グリコシル化ポリアミノ酸、トランスフェリン、ビスホスフォネート、ポリグルタメート、ポリアルパルテート、またはRGDペプチドもしくはRGDペプチド疑似物を含んでいてもよい。
【0068】
リガンドは、タンパク質、たとえば糖タンパク質、リポタンパク質、例えば低密度リポタンパク質(LDL)、またはアルブミン、たとえばヒト血清アルブミン(HSA)、またはペプチド、たとえば、共リガンドに対する特異的親和性を有する分子、または抗体、たとえば、がん細胞、内皮細胞、もしくは骨細胞などの特定の細胞種に結合する抗体であってよい。リガンドは、ホルモンおよびホルモン受容体を含んでいてもよい。それらは、非ペプチド性のもの、たとえば補因子、多価ラクトース、多価ガラクトース、N−アセチル−ガラクトサミン、N−アセチル−グルコサミン、多価マンノース、または多価フコースを含んでいてもよい。リガンドは、たとえば、リポ多糖、p38MAPキナーゼの活性化剤、またはNF−κBの活性化剤であってもよい。
【0069】
リガンドは、物質、たとえば薬剤であって、たとえば細胞の細胞骨格を崩壊させることにより、たとえば、細胞の微小管、マイクロフィラメント、および/または中間径フィラメントを崩壊させることにより、細胞へのオリゴヌクレオチド剤の取り込みを高めることのできる薬剤であってもよい。この薬剤は、たとえば、タキソン、ビンクリスチン、ビンブラスチン、サイトカラシン、ノコダゾール、ジャプラキノリド(japlakinolide)、ラトランクリンA、ファロイジン、スウィンホライドA、インダノシン、またはミオセルビンなどであってよい。
【0070】
一実施形態において、リガンドは脂質または脂質系分子である。このような脂質または脂質系分子は、血清タンパク質、たとえば、ヒト血清アルブミン(HSA)に結合することが好ましい。HSA結合リガンドは、標的組織、たとえば肝臓実質細胞を含む肝臓組織への複合体の分布を可能にする。HSAに結合しうる他の分子もリガンドとして用いることができる。たとえば、ネプロキシンまたはアスピリンを用いることができる。脂質または脂質系リガンドは、(a)複合体の分解に対する耐性を増大させる、(b)標的細胞または標的膜への標的化または輸送を増大させる、および/または(c)たとえばHSAなどの血清タンパク質への結合を調節するために用いることができる。
【0071】
脂質系リガンドは、標的組織への複合体の結合を調節、たとえば制御するために用いることができる。たとえば、HSAに比較的強く結合する脂質または脂質系リガンドは、腎臓を標的としにくく、したがって、体から除去されにくい。HSAに比較的弱く結合する脂質または脂質系リガンドは、複合体の標的を腎臓とするために用いることができる。
【0072】
別の実施形態において、リガンドは、例えば増殖中の細胞などの標的細胞によって取り込まれる部分、例えばビタミンまたは栄養素である。これらは、悪性型または非悪性型のたとえばがん細胞などの望ましくない細胞増殖を特徴とする疾患を治療するために特に有用である。ビタミンの例としては、ビタミンA、E、およびKが挙げられる。他のビタミンの例としては、Bビタミン類、たとえば、葉酸、B12、リボフラビン、ビオチン、ピリドキサルまたはがん細胞によって取り込まれる他のビタミンまたは栄養素が挙げられる。
【0073】
別の実施形態において、リガンドは細胞透過剤であり、好ましくはヘリックス細胞透過剤である。好ましくは、同剤は両親媒性である。剤としては、たとえば、tatまたはアンテナペディアなどのペプチドが挙げられる。剤がペプチドであれば、ペプチジル疑似物、インバートマー、非ペプチドまたは疑似ペプチド結合、およびD−アミノ酸の使用も含めて修飾することができる。ヘリックス剤は、好ましくは脂溶性相および疎油性相を有する好ましくはαヘリックス剤である。
【0074】
好ましいリガンドは、本発明の剤に、細胞に結合する能力、好ましくは、問題の病状と最も関連する特定の種類の細胞に結合する能力を与える。たとえば、アシアロ糖タンパク質受容体(ASGPr)(ウー(Wu)およびウー(Wu)、1987,J.Biol.Chem.262,4429〜4432)は、幹細胞に独特のものであり、分枝状ガラクトース末端糖タンパク質、たとえばアシアロオロソムコイド(ASOR)と結合する。他の例では、葉酸受容体は多くのがん細胞において過剰発現される。このような糖タンパク質、合成糖複合体、または葉酸塩の受容体への結合は、オリゴサッカライド鎖の分枝の程度に強く依存する親和性で起こり、たとえば、トリアンテナ型構造は、バイアンテナ型またはモノアンテナ型鎖よりも大きな親和性で結合する(ベツィンガー(Baenziger)およびフィーテ(Fiete)、1980,Cell,22,611〜620;コノリー(Connolly)ら、1982,J.Biol.Chem.,257,939〜945)。リ(Lee)およびリ(Lee)、1987,Glycoconjugate
J.,4,317〜328では、この高い特異性を、ガラクトースに比べて高い受容体親和性を有するN−アセチル−D−ガラクトサミンを炭水化物部分として使用することによって得ている。この「クラスタリング効果」は、マンノシル末端糖タンパク質または糖複合体の結合および取り込みについても記載されている(ポンパイポム(Ponpipom)ら、1981,J.Med.Chem.,24,1388〜1395)。ガラクトース、ガラクトサミン、または葉酸塩に基づく複合体を用いて外来化合物を細胞膜を通して輸送することにより、たとえば、肝疾患、肝臓がん、または他のがんの治療に対するターゲッティド(標的を定めた)送達手法を提供することができる。生物複合体を用いることにより、治療に必要な治療用化合物の必要用量を低減することもできる。さらに、治療上
の生物利用性、薬力学、および薬物動態パラメータを、本発明の核酸生物複合体を使用することによって調節することができる。このような生物複合体の非限定的な例が、バルギース(Vargeese)らの米国特許出願番号第10/201,394号(2001年8月13日出願);およびマトゥーリック‐アダミック(Matulic−Adamic)らの米国特許出願番号第60/362,016号(2002年3月6日出願)に記載されている。
【0075】
5’リン酸修飾
他の実施形態において、オリゴヌクレオチド剤は、5’リン酸化されているか、または5’末端にホスホリルアナログを含む。アンチセンス鎖の5’リン酸修飾には、RISC媒介性遺伝子サイレンシングに適合するものが挙げられる。適切な修飾には、5’−モノホスフェート((HO)2(O)P−O−5’);5’二リン酸((HO)2(O)P−O−P(HO)(O)−O−5’);5’三リン酸((HO)2(O)P−O−(HO)(O)P−O−P(HO)(O)−O−5’);5’グアノシンキャップ(7−メチル化または非メチル化)(7m−G−O−5’−(HO)(O)P−O−(HO)(O)P−O−P(HO)(O)−O−5’);5’アデノシンキャップ(Appp)、および修飾または非修飾のヌクレオチドキャップ構造がある。他の適切な5’リン酸修飾は当業者に周知である。
【0076】
製剤
本明細書において記載するオリゴヌクレオチド剤は、対象への投与、好ましくは、限定はされないが静脈内、筋肉内、腹腔内、直腸、皮内、皮下、または、経皮投与などの、たとえば非経口または経口投与などの全身投与用として、または、組織、たとえば肺や鼻腔(呼吸組織)などへのたとえば吸入または経鼻投与、肝臓、腎臓、脾臓、脳、脊髄、目、皮膚、腸、粘膜、胎盤、または当該オリゴヌクレオチド剤の効果に対する好適な標的である他の任意の組織または器官への標的を定めた送達用として、製剤することができる。
【0077】
説明を容易にするために、本セクションにおける製剤、組成物、および方法は、主に非修飾オリゴヌクレオチド剤に関して説明する。しかしながら、これらの製剤、組成物、および方法は、他のオリゴヌクレオチド剤、たとえば修飾オリゴヌクレオチド剤を用いても実施することができ、そのような実施も本発明に含まれることは当然のことである。
【0078】
製剤されたオリゴヌクレオチド剤組成物は、様々な形態をとりうる。いくつかの例において、組成物は少なくとも部分的に結晶、均一な結晶および/または無水物(たとえば、水分が80,50,30,20または10%未満)である。別の例において、オリゴヌクレオチド剤は水性相にあり、たとえば、水を含む溶液状態であり、この形態が非経口投与には好ましい。
【0079】
水性相または結晶組成物は、輸送ビヒクル、たとえばリポソーム(特に水性相に対して)または粒子(たとえば、結晶組成物に対して適切であるような微粒子)内に組み込んでもよい。一般に、オリゴヌクレオチド剤組成物は、対象とする投与方法に適合するような様式で調合される。
【0080】
オリゴヌクレオチド剤製剤は、別の剤、たとえば別の治療剤または前記オリゴヌクレオチド剤を安定化させる剤、たとえば、オリゴヌクレオチド剤と複合体を形成するタンパク質と組み合わせて調合してもよい。さらに他の剤としては、キレート剤、たとえばEDTA(たとえば、Mg2+などの二価カチオンを除去するため)、塩、ヌクレアーゼ阻害剤(たとえば、RNAsinなどの広い特異性のヌクレアーゼ阻害剤)などが挙げられる。
【0081】
一実施形態において、オリゴヌクレオチド剤製剤は、別のオリゴヌクレオチド剤、たと
えば、標的遺伝子に関してRNAiを媒介することのできるsiRNA剤を含む。そのような用途では、本発明のオリゴヌクレオチド剤により、標的遺伝子は細胞内で崩壊するとともに、該細胞は刺激されてIFNを産生する。このような同時治療は、がんおよびウィルス感染などの疾患の治療において重要である。
【0082】
核酸分子の送達方法は、アクタール(Akhtar)ら、1992、Trends Cell Bio.,2,139;「アンチセンスオリゴヌクレオチド治療のための送達戦略(Delivery Strategies for Antisense Oligonucleotide Therapeutics)」、アクタール(Akhtar)編、1995、マウレル(Maurer)ら、1999、Mol.Membr.Biol.,16,129〜140;ホフランド(Hofland)およびヒュアン(Huang)、1999、Handb.Exp.Pharmacol.,137,165〜192;およびリ(Lee)ら,2000、ACS Symp.Ser.,752,184〜192に記載されており、これらのすべての文献は参照により本願に組み入れる。バイゲルマン(Beigelman)ら、米国特許第6,395,713号、およびサリバン(Sullivan)ら、国際公開公報第94/02595号パンフレットは、さらに、核酸分子のための一般的な送達方法を記載している。これらのプロトコールは、事実上あらゆる核酸分子の送達のために利用することができる。核酸分子は、限定はされないが、イオントフォレシスによるリポソームへのカプセル化、他のビヒクルたとえば生分解性ポリマー、ハイドロゲル、シクロデキストリン(たとえば、ゴンザレス(Gonzalez)ら、1999、Bioconjugate Chem.,10,1068〜1074;ワン(Wang)ら、国際公開公報第03/47518号および同第03/46185号パンフレット)、ポリ(乳酸−グリコール酸共重合体)(PLGA)およびPLCAミクロスフェア(たとえば、米国特許第6,447,796号、および米国特許出願公開番号第2002130430号を参照)、生分解性ナノカプセル、および生体接着性ミクロスフェアへの組み込みによって、またはタンパク様ベクター(オヘア(O’Hare)およびノーマンド(Normand)、国際公開公報第00/53722号パンフレット)によってなど、当業者に周知の様々な方法によって投与することができる。あるいは、核酸/ビヒクルの組み合わせは、直接注射によって、または注入ポンプを用いることによって局所的に送達される。本発明の核酸分子の直接注射は、皮下、筋肉内、皮内にかかわらず、標準的な針とシリンジの方法を用いて、またはコンリー(Conry)ら、1999、Clin.Cancer Res.,5,2330〜2337およびバリー(Barry)ら、国際公開公報第99/31262号パンフレットに記載されるような無針技術によって行うことができる。
【0083】
別の実施形態において、本発明の核酸分子は、ポリエチレンイミンおよびその誘導体、たとえば、ポリエチレンイミン−ポリエチレングリコール−N−アセチルガラクトサミン(PEI−PEG−GAL)やポリエチレンイミン−ポリエチレングリコール−トリ−N−アセチルガラクトサミン(PEI−PEG−トリGAL)誘導体とともに製剤化または複合体形成してもよい。一実施形態において、本発明の核酸分子は、参照によりその全体を本願に組み込む米国特許出願公開番号第20030077829号に記載されているように製剤する。
【0084】
一実施形態において、本発明のオリゴヌクレオチド剤は、参照により図面も含めたその全体を本願に組み込む米国特許出願公開番号第20010007666号に記載されるような膜破壊剤と複合化される。別の実施形態において、膜破壊剤およびオリゴヌクレオチド剤は、カチオン脂質またはヘルパー脂質分子、たとえば、参照により図面も含めたその全体を本願に組み込む米国特許第6,235,310号に記載されるような脂質とも複合化される。
【0085】
一実施形態において、本発明のオリゴヌクレオチド剤は、図面を含めた全体を参照により本願に組み込む米国特許出願公報番号2003077829号明細書および国際公開公報第00/03683号および同第02/087541号パンフレットに記載されるような送達系と複合化される。
【0086】
一実施形態において、本発明の核酸分子は、肺送達、たとえば、吸入装置もしくはネブライザーによって投与されるエアロゾルまたはスプレー乾燥製剤の吸入などによって、肺送達を介して投与され、核酸分子を迅速に関連する肺組織に局所的に取り込ませる。微粉化核酸組成物の呼吸用乾燥粒子を含む固体粒状組成物は、乾燥または凍結乾燥した核酸組成物を粉砕して、その微粉化組成物を、たとえば400メッシュスクリーンに通して、大きな凝集体を分割もしくは分離することによって調製することができる。本発明の核酸組成物を含む固体粒状組成物は、任意選択で、エアロゾルならびに他の治療用化合物の作成を容易にするためにはたらく分散剤を含んでいてもよい。適切な分散剤はラクトースであり、1対1の重量比などの任意の適切な比率で核酸化合物と混合することができる。
【0087】
本発明の核酸組成物を含む液体粒子のエアロゾルは、ネブライザーを用いるなど任意の手段によって発生させることができる(たとえば、米国特許第4,501,729号を参照)。ネブライザーは市販の装置であり、有効成分の溶液または懸濁液を、典型的には空気または酸素などの圧縮ガスを狭いベンチュリを通して加速するか、あるいは超音波攪拌によって、治療用エアロゾルミストに変えるものである。ネブライザーにおいて用いるのに適した製剤は、液体担体中に、有効成分を、製剤の40%(w/w)まで、好ましくは20%(w/w)未満の量で含む。担体は典型的には水または希釈水性アルコール溶液であり、好ましくはたとえば塩化ナトリウムまたは他の適切な塩などを加えることにより体液と等張にしたものである。任意選択の添加物としては、製剤が無菌的に調製されない場合には保存剤、たとえば、メチルヒドロキシベンゾエート、抗酸化剤、着香剤、揮発油、緩衝剤、および乳化剤、ならびに他の調合界面活性剤が挙げられる。有効組成物と界面活性剤とを含む固体粒子のエアロゾルも同様に、任意の固体粒状エアロゾル発生器を用いて発生させることができる。固体粒状治療薬を対象に投与するためのエアロゾル発生器は、上述のように吸入可能な粒子を発生し、所定量の治療組成物を含む一定体積のエアロゾルをヒトへの投与に適した速度で発生させる。固体粒状エアロゾル発生器の説明的な例として、吸入器がある。吸入による投与に適した製剤は、吸入器によって送達可能な細かく砕いた粉末を含む。吸入器において、粉末、たとえば、本明細書において記載する治療を行うのに有効な一定量の粉末は、典型的にはゼラチンまたはプラスチックからなるカプセルまたはカートリッジに含まれ、該カプセルまたはカートリッジはin situにおいて穿刺または開口され、吸入時に装置を通って吸引される空気によって、または手動ポンプによって、粉末が送達される。吸入器において用いられる粉末は、有効成分だけで構成されるか、有効成分と、適切な粉末希釈剤、たとえばラクトースと、任意選択の界面活性剤とからなる粉末混成物のいずれかである。有効成分は典型的には、製剤の0.1〜100(w/w)である。第2の説明的なエアロゾル発生器は、定量吸入器からなる。定量吸入器は、典型的には液化推進剤中に有効成分の懸濁物または溶液製剤を含む加圧エアロゾルディスペンサである。使用中にはこれらの装置は、定体積を送達するようにしたバルブを介して製剤を放出し、有効成分を含んだ微細粒状スプレーを発生する。適切な推進剤としては、ある種のクロロフルオロカーボン化合物、たとえば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、およびその混合物が挙げられる。製剤は、さらに、1つ以上の共溶媒、たとえば、エタノール、乳化剤および他の製剤界面活性剤、たとえばオレイン酸または三オレイン酸ソルビタン、抗酸化剤および適切な着香剤を含んでいてもよい。肺送達のための他の方法は、たとえば、米国特許出願番号第20040037780号、および米国特許第6,592,904号、同第6,582,728号、同第6,565,885号に記載されている。
【0088】
一実施形態において、本発明の核酸分子は、中枢神経系(CNS)または末梢神経系(PNS)に投与される。実験から、ニューロンによる核酸の有効なin vivoでの取り込みが証明された。神経細胞への核酸の局所投与の例として、ソマー(Sommer)ら、1998、Antisense Nuc.Acid Drug Dev.,8,75は、c−fosに対する15量体のホスホロチオエートアンチセンス核酸分子を、脳へのマイクロインジェクションによりラットに投与する研究について述べている。テトラメチルローダミン−イソチオシアネート(TRITC)またはフルオレセインイソチオシアネート(FITC)で標識されたアンチセンス分子は、注入後30分の間に専らニューロンによって取り込まれた。広範な細胞質染色および核染色がこれらの細胞において見られた。神経細胞への核酸の全身投与の例としては、エパ(Epa)ら、2000、Antisense Nuc.Acid Drug Dev.,10,469は、神経系に分化したPC12細胞においてp75ニューロトロピン受容体を標的とするためにβ−シクロデキストリン−アダマンタン−オリゴヌクレオチド複合体を使用した、マウスでのin vivo研究について述べている。2週間にわたる腹腔内投与に続いて、p75ニューロトロピン受容体アンチセンスの顕著な取り込みが、後根神経節(DRG)細胞において観察された。さらに、p75の際だった一貫したダウンレギュレーションが、DRGニューロンにおいて観察された。核酸の標的をニューロンに定めるためのさらなるアプローチが、ブローダス(Broaddus)ら、1998、J.Neurosurg.,88(4),734;カーレ(Karle)ら、1997、Eur.J.Pharmocol.,340(2/3),153;バナイ(Bannai)ら、1998、Brain Research,784(1,2),304;ラジャクマー(Rajakumar)ら、1997、Synapse,26(3),199;ウー‐ポン(Wu−pong)ら、1999、BioPharm,12(1),32;バナイ(Bannai)ら、1998、Brain Res.Protoc,3(1),83;シマトフ(Simantov)ら、1996、Neuroscience,74(1),39に記載されている。したがって、本発明の核酸分子は、CNSおよび/またはPNSにおいて細胞に送達され取り込まれやすい。
【0089】
CNSへの本発明の核酸分子の送達は、様々な異なる戦略によって提供される。使用しうるCNS送達に対する伝統的なアプローチとしては、限定はされないが、髄腔内および脳室内投与、カテーテルおよびポンプの移植、障害または損傷の部位における直接注入または潅流、脳動脈系への注入、または血液−脳関門の化学的または浸透性開口によるものが挙げられる。他のアプローチとしては、たとえば複合体および生分解性ポリマーの使用を介した、様々な輸送システムおよび担体システムの使用が挙げられる。さらに、たとえばカプリット(Kaplitt)らの米国特許第6,180,613号およびデビッドソン(Davidson)の国際公開公報第04/013280号パンフレットに記載されるような遺伝子治療アプローチを用いて、CNSにおいて核酸分子を発現させることができる。
【0090】
一実施形態において、本発明の送達系は、たとえば、水性または非水性ゲル、クリーム、多重エマルジョン、ミクロエマルジョン、リポソーム、軟膏、水性および非水性溶液、ローション、エアロゾル、ハイドロカーボン基剤および粉末を含み、また賦形剤、たとえば、可溶化剤、透過促進剤(たとえば、脂肪酸、脂肪酸エステル、脂肪アルコール、およびアミノ酸)、および親水性ポリマー(たとえば、ポリカルボフィルおよびポリビニルピロリドン)を含んでいてもよい。一実施形態において、薬学的に許容される担体はリポソームまたは経皮増強剤である。本発明において使用しうるリポソームの例は次の通り、すなわち(1)CellFectin(R)、カチオン脂質N,NI,NII,NIII−テトラメチル−N,NI,NII,NIII−−テトラパルミット−y−スペルミンおよびジオレオイルホスファチジルエタノールアミン(DOPE)の1:1.5(M/M)リポソーム製剤(ギブコ・ビーアールエル(GIBCO BRL));(2)Cytofe
ctin GSV(R)、カチオン脂質およびDOPEの2:1(M/M)リポソーム製剤(グレン・リサーチ(Glen Research));(3)DOTAP(N−[1−(2,3−ジオレオイルオキシ)−N,N,N−トリメチルアンモニウムメチルスルフェート)(ベーリンガー・マンハイム(Boehringer Manheim));および(4)Lipofectamine(TM)、ポリカチオン脂質DOSPAおよび中性脂質DOPEの3:1(M/M)リポソーム製剤(ギブコ・ビーアールエル)。
【0091】
一実施形態において、本発明の送達系は、パッチ剤、錠剤、坐剤、腟坐薬、ゲル剤、およびクリーム剤を含み、可溶化剤および増強剤などの賦形剤(たとえば、ポリエチレングリコール、胆汁酸塩およびアミノ酸)、および他のビヒクル(たとえば、ポリエチレングリコール、脂肪酸エステルおよび誘導体、および親水性ポリマー、たとえばヒドロキシプロピルメチルセルロースおよびヒアルロン酸)を含有していてもよい。
【0092】
一実施形態において、本発明のオリゴヌクレオチド剤は、ポリエチレンイミン(たとえば、直鎖または分枝状PEI)および/またはポリエチレンイミン誘導体、たとえばガラクトースPEI、コレステロールPEI,抗体誘導化PEI、およびそれらのポリエチレングリコールPEI(PEG−PEI)誘導体などのグラフトPEIとともに製剤または複合体形成される(たとえば、参照により本願に組み込む以下の文献、すなわちオグリス(Ogris)ら,2001,AAPA PharmSci,3,1〜11;ファーガソン(Furgeson)ら,2003,Bioconjugate Chem.,14,840〜847;クナス(Kunath)ら,2002,Phramaceutical
Research,19,810〜817;チョイ(Choi)ら,2001,Bull.Korean Chem.Soc,22,46〜52;ベッティンガー(Bettinger)ら,1999,Bioconjugate Chem.,10,558〜561;ピーターソン(Peterson)ら,2002,Bioconjugate Chem.,13,845〜854;エルバシャー(Erbacher)ら,1999,Journal of Gene Medicine Preprint,1,1〜18;ゴドベイ(Godbey)ら,1999.,PNAS USA,96,5177〜5181;ゴドベイ(Godbey)ら,1999,Journal of Controlled Release,60,149〜160;ディーボルド(Diebold)ら,1999,Journal of Biological Chemistry,274,19087〜19094;トマス(Thomas)およびクリバノフ(Klibanov),2002,PNAS USA,99,14640〜14645;およびサガラ(Sagara),米国特許第6,586,524号を参照のこと)。
【0093】
したがって、本発明は、記載の化合物の薬学的に許容される製剤をも含む。これらの製剤は、上記化合物の塩、たとえば酸付加塩、たとえば、塩酸、シュウ酸、酢酸およびベンゼンスルホン酸の塩を含む。
【0094】
本発明は、ポリ(エチレングリコール)脂質を含む表面修飾リポソーム(PEG修飾、または長期循環リポソームまたはステルスリポソーム)を含む組成物も特徴とする。これらの製剤は、標的組織における薬物の蓄積を増加させるための方法も提供する。この部類の薬物担体は、オプソニン化および単核性食細胞系(MPSまたはRES)による排除に耐えることにより、より長い血液循環時間を可能にするとともに、カプセルに封入された薬物に対する組織の曝露を増強する(ラシック(Lasic)ら、Chem.Rev.1995,95,2601〜2627;イシワタ(Ishiwata)ら,Chem.Pharm.Bull.1995,43,1005〜1011)。このようなリポソームは、おそらくは血管新生が生じた標的組織における遊出と取り込みにより、腫瘍内に選択的に蓄積することが示されている(ラシック(Lasic)ら,Science 1995,267,1275〜1276;オク(Oku)ら,1995,Biochim.Biop
hys.Acta,1238,86〜90)。長期間循環リポソームは、特にMPSの組織内に蓄積することが知られている従来のカチオン性リポソームと比べて、DNAおよびRNAの薬物動態および薬力学を増強する。(リウ(Liu)ら,J.Biol.Chem.1995,42,24864〜24870;チョイ(Choi)ら,国際公開公報第96/10391号パンフレット;アンセル(Ansell)ら,国際公開公報第96/10390号パンフレット;ホランド(Holland)ら,国際公開公報第96/10392号パンフレット)。長期間循環リポソームは、代謝的に活発なMPS組織、たとえば肝臓や脾臓などにおける蓄積を回避できることから、カチオン性リポソームに比べて、薬物をヌクレアーゼ分解から大きく保護するようである。
【0095】
IFN産生を介した免疫応答の調節方法
本発明は、さらに、脊椎動物における免疫応答を調節するための方法を提供する。本方法は、脊椎動物に、本発明の免疫刺激性オリゴヌクレオチドを投与する工程を含む。
【0096】
本明細書において、用語「脊椎動物」には、限定はされないが、魚類、鳥類、または哺乳類が含まれる。本明細書において、「哺乳類」には、限定はされないが、ラット、マウス、ネコ、イヌ、ウマ、ウシ、乳牛、ブタ、ウサギ、ヒト以外の霊長類、およびヒトが含まれる。
【0097】
明細書において、「免疫応答を調節する」とは、B細胞誘導、T細胞誘導、サイトカイン誘導、ナチュラルキラー細胞誘導、特異的細胞表面マーカー発現、ケモカイン誘導および、たとえば樹状細胞、単球およびマクロファージなどの抗原提示細胞の活性化のうちの一つ以上の増大または活性化を引き起こすことを意味する。とりわけ、このような免疫応答には、PDCなどのTLR7タンパク質を発現する細胞におけるIFNの産生を伴う。
【0098】
本発明は、IFN産生を誘導することによって改善可能な疾患を有した脊椎動物の治療方法も提供する。本発明の本実施形態による方法は、脊椎動物に本発明のオリゴヌクレオチド剤、たとえば、配列番号:1で構成されるか、本質的に該配列で構成されるか、または該配列を含む剤を投与することを含む。そのような用途において、本発明のオリゴヌクレオチド剤は、脊椎動物におけるIFN産生を刺激して、その状態を直接治療するか、他の治療を増強するために用いられる。IFN産生の選択的活性化が望まれる場合には、よく認知された臨床設定が存在する。
【0099】
別の実施形態において、本発明は、疾患または疾病を有する患者を治療的に処置する方法も提供し、該方法は、患者に、本発明による免疫調節性オリゴヌクレオチド、免疫調節性オリゴヌクレオチド複合体、オリゴヌクレオチド剤またはオリゴヌクレオチド剤複合体を投与することを含む。様々な実施形態において、治療される疾患または疾病は、がん、自己免疫疾患、気道炎症、炎症性疾患、アレルギー、ぜんそく、または病原体によって引き起こされる疾病である。病原体としては、細菌、寄生虫、真菌、ウィルス、ウィロイド、およびプリオンが挙げられる。投与は本明細書中に別途記載してあるようにして実施する。
【0100】
本明細書において、「アレルギー」という用語には、限定はされないが、食品アレルギーと呼吸器系アレルギーとが含まれる。「気道炎症」という用語には、限定はされないが、ぜんそくが含まれる。
【0101】
本明細書において、「自己免疫疾患」という用語は、「自己」のタンパク質が免疫系によって攻撃を受ける疾患のことをいう。このような用語には、自己免疫ぜんそくが含まれる。
【0102】
本発明のいずれの方法においても、免疫調節性オリゴヌクレオチド、免疫調節性オリゴヌクレオチド複合体、オリゴヌクレオチド剤またはオリゴヌクレオチド剤複合体は、疾病または状態を治療するために有用な、該オリゴヌクレオチド剤の免疫刺激効果を減退させることのない他の任意の剤と組み合わせて投与してもよい。たとえば、がんの治療において、免疫調節性オリゴヌクレオチド、免疫調節性オリゴヌクレオチド複合体、オリゴヌクレオチド剤またはオリゴヌクレオチド剤複合体は、化学治療化合物と組み合わせて投与してもよいものとする。
【0103】
細胞の増殖性疾患および/または分化不全の例としては、がん、たとえば、癌腫、肉腫、転移性疾患、または造血系新生物疾患、たとえば白血病などが挙げられる。転移性腫瘍は、限定はされないが、前立腺、結腸、肺、乳房および肝臓を起源とするものを含む多数の原発性腫瘍から発生しうる。本明細書において、「がん」「過剰増殖性」および「新生物の」という用語は、自律的に増殖する能力を有する細胞のことをいい、すなわち、急速に増殖する細胞増殖によって特徴づけられる異常な状況または状態のことをいう。これらの用語は、組織病理学上のタイプまたは侵襲性のステージに関係なく、あらゆるタイプのがん性増殖または発がんプロセス、転移性組織または悪性形質転換細胞、組織、または器官を含むことを意味する。増殖性疾患は、たとえば、脊髄、リンパ球、または赤血球系統、またはそれらの前駆細胞から発生する、造血系起源の増生/新生細胞を伴う疾患を含む造血系新生物疾患も含む。
【0104】
本発明の薬学的組成物は、様々な造血系疾患を治療するために用いることができる。造血系の疾患または疾病の例としては、限定はされないが、自己免疫疾患(たとえば、糖尿病、関節炎(リウマチ性関節炎、若年性関節リウマチ、変形性関節症、乾癬性関節炎を含む)、多発性硬化症、脳脊髄炎、重症筋無力症、全身性紅斑性狼瘡、自己免疫甲状腺炎、皮膚炎(アトピー性皮膚炎および湿疹様皮膚炎を含む)、乾癬、シューグレン症候群、クローン病、アフター性潰瘍、虹彩炎、結膜炎、角結膜炎、潰瘍性大腸炎、ぜんそく、アレルギー性ぜんそく、皮膚エリテマトーデス、強皮症、膣炎、直腸炎、薬物発疹、ハンセン病逆転反応、らい性結節性紅斑、自己免疫性ブドウ膜炎、アレルギー性脳髄膜炎、急性壊死性出血性脳障害、突発性両側性進行性感音難聴、喪失、再生不良性貧血、赤芽球貧血、突発性血小板減少症、多発性軟骨炎、ヴェーゲナー肉芽腫症、慢性活動性肝炎、スティーブンス・ジョンソン症候群、突発性スプルー、扁平苔癬、グレーブス病、サルコイドーシス、原発性胆汁性肝硬変、後部ブドウ膜炎、および間質肺線維症)、移植片対宿主病、移植症例、およびアレルギーが挙げられる。
【0105】
別の実施形態において、本発明は、限定はされないが、C型肝炎、B型肝炎、単純ヘルペスウィルス(HSV),HΓV−AIDS、ポリオウィルス、および天然痘ウィルスを含むウィルス疾患を治療するための方法に関する。(+)鎖RNAウィルスの例としては、限定はされないが、ピコルナウィルス、カリシウィルス、ノダウィルス、コロナウィルス、アルテリウィルス、フラビウィルス、およびトガウィルスが挙げられる。ピコルナウィルスの例としては、エンテロウィルス(ポリオウィルス1)、リノウィルス(ヒトリノウィルス1A)、ヘパトウィルス(A型肝炎ウィルス)、カルディオウィルス(脳心筋炎ウィルス)、アフト・ウィルス属(口蹄疫ウィルスO)、およびパレコウィルス(ヒトエコウィルス22)が挙げられる。カリシウィルスの例としては、ベシクロウィルス(ブタ水疱性発疹ウィルス)、ラゴウィルス(ウサギ出血性疾患ウィルス)、「ノーウォーク様ウィルス」(ノーウォークウィルス)、「サッポロ様ウィルス」(サッポロウィルス)、および、「E型肝炎様ウィルス」(E型肝炎ウィルス)が挙げられる。ベータノダウィルス(ストライプジャック(striped jack)神経壊死ウィルス)が代表的なノダウィルスである。コロナウィルスには、コロナウィルス(鳥類伝染性気管支炎ウィルス)およびトロウィルス(ベルネウィルス)が含まれる。アルテリウィルス(ウマ動脈炎ウィルス)は、代表的なアルテリウィルスである。トガウィルスには、アルファウィルス(
シンドビスウィルス)と、ルビウィルス(ルベラウィルス)が含まれる。最後に、フラビウィルスは、フラビウィルス(黄熱ウィルス)とペストウィルス(ウシ下痢ウィルス)、およびヘパチウィルス(C型肝炎ウィルス)を含む。ある好ましい実施形態において、ウィルスはヘパチウィルス、C型肝炎ウィルスである。
【0106】
薬学的組成物
一実施形態において、本発明は、前セクションにおいて記載したようなオリゴヌクレオチド剤と、以下に示すような薬学的に許容される担体とを含有する薬学的組成物にも関する。該オリゴヌクレオチド剤を含む薬学的組成物は、IFN産生によって改善可能な疾患の治療に有用である。本発明の本形態において、本発明のオリゴヌクレオチド剤は、後述のように調製される。本発明の薬学的組成物は、IFN産生を誘導するのに十分な用量で投与される。薬学的組成物はiRNA剤からなり、用量は、標的遺伝子の発現または活性を阻害するのに十分な量である。本発明のオリゴヌクレオチド剤を含有する組成物は、驚くほど低用量での投与が可能である。IFN産生を誘導するには、また応用できる場合には、標的遺伝子の発現または活性を阻害または完全に抑制するためには、一日あたり体重1kgにつき5mgの最大用量のオリゴヌクレオチド剤で十分である。
【0107】
治療用途のための許容される担体または希釈剤は、製薬分野においてはよく知られており、たとえば、参照により本願に組み入れる「Remington’s Pharmaceutical Sciences」、Mack Publishing Co.(A.R.Gennaro編、1985)に記載されている。たとえば、防腐剤、安定剤、染料および着香料が提供されてもよい。これらには、安息香酸ナトリウム、ソルビン酸、およびp−ヒドロキシ安息香酸のエステルが含まれる。さらに、抗酸化剤および懸濁化剤を用いてもよい。
【0108】
一般に、オリゴヌクレオチド剤の適切な用量は、1日につき受容者の体重1kgあたり0.001〜500ミリグラムの範囲(たとえば、1kgあたり約1μgから1kgあたり約500mg、1kgあたり約100μgから1kgあたり約100mg、1kgあたり約1mgから1kgあたり約75mg、1kgあたり約10μgから1kgあたり約50mg、または1kgあたり約1μgから1kgあたり約50μg)である。薬学的組成物は、1日につき1回投与してもよいし、オリゴヌクレオチド剤は、1日のあいだに2回、3回、4回、5回、6回またはそれ以上の回数に分けて適当な間隔で投与してもよい。その場合、各分回用量に含まれるオリゴヌクレオチド剤は、1日の総用量を達成するために対応して少なくなるはずである。用量単位は、数日間の期間にわたってオリゴヌクレオチド剤を徐放させる従来の徐放製剤を例えば用いて、数日間にわたって送達するように構成することもできる。徐放製剤は、当該技術分野において周知である。この実施形態において、用量単位は、1日用量の相応の複数倍を含んでいる。
【0109】
当業者であれば、ある特定の要因が対象を有効に治療するのに必要な用量およびタイミングに影響を与えうること、該要因は例えば、限定はされないが、感染または疾病の重症度、以前の治療、対象の全体的な健康および/または年齢、および他の疾病の存在などであることを認識しているであろう。さらに、治療上有効な量の組成物による対象の治療は、1回の治療であっても、一連の複数回の治療であってもよい。本発明によって含意される個々のオリゴヌクレオチド剤についての有効用量およびin vivo半減期の評価は、従来の方法論を用いて、または本明細書中に別途記載する適切な動物モデルを用いたin vivo試験に基づいて行うことができる。
【0110】
本発明によって含意される薬学的組成物は、限定はされないが、経口または非経口経路、例えば静脈内、筋肉内、腹腔内、皮下、経皮、気道(エアロゾル)、眼内、直腸内、膣内および局所(例えば口腔内および舌下)投与を含む、当該技術分野において知られる任
意の手段によって投与することができる。好ましい実施形態において、薬学的組成物は、静脈内または腹腔内注入または注射によって投与される。薬学的組成物は、実質内、髄腔内投与してもよいし、および/または定位注射によって投与してもよい。
【0111】
経口投与については、本発明において有用なオリゴヌクレオチド剤は、一般的に錠剤またはカプセル剤の形態で、粉末または顆粒として、または水性溶液または懸濁液として提供される。経口使用のためのカプセルは、有効成分が固体希釈剤と混合される硬ゼラチンカプセルと、有効成分が水または油、例えばピーナツ油、流動パラフィンまたはオリーブ油などと混合される軟ゼラチンカプセルとを含む。
【0112】
筋肉内、腹腔内、皮下、および静脈内使用に対しては、本発明の薬学的組成物は、一般的に、適当なpHおよび等張性に緩衝された無菌の水性溶液または懸濁液として提供される。適切な水性ビヒクルには、リンガー(Ringer)溶液および等張塩化ナトリウムが含まれる。ある好ましい実施形態において、担体は専ら水性バッファのみからなる。本文中において「専ら〜のみ」とは、標的遺伝子またはウィルスを有する細胞中のオリゴヌクレオチド剤の取り込みに影響を与えるか、これを媒介する可能性のある補助剤またはカプセル化物質が全く存在しないことを意味する。このような物質としては、たとえば、ミセル構造、たとえば以下に示すようなリポソームまたはカプシドが挙げられる。オリゴヌクレオチド剤を細胞培養物内に導入するには、マイクロインジェクション、リポフェクション、ウィルス、ウィロイド、カプシド、カプソイド、または他の補助剤が必要であるが、驚くべきことに、これらの方法および物質はin vivoにおけるオリゴヌクレオチド剤の取り込みには必要とされない。本発明のオリゴヌクレオチド剤は、オリゴヌクレオチド剤の細胞内への取り込みを媒介する補助剤の使用を必要としないという点で特に有用であるが、それはこれらの補助剤の多くが毒性であるか、有害な副作用を伴うためである。本発明による水性懸濁剤は、セルロース誘導体、アルギン酸ナトリウム、ポリビニルピロリドンおよびトラガカントガム、およびレシチンなどの湿潤剤を含んでいてもよい。水性懸濁液のための適切な防腐剤には、エチルおよびn−プロピルp−ヒドロキシベンゾエートが含まれる。
【0113】
本発明の核酸分子は、たとえば薬物の直腸投与のために、坐剤の形態で投与することもできる。これらの組成物は、薬物を、常温では固体であるが直腸温度においては液体となるため直腸内で溶けて薬物を放出する適当な非刺激性賦形剤と混合することによって、調製することができる。このような材料としては、ココアバターおよびポリエチレングリコールが含まれる。
【0114】
薬学的組成物は、オリゴヌクレオチド剤を体からの迅速な排除から保護するための、カプセル化製剤、たとえば、移植物およびミクロカプセル化送達系を含む、放出制御製剤を含んでいてもよい。生分解性、生体適合性ポリマー、たとえばエチレン酢酸ビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、およびポリ乳酸などを用いてもよい。このような製剤の調製方法は、当業者にとっては明白である。材料もアルツァ・コーポレーション(Alza Corporation)およびノバ・ファーマシューティカルズ・インコーポレイテッド(Nova Pharmaceuticals,Inc.)から市販されているものを入手することができる。リポソーム懸濁液(ウィルス抗原に対するモノクローナル抗体によって感染細胞を標的とするリポソームを含む)もまた、薬学的に許容される担体として使用できる。これらは、たとえば、参照により本願に組み入れる米国特許第4,522,811号;国際公開公報第91/06309号パンフレット;および欧州特許公報EP−A−43075号に記載されるような、当業者に周知の方法によって調製することができる。
【0115】
本発明による好ましい薬学的組成物は、ワクチンである。ワクチンは、本発明のオリゴ
ヌクレオチド以外に抗原を含んでいなければならない。この抗原が、ワクチン接種した個体の防御/免疫反応を高める潜在性は、該抗原を本発明のオリゴヌクレオチドと組み合わせることによって、特に該オリゴヌクレオチドの免疫刺激活性により、強力に向上する。
【0116】
ワクチンは、種々の異なる抗原を含んでいてもよい。抗原の例としては、不活化されたウィルスまたは細菌、真菌、原虫などの死生物全体、あるいはがん細胞が挙げられる。抗原は、これらの生物/組織、タンパク質、またはそれらの最も単純な形のペプチドの、サブフラクションからなるものであってよい。抗原は、グリコシル化タンパク質またはペプチドの形態で免疫系によって認識されてもよいし、多糖または脂質であるか、多糖または脂質を含むものであってよい。たとえば、細胞傷害性T細胞(CTL)は、主要組織適合抗原(MHC)と複合化した、通常は8〜11アミノ酸長の短いペプチドの形態の抗原を認識するので、短いペプチドを使用してもよい(ラメンシー(Rammensee)ら,Immunogenetics,41,178〜228(1995))。B細胞は15アミノ酸程度からのより長いペプチドを認識する(ハロウ(Harrow)ら,Cold Spring Harbor:Cold Spring Harbor Laboratory,(1988))。T細胞エピトープとは対照的に、B細胞抗原の三次元構造も、抗体による認識にとって重要であるのかもしれない。持続的な抗原特異的免疫応答を得るために、必要な免疫系のすべての細胞を含む免疫カスケードをトリガーするためには、アジュバントが助けとなる。主としてアジュバントはいわゆる抗原提示細胞(APC)に作用するが、それらの作用様式において制限されていない。抗原提示細胞は通常は、最初に抗原と遭遇してから、免疫エフェクタに対してプロセシング済みまたは非修飾の抗原の提示を行う。中間種の細胞が関与してもよい。適切な特異性を有したエフェクタ細胞だけが、生産性免疫反応において活性化される。アジュバントもまた局所的に抗原および同時注射された他の因子を保持しうる。さらにアジュバントは他の免疫細胞に対する化学誘引物質として作用することもあるし、免疫系の刺激剤として局所的および/または全身的に作用する場合もある。
【0117】
本発明の組成物において用いる抗原はさほど重要でない。好ましくは、ウィルスまたは細菌病原体に由来する、または真菌または寄生虫に由来するタンパク質またはペプチドをこのような抗原(たとえば、誘導体化した抗原またはグリコシル化もしくは脂質化した抗原または多糖または脂質を含む)として用いる。抗原の別の好ましい供給源は、腫瘍抗原である。好ましい病原体は、ヒト免疫不全ウィルス(HIV)、A型およびB型肝炎ウィルス、C型肝炎ウィルス(HCV)、ラウス肉腫ウィルス(RSV)、エプスタインバーウィルス(EBV)、インフルエンザウィルス、ロタウィルス、スタフィロコッカス・アウレウス、クラミジア・ニューモニア、クラミジア・トラコマティス、ミコバクテリウム・ツベルクロシス、ストレプトコッカス・ニューモニア、バチルス・アントラシス、ビブリオ・コレラエ、プラスモディウム属生物種(プラズモディウム・ファルシパルム、プラズモディウム・ヴィバックスなど)、アスペルギルス属生物種またはカンジダ・アルビカンスより選択される。抗原は、がん細胞によって発現される分子(腫瘍抗原)であってもよい。誘導体化のプロセスは、病原体/がん細胞から特定のタンパク質を精製すること、病原体の不活化、ならびにそのようなタンパク質の化学的誘導体化または安定化を含みうる。同様に、腫瘍抗原(がんワクチン)または自己免疫抗原を本発明による薬学的組成物において用いてもよい。そのような組成物を用いて、腫瘍ワクチン接種または自己免疫疾患に対する治療を行うことができる。
【0118】
ペプチド抗原の場合、ペプチドミミトープ/アゴニスト/スーパーアゴニスト/アンタゴニストまたは免疫学的特性に影響を与えることなくある部位が変更されたペプチド、または非ペプチドミミトープ/アゴニスト/スーパーアゴニスト/アンタゴニスト(総説としてスパルビア(Sparbier)およびバルデン(Walden),Curr Opin Immunol,11,214〜218(1999))の使用が本発明に含まれる
。ペプチド抗原は、該ペプチド抗原のカルボキシ末端またはアミノ末端のいずれかに、ポリカチオン性化合物または免疫刺激性化合物との相互作用を容易にする延長部を有していてもよい。自己免疫疾患の治療のためには、ペプチドアンタゴニストを適用してもよい。抗原提示と、抗原提示細胞への抗原の標的化を高める分子を含むように、抗原を誘導体化してもよい。
【0119】
オリゴヌクレオチド剤の毒性および治療効力は、例えばLD50(集団の50%致死用量)およびED50(集団の50%において治療上有効な用量)を決定するための、細胞培養物または実験動物における標準的な薬学的手順によって判定することができる。毒性と治療効果との間の用量比が治療指標であり、比LD50/ED50で表すことができる。高い治療指標を示すオリゴヌクレオチド剤が好ましい。
【0120】
細胞培養アッセイおよび動物実験から得られたデータを用いて、ヒトにおいて使用する用量の範囲を策定することができる。本発明の組成物の用量は、好ましくは、毒性が殆どまたは全く無いED50を含む血中濃度の範囲にある。用量は、採用する剤形および利用する投与経路に応じてこの範囲内で変えることができる。本発明の方法において用いられる任意のオリゴヌクレオチド剤において、治療上有効な用量は、最初に細胞培養アッセイから推定することができる。用量を、細胞培養において決定されるIC50(すなわち、兆候の最大阻害の半分の阻害を達成する試験オリゴヌクレオチド剤の濃度)を含む、オリゴヌクレオチド剤またはIFNの循環血漿中濃度を達成するように、または必要に応じてiRNA剤の標的配列のポリペプチド生成物の循環血漿中濃度を達成するように(たとえば、ポリペプチド濃度の減少を達成)、動物モデルにおいて策定してもよい。このような情報を用いて、ヒトにおける有用な用量をより正確に決定することができる。血漿中の濃度は、たとえば、高速液体クロマトグラフィーによって測定することができる。
【0121】
上述のように個別または複数として投与することに加えて、本発明に関するオリゴヌクレオチド剤は、ウィルス感染および疾患を治療するのに有効な他の既知の剤と組み合わせて投与することもできる。いずれの場合も、投与を行う医師は、当該技術分野において周知であるかまたは本明細書に記載するような、標準的な有効性の尺度を用いて観察された結果に基づいて、オリゴヌクレオチド剤投与の量とタイミングを調整することができる。
【0122】
本発明の数々の実施形態について記載してきた。しかしながら、本発明の精神と範囲から逸脱しない限りにおいて様々な変更を行ってよいことが理解できるであろう。他の実施形態は特許請求の範囲に記載されている。
【実施例1】
【0123】
プラズマサイトイド樹状細胞の単離
PBMCは、健康な個体の全血液からフィコール・ハイパック(Ficoll−Hypaque)密度勾配遠心分離(ドイツ連邦共和国ベルリン所在のバイオクロム(Biochrom))により得た。PDCは、ミルテニル・バイオテク(Miltenyi Biotec)製のBDCA−4樹状細胞単離キットを用いてMACSによって単離した。すなわち、PDCを、コロイド状常磁性マイクロビーズを連結した抗BDCA−4抗体で標識し、磁気分離カラム(LSカラム;ミルテニル・バイオテク)に1回通した。単離したPDC(lineage陰性、MHC−II陽性,およびCD123陽性細胞)の純度は、75%〜100%であった。混入細胞は主としてT細胞であった。トリパンブルー排除法で判定した生存率は、95%を超えていた。
【0124】
細胞培養 単離したPDCを96ウェル平底プレート中にて、10ng/mLのIL−3(ドイツ連邦共和国ヴィースバーデン所在のR&Dシステムズ)を添加した150μLのOPTIMEM(R)(ドイツ連邦共和国カールスルーエ所在のインビトロジェン(I
nvitroge))中、5×104細胞の濃度で培養した。C末端黄色蛍光タンパク質(YFP)タグを有したヒトTLR9遺伝子を含む構築物で安定的にトランスフェクトされたHEK293細胞は、ディ.ゴレンボック氏(D.Golenbock)(米国マサチューセッツ州ワーチェスター(Worcester))の好意により提供されたものである。HEK293細胞は、10%(v/v)ウシ胎仔血清(米国メリーランド州ウォーカーズビル(Walkersville)所在のバイオウィッテイカー(BioWhittaker))、1.5mMのL−グルタミン、100U/mlペニシリン、および100μg/mLストレプトマイシン(すべてドイツ連邦共和国ミュンヘン所在のシグマ・アルドリッチ(Sigma−Aldrich)より入手)を添加したRPMI1640培養培地(バイオクロム)中で培養した。EBV陰性のバーキットリンパ腫細胞株BL41は、10%(v/v)ウシ胎仔血清(バイオクロム)、2mMのL−グルタミン、0.1mg/mL ペニシリン/ストレプトマイシンおよび1%の1mMピルベート(すべてオーストリア国リンツ所在のPAAより入手)を添加したRPMI1640(PAA)中で増殖させた。細胞は37℃および5%CO2においてインキュベートした。
【0125】
In Vitroでの細胞の刺激、トランスフェクションおよびエレクトロポーレション
CpG ODNは、コリー・ファーマシューティカル・グループ(Coley Pharmaceutical Group)(米国マサチューセッツ州ウェルスレイ(Wellesley))から供給されたものである(下線を付けた文字:該塩基の3’ホスホロチオエート結合;太字:CpGジヌクレオチド):
【0126】
【化1】

【0127】
R848はインビボゲン(Invivogen)(フランス国トゥールーズ所在)より購入した。R848およびODN2216は、それぞれ最終濃度500ng/mLおよび3μg/mLで添加した。siRNA配列(表1を参照)はダーマコン(Dharmacon)(米国コロラド州ラファイエット所在)によって合成およびアニールされたものである。siRNAをリポフェクタミン2000(ドイツ連邦共和国カールスルーエ所在のインビトロジェン)を用いてトランスフェクトした。特に示さない限り、200ngの核酸を25μLのOPTIMEM(R)と混合した。別のチューブにおいて、0.5μLのリポフェクタミンを25μLのOPTIMEMに加え、室温で5分間インキュベートした。複合体形成のために、両溶液を混合し、室温でさらに20分間インキュベートし、96ウェルプレートにおいて細胞(100μL)に加えた(最終容量150μL)。トランスフェクション溶液中の細胞はさらなる洗浄を行うことなく、37℃でインキュベートした。
【0128】
エレクトロポーレションのために、250,000PDCを、siRNA(2.5μg/mL)含有または非含有の400μLの「等浸透圧エレクトロポーレション−バッファ」(ドイツ連邦共和国ハンブルク所在のエッペンドルフ(Eppendorf))に再懸濁し、100Vで50μ秒間の1回のパルスを行った(Multiporator(R)、エッペンドルフ)。5分後、800μLの完全培地を加え、細胞を24ウェルの平底ウェルでさらに36時間インキュベートした。
【0129】
マウス実験
in vivo刺激については、129P2/OlaHsdマウスまたは129Svマウスを麻酔して、1,2−ジオレイルオキシ−3−トリメチルアンモニウムプロパン(DOTAP)複合体形成(30μLのDOTAP(ベーリンガー・マンハイム)を170μLのHepes緩衝生理食塩水(HBS)中の5μgの核酸と混合した)を事前に行った、または行っていない、5μgのCpG ODN1826またはsiRNA TLR9.2を含む200μLを後眼窩静脈に静脈注射した。対照のマウスにはHBS単独(対照)またはHBSおよびDOTAP(DOTAP)のいずれかを与えた。全血液試料は、注射から7時間、18時間、または24時間のいずれかにおいて、テールクリッピングによって得た。血清は37℃で30分間凝固させてから遠心分離することによって全血液より調製した。
【0130】
サイトカインの検出
IFN−α全体は14の異なる異性体からなるので、ELISAによって測定されるIFN−αの量は、これらの異性体の検出に用いた抗体の特異性に依存し、従ってELISAが異なれば同一でなくなる。この実験には、ベンダー・メドシステムズ(Bender
MedSystems(オーストリア国グラーツ(Graz)所在)のIFN−αキット(検出範囲8〜500pg/mL)を使用した。このELISAは、IFN−α異性体の殆どを検出するが、IFN−BおよびIFN−Fは検出しない。ヒトTNF−αELISA(検出範囲8〜500pg/mL)およびヒトIL−6ELISA(検出範囲5〜300pg/mL)は、ビーディー・ファルミンゲン(BD PharMingen(ドイツ連邦共和国ハイデルベルク所在))から得た。マウスIFN−αは、ピービーエル・バイオメディカル・ラボラトリーズ(PBL Biomedical Laboratories(米国ピスカタウェイ所在))製のマウスIFN−αELISAキットを用いて判定した。すべてのELISA手順は、製造業者の推奨に従って行った。
【0131】
フローサイトメトリー
フローサイトメトリーデータは、2つのレーザ(波長488nmおよび635nmで励起)を備えたビーディー・バイオサイエンシズ(BD Biosciences)(ドイツ連邦共和国ハイデルベルク所在))のFACSCalibur(商標)で得た。概して、細胞は示した特定の抗体および適当なアイソタイプ対照を用いて、4℃で20分間染色した。ヒトPDCは、抗CD123PEおよび抗MHCIIPerCPによるポジティブ染色、および抗lineageFITCによるネガティブ染色によって同定した。共刺激分子の発現は、抗CD86APCを用いて判定した(すべてビーディー・ファルミンゲン)。PDCの生き残りについては、刺激から36時間後に細胞を回収し、吸引体積50μLあたりの生きている細胞の絶対数をフローサイトメトリーによって判定した。PDCの生存率は、TO−PRO−3ヨウ素(米国オレゴン州ユージーン所在のモレキュラー・プローブス(Molecular Probes))に対してネガティブの染色、および形態学に基づくライブゲート(live gate)によって判定した。マウスMDCの表現型(CD11c++,CD11b++およびB220−)およびPDCの表現型(CD11c+,CD11b−およびB220++)の解析のために、新鮮な単離脾臓細胞を抗CD86FITC、抗CD45R/B220PE、抗CD11bPerCPおよび抗CD11cAPC(すべてビーディー・ファルミンゲン)で染色した。脾臓NK細胞およびT細胞の活性化は、抗pan−NK FITC陽性細胞(NK細胞)および抗CD3APC陽性細胞(T細胞)上で抗CD69PEによって判定した(すべてビーディー・ファルミンゲン)。データは、CellQuest(商標)(ビーディー・バイオサイエンシズ)またはFlowJo(R)ソフトウェア(バージョン2.5.1;米国カリフォルニア州スタンフォード所在のツリー・スター(Tree Star))を用いて解析した。
【0132】
ウェスタンブロット分析
細胞はリン酸緩衝食塩水(PBS)中で1回洗浄し、計数し、ラエムリ(Laemmli)サンプルバッファ(106細胞/50μL)中への再懸濁と10秒間の超音波処理により溶菌した。この試料をSDSポリアクリルアミドゲル(10%)上で分離し、ニトロセルロース膜(Hybond−ECL(商標)、アマシャム(Amersham))上に写し取った。写し取りに続いて、膜をポンソーレッド中で染色し、等量のタンパク質がロードされていたことを確認した。次に、膜をTBST(トリス10mM,pH8.0,NaCl 30mM,0.1%Tween)中で5分間洗浄し、TBST−MLK(5%乾燥スキムミルクを添加したTBST)中で30分間インキュベートした。水で2回リンスした後、TBST−MLK中の特異抗体(1:1000)を加え4℃で1時間または一晩処理した。水で2回リンスし、TBSTによる5分間の洗浄を3回行った後、セイヨウワサビペルオキシダーゼと複合化された二次抗体(TBS−MLK中1:3000)を加えて1.5時間処理し、水で3回リンスし、TBST中で5分間の洗浄を3回行い、水で5回リンスした。バンドは、ECLフィルム(アマシャム)上で、供給業者の方法(アマシャム)に従った強化化学発光によって可視化した。以下のタンパク質に対する抗体:ホスホ(チロシン701)−STATl(米国マサチューセッツ州ビバリー所在のニューイングランド・バイオラボ(New−England Biolabs))およびホスホ(チロシン689)−STAT2(米国マサチューセッツ州ウォルサム所在のアップステート(Upstate))を用いた。
【0133】
統計学的解析
データは、平均±SEMとして表す。差の統計学的有意性は、対応のある両側スチューデントt検定によって判定した。差は、p<0.05である場合に統計学的に有意であるとみなした。統計学的解析は、StatView(R)4.51ソフトウェア(米国カリフォルニア州カラバサス所在のアバカス・コンセプツ・インコーポレイテッド(Abacus Concepts Inc.))を用いて行った。
【0134】
特異的siRNAによって媒介されるHEK293細胞におけるTLR9発現の阻害
プラズマサイトイド樹状細胞(PDC)は、CpGモチーフの重要なセンサとして同定されてきた。siRNAを用いてPDCにおけるTLR9を選択的に阻害することにより、ウィルスおよび種々のCpGモチーフ含有オリゴデオキシヌクレオチド(CpG ODN)の認識におけるTLR9の関与について解析することが可能となる。本発明者らは、C末端黄色蛍光タンパク質(YFP)タグを有したヒトTLR9遺伝子を含む構築物で安定的にトランスフェクトされたHEK293細胞株における、siRNA媒介性のTLR9のダウンレギュレーションを確立した。ヒトTLR9mRNAを標的とする4つのsiRNA分子(TLR9.1,TLR9.2,TLR9.3,TLR9.4)を設計した(表1)。標準BLAST検索によって、これらのsiRNA標的配列が、他のヒト遺伝子といかなる相同性も有しないことを確認した。ヒトTLR2mRNAを標的とするsiRNAを陰性対照として用いて、TLR9構築物のC末端YFPタグを標的とする以前に確立されたsiRNAを阻害の陽性対照として用いた(表1を参照)。接着性のHEK293細胞を、96ウェルプレート中でリポフェクタミンを用いて200ngのsiRNAでトランスフェクトした。20時間、30時間、および54時間後、HEK293細胞をハーベストし、フローサイトメトリーによってYFP蛍光強度を定量することによりTLR9の発現を評定した。分析した3つの時点のすべてにおいて、調べた4つのTLR9特異的siRNAのうちの2つ(TLR9.2およびTLR9.3)が、阻害の陽性対照として用いた抗YFPsiRNAと同範囲の、強力なTLR9−YFP融合タンパク質発現の阻害を示した(20時間後のTLR9発現を図1Aに示す;30時間後:TLR2.1:151±10;TLR9.1:71±10;TLR9.2:43±2;TLR9.3:48±2;TLR9.4:119±5;GFP:37±3;54時間後:TLR2.1:167±8,TLR9.1:65±4;TLR9.2:32±1;TLR9.3:34±2;TLR9.4:110±7;GFP:24±1)。
【0135】
HEK293細胞中の標的遺伝子のダウンレギュレーションが、標的特異的ではないI型IFNの誘導に関係している可能性を除外するために、HEK293細胞の上清について、I型IFN活性を分析した。BL41細胞におけるSTATlおよびSTAT2リン酸化の誘導を、I型IFNの高感度の尺度として用いた。4つの異なる抗TLR9siRNAであるTLR9.1、TLR9.2、TLR9.3、TLR9.4でトランスフェクトしたHEK293細胞の上清には、I型IFN活性は全く検出されなかった(図1B)。予想どおり、リポフェクタミンと複合化した500塩基対の長さの二本鎖RNA(リポフェクタミンは含まない)は、陽性対照の組換えIFN−βを用いた場合と同様のSTATlおよびSTAT2リン酸化活性を誘導した(図1B)。これらの結果は、2つの抗TLR9siRNA、TLR9.2およびTLR9.3が、HEK293細胞におけるTLR9発現の特異的ダウンレギュレーションを可能にすること、およびこの細胞株において、siRNAによるトランスフェクションが標的非特異的な効果としてI型IFNを誘導するのではないことを実証した。
【0136】
プラズマサイトイド樹状細胞におけるsiRNAによるIFN−αの配列依存性の強力な誘導
次に、HEK293細胞におけるTLR9発現を阻害した抗TLR9siRNAが、TLR9リガンドによる刺激に対してPDSを脱感作するかどうかを調べた。PDCは、ヒト免疫系におけるI型IFNの主な生産者であるので、二本鎖(ds)RNAをPDCにおける選択的標的タンパク質阻害に用いると、PDCにおけるタンパク質阻害は、二本鎖RNAに媒介される標的非特異的なI型IFN誘導によって複雑になると考えられる。この可能性を調べるために、ヒト末梢血からのPDCを、いずれも細胞質送達のためにリポフェクタミンと複合化した二本鎖RNAのプロトタイプ刺激剤であるポリ(I:C)、または500塩基対(bp)長の二本鎖RNA分子のいずれかとともにインキュベートした。TLR9リガンドであるCpG−A ODN2216(クルグ、エイ((Krug,A.)ら Eur J Immunol 31,2154〜63(2001))およびTLR7リガンドであるR848を陽性対照とした。陽性対照のCpG−A ODN2216およびR848が、活発なIFN−α応答を示したのに対し、どちらの二本鎖RNA分子もPDCにおけるIFN−αの誘導能を欠いていることがわかった。これらの結果は、二本鎖RNAが、PDCにおける標的遺伝子の選択的ノックダウンに有用であることを示唆している。
【0137】
驚くべきことに、4つの抗TLR9siRNAの200ngでのトランスフェクションでは、PDCにおけるIFN−α産生の一貫性のあるパターンが誘導された(図2A)。TLR9.2およびTLR9.3は、TLR9.1およびTLR9.4と比べて、PDCにおいて有意に多いIFN−α産生を誘導した(図2A)。TLR9.1およびTLR9.4によるインターフェロン誘導の程度の低さ(図2Aを参照)にRNAの分解が関与していることを除外するために、4つすべての配列の減少量を比較した。25ng(12.5nM)において、2つの配列TLR9.2およびTLR9.3は、200ng(100nM)のTLR9.1より依然として高いレベルのIFN−αを誘導することから(図2B)、PDCにおけるIFN−αの誘導における4つの抗TLR9siRNAの活性の違いが確認された。TLR9.1およびTLR9.2の異なるIFN−α誘導活性は、siRNAがエレクトロポーレションによってPDCのサイトゾルへ送達される際にも観察されたことから、リポフェクタミンとsiRNAとの複合体形成はsiRNAによるIFN−α誘導には必要なく、むしろsiRNA分子そのものが有効成分のようであることが示された。B細胞または骨髄樹状細胞においては、siRNAによるIFN−α誘導は全く見られなかった(データ示さず)。
【0138】
注目すべきは、調べた4つの抗TLR9siRNAのうち、HEK293細胞における
TLR9発現をダウンレギュレートする最も高い活性を有する2つが、PDCにおけるIFN−αを誘導する最も強力な配列でもあったことである(図1Aと図2Aを比較)。ありそうもないことではあるが、標的非特異的な免疫刺激効果ではなく、標的特異的効果(TLR9の阻害)が、PDCにおけるIFN−α誘導に関与しているのかもしれない。この可能性を排除するために、PDCにおいて発現されるmRNA(TLR9)、PDCにおいて発現されないmRNA(TLR2,TLR3,TLR4,表1を参照)を標的とするsiRNAのパネルを比較した。これらのsiRNAがIFN−αを誘導する効力には有意な違いが見られたが、IFN−αの誘導効力と、PDC中の標的mRNAの有無との間に相関関係は見つからなかった(ODN 2216:xADD VALUE±SEM;IFN−α誘導の低い順に:TLR4.1:491±59;TLR9.1:500±88;TLR9.4:760±131;TLR4.2:1208±267;TLR3.2:1219±204;TLR2.1:1535±235;TLR3.1:2503±552;TLR9.3:3592±283;TLR9.2:4845±621:n=6)。調製品質の違いまたは混入物がsiRNAのIFN−α誘導活性の違いに寄与する可能性は、種々の市販供給源のsiRNA配列を用いて同じ結果が得られたことから排除された(データ示さず)。これらのデータは、siRNAによるPDCにおけるIFN−αの誘導が配列依存性であり、標的mRNAの有無とは関係がないことを示すものである。
【0139】
IFN−α誘導性RNA配列の同定
グアノシンおよびウリジンに富む一本鎖RNAがPDCにおけるIFN−αを誘導することが報告されている。グアノシンおよびウリジンモノマーの混合物もまた、免疫刺激活性を示した。したがって、我々の研究におけるsiRNAのグアノシンおよびウリジン含量の違いが、siRNAのPDCにおけるIFN−α誘導能力の差をもたらしているのではないかとの仮説をたてた。siRNAは二本鎖であるので、19量体のsiRNA中のグアノシンおよびウリジンの総含量は、常に19である。調べたsiRNA内のウリジンの数は、9から11の範囲であり、ウリジンの数とIFN−α誘導活性との間には何ら相関関係は無かった(表1を参照)。免疫活性siRNAは、様々なグアノシンおよびウリジン含量の特異的一本鎖(センスまたはアンチセンス)を含みうる。しかしながら、グアノシンとウリジンの合計数は、活性siRNA(TLR9.2およびTLR9.3)の一本鎖において、またより低い活性を有するsiRNA(TLR9.1,TLR9.4,TLR2.1,TLR4.1,TLR4.2,TLR3.1,TLR3.2)の一本鎖においても、7〜12の範囲であり、さらに、グアノシンに対するウリジンの比は、免疫学的活性とは関連がなかった(表1を参照)。したがって、単にグアノシンおよびウリジンの含量ではなく、特定の配列がTLR9.2およびTLR9.3の免疫学的活性に関与していると思われる。
【0140】
この免疫刺激配列を同定するために、TLR9.2の2本の一本鎖(センスおよびアンチセンス)のIFN−α誘導活性を、二本鎖の活性と比較した。TLR9.2のセンス鎖は、二本鎖と比べてPDCにおいてIFN−αを同等の強さで誘導したが、TLR9.2のアンチセンス鎖は、弱い活性しか示さなかった(図2C、左パネル)。ポリ(U)またはポリ(A)一本鎖RNAおよびポリ(U:A)二本鎖RNAによるIFN−α誘導は、TLR9.2siRNAのセンス鎖に比べて低く(RNA9.2s:4962±797;ポリ(U):574±165;ポリ(A):244±120;ポリ(U:A):111±53;n=7;ポリ(A)については、図3Bの左から二番目のバーも参照のこと)、このことは、TLR9.2のセンス鎖がPDCによって認識される特異的免疫刺激モチーフを含んでいるという概念をさらに支持するものである。
【0141】
siRNAは、センスおよびアンチセンス鎖のアニーリングによって生成されるので、TLR9.2siRNAの免疫刺激活性は、siRNA調製物中の非結合のセンス鎖によるものであり、二本鎖によるものではないかもしれない。この可能性を排除するために、
TLR9.2のセンス鎖と二本鎖を一本鎖RNAseに曝露した。予想どおり、センス鎖はRNAse処理によって完全に分解され(図2D、左パネル)、免疫活性が失われた(図2D、右パネル)。これに対して、二本鎖は、RNAse処理による影響は受けず、IFN−αの誘導活性は維持されていた(図2D)。siRNA調製物に混入した一本鎖RNAの寄与をさらに排除するために、二本鎖領域に完全なTLR9.2siRNAの二本鎖が含まれたエネルギー的に安定なヘアピン(ミクロRNAと同様)を形成する一本鎖RNAを設計した(表2)。このヘアピンは、TLR9.2siRNA二本鎖と同様にIFN−αを誘導する活性をもつことが判った(図2E)。これらのデータは、siRNAの免疫刺激活性が、siRNA調製物中の一本鎖混入物を除去することでは防げないこと、また免疫刺激がヘアピン型RNAの干渉(すなわちミクロRNA)にも関係することを実証するものである。
【0142】
TLR9.2およびTLR9.3の配列は、13塩基の重複を示している(表1を参照)。どちらのsiRNAもPDCにおけるIFN−αの強力な誘導剤であるので、IFNα誘導に関与する配列モチーフがこのTLR9.2とTLR9.3との重複領域に存在するとの仮説をたてた。このように、免疫刺激モチーフの局在化から、TLR9.2のセンス鎖の3’末端にある13塩基に着目した。この仮説は、FITC分子を3’末端に連結し、5’末端には連結しない場合に、センス鎖の活性が低下したことから支持された(図3A、5’Fを3’Fと比較のこと)。ポリ(A)には免疫学的活性が欠如していることから(図3A)、モチーフを絞り混むために、TLR9.2のセンス鎖内の塩基をAに置換することができた。TLR9.2のセンス鎖の3’末端の13塩基内に免疫刺激モチーフが局在することと矛盾することなく、3’末端の8塩基を置換すると(R8A,Rは右を表す)、センス鎖の免疫学的活性が無効となり、5’末端の8塩基を置換しても(L8A,Lは左を表す)センス鎖の免疫学的活性は無効とはならなかった(図3B)。5’末端からAの数をさらに増加させることにより(L8AからL12A)、部位11が3’末端のモチーフに必須であることが同定され、TLR9.2センス鎖の3’末端の9塩基(5’GUCCUUCAA3’,配列番号:1)がTLR9.2センス鎖の免疫刺激活性に関与していることが示唆される。この9量体配列における塩基の交換数を増加していくと、TLR9.2センス鎖の免疫学的活性が徐々に低下し、9量体配列のうちの6塩基を交換した場合に活性は完全に損失した(図3B;R8A)。IFNα誘導に必要なRNAの最小の長さは19塩基の範囲内にあることが判ったが、これは、前記9量体配列を含む12量体および16量体はいずれもはるかに低い活性しか示さなかったためである(図3B)。一方、19量体RNAオリゴヌクレオチド中に9量体配列を2度配置することにより(DRとよぶ)、1つの免疫刺激性9量体配列しか含まないTLR9.2のセンス鎖(nとよぶ、図3B)と比べて免疫学的活性はさらに増加する。
【0143】
siRNAの免疫刺激活性およびサイレンシング活性についての検討
上記の研究によれば、TLR9.2の免疫刺激活性はセンス鎖内に局在し、サイレンシング活性は二本鎖のアンチセンス鎖に局在する。TLR9.2の一本鎖RNA鎖の両方を適当に修飾して、サイレンシング活性から免疫刺激性を分離しても、またその逆を行うようにしてもよい。siRNAの標的阻害に関する特性を変更するために、骨格の修飾であるロックト核酸(LNA)が用いられてきた。本発明者らは、センス鎖およびアンチセンス鎖のLNA修飾を用いて、サイレンシングだけでなくsiRNAの免疫学的活性をも調節できるかどうかに興味を持った。最初に、TLR9.2のセンス鎖の免疫学的活性に対する5’および3’LNAの影響を調べた(表2を参照)。FITC分子を5’または3’末端に連結した場合(図3Aを参照)と矛盾することなく、5’末端ではなく3’末端におけるLNA修飾により、センス鎖がIFNαを誘導する活性が強く阻害された(図4A)。次に、異なるLNA修飾を有する(5’末端、3’末端、または5’および3’末端のLNA)、またはLNA修飾を有しないセンスおよびアンチセンス鎖をアニーリングして、全部で16の異なるTLR9.2siRNA誘導体を作成した。この一連のTLR
9.2二本鎖がPDCにおけるIFNαを誘導する活性について評定した(図4B,黒色バー)。センス鎖単独の場合(図4A)と同様に、センス鎖の3’末端または3’末端と5’末端の両方にLNA修飾を有する二本鎖は、IFNα誘導活性を強く阻害したが、センス鎖の5’末端におけるLNA修飾では、大きな活性変化は見られなかった(図4B)。アンチセンス鎖のLNA修飾は、非修飾センス鎖を含むsiRNAの免疫刺激性に影響を与えることはなかった(図4B)。
【0144】
次に、TLR9.2siRNAのサイレンシング活性に対するLNA修飾の影響を調べた。IFNα誘導の場合と異なり、センス鎖のLNA修飾は、TLR9.2siRNAのサイレンシング活性にほとんど影響を及ぼさなかった(図4B、白抜きバー)。これに対し、アンチセンス鎖のLNA修飾は、TLR9.2siRNAのサイレンシング活性に強く影響を及ぼした。アンチセンス鎖の3’末端のLNA修飾は、アンチセンス鎖の5’末端のLNA修飾よりもサイレンシング活性に与える影響がより小さかった。サイレンシング活性は、3’および5’末端の両方をLNAによって修飾した場合に、完全に失われた。これらのデータを合わせると、センスおよびアンチセンス鎖の異なる領域にLNA修飾を導入することによりsiRNAの2つの機能的活性を分離することが可能であり、siRNAの免疫刺激成分を最小限にしながらサイレンシング活性を維持することもできるし(たとえば:センス鎖の3’末端にLNA);siRNAのサイレンシング活性を無効にしながら免疫刺激活性を維持することもできる(すなわち、アンチセンス鎖の3’および5’末端にLNA)ことがわかる。
【0145】
免疫刺激性のsiRNAは、in vivoでマウスの全身性免疫反応を誘導する
siRNAのin vivoでの全身作用を検討するために、最初にマウスの系においてsiRNA配列のin vitro免疫刺激活性について調べた。ヒトの系と同様に、TLR9.2の二本鎖およびセンス鎖がIFNαを誘導する一方、TLR9.2のアンチセンス鎖ははるかに活性が低く、ポリ(A)は活性を持たないことが判った(図5A)。
【0146】
次に、TLR9.2二本鎖、TLR9.2センス鎖、およびTLR9.2アンチセンス鎖の免疫学的活性をin vivoにおいて評価した。この分析には、ヒトの系においてTLR9.2よりも活性の低かったsiRNAとしてTLR2.1を含めた。129Svマウスへの静脈注射の7時間後に、マウス血清中のIFN−αの濃度を測定した(図5B)。さらに、脾臓における免疫細胞サブセットの活性化を、43時間後にフローサイトメトリーによって評価した(図5C)。in vitroデータと矛盾することなく、TLR9.2二本鎖およびTLR9.2センス鎖は、IFN−αの全身レベルを誘導し、CD4およびCD8 T細胞および骨髄樹状細胞を活性化する最も高い活性を示した(図5C)。カチオン性リポソーム(DOTAP)またはsiRNA単独のいずれかでは免疫学的活性は観察されなかった(図5D)。同時に上記の結果は、in vivoにおけるsiRNAの投与が、血液および脾臓のいずれにおいても検出可能な全身性免疫反応を誘引すること、ならびにマウスにおける免疫学的活性がヒトの系におけるものと同じ配列依存性を示すことを実証するものである。
【0147】
siRNAの免疫認識はTLR7を必要とする
マウスとヒトにおいてsiRNAの配列依存性免疫認識が保存されていることから、関係する受容体を同定するためにノックアウトマウスを使用することができた。TLR7およびTLR9は、PDCにおいて発現され(FIX REFERENCE{Krug,2001#5;Hornung,2002#37})、IFN−α産生と関係することが知られているTLRファミリーの唯一のメンバーである。これまでのところ、TLR7を介して特異的に検出されるRNA配列モチーフは同定されていない。本発明者らは、TLR7がTLR9.2siRNAに含まれる免疫刺激配列モチーフの認識に関与しているという仮説をたてた。実際に本発明者らは、in vitroにおけるTLR9.2二本鎖お
よびTLR9.2センス鎖による、また確立されたTLR7リガンド(ロキソリビン)によるIFN−α誘導が、TLR7欠失マウス由来の骨髄細胞には存在しないことを発見した(図6A)。対照的に、TLR9リガンドであるCpG ODN1826によるIFN−α誘導は、TLR7欠失マウス由来の骨髄細胞においては減少しなかった(図6A)。
【0148】
in vitroでは検出不可能な、siRNAの免疫認識のさらなるin vivoメカニズムが存在するかもしれない。そのようなものとして、TLR9.2siRNAをTLR7欠失マウスおよび野生型の対照マウスに静脈注射した。野生型マウスとは対照的に、TLR7欠失マウスは、7時間および24時間後の血清中に検出可能なIFN−αは全くみられなかった(図6B)。さらに、TLR7欠失マウスの脾臓細胞においては、CD4T細胞、CD8T細胞、骨髄樹状細胞およびPDCの活性化は全く見られなかったが、野生型マウスにおいては4つすべての細胞サブセットに強い活性化が見られた(図6C)。これらのデータを合わせると、TLR7がTLR9.2siRNAの免疫認識のために必要とされていることがわかる。
【0149】
考察
RNA干渉技術における最も顕著な進歩の一つとして、二本鎖RNA分子の長さを22塩基対まで減らすことにより、標的mRNAの配列特異的ダウンレギュレーションを維持しながら、PKRによって媒介される非特異的I型IFN誘導を回避できるということがある。この概念どおり、本発明者らは、IFN応答を伴わないヒトHEK293細胞株におけるsiRNA媒介性の配列特異的なTLR9ダウンレギュレーションを実証することができた。しかしながら、この方法を初代プラズマサイトイド樹状細胞(PDC)に適用しようとしたところ、以前に提案された長さ依存性の二本鎖RNA認識が逆転しているようであり、500塩基対長の二本鎖RNA分子またはポリ(I:C)(長い二本鎖RNAの模倣物)によるPDCのトランスフェクションでは、IFN−αが誘導できず、調べたsiRNA配列のいくつかが活発なIFN−α反応を示すという驚くべき観察結果を得た。
【0150】
強力なIFN−α誘導活性を有した2つのsiRNAの重複配列に基づいて、9塩基(5’GUCCUUCAA3’,配列番号:1)で構成される免疫刺激性の一本鎖RNA配列を同定することができた。免疫刺激性siRNAの両鎖の異なる領域の化学的骨格修飾により、免疫刺激とRNAサイレンシングを、2つの独立した機能的活性として分けることができた。siRNAによるIFN−α誘導に関する同じタイプの配列特異性が、マウスにおいても見られた。in vitroの免疫刺激活性およびin vivoの全身性免疫反応はTLR7欠失マウスにおいては無効になったことから、siRNAの配列特異的免疫認識は、TLR7によって媒介されることが実証された。
【0151】
本発明者らの結果は、siRNAの免疫刺激活性が、不完全なアニーリング処理後のsiRNA調製物に残された一本鎖RNA分子によって媒介されるのではないという証拠を与えるものである。すなわち、i)siRNA調製物を一本鎖RNAseで処理しても、siRNAの免疫学的活性に影響はないが、対応する免疫刺激性一本鎖RNAの活性は損なわれた。ii)免疫刺激性siRNAの完全な二本鎖を含む、エネルギー的に安定なヘアピンを自然に形成するように設計された一本鎖RNAオリゴヌクレオチド(ミクロRNAの形態)は、免疫刺激性siRNAと同等の活性を有していた。これらのデータから、siRNAの認識に関与する認識メカニズムによって、RNA二本鎖の内の一本鎖RNAモチーフの検出が可能になっていることが確認された。
【0152】
siRNAおよびTLR9リガンド(CpG DNA)の認識に関して、siRNAと微生物DNAのいずれも最初は二本鎖(ウィルスまたは細菌のDNAゲノムは通常は二本鎖)であるにもかかわらず、免疫刺激配列モチーフの検出は一本鎖レベルにおいて行われ
るということは興味深い。これまで、ヘリカーゼ活性が認識プロセスの一部であるかどうかについての情報はなかった。RNAおよびDNAのいずれに対しても、対応するタイプの免疫反応を誘起するために、適当な配列モチーフを含む合成一本鎖オリゴヌクレオチドを用いることができる。免疫刺激性RNAオリゴヌクレオチドの最短の長さは、約19塩基であった。同様に、活性TLR9リガンドになるためには、6量体CpGモチーフは、より長いオリゴヌクレオチドの一部でなければならない(ハートマン、ジー(Hartmann,G.)ら、J Immunol 2000,164:944〜53)。ポリA RNAは免疫学的活性を全く示さないので、9量体の刺激配列を含むRNAオリゴヌクレオチドを、19量体の長さにまで延長するためにポリAの添加を利用することができた。19量体RNAオリゴヌクレオチド中に2つの刺激性9量体配列を挿入することによって、免疫刺激活性がさらに増大した。同様に、ポリ(C)DNA(ホスホロチオエート修飾を有するものも有しないものも)は免疫刺激活性を欠如していることから、ポリ(C)は、以前の研究においてオリゴデスオキシヌクレオチドを含んだCpGモチーフの延長のために用いられていた(ハートマン、ジー(Hartmann,G.)ら J Immunol 2000,164:944〜53)。
【0153】
水疱性口内炎ウィルスやインフルエンザウィルスなどのある種の一本鎖RNAウィルスは、TLR7を介して免疫細胞によって認識されることが報告されているが(ランド(Lund)ら、Proc.Natl.Acad.Sci.USA 2004,101:5598〜603;ハイル(Heil)ら、Science 2004,303:1526〜9;ディーボルト(Diebold)ら、Science 2004,303:1526〜9)、ウィルスRNAの認識に関与する特定の配列モチーフはこれまで同定されていない。その代わりに、ポリ(U)が活性であることが報告されており、ウィルスRNAにおいてはGUが豊富な配列が免疫認識に関与し、さらにモノマーのGおよびUの混合物が免疫刺激性であることが提案されている。後者は、RNA分解産物の関与している可能性を示すものである。本研究におけるRNA分子の免疫刺激活性がGU含量によるものではないという証拠がいくつかある。最初に、当然のことながら、二本鎖RNAのGおよびUの総数は、二本鎖の長さと常に一致する(すなわち、19量体二本鎖のGU数は、常に19である)。第2に、siRNAの2つの一本鎖の一方または他方において、GまたはUの数、またはG対Uの比が大きくなっても、siRNAの免疫学的活性には関係しなかった。第3に、免疫刺激性一本鎖RNAにおけるGの数を増加すると、免疫学活性は強化されるよりもむしろ減少した。そして、第4に、本研究において記載する免疫刺激性RNA配列を含むRNAオリゴヌクレオチドと比べて、ポリ(U)は弱かった。
【0154】
本発明者らの結果は、PDCによるsiRNAの免疫認識が、配列依存性かつGU含量非依存性であり、本研究において記載された配列がいくつかの異なる免疫刺激性RNA配列モチーフの1つであるかもしれないことを明確に実証するものである。本研究の配列の最適化と、さらなる配列の同定は、最も強力な免疫刺激性RNAモチーフを同定するための幅広い配列スクリーニングの課題となるであろう。
【0155】
少なくとも本研究において記載するRNA配列については、siRNAの認識はマウスとヒトとの間で保存されているようである。DOTAPに複合化した免疫刺激性siRNAを静脈注射したところ、血清中のIFN−αならびにT細胞、PDCおよび骨髄樹状細胞の活性化を含む強い全身免疫反応が観察された。免疫活性化のレベルは、TLR9リガンドであるCpGの場合と同じ範囲にあった。siRNAによる骨髄樹状細胞およびT細胞のin vivo活性化は、すでにヒトの系において実証されているように(クルグ、エイ(Krug,A.)ら J Immunol 170,3468〜77(2003),ローテンファッサー、エス(Rothenfusser,S.)ら、Blood 103,2162〜9(2004),ローテンファッサー、エス(Rothenfusser,S.)ら、Eur J Immunol 31,3525〜34(2001))、IF
N−αによって媒介される二次的効果によるものであるかもしれない。結果として、カチオン性脂質と複合化したsiRNAは、CpGと同様に、ウィルス(ディトマー、ユー(Dittmer,U.)&オルブリッチ、エイ・アール(Olbrich,A.R.)、Curr Opin Microbiol 6,472〜7(2003))および細菌感染(ワグナー、エイチ(Wagner,H.)、Springer Semin Immunopathol 22,147〜52(2000))および腫瘍(ヘッケルスミラー、ケイ(Heckelsmiller,K.)ら、Eur J Immunol 32,3235〜45(2002)、ヘッケルスミラー、ケイ(Heckelsmiller,K.)ら、J Immunol 169,3892〜9(2002)、ワイナー、ジー・ジェイ(Weiner,G.J.)、Curr Top Microbiol Immunol 247,157〜70(2000))に対して、強力な治療活性を示すかもしれない。B型肝炎のマウスモデルにおいてウィルスの複製と転写を阻害するためにsiRNAがうまく用いられたことは興味深い(クライン、シー(Klein,C.)ら、Gastroenterology 125,9〜18(2003)、デビッドソン、ビー・エル(Davidson,B.L.)、N Engl J Med 349,2357〜9(2003))。IFN−αはB型肝炎治療の中心となるものであるから、PDCに由来するIFN−αがsiRNAの治療効果に寄与しているかもしれない。
【0156】
本研究において、in vitroおよびin vivoの両方においてsiRNAによって誘導される免疫反応は、完全にTLR7の存在に依存していた。しかしながら、HEK293細胞などの多くの細胞株においてTLR7は発現されず、したがって、TLR7を介したsiRNAの免疫認識は期待されない。このことは、siRNAでトランスフェクトしたHEK293細胞の上清が、長い二本鎖RNA分子によるトランスフェクションとは対照的に、STATlまたはSTAT2リン酸化活性の欠如によって証明されるようにI型IFN反応を示さないという我々のin vitroでの観察に矛盾しない。これらの結果は、in vitroのTLR7欠損細胞株において、21塩基対の短い二本鎖RNA(siRNA)が免疫刺激活性を欠き、標的遺伝子の配列特異的ダウンレギュレーションについては有用であるという概念と一致する。
【0157】
この概念に反する報告として、siRNAの細胞株へのトランスフェクションが、PKR依存性のI型IFN媒介性のSTAT経路の活性化をもたらし、IFNによって刺激される遺伝子のアップレギュレーションにつながることを示唆したものがある(スレズ、シー・エイ(Sledz,C.A.)ら、Nat Cell Biol 5,834〜9(2003))。さらに、siRNAは、HEK293細胞などの細胞株において発現されるTLR3を介してI型IFN反応を誘導することが報告されている(カリコ、ケイ(Kariko,K.)ら、J Immunol 172,6545〜9(2004),カリコ、ケイ(Kariko,K.)ら、Cells Tissues Organs 177,132〜8(2004))。しかしながら、本研究におけるTLR7欠損マウスでのsiRNAの免疫刺激活性の完全な損失は、PKRおよびTLR3が、天然の免疫系によってsiRNAを検出する主たるメカニズムを示すものではないという証拠を提供する。このことは、siRNAの免疫学的活性がTRIF欠損マウスでは影響されないという我々の最近の知見(データ示さず)によって支持される。TRIFは、TLR3シグナル伝達に必要なアダプタ分子である。TRIF欠損マウスにおけるsiRNAの免疫学的活性の欠如は、ホーベ(Hoebe)および共同研究者(ホーベ、ケイ(Hoebe,K.)ら、Nat Immunol 4,1223〜9(2003))によって提案された、代替のTLR3およびTRIF非依存性の長い二本鎖RNA(ポリ[I:C])認識の経路が、siRNAの免疫認識に関与していないことも示す。
【0158】
siRNAによって誘導されるI型IFN産生による、タンパク質発現の標的非特異的ダウンレギュレーションは、RNA干渉技術における大きな問題である。siRNAのサ
イレンシング活性からI型IFN誘導特性を分離する方法によって、siRNAの用途は進化するであろう。本研究において、siRNA TLR9.2は、サイレンシング活性と免疫刺激活性とがsiRNAの2つの無関係の機能的特性であることを実証するための優れたモデルであることが判った。IFN−α誘導に関与するRNA配列がアンチセンス鎖上ではなくセンス鎖上に見つかったので、両機能的活性の解離が可能であった。siRNA TLR9.2のセンス鎖またはアンチセンス鎖上のある領域に選択された骨格修飾(ロックト核酸;LNAによるもの)を施すことにより、サイレンシング活性は維持されているが免疫刺激活性が無効になった、またはその逆の、siRNA TLR9.2誘導体を作成することができた。これにより、siRNAの機能的特性は、免疫刺激および/または標的mRNAのサイレンシングを好むように変更できることが実証された。明らかに、mRNAサイレンシングに対するその効果に加えて、ある種のsiRNAは、その潜在的免疫刺激特性ゆえに、とくに該siRNAが抗感染または抗腫瘍治療薬としての使用に関する場合には、さらなる治療的可能性を有しうる。本研究において用いた刺激性配列は、PDCにおいて見られた最大刺激(刺激:CpG−A ODN2216)の約30%のIFN−α誘導を起こした。この刺激性配列が最適であるとは思えないが、このRNA配列によるin vivoでの結果は、免疫刺激性siRNA分子のさらなる開発に対する潜在性を浮き彫りにするものである。
【実施例2】
【0159】
免疫刺激を調節するための修飾オリゴヌクレオチドの合成
(a)RNA,2’−O−メチル修飾、2’−デオキシ−2’−フルオロ修飾、およびチオエート修飾を施したオリゴヌクレオチド
RNA分子は、394ABI合成機で、製造業者によって記載された標準サイクルを用い、下記に記載するように数箇所の待ち工程に改変を加えて合成した。固体支持体は、多孔性ガラス(CPG;500Å、米国ペンシルベニア州アストン所在のプライム・シンセシス・インコーポレイテッド(Prime Synthesis,Inc.))とした。モノマーは、ピアス・ヌクレイック・アシド・テクノロジーズ(Pierce Nucleic Acid Technologies)(米国ウィスコンシン州ミルウォーキー所在のピアス・ミルウォーキー・エルエルシー(Pierce Milwaukee LLC))から入手した標準的な保護基を有するRNAホスホルアミダイトまたは2’−O−メチル(2’−OMe)RNAホスホルアミダイトであって、特に述べない限り、CH3CN中に0.15Mの濃度で使用した。具体的には、RNAホスホルアミダイトは、5’−O−ジメトキシトリチル−N6−ベンゾイル−2’−O−tブチルジメチルシリル−アデノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N2−イソブチリル−2’−O−tブチルジメチルシリル−グアノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N4−アセチル−2’−O−tブチルジメチルシリル−シチジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−2’−O−tブチルジメチルシリル−ウリジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N6−ベンゾイル−2’−O−メチル−アデノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N2−イソブチリル−2’−O−メチル−グアノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、5’−O−ジメトキシトリチル−N4−アセチル−2’−O−メチル−シチジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト、および5’−O−ジメトキシトリチル−2’−O−メチル−ウリジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイトであった。2’−デオキシ−2’−フルオロ(2’−F)ホスホルアミダイト、5’−O−ジメトキシトリチル−N4−アセチル−2’−デオキシ−2’−フルオロ−シチジン−3’−O−N,N’−ジイソ
プロピル−2−シアノエチル−ホスホルアミダイトおよび5’−O−ジメトキシトリチル−2’−デオキシ−2’−フルオロ−ウリジン−3’−O−N,N’−ジイソプロピル−2−シアノエチル−ホスホルアミダイトは、プロメガ・コーポレイション(Promega Corp.(米国ウィスコンシン州マディソン所在))より購入した。5’−O−ジメトキシトリチル−N6−ベンゾイル−2’−デオキシ−2’−フルオロ−アデノシン−3’−O−N,N’−ジイソプロピル−2−シアノエチル−ホスホルアミダイトおよび5’−O−ジメトキシトリチル−N2−イソブチリル−2’−デオキシ−2’−フルオロ−グアノシン−3’−O−N,N’−ジイソプロピル−2−シアノエチル−ホスホルアミダイトは、文献プロトコールに従って合成した(引用)。すべてのモノマーに対してカップリング時間は10分間とした。他の試薬の詳細は以下の通りである;アクチベータ,5−エチルチオテトラゾール(0.25M、米国VIスターリング所在のグレン・リサーチ(Glen Research));CapA,5%無水酢酸/THF/ピリジン(米国VIスターリング所在のグレン・リサーチ);CapB:10%N−メチルイミダゾール/THF(米国VIスターリング所在のグレン・リサーチ);PO酸化には0.02M I2/THF/H2O(米国VIスターリング所在のグレン・リサーチ)を用いた。PS酸化には、Beaucage試薬(英国グラスゴー所在のクルアケム・リミテッド(Chruachem Ltd))のアセトニトリル溶液(1%)を使用した。トリチル基は、合成機において、3%TCA/ジクロロメタン(米国VIスターリング所在のグレン・リサーチ)によって除去した。
【0160】
(b)LNA結合を有するオリゴヌクレオチドの合成
RNA分子は、394ABI合成機で、製造業者によって記載された標準サイクルを用い、下記に記載するように数箇所の待ち工程に改変を加えて合成した。固体支持体は、rA CPG(2マイクロモル、520Å、米国ペンシルベニア州アストン所在のプライム・シンセシス・インコーポレイテッド、バッチ番号CPG60N11RASN)、rU CPG(G311103がこれ、米国ペンシルベニア州アストン所在のプライム・シンセシス・インコーポレイテッド、バッチ番号も同様か)、LocA(2マイクロモル、米国コロラド州ボルダー所在のプロリゴ・エルエルシー(Proligo LLC)、40.0マイクロモル/g、バッチ番号225401)、またはLocT(2マイクロモル、米国コロラド州ボルダー所在のプロリゴ・エルエルシー、39.0マイクロモル/g、バッチ番号224597)とした。Locは、LNA構築ブロックを表す。モノマーは、RNAホスホルアミダイト(ピアス・ヌクレイック・アシド・テクノロジーズ、ピアス・ミルウォーキー・エルエルシー(Pierce Nucleic Acid Technologies,Pierce Milwaukee LLC)、米国ウィスコンシン州ミルウォーキー所在)またはLNAホスホルアミダイトLocABz(米国コロラド州ボルダー所在のプロリゴ・エルエルシー、カタログ番号223917),5’DMTCELoc5meCBz(米国コロラド州ボルダー所在のプロリゴ・エルエルシー、カタログ番号223816),5’DMTCELoc5meGiBu(米国コロラド州ボルダー所在のプロリゴ・エルエルシー、カタログ番号223817),5’DMTCELocT(米国コロラド州ボルダー所在のプロリゴ・エルエルシー、カタログ番号22818)とした。特に注記のない限り、すべて標準的な保護基を有し、CH3CN中0.15Mの濃度で使用した。具体的には、RNAホスホルアミダイトは、5’−O−ジメトキシトリチル−N6−ベンゾイル−2’−O−tブチルジメチルシリル−アデノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト(バッチ番号FG0082)、5’−O−ジメトキシトリチル−N2−イソブチリル−2’−O−tブチルジメチルシリル−グアノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト(バッチ番号FE0031)、5’−O−ジメトキシトリチル−N4−アセチル−2’−O−tブチルジメチルシリル−シチジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト(バッチ番号FF0046)、および5’−O−ジメトキシトリチル−2’−O−tブチルジメチルシリル−ウリジン−3’−O
−(β−シアノエチル−N,N’−ジイソプロピル)ホスホルアミダイト(バッチ番号FF0036)とした。LNAホスホルアミダイトは、5’−O−ジメトキシトリチル−N6−ベンゾイル−アデノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)LNAホスホルアミダイト、5’−O−ジメトキシトリチル−N2−イソブチリル−グアノシン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)LNAホスホルアミダイト、5’−O−ジメトキシトリチル−N4−アセチル−5−メチル−シチジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)LNAホスホルアミダイト、および5’−O−ジメトキシトリチル−5−メチル−チミジン−3’−O−(β−シアノエチル−N,N’−ジイソプロピル)LNAホスホルアミダイトとした。
【0161】
すべてのモノマーに対してカップリング時間は10分間とした。他の試薬の詳細は以下の通りである:アクチベータ、5−エチルチオテトラゾール(0.25M、米国VIスターリング所在のグレン・リサーチ);CapA、5%無水酢酸/THF/ピリジン(米国VIスターリング所在のグレン・リサーチ);およびCapB、10%N−メチルイミダゾール/THF(米国VIスターリング所在のグレン・リサーチ);PO酸化には0.02M I2/THF/H2O(米国VIスターリング所在のグレン・リサーチ)を用いた。トリチル基は、合成機において、3%TCA/ジクロロメタン(米国VIスターリング所在のグレン・リサーチ)によって除去した。
【0162】
脱保護
合成の完了後、多孔性ガラス(CPG)をネジ蓋付無菌微量遠心チューブに移した。オリゴヌクレオチドを切断し、同時に、塩基およびリン酸基を1.0mLのエタノール性アンモニアの混合物(1:3)中、55℃で5時間かけて脱保護した。遠心チューブを氷上で短時間冷却し、溶液を5mLの遠心チューブに移した。固体支持体を、50%CH3CN水溶液0.25mLを用いて3回洗浄し、洗浄液は元の溶液に加えた。遠心チューブを−80℃で15分間冷却し、溶液を凍結乾燥器中で乾燥させた。
【0163】
得られた白色の残渣は、200μLのトリエチルアミントリヒドロフルオリド中に再懸濁し、65℃で1.5時間加熱して、2’位にあるTBDMS基を除去した。次にオリゴヌクレオチドを乾燥メタノール(400μL)中で沈殿させた。液体を注意深く除去したところ、チューブの底にペレットが得られた。残ったメタノールを高速真空遠心機中で除去して、粗RNAを白色のふわふわした物質として得た。
【0164】
精製
試料を1mLのRNaseを含まない水に溶解し、260nmで定量した。粗オリゴヌクレオチドは、変性ゲル電気泳動(20%アクリルアミド、6M尿素)によって精製した。精製したオリゴヌクレオチドは、セファデックスG25M(米国ニュージャージー州ピスカタウェイ所在のアマシャム・バイオサイエンシズ・コーポレイション(Amersham Biosciences Corp))を用いて脱塩した。
【0165】
表3〜6は、合成された、記載のように修飾したオリゴヌクレオチドの配列を示したものである。
活性の測定
修飾オリゴヌクレオチドを、実施例1において上記したようにPDCとともにインキュベートし、IFN−α産生を測定した。表7は、末端チミジン以外はTLR9.2sと同じ塩基配列を有するが、1および2位、1、2、18および19位、1〜4および16〜19位、ならびに16〜19位に2’−フルオロまたは2’−O−メチル修飾を含むか、または完全にホスホロチオエートで置換された骨格を含むオリゴヌクレオチドについて得られた結果を、それぞれ、TLR9.2sについて測定されたIFN−α産生に対する%で表して示すものである。2’−フルオロ修飾は一般にこれらのオリゴヌクレオチドの免
疫刺激性活性への影響は少ないのに対し、2’−O−メチル修飾はこの活性をほぼ完全に無効にすることが明らかである。2’−フルオロ修飾に関しては、5’−GUCCUUCAA−3’(配列番号:1)モチーフから最も遠い5’末端のヌクレオチドのみを修飾すると、影響は最小限であるが、両端の4ヌクレオチドを修飾するとオリゴヌクレオチドの免疫刺激活性を著しく減退させた。ホスホロチオエートは、IFN−α誘導活性を穏やかに減退させた。
【0166】
したがって、たとえばヌクレアーゼによる分解から保護するために、本発明の免疫刺激性オリゴヌクレオチドを修飾することが望ましいようであれば、2’−フルオロ修飾を導入することにより、また好ましくは2’−フルオロ修飾を配列番号:1のヌクレオチドが非修飾のままであるように導入することによって達成することができる。しかしながら、配列番号:1を含むオリゴヌクレオチド、またはヌクレオチド配列番号:1由来の4以上、5以上、6以上、7以上または8以上の連続したヌクレオチド、たとえば、5’−GUCC−3’(配列番号:2),5’−GUCCU−3’(配列番号:3),5’−GUCCUU−3’(配列番号:4),5’−GUCCUUC−3’(配列番号:5),または5’−GUCCUUCA−3’(配列番号:6)を含むオリゴヌクレオチドを作成し、免疫刺激活性は回避することが望ましい場合、2’−O−メチル修飾を導入することにより、また好ましくは、2’−O−メチル修飾を、配列番号:1のヌクレオチドが修飾されるように導入することにより、達成することができる。
【0167】
【表1】

【0168】
【表2】

【0169】
【表3】

【0170】
【表4】

【0171】
【表5】

【0172】
【表6】

【0173】
表3〜6において、鎖は5’から3’の方向に示した。dTは2’−デオキシチミジンを示し、前に小文字の「s」が付いたものは5’−ホスホロチオエート基を表す。ロックト核酸は、後ろに「L」を付けて示した。前に小文字の「d」が付いたものはデオキシ残基を示す。前に「o」が付いたものは2’−O−メチル修飾ヌクレオチドを表す。前に「f」が付いたものは2’−フルオロヌクレオチドを示す。「T」は5−メチル−ウリジン
を表し、「mC5」は5−メチル−シチジンを表す。フルオロ修飾セットの配列のうち6つが「dT」突出部で終わっているのは、リボフルオロヌクレオシドを含む適切なCPGがこの時点では入手できなかったからである。これらは、2793、2794、2795、2797、2798、および2799である。「Extn coeff.e260*10−3」は、波長260nmにおけるオリゴヌクレオチドのモル吸光係数を(1000×l/(mol×cm)で割ったものである。
【0174】
【表7】

【0175】
【表8】

【0176】

【0177】

【特許請求の範囲】
【請求項1】
哺乳類における免疫応答を刺激する方法であって、 前記哺乳類に、配列番号:1からの、好ましくは当該配列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含むか、該配列で構成されるか、または、本質的に該配列で構成されるオリゴヌクレオチド剤を投与する工程を含む方法。
【請求項1】
哺乳類における免疫応答を刺激する方法であって、 前記哺乳類に、配列番号:1からの、好ましくは当該配列の5’末端からの、4以上、5以上、6以上、7以上、または8以上の連続したヌクレオチドの配列を含むか、該配列で構成されるか、または、本質的に該配列で構成されるオリゴヌクレオチド剤を投与する工程を含む方法。
【図1】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図6C】




【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図6C】


【公開番号】特開2012−31191(P2012−31191A)
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願番号】特願2011−221109(P2011−221109)
【出願日】平成23年10月5日(2011.10.5)
【分割の表示】特願2007−545671(P2007−545671)の分割
【原出願日】平成17年12月9日(2005.12.9)
【出願人】(505369158)アルナイラム ファーマシューティカルズ, インコーポレイテッド (51)
【氏名又は名称原語表記】ALNYLAM PHARMACEUTICALS, INC.
【出願人】(507189840)
【氏名又は名称原語表記】HARTMANN,Gunther
【出願人】(507189851)
【氏名又は名称原語表記】HORNUNG,Veit
【出願人】(507189862)
【氏名又は名称原語表記】ENDRES,Stefan
【Fターム(参考)】
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願日】平成23年10月5日(2011.10.5)
【分割の表示】特願2007−545671(P2007−545671)の分割
【原出願日】平成17年12月9日(2005.12.9)
【出願人】(505369158)アルナイラム ファーマシューティカルズ, インコーポレイテッド (51)
【氏名又は名称原語表記】ALNYLAM PHARMACEUTICALS, INC.
【出願人】(507189840)

【氏名又は名称原語表記】HARTMANN,Gunther
【出願人】(507189851)

【氏名又は名称原語表記】HORNUNG,Veit
【出願人】(507189862)

【氏名又は名称原語表記】ENDRES,Stefan
【Fターム(参考)】
[ Back to top ]

