唾液成分のオンチップ分析方法
【課題】本発明は、マイクロチップ電気泳動法において、唾液中のアミノ基を有する成分をオンチップで簡便、迅速かつ高精度に分析する方法を提供する。
【解決手段】2個のリザーバー1及び2の間が電気泳動用緩衝液を含むマイクロ流路で結ばれた電気泳動用マイクロチップを用いて、唾液中のアミノ基を有する成分をオンチップ分析する方法であって、(1)唾液及び蛍光ラベル化試薬をリザーバー1に導入して、これをオイルで被覆し、唾液中のアミノ基を有する成分を蛍光ラベル化する工程、及び(2)2個のリザーバー1及び2の間に電圧を印加して、上記(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1からリザーバー2の方向に移動させて分析を行う工程、を含むオンチップ分析方法。
【解決手段】2個のリザーバー1及び2の間が電気泳動用緩衝液を含むマイクロ流路で結ばれた電気泳動用マイクロチップを用いて、唾液中のアミノ基を有する成分をオンチップ分析する方法であって、(1)唾液及び蛍光ラベル化試薬をリザーバー1に導入して、これをオイルで被覆し、唾液中のアミノ基を有する成分を蛍光ラベル化する工程、及び(2)2個のリザーバー1及び2の間に電圧を印加して、上記(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1からリザーバー2の方向に移動させて分析を行う工程、を含むオンチップ分析方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、マイクロチップ電気泳動を用いた唾液中のアミノ酸や生体アミン類を高感度に分析する方法に関する。
【背景技術】
【0002】
近年、マイクロマシニング技術を用いて、分析装置の超小型化を図る研究が行われている。この様な、研究の背景には、小型、軽量、安価なオンチップ分析装置は医療や環境分析などの分野で要求されるオンサイト(on site)分析につながること、サンプルや溶媒
の消費量の低減化につながること、分析の高速化につながることなどが挙げられる。
【0003】
この分析装置として代表的なものがマイクロチップ電気泳動装置であり、通常、電気泳動装置本体と制御用PCから構成される。マイクロチップには、石英ガラス製又はポリメチルメタクリレート等のプラスチック製の電気泳動用チップが用いられている(特許文献1及び2)。
【0004】
電気泳動用チップを用いた場合、通常、オフラインで試料を蛍光ラベル化した後、これを電気泳動用チップのリザーバーに導入して、電気泳動分離、レーザー励起蛍光検出を行う方法が採用されている(非特許文献1)。しかし、オフラインで蛍光ラベル化の操作を行う場合、分析に時間がかかり分析操作が煩雑となるため迅速な分析が困難となる。
【0005】
また、近年、電気泳動用チップのマイクロチャネル(流路)でオンライン誘導体化を行う方法が報告されているが(非特許文献2)、この方法では、試料と蛍光ラベル化剤が瞬時に反応する必要がある、蛍光ラベル化剤導入用のリザーバーとチャネルを必要とする等問題点を有している。
【0006】
さらに、キャピラリー電気泳動法ではオンキャピラリー誘導体化法が報告されている(特許文献3)が、この場合もプラグとしてキャピラリー内に誘導体化試薬と分析試料を注入する為、これをチップに適用するには蛍光ラベル化剤導入用のリザーバーとチャネルが必要となり、チップの構造が複雑となる。
【特許文献1】特開2000−314719号公報
【特許文献2】特開2001−242138号公報
【特許文献3】米国特許第5318680号明細書
【非特許文献1】Anal. Chem. 1996, 68, 2044-2053
【非特許文献2】Anal. Chem. 1994, 66, 3472-3476
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明の主な目的は、マイクロチップ電気泳動法において、唾液中のアミノ基を有する成分をオンチップで簡便、迅速かつ高精度に分析する方法を提供することにある。具体的には、唾液中のアミノ基を有する成分をオンチップで蛍光ラベル化を行い、安定かつ精度の高い電気泳動原理を用いた流体制御法を用いて、簡便かつ迅速に分析する方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者は、上記した目的を達成すべく鋭意研究を重ねた結果、水系試料(唾液)と蛍光ラベル化試薬をマイクロチップ上のリザーバーに直接導入して、該リザーバー上で唾液中のアミノ基を有する成分を蛍光ラベル化することにより、試料導入・電気泳動分離・レ
ーザー励起蛍光検出の一連の操作が迅速かつ簡便に行えることを見出した。しかも、水系試料(唾液)と相溶性の低いオイルでリザーバー内の試料溶液を覆うことで、反応リザーバー(リザーバー1)からの溶媒の蒸発を抑制できること、また、マイクロ流路(チャネル)にある泳動緩衝溶液に、メチルセルロースを添加して粘性を持たせることにより、リザーバーからマイクロ流路への試料の拡散が抑制できることをも見出した。かかる知見に基づきさらに研究を行った結果、本発明を完成するに至った。
【0009】
すなわち、本発明は、下記の唾液中のアミノ基を有する成分のオンチップ分析方法を提供する。
【0010】
項1. 2個のリザーバー1及び2の間が電気泳動用緩衝液を含むマイクロ流路で結ばれたユニットを複数有する電気泳動用マイクロチップを用いて、唾液中のアミノ基を有する成分をオンチップ分析する方法であって、
(1)唾液及び蛍光ラベル化試薬をリザーバー1に導入して、これをオイルで被覆し、唾液中のアミノ基を有する成分を蛍光ラベル化する工程、及び
(2)2個のリザーバー1及び2の間に電圧を印加して、上記(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1からリザーバー2の方向に移動させて分析を行う工程、
を含むオンチップ分析方法。
【0011】
項2. 電気泳動用緩衝液が、メチルセルロースを含むホウ酸塩緩衝液である項1に記載のオンチップ分析方法。
【0012】
項3. 工程(1)で用いられる蛍光ラベル化試薬が、4−フルオロ−7−ニトロ−2,1,3−ベンズオキサジアゾールである項1に記載のオンチップ分析方法。
【0013】
項4. 工程(1)で用いられるオイルが、ポリ−α−オレフィンオイルである項1に記載のオンチップ分析方法。
【発明の効果】
【0014】
本発明の分析方法によれば、マイクロチップ電気泳動を用いて簡便かつ迅速に唾液中のアミノ酸や生体アミン類の高感度分析を行うことができる。
【0015】
また、リザーバー上でラベル化を実行する場合に、水系試料と混合しないオイルでリザーバーの試料溶液を覆うことで、反応中の溶媒の蒸発を回避できる。
【0016】
しかも、流路(チャネル)を満たす電気泳動用溶液にメチルセルロースを添加することにより粘性を持たせることで、リザーバーからのマイクロ流路への試料拡散が抑制できる。
【発明を実施するための最良の形態】
【0017】
以下、本発明について詳細に説明する。
【0018】
本発明で用いられる電気泳動用マイクロチップは、2個のリザーバー1及びリザーバー2の間が電気泳動用緩衝液を含むマイクロ流路で結ばれたユニットを複数(好ましくは3個以上)有している。複数のユニットはチップ上に設けられており、その配列の仕方は特に限定はなく、該ユニットのマイクロ流路は並列していても、交差していても良い。
【0019】
ここで、リザーバーとは、分析対象となる試料を受容するくぼみ部分を意味し、その形状は、必要量の試料溶液を満たすことができる形状であれば特に限定はない。オンチップ
で唾液中のアミノ基を有する成分を蛍光ラベル化することを考慮すると、通常、オイルの被膜が形成しやすい円形のものが好適である。リザーバー1は水系試料(唾液)を蛍光ラベル化試薬で蛍光ラベル化するための反応リザーバーとして用い、リザーバー2は後述する電気泳動によって試料が移動する先のリザーバーとして用いられる。
【0020】
マイクロ流路は、電気泳動用緩衝液が満たされ蛍光ラベル化されたアミノ基を有する成分が移動できるものであれば特に限定はなく、例えば、深さ10〜200μm、幅20〜200μmの溝であればよい。また、マイクロ流路の長さは通常、1〜100mm(好ましくは5〜20mm)である。該マイクロ流路は、試料や溶液の乾燥等を防ぐため通常チップ内部に形成されている。
【0021】
また、電気泳動用マイクロチップとは、上記した複数のリザーバーと複数の溝(マイクロ流路)が形成されたチップを意味し、分析実験室で行われる試料の前処理、電気泳動分離や検出機能を集積化したチップに相当する。該マイクロチップは、分析に用いる試薬や試料により影響を受けない材質(例えば、ガラス、透明プラスチック等)で構成されている。
【0022】
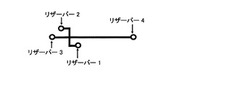
本発明で用いられる電気泳動型ラボチップの一実施例を図1に示す。これを用いて具体的に説明する。但しこれに限定されるものではない。
【0023】
図1の電気泳動用マイクロチップは、リザーバー1、リザーバー2及びこれらを結ぶマイクロ流路Aを有し、リザーバー3、リザーバー4及びこれらを結ぶマイクロ流路Bを有している。マイクロ流路Aとマイクロ流路Bとは交差しており、マイクロ流路Bの交差部からリザーバー4までがアミノ基を有する成分の分析流路として機能する。有効長は交差部から検出部までである。
【0024】
電気泳動用マイクロチップ上には、上記のリザーバー1〜4、並びにマイクロ流路A及びBを含む構成が、1又は2以上設けられていても良い。
【0025】
リザーバー1〜4の形状は、必要量の溶液を満たすことができる形状であれば特に限定はなく、通常、オイルの被膜が形成しやすい円形のものが好適である。
【0026】
流路A及びBは、電気泳動用緩衝液が満たされ蛍光ラベル化されたアミノ基を有する成分が移動できるものであれば特に限定はなく、例えば、深さ10〜200μm、幅20〜200μmの溝であればよい。また、流路Aは、試料導入するためのものであるから、その長さは通常、1〜100mm(好ましくは5〜20mm)である。流路Bは、分離するためのものであるから、その長さは通常、5〜500mm(好ましくは5〜50mm)であり、アミノ基を有する成分の分析流路として機能する交差部からリザーバー4までの長さは5mm以上(好ましくは10〜500mm)である。
【0027】
電気泳動用マイクロチップの具体例としては、例えば、DNA用i−チップIC−9001(日立ハイテクノロジーズ社製)、Type U [50×20]、Type D [110×50](島津製作
所製)等が例示される。
【0028】
本発明は上記電気泳動用マイクロチップを用いて、唾液中のアミノ基を有する成分をオンチップ分析する方法である。具体的には、次の工程を含むものである。
(1)唾液及び蛍光ラベル化試薬をリザーバー1に導入して、これをオイルで被覆し、唾液中のアミノ基を有する成分を蛍光ラベル化する工程、及び
(2)2個のリザーバー1及び2の間に電圧を印加して、上記(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1からリザーバー2の方向に移動させて
分析を行う工程。
【0029】
上記工程(1)の試料である唾液とは、ヒト或いは動物の唾液であれば特に限定はなく、そのまま試料として用いることもでき、必要に応じて水等で希釈してもよい。唾液成分の中には、ストレスに応じて増減が観測されるアミノ基を有する成分などのストレス指標物質が存在し、かかるストレス増減を定量的かつ高精度に測定することにより、ストレス評価実験に適用することが可能である。唾液成分中のストレス指標物質としては、例えば、アミノ酸(グリシン等)、カテコールアミン類(ドーパミン、エピネフリン、ノルエピネフリン等)、クロモグラニンA、コルチゾール,分泌型免疫イムノグロブリンA(sIgA
)等が例示される。
【0030】
上記工程(1)で用いられる蛍光ラベル化試薬とは、微量な目的成分であるアミノ基を有する成分を高感度に検出するために、該アミノ基を有する成分のアミノ基と容易に反応してラベル化し、より光感受性の高い物質に変換できる試薬であればよい。例えば、OPA
(o−フタルアルデヒド)、DPS−Cl(4-(5,6-ジメトキシ-1,3-ジハイドロ-1-オキソ-2H-イソインドール-2-イル)ベンゼンスルホニルクロライド)、NBD−Cl
(4−クロロ−7−ニトロ−2,1,3−ベンズオキサジアゾール)、NBD−F(4−フルオロ−7−ニトロ−2,1,3−ベンズオキサジアゾール)、Phisyl−Cl(4-(1,3-ジヒドロ-1-オキソ-2H-イソインドール-2-イル)ベンゼンスルホニルクロライド)、DNBC(3,5-ジニトロベンゾイクロリド)、FITC(フルオレセインイソチオシアネ
ート)、等が例示される。このうち、温和な条件下において短時間で反応が進行する点からNBD−FやOPA等が望ましい。
【0031】
蛍光ラベル化試薬は、唾液とともにリザーバー1に導入する前に、唾液に含まれる水と相溶性のある極性有機溶媒に溶解させて溶液として使用する。該極性有機溶媒としては、アセトニトリル、ジオキサン、メタノール、ジメチルスルホキシド等が例示され、特に、反応性の点から、アセトニトリルが好適である。蛍光ラベル化試薬のアセトニトリルの濃度は、通常、5〜50体積%までであればよい。好ましくは、1〜50mMのNBD−Fアセトニトリル溶液である。
【0032】
上記の唾液と蛍光ラベル化試薬の溶液をリザーバー1に導入して、リザーバー1上でオンチップで唾液中のアミノ基を有する成分を蛍光ラベル化する場合、ラベル化反応に要する時間の間に、溶媒(特に、極性有機溶媒のアセトニトリル等)が蒸発してしまう場合がある。溶媒が蒸発すると、反応リザーバー中の試料濃度が変化し、定量が不可能となる。
【0033】
しかし、唾液と蛍光ラベル化試薬の溶液をリザーバー1に導入した後に、所定のオイルを用いてリザーバー上の試料を覆うことにより上記の問題点が解消される。即ち、水性の試料溶液の全面を水と相溶せず水より比重の小さいオイルで被覆することにより、試料中の極性有機溶媒の気散、蒸発を抑制することができるのである。これにより、より高精度の分析が可能となる。上記のオイルとしては、ポリ−α−オレフィンオイル、ミネラルオイル等が例示される。
【0034】
唾液と蛍光ラベル化試薬の反応は、通常、リザーバー1に唾液を導入して、これに25〜150mMホウ酸塩緩衝液(pH8〜10)を等量加えて、弱塩基性に調製し、これに蛍光ラベル化試薬の溶液を加えて行う。反応条件は、通常、室温(20〜30℃)で3〜15分であればよい。
【0035】
この場合、pH調製した唾液試料、蛍光ラベル化試薬の溶液、オイルの使用量は、それぞれの特性にも依存するが、通常、蛍光ラベル化試薬の溶液1容量部に対し、pH調製した唾液試料1〜10容量部、オイル1〜10容量部にすることが好ましい。これにより、
オイルがリザーバーの試料溶液を完全に被覆することができ、極性有機溶媒の蒸発を抑制できるからである。
【0036】
本発明において、該マイクロ流路A及びBに有する電気泳動用緩衝液として、通常、25〜150mMホウ酸塩緩衝液(pH8〜10)が、用いられる。この場合、リザーバー1においてラベル化反応の時間が長い場合、反応中にマイクロ流路へ試料の拡散が生じる場合がある。しかし、電気泳動用緩衝液に、粘度の高い(例えば、0.1〜5.0体積%)メチルセルロース等を添加したホウ酸塩緩衝液を用いると、かかる試料の拡散が抑制される。電気泳動用緩衝液中の粘性物質の濃度は該粘性物質の粘性にもよるが、チャネル内に導入できる程度(例えばメチルセルロースの場合0.1〜1.5%)であればよい。
【0037】
上記のようにして唾液中のアミノ基を有する成分が効果的に蛍光ラベル化される。
【0038】
次に、上記工程(2)では、工程(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1とリザーバー2の間に電圧を印加して、リザーバー1からマイクロ流路を通ってリザーバー2の方向へ移動
させて分析を行う。分析は、マイクロチップ電気泳動装置を用いて行う。
【0039】
工程(2)は、いずれも公知の方法を用いて実施することができる。例えば、非特許文献1(Anal. Chem. 1996, 68, 2044-2053)の記載に従い或いは準じて実施できる。マイ
クロチップ電気泳動装置としては、コスモアイSV1100(日立ハイテクノロジーズ社製)、MCE-2010(島津製作所製)等が例示される。
【実施例】
【0040】
以下に、実施例に基づいて本発明をより詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【0041】
実施例1(唾液成分のオンチップ蛍光ラベル化条件の予備的検討)
(1)蛍光ラベル化試薬の選定
アミノ基と短時間で反応する蛍光ラベル化試薬として、市販のマイクロチップ電気泳動(MCE)装置の検出波長(励起波長473 nm,蛍光検出波長580 nm以上)を考慮した上で,カテコールアミン類との反応が報告されている蛍光ラベル化試薬4-fluoro-7-nitro-2,1,3- benzoxadiazole (NBD-F)を選定した(X. Zhu, P.N. Shaw, D.A. Barrett, Anal. Chim. Acta, 478 (2003) 259-269.)。唾液にはアミノ酸なども多数含まれておりNBD-Fと反
応する(E. Soderling, K.Parto, O. Simell, Braz. J. Oral. Sci., 1 (2002) 40-43. P. Coufal, J. Zuska, T. van de Goor, V. Smith, B. Gas, Electrophoresis, 24 (2003) 671-677.)。
図2に,アミノ酸及びカテコールアミンとNBD-Fとの反応式を示す。
【0042】
(2)蛍光ラベル化試薬との反応条件
図2のグリシン(R=H)及びノルエピネフリン(R1=H,R2=OH)を標準試料として用い,各標準溶液に対して50mMホウ酸塩緩衝液(pH8.0)を等量加えてpH調整し、
この液に等量の25mM NBD-Fアセトニトリル溶液を加えて反応させた。室温放置(グリシン溶液:約5分,ノルエピネフリン溶液:15〜30分)した液につき,NBD-Fラベル化反応生成物を質量スペクトルで確認した。
【0043】
図3に示すとおり,ノルエピネフリンでは3種類の反応生成物をすべて検出した。(a
)は正イオンモードの質量スペクトルであり、ラベル化反応時間30分,250 μMノルエピ
ネフリン反応液に対し,0.05%ギ酸を含む水及びメタノール混液(1:1)で50倍希釈した
。試料導入量は3 μL/minであった。(b)は負イオンモードの質量スペクトルであり、
ラベル化反応時間15分,250 μMノルエピネフリン反応液に対し,水及び2-プロパノール
混液(1:1)で10倍希釈した。試料導入量は2 μL/minであった。
【0044】
(3)オンチップラベル化条件の検討
ヒト唾液を用いて,前述のラベル化条件でオンチップラベル化を実施し,蛍光顕微鏡を用いて状態観察を行った。その結果,反応中にアセトニトリルの揮発が認められた(図4)。
【0045】
ミネラルオイルとポリ-α-オレフィンオイルを検討したところ,低粘性で取り扱いやすく,添加したときのオイル層も広がりやすいポリ-α-オレフィンオイルを選択した。
【0046】
反応リザーバー全面を一様にカバーする条件を得るために,アセトニトリルの比率変更も必要となった。なお,水:アセトニトリル(唾液:NBD-Fアセトニトリル溶液)の体積
比率を9:1に低減させても蛍光ラベル化反応に支障がないことは,アミノ酸のプレラベル化標準試料を用いてマイクロチップ電気泳動で確認した(図5)。
(a)は、唾液 5 μL, NBD-F溶液 5 μL, オイル 5 μLであり、(b)は、唾液 9 μL, NBD-F溶液 1 μL, オイル 5 μLであり、(c)は、唾液 8 μL, NBD-F溶液 1 μL, オイル 6
μLである。
【0047】
以上より,オンチップラベル化条件は唾液 8 μL, NBD-Fアセトニトリル溶液 1 μL,
ポリ-α-オレフィンオイル 6 μLが好適であることが分かった。
【0048】
実施例2(MCE法における分離分析条件の検討)
(1)プレラベル化試料による検討
アミノ酸標準溶液(a)及びヒト唾液試料(b)に対し,50mMホウ酸塩緩衝液(pH8.0)を等
量加えてpH調整し,この液に等量の25mM NBD-Fアセトニトリル溶液を加えてラベル化した(室温,15分間放置)。これらの試料につき,MCE法で測定した。このとき,マイクロチ
ップ流路のプレコンディショニング(流路表面の平衡化)を測定直前に実施することで,分析再現性の大幅な向上が図れることが分かった。
【0049】
また、電気泳動液にメチルセルロースを添加することで唾液の個人差による影響を受けにくい頑健性の高い下記の分析条件を見出しこれを適用することで,唾液中成分(アミノ酸類と推定)の測定を行った。(図6)。
<装置>
マイクロチップ電気泳動装置:コスモアイSV1100(日立ハイテクノロジーズ)
プラスチック製マイクロチップ:DNA用i-チップ IC-9001(日立ハイテクノロジーズ)
(流路幅100 μm,深さ30 μm,有効分離流路長30 mm)
<電気泳動液>
1.0%(w/v)メチルセルロースを含む50 mMホウ酸塩緩衝液(pH 9.3)
<泳動条件>
図1に記載のプラスチック製マイクロチップを用いて、下記の泳動条件で測定を行った。
【0050】
【表1】

<試料検出>
励起波長473 nm,蛍光波長580 nm以上を用いて、試料の検出を行った。その結果を図6に示す。
【0051】
(2)オンチップラベル化への適用
実施例1(3)で定めたオンチップラベル化反応条件(試料溶液 8 μL, NBD-F溶液 1 μL, オイル 6 μL)で,反応中のマイクロチップ流路への試料拡散について検証した。
その結果,15分で約1.8 mm,30分で約2.9 mmの流路への流入が認められた(図7)。
【0052】
(3)プレラベル化及びオンチップラベル化ヒト唾液の比較
プレラベル化したヒト唾液及びオンチップラベル化したヒト唾液について,ラベル化反応時間を室温15分間とし,MCE法で測定を行った。ラベル化反応率及び試料導入量に若干
の相違は認められているが,両者で類似した泳動結果が得られた(図8)。
【0053】
また,チップ流路の交差部分に到達していない程度の試料拡散では,分離分析への影響が軽微であるとの確証を得た。以上より,NBD-Fによるオンチップラベル化法が実用可能
であることが明らかとなった(図8)。
【0054】
比較例1
オイル皮膜なしの場合、図4に示すように反応中に試料中の溶媒が蒸発してしまい、測定値から濃度を定量できなくなる。
【0055】
比較例2
緩衝液にメチルセルロースを含まない場合、ラベル化反応中に拡散により試料がチップチャネル内へ流れ込んでしまう。メチルセルロース添加により試料拡散を電気泳動分離に影響がないように最小限に抑えている。
【図面の簡単な説明】
【0056】
【図1】実施例2(1)で使用するプラスチック製マイクロチップ流路部の模式図を示す。
【図2】実施例1(1)におけるアミノ酸及びカテコールアミンとNBD−Fとの反応式を示す。
【図3】実施例1(2)におけるノルエピネフリンのNBDラベル化反応生成物の質量スペクトルを示す。
【図4】実施例1(3)におけるリザーバーでラベル化したときの蛍光顕微鏡観察図である。
【図5】実施例1(3)におけるリザーバーへのポリ−α−オレフィンオイルを添加したときの蛍光顕微鏡観察図である。
【図6】実施例2(1)におけるプレラベル化したアミノ酸標準溶液(a)及びヒト唾液試料(b)の泳動結果を示す。
【図7】実施例2(2)におけるオンチップラベル化時の試料拡散(30分)の様子を示す。
【図8】実施例2(3)におけるプレラベル化試料(a)及びオンチップラベル化試料(b)の泳動結果を示す。
【技術分野】
【0001】
本発明は、マイクロチップ電気泳動を用いた唾液中のアミノ酸や生体アミン類を高感度に分析する方法に関する。
【背景技術】
【0002】
近年、マイクロマシニング技術を用いて、分析装置の超小型化を図る研究が行われている。この様な、研究の背景には、小型、軽量、安価なオンチップ分析装置は医療や環境分析などの分野で要求されるオンサイト(on site)分析につながること、サンプルや溶媒
の消費量の低減化につながること、分析の高速化につながることなどが挙げられる。
【0003】
この分析装置として代表的なものがマイクロチップ電気泳動装置であり、通常、電気泳動装置本体と制御用PCから構成される。マイクロチップには、石英ガラス製又はポリメチルメタクリレート等のプラスチック製の電気泳動用チップが用いられている(特許文献1及び2)。
【0004】
電気泳動用チップを用いた場合、通常、オフラインで試料を蛍光ラベル化した後、これを電気泳動用チップのリザーバーに導入して、電気泳動分離、レーザー励起蛍光検出を行う方法が採用されている(非特許文献1)。しかし、オフラインで蛍光ラベル化の操作を行う場合、分析に時間がかかり分析操作が煩雑となるため迅速な分析が困難となる。
【0005】
また、近年、電気泳動用チップのマイクロチャネル(流路)でオンライン誘導体化を行う方法が報告されているが(非特許文献2)、この方法では、試料と蛍光ラベル化剤が瞬時に反応する必要がある、蛍光ラベル化剤導入用のリザーバーとチャネルを必要とする等問題点を有している。
【0006】
さらに、キャピラリー電気泳動法ではオンキャピラリー誘導体化法が報告されている(特許文献3)が、この場合もプラグとしてキャピラリー内に誘導体化試薬と分析試料を注入する為、これをチップに適用するには蛍光ラベル化剤導入用のリザーバーとチャネルが必要となり、チップの構造が複雑となる。
【特許文献1】特開2000−314719号公報
【特許文献2】特開2001−242138号公報
【特許文献3】米国特許第5318680号明細書
【非特許文献1】Anal. Chem. 1996, 68, 2044-2053
【非特許文献2】Anal. Chem. 1994, 66, 3472-3476
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明の主な目的は、マイクロチップ電気泳動法において、唾液中のアミノ基を有する成分をオンチップで簡便、迅速かつ高精度に分析する方法を提供することにある。具体的には、唾液中のアミノ基を有する成分をオンチップで蛍光ラベル化を行い、安定かつ精度の高い電気泳動原理を用いた流体制御法を用いて、簡便かつ迅速に分析する方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者は、上記した目的を達成すべく鋭意研究を重ねた結果、水系試料(唾液)と蛍光ラベル化試薬をマイクロチップ上のリザーバーに直接導入して、該リザーバー上で唾液中のアミノ基を有する成分を蛍光ラベル化することにより、試料導入・電気泳動分離・レ
ーザー励起蛍光検出の一連の操作が迅速かつ簡便に行えることを見出した。しかも、水系試料(唾液)と相溶性の低いオイルでリザーバー内の試料溶液を覆うことで、反応リザーバー(リザーバー1)からの溶媒の蒸発を抑制できること、また、マイクロ流路(チャネル)にある泳動緩衝溶液に、メチルセルロースを添加して粘性を持たせることにより、リザーバーからマイクロ流路への試料の拡散が抑制できることをも見出した。かかる知見に基づきさらに研究を行った結果、本発明を完成するに至った。
【0009】
すなわち、本発明は、下記の唾液中のアミノ基を有する成分のオンチップ分析方法を提供する。
【0010】
項1. 2個のリザーバー1及び2の間が電気泳動用緩衝液を含むマイクロ流路で結ばれたユニットを複数有する電気泳動用マイクロチップを用いて、唾液中のアミノ基を有する成分をオンチップ分析する方法であって、
(1)唾液及び蛍光ラベル化試薬をリザーバー1に導入して、これをオイルで被覆し、唾液中のアミノ基を有する成分を蛍光ラベル化する工程、及び
(2)2個のリザーバー1及び2の間に電圧を印加して、上記(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1からリザーバー2の方向に移動させて分析を行う工程、
を含むオンチップ分析方法。
【0011】
項2. 電気泳動用緩衝液が、メチルセルロースを含むホウ酸塩緩衝液である項1に記載のオンチップ分析方法。
【0012】
項3. 工程(1)で用いられる蛍光ラベル化試薬が、4−フルオロ−7−ニトロ−2,1,3−ベンズオキサジアゾールである項1に記載のオンチップ分析方法。
【0013】
項4. 工程(1)で用いられるオイルが、ポリ−α−オレフィンオイルである項1に記載のオンチップ分析方法。
【発明の効果】
【0014】
本発明の分析方法によれば、マイクロチップ電気泳動を用いて簡便かつ迅速に唾液中のアミノ酸や生体アミン類の高感度分析を行うことができる。
【0015】
また、リザーバー上でラベル化を実行する場合に、水系試料と混合しないオイルでリザーバーの試料溶液を覆うことで、反応中の溶媒の蒸発を回避できる。
【0016】
しかも、流路(チャネル)を満たす電気泳動用溶液にメチルセルロースを添加することにより粘性を持たせることで、リザーバーからのマイクロ流路への試料拡散が抑制できる。
【発明を実施するための最良の形態】
【0017】
以下、本発明について詳細に説明する。
【0018】
本発明で用いられる電気泳動用マイクロチップは、2個のリザーバー1及びリザーバー2の間が電気泳動用緩衝液を含むマイクロ流路で結ばれたユニットを複数(好ましくは3個以上)有している。複数のユニットはチップ上に設けられており、その配列の仕方は特に限定はなく、該ユニットのマイクロ流路は並列していても、交差していても良い。
【0019】
ここで、リザーバーとは、分析対象となる試料を受容するくぼみ部分を意味し、その形状は、必要量の試料溶液を満たすことができる形状であれば特に限定はない。オンチップ
で唾液中のアミノ基を有する成分を蛍光ラベル化することを考慮すると、通常、オイルの被膜が形成しやすい円形のものが好適である。リザーバー1は水系試料(唾液)を蛍光ラベル化試薬で蛍光ラベル化するための反応リザーバーとして用い、リザーバー2は後述する電気泳動によって試料が移動する先のリザーバーとして用いられる。
【0020】
マイクロ流路は、電気泳動用緩衝液が満たされ蛍光ラベル化されたアミノ基を有する成分が移動できるものであれば特に限定はなく、例えば、深さ10〜200μm、幅20〜200μmの溝であればよい。また、マイクロ流路の長さは通常、1〜100mm(好ましくは5〜20mm)である。該マイクロ流路は、試料や溶液の乾燥等を防ぐため通常チップ内部に形成されている。
【0021】
また、電気泳動用マイクロチップとは、上記した複数のリザーバーと複数の溝(マイクロ流路)が形成されたチップを意味し、分析実験室で行われる試料の前処理、電気泳動分離や検出機能を集積化したチップに相当する。該マイクロチップは、分析に用いる試薬や試料により影響を受けない材質(例えば、ガラス、透明プラスチック等)で構成されている。
【0022】
本発明で用いられる電気泳動型ラボチップの一実施例を図1に示す。これを用いて具体的に説明する。但しこれに限定されるものではない。
【0023】
図1の電気泳動用マイクロチップは、リザーバー1、リザーバー2及びこれらを結ぶマイクロ流路Aを有し、リザーバー3、リザーバー4及びこれらを結ぶマイクロ流路Bを有している。マイクロ流路Aとマイクロ流路Bとは交差しており、マイクロ流路Bの交差部からリザーバー4までがアミノ基を有する成分の分析流路として機能する。有効長は交差部から検出部までである。
【0024】
電気泳動用マイクロチップ上には、上記のリザーバー1〜4、並びにマイクロ流路A及びBを含む構成が、1又は2以上設けられていても良い。
【0025】
リザーバー1〜4の形状は、必要量の溶液を満たすことができる形状であれば特に限定はなく、通常、オイルの被膜が形成しやすい円形のものが好適である。
【0026】
流路A及びBは、電気泳動用緩衝液が満たされ蛍光ラベル化されたアミノ基を有する成分が移動できるものであれば特に限定はなく、例えば、深さ10〜200μm、幅20〜200μmの溝であればよい。また、流路Aは、試料導入するためのものであるから、その長さは通常、1〜100mm(好ましくは5〜20mm)である。流路Bは、分離するためのものであるから、その長さは通常、5〜500mm(好ましくは5〜50mm)であり、アミノ基を有する成分の分析流路として機能する交差部からリザーバー4までの長さは5mm以上(好ましくは10〜500mm)である。
【0027】
電気泳動用マイクロチップの具体例としては、例えば、DNA用i−チップIC−9001(日立ハイテクノロジーズ社製)、Type U [50×20]、Type D [110×50](島津製作
所製)等が例示される。
【0028】
本発明は上記電気泳動用マイクロチップを用いて、唾液中のアミノ基を有する成分をオンチップ分析する方法である。具体的には、次の工程を含むものである。
(1)唾液及び蛍光ラベル化試薬をリザーバー1に導入して、これをオイルで被覆し、唾液中のアミノ基を有する成分を蛍光ラベル化する工程、及び
(2)2個のリザーバー1及び2の間に電圧を印加して、上記(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1からリザーバー2の方向に移動させて
分析を行う工程。
【0029】
上記工程(1)の試料である唾液とは、ヒト或いは動物の唾液であれば特に限定はなく、そのまま試料として用いることもでき、必要に応じて水等で希釈してもよい。唾液成分の中には、ストレスに応じて増減が観測されるアミノ基を有する成分などのストレス指標物質が存在し、かかるストレス増減を定量的かつ高精度に測定することにより、ストレス評価実験に適用することが可能である。唾液成分中のストレス指標物質としては、例えば、アミノ酸(グリシン等)、カテコールアミン類(ドーパミン、エピネフリン、ノルエピネフリン等)、クロモグラニンA、コルチゾール,分泌型免疫イムノグロブリンA(sIgA
)等が例示される。
【0030】
上記工程(1)で用いられる蛍光ラベル化試薬とは、微量な目的成分であるアミノ基を有する成分を高感度に検出するために、該アミノ基を有する成分のアミノ基と容易に反応してラベル化し、より光感受性の高い物質に変換できる試薬であればよい。例えば、OPA
(o−フタルアルデヒド)、DPS−Cl(4-(5,6-ジメトキシ-1,3-ジハイドロ-1-オキソ-2H-イソインドール-2-イル)ベンゼンスルホニルクロライド)、NBD−Cl
(4−クロロ−7−ニトロ−2,1,3−ベンズオキサジアゾール)、NBD−F(4−フルオロ−7−ニトロ−2,1,3−ベンズオキサジアゾール)、Phisyl−Cl(4-(1,3-ジヒドロ-1-オキソ-2H-イソインドール-2-イル)ベンゼンスルホニルクロライド)、DNBC(3,5-ジニトロベンゾイクロリド)、FITC(フルオレセインイソチオシアネ
ート)、等が例示される。このうち、温和な条件下において短時間で反応が進行する点からNBD−FやOPA等が望ましい。
【0031】
蛍光ラベル化試薬は、唾液とともにリザーバー1に導入する前に、唾液に含まれる水と相溶性のある極性有機溶媒に溶解させて溶液として使用する。該極性有機溶媒としては、アセトニトリル、ジオキサン、メタノール、ジメチルスルホキシド等が例示され、特に、反応性の点から、アセトニトリルが好適である。蛍光ラベル化試薬のアセトニトリルの濃度は、通常、5〜50体積%までであればよい。好ましくは、1〜50mMのNBD−Fアセトニトリル溶液である。
【0032】
上記の唾液と蛍光ラベル化試薬の溶液をリザーバー1に導入して、リザーバー1上でオンチップで唾液中のアミノ基を有する成分を蛍光ラベル化する場合、ラベル化反応に要する時間の間に、溶媒(特に、極性有機溶媒のアセトニトリル等)が蒸発してしまう場合がある。溶媒が蒸発すると、反応リザーバー中の試料濃度が変化し、定量が不可能となる。
【0033】
しかし、唾液と蛍光ラベル化試薬の溶液をリザーバー1に導入した後に、所定のオイルを用いてリザーバー上の試料を覆うことにより上記の問題点が解消される。即ち、水性の試料溶液の全面を水と相溶せず水より比重の小さいオイルで被覆することにより、試料中の極性有機溶媒の気散、蒸発を抑制することができるのである。これにより、より高精度の分析が可能となる。上記のオイルとしては、ポリ−α−オレフィンオイル、ミネラルオイル等が例示される。
【0034】
唾液と蛍光ラベル化試薬の反応は、通常、リザーバー1に唾液を導入して、これに25〜150mMホウ酸塩緩衝液(pH8〜10)を等量加えて、弱塩基性に調製し、これに蛍光ラベル化試薬の溶液を加えて行う。反応条件は、通常、室温(20〜30℃)で3〜15分であればよい。
【0035】
この場合、pH調製した唾液試料、蛍光ラベル化試薬の溶液、オイルの使用量は、それぞれの特性にも依存するが、通常、蛍光ラベル化試薬の溶液1容量部に対し、pH調製した唾液試料1〜10容量部、オイル1〜10容量部にすることが好ましい。これにより、
オイルがリザーバーの試料溶液を完全に被覆することができ、極性有機溶媒の蒸発を抑制できるからである。
【0036】
本発明において、該マイクロ流路A及びBに有する電気泳動用緩衝液として、通常、25〜150mMホウ酸塩緩衝液(pH8〜10)が、用いられる。この場合、リザーバー1においてラベル化反応の時間が長い場合、反応中にマイクロ流路へ試料の拡散が生じる場合がある。しかし、電気泳動用緩衝液に、粘度の高い(例えば、0.1〜5.0体積%)メチルセルロース等を添加したホウ酸塩緩衝液を用いると、かかる試料の拡散が抑制される。電気泳動用緩衝液中の粘性物質の濃度は該粘性物質の粘性にもよるが、チャネル内に導入できる程度(例えばメチルセルロースの場合0.1〜1.5%)であればよい。
【0037】
上記のようにして唾液中のアミノ基を有する成分が効果的に蛍光ラベル化される。
【0038】
次に、上記工程(2)では、工程(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1とリザーバー2の間に電圧を印加して、リザーバー1からマイクロ流路を通ってリザーバー2の方向へ移動
させて分析を行う。分析は、マイクロチップ電気泳動装置を用いて行う。
【0039】
工程(2)は、いずれも公知の方法を用いて実施することができる。例えば、非特許文献1(Anal. Chem. 1996, 68, 2044-2053)の記載に従い或いは準じて実施できる。マイ
クロチップ電気泳動装置としては、コスモアイSV1100(日立ハイテクノロジーズ社製)、MCE-2010(島津製作所製)等が例示される。
【実施例】
【0040】
以下に、実施例に基づいて本発明をより詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【0041】
実施例1(唾液成分のオンチップ蛍光ラベル化条件の予備的検討)
(1)蛍光ラベル化試薬の選定
アミノ基と短時間で反応する蛍光ラベル化試薬として、市販のマイクロチップ電気泳動(MCE)装置の検出波長(励起波長473 nm,蛍光検出波長580 nm以上)を考慮した上で,カテコールアミン類との反応が報告されている蛍光ラベル化試薬4-fluoro-7-nitro-2,1,3- benzoxadiazole (NBD-F)を選定した(X. Zhu, P.N. Shaw, D.A. Barrett, Anal. Chim. Acta, 478 (2003) 259-269.)。唾液にはアミノ酸なども多数含まれておりNBD-Fと反
応する(E. Soderling, K.Parto, O. Simell, Braz. J. Oral. Sci., 1 (2002) 40-43. P. Coufal, J. Zuska, T. van de Goor, V. Smith, B. Gas, Electrophoresis, 24 (2003) 671-677.)。
図2に,アミノ酸及びカテコールアミンとNBD-Fとの反応式を示す。
【0042】
(2)蛍光ラベル化試薬との反応条件
図2のグリシン(R=H)及びノルエピネフリン(R1=H,R2=OH)を標準試料として用い,各標準溶液に対して50mMホウ酸塩緩衝液(pH8.0)を等量加えてpH調整し、
この液に等量の25mM NBD-Fアセトニトリル溶液を加えて反応させた。室温放置(グリシン溶液:約5分,ノルエピネフリン溶液:15〜30分)した液につき,NBD-Fラベル化反応生成物を質量スペクトルで確認した。
【0043】
図3に示すとおり,ノルエピネフリンでは3種類の反応生成物をすべて検出した。(a
)は正イオンモードの質量スペクトルであり、ラベル化反応時間30分,250 μMノルエピ
ネフリン反応液に対し,0.05%ギ酸を含む水及びメタノール混液(1:1)で50倍希釈した
。試料導入量は3 μL/minであった。(b)は負イオンモードの質量スペクトルであり、
ラベル化反応時間15分,250 μMノルエピネフリン反応液に対し,水及び2-プロパノール
混液(1:1)で10倍希釈した。試料導入量は2 μL/minであった。
【0044】
(3)オンチップラベル化条件の検討
ヒト唾液を用いて,前述のラベル化条件でオンチップラベル化を実施し,蛍光顕微鏡を用いて状態観察を行った。その結果,反応中にアセトニトリルの揮発が認められた(図4)。
【0045】
ミネラルオイルとポリ-α-オレフィンオイルを検討したところ,低粘性で取り扱いやすく,添加したときのオイル層も広がりやすいポリ-α-オレフィンオイルを選択した。
【0046】
反応リザーバー全面を一様にカバーする条件を得るために,アセトニトリルの比率変更も必要となった。なお,水:アセトニトリル(唾液:NBD-Fアセトニトリル溶液)の体積
比率を9:1に低減させても蛍光ラベル化反応に支障がないことは,アミノ酸のプレラベル化標準試料を用いてマイクロチップ電気泳動で確認した(図5)。
(a)は、唾液 5 μL, NBD-F溶液 5 μL, オイル 5 μLであり、(b)は、唾液 9 μL, NBD-F溶液 1 μL, オイル 5 μLであり、(c)は、唾液 8 μL, NBD-F溶液 1 μL, オイル 6
μLである。
【0047】
以上より,オンチップラベル化条件は唾液 8 μL, NBD-Fアセトニトリル溶液 1 μL,
ポリ-α-オレフィンオイル 6 μLが好適であることが分かった。
【0048】
実施例2(MCE法における分離分析条件の検討)
(1)プレラベル化試料による検討
アミノ酸標準溶液(a)及びヒト唾液試料(b)に対し,50mMホウ酸塩緩衝液(pH8.0)を等
量加えてpH調整し,この液に等量の25mM NBD-Fアセトニトリル溶液を加えてラベル化した(室温,15分間放置)。これらの試料につき,MCE法で測定した。このとき,マイクロチ
ップ流路のプレコンディショニング(流路表面の平衡化)を測定直前に実施することで,分析再現性の大幅な向上が図れることが分かった。
【0049】
また、電気泳動液にメチルセルロースを添加することで唾液の個人差による影響を受けにくい頑健性の高い下記の分析条件を見出しこれを適用することで,唾液中成分(アミノ酸類と推定)の測定を行った。(図6)。
<装置>
マイクロチップ電気泳動装置:コスモアイSV1100(日立ハイテクノロジーズ)
プラスチック製マイクロチップ:DNA用i-チップ IC-9001(日立ハイテクノロジーズ)
(流路幅100 μm,深さ30 μm,有効分離流路長30 mm)
<電気泳動液>
1.0%(w/v)メチルセルロースを含む50 mMホウ酸塩緩衝液(pH 9.3)
<泳動条件>
図1に記載のプラスチック製マイクロチップを用いて、下記の泳動条件で測定を行った。
【0050】
【表1】

<試料検出>
励起波長473 nm,蛍光波長580 nm以上を用いて、試料の検出を行った。その結果を図6に示す。
【0051】
(2)オンチップラベル化への適用
実施例1(3)で定めたオンチップラベル化反応条件(試料溶液 8 μL, NBD-F溶液 1 μL, オイル 6 μL)で,反応中のマイクロチップ流路への試料拡散について検証した。
その結果,15分で約1.8 mm,30分で約2.9 mmの流路への流入が認められた(図7)。
【0052】
(3)プレラベル化及びオンチップラベル化ヒト唾液の比較
プレラベル化したヒト唾液及びオンチップラベル化したヒト唾液について,ラベル化反応時間を室温15分間とし,MCE法で測定を行った。ラベル化反応率及び試料導入量に若干
の相違は認められているが,両者で類似した泳動結果が得られた(図8)。
【0053】
また,チップ流路の交差部分に到達していない程度の試料拡散では,分離分析への影響が軽微であるとの確証を得た。以上より,NBD-Fによるオンチップラベル化法が実用可能
であることが明らかとなった(図8)。
【0054】
比較例1
オイル皮膜なしの場合、図4に示すように反応中に試料中の溶媒が蒸発してしまい、測定値から濃度を定量できなくなる。
【0055】
比較例2
緩衝液にメチルセルロースを含まない場合、ラベル化反応中に拡散により試料がチップチャネル内へ流れ込んでしまう。メチルセルロース添加により試料拡散を電気泳動分離に影響がないように最小限に抑えている。
【図面の簡単な説明】
【0056】
【図1】実施例2(1)で使用するプラスチック製マイクロチップ流路部の模式図を示す。
【図2】実施例1(1)におけるアミノ酸及びカテコールアミンとNBD−Fとの反応式を示す。
【図3】実施例1(2)におけるノルエピネフリンのNBDラベル化反応生成物の質量スペクトルを示す。
【図4】実施例1(3)におけるリザーバーでラベル化したときの蛍光顕微鏡観察図である。
【図5】実施例1(3)におけるリザーバーへのポリ−α−オレフィンオイルを添加したときの蛍光顕微鏡観察図である。
【図6】実施例2(1)におけるプレラベル化したアミノ酸標準溶液(a)及びヒト唾液試料(b)の泳動結果を示す。
【図7】実施例2(2)におけるオンチップラベル化時の試料拡散(30分)の様子を示す。
【図8】実施例2(3)におけるプレラベル化試料(a)及びオンチップラベル化試料(b)の泳動結果を示す。
【特許請求の範囲】
【請求項1】
2個のリザーバー1及び2の間が電気泳動用緩衝液を含むマイクロ流路で結ばれたユニットを複数有する電気泳動用マイクロチップを用いて、唾液中のアミノ基を有する成分をオンチップ分析する方法であって、
(1)唾液及び蛍光ラベル化試薬をリザーバー1に導入して、これをオイルで被覆し、唾液中のアミノ基を有する成分を蛍光ラベル化する工程、及び
(2)リザーバー1及び2の間に電圧を印加して、上記(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1からリザーバー2の方向に移動させて分析を行う工程、
を含むオンチップ分析方法。
【請求項2】
電気泳動用緩衝液が、メチルセルロースを含むホウ酸塩緩衝液である請求項1に記載のオンチップ分析方法。
【請求項3】
工程(1)で用いられる蛍光ラベル化試薬が、4−フルオロ−7−ニトロ−2,1,3−ベンズオキサジアゾールである請求項1に記載のオンチップ分析方法。
【請求項4】
工程(1)で用いられるオイルが、ポリ−α−オレフィンオイルである請求項1に記載のオンチップ分析方法。
【請求項1】
2個のリザーバー1及び2の間が電気泳動用緩衝液を含むマイクロ流路で結ばれたユニットを複数有する電気泳動用マイクロチップを用いて、唾液中のアミノ基を有する成分をオンチップ分析する方法であって、
(1)唾液及び蛍光ラベル化試薬をリザーバー1に導入して、これをオイルで被覆し、唾液中のアミノ基を有する成分を蛍光ラベル化する工程、及び
(2)リザーバー1及び2の間に電圧を印加して、上記(1)で得られた蛍光ラベル化されたアミノ基を有する成分を、リザーバー1からリザーバー2の方向に移動させて分析を行う工程、
を含むオンチップ分析方法。
【請求項2】
電気泳動用緩衝液が、メチルセルロースを含むホウ酸塩緩衝液である請求項1に記載のオンチップ分析方法。
【請求項3】
工程(1)で用いられる蛍光ラベル化試薬が、4−フルオロ−7−ニトロ−2,1,3−ベンズオキサジアゾールである請求項1に記載のオンチップ分析方法。
【請求項4】
工程(1)で用いられるオイルが、ポリ−α−オレフィンオイルである請求項1に記載のオンチップ分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2008−128918(P2008−128918A)
【公開日】平成20年6月5日(2008.6.5)
【国際特許分類】
【出願番号】特願2006−316421(P2006−316421)
【出願日】平成18年11月24日(2006.11.24)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成20年6月5日(2008.6.5)
【国際特許分類】
【出願日】平成18年11月24日(2006.11.24)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

