唾液mRNAプロファイリング、バイオマーカーならびに関連した方法およびキット
【課題】被検者において、口腔もしくは全身性の病態、疾患または障害を診断するための方法を提供する。
【解決手段】無細胞唾液においてトランスクリプトームパターンを検出する段階を含む、唾液のトランスクリプトーム分析;無細胞唾液において遺伝子のトランスクリプトームパターンおよび/またはmRNAプロファイリングを検出する段階を含む、唾液を分析することにより器官におけるまたは器官での遺伝子における遺伝的変化を検出するための方法;方法の少なくとも1つを行うための少なくとも1つのバイオマーカーについての識別子を含むキット;ならびに、口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとしての唾液バイオマーカー、唾液および/または血清mRNAの使用に関する。
【解決手段】無細胞唾液においてトランスクリプトームパターンを検出する段階を含む、唾液のトランスクリプトーム分析;無細胞唾液において遺伝子のトランスクリプトームパターンおよび/またはmRNAプロファイリングを検出する段階を含む、唾液を分析することにより器官におけるまたは器官での遺伝子における遺伝的変化を検出するための方法;方法の少なくとも1つを行うための少なくとも1つのバイオマーカーについての識別子を含むキット;ならびに、口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとしての唾液バイオマーカー、唾液および/または血清mRNAの使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
開示の分野
本開示は、バイオマーカーのプロファイリング、ならびにそのバイオマーカーを用いる方法およびキットに関する。特に、本開示は、癌、特に、口腔および口腔咽頭の扁平上皮細胞癌(OSCC)、の検出のためのバイオマーカーに関する。
【0002】
本発明は、NIHにより授与された助成金U01-DE15018の政府支援を以てなされた。政府は、本発明において一定の権利を有する。
【背景技術】
【0003】
開示の背景
バイオマーカーは、疾患の進行または処置の効果を測定するために用いられうる特定の生物学的性質、生化学的特徴または面の分子指標である。
【0004】
タンパク質および核酸は、例示的なバイオマーカーである。特に、細胞外で検出されるゲノムメッセンジャーが、疾患についてのバイオマーカーとしての役割を果たしうることは、広く受け入れられている[6]。特に、核酸は、血液、尿および髄液を含むたいていの体液において同定されており、疾患についての診断バイオマーカーとして用いることに採用するのに成功している[28,42,49]。
【0005】
唾液は、血清の受動的「限外ろ過液」[41]ではないが、酵素、ホルモン、抗体および他の分子の特有の組成物を含む。過去10年間において、唾液の診断用液体としての使用は、診断法および様々な疾患のリスクがある集団を予想することに適用されるのに成功した[47]。
【0006】
唾液における特異的かつ情報価値のあるバイオマーカーは、疾患を診断する、およびヒトの健康をモニターする役割を果たすのに望ましい[30,47,6]。例えば、バイオマーカーは、虫歯、歯周炎、口腔癌、唾液腺病、ならびに全身性疾患、例えば、肝炎およびHIV、をモニターするために唾液において同定されている[35]。また、以前の研究は、ヒトDNAバイオマーカーが唾液において同定され、かつ口腔癌検出のために用いられうることを示している[30,36]。RNAはDNAより不安定であり、リボヌクレアーゼによる分解に対して非常に感受性が高いことが推定される。さらに、理想的な診断媒体として働くのに適した、費用のかからない、非侵襲性の、入手しやすい体液を構成する唾液において、リボヌクレアーゼ活性は上昇していることが報告されている。特に、リボヌクレアーゼ活性は、癌患者の唾液において上昇していることが報告されている[83]。従って、ヒトmRNAは、唾液において細胞外で生存することはできないと、一般的に推定されている。世界で、OSCCは6番目に多い癌であり、毎年50,000人の米国人を冒している。世界中で、口腔および口腔咽頭の癌は、大きな公衆衛生問題を表している。OSCCは、インドにおいてすべての新しく診断された癌のほとんど50%を占め、フランスにおいては、主な死亡原因である[1]。
【0007】
局所領域的管理における改善にもかかわらず、罹患率および死亡率は、過去30年間、ほとんど改善されていない[2]。それゆえに、この疾患の初期検出または予防は、最も効果的である可能性が高い。初期段階でOSCCを検出することは、この疾患から死亡および美観を損なうことを低減させうる最も効果的な手段であると考えられる。たいていの頭頸部癌についての確定的な初期警告徴候の欠如は、感度が高くかつ特異的なバイオマーカーが、高リスク患者をスクリーニングするにおいて重要である可能性が高いことを示唆する。
【発明の概要】
【0008】
開示の概要
第一局面により、細胞相および流体相を含む体液中のバイオマーカーを検出するための方法であって、バイオマーカーが細胞外mRNAであり、かつ体液が唾液、好ましくは刺激されていない唾液である、方法が開示されている。方法は以下の段階を含む:体液の無細胞流体相部分を供給する段階;および体液の無細胞流体相部分中の細胞外mRNAを検出する段階。
【0009】
特に、細胞外mRNAを検出する段階は、以下の段階を含みうる:体液の無細胞流体相部分から細胞外mRNAを単離する段階、および細胞外mRNAを増幅する段階。
【0010】
第二局面により、細胞相および流体相を含む体液のトランスクリプトーム分析であって、体液が唾液である、分析が開示されている。方法は以下の段階を含む:体液の無細胞流体相部分を供給する段階;および体液の無細胞流体相部分においてトランスクリプトームパターンを検出する段階。体液は、好ましくは、刺激されていない唾液である。
【0011】
特に、唾液上清においてトランスクリプトームパターンを検出する段階は、好ましくは、マイクロアレイアッセイにより、最も好ましくは高密度オリゴヌクレオチドマイクロアレイアッセイにより、行われる。唾液上清においてトランスクリプトームパターンを検出する段階はまた、定量的PCR分析またはRT-PCR分析により行われうる。
【0012】
第三局面により、器官から流出し、かつ細胞相および流体相を含む体液を分析することにより器官における遺伝的変化を検出するための方法が開示されている。体液は、特に、唾液、好ましくは、刺激されていない唾液であり、方法は以下の段階を含む:体液の無細胞流体相部分を供給する段階;体液の無細胞流体相部分においてトランスクリプトームパターンを検出する段階;およびトランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、あらかじめ決められたパターンが、体液の正常な無細胞流体相部分の共通のトランスクリプトームパターンを示している、段階。
【0013】
第四局面により、器官から流出し、かつ細胞相および流体相を含む体液を分析することにより器官における遺伝子の遺伝的変化を検出するための方法が開示されている。体液は、特に、唾液であり、方法は以下の段階を含む:体液の無細胞流体相部分を供給する段階;体液の無細胞流体相部分において遺伝子のmRNAプロファイルを検出する段階;および遺伝子のmRNAプロファイルを遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、遺伝子のあらかじめ決められたmRNAプロファイルが、体液の正常な無細胞流体相部分における遺伝子のmRNAプロファイルを示している、段階。
【0014】
第五局面により、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:被検者の唾液の無細胞流体相部分を供給する段階;供給された無細胞唾液流体相部分において、病態、疾患または障害と関連した遺伝子のmRNAプロファイルを検出する段階;および遺伝子のRNAプロファイルを遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、遺伝子のあらかじめ決められたmRNAプロファイルが、被検者における病態、疾患または障害の存在を示している、段階。
【0015】
第一態様において、病態、疾患または障害は、口腔および/または口腔咽頭の癌であり、体液は唾液であり、遺伝子は、IL8(インターロイキン8)、IL1B(インターロイキン1、β)、DUSP1(二重特異性ホスファターゼ1)、H3F3A(H3ヒストン、ファミリー3A)、OAZ1(オルニチンデカルボキシラーゼ抗酵素1)、S100P(S100カルシウム結合タンパク質P)およびSAT(スペルミジン/スペルミンN1-アセチルトランスフェラーゼ)をコードする遺伝子からなる群より選択される。
【0016】
第二態様において、病態、疾患または障害は、口腔および/または口腔咽頭の癌であり、体液は血清であり、遺伝子は、選択されるIL6(インターロイキン6)、H3F3A、TPT1(翻訳調節された腫瘍タンパク質1)、FTH1(フェリチン重ポリペプチド1)、NCOA4(核受容体活性化補助因子4)、およびARCR(Ras相同体遺伝子ファミリー、メンバーA)である。
【0017】
診断されうる疾患は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。
【0018】
第六局面により、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:被検者の唾液の無細胞流体相部分を供給する段階;供給された無細胞流体相部分において、病態、疾患または障害と関連したトランスクリプトームパターンを検出する段階;およびトランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、トランスクリプトームパターンにおける、あらかじめ決められたパターンの特徴の認識が、被検者における病態、疾患または障害についての診断となる、段階。
【0019】
態様において、病態、疾患または障害は、口腔および/または口腔咽頭の癌であり、トランスクリプトームは、唾液由来のIL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SATについての転写産物からなる群より選択される。
【0020】
第七局面により、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されており、方法は以下の段階を含む:被検者の血清を供給する段階;供給された血清において、病態、疾患または障害と関連したトランスクリプトームパターンを検出する段階;およびトランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、トランスクリプトームパターンにおける、あらかじめ決められたパターンの特徴の認識が、被検者における病態、疾患または障害の診断となる、段階。
【0021】
態様において、病態、疾患または障害は、口腔および/または口腔咽頭の癌であり、トランスクリプトームは、血清由来のIL6、H3F3A、TPT1、FTH1、NCOA4およびARCRについての転写産物からなる群より選択される。
【0022】
診断されうる疾患は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。
【0023】
第八局面により、被検者において癌を診断するための方法が開示されている。方法は以下の段階を含む:被検者の体液を供給する段階;体液において、バイオマーカーのプロファイルを検出する段階;およびバイオマーカーのプロファイルをあらかじめ決められたバイオマーカーのプロファイルと比較する段階であって、バイオマーカーのあらかじめ決められたプロファイルの特徴の、バイオマーカーのプロファイルにおける認識が癌の診断となる、段階。
【0024】
診断されうる病態、疾患または障害は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。バイオマーカーは、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRを含む。
【0025】
第一態様において、病態、疾患または障害は、口腔咽頭扁平上皮細胞癌であり、バイオマーカーは、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SATからなる群より選択され、体液は唾液であり、バイオマーカーのプロファイルを検出する段階は、バイオマーカーのmRNAプロファイルを検出することにより行われる。
【0026】
第二態様において、病態、疾患または障害は、口腔咽頭扁平上皮細胞癌であり、バイオマーカーは、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択され、体液は血清であり、バイオマーカーのプロファイルを検出する段階は、バイオマーカーのmRNAプロファイルを検出することにより行われる。
【0027】
第三態様において、病態、疾患または障害は、口腔咽頭扁平上皮細胞癌であり、バイオマーカーはIL6であり、体液は血清であり、バイオマーカーのプロファイルを検出する段階は、バイオマーカーのタンパク質プロファイルを検出することにより行われる。
【0028】
第八局面により、口腔および/もしくは全身性の病態、疾患または障害の診断のためのキットが開示されており、キットは以下のものを含む:バイオマーカーがIL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される、体液における少なくとも1つのバイオマーカーの識別子;ならびに識別子についての検出器。
【0029】
診断されうる病態、疾患または障害は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。
【0030】
識別子および検出器は、本明細書に開示された方法によりバイオマーカーの体液プロファイルを検出するにおいて用いられうる。特に、識別子は、体液中のバイオマーカーへ結合しており、検出器は、識別子を検出するために用いられ、それにより、識別子および検出器はバイオマーカーの体液プロファイルの検出を可能にする。
【0031】
第九局面により、口腔および/もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとして唾液および/または血清mRNAを用いる段階。
【0032】
好ましい態様において、mRNAは、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択されるバイオマーカーの少なくとも1つをコード化する。
【0033】
診断されうる疾患は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。
【0034】
第十局面により、口腔および/または全身性の病態を診断するための方法が開示されている。方法は以下の段階を含む:口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとして唾液または血清タンパク質、特に、血清におけるIL6タンパク質および唾液におけるIL8タンパク質、を用いる段階。
【0035】
開示の方法およびキットは、添付の図面を用いて例示される。
【図面の簡単な説明】
【0036】
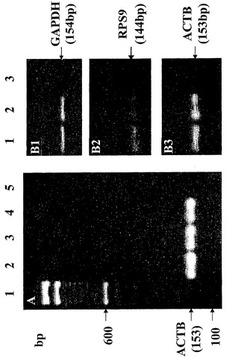
【図1】図1Aは、1ヶ月間(レーン2)、3ヶ月間(レーン3)および6ヶ月間(レーン4)の貯蔵後、人間由来の無細胞唾液上清から単離されたRNAにおいて行われたACTBについてのRT-PCRタイピングの結果を示し、100 bpのラダー分子量マーカー(レーン1)および陰性対照(鋳型を除く)(レーン5)を含む。分子サイズマーカーは、矢印で図の左側に示されている。図1Bは、人間由来の無細胞唾液上清から単離されたRNAにおいて行われたRT-PCRの結果、ならびにGAPDH(B1)、RPS9(B2)およびACTB(B3)のタイピングを示し、陽性対照(ヒト全RNA、BD Biosciences Clontech, Palo Alto, CA, USA)(レーン2)および陰性対照(鋳型を除く)(レーン3)を含む。分子サイズマーカーは、矢印で図の左側に示されている。
【図2】図2Aは、人間由来の無細胞唾液上清から単離されたRNAからのRNA増幅をモニターするために行われたキャピラリー電気泳動の結果を示す。レーン1〜5は、1 kb DNAラダー(レーン1)、RNA単離後の5 μl 唾液(検出不可能)(レーン2)、1 μl 2ラウンド増幅されたcRNA(200 bpから〜4 kbまでの範囲)(レーン3)、断片化後の1 μl cRNA(約100 bp)(レーン4)、およびAmbion RNA Century Marker(レーン5)を示す。分子サイズマーカーは、矢印で図の左側および右側に示されている。図2Bは、人間由来の無細胞唾液上清から単離されたRNAにおいて行われたPCRの、増幅の様々な段階における結果、およびACTBについてのタイピングを示す。レーン1〜8は、100 bp DNAラダー(レーン1)、無細胞唾液から単離された全RNA(レーン2)、第1ラウンドcDNA(レーン3)、RT後の第1ラウンドcRNA(レーン4)、第2ラウンドcDNA(レーン5)、RT後の第2ラウンドcRNA(レーン6)、陽性対照(ヒト全RNA、BD Biosciences Clontech, Palo Alto, CA, USA)(レーン7)および陰性対照(鋳型を除く)(レーン8)を示す。分子サイズマーカーは、矢印で図の左側に示されている。図2Cは、マイクロアレイ上でハイブリダイゼーションの前にAgilent 2100 Bioanalyzerにより行われた標的cRNAの分析の結果を報告する図を示す。x軸において、マーカーRNAを参照した、断片化cRNAの分子量(bp)が示されている。y軸において、Bioanalyzerにより測定可能である断片化cRNA(ug/ml)の量が示されている。
【図3】ラダー(Mrkr)、陽性対照(Ctrl(+))、および陰性対照(Ctrl(-))と共に、人間由来の無細胞唾液上清から単離されたRNAにおいて行われたRT-PCRの結果、ならびにIL6(IL6)、IL8(IL8)、およびβ-アクチン(β-アクチン)についてのタイピングを示す。
【図4】細胞溶解および細胞内化合物の流出についてのマーカー(Mrkr)としてゲノムDNAを用いる、全唾液、血清試料、ならびに0 xg(0 xg)、1,000 xg(1,000 xg)、2,600 xg(2,600 xg)、5,000 xg(5,000 xg)、および10,000 xg(10,000 xg)で遠心分離されている試料において、ハウスキーピングβ-アクチンについて行われたPCRの結果を示す。
【図5】図5Aは、OSCCをもつ患者(癌)および正常な被検者(対照)由来の唾液においてqRT-PCRにより反復試験試料で検出されるIL8についてのmRNAの平均濃度を報告する図を示す。x軸において、試料群が報告されている。y軸において、検出されたコピーの数が報告されている。図5Bは、OSCCをもつ患者(癌)および正常な被検者(対照)由来の唾液においてELISAにより反復試験試料で検出されるIL8の平均濃度を報告する図を示す。x軸において、試料群が報告されている。y軸において、pg/mlで表された濃度が報告されている。
【図6】図6Aは、OSCCをもつ患者(癌)および正常な被検者(対照)由来の血清においてqRT-PCRにより反復試験試料で検出されるIL6についてのmRNAの平均濃度を報告する図を示す。x軸において、試料群が報告されている。y軸において、検出されたコピーの数が報告されている。図6Bは、OSCCをもつ患者(癌)および正常な被検者(対照)由来の血清においてELISAにより反復試験試料で検出されるIL6の平均濃度を報告する図を示す。x軸において、試料群が報告されている。y軸において、pg/mlで表された濃度が報告されている。
【図7】図7Aは、唾液におけるIL8について計算された受信者動作特性(ROC)曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。図7Bは、血清におけるIL6について計算されたROC曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。図7Cは、唾液におけるIL8および血清におけるIL6の組み合わせについて計算されたROC曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。
【図8】対照としてDNAラダー(レーン1)と共に、RPS9(レーン2、3および4);GAPDH(レーン5、6および7);B2M(レーン8、9および10)およびACTB(レーン11、12および13)に対する唾液mRNAの血清ヒトmRNA表現型解析(phenotyping)において行われたPCR反応の結果を示す。
【図9】血清における循環mRNAについてのロジスティック回帰モデルのROC曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。
【図10】OSCCについての血清mRNA予知物質を評価する分類および回帰ツリー(CART)を報告する図を示す。
【図11】組み合わされた唾液mRNAバイオマーカーの予測力についてのロジスティック回帰モデルのROC曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。
【図12】OSCCについての唾液mRNA予知物質を評価する分類および回帰ツリー(CART)モデルを報告する図を示す。
【発明を実施するための形態】
【0037】
好ましい態様の詳細な説明
体液が唾液であり、かつ細胞外mRNAが唾液の無細胞流体相部分において検出される、体液中の細胞外mRNAを検出するための方法が開示されている。唾液の無細胞流体相部分におけるRNAの存在は、実施例で広範に記載された手順により確認され、検出されたmRNAの質は、PCR、qPCRおよびマイクロアレイアッセイのような技術についての要求を満たしている。
【0038】
本方法において、細胞外mRNA、本明細書ではまた情報価値のあるmRNA、を検出する段階は、体液、調査分析のための理想的な媒体として働く、費用のかからない、非侵襲性で入手しやすい体液の要求を満たす唾液、において行われる。
【0039】
情報価値のあるmRNAを検出する段階は、特に、単純かつ正確な方式で分子を分析することを可能にする、微生物および食物細片のような外来物質の存在が最小化されている、唾液の部分(無細胞流体相)において行われる。好ましくは、刺激されていない唾液由来の無細胞流体相部分。
【0040】
本方法において、唾液は、当技術分野において公知の手順に従って収集され、その後、例えば、収集された唾液の遠心分離により、その無細胞流体相部分を引き出すために処理されうり、結果として、ペレット化された唾液細胞相および無細胞唾液流体相上清を生じる。(実施例1、5および13に広範に記載された手順を参照)。
【0041】
本開示により、唾液の細胞相および流体相を分離するための条件は、流体無細胞相において検出されるRNAに寄与すると思われる細胞要素の機械的破壊を避けるように最適化される。
【0042】
分離が遠心分離により行われる態様において、最適化は、最適化遠心分離速度を導くために、細胞溶解および流出のマーカーとしてDNAを用いて、様々な速度で遠心分離された試料において、および全唾液試料において、ハウスキーピング遺伝子を検査することにより行われうる。(実施例5に記載された手順を参照)。
【0043】
無細胞唾液流体相部分における細胞外mRNA(唾液mRNA)の検出は、その後、RT-PCR、Q-PCRおよびマイクロアレイのようなmRNA定性的および/または定量的分析を可能にする当技術分野において公知の技術により行われうる。検出は、特に、唾液mRNAの単離および増幅を含みうる、ならびに実施例に例示されている、手順に従って行われうる。
【0044】
方法における唾液mRNAの検出は、唾液mRNAをプロファイリングすることを目的として行われうる。
【0045】
第一連の態様において、あらかじめ決められた遺伝子の発現は、唾液の無細胞流体相部分においてプロファイリングされうる。それらの態様において、mRNAプロファイルの検出は、RT-PCR、またはあらかじめ決められた標的mRNAの同定を可能にする任意の技術により行われうる。定量的分析は、その後、RT-PCRにより同定されたmRNAの存在を確認するために定量的PCR(Q-PCR)のような技術で行われうる。参照データベースは、その後、そのように得られたmRNAプロファイルに基づいて作製されうる。唾液mRNAのそのような定性的および定量的分析を行うための例示的手順は、実施例1、4および9で詳細に記載されている。
【0046】
第二連の態様において、唾液のトランスクリプトーム分析は、唾液の無細胞流体相部分においてトランスクリプトームパターンを検出することにより行われうる。トランスクリプトームパターンの検出は、唾液mRNAを単離して、直線的に増幅することにより行われうり、その後、高密度オリゴヌクレオチドマイクロアレイのような技術でプロファイリングされうる。定量的分析は、マイクロアレイにより同定されたパターンにおけるmRNAの存在を確認するためにQ-PCRのような技術で行われうる。参照データベースは、その後、そのように得られたmRNAプロファイルに基づいて作製されうる。唾液mRNAのそのような定性的および定量的分析を行うための例示的手順は、実施例2〜3、9〜10および14〜15で詳細に記載されている。
【0047】
唾液RNAをプロファイリングすることは、ヒトの健康および疾患を検出するおよび/もしくはモニターするために、または、例えば、唾液におけるmRNAの源、放出およびクリアランスのような生物学的問題を研究するために、行われうる。唾液mRNAは、口腔および全身性の病態、疾患または障害の高いリスクがある集団ならびに患者を同定するための実際のまたは可能性のあるバイオマーカーを提供する。
【0048】
正常な被検者の唾液の無細胞流体相部分を特徴付ける唾液mRNAプロファイルおよびトランスクリプトームパターンの変化は、様々な源の病態、疾患または障害を示しうる。それらの病態、疾患または障害の例は、口腔の炎症性状態、OSCC、または、糖尿病、乳癌およびHIVのような他の状態により提供される。
【0049】
また、決められた病態、疾患または障害に冒されている被検者のmRNAプロファイルとトランスクリプトームパターンの間の比較は、結果として、決められた病態、疾患または障害について情報価値のあるバイオマーカーの同定を生じうる。特に、唾液mRNAは、口腔において顕在化されうる口腔および全身性の病態、疾患または障害についての診断バイオマーカーとして用いられうる。
【0050】
特に、唾液mRNAは、口腔に顕在化されうるおよび/または口腔を冒しうる癌についての診断バイオマーカーとして用いられうる。唾液に基づいたmRNAアッセイは、信頼性のある診断のための必要とされる特異性および感度を有する。
【0051】
様々な型の癌の場合において、正常な唾液mRNAおよびトランスクリプトームパターンの変化はまた、腫瘍の存在に関連している口腔の1つまたは複数の部分における遺伝的変化を反映しうる。口腔癌患者について、検出された癌関連RNAシグネチャーは、適合した腫瘍および/または3つの主要な源(唾液腺、歯肉溝滲出液、および口腔粘膜細胞)のそれぞれから来た全唾液においてさらにそれ自身を反映する全身性応答(局所的または遠位)から生じる可能性が高い。疾患関連RNAは、唾液腺または歯肉溝滲出液による循環を経由して口腔にたどり着くことができると考えられる。良い例は、乳癌患者の唾液におけるHER-2タンパク質の存在の上昇である[87]。
【0052】
正常唾液コアトランスクリプトーム(Normal Salivary Core Transcriptome)(NSCT)としても定義される、約185個の異なるヒトmRNAを含む正常な無細胞唾液の共通のトランスクリプトームは、正常な被検者由来の唾液の無細胞流体相において行われたトランスクリプトーム分析の結果において同定された(実施例2、表2参照)。
【0053】
NSCTは、〜19,000個のヒト遺伝子のみを表すHG U1 33Aマイクロアレイにおいてプローブセットを用いて同定され、ヒトゲノムは、30,000個より多い遺伝子から構成される[48]ことから、他の方法により、より多いヒトmRNAが唾液において同定されることが予想され、追加の唾液パターンが、本明細書に開示された方法により同定可能である。
【0054】
正常な集団由来の無細胞唾液におけるNSCTおよび/または他の唾液トランスクリプトームパターンは、疾患診断法および正常な健康監視における可能性のある適用として、唾液トランスクリプトーム診断法(Salivary Transcriptome Diagnostics)(SlvTD)において役割を果たしうる。
【0055】
従って、SlvTDの第一態様において、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:被検者の唾液の無細胞流体相を供給する段階;供給された無細胞唾液流体相部分において、疾患と関連した遺伝子のmRNAプロファイルを検出する段階;および遺伝子のRNAプロファイルを遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、遺伝子のあらかじめ決められたmRNAプロファイルが被検者における疾患の存在を示している、段階。
【0056】
SlvTDの第二態様において、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:被検者の無細胞唾液上清を供給する段階;無細胞唾液上清において、病態、疾患または障害と関連したトランスクリプトームパターンを検出する段階;およびトランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、トランスクリプトームパターンにおける、あらかじめ決められたパターンの特徴の認識が、被検者における病態、疾患または障害についての診断となる、段階。
【0057】
SlvTDの第三態様において、あらかじめ決められた病態、疾患または障害と関連したバイオマーカーを同定するための方法が開示されている。方法は以下の段階を含む:病態、疾患または障害に冒されている被検者の唾液の無細胞流体相部分においてあらかじめ決められた遺伝子の第一mRNAプロファイリングを検出する段階;正常な被検者の唾液の無細胞流体相部分においてあらかじめ決められた遺伝子の第二mRNAプロファイリングを検出する段階;第一mRNAプロファイリングを第二mRNAプロファイリングと比較する段階であって、第一mRNAプロファイリングと第二mRNAプロファイリングの間の違い、その違いは統計学的解析により確証されるのだが、その認識が、あらかじめ決められた病態、疾患または障害についてのバイオマーカーとしてのあらかじめ決められた遺伝子の同定を示している、段階。
【0058】
特に、1つの疾患カテゴリーと1つの健康なカテゴリーのRNAプロファイリング間の違いは、マイクロアレイ統計学的方法により解析される。用いられるアルゴリズムは、MAS 5.0 DNA-Chipアナライザー1.3およびRMA 3.0を含む。好ましくは、解析は、より効果的かつ正確な、検査されうるマーカーを提供するために、これらの方法の組み合わせにより行われる。マイクロアレイにより同定されたマーカーは、その後、Q-PCRのような通常の技術により検査される。
【0059】
SlvTDの第四態様において、無細胞唾液が、バイオマーカーの存在または発現について識別子と接触させられ、バイオマーカーの存在または発現へ結合した識別子の存在が、好ましくは検出器の手段により、検出される、診断方法が行われうる。
【0060】
SlvTDは、高感度および高特異性の組み合わされた特徴を示すスクリーニングツールで、処置が成功する可能性が高くあるのに十分初期の段階で腫瘍のような疾患の検出を可能にする。さらに、スクリーニングツールは、広範囲に及ぶ適用を可能にするのに十分、非侵襲性でかつ費用がかからない。
【0061】
SlvTDの上の方法の結果は、mRNAおよび/もしくはタンパク質レベルで、ならびに/または血清のような他の体液において、行われた対応する分析と統合されうる。
【0062】
血清において検出されるタンパク質またはトランスクリプトームパターンのようなバイオマーカーもまた、疾患診断法および正常な健康監視における可能性のある適用として、血清トランスクリプトーム診断法(Serum Transcriptome Diagnostics)(SrmTD)において役割を果たしうる。SrmTDの態様は、分析される体液が無細胞唾液の代わりに血清である、SlvTDについての上で報告されたものに対応する方法を含む。
【0063】
特に、SlvTDに従って得られた結果は、組み合わされた唾液血清トランスクリプトームアプローチ(Salivary and Serum Transcriptome approach)(SSTD)において、SrmTDで得られた結果と組み合わされうる。
【0064】
SSTDに従って、体液、血清および/または唾液が、バイオマーカーの存在または発現について識別子と接触させられ、バイオマーカーがタンパク質またはmRNAでありうり、バイオマーカーの存在または発現に結合した識別子の存在が、好ましくは検出器の手段により、検出される、診断方法が行われうる。
【0065】
SlvTD、SrmTDおよびSSTDの例は、OSCCに関して本明細書に提供されている。当業者は、本開示を読むことにより、OSCCとは異なる疾患について、本明細書に例示されたSTDの適切な改変を導くことができる。
【0066】
2つの特定のサイトカイン、IL6およびIL8のプロファイリングは、実施例4〜8に広範に開示された手順に従って、OSCCをもつ患者の唾液および血清の無細胞流体相部分において測定された。IL8は、OSCCをもつ患者の唾液においてより高い濃度で検出され(P<0.01)、IL6は、OSCCをもつ患者の血清においてより高い濃度で検出された(P<0.01)。これらの結果は、mRNAおよびタンパク質の両方のレベルで確認され、結果は一致した。唾液におけるIL8および血清におけるIL6の濃度は、性別、年齢、またはアルコールもしくはタバコの使用と関連しているようには思われなかった(P>0.75)。データは、統計学的解析、特にROC解析にかけられ、OSCCを検出するための各バイオマーカーの閾値、感度および特異性を決定することができた(実施例8、表3参照)。さらに、本発明者らは、唾液検体においてmRNAを測定することができた。
【0067】
OSCCをもつ患者および正常な被検者から収集された刺激されていない唾液のトランスクリプトーム分析は、実施例9〜12において、および実施例13〜16において開示されているように、行われた。
【0068】
RNA単離は、唾液上清から行われ、続いて、T7 RNAポリメラーゼで2ラウンドの直線的増幅が行われた。ヒトゲノムU133Aマイクロアレイは、ヒト唾液トランスクリプトームをプロファイリングするために適用された。異なる遺伝子発現パターンは、10人の整合された癌患者および対照においてt検定比較および倍変化分析を組み合わせることにより解析された。定量的ポリメラーゼ連鎖反応(qPCR)は、マイクロアレイにより有意差(P<0.01)を示した選択された遺伝子を確証するために用いられた。これらの唾液mRNAバイオマーカーの予測力は、受信者動作特性曲線および分類モデルにより解析された。
【0069】
マイクロアレイ分析の第一セットの結果は、癌患者と対照の間で唾液において有意に異なる発現レベル(P<0.05)を示した1,679個の遺伝子があることを示した。OSCC唾液において少なくとも3.5倍上昇を示した(P<0.01)7つの癌関連mRNAバイオマーカーは、OSCC患者(n=32)および対照(n=32)からの唾液試料におけるqPCRにより一貫して確証された。これらの唾液RNAバイオマーカーは、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、およびSATの転写産物である。これらのバイオマーカーの組み合わせは、OSCCを対照から識別するにおいて、感度(91%)および特異性(91%)を生じた。(実施例13〜16を参照)。
【0070】
マイクロアレイ分析の第二セットの結果は、報告された癌関連に基づいて選択された10個の上方制御された遺伝子のうちの5個が、OSCC患者の血清において転写産物の有意な上昇を示したことを示した。これらのRNAバイオマーカーは、H3F3A、TPT1、FTH1、NCOA4およびARCRの転写産物である。qPCRにより確証された結果は、これらの5個の遺伝子の転写産物が、OSCC患者の血清において有意に上昇したことを確認した(ウイルコクソンの符号付き検定、P<0.05)。(実施例9〜12参照)。
【0071】
記載された収集物および処理プロトコールを用いて、ACTB、B2W、GAPDHおよびRPS9 mRNA(対照mRNA)の存在が、RT-PCRによりすべての血清(患者および対照)において確認された。
【0072】
従って、被検者において癌、特にOSCC、を診断するための方法が開示されている。方法は以下の段階を含む:被検者の体液を供給する段階;体液において、バイオマーカーのプロファイルを検出する段階であって、バイオマーカーが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される、段階;ならびにバイオマーカーのプロファイルをバイオマーカーのあらかじめ決められたプロファイルと比較する段階であって、バイオマーカーのあらかじめ決められたプロファイルの特徴の、バイオマーカーのプロファイルにおける認識が癌についての診断になる、段階。
【0073】
口腔および/もしくは全身性の病態、疾患または障害、特にOSCCを診断するための方法もまた開示されている。方法は、口腔および/または全身性疾患についてのバイオマーカーとして唾液mRNA、特に、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、およびSATからなる群より選択される唾液mRNA、を用いることを含む。
【0074】
さらに、口腔および/もしくは全身性の病態、疾患または障害、特にOSCCを診断するための方法が開示されている。方法は以下の段階を含む:口腔および/または全身性疾患についてのバイオマーカーとして血清mRNAおよび/またはタンパク質、特に、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される血清mRNAならびに血清IL6タンパク質、を用いる段階。
【0075】
発癌の多因子性性質および発癌経路における不均一性を考慮すれば、より高い特異性および感度を保証する、唾液および/または血清バイオマーカーの組み合わせの使用は好ましい。報告された複数の統計学的ストラテジーおよび実施例に記載されたリスクモデルは、OSCC患者試料を同定することができるバイオマーカーの組み合わせを同定するために、および患者の特定の癌リスクについての適切な血清トランスクリプトームに基づいた診断を割り当てることを容易にするために、用いられうる。
【0076】
唾液の無細胞流体相部分における、および/または血清のような他の体液における、唾液mRNAのプロファイルのモニタリングは、OSCC患者の術後管理において用いられうる。それは、処置の効力、または治療が終わった後の疾患再発をモニターするために用いられうる可能性がある。唾液mRNAおよび特にIL8はまた、口腔癌をもつ患者の処置を方向づけるための予後指標としての役割を果たしうる。見通しとして、高リスクの患者は、より攻撃的またはアジュバント治療計画へと方向づけられうる。
【0077】
これらのバイオマーカーの使用はまた、腫瘍の病期診断を向上させうる。伝統的な技術では、顕微鏡的遠位の疾患の存在は、しばしば、認識されない。近年、推定される局所領域的疾患について処置される患者について、局所領域的不全から遠位不全へのシフトがあった[18]。これは一部、治療の開始の前に存在する無症状性遠位疾患の反映である。バイオマーカーの存在について検査することは、正常組織の背景において少量の腫瘍細胞の検出を可能にしうる。頭頸部腫瘍に特異的なバイオマーカーまたはそのようなバイオマーカーのパネルとしての唾液mRNAは、遠位の顕微鏡的疾患の検出を可能にしうる。口腔癌について、この点において、STDアプローチの最も重要な適用の一つは、口腔前悪性病変の癌転換を検出することである。
【0078】
唾液mRNAのプロファイリングはまた、癌の発生における遺伝子の役割、特に、これらの遺伝子の異常な発現が、ヒトOSCCの発症に機能的に寄与しているかどうか、を調べるために用いられうる。頭頸部/口腔癌におけるこれらの遺伝子の示差的発現の生物学的有意性が測定されるはずである。癌患者において一貫して変化している癌関連遺伝子の同定は、診断マーカーだけでなく、頭頸部癌発生に関与する分子プロファイルについての洞察も提供する。任意の特定の癌において分子変化のプロファイルを理解することは、結果として生じるその癌の表現型を分子事象と相関させることが可能になるため、非常に有用である。
【0079】
本明細書に開示された方法と関連したキット(Kits of parts)もまた開示されている。例示的態様において、キットは以下のものを含む:唾液mRNAまたはタンパク質、および血清mRNAまたはタンパク質のような体液中のバイオマーカーの識別子(バイオマーカーはIL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される);ならびに識別子についての検出器(本明細書に開示された方法の1つによりバイオマーカーの体液プロファイルを検出するにおいて用いられうる識別子および検出器であって、識別子が体液中のバイオマーカーに結合しており、検出器が識別子を検出するために用いられ、それにより、識別子および検出器がバイオマーカーの体液プロファイルの検出を可能にする)。
【0080】
体液は唾液でありうり、検出は、その無細胞流体相部分、または血清のような別の体液において行われる。
【0081】
識別子および識別子を検出することができる検出器は、当業者により特定可能である。キットに適切に含まれうる他の組成物および/または成分もまた当業者により特定可能である。
【0082】
識別子および試薬は、識別子および/または試薬が適した媒体、担体または補助剤と共に含まれている、1つまたは複数の組成物に含まれうる。
【0083】
本明細書に開示された診断キットにおいて、作用物質および識別子試薬が、本明細書に開示された方法を行うために、適した使用説明書および他の必要な試薬と共に、キットで提供されうる。キットは、通常、別々の容器に組成物を含む。アッセイを実行するについての使用説明書、例えば、紙、またはテープもしくはCD-ROMのような電子的支持体上の書いたまたは音の使用説明書は、通常、キットに含まれる。キットはまた、用いられる特定の方法に依存して、他のパッケージされた試薬および材料(すなわち、洗浄緩衝液など)を含みうる。
【0084】
組成物の適した担体剤または補助剤の特定、ならびに一般的なキットの製造およびパッケージングに関するさらなる詳細は、本開示を読むことにより当業者により特定されうる。
【0085】
本明細書に開示されたキットは、特に診断目的として用いられうる。結果として、患者における、病態、疾患または障害、ならびに特に、口腔の、および口腔咽頭癌、の非侵襲性診断検出が開示されている。
【0086】
唾液の流体相の使用は、剥離した細胞の使用を凌ぐ独特の利点をもつ。腫瘍の位置に依存するが、腫瘍ベッドに容易に接触して採取することができない可能性がある。唾液バイオマーカーは腫瘍が発生している部位を同定できないとしても、それらは、リスクのある患者を同定することができる。そのような唾液検査は、上部気道消化管の慎重な評価のための紹介について患者を選択しうるスクリーニングツールとして、リモート位置において非専門家により施されうる。初期段階の、以前には検出されなかった疾患を見出すことは、究極的には命を救いうる。さらに、容易にアクセス可能なバイオマーカーの使用は、大きな集団または化学的予防試験において高い有益性を立証しうる。これは、日常的歯科通院中または疾患の発生のリスクが高い個体のターゲットされたスクリーニングを構想されうる。家庭用検査キットもまた構想されうる。
【0087】
血液検査の使用もまた、特に、癌初期検出として構想される。OSCCについての診断用の、IL6 mRNAおよびタンパク質、H3F3A mRNA、TPT1 mRNA、FTH1 mRNA、NCOA4 mRNAおよびARCR mRNAのような、腫瘍遺伝的変化の特徴を表す癌患者の血清において無細胞循環mRNAまたはタンパク質を回収することは、血液作業をもつ日常的な医師の往診中の潜伏OSCCの存在についてのスクリーニング検査、または口腔癌発生のリスクが高い個体のターゲットされたスクリーニングとして、構想されうる。家庭用検査キットもまた構想されうり、好ましくは含む。
【0088】
特に、末梢血が、日常的臨床手順を用いて被検者から得られうり、mRNAおよびタンパク質が、好ましくは本明細書に開示された最適化手順で単離されうる。それぞれのサイトカインについてのリアルタイム定量的PCRおよびELISAが、IL6のような1つまたは複数のバイオマーカーについて行われる。
【0089】
本明細書に開示された展望的態様は、口腔液体における分子バイオマーカーの超高感度検出のためのマイクロ/ナノ電気機械システム(MEMS/NEMS)へと方向づけられる。確証されたOSCCバイオマーカーについてのRNAおよびタンパク質発現は、癌検出のための標的として選択される。複数のOSCCバイオマーカーについてのmRNAおよびタンパク質の同時検出のためのこれらの検出システムの統合は、結果として、口腔液体に基づいた癌診断法のための効率的な、自動化の、手頃な価格のシステムを生じる。
【0090】
開示の方法およびキットに用いられうる試薬、条件、組成物および技術に関するさらなる詳細は、本開示を読むことにより当業者により特定可能である。
【0091】
他の病態、疾患および障害の調査および診断に関連したmRNAプロファイリングならびにトランスクリプトーム分析のための、OSCCおよび/またはHSNCCへ関連づけられるような本明細書に開示および例示されたSTD方法ならびにキットの適切な改変もまた、本開示を読むことにより当業者によりなされうる。
【0092】
以下の実施例は、本発明をさらに詳細に記載するために提供される。これらの実施例は、本発明を実施するために現在、企図された好ましい様式を示しているが、例証することを意図され、本発明を限定するものではない。
【実施例】
【0093】
実施例1:正常なドナーの無細胞唾液からのRNA単離、増幅および遺伝子発現プロファイリング
正常な被検者
唾液試料は、Medical Center, University of California, Los Angeles (UCLA), CAにおけるDivision of Otolaryngology, Head and Neck Surgeryからの10人の正常なドナーから、UCLA Institutional Review Boardにより承認されたプロトコールに従って、得られた。以下の試験対象患者基準が用いられた:年齢30歳;悪性腫瘍、免疫不全、自己免疫疾患、肝炎、HIV感染または喫煙の経歴無し。対象集団は、平均年齢42歳(32歳から55歳までの範囲)である、6人の男性および4人の女性から構成された。
【0094】
唾液収集および関連した流体相を得るための処理
刺激されていない唾液が、公開されたプロトコール[38]に従って午前9時と午前10時の間に収集された。被検者は、唾液収集前の少なくとも1時間、食べること、飲むこと、喫煙または口腔衛生処置を断つよう求められた。唾液試料を、4℃で15 min、2,600 x gで遠心分離した。唾液上清は、細胞相から分離された。リボヌクレアーゼ阻害剤(Superase-In, Ambion Inc., Austin, TX, USA)およびプロテアーゼ阻害剤(アプロチニン, Sigma, St. Louis, MO, USA)を、その後、無細胞唾液上清へ添加した。
【0095】
無細胞唾液からのRNA単離
RNAは、製造会社(QIAamp Viral RNAキット, Qiagen, Valencia, CA, USA)からの改変されたプロトコールを用いて無細胞唾液上清から単離された。AVL緩衝液(2,240 μL)と十分に混合された唾液(560 μL)を、室温で10 min、インキュベートした。無水エタノール(2,240 μL)を添加し、溶液を、6,000 x gで1 min、遠心分離によりシリカカラムに通した。その後、カラムを2回、洗浄し、20,000 x gで2 min、遠心分離し、9,000 x gで2 min、30 μL リボヌクレアーゼを含まない水で溶出した。RNAのアリコートを、製造会社の使用説明書に従って、リボヌクレアーゼを含まないデオキシリボヌクレアーゼ(DNase I-DNA-free, Ambion Inc., Austin, TX, USA)で処理した。
【0096】
単離されたRNAの安定性は、1、3および6ヶ月間の保存後、アクチン-β(ACTB)についてのRT-PCRタイピングにより調べられた。図1Aに報告された結果は、単離されたmRNAを、-80℃で6ヶ月間より長く、有意な分解無しに保存することができたことを示している。
【0097】
単離されたRNAの質は、3つのハウスキーピング遺伝子転写産物:グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)、アクチン-β(ACTB)およびリボソームタンパク質S9(RPS9)についてのRT-PCRにより調べられた。プライマーは、PRIMER3ソフトウェア(http://www.genome.wi.mit.edu)を用いて設計され、以下のように商業的に(Fisher Scientific, Tustin, CA, USA)合成された:GAPDHについて添付配列リストをSEQ ID NO:1およびSEQ ID NO:2として報告された配列を有するプライマー;ACTBについて添付配列リストをSEQ ID NO:3およびSEQ ID NO:4として報告された配列を有するプライマー;RPS9について添付配列リストをSEQ ID NO:5およびSEQ ID NO:6として報告された配列を有するプライマー。RNAの量は、Ribogreen(登録商標)RNA Quantitation Kit(Molecular Probes, Eugene, OR, USA)を用いて推定された。結果は、図1Bに示されているが、GAPDH(B1)、RPS9(B2)およびACTB(B3)が試験されたすべての10個の場合において一貫して検出され、すべての10個の唾液試料が、ハウスキーピング遺伝子:GAPDH、ACTBおよびRPS9をコードするmRNAを含むことを実証した。
【0098】
これらの遺伝子のmRNAを、-80℃で6ヶ月間より長く、有意な分解無しに保存することができた(図1Aで報告されたACTBについての結果を参照)。
【0099】
標的cRNA調製
単離されたRNAは、その後、本発明者らの研究室から発表された方法に従って、直線的増幅にかけられた(Ohyama et al., 2000)。簡単には、プライマーとしてT7-オリゴ-(dT)24を用いる逆転写を、第一鎖cDNAを合成するために行った。インビトロ転写(IVT)の第一ラウンドをT7 RNAポリメラーゼ(Ambion Inc., Austin, TX, USA)を用いて行った。BioArray(商標)High Yield RNA Transcript Labeling System(Enzo Life Sciences, Farmingdale, NY, USA)は、cRNA産物をビオチン化するための第二ラウンドIVTに用いられた;標識されたcRNAは、GeneChip(登録商標)Sample Cleanup Module(Affymetrix, Santa Clara, CA, USA)を用いて精製された。
【0100】
cRNAの質および量は、分光測光法およびゲル電気泳動法により測定された。図2Aで報告されたアガロースゲル電気泳動試験の例示的結果は、RNA増幅の異なる段階における増幅されたcRNAの異なる量を示している。
【0101】
単離および増幅段階のそれぞれからの少量のアリコートもまた、RT-PCRにより質を評価するために用いられた。図2Bに報告された例示的結果は、RNA増幅の様々な段階で行われたPCRタイピングACTBを示しているが、予想された単一バンド(153 bp)が唾液RNA増幅過程のあらゆる主要な段階において検出されることができた。
【0102】
断片化cRNA(Kelly, 2002により記載されているように調製された)の質もまた、2100 Bioanalyzer(Agilent Technologies, Palo Alto, CA, USA)を用いるキャピラリー電気泳動により評価された。図2Cに報告された例示的結果は、適切な断片化を実証する狭い範囲(50〜200 bp)での1つの単一ピークを示している。
【0103】
ターゲットされたcRNA調製における遺伝子発現プロファイリング
遺伝子発現プロファイリングは、10人の正常なドナーから得られた無細胞唾液において行われ、平均して、60.5±13.1 ng(n=10)の全RNAが、560 μL 無細胞唾液試料から得られた。結果は表1に報告されている。
【0104】
【表1】

【0105】
全RNA量は、560p.L 無細胞唾液上清におけるRNAである;cRNA量は、T7増幅の2ラウンド後である。プローブの数は、HG U133Aマイクロアレイ上での存在コールを示す(検出p<0.04)。存在パーセンテージ(P%)=存在コールに割り当てられたプローブの数/全プローブの数(HG U133Aマイクロアレイについて22,283個)。
【0106】
T7 RNA直線的増幅の2ラウンド後、ビオチン化cRNAの平均収量は、A260/280=2.067±0.082で42.2±3.9 μgであった(表1)。cRNAは、断片化前には、200 bpから4 kbまでの範囲であった;断片後、約100 bpへ集中された。cRNAプローブの質は、ハイブリダイゼーションの前にキャピラリー電気泳動により確認された。ACTB mRNAは、最初の試料、ならびに各増幅段階からの産物:第一cDNA、第一インビトロ転写(IVT)、第二cDNAおよび第二IVT、においてPCR/RT-PCRを用いて検出可能であり、結果として生じたアガロース電気泳動パターンは、図2Bに示されたものに匹敵した。
【0107】
実施例2:正常なドナーの無細胞唾液由来のmRNAのマイクロアレイプロファイリング
実施例1に報告されているように、唾液を収集して処理し、RNAを単離した。RNAの安定性、質および量もまた、実施例1に報告されているように評価された。
【0108】
HG-U1331Aマイクロアレイ分析
〜19,000遺伝子を表す22,215個のヒト遺伝子cDNAプローブセットを含む(すなわち、各遺伝子は、1個より多いプローブセットにより表されうる)、Affymetrix Human Genome U133A Arrayが、遺伝子発現プロファイリングのために適用された。アレイデータは、標準化され、Microarray Suite(MAS)ソフトウェア(Affymetrix)を用いて解析された。検出p値は、各プローブセットについて得られた。p<0.04をもつ任意のプローブセットが、適合する遺伝子転写産物が信頼性をもって検出されることを示す、「存在する」に割り当てられた(Affymetrix, 2001)。各アレイ上の存在プローブセットの総数が得られ、存在遺伝子の存在パーセンテージ(P%)が計算された。機能的分類は、Gene Ontology Mining Tool(www.netaffx.com)を用いることにより選択された遺伝子(すべての10個のアレイ上に存在する、p<0.01)において行われた。
【0109】
10人の正常な被検者の唾液mRNAプロファイルは、22,283個のcDNAプローブを含むHG U133Aアレイを用いて得られた。割り当てられた存在コールをもつ、平均3,143±665.0個のプローブセット(p<0.04)が各アレイ(n=10)に見出された。これらのプローブセットは、約3,000個の異なるmRNAを表す。平均の存在コールパーセンテージは、14.11±2.98%(n=10)であった。10個のアレイからのデータを含む参照データベースが作成された。GAPDH、ACTBおよびRPS9を表すプローブセットが、すべての10個のアレイにおいて存在コールを割り当てた。検出p<0.01をもつ、すべての10個のアレイにおいて存在コールを割り当てられた185個の遺伝子を表す、全体として207個のプローブセットがあった。これらの10個の遺伝子は、生物過程および分子機能におけるそれらの公知の役割に基づいて分類された。10人の正常なドナー由来の無細胞唾液における185個の遺伝子の生物過程および分子機能(Gene Ontology Mining Toolを用いることにより得られたデータ)は、表2に報告されている。
【0110】
【表2】

【0111】
1つの遺伝子は、複数の分子機能をもちうる、または異なる生物過程に関与しうる。特定の群/下位群へ分類された遺伝子の数。185個の遺伝子の主要な機能は、細胞成長/維持(119個の遺伝子)、分子結合(118個の遺伝子)、および細胞構造構成(95個の遺伝子)に関連している。本発明者らは、これらの185個の遺伝子を「正常唾液コアトランスクリプトーム(Normal Salivary Core Transcriptome)(NSCT)」と名付けた。
【0112】
実施例3:正常なドナーの無細胞唾液からのマイクロアレイプロファイリングのQ-PCR確証および定量分析
実施例2で行われたマイクロアレイ分析は、Q-PCRによる定量的遺伝子発現分析を通して確証された。
【0113】
Q-PCRによる定量的遺伝子発現分析
リアルタイム定量的PCR(Q-PCR)は、実施例2で報告されたマイクロアレイプロファイリングにより検出された185個の「正常唾液コアトランスクリプトーム」遺伝子から選択された遺伝子を定量することにより、唾液におけるヒトmRNAの存在を確証するために用いられた。すべての10個のアレイ上で存在コールに割り当てられた、遺伝子IL1B、SFNおよびK-ALPHA-1は、確証のために無作為に選択された。
【0114】
Q-PCRは、iCyclerTM thermal Cycler(Bio-Rad, Hercules, CA, USA)を用いて実行された。単離された唾液RNA(増幅なし)の2 μLのアリコートを、MulV Reverse Transcriptase(Applied Biosystems, Foster City, CA, USA)を用いてcDNAへ逆転写した。結果として生じたcDNA(3 μL)を、iQ SYBR Green Supermix(Bio-Rad, Hercules, CA, USA)を用いるPCR増幅に用いた。プライマーは、以下のように、Sigma-Genosys(Woodlands, TX, USA)により合成された:インターロイキン1、β(IL1B)についての添付配列リストをSEQ ID NO:7およびSEQ ID NO:8として報告された配列を有するプライマー;ストラティフィン(stratifin)(SFN)についての添付配列リストをSEQ ID NO:9およびSEQ ID NO:10として報告された配列を有するプライマー;チューブリン、α、遍在性(K-ALPHA-1)についての添付配列リストをSEQ ID NO:11およびSEQ ID NO:12として報告された配列を有するプライマー。すべての反応は、特定のPCR産物についてカスタマイズされた条件で、3連で行われた。特定の鋳型のcDNAの最初の量は、LightCyclerソフトウェア3.0(Bio-Rad, Hercules, CA, USA)を用いて標準曲線から外挿された。標準曲線による定量のための詳細な手順は、以前に記載されている(Ginzinger, 2002)。
【0115】
Q-PCR結果は、IL1B、SFNおよびK-ALPHA-1のmRNAがすべての10個の最初の増幅されていない無細胞唾液において検出可能であることを示した。これらの転写産物(n=10)の相対量(コピー数における)は以下である:IL1Bについて8.68X103±4.15X103;SFNについて1.29X105±1.08X105;およびK-ALPHA-1について4.71X106±8.37X105。Q-PCRにより測定されたこれらの遺伝子の相対RNA発現レベルは、マイクロアレイにより測定されたもの(データ示されず)と類似した。
【0116】
実施例4:OSCC患者の無細胞唾液におけるIL6およびIL8 mRNA単離増幅ならびに発現の分析
患者選択
患者は、University of California, Los Angeles (UCLA) Medical Center, Los Angeles, CAにおけるDivision of Head and Neck Surgery;University of Southern California (USC) Medical Center, Los Angeles, CA;およびUniversity of California San Francisco (UCSF) Medical Center, San Francisco, CAから6ヶ月間に渡って採用された。
【0117】
口腔(OC)または口腔咽頭(OP)の実証された原発性T1またはT2扁平上皮細胞癌をもつ32人の患者がこの研究に含まれた。すべての患者は、最近、原発性疾患と診断されており、化学療法、放射線治療、手術または代替療法の形をとるいずれの事前処置も受けなかった。同程度の喫煙歴をもつ年齢および性別の整合された被検者の同じくらいの数が対照比較群として選択された。
【0118】
2つの被検者群の間に、平均年齢(標準偏差、SD):OSCC患者、49.3(7.5)歳;正常な被検者、48.8(5.7)歳(スチューデントt検定P>0.80);性別(スチューデントt検定P>0.90);または喫煙歴(スチューデントt検定P>0.75)に関する有意差はなかった。前の悪性腫瘍、免疫不全、自己免疫疾患、肝炎またはHIV感染の病歴をもつ被検者はなかった。対照群における個体のそれぞれは、疑わしい粘膜病変が存在しないことを保証するために、頭頸部外科医により理学的検査を受けた。
【0119】
唾液収集および処理
インフォームド・コンセントは、すべての患者により与えられた。唾液および血清調達手順は、各機関:University of California, Los Angeles (UCLA);University of Southern California (USC);およびUniversity of California San Francisco (UCSF)における機関の審査委員会により承認された。
【0120】
OCまたはOP SCCAをもつ32人の患者、ならびに32人の罹患していない年齢および性別の整合された対照被検者由来の唾液は、サイトカイン濃度の前向きな比較のために採取された。
【0121】
被検者は、唾液収集前の少なくとも1時間、食べること、飲むこと、喫煙または口腔衛生製品を用いることを断つように要求された。唾液収集は、5 cc 唾液の全供与として、NavazeshおよびChristensen, [7]の「排出(流涎)」方法を用いて行われた。唾液試料を、Sorvall RT6000D遠心分離機(DuPont, Wilmington, DE)により4℃で15分間、3500 rpm(2600xg)での遠心分離にかけた。その後、流体相を取り出し、リボヌクレアーゼ阻害剤(Superase-In, RNAse阻害剤, Ambion Inc., Austin, TX)およびプロテアーゼ阻害剤(アプロチニン、Sigma, St. Louis, MO;フェニルメチルスルホニルフロリド、Sigma, St. Louis, MO;オルトバナジウム酸ナトリウム、Sigma, St. Louis, MO)をその後、氷上で素速く添加した。唾液の細胞相および流体相の分離のための条件は、流体相において検出されるmRNAに寄与するものと思われる細胞要素の機械的破壊のないことを保証するように最適化された。すべての試料は、その後、デオキシリボヌクレアーゼ(DNAseI-DNA-free, Ambion Inc., Austin, TX)で処理された。細胞ペレットは、保持され、-80℃で保存された。
【0122】
無細胞唾液からのRNA単離
唾液上清の560 μLは、その後、QIAamp Viral RNAミニキット(QIAGEN, Chatsworth, CA)を用いて処理された。RNAは、製造会社の使用説明書に従って抽出された。試料を、空気乾燥させ、ジエチルピロカルボネートで処理された水に再懸濁し、即時使用について氷上に保持した、または-80℃で保存した。RNAのアリコートを、製造会社の使用説明書に従って、リボヌクレアーゼを含まないデオキシリボヌクレアーゼ(DNAseI-DNA-free, Ambion Inc., Austin, TX)で処理した。RNAの濃度は、分光光度法で測定され、完全性は、ホルムアルデヒドを含むアガロースゲルにおける電気泳動によりチェックされた。
【0123】
逆転写酵素-ポリメラーゼ連鎖反応
唾液での流体相におけるIL6およびIL8 mRNA転写産物の存在は、逆転写酵素-ポリメラーゼ連鎖反応(RT-PCR)を用いることにより試験された。
【0124】
各試料由来のRNAを、モロニーマウス白血病ウイルス逆転写酵素(Applied Biosystems Inc.(ABI), Foster City, CA)の2.5 Uおよびランダムヘキサヌクレオチド(ABI, Foster City, CA)の50 pmolを含む反応混合物の40 μLにおいて、42℃で45分間、逆転写させた。発表された配列に基づいて、オリゴヌクレオチドプライマーは、以下のように、PCRのためにFisher Scientific(Tustin, CA)で商業的に合成された:β-アクチンについて添付配列リストをSEQ ID NO:13およびSEQ ID NO:14として報告された配列を有するプライマー;IL8について添付配列リストをSEQ ID NO:15およびSEQ ID NO:16として報告された配列を有するプライマー;ならびにIL6について添付配列リストをSEQ ID NO:17およびSEQ ID NO:18として報告された配列を有するプライマー。
【0125】
相補DNA(cDNA)の増幅は、95℃で20秒間、60℃で30秒間、および72℃で30秒間の50サイクル、続いて72℃で7分間の最終伸長サイクルを用いて実行された。PCR産物の特異性は、推定サイズにより、および制限酵素消化により、検証された。応答の特異性を確立するために、入力RNAが除かれている、またはRNAが用いられるが、逆転写酵素が除かれている、陰性対照が用いられた。陽性対照として、mRNAが、全唾液腺RNA(Human Salivary Gland Total RNA, Clontech, Palo Alto, CA)から抽出された。RNA質を保証するために、すべての調製物は、発現の分析にかけられた。
【0126】
そのように行われたRT-PCR研究は、唾液および血清が、IL6およびIL8をコードするmRNAを含むことを示した。図3に報告された例示的結果は、選択されたプライマーから予想されたサイズ(IL6について95 bpおよびIL8について88 bp)のPCR産物を示している。同じサイズの産物が陽性対照に発現されていた。
【0127】
分析されるRNAおよびタンパク質が唾液の流体相のみからであることを保証するために、および細胞内成分による混入の欠如を保証するために、唾液試料についての遠心分離速度を最適化した。唾液試料全体および様々な速度で遠心分離された試料における、細胞溶解および細胞内成分のこぼれたもののマーカーとしてDNAを用いる、ハウスキーピング遺伝子β-アクチンおよびユビキチンについてのPCR。結果は、好ましい速度が2,600 xgである、2,600±52 xgの唾液試料についての最適遠心分離速度を支持している(図4で報告された例示的結果を参照)。
【0128】
実施例5:OSCC患者の血清におけるIL6およびIL8 mRNA単離、増幅および発現の分析
実施例4に報告されているように患者が採用され、血清におけるIL6およびIL8 mRNAの存在の分析にかけられた。
【0129】
血清収集および処理
OCまたはOP SCCAをもつ19人の患者、ならびに32人の罹患していない年齢および性別の整合された対照被検者由来の血清が、前向きなサイトカイン濃度の比較のために採取された。被検者群の間で、年齢、性別、アルコール消費または喫煙歴に関して有意差はなかった(P>0.75)。
【0130】
血液は、処理の前に対照被検者および患者から抜き取られた。血清を、Sorvall RT6000D遠心分離機(DuPont, Wilmington, DE)により15℃で10分間、3000 rpm(1000 xg)で全血を遠心分離することにより収集した。その後、血清を分離し、リボヌクレアーゼ阻害剤(Superase-In, RNAse阻害剤, Ambion Inc., Austin, TX)およびプロテアーゼ阻害剤(アプロチニン、Sigma, St. Louis, MO;フェニルメチルスルホニルフロリド、Sigma, St. Louis, MO;オルトバナジウム酸ナトリウム、Sigma, St. Louis, MO)をその後、氷上で素速く添加した。すべての試料は、その後、デオキシリボヌクレアーゼ(DNAseI-DNA-free, Ambion Inc., Austin, TX)で処理された。アリコートは、さらなる使用まで-80℃で保存された。
【0131】
逆転写酵素-ポリメラーゼ連鎖反応
血清におけるIL6およびIL8 mRNA転写産物の存在は、上の実施例4に記載されているように行われる逆転写酵素-ポリメラーゼ連鎖反応(RT-PCR)を用いることにより試験された。
【0132】
そのように行われたRT-PCR研究は、電気泳動ゲルパターンが図3に示されたものと匹敵して、血清がIL6およびIL8をコードするmRNAを含むことを示した。
【0133】
分析されるRNAおよびタンパク質が血清の流体相のみからであることを保証するために、および細胞内成分による混入の欠如を保証するために、血清試料についての遠心分離速度を、唾液試料についての実施例4で記載された同じアプローチに従って最適化した。結果は、好ましい速度が1,000 xgである、1,000±20 xgの唾液試料についての最適遠心分離速度を支持している。
【0134】
実施例6:OSCC患者由来の唾液におけるIL6およびIL8サイトカインレベル分析
IL6およびIL8 mRNA転写産物が唾液での流体相に存在することを実証するにおいて、本発明者らは、定量的リアルタイムPCR(qRT-PCR)およびELISAを用いて、罹患していない被検者およびOSCCをもつ患者の唾液においてIL6およびIL8のレベルを前向きに調べ、比較した。
【0135】
OSCCをもつ32人の患者、ならびに32人の年齢および性別の整合された対照被検者由来の唾液が、採取された。被検者群の間で、年齢、性別、アルコール消費または喫煙歴に関して有意差はなかった(P>0.75)。
【0136】
患者および正常な被検者由来の唾液におけるIL6およびIL8 mRNA濃度の定量のためのリアルタイムPCR
RT-PCRの結果を定量的に分析するために、定量的リアルタイムPCR(Bio-Rad iCycler, Thermal Cycler, Bio-Rad Laboratories, Hercules, CA)が用いられた。各試料は、3連で試験された。増幅反応は、iQ SYBR Green Supermix(Bio-Rad Laboratories, Hercules, CA)を用いて20 μL 混合物において行われた。95℃で3分間の最初の変性後、60℃で20秒間、その後72℃で20秒間、その後83℃で20秒間の50PCRサイクルを実行し、続いて、95℃で1分間、その後、続いて、55℃で最終の1分間伸長を行った。アリコートは、各ウェルから取られ、産物の特異性を保証するためにアガロースゲルにおける電気泳動によりチェックされた。
【0137】
RT-PCR結果は、図5Aに示された図により例証されている。そのような結果は、mRNAおよびタンパク質の両方のレベルにおけるIL8が、対照被検者と比較した場合、OSCCをもつ患者の唾液においてより高い濃度で検出されたことを示している(t検定、P<0.01)。OSCC患者と疾患のない対照由来の唾液の間に、IL8 mRNA発現の量における有意差があった。平均コピー数は、OSCC群について1.1x103個、および対照群について2.6x101個であった。2つの群の間での差は、非常に統計学的に有意であった(P<0.0008)。
【0138】
その代わりに、mRNAレベルにおけるIL6の唾液濃度において、有意差が見出されなかった。試料サイズ研究内で、本発明者らはまた、喫煙と非喫煙の被検者間に差を検出することができなかった。
【0139】
患者および正常な被検者由来の唾液におけるIL6およびIL8タンパク質濃度の定量のためのELISA
IL6およびIL8についてのELISAキットが製造会社の使用説明書に従って用いられた(Pierce Endogen, Rockford, IL)。各試料は、2つの反復実験のそれぞれにおいて2連で試験された。比色反応の発生後、450 nmにおける吸光度を、8チャネルの分光光度計(EL800 Universal Microplate Reader, BIO-TEK Instruments Inc., Winooski, VT)により定量し、吸光度読みを、各アッセイにおいて組換えサイトカインで得られた標準曲線に基づいてpg/mlへ変換した。吸光度読みが標準曲線の直線範囲を越えた場合には、ELISAアッセイは、上清の段階希釈後に繰り返された。各試料は、少なくとも2つのELISA実験において試験され、データは、各試料についての試験の平均から計算された。
【0140】
ELISA試験結果は、図5Bに示された図により例証されている。OSCC患者の唾液におけるIL8のレベル(720 pg/dL)は、対照群の唾液におけるそれら(250 pg/dL)よりも有意に高かった(P<0.0001)。唾液におけるIL8タンパク質のレベルの上昇が、OSCC患者の唾液における総タンパク質レベルの上昇のせいではなかったことを保証するために、本発明者らは、2つの群間で唾液における総タンパク質濃度を比較した。有意差は見出されなかった(P>0.05)。
【0141】
タンパク質レベルにおけるIL6の唾液濃度において、有意差は見出されなかった。また、ELISA分析において、喫煙と非喫煙の被検者の間での試料サイズ研究内で差は検出されなかった。
【0142】
実施例7:OSCC患者由来の血清におけるIL6およびIL8サイトカインレベル分析
本発明者らはまた、qRT-PCRおよびELISAを用いて、罹患していない被検者およびOSCCをもつ患者の血清において、IL6およびIL8のレベルを調べ、比較した。患者は、実施例4に記載されているように選択され、血清は、実施例5に記載されているように処理された。
【0143】
患者および正常な被検者由来の血清におけるIL6およびIL8 mRNAの定量のためのリアルタイムPCR
RT-PCRの結果を定量的に分析するために、定量的リアルタイムPCRが、実施例6に記載されているように行われた。
【0144】
RT-PCR結果は、図6Aに示された図により例証されている。そのような結果は、mRNAレベルにおけるIL6が、対照被検者と比較した場合、OSCCをもつ患者の血清においてより高い濃度で検出されたことを示している(t検定、P<0.001)。OSCC患者と疾患のない対照由来の唾液の間でのIL6 mRNA発現の量における有意差が注目された。平均コピー数は、OSCC群について5.2x104個、対照群について3.3x103個であった。2つの群間の差は、非常に統計学的に有意であった(P<0.0004)。
【0145】
その代わりに、mRNAレベルにおけるIL8の唾液濃度において、有意差が見出されなかった。試料サイズ研究内で、本発明者らはまた、喫煙と非喫煙の被検者間に差を検出することができなかった。
【0146】
患者および正常な被検者由来の血清におけるIL6およびIL8タンパク質濃度の定量のためのELISA
血清におけるIL6およびIL8タンパク質濃度の定量のためのELISA試験は、実施例6に記載されているように行われた。
【0147】
関連したELISA試験結果は、図6Bに示された図により例証されている。OSCC患者の血清におけるIL6の平均レベル(87 pg/dL)は、対照群の血清におけるそれら(0 pg/dL)よりも有意に高かった(P<0.0001)。
【0148】
タンパク質レベルにおけるIL8の血清濃度において、有意差は見出されなかった。また、ELISA分析において、喫煙と非喫煙の被検者の間での試料サイズ研究内で差は検出されなかった。
【0149】
実施例8:ROCおよび感度/特異性解析
上の実施例1〜7で報告された実験の結果において収集されたデータの統計学的解析は、HNSCCについてのこれらのバイオマーカーの特異性および感度、ならびにそれらの適中率を実証している。
【0150】
統計学的解析
患者人口統計の分布は、OSCC症例および対照について、全体的におよび別々に、計算され、連続測定についてのスチューデントt検定かまたはカテゴリー測定についての2X2のカイ二乗表のいずれかを用いて2つのアーム間で比較された。唾液および血清におけるIL6ならびにIL8レベルの分布は、計算され、2つの独立群t検定を用いてOSCC症例と対照の間で比較された。差は、0.01未満のP値について有意とみなされた。IL6およびIL8レベルの範囲のために、これらの測定値の対数変換もまた、解析に用いられた。データは、平均±SDとして表された。年齢、性別および喫煙歴は、実験計画において群レベルで調節された;これらの患者因子はまた、回帰モデリングを通してIL6およびIL8を比較する場合の解析において調整された。
【0151】
従属変数として疾患(OSCC症例)および非疾患(対照)の2項結果を用いる、ロジスティック回帰モデルを、患者の年齢、性別および喫煙歴について調節して、可能性のあるバイオマーカー(IL6またはIL8)のそれぞれの関数としてOSCCを発症している確率を推定するように適合させた。適合したロジスティックモデルを用いて、受信者動作特性(ROC)曲線解析は、バイオマーカーのそれぞれの予測力を評価するために行われた[8][9][10]。ROC解析を通して、本発明者らは、最小ストリンジェント性(0の確率でカット)から最大ストリンジェント性(1の確率でカット)まで陽性の基準を変化させることにより、感度および特異性を計算した。最適な感度および特異性は、バイオマーカーのそれぞれについて決定され、バイオマーカーのそれぞれの対応するカットオフ/閾値が同定された。ROC曲線下で最も大きい領域を有するバイオマーカーは、OSCCを検出するための最も強い予測力をもつとして同定された。
【0152】
臨床データ
OSCCをもつ患者の平均(SD)年齢は49.3(7.5)歳(範囲、42〜67歳)対、対照群における48.8(5.7)歳(範囲、40〜65歳)であった;(スチューデントt検定P>0.80)。2つの被検者群の間で、年齢(平均年齢);OSCC患者、49.3歳;正常な被検者、48.8歳(スチューデントt検定P>0.80);性別(スチューデントt検定P>0.90);または喫煙歴(スチューデントt検定P>0.75)に関して有意差はなかった。
【0153】
ROC(受信者動作特性)曲線、感度対1-特異性のプロット、は可能性のあるバイオマーカーのそれぞれについて作成された。年齢、性別および喫煙歴は、上記のように調節された。ROC曲線下の面積は、OSCCを検出するための各バイオマーカーの有用性の測度として計算された。
【0154】
図7Aおよび図7Bは、唾液におけるIL8および血清におけるIL6についてのROC曲線をそれぞれ、示している。計算されたROC値(OSCCを予測することについて)は、唾液におけるIL8について0.978;および血清におけるIL6について0.824であった。感度および特異性の分布に基づいて、バイオマーカーの閾値は、OSCCを検出することについて選択された。本発明者らのデータに基づいて、唾液におけるIL8について、600 pg/dLの閾値は、86%の感度および97%の特異性を生じる。同様に、血清におけるIL6について、0 pg/dLより大きい閾値は、64%の感度および81%の特異性を生じる。
【0155】
バイオマーカーの組み合わせ:唾液におけるIL8および血清におけるIL6は、図7Cに示されているように、ROC解析が99%の感度および90%の特異性を生じていることから、OSCC診断法として大きな可能性をもっている。
【0156】
唾液および血清における可能性のあるバイオマーカーのそれぞれについての、ROC曲線下の面積の詳細な統計値、閾値、ならびに対応する感度および特異性は表3に列挙されている。
【0157】
唾液および血清における可能性のあるバイオマーカーのそれぞれについての、ROC曲線下の面積の詳細な統計値、閾値、ならびに対応する感度および特異性は、下の表3に列挙されている。
【0158】
【表3】

【0159】
実施例9:OSCC患者の血清からのRNA単離、増幅および遺伝子発現プロファイリング
被検者選択
32人のOSCC患者は、University of California, Los Angeles (UCLA)におけるMedical CentersおよびUniversity of Southern California(USC), Los Angeles, CAから採用された。すべての患者は、最近、原発性T1/T2OSCCと診断されており、化学療法、放射線治療、手術または代替療法の形をとるいずれの事前処置も受けなかった。35人の正常なドナーが、School of Dentistry, UCLAにおける一般的な集団から対照として採用された。いずれの被検者も前の悪性腫瘍、免疫不全、自己免疫疾患、肝炎、またはHIV感染の病歴をもたなかった。すべての被検者は、この研究のための供血者となることを同意する機関審査委員会(Institutional Review Board)に承認された同意書にサインした。
【0160】
32人のOSCC患者および35人の正常な被検者を含む全体として67人の被検者が採用された。2つの被検者群の間に、平均年齢(標準偏差、SD)に関して有意差はなかった:OSCC患者、49.3(7.5)歳;正常な被検者、47.8(6.4)歳 (スチューデントt検定P=0.84)。OSCC群における性別分布は、10:22(女性の数/男性の数)であり、対照群においては、14:21(カイ二乗検定P=1)であった。本発明者らは、以下のことを測定することによりこれらの2つの群の喫煙歴を適合させた。すべての被検者は以下を尋ねられた:(1)何年間、タバコを吸ったか?(2)1日あたり何箱、タバコを吸ったか?(3)タバコを吸うのを止めてから何年間、経過したか?(4)紙巻きタバコを吸うのみだったか、または葉巻、パイプ、かみタバコ、もしくはタイマも使用したか?本発明者らは、その後、上記に関して患者と対照の間の整合を最適化した:(1)類似した箱-年数歴(2)タバコを吸うのを止めてからの類似した経過(3)全く紙巻きタバコのみの使用。喫煙歴において2つの群間に有意差はなかった(スチューデントt検定P=0.77)。
【0161】
血液収集および処理
血液調達手順は、UCLAおよびUSCにおける機関の審査委員会により承認された。血液は、処理の前に対照被検者および患者から抜き取られた。その後、全血は、Sorvall RT6000D遠心分離機(DuPont, Wilmington, DE)により15℃で10分間、1,000 xgによる遠心分離を受けた。血清は、その後、分離され、100 U/mL リボヌクレアーゼ阻害剤(Superase-In, Ambion Inc., Austin, IX)が血清へ素速く添加された。アリコートは、さらなる使用まで-80℃で保存された。
【0162】
血清からのRNA単離
RNAは、QIAamp Viral RNAキット(Qiagen, Valencia, CA)を用いて560 μl 血清から単離された。単離されたRNAのアリコートは、製造会社の使用説明書に従って、リボヌクレアーゼを含まないデオキシリボヌクレアーゼ(DNaseI-DNA-free, Ambion Inc., Austin, TX)で処理された。単離されたRNAの質は、4つのハウスキーピング遺伝子転写産物:β-アクチン(ACTB)、β-2-ミクログロブリン(B2M)、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)、およびリボソームタンパク質S9(RPS9)についてのRT-PCRにより調べられた。公開された配列に基づいて、オリゴヌクレオチドプライマーは、設計され、その後、PCRのために合成された(Sigma Genosis, Woodlands, TX)。RT-PCRは、表4に示されたRT-PCRのための4つのハウスキーピング遺伝子転写産物から選択された共通の上流プライマーおよび3つの異なる下流プライマーを用いて3つのセグメントに表現型を示されたmRNAのコード領域を増幅するために用いられた。
【0163】
【表4】

【0164】
特に、4つの血清ヒトmRNAが選択され、コード領域は、そのコード領域をおよそ3つの部分へ分割する共通の上流プライマーおよび3つの異なる下流プライマーを用いて3つのセグメントに表現型を示した。各PCR反応の10 μlは、2%アガロースゲル上で電気泳動され、EtBrで染色された。
【0165】
すべてのPCR産物の特異性は、陽性対照(Human Salivary Gland Total RNA, clontech, Palo Alto, CA)と比較する推定サイズにより検証された。入力RNAが除かれている、またはRNAが用いられるが、逆転写酵素が除かれている陰性対照が、用いられた。
【0166】
ヒト由来のmRNA産物の血清表現型は、RT-PCRおよび電気泳動により評価された。図8に報告された例示的結果は、4つのハウスキーピング遺伝子(ACTB、B2M、GAPDH、およびRPS9)からの転写産物が検出されることができることを示した。特に、188 bp、426 bpおよび614 bpのサイズをもつRPS9についての単位複製配列が検出された(図8のレーン2、3および4をそれぞれ、参照);140,755 bpおよび1,184 bpのサイズをもつGAPDHについての単位複製配列が検出された(図8のレーン5、6および7をそれぞれ、参照);216,591 bpおよび848 bpのサイズをもつB2Mについての単位複製配列が検出された(図8のレーン8、9および10をそれぞれ、参照);および195,705 bpおよび1,000 bpのサイズをもつACTBについての単位複製配列が検出された(図8のレーン11、12および13をそれぞれ、参照)。対照データが図に示されていない場合でも、対照は行われた。
【0167】
本発明者らが増幅した最も長いPCR産物は、NCBI GenBankデータベースによる、対応するmRNAの完全長の56.8%(ACTB)、85.9%(B2M)、93.4%(GAPDH)および88.9%(RPS9)に及んだ。この結果はまた、無細胞の形をとる血液において循環する無傷ヒトmRNAが存在しうることを示した。
【0168】
実施例10:OSCC患者由来の血清のmRNAのマイクロアレイプロファイリング
10人のOSCC患者(8人の男性、2人の女性、年齢=51±9.0)由来ならびに10人の性別および年齢の整合された正常なドナー(年齢49±5.6)由来の血清が、収集され、マイクロアレイ分析に用いるために実施例9に報告されているように処理された。
【0169】
マイクロアレイ分析
血清から単離されたRNAは、RiboAmp(商標)RNA Amplificationキット(Arcturus, Mountain View, CA)により直線的増幅にかけられた。以前に報告されたプロトコール[55]に従って、〜19,000遺伝子を表す22,215個のヒト遺伝子cDNAプローブセット(すなわち、各遺伝子は、1個より多いプローブセットにより表されうる)を含むAffymetrix Human Genome U133A Arrayが、遺伝子発現プロファイリングのために適用された。
【0170】
生データは、標準化およびモデルに基づいた解析のためのDNA-Chip Analyzer 1.3 (dChip)ソフトウェアへインポートされた[60]。dChipは、mRNA/遺伝子発現の量を表す発現指標、およびmRNA転写産物が実際、試料に存在するかどうか、存在コールと呼ばれるもう一つのパラメーターを与える(14)。S-plus 6.0(Insightful, Seattle, WA)がすべての統計学的検定に用いられた。
【0171】
3つの基準が、OSCCと対照の間で異なって発現された遺伝子を決定するために用いられた。第一に、すべての試料において「不在」コールと割り当てられた遺伝子は排除された。第二に、両側スチューデントt検定が、OSCC(n=10)と対照(n=10)の間での平均遺伝子発現レベルの比較に用いられた。0.05の臨界アルファレベルが、統計学的有意性として定義された。第三に、倍比率が、統計学的有意差(P<0.05)を示すそれらの遺伝子について計算された。少なくとも2倍変化を示すそれらの遺伝子のみが、さらなる分析のために含まれる。
【0172】
HG U133Aマイクロアレイは、癌患者と整合された正常な被検者の間で唾液RNAプロファイルにおける違いを同定するために用いられた。前に記載された基準により含まれる14,268個の遺伝子の間で、本発明者らは、0.05未満のP値および≧2の倍変化をもつ335個の遺伝子を同定した。これらの遺伝子の間で、OSCC群において、223個の上方制御された遺伝子および112個の下方制御された遺伝子がある。Affymetrixにより、存在コールを割り当てられた遺伝子は、この遺伝子が最初の試料において信頼性をもって検出されることを示す。存在と割り当てられた遺伝子の数および各アレイにおける存在パーセンテージは、血清におけるヒトmRNA発現プロファイリングを報告する表5に示されている。
【0173】
【表5】

【0174】
(a)HG U133Aマイクロアレイにおける存在コールを示すプローブの数(検出P<0.04)。
【0175】
(b)存在パーセンテージ(P%)=存在コールに割り当てられたプローブの数/全プローブの数(HG U133Aマイクロアレイについて22,283個)。
【0176】
*OSCCについてのアレイは、対照群についてのそれらよりも多い、存在コールに割り当てられた有意なプローブを有する(P≦0.002、ウイルコクソン検定)。
【0177】
平均して、存在コールを割り当てられた、OSCCアレイにおいて2623±868個のプローブ、および対照アレイにおいて1792±165個のプローブがある。OSCC群は、対照群より多い有意な存在プローブを有する(P≦0.002、ウイルコクソン検定)。
【0178】
特定の遺伝子について、すべての癌(n=10)またはすべての対照(n=10)の間ですべてのアレイに一貫して存在コールが割り当てられるというよりストリンジェントな基準を用いて、本発明者らは、さらなる分析のための候補でありうる62個の遺伝子を同定した。これらの62個の遺伝子はOSCC血清においてすべて上方制御されるが、同じフィルタリング基準を用いて下方制御されるのを見出された遺伝子はないことが注目された。
【0179】
実施例11:OSCC患者の無細胞唾液からのマイクロアレイプロファイリングのQ-PCR確証および定量的分析
qPCRは、唾液において異なって発現された転写産物のサブセットを定量するために、32人のOSCC患者および35人の対照由来の唾液を含む拡大された試料サイズにおいて、実施例10のマイクロアレイの発見を確証するために、行われた。
【0180】
定量的PCR(qPCR)アッセイ
プライマーセットは、PRIMER3ソフトウェアを用いることにより設計された(表2)。MuLV逆転写酵素(Applied Biosystems, Foster City, CA)およびプライマーとしてランダムヘキサマー(ABI, Foster City, CA)を用いて、cDNAは、最初の、増幅されていない血清RNAから合成された。qPCR反応は、iQ SYBR Green Supermix(Bio-Rad, Herucules, CA)を用いて、iCycler(商標)iQリアルタイムPCR検出システム(Bio-Rad, Hercules, CA, USA)において行われた。すべての反応は、特定の産物についてカスタマイズされた条件を用いて3連で行われた。特定の鋳型のcDNA/RNAの相対量は、LightCyclerソフトウェア3.0(Bio-Rad, Hercules, CA, USA)を用いて標準曲線から外挿された。両側スチューデントt検定は、統計学的解析に用いられた。
【0181】
10個の有意な上方制御された遺伝子:H3F3A、TPT1、FTH1、NCOA4、ARCR、THSMB(チモシンβ10)、PRKCB1(プロテインキナーゼC、β1)、FTL1(フェリチン軽ポリペプチド)、COX4I1(チトクロムcオキシダーゼサブユニットIVアイソフォーム1)、およびSERP1(ストレス関連小胞体タンパク質1;リボソーム関連膜タンパク質4)は、qPCR確証について選択された10個の遺伝子を報告している表6に示されているように、それらの報告された癌関連に基づいて選択された。
【0182】
【表6】

【0183】
表6は、qPCRにより測定されたOSCC患者由来の血清におけるそれらの定量的変化を示す。結果は、H3F3A、TPT1、FTH1、NCOA4およびARCRの転写産物が、OSCC患者の唾液において有意に上昇したことを確認した(ウイルコクソンの符号付き検定、P<0.05)。本発明者らは、qPCRにより、他の5つの転写産物の量において統計学的有意差を検出しなかった。
【0184】
実施例12:ROCおよび感度/特異性解析
上の実施例9〜11で報告された実験の結果において収集されたデータの統計学的解析は、HNSCCについてのこれらのバイオマーカーの特異性および感度、ならびにそれらの適中率を実証している。
【0185】
受信者動作特性曲線解析および予測モデル
qPCR結果を利用して、多変量分類モデルが、癌予測のための選択された血清転写産物の最良の組み合わせを決定するために構築された。第一に、従属変数として疾患(OSCC)および非疾患(正常)の2項結果を用いて、ロジスティック回帰モデルが構築された[61]。年齢、性別および喫煙歴は、データ収集手順において調節される。
【0186】
leave-one out cross validation法が、ロジスティック回帰モデルを確証するために用いられた。交差検定(cross validation)ストラテジーは、まず、1つの観測を除去し、その後、すべてのマーカーを用いて残っている事例からロジスティック回帰モデルを適合させる。段階的モデル選択は、モデルを改善しない変数を除去するためにこれらのモデルのそれぞれについて用いられる。その後、除外された事例についての観測値は、その観測について推定されるクラスを計算するために用いられた。交差検定誤差率は、その時、試料の数で割った、間違って予測された試料の数である。
【0187】
受信者動作特性(ROC)曲線解析は、その後、感度および特異性の計算のための可能性のあるカットポイントとしてモデルからの適合した確率を用いて、最良の最終ロジスティックモデル(S-plus 6.0)について計算された。曲線下の面積は、ROC曲線の数値積分法により計算された。
【0188】
OSCC識別のために血清における循環mRNAの利用を実証するために、2つの分類/予測モデルが観察された。qPCRデータを用いて、ロジスティック回帰モデルが、前に調べられた6つの血清転写産物、ARHA、FTH1、H3F3A、TPT1、COX4I1およびFTL1、から構成されて構築された。組み合わせたそれらの6つの転写産物は、最良の予測を提供し、その後、leave-one out validation法により確証された。67個から1つを除外する試行のうち、最良ロジスティックモデルの54個(81%)が、データ全体から抜き出した1つのモデルと同じであることが見出され、確証誤差率は31.3%(21/67)であった。
【0189】
結果は図9に報告されているが、このロジスティック回帰モデルについて計算されたROC曲線が示されている。
【0190】
44%のカットオフ確率を用いて、84%の感度および83%の特異性が得られた。最終モデルは、0.84(27/32)感度および0.83(29/35)特異性を以て、67人のうち56人(83.5%)の被検者について正しく予測し、対照について6人の被検者およびOSCCについて5人の分類を誤っている。ROC曲線下の計算された領域は、このロジスティック回帰モデルについて0.88であった。
【0191】
ツリーに基づいた分類モデル、分類および回帰ツリー(CART)
第二に、qPCR結果を利用するもう一つの予測モデルは、ツリーに基づいた分類方法により構築された。分類および回帰ツリー(CART)は、qPCR結果から予知物質として血清転写産物を用いてS-plus 6.0により構築された。CARTは、各段階が、結果として癌群 対 正常群の最良の分割を生じる予測変数を検索することを含む、二元再帰分割分析(binary recursive partitioning)による分類モデルに適合する[62]。CARTは、S-plusについてのデフォルト設定により決定された分割基準をもつエントロピー関数を用いた。このアプローチにより、試料全体(n=67)を含む親群は、その後、癌群および正常群へ分割された。本発明者らの最初のツリーは、結果として、異なる分類をもつ小枝を生じなかったすべての分割を除去するように剪定された。
【0192】
第二モデル、「分類および回帰ツリー(CART)モデル」、は図10に報告された図により作成された。
【0193】
本発明者らの適合したCARTモデルは、OSCCについての予測変数としてTHSMBおよびFTH1の血清mRNA濃度を用いた。4.59E-17 Mの閾値をもつ最初の分割として選択されたTHSMBは、合計67個の試料を含む親群から2つの子群を生じた。THSMB濃度<4.59E-17 Mをもつ47個の試料は、「正常-1」へ割り当てられ、THSMB濃度≧4.59E-17 Mをもつ20個は、「癌-1」へ割り当てられた。「正常-1」群は、8.44E-16 Mの閾値をもつFTH1によりさらに分割された。結果として生じた下位群、「正常-2」は、FTH1濃度<8.44E-16 Mをもつ28個の試料を含み、「癌-2」は、FTH1濃度≧8.44E-16 Mをもつ19個の試料を含んだ。結果として、本発明者らの研究に含まれた67個の血清試料は、CART解析により「正常」群および「癌」群へ分類された。
【0194】
「正常」群は、合計28個の試料、正常な被検者からの25個および癌患者からの3個、を含む「正常-2」からの試料から構成された。従って、OSCC予測についてTHSMBおよびFTH1の組み合わせを用いることにより、全体の特異性は78%(25/35)である。「癌」群は、「癌-1」および「癌-2」からの試料から構成された。最終「癌」群において割り当てられた合計39個の試料、癌患者からの29個および正常な被検者からの10個、がある。それゆえに、OSCC予測についてこれらの2つの血清mRNAの組み合わせを用いることにより、全体の感度は91%(癌群において、29/32)であり、特異性は、78%(正常群において、25/35)である。
【0195】
実施例13:OSCC患者の唾液からのRNA単離、増幅および遺伝子発現プロファイリング
患者選択
OSCC患者は、University of California, Los Angeles (UCLA);University of Southern California (USC), Los Angeles, CA;およびUniversity of California San Francisco, San Francisco, CAにおけるMedical Centerから採用された。
【0196】
実証された原発性T1またはT2 OSCCをもつ32人の患者が含まれた。患者のすべては、最近、原発性疾患の診断を受けており、化学療法、放射線治療、手術または代替療法の形をとるいずれの事前処置も受けなかった。
【0197】
同程度の喫煙歴をもつ年齢および性別の整合された被検者の同じくらいの数が対照群として選択された。2つの被検者群の間に、平均年齢:OSCC患者、49.8±7.6歳;正常な被検者、49.1±5.9歳(スチューデントt検定、P>0.80);性別(P>0.90);または喫煙歴(P>0.75)に関する有意差はなかった。前の悪性腫瘍、免疫不全、自己免疫疾患、肝炎またはHIV感染の病歴をもつ被検者はなかった。すべての被検者は、実験のための唾液供与者となることを同意する機関審査委員会に承認された同意書にサインした。
【0198】
唾液収集およびRNA単離
刺激されていない唾液試料は、以前に確立されたプロトコール[38]で午前9時と午前10時の間に収集された。被検者は、収集前の少なくとも1時間、食べること、飲むこと、喫煙または口腔衛生処置を断つよう求められた。唾液試料は、4℃で15分間、2,600 x gで遠心分離された。
【0199】
上清は、ペレットから取り出され、リボヌクレアーゼ阻害剤(Superase-In, Ambion Inc., Austin, TX)で処理された。RNAは、QIAamp Viral RNAキット(Qiagen, Valencia, CA)で唾液上清の560 μLから単離された。単離されたRNAのアリコートは、製造会社の使用説明書に従って、リボヌクレアーゼを含まないデオキシリボヌクレアーゼ(DNaseI-DNA-free, Ambion Inc.)で処理された。単離されたRNAの質は、3つの細胞維持遺伝子転写産物:グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)、アクチン-β(ACTB)およびリボソームタンパク質S9(RPS9)についてのRT-PCRにより調べられた。すべての3つのmRNAについてのPCR産物を示すそれらの試料のみが、その後の分析に用いられた。
【0200】
平均して、全RNAの54.2±20.1 ng(n=64)が、唾液上清の560 μLから得られた。OSCCと整合された対照の間に全RNA量における有意差があった(t検定、P=0.29、n=64)。RT-PCR結果は、唾液試料のすべて(n=64)が、ヒト唾液RNAについての品質管理として用いられる[55]、3つの遺伝子(GAPDH、ACTBおよびRPS9)からの転写産物を含むことを実証した。一貫した増幅規模(658±47.2、n=5)が、RNA増幅の2ラウンド後、得られた。平均して、ビオチン化cRNAの収量は、39.3±6.0 μgであった(n=20)。OSCCと対照の間に、生じたcRNA量の有意差はなかった(t検定、P=0.31、n=20)。
【0201】
実施例14:OSCC患者由来の唾液のmRNAのマイクロアレイプロファイリング
10人のOSCC患者(7人の男性、3人の女性;年齢、52±9.0歳)由来ならびに10人の性別および年齢の整合された正常なドナー(年齢、49±5.6歳)由来の唾液が、マイクロアレイ研究に用いられた。唾液からの単離されたRNAは、RiboAmp RNA Amplificationキット(Arcturus, Mountain View, CA)による直線的増幅にかけられた。RNA増幅効率は、5つの独立した実行において20個の試料で並行して実行する既知の量(0.1 μg)の対照RNAを用いることにより測定された。
【0202】
マイクロアレイ分析
前に報告されたプロトコール[55]に従って、Human Genome U133A Array(HG U133A, Affymetrix, Santa Clara, CA)が遺伝子発現分析に適用された。アレイはスキャンされ、蛍光強度が、Microarray Suit 5.0ソフトウェア(Affymetrix, Santa Clara, CA)により測定された;アレイは、その後、標準化およびモデルに基づいた解析のためのDNA-Chip Analyzerソフトウェア(http://www.dchp.org)へインポートされた[60]。S-plus 6.0(Insightful, Seattle, WA)がすべての統計学的検定を行うために用いられた。
【0203】
3つの基準が、異なって発現される遺伝子転写産物を測定するために用いられた。第一に、すべての試料において「不在」コールと割り当てられたアレイ上のプローブセットは排除された。第二に、両側スチューデントt検定が、OSCC(n=10)と対照(n=10)の間での平均遺伝子発現シグナル強度の比較に用いられた。0.05の臨界レベルが、統計学的有意性として定義された。第三に、倍比率が、統計学的有意差(P<0.05)を示すそれらの遺伝子転写産物について計算された。少なくとも2倍変化を示すそれらの遺伝子転写産物のみが、さらなる分析のために含まれた。
【0204】
HG U133Aマイクロアレイは、癌患者と整合された正常な被検者の間で唾液RNAプロファイルにおける違いを同定するために用いられた。前に記載された基準により含まれる10,316個の転写産物の間で、本発明者らは、0.05未満のP値をもつ1,679個の転写産物を同定した。これらの転写産物の間で、OSCC群において、836個が上方制御され、843個が下方制御された。観察されたこれらの転写産物は、偶然のみに帰される可能性は低く(2検定、P<0.0001)、P<0.05をもつ偽陽性とみなされた。すべての10個のOSCC唾液検体において、制御における変化>3倍の所定の基準およびP値<0.01のカットオフを用いて、OSCC唾液において有意な上方制御を示す17個のmRNAが同定された。17個の転写産物は、すべての10個のOSCC唾液検体において制御における変化>3倍、およびP値<0.01のよりストリンジェントなカットオフを示した。これらの17個の唾液mRNAはOSCC唾液においてすべて、上方制御されるが、同じフィルタリング基準で下方制御されたことが見出されたmRNAはないことは、注目されるべきである。これらの遺伝子およびそれらの産物の生物学的機能は、マイクロアレイにより同定されたOSCCにおける上方制御された(>3倍、P<0.01)唾液mRNAを示す、表7に示されている。
【0205】
【表7】

【0206】
Human Genome U133Aマイクロアレイは、10人の癌患者および10人の整合された正常な被検者由来の唾液でのRNA発現パターンにおける違いを同定するために用いられた。すべての10個のOSCC唾液検体での制御における変化>3倍の基準、およびP値<0.01のカットオフを用いて、本発明者らは、OSCC唾液において有意な上方制御を示す17個のmRNAを同定した。
【0207】
実施例15:OSCC患者の無細胞唾液からのマイクロアレイプロファイリングのQ-PCR確証および定量分析
定量的ポリメラーゼ連鎖反応(qPCR)は、実施例14のマイクロアレイ分析により同定された異なって発現された転写産物のサブセットを確証するために行われた。
【0208】
定量的ポリメラーゼ連鎖反応確証
最初の増幅されていない唾液RNA由来のcDNAは、MulV逆転写酵素(Applied Biosystems, Foster City, CA)およびプライマーとしてランダムヘキサマー(Applied Biosystems)を用いて合成された。qPCR反応は、iQ SYBR Green Supermix(Bio-Rad, Heucules, CA)でのiCycler PCRシステムにおいて行われた。プライマーセットは、PRIMER3ソフトウェア(http://www.genome.wi.mit.edu)を用いることにより設計された。
【0209】
反応のすべては、特定の産物についてカスタマイズされた条件を用いて3連で行われた。特定の鋳型のcDNA/RNAの最初の量は、前に記載されているように[32]、標準曲線から外挿された。この確証は、マイクロアレイ研究に前に用いられたそれらの20個を含む試料のすべて(n=64)を検査することにより完了した。ウイルコクソンの符号付き検定が統計学的解析に用いられた。
【0210】
定量的PCRは、32人のOSCC患者および32人の整合された対照由来の唾液を含む拡大された試料サイズにおいてマイクロアレイ発見を確証するために行われた。唾液mRNAバイオマーカーの9つの候補:DUSP1、GADD45B、H3F3A、IL1B、IL8、OAZ1、RGS2、S100P、およびSAT、は表7に報告されている、それらの報告された癌関連に基づいて選択された。表8は、qPCRにより測定されたOSCC患者由来の唾液における上の9つの候補の定量的変化を示している。
【0211】
【表8】

9つの可能性のある候補のうちの7つは、qPCRにより確証された(P<0.05)。*ウイルコクソンの符号付き検定:P<0.05の場合には、確証される(はい);P≧0.05の場合には、確証されない(いいえ)。
【0212】
結果は、9つの候補mRNAのうちの7つ(78%)、DUSP1、H3F3A、IL1B、IL8、OAZ1、S100PおよびSAT、の転写産物は、OSCC患者の唾液において有意に上昇したことを確証した(ウイルコクソンの符号付き検定、P<0.05)。本発明者らは、qPCRによりRGS2(P=0.149)およびGADD45B(P=0.116)の量において統計学的有意差を検出しなかった。確証された7つの遺伝子は、増加の大きさにより3つのランクに分類されることができた:IL8(24.3倍)を含む高く上方制御されたmRNA;H3F3A(5.61倍)、IL1B(5.48倍)、およびS100P(4.88倍)を含む中位に上方制御されたmRNA;ならびにDUSP1(2.60倍)、OAZ1(2.82倍)およびSAT(2.98倍)を含む低く上方制御されたmRNA。
【0213】
実施例16:ROCおよび感度/特異性解析
qPCR結果を用いて、受信者動作特性(ROC)曲線解析が、実施例15において同定されたバイオマーカーのそれぞれの予測力を評価するためにS-plus 6.0により行われた[82]。
【0214】
受信者動作特性曲線解析および予測モデル
最適なカットポイントは、最大の対応する感度および特異性を生じるそれらについて検索することにより、各バイオマーカーについて決定された。ROC曲線は、その後、最適な感度および特異性値のセットに基づいてプロットされた。曲線下の面積は、ROC曲線の数値積分法により計算された。ROC曲線下の最大の領域は、OSCCを検出するための最強の予測力をもつとして同定された。
【0215】
次に、多変量分類モデルが、癌予測についての唾液マーカーの最良組み合わせを決定するために構築された。最初に、疾患(OSCC)および非疾患(正常)の二項結果を従属変数として用いて、本発明者らは、患者年齢、性別および喫煙歴について調節されたロジスティック回帰モデルを構築した。逆行段階的回帰[61]が、最良の最終モデルを見出すために用いられた。
【0216】
leave-one out cross validation法は、ロジスティック回帰モデルを確証するために用いられた。交差検定ストラテジーは、まず、1つの観測を除去し、その後、すべてのマーカーを用いて残っている事例からロジスティック回帰モデルを適合させる。段階的モデル選択は、モデルを改善しない変数を除去するためにこれらのモデルのそれぞれについて用いられる。その後、マーカー値は、除外された事例について、その観測について推定されるクラスを計算するために用いられた。交差検定誤差率は、その時、試料の数で割った、間違って予測された試料の数である。
【0217】
図11に例証されたROC曲線は、その後、感度および特異性の計算のための可能性のあるカットポイントとしてモデルからの適合した確率を用いて、類似した手順によりロジスティックモデルについて計算された。
【0218】
OSCCについての7つの可能性のある唾液mRNAバイオマーカーのそれぞれについての受信者動作特性(ROC)曲線下の面積、閾値、および対応する感度および特異性の詳細な統計は、OSCC関連唾液mRNAバイオマーカーのROC曲線解析を示す表9に列挙されている。
【0219】
【表9】

【0220】
qPCR結果を利用して、本発明者らは、バイオマーカーのそれぞれの予測力を評価するためにROC曲線解析を行った。最適なカットポイントは、最大の対応する感度および特異性を生じるように決定された。ROC曲線下の最大面積を有するバイオマーカーが、OSCCを検出するための最強の予測力をもつとして同定された。
【0221】
データは、IL8 mRNAが、OSCCの存在を予測するために7つの可能性のあるバイオマーカーの中で最も良く機能することを示した。IL8についてのROC曲線下の計算された面積は、0.85であった。3.19E-18 mol/Lの閾値をもって、唾液におけるIL8 mRNAは、正常からOSCCを識別するための88%の感度および81%の特異性を生じる。
【0222】
疾患識別のための唾液mRNAの利用を実証するために、2つの分類/予測モデルが調べられた。ロジスティック回帰モデルは、組み合わせて最良の予測を提供する、7つの確証されたバイオマーカーのうちの4つ、IL1B、OAZ1、SATおよびIL8、に基づいて構築された(表10)。表10は、ロジスティック回帰モデルにより選択されたOSCCについての唾液を示す。
【0223】
【表10】

【0224】
ロジスティック回帰モデルは、組み合わせて最良の予測を提供する、7つの確証されたバイオマーカーのうちの4つ(IL1B、OAZ1、SATおよびIL8)に基づいて構築された。係数値は、これらの4つのマーカーについて正であり、唾液でのそれらの濃度における同期化した増加が、試料がOSCC被検者から得られたという確率を増加させたことを示している。
【0225】
係数値は、これらの4つのマーカーについて正であり、唾液でのそれらの濃度における同期化した上昇が、試料がOSCC被検者から得られたという確率を増加させたことを示している。ロジスティック回帰モデルに基づいたleave-one out cross validation法の誤差率は、19%(64個のうち12個)であった。4つのマーカーの同じセットを用いた1つ除外解析において作成されたモデルの(64個のうちの)1個を除くすべては、表10に特定された完全データモデルにおいて有意であることが見出された。
【0226】
ROC曲線は、ロジスティック回帰モデルについて計算された。50%のカットオフ確率を用いて、本発明者らは、91%の感度および91%の特異性を得た。ROC曲線下の計算された面積は、ロジスティック回帰モデルについて0.95であった(図11)。
【0227】
ツリーに基づいた分類モデル、分類および回帰ツリー(CART)
第二モデル、ツリーに基づいた分類モデル、分類および回帰ツリー(CART)モデル、が作成された。CARTモデルは、予知物質として確証されたmRNAバイオマーカーを用いてS-plus 6.0により構築された。CARTは、各段階が、結果として、癌群対正常群の最良の分割を生じる予測変数を検索することを含む、二元再帰分割分析による分類モデルに適合する[62]。CARTは、S-plusについてのデフォルト設定により決定された分割基準をもつエントロピー関数を用いた。このアプローチにより、試料全体(n=64)を含む親群は、その後、癌群および正常群へ分割された。本発明者らの最初のツリーは、結果として、異なる分類をもつ小枝を生じなかったすべての分割を除去するように剪定された。
【0228】
結果は、図12の図に示されている。本発明者らの適合したCARTモデルは、OSCCについての予測変数としてIL8、H3F3AおよびSATの唾液mRNA濃度を用いた。3.14E-18 mol/Lの閾値をもつ最初の分割として選択されたIL8は、合計64個の試料を含む親群から2つの子群を生じた。IL8濃度<3.14E-18 mol/Lをもつ30個の試料は、「正常-1」へ割り当てられ、IL8濃度≧3.14E-18をもつ34個は、「癌-1」へ割り当てられた。「正常-1」群は、1.13E-14 mol/Lの閾値をもつSATによりさらに分割された。
【0229】
結果として生じた下位群、「正常-2」は、SAT濃度<1.13E-14 mol/Lをもつ25個の試料を含み、「癌-2」は、SAT濃度≧1.13E-14 mol/Lをもつ5個の試料を含んだ。同様に、「癌-1」群は、2.07E-16 mol/Lの閾値をもつH3F3Aによりさらに分割された。結果として生じた下位群、「癌-3」は、H3F3A濃度≧2.07E-16 mol/Lをもつ27個の試料を含み、「正常-3」群は、H3F3A濃度<2.07E-16 mol/Lをもつ7個の試料を含んだ。
【0230】
結果として、本発明者らの研究に含まれた64個の唾液試料は、CART解析により「癌」群および「正常」群へ分類された。「正常」群は、「正常-2」からの試料および「正常-3」からの試料から構成された。「正常」群に割り当てられた合計32個の試料、正常被検者からの29個および癌患者からの3個、がある。
【0231】
従って、OSCC予測のためにIL8、SATおよびH3F3Aの組み合わせを用いることにより、全体の感度は、90.6%(32のうち29)である。「癌」群は、「癌-2」および「癌-3」からの試料から構成された。最終の「癌」群に割り当てられた合計32個の試料、癌患者からの29個および正常被検者からの3個、がある。それゆえに、OSCC予測のためにこれらの唾液mRNAバイオマーカーの組み合わせを用いることにより、全体の特異性は、90.6%(32のうち29)である。
【0232】
要約すれば、本開示は、無細胞唾液において細胞外mRNAを検出する段階を含む、バイオマーカーが細胞外mRNAである、唾液においてバイオマーカーを検出するための方法;無細胞唾液においてトランスクリプトームパターンを検出する段階を含む、唾液のトランスクリプトーム分析;無細胞唾液において遺伝子のトランスクリプトームパターンおよび/またはmRNAプロファイリングを検出する段階を含む、唾液を分析することにより器官におけるまたは器官での遺伝子における遺伝的変化を検出するための方法;無細胞唾液および/または血清において、病態、疾患または障害に関連したバイオマーカー、特にmRNAおよび/またはタンパク質、のプロファイルを検出する段階を含む、被検者において、口腔もしくは全身性の病態、疾患または障害を診断するための方法;方法の少なくとも1つを行うための少なくとも1つのバイオマーカーについての識別子を含むキット;ならびに、口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとして唾液および/または血清mRNAの使用を言及する。
【0233】
本明細書に引用されたありとあらゆる刊行物および参照文献の開示は、参照により全体として本明細書に組み入れられている。
【0234】
本開示は、特定の態様に関して説明されている。他の態様は、前の記載に照らせば、当業者にとって明らかであると思われる。本開示の保護の範囲は、添付された特許請求の範囲により限定される。
【0235】
参照文献












【技術分野】
【0001】
開示の分野
本開示は、バイオマーカーのプロファイリング、ならびにそのバイオマーカーを用いる方法およびキットに関する。特に、本開示は、癌、特に、口腔および口腔咽頭の扁平上皮細胞癌(OSCC)、の検出のためのバイオマーカーに関する。
【0002】
本発明は、NIHにより授与された助成金U01-DE15018の政府支援を以てなされた。政府は、本発明において一定の権利を有する。
【背景技術】
【0003】
開示の背景
バイオマーカーは、疾患の進行または処置の効果を測定するために用いられうる特定の生物学的性質、生化学的特徴または面の分子指標である。
【0004】
タンパク質および核酸は、例示的なバイオマーカーである。特に、細胞外で検出されるゲノムメッセンジャーが、疾患についてのバイオマーカーとしての役割を果たしうることは、広く受け入れられている[6]。特に、核酸は、血液、尿および髄液を含むたいていの体液において同定されており、疾患についての診断バイオマーカーとして用いることに採用するのに成功している[28,42,49]。
【0005】
唾液は、血清の受動的「限外ろ過液」[41]ではないが、酵素、ホルモン、抗体および他の分子の特有の組成物を含む。過去10年間において、唾液の診断用液体としての使用は、診断法および様々な疾患のリスクがある集団を予想することに適用されるのに成功した[47]。
【0006】
唾液における特異的かつ情報価値のあるバイオマーカーは、疾患を診断する、およびヒトの健康をモニターする役割を果たすのに望ましい[30,47,6]。例えば、バイオマーカーは、虫歯、歯周炎、口腔癌、唾液腺病、ならびに全身性疾患、例えば、肝炎およびHIV、をモニターするために唾液において同定されている[35]。また、以前の研究は、ヒトDNAバイオマーカーが唾液において同定され、かつ口腔癌検出のために用いられうることを示している[30,36]。RNAはDNAより不安定であり、リボヌクレアーゼによる分解に対して非常に感受性が高いことが推定される。さらに、理想的な診断媒体として働くのに適した、費用のかからない、非侵襲性の、入手しやすい体液を構成する唾液において、リボヌクレアーゼ活性は上昇していることが報告されている。特に、リボヌクレアーゼ活性は、癌患者の唾液において上昇していることが報告されている[83]。従って、ヒトmRNAは、唾液において細胞外で生存することはできないと、一般的に推定されている。世界で、OSCCは6番目に多い癌であり、毎年50,000人の米国人を冒している。世界中で、口腔および口腔咽頭の癌は、大きな公衆衛生問題を表している。OSCCは、インドにおいてすべての新しく診断された癌のほとんど50%を占め、フランスにおいては、主な死亡原因である[1]。
【0007】
局所領域的管理における改善にもかかわらず、罹患率および死亡率は、過去30年間、ほとんど改善されていない[2]。それゆえに、この疾患の初期検出または予防は、最も効果的である可能性が高い。初期段階でOSCCを検出することは、この疾患から死亡および美観を損なうことを低減させうる最も効果的な手段であると考えられる。たいていの頭頸部癌についての確定的な初期警告徴候の欠如は、感度が高くかつ特異的なバイオマーカーが、高リスク患者をスクリーニングするにおいて重要である可能性が高いことを示唆する。
【発明の概要】
【0008】
開示の概要
第一局面により、細胞相および流体相を含む体液中のバイオマーカーを検出するための方法であって、バイオマーカーが細胞外mRNAであり、かつ体液が唾液、好ましくは刺激されていない唾液である、方法が開示されている。方法は以下の段階を含む:体液の無細胞流体相部分を供給する段階;および体液の無細胞流体相部分中の細胞外mRNAを検出する段階。
【0009】
特に、細胞外mRNAを検出する段階は、以下の段階を含みうる:体液の無細胞流体相部分から細胞外mRNAを単離する段階、および細胞外mRNAを増幅する段階。
【0010】
第二局面により、細胞相および流体相を含む体液のトランスクリプトーム分析であって、体液が唾液である、分析が開示されている。方法は以下の段階を含む:体液の無細胞流体相部分を供給する段階;および体液の無細胞流体相部分においてトランスクリプトームパターンを検出する段階。体液は、好ましくは、刺激されていない唾液である。
【0011】
特に、唾液上清においてトランスクリプトームパターンを検出する段階は、好ましくは、マイクロアレイアッセイにより、最も好ましくは高密度オリゴヌクレオチドマイクロアレイアッセイにより、行われる。唾液上清においてトランスクリプトームパターンを検出する段階はまた、定量的PCR分析またはRT-PCR分析により行われうる。
【0012】
第三局面により、器官から流出し、かつ細胞相および流体相を含む体液を分析することにより器官における遺伝的変化を検出するための方法が開示されている。体液は、特に、唾液、好ましくは、刺激されていない唾液であり、方法は以下の段階を含む:体液の無細胞流体相部分を供給する段階;体液の無細胞流体相部分においてトランスクリプトームパターンを検出する段階;およびトランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、あらかじめ決められたパターンが、体液の正常な無細胞流体相部分の共通のトランスクリプトームパターンを示している、段階。
【0013】
第四局面により、器官から流出し、かつ細胞相および流体相を含む体液を分析することにより器官における遺伝子の遺伝的変化を検出するための方法が開示されている。体液は、特に、唾液であり、方法は以下の段階を含む:体液の無細胞流体相部分を供給する段階;体液の無細胞流体相部分において遺伝子のmRNAプロファイルを検出する段階;および遺伝子のmRNAプロファイルを遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、遺伝子のあらかじめ決められたmRNAプロファイルが、体液の正常な無細胞流体相部分における遺伝子のmRNAプロファイルを示している、段階。
【0014】
第五局面により、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:被検者の唾液の無細胞流体相部分を供給する段階;供給された無細胞唾液流体相部分において、病態、疾患または障害と関連した遺伝子のmRNAプロファイルを検出する段階;および遺伝子のRNAプロファイルを遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、遺伝子のあらかじめ決められたmRNAプロファイルが、被検者における病態、疾患または障害の存在を示している、段階。
【0015】
第一態様において、病態、疾患または障害は、口腔および/または口腔咽頭の癌であり、体液は唾液であり、遺伝子は、IL8(インターロイキン8)、IL1B(インターロイキン1、β)、DUSP1(二重特異性ホスファターゼ1)、H3F3A(H3ヒストン、ファミリー3A)、OAZ1(オルニチンデカルボキシラーゼ抗酵素1)、S100P(S100カルシウム結合タンパク質P)およびSAT(スペルミジン/スペルミンN1-アセチルトランスフェラーゼ)をコードする遺伝子からなる群より選択される。
【0016】
第二態様において、病態、疾患または障害は、口腔および/または口腔咽頭の癌であり、体液は血清であり、遺伝子は、選択されるIL6(インターロイキン6)、H3F3A、TPT1(翻訳調節された腫瘍タンパク質1)、FTH1(フェリチン重ポリペプチド1)、NCOA4(核受容体活性化補助因子4)、およびARCR(Ras相同体遺伝子ファミリー、メンバーA)である。
【0017】
診断されうる疾患は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。
【0018】
第六局面により、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:被検者の唾液の無細胞流体相部分を供給する段階;供給された無細胞流体相部分において、病態、疾患または障害と関連したトランスクリプトームパターンを検出する段階;およびトランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、トランスクリプトームパターンにおける、あらかじめ決められたパターンの特徴の認識が、被検者における病態、疾患または障害についての診断となる、段階。
【0019】
態様において、病態、疾患または障害は、口腔および/または口腔咽頭の癌であり、トランスクリプトームは、唾液由来のIL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SATについての転写産物からなる群より選択される。
【0020】
第七局面により、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されており、方法は以下の段階を含む:被検者の血清を供給する段階;供給された血清において、病態、疾患または障害と関連したトランスクリプトームパターンを検出する段階;およびトランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、トランスクリプトームパターンにおける、あらかじめ決められたパターンの特徴の認識が、被検者における病態、疾患または障害の診断となる、段階。
【0021】
態様において、病態、疾患または障害は、口腔および/または口腔咽頭の癌であり、トランスクリプトームは、血清由来のIL6、H3F3A、TPT1、FTH1、NCOA4およびARCRについての転写産物からなる群より選択される。
【0022】
診断されうる疾患は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。
【0023】
第八局面により、被検者において癌を診断するための方法が開示されている。方法は以下の段階を含む:被検者の体液を供給する段階;体液において、バイオマーカーのプロファイルを検出する段階;およびバイオマーカーのプロファイルをあらかじめ決められたバイオマーカーのプロファイルと比較する段階であって、バイオマーカーのあらかじめ決められたプロファイルの特徴の、バイオマーカーのプロファイルにおける認識が癌の診断となる、段階。
【0024】
診断されうる病態、疾患または障害は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。バイオマーカーは、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRを含む。
【0025】
第一態様において、病態、疾患または障害は、口腔咽頭扁平上皮細胞癌であり、バイオマーカーは、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SATからなる群より選択され、体液は唾液であり、バイオマーカーのプロファイルを検出する段階は、バイオマーカーのmRNAプロファイルを検出することにより行われる。
【0026】
第二態様において、病態、疾患または障害は、口腔咽頭扁平上皮細胞癌であり、バイオマーカーは、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択され、体液は血清であり、バイオマーカーのプロファイルを検出する段階は、バイオマーカーのmRNAプロファイルを検出することにより行われる。
【0027】
第三態様において、病態、疾患または障害は、口腔咽頭扁平上皮細胞癌であり、バイオマーカーはIL6であり、体液は血清であり、バイオマーカーのプロファイルを検出する段階は、バイオマーカーのタンパク質プロファイルを検出することにより行われる。
【0028】
第八局面により、口腔および/もしくは全身性の病態、疾患または障害の診断のためのキットが開示されており、キットは以下のものを含む:バイオマーカーがIL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される、体液における少なくとも1つのバイオマーカーの識別子;ならびに識別子についての検出器。
【0029】
診断されうる病態、疾患または障害は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。
【0030】
識別子および検出器は、本明細書に開示された方法によりバイオマーカーの体液プロファイルを検出するにおいて用いられうる。特に、識別子は、体液中のバイオマーカーへ結合しており、検出器は、識別子を検出するために用いられ、それにより、識別子および検出器はバイオマーカーの体液プロファイルの検出を可能にする。
【0031】
第九局面により、口腔および/もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとして唾液および/または血清mRNAを用いる段階。
【0032】
好ましい態様において、mRNAは、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択されるバイオマーカーの少なくとも1つをコード化する。
【0033】
診断されうる疾患は、口腔咽頭扁平上皮細胞癌、および場合により、他の全身性疾患を含む。
【0034】
第十局面により、口腔および/または全身性の病態を診断するための方法が開示されている。方法は以下の段階を含む:口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとして唾液または血清タンパク質、特に、血清におけるIL6タンパク質および唾液におけるIL8タンパク質、を用いる段階。
【0035】
開示の方法およびキットは、添付の図面を用いて例示される。
【図面の簡単な説明】
【0036】
【図1】図1Aは、1ヶ月間(レーン2)、3ヶ月間(レーン3)および6ヶ月間(レーン4)の貯蔵後、人間由来の無細胞唾液上清から単離されたRNAにおいて行われたACTBについてのRT-PCRタイピングの結果を示し、100 bpのラダー分子量マーカー(レーン1)および陰性対照(鋳型を除く)(レーン5)を含む。分子サイズマーカーは、矢印で図の左側に示されている。図1Bは、人間由来の無細胞唾液上清から単離されたRNAにおいて行われたRT-PCRの結果、ならびにGAPDH(B1)、RPS9(B2)およびACTB(B3)のタイピングを示し、陽性対照(ヒト全RNA、BD Biosciences Clontech, Palo Alto, CA, USA)(レーン2)および陰性対照(鋳型を除く)(レーン3)を含む。分子サイズマーカーは、矢印で図の左側に示されている。
【図2】図2Aは、人間由来の無細胞唾液上清から単離されたRNAからのRNA増幅をモニターするために行われたキャピラリー電気泳動の結果を示す。レーン1〜5は、1 kb DNAラダー(レーン1)、RNA単離後の5 μl 唾液(検出不可能)(レーン2)、1 μl 2ラウンド増幅されたcRNA(200 bpから〜4 kbまでの範囲)(レーン3)、断片化後の1 μl cRNA(約100 bp)(レーン4)、およびAmbion RNA Century Marker(レーン5)を示す。分子サイズマーカーは、矢印で図の左側および右側に示されている。図2Bは、人間由来の無細胞唾液上清から単離されたRNAにおいて行われたPCRの、増幅の様々な段階における結果、およびACTBについてのタイピングを示す。レーン1〜8は、100 bp DNAラダー(レーン1)、無細胞唾液から単離された全RNA(レーン2)、第1ラウンドcDNA(レーン3)、RT後の第1ラウンドcRNA(レーン4)、第2ラウンドcDNA(レーン5)、RT後の第2ラウンドcRNA(レーン6)、陽性対照(ヒト全RNA、BD Biosciences Clontech, Palo Alto, CA, USA)(レーン7)および陰性対照(鋳型を除く)(レーン8)を示す。分子サイズマーカーは、矢印で図の左側に示されている。図2Cは、マイクロアレイ上でハイブリダイゼーションの前にAgilent 2100 Bioanalyzerにより行われた標的cRNAの分析の結果を報告する図を示す。x軸において、マーカーRNAを参照した、断片化cRNAの分子量(bp)が示されている。y軸において、Bioanalyzerにより測定可能である断片化cRNA(ug/ml)の量が示されている。
【図3】ラダー(Mrkr)、陽性対照(Ctrl(+))、および陰性対照(Ctrl(-))と共に、人間由来の無細胞唾液上清から単離されたRNAにおいて行われたRT-PCRの結果、ならびにIL6(IL6)、IL8(IL8)、およびβ-アクチン(β-アクチン)についてのタイピングを示す。
【図4】細胞溶解および細胞内化合物の流出についてのマーカー(Mrkr)としてゲノムDNAを用いる、全唾液、血清試料、ならびに0 xg(0 xg)、1,000 xg(1,000 xg)、2,600 xg(2,600 xg)、5,000 xg(5,000 xg)、および10,000 xg(10,000 xg)で遠心分離されている試料において、ハウスキーピングβ-アクチンについて行われたPCRの結果を示す。
【図5】図5Aは、OSCCをもつ患者(癌)および正常な被検者(対照)由来の唾液においてqRT-PCRにより反復試験試料で検出されるIL8についてのmRNAの平均濃度を報告する図を示す。x軸において、試料群が報告されている。y軸において、検出されたコピーの数が報告されている。図5Bは、OSCCをもつ患者(癌)および正常な被検者(対照)由来の唾液においてELISAにより反復試験試料で検出されるIL8の平均濃度を報告する図を示す。x軸において、試料群が報告されている。y軸において、pg/mlで表された濃度が報告されている。
【図6】図6Aは、OSCCをもつ患者(癌)および正常な被検者(対照)由来の血清においてqRT-PCRにより反復試験試料で検出されるIL6についてのmRNAの平均濃度を報告する図を示す。x軸において、試料群が報告されている。y軸において、検出されたコピーの数が報告されている。図6Bは、OSCCをもつ患者(癌)および正常な被検者(対照)由来の血清においてELISAにより反復試験試料で検出されるIL6の平均濃度を報告する図を示す。x軸において、試料群が報告されている。y軸において、pg/mlで表された濃度が報告されている。
【図7】図7Aは、唾液におけるIL8について計算された受信者動作特性(ROC)曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。図7Bは、血清におけるIL6について計算されたROC曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。図7Cは、唾液におけるIL8および血清におけるIL6の組み合わせについて計算されたROC曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。
【図8】対照としてDNAラダー(レーン1)と共に、RPS9(レーン2、3および4);GAPDH(レーン5、6および7);B2M(レーン8、9および10)およびACTB(レーン11、12および13)に対する唾液mRNAの血清ヒトmRNA表現型解析(phenotyping)において行われたPCR反応の結果を示す。
【図9】血清における循環mRNAについてのロジスティック回帰モデルのROC曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。
【図10】OSCCについての血清mRNA予知物質を評価する分類および回帰ツリー(CART)を報告する図を示す。
【図11】組み合わされた唾液mRNAバイオマーカーの予測力についてのロジスティック回帰モデルのROC曲線を報告する図を示す。x軸において、1-特異性が報告されている。y軸において、感度が報告されている。
【図12】OSCCについての唾液mRNA予知物質を評価する分類および回帰ツリー(CART)モデルを報告する図を示す。
【発明を実施するための形態】
【0037】
好ましい態様の詳細な説明
体液が唾液であり、かつ細胞外mRNAが唾液の無細胞流体相部分において検出される、体液中の細胞外mRNAを検出するための方法が開示されている。唾液の無細胞流体相部分におけるRNAの存在は、実施例で広範に記載された手順により確認され、検出されたmRNAの質は、PCR、qPCRおよびマイクロアレイアッセイのような技術についての要求を満たしている。
【0038】
本方法において、細胞外mRNA、本明細書ではまた情報価値のあるmRNA、を検出する段階は、体液、調査分析のための理想的な媒体として働く、費用のかからない、非侵襲性で入手しやすい体液の要求を満たす唾液、において行われる。
【0039】
情報価値のあるmRNAを検出する段階は、特に、単純かつ正確な方式で分子を分析することを可能にする、微生物および食物細片のような外来物質の存在が最小化されている、唾液の部分(無細胞流体相)において行われる。好ましくは、刺激されていない唾液由来の無細胞流体相部分。
【0040】
本方法において、唾液は、当技術分野において公知の手順に従って収集され、その後、例えば、収集された唾液の遠心分離により、その無細胞流体相部分を引き出すために処理されうり、結果として、ペレット化された唾液細胞相および無細胞唾液流体相上清を生じる。(実施例1、5および13に広範に記載された手順を参照)。
【0041】
本開示により、唾液の細胞相および流体相を分離するための条件は、流体無細胞相において検出されるRNAに寄与すると思われる細胞要素の機械的破壊を避けるように最適化される。
【0042】
分離が遠心分離により行われる態様において、最適化は、最適化遠心分離速度を導くために、細胞溶解および流出のマーカーとしてDNAを用いて、様々な速度で遠心分離された試料において、および全唾液試料において、ハウスキーピング遺伝子を検査することにより行われうる。(実施例5に記載された手順を参照)。
【0043】
無細胞唾液流体相部分における細胞外mRNA(唾液mRNA)の検出は、その後、RT-PCR、Q-PCRおよびマイクロアレイのようなmRNA定性的および/または定量的分析を可能にする当技術分野において公知の技術により行われうる。検出は、特に、唾液mRNAの単離および増幅を含みうる、ならびに実施例に例示されている、手順に従って行われうる。
【0044】
方法における唾液mRNAの検出は、唾液mRNAをプロファイリングすることを目的として行われうる。
【0045】
第一連の態様において、あらかじめ決められた遺伝子の発現は、唾液の無細胞流体相部分においてプロファイリングされうる。それらの態様において、mRNAプロファイルの検出は、RT-PCR、またはあらかじめ決められた標的mRNAの同定を可能にする任意の技術により行われうる。定量的分析は、その後、RT-PCRにより同定されたmRNAの存在を確認するために定量的PCR(Q-PCR)のような技術で行われうる。参照データベースは、その後、そのように得られたmRNAプロファイルに基づいて作製されうる。唾液mRNAのそのような定性的および定量的分析を行うための例示的手順は、実施例1、4および9で詳細に記載されている。
【0046】
第二連の態様において、唾液のトランスクリプトーム分析は、唾液の無細胞流体相部分においてトランスクリプトームパターンを検出することにより行われうる。トランスクリプトームパターンの検出は、唾液mRNAを単離して、直線的に増幅することにより行われうり、その後、高密度オリゴヌクレオチドマイクロアレイのような技術でプロファイリングされうる。定量的分析は、マイクロアレイにより同定されたパターンにおけるmRNAの存在を確認するためにQ-PCRのような技術で行われうる。参照データベースは、その後、そのように得られたmRNAプロファイルに基づいて作製されうる。唾液mRNAのそのような定性的および定量的分析を行うための例示的手順は、実施例2〜3、9〜10および14〜15で詳細に記載されている。
【0047】
唾液RNAをプロファイリングすることは、ヒトの健康および疾患を検出するおよび/もしくはモニターするために、または、例えば、唾液におけるmRNAの源、放出およびクリアランスのような生物学的問題を研究するために、行われうる。唾液mRNAは、口腔および全身性の病態、疾患または障害の高いリスクがある集団ならびに患者を同定するための実際のまたは可能性のあるバイオマーカーを提供する。
【0048】
正常な被検者の唾液の無細胞流体相部分を特徴付ける唾液mRNAプロファイルおよびトランスクリプトームパターンの変化は、様々な源の病態、疾患または障害を示しうる。それらの病態、疾患または障害の例は、口腔の炎症性状態、OSCC、または、糖尿病、乳癌およびHIVのような他の状態により提供される。
【0049】
また、決められた病態、疾患または障害に冒されている被検者のmRNAプロファイルとトランスクリプトームパターンの間の比較は、結果として、決められた病態、疾患または障害について情報価値のあるバイオマーカーの同定を生じうる。特に、唾液mRNAは、口腔において顕在化されうる口腔および全身性の病態、疾患または障害についての診断バイオマーカーとして用いられうる。
【0050】
特に、唾液mRNAは、口腔に顕在化されうるおよび/または口腔を冒しうる癌についての診断バイオマーカーとして用いられうる。唾液に基づいたmRNAアッセイは、信頼性のある診断のための必要とされる特異性および感度を有する。
【0051】
様々な型の癌の場合において、正常な唾液mRNAおよびトランスクリプトームパターンの変化はまた、腫瘍の存在に関連している口腔の1つまたは複数の部分における遺伝的変化を反映しうる。口腔癌患者について、検出された癌関連RNAシグネチャーは、適合した腫瘍および/または3つの主要な源(唾液腺、歯肉溝滲出液、および口腔粘膜細胞)のそれぞれから来た全唾液においてさらにそれ自身を反映する全身性応答(局所的または遠位)から生じる可能性が高い。疾患関連RNAは、唾液腺または歯肉溝滲出液による循環を経由して口腔にたどり着くことができると考えられる。良い例は、乳癌患者の唾液におけるHER-2タンパク質の存在の上昇である[87]。
【0052】
正常唾液コアトランスクリプトーム(Normal Salivary Core Transcriptome)(NSCT)としても定義される、約185個の異なるヒトmRNAを含む正常な無細胞唾液の共通のトランスクリプトームは、正常な被検者由来の唾液の無細胞流体相において行われたトランスクリプトーム分析の結果において同定された(実施例2、表2参照)。
【0053】
NSCTは、〜19,000個のヒト遺伝子のみを表すHG U1 33Aマイクロアレイにおいてプローブセットを用いて同定され、ヒトゲノムは、30,000個より多い遺伝子から構成される[48]ことから、他の方法により、より多いヒトmRNAが唾液において同定されることが予想され、追加の唾液パターンが、本明細書に開示された方法により同定可能である。
【0054】
正常な集団由来の無細胞唾液におけるNSCTおよび/または他の唾液トランスクリプトームパターンは、疾患診断法および正常な健康監視における可能性のある適用として、唾液トランスクリプトーム診断法(Salivary Transcriptome Diagnostics)(SlvTD)において役割を果たしうる。
【0055】
従って、SlvTDの第一態様において、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:被検者の唾液の無細胞流体相を供給する段階;供給された無細胞唾液流体相部分において、疾患と関連した遺伝子のmRNAプロファイルを検出する段階;および遺伝子のRNAプロファイルを遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、遺伝子のあらかじめ決められたmRNAプロファイルが被検者における疾患の存在を示している、段階。
【0056】
SlvTDの第二態様において、被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法が開示されている。方法は以下の段階を含む:被検者の無細胞唾液上清を供給する段階;無細胞唾液上清において、病態、疾患または障害と関連したトランスクリプトームパターンを検出する段階;およびトランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、トランスクリプトームパターンにおける、あらかじめ決められたパターンの特徴の認識が、被検者における病態、疾患または障害についての診断となる、段階。
【0057】
SlvTDの第三態様において、あらかじめ決められた病態、疾患または障害と関連したバイオマーカーを同定するための方法が開示されている。方法は以下の段階を含む:病態、疾患または障害に冒されている被検者の唾液の無細胞流体相部分においてあらかじめ決められた遺伝子の第一mRNAプロファイリングを検出する段階;正常な被検者の唾液の無細胞流体相部分においてあらかじめ決められた遺伝子の第二mRNAプロファイリングを検出する段階;第一mRNAプロファイリングを第二mRNAプロファイリングと比較する段階であって、第一mRNAプロファイリングと第二mRNAプロファイリングの間の違い、その違いは統計学的解析により確証されるのだが、その認識が、あらかじめ決められた病態、疾患または障害についてのバイオマーカーとしてのあらかじめ決められた遺伝子の同定を示している、段階。
【0058】
特に、1つの疾患カテゴリーと1つの健康なカテゴリーのRNAプロファイリング間の違いは、マイクロアレイ統計学的方法により解析される。用いられるアルゴリズムは、MAS 5.0 DNA-Chipアナライザー1.3およびRMA 3.0を含む。好ましくは、解析は、より効果的かつ正確な、検査されうるマーカーを提供するために、これらの方法の組み合わせにより行われる。マイクロアレイにより同定されたマーカーは、その後、Q-PCRのような通常の技術により検査される。
【0059】
SlvTDの第四態様において、無細胞唾液が、バイオマーカーの存在または発現について識別子と接触させられ、バイオマーカーの存在または発現へ結合した識別子の存在が、好ましくは検出器の手段により、検出される、診断方法が行われうる。
【0060】
SlvTDは、高感度および高特異性の組み合わされた特徴を示すスクリーニングツールで、処置が成功する可能性が高くあるのに十分初期の段階で腫瘍のような疾患の検出を可能にする。さらに、スクリーニングツールは、広範囲に及ぶ適用を可能にするのに十分、非侵襲性でかつ費用がかからない。
【0061】
SlvTDの上の方法の結果は、mRNAおよび/もしくはタンパク質レベルで、ならびに/または血清のような他の体液において、行われた対応する分析と統合されうる。
【0062】
血清において検出されるタンパク質またはトランスクリプトームパターンのようなバイオマーカーもまた、疾患診断法および正常な健康監視における可能性のある適用として、血清トランスクリプトーム診断法(Serum Transcriptome Diagnostics)(SrmTD)において役割を果たしうる。SrmTDの態様は、分析される体液が無細胞唾液の代わりに血清である、SlvTDについての上で報告されたものに対応する方法を含む。
【0063】
特に、SlvTDに従って得られた結果は、組み合わされた唾液血清トランスクリプトームアプローチ(Salivary and Serum Transcriptome approach)(SSTD)において、SrmTDで得られた結果と組み合わされうる。
【0064】
SSTDに従って、体液、血清および/または唾液が、バイオマーカーの存在または発現について識別子と接触させられ、バイオマーカーがタンパク質またはmRNAでありうり、バイオマーカーの存在または発現に結合した識別子の存在が、好ましくは検出器の手段により、検出される、診断方法が行われうる。
【0065】
SlvTD、SrmTDおよびSSTDの例は、OSCCに関して本明細書に提供されている。当業者は、本開示を読むことにより、OSCCとは異なる疾患について、本明細書に例示されたSTDの適切な改変を導くことができる。
【0066】
2つの特定のサイトカイン、IL6およびIL8のプロファイリングは、実施例4〜8に広範に開示された手順に従って、OSCCをもつ患者の唾液および血清の無細胞流体相部分において測定された。IL8は、OSCCをもつ患者の唾液においてより高い濃度で検出され(P<0.01)、IL6は、OSCCをもつ患者の血清においてより高い濃度で検出された(P<0.01)。これらの結果は、mRNAおよびタンパク質の両方のレベルで確認され、結果は一致した。唾液におけるIL8および血清におけるIL6の濃度は、性別、年齢、またはアルコールもしくはタバコの使用と関連しているようには思われなかった(P>0.75)。データは、統計学的解析、特にROC解析にかけられ、OSCCを検出するための各バイオマーカーの閾値、感度および特異性を決定することができた(実施例8、表3参照)。さらに、本発明者らは、唾液検体においてmRNAを測定することができた。
【0067】
OSCCをもつ患者および正常な被検者から収集された刺激されていない唾液のトランスクリプトーム分析は、実施例9〜12において、および実施例13〜16において開示されているように、行われた。
【0068】
RNA単離は、唾液上清から行われ、続いて、T7 RNAポリメラーゼで2ラウンドの直線的増幅が行われた。ヒトゲノムU133Aマイクロアレイは、ヒト唾液トランスクリプトームをプロファイリングするために適用された。異なる遺伝子発現パターンは、10人の整合された癌患者および対照においてt検定比較および倍変化分析を組み合わせることにより解析された。定量的ポリメラーゼ連鎖反応(qPCR)は、マイクロアレイにより有意差(P<0.01)を示した選択された遺伝子を確証するために用いられた。これらの唾液mRNAバイオマーカーの予測力は、受信者動作特性曲線および分類モデルにより解析された。
【0069】
マイクロアレイ分析の第一セットの結果は、癌患者と対照の間で唾液において有意に異なる発現レベル(P<0.05)を示した1,679個の遺伝子があることを示した。OSCC唾液において少なくとも3.5倍上昇を示した(P<0.01)7つの癌関連mRNAバイオマーカーは、OSCC患者(n=32)および対照(n=32)からの唾液試料におけるqPCRにより一貫して確証された。これらの唾液RNAバイオマーカーは、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、およびSATの転写産物である。これらのバイオマーカーの組み合わせは、OSCCを対照から識別するにおいて、感度(91%)および特異性(91%)を生じた。(実施例13〜16を参照)。
【0070】
マイクロアレイ分析の第二セットの結果は、報告された癌関連に基づいて選択された10個の上方制御された遺伝子のうちの5個が、OSCC患者の血清において転写産物の有意な上昇を示したことを示した。これらのRNAバイオマーカーは、H3F3A、TPT1、FTH1、NCOA4およびARCRの転写産物である。qPCRにより確証された結果は、これらの5個の遺伝子の転写産物が、OSCC患者の血清において有意に上昇したことを確認した(ウイルコクソンの符号付き検定、P<0.05)。(実施例9〜12参照)。
【0071】
記載された収集物および処理プロトコールを用いて、ACTB、B2W、GAPDHおよびRPS9 mRNA(対照mRNA)の存在が、RT-PCRによりすべての血清(患者および対照)において確認された。
【0072】
従って、被検者において癌、特にOSCC、を診断するための方法が開示されている。方法は以下の段階を含む:被検者の体液を供給する段階;体液において、バイオマーカーのプロファイルを検出する段階であって、バイオマーカーが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される、段階;ならびにバイオマーカーのプロファイルをバイオマーカーのあらかじめ決められたプロファイルと比較する段階であって、バイオマーカーのあらかじめ決められたプロファイルの特徴の、バイオマーカーのプロファイルにおける認識が癌についての診断になる、段階。
【0073】
口腔および/もしくは全身性の病態、疾患または障害、特にOSCCを診断するための方法もまた開示されている。方法は、口腔および/または全身性疾患についてのバイオマーカーとして唾液mRNA、特に、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、およびSATからなる群より選択される唾液mRNA、を用いることを含む。
【0074】
さらに、口腔および/もしくは全身性の病態、疾患または障害、特にOSCCを診断するための方法が開示されている。方法は以下の段階を含む:口腔および/または全身性疾患についてのバイオマーカーとして血清mRNAおよび/またはタンパク質、特に、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される血清mRNAならびに血清IL6タンパク質、を用いる段階。
【0075】
発癌の多因子性性質および発癌経路における不均一性を考慮すれば、より高い特異性および感度を保証する、唾液および/または血清バイオマーカーの組み合わせの使用は好ましい。報告された複数の統計学的ストラテジーおよび実施例に記載されたリスクモデルは、OSCC患者試料を同定することができるバイオマーカーの組み合わせを同定するために、および患者の特定の癌リスクについての適切な血清トランスクリプトームに基づいた診断を割り当てることを容易にするために、用いられうる。
【0076】
唾液の無細胞流体相部分における、および/または血清のような他の体液における、唾液mRNAのプロファイルのモニタリングは、OSCC患者の術後管理において用いられうる。それは、処置の効力、または治療が終わった後の疾患再発をモニターするために用いられうる可能性がある。唾液mRNAおよび特にIL8はまた、口腔癌をもつ患者の処置を方向づけるための予後指標としての役割を果たしうる。見通しとして、高リスクの患者は、より攻撃的またはアジュバント治療計画へと方向づけられうる。
【0077】
これらのバイオマーカーの使用はまた、腫瘍の病期診断を向上させうる。伝統的な技術では、顕微鏡的遠位の疾患の存在は、しばしば、認識されない。近年、推定される局所領域的疾患について処置される患者について、局所領域的不全から遠位不全へのシフトがあった[18]。これは一部、治療の開始の前に存在する無症状性遠位疾患の反映である。バイオマーカーの存在について検査することは、正常組織の背景において少量の腫瘍細胞の検出を可能にしうる。頭頸部腫瘍に特異的なバイオマーカーまたはそのようなバイオマーカーのパネルとしての唾液mRNAは、遠位の顕微鏡的疾患の検出を可能にしうる。口腔癌について、この点において、STDアプローチの最も重要な適用の一つは、口腔前悪性病変の癌転換を検出することである。
【0078】
唾液mRNAのプロファイリングはまた、癌の発生における遺伝子の役割、特に、これらの遺伝子の異常な発現が、ヒトOSCCの発症に機能的に寄与しているかどうか、を調べるために用いられうる。頭頸部/口腔癌におけるこれらの遺伝子の示差的発現の生物学的有意性が測定されるはずである。癌患者において一貫して変化している癌関連遺伝子の同定は、診断マーカーだけでなく、頭頸部癌発生に関与する分子プロファイルについての洞察も提供する。任意の特定の癌において分子変化のプロファイルを理解することは、結果として生じるその癌の表現型を分子事象と相関させることが可能になるため、非常に有用である。
【0079】
本明細書に開示された方法と関連したキット(Kits of parts)もまた開示されている。例示的態様において、キットは以下のものを含む:唾液mRNAまたはタンパク質、および血清mRNAまたはタンパク質のような体液中のバイオマーカーの識別子(バイオマーカーはIL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される);ならびに識別子についての検出器(本明細書に開示された方法の1つによりバイオマーカーの体液プロファイルを検出するにおいて用いられうる識別子および検出器であって、識別子が体液中のバイオマーカーに結合しており、検出器が識別子を検出するために用いられ、それにより、識別子および検出器がバイオマーカーの体液プロファイルの検出を可能にする)。
【0080】
体液は唾液でありうり、検出は、その無細胞流体相部分、または血清のような別の体液において行われる。
【0081】
識別子および識別子を検出することができる検出器は、当業者により特定可能である。キットに適切に含まれうる他の組成物および/または成分もまた当業者により特定可能である。
【0082】
識別子および試薬は、識別子および/または試薬が適した媒体、担体または補助剤と共に含まれている、1つまたは複数の組成物に含まれうる。
【0083】
本明細書に開示された診断キットにおいて、作用物質および識別子試薬が、本明細書に開示された方法を行うために、適した使用説明書および他の必要な試薬と共に、キットで提供されうる。キットは、通常、別々の容器に組成物を含む。アッセイを実行するについての使用説明書、例えば、紙、またはテープもしくはCD-ROMのような電子的支持体上の書いたまたは音の使用説明書は、通常、キットに含まれる。キットはまた、用いられる特定の方法に依存して、他のパッケージされた試薬および材料(すなわち、洗浄緩衝液など)を含みうる。
【0084】
組成物の適した担体剤または補助剤の特定、ならびに一般的なキットの製造およびパッケージングに関するさらなる詳細は、本開示を読むことにより当業者により特定されうる。
【0085】
本明細書に開示されたキットは、特に診断目的として用いられうる。結果として、患者における、病態、疾患または障害、ならびに特に、口腔の、および口腔咽頭癌、の非侵襲性診断検出が開示されている。
【0086】
唾液の流体相の使用は、剥離した細胞の使用を凌ぐ独特の利点をもつ。腫瘍の位置に依存するが、腫瘍ベッドに容易に接触して採取することができない可能性がある。唾液バイオマーカーは腫瘍が発生している部位を同定できないとしても、それらは、リスクのある患者を同定することができる。そのような唾液検査は、上部気道消化管の慎重な評価のための紹介について患者を選択しうるスクリーニングツールとして、リモート位置において非専門家により施されうる。初期段階の、以前には検出されなかった疾患を見出すことは、究極的には命を救いうる。さらに、容易にアクセス可能なバイオマーカーの使用は、大きな集団または化学的予防試験において高い有益性を立証しうる。これは、日常的歯科通院中または疾患の発生のリスクが高い個体のターゲットされたスクリーニングを構想されうる。家庭用検査キットもまた構想されうる。
【0087】
血液検査の使用もまた、特に、癌初期検出として構想される。OSCCについての診断用の、IL6 mRNAおよびタンパク質、H3F3A mRNA、TPT1 mRNA、FTH1 mRNA、NCOA4 mRNAおよびARCR mRNAのような、腫瘍遺伝的変化の特徴を表す癌患者の血清において無細胞循環mRNAまたはタンパク質を回収することは、血液作業をもつ日常的な医師の往診中の潜伏OSCCの存在についてのスクリーニング検査、または口腔癌発生のリスクが高い個体のターゲットされたスクリーニングとして、構想されうる。家庭用検査キットもまた構想されうり、好ましくは含む。
【0088】
特に、末梢血が、日常的臨床手順を用いて被検者から得られうり、mRNAおよびタンパク質が、好ましくは本明細書に開示された最適化手順で単離されうる。それぞれのサイトカインについてのリアルタイム定量的PCRおよびELISAが、IL6のような1つまたは複数のバイオマーカーについて行われる。
【0089】
本明細書に開示された展望的態様は、口腔液体における分子バイオマーカーの超高感度検出のためのマイクロ/ナノ電気機械システム(MEMS/NEMS)へと方向づけられる。確証されたOSCCバイオマーカーについてのRNAおよびタンパク質発現は、癌検出のための標的として選択される。複数のOSCCバイオマーカーについてのmRNAおよびタンパク質の同時検出のためのこれらの検出システムの統合は、結果として、口腔液体に基づいた癌診断法のための効率的な、自動化の、手頃な価格のシステムを生じる。
【0090】
開示の方法およびキットに用いられうる試薬、条件、組成物および技術に関するさらなる詳細は、本開示を読むことにより当業者により特定可能である。
【0091】
他の病態、疾患および障害の調査および診断に関連したmRNAプロファイリングならびにトランスクリプトーム分析のための、OSCCおよび/またはHSNCCへ関連づけられるような本明細書に開示および例示されたSTD方法ならびにキットの適切な改変もまた、本開示を読むことにより当業者によりなされうる。
【0092】
以下の実施例は、本発明をさらに詳細に記載するために提供される。これらの実施例は、本発明を実施するために現在、企図された好ましい様式を示しているが、例証することを意図され、本発明を限定するものではない。
【実施例】
【0093】
実施例1:正常なドナーの無細胞唾液からのRNA単離、増幅および遺伝子発現プロファイリング
正常な被検者
唾液試料は、Medical Center, University of California, Los Angeles (UCLA), CAにおけるDivision of Otolaryngology, Head and Neck Surgeryからの10人の正常なドナーから、UCLA Institutional Review Boardにより承認されたプロトコールに従って、得られた。以下の試験対象患者基準が用いられた:年齢30歳;悪性腫瘍、免疫不全、自己免疫疾患、肝炎、HIV感染または喫煙の経歴無し。対象集団は、平均年齢42歳(32歳から55歳までの範囲)である、6人の男性および4人の女性から構成された。
【0094】
唾液収集および関連した流体相を得るための処理
刺激されていない唾液が、公開されたプロトコール[38]に従って午前9時と午前10時の間に収集された。被検者は、唾液収集前の少なくとも1時間、食べること、飲むこと、喫煙または口腔衛生処置を断つよう求められた。唾液試料を、4℃で15 min、2,600 x gで遠心分離した。唾液上清は、細胞相から分離された。リボヌクレアーゼ阻害剤(Superase-In, Ambion Inc., Austin, TX, USA)およびプロテアーゼ阻害剤(アプロチニン, Sigma, St. Louis, MO, USA)を、その後、無細胞唾液上清へ添加した。
【0095】
無細胞唾液からのRNA単離
RNAは、製造会社(QIAamp Viral RNAキット, Qiagen, Valencia, CA, USA)からの改変されたプロトコールを用いて無細胞唾液上清から単離された。AVL緩衝液(2,240 μL)と十分に混合された唾液(560 μL)を、室温で10 min、インキュベートした。無水エタノール(2,240 μL)を添加し、溶液を、6,000 x gで1 min、遠心分離によりシリカカラムに通した。その後、カラムを2回、洗浄し、20,000 x gで2 min、遠心分離し、9,000 x gで2 min、30 μL リボヌクレアーゼを含まない水で溶出した。RNAのアリコートを、製造会社の使用説明書に従って、リボヌクレアーゼを含まないデオキシリボヌクレアーゼ(DNase I-DNA-free, Ambion Inc., Austin, TX, USA)で処理した。
【0096】
単離されたRNAの安定性は、1、3および6ヶ月間の保存後、アクチン-β(ACTB)についてのRT-PCRタイピングにより調べられた。図1Aに報告された結果は、単離されたmRNAを、-80℃で6ヶ月間より長く、有意な分解無しに保存することができたことを示している。
【0097】
単離されたRNAの質は、3つのハウスキーピング遺伝子転写産物:グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)、アクチン-β(ACTB)およびリボソームタンパク質S9(RPS9)についてのRT-PCRにより調べられた。プライマーは、PRIMER3ソフトウェア(http://www.genome.wi.mit.edu)を用いて設計され、以下のように商業的に(Fisher Scientific, Tustin, CA, USA)合成された:GAPDHについて添付配列リストをSEQ ID NO:1およびSEQ ID NO:2として報告された配列を有するプライマー;ACTBについて添付配列リストをSEQ ID NO:3およびSEQ ID NO:4として報告された配列を有するプライマー;RPS9について添付配列リストをSEQ ID NO:5およびSEQ ID NO:6として報告された配列を有するプライマー。RNAの量は、Ribogreen(登録商標)RNA Quantitation Kit(Molecular Probes, Eugene, OR, USA)を用いて推定された。結果は、図1Bに示されているが、GAPDH(B1)、RPS9(B2)およびACTB(B3)が試験されたすべての10個の場合において一貫して検出され、すべての10個の唾液試料が、ハウスキーピング遺伝子:GAPDH、ACTBおよびRPS9をコードするmRNAを含むことを実証した。
【0098】
これらの遺伝子のmRNAを、-80℃で6ヶ月間より長く、有意な分解無しに保存することができた(図1Aで報告されたACTBについての結果を参照)。
【0099】
標的cRNA調製
単離されたRNAは、その後、本発明者らの研究室から発表された方法に従って、直線的増幅にかけられた(Ohyama et al., 2000)。簡単には、プライマーとしてT7-オリゴ-(dT)24を用いる逆転写を、第一鎖cDNAを合成するために行った。インビトロ転写(IVT)の第一ラウンドをT7 RNAポリメラーゼ(Ambion Inc., Austin, TX, USA)を用いて行った。BioArray(商標)High Yield RNA Transcript Labeling System(Enzo Life Sciences, Farmingdale, NY, USA)は、cRNA産物をビオチン化するための第二ラウンドIVTに用いられた;標識されたcRNAは、GeneChip(登録商標)Sample Cleanup Module(Affymetrix, Santa Clara, CA, USA)を用いて精製された。
【0100】
cRNAの質および量は、分光測光法およびゲル電気泳動法により測定された。図2Aで報告されたアガロースゲル電気泳動試験の例示的結果は、RNA増幅の異なる段階における増幅されたcRNAの異なる量を示している。
【0101】
単離および増幅段階のそれぞれからの少量のアリコートもまた、RT-PCRにより質を評価するために用いられた。図2Bに報告された例示的結果は、RNA増幅の様々な段階で行われたPCRタイピングACTBを示しているが、予想された単一バンド(153 bp)が唾液RNA増幅過程のあらゆる主要な段階において検出されることができた。
【0102】
断片化cRNA(Kelly, 2002により記載されているように調製された)の質もまた、2100 Bioanalyzer(Agilent Technologies, Palo Alto, CA, USA)を用いるキャピラリー電気泳動により評価された。図2Cに報告された例示的結果は、適切な断片化を実証する狭い範囲(50〜200 bp)での1つの単一ピークを示している。
【0103】
ターゲットされたcRNA調製における遺伝子発現プロファイリング
遺伝子発現プロファイリングは、10人の正常なドナーから得られた無細胞唾液において行われ、平均して、60.5±13.1 ng(n=10)の全RNAが、560 μL 無細胞唾液試料から得られた。結果は表1に報告されている。
【0104】
【表1】

【0105】
全RNA量は、560p.L 無細胞唾液上清におけるRNAである;cRNA量は、T7増幅の2ラウンド後である。プローブの数は、HG U133Aマイクロアレイ上での存在コールを示す(検出p<0.04)。存在パーセンテージ(P%)=存在コールに割り当てられたプローブの数/全プローブの数(HG U133Aマイクロアレイについて22,283個)。
【0106】
T7 RNA直線的増幅の2ラウンド後、ビオチン化cRNAの平均収量は、A260/280=2.067±0.082で42.2±3.9 μgであった(表1)。cRNAは、断片化前には、200 bpから4 kbまでの範囲であった;断片後、約100 bpへ集中された。cRNAプローブの質は、ハイブリダイゼーションの前にキャピラリー電気泳動により確認された。ACTB mRNAは、最初の試料、ならびに各増幅段階からの産物:第一cDNA、第一インビトロ転写(IVT)、第二cDNAおよび第二IVT、においてPCR/RT-PCRを用いて検出可能であり、結果として生じたアガロース電気泳動パターンは、図2Bに示されたものに匹敵した。
【0107】
実施例2:正常なドナーの無細胞唾液由来のmRNAのマイクロアレイプロファイリング
実施例1に報告されているように、唾液を収集して処理し、RNAを単離した。RNAの安定性、質および量もまた、実施例1に報告されているように評価された。
【0108】
HG-U1331Aマイクロアレイ分析
〜19,000遺伝子を表す22,215個のヒト遺伝子cDNAプローブセットを含む(すなわち、各遺伝子は、1個より多いプローブセットにより表されうる)、Affymetrix Human Genome U133A Arrayが、遺伝子発現プロファイリングのために適用された。アレイデータは、標準化され、Microarray Suite(MAS)ソフトウェア(Affymetrix)を用いて解析された。検出p値は、各プローブセットについて得られた。p<0.04をもつ任意のプローブセットが、適合する遺伝子転写産物が信頼性をもって検出されることを示す、「存在する」に割り当てられた(Affymetrix, 2001)。各アレイ上の存在プローブセットの総数が得られ、存在遺伝子の存在パーセンテージ(P%)が計算された。機能的分類は、Gene Ontology Mining Tool(www.netaffx.com)を用いることにより選択された遺伝子(すべての10個のアレイ上に存在する、p<0.01)において行われた。
【0109】
10人の正常な被検者の唾液mRNAプロファイルは、22,283個のcDNAプローブを含むHG U133Aアレイを用いて得られた。割り当てられた存在コールをもつ、平均3,143±665.0個のプローブセット(p<0.04)が各アレイ(n=10)に見出された。これらのプローブセットは、約3,000個の異なるmRNAを表す。平均の存在コールパーセンテージは、14.11±2.98%(n=10)であった。10個のアレイからのデータを含む参照データベースが作成された。GAPDH、ACTBおよびRPS9を表すプローブセットが、すべての10個のアレイにおいて存在コールを割り当てた。検出p<0.01をもつ、すべての10個のアレイにおいて存在コールを割り当てられた185個の遺伝子を表す、全体として207個のプローブセットがあった。これらの10個の遺伝子は、生物過程および分子機能におけるそれらの公知の役割に基づいて分類された。10人の正常なドナー由来の無細胞唾液における185個の遺伝子の生物過程および分子機能(Gene Ontology Mining Toolを用いることにより得られたデータ)は、表2に報告されている。
【0110】
【表2】

【0111】
1つの遺伝子は、複数の分子機能をもちうる、または異なる生物過程に関与しうる。特定の群/下位群へ分類された遺伝子の数。185個の遺伝子の主要な機能は、細胞成長/維持(119個の遺伝子)、分子結合(118個の遺伝子)、および細胞構造構成(95個の遺伝子)に関連している。本発明者らは、これらの185個の遺伝子を「正常唾液コアトランスクリプトーム(Normal Salivary Core Transcriptome)(NSCT)」と名付けた。
【0112】
実施例3:正常なドナーの無細胞唾液からのマイクロアレイプロファイリングのQ-PCR確証および定量分析
実施例2で行われたマイクロアレイ分析は、Q-PCRによる定量的遺伝子発現分析を通して確証された。
【0113】
Q-PCRによる定量的遺伝子発現分析
リアルタイム定量的PCR(Q-PCR)は、実施例2で報告されたマイクロアレイプロファイリングにより検出された185個の「正常唾液コアトランスクリプトーム」遺伝子から選択された遺伝子を定量することにより、唾液におけるヒトmRNAの存在を確証するために用いられた。すべての10個のアレイ上で存在コールに割り当てられた、遺伝子IL1B、SFNおよびK-ALPHA-1は、確証のために無作為に選択された。
【0114】
Q-PCRは、iCyclerTM thermal Cycler(Bio-Rad, Hercules, CA, USA)を用いて実行された。単離された唾液RNA(増幅なし)の2 μLのアリコートを、MulV Reverse Transcriptase(Applied Biosystems, Foster City, CA, USA)を用いてcDNAへ逆転写した。結果として生じたcDNA(3 μL)を、iQ SYBR Green Supermix(Bio-Rad, Hercules, CA, USA)を用いるPCR増幅に用いた。プライマーは、以下のように、Sigma-Genosys(Woodlands, TX, USA)により合成された:インターロイキン1、β(IL1B)についての添付配列リストをSEQ ID NO:7およびSEQ ID NO:8として報告された配列を有するプライマー;ストラティフィン(stratifin)(SFN)についての添付配列リストをSEQ ID NO:9およびSEQ ID NO:10として報告された配列を有するプライマー;チューブリン、α、遍在性(K-ALPHA-1)についての添付配列リストをSEQ ID NO:11およびSEQ ID NO:12として報告された配列を有するプライマー。すべての反応は、特定のPCR産物についてカスタマイズされた条件で、3連で行われた。特定の鋳型のcDNAの最初の量は、LightCyclerソフトウェア3.0(Bio-Rad, Hercules, CA, USA)を用いて標準曲線から外挿された。標準曲線による定量のための詳細な手順は、以前に記載されている(Ginzinger, 2002)。
【0115】
Q-PCR結果は、IL1B、SFNおよびK-ALPHA-1のmRNAがすべての10個の最初の増幅されていない無細胞唾液において検出可能であることを示した。これらの転写産物(n=10)の相対量(コピー数における)は以下である:IL1Bについて8.68X103±4.15X103;SFNについて1.29X105±1.08X105;およびK-ALPHA-1について4.71X106±8.37X105。Q-PCRにより測定されたこれらの遺伝子の相対RNA発現レベルは、マイクロアレイにより測定されたもの(データ示されず)と類似した。
【0116】
実施例4:OSCC患者の無細胞唾液におけるIL6およびIL8 mRNA単離増幅ならびに発現の分析
患者選択
患者は、University of California, Los Angeles (UCLA) Medical Center, Los Angeles, CAにおけるDivision of Head and Neck Surgery;University of Southern California (USC) Medical Center, Los Angeles, CA;およびUniversity of California San Francisco (UCSF) Medical Center, San Francisco, CAから6ヶ月間に渡って採用された。
【0117】
口腔(OC)または口腔咽頭(OP)の実証された原発性T1またはT2扁平上皮細胞癌をもつ32人の患者がこの研究に含まれた。すべての患者は、最近、原発性疾患と診断されており、化学療法、放射線治療、手術または代替療法の形をとるいずれの事前処置も受けなかった。同程度の喫煙歴をもつ年齢および性別の整合された被検者の同じくらいの数が対照比較群として選択された。
【0118】
2つの被検者群の間に、平均年齢(標準偏差、SD):OSCC患者、49.3(7.5)歳;正常な被検者、48.8(5.7)歳(スチューデントt検定P>0.80);性別(スチューデントt検定P>0.90);または喫煙歴(スチューデントt検定P>0.75)に関する有意差はなかった。前の悪性腫瘍、免疫不全、自己免疫疾患、肝炎またはHIV感染の病歴をもつ被検者はなかった。対照群における個体のそれぞれは、疑わしい粘膜病変が存在しないことを保証するために、頭頸部外科医により理学的検査を受けた。
【0119】
唾液収集および処理
インフォームド・コンセントは、すべての患者により与えられた。唾液および血清調達手順は、各機関:University of California, Los Angeles (UCLA);University of Southern California (USC);およびUniversity of California San Francisco (UCSF)における機関の審査委員会により承認された。
【0120】
OCまたはOP SCCAをもつ32人の患者、ならびに32人の罹患していない年齢および性別の整合された対照被検者由来の唾液は、サイトカイン濃度の前向きな比較のために採取された。
【0121】
被検者は、唾液収集前の少なくとも1時間、食べること、飲むこと、喫煙または口腔衛生製品を用いることを断つように要求された。唾液収集は、5 cc 唾液の全供与として、NavazeshおよびChristensen, [7]の「排出(流涎)」方法を用いて行われた。唾液試料を、Sorvall RT6000D遠心分離機(DuPont, Wilmington, DE)により4℃で15分間、3500 rpm(2600xg)での遠心分離にかけた。その後、流体相を取り出し、リボヌクレアーゼ阻害剤(Superase-In, RNAse阻害剤, Ambion Inc., Austin, TX)およびプロテアーゼ阻害剤(アプロチニン、Sigma, St. Louis, MO;フェニルメチルスルホニルフロリド、Sigma, St. Louis, MO;オルトバナジウム酸ナトリウム、Sigma, St. Louis, MO)をその後、氷上で素速く添加した。唾液の細胞相および流体相の分離のための条件は、流体相において検出されるmRNAに寄与するものと思われる細胞要素の機械的破壊のないことを保証するように最適化された。すべての試料は、その後、デオキシリボヌクレアーゼ(DNAseI-DNA-free, Ambion Inc., Austin, TX)で処理された。細胞ペレットは、保持され、-80℃で保存された。
【0122】
無細胞唾液からのRNA単離
唾液上清の560 μLは、その後、QIAamp Viral RNAミニキット(QIAGEN, Chatsworth, CA)を用いて処理された。RNAは、製造会社の使用説明書に従って抽出された。試料を、空気乾燥させ、ジエチルピロカルボネートで処理された水に再懸濁し、即時使用について氷上に保持した、または-80℃で保存した。RNAのアリコートを、製造会社の使用説明書に従って、リボヌクレアーゼを含まないデオキシリボヌクレアーゼ(DNAseI-DNA-free, Ambion Inc., Austin, TX)で処理した。RNAの濃度は、分光光度法で測定され、完全性は、ホルムアルデヒドを含むアガロースゲルにおける電気泳動によりチェックされた。
【0123】
逆転写酵素-ポリメラーゼ連鎖反応
唾液での流体相におけるIL6およびIL8 mRNA転写産物の存在は、逆転写酵素-ポリメラーゼ連鎖反応(RT-PCR)を用いることにより試験された。
【0124】
各試料由来のRNAを、モロニーマウス白血病ウイルス逆転写酵素(Applied Biosystems Inc.(ABI), Foster City, CA)の2.5 Uおよびランダムヘキサヌクレオチド(ABI, Foster City, CA)の50 pmolを含む反応混合物の40 μLにおいて、42℃で45分間、逆転写させた。発表された配列に基づいて、オリゴヌクレオチドプライマーは、以下のように、PCRのためにFisher Scientific(Tustin, CA)で商業的に合成された:β-アクチンについて添付配列リストをSEQ ID NO:13およびSEQ ID NO:14として報告された配列を有するプライマー;IL8について添付配列リストをSEQ ID NO:15およびSEQ ID NO:16として報告された配列を有するプライマー;ならびにIL6について添付配列リストをSEQ ID NO:17およびSEQ ID NO:18として報告された配列を有するプライマー。
【0125】
相補DNA(cDNA)の増幅は、95℃で20秒間、60℃で30秒間、および72℃で30秒間の50サイクル、続いて72℃で7分間の最終伸長サイクルを用いて実行された。PCR産物の特異性は、推定サイズにより、および制限酵素消化により、検証された。応答の特異性を確立するために、入力RNAが除かれている、またはRNAが用いられるが、逆転写酵素が除かれている、陰性対照が用いられた。陽性対照として、mRNAが、全唾液腺RNA(Human Salivary Gland Total RNA, Clontech, Palo Alto, CA)から抽出された。RNA質を保証するために、すべての調製物は、発現の分析にかけられた。
【0126】
そのように行われたRT-PCR研究は、唾液および血清が、IL6およびIL8をコードするmRNAを含むことを示した。図3に報告された例示的結果は、選択されたプライマーから予想されたサイズ(IL6について95 bpおよびIL8について88 bp)のPCR産物を示している。同じサイズの産物が陽性対照に発現されていた。
【0127】
分析されるRNAおよびタンパク質が唾液の流体相のみからであることを保証するために、および細胞内成分による混入の欠如を保証するために、唾液試料についての遠心分離速度を最適化した。唾液試料全体および様々な速度で遠心分離された試料における、細胞溶解および細胞内成分のこぼれたもののマーカーとしてDNAを用いる、ハウスキーピング遺伝子β-アクチンおよびユビキチンについてのPCR。結果は、好ましい速度が2,600 xgである、2,600±52 xgの唾液試料についての最適遠心分離速度を支持している(図4で報告された例示的結果を参照)。
【0128】
実施例5:OSCC患者の血清におけるIL6およびIL8 mRNA単離、増幅および発現の分析
実施例4に報告されているように患者が採用され、血清におけるIL6およびIL8 mRNAの存在の分析にかけられた。
【0129】
血清収集および処理
OCまたはOP SCCAをもつ19人の患者、ならびに32人の罹患していない年齢および性別の整合された対照被検者由来の血清が、前向きなサイトカイン濃度の比較のために採取された。被検者群の間で、年齢、性別、アルコール消費または喫煙歴に関して有意差はなかった(P>0.75)。
【0130】
血液は、処理の前に対照被検者および患者から抜き取られた。血清を、Sorvall RT6000D遠心分離機(DuPont, Wilmington, DE)により15℃で10分間、3000 rpm(1000 xg)で全血を遠心分離することにより収集した。その後、血清を分離し、リボヌクレアーゼ阻害剤(Superase-In, RNAse阻害剤, Ambion Inc., Austin, TX)およびプロテアーゼ阻害剤(アプロチニン、Sigma, St. Louis, MO;フェニルメチルスルホニルフロリド、Sigma, St. Louis, MO;オルトバナジウム酸ナトリウム、Sigma, St. Louis, MO)をその後、氷上で素速く添加した。すべての試料は、その後、デオキシリボヌクレアーゼ(DNAseI-DNA-free, Ambion Inc., Austin, TX)で処理された。アリコートは、さらなる使用まで-80℃で保存された。
【0131】
逆転写酵素-ポリメラーゼ連鎖反応
血清におけるIL6およびIL8 mRNA転写産物の存在は、上の実施例4に記載されているように行われる逆転写酵素-ポリメラーゼ連鎖反応(RT-PCR)を用いることにより試験された。
【0132】
そのように行われたRT-PCR研究は、電気泳動ゲルパターンが図3に示されたものと匹敵して、血清がIL6およびIL8をコードするmRNAを含むことを示した。
【0133】
分析されるRNAおよびタンパク質が血清の流体相のみからであることを保証するために、および細胞内成分による混入の欠如を保証するために、血清試料についての遠心分離速度を、唾液試料についての実施例4で記載された同じアプローチに従って最適化した。結果は、好ましい速度が1,000 xgである、1,000±20 xgの唾液試料についての最適遠心分離速度を支持している。
【0134】
実施例6:OSCC患者由来の唾液におけるIL6およびIL8サイトカインレベル分析
IL6およびIL8 mRNA転写産物が唾液での流体相に存在することを実証するにおいて、本発明者らは、定量的リアルタイムPCR(qRT-PCR)およびELISAを用いて、罹患していない被検者およびOSCCをもつ患者の唾液においてIL6およびIL8のレベルを前向きに調べ、比較した。
【0135】
OSCCをもつ32人の患者、ならびに32人の年齢および性別の整合された対照被検者由来の唾液が、採取された。被検者群の間で、年齢、性別、アルコール消費または喫煙歴に関して有意差はなかった(P>0.75)。
【0136】
患者および正常な被検者由来の唾液におけるIL6およびIL8 mRNA濃度の定量のためのリアルタイムPCR
RT-PCRの結果を定量的に分析するために、定量的リアルタイムPCR(Bio-Rad iCycler, Thermal Cycler, Bio-Rad Laboratories, Hercules, CA)が用いられた。各試料は、3連で試験された。増幅反応は、iQ SYBR Green Supermix(Bio-Rad Laboratories, Hercules, CA)を用いて20 μL 混合物において行われた。95℃で3分間の最初の変性後、60℃で20秒間、その後72℃で20秒間、その後83℃で20秒間の50PCRサイクルを実行し、続いて、95℃で1分間、その後、続いて、55℃で最終の1分間伸長を行った。アリコートは、各ウェルから取られ、産物の特異性を保証するためにアガロースゲルにおける電気泳動によりチェックされた。
【0137】
RT-PCR結果は、図5Aに示された図により例証されている。そのような結果は、mRNAおよびタンパク質の両方のレベルにおけるIL8が、対照被検者と比較した場合、OSCCをもつ患者の唾液においてより高い濃度で検出されたことを示している(t検定、P<0.01)。OSCC患者と疾患のない対照由来の唾液の間に、IL8 mRNA発現の量における有意差があった。平均コピー数は、OSCC群について1.1x103個、および対照群について2.6x101個であった。2つの群の間での差は、非常に統計学的に有意であった(P<0.0008)。
【0138】
その代わりに、mRNAレベルにおけるIL6の唾液濃度において、有意差が見出されなかった。試料サイズ研究内で、本発明者らはまた、喫煙と非喫煙の被検者間に差を検出することができなかった。
【0139】
患者および正常な被検者由来の唾液におけるIL6およびIL8タンパク質濃度の定量のためのELISA
IL6およびIL8についてのELISAキットが製造会社の使用説明書に従って用いられた(Pierce Endogen, Rockford, IL)。各試料は、2つの反復実験のそれぞれにおいて2連で試験された。比色反応の発生後、450 nmにおける吸光度を、8チャネルの分光光度計(EL800 Universal Microplate Reader, BIO-TEK Instruments Inc., Winooski, VT)により定量し、吸光度読みを、各アッセイにおいて組換えサイトカインで得られた標準曲線に基づいてpg/mlへ変換した。吸光度読みが標準曲線の直線範囲を越えた場合には、ELISAアッセイは、上清の段階希釈後に繰り返された。各試料は、少なくとも2つのELISA実験において試験され、データは、各試料についての試験の平均から計算された。
【0140】
ELISA試験結果は、図5Bに示された図により例証されている。OSCC患者の唾液におけるIL8のレベル(720 pg/dL)は、対照群の唾液におけるそれら(250 pg/dL)よりも有意に高かった(P<0.0001)。唾液におけるIL8タンパク質のレベルの上昇が、OSCC患者の唾液における総タンパク質レベルの上昇のせいではなかったことを保証するために、本発明者らは、2つの群間で唾液における総タンパク質濃度を比較した。有意差は見出されなかった(P>0.05)。
【0141】
タンパク質レベルにおけるIL6の唾液濃度において、有意差は見出されなかった。また、ELISA分析において、喫煙と非喫煙の被検者の間での試料サイズ研究内で差は検出されなかった。
【0142】
実施例7:OSCC患者由来の血清におけるIL6およびIL8サイトカインレベル分析
本発明者らはまた、qRT-PCRおよびELISAを用いて、罹患していない被検者およびOSCCをもつ患者の血清において、IL6およびIL8のレベルを調べ、比較した。患者は、実施例4に記載されているように選択され、血清は、実施例5に記載されているように処理された。
【0143】
患者および正常な被検者由来の血清におけるIL6およびIL8 mRNAの定量のためのリアルタイムPCR
RT-PCRの結果を定量的に分析するために、定量的リアルタイムPCRが、実施例6に記載されているように行われた。
【0144】
RT-PCR結果は、図6Aに示された図により例証されている。そのような結果は、mRNAレベルにおけるIL6が、対照被検者と比較した場合、OSCCをもつ患者の血清においてより高い濃度で検出されたことを示している(t検定、P<0.001)。OSCC患者と疾患のない対照由来の唾液の間でのIL6 mRNA発現の量における有意差が注目された。平均コピー数は、OSCC群について5.2x104個、対照群について3.3x103個であった。2つの群間の差は、非常に統計学的に有意であった(P<0.0004)。
【0145】
その代わりに、mRNAレベルにおけるIL8の唾液濃度において、有意差が見出されなかった。試料サイズ研究内で、本発明者らはまた、喫煙と非喫煙の被検者間に差を検出することができなかった。
【0146】
患者および正常な被検者由来の血清におけるIL6およびIL8タンパク質濃度の定量のためのELISA
血清におけるIL6およびIL8タンパク質濃度の定量のためのELISA試験は、実施例6に記載されているように行われた。
【0147】
関連したELISA試験結果は、図6Bに示された図により例証されている。OSCC患者の血清におけるIL6の平均レベル(87 pg/dL)は、対照群の血清におけるそれら(0 pg/dL)よりも有意に高かった(P<0.0001)。
【0148】
タンパク質レベルにおけるIL8の血清濃度において、有意差は見出されなかった。また、ELISA分析において、喫煙と非喫煙の被検者の間での試料サイズ研究内で差は検出されなかった。
【0149】
実施例8:ROCおよび感度/特異性解析
上の実施例1〜7で報告された実験の結果において収集されたデータの統計学的解析は、HNSCCについてのこれらのバイオマーカーの特異性および感度、ならびにそれらの適中率を実証している。
【0150】
統計学的解析
患者人口統計の分布は、OSCC症例および対照について、全体的におよび別々に、計算され、連続測定についてのスチューデントt検定かまたはカテゴリー測定についての2X2のカイ二乗表のいずれかを用いて2つのアーム間で比較された。唾液および血清におけるIL6ならびにIL8レベルの分布は、計算され、2つの独立群t検定を用いてOSCC症例と対照の間で比較された。差は、0.01未満のP値について有意とみなされた。IL6およびIL8レベルの範囲のために、これらの測定値の対数変換もまた、解析に用いられた。データは、平均±SDとして表された。年齢、性別および喫煙歴は、実験計画において群レベルで調節された;これらの患者因子はまた、回帰モデリングを通してIL6およびIL8を比較する場合の解析において調整された。
【0151】
従属変数として疾患(OSCC症例)および非疾患(対照)の2項結果を用いる、ロジスティック回帰モデルを、患者の年齢、性別および喫煙歴について調節して、可能性のあるバイオマーカー(IL6またはIL8)のそれぞれの関数としてOSCCを発症している確率を推定するように適合させた。適合したロジスティックモデルを用いて、受信者動作特性(ROC)曲線解析は、バイオマーカーのそれぞれの予測力を評価するために行われた[8][9][10]。ROC解析を通して、本発明者らは、最小ストリンジェント性(0の確率でカット)から最大ストリンジェント性(1の確率でカット)まで陽性の基準を変化させることにより、感度および特異性を計算した。最適な感度および特異性は、バイオマーカーのそれぞれについて決定され、バイオマーカーのそれぞれの対応するカットオフ/閾値が同定された。ROC曲線下で最も大きい領域を有するバイオマーカーは、OSCCを検出するための最も強い予測力をもつとして同定された。
【0152】
臨床データ
OSCCをもつ患者の平均(SD)年齢は49.3(7.5)歳(範囲、42〜67歳)対、対照群における48.8(5.7)歳(範囲、40〜65歳)であった;(スチューデントt検定P>0.80)。2つの被検者群の間で、年齢(平均年齢);OSCC患者、49.3歳;正常な被検者、48.8歳(スチューデントt検定P>0.80);性別(スチューデントt検定P>0.90);または喫煙歴(スチューデントt検定P>0.75)に関して有意差はなかった。
【0153】
ROC(受信者動作特性)曲線、感度対1-特異性のプロット、は可能性のあるバイオマーカーのそれぞれについて作成された。年齢、性別および喫煙歴は、上記のように調節された。ROC曲線下の面積は、OSCCを検出するための各バイオマーカーの有用性の測度として計算された。
【0154】
図7Aおよび図7Bは、唾液におけるIL8および血清におけるIL6についてのROC曲線をそれぞれ、示している。計算されたROC値(OSCCを予測することについて)は、唾液におけるIL8について0.978;および血清におけるIL6について0.824であった。感度および特異性の分布に基づいて、バイオマーカーの閾値は、OSCCを検出することについて選択された。本発明者らのデータに基づいて、唾液におけるIL8について、600 pg/dLの閾値は、86%の感度および97%の特異性を生じる。同様に、血清におけるIL6について、0 pg/dLより大きい閾値は、64%の感度および81%の特異性を生じる。
【0155】
バイオマーカーの組み合わせ:唾液におけるIL8および血清におけるIL6は、図7Cに示されているように、ROC解析が99%の感度および90%の特異性を生じていることから、OSCC診断法として大きな可能性をもっている。
【0156】
唾液および血清における可能性のあるバイオマーカーのそれぞれについての、ROC曲線下の面積の詳細な統計値、閾値、ならびに対応する感度および特異性は表3に列挙されている。
【0157】
唾液および血清における可能性のあるバイオマーカーのそれぞれについての、ROC曲線下の面積の詳細な統計値、閾値、ならびに対応する感度および特異性は、下の表3に列挙されている。
【0158】
【表3】

【0159】
実施例9:OSCC患者の血清からのRNA単離、増幅および遺伝子発現プロファイリング
被検者選択
32人のOSCC患者は、University of California, Los Angeles (UCLA)におけるMedical CentersおよびUniversity of Southern California(USC), Los Angeles, CAから採用された。すべての患者は、最近、原発性T1/T2OSCCと診断されており、化学療法、放射線治療、手術または代替療法の形をとるいずれの事前処置も受けなかった。35人の正常なドナーが、School of Dentistry, UCLAにおける一般的な集団から対照として採用された。いずれの被検者も前の悪性腫瘍、免疫不全、自己免疫疾患、肝炎、またはHIV感染の病歴をもたなかった。すべての被検者は、この研究のための供血者となることを同意する機関審査委員会(Institutional Review Board)に承認された同意書にサインした。
【0160】
32人のOSCC患者および35人の正常な被検者を含む全体として67人の被検者が採用された。2つの被検者群の間に、平均年齢(標準偏差、SD)に関して有意差はなかった:OSCC患者、49.3(7.5)歳;正常な被検者、47.8(6.4)歳 (スチューデントt検定P=0.84)。OSCC群における性別分布は、10:22(女性の数/男性の数)であり、対照群においては、14:21(カイ二乗検定P=1)であった。本発明者らは、以下のことを測定することによりこれらの2つの群の喫煙歴を適合させた。すべての被検者は以下を尋ねられた:(1)何年間、タバコを吸ったか?(2)1日あたり何箱、タバコを吸ったか?(3)タバコを吸うのを止めてから何年間、経過したか?(4)紙巻きタバコを吸うのみだったか、または葉巻、パイプ、かみタバコ、もしくはタイマも使用したか?本発明者らは、その後、上記に関して患者と対照の間の整合を最適化した:(1)類似した箱-年数歴(2)タバコを吸うのを止めてからの類似した経過(3)全く紙巻きタバコのみの使用。喫煙歴において2つの群間に有意差はなかった(スチューデントt検定P=0.77)。
【0161】
血液収集および処理
血液調達手順は、UCLAおよびUSCにおける機関の審査委員会により承認された。血液は、処理の前に対照被検者および患者から抜き取られた。その後、全血は、Sorvall RT6000D遠心分離機(DuPont, Wilmington, DE)により15℃で10分間、1,000 xgによる遠心分離を受けた。血清は、その後、分離され、100 U/mL リボヌクレアーゼ阻害剤(Superase-In, Ambion Inc., Austin, IX)が血清へ素速く添加された。アリコートは、さらなる使用まで-80℃で保存された。
【0162】
血清からのRNA単離
RNAは、QIAamp Viral RNAキット(Qiagen, Valencia, CA)を用いて560 μl 血清から単離された。単離されたRNAのアリコートは、製造会社の使用説明書に従って、リボヌクレアーゼを含まないデオキシリボヌクレアーゼ(DNaseI-DNA-free, Ambion Inc., Austin, TX)で処理された。単離されたRNAの質は、4つのハウスキーピング遺伝子転写産物:β-アクチン(ACTB)、β-2-ミクログロブリン(B2M)、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)、およびリボソームタンパク質S9(RPS9)についてのRT-PCRにより調べられた。公開された配列に基づいて、オリゴヌクレオチドプライマーは、設計され、その後、PCRのために合成された(Sigma Genosis, Woodlands, TX)。RT-PCRは、表4に示されたRT-PCRのための4つのハウスキーピング遺伝子転写産物から選択された共通の上流プライマーおよび3つの異なる下流プライマーを用いて3つのセグメントに表現型を示されたmRNAのコード領域を増幅するために用いられた。
【0163】
【表4】

【0164】
特に、4つの血清ヒトmRNAが選択され、コード領域は、そのコード領域をおよそ3つの部分へ分割する共通の上流プライマーおよび3つの異なる下流プライマーを用いて3つのセグメントに表現型を示した。各PCR反応の10 μlは、2%アガロースゲル上で電気泳動され、EtBrで染色された。
【0165】
すべてのPCR産物の特異性は、陽性対照(Human Salivary Gland Total RNA, clontech, Palo Alto, CA)と比較する推定サイズにより検証された。入力RNAが除かれている、またはRNAが用いられるが、逆転写酵素が除かれている陰性対照が、用いられた。
【0166】
ヒト由来のmRNA産物の血清表現型は、RT-PCRおよび電気泳動により評価された。図8に報告された例示的結果は、4つのハウスキーピング遺伝子(ACTB、B2M、GAPDH、およびRPS9)からの転写産物が検出されることができることを示した。特に、188 bp、426 bpおよび614 bpのサイズをもつRPS9についての単位複製配列が検出された(図8のレーン2、3および4をそれぞれ、参照);140,755 bpおよび1,184 bpのサイズをもつGAPDHについての単位複製配列が検出された(図8のレーン5、6および7をそれぞれ、参照);216,591 bpおよび848 bpのサイズをもつB2Mについての単位複製配列が検出された(図8のレーン8、9および10をそれぞれ、参照);および195,705 bpおよび1,000 bpのサイズをもつACTBについての単位複製配列が検出された(図8のレーン11、12および13をそれぞれ、参照)。対照データが図に示されていない場合でも、対照は行われた。
【0167】
本発明者らが増幅した最も長いPCR産物は、NCBI GenBankデータベースによる、対応するmRNAの完全長の56.8%(ACTB)、85.9%(B2M)、93.4%(GAPDH)および88.9%(RPS9)に及んだ。この結果はまた、無細胞の形をとる血液において循環する無傷ヒトmRNAが存在しうることを示した。
【0168】
実施例10:OSCC患者由来の血清のmRNAのマイクロアレイプロファイリング
10人のOSCC患者(8人の男性、2人の女性、年齢=51±9.0)由来ならびに10人の性別および年齢の整合された正常なドナー(年齢49±5.6)由来の血清が、収集され、マイクロアレイ分析に用いるために実施例9に報告されているように処理された。
【0169】
マイクロアレイ分析
血清から単離されたRNAは、RiboAmp(商標)RNA Amplificationキット(Arcturus, Mountain View, CA)により直線的増幅にかけられた。以前に報告されたプロトコール[55]に従って、〜19,000遺伝子を表す22,215個のヒト遺伝子cDNAプローブセット(すなわち、各遺伝子は、1個より多いプローブセットにより表されうる)を含むAffymetrix Human Genome U133A Arrayが、遺伝子発現プロファイリングのために適用された。
【0170】
生データは、標準化およびモデルに基づいた解析のためのDNA-Chip Analyzer 1.3 (dChip)ソフトウェアへインポートされた[60]。dChipは、mRNA/遺伝子発現の量を表す発現指標、およびmRNA転写産物が実際、試料に存在するかどうか、存在コールと呼ばれるもう一つのパラメーターを与える(14)。S-plus 6.0(Insightful, Seattle, WA)がすべての統計学的検定に用いられた。
【0171】
3つの基準が、OSCCと対照の間で異なって発現された遺伝子を決定するために用いられた。第一に、すべての試料において「不在」コールと割り当てられた遺伝子は排除された。第二に、両側スチューデントt検定が、OSCC(n=10)と対照(n=10)の間での平均遺伝子発現レベルの比較に用いられた。0.05の臨界アルファレベルが、統計学的有意性として定義された。第三に、倍比率が、統計学的有意差(P<0.05)を示すそれらの遺伝子について計算された。少なくとも2倍変化を示すそれらの遺伝子のみが、さらなる分析のために含まれる。
【0172】
HG U133Aマイクロアレイは、癌患者と整合された正常な被検者の間で唾液RNAプロファイルにおける違いを同定するために用いられた。前に記載された基準により含まれる14,268個の遺伝子の間で、本発明者らは、0.05未満のP値および≧2の倍変化をもつ335個の遺伝子を同定した。これらの遺伝子の間で、OSCC群において、223個の上方制御された遺伝子および112個の下方制御された遺伝子がある。Affymetrixにより、存在コールを割り当てられた遺伝子は、この遺伝子が最初の試料において信頼性をもって検出されることを示す。存在と割り当てられた遺伝子の数および各アレイにおける存在パーセンテージは、血清におけるヒトmRNA発現プロファイリングを報告する表5に示されている。
【0173】
【表5】

【0174】
(a)HG U133Aマイクロアレイにおける存在コールを示すプローブの数(検出P<0.04)。
【0175】
(b)存在パーセンテージ(P%)=存在コールに割り当てられたプローブの数/全プローブの数(HG U133Aマイクロアレイについて22,283個)。
【0176】
*OSCCについてのアレイは、対照群についてのそれらよりも多い、存在コールに割り当てられた有意なプローブを有する(P≦0.002、ウイルコクソン検定)。
【0177】
平均して、存在コールを割り当てられた、OSCCアレイにおいて2623±868個のプローブ、および対照アレイにおいて1792±165個のプローブがある。OSCC群は、対照群より多い有意な存在プローブを有する(P≦0.002、ウイルコクソン検定)。
【0178】
特定の遺伝子について、すべての癌(n=10)またはすべての対照(n=10)の間ですべてのアレイに一貫して存在コールが割り当てられるというよりストリンジェントな基準を用いて、本発明者らは、さらなる分析のための候補でありうる62個の遺伝子を同定した。これらの62個の遺伝子はOSCC血清においてすべて上方制御されるが、同じフィルタリング基準を用いて下方制御されるのを見出された遺伝子はないことが注目された。
【0179】
実施例11:OSCC患者の無細胞唾液からのマイクロアレイプロファイリングのQ-PCR確証および定量的分析
qPCRは、唾液において異なって発現された転写産物のサブセットを定量するために、32人のOSCC患者および35人の対照由来の唾液を含む拡大された試料サイズにおいて、実施例10のマイクロアレイの発見を確証するために、行われた。
【0180】
定量的PCR(qPCR)アッセイ
プライマーセットは、PRIMER3ソフトウェアを用いることにより設計された(表2)。MuLV逆転写酵素(Applied Biosystems, Foster City, CA)およびプライマーとしてランダムヘキサマー(ABI, Foster City, CA)を用いて、cDNAは、最初の、増幅されていない血清RNAから合成された。qPCR反応は、iQ SYBR Green Supermix(Bio-Rad, Herucules, CA)を用いて、iCycler(商標)iQリアルタイムPCR検出システム(Bio-Rad, Hercules, CA, USA)において行われた。すべての反応は、特定の産物についてカスタマイズされた条件を用いて3連で行われた。特定の鋳型のcDNA/RNAの相対量は、LightCyclerソフトウェア3.0(Bio-Rad, Hercules, CA, USA)を用いて標準曲線から外挿された。両側スチューデントt検定は、統計学的解析に用いられた。
【0181】
10個の有意な上方制御された遺伝子:H3F3A、TPT1、FTH1、NCOA4、ARCR、THSMB(チモシンβ10)、PRKCB1(プロテインキナーゼC、β1)、FTL1(フェリチン軽ポリペプチド)、COX4I1(チトクロムcオキシダーゼサブユニットIVアイソフォーム1)、およびSERP1(ストレス関連小胞体タンパク質1;リボソーム関連膜タンパク質4)は、qPCR確証について選択された10個の遺伝子を報告している表6に示されているように、それらの報告された癌関連に基づいて選択された。
【0182】
【表6】

【0183】
表6は、qPCRにより測定されたOSCC患者由来の血清におけるそれらの定量的変化を示す。結果は、H3F3A、TPT1、FTH1、NCOA4およびARCRの転写産物が、OSCC患者の唾液において有意に上昇したことを確認した(ウイルコクソンの符号付き検定、P<0.05)。本発明者らは、qPCRにより、他の5つの転写産物の量において統計学的有意差を検出しなかった。
【0184】
実施例12:ROCおよび感度/特異性解析
上の実施例9〜11で報告された実験の結果において収集されたデータの統計学的解析は、HNSCCについてのこれらのバイオマーカーの特異性および感度、ならびにそれらの適中率を実証している。
【0185】
受信者動作特性曲線解析および予測モデル
qPCR結果を利用して、多変量分類モデルが、癌予測のための選択された血清転写産物の最良の組み合わせを決定するために構築された。第一に、従属変数として疾患(OSCC)および非疾患(正常)の2項結果を用いて、ロジスティック回帰モデルが構築された[61]。年齢、性別および喫煙歴は、データ収集手順において調節される。
【0186】
leave-one out cross validation法が、ロジスティック回帰モデルを確証するために用いられた。交差検定(cross validation)ストラテジーは、まず、1つの観測を除去し、その後、すべてのマーカーを用いて残っている事例からロジスティック回帰モデルを適合させる。段階的モデル選択は、モデルを改善しない変数を除去するためにこれらのモデルのそれぞれについて用いられる。その後、除外された事例についての観測値は、その観測について推定されるクラスを計算するために用いられた。交差検定誤差率は、その時、試料の数で割った、間違って予測された試料の数である。
【0187】
受信者動作特性(ROC)曲線解析は、その後、感度および特異性の計算のための可能性のあるカットポイントとしてモデルからの適合した確率を用いて、最良の最終ロジスティックモデル(S-plus 6.0)について計算された。曲線下の面積は、ROC曲線の数値積分法により計算された。
【0188】
OSCC識別のために血清における循環mRNAの利用を実証するために、2つの分類/予測モデルが観察された。qPCRデータを用いて、ロジスティック回帰モデルが、前に調べられた6つの血清転写産物、ARHA、FTH1、H3F3A、TPT1、COX4I1およびFTL1、から構成されて構築された。組み合わせたそれらの6つの転写産物は、最良の予測を提供し、その後、leave-one out validation法により確証された。67個から1つを除外する試行のうち、最良ロジスティックモデルの54個(81%)が、データ全体から抜き出した1つのモデルと同じであることが見出され、確証誤差率は31.3%(21/67)であった。
【0189】
結果は図9に報告されているが、このロジスティック回帰モデルについて計算されたROC曲線が示されている。
【0190】
44%のカットオフ確率を用いて、84%の感度および83%の特異性が得られた。最終モデルは、0.84(27/32)感度および0.83(29/35)特異性を以て、67人のうち56人(83.5%)の被検者について正しく予測し、対照について6人の被検者およびOSCCについて5人の分類を誤っている。ROC曲線下の計算された領域は、このロジスティック回帰モデルについて0.88であった。
【0191】
ツリーに基づいた分類モデル、分類および回帰ツリー(CART)
第二に、qPCR結果を利用するもう一つの予測モデルは、ツリーに基づいた分類方法により構築された。分類および回帰ツリー(CART)は、qPCR結果から予知物質として血清転写産物を用いてS-plus 6.0により構築された。CARTは、各段階が、結果として癌群 対 正常群の最良の分割を生じる予測変数を検索することを含む、二元再帰分割分析(binary recursive partitioning)による分類モデルに適合する[62]。CARTは、S-plusについてのデフォルト設定により決定された分割基準をもつエントロピー関数を用いた。このアプローチにより、試料全体(n=67)を含む親群は、その後、癌群および正常群へ分割された。本発明者らの最初のツリーは、結果として、異なる分類をもつ小枝を生じなかったすべての分割を除去するように剪定された。
【0192】
第二モデル、「分類および回帰ツリー(CART)モデル」、は図10に報告された図により作成された。
【0193】
本発明者らの適合したCARTモデルは、OSCCについての予測変数としてTHSMBおよびFTH1の血清mRNA濃度を用いた。4.59E-17 Mの閾値をもつ最初の分割として選択されたTHSMBは、合計67個の試料を含む親群から2つの子群を生じた。THSMB濃度<4.59E-17 Mをもつ47個の試料は、「正常-1」へ割り当てられ、THSMB濃度≧4.59E-17 Mをもつ20個は、「癌-1」へ割り当てられた。「正常-1」群は、8.44E-16 Mの閾値をもつFTH1によりさらに分割された。結果として生じた下位群、「正常-2」は、FTH1濃度<8.44E-16 Mをもつ28個の試料を含み、「癌-2」は、FTH1濃度≧8.44E-16 Mをもつ19個の試料を含んだ。結果として、本発明者らの研究に含まれた67個の血清試料は、CART解析により「正常」群および「癌」群へ分類された。
【0194】
「正常」群は、合計28個の試料、正常な被検者からの25個および癌患者からの3個、を含む「正常-2」からの試料から構成された。従って、OSCC予測についてTHSMBおよびFTH1の組み合わせを用いることにより、全体の特異性は78%(25/35)である。「癌」群は、「癌-1」および「癌-2」からの試料から構成された。最終「癌」群において割り当てられた合計39個の試料、癌患者からの29個および正常な被検者からの10個、がある。それゆえに、OSCC予測についてこれらの2つの血清mRNAの組み合わせを用いることにより、全体の感度は91%(癌群において、29/32)であり、特異性は、78%(正常群において、25/35)である。
【0195】
実施例13:OSCC患者の唾液からのRNA単離、増幅および遺伝子発現プロファイリング
患者選択
OSCC患者は、University of California, Los Angeles (UCLA);University of Southern California (USC), Los Angeles, CA;およびUniversity of California San Francisco, San Francisco, CAにおけるMedical Centerから採用された。
【0196】
実証された原発性T1またはT2 OSCCをもつ32人の患者が含まれた。患者のすべては、最近、原発性疾患の診断を受けており、化学療法、放射線治療、手術または代替療法の形をとるいずれの事前処置も受けなかった。
【0197】
同程度の喫煙歴をもつ年齢および性別の整合された被検者の同じくらいの数が対照群として選択された。2つの被検者群の間に、平均年齢:OSCC患者、49.8±7.6歳;正常な被検者、49.1±5.9歳(スチューデントt検定、P>0.80);性別(P>0.90);または喫煙歴(P>0.75)に関する有意差はなかった。前の悪性腫瘍、免疫不全、自己免疫疾患、肝炎またはHIV感染の病歴をもつ被検者はなかった。すべての被検者は、実験のための唾液供与者となることを同意する機関審査委員会に承認された同意書にサインした。
【0198】
唾液収集およびRNA単離
刺激されていない唾液試料は、以前に確立されたプロトコール[38]で午前9時と午前10時の間に収集された。被検者は、収集前の少なくとも1時間、食べること、飲むこと、喫煙または口腔衛生処置を断つよう求められた。唾液試料は、4℃で15分間、2,600 x gで遠心分離された。
【0199】
上清は、ペレットから取り出され、リボヌクレアーゼ阻害剤(Superase-In, Ambion Inc., Austin, TX)で処理された。RNAは、QIAamp Viral RNAキット(Qiagen, Valencia, CA)で唾液上清の560 μLから単離された。単離されたRNAのアリコートは、製造会社の使用説明書に従って、リボヌクレアーゼを含まないデオキシリボヌクレアーゼ(DNaseI-DNA-free, Ambion Inc.)で処理された。単離されたRNAの質は、3つの細胞維持遺伝子転写産物:グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)、アクチン-β(ACTB)およびリボソームタンパク質S9(RPS9)についてのRT-PCRにより調べられた。すべての3つのmRNAについてのPCR産物を示すそれらの試料のみが、その後の分析に用いられた。
【0200】
平均して、全RNAの54.2±20.1 ng(n=64)が、唾液上清の560 μLから得られた。OSCCと整合された対照の間に全RNA量における有意差があった(t検定、P=0.29、n=64)。RT-PCR結果は、唾液試料のすべて(n=64)が、ヒト唾液RNAについての品質管理として用いられる[55]、3つの遺伝子(GAPDH、ACTBおよびRPS9)からの転写産物を含むことを実証した。一貫した増幅規模(658±47.2、n=5)が、RNA増幅の2ラウンド後、得られた。平均して、ビオチン化cRNAの収量は、39.3±6.0 μgであった(n=20)。OSCCと対照の間に、生じたcRNA量の有意差はなかった(t検定、P=0.31、n=20)。
【0201】
実施例14:OSCC患者由来の唾液のmRNAのマイクロアレイプロファイリング
10人のOSCC患者(7人の男性、3人の女性;年齢、52±9.0歳)由来ならびに10人の性別および年齢の整合された正常なドナー(年齢、49±5.6歳)由来の唾液が、マイクロアレイ研究に用いられた。唾液からの単離されたRNAは、RiboAmp RNA Amplificationキット(Arcturus, Mountain View, CA)による直線的増幅にかけられた。RNA増幅効率は、5つの独立した実行において20個の試料で並行して実行する既知の量(0.1 μg)の対照RNAを用いることにより測定された。
【0202】
マイクロアレイ分析
前に報告されたプロトコール[55]に従って、Human Genome U133A Array(HG U133A, Affymetrix, Santa Clara, CA)が遺伝子発現分析に適用された。アレイはスキャンされ、蛍光強度が、Microarray Suit 5.0ソフトウェア(Affymetrix, Santa Clara, CA)により測定された;アレイは、その後、標準化およびモデルに基づいた解析のためのDNA-Chip Analyzerソフトウェア(http://www.dchp.org)へインポートされた[60]。S-plus 6.0(Insightful, Seattle, WA)がすべての統計学的検定を行うために用いられた。
【0203】
3つの基準が、異なって発現される遺伝子転写産物を測定するために用いられた。第一に、すべての試料において「不在」コールと割り当てられたアレイ上のプローブセットは排除された。第二に、両側スチューデントt検定が、OSCC(n=10)と対照(n=10)の間での平均遺伝子発現シグナル強度の比較に用いられた。0.05の臨界レベルが、統計学的有意性として定義された。第三に、倍比率が、統計学的有意差(P<0.05)を示すそれらの遺伝子転写産物について計算された。少なくとも2倍変化を示すそれらの遺伝子転写産物のみが、さらなる分析のために含まれた。
【0204】
HG U133Aマイクロアレイは、癌患者と整合された正常な被検者の間で唾液RNAプロファイルにおける違いを同定するために用いられた。前に記載された基準により含まれる10,316個の転写産物の間で、本発明者らは、0.05未満のP値をもつ1,679個の転写産物を同定した。これらの転写産物の間で、OSCC群において、836個が上方制御され、843個が下方制御された。観察されたこれらの転写産物は、偶然のみに帰される可能性は低く(2検定、P<0.0001)、P<0.05をもつ偽陽性とみなされた。すべての10個のOSCC唾液検体において、制御における変化>3倍の所定の基準およびP値<0.01のカットオフを用いて、OSCC唾液において有意な上方制御を示す17個のmRNAが同定された。17個の転写産物は、すべての10個のOSCC唾液検体において制御における変化>3倍、およびP値<0.01のよりストリンジェントなカットオフを示した。これらの17個の唾液mRNAはOSCC唾液においてすべて、上方制御されるが、同じフィルタリング基準で下方制御されたことが見出されたmRNAはないことは、注目されるべきである。これらの遺伝子およびそれらの産物の生物学的機能は、マイクロアレイにより同定されたOSCCにおける上方制御された(>3倍、P<0.01)唾液mRNAを示す、表7に示されている。
【0205】
【表7】

【0206】
Human Genome U133Aマイクロアレイは、10人の癌患者および10人の整合された正常な被検者由来の唾液でのRNA発現パターンにおける違いを同定するために用いられた。すべての10個のOSCC唾液検体での制御における変化>3倍の基準、およびP値<0.01のカットオフを用いて、本発明者らは、OSCC唾液において有意な上方制御を示す17個のmRNAを同定した。
【0207】
実施例15:OSCC患者の無細胞唾液からのマイクロアレイプロファイリングのQ-PCR確証および定量分析
定量的ポリメラーゼ連鎖反応(qPCR)は、実施例14のマイクロアレイ分析により同定された異なって発現された転写産物のサブセットを確証するために行われた。
【0208】
定量的ポリメラーゼ連鎖反応確証
最初の増幅されていない唾液RNA由来のcDNAは、MulV逆転写酵素(Applied Biosystems, Foster City, CA)およびプライマーとしてランダムヘキサマー(Applied Biosystems)を用いて合成された。qPCR反応は、iQ SYBR Green Supermix(Bio-Rad, Heucules, CA)でのiCycler PCRシステムにおいて行われた。プライマーセットは、PRIMER3ソフトウェア(http://www.genome.wi.mit.edu)を用いることにより設計された。
【0209】
反応のすべては、特定の産物についてカスタマイズされた条件を用いて3連で行われた。特定の鋳型のcDNA/RNAの最初の量は、前に記載されているように[32]、標準曲線から外挿された。この確証は、マイクロアレイ研究に前に用いられたそれらの20個を含む試料のすべて(n=64)を検査することにより完了した。ウイルコクソンの符号付き検定が統計学的解析に用いられた。
【0210】
定量的PCRは、32人のOSCC患者および32人の整合された対照由来の唾液を含む拡大された試料サイズにおいてマイクロアレイ発見を確証するために行われた。唾液mRNAバイオマーカーの9つの候補:DUSP1、GADD45B、H3F3A、IL1B、IL8、OAZ1、RGS2、S100P、およびSAT、は表7に報告されている、それらの報告された癌関連に基づいて選択された。表8は、qPCRにより測定されたOSCC患者由来の唾液における上の9つの候補の定量的変化を示している。
【0211】
【表8】

9つの可能性のある候補のうちの7つは、qPCRにより確証された(P<0.05)。*ウイルコクソンの符号付き検定:P<0.05の場合には、確証される(はい);P≧0.05の場合には、確証されない(いいえ)。
【0212】
結果は、9つの候補mRNAのうちの7つ(78%)、DUSP1、H3F3A、IL1B、IL8、OAZ1、S100PおよびSAT、の転写産物は、OSCC患者の唾液において有意に上昇したことを確証した(ウイルコクソンの符号付き検定、P<0.05)。本発明者らは、qPCRによりRGS2(P=0.149)およびGADD45B(P=0.116)の量において統計学的有意差を検出しなかった。確証された7つの遺伝子は、増加の大きさにより3つのランクに分類されることができた:IL8(24.3倍)を含む高く上方制御されたmRNA;H3F3A(5.61倍)、IL1B(5.48倍)、およびS100P(4.88倍)を含む中位に上方制御されたmRNA;ならびにDUSP1(2.60倍)、OAZ1(2.82倍)およびSAT(2.98倍)を含む低く上方制御されたmRNA。
【0213】
実施例16:ROCおよび感度/特異性解析
qPCR結果を用いて、受信者動作特性(ROC)曲線解析が、実施例15において同定されたバイオマーカーのそれぞれの予測力を評価するためにS-plus 6.0により行われた[82]。
【0214】
受信者動作特性曲線解析および予測モデル
最適なカットポイントは、最大の対応する感度および特異性を生じるそれらについて検索することにより、各バイオマーカーについて決定された。ROC曲線は、その後、最適な感度および特異性値のセットに基づいてプロットされた。曲線下の面積は、ROC曲線の数値積分法により計算された。ROC曲線下の最大の領域は、OSCCを検出するための最強の予測力をもつとして同定された。
【0215】
次に、多変量分類モデルが、癌予測についての唾液マーカーの最良組み合わせを決定するために構築された。最初に、疾患(OSCC)および非疾患(正常)の二項結果を従属変数として用いて、本発明者らは、患者年齢、性別および喫煙歴について調節されたロジスティック回帰モデルを構築した。逆行段階的回帰[61]が、最良の最終モデルを見出すために用いられた。
【0216】
leave-one out cross validation法は、ロジスティック回帰モデルを確証するために用いられた。交差検定ストラテジーは、まず、1つの観測を除去し、その後、すべてのマーカーを用いて残っている事例からロジスティック回帰モデルを適合させる。段階的モデル選択は、モデルを改善しない変数を除去するためにこれらのモデルのそれぞれについて用いられる。その後、マーカー値は、除外された事例について、その観測について推定されるクラスを計算するために用いられた。交差検定誤差率は、その時、試料の数で割った、間違って予測された試料の数である。
【0217】
図11に例証されたROC曲線は、その後、感度および特異性の計算のための可能性のあるカットポイントとしてモデルからの適合した確率を用いて、類似した手順によりロジスティックモデルについて計算された。
【0218】
OSCCについての7つの可能性のある唾液mRNAバイオマーカーのそれぞれについての受信者動作特性(ROC)曲線下の面積、閾値、および対応する感度および特異性の詳細な統計は、OSCC関連唾液mRNAバイオマーカーのROC曲線解析を示す表9に列挙されている。
【0219】
【表9】

【0220】
qPCR結果を利用して、本発明者らは、バイオマーカーのそれぞれの予測力を評価するためにROC曲線解析を行った。最適なカットポイントは、最大の対応する感度および特異性を生じるように決定された。ROC曲線下の最大面積を有するバイオマーカーが、OSCCを検出するための最強の予測力をもつとして同定された。
【0221】
データは、IL8 mRNAが、OSCCの存在を予測するために7つの可能性のあるバイオマーカーの中で最も良く機能することを示した。IL8についてのROC曲線下の計算された面積は、0.85であった。3.19E-18 mol/Lの閾値をもって、唾液におけるIL8 mRNAは、正常からOSCCを識別するための88%の感度および81%の特異性を生じる。
【0222】
疾患識別のための唾液mRNAの利用を実証するために、2つの分類/予測モデルが調べられた。ロジスティック回帰モデルは、組み合わせて最良の予測を提供する、7つの確証されたバイオマーカーのうちの4つ、IL1B、OAZ1、SATおよびIL8、に基づいて構築された(表10)。表10は、ロジスティック回帰モデルにより選択されたOSCCについての唾液を示す。
【0223】
【表10】

【0224】
ロジスティック回帰モデルは、組み合わせて最良の予測を提供する、7つの確証されたバイオマーカーのうちの4つ(IL1B、OAZ1、SATおよびIL8)に基づいて構築された。係数値は、これらの4つのマーカーについて正であり、唾液でのそれらの濃度における同期化した増加が、試料がOSCC被検者から得られたという確率を増加させたことを示している。
【0225】
係数値は、これらの4つのマーカーについて正であり、唾液でのそれらの濃度における同期化した上昇が、試料がOSCC被検者から得られたという確率を増加させたことを示している。ロジスティック回帰モデルに基づいたleave-one out cross validation法の誤差率は、19%(64個のうち12個)であった。4つのマーカーの同じセットを用いた1つ除外解析において作成されたモデルの(64個のうちの)1個を除くすべては、表10に特定された完全データモデルにおいて有意であることが見出された。
【0226】
ROC曲線は、ロジスティック回帰モデルについて計算された。50%のカットオフ確率を用いて、本発明者らは、91%の感度および91%の特異性を得た。ROC曲線下の計算された面積は、ロジスティック回帰モデルについて0.95であった(図11)。
【0227】
ツリーに基づいた分類モデル、分類および回帰ツリー(CART)
第二モデル、ツリーに基づいた分類モデル、分類および回帰ツリー(CART)モデル、が作成された。CARTモデルは、予知物質として確証されたmRNAバイオマーカーを用いてS-plus 6.0により構築された。CARTは、各段階が、結果として、癌群対正常群の最良の分割を生じる予測変数を検索することを含む、二元再帰分割分析による分類モデルに適合する[62]。CARTは、S-plusについてのデフォルト設定により決定された分割基準をもつエントロピー関数を用いた。このアプローチにより、試料全体(n=64)を含む親群は、その後、癌群および正常群へ分割された。本発明者らの最初のツリーは、結果として、異なる分類をもつ小枝を生じなかったすべての分割を除去するように剪定された。
【0228】
結果は、図12の図に示されている。本発明者らの適合したCARTモデルは、OSCCについての予測変数としてIL8、H3F3AおよびSATの唾液mRNA濃度を用いた。3.14E-18 mol/Lの閾値をもつ最初の分割として選択されたIL8は、合計64個の試料を含む親群から2つの子群を生じた。IL8濃度<3.14E-18 mol/Lをもつ30個の試料は、「正常-1」へ割り当てられ、IL8濃度≧3.14E-18をもつ34個は、「癌-1」へ割り当てられた。「正常-1」群は、1.13E-14 mol/Lの閾値をもつSATによりさらに分割された。
【0229】
結果として生じた下位群、「正常-2」は、SAT濃度<1.13E-14 mol/Lをもつ25個の試料を含み、「癌-2」は、SAT濃度≧1.13E-14 mol/Lをもつ5個の試料を含んだ。同様に、「癌-1」群は、2.07E-16 mol/Lの閾値をもつH3F3Aによりさらに分割された。結果として生じた下位群、「癌-3」は、H3F3A濃度≧2.07E-16 mol/Lをもつ27個の試料を含み、「正常-3」群は、H3F3A濃度<2.07E-16 mol/Lをもつ7個の試料を含んだ。
【0230】
結果として、本発明者らの研究に含まれた64個の唾液試料は、CART解析により「癌」群および「正常」群へ分類された。「正常」群は、「正常-2」からの試料および「正常-3」からの試料から構成された。「正常」群に割り当てられた合計32個の試料、正常被検者からの29個および癌患者からの3個、がある。
【0231】
従って、OSCC予測のためにIL8、SATおよびH3F3Aの組み合わせを用いることにより、全体の感度は、90.6%(32のうち29)である。「癌」群は、「癌-2」および「癌-3」からの試料から構成された。最終の「癌」群に割り当てられた合計32個の試料、癌患者からの29個および正常被検者からの3個、がある。それゆえに、OSCC予測のためにこれらの唾液mRNAバイオマーカーの組み合わせを用いることにより、全体の特異性は、90.6%(32のうち29)である。
【0232】
要約すれば、本開示は、無細胞唾液において細胞外mRNAを検出する段階を含む、バイオマーカーが細胞外mRNAである、唾液においてバイオマーカーを検出するための方法;無細胞唾液においてトランスクリプトームパターンを検出する段階を含む、唾液のトランスクリプトーム分析;無細胞唾液において遺伝子のトランスクリプトームパターンおよび/またはmRNAプロファイリングを検出する段階を含む、唾液を分析することにより器官におけるまたは器官での遺伝子における遺伝的変化を検出するための方法;無細胞唾液および/または血清において、病態、疾患または障害に関連したバイオマーカー、特にmRNAおよび/またはタンパク質、のプロファイルを検出する段階を含む、被検者において、口腔もしくは全身性の病態、疾患または障害を診断するための方法;方法の少なくとも1つを行うための少なくとも1つのバイオマーカーについての識別子を含むキット;ならびに、口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとして唾液および/または血清mRNAの使用を言及する。
【0233】
本明細書に引用されたありとあらゆる刊行物および参照文献の開示は、参照により全体として本明細書に組み入れられている。
【0234】
本開示は、特定の態様に関して説明されている。他の態様は、前の記載に照らせば、当業者にとって明らかであると思われる。本開示の保護の範囲は、添付された特許請求の範囲により限定される。
【0235】
参照文献












【特許請求の範囲】
【請求項1】
細胞相および流体相を含む体液中の細胞外mRNAを検出するための方法であって、
体液の無細胞流体相部分を供給する段階;および
体液の無細胞流体相部分中の細胞外mRNAを検出する段階
を含む方法であり、ここで体液が唾液である方法。
【請求項2】
体液が刺激されていない唾液である、請求項1記載の方法。
【請求項3】
細胞外mRNAを検出する段階が、
体液の無細胞流体相部分から細胞外mRNAを単離する段階;および
細胞外mRNAを増幅する段階
を含む、請求項1記載の方法。
【請求項4】
細胞相および流体相を含む体液のトランスクリプトーム分析を行うための方法であって、
体液の無細胞流体相部分を供給する段階;および
体液の無細胞流体相部分においてトランスクリプトームパターンを検出する段階
を含む方法であり、ここで体液が唾液である方法。
【請求項5】
トランスクリプトームパターンを検出する段階がマイクロアレイアッセイにより行われる、請求項4記載の方法。
【請求項6】
トランスクリプトームパターンを検出する段階が高密度オリゴヌクレオチドマイクロアレイアッセイにより行われる、請求項5記載の方法。
【請求項7】
トランスクリプトームパターンを検出する段階が定量的PCR分析またはRT-PCR分析により行われる、請求項4記載の方法。
【請求項8】
器官から流出する、細胞相および流体相を含む体液を分析することにより器官における遺伝的変化を検出するための方法であって、
体液の無細胞流体相部分を供給する段階;
体液の無細胞流体相部分においてトランスクリプトームパターンを検出する段階;および
トランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、あらかじめ決められたパターンが、体液の正常な無細胞流体相部分の共通のトランスクリプトームパターンを示している、段階
を含む方法であり、ここで体液が唾液である方法。
【請求項9】
器官から流出する、細胞相および流体相を含む体液を分析することにより器官における遺伝子の遺伝的変化を検出するための方法であって、
体液の無細胞流体相部分を供給する段階;
体液の無細胞流体相部分において遺伝子のmRNAプロファイルを検出する段階;および
遺伝子のmRNAプロファイルをその遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、その遺伝子のあらかじめ決められたmRNAプロファイルが、体液の正常な無細胞流体相部分におけるその遺伝子のmRNAプロファイルを示している、段階
を含む方法であり、ここで体液が唾液である方法。
【請求項10】
被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法であって、以下の段階を含む方法:
被検者の唾液の無細胞流体相部分を供給する段階;
供給された無細胞唾液流体相部分において、病態、疾患または障害に関連した遺伝子のmRNAプロファイルを検出する段階;および
遺伝子のRNAプロファイルをその遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、その遺伝子のあらかじめ決められたmRNAプロファイルが、被検者における病態、疾患または障害の存在を示している、段階。
【請求項11】
疾患が口腔および/または口腔咽頭の癌であり、遺伝子が、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100PおよびSATをコードする遺伝子からなる群より選択される、請求項10記載の方法。
【請求項12】
疾患が口腔および/または口腔咽頭の癌であり、遺伝子がIL8をコードする遺伝子である、請求項10記載の方法。
【請求項13】
疾患が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌である、請求項12記載の方法。
【請求項14】
被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法であって、以下の段階を含む方法:
被検者の唾液の無細胞流体相部分を供給する段階;
供給された無細胞流体相部分において、病態、疾患または障害に関連したトランスクリプトームパターンを検出する段階;および
トランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、トランスクリプトームパターンにおける、あらかじめ決められたパターンの特徴の認識が、被検者における病態、疾患または障害についての診断となる、段階。
【請求項15】
疾患が口腔および/または口腔咽頭の癌であり、トランスクリプトームが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100PおよびSATについての転写産物からなる群より選択される転写産物を含む、請求項14記載の方法。
【請求項16】
疾患が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌である、請求項14記載の方法。
【請求項17】
被検者において癌を診断するための方法であって、以下の段階を含む方法:
被検者の体液を供給する段階;
体液中のバイオマーカーのプロファイルを検出する段階であって、バイオマーカーが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される、段階;
バイオマーカーのプロファイルをそのバイオマーカーのあらかじめ決められたプロファイルと比較する段階であって、そのバイオマーカーのあらかじめ決められたプロファイルの特徴の、バイオマーカーのプロファイルにおける認識が、癌についての診断となる、段階。
【請求項18】
癌が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌であり、バイオマーカーが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、およびSATからなる群より選択され、体液が唾液であり、かつバイオマーカーのプロファイルを検出する段階が、バイオマーカーのmRNAプロファイルを検出することにより行われる、請求項17記載の方法。
【請求項19】
癌が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌であり、バイオマーカーが、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択され、体液が血清であり、かつバイオマーカーのプロファイルを検出する段階が、バイオマーカーのmRNAプロファイルを検出することにより行われる、請求項17記載の方法。
【請求項20】
癌が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌であり、バイオマーカーが、IL6であり、体液が血清であり、かつバイオマーカーのプロファイルを検出する段階が、バイオマーカーのタンパク質プロファイルを検出することにより行われる、請求項17記載の方法。
【請求項21】
口腔および/もしくは全身性の病態、疾患または障害の診断のためのキットであって、
体液中のバイオマーカーの識別子であって、バイオマーカーが病態、疾患または障害についてのバイオマーカーであり、バイオマーカーが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される、識別子;ならびに
識別子についての検出器
を含むキットであり、
識別子および検出器が請求項14〜16または17〜21のいずれか一項記載の方法のバイオマーカーの体液プロファイルを検出するにおいて用いられうり、ここで識別子が体液中のバイオマーカーに結合し、検出器が識別子を検出するために用いられ、それにより、識別子および検出器がバイオマーカーの体液プロファイルの検出を可能にする、キット。
【請求項22】
疾患が口腔および口腔咽頭の扁平上皮細胞癌である、請求項21記載のキット。
【請求項23】
疾患が頭頸部扁平上皮細胞癌である、請求項21記載のキット。
【請求項24】
口腔および/もしくは全身性の病態、疾患または障害を診断するための方法であって、 口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとして唾液mRNAを用いる段階を含む方法。
【請求項25】
mRNAがIL8、IL1B、DUSP1、H3F3A、OAZ1、S100PおよびSATに対して体系化する、請求項24記載の方法。
【請求項26】
疾患が口腔および口腔咽頭の扁平上皮細胞癌である、請求項25記載の方法。
【請求項27】
疾患が頭頸部扁平上皮細胞癌である、請求項25記載の方法。
【請求項1】
細胞相および流体相を含む体液中の細胞外mRNAを検出するための方法であって、
体液の無細胞流体相部分を供給する段階;および
体液の無細胞流体相部分中の細胞外mRNAを検出する段階
を含む方法であり、ここで体液が唾液である方法。
【請求項2】
体液が刺激されていない唾液である、請求項1記載の方法。
【請求項3】
細胞外mRNAを検出する段階が、
体液の無細胞流体相部分から細胞外mRNAを単離する段階;および
細胞外mRNAを増幅する段階
を含む、請求項1記載の方法。
【請求項4】
細胞相および流体相を含む体液のトランスクリプトーム分析を行うための方法であって、
体液の無細胞流体相部分を供給する段階;および
体液の無細胞流体相部分においてトランスクリプトームパターンを検出する段階
を含む方法であり、ここで体液が唾液である方法。
【請求項5】
トランスクリプトームパターンを検出する段階がマイクロアレイアッセイにより行われる、請求項4記載の方法。
【請求項6】
トランスクリプトームパターンを検出する段階が高密度オリゴヌクレオチドマイクロアレイアッセイにより行われる、請求項5記載の方法。
【請求項7】
トランスクリプトームパターンを検出する段階が定量的PCR分析またはRT-PCR分析により行われる、請求項4記載の方法。
【請求項8】
器官から流出する、細胞相および流体相を含む体液を分析することにより器官における遺伝的変化を検出するための方法であって、
体液の無細胞流体相部分を供給する段階;
体液の無細胞流体相部分においてトランスクリプトームパターンを検出する段階;および
トランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、あらかじめ決められたパターンが、体液の正常な無細胞流体相部分の共通のトランスクリプトームパターンを示している、段階
を含む方法であり、ここで体液が唾液である方法。
【請求項9】
器官から流出する、細胞相および流体相を含む体液を分析することにより器官における遺伝子の遺伝的変化を検出するための方法であって、
体液の無細胞流体相部分を供給する段階;
体液の無細胞流体相部分において遺伝子のmRNAプロファイルを検出する段階;および
遺伝子のmRNAプロファイルをその遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、その遺伝子のあらかじめ決められたmRNAプロファイルが、体液の正常な無細胞流体相部分におけるその遺伝子のmRNAプロファイルを示している、段階
を含む方法であり、ここで体液が唾液である方法。
【請求項10】
被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法であって、以下の段階を含む方法:
被検者の唾液の無細胞流体相部分を供給する段階;
供給された無細胞唾液流体相部分において、病態、疾患または障害に関連した遺伝子のmRNAプロファイルを検出する段階;および
遺伝子のRNAプロファイルをその遺伝子のあらかじめ決められたmRNAプロファイルと比較する段階であって、その遺伝子のあらかじめ決められたmRNAプロファイルが、被検者における病態、疾患または障害の存在を示している、段階。
【請求項11】
疾患が口腔および/または口腔咽頭の癌であり、遺伝子が、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100PおよびSATをコードする遺伝子からなる群より選択される、請求項10記載の方法。
【請求項12】
疾患が口腔および/または口腔咽頭の癌であり、遺伝子がIL8をコードする遺伝子である、請求項10記載の方法。
【請求項13】
疾患が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌である、請求項12記載の方法。
【請求項14】
被検者において口腔もしくは全身性の病態、疾患または障害を診断するための方法であって、以下の段階を含む方法:
被検者の唾液の無細胞流体相部分を供給する段階;
供給された無細胞流体相部分において、病態、疾患または障害に関連したトランスクリプトームパターンを検出する段階;および
トランスクリプトームパターンをあらかじめ決められたパターンと比較する段階であって、トランスクリプトームパターンにおける、あらかじめ決められたパターンの特徴の認識が、被検者における病態、疾患または障害についての診断となる、段階。
【請求項15】
疾患が口腔および/または口腔咽頭の癌であり、トランスクリプトームが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100PおよびSATについての転写産物からなる群より選択される転写産物を含む、請求項14記載の方法。
【請求項16】
疾患が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌である、請求項14記載の方法。
【請求項17】
被検者において癌を診断するための方法であって、以下の段階を含む方法:
被検者の体液を供給する段階;
体液中のバイオマーカーのプロファイルを検出する段階であって、バイオマーカーが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される、段階;
バイオマーカーのプロファイルをそのバイオマーカーのあらかじめ決められたプロファイルと比較する段階であって、そのバイオマーカーのあらかじめ決められたプロファイルの特徴の、バイオマーカーのプロファイルにおける認識が、癌についての診断となる、段階。
【請求項18】
癌が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌であり、バイオマーカーが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、およびSATからなる群より選択され、体液が唾液であり、かつバイオマーカーのプロファイルを検出する段階が、バイオマーカーのmRNAプロファイルを検出することにより行われる、請求項17記載の方法。
【請求項19】
癌が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌であり、バイオマーカーが、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択され、体液が血清であり、かつバイオマーカーのプロファイルを検出する段階が、バイオマーカーのmRNAプロファイルを検出することにより行われる、請求項17記載の方法。
【請求項20】
癌が口腔咽頭扁平上皮細胞癌または頭頸部扁平上皮細胞癌であり、バイオマーカーが、IL6であり、体液が血清であり、かつバイオマーカーのプロファイルを検出する段階が、バイオマーカーのタンパク質プロファイルを検出することにより行われる、請求項17記載の方法。
【請求項21】
口腔および/もしくは全身性の病態、疾患または障害の診断のためのキットであって、
体液中のバイオマーカーの識別子であって、バイオマーカーが病態、疾患または障害についてのバイオマーカーであり、バイオマーカーが、IL8、IL1B、DUSP1、H3F3A、OAZ1、S100P、SAT、IL6、H3F3A、TPT1、FTH1、NCOA4およびARCRからなる群より選択される、識別子;ならびに
識別子についての検出器
を含むキットであり、
識別子および検出器が請求項14〜16または17〜21のいずれか一項記載の方法のバイオマーカーの体液プロファイルを検出するにおいて用いられうり、ここで識別子が体液中のバイオマーカーに結合し、検出器が識別子を検出するために用いられ、それにより、識別子および検出器がバイオマーカーの体液プロファイルの検出を可能にする、キット。
【請求項22】
疾患が口腔および口腔咽頭の扁平上皮細胞癌である、請求項21記載のキット。
【請求項23】
疾患が頭頸部扁平上皮細胞癌である、請求項21記載のキット。
【請求項24】
口腔および/もしくは全身性の病態、疾患または障害を診断するための方法であって、 口腔および/もしくは全身性の病態、疾患または障害についてのバイオマーカーとして唾液mRNAを用いる段階を含む方法。
【請求項25】
mRNAがIL8、IL1B、DUSP1、H3F3A、OAZ1、S100PおよびSATに対して体系化する、請求項24記載の方法。
【請求項26】
疾患が口腔および口腔咽頭の扁平上皮細胞癌である、請求項25記載の方法。
【請求項27】
疾患が頭頸部扁平上皮細胞癌である、請求項25記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2011−229532(P2011−229532A)
【公開日】平成23年11月17日(2011.11.17)
【国際特許分類】
【出願番号】特願2011−115333(P2011−115333)
【出願日】平成23年5月24日(2011.5.24)
【分割の表示】特願2006−554246(P2006−554246)の分割
【原出願日】平成17年2月17日(2005.2.17)
【出願人】(592130699)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【Fターム(参考)】
【公開日】平成23年11月17日(2011.11.17)
【国際特許分類】
【出願日】平成23年5月24日(2011.5.24)
【分割の表示】特願2006−554246(P2006−554246)の分割
【原出願日】平成17年2月17日(2005.2.17)
【出願人】(592130699)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【Fターム(参考)】
[ Back to top ]

