嗅覚GPCRを産生するための方法
【課題】細胞中で嗅覚GPCRを産生するための強固で、確実かつ効率的な方法に対する大きな必要がある。
【解決手段】本発明は、細胞中で嗅覚GPCRを産生するための方法を提供する。一般に、本方法は、嗅覚GPCRをコードする核酸へ作動可能に連結したプロモーターを含有する発現カセットを大グリア細胞、例えばシュヴァン細胞もしくは希突起膠細胞中へ導入する工程、および嗅覚GPCRを産生するために適切な条件下で前記細胞を維持する工程を包含する。さらに、嗅覚GPCRをコードする組換え核酸を含有する大グリア細胞、嗅覚GPCR活性の調節因子についてスクリーニングする方法、および大グリア細胞中で嗅覚GPCRを産生するためのキットも提供される。本発明は、香味料および芳香剤に関する研究において最も多く利用できるので、その結果として多種多様な研究および産業上の用途を有する。
【解決手段】本発明は、細胞中で嗅覚GPCRを産生するための方法を提供する。一般に、本方法は、嗅覚GPCRをコードする核酸へ作動可能に連結したプロモーターを含有する発現カセットを大グリア細胞、例えばシュヴァン細胞もしくは希突起膠細胞中へ導入する工程、および嗅覚GPCRを産生するために適切な条件下で前記細胞を維持する工程を包含する。さらに、嗅覚GPCRをコードする組換え核酸を含有する大グリア細胞、嗅覚GPCR活性の調節因子についてスクリーニングする方法、および大グリア細胞中で嗅覚GPCRを産生するためのキットも提供される。本発明は、香味料および芳香剤に関する研究において最も多く利用できるので、その結果として多種多様な研究および産業上の用途を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、以下の仮出願からの優先権の利益を主張する:米国特許商標庁に米国速達郵便で指示された日付に出願された、2003年11月21日出願の米国仮出願番号第60/523,940号。先の出願の開示は、本明細書中にその全体が参考として援用される。
【0002】
(発明の分野)
本発明は、細胞中でGPCRタンパク質、詳細には嗅覚GPCRタンパク質を産生するための方法に関する。
【背景技術】
【0003】
(発明の背景)
すべての動物は、環境内における化学的感覚情報の認識および識別を可能にする嗅覚感覚器である「鼻」を有している。例えばヒトは、他の動物に比較してニオイについて不良な感覚を有するが、それでもヒトは、10,000種を超える、典型的には400Da未満の小さな有機分子である、揮発性化学物質(「臭気物質」)を感知する、すなわちニオイを嗅ぐことができる。これらの化学物質は構造が高度に相違しており、一連の多種多様な脂肪族系酸、アルコール、アルデヒド、ケトン、およびエステル;芳香環、脂環、多環および複素環の構造を備える化学物質;およびこれらのタイプ各々の無数の置換化学物質、ならびにそれらの組み合わせを含んでいる。注目すべきことに、これらの分子は嗅覚系によって検出されるだけではなく、嗅覚系自体によって識別される。
【0004】
一部のニオイは望ましく、そして他のニオイは嫌われるので、新しいニオイを作り出す、ニオイを模倣する、そしてニオイの知覚を操作する能力は極めて望ましい。このために、ニオイの知覚に関する研究が近年強められてきた。ヒトおよび他の動物種では、嗅覚感覚ニューロンの特殊タイプの樹状突起である嗅覚繊毛上で極めて多数の臭気物質受容体が同定されている。これらの臭気物質受容体はGタンパク質共役受容体のスーパーファミリーに特徴的な7回膜貫通ドメイントポロジーを示すので、したがって「嗅覚GPCR」と呼ばれている。各嗅覚感覚ニューロンは1つのタイプの嗅覚GPCRしか発現せず、ヒトゲノムはおよそ500種の活性嗅覚GPCRをコードすると推定されている。
【0005】
したがって、比較的少数の受容体によって極めて多数の化学物質を検出かつ識別することができる。これは各嗅覚GPCRが1種より多くの臭気物質を認識し、各臭気物質が1種より多くの嗅覚GPCRによって認識されるコンビナトリアル受容体コ―ディングスキーム(combinatorial receptor coding scheme)を用いて達成される。そこで臭気物質は、活性化GPCRの「フィンガープリント」によって特徴付けることができる。いったん決定されると、この「フィンガープリント」は臭気物質の正体(identity)、ならびに類似の「フィンガープリント」、従ってニオイを示す他の分子を同定するための根拠を提供する。
アデノウイルスベクターを用いて外来的に導入された場合にその組換え嗅覚GPCRは嗅覚感覚ニューロンによってインビボで高レベルで効率的に発現され得る(例、非特許文献1)という事実にもかかわらず、嗅覚GPCRは、それらが細胞内でそれらの機能を提供する方法で、異種培養細胞系で容易に発現できないという点で極めて例外的である(例、非特許文献2)。この問題の正確な原因は不明ではあるが、1つの理論は、非内因性細胞中で発現したときに嗅覚GPCRが細胞の原形質膜へ運ばれず、小胞体中に隔離されるようになるというものである。また別の理論は、機能的発現は正しい膜局在化のために必要とされる嗅覚特異的因子または非嗅覚細胞中での情報伝達機構への非効率な共役に起因する可能性があると示唆している(非特許文献3)。非内因性培養細胞中での組換え嗅覚GPCRの非効率的および/または本質的に非機能的な発現を生じさせる機構とは無関係に、この問題に対する解決策はこれまで知られていない。本発明までは、嗅覚GPCRはインビトロでは哺乳動物細胞中で発現するのが格別に困難であり、そしてそのような方法が極めて望ましいのではあるが、これまではそれらのGPCRを産生およびアッセイする強固で確実かつ効率的な方法はなかった。臭気物質の認識および識別を理解することにおける進歩は、嗅覚GPCRを産生できないために強度に妨害されている(非特許文献4)。
さらに上記から、哺乳動物細胞中で嗅覚GPCRを産生するための強固で、確実かつ効率的な方法に対する大きな必要がある。本発明は、この必要や他の必要を満たし、予想外に高水準の成功を生じさせる。
(文献)
目的の文献には下記の参考文献が含まれる:非特許文献5;非特許文献6;非特許文献7;非特許文献8;非特許文献9;非特許文献10;非特許文献11;非特許文献12;非特許文献13;非特許文献14;非特許文献15;非特許文献16;非特許文献17;非特許文献18および非特許文献19;特許文献1および特許文献2;ならびに特許文献3、特許文献4および特許文献5。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許出願公開第2003/0143679号明細書
【特許文献2】米国特許出願公開第2003/0105285号明細書
【特許文献3】米国特許第6,610,511号明細書
【特許文献4】米国特許第6,492,143号明細書
【特許文献5】米国特許第6,410,249号明細書
【非特許文献】
【0007】
【非特許文献1】Touharaら、Proc.Natl.Acad.Sci.、1999年、96:p.4040−4045
【非特許文献2】McClintock、Mol.Brain Res.、1997年、48:p.270−278
【非特許文献3】Kriegerら、Eur.J.Biochem、1994年、219:p.829−835
【非特許文献4】Firestein、Nature、2001年、413:p.211−218
【非特許文献5】Zozulyaら、Genome Biology、2001年、2:p.0018.1−0018.12
【非特許文献6】Mombairts、Annu.Rev.Neurosci、1999年、22:p.487−509
【非特許文献7】Ramingら、Nature、1993年、361:p.353−356
【非特許文献8】Belluscioら、Neuron、1988年、20:p.69−81
【非特許文献9】Ronnetら、Annu.Rev.Physiol.、2002年、64:p.189−222
【非特許文献10】Luら、Traffic、2003年、4:p.416−533
【非特許文献11】Buck、Cell、2000年、100:p.611−618
【非特許文献12】Malnicら、Cell、1999年、96:p.713−723
【非特許文献13】Firestein、Nature、2001年、413:p.211−218
【非特許文献14】Zhaoら、Science、1998年、279:p.237−242
【非特許文献15】Touharaら、Proc.Natl.Acad.Sci.、1999年、96:p.4040−4045
【非特許文献16】Sklarら、J.Biol.Chem、1986年、261:p.15538−15543
【非特許文献17】Dryerら、TiPS、1999年、20:p.413−417
【非特許文献18】Ivicら、J Neurobiol.、2002年、50:p.56−68
【非特許文献19】Fuchsら、Hum.Genet.、2001年 108:p.1−13
【発明の概要】
【課題を解決するための手段】
【0008】
(発明の要旨)
本発明は、細胞中で嗅覚GPCRを産生するための方法を提供する。一般に、本方法は、嗅覚GPCRをコードする核酸へ作動可能に連結したプロモーターを含有する発現カセットを大グリア細胞、例えばシュヴァン(Schwann)細胞もしくは希突起膠細胞(oligodendritic cell)中へ導入する工程と、および嗅覚GPCRを産生するために適切な条件下で前記細胞を維持する工程と、を含んでいる。さらに、嗅覚GPCRをコードする組換え核酸を含有する大グリア細胞、嗅覚GPCR活性の調節因子についてスクリーニングする方法、および大グリア細胞中で嗅覚GPCRを産生するためのキットも提供される。本発明は、香味料および芳香剤に関する研究において最も有用であるので、その結果として多種多様な研究および産業上の用途を有する。
本発明は、さらに以下の項目を提供する:
(項目1)
嗅覚GPCRを産生する方法であって、
該嗅覚GPCRをコードする核酸に作動可能に連結したプロモーターを含む発現カセットを、インビトロで大グリア細胞中へ導入する工程、および
該嗅覚GPCRの産生に適した条件下で、該細胞を維持し、該嗅覚GPCRを産生する工程、
を包含する、方法。
(項目2)
前記大グリア細胞がミエリン産生細胞である、項目1に記載の方法。
(項目3)
前記大グリア細胞がシュヴァン細胞、希突起膠細胞または嗅神経鞘細胞である、項目1に記載の方法。
(項目4)
前記大グリア細胞が初代シュヴァン細胞である、項目3に記載の方法。
(項目5)
前記細胞が不死化大グリア細胞である、項目1に記載の方法。
(項目6)
前記嗅覚GPCRが細胞表面で検出可能である、項目1に記載の方法。
(項目7)
嗅覚調節因子をスクリーニングする方法であって、
項目1に記載の方法に従って大グリア細胞中において嗅覚GPCRを産生する工程であって、ここで、該嗅覚GPCRがGタンパク質へ共役されている、工程;
該細胞を候補因子と接触させる工程;および
該嗅覚GPCRの活性に対する該候補因子の作用を評価する工程
を包含し、ここで、該嗅覚GPCRの活性を調節する候補因子が嗅覚調節因子である、方法。
(項目8)
嗅覚GPCRの調節因子をスクリーニングする方法であって、
項目1に記載の方法に従って大グリア細胞中において該嗅覚GPCRを産生する工程であって、ここで、該嗅覚GPCRがGタンパク質へ共役されている、工程;
該細胞を候補因子と接触させる工程;および
該嗅覚GPCRの活性に対する該候補因子の作用を評価する工程
を包含し、ここで、該嗅覚GPCRの活性を調節する候補因子が該嗅覚GPCRの調節因子である、方法。
(項目9)
前記因子が小有機分子である、項目7または項目8に記載の方法。
(項目10)
前記因子が臭気物質である、項目7または項目8に記載の方法。
(項目11)
前記接触させる工程が前記嗅覚GPCRの既知のアゴニストの存在下で実施される、項目7または項目8に記載の方法。
(項目12)
前記調節因子が、アゴニスト、部分アゴニスト、インバースアゴニストおよびアンタゴニストからなる群から選択される、項目7または項目8に記載の方法。
(項目13)
前記評価する工程がGTPγS結合のレベルの測定を通して行われる、項目7または項目8に記載の方法。
(項目14)
前記評価する工程が、環状AMP(cAMP)、環状GMP(cGMP)、イノシトール1,4,5−三リン酸(IP3)、ジアシルグリセロール(DAG)、およびCa2+の群から選択される第2メッセンジャーのレベルの測定を通して行われる、項目7または項目8に記載の方法。
(項目15)
前記第2メッセンジャーがcAMPである、項目14に記載の方法。
(項目16)
嗅覚GPCRのリガンドをスクリーニングする方法であって、
項目1に記載の方法に従って大グリア細胞中において該嗅覚GPCRを産生する工程;
該嗅覚GPCRを候補因子と接触させる工程;および
該候補因子の該嗅覚GPCRへの結合を評価する工程、
を包含する、方法。
(項目17)
前記候補因子が標識される、項目16に記載の方法。
(項目18)
嗅覚GPCRのリガンドをスクリーニングする方法であって、
項目1に記載の方法に従って大グリア細胞中において該嗅覚GPCRを産生する工程;
該嗅覚GPCRを、該嗅覚GPCRの標識された既知のリガンドの存在下で候補因子と接触させる工程;および
該嗅覚GPCRの該標識された既知のリガンドの結合を評価する工程
を包含し、ここで、該候補因子の存在下での該標識された既知のリガンドの結合の減少は、該候補因子が該嗅覚GPCRのリガンドであることの指標である、方法。
(項目19)
嗅覚調節因子をスクリーニングする方法であって、
項目1に記載の方法に従って複数の異なる嗅覚GPCRを産生する工程であって、ここで、該嗅覚GPCRの各々がGタンパク質へ共役されている、工程;
第1の因子によって活性化される異なる嗅覚GPCRのセットを同定する工程であって、ここで、該第1の因子が既知の嗅覚調節因子である、工程;
該GPCRのセットを第2の因子と接触させる工程;および
該第2の因子の該嗅覚GPCRの活性に対する作用を評価する工程
を包含し、ここで、該第1の因子によって調節された該異なるGPCRセットの1つ以上のGPCRを調節する第2の因子が、嗅覚調節因子である、方法。
(項目20)
前記セットが3つ以上のGPCRを含む、項目19に記載の方法。
(項目21)
嗅覚GPCRをコードする組換え核酸を含む大グリア細胞。
(項目22)
大グリア細胞;および
嗅覚GPCRをコードする核酸
を備える、キット。
(項目23)
前記大グリア細胞を用いて前記嗅覚GPCRを産生するための指示書をさらに備える、項目22に記載のキット。
(項目24)
サンプル中において目的の臭気物質を同定する方法であって、
サンプルを、項目1に記載の方法に従って複数の異なる嗅覚GPCRを産生する複数の大グリア細胞と接触させる工程であって、ここで、該嗅覚GPCRの各々がGタンパク質へ共役されている、工程;および
該臭気物質の存在に対する該嗅覚GPCRの活性化を評価する工程
を包含し、ここで、予め決定された嗅覚GPCRのセットの活性化が、該サンプルにおける該臭気物質の存在を示す、方法。
(項目25)
臭気物質の「フィンガープリント」を決定する方法であって、
サンプルを、項目1に記載の方法に従って複数の異なる嗅覚GPCRを産生する複数の大グリア細胞と接触させる工程であって、ここで、該嗅覚GPCRの各々がGタンパク質へ共役されている、工程;および
該臭気物質による活性化に対する該嗅覚GPCRの活性化を評価する工程
を包含し、ここで、該「フィンガープリント」が該臭気物質によって活性化された異なる嗅覚GPCRのセットを含む、方法。
(項目26)
前記接触させる工程が、前記複数の嗅覚GPCRのうちの1つ以上の既知のアゴニストの存在下で実施される、項目25に記載の方法。
(項目27)
前記複数の細胞が、細胞のアドレス指定可能なアレイであり、ここで、該アレイの各アドレスが単一の組換え嗅覚GPCRを産生する大グリア細胞を含有する、項目24〜26のいずれか一項に記載の方法。
(項目28)
前記GPCR活性化が、GPCR活性化の発光レポーターを用いて評価される、項目27に記載の方法。
【図面の簡単な説明】
【0009】
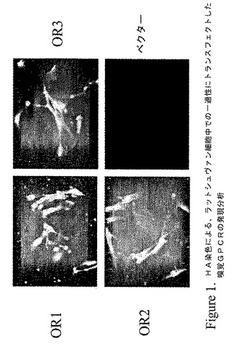
【図1】図1は初代ラットシュヴァン細胞の表面上での組換えヒト嗅覚GPCRの発現を示している4枚の写真パネルである。パネルOR1は、Genbankアクセッション番号P47893を有する嗅覚GPCRである。パネルOR2は、Genbankアクセッション番号NP_036505を有する嗅覚GPCRである。パネルOR3は、Genbankアクセッション番号XP_166868を有する嗅覚GPCRである。ベクターは空の発現ベクターでネガティブコントロールである。嗅覚GPCRは、ロドプシンシグナルペプチドおよびヘマグルチニン(HA)エピトープタグを含むN末端融合タンパク質としてCMVプロモーターに基づく発現ベクターから発現させられる。
【発明を実施するための形態】
【0010】
(定義)
本発明についてさらに詳細に説明する前に、本発明は当然ながら変動する可能性があるので、記載した特定の実施形態には限定されないことを理解されたい。さらに、本明細書で使用する用語は特定の実施形態を記載するためのみであって、限定することは企図されていないことも理解されたい。他に特別に規定しない限り、本明細書で使用するすべての技術用語および科学用語は、本発明が属する技術分野における当業者によって一般に理解される意味と同一の意味を有する。
【0011】
ある範囲の値が提供される場合は、その範囲の上限と下限との間に介在する各値ならびにその記載した範囲内の任意の他の記載した、もしくは介在する値の間に介在する値は、その状況が明白にそうでないことを指示しない限り下限の単位の10分の1まで、本発明の範囲内に含まれると理解されている。これらの小さな範囲の上限および下限は小さな範囲内に独立して含まれる可能性があり、そしてさらに、記載された範囲内のいずれか具体的な限度が排除された、本発明の範囲内に含まれる。記載された範囲が一方もしくは両方の限度を含む場合は、それらの含まれた限度の一方もしくは両方を除外する範囲もまた本発明に含まれる。
【0012】
本出願を通して、様々な出版物、特許および公表された特許出願が引用される。本特許出願において言及したこれらの出版物、特許および公表された特許出願の開示は、これによりそれらの全体が本発明の開示の中に参考として援用される。出版物、特許、または公表された特許出願についての本出願人による本明細書での引用は、前記出版物、特許、もしくは公表された特許出願が先行技術であることを本出願人が認めたわけではない。
【0013】
本明細書および添付の特許請求の範囲で使用する単数形の「1つの」「および」および「その」は、その内容が明白にそうでないことを指示していない限り、複数の対象を含むことに留意しなければならない。そこで、例えば「1つの因子」との言及は複数のそのような因子を含んでおり、そして「GPCR」との言及は1つ以上のGPCRおよび当業者には公知のそれらの同等物についての言及を含んでいる、などである。さらに、特許請求の範囲は任意の必要に応じた要素を排除するように起草できることも留意されたい。したがって、この陳述は「単独で」、「〜だけ」などの排他的な用語を請求項の構成要件の記載と、または「否定的」制限の使用と結び付けて使用するための記述の根拠として機能することが企図されている。
【0014】
「Gタンパク質共役受容体」もしくは「GPCR」は、共通の構造モチーフを共有し、各々が1枚の膜にわたっている7つのαヘリックスを形成する22〜24の間の疎水性アミノ酸の7つの領域を有するポリペプチドである[各範囲は、番号、すなわち膜貫通−1(transmembrane−1;TM1)、膜貫通−2(transmembrane−2;TM2)などによって同定される]。膜貫通ヘリックスは、細胞膜の外側、すなわち「細胞外」側で膜貫通−2と膜貫通−3(transmembrane−3)との間、膜貫通−4(transmembrane−4)と膜貫通−5(transmembrane−5)との間、および膜貫通−6(transmembrane−6)と膜貫通−7(transmembrane−7)との間のアミノ酸の領域によって連結されている[これらは、各々「細胞外」領域1、2および3(EC1、EC2およびEC3)と呼ばれている]。膜貫通ヘリックスは、さらにまた細胞膜の内側、すなわち「細胞内」側で膜貫通−1と膜貫通−2との間、膜貫通−3と膜貫通−4との間、および膜貫通−5と膜貫通−6との間のアミノ酸の領域によって連結されている[これらは、各々「細胞内」領域1、2および3(IC1、IC2およびIC3)と呼ばれている]。この受容体の「カルボキシ」(「C」)末端は細胞内の細胞内空間中に存在し、そしてこの受容体の「アミノ」(「N」)末端は細胞外の細胞外空間中に存在する。GPCRの構造および分類は当技術分野において一般によく知られており、GPCRについてのさらなる考察はProbst, DNA Cell Biol. 1992 11:1−20;Marchese et al Genomics 23:609−618,1994;ならびに以下の書籍:Wiley−Lissによって出版されたJuergen Wess(Ed) Structure−Function Analysis of G Protein−Coupled Receptors(1st edition;October 15, 1999);John Wiley & Sonsによって出版されたKevin R. Lynch(Ed) Identification and Expression of G Protein−Coupled Receptors(March 1998)およびCRC Pressによって出版されたTatsuya Haga(Ed), G Protein−Coupled Receptors(September 24, 1999);そしてAcademic Pressによって出版されたSteve Watson(Ed) G−Protein Linked Receptor Factsbook(1st edition;1994)の中に見いだすことができる。
【0015】
「天然GPCR」(native GPCR)は、動物、例えばヒトもしくはマウスなどの哺乳動物によって産生されるGPCRである。天然GPCRの詳細な説明は、全米バイオテクノロジー情報センター(NCBI)のワールドワイドウェブサイトで見いだされるOn−line Mendelian Inheritance in Man database(ヒトにおけるメンデル性遺伝についてのオンラインデータベース)の中に見いだすことができる。天然GPCRについての追加の説明は、primalinc.comのワールドワイドウェブサイトおよび表1に記載した本方法において使用するための代表的GPCRのリストに見いだすことができる。
【0016】
用語「リガンド」は、GPCRへ特異的に結合する分子を意味する。リガンドは、例えばポリペプチド、脂質、小分子または抗体などであってよい。「天然リガンド」(native ligand)は、天然GPCRのための内因性の天然リガンドである。リガンドは、GPCR「アンタゴニスト」、「アゴニスト」、「部分アゴニスト」または「インバースアゴニスト」(inverse agonist)などであってよい。
【0017】
「調節因子」は、それが細胞中で発現するGPCRと接触した、例えば結合した場合にGPCR細胞内応答を増加もしくは減少させるリガンドである。
【0018】
用語「第2メッセンジャー」は、受容体活性化の結果として産生される細胞内応答を意味するものとする。第2メッセンジャーは、例えばイノシトール1,4,5−三リン酸(IP3)、ジアシルグリセロール(DAG)、環状AMP(cAMP)、環状GMP(cGMP)およびCa2+を含むことができる。第2メッセンジャー応答を測定すると、受容体活性化を決定できる。さらに、第2メッセンジャー応答を測定すると、候補因子、例えばアゴニスト、部分アゴニスト、インバースアゴニスト、およびアンタゴニストを同定できる。
【0019】
「アゴニスト」は、それがGPCRに結合するとGPCR細胞内応答を活性化するリガンドである。
【0020】
「部分アゴニスト」は、それがGPCRに結合すると、アゴニストより低い程度まで、GPCR細胞内応答を活性化するリガンドである。
【0021】
「アンタゴニスト」は、アゴニストと同一部位でGPCRへ競合的に結合するが、GPCRの活性形によって産生される細胞内応答を活性化しないリガンドである。アンタゴニストは、アゴニストもしくは部分アゴニストによる細胞内応答を通常は阻害する。アンタゴニストは、通常はアゴニストもしくは部分アゴニストの不在下ではベースライン細胞内応答を減少させない。
【0022】
「インバースアゴニスト」は、GPCRに結合し、アゴニストもしくは部分アゴニストの不在下で観察されたGPCRのベースライン(基底)細胞内応答を阻害するリガンドである。大多数の実施形態では、ベースライン細胞内応答はインバースアゴニストの存在下では、インバースアゴニストの不在下でのベースライン応答に比較して、少なくとも約30%、少なくとも約50%、もしくは少なくとも約75%阻害される。
【0023】
用語「臭気物質」は、嗅覚GPCRを活性化する、既知または未知の構造の天然型もしくは化学合成された任意の化合物を含んでいる。上記の背景のセクションにおいて考察したように、臭気物質は、通常は揮発性の、400Da未満の小有機分子である。香味料、香水、芳香、臭気、芳香剤は臭気物質のタイプである。「ニオイ」は、特定臭気物質に結び付いた感覚である。
【0024】
本明細書で使用する用語「嗅覚GPCR活性に結び付いた現象」は、嗅覚GPCR活性に結び付いた、特にヒトもしくは動物モデルにおいて容易に評価できる特徴などの構造的、分子的、または機能的特徴をいう。そのような特徴には、GPCRの活性化によって誘導された下流分子事象、およびニオイ、味、またはGPCRの活性化によって誘導されたその他の挙動的もしくは生理的事象などの感覚現象が含まれるが、それらに限定されない。
【0025】
「欠失」は、親GPCRポリペプチドもしくは核酸のアミノ酸配列もしくはヌクレオチド配列に比較してその中で1つ以上のアミノ酸もしくはヌクレオチド残基が各々欠如している、アミノ酸もしくはヌクレオチドのいずれかの配列における変化であると規定されている。GPCRまたはそのフラグメントの状況においては、欠失は、約2個、約5個、約10個、約20個まで、約30個までもしくは約50個まで、またはそれ以上のアミノ酸の欠失を含んでいてよい。GPCRもしくはそのフラグメントは1より多くの欠失を含有していてよい。
【0026】
「挿入」もしくは「付加」は、親GPCRのアミノ酸配列もしくはヌクレオチド配列に比較して、各々1つ以上のアミノ酸もしくはヌクレオチド残基の付加を生じさせている、アミノ酸もしくはヌクレオチド配列における変化である。「挿入」は、一般にポリペプチドのアミノ酸配列内の1つ以上のアミノ酸残基への付加をいうが、「付加」は挿入であってよい、またはN末端もしくはC末端、または両端で付加されたアミノ酸残基をいう。GPCRまたはそのフラグメントの状況においては、挿入もしくは付加は、通常、約1個、約3個、約5個、約10個、約20個まで、約30個まで、もしくは約50個まで、またはそれ以上のアミノ酸の挿入もしくは付加である。GPCRもしくはそのフラグメントは1より多くの挿入を含有していてよい。
【0027】
「置換」は、各々親GPCRもしくはそのフラグメントのアミノ酸配列もしくはヌクレオチド配列と比較して、相違するアミノ酸もしくはヌクレオチドによる1つ以上のアミノ酸もしくはヌクレオチドの置換の結果として生じる。GPCRもしくはそのフラグメントは、GPCR活性へ実質的に作用を及ぼさない保存的アミノ酸置換を有する可能性があることは理解されている。保存的置換は、gly、ala;val、ile、leu;asp、glu;asn、gln;ser、thr;lys、arg;およびphe、tyrなどの組み合わせが企図されている。
【0028】
用語「生物活性」GPCRは、天然に存在するGPCRの構造的および生化学的機能を有するGPCRをいう。
【0029】
本明細書で使用する用語「決定する工程」、「測定する工程」、「評価する工程」、および「アッセイする工程」は交換可能に使用され、定量的および定性的決定の両方を含んでいる。これらの状況におけるGPCRの「量」についての言及が定量的評価を必要とすることは意図されておらず、そして他に具体的に指示されない限り、定性的または定量的のいずれであってもよい。
【0030】
本明細書で交換可能に使用される用語「ポリペプチド」および「タンパク質」は、任意の長さの高分子形のアミノ酸をいい、コードされたアミノ酸およびコードされたものではないアミノ酸、化学的もしくは生化学的に修飾もしくは誘導体化されたアミノ酸、ならびに修飾ペプチド主鎖を有するポリペプチドを含むことができる。この用語には、N末端メチオニン残基を備える、もしくは備えない、異種および同種リーダー配列との融合体である異種アミノ酸配列を備える融合タンパク質;免疫学的にタグ付けされたタンパク質;融合パートナーとして例えば蛍光タンパク質、β−ガラクトシダーゼ、ルシフェラーゼなどを含む融合タンパク質のような検出可能な融合パートナーを備える融合タンパク質などを含むがそれらに限定されない融合タンパク質が含まれる。
【0031】
用語「核酸分子」および「ポリヌクレオチド」は交換可能に使用され、デオキシリボヌクレオチドもしくはリボヌクレオチド、またはそれらのアナログのいずれかである、任意の長さの高分子形のヌクレオチドをいう。ポリヌクレオチドは任意の三次元構造を有していてよく、既知または未知の任意の機能を実行することができる。ポリヌクレオチドの非限定的例には、遺伝子、遺伝子フラグメント、エクソン、イントロン、メッセンジャーRNA(mRNA)、トランスファーRNA、リボソームRNA、リボザイム、cDNA、組換えポリヌクレオチド、分枝状ポリヌクレオチド、プラスミド、ベクター、任意の配列の単離DNA、制御領域、任意の配列の単離RNA、核酸プローブ、およびプライマーが含まれる。核酸分子は、直鎖状であっても環状であってもよい。
【0032】
本明細書で使用する用語「単離(された)」は、単離化合物の状況において使用する場合は、その中で化合物が自然に発生する環境とは相違する環境内にある目的の化合物をいう。「単離(された)」は、目的の化合物が実質的に富化されている、および/または目的の化合物が部分的もしくは実質的に精製されているサンプル内にある化合物を含むことが意図されている。
【0033】
本明細書で使用する用語「実質的に純粋」は、その天然環境から取り出されており、自然にはそれに結び付いている他の成分を少なくとも60%含まない、好ましくは75%含まない、および最も好ましくは90%含まない化合物をいう。
【0034】
「コーディング配列」もしくは選択されたポリペプチドを「コードする」配列は、例えば適切な調節配列(もしくは「制御エレメント」の制御下に置かれたときに、宿主細胞中で(DNAの場合は)転写することができることおよび(mRNAの場合は)ポリペプチドへ翻訳することのできる核酸分子である。コーディング配列の境界は、典型的には5’(アミノ)末端にある開始コドンおよび3’(カルボキシ)末端にある翻訳停止コドンによって決定される。コーディング配列には、ウイルス由来cDNA、原核細胞もしくは真核細胞mRNA、ウイルスもしくは原核細胞DNA由来のゲノムDNA配列、および合成DNA配列を含むことができるが、それらに限定されない。転写終結配列はコーディング配列に対して3’に位置していてよい。その他の「制御エレメント」はさらにまたコーディング配列と結び付いていてもよい。ポリペプチドをコードするDNA配列は、所望のポリペプチドコーディング配列のDNAコピーを表すために選択された細胞にとって好ましいコドンを使用することによって選択された細胞内での発現に最適化することができる。
【0035】
「によってコードされた」は、ポリペプチド配列をコードする核酸配列をいい、このときポリペプチド配列もしくはその一部分は、核酸配列によってコードされたポリペプチドから少なくとも3〜5アミノ酸、より好ましくは少なくとも8〜10アミノ酸、およびいっそうより好ましくは少なくとも15〜20アミノ酸の配列を含有している。さらに、その配列によってコードされたポリペプチドを用いて免疫学的に同定可能なポリペプチド配列も含まれる。
【0036】
「作動可能に連結した」は、そのように記載された構成成分がそれらの通常の機能を実行できるように構成されているエレメントの配置をいう。コーディング配列へ作動可能に連結したプロモーターは、コーディング配列の発現を達成するであろう。プロモーターもしくはその他の制御エレメントは、それらがそれらの発現を指令するように機能する限り、コーディング配列と隣接している必要はない。例えば、介在する翻訳されないが転写される配列がプロモーター配列とコーディング配列との間に存在していてよく、プロモーター配列はそれでもまだコーディング配列と「作動可能に連結した」と見なすことができる。
【0037】
「核酸構築物」は、自然には一緒に見いだされない1つ以上の機能的ユニットを含むように構築されている核酸配列を意味する。例には、環状、直鎖状、二本鎖、染色体外DNA分子(プラスミド)、コスミド(ラムダファージ由来のCOS配列を含有するプラスミド)、非天然核酸配列を含むウイルスゲノムなどが含まれる。
【0038】
「ベクター」は、遺伝子配列を宿主細胞へ移すことができる。典型的には、「ベクター構築物」、「発現ベクター」および「遺伝子移入ベクター」は目的の遺伝子の発現を指令できる、そしてベクターの全部もしくは一部分のゲノム組込み、または染色体外エレメントとしてのベクターの一過性もしくは遺伝性維持によって達成できる、遺伝子配列を宿主細胞へ移入できる任意の核酸構築物を意味している。そこで、この用語は、クローニングおよび発現ビヒクルならびに組込み型ベクターを含んでいる。
【0039】
「発現カセット」は、発現カセットのプロモーターへ作動可能に連結した、目的の遺伝子/コーディング配列の発現を指令できる任意の核酸構築物を含んでいる。そのようなカセットは、宿主細胞中へ発現カセットを移入するために、「ベクター」、「ベクター構築物」、「発現ベクター」、もしくは「遺伝子移入ベクター」内へ構築することができる。そこで、この用語は、クローニングおよび発現ビヒクルならびにウイルスベクターを含んでいる。
【0040】
第1ポリヌクレオチドは、それが第2ポリヌクレオチド、そのcDNA、それらの相補体の1領域と同一もしくは実質的に同一のヌクレオチド配列を有する場合、またはそれが上述した配列同一性を表示する場合は、第2ポリヌクレオチドに「由来する」または「対応する」。
【0041】
第1ポリペプチドは、それが(i)第2ポリヌクレオチドに由来する第1ポリヌクレオチドによってコードされるかまたは(ii)上述したように第2ポリペプチドに対する配列同一性を表示する場合は、第2ポリペプチドに「由来する」、または「対応する」。
【0042】
用語「投与する工程」などは、所望の薬理学的および/または生理学的作用を入手するためにGPCR調節因子を添加する工程をいう。多数の実施形態では、本GPCR調節因子は揮発性であり、したがってそれらは食材または大気への添加によって直接的もしくは間接的のいずれかで、経口もしくは鼻腔内投与される。この作用は臭気の知覚を完全もしくは部分的に防止することができる、臭気物質の知覚を増加させることができる、または新しい臭気を発生させることができる。
【0043】
用語「天然に存在しない」もしくは「組換え」は、人工的もしくはさもなければ天然では見いだされないことを意味する。組換え細胞は通常はその細胞内で見いだされない核酸を含有しており、組換え核酸は通常は自然では見いだされない2つ以上の核酸の融合体を含有しており、そして組換えポリペプチドは通常は組換え核酸によって産生される。
【0044】
「被験体」、「個体」、「宿主」および「患者」は、本明細書では交換可能に使用され、嗅覚GPCRを有する任意の動物、例えば哺乳動物、ヒトもしくは非ヒトをいう。一般に、被験体は哺乳動物被験体である。代表的な被験体には、ヒト、非ヒト霊長類、マウス、ラット、ウシ、ヒツジ、ヤギ、ブタ、イヌ、ネコ、およびウマを含むが必ずしもそれらに限定されず、特に関心対象となるのはヒトである。
【0045】
(発明の詳細な説明)
本発明は、細胞中で嗅覚GPCRを産生するための方法を提供する。一般に、本方法は、嗅覚GPCRをコードする核酸へ作動可能に連結したプロモーターを含有する発現カセットを大グリア細胞、例えばシュヴァン細胞もしくは希突起膠細胞中へ導入する工程と、および嗅覚GPCRを産生するために適切な条件下で前記細胞を維持する工程と、を含んでいる。さらに、嗅覚GPCRをコードする組換え核酸を含有する大グリア細胞、嗅覚GPCR活性の調節因子についてスクリーニングする方法、および大グリア細胞中で嗅覚GPCRを産生するためのキットも提供される。本発明は、例えば香味料および芳香剤の分析および同定において利用されるので、その結果として多種多様な研究および産業上の用途を有する。
【0046】
要約のセクションに提供するより、そして上述した背景技術および用語の定義によって提供したよりもはるかに詳細に本発明を説明する際に、嗅覚GPCRを産生する方法について最初に記載し、次に本発明の方法を実施する際に利用する組成物およびキットの説明を続ける。最後に、嗅覚GPCR活性の調節因子をスクリーニングする方法および臭気物質ミメティックをスクリーニングする方法について考察する。
【0047】
(嗅覚GPCRを産生するための方法)
1つの局面では、本発明は、細胞中で嗅覚GPCRを産生する方法を提供する。これらの方法を記載する際に、本方法において使用するための組成物を最初に記載しよう。
【0048】
(嗅覚Gタンパク質共役受容体)
用語「嗅覚Gタンパク質共役受容体」(もしくはその略語、例えば「嗅覚GPCR」)は、化学的感覚に含まれるGPCRスーパーファミリーの系統発生的に別個の当技術分野において認識されたサブファミリーの任意のメンバーをいう。嗅覚GPCRは、それらの全体が本明細書に特別に援用されるZozulya et al, (Genome Biol. 2:0018, 2001);Glusman et al, (Genome Res. 11:685−702, 2001)およびCrasto et al, (Nucleic Acids Res. 30:354−60, 2002)を含む、極めて多種多様な出版物および公共データベース内で一般的および詳細に開示されている。特に、Senselab.med.yale.eduのワールドワイドウェブサイトで見いだされる嗅覚GPCR配列のデータバース内で記載された嗅覚GPCRが関心の対象である。本方法において使用するために適切な代表的な嗅覚GPCRの非限定的リストは、特許請求の範囲の前に挿入した表1に提供した。表1は、European Bioinformatics Instituteのワールドワイドウェブサイトで見いだされるような、Swiss−Protデータベースからのタンパク質配列登録のアクセッション番号のリストである。表1に列挙したこれらのデータベース登録、特にそれらの登録に記載されたアミノ酸配列は、それらの全体が参考として本明細書に特別に援用される。
【0049】
嗅覚GPCRはヒト起源もしくは非ヒト動物起源のものであってよいことは明示的に企図されている。特定の実施形態では、非ヒト動物は、マウス、ラット、イヌ、またはニオイの識別的な鋭い感覚を備える任意の他の非ヒト動物であってよい。特定の実施形態では、嗅覚GPCRは昆虫(例、カ、アリ、アブラムシ、カブトムシ、ハエ、スズメバチ、ミツバチ、クモ、あるいはヒトもしくは非ヒト動物へ疾患を伝播する、または農作物もしくは観賞用植物に対する損害を引き起こす任意の昆虫)起源のものであってよい。特定の実施形態では、嗅覚GPCRはヒトのものである。
【0050】
本方法では天然GPCRおよび変更された天然嗅覚GPCRの両方を使用できることが認識されている。したがって、用語「嗅覚Gタンパク質共役受容体」は、さらにまたそれが対応する天然GPCRと同一リガンドに結合するように、変化した天然嗅覚GPCR(例、レポーターの付加などの付加、置換、欠失および挿入などによって変化した天然嗅覚GPCR)を含むことも企図されている。
【0051】
このため用語「嗅覚Gタンパク質共役受容体」は、表1に列挙したGPCRポリペプチドの変異体を含んでいる。言い換えると、本方法では任意の嗅覚GPCRの変異体を使用できる。このため特定の実施形態では、嗅覚GPCRは天然配列(例、NCBIのGenbankデータベースなどに寄託された配列など)に比較して変化した配列を有していてよい。例えば、嗅覚GPCRは、ポリペプチド内の任意の位置(例、C末端もしくはN末端、または内部位置)での任意の数のアミノ酸置換、アミノ酸欠失、もしくはアミノ酸付加を有する天然ポリペプチドであってよい。
【0052】
特定の実施形態では、嗅覚GPCRは融合タンパク質であり、例えば親和性タグドメインもしくはレポータードメインを含有していてよい。適切な親和性タグには、他の部分、通常は他のポリペプチド、最も一般的には抗体へ特異的に結合することのできる任意のアミノ酸配列が含まれる。適切な親和性タグには、当技術分野において公知のように、エピトープタグ、例えば、V5タグ、FLAGタグ、HAタグ(ヘマグルチニンインフルエンザウイルス由来)、mycタグなどが含まれる。適切な親和性タグには、さらに当技術分野において公知のように、それらに対する結合基質、例えばHIS、GSTおよびMBPタグが既知のドメイン、ならびにそれらに対する特異的結合パートナー、例えば抗体、詳細にはモノクローナル抗体を利用できる他のタンパク質由来のドメインが含まれる。適切な親和性タグには、さらに特異的に結合して適切な結合パートナー、例えばIgG Fc受容体を用いて検出できるIgG Fc領域などの任意のタンパク質−タンパク質相互作用ドメインが含まれる。そのような融合タンパク質が、N末端メチオニン残基が欠失しているかもしくは代替アミノ酸と置換されているGPCRとインフレームで融合された異種N末端ドメイン(例、エピトープタグ)を含有していてよいことは明示的に企図されている。特定の実施形態では、嗅覚GPCR融合タンパク質はそのN末端で、単独もしくはヘマグルチニンエピトープタグと組み合わせてロドプシンシグナルペプチドを含んでいてよい。特定の実施形態では、嗅覚GPCR融合タンパク質はアミノ酸配列MNGTEGPNFYVPFSNKTGVVYPYDVPDYAKLを有するN末端を含んでいてよいが、このときMNGTEGPNFYVPFSNKTGVVはロドプシンシグナルペプチドであり、YPYDVPDYAKLはヘマグルチニンエピトープタグである。融合タンパク質としての嗅覚GPCRの発現を可能にする発現カセットを構築することは当業者の技術の範囲内に明確に含まれる(例えば、Krautwurst et al, Cell 95:917−926, 1998を参照されたい)。目的のポリペプチドは最初に天然ポリペプチドから作製して、次に上述したとおり適切なレポーター/タグへ作動可能に連結させることができることは理解されている。他の実施形態では、嗅覚GPCRはGPCRのフラグメントであってよく、このとき前記GPCRフラグメントは生物活性である。
【0053】
適切なレポータードメインには、ポリペプチドの存在を報告できる任意のドメインが含まれる。親和性タグを使用して例えばタグへ特異的に結合する標識抗体を用いてポリペプチドの存在を報告できることは認識されているが、発光レポータードメインはより日常的に使用される。適切な発光レポータードメインには、ルシフェラーゼ(例えば、ホタル、ウミホタル(Vargula)、Renilla reniformisもしくはRenilla muelleri由来)、およびそれらの発光改変体が含まれる。その他の適切なレポータードメインには、蛍光タンパク質(例えば、クラゲ、サンゴならびにAequoria種、Renilla種、Ptilosarcus種、Stylatula種などの他の腔腸動物由来)、またはそれらの発光改変体が含まれる。これらのレポータータンパク質の発光改変体は当技術分野において極めてよく知られており、天然レポータータンパク質に比較して、より明るい、より薄暗い場合がある、または相違する励起および/または発光スペクトルを有することがある。例えば、一部の改変体は、それらがもはや緑色に見えないように変化させられている、そして当技術分野において公知のように、ブルー、シアン、イエロー、強化イエロー、レッド(各々、BFP、CFP、YFP、eYFPおよびRFPと名付ける)に見える、または他の発光スペクトルを有していることがある。他の適切なレポータードメインには、β−ガラクトシダーゼ、β−グルクロニダーゼ、クロラムフェニコールアセチルトランスフェラーゼ、および分泌された胚アルカリホスファターゼなどの生化学的変化もしくは変色を通してポリペプチドの存在を報告できるドメインが含まれる。一部の実施形態では、レポータードメインはRenillaルシフェラーゼ(例、pRLCMV;Promega社製、カタログ番号E2661)である。
【0054】
さらに、当技術分野において公知のように、親和性タグもしくはレポータードメインは、嗅覚GPCR内の任意の位置に存在していてよい。しかし、大多数の実施形態では、それらは嗅覚GPCRのC末端もしくはN末端に存在している。
【0055】
多数の実施形態では、嗅覚GPCRは嗅覚GPCRのライブラリーのメンバーである。典型的には、ライブラリーは複数のメンバーを含有するが、このとき複数は2以上、5以上、約10以上、約20以上、約50以上、約100以上、約200以上、約300以上、約500以上、約1,000以上、または約10,000以上まででさえあってよい。このためライブラリーは、約5、約10、約20、約30以上、約50以上、約100以上、約200以上、通常は約500以上まで、通常は約1,000以上までの嗅覚GPCRポリペプチドを含有していてよい。ライブラリーのメンバーは、正体が既知のもの、もしくは正体が知られていないもの、またはそれらの混合物であってよい。ライブラリーのメンバーは完全に1つの種由来であってよい、または複数の種由来であってよい。
【0056】
(嗅覚Gタンパク質共役受容体をコードする核酸)
核酸を操作するための遺伝子コードおよび組換え技術は知られており、そして嗅覚GPCRポリペプチドのアミノ酸配列は上述したので、嗅覚GPCRポリペプチドをコードする核酸の設計および産生は当業者の技術の範囲内に明白に含まれている。特定の実施形態では、標準組換えDNAテクノロジー(Ausubel, et al, Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995;Sambrook, et al., Molecular Cloning:A Laboratoty Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.)法が使用される。例えば、嗅覚GPCRコーディング配列は、本明細書において詳細に記載する必要のない多種多様な組み換え方法の1つもしくは組み合わせを用いてライブラリーの嗅覚GPCRコーディング配列から単離することができる。タンパク質をコードする核酸配列中でのヌクレオチドの引き続いての置換、欠失、および/または付加は、さらにまた標準的な組換えDNA技術を用いて実施することもできる。
【0057】
例えば、部位特異的変異誘発およびサブクローニングを使用すると、目的のポリペプチドをコードするポリヌクレオチド中の核酸残基を導入する/欠失させる/置換することができる。他の実施形態では、PCRを使用できる。目的のポリペプチドをコードする核酸は、さらにまたオリゴヌクレオチドから完全に化学合成によって作製することもできる(例、Cello et al., Science (2002) 297:1016−8)。
【0058】
特定の実施形態では、目的のポリペプチドをコードする核酸のコドンは、特定種、詳細には哺乳動物、例えばヒトもしくはマウス種の細胞中で発現させるために最適化される。
【0059】
本発明は、さらに本核酸を含むベクター(さらに「構築物」とも呼ばれる)を提供する。本発明の多数の実施形態では、本核酸配列は、配列が例えば発現カセットを形成するためのプロモーターを含む発現制御配列へ作動可能に連結した後に宿主内で発現されるであろう。本発現カセットは、典型的には宿主染色体DNAのエピソームまたは一体部分のいずれかとして宿主細胞中で複製できる発現ベクター内に配置される。一般に、発現ベクターは、所望のDNA配列を用いて形質転換されたそれらの細胞の検出を許容するために、選択マーカー、例えばテトラサイクリンもしくはネオマイシンを含有するであろう(例えば、参照して本明細書に組み込まれる米国特許第4,704,362号を参照されたい)。単一および二重発現カセットを含むベクターは当技術分野においてよく公知の(Ausubel, et al, Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995;Sambrook, et al., Molecular Cloning:A Laboratoty Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.)。適切なベクターには、ウイルスベクター、プラスミド、コスミド、人工染色体(ヒト人工染色体、細菌人工染色体、酵母人工染色体など)、ミニ染色体などが含まれる。レトロウイルス、アデノウイルスおよびアデノ随伴ウイルスベクターが使用されてよい。
【0060】
細胞中での目的のポリペプチドを産生するために、当業者は様々な発現ベクターを利用できる。1つの適切なベクターは、特定の実施形態において使用されるpCMVである。このベクターは、特許手続上の微生物の寄託の国際的承認に関するブダペスト条約の規定下で1998年10月13日にアメリカンタイプカルチャーコレクション(ATCC)(10801 University Blvd、20110−2209米国バージニア州マナッサス)へ寄託された。このDNAは、ATCCによって試験され、生存可能であると決定された。このATCCは、pCMVに次の寄託番号:ATCC番号203351を指定した。
【0061】
本発現カセットは通常、嗅覚GPCRをコードする単一オープンリーディングフレームを含んでいるが、しかし特定の実施形態では、嗅覚GPCRを発現させるための宿主細胞が真核細胞、例えばヒト細胞などの哺乳動物細胞である可能性があるので、オープンリーディングフレームはイントロンによって中断されることがある。本発現カセットは、典型的には本核酸に加えて、RNA安定性、翻訳効率などを指令することのできる3’および5’非翻訳領域(UTR)を含有していてよい転写単位の一部である。発現カセットは、さらにまた本核酸に加えて転写ターミネーターを含有する核酸の一部であってもよい。
【0062】
本発現カセットは、嗅覚GPCRを融合タンパク質として発現させることのできる核酸配列を含んでいてよい。特定の実施形態では、嗅覚GPCR融合タンパク質はそのN末端で、ロドプシンシグナルペプチドおよび/またはヘマグルチニンエピトープタグを含んでいてよい。特定の実施形態では、嗅覚GPCR融合タンパク質はアミノ酸配列MNGTEGPNFYVPFSNKTGVVYPYDVPDYAKLを有するN末端を含んでいてよいが、このときMNGTEGPNFYVPFSNKTGVVはロドプシンシグナルペプチドであり、YPYDVPDYAKLはヘマグルチニンエピトープタグである。融合タンパク質としての嗅覚GPCRの発現を可能にする発現カセットを構築することは当業者の技術の範囲内に明確に含まれる(例えば、Krautwurst et al, Cell
95:917−926, 1998を参照されたい)。
【0063】
真核細胞プロモーター(すなわち、真核細胞中で機能するプロモーター)は、ウイルスプロモーターおよび真核細胞遺伝子由来プロモーターを含む、大グリア細胞中で機能性である任意のプロモーターであってよい。代表的な真核細胞プロモーターには、次の:マウスメタロチオネインI遺伝子配列のプロモーター(Hamer et al., J. Mol. Appl. Gen. 1:273−288, 1982);ヘルペスウイルスのTKプロモーター(McKnight, Cell 31:355−365, 1982);SV40初期プロモーター(Benoist et al., Nature (London) 290:304−310, 1981);酵母gall遺伝子配列プロモーター(Johnston et al., Proc. Natl. Acad.
Sci. (USA) 79:6971−6975, 1982;Silver et al., Proc. Natl. Acad. Sci. (USA)81:5951−59SS, 1984)、CMVプロモーター、EF−1プロモーター、エクジソン応答性プロモーター、テトラサイクリン応答性プロモーターなどが含まれるが、それらに限定されない。ウイルスプロモーターは、それらは一般に特別に強力なプロモーターであるので、特に関心対象となることがある。特定の実施形態では、ウイルスプロモーターであるプロモーターが使用される。本発明において使用するためのプロモーターは、それらがその中に導入されている大グリア細胞(および/または動物)中で機能性であるように選択される。特定の実施形態では、プロモーターはCMVプロモーターである。
【0064】
特定の実施形態では、本ベクターはさらにまた選択可能なマーカーの発現も提供できる。適切なベクターおよび選択可能なマーカーは当技術分野においてよく知られており、Ausubel, et al (Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995)およびSambrook, et al, (Molecular Cloning:A Laboratoty Manual, Third Edition, (2001) Cold Spring Harbor, N.Y.)の中で考察されている。多種多様な遺伝子が選択可能なマーカーとして使用されてきており、選択可能なマーカーとして本ベクター内で使用される特定遺伝子は主として便宜上選択されている。既知の選択可能なマーカー遺伝子には:チミジンキナーゼ遺伝子、ジヒドロ葉酸還元酵素遺伝子、キサンチン−グアニンホスホリボシルトランスフェラーゼ遺伝子、CAD、アデノシンデアミナーゼ遺伝子、アスパラギンシンテターゼ遺伝子、抗生物質耐性遺伝子、例えばtetr、ampr、Cmrまたはcat、kanrもしくはneor(アミノ配糖体ホスホトランスフェラーゼ遺伝子)、ハイグロマイシンBホスホトランスフェラーゼ遺伝子などが含まれる。
【0065】
上述したように、嗅覚GPCRは、親和性ドメインおよび/またはレポータードメインを含有する融合タンパク質であってよい。例えばGPCRのC末端もしくはN末端で、レポーターもしくはタグとGPCRとの間の融合体を作製するための方法は、当業者の技術の範囲内に明確に含まれているので(例、McLean et al, Mol. Pharma. Mol Pharmacol. 1999 56:1182−91;Ramsay et al., Br. J. Pharmacology, 2001, 315−323)、これ以上は説明しない。そのような融合タンパク質が、N末端メチオニン残基が欠失しているかもしくは代替アミノ酸と置換されているGPCRとインフレームで融合された異種N末端ドメイン(例、エピトープタグ)を含有していてよいことは明示的に企図されている。目的のポリペプチドは最初に天然ポリペプチドから作製して、次に上述した適切なレポーター/タグへ作動可能に連結させることができることは理解されている。
【0066】
本核酸は、さらにまた通例は嗅覚GPCRをコードする核酸の構築を促進するために、制限部位、多重クローニング部位、プライマー結合部位、ライゲーション可能な末端、組換え部位なども含有していてよい。
【0067】
嗅覚GPCRは目的のポリペプチドのライブラリーのメンバーであってよいので、そのような目的のポリペプチドをコードする核酸は、類似サイズの嗅覚GPCRをコードする核酸のライブラリーであってもよい。
【0068】
(宿主細胞)
本明細書に記載した方法は、一般に培養大グリア細胞(すなわち、インビトロで培養された初代もしくは不死大グリア細胞)中で嗅覚GPCRを産生する工程を含んでいる。「大グリア細胞」は、シュヴァン細胞、希突起膠細胞および星状細胞ならびにそれらの誘導体を含む、様々なニューロン関連細胞タイプの任意の細胞を意味する。多数の実施形態では、適切な宿主細胞は、神経軸索の鞘を形成する物質であるミエリンを産生する「ミエリン産生」細胞であってよい。ミエリン産生大グリア細胞には、シュヴァン細胞、希突起膠細胞、ならびにミエリンを産生する所定タイプの星状細胞(例、嗅神経鞘細胞(olfactory sheathing cell))が含まれる。ミエリン産生細胞は、通常は、それらがミエリンの構成要素であるガラクトセレブロシド、galCを合成することによって同定できる。
【0069】
用語「大グリア細胞」には、さらにまた癌性大グリア細胞、例えば神経鞘腫、神経線維腫、星状細胞腫細胞、および希突起膠細胞腫;不死性大グリア細胞、例えばHPV E6−E7、T抗原などの適切な腫瘍遺伝子の導入によって不死化された細胞など;大グリア細胞が相違する(非大グリア細胞)もしくは同様の(大グリア細胞)タイプの細胞と融合される細胞融合によって産生されたハイブリッド細胞;ならびに例えば外因性核酸を含有している細胞のような組換え大グリア細胞、または例えばミエリンの合成のために必要とされる遺伝子もしくはミエリンの合成を阻害する遺伝子などの内因性遺伝子内での「ノックアウト」を含む大グリア細胞の改変バージョンが含まれる。大グリア細胞は、通例は齧歯類(例、マウス)もしくはヒトなどの哺乳動物種由来である。代表的な非限定的細胞系には、RN2およびEJ(Coulter−Mackie, Virus Research 1:477−487, 1984)、RN22(Kreider, Brain Research 397:238−244, 1986)、ならびにHOGおよびMO3.13(Buntinx, Journal of Neurocytology 32:25−38, 2003)が含まれる。嗅覚GPCR以外についての大グリア細胞組換え体は、用語「大グリア細胞」に含まれることが明示的に企図されている。
【0070】
したがって、大グリア細胞を培養する方法は当技術分野においてよく知られているので(例えば、Mosahebi Glia, 34:8−17, 2001;Shen, Microsurgery 19:356−63, 1999;Acta Neuropathol (Berl), 78:317−24, 1989;Barnett, Developmental Biology, 155:337−350, 1993;およびHung et al, International Journal of Oncology 20:475−482, 2002を参照されたい)、不死化HEI193細胞などを含む嗅覚GPCRを産生するために多種多様な適切な宿主細胞を利用できる。
【0071】
詳細には、シュヴァン細胞は次の方法を用いて培養することができる:Hung, (Int. J. Oncol. 20:475−82, 2002);Hung, (Int. J. Oncol. 1999 14:409−15);Wood, (Brain Res. 115:361−75, 1976);Wood, (Ann. N.Y. Acad. Sci. 605:1−14, 1990);およびBrockes, (J. Exp. Biol. Dec;95:215−30, 1981)。
【0072】
追加の細胞系は当業者には明白になるであろう、そしてアメリカンタイプカルチャーコレクション(10801 University Boulevard、バージニア州マナッサス20110−2209)から入手できる。
【0073】
(方法)
一般に本方法によると、嗅覚GPCR発現カセットがインビトロで大グリア細胞中に導入され、その細胞は嗅覚GPCRを発現させるために適する条件に曝され、そしてGPCRは細胞内で発現して、細胞表面へ輸送される。
【0074】
したがって、大多数の実施形態では、発現カセットは、ウイルス感染、トランスフェクション、接合、プロトプラスト融合、エレクトロポレーション、リン酸カルシウム沈降、直接マイクロインジェクションなどを含む様々な方法を用いて宿主細胞中へ導入されてよい。方法の選択は、一般に形質転換される細胞のタイプおよび形質転換が発生させられる状況(例、インビトロなど)に依存する。これらの方法についての一般的考察は、Ausubel, et al, Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995の中に見いだすことができる。
【0075】
細胞中へ嗅覚GPCRの発現カセットを導入した後、細胞は、典型的にはポリペプチド発現を生じさせるためにインキュベートされる。これを実施するために、細胞は12〜24時間、24〜48時間、または48〜96時間以上にわたり適切な培地中でインキュベートすることができる。ポリペプチドの一過性発現は、この方法で実施されてよい。これは明示的に企図されているが、しかしポリペプチドの発現はまたは安定性であってもよい。安定性トランスフェクションでは、発現カセットは選択可能なマーカー遺伝子を含有しており、ポリペプチドを発現する安定性細胞系の樹立は選択可能なマーカー遺伝子のための選択を含んでいる。2つの発現カセットが1つの細胞中に導入された場合は、2つの発現カセットは通常は相違する2つの選択可能なマーカー遺伝子(例、ネオマイシン耐性遺伝子およびハイグロマイシン耐性遺伝子)を含有している。一過性および安定性トランスフェクションの方法は、当業者にはよく公知である。
【0076】
嗅覚GPCRは大グリア細胞中で産生され、そして通常は、GPCRが原形質膜中に存在するように細胞表面へ輸送される。
【0077】
(組成物)
また別の局面では、本発明は生物活性嗅覚GPCRを産生する大グリア細胞を提供する。そのような細胞は、通常は嗅覚GPCRをコードする組換え核酸を含有しており、そして通常はその細胞(すなわち、組換え核酸の不在下の大グリア細胞)中で産生しない嗅覚GPCRを産生することができる。
【0078】
上述したように、本発明は、通常はGPCRに特徴的な方法で細胞の原形質膜にわたる大グリア細胞の表面で存在する(すなわち、検出可能に存在する)嗅覚GPCRを含有する大グリア細胞を提供する。したがって、本細胞は、それらがリガンドに結合できる、そして存在する場合は適切なGタンパク質を介してシグナルを伝達することができる点で「活性」嗅覚GPCRを含有している。そこで本細胞は、例えば以下で詳細に説明するスクリーニングアッセイなどの活性アッセイにおいて利用される。
【0079】
本細胞は、通常はその中に同一発現カセットが産生させられている例えばNIH−3T3細胞、COS細胞などのような非大グリア細胞のようなコントロール細胞のレベルより有意に高いレベルで嗅覚GPCRを産生する。大多数の実施形態では、本細胞は、モルベースで、コントロール細胞より少なくとも5×(「5倍」)、少なくとも10×、少なくとも50×、少なくとも100×、通常は少なくとも1,000×以上までのより多くの嗅覚GPCRを産生する。特定の実施形態では、本細胞は、モルベースで、コントロール細胞より少なくとも5×(「5倍」)、少なくとも10×、少なくとも50×、少なくとも100×、通常は少なくとも1,000×以上までのより多くの嗅覚GPCRを細胞表面で産生する(例えば、免疫細胞化学的方法またはフローサイトメトリーによって決定した場合に)。本細胞が液体培地中で増殖させられる場合は、それらは通常、例えば10μg/L超、100μg/L超、1mg/L超、10mg/L超もしくは約50mg/L以上の有意な量で嗅覚GPCRを産生する。特に、本細胞が液体培地中で増殖させられる場合は、それらは通常、例えば10μg/L超、100μg/L超、1mg/L超、10mg/L超もしくは約50mg/L以上の有意な量で細胞表面嗅覚GPCRを産生する。
【0080】
多数の様々な嗅覚GPCRがあるので、本発明は様々な嗅覚GPCRをコードする対応する複数の組換え核酸を含有する複数の大グリア細胞(すなわち、大グリア細胞のライブラリー)も提供する。これらの実施形態では、複数のうちの各大グリア細胞は、通常は単一嗅覚GPCRのための組換え核酸を含有しており、そして各細胞は相違する核酸を含有する。したがって、本発明は大グリア細胞のライブラリーを提供するが、それらの細胞は2以上、5以上、約10以上、約20以上、約50以上、約100以上、約200以上、約300以上、約500以上、約1,000以上の相違する嗅覚GPCRをコードする組換え核酸を含有している。嗅覚GPCRは、正体が既知かもしくは正体が未知の嗅覚GPCR、またはそれらの混合物であってよい。嗅覚GPCRは、単一種の動物由来であってよい、または2種、約5種まで、約10種まで、約50種まで、約100種まで、もしくは約1,000種までの動物由来のものであってよい。特定の実施形態では、嗅覚GPCRはヒトのものである。
【0081】
(キット)
本発明によって、さらにまた上述した本方法を実行するためのキットも提供される。本キットは、大グリア細胞、嗅覚GPCRをコードする核酸および嗅覚GPCRを含有する大グリア細胞のうちの1つ以上を少なくとも含んでいる。本キットの核酸は、他のプラスミド内へのライゲーションを促進するために制限部位、複数のクローニング部位、プライマー部位なども有してもよい。キットのその他のオプション構成要素には、本アッセイを実行するための、培養培地、GPCR活性を試験するための構成要素、およびGタンパク質をコードする核酸などが含まれる。本キットの様々な構成要素は個別容器中に存在していてよい、または必要に応じて特定の適合する構成要素が単一容器中で事前に合わされていてよい。
【0082】
上述の構成要素に加えて、本キットは、典型的には例えば嗅覚GPCRを産生する方法などの本方法を実行するためにキットの構成要素を使用するための指示書をさらに含んでいる。本方法を実行するための指示書は,一般には適切な記録媒体上に記録されている。例えば、指示書は紙もしくはプラスチックなどの基材上に印刷されてよい。したがって、指示書は、キットもしくはその構成要素の容器のラベル表示(すなわち、パッケージングもしくはサブパッケージングと結び付けて)などにおいて包装添付文書としてキット内に存在してよい。他の実施形態では、指示書は例えばCD−ROM、ディスクなどのような適切なコンピュータ可読記憶媒体上に存在する電子記憶データファイルとして存在する。また別の実施形態では、キット内に実際的な指示書は存在しないが、例えばインターネットを介して遠隔起源から指示書を入手するための手段が提供される。この実施形態の例は、指示書を見ることができる、および/またはそれから指示書をダウンロードすることのできるウェブのアドレスを含んでいるキットである。指示書と同様に、指示書を入手するためのこの手段は適切な基材上に記録されている。
【0083】
(嗅覚GPCR活性の調節因子を同定するための方法)
本発明は、嗅覚GPCR調節因子(すなわち、目的の嗅覚GPCRの活性を増加もしくは減少させる化合物)をスクリーニングする方法を提供する。特定の実施形態では、嗅覚GPCR調節因子は、アゴニスト、部分アゴニスト、インバースアゴニスト、およびアンタゴニストからなる群から選択される。一般に、本方法は、上述した方法によって生物活性嗅覚GPCRを産生する大グリア細胞(本明細書では「本大グリア細胞」と称する)を提供するために大グリア細胞中で嗅覚GPCRを産生する工程と、該細胞を候補因子と接触させる工程と、嗅覚GPCRの活性へ及ぼす候補因子の作用を評価する工程と、を含んでいる。
【0084】
他の実施形態では、嗅覚GPCRの調節因子(例、そのGPCRに対する天然もしくは合成リガンド)を、そのGPCRを産生する大グリア細胞と接触させることができ、そしてその調節因子が嗅覚GPCRの活性に及ぼす作用を評価することができる。さらにまた、2種の嗅覚GPCR調節因子、例えば嗅覚GPCRの活性化因子(例、そのGPCRに対するリガンド)およびその活性化因子の調節活性を遮断する物質を用いて実施されるアッセイも予期されている。
【0085】
当技術分野において公知のように、本アッセイは、例えば35S GTPγSを用いる膜結合アッセイ、アデニリルシクラーゼアッセイ(例、New England Nuclear社製のFLASH PLATETMアデニリルシクラーゼキット;カタログ番号SMP004Aを用いて)、細胞ベースcAMPアッセイ、レポーターベースアッセイ、AP1レポーターアッセイ、SRF−LUCレポーターアッセイ、細胞内IP3蓄積アッセイ、細胞内カルシウム濃度を測定するための蛍光測定イメージングプレートリーダー(FLIPR)アッセイなどの様々な方法を用いて実施することができる。
【0086】
調節因子が嗅覚GPCR活性を増加させる実施形態では、嗅覚GPCRの活性は、調節因子の存在下では、その因子の不在下における適切なコントロールに比較して、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約50%、少なくとも約80%、少なくとも約100%、少なくとも約500%、または少なくとも約10倍以上まで上昇する。適切なコントロールは、GPCRに対する天然リガンドの存在下もしくは不在下にあってよい。
【0087】
調節因子が嗅覚GPCR活性を減少させる実施形態では、嗅覚GPCRの活性は、調節因子の存在下では、その因子の不在下における適切なコントロールに比較して、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約50%、少なくとも約70%、少なくとも約80%、少なくとも約90%、または少なくとも約95%以上まで減少する。適切なコントロールは、GPCRに対する天然リガンドの存在下もしくは不在下にあってよい。
【0088】
特定の実施形態では、これらの方法は、試験化合物、例えば候補因子の存在下もしくは不在下でGPCR活性を測定する工程もまた含んでいる。これらのアッセイは、単離した本大グリア細胞(例、培養細胞)、本大グリア細胞から単離した膜、本大グリア細胞の抽出物を該GPCRの活性を調節するために有効な量のGPCR調節因子と接触させる工程を含んでいることがある。
【0089】
したがって、本発明は、リガンド、例えばそのGPCRに対する天然リガンドの存在下もしくは不在下で嗅覚GPCRの活性を減少させるための嗅覚GPCR活性の阻害剤、およびGPCR活性の誘導因子を提供するが、このときGPCRはそのGPCRの天然リガンドである、もしくは天然リガンドではない化合物によって誘導される。
【0090】
特定の実施形態では、GPCR活性はレポーターシグナルを評価することによって測定できる。これらの実施形態では、アッセイはハイスループットアッセイのために適切なフォーマット、例えば96もしくは384ウェルフォーマットで実施することができ、そして適切なロボット(例、ピペッティングロボット)および器具類(レポーター活性を決定するための96および384ウェルフォーマットの照度計もしくは蛍光リーダー)を使用できる。具体的に例示するためで限定するためではなく、レポーター活性を決定することは、Wallac 1450 Microbetaカウンター(Perkin−Elmer社製)またはCCDカメラを使用する照度計を使用できる。
【0091】
関連実施形態では、本アッセイは、候補因子の嗅覚GPCRへの結合が評価される結合アッセイであってよい。これらの実施形態では、候補因子は通常最初に標識され、本大グリア細胞と接触させられ、そして候補因子の大グリア細胞への結合が評価される。
【0092】
(候補因子)
多種多様な試験化合物は、上記の方法によってスクリーニングすることができる。試験化合物は極めて多数の化学物質のクラスを含んでいるが、典型的にはそれらは有機分子、好ましくは小さい有機化合物である(すなわち、50ダルトンより大きく、かつ約2,500ダルトン未満(例、100〜1,000Da、通常は約500Da未満)の分子量を有する化合物)。試験化合物は、タンパク質との構造的相互作用、詳細には水素結合のために必要な官能基を含んでおり、そして典型的には少なくとも1つのアミン、カルボニル、ヒドロキシルもしくはカルボキシル基、好ましくは化学官能基のうちの少なくとも2つを含んでいる。試験化合物は、しばしば環状炭素もしくは複素環の構造および/または上述した官能基の1つ以上で置換された芳香環もしくは多環芳香環構造を含んでいる。代表的および非限定的試験化合物は、脂肪族系酸、アルコール、ケトン、およびエステル;芳香環、脂環、多環および複素環の構造を備える化学物質;およびこれらのタイプ各々の無数の置換化学物質、ならびにそれらの組み合わせを含んでいる。試験化合物は、さらにまたペプチド、糖類、脂肪酸、ステロイド、プリン、ピリミジン、誘導体、構造的アナログもしくはそれらの組み合わせを含む生体分子間でも見いだされる。さらにまた別の試験化合物は、GPCRの天然リガンドの改変体を含んでいる。
【0093】
試験化合物は、合成もしくは天然化合物のライブラリーを含む極めて広範囲の起源から入手できる。例えば、ランダム化オリゴヌクレオチドおよびオリゴペプチドの発現を含む、広範囲の有機化合物および生体分子のランダム合成および指向性合成のために極めて多数の手段を利用することができる。あるいは、細菌、真菌、植物および動物抽出物の形状にある天然化合物のライブラリーを利用できる、または容易に産生できる。ライブラリーは、ニオイと結び付けられた天然または合成生成化合物を優先的に含んでいる可能性がある。さらに、天然もしくは合成生成ライブラリーおよび化合物は、従来型の化学的、物理的および生化学的手段を通して容易に改変され、コンビナトリアルライブラリーを生成するために使用できる。既知の薬理学的物質は、アシル化、アルキル化、エステル化、アミド化などのような構造的アナログを産生するための指向性もしくはランダム化学修飾に曝すことができる。
【0094】
関心対象であるのは、ポリペプチド、例えばタンパク質様物質である試験化合物である。目的の特定タイプのポリペプチド試験化合物は、GPCRに対する抗体、またはそれらのGPCR結合フラグメントである。この抗体はモノクローナルもしくはポリクローナルであってよく、当技術分野において公知の方法によって産生することができる。また別の試験化合物は、既知の天然リガンドのあるGPCRについては、例えば少なくとも1つのアミノ酸の置換、欠失もしくは付加によって変化させられているかまたは化学修飾された天然リガンドである、GCPRの天然リガンドの改変体を含んでいる。特定の実施形態では、試験化合物はGPCRのリガンドであるとは知られていない内因性ポリペプチドを含んでいる。
【0095】
試験化合物の上記の特性解析は、例示するためで限定的ではないことが企図されている。
【0096】
(嗅覚GPCRのリガンドとしての候補因子を同定する方法)
嗅覚GPCRのリガンドは、候補因子と嗅覚GPCRとを接触させる工程と、候補因子が嗅覚GPCRへ結合するかどうかを決定する工程とによって同定できるが、このとき前記結合は候補因子が嗅覚GPCRのリガンドであるという指標となる。特定の実施形態では、候補因子は標識することができる。特定の実施形態では、候補因子は放射標識することができる。
【0097】
本候補因子内に組み込むことができる適切な放射性核種は、2H(ジュウテリウム)、3H(トリチウム)、11C、13C、14C、13N、15N、15O、17O、18O、18F、35S、36Cl、82Br、75Br、76Br、77Br、123I、124I、125Iおよび131Iを含むがそれらに限定されない。3H、14C、82Br、125I、131I、35Sの組込みは、概して最も有用な可能性がある。
【0098】
放射性同位体を有機化合物内に組み込むための合成方法は、本候補因子に適用することができ、当技術分野において周知である。これらの合成方法、例えば標的分子内への活性レベルのトリチウムの組込みは下記のとおりである:
A. トリチウムガスを用いた触媒還元 − この手順は、通常は高比活性生成物を産生し、ハロゲン化もしくは未飽和前駆物質を必要とする。
B. 水素化ホウ素ナトリウム[3H]を用いた還元 − この手順は余り費用がかからず、アルデヒド、ケトン、ラクトン、エステルなどの還元性官能基を含有する前駆物質を必要とする。
C. 水素化アルミニウムリチウム[3H]を用いた還元 − この手順は、ほぼ理論的比活性で生成物を提供する。これもまた、アルデヒド、ケトン、ラクトン、エステルなどの還元性官能基を含有する前駆物質を必要とする。
D. トリチウムガス曝露による標識化 − この手順は、適切な触媒の存在下で置換可能な陽子を含有する前駆物質をトリチウムガスへ曝露させることを含んでいる。
E. ヨウ化メチル[3H]を用いたN−メチル化 − この手順は、高比活性ヨウ化メチル(3H)を用いて適切な前駆物質を処理することによって、通常はO−メチルもしくはN−メチル(3H)生成物を調製するために使用される。この方法は、一般に例えば約70〜90Ci/mmolなどのより高い比活性を可能にする。
【0099】
125Iの活性レベルを標的分子中へ組み込むための合成方法は下記を含んでいる:
A. サンドマイヤー(Sandmeyer)および類似反応 − この手順はアリールもしくはヘテロアリールアミンをテトラフルオロホウ酸塩などのジアゾニウム塩へ、そして引き続きNa125Iを用いて125I標識化合物へ転換させる。代表的な手順は、Zhu,D.−G. and co−workers、J. Org Chem.2002,67,943−948によって報告された。
B. フェノールのオルト125ヨウ素化 − この手順はCollier, T. L. and co−workers、J. Labeled Compd Radiopharm.1999,42,S264−S266.によって報告されたように、フェノールのオルト位置での125Iの組込みを可能にする。
C. 125Iを用いたアリールおよびヘテロアリールブロミドの置換 − この方法は、一般に2段階プロセスである。第1工程は、例えばPd触媒反応[すなわち、Pd(Ph3P)4]を用いて、またはトリ−アルキルスズハライドもしくはヘキサアルキルジスズ[例、(CH3)3SnSn(CH3)3]の存在下でアリールもしくはヘテロアリールリチウムを通しての、アリールもしくはヘテロアリールブロミドから対応するトリーアルキルスズ中間物への変換である。代表的な手順は、Bas, M.−D. and co−workers、J. Labeled Compd Radiopharm.2001,44,S280−S282によって報告された。
【0100】
嗅覚GPCRのリガンドは、あるいはまた嗅覚GPCRの標識した既知のリガンドの存在下で候補因子と嗅覚GPCRとを接触させることによって同定できるが、このとき候補因子の存在下での標識した既知のリガンドの結合の減少は候補因子が嗅覚GPCRのリガンドであるという指標である。
【0101】
(臭気物質ミメティックを同定するための方法)
本発明はさらにまた、臭気物質ミメティックを同定する方法を提供するが、このときミメティックは特定臭気物質と類似の、実質的に同様もしくは同一の機能的特徴を有するが、該臭気物質とは相違する化学構造を有する合成もしくは天然化合物である。言い換えると、本発明は目的の臭気物質と同一の「ニオイがする」が、目的の臭気物質と同一の化学構造を有していない臭気物質ミメティックを同定する方法を提供する。一般に、これらの方法は、上述した方法を用いて1ライブラリーの嗅覚GPCRを産生する工程と、目的の臭気物質によって活性化される1セットの嗅覚GPCRを同定する工程と、および同一セットの嗅覚GPCRを活性化する物質を同定するために該ライブラリーの嗅覚GPCRを候補因子と接触させる工程と、を含んでいる。大多数の実施形態では、目的の臭気物質と同一セットの嗅覚GPCRを活性化する因子は目的の臭気物質のミメティックである、すなわち目的の臭気物質と類似の臭気を有しているはずである。
【0102】
したがって、これらの方法は、上述した方法を用いて通常はライブラリー(例、100以上、200以上、300以上、400以上、500以上、600以上、通常は約1,000以上まで)の様々な嗅覚GPCRを産生する工程と、およびそれらが目的の臭気物質、例えば所望のニオイもしくは味覚を有する既知もしくは未知の化学構造の化合物によって活性化されるかどうかを決定するためにGPCRを評価する工程と、を含んでいる。多数の実施形態では、目的の臭気物質は1セットの嗅覚GPCRを活性化するであろうが、このとき1セットは通常2〜50、2〜20または3〜10種のメンバーを含有する。単一臭気物質によって活性化された嗅覚GPCRのセットは「GPCRフィンガープリント」を提供するが、このとき単一臭気物質はそれが活性化する嗅覚GPCRのセットによって規定される。目的の臭気物質に対するミメティックは、目的の臭気物質と同一もしくはほぼ同一のGPCRフィンガープリントを有する因子を同定するために候補因子のライブラリーをスクリーニングすることによって同定することができる。
【0103】
例えば、臭気物質ミメティックは、目的の臭気物質のフィンガープリントに類似する、例えば該ミメティックは該臭気物質によって活性化された場合のGPCRまたはGPCR活性の約60%、約75%、約80%、約90%、約95%のGPCRを活性化する、活性化GPCRの「フィンガープリント」を有すると同定できる。
【0104】
したがって、目的の臭気物質のミメティックを同定できる。
【0105】
(バイオセンシング法)
本発明は、バイオセンサーをさらに提供するが、このときバイオセンサーは、典型的には複数の相違する嗅覚GPCRを産生する複数の大グリア細胞である。多数の実施形態では、細胞はアドレス指定可能なフォーマットで配列されるが、このときそのアレイの各アドレスは単一組換え嗅覚GPCRを産生する大グリア細胞を含有している。典型的には、前記複数は2以上、5以上、約10以上、約20以上、約50以上、約100以上、約200以上、約300以上、約500以上、約1,000以上、または約10,000以上まででさえあってよい。このためバイオセンサーは、約5、約10、約20、約30以上、約50以上、約100以上、約200以上、通常は約500以上まで、通常は約1,000以上までの組換え嗅覚GPCRを含有していてよい。嗅覚GPCRは、正体が既知の、もしくは正体が知られていない嗅覚GPCR、またはそれらの混合物であってよい。嗅覚GPCRは、単一種の動物由来であってよい、または2種、約5種まで、約10種まで、約50種まで、約100種まで、もしくは約1,000種までの動物由来であってよい。特定の実施形態では、嗅覚GPCRはヒトのものである。
【0106】
本明細書に記載した方法は、単一組換え嗅覚GPCRを産生する前記大グリア細胞を「親和性基材」へ結合させることを含んでいる。特定の実施形態では、前記親和性基材はアドレス指定可能である。特定の実施形態では、前記アドレス指定可能な親和性基材は空間的にアドレス指定可能である。親和性基材は固体、半固体、もしくは不溶性支持体を含有しており、前記組換え大グリア細胞の結合のために適切な任意の材料から製造され、使用された検出方法を妨害しない。当業者には理解されるように、可能な親和性基材の数は極めて多い。可能な基材には、ガラスまたは改変されたガラスかまたは機能化ガラス、プラスチック(アクリル、ポリスチレンおよびスチレンと他の物質とのコポリマー、ポリプロピレン、ポリエチレン、ポリブチレン、ポリウレタン、Teflonなどを含む)、多糖類、ナイロンもしくはニトロセルロース、樹脂、ケイ素またはシリコンもしくは改変シリコンを含むケイ素に基づく物質、炭素、金属、無機ガラス、プラスチック、セラミックおよび多種多様な他のポリマーが含まれるが、それらに限定されない。好ましい実施形態では、基材は光学的検出を許容するが、それら自体は感知できるほど蛍光を発することも発光することもない。さらに、当技術分野において公知のように、基材はデキストラン、アクリルアミド、ゼラチン、アガロース、ウシおよびその他の哺乳動物血清アルブミンを含むタンパク質などの生体適合性物質などのポリマーを含む任意の数の物質で被覆され得る。
【0107】
「空間的にアドレス指定可能な」親和性基材は、各領域が特定の事前に決定された場所(「アドレス」)にあるように、複数の別個の領域(例、複数の目的のポリペプチド結合領域)を有する。マルチウェルマイクロタイタープレートはアドレス指定可能であり(各ウェルが1つのアドレスを有する)、1アレイのキャピラリーカラムはアドレス指定可能であり、固体支持体(例、ナイロンもしくはニトロセルロース膜)上に配置された1アレイのサンプルはアドレス指定可能である。本明細書に記載の方法に使用するための親和性基材は、典型的には少なくとも4以上、少なくとも約12、少なくとも約24、少なくとも約48、少なくとも約96もしくは少なくとも約384のアドレス指定可能な領域を有する。特定の実施形態では、親和性基材は、ハイスループットアッセイのために適切なアドレス指定可能なフォーマットに、例えば24、48、96もしくは384ウェルフォーマットにある。
【0108】
そのようなマルチウェルフォーマットは、ロボット(例、ピペッティングロボット)、およびその他の器具類(レポーター活性の決定のための96もしくは384ウェルフォーマットの照度計(illuminator)もしくは蛍光リーダー)による使用のために適切である。具体的に例示するためであって限定するためではなく、レポーター活性はCCDカメラに基づく照度計を用いて測定できる。
【0109】
使用時には、そのようなバイオセンサーは通常はサンプルと接触させられ、そして組換え嗅覚GPCRの各々の活性化が評価される。目的の臭気物質の存在は、事前に決定された嗅覚GPCRのサブセットの活性化によって検出されるが、このとき事前に決定された嗅覚GPCRのサブセットは、その臭気物質の以前に決定された「GPCRフィンガープリント」に対応する。したがって、目的の臭気物質に対する事前に決定された嗅覚GPCRのサブセットが該サンプルによって活性化された場合は、目的の臭気物質が該サンプル内に存在する。
【0110】
また別の使用時には、そのようなバイオセンサーは通常は臭気物質と接触させられ、そして組換えGPCRの各々の活性化が評価される。その臭気物質に対する「フィンガープリント」の同定は、活性化された嗅覚GPCRのサブセットに基づいて指定される。前記の別の使用の変形では、前記接触させる工程は、バイオセンサーの嗅覚GPCRに対する1つ以上のアゴニストの存在下で、臭気物質へ「フィンガープリント」を指定するまた別の手段を表す、前記1つ以上のアゴニストの存在下で該臭気物質によって活性化されたGPCRのサブセットを用いて実施されてよい。アゴニスト、インバースアゴニストもしくはアンタゴニストの存在下で1つ以上の嗅覚GPCRの活性を臭気物質の「フィンガープリント」内へ組み込めることが企図されている。
【0111】
特定の実施形態では、GPCR活性化は、GPCR活性化の発光レポーターを用いて検出することができる。例えば、以下で説明するようなルシフェラーゼ/GFPに基づくアッセイ、またはその変形などの任意の発光レポーター(例、蛍光レポーターなど)アッセイをこれらのアッセイのために使用できる。
【0112】
特定の実施形態では、臭気物質への1つ以上の嗅覚GPCRの活性化は、例えば例示するためであり限定するためではなく事前に規定された最高応答の0〜10%、11〜25%、26〜50%、51〜75%、もしくは76〜100%のなどの特定レベルであるとスコア付けすることができる。臭気物質の「フィンガープリント」は、少なくとも一部には1つ以上の嗅覚GPCRの活性化のレベルによって決定され得ることが企図されている。
【0113】
したがって、本発明は、嗅覚GPCRを含有するアドレス指定可能な大グリア細胞のアレイを含有する発光バイオセンサーを提供するが、このとき目的の臭気物質は該バイオセンサーからの特定光パターンの発光によって検出することができる。
【0114】
特定の実施形態では、試験すべきサンプルは環境上の試験サンプル、例えばガス(呼吸可能な大気または起源もしくは組成が知られていないガスのサンプルなど)、液体(水または起源もしくは組成が知られていない液体のサンプルなど)、または任意の固体のサンプルである。
【0115】
上述したバイオセンサー法は、例えば、例えばニオイについての知識が犯罪の被疑者の逮捕を導くことのある犯罪現場;特定の化学物質、例えば生物学/化学戦物質が検出される可能性がある紛争地帯(例、戦場);例えば特定の汚染物質または望ましい、もしくは望ましくないニオイを検出できる食品材料;および望ましい、もしくは望ましくない嗅覚感覚のどちらかへの特定の嗅覚GPCRもしくは特定サブセットの嗅覚GPCRの合理的指定において;および有害化学物質を監視することが望ましい研究所において;および一般に、目的の臭気物質を監視もしくは検出することが望ましい任意の状況において特に利用される。
【0116】
目的の臭気物質は、一般にヒト嗅覚系の嗅覚GPCRによって検出できる任意の化合物、例えばニオイを嗅ぐことによって検出できる任意の化合物を含んでいる。臭気物質は、精製化合物の場合がある、または(例えば、複雑な組成の)未精製化合物の場合がある。そのような臭気物質は、脂肪族系酸、アルコール、ケトン、およびエステル;芳香環、脂環、多環および複素環の構造を備える化学物質;およびこれらのタイプ各々の無数の置換化学物質、ならびにそれらの組み合わせを含むがそれらに限定されない。
【0117】
(有用性)
嗅覚GPCRを産生する本方法は、特に食品および芳香剤に関連する様々な研究および産業上の用途において利用される。
【0118】
多くの用途では、製品、例えば食品もしくは芳香剤を改良する、すなわち必要に応じて、上述した方法を用いて同定された嗅覚GPCR調節因子の添加によって、幾分望ましいものにすることができる。一般に、そのような調節因子は、通常は例えば食品材料または香水などの芳香剤のような製品と、それらの製品の味もしくはニオイを改良するために混合される。多数の実施形態では、調節因子は嗅覚GPCR活性の阻害剤であってよく、このために不愉快な味もしくはニオイを「マスキング」することができる。他の実施形態では、調節因子は特定の嗅覚GPCRの活性因子であってよく、そしてそれが添加される物質にとっての新しい香味料もしくは芳香剤を改善もしくは添加するために使用できる。他の実施形態では、調節因子は特定の嗅覚GPCRの活性因子であってよく、殺虫剤の有効性を改良するために使用できる。特定の実施形態では、毒物および医薬品などの一部の製品のニオイをそれらが間違って消費されないように望ましくないようにすることが有益である。この場合には、不愉快なニオイを提供する物質は上述した方法によって見いだし、そしてそれらの製品へ添加することができる。
【0119】
他の用途では、望ましい臭気物質(例、ある種の珍しい花から入手され、現代の多数の香水のための出発物質として使用される臭気物質)を提供する費用は、上述した方法を用いてその臭気物質のミメティックを同定することによって減少させることができる。そのような実施形態では、これらのミメティックは望ましい臭気物質より実質的に低い価格で製造することができ、そして例えば香水などの製品中に望ましい臭気物質を補給するか、または置換するために使用できる。
【0120】
他の用途では、個体によって生成された特定臭気物質の検出は、疾患もしくは障害に関連するので診断的もしくは予後的価値を有する可能性があり、このとき特定臭気物質の上昇もしくは減少は前記疾患もしくは障害と関連付けられている。
【0121】
当然ながら、上述した方法を用いて入手された嗅覚GPCR調節因子を様々な個体に投与することができる。一般に、そのような個体は哺乳動物もしくは哺乳類であり、このときこれらの用語は食肉目(例、イヌおよびネコ)、齧歯目(例、マウス、モルモット、およびラット)、および霊長目(例、ヒト、チンパンジー、およびサル)、ならびに例えばウシ、ヒツジ、ブタおよびウマなどの産業上重要な哺乳動物を含む哺乳綱に含まれる生物体を記載するために広範囲に使用されている。非哺乳類動物にもまた上述した方法を用いて入手された嗅覚GPCR調節因子を投与することができることが企図される。代表的および非限定的非哺乳類動物には、鳥類(例、ニワトリ)、爬虫類、魚類、節足動物、および昆虫類(例、カ、アリ、アブラムシ、カブトムシ、ハエ、スズメバチ、ミツバチ、クモ、あるいはヒトもしくは非ヒト動物へ疾患を伝播する、または農作物もしくは観賞用植物に対する損害を引き起こす任意の昆虫)が含まれる。多数の実施形態では、個体はヒトであろう。
【実施例】
【0122】
下記の実施例は、当業者に本発明の作製および使用方法についての完全な開示および説明を提供できるように記載するが、本発明者らが発明と見なしている範囲を限定することを企図しておらず、下記の実験が実施された実験のすべてである、またはそれらだけが実施された実験であることを表すことも企図していない。
【0123】
本発明はその特定の実施形態を参照しながら説明してきたが、当業者には、本発明の真の精神および範囲から逸脱せずに、様々な変更を加えたり、同等物を置換したりできることが理解されるはずである。さらに、本発明の目的、精神および範囲に、特定の状況、材料、組成物、工程、1つ以上の工程を適合させるために多数の改変を加えることができる。すべてのそのような改変は、本発明の範囲内にあることが企図されている。
【0124】
(実施例1:シュヴァン細胞中での嗅覚GPCRの発現)
初代ラットシュヴァン細胞の単離:
シュヴァン細胞の調製は以前に記載されたとおりに実施した(例、Hung, Int. J. Oncol. 20:475−82, 2002;Hung, Int. J. Oncol. 1999 14:409−15;Wood, Brain Res. 115:361−75, 1976;Wood, Ann. N.Y. Acad. Sci. 605:1−14, 1990;およびBrockes, J. Exp. Biol. Dec;95:215−30, 1981など)。手短には、P1ラット新生児由来の坐骨神経を採取し、10%熱不活化ウシ胎児血清を補給したダルベッコの改変イーグル培地中で細胞を維持した。2μMフォルスコリンおよびウシ下垂体抽出物(Sigma社製)を用いてシュヴァン細胞を拡張(expand)させた。第3継代まで細胞を増殖させ、保管するために冷凍した。
【0125】
嗅覚GPCRの一過性トランスフェクション:
第5継代のシュヴァン細胞を1ウェル当たり8×104細胞でポリ−D−リジンを被覆した8ウェルチャンバースライド(Falcon社製)上に蒔いた。Fugene 6試薬(Roche社製)およびOptimem血清無含有培地(Invitrogen社製)を用いて、0.5μgの嗅覚GPCR発現プラスミドによりシュヴァン細胞をトランスフェクトした。トランスフェクトした細胞は、4時間にわたり37℃の5% CO2加湿インキュベーター内で維持した。PBSを用いて細胞を洗浄し、新鮮増殖培地と取り換えた。24時間後、細胞を発現についてアッセイした。
【0126】
HA染色によって決定した嗅覚GPCRの発現分析:
PBSCM(PBS+0.5mM Ca2++1mM MgCl2)を用いてトランスフェクトした細胞を洗浄し、4%ホルマリンを用いて固定した。50mM NH4Cl/PBSCMを用いて細胞をクエンチし、2回洗浄した。一次抗体抗マウスHA(Roche社製)をブロッキングバッファー(トリトンなしのPBSCM中の2% BSA)中で1:1,000に希釈し、細胞上に1時間放置した。PBSCMを用いて3回洗浄した後、二次抗体(Alexa 488結合体化ロバ抗マウスIgG)1:2,000およびDAPI 1:2,000は暗所で30分間にわたり細胞上に放置した。細胞はPBSCMを用いて3回洗浄し、フルオロセーブ(flourosave)(Calbiochem社製)を被覆してカバースリップを被せた。細胞は適切なUVフィルターによって分析した。
【0127】
それらの表面上で嗅覚GPCRを産生する細胞が観察された(図1を参照)。
【0128】
(実施例2:GPCR活性化のアッセイ)
受容体の発現:
大グリア細胞の一過性トランスフェクションは初代ラットシュヴァン細胞について実施例1に記載したとおりに実施できる。大グリア細胞系の安定性トランスフェクションは、本明細書に記載したとおりに実施できる。
【0129】
約12×106個の大グリア細胞を15cm組織培養プレート上に蒔き、10%ウシ胎児血清および1%ピルビン酸ナトリウム、L−グルタミン、および抗生物質を含有するDME高グルコース培地中で増殖させる。大グリア細胞を蒔いた24時間後(または約80%のコンフルエンシーまで)、12μgのDNAを用いて細胞をトランスフェクトする。12μgのDNAを60μLのリポフェクトアミンおよび血清を含有していない2mLのDME高グルコース培地と合わせる。プレートから培地を吸引し、血清を含有しない培地を用いて細胞を1回洗浄する。DNA、リポフェクトアミン、および培地混合物を、血清を含有しない10mLの培地と一緒にプレートへ添加する。37℃で4〜5時間インキュベートした後、培地を吸引し、血清を含有する培地25mLを添加する。トランスフェクションの24時間後、培地を再び吸引し、血清を含有する新鮮培地を添加する。トランスフェクションの48時間後、培地を吸引し、最終濃度500μg/mLで、ジェネティシン(G418薬)を含有する血清含有培地を添加する。トランスフェクトした細胞を、今度はG418耐性遺伝子を含有する陽性トランスフェクト細胞についての選択を受けさせる。培地は、選択が発生すると4〜5日間毎に取り換える。選択中、安定性プールを作製するために細胞を増殖させるかまたは安定性クローン選択のために細胞を分割する。
【0130】
膜結合アッセイ:
[35S]GTPγSアッセイ:Gタンパク質共役受容体がリガンド結合または構成性活性化のいずれかの結果として活性状態にある場合は、受容体はGタンパク質に共役し、GDPの放出およびそれに続くGTPのGタンパク質への結合を刺激する。Gタンパク質受容体複合体のαサブユニットはGTPaseとして機能し、GTPからGDPへ緩徐に加水分解し、その時点で受容体は通常不活性化される。活性化された受容体は、GTPをGDPに置換し続ける。非加水分解性GTPアナログである[35S]GTPγSを利用すると、活性化受容体を発現する膜への[35S]GTPγSの強化された結合を証明することができる。活性化を測定するために[35S]GTPγS結合を使用することの長所は:(a)これが一般にすべてのGタンパク質共役受容体へ適用できること;
(b)これは膜表面の近位に存在するので細胞内カスケードに影響を及ぼす分子を取り上げる可能性を低くさせることである。
【0131】
本アッセイは、Gタンパク質共役受容体が関連受容体を発現する膜への[35S]GTPγS結合を刺激する能力を利用する。このため本アッセイは、内因性GPCRおよび非内因性の構成的に活性化されたGPCRについて候補化合物をスクリーニングするために直接同定方法において使用できる。本アッセイは一般的であり、すべてのGタンパク質共役受容体での新薬発見に適用される。
【0132】
[35S]GTPγSアッセイは20mM HEPES、1〜約20mM MgCl2(この量は結果を最適化するために調整できるが、20mMが好ましい)pH7.4、約0.3〜約1.2nM[35S]GTPγS(この量は結果を最適化するために調整できるが、1.2が好ましい)および12.5〜75μg膜タンパク質(この量は最適化するために調整できる)を備える結合バッファーおよび10μM GDP(この量は最適化するために変更できる)中で1時間にわたりインキュベートする。コムギ胚芽凝集素ビーズ(25μL;Amersham社製)を次に添加し、この混合物を室温でさらに30分間インキュベートする。これらのチューブを次に室温で5分間、1500×gで遠心し、シンチレーションカウンターで計数する。
【0133】
アデニリルシクラーゼ
細胞ベースアッセイのために設計されたFlash PlateTMアデニリルシクラーゼキット(New England Nuclear社製;カタログ番号SMP004A)は粗原形質膜と一緒に使用するために改変することができる。Flash Plateウェルは、cAMPを認識する特異的抗体も含有するシンチラントコーティングを含有していてよい。ウェル内で生成されたcAMPは、cAMP抗体への放射性cAMPトレーサーの結合について直接競合によって定量することができる。下記は、受容体を発現する細胞全体中でのcAMPレベルの変化を測定するための手短なプロトコールとして役立つ。
【0134】
一過性トランスフェクションの約24時間後にトランスフェクトした細胞を採取した。注意深く培地を吸引して取り除き、廃棄した。各皿の細胞へ10mLのPBSを穏やかに添加し、次に注意深く吸引する。1mLのSigma社製細胞解離バッファーおよび3mLのPBSを各プレートへ添加する。ピペットを用いてプレートから細胞を取り出し、50mLの円錐形遠心チューブ内へ細胞懸濁液を収集した。細胞は室温で5分間かけて1,100rpmで遠心した。細胞ペレットを適切な容量のPBS(約3mL/プレート)中へ注意深く再懸濁させた。血球計数器を用いて細胞数を計数し、追加のPBSを添加して適切な数の細胞(約50μL/ウェルの最終容量)を得た。
【0135】
cAMP標準物質および検出用バッファー(11mLの検出用バッファーに対して1μCiのトレーサー[125I cAMP]50μL)を含む)を調製し、製造業者の指示書にしたがって維持した。アッセイバッファーはスクリーニングのために新しく調製したが、50μLの刺激バッファー、3μLの試験化合物(12μMのアッセイ最終濃度)および50μLの細胞を含有していた。アッセイバッファーは使用時まで氷上に保管した。50μLのcAMP標準物質を適切なウェルへ添加し、次にウェルH−11およびH12へ50μLのPBSAを添加することによってアッセイを開始した。50μLの刺激バッファーを全ウェルへ添加した。試験化合物の12μMの最終アッセイ濃度および100μLの全アッセイ容量で、3μLの化合物溶液を分注できるピン状ツールを用いてDMSO(もしくは選択した候補化合物)を適切なウェルへ添加した。次に細胞をウェルへ添加し、室温で60分間インキュベートした。トレーサーcAMPを含有する100μLの検出ミックスをウェルへ添加した。プレートをさらに2時間インキュベートし、次にWallac MicroBetaシンチレーションカウンターで計数した。cAMP/ウェルの数値は、各アッセイプレート内に含有された標準cAMP曲線から外挿した。
【0136】
Gi共役標的GPCRに対する細胞ベースcAMP:
TSHRは、活性化されるとcAMPの蓄積を誘発するGs共役GPCRである。TSHRは、アミノ酸残基623を突然変異させること(すなわち、アラニン残基をイソロイシン残基へ変化させること)によって構成的に活性化される。Gi共役受容体はアデニリルシクラーゼを阻害し、そしてこのためcAMP産生のレベルを減少させると予想され、cAMPレベルの評価を難題にする可能性がある。Gi共役受容体の構成的活性化の指標としてのcAMPの産生の減少を測定するために有効な技術は、cAMPのベースラインレベルを確定するために、最も好ましくは「シグナルエンハンサー」としての非内因性の構成的に活性化されたTSHR(TSHR−A623I)(もしくは内因性の構成的に活性なGs共役受容体)を、Gi連結標的GPCRを用いてコトランスフェクトすることによって遂行できる。Gi共役受容体の非内因性バージョンを作製すると、標的GPCRの非内因性バージョンは次にシグナルエンハンサーを用いてコトランスフェクトされ、スクリーニングのために使用できるのはこの物質である。本発明者らは、cAMPアッセイが使用される場合はシグナルを効果的に産生するためにそのようなアプローチを利用する;このアプローチは、好ましくはGi共役受容体に対する候補化合物の直接的同定において使用される。Gi共役GPCRに対してこのアプローチを使用した場合は、標的GPCRのインバースアゴニストはcAMPシグナルを増加させ、アゴニストはcAMPシグナルを減少させることが留意される。
【0137】
第1日には、大グリア細胞を2×104個/ウェルをプレーティングする。第2日に、2本の反応チューブを用意する(各チューブについて従うべき比率は1プレート当たりの比率である):チューブAは1.2mLの血清無含有DMEM(Irvine Scientific社製、カリフォルニア州アーヴィン)中で計4μgのDNA(例、pCMVベクター;変異したTHSR(TSHR−A623I)を有するpCMVベクター;TSHR−A623IおよびGPCR、など)に対して、哺乳動物細胞中へトランスフェクトした各受容体の2μgのDNAを混合することによって調製される;チューブBは1.2mLの血清無含有DMEM中に120μLのリポフェクトアミン(Gibco BRL社製)を混合することによって調製される。チューブAおよびBを(数回)反転させ、室温で30〜45分間インキュベートすることによって混合する。この混合物を「トランスフェクション混合物」と呼ぶ。プレートに蒔いた大グリア細胞は、1×PBSを用いて洗浄し、その後に10mLの血清無含有DMEMを添加する。2.4mLのトランスフェクション混合物を次に細胞へ添加し、その後に37℃/5% CO2で4時間にわたりインキュベーションする。トランスフェクション混合物を吸引によって除去し、その後に25mLのDMEM/10%ウシ胎児血清を添加する。その後、細胞を37℃/5% CO2でインキュベートする。24時間のインキュベーション後、細胞を採取し、分析に使用する。
【0138】
Flash PlateTMアデニリルシクラーゼキット(New England Nuclear社製;カタログ番号SMP004A)は細胞ベースアッセイのために設計されているが、当業者の必要に依存して粗原形質膜と一緒に使用するために改変され得る。Flash Plateウェルは、cAMPを認識する特異的抗体も含有する、シンチラントコーティングを含有する。ウェル内で産生されたcAMPは、cAMP抗体への放射性cAMPトレーサーの結合について直接競合によって定量することができる。下記は、受容体を発現する細胞全体中でのcAMPレベルの変化を測定するための手短なプロトコールとして役立つ。
【0139】
トランスフェクトした細胞を、一過性トランスフェクションの約24時間後に採取する。注意深く培地を吸引して取り除き、廃棄する。各皿の細胞へ10mLのPBSを穏やかに添加し、次に注意深く吸引する。1mLのSigma社製細胞解離バッファーおよび3mLのPBSを各プレートへ添加する。ピペットを用いてプレートから細胞を取り出し、50mLの円錐形遠心チューブ内へ細胞懸濁液を回収する。細胞は室温で5分間1,100rpmで遠心する。細胞ペレットを適切な容量のPBS(約3mL/プレート)中へ注意深く再懸濁する。血球計数器を用いて細胞数を計数し、追加のPBSを添加して適切な数の細胞(約50μL/ウェルの最終容量)を得る。
【0140】
cAMP標準物質および検出用バッファー(11mLの検出用バッファーに対して1μCiのトレーサー[125I cAMP(50μL)]を含む)を調製し、製造業者の指示書にしたがって維持する。アッセイバッファーはスクリーニングのために新しく調製しなければならず、50μLの刺激バッファー、3μLの試験化合物(12μMのアッセイ最終濃度)および50μLの細胞を含有していなければならない。アッセイバッファーは使用時まで氷上に保管され得る。50μLのcAMP標準物質を適切なウェルへ添加し、次にウェルH−11およびH12へ50μLのPBSAを添加することによってアッセイを開始できる。50μLの刺激バッファーを全ウェルへ添加する。試験化合物の12μMの最終アッセイ濃度および100μLの全アッセイ容量で、3μLの化合物溶液を分注できるピン状ツールを用いて選択した化合物(例、TSH)を適切なウェルへ添加する。次に細胞をウェルへ添加し、室温で60分間インキュベートする。トレーサーcAMPを含有する100μLの検出ミックスをウェルへ添加する。プレートをさらに2時間インキュベートし、次にWallac MicroBetaシンチレーションカウンターで計数した。cAMP/ウェルの値は、各アッセイプレート内に含有された標準cAMP曲線から外挿する。
【0141】
レポーターベースアッセイ:
Cre−Lucレポーターアッセイ(Gs関連受容体):大グリア細胞は1ウェル当たり2×104細胞の密度で96ウェルプレート上に蒔き、製造業者の指示書にしたがって翌日、リポフェクトアミン試薬(BRL社製)を用いてトランスフェクトした。DNA/脂質混合物は各6ウェルトランスフェクションのために下記のとおりに調製する:100μLのDMEM中の260ngのプラスミドDNAを100μLのDMEM中の2μLの脂質と穏やかに混合した(260ngのプラスミドDNAは200ngの8×CRE−Lucレポータープラスミド、内因性受容体もしくは非内因性受容体を含む50ngのpCMVまたはpCMV単独、および10ngのGPRS発現プラスミド(pcDNA3(Invitrogen社製)中のGPRS)から構成された。8×CRE−Luc受容体プラスミドは下記のとおりに調製した:ベクターSRIF−β−galは、pβgal−Basic Vector(Clontech社製)中のBglV−HindIII部位でラットソマトスタチンプロモーター(−71/+51)をクローニングすることによって入手した。8コピーのcAMP応答エレメントをPCRによってアデノウイルステンプレートAdpCF126CCRE8(7 Human Gene Therapy 1883(1996)を参照されたい)から入手し、Kpn−BglV部位でSRIF−β−galベクター内へクローニングすると、8×CRE−β−galレポーターベクターが生じた。この8×CRE−Lucレポータープラスミドは、8×CRE−β−galレポーターベクター内のβ−ガラクトシダーゼ遺伝子をHindIII−BamHI部位でpGL3−ベーシックベクター(Promega社製)から入手したルシフェラーゼ遺伝子と置換することによって作製した。室温での30分間のインキュベーション後、400μLのDMEMを用いてDNA/脂質混合物を希釈し、希釈混合物100μLを各ウェルへ添加した。細胞培養インキュベーター内での4時間のインキュベーション後、各ウェルへ10%FCSを含む100μLのDMEMを添加した。翌日、トランスフェクトした細胞は10%FCSを含む200μL/ウェルのDMEMに変更した。8時間後、ウェルは、PBSを用いた1回の洗浄後、フェノールレッドを含まない100μL/ウェルのDMEMへ変更した。ルシフェラーゼ活性は、製造業者の指示書にしたがってLucLite(商標)レポーター遺伝子アッセイキット(Packard社製)を用いて翌日測定し、1450 MicroBeta(商標)シンチレーションおよびルミネセンスカウンター(Wallac社製)上で読み取った。
【0142】
AP1レポーターアッセイ(Gq関連受容体):
Gq刺激を検出する方法は、Gq依存性ホスホリパーゼCがそれらのプロモーター中でAP1エレメントを含有する遺伝子の活性化を誘発する既知の特性に左右される。PathdetectTMAP−1 cis−Reporting System(Stratagene社製、カタログ番号219073)は、リン酸カルシウム沈降物の構成成分が410ngのpAP1−Luc、80ngのpCMV−受容体発現プラスミド、および20ngのCMV−SEAPであった以外は、CREBレポーターアッセイに関して上述したプロトコールセットにしたがって使用できる。
【0143】
SRF−Lucレポーターアッセイ(Gq関連受容体):
Gq刺激を検出する1つの方法は、Gq依存性ホスホリパーゼCがそれらのプロモーター中で血清応答因子を含有する遺伝子の活性化を誘発する既知の特性に左右される。Pathdetect(商標)SRF−Luc−Reporting System(Stratagene社製)を使用すると、例えばCOS7細胞中でGq共役活性についてアッセイすることができる。細胞は、Mammalian TransfectionTM
Kit(Stratagene社製、カタログ番号200285)を製造業者の指示書にしたがって用いて、本システムのプラスミド構成成分および内因性もしくは非内因性GPCRをコードする指定発現プラスミドを用いてトランスフェクトされる。手短には、410ngのSRF−Luc、80ngのpCMV−受容体発現プラスミドおよび20ngのCMV−SEAP(分泌アルカリホスファターゼ発現プラスミド;サンプル間のトランスフェクト効率における変動について対照するためにアルカリホスファターゼ活性はトランスフェクトした細胞の培地中で測定する)を製造業者の指示書にしたがってリン酸カルシウム沈降物中で結合させる。沈降物の半分を96ウェルプレート上の3つのウェルの上方に同等に分布させ、血清無含有培地中で細胞を24時間維持する。最後の5時間に、細胞を選択した化合物と一緒にインキュベートする。次いで細胞を溶解させ、LucliteTMキット(Packard社製、カタログ番号6016911)ならびに「Trilux 1450 Microbeta」液体シンチレーションおよびルミネセンスカウンター(Wallac社製)を製造業者の指示書にしたがって用いてルシフェラーゼ活性についてアッセイする。データは、GraphPad PrismTM2.0a(GraphPad Software Inc.社製)を用いて分析できる。
【0144】
細胞内イノシトール1,4,5−三リン酸(IP3)蓄積アッセイ(Gq関連受容体):
第1日に、受容体(内因性および/または非内因性)を含む細胞は24ウェルプレート上で、通常は1ウェルに付き1×105細胞でプレートに蒔かれ得る(しかしこの数は最適化できる)。第2日に、細胞は1ウェルに付き50μLの血清無含有DMEM中の0.25μgのDNAおよび1ウェルに付き50μLの血清無含有DMEM中の2μLリポフェクトアミンを最初に混合することによってトランスフェクトすることができる。溶液を穏やかに混合し、室温で15〜30分間にわたりインキュベートする。細胞は0.5mLのPBSを用いて洗浄し、400μLの血清無含有培地をトランスフェクション培地と混合し、細胞に添加する。細胞を次に37℃/5% CO2で3〜4時間インキュベートし、トランスフェクション培地を除去し、1mL/ウェルの標準増殖培地と取り替える。
【0145】
第3日に、この細胞を3H−ミオ−イノシトールを用いて標識する。手短には、培地を除去し、0.5mLのPBSを用いて細胞を洗浄する。1ウェルに付き0.5mLのイノシトール無含有/血清無含有培地(GIBCO BRL社製)とともに1ウェルに付き0.25μCiの3H−ミオ−イノシトールを添加し、細胞を37℃/5%CO2で16〜18時間にわたりインキュベートする。第4日に、0.5mLのPBSを用いて細胞を洗浄し、10μMパルジリン、10mM塩化リチウムを含むイノシトール無含有/血清無含有培地を含有する0.45mLのアッセイ培地、または0.4mLのアッセイ培地および最終濃度が10μMになるような50μLの10×ケタンセリン(ket)を添加する。この細胞を次に37℃で30分間インキュベートする。0.5mLのPBSを用いて細胞を洗浄し、1ウェルに付き200μLの新鮮/氷冷停止液(1M KOH;18mM ホウ酸ナトリウム溶液;3.8mM EDTA)を添加する。この溶液を氷上で5〜10分間または細胞が溶解するまで維持し、次に200μLの新鮮/氷冷中和溶液(7.5%HCl)によって中和する。
【0146】
この溶解液を1.5mLのエッペンドルフチューブ内へ移し、チューブ1本に付き1mLのクロロホルム/メタノール(1:2)を添加する。この溶液を15秒間ボルテックスミキサーにかけ、上層をBiorad AG1−X8TMアニオン交換樹脂(100〜200メッシュ)へ適用する。最初に、1:1.25(W/V)で水を用いて樹脂を洗浄し、0.9mLの上層をカラムへ入れる。10mLの5mMミオ−イノシトールおよび10mLの5mMホウ酸ナトリウム/60mMギ酸ナトリウムを用いてカラムを洗浄する。2mLの0.1Mギ酸/1Mギ酸アンモニウムを含む10mLのシンチレーションカクテルを含有するシンチレーションバイアル内へイノシトールTrisリン酸塩を溶出させる。このカラムは10mLの0.1Mギ酸/3Mギ酸アンモニウムを用いて洗浄する工程によって再生され、ddH2Oを用いて2回すすぎ洗いし、4℃の水中へ保管される。
【0147】
細胞内カルシウム濃度を測定するための蛍光測定イメージングプレートリーダー(FLIPR)アッセイ:
各クローン系から安定性にトランスフェクトした標的受容体(実験的)およびpCMV(ネガティブコントロール)細胞を、翌日アッセイするために、完全培養培地(10%FBS、2mM L−グルタミン、1mM ピルビン酸ナトリウムを含むDMEM)を含むポリ−D−リジン前処理96ウェルプレート(Becton−Dickinson社製、番号356640)内へ1ウェルにつき5.5×104細胞で播種する。Fluo4−AM(Molecular Probe社製、番号F14202)インキュベーションバッファーストック液を調製するために、1mg Fluo4−AMを467μLのDMSOおよび467μLのPluoronic acid(Molecular Probe社製、番号P3000)中へ溶解させて、−20℃で1カ月間にわたり保管できる1mMストック溶液を入手する。Fluo4−AMは、蛍光カルシウム指示染料である。
【0148】
候補化合物は、洗浄バッファー(1×HBSS/2.5mM プロベニシド(Probenicid)/20mM HEPES(pH7.4))中で調製される。
【0149】
アッセイ時に、培地をウェルから取り除き、この細胞に100μLの4μM Fluo4−AM/2.5mM プロベニシド(Sigma社製、番号P8761)/20mM HEPES/完全培地(pH7.4)を添加する。37℃/5% CO2でのインキュベーションを60分間にわたり進行させる。
【0150】
1時間のインキュベーション後、Fluo4−AMインキュベーションバッファーを取り除き、100μLの洗浄バッファーを用いて細胞を2回洗浄する。各ウェル内に100μLの洗浄バッファーを放置する。プレートを60分間にわたり37℃/5%CO2に設定したインキュベーターに戻す。
【0151】
FLIPR(蛍光測定イメージングプレートリーダー;Molecular Device社製)を、30秒毎に50μLの候補化合物を添加し、その後の150秒間について候補化合物によって引き起こされる細胞内カルシウム濃度([Ca2+])の一過性変化を記録するようにプログラミングする。FLIPRソフトウエアを用いてアゴニスト活性を決定するために全蛍光変化数を使用する。機器のソフトウエアは、ゼロで同等の初期読み取り値を得るように蛍光読み取り値を標準化する。
【0152】
一部の実施形態では、標的受容体を含む細胞は、無差別Gα15/16またはキメラGq/Giαユニットをさらに含んでいる。
【0153】
上記は安定性にトランスフェクトした細胞を用いてアゴニスト活性についてのFLIPRアッセイを提供するが、当業者であればアンタゴニスト活性を特性解析するために本アッセイを容易に改変できるであろう。前記当業者は、あるいはまた一過性トランスフェクト細胞も使用できることを容易に理解するであろう。
【0154】
上記の試験結果および考察から、本発明が嗅覚GPCRを産生するための重要な新規手段を提供することが明らかである。詳細には、本発明は嗅覚GPCR調節因子を見いだすための化学物質ライブラリーをスクリーニングするためのシステムを提供する。したがって、本方法およびシステムは、研究、食品および芳香剤の改良を含む様々な用途、およびその他の用途において利用される。したがって、本発明は当技術分野にとって有意な貢献を意味する。
【0155】
【表1−1】

【0156】
【表1−2】

【0157】
【表1−3】

【0158】
【表1−4】

【技術分野】
【0001】
本出願は、以下の仮出願からの優先権の利益を主張する:米国特許商標庁に米国速達郵便で指示された日付に出願された、2003年11月21日出願の米国仮出願番号第60/523,940号。先の出願の開示は、本明細書中にその全体が参考として援用される。
【0002】
(発明の分野)
本発明は、細胞中でGPCRタンパク質、詳細には嗅覚GPCRタンパク質を産生するための方法に関する。
【背景技術】
【0003】
(発明の背景)
すべての動物は、環境内における化学的感覚情報の認識および識別を可能にする嗅覚感覚器である「鼻」を有している。例えばヒトは、他の動物に比較してニオイについて不良な感覚を有するが、それでもヒトは、10,000種を超える、典型的には400Da未満の小さな有機分子である、揮発性化学物質(「臭気物質」)を感知する、すなわちニオイを嗅ぐことができる。これらの化学物質は構造が高度に相違しており、一連の多種多様な脂肪族系酸、アルコール、アルデヒド、ケトン、およびエステル;芳香環、脂環、多環および複素環の構造を備える化学物質;およびこれらのタイプ各々の無数の置換化学物質、ならびにそれらの組み合わせを含んでいる。注目すべきことに、これらの分子は嗅覚系によって検出されるだけではなく、嗅覚系自体によって識別される。
【0004】
一部のニオイは望ましく、そして他のニオイは嫌われるので、新しいニオイを作り出す、ニオイを模倣する、そしてニオイの知覚を操作する能力は極めて望ましい。このために、ニオイの知覚に関する研究が近年強められてきた。ヒトおよび他の動物種では、嗅覚感覚ニューロンの特殊タイプの樹状突起である嗅覚繊毛上で極めて多数の臭気物質受容体が同定されている。これらの臭気物質受容体はGタンパク質共役受容体のスーパーファミリーに特徴的な7回膜貫通ドメイントポロジーを示すので、したがって「嗅覚GPCR」と呼ばれている。各嗅覚感覚ニューロンは1つのタイプの嗅覚GPCRしか発現せず、ヒトゲノムはおよそ500種の活性嗅覚GPCRをコードすると推定されている。
【0005】
したがって、比較的少数の受容体によって極めて多数の化学物質を検出かつ識別することができる。これは各嗅覚GPCRが1種より多くの臭気物質を認識し、各臭気物質が1種より多くの嗅覚GPCRによって認識されるコンビナトリアル受容体コ―ディングスキーム(combinatorial receptor coding scheme)を用いて達成される。そこで臭気物質は、活性化GPCRの「フィンガープリント」によって特徴付けることができる。いったん決定されると、この「フィンガープリント」は臭気物質の正体(identity)、ならびに類似の「フィンガープリント」、従ってニオイを示す他の分子を同定するための根拠を提供する。
アデノウイルスベクターを用いて外来的に導入された場合にその組換え嗅覚GPCRは嗅覚感覚ニューロンによってインビボで高レベルで効率的に発現され得る(例、非特許文献1)という事実にもかかわらず、嗅覚GPCRは、それらが細胞内でそれらの機能を提供する方法で、異種培養細胞系で容易に発現できないという点で極めて例外的である(例、非特許文献2)。この問題の正確な原因は不明ではあるが、1つの理論は、非内因性細胞中で発現したときに嗅覚GPCRが細胞の原形質膜へ運ばれず、小胞体中に隔離されるようになるというものである。また別の理論は、機能的発現は正しい膜局在化のために必要とされる嗅覚特異的因子または非嗅覚細胞中での情報伝達機構への非効率な共役に起因する可能性があると示唆している(非特許文献3)。非内因性培養細胞中での組換え嗅覚GPCRの非効率的および/または本質的に非機能的な発現を生じさせる機構とは無関係に、この問題に対する解決策はこれまで知られていない。本発明までは、嗅覚GPCRはインビトロでは哺乳動物細胞中で発現するのが格別に困難であり、そしてそのような方法が極めて望ましいのではあるが、これまではそれらのGPCRを産生およびアッセイする強固で確実かつ効率的な方法はなかった。臭気物質の認識および識別を理解することにおける進歩は、嗅覚GPCRを産生できないために強度に妨害されている(非特許文献4)。
さらに上記から、哺乳動物細胞中で嗅覚GPCRを産生するための強固で、確実かつ効率的な方法に対する大きな必要がある。本発明は、この必要や他の必要を満たし、予想外に高水準の成功を生じさせる。
(文献)
目的の文献には下記の参考文献が含まれる:非特許文献5;非特許文献6;非特許文献7;非特許文献8;非特許文献9;非特許文献10;非特許文献11;非特許文献12;非特許文献13;非特許文献14;非特許文献15;非特許文献16;非特許文献17;非特許文献18および非特許文献19;特許文献1および特許文献2;ならびに特許文献3、特許文献4および特許文献5。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許出願公開第2003/0143679号明細書
【特許文献2】米国特許出願公開第2003/0105285号明細書
【特許文献3】米国特許第6,610,511号明細書
【特許文献4】米国特許第6,492,143号明細書
【特許文献5】米国特許第6,410,249号明細書
【非特許文献】
【0007】
【非特許文献1】Touharaら、Proc.Natl.Acad.Sci.、1999年、96:p.4040−4045
【非特許文献2】McClintock、Mol.Brain Res.、1997年、48:p.270−278
【非特許文献3】Kriegerら、Eur.J.Biochem、1994年、219:p.829−835
【非特許文献4】Firestein、Nature、2001年、413:p.211−218
【非特許文献5】Zozulyaら、Genome Biology、2001年、2:p.0018.1−0018.12
【非特許文献6】Mombairts、Annu.Rev.Neurosci、1999年、22:p.487−509
【非特許文献7】Ramingら、Nature、1993年、361:p.353−356
【非特許文献8】Belluscioら、Neuron、1988年、20:p.69−81
【非特許文献9】Ronnetら、Annu.Rev.Physiol.、2002年、64:p.189−222
【非特許文献10】Luら、Traffic、2003年、4:p.416−533
【非特許文献11】Buck、Cell、2000年、100:p.611−618
【非特許文献12】Malnicら、Cell、1999年、96:p.713−723
【非特許文献13】Firestein、Nature、2001年、413:p.211−218
【非特許文献14】Zhaoら、Science、1998年、279:p.237−242
【非特許文献15】Touharaら、Proc.Natl.Acad.Sci.、1999年、96:p.4040−4045
【非特許文献16】Sklarら、J.Biol.Chem、1986年、261:p.15538−15543
【非特許文献17】Dryerら、TiPS、1999年、20:p.413−417
【非特許文献18】Ivicら、J Neurobiol.、2002年、50:p.56−68
【非特許文献19】Fuchsら、Hum.Genet.、2001年 108:p.1−13
【発明の概要】
【課題を解決するための手段】
【0008】
(発明の要旨)
本発明は、細胞中で嗅覚GPCRを産生するための方法を提供する。一般に、本方法は、嗅覚GPCRをコードする核酸へ作動可能に連結したプロモーターを含有する発現カセットを大グリア細胞、例えばシュヴァン(Schwann)細胞もしくは希突起膠細胞(oligodendritic cell)中へ導入する工程と、および嗅覚GPCRを産生するために適切な条件下で前記細胞を維持する工程と、を含んでいる。さらに、嗅覚GPCRをコードする組換え核酸を含有する大グリア細胞、嗅覚GPCR活性の調節因子についてスクリーニングする方法、および大グリア細胞中で嗅覚GPCRを産生するためのキットも提供される。本発明は、香味料および芳香剤に関する研究において最も有用であるので、その結果として多種多様な研究および産業上の用途を有する。
本発明は、さらに以下の項目を提供する:
(項目1)
嗅覚GPCRを産生する方法であって、
該嗅覚GPCRをコードする核酸に作動可能に連結したプロモーターを含む発現カセットを、インビトロで大グリア細胞中へ導入する工程、および
該嗅覚GPCRの産生に適した条件下で、該細胞を維持し、該嗅覚GPCRを産生する工程、
を包含する、方法。
(項目2)
前記大グリア細胞がミエリン産生細胞である、項目1に記載の方法。
(項目3)
前記大グリア細胞がシュヴァン細胞、希突起膠細胞または嗅神経鞘細胞である、項目1に記載の方法。
(項目4)
前記大グリア細胞が初代シュヴァン細胞である、項目3に記載の方法。
(項目5)
前記細胞が不死化大グリア細胞である、項目1に記載の方法。
(項目6)
前記嗅覚GPCRが細胞表面で検出可能である、項目1に記載の方法。
(項目7)
嗅覚調節因子をスクリーニングする方法であって、
項目1に記載の方法に従って大グリア細胞中において嗅覚GPCRを産生する工程であって、ここで、該嗅覚GPCRがGタンパク質へ共役されている、工程;
該細胞を候補因子と接触させる工程;および
該嗅覚GPCRの活性に対する該候補因子の作用を評価する工程
を包含し、ここで、該嗅覚GPCRの活性を調節する候補因子が嗅覚調節因子である、方法。
(項目8)
嗅覚GPCRの調節因子をスクリーニングする方法であって、
項目1に記載の方法に従って大グリア細胞中において該嗅覚GPCRを産生する工程であって、ここで、該嗅覚GPCRがGタンパク質へ共役されている、工程;
該細胞を候補因子と接触させる工程;および
該嗅覚GPCRの活性に対する該候補因子の作用を評価する工程
を包含し、ここで、該嗅覚GPCRの活性を調節する候補因子が該嗅覚GPCRの調節因子である、方法。
(項目9)
前記因子が小有機分子である、項目7または項目8に記載の方法。
(項目10)
前記因子が臭気物質である、項目7または項目8に記載の方法。
(項目11)
前記接触させる工程が前記嗅覚GPCRの既知のアゴニストの存在下で実施される、項目7または項目8に記載の方法。
(項目12)
前記調節因子が、アゴニスト、部分アゴニスト、インバースアゴニストおよびアンタゴニストからなる群から選択される、項目7または項目8に記載の方法。
(項目13)
前記評価する工程がGTPγS結合のレベルの測定を通して行われる、項目7または項目8に記載の方法。
(項目14)
前記評価する工程が、環状AMP(cAMP)、環状GMP(cGMP)、イノシトール1,4,5−三リン酸(IP3)、ジアシルグリセロール(DAG)、およびCa2+の群から選択される第2メッセンジャーのレベルの測定を通して行われる、項目7または項目8に記載の方法。
(項目15)
前記第2メッセンジャーがcAMPである、項目14に記載の方法。
(項目16)
嗅覚GPCRのリガンドをスクリーニングする方法であって、
項目1に記載の方法に従って大グリア細胞中において該嗅覚GPCRを産生する工程;
該嗅覚GPCRを候補因子と接触させる工程;および
該候補因子の該嗅覚GPCRへの結合を評価する工程、
を包含する、方法。
(項目17)
前記候補因子が標識される、項目16に記載の方法。
(項目18)
嗅覚GPCRのリガンドをスクリーニングする方法であって、
項目1に記載の方法に従って大グリア細胞中において該嗅覚GPCRを産生する工程;
該嗅覚GPCRを、該嗅覚GPCRの標識された既知のリガンドの存在下で候補因子と接触させる工程;および
該嗅覚GPCRの該標識された既知のリガンドの結合を評価する工程
を包含し、ここで、該候補因子の存在下での該標識された既知のリガンドの結合の減少は、該候補因子が該嗅覚GPCRのリガンドであることの指標である、方法。
(項目19)
嗅覚調節因子をスクリーニングする方法であって、
項目1に記載の方法に従って複数の異なる嗅覚GPCRを産生する工程であって、ここで、該嗅覚GPCRの各々がGタンパク質へ共役されている、工程;
第1の因子によって活性化される異なる嗅覚GPCRのセットを同定する工程であって、ここで、該第1の因子が既知の嗅覚調節因子である、工程;
該GPCRのセットを第2の因子と接触させる工程;および
該第2の因子の該嗅覚GPCRの活性に対する作用を評価する工程
を包含し、ここで、該第1の因子によって調節された該異なるGPCRセットの1つ以上のGPCRを調節する第2の因子が、嗅覚調節因子である、方法。
(項目20)
前記セットが3つ以上のGPCRを含む、項目19に記載の方法。
(項目21)
嗅覚GPCRをコードする組換え核酸を含む大グリア細胞。
(項目22)
大グリア細胞;および
嗅覚GPCRをコードする核酸
を備える、キット。
(項目23)
前記大グリア細胞を用いて前記嗅覚GPCRを産生するための指示書をさらに備える、項目22に記載のキット。
(項目24)
サンプル中において目的の臭気物質を同定する方法であって、
サンプルを、項目1に記載の方法に従って複数の異なる嗅覚GPCRを産生する複数の大グリア細胞と接触させる工程であって、ここで、該嗅覚GPCRの各々がGタンパク質へ共役されている、工程;および
該臭気物質の存在に対する該嗅覚GPCRの活性化を評価する工程
を包含し、ここで、予め決定された嗅覚GPCRのセットの活性化が、該サンプルにおける該臭気物質の存在を示す、方法。
(項目25)
臭気物質の「フィンガープリント」を決定する方法であって、
サンプルを、項目1に記載の方法に従って複数の異なる嗅覚GPCRを産生する複数の大グリア細胞と接触させる工程であって、ここで、該嗅覚GPCRの各々がGタンパク質へ共役されている、工程;および
該臭気物質による活性化に対する該嗅覚GPCRの活性化を評価する工程
を包含し、ここで、該「フィンガープリント」が該臭気物質によって活性化された異なる嗅覚GPCRのセットを含む、方法。
(項目26)
前記接触させる工程が、前記複数の嗅覚GPCRのうちの1つ以上の既知のアゴニストの存在下で実施される、項目25に記載の方法。
(項目27)
前記複数の細胞が、細胞のアドレス指定可能なアレイであり、ここで、該アレイの各アドレスが単一の組換え嗅覚GPCRを産生する大グリア細胞を含有する、項目24〜26のいずれか一項に記載の方法。
(項目28)
前記GPCR活性化が、GPCR活性化の発光レポーターを用いて評価される、項目27に記載の方法。
【図面の簡単な説明】
【0009】
【図1】図1は初代ラットシュヴァン細胞の表面上での組換えヒト嗅覚GPCRの発現を示している4枚の写真パネルである。パネルOR1は、Genbankアクセッション番号P47893を有する嗅覚GPCRである。パネルOR2は、Genbankアクセッション番号NP_036505を有する嗅覚GPCRである。パネルOR3は、Genbankアクセッション番号XP_166868を有する嗅覚GPCRである。ベクターは空の発現ベクターでネガティブコントロールである。嗅覚GPCRは、ロドプシンシグナルペプチドおよびヘマグルチニン(HA)エピトープタグを含むN末端融合タンパク質としてCMVプロモーターに基づく発現ベクターから発現させられる。
【発明を実施するための形態】
【0010】
(定義)
本発明についてさらに詳細に説明する前に、本発明は当然ながら変動する可能性があるので、記載した特定の実施形態には限定されないことを理解されたい。さらに、本明細書で使用する用語は特定の実施形態を記載するためのみであって、限定することは企図されていないことも理解されたい。他に特別に規定しない限り、本明細書で使用するすべての技術用語および科学用語は、本発明が属する技術分野における当業者によって一般に理解される意味と同一の意味を有する。
【0011】
ある範囲の値が提供される場合は、その範囲の上限と下限との間に介在する各値ならびにその記載した範囲内の任意の他の記載した、もしくは介在する値の間に介在する値は、その状況が明白にそうでないことを指示しない限り下限の単位の10分の1まで、本発明の範囲内に含まれると理解されている。これらの小さな範囲の上限および下限は小さな範囲内に独立して含まれる可能性があり、そしてさらに、記載された範囲内のいずれか具体的な限度が排除された、本発明の範囲内に含まれる。記載された範囲が一方もしくは両方の限度を含む場合は、それらの含まれた限度の一方もしくは両方を除外する範囲もまた本発明に含まれる。
【0012】
本出願を通して、様々な出版物、特許および公表された特許出願が引用される。本特許出願において言及したこれらの出版物、特許および公表された特許出願の開示は、これによりそれらの全体が本発明の開示の中に参考として援用される。出版物、特許、または公表された特許出願についての本出願人による本明細書での引用は、前記出版物、特許、もしくは公表された特許出願が先行技術であることを本出願人が認めたわけではない。
【0013】
本明細書および添付の特許請求の範囲で使用する単数形の「1つの」「および」および「その」は、その内容が明白にそうでないことを指示していない限り、複数の対象を含むことに留意しなければならない。そこで、例えば「1つの因子」との言及は複数のそのような因子を含んでおり、そして「GPCR」との言及は1つ以上のGPCRおよび当業者には公知のそれらの同等物についての言及を含んでいる、などである。さらに、特許請求の範囲は任意の必要に応じた要素を排除するように起草できることも留意されたい。したがって、この陳述は「単独で」、「〜だけ」などの排他的な用語を請求項の構成要件の記載と、または「否定的」制限の使用と結び付けて使用するための記述の根拠として機能することが企図されている。
【0014】
「Gタンパク質共役受容体」もしくは「GPCR」は、共通の構造モチーフを共有し、各々が1枚の膜にわたっている7つのαヘリックスを形成する22〜24の間の疎水性アミノ酸の7つの領域を有するポリペプチドである[各範囲は、番号、すなわち膜貫通−1(transmembrane−1;TM1)、膜貫通−2(transmembrane−2;TM2)などによって同定される]。膜貫通ヘリックスは、細胞膜の外側、すなわち「細胞外」側で膜貫通−2と膜貫通−3(transmembrane−3)との間、膜貫通−4(transmembrane−4)と膜貫通−5(transmembrane−5)との間、および膜貫通−6(transmembrane−6)と膜貫通−7(transmembrane−7)との間のアミノ酸の領域によって連結されている[これらは、各々「細胞外」領域1、2および3(EC1、EC2およびEC3)と呼ばれている]。膜貫通ヘリックスは、さらにまた細胞膜の内側、すなわち「細胞内」側で膜貫通−1と膜貫通−2との間、膜貫通−3と膜貫通−4との間、および膜貫通−5と膜貫通−6との間のアミノ酸の領域によって連結されている[これらは、各々「細胞内」領域1、2および3(IC1、IC2およびIC3)と呼ばれている]。この受容体の「カルボキシ」(「C」)末端は細胞内の細胞内空間中に存在し、そしてこの受容体の「アミノ」(「N」)末端は細胞外の細胞外空間中に存在する。GPCRの構造および分類は当技術分野において一般によく知られており、GPCRについてのさらなる考察はProbst, DNA Cell Biol. 1992 11:1−20;Marchese et al Genomics 23:609−618,1994;ならびに以下の書籍:Wiley−Lissによって出版されたJuergen Wess(Ed) Structure−Function Analysis of G Protein−Coupled Receptors(1st edition;October 15, 1999);John Wiley & Sonsによって出版されたKevin R. Lynch(Ed) Identification and Expression of G Protein−Coupled Receptors(March 1998)およびCRC Pressによって出版されたTatsuya Haga(Ed), G Protein−Coupled Receptors(September 24, 1999);そしてAcademic Pressによって出版されたSteve Watson(Ed) G−Protein Linked Receptor Factsbook(1st edition;1994)の中に見いだすことができる。
【0015】
「天然GPCR」(native GPCR)は、動物、例えばヒトもしくはマウスなどの哺乳動物によって産生されるGPCRである。天然GPCRの詳細な説明は、全米バイオテクノロジー情報センター(NCBI)のワールドワイドウェブサイトで見いだされるOn−line Mendelian Inheritance in Man database(ヒトにおけるメンデル性遺伝についてのオンラインデータベース)の中に見いだすことができる。天然GPCRについての追加の説明は、primalinc.comのワールドワイドウェブサイトおよび表1に記載した本方法において使用するための代表的GPCRのリストに見いだすことができる。
【0016】
用語「リガンド」は、GPCRへ特異的に結合する分子を意味する。リガンドは、例えばポリペプチド、脂質、小分子または抗体などであってよい。「天然リガンド」(native ligand)は、天然GPCRのための内因性の天然リガンドである。リガンドは、GPCR「アンタゴニスト」、「アゴニスト」、「部分アゴニスト」または「インバースアゴニスト」(inverse agonist)などであってよい。
【0017】
「調節因子」は、それが細胞中で発現するGPCRと接触した、例えば結合した場合にGPCR細胞内応答を増加もしくは減少させるリガンドである。
【0018】
用語「第2メッセンジャー」は、受容体活性化の結果として産生される細胞内応答を意味するものとする。第2メッセンジャーは、例えばイノシトール1,4,5−三リン酸(IP3)、ジアシルグリセロール(DAG)、環状AMP(cAMP)、環状GMP(cGMP)およびCa2+を含むことができる。第2メッセンジャー応答を測定すると、受容体活性化を決定できる。さらに、第2メッセンジャー応答を測定すると、候補因子、例えばアゴニスト、部分アゴニスト、インバースアゴニスト、およびアンタゴニストを同定できる。
【0019】
「アゴニスト」は、それがGPCRに結合するとGPCR細胞内応答を活性化するリガンドである。
【0020】
「部分アゴニスト」は、それがGPCRに結合すると、アゴニストより低い程度まで、GPCR細胞内応答を活性化するリガンドである。
【0021】
「アンタゴニスト」は、アゴニストと同一部位でGPCRへ競合的に結合するが、GPCRの活性形によって産生される細胞内応答を活性化しないリガンドである。アンタゴニストは、アゴニストもしくは部分アゴニストによる細胞内応答を通常は阻害する。アンタゴニストは、通常はアゴニストもしくは部分アゴニストの不在下ではベースライン細胞内応答を減少させない。
【0022】
「インバースアゴニスト」は、GPCRに結合し、アゴニストもしくは部分アゴニストの不在下で観察されたGPCRのベースライン(基底)細胞内応答を阻害するリガンドである。大多数の実施形態では、ベースライン細胞内応答はインバースアゴニストの存在下では、インバースアゴニストの不在下でのベースライン応答に比較して、少なくとも約30%、少なくとも約50%、もしくは少なくとも約75%阻害される。
【0023】
用語「臭気物質」は、嗅覚GPCRを活性化する、既知または未知の構造の天然型もしくは化学合成された任意の化合物を含んでいる。上記の背景のセクションにおいて考察したように、臭気物質は、通常は揮発性の、400Da未満の小有機分子である。香味料、香水、芳香、臭気、芳香剤は臭気物質のタイプである。「ニオイ」は、特定臭気物質に結び付いた感覚である。
【0024】
本明細書で使用する用語「嗅覚GPCR活性に結び付いた現象」は、嗅覚GPCR活性に結び付いた、特にヒトもしくは動物モデルにおいて容易に評価できる特徴などの構造的、分子的、または機能的特徴をいう。そのような特徴には、GPCRの活性化によって誘導された下流分子事象、およびニオイ、味、またはGPCRの活性化によって誘導されたその他の挙動的もしくは生理的事象などの感覚現象が含まれるが、それらに限定されない。
【0025】
「欠失」は、親GPCRポリペプチドもしくは核酸のアミノ酸配列もしくはヌクレオチド配列に比較してその中で1つ以上のアミノ酸もしくはヌクレオチド残基が各々欠如している、アミノ酸もしくはヌクレオチドのいずれかの配列における変化であると規定されている。GPCRまたはそのフラグメントの状況においては、欠失は、約2個、約5個、約10個、約20個まで、約30個までもしくは約50個まで、またはそれ以上のアミノ酸の欠失を含んでいてよい。GPCRもしくはそのフラグメントは1より多くの欠失を含有していてよい。
【0026】
「挿入」もしくは「付加」は、親GPCRのアミノ酸配列もしくはヌクレオチド配列に比較して、各々1つ以上のアミノ酸もしくはヌクレオチド残基の付加を生じさせている、アミノ酸もしくはヌクレオチド配列における変化である。「挿入」は、一般にポリペプチドのアミノ酸配列内の1つ以上のアミノ酸残基への付加をいうが、「付加」は挿入であってよい、またはN末端もしくはC末端、または両端で付加されたアミノ酸残基をいう。GPCRまたはそのフラグメントの状況においては、挿入もしくは付加は、通常、約1個、約3個、約5個、約10個、約20個まで、約30個まで、もしくは約50個まで、またはそれ以上のアミノ酸の挿入もしくは付加である。GPCRもしくはそのフラグメントは1より多くの挿入を含有していてよい。
【0027】
「置換」は、各々親GPCRもしくはそのフラグメントのアミノ酸配列もしくはヌクレオチド配列と比較して、相違するアミノ酸もしくはヌクレオチドによる1つ以上のアミノ酸もしくはヌクレオチドの置換の結果として生じる。GPCRもしくはそのフラグメントは、GPCR活性へ実質的に作用を及ぼさない保存的アミノ酸置換を有する可能性があることは理解されている。保存的置換は、gly、ala;val、ile、leu;asp、glu;asn、gln;ser、thr;lys、arg;およびphe、tyrなどの組み合わせが企図されている。
【0028】
用語「生物活性」GPCRは、天然に存在するGPCRの構造的および生化学的機能を有するGPCRをいう。
【0029】
本明細書で使用する用語「決定する工程」、「測定する工程」、「評価する工程」、および「アッセイする工程」は交換可能に使用され、定量的および定性的決定の両方を含んでいる。これらの状況におけるGPCRの「量」についての言及が定量的評価を必要とすることは意図されておらず、そして他に具体的に指示されない限り、定性的または定量的のいずれであってもよい。
【0030】
本明細書で交換可能に使用される用語「ポリペプチド」および「タンパク質」は、任意の長さの高分子形のアミノ酸をいい、コードされたアミノ酸およびコードされたものではないアミノ酸、化学的もしくは生化学的に修飾もしくは誘導体化されたアミノ酸、ならびに修飾ペプチド主鎖を有するポリペプチドを含むことができる。この用語には、N末端メチオニン残基を備える、もしくは備えない、異種および同種リーダー配列との融合体である異種アミノ酸配列を備える融合タンパク質;免疫学的にタグ付けされたタンパク質;融合パートナーとして例えば蛍光タンパク質、β−ガラクトシダーゼ、ルシフェラーゼなどを含む融合タンパク質のような検出可能な融合パートナーを備える融合タンパク質などを含むがそれらに限定されない融合タンパク質が含まれる。
【0031】
用語「核酸分子」および「ポリヌクレオチド」は交換可能に使用され、デオキシリボヌクレオチドもしくはリボヌクレオチド、またはそれらのアナログのいずれかである、任意の長さの高分子形のヌクレオチドをいう。ポリヌクレオチドは任意の三次元構造を有していてよく、既知または未知の任意の機能を実行することができる。ポリヌクレオチドの非限定的例には、遺伝子、遺伝子フラグメント、エクソン、イントロン、メッセンジャーRNA(mRNA)、トランスファーRNA、リボソームRNA、リボザイム、cDNA、組換えポリヌクレオチド、分枝状ポリヌクレオチド、プラスミド、ベクター、任意の配列の単離DNA、制御領域、任意の配列の単離RNA、核酸プローブ、およびプライマーが含まれる。核酸分子は、直鎖状であっても環状であってもよい。
【0032】
本明細書で使用する用語「単離(された)」は、単離化合物の状況において使用する場合は、その中で化合物が自然に発生する環境とは相違する環境内にある目的の化合物をいう。「単離(された)」は、目的の化合物が実質的に富化されている、および/または目的の化合物が部分的もしくは実質的に精製されているサンプル内にある化合物を含むことが意図されている。
【0033】
本明細書で使用する用語「実質的に純粋」は、その天然環境から取り出されており、自然にはそれに結び付いている他の成分を少なくとも60%含まない、好ましくは75%含まない、および最も好ましくは90%含まない化合物をいう。
【0034】
「コーディング配列」もしくは選択されたポリペプチドを「コードする」配列は、例えば適切な調節配列(もしくは「制御エレメント」の制御下に置かれたときに、宿主細胞中で(DNAの場合は)転写することができることおよび(mRNAの場合は)ポリペプチドへ翻訳することのできる核酸分子である。コーディング配列の境界は、典型的には5’(アミノ)末端にある開始コドンおよび3’(カルボキシ)末端にある翻訳停止コドンによって決定される。コーディング配列には、ウイルス由来cDNA、原核細胞もしくは真核細胞mRNA、ウイルスもしくは原核細胞DNA由来のゲノムDNA配列、および合成DNA配列を含むことができるが、それらに限定されない。転写終結配列はコーディング配列に対して3’に位置していてよい。その他の「制御エレメント」はさらにまたコーディング配列と結び付いていてもよい。ポリペプチドをコードするDNA配列は、所望のポリペプチドコーディング配列のDNAコピーを表すために選択された細胞にとって好ましいコドンを使用することによって選択された細胞内での発現に最適化することができる。
【0035】
「によってコードされた」は、ポリペプチド配列をコードする核酸配列をいい、このときポリペプチド配列もしくはその一部分は、核酸配列によってコードされたポリペプチドから少なくとも3〜5アミノ酸、より好ましくは少なくとも8〜10アミノ酸、およびいっそうより好ましくは少なくとも15〜20アミノ酸の配列を含有している。さらに、その配列によってコードされたポリペプチドを用いて免疫学的に同定可能なポリペプチド配列も含まれる。
【0036】
「作動可能に連結した」は、そのように記載された構成成分がそれらの通常の機能を実行できるように構成されているエレメントの配置をいう。コーディング配列へ作動可能に連結したプロモーターは、コーディング配列の発現を達成するであろう。プロモーターもしくはその他の制御エレメントは、それらがそれらの発現を指令するように機能する限り、コーディング配列と隣接している必要はない。例えば、介在する翻訳されないが転写される配列がプロモーター配列とコーディング配列との間に存在していてよく、プロモーター配列はそれでもまだコーディング配列と「作動可能に連結した」と見なすことができる。
【0037】
「核酸構築物」は、自然には一緒に見いだされない1つ以上の機能的ユニットを含むように構築されている核酸配列を意味する。例には、環状、直鎖状、二本鎖、染色体外DNA分子(プラスミド)、コスミド(ラムダファージ由来のCOS配列を含有するプラスミド)、非天然核酸配列を含むウイルスゲノムなどが含まれる。
【0038】
「ベクター」は、遺伝子配列を宿主細胞へ移すことができる。典型的には、「ベクター構築物」、「発現ベクター」および「遺伝子移入ベクター」は目的の遺伝子の発現を指令できる、そしてベクターの全部もしくは一部分のゲノム組込み、または染色体外エレメントとしてのベクターの一過性もしくは遺伝性維持によって達成できる、遺伝子配列を宿主細胞へ移入できる任意の核酸構築物を意味している。そこで、この用語は、クローニングおよび発現ビヒクルならびに組込み型ベクターを含んでいる。
【0039】
「発現カセット」は、発現カセットのプロモーターへ作動可能に連結した、目的の遺伝子/コーディング配列の発現を指令できる任意の核酸構築物を含んでいる。そのようなカセットは、宿主細胞中へ発現カセットを移入するために、「ベクター」、「ベクター構築物」、「発現ベクター」、もしくは「遺伝子移入ベクター」内へ構築することができる。そこで、この用語は、クローニングおよび発現ビヒクルならびにウイルスベクターを含んでいる。
【0040】
第1ポリヌクレオチドは、それが第2ポリヌクレオチド、そのcDNA、それらの相補体の1領域と同一もしくは実質的に同一のヌクレオチド配列を有する場合、またはそれが上述した配列同一性を表示する場合は、第2ポリヌクレオチドに「由来する」または「対応する」。
【0041】
第1ポリペプチドは、それが(i)第2ポリヌクレオチドに由来する第1ポリヌクレオチドによってコードされるかまたは(ii)上述したように第2ポリペプチドに対する配列同一性を表示する場合は、第2ポリペプチドに「由来する」、または「対応する」。
【0042】
用語「投与する工程」などは、所望の薬理学的および/または生理学的作用を入手するためにGPCR調節因子を添加する工程をいう。多数の実施形態では、本GPCR調節因子は揮発性であり、したがってそれらは食材または大気への添加によって直接的もしくは間接的のいずれかで、経口もしくは鼻腔内投与される。この作用は臭気の知覚を完全もしくは部分的に防止することができる、臭気物質の知覚を増加させることができる、または新しい臭気を発生させることができる。
【0043】
用語「天然に存在しない」もしくは「組換え」は、人工的もしくはさもなければ天然では見いだされないことを意味する。組換え細胞は通常はその細胞内で見いだされない核酸を含有しており、組換え核酸は通常は自然では見いだされない2つ以上の核酸の融合体を含有しており、そして組換えポリペプチドは通常は組換え核酸によって産生される。
【0044】
「被験体」、「個体」、「宿主」および「患者」は、本明細書では交換可能に使用され、嗅覚GPCRを有する任意の動物、例えば哺乳動物、ヒトもしくは非ヒトをいう。一般に、被験体は哺乳動物被験体である。代表的な被験体には、ヒト、非ヒト霊長類、マウス、ラット、ウシ、ヒツジ、ヤギ、ブタ、イヌ、ネコ、およびウマを含むが必ずしもそれらに限定されず、特に関心対象となるのはヒトである。
【0045】
(発明の詳細な説明)
本発明は、細胞中で嗅覚GPCRを産生するための方法を提供する。一般に、本方法は、嗅覚GPCRをコードする核酸へ作動可能に連結したプロモーターを含有する発現カセットを大グリア細胞、例えばシュヴァン細胞もしくは希突起膠細胞中へ導入する工程と、および嗅覚GPCRを産生するために適切な条件下で前記細胞を維持する工程と、を含んでいる。さらに、嗅覚GPCRをコードする組換え核酸を含有する大グリア細胞、嗅覚GPCR活性の調節因子についてスクリーニングする方法、および大グリア細胞中で嗅覚GPCRを産生するためのキットも提供される。本発明は、例えば香味料および芳香剤の分析および同定において利用されるので、その結果として多種多様な研究および産業上の用途を有する。
【0046】
要約のセクションに提供するより、そして上述した背景技術および用語の定義によって提供したよりもはるかに詳細に本発明を説明する際に、嗅覚GPCRを産生する方法について最初に記載し、次に本発明の方法を実施する際に利用する組成物およびキットの説明を続ける。最後に、嗅覚GPCR活性の調節因子をスクリーニングする方法および臭気物質ミメティックをスクリーニングする方法について考察する。
【0047】
(嗅覚GPCRを産生するための方法)
1つの局面では、本発明は、細胞中で嗅覚GPCRを産生する方法を提供する。これらの方法を記載する際に、本方法において使用するための組成物を最初に記載しよう。
【0048】
(嗅覚Gタンパク質共役受容体)
用語「嗅覚Gタンパク質共役受容体」(もしくはその略語、例えば「嗅覚GPCR」)は、化学的感覚に含まれるGPCRスーパーファミリーの系統発生的に別個の当技術分野において認識されたサブファミリーの任意のメンバーをいう。嗅覚GPCRは、それらの全体が本明細書に特別に援用されるZozulya et al, (Genome Biol. 2:0018, 2001);Glusman et al, (Genome Res. 11:685−702, 2001)およびCrasto et al, (Nucleic Acids Res. 30:354−60, 2002)を含む、極めて多種多様な出版物および公共データベース内で一般的および詳細に開示されている。特に、Senselab.med.yale.eduのワールドワイドウェブサイトで見いだされる嗅覚GPCR配列のデータバース内で記載された嗅覚GPCRが関心の対象である。本方法において使用するために適切な代表的な嗅覚GPCRの非限定的リストは、特許請求の範囲の前に挿入した表1に提供した。表1は、European Bioinformatics Instituteのワールドワイドウェブサイトで見いだされるような、Swiss−Protデータベースからのタンパク質配列登録のアクセッション番号のリストである。表1に列挙したこれらのデータベース登録、特にそれらの登録に記載されたアミノ酸配列は、それらの全体が参考として本明細書に特別に援用される。
【0049】
嗅覚GPCRはヒト起源もしくは非ヒト動物起源のものであってよいことは明示的に企図されている。特定の実施形態では、非ヒト動物は、マウス、ラット、イヌ、またはニオイの識別的な鋭い感覚を備える任意の他の非ヒト動物であってよい。特定の実施形態では、嗅覚GPCRは昆虫(例、カ、アリ、アブラムシ、カブトムシ、ハエ、スズメバチ、ミツバチ、クモ、あるいはヒトもしくは非ヒト動物へ疾患を伝播する、または農作物もしくは観賞用植物に対する損害を引き起こす任意の昆虫)起源のものであってよい。特定の実施形態では、嗅覚GPCRはヒトのものである。
【0050】
本方法では天然GPCRおよび変更された天然嗅覚GPCRの両方を使用できることが認識されている。したがって、用語「嗅覚Gタンパク質共役受容体」は、さらにまたそれが対応する天然GPCRと同一リガンドに結合するように、変化した天然嗅覚GPCR(例、レポーターの付加などの付加、置換、欠失および挿入などによって変化した天然嗅覚GPCR)を含むことも企図されている。
【0051】
このため用語「嗅覚Gタンパク質共役受容体」は、表1に列挙したGPCRポリペプチドの変異体を含んでいる。言い換えると、本方法では任意の嗅覚GPCRの変異体を使用できる。このため特定の実施形態では、嗅覚GPCRは天然配列(例、NCBIのGenbankデータベースなどに寄託された配列など)に比較して変化した配列を有していてよい。例えば、嗅覚GPCRは、ポリペプチド内の任意の位置(例、C末端もしくはN末端、または内部位置)での任意の数のアミノ酸置換、アミノ酸欠失、もしくはアミノ酸付加を有する天然ポリペプチドであってよい。
【0052】
特定の実施形態では、嗅覚GPCRは融合タンパク質であり、例えば親和性タグドメインもしくはレポータードメインを含有していてよい。適切な親和性タグには、他の部分、通常は他のポリペプチド、最も一般的には抗体へ特異的に結合することのできる任意のアミノ酸配列が含まれる。適切な親和性タグには、当技術分野において公知のように、エピトープタグ、例えば、V5タグ、FLAGタグ、HAタグ(ヘマグルチニンインフルエンザウイルス由来)、mycタグなどが含まれる。適切な親和性タグには、さらに当技術分野において公知のように、それらに対する結合基質、例えばHIS、GSTおよびMBPタグが既知のドメイン、ならびにそれらに対する特異的結合パートナー、例えば抗体、詳細にはモノクローナル抗体を利用できる他のタンパク質由来のドメインが含まれる。適切な親和性タグには、さらに特異的に結合して適切な結合パートナー、例えばIgG Fc受容体を用いて検出できるIgG Fc領域などの任意のタンパク質−タンパク質相互作用ドメインが含まれる。そのような融合タンパク質が、N末端メチオニン残基が欠失しているかもしくは代替アミノ酸と置換されているGPCRとインフレームで融合された異種N末端ドメイン(例、エピトープタグ)を含有していてよいことは明示的に企図されている。特定の実施形態では、嗅覚GPCR融合タンパク質はそのN末端で、単独もしくはヘマグルチニンエピトープタグと組み合わせてロドプシンシグナルペプチドを含んでいてよい。特定の実施形態では、嗅覚GPCR融合タンパク質はアミノ酸配列MNGTEGPNFYVPFSNKTGVVYPYDVPDYAKLを有するN末端を含んでいてよいが、このときMNGTEGPNFYVPFSNKTGVVはロドプシンシグナルペプチドであり、YPYDVPDYAKLはヘマグルチニンエピトープタグである。融合タンパク質としての嗅覚GPCRの発現を可能にする発現カセットを構築することは当業者の技術の範囲内に明確に含まれる(例えば、Krautwurst et al, Cell 95:917−926, 1998を参照されたい)。目的のポリペプチドは最初に天然ポリペプチドから作製して、次に上述したとおり適切なレポーター/タグへ作動可能に連結させることができることは理解されている。他の実施形態では、嗅覚GPCRはGPCRのフラグメントであってよく、このとき前記GPCRフラグメントは生物活性である。
【0053】
適切なレポータードメインには、ポリペプチドの存在を報告できる任意のドメインが含まれる。親和性タグを使用して例えばタグへ特異的に結合する標識抗体を用いてポリペプチドの存在を報告できることは認識されているが、発光レポータードメインはより日常的に使用される。適切な発光レポータードメインには、ルシフェラーゼ(例えば、ホタル、ウミホタル(Vargula)、Renilla reniformisもしくはRenilla muelleri由来)、およびそれらの発光改変体が含まれる。その他の適切なレポータードメインには、蛍光タンパク質(例えば、クラゲ、サンゴならびにAequoria種、Renilla種、Ptilosarcus種、Stylatula種などの他の腔腸動物由来)、またはそれらの発光改変体が含まれる。これらのレポータータンパク質の発光改変体は当技術分野において極めてよく知られており、天然レポータータンパク質に比較して、より明るい、より薄暗い場合がある、または相違する励起および/または発光スペクトルを有することがある。例えば、一部の改変体は、それらがもはや緑色に見えないように変化させられている、そして当技術分野において公知のように、ブルー、シアン、イエロー、強化イエロー、レッド(各々、BFP、CFP、YFP、eYFPおよびRFPと名付ける)に見える、または他の発光スペクトルを有していることがある。他の適切なレポータードメインには、β−ガラクトシダーゼ、β−グルクロニダーゼ、クロラムフェニコールアセチルトランスフェラーゼ、および分泌された胚アルカリホスファターゼなどの生化学的変化もしくは変色を通してポリペプチドの存在を報告できるドメインが含まれる。一部の実施形態では、レポータードメインはRenillaルシフェラーゼ(例、pRLCMV;Promega社製、カタログ番号E2661)である。
【0054】
さらに、当技術分野において公知のように、親和性タグもしくはレポータードメインは、嗅覚GPCR内の任意の位置に存在していてよい。しかし、大多数の実施形態では、それらは嗅覚GPCRのC末端もしくはN末端に存在している。
【0055】
多数の実施形態では、嗅覚GPCRは嗅覚GPCRのライブラリーのメンバーである。典型的には、ライブラリーは複数のメンバーを含有するが、このとき複数は2以上、5以上、約10以上、約20以上、約50以上、約100以上、約200以上、約300以上、約500以上、約1,000以上、または約10,000以上まででさえあってよい。このためライブラリーは、約5、約10、約20、約30以上、約50以上、約100以上、約200以上、通常は約500以上まで、通常は約1,000以上までの嗅覚GPCRポリペプチドを含有していてよい。ライブラリーのメンバーは、正体が既知のもの、もしくは正体が知られていないもの、またはそれらの混合物であってよい。ライブラリーのメンバーは完全に1つの種由来であってよい、または複数の種由来であってよい。
【0056】
(嗅覚Gタンパク質共役受容体をコードする核酸)
核酸を操作するための遺伝子コードおよび組換え技術は知られており、そして嗅覚GPCRポリペプチドのアミノ酸配列は上述したので、嗅覚GPCRポリペプチドをコードする核酸の設計および産生は当業者の技術の範囲内に明白に含まれている。特定の実施形態では、標準組換えDNAテクノロジー(Ausubel, et al, Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995;Sambrook, et al., Molecular Cloning:A Laboratoty Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.)法が使用される。例えば、嗅覚GPCRコーディング配列は、本明細書において詳細に記載する必要のない多種多様な組み換え方法の1つもしくは組み合わせを用いてライブラリーの嗅覚GPCRコーディング配列から単離することができる。タンパク質をコードする核酸配列中でのヌクレオチドの引き続いての置換、欠失、および/または付加は、さらにまた標準的な組換えDNA技術を用いて実施することもできる。
【0057】
例えば、部位特異的変異誘発およびサブクローニングを使用すると、目的のポリペプチドをコードするポリヌクレオチド中の核酸残基を導入する/欠失させる/置換することができる。他の実施形態では、PCRを使用できる。目的のポリペプチドをコードする核酸は、さらにまたオリゴヌクレオチドから完全に化学合成によって作製することもできる(例、Cello et al., Science (2002) 297:1016−8)。
【0058】
特定の実施形態では、目的のポリペプチドをコードする核酸のコドンは、特定種、詳細には哺乳動物、例えばヒトもしくはマウス種の細胞中で発現させるために最適化される。
【0059】
本発明は、さらに本核酸を含むベクター(さらに「構築物」とも呼ばれる)を提供する。本発明の多数の実施形態では、本核酸配列は、配列が例えば発現カセットを形成するためのプロモーターを含む発現制御配列へ作動可能に連結した後に宿主内で発現されるであろう。本発現カセットは、典型的には宿主染色体DNAのエピソームまたは一体部分のいずれかとして宿主細胞中で複製できる発現ベクター内に配置される。一般に、発現ベクターは、所望のDNA配列を用いて形質転換されたそれらの細胞の検出を許容するために、選択マーカー、例えばテトラサイクリンもしくはネオマイシンを含有するであろう(例えば、参照して本明細書に組み込まれる米国特許第4,704,362号を参照されたい)。単一および二重発現カセットを含むベクターは当技術分野においてよく公知の(Ausubel, et al, Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995;Sambrook, et al., Molecular Cloning:A Laboratoty Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.)。適切なベクターには、ウイルスベクター、プラスミド、コスミド、人工染色体(ヒト人工染色体、細菌人工染色体、酵母人工染色体など)、ミニ染色体などが含まれる。レトロウイルス、アデノウイルスおよびアデノ随伴ウイルスベクターが使用されてよい。
【0060】
細胞中での目的のポリペプチドを産生するために、当業者は様々な発現ベクターを利用できる。1つの適切なベクターは、特定の実施形態において使用されるpCMVである。このベクターは、特許手続上の微生物の寄託の国際的承認に関するブダペスト条約の規定下で1998年10月13日にアメリカンタイプカルチャーコレクション(ATCC)(10801 University Blvd、20110−2209米国バージニア州マナッサス)へ寄託された。このDNAは、ATCCによって試験され、生存可能であると決定された。このATCCは、pCMVに次の寄託番号:ATCC番号203351を指定した。
【0061】
本発現カセットは通常、嗅覚GPCRをコードする単一オープンリーディングフレームを含んでいるが、しかし特定の実施形態では、嗅覚GPCRを発現させるための宿主細胞が真核細胞、例えばヒト細胞などの哺乳動物細胞である可能性があるので、オープンリーディングフレームはイントロンによって中断されることがある。本発現カセットは、典型的には本核酸に加えて、RNA安定性、翻訳効率などを指令することのできる3’および5’非翻訳領域(UTR)を含有していてよい転写単位の一部である。発現カセットは、さらにまた本核酸に加えて転写ターミネーターを含有する核酸の一部であってもよい。
【0062】
本発現カセットは、嗅覚GPCRを融合タンパク質として発現させることのできる核酸配列を含んでいてよい。特定の実施形態では、嗅覚GPCR融合タンパク質はそのN末端で、ロドプシンシグナルペプチドおよび/またはヘマグルチニンエピトープタグを含んでいてよい。特定の実施形態では、嗅覚GPCR融合タンパク質はアミノ酸配列MNGTEGPNFYVPFSNKTGVVYPYDVPDYAKLを有するN末端を含んでいてよいが、このときMNGTEGPNFYVPFSNKTGVVはロドプシンシグナルペプチドであり、YPYDVPDYAKLはヘマグルチニンエピトープタグである。融合タンパク質としての嗅覚GPCRの発現を可能にする発現カセットを構築することは当業者の技術の範囲内に明確に含まれる(例えば、Krautwurst et al, Cell
95:917−926, 1998を参照されたい)。
【0063】
真核細胞プロモーター(すなわち、真核細胞中で機能するプロモーター)は、ウイルスプロモーターおよび真核細胞遺伝子由来プロモーターを含む、大グリア細胞中で機能性である任意のプロモーターであってよい。代表的な真核細胞プロモーターには、次の:マウスメタロチオネインI遺伝子配列のプロモーター(Hamer et al., J. Mol. Appl. Gen. 1:273−288, 1982);ヘルペスウイルスのTKプロモーター(McKnight, Cell 31:355−365, 1982);SV40初期プロモーター(Benoist et al., Nature (London) 290:304−310, 1981);酵母gall遺伝子配列プロモーター(Johnston et al., Proc. Natl. Acad.
Sci. (USA) 79:6971−6975, 1982;Silver et al., Proc. Natl. Acad. Sci. (USA)81:5951−59SS, 1984)、CMVプロモーター、EF−1プロモーター、エクジソン応答性プロモーター、テトラサイクリン応答性プロモーターなどが含まれるが、それらに限定されない。ウイルスプロモーターは、それらは一般に特別に強力なプロモーターであるので、特に関心対象となることがある。特定の実施形態では、ウイルスプロモーターであるプロモーターが使用される。本発明において使用するためのプロモーターは、それらがその中に導入されている大グリア細胞(および/または動物)中で機能性であるように選択される。特定の実施形態では、プロモーターはCMVプロモーターである。
【0064】
特定の実施形態では、本ベクターはさらにまた選択可能なマーカーの発現も提供できる。適切なベクターおよび選択可能なマーカーは当技術分野においてよく知られており、Ausubel, et al (Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995)およびSambrook, et al, (Molecular Cloning:A Laboratoty Manual, Third Edition, (2001) Cold Spring Harbor, N.Y.)の中で考察されている。多種多様な遺伝子が選択可能なマーカーとして使用されてきており、選択可能なマーカーとして本ベクター内で使用される特定遺伝子は主として便宜上選択されている。既知の選択可能なマーカー遺伝子には:チミジンキナーゼ遺伝子、ジヒドロ葉酸還元酵素遺伝子、キサンチン−グアニンホスホリボシルトランスフェラーゼ遺伝子、CAD、アデノシンデアミナーゼ遺伝子、アスパラギンシンテターゼ遺伝子、抗生物質耐性遺伝子、例えばtetr、ampr、Cmrまたはcat、kanrもしくはneor(アミノ配糖体ホスホトランスフェラーゼ遺伝子)、ハイグロマイシンBホスホトランスフェラーゼ遺伝子などが含まれる。
【0065】
上述したように、嗅覚GPCRは、親和性ドメインおよび/またはレポータードメインを含有する融合タンパク質であってよい。例えばGPCRのC末端もしくはN末端で、レポーターもしくはタグとGPCRとの間の融合体を作製するための方法は、当業者の技術の範囲内に明確に含まれているので(例、McLean et al, Mol. Pharma. Mol Pharmacol. 1999 56:1182−91;Ramsay et al., Br. J. Pharmacology, 2001, 315−323)、これ以上は説明しない。そのような融合タンパク質が、N末端メチオニン残基が欠失しているかもしくは代替アミノ酸と置換されているGPCRとインフレームで融合された異種N末端ドメイン(例、エピトープタグ)を含有していてよいことは明示的に企図されている。目的のポリペプチドは最初に天然ポリペプチドから作製して、次に上述した適切なレポーター/タグへ作動可能に連結させることができることは理解されている。
【0066】
本核酸は、さらにまた通例は嗅覚GPCRをコードする核酸の構築を促進するために、制限部位、多重クローニング部位、プライマー結合部位、ライゲーション可能な末端、組換え部位なども含有していてよい。
【0067】
嗅覚GPCRは目的のポリペプチドのライブラリーのメンバーであってよいので、そのような目的のポリペプチドをコードする核酸は、類似サイズの嗅覚GPCRをコードする核酸のライブラリーであってもよい。
【0068】
(宿主細胞)
本明細書に記載した方法は、一般に培養大グリア細胞(すなわち、インビトロで培養された初代もしくは不死大グリア細胞)中で嗅覚GPCRを産生する工程を含んでいる。「大グリア細胞」は、シュヴァン細胞、希突起膠細胞および星状細胞ならびにそれらの誘導体を含む、様々なニューロン関連細胞タイプの任意の細胞を意味する。多数の実施形態では、適切な宿主細胞は、神経軸索の鞘を形成する物質であるミエリンを産生する「ミエリン産生」細胞であってよい。ミエリン産生大グリア細胞には、シュヴァン細胞、希突起膠細胞、ならびにミエリンを産生する所定タイプの星状細胞(例、嗅神経鞘細胞(olfactory sheathing cell))が含まれる。ミエリン産生細胞は、通常は、それらがミエリンの構成要素であるガラクトセレブロシド、galCを合成することによって同定できる。
【0069】
用語「大グリア細胞」には、さらにまた癌性大グリア細胞、例えば神経鞘腫、神経線維腫、星状細胞腫細胞、および希突起膠細胞腫;不死性大グリア細胞、例えばHPV E6−E7、T抗原などの適切な腫瘍遺伝子の導入によって不死化された細胞など;大グリア細胞が相違する(非大グリア細胞)もしくは同様の(大グリア細胞)タイプの細胞と融合される細胞融合によって産生されたハイブリッド細胞;ならびに例えば外因性核酸を含有している細胞のような組換え大グリア細胞、または例えばミエリンの合成のために必要とされる遺伝子もしくはミエリンの合成を阻害する遺伝子などの内因性遺伝子内での「ノックアウト」を含む大グリア細胞の改変バージョンが含まれる。大グリア細胞は、通例は齧歯類(例、マウス)もしくはヒトなどの哺乳動物種由来である。代表的な非限定的細胞系には、RN2およびEJ(Coulter−Mackie, Virus Research 1:477−487, 1984)、RN22(Kreider, Brain Research 397:238−244, 1986)、ならびにHOGおよびMO3.13(Buntinx, Journal of Neurocytology 32:25−38, 2003)が含まれる。嗅覚GPCR以外についての大グリア細胞組換え体は、用語「大グリア細胞」に含まれることが明示的に企図されている。
【0070】
したがって、大グリア細胞を培養する方法は当技術分野においてよく知られているので(例えば、Mosahebi Glia, 34:8−17, 2001;Shen, Microsurgery 19:356−63, 1999;Acta Neuropathol (Berl), 78:317−24, 1989;Barnett, Developmental Biology, 155:337−350, 1993;およびHung et al, International Journal of Oncology 20:475−482, 2002を参照されたい)、不死化HEI193細胞などを含む嗅覚GPCRを産生するために多種多様な適切な宿主細胞を利用できる。
【0071】
詳細には、シュヴァン細胞は次の方法を用いて培養することができる:Hung, (Int. J. Oncol. 20:475−82, 2002);Hung, (Int. J. Oncol. 1999 14:409−15);Wood, (Brain Res. 115:361−75, 1976);Wood, (Ann. N.Y. Acad. Sci. 605:1−14, 1990);およびBrockes, (J. Exp. Biol. Dec;95:215−30, 1981)。
【0072】
追加の細胞系は当業者には明白になるであろう、そしてアメリカンタイプカルチャーコレクション(10801 University Boulevard、バージニア州マナッサス20110−2209)から入手できる。
【0073】
(方法)
一般に本方法によると、嗅覚GPCR発現カセットがインビトロで大グリア細胞中に導入され、その細胞は嗅覚GPCRを発現させるために適する条件に曝され、そしてGPCRは細胞内で発現して、細胞表面へ輸送される。
【0074】
したがって、大多数の実施形態では、発現カセットは、ウイルス感染、トランスフェクション、接合、プロトプラスト融合、エレクトロポレーション、リン酸カルシウム沈降、直接マイクロインジェクションなどを含む様々な方法を用いて宿主細胞中へ導入されてよい。方法の選択は、一般に形質転換される細胞のタイプおよび形質転換が発生させられる状況(例、インビトロなど)に依存する。これらの方法についての一般的考察は、Ausubel, et al, Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995の中に見いだすことができる。
【0075】
細胞中へ嗅覚GPCRの発現カセットを導入した後、細胞は、典型的にはポリペプチド発現を生じさせるためにインキュベートされる。これを実施するために、細胞は12〜24時間、24〜48時間、または48〜96時間以上にわたり適切な培地中でインキュベートすることができる。ポリペプチドの一過性発現は、この方法で実施されてよい。これは明示的に企図されているが、しかしポリペプチドの発現はまたは安定性であってもよい。安定性トランスフェクションでは、発現カセットは選択可能なマーカー遺伝子を含有しており、ポリペプチドを発現する安定性細胞系の樹立は選択可能なマーカー遺伝子のための選択を含んでいる。2つの発現カセットが1つの細胞中に導入された場合は、2つの発現カセットは通常は相違する2つの選択可能なマーカー遺伝子(例、ネオマイシン耐性遺伝子およびハイグロマイシン耐性遺伝子)を含有している。一過性および安定性トランスフェクションの方法は、当業者にはよく公知である。
【0076】
嗅覚GPCRは大グリア細胞中で産生され、そして通常は、GPCRが原形質膜中に存在するように細胞表面へ輸送される。
【0077】
(組成物)
また別の局面では、本発明は生物活性嗅覚GPCRを産生する大グリア細胞を提供する。そのような細胞は、通常は嗅覚GPCRをコードする組換え核酸を含有しており、そして通常はその細胞(すなわち、組換え核酸の不在下の大グリア細胞)中で産生しない嗅覚GPCRを産生することができる。
【0078】
上述したように、本発明は、通常はGPCRに特徴的な方法で細胞の原形質膜にわたる大グリア細胞の表面で存在する(すなわち、検出可能に存在する)嗅覚GPCRを含有する大グリア細胞を提供する。したがって、本細胞は、それらがリガンドに結合できる、そして存在する場合は適切なGタンパク質を介してシグナルを伝達することができる点で「活性」嗅覚GPCRを含有している。そこで本細胞は、例えば以下で詳細に説明するスクリーニングアッセイなどの活性アッセイにおいて利用される。
【0079】
本細胞は、通常はその中に同一発現カセットが産生させられている例えばNIH−3T3細胞、COS細胞などのような非大グリア細胞のようなコントロール細胞のレベルより有意に高いレベルで嗅覚GPCRを産生する。大多数の実施形態では、本細胞は、モルベースで、コントロール細胞より少なくとも5×(「5倍」)、少なくとも10×、少なくとも50×、少なくとも100×、通常は少なくとも1,000×以上までのより多くの嗅覚GPCRを産生する。特定の実施形態では、本細胞は、モルベースで、コントロール細胞より少なくとも5×(「5倍」)、少なくとも10×、少なくとも50×、少なくとも100×、通常は少なくとも1,000×以上までのより多くの嗅覚GPCRを細胞表面で産生する(例えば、免疫細胞化学的方法またはフローサイトメトリーによって決定した場合に)。本細胞が液体培地中で増殖させられる場合は、それらは通常、例えば10μg/L超、100μg/L超、1mg/L超、10mg/L超もしくは約50mg/L以上の有意な量で嗅覚GPCRを産生する。特に、本細胞が液体培地中で増殖させられる場合は、それらは通常、例えば10μg/L超、100μg/L超、1mg/L超、10mg/L超もしくは約50mg/L以上の有意な量で細胞表面嗅覚GPCRを産生する。
【0080】
多数の様々な嗅覚GPCRがあるので、本発明は様々な嗅覚GPCRをコードする対応する複数の組換え核酸を含有する複数の大グリア細胞(すなわち、大グリア細胞のライブラリー)も提供する。これらの実施形態では、複数のうちの各大グリア細胞は、通常は単一嗅覚GPCRのための組換え核酸を含有しており、そして各細胞は相違する核酸を含有する。したがって、本発明は大グリア細胞のライブラリーを提供するが、それらの細胞は2以上、5以上、約10以上、約20以上、約50以上、約100以上、約200以上、約300以上、約500以上、約1,000以上の相違する嗅覚GPCRをコードする組換え核酸を含有している。嗅覚GPCRは、正体が既知かもしくは正体が未知の嗅覚GPCR、またはそれらの混合物であってよい。嗅覚GPCRは、単一種の動物由来であってよい、または2種、約5種まで、約10種まで、約50種まで、約100種まで、もしくは約1,000種までの動物由来のものであってよい。特定の実施形態では、嗅覚GPCRはヒトのものである。
【0081】
(キット)
本発明によって、さらにまた上述した本方法を実行するためのキットも提供される。本キットは、大グリア細胞、嗅覚GPCRをコードする核酸および嗅覚GPCRを含有する大グリア細胞のうちの1つ以上を少なくとも含んでいる。本キットの核酸は、他のプラスミド内へのライゲーションを促進するために制限部位、複数のクローニング部位、プライマー部位なども有してもよい。キットのその他のオプション構成要素には、本アッセイを実行するための、培養培地、GPCR活性を試験するための構成要素、およびGタンパク質をコードする核酸などが含まれる。本キットの様々な構成要素は個別容器中に存在していてよい、または必要に応じて特定の適合する構成要素が単一容器中で事前に合わされていてよい。
【0082】
上述の構成要素に加えて、本キットは、典型的には例えば嗅覚GPCRを産生する方法などの本方法を実行するためにキットの構成要素を使用するための指示書をさらに含んでいる。本方法を実行するための指示書は,一般には適切な記録媒体上に記録されている。例えば、指示書は紙もしくはプラスチックなどの基材上に印刷されてよい。したがって、指示書は、キットもしくはその構成要素の容器のラベル表示(すなわち、パッケージングもしくはサブパッケージングと結び付けて)などにおいて包装添付文書としてキット内に存在してよい。他の実施形態では、指示書は例えばCD−ROM、ディスクなどのような適切なコンピュータ可読記憶媒体上に存在する電子記憶データファイルとして存在する。また別の実施形態では、キット内に実際的な指示書は存在しないが、例えばインターネットを介して遠隔起源から指示書を入手するための手段が提供される。この実施形態の例は、指示書を見ることができる、および/またはそれから指示書をダウンロードすることのできるウェブのアドレスを含んでいるキットである。指示書と同様に、指示書を入手するためのこの手段は適切な基材上に記録されている。
【0083】
(嗅覚GPCR活性の調節因子を同定するための方法)
本発明は、嗅覚GPCR調節因子(すなわち、目的の嗅覚GPCRの活性を増加もしくは減少させる化合物)をスクリーニングする方法を提供する。特定の実施形態では、嗅覚GPCR調節因子は、アゴニスト、部分アゴニスト、インバースアゴニスト、およびアンタゴニストからなる群から選択される。一般に、本方法は、上述した方法によって生物活性嗅覚GPCRを産生する大グリア細胞(本明細書では「本大グリア細胞」と称する)を提供するために大グリア細胞中で嗅覚GPCRを産生する工程と、該細胞を候補因子と接触させる工程と、嗅覚GPCRの活性へ及ぼす候補因子の作用を評価する工程と、を含んでいる。
【0084】
他の実施形態では、嗅覚GPCRの調節因子(例、そのGPCRに対する天然もしくは合成リガンド)を、そのGPCRを産生する大グリア細胞と接触させることができ、そしてその調節因子が嗅覚GPCRの活性に及ぼす作用を評価することができる。さらにまた、2種の嗅覚GPCR調節因子、例えば嗅覚GPCRの活性化因子(例、そのGPCRに対するリガンド)およびその活性化因子の調節活性を遮断する物質を用いて実施されるアッセイも予期されている。
【0085】
当技術分野において公知のように、本アッセイは、例えば35S GTPγSを用いる膜結合アッセイ、アデニリルシクラーゼアッセイ(例、New England Nuclear社製のFLASH PLATETMアデニリルシクラーゼキット;カタログ番号SMP004Aを用いて)、細胞ベースcAMPアッセイ、レポーターベースアッセイ、AP1レポーターアッセイ、SRF−LUCレポーターアッセイ、細胞内IP3蓄積アッセイ、細胞内カルシウム濃度を測定するための蛍光測定イメージングプレートリーダー(FLIPR)アッセイなどの様々な方法を用いて実施することができる。
【0086】
調節因子が嗅覚GPCR活性を増加させる実施形態では、嗅覚GPCRの活性は、調節因子の存在下では、その因子の不在下における適切なコントロールに比較して、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約50%、少なくとも約80%、少なくとも約100%、少なくとも約500%、または少なくとも約10倍以上まで上昇する。適切なコントロールは、GPCRに対する天然リガンドの存在下もしくは不在下にあってよい。
【0087】
調節因子が嗅覚GPCR活性を減少させる実施形態では、嗅覚GPCRの活性は、調節因子の存在下では、その因子の不在下における適切なコントロールに比較して、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約50%、少なくとも約70%、少なくとも約80%、少なくとも約90%、または少なくとも約95%以上まで減少する。適切なコントロールは、GPCRに対する天然リガンドの存在下もしくは不在下にあってよい。
【0088】
特定の実施形態では、これらの方法は、試験化合物、例えば候補因子の存在下もしくは不在下でGPCR活性を測定する工程もまた含んでいる。これらのアッセイは、単離した本大グリア細胞(例、培養細胞)、本大グリア細胞から単離した膜、本大グリア細胞の抽出物を該GPCRの活性を調節するために有効な量のGPCR調節因子と接触させる工程を含んでいることがある。
【0089】
したがって、本発明は、リガンド、例えばそのGPCRに対する天然リガンドの存在下もしくは不在下で嗅覚GPCRの活性を減少させるための嗅覚GPCR活性の阻害剤、およびGPCR活性の誘導因子を提供するが、このときGPCRはそのGPCRの天然リガンドである、もしくは天然リガンドではない化合物によって誘導される。
【0090】
特定の実施形態では、GPCR活性はレポーターシグナルを評価することによって測定できる。これらの実施形態では、アッセイはハイスループットアッセイのために適切なフォーマット、例えば96もしくは384ウェルフォーマットで実施することができ、そして適切なロボット(例、ピペッティングロボット)および器具類(レポーター活性を決定するための96および384ウェルフォーマットの照度計もしくは蛍光リーダー)を使用できる。具体的に例示するためで限定するためではなく、レポーター活性を決定することは、Wallac 1450 Microbetaカウンター(Perkin−Elmer社製)またはCCDカメラを使用する照度計を使用できる。
【0091】
関連実施形態では、本アッセイは、候補因子の嗅覚GPCRへの結合が評価される結合アッセイであってよい。これらの実施形態では、候補因子は通常最初に標識され、本大グリア細胞と接触させられ、そして候補因子の大グリア細胞への結合が評価される。
【0092】
(候補因子)
多種多様な試験化合物は、上記の方法によってスクリーニングすることができる。試験化合物は極めて多数の化学物質のクラスを含んでいるが、典型的にはそれらは有機分子、好ましくは小さい有機化合物である(すなわち、50ダルトンより大きく、かつ約2,500ダルトン未満(例、100〜1,000Da、通常は約500Da未満)の分子量を有する化合物)。試験化合物は、タンパク質との構造的相互作用、詳細には水素結合のために必要な官能基を含んでおり、そして典型的には少なくとも1つのアミン、カルボニル、ヒドロキシルもしくはカルボキシル基、好ましくは化学官能基のうちの少なくとも2つを含んでいる。試験化合物は、しばしば環状炭素もしくは複素環の構造および/または上述した官能基の1つ以上で置換された芳香環もしくは多環芳香環構造を含んでいる。代表的および非限定的試験化合物は、脂肪族系酸、アルコール、ケトン、およびエステル;芳香環、脂環、多環および複素環の構造を備える化学物質;およびこれらのタイプ各々の無数の置換化学物質、ならびにそれらの組み合わせを含んでいる。試験化合物は、さらにまたペプチド、糖類、脂肪酸、ステロイド、プリン、ピリミジン、誘導体、構造的アナログもしくはそれらの組み合わせを含む生体分子間でも見いだされる。さらにまた別の試験化合物は、GPCRの天然リガンドの改変体を含んでいる。
【0093】
試験化合物は、合成もしくは天然化合物のライブラリーを含む極めて広範囲の起源から入手できる。例えば、ランダム化オリゴヌクレオチドおよびオリゴペプチドの発現を含む、広範囲の有機化合物および生体分子のランダム合成および指向性合成のために極めて多数の手段を利用することができる。あるいは、細菌、真菌、植物および動物抽出物の形状にある天然化合物のライブラリーを利用できる、または容易に産生できる。ライブラリーは、ニオイと結び付けられた天然または合成生成化合物を優先的に含んでいる可能性がある。さらに、天然もしくは合成生成ライブラリーおよび化合物は、従来型の化学的、物理的および生化学的手段を通して容易に改変され、コンビナトリアルライブラリーを生成するために使用できる。既知の薬理学的物質は、アシル化、アルキル化、エステル化、アミド化などのような構造的アナログを産生するための指向性もしくはランダム化学修飾に曝すことができる。
【0094】
関心対象であるのは、ポリペプチド、例えばタンパク質様物質である試験化合物である。目的の特定タイプのポリペプチド試験化合物は、GPCRに対する抗体、またはそれらのGPCR結合フラグメントである。この抗体はモノクローナルもしくはポリクローナルであってよく、当技術分野において公知の方法によって産生することができる。また別の試験化合物は、既知の天然リガンドのあるGPCRについては、例えば少なくとも1つのアミノ酸の置換、欠失もしくは付加によって変化させられているかまたは化学修飾された天然リガンドである、GCPRの天然リガンドの改変体を含んでいる。特定の実施形態では、試験化合物はGPCRのリガンドであるとは知られていない内因性ポリペプチドを含んでいる。
【0095】
試験化合物の上記の特性解析は、例示するためで限定的ではないことが企図されている。
【0096】
(嗅覚GPCRのリガンドとしての候補因子を同定する方法)
嗅覚GPCRのリガンドは、候補因子と嗅覚GPCRとを接触させる工程と、候補因子が嗅覚GPCRへ結合するかどうかを決定する工程とによって同定できるが、このとき前記結合は候補因子が嗅覚GPCRのリガンドであるという指標となる。特定の実施形態では、候補因子は標識することができる。特定の実施形態では、候補因子は放射標識することができる。
【0097】
本候補因子内に組み込むことができる適切な放射性核種は、2H(ジュウテリウム)、3H(トリチウム)、11C、13C、14C、13N、15N、15O、17O、18O、18F、35S、36Cl、82Br、75Br、76Br、77Br、123I、124I、125Iおよび131Iを含むがそれらに限定されない。3H、14C、82Br、125I、131I、35Sの組込みは、概して最も有用な可能性がある。
【0098】
放射性同位体を有機化合物内に組み込むための合成方法は、本候補因子に適用することができ、当技術分野において周知である。これらの合成方法、例えば標的分子内への活性レベルのトリチウムの組込みは下記のとおりである:
A. トリチウムガスを用いた触媒還元 − この手順は、通常は高比活性生成物を産生し、ハロゲン化もしくは未飽和前駆物質を必要とする。
B. 水素化ホウ素ナトリウム[3H]を用いた還元 − この手順は余り費用がかからず、アルデヒド、ケトン、ラクトン、エステルなどの還元性官能基を含有する前駆物質を必要とする。
C. 水素化アルミニウムリチウム[3H]を用いた還元 − この手順は、ほぼ理論的比活性で生成物を提供する。これもまた、アルデヒド、ケトン、ラクトン、エステルなどの還元性官能基を含有する前駆物質を必要とする。
D. トリチウムガス曝露による標識化 − この手順は、適切な触媒の存在下で置換可能な陽子を含有する前駆物質をトリチウムガスへ曝露させることを含んでいる。
E. ヨウ化メチル[3H]を用いたN−メチル化 − この手順は、高比活性ヨウ化メチル(3H)を用いて適切な前駆物質を処理することによって、通常はO−メチルもしくはN−メチル(3H)生成物を調製するために使用される。この方法は、一般に例えば約70〜90Ci/mmolなどのより高い比活性を可能にする。
【0099】
125Iの活性レベルを標的分子中へ組み込むための合成方法は下記を含んでいる:
A. サンドマイヤー(Sandmeyer)および類似反応 − この手順はアリールもしくはヘテロアリールアミンをテトラフルオロホウ酸塩などのジアゾニウム塩へ、そして引き続きNa125Iを用いて125I標識化合物へ転換させる。代表的な手順は、Zhu,D.−G. and co−workers、J. Org Chem.2002,67,943−948によって報告された。
B. フェノールのオルト125ヨウ素化 − この手順はCollier, T. L. and co−workers、J. Labeled Compd Radiopharm.1999,42,S264−S266.によって報告されたように、フェノールのオルト位置での125Iの組込みを可能にする。
C. 125Iを用いたアリールおよびヘテロアリールブロミドの置換 − この方法は、一般に2段階プロセスである。第1工程は、例えばPd触媒反応[すなわち、Pd(Ph3P)4]を用いて、またはトリ−アルキルスズハライドもしくはヘキサアルキルジスズ[例、(CH3)3SnSn(CH3)3]の存在下でアリールもしくはヘテロアリールリチウムを通しての、アリールもしくはヘテロアリールブロミドから対応するトリーアルキルスズ中間物への変換である。代表的な手順は、Bas, M.−D. and co−workers、J. Labeled Compd Radiopharm.2001,44,S280−S282によって報告された。
【0100】
嗅覚GPCRのリガンドは、あるいはまた嗅覚GPCRの標識した既知のリガンドの存在下で候補因子と嗅覚GPCRとを接触させることによって同定できるが、このとき候補因子の存在下での標識した既知のリガンドの結合の減少は候補因子が嗅覚GPCRのリガンドであるという指標である。
【0101】
(臭気物質ミメティックを同定するための方法)
本発明はさらにまた、臭気物質ミメティックを同定する方法を提供するが、このときミメティックは特定臭気物質と類似の、実質的に同様もしくは同一の機能的特徴を有するが、該臭気物質とは相違する化学構造を有する合成もしくは天然化合物である。言い換えると、本発明は目的の臭気物質と同一の「ニオイがする」が、目的の臭気物質と同一の化学構造を有していない臭気物質ミメティックを同定する方法を提供する。一般に、これらの方法は、上述した方法を用いて1ライブラリーの嗅覚GPCRを産生する工程と、目的の臭気物質によって活性化される1セットの嗅覚GPCRを同定する工程と、および同一セットの嗅覚GPCRを活性化する物質を同定するために該ライブラリーの嗅覚GPCRを候補因子と接触させる工程と、を含んでいる。大多数の実施形態では、目的の臭気物質と同一セットの嗅覚GPCRを活性化する因子は目的の臭気物質のミメティックである、すなわち目的の臭気物質と類似の臭気を有しているはずである。
【0102】
したがって、これらの方法は、上述した方法を用いて通常はライブラリー(例、100以上、200以上、300以上、400以上、500以上、600以上、通常は約1,000以上まで)の様々な嗅覚GPCRを産生する工程と、およびそれらが目的の臭気物質、例えば所望のニオイもしくは味覚を有する既知もしくは未知の化学構造の化合物によって活性化されるかどうかを決定するためにGPCRを評価する工程と、を含んでいる。多数の実施形態では、目的の臭気物質は1セットの嗅覚GPCRを活性化するであろうが、このとき1セットは通常2〜50、2〜20または3〜10種のメンバーを含有する。単一臭気物質によって活性化された嗅覚GPCRのセットは「GPCRフィンガープリント」を提供するが、このとき単一臭気物質はそれが活性化する嗅覚GPCRのセットによって規定される。目的の臭気物質に対するミメティックは、目的の臭気物質と同一もしくはほぼ同一のGPCRフィンガープリントを有する因子を同定するために候補因子のライブラリーをスクリーニングすることによって同定することができる。
【0103】
例えば、臭気物質ミメティックは、目的の臭気物質のフィンガープリントに類似する、例えば該ミメティックは該臭気物質によって活性化された場合のGPCRまたはGPCR活性の約60%、約75%、約80%、約90%、約95%のGPCRを活性化する、活性化GPCRの「フィンガープリント」を有すると同定できる。
【0104】
したがって、目的の臭気物質のミメティックを同定できる。
【0105】
(バイオセンシング法)
本発明は、バイオセンサーをさらに提供するが、このときバイオセンサーは、典型的には複数の相違する嗅覚GPCRを産生する複数の大グリア細胞である。多数の実施形態では、細胞はアドレス指定可能なフォーマットで配列されるが、このときそのアレイの各アドレスは単一組換え嗅覚GPCRを産生する大グリア細胞を含有している。典型的には、前記複数は2以上、5以上、約10以上、約20以上、約50以上、約100以上、約200以上、約300以上、約500以上、約1,000以上、または約10,000以上まででさえあってよい。このためバイオセンサーは、約5、約10、約20、約30以上、約50以上、約100以上、約200以上、通常は約500以上まで、通常は約1,000以上までの組換え嗅覚GPCRを含有していてよい。嗅覚GPCRは、正体が既知の、もしくは正体が知られていない嗅覚GPCR、またはそれらの混合物であってよい。嗅覚GPCRは、単一種の動物由来であってよい、または2種、約5種まで、約10種まで、約50種まで、約100種まで、もしくは約1,000種までの動物由来であってよい。特定の実施形態では、嗅覚GPCRはヒトのものである。
【0106】
本明細書に記載した方法は、単一組換え嗅覚GPCRを産生する前記大グリア細胞を「親和性基材」へ結合させることを含んでいる。特定の実施形態では、前記親和性基材はアドレス指定可能である。特定の実施形態では、前記アドレス指定可能な親和性基材は空間的にアドレス指定可能である。親和性基材は固体、半固体、もしくは不溶性支持体を含有しており、前記組換え大グリア細胞の結合のために適切な任意の材料から製造され、使用された検出方法を妨害しない。当業者には理解されるように、可能な親和性基材の数は極めて多い。可能な基材には、ガラスまたは改変されたガラスかまたは機能化ガラス、プラスチック(アクリル、ポリスチレンおよびスチレンと他の物質とのコポリマー、ポリプロピレン、ポリエチレン、ポリブチレン、ポリウレタン、Teflonなどを含む)、多糖類、ナイロンもしくはニトロセルロース、樹脂、ケイ素またはシリコンもしくは改変シリコンを含むケイ素に基づく物質、炭素、金属、無機ガラス、プラスチック、セラミックおよび多種多様な他のポリマーが含まれるが、それらに限定されない。好ましい実施形態では、基材は光学的検出を許容するが、それら自体は感知できるほど蛍光を発することも発光することもない。さらに、当技術分野において公知のように、基材はデキストラン、アクリルアミド、ゼラチン、アガロース、ウシおよびその他の哺乳動物血清アルブミンを含むタンパク質などの生体適合性物質などのポリマーを含む任意の数の物質で被覆され得る。
【0107】
「空間的にアドレス指定可能な」親和性基材は、各領域が特定の事前に決定された場所(「アドレス」)にあるように、複数の別個の領域(例、複数の目的のポリペプチド結合領域)を有する。マルチウェルマイクロタイタープレートはアドレス指定可能であり(各ウェルが1つのアドレスを有する)、1アレイのキャピラリーカラムはアドレス指定可能であり、固体支持体(例、ナイロンもしくはニトロセルロース膜)上に配置された1アレイのサンプルはアドレス指定可能である。本明細書に記載の方法に使用するための親和性基材は、典型的には少なくとも4以上、少なくとも約12、少なくとも約24、少なくとも約48、少なくとも約96もしくは少なくとも約384のアドレス指定可能な領域を有する。特定の実施形態では、親和性基材は、ハイスループットアッセイのために適切なアドレス指定可能なフォーマットに、例えば24、48、96もしくは384ウェルフォーマットにある。
【0108】
そのようなマルチウェルフォーマットは、ロボット(例、ピペッティングロボット)、およびその他の器具類(レポーター活性の決定のための96もしくは384ウェルフォーマットの照度計(illuminator)もしくは蛍光リーダー)による使用のために適切である。具体的に例示するためであって限定するためではなく、レポーター活性はCCDカメラに基づく照度計を用いて測定できる。
【0109】
使用時には、そのようなバイオセンサーは通常はサンプルと接触させられ、そして組換え嗅覚GPCRの各々の活性化が評価される。目的の臭気物質の存在は、事前に決定された嗅覚GPCRのサブセットの活性化によって検出されるが、このとき事前に決定された嗅覚GPCRのサブセットは、その臭気物質の以前に決定された「GPCRフィンガープリント」に対応する。したがって、目的の臭気物質に対する事前に決定された嗅覚GPCRのサブセットが該サンプルによって活性化された場合は、目的の臭気物質が該サンプル内に存在する。
【0110】
また別の使用時には、そのようなバイオセンサーは通常は臭気物質と接触させられ、そして組換えGPCRの各々の活性化が評価される。その臭気物質に対する「フィンガープリント」の同定は、活性化された嗅覚GPCRのサブセットに基づいて指定される。前記の別の使用の変形では、前記接触させる工程は、バイオセンサーの嗅覚GPCRに対する1つ以上のアゴニストの存在下で、臭気物質へ「フィンガープリント」を指定するまた別の手段を表す、前記1つ以上のアゴニストの存在下で該臭気物質によって活性化されたGPCRのサブセットを用いて実施されてよい。アゴニスト、インバースアゴニストもしくはアンタゴニストの存在下で1つ以上の嗅覚GPCRの活性を臭気物質の「フィンガープリント」内へ組み込めることが企図されている。
【0111】
特定の実施形態では、GPCR活性化は、GPCR活性化の発光レポーターを用いて検出することができる。例えば、以下で説明するようなルシフェラーゼ/GFPに基づくアッセイ、またはその変形などの任意の発光レポーター(例、蛍光レポーターなど)アッセイをこれらのアッセイのために使用できる。
【0112】
特定の実施形態では、臭気物質への1つ以上の嗅覚GPCRの活性化は、例えば例示するためであり限定するためではなく事前に規定された最高応答の0〜10%、11〜25%、26〜50%、51〜75%、もしくは76〜100%のなどの特定レベルであるとスコア付けすることができる。臭気物質の「フィンガープリント」は、少なくとも一部には1つ以上の嗅覚GPCRの活性化のレベルによって決定され得ることが企図されている。
【0113】
したがって、本発明は、嗅覚GPCRを含有するアドレス指定可能な大グリア細胞のアレイを含有する発光バイオセンサーを提供するが、このとき目的の臭気物質は該バイオセンサーからの特定光パターンの発光によって検出することができる。
【0114】
特定の実施形態では、試験すべきサンプルは環境上の試験サンプル、例えばガス(呼吸可能な大気または起源もしくは組成が知られていないガスのサンプルなど)、液体(水または起源もしくは組成が知られていない液体のサンプルなど)、または任意の固体のサンプルである。
【0115】
上述したバイオセンサー法は、例えば、例えばニオイについての知識が犯罪の被疑者の逮捕を導くことのある犯罪現場;特定の化学物質、例えば生物学/化学戦物質が検出される可能性がある紛争地帯(例、戦場);例えば特定の汚染物質または望ましい、もしくは望ましくないニオイを検出できる食品材料;および望ましい、もしくは望ましくない嗅覚感覚のどちらかへの特定の嗅覚GPCRもしくは特定サブセットの嗅覚GPCRの合理的指定において;および有害化学物質を監視することが望ましい研究所において;および一般に、目的の臭気物質を監視もしくは検出することが望ましい任意の状況において特に利用される。
【0116】
目的の臭気物質は、一般にヒト嗅覚系の嗅覚GPCRによって検出できる任意の化合物、例えばニオイを嗅ぐことによって検出できる任意の化合物を含んでいる。臭気物質は、精製化合物の場合がある、または(例えば、複雑な組成の)未精製化合物の場合がある。そのような臭気物質は、脂肪族系酸、アルコール、ケトン、およびエステル;芳香環、脂環、多環および複素環の構造を備える化学物質;およびこれらのタイプ各々の無数の置換化学物質、ならびにそれらの組み合わせを含むがそれらに限定されない。
【0117】
(有用性)
嗅覚GPCRを産生する本方法は、特に食品および芳香剤に関連する様々な研究および産業上の用途において利用される。
【0118】
多くの用途では、製品、例えば食品もしくは芳香剤を改良する、すなわち必要に応じて、上述した方法を用いて同定された嗅覚GPCR調節因子の添加によって、幾分望ましいものにすることができる。一般に、そのような調節因子は、通常は例えば食品材料または香水などの芳香剤のような製品と、それらの製品の味もしくはニオイを改良するために混合される。多数の実施形態では、調節因子は嗅覚GPCR活性の阻害剤であってよく、このために不愉快な味もしくはニオイを「マスキング」することができる。他の実施形態では、調節因子は特定の嗅覚GPCRの活性因子であってよく、そしてそれが添加される物質にとっての新しい香味料もしくは芳香剤を改善もしくは添加するために使用できる。他の実施形態では、調節因子は特定の嗅覚GPCRの活性因子であってよく、殺虫剤の有効性を改良するために使用できる。特定の実施形態では、毒物および医薬品などの一部の製品のニオイをそれらが間違って消費されないように望ましくないようにすることが有益である。この場合には、不愉快なニオイを提供する物質は上述した方法によって見いだし、そしてそれらの製品へ添加することができる。
【0119】
他の用途では、望ましい臭気物質(例、ある種の珍しい花から入手され、現代の多数の香水のための出発物質として使用される臭気物質)を提供する費用は、上述した方法を用いてその臭気物質のミメティックを同定することによって減少させることができる。そのような実施形態では、これらのミメティックは望ましい臭気物質より実質的に低い価格で製造することができ、そして例えば香水などの製品中に望ましい臭気物質を補給するか、または置換するために使用できる。
【0120】
他の用途では、個体によって生成された特定臭気物質の検出は、疾患もしくは障害に関連するので診断的もしくは予後的価値を有する可能性があり、このとき特定臭気物質の上昇もしくは減少は前記疾患もしくは障害と関連付けられている。
【0121】
当然ながら、上述した方法を用いて入手された嗅覚GPCR調節因子を様々な個体に投与することができる。一般に、そのような個体は哺乳動物もしくは哺乳類であり、このときこれらの用語は食肉目(例、イヌおよびネコ)、齧歯目(例、マウス、モルモット、およびラット)、および霊長目(例、ヒト、チンパンジー、およびサル)、ならびに例えばウシ、ヒツジ、ブタおよびウマなどの産業上重要な哺乳動物を含む哺乳綱に含まれる生物体を記載するために広範囲に使用されている。非哺乳類動物にもまた上述した方法を用いて入手された嗅覚GPCR調節因子を投与することができることが企図される。代表的および非限定的非哺乳類動物には、鳥類(例、ニワトリ)、爬虫類、魚類、節足動物、および昆虫類(例、カ、アリ、アブラムシ、カブトムシ、ハエ、スズメバチ、ミツバチ、クモ、あるいはヒトもしくは非ヒト動物へ疾患を伝播する、または農作物もしくは観賞用植物に対する損害を引き起こす任意の昆虫)が含まれる。多数の実施形態では、個体はヒトであろう。
【実施例】
【0122】
下記の実施例は、当業者に本発明の作製および使用方法についての完全な開示および説明を提供できるように記載するが、本発明者らが発明と見なしている範囲を限定することを企図しておらず、下記の実験が実施された実験のすべてである、またはそれらだけが実施された実験であることを表すことも企図していない。
【0123】
本発明はその特定の実施形態を参照しながら説明してきたが、当業者には、本発明の真の精神および範囲から逸脱せずに、様々な変更を加えたり、同等物を置換したりできることが理解されるはずである。さらに、本発明の目的、精神および範囲に、特定の状況、材料、組成物、工程、1つ以上の工程を適合させるために多数の改変を加えることができる。すべてのそのような改変は、本発明の範囲内にあることが企図されている。
【0124】
(実施例1:シュヴァン細胞中での嗅覚GPCRの発現)
初代ラットシュヴァン細胞の単離:
シュヴァン細胞の調製は以前に記載されたとおりに実施した(例、Hung, Int. J. Oncol. 20:475−82, 2002;Hung, Int. J. Oncol. 1999 14:409−15;Wood, Brain Res. 115:361−75, 1976;Wood, Ann. N.Y. Acad. Sci. 605:1−14, 1990;およびBrockes, J. Exp. Biol. Dec;95:215−30, 1981など)。手短には、P1ラット新生児由来の坐骨神経を採取し、10%熱不活化ウシ胎児血清を補給したダルベッコの改変イーグル培地中で細胞を維持した。2μMフォルスコリンおよびウシ下垂体抽出物(Sigma社製)を用いてシュヴァン細胞を拡張(expand)させた。第3継代まで細胞を増殖させ、保管するために冷凍した。
【0125】
嗅覚GPCRの一過性トランスフェクション:
第5継代のシュヴァン細胞を1ウェル当たり8×104細胞でポリ−D−リジンを被覆した8ウェルチャンバースライド(Falcon社製)上に蒔いた。Fugene 6試薬(Roche社製)およびOptimem血清無含有培地(Invitrogen社製)を用いて、0.5μgの嗅覚GPCR発現プラスミドによりシュヴァン細胞をトランスフェクトした。トランスフェクトした細胞は、4時間にわたり37℃の5% CO2加湿インキュベーター内で維持した。PBSを用いて細胞を洗浄し、新鮮増殖培地と取り換えた。24時間後、細胞を発現についてアッセイした。
【0126】
HA染色によって決定した嗅覚GPCRの発現分析:
PBSCM(PBS+0.5mM Ca2++1mM MgCl2)を用いてトランスフェクトした細胞を洗浄し、4%ホルマリンを用いて固定した。50mM NH4Cl/PBSCMを用いて細胞をクエンチし、2回洗浄した。一次抗体抗マウスHA(Roche社製)をブロッキングバッファー(トリトンなしのPBSCM中の2% BSA)中で1:1,000に希釈し、細胞上に1時間放置した。PBSCMを用いて3回洗浄した後、二次抗体(Alexa 488結合体化ロバ抗マウスIgG)1:2,000およびDAPI 1:2,000は暗所で30分間にわたり細胞上に放置した。細胞はPBSCMを用いて3回洗浄し、フルオロセーブ(flourosave)(Calbiochem社製)を被覆してカバースリップを被せた。細胞は適切なUVフィルターによって分析した。
【0127】
それらの表面上で嗅覚GPCRを産生する細胞が観察された(図1を参照)。
【0128】
(実施例2:GPCR活性化のアッセイ)
受容体の発現:
大グリア細胞の一過性トランスフェクションは初代ラットシュヴァン細胞について実施例1に記載したとおりに実施できる。大グリア細胞系の安定性トランスフェクションは、本明細書に記載したとおりに実施できる。
【0129】
約12×106個の大グリア細胞を15cm組織培養プレート上に蒔き、10%ウシ胎児血清および1%ピルビン酸ナトリウム、L−グルタミン、および抗生物質を含有するDME高グルコース培地中で増殖させる。大グリア細胞を蒔いた24時間後(または約80%のコンフルエンシーまで)、12μgのDNAを用いて細胞をトランスフェクトする。12μgのDNAを60μLのリポフェクトアミンおよび血清を含有していない2mLのDME高グルコース培地と合わせる。プレートから培地を吸引し、血清を含有しない培地を用いて細胞を1回洗浄する。DNA、リポフェクトアミン、および培地混合物を、血清を含有しない10mLの培地と一緒にプレートへ添加する。37℃で4〜5時間インキュベートした後、培地を吸引し、血清を含有する培地25mLを添加する。トランスフェクションの24時間後、培地を再び吸引し、血清を含有する新鮮培地を添加する。トランスフェクションの48時間後、培地を吸引し、最終濃度500μg/mLで、ジェネティシン(G418薬)を含有する血清含有培地を添加する。トランスフェクトした細胞を、今度はG418耐性遺伝子を含有する陽性トランスフェクト細胞についての選択を受けさせる。培地は、選択が発生すると4〜5日間毎に取り換える。選択中、安定性プールを作製するために細胞を増殖させるかまたは安定性クローン選択のために細胞を分割する。
【0130】
膜結合アッセイ:
[35S]GTPγSアッセイ:Gタンパク質共役受容体がリガンド結合または構成性活性化のいずれかの結果として活性状態にある場合は、受容体はGタンパク質に共役し、GDPの放出およびそれに続くGTPのGタンパク質への結合を刺激する。Gタンパク質受容体複合体のαサブユニットはGTPaseとして機能し、GTPからGDPへ緩徐に加水分解し、その時点で受容体は通常不活性化される。活性化された受容体は、GTPをGDPに置換し続ける。非加水分解性GTPアナログである[35S]GTPγSを利用すると、活性化受容体を発現する膜への[35S]GTPγSの強化された結合を証明することができる。活性化を測定するために[35S]GTPγS結合を使用することの長所は:(a)これが一般にすべてのGタンパク質共役受容体へ適用できること;
(b)これは膜表面の近位に存在するので細胞内カスケードに影響を及ぼす分子を取り上げる可能性を低くさせることである。
【0131】
本アッセイは、Gタンパク質共役受容体が関連受容体を発現する膜への[35S]GTPγS結合を刺激する能力を利用する。このため本アッセイは、内因性GPCRおよび非内因性の構成的に活性化されたGPCRについて候補化合物をスクリーニングするために直接同定方法において使用できる。本アッセイは一般的であり、すべてのGタンパク質共役受容体での新薬発見に適用される。
【0132】
[35S]GTPγSアッセイは20mM HEPES、1〜約20mM MgCl2(この量は結果を最適化するために調整できるが、20mMが好ましい)pH7.4、約0.3〜約1.2nM[35S]GTPγS(この量は結果を最適化するために調整できるが、1.2が好ましい)および12.5〜75μg膜タンパク質(この量は最適化するために調整できる)を備える結合バッファーおよび10μM GDP(この量は最適化するために変更できる)中で1時間にわたりインキュベートする。コムギ胚芽凝集素ビーズ(25μL;Amersham社製)を次に添加し、この混合物を室温でさらに30分間インキュベートする。これらのチューブを次に室温で5分間、1500×gで遠心し、シンチレーションカウンターで計数する。
【0133】
アデニリルシクラーゼ
細胞ベースアッセイのために設計されたFlash PlateTMアデニリルシクラーゼキット(New England Nuclear社製;カタログ番号SMP004A)は粗原形質膜と一緒に使用するために改変することができる。Flash Plateウェルは、cAMPを認識する特異的抗体も含有するシンチラントコーティングを含有していてよい。ウェル内で生成されたcAMPは、cAMP抗体への放射性cAMPトレーサーの結合について直接競合によって定量することができる。下記は、受容体を発現する細胞全体中でのcAMPレベルの変化を測定するための手短なプロトコールとして役立つ。
【0134】
一過性トランスフェクションの約24時間後にトランスフェクトした細胞を採取した。注意深く培地を吸引して取り除き、廃棄した。各皿の細胞へ10mLのPBSを穏やかに添加し、次に注意深く吸引する。1mLのSigma社製細胞解離バッファーおよび3mLのPBSを各プレートへ添加する。ピペットを用いてプレートから細胞を取り出し、50mLの円錐形遠心チューブ内へ細胞懸濁液を収集した。細胞は室温で5分間かけて1,100rpmで遠心した。細胞ペレットを適切な容量のPBS(約3mL/プレート)中へ注意深く再懸濁させた。血球計数器を用いて細胞数を計数し、追加のPBSを添加して適切な数の細胞(約50μL/ウェルの最終容量)を得た。
【0135】
cAMP標準物質および検出用バッファー(11mLの検出用バッファーに対して1μCiのトレーサー[125I cAMP]50μL)を含む)を調製し、製造業者の指示書にしたがって維持した。アッセイバッファーはスクリーニングのために新しく調製したが、50μLの刺激バッファー、3μLの試験化合物(12μMのアッセイ最終濃度)および50μLの細胞を含有していた。アッセイバッファーは使用時まで氷上に保管した。50μLのcAMP標準物質を適切なウェルへ添加し、次にウェルH−11およびH12へ50μLのPBSAを添加することによってアッセイを開始した。50μLの刺激バッファーを全ウェルへ添加した。試験化合物の12μMの最終アッセイ濃度および100μLの全アッセイ容量で、3μLの化合物溶液を分注できるピン状ツールを用いてDMSO(もしくは選択した候補化合物)を適切なウェルへ添加した。次に細胞をウェルへ添加し、室温で60分間インキュベートした。トレーサーcAMPを含有する100μLの検出ミックスをウェルへ添加した。プレートをさらに2時間インキュベートし、次にWallac MicroBetaシンチレーションカウンターで計数した。cAMP/ウェルの数値は、各アッセイプレート内に含有された標準cAMP曲線から外挿した。
【0136】
Gi共役標的GPCRに対する細胞ベースcAMP:
TSHRは、活性化されるとcAMPの蓄積を誘発するGs共役GPCRである。TSHRは、アミノ酸残基623を突然変異させること(すなわち、アラニン残基をイソロイシン残基へ変化させること)によって構成的に活性化される。Gi共役受容体はアデニリルシクラーゼを阻害し、そしてこのためcAMP産生のレベルを減少させると予想され、cAMPレベルの評価を難題にする可能性がある。Gi共役受容体の構成的活性化の指標としてのcAMPの産生の減少を測定するために有効な技術は、cAMPのベースラインレベルを確定するために、最も好ましくは「シグナルエンハンサー」としての非内因性の構成的に活性化されたTSHR(TSHR−A623I)(もしくは内因性の構成的に活性なGs共役受容体)を、Gi連結標的GPCRを用いてコトランスフェクトすることによって遂行できる。Gi共役受容体の非内因性バージョンを作製すると、標的GPCRの非内因性バージョンは次にシグナルエンハンサーを用いてコトランスフェクトされ、スクリーニングのために使用できるのはこの物質である。本発明者らは、cAMPアッセイが使用される場合はシグナルを効果的に産生するためにそのようなアプローチを利用する;このアプローチは、好ましくはGi共役受容体に対する候補化合物の直接的同定において使用される。Gi共役GPCRに対してこのアプローチを使用した場合は、標的GPCRのインバースアゴニストはcAMPシグナルを増加させ、アゴニストはcAMPシグナルを減少させることが留意される。
【0137】
第1日には、大グリア細胞を2×104個/ウェルをプレーティングする。第2日に、2本の反応チューブを用意する(各チューブについて従うべき比率は1プレート当たりの比率である):チューブAは1.2mLの血清無含有DMEM(Irvine Scientific社製、カリフォルニア州アーヴィン)中で計4μgのDNA(例、pCMVベクター;変異したTHSR(TSHR−A623I)を有するpCMVベクター;TSHR−A623IおよびGPCR、など)に対して、哺乳動物細胞中へトランスフェクトした各受容体の2μgのDNAを混合することによって調製される;チューブBは1.2mLの血清無含有DMEM中に120μLのリポフェクトアミン(Gibco BRL社製)を混合することによって調製される。チューブAおよびBを(数回)反転させ、室温で30〜45分間インキュベートすることによって混合する。この混合物を「トランスフェクション混合物」と呼ぶ。プレートに蒔いた大グリア細胞は、1×PBSを用いて洗浄し、その後に10mLの血清無含有DMEMを添加する。2.4mLのトランスフェクション混合物を次に細胞へ添加し、その後に37℃/5% CO2で4時間にわたりインキュベーションする。トランスフェクション混合物を吸引によって除去し、その後に25mLのDMEM/10%ウシ胎児血清を添加する。その後、細胞を37℃/5% CO2でインキュベートする。24時間のインキュベーション後、細胞を採取し、分析に使用する。
【0138】
Flash PlateTMアデニリルシクラーゼキット(New England Nuclear社製;カタログ番号SMP004A)は細胞ベースアッセイのために設計されているが、当業者の必要に依存して粗原形質膜と一緒に使用するために改変され得る。Flash Plateウェルは、cAMPを認識する特異的抗体も含有する、シンチラントコーティングを含有する。ウェル内で産生されたcAMPは、cAMP抗体への放射性cAMPトレーサーの結合について直接競合によって定量することができる。下記は、受容体を発現する細胞全体中でのcAMPレベルの変化を測定するための手短なプロトコールとして役立つ。
【0139】
トランスフェクトした細胞を、一過性トランスフェクションの約24時間後に採取する。注意深く培地を吸引して取り除き、廃棄する。各皿の細胞へ10mLのPBSを穏やかに添加し、次に注意深く吸引する。1mLのSigma社製細胞解離バッファーおよび3mLのPBSを各プレートへ添加する。ピペットを用いてプレートから細胞を取り出し、50mLの円錐形遠心チューブ内へ細胞懸濁液を回収する。細胞は室温で5分間1,100rpmで遠心する。細胞ペレットを適切な容量のPBS(約3mL/プレート)中へ注意深く再懸濁する。血球計数器を用いて細胞数を計数し、追加のPBSを添加して適切な数の細胞(約50μL/ウェルの最終容量)を得る。
【0140】
cAMP標準物質および検出用バッファー(11mLの検出用バッファーに対して1μCiのトレーサー[125I cAMP(50μL)]を含む)を調製し、製造業者の指示書にしたがって維持する。アッセイバッファーはスクリーニングのために新しく調製しなければならず、50μLの刺激バッファー、3μLの試験化合物(12μMのアッセイ最終濃度)および50μLの細胞を含有していなければならない。アッセイバッファーは使用時まで氷上に保管され得る。50μLのcAMP標準物質を適切なウェルへ添加し、次にウェルH−11およびH12へ50μLのPBSAを添加することによってアッセイを開始できる。50μLの刺激バッファーを全ウェルへ添加する。試験化合物の12μMの最終アッセイ濃度および100μLの全アッセイ容量で、3μLの化合物溶液を分注できるピン状ツールを用いて選択した化合物(例、TSH)を適切なウェルへ添加する。次に細胞をウェルへ添加し、室温で60分間インキュベートする。トレーサーcAMPを含有する100μLの検出ミックスをウェルへ添加する。プレートをさらに2時間インキュベートし、次にWallac MicroBetaシンチレーションカウンターで計数した。cAMP/ウェルの値は、各アッセイプレート内に含有された標準cAMP曲線から外挿する。
【0141】
レポーターベースアッセイ:
Cre−Lucレポーターアッセイ(Gs関連受容体):大グリア細胞は1ウェル当たり2×104細胞の密度で96ウェルプレート上に蒔き、製造業者の指示書にしたがって翌日、リポフェクトアミン試薬(BRL社製)を用いてトランスフェクトした。DNA/脂質混合物は各6ウェルトランスフェクションのために下記のとおりに調製する:100μLのDMEM中の260ngのプラスミドDNAを100μLのDMEM中の2μLの脂質と穏やかに混合した(260ngのプラスミドDNAは200ngの8×CRE−Lucレポータープラスミド、内因性受容体もしくは非内因性受容体を含む50ngのpCMVまたはpCMV単独、および10ngのGPRS発現プラスミド(pcDNA3(Invitrogen社製)中のGPRS)から構成された。8×CRE−Luc受容体プラスミドは下記のとおりに調製した:ベクターSRIF−β−galは、pβgal−Basic Vector(Clontech社製)中のBglV−HindIII部位でラットソマトスタチンプロモーター(−71/+51)をクローニングすることによって入手した。8コピーのcAMP応答エレメントをPCRによってアデノウイルステンプレートAdpCF126CCRE8(7 Human Gene Therapy 1883(1996)を参照されたい)から入手し、Kpn−BglV部位でSRIF−β−galベクター内へクローニングすると、8×CRE−β−galレポーターベクターが生じた。この8×CRE−Lucレポータープラスミドは、8×CRE−β−galレポーターベクター内のβ−ガラクトシダーゼ遺伝子をHindIII−BamHI部位でpGL3−ベーシックベクター(Promega社製)から入手したルシフェラーゼ遺伝子と置換することによって作製した。室温での30分間のインキュベーション後、400μLのDMEMを用いてDNA/脂質混合物を希釈し、希釈混合物100μLを各ウェルへ添加した。細胞培養インキュベーター内での4時間のインキュベーション後、各ウェルへ10%FCSを含む100μLのDMEMを添加した。翌日、トランスフェクトした細胞は10%FCSを含む200μL/ウェルのDMEMに変更した。8時間後、ウェルは、PBSを用いた1回の洗浄後、フェノールレッドを含まない100μL/ウェルのDMEMへ変更した。ルシフェラーゼ活性は、製造業者の指示書にしたがってLucLite(商標)レポーター遺伝子アッセイキット(Packard社製)を用いて翌日測定し、1450 MicroBeta(商標)シンチレーションおよびルミネセンスカウンター(Wallac社製)上で読み取った。
【0142】
AP1レポーターアッセイ(Gq関連受容体):
Gq刺激を検出する方法は、Gq依存性ホスホリパーゼCがそれらのプロモーター中でAP1エレメントを含有する遺伝子の活性化を誘発する既知の特性に左右される。PathdetectTMAP−1 cis−Reporting System(Stratagene社製、カタログ番号219073)は、リン酸カルシウム沈降物の構成成分が410ngのpAP1−Luc、80ngのpCMV−受容体発現プラスミド、および20ngのCMV−SEAPであった以外は、CREBレポーターアッセイに関して上述したプロトコールセットにしたがって使用できる。
【0143】
SRF−Lucレポーターアッセイ(Gq関連受容体):
Gq刺激を検出する1つの方法は、Gq依存性ホスホリパーゼCがそれらのプロモーター中で血清応答因子を含有する遺伝子の活性化を誘発する既知の特性に左右される。Pathdetect(商標)SRF−Luc−Reporting System(Stratagene社製)を使用すると、例えばCOS7細胞中でGq共役活性についてアッセイすることができる。細胞は、Mammalian TransfectionTM
Kit(Stratagene社製、カタログ番号200285)を製造業者の指示書にしたがって用いて、本システムのプラスミド構成成分および内因性もしくは非内因性GPCRをコードする指定発現プラスミドを用いてトランスフェクトされる。手短には、410ngのSRF−Luc、80ngのpCMV−受容体発現プラスミドおよび20ngのCMV−SEAP(分泌アルカリホスファターゼ発現プラスミド;サンプル間のトランスフェクト効率における変動について対照するためにアルカリホスファターゼ活性はトランスフェクトした細胞の培地中で測定する)を製造業者の指示書にしたがってリン酸カルシウム沈降物中で結合させる。沈降物の半分を96ウェルプレート上の3つのウェルの上方に同等に分布させ、血清無含有培地中で細胞を24時間維持する。最後の5時間に、細胞を選択した化合物と一緒にインキュベートする。次いで細胞を溶解させ、LucliteTMキット(Packard社製、カタログ番号6016911)ならびに「Trilux 1450 Microbeta」液体シンチレーションおよびルミネセンスカウンター(Wallac社製)を製造業者の指示書にしたがって用いてルシフェラーゼ活性についてアッセイする。データは、GraphPad PrismTM2.0a(GraphPad Software Inc.社製)を用いて分析できる。
【0144】
細胞内イノシトール1,4,5−三リン酸(IP3)蓄積アッセイ(Gq関連受容体):
第1日に、受容体(内因性および/または非内因性)を含む細胞は24ウェルプレート上で、通常は1ウェルに付き1×105細胞でプレートに蒔かれ得る(しかしこの数は最適化できる)。第2日に、細胞は1ウェルに付き50μLの血清無含有DMEM中の0.25μgのDNAおよび1ウェルに付き50μLの血清無含有DMEM中の2μLリポフェクトアミンを最初に混合することによってトランスフェクトすることができる。溶液を穏やかに混合し、室温で15〜30分間にわたりインキュベートする。細胞は0.5mLのPBSを用いて洗浄し、400μLの血清無含有培地をトランスフェクション培地と混合し、細胞に添加する。細胞を次に37℃/5% CO2で3〜4時間インキュベートし、トランスフェクション培地を除去し、1mL/ウェルの標準増殖培地と取り替える。
【0145】
第3日に、この細胞を3H−ミオ−イノシトールを用いて標識する。手短には、培地を除去し、0.5mLのPBSを用いて細胞を洗浄する。1ウェルに付き0.5mLのイノシトール無含有/血清無含有培地(GIBCO BRL社製)とともに1ウェルに付き0.25μCiの3H−ミオ−イノシトールを添加し、細胞を37℃/5%CO2で16〜18時間にわたりインキュベートする。第4日に、0.5mLのPBSを用いて細胞を洗浄し、10μMパルジリン、10mM塩化リチウムを含むイノシトール無含有/血清無含有培地を含有する0.45mLのアッセイ培地、または0.4mLのアッセイ培地および最終濃度が10μMになるような50μLの10×ケタンセリン(ket)を添加する。この細胞を次に37℃で30分間インキュベートする。0.5mLのPBSを用いて細胞を洗浄し、1ウェルに付き200μLの新鮮/氷冷停止液(1M KOH;18mM ホウ酸ナトリウム溶液;3.8mM EDTA)を添加する。この溶液を氷上で5〜10分間または細胞が溶解するまで維持し、次に200μLの新鮮/氷冷中和溶液(7.5%HCl)によって中和する。
【0146】
この溶解液を1.5mLのエッペンドルフチューブ内へ移し、チューブ1本に付き1mLのクロロホルム/メタノール(1:2)を添加する。この溶液を15秒間ボルテックスミキサーにかけ、上層をBiorad AG1−X8TMアニオン交換樹脂(100〜200メッシュ)へ適用する。最初に、1:1.25(W/V)で水を用いて樹脂を洗浄し、0.9mLの上層をカラムへ入れる。10mLの5mMミオ−イノシトールおよび10mLの5mMホウ酸ナトリウム/60mMギ酸ナトリウムを用いてカラムを洗浄する。2mLの0.1Mギ酸/1Mギ酸アンモニウムを含む10mLのシンチレーションカクテルを含有するシンチレーションバイアル内へイノシトールTrisリン酸塩を溶出させる。このカラムは10mLの0.1Mギ酸/3Mギ酸アンモニウムを用いて洗浄する工程によって再生され、ddH2Oを用いて2回すすぎ洗いし、4℃の水中へ保管される。
【0147】
細胞内カルシウム濃度を測定するための蛍光測定イメージングプレートリーダー(FLIPR)アッセイ:
各クローン系から安定性にトランスフェクトした標的受容体(実験的)およびpCMV(ネガティブコントロール)細胞を、翌日アッセイするために、完全培養培地(10%FBS、2mM L−グルタミン、1mM ピルビン酸ナトリウムを含むDMEM)を含むポリ−D−リジン前処理96ウェルプレート(Becton−Dickinson社製、番号356640)内へ1ウェルにつき5.5×104細胞で播種する。Fluo4−AM(Molecular Probe社製、番号F14202)インキュベーションバッファーストック液を調製するために、1mg Fluo4−AMを467μLのDMSOおよび467μLのPluoronic acid(Molecular Probe社製、番号P3000)中へ溶解させて、−20℃で1カ月間にわたり保管できる1mMストック溶液を入手する。Fluo4−AMは、蛍光カルシウム指示染料である。
【0148】
候補化合物は、洗浄バッファー(1×HBSS/2.5mM プロベニシド(Probenicid)/20mM HEPES(pH7.4))中で調製される。
【0149】
アッセイ時に、培地をウェルから取り除き、この細胞に100μLの4μM Fluo4−AM/2.5mM プロベニシド(Sigma社製、番号P8761)/20mM HEPES/完全培地(pH7.4)を添加する。37℃/5% CO2でのインキュベーションを60分間にわたり進行させる。
【0150】
1時間のインキュベーション後、Fluo4−AMインキュベーションバッファーを取り除き、100μLの洗浄バッファーを用いて細胞を2回洗浄する。各ウェル内に100μLの洗浄バッファーを放置する。プレートを60分間にわたり37℃/5%CO2に設定したインキュベーターに戻す。
【0151】
FLIPR(蛍光測定イメージングプレートリーダー;Molecular Device社製)を、30秒毎に50μLの候補化合物を添加し、その後の150秒間について候補化合物によって引き起こされる細胞内カルシウム濃度([Ca2+])の一過性変化を記録するようにプログラミングする。FLIPRソフトウエアを用いてアゴニスト活性を決定するために全蛍光変化数を使用する。機器のソフトウエアは、ゼロで同等の初期読み取り値を得るように蛍光読み取り値を標準化する。
【0152】
一部の実施形態では、標的受容体を含む細胞は、無差別Gα15/16またはキメラGq/Giαユニットをさらに含んでいる。
【0153】
上記は安定性にトランスフェクトした細胞を用いてアゴニスト活性についてのFLIPRアッセイを提供するが、当業者であればアンタゴニスト活性を特性解析するために本アッセイを容易に改変できるであろう。前記当業者は、あるいはまた一過性トランスフェクト細胞も使用できることを容易に理解するであろう。
【0154】
上記の試験結果および考察から、本発明が嗅覚GPCRを産生するための重要な新規手段を提供することが明らかである。詳細には、本発明は嗅覚GPCR調節因子を見いだすための化学物質ライブラリーをスクリーニングするためのシステムを提供する。したがって、本方法およびシステムは、研究、食品および芳香剤の改良を含む様々な用途、およびその他の用途において利用される。したがって、本発明は当技術分野にとって有意な貢献を意味する。
【0155】
【表1−1】

【0156】
【表1−2】

【0157】
【表1−3】

【0158】
【表1−4】

【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】




【公開番号】特開2011−139709(P2011−139709A)
【公開日】平成23年7月21日(2011.7.21)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−43290(P2011−43290)
【出願日】平成23年2月28日(2011.2.28)
【分割の表示】特願2006−541322(P2006−541322)の分割
【原出願日】平成16年11月15日(2004.11.15)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(500478097)アリーナ ファーマシューティカルズ, インコーポレイテッド (97)
【Fターム(参考)】
【公開日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願番号】特願2011−43290(P2011−43290)
【出願日】平成23年2月28日(2011.2.28)
【分割の表示】特願2006−541322(P2006−541322)の分割
【原出願日】平成16年11月15日(2004.11.15)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(500478097)アリーナ ファーマシューティカルズ, インコーポレイテッド (97)
【Fターム(参考)】
[ Back to top ]

