固体組成物
固体の埋め込み可能な剤形であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなり、前記の1又は2以上の賦形剤が存在する場合は、インビトロで試験した時に、賦形剤を含有しない同等の剤形と比較して、活性物質放出の著明な遅延又は延長を導かない、剤形。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、固体医薬組成物、及び、特に疾患を予防又は治療するための局所デリバリーのための、実質上水不溶性の治療活性物質の使用に関するものである。より詳細には、本発明は、固体マトリックスメタロプロテイナーゼ(MMP)インヒビター組成物及び瘢痕形成防止におけるそれらの使用に関するものである。本発明はさらに、特別なMMPインヒビター固体剤形に関するものである。
【背景技術】
【0002】
実質的に水不溶性の治療物質は一般に、適当な溶媒、例えばDMSO等に入れてヒト又は動物の身体にデリバリーされる。しかしながら、通常、治療物質を溶液としてデリバリーすることにより、この物質は全身的に投与される。このような溶液が局所に投与された場合、一般にそれは投与部位に短時間(即ち、数分間ないし数時間)しかとどまらない。治療物質を局所にデリバリーし、その結果身体の関連部分のみが該物質に暴露されることが望ましい。さらに、身体にデリバリーされるいかなる治療活性物質も、処置を可能にするに充分な長時間の活性物質の治療有効濃度を達成させる、適切な溶解プロファイルを持つことが重要である。これらの問題の解決を目指して数多くの多成分及び複雑な医薬製剤が開発されてきたが、そのような製剤は、高価で、物理的及び化学的に反応し易く不安定であり、そしてデリバリーされる治療活性物質に対して固有のものであり得る。
【0003】
本発明の1つの好ましい局面は、組織の瘢痕形成を予防又は治療することに関するものである。瘢痕形成に含まれるプロセスは、様々な状況での治療の失敗において役割を演じている。さらに、瘢痕形成は、今日、全世界の事実上全ての失明に至る病における治療失敗に関与している。眼の治癒及び瘢痕形成の重要性を示す非常に良い例が、眼圧を下げるための瘻孔を作る緑内障手術の後に起こる事柄である。最終的な眼圧がこの手術の成功を決定するが、それは治癒及び瘢痕形成プロセスに依存する。線維柱帯切除術後の眼に起こる創傷治癒プロセスは、最初の結膜切開後に始まる。血漿蛋白及び血球が創傷領域に放出され、フィブリン塊が形成される。この創傷部分に好中球及びマクロファージが動員され、幾つかの酵素及びMMP、特にMMP−8及び−9を発現させることによってこの凝血塊を分解する。
【0004】
線維芽細胞の活性化及び創傷部位への遊走もまた起こる。正常な創傷のない組織の線維芽細胞は、線維細胞として知られる休止した未分化の間葉細胞である。それらは結膜下結合組織−テノン嚢に少数存在している(Wong et al. 2002)。活性化後、これらの線維芽細胞は大量の細胞外マトリックス(ECM)分子、例えばコラーゲン、グルコサミノグリカン及びエラスチンを産生する。これらはまた、ECMの開裂を促すMMPをも産生する。
【0005】
多くの研究グループが、緑内障濾過手術(GFS)後の創傷治癒におけるMMPの役割を研究してきた(Kawashima et al. 1998)。彼等はモノクローナル抗体を使用して、ヒト結膜下結合組織から単離された線維芽細胞の細胞質中のMMP−1、MMP−2、TIMP−1及びTIMP−2の染色を観察した。さらに、正常結膜及び治癒しつつある結膜の比較は、MMP−1及びTIMP−1が、治癒しつつある結膜下組織にのみ局在することを示した。正常結膜下組織及び結膜上皮の何れにも両分子は見出されなかった。これらの結果に基づき、術後結膜下瘢痕形成におけるMMPの潜在的役割が提唱されている。
【0006】
これら初期の研究以来、他のMMP分子の発現が培養ヒトテノン線維芽細胞(HTF)で検出されている(Mietz et al. 2003)。MMP−1、−2、−3、−9、−14及びTIMP−1及び−2は、インビトロ培養されたHTFから発現される。フィブロネクチン界面を超えた線維芽細胞遊走中に、下層の基質に牽引力が発生し、創傷の収縮を引き起こす(Harris, Stopak, & Wild 1981)。線維血管性肉芽組織が徐々に形成され、創傷部位にある線維芽細胞集団の一部が、機械的ストレス及び成長因子の刺激(主としてTGF−β及びPDGF)のため、筋線維芽細胞へと分化する。肉芽組織の連続的リモデリング及び筋線維芽細胞のアポトーシスの後、稠密なコラーゲン性結膜下瘢痕組織が形成される。広範な結膜下線維化及び組織の収縮が最終結果である。これは、ブレブの機能喪失と、その後の眼内圧(IOP)上昇を惹起する。
【0007】
マイトマイシンC(MMC)及び5−フルオロウラシル(5−FU)といった代謝拮抗物質の溶液が、線維柱帯切除術後の瘢痕形成の低減に有効であることが示されている(Dahlmann et al. 2005;Skuta et al. 1992)。ブレブにおける流出路の機能期間延長を記載する多くの研究が、本発明者によって公表されている。その結果は、手術中、5−FU又はマイトマイシンC溶液の単回5分間適用が治癒反応を低減させ、瘢痕形成を減少させることを示している。これは主として、ブレブの生存を延長させる、線維芽細胞増殖の抑制によるものであると考えられる(Doyle et al. 1993;Khaw et al. 1994;Khaw et al. 1992)。あいにく、これらの代謝産物による処置の後には重篤な合併症がしばしば起こる。ブレブはしばしば漏洩し、そこで、低眼圧症、眼内炎、及び不可逆的視力喪失を引き起こし得る過剰の眼細胞アポトーシス等、他の副作用が起こる。このことにも拘わらず、MMC及び5−FUは尚、使用されている。よって、GFS後の瘢痕形成を低減させ、治癒を制御するために、より安全且つより有効な物質が必要とされる。
【0008】
MMPは幾つかの病態に関与しているため、治療的使用ができる選択的インヒビターを特定し、明確な方法でMMP活性を制御することが重要である。天然TIMPインヒビターの使用は、高い分子量及び劣悪な経口バイオアベイラビリティーといった重大な欠点があり、それが臨床使用を妨げている(Glasspool & Twelves 2001b)。
【0009】
これらの困難を克服するため、MMP活性をブロックする合成化合物(MMPインヒビター)が設計された。最もよく知られているMMPインヒビターの幾つかは、バチマスタット(BB−94)、マリマスタット(BB−2516)、プリノマスタット(AG3340)、タノマスタット(BAY12−9566)(Glasspool & Twelves 2001a)及びイロマスタット(GM6001)(Galardy et al. 1994d)である。これらは、MMPの活性部位において亜鉛と可逆的に結合するヒドロキサム酸誘導体である。今日までに設計された強力なインヒビターの殆どは右側結合体である。これは、恐らくは基質開裂のカルボキシラート生成物が該酵素の強力なインヒビターになることを防ぐその天然の能力の故に、左側結合が遙かに弱いためである(Skiles, Gonnella, & Jeng 2001)。
【0010】
MMPは創傷収縮に重要な役割を果たす(Daniels et al. 2003;Porter et al. 1998)。特にMMPの阻害は、創傷収縮モデルとしてコラーゲンI格子を用いるインビトロ実験において創傷の収縮を低下させた(Scott, Wood, & Karran 1998)。収縮モデルにおけるMMPインヒビターの効果を調べるため、インビトロ及びインビボ両方の研究が実施されている。Daniels et al., 2003は、HTF包埋コラーゲンゲルにおける3種類のMMPインヒビター(イロマスタット、BB−94及びBMS−275291(Cell Tech))の効果を試験した。観察により、この3種のMMPインヒビターの適用で、ゲルの収縮が用量依存的に阻害されることが明らかとなり、イロマスタットが最も有効であるとわかった。
【0011】
試験されたMMPインヒビターはさらに、非毒性及び可逆的効果を有することが判明し、ザイモグラフィーの結果は、MMPインヒビター適用後に検出されたMMPバンドの蛋白分解活性の著明な低下を示した。イロマスタットが線維芽細胞からのコラーゲン産生を用量依存的に阻害することも示された。これは重要な発見であった。何故なら、切開領域における過剰なコラーゲン産生及び沈着が、ブレブの不全の主たる原因であるからである(Cordeiro et al. 2000;Daniels et al. 1998)。
【0012】
線維柱帯切除術後のインビボ30日間ウサギ収縮モデルに、DMSOに溶解したイロマスタットを17回注入投与したところ、DMSOのみの対照群と比較してブレブの生存が著明に延長され、また、この実験の間ずっとIOP低下効果があることが判明した(Wong, Mead, & Khaw 2003)。組織学的所見は、イロマスタット処置群における瘢痕組織形成の低下は、対照群と比較して細胞の減少を伴って起こることを示した。さらに、細胞アポトーシスの減少(別の研究からMMCに関連することがわかっている)、創傷領域における筋線維芽細胞の減少(恐らくは線維芽細胞遊走におけるイロマスタットの阻害効果による)及び対照群と比較して大きなブレブ領域が存在した。
【0013】
イロマスタットの抗瘢痕効果をMMCと比較する必要性は、新たなインビボ比較試験の設計を導いた(Wong, Mead, & Khaw 2005)。イロマスタット処置群は、MMC処置群と同様のブレブ生存延長及びIOP低下結果を有していた。重要なことに、この研究は、結膜下組織の形態が、イロマスタット群では正常であるがMMC群では低細胞性であることを示した。本発明者等によるいかなるインビボ実験でも、イロマスタットは、MMCの事例で起こり得るような結膜の損傷を起こさなかったということは言及する価値がある。
【0014】
術後創傷管理のためのイロマスタットの臨床使用は、現在使用されている細胞毒性代謝拮抗物質に優る利点を有し得る。イロマスタットは特異的MMP阻害を示し、線維芽細胞の活性化を遮断する。毒性の報告は公表されておらず、よってイロマスタットは、代謝拮抗物質よりも術後GFS処置に対する忍容性がより優れているであろう。但し、瘢痕形成を低下させるための線維柱帯切除術後処置の利点を増大させる、言及すべきその他幾つかの試みがある(Wong, Mead, & Khaw 2005)。
【0015】
組織収縮防止におけるMMPインヒビターの使用が国際特許出願WO95/24921に記載されている。
【0016】
現在、線維柱帯切除術中に、強膜弁の下へのMMC単回投与が採用されている。この薬物に付随する毒性、及び複数回注射によって起こる患者にとっての不快感及び感染リスクのため、代謝拮抗物質の複数回反復注射は実行不可能である。そのうえ、ブレブ(その容量はおよそ200μlである)内に一定の局所濃度の活性物質を維持することは、ボーラス注射では不可能である。前房からブレブへの房水流出は2μl/分であり、これは、注射された物質の濃度が速やかに低下するであろうことを意味するというのがその理由である。この物質を持続的に注入することもまたできない。
【0017】
線維柱帯切除術後の結膜下腔に入れることのできる連続的持続薬物放出系の開発が必要とされる。
【0018】
本発明者等の初期の研究は、イロマスタットのデリバリーシステム開発に取り組むことであった。イロマスタットは、10〜100nMの範囲の濃度において用量依存的にコラーゲンIゲルでの収縮をインビトロ阻害することが知られている(Daniels et al. 2003及び国際特許出願WO95/24921号)。濃度100nMのイロマスタットを複数回注射投与するインビボ研究で、有効性の増大が観察されている(Wong, Mead, & Khaw 2005;Wong, Mead, & Khaw 2003)。この予備研究はイロマスタットの好ましい薬理効果を確立したが、治療濃度は、水性DMSO溶液から調製された注射によってのみ達成された。DMSOはヒトの眼への使用が認可されていない。
【0019】
疾患を予防又は治療するための、実質上水不溶性の治療活性物質を局所デリバリーする方法に対する必要性がある。さらに、適切な抗瘢痕形成活性、ヒト又は動物の身体に埋め込まれた時に活性物質が局所的にも全身的にも低毒性であるような低い毒性、並びに長期の抗瘢痕形成活性を提供するための最適な溶解プロファイルを有する物質に対する特段の必要性が存在する。
【発明の概要】
【発明が解決しようとする課題】
【0020】
本発明は、先行技術の方法に伴う問題の少なくとも幾つかを打開する。
【課題を解決するための手段】
【0021】
本発明の第一の局面によれば、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤[ここで、この1又は2以上の賦形剤は、それが存在する場合、インビトロで試験した時に、賦形剤を含有しない同等の剤形と比較して、活性物質放出の著明な遅延又は延長を導かない]と共に含んでなる、固体の埋め込み可能な剤形が提供される。
【0022】
第一の局面の剤形は、比較的単純な固体剤形を選択された部位にインビボで埋め込むことができ、これらの剤形が、放出プロファイルが主として賦形剤により制御される、複雑な持続放出製剤を必要とせずに、活性物質の安定な放出を提供するという、驚くべき発見に基づいている。賦形剤含有剤形及び賦形剤非含有剤形の溶解速度の比較は、組織埋め込み後の媒質のインビボ流動を模倣した媒質の流動を提供する任意の適当な溶解装置、例えば本明細書に記載のフロースルーリグを用いて実施できる。この溶解は、37℃付近及びpH7.4付近の媒質中で実施されねばならない。
【0023】
この剤形は、好ましくは疾患の局所的な予防又は治療に好適なものである。第一局面の剤形は、活性物質の全身デリバリーのために埋め込むことが可能である。しかしながら、埋め込み部位の領域においてのみ放出及び/又は有効性が適切となるような量の、適当な治療物質を含む剤形を製造することが好ましい。
【0024】
好ましい態様では、この剤形は、眼への、眼周囲への、又は眼内への埋め込みに適した剤形である。例えば、この剤形は結膜下腔への埋め込みに好適であり得る。
【0025】
好ましい態様では、この剤形は滅菌されている。このような処理により、該剤形はインビボでより広範囲に安全に埋め込むことが可能となる。本明細書で使用する「滅菌された」という語は、無菌製造装置により製造された剤形、及び非無菌製造装置で製造され、それが製造後の滅菌プロセス、例えばガンマ線照射に付される剤形の両者を包含する。
【0026】
この剤形が1又は2以上の賦形剤を含有する時、これらはインビボ埋め込みの後に生分解性及び/又は生体吸収性であることが好ましい。このことは、該剤形が埋め込まれ、そして活性物質の完全又は部分的放出の後に該剤形の何らかの構成成分を除去するその後の工程を必要とすることなく、溶解及び/又は生分解に委ねられ得るという利点を有する。さらに、多くの活性物質について、賦形剤は、それが存在する場合、埋め込み部位において非常に可溶性又は分散性という訳ではなく、そのことにより、投与量の廃棄及び/又は活性物質の分散に起因する溶解の増大が回避される、という事は、重要な考察である。本発明は、その中に埋め込みが行われる組織の「非沈降」状態を利用するものである(多くの活性物質、特にマトリックスメタロプロテイナーゼインヒビターについて)。関係する活性物質の溶解度に応じて、そして埋め込みが行われる組織を通過する生物学的水性媒質の流動に応じて(何れも容易に測定できる)、一般に非沈降状態が達成できる。組織が非沈降性であるため、薬物放出に関する限り、剤形が賦形剤を有するか否かは問題ではない。賦形剤がないと、活性物質が溶解しさえすればいいことから、剤形はより単純となる。溶解する、及び/又はインビボで問題を起こす(例えば炎症)他の構成成分を考慮する必要はない。事実、多くの例では、賦形剤を使用する唯一の理由は、その剤形の製造規格への準拠を確実にすることである。一般に賦形剤の使用は、主としてその剤形の製造における加工要件のためである。本発明に従う有用な活性物質の大半は、溶解又は放出特性を支援するための賦形剤の使用は必要とされない。
【0027】
驚くべき事に、これまで、その大多数が様々な賦形剤を含んで固体剤形として製剤化されることが知られてきた幾つかの活性物質が、賦形剤を殆ど又は全く含まずに埋め込み可能な錠剤として製剤化できることが判明した。このことは、その剤形が既存の打錠装置を用いて効率的に製造されることを可能にし、そしてさらに、そのようにして製造された剤形の溶解プロファイルの点で好都合な結果を提供する。
【0028】
幾つかの態様では、この剤形は0.1mm3〜1.5cm3の体積を持ち、及び/又は5mm以下の最大寸法を有し、及び/又は10mg以下の重量を有する。このような制約は、該剤形が多岐にわたる部位にインビボで埋め込まれることを可能にする。
【0029】
特別な態様では、この剤形は実質上賦形剤を含まない。様々な活性物質を固体単位剤形、例えば圧縮剤形(例えば錠剤)に形作ることができ、なお且つ埋め込み後に活性成分の安定なインビボ放出を提供できるという事は驚くべき発見である。
【0030】
好ましい態様では、活性物質は実質上水不溶性である。このような不溶性は、本発明に係る剤形中の活性物質の持続放出を強化する。本明細書で使用する「実質上水不溶性」という語は、水にやや溶けにくい(即ち、その治療物質1部を溶解するために少なくとも30部の水を必要とする。換言すると、35mg/ml前後又はそれ以下)、好ましくは僅かに溶ける(即ち、その治療物質1部を溶解するために少なくとも100部の水を必要とする。換言すると、10mg/ml前後又はそれ以下)、より好ましくは極めて僅かに水に溶ける((即ち、その治療物質1部を溶解するために少なくとも1000部の水を必要とする。換言すると、1mg/ml前後又はそれ以下)、そして最も好ましくは事実上水不溶性である(即ち、その治療物質1部を溶解するために少なくとも10000部の水を必要とする。換言すると、0.1mg/ml前後又はそれ以下)ことを意味することを意図している。溶解度は、生理的に許容し得るpH(即ち、約5.0〜8.0)の水を用いて室温(約20℃)で測定する。
【0031】
特別な態様では、活性物質はマトリックスメタロプロテイナーゼ(MMP)インヒビターであり、これは、マトリックスメタロプロテイナーゼの活性部位にある亜鉛に可逆的に結合するヒドロキサム酸誘導体であってよく、及び/又はこれは右側結合体であってよい。
【0032】
一般に、治療活性物質は、周囲温度で固体であり、且つ固体の単位剤形に製剤化できる任意の適当な物質であってよい。このような制約は、通常の技術を有する製剤者により容易に評価できる。治療活性物質は天然物質であっても合成物質であってもよい。多くの例において、活性物質は少なくとも部分的に結晶性である。好ましくは治療活性物質は合成化学化合物である。MMPインヒビター(及びその他のレセプターアンタゴニスト又は酵素インヒビター)については、低いKi値、即ち高いpKi値を持つ物質が一般的に好ましい。例えば、イロマスタットはコラゲナーゼに対して0.4nMのKiを有する。
【0033】
本発明の利点は、比較的溶解度の低い化合物を、記載の剤形によってうまくデリバリーできることである。伝統的には、そのような化合物(これらにはしばしば遭遇する)は、溶解度を改善し及び/又は持続放出を提供するために、高い薬物含有量及び/又は複雑な賦形剤混合物を使用して製剤化せねばならなかった。同様に、固体活性物質に対する伝統的な製剤化アプローチにおいては、活性物質の溶解度及び組織透過性が最重要事項である。本発明に係る埋め込み可能剤形、並びに関連方法及び使用においては、粘膜を通る(例えば腸管からの)透過は必要でない。このことにより本発明は極めて広範な適用可能性を有することになる。
【0034】
好ましい物質には、MMPインヒビター並びにその他の抗瘢痕形成物質、ステロイド、抗生物質、抗癌剤、抗体分子及び抗炎症物質がある。抗瘢痕形成物質には、MMPインヒビター(これは下記に定義する)、代謝拮抗物質、例えばMMC及び5−FU、並びにTGFβがある。好適なステロイドには、コルチコステロイド、例えばデキサメタゾン、ヒドロコルチゾン、プレドニゾロン、トリアムシノロン及びメチルプレドニゾロンがある。好適な抗生物質には、β−ラクタム抗生物質、例えばペニシリン類、マクロライド抗生物質、例えばエリスロマイシン、及びドキシサイクリンなどの、一般に使用される任意の抗生物質が包含される。好適な抗癌剤には、5FU、パクリタキセル及びクロラムブシルがある。
【0035】
任意の抗体分子を使用できる。「抗体分子」という語は、ポリクローナル抗体、モノクローナル抗体又はその抗原結合フラグメント、例えばFv、Fab、F(ab’)2フラグメント及び一本鎖Fvフラグメントを包含する。好ましくは抗体分子は凍結乾燥抗体分子である。抗体の標的抗原は、その抗体の治療活性を決定する。当業者には多数の治療用抗体が知られている。
【0036】
好適な抗炎症物質には、ステロイド性及び非ステロイド性抗炎症物質がある。好ましくはこの抗炎症物質は、ナプロキセン、イブプロフェン、ジクロフェナク及びケトロラクといった非ステロイド物質である。
【0037】
治療活性物質は、好ましくは疾患部位に局所投与するための物質である。例えば、その物質が抗癌剤である場合、その物質を腫瘍部位にデリバリーすることが望ましい。或いは、治療活性物質が抗瘢痕形成物質又は抗炎症物質である場合、それは、炎症又は組織瘢痕形成を予防又は治療するために、手術、外傷又は炎症の部位に埋め込むためのものである。
【0038】
治療活性物質は疾患を予防又は治療するためのものである。予防されるべき疾患は、その治療活性物質によって変わる。例えば、その物質が抗炎症物質である場合、該物質は炎症を予防又は治療するために使用される。炎症は、喘息、関節炎、局所感染、手術又は外傷により惹起された組織損傷を包含する種々の疾患に随伴し得る。その物質が抗癌剤である場合、該物質は癌を予防又は治療するために使用される。抗癌剤は好ましくは腫瘍を治療するために使用される。その物質が抗生物質である場合、該物質は好ましくは感染症を治療するために使用される。その物質が抗瘢痕形成物質である場合、それは、感染症、手術、外傷等により惹起される組織瘢痕形成を防止又は低減させるために使用される。当業者には明らかであるように、活性物質は1以上の治療用途を有することがある。例えば、5−FUは、抗瘢痕形成物質であると共に抗癌剤でもある。
【0039】
第一の局面の好ましい態様では、活性物質は、イロマスタット、バチマスタット、マリマスタット、プリノマスタット、タノマスタット、トロケード(シペマスタット)、AG3340、CGs227023A、BAY12−9566、及びBMS−275291より成る群から選ばれるMMPインヒビター又はそれらの任意の機能的誘導体である。
【0040】
上の選好にもかかわらず、マトリックスメタロプロテイナーゼ(MMP)インヒビターは、固体単位剤形に製剤化できる任意のMMPインヒビターであってよい。MMPインヒビターは天然又は合成MMPインヒビターであってよい。天然に存在するMMPインヒビターには、ヒトの血液中に見出される主たるコラゲナーゼインヒビターである、α2−マクログロブリンが包含される。多数の合成MMPインヒビターが開発されており、文献に記載されている。例えば、米国特許明細書第5183900、5189178及び5114953号は、GM6001又はガラルジンとしても知られるイロマスタット(N[2(R)−2−(ヒドロキサミドカルボニルメチル)−4−メチルペンタノイル−L−トリプトファンメチルアミド)及びその他のMMPインヒビターの合成を記載している。ヒドロキサム酸に基づくその他のMMPインヒビターが、国際特許出願WO90/05716、WO90/05719及びWO92/13831号に開示されている。さらなる合成MMPインヒビターには、欧州特許出願EP−A−126974及びEP−A−159396号並びに米国特許4599361及び4743587号に記載されているものが包含される。さらに別のインヒビターは、バチマスタット(British Bio-technology Ltd.)としても知られるBB−94であり、例えば欧州特許出願EP−A−276436号を参照されたい。国際特許出願WO90/05719号は、MMPインヒビター4−(N−ヒドロキシアミノ)−2R−イソブチル−3S−(チオ−フェニルチオメチル)スクシニル]−L−フェニルアラニン−N−メチルアミド及び4−(N−ヒドロキシアミノ)−2R−イソブチル−3S(チオメチル)スクシニル]−L−フェニルアラニン−N−メチル−アミドをも開示している。国際特許出願WO90/05716号は、MMPインヒビター4−(N−ヒドロキシアミノ)−2R−イソブチルスクシニル−L−フェニルアラニン−N−(3−アミノメチルピリジン)アミド及び[4−N−ヒドロキシアミノ)−2R−イソブチル−3S−メチルスクシニル]−L−フェニルアラニン−N−4−(2−アミノエチル)−モルホリノアミドを開示している。
【0041】
天然及び合成コラーゲンインヒビターの性質は異なっていることがある。個々のインヒビターはしばしば異なる特異性及び力価を有する。可逆性であるインヒビターもあれば非可逆性のものもある。一般に、インヒビターの阻害効果が強いほど良い。一般的には、広域スペクトルMMPインヒビター、例えばイロマスタットが好ましい。
【0042】
MMPインヒビターは、抗MMPポリクローナル又はモノクローナル抗体分子であってよい。特定のMMPに特異的な抗体を作製でき、或る状況ではそのような特異的インヒビターの使用が好ましいであろう。例えば、MMP1、MMP2又はMMP3(それぞれコラゲナーゼ、72kDゼラチナーゼ又はストロメリシン)に対する抗体又はこれらの2若しくはそれ以上の混合物を使用できる。そのような抗MMP抗体の作製方法は当業者に周知である。
【0043】
好ましくはMMPインヒビターは上に述べた合成インヒビターの何れか1つである。好ましいインヒビターには、ペプチドヒドロキサム酸又はその医薬的に許容し得る誘導体が包含される。特に好ましいのは、米国特許5189178;5183900及び5114953号に記載及び特許請求されている化合物である。低いKi値、即ち高いpKi値を持つ化合物もまた一般的に好ましい。好ましくは、MMPインヒビターは、MMPの活性部位にある亜鉛に可逆的に結合するヒドロキサム酸誘導体、より好ましくは右側結合体である。
【0044】
上に述べたように、特に好ましい態様では、MMPインヒビターは、バチマスタット、マリマスタット、プリノマスタット、タノマスタット、トロケード、AG3340、CGs227023A、BAY12−9566、BMS−275291、及びイロマスタットより成る群、又はこれらの任意の機能的誘導体から選ばれる。より好ましくは、MMPインヒビターはイロマスタット、又はその任意の機能的誘導体である。種々のMMPインヒビターの機能的誘導体は当業者に周知である。例えば、イロマスタットの機能的誘導体が米国特許5183900号に開示されている。イロマスタットは現在知られている最も強力なコラゲナーゼインヒビターの1つであるため、特に好ましい。しかしながら或る適用では、より強力でない(より弱い)インヒビターの使用が好ましいこともある。
【0045】
本発明者等による研究は、イロマスタットが、結膜下創傷治癒の際に毒性作用なしにMMPを阻害できることを証明した。これらの理由で本発明者等は、瘢痕形成阻害に使用するため、始めにイロマスタットに焦点を合わせた。
【0046】
上に指摘したように、イロマスタット(分子式C20H28N4O4、388.47g/mol)は、正式化学名がN−[(2R)−2−(ヒドロキサミドカルボニルメチル)−4−メチルペンタノイル]−Lトリプトファンメチルアミドであるペプチド類似体である。これは広域スペクトルヒドロキサマートMMPインヒビターである(Galardy et al. 1994a)。報告されているKi値は以下のとおりである:ヒトMMP−1(線維芽細胞コラゲナーゼ):0.4nM、ヒトMMP−3(ストロメリシン):27nM、ヒトMMP−2(72kDaゼラチナーゼ);0.5nM、ヒトMMP−8(好中球コラゲナーゼ):0.1nM、ヒトMMP−9(92kDaゼラチナーゼ):0.2nM(Galardy et al. 1994c)。
【0047】
本発明に係る固体剤形は、1以上の治療活性物質、例えば1以上のMMPインヒビター又は2若しくはそれ以上の異なるクラスの治療活性物質を含んでなる。しかしながら、この固体剤形は、ただ1つの治療活性物質、例えばMMPインヒビターを含んでなることが好ましい。
【0048】
本発明の第二の局面によれば、治療に使用するための、第一局面による剤形が提供される。
【0049】
特にこの剤形がMMPインヒビターを含有する場合、組織瘢痕形成を防止又は低減させる際の使用が好ましい。或る態様では、瘢痕形成は、眼の、眼周囲の、又は眼内である。特別な態様では、この剤形を緑内障濾過手術後に埋め込む。記載したような例においてこの剤形は結膜下腔に埋め込むことができる。
【0050】
MMPインヒビターを固体剤形で提供することにより、緩徐な溶解速度が達成され、それにより、必要な原位置(in situ)MMPインヒビター濃度を少なくとも30日間達成することが可能となる。こうした緩徐な溶解速度は、瘢痕形成の防止又は実質的な低減をもたらし、処置される患者にとってより良い転帰を導く。MMPインヒビター溶液を注射する従来の方法では、MMPインヒビターのクリアランスは数分以内に起こる。MMPインヒビターの投与に徐放性ゲルを使用したとしても、約3〜6時間以内にクリアランスが起こる。固体剤形のMMPインヒビターを投与することにより、クリアランスは30日間にわたって起こらない。本発明に係る適切な剤形のさらなる利点は、この固体剤形が原位置(in situ)で完全に溶解及び/又は生分解するため、取り除く必要がないことである。
【0051】
本発明は、抗瘢痕形成剤を眼に何度も注射する不都合で危険な手技を回避できる。さらに、抗瘢痕形成剤への個体の暴露を減少させることにより、全身合併症(例えば関節炎)のリスクが回避される。
【0052】
本発明はさらに、疾患の局所的予防又は治療のための埋め込み用薬剤の製造における第一局面の剤形の使用を提供する。特別な態様では、特に活性物質がMMPインヒビターである場合、その薬剤は組織における瘢痕形成の局所的予防又は治療のための埋め込みのためのものであってよい。
【0053】
関連して、本発明はさらに、それを必要とする患者において疾患を局所的に予防又は治療する方法を提供するものであり、その方法は、第一局面の固体剤形を、該疾患を予防又は治療するに充分な量で、埋め込みにより該患者に投与することを含んでなる。好ましい態様では、活性物質はMMPインヒビターであり、該患者の瘢痕形成を局所的に予防又は治療するために該剤形を投与する。そのような例においては、この剤形を、眼への、眼周囲への、又は眼内への埋め込みにより(例えば結膜下腔に埋め込むことにより)投与できる。予防又は治療すべき瘢痕形成は、緑内障濾過手術後のものであってよい。
【0054】
第三の局面では、本発明はさらに、局所埋め込みにより組織瘢痕形成を防止又は低減させるための埋め込み可能な固体薬剤の製造におけるMMPインヒビターの使用を提供する。同様に本発明は、組織瘢痕形成の防止又は低減に使用するためのMMPインヒビターを提供し、ここで、該MMPインヒビターは、任意により1又は2以上の医薬的に許容し得る賦形剤を含有していてもよい、局所埋め込みのための埋め込み可能な固体薬剤として製剤化される。それを必要とする患者における組織瘢痕形成の局所的予防又は治療方法であって、マトリックスメタロプロテイナーゼインヒビターを任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、局所埋め込みのための埋め込み可能な固体剤形を投与することを含んでなる方法。
【0055】
本発明の第四の局面によれば、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、眼への、眼周囲への、又は眼内への埋め込みによる治療に使用するための、埋め込み可能な固体剤形が提供される。同様に本発明は、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、眼への、眼周囲への、又は眼内への埋め込みによる、疾患の局所的予防又は治療用薬剤の製造のための、埋め込み可能な固体剤形の使用を提供する。それを必要とする患者において疾患を局所的に予防又は治療する方法であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形を、眼への、眼周囲への、又は眼内への埋め込みにより投与することを含んでなる方法もまた提供される。
【0056】
この第四局面は、固体形態の活性物質を含有する固体単位剤形を、その場所での活性物質の放出にとって適切な、眼の、眼内の、又は眼周囲の部位に埋め込むことができるという驚くべき発見に基づいている。この活性物質は、好ましくは実質上水不溶性(上に定義のとおり)である。このような特徴は、該剤形からの活性物質のより長期且つより安定な放出を実現する。第三局面の好ましい態様では、活性物質はマトリックスメタロプロテイナーゼインヒビターである。MMPインヒビターは第一局面に関連して上に定義したとおりであってよい。
【0057】
第五の局面では、本発明は、マトリックスメタロプロテイナーゼインヒビターを、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、滅菌された、埋め込み可能な固体剤形を提供する。このような剤形の滅菌は、それがインビボで無菌部位に埋め込まれることを可能にする。
【0058】
さらに本発明は、上記のような固体剤形の製造におけるマトリックスメタロプロテイナーゼインヒビターの使用を提供する。
【0059】
第五局面による剤形の製造方法もまた提供され、その方法は、
i.マトリックスメタロプロテイナーゼインヒビター及び存在する場合は賦形剤を含有する圧縮剤形、例えば錠剤を製造し、そして、
ii.その圧縮剤形をガンマ線照射することにより滅菌する、
ことを含んでなる。
【0060】
さらに本発明は、上記の、そしてMMPインヒビターを含有する剤形を、緑内障濾過手術の実施に必要な手術用機器と共に含んでなるキットを提供する。
【0061】
本発明はさらに、それを必要とする患者における組織瘢痕形成を防止又は低減させる方法であって、固体剤形のマトリックスメタロプロテイナーゼインヒビターを、組織瘢痕形成を防止又は低減させるに充分な量で当該患者に投与することを含んでなる方法を提供する。
【0062】
特に記載の無い限り、本発明に係る固体剤形は、所望の溶解速度を持つ任意の固体剤形、例えば錠剤であってよい。所望の溶解速度とは、周囲の媒質中に治療有効濃度の該治療物質を実質的な時間放出させ得るような速度である。例えば、少なくとも1時間、より好ましくは少なくとも1日、さらに好ましくは少なくとも5日間、より好ましくは少なくとも20日間、より好ましくは少なくとも30日間、そして幾つかの例では60日間に至るまでである。様々な投薬レジメンもまた使用できる。例えば、各々5日間の放出を提供する一連の、例えば5個の錠剤を、術後に1部位へ埋め込むことが可能であろう。これらの錠剤は様々な用量を含有し得る。このことにより、ことによると種々の濃度を用いた活性物質(例えばMMPインヒビター)を使用する25日間程の継続処置が可能となるであろう。
【0063】
治療活性物質がイロマスタットである場合、重量約2〜5mgの固体剤形を使用すると、10μMのMMP阻害濃度が少なくとも30日間維持されることが判明した。原位置(in situ)で維持される活性物質の濃度は、その物質の溶解度及び該固体剤形が埋め込まれる組織内の流体の固有の流速によって変化する。
【0064】
好ましくはこの固体剤形は、組織内への埋め込みに好適であり、埋め込まれると徐々に溶解する。好ましくはこの固体剤形は、少なくとも1日、好ましくは少なくとも5日間、より好ましくは少なくとも10日間、より好ましくは少なくとも20日間、そして最も好ましくは少なくとも30日間、そして幾つかの例では最長60日間にわたって溶解する。
【0065】
この固体剤形の形状は、その表面積を変えることにより溶解速度に影響を及ぼし得る。この固体剤形は、溶解速度に影響を及ぼすポリマーで被覆することができる。そのようなポリマーは当業者に周知である。しかしながら、好ましくは該固体剤形はポリマーで被覆されていない。特に、分解生成物が毒性を示し得る分解性ポリマーの場合、組織から排泄される際に局所炎症反応が誘発され得るため、係るポリマーの使用は一般的に好ましくない。賦形剤及び/又は被覆のない錠剤を使用するもう一つの利点は、該剤形の周囲にインビボで蛋白性カプセルが形成されないことである。殆どの埋め込み剤はカプセル形成を導く異物反応を惹起し、また、殆どの被覆剤は、組織に残された場合にカプセル形成を引き起こすと予想されるが、これは炎症反応の一形態である。
【0066】
疾患を予防又は治療するためにデリバリーされる治療活性物質の濃度は、標準技術を用いて決定できるが、活性物質がMMPインヒビターである場合、組織瘢痕形成を防止又は低減させるのに必要な濃度は、約1μM〜約1000μM、より好ましくは約10μM〜約500μMである。
【0067】
該固体剤形の形状は、意図する用途によって変わるであろう。例えば、この固体剤形をGFS後の組織瘢痕形成を防止するために使用しようとする場合は、それが結膜下腔にデリバリーされ得る形状及びサイズであるのが好ましい。例えば該固体剤形は、直径5mm又はそれ以下で厚さ2mm又はそれ以下の錠剤であるのが好ましい。好ましくはこの錠剤は、0.1〜4mmの直径及び0.1〜1mmの厚さを持つ。固体剤形の形状は、予防又は治療しようとする疾患によって変わるであろう。該固体剤形は、処置されるべき組織、例えば腫瘍組織、硝子体液等の中に注射できるようなサイズとすることができる。
【0068】
本発明は、疾患の局所的予防又は治療のための、固体剤形中に入れた実質上水不溶性の治療活性物質を提供する。
【0069】
緩徐な溶解速度が達成される固体剤形中の実質上水不溶性治療活性物質を提供することにより、該物質の必要なin situ濃度が治療有効時間の間達成されることが可能であるということが見出された。この緩徐な溶解速度は、身体の限局された領域が該物質に長時間暴露される結果をもたらし、より有効な局所処置を導く。さらなる利点は、該固体剤形は、in situで溶解するので取り除く必要がないことである。本発明は、患者個人に治療活性物質を何度も注射する不都合な手技を回避できる。さらに、該物質への個体の暴露を減らすことにより、全身合併症のリスクを回避できる。
【0070】
本発明はさらに、疾患の予防又は治療のための局所デリバリー用固体薬剤の製造における実質上水不溶性治療活性物質の使用を提供する。
【0071】
さらに本発明は、固体剤形に入れた、疾患を予防又は治療するに充分な量の、実質上水不溶性の治療活性物質を該患者に局所投与することを含んでなる、それを必要とする患者における該疾患の予防又は治療方法を提供する。「実質上水不溶性」という語は上に定義した。
【0072】
本発明に係る固体剤形は、好ましくは、総体積が0.1mm3〜1.5cm3、より好ましくは0.5mm3〜1cm3である。該固体剤形は1又は2以上の賦形剤を含んでいてよいが、好ましくは実質的に賦形剤を含まない。「実質的に賦形剤を含まない」という語は、該固体剤形が50%(w/w)未満の賦形剤、好ましくは40%(w/w)未満の賦形剤、より好ましくは10%(w/w)未満の賦形剤を含んでなることを意味し、最も好ましくは該固体剤形が最大限でも微量(1〜2%(w/w))の賦形剤を含んでなることを意味する。上記のように、本発明の剤形は、賦形剤が好ましくはインビボで生体吸収性及び/又は生分解性である限り、必要とあらばこれらの限界を超えたレベルで賦形剤を含有することができる。驚くべき事に、全てMMPインヒビターで構成される固体剤形は、組織瘢痕形成を防止又は低減させるための適切な溶解速度を有することが判明した。
【0073】
好適な賦形剤は当業者に周知であり、任意の常套的な非毒性の医薬的に許容し得る担体、アジュバント又は媒質を包含する。例えば、使用できる医薬的に許容し得る担体、アジュバント及び媒質には、イオン交換樹脂、アルミナ、ステアリン酸アルミニウム、レシチン、緩衝物質、例えば燐酸塩、グリシン、ソルビン酸、ソルビン酸カリウム、飽和植物性脂肪酸の部分グリセリド混合物、塩化ナトリウム、亜鉛塩、コロイドシリカ、三珪酸マグネシウム、ポリビニルピロリドン、セルロースに基づく物質、エチルセルロース、中又は高分子量(例えば、数平均分子量600又はそれ以上)、ポリエチレングリコール、カルボキシメチルセルロースナトリウム、ポリアクリラート、ロウ、固体ポリオキシエチレンポリオキシプロピレンブロックコポリマー、羊毛脂、乳糖及びコーンスターチがある。好ましい賦形剤は、インビボで生分解性及び/又は埋め込み部位から生体吸収性である。
【0074】
該固体剤形は1又は2以上のさらなる活性物質を含んでいてもよい。好適なさらなる活性物質は、代謝拮抗物質、細胞毒性物質、抗成長因子(例えば、TGFβ、VEGF等)、又は該治療処置を支援できるその他任意の物質を包含する。例えば、治療物質がMMPインヒビターである場合、さらなる活性物質もまた組織瘢痕形成を防止することが好ましい。しかしながら、該固体剤形中に含まれる唯一の活性物質が実質上水不溶性治療物質、例えばMMPインヒビターであることが好ましい。
【0075】
該固体剤形の重量は、その意図する用途及び存在するかも知れない賦形剤又はさらなる活性物質の量によって変わるであろう。例えば、該固体剤形がGFSの間の組織瘢痕形成の防止に使用されるべきものであり、全体が、実質上水不溶性治療物質、例えばMMPインヒビターで構成される場合、固体剤形の重量は、10mg未満、より好ましくは6mg未満、最も好ましくは1〜5mgであるのが好ましい。固体剤形の重量は、その意図する用途によって変わるであろう。好ましくは該固体剤形は、1〜5mgの実質上水不溶性治療物質、例えばMMPインヒビターを含んでなる。この固体剤形は、使用に際して、疾患が起こった、又は起こりそうな身体内の部位に位置させるのであるから、滅菌するのが好ましい。該固体剤形は任意の標準技術を用いて滅菌できる。好ましくは該固体剤形はガンマ線照射を用いて滅菌する。
【0076】
本発明の好ましい態様によれば、実質上水不溶性治療物質は、組織瘢痕形成を防止又は低減させるためのMMPインヒビターである。本明細書に記載のMMPインヒビターの固体剤形を使用して、いかなる種類の組織瘢痕形成も防止又は低減させ得る。
【0077】
瘢痕形成はしばしば火傷の治癒の際に起こる。この火傷は、化学的、熱的又は放射線火傷であってよく、眼、皮膚表面又は皮膚及び下層組織のものであってよい。例えば放射線治療により惹起された、内部組織の火傷がある場合もある。瘢痕形成は物理的及び/又は美容上の問題、例えば運動の喪失及び/又は外観の変形を導くことがある。
【0078】
瘢痕形成は、皮膚移植片を作製する場合にも起こる。様々な理由で皮膚移植片が適用され、瘢痕形成が物理的及び美容的問題をもたらすことがある。例えば重度の火傷の場合のように多くの皮膚移植片を要する場合、これは特に重大な問題である。
【0079】
防止又は低減させることのできる特別な種類の組織瘢痕形成には、眼科手術後の眼の組織の瘢痕形成がある。殆どの種類の眼科手術は幾らかの組織瘢痕形成を引き起こす。例えば、新たな流出経路を創設する緑内障濾過手術(GFS)は、組織の瘢痕形成のためにしばしば失敗する。故に、瘢痕組織形成を防止する方法は極めて貴重である。瘢痕組織は角膜外傷又は角膜手術、例えば近視又は屈折異常のレーザー又は外科的処置の後にも形成され得る。角膜混濁及び水晶体摘出もまた瘢痕形成を惹起し得る。瘢痕組織はさらに、硝子体液又は網膜の上/中にも形成されることがあり、例えばこれは若干の糖尿病患者において最終的に失明を引き起こし、また、網膜剥離手術後に形成される。防止又は低減させることのできる他のタイプの瘢痕形成には、斜視、眼窩若しくは眼瞼手術後の眼窩内若しくは眼及び眼瞼筋上に形成される瘢痕、又は、緑内障手術後に起こり得る甲状腺眼症の際に起こる結膜の瘢痕形成、又は瘢痕性疾患、炎症性疾患(例えば類天疱瘡)若しくは感染性疾患(例えばトラコーマ)において起こる結膜の瘢痕形成が包含される。さらに、組織再生を可能にさせるような局所眼環境の調製は、本発明に係る剤形の恩恵を受けるであろう。
【0080】
瘢痕形成は、未熟児網膜症、黄斑変性、及び近視にも関連する。眼神経の瘢痕形成もまた緑内障で起こり得る。
【0081】
別の形態の瘢痕形成は、瘢痕収縮、即ち瘢痕の線維組織が縮むことによる収縮である。幾つかの場合には、瘢痕は、その収縮が重大な変形を惹起する瘢痕である、悪性瘢痕となることがある。胃潰瘍が治癒する時に形成される瘢痕組織の収縮により、患者の胃は、砂時計拘縮で事実上二つの別々のチェンバーに分かれることがある。瘢痕組織の収縮により、通路及び管路の閉塞、瘢痕狭窄が起こり得る。血管の収縮は、例えば手術又は血管形成術後に、原発性閉塞又は外科的外傷が原因で起こり得る。他の管腔臓器、例えば尿管の狭窄もまた起こり得る。偶発的創傷に由来するものであろうと手術に由来するものであろうと、いかなる形態の瘢痕形成が起こっても問題が発生し得る。
【0082】
瘢痕組織が形成されそうな場合であろうと、形成されつつある場合であろうと、又は形成されてしまった場合であろうと、MMPインヒビターの固体剤形が使用できる。
【0083】
さらに瘢痕形成は、コラーゲン含有組織の収縮に関わり、手術又は事故に起因する外傷後状態、例えば手又は足の腱の損傷、移植後状態及び病的状態、例えば強皮症、デュピュイトラン拘縮及び表皮水疱症を含む、皮膚及び腱の状態にも関わっている。
【0084】
MMPインヒビターの固体剤形は、好ましくは化学的火傷、熱的火傷若しくは放射線火傷、皮膚移植、手術若しくは事故に起因する外傷後状態、緑内障手術、糖尿病関連眼疾患、強皮症、デュピュイトラン拘縮、表皮水疱症又は手若しくは足の腱の損傷に関連する組織瘢痕形成の予防若しくは治療に使用される。好ましくは、処置はできるだけ早く、有利にするには直ちに、そして最も有利なのは最初の瘢痕形成の徴候の前に行うべきである。上に指摘したように、該固体剤形は、好ましくは組織瘢痕形成を防止又は低減させるために手術部位に埋め込むためのものである。
【0085】
MMPインヒビターを含んでなる固体剤形は、眼へのデリバリー及び眼組織の瘢痕形成を防止するためのものであることが特に好ましい。したがって、MMPインヒビターを含んでなる固体剤形は、好ましくは眼科手術、とりわけGFSの後の眼組織の瘢痕形成を防止又は低減させるために使用される。特に、GFSの後に結膜下腔内に該固体剤形を入れることにより、MMPインヒビターが房水中に徐々に放出されることが見出された。MMPインヒビターの存在は、ブレブ(切開創を覆う組織)が瘢痕形成するのを防止し、それにより、流体が、房水から切開創を通って流出することを防ぐ。
【0086】
本発明の好ましい態様では、実質上水不溶性の治療物質、例えばMMPインヒビターの固体剤形は、本質的に、実質上水不溶性の治療物質、例えばMMPインヒビターで構成される。本明細書で使用する「本質的に〜で構成される」という語は、該固体剤形が、実質上水不溶性の治療物質、例えばMMPインヒビターで構成されており、他の構成成分を微量(最大約1〜2%(w/w))含むに過ぎないことを意味する。
【0087】
本発明はさらに、埋め込み可能な錠剤の形態である、実質上水不溶性の治療物質を含んでなる固体医薬組成物を提供する。好ましくはこの錠剤は、直径5mm又はそれ以下で、且つ好ましくは2mm又はそれ以下の厚さを有する。この錠剤は好ましくは、0.1mm3〜1.5cm3の総体積を有する。治療物質は上に定義のとおりである。上に述べたようにこの錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的に該治療活性物質で構成される。
【0088】
好ましい態様では、本発明はさらに、マトリックスメタロプロテイナーゼインヒビターを含んでなる、錠剤の形態の、埋め込み可能な固体医薬組成物を提供する。好ましくは、該錠剤は直径5mm又はそれ以下で、且つ好ましくは2mm又はそれ以下の厚さを有する。この錠剤は好ましくは、0.1mm3〜1.5cm3の総体積を有する。
【0089】
MMPインヒビターは上に定義のとおりである。この錠剤は、好ましくは、眼科手術、特にGFS後の組織瘢痕形成を防止するために結膜下腔内に挿入できるようなサイズとする。上に指摘したように、この錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的にMMPインヒビターで構成される。
【0090】
さらに本発明は、実質上水不溶性の治療物質を含んでなる、重量10mg未満、好ましくは6mg未満の錠剤の形態の、固体医薬組成物を提供する。
【0091】
治療物質は上に定義のとおりである。上に指摘したように、この錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的に該治療物質で構成される。
【0092】
好ましい態様では、さらに本発明は、マトリックスメタロプロテイナーゼインヒビターを含んでなる、重量10mg未満、好ましくは6mg未満の錠剤の形態の、固体医薬組成物を提供する。
【0093】
MMPインヒビターは上に定義のとおりである。上に指摘したように、この錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的にMMPインヒビターで構成される。
【0094】
さらに本発明は、実質上水不溶性の治療物質を含んでなる、滅菌された固体医薬組成物を提供する。好ましくはこの実質上水不溶性の治療物質は、マトリックスメタロプロテイナーゼインヒビターである。このMMPインヒビターは上に定義のとおりである。好ましくはこの医薬組成物は錠剤の形態である。上に指摘したように、この医薬組成物は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的には、唯一の活性物質としての実質上水不溶性の治療物質で構成される。この固体医薬組成物は、ガンマ線への暴露によって滅菌される。
【0095】
本発明はさらに、
i.実質上水不溶性の治療物質の固体錠剤を形作り;そして、
ii.この錠剤をガンマ線で照射して滅菌する、
ことを含んでなる、実質上水不溶性の治療物質を含んでなる滅菌された固体医薬組成物を製造する方法を提供する。
【0096】
本発明方法は、組織瘢痕形成を防止又は低減させるための滅菌固体医薬組成物の製造を可能にする。実質上水不溶性の治療物質の固体錠剤を形作る工程は、任意の適当な技術を用いて実施できる。好ましくは、この固体錠剤は、打ち抜き型又はその他の適当な技術を用いて、実質上水不溶性治療物質を固体錠剤に圧縮することにより形作る。この錠剤をガンマ線照射する工程は、好ましくは、滅菌を確実とするために錠剤を25KGy線量に付すことを含んでなるが、より低い線量で充分であることもある。治療物質は上に定義のとおりであり、好ましくはMMPインヒビターである。上に指摘したように、この錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的に、実質上水不溶性の治療物質で構成される。
【0097】
本発明はさらに、MMPインヒビターを含んでなる固体剤形及び緑内障濾過手術の実施に必要な手術用機器を含んでなるキットを提供する。
【0098】
MMPインヒビターは上に定義のとおりである。固体剤形もまた上に定義のとおりであるのが好ましい。このキットは複数の該固体剤形を含んでなるかも知れず、その場合、必要な用量に応じて幾つかの固体剤形を患者に埋め込むことができる。このキットはまた、この固体剤形の使用方法を指示する説明書をも含んでなることがある。
【0099】
多くの身体組織、例えば結膜下は、容量が小さく水流動性が低いため、非沈降状態が存在する。固体形態の殆どの活性物質の溶解の律速段階は、これらの非沈降状態により引き起こされる。流動性が一定範囲内であると考えられる状態における溶解は、主として直線的であろう。このことは投与量の廃棄及びバースト放出動態を防ぎ、一定の持続的な活性物質濃度を可能にする。驚くべき事に、賦形剤のない錠剤剤形を使用する場合、局所接触組織の毒性は観察されない。これもまた驚くべき事に、砕けたり粉々になったりしない小錠剤を製造することができる。これについての特定の理論に拘束される訳ではないが、これは、微量の残留水及び生物活性物質の難溶性に起因すると思われる。賦形剤の不在は、活性物質がその賦形剤と混和及び共存することを確保する必要性を排除する。これは、典型的には、最終剤形において活性物質の相分離が起こらないことを確実にするために必要とされる。
【0100】
実質上水不溶性の治療物質、例えばMMPインヒビターを、賦形剤無しで使用することは、それがこの形態において安定であり且つその活性を維持するということから、驚くべき事である。一般に、賦形剤は活性物質の安定な分散を維持し凝集現象を防止するために必要であると予想されるため、これは驚くべき事である。よって、埋め込み用に設計された、賦形剤を殆ど含まない固体剤形において、活性物質を反復投与する必要無しにその有効性が観察されることは、驚くべき事である。
【0101】
この剤形は、結膜下に固有の、そして一般には組織に固有の、非沈降状態での使用に合わせて設計されるため、大部分が活性物質から作られている固体錠剤形態の使用は、生物活性物質の長期且つ一定の局所濃度の維持に最適となるであろう。
【0102】
本発明の第六の局面によれば、固体形態の抗体を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる固体単位剤形の医薬組成物が提供される。
【0103】
「抗体分子」と同義である「抗体」という語は、本発明の第一局面に関連して使用される意義と同じ意義を有する。
【0104】
これまで、治療用又は診断用抗体は一般に水溶液として製剤化及び投与されてきた。或る場合には、抗体は凍結乾燥固体として供されてきたが、この固体は使用前に再構成されねばならず、そこから得られる溶液から適切な用量を得なければならない。驚くべき事に本発明者等は、抗原結合を保持し、且つインビボ使用のための適当な放出特性を伴った、固体単位剤形として抗体を製剤化することが可能であることを見出した。さらに、抗体を固体単位剤形として製剤化することによりインビボ埋め込み後の抗体の持続放出の達成が可能であるが、そのような放出は水性注射用製剤では達成できない。このような結果は他の蛋白型治療用又は診断用物質でも達成できる。
【0105】
或る態様では、抗体はモノクローナル抗体である。特にこの抗体は腫瘍性疾患の予防又は治療を適応とすることができ、例えば抗VEGF抗体であってよい。抗VEGF抗体の例はベバシズマブ(アバスチン)である。
【0106】
本発明のこの局面の組成物は、好ましくは滅菌される。
【0107】
1又は2以上の賦形剤が存在する場合、これらは好ましくは、インビボ埋め込み後に生分解性及び/又は生体吸収性である。或る態様では、該組成物は実質上賦形剤を含まない(上に定義のとおりである)。幾つかの態様では、或る種の賦形剤、例えば安定化用糖類(例えばトレハロース)、緩衝塩、界面活性剤及び/又は、水性注射用抗体製剤に典型的に含有される類似の比較的可溶性の賦形剤を存在させることができ、幾つかの例では、本発明に係る組成物の有利な性質に著明な影響を及ぼさない、かなりの量で存在させることができる。事実、幾つかの例では、賦形剤の配合を利用して、該組成物からの抗体の放出を改善及び/又は制御できる。したがって、親水性ポリマー、例えばヒアルロン酸を本発明に係る抗体錠剤組成物に含有させ得ること、そしてそれらが適当量存在する場合には抗体放出の増強を導き得ることが判明した。より大量では、ヒアルロン酸のような親水性ポリマーは、より持続的な抗体放出を導くことができるかも知れない。
【0108】
この局面の組成物は圧縮によって製造できる。この種の好ましい組成物は錠剤である。何れにせよ各々の固体単位剤形は、好ましくは0.1mm3〜1.5cm3の体積を持ち、及び/又は最大寸法5mm以下であり、及び/又は重量10mg以下である。
【0109】
この局面の組成物は、1又は2以上のさらなる治療活性成分を含有でき、それは抗体であってもそうでなくてもよく、そして固体形態であってもそうでなくてもよい。
【0110】
本発明はさらに、治療に使用するための第六局面による組成物を提供する。加えて本発明は、腫瘍性疾患の予防又は治療に使用するための、第六局面による組成物を提供する。同様に本発明は、それを必要とする患者における腫瘍性疾患の予防又は治療方法を提供し、この方法は、該患者に第六局面による医薬組成物を投与することを含んでなる。
【0111】
本発明の第七の局面によれば、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形[ここで、この1又は2以上の賦形剤は、それが存在する場合、その1又は2以上の賦形剤の化学的又は生化学的分解により活性物質の放出を制御することはない]が提供される。この剤形は好ましくは滅菌される。
【0112】
本発明の第八の局面によれば、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形[ここで、この剤形は圧縮により製造される]が提供される。この剤形は好ましくは滅菌される。
【0113】
本発明の第九の局面によれば、固体形態の治療用又は診断用蛋白物質、例えば抗体を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる固体単位剤形の医薬組成物[ここで、この剤形は圧縮により製造される]が提供される。この局面の剤形は、好ましくは錠剤の形態である。この局面の剤形は、好ましくは実質上賦形剤を含まない。該剤形はさらに、好ましくは滅菌されている。該剤形は好ましくは埋め込み可能であり、そして好ましくは、埋め込みへの適合性に関して上に記載した1又は2以上のさらなる特徴を有する。
【0114】
第十の局面によれば、本発明はさらに、その部位を冒している状態の局所的予防又は治療のために、インビボ部位に治療活性物質をデリバリーする方法であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる固体剤形を、当該部位に埋め込むことを含んでなる方法を提供する。或る態様では、この剤形は実質上賦形剤を含まない。或る態様では、この賦形剤は非ポリマー性である。
【0115】
ここに本発明を、単なる例として以下の図面に準拠して説明する。
【図面の簡単な説明】
【0116】
【図1】図1は、pH7.6の水溶液中でのイロマスタットの溶解度の検量線を示す。
【図2】図2は、イロマスタット錠1からの放出プロファイルを示す。
【図3】図3は、錠剤1を入れたリグから採集された試料中のイロマスタット濃度を示す。
【図4】図4は、イロマスタット錠2からの放出プロファイルを示す。
【図5】図5は、錠剤2を入れたリグから採集された試料中のイロマスタット濃度を示す。
【図6】図6は、5−FUの溶解度の検量線を示す。
【図7】図7は、5−FU錠からの放出プロファイルを示す。
【図8】図8は、リグから採集された試料中の5−FU濃度を示す。
【図9】図9は、種々の条件下での、賦形剤を含まない錠剤から放出された5−FUの累積放出(a)及び濃度(b)を示す。この放出プロファイルは、
【化1】

、を示す。
【図10】図10は、賦形剤を含まない錠剤から放出されたトリアムシノロンの累積放出(a)及び濃度(b)を示す。
【図11】図11は、賦形剤を含まない錠剤から放出されたデキサメタゾンの累積放出(a)及び濃度(b)を示す。
【0117】
【図12】図12は、賦形剤を含まない錠剤から放出されたナプロキセンの累積放出(a)及び濃度(b)を示す。
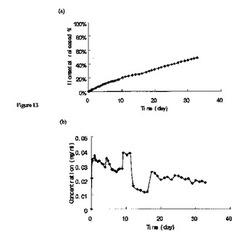
【図13】図13は、200μl流動溶解リグに入れた賦形剤を含まない錠剤から放出されたイロマスタットの累積放出(a)及び濃度(b)を示す。
【図14】図14は、実質上賦形剤を含まない錠剤からのベバシズマブの放出プロファイル及び活性保持を示す。
【図15】図15は、実際のデータ点をプロットした、図14の「活性蛋白」データを示す。
【図16】図16は、市販の注射用製品アバスチンから得られたものと比較した、賦形剤を含まない錠剤からのベバシズマブのサイズ排除クロマトグラフィー軌跡を示す。
【図17】図17は、本発明に係る錠剤及び賦形剤としてヒアルロン酸を含有する錠剤からのベバシズマブの放出プロファイルを示す。
【実施例】
【0118】
実施例
溶解性実験は、イロマスタット及びその他のMMPインヒビターの治療用量が、固体錠剤形態のイロマスタット又はその他のMMPインヒビターの遅速溶解によって達成できる可能性を示唆した。クリアランスがインビトロフローセルにおいて5分未満で起こる単純な注射と比較して、この錠剤形態のイロマスタットでは長期放出が達成されることが証明された。次に、臨床的に検証されたインビボGFSモデルを用いて、最長30日間の様々な時点での、手術部位における長期放出の効果を調べた。GFSに関してイロマスタットは毒性でないことが見出されているが、この教示は、種々のMMPインヒビター及びその他の実質上水不溶性治療物質にも適用できる。
【0119】
材料及び方法
流動システム
放出動態について幾らかの指標を得るために、50〜200μl容量の流動リグを用いてブレブのモデルとした。イロマスタット錠剤(1リグあたり1個の錠剤)をフローチェンバー内に置いた。2本の管を各リグに接続する。一方は水溶液を導入する蠕動ポンプに接続し、他方はリグからこの溶液を排出させる。流速を利用して、結膜下腔への、及び結膜下腔から強膜静脈に至るこの水溶液の流動をモデル化する。溶液がリグから流出する際に試料を採取し、この徐放系におけるイロマスタットの濃度を決定する。
【0120】
一定範囲の流速をこのリグ実験に使用したが、殆どの実験では、流速2μl/分を使用して、ブレブにおける水の流速をシミュレートした。眼内の実際の状態をさらにシミュレートするため、使用した水溶液をpH7.4〜7.6(これが正常なヒト房水のpHであるため)に維持し、温度を37℃に維持した。この水溶液はOxoid(登録商標)リン酸緩衝化生理食塩水錠剤を用いて調製した(脱イオン水100mlあたり1錠)。このPBS錠を脱イオン水に溶解し、pHを7.6に調節した。この水溶液を37℃に保持した。
【0121】
錠剤の製造
錠剤用パンチ及びダイを使用し、固体イロマスタットをダイに置き、パンチを取り付ける。この固体イロマスタットは、ダイに置く前に精確に秤量した。次に、取り付けたパンチ−ダイを錠剤圧縮機中に入れ、約10秒間5barの圧力で圧縮した。
【0122】
HPLC方法
幾つかの逆相カラム及び移動相を評価し、イロマスタットのHPLC分離に必要な最適条件を決定した。C−18カラム(SIGMA)及び25%アセトニトリル水性移動相が良好な基線分離を与えることが判明した。移動相は以下のように調製した。緩衝液1000mlを作製するために、酢酸アンモニウム(Fluka)1.54gm、99.5%トリエチルアミン6ml(Sigma Aldrich)、脱イオン水〜950mlを混合し、次いで100%酢酸(Analar BDH)およそ10mlを加え、この緩衝液のpHを5.0±0.1に調節した。pHを調節する際、脱イオン水を加えて緩衝液の容量を1000mlとした。各試料のアリコート(0.1ml)をHPLCバイアルに移し、次にこれをHPLCオートサンプラーに入れた。移動相を1ml/分で溶出し、UV検出機を280nmに設定し、イロマスタット溶液の濃度を決定した(Galardy et al. 1994b)。各時点で3回の注入(各10μl)を評価した。UV検出機にコンピューターを接続し、プログラムChrom+を使用してピーク面積を解析し、イロマスタットの量を決定した。ピーク表面は、被験溶液中のイロマスタットの濃度を表す。3個の測定値の平均を用いてイロマスタットの量を決定した。
【0123】
ガンマ線照射による錠剤の滅菌
欧州及び米国薬局方の規定に従い、投与される薬物の最終剤形は無菌である必要がある。錠剤製造は無菌条件で実施される訳ではなく、滅菌イロマスタットは市販されていないため、イロマスタット錠をガンマ線照射によって滅菌する必要があった。ガンマ線照射は、無菌処理及び濾過よりも優れた製品滅菌の確実性といった著明な利点を持つこと、製造された最終製品の内部を貫通すること、低温プロセスであること、そして単純な検証プロセスを有することから、幅広く利用されている。さらに、例えばエチレンオキシド滅菌の場合のような除去すべき残留物がない。潜在的な1つの不都合は、ガンマ線照射は試料内部の化学構造の改変を導き得る化学反応を開始させ得ることである。一般に、最低限の無菌性保証レベルSAL=10−6(処理後にその物体が非無菌である確率が百万分の一)の達成には25kGyの線量が必要である。より低い線量は、適当な無菌試験を使用して検証できる。欧州及び米国薬局方の規定の下では、25kGy線量の照射が無菌性を保証する(2000a;2000b)。英国のクランフィールド大学と協力して、コバルト60ガンマ線源を利用した。これは、薬物及び生体材料を照射により滅菌するのに好適であると考えられる。よってイロマスタットを未加工粉末及び製造済み錠剤として照射した。コバルト60ガンマ線源は1時間あたり約4500kGyの照射にあたることから、25kGyの暴露を達成するために試料をコバルト60パノラマ式チェンバーに約5時間35分間放置した。
【0124】
インビトロ実験
1.ヒトテノン線維芽細胞(HTF)
インビトロ培養用にヒトテノン線維芽細胞(HTF)を使用した。これらの細胞は結膜下瘢痕形成に関与している。ヘルシンキ宣言の信条(1989)の下にモアフィールド病院アイバンクから取得したドナー眼由来の0.5cm3の組織外植片を使用して、HTF単離及び増殖の処理を実施した。0.5cm3の外植片を、25cm3のフラスコの底に、カバースリップを載せて2時間保持した。各フラスコには、10%牛胎児血清、2mM L−グルタミン、100U/mlペニシリン、50mg/mlゲンタマイシン、100μg/mlストレプトマイシン及び0.25μg/mlアムホテリシンを加えたダルベッコ改良イーグル培地(DMEM)で構成される通常培地5mlを入れた。フラスコを、37℃及び空気中5%加湿CO2のインキュベーターに入れた。培地を3日毎に交換し、コンフルエントになった時に(通常1ヶ月以内)、新たなフラスコに継代し、直接実験に使用するか、液体窒素中に保存した。
【0125】
2.細胞培養の継代及び維持
HTFがコンフルエントに達した後、培地を吸引し、単層をトリプシン1x(Gibco)1mlで洗浄し、このトリプシンを約15秒間速やかに吸引した。次に、トリプシン1x(Gibco)2mlを各フラスコに加え、37℃及び空気中5%加湿CO2で2分間インキュベートすることにより、HTFをフラスコから剥離させた。x10倍率のLeica顕微鏡を用いる位相差顕微鏡検査によって、細胞がフラスコの底から剥離し、それらが球形を獲得したことを確認した後、細胞培地2mlを加えてトリプシン処理を中和した。細胞懸濁液を15ml遠心管(STARLAB GMBH)に移し、1600rpmで5分間遠心分離した。次いでこの細胞ペレットを細胞培地10mlに再懸濁し、4個の異なる75cm3フラスコに分けた(1:4の拡大)。各フラスコに細胞培地7.5mlを加えた。フラスコを37℃及び空気中5%加湿CO2のインキュベーターに入れ、3日毎に培地を交換した。コンフルエントに到達させるために継代から継代までに必要な時間は平均1週間であった。
【0126】
3.コラーゲンゲルの調製(インビトロ収縮モデル)
ノイバウエルプレートを用いて6.2x104HTFを計数し、次いで50mlユニバーサル管に入れたFBS170μlに再懸濁した。濃縮培地(160μl)を加えた(3.5mlDMEM(x10原液)、0.35mlグルタミン(2mM原液)及び0.9ml重炭酸ナトリウム(7.5%原液)より成る保存溶液)。次に、First LinkI型コラーゲン溶液のコラーゲン(0.6%酢酸中原液2.2mg/ml)830μlを加え、気泡ができないよう、この溶液を回転させて混合した。滅菌1M NaOH(75〜80μl)を速やかに添加して溶液の酸性pHを変化させた。これにより溶液はピンク色となり、元の黄色には戻らなかった。直ちにコラーゲンゲル溶液150μlをMattek皿のウェルに流し入れ、ピペットチップを用いてこのゲルが確実に中央溝の隅に入っているようにした。ゲルをチップから排出する際、気泡の生成を回避せねばならない。気泡ができた場合はそれらを吸入除去した。通常、ゲル懸濁液1.2mlから6個のゲルが容易にできる。この処理の後、ゲルの入ったMakket皿のウェルをインキュベーターに入れ、少なくとも10〜15分間(最長30分間)で固まらせた。黄色のチップを用いて中央溝の隅からゲルを剥離し、ポリマー化しなかった過剰の溶液を吸引除去した。細胞培地2mlを加え、皿を37℃及び空気中5%加湿CO2のインキュベーターに入れた。培地は3日毎に交換した。
【0127】
4.イロマスタットを含有する培地の調製
一般に固体イロマスタットは培地に添加する前にDMSOで希釈するが、この実験では、イロマスタットをDMSOを含まない通常培地に直接溶解できた。培地及び滅菌しておいた固体イロマスタット、並びに培地及び非照射固体イロマスタットを、異なる50mlユニバーサル管に入れ、約5〜6時間攪拌した。次いで両試料の濃度をHPLCで確認した。
【0128】
5.イロマスタット活性のインビトロ評価
コラーゲンIゲルのHTF収縮に及ぼす非照射イロマスタットの阻害効果が知られている。照射したイロマスタットと比較するため、3つの異なるコラーゲンゲルの処置群による実験を行った。各処置群はHTFを伴う3つのコラーゲンIゲルを有していた。第一群のゲルはイロマスタット無しの培地で処理し(負の対照)、第二群のゲルは非照射イロマスタットを加えた培地で処理し(正の対照)、そして第三群のゲルは照射したイロマスタットを加えた培地で処理した。
【0129】
第二のインビトロ実験では、通常培地に直接溶解した照射イロマスタット錠の阻害効果を、最初にDMSOに、次いで通常培地に溶解した非照射イロマスタット粉末と比較した。この実験は、錠剤の製造プロセスが固体状態の変化、例えばイロマスタットの有効性低下を導き得る結晶化をもたらすかどうかを決定するために実施した。
【0130】
イロマスタットの阻害効果を、コラーゲンゲルの収縮を測定することにより決定した。ゲルの写真を毎日撮影した。収縮%は、Image Jと呼ばれるソフトウェアを用いて決定した。次いで処理したゲルの培地を、活性MMPのレベルを調べるための将来のザイモグラフィー解析のために−70℃で保存した。
【0131】
インビボ実験
1.実験設計
左目に緑内障ドレナージ手術を受ける4匹のウサギによってランダムな1ブロック研究の設計を実施した。動物を30日間観察した。この実験は、マスキングされた観察者を用いるランダム化盲検対照研究として実施した。一人の観察者を臨床データの評価に利用した。
【0132】
2.動物
4匹の雌性ニュージーランドホワイトウサギ(Harlan UK Ltd; c.2〜2.2kg、12〜14週齢)を使用した。動物を眼科用BRUユニットに収容し、通常必要とされる順応期間7日間を与えた。
【0133】
3.処置レジメン
表1に示すように動物を2群の何れかにランダムに割り付けた。A群の動物には賦形剤不含イロマスタット錠(ペレットとも称する)を投与し、B群には対照としてエチルセルロース錠を投与した。エチルセルロースは水溶液に溶解しない賦形剤であり、MMPに対して既知の阻害活性を持たない。エチルセルロース錠のサイズは30日間のインビボ実験の間不変であった。単に不活性エチルセルロース錠を入れたためではなく、イロマスタット自体がブレブ及びその機能性を維持したのかどうかを判定するために、対照ペレットはイロマスタットペレットと同サイズとした。
【0134】
【表1】

【0135】
GFS終了時、結膜閉鎖の直前に、イロマスタット又はエチルセルロース錠の何れかを左眼の結膜下に配置した。
【0136】
4.緑内障濾過操作 − 緑内障濾過手術のモデル
手術は、文献に詳細に記載されている標準法を用いて実施する。外科的手技及びウサギにおけるその使用を一致させることにより、過去の研究とのおおよその比較が可能となる。このモデルは臨床的に検証されており、且つこの外科的手技は広く臨床使用されていることから、このことは特に重要である。
【0137】
試料の採取
HPLCでイロマスタットの検出を行うため、第30日目の実験終了時に、房水、硝子体及び血液を採取した。
【0138】
結果
検量線
DMSOを含まないpH7.6の水溶液中でのイロマスタットの検量線を図1に示す。この曲線は、Chrom+と称するソフトウェアと共に上記の移動相及びUV検出機(280nm)を使用するHPLCカラム(C18)から溶出するイロマスタットを測定することにより作製した。
【0139】
この曲線は以下のように作製した。イロマスタット(0.3885mg)(Caldiochem、純度>95%)をpH7.6の水溶液(10ml)に溶解し、100μM濃度の保存溶液を得た。次にこの保存溶液を個々の容器中に希釈して、以下の濃度を持つ6種類の溶液を得た:80μM、60μM、40μM、20μM、10μM及び5μM。次いで各溶液をHPLCで3回評価し、吸光度を決定した。イロマスタットのピークは注入のおよそ6〜8分後に検出された。得られた平均の検量線を図1に示す。
【0140】
イロマスタット錠の放出
全般的な狙いは、緑内障濾過手術後に結膜下腔に純粋な圧縮イロマスタットで作られた小錠剤を配置したならば、イロマスタットが房水に持続放出する結果となるかどうかを確定することであった。イロマスタットは極めて高価な化合物であるため、イロマスタット錠の製造に先立ち、5−FUのような他の化合物を用いる小錠剤製造において経験を得た。6.5mg、5.6mg及び3.2mgの固体イロマスタットを用いて3種の賦形剤不含イロマスタット錠を製造した。標準的な錠剤用パンチ及びダイ並びに適用圧力5barのプレス機を使用した。第一の錠剤は直径3mm、厚さ0.87mm及び重量4.8mgであった。第二の錠剤は同じ直径、厚さ0.62mm及び重量4.1mgであった。第三の錠剤は直径3mm、厚さ0.4mm及び重量2.3mgであった。少量のイロマスタットがパンチ及びダイの表面に残留した。第一の錠剤の製造に用いられたイロマスタットの量は、30日間のあらゆる時点でイロマスタットが水溶液(約100μM)中で理論上最大の溶解性を維持するという仮説に基づいた。
【0141】
各錠剤をリグ内に配置した後、pH7.6の水溶液をリグ内にポンプ注入した。流速は、小柱網を通る房水の流速と同様の2μl/分に設定した。リグを出た後の液体試料を集めた。次に、濾過後の試料をHPLCで分析し、検量線を用いてイロマスタットの濃度を決定した。
【0142】
表A及びBのデータを利用して各錠剤についての放出プロファイルをグラフで表した(図2、3、4及び5)。
【0143】
インビボ実験に使用するイロマスタット錠の製造
試験された2個の錠剤が流動リグ内で30日後に完全に溶解していないことが判明したため、本発明者等は、2.3mgのイロマスタットを使用して、より柔らかい錠剤を作ろうと試みた。本発明者等はこの錠剤を200μl容量の流動リグに配置し、この系を流速2μl/分に設定した。この錠剤の放出プロファイルを表4に示す。
【0144】
【表2−1】

【表2−2】

【0145】
【表3−1】

【表3−2】

【0146】
【表4−1】

【表4−2】

【0147】
HPLCによる、照射イロマスタット及び非照射イロマスタットの比較
緑内障濾過手術中にイロマスタット錠を埋め込むためには、この錠剤が無菌である必要があった。医薬品規制調和国際会議(ICH)は、照射された製品と照射されていない製品の特性解明及び比較に、高速液体クロマトグラフィー(HPLC)、質量分析又はガスクロマトグラフィーの使用を推奨している。これらの指針に従い、ガンマ線照射イロマスタットをpH7.6の水溶液に溶解し、それをHPLCで評価した。照射されたイロマスタットのクロマトグラムを非照射イロマスタットのクロマトグラムと比較した。照射イロマスタットのクロマトグラムは、イロマスタット全体と比較して、照射後に形成される0.25%の微量生成物を表す追加のピークを示した。これは、米国及び欧州薬局方何れの基準にも適合する。
【0148】
イロマスタット錠の安定性
イロマスタットを0.1mMの濃度でDMSO又は水に溶解した溶液は、4℃で1ヶ月あたり1%が分解し、37℃ではこれが一日あたり1%に増大する(Caldiochemのデータ)。37℃の湿潤環境で数日間放置した場合のイロマスタット固体錠剤の安定性を記載したデータは公表されていない。イロマスタット錠を、37℃の水性環境で30日間潜在的分解について評価した。第二の錠剤から試料を採取した後、本発明者等は、リグから残存固体を除去し、それを水溶液(pH7.6)に溶解した。残存イロマスタット化合物を含むこの水溶液の第30日目におけるクロマトグラム及び第一の時点においてリグから採取された水溶液のクロマトグラムを比較した。両クロマトグラムは極めて似通っており、この30日間で分解が起こらなかったことを示唆した(データは記載されていない)。
【実施例1】
【0149】
実施例1
DMSO無しで直接媒質に溶解した照射イロマスタット粉末及び照射イロマスタット錠がインビトロで収縮を阻害する能力
3種類の処置カテゴリー(通常媒質、非照射及び照射イロマスタット)のゲルはすぐには収縮を開始させなかった。この理由により、3つの処置群において第1日目までは著明な変化が見られなかった。第2日目からゲルが収縮し始め、照射及び非照射イロマスタットの阻害効果が明らかとなった。実験が終了した7日目までに、負の対照群及びイロマスタット群の収縮に統計的有意差があった。
【0150】
【表5】

【0151】
第2のインビトロ実験
【表6−1】

【表6−2】

【0152】
実施例2
インビボ実験におけるイロマスタット錠の有効性
1.臨床的観察
エチルセルロース錠(対照)を投与されたウサギのブレブは、緑内障濾過手術の10日後に不全となった。対照的に、イロマスタット錠を投与された3匹のウサギのブレブは不全とならなかった。30日後、計画された実験は終了した。1匹のウサギにおいて、7日目に強膜の縫合が裂け、管が前房に落下した。これが起こった場合、通常の予想ではブレブが不全になる。しかしながら驚くべき事に、良好な構造のブレブが30日目までこのウサギに存続した。処置群及び対照群のウサギに角膜上皮症は観察されなかった。さらに、ブレブ領域上部の結膜は正常で無血管性ではなかった。緑内障濾過手術においてMMCを使用した後には無血管性ブレブが観察されてきた。そのうえ、柔らかい眼は観察されなかった。
【0153】
2.30日目にウサギから採取した液体試料におけるイロマスタットの検出
上記のHPLC法を使用したところ、30日目にウサギの左(手術された)眼から採取した前房由来の房水、硝子体又は血液試料にはイロマスタットが検出されなかった。先に述べたようにイロマスタットの保持時間は6.5〜8分間であり、その時点付近でピークは検出されなかった。これらの観察は、GFS処置について、いかなる潜在的局所毒性も回避できるという結果を伴ってイロマスタットの流出が起こることを示している。
【0154】
結論
本発明者等は、試験された錠剤からのイロマスタットの持続放出を観察した。これらの錠剤は、賦形剤を使用せずに製造された。放出期間(30日間)の間、イロマスタットの治療用量(10μM)が達成された。固体形態のイロマスタットの使用は、複数回の注射を必要としない組織瘢痕形成の防止方法を提供する。過去のインビトロ及びインビボ実験とは対照的に、本発明者等は実験全体を通じてDMSOの使用を回避したが、それは、眼科での臨床使用が認可されていないためである。
【0155】
極めて重要な論点は、錠剤を滅菌する必要性である。他のメタロプロテイナーゼインヒビター、例えばカプトプリルにおける照射の効果が評価されている(Engalytcheff et al. 2004;Engalytcheff, Vanhelleputte, & Tilquin 2004)。照射が引き起こすカプトプリルの分解は著明でなかった。本発明者等は、25KGyのガンマ線照射により惹起されるイロマスタットの分解は著明でなく、欧州及び米国薬局方により規定された許容限度内であるということを見出した。ガンマ線照射は、イロマスタット錠の滅菌を包装したまま実施するのに著しく有利であり、何故ならその包装は、ガンマ線照射及び結膜下腔への該錠剤の配置の間にいかなる追加処理をも行う必要なしに手術室で開封できるためである。
【0156】
さらに本発明者等は、コラーゲンIゲルの収縮を阻害する照射イロマスタットの有効性を試験し、負の対照に比較して著明な阻害、及び、正の対照とほぼ同レベルの阻害を観察した。照射イロマスタットは非照射イロマスタットよりゲル収縮の阻害において僅かに強力であるように思われるが、この相違は統計的に有意ではない。本発明者等は、この相違の主な理由は、非照射イロマスタットゲルにおいて僅かに多い数の細胞を使用したことによるのではないかと考える。あいにく各ゲルに使用した細胞数は、非常に正確という訳ではないパラメータであり、このことが、観察される収縮に僅かな相違を産むことがある。
【0157】
最後に、このインビボGFSモデルにおいて本発明者等は、実験を終了する必要があった30日目まで、イロマスタットが全部のウサギにおいてGFS後の瘢痕形成を阻害することを観察した。もう一つの心強い結果は、房水、硝子体及び血液中にイロマスタットが検出されなかったことであった。したがってイロマスタットは、他の眼構造及び他の身体部分を害することがないと予想される。
【0158】
手術部位への埋め込み用固体錠剤形態のイロマスタット及び他のMMPインヒビターの使用は、組織瘢痕形成を防止及び低減させる極めて有益な利点を有することが示された。
【0159】
実施例3
5−FUを用いたインビトロ実験
上に指摘したように、固体5−FUの錠剤を上記と同じ技術を用いて製造した。次にこの錠剤の溶解速度を上記と同じリグを用いて測定した。
【0160】
結果
検量線
DMSOを含まないpH7.6の水溶液における5−FU溶解の検量線を図6に示す。この曲線は、ソフトウェアPC Chrom+を使用してHPLC読み取り機で5−FUのピークを測定することにより作製した。
【0161】
5−FUの検量線をイロマスタットと同じ方法で作成した。
【0162】
放出プロファイル
第一の錠剤(錠剤A)は、直径3mm、厚さ0.71mm及び重量7.1mgであった。第二の錠剤(錠剤B)は、同じ直径、厚さ0.88mm及び重量8.7mgであった。第三の錠剤(錠剤C)は、直径3mm、厚さ0.76mm及び重量7mgであった。
【0163】
各錠剤を上記のようなリグ内に入れ、液体試料をHPLCで分析し、5−FUの濃度を検量線を用いて決定した。
【0164】
錠剤A、B及びCから得たデータを平均し、放出プロファイルを図7及び8にグラフ表示した。
【0165】
データは5−FUの持続放出を示す。これらの錠剤は賦形剤を使用せずに製造した。放出時間(25時間)の間、実質上一定の5−FU治療用量が達成された。5−FUの固体剤形の使用は、組織瘢痕形成の防止に有効な持続放出を提供する。
【0166】
実施例4
賦形剤を含まない錠剤からの活性物質の持続放出
図9〜13は、フロースルー溶解リグを使用し、賦形剤不含錠剤(上に記載のとおり)として製剤化された様々な化学的に無関係の活性物質を用いて得られた結果を示す。各々の場合において、(a)は錠剤中の総薬物含有量のパーセントとして薬物の累積放出を示し、(b)は、各時点でのフロースルーセル中の濃度を示す。
【0167】
試験された各錠剤は本質的に薬物のゼロ次(即ち定速)放出をもたらすことが観察されるであろう。これは、(a)における直線状の軌跡によって、そして(b)における本質的に平坦な軌跡(大部分)によって説明される。このことは、このような錠剤が、インビボで埋め込み部位において何日もの間、本質的に一定の、治療関連レベルの薬物をもたらすことができることを裏付けるものである。遙かに可溶性の高い薬物5−FU(図9)を含有する剤形であっても、何日もの間本質的に直線状の薬物放出をもたらすことが示される。これらの結果は、眼への局所薬物投与のための常套的剤形(例えば、点眼剤又は眼科用注射剤)と比較して、本発明に係る剤形の滞留時間は遙かに長くなることを示している。活性物質は組織に遙かに長く存在するため、これは著しい臨床上の利益を提供することになろう。
【0168】
実施例5
固体抗体を含有する錠剤組成物
ベバシズマブの水性注射剤(アバスチンとして市販されている)を出発材料として使用した。賦形剤(例えばトレハロース)を除去するため、医薬品アバスチン(25mg/mlを50μl)をカットオフ10000ダルトンの膜を付けたスピンカラム(Vivascience社製Vivaspin 10000)に入れた。蒸留水(4ml)を加え、カラムを4000rpmで4分間遠心分離した。この工程を2回反復した。薄層クロマトグラフィー(TLC;水性メタノール90%)でトレハロースの除去を確認した。種々の濃度のトレハロース及び未処理アバスチンを対照に使用した。TLCフィルムを硫酸(10%)及びエタノール(90%)の混合物に浸し、次いで加熱した。
【0169】
次に、得られたベバシズマブの溶液を凍結乾燥してこの抗体を粉末として単離し、次いでこれを用いて1.25mgベバシズマブ錠(上に記載のとおりであり、本質的に凍結乾燥抗体のみを含有する)を製造した。放出プロファイルを図14に示すが、ここでは、総蛋白(BCAアッセイ。図14の上側の線)及びVEGFチップに結合する蛋白(Biacoreバイオセンサーを用いて測定)を比較している。これらのデータは、この抗体が錠剤から恐らくは数日間放出されることを裏付けており、そしてまた抗体のかなりの部分がそのVEGF結合活性を保持していることを裏付けている。「活性蛋白」放出のデータは、実際のデータ点を示した図15で再プロットしてある。
【0170】
図16は、未処理アバスチン溶液(aと表示)と比較した、そして、賦形剤を除去していない本発明に係る錠剤から再構成されたベバシズマブと比較した(表示のない軌跡)、本発明に係る賦形剤不含錠剤から再構成されたベバシズマブ(bと表示)についてのサイズ排除クロマトグラフィー(SEC)結果を示す。簡潔に述べると、SEC条件は以下のとおりであった:
試料の注入容量:150μl
移動相:リン酸緩衝液(NaH2PO4、25mM、pH6.8及びNaCl 150mM)
流速:1mL/分
カラム:(Hiload TM、Superdex TM 200)
UV検出機:280nm
図16のデータは、製剤化されたベバシズマブの分子量は、アバスチン対照溶液と比較して変化がない、即ち、精製及び錠剤化工程はこの抗体の凝集を導いていないことを裏付けている。実施例4に示した結果でも同様であるが、本実施例に従って製造された剤形の埋め込み部位への滞留は、例えば点眼剤や眼科用注射剤よりはるかに長いであろう。これは著しい臨床上の利益を提供することになるであろう。
【0171】
本発明に係る抗体含有組成物、例えば錠剤の放出プロファイルのコントロールが、或る種の賦形剤を添加することによって達成できる。このアプローチはさらに、抗体活性の保持における改善をもたらし得る。図17は、1錠あたりヒアルロン酸(ヒーロン)1.75mgを添加した効果を示している。放出の初期48時間ほどで得られた濃度は、同等の賦形剤不含錠剤から得られた濃度よりずっと高い(図14及び15を参照されたい)。この効果は、抗体の放出自体が増大したことによるものであるかも知れず、且つ/又はヒアルロン酸含有錠剤における抗体結合の保持の改善に関連するものであるかも知れない。図17に示した二相性放出プロファイルは、使用された溶解リグのアーチファクトと考えられることに留意されたい。
【0172】
ヒアルロン酸の量を1錠あたり3.5mgに増加させた場合、抗体の放出は劇的に低下する。ここでも溶解器具のアーチファクトがこのデータに反映されている可能性があるが(この製剤の小さな玉がフローセルの側面に付着しているのが観察された)、ヒアルロン酸含有量が高くなる程、抗体のより持続的且つ安定な放出が導かれると考えられる。したがってこの抗体錠剤の溶解プロファイルは、賦形剤の適切な選択によって調整することができる。
【0173】
本明細書に引用した全ての文書は引用により本明細書の一部とする。
【技術分野】
【0001】
本発明は、固体医薬組成物、及び、特に疾患を予防又は治療するための局所デリバリーのための、実質上水不溶性の治療活性物質の使用に関するものである。より詳細には、本発明は、固体マトリックスメタロプロテイナーゼ(MMP)インヒビター組成物及び瘢痕形成防止におけるそれらの使用に関するものである。本発明はさらに、特別なMMPインヒビター固体剤形に関するものである。
【背景技術】
【0002】
実質的に水不溶性の治療物質は一般に、適当な溶媒、例えばDMSO等に入れてヒト又は動物の身体にデリバリーされる。しかしながら、通常、治療物質を溶液としてデリバリーすることにより、この物質は全身的に投与される。このような溶液が局所に投与された場合、一般にそれは投与部位に短時間(即ち、数分間ないし数時間)しかとどまらない。治療物質を局所にデリバリーし、その結果身体の関連部分のみが該物質に暴露されることが望ましい。さらに、身体にデリバリーされるいかなる治療活性物質も、処置を可能にするに充分な長時間の活性物質の治療有効濃度を達成させる、適切な溶解プロファイルを持つことが重要である。これらの問題の解決を目指して数多くの多成分及び複雑な医薬製剤が開発されてきたが、そのような製剤は、高価で、物理的及び化学的に反応し易く不安定であり、そしてデリバリーされる治療活性物質に対して固有のものであり得る。
【0003】
本発明の1つの好ましい局面は、組織の瘢痕形成を予防又は治療することに関するものである。瘢痕形成に含まれるプロセスは、様々な状況での治療の失敗において役割を演じている。さらに、瘢痕形成は、今日、全世界の事実上全ての失明に至る病における治療失敗に関与している。眼の治癒及び瘢痕形成の重要性を示す非常に良い例が、眼圧を下げるための瘻孔を作る緑内障手術の後に起こる事柄である。最終的な眼圧がこの手術の成功を決定するが、それは治癒及び瘢痕形成プロセスに依存する。線維柱帯切除術後の眼に起こる創傷治癒プロセスは、最初の結膜切開後に始まる。血漿蛋白及び血球が創傷領域に放出され、フィブリン塊が形成される。この創傷部分に好中球及びマクロファージが動員され、幾つかの酵素及びMMP、特にMMP−8及び−9を発現させることによってこの凝血塊を分解する。
【0004】
線維芽細胞の活性化及び創傷部位への遊走もまた起こる。正常な創傷のない組織の線維芽細胞は、線維細胞として知られる休止した未分化の間葉細胞である。それらは結膜下結合組織−テノン嚢に少数存在している(Wong et al. 2002)。活性化後、これらの線維芽細胞は大量の細胞外マトリックス(ECM)分子、例えばコラーゲン、グルコサミノグリカン及びエラスチンを産生する。これらはまた、ECMの開裂を促すMMPをも産生する。
【0005】
多くの研究グループが、緑内障濾過手術(GFS)後の創傷治癒におけるMMPの役割を研究してきた(Kawashima et al. 1998)。彼等はモノクローナル抗体を使用して、ヒト結膜下結合組織から単離された線維芽細胞の細胞質中のMMP−1、MMP−2、TIMP−1及びTIMP−2の染色を観察した。さらに、正常結膜及び治癒しつつある結膜の比較は、MMP−1及びTIMP−1が、治癒しつつある結膜下組織にのみ局在することを示した。正常結膜下組織及び結膜上皮の何れにも両分子は見出されなかった。これらの結果に基づき、術後結膜下瘢痕形成におけるMMPの潜在的役割が提唱されている。
【0006】
これら初期の研究以来、他のMMP分子の発現が培養ヒトテノン線維芽細胞(HTF)で検出されている(Mietz et al. 2003)。MMP−1、−2、−3、−9、−14及びTIMP−1及び−2は、インビトロ培養されたHTFから発現される。フィブロネクチン界面を超えた線維芽細胞遊走中に、下層の基質に牽引力が発生し、創傷の収縮を引き起こす(Harris, Stopak, & Wild 1981)。線維血管性肉芽組織が徐々に形成され、創傷部位にある線維芽細胞集団の一部が、機械的ストレス及び成長因子の刺激(主としてTGF−β及びPDGF)のため、筋線維芽細胞へと分化する。肉芽組織の連続的リモデリング及び筋線維芽細胞のアポトーシスの後、稠密なコラーゲン性結膜下瘢痕組織が形成される。広範な結膜下線維化及び組織の収縮が最終結果である。これは、ブレブの機能喪失と、その後の眼内圧(IOP)上昇を惹起する。
【0007】
マイトマイシンC(MMC)及び5−フルオロウラシル(5−FU)といった代謝拮抗物質の溶液が、線維柱帯切除術後の瘢痕形成の低減に有効であることが示されている(Dahlmann et al. 2005;Skuta et al. 1992)。ブレブにおける流出路の機能期間延長を記載する多くの研究が、本発明者によって公表されている。その結果は、手術中、5−FU又はマイトマイシンC溶液の単回5分間適用が治癒反応を低減させ、瘢痕形成を減少させることを示している。これは主として、ブレブの生存を延長させる、線維芽細胞増殖の抑制によるものであると考えられる(Doyle et al. 1993;Khaw et al. 1994;Khaw et al. 1992)。あいにく、これらの代謝産物による処置の後には重篤な合併症がしばしば起こる。ブレブはしばしば漏洩し、そこで、低眼圧症、眼内炎、及び不可逆的視力喪失を引き起こし得る過剰の眼細胞アポトーシス等、他の副作用が起こる。このことにも拘わらず、MMC及び5−FUは尚、使用されている。よって、GFS後の瘢痕形成を低減させ、治癒を制御するために、より安全且つより有効な物質が必要とされる。
【0008】
MMPは幾つかの病態に関与しているため、治療的使用ができる選択的インヒビターを特定し、明確な方法でMMP活性を制御することが重要である。天然TIMPインヒビターの使用は、高い分子量及び劣悪な経口バイオアベイラビリティーといった重大な欠点があり、それが臨床使用を妨げている(Glasspool & Twelves 2001b)。
【0009】
これらの困難を克服するため、MMP活性をブロックする合成化合物(MMPインヒビター)が設計された。最もよく知られているMMPインヒビターの幾つかは、バチマスタット(BB−94)、マリマスタット(BB−2516)、プリノマスタット(AG3340)、タノマスタット(BAY12−9566)(Glasspool & Twelves 2001a)及びイロマスタット(GM6001)(Galardy et al. 1994d)である。これらは、MMPの活性部位において亜鉛と可逆的に結合するヒドロキサム酸誘導体である。今日までに設計された強力なインヒビターの殆どは右側結合体である。これは、恐らくは基質開裂のカルボキシラート生成物が該酵素の強力なインヒビターになることを防ぐその天然の能力の故に、左側結合が遙かに弱いためである(Skiles, Gonnella, & Jeng 2001)。
【0010】
MMPは創傷収縮に重要な役割を果たす(Daniels et al. 2003;Porter et al. 1998)。特にMMPの阻害は、創傷収縮モデルとしてコラーゲンI格子を用いるインビトロ実験において創傷の収縮を低下させた(Scott, Wood, & Karran 1998)。収縮モデルにおけるMMPインヒビターの効果を調べるため、インビトロ及びインビボ両方の研究が実施されている。Daniels et al., 2003は、HTF包埋コラーゲンゲルにおける3種類のMMPインヒビター(イロマスタット、BB−94及びBMS−275291(Cell Tech))の効果を試験した。観察により、この3種のMMPインヒビターの適用で、ゲルの収縮が用量依存的に阻害されることが明らかとなり、イロマスタットが最も有効であるとわかった。
【0011】
試験されたMMPインヒビターはさらに、非毒性及び可逆的効果を有することが判明し、ザイモグラフィーの結果は、MMPインヒビター適用後に検出されたMMPバンドの蛋白分解活性の著明な低下を示した。イロマスタットが線維芽細胞からのコラーゲン産生を用量依存的に阻害することも示された。これは重要な発見であった。何故なら、切開領域における過剰なコラーゲン産生及び沈着が、ブレブの不全の主たる原因であるからである(Cordeiro et al. 2000;Daniels et al. 1998)。
【0012】
線維柱帯切除術後のインビボ30日間ウサギ収縮モデルに、DMSOに溶解したイロマスタットを17回注入投与したところ、DMSOのみの対照群と比較してブレブの生存が著明に延長され、また、この実験の間ずっとIOP低下効果があることが判明した(Wong, Mead, & Khaw 2003)。組織学的所見は、イロマスタット処置群における瘢痕組織形成の低下は、対照群と比較して細胞の減少を伴って起こることを示した。さらに、細胞アポトーシスの減少(別の研究からMMCに関連することがわかっている)、創傷領域における筋線維芽細胞の減少(恐らくは線維芽細胞遊走におけるイロマスタットの阻害効果による)及び対照群と比較して大きなブレブ領域が存在した。
【0013】
イロマスタットの抗瘢痕効果をMMCと比較する必要性は、新たなインビボ比較試験の設計を導いた(Wong, Mead, & Khaw 2005)。イロマスタット処置群は、MMC処置群と同様のブレブ生存延長及びIOP低下結果を有していた。重要なことに、この研究は、結膜下組織の形態が、イロマスタット群では正常であるがMMC群では低細胞性であることを示した。本発明者等によるいかなるインビボ実験でも、イロマスタットは、MMCの事例で起こり得るような結膜の損傷を起こさなかったということは言及する価値がある。
【0014】
術後創傷管理のためのイロマスタットの臨床使用は、現在使用されている細胞毒性代謝拮抗物質に優る利点を有し得る。イロマスタットは特異的MMP阻害を示し、線維芽細胞の活性化を遮断する。毒性の報告は公表されておらず、よってイロマスタットは、代謝拮抗物質よりも術後GFS処置に対する忍容性がより優れているであろう。但し、瘢痕形成を低下させるための線維柱帯切除術後処置の利点を増大させる、言及すべきその他幾つかの試みがある(Wong, Mead, & Khaw 2005)。
【0015】
組織収縮防止におけるMMPインヒビターの使用が国際特許出願WO95/24921に記載されている。
【0016】
現在、線維柱帯切除術中に、強膜弁の下へのMMC単回投与が採用されている。この薬物に付随する毒性、及び複数回注射によって起こる患者にとっての不快感及び感染リスクのため、代謝拮抗物質の複数回反復注射は実行不可能である。そのうえ、ブレブ(その容量はおよそ200μlである)内に一定の局所濃度の活性物質を維持することは、ボーラス注射では不可能である。前房からブレブへの房水流出は2μl/分であり、これは、注射された物質の濃度が速やかに低下するであろうことを意味するというのがその理由である。この物質を持続的に注入することもまたできない。
【0017】
線維柱帯切除術後の結膜下腔に入れることのできる連続的持続薬物放出系の開発が必要とされる。
【0018】
本発明者等の初期の研究は、イロマスタットのデリバリーシステム開発に取り組むことであった。イロマスタットは、10〜100nMの範囲の濃度において用量依存的にコラーゲンIゲルでの収縮をインビトロ阻害することが知られている(Daniels et al. 2003及び国際特許出願WO95/24921号)。濃度100nMのイロマスタットを複数回注射投与するインビボ研究で、有効性の増大が観察されている(Wong, Mead, & Khaw 2005;Wong, Mead, & Khaw 2003)。この予備研究はイロマスタットの好ましい薬理効果を確立したが、治療濃度は、水性DMSO溶液から調製された注射によってのみ達成された。DMSOはヒトの眼への使用が認可されていない。
【0019】
疾患を予防又は治療するための、実質上水不溶性の治療活性物質を局所デリバリーする方法に対する必要性がある。さらに、適切な抗瘢痕形成活性、ヒト又は動物の身体に埋め込まれた時に活性物質が局所的にも全身的にも低毒性であるような低い毒性、並びに長期の抗瘢痕形成活性を提供するための最適な溶解プロファイルを有する物質に対する特段の必要性が存在する。
【発明の概要】
【発明が解決しようとする課題】
【0020】
本発明は、先行技術の方法に伴う問題の少なくとも幾つかを打開する。
【課題を解決するための手段】
【0021】
本発明の第一の局面によれば、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤[ここで、この1又は2以上の賦形剤は、それが存在する場合、インビトロで試験した時に、賦形剤を含有しない同等の剤形と比較して、活性物質放出の著明な遅延又は延長を導かない]と共に含んでなる、固体の埋め込み可能な剤形が提供される。
【0022】
第一の局面の剤形は、比較的単純な固体剤形を選択された部位にインビボで埋め込むことができ、これらの剤形が、放出プロファイルが主として賦形剤により制御される、複雑な持続放出製剤を必要とせずに、活性物質の安定な放出を提供するという、驚くべき発見に基づいている。賦形剤含有剤形及び賦形剤非含有剤形の溶解速度の比較は、組織埋め込み後の媒質のインビボ流動を模倣した媒質の流動を提供する任意の適当な溶解装置、例えば本明細書に記載のフロースルーリグを用いて実施できる。この溶解は、37℃付近及びpH7.4付近の媒質中で実施されねばならない。
【0023】
この剤形は、好ましくは疾患の局所的な予防又は治療に好適なものである。第一局面の剤形は、活性物質の全身デリバリーのために埋め込むことが可能である。しかしながら、埋め込み部位の領域においてのみ放出及び/又は有効性が適切となるような量の、適当な治療物質を含む剤形を製造することが好ましい。
【0024】
好ましい態様では、この剤形は、眼への、眼周囲への、又は眼内への埋め込みに適した剤形である。例えば、この剤形は結膜下腔への埋め込みに好適であり得る。
【0025】
好ましい態様では、この剤形は滅菌されている。このような処理により、該剤形はインビボでより広範囲に安全に埋め込むことが可能となる。本明細書で使用する「滅菌された」という語は、無菌製造装置により製造された剤形、及び非無菌製造装置で製造され、それが製造後の滅菌プロセス、例えばガンマ線照射に付される剤形の両者を包含する。
【0026】
この剤形が1又は2以上の賦形剤を含有する時、これらはインビボ埋め込みの後に生分解性及び/又は生体吸収性であることが好ましい。このことは、該剤形が埋め込まれ、そして活性物質の完全又は部分的放出の後に該剤形の何らかの構成成分を除去するその後の工程を必要とすることなく、溶解及び/又は生分解に委ねられ得るという利点を有する。さらに、多くの活性物質について、賦形剤は、それが存在する場合、埋め込み部位において非常に可溶性又は分散性という訳ではなく、そのことにより、投与量の廃棄及び/又は活性物質の分散に起因する溶解の増大が回避される、という事は、重要な考察である。本発明は、その中に埋め込みが行われる組織の「非沈降」状態を利用するものである(多くの活性物質、特にマトリックスメタロプロテイナーゼインヒビターについて)。関係する活性物質の溶解度に応じて、そして埋め込みが行われる組織を通過する生物学的水性媒質の流動に応じて(何れも容易に測定できる)、一般に非沈降状態が達成できる。組織が非沈降性であるため、薬物放出に関する限り、剤形が賦形剤を有するか否かは問題ではない。賦形剤がないと、活性物質が溶解しさえすればいいことから、剤形はより単純となる。溶解する、及び/又はインビボで問題を起こす(例えば炎症)他の構成成分を考慮する必要はない。事実、多くの例では、賦形剤を使用する唯一の理由は、その剤形の製造規格への準拠を確実にすることである。一般に賦形剤の使用は、主としてその剤形の製造における加工要件のためである。本発明に従う有用な活性物質の大半は、溶解又は放出特性を支援するための賦形剤の使用は必要とされない。
【0027】
驚くべき事に、これまで、その大多数が様々な賦形剤を含んで固体剤形として製剤化されることが知られてきた幾つかの活性物質が、賦形剤を殆ど又は全く含まずに埋め込み可能な錠剤として製剤化できることが判明した。このことは、その剤形が既存の打錠装置を用いて効率的に製造されることを可能にし、そしてさらに、そのようにして製造された剤形の溶解プロファイルの点で好都合な結果を提供する。
【0028】
幾つかの態様では、この剤形は0.1mm3〜1.5cm3の体積を持ち、及び/又は5mm以下の最大寸法を有し、及び/又は10mg以下の重量を有する。このような制約は、該剤形が多岐にわたる部位にインビボで埋め込まれることを可能にする。
【0029】
特別な態様では、この剤形は実質上賦形剤を含まない。様々な活性物質を固体単位剤形、例えば圧縮剤形(例えば錠剤)に形作ることができ、なお且つ埋め込み後に活性成分の安定なインビボ放出を提供できるという事は驚くべき発見である。
【0030】
好ましい態様では、活性物質は実質上水不溶性である。このような不溶性は、本発明に係る剤形中の活性物質の持続放出を強化する。本明細書で使用する「実質上水不溶性」という語は、水にやや溶けにくい(即ち、その治療物質1部を溶解するために少なくとも30部の水を必要とする。換言すると、35mg/ml前後又はそれ以下)、好ましくは僅かに溶ける(即ち、その治療物質1部を溶解するために少なくとも100部の水を必要とする。換言すると、10mg/ml前後又はそれ以下)、より好ましくは極めて僅かに水に溶ける((即ち、その治療物質1部を溶解するために少なくとも1000部の水を必要とする。換言すると、1mg/ml前後又はそれ以下)、そして最も好ましくは事実上水不溶性である(即ち、その治療物質1部を溶解するために少なくとも10000部の水を必要とする。換言すると、0.1mg/ml前後又はそれ以下)ことを意味することを意図している。溶解度は、生理的に許容し得るpH(即ち、約5.0〜8.0)の水を用いて室温(約20℃)で測定する。
【0031】
特別な態様では、活性物質はマトリックスメタロプロテイナーゼ(MMP)インヒビターであり、これは、マトリックスメタロプロテイナーゼの活性部位にある亜鉛に可逆的に結合するヒドロキサム酸誘導体であってよく、及び/又はこれは右側結合体であってよい。
【0032】
一般に、治療活性物質は、周囲温度で固体であり、且つ固体の単位剤形に製剤化できる任意の適当な物質であってよい。このような制約は、通常の技術を有する製剤者により容易に評価できる。治療活性物質は天然物質であっても合成物質であってもよい。多くの例において、活性物質は少なくとも部分的に結晶性である。好ましくは治療活性物質は合成化学化合物である。MMPインヒビター(及びその他のレセプターアンタゴニスト又は酵素インヒビター)については、低いKi値、即ち高いpKi値を持つ物質が一般的に好ましい。例えば、イロマスタットはコラゲナーゼに対して0.4nMのKiを有する。
【0033】
本発明の利点は、比較的溶解度の低い化合物を、記載の剤形によってうまくデリバリーできることである。伝統的には、そのような化合物(これらにはしばしば遭遇する)は、溶解度を改善し及び/又は持続放出を提供するために、高い薬物含有量及び/又は複雑な賦形剤混合物を使用して製剤化せねばならなかった。同様に、固体活性物質に対する伝統的な製剤化アプローチにおいては、活性物質の溶解度及び組織透過性が最重要事項である。本発明に係る埋め込み可能剤形、並びに関連方法及び使用においては、粘膜を通る(例えば腸管からの)透過は必要でない。このことにより本発明は極めて広範な適用可能性を有することになる。
【0034】
好ましい物質には、MMPインヒビター並びにその他の抗瘢痕形成物質、ステロイド、抗生物質、抗癌剤、抗体分子及び抗炎症物質がある。抗瘢痕形成物質には、MMPインヒビター(これは下記に定義する)、代謝拮抗物質、例えばMMC及び5−FU、並びにTGFβがある。好適なステロイドには、コルチコステロイド、例えばデキサメタゾン、ヒドロコルチゾン、プレドニゾロン、トリアムシノロン及びメチルプレドニゾロンがある。好適な抗生物質には、β−ラクタム抗生物質、例えばペニシリン類、マクロライド抗生物質、例えばエリスロマイシン、及びドキシサイクリンなどの、一般に使用される任意の抗生物質が包含される。好適な抗癌剤には、5FU、パクリタキセル及びクロラムブシルがある。
【0035】
任意の抗体分子を使用できる。「抗体分子」という語は、ポリクローナル抗体、モノクローナル抗体又はその抗原結合フラグメント、例えばFv、Fab、F(ab’)2フラグメント及び一本鎖Fvフラグメントを包含する。好ましくは抗体分子は凍結乾燥抗体分子である。抗体の標的抗原は、その抗体の治療活性を決定する。当業者には多数の治療用抗体が知られている。
【0036】
好適な抗炎症物質には、ステロイド性及び非ステロイド性抗炎症物質がある。好ましくはこの抗炎症物質は、ナプロキセン、イブプロフェン、ジクロフェナク及びケトロラクといった非ステロイド物質である。
【0037】
治療活性物質は、好ましくは疾患部位に局所投与するための物質である。例えば、その物質が抗癌剤である場合、その物質を腫瘍部位にデリバリーすることが望ましい。或いは、治療活性物質が抗瘢痕形成物質又は抗炎症物質である場合、それは、炎症又は組織瘢痕形成を予防又は治療するために、手術、外傷又は炎症の部位に埋め込むためのものである。
【0038】
治療活性物質は疾患を予防又は治療するためのものである。予防されるべき疾患は、その治療活性物質によって変わる。例えば、その物質が抗炎症物質である場合、該物質は炎症を予防又は治療するために使用される。炎症は、喘息、関節炎、局所感染、手術又は外傷により惹起された組織損傷を包含する種々の疾患に随伴し得る。その物質が抗癌剤である場合、該物質は癌を予防又は治療するために使用される。抗癌剤は好ましくは腫瘍を治療するために使用される。その物質が抗生物質である場合、該物質は好ましくは感染症を治療するために使用される。その物質が抗瘢痕形成物質である場合、それは、感染症、手術、外傷等により惹起される組織瘢痕形成を防止又は低減させるために使用される。当業者には明らかであるように、活性物質は1以上の治療用途を有することがある。例えば、5−FUは、抗瘢痕形成物質であると共に抗癌剤でもある。
【0039】
第一の局面の好ましい態様では、活性物質は、イロマスタット、バチマスタット、マリマスタット、プリノマスタット、タノマスタット、トロケード(シペマスタット)、AG3340、CGs227023A、BAY12−9566、及びBMS−275291より成る群から選ばれるMMPインヒビター又はそれらの任意の機能的誘導体である。
【0040】
上の選好にもかかわらず、マトリックスメタロプロテイナーゼ(MMP)インヒビターは、固体単位剤形に製剤化できる任意のMMPインヒビターであってよい。MMPインヒビターは天然又は合成MMPインヒビターであってよい。天然に存在するMMPインヒビターには、ヒトの血液中に見出される主たるコラゲナーゼインヒビターである、α2−マクログロブリンが包含される。多数の合成MMPインヒビターが開発されており、文献に記載されている。例えば、米国特許明細書第5183900、5189178及び5114953号は、GM6001又はガラルジンとしても知られるイロマスタット(N[2(R)−2−(ヒドロキサミドカルボニルメチル)−4−メチルペンタノイル−L−トリプトファンメチルアミド)及びその他のMMPインヒビターの合成を記載している。ヒドロキサム酸に基づくその他のMMPインヒビターが、国際特許出願WO90/05716、WO90/05719及びWO92/13831号に開示されている。さらなる合成MMPインヒビターには、欧州特許出願EP−A−126974及びEP−A−159396号並びに米国特許4599361及び4743587号に記載されているものが包含される。さらに別のインヒビターは、バチマスタット(British Bio-technology Ltd.)としても知られるBB−94であり、例えば欧州特許出願EP−A−276436号を参照されたい。国際特許出願WO90/05719号は、MMPインヒビター4−(N−ヒドロキシアミノ)−2R−イソブチル−3S−(チオ−フェニルチオメチル)スクシニル]−L−フェニルアラニン−N−メチルアミド及び4−(N−ヒドロキシアミノ)−2R−イソブチル−3S(チオメチル)スクシニル]−L−フェニルアラニン−N−メチル−アミドをも開示している。国際特許出願WO90/05716号は、MMPインヒビター4−(N−ヒドロキシアミノ)−2R−イソブチルスクシニル−L−フェニルアラニン−N−(3−アミノメチルピリジン)アミド及び[4−N−ヒドロキシアミノ)−2R−イソブチル−3S−メチルスクシニル]−L−フェニルアラニン−N−4−(2−アミノエチル)−モルホリノアミドを開示している。
【0041】
天然及び合成コラーゲンインヒビターの性質は異なっていることがある。個々のインヒビターはしばしば異なる特異性及び力価を有する。可逆性であるインヒビターもあれば非可逆性のものもある。一般に、インヒビターの阻害効果が強いほど良い。一般的には、広域スペクトルMMPインヒビター、例えばイロマスタットが好ましい。
【0042】
MMPインヒビターは、抗MMPポリクローナル又はモノクローナル抗体分子であってよい。特定のMMPに特異的な抗体を作製でき、或る状況ではそのような特異的インヒビターの使用が好ましいであろう。例えば、MMP1、MMP2又はMMP3(それぞれコラゲナーゼ、72kDゼラチナーゼ又はストロメリシン)に対する抗体又はこれらの2若しくはそれ以上の混合物を使用できる。そのような抗MMP抗体の作製方法は当業者に周知である。
【0043】
好ましくはMMPインヒビターは上に述べた合成インヒビターの何れか1つである。好ましいインヒビターには、ペプチドヒドロキサム酸又はその医薬的に許容し得る誘導体が包含される。特に好ましいのは、米国特許5189178;5183900及び5114953号に記載及び特許請求されている化合物である。低いKi値、即ち高いpKi値を持つ化合物もまた一般的に好ましい。好ましくは、MMPインヒビターは、MMPの活性部位にある亜鉛に可逆的に結合するヒドロキサム酸誘導体、より好ましくは右側結合体である。
【0044】
上に述べたように、特に好ましい態様では、MMPインヒビターは、バチマスタット、マリマスタット、プリノマスタット、タノマスタット、トロケード、AG3340、CGs227023A、BAY12−9566、BMS−275291、及びイロマスタットより成る群、又はこれらの任意の機能的誘導体から選ばれる。より好ましくは、MMPインヒビターはイロマスタット、又はその任意の機能的誘導体である。種々のMMPインヒビターの機能的誘導体は当業者に周知である。例えば、イロマスタットの機能的誘導体が米国特許5183900号に開示されている。イロマスタットは現在知られている最も強力なコラゲナーゼインヒビターの1つであるため、特に好ましい。しかしながら或る適用では、より強力でない(より弱い)インヒビターの使用が好ましいこともある。
【0045】
本発明者等による研究は、イロマスタットが、結膜下創傷治癒の際に毒性作用なしにMMPを阻害できることを証明した。これらの理由で本発明者等は、瘢痕形成阻害に使用するため、始めにイロマスタットに焦点を合わせた。
【0046】
上に指摘したように、イロマスタット(分子式C20H28N4O4、388.47g/mol)は、正式化学名がN−[(2R)−2−(ヒドロキサミドカルボニルメチル)−4−メチルペンタノイル]−Lトリプトファンメチルアミドであるペプチド類似体である。これは広域スペクトルヒドロキサマートMMPインヒビターである(Galardy et al. 1994a)。報告されているKi値は以下のとおりである:ヒトMMP−1(線維芽細胞コラゲナーゼ):0.4nM、ヒトMMP−3(ストロメリシン):27nM、ヒトMMP−2(72kDaゼラチナーゼ);0.5nM、ヒトMMP−8(好中球コラゲナーゼ):0.1nM、ヒトMMP−9(92kDaゼラチナーゼ):0.2nM(Galardy et al. 1994c)。
【0047】
本発明に係る固体剤形は、1以上の治療活性物質、例えば1以上のMMPインヒビター又は2若しくはそれ以上の異なるクラスの治療活性物質を含んでなる。しかしながら、この固体剤形は、ただ1つの治療活性物質、例えばMMPインヒビターを含んでなることが好ましい。
【0048】
本発明の第二の局面によれば、治療に使用するための、第一局面による剤形が提供される。
【0049】
特にこの剤形がMMPインヒビターを含有する場合、組織瘢痕形成を防止又は低減させる際の使用が好ましい。或る態様では、瘢痕形成は、眼の、眼周囲の、又は眼内である。特別な態様では、この剤形を緑内障濾過手術後に埋め込む。記載したような例においてこの剤形は結膜下腔に埋め込むことができる。
【0050】
MMPインヒビターを固体剤形で提供することにより、緩徐な溶解速度が達成され、それにより、必要な原位置(in situ)MMPインヒビター濃度を少なくとも30日間達成することが可能となる。こうした緩徐な溶解速度は、瘢痕形成の防止又は実質的な低減をもたらし、処置される患者にとってより良い転帰を導く。MMPインヒビター溶液を注射する従来の方法では、MMPインヒビターのクリアランスは数分以内に起こる。MMPインヒビターの投与に徐放性ゲルを使用したとしても、約3〜6時間以内にクリアランスが起こる。固体剤形のMMPインヒビターを投与することにより、クリアランスは30日間にわたって起こらない。本発明に係る適切な剤形のさらなる利点は、この固体剤形が原位置(in situ)で完全に溶解及び/又は生分解するため、取り除く必要がないことである。
【0051】
本発明は、抗瘢痕形成剤を眼に何度も注射する不都合で危険な手技を回避できる。さらに、抗瘢痕形成剤への個体の暴露を減少させることにより、全身合併症(例えば関節炎)のリスクが回避される。
【0052】
本発明はさらに、疾患の局所的予防又は治療のための埋め込み用薬剤の製造における第一局面の剤形の使用を提供する。特別な態様では、特に活性物質がMMPインヒビターである場合、その薬剤は組織における瘢痕形成の局所的予防又は治療のための埋め込みのためのものであってよい。
【0053】
関連して、本発明はさらに、それを必要とする患者において疾患を局所的に予防又は治療する方法を提供するものであり、その方法は、第一局面の固体剤形を、該疾患を予防又は治療するに充分な量で、埋め込みにより該患者に投与することを含んでなる。好ましい態様では、活性物質はMMPインヒビターであり、該患者の瘢痕形成を局所的に予防又は治療するために該剤形を投与する。そのような例においては、この剤形を、眼への、眼周囲への、又は眼内への埋め込みにより(例えば結膜下腔に埋め込むことにより)投与できる。予防又は治療すべき瘢痕形成は、緑内障濾過手術後のものであってよい。
【0054】
第三の局面では、本発明はさらに、局所埋め込みにより組織瘢痕形成を防止又は低減させるための埋め込み可能な固体薬剤の製造におけるMMPインヒビターの使用を提供する。同様に本発明は、組織瘢痕形成の防止又は低減に使用するためのMMPインヒビターを提供し、ここで、該MMPインヒビターは、任意により1又は2以上の医薬的に許容し得る賦形剤を含有していてもよい、局所埋め込みのための埋め込み可能な固体薬剤として製剤化される。それを必要とする患者における組織瘢痕形成の局所的予防又は治療方法であって、マトリックスメタロプロテイナーゼインヒビターを任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、局所埋め込みのための埋め込み可能な固体剤形を投与することを含んでなる方法。
【0055】
本発明の第四の局面によれば、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、眼への、眼周囲への、又は眼内への埋め込みによる治療に使用するための、埋め込み可能な固体剤形が提供される。同様に本発明は、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、眼への、眼周囲への、又は眼内への埋め込みによる、疾患の局所的予防又は治療用薬剤の製造のための、埋め込み可能な固体剤形の使用を提供する。それを必要とする患者において疾患を局所的に予防又は治療する方法であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形を、眼への、眼周囲への、又は眼内への埋め込みにより投与することを含んでなる方法もまた提供される。
【0056】
この第四局面は、固体形態の活性物質を含有する固体単位剤形を、その場所での活性物質の放出にとって適切な、眼の、眼内の、又は眼周囲の部位に埋め込むことができるという驚くべき発見に基づいている。この活性物質は、好ましくは実質上水不溶性(上に定義のとおり)である。このような特徴は、該剤形からの活性物質のより長期且つより安定な放出を実現する。第三局面の好ましい態様では、活性物質はマトリックスメタロプロテイナーゼインヒビターである。MMPインヒビターは第一局面に関連して上に定義したとおりであってよい。
【0057】
第五の局面では、本発明は、マトリックスメタロプロテイナーゼインヒビターを、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、滅菌された、埋め込み可能な固体剤形を提供する。このような剤形の滅菌は、それがインビボで無菌部位に埋め込まれることを可能にする。
【0058】
さらに本発明は、上記のような固体剤形の製造におけるマトリックスメタロプロテイナーゼインヒビターの使用を提供する。
【0059】
第五局面による剤形の製造方法もまた提供され、その方法は、
i.マトリックスメタロプロテイナーゼインヒビター及び存在する場合は賦形剤を含有する圧縮剤形、例えば錠剤を製造し、そして、
ii.その圧縮剤形をガンマ線照射することにより滅菌する、
ことを含んでなる。
【0060】
さらに本発明は、上記の、そしてMMPインヒビターを含有する剤形を、緑内障濾過手術の実施に必要な手術用機器と共に含んでなるキットを提供する。
【0061】
本発明はさらに、それを必要とする患者における組織瘢痕形成を防止又は低減させる方法であって、固体剤形のマトリックスメタロプロテイナーゼインヒビターを、組織瘢痕形成を防止又は低減させるに充分な量で当該患者に投与することを含んでなる方法を提供する。
【0062】
特に記載の無い限り、本発明に係る固体剤形は、所望の溶解速度を持つ任意の固体剤形、例えば錠剤であってよい。所望の溶解速度とは、周囲の媒質中に治療有効濃度の該治療物質を実質的な時間放出させ得るような速度である。例えば、少なくとも1時間、より好ましくは少なくとも1日、さらに好ましくは少なくとも5日間、より好ましくは少なくとも20日間、より好ましくは少なくとも30日間、そして幾つかの例では60日間に至るまでである。様々な投薬レジメンもまた使用できる。例えば、各々5日間の放出を提供する一連の、例えば5個の錠剤を、術後に1部位へ埋め込むことが可能であろう。これらの錠剤は様々な用量を含有し得る。このことにより、ことによると種々の濃度を用いた活性物質(例えばMMPインヒビター)を使用する25日間程の継続処置が可能となるであろう。
【0063】
治療活性物質がイロマスタットである場合、重量約2〜5mgの固体剤形を使用すると、10μMのMMP阻害濃度が少なくとも30日間維持されることが判明した。原位置(in situ)で維持される活性物質の濃度は、その物質の溶解度及び該固体剤形が埋め込まれる組織内の流体の固有の流速によって変化する。
【0064】
好ましくはこの固体剤形は、組織内への埋め込みに好適であり、埋め込まれると徐々に溶解する。好ましくはこの固体剤形は、少なくとも1日、好ましくは少なくとも5日間、より好ましくは少なくとも10日間、より好ましくは少なくとも20日間、そして最も好ましくは少なくとも30日間、そして幾つかの例では最長60日間にわたって溶解する。
【0065】
この固体剤形の形状は、その表面積を変えることにより溶解速度に影響を及ぼし得る。この固体剤形は、溶解速度に影響を及ぼすポリマーで被覆することができる。そのようなポリマーは当業者に周知である。しかしながら、好ましくは該固体剤形はポリマーで被覆されていない。特に、分解生成物が毒性を示し得る分解性ポリマーの場合、組織から排泄される際に局所炎症反応が誘発され得るため、係るポリマーの使用は一般的に好ましくない。賦形剤及び/又は被覆のない錠剤を使用するもう一つの利点は、該剤形の周囲にインビボで蛋白性カプセルが形成されないことである。殆どの埋め込み剤はカプセル形成を導く異物反応を惹起し、また、殆どの被覆剤は、組織に残された場合にカプセル形成を引き起こすと予想されるが、これは炎症反応の一形態である。
【0066】
疾患を予防又は治療するためにデリバリーされる治療活性物質の濃度は、標準技術を用いて決定できるが、活性物質がMMPインヒビターである場合、組織瘢痕形成を防止又は低減させるのに必要な濃度は、約1μM〜約1000μM、より好ましくは約10μM〜約500μMである。
【0067】
該固体剤形の形状は、意図する用途によって変わるであろう。例えば、この固体剤形をGFS後の組織瘢痕形成を防止するために使用しようとする場合は、それが結膜下腔にデリバリーされ得る形状及びサイズであるのが好ましい。例えば該固体剤形は、直径5mm又はそれ以下で厚さ2mm又はそれ以下の錠剤であるのが好ましい。好ましくはこの錠剤は、0.1〜4mmの直径及び0.1〜1mmの厚さを持つ。固体剤形の形状は、予防又は治療しようとする疾患によって変わるであろう。該固体剤形は、処置されるべき組織、例えば腫瘍組織、硝子体液等の中に注射できるようなサイズとすることができる。
【0068】
本発明は、疾患の局所的予防又は治療のための、固体剤形中に入れた実質上水不溶性の治療活性物質を提供する。
【0069】
緩徐な溶解速度が達成される固体剤形中の実質上水不溶性治療活性物質を提供することにより、該物質の必要なin situ濃度が治療有効時間の間達成されることが可能であるということが見出された。この緩徐な溶解速度は、身体の限局された領域が該物質に長時間暴露される結果をもたらし、より有効な局所処置を導く。さらなる利点は、該固体剤形は、in situで溶解するので取り除く必要がないことである。本発明は、患者個人に治療活性物質を何度も注射する不都合な手技を回避できる。さらに、該物質への個体の暴露を減らすことにより、全身合併症のリスクを回避できる。
【0070】
本発明はさらに、疾患の予防又は治療のための局所デリバリー用固体薬剤の製造における実質上水不溶性治療活性物質の使用を提供する。
【0071】
さらに本発明は、固体剤形に入れた、疾患を予防又は治療するに充分な量の、実質上水不溶性の治療活性物質を該患者に局所投与することを含んでなる、それを必要とする患者における該疾患の予防又は治療方法を提供する。「実質上水不溶性」という語は上に定義した。
【0072】
本発明に係る固体剤形は、好ましくは、総体積が0.1mm3〜1.5cm3、より好ましくは0.5mm3〜1cm3である。該固体剤形は1又は2以上の賦形剤を含んでいてよいが、好ましくは実質的に賦形剤を含まない。「実質的に賦形剤を含まない」という語は、該固体剤形が50%(w/w)未満の賦形剤、好ましくは40%(w/w)未満の賦形剤、より好ましくは10%(w/w)未満の賦形剤を含んでなることを意味し、最も好ましくは該固体剤形が最大限でも微量(1〜2%(w/w))の賦形剤を含んでなることを意味する。上記のように、本発明の剤形は、賦形剤が好ましくはインビボで生体吸収性及び/又は生分解性である限り、必要とあらばこれらの限界を超えたレベルで賦形剤を含有することができる。驚くべき事に、全てMMPインヒビターで構成される固体剤形は、組織瘢痕形成を防止又は低減させるための適切な溶解速度を有することが判明した。
【0073】
好適な賦形剤は当業者に周知であり、任意の常套的な非毒性の医薬的に許容し得る担体、アジュバント又は媒質を包含する。例えば、使用できる医薬的に許容し得る担体、アジュバント及び媒質には、イオン交換樹脂、アルミナ、ステアリン酸アルミニウム、レシチン、緩衝物質、例えば燐酸塩、グリシン、ソルビン酸、ソルビン酸カリウム、飽和植物性脂肪酸の部分グリセリド混合物、塩化ナトリウム、亜鉛塩、コロイドシリカ、三珪酸マグネシウム、ポリビニルピロリドン、セルロースに基づく物質、エチルセルロース、中又は高分子量(例えば、数平均分子量600又はそれ以上)、ポリエチレングリコール、カルボキシメチルセルロースナトリウム、ポリアクリラート、ロウ、固体ポリオキシエチレンポリオキシプロピレンブロックコポリマー、羊毛脂、乳糖及びコーンスターチがある。好ましい賦形剤は、インビボで生分解性及び/又は埋め込み部位から生体吸収性である。
【0074】
該固体剤形は1又は2以上のさらなる活性物質を含んでいてもよい。好適なさらなる活性物質は、代謝拮抗物質、細胞毒性物質、抗成長因子(例えば、TGFβ、VEGF等)、又は該治療処置を支援できるその他任意の物質を包含する。例えば、治療物質がMMPインヒビターである場合、さらなる活性物質もまた組織瘢痕形成を防止することが好ましい。しかしながら、該固体剤形中に含まれる唯一の活性物質が実質上水不溶性治療物質、例えばMMPインヒビターであることが好ましい。
【0075】
該固体剤形の重量は、その意図する用途及び存在するかも知れない賦形剤又はさらなる活性物質の量によって変わるであろう。例えば、該固体剤形がGFSの間の組織瘢痕形成の防止に使用されるべきものであり、全体が、実質上水不溶性治療物質、例えばMMPインヒビターで構成される場合、固体剤形の重量は、10mg未満、より好ましくは6mg未満、最も好ましくは1〜5mgであるのが好ましい。固体剤形の重量は、その意図する用途によって変わるであろう。好ましくは該固体剤形は、1〜5mgの実質上水不溶性治療物質、例えばMMPインヒビターを含んでなる。この固体剤形は、使用に際して、疾患が起こった、又は起こりそうな身体内の部位に位置させるのであるから、滅菌するのが好ましい。該固体剤形は任意の標準技術を用いて滅菌できる。好ましくは該固体剤形はガンマ線照射を用いて滅菌する。
【0076】
本発明の好ましい態様によれば、実質上水不溶性治療物質は、組織瘢痕形成を防止又は低減させるためのMMPインヒビターである。本明細書に記載のMMPインヒビターの固体剤形を使用して、いかなる種類の組織瘢痕形成も防止又は低減させ得る。
【0077】
瘢痕形成はしばしば火傷の治癒の際に起こる。この火傷は、化学的、熱的又は放射線火傷であってよく、眼、皮膚表面又は皮膚及び下層組織のものであってよい。例えば放射線治療により惹起された、内部組織の火傷がある場合もある。瘢痕形成は物理的及び/又は美容上の問題、例えば運動の喪失及び/又は外観の変形を導くことがある。
【0078】
瘢痕形成は、皮膚移植片を作製する場合にも起こる。様々な理由で皮膚移植片が適用され、瘢痕形成が物理的及び美容的問題をもたらすことがある。例えば重度の火傷の場合のように多くの皮膚移植片を要する場合、これは特に重大な問題である。
【0079】
防止又は低減させることのできる特別な種類の組織瘢痕形成には、眼科手術後の眼の組織の瘢痕形成がある。殆どの種類の眼科手術は幾らかの組織瘢痕形成を引き起こす。例えば、新たな流出経路を創設する緑内障濾過手術(GFS)は、組織の瘢痕形成のためにしばしば失敗する。故に、瘢痕組織形成を防止する方法は極めて貴重である。瘢痕組織は角膜外傷又は角膜手術、例えば近視又は屈折異常のレーザー又は外科的処置の後にも形成され得る。角膜混濁及び水晶体摘出もまた瘢痕形成を惹起し得る。瘢痕組織はさらに、硝子体液又は網膜の上/中にも形成されることがあり、例えばこれは若干の糖尿病患者において最終的に失明を引き起こし、また、網膜剥離手術後に形成される。防止又は低減させることのできる他のタイプの瘢痕形成には、斜視、眼窩若しくは眼瞼手術後の眼窩内若しくは眼及び眼瞼筋上に形成される瘢痕、又は、緑内障手術後に起こり得る甲状腺眼症の際に起こる結膜の瘢痕形成、又は瘢痕性疾患、炎症性疾患(例えば類天疱瘡)若しくは感染性疾患(例えばトラコーマ)において起こる結膜の瘢痕形成が包含される。さらに、組織再生を可能にさせるような局所眼環境の調製は、本発明に係る剤形の恩恵を受けるであろう。
【0080】
瘢痕形成は、未熟児網膜症、黄斑変性、及び近視にも関連する。眼神経の瘢痕形成もまた緑内障で起こり得る。
【0081】
別の形態の瘢痕形成は、瘢痕収縮、即ち瘢痕の線維組織が縮むことによる収縮である。幾つかの場合には、瘢痕は、その収縮が重大な変形を惹起する瘢痕である、悪性瘢痕となることがある。胃潰瘍が治癒する時に形成される瘢痕組織の収縮により、患者の胃は、砂時計拘縮で事実上二つの別々のチェンバーに分かれることがある。瘢痕組織の収縮により、通路及び管路の閉塞、瘢痕狭窄が起こり得る。血管の収縮は、例えば手術又は血管形成術後に、原発性閉塞又は外科的外傷が原因で起こり得る。他の管腔臓器、例えば尿管の狭窄もまた起こり得る。偶発的創傷に由来するものであろうと手術に由来するものであろうと、いかなる形態の瘢痕形成が起こっても問題が発生し得る。
【0082】
瘢痕組織が形成されそうな場合であろうと、形成されつつある場合であろうと、又は形成されてしまった場合であろうと、MMPインヒビターの固体剤形が使用できる。
【0083】
さらに瘢痕形成は、コラーゲン含有組織の収縮に関わり、手術又は事故に起因する外傷後状態、例えば手又は足の腱の損傷、移植後状態及び病的状態、例えば強皮症、デュピュイトラン拘縮及び表皮水疱症を含む、皮膚及び腱の状態にも関わっている。
【0084】
MMPインヒビターの固体剤形は、好ましくは化学的火傷、熱的火傷若しくは放射線火傷、皮膚移植、手術若しくは事故に起因する外傷後状態、緑内障手術、糖尿病関連眼疾患、強皮症、デュピュイトラン拘縮、表皮水疱症又は手若しくは足の腱の損傷に関連する組織瘢痕形成の予防若しくは治療に使用される。好ましくは、処置はできるだけ早く、有利にするには直ちに、そして最も有利なのは最初の瘢痕形成の徴候の前に行うべきである。上に指摘したように、該固体剤形は、好ましくは組織瘢痕形成を防止又は低減させるために手術部位に埋め込むためのものである。
【0085】
MMPインヒビターを含んでなる固体剤形は、眼へのデリバリー及び眼組織の瘢痕形成を防止するためのものであることが特に好ましい。したがって、MMPインヒビターを含んでなる固体剤形は、好ましくは眼科手術、とりわけGFSの後の眼組織の瘢痕形成を防止又は低減させるために使用される。特に、GFSの後に結膜下腔内に該固体剤形を入れることにより、MMPインヒビターが房水中に徐々に放出されることが見出された。MMPインヒビターの存在は、ブレブ(切開創を覆う組織)が瘢痕形成するのを防止し、それにより、流体が、房水から切開創を通って流出することを防ぐ。
【0086】
本発明の好ましい態様では、実質上水不溶性の治療物質、例えばMMPインヒビターの固体剤形は、本質的に、実質上水不溶性の治療物質、例えばMMPインヒビターで構成される。本明細書で使用する「本質的に〜で構成される」という語は、該固体剤形が、実質上水不溶性の治療物質、例えばMMPインヒビターで構成されており、他の構成成分を微量(最大約1〜2%(w/w))含むに過ぎないことを意味する。
【0087】
本発明はさらに、埋め込み可能な錠剤の形態である、実質上水不溶性の治療物質を含んでなる固体医薬組成物を提供する。好ましくはこの錠剤は、直径5mm又はそれ以下で、且つ好ましくは2mm又はそれ以下の厚さを有する。この錠剤は好ましくは、0.1mm3〜1.5cm3の総体積を有する。治療物質は上に定義のとおりである。上に述べたようにこの錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的に該治療活性物質で構成される。
【0088】
好ましい態様では、本発明はさらに、マトリックスメタロプロテイナーゼインヒビターを含んでなる、錠剤の形態の、埋め込み可能な固体医薬組成物を提供する。好ましくは、該錠剤は直径5mm又はそれ以下で、且つ好ましくは2mm又はそれ以下の厚さを有する。この錠剤は好ましくは、0.1mm3〜1.5cm3の総体積を有する。
【0089】
MMPインヒビターは上に定義のとおりである。この錠剤は、好ましくは、眼科手術、特にGFS後の組織瘢痕形成を防止するために結膜下腔内に挿入できるようなサイズとする。上に指摘したように、この錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的にMMPインヒビターで構成される。
【0090】
さらに本発明は、実質上水不溶性の治療物質を含んでなる、重量10mg未満、好ましくは6mg未満の錠剤の形態の、固体医薬組成物を提供する。
【0091】
治療物質は上に定義のとおりである。上に指摘したように、この錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的に該治療物質で構成される。
【0092】
好ましい態様では、さらに本発明は、マトリックスメタロプロテイナーゼインヒビターを含んでなる、重量10mg未満、好ましくは6mg未満の錠剤の形態の、固体医薬組成物を提供する。
【0093】
MMPインヒビターは上に定義のとおりである。上に指摘したように、この錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的にMMPインヒビターで構成される。
【0094】
さらに本発明は、実質上水不溶性の治療物質を含んでなる、滅菌された固体医薬組成物を提供する。好ましくはこの実質上水不溶性の治療物質は、マトリックスメタロプロテイナーゼインヒビターである。このMMPインヒビターは上に定義のとおりである。好ましくはこの医薬組成物は錠剤の形態である。上に指摘したように、この医薬組成物は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的には、唯一の活性物質としての実質上水不溶性の治療物質で構成される。この固体医薬組成物は、ガンマ線への暴露によって滅菌される。
【0095】
本発明はさらに、
i.実質上水不溶性の治療物質の固体錠剤を形作り;そして、
ii.この錠剤をガンマ線で照射して滅菌する、
ことを含んでなる、実質上水不溶性の治療物質を含んでなる滅菌された固体医薬組成物を製造する方法を提供する。
【0096】
本発明方法は、組織瘢痕形成を防止又は低減させるための滅菌固体医薬組成物の製造を可能にする。実質上水不溶性の治療物質の固体錠剤を形作る工程は、任意の適当な技術を用いて実施できる。好ましくは、この固体錠剤は、打ち抜き型又はその他の適当な技術を用いて、実質上水不溶性治療物質を固体錠剤に圧縮することにより形作る。この錠剤をガンマ線照射する工程は、好ましくは、滅菌を確実とするために錠剤を25KGy線量に付すことを含んでなるが、より低い線量で充分であることもある。治療物質は上に定義のとおりであり、好ましくはMMPインヒビターである。上に指摘したように、この錠剤は賦形剤及びその他の活性物質を含んでなることがあるが、好ましくは実質的に賦形剤を含まず、本質的に、実質上水不溶性の治療物質で構成される。
【0097】
本発明はさらに、MMPインヒビターを含んでなる固体剤形及び緑内障濾過手術の実施に必要な手術用機器を含んでなるキットを提供する。
【0098】
MMPインヒビターは上に定義のとおりである。固体剤形もまた上に定義のとおりであるのが好ましい。このキットは複数の該固体剤形を含んでなるかも知れず、その場合、必要な用量に応じて幾つかの固体剤形を患者に埋め込むことができる。このキットはまた、この固体剤形の使用方法を指示する説明書をも含んでなることがある。
【0099】
多くの身体組織、例えば結膜下は、容量が小さく水流動性が低いため、非沈降状態が存在する。固体形態の殆どの活性物質の溶解の律速段階は、これらの非沈降状態により引き起こされる。流動性が一定範囲内であると考えられる状態における溶解は、主として直線的であろう。このことは投与量の廃棄及びバースト放出動態を防ぎ、一定の持続的な活性物質濃度を可能にする。驚くべき事に、賦形剤のない錠剤剤形を使用する場合、局所接触組織の毒性は観察されない。これもまた驚くべき事に、砕けたり粉々になったりしない小錠剤を製造することができる。これについての特定の理論に拘束される訳ではないが、これは、微量の残留水及び生物活性物質の難溶性に起因すると思われる。賦形剤の不在は、活性物質がその賦形剤と混和及び共存することを確保する必要性を排除する。これは、典型的には、最終剤形において活性物質の相分離が起こらないことを確実にするために必要とされる。
【0100】
実質上水不溶性の治療物質、例えばMMPインヒビターを、賦形剤無しで使用することは、それがこの形態において安定であり且つその活性を維持するということから、驚くべき事である。一般に、賦形剤は活性物質の安定な分散を維持し凝集現象を防止するために必要であると予想されるため、これは驚くべき事である。よって、埋め込み用に設計された、賦形剤を殆ど含まない固体剤形において、活性物質を反復投与する必要無しにその有効性が観察されることは、驚くべき事である。
【0101】
この剤形は、結膜下に固有の、そして一般には組織に固有の、非沈降状態での使用に合わせて設計されるため、大部分が活性物質から作られている固体錠剤形態の使用は、生物活性物質の長期且つ一定の局所濃度の維持に最適となるであろう。
【0102】
本発明の第六の局面によれば、固体形態の抗体を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる固体単位剤形の医薬組成物が提供される。
【0103】
「抗体分子」と同義である「抗体」という語は、本発明の第一局面に関連して使用される意義と同じ意義を有する。
【0104】
これまで、治療用又は診断用抗体は一般に水溶液として製剤化及び投与されてきた。或る場合には、抗体は凍結乾燥固体として供されてきたが、この固体は使用前に再構成されねばならず、そこから得られる溶液から適切な用量を得なければならない。驚くべき事に本発明者等は、抗原結合を保持し、且つインビボ使用のための適当な放出特性を伴った、固体単位剤形として抗体を製剤化することが可能であることを見出した。さらに、抗体を固体単位剤形として製剤化することによりインビボ埋め込み後の抗体の持続放出の達成が可能であるが、そのような放出は水性注射用製剤では達成できない。このような結果は他の蛋白型治療用又は診断用物質でも達成できる。
【0105】
或る態様では、抗体はモノクローナル抗体である。特にこの抗体は腫瘍性疾患の予防又は治療を適応とすることができ、例えば抗VEGF抗体であってよい。抗VEGF抗体の例はベバシズマブ(アバスチン)である。
【0106】
本発明のこの局面の組成物は、好ましくは滅菌される。
【0107】
1又は2以上の賦形剤が存在する場合、これらは好ましくは、インビボ埋め込み後に生分解性及び/又は生体吸収性である。或る態様では、該組成物は実質上賦形剤を含まない(上に定義のとおりである)。幾つかの態様では、或る種の賦形剤、例えば安定化用糖類(例えばトレハロース)、緩衝塩、界面活性剤及び/又は、水性注射用抗体製剤に典型的に含有される類似の比較的可溶性の賦形剤を存在させることができ、幾つかの例では、本発明に係る組成物の有利な性質に著明な影響を及ぼさない、かなりの量で存在させることができる。事実、幾つかの例では、賦形剤の配合を利用して、該組成物からの抗体の放出を改善及び/又は制御できる。したがって、親水性ポリマー、例えばヒアルロン酸を本発明に係る抗体錠剤組成物に含有させ得ること、そしてそれらが適当量存在する場合には抗体放出の増強を導き得ることが判明した。より大量では、ヒアルロン酸のような親水性ポリマーは、より持続的な抗体放出を導くことができるかも知れない。
【0108】
この局面の組成物は圧縮によって製造できる。この種の好ましい組成物は錠剤である。何れにせよ各々の固体単位剤形は、好ましくは0.1mm3〜1.5cm3の体積を持ち、及び/又は最大寸法5mm以下であり、及び/又は重量10mg以下である。
【0109】
この局面の組成物は、1又は2以上のさらなる治療活性成分を含有でき、それは抗体であってもそうでなくてもよく、そして固体形態であってもそうでなくてもよい。
【0110】
本発明はさらに、治療に使用するための第六局面による組成物を提供する。加えて本発明は、腫瘍性疾患の予防又は治療に使用するための、第六局面による組成物を提供する。同様に本発明は、それを必要とする患者における腫瘍性疾患の予防又は治療方法を提供し、この方法は、該患者に第六局面による医薬組成物を投与することを含んでなる。
【0111】
本発明の第七の局面によれば、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形[ここで、この1又は2以上の賦形剤は、それが存在する場合、その1又は2以上の賦形剤の化学的又は生化学的分解により活性物質の放出を制御することはない]が提供される。この剤形は好ましくは滅菌される。
【0112】
本発明の第八の局面によれば、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形[ここで、この剤形は圧縮により製造される]が提供される。この剤形は好ましくは滅菌される。
【0113】
本発明の第九の局面によれば、固体形態の治療用又は診断用蛋白物質、例えば抗体を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる固体単位剤形の医薬組成物[ここで、この剤形は圧縮により製造される]が提供される。この局面の剤形は、好ましくは錠剤の形態である。この局面の剤形は、好ましくは実質上賦形剤を含まない。該剤形はさらに、好ましくは滅菌されている。該剤形は好ましくは埋め込み可能であり、そして好ましくは、埋め込みへの適合性に関して上に記載した1又は2以上のさらなる特徴を有する。
【0114】
第十の局面によれば、本発明はさらに、その部位を冒している状態の局所的予防又は治療のために、インビボ部位に治療活性物質をデリバリーする方法であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる固体剤形を、当該部位に埋め込むことを含んでなる方法を提供する。或る態様では、この剤形は実質上賦形剤を含まない。或る態様では、この賦形剤は非ポリマー性である。
【0115】
ここに本発明を、単なる例として以下の図面に準拠して説明する。
【図面の簡単な説明】
【0116】
【図1】図1は、pH7.6の水溶液中でのイロマスタットの溶解度の検量線を示す。
【図2】図2は、イロマスタット錠1からの放出プロファイルを示す。
【図3】図3は、錠剤1を入れたリグから採集された試料中のイロマスタット濃度を示す。
【図4】図4は、イロマスタット錠2からの放出プロファイルを示す。
【図5】図5は、錠剤2を入れたリグから採集された試料中のイロマスタット濃度を示す。
【図6】図6は、5−FUの溶解度の検量線を示す。
【図7】図7は、5−FU錠からの放出プロファイルを示す。
【図8】図8は、リグから採集された試料中の5−FU濃度を示す。
【図9】図9は、種々の条件下での、賦形剤を含まない錠剤から放出された5−FUの累積放出(a)及び濃度(b)を示す。この放出プロファイルは、
【化1】

、を示す。
【図10】図10は、賦形剤を含まない錠剤から放出されたトリアムシノロンの累積放出(a)及び濃度(b)を示す。
【図11】図11は、賦形剤を含まない錠剤から放出されたデキサメタゾンの累積放出(a)及び濃度(b)を示す。
【0117】
【図12】図12は、賦形剤を含まない錠剤から放出されたナプロキセンの累積放出(a)及び濃度(b)を示す。
【図13】図13は、200μl流動溶解リグに入れた賦形剤を含まない錠剤から放出されたイロマスタットの累積放出(a)及び濃度(b)を示す。
【図14】図14は、実質上賦形剤を含まない錠剤からのベバシズマブの放出プロファイル及び活性保持を示す。
【図15】図15は、実際のデータ点をプロットした、図14の「活性蛋白」データを示す。
【図16】図16は、市販の注射用製品アバスチンから得られたものと比較した、賦形剤を含まない錠剤からのベバシズマブのサイズ排除クロマトグラフィー軌跡を示す。
【図17】図17は、本発明に係る錠剤及び賦形剤としてヒアルロン酸を含有する錠剤からのベバシズマブの放出プロファイルを示す。
【実施例】
【0118】
実施例
溶解性実験は、イロマスタット及びその他のMMPインヒビターの治療用量が、固体錠剤形態のイロマスタット又はその他のMMPインヒビターの遅速溶解によって達成できる可能性を示唆した。クリアランスがインビトロフローセルにおいて5分未満で起こる単純な注射と比較して、この錠剤形態のイロマスタットでは長期放出が達成されることが証明された。次に、臨床的に検証されたインビボGFSモデルを用いて、最長30日間の様々な時点での、手術部位における長期放出の効果を調べた。GFSに関してイロマスタットは毒性でないことが見出されているが、この教示は、種々のMMPインヒビター及びその他の実質上水不溶性治療物質にも適用できる。
【0119】
材料及び方法
流動システム
放出動態について幾らかの指標を得るために、50〜200μl容量の流動リグを用いてブレブのモデルとした。イロマスタット錠剤(1リグあたり1個の錠剤)をフローチェンバー内に置いた。2本の管を各リグに接続する。一方は水溶液を導入する蠕動ポンプに接続し、他方はリグからこの溶液を排出させる。流速を利用して、結膜下腔への、及び結膜下腔から強膜静脈に至るこの水溶液の流動をモデル化する。溶液がリグから流出する際に試料を採取し、この徐放系におけるイロマスタットの濃度を決定する。
【0120】
一定範囲の流速をこのリグ実験に使用したが、殆どの実験では、流速2μl/分を使用して、ブレブにおける水の流速をシミュレートした。眼内の実際の状態をさらにシミュレートするため、使用した水溶液をpH7.4〜7.6(これが正常なヒト房水のpHであるため)に維持し、温度を37℃に維持した。この水溶液はOxoid(登録商標)リン酸緩衝化生理食塩水錠剤を用いて調製した(脱イオン水100mlあたり1錠)。このPBS錠を脱イオン水に溶解し、pHを7.6に調節した。この水溶液を37℃に保持した。
【0121】
錠剤の製造
錠剤用パンチ及びダイを使用し、固体イロマスタットをダイに置き、パンチを取り付ける。この固体イロマスタットは、ダイに置く前に精確に秤量した。次に、取り付けたパンチ−ダイを錠剤圧縮機中に入れ、約10秒間5barの圧力で圧縮した。
【0122】
HPLC方法
幾つかの逆相カラム及び移動相を評価し、イロマスタットのHPLC分離に必要な最適条件を決定した。C−18カラム(SIGMA)及び25%アセトニトリル水性移動相が良好な基線分離を与えることが判明した。移動相は以下のように調製した。緩衝液1000mlを作製するために、酢酸アンモニウム(Fluka)1.54gm、99.5%トリエチルアミン6ml(Sigma Aldrich)、脱イオン水〜950mlを混合し、次いで100%酢酸(Analar BDH)およそ10mlを加え、この緩衝液のpHを5.0±0.1に調節した。pHを調節する際、脱イオン水を加えて緩衝液の容量を1000mlとした。各試料のアリコート(0.1ml)をHPLCバイアルに移し、次にこれをHPLCオートサンプラーに入れた。移動相を1ml/分で溶出し、UV検出機を280nmに設定し、イロマスタット溶液の濃度を決定した(Galardy et al. 1994b)。各時点で3回の注入(各10μl)を評価した。UV検出機にコンピューターを接続し、プログラムChrom+を使用してピーク面積を解析し、イロマスタットの量を決定した。ピーク表面は、被験溶液中のイロマスタットの濃度を表す。3個の測定値の平均を用いてイロマスタットの量を決定した。
【0123】
ガンマ線照射による錠剤の滅菌
欧州及び米国薬局方の規定に従い、投与される薬物の最終剤形は無菌である必要がある。錠剤製造は無菌条件で実施される訳ではなく、滅菌イロマスタットは市販されていないため、イロマスタット錠をガンマ線照射によって滅菌する必要があった。ガンマ線照射は、無菌処理及び濾過よりも優れた製品滅菌の確実性といった著明な利点を持つこと、製造された最終製品の内部を貫通すること、低温プロセスであること、そして単純な検証プロセスを有することから、幅広く利用されている。さらに、例えばエチレンオキシド滅菌の場合のような除去すべき残留物がない。潜在的な1つの不都合は、ガンマ線照射は試料内部の化学構造の改変を導き得る化学反応を開始させ得ることである。一般に、最低限の無菌性保証レベルSAL=10−6(処理後にその物体が非無菌である確率が百万分の一)の達成には25kGyの線量が必要である。より低い線量は、適当な無菌試験を使用して検証できる。欧州及び米国薬局方の規定の下では、25kGy線量の照射が無菌性を保証する(2000a;2000b)。英国のクランフィールド大学と協力して、コバルト60ガンマ線源を利用した。これは、薬物及び生体材料を照射により滅菌するのに好適であると考えられる。よってイロマスタットを未加工粉末及び製造済み錠剤として照射した。コバルト60ガンマ線源は1時間あたり約4500kGyの照射にあたることから、25kGyの暴露を達成するために試料をコバルト60パノラマ式チェンバーに約5時間35分間放置した。
【0124】
インビトロ実験
1.ヒトテノン線維芽細胞(HTF)
インビトロ培養用にヒトテノン線維芽細胞(HTF)を使用した。これらの細胞は結膜下瘢痕形成に関与している。ヘルシンキ宣言の信条(1989)の下にモアフィールド病院アイバンクから取得したドナー眼由来の0.5cm3の組織外植片を使用して、HTF単離及び増殖の処理を実施した。0.5cm3の外植片を、25cm3のフラスコの底に、カバースリップを載せて2時間保持した。各フラスコには、10%牛胎児血清、2mM L−グルタミン、100U/mlペニシリン、50mg/mlゲンタマイシン、100μg/mlストレプトマイシン及び0.25μg/mlアムホテリシンを加えたダルベッコ改良イーグル培地(DMEM)で構成される通常培地5mlを入れた。フラスコを、37℃及び空気中5%加湿CO2のインキュベーターに入れた。培地を3日毎に交換し、コンフルエントになった時に(通常1ヶ月以内)、新たなフラスコに継代し、直接実験に使用するか、液体窒素中に保存した。
【0125】
2.細胞培養の継代及び維持
HTFがコンフルエントに達した後、培地を吸引し、単層をトリプシン1x(Gibco)1mlで洗浄し、このトリプシンを約15秒間速やかに吸引した。次に、トリプシン1x(Gibco)2mlを各フラスコに加え、37℃及び空気中5%加湿CO2で2分間インキュベートすることにより、HTFをフラスコから剥離させた。x10倍率のLeica顕微鏡を用いる位相差顕微鏡検査によって、細胞がフラスコの底から剥離し、それらが球形を獲得したことを確認した後、細胞培地2mlを加えてトリプシン処理を中和した。細胞懸濁液を15ml遠心管(STARLAB GMBH)に移し、1600rpmで5分間遠心分離した。次いでこの細胞ペレットを細胞培地10mlに再懸濁し、4個の異なる75cm3フラスコに分けた(1:4の拡大)。各フラスコに細胞培地7.5mlを加えた。フラスコを37℃及び空気中5%加湿CO2のインキュベーターに入れ、3日毎に培地を交換した。コンフルエントに到達させるために継代から継代までに必要な時間は平均1週間であった。
【0126】
3.コラーゲンゲルの調製(インビトロ収縮モデル)
ノイバウエルプレートを用いて6.2x104HTFを計数し、次いで50mlユニバーサル管に入れたFBS170μlに再懸濁した。濃縮培地(160μl)を加えた(3.5mlDMEM(x10原液)、0.35mlグルタミン(2mM原液)及び0.9ml重炭酸ナトリウム(7.5%原液)より成る保存溶液)。次に、First LinkI型コラーゲン溶液のコラーゲン(0.6%酢酸中原液2.2mg/ml)830μlを加え、気泡ができないよう、この溶液を回転させて混合した。滅菌1M NaOH(75〜80μl)を速やかに添加して溶液の酸性pHを変化させた。これにより溶液はピンク色となり、元の黄色には戻らなかった。直ちにコラーゲンゲル溶液150μlをMattek皿のウェルに流し入れ、ピペットチップを用いてこのゲルが確実に中央溝の隅に入っているようにした。ゲルをチップから排出する際、気泡の生成を回避せねばならない。気泡ができた場合はそれらを吸入除去した。通常、ゲル懸濁液1.2mlから6個のゲルが容易にできる。この処理の後、ゲルの入ったMakket皿のウェルをインキュベーターに入れ、少なくとも10〜15分間(最長30分間)で固まらせた。黄色のチップを用いて中央溝の隅からゲルを剥離し、ポリマー化しなかった過剰の溶液を吸引除去した。細胞培地2mlを加え、皿を37℃及び空気中5%加湿CO2のインキュベーターに入れた。培地は3日毎に交換した。
【0127】
4.イロマスタットを含有する培地の調製
一般に固体イロマスタットは培地に添加する前にDMSOで希釈するが、この実験では、イロマスタットをDMSOを含まない通常培地に直接溶解できた。培地及び滅菌しておいた固体イロマスタット、並びに培地及び非照射固体イロマスタットを、異なる50mlユニバーサル管に入れ、約5〜6時間攪拌した。次いで両試料の濃度をHPLCで確認した。
【0128】
5.イロマスタット活性のインビトロ評価
コラーゲンIゲルのHTF収縮に及ぼす非照射イロマスタットの阻害効果が知られている。照射したイロマスタットと比較するため、3つの異なるコラーゲンゲルの処置群による実験を行った。各処置群はHTFを伴う3つのコラーゲンIゲルを有していた。第一群のゲルはイロマスタット無しの培地で処理し(負の対照)、第二群のゲルは非照射イロマスタットを加えた培地で処理し(正の対照)、そして第三群のゲルは照射したイロマスタットを加えた培地で処理した。
【0129】
第二のインビトロ実験では、通常培地に直接溶解した照射イロマスタット錠の阻害効果を、最初にDMSOに、次いで通常培地に溶解した非照射イロマスタット粉末と比較した。この実験は、錠剤の製造プロセスが固体状態の変化、例えばイロマスタットの有効性低下を導き得る結晶化をもたらすかどうかを決定するために実施した。
【0130】
イロマスタットの阻害効果を、コラーゲンゲルの収縮を測定することにより決定した。ゲルの写真を毎日撮影した。収縮%は、Image Jと呼ばれるソフトウェアを用いて決定した。次いで処理したゲルの培地を、活性MMPのレベルを調べるための将来のザイモグラフィー解析のために−70℃で保存した。
【0131】
インビボ実験
1.実験設計
左目に緑内障ドレナージ手術を受ける4匹のウサギによってランダムな1ブロック研究の設計を実施した。動物を30日間観察した。この実験は、マスキングされた観察者を用いるランダム化盲検対照研究として実施した。一人の観察者を臨床データの評価に利用した。
【0132】
2.動物
4匹の雌性ニュージーランドホワイトウサギ(Harlan UK Ltd; c.2〜2.2kg、12〜14週齢)を使用した。動物を眼科用BRUユニットに収容し、通常必要とされる順応期間7日間を与えた。
【0133】
3.処置レジメン
表1に示すように動物を2群の何れかにランダムに割り付けた。A群の動物には賦形剤不含イロマスタット錠(ペレットとも称する)を投与し、B群には対照としてエチルセルロース錠を投与した。エチルセルロースは水溶液に溶解しない賦形剤であり、MMPに対して既知の阻害活性を持たない。エチルセルロース錠のサイズは30日間のインビボ実験の間不変であった。単に不活性エチルセルロース錠を入れたためではなく、イロマスタット自体がブレブ及びその機能性を維持したのかどうかを判定するために、対照ペレットはイロマスタットペレットと同サイズとした。
【0134】
【表1】

【0135】
GFS終了時、結膜閉鎖の直前に、イロマスタット又はエチルセルロース錠の何れかを左眼の結膜下に配置した。
【0136】
4.緑内障濾過操作 − 緑内障濾過手術のモデル
手術は、文献に詳細に記載されている標準法を用いて実施する。外科的手技及びウサギにおけるその使用を一致させることにより、過去の研究とのおおよその比較が可能となる。このモデルは臨床的に検証されており、且つこの外科的手技は広く臨床使用されていることから、このことは特に重要である。
【0137】
試料の採取
HPLCでイロマスタットの検出を行うため、第30日目の実験終了時に、房水、硝子体及び血液を採取した。
【0138】
結果
検量線
DMSOを含まないpH7.6の水溶液中でのイロマスタットの検量線を図1に示す。この曲線は、Chrom+と称するソフトウェアと共に上記の移動相及びUV検出機(280nm)を使用するHPLCカラム(C18)から溶出するイロマスタットを測定することにより作製した。
【0139】
この曲線は以下のように作製した。イロマスタット(0.3885mg)(Caldiochem、純度>95%)をpH7.6の水溶液(10ml)に溶解し、100μM濃度の保存溶液を得た。次にこの保存溶液を個々の容器中に希釈して、以下の濃度を持つ6種類の溶液を得た:80μM、60μM、40μM、20μM、10μM及び5μM。次いで各溶液をHPLCで3回評価し、吸光度を決定した。イロマスタットのピークは注入のおよそ6〜8分後に検出された。得られた平均の検量線を図1に示す。
【0140】
イロマスタット錠の放出
全般的な狙いは、緑内障濾過手術後に結膜下腔に純粋な圧縮イロマスタットで作られた小錠剤を配置したならば、イロマスタットが房水に持続放出する結果となるかどうかを確定することであった。イロマスタットは極めて高価な化合物であるため、イロマスタット錠の製造に先立ち、5−FUのような他の化合物を用いる小錠剤製造において経験を得た。6.5mg、5.6mg及び3.2mgの固体イロマスタットを用いて3種の賦形剤不含イロマスタット錠を製造した。標準的な錠剤用パンチ及びダイ並びに適用圧力5barのプレス機を使用した。第一の錠剤は直径3mm、厚さ0.87mm及び重量4.8mgであった。第二の錠剤は同じ直径、厚さ0.62mm及び重量4.1mgであった。第三の錠剤は直径3mm、厚さ0.4mm及び重量2.3mgであった。少量のイロマスタットがパンチ及びダイの表面に残留した。第一の錠剤の製造に用いられたイロマスタットの量は、30日間のあらゆる時点でイロマスタットが水溶液(約100μM)中で理論上最大の溶解性を維持するという仮説に基づいた。
【0141】
各錠剤をリグ内に配置した後、pH7.6の水溶液をリグ内にポンプ注入した。流速は、小柱網を通る房水の流速と同様の2μl/分に設定した。リグを出た後の液体試料を集めた。次に、濾過後の試料をHPLCで分析し、検量線を用いてイロマスタットの濃度を決定した。
【0142】
表A及びBのデータを利用して各錠剤についての放出プロファイルをグラフで表した(図2、3、4及び5)。
【0143】
インビボ実験に使用するイロマスタット錠の製造
試験された2個の錠剤が流動リグ内で30日後に完全に溶解していないことが判明したため、本発明者等は、2.3mgのイロマスタットを使用して、より柔らかい錠剤を作ろうと試みた。本発明者等はこの錠剤を200μl容量の流動リグに配置し、この系を流速2μl/分に設定した。この錠剤の放出プロファイルを表4に示す。
【0144】
【表2−1】

【表2−2】

【0145】
【表3−1】

【表3−2】

【0146】
【表4−1】

【表4−2】

【0147】
HPLCによる、照射イロマスタット及び非照射イロマスタットの比較
緑内障濾過手術中にイロマスタット錠を埋め込むためには、この錠剤が無菌である必要があった。医薬品規制調和国際会議(ICH)は、照射された製品と照射されていない製品の特性解明及び比較に、高速液体クロマトグラフィー(HPLC)、質量分析又はガスクロマトグラフィーの使用を推奨している。これらの指針に従い、ガンマ線照射イロマスタットをpH7.6の水溶液に溶解し、それをHPLCで評価した。照射されたイロマスタットのクロマトグラムを非照射イロマスタットのクロマトグラムと比較した。照射イロマスタットのクロマトグラムは、イロマスタット全体と比較して、照射後に形成される0.25%の微量生成物を表す追加のピークを示した。これは、米国及び欧州薬局方何れの基準にも適合する。
【0148】
イロマスタット錠の安定性
イロマスタットを0.1mMの濃度でDMSO又は水に溶解した溶液は、4℃で1ヶ月あたり1%が分解し、37℃ではこれが一日あたり1%に増大する(Caldiochemのデータ)。37℃の湿潤環境で数日間放置した場合のイロマスタット固体錠剤の安定性を記載したデータは公表されていない。イロマスタット錠を、37℃の水性環境で30日間潜在的分解について評価した。第二の錠剤から試料を採取した後、本発明者等は、リグから残存固体を除去し、それを水溶液(pH7.6)に溶解した。残存イロマスタット化合物を含むこの水溶液の第30日目におけるクロマトグラム及び第一の時点においてリグから採取された水溶液のクロマトグラムを比較した。両クロマトグラムは極めて似通っており、この30日間で分解が起こらなかったことを示唆した(データは記載されていない)。
【実施例1】
【0149】
実施例1
DMSO無しで直接媒質に溶解した照射イロマスタット粉末及び照射イロマスタット錠がインビトロで収縮を阻害する能力
3種類の処置カテゴリー(通常媒質、非照射及び照射イロマスタット)のゲルはすぐには収縮を開始させなかった。この理由により、3つの処置群において第1日目までは著明な変化が見られなかった。第2日目からゲルが収縮し始め、照射及び非照射イロマスタットの阻害効果が明らかとなった。実験が終了した7日目までに、負の対照群及びイロマスタット群の収縮に統計的有意差があった。
【0150】
【表5】

【0151】
第2のインビトロ実験
【表6−1】

【表6−2】

【0152】
実施例2
インビボ実験におけるイロマスタット錠の有効性
1.臨床的観察
エチルセルロース錠(対照)を投与されたウサギのブレブは、緑内障濾過手術の10日後に不全となった。対照的に、イロマスタット錠を投与された3匹のウサギのブレブは不全とならなかった。30日後、計画された実験は終了した。1匹のウサギにおいて、7日目に強膜の縫合が裂け、管が前房に落下した。これが起こった場合、通常の予想ではブレブが不全になる。しかしながら驚くべき事に、良好な構造のブレブが30日目までこのウサギに存続した。処置群及び対照群のウサギに角膜上皮症は観察されなかった。さらに、ブレブ領域上部の結膜は正常で無血管性ではなかった。緑内障濾過手術においてMMCを使用した後には無血管性ブレブが観察されてきた。そのうえ、柔らかい眼は観察されなかった。
【0153】
2.30日目にウサギから採取した液体試料におけるイロマスタットの検出
上記のHPLC法を使用したところ、30日目にウサギの左(手術された)眼から採取した前房由来の房水、硝子体又は血液試料にはイロマスタットが検出されなかった。先に述べたようにイロマスタットの保持時間は6.5〜8分間であり、その時点付近でピークは検出されなかった。これらの観察は、GFS処置について、いかなる潜在的局所毒性も回避できるという結果を伴ってイロマスタットの流出が起こることを示している。
【0154】
結論
本発明者等は、試験された錠剤からのイロマスタットの持続放出を観察した。これらの錠剤は、賦形剤を使用せずに製造された。放出期間(30日間)の間、イロマスタットの治療用量(10μM)が達成された。固体形態のイロマスタットの使用は、複数回の注射を必要としない組織瘢痕形成の防止方法を提供する。過去のインビトロ及びインビボ実験とは対照的に、本発明者等は実験全体を通じてDMSOの使用を回避したが、それは、眼科での臨床使用が認可されていないためである。
【0155】
極めて重要な論点は、錠剤を滅菌する必要性である。他のメタロプロテイナーゼインヒビター、例えばカプトプリルにおける照射の効果が評価されている(Engalytcheff et al. 2004;Engalytcheff, Vanhelleputte, & Tilquin 2004)。照射が引き起こすカプトプリルの分解は著明でなかった。本発明者等は、25KGyのガンマ線照射により惹起されるイロマスタットの分解は著明でなく、欧州及び米国薬局方により規定された許容限度内であるということを見出した。ガンマ線照射は、イロマスタット錠の滅菌を包装したまま実施するのに著しく有利であり、何故ならその包装は、ガンマ線照射及び結膜下腔への該錠剤の配置の間にいかなる追加処理をも行う必要なしに手術室で開封できるためである。
【0156】
さらに本発明者等は、コラーゲンIゲルの収縮を阻害する照射イロマスタットの有効性を試験し、負の対照に比較して著明な阻害、及び、正の対照とほぼ同レベルの阻害を観察した。照射イロマスタットは非照射イロマスタットよりゲル収縮の阻害において僅かに強力であるように思われるが、この相違は統計的に有意ではない。本発明者等は、この相違の主な理由は、非照射イロマスタットゲルにおいて僅かに多い数の細胞を使用したことによるのではないかと考える。あいにく各ゲルに使用した細胞数は、非常に正確という訳ではないパラメータであり、このことが、観察される収縮に僅かな相違を産むことがある。
【0157】
最後に、このインビボGFSモデルにおいて本発明者等は、実験を終了する必要があった30日目まで、イロマスタットが全部のウサギにおいてGFS後の瘢痕形成を阻害することを観察した。もう一つの心強い結果は、房水、硝子体及び血液中にイロマスタットが検出されなかったことであった。したがってイロマスタットは、他の眼構造及び他の身体部分を害することがないと予想される。
【0158】
手術部位への埋め込み用固体錠剤形態のイロマスタット及び他のMMPインヒビターの使用は、組織瘢痕形成を防止及び低減させる極めて有益な利点を有することが示された。
【0159】
実施例3
5−FUを用いたインビトロ実験
上に指摘したように、固体5−FUの錠剤を上記と同じ技術を用いて製造した。次にこの錠剤の溶解速度を上記と同じリグを用いて測定した。
【0160】
結果
検量線
DMSOを含まないpH7.6の水溶液における5−FU溶解の検量線を図6に示す。この曲線は、ソフトウェアPC Chrom+を使用してHPLC読み取り機で5−FUのピークを測定することにより作製した。
【0161】
5−FUの検量線をイロマスタットと同じ方法で作成した。
【0162】
放出プロファイル
第一の錠剤(錠剤A)は、直径3mm、厚さ0.71mm及び重量7.1mgであった。第二の錠剤(錠剤B)は、同じ直径、厚さ0.88mm及び重量8.7mgであった。第三の錠剤(錠剤C)は、直径3mm、厚さ0.76mm及び重量7mgであった。
【0163】
各錠剤を上記のようなリグ内に入れ、液体試料をHPLCで分析し、5−FUの濃度を検量線を用いて決定した。
【0164】
錠剤A、B及びCから得たデータを平均し、放出プロファイルを図7及び8にグラフ表示した。
【0165】
データは5−FUの持続放出を示す。これらの錠剤は賦形剤を使用せずに製造した。放出時間(25時間)の間、実質上一定の5−FU治療用量が達成された。5−FUの固体剤形の使用は、組織瘢痕形成の防止に有効な持続放出を提供する。
【0166】
実施例4
賦形剤を含まない錠剤からの活性物質の持続放出
図9〜13は、フロースルー溶解リグを使用し、賦形剤不含錠剤(上に記載のとおり)として製剤化された様々な化学的に無関係の活性物質を用いて得られた結果を示す。各々の場合において、(a)は錠剤中の総薬物含有量のパーセントとして薬物の累積放出を示し、(b)は、各時点でのフロースルーセル中の濃度を示す。
【0167】
試験された各錠剤は本質的に薬物のゼロ次(即ち定速)放出をもたらすことが観察されるであろう。これは、(a)における直線状の軌跡によって、そして(b)における本質的に平坦な軌跡(大部分)によって説明される。このことは、このような錠剤が、インビボで埋め込み部位において何日もの間、本質的に一定の、治療関連レベルの薬物をもたらすことができることを裏付けるものである。遙かに可溶性の高い薬物5−FU(図9)を含有する剤形であっても、何日もの間本質的に直線状の薬物放出をもたらすことが示される。これらの結果は、眼への局所薬物投与のための常套的剤形(例えば、点眼剤又は眼科用注射剤)と比較して、本発明に係る剤形の滞留時間は遙かに長くなることを示している。活性物質は組織に遙かに長く存在するため、これは著しい臨床上の利益を提供することになろう。
【0168】
実施例5
固体抗体を含有する錠剤組成物
ベバシズマブの水性注射剤(アバスチンとして市販されている)を出発材料として使用した。賦形剤(例えばトレハロース)を除去するため、医薬品アバスチン(25mg/mlを50μl)をカットオフ10000ダルトンの膜を付けたスピンカラム(Vivascience社製Vivaspin 10000)に入れた。蒸留水(4ml)を加え、カラムを4000rpmで4分間遠心分離した。この工程を2回反復した。薄層クロマトグラフィー(TLC;水性メタノール90%)でトレハロースの除去を確認した。種々の濃度のトレハロース及び未処理アバスチンを対照に使用した。TLCフィルムを硫酸(10%)及びエタノール(90%)の混合物に浸し、次いで加熱した。
【0169】
次に、得られたベバシズマブの溶液を凍結乾燥してこの抗体を粉末として単離し、次いでこれを用いて1.25mgベバシズマブ錠(上に記載のとおりであり、本質的に凍結乾燥抗体のみを含有する)を製造した。放出プロファイルを図14に示すが、ここでは、総蛋白(BCAアッセイ。図14の上側の線)及びVEGFチップに結合する蛋白(Biacoreバイオセンサーを用いて測定)を比較している。これらのデータは、この抗体が錠剤から恐らくは数日間放出されることを裏付けており、そしてまた抗体のかなりの部分がそのVEGF結合活性を保持していることを裏付けている。「活性蛋白」放出のデータは、実際のデータ点を示した図15で再プロットしてある。
【0170】
図16は、未処理アバスチン溶液(aと表示)と比較した、そして、賦形剤を除去していない本発明に係る錠剤から再構成されたベバシズマブと比較した(表示のない軌跡)、本発明に係る賦形剤不含錠剤から再構成されたベバシズマブ(bと表示)についてのサイズ排除クロマトグラフィー(SEC)結果を示す。簡潔に述べると、SEC条件は以下のとおりであった:
試料の注入容量:150μl
移動相:リン酸緩衝液(NaH2PO4、25mM、pH6.8及びNaCl 150mM)
流速:1mL/分
カラム:(Hiload TM、Superdex TM 200)
UV検出機:280nm
図16のデータは、製剤化されたベバシズマブの分子量は、アバスチン対照溶液と比較して変化がない、即ち、精製及び錠剤化工程はこの抗体の凝集を導いていないことを裏付けている。実施例4に示した結果でも同様であるが、本実施例に従って製造された剤形の埋め込み部位への滞留は、例えば点眼剤や眼科用注射剤よりはるかに長いであろう。これは著しい臨床上の利益を提供することになるであろう。
【0171】
本発明に係る抗体含有組成物、例えば錠剤の放出プロファイルのコントロールが、或る種の賦形剤を添加することによって達成できる。このアプローチはさらに、抗体活性の保持における改善をもたらし得る。図17は、1錠あたりヒアルロン酸(ヒーロン)1.75mgを添加した効果を示している。放出の初期48時間ほどで得られた濃度は、同等の賦形剤不含錠剤から得られた濃度よりずっと高い(図14及び15を参照されたい)。この効果は、抗体の放出自体が増大したことによるものであるかも知れず、且つ/又はヒアルロン酸含有錠剤における抗体結合の保持の改善に関連するものであるかも知れない。図17に示した二相性放出プロファイルは、使用された溶解リグのアーチファクトと考えられることに留意されたい。
【0172】
ヒアルロン酸の量を1錠あたり3.5mgに増加させた場合、抗体の放出は劇的に低下する。ここでも溶解器具のアーチファクトがこのデータに反映されている可能性があるが(この製剤の小さな玉がフローセルの側面に付着しているのが観察された)、ヒアルロン酸含有量が高くなる程、抗体のより持続的且つ安定な放出が導かれると考えられる。したがってこの抗体錠剤の溶解プロファイルは、賦形剤の適切な選択によって調整することができる。
【0173】
本明細書に引用した全ての文書は引用により本明細書の一部とする。
【特許請求の範囲】
【請求項1】
固体の埋め込み可能な剤形であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなり、前記の1又は2以上の賦形剤が存在する場合は、インビトロで試験した時に、賦形剤を含有しない同等の剤形と比較して、活性物質放出の著明な遅延又は延長を導かない、剤形。
【請求項2】
疾患の局所的予防又は治療に好適な、請求項1に記載の剤形。
【請求項3】
眼への、眼周囲への、又は眼内への埋め込みに好適な、請求項1又は請求項2に記載の剤形。
【請求項4】
滅菌されている、請求項1〜3の何れかに記載の剤形。
【請求項5】
1又は2以上の賦形剤が、それが存在する場合、インビボ埋め込み後に生分解性及び/又は生体吸収性である、請求項1〜4の何れかに記載の剤形。
【請求項6】
圧縮により製造される、請求項1〜5の何れかに記載の剤形。
【請求項7】
錠剤である、請求項6に記載の剤形。
【請求項8】
0.1mm3〜1.5cm3の体積を持ち、及び/又は5mm以下の最大寸法を有し、及び/又は10mg以下の重量を有する、請求項1〜7の何れかに記載の剤形。
【請求項9】
実質上賦形剤を含まない、請求項1〜8の何れかに記載の剤形。
【請求項10】
活性物質が実質上水不溶性である、請求項1〜9の何れかに記載の剤形。
【請求項11】
活性物質がマトリックスメタロプロテイナーゼインヒビターである、請求項1〜10の何れかに記載の剤形。
【請求項12】
マトリックスメタロプロテイナーゼインヒビターが、マトリックスメタロプロテイナーゼの活性部位において亜鉛と可逆的に結合するヒドロキサム酸誘導体である、請求項11に記載の剤形。
【請求項13】
マトリックスメタロプロテイナーゼインヒビターが右側結合体である、請求項12に記載のマトリックスメタロプロテイナーゼインヒビター。
【請求項14】
活性物質が、イロマスタット、バチマスタット、マリマスタット、プリノマスタット、タノマスタット、トロケード(シペマスタット)、AG3340、CGs227023A、BAY12−9566、及びBMS−275291より成る群、又はそれらの任意の機能的誘導体から選ばれる、請求項11に記載の剤形。
【請求項15】
活性物質が、抗癌剤、ステロイド、抗生物質、抗体分子、抗炎症物質及び抗瘢痕形成物質より成る群から選ばれる、請求項1〜10の何れかに記載の剤形。
【請求項16】
抗癌剤が5−フルオロウラシルであり、ステロイドがトリアムシノロン及びデキサメタゾンから選ばれ、そして、抗炎症物質がナプロキセンである、請求項15に記載の剤形。
【請求項17】
治療に使用するための、請求項1〜16の何れかに記載の剤形。
【請求項18】
組織瘢痕形成を防止又は低減させるための、請求項11〜14の何れかに記載の剤形。
【請求項19】
瘢痕形成が眼、眼周囲又は眼内である、請求項18に記載の剤形。
【請求項20】
該剤形を緑内障濾過手術後に埋め込む、請求項18又は請求項19に記載の剤形。
【請求項21】
該剤形を結膜下腔に埋め込む、請求項19又は請求項20に記載の剤形。
【請求項22】
眼への、眼周囲への、又は眼内への埋め込みによる治療に使用するための埋め込み可能な固体剤形であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、剤形。
【請求項23】
活性物質が実質上水不溶性である、請求項22に記載の剤形。
【請求項24】
活性物質がマトリックスメタロプロテイナーゼインヒビターである、請求項22又は請求項23に記載の剤形。
【請求項25】
疾患の局所的予防又は治療のための埋め込み用薬剤の製造における、請求項1〜10、又は15の何れかに記載の剤形の使用。
【請求項26】
組織瘢痕形成の局所的予防又は治療のための埋め込み用薬剤の製造における、請求項11〜14の何れかに記載の剤形の使用。
【請求項27】
固体形態の治療活性物質を任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形の使用であって、眼への、眼周囲への、又は眼内への埋め込みによる疾患の局所的予防又は治療のための埋め込み用薬剤の製造のための使用。
【請求項28】
患者において疾患を局所的に予防又は治療する方法であって、請求項1〜10、又は15の何れかに記載の固体剤形を、該疾患を予防又は治療するに充分な量で、埋め込みにより患者に投与することを含んでなる方法。
【請求項29】
患者において瘢痕形成を局所的に防止する方法であって、請求項11〜14の何れかに記載の固体剤形を、該瘢痕形成の改善に充分な量で、埋め込みにより患者に投与することを含んでなる方法。
【請求項30】
該剤形を眼への、眼周囲への、又は眼内への埋め込みにより投与する、請求項29に記載の方法。
【請求項31】
該剤形を結膜下腔に埋め込む、請求項30に記載の方法。
【請求項32】
瘢痕形成が緑内障濾過手術後のものである、請求項29〜31の何れかに記載の方法。
【請求項33】
請求項1〜15の何れかに記載の固体剤形の製造におけるマトリックスメタロプロテイナーゼインヒビターの使用。
【請求項34】
患者において疾患を局所的に予防又は治療する方法であって、固体形態の治療活性物質を任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる埋め込み可能な固体剤形を、眼への、眼周囲への、又は眼内への埋め込みにより投与することを含んでなる方法。
【請求項35】
活性物質が実質上水不溶性である、請求項34に記載の方法。
【請求項36】
活性物質がマトリックスメタロプロテイナーゼインヒビターである、請求項34又は請求項35に記載の方法。
【請求項37】
患者において組織瘢痕形成を局所的に予防又は治療する方法であって、マトリックスメタロプロテイナーゼインヒビターを任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる埋め込み可能な固体剤形を、局所埋め込みにより投与することを含んでなる方法。
【請求項38】
組織瘢痕形成の局所的防止又は低減に使用するためのMMPインヒビターであって、MMPインヒビターが、局所埋め込みのための、任意により1又は2以上の医薬的に許容し得る賦形剤を含有していてもよい埋め込み可能な固体薬剤として製剤化される、MMPインヒビター。
【請求項39】
マトリックスメタロプロテイナーゼインヒビターを任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、滅菌されている埋め込み可能な固体剤形。
【請求項40】
請求項39に記載の剤形を製造する方法であって、
i.マトリックスメタロプロテイナーゼインヒビター及び存在する場合には賦形剤を含有する圧縮剤形、例えば錠剤を製造し、そして、
ii.その圧縮剤形をガンマ線で照射することにより滅菌する、
ことを含んでなる方法。
【請求項41】
請求項11〜14の何れか1項に記載の剤形及び緑内障濾過手術の実施に必要な手術用機器を含んでなるキット。
【請求項42】
固体形態の抗体を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、固体単位剤形の医薬組成物。
【請求項43】
抗体がモノクローナル抗体である、請求項42に記載の組成物。
【請求項44】
抗体が、腫瘍性疾患の予防又は治療を適応とする、例えば抗VEGF抗体である、請求項42又は43に記載の組成物。
【請求項45】
滅菌されている、請求項42〜44の何れかに記載の組成物。
【請求項46】
1又は2以上の賦形剤が、それが存在する場合、インビボ埋め込み後に生分解性及び/又は生体吸収性である、請求項42〜45の何れかに記載の組成物。
【請求項47】
実質上賦形剤を含まない、請求項42〜45の何れかに記載の組成物。
【請求項48】
圧縮により製造される、請求項42〜47の何れかに記載の組成物。
【請求項49】
錠剤である、請求項48に記載の組成物。
【請求項50】
各固体単位剤形が、0.1mm3〜1.5cm3の体積を持ち、及び/又は、5mm以下の最大寸法を有し、及び/又は、10mg以下の重量を有する、請求項42〜49の何れかに記載の組成物。
【請求項51】
抗体又は非抗体の、固体形態又は非固体形態の、1又は2以上のさらなる治療活性成分を含有する、請求項42〜50の何れかに記載の組成物。
【請求項52】
治療に使用するための、請求項42〜51の何れかに記載の組成物。
【請求項53】
腫瘍性疾患の予防又は治療に使用するための、請求項44に記載の組成物。
【請求項54】
患者において腫瘍性疾患を予防又は治療する方法であって、請求項44に記載の医薬組成物を該患者に投与することを含んでなる方法。
【請求項55】
固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形であって、前記1又は2以上の賦形剤が存在する場合、その1又は2以上の賦形剤の化学的又は生化学的分解により活性物質の放出が制御されない、剤形。
【請求項56】
固体形態の治療活性物質を任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形であって、圧縮により製造される剤形。
【請求項57】
固体形態の治療用又は診断用蛋白物質、例えば抗体を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、固体単位剤形の医薬組成物であって、該剤形が圧縮により製造される医薬組成物。
【請求項58】
インビボ部位を冒している状態を局所的に予防又は治療するために、治療活性物質を前記インビボ部位にデリバリーする方法であって、固体形態の治療活性物質を任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる固体剤形を該部位に埋め込むことを含んでなる方法。
【請求項1】
固体の埋め込み可能な剤形であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなり、前記の1又は2以上の賦形剤が存在する場合は、インビトロで試験した時に、賦形剤を含有しない同等の剤形と比較して、活性物質放出の著明な遅延又は延長を導かない、剤形。
【請求項2】
疾患の局所的予防又は治療に好適な、請求項1に記載の剤形。
【請求項3】
眼への、眼周囲への、又は眼内への埋め込みに好適な、請求項1又は請求項2に記載の剤形。
【請求項4】
滅菌されている、請求項1〜3の何れかに記載の剤形。
【請求項5】
1又は2以上の賦形剤が、それが存在する場合、インビボ埋め込み後に生分解性及び/又は生体吸収性である、請求項1〜4の何れかに記載の剤形。
【請求項6】
圧縮により製造される、請求項1〜5の何れかに記載の剤形。
【請求項7】
錠剤である、請求項6に記載の剤形。
【請求項8】
0.1mm3〜1.5cm3の体積を持ち、及び/又は5mm以下の最大寸法を有し、及び/又は10mg以下の重量を有する、請求項1〜7の何れかに記載の剤形。
【請求項9】
実質上賦形剤を含まない、請求項1〜8の何れかに記載の剤形。
【請求項10】
活性物質が実質上水不溶性である、請求項1〜9の何れかに記載の剤形。
【請求項11】
活性物質がマトリックスメタロプロテイナーゼインヒビターである、請求項1〜10の何れかに記載の剤形。
【請求項12】
マトリックスメタロプロテイナーゼインヒビターが、マトリックスメタロプロテイナーゼの活性部位において亜鉛と可逆的に結合するヒドロキサム酸誘導体である、請求項11に記載の剤形。
【請求項13】
マトリックスメタロプロテイナーゼインヒビターが右側結合体である、請求項12に記載のマトリックスメタロプロテイナーゼインヒビター。
【請求項14】
活性物質が、イロマスタット、バチマスタット、マリマスタット、プリノマスタット、タノマスタット、トロケード(シペマスタット)、AG3340、CGs227023A、BAY12−9566、及びBMS−275291より成る群、又はそれらの任意の機能的誘導体から選ばれる、請求項11に記載の剤形。
【請求項15】
活性物質が、抗癌剤、ステロイド、抗生物質、抗体分子、抗炎症物質及び抗瘢痕形成物質より成る群から選ばれる、請求項1〜10の何れかに記載の剤形。
【請求項16】
抗癌剤が5−フルオロウラシルであり、ステロイドがトリアムシノロン及びデキサメタゾンから選ばれ、そして、抗炎症物質がナプロキセンである、請求項15に記載の剤形。
【請求項17】
治療に使用するための、請求項1〜16の何れかに記載の剤形。
【請求項18】
組織瘢痕形成を防止又は低減させるための、請求項11〜14の何れかに記載の剤形。
【請求項19】
瘢痕形成が眼、眼周囲又は眼内である、請求項18に記載の剤形。
【請求項20】
該剤形を緑内障濾過手術後に埋め込む、請求項18又は請求項19に記載の剤形。
【請求項21】
該剤形を結膜下腔に埋め込む、請求項19又は請求項20に記載の剤形。
【請求項22】
眼への、眼周囲への、又は眼内への埋め込みによる治療に使用するための埋め込み可能な固体剤形であって、固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、剤形。
【請求項23】
活性物質が実質上水不溶性である、請求項22に記載の剤形。
【請求項24】
活性物質がマトリックスメタロプロテイナーゼインヒビターである、請求項22又は請求項23に記載の剤形。
【請求項25】
疾患の局所的予防又は治療のための埋め込み用薬剤の製造における、請求項1〜10、又は15の何れかに記載の剤形の使用。
【請求項26】
組織瘢痕形成の局所的予防又は治療のための埋め込み用薬剤の製造における、請求項11〜14の何れかに記載の剤形の使用。
【請求項27】
固体形態の治療活性物質を任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形の使用であって、眼への、眼周囲への、又は眼内への埋め込みによる疾患の局所的予防又は治療のための埋め込み用薬剤の製造のための使用。
【請求項28】
患者において疾患を局所的に予防又は治療する方法であって、請求項1〜10、又は15の何れかに記載の固体剤形を、該疾患を予防又は治療するに充分な量で、埋め込みにより患者に投与することを含んでなる方法。
【請求項29】
患者において瘢痕形成を局所的に防止する方法であって、請求項11〜14の何れかに記載の固体剤形を、該瘢痕形成の改善に充分な量で、埋め込みにより患者に投与することを含んでなる方法。
【請求項30】
該剤形を眼への、眼周囲への、又は眼内への埋め込みにより投与する、請求項29に記載の方法。
【請求項31】
該剤形を結膜下腔に埋め込む、請求項30に記載の方法。
【請求項32】
瘢痕形成が緑内障濾過手術後のものである、請求項29〜31の何れかに記載の方法。
【請求項33】
請求項1〜15の何れかに記載の固体剤形の製造におけるマトリックスメタロプロテイナーゼインヒビターの使用。
【請求項34】
患者において疾患を局所的に予防又は治療する方法であって、固体形態の治療活性物質を任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる埋め込み可能な固体剤形を、眼への、眼周囲への、又は眼内への埋め込みにより投与することを含んでなる方法。
【請求項35】
活性物質が実質上水不溶性である、請求項34に記載の方法。
【請求項36】
活性物質がマトリックスメタロプロテイナーゼインヒビターである、請求項34又は請求項35に記載の方法。
【請求項37】
患者において組織瘢痕形成を局所的に予防又は治療する方法であって、マトリックスメタロプロテイナーゼインヒビターを任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる埋め込み可能な固体剤形を、局所埋め込みにより投与することを含んでなる方法。
【請求項38】
組織瘢痕形成の局所的防止又は低減に使用するためのMMPインヒビターであって、MMPインヒビターが、局所埋め込みのための、任意により1又は2以上の医薬的に許容し得る賦形剤を含有していてもよい埋め込み可能な固体薬剤として製剤化される、MMPインヒビター。
【請求項39】
マトリックスメタロプロテイナーゼインヒビターを任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、滅菌されている埋め込み可能な固体剤形。
【請求項40】
請求項39に記載の剤形を製造する方法であって、
i.マトリックスメタロプロテイナーゼインヒビター及び存在する場合には賦形剤を含有する圧縮剤形、例えば錠剤を製造し、そして、
ii.その圧縮剤形をガンマ線で照射することにより滅菌する、
ことを含んでなる方法。
【請求項41】
請求項11〜14の何れか1項に記載の剤形及び緑内障濾過手術の実施に必要な手術用機器を含んでなるキット。
【請求項42】
固体形態の抗体を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、固体単位剤形の医薬組成物。
【請求項43】
抗体がモノクローナル抗体である、請求項42に記載の組成物。
【請求項44】
抗体が、腫瘍性疾患の予防又は治療を適応とする、例えば抗VEGF抗体である、請求項42又は43に記載の組成物。
【請求項45】
滅菌されている、請求項42〜44の何れかに記載の組成物。
【請求項46】
1又は2以上の賦形剤が、それが存在する場合、インビボ埋め込み後に生分解性及び/又は生体吸収性である、請求項42〜45の何れかに記載の組成物。
【請求項47】
実質上賦形剤を含まない、請求項42〜45の何れかに記載の組成物。
【請求項48】
圧縮により製造される、請求項42〜47の何れかに記載の組成物。
【請求項49】
錠剤である、請求項48に記載の組成物。
【請求項50】
各固体単位剤形が、0.1mm3〜1.5cm3の体積を持ち、及び/又は、5mm以下の最大寸法を有し、及び/又は、10mg以下の重量を有する、請求項42〜49の何れかに記載の組成物。
【請求項51】
抗体又は非抗体の、固体形態又は非固体形態の、1又は2以上のさらなる治療活性成分を含有する、請求項42〜50の何れかに記載の組成物。
【請求項52】
治療に使用するための、請求項42〜51の何れかに記載の組成物。
【請求項53】
腫瘍性疾患の予防又は治療に使用するための、請求項44に記載の組成物。
【請求項54】
患者において腫瘍性疾患を予防又は治療する方法であって、請求項44に記載の医薬組成物を該患者に投与することを含んでなる方法。
【請求項55】
固体形態の治療活性物質を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形であって、前記1又は2以上の賦形剤が存在する場合、その1又は2以上の賦形剤の化学的又は生化学的分解により活性物質の放出が制御されない、剤形。
【請求項56】
固体形態の治療活性物質を任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、埋め込み可能な固体剤形であって、圧縮により製造される剤形。
【請求項57】
固体形態の治療用又は診断用蛋白物質、例えば抗体を、任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる、固体単位剤形の医薬組成物であって、該剤形が圧縮により製造される医薬組成物。
【請求項58】
インビボ部位を冒している状態を局所的に予防又は治療するために、治療活性物質を前記インビボ部位にデリバリーする方法であって、固体形態の治療活性物質を任意により1又は2以上の医薬的に許容し得る賦形剤と共に含んでなる固体剤形を該部位に埋め込むことを含んでなる方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公表番号】特表2011−503162(P2011−503162A)
【公表日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2010−533657(P2010−533657)
【出願日】平成20年11月17日(2008.11.17)
【国際出願番号】PCT/GB2008/003851
【国際公開番号】WO2009/063222
【国際公開日】平成21年5月22日(2009.5.22)
【出願人】(510133975)ユーシーエル ビジネス パブリック リミティド カンパニー (1)
【Fターム(参考)】
【公表日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成20年11月17日(2008.11.17)
【国際出願番号】PCT/GB2008/003851
【国際公開番号】WO2009/063222
【国際公開日】平成21年5月22日(2009.5.22)
【出願人】(510133975)ユーシーエル ビジネス パブリック リミティド カンパニー (1)
【Fターム(参考)】
[ Back to top ]

