固形医薬組成物及び医薬製剤
【課題】プロピオン酸又は酢酸系の非ステロイド性抗炎症薬の溶出性が向上すると共に、経時での凝集固化が抑制され、経時でも溶出性が維持されるという、経時安定性に優れたプロピオン酸又は酢酸系の非ステロイド性抗炎症を含有する固形医薬組成物、及びこれを配合してなる医薬製剤を提供する。
【解決手段】(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEと、(C)アセトアミノフェン及び/又はカフェインとを含有する固形医薬組成物。
【解決手段】(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEと、(C)アセトアミノフェン及び/又はカフェインとを含有する固形医薬組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プロピオン酸又は酢酸系の非ステロイド性抗炎症薬を含有する固形医薬組成物、及びこれを配合してなる医薬製剤に関するものである。
【背景技術】
【0002】
プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬には、水への溶出性が低い難溶性薬物が多い。難溶性薬物の溶出性を向上させ溶出速度を高める技術として、難溶性薬物と高分子化合物とを含有する組成物とする技術が知られている(特許文献1:特開平3−83922号公報、特許文献2:特開平8−291063号公報参照)。例えば、特開平8−291063号公報には、カルボキシル基を含有する難溶性薬物と、特定のアミノ基含有高分子化合物と、賦形剤とを含む易吸収性製剤が提案されている。しかしながら、上記易吸収性製剤は、経時で組成物が硬化・凝集固化する結果、初期で溶出性が良くても、経時での溶出性が低くなり、経時安定性に課題があった。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開平3−83922号公報
【特許文献2】特開平8−291063号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は上記事情に鑑みなされたもので、プロピオン酸又は酢酸系の非ステロイド性抗炎症薬の溶出性が向上すると共に、経時での凝集固化が抑制され、経時でも溶出性が維持されるという、経時安定性に優れたプロピオン酸又は酢酸系の非ステロイド性抗炎症を含有する固形医薬組成物、及びこれを配合してなる医薬製剤を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明者らは、上記目的を達成するため鋭意検討した結果、(A)プロピオン酸又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEとを含有する固形医薬組成物とを併用することにより、上記(A)成分の溶出性が向上するが、経時での凝集固化が発生し、経時での溶出性が低くなるという課題を、(C)アセトアミノフェン及び/又はカフェインを配合することにより、解決できることを知見し、本発明をなすに至ったものである。
【0006】
従って、本発明は、下記固形医薬組成物及び医薬製剤を提供する。
[1].(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEと、(C)アセトアミノフェン及び/又はカフェインとを含有する固形医薬組成物。
[2].(A)成分が、イブプロフェンである[1]記載の固形医薬組成物。
[3].(B)/(A)で表される、(A)成分に対する(B)成分の含有質量比が0.3〜3であり、(C)/(A)で表される、(A)成分に対する(C)成分の含有質量比が0.3〜3である[1]又は[2]記載の固形医薬組成物。
[4]さらに、(D)賦形剤を含有する[1]、[2]又は[3]記載の固形医薬組成物。
[5](D)成分が、二酸化珪素、結晶セルロース及び糖アルコールから選ばれる化合物である[4]記載の固形医薬組成物。
[6](D)/[(A)+(B)+(C)]で表される、(A)成分、(B)成分及び(C)成分の合計に対する(D)成分の含有質量比が0.1〜0.6である[4]又は[5]記載の固形医薬組成物。
[7]さらに、(E)水酸化アルミニウム又はメタケイ酸アルミン酸マグネシウムを含有する[1]〜[6]のいずれかに記載の固形医薬組成物。
[8][1]〜[7]のいずれかに記載の固形医薬組成物を配合してなり、錠剤、粒状剤、細粒剤又はカプセル剤である医薬製剤。
【発明の効果】
【0007】
本発明によれば、プロピオン酸又は酢酸系の非ステロイド性抗炎症薬の溶出性が向上すると共に、経時での凝集固化が抑制され、経時でも溶出性が維持された経時安定性に優れる、プロピオン酸又は酢酸系の非ステロイド性抗炎症を含有する固形医薬組成物、及びこれを配合してなる医薬製剤を提供することができる。
【図面の簡単な説明】
【0008】
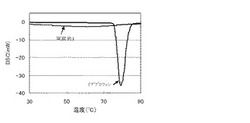
【図1】実施例1の造粒粒子(固形医薬組成物)及びイブプロフェンのDSCチャートである。
【発明を実施するための形態】
【0009】
以下、本発明について詳細に説明する。本発明の固形医薬組成物は、(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEと、(C)アセトアミノフェン及び/又はカフェインとを含有するものである。
【0010】
(I)固形医薬組成物
(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬
プロピオン酸系、酢酸系とは、それぞれプロピオン酸基、酢酸基を有するものをいい、1種単独で又は2種以上を適宜組み合わせて用いることができる。非ステロイド性抗炎症薬としては公知のものが挙げられ、例えば、プロピオン酸系非ステロイド性抗炎症薬としては、イブプロフェン、ケトプロフェン、ナプロキセン、フルルビプロフェン、ロキソプロフェンナトリウム等が挙げられる。酢酸系非ステロイド性抗炎症薬としては、ジクロフェナク、ジクロフェナクナトリウム、インドメタシン、フェルビナク等が挙げられる。
【0011】
(A)成分の含有量は内服薬に許容される範囲内(医薬品承認基準量)であれば、特に限定されない。OTC医薬品とする場合、例えば、イブプロフェン1日量として200〜600mgが好ましく、390〜450mgがより好ましい。また、固形医薬組成物中に1〜50質量%が好ましく、5〜50質量%がより好ましく、10〜50質量%がさらに好ましい。
【0012】
(B)アミノアルキルメタアクリレートコポリマーE
アミノアルキルメタアクリレートコポリマーEは、化学名:メタアクリル酸メチル・メタアクリル酸ブチル・メタアクリル酸ジメチルアミノエチルコポリマーであり、医薬品添加物規格又は日本薬局方外医薬品成分規格に記載された成分である。前記(B)成分としては、市販のものを用いることができ、例えば、エボニック社のオイドラギットE100、オイドラギットEPO(モノマーモル比;メタクリル酸メチル1:メタクリル酸ブチル1:メタクリル酸ジメチルアミノエチル2、いずれも商品名)等が挙げられ、1種単独で又は2種以上を適宜組み合わせて用いることができる。
【0013】
(A)成分は水難溶性の薬物で、溶出性の改善が課題であるが、(A)成分と(B)成分とを混合し複合化することで、(A)成分の溶出性が向上する。そのメカニズムは不明であるが、(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬が有するカルボキシ基と、(B)成分の(メタアクリル酸ジメチルアミノエチル)のアミノ基とで、(A)成分と(B)成分とが複合化するものと予想される。複合化は(A)成分が非晶質化(非結晶化)することにより確認することができる。(A)成分の非晶質化は、例えば、DSCやXRD等での(A)成分のピークにより確認することができる。
【0014】
(B)成分の含有量は内服薬として許容される範囲内(医薬品使用前例量)であれば、特に限定されないが、1日量としては60〜1800mgが好ましく、100〜1200mgがより好ましい。また、(B)/(A)で表される、(A)成分に対する(B)成分の含有質量比が0.3〜3が好ましい。上記比率を0.3以上とすることで、(A)成分の溶出性向上、経時での凝集固化抑制という、本発明の効果がより良好となり、3を超えると、混合機や打錠機等の製造機器への付着が生じ、均一混合、打錠が困難となるといった製造上の課題を生じるおそれがある。さらに、溶出性の点から下限は0.4以上がより好ましく、0.5以上がさらに好ましい。また、製造のしやすさから、上限は2.5以下がより好ましく、2以下がさらに好ましい。なお、本発明の効果は、(B)成分の含有量よりも、(A)成分に対する(B)成分の含有質量比の影響が大きく、(B)成分の含有量は特に限定されないが、固形医薬組成物中に0.1〜50質量%が好ましく、1〜50質量%がより好ましく、1〜30質量%がさらに好ましい。
【0015】
(C)アセトアミノフェン及び/又はカフェイン
アセトアミノフェン、カフェイン(無水カフェイン)は、解熱鎮痛薬又は鎮痛補助薬であるが、驚くべきことに、(A)成分と(B)成分とを含有する組成物に、(C)成分を配合することにより、経時(高温保存時)での凝集固化が抑制され、経時でも溶出性が維持される。
【0016】
(C)成分の含有量は内服薬として許容される範囲内であれば、特に限定されないが、アセトアミノフェンの1日量としては60〜1800mgが好ましく、100〜1200mgがより好ましい。無水カフェインの1日量としては、単独使用の場合は、60〜300mgが好ましく、60〜250mgがより好ましい。また、アセトアミノフェンと併用する場合、10〜250mgが好ましく、30〜240mgがより好ましい。なお、(C)成分は1種単独で又は2種以上を適宜組み合わせて用いることができる。
【0017】
また、(C)/(A)で表される、(A)成分に対する(C)成分の含有質量比が0.3〜3が好ましい。上記比率を0.3以上とすることで、(A)成分の溶出性向上、経時での凝集固化抑制という、本発明の効果がより良好となり、3を超えると、混合機や打錠機等の製造機器への付着が生じ、均一混合、打錠が困難となるといった製造上の課題を生じるおそれがある。さらに、溶出性の点から下限は0.4以上がより好ましく、0.5以上がさらに好ましい。また、製造のしやすさから、上限は2.5以下がより好ましく、2以下がさらに好ましい。なお、本発明の効果は、(A)成分に対する(C)成分の含有質量比の影響が大きく、(C)成分の含有量は特に限定されないが、固形医薬組成物中に1〜70質量%が好ましく、5〜60質量%がより好ましく、5〜50質量%がさらに好ましい。
【0018】
(D)賦形剤
(D)成分としては、二酸化珪素、結晶セルロース、糖アルコール、珪酸カルシウム等の珪酸塩等が挙げられ、1種単独で又は2種以上を適宜組み合わせて用いることができる。これらの化合物を配合することにより、(A)成分の溶出性をより向上させ、組成物の凝集をさらに抑制することができる。中でも、二酸化珪素、結晶セルロース及び糖アルコールから選ばれる化合物が好ましい。二酸化珪素としては、軽質無水珪酸、含水二酸化珪素、シリカ、ホワイトカーボン等の一般名称を有する。また、市販品を用いることもでき、富士シリシア化学社の「サイリシア」、「サイロスフェア」(いずれも商品名)等が挙げられる。糖アルコールとしては、ソルビトール、エリスリトール、キシリトール、マンニトール、マルチトール、ラクチトール、パラチニット等が挙げられる。この中でも、マンニトールが好ましい。
【0019】
(D)成分の含有量は内服薬として許容される範囲内であれば、特に限定されないが、OTC医薬品とする場合、二酸化珪素を1日量として1〜3000mgが好ましい。また、(D)/[(A)+(B)+(C)]で表される、(A)成分、(B)成分及び(C)成分の合計に対する(D)成分の含有質量比が0.1〜0.6が好ましい。この比率を0.1以上とすることで、さらに経時での溶出性向上、経時での凝集固化抑制効果が高くなる。また、0.6以下とすることで、粉っぽさがなく特に良好な服用感が得られる。下限は0.2以上がより好ましく、0.3以上がさらに好ましい。上限は0.5以下が好ましく、0.4以下がより好ましい。(D)成分の含有量は特に限定されないが、固形医薬組成物中50質量%以下にすることで、粉っぽさがなく服用感に優れた固形医薬組成物が得られ、5〜30質量%がより好ましい。
【0020】
本発明の固形医薬組成物中の(A)、(B)、(C)必要に応じて(D)成分の合計含有量は、50〜100質量%とすることが好ましい。本発明の固形医薬組成物には、上記成分以外に本発明の効果を損なわない範囲で、他の成分を適量配合することができる。
他の成分としては、(E)水酸化アルミニウム(乾燥水酸化アルミニウムゲル等)又はメタケイ酸アルミン酸マグネシウムが好ましく、1種単独で又は2種以上を適宜組み合わせて用いることができる。水酸化アルミニウム、メタケイ酸アルミン酸マグネシウムは制酸剤であるが、これらの成分を配合することで、非晶質の(A)成分が、低温保存時において再結晶化することを抑制し、溶出性が低温保存後でも維持される。その結果、低温保存後の溶出性及び経時での凝集固化抑制が向上する。
【0021】
(E)成分の含有量は内服薬として許容される範囲内であれば、特に限定されないが、1日量としては200〜1500mgが好ましく、200〜1300mgがより好ましい。また、(E)/(A)で表される、(A)成分に対する(E)成分の含有質量比が0.3〜5が好ましく、0.3〜4がより好ましく、0.3〜3がさらに好ましい。上記(E)/(A)が、0.3未満だと、再結晶化抑制効果が不十分となるおそれがある。5を超えると、組成配合量が多くなり、服用性が低下したり、経済的でないなどの課題が生じる。なお、本発明の効果は、(A)成分に対する(E)成分の含有質量比の影響が大きく、(E)成分の含有量は特に限定されないが、固形医薬組成物中に1〜50質量%が好ましく、10〜30質量%がより好ましく、15〜20質量%がさらに好ましい。
【0022】
(F)ヒドロキシプロピルセルロース
上記(A)〜(C)成分(必要に応じて(D)及び(E)成分を含む)を湿式造粒する場合、バインダーとしてヒドロキシプロピルセルロースを用いることにより、イブプロフェン造粒物の固化を防止し、高溶出状態に保つことができ、溶出性を向上させることができる。
【0023】
(F)成分の含有量は、内服薬として許容される範囲内であれば特に限定されないが、湿式造粒のバインダーとして使用する場合、被造粒物100質量%に対するヒドロキシプロピルセルロースの量は特に限定されないが、0.1〜20質量%が好ましく、1〜10質量%がより好ましい。ヒドロキシプロピルセルロースとしては、市販のものを用いることができ、例えば、日本曹達社のHPC−SSL、HPC−SL、HPC−L、HPC−M、HPC−H等が好適に使用できる。
【0024】
その他の成分としては、例えば、上記成分以外の医薬品の有効成分や機能性食品の機能成分等の生理活性成分、結合剤、崩壊剤、滑沢剤、香料、矯味剤(甘味料、酸味料等)、界面活性剤等が挙げられる。
【0025】
具体的には、生理活性成分としては、アスピリン、エトドラック、メフェナミック、メクロフェナミック、ピロキシカム、イソプロピルアンチピリン、トラネキサム酸等の(A),(C)以外の抗炎症剤;ニトラゼパム、トリアゾラム、フェノバルビタール、アミバルビタ−ル、アリルイソプロピルアセチル尿素、ブロムワレニル尿素等の催眠・鎮静剤;フェニトイン、メタルビタール、プリミドン、クロナゼパム、カルバマゼピン、バルプロ酸等の抗てんかん剤;塩酸メクリジン、ジメンヒドリナート等の鎮うん剤;イミプラニン、ノキシプチリン、フェネルジン等の抗うつ剤;ハロペリドール、メプロバメート、クロルジアゼポキシド、ジアゼバム、オキサゼバム、スルピリド等の精神神経用剤;パパベリン、アトロピン、エトミドリン等の鎮けい剤;ジゴキシン、ジギトキシン、メチルジゴキシン、ユビデカレノン等の強心剤;ピンドロール、アジマリン、ジソピラミド等の不整脈剤;ヒドロクロロチアジド、スピロノラクトン、トリアムテレン、フロセミド、ブメタニド等の利尿剤;レセルピン、メシル酸ジヒドロエルゴトキシン、塩酸プラゾシン、メトプロロール、プロプラノロール、アテノロール等の抗高血圧剤;ニトログリセリン、硝酸イソソルビド、ジルチアゼム、ニフェジピン、ジピリダモール等の冠血管拡張剤;ノスカピン、サルブタモール、プロカテロール、ツロプテロール、トラニラスト、臭化水素酸デキストロメトルファン、リン酸ジヒドロコデイン等の鎮咳剤;ブロムヘキシン塩酸塩、アンブロキソール塩酸塩、グアイフェネシン等の去痰剤;ニカルジピン、ピンポセチン等の脳循環改善剤;塩酸メチルエフェドリン等の交感神経興奮剤;エリスロマイシン、ジョサマイシン、クロラムフェニコール、テトラサイクリン、リファンピシン、グリセオフルビン等の抗生物質;ジフェンヒドラミン、プロメタジン、メキタジン、クレマスチンフマル酸塩等の抗ヒスタミン剤;トリアムシノロン、デキサメタゾン、ベタメタゾン、プレドニソロン、ダナゾール、メチルテストステロン、酢酸クロルマジノン等のステロイド剤;ビタミンA類、ビタミンB類、ビタミンC類(アスコルビン酸等)、ビタミンD類、ビタミンE類、ビタミンK類、葉酸(ビタミンM類)等のビタミン剤;ジメチコン、ファモチジン、ラニチジン、シメチジン、ニザチジン、メトクロプラミド、ファモチジン、オメプラゾール、スルピリド、トレピブトン、スクラルファート、制酸剤(合成ヒドロタルサイト、酸化マグネシウム等)等の消化器系疾患治療剤;ジクマロール、シンナリジン、クロフィブラート、ゲファルナート、ブロベネシド、メルカプトプリン、メトトレキサート、ウルソデスオキシコール酸、メシル酸ジヒドロエルゴタミン、グルクロノラクトン、γ−アミノ酪酸、コンドロイチン、コンドロイチン硫酸ナトリウム、ラクトフェリン、乳性タンパク、システイン、コラーゲン等が挙げられる。
【0026】
結合剤としては、例えば、澱粉、α化デンプン、ショ糖、ゼラチン、アラビアゴム末、メチルセルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、プルラン、デキストリン等を用いることができる。
【0027】
崩壊剤としては、例えば、カルメロース、カルメロースカルシウム、カルメロースナトリウム、クロスカルメロースナトリウム、カルボキシメチルセルロースカルシウム、低置換度ヒドロキシプロピルセルロース、クロスポビドン等を用いることができる。
【0028】
滑沢剤としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、ポリエチレングリコール、タルク、ステアリン酸、ショ糖脂肪酸エステル等を用いることができる。香料としては、例えば、メントール、リモネン、植物精油(ハッカ油、ミント油、ライチ油、オレンジ油、レモン油等)等が挙げられる。
【0029】
甘味料としては、例えば、サッカリンナトリウム、アスパルテーム、ステビア、グリチルリチン酸二カリウム、アセスルファムカリウム、ソーマチン、スクラロース、果糖等が挙げられる。
酸味料としては、例えば、クエン酸、酒石酸、リンゴ酸、コハク酸、フマル酸、乳酸又はそれらの塩等が挙げられる。
界面活性剤としては、ノニオン界面活性剤、アニオン界面活性剤、カチオン界面活性剤、両性界面活性剤等が挙げられる。
【0030】
本発明の固形医薬組成物は、例えば下記(1)〜(4)の方法で製造することができ、中でも(2)の方法が好適である。
(1).(A)、(B)、(C)及び必要に応じて(D)成分、他の任意成分を、ボーレ型混合機、V型混合機等にて混合し、室温付近で1晩熟成する。
(2).(A)、(B)、(C)及び必要に応じて(D)成分、他の任意成分を、流動層造粒、撹拌造粒、押出造粒等を用いて湿式造粒する。バインダーは、(F)ヒドロキシプロピルセルロース(HPC)、ヒドロキシピロピルメチルセルロース(HPMC)、ポリビニルピロリドン(PVP)、デンプン系等の公知のバインダーを用いることができる。
(3).(A)、(B)、(C)及び必要に応じて(D)成分、他の任意成分を、ローラーコンパクター等にて乾式造粒することもできる。造粒条件によっては室温付近で1晩熟成が必要な場合がある。
(4).(A)、(B)、(C)及び必要に応じて(D)成分、他の任意成分を、ピンミルやボールミル等にて混合粉砕する。この場合は熟成不要である。
また、さらに、振動篩やコーミル、フラッシュミル、パワーミル等にて粉砕・解砕・整粒することができる。
(A)成分と(B)成分との混合は室温(20℃)以上であれば、特に限定されず、(B)成分により(A)成分が非晶質化する。
【0031】
本発明においては、(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEとの加熱混合物を用いることが好ましい。本発明において、加熱混合物とは、(A)成分と(B)成分とを加熱混合し、冷却して固体としたものをいう。なお、加熱混合の温度は40℃以上が好ましく、50℃以上がより好ましく、70℃以上がさらに好ましい。上限は、変色等の安定性の点から100℃以下とすることが好ましい。冷却の温度は35℃以下が好ましく、30℃以下がより好ましく、放冷で常温にしてもよい。本発明は(C)成分を用いるため製法による影響は少ないが、加熱混合物とすることで、(B)成分により非晶質化した(A)成分が、低温保存時に再結晶化することを抑制し、低温保存後の溶出性が維持されやすい。
【0032】
加熱混合物を用いる方法としては、(A)成分と(B)成分とを上記加熱混合温度の範囲で加熱混合する工程を含むものであり、例えば、下記の方法が挙げられる。
(5).(A)、(B)及び(C)成分、必要に応じて任意成分を、上記加熱混合温度の範囲で加熱混合する方法。
(6).(A)及び(B)成分を上記加熱混合温度の範囲で加熱混合し、得られた加熱混合物と、(C)成分と、必要に応じて任意成分を、流動層造粒、撹拌造粒、押出造粒等を用いて湿式造粒する。バインダーは上記と同様の成分の液をバインダー液として添加することが好ましい。
(7).(A)及び(B)成分を上記加熱混合温度の範囲で加熱混合し、得られた加熱混合物と、(C)成分と、必要に応じて任意成分を、ローラーコンパクター等にて乾式造粒することもできる。
(8).(A)及び(B)成分を上記加熱混合温度の範囲で加熱混合し、得られた加熱混合物と、(C)成分と、必要に応じて任意成分を混合する。
また、加熱後は環境温度、例えば、室温(20℃)への冷却工程や、振動篩やコーミル、フラッシュミル、パワーミル等にて粉砕・解砕・整粒する工程を含むこともできる。
なお、(E)成分を配合する場合、加熱混合時に添加してもよく、加熱混合後に添加してもよいが、加熱混合時に添加することが好ましい。
【0033】
上述したように、本発明の固形医薬組成物は、(A)成分が非晶質化したもので、(A)成分と(B)成分とが複合した複合物である。本発明の固形医薬組成物の構造は、例えば、(A)成分が非晶質化したもので、共溶融した(A)成分と(B)成分からなる複合物が、(C)成分(及び(D)成分)の粒子間に保持されている状態と予測される。
【0034】
固形医薬組成物の平均粒径は20〜1000μmが好ましく、50〜850μmがより好ましく、80〜600μmがさらに好ましい。なお、平均粒径はレーザー回折散乱式粒度分布測定器(乾式)によるメジアン径(D50)である。
【0035】
(II)医薬製剤
固形医薬組成物は内服用とすることができ、そのまま(この場合は固形医薬組成物と医薬製剤は同じ組成である)、又は他の任意成分と混合して医薬製剤とすることができる。例えば、粒状剤(顆粒剤、細粒剤、散剤)としたり、さらに必要に応じて打錠して錠剤、カプセル剤等の内服用固形医薬製剤にすることができる。固形医薬組成物の含有量は、医薬製剤中30〜100質量%が好ましく、50〜100質量%がより好ましい。
【0036】
医薬製剤には、固形医薬組成物以外の任意成分を適量配合することができる。任意成分としては、錠剤、粒状剤、カプセル剤に配合される成分を、本発明の効果を損なわない範囲で配合することができる。これらの成分は1種単独で又は2種以上を適宜組み合わせて用いることができ、その適量を配合することができる。任意成分としては、下記のものが挙げられる。なお、医薬製剤には、上記(C),(D)成分を、固形医薬組成物とは別に配合することができる。医薬製剤中の(C)成分の含有量はOTC医薬品として許容される含有量であれば特に限定されないが、通常10〜60質量%が好ましく、例えばアセトアミノフェンは1日量として180〜1000mg、カフェイン及び/又は無水カフェインは1日量として30〜250mgとすることができる。医薬製剤中の(D)成分の配合量はOTC医薬品として許容される配合量であれば特に限定されず、0.5〜50質量%が好ましい。
【0037】
具体的には、生理活性成分としては、アスピリン、エトドラック、メフェナミック、メクロフェナミック、ピロキシカム、イソプロピルアンチピリン、トラネキサム酸等の(A),(C)以外の抗炎症剤;ニトラゼパム、トリアゾラム、フェノバルビタール、アミバルビタ−ル、アリルイソプロピルアセチル尿素、ブロムワレニル尿素等の催眠・鎮静剤;フェニトイン、メタルビタール、プリミドン、クロナゼパム、カルバマゼピン、バルプロ酸等の抗てんかん剤;塩酸メクリジン、ジメンヒドリナート等の鎮うん剤;イミプラニン、ノキシプチリン、フェネルジン等の抗うつ剤;ハロペリドール、メプロバメート、クロルジアゼポキシド、ジアゼバム、オキサゼバム、スルピリド等の精神神経用剤;パパベリン、アトロピン、エトミドリン等の鎮けい剤;ジゴキシン、ジギトキシン、メチルジゴキシン、ユビデカレノン等の強心剤;ピンドロール、アジマリン、ジソピラミド等の不整脈剤;ヒドロクロロチアジド、スピロノラクトン、トリアムテレン、フロセミド、ブメタニド等の利尿剤;レセルピン、メシル酸ジヒドロエルゴトキシン、塩酸プラゾシン、メトプロロール、プロプラノロール、アテノロール等の抗高血圧剤;ニトログリセリン、硝酸イソソルビド、ジルチアゼム、ニフェジピン、ジピリダモール等の冠血管拡張剤;ノスカピン、サルブタモール、プロカテロール、ツロプテロール、トラニラスト、臭化水素酸デキストロメトルファン、リン酸ジヒドロコデイン等の鎮咳剤;ブロムヘキシン塩酸塩、アンブロキソール塩酸塩、グアイフェネシン等の去痰剤;ニカルジピン、ピンポセチン等の脳循環改善剤;塩酸メチルエフェドリン等の交感神経興奮剤;エリスロマイシン、ジョサマイシン、クロラムフェニコール、テトラサイクリン、リファンピシン、グリセオフルビン等の抗生物質;ジフェンヒドラミン、プロメタジン、メキタジン、クレマスチンフマル酸塩等の抗ヒスタミン剤;トリアムシノロン、デキサメタゾン、ベタメタゾン、プレドニソロン、ダナゾール、メチルテストステロン、酢酸クロルマジノン等のステロイド剤;ビタミンA類、ビタミンB類、ビタミンC類(アスコルビン酸等)、ビタミンD類、ビタミンE類、ビタミンK類、葉酸(ビタミンM類)等のビタミン剤;ジメチコン、ファモチジン、ラニチジン、シメチジン、ニザチジン、メトクロプラミド、ファモチジン、オメプラゾール、スルピリド、トレピブトン、スクラルファート、制酸剤(水酸化アルミニウム、合成ヒドロタルサイト、メタケイ酸アルミン酸マグネシウム等)等の消化器系疾患治療剤;カフェイン、ジクマロール、シンナリジン、クロフィブラート、ゲファルナート、ブロベネシド、メルカプトプリン、メトトレキサート、ウルソデスオキシコール酸、メシル酸ジヒドロエルゴタミン、グルクロノラクトン、γ−アミノ酪酸、コンドロイチン、コンドロイチン硫酸ナトリウム、ラクトフェリン、乳性タンパク、システイン、コラーゲン等が挙げられる。
【0038】
結合剤としては、例えば、澱粉、α化デンプン、ショ糖、ゼラチン、アラビアゴム末、メチルセルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、プルラン、デキストリン等を用いることができる。
【0039】
崩壊剤としては、例えば、カルメロース、カルメロースカルシウム、カルメロースナトリウム、クロスカルメロースナトリウム、カルボキシメチルセルロースカルシウム、低置換度ヒドロキシプロピルセルロース、クロスポビドン等を用いることができる。
【0040】
滑沢剤としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、ポリエチレングリコール、タルク、ステアリン酸、ショ糖脂肪酸エステル等を用いることができる。香料としては、例えば、メントール、リモネン、植物精油(ハッカ油、ミント油、ライチ油、オレンジ油、レモン油等)等が挙げられる。
【0041】
甘味料としては、例えば、サッカリンナトリウム、アスパルテーム、ステビア、グリチルリチン酸二カリウム、アセスルファムカリウム、ソーマチン、スクラロース、果糖等が挙げられる。
酸味料としては、例えば、クエン酸、酒石酸、リンゴ酸、コハク酸、フマル酸、乳酸又はそれらの塩等が挙げられる。
界面活性剤としては、ノニオン界面活性剤、アニオン界面活性剤、カチオン界面活性剤、両性界面活性剤等が挙げられる。
【実施例】
【0042】
以下、実施例及び比較例を示し、本発明を具体的に説明するが、本発明は下記の実施例に制限されるものではない。下記の例において特に明記のない場合は、比率は質量比を示す。
【0043】
[実施例1〜24、比較例1〜8]
表1〜4の各成分を、パウレック(株)製MP−01流動層造粒機を用い、常法に従い湿式造粒した。具体的には、バインダー液にはヒドロキシプロピルセルロース(日本曹達(株)HPC−SSL)の8質量%水溶液を用い、この水溶液の固形分が(A)〜(D)の合計量の10質量%となるように噴霧した。得られた造粒粒子(顆粒・固体医薬組成物)をアルミパウチに封入し、50℃・1ヶ月保存した。初期及び50℃・1ヶ月保存後それぞれについて下記評価を行った。結果を表中に示す。なお、実施例の平均粒径(レーザー回折散乱式粒度分布測定器(乾式)によるメジアン径(D50))は、80〜600μmの範囲内であった。
【0044】
[溶出率(%)]
イブプロフェンの溶出試験は日本薬局方に溶出試験で確認した。試験液にはpH4.5の酢酸緩衝液を用い、130mg/900mLの条件で測定した(5分後の溶出性)。
【0045】
[凝集固化抑制]
下記基準に従い目視にて判断した。
〈基準〉
◎:全くない
○:わずかに凝集が認められるが、簡単にほぐせる
×:かなりの凝集が認められ、塊が固化してほぐせない
××:著しく凝集し、全体が固化している
【0046】
【表1】

【0047】
【表2】

【0048】
【表3】

【0049】
【表4】

【0050】
実施例1の造粒粒子(固形医薬組成物)及びイブプロフェンのDSC測定を行った。実施例1の造粒粒子は、DSCによるイブプロフェンのピークが認められず、イブプロフェンが非晶質化(非結晶化)し、複合物であることが確認された。図1に実施例1の造粒粒子(固形医薬組成物)及び原料イブプロフェンのDSCチャートを示す。
【0051】
[実施例25]
下記組成を混合し、タブレッティングテスターにて打錠して直径10mmの錠剤を得た。
組成 g
実施例1の顆粒(固体医薬組成物) 390g
ブロムヘキシン塩酸塩 4g
クレマスチンフマル酸塩 0.45g
無水カフェイン 25g
アスコルビン酸 100g
デキストロメトルファン臭化水素酸塩水和物 16g
dl−メチルエフェドリン塩酸塩 20g
二酸化珪素(サイリシア740) 10g
結晶セルロース(セオラスKG801) 150g
乳糖 150g
低置換度ヒドロキシプロピルセルロース 30g
クロスカルメロースナトリウム 20g
ステアリン酸マグネシウム 3g
【0052】
[実施例26]
下記組成を混合し、細粒剤を得た。
組成 g
実施例3の顆粒(固体医薬組成物) 415g
ブロムヘキシン塩酸塩 4g
クレマスチンフマル酸塩 0.45g
アスコルビン酸 100g
ジヒドロコデインリン酸塩 8g
dl−メチルエフェドリン塩酸塩 20g
二酸化珪素(サイリシア740) 30g
D−マンニトール 150g
香料 0.5g
【0053】
[実施例27]
下記組成を混合し、タブレッティングテスターにて打錠して直径10mmの錠剤を得た。
組成 g
実施例4の顆粒(固体医薬組成物) 460g
無水カフェイン 25g
結晶セルロース(セオラスPH302) 150g
D−マンニトール 150g
低置換度ヒドロキシプロピルセルロース 30g
クロスポビドン(XL−10) 20g
ステアリン酸マグネシウム 3g
スクラロース 1.5g
香料 0.5g
【0054】
[実施例28]
下記組成を混合し、細粒剤を得た。
組成 g
実施例5の顆粒(固体医薬組成物) 520g
無水カフェイン 25g
アリルイソプロピルアセチル尿素 60g
結晶セルロース(セオラスKG801) 150g
乳糖 150g
【0055】
[実施例29]
下記組成を混合し、タブレッティングテスターにて打錠して直径10mmの錠剤を得た。
組成 g
実施例6の顆粒(固体医薬組成物) 575g
アンブロキソール塩酸塩 15g
クレマスチンフマル酸塩 0.45g
アスコルビン酸 100g
デキストロメトルファン臭化水素酸塩水和物 16g
dl−メチルエフェドリン塩酸塩 20g
乾燥水酸化アルミニウムゲル 70g
結晶セルロース(セオラスKG801) 150g
クロスカルメロースナトリウム 20g
ステアリン酸マグネシウム 3g
香料 0.5g
【0056】
[実施例30]
下記組成を混合し、細粒剤を得た。
組成 g
実施例6のイブプロフェンをナプロキセンに変えた以外は同様の方法で得た顆粒(固体医薬組成物) 460g
乾燥水酸化アルミニウムゲル 70g
結晶セルロース(セオラスPH302) 150g
D−マンニトール 150g
ヒドロキシプロピルセルロース 30g
クロスポピドン(コリドンCL) 20g
ステアリン酸マグネシウム 3g
スクラロース 0.5g
香料 0.5g
【0057】
[実施例31]
下記組成を混合し、ゼラチンカプセルに充填してカプセル剤とした。
組成 g
実施例6のイブプロフェンをケトプロフェンに変えた以外は同様の方法で得た顆粒(固体医薬組成物) 460g
アリルイソプロピルアセチル尿素 60g
結晶セルロース(セオラスPH302) 150g
D−マンニトール 150g
ヒドロキシプロピルセルロース 30g
クロスポピドン(コリドンCL) 20g
ステアリン酸マグネシウム 3g
スクラロース 1.5g
香料 0.5g
【0058】
実施例25〜31の(A)成分の溶出性は、50℃・1ヶ月保存後も実施例1〜24と同様に高いものであり、凝集固化もなかった。
【0059】
[実施例32〜43]
表5,6の各成分を、80℃で10分間粉体混合し、その後室温で冷却した。
得られた混合物(固形医薬組成物)について、上記と同様の評価を行った。結果を表中に併記する。
【0060】
【表5】

【0061】
【表6】

【0062】
実施例32〜43の組成物は、初期及び50℃・1ヶ月保存後共に、溶出性、凝集固化抑制が良好で、さらに、5℃・1ヶ月保存後も(A)成分が非晶質を維持していた。
【0063】
上記実施例で使用した原料を下記に示す。なお、表中の量は各成分の量である。
【表7】

【技術分野】
【0001】
本発明は、プロピオン酸又は酢酸系の非ステロイド性抗炎症薬を含有する固形医薬組成物、及びこれを配合してなる医薬製剤に関するものである。
【背景技術】
【0002】
プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬には、水への溶出性が低い難溶性薬物が多い。難溶性薬物の溶出性を向上させ溶出速度を高める技術として、難溶性薬物と高分子化合物とを含有する組成物とする技術が知られている(特許文献1:特開平3−83922号公報、特許文献2:特開平8−291063号公報参照)。例えば、特開平8−291063号公報には、カルボキシル基を含有する難溶性薬物と、特定のアミノ基含有高分子化合物と、賦形剤とを含む易吸収性製剤が提案されている。しかしながら、上記易吸収性製剤は、経時で組成物が硬化・凝集固化する結果、初期で溶出性が良くても、経時での溶出性が低くなり、経時安定性に課題があった。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開平3−83922号公報
【特許文献2】特開平8−291063号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は上記事情に鑑みなされたもので、プロピオン酸又は酢酸系の非ステロイド性抗炎症薬の溶出性が向上すると共に、経時での凝集固化が抑制され、経時でも溶出性が維持されるという、経時安定性に優れたプロピオン酸又は酢酸系の非ステロイド性抗炎症を含有する固形医薬組成物、及びこれを配合してなる医薬製剤を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明者らは、上記目的を達成するため鋭意検討した結果、(A)プロピオン酸又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEとを含有する固形医薬組成物とを併用することにより、上記(A)成分の溶出性が向上するが、経時での凝集固化が発生し、経時での溶出性が低くなるという課題を、(C)アセトアミノフェン及び/又はカフェインを配合することにより、解決できることを知見し、本発明をなすに至ったものである。
【0006】
従って、本発明は、下記固形医薬組成物及び医薬製剤を提供する。
[1].(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEと、(C)アセトアミノフェン及び/又はカフェインとを含有する固形医薬組成物。
[2].(A)成分が、イブプロフェンである[1]記載の固形医薬組成物。
[3].(B)/(A)で表される、(A)成分に対する(B)成分の含有質量比が0.3〜3であり、(C)/(A)で表される、(A)成分に対する(C)成分の含有質量比が0.3〜3である[1]又は[2]記載の固形医薬組成物。
[4]さらに、(D)賦形剤を含有する[1]、[2]又は[3]記載の固形医薬組成物。
[5](D)成分が、二酸化珪素、結晶セルロース及び糖アルコールから選ばれる化合物である[4]記載の固形医薬組成物。
[6](D)/[(A)+(B)+(C)]で表される、(A)成分、(B)成分及び(C)成分の合計に対する(D)成分の含有質量比が0.1〜0.6である[4]又は[5]記載の固形医薬組成物。
[7]さらに、(E)水酸化アルミニウム又はメタケイ酸アルミン酸マグネシウムを含有する[1]〜[6]のいずれかに記載の固形医薬組成物。
[8][1]〜[7]のいずれかに記載の固形医薬組成物を配合してなり、錠剤、粒状剤、細粒剤又はカプセル剤である医薬製剤。
【発明の効果】
【0007】
本発明によれば、プロピオン酸又は酢酸系の非ステロイド性抗炎症薬の溶出性が向上すると共に、経時での凝集固化が抑制され、経時でも溶出性が維持された経時安定性に優れる、プロピオン酸又は酢酸系の非ステロイド性抗炎症を含有する固形医薬組成物、及びこれを配合してなる医薬製剤を提供することができる。
【図面の簡単な説明】
【0008】
【図1】実施例1の造粒粒子(固形医薬組成物)及びイブプロフェンのDSCチャートである。
【発明を実施するための形態】
【0009】
以下、本発明について詳細に説明する。本発明の固形医薬組成物は、(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEと、(C)アセトアミノフェン及び/又はカフェインとを含有するものである。
【0010】
(I)固形医薬組成物
(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬
プロピオン酸系、酢酸系とは、それぞれプロピオン酸基、酢酸基を有するものをいい、1種単独で又は2種以上を適宜組み合わせて用いることができる。非ステロイド性抗炎症薬としては公知のものが挙げられ、例えば、プロピオン酸系非ステロイド性抗炎症薬としては、イブプロフェン、ケトプロフェン、ナプロキセン、フルルビプロフェン、ロキソプロフェンナトリウム等が挙げられる。酢酸系非ステロイド性抗炎症薬としては、ジクロフェナク、ジクロフェナクナトリウム、インドメタシン、フェルビナク等が挙げられる。
【0011】
(A)成分の含有量は内服薬に許容される範囲内(医薬品承認基準量)であれば、特に限定されない。OTC医薬品とする場合、例えば、イブプロフェン1日量として200〜600mgが好ましく、390〜450mgがより好ましい。また、固形医薬組成物中に1〜50質量%が好ましく、5〜50質量%がより好ましく、10〜50質量%がさらに好ましい。
【0012】
(B)アミノアルキルメタアクリレートコポリマーE
アミノアルキルメタアクリレートコポリマーEは、化学名:メタアクリル酸メチル・メタアクリル酸ブチル・メタアクリル酸ジメチルアミノエチルコポリマーであり、医薬品添加物規格又は日本薬局方外医薬品成分規格に記載された成分である。前記(B)成分としては、市販のものを用いることができ、例えば、エボニック社のオイドラギットE100、オイドラギットEPO(モノマーモル比;メタクリル酸メチル1:メタクリル酸ブチル1:メタクリル酸ジメチルアミノエチル2、いずれも商品名)等が挙げられ、1種単独で又は2種以上を適宜組み合わせて用いることができる。
【0013】
(A)成分は水難溶性の薬物で、溶出性の改善が課題であるが、(A)成分と(B)成分とを混合し複合化することで、(A)成分の溶出性が向上する。そのメカニズムは不明であるが、(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬が有するカルボキシ基と、(B)成分の(メタアクリル酸ジメチルアミノエチル)のアミノ基とで、(A)成分と(B)成分とが複合化するものと予想される。複合化は(A)成分が非晶質化(非結晶化)することにより確認することができる。(A)成分の非晶質化は、例えば、DSCやXRD等での(A)成分のピークにより確認することができる。
【0014】
(B)成分の含有量は内服薬として許容される範囲内(医薬品使用前例量)であれば、特に限定されないが、1日量としては60〜1800mgが好ましく、100〜1200mgがより好ましい。また、(B)/(A)で表される、(A)成分に対する(B)成分の含有質量比が0.3〜3が好ましい。上記比率を0.3以上とすることで、(A)成分の溶出性向上、経時での凝集固化抑制という、本発明の効果がより良好となり、3を超えると、混合機や打錠機等の製造機器への付着が生じ、均一混合、打錠が困難となるといった製造上の課題を生じるおそれがある。さらに、溶出性の点から下限は0.4以上がより好ましく、0.5以上がさらに好ましい。また、製造のしやすさから、上限は2.5以下がより好ましく、2以下がさらに好ましい。なお、本発明の効果は、(B)成分の含有量よりも、(A)成分に対する(B)成分の含有質量比の影響が大きく、(B)成分の含有量は特に限定されないが、固形医薬組成物中に0.1〜50質量%が好ましく、1〜50質量%がより好ましく、1〜30質量%がさらに好ましい。
【0015】
(C)アセトアミノフェン及び/又はカフェイン
アセトアミノフェン、カフェイン(無水カフェイン)は、解熱鎮痛薬又は鎮痛補助薬であるが、驚くべきことに、(A)成分と(B)成分とを含有する組成物に、(C)成分を配合することにより、経時(高温保存時)での凝集固化が抑制され、経時でも溶出性が維持される。
【0016】
(C)成分の含有量は内服薬として許容される範囲内であれば、特に限定されないが、アセトアミノフェンの1日量としては60〜1800mgが好ましく、100〜1200mgがより好ましい。無水カフェインの1日量としては、単独使用の場合は、60〜300mgが好ましく、60〜250mgがより好ましい。また、アセトアミノフェンと併用する場合、10〜250mgが好ましく、30〜240mgがより好ましい。なお、(C)成分は1種単独で又は2種以上を適宜組み合わせて用いることができる。
【0017】
また、(C)/(A)で表される、(A)成分に対する(C)成分の含有質量比が0.3〜3が好ましい。上記比率を0.3以上とすることで、(A)成分の溶出性向上、経時での凝集固化抑制という、本発明の効果がより良好となり、3を超えると、混合機や打錠機等の製造機器への付着が生じ、均一混合、打錠が困難となるといった製造上の課題を生じるおそれがある。さらに、溶出性の点から下限は0.4以上がより好ましく、0.5以上がさらに好ましい。また、製造のしやすさから、上限は2.5以下がより好ましく、2以下がさらに好ましい。なお、本発明の効果は、(A)成分に対する(C)成分の含有質量比の影響が大きく、(C)成分の含有量は特に限定されないが、固形医薬組成物中に1〜70質量%が好ましく、5〜60質量%がより好ましく、5〜50質量%がさらに好ましい。
【0018】
(D)賦形剤
(D)成分としては、二酸化珪素、結晶セルロース、糖アルコール、珪酸カルシウム等の珪酸塩等が挙げられ、1種単独で又は2種以上を適宜組み合わせて用いることができる。これらの化合物を配合することにより、(A)成分の溶出性をより向上させ、組成物の凝集をさらに抑制することができる。中でも、二酸化珪素、結晶セルロース及び糖アルコールから選ばれる化合物が好ましい。二酸化珪素としては、軽質無水珪酸、含水二酸化珪素、シリカ、ホワイトカーボン等の一般名称を有する。また、市販品を用いることもでき、富士シリシア化学社の「サイリシア」、「サイロスフェア」(いずれも商品名)等が挙げられる。糖アルコールとしては、ソルビトール、エリスリトール、キシリトール、マンニトール、マルチトール、ラクチトール、パラチニット等が挙げられる。この中でも、マンニトールが好ましい。
【0019】
(D)成分の含有量は内服薬として許容される範囲内であれば、特に限定されないが、OTC医薬品とする場合、二酸化珪素を1日量として1〜3000mgが好ましい。また、(D)/[(A)+(B)+(C)]で表される、(A)成分、(B)成分及び(C)成分の合計に対する(D)成分の含有質量比が0.1〜0.6が好ましい。この比率を0.1以上とすることで、さらに経時での溶出性向上、経時での凝集固化抑制効果が高くなる。また、0.6以下とすることで、粉っぽさがなく特に良好な服用感が得られる。下限は0.2以上がより好ましく、0.3以上がさらに好ましい。上限は0.5以下が好ましく、0.4以下がより好ましい。(D)成分の含有量は特に限定されないが、固形医薬組成物中50質量%以下にすることで、粉っぽさがなく服用感に優れた固形医薬組成物が得られ、5〜30質量%がより好ましい。
【0020】
本発明の固形医薬組成物中の(A)、(B)、(C)必要に応じて(D)成分の合計含有量は、50〜100質量%とすることが好ましい。本発明の固形医薬組成物には、上記成分以外に本発明の効果を損なわない範囲で、他の成分を適量配合することができる。
他の成分としては、(E)水酸化アルミニウム(乾燥水酸化アルミニウムゲル等)又はメタケイ酸アルミン酸マグネシウムが好ましく、1種単独で又は2種以上を適宜組み合わせて用いることができる。水酸化アルミニウム、メタケイ酸アルミン酸マグネシウムは制酸剤であるが、これらの成分を配合することで、非晶質の(A)成分が、低温保存時において再結晶化することを抑制し、溶出性が低温保存後でも維持される。その結果、低温保存後の溶出性及び経時での凝集固化抑制が向上する。
【0021】
(E)成分の含有量は内服薬として許容される範囲内であれば、特に限定されないが、1日量としては200〜1500mgが好ましく、200〜1300mgがより好ましい。また、(E)/(A)で表される、(A)成分に対する(E)成分の含有質量比が0.3〜5が好ましく、0.3〜4がより好ましく、0.3〜3がさらに好ましい。上記(E)/(A)が、0.3未満だと、再結晶化抑制効果が不十分となるおそれがある。5を超えると、組成配合量が多くなり、服用性が低下したり、経済的でないなどの課題が生じる。なお、本発明の効果は、(A)成分に対する(E)成分の含有質量比の影響が大きく、(E)成分の含有量は特に限定されないが、固形医薬組成物中に1〜50質量%が好ましく、10〜30質量%がより好ましく、15〜20質量%がさらに好ましい。
【0022】
(F)ヒドロキシプロピルセルロース
上記(A)〜(C)成分(必要に応じて(D)及び(E)成分を含む)を湿式造粒する場合、バインダーとしてヒドロキシプロピルセルロースを用いることにより、イブプロフェン造粒物の固化を防止し、高溶出状態に保つことができ、溶出性を向上させることができる。
【0023】
(F)成分の含有量は、内服薬として許容される範囲内であれば特に限定されないが、湿式造粒のバインダーとして使用する場合、被造粒物100質量%に対するヒドロキシプロピルセルロースの量は特に限定されないが、0.1〜20質量%が好ましく、1〜10質量%がより好ましい。ヒドロキシプロピルセルロースとしては、市販のものを用いることができ、例えば、日本曹達社のHPC−SSL、HPC−SL、HPC−L、HPC−M、HPC−H等が好適に使用できる。
【0024】
その他の成分としては、例えば、上記成分以外の医薬品の有効成分や機能性食品の機能成分等の生理活性成分、結合剤、崩壊剤、滑沢剤、香料、矯味剤(甘味料、酸味料等)、界面活性剤等が挙げられる。
【0025】
具体的には、生理活性成分としては、アスピリン、エトドラック、メフェナミック、メクロフェナミック、ピロキシカム、イソプロピルアンチピリン、トラネキサム酸等の(A),(C)以外の抗炎症剤;ニトラゼパム、トリアゾラム、フェノバルビタール、アミバルビタ−ル、アリルイソプロピルアセチル尿素、ブロムワレニル尿素等の催眠・鎮静剤;フェニトイン、メタルビタール、プリミドン、クロナゼパム、カルバマゼピン、バルプロ酸等の抗てんかん剤;塩酸メクリジン、ジメンヒドリナート等の鎮うん剤;イミプラニン、ノキシプチリン、フェネルジン等の抗うつ剤;ハロペリドール、メプロバメート、クロルジアゼポキシド、ジアゼバム、オキサゼバム、スルピリド等の精神神経用剤;パパベリン、アトロピン、エトミドリン等の鎮けい剤;ジゴキシン、ジギトキシン、メチルジゴキシン、ユビデカレノン等の強心剤;ピンドロール、アジマリン、ジソピラミド等の不整脈剤;ヒドロクロロチアジド、スピロノラクトン、トリアムテレン、フロセミド、ブメタニド等の利尿剤;レセルピン、メシル酸ジヒドロエルゴトキシン、塩酸プラゾシン、メトプロロール、プロプラノロール、アテノロール等の抗高血圧剤;ニトログリセリン、硝酸イソソルビド、ジルチアゼム、ニフェジピン、ジピリダモール等の冠血管拡張剤;ノスカピン、サルブタモール、プロカテロール、ツロプテロール、トラニラスト、臭化水素酸デキストロメトルファン、リン酸ジヒドロコデイン等の鎮咳剤;ブロムヘキシン塩酸塩、アンブロキソール塩酸塩、グアイフェネシン等の去痰剤;ニカルジピン、ピンポセチン等の脳循環改善剤;塩酸メチルエフェドリン等の交感神経興奮剤;エリスロマイシン、ジョサマイシン、クロラムフェニコール、テトラサイクリン、リファンピシン、グリセオフルビン等の抗生物質;ジフェンヒドラミン、プロメタジン、メキタジン、クレマスチンフマル酸塩等の抗ヒスタミン剤;トリアムシノロン、デキサメタゾン、ベタメタゾン、プレドニソロン、ダナゾール、メチルテストステロン、酢酸クロルマジノン等のステロイド剤;ビタミンA類、ビタミンB類、ビタミンC類(アスコルビン酸等)、ビタミンD類、ビタミンE類、ビタミンK類、葉酸(ビタミンM類)等のビタミン剤;ジメチコン、ファモチジン、ラニチジン、シメチジン、ニザチジン、メトクロプラミド、ファモチジン、オメプラゾール、スルピリド、トレピブトン、スクラルファート、制酸剤(合成ヒドロタルサイト、酸化マグネシウム等)等の消化器系疾患治療剤;ジクマロール、シンナリジン、クロフィブラート、ゲファルナート、ブロベネシド、メルカプトプリン、メトトレキサート、ウルソデスオキシコール酸、メシル酸ジヒドロエルゴタミン、グルクロノラクトン、γ−アミノ酪酸、コンドロイチン、コンドロイチン硫酸ナトリウム、ラクトフェリン、乳性タンパク、システイン、コラーゲン等が挙げられる。
【0026】
結合剤としては、例えば、澱粉、α化デンプン、ショ糖、ゼラチン、アラビアゴム末、メチルセルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、プルラン、デキストリン等を用いることができる。
【0027】
崩壊剤としては、例えば、カルメロース、カルメロースカルシウム、カルメロースナトリウム、クロスカルメロースナトリウム、カルボキシメチルセルロースカルシウム、低置換度ヒドロキシプロピルセルロース、クロスポビドン等を用いることができる。
【0028】
滑沢剤としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、ポリエチレングリコール、タルク、ステアリン酸、ショ糖脂肪酸エステル等を用いることができる。香料としては、例えば、メントール、リモネン、植物精油(ハッカ油、ミント油、ライチ油、オレンジ油、レモン油等)等が挙げられる。
【0029】
甘味料としては、例えば、サッカリンナトリウム、アスパルテーム、ステビア、グリチルリチン酸二カリウム、アセスルファムカリウム、ソーマチン、スクラロース、果糖等が挙げられる。
酸味料としては、例えば、クエン酸、酒石酸、リンゴ酸、コハク酸、フマル酸、乳酸又はそれらの塩等が挙げられる。
界面活性剤としては、ノニオン界面活性剤、アニオン界面活性剤、カチオン界面活性剤、両性界面活性剤等が挙げられる。
【0030】
本発明の固形医薬組成物は、例えば下記(1)〜(4)の方法で製造することができ、中でも(2)の方法が好適である。
(1).(A)、(B)、(C)及び必要に応じて(D)成分、他の任意成分を、ボーレ型混合機、V型混合機等にて混合し、室温付近で1晩熟成する。
(2).(A)、(B)、(C)及び必要に応じて(D)成分、他の任意成分を、流動層造粒、撹拌造粒、押出造粒等を用いて湿式造粒する。バインダーは、(F)ヒドロキシプロピルセルロース(HPC)、ヒドロキシピロピルメチルセルロース(HPMC)、ポリビニルピロリドン(PVP)、デンプン系等の公知のバインダーを用いることができる。
(3).(A)、(B)、(C)及び必要に応じて(D)成分、他の任意成分を、ローラーコンパクター等にて乾式造粒することもできる。造粒条件によっては室温付近で1晩熟成が必要な場合がある。
(4).(A)、(B)、(C)及び必要に応じて(D)成分、他の任意成分を、ピンミルやボールミル等にて混合粉砕する。この場合は熟成不要である。
また、さらに、振動篩やコーミル、フラッシュミル、パワーミル等にて粉砕・解砕・整粒することができる。
(A)成分と(B)成分との混合は室温(20℃)以上であれば、特に限定されず、(B)成分により(A)成分が非晶質化する。
【0031】
本発明においては、(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEとの加熱混合物を用いることが好ましい。本発明において、加熱混合物とは、(A)成分と(B)成分とを加熱混合し、冷却して固体としたものをいう。なお、加熱混合の温度は40℃以上が好ましく、50℃以上がより好ましく、70℃以上がさらに好ましい。上限は、変色等の安定性の点から100℃以下とすることが好ましい。冷却の温度は35℃以下が好ましく、30℃以下がより好ましく、放冷で常温にしてもよい。本発明は(C)成分を用いるため製法による影響は少ないが、加熱混合物とすることで、(B)成分により非晶質化した(A)成分が、低温保存時に再結晶化することを抑制し、低温保存後の溶出性が維持されやすい。
【0032】
加熱混合物を用いる方法としては、(A)成分と(B)成分とを上記加熱混合温度の範囲で加熱混合する工程を含むものであり、例えば、下記の方法が挙げられる。
(5).(A)、(B)及び(C)成分、必要に応じて任意成分を、上記加熱混合温度の範囲で加熱混合する方法。
(6).(A)及び(B)成分を上記加熱混合温度の範囲で加熱混合し、得られた加熱混合物と、(C)成分と、必要に応じて任意成分を、流動層造粒、撹拌造粒、押出造粒等を用いて湿式造粒する。バインダーは上記と同様の成分の液をバインダー液として添加することが好ましい。
(7).(A)及び(B)成分を上記加熱混合温度の範囲で加熱混合し、得られた加熱混合物と、(C)成分と、必要に応じて任意成分を、ローラーコンパクター等にて乾式造粒することもできる。
(8).(A)及び(B)成分を上記加熱混合温度の範囲で加熱混合し、得られた加熱混合物と、(C)成分と、必要に応じて任意成分を混合する。
また、加熱後は環境温度、例えば、室温(20℃)への冷却工程や、振動篩やコーミル、フラッシュミル、パワーミル等にて粉砕・解砕・整粒する工程を含むこともできる。
なお、(E)成分を配合する場合、加熱混合時に添加してもよく、加熱混合後に添加してもよいが、加熱混合時に添加することが好ましい。
【0033】
上述したように、本発明の固形医薬組成物は、(A)成分が非晶質化したもので、(A)成分と(B)成分とが複合した複合物である。本発明の固形医薬組成物の構造は、例えば、(A)成分が非晶質化したもので、共溶融した(A)成分と(B)成分からなる複合物が、(C)成分(及び(D)成分)の粒子間に保持されている状態と予測される。
【0034】
固形医薬組成物の平均粒径は20〜1000μmが好ましく、50〜850μmがより好ましく、80〜600μmがさらに好ましい。なお、平均粒径はレーザー回折散乱式粒度分布測定器(乾式)によるメジアン径(D50)である。
【0035】
(II)医薬製剤
固形医薬組成物は内服用とすることができ、そのまま(この場合は固形医薬組成物と医薬製剤は同じ組成である)、又は他の任意成分と混合して医薬製剤とすることができる。例えば、粒状剤(顆粒剤、細粒剤、散剤)としたり、さらに必要に応じて打錠して錠剤、カプセル剤等の内服用固形医薬製剤にすることができる。固形医薬組成物の含有量は、医薬製剤中30〜100質量%が好ましく、50〜100質量%がより好ましい。
【0036】
医薬製剤には、固形医薬組成物以外の任意成分を適量配合することができる。任意成分としては、錠剤、粒状剤、カプセル剤に配合される成分を、本発明の効果を損なわない範囲で配合することができる。これらの成分は1種単独で又は2種以上を適宜組み合わせて用いることができ、その適量を配合することができる。任意成分としては、下記のものが挙げられる。なお、医薬製剤には、上記(C),(D)成分を、固形医薬組成物とは別に配合することができる。医薬製剤中の(C)成分の含有量はOTC医薬品として許容される含有量であれば特に限定されないが、通常10〜60質量%が好ましく、例えばアセトアミノフェンは1日量として180〜1000mg、カフェイン及び/又は無水カフェインは1日量として30〜250mgとすることができる。医薬製剤中の(D)成分の配合量はOTC医薬品として許容される配合量であれば特に限定されず、0.5〜50質量%が好ましい。
【0037】
具体的には、生理活性成分としては、アスピリン、エトドラック、メフェナミック、メクロフェナミック、ピロキシカム、イソプロピルアンチピリン、トラネキサム酸等の(A),(C)以外の抗炎症剤;ニトラゼパム、トリアゾラム、フェノバルビタール、アミバルビタ−ル、アリルイソプロピルアセチル尿素、ブロムワレニル尿素等の催眠・鎮静剤;フェニトイン、メタルビタール、プリミドン、クロナゼパム、カルバマゼピン、バルプロ酸等の抗てんかん剤;塩酸メクリジン、ジメンヒドリナート等の鎮うん剤;イミプラニン、ノキシプチリン、フェネルジン等の抗うつ剤;ハロペリドール、メプロバメート、クロルジアゼポキシド、ジアゼバム、オキサゼバム、スルピリド等の精神神経用剤;パパベリン、アトロピン、エトミドリン等の鎮けい剤;ジゴキシン、ジギトキシン、メチルジゴキシン、ユビデカレノン等の強心剤;ピンドロール、アジマリン、ジソピラミド等の不整脈剤;ヒドロクロロチアジド、スピロノラクトン、トリアムテレン、フロセミド、ブメタニド等の利尿剤;レセルピン、メシル酸ジヒドロエルゴトキシン、塩酸プラゾシン、メトプロロール、プロプラノロール、アテノロール等の抗高血圧剤;ニトログリセリン、硝酸イソソルビド、ジルチアゼム、ニフェジピン、ジピリダモール等の冠血管拡張剤;ノスカピン、サルブタモール、プロカテロール、ツロプテロール、トラニラスト、臭化水素酸デキストロメトルファン、リン酸ジヒドロコデイン等の鎮咳剤;ブロムヘキシン塩酸塩、アンブロキソール塩酸塩、グアイフェネシン等の去痰剤;ニカルジピン、ピンポセチン等の脳循環改善剤;塩酸メチルエフェドリン等の交感神経興奮剤;エリスロマイシン、ジョサマイシン、クロラムフェニコール、テトラサイクリン、リファンピシン、グリセオフルビン等の抗生物質;ジフェンヒドラミン、プロメタジン、メキタジン、クレマスチンフマル酸塩等の抗ヒスタミン剤;トリアムシノロン、デキサメタゾン、ベタメタゾン、プレドニソロン、ダナゾール、メチルテストステロン、酢酸クロルマジノン等のステロイド剤;ビタミンA類、ビタミンB類、ビタミンC類(アスコルビン酸等)、ビタミンD類、ビタミンE類、ビタミンK類、葉酸(ビタミンM類)等のビタミン剤;ジメチコン、ファモチジン、ラニチジン、シメチジン、ニザチジン、メトクロプラミド、ファモチジン、オメプラゾール、スルピリド、トレピブトン、スクラルファート、制酸剤(水酸化アルミニウム、合成ヒドロタルサイト、メタケイ酸アルミン酸マグネシウム等)等の消化器系疾患治療剤;カフェイン、ジクマロール、シンナリジン、クロフィブラート、ゲファルナート、ブロベネシド、メルカプトプリン、メトトレキサート、ウルソデスオキシコール酸、メシル酸ジヒドロエルゴタミン、グルクロノラクトン、γ−アミノ酪酸、コンドロイチン、コンドロイチン硫酸ナトリウム、ラクトフェリン、乳性タンパク、システイン、コラーゲン等が挙げられる。
【0038】
結合剤としては、例えば、澱粉、α化デンプン、ショ糖、ゼラチン、アラビアゴム末、メチルセルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、プルラン、デキストリン等を用いることができる。
【0039】
崩壊剤としては、例えば、カルメロース、カルメロースカルシウム、カルメロースナトリウム、クロスカルメロースナトリウム、カルボキシメチルセルロースカルシウム、低置換度ヒドロキシプロピルセルロース、クロスポビドン等を用いることができる。
【0040】
滑沢剤としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、ポリエチレングリコール、タルク、ステアリン酸、ショ糖脂肪酸エステル等を用いることができる。香料としては、例えば、メントール、リモネン、植物精油(ハッカ油、ミント油、ライチ油、オレンジ油、レモン油等)等が挙げられる。
【0041】
甘味料としては、例えば、サッカリンナトリウム、アスパルテーム、ステビア、グリチルリチン酸二カリウム、アセスルファムカリウム、ソーマチン、スクラロース、果糖等が挙げられる。
酸味料としては、例えば、クエン酸、酒石酸、リンゴ酸、コハク酸、フマル酸、乳酸又はそれらの塩等が挙げられる。
界面活性剤としては、ノニオン界面活性剤、アニオン界面活性剤、カチオン界面活性剤、両性界面活性剤等が挙げられる。
【実施例】
【0042】
以下、実施例及び比較例を示し、本発明を具体的に説明するが、本発明は下記の実施例に制限されるものではない。下記の例において特に明記のない場合は、比率は質量比を示す。
【0043】
[実施例1〜24、比較例1〜8]
表1〜4の各成分を、パウレック(株)製MP−01流動層造粒機を用い、常法に従い湿式造粒した。具体的には、バインダー液にはヒドロキシプロピルセルロース(日本曹達(株)HPC−SSL)の8質量%水溶液を用い、この水溶液の固形分が(A)〜(D)の合計量の10質量%となるように噴霧した。得られた造粒粒子(顆粒・固体医薬組成物)をアルミパウチに封入し、50℃・1ヶ月保存した。初期及び50℃・1ヶ月保存後それぞれについて下記評価を行った。結果を表中に示す。なお、実施例の平均粒径(レーザー回折散乱式粒度分布測定器(乾式)によるメジアン径(D50))は、80〜600μmの範囲内であった。
【0044】
[溶出率(%)]
イブプロフェンの溶出試験は日本薬局方に溶出試験で確認した。試験液にはpH4.5の酢酸緩衝液を用い、130mg/900mLの条件で測定した(5分後の溶出性)。
【0045】
[凝集固化抑制]
下記基準に従い目視にて判断した。
〈基準〉
◎:全くない
○:わずかに凝集が認められるが、簡単にほぐせる
×:かなりの凝集が認められ、塊が固化してほぐせない
××:著しく凝集し、全体が固化している
【0046】
【表1】

【0047】
【表2】

【0048】
【表3】

【0049】
【表4】

【0050】
実施例1の造粒粒子(固形医薬組成物)及びイブプロフェンのDSC測定を行った。実施例1の造粒粒子は、DSCによるイブプロフェンのピークが認められず、イブプロフェンが非晶質化(非結晶化)し、複合物であることが確認された。図1に実施例1の造粒粒子(固形医薬組成物)及び原料イブプロフェンのDSCチャートを示す。
【0051】
[実施例25]
下記組成を混合し、タブレッティングテスターにて打錠して直径10mmの錠剤を得た。
組成 g
実施例1の顆粒(固体医薬組成物) 390g
ブロムヘキシン塩酸塩 4g
クレマスチンフマル酸塩 0.45g
無水カフェイン 25g
アスコルビン酸 100g
デキストロメトルファン臭化水素酸塩水和物 16g
dl−メチルエフェドリン塩酸塩 20g
二酸化珪素(サイリシア740) 10g
結晶セルロース(セオラスKG801) 150g
乳糖 150g
低置換度ヒドロキシプロピルセルロース 30g
クロスカルメロースナトリウム 20g
ステアリン酸マグネシウム 3g
【0052】
[実施例26]
下記組成を混合し、細粒剤を得た。
組成 g
実施例3の顆粒(固体医薬組成物) 415g
ブロムヘキシン塩酸塩 4g
クレマスチンフマル酸塩 0.45g
アスコルビン酸 100g
ジヒドロコデインリン酸塩 8g
dl−メチルエフェドリン塩酸塩 20g
二酸化珪素(サイリシア740) 30g
D−マンニトール 150g
香料 0.5g
【0053】
[実施例27]
下記組成を混合し、タブレッティングテスターにて打錠して直径10mmの錠剤を得た。
組成 g
実施例4の顆粒(固体医薬組成物) 460g
無水カフェイン 25g
結晶セルロース(セオラスPH302) 150g
D−マンニトール 150g
低置換度ヒドロキシプロピルセルロース 30g
クロスポビドン(XL−10) 20g
ステアリン酸マグネシウム 3g
スクラロース 1.5g
香料 0.5g
【0054】
[実施例28]
下記組成を混合し、細粒剤を得た。
組成 g
実施例5の顆粒(固体医薬組成物) 520g
無水カフェイン 25g
アリルイソプロピルアセチル尿素 60g
結晶セルロース(セオラスKG801) 150g
乳糖 150g
【0055】
[実施例29]
下記組成を混合し、タブレッティングテスターにて打錠して直径10mmの錠剤を得た。
組成 g
実施例6の顆粒(固体医薬組成物) 575g
アンブロキソール塩酸塩 15g
クレマスチンフマル酸塩 0.45g
アスコルビン酸 100g
デキストロメトルファン臭化水素酸塩水和物 16g
dl−メチルエフェドリン塩酸塩 20g
乾燥水酸化アルミニウムゲル 70g
結晶セルロース(セオラスKG801) 150g
クロスカルメロースナトリウム 20g
ステアリン酸マグネシウム 3g
香料 0.5g
【0056】
[実施例30]
下記組成を混合し、細粒剤を得た。
組成 g
実施例6のイブプロフェンをナプロキセンに変えた以外は同様の方法で得た顆粒(固体医薬組成物) 460g
乾燥水酸化アルミニウムゲル 70g
結晶セルロース(セオラスPH302) 150g
D−マンニトール 150g
ヒドロキシプロピルセルロース 30g
クロスポピドン(コリドンCL) 20g
ステアリン酸マグネシウム 3g
スクラロース 0.5g
香料 0.5g
【0057】
[実施例31]
下記組成を混合し、ゼラチンカプセルに充填してカプセル剤とした。
組成 g
実施例6のイブプロフェンをケトプロフェンに変えた以外は同様の方法で得た顆粒(固体医薬組成物) 460g
アリルイソプロピルアセチル尿素 60g
結晶セルロース(セオラスPH302) 150g
D−マンニトール 150g
ヒドロキシプロピルセルロース 30g
クロスポピドン(コリドンCL) 20g
ステアリン酸マグネシウム 3g
スクラロース 1.5g
香料 0.5g
【0058】
実施例25〜31の(A)成分の溶出性は、50℃・1ヶ月保存後も実施例1〜24と同様に高いものであり、凝集固化もなかった。
【0059】
[実施例32〜43]
表5,6の各成分を、80℃で10分間粉体混合し、その後室温で冷却した。
得られた混合物(固形医薬組成物)について、上記と同様の評価を行った。結果を表中に併記する。
【0060】
【表5】

【0061】
【表6】

【0062】
実施例32〜43の組成物は、初期及び50℃・1ヶ月保存後共に、溶出性、凝集固化抑制が良好で、さらに、5℃・1ヶ月保存後も(A)成分が非晶質を維持していた。
【0063】
上記実施例で使用した原料を下記に示す。なお、表中の量は各成分の量である。
【表7】

【特許請求の範囲】
【請求項1】
(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEと、(C)アセトアミノフェン及び/又はカフェインとを含有する固形医薬組成物。
【請求項2】
(A)成分が、イブプロフェンである請求項1記載の固形医薬組成物。
【請求項3】
(B)/(A)で表される、(A)成分に対する(B)成分の含有質量比が0.3〜3であり、(C)/(A)で表される、(A)成分に対する(C)成分の含有質量比が0.3〜3である請求項1又は2記載の固形医薬組成物。
【請求項4】
さらに、(D)賦形剤を含有する請求項1、2又は3記載の固形医薬組成物。
【請求項5】
(D)成分が、二酸化珪素、結晶セルロース及び糖アルコールから選ばれる化合物である請求項4記載の固形医薬組成物。
【請求項6】
(D)/[(A)+(B)+(C)]で表される、(A)成分、(B)成分及び(C)成分の合計に対する(D)成分の含有質量比が0.1〜0.6である請求項4又は5記載の固形医薬組成物。
【請求項7】
さらに、(E)水酸化アルミニウム又はメタケイ酸アルミン酸マグネシウムを含有する請求項1〜6のいずれか1項記載の固形医薬組成物。
【請求項8】
請求項1〜7のいずれか1項記載の固形医薬組成物を配合してなり、錠剤、粒状剤、細粒剤又はカプセル剤である医薬製剤。
【請求項1】
(A)プロピオン酸系又は酢酸系の非ステロイド性抗炎症薬と、(B)アミノアルキルメタアクリレートコポリマーEと、(C)アセトアミノフェン及び/又はカフェインとを含有する固形医薬組成物。
【請求項2】
(A)成分が、イブプロフェンである請求項1記載の固形医薬組成物。
【請求項3】
(B)/(A)で表される、(A)成分に対する(B)成分の含有質量比が0.3〜3であり、(C)/(A)で表される、(A)成分に対する(C)成分の含有質量比が0.3〜3である請求項1又は2記載の固形医薬組成物。
【請求項4】
さらに、(D)賦形剤を含有する請求項1、2又は3記載の固形医薬組成物。
【請求項5】
(D)成分が、二酸化珪素、結晶セルロース及び糖アルコールから選ばれる化合物である請求項4記載の固形医薬組成物。
【請求項6】
(D)/[(A)+(B)+(C)]で表される、(A)成分、(B)成分及び(C)成分の合計に対する(D)成分の含有質量比が0.1〜0.6である請求項4又は5記載の固形医薬組成物。
【請求項7】
さらに、(E)水酸化アルミニウム又はメタケイ酸アルミン酸マグネシウムを含有する請求項1〜6のいずれか1項記載の固形医薬組成物。
【請求項8】
請求項1〜7のいずれか1項記載の固形医薬組成物を配合してなり、錠剤、粒状剤、細粒剤又はカプセル剤である医薬製剤。
【図1】




【公開番号】特開2011−201876(P2011−201876A)
【公開日】平成23年10月13日(2011.10.13)
【国際特許分類】
【出願番号】特願2011−46336(P2011−46336)
【出願日】平成23年3月3日(2011.3.3)
【出願人】(000006769)ライオン株式会社 (1,816)
【Fターム(参考)】
【公開日】平成23年10月13日(2011.10.13)
【国際特許分類】
【出願日】平成23年3月3日(2011.3.3)
【出願人】(000006769)ライオン株式会社 (1,816)
【Fターム(参考)】
[ Back to top ]

