固形医薬組成物
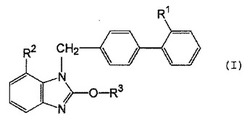
本発明は、式(I):

(式中、各記号は明細書中と同義を示す。)で表される化合物またはその塩、pH調整剤および利尿剤を含有することを特徴とする、式(I)で表される化合物、および利尿剤の安定性、ならびに溶出性に優れた固形製剤に関する。

(式中、各記号は明細書中と同義を示す。)で表される化合物またはその塩、pH調整剤および利尿剤を含有することを特徴とする、式(I)で表される化合物、および利尿剤の安定性、ならびに溶出性に優れた固形製剤に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、後記式(I)で表される化合物、pH調整剤および利尿剤を含有することを特徴とする、化合物(I)および利尿剤の安定性および溶出性に優れた固形製剤に関する。
【0002】
(発明の背景)
医薬品は有効かつ安全であることが重要であり、たとえ製造直後に有効かつ安全な状態であっても、流通過程で薬物が容易に分解・変質してしまうようなものは、医薬品としての有効性と安全性が担保されているとは言えない。従って、薬物の安定性は、医薬品にとって極めて重要である。
【0003】
また、医薬品の有効性と安全性を担保するためには、薬効成分自体の有効性や安全性が重要であるばかりでなく、生体内における薬物溶出性など、製剤の持つ特性も極めて重要である。例えば、製剤からの薬物溶出が遅すぎると、血中の薬物が有効な濃度に達せず、期待された薬効が十分に発揮されない可能性がある。一方、製剤からの薬物溶出が速すぎると、血中の薬物濃度が急激に上昇し、副作用の危険性が高まる。
すなわち、医薬品には、有効性と安全性に加え、安定性と一定の薬物溶出性が保証されていることが要求される。
一方、薬物溶出性は、薬物の溶解度と相関することが知られている。すなわち一般に、薬物の溶解度が低いほど、薬物の溶出性は悪くなることが知られている。
【0004】
強力なアンジオテンシンII受容体拮抗作用を有するベンズイミダゾール誘導体式(I)

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)またはその塩(以下、これらを総称して化合物(I)と称する場合がある)、とりわけ2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチルの塩(特許文献1)は、高血圧症などの治療薬として有望視されている。ところが、化合物(I)は通常の製剤化条件である中性のpH領域においては不安定であることから、化合物(I)が安定化するように製剤の特性を調整する必要がある。しかし、化合物(I)が安定化するpH領域においては、化合物(I)の溶解度が低い。また化合物(I)と利尿剤等の他の有効成分との配合剤は化学的特性の違いもあり、安定性および溶出性に優れた製剤への製剤化が困難であった。
【0005】
配合剤としては、アンジオテンシンII拮抗作用を有する化合物と利尿作用を有する化合物との組合せ(特許文献2)、アセトアミノフェンの内服固形製剤であって、アセトアミノフェンの不快な呈味抑制・変色防止のために二群造粒法で調製した製剤(特許文献3)が知られている。しかしながら、化合物(I)と利尿剤との配合剤で薬物の安定性と溶解性、即ち溶出性を兼ね備えた製剤は知られていない。
[先行技術文献]
[特許文献]
【特許文献1】国際公開第2005/080384号公報
【特許文献2】米国特許5721263号
【特許文献3】特開2001-294524号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
化合物(I)と利尿剤とを含有する製剤は、高血圧症、心不全、糖尿病性腎症、動脈硬化症などの循環器系疾患の予防・治療に有効であり、臨床上の有用性が極めて高い。
本発明の課題は化合物(I)および利尿剤の安定性に優れ、またそれらの溶出性にも優れた、固形製剤を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、化合物(I)の製剤中の安定性と製剤からの溶出性とを両立すべく鋭意研究を行った結果、化合物(I)にpH調整剤を共存させることにより、延いては固形製剤をpH調整剤にて化合物(I)の溶解度が低くなるpH領域に調整しうるようにすることにより、予想外にも化合物(I)の製剤中の安定性と製剤からの溶出性とが両立されることを見出した。また、化合物(I)と利尿剤との併用においても化合物(I)および利尿剤の安定性にも優れることを見出した。また、pH調整剤を添加した化合物(I)と、利尿剤とを個別に造粒することにより、両者のさらなる安定化を可能とし、通常造粒製剤に比べ化合物(I)の溶出性にもさらに優れた製剤が得られることを見出し、本発明を完成するに至った。
【0008】
すなわち、本発明は、
[1]式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、pH調整剤、および利尿剤を含有する、固形製剤。
[2]式(I)で表される化合物またはその塩が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩である[1]記載の固形製剤。
[3]利尿剤がクロルタリドンまたはヒドロクロロチアジドである、[1]又は[2]記載の固形製剤。
[4]式(I)で表される化合物の塩が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩であり、利尿剤がクロルタリドンである[1]記載の固形製剤。
[5]pH調整剤がpH2ないし5のpH調整剤である[1]記載の固形製剤。
[6]pH調整剤が酒石酸、クエン酸、乳酸、フマル酸、コハク酸、リン酸、リンゴ酸、アスコルビン酸、酢酸、および酸性アミノ酸から選ばれる酸性物質、もしくはその塩、またはそれらの溶媒和物である[1]記載の固形製剤。
[7]pH調整剤がフマル酸一ナトリウム、またはフマル酸とナトリウムイオンの供与体の組み合わせである[1]記載の固形製剤。
[8]式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、およびpH調整剤を含有する第一の部分、ならびに利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分および第二の部分をそれぞれ個別に造粒して得られる固形製剤。
[9]式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、およびpH調整剤を含有する第一の部分、ならびに利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分からなる第一層、および第二の部分からなる第二層を含む積層錠剤である、[1]記載の固形製剤。
[10]pH調整剤の配合量が、製剤に対して0.01〜20重量%である[1]記載の固形製剤。
[11]pH調整剤を配合することを特徴とする、固形製剤における式(I)で表される化合物またはその塩、および利尿剤の安定化方法。
[12]式(I)で表される化合物またはその塩、および利尿剤を含有する固形製剤において、pH調整剤を配合することを特徴とする、固形製剤からの式(I)で表される化合物またはその塩の溶出改善方法。
;などに関する。
【発明の効果】
【0009】
化合物(I)、pH調整剤および利尿剤を含有することを特徴とする本発明の固形製剤とすることにより、化合物(I)および利尿剤の安定性および溶出性に優れた製剤を提供することができる。
【図面の簡単な説明】
【0010】
【図1】実施例14および参考例3で得られた錠剤の溶出率を示す。
【図2】実施例15および参考例4で得られた錠剤の溶出率を示す。
【0011】
以下に、本発明の固形製剤を詳細に説明する。
本発明の固形製剤は、化合物(I)、pH調整剤および利尿剤を含有する、固形製剤である(本発明の固形製剤ともいう)。本発明の固形製剤は、化合物(I)の安定性に優れ、かつ該化合物の溶出性にも優れている。さらに利尿剤の安定性にも優れている。
【0012】
前記式(I)において、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、例えば、テトラゾリル基または式

〔式中、iは−O−または−S−を示し、jは>C=O、>C=Sまたは>S(O)mを示す(式中、mは0、1または2を示す)〕で表される基(例えば、4,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル基など)などが好ましい。
なお、4,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル基には、式:

で示される3つの互変異性体(a′,b′およびc′)が存在し、4,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル基は上記a′,b′およびc′のすべてを含む。
【0013】
前記式(I)において、R2はエステル化されたカルボキシル基を示し、例えば、水酸基、アミノ、ハロゲン、低級(C2-6)アルカノイルオキシ(例、アセチルオキシ、ピバロイルオキシなど)、低級(C4-7)シクロアルカノイルオキシ、 (低級(C1-6)アルコキシ)カルボニルオキシ(例、メトキシカルボニルオキシ、エトキシカルボニルオキシなど)、(低級(C3-7)シクロアルコキシ)カルボニルオキシ(例、シクロヘキシルオキシカルボニルオキシなど)、低級(C1-4)アルコキシおよび5−メチル−2−オキソ−1,3−ジオキソレン−4−イルから選ばれる置換基で置換されていてもよい低級(C1-4)アルキルでエステル化されたカルボキシル基(例えば、(5−メチル−2−オキソ−1,3−ジオキソレン−4−イル)メトキシカルボニル基、1−(シクロヘキシルオキシカルボニルオキシ)エトキシカルボニル基)などが好ましい。
【0014】
前記式(I)において、R3は置換されてもよい低級アルキルを示し、R3としては水酸基、アミノ基、ハロゲン原子および低級(C1−4)アルコキシ基から選ばれる置換基で置換されていてもよい低級(C1−5)アルキル(好ましくは、低級(C2−3)アルキル;特に好ましくは、エチル)が好ましい。
【0015】
式(I)で表される化合物の塩としては、薬学的に許容される塩が挙げられ、例えば、式(I)で表される化合物の、無機塩基との塩、有機塩基との塩、無機酸との塩、有機酸との塩、塩基性または酸性アミノ酸との塩などが挙げられる。無機塩基との塩の好適な例としては、例えばナトリウム塩、カリウム塩などのアルカリ金属塩;カルシウム塩、マグネシウム塩などのアルカリ土類金属塩;アルミニウム塩、アンモニウム塩などが挙げられる。有機塩基との塩の好適な例としては、例えば、トリメチルアミン、トリエチルアミン、ピリジン、ピコリン、エタノールアミン、ジエタノールアミン、トリエタノールアミン、ジシクロヘキシルアミン、N,N’−ジベンジルエチレンジアミンなどとの塩が挙げられる。無機酸との塩の好適な例としては、例えば、塩酸、臭化水素酸、硝酸、硫酸、リン酸などとの塩が挙げられる。有機酸との塩の好適な例としては、例えば、ギ酸、酢酸、トリフルオロ酢酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、メタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸などとの塩が挙げられる。塩基性アミノ酸との塩の好適な例としては、例えば、アルギニン、リジン、オルニチンなどとの塩が挙げられ、酸性アミノ酸との塩の好適な例としては、例えばアスパラギン酸、グルタミン酸などとの塩が挙げられる。
【0016】
式(I)で表される化合物またはその塩としては、2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチルの塩が好ましく、2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩が特に好ましい。
式(I)で表される化合物の塩は水和物または非水和物のいずれであってもよい。
また、化合物(I)は水和物を含む溶媒和物または非溶媒和物のいずれであってもよい。
【0017】
化合物(I)は、結晶状であることが好ましく、かつ融点が100〜250℃、なかでも120〜200℃、とりわけ130〜180℃であるものが好ましい。
【0018】
化合物(I)は、本発明の固形製剤中に0.1〜60重量%、好ましくは1〜40重量%、より好ましくは5〜30重量%含有される。
【0019】
本発明で用いるpH調整剤としては、化合物(I)の製剤中の安定性と製剤からの溶出性とを両立させるものであって、医薬品に適用可能であれば如何なるpH調整剤であってもよく、また複数のpH調整剤を組み合わせて用いてもよい。本発明で用いるpH調整剤としては、pHが約2ないし約5、好ましくは約3ないし約5、より好ましくは約3ないし約4を示すpH調整剤が好ましく用いられ、例えば、酒石酸、クエン酸、乳酸、フマル酸、リン酸、リンゴ酸、コハク酸、アスコルビン酸、酢酸、酸性アミノ酸(例えば、グルタミン酸、アスパラギン酸)などの酸性物質、これら酸性物質の無機塩(例えば、アルカリ金属塩、アルカリ土類金属塩、アンモニウム塩など)、これら酸性物質と有機塩基(例えば、リジン、アルギニンなどの塩基性アミノ酸、メグルミンなど)との塩、並びにそれらの溶媒和物(例えば、水和物)などが用いられる。また、当該pH調整剤は利尿剤に対しても製剤中の安定性と製剤からの溶出性とを両立させる。
ここに、pH調整剤におけるpHは次の条件下に測定したものである。即ち、25℃で水に1w/v%にてpH調整剤を溶解または懸濁させて得た溶液または懸濁液のpHである。
【0020】
本発明で用いるpH調整剤としては、酸性物質と塩基性物質とを組み合わせて用い、組み合わせたpH調整剤を25℃で水に1w/v%で溶解または懸濁させた場合に、溶液または懸濁液のpHが約2ないし約5、好ましくは約3ないし約5、より好ましくは約3ないし約4を示すように調節して用いてもよい。組み合わせて用いる酸性物質としては、上記のpH約2ないし約5の酸性物質およびそれらの塩に加え、塩酸、硫酸、リン酸などの強酸も用いることができる。組み合わせて用いる塩基性物質としては、無機塩基(例えば、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸水素ナトリウム、炭酸マグネシウム、炭酸カルシウム、酸化マグネシウム、アンモニア、合成ヒドロタルサイト)、有機塩基(例えば、リジン、アルギニンなどの塩基性アミノ酸、メグルミンなど)などが挙げられる。
さらに、本発明で用いるpH調整剤としては、リン酸二水素ナトリウム、フマル酸一ナトリウムまたはフマル酸とナトリウムイオンの供与体の組合せなどのように、溶液が当該pHにおいて緩衝能を有するものが好ましい。
本発明で用いるpH調整剤としては、フマル酸一ナトリウムまたはフマル酸とナトリウムイオンの供与体の組合せが好ましく、フマル酸と水酸化ナトリウムとを組み合わせて用いてもよい。
【0021】
本発明の固形製剤において、pH調整剤は固形製剤中、0.01〜20重量%、好ましくは0.05〜10重量%、さらに好ましくは0.1〜5重量%含有される。
【0022】
本発明における利尿剤としては、例えばキサンチン誘導体(例、サリチル酸ナトリウムテオブロミン、サリチル酸カルシウムテオブロミン等)、チアジド系製剤(例、エチアジド、シクロペンチアジド、トリクロルメチアジド、ヒドロクロロチアジド、ヒドロフルメチアジド、ベンチルヒドロクロロチアジド、ペンフルチジド、ポリチアジド、メチクロチアジド等)、抗アルドステロン製剤(例、スピロノラクトン、トリアムテレン等)、炭酸脱水酵素阻害剤(例、アセタゾラミド等)、クロルベンゼンスルホンアミド系製剤(例、クロルタリドン、メフルシド、インダパミド等)、アゾセミド、イソソルビド、エタクリン酸、ピレタニド、ブメタニド、フロセミド等が挙げられる。本発明における利尿剤には、上記利尿剤として挙げられた化合物の塩も含まれる。
本発明における利尿剤としてはクロルベンゼンスルホンアミド系製剤、チアジド系製剤等が好ましく、なかでもクロルタリドン、ヒドロクロロチアジドなどがより好ましい。とりわけクロルタリドンが好ましい。
【0023】
本発明における利尿剤は、固形製剤中、通常、0.1〜60重量%(ただし、化合物(I)およびpH調整剤との合計が100%を超えない範囲で適宜調整される)、好ましくは0.5〜40重量%、さらに好ましくは1〜30重量%含有される。具体的には、クロルタリドン(フリー体に換算して)は、通常0.1〜60重量%、好ましくは0.5〜40重量%、さらに好ましくは1〜30重量%含有される。ヒドロクロロチアジド(フリー体に換算して)は、通常0.1〜60重量%、好ましくは0.5〜40重量%、さらに好ましくは1〜30重量%含有される。
【0024】
本発明の固形製剤として好ましい形態としては、化合物(I)が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩であり利尿剤がクロルタリドンである製剤が挙げられる。
【0025】
本発明の固形製剤としては、例えば、錠剤、顆粒剤、細粒剤、カプセル剤、丸剤などの経口投与に適した固形製剤が挙げられる。
而して、本発明における固形製剤の態様としては、次のような製剤が挙げられる。
(1)化合物(I)、pH調整剤、利尿剤を混合して造粒して得られる固形製剤(一群造粒製剤)。
(2)化合物(I)およびpH調整剤を含有する第一の部分、ならびに利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分および第二の部分をそれぞれ個別に造粒して得られる固形製剤(二群造粒製剤−単層錠剤)。
(3)個別に造粒された、化合物(I)およびpH調整剤を含有する第一の部分と利尿剤を含有する第二の部分を独立させて、圧縮成形する(二群造粒製剤−積層錠剤)か、または一方の部分に他方の部分を被覆する(二群造粒製剤−被覆錠剤)ことによって得られる固形製剤。
【0026】
上記(1)の固形製剤は、pH調整剤の配合により、化合物(I)および利尿剤のそれぞれの製剤からの溶出性と安定性が両立する。また上記(2)(3)においては、化合物(I)および利尿剤のそれぞれの溶出性と安定性がより改善する。
【0027】
上記(1)の固形製剤は、自体公知の方法(例えば、第14改正日本薬局方の製剤総則に記載されている方法)により製造できる。
例えば、化合物(I)、pH調整剤、利尿剤および添加剤などを加えて混合し、結合剤を加えて顆粒とし、顆粒に滑沢剤等を加えて打錠して錠剤とする。また顆粒剤、細粒剤においても錠剤とほぼ同様の方法で製造することができる。
カプセル剤の場合は、上記の顆粒剤、細粒剤をゼラチンやヒドロキシプロピルメチルセルロース等を含有するカプセルに充填するか、もしくは有効成分を賦形剤とともに、ゼラチンやヒドロキシプロピルメチルセルロース等を含有するカプセルに充填すればよい。
【0028】
固形製剤を製造する際には、製剤分野において慣用の添加剤を含有していてもよい。該添加剤としては、例えば、賦形剤、崩壊剤、結合剤、滑沢剤、着色剤、pH調整剤、界面活性剤、安定化剤、酸味料、香料、流動化剤などが挙げられる。これら添加剤は、製剤分野において慣用の量が用いられる。
【0029】
賦形剤としては、例えば、コーンスターチ、馬鈴薯デンプン、コムギデンプン、コメデンプン、部分アルファー化デンプン、アルファー化デンプン、有孔デンプン等のデンプン類;乳糖、果糖、ブドウ糖、マンニトール(例、D−マンニトール)、ソルビトール(例、D−ソルビトール)、エリスリトール(例、D−エリスリトール)、ショ糖等の糖または糖アルコール類:無水リン酸カルシウム、結晶セルロース、微結晶セルロース、カンゾウ末、炭酸水素ナトリウム、リン酸カルシウム、硫酸カルシウム、炭酸カルシウム、沈降炭酸カルシウム、ケイ酸カルシウムなどが挙げられる。
【0030】
崩壊剤としては、例えば、アミノ酸、デンプン、コーンスターチ、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、カルボキシメチルスターチナトリウム、カルメロースナトリウム、カルメロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルスターチ、カルボキシメチルスターチナトリウム等が用いられる。
【0031】
結合剤としては、例えば、結晶セルロース(例、微結晶セルロース)、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ゼラチン、デンプン、アラビアゴム末、トラガント、カルボキシメチルセルロース、アルギン酸ナトリウム、プルラン、グリセリン等が挙げられる。
【0032】
滑沢剤の好適な例としては、例えば、ステアリン酸マグネシウム、ステアリン酸、ステアリン酸カルシウム、タルク(精製タルク)、蔗糖脂肪酸エステル、フマル酸ステアリルナトリウムなどが挙げられる。
【0033】
着色剤としては、例えば、食用黄色5号、食用赤色2号、食用青色2号などの食用色素、食用レーキ色素、三二酸化鉄などが挙げられる。
【0034】
界面活性剤としては、ラウリル硫酸ナトリウム、ポリソルベート80、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコールなどが挙げられる。
安定化剤としては、例えばトコフェロール、エデト酸四ナトリウム、ニコチン酸アミド、シクロデキストリン類などが挙げられる。
【0035】
酸味料としては、例えばアスコルビン酸、クエン酸、酒石酸、リンゴ酸などが挙げられる。
香料としては、例えばメントール、ハッカ油、レモン油、バニリンなどが挙げられる。
流動化剤としては、例えば軽質無水ケイ酸、含水二酸化ケイ素などが挙げられる。
上記した添加剤は、2種以上を適宜の割合で混合して用いてもよい。
【0036】
上記(2)の固形製剤は、第一の部分と第二の部分とが個別に造粒された製剤であり、自体公知の方法により製造することができる。
上記(2)の固形製剤であって、本発明における第一の部分は、化合物(I)およびpH調整剤を含有する部分(組成物)である。
【0037】
本発明におけるpH調整剤の使用量は、上記第一の部分100重量部に対して好ましくは0.01〜20重量部、好ましくは0.05〜10重量部、さらに好ましくは0.1〜5重量部である。
【0038】
また、pH調整剤に対する化合物(I)の重量比(化合物(I):pH調整剤)は、好ましくは1〜30:1、より好ましくは5〜25:1、さらに好ましくは10〜20:1である。
【0039】
上記第一の部分は、後述する第二の部分と一緒に固形製剤を形成できる形状、大きさであれば限定されない。
【0040】
上記第一の部分は、さらに製剤分野において慣用の添加剤を含有していてもよい。添加剤として、上述したと同様のものが用いられる。
上記第一の部分は、化合物(I)とpH調整剤とを、必要により上記添加剤とともに、自体公知の方法に従って混合し、造粒することによって製造することができる。
【0041】
上記第一の部分は、好ましくは、化合物(I)(好ましくは、2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩);pH調整剤(好ましくはフマル酸および水酸化ナトリウム);賦形剤(好ましくはマンニトールおよび結晶セルロース);結合剤(好ましくはヒドロキシプロピルセルロース)を含有する。
【0042】
本発明における第二の部分とは、利尿剤を含有する部分(組成物)である。
上記第二の部分は、前述した第一の部分と一緒に固形製剤を形成できる形状、大きさであれば限定されない。
【0043】
上記第二の部分は、さらに製剤分野において慣用の添加剤を含有していてもよく、添加剤としては、上述したと同様のものが用いられる。
具体的には、利尿剤(好ましくはクロルタリドン);賦形剤(好ましくはマンニトールおよび結晶セルロース);結合剤(好ましくはヒドロキシプロピルセルロース)を含有する。
【0044】
上記第二の部分は、利尿剤を、必要により上記添加剤とともに、自体公知の方法に従って混合し造粒することによって製造することができる。
当該利尿剤は、上記第二の部分100重量部に対して、好ましくは0.1〜60重量部、より好ましくは0.5〜40重量部、さらに好ましくは1〜30重量部である。
【0045】
本発明の固形製剤における、第一の部分に対する第二の部分の重量比(第二の部分:第一の部分)は、好ましくは0.1〜10:1、より好ましくは0.3〜5:1、さらに好ましくは、0.5〜3:1である。
個別に造粒された第一の部分と第二の部分を、さらに製剤分野において慣用の添加剤とともに混合し、圧縮成形することによって製造される単層錠剤も本発明の固形製剤に含まれる。上記単層錠剤を、カプセル(例、ヒドロキシプロピルメチルセルロースカプセル)に充填することによって製造されるカプセル剤も本発明の固形製剤に含まれる。
また、個別に造粒された第一の部分と第二の部分を、そのまま、または上記添加剤とともに混合して、カプセル(例、ヒドロキシプロピルメチルセルロースカプセル)に充填することによって製造されるカプセル剤も本発明の固形製剤に含まれる。
【0046】
上記(3)の固形製剤は、第一の部分と第二の部分とが個別に造粒された製剤であり、これらの部分を独立させて圧縮成形するか、または一方の部分に他方の部分を被覆することによって製造することができる。
【0047】
上記(3)の固形製剤の具体例としては、[1]第一の部分からなる内核および第二の部分からなる外層を含む被覆錠剤(A);[2]第二の部分からなる内核および第一の部分からなる外層を含む被覆錠剤(B); [3]第一の部分からなる第一層および第二の部分からなる第二層を含む積層錠剤が挙げられる。
【0048】
第一の部分からなる内核は、例えば、化合物(I)とpH調整剤を、必要に応じて添加剤と共に、造粒することによって製造することができる。また、造粒の後、必要により乾燥、整粒、圧縮成形などの操作を行ってもよい。
【0049】
一方、第二の部分からなる外層は、利尿剤、例えば、クロルタリドンまたはその塩を、必要に応じて添加剤と共に、造粒することによって製造することができる。
当該被覆は、例えば、圧縮成形、コーティングなどによって行われる。また、該添加剤は、好ましくは結合剤などである。
【0050】
被覆錠剤(A)を製造する際、内核と外層の直接接触を回避することを目的として、これらの間に不活性な中間層を設けてもよい。該中間層は、例えば、下記したコーティング基剤およびコーティング添加剤を含有する。該中間層は、好ましくは、水溶性フィルムコーティング基剤および流動化剤を含有する。
【0051】
上記被覆錠剤(B)は、内核として第二の部分を、外層として第一の部分を用いる以外は、被覆錠剤(A)と同様にして製造することができる。
【0052】
本発明における積層錠剤は、式(I)で表される化合物またはその塩およびpH調整剤を含有する第一の部分、および利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分からなる第一層および、第二の部分からなる第二層を含む錠剤である。
【0053】
本発明における積層錠剤は、少なくとも第一の部分からなる第一層と第二の部分からなる第二層とが一体的に成型された製剤であれば特に制限はない。
【0054】
また、本発明における積層錠剤は、第一層と第二層との間に、不活性な中間層を有していてもよい。
【0055】
本発明における積層錠剤が、このような中間層を有する場合、活性成分が互いに作用することによる悪影響(経時的な活性成分の分解や活性低下などの保存安定性の低下、経時的な活性成分溶出パターンの変化などの溶出安定性の低下など)をより効果的に抑えることができる。
【0056】
積層錠剤は、例えば、以下の製造工程にしたがって製造することができる。
化合物(I)とpH調整剤とを、必要に応じて添加剤と混合し、得られた混合物を造粒し第一の部分を得る。造粒の後、必要により乾燥、整粒などの操作を行ってもよい。その後、必要に応じて添加剤と混合し第一層とする。
次いで、利尿剤を、必要に応じて添加剤と共に造粒し、得られた第二の部分に、必要に応じて添加剤を混合した第二層を上記第一層に層状に積み重ねて圧縮成形(好ましくは打錠)する。
この際、各層の直接接触を回避するために、各層の間に不活性な中間層を設けてもよい。該中間層は、例えば、上記した賦形剤、崩壊剤、結合剤、滑沢剤、着色剤等を含有する。
【0057】
上記被覆錠剤(A)または(B)あるいは積層錠剤を、カプセル(例、ヒドロキシプロピルメチルセルロースカプセル)に充填することによって製造されるカプセル剤も本発明の固形製剤に含まれる。
【0058】
また、上記(1)〜(3)の固形製剤を、下記コーティング基剤およびコーティング添加剤によってフィルムコーティングすることによって製造されるフィルムコーティング製剤も本発明の固形製剤に含まれる。
【0059】
コーティング基剤の好適な例としては、糖衣基剤、水溶性フィルムコーティング基剤、腸溶性フィルムコーティング基剤、徐放性フィルムコーティング基剤などが挙げられる。
【0060】
糖衣基剤としては、白糖が用いられる。さらに、タルク、沈降炭酸カルシウム、ゼラチン、アラビアゴム、プルラン、カルナバロウなどから選ばれる1種または2種以上を併用してもよい。
【0061】
水溶性フィルムコーティング基剤としては、例えば、ヒドロキシプロピルセルロース[例、グレード:L、SL、SL−T、SSL(商品名);日本曹達(株)]、ヒドロキシプロピルメチルセルロース[例、TC−5(グレード:MW、E、EW、R、RW)(商品名);信越化学(株)]、ヒドロキシエチルセルロース、メチルヒドロキシエチルセルロースなどのセルロース系高分子;ポリビニルアセタールジエチルアミノアセテート、アミノアルキルメタアクリレートコポリマーE[オイドラギットE(商品名)]、ポリビニルピロリドンなどの合成高分子;プルランなどの多糖類などが挙げられる。
【0062】
腸溶性フィルムコーティング基剤としては、例えば、ヒドロキシプロピルメチルセルロース フタレート、ヒドロキシプロピルメチルセルロース アセテートサクシネート、カルボキシメチルエチルセルロース、酢酸フタル酸セルロースなどのセルロース系高分子;メタアクリル酸コポリマーL[オイドラギットL(商品名)]、メタアクリル酸コポリマーLD[オイドラギットL−30D55(商品名)]、メタアクリル酸コポリマーS[オイドラギットS(商品名)]などのアクリル酸系高分子;セラックなどの天然物などが挙げられる。
【0063】
徐放性フィルムコーティング基剤としては、例えば、エチルセルロースなどのセルロース系高分子;アミノアルキルメタアクリレートコポリマーRS[オイドラギットRS(商品名)]、アクリル酸エチル・メタアクリル酸メチル共重合体懸濁液[オイドラギットNE(商品名)]などのアクリル酸系高分子などが挙げられる。
【0064】
コーティング添加剤の好適な例としては、酸化チタンなどの遮光剤、タルクなどの流動化剤、および/または三二酸化鉄、黄色三二酸化鉄などの着色剤;ポリエチレングリコール[例、マクロゴール6000(商品名)]、クエン酸トリエチル、ヒマシ油、ポリソルベート類などの可塑剤;クエン酸、酒石酸、リンゴ酸、アスコルビン酸などの有機酸;などが挙げられる。
【0065】
また、本発明の固形製剤には、識別性のための刻印あるいは文字を印刷してあってもよく、分割用の割線を付してあってもよい。
【0066】
本発明の固形製剤は、服用性、製剤強度などの観点から、フィルムコーティングされていることが好ましい。
前記製造工程において、混合、圧縮成形、コーティングなどの操作は、製剤技術分野において慣用の方法にしたがって行われる。
【0067】
混合は、例えば、V型混合機、タンブラー混合機などの混合機;および高速攪拌造粒機、流動層造粒乾燥機、押し出し造粒機、ローラーコンパクターなどの造粒機を用いて行われる。
【0068】
圧縮成形は、例えば、単発錠剤機、ロータリー式打錠機などを用いて行われる。
なお、単発錠剤機、ロータリー式打錠機などを用いて圧縮成形を行う際には、通常1〜20kN/cm2(好ましくは5〜15kN/cm2)の打錠圧を採用することが好ましく、さらに、キャッピング防止を目的として、テーパー形状の臼を用いることが好ましい。
【0069】
コーティングは、例えば、フィルムコーティング装置などを用いて行われる。
【0070】
本発明の固形製剤は、哺乳動物(例えば、ヒト、イヌ、ウサギ、ラット、マウスなど)の医薬として安全に使用することができる。
患者に対する化合物(I)の投与量は、年齢、体重、一般的健康状態、性別、食事、投与時間、排泄速度、薬物の組み合わせなどを考慮し、また患者のその時に治療を行っている病状の程度に応じて決められるが、一日投与量約0.05〜500mg、好ましくは0.1〜100mgである。
患者に対する利尿剤の投与量は、年齢、体重、一般的健康状態、性別、食事、投与時間、排泄速度、薬物の組み合わせなどを考慮し、また患者のその時に治療を行っている病状の程度に応じて決められるが、例えば、クロルタリドン(フリー体に換算して)は、一日投与量約12.5〜100mg、好ましくは15〜50mgである。ヒドロクロロチアジド(フリー体に換算して)の場合は、一日投与量約12.5〜100mg、好ましくは15〜50mgである。
【0071】
化合物(I)は、強力なアンジオテンシンII拮抗作用を有することから、本発明の医薬組成物は、哺乳動物(例、ヒト、サル、ネコ、ブタ、ウマ、ウシ、マウス、ラット、モルモット、イヌ、ウサギなど)に対し、アンジオテンシンII受容体を介して発現する血管の収縮および増殖や臓器障害により、アンジオテンシンIIの存在により、あるいはアンジオテンシンIIが存在すると誘発される因子により発症する疾患(または発症が促進される疾患)の予防または治療薬として有用である。
本発明の固形製剤は、化合物(I)と利尿剤を組み合わせることにより、上記疾患の予防または治療薬として有用であり、化合物(I)や利尿剤を単独で使用する場合における投与量を減らすことが可能であり、副作用の発現を抑えることができる。
【0072】
本願においては、式(I)で表される化合物またはその塩、および利尿剤を含有する固形製剤において、pH調整剤を配合することを特徴とする、固形製剤における式(I)で表される化合物またはその塩および利尿剤の安定化方法を提供する。本発明の安定化方法によれば、固形製剤中における化合物(I)および利尿剤が有意に安定化される。また、式(I)で表される化合物またはその塩、および利尿剤を含有する固形製剤において、pH調整剤を配合することを特徴とする、固形製剤からの式(I)で表される化合物またはその塩の溶出改善方法を提供する。本発明の溶出改善方法によれば、固形製剤からの化合物(I)および利尿剤の溶出性が有意に改善される。
【実施例】
【0073】
以下に、実施例、実験例を挙げて本発明をさらに詳細に説明するが、本発明はこれらにより限定されるものではない。
なお、実施例として記載された処方において活性成分以外の成分(添加物)は、日本薬局方、日本薬局方外医薬品規格または医薬品添加物規格における収載品などを用いることができる。
【0074】
実施例1
(1)流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩(以下化合物Aという)(1067g)およびマンニトール(1968g)を均一に混合後、ヒドロキシプロピルセルロース(112.5g)、フマル酸(46.5g)および水酸化ナトリウム(16g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Aを得た。
(2)流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、クロルタリドン(300g)、およびマンニトール(402g)を均一に混合後、ヒドロキシプロピルセルロース(27g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Bを得た。
(3)得られた整粒末A(128.4g)、および整粒末B(121.5g)にクロスカルメロースナトリウム(24.68g)、結晶セルロース(30.86g)およびステアリン酸マグネシウム(3.08g)を加え、袋中で混合した。
(4)得られた混合物をロータリー打錠機(アクエリアス、菊水製作所)で7mmφの杵を用いて打錠(打錠圧:4KN/杵、錠剤1錠あたりの重量:154.26mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0075】
製剤(154.26mgあたり)の組成
化合物A 21.34mg
マンニトール 39.36mg
ヒドロキシプロピルセルロース 2.25mg
フマル酸 0.93mg
水酸化ナトリウム 0.32mg
クロルタリドン 25 mg
マンニトール 33.5 mg
ヒドロキシプロピルセルロース 2.25mg
クロスカルメロースナトリウム 12.34mg
結晶セルロース 15.43mg
ステアリン酸マグネシウム 1.54mg
計 154.26mg
【0076】
実施例2
(1)流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、化合物A(256.1g)およびマンニトール(429.8g)を均一に混合後、ヒドロキシプロピルセルロース(27g)、フマル酸(12g)および水酸化ナトリウム(4.14g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Aを得た。得られた整粒末A(85.36g)、にクロスカルメロースナトリウム(24g)、結晶セルロース(30g)およびステアリン酸マグネシウム(3g)を加え、袋中で混合し、混合末Aを得た。
(2)転動流動層造粒乾燥機(SPIR−A−FLOW、フロイント産業株式会社)中に、結晶セルロース(粒)を投入し、クロルタリドン(105g)、結晶セルロース(6.3g)、低置換度ヒドロキシプロピルセルロース(16.8mg)、およびヒドロキシプロピルメチルセルロース(16.8g)の分散液を噴霧してレイアリングし、ついで機内で乾燥した。得られた細粒を篩で篩過し、150〜500μmの細粒Bを得た。
(3)得られた混合末A(3g)と細粒B(0.525g)をガラス瓶中で混合した。得られた混合物をオートグラフ(島津製作所製、AG−5000B)で9.5mmφの杵を用いて打錠(打錠圧:7KN/杵、錠剤1錠あたりの重量:352.5mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0077】
製剤(352.5mgあたり)の組成
化合物A 85.36mg
マンニトール 143.26mg
ヒドロキシプロピルセルロース 9 mg
フマル酸 4 mg
水酸化ナトリウム 1.38mg
クロルタリドン 25 mg
結晶セルロース(粒) 18 mg
結晶セルロース 1.5 mg
低置換度ヒドロキシプロピルセルロース 4 mg
ヒドロキシプロピルメチルセルロース 4 mg
クロスカルメロースナトリウム 24 mg
結晶セルロース 30 mg
ステアリン酸マグネシウム 3 mg
計 352.5 mg
【0078】
実施例3
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(54430g)および整粒末B(26410g)に結晶セルロース(9720g)、クロスポビドン(5670g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で8.5mmφの杵を用いて打錠(打錠圧:8kN、1錠あたりの重量:270mg)し、素錠を得た。
(5)精製水(37800g)にヒドロキシプロピルメチルセルロース(4095g)とタルク(630g)を溶解、分散して、分散液Iを得た。精製水(9450g)に酸化チタン(493.5g)および酸化鉄(31.5g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0079】
製剤(280mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 21. 34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
水酸化ナトリウム 0.345mg
フマル酸 1 mg
ヒドロキシプロピルセルロース 2.7 mg
結晶セルロース 27 mg
クロスポビドン 15.75 mg
ステアリン酸マグネシウム 2.7 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0080】
実施例4
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(54430g)および整粒末B(26410g)に結晶セルロース(9720g)、クロスポビドン(5670g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で8.5mmφの杵を用いて打錠(打錠圧:8kN、1錠あたりの重量:270mg)し、素錠を得た。
(5)精製水(37800g)にヒドロキシプロピルメチルセルロース(4095g)とタルク(630g)を溶解、分散して、分散液Iを得た。精製水(9450g)に酸化チタン(493.5g)および酸化鉄(31.5g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0081】
製剤(280mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 21. 34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
水酸化ナトリウム 0.345mg
フマル酸 1 mg
ヒドロキシプロピルセルロース 2.7 mg
結晶セルロース 27 mg
クロスポビドン 15.75 mg
ステアリン酸マグネシウム 2.7 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0082】
実施例5
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(40820g)および整粒末B(39610g)に結晶セルロース(9720g)、クロスポビドン(6075g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で9.5mmφの杵を用いて打錠(打錠圧:9kN、1錠あたりの重量:360mg)し、素錠を得た。
(5)精製水(32040g)にヒドロキシプロピルメチルセルロース(3471g)とタルク(534g)を溶解、分散して、分散液Iを得た。精製水(8010g)に酸化チタン(418.3g)および酸化鉄(26.7g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0083】
製剤(370mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 42.68 mg
マンニトール 86.93 mg
結晶セルロース 9 mg
水酸化ナトリウム 0.69 mg
フマル酸 2 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 36 mg
クロスポビドン 22.5 mg
ステアリン酸マグネシウム 3.6 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 370 mg
【0084】
実施例6
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(40820g)および整粒末B(39610g)に結晶セルロース(9720g)、クロスポビドン(6075g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で9.5mmφの杵を用いて打錠(打錠圧:9kN、1錠あたりの重量:360mg)し、素錠を得た。
(5)精製水(32040g)にヒドロキシプロピルメチルセルロース(3471g)とタルク(534g)を溶解、分散して、分散液Iを得た。精製水(8010g)に酸化チタン(418.3g)および酸化鉄(26.7g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0085】
製剤(370mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 42.68 mg
マンニトール 86.93 mg
結晶セルロース 9 mg
水酸化ナトリウム 0.69 mg
フマル酸 2 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 36 mg
クロスポビドン 22.5 mg
ステアリン酸マグネシウム 3.6 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 370 mg
【0086】
実施例7
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(27220g)および整粒末B(52810g)に結晶セルロース(9720g)、クロスポビドン(6480g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で長径14mm、短径8mmの杵を用いて打錠(打錠圧:10kN、1錠あたりの重量:540mg)し、素錠を得た。
(5)精製水(37440g)にヒドロキシプロピルメチルセルロース(4056g)とタルク(624g)を溶解、分散して、分散液Iを得た。精製水(9360g)に酸化チタン(488.8g)および酸化鉄(31.2g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0087】
製剤(560mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0088】
実施例8
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(27220g)および整粒末B(52810g)に結晶セルロース(9720g)、クロスポビドン(6480g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で長径14mm、短径8mmの杵を用いて打錠(打錠圧:10kN、1錠あたりの重量:540mg)し、素錠を得た。
(5)精製水(37440g)にヒドロキシプロピルメチルセルロース(4056g)とタルク(624g)を溶解、分散して、分散液Iを得た。精製水(9360g)に酸化チタン(488.8g)および酸化鉄(31.2g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0089】
製剤(560mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0090】
実施例9
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(60480g)に結晶セルロース(7200g)、クロスポビドン(3600g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(58680g)に結晶セルロース(7200g)、クロスポビドン(5400g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Bを得た。
(3)混合末A(180mg)および混合末B(90mg)をロータリー式打錠機(アクア08242L2JI、菊水製作所)で8.5mmφの杵を用いて打錠(打錠圧7kN、1錠あたりの重量:270mg)し、素錠を得た。
(4)精製水(7750g)にヒドロキシプロピルメチルセルロース(780g)とタルク(120g)を溶解、分散して分散液Iを調製した。精製水(1000g)に酸化チタン(94g)、酸化鉄(6g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(250g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0091】
製剤(280mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 18 mg
クロスポビドン 9 mg
ステアリン酸マグネシウム 1.8 mg
化合物A 21.34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
水酸化ナトリウム 0.345mg
フマル酸 1 mg
ヒドロキシプロピルセルロース 2.7 mg
結晶セルロース 9 mg
クロスポビドン 6. 75 mg
ステアリン酸マグネシウム 0.9 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0092】
実施例10
(1)精製水(80620g)にヒドロキシプロピルセルロース(5122g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10740g)、マンニトール(48080g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(60480g)に結晶セルロース(7200g)、クロスポビドン(3600g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(58680g)に結晶セルロース(7200g)、クロスポビドン(5400g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Bを得た。
(3)混合末A(180mg)および混合末B(90mg)をロータリー式打錠機(アクア08242L2JI、菊水製作所)で8.5mmφの杵を用いて打錠(打錠圧7kN、1錠あたりの重量:270mg)し、素錠を得た。
(4)精製水(7750g)にヒドロキシプロピルメチルセルロース(780g)とタルク(120g)を溶解、分散して分散液Iを調製した。精製水(1000g)に酸化チタン(94g)、酸化鉄(6g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(250g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0093】
製剤(280mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 18 mg
クロスポビドン 9 mg
ステアリン酸マグネシウム 1.8 mg
化合物A 21.34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
水酸化ナトリウム 0.345mg
フマル酸 1 mg
ヒドロキシプロピルセルロース 2.7 mg
結晶セルロース 9 mg
クロスポビドン 6. 75 mg
ステアリン酸マグネシウム 0.9 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0094】
実施例11
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(60480g)に結晶セルロース(7200g)、クロスポビドン(3600g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(58680g)に結晶セルロース(7200g)、クロスポビドン(5400g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Bを得た。
(3)混合末A(180mg)および混合末B(360mg)をロータリー式打錠機(アクア08242L2JI、菊水製作所)で長径14mm、短径8mmの杵を用いて打錠(打錠圧10kN、1錠あたりの重量:540mg)し、素錠を得た。
(4)精製水(7750g)にヒドロキシプロピルメチルセルロース(780g)とタルク(120g)を溶解、分散して分散液Iを調製した。精製水(1000g)に酸化チタン(94g)、酸化鉄(6g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(250g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0095】
製剤(560mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 18 mg
クロスポビドン 9 mg
ステアリン酸マグネシウム 1.8 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 36 mg
クロスポビドン 27 mg
ステアリン酸マグネシウム 3.6 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0096】
実施例12
(1)精製水(80620g)にヒドロキシプロピルセルロース(5122g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10740g)、マンニトール(48080g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(60480g)に結晶セルロース(7200g)、クロスポビドン(3600g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(58680g)に結晶セルロース(7200g)、クロスポビドン(5400g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Bを得た。
(3)混合末A(180mg)および混合末B(360mg)をロータリー式打錠機(アクア08242L2JI、菊水製作所)で長径14mm、短径8mmの杵を用いて打錠(打錠圧10kN、1錠あたりの重量:540mg)し、素錠を得た。
(4)精製水(35000g)にヒドロキシプロピルメチルセルロース(3900g)とタルク(600g)を溶解、分散して、分散液Iを得た。精製水(10000g)に酸化チタン(470g)および酸化鉄(30g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0097】
製剤(560mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 18 mg
クロスポビドン 9 mg
ステアリン酸マグネシウム 1.8 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 36 mg
クロスポビドン 27 mg
ステアリン酸マグネシウム 3.6 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0098】
実施例13
(1)流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、化合物A(85.36g)、クロルタリドン(100g)、およびマンニトール(91.26g)を均一に混合後、ヒドロキシプロピルセルロース(10.8g)、フマル酸(4g)および水酸化ナトリウム(1.38g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(248.88g)にクロスカルメロースナトリウム(23.46g)、結晶セルロース(30.6g)およびステアリン酸マグネシウム(3.06g)を加え、袋中で混合した。
(2)得られた混合物をロータリー打錠機(アクエリアス、菊水製作所)で6mmφの杵を用いて打錠(打錠圧:3KN/杵、錠剤1錠あたりの重量:90mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0099】
製剤(90mgあたり)の組成
化合物A 21.34 mg
クロルタリドン 25 mg
マンニトール 22.815mg
ヒドロキシプロピルセルロース 2.7 mg
フマル酸 1 mg
水酸化ナトリウム 0.345mg
クロスカルメロースナトリウム 6.9 mg
結晶セルロース 9 mg
ステアリン酸マグネシウム 0.9 mg
計 90 mg
【0100】
実施例14
流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、化合物A(597.5g)、クロルタリドン(175g)、マンニトール(2000g)および結晶セルロース(189g)を均一に混合後、ヒドロキシプロピルセルロース(113.4g)、フマル酸(28g)および水酸化ナトリウム(9.66g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(2668g)に結晶セルロース(324g)、クロスポビドン(216g)およびステアリン酸マグネシウム(32.4g)を加え、タンブラー混合機(TM−15、昭和化学機械工作所)内で混合した。得られた混合物をロータリー打錠機(VEL50306SS2MZ、菊水製作所製)で長径14.8mm、短径8mmの杵を用いて打錠(打錠圧:8KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で15時間真空乾燥した。
【0101】
製剤(540mgあたり)の組成
クロルタリドン 25 mg
化合物A 85.36 mg
マンニトール 285.66 mg
結晶セルロース 27 mg
ヒドロキシプロピルセルロース 16.2 mg
フマル酸 4 mg
水酸化ナトリウム 1.38 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
計 540 mg
【0102】
実施例15
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、化合物A(1024g)、マンニトール(2086g)および結晶セルロース(216g)を均一に混合後、ヒドロキシプロピルセルロース(129.6g)、フマル酸(48g)および水酸化ナトリウム(16.56g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Bを得た。
(3)得られた整粒末A(907.2g)および整粒末B(1760g)に結晶セルロース(324g)、クロスポビドン(216g)およびステアリン酸マグネシウム(32.4g)を加え、タンブラー混合機(TM−15、昭和化学機械工作所)で混合することにより、混合末を得た。得られた混合物をロータリー打錠機(VEL50306SS2MZ、菊水製作所製)で長径14.8mm、短径8mmの杵を用いて打錠(打錠圧:8KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で15時間真空乾燥した。
【0103】
製剤(540mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
ヒドロキシプロピルセルロース 10.8 mg
フマル酸 4 mg
水酸化ナトリウム 1.38 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
計 540 mg
【0104】
実施例16
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(2688g)、マンニトール(56140g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)および結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(8467g)および整粒末B(4108g)に結晶セルロース(1512g)、クロスポビドン(882g)およびステアリン酸マグネシウム(151.2g)を加え、タンブラー混合機(TM−60S、昭和化学機械工作所)で混合することにより、混合末を得た。得られた混合物をロータリー打錠機(コレクト12K、菊水製作所製)で8.5mmφの杵を用いて打錠(打錠圧:6KN/杵、錠剤1錠あたりの重量:270mg)し、下記組成の素錠を得た。
(4)精製水(3850g)にヒドロキシプロピルメチルセルロース(390g)とタルク(60g)を溶解、分散して分散液Iを調製した。精製水(500g)に酸化チタン(47g)、酸化鉄(3g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(150g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0105】
製剤(280mgあたり)の組成
クロルタリドン 6.25 mg
マンニトール 130.55 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 21.34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
ヒドロキシプロピルセルロース 2.7 mg
フマル酸 1 mg
水酸化ナトリウム 0.345mg
結晶セルロース 27 mg
クロスポビドン 15.75 mg
ステアリン酸マグネシウム 2.7 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0106】
実施例17
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(2688g)、マンニトール(56140g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)および結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(4234g)および整粒末B(8215g)に結晶セルロース(1512g)、クロスポビドン(1008g)およびステアリン酸マグネシウム(151.2g)を加え、タンブラー混合機(TM−60S、昭和化学機械工作所)で混合することにより、混合末を得た。得られた混合物をロータリー打錠機(コレクト12K、菊水製作所製)で長径14mm、短径8mmの杵を用いて打錠(打錠圧:10.5KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。
(4)精製水(3850g)にヒドロキシプロピルメチルセルロース(390g)とタルク(60g)を溶解、分散して分散液Iを調製した。精製水(500g)に酸化チタン(47g)、酸化鉄(3g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(150g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0107】
製剤(560mgあたり)の組成
クロルタリドン 6.25 mg
マンニトール 130.55 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0108】
参考例1
流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、化合物A(42.68g)、乳糖(217.32g)、結晶セルロース(32g)およびフマル酸一ナトリウム(10g)を均一に混合後、ヒドロキシプロピルセルロース(12g)およびフマル酸一ナトリウム(10g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(16.2g)に低置換度ヒドロキシプロピルセルロース(0.8g)を加え、ガラス瓶中で混合した。得られた混合物をオートグラフ(島津製作所製、AG−5000B)で9.5mmφの杵を用いて打錠(打錠圧:7.5KN/杵、錠剤1錠あたりの重量:398.3mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0109】
製剤(398.3mgあたり)の組成
化合物A 50 mg
乳糖 254.6mg
結晶セルロース 37.5mg
ヒドロキシプロピルセルロース 14.1mg
フマル酸一ナトリウム 23.4mg
低置換度ヒドロキシプロピルセルロース 18.7mg
計 398.3mg
【0110】
参考例2
流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、化合物A(42.68g)、乳糖(217.32g)、および結晶セルロース(32g)を均一に混合後、ヒドロキシプロピルセルロース(12g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(15.2g)に低置換度ヒドロキシプロピルセルロース(0.8g)を加え、ガラス瓶中で混合した。得られた混合物をオートグラフ(島津製作所製、AG−5000B)で9.5mmφの杵を用いて打錠(打錠圧:7.5KN/杵、錠剤1錠あたりの重量:374.9mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0111】
製剤(374.9mgあたり)の組成
化合物A 50 mg
乳糖 254.6mg
結晶セルロース 37.5mg
ヒドロキシプロピルセルロース 14.1mg
低置換度ヒドロキシプロピルセルロース 18.7mg
計 374.9mg
【0112】
参考例3
流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、化合物A(597.5g)、クロルタリドン(175g)、マンニトール(2037g)、結晶セルロース(189g)を均一に混合後、ヒドロキシプロピルセルロース(113.4g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(2668g)に結晶セルロース(324g)、クロスポビドン(216g)およびステアリン酸マグネシウム(32.4g)を加え、タンブラー混合機(TM−15、昭和化学機械工作所)内で混合した。得られた混合物をロータリー打錠機(VEL50306SS2MZ、菊水製作所製)で長径14.8mm、短径8mmの杵を用いて打錠(打錠圧:8KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で15時間真空乾燥した。
【0113】
製剤(540mgあたり)の組成
クロルタリドン 25 mg
化合物A 85.36 mg
マンニトール 291.04 mg
結晶セルロース 27 mg
ヒドロキシプロピルセルロース 16.2 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
計 540 mg
【0114】
参考例4
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、化合物A(1024g)、マンニトール(2151g)、結晶セルロース(216g)を均一に混合後、ヒドロキシプロピルセルロース(129.6g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Bを得た。
(3)得られた整粒末A(907.2g)および整粒末B(1760g)に結晶セルロース(324g)、クロスポビドン(216g)およびステアリン酸マグネシウム(32.4g)を加え、タンブラー混合機(TM−15、昭和化学機械工作所)で混合することにより、混合末を得た。得られた混合物をロータリー打錠機(VEL50306SS2MZ、菊水製作所製)で長径14.8mm、短径8mmの杵を用いて打錠(打錠圧:8KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で15時間真空乾燥した。
【0115】
製剤(540mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 179.24 mg
結晶セルロース 18 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
計 540 mg
【0116】
実験例1
実施例1および実施例13で得た乾燥素錠を、ガラス瓶に乾燥剤とともに入れ、60℃に2週間保存した際の、分解物の増加量を以下のような方法で測定した。
化合物Aが約1μg/mLとなるように抽出液で溶解し、非水系フィルター(0.45μm)でろ過した後、次の条件で高速液体カラムクロマトグラフィー(HPLC)法により定量した。
【0117】
HPLC条件
検出器:紫外線吸光光度計、測定波長:240nm
カラム:YMC−Pack ProC18、5μm、内径:4.6mm、長さ:150mm
カラム温度:25℃
移動相(A):0.05mol/Lリン酸緩衝液(pH3.0)/アセトニトリル混液(9:1)
移動相(B):0.05mol/Lリン酸緩衝液(pH3.0)/アセトニトリル混液(3:7)
流量:1mL/分
グラジェントプログラム(リニア)

【0118】
結果を表1に示す。表1に示すように、それぞれの化合物を個別に造粒することにより、化合物Aの分解が抑えられることが示された。
【0119】
表1

【0120】
実験例2
実施例14および参考例3で得た乾燥素錠の薬物溶出性を溶出試験(0.5w/w%ドデシル硫酸ナトリウム含有リン酸緩衝液(pH6.8)900mL、パドル法、回転数50rpm、37℃)により評価した。結果を図1に示す。−●−は実施例14の乾燥素錠の結果を示す。−○−は参考例3の乾燥素錠の結果を示す。
図1に示すように、pH調整剤の添加により、溶出性が改善されることが示された。
【0121】
実験例3
実施例14および参考例3で得た乾燥素錠を、ガラス瓶に乾燥剤とともに入れ、40℃に1ヶ月間保存した際の、分解物の増加量を以下のような方法で測定した。
化合物Aが約1μg/mLとなるように抽出液で溶解し、非水系フィルター(0.45μm)でろ過した後、次の条件で高速液体カラムクロマトグラフィー(HPLC)法により定量した。
【0122】
HPLC条件
検出器:紫外線吸光光度計、測定波長:240nm
カラム:YMC−Pack ProC18、5μm、内径:4.6mm、長さ:150mm
カラム温度:25℃
移動相(A):0.05mol/Lリン酸緩衝液(pH4.0)/アセトニトリル/テトラヒドロフラン混液(40:7:3)
移動相(B):アセトニトリル/0.05mol/Lリン酸緩衝液(pH4.0)/テトラヒドロフラン混液(49:30:21)
流量:1mL/分
グラジェントプログラム(リニア)

結果を表2に示す。表2に示すように、pH調整剤の添加により、化合物Aの分解が抑えられることが示された。
【0123】
表2

【0124】
実験例4
実施例15および参考例4で得た乾燥素錠の薬物溶出性を実験例2と同様の方法で評価した。結果を図2に示す。−●−は実施例15の乾燥素錠の結果を示す。−○−は参考例4の乾燥素錠の結果を示す。
図2に示すように、pH調整剤の添加により、溶出性が改善されることが示された。
【0125】
実験例5
実施例14および実施例15で得た乾燥素錠を、ガラス瓶に乾燥剤とともに入れ、40℃に1ヶ月間保存した際の、分解物の増加量を実験例3と同様の方法で測定した。
【0126】
結果を表3に示す。表3に示すように、それぞれの化合物を個別に造粒することにより、化合物Aの分解が抑えられることが示された。
【0127】
表3

【産業上の利用可能性】
【0128】
本発明の固形製剤は、高血圧症、心不全、糖尿病性腎症、動脈硬化症などの循環器系疾患の予防・治療に有用である。前記式(I)で表される化合物および利尿剤と共にpH調整剤を含有する本発明の固形製剤は、式(I)で表される化合物および利尿剤の優れた安全性並びに溶出性を示す。
【0129】
以上、本発明の具体的な態様のいくつかを詳細に説明したが、当業者であれば示された特定の態様には、本発明の教示と利点から実質的に逸脱しない範囲で様々な修正と変更をなすことは可能である。従って、そのような修正及び変更も、すべて後記の請求の範囲で請求される本発明の精神と範囲内に含まれるものである。
【0130】
本出願は、米国仮出願61/085,201及び61/085,627を基礎としており、その内容は本明細書に全て包含されるものである。
【技術分野】
【0001】
本発明は、後記式(I)で表される化合物、pH調整剤および利尿剤を含有することを特徴とする、化合物(I)および利尿剤の安定性および溶出性に優れた固形製剤に関する。
【0002】
(発明の背景)
医薬品は有効かつ安全であることが重要であり、たとえ製造直後に有効かつ安全な状態であっても、流通過程で薬物が容易に分解・変質してしまうようなものは、医薬品としての有効性と安全性が担保されているとは言えない。従って、薬物の安定性は、医薬品にとって極めて重要である。
【0003】
また、医薬品の有効性と安全性を担保するためには、薬効成分自体の有効性や安全性が重要であるばかりでなく、生体内における薬物溶出性など、製剤の持つ特性も極めて重要である。例えば、製剤からの薬物溶出が遅すぎると、血中の薬物が有効な濃度に達せず、期待された薬効が十分に発揮されない可能性がある。一方、製剤からの薬物溶出が速すぎると、血中の薬物濃度が急激に上昇し、副作用の危険性が高まる。
すなわち、医薬品には、有効性と安全性に加え、安定性と一定の薬物溶出性が保証されていることが要求される。
一方、薬物溶出性は、薬物の溶解度と相関することが知られている。すなわち一般に、薬物の溶解度が低いほど、薬物の溶出性は悪くなることが知られている。
【0004】
強力なアンジオテンシンII受容体拮抗作用を有するベンズイミダゾール誘導体式(I)

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)またはその塩(以下、これらを総称して化合物(I)と称する場合がある)、とりわけ2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチルの塩(特許文献1)は、高血圧症などの治療薬として有望視されている。ところが、化合物(I)は通常の製剤化条件である中性のpH領域においては不安定であることから、化合物(I)が安定化するように製剤の特性を調整する必要がある。しかし、化合物(I)が安定化するpH領域においては、化合物(I)の溶解度が低い。また化合物(I)と利尿剤等の他の有効成分との配合剤は化学的特性の違いもあり、安定性および溶出性に優れた製剤への製剤化が困難であった。
【0005】
配合剤としては、アンジオテンシンII拮抗作用を有する化合物と利尿作用を有する化合物との組合せ(特許文献2)、アセトアミノフェンの内服固形製剤であって、アセトアミノフェンの不快な呈味抑制・変色防止のために二群造粒法で調製した製剤(特許文献3)が知られている。しかしながら、化合物(I)と利尿剤との配合剤で薬物の安定性と溶解性、即ち溶出性を兼ね備えた製剤は知られていない。
[先行技術文献]
[特許文献]
【特許文献1】国際公開第2005/080384号公報
【特許文献2】米国特許5721263号
【特許文献3】特開2001-294524号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
化合物(I)と利尿剤とを含有する製剤は、高血圧症、心不全、糖尿病性腎症、動脈硬化症などの循環器系疾患の予防・治療に有効であり、臨床上の有用性が極めて高い。
本発明の課題は化合物(I)および利尿剤の安定性に優れ、またそれらの溶出性にも優れた、固形製剤を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、化合物(I)の製剤中の安定性と製剤からの溶出性とを両立すべく鋭意研究を行った結果、化合物(I)にpH調整剤を共存させることにより、延いては固形製剤をpH調整剤にて化合物(I)の溶解度が低くなるpH領域に調整しうるようにすることにより、予想外にも化合物(I)の製剤中の安定性と製剤からの溶出性とが両立されることを見出した。また、化合物(I)と利尿剤との併用においても化合物(I)および利尿剤の安定性にも優れることを見出した。また、pH調整剤を添加した化合物(I)と、利尿剤とを個別に造粒することにより、両者のさらなる安定化を可能とし、通常造粒製剤に比べ化合物(I)の溶出性にもさらに優れた製剤が得られることを見出し、本発明を完成するに至った。
【0008】
すなわち、本発明は、
[1]式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、pH調整剤、および利尿剤を含有する、固形製剤。
[2]式(I)で表される化合物またはその塩が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩である[1]記載の固形製剤。
[3]利尿剤がクロルタリドンまたはヒドロクロロチアジドである、[1]又は[2]記載の固形製剤。
[4]式(I)で表される化合物の塩が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩であり、利尿剤がクロルタリドンである[1]記載の固形製剤。
[5]pH調整剤がpH2ないし5のpH調整剤である[1]記載の固形製剤。
[6]pH調整剤が酒石酸、クエン酸、乳酸、フマル酸、コハク酸、リン酸、リンゴ酸、アスコルビン酸、酢酸、および酸性アミノ酸から選ばれる酸性物質、もしくはその塩、またはそれらの溶媒和物である[1]記載の固形製剤。
[7]pH調整剤がフマル酸一ナトリウム、またはフマル酸とナトリウムイオンの供与体の組み合わせである[1]記載の固形製剤。
[8]式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、およびpH調整剤を含有する第一の部分、ならびに利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分および第二の部分をそれぞれ個別に造粒して得られる固形製剤。
[9]式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、およびpH調整剤を含有する第一の部分、ならびに利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分からなる第一層、および第二の部分からなる第二層を含む積層錠剤である、[1]記載の固形製剤。
[10]pH調整剤の配合量が、製剤に対して0.01〜20重量%である[1]記載の固形製剤。
[11]pH調整剤を配合することを特徴とする、固形製剤における式(I)で表される化合物またはその塩、および利尿剤の安定化方法。
[12]式(I)で表される化合物またはその塩、および利尿剤を含有する固形製剤において、pH調整剤を配合することを特徴とする、固形製剤からの式(I)で表される化合物またはその塩の溶出改善方法。
;などに関する。
【発明の効果】
【0009】
化合物(I)、pH調整剤および利尿剤を含有することを特徴とする本発明の固形製剤とすることにより、化合物(I)および利尿剤の安定性および溶出性に優れた製剤を提供することができる。
【図面の簡単な説明】
【0010】
【図1】実施例14および参考例3で得られた錠剤の溶出率を示す。
【図2】実施例15および参考例4で得られた錠剤の溶出率を示す。
【0011】
以下に、本発明の固形製剤を詳細に説明する。
本発明の固形製剤は、化合物(I)、pH調整剤および利尿剤を含有する、固形製剤である(本発明の固形製剤ともいう)。本発明の固形製剤は、化合物(I)の安定性に優れ、かつ該化合物の溶出性にも優れている。さらに利尿剤の安定性にも優れている。
【0012】
前記式(I)において、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、例えば、テトラゾリル基または式

〔式中、iは−O−または−S−を示し、jは>C=O、>C=Sまたは>S(O)mを示す(式中、mは0、1または2を示す)〕で表される基(例えば、4,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル基など)などが好ましい。
なお、4,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル基には、式:

で示される3つの互変異性体(a′,b′およびc′)が存在し、4,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル基は上記a′,b′およびc′のすべてを含む。
【0013】
前記式(I)において、R2はエステル化されたカルボキシル基を示し、例えば、水酸基、アミノ、ハロゲン、低級(C2-6)アルカノイルオキシ(例、アセチルオキシ、ピバロイルオキシなど)、低級(C4-7)シクロアルカノイルオキシ、 (低級(C1-6)アルコキシ)カルボニルオキシ(例、メトキシカルボニルオキシ、エトキシカルボニルオキシなど)、(低級(C3-7)シクロアルコキシ)カルボニルオキシ(例、シクロヘキシルオキシカルボニルオキシなど)、低級(C1-4)アルコキシおよび5−メチル−2−オキソ−1,3−ジオキソレン−4−イルから選ばれる置換基で置換されていてもよい低級(C1-4)アルキルでエステル化されたカルボキシル基(例えば、(5−メチル−2−オキソ−1,3−ジオキソレン−4−イル)メトキシカルボニル基、1−(シクロヘキシルオキシカルボニルオキシ)エトキシカルボニル基)などが好ましい。
【0014】
前記式(I)において、R3は置換されてもよい低級アルキルを示し、R3としては水酸基、アミノ基、ハロゲン原子および低級(C1−4)アルコキシ基から選ばれる置換基で置換されていてもよい低級(C1−5)アルキル(好ましくは、低級(C2−3)アルキル;特に好ましくは、エチル)が好ましい。
【0015】
式(I)で表される化合物の塩としては、薬学的に許容される塩が挙げられ、例えば、式(I)で表される化合物の、無機塩基との塩、有機塩基との塩、無機酸との塩、有機酸との塩、塩基性または酸性アミノ酸との塩などが挙げられる。無機塩基との塩の好適な例としては、例えばナトリウム塩、カリウム塩などのアルカリ金属塩;カルシウム塩、マグネシウム塩などのアルカリ土類金属塩;アルミニウム塩、アンモニウム塩などが挙げられる。有機塩基との塩の好適な例としては、例えば、トリメチルアミン、トリエチルアミン、ピリジン、ピコリン、エタノールアミン、ジエタノールアミン、トリエタノールアミン、ジシクロヘキシルアミン、N,N’−ジベンジルエチレンジアミンなどとの塩が挙げられる。無機酸との塩の好適な例としては、例えば、塩酸、臭化水素酸、硝酸、硫酸、リン酸などとの塩が挙げられる。有機酸との塩の好適な例としては、例えば、ギ酸、酢酸、トリフルオロ酢酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、メタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸などとの塩が挙げられる。塩基性アミノ酸との塩の好適な例としては、例えば、アルギニン、リジン、オルニチンなどとの塩が挙げられ、酸性アミノ酸との塩の好適な例としては、例えばアスパラギン酸、グルタミン酸などとの塩が挙げられる。
【0016】
式(I)で表される化合物またはその塩としては、2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチルの塩が好ましく、2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩が特に好ましい。
式(I)で表される化合物の塩は水和物または非水和物のいずれであってもよい。
また、化合物(I)は水和物を含む溶媒和物または非溶媒和物のいずれであってもよい。
【0017】
化合物(I)は、結晶状であることが好ましく、かつ融点が100〜250℃、なかでも120〜200℃、とりわけ130〜180℃であるものが好ましい。
【0018】
化合物(I)は、本発明の固形製剤中に0.1〜60重量%、好ましくは1〜40重量%、より好ましくは5〜30重量%含有される。
【0019】
本発明で用いるpH調整剤としては、化合物(I)の製剤中の安定性と製剤からの溶出性とを両立させるものであって、医薬品に適用可能であれば如何なるpH調整剤であってもよく、また複数のpH調整剤を組み合わせて用いてもよい。本発明で用いるpH調整剤としては、pHが約2ないし約5、好ましくは約3ないし約5、より好ましくは約3ないし約4を示すpH調整剤が好ましく用いられ、例えば、酒石酸、クエン酸、乳酸、フマル酸、リン酸、リンゴ酸、コハク酸、アスコルビン酸、酢酸、酸性アミノ酸(例えば、グルタミン酸、アスパラギン酸)などの酸性物質、これら酸性物質の無機塩(例えば、アルカリ金属塩、アルカリ土類金属塩、アンモニウム塩など)、これら酸性物質と有機塩基(例えば、リジン、アルギニンなどの塩基性アミノ酸、メグルミンなど)との塩、並びにそれらの溶媒和物(例えば、水和物)などが用いられる。また、当該pH調整剤は利尿剤に対しても製剤中の安定性と製剤からの溶出性とを両立させる。
ここに、pH調整剤におけるpHは次の条件下に測定したものである。即ち、25℃で水に1w/v%にてpH調整剤を溶解または懸濁させて得た溶液または懸濁液のpHである。
【0020】
本発明で用いるpH調整剤としては、酸性物質と塩基性物質とを組み合わせて用い、組み合わせたpH調整剤を25℃で水に1w/v%で溶解または懸濁させた場合に、溶液または懸濁液のpHが約2ないし約5、好ましくは約3ないし約5、より好ましくは約3ないし約4を示すように調節して用いてもよい。組み合わせて用いる酸性物質としては、上記のpH約2ないし約5の酸性物質およびそれらの塩に加え、塩酸、硫酸、リン酸などの強酸も用いることができる。組み合わせて用いる塩基性物質としては、無機塩基(例えば、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸水素ナトリウム、炭酸マグネシウム、炭酸カルシウム、酸化マグネシウム、アンモニア、合成ヒドロタルサイト)、有機塩基(例えば、リジン、アルギニンなどの塩基性アミノ酸、メグルミンなど)などが挙げられる。
さらに、本発明で用いるpH調整剤としては、リン酸二水素ナトリウム、フマル酸一ナトリウムまたはフマル酸とナトリウムイオンの供与体の組合せなどのように、溶液が当該pHにおいて緩衝能を有するものが好ましい。
本発明で用いるpH調整剤としては、フマル酸一ナトリウムまたはフマル酸とナトリウムイオンの供与体の組合せが好ましく、フマル酸と水酸化ナトリウムとを組み合わせて用いてもよい。
【0021】
本発明の固形製剤において、pH調整剤は固形製剤中、0.01〜20重量%、好ましくは0.05〜10重量%、さらに好ましくは0.1〜5重量%含有される。
【0022】
本発明における利尿剤としては、例えばキサンチン誘導体(例、サリチル酸ナトリウムテオブロミン、サリチル酸カルシウムテオブロミン等)、チアジド系製剤(例、エチアジド、シクロペンチアジド、トリクロルメチアジド、ヒドロクロロチアジド、ヒドロフルメチアジド、ベンチルヒドロクロロチアジド、ペンフルチジド、ポリチアジド、メチクロチアジド等)、抗アルドステロン製剤(例、スピロノラクトン、トリアムテレン等)、炭酸脱水酵素阻害剤(例、アセタゾラミド等)、クロルベンゼンスルホンアミド系製剤(例、クロルタリドン、メフルシド、インダパミド等)、アゾセミド、イソソルビド、エタクリン酸、ピレタニド、ブメタニド、フロセミド等が挙げられる。本発明における利尿剤には、上記利尿剤として挙げられた化合物の塩も含まれる。
本発明における利尿剤としてはクロルベンゼンスルホンアミド系製剤、チアジド系製剤等が好ましく、なかでもクロルタリドン、ヒドロクロロチアジドなどがより好ましい。とりわけクロルタリドンが好ましい。
【0023】
本発明における利尿剤は、固形製剤中、通常、0.1〜60重量%(ただし、化合物(I)およびpH調整剤との合計が100%を超えない範囲で適宜調整される)、好ましくは0.5〜40重量%、さらに好ましくは1〜30重量%含有される。具体的には、クロルタリドン(フリー体に換算して)は、通常0.1〜60重量%、好ましくは0.5〜40重量%、さらに好ましくは1〜30重量%含有される。ヒドロクロロチアジド(フリー体に換算して)は、通常0.1〜60重量%、好ましくは0.5〜40重量%、さらに好ましくは1〜30重量%含有される。
【0024】
本発明の固形製剤として好ましい形態としては、化合物(I)が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩であり利尿剤がクロルタリドンである製剤が挙げられる。
【0025】
本発明の固形製剤としては、例えば、錠剤、顆粒剤、細粒剤、カプセル剤、丸剤などの経口投与に適した固形製剤が挙げられる。
而して、本発明における固形製剤の態様としては、次のような製剤が挙げられる。
(1)化合物(I)、pH調整剤、利尿剤を混合して造粒して得られる固形製剤(一群造粒製剤)。
(2)化合物(I)およびpH調整剤を含有する第一の部分、ならびに利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分および第二の部分をそれぞれ個別に造粒して得られる固形製剤(二群造粒製剤−単層錠剤)。
(3)個別に造粒された、化合物(I)およびpH調整剤を含有する第一の部分と利尿剤を含有する第二の部分を独立させて、圧縮成形する(二群造粒製剤−積層錠剤)か、または一方の部分に他方の部分を被覆する(二群造粒製剤−被覆錠剤)ことによって得られる固形製剤。
【0026】
上記(1)の固形製剤は、pH調整剤の配合により、化合物(I)および利尿剤のそれぞれの製剤からの溶出性と安定性が両立する。また上記(2)(3)においては、化合物(I)および利尿剤のそれぞれの溶出性と安定性がより改善する。
【0027】
上記(1)の固形製剤は、自体公知の方法(例えば、第14改正日本薬局方の製剤総則に記載されている方法)により製造できる。
例えば、化合物(I)、pH調整剤、利尿剤および添加剤などを加えて混合し、結合剤を加えて顆粒とし、顆粒に滑沢剤等を加えて打錠して錠剤とする。また顆粒剤、細粒剤においても錠剤とほぼ同様の方法で製造することができる。
カプセル剤の場合は、上記の顆粒剤、細粒剤をゼラチンやヒドロキシプロピルメチルセルロース等を含有するカプセルに充填するか、もしくは有効成分を賦形剤とともに、ゼラチンやヒドロキシプロピルメチルセルロース等を含有するカプセルに充填すればよい。
【0028】
固形製剤を製造する際には、製剤分野において慣用の添加剤を含有していてもよい。該添加剤としては、例えば、賦形剤、崩壊剤、結合剤、滑沢剤、着色剤、pH調整剤、界面活性剤、安定化剤、酸味料、香料、流動化剤などが挙げられる。これら添加剤は、製剤分野において慣用の量が用いられる。
【0029】
賦形剤としては、例えば、コーンスターチ、馬鈴薯デンプン、コムギデンプン、コメデンプン、部分アルファー化デンプン、アルファー化デンプン、有孔デンプン等のデンプン類;乳糖、果糖、ブドウ糖、マンニトール(例、D−マンニトール)、ソルビトール(例、D−ソルビトール)、エリスリトール(例、D−エリスリトール)、ショ糖等の糖または糖アルコール類:無水リン酸カルシウム、結晶セルロース、微結晶セルロース、カンゾウ末、炭酸水素ナトリウム、リン酸カルシウム、硫酸カルシウム、炭酸カルシウム、沈降炭酸カルシウム、ケイ酸カルシウムなどが挙げられる。
【0030】
崩壊剤としては、例えば、アミノ酸、デンプン、コーンスターチ、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、カルボキシメチルスターチナトリウム、カルメロースナトリウム、カルメロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルスターチ、カルボキシメチルスターチナトリウム等が用いられる。
【0031】
結合剤としては、例えば、結晶セルロース(例、微結晶セルロース)、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ゼラチン、デンプン、アラビアゴム末、トラガント、カルボキシメチルセルロース、アルギン酸ナトリウム、プルラン、グリセリン等が挙げられる。
【0032】
滑沢剤の好適な例としては、例えば、ステアリン酸マグネシウム、ステアリン酸、ステアリン酸カルシウム、タルク(精製タルク)、蔗糖脂肪酸エステル、フマル酸ステアリルナトリウムなどが挙げられる。
【0033】
着色剤としては、例えば、食用黄色5号、食用赤色2号、食用青色2号などの食用色素、食用レーキ色素、三二酸化鉄などが挙げられる。
【0034】
界面活性剤としては、ラウリル硫酸ナトリウム、ポリソルベート80、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコールなどが挙げられる。
安定化剤としては、例えばトコフェロール、エデト酸四ナトリウム、ニコチン酸アミド、シクロデキストリン類などが挙げられる。
【0035】
酸味料としては、例えばアスコルビン酸、クエン酸、酒石酸、リンゴ酸などが挙げられる。
香料としては、例えばメントール、ハッカ油、レモン油、バニリンなどが挙げられる。
流動化剤としては、例えば軽質無水ケイ酸、含水二酸化ケイ素などが挙げられる。
上記した添加剤は、2種以上を適宜の割合で混合して用いてもよい。
【0036】
上記(2)の固形製剤は、第一の部分と第二の部分とが個別に造粒された製剤であり、自体公知の方法により製造することができる。
上記(2)の固形製剤であって、本発明における第一の部分は、化合物(I)およびpH調整剤を含有する部分(組成物)である。
【0037】
本発明におけるpH調整剤の使用量は、上記第一の部分100重量部に対して好ましくは0.01〜20重量部、好ましくは0.05〜10重量部、さらに好ましくは0.1〜5重量部である。
【0038】
また、pH調整剤に対する化合物(I)の重量比(化合物(I):pH調整剤)は、好ましくは1〜30:1、より好ましくは5〜25:1、さらに好ましくは10〜20:1である。
【0039】
上記第一の部分は、後述する第二の部分と一緒に固形製剤を形成できる形状、大きさであれば限定されない。
【0040】
上記第一の部分は、さらに製剤分野において慣用の添加剤を含有していてもよい。添加剤として、上述したと同様のものが用いられる。
上記第一の部分は、化合物(I)とpH調整剤とを、必要により上記添加剤とともに、自体公知の方法に従って混合し、造粒することによって製造することができる。
【0041】
上記第一の部分は、好ましくは、化合物(I)(好ましくは、2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩);pH調整剤(好ましくはフマル酸および水酸化ナトリウム);賦形剤(好ましくはマンニトールおよび結晶セルロース);結合剤(好ましくはヒドロキシプロピルセルロース)を含有する。
【0042】
本発明における第二の部分とは、利尿剤を含有する部分(組成物)である。
上記第二の部分は、前述した第一の部分と一緒に固形製剤を形成できる形状、大きさであれば限定されない。
【0043】
上記第二の部分は、さらに製剤分野において慣用の添加剤を含有していてもよく、添加剤としては、上述したと同様のものが用いられる。
具体的には、利尿剤(好ましくはクロルタリドン);賦形剤(好ましくはマンニトールおよび結晶セルロース);結合剤(好ましくはヒドロキシプロピルセルロース)を含有する。
【0044】
上記第二の部分は、利尿剤を、必要により上記添加剤とともに、自体公知の方法に従って混合し造粒することによって製造することができる。
当該利尿剤は、上記第二の部分100重量部に対して、好ましくは0.1〜60重量部、より好ましくは0.5〜40重量部、さらに好ましくは1〜30重量部である。
【0045】
本発明の固形製剤における、第一の部分に対する第二の部分の重量比(第二の部分:第一の部分)は、好ましくは0.1〜10:1、より好ましくは0.3〜5:1、さらに好ましくは、0.5〜3:1である。
個別に造粒された第一の部分と第二の部分を、さらに製剤分野において慣用の添加剤とともに混合し、圧縮成形することによって製造される単層錠剤も本発明の固形製剤に含まれる。上記単層錠剤を、カプセル(例、ヒドロキシプロピルメチルセルロースカプセル)に充填することによって製造されるカプセル剤も本発明の固形製剤に含まれる。
また、個別に造粒された第一の部分と第二の部分を、そのまま、または上記添加剤とともに混合して、カプセル(例、ヒドロキシプロピルメチルセルロースカプセル)に充填することによって製造されるカプセル剤も本発明の固形製剤に含まれる。
【0046】
上記(3)の固形製剤は、第一の部分と第二の部分とが個別に造粒された製剤であり、これらの部分を独立させて圧縮成形するか、または一方の部分に他方の部分を被覆することによって製造することができる。
【0047】
上記(3)の固形製剤の具体例としては、[1]第一の部分からなる内核および第二の部分からなる外層を含む被覆錠剤(A);[2]第二の部分からなる内核および第一の部分からなる外層を含む被覆錠剤(B); [3]第一の部分からなる第一層および第二の部分からなる第二層を含む積層錠剤が挙げられる。
【0048】
第一の部分からなる内核は、例えば、化合物(I)とpH調整剤を、必要に応じて添加剤と共に、造粒することによって製造することができる。また、造粒の後、必要により乾燥、整粒、圧縮成形などの操作を行ってもよい。
【0049】
一方、第二の部分からなる外層は、利尿剤、例えば、クロルタリドンまたはその塩を、必要に応じて添加剤と共に、造粒することによって製造することができる。
当該被覆は、例えば、圧縮成形、コーティングなどによって行われる。また、該添加剤は、好ましくは結合剤などである。
【0050】
被覆錠剤(A)を製造する際、内核と外層の直接接触を回避することを目的として、これらの間に不活性な中間層を設けてもよい。該中間層は、例えば、下記したコーティング基剤およびコーティング添加剤を含有する。該中間層は、好ましくは、水溶性フィルムコーティング基剤および流動化剤を含有する。
【0051】
上記被覆錠剤(B)は、内核として第二の部分を、外層として第一の部分を用いる以外は、被覆錠剤(A)と同様にして製造することができる。
【0052】
本発明における積層錠剤は、式(I)で表される化合物またはその塩およびpH調整剤を含有する第一の部分、および利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分からなる第一層および、第二の部分からなる第二層を含む錠剤である。
【0053】
本発明における積層錠剤は、少なくとも第一の部分からなる第一層と第二の部分からなる第二層とが一体的に成型された製剤であれば特に制限はない。
【0054】
また、本発明における積層錠剤は、第一層と第二層との間に、不活性な中間層を有していてもよい。
【0055】
本発明における積層錠剤が、このような中間層を有する場合、活性成分が互いに作用することによる悪影響(経時的な活性成分の分解や活性低下などの保存安定性の低下、経時的な活性成分溶出パターンの変化などの溶出安定性の低下など)をより効果的に抑えることができる。
【0056】
積層錠剤は、例えば、以下の製造工程にしたがって製造することができる。
化合物(I)とpH調整剤とを、必要に応じて添加剤と混合し、得られた混合物を造粒し第一の部分を得る。造粒の後、必要により乾燥、整粒などの操作を行ってもよい。その後、必要に応じて添加剤と混合し第一層とする。
次いで、利尿剤を、必要に応じて添加剤と共に造粒し、得られた第二の部分に、必要に応じて添加剤を混合した第二層を上記第一層に層状に積み重ねて圧縮成形(好ましくは打錠)する。
この際、各層の直接接触を回避するために、各層の間に不活性な中間層を設けてもよい。該中間層は、例えば、上記した賦形剤、崩壊剤、結合剤、滑沢剤、着色剤等を含有する。
【0057】
上記被覆錠剤(A)または(B)あるいは積層錠剤を、カプセル(例、ヒドロキシプロピルメチルセルロースカプセル)に充填することによって製造されるカプセル剤も本発明の固形製剤に含まれる。
【0058】
また、上記(1)〜(3)の固形製剤を、下記コーティング基剤およびコーティング添加剤によってフィルムコーティングすることによって製造されるフィルムコーティング製剤も本発明の固形製剤に含まれる。
【0059】
コーティング基剤の好適な例としては、糖衣基剤、水溶性フィルムコーティング基剤、腸溶性フィルムコーティング基剤、徐放性フィルムコーティング基剤などが挙げられる。
【0060】
糖衣基剤としては、白糖が用いられる。さらに、タルク、沈降炭酸カルシウム、ゼラチン、アラビアゴム、プルラン、カルナバロウなどから選ばれる1種または2種以上を併用してもよい。
【0061】
水溶性フィルムコーティング基剤としては、例えば、ヒドロキシプロピルセルロース[例、グレード:L、SL、SL−T、SSL(商品名);日本曹達(株)]、ヒドロキシプロピルメチルセルロース[例、TC−5(グレード:MW、E、EW、R、RW)(商品名);信越化学(株)]、ヒドロキシエチルセルロース、メチルヒドロキシエチルセルロースなどのセルロース系高分子;ポリビニルアセタールジエチルアミノアセテート、アミノアルキルメタアクリレートコポリマーE[オイドラギットE(商品名)]、ポリビニルピロリドンなどの合成高分子;プルランなどの多糖類などが挙げられる。
【0062】
腸溶性フィルムコーティング基剤としては、例えば、ヒドロキシプロピルメチルセルロース フタレート、ヒドロキシプロピルメチルセルロース アセテートサクシネート、カルボキシメチルエチルセルロース、酢酸フタル酸セルロースなどのセルロース系高分子;メタアクリル酸コポリマーL[オイドラギットL(商品名)]、メタアクリル酸コポリマーLD[オイドラギットL−30D55(商品名)]、メタアクリル酸コポリマーS[オイドラギットS(商品名)]などのアクリル酸系高分子;セラックなどの天然物などが挙げられる。
【0063】
徐放性フィルムコーティング基剤としては、例えば、エチルセルロースなどのセルロース系高分子;アミノアルキルメタアクリレートコポリマーRS[オイドラギットRS(商品名)]、アクリル酸エチル・メタアクリル酸メチル共重合体懸濁液[オイドラギットNE(商品名)]などのアクリル酸系高分子などが挙げられる。
【0064】
コーティング添加剤の好適な例としては、酸化チタンなどの遮光剤、タルクなどの流動化剤、および/または三二酸化鉄、黄色三二酸化鉄などの着色剤;ポリエチレングリコール[例、マクロゴール6000(商品名)]、クエン酸トリエチル、ヒマシ油、ポリソルベート類などの可塑剤;クエン酸、酒石酸、リンゴ酸、アスコルビン酸などの有機酸;などが挙げられる。
【0065】
また、本発明の固形製剤には、識別性のための刻印あるいは文字を印刷してあってもよく、分割用の割線を付してあってもよい。
【0066】
本発明の固形製剤は、服用性、製剤強度などの観点から、フィルムコーティングされていることが好ましい。
前記製造工程において、混合、圧縮成形、コーティングなどの操作は、製剤技術分野において慣用の方法にしたがって行われる。
【0067】
混合は、例えば、V型混合機、タンブラー混合機などの混合機;および高速攪拌造粒機、流動層造粒乾燥機、押し出し造粒機、ローラーコンパクターなどの造粒機を用いて行われる。
【0068】
圧縮成形は、例えば、単発錠剤機、ロータリー式打錠機などを用いて行われる。
なお、単発錠剤機、ロータリー式打錠機などを用いて圧縮成形を行う際には、通常1〜20kN/cm2(好ましくは5〜15kN/cm2)の打錠圧を採用することが好ましく、さらに、キャッピング防止を目的として、テーパー形状の臼を用いることが好ましい。
【0069】
コーティングは、例えば、フィルムコーティング装置などを用いて行われる。
【0070】
本発明の固形製剤は、哺乳動物(例えば、ヒト、イヌ、ウサギ、ラット、マウスなど)の医薬として安全に使用することができる。
患者に対する化合物(I)の投与量は、年齢、体重、一般的健康状態、性別、食事、投与時間、排泄速度、薬物の組み合わせなどを考慮し、また患者のその時に治療を行っている病状の程度に応じて決められるが、一日投与量約0.05〜500mg、好ましくは0.1〜100mgである。
患者に対する利尿剤の投与量は、年齢、体重、一般的健康状態、性別、食事、投与時間、排泄速度、薬物の組み合わせなどを考慮し、また患者のその時に治療を行っている病状の程度に応じて決められるが、例えば、クロルタリドン(フリー体に換算して)は、一日投与量約12.5〜100mg、好ましくは15〜50mgである。ヒドロクロロチアジド(フリー体に換算して)の場合は、一日投与量約12.5〜100mg、好ましくは15〜50mgである。
【0071】
化合物(I)は、強力なアンジオテンシンII拮抗作用を有することから、本発明の医薬組成物は、哺乳動物(例、ヒト、サル、ネコ、ブタ、ウマ、ウシ、マウス、ラット、モルモット、イヌ、ウサギなど)に対し、アンジオテンシンII受容体を介して発現する血管の収縮および増殖や臓器障害により、アンジオテンシンIIの存在により、あるいはアンジオテンシンIIが存在すると誘発される因子により発症する疾患(または発症が促進される疾患)の予防または治療薬として有用である。
本発明の固形製剤は、化合物(I)と利尿剤を組み合わせることにより、上記疾患の予防または治療薬として有用であり、化合物(I)や利尿剤を単独で使用する場合における投与量を減らすことが可能であり、副作用の発現を抑えることができる。
【0072】
本願においては、式(I)で表される化合物またはその塩、および利尿剤を含有する固形製剤において、pH調整剤を配合することを特徴とする、固形製剤における式(I)で表される化合物またはその塩および利尿剤の安定化方法を提供する。本発明の安定化方法によれば、固形製剤中における化合物(I)および利尿剤が有意に安定化される。また、式(I)で表される化合物またはその塩、および利尿剤を含有する固形製剤において、pH調整剤を配合することを特徴とする、固形製剤からの式(I)で表される化合物またはその塩の溶出改善方法を提供する。本発明の溶出改善方法によれば、固形製剤からの化合物(I)および利尿剤の溶出性が有意に改善される。
【実施例】
【0073】
以下に、実施例、実験例を挙げて本発明をさらに詳細に説明するが、本発明はこれらにより限定されるものではない。
なお、実施例として記載された処方において活性成分以外の成分(添加物)は、日本薬局方、日本薬局方外医薬品規格または医薬品添加物規格における収載品などを用いることができる。
【0074】
実施例1
(1)流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩(以下化合物Aという)(1067g)およびマンニトール(1968g)を均一に混合後、ヒドロキシプロピルセルロース(112.5g)、フマル酸(46.5g)および水酸化ナトリウム(16g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Aを得た。
(2)流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、クロルタリドン(300g)、およびマンニトール(402g)を均一に混合後、ヒドロキシプロピルセルロース(27g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Bを得た。
(3)得られた整粒末A(128.4g)、および整粒末B(121.5g)にクロスカルメロースナトリウム(24.68g)、結晶セルロース(30.86g)およびステアリン酸マグネシウム(3.08g)を加え、袋中で混合した。
(4)得られた混合物をロータリー打錠機(アクエリアス、菊水製作所)で7mmφの杵を用いて打錠(打錠圧:4KN/杵、錠剤1錠あたりの重量:154.26mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0075】
製剤(154.26mgあたり)の組成
化合物A 21.34mg
マンニトール 39.36mg
ヒドロキシプロピルセルロース 2.25mg
フマル酸 0.93mg
水酸化ナトリウム 0.32mg
クロルタリドン 25 mg
マンニトール 33.5 mg
ヒドロキシプロピルセルロース 2.25mg
クロスカルメロースナトリウム 12.34mg
結晶セルロース 15.43mg
ステアリン酸マグネシウム 1.54mg
計 154.26mg
【0076】
実施例2
(1)流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、化合物A(256.1g)およびマンニトール(429.8g)を均一に混合後、ヒドロキシプロピルセルロース(27g)、フマル酸(12g)および水酸化ナトリウム(4.14g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Aを得た。得られた整粒末A(85.36g)、にクロスカルメロースナトリウム(24g)、結晶セルロース(30g)およびステアリン酸マグネシウム(3g)を加え、袋中で混合し、混合末Aを得た。
(2)転動流動層造粒乾燥機(SPIR−A−FLOW、フロイント産業株式会社)中に、結晶セルロース(粒)を投入し、クロルタリドン(105g)、結晶セルロース(6.3g)、低置換度ヒドロキシプロピルセルロース(16.8mg)、およびヒドロキシプロピルメチルセルロース(16.8g)の分散液を噴霧してレイアリングし、ついで機内で乾燥した。得られた細粒を篩で篩過し、150〜500μmの細粒Bを得た。
(3)得られた混合末A(3g)と細粒B(0.525g)をガラス瓶中で混合した。得られた混合物をオートグラフ(島津製作所製、AG−5000B)で9.5mmφの杵を用いて打錠(打錠圧:7KN/杵、錠剤1錠あたりの重量:352.5mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0077】
製剤(352.5mgあたり)の組成
化合物A 85.36mg
マンニトール 143.26mg
ヒドロキシプロピルセルロース 9 mg
フマル酸 4 mg
水酸化ナトリウム 1.38mg
クロルタリドン 25 mg
結晶セルロース(粒) 18 mg
結晶セルロース 1.5 mg
低置換度ヒドロキシプロピルセルロース 4 mg
ヒドロキシプロピルメチルセルロース 4 mg
クロスカルメロースナトリウム 24 mg
結晶セルロース 30 mg
ステアリン酸マグネシウム 3 mg
計 352.5 mg
【0078】
実施例3
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(54430g)および整粒末B(26410g)に結晶セルロース(9720g)、クロスポビドン(5670g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で8.5mmφの杵を用いて打錠(打錠圧:8kN、1錠あたりの重量:270mg)し、素錠を得た。
(5)精製水(37800g)にヒドロキシプロピルメチルセルロース(4095g)とタルク(630g)を溶解、分散して、分散液Iを得た。精製水(9450g)に酸化チタン(493.5g)および酸化鉄(31.5g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0079】
製剤(280mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 21. 34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
水酸化ナトリウム 0.345mg
フマル酸 1 mg
ヒドロキシプロピルセルロース 2.7 mg
結晶セルロース 27 mg
クロスポビドン 15.75 mg
ステアリン酸マグネシウム 2.7 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0080】
実施例4
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(54430g)および整粒末B(26410g)に結晶セルロース(9720g)、クロスポビドン(5670g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で8.5mmφの杵を用いて打錠(打錠圧:8kN、1錠あたりの重量:270mg)し、素錠を得た。
(5)精製水(37800g)にヒドロキシプロピルメチルセルロース(4095g)とタルク(630g)を溶解、分散して、分散液Iを得た。精製水(9450g)に酸化チタン(493.5g)および酸化鉄(31.5g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0081】
製剤(280mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 21. 34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
水酸化ナトリウム 0.345mg
フマル酸 1 mg
ヒドロキシプロピルセルロース 2.7 mg
結晶セルロース 27 mg
クロスポビドン 15.75 mg
ステアリン酸マグネシウム 2.7 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0082】
実施例5
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(40820g)および整粒末B(39610g)に結晶セルロース(9720g)、クロスポビドン(6075g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で9.5mmφの杵を用いて打錠(打錠圧:9kN、1錠あたりの重量:360mg)し、素錠を得た。
(5)精製水(32040g)にヒドロキシプロピルメチルセルロース(3471g)とタルク(534g)を溶解、分散して、分散液Iを得た。精製水(8010g)に酸化チタン(418.3g)および酸化鉄(26.7g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0083】
製剤(370mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 42.68 mg
マンニトール 86.93 mg
結晶セルロース 9 mg
水酸化ナトリウム 0.69 mg
フマル酸 2 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 36 mg
クロスポビドン 22.5 mg
ステアリン酸マグネシウム 3.6 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 370 mg
【0084】
実施例6
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(40820g)および整粒末B(39610g)に結晶セルロース(9720g)、クロスポビドン(6075g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で9.5mmφの杵を用いて打錠(打錠圧:9kN、1錠あたりの重量:360mg)し、素錠を得た。
(5)精製水(32040g)にヒドロキシプロピルメチルセルロース(3471g)とタルク(534g)を溶解、分散して、分散液Iを得た。精製水(8010g)に酸化チタン(418.3g)および酸化鉄(26.7g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0085】
製剤(370mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 42.68 mg
マンニトール 86.93 mg
結晶セルロース 9 mg
水酸化ナトリウム 0.69 mg
フマル酸 2 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 36 mg
クロスポビドン 22.5 mg
ステアリン酸マグネシウム 3.6 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 370 mg
【0086】
実施例7
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(27220g)および整粒末B(52810g)に結晶セルロース(9720g)、クロスポビドン(6480g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で長径14mm、短径8mmの杵を用いて打錠(打錠圧:10kN、1錠あたりの重量:540mg)し、素錠を得た。
(5)精製水(37440g)にヒドロキシプロピルメチルセルロース(4056g)とタルク(624g)を溶解、分散して、分散液Iを得た。精製水(9360g)に酸化チタン(488.8g)および酸化鉄(31.2g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0087】
製剤(560mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0088】
実施例8
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(27220g)および整粒末B(52810g)に結晶セルロース(9720g)、クロスポビドン(6480g)およびステアリン酸マグネシウム(972g)を加え、タンブラー混合機(TM−400S、昭和化学機械工作所)で混合することにより、混合末を得た。
(4)混合末をロータリー式打錠機(アクエリアス36K、菊水製作所)で長径14mm、短径8mmの杵を用いて打錠(打錠圧:10kN、1錠あたりの重量:540mg)し、素錠を得た。
(5)精製水(37440g)にヒドロキシプロピルメチルセルロース(4056g)とタルク(624g)を溶解、分散して、分散液Iを得た。精製水(9360g)に酸化チタン(488.8g)および酸化鉄(31.2g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0089】
製剤(560mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0090】
実施例9
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(60480g)に結晶セルロース(7200g)、クロスポビドン(3600g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(58680g)に結晶セルロース(7200g)、クロスポビドン(5400g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Bを得た。
(3)混合末A(180mg)および混合末B(90mg)をロータリー式打錠機(アクア08242L2JI、菊水製作所)で8.5mmφの杵を用いて打錠(打錠圧7kN、1錠あたりの重量:270mg)し、素錠を得た。
(4)精製水(7750g)にヒドロキシプロピルメチルセルロース(780g)とタルク(120g)を溶解、分散して分散液Iを調製した。精製水(1000g)に酸化チタン(94g)、酸化鉄(6g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(250g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0091】
製剤(280mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 18 mg
クロスポビドン 9 mg
ステアリン酸マグネシウム 1.8 mg
化合物A 21.34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
水酸化ナトリウム 0.345mg
フマル酸 1 mg
ヒドロキシプロピルセルロース 2.7 mg
結晶セルロース 9 mg
クロスポビドン 6. 75 mg
ステアリン酸マグネシウム 0.9 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0092】
実施例10
(1)精製水(80620g)にヒドロキシプロピルセルロース(5122g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10740g)、マンニトール(48080g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(60480g)に結晶セルロース(7200g)、クロスポビドン(3600g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(58680g)に結晶セルロース(7200g)、クロスポビドン(5400g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Bを得た。
(3)混合末A(180mg)および混合末B(90mg)をロータリー式打錠機(アクア08242L2JI、菊水製作所)で8.5mmφの杵を用いて打錠(打錠圧7kN、1錠あたりの重量:270mg)し、素錠を得た。
(4)精製水(7750g)にヒドロキシプロピルメチルセルロース(780g)とタルク(120g)を溶解、分散して分散液Iを調製した。精製水(1000g)に酸化チタン(94g)、酸化鉄(6g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(250g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0093】
製剤(280mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 18 mg
クロスポビドン 9 mg
ステアリン酸マグネシウム 1.8 mg
化合物A 21.34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
水酸化ナトリウム 0.345mg
フマル酸 1 mg
ヒドロキシプロピルセルロース 2.7 mg
結晶セルロース 9 mg
クロスポビドン 6. 75 mg
ステアリン酸マグネシウム 0.9 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0094】
実施例11
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(5375g)、マンニトール(53450g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(60480g)に結晶セルロース(7200g)、クロスポビドン(3600g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(58680g)に結晶セルロース(7200g)、クロスポビドン(5400g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Bを得た。
(3)混合末A(180mg)および混合末B(360mg)をロータリー式打錠機(アクア08242L2JI、菊水製作所)で長径14mm、短径8mmの杵を用いて打錠(打錠圧10kN、1錠あたりの重量:540mg)し、素錠を得た。
(4)精製水(7750g)にヒドロキシプロピルメチルセルロース(780g)とタルク(120g)を溶解、分散して分散液Iを調製した。精製水(1000g)に酸化チタン(94g)、酸化鉄(6g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(250g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0095】
製剤(560mgあたり)の組成
クロルタリドン 12.5 mg
マンニトール 124.3 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 18 mg
クロスポビドン 9 mg
ステアリン酸マグネシウム 1.8 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 36 mg
クロスポビドン 27 mg
ステアリン酸マグネシウム 3.6 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0096】
実施例12
(1)精製水(80620g)にヒドロキシプロピルセルロース(5122g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10740g)、マンニトール(48080g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(60480g)に結晶セルロース(7200g)、クロスポビドン(3600g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)、結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末を得た。得られた整粒末(58680g)に結晶セルロース(7200g)、クロスポビドン(5400g)およびステアリン酸マグネシウム(720g)を加え、タンブラー混合機(TM−400S、昭和化学機械製作所)で混合することにより、混合末Bを得た。
(3)混合末A(180mg)および混合末B(360mg)をロータリー式打錠機(アクア08242L2JI、菊水製作所)で長径14mm、短径8mmの杵を用いて打錠(打錠圧10kN、1錠あたりの重量:540mg)し、素錠を得た。
(4)精製水(35000g)にヒドロキシプロピルメチルセルロース(3900g)とタルク(600g)を溶解、分散して、分散液Iを得た。精製水(10000g)に酸化チタン(470g)および酸化鉄(30g)を分散して、分散液IIを調製した。分散液Iに分散液IIを加え、撹拌混合し、コーティング液を得た。コーティング機(DRC−1200、株式会社パウレック)を用いて、(4)で得た素錠に該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0097】
製剤(560mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
結晶セルロース 18 mg
クロスポビドン 9 mg
ステアリン酸マグネシウム 1.8 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 36 mg
クロスポビドン 27 mg
ステアリン酸マグネシウム 3.6 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0098】
実施例13
(1)流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、化合物A(85.36g)、クロルタリドン(100g)、およびマンニトール(91.26g)を均一に混合後、ヒドロキシプロピルセルロース(10.8g)、フマル酸(4g)および水酸化ナトリウム(1.38g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(248.88g)にクロスカルメロースナトリウム(23.46g)、結晶セルロース(30.6g)およびステアリン酸マグネシウム(3.06g)を加え、袋中で混合した。
(2)得られた混合物をロータリー打錠機(アクエリアス、菊水製作所)で6mmφの杵を用いて打錠(打錠圧:3KN/杵、錠剤1錠あたりの重量:90mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0099】
製剤(90mgあたり)の組成
化合物A 21.34 mg
クロルタリドン 25 mg
マンニトール 22.815mg
ヒドロキシプロピルセルロース 2.7 mg
フマル酸 1 mg
水酸化ナトリウム 0.345mg
クロスカルメロースナトリウム 6.9 mg
結晶セルロース 9 mg
ステアリン酸マグネシウム 0.9 mg
計 90 mg
【0100】
実施例14
流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、化合物A(597.5g)、クロルタリドン(175g)、マンニトール(2000g)および結晶セルロース(189g)を均一に混合後、ヒドロキシプロピルセルロース(113.4g)、フマル酸(28g)および水酸化ナトリウム(9.66g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(2668g)に結晶セルロース(324g)、クロスポビドン(216g)およびステアリン酸マグネシウム(32.4g)を加え、タンブラー混合機(TM−15、昭和化学機械工作所)内で混合した。得られた混合物をロータリー打錠機(VEL50306SS2MZ、菊水製作所製)で長径14.8mm、短径8mmの杵を用いて打錠(打錠圧:8KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で15時間真空乾燥した。
【0101】
製剤(540mgあたり)の組成
クロルタリドン 25 mg
化合物A 85.36 mg
マンニトール 285.66 mg
結晶セルロース 27 mg
ヒドロキシプロピルセルロース 16.2 mg
フマル酸 4 mg
水酸化ナトリウム 1.38 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
計 540 mg
【0102】
実施例15
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、化合物A(1024g)、マンニトール(2086g)および結晶セルロース(216g)を均一に混合後、ヒドロキシプロピルセルロース(129.6g)、フマル酸(48g)および水酸化ナトリウム(16.56g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Bを得た。
(3)得られた整粒末A(907.2g)および整粒末B(1760g)に結晶セルロース(324g)、クロスポビドン(216g)およびステアリン酸マグネシウム(32.4g)を加え、タンブラー混合機(TM−15、昭和化学機械工作所)で混合することにより、混合末を得た。得られた混合物をロータリー打錠機(VEL50306SS2MZ、菊水製作所製)で長径14.8mm、短径8mmの杵を用いて打錠(打錠圧:8KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で15時間真空乾燥した。
【0103】
製剤(540mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
ヒドロキシプロピルセルロース 10.8 mg
フマル酸 4 mg
水酸化ナトリウム 1.38 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
計 540 mg
【0104】
実施例16
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(2688g)、マンニトール(56140g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)および結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(8467g)および整粒末B(4108g)に結晶セルロース(1512g)、クロスポビドン(882g)およびステアリン酸マグネシウム(151.2g)を加え、タンブラー混合機(TM−60S、昭和化学機械工作所)で混合することにより、混合末を得た。得られた混合物をロータリー打錠機(コレクト12K、菊水製作所製)で8.5mmφの杵を用いて打錠(打錠圧:6KN/杵、錠剤1錠あたりの重量:270mg)し、下記組成の素錠を得た。
(4)精製水(3850g)にヒドロキシプロピルメチルセルロース(390g)とタルク(60g)を溶解、分散して分散液Iを調製した。精製水(500g)に酸化チタン(47g)、酸化鉄(3g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(150g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり10mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0105】
製剤(280mgあたり)の組成
クロルタリドン 6.25 mg
マンニトール 130.55 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 21.34 mg
マンニトール 43.465mg
結晶セルロース 4.5 mg
ヒドロキシプロピルセルロース 2.7 mg
フマル酸 1 mg
水酸化ナトリウム 0.345mg
結晶セルロース 27 mg
クロスポビドン 15.75 mg
ステアリン酸マグネシウム 2.7 mg
ヒドロキシプロピルメチルセルロース 7.8 mg
タルク 1.2 mg
酸化チタン 0.94 mg
酸化鉄 0.06 mg
計 280 mg
【0106】
実施例17
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(2688g)、マンニトール(56140g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)精製水(38230g)に水酸化ナトリウム(405.8g)およびフマル酸(1176g)を溶解して、緩衝液を調製した。精製水(47240g)にヒドロキシプロピルセルロース(3019g)を溶解して結合液IIを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で化合物A(20060g)、マンニトール(40860g)および結晶セルロース(4230g)を均一に混合した後、緩衝液(31810g)を噴霧し、さらに結合液II(42260g)を噴霧しながら造粒し、ついで乾燥して造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Bを得た。
(3)得られた整粒末A(4234g)および整粒末B(8215g)に結晶セルロース(1512g)、クロスポビドン(1008g)およびステアリン酸マグネシウム(151.2g)を加え、タンブラー混合機(TM−60S、昭和化学機械工作所)で混合することにより、混合末を得た。得られた混合物をロータリー打錠機(コレクト12K、菊水製作所製)で長径14mm、短径8mmの杵を用いて打錠(打錠圧:10.5KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。
(4)精製水(3850g)にヒドロキシプロピルメチルセルロース(390g)とタルク(60g)を溶解、分散して分散液Iを調製した。精製水(500g)に酸化チタン(47g)、酸化鉄(3g)を分散して分散液IIを調製した。分散液Iに分散液IIおよび精製水(150g)を混合し、コーティング液を調製した。コーティング機(DRC−650、株式会社パウレック)を用いて、(3)で得た該素錠の重量が1錠あたり20mg増加するまでコーティング液を噴霧することにより、下記組成のフィルム錠を得た。次いで、該フィルム錠を40℃で15時間真空乾燥した。
【0107】
製剤(560mgあたり)の組成
クロルタリドン 6.25 mg
マンニトール 130.55 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 173.86 mg
結晶セルロース 18 mg
水酸化ナトリウム 1.38 mg
フマル酸 4 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
ヒドロキシプロピルメチルセルロース 15.6 mg
タルク 2.4 mg
酸化チタン 1.88 mg
酸化鉄 0.12 mg
計 560 mg
【0108】
参考例1
流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、化合物A(42.68g)、乳糖(217.32g)、結晶セルロース(32g)およびフマル酸一ナトリウム(10g)を均一に混合後、ヒドロキシプロピルセルロース(12g)およびフマル酸一ナトリウム(10g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(16.2g)に低置換度ヒドロキシプロピルセルロース(0.8g)を加え、ガラス瓶中で混合した。得られた混合物をオートグラフ(島津製作所製、AG−5000B)で9.5mmφの杵を用いて打錠(打錠圧:7.5KN/杵、錠剤1錠あたりの重量:398.3mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0109】
製剤(398.3mgあたり)の組成
化合物A 50 mg
乳糖 254.6mg
結晶セルロース 37.5mg
ヒドロキシプロピルセルロース 14.1mg
フマル酸一ナトリウム 23.4mg
低置換度ヒドロキシプロピルセルロース 18.7mg
計 398.3mg
【0110】
参考例2
流動層造粒乾燥機(Lab−1、株式会社パウレック)中で、化合物A(42.68g)、乳糖(217.32g)、および結晶セルロース(32g)を均一に混合後、ヒドロキシプロピルセルロース(12g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(15.2g)に低置換度ヒドロキシプロピルセルロース(0.8g)を加え、ガラス瓶中で混合した。得られた混合物をオートグラフ(島津製作所製、AG−5000B)で9.5mmφの杵を用いて打錠(打錠圧:7.5KN/杵、錠剤1錠あたりの重量:374.9mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で16時間真空乾燥した。
【0111】
製剤(374.9mgあたり)の組成
化合物A 50 mg
乳糖 254.6mg
結晶セルロース 37.5mg
ヒドロキシプロピルセルロース 14.1mg
低置換度ヒドロキシプロピルセルロース 18.7mg
計 374.9mg
【0112】
参考例3
流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、化合物A(597.5g)、クロルタリドン(175g)、マンニトール(2037g)、結晶セルロース(189g)を均一に混合後、ヒドロキシプロピルセルロース(113.4g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末を得た。得られた整粒末(2668g)に結晶セルロース(324g)、クロスポビドン(216g)およびステアリン酸マグネシウム(32.4g)を加え、タンブラー混合機(TM−15、昭和化学機械工作所)内で混合した。得られた混合物をロータリー打錠機(VEL50306SS2MZ、菊水製作所製)で長径14.8mm、短径8mmの杵を用いて打錠(打錠圧:8KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で15時間真空乾燥した。
【0113】
製剤(540mgあたり)の組成
クロルタリドン 25 mg
化合物A 85.36 mg
マンニトール 291.04 mg
結晶セルロース 27 mg
ヒドロキシプロピルセルロース 16.2 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
計 540 mg
【0114】
参考例4
(1)精製水(44070g)にヒドロキシプロピルセルロース(2800g)を溶解して結合液Iを調製した。流動層造粒乾燥機(WSG−60、株式会社パウレック)中で、クロルタリドン(10750g)、マンニトール(48070g)および結晶セルロース(3870g)を均一に混合した後、結合液I(38870g)を噴霧しながら、造粒し、ついで乾燥して、造粒末を得た。得られた造粒末の一部をパワーミル粉砕機(P−7S、昭和化学機械工作所)を用い、1.5mmφパンチングスクリーンで解砕して、整粒末Aを得た。
(2)流動層造粒乾燥機(FD−5S、株式会社パウレック)中で、化合物A(1024g)、マンニトール(2151g)、結晶セルロース(216g)を均一に混合後、ヒドロキシプロピルセルロース(129.6g)の水溶液を噴霧して造粒し、ついで機内で乾燥した。得られた造粒物を16メッシュ(目開き1.0mm)の篩で篩過し整粒末Bを得た。
(3)得られた整粒末A(907.2g)および整粒末B(1760g)に結晶セルロース(324g)、クロスポビドン(216g)およびステアリン酸マグネシウム(32.4g)を加え、タンブラー混合機(TM−15、昭和化学機械工作所)で混合することにより、混合末を得た。得られた混合物をロータリー打錠機(VEL50306SS2MZ、菊水製作所製)で長径14.8mm、短径8mmの杵を用いて打錠(打錠圧:8KN/杵、錠剤1錠あたりの重量:540mg)し、下記組成の素錠を得た。次いで、該素錠を40℃で15時間真空乾燥した。
【0115】
製剤(540mgあたり)の組成
クロルタリドン 25 mg
マンニトール 111.8 mg
結晶セルロース 9 mg
ヒドロキシプロピルセルロース 5.4 mg
化合物A 85.36 mg
マンニトール 179.24 mg
結晶セルロース 18 mg
ヒドロキシプロピルセルロース 10.8 mg
結晶セルロース 54 mg
クロスポビドン 36 mg
ステアリン酸マグネシウム 5.4 mg
計 540 mg
【0116】
実験例1
実施例1および実施例13で得た乾燥素錠を、ガラス瓶に乾燥剤とともに入れ、60℃に2週間保存した際の、分解物の増加量を以下のような方法で測定した。
化合物Aが約1μg/mLとなるように抽出液で溶解し、非水系フィルター(0.45μm)でろ過した後、次の条件で高速液体カラムクロマトグラフィー(HPLC)法により定量した。
【0117】
HPLC条件
検出器:紫外線吸光光度計、測定波長:240nm
カラム:YMC−Pack ProC18、5μm、内径:4.6mm、長さ:150mm
カラム温度:25℃
移動相(A):0.05mol/Lリン酸緩衝液(pH3.0)/アセトニトリル混液(9:1)
移動相(B):0.05mol/Lリン酸緩衝液(pH3.0)/アセトニトリル混液(3:7)
流量:1mL/分
グラジェントプログラム(リニア)

【0118】
結果を表1に示す。表1に示すように、それぞれの化合物を個別に造粒することにより、化合物Aの分解が抑えられることが示された。
【0119】
表1

【0120】
実験例2
実施例14および参考例3で得た乾燥素錠の薬物溶出性を溶出試験(0.5w/w%ドデシル硫酸ナトリウム含有リン酸緩衝液(pH6.8)900mL、パドル法、回転数50rpm、37℃)により評価した。結果を図1に示す。−●−は実施例14の乾燥素錠の結果を示す。−○−は参考例3の乾燥素錠の結果を示す。
図1に示すように、pH調整剤の添加により、溶出性が改善されることが示された。
【0121】
実験例3
実施例14および参考例3で得た乾燥素錠を、ガラス瓶に乾燥剤とともに入れ、40℃に1ヶ月間保存した際の、分解物の増加量を以下のような方法で測定した。
化合物Aが約1μg/mLとなるように抽出液で溶解し、非水系フィルター(0.45μm)でろ過した後、次の条件で高速液体カラムクロマトグラフィー(HPLC)法により定量した。
【0122】
HPLC条件
検出器:紫外線吸光光度計、測定波長:240nm
カラム:YMC−Pack ProC18、5μm、内径:4.6mm、長さ:150mm
カラム温度:25℃
移動相(A):0.05mol/Lリン酸緩衝液(pH4.0)/アセトニトリル/テトラヒドロフラン混液(40:7:3)
移動相(B):アセトニトリル/0.05mol/Lリン酸緩衝液(pH4.0)/テトラヒドロフラン混液(49:30:21)
流量:1mL/分
グラジェントプログラム(リニア)

結果を表2に示す。表2に示すように、pH調整剤の添加により、化合物Aの分解が抑えられることが示された。
【0123】
表2

【0124】
実験例4
実施例15および参考例4で得た乾燥素錠の薬物溶出性を実験例2と同様の方法で評価した。結果を図2に示す。−●−は実施例15の乾燥素錠の結果を示す。−○−は参考例4の乾燥素錠の結果を示す。
図2に示すように、pH調整剤の添加により、溶出性が改善されることが示された。
【0125】
実験例5
実施例14および実施例15で得た乾燥素錠を、ガラス瓶に乾燥剤とともに入れ、40℃に1ヶ月間保存した際の、分解物の増加量を実験例3と同様の方法で測定した。
【0126】
結果を表3に示す。表3に示すように、それぞれの化合物を個別に造粒することにより、化合物Aの分解が抑えられることが示された。
【0127】
表3

【産業上の利用可能性】
【0128】
本発明の固形製剤は、高血圧症、心不全、糖尿病性腎症、動脈硬化症などの循環器系疾患の予防・治療に有用である。前記式(I)で表される化合物および利尿剤と共にpH調整剤を含有する本発明の固形製剤は、式(I)で表される化合物および利尿剤の優れた安全性並びに溶出性を示す。
【0129】
以上、本発明の具体的な態様のいくつかを詳細に説明したが、当業者であれば示された特定の態様には、本発明の教示と利点から実質的に逸脱しない範囲で様々な修正と変更をなすことは可能である。従って、そのような修正及び変更も、すべて後記の請求の範囲で請求される本発明の精神と範囲内に含まれるものである。
【0130】
本出願は、米国仮出願61/085,201及び61/085,627を基礎としており、その内容は本明細書に全て包含されるものである。
【特許請求の範囲】
【請求項1】
式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、pH調整剤、および利尿剤を含有する、固形製剤。
【請求項2】
式(I)で表される化合物またはその塩が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩である請求項1記載の固形製剤。
【請求項3】
利尿剤がクロルタリドンまたはヒドロクロロチアジドである、請求項1又は2記載の固形製剤。
【請求項4】
式(I)で表される化合物の塩が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩であり、利尿剤がクロルタリドンである請求項1記載の固形製剤。
【請求項5】
pH調整剤がpH2ないし5のpH調整剤である請求項1記載の固形製剤。
【請求項6】
pH調整剤が酒石酸、クエン酸、乳酸、フマル酸、コハク酸、リン酸、リンゴ酸、アスコルビン酸、酢酸、および酸性アミノ酸から選ばれる酸性物質、もしくはその塩、またはそれらの溶媒和物である請求項1記載の固形製剤。
【請求項7】
pH調整剤がフマル酸一ナトリウム、またはフマル酸とナトリウムイオンの供与体の組み合わせである請求項1記載の固形製剤。
【請求項8】
式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、およびpH調整剤を含有する第一の部分、ならびに
利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分および第二の部分をそれぞれ個別に造粒して得られる固形製剤。
【請求項9】
式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩およびpH調整剤を含有する第一の部分、ならびに
利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分からなる第一層、および第二の部分からなる第二層を含む積層錠剤である、請求項1記載の固形製剤。
【請求項10】
pH調整剤の配合量が、製剤に対して0.01〜20重量%である請求項1記載の固形製剤。
【請求項11】
pH調整剤を配合することを特徴とする、固形製剤における式(I)で表される化合物またはその塩、および利尿剤の安定化方法。
【請求項12】
式(I)で表される化合物またはその塩、および利尿剤を含有する固形製剤において、pH調整剤を配合することを特徴とする、固形製剤からの式(I)で表される化合物またはその塩の溶出改善方法。
【請求項1】
式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、pH調整剤、および利尿剤を含有する、固形製剤。
【請求項2】
式(I)で表される化合物またはその塩が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩である請求項1記載の固形製剤。
【請求項3】
利尿剤がクロルタリドンまたはヒドロクロロチアジドである、請求項1又は2記載の固形製剤。
【請求項4】
式(I)で表される化合物の塩が2-エトキシ-1-{[2'-(5-オキソ-4,5-ジヒドロ-1,2,4-オキサジアゾール-3-イル)ビフェニル-4-イル]メチル}-1H-ベンズイミダゾール-7-カルボン酸 (5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル カリウム塩であり、利尿剤がクロルタリドンである請求項1記載の固形製剤。
【請求項5】
pH調整剤がpH2ないし5のpH調整剤である請求項1記載の固形製剤。
【請求項6】
pH調整剤が酒石酸、クエン酸、乳酸、フマル酸、コハク酸、リン酸、リンゴ酸、アスコルビン酸、酢酸、および酸性アミノ酸から選ばれる酸性物質、もしくはその塩、またはそれらの溶媒和物である請求項1記載の固形製剤。
【請求項7】
pH調整剤がフマル酸一ナトリウム、またはフマル酸とナトリウムイオンの供与体の組み合わせである請求項1記載の固形製剤。
【請求項8】
式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩、およびpH調整剤を含有する第一の部分、ならびに
利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分および第二の部分をそれぞれ個別に造粒して得られる固形製剤。
【請求項9】
式(I):

(式中、R1は脱プロトン化しうる水素原子を有する単環状の含窒素複素環基を示し、R2はエステル化されたカルボキシル基を示し、R3は置換されてもよい低級アルキルを示す)で表される化合物またはその塩およびpH調整剤を含有する第一の部分、ならびに
利尿剤を含有する第二の部分を含む固形製剤であって、第一の部分からなる第一層、および第二の部分からなる第二層を含む積層錠剤である、請求項1記載の固形製剤。
【請求項10】
pH調整剤の配合量が、製剤に対して0.01〜20重量%である請求項1記載の固形製剤。
【請求項11】
pH調整剤を配合することを特徴とする、固形製剤における式(I)で表される化合物またはその塩、および利尿剤の安定化方法。
【請求項12】
式(I)で表される化合物またはその塩、および利尿剤を含有する固形製剤において、pH調整剤を配合することを特徴とする、固形製剤からの式(I)で表される化合物またはその塩の溶出改善方法。
【図1】


【図2】




【図2】


【公表番号】特表2011−529444(P2011−529444A)
【公表日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願番号】特願2011−503295(P2011−503295)
【出願日】平成21年7月29日(2009.7.29)
【国際出願番号】PCT/JP2009/063833
【国際公開番号】WO2010/013835
【国際公開日】平成22年2月4日(2010.2.4)
【出願人】(000002934)武田薬品工業株式会社 (396)
【Fターム(参考)】
【公表日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願日】平成21年7月29日(2009.7.29)
【国際出願番号】PCT/JP2009/063833
【国際公開番号】WO2010/013835
【国際公開日】平成22年2月4日(2010.2.4)
【出願人】(000002934)武田薬品工業株式会社 (396)
【Fターム(参考)】
[ Back to top ]

