固形製剤
【課題】服用後に胃内部に滞留し、胃内部に確実に薬物を放出することができる固形製剤を提供すること。
【解決手段】固形製剤1は、一対の可食性フィルム10と、当該一対の可食性フィルム10の周縁部を接合して形成した空間部20と、当該空間部20内に収容された薬物含有部30とを有している。また、空間部20内部の体積に対する薬物含有部30の体積比は、0.5〜0.95である。空間部20中には、不活性ガスが充填されている。また、空間部の形状は、略球状である。また、可食性フィルム10は、付着防止層11と、ゲル形成層12と、接着層13とを有している。
【解決手段】固形製剤1は、一対の可食性フィルム10と、当該一対の可食性フィルム10の周縁部を接合して形成した空間部20と、当該空間部20内に収容された薬物含有部30とを有している。また、空間部20内部の体積に対する薬物含有部30の体積比は、0.5〜0.95である。空間部20中には、不活性ガスが充填されている。また、空間部の形状は、略球状である。また、可食性フィルム10は、付着防止層11と、ゲル形成層12と、接着層13とを有している。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は固形製剤に関する。
【背景技術】
【0002】
薬物を含有し、口から服用する経口投与剤としては、例えば、錠剤、カプセル剤等の固形製剤が知られている。
【0003】
このような経口投与剤は、薬物の苦味や渋味等による不快感、服薬による嘔気や嘔吐、服薬拒否等の様々な原因によって服薬コンプライアンスが低下する場合がある。
【0004】
嚥下することを比較的容易にするために、例えば、口腔内において唾液によってその表面が溶解するよう構成したり、または、吸水してゲル状になるよう構成したり、種々の試みが行われている(例えば、特許文献1参照)。
【0005】
しかしながら、従来の固形製剤は、比重が高いことから胃液内に容易に沈んでしまうため、胃内部に十分に滞留させることが困難であった。このため、胃内部において薬物を安定して放出するのが困難であった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平11−116469号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、服用後に胃内部に滞留し、胃内部に確実に薬物を放出することができる固形製剤を提供することにある。
【課題を解決するための手段】
【0008】
このような目的は、下記(1)〜(6)の本発明により達成される。
(1) 一対の可食性フィルムと、
前記一対の可食性フィルム同士をこれらの外縁部において接合することによって形成された空間部と、
前記空間部内に内包された薬物含有部と、を有し、
前記空間部に対する前記薬物含有部の体積比が、0.5〜0.95であることを特徴とする固形製剤。
【0009】
(2) 前記空間部中には、不活性ガスが充填されている上記(1)に記載の固形製剤。
【0010】
(3) 前記空間部の形状は、略球状である上記(1)または(2)に記載の固形製剤。
【0011】
(4) 前記薬物含有部は、打錠された錠剤で構成されている上記(1)ないし(3)のいずれか1項に記載の固形製剤。
【0012】
(5) 前記可食性フィルムは、前記空間部とは反対側の面に、水に溶解することにより固形製剤が口腔の内壁へ付着することを防止する付着防止層が設けられている上記(1)ないし(4)のいずれか1項に記載の固形製剤。
【0013】
(6) 前記可食性フィルムは、前記空間部側に、接着層を有し、
前記一対の可食性フィルムは、各可食性フィルムの外縁部の前記接着層同士が接合している上記(1)ないし(5)のいずれか1項に記載の固形製剤。
【発明の効果】
【0014】
本発明によれば、服用後に、胃液中に浮遊して胃内部に滞留し、胃内で薬物を放出することのできる固形製剤を提供することができる。
【図面の簡単な説明】
【0015】
【図1】本実施形態の固形製剤の好適な実施形態を示す正面図である。
【図2】本実施形態の固形製剤の好適な実施形態を示す平面図である。
【図3】図2のA−Aにおける固形製剤の断面図である。
【図4】可食性フィルムの好適な実施形態を示す断面図である。
【発明を実施するための形態】
【0016】
以下、本発明を好適な実施形態に基づいて詳細に説明する。
図1は、本実施形態の固形製剤の好適な実施形態を示す正面図、図2は、本実施形態の固形製剤の好適な実施形態を示す平面図、図3は、図2のA−Aにおける固形製剤の断面図、図4は、可食性フィルムの好適な実施形態を示す断面図である。
【0017】
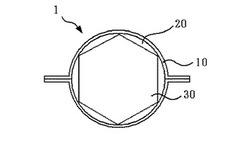
図1〜図3に示すように、固形製剤1は、一対の可食性フィルム10と、当該一対の可食性フィルム10の周縁部を接合して形成した空間部20と、当該空間部20内に収容された薬物含有部30とを有している。
【0018】
可食性フィルム10は、可食性の材料で構成されたフィルムである。このような可食性フィルム10の一対をその外縁部において接合することにより、後述する空間部20が形成される。
【0019】
本実施形態において、可食性フィルム10は、図4に示すように、付着防止層11と、ゲル形成層12と、接着層13とを有している。
【0020】
付着防止層11は、空間部20とは反対側の主面に積層され、可食性フィルム10の表面に位置する表面層として設けられている。
【0021】
また、付着防止層11は、口腔内において唾液等の水分により素早く溶解し、口腔内の内壁に固形製剤1(可食性フィルム10)が付着することを防止する機能を有している。
【0022】
このような付着防止層11を設けられていることにより、固形製剤1が口腔内へ投与された際に、付着防止層11の表面部分が素早く唾液に溶解することにより、付着防止層11と口腔内の内壁との間に液体の膜が速やかに形成され、固形製剤1が内壁に対し滑りやすくなる。このため、固形製剤1は、内壁に接触することが防止され、口腔の内壁に付着しにくいものとなる。また、固形製剤1の一部が内壁に付着した場合であっても、固形製剤1は、内壁から剥がれやすいものとなる。これにより、固形製剤1が内壁に付着して不快感を催すことを防止することができるとともに、固形製剤1を嚥下することが容易となる。また、薬物を目的とする体内の部位まで確実に搬送することができる。また、固形製剤1に不快な味(例えば苦味、渋み、痺れ感)、臭い等を呈する薬剤を適用することが可能となる。
【0023】
付着防止層11を構成する材料(付着防止剤)としては、特に限定されず、例えば、ヒドロキシアルキルセルロース、ポリエチレングリコール、ポリプロピレングリコール、ポリビニルアルコール、ステアリン酸ポリオキシル、ポリオキシエチレンポリオキシプロピレングリコール、ポリオキシエチレン硬化ヒマシ油、アラビアガム、ゼラチン等の水溶性高分子材料、エリスリトール、ソルビトール、キシリトール、マンニトール、イノシトール、マルチトール、ラクチトール、グルコース、キシロース、マンノース、フルクトース、ガラクトース、蔗糖、果糖、白糖等の糖類、プロピレングリコール、グリセリン等が挙げられ、このうち1種または2種以上を組み合わせて用いることができる。また、ヒドロキシアルキルセルロースとしては、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース等が挙げられる。
【0024】
上述した中でも、付着防止層11は、付着防止剤として水溶性高分子材料を含むことが好ましい。水溶性高分子材料は、水分に好適に溶解することができるとともに、適度な長さの分子鎖を有している。このため、水溶性高分子材料は、構成する複数の水溶性高分子の分子鎖同士が適度に絡み合うことができ、付着防止層11から溶出した際に、より確実に固形製剤1の周辺に水溶液の状態で偏在することができる。このため、固形製剤1は、より長期にわたって、確実に口腔の内壁に付着することが防止される。また、上述したような水溶性高分子材料は、付着防止層11の基剤としても機能することができ、可食性フィルム10の製造を容易にすることができるとともに、製造された可食性フィルム10の保存時における耐久性を特に優れたものとすることができる。また、特に、上述した水溶性高分子材料の中でも、ヒドロキシプロピルメチルセルロース、ポリエチレングリコールおよびポリビニルアルコールから選択される少なくとも1種を用いた場合、上述したような効果をより顕著に得ることができる。
【0025】
また、付着防止層11は、上述した以外の成分が含まれていてもよい。例えば、付着防止層11は、可塑剤、マスキング剤、防腐剤、着色剤等を含むものであってもよい。
【0026】
可塑剤としては、例えばグリセリン、ポリエチレングリコール、クエン酸トリエチル、プロピレングリコール、ポリオキシエチレン・ポリオキシプロピレングリコール、トリアセチレン、ポリソルベート80等が挙げられる。また、マスキング剤としては、例えばサッカリン、グリチルリチン酸、白糖、果糖、マンニトール、アセスルファムカリウム、サッカリンナトリウム、ステビア抽出物、アスパルテーム、スクラロース、ネオテーム、タウマチン等の甘味料;クエン酸、酒石酸、フマル酸等の酸味料;等が挙げられる。また、防腐剤としては、例えばベンザルコニウム塩化物、パラベン等が挙げられる。また、着色剤としては、例えば酸化チタン、三二酸化鉄、食紅等が挙げられる。
【0027】
ゲル形成層12は、付着防止層11と、後述する接着層13との間に設けられており、水分を吸収することにより、膨潤してゲルを形成することのできる層である。
【0028】
ゲル形成層12が口腔内にある唾液中の水分を素早く吸収してゲルを形成することで、口腔内において、固形製剤1は、迅速に柔軟性が付与され、嚥下することが容易なものとなる。
【0029】
ゲル形成層12は、水分を吸収することにより膨潤してゲルを形成するゲル形成剤を含む。このようなゲル形成剤を含むことにより、ゲル形成層12は、容易かつ迅速に周囲にある水分を吸収することができ、ゲルを形成する。
【0030】
ゲル形成剤としては、特には限定されず、例えば、カルボキシビニルポリマー、デンプン及びその誘導体、寒天、アルギン酸、アラビノガラクタン、ガラクトマンナン、セルロース及びその誘導体、カラゲーン、デキストラン、トラガカント、ゼラチン、ペクチン、ヒアルロン酸、ジェランガム、コラーゲン、カゼイン、キサンタンガム等が挙げられ、これらのうち1種または2種以上を組み合わせて用いることができる。
【0031】
また、ゲル形成剤は、イオン結合または共有結合によって架橋されていてもよいし架橋されていなくてもよい。
【0032】
また、ゲル形成層12は、ゲル形成層12の吸水を促進させる吸水促進剤を含んでいてもよい。ゲル形成層12が吸水促進剤を含むことにより、口腔内におけるゲル形成層12の吸水速度が十分に速いものとなる。このため、固形製剤1の嚥下性が特に優れたものとなる。
【0033】
吸水促進剤としては、例えば、水への溶解性が比較的高い成分を用いることができる。水への溶解性が比較的高い成分が水へ溶解するために、ゲル形成層12内へ水を搬送することができ、結果としてゲル形成層12が素早く水分を吸収することができる。
【0034】
吸水促進剤としては、特に限定されないが、例えば、プロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、ステアリン酸ポリオキシル、ポリオキシエチレンポリオキシプロピレングリコール、ポリオキシエチレン硬化ヒマシ油等のグリコール類、グリセリン、エリスリトール、ソルビトール、キシリトール、マンニトール、イノシトール、マルチトール、ラクチトール、グルコース、キシロース、マンノース、フルクトース、ガラクトース、蔗糖、果糖、白糖等の糖類等が挙げられ、このうち1種または2種以上を組み合わせて用いることができる。
【0035】
また、ゲル形成層12は、上述した以外の成分が含まれていてもよい。例えば、付着防止層11の説明で述べた可塑剤、マスキング剤、防腐剤、着色剤等を含むものであってもよい。
【0036】
接着層13は、一対の可食性フィルム10の周縁部を接着する機能を有する層であり、空間部20側に設けられている。
【0037】
接着層13を構成する材料としては、特に限定されないが、ポリビニルピロリドン、酢酸ビニルおよび酢酸ビニル・ビニルピロリドン共重合体からなる群から選択される少なくとも1種の材料で構成されているのが好ましい。これにより、熱によって容易に可食性フィルム10同士を接合することが可能となる。
【0038】
また、接着層13は、上述した以外の成分が含まれていてもよい。例えば、付着防止層11の説明で述べた可塑剤、マスキング剤、防腐剤、着色剤等を含むものであってもよい。
【0039】
空間部20は、上述した一対の可食性フィルム10の互いの周縁部を接合することにより形成される空間であり、後述する薬物含有部30を収容する機能を備えている。
【0040】
空間部20の形状は、図1、図2に示すように、略球状であるのが好ましい。これにより、固形製剤1を服用する際に、口腔内や食道等との接触面積を比較的小さいものとすることができ、容易に嚥下することが可能となる。
【0041】
また、空間部20内には、不活性ガスが充填されているのが好ましい。これにより、薬物含有部30内の薬物の安定性を向上させることができる。
【0042】
なお、本明細書において、不活性ガスとは、化学反応を起こしにくい気体のことを言い、例えば、ヘリウム、ネオン、アルゴン等の希ガス族元素や、窒素等を含む概念である。
また、空間部20内の酸素濃度は、1%以下であることが好ましく、0.1%以下であることがより好ましく、0.01%以下であることが特に好ましい。
【0043】
薬物含有部30は、投与すべき薬物を含有する部位である。
本発明において、空間部20内部の体積に対する薬物含有部30の体積比は、0.5〜0.95である。このような特徴を有することにより、固形製剤1は、服用後の胃内において、従来の固形製剤のように胃液中に沈むことなく、胃液中に浮遊して胃内に滞留することができる。その結果、胃内部に必要な量の薬物を確実に放出することができる。
【0044】
本発明において、空間部20に対する薬物含有部30の体積比は、0.5〜0.95であるが、0.6〜0.9であるのがより好ましい。これにより、本発明の効果をより顕著なものとすることができる。
【0045】
薬物含有部30に含まれる薬物としては、例えば、中枢神経に作用する薬物としては、アモバルビタール、エスタゾラム、トリアゾラム、ニトラゼパム、ペントバルビタール等の催眠薬、塩酸アミトリプチン、塩酸イミプラミン、オキサゾラム、クロルジアゼポキシド、クロルプロマジン、ジアゼパム、スルピリド、ハロペリドール等の向精神薬、トリヘキシフェニジル、レボドパ等の抗パーキンソン薬、アスピリン、イソプロピルアンチピリン、インドメタシン、ジクロフェナクナトリウム、メフェナム酸、ストレプトキナーゼ、ストレプトドルナーゼ、セラペプターゼ、プロナーゼ等の鎮痛薬および抗炎症薬、ATP、ビンポセチン等の中枢神経代謝賦活薬、呼吸器に作用する薬物としては、カルボシステイン、塩酸プロムヘキシン等の去痰薬、塩酸アゼラスチン、オキサトミド、テオフィリン、硫酸テルブタリン、トラニラスト、塩酸プロカテロール、フマル酸ケトチフェン等の抗喘息薬、循環器系に作用する薬物としては、アミノフィリン、ジギトキシン、ジゴキシン等の強心薬、アジマリン、ジソピラミド、塩酸プロカインアミド、塩酸メキシレチン等の抗不整脈薬、亜硝酸アミル、塩酸アルプレノロール、硝酸イソソルビド、ニコランジル、オキシフェドリン、ジピリダモール、塩酸ジラゼプ、塩酸ジルチアゼム、ニトログリセリン、ニフェジピン、塩酸ベラパミル等の抗狭心症薬、カリジノゲナーゼ等の末梢血管拡張薬、アテノロール、カプトプリル、塩酸クロニジン、酒石酸メトプロロール、スピロノラクトン、トリアムテレン、トリクロルメチアジド、ニカルジピン、塩酸ヒドララジン、ヒドロクロロチアジド、塩酸プラゾシン、フロセミド、塩酸プロプラノロール、マレイン酸エナラプリル、メチルドパ、塩酸ラベタロール、レセルピン等の抗高血圧薬、クロフィブラート、デキストラン硫酸、ニコモール、ニセリトロール等の抗動脈硬化薬、血液および造血作用薬として、カルバゾクロムスルホン酸ナトリウム、トラネキサム酸等の止血薬、塩酸チクロピジン、ワルファリンカリウム等の抗血栓症薬、硫酸鉄等の貧血治療薬、消化器系に作用する薬物として、アズレン、アルジオキサ、シメチジン、塩酸ラニチジン、ファモチジン、テプレノン、レバミピド等の抗潰瘍薬、ドンペリドン、メトクロプラミド等の制吐剤、センノシド等のしゃ下薬、消化酵素製剤、グリチルリチン、肝臓エキス製剤等の肝疾患治療薬、代謝性疾患に作用する薬物として、グリベンクラミド、クロルプロパミド、トルブタミド等の抗糖尿病薬、アロプリノール、コルヒチン等の痛風治療薬、眼科領域の薬物として、アセタゾラミド、耳鼻科領域の薬物として、塩酸ジフェニドール、メシル酸ベタヒスチン等の抗めまい薬、化学療法薬および抗生物質として、イソニアジド、塩酸エタンブトール、オフロキサシン、ステアリン酸エリスロマイシン、セファクロル、ノルフロキサシン、ホスホマイシンカルシウム、塩酸ミノサイクリン、リファンピシン、ロキタマイシン等、抗悪性腫瘍薬として、シクロホスファミド、テガフール等;免疫抑制薬として、アザチオプリン等、ホルモン類および内分泌治療薬として、黄体ホルモン、唾液腺ホルモン、チアマゾール、プレドニゾロン、ベタメタゾン、リオチロニン、レボチロキシン等、生体内活性物質(オータコイド)として、塩酸ジフェンヒドラミン、フマル酸クレマスチン、D−マレイン酸クロルフェニラミン等の抗ヒスタミン薬、アルファカルシドール、コバマミド、ニコチン酸トコフェロール、メコパラミン等のビタミン等が挙げられ、治療・予防目的等に応じて、これらの1種または2種以上を組み合わせて用いることができる。
【0046】
また、薬物含有部30は、基剤を含有してもよい。基剤としては、例えば、結晶セルロース、カルボキシメチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース、エチルセルロース、酢酸セルロース、セルロースアセテートフタレート、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、カルボキシメチルエチルセルロース等のセルロース及びその誘導体又はそれらの薬学的に許容される塩(例えばナトリウム塩);α−デンプン、酸化デンプン、カルボキシメチルスターチナトリウム、ヒドロキシプロピルスターチ、デキストリン、デキストラン等のデンプン及びそれらの誘導体;メタアクリル酸ジメチルアミノエチル・メタアクリル酸コポリマー、メタアクリル酸・アクリル酸エチルコポリマー、メタアクリル酸・メタアクリル酸メチルコポリマー、メタアクリル酸エチル・メタアクリル酸塩化トリメチルアンモニウムコポリマー、メタアクリル酸ジメチルアミノエチル・メタアクリル酸塩化メチルコポリマー、メタアクリル酸・アクリル酸塩化エチルコポリマー等のアクリル酸誘導体;シエラック;ポリビニルアセタールジエチルアミノアセテート;ポリ酢酸ビニル;ポリビニルアルコール;ポリビニルピロリドン;酢酸ビニル−ビニルピロリドン共重合体;アラビアゴム、トラガカントゴム等の天然ゴム類;キチン、キトサン等のポリグルコサミン類;ゼラチン、カゼイン、ダイズ蛋白等の蛋白質;リン酸一水素カルシウム;炭酸カルシウム;タルク;ステアリン酸塩;メタケイ酸アルミン酸マグネシウム;ケイ酸マグネシウム;無水ケイ酸等が挙げられ、添加目的に応じて、これらのうちの1種類又は2種類以上を選択して使用することができる。
【0047】
また、薬物含有部30は、上述した以外の成分が含まれていてもよい。例えば、付着防止層11の説明で述べた可塑剤、マスキング剤、防腐剤、着色剤等を含むものであってもよい。
【0048】
なお、薬物含有部30は、打錠された錠剤で構成されているのが好ましい。これにより、口腔内において不本意に薬物が放出されるのを防止することができ、胃内において確実に薬物を放出することができる。また、打錠された錠剤の比重が1g/cm3を超える場合であっても、空間部20内部の体積に対する薬物含有部30の体積比を調整して、固形製剤の比重を1g/cm3未満(好ましくは0.95g/cm3未満)とすることにより、胃液中に浮遊して胃内に滞留することができる。
【0049】
以上、本発明を図示の実施形態について説明したが、本発明は、これに限定されるものではない。
【0050】
例えば、本発明の固形製剤を構成する可食性フィルムは、付着防止層、ゲル形成層、接着層以外の任意の層を有するものであってもよい。
【0051】
上記任意の層の具体例としては、胃液と接触することにより溶解する胃溶性材料を含む材料で構成された崩壊制御層が挙げられる。
【0052】
胃溶性材料としては、特に限定されず、例えば、酸性条件下において溶解し、中性およびアルカリ性条件下においては溶解しにくい材料を用いることができる。具体的に胃溶性材料は、炭酸カルシウム、炭酸水素ナトリウム等の各種無機化合物や、各種胃溶性高分子等を用いることができる。これらの化合物は1種または2種以上組み合わせて用いることができる。
【0053】
胃溶性高分子としては、ポリビニルアミノアセタール、ポリビニルアセタールジエチルアミノアセテート等の胃溶性ポリビニル誘導体、(メタ)アクリル酸メチル-(メタ)アクリル酸ブチル-(メタ)アクリル酸ジメチルアミノエチル共重合体、アミノアルキル(メタ)アクリレートコポリマー等の胃溶性アクリル酸系共重合体等が挙げられる。
【0054】
また、例えば、本発明の固形製剤を構成する可食性フィルムは、付着防止層、ゲル形成層、崩壊制御層などの単層フィルムでもよいし、それらの積層フィルムでもよい。
【0055】
上記積層フィルムとしては、例えば、付着防止層/ゲル形成層、付着防止層/崩壊制御層、付着防止層/接着層、ゲル形成層/接着層、崩壊制御層/接着層、ゲル形成層/崩壊制御層、崩壊制御層/ゲル形成層、ゲル形成層/崩壊制御層/接着層、付着防止層/ゲル形成層/崩壊制御層、付着防止層/崩壊制御層/ゲル形成層、付着防止層/ゲル形成層/崩壊制御層/接着層、付着防止層/崩壊制御層/ゲル形成層/接着層等およびそれらの各層間に任意の層を有するフィルムが挙げられる。
【0056】
また、前述した実施形態では、空間部が略球状のものについて説明したが、これに限定されない。
【符号の説明】
【0057】
1 ・・・固形製剤
10 ・・・可食性フィルム
11 ・・・付着防止層
12 ・・・ゲル形成層
13 ・・・接着層
20 ・・・空間部
30 ・・・薬物含有部
【技術分野】
【0001】
本発明は固形製剤に関する。
【背景技術】
【0002】
薬物を含有し、口から服用する経口投与剤としては、例えば、錠剤、カプセル剤等の固形製剤が知られている。
【0003】
このような経口投与剤は、薬物の苦味や渋味等による不快感、服薬による嘔気や嘔吐、服薬拒否等の様々な原因によって服薬コンプライアンスが低下する場合がある。
【0004】
嚥下することを比較的容易にするために、例えば、口腔内において唾液によってその表面が溶解するよう構成したり、または、吸水してゲル状になるよう構成したり、種々の試みが行われている(例えば、特許文献1参照)。
【0005】
しかしながら、従来の固形製剤は、比重が高いことから胃液内に容易に沈んでしまうため、胃内部に十分に滞留させることが困難であった。このため、胃内部において薬物を安定して放出するのが困難であった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平11−116469号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、服用後に胃内部に滞留し、胃内部に確実に薬物を放出することができる固形製剤を提供することにある。
【課題を解決するための手段】
【0008】
このような目的は、下記(1)〜(6)の本発明により達成される。
(1) 一対の可食性フィルムと、
前記一対の可食性フィルム同士をこれらの外縁部において接合することによって形成された空間部と、
前記空間部内に内包された薬物含有部と、を有し、
前記空間部に対する前記薬物含有部の体積比が、0.5〜0.95であることを特徴とする固形製剤。
【0009】
(2) 前記空間部中には、不活性ガスが充填されている上記(1)に記載の固形製剤。
【0010】
(3) 前記空間部の形状は、略球状である上記(1)または(2)に記載の固形製剤。
【0011】
(4) 前記薬物含有部は、打錠された錠剤で構成されている上記(1)ないし(3)のいずれか1項に記載の固形製剤。
【0012】
(5) 前記可食性フィルムは、前記空間部とは反対側の面に、水に溶解することにより固形製剤が口腔の内壁へ付着することを防止する付着防止層が設けられている上記(1)ないし(4)のいずれか1項に記載の固形製剤。
【0013】
(6) 前記可食性フィルムは、前記空間部側に、接着層を有し、
前記一対の可食性フィルムは、各可食性フィルムの外縁部の前記接着層同士が接合している上記(1)ないし(5)のいずれか1項に記載の固形製剤。
【発明の効果】
【0014】
本発明によれば、服用後に、胃液中に浮遊して胃内部に滞留し、胃内で薬物を放出することのできる固形製剤を提供することができる。
【図面の簡単な説明】
【0015】
【図1】本実施形態の固形製剤の好適な実施形態を示す正面図である。
【図2】本実施形態の固形製剤の好適な実施形態を示す平面図である。
【図3】図2のA−Aにおける固形製剤の断面図である。
【図4】可食性フィルムの好適な実施形態を示す断面図である。
【発明を実施するための形態】
【0016】
以下、本発明を好適な実施形態に基づいて詳細に説明する。
図1は、本実施形態の固形製剤の好適な実施形態を示す正面図、図2は、本実施形態の固形製剤の好適な実施形態を示す平面図、図3は、図2のA−Aにおける固形製剤の断面図、図4は、可食性フィルムの好適な実施形態を示す断面図である。
【0017】
図1〜図3に示すように、固形製剤1は、一対の可食性フィルム10と、当該一対の可食性フィルム10の周縁部を接合して形成した空間部20と、当該空間部20内に収容された薬物含有部30とを有している。
【0018】
可食性フィルム10は、可食性の材料で構成されたフィルムである。このような可食性フィルム10の一対をその外縁部において接合することにより、後述する空間部20が形成される。
【0019】
本実施形態において、可食性フィルム10は、図4に示すように、付着防止層11と、ゲル形成層12と、接着層13とを有している。
【0020】
付着防止層11は、空間部20とは反対側の主面に積層され、可食性フィルム10の表面に位置する表面層として設けられている。
【0021】
また、付着防止層11は、口腔内において唾液等の水分により素早く溶解し、口腔内の内壁に固形製剤1(可食性フィルム10)が付着することを防止する機能を有している。
【0022】
このような付着防止層11を設けられていることにより、固形製剤1が口腔内へ投与された際に、付着防止層11の表面部分が素早く唾液に溶解することにより、付着防止層11と口腔内の内壁との間に液体の膜が速やかに形成され、固形製剤1が内壁に対し滑りやすくなる。このため、固形製剤1は、内壁に接触することが防止され、口腔の内壁に付着しにくいものとなる。また、固形製剤1の一部が内壁に付着した場合であっても、固形製剤1は、内壁から剥がれやすいものとなる。これにより、固形製剤1が内壁に付着して不快感を催すことを防止することができるとともに、固形製剤1を嚥下することが容易となる。また、薬物を目的とする体内の部位まで確実に搬送することができる。また、固形製剤1に不快な味(例えば苦味、渋み、痺れ感)、臭い等を呈する薬剤を適用することが可能となる。
【0023】
付着防止層11を構成する材料(付着防止剤)としては、特に限定されず、例えば、ヒドロキシアルキルセルロース、ポリエチレングリコール、ポリプロピレングリコール、ポリビニルアルコール、ステアリン酸ポリオキシル、ポリオキシエチレンポリオキシプロピレングリコール、ポリオキシエチレン硬化ヒマシ油、アラビアガム、ゼラチン等の水溶性高分子材料、エリスリトール、ソルビトール、キシリトール、マンニトール、イノシトール、マルチトール、ラクチトール、グルコース、キシロース、マンノース、フルクトース、ガラクトース、蔗糖、果糖、白糖等の糖類、プロピレングリコール、グリセリン等が挙げられ、このうち1種または2種以上を組み合わせて用いることができる。また、ヒドロキシアルキルセルロースとしては、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース等が挙げられる。
【0024】
上述した中でも、付着防止層11は、付着防止剤として水溶性高分子材料を含むことが好ましい。水溶性高分子材料は、水分に好適に溶解することができるとともに、適度な長さの分子鎖を有している。このため、水溶性高分子材料は、構成する複数の水溶性高分子の分子鎖同士が適度に絡み合うことができ、付着防止層11から溶出した際に、より確実に固形製剤1の周辺に水溶液の状態で偏在することができる。このため、固形製剤1は、より長期にわたって、確実に口腔の内壁に付着することが防止される。また、上述したような水溶性高分子材料は、付着防止層11の基剤としても機能することができ、可食性フィルム10の製造を容易にすることができるとともに、製造された可食性フィルム10の保存時における耐久性を特に優れたものとすることができる。また、特に、上述した水溶性高分子材料の中でも、ヒドロキシプロピルメチルセルロース、ポリエチレングリコールおよびポリビニルアルコールから選択される少なくとも1種を用いた場合、上述したような効果をより顕著に得ることができる。
【0025】
また、付着防止層11は、上述した以外の成分が含まれていてもよい。例えば、付着防止層11は、可塑剤、マスキング剤、防腐剤、着色剤等を含むものであってもよい。
【0026】
可塑剤としては、例えばグリセリン、ポリエチレングリコール、クエン酸トリエチル、プロピレングリコール、ポリオキシエチレン・ポリオキシプロピレングリコール、トリアセチレン、ポリソルベート80等が挙げられる。また、マスキング剤としては、例えばサッカリン、グリチルリチン酸、白糖、果糖、マンニトール、アセスルファムカリウム、サッカリンナトリウム、ステビア抽出物、アスパルテーム、スクラロース、ネオテーム、タウマチン等の甘味料;クエン酸、酒石酸、フマル酸等の酸味料;等が挙げられる。また、防腐剤としては、例えばベンザルコニウム塩化物、パラベン等が挙げられる。また、着色剤としては、例えば酸化チタン、三二酸化鉄、食紅等が挙げられる。
【0027】
ゲル形成層12は、付着防止層11と、後述する接着層13との間に設けられており、水分を吸収することにより、膨潤してゲルを形成することのできる層である。
【0028】
ゲル形成層12が口腔内にある唾液中の水分を素早く吸収してゲルを形成することで、口腔内において、固形製剤1は、迅速に柔軟性が付与され、嚥下することが容易なものとなる。
【0029】
ゲル形成層12は、水分を吸収することにより膨潤してゲルを形成するゲル形成剤を含む。このようなゲル形成剤を含むことにより、ゲル形成層12は、容易かつ迅速に周囲にある水分を吸収することができ、ゲルを形成する。
【0030】
ゲル形成剤としては、特には限定されず、例えば、カルボキシビニルポリマー、デンプン及びその誘導体、寒天、アルギン酸、アラビノガラクタン、ガラクトマンナン、セルロース及びその誘導体、カラゲーン、デキストラン、トラガカント、ゼラチン、ペクチン、ヒアルロン酸、ジェランガム、コラーゲン、カゼイン、キサンタンガム等が挙げられ、これらのうち1種または2種以上を組み合わせて用いることができる。
【0031】
また、ゲル形成剤は、イオン結合または共有結合によって架橋されていてもよいし架橋されていなくてもよい。
【0032】
また、ゲル形成層12は、ゲル形成層12の吸水を促進させる吸水促進剤を含んでいてもよい。ゲル形成層12が吸水促進剤を含むことにより、口腔内におけるゲル形成層12の吸水速度が十分に速いものとなる。このため、固形製剤1の嚥下性が特に優れたものとなる。
【0033】
吸水促進剤としては、例えば、水への溶解性が比較的高い成分を用いることができる。水への溶解性が比較的高い成分が水へ溶解するために、ゲル形成層12内へ水を搬送することができ、結果としてゲル形成層12が素早く水分を吸収することができる。
【0034】
吸水促進剤としては、特に限定されないが、例えば、プロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、ステアリン酸ポリオキシル、ポリオキシエチレンポリオキシプロピレングリコール、ポリオキシエチレン硬化ヒマシ油等のグリコール類、グリセリン、エリスリトール、ソルビトール、キシリトール、マンニトール、イノシトール、マルチトール、ラクチトール、グルコース、キシロース、マンノース、フルクトース、ガラクトース、蔗糖、果糖、白糖等の糖類等が挙げられ、このうち1種または2種以上を組み合わせて用いることができる。
【0035】
また、ゲル形成層12は、上述した以外の成分が含まれていてもよい。例えば、付着防止層11の説明で述べた可塑剤、マスキング剤、防腐剤、着色剤等を含むものであってもよい。
【0036】
接着層13は、一対の可食性フィルム10の周縁部を接着する機能を有する層であり、空間部20側に設けられている。
【0037】
接着層13を構成する材料としては、特に限定されないが、ポリビニルピロリドン、酢酸ビニルおよび酢酸ビニル・ビニルピロリドン共重合体からなる群から選択される少なくとも1種の材料で構成されているのが好ましい。これにより、熱によって容易に可食性フィルム10同士を接合することが可能となる。
【0038】
また、接着層13は、上述した以外の成分が含まれていてもよい。例えば、付着防止層11の説明で述べた可塑剤、マスキング剤、防腐剤、着色剤等を含むものであってもよい。
【0039】
空間部20は、上述した一対の可食性フィルム10の互いの周縁部を接合することにより形成される空間であり、後述する薬物含有部30を収容する機能を備えている。
【0040】
空間部20の形状は、図1、図2に示すように、略球状であるのが好ましい。これにより、固形製剤1を服用する際に、口腔内や食道等との接触面積を比較的小さいものとすることができ、容易に嚥下することが可能となる。
【0041】
また、空間部20内には、不活性ガスが充填されているのが好ましい。これにより、薬物含有部30内の薬物の安定性を向上させることができる。
【0042】
なお、本明細書において、不活性ガスとは、化学反応を起こしにくい気体のことを言い、例えば、ヘリウム、ネオン、アルゴン等の希ガス族元素や、窒素等を含む概念である。
また、空間部20内の酸素濃度は、1%以下であることが好ましく、0.1%以下であることがより好ましく、0.01%以下であることが特に好ましい。
【0043】
薬物含有部30は、投与すべき薬物を含有する部位である。
本発明において、空間部20内部の体積に対する薬物含有部30の体積比は、0.5〜0.95である。このような特徴を有することにより、固形製剤1は、服用後の胃内において、従来の固形製剤のように胃液中に沈むことなく、胃液中に浮遊して胃内に滞留することができる。その結果、胃内部に必要な量の薬物を確実に放出することができる。
【0044】
本発明において、空間部20に対する薬物含有部30の体積比は、0.5〜0.95であるが、0.6〜0.9であるのがより好ましい。これにより、本発明の効果をより顕著なものとすることができる。
【0045】
薬物含有部30に含まれる薬物としては、例えば、中枢神経に作用する薬物としては、アモバルビタール、エスタゾラム、トリアゾラム、ニトラゼパム、ペントバルビタール等の催眠薬、塩酸アミトリプチン、塩酸イミプラミン、オキサゾラム、クロルジアゼポキシド、クロルプロマジン、ジアゼパム、スルピリド、ハロペリドール等の向精神薬、トリヘキシフェニジル、レボドパ等の抗パーキンソン薬、アスピリン、イソプロピルアンチピリン、インドメタシン、ジクロフェナクナトリウム、メフェナム酸、ストレプトキナーゼ、ストレプトドルナーゼ、セラペプターゼ、プロナーゼ等の鎮痛薬および抗炎症薬、ATP、ビンポセチン等の中枢神経代謝賦活薬、呼吸器に作用する薬物としては、カルボシステイン、塩酸プロムヘキシン等の去痰薬、塩酸アゼラスチン、オキサトミド、テオフィリン、硫酸テルブタリン、トラニラスト、塩酸プロカテロール、フマル酸ケトチフェン等の抗喘息薬、循環器系に作用する薬物としては、アミノフィリン、ジギトキシン、ジゴキシン等の強心薬、アジマリン、ジソピラミド、塩酸プロカインアミド、塩酸メキシレチン等の抗不整脈薬、亜硝酸アミル、塩酸アルプレノロール、硝酸イソソルビド、ニコランジル、オキシフェドリン、ジピリダモール、塩酸ジラゼプ、塩酸ジルチアゼム、ニトログリセリン、ニフェジピン、塩酸ベラパミル等の抗狭心症薬、カリジノゲナーゼ等の末梢血管拡張薬、アテノロール、カプトプリル、塩酸クロニジン、酒石酸メトプロロール、スピロノラクトン、トリアムテレン、トリクロルメチアジド、ニカルジピン、塩酸ヒドララジン、ヒドロクロロチアジド、塩酸プラゾシン、フロセミド、塩酸プロプラノロール、マレイン酸エナラプリル、メチルドパ、塩酸ラベタロール、レセルピン等の抗高血圧薬、クロフィブラート、デキストラン硫酸、ニコモール、ニセリトロール等の抗動脈硬化薬、血液および造血作用薬として、カルバゾクロムスルホン酸ナトリウム、トラネキサム酸等の止血薬、塩酸チクロピジン、ワルファリンカリウム等の抗血栓症薬、硫酸鉄等の貧血治療薬、消化器系に作用する薬物として、アズレン、アルジオキサ、シメチジン、塩酸ラニチジン、ファモチジン、テプレノン、レバミピド等の抗潰瘍薬、ドンペリドン、メトクロプラミド等の制吐剤、センノシド等のしゃ下薬、消化酵素製剤、グリチルリチン、肝臓エキス製剤等の肝疾患治療薬、代謝性疾患に作用する薬物として、グリベンクラミド、クロルプロパミド、トルブタミド等の抗糖尿病薬、アロプリノール、コルヒチン等の痛風治療薬、眼科領域の薬物として、アセタゾラミド、耳鼻科領域の薬物として、塩酸ジフェニドール、メシル酸ベタヒスチン等の抗めまい薬、化学療法薬および抗生物質として、イソニアジド、塩酸エタンブトール、オフロキサシン、ステアリン酸エリスロマイシン、セファクロル、ノルフロキサシン、ホスホマイシンカルシウム、塩酸ミノサイクリン、リファンピシン、ロキタマイシン等、抗悪性腫瘍薬として、シクロホスファミド、テガフール等;免疫抑制薬として、アザチオプリン等、ホルモン類および内分泌治療薬として、黄体ホルモン、唾液腺ホルモン、チアマゾール、プレドニゾロン、ベタメタゾン、リオチロニン、レボチロキシン等、生体内活性物質(オータコイド)として、塩酸ジフェンヒドラミン、フマル酸クレマスチン、D−マレイン酸クロルフェニラミン等の抗ヒスタミン薬、アルファカルシドール、コバマミド、ニコチン酸トコフェロール、メコパラミン等のビタミン等が挙げられ、治療・予防目的等に応じて、これらの1種または2種以上を組み合わせて用いることができる。
【0046】
また、薬物含有部30は、基剤を含有してもよい。基剤としては、例えば、結晶セルロース、カルボキシメチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース、エチルセルロース、酢酸セルロース、セルロースアセテートフタレート、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、カルボキシメチルエチルセルロース等のセルロース及びその誘導体又はそれらの薬学的に許容される塩(例えばナトリウム塩);α−デンプン、酸化デンプン、カルボキシメチルスターチナトリウム、ヒドロキシプロピルスターチ、デキストリン、デキストラン等のデンプン及びそれらの誘導体;メタアクリル酸ジメチルアミノエチル・メタアクリル酸コポリマー、メタアクリル酸・アクリル酸エチルコポリマー、メタアクリル酸・メタアクリル酸メチルコポリマー、メタアクリル酸エチル・メタアクリル酸塩化トリメチルアンモニウムコポリマー、メタアクリル酸ジメチルアミノエチル・メタアクリル酸塩化メチルコポリマー、メタアクリル酸・アクリル酸塩化エチルコポリマー等のアクリル酸誘導体;シエラック;ポリビニルアセタールジエチルアミノアセテート;ポリ酢酸ビニル;ポリビニルアルコール;ポリビニルピロリドン;酢酸ビニル−ビニルピロリドン共重合体;アラビアゴム、トラガカントゴム等の天然ゴム類;キチン、キトサン等のポリグルコサミン類;ゼラチン、カゼイン、ダイズ蛋白等の蛋白質;リン酸一水素カルシウム;炭酸カルシウム;タルク;ステアリン酸塩;メタケイ酸アルミン酸マグネシウム;ケイ酸マグネシウム;無水ケイ酸等が挙げられ、添加目的に応じて、これらのうちの1種類又は2種類以上を選択して使用することができる。
【0047】
また、薬物含有部30は、上述した以外の成分が含まれていてもよい。例えば、付着防止層11の説明で述べた可塑剤、マスキング剤、防腐剤、着色剤等を含むものであってもよい。
【0048】
なお、薬物含有部30は、打錠された錠剤で構成されているのが好ましい。これにより、口腔内において不本意に薬物が放出されるのを防止することができ、胃内において確実に薬物を放出することができる。また、打錠された錠剤の比重が1g/cm3を超える場合であっても、空間部20内部の体積に対する薬物含有部30の体積比を調整して、固形製剤の比重を1g/cm3未満(好ましくは0.95g/cm3未満)とすることにより、胃液中に浮遊して胃内に滞留することができる。
【0049】
以上、本発明を図示の実施形態について説明したが、本発明は、これに限定されるものではない。
【0050】
例えば、本発明の固形製剤を構成する可食性フィルムは、付着防止層、ゲル形成層、接着層以外の任意の層を有するものであってもよい。
【0051】
上記任意の層の具体例としては、胃液と接触することにより溶解する胃溶性材料を含む材料で構成された崩壊制御層が挙げられる。
【0052】
胃溶性材料としては、特に限定されず、例えば、酸性条件下において溶解し、中性およびアルカリ性条件下においては溶解しにくい材料を用いることができる。具体的に胃溶性材料は、炭酸カルシウム、炭酸水素ナトリウム等の各種無機化合物や、各種胃溶性高分子等を用いることができる。これらの化合物は1種または2種以上組み合わせて用いることができる。
【0053】
胃溶性高分子としては、ポリビニルアミノアセタール、ポリビニルアセタールジエチルアミノアセテート等の胃溶性ポリビニル誘導体、(メタ)アクリル酸メチル-(メタ)アクリル酸ブチル-(メタ)アクリル酸ジメチルアミノエチル共重合体、アミノアルキル(メタ)アクリレートコポリマー等の胃溶性アクリル酸系共重合体等が挙げられる。
【0054】
また、例えば、本発明の固形製剤を構成する可食性フィルムは、付着防止層、ゲル形成層、崩壊制御層などの単層フィルムでもよいし、それらの積層フィルムでもよい。
【0055】
上記積層フィルムとしては、例えば、付着防止層/ゲル形成層、付着防止層/崩壊制御層、付着防止層/接着層、ゲル形成層/接着層、崩壊制御層/接着層、ゲル形成層/崩壊制御層、崩壊制御層/ゲル形成層、ゲル形成層/崩壊制御層/接着層、付着防止層/ゲル形成層/崩壊制御層、付着防止層/崩壊制御層/ゲル形成層、付着防止層/ゲル形成層/崩壊制御層/接着層、付着防止層/崩壊制御層/ゲル形成層/接着層等およびそれらの各層間に任意の層を有するフィルムが挙げられる。
【0056】
また、前述した実施形態では、空間部が略球状のものについて説明したが、これに限定されない。
【符号の説明】
【0057】
1 ・・・固形製剤
10 ・・・可食性フィルム
11 ・・・付着防止層
12 ・・・ゲル形成層
13 ・・・接着層
20 ・・・空間部
30 ・・・薬物含有部
【特許請求の範囲】
【請求項1】
一対の可食性フィルムと、
前記一対の可食性フィルム同士をこれらの外縁部において接合することによって形成された空間部と、
前記空間部内に内包された薬物含有部と、を有し、
前記空間部に対する前記薬物含有部の体積比が、0.5〜0.95であることを特徴とする固形製剤。
【請求項2】
前記空間部中には、不活性ガスが充填されている請求項1に記載の固形製剤。
【請求項3】
前記空間部の形状は、略球状である請求項1または2に記載の固形製剤。
【請求項4】
前記薬物含有部は、打錠された錠剤で構成されている請求項1ないし3のいずれか1項に記載の固形製剤。
【請求項5】
前記可食性フィルムは、前記空間部とは反対側の面に、水に溶解することにより固形製剤が口腔の内壁へ付着することを防止する付着防止層が設けられている請求項1ないし4のいずれか1項に記載の固形製剤。
【請求項6】
前記可食性フィルムは、前記空間部側に、接着層を有し、
前記一対の可食性フィルムは、各可食性フィルムの外縁部の前記接着層同士が接合している請求項1ないし5のいずれか1項に記載の固形製剤。
【請求項1】
一対の可食性フィルムと、
前記一対の可食性フィルム同士をこれらの外縁部において接合することによって形成された空間部と、
前記空間部内に内包された薬物含有部と、を有し、
前記空間部に対する前記薬物含有部の体積比が、0.5〜0.95であることを特徴とする固形製剤。
【請求項2】
前記空間部中には、不活性ガスが充填されている請求項1に記載の固形製剤。
【請求項3】
前記空間部の形状は、略球状である請求項1または2に記載の固形製剤。
【請求項4】
前記薬物含有部は、打錠された錠剤で構成されている請求項1ないし3のいずれか1項に記載の固形製剤。
【請求項5】
前記可食性フィルムは、前記空間部とは反対側の面に、水に溶解することにより固形製剤が口腔の内壁へ付着することを防止する付着防止層が設けられている請求項1ないし4のいずれか1項に記載の固形製剤。
【請求項6】
前記可食性フィルムは、前記空間部側に、接着層を有し、
前記一対の可食性フィルムは、各可食性フィルムの外縁部の前記接着層同士が接合している請求項1ないし5のいずれか1項に記載の固形製剤。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−18758(P2013−18758A)
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2011−155209(P2011−155209)
【出願日】平成23年7月13日(2011.7.13)
【出願人】(000102980)リンテック株式会社 (1,750)
【Fターム(参考)】
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願日】平成23年7月13日(2011.7.13)
【出願人】(000102980)リンテック株式会社 (1,750)
【Fターム(参考)】
[ Back to top ]

