固相をベースとする生物学的検定におけるシグナル可読性の改善のためのシグナル生成とシグナル局在化の方法
【課題】標的材料を含む溶液中におけるシグナル生成分子の拡散を妨げ、シグナルの可読性を改善する。
【解決手段】本発明は、固相基板検出システムにおいてシグナルを生成し、生成されたシグナルを局部にとどめる方法を提供する。本発明は、固相基板に標的材料の溶液を投入するステップと、多数のシグナル前駆体分子を含む非触媒性標識が取り付けられた標的材料を特有の親和性分子と結合させるステップと、固相基板にキャリア媒体を重ねるステップと、多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために非触媒性標識を処理するステップとを備える。キャリア媒体は、非触媒性標識を溶解させるための溶媒と、標的の存在および/または量を示す多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含む。
【解決手段】本発明は、固相基板検出システムにおいてシグナルを生成し、生成されたシグナルを局部にとどめる方法を提供する。本発明は、固相基板に標的材料の溶液を投入するステップと、多数のシグナル前駆体分子を含む非触媒性標識が取り付けられた標的材料を特有の親和性分子と結合させるステップと、固相基板にキャリア媒体を重ねるステップと、多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために非触媒性標識を処理するステップとを備える。キャリア媒体は、非触媒性標識を溶解させるための溶媒と、標的の存在および/または量を示す多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、体液のような液体サンプルの中の検体、例えば、抗原のための検定に関する。更に詳細には、本発明は、側方流デバイスのような固相プラットフォームを使用するポイント・オブ・ケアテストデバイスにおいて検出可能な材料を含む複合体を用いて、尿、血液、血清、血漿、唾液のような体液または排せつ物の抽出溶液の中の検体を検出するための非触媒法に関する。また、本発明は、汚染物質に対して食物や水をテストすることのような、または獣医学領域や軍隊における非臨床的状況に適用することができる。
【0002】
本発明は、検定中にシグナルの生成とシグナルの局在化のために異なる試薬を運ぶキャリア媒体を使う。そのキャリア媒体は以下のものを含む。:
(i)溶媒(例えば、バッファーを含む水溶液、塩溶液、水、有機溶媒、例えば、エタノール、プロパノールのようなアルコール、テトラヒドロフラン(THF)のような他のもの、およびジメチル・スルホキシド(DMSO)のような極性非プロトン性溶媒);
(ii)増粘剤、増粘剤は高い粘度の流体からゲルまでに及ぶキャリア媒体特性を与える内部構造を形成するコロイド混合物として溶媒の中で溶ける。ゲルタイプのキャリア媒体は固体の外観を持つが、主に溶媒からできている。実例は、ポリアクリルアミドおよびポリイソブチレンのようなポリマー;褐藻類、寒天、カラギーナン、ペクチンから得られるアルギン酸塩、でんぷん、セルロースのような多糖類;ローカストビーンガムおよびグアーガムのような天然ガム;コラーゲン、アルブミン、およびゼラチンのようなタンパク質を含む。
【0003】
いくつかの実施形態において、キャリア媒体は、また、シグナル展開試薬を含む。シグナル展開試薬は検出可能なシグナルを生成する状態にシグナル前駆体分子を変換する材料である。他の実施形態では、温度の変化、pHの変化、高周波音による分解、光の照射、またはマイクロウエーブ加熱のような物理的手段によって、多数のシグナル前駆体分子が多数の検出可能なシグナル分子に変換されるので、シグナル展開試薬は必要でない。
【0004】
キャリア媒体の機能は以下の通りである。:
(i)シグナル分子の拡散を妨げ、シグナルの蓄積に導くこと。
(ii)固相プラットフォームにおけるシグナルの可読性(鮮明さ、シグナル保持時間の延長)を改善し、従って感度を高めること。
いくつかの実施形態において、多数のシグナル前駆体分子から多数の検出可能なシグナル生成分子への変換は科学的または生科学的手段によってもたらされ、キャリア媒体は第3の機能を持つ。:
(iii)多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換することによって、シグナルを生成すること。
目に見える光の検出を使う検定のために、キャリア媒体は実質的に光学的に透明である。
【背景技術】
【0005】
尿、血液、血清、血漿、唾液のような体液または排せつ物の抽出溶液の中のさまざまな標的物質の存在を検出するために、多くのタイプの標的−受容体検定が使われている。これらの検定は、一般的に抗原抗体反応や、放射能による、酵素による、蛍光による、発光による、化学発光による、または視覚的に観察できる金属タグを持った合成複合体を含み、特別に設計された反応チャンバーを使う。すべてのそのような検定において、選択された標的、例えば抗原に対して固有の受容体、例えば抗体があり、標的−受容体反応の生成物の存在を検出し、しばしばその量を検出する手段がある。多くの現在のテストは、半定量的または定量的な決定を与えるために設計される。しかし、多くの環境では、必要とされる全ては、標的種の存在の肯定的または否定的なしるしを与える定性的検出である。そのような定性的検定の例は、血液型判定、大部分の種類の尿検査、および結腸直腸癌のためのスクリーニング検定のような非常に重要な糞便潜血検査を含む。これらのテストのために、有色の粒子、例えば、金粒子の蓄積、塊の存在、または色の変化のような視覚的に観察可能なしるしが好ましい。
【0006】
それにもかかわらず、テスト流体における検定対象の標的がしばしば低濃度であるために、定性的な検定は非常に高感度でなければならない。金属ゾルまたは他のタイプの有色粒子を使うサンドイッチ分析と他の高感度検出方法が開発された。けれども、これらのテクニックは迅速検出法の直面する問題の全てを解決しなかった。それで、常に更なる改善が求められている。
【0007】
例として、側方流サンドイッチ分析において、他の抗体(2)はニトロセルロース膜のような薄膜上でよく規定された検出サイトに固定されるのに対して、コロイド金はしばしば最初の検体(1)の標識として使われる。もし問題となっている検体がサンプルの中に存在するならば、そのときその検体は金で標識された検体(1)と反応し、ニトロセルロース膜と結合した抗体(2)に移動する。そこで、それはサンドイッチを形成し、それからこれらのサンドイッチ複合体は検出サイトに集められ、集中させられる。このサイトは、銀イオンとの付加的な反応によって(増幅されて)ある程度目に見えるようにされることができる。
【0008】
けれども、分析感度が極めて優れているわけではない。そして、この技術はある検定には容易に適用できない。例えば、診断上とても重要である低濃度範囲において、甲状腺刺激ホルモン(TSH)、前立腺特異抗原(PSA)、トロポニンI、またはトロポニンTの決定のために容易には適用できない。
【0009】
従って、そのような検定をもっと効果的に行うために、(”シグナル増幅前駆体分子”と名づけられた)他の標識が使われ、それは決定反応の終わり、例えば、サンドイッチ(固定された抗体(2)−検体−{検体(1)−標識})の構成の終わりに増幅されることができる。
【0010】
もし増幅標識がフルオレセイン二酢酸(FDA)結晶−数百万のFDA分子から成る−を含むマイクロカプセルであるならば、そのとき、そのマイクロカプセルを分解し、非蛍光性のFDA−分子を蛍光性のフルオレセイン分子に加水分解することによって、決定反応の後で増幅が生じる。この増幅は特許文献1において十分に証明され、記載されている。その開示は、参照によって本明細書に含められる。
【0011】
通常、増幅反応は解放試薬の溶液の中で起こる。これは、希釈要因−解放されたフルオレセイン分子が解放試薬の反応体積に希釈されること−のために分析感度の理想からのわずかな減少に導く。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】欧州特許第1309867号明細書
【発明の概要】
【発明が解決しようとする課題】
【0013】
不幸にも、ある環境では、増幅の利益はシグナル消失の不利益によって相殺され、上回られさえする。一例として、検出または決定が薄膜上で、例えば、側方流テストストリップの中で実行されるならば、シグナルの増幅を可能にする解放試薬溶液の投入は増幅されたシグナルが薄膜に沿って拡散することに帰着する。解放された/増幅された分子は局部にとどまらない。このため、シグナルは増幅の後でさえ検出困難であるかも知れない。基本的なテスト反応の完了後におけるいかなる溶液の投入も、検出ライン、スポット、またはゾーンの拡大に導く。拡散は検出サイトを広げ、検出サイトの色強度を信頼できるように測定することを不可能にする。
【0014】
また、先行技術は、標識が高いターンオーバー数を持った酵素である例を含む。その酵素は、基質と反応するとき、非常に多くの反応生成物分子を形成する。再び、これは、水溶液の中で、もっと正確に言えば、酵素に対する特有の基質分子を持った緩衝溶液の中で実行される。酵素をベースとするシステムの一つの欠点は、それらが触媒であるので、基質の変換が起こり、これが持続しているプロセスであるとき、増幅が始まるということである。増幅は、基質濃度と酵素の反応に対して選択される時間とに依存している。停止試薬が加えられないならば、測定時間の間(そして、その後も)酵素が機能する。それで、一定のシグナルはない。停止試薬の投入は希釈効果を増加させるだろう。
【0015】
従って、シグナル分子の拡散を妨げることによって最先端技術で制限を克服し、シグナルが確実に検出されるように鮮明さを維持してシグナル保持時間を延ばすことによってシグナルの可読性を改善することが本発明の目的である。また、流体サンプル、特に体液のサンプルの中で検体を検出する迅速で高感度の方法を提供することが本発明の目的である。他の目的は、通常の検定に比べて高い感度を有する検定を提供することである。さらなる目的は、流体中の低レベルの検体を検出するためのテストデバイスを提供することである。
【課題を解決するための手段】
【0016】
<用語の定義>
キャリア媒体:
キャリア媒体は多数の検出可能なシグナル生成分子の拡散を妨げ、シグナルの蓄積に導く。これは、固相プラットフォーム上で多数の検出可能なシグナル生成分子の改善された可読性(鮮明さ、シグナル保持時間の延長)に帰着し、従って感度を高める。
キャリア媒体は以下のものを含む。:
(i)溶媒(例えば、バッファーを含む水溶液、塩溶液、水、有機溶媒、例えば、エタノール、プロパノールのようなアルコール、テトラヒドロフラン(THF)のような他のもの、およびジメチル・スルホキシド(DMSO)のような極性非プロトン性溶媒);
(ii)増粘剤、増粘剤は高い粘度の流体からゲルまでに及ぶキャリア媒体特性を与える内部構造を形成するコロイド混合物として溶媒の中で溶ける。
また、キャリア媒体は、化学的または生化学的活性化を必要とするシグナル前駆体分子のために、以下のものを含む。:
(iii)シグナル展開試薬、シグナル展開試薬は検出可能なシグナルを生成する状態にシグナル前駆体分子を変換する材料である。
【0017】
増粘剤:
増粘剤は、溶液、乳液、および懸濁液を濃くし、安定化させるために使われる材料である。それらは高い粘度の流体からゲルまでに及ぶキャリア媒体特性を与える内部構造を形成するコロイド混合物として液相の中で溶ける。ゲルタイプのキャリア媒体は固体の外観を持つが、主に液体からできている。増粘剤の実例は、ポリアクリルアミドおよびポリイソブチレンのようなゲルを形成するポリマー;褐藻類、寒天、カラギーナン、ペクチンから得られるアルギン酸塩、セルロース、でんぷんのような多糖類;ローカストビーンガムおよびグアーガムのような天然ガム;コラーゲン、アルブミン、およびゼラチンのようなタンパク質を含む。
【0018】
シグナル前駆体分子:
シグナル前駆体分子は、1つ以上の他の試薬と反応するとき、検出可能なシグナルに導く分子である。初期反応を経て検出可能なシグナルに導くさまざまな化学的分類の非常に多くの異なる物質がある。例えば、蛍光色素分子とそれらの誘導体、発光団とそれらの誘導体、発色団とそれらの誘導体、接合団、または、レドックスメディテーターから選択された酸化還元活性物質、電極活性物質、生物発光性および蛍光発光性のタンパク質、可視色素、蛍光色素、生物発光若しくは化学発光の材料、電気化学的に活性な材料、または磁性材料がある。シグナル前駆体分子は非触媒性標識である。
検出可能なシグナルは、以下に示すもののベースとされることができる。
−蛍光定量法
−ルミノメトリー
−紫外線、可視光、および近赤外線範囲における色変化
−酸化還元電位の変化
−複合体の形成または沈殿物から生じる塊の変化
−放射性崩壊生成物の検出
−磁場の検出
【0019】
シグナル分子:
本明細書において、シグナル分子という用語は、文脈がシグナル前駆状態とシグナル生成状態のうち特定の状態にあることを求めない場合に、シグナル前駆体分子とシグナル生成分子の両方またはいずれか一方を示すために使用される。それは、また、シグナル前駆体分子とシグナル生成分子が両方とも同時に存在するかも知れない場合に使用される。
【0020】
シグナル展開試薬:
シグナル展開試薬は、存在する場合には、シグナル前駆体分子が検出可能なシグナルを生成できるようにする材料である。シグナル展開試薬は、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、またはフルオレセイン二酢酸マレイミド(FDA−マレイミド)などのフルオレセインとそれらの誘導体、シアニン、カルボシアニン、ローダミン、キサンテン、ジアゾ色素をベースとする蛍光物質、並びに、蛍光芳香族低分子およびヘテロ芳香族低分子から成る群から選択された蛍光色素分子を活性化するように構成される。あるいは、シグナル展開試薬は、シアニン、ピラゾロン、アントラキノン、カルボシアニン、ローダミン、キサンテン、カロテノイド、並びに、ジアゾおよびモノアゾ、オキサジン、インジゴイド、またはリボフラビンをベースとする染料物質から成る群から選択された発色団を活性化することができる。
【0021】
テストデバイス:
本明細書で使用されるように、テストデバイスという用語は固相基板を包含するデバイスを示すために使われる。固相基板は、薄膜、マイクロタイタープレート、ビーズ(磁性および非磁性)、チューブ、並びに、スライドから成るグループから選択されることができる。テストデバイスは、側方流、垂直流、テストチューブ、マイクロタイタープレート、ペタルなどを含む異なるフォーマットの検定に適合する。固相基板のための材料と形は、ニトロセルロースやナイロンのような多孔質薄膜、ガラス、ポリスチレン、金属、カーボンのような非多孔質の平らな表面、テストチューブまたはマイクロタイタープレートの内壁、磁性または非磁性のビーズのような球であることができる。
【0022】
検出膜:
検出膜は、試薬に関していくつかの別々のパッド(例えば、結合パッド、サンプルパッド、吸収パッド)が取り付けられたニトロセルロースストリップのような反応薄膜から成る。抗体または抗原に関する反応サイト(検出サイト、制御サイト)は、反応薄膜上の明確に規定された位置でコーティングされる。反応サイトでのコーティングは、反応薄膜上で受動的に吸着されて、例えば、ストレプトアビジン(コーティングされたストレプトアビジン←ビオチン化抗体)または種特異抗体(ヤギ・反マウス抗体←マウス抗体)によって共有結合し、または免疫化学的に結合する。
【0023】
親和性分子:
親和性分子は、材料の次の群から選択された生物学的認識分子である。
(a)抗体、遺伝子組み換え抗体、モノクロナール抗体、ポリクロナール抗体、受容体、抗原、レクチン、アビジン、オリゴペプチド、リポタンパク質、糖タンパク質、ペプチド・ホルモン、およびアレルゲン、またはそれらの一部から成る群から選択されたペプチドまたはタンパク質、
(b)DNA、RNA、オリゴヌクレオチド、アプタマー、およびそれらの一部から成る群から選択された核酸、
(c)単糖、オリゴ糖、多糖類、糖脂質、プロテオ多糖類、およびそれらの一部から成る群から選択された炭水化物、
または
(d)ビオチン、ビオチン誘導体、ステロイド、ホルモン、補因子、活性化因子、抑制因子、ドラッグ、アレルゲン、またはハプテンから成る群から選択された低分子量のリガンド。
【0024】
標的:本明細書において、”標的”という用語は、サンドイッチ型分析における検体、または競合型分析における競合相手を意味するために使用される。
【0025】
本発明は、固相基板検出システムにおいてシグナルを生成し、局部にとどめる方法であって、
固相基板に標的材料の溶液を投入するステップと、
多数のシグナル前駆体分子を含む非触媒性標識が取り付けられた前記標的材料を特有の親和性分子と結合させるステップと、
前記固相基板にキャリア媒体を重ねるステップと、
前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために前記非触媒性標識を処理するステップと、
を備え、
前記キャリア媒体が、前記非触媒性標識を溶解させるための溶媒と、前記標的の存在および/または量を示す前記多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含む、
ことを特徴とする方法を提供する。
【0026】
いくつかの実施形態において、キャリア媒体は、また、検出可能なシグナルを生成する状態にシグナル前駆体分子を変換する材料であるシグナル展開試薬を含む。これらの実施形態では、シグナルの生成とシグナルの局在化は同時に起こる。
【0027】
他の実施形態では、温度の変化、pHの変化、高周波音による分解、光の照射、またはマイクロウエーブ加熱のような物理的手段によって、多数のシグナル前駆体分子が多数の検出可能なシグナル生成分子に変換されるので、シグナル展開試薬は必要でない。望ましくは、固相基板にキャリア媒体を重ねるステップと、多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために非触媒性標識を処理するステップとは実質的に同時に実行される。実際には、固相基板にキャリア媒体を重ねる処理ステップには短時間の中断がある。または、キャリア媒体を重ねた後で処理ステップを始めるときにわずかな遅れがある。
【0028】
複数の異なる方法でキャリア媒体を固相基板に重ねることができる。キャリア媒体は薄膜として直接重ねられるマトリクスゲルの形であってよい。あるいは、マトリクスゲルは、固相基板とマトリクスゲルを接触させることが望まれるときに除去される保護層によって固相基板から分離されていてもよい。キャリア媒体が液体である場合には、それは噴霧することによって重ねられてもよい。別の選択肢は、キャリア媒体に固相基板を浸すこと、または固相基板上にキャリア媒体を垂らすことである。さらに別の選択肢は、容器の中の高い粘度の液体またはマトリクスゲルに固相基板を浸すことである。
【0029】
第2の態様では、本発明は、液体サンプルの中の標的材料を検出するためのテストデバイスであって、
サンプル投入サイトから検出サイトへ液体サンプルを輸送するための手段を有する固相基板検出システムを備え、
前記検出サイトから離れた位置で処理され、前記標的材料のための特有の親和性分子に非触媒性標識が取り付けられ、前記非触媒性標識が多数のシグナル前駆体分子を含み、前記シグナル前駆体分子が多数の検出可能なシグナル生成分子に変換可能であり、
前記非触媒性標識を溶解するための溶媒と、前記標的材料の存在および/または量を示す前記検出サイトで前記多数の検出可能なシグナル生成分子によって生成されるシグナルの局在化を生じさせるための増粘剤とを含むキャリア媒体を備え、
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段を備え、
前記キャリア媒体が、少なくとも前記検出サイトで前記検出可能な材料と接触するように構成される、
ことを特徴とするテストデバイスを提供する。
【0030】
いくつかの実施形態において、キャリア媒体は、また、検出可能なシグナルを生成する多数の検出可能なシグナル生成分子に多数のシグナル前駆体分子を変換する材料であるシグナル展開試薬を含む。他の実施形態では、温度の変化、pHの変化、高周波音による分解、光の照射、またはマイクロウエーブ加熱のような物理的手段によって、多数のシグナル前駆体分子が多数の検出可能なシグナル生成分子に変換されるので、シグナル展開試薬は必要でない。
【0031】
本発明は、さらに、液体サンプルの中の標的材料の存在を決定するためのパーツのキットであって、
サンプル投入サイトから検出サイトへ液体サンプルを輸送するための手段を有する固相基板検出システムを備え、
前記検出サイトから離れた位置で処理され、前記標的材料のための特有の親和性分子に非触媒性標識が取り付けられ、前記非触媒性標識が多数のシグナル前駆体分子を含み、前記シグナル前駆体分子が多数の検出可能なシグナル生成分子に変換可能であり、
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段を備える、
ことを特徴とするキットを提供する。
【0032】
そのキットは、さらに、前記非触媒性標識を溶解させるための溶媒と、前記検出サイトで前記多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含むキャリア媒体を形成するための原料を有する。前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段は、前記キャリア媒体に包含されるシグナル展開試薬である。キットの中のシグナル前駆体材料は、蛍光色素分子とそれらの誘導体、発光団とそれらの誘導体、発色団とそれらの誘導体、接合団、または、レドックスメディテーターから選択された酸化還元活性物質、電極活性物質、生物発光性および蛍光発光性のタンパク質、可視色素、蛍光色素、生物発光若しくは化学発光の材料、または磁性材料を含むことができる。
【0033】
誤解を避けるために、非触媒という語句はまた非酵素を含み、本発明は、多数の検出可能なシグナル生成分子に変換可能な多数のシグナル前駆体分子を含むシグナル前駆体材料の使用に基づく。従って、多数のシグナル前駆体分子を含む非触媒性標識が取り付けられている標的材料に対して特有の親和性分子とその標的材料が結合するとき、各々の標的分子が多数のシグナル前駆体分子と関連するので、検出可能なシグナルの内在するまたは潜在的な増幅が生じる。言い換えると、決定反応が起こると、シグナル前駆体分子が”活性化”され、多数の検出可能なシグナル生成分子に変換される。
【0034】
例えば、標的材料が抗原であり、その標的材料と特に結合する親和性分子と結合した非触媒性標識がフルオレセイン二酢酸結晶(FDA、すなわちシグナル前駆体分子の結晶)を含むマイクロカプセルと結合した検出器抗体であるケースを考える。(例えば、固相担体上の捕捉抗体によって)抗原/検出器抗体が検出サイトで捕らえられると、溶媒によるFDA結晶の溶解と、(例えば、KHOを用いた処理による)FDAのフルオレセインへの転換とが各標的抗原のために何百万という数の蛍光性分子を解放する。
【発明の効果】
【0035】
本発明は検出サイトでライン、ドット、スポット、またはゾーンが拡大するという問題に対する技術的な解決策を提供し、特にPoCテストデバイスにおけるテストラインと制御ラインの可読性を改善する。その拡大は、通常、必要な解放試薬を水溶液に加えることによって誘発されて始まる。溶液中で物質が拡散すると、検出サイトははっきりした反応ラインではなくなり、不鮮明となって広がり、曖昧になる。本発明によって、形成されたその場所にシグナルをとどめるための必要性が満たされる。
【0036】
本発明は、以下に図面を参照して制限なしに例によって記載される。
【図面の簡単な説明】
【0037】
【図1】公知の側方流テストストリップの構造を示す概略図である。
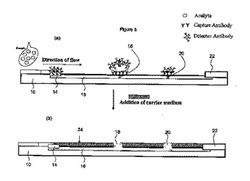
【図2】使用中の従来技術である側方流テストストリップを概略的に示す2つの図である。図2(a)は、直接標識(すなわち、増幅されない標識)を使うテストストリップを示す。図2(b)は標識を増幅するために従来の溶液技術を使うテストストリップを示す。
【図3】本発明に従ってシグナルを局部にとどめるためのキャリア媒体の薄い膜の応用を示すテストストリップの他の概略図である。
【図4】従来の解放溶液を使って生成されたシグナル(左側のストリップ)と本発明に係るマトリクスゲルを使って局部にとどめられたシグナル(右側のストリップ)に対する異なる時間間隔での蛍光シグナルの変化を示す。
【図5】多重検出プラットフォームの略図である。
【図6】目に見えるシグナルの効果的な局在化のために決定反応の完了後にテストストリップの上に配置するためにマトリクスゲルとともに装着される透明な蓋を有するテストストリップの略図である。
【発明を実施するための形態】
【0038】
以下の記載の中で、後ろ、左、右等のような相対的に空間的な用語は、技術のある読者に便利なように使われ、そして図に描かれるようなテストデバイスとそれらの構成部品の方向に関する。これらの用語の使用は、製造、出荷、保管、または販売の間、または構成部品の組立の間、または他の装置に組み込み、または組み合わせるとき、本発明の実施に如何なる制限も意図しない。
【0039】
図1は、従来の側方流テストストリップを示す平面図(図1(a))と側面図(図1(b))である。参照符号10は、多孔質部材を保持するための後方積層板を示す。この上に使用時にサンプルが置かれるサンプル積載パッド12がある。ニトロセルロース膜16によって運ばれる液体サンプルの中で標的がテストストリップに沿って通過するとき、標的と反応する検出器材料またはプローブを含む結合パッド14がこの隣にある。図に描かれているように左から右への流れの方向において、検出サイト18は、テストストリップの幅を横切って当てられ、標的/検出器複合体を捕らえる捕獲プローブのラインである。一方、制御サイト20は、検出サイト18の下流でテストストリップの幅を横切って当てられる更なる材料のラインである。制御サイト20は、サンプルの中の何も検出しないが、ストリップが正しく湿っており、テスト部材の全てが機能していることを示す。如何なる検出可能な標的も含まず、従って検出サイト18において信号が生じないサンプルに対してさえ、テストが正しく行われていることを確認するために、制御サイト20はいつでも目に見える信号を生じるべきである。過度の液体は吸収パッド22によって吸収される。
【0040】
今図2に替わると、図2は、使用中の2つの側方流テストストリップの概要を示す図である。図2(a)において、テストストリップは直接標識を使って示される。そこでは、シグナル前駆体分子をシグナル生成分子に変換する必要はなく、検出サイト18と制御サイト20での検出ラインは、はっきりと、かつ明確に規定されている。図2(b)は、決定反応が起こった後で、検出可能なシグナル生成分子へのシグナル前駆体分子の変換を始めるためにシグナル展開試薬の溶液が加えられたテストストリップの図である。ここで、検出サイト18と制御サイト20での検出ラインは、明確には規定されていない。それらは、シグナル展開試薬を加えるために使われた溶液によるシグナル生成分子の拡散のために広がっている。
【0041】
本発明において、そのような拡散は妨害される。本発明は、検出可能なシグナル生成分子へのシグナル前駆体分子の変換を実行できるようにするが、検出サイト18と制御サイト20での良く規定された検出ラインを維持する。これは、シグナル分子の拡散と分布を最小化するキャリア媒体を使って達成される。いくつかの実施形態において、キャリア媒体はシグナル前駆体分子を検出可能なシグナル生成分子に変換するシグナル展開試薬を含む。しかし、キャリア媒体は検出膜を通る急速な拡散を許す形式ではない。
【0042】
キャリア媒体は”マトリクスに結合した水”を持った増粘剤の開発に基づく。増粘剤の中で、溶媒、そしていくつかの実施形態ではまたシグナル展開試薬は、ゲル状態が形成される前にゾル状態で溶かされる。ゲル状態において、マトリクスは、検出膜に支持された多数の検出可能なシグナル生成分子の拡散を最小化する。
【0043】
図3は、図1に描かれたストリップのようなテストストリップの他の概略図である。図3(b)は、本発明に従って、多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換し、多数の検出可能なシグナル生成分子を局部にとどめることによってシグナルの生成を引き起こすための検出膜16の上面に配置されたキャリア媒体24の薄い層の応用を示す。都合の良いことには、キャリア媒体24は、露出した検出膜16の上面に好ましくはサイズの面で一致する膜の薄いストリップにカットされたマトリクスゲルである。
【0044】
図4は、従来の解放溶液を使って生成されたシグナル(左側のストリップ)と、マトリクスゲルの形でシグナル展開試薬を含むキャリア媒体を使って生成されたシグナル(右側のストリップ)に対する異なる時間間隔での蛍光シグナルの変化を示す写真である。フルオレセイン二酢酸シグナル前駆体分子からフルオレセインを解放するために従来の解放溶液を加えた直後に、または本発明に係るマトリクスゲルを加えた直後に、ストリップのペアは撮影された。それから同じストリップのペアが再び次の連続的な時間間隔で撮影された。:1,2,3,4,5,7,9,12および15分。シグナルがマトリクスゲルを使って生成されたストリップは15分後でさえよく規定されたラインを維持するが、一方シグナルが従来通り解放溶液を使って生成されたストリップは最初の間隔でさえ拡散の兆候を示し始めた。15分後に、これらの従来のストリップは実際には実質的に再現して読むことができないとても拡散したラインを示した。
【0045】
図5に替わると、これはマトリクスゲルの実施形態がどのように多重検出プラットフォームに適用されるかを示す略図である。図5(a)には、予め定められた位置を覆う異なる捕獲プローブを有する透明な容器が示される。異なる捕獲プローブはある標的に特有である。図5(b)では、捕獲プローブの特有のものと結合する複数の標的を含むサンプルに捕獲プローブがさらされる。図5(c)では、捕獲された標的は、更に、標的材料に対して特有の親和性抗体と結合させられる。その抗体には、シグナル前駆体分子としてFDAから成る非触媒性標識が取り付けられている。図5(d)では、FDAに対するシグナル展開試薬を有するマトリクスゲルが容器に加えられ、標的がそれぞれの捕獲プローブに結合したサイトで局部的な蛍光シグナルが生成される。
【0046】
図6は、目に見えるシグナルの効果的な局在化のために決定反応の完了後にテストストリップの上にマトリクスゲル24とともに装着される透明な蓋26を有するテストストリップの略図である。蓋は、分離したものであってよいが、ここで示されるように、多孔質部材を支える後方積層板10にヒンジ28によって取り付けられる。
【0047】
本発明は、以下に示す従来の方法の問題と制限に取り組む。:
・シグナル生成分子の拡散は測定の焦点を測定エリアに合わせることができないということを意味するので、蛍光、発光、または吸光を信頼できるように決定することができない。
・分析感度が減少する。拡散は、蛍光、発光、または吸光が良く規定されたサイトの中に固定されず、その代わりに検出サイトであることを意図されていない薄膜の部分の上に分散されるということを意味する。これは、構成のそれらの場所からの流れによる検出可能なシグナル生成分子の損失に導く。従って、分析感度が減少する。
・もし側方流デバイスが半定量的なものと考えられるならば、そのとき、複数の抗体(2)ラインが薄膜の上に与えられる。検出可能なシグナル生成分子がそれらのラインの間およびそれらのラインの後でぼやけ、分散するので、その結果を解釈することはできない。
【0048】
本発明は、拡散束を取り扱うよく知られたフィックの第一法則と第二法則の拡散係数における粘性項の修正に基づく問題に取り組む。フィックは、濃度勾配(dc/dx)に比例する大きさで高い濃度の領域から低い濃度の領域に流れが生じることを仮定する。1次元では、その式は次の通りである。
【数1】

ここで、
・Jは拡散束である。それは、短い時間間隔の間に小さなエリアを通って流れる物質の量の程度である。本発明では、Jの値は最小であることが望ましい。
・Dは細孔の大きさ、それらの分布、および特に”液体”の粘度によって決まる”結合した”ゲル水における拡散係数である。
・cは濃度である。;ここでは、cは、例えば、形成されたフルオレセインの濃度である。
・xは、位置、または構成の場所からの距離である。;ここでは、xは検出サイトからの距離である。
【0049】
拡散係数(D)は、拡散粒子の粘度の二乗に比例し、温度、流体の粘度、および粒子サイズに依存する。薄い水溶液の中で、大部分のイオンの拡散係数は同様であり、典型的に0.6×10−9から2×10−9m2/sまでの範囲の値を持つ。生物学的な分子に対して、拡散係数は通常10−11から10−10m2/sまでの範囲である。
【0050】
本発明は、シグナル分子の局在化のために必要な試薬を含むキャリア媒体を使う。上述したように、いくつかの実施形態の中でキャリア媒体はまたシグナル前駆体分子を検出可能なシグナル生成分子に変換するためにシグナル展開試薬を含む。他の実施形態の中で、この変換は、温度の変化、pHの変化、高周波音による分解、光の照射、またはマイクロウエーブ加熱のような物理的手段によって達成される。水性ゲルの場合には、水は、ゾル状態からゲル状態が形成された後で、ゲルのマトリクスの中でしっかりと結合され/固定される。ゲルの中の液体(水)がより多くまたはより少なく凝固するので、拡散は著しく妨げられる。高い剛性率を持った液体の場合には、溶媒はシグナル分子の拡散を遅らせる。
【0051】
重要な試薬を含むゲルは、ゾル状態のゲル構成化合物の中に試薬を溶かすことによって容易に生じさせることができる。ゾルの中への試薬の投入の後で、ある程度の時間が経過するとゾルはゲル状態に変わる。または、その変換は温度の変化によって誘導されてもよい(例えば、寒天はより高い温度で液体(ゾル状態)であり、より低い温度で固体(ゲル状態)である。)。
【0052】
ゾルとゲルの両方の状態で存在する多数の物質がある。水を持ったゲルとゾルは、ゾル状態ではゲル形成物質−増粘剤−が水の中にコロイド的に分散しているが、ゲル状態では水が増粘剤のゲル形成網の中に分散しているという特徴がある。
【0053】
特に好ましい実施形態では、本発明は特許文献1で開示された原理を使用する。そして、その中で1つの反応相手の標識は数百万の非蛍光FDA分子を包含するFDA結晶である。これらは、検出サイトで数百万のフルオレセイン分子に加水分解される。キャリア媒体に包含される増粘剤のおかげで、このように形成されたフルオレセイン分子は検出サイトから離れて拡散することを妨げられる。
【0054】
このプロセスでは、DMSOとNaOHがキャリア媒体に包含される溶媒とシグナル展開試薬である。シグナル局在化効果は、キャリア媒体から検出膜の表面へのDMSOとNaOHの部分的な拡散(すなわち、DMSOとNaOH溶液の高い濃度の領域からより低い濃度の領域への流れ)によって説明される。FDA−結晶はDMSOの中に溶け、NaOHによってフルオレセインに加水分解される。フルオレセインは蛍光を発する。水はキャリア媒体の中で強く結合し、キャリア媒体は増粘剤の反応のおかげで交差結合された3次元ネットワークと考えられるので、小さな分子量の物質のみが結合水を持ったキャリア媒体を通って拡散し、検出膜と素早く接触する。このプロセスは約30秒より長くは続かない。
【0055】
非結合水を持つ水溶液は加えられないので、検出膜の吸収性パッドによって支援されるフルオレセイン分子の拡散と分配は生じない。従って、フルオレセイン分子は、局部にとどめられ、検出感度を損なうこと無しに測定されることができる。また、半定量的決定の中で更なる検出ラインが存在するならば、可読性は減少しない。
【0056】
ある検出プラットフォームのために、キャリア媒体は、検出膜の上に配置するために適切なサイズに切断された大きな薄いシートとして作られるマトリクスゲルの形であることができる。フィージビリティ・スタディでは、この配置はフォーセプスを使って実行された。
【0057】
他のアプローチは、キャリア媒体を分離した透明なカバーデバイスに組み入れ、決定反応の完了後にそのカバーデバイスが閉じられるとき、キャリア媒体を検出膜に接触させることである。この場合には、検出装置は箱の形で2つの部分からなる。検出装置(箱)が開かれ、検出膜を持った箱の下側の部分で決定反応が生じる。続いて、その箱はキャリア媒体が組み入れられたカバーで閉じられる。カバーが閉められるのが早すぎたことによってシグナル前駆体分子とキャリア媒体が不注意に接触することを防ぐために、キャリア媒体は、決定反応が実行された後で除かれる除去可能なフィルムの薄いシートの保護カバーを持つ。そのときのみ、キャリア媒体は検出膜の上の検出サイトに接触することができる。
【0058】
<キャリア媒体の準備/生産>
キャリア媒体は、一般に溶媒、(存在するならば)シグナル展開試薬、および増粘剤を混合することによって形成される。増粘剤の選択に依存して加熱と冷却が必要とされる。
【0059】
プロセスを形成するキャリア媒体のために、異なる増粘剤または増粘剤の混合物が使われてよい。増粘剤の各タイプに対して、増粘剤が検出可能なシグナル生成分子の局在化を達成するための適切な濃度は、結合水の含有量、ゲルのずれ特性、凝固プロセスの間の縮小、統合された反応相手の拡散定数、緻密化、透明性、安定性、および温度変化へのロバスト性に関して最適化されなければならない。
【0060】
マトリクスゲルの形であるとき、キャリア媒体の粘度はSDS−PAGEの中で使われるポリアクリルアミドゲルの粘度と比較される。低いパーセントのゲルは、あまり厚くはないが、噴霧することによって検出膜の表面に塗布される。高いパーセントの厚いゲルは、局在化されたシグナルを展開するためにコーティングされたペタルがゲルの中に浸されたある多重検出プラットフォームにもっと適合する。ゲルのパーセントは、その媒体の全重量に対して0.05%から50%までの範囲の重量であり、より好ましくは0.1%から20%までの範囲である。他の実施形態では、ゲルの比率に対する下限は0.05%、0.1%、0.2%、0.3%、0.4%、および0.5%の値のいずれか1つであり、上限は3%、4%、5%、10%、20%、および50%の値のいずれか1つであってよい。従って、ゲルの比率に対する範囲は、上記下限のいずれかと上記上限のいずれかの組み合わせであってよい。
【0061】
キャリア媒体の剛性率は、添加される増粘剤の量を変えることによって調整されることができる。もちろん、高い粘度を持つ溶液は、また、拡散のペースを落とすことができるが、シグナルの保持タイムは凝固した形を使って得られるものよりも短いであろう。
【0062】
マトリクスゲルが最適化されるならば、実験結果に基づいて図4に示すように、検出サイトの位置で局部にとどめられた反応ライン(シグナルライン)が得られる。繰り返すと、図4は、水溶液よりむしろマトリクスゲルがシグナルの生成とシグナルの局在化のために使われるならば、検出サイトの形に著しい差が生じることを示す。
【0063】
<実施例>
今、さまざまな実施例を参照して本発明を特に記載するが、これらは本発明に何の制限も課さない。
【0064】
実施例1:
[FDA−結晶をベースとするシグナルシステムのためのDMSOをベースとするキャリア媒体の準備]
FDAのためのキャリア媒体は、DMSO、NaOH、およびポリソルベート20からなる。DMSOの目的はFDAを溶かすことであり、NaOHは溶解したFDAを加水分解するために使われる。ポリソルベート20は、ゲル形成のためにアクティブな成分である。特に、それらの成分は混合され(例えば、1mlのDMSOと、1mlの1M NaOHと、50μlのポリソルベート20を混合する。)、凝固のために5−10分間室温に保たれる。
表1は、マトリクスゲルの形であるキャリア媒体の組成と外観の最適化を示す。
【0065】
【表1】

【0066】
実施例2:
[FDA−結晶をベースとするシグナルシステムのためのイソプロパノール(IPA)をベースとするキャリア媒体の準備]
FDAのためのIPAをベースとするキャリア媒体は、IPA、NaOH、およびポリビニルピロリドン(PVP)からなる。IPAの目的はFDAを溶かすことであり、NaOHは溶解したFDAを加水分解するために使われる。PVPは、キャリア媒体の粘度を上げるために使われる。特に、それらの成分は混合される(例えば、1mlのIPAと、1mlの1M NaOHと、0.2gのPVPを混合する。)。
【0067】
実施例3:
[マイクロタイタープレートをベースとするテストにおけるキャリア媒体の応用]
直径1mmのマイクロシリンジポンプによってマイクロタイタープレートの各ウェルの内側に配置されたナイロン被膜の上に1μgのGt−α−MIgGをドットとしてコーティングした。それから、そのプレートを真空中で2時間乾燥させた。その後、ウォッシングバッファー[10mMのPBS、0.1%(重量/体積パーセント)のBSA、0.5%(重量/体積パーセント)のポリソルベート20]によって5回そのプレートを洗った。それから、100μLの1%BSA溶液を用いて37℃で30分間それらのウェルを塞いだ。25μLのMIgG(100μg/L)と25μLのビオチン−Gt−α−MIgGを各ウェルに加えて37℃で1時間培養した。5回の洗浄サイクルの後、FDAナノ結晶と結合しているアビジンを各ウェルに加え、再び、37℃で1時間培養した。5回の洗浄サイクルの後、実施例2に記載されたキャリア媒体を各ウェルに加えた。蛍光を発するドットが紫外線ライトの下で直ちに観察された。このスキームは、複数の標的の検出のために図5を参照して上述された。そこでは、異なる捕獲抗体がマイクロタイタープレートの内側に配置されたナイロン被膜の上にドットとしてコーティングされた。
【技術分野】
【0001】
本発明は、体液のような液体サンプルの中の検体、例えば、抗原のための検定に関する。更に詳細には、本発明は、側方流デバイスのような固相プラットフォームを使用するポイント・オブ・ケアテストデバイスにおいて検出可能な材料を含む複合体を用いて、尿、血液、血清、血漿、唾液のような体液または排せつ物の抽出溶液の中の検体を検出するための非触媒法に関する。また、本発明は、汚染物質に対して食物や水をテストすることのような、または獣医学領域や軍隊における非臨床的状況に適用することができる。
【0002】
本発明は、検定中にシグナルの生成とシグナルの局在化のために異なる試薬を運ぶキャリア媒体を使う。そのキャリア媒体は以下のものを含む。:
(i)溶媒(例えば、バッファーを含む水溶液、塩溶液、水、有機溶媒、例えば、エタノール、プロパノールのようなアルコール、テトラヒドロフラン(THF)のような他のもの、およびジメチル・スルホキシド(DMSO)のような極性非プロトン性溶媒);
(ii)増粘剤、増粘剤は高い粘度の流体からゲルまでに及ぶキャリア媒体特性を与える内部構造を形成するコロイド混合物として溶媒の中で溶ける。ゲルタイプのキャリア媒体は固体の外観を持つが、主に溶媒からできている。実例は、ポリアクリルアミドおよびポリイソブチレンのようなポリマー;褐藻類、寒天、カラギーナン、ペクチンから得られるアルギン酸塩、でんぷん、セルロースのような多糖類;ローカストビーンガムおよびグアーガムのような天然ガム;コラーゲン、アルブミン、およびゼラチンのようなタンパク質を含む。
【0003】
いくつかの実施形態において、キャリア媒体は、また、シグナル展開試薬を含む。シグナル展開試薬は検出可能なシグナルを生成する状態にシグナル前駆体分子を変換する材料である。他の実施形態では、温度の変化、pHの変化、高周波音による分解、光の照射、またはマイクロウエーブ加熱のような物理的手段によって、多数のシグナル前駆体分子が多数の検出可能なシグナル分子に変換されるので、シグナル展開試薬は必要でない。
【0004】
キャリア媒体の機能は以下の通りである。:
(i)シグナル分子の拡散を妨げ、シグナルの蓄積に導くこと。
(ii)固相プラットフォームにおけるシグナルの可読性(鮮明さ、シグナル保持時間の延長)を改善し、従って感度を高めること。
いくつかの実施形態において、多数のシグナル前駆体分子から多数の検出可能なシグナル生成分子への変換は科学的または生科学的手段によってもたらされ、キャリア媒体は第3の機能を持つ。:
(iii)多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換することによって、シグナルを生成すること。
目に見える光の検出を使う検定のために、キャリア媒体は実質的に光学的に透明である。
【背景技術】
【0005】
尿、血液、血清、血漿、唾液のような体液または排せつ物の抽出溶液の中のさまざまな標的物質の存在を検出するために、多くのタイプの標的−受容体検定が使われている。これらの検定は、一般的に抗原抗体反応や、放射能による、酵素による、蛍光による、発光による、化学発光による、または視覚的に観察できる金属タグを持った合成複合体を含み、特別に設計された反応チャンバーを使う。すべてのそのような検定において、選択された標的、例えば抗原に対して固有の受容体、例えば抗体があり、標的−受容体反応の生成物の存在を検出し、しばしばその量を検出する手段がある。多くの現在のテストは、半定量的または定量的な決定を与えるために設計される。しかし、多くの環境では、必要とされる全ては、標的種の存在の肯定的または否定的なしるしを与える定性的検出である。そのような定性的検定の例は、血液型判定、大部分の種類の尿検査、および結腸直腸癌のためのスクリーニング検定のような非常に重要な糞便潜血検査を含む。これらのテストのために、有色の粒子、例えば、金粒子の蓄積、塊の存在、または色の変化のような視覚的に観察可能なしるしが好ましい。
【0006】
それにもかかわらず、テスト流体における検定対象の標的がしばしば低濃度であるために、定性的な検定は非常に高感度でなければならない。金属ゾルまたは他のタイプの有色粒子を使うサンドイッチ分析と他の高感度検出方法が開発された。けれども、これらのテクニックは迅速検出法の直面する問題の全てを解決しなかった。それで、常に更なる改善が求められている。
【0007】
例として、側方流サンドイッチ分析において、他の抗体(2)はニトロセルロース膜のような薄膜上でよく規定された検出サイトに固定されるのに対して、コロイド金はしばしば最初の検体(1)の標識として使われる。もし問題となっている検体がサンプルの中に存在するならば、そのときその検体は金で標識された検体(1)と反応し、ニトロセルロース膜と結合した抗体(2)に移動する。そこで、それはサンドイッチを形成し、それからこれらのサンドイッチ複合体は検出サイトに集められ、集中させられる。このサイトは、銀イオンとの付加的な反応によって(増幅されて)ある程度目に見えるようにされることができる。
【0008】
けれども、分析感度が極めて優れているわけではない。そして、この技術はある検定には容易に適用できない。例えば、診断上とても重要である低濃度範囲において、甲状腺刺激ホルモン(TSH)、前立腺特異抗原(PSA)、トロポニンI、またはトロポニンTの決定のために容易には適用できない。
【0009】
従って、そのような検定をもっと効果的に行うために、(”シグナル増幅前駆体分子”と名づけられた)他の標識が使われ、それは決定反応の終わり、例えば、サンドイッチ(固定された抗体(2)−検体−{検体(1)−標識})の構成の終わりに増幅されることができる。
【0010】
もし増幅標識がフルオレセイン二酢酸(FDA)結晶−数百万のFDA分子から成る−を含むマイクロカプセルであるならば、そのとき、そのマイクロカプセルを分解し、非蛍光性のFDA−分子を蛍光性のフルオレセイン分子に加水分解することによって、決定反応の後で増幅が生じる。この増幅は特許文献1において十分に証明され、記載されている。その開示は、参照によって本明細書に含められる。
【0011】
通常、増幅反応は解放試薬の溶液の中で起こる。これは、希釈要因−解放されたフルオレセイン分子が解放試薬の反応体積に希釈されること−のために分析感度の理想からのわずかな減少に導く。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】欧州特許第1309867号明細書
【発明の概要】
【発明が解決しようとする課題】
【0013】
不幸にも、ある環境では、増幅の利益はシグナル消失の不利益によって相殺され、上回られさえする。一例として、検出または決定が薄膜上で、例えば、側方流テストストリップの中で実行されるならば、シグナルの増幅を可能にする解放試薬溶液の投入は増幅されたシグナルが薄膜に沿って拡散することに帰着する。解放された/増幅された分子は局部にとどまらない。このため、シグナルは増幅の後でさえ検出困難であるかも知れない。基本的なテスト反応の完了後におけるいかなる溶液の投入も、検出ライン、スポット、またはゾーンの拡大に導く。拡散は検出サイトを広げ、検出サイトの色強度を信頼できるように測定することを不可能にする。
【0014】
また、先行技術は、標識が高いターンオーバー数を持った酵素である例を含む。その酵素は、基質と反応するとき、非常に多くの反応生成物分子を形成する。再び、これは、水溶液の中で、もっと正確に言えば、酵素に対する特有の基質分子を持った緩衝溶液の中で実行される。酵素をベースとするシステムの一つの欠点は、それらが触媒であるので、基質の変換が起こり、これが持続しているプロセスであるとき、増幅が始まるということである。増幅は、基質濃度と酵素の反応に対して選択される時間とに依存している。停止試薬が加えられないならば、測定時間の間(そして、その後も)酵素が機能する。それで、一定のシグナルはない。停止試薬の投入は希釈効果を増加させるだろう。
【0015】
従って、シグナル分子の拡散を妨げることによって最先端技術で制限を克服し、シグナルが確実に検出されるように鮮明さを維持してシグナル保持時間を延ばすことによってシグナルの可読性を改善することが本発明の目的である。また、流体サンプル、特に体液のサンプルの中で検体を検出する迅速で高感度の方法を提供することが本発明の目的である。他の目的は、通常の検定に比べて高い感度を有する検定を提供することである。さらなる目的は、流体中の低レベルの検体を検出するためのテストデバイスを提供することである。
【課題を解決するための手段】
【0016】
<用語の定義>
キャリア媒体:
キャリア媒体は多数の検出可能なシグナル生成分子の拡散を妨げ、シグナルの蓄積に導く。これは、固相プラットフォーム上で多数の検出可能なシグナル生成分子の改善された可読性(鮮明さ、シグナル保持時間の延長)に帰着し、従って感度を高める。
キャリア媒体は以下のものを含む。:
(i)溶媒(例えば、バッファーを含む水溶液、塩溶液、水、有機溶媒、例えば、エタノール、プロパノールのようなアルコール、テトラヒドロフラン(THF)のような他のもの、およびジメチル・スルホキシド(DMSO)のような極性非プロトン性溶媒);
(ii)増粘剤、増粘剤は高い粘度の流体からゲルまでに及ぶキャリア媒体特性を与える内部構造を形成するコロイド混合物として溶媒の中で溶ける。
また、キャリア媒体は、化学的または生化学的活性化を必要とするシグナル前駆体分子のために、以下のものを含む。:
(iii)シグナル展開試薬、シグナル展開試薬は検出可能なシグナルを生成する状態にシグナル前駆体分子を変換する材料である。
【0017】
増粘剤:
増粘剤は、溶液、乳液、および懸濁液を濃くし、安定化させるために使われる材料である。それらは高い粘度の流体からゲルまでに及ぶキャリア媒体特性を与える内部構造を形成するコロイド混合物として液相の中で溶ける。ゲルタイプのキャリア媒体は固体の外観を持つが、主に液体からできている。増粘剤の実例は、ポリアクリルアミドおよびポリイソブチレンのようなゲルを形成するポリマー;褐藻類、寒天、カラギーナン、ペクチンから得られるアルギン酸塩、セルロース、でんぷんのような多糖類;ローカストビーンガムおよびグアーガムのような天然ガム;コラーゲン、アルブミン、およびゼラチンのようなタンパク質を含む。
【0018】
シグナル前駆体分子:
シグナル前駆体分子は、1つ以上の他の試薬と反応するとき、検出可能なシグナルに導く分子である。初期反応を経て検出可能なシグナルに導くさまざまな化学的分類の非常に多くの異なる物質がある。例えば、蛍光色素分子とそれらの誘導体、発光団とそれらの誘導体、発色団とそれらの誘導体、接合団、または、レドックスメディテーターから選択された酸化還元活性物質、電極活性物質、生物発光性および蛍光発光性のタンパク質、可視色素、蛍光色素、生物発光若しくは化学発光の材料、電気化学的に活性な材料、または磁性材料がある。シグナル前駆体分子は非触媒性標識である。
検出可能なシグナルは、以下に示すもののベースとされることができる。
−蛍光定量法
−ルミノメトリー
−紫外線、可視光、および近赤外線範囲における色変化
−酸化還元電位の変化
−複合体の形成または沈殿物から生じる塊の変化
−放射性崩壊生成物の検出
−磁場の検出
【0019】
シグナル分子:
本明細書において、シグナル分子という用語は、文脈がシグナル前駆状態とシグナル生成状態のうち特定の状態にあることを求めない場合に、シグナル前駆体分子とシグナル生成分子の両方またはいずれか一方を示すために使用される。それは、また、シグナル前駆体分子とシグナル生成分子が両方とも同時に存在するかも知れない場合に使用される。
【0020】
シグナル展開試薬:
シグナル展開試薬は、存在する場合には、シグナル前駆体分子が検出可能なシグナルを生成できるようにする材料である。シグナル展開試薬は、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、またはフルオレセイン二酢酸マレイミド(FDA−マレイミド)などのフルオレセインとそれらの誘導体、シアニン、カルボシアニン、ローダミン、キサンテン、ジアゾ色素をベースとする蛍光物質、並びに、蛍光芳香族低分子およびヘテロ芳香族低分子から成る群から選択された蛍光色素分子を活性化するように構成される。あるいは、シグナル展開試薬は、シアニン、ピラゾロン、アントラキノン、カルボシアニン、ローダミン、キサンテン、カロテノイド、並びに、ジアゾおよびモノアゾ、オキサジン、インジゴイド、またはリボフラビンをベースとする染料物質から成る群から選択された発色団を活性化することができる。
【0021】
テストデバイス:
本明細書で使用されるように、テストデバイスという用語は固相基板を包含するデバイスを示すために使われる。固相基板は、薄膜、マイクロタイタープレート、ビーズ(磁性および非磁性)、チューブ、並びに、スライドから成るグループから選択されることができる。テストデバイスは、側方流、垂直流、テストチューブ、マイクロタイタープレート、ペタルなどを含む異なるフォーマットの検定に適合する。固相基板のための材料と形は、ニトロセルロースやナイロンのような多孔質薄膜、ガラス、ポリスチレン、金属、カーボンのような非多孔質の平らな表面、テストチューブまたはマイクロタイタープレートの内壁、磁性または非磁性のビーズのような球であることができる。
【0022】
検出膜:
検出膜は、試薬に関していくつかの別々のパッド(例えば、結合パッド、サンプルパッド、吸収パッド)が取り付けられたニトロセルロースストリップのような反応薄膜から成る。抗体または抗原に関する反応サイト(検出サイト、制御サイト)は、反応薄膜上の明確に規定された位置でコーティングされる。反応サイトでのコーティングは、反応薄膜上で受動的に吸着されて、例えば、ストレプトアビジン(コーティングされたストレプトアビジン←ビオチン化抗体)または種特異抗体(ヤギ・反マウス抗体←マウス抗体)によって共有結合し、または免疫化学的に結合する。
【0023】
親和性分子:
親和性分子は、材料の次の群から選択された生物学的認識分子である。
(a)抗体、遺伝子組み換え抗体、モノクロナール抗体、ポリクロナール抗体、受容体、抗原、レクチン、アビジン、オリゴペプチド、リポタンパク質、糖タンパク質、ペプチド・ホルモン、およびアレルゲン、またはそれらの一部から成る群から選択されたペプチドまたはタンパク質、
(b)DNA、RNA、オリゴヌクレオチド、アプタマー、およびそれらの一部から成る群から選択された核酸、
(c)単糖、オリゴ糖、多糖類、糖脂質、プロテオ多糖類、およびそれらの一部から成る群から選択された炭水化物、
または
(d)ビオチン、ビオチン誘導体、ステロイド、ホルモン、補因子、活性化因子、抑制因子、ドラッグ、アレルゲン、またはハプテンから成る群から選択された低分子量のリガンド。
【0024】
標的:本明細書において、”標的”という用語は、サンドイッチ型分析における検体、または競合型分析における競合相手を意味するために使用される。
【0025】
本発明は、固相基板検出システムにおいてシグナルを生成し、局部にとどめる方法であって、
固相基板に標的材料の溶液を投入するステップと、
多数のシグナル前駆体分子を含む非触媒性標識が取り付けられた前記標的材料を特有の親和性分子と結合させるステップと、
前記固相基板にキャリア媒体を重ねるステップと、
前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために前記非触媒性標識を処理するステップと、
を備え、
前記キャリア媒体が、前記非触媒性標識を溶解させるための溶媒と、前記標的の存在および/または量を示す前記多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含む、
ことを特徴とする方法を提供する。
【0026】
いくつかの実施形態において、キャリア媒体は、また、検出可能なシグナルを生成する状態にシグナル前駆体分子を変換する材料であるシグナル展開試薬を含む。これらの実施形態では、シグナルの生成とシグナルの局在化は同時に起こる。
【0027】
他の実施形態では、温度の変化、pHの変化、高周波音による分解、光の照射、またはマイクロウエーブ加熱のような物理的手段によって、多数のシグナル前駆体分子が多数の検出可能なシグナル生成分子に変換されるので、シグナル展開試薬は必要でない。望ましくは、固相基板にキャリア媒体を重ねるステップと、多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために非触媒性標識を処理するステップとは実質的に同時に実行される。実際には、固相基板にキャリア媒体を重ねる処理ステップには短時間の中断がある。または、キャリア媒体を重ねた後で処理ステップを始めるときにわずかな遅れがある。
【0028】
複数の異なる方法でキャリア媒体を固相基板に重ねることができる。キャリア媒体は薄膜として直接重ねられるマトリクスゲルの形であってよい。あるいは、マトリクスゲルは、固相基板とマトリクスゲルを接触させることが望まれるときに除去される保護層によって固相基板から分離されていてもよい。キャリア媒体が液体である場合には、それは噴霧することによって重ねられてもよい。別の選択肢は、キャリア媒体に固相基板を浸すこと、または固相基板上にキャリア媒体を垂らすことである。さらに別の選択肢は、容器の中の高い粘度の液体またはマトリクスゲルに固相基板を浸すことである。
【0029】
第2の態様では、本発明は、液体サンプルの中の標的材料を検出するためのテストデバイスであって、
サンプル投入サイトから検出サイトへ液体サンプルを輸送するための手段を有する固相基板検出システムを備え、
前記検出サイトから離れた位置で処理され、前記標的材料のための特有の親和性分子に非触媒性標識が取り付けられ、前記非触媒性標識が多数のシグナル前駆体分子を含み、前記シグナル前駆体分子が多数の検出可能なシグナル生成分子に変換可能であり、
前記非触媒性標識を溶解するための溶媒と、前記標的材料の存在および/または量を示す前記検出サイトで前記多数の検出可能なシグナル生成分子によって生成されるシグナルの局在化を生じさせるための増粘剤とを含むキャリア媒体を備え、
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段を備え、
前記キャリア媒体が、少なくとも前記検出サイトで前記検出可能な材料と接触するように構成される、
ことを特徴とするテストデバイスを提供する。
【0030】
いくつかの実施形態において、キャリア媒体は、また、検出可能なシグナルを生成する多数の検出可能なシグナル生成分子に多数のシグナル前駆体分子を変換する材料であるシグナル展開試薬を含む。他の実施形態では、温度の変化、pHの変化、高周波音による分解、光の照射、またはマイクロウエーブ加熱のような物理的手段によって、多数のシグナル前駆体分子が多数の検出可能なシグナル生成分子に変換されるので、シグナル展開試薬は必要でない。
【0031】
本発明は、さらに、液体サンプルの中の標的材料の存在を決定するためのパーツのキットであって、
サンプル投入サイトから検出サイトへ液体サンプルを輸送するための手段を有する固相基板検出システムを備え、
前記検出サイトから離れた位置で処理され、前記標的材料のための特有の親和性分子に非触媒性標識が取り付けられ、前記非触媒性標識が多数のシグナル前駆体分子を含み、前記シグナル前駆体分子が多数の検出可能なシグナル生成分子に変換可能であり、
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段を備える、
ことを特徴とするキットを提供する。
【0032】
そのキットは、さらに、前記非触媒性標識を溶解させるための溶媒と、前記検出サイトで前記多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含むキャリア媒体を形成するための原料を有する。前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段は、前記キャリア媒体に包含されるシグナル展開試薬である。キットの中のシグナル前駆体材料は、蛍光色素分子とそれらの誘導体、発光団とそれらの誘導体、発色団とそれらの誘導体、接合団、または、レドックスメディテーターから選択された酸化還元活性物質、電極活性物質、生物発光性および蛍光発光性のタンパク質、可視色素、蛍光色素、生物発光若しくは化学発光の材料、または磁性材料を含むことができる。
【0033】
誤解を避けるために、非触媒という語句はまた非酵素を含み、本発明は、多数の検出可能なシグナル生成分子に変換可能な多数のシグナル前駆体分子を含むシグナル前駆体材料の使用に基づく。従って、多数のシグナル前駆体分子を含む非触媒性標識が取り付けられている標的材料に対して特有の親和性分子とその標的材料が結合するとき、各々の標的分子が多数のシグナル前駆体分子と関連するので、検出可能なシグナルの内在するまたは潜在的な増幅が生じる。言い換えると、決定反応が起こると、シグナル前駆体分子が”活性化”され、多数の検出可能なシグナル生成分子に変換される。
【0034】
例えば、標的材料が抗原であり、その標的材料と特に結合する親和性分子と結合した非触媒性標識がフルオレセイン二酢酸結晶(FDA、すなわちシグナル前駆体分子の結晶)を含むマイクロカプセルと結合した検出器抗体であるケースを考える。(例えば、固相担体上の捕捉抗体によって)抗原/検出器抗体が検出サイトで捕らえられると、溶媒によるFDA結晶の溶解と、(例えば、KHOを用いた処理による)FDAのフルオレセインへの転換とが各標的抗原のために何百万という数の蛍光性分子を解放する。
【発明の効果】
【0035】
本発明は検出サイトでライン、ドット、スポット、またはゾーンが拡大するという問題に対する技術的な解決策を提供し、特にPoCテストデバイスにおけるテストラインと制御ラインの可読性を改善する。その拡大は、通常、必要な解放試薬を水溶液に加えることによって誘発されて始まる。溶液中で物質が拡散すると、検出サイトははっきりした反応ラインではなくなり、不鮮明となって広がり、曖昧になる。本発明によって、形成されたその場所にシグナルをとどめるための必要性が満たされる。
【0036】
本発明は、以下に図面を参照して制限なしに例によって記載される。
【図面の簡単な説明】
【0037】
【図1】公知の側方流テストストリップの構造を示す概略図である。
【図2】使用中の従来技術である側方流テストストリップを概略的に示す2つの図である。図2(a)は、直接標識(すなわち、増幅されない標識)を使うテストストリップを示す。図2(b)は標識を増幅するために従来の溶液技術を使うテストストリップを示す。
【図3】本発明に従ってシグナルを局部にとどめるためのキャリア媒体の薄い膜の応用を示すテストストリップの他の概略図である。
【図4】従来の解放溶液を使って生成されたシグナル(左側のストリップ)と本発明に係るマトリクスゲルを使って局部にとどめられたシグナル(右側のストリップ)に対する異なる時間間隔での蛍光シグナルの変化を示す。
【図5】多重検出プラットフォームの略図である。
【図6】目に見えるシグナルの効果的な局在化のために決定反応の完了後にテストストリップの上に配置するためにマトリクスゲルとともに装着される透明な蓋を有するテストストリップの略図である。
【発明を実施するための形態】
【0038】
以下の記載の中で、後ろ、左、右等のような相対的に空間的な用語は、技術のある読者に便利なように使われ、そして図に描かれるようなテストデバイスとそれらの構成部品の方向に関する。これらの用語の使用は、製造、出荷、保管、または販売の間、または構成部品の組立の間、または他の装置に組み込み、または組み合わせるとき、本発明の実施に如何なる制限も意図しない。
【0039】
図1は、従来の側方流テストストリップを示す平面図(図1(a))と側面図(図1(b))である。参照符号10は、多孔質部材を保持するための後方積層板を示す。この上に使用時にサンプルが置かれるサンプル積載パッド12がある。ニトロセルロース膜16によって運ばれる液体サンプルの中で標的がテストストリップに沿って通過するとき、標的と反応する検出器材料またはプローブを含む結合パッド14がこの隣にある。図に描かれているように左から右への流れの方向において、検出サイト18は、テストストリップの幅を横切って当てられ、標的/検出器複合体を捕らえる捕獲プローブのラインである。一方、制御サイト20は、検出サイト18の下流でテストストリップの幅を横切って当てられる更なる材料のラインである。制御サイト20は、サンプルの中の何も検出しないが、ストリップが正しく湿っており、テスト部材の全てが機能していることを示す。如何なる検出可能な標的も含まず、従って検出サイト18において信号が生じないサンプルに対してさえ、テストが正しく行われていることを確認するために、制御サイト20はいつでも目に見える信号を生じるべきである。過度の液体は吸収パッド22によって吸収される。
【0040】
今図2に替わると、図2は、使用中の2つの側方流テストストリップの概要を示す図である。図2(a)において、テストストリップは直接標識を使って示される。そこでは、シグナル前駆体分子をシグナル生成分子に変換する必要はなく、検出サイト18と制御サイト20での検出ラインは、はっきりと、かつ明確に規定されている。図2(b)は、決定反応が起こった後で、検出可能なシグナル生成分子へのシグナル前駆体分子の変換を始めるためにシグナル展開試薬の溶液が加えられたテストストリップの図である。ここで、検出サイト18と制御サイト20での検出ラインは、明確には規定されていない。それらは、シグナル展開試薬を加えるために使われた溶液によるシグナル生成分子の拡散のために広がっている。
【0041】
本発明において、そのような拡散は妨害される。本発明は、検出可能なシグナル生成分子へのシグナル前駆体分子の変換を実行できるようにするが、検出サイト18と制御サイト20での良く規定された検出ラインを維持する。これは、シグナル分子の拡散と分布を最小化するキャリア媒体を使って達成される。いくつかの実施形態において、キャリア媒体はシグナル前駆体分子を検出可能なシグナル生成分子に変換するシグナル展開試薬を含む。しかし、キャリア媒体は検出膜を通る急速な拡散を許す形式ではない。
【0042】
キャリア媒体は”マトリクスに結合した水”を持った増粘剤の開発に基づく。増粘剤の中で、溶媒、そしていくつかの実施形態ではまたシグナル展開試薬は、ゲル状態が形成される前にゾル状態で溶かされる。ゲル状態において、マトリクスは、検出膜に支持された多数の検出可能なシグナル生成分子の拡散を最小化する。
【0043】
図3は、図1に描かれたストリップのようなテストストリップの他の概略図である。図3(b)は、本発明に従って、多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換し、多数の検出可能なシグナル生成分子を局部にとどめることによってシグナルの生成を引き起こすための検出膜16の上面に配置されたキャリア媒体24の薄い層の応用を示す。都合の良いことには、キャリア媒体24は、露出した検出膜16の上面に好ましくはサイズの面で一致する膜の薄いストリップにカットされたマトリクスゲルである。
【0044】
図4は、従来の解放溶液を使って生成されたシグナル(左側のストリップ)と、マトリクスゲルの形でシグナル展開試薬を含むキャリア媒体を使って生成されたシグナル(右側のストリップ)に対する異なる時間間隔での蛍光シグナルの変化を示す写真である。フルオレセイン二酢酸シグナル前駆体分子からフルオレセインを解放するために従来の解放溶液を加えた直後に、または本発明に係るマトリクスゲルを加えた直後に、ストリップのペアは撮影された。それから同じストリップのペアが再び次の連続的な時間間隔で撮影された。:1,2,3,4,5,7,9,12および15分。シグナルがマトリクスゲルを使って生成されたストリップは15分後でさえよく規定されたラインを維持するが、一方シグナルが従来通り解放溶液を使って生成されたストリップは最初の間隔でさえ拡散の兆候を示し始めた。15分後に、これらの従来のストリップは実際には実質的に再現して読むことができないとても拡散したラインを示した。
【0045】
図5に替わると、これはマトリクスゲルの実施形態がどのように多重検出プラットフォームに適用されるかを示す略図である。図5(a)には、予め定められた位置を覆う異なる捕獲プローブを有する透明な容器が示される。異なる捕獲プローブはある標的に特有である。図5(b)では、捕獲プローブの特有のものと結合する複数の標的を含むサンプルに捕獲プローブがさらされる。図5(c)では、捕獲された標的は、更に、標的材料に対して特有の親和性抗体と結合させられる。その抗体には、シグナル前駆体分子としてFDAから成る非触媒性標識が取り付けられている。図5(d)では、FDAに対するシグナル展開試薬を有するマトリクスゲルが容器に加えられ、標的がそれぞれの捕獲プローブに結合したサイトで局部的な蛍光シグナルが生成される。
【0046】
図6は、目に見えるシグナルの効果的な局在化のために決定反応の完了後にテストストリップの上にマトリクスゲル24とともに装着される透明な蓋26を有するテストストリップの略図である。蓋は、分離したものであってよいが、ここで示されるように、多孔質部材を支える後方積層板10にヒンジ28によって取り付けられる。
【0047】
本発明は、以下に示す従来の方法の問題と制限に取り組む。:
・シグナル生成分子の拡散は測定の焦点を測定エリアに合わせることができないということを意味するので、蛍光、発光、または吸光を信頼できるように決定することができない。
・分析感度が減少する。拡散は、蛍光、発光、または吸光が良く規定されたサイトの中に固定されず、その代わりに検出サイトであることを意図されていない薄膜の部分の上に分散されるということを意味する。これは、構成のそれらの場所からの流れによる検出可能なシグナル生成分子の損失に導く。従って、分析感度が減少する。
・もし側方流デバイスが半定量的なものと考えられるならば、そのとき、複数の抗体(2)ラインが薄膜の上に与えられる。検出可能なシグナル生成分子がそれらのラインの間およびそれらのラインの後でぼやけ、分散するので、その結果を解釈することはできない。
【0048】
本発明は、拡散束を取り扱うよく知られたフィックの第一法則と第二法則の拡散係数における粘性項の修正に基づく問題に取り組む。フィックは、濃度勾配(dc/dx)に比例する大きさで高い濃度の領域から低い濃度の領域に流れが生じることを仮定する。1次元では、その式は次の通りである。
【数1】

ここで、
・Jは拡散束である。それは、短い時間間隔の間に小さなエリアを通って流れる物質の量の程度である。本発明では、Jの値は最小であることが望ましい。
・Dは細孔の大きさ、それらの分布、および特に”液体”の粘度によって決まる”結合した”ゲル水における拡散係数である。
・cは濃度である。;ここでは、cは、例えば、形成されたフルオレセインの濃度である。
・xは、位置、または構成の場所からの距離である。;ここでは、xは検出サイトからの距離である。
【0049】
拡散係数(D)は、拡散粒子の粘度の二乗に比例し、温度、流体の粘度、および粒子サイズに依存する。薄い水溶液の中で、大部分のイオンの拡散係数は同様であり、典型的に0.6×10−9から2×10−9m2/sまでの範囲の値を持つ。生物学的な分子に対して、拡散係数は通常10−11から10−10m2/sまでの範囲である。
【0050】
本発明は、シグナル分子の局在化のために必要な試薬を含むキャリア媒体を使う。上述したように、いくつかの実施形態の中でキャリア媒体はまたシグナル前駆体分子を検出可能なシグナル生成分子に変換するためにシグナル展開試薬を含む。他の実施形態の中で、この変換は、温度の変化、pHの変化、高周波音による分解、光の照射、またはマイクロウエーブ加熱のような物理的手段によって達成される。水性ゲルの場合には、水は、ゾル状態からゲル状態が形成された後で、ゲルのマトリクスの中でしっかりと結合され/固定される。ゲルの中の液体(水)がより多くまたはより少なく凝固するので、拡散は著しく妨げられる。高い剛性率を持った液体の場合には、溶媒はシグナル分子の拡散を遅らせる。
【0051】
重要な試薬を含むゲルは、ゾル状態のゲル構成化合物の中に試薬を溶かすことによって容易に生じさせることができる。ゾルの中への試薬の投入の後で、ある程度の時間が経過するとゾルはゲル状態に変わる。または、その変換は温度の変化によって誘導されてもよい(例えば、寒天はより高い温度で液体(ゾル状態)であり、より低い温度で固体(ゲル状態)である。)。
【0052】
ゾルとゲルの両方の状態で存在する多数の物質がある。水を持ったゲルとゾルは、ゾル状態ではゲル形成物質−増粘剤−が水の中にコロイド的に分散しているが、ゲル状態では水が増粘剤のゲル形成網の中に分散しているという特徴がある。
【0053】
特に好ましい実施形態では、本発明は特許文献1で開示された原理を使用する。そして、その中で1つの反応相手の標識は数百万の非蛍光FDA分子を包含するFDA結晶である。これらは、検出サイトで数百万のフルオレセイン分子に加水分解される。キャリア媒体に包含される増粘剤のおかげで、このように形成されたフルオレセイン分子は検出サイトから離れて拡散することを妨げられる。
【0054】
このプロセスでは、DMSOとNaOHがキャリア媒体に包含される溶媒とシグナル展開試薬である。シグナル局在化効果は、キャリア媒体から検出膜の表面へのDMSOとNaOHの部分的な拡散(すなわち、DMSOとNaOH溶液の高い濃度の領域からより低い濃度の領域への流れ)によって説明される。FDA−結晶はDMSOの中に溶け、NaOHによってフルオレセインに加水分解される。フルオレセインは蛍光を発する。水はキャリア媒体の中で強く結合し、キャリア媒体は増粘剤の反応のおかげで交差結合された3次元ネットワークと考えられるので、小さな分子量の物質のみが結合水を持ったキャリア媒体を通って拡散し、検出膜と素早く接触する。このプロセスは約30秒より長くは続かない。
【0055】
非結合水を持つ水溶液は加えられないので、検出膜の吸収性パッドによって支援されるフルオレセイン分子の拡散と分配は生じない。従って、フルオレセイン分子は、局部にとどめられ、検出感度を損なうこと無しに測定されることができる。また、半定量的決定の中で更なる検出ラインが存在するならば、可読性は減少しない。
【0056】
ある検出プラットフォームのために、キャリア媒体は、検出膜の上に配置するために適切なサイズに切断された大きな薄いシートとして作られるマトリクスゲルの形であることができる。フィージビリティ・スタディでは、この配置はフォーセプスを使って実行された。
【0057】
他のアプローチは、キャリア媒体を分離した透明なカバーデバイスに組み入れ、決定反応の完了後にそのカバーデバイスが閉じられるとき、キャリア媒体を検出膜に接触させることである。この場合には、検出装置は箱の形で2つの部分からなる。検出装置(箱)が開かれ、検出膜を持った箱の下側の部分で決定反応が生じる。続いて、その箱はキャリア媒体が組み入れられたカバーで閉じられる。カバーが閉められるのが早すぎたことによってシグナル前駆体分子とキャリア媒体が不注意に接触することを防ぐために、キャリア媒体は、決定反応が実行された後で除かれる除去可能なフィルムの薄いシートの保護カバーを持つ。そのときのみ、キャリア媒体は検出膜の上の検出サイトに接触することができる。
【0058】
<キャリア媒体の準備/生産>
キャリア媒体は、一般に溶媒、(存在するならば)シグナル展開試薬、および増粘剤を混合することによって形成される。増粘剤の選択に依存して加熱と冷却が必要とされる。
【0059】
プロセスを形成するキャリア媒体のために、異なる増粘剤または増粘剤の混合物が使われてよい。増粘剤の各タイプに対して、増粘剤が検出可能なシグナル生成分子の局在化を達成するための適切な濃度は、結合水の含有量、ゲルのずれ特性、凝固プロセスの間の縮小、統合された反応相手の拡散定数、緻密化、透明性、安定性、および温度変化へのロバスト性に関して最適化されなければならない。
【0060】
マトリクスゲルの形であるとき、キャリア媒体の粘度はSDS−PAGEの中で使われるポリアクリルアミドゲルの粘度と比較される。低いパーセントのゲルは、あまり厚くはないが、噴霧することによって検出膜の表面に塗布される。高いパーセントの厚いゲルは、局在化されたシグナルを展開するためにコーティングされたペタルがゲルの中に浸されたある多重検出プラットフォームにもっと適合する。ゲルのパーセントは、その媒体の全重量に対して0.05%から50%までの範囲の重量であり、より好ましくは0.1%から20%までの範囲である。他の実施形態では、ゲルの比率に対する下限は0.05%、0.1%、0.2%、0.3%、0.4%、および0.5%の値のいずれか1つであり、上限は3%、4%、5%、10%、20%、および50%の値のいずれか1つであってよい。従って、ゲルの比率に対する範囲は、上記下限のいずれかと上記上限のいずれかの組み合わせであってよい。
【0061】
キャリア媒体の剛性率は、添加される増粘剤の量を変えることによって調整されることができる。もちろん、高い粘度を持つ溶液は、また、拡散のペースを落とすことができるが、シグナルの保持タイムは凝固した形を使って得られるものよりも短いであろう。
【0062】
マトリクスゲルが最適化されるならば、実験結果に基づいて図4に示すように、検出サイトの位置で局部にとどめられた反応ライン(シグナルライン)が得られる。繰り返すと、図4は、水溶液よりむしろマトリクスゲルがシグナルの生成とシグナルの局在化のために使われるならば、検出サイトの形に著しい差が生じることを示す。
【0063】
<実施例>
今、さまざまな実施例を参照して本発明を特に記載するが、これらは本発明に何の制限も課さない。
【0064】
実施例1:
[FDA−結晶をベースとするシグナルシステムのためのDMSOをベースとするキャリア媒体の準備]
FDAのためのキャリア媒体は、DMSO、NaOH、およびポリソルベート20からなる。DMSOの目的はFDAを溶かすことであり、NaOHは溶解したFDAを加水分解するために使われる。ポリソルベート20は、ゲル形成のためにアクティブな成分である。特に、それらの成分は混合され(例えば、1mlのDMSOと、1mlの1M NaOHと、50μlのポリソルベート20を混合する。)、凝固のために5−10分間室温に保たれる。
表1は、マトリクスゲルの形であるキャリア媒体の組成と外観の最適化を示す。
【0065】
【表1】

【0066】
実施例2:
[FDA−結晶をベースとするシグナルシステムのためのイソプロパノール(IPA)をベースとするキャリア媒体の準備]
FDAのためのIPAをベースとするキャリア媒体は、IPA、NaOH、およびポリビニルピロリドン(PVP)からなる。IPAの目的はFDAを溶かすことであり、NaOHは溶解したFDAを加水分解するために使われる。PVPは、キャリア媒体の粘度を上げるために使われる。特に、それらの成分は混合される(例えば、1mlのIPAと、1mlの1M NaOHと、0.2gのPVPを混合する。)。
【0067】
実施例3:
[マイクロタイタープレートをベースとするテストにおけるキャリア媒体の応用]
直径1mmのマイクロシリンジポンプによってマイクロタイタープレートの各ウェルの内側に配置されたナイロン被膜の上に1μgのGt−α−MIgGをドットとしてコーティングした。それから、そのプレートを真空中で2時間乾燥させた。その後、ウォッシングバッファー[10mMのPBS、0.1%(重量/体積パーセント)のBSA、0.5%(重量/体積パーセント)のポリソルベート20]によって5回そのプレートを洗った。それから、100μLの1%BSA溶液を用いて37℃で30分間それらのウェルを塞いだ。25μLのMIgG(100μg/L)と25μLのビオチン−Gt−α−MIgGを各ウェルに加えて37℃で1時間培養した。5回の洗浄サイクルの後、FDAナノ結晶と結合しているアビジンを各ウェルに加え、再び、37℃で1時間培養した。5回の洗浄サイクルの後、実施例2に記載されたキャリア媒体を各ウェルに加えた。蛍光を発するドットが紫外線ライトの下で直ちに観察された。このスキームは、複数の標的の検出のために図5を参照して上述された。そこでは、異なる捕獲抗体がマイクロタイタープレートの内側に配置されたナイロン被膜の上にドットとしてコーティングされた。
【特許請求の範囲】
【請求項1】
固相基板検出システムにおいてシグナルを生成し、局部にとどめる方法であって、
(a)固相基板に標的材料の溶液を投入するステップと、
(b)多数のシグナル前駆体分子を含む非触媒性標識が取り付けられた前記標的材料を特有の親和性分子と結合させるステップと、
(c)前記固相基板にキャリア媒体を重ねるステップと、
(d)前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために前記非触媒性標識を処理するステップと、
を備え、
前記キャリア媒体が、前記非触媒性標識を溶解させるための溶媒と、前記標的の存在および/または量を示す前記多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含む、
ことを特徴とする方法。
【請求項2】
前記固相基板にキャリア媒体を重ねる前記ステップ(c)と、前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために前記非触媒性標識を処理する前記ステップ(d)とが、前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するためにシグナル展開試薬を含むキャリア媒体を重ねることを特徴とする請求項1に記載の方法。
【請求項3】
前記シグナル展開試薬が、フルオレセインとそれらの誘導体、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、フルオレセイン二酢酸マレイミド(FDA−マレイミド)、シアニン、カルボシアニン、ローダミン、キサンテン、ジアゾ色素をベースとする蛍光物質、並びに、蛍光芳香族低分子およびヘテロ芳香族低分子から成る群から選択された蛍光色素分子を活性化するように構成されることを特徴とする請求項2に記載の方法。
【請求項4】
前記シグナル展開試薬が、シアニン、ピラゾロン、アントラキノン、カルボシアニン、ローダミン、キサンテン、カロテノイド、並びに、ジアゾおよびモノアゾ、オキサジン、インジゴイド、またはリボフラビンをベースとする染料物質から成る群から選択された発色団を活性化するように構成されることを特徴とする請求項2に記載の方法。
【請求項5】
前記シグナル展開試薬が、塩基またはエステル分解酵素であることを特徴とする請求項2または3に記載の方法。
【請求項6】
前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために前記非触媒性標識を処理する前記ステップ(d)が、物理的手段によって実行されることを特徴とする請求項1に記載の方法。
【請求項7】
前記物理的手段が、温度の変化、pHの変化、音波処理、光の照射、またはマイクロウエーブ加熱から選択されることを特徴とする請求項6に記載の方法。
【請求項8】
前記シグナル前駆体分子が、蛍光色素分子とそれらの誘導体、発光団とそれらの誘導体、発色団とそれらの誘導体、接合団、または、レドックスメディテーターから選択された酸化還元活性物質、電極活性物質、生物発光性および蛍光発光性のタンパク質、可視色素、蛍光色素、生物発光若しくは化学発光の材料、電気化学的に活性な材料、または磁性材料から成る群から選択されることを特徴とする請求項1ないし7のいずれか1項に記載の方法。
【請求項9】
前記シグナル前駆体分子が、非触媒性標識であることを特徴とする請求項8に記載の方法。
【請求項10】
前記シグナル前駆体分子が、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、およびフルオレセイン二酢酸マレイミド(FDA−マレイミド)から選択されることを特徴とする請求項8または9に記載の方法。
【請求項11】
前記親和性分子が、
(a)抗体、遺伝子組み換え抗体、モノクロナール抗体、ポリクロナール抗体、受容体、抗原、レクチン、アビジン、オリゴペプチド、リポタンパク質、糖タンパク質、ペプチド・ホルモン、およびアレルゲン、またはそれらの一部から成る群から選択されたペプチドまたはタンパク質、
(b)DNA、RNA、オリゴヌクレオチド、アプタマー、およびそれらの一部から成る群から選択された核酸、
(c)単糖、オリゴ糖、多糖類、糖脂質、プロテオ多糖類、およびそれらの一部から成る群から選択された炭水化物、
または
(d)ビオチン、ビオチン誘導体、ステロイド、ホルモン、補因子、活性化因子、抑制因子、ドラッグ、アレルゲン、またはハプテンから成る群から選択された低分子量のリガンド、
から成る群から選択されることを特徴とする請求項1ないし10のいずれか1項に記載の方法。
【請求項12】
前記増粘剤が、ゲル形成ポリマー、多糖類、タンパク質、天然ガム、界面活性剤、でんぷん、ペクチン、寒天、アガロース、およびゼラチンから成る群から選択されることを特徴とする請求項1ないし11のいずれか1項に記載の方法。
【請求項13】
前記キャリア媒体が、薄膜の形で前記固相基板に重ねられることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項14】
前記薄膜が、除去可能な保護層によって前記固相基板から分離されており、
前記固相基板と前記キャリア媒体を接触させるために前記保護層を除去するステップを含む、
ことを特徴とする請求項13に記載の方法。
【請求項15】
噴霧することによって前記固相基板に前記キャリア媒体を重ねることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項16】
前記キャリア媒体に前記固相基板を浸すことによって、前記キャリア媒体が前記固相基板に重ねられることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項17】
容器の中の高い粘度の液体またはマトリクスゲルに前記固相基板を浸すことによって、前記キャリア媒体が前記固相基板に重ねられることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項18】
垂らすことによって、前記キャリア媒体が前記固相基板に重ねられることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項19】
蛍光色素分子とそれらの誘導体、発光団とそれらの誘導体、発色団とそれらの誘導体、接合団、または、レドックスメディテーターから選択された酸化還元活性物質、電極活性物質、生物発光性および蛍光発光性のタンパク質、可視色素、蛍光色素、生物発光若しくは化学発光の材料、電気化学的に活性な材料、または磁性材料から成る群から選択された前記シグナル前駆体分子を活性化するステップを備えることを特徴とする請求項1ないし18のいずれか1項に記載の方法。
【請求項20】
蛍光色素分子を活性化するためにシグナル展開試薬を使うステップを備えることを特徴とする請求項19に記載の方法。
【請求項21】
前記蛍光色素分子が、フルオレセインとそれらの誘導体、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、フルオレセイン二酢酸マレイミド(FDA−マレイミド)、シアニン、カルボシアニン、ローダミン、キサンテン、ジアゾ色素をベースとする蛍光物質、並びに、蛍光芳香族低分子およびヘテロ芳香族低分子から成る群から選択されることを特徴とする請求項20に記載の方法。
【請求項22】
フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、またはフルオレセイン二酢酸マレイミド(FDA−マレイミド)を加水分解するためにシグナル展開試薬を使うステップを備えることを特徴とする請求項20に記載の方法。
【請求項23】
前記シグナル展開試薬が、塩基またはエステル分解酵素であることを特徴とする請求項22に記載の方法。
【請求項24】
発色団を活性化するためにシグナル展開試薬を使うステップを備えることを特徴とする請求項19に記載の方法。
【請求項25】
前記発色団が、シアニン、ピラゾロン、アントラキノン、カルボシアニン、ローダミン、キサンテン、カロテノイド、並びに、ジアゾおよびモノアゾ、オキサジン、インジゴイド、またはリボフラビンをベースとする染料物質から成る群から選択されることを特徴とする請求項24に記載の方法。
【請求項26】
フルオレセイン分子をフルオレセイン二酢酸(FDA)の結晶から解放するために、FDAのための溶媒、シグナル展開試薬、および増粘剤を含むキャリア媒体を使うステップを備えることを特徴とする請求項2に記載の方法。
【請求項27】
前記キャリア媒体が、ジメチル・スルホキシド、水を含む水酸化ナトリウム、およびポリソルベートを含むことを特徴とする請求項26に記載の方法。
【請求項28】
前記キャリア媒体の総重量に基づいた重量によって0.05から50%までの範囲の比率で、前記キャリア媒体の中で増粘剤を使うステップを備えることを特徴とする請求項1ないし27のいずれか1項に記載の方法。
【請求項29】
前記キャリア媒体における増粘剤の比率が、前記キャリア媒体の総重量に基づいた重量によって0.1から20%までの範囲であることを特徴とする請求項28に記載の方法。
【請求項30】
液体サンプルの中の標的材料を検出するためのテストデバイスであって、
サンプル投入サイトから検出サイトへ液体サンプルを輸送するための手段を有する固相基板検出システムを備え、
前記検出サイトから離れた位置で処理され、非触媒性標識が前記標的材料に対して特有の親和性分子と結合し、前記非触媒性標識が多数のシグナル前駆体分子を含み、前記シグナル前駆体分子が多数の検出可能なシグナル生成分子に変換可能であり、
前記非触媒性標識を溶解するための溶媒と、前記標的材料の存在および/または量を示す前記検出サイトで前記多数の検出可能なシグナル生成分子によって生成されるシグナルの局在化を生じさせるための増粘剤とを含むキャリア媒体を備え、
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段を備え、
前記キャリア媒体が、少なくとも前記検出サイトで前記シグナル分子と接触するように構成される、
ことを特徴とするテストデバイス。
【請求項31】
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段が、前記キャリア媒体に含まれるシグナル展開試薬で構成されることを特徴とする請求項30に記載のテストデバイス。
【請求項32】
前記シグナル展開試薬が、フルオレセインとそれらの誘導体、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、フルオレセイン二酢酸マレイミド(FDA−マレイミド)、シアニン、カルボシアニン、ローダミン、キサンテン、ジアゾ色素をベースとする蛍光物質、並びに、蛍光芳香族低分子およびヘテロ芳香族低分子から成る群から選択された蛍光色素分子を活性化するように構成されることを特徴とする請求項31に記載のテストデバイス。
【請求項33】
前記シグナル展開試薬が、シアニン、ピラゾロン、アントラキノン、カルボシアニン、ローダミン、キサンテン、カロテノイド、並びに、ジアゾおよびモノアゾ、オキサジン、インジゴイド、またはリボフラビンをベースとする染料物質から成る群から選択された発色団を活性化するように構成されることを特徴とする請求項31に記載のテストデバイス。
【請求項34】
前記シグナル展開試薬が、塩基またはエステル分解酵素であることを特徴とする請求項31に記載のテストデバイス。
【請求項35】
前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するための手段が、物理的手段であることを特徴とする請求項30に記載のテストデバイス。
【請求項36】
前記物理的手段が、温度の変化、pHの変化、音波処理、光の照射、またはマイクロウエーブ加熱を引き起こすように構成されることを特徴とする請求項35に記載のテストデバイス。
【請求項37】
側方流テストデバイス、垂直流テストデバイス、テストチューブ、または多重検出プラットフォームから選択されることを特徴とする請求項30ないし36のいずれか1項に記載のテストデバイス。
【請求項38】
前記固相基板が、ニトロセルロースやナイロンなどの多孔質薄膜、ガラス、ポリスチレン、金属、カーボンなどの非多孔質の平らな表面、テストチューブまたはマイクロタイタープレートの内壁、磁性または非磁性のビーズなどの球から選択されることを特徴とする請求項30ないし37のいずれか1項に記載のテストデバイス。
【請求項39】
前記キャリア媒体が、固体の外観を備えたマトリクスゲルであることを特徴とする請求項30ないし38のいずれか1項に記載のテストデバイス。
【請求項40】
決定反応の完了後にテストストリップの上に前記キャリア媒体とともに装着される透明な蓋を更に有する側方流テストストリップであることを特徴とする請求項37ないし39のいずれか1項に記載のテストデバイス。
【請求項41】
前記透明な蓋が、多孔質部材を保持するための後方積層板にヒンジで接続されることを特徴とする請求項40に記載のテストデバイス。
【請求項42】
液体サンプルの中の標的材料の存在を決定するためのパーツのキットであって、
サンプル投入サイトから検出サイトへ液体サンプルを輸送するための手段を有する固相基板検出システムを備え、
前記検出サイトから離れた位置で処理され、非触媒性標識が前記標的材料に対して特有の親和性分子と結合し、前記非触媒性標識が多数のシグナル前駆体分子を含み、前記シグナル前駆体分子が多数の検出可能なシグナル生成分子に変換可能であり、
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段を備える、
ことを特徴とするキット。
【請求項43】
前記非触媒性標識を溶解させるための溶媒と、前記検出サイトで前記多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含むキャリア媒体を形成するための原料を更に有することを特徴とする請求項42に記載のキット。
【請求項44】
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段が、前記キャリア媒体に包含されるシグナル展開試薬を含むことを特徴とする請求項43に記載のキット。
【請求項45】
前記シグナル前駆体分子が、蛍光色素、可視色素、生物発光若しくは化学発光の材料、電気化学的に活性な材料、または磁性材料を含むことを特徴とする請求項42ないし44のいずれか1項に記載のキット。
【請求項1】
固相基板検出システムにおいてシグナルを生成し、局部にとどめる方法であって、
(a)固相基板に標的材料の溶液を投入するステップと、
(b)多数のシグナル前駆体分子を含む非触媒性標識が取り付けられた前記標的材料を特有の親和性分子と結合させるステップと、
(c)前記固相基板にキャリア媒体を重ねるステップと、
(d)前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために前記非触媒性標識を処理するステップと、
を備え、
前記キャリア媒体が、前記非触媒性標識を溶解させるための溶媒と、前記標的の存在および/または量を示す前記多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含む、
ことを特徴とする方法。
【請求項2】
前記固相基板にキャリア媒体を重ねる前記ステップ(c)と、前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために前記非触媒性標識を処理する前記ステップ(d)とが、前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するためにシグナル展開試薬を含むキャリア媒体を重ねることを特徴とする請求項1に記載の方法。
【請求項3】
前記シグナル展開試薬が、フルオレセインとそれらの誘導体、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、フルオレセイン二酢酸マレイミド(FDA−マレイミド)、シアニン、カルボシアニン、ローダミン、キサンテン、ジアゾ色素をベースとする蛍光物質、並びに、蛍光芳香族低分子およびヘテロ芳香族低分子から成る群から選択された蛍光色素分子を活性化するように構成されることを特徴とする請求項2に記載の方法。
【請求項4】
前記シグナル展開試薬が、シアニン、ピラゾロン、アントラキノン、カルボシアニン、ローダミン、キサンテン、カロテノイド、並びに、ジアゾおよびモノアゾ、オキサジン、インジゴイド、またはリボフラビンをベースとする染料物質から成る群から選択された発色団を活性化するように構成されることを特徴とする請求項2に記載の方法。
【請求項5】
前記シグナル展開試薬が、塩基またはエステル分解酵素であることを特徴とする請求項2または3に記載の方法。
【請求項6】
前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するために前記非触媒性標識を処理する前記ステップ(d)が、物理的手段によって実行されることを特徴とする請求項1に記載の方法。
【請求項7】
前記物理的手段が、温度の変化、pHの変化、音波処理、光の照射、またはマイクロウエーブ加熱から選択されることを特徴とする請求項6に記載の方法。
【請求項8】
前記シグナル前駆体分子が、蛍光色素分子とそれらの誘導体、発光団とそれらの誘導体、発色団とそれらの誘導体、接合団、または、レドックスメディテーターから選択された酸化還元活性物質、電極活性物質、生物発光性および蛍光発光性のタンパク質、可視色素、蛍光色素、生物発光若しくは化学発光の材料、電気化学的に活性な材料、または磁性材料から成る群から選択されることを特徴とする請求項1ないし7のいずれか1項に記載の方法。
【請求項9】
前記シグナル前駆体分子が、非触媒性標識であることを特徴とする請求項8に記載の方法。
【請求項10】
前記シグナル前駆体分子が、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、およびフルオレセイン二酢酸マレイミド(FDA−マレイミド)から選択されることを特徴とする請求項8または9に記載の方法。
【請求項11】
前記親和性分子が、
(a)抗体、遺伝子組み換え抗体、モノクロナール抗体、ポリクロナール抗体、受容体、抗原、レクチン、アビジン、オリゴペプチド、リポタンパク質、糖タンパク質、ペプチド・ホルモン、およびアレルゲン、またはそれらの一部から成る群から選択されたペプチドまたはタンパク質、
(b)DNA、RNA、オリゴヌクレオチド、アプタマー、およびそれらの一部から成る群から選択された核酸、
(c)単糖、オリゴ糖、多糖類、糖脂質、プロテオ多糖類、およびそれらの一部から成る群から選択された炭水化物、
または
(d)ビオチン、ビオチン誘導体、ステロイド、ホルモン、補因子、活性化因子、抑制因子、ドラッグ、アレルゲン、またはハプテンから成る群から選択された低分子量のリガンド、
から成る群から選択されることを特徴とする請求項1ないし10のいずれか1項に記載の方法。
【請求項12】
前記増粘剤が、ゲル形成ポリマー、多糖類、タンパク質、天然ガム、界面活性剤、でんぷん、ペクチン、寒天、アガロース、およびゼラチンから成る群から選択されることを特徴とする請求項1ないし11のいずれか1項に記載の方法。
【請求項13】
前記キャリア媒体が、薄膜の形で前記固相基板に重ねられることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項14】
前記薄膜が、除去可能な保護層によって前記固相基板から分離されており、
前記固相基板と前記キャリア媒体を接触させるために前記保護層を除去するステップを含む、
ことを特徴とする請求項13に記載の方法。
【請求項15】
噴霧することによって前記固相基板に前記キャリア媒体を重ねることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項16】
前記キャリア媒体に前記固相基板を浸すことによって、前記キャリア媒体が前記固相基板に重ねられることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項17】
容器の中の高い粘度の液体またはマトリクスゲルに前記固相基板を浸すことによって、前記キャリア媒体が前記固相基板に重ねられることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項18】
垂らすことによって、前記キャリア媒体が前記固相基板に重ねられることを特徴とする請求項1ないし12のいずれか1項に記載の方法。
【請求項19】
蛍光色素分子とそれらの誘導体、発光団とそれらの誘導体、発色団とそれらの誘導体、接合団、または、レドックスメディテーターから選択された酸化還元活性物質、電極活性物質、生物発光性および蛍光発光性のタンパク質、可視色素、蛍光色素、生物発光若しくは化学発光の材料、電気化学的に活性な材料、または磁性材料から成る群から選択された前記シグナル前駆体分子を活性化するステップを備えることを特徴とする請求項1ないし18のいずれか1項に記載の方法。
【請求項20】
蛍光色素分子を活性化するためにシグナル展開試薬を使うステップを備えることを特徴とする請求項19に記載の方法。
【請求項21】
前記蛍光色素分子が、フルオレセインとそれらの誘導体、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、フルオレセイン二酢酸マレイミド(FDA−マレイミド)、シアニン、カルボシアニン、ローダミン、キサンテン、ジアゾ色素をベースとする蛍光物質、並びに、蛍光芳香族低分子およびヘテロ芳香族低分子から成る群から選択されることを特徴とする請求項20に記載の方法。
【請求項22】
フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、またはフルオレセイン二酢酸マレイミド(FDA−マレイミド)を加水分解するためにシグナル展開試薬を使うステップを備えることを特徴とする請求項20に記載の方法。
【請求項23】
前記シグナル展開試薬が、塩基またはエステル分解酵素であることを特徴とする請求項22に記載の方法。
【請求項24】
発色団を活性化するためにシグナル展開試薬を使うステップを備えることを特徴とする請求項19に記載の方法。
【請求項25】
前記発色団が、シアニン、ピラゾロン、アントラキノン、カルボシアニン、ローダミン、キサンテン、カロテノイド、並びに、ジアゾおよびモノアゾ、オキサジン、インジゴイド、またはリボフラビンをベースとする染料物質から成る群から選択されることを特徴とする請求項24に記載の方法。
【請求項26】
フルオレセイン分子をフルオレセイン二酢酸(FDA)の結晶から解放するために、FDAのための溶媒、シグナル展開試薬、および増粘剤を含むキャリア媒体を使うステップを備えることを特徴とする請求項2に記載の方法。
【請求項27】
前記キャリア媒体が、ジメチル・スルホキシド、水を含む水酸化ナトリウム、およびポリソルベートを含むことを特徴とする請求項26に記載の方法。
【請求項28】
前記キャリア媒体の総重量に基づいた重量によって0.05から50%までの範囲の比率で、前記キャリア媒体の中で増粘剤を使うステップを備えることを特徴とする請求項1ないし27のいずれか1項に記載の方法。
【請求項29】
前記キャリア媒体における増粘剤の比率が、前記キャリア媒体の総重量に基づいた重量によって0.1から20%までの範囲であることを特徴とする請求項28に記載の方法。
【請求項30】
液体サンプルの中の標的材料を検出するためのテストデバイスであって、
サンプル投入サイトから検出サイトへ液体サンプルを輸送するための手段を有する固相基板検出システムを備え、
前記検出サイトから離れた位置で処理され、非触媒性標識が前記標的材料に対して特有の親和性分子と結合し、前記非触媒性標識が多数のシグナル前駆体分子を含み、前記シグナル前駆体分子が多数の検出可能なシグナル生成分子に変換可能であり、
前記非触媒性標識を溶解するための溶媒と、前記標的材料の存在および/または量を示す前記検出サイトで前記多数の検出可能なシグナル生成分子によって生成されるシグナルの局在化を生じさせるための増粘剤とを含むキャリア媒体を備え、
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段を備え、
前記キャリア媒体が、少なくとも前記検出サイトで前記シグナル分子と接触するように構成される、
ことを特徴とするテストデバイス。
【請求項31】
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段が、前記キャリア媒体に含まれるシグナル展開試薬で構成されることを特徴とする請求項30に記載のテストデバイス。
【請求項32】
前記シグナル展開試薬が、フルオレセインとそれらの誘導体、フルオレセイン二酢酸(FDA)、フルオレセイン二酢酸イソチオシアネート(FDA−イソチオシアネート)、フルオレセイン二酢酸マレイミド(FDA−マレイミド)、シアニン、カルボシアニン、ローダミン、キサンテン、ジアゾ色素をベースとする蛍光物質、並びに、蛍光芳香族低分子およびヘテロ芳香族低分子から成る群から選択された蛍光色素分子を活性化するように構成されることを特徴とする請求項31に記載のテストデバイス。
【請求項33】
前記シグナル展開試薬が、シアニン、ピラゾロン、アントラキノン、カルボシアニン、ローダミン、キサンテン、カロテノイド、並びに、ジアゾおよびモノアゾ、オキサジン、インジゴイド、またはリボフラビンをベースとする染料物質から成る群から選択された発色団を活性化するように構成されることを特徴とする請求項31に記載のテストデバイス。
【請求項34】
前記シグナル展開試薬が、塩基またはエステル分解酵素であることを特徴とする請求項31に記載のテストデバイス。
【請求項35】
前記多数のシグナル前駆体分子を多数の検出可能なシグナル生成分子に変換するための手段が、物理的手段であることを特徴とする請求項30に記載のテストデバイス。
【請求項36】
前記物理的手段が、温度の変化、pHの変化、音波処理、光の照射、またはマイクロウエーブ加熱を引き起こすように構成されることを特徴とする請求項35に記載のテストデバイス。
【請求項37】
側方流テストデバイス、垂直流テストデバイス、テストチューブ、または多重検出プラットフォームから選択されることを特徴とする請求項30ないし36のいずれか1項に記載のテストデバイス。
【請求項38】
前記固相基板が、ニトロセルロースやナイロンなどの多孔質薄膜、ガラス、ポリスチレン、金属、カーボンなどの非多孔質の平らな表面、テストチューブまたはマイクロタイタープレートの内壁、磁性または非磁性のビーズなどの球から選択されることを特徴とする請求項30ないし37のいずれか1項に記載のテストデバイス。
【請求項39】
前記キャリア媒体が、固体の外観を備えたマトリクスゲルであることを特徴とする請求項30ないし38のいずれか1項に記載のテストデバイス。
【請求項40】
決定反応の完了後にテストストリップの上に前記キャリア媒体とともに装着される透明な蓋を更に有する側方流テストストリップであることを特徴とする請求項37ないし39のいずれか1項に記載のテストデバイス。
【請求項41】
前記透明な蓋が、多孔質部材を保持するための後方積層板にヒンジで接続されることを特徴とする請求項40に記載のテストデバイス。
【請求項42】
液体サンプルの中の標的材料の存在を決定するためのパーツのキットであって、
サンプル投入サイトから検出サイトへ液体サンプルを輸送するための手段を有する固相基板検出システムを備え、
前記検出サイトから離れた位置で処理され、非触媒性標識が前記標的材料に対して特有の親和性分子と結合し、前記非触媒性標識が多数のシグナル前駆体分子を含み、前記シグナル前駆体分子が多数の検出可能なシグナル生成分子に変換可能であり、
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段を備える、
ことを特徴とするキット。
【請求項43】
前記非触媒性標識を溶解させるための溶媒と、前記検出サイトで前記多数の検出可能なシグナル生成分子によって生成されたシグナルの局在化を引き起こすための増粘剤とを含むキャリア媒体を形成するための原料を更に有することを特徴とする請求項42に記載のキット。
【請求項44】
前記多数のシグナル前駆体分子を前記多数の検出可能なシグナル生成分子に変換するための手段が、前記キャリア媒体に包含されるシグナル展開試薬を含むことを特徴とする請求項43に記載のキット。
【請求項45】
前記シグナル前駆体分子が、蛍光色素、可視色素、生物発光若しくは化学発光の材料、電気化学的に活性な材料、または磁性材料を含むことを特徴とする請求項42ないし44のいずれか1項に記載のキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2012−529645(P2012−529645A)
【公表日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願番号】特願2012−514532(P2012−514532)
【出願日】平成22年6月14日(2010.6.14)
【国際出願番号】PCT/GB2010/001152
【国際公開番号】WO2010/142963
【国際公開日】平成22年12月16日(2010.12.16)
【出願人】(511290972)スーパーノヴァ・ダイアグノスティクス、インコーポレイティド (2)
【Fターム(参考)】
【公表日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願日】平成22年6月14日(2010.6.14)
【国際出願番号】PCT/GB2010/001152
【国際公開番号】WO2010/142963
【国際公開日】平成22年12月16日(2010.12.16)
【出願人】(511290972)スーパーノヴァ・ダイアグノスティクス、インコーポレイティド (2)
【Fターム(参考)】
[ Back to top ]

