固相有機反応方法
【課題】有機合成において、これまで日常的に利用していた有機溶媒を全く用いることなく、炭素−炭素結合形成反応等を行うことのできる新しい有機反応の手法を提供する。
【解決手段】固体分散剤存在下で少なくとも一部がナノサイズの金属粒子と原料とを接触させ、前記金属粒子を反応の開始剤とし無溶媒で有機反応を行う。ナノサイズの金属粒子と原料とを接触させる方法としては、金属ナノ分散体を用いて行なう方法、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行う方法がある。触媒や還元剤をナノサイズまで微細化すると活性が高まる一方で、活性を維持することが困難となるが、ナノサイズの金属粒子を分散剤中に混合することで、高い活性を安定的に維持することができ、これまで日常的に利用していた有機溶媒を全く用いることなく、炭素−炭素結合形成反応等を行うことができる。
【解決手段】固体分散剤存在下で少なくとも一部がナノサイズの金属粒子と原料とを接触させ、前記金属粒子を反応の開始剤とし無溶媒で有機反応を行う。ナノサイズの金属粒子と原料とを接触させる方法としては、金属ナノ分散体を用いて行なう方法、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行う方法がある。触媒や還元剤をナノサイズまで微細化すると活性が高まる一方で、活性を維持することが困難となるが、ナノサイズの金属粒子を分散剤中に混合することで、高い活性を安定的に維持することができ、これまで日常的に利用していた有機溶媒を全く用いることなく、炭素−炭素結合形成反応等を行うことができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、溶媒を全く使用することなく有機反応を行う固相有機反応方法に関する。
【背景技術】
【0002】
有機合成反応は、新機能性材料を合成したり、新薬の合成に用いる極めて重要な手段である。近年、有機合成反応の新たな手法も幾つか開発されている。例えば、有機合成反応において、反応終了後の液相から不要な化合物を分離する有機合成用試薬を用いた有機合成反応方法が提案されている(例えば特許文献1参照)。またフルオラスケミストリーを用いた有機合成反応の研究も進められている。フルオラスケミストリーは、グリーンケミストリーの一手法であり、炭化水素系溶媒とフルオラス溶媒からなる2相系システムを用いることで、生成物と触媒などを容易に分離することができる(例えば特許文献2参照)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2009―185063号公報
【特許文献2】特開2008―138077号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
これまでの有機合成反応は、有機原料を用いるゆえに、有機溶媒中での反応例がほとんどである。有機溶媒を用いた有機合成法にあっては、有機溶媒には沸点が180℃を超えるようなものがあり、反応で使用した有機溶媒の完全除去は困難であった。その場合、機能性材料の劣化原因や薬の安全性についての不安要因となる。そのような観点から、実用的な無溶媒有機合成に関する新手法の開発が待たれている。
【0005】
本発明の目的は、有機合成において、これまで日常的に利用していた有機溶媒を全く用いることなく、炭素−炭素結合形成反応等を行うことのできる新しい有機反応の手法を提供することである。
【課題を解決するための手段】
【0006】
本発明者等は、有機溶媒を全く用いることなく有機合成を行う方法として、触媒や還元剤のナノ粒子化に着目し鋭意研究を進めた。触媒や還元剤をナノサイズまで微細化すると活性が高まる一方で、発火などの危険性が増し、また活性を維持することが困難となるが、ナノサイズの触媒や還元剤を分散剤中に混合することで、高い活性を安定的に維持することができることを見出し、本発明を完成するに至った。
【0007】
すなわち本発明は、固体分散剤存在下で少なくとも一部がナノサイズの金属粒子と原料とを接触させ、前記金属粒子を反応の開始剤とし無溶媒で有機反応を行うことを特徴とする固相有機反応方法である。
【0008】
また本発明は、前記発明において、前記少なくとも一部がナノサイズの金属粒子は、少なくとも一部がナノサイズの金属粒子を固体分散剤に分散させた金属ナノ分散体として与えられることを特徴とする。
【0009】
また本発明は、前記発明において、前記金属ナノ分散体は、固形状の金属と固体分散剤とを固形状の金属の少なくとも一部がナノサイズとなるまで粉砕し得られることを特徴とする。
【0010】
また本発明は、前記発明において、前記固体分散剤存在下での少なくとも一部がナノサイズの金属粒子と原料との接触は、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行われることを特徴とする。
【0011】
また本発明は、前記発明において、前記金属粒子が、水素化触媒、還元的カップリング剤、アルカリ剤、脱酸素剤、脱炭酸剤、脱リン酸剤、脱ハロゲン剤又は脱水剤として機能することを特徴とする。
【0012】
また本発明は、前記発明において、前記金属粒子は、アルカリ金属、アルカリ土類金属、アルミニウム族元素、鉄族元素、白金族元素、銅族元素、亜鉛族元素及びこれらを含む合金のうち少なくともいずれか1を含むことを特徴とする。
【0013】
また本発明は、前記発明において、前記固体分散剤は、水吸脱着剤及び/又は多孔質無機材であることを特徴とする。
【0014】
また本発明は、前記発明において、前記固体分散剤は、水吸脱着剤及び/又は多孔質無機材であり、前記金属ナノ分散体は、ナノサイズの金属粒子の表面を前記水吸脱着剤及び/又は多孔質無機材がコーティングし、水吸脱着剤及び/又は多孔質無機材が、ナノサイズの金属粒子の大部分が酸素、二酸化炭素又は水と直接接触することを阻止することを特徴とする。
【発明の効果】
【0015】
本発明に係る固相有機反応方法を用いることで、これまで日常的に利用していた有機溶媒を全く用いることなく、炭素−炭素結合形成反応等を行うことができ、有用な化学物質をクリーンで安全な環境で合成することが可能となる。
【図面の簡単な説明】
【0016】
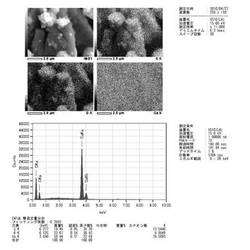
【図1】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cの電子顕微鏡写真(SEM)及び成分分析(EDS)結果を示す図である。
【図2】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cの線分析結果である。
【図3】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cの線分析結果である。
【図4】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cに使用する活性炭の粉砕前のSEM写真である。
【図5】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cの調製時のミル粉砕後のSEM写真である。
【発明を実施するための形態】
【0017】
以下、本発明の固相有機反応方法を詳細に説明する。本発明の固相有機反応方法は、固体分散剤存在下で少なくとも一部がナノサイズの金属粒子と原料とを接触させ、前記金属粒子を反応の開始剤とし無溶媒で有機反応を行う。このときナノサイズの金属粒子と原料とを接触させる方法として、金属ナノ分散体を用いて行なう方法、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行う方法がある。まず金属ナノ分散体を用いる方法について説明する。金属ナノ分散体は、少なくとも一部がナノサイズの金属粒子を固体分散剤に分散させたものである。
【0018】
従来の固相反応では、固体深部まで化学反応を起こさせることが難しく、また一旦化学反応が始まると火薬に代表されるように制御することが難しい。そこで化学反応を起こさせる開始剤をナノ粒子化する一方で、ナノ粒子が安定的に存在できる固体分散剤中に混合する。基質(原料)には、固体分散剤に親和性の高い原料を用いる。すると、基質が液体の場合、固体分散剤内部に基質が浸透し、開始剤と接触して化学反応が起こる。基質が固体の場合も固体分散剤といっしょに攪拌混合することで開始剤と接触して化学反応が起こる。この方法により、固相反応を均一に、かつ、安全に制御することが可能になるとともに、従来法に比較して目的物を収率よく得ることが可能となる。
【0019】
開始剤である金属粒子は、少なくとも一部の粒子がナノサイズの粒子であり、固体分散剤に分散させた金属ナノ分散体の形態で使用する。なお、このとき金属粒子の全てがナノサイズであってもよいことは言うまでもない。金属粒子としては、アルカリ金属、アルカリ土類金属、アルミニウム族元素、鉄族元素、白金族元素、銅族元素、亜鉛族元素及びこれらを含む合金が例示される。これらは単独で使用してもよく、混合して使用してもよく、金属カルシウムを好適に使用することができる。これらは水素化触媒、還元的カップリング剤、アルカリ剤、脱酸素剤、脱炭酸剤、脱リン酸剤、脱ハロゲン剤又は脱水剤として機能する。
【0020】
固体分散剤は、金属粒子を安定的に保護する役目を担う。固体分散剤としては、酸化カルシウム、セライト(Celiteは、セライトコーポレーションの登録商標)、活性炭、シリカゲル、ゼオライトなど水吸脱着剤及び/又は多孔質無機材が好ましい。セライトは、炭酸ナトリウムとともに焼成した珪藻土であり、水分を大量に保持することができる。水吸脱着剤及び/又は多孔質無機材は、吸着した水を脱着させ、反応形態により、脱着した水は水素源として作用する。
【0021】
少なくとも一部がナノサイズの金属粒子が固体分散剤に分散した金属ナノ分散体は、固形状の金属と水吸脱着剤及び/又は多孔質無機材との混合物を、粉砕機で固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで得ることができる。粉砕を行う際の金属と水吸脱着剤及び/又は多孔質無機材との混合割合は、特定の混合割合に限定されるものではなく、例えば重量比で1:1〜10とすることができる。金属カルシウムと酸化カルシウムとを遊星ボールミルで粉砕した場合、金属カルシウムと酸化カルシウムとを重量比で1:5とすればそれ以上金属カルシウムの割合を増やしても、粉砕した酸化カルシウムに含まれるナノサイズの金属カルシウムの量は殆ど変わりなかった。
【0022】
このようにして得られる金属ナノ分散体は、ナノサイズの金属粒子を含む金属粒子が、水吸脱着剤及び/又は多孔質無機材中に分散した金属分散体であり、ナノサイズの金属粒子の表面は水吸脱着剤及び/又は多孔質無機材でコーティングされている。一般的に金属をナノサイズまで微細化すると、環境中では酸化し失活するが、金属ナノ分散体においては、ナノサイズの金属粒子の表面を覆う水吸脱着剤及び/又は多孔質無機材が、該金属粒子の大部分が酸素、二酸化炭素又は水と直接接触することを阻止するので、ナノサイズの金属粒子は、大気中においても高い活性を維持することができる。実験の結果、セライト(登録商標)と共に粉砕した金属カルシウムは、電子源として90%以上の活性を有し、2ヶ月以上大気中で安定的に存在させることができた。
【0023】
有機反応の原料は、液体、固体、又はスラリー状であってもよい。原料が液体の場合、原料と金属ナノ分散体とを接触させると、金属ナノ分散体内部に原料が浸透し、開始剤である金属粒子と接触して化学反応が起こる。原料が固体の場合も、原料と金属ナノ分散体とを接触させることで、原料が開始剤である金属粒子と接触して化学反応が起こる。原料が固体の場合、液体に比べ、原料と金属粒子との接触面積、接触機会が少ないので攪拌混合操作を行うことが好ましく、表面更新が行われる攪拌混合操作がより好ましい。このため粉砕機能を備えるミルは反応器として好ましい。但し、後述の実施例からも分かるように遊星ボールミルのような非常に高い攪拌強度を与えなくても有機反応は十分に進行する。また、原料と金属ナノ分散体との接触を高める方法として、原料と金属ナノ分散体との混合物に対して、ホットプレス法などのように上方からプレス機などで荷重を加える方法も使用することができる。
【0024】
前記金属ナノ分散体を用い、金属ナノ分散体と原料とを接触させ、金属粒子を反応の開始剤とし無溶媒で反応させることができる有機反応としては、マイケル反応、アセト酢酸エステル合成、アルドール反応、クライゼン縮合、ディークマン縮合、ヘンリー反応で代表される酸性の高い水素引き抜き反応、アシロイン縮合、バイビエールカップリング反応、ベンゾイン縮合、グリニャール反応、カガン・モーランダー・ジョード反応、マクマリーカップリング、リフォマトスキー反応、ウルマンカップリング反応、ウルツカップリングで代表される電子供与によるアニオンラジカルの生成反応、バーチ還元、クレメンゼン還元、メーヤーワインポンドルフバーレー還元で代表される還元反応、フィッシャーインドール合成で代表される脱水反応が例示される。
【0025】
次にナノサイズの金属粒子と原料とを接触させる方法として、金属ナノ分散体を用いる方法に代え、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行う方法について説明する。以下、金属ナノ分散体を用いる方法との相違点を中心に説明する。
【0026】
金属ナノ分散体を用いる方法が、予めナノサイズの金属粒子を製造し、これを原料と接触させるのに対し、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行う方法の場合、金属粒子をナノサイズにしつつ原料と接触させる。この方法の場合も、周囲に水吸脱着剤及び/又は多孔質無機材など固体分散剤が存在するので、金属粒子がナノサイズまで微細化されても失活せず、十分に固相有機反応が進行する。
【0027】
固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕する方法は、特に限定されず、遊星ボールミルなど公知の微粉砕機を使用して行うことができる。
【0028】
固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕しながら、ナノサイズの金属粒子と原料とを接触させ固相有機反応をなさしめる方法は、金属ナノ分散体を用いる方法と異なり予めナノサイズの金属粒子を準備する必要がないため簡便に行える利点がある。一方で固形状の金属の少なくとも一部がナノサイズとなるまで粉砕する必要があることから、反応器として微粉砕が可能な装置を使用する必要がある。これに対して金属ナノ分散体を使用する場合は、金属粒子を粉砕する必要がないことから、攪拌強度の小さい汎用攪拌機を使用することができる。また後述の実施例で示すように使用する金属の量が同一の場合、金属ナノ分散体を用いる方が反応率が高く、反応を効率的に行うことができることが分かった。このように2つの方法は長所が異なるので、目的の固相有機反応に応じて適宜好ましい方法を選択し使用すればよい。
【実施例】
【0029】
金属カルシウムナノ分散体Ca/Cの調製
金属カルシウム1gと活性炭1gとを遊星ボールミルを用いて、窒素ガス雰囲気下、600rpmで60分間、常温粉砕処理を行った。ミル粉砕物を窒素ガス雰囲気下、分級し、2mm篩下の粉砕物を得た。これを金属カルシウムナノ分散体Ca/Cとした。電子顕微鏡写真(SEM)及び成分分析(EDS)結果を図1に示した。図2及び図3に線分析結果を示した。図2(a)及び図3はカーボン(C)、酸素(O)、カルシウム(Ca)を、図2(b)はカーボン(C)を、図2(c)は酸素(O)を、図2(d)はカルシウム(Ca)を線分析した結果である。図2及び図3中、横線が分析位置を示し、波形が各成分の強度を示す。図4は、粉砕前の活性炭のSEM写真、図5は、ミル粉砕後のSEM写真である。電子顕微鏡写真において比較的大きく見える粒子も、実際は、数十から百nm程度の大きさのナノ粒子が凝集したものであり、金属カルシウムは十分にナノサイズまで粉砕されている。
【0030】
金属カルシウムナノ分散体Ca/CaO、亜鉛ナノ分散体Zn/C、アルミニウムナノ分散体Al/C、鉄ナノ分散体Fe/C、金属カルシウムナノ分散体Ca/Celiteの調製
活性炭に代え、酸化カルシウムCaOを分散剤とし、金属カルシウムナノ分散体Ca/Cと同様の要領で、金属カルシウムナノ分散体Ca/CaOを得た。また、亜鉛と活性炭、アルミニウムと活性炭、鉄と活性炭を用い、亜鉛ナノ分散体Zn/C、アルミニウムナノ分散体Al/C、鉄ナノ分散体Fe/Cを得た。さらにセライトを分散剤とし金属カルシウムナノ分散体Ca/Celiteを得た。
【0031】
実施例1〜4
アルゴンガスで置換したグローブボックス内で、テフロン(登録商標)製攪拌子、金属カルシウムナノ分散体Ca/C(金属カルシウム含有量に換算して5mmol相当量)、出発原料1mmolの順で耐圧ガラス反応器に入れ密封した。耐圧ガラス反応器を25℃に調温した恒温槽で、マグネチックスターラを用いて攪拌した。24時間の攪拌後、酸性水溶液(HCl 1N)、あるいは、アルカリ性水溶液(NaOH 1N)を生成物に応じて加えて未反応の金属Ca成分をクエンチした後、ジエチルエーテルで抽出した。抽出液に無水硫酸マグネシウムを加えて脱水処理し、メンブレンフィルターを用いてろ過した。ろ液をGC/MSやGC−FIDにより分析した。出発原料には、ニトロベンゼン、安息香酸、N−ベンジリデンアニリン、ベンズアルデヒドを用いた。
【0032】
ニトロベンゼンの反応の結果を示した。ニトロベンゼンと金属カルシウムナノ分散体Ca/Cとを攪拌し接触させることで脱窒素反応、脱酸素反応が起こった。
【0033】
【化1】

【0034】
【表1】

【0035】
安息香酸の反応の結果を示した。安息香酸と金属カルシウムナノ分散体Ca/Cとを攪拌し接触させることで、脱炭酸反応、脱酸素反応が起こった。
【0036】
【化2】

【0037】
【表2】

【0038】
N―ベンジリンデンアニリンの反応の結果を示した。N―ベンジリンデンアニリンと金属カルシウムナノ分散体Ca/Cとを攪拌し接触させることで、還元反応が起こった。
【0039】
【化3】

【0040】
【表3】

【0041】
ベンズアルデヒドの反応の結果を示した。ベンズアルデヒドと金属カルシウムナノ分散体Ca/Cとを攪拌し接触させることで還元反応が起こった。
【0042】
【化4】

【0043】
【表4】

【0044】
実施例5:ウルマンカップリング反応
乳鉢に4−ブロモトルエン5mmolを投入し、上記金属カルシウムナノ分散体Ca/CaOを1g添加した後、室温下ですり潰すように回転数100rpmで攪拌した。24時間の攪拌後、ジエチルエーテル20mlを加え抽出した。次にエバポレータで濃縮しGC/MSにより分析した。結果は次の通りであり、脱ハロゲン反応が起こった。
【0045】
【化5】

【0046】
【表5】

【0047】
実施例6
アニリンとベンズアルデヒドとの混合物を基質とし、金属カルシウムナノ分散体Ca/Cを還元剤として、次の要領で実験を行った。反応器に3つ口フラスコを用い、1mmolのアニリンと金属カルシウムナノ分散体Ca/Cを0.978gとを投入後、10mmolのベンズアルデヒドを添加し、室温下で24時間反応させた。結果は次の通りであり、脱水反応が起こった。
【0048】
【表6】

【0049】
実施例7
ベンズアルデヒドを基質とし、亜鉛ナノ分散体Zn/Cを還元剤として、次の要領で実験を行った。反応器に耐圧ガラス容器を用い、10mmolのベンズアルデヒドと1.05gの亜鉛ナノ分散体Zn/Cとを室温下で24時間反応させた。結果は次の通りであった。
【0050】
【表7】

【0051】
実施例8
ベンズアルデヒドを基質とし、アルミニウムナノ分散体Al/Cを還元剤として、次の要領で実験を行った。反応器に耐圧ガラス容器を用い、10mmolのベンズアルデヒドと0.65gのアルミニウムナノ分散体Al/Cとを室温下で24時間反応させた。結果は次の通りであった。
【0052】
【表8】

【0053】
実施例9
ベンズアルデヒドを基質とし、鉄ナノ分散体Fe/Cを還元剤として、次の要領で実験を行った。反応器に耐圧ガラス容器を用い、1mmolのベンズアルデヒドと1.12gの鉄ナノ分散体Fe/Cとを室温下で24時間反応させた。結果は次の通りであった。
【0054】
【表9】

【0055】
実施例10〜15
ブロモベンゼンを基質とし、金属カルシウムナノ分散体Ca/Celiteを使用し反応させる場合(実施例10から12)、固形の金属カルシウムをナノサイズに粉砕させながら反応させる場合(実施例13から15)の実験を次の要領で行った。反応器には遊星ボールミルを用い、室温下で24時間反応させた。実験条件及び結果を表10に示した。なお、実施例13から15で添加した金属カルシウムの量は、実施例10から12の金属カルシウムナノ分散体Ca/Celiteに含まれる金属カルシウムを水素発生量から算出した量と同量とした。つまり実施例10と実施例13、実施例11と実施例14、実施例12と実施例15で添加した金属カルシウム量はほぼ同量である。このとき各実施例において、酸化カルシウムを添加し、金属カルシウムナノ分散体Ca/Celite+酸化カルシウム、金属カルシウム+酸化カルシウムの量を10gとした。
【0056】
実験の結果、実施例10から15の全てにおいて脱ハロゲン反応が進行した。金属カルシウムナノ分散体を使用する場合と金属カルシウムをナノ粒子化させながら反応させる場合とを比較すると、金属カルシウムナノ分散体を使用する場合の方が、未反応のブロモベンゼンの量が少なく、脱ハロゲン反応が進行することが分かった。この傾向は、使用する金属カルシウムの量が多いほど顕著であった。
【0057】
【表10】

【技術分野】
【0001】
本発明は、溶媒を全く使用することなく有機反応を行う固相有機反応方法に関する。
【背景技術】
【0002】
有機合成反応は、新機能性材料を合成したり、新薬の合成に用いる極めて重要な手段である。近年、有機合成反応の新たな手法も幾つか開発されている。例えば、有機合成反応において、反応終了後の液相から不要な化合物を分離する有機合成用試薬を用いた有機合成反応方法が提案されている(例えば特許文献1参照)。またフルオラスケミストリーを用いた有機合成反応の研究も進められている。フルオラスケミストリーは、グリーンケミストリーの一手法であり、炭化水素系溶媒とフルオラス溶媒からなる2相系システムを用いることで、生成物と触媒などを容易に分離することができる(例えば特許文献2参照)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2009―185063号公報
【特許文献2】特開2008―138077号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
これまでの有機合成反応は、有機原料を用いるゆえに、有機溶媒中での反応例がほとんどである。有機溶媒を用いた有機合成法にあっては、有機溶媒には沸点が180℃を超えるようなものがあり、反応で使用した有機溶媒の完全除去は困難であった。その場合、機能性材料の劣化原因や薬の安全性についての不安要因となる。そのような観点から、実用的な無溶媒有機合成に関する新手法の開発が待たれている。
【0005】
本発明の目的は、有機合成において、これまで日常的に利用していた有機溶媒を全く用いることなく、炭素−炭素結合形成反応等を行うことのできる新しい有機反応の手法を提供することである。
【課題を解決するための手段】
【0006】
本発明者等は、有機溶媒を全く用いることなく有機合成を行う方法として、触媒や還元剤のナノ粒子化に着目し鋭意研究を進めた。触媒や還元剤をナノサイズまで微細化すると活性が高まる一方で、発火などの危険性が増し、また活性を維持することが困難となるが、ナノサイズの触媒や還元剤を分散剤中に混合することで、高い活性を安定的に維持することができることを見出し、本発明を完成するに至った。
【0007】
すなわち本発明は、固体分散剤存在下で少なくとも一部がナノサイズの金属粒子と原料とを接触させ、前記金属粒子を反応の開始剤とし無溶媒で有機反応を行うことを特徴とする固相有機反応方法である。
【0008】
また本発明は、前記発明において、前記少なくとも一部がナノサイズの金属粒子は、少なくとも一部がナノサイズの金属粒子を固体分散剤に分散させた金属ナノ分散体として与えられることを特徴とする。
【0009】
また本発明は、前記発明において、前記金属ナノ分散体は、固形状の金属と固体分散剤とを固形状の金属の少なくとも一部がナノサイズとなるまで粉砕し得られることを特徴とする。
【0010】
また本発明は、前記発明において、前記固体分散剤存在下での少なくとも一部がナノサイズの金属粒子と原料との接触は、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行われることを特徴とする。
【0011】
また本発明は、前記発明において、前記金属粒子が、水素化触媒、還元的カップリング剤、アルカリ剤、脱酸素剤、脱炭酸剤、脱リン酸剤、脱ハロゲン剤又は脱水剤として機能することを特徴とする。
【0012】
また本発明は、前記発明において、前記金属粒子は、アルカリ金属、アルカリ土類金属、アルミニウム族元素、鉄族元素、白金族元素、銅族元素、亜鉛族元素及びこれらを含む合金のうち少なくともいずれか1を含むことを特徴とする。
【0013】
また本発明は、前記発明において、前記固体分散剤は、水吸脱着剤及び/又は多孔質無機材であることを特徴とする。
【0014】
また本発明は、前記発明において、前記固体分散剤は、水吸脱着剤及び/又は多孔質無機材であり、前記金属ナノ分散体は、ナノサイズの金属粒子の表面を前記水吸脱着剤及び/又は多孔質無機材がコーティングし、水吸脱着剤及び/又は多孔質無機材が、ナノサイズの金属粒子の大部分が酸素、二酸化炭素又は水と直接接触することを阻止することを特徴とする。
【発明の効果】
【0015】
本発明に係る固相有機反応方法を用いることで、これまで日常的に利用していた有機溶媒を全く用いることなく、炭素−炭素結合形成反応等を行うことができ、有用な化学物質をクリーンで安全な環境で合成することが可能となる。
【図面の簡単な説明】
【0016】
【図1】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cの電子顕微鏡写真(SEM)及び成分分析(EDS)結果を示す図である。
【図2】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cの線分析結果である。
【図3】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cの線分析結果である。
【図4】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cに使用する活性炭の粉砕前のSEM写真である。
【図5】本発明の固相有機反応方法で使用する金属カルシウムナノ分散体Ca/Cの調製時のミル粉砕後のSEM写真である。
【発明を実施するための形態】
【0017】
以下、本発明の固相有機反応方法を詳細に説明する。本発明の固相有機反応方法は、固体分散剤存在下で少なくとも一部がナノサイズの金属粒子と原料とを接触させ、前記金属粒子を反応の開始剤とし無溶媒で有機反応を行う。このときナノサイズの金属粒子と原料とを接触させる方法として、金属ナノ分散体を用いて行なう方法、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行う方法がある。まず金属ナノ分散体を用いる方法について説明する。金属ナノ分散体は、少なくとも一部がナノサイズの金属粒子を固体分散剤に分散させたものである。
【0018】
従来の固相反応では、固体深部まで化学反応を起こさせることが難しく、また一旦化学反応が始まると火薬に代表されるように制御することが難しい。そこで化学反応を起こさせる開始剤をナノ粒子化する一方で、ナノ粒子が安定的に存在できる固体分散剤中に混合する。基質(原料)には、固体分散剤に親和性の高い原料を用いる。すると、基質が液体の場合、固体分散剤内部に基質が浸透し、開始剤と接触して化学反応が起こる。基質が固体の場合も固体分散剤といっしょに攪拌混合することで開始剤と接触して化学反応が起こる。この方法により、固相反応を均一に、かつ、安全に制御することが可能になるとともに、従来法に比較して目的物を収率よく得ることが可能となる。
【0019】
開始剤である金属粒子は、少なくとも一部の粒子がナノサイズの粒子であり、固体分散剤に分散させた金属ナノ分散体の形態で使用する。なお、このとき金属粒子の全てがナノサイズであってもよいことは言うまでもない。金属粒子としては、アルカリ金属、アルカリ土類金属、アルミニウム族元素、鉄族元素、白金族元素、銅族元素、亜鉛族元素及びこれらを含む合金が例示される。これらは単独で使用してもよく、混合して使用してもよく、金属カルシウムを好適に使用することができる。これらは水素化触媒、還元的カップリング剤、アルカリ剤、脱酸素剤、脱炭酸剤、脱リン酸剤、脱ハロゲン剤又は脱水剤として機能する。
【0020】
固体分散剤は、金属粒子を安定的に保護する役目を担う。固体分散剤としては、酸化カルシウム、セライト(Celiteは、セライトコーポレーションの登録商標)、活性炭、シリカゲル、ゼオライトなど水吸脱着剤及び/又は多孔質無機材が好ましい。セライトは、炭酸ナトリウムとともに焼成した珪藻土であり、水分を大量に保持することができる。水吸脱着剤及び/又は多孔質無機材は、吸着した水を脱着させ、反応形態により、脱着した水は水素源として作用する。
【0021】
少なくとも一部がナノサイズの金属粒子が固体分散剤に分散した金属ナノ分散体は、固形状の金属と水吸脱着剤及び/又は多孔質無機材との混合物を、粉砕機で固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで得ることができる。粉砕を行う際の金属と水吸脱着剤及び/又は多孔質無機材との混合割合は、特定の混合割合に限定されるものではなく、例えば重量比で1:1〜10とすることができる。金属カルシウムと酸化カルシウムとを遊星ボールミルで粉砕した場合、金属カルシウムと酸化カルシウムとを重量比で1:5とすればそれ以上金属カルシウムの割合を増やしても、粉砕した酸化カルシウムに含まれるナノサイズの金属カルシウムの量は殆ど変わりなかった。
【0022】
このようにして得られる金属ナノ分散体は、ナノサイズの金属粒子を含む金属粒子が、水吸脱着剤及び/又は多孔質無機材中に分散した金属分散体であり、ナノサイズの金属粒子の表面は水吸脱着剤及び/又は多孔質無機材でコーティングされている。一般的に金属をナノサイズまで微細化すると、環境中では酸化し失活するが、金属ナノ分散体においては、ナノサイズの金属粒子の表面を覆う水吸脱着剤及び/又は多孔質無機材が、該金属粒子の大部分が酸素、二酸化炭素又は水と直接接触することを阻止するので、ナノサイズの金属粒子は、大気中においても高い活性を維持することができる。実験の結果、セライト(登録商標)と共に粉砕した金属カルシウムは、電子源として90%以上の活性を有し、2ヶ月以上大気中で安定的に存在させることができた。
【0023】
有機反応の原料は、液体、固体、又はスラリー状であってもよい。原料が液体の場合、原料と金属ナノ分散体とを接触させると、金属ナノ分散体内部に原料が浸透し、開始剤である金属粒子と接触して化学反応が起こる。原料が固体の場合も、原料と金属ナノ分散体とを接触させることで、原料が開始剤である金属粒子と接触して化学反応が起こる。原料が固体の場合、液体に比べ、原料と金属粒子との接触面積、接触機会が少ないので攪拌混合操作を行うことが好ましく、表面更新が行われる攪拌混合操作がより好ましい。このため粉砕機能を備えるミルは反応器として好ましい。但し、後述の実施例からも分かるように遊星ボールミルのような非常に高い攪拌強度を与えなくても有機反応は十分に進行する。また、原料と金属ナノ分散体との接触を高める方法として、原料と金属ナノ分散体との混合物に対して、ホットプレス法などのように上方からプレス機などで荷重を加える方法も使用することができる。
【0024】
前記金属ナノ分散体を用い、金属ナノ分散体と原料とを接触させ、金属粒子を反応の開始剤とし無溶媒で反応させることができる有機反応としては、マイケル反応、アセト酢酸エステル合成、アルドール反応、クライゼン縮合、ディークマン縮合、ヘンリー反応で代表される酸性の高い水素引き抜き反応、アシロイン縮合、バイビエールカップリング反応、ベンゾイン縮合、グリニャール反応、カガン・モーランダー・ジョード反応、マクマリーカップリング、リフォマトスキー反応、ウルマンカップリング反応、ウルツカップリングで代表される電子供与によるアニオンラジカルの生成反応、バーチ還元、クレメンゼン還元、メーヤーワインポンドルフバーレー還元で代表される還元反応、フィッシャーインドール合成で代表される脱水反応が例示される。
【0025】
次にナノサイズの金属粒子と原料とを接触させる方法として、金属ナノ分散体を用いる方法に代え、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行う方法について説明する。以下、金属ナノ分散体を用いる方法との相違点を中心に説明する。
【0026】
金属ナノ分散体を用いる方法が、予めナノサイズの金属粒子を製造し、これを原料と接触させるのに対し、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行う方法の場合、金属粒子をナノサイズにしつつ原料と接触させる。この方法の場合も、周囲に水吸脱着剤及び/又は多孔質無機材など固体分散剤が存在するので、金属粒子がナノサイズまで微細化されても失活せず、十分に固相有機反応が進行する。
【0027】
固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕する方法は、特に限定されず、遊星ボールミルなど公知の微粉砕機を使用して行うことができる。
【0028】
固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕しながら、ナノサイズの金属粒子と原料とを接触させ固相有機反応をなさしめる方法は、金属ナノ分散体を用いる方法と異なり予めナノサイズの金属粒子を準備する必要がないため簡便に行える利点がある。一方で固形状の金属の少なくとも一部がナノサイズとなるまで粉砕する必要があることから、反応器として微粉砕が可能な装置を使用する必要がある。これに対して金属ナノ分散体を使用する場合は、金属粒子を粉砕する必要がないことから、攪拌強度の小さい汎用攪拌機を使用することができる。また後述の実施例で示すように使用する金属の量が同一の場合、金属ナノ分散体を用いる方が反応率が高く、反応を効率的に行うことができることが分かった。このように2つの方法は長所が異なるので、目的の固相有機反応に応じて適宜好ましい方法を選択し使用すればよい。
【実施例】
【0029】
金属カルシウムナノ分散体Ca/Cの調製
金属カルシウム1gと活性炭1gとを遊星ボールミルを用いて、窒素ガス雰囲気下、600rpmで60分間、常温粉砕処理を行った。ミル粉砕物を窒素ガス雰囲気下、分級し、2mm篩下の粉砕物を得た。これを金属カルシウムナノ分散体Ca/Cとした。電子顕微鏡写真(SEM)及び成分分析(EDS)結果を図1に示した。図2及び図3に線分析結果を示した。図2(a)及び図3はカーボン(C)、酸素(O)、カルシウム(Ca)を、図2(b)はカーボン(C)を、図2(c)は酸素(O)を、図2(d)はカルシウム(Ca)を線分析した結果である。図2及び図3中、横線が分析位置を示し、波形が各成分の強度を示す。図4は、粉砕前の活性炭のSEM写真、図5は、ミル粉砕後のSEM写真である。電子顕微鏡写真において比較的大きく見える粒子も、実際は、数十から百nm程度の大きさのナノ粒子が凝集したものであり、金属カルシウムは十分にナノサイズまで粉砕されている。
【0030】
金属カルシウムナノ分散体Ca/CaO、亜鉛ナノ分散体Zn/C、アルミニウムナノ分散体Al/C、鉄ナノ分散体Fe/C、金属カルシウムナノ分散体Ca/Celiteの調製
活性炭に代え、酸化カルシウムCaOを分散剤とし、金属カルシウムナノ分散体Ca/Cと同様の要領で、金属カルシウムナノ分散体Ca/CaOを得た。また、亜鉛と活性炭、アルミニウムと活性炭、鉄と活性炭を用い、亜鉛ナノ分散体Zn/C、アルミニウムナノ分散体Al/C、鉄ナノ分散体Fe/Cを得た。さらにセライトを分散剤とし金属カルシウムナノ分散体Ca/Celiteを得た。
【0031】
実施例1〜4
アルゴンガスで置換したグローブボックス内で、テフロン(登録商標)製攪拌子、金属カルシウムナノ分散体Ca/C(金属カルシウム含有量に換算して5mmol相当量)、出発原料1mmolの順で耐圧ガラス反応器に入れ密封した。耐圧ガラス反応器を25℃に調温した恒温槽で、マグネチックスターラを用いて攪拌した。24時間の攪拌後、酸性水溶液(HCl 1N)、あるいは、アルカリ性水溶液(NaOH 1N)を生成物に応じて加えて未反応の金属Ca成分をクエンチした後、ジエチルエーテルで抽出した。抽出液に無水硫酸マグネシウムを加えて脱水処理し、メンブレンフィルターを用いてろ過した。ろ液をGC/MSやGC−FIDにより分析した。出発原料には、ニトロベンゼン、安息香酸、N−ベンジリデンアニリン、ベンズアルデヒドを用いた。
【0032】
ニトロベンゼンの反応の結果を示した。ニトロベンゼンと金属カルシウムナノ分散体Ca/Cとを攪拌し接触させることで脱窒素反応、脱酸素反応が起こった。
【0033】
【化1】

【0034】
【表1】

【0035】
安息香酸の反応の結果を示した。安息香酸と金属カルシウムナノ分散体Ca/Cとを攪拌し接触させることで、脱炭酸反応、脱酸素反応が起こった。
【0036】
【化2】

【0037】
【表2】

【0038】
N―ベンジリンデンアニリンの反応の結果を示した。N―ベンジリンデンアニリンと金属カルシウムナノ分散体Ca/Cとを攪拌し接触させることで、還元反応が起こった。
【0039】
【化3】

【0040】
【表3】

【0041】
ベンズアルデヒドの反応の結果を示した。ベンズアルデヒドと金属カルシウムナノ分散体Ca/Cとを攪拌し接触させることで還元反応が起こった。
【0042】
【化4】

【0043】
【表4】

【0044】
実施例5:ウルマンカップリング反応
乳鉢に4−ブロモトルエン5mmolを投入し、上記金属カルシウムナノ分散体Ca/CaOを1g添加した後、室温下ですり潰すように回転数100rpmで攪拌した。24時間の攪拌後、ジエチルエーテル20mlを加え抽出した。次にエバポレータで濃縮しGC/MSにより分析した。結果は次の通りであり、脱ハロゲン反応が起こった。
【0045】
【化5】

【0046】
【表5】

【0047】
実施例6
アニリンとベンズアルデヒドとの混合物を基質とし、金属カルシウムナノ分散体Ca/Cを還元剤として、次の要領で実験を行った。反応器に3つ口フラスコを用い、1mmolのアニリンと金属カルシウムナノ分散体Ca/Cを0.978gとを投入後、10mmolのベンズアルデヒドを添加し、室温下で24時間反応させた。結果は次の通りであり、脱水反応が起こった。
【0048】
【表6】

【0049】
実施例7
ベンズアルデヒドを基質とし、亜鉛ナノ分散体Zn/Cを還元剤として、次の要領で実験を行った。反応器に耐圧ガラス容器を用い、10mmolのベンズアルデヒドと1.05gの亜鉛ナノ分散体Zn/Cとを室温下で24時間反応させた。結果は次の通りであった。
【0050】
【表7】

【0051】
実施例8
ベンズアルデヒドを基質とし、アルミニウムナノ分散体Al/Cを還元剤として、次の要領で実験を行った。反応器に耐圧ガラス容器を用い、10mmolのベンズアルデヒドと0.65gのアルミニウムナノ分散体Al/Cとを室温下で24時間反応させた。結果は次の通りであった。
【0052】
【表8】

【0053】
実施例9
ベンズアルデヒドを基質とし、鉄ナノ分散体Fe/Cを還元剤として、次の要領で実験を行った。反応器に耐圧ガラス容器を用い、1mmolのベンズアルデヒドと1.12gの鉄ナノ分散体Fe/Cとを室温下で24時間反応させた。結果は次の通りであった。
【0054】
【表9】

【0055】
実施例10〜15
ブロモベンゼンを基質とし、金属カルシウムナノ分散体Ca/Celiteを使用し反応させる場合(実施例10から12)、固形の金属カルシウムをナノサイズに粉砕させながら反応させる場合(実施例13から15)の実験を次の要領で行った。反応器には遊星ボールミルを用い、室温下で24時間反応させた。実験条件及び結果を表10に示した。なお、実施例13から15で添加した金属カルシウムの量は、実施例10から12の金属カルシウムナノ分散体Ca/Celiteに含まれる金属カルシウムを水素発生量から算出した量と同量とした。つまり実施例10と実施例13、実施例11と実施例14、実施例12と実施例15で添加した金属カルシウム量はほぼ同量である。このとき各実施例において、酸化カルシウムを添加し、金属カルシウムナノ分散体Ca/Celite+酸化カルシウム、金属カルシウム+酸化カルシウムの量を10gとした。
【0056】
実験の結果、実施例10から15の全てにおいて脱ハロゲン反応が進行した。金属カルシウムナノ分散体を使用する場合と金属カルシウムをナノ粒子化させながら反応させる場合とを比較すると、金属カルシウムナノ分散体を使用する場合の方が、未反応のブロモベンゼンの量が少なく、脱ハロゲン反応が進行することが分かった。この傾向は、使用する金属カルシウムの量が多いほど顕著であった。
【0057】
【表10】

【特許請求の範囲】
【請求項1】
固体分散剤存在下で少なくとも一部がナノサイズの金属粒子と原料とを接触させ、前記金属粒子を反応の開始剤とし無溶媒で有機反応を行うことを特徴とする固相有機反応方法。
【請求項2】
前記少なくとも一部がナノサイズの金属粒子は、少なくとも一部がナノサイズの金属粒子を固体分散剤に分散させた金属ナノ分散体として与えられることを特徴とする請求項1に記載の固相有機反応方法。
【請求項3】
前記金属ナノ分散体は、固形状の金属と固体分散剤とを固形状の金属の少なくとも一部がナノサイズとなるまで粉砕し得られることを特徴とする請求項2に記載の固相有機反応方法。
【請求項4】
前記固体分散剤存在下での少なくとも一部がナノサイズの金属粒子と原料との接触は、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行われることを特徴とする請求項1に記載の固相有機反応方法。
【請求項5】
前記金属粒子が、水素化触媒、還元的カップリング剤、アルカリ剤、脱酸素剤、脱炭酸剤、脱リン酸剤、脱ハロゲン剤又は脱水剤として機能することを特徴とする請求項1から4のいずれか1に記載の固相有機反応方法。
【請求項6】
前記金属粒子は、アルカリ金属、アルカリ土類金属、アルミニウム族元素、鉄族元素、白金族元素、銅族元素、亜鉛族元素及びこれらを含む合金のうち少なくともいずれか1を含むことを特徴とする請求項1から5のいずれか1に記載の固相有機反応方法。
【請求項7】
前記固体分散剤は、水吸脱着剤及び/又は多孔質無機材であることを特徴とする請求項1から6のいずれか1に記載の固相有機反応方法。
【請求項8】
前記固体分散剤は、水吸脱着剤及び/又は多孔質無機材であり、
前記金属ナノ分散体は、ナノサイズの金属粒子の表面を前記水吸脱着剤及び/又は多孔質無機材がコーティングし、水吸脱着剤及び/又は多孔質無機材が、ナノサイズの金属粒子の大部分が酸素、二酸化炭素又は水と直接接触することを阻止することを特徴とする請求項2、3、5又は6のいずれか1に記載の固相有機反応方法。
【請求項1】
固体分散剤存在下で少なくとも一部がナノサイズの金属粒子と原料とを接触させ、前記金属粒子を反応の開始剤とし無溶媒で有機反応を行うことを特徴とする固相有機反応方法。
【請求項2】
前記少なくとも一部がナノサイズの金属粒子は、少なくとも一部がナノサイズの金属粒子を固体分散剤に分散させた金属ナノ分散体として与えられることを特徴とする請求項1に記載の固相有機反応方法。
【請求項3】
前記金属ナノ分散体は、固形状の金属と固体分散剤とを固形状の金属の少なくとも一部がナノサイズとなるまで粉砕し得られることを特徴とする請求項2に記載の固相有機反応方法。
【請求項4】
前記固体分散剤存在下での少なくとも一部がナノサイズの金属粒子と原料との接触は、固形状の金属と固体分散剤と原料との混合物を固形状の金属の少なくとも一部がナノサイズとなるまで粉砕することで行われることを特徴とする請求項1に記載の固相有機反応方法。
【請求項5】
前記金属粒子が、水素化触媒、還元的カップリング剤、アルカリ剤、脱酸素剤、脱炭酸剤、脱リン酸剤、脱ハロゲン剤又は脱水剤として機能することを特徴とする請求項1から4のいずれか1に記載の固相有機反応方法。
【請求項6】
前記金属粒子は、アルカリ金属、アルカリ土類金属、アルミニウム族元素、鉄族元素、白金族元素、銅族元素、亜鉛族元素及びこれらを含む合金のうち少なくともいずれか1を含むことを特徴とする請求項1から5のいずれか1に記載の固相有機反応方法。
【請求項7】
前記固体分散剤は、水吸脱着剤及び/又は多孔質無機材であることを特徴とする請求項1から6のいずれか1に記載の固相有機反応方法。
【請求項8】
前記固体分散剤は、水吸脱着剤及び/又は多孔質無機材であり、
前記金属ナノ分散体は、ナノサイズの金属粒子の表面を前記水吸脱着剤及び/又は多孔質無機材がコーティングし、水吸脱着剤及び/又は多孔質無機材が、ナノサイズの金属粒子の大部分が酸素、二酸化炭素又は水と直接接触することを阻止することを特徴とする請求項2、3、5又は6のいずれか1に記載の固相有機反応方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−20977(P2012−20977A)
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願番号】特願2010−161238(P2010−161238)
【出願日】平成22年7月16日(2010.7.16)
【出願人】(507234438)公立大学法人県立広島大学 (24)
【Fターム(参考)】
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願日】平成22年7月16日(2010.7.16)
【出願人】(507234438)公立大学法人県立広島大学 (24)
【Fターム(参考)】
[ Back to top ]

