圧縮性コーティングで被覆された医薬組成物及び錠剤並びに製造方法
圧縮性コーティングで被覆された、味がマスキングされた薬物含有粒子及び/又は制御放出性コーティングで被覆された薬物含有粒子と、崩壊剤及び糖アルコール、サッカリド、又はその混合物を含む速分散性微顆粒と、他の任意選択の薬学的に許容可能な賦形剤とを含む医薬組成物の調製方法が提供され、ここで口腔内崩壊錠(ODT)又は速分散錠(RDT)組成物は、許容可能な打錠特性、官能特性、及び薬物動態特性を有する。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本願は、2009年11月30日に出願された米国仮特許出願第61/265,213号明細書の利益を主張し、これはあらゆる目的から全体として参照により本明細書に援用される。
【背景技術】
【0002】
錠剤及びカプセルは最も広く用いられている剤形の2つであるが、かかる剤形にはいくつかの欠点がある。例えば、人口の推定50%が錠剤の嚥下に障害を有する(Seager in Journal of Pharmacol.and Pharm.50,pages 375−382,1998を参照のこと);特に、老年者が錠剤若しくはカプセルを嚥下すること、又は錠剤若しくはカプセルを嚥下できない、若しくは嚥下を嫌がる小児に投薬することは困難である。これにより治療に対するコンプライアンスが不十分となり、さらにはノンコンプライアンスとなることさえあるため、治療の効力に負の影響が及ぶ。多くの薬物は苦味を呈し、そのため、小児に対する薬剤投与方法として一般に用いられるように、薬剤を簡便にアップルソースなどの食品にまぶすことができない。従来のカプセル又は錠剤の剤形はまた、飲用の水又は液体を入手できないことの多い「あちこち動き回っている人」には不都合である。
【0003】
口腔内崩壊性の剤形は、従来の錠剤及びカプセルに代わるより簡便且つ潜在的により安全なものとして着実に人気が高まっている。こうした速崩壊性剤形は口腔内で崩壊又は溶解し、水なしに容易に嚥下される。この剤形は、従来の錠剤の嚥下に困難を伴う人(高齢患者及び小児患者によく見られる);水を容易に入手できない人(例えば、寝たきり患者若しくは動けない患者、又は外出の多い活動的な人);及び薬剤を服用したがらない患者を介護する者にとって重宝する。口腔内崩壊性剤形は投与が簡単で、どこでも人目を引かず服用するのに好都合で、及び一度投与すると吐き捨てることが困難であるため、経口投薬レジメンに対する患者コンプライアンスの向上を促進する。
【0004】
薬物粒子は、十分に小さいもので、有効に味をマスキングする1つ又は複数のポリマーで被覆されたもので、且つ口腔内崩壊錠(「ODT」)に製剤化された、それによりODTが患者の口腔内で急速に崩壊して、ざらついた舌触り及び後味のない、被覆された薬物粒子を含有する滑らかな嚥下し易い懸濁液を生じるものでなければならない。口腔内崩壊錠に組み込むのに好適な薬物含有粒子は、以下の特徴の1つ又は複数を呈する必要がある:
・望ましい官能特性を実現するのに適切な被覆レベルで1つ又は複数のポリマーによって被覆されていること(例えば、有効に味がマスキングされるよう口腔内での薬物放出が、及び後味が、全くない、又は僅かである)。
・ざらつきのない舌触りを実現する望ましい平均粒度(例えば、典型的には<500μm)
・望ましい薬物動態学的特性(すなわち、インビトロ薬物放出、血漿濃度−時間プロファイル、Cmax、Tmax、終末相消失半減期、及びAUC)。
【0005】
マイクロカプセルは、口腔内での薬物放出を妨げるのに十分な厚さの、1つ又は複数のポリマー又は脂肪酸及び/又はエステルを含むコーティング層で封入された小粒子(典型的には平均直径<400μm)であり、すなわち、実際にはコーティング層が下層にある薬物の味を有効にマスキングし、ODT製剤に特に好適である。その場合、被覆された薬物粒子がインビトロ及びインビボ条件下で望ましい薬物放出プロファイルを提供することを確実にする必要がある。即時放出性(IR)の剤形の場合、望ましいインビトロ薬物放出/薬物動態特性(すなわち、急速な薬物放出、Cmax、及びAUC)は、生物学的に同等であるべきRLD(収載基準薬物(reference listed drug))と同様のものでなければならない。対照的に、制御放出性の薬物粒子を含むODTは、1日1回又は2回の投与レジメンに好適とするのに望ましいインビトロ薬物放出/薬物動態特性[例えば、持続放出性(SR)、二峰性{IR+SR、IR+TPR(時限パルス放出)、又はIR+TSR(時限持続放出)}プロファイル、血漿濃度−時間プロファイル、Cmax、Tmax、血漿中消失半減期、及びAUC]を呈するものでなければならない。
【0006】
薬物含有小粒子の被覆を、IR剤形の場合において有効な味マスキングと生物学的に同等な急速薬物放出との均衡が得られるように行うこと、又はMicrocaps(登録商標)(マイクロカプセル化)若しくはDiffucaps(登録商標)(流動層コーティング法)の技術を用いたCR剤形の場合において長時間持続するインビトロ薬物放出プロファイルが得られるように行うことは、難題であり得る。これは特に、薬物が極めて強い苦味を呈したり、水又は胃腸液に溶け易かったり、及び/又はpH依存性の溶解度プロファイルを有したりする場合に当てはまる。米国特許第6,139,865号明細書又は同時係属中の2004年4月19日に出願された米国特許出願第10/827,106号明細書(米国特許出願公開第2005/0232988号明細書)、2005年8月26日に出願された米国特許出願第11/213,266号明細書(米国特許出願公開第2006/0105038号明細書);2005年10月21日に出願された米国特許出願第11/256,653号明細書(米国特許出願公開第2006/0105039号明細書);2005年10月12日に出願された米国特許出願第11/248,596号明細書(米国特許出願公開第2006/0078614号明細書)、及び2009年2月13日に出願された米国特許出願第12/370,852号明細書(米国特許出願公開第2009/0202630号明細書)(これらはあらゆる目的から全体として参照により援用される)の開示における一つの手法は、薬物含有粒子(薬物結晶、薬物顆粒、薬物ペレット、又は薬物層がレイヤリングされたビーズ)を、約10%〜65%w/wの水不溶性ポリマー(例えば、平均粘度が100cpsのエチルセルロース)を含む1つ又は複数の厚い層により、それ単独で、又は胃溶性有機、無機若しくはポリマー細孔形成剤と組み合わせて溶媒コアセルベーション法又は流動層コーティング法で被覆し、それにより口腔内にある間に苦いAPIが露出しないよう確実にすることであった。米国特許第6,627,223号明細書;米国特許第7,387,793号明細書、又は同時係属中の2007年1月29日に出願された米国特許出願第11/668,408号明細書(米国特許出願公開第2008/0196491号明細書)、2006年8月29日に出願された米国特許出願第11/847,219号明細書(米国特許出願公開第2007/0069878号明細書)、及び2009年4月15日に出願された米国特許出願第12/424,201号明細書(米国特許出願公開第2009/0258066号明細書)、並びに国際公開第2010/096820号パンフレット及び国際公開第2010/096814号パンフレット(これらはあらゆる目的から全体として参照により援用される)の開示に基づく別の手法は、持続放出性又は時限パルス放出性のプロファイルを呈するSRビーズ又はTPRビーズを生成することである。さらに、被覆された薬物含有粒子(例えば、味がマスキングされた微粒子、SRコーティングで被覆された微粒子又はTPRコーティングで被覆された微粒子)において、ODT中に組み込むため平均粒度が500μm以下で、前記ODTが口腔内で急速に崩壊して滑らかな嚥下し易い懸濁液となるものは、ざらついた舌触り及び後味を呈しないことが要件である。結果として、胃腸管内で急速に放出されることが求められる苦味を呈する薬物は、口腔内溶解剤形の製剤化において固有の難題を提示する。
【0007】
最後に、口腔内崩壊錠は口腔内で、又はUSP崩壊時間試験に従い試験するときに、急速な崩壊を達成するように、典型的には低い圧縮力で圧縮される。結果的にOTDは従来の錠剤より摩損度が高い。錠剤の硬度及び摩損度は、錠剤基質中に微結晶性セルロースなどの圧縮助剤を含めることにより向上し得る。しかしながら、それにより舌触りがチョーク質となる。さらに、許容される錠剤硬度及び摩損度を呈するロバストな錠剤製剤はまた、輸送、商品流通、及び最終使用に向けてバルク包装する、及び/又はHDPEボトル若しくはプッシュスルーブリスター(最も好ましい包装)に包装するためにも必要とされる。ODTは1980年代に市場に導入されたが、これらの課題はいまだ十分には対処されていない。
【0008】
製剤学的及び実際的な観点から、本発明の発明者らは、厚く被覆した薬物含有微粒子を含むOTDの打錠特性の改善(例えば、より高い硬度及びより低い摩損度)を、官能特性(例えば、有効な味マスキング、ざらつきのない舌触り及び後味がないこと)を犠牲にすることなく行う様々な方法を検討した。有効な味マスキング及び急速放出、持続放出、又は時限パルス放出特性のため、OTDへの組込み前にスクラロースなどの非ポリマー性水溶性圧縮性甘味料を含む圧縮性コーティング層を、ポリマーコーティングで被覆された薬物含有微粒子上に配置して施す方法が、意外にも、著しく低い圧縮力で圧縮しても打錠特性が著しく向上したOTDをもたらすことが分かった。
【発明の概要】
【0009】
一実施形態において、本発明は、1つ又は複数の薬物を含む被覆された微粒子を含む多粒子医薬組成物において、被覆された粒子が打錠特性を向上させる圧縮性コーティング剤でさらに被覆される多粒子医薬組成物、並びに圧縮性コーティングで被覆された微粒子を含む医薬組成物及び口腔内崩壊錠を調製する方法に関する。
【0010】
別の実施形態では、本発明は、薬物の味並びに後味を有効にマスキングし、且つ薬剤を必要とする患者に経口投与すると望ましい薬物動態プロファイルを提供する1つ又は複数の膜層を含む、治療有効量の薬物含有粒子を含む医薬組成物に関する。別の実施形態では、本発明は、味を有効にマスキングするとともに、胃に入ると収載基準即時放出(IR)薬物製品と生物学的に同等である急速な用量放出をもたらす1つ又は複数の膜層を含む、治療有効量の薬物含有粒子を含む医薬組成物に関する。特定の他の実施形態において、本発明は、薬物の味を有効にマスキングするとともに、1日1回又は2回の投与レジメンに好適であるように制御放出プロファイル(例えば、持続放出(SR)、時限パルス放出(TPR)、時限持続放出(TSR)又は修飾放出(IR+TPR、−IR+SR、SR+TPR又はIR+TSR))を提供する1つ又は複数の膜層を含む薬物を含む医薬組成物に関し、すなわち換言すれば本発明は、薬物の味を有効にマスキングするのみならず、制御放出(CR)プロファイルも提供し、それにより患者コンプライアンスを向上させる1つ又は複数の膜層を含む薬物を含む医薬組成物に関する。そのそれぞれの場合に、被覆された薬物含有微粒子はスクラロース、ラクチトール、ソルビトール、又はマルチトールなどの非ポリマー性圧縮性甘味料でさらに被覆され、それにより、味がマスキングされた及び/又は制御放出性コーティングで被覆された微粒子と、速分散性微顆粒と、1つ又は複数の香味料、甘味料等を含む他のODT賦形剤とを含む圧縮ブレンド物は打錠中における膜の破断が最小限に抑えられ、又は解消され、ここでこのように生成されたODT錠剤は口腔内で急速に崩壊し、ざらついた舌触り及び後味を呈しない滑らかな嚥下し易い懸濁液を形成する。
【0011】
特定の他の実施形態において、本発明は、コアセルベート化ポリマー材料を含む第1のコーティング層と、任意選択により、味がマスキングされた微粒子を生成する水不溶性ポリマーと水溶性又は胃溶性細孔形成ポリマーとの組み合わせを含む流動層コーティング法で被覆されたブレンドポリマー材料を含む第2のコーティング層とを含む、味がマスキングされた組成物に関する。味がマスキングされた及び/又は制御放出性の微粒子はラクチトールの圧縮性コーティング層でさらに被覆され、及び圧縮性コーティングで被覆された薬物粒子は他の薬学的に許容可能な賦形剤(例えば、希釈剤、圧縮助剤、潤滑剤等)とブレンドされ、速分散錠に圧縮される。速分散錠は水又は体液に接触すると、薬物放出及び薬物動態プロファイルを制御する被覆された微粒子を急速に分散させる。
【0012】
本発明のこれらの及び他の実施形態、利点及び特徴は、以降の節に提供される詳細な説明及び例から明らかとなる。
【図面の簡単な説明】
【0013】
【図1】図1は、VFC−Lab 3に装着されたGranurex GRX−35インサートを示す。
【図2】図2はヒストグラムを示す:実施例3のイブプロフェンペレットのQICPIC粒度解析。
【発明を実施するための形態】
【0014】
用語「薬物」、「有効分」、「治療剤」又は「医薬品有効成分」は、本明細書で使用されるとき、薬学的に許容可能且つ治療上有効な量のラニチジンなどの薬物、又はその(例えばラニチジンの)薬学的に許容可能な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形、及び/又はエステルを含む。本発明の様々な実施形態の記載においてラニチジンなどの薬物を参照するとき、その参照には前記薬物の薬学的に許容可能な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形、及び/又はエステルもまた包含される。
【0015】
用語「口腔内崩壊錠」、「口腔内溶解錠」、「口腔内分散錠」又は「ODT」は、投与後に患者の口腔内で咀嚼なしに急速に崩壊する本発明の固形剤形を指す。崩壊速度は様々であり得るが、水で直ちに嚥下すること又は投与後咀嚼することを意図した従来の固形剤形又はチュアブルな固形剤形(例えば錠剤)の崩壊速度より速い。本発明の口腔内崩壊性組成物は、膨潤し、溶解し、又は他の形でODT組成物の崩壊又は溶解を促進する薬学的に許容可能な成分を含有し得る。かかる成分としては、クロスポビドンなどの医薬崩壊剤、マンニトールなどの水溶性糖アルコール、ラクトースなどのサッカリド、又はその混合物、ポビドンなどの水溶性結合剤、融解性固形物(例えばワックス)のポリエチレングリコールなど、胃に入ると薬物を放出することができるものを挙げることができる。本発明の口腔内崩壊性組成物は、錠剤又はミニ錠剤の形態であってもよい。
【0016】
用語「約」は、本明細書で使用されるとき数量を指し、「ちょうど」を含む。例えば、「約60秒」は、60秒ちょうど、並びに60秒に近い値(例えば、50秒、55秒、59秒、61秒、65秒、70秒等)を含む。
【0017】
用語「コア」には、限定はされないが、典型的には約100μm〜約800μm、約100μm〜約600μm、約100μm〜約500μm、約100μm〜約400μm、約200μm〜約600μm、約200μm〜約500μm、約200μm〜約400μm、約300μm〜約500μm、約300μm〜約600μmの範囲及びその部分的な範囲のサイズを有するビーズ、ペレット、微顆粒、粒状物、ミニ錠剤、薬物結晶等が含まれる。
【0018】
本明細書で使用されるとき、用語「修飾放出」コーティングは、かかるコーティングを含まず薬物を比較的速く放出する製剤(すなわち「即時放出」組成物)と比べて薬物の放出を遅延させ、放出を持続させ、放出を延長させ、放出を阻止し、及び/又は他の形で放出を長引かせる味マスキングを含むコーティングを包含する。用語「制御放出性」は、「持続放出」、「長期放出」、「遅延放出」及び「時限パルス放出」を包含する。用語「タイムラグ」コーティングは特別な種類の「制御放出」コーティングを指し、ここではタイムラグコーティングにより投与後の薬物放出が遅延する。用語「制御放出」はまた、「修飾放出」と同義的に使用される。用語「制御放出性粒子」は、本明細書に記載されるとおりの、1つ又は複数の制御放出特性を示す粒子を指す。用語「制御放出性粒子」はまた、本明細書に記載されるとおりの、1つ又は複数の制御放出性コーティングで被覆された薬物含有粒子も指す。
【0019】
用語「ラグタイム」は、薬物含有粒子の投与直後において、粒子から放出される薬物が約10%未満、例えば約9%未満、約8%未満、約7%未満、約6%未満、約5%未満、約4%未満、約3%未満、約2%未満、約1%未満、又はさらには実質的に約0%である期間を指す。インビトロ溶解試験との関連では、ラグタイムは溶解条件に曝露された直後において、薬物含有粒子から放出される薬物が約10%未満、例えば約9%未満、約8%未満、約7%未満、約6%未満、約5%未満、約4%未満、約3%未満、約2%未満、約1%未満、又はさらには実質的に約0%である期間を指す。
【0020】
本明細書で使用されるとき、用語「即時放出」(IR)は、剤形の投与後約2時間以内、又は他の実施形態では約1時間以内に薬物の約50%以上(特に口腔内崩壊錠に組み込むため味がマスキングされる場合)、いくつかの実施形態では約75%超、他の実施形態では約90%超、及びさらに他の実施形態では約95%超が放出されることを指す。
【0021】
本明細書で使用されるとき、用語「即時放出性コア」は、任意選択によりシーラント層がレイヤリングされた、薬物とアルカリ性剤とを含む本明細書に定義されるとおりのコアを指し、ここで任意選択のシーラント層は即時放出性コアを摩耗及び摩擦から保護する働きをするが、実質的な制御放出特性は全く提供しない。「即時放出性コア」には、薬物結晶(又は非晶質粒子);アルカリ性剤と薬物の顆粒又は粒状物とにおいて1つ又は複数の賦形剤を伴うもの、薬物(及び任意選択の結合剤)と任意選択の保護シーラントコーティングとアルカリ性緩衝層とがレイヤリングされた不活性コア(例えば、球状糖)、又は薬物(及び任意選択の結合剤)と任意選択の保護シーラントコーティングとがレイヤリングされたアルカリ性剤が含まれ得る。即時放出性コアは本明細書に記載されるとおりの即時放出特性を有する。即時放出性コアを1つ又は複数の制御放出性コーティングで被覆することにより、制御放出性粒子(例えば、長期放出性粒子;持続放出性粒子;遅延放出性粒子;時限パルス放出粒子等)を調製することができる。
【0022】
本明細書で使用されるとき、用語「持続放出性」(SR)は、感知され得るラグタイムなしに薬物含有コア粒子からの薬物放出が減速する特性を指す。用語「持続放出性コーティング」又は「SRコーティング」は、持続放出特性を示すコーティングを指す。用語「持続放出性粒子」は、持続放出特性を示す薬物含有粒子を指す。一実施形態において、持続放出性コーティングは水不溶性ポリマーと、任意選択により水溶性ポリマーとを含む。SRコーティングは、任意選択により可塑剤又はコーティングの「持続放出」特性を妨げない他の成分を含有してもよい。
【0023】
本明細書で使用されるとき、用語「時限パルス放出」(TPR)は、所定のラグタイム後の修飾された薬物放出の特性を指す。用語「時限パルス放出性コーティング」又は「TPRコーティング」は、時限パルス放出特性を示すコーティングを指す。用語「時限パルス放出性粒子」は、時限パルス放出特性を示す薬物含有粒子を指す。いくつかの実施形態では、例えば少なくとも1つの水不溶性ポリマーと少なくとも1つの腸溶性ポリマーとの組み合わせ(例えば、エチルセルロースとフタル酸ヒプロメロースとの組み合わせ)で粒子を被覆することにより、少なくとも約2〜約10時間のラグタイムが実現される。TPRコーティングは、任意選択により可塑剤又はコーティングの「時限パルス放出」特性を妨げない他の成分を含有してもよい。
【0024】
本明細書で使用されるとき、用語「遅延放出」(DR)は、所定のラグタイム後に薬物が即時放出される特性を指す。用語「遅延放出コーティング」又は「DRコーティング」は、遅延放出特性を示すコーティングを指す。用語「遅延放出性粒子」は、遅延放出特性を示す薬物含有粒子を指す。いくつかの実施形態では、アルカリ性pHに曝露されるまで実質的な薬物放出が起こらないような遅延放出特性を示す薬物含有粒子が、粒子を腸溶性ポリマー(例えばフタル酸ヒプロメロース)で被覆することにより実現される。遅延放出性コーティングは、任意選択により可塑剤又はコーティングの遅延放出特性を妨げない他の成分を含有してもよい。
【0025】
例えば基体上のコーティングに関連して用語「〜を覆って配置される」は、例えば基体に対するコーティングの相対的な位置を指し、しかしながらコーティングが基体と直接接触している必要はない。例えば、基体を「覆って配置される」第1のコーティングは、基体と直接接触していてもよく、又は1つ以上の介在する材料若しくはコーティングが第1のコーティングと基体との間に置かれてもよい。換言すれば、例えば、薬物含有コアを覆って配置されるSRコーティングは、薬物含有コア上に直接堆積したSRコーティングを指すこともあり、又は薬物含有コア上に堆積した保護シールコーティング上に堆積したSRコーティングを指すこともある。
【0026】
用語「シーラント層」又は「シールコーティング」は、薬物層がレイヤリングされたビーズなどの薬物含有コア粒子を覆って配置された保護膜を指す。
【0027】
用語「実質的に崩壊する」は、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%の崩壊、又は約100%崩壊に達する崩壊レベルを指す。用語「崩壊」が、錠剤を含む例えば構成粒子の構造的まとまりが壊れること、又はそれが失われることを指す一方、用語「溶解」が液体中における固体の可溶化(例えば、溶媒又は胃液中における薬物の可溶化)を指す点で、「崩壊」は「溶解」と区別される。
【0028】
剤形中のIR粒子の味マスキング層(存在する場合)に関連して用語「味を実質的にマスキングする」は、患者の口腔内で薬物が放出又は溶解することを実質的に阻止し、それにより患者が薬物の味を知覚することを阻止する味マスキング層の特性を指す。薬物の味を「実質的にマスキングする」味マスキング層は、典型的には患者の口腔内で薬物の約10%未満、他の実施形態では薬物の約5%未満、約1%未満、約0.5%未満、約0.1%未満、約0.05%未満、約0.03%未満、又は約0.01%未満を放出する。本発明の組成物の味マスキング層の味マスキング特性は、インビボで(例えば、当該技術分野において公知の従来の官能検査方法を用いて)、又はインビトロで(例えば、本明細書に記載されるとおりの溶解試験を用いて)計測することができる。当業者は、薬物の味を「実質的にマスキングする」味マスキング層に関連する薬物放出の量が本明細書に明示的に開示される範囲に限定されず、知覚される薬物の苦味、及び例えば組成物中における香味剤の存在などの他の要因に応じて様々であり得ることを認識するであろう。
【0029】
用語「実質的に不含」は、指示される成分が存在しないか、又はほんの僅かな量のみ存在することを意味する。一実施形態では、「実質的に不含」は約10%未満を意味する。他の実施形態では、「実質的に不含」は約5%未満、約2%未満、又は約1%未満、又は約0%を意味する。例えば、実質的に水不溶性ポリマー不含のコーティングは、いかなる水不溶性ポリマーも多量に含有することはない。用語「実質的に水不溶性ポリマー不含」は、水溶性であるポリマー又はポリマーでない水不溶性成分を除外するものではない。
【0030】
用語「水不溶性」は、水性媒体中でpHとは無関係に、又は生理学的に関連性のある広いpH範囲(例えば、pH1〜約pH8)に対して不溶性又は極めて難溶性であることを意味する。水性媒体中で膨潤はするが溶解しないポリマーは、本明細書で使用されるとき「水不溶性」であり得る。
【0031】
用語「水溶性」は、水性媒体中でpHとは無関係に可溶性である(すなわち相当量が溶解する)ことを意味する。限られたpH範囲に対して可溶性である成分は、本明細書で使用されるとき「水溶性」と見なすことが(必須ではないが)できる。「水溶性」(本明細書で使用されるとき)である成分は、イオン性官能基;すなわちpHの変化でイオン化する官能基を含有しない。例えば、ほぼ中性〜アルカリ性条件下で可溶性であり、すなわちpH5.5以上、pH6以上、又は約pH7.0で可溶性であり、及び低いpH条件下で不溶性であるポリマーは、本明細書で使用されるとき「水溶性」と見なすことが(必須ではないが)できる。
【0032】
用語「腸溶性」又は「腸可溶性」は、腸内条件下;すなわちアルカリ性条件下の水性媒体中で可溶性であり(すなわち相当量が溶解し)、及び酸性条件下(すなわち低pH)で不溶性であることを意味する。例えば、中性〜アルカリ性条件下で可溶性であり、及びより低いpH条件下で不溶性である腸溶性ポリマーは、本明細書で使用されるとき必ずしも「水溶性」ではない。ポリビニルアセテートフタレートはpH4.5以上で可溶性であり、腸溶性ポリマーの例である。
【0033】
用語「逆腸溶性」は、酸性条件下で可溶性であり、及び中性〜アルカリ性条件下で不溶性であることを意味する。逆腸溶性ポリマーは、本明細書で使用されるとき「水溶性」とは見なされない。
【0034】
用語「胃溶性細孔形成剤」は、中性〜アルカリ性pHで不溶性であるが、酸性条件下では易溶性である細孔形成剤を指す。本発明における胃溶性細孔形成剤としては、有機細孔形成剤(例えば、カルシウムサッカリド、コハク酸カルシウム)、無機細孔形成剤(例えば、炭酸カルシウム、酸化マグネシウム)、又はポリマー細孔形成剤(例えば、Eudragit EPO又はAEA(登録商標))を利用することができる。
【0035】
用語「速分散錠」は、水及び/又は体液に接触すると急速に分散する錠剤を指し、この錠剤においては、味がマスキングされた又は制御放出性の微粒子(例えば、少なくとも1つの味マスキングポリマー膜層又は少なくとも1つの水不溶性持続放出ポリマー層で被覆された、薬物結晶粒子、不活性コア上にレイヤリングされた薬物、及び球状化又は粉末レイヤリングによるペレットなどの薬物含有コア)が賦形剤基質に埋め込まれている。前記分散した微粒子上に配置される膜が薬物放出を制御する。このような錠剤は嚥下されるように意図されるが、薬剤を必要とする対象又は患者において錠剤又はカプセルの嚥下に困難を覚える者に対する経口投与方法が他に少なくとも2つある−速分散錠を2つに半割し、一方の半錠を摂取してから他方を摂取すること、及び約150mLの水中に錠剤を急速に分散させ、かき混ぜて、その薬物調製物を飲むこと。
【0036】
用語「血漿濃度対時間プロファイル」、「Cmax」、「AUC」、「Tmax」、及び「消失半減期」は、「FDA Guidance for Industry:Bioavailability and Bioequivalence Studies for Orally Administered Drug Products−General Considerations(2003年3月発行)」に定義されるとおりの、その一般に認められている意味を有する。
【0037】
一実施形態において、本発明の口腔内崩壊性組成物は治療有効量の高度に球形の薬物粒子、例えば塩酸ラニチジンを含み、それらの薬物粒子は少なくとも1つの味マスキング層で被覆され、且つ前記味がマスキングされた微粒子を覆って圧縮性コーティング層が配置され、及び崩壊剤と、糖アルコール、サッカリド又はその混合物とを含む速分散性微顆粒をさらに含む口腔内崩壊錠(ODT)の形態である。口腔内崩壊性組成物が本発明の経口剤形(例えばODT)で患者の口腔内に投与されると、経口剤形(例えば錠剤)は患者の口腔内で急速に崩壊する一方、速分散性微顆粒が溶解して、味がマスキングされた薬物粒子を含む滑らかな嚥下し易い懸濁液となる。
【0038】
患者の口腔内での口腔内崩壊性組成物の崩壊速度は、約60秒以下、約50秒以下、約40秒以下、約30秒以下、約20秒以下、又は約10秒以下程度であり得る。
【0039】
或いは、本発明の口腔内崩壊性組成物の崩壊速度は、様々なインビトロ試験方法、例えばUSP<701>崩壊試験法を用いて計測することができる。USP<701>崩壊試験法を用いる場合、口腔内崩壊性組成物の崩壊速度は従来の非口腔内崩壊性経口組成物の速度より速く、例えば約60秒以下、約30秒以下、約20秒以下、又は約10秒以下である。
【0040】
用語「薬物溶解プロファイル」は、薬物含有組成物の溶解プロファイルを指す。味がマスキングされたIR微粒子を含む本発明の口腔内崩壊性組成物の溶解速度は、米国薬局方装置2(パドル、50rpm又は75rpm、900mLの0.1N HCl中又はpH=4.5、5.8又は6.8の緩衝液中)を使用して評価することができる。米国薬局方装置2試験を用いる場合、薬物(例えばラニチジン)の溶解速度は従来の非口腔内崩壊性組成物(すなわち、収載基準薬物(RLD)の即時放出製剤(例えばZantac(登録商標)))の速度と同程度でなければならず、例えば薬物総量の約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%が45分間で放出される。
【0041】
用語「非口腔内崩壊性即時放出薬物組成物」は、当該技術分野において公知の、嚥下されて胃腸管内で吸収されることを意図した従来の錠剤又はカプセル、錠剤構造を崩すために咀嚼が必要なチュアブル錠などの、前記薬物を含有する非口腔内崩壊性組成物を指す。
【0042】
従って、本発明の即時放出性(IR)の又は味がマスキングされた薬物粒子を含む口腔内崩壊性組成物は、非口腔内崩壊性即時放出組成物と実質的に同様の血漿濃度−時間プロファイルを有し得るとともに、薬物動態(PK)パラメータ、AUC(0−24)及びCmaxが、市販品と生物学的に同等であるように、適切に行われたPK交差試験において同一の条件下で投与されたZantacなどのRLD製剤についてのそれぞれの値の80.0%〜125.0%の90%信頼区間(CI)の範囲内に含まれ得る。
【0043】
或いは、本発明の口腔内崩壊性組成物を構成する多重被覆された薬物含有粒子からの薬物放出速度は、米国薬局方装置2(パドル、50rpm、37℃及び二段階溶解媒体(例えば、最初の2時間について700mLの0.1N HCl緩衝液中、その後900mLのpH=6.8の緩衝液中で試験)を使用して評価することができる。
【0044】
微粒子は、本発明で使用されるとき、平均粒度が約500μm以下、より詳細には約400μm以下の粒子又は顆粒を指す。用語「粒子」、「微粒子」、「顆粒」及び/又は「微顆粒」は本明細書では同義的に使用され、粒子が薬物及び/又は糖アルコールを含むか否かとは無関係に、平均粒度が約500μm以下の粒子を意味する。用語「マイクロキャップス(microcaps)」は、平均粒度が約500μm以下の、特別に味がマスキングされた薬物含有粒子を指す。
【0045】
微粒子は、一次粒子又は二次粒子として記載することができる。一次粒子は凝集していない一方、二次粒子は一次粒子が凝集したものである。従って、糖アルコール、サッカリド、又はその混合物(例えば、平均粒度又は粒径が30μm以下のD−マンニトール)と崩壊剤(例えば、平均粒度又は粒径が30μm以下のクロスポビドンXL−10)とを含む微顆粒を急速に分散させる一次粒子は、概して二次粒子(例えば、平均粒度又は粒径が400μm以下の微顆粒を急速に分散させる)より小さい。
【0046】
特に指示がない限り、全ての百分率及び比は重量で計算される。特に指示がない限り、全ての百分率及び比は全組成物を基準として計算される。
【0047】
本発明の口腔内崩壊性組成物は、以下の利点の1つ又は複数を有し得る:良好な崩壊特性及び薬物動態を有する美味な薬物製剤;従来の錠剤の嚥下に困難を伴う患者についての患者コンプライアンスの向上;及び患者又は患者の介護者による容易及び/又は簡便な投与。
【0048】
理想的には、口腔内崩壊性組成物は美味でなければならず、例えば許容される味及び舌触りの特徴を有しなければならない。ラニチジンなどの苦味を呈する薬物には、口腔内崩壊性製剤に味マスキングポリマーを含めることで製剤の味覚的特性が改善され得るとともに、崩壊剤、糖アルコール、サッカリド、又はその混合物を含めることで口腔内での急速な崩壊並びに「クリーム様の」舌触りがもたらされ得る。加えて、口腔内崩壊性製剤はまた、許容される薬物動態及びバイオアベイラビリティを提供して望ましい治療効果を提供しなければならない。口腔内崩壊性製剤のこれらの望ましい特性は、製剤のうち許容可能な味マスキング特性を提供する構成成分が薬物放出を妨害し、又は遅延させることによって許容し難い薬物動態特性をもたらし得る点で、相容れないものであり得る。逆に、製剤のうち口腔内での薬物放出を促進する構成成分は、望ましくない味又は舌触り特性を生じる。従って、IR薬物製品と生物学的に同等であるように設計された許容可能な口腔内崩壊錠製剤は、許容される薬物動態(例えば、胃に入ったときの急速な薬物溶解)を有する美味な(例えば、味が十分にマスキングされた)速崩壊錠組成物を提供するため、これらの相反する特性の均衡をとらなければならない。さらに、こうした錠剤は、輸送、商品流通、及び最終使用のためバルク容器、HDPEボトル又はプッシュスルーブリスターに包装されたときの摩耗の厳しさに耐えるのに十分な硬度及び低い摩損度を備えることが求められる。しかしながら、有効な味マスキング及び/又は長時間持続する薬物放出のため1つ又は複数の水不溶性ポリマーで厚く被覆された薬物含有粒子は典型的には剛性で、結果的に、特に低い圧縮力でOTDに圧縮されたとき、高摩損度の錠剤となる。従って、ポリマーで被覆された薬物粒子が、構造的完全性、すなわち錠剤圧縮中のひび割れ又は膜の破断を回避することを含めた最も望ましい打錠特性を実現するには、薬物含有粒子を覆って配置される圧縮性コーティング材料(例えば、スクラロース)による圧縮性コーティングが必要となる。
【0049】
本発明の組成物は、治療有効量の1つ又は複数の薬物と、味マスキングポリマーと、本明細書に定義されるとおりの口腔内崩壊性組成物を提供する1つ又は複数の薬学的に許容可能な成分との任意の組み合わせを含むことができる。例えば、望ましい粒度範囲[例えば、5%以下が30メッシュ(600μm)スクリーン上に残り、及び10%以下が270メッシュスクリーン(53μm)を通過する]を有する塩酸ラニチジン原薬が、米国特許第6,139,863号明細書及び同時係属中の2004年4月19日に出願された米国特許出願第10/827,106号明細書(米国特許出願公開第2005/0232988号明細書)(これらの内容は本明細書によってあらゆる目的から全体として参照により援用される)の開示に従う溶媒コアセルベーション法により水不溶性ポリマーでマイクロカプセル化される。水溶性スクラロースでさらに被覆されるこの味がマスキングされた粒子は、高剪断造粒機において精製水で造粒し、トレイ乾燥式の従来のオーブンで、又は流動層乾燥機で乾燥させた、崩壊剤、糖アルコール及び/又はサッカリドを含む顆粒(この材料は、以下では速分散性微顆粒と称する)と組み合わされ、バルク容器又はHDPEボトルでの輸送の厳しさに耐える十分に強固な口腔内崩壊錠に圧縮され、従って患者の口腔の唾液中で崩壊剤、糖アルコール又はサッカリドが膨潤及び/又は溶解し、それにより味がマスキングされた又はCRコーティングで被覆された薬物粒子を含有する滑らかな嚥下し易い懸濁液を形成する。加えて他のODT賦形剤、例えば、チェリー又はミント香味料などの1つ又は複数の香味剤、スクラロースなどの甘味料、急速な崩壊を促進する追加的な崩壊剤(同じ又は異なる崩壊剤)、及び任意選択により1つ又は複数の着色料が含まれ、口腔内崩壊錠製剤の官能特性をさらに改善する。
【0050】
特定の実施形態において、本発明は、制御放出性微粒子の1つ又は複数の集合を含む医薬組成物に関し、ここで各微粒子は、少なくとも1つの薬物又はその薬学的に許容可能な塩、溶媒和物、及び/又はエステルを含むコアと、前記コアを覆って配置された、水不溶性皮膜形成材料(例えば、エチルセルロース又は脂肪酸エステル)を含む第1のコーティングと、前記コアを覆って配置された、圧縮性コーティング材料(例えば、水溶性スクラロース)を含む外側コーティングとを含み、ここで前記圧縮性コーティング材料は実質的にポリマー不含であり、それにより打錠特性の著しい向上を実現する。
【0051】
一実施形態において、本発明は、制御放出性粒子の第1又は第2の集合を含む医薬組成物に関し、ここで各制御放出性粒子は、少なくとも1つの薬物又はその薬学的に許容可能な塩、溶媒和物、及び/又はエステルを含むコアと;水不溶性ポリマー(例えば、エチルセルロース)と、第1のコーティングを覆って配置された、水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含む(例えば、約9:1〜約1:2の比のエチルセルロースとフタル酸ヒプロメロースとの)第2の任意選択のコーティングと、第2のコーティングを覆って配置された、実質的にポリマー不含の圧縮性コーティング材料(例えば、水溶性スクラロース)を含む第3のコーティングとを含む。
【0052】
2007年1月29日に出願された米国特許出願第11/668,408号明細書(米国特許出願公開第2008/0196491号明細書)、2007年8月29日に出願された米国特許出願第11/847,219号明細書(米国特許出願公開第2008/0069878号明細書)、及び2009年4月15日に出願された米国特許出願第12/424,201号明細書(米国特許出願公開第2009/0258066号明細書)、並びに国際公開第2010/096820号パンフレット及び国際公開第2010/096814号パンフレット(これらの内容は本明細書によってあらゆる目的から全体として参照により援用される)に開示されるとおりの特定の他の実施形態において、本発明は、制御放出性微粒子の1つ又は複数の集合を含む医薬組成物に関し、ここで各微粒子は、少なくとも1つの薬物又はその薬学的に許容可能な塩、溶媒和物、エステル、及び/又は混合物を含むコアと、前記コアを覆って配置された、水不溶性皮膜形成材料(例えば、エチルセルロース又は脂肪酸エステル)を含む第1のコーティング、及び/又は水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含む任意選択の第2のコーティングと、前記CRコーティング被覆コアを覆って配置された外側コーティング層とを含み、ここで前記圧縮性コーティング材料は、ヒドロキシプロピルセルロースなどの親水性ポリマーである。圧縮性ポリマーで被覆された薬物粒子を速分散性微顆粒との組み合わせで含む口腔内崩壊錠は、十分な硬さの摩損度が低い錠剤をもたらし、輸送、商品流通、及び最終使用に向けた高密度ポリエチレン(HDPE)ボトル及び/又はプッシュスルー又は剥離式背面台紙ブリスター包装での包装が利用可能となる。その場合、非ポリマー性圧縮性コーティング材料(例えば、スクラロース)によるさらなるコーティングは、打錠特性の著しい向上をもたらすことも、又はもたらさないこともある。
【0053】
別の実施形態において、本発明は速分散錠としての医薬剤形に関し、これは、(i)制御放出性粒子の第1又は第2の集合であって、各制御放出性粒子が、少なくとも1つの薬物又はその薬学的に許容可能な塩、溶媒和物、エステル、及び/又は混合物を含むコアを含み;コアを覆って、腸溶性ポリマーを含む遅延放出性コーティングを配置し;及びコアを覆って、腸溶性ポリマーを水不溶性ポリマーとの組み合わせで含む時限パルス放出性コーティングを配置し;及び時限パルス放出性コーティングを覆って配置された、実質的にポリマー不含の圧縮性コーティング材料(例えば、水溶性スクラロース)を含む外側コーティングを含む、第1又は第2の集合と、(ii)充填剤、希釈剤、圧縮助剤、及びサッカリド及び/又は糖アルコールを崩壊剤との組み合わせで含む速分散性顆粒を含めた、薬学的に許容可能な賦形剤とを含む。
【0054】
さらに別の実施形態において、本発明は口腔内崩壊錠の調製方法に関し、これは(i)本明細書に記載されるとおりの、制御放出性粒子の1つ又は複数の集合を、サッカリド及び/又は糖アルコールを崩壊剤との組み合わせで含む速分散性顆粒、及び他のODT賦形剤(例えば、香味料、甘味料、追加的な崩壊剤、圧縮助剤(微結晶性セルロース及び/又は噴霧乾燥マンニトールなどの充填剤)、着色料等)と混合するステップであって、それにより圧縮ブレンド物を形成するステップと;(ii)圧縮ブレンド物を口腔内崩壊錠に圧縮するステップとを含む。
【0055】
別の実施形態において、本発明の薬物粒子は、相分離によって水不溶性ポリマー(例えば、エチルセルロース)を含む第1のコーティングで被覆され、米国特許出願公開第2009/0202630号明細書に開示されるとおりの水不溶性ポリマーの胃溶性ポリマーとの約9:1〜約5:5の比の組み合わせにより流動層コーターにおいて第2のコーティングで被覆され、続いて圧縮性スクラロースで流動層コーティング法により被覆される。本発明のさらに別の実施形態において、薬物含有粒子は初めに、同時係属中の米国特許出願公開第2005/0232988号明細書(その全体があらゆる目的から参照により援用される)に従い全重量増加が約30%〜約60%w/wとなるよう相分離によって皮膜形成水不溶性ポリマー(例えば、エチルセルロース)で被覆される。第1のコーティングは、続いて圧縮性スクラロースで流動層コーティング法により被覆される。
【0056】
本発明の特定の他の実施形態において、薬物粒子は、米国特許出願公開第2006/0078614号明細書、米国特許出願公開第2006/0105038号明細書、及び米国特許出願公開第2006/0105039号明細書(これらの内容は本明細書によってあらゆる目的から参照により援用される)の開示に従い、水不溶性ポリマー(例えば、80%トルエン/20%アルコール中5%溶液として周囲温度で試験したときの平均粘度が10cpsのエチルセルロース)と、Eudragit EPO、カチオン性ポリマー、炭酸カルシウム又はコハク酸カルシウムなどの胃溶性細孔形成剤との組み合わせで流動層コーティング法により被覆することにより味がマスキングされる。これらの味がマスキングされた薬物粒子の各々は、さらに圧縮性スクラロースの膜で被覆される。
【0057】
本発明のさらに別の実施形態において、80%トルエン/20%アルコール中5%溶液として周囲温度で試験したとき平均粘度が100cpsのエチルセルロースを用いた温度誘起相分離法による約5%〜約20%w/wの重量増加となる水不溶性ポリマーのコーティングと、水不溶性ポリマー(例えば、平均粘度が10cps以上のエチルセルロース)を逆腸溶性ポリマーと組み合わせた外側コーティングとを有する高度に球形の薬物粒子に、米国特許出願公開第2009/0202630号明細書に従い前記第1のコーティングと第2のコーティングとの間に挟まれる香味料−甘味料の組み合わせの中間コーティングが提供され、それにより誤って被覆薬物粒子に歯が食い込んだ場合に薬物の味が知覚されることが回避される。この三重層は、さらに圧縮性スクラロースで被膜される。
【0058】
薬物粒子上に保護シールコーティング層として施される皮膜形成ポリマーは、任意の水溶性ポリマーを含み得る。好適な皮膜形成ポリマーの非限定的な例としては、水溶性、アルコール可溶性又はアセトン/水可溶性ヒドロキシプロピルメチルセルロース(HPMC;例えば、ColorconのOpadry(登録商標)Clear)、ヒドロキシプロピルセルロース(HPC;AqualonのKlucel(登録商標)LF)、及びポリビニルピロリドン(PVP)が挙げられる。薬物粒子上に適用される皮膜形成ポリマーの量は、約0.5%〜約5%、例えば約1%〜約3%の範囲、又は約2%w/wであり得る。
【0059】
本発明に従い薬物粒子の味をマスキングするのに有用な水不溶性ポリマーの代表的な例としては、エチルセルロース、ポリ酢酸ビニル(例えば、BASFのKollicoat SR#30D)、酢酸セルロース、酢酸酪酸セルロース、アクリル酸エチル及びメタクリル酸メチルをベースとする中性の共重合体、アクリル酸エステル及びメタクリル酸エステルとEudragit NE、RS及びRS30D、RL又はRL30Dなどの第四級アンモニウム基との共重合体が挙げられる。
【0060】
本発明に従い薬物粒子の味をマスキングするのに有用な胃溶性有機又は無機細孔形成剤の代表的な例としては、限定はされないが、炭酸カルシウム、リン酸カルシウム、カルシウムサッカリド、コハク酸カルシウム、酒石酸カルシウム、酢酸第二鉄、水酸化第二鉄、リン酸第二鉄、炭酸マグネシウム、クエン酸マグネシウム、水酸化マグネシウム、リン酸マグネシウムなど及びそれらの混合物が挙げられる。味がマスキングされた粒子を生成するための、水不溶性ポリマーの胃溶性有機又は無機細孔形成剤との比は、典型的には約95/5から約50/50まで、又はいくつかの実施形態では約85/15から65/35まで様々であってよく、厚さが被覆薬物粒子の約5重量%〜約50重量%、より詳細には約10重量%〜約60重量%である。
【0061】
別の実施形態では、細孔形成ポリマー材料は本質的に、アクリル酸又はメタクリル酸アミノアルキル、アクリル酸又はメタクリル酸ブチル、及びメタクリレートをベースとするターポリマーからなる。別の実施形態では細孔形成ポリマー材料は、メタクリル酸ジメチルアミノエチル、メタクリル酸ブチル、及びメタクリル酸メチルをベースとするターポリマーであってよく;及びさらに別の実施形態ではターポリマーは150,000の平均分子量を有し、単量体比がメタクリル酸メチルとN,N−メタクリル酸ジメチルアミノエチルとメタクリル酸ブチルとの1:2:1である。細孔形成ポリマー材料の例はEUDRAGITO(登録商標)Eシリーズのポリマー(例えば、EUDRAGITO(登録商標)E100又はEUDRAGITO(登録商標)EPO)である。このシリーズのポリマーはpKaが6.3であり、pHが5より低い胃液に対して可溶性である一方、pHが5.0より高い水及び緩衝溶液中では膨潤し、及び/又は透過性である。唾液は典型的には約6.7〜7.4のpH範囲である。胃溶性細孔形成ポリマーの別の例は、ポリ(ビニルアセタルジエチルアミノアセテート)、例えば三共株式会社、東京(日本)から入手可能なAEA(登録商標)である。一実施形態では、逆腸溶性ポリマーは、メタクリル酸ジメチルアミノエチル、メタクリル酸ブチル、及びメタクリル酸メチルをベースとするターポリマーである。別の実施形態ではターポリマーは150,000の平均分子量を有し、単量体比がメタクリル酸メチルとN,N−メタクリル酸ジメチルアミノエチルとメタクリル酸ブチルとの1:2:1である。味がマスキングされたラニチジンHCl薬物粒子を生成するための、水不溶性ポリマーの細孔形成ポリマー材料との比は、典型的には約95/5から約50/50まで様々であり得る。味マスキングコーティングの量は、味がマスキングされたラニチジン含有顆粒の重量で約5%〜約30%、又は約5%〜25%、約5%〜20%、約5%〜15%、約5%〜10%、約10%〜30%、約10%〜25%、約10%〜20%、約10%〜15%、約15%〜30%、約50%〜25%、約15%〜20%、約20%〜30%、約20%〜25%、又は約25%〜30%の範囲である。
【0062】
本明細書に記載される中間膜及び外側膜は1つ又は複数の可塑剤を含む。膜の可塑化に用いられ得る可塑剤の代表的な例としては、好ましくは以下のサブグループ:アセチル化モノグリセリド又はジグリセリド(例えば、Myvacet(登録商標)9−45)、モノステアリン酸グリセリン、トリステアリン酸グリセリン、三酪酸グリセリンからのグリセロール及びそのエステル、好ましくは以下のサブグループ:フタル酸ジブチル、フタル酸ジエチル、フタル酸ジメチル、フタル酸ジオクチルからのフタレート、好ましくは以下のサブグループ:アセチルクエン酸トリブチルエステル、アセチルクエン酸トリエチルエステル、クエン酸トリブチル、クエン酸アセチルトリブチル、クエン酸トリエチルからのシトレート、グリセロールトリブチレート;好ましくは以下のサブグループ:セバシン酸ジエチル、セバシン酸ジブチルからのセバケート、アジペート、アゼレート、ベンゾエート、クロロブタノール、ポリエチレングリコール、植物油、フマレート、好ましくはフマル酸ジエチル、マレート、好ましくはリンゴ酸ジエチル、オキサレート、好ましくはシュウ酸ジエチル、スクシネート、好ましくはコハク酸ジブチル、ブチレート、セチルアルコールエステル、マロネート、好ましくはマロン酸ジエチル、ヒマシ油(これは特に好ましい)、及び混合物が挙げられる。本発明の実施形態で使用されるとき、可塑剤は水不溶性ポリマーの約3重量%〜約30重量%を構成し得る。別の実施形態では、可塑剤は水不溶性ポリマーの10重量%〜約25重量%を構成する。さらに他の実施形態では、水不溶性ポリマーの重量に対する可塑剤の量は、約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、及び約30%である(全ての範囲及びその間の部分的範囲を含む)。当業者であれば、その1つ又は複数のポリマー及びコーティング系の性質(例えば、水性又は溶媒ベース、溶液又は分散体ベース)及び全固形分に基づいて可塑剤の種類を選ぶことが分かるであろう。さらに、本発明の特定の実施形態において、逆腸溶性ポリマーを含有する外側膜は粘着防止剤をさらに含む。粘着防止剤の代表的な例としては、タルク、ステアリン酸マグネシウムなどが挙げられる。
【0063】
本発明の口腔内崩壊性組成物は、崩壊剤と糖アルコール及び/又はサッカリドとを含む速分散性顆粒を含む。崩壊剤含有顆粒に好適な崩壊剤の非限定的な例としては、崩壊剤又はいわゆるスーパーディスインテグラント(super−disintegrant)、例えばクロスポビドン(架橋PVP)、デンプングリコール酸ナトリウム、架橋カルボキシメチルセルロースナトリウム、低置換度ヒドロキシプロピルセルロース、及びそれらの混合物を挙げることができる。速分散性顆粒中の崩壊剤の量は、速分散性顆粒の全重量の約1%〜10%、又は約5%〜10%の範囲であり得る(全ての範囲及びその間の部分的範囲を含む)。
【0064】
糖アルコールは水素化された形態の炭水化物であり、ここではカルボニル基(すなわち、アルデヒド又はケトン)が第一級又は第二級ヒドロキシル基に還元されている。本発明の口腔内崩壊性組成物の速分散性顆粒に好適な糖アルコールの非限定的な例としては、例えば、アラビトール、イソマルト、エリスリトール、グリセロール、ラクチトール、マンニトール、ソルビトール、キシリトール、マルチトール、及びそれらの混合物が挙げられる。用語「サッカリド」は用語「糖類」と同義語であり、グルコース、フルクトース、ラクトース、マルトース、トレハロース、及びリボースなどの単糖類;及びスクロース、ラクトース、マルトース、及びセロビオースなどの二糖類を含む。一実施形態において、本発明の組成物での使用に好適なサッカリドの非限定的な例としては、例えばラクトース、スクロース、マルトース、及びそれらの混合物を挙げることができる。別の実施形態において、速分散性顆粒は少なくとも1つの崩壊剤を糖アルコールとの組み合わせで含む。別の実施形態において、速分散性顆粒は少なくとも1つの崩壊剤をサッカリドとの組み合わせで含む。さらに別の実施形態において、崩壊剤含有顆粒は少なくとも1つの崩壊剤を糖アルコール及びサッカリドとの組み合わせで含む。速分散性顆粒中の糖アルコール及び/又はサッカリドの量は崩壊剤含有顆粒の全重量の約99%〜90%、又は約95%〜90%の範囲である(全ての範囲及びその間の部分的範囲を含む)。一実施形態において、糖アルコール及び/又はサッカリドの平均粒度は30μm以下、例えば約1〜30μm、約5〜30μm、約5〜25μm、約5〜20μm、約5〜15μm、約5〜10μm、約10〜30μm、約10〜25μm、約10〜20μm、約10〜15μm、約15〜30μm、約15〜25μm、約15〜20μm、約20〜30μm、約20〜25μm、又は約25〜30μmである。
【0065】
本発明の速分散性顆粒は任意の好適な方法により調製することができる。例えば、速分散性顆粒は、1つ又は複数の崩壊剤と1つ又は複数の糖アルコール及び/又はサッカリドとを高剪断造粒機において造粒し、流動層機器において、又は従来のオーブンのトレイ上で乾燥させることで、例えば速分散性微顆粒の形態の速分散性顆粒を生成することにより調製することができる。速分散性微顆粒はまた、米国特許出願公開第2005/0232988 A1号明細書(これはあらゆる目的から全体として参照により本明細書に援用される)に記載される方法によっても調製することができる。
【0066】
本発明の組成物は、患者の口腔内で好適な崩壊速度を提供して滑らかで美味な嚥下し易い薬物粒子含有懸濁液を形成するのに十分な量の速分散性顆粒及び/又は崩壊剤と糖アルコール及び/又はサッカリドとの混合物を含む。速分散性顆粒中の崩壊剤の量及び/又は本発明の組成物中における薬物に対する崩壊剤−糖アルコール/サッカリドの組み合わせの量は、好適な崩壊速度を提供するように、並びに薬物粒子を含有する滑らかで美味な嚥下し易い懸濁液を形成するように調整することができる。例えば、本発明の組成物は、約≦30秒(USP<701>崩壊試験法)のインビトロ崩壊速度を提供するのに十分な対薬物量の崩壊剤−糖アルコール/サッカリドの組み合わせを含む。
【0067】
速分散性顆粒の量又は味がマスキングされた薬物粒子に対する速分散性顆粒(すなわち、崩壊剤−糖アルコール/サッカリドの組み合わせ)の量は、望ましい崩壊速度、並びに味マスキング、舌触り及び後味を含めた望ましい官能特性に応じて様々であり得る。本発明の組成物中の速分散性顆粒の量は、約30%〜約90%の範囲、例えば約40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、及び約85%であり得る(全ての値、範囲、及びその間の部分的範囲を含む)。一実施形態において、速分散性顆粒の量は組成物の全重量の約60〜70%である。別の実施形態において、速分散性顆粒の量は約65重量%である。
【0068】
本発明の口腔内崩壊性組成物中における薬物を含む多重被覆粒子の1つ又は複数の集合の総量は、約5%〜約50%の範囲、例えば約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、約45%、及び約50%であり得る(全ての値、範囲、及びその間の部分的範囲を含む)。一実施形態において、本発明の口腔内崩壊性組成物中における味がマスキングされた薬物粒子の量は、口腔内崩壊性組成物の約30重量%である。
【0069】
いくつかの実施形態において、本発明のODT組成物中における味がマスキングされた薬物粒子の集合の、CRコーティングで被覆された粒子の集合との比は、約1:4から約1:1まで様々であり得る。1つ又は複数の味マスキング層(本明細書に記載されるとおりの)は、味マスキング方法の任意の好適な組み合わせ、例えば(1)コアセルベーション法、続いて流動層コーティング法、(2)流動層コーティング法、続いてコアセルベーション法、(3)コアセルベーション法、続いて2回の連続する流動層コーティング法、及び(4)流動層コーティング法、続いてコアセルベーション法、続いて流動層コーティング法により薬物粒子上に施すことができる。
【0070】
本発明の組成物は、1つ又は複数の薬学的に許容可能な香味剤をさらに含み得る。かかる香味剤の非限定的な例としては、例えば、錠剤重量を基準として最大約5%までの、チェリー、スペアミント、オレンジ、若しくは他の許容可能な果実香味料、又はチェリー、スペアミント、オレンジ、及び他の許容可能な果実香味料の混合物が挙げられる。加えて、本発明の組成物はまた、アスパルテーム、スクラロース、又は他の薬学的に許容可能な甘味料などの1つ又は複数の甘味料、又はかかる甘味料の混合物も、錠剤重量を基準として最大約2重量%まで含むことができる。さらに本発明の組成物は、1つ又は複数のFD&C着色料を、錠剤重量を基準として最大約0.2重量%〜約2重量%まで含むことができる。
【0071】
本発明の組成物はまた、崩壊剤含有顆粒(例えば、ラニチジンを含有する顆粒及び/又は速分散性の顆粒)中の崩壊剤に加え、追加的な崩壊剤も含むことができる。追加的な崩壊剤は、崩壊剤含有顆粒中に使用されるものと同じ崩壊剤であっても、又は異なる崩壊剤であってもよい。追加的な崩壊剤は本発明の組成物中に、錠剤重量を基準として最大約10%まで存在してもよい。
【0072】
本発明の組成物はまた、微結晶性セルロースなどの薬学的に許容可能な充填剤、例えばAvicel PH101、Avicel PH102、Ceolus KG−802、Ceolus KG−1000、Ceolus UF 711、Prosolv SMCC 50又はSMCC 90又は他の薬学的に許容可能な等級の微結晶性セルロース、並びにそれらの混合物も含むことができる。
【0073】
一実施形態において、本発明の口腔内崩壊性組成物は、水不溶性ポリマー(例えば、エチルセルロース)を含む味マスキング層と、それに続いて非ポリマー性甘味料の圧縮性コーティング層とでコアセルベート化した約25〜35%の薬物粒子、約60〜70%の速分散性顆粒(例えば、クロスポビドン及びマンニトールを含む);約5%の追加的な崩壊剤(例えばクロスポビドン);約5重量%〜15重量%の微結晶性セルロース、約0.5〜2.0%の1つ又は複数の香味料、及び約0.5%〜1%の甘味料(例えばスクラロース)を含む。さらに、速分散性微顆粒は、噴霧乾燥マンニトール、又はMerck KGaAから「Parteck(登録商標)200又は300」として市販される特別に加工されたマンニトール顆粒、BASFからの「Ludiplus(登録商標)(特別に加工されたラクトース顆粒)」及び「Ludiflash(登録商標)(特別に加工されたマンニトール顆粒)」、GalenIQ(登録商標)凝集イソマルトに部分的に置き換えられてもよい。
【0074】
本発明の特定の実施形態において、本方法は以下のステップを含み得る:
i.薬物粒子(例えば、結晶、薬物層がレイヤリングされたビーズ、顆粒、又はVector Freund(Iowa)のGranurexを使用する球形化の制御又は粉末レイヤリングによるペレット、平均粒度約400μm以下)の味を以下によりマスキングするステップ、すなわち(a)水不溶性ポリマー(例えば、平均粘度が100cpsのエチルセルロース)による、及び任意選択により微粉化炭酸カルシウムなどの無機又は有機細孔形成剤との組み合わせでの、約10%w/w〜約40%w/wの重量増加とする溶媒コアセルベーション、又は(b)同時係属中の2005年8月26日に出願された米国特許出願第11/213,266号明細書(米国特許出願公開第2006/0105038号明細書)、2005年8月26日に出願された米国特許出願第11/256,653号明細書(米国特許出願公開第2006/0105039号明細書)、又は2005年10月12日に出願された米国特許出願第11/248,596号明細書(米国特許出願公開第20060078614号明細書)(これらの内容はあらゆる目的から参照により援用される)の開示に従う、水不溶性ポリマー(例えば、エチルセルロース)による約10%w/w〜約20%w/wの重量増加とする溶媒コアセルベーションと、それに続く水不溶性ポリマー(例えば、エチルセルロース)の胃溶性細孔形成剤(例えば、炭酸カルシウム)との組み合わせによる流動層コーティング、及び(c)非ポリマー性圧縮性甘味料(例えば、スクラロース)による圧縮性コーティングの適用、スクラロースなどの非ポリマー性圧縮性コーティング材料を含む圧縮性コーティングによる、味がマスキングされた薬物粒子のさらなる被覆;
ii.マンニトールなどの糖アルコール又はラクトースなどのサッカリドとクロスポビドンとの粉末混合物を、例えば欧州特許第0914818号明細書及び同時係属中の2004年4月19日に出願された米国特許出願第10/827,106号明細書(米国特許出願公開第2005/0232988号明細書)(これらの内容は本明細書によって参照により援用される)の開示を使用して造粒するステップであって、それにより速分散性微顆粒を生成するステップ;
iii.ステップ(i)の味がマスキングされた薬物粒子と、ステップ(ii)の速分散性微顆粒と、他の薬学的に許容可能な賦形剤との適量をブレンドするステップ;及び
iv.口腔内で唾液と接触すると急速に崩壊して滑らかな嚥下し易い懸濁液を形成し、且つ90%信頼区間80.0%〜125.0の範囲の薬物動態パラメータを呈し得る前記薬物の必要用量を含む口腔内崩壊錠となるように、米国特許第6,964,779号明細書及び米国特許第5,700,492号明細書(これらは各々、全体として参照により援用される)の開示に従いステップ(iii)のブレンド物を圧縮するステップ。
【0075】
本発明の、味がマスキングされた組成物の調製方法の一実施形態は、以下を含む:
a.第1のコーティングステップ、これは、流動層コーターで薬物粒子(例えば、結晶、薬物層がレイヤリングされたビーズ、顆粒、又はVector Freund(Iowa)のGranurexを使用する球形化の制御又は粉末レイヤリングによるペレット、平均粒度約400μ以下)を水不溶性ポリマー、腸溶性ポリマー、又は脂肪酸及び/又はエステルで2重量%〜50重量%の重量増加となるよう被覆するステップを含む;
b.第2の任意選択のコーティングステップ、これは、ステップ(a)の前記被覆薬物粒子を、水不溶性ポリマーと腸溶性ポリマーとを含む第2のポリマーコーティング材料で10重量%〜40重量%の重量増加となるよう被覆し、それにより制御放出性コーティングで被覆された薬物粒子を形成することを含む;及び
c.非ポリマー性甘味料(例えば、スクラロース、ラクチトール、又はマルチトール)による2重量%〜10重量%の重量増加とする外側圧縮性コーティング、これにより圧縮性コーティングで被覆された制御放出性(CR)薬物含有微粒子が形成される。
【0076】
ポリマー材料は、前記マイクロカプセルに対して約10重量%〜約30重量%の前記第1又は第2の膜を含み得る。
【0077】
本発明の特定の実施形態において、本方法は以下のステップを含み得る
i.水不溶性ポリマー(例えば、平均粘度が100cpsのエチルセルロース)による約4〜8%w/wの重量増加とするコアセルベーション法により、薬理活性薬物又はその薬学的に許容可能な塩、溶媒和物、エステル及び/又は混合物の薬物含有微粒子を調製するステップ;
ii.ステップ(i)の薬物粒子上にポリマー結合剤溶液から低用量成分(例えば、ヒドロコドンなどのオピオイド鎮痛薬)をレイヤリングするステップ;
iii.前記オピオイドコーティングで被覆された薬物粒子を覆って配置して、親水性ポリマーを単独で又は水不溶性ポリマーとの組み合わせで含む第2の味マスキング層を、2010年5月3日に出願された米国特許出願第12/772,770号明細書又は2010年5月3日に出願された米国特許出願第12/772,776号明細書(これらの内容は本明細書によってあらゆる目的から全体として参照により援用される)の開示に従い施すステップ;及び
iv.外側圧縮性コーティングを、非ポリマー性甘味料(例えば、スクラロース、ラクチトール、又はマルチトール)により2重量%〜10重量%の重量増加となるよう施すステップであって、それにより味がマスキングされた薬物粒子を打錠する間の膜の破断を最小限に抑えるステップ。
【0078】
本発明の特定の他の実施形態において、本方法は以下のステップを含み得る:
i.上記に記載したとおりの平均粒度が400μm以下の粒子を含有する圧縮性コーティング被覆CR薬物を調製するステップ;
ii.マンニトールなどの糖アルコール又はラクトースなどのサッカリドとクロスポビドンなどのスーパーディスインテグラント(super disintegrant)との粉末混合物を造粒するステップであって、それにより速分散性微顆粒を生成するステップ;
iii.ステップ(i)のCRコーティング被覆薬物粒子と、ステップ(ii)の速分散性微顆粒及び/又は他の薬学的に許容可能な賦形剤、例えば、1つ又は複数の香味剤、着色料、甘味料、希釈剤/充填剤/圧縮助剤、例えば微結晶性セルロースなど、噴霧乾燥ラクトース、及び追加的な崩壊剤などとの適量をブレンドするステップ;及び
iv.ステップ(iii)のブレンド物を、薬剤を必要とする患者又は対象への経口投与に必要な用量の薬物を含む口腔内崩壊錠又は速分散錠に圧縮するステップ。このように生成されたODT錠剤は、口腔内で唾液に接触すると急速に崩壊して滑らかな嚥下し易い懸濁液を形成し得る。速分散錠は水又は体液に接触すると急速に分散し、消化されると望ましい薬物動態パラメータを呈する。
【0079】
一実施形態において、第1のコーティングステップは、(i)水溶性ポリマーを極性及び/又は非極性有機溶媒混合物と混合して前記ポリマーを溶解させること、及び前記薬物粒子を望ましい流動化生成物層温度に維持しながら前記薬物粒子上にコーティングを施すことを含み、及び前記第2のコーティングステップは、(i)前記第1の被覆薬物粒子を第1の水不溶性ポリマー(エチルセルロース)及び非極性有機溶媒(シクロヘキサン)及び相誘導剤(phase inducer)(ポリエチレンワックス)と混合して前記薬物粒子−ポリマー混合物を形成すること;(ii)前記薬物粒子−ポリマー混合物を第1の温度で加熱し、それにより前記第1のポリマー材料を前記非極性有機溶媒中に溶解させること;(iii)前記薬物粒子−ポリマー混合物を撹拌しながら時間をかけて第2の温度に冷却し、被覆薬物粒子の分散体を形成すること;(iv)前記被覆薬物粒子を回収すること;及び(v)非ポリマー性圧縮性材料(例えば、スクラロース)の圧縮性コーティングを乾燥させた前記被覆薬物粒子上に施すことを含む。別の実施形態では、この製造工程に、圧縮性コーティングを施す前に流動層コーターで前記コアセルベート化した第1のポリマー被覆薬物粒子に香味料−甘味料コーティング組成物を施すさらなるステップが含まれてもよい。さらに別の実施形態では、この全製造工程に、圧縮性コーティングの前に流動層コーターで前記香味料被覆薬物粒子に第2のコーティング組成物を施すさらなるステップが含まれてもよい。
【0080】
一実施形態において、上記に記載したとおりの前記第1のコーティングを有する薬物粒子は第2のコーティングでさらに被覆され、これは(i)水不溶性ポリマー(エチルセルロース)、逆腸溶性ポリマー(Eudragit E100)、可塑剤(クエン酸トリエチル)を非極性溶媒と混合して溶解させるステップと、(ii)粘着防止剤(タルク又はステアリン酸マグネシウム)を均一に懸濁するステップと、(iii)一個ずつ被覆された薬物粒子上に、前記一個ずつ被覆された薬物粒子を望ましい生成物温度に維持しながら、且つ前記薬物粒子の凝塊形成を回避するよう適切に流動化された状態で噴霧するステップと、(iv)前記被覆薬物粒子上に圧縮性コーティングを施すステップと、により行われる。別の実施形態では、この全製造工程に、流動層コーターで前記第1のポリマー被覆薬物粒子上に香味料−甘味料コーティング組成物を施すさらなるステップが含まれてもよい。
【0081】
別の実施形態において、流動層コーターで施される第1及び第2の双方のコーティングステップには、約2%〜約20%w/wの増加量となるように施される水不溶性ポリマーと任意選択の水溶性又は逆腸溶性ポリマーとを含む第1の膜と、被覆薬物粒子の最大約40重量%の全重量増加となるように施される水不溶性ポリマーを腸溶性ポリマーと組み合わせて約9:1〜約1:4の比で含む第2の膜と、それに続く圧縮性コーティングとが含まれる。
【0082】
別の実施形態において、本発明の組成物の調製方法はまた、非ポリマー性圧縮性コーティング材料(例えば、スクラロース)で被覆される被覆薬物粒子、すなわち持続放出性(SR)、遅延放出性(DR)、時限パルス放出性(TPR)及び/又は制御放出性(SRコーティング又はDRコーティング上のTPRコーティング)ビーズを生成するための被覆ステップも含む。本発明の組成物の味がマスキングされた及び/又は制御放出性コーティングで被覆された薬物粒子は様々な方法により調製することができ、例えば、エチルセルロースなどの水不溶性ポリマーによる、若しくは水不溶性ポリマーの胃溶性細孔形成剤との組み合わせによる溶媒コアセルベーション法、又は水不溶性ポリマー、腸溶性ポリマー、逆腸溶性ポリマー、及びその混合物による流動層コーティング法が挙げられる。マイクロカプセル化された薬物粒子のコーティング重量は、約5%〜約50%の範囲、例えば、約10%、15%、20%、25%、30%、35%、40%、及び45%であり得る(全ての範囲及びその間の部分的範囲を含む)。
【0083】
或いは、薬物粒子は初めに、流動層コーターにおいて、水不溶性ポリマー(例えばエチルセルロース)又は腸溶性ポリマー(例えばフタル酸ヒプロメロース)と有機溶媒とを含む溶液、及び/又は水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含む溶液により約10%〜約50%w/wの重量増加となるよう被覆される。水不溶性ポリマーの腸溶性ポリマーとの比は、約50/50〜95/05の範囲、例えば、約55/45、約60/40、約65/35、約70/30、約75/25、約80/20、約85/15、及び約90/10であり得る(全ての範囲及びその間の部分的範囲を含む)。マイクロカプセル化された薬物粒子のコーティング重量は、約5%〜約30%の範囲、例えば、約10%、15%、20%、及び25%であり得る(全ての範囲及びその間の部分的範囲を含む)。かかる制御放出性コーティングの被覆プロセスの例は、米国特許第6,627,223号明細書;米国特許第6,500,454号明細書;米国特許第7,387,793号明細書及び同時係属出願の米国特許出願公開第2006/0246134号明細書;米国特許出願公開第2007/0190145号明細書;米国特許出願公開第2007/0196491号明細書;米国特許出願公開第2009/0232885号明細書;米国特許出願公開第2009/0258066号明細書;国際公開第2010/096820号パンフレット;国際公開第2010/096814号パンフレット)(これらの内容はあらゆる目的から全体として参照により本明細書に援用される)に開示されている。これらのCRコーティング被覆薬物粒子は、非ポリマー性圧縮性甘味料(例えばラクチトール)を含む最外層の圧縮性コーティングでさらに被覆される。
【0084】
球形化の制御又は粉末レイヤリングによるVector CorporationのGranurex(商標)又は同等の機器(例えば、回転式造粒機)を使用して生成された高薬物負荷ペレットを含む、本発明の快い味を呈する口腔内崩壊錠又は速分散錠(すなわち、ODT又はRDT)製剤を生成する方法の一実施形態は、(i)医薬品有効成分、任意選択の流動助剤(W.R.GraceのコロイドシリカSyloid)、及び任意選択の結合剤(例えば、PVP K−30)をGranurexボウルに装入するステップと、(ii)10%結合剤溶液を回転している材料層に制御された速度で噴霧すると同時に、粉末レイヤー(powder layer)(K−Tron)でユニット内に粉末を制御された速度で加え、ペレットの形態の混合粉体を結合させるステップと、(iii)このように生成したペレットを乾燥させるステップと、(iv)前記ペレット上に1つ又は複数の味マスキング膜又はCRコーティング膜を施し、続いて非ポリマー性圧縮性材料の圧縮性コーティングを施すステップと、(v)崩壊剤、糖アルコール及び/又はサッカリドを含む速分散性顆粒を調製するステップと、(vi)経口剤形を形成するステップとを含む。経口剤形をODT又はRDTとして形成するステップは、例えば、前記圧縮性コーティングで被覆された、味がマスキングされた微粒子又はCR薬物を含有する微粒子と、前記速分散性顆粒及び/又は充填剤とを含むブレンド物を、任意選択により薬学的に許容可能な1つ以上の矯味剤、1つ以上の甘味料、1つ以上の他の崩壊剤、1つ以上の着色料及び/又は微結晶性セルロースなどの圧縮助剤と共に十分な分量で、錠剤成形機、例えば圧縮前に杵及び臼を潤滑させる外部潤滑システムを備えた回転式錠剤成形機を使用して、口腔内崩壊錠又は速分散錠形態に圧縮するステップを含み得る。これらの口腔内崩壊錠は、口の中で唾液に曝露されると急速に崩壊し、ざらついた後味のない滑らかな嚥下し易い懸濁液になる。速分散錠は、薬剤を必要とする対象又は患者において疾患状態の治療のため、投与様式−(1)錠剤を丸ごと嚥下する、(2)錠剤を2つに半割して個別に嚥下する、及び(3)錠剤を約150mLの水に分散させ、かき混ぜて飲む−のうちの一つによって経口投与するのに好適である。
【0085】
別の実施形態において、本発明の方法は、圧縮性コーティングで被覆された、味がマスキングされた微粒子又はCRコーティングで被覆された微粒子と、1つ又は複数の香味剤と、甘味料と、速分散性微顆粒と、微結晶性セルロースと、追加的な崩壊剤と、ステアリン酸マグネシウムとを混合し、従来の回転式錠剤成形機を使用してその混合物を口腔内崩壊錠に圧縮することによる、口腔内崩壊錠の調製ステップを含む。これにより形成された口腔内崩壊錠は、以下を提供し得る:口腔内で唾液に接触したときの急速な崩壊、快い味(良質なクリーム様の口当たり)、及び胃内での急速で実質的に完全な用量放出又は患者体内での1つ又は複数の疾患状態の治療に望ましい目標放出又は血漿濃度−時間プロファイル。
【0086】
別の実施形態において、本発明の方法は、圧縮性コーティングで被覆された、圧縮性コーティングで被覆された、味がマスキングされた微粒子又はCRコーティングで被覆された微粒子と、1つ又は複数の充填剤/希釈剤(例えば、噴霧乾燥ラクトース(例えば、Fast Floラクトース)と、微結晶性セルロースと、噴霧乾燥マンニトールと、Ludiplus(登録商標)(顆粒化ラクトース)と、Ludiflash(登録商標)(顆粒化マンニトール)と、Parteck(登録商標)200/300(加工マンニトール)と、追加的な崩壊剤と、ステアリン酸マグネシウムとを混合し、従来の回転式錠剤成形機を使用してその混合物を速分散錠に圧縮することによる、速分散錠の調製ステップを含む。これにより形成された速分散錠は、以下を提供し得る:水又は体液に接触したときの急速な分散、及び胃内での急速で実質的に完全な用量放出又は望ましい目標放出プロファイル。
【0087】
理論及び/又は作用機序に拘束されるものではないが、前記被覆薬物粒子(すなわち、味がマスキングされた、又は制御放出性コーティングで被覆された苦味を呈する薬物コア)上に配置される圧縮性コーティングにより、以下を実現することが可能となる−(i)前記圧縮ブレンド物をODT又はRDTに打錠する間の膜の破断を最小限に抑え/解消する、(ii)口腔内で唾液に接触したときに薬物の苦味(biiter)が知覚されることを最小限に抑え/解消する、(iii)前記ODT又はRDT製剤の前記制御放出性コーティングで被覆された薬物粒子からの同様のインビトロ−インビボ放出プロファイル、及び(iv)場合によっては、前記圧縮性コーティングが存在しない場合に有効な味マスキングを達成するのに必要な被覆レベルを低下させる。
【0088】
インビトロ崩壊時間/溶解試験
崩壊時間はUSP<701>崩壊試験手順を用いて計測される。味がマスキングされた、及び/又はCRコーティングで被覆された微粒子及び口腔内崩壊錠の味マスキング特性は、必要であれば監督のもと、承認されたプロトコルにより健常ボランティアパネルを使用して評価されてもよい。例えば、pHが約6.8〜7.0の500mLの模擬唾液中においてUSP装置2(パドル、50rpm)を使用して溶解試験を行ったときの薬物放出率(約3分間で約10%以下の用量放出が許容範囲と見なされる)が決定される。加えて、薬物放出率を決定することにより、37.0±0.5℃で900mLの0.01N HCl中においてUSP装置2(パドル、50rpm)を使用して溶解試験を行ったときの、味がマスキングされた微粒子及び口腔内崩壊錠の胃内急速放出特性が評価され得る(塩酸ラニチジンの場合には、約30分間で約70%以上の用量放出が許容範囲と見なされる)。米国薬局方装置1(バスケット、100rpm)又は装置2(パドル、50rpm)、薬物毎に特別に開発されたHPLC法を使用して、錠剤の効力並びにCRコーティング被覆薬物粒子及びODT CR又はRDT CR製剤の薬物放出プロファイルが決定される。
【0089】
その様々な実施形態において、圧縮性コーティングで被覆された、味がマスキングされた微粒子及び/又はCR微粒子を含む本発明の口腔内崩壊錠組成物は、以下の特性の1つ又は複数を示す:
(1)ボトル及びプッシュスルー又は剥離式背面台紙ブリスターパッケージングへの包装、保管、輸送及び商品流通に好適な許容される硬度及び摩損度;
(2)口腔内で唾液に接触すると約60秒で崩壊し、快い味の(ざらつき又は後味のない)滑らかな嚥下し易い懸濁液を形成し、<USP 701>崩壊試験法で30秒以下の規格を満たす;
(3)味がマスキングされた及び/又はCRコーティングで被覆された薬物粒子が滑らかな舌触りを呈し(ざらつきがない)、且つ後味を呈しない;及び
(4)USP装置2(パドル、75rpm)を使用して溶解試験を行ったとき、900mLの0.01N HCl緩衝液中約45分間で用量の約85%の溶解規格を満たすことから明らかなとおり、胃に入ると、味がマスキングされた薬物粒子からの急速で実質的に完全な用量放出をもたらす、及び/又はUSP装置2(パドル、50rpm、最初の2時間について700mLの0.1N HCl中、続いて900mLの緩衝液中pH6.8でさらに試験)を使用して溶解試験を行ったとき薬物放出規格を満たすことから明らかなとおり、1つ以上の望ましい(目標)放出プロファイルを提供する。
【0090】
その様々な実施形態において、圧縮性コーティングで被覆された、味がマスキングされた微粒子及び/又はCR微粒子を含む本発明の速分散錠組成物は、以下の特性の1つ又は複数を示す:
(5)ボトル及びプッシュスルー又は剥離式背面台紙ブリスターパッケージングへの包装、保管、輸送、商品流通、及び最終使用に好適な許容される硬度及び摩損度;
(6)水又は体液に接触すると急速に分散し、それにより1つ又は複数の疾患状態を治療するため3つの投与様式のうちの1つにより患者又は対象に経口投与することが可能である;
(7)味がマスキングされた及び/又はCRコーティングで被覆された薬物粒子が、RDTに高速圧縮する間の膜の破断に抵抗性を示す;及び
(8)USP装置2(パドル、75rpm)を使用して溶解試験を行ったとき、900mLの0.01N HCl緩衝液中約45分間で用量の約85%の溶解規格を満たすことから明らかなとおり、胃に入ると、味がマスキングされた薬物粒子からの急速で実質的に完全な用量放出をもたらす、及び/又はUSP装置2(パドル、50rpm、最初の2時間について700mLの0.1N HCl中、続いて900mLの緩衝液中pH6.8でさらに試験)を使用して溶解試験を行ったとき薬物放出規格を満たすことから明らかなとおり、1つ以上の望ましい(目標)放出プロファイルを提供する。
【0091】
本発明の組成物は、胃腸障害、心血管疾患、中枢神経系疾患、糖尿病、アルツハイマー病又はパーキンソン病、統合失調症、精神病、癲癇、うつ病、双極性障害、感染症、肥満症、又は炎症性障害などの病態の治療又は予防に有用である。本発明の組成物は、必要量の1つ以上の薬物を、疾患状態の重症度及び、及び/又は患者の健康状態に応じた望ましい血漿濃度−時間プロファイルを提供する適切な比で含み得る。例えば、本発明の組成物は、例えば病態の重症度及び患者の健康状態に応じて、単一の1日量、又は複数の1日量で投与することができる。
【0092】
以下の非限定的な例は、圧縮性コーティングで被覆された、味がマスキングされた微粒子及び/又はCR薬物を含有する微粒子を含む本発明の組成物、又は口腔内崩壊錠若しくは速分散錠剤形を例示し、ここで組成物は、圧縮性コーティングで被覆された薬物、又はその薬学的に許容可能な塩、異性体、エステル、及び/又は混合物を含む。本発明の組成物は本明細書に記載されるとおり調製され、許容される官能又は容易な経口投与様式及び/又は打錠の特性並びに意図した投与レジメンに応じた摂取時の望ましい薬物動態プロファイルを示す。
【実施例】
【0093】
実施例1
1.A アセトアミノフェンを含むマイクロカプセル:工業規模の200ガロン、500ガロン又は1000ガロンシステムを使用する工業規模のアセトアミノフェンマイクロカプセルの生成は、プロセスにコンピュータ処理されたレシピ(例えば、6%コーティングでの200ガロンシステムに対する分量−アセトアミノフェン(APAP):94.1kg;Ethocel 100:10.5kg、Epolene:2.1kg及びシクロヘキサン:142ガロン)を使用する。タンクを約107±5rpmで撹拌しながら予め定義した加熱プロファイルにより約80℃に加熱し、続いて制御しながら周囲温度の35℃NMT(以下)に冷却する。マイクロカプセル層を真空ろ過に供し、シクロヘキサンでリンスして残留ポリエチレンを洗い流す。マイクロカプセルを流動層乾燥機に移し、段階的な乾燥レシピ(例えば、入口温度設定25℃、35℃及び最後に99℃)に供し、4〜6時間にわたり乾燥させてシクロヘキサンレベルを1000ppm以下に低下させる。乾燥したマイクロカプセルを16MGメッシュスクリーンで篩別して、形成された場合には大きい凝集体を廃棄する。同じ手順の後、10%EC−100コーティングのマイクロカプセルのバッチを500ガロンシステム(単一のタンク)において溶媒コアセルベーション法によって調製した。
【0094】
1.B 味がマスキングされた、ヒドロコドン層をレイヤリングしたアセトアミノフェンマイクロカプセル:酒石酸水素ヒドロコドン(HCB)(240g)をヒドロキシプロピルセルロースの水溶液(2400gの水中26.7gのヒドロキシプロピルセルロース(Klucel LF)に徐々に添加し、十分に混合して溶解させた。上記ステップ1.Aの6重量%(3733.3g)のアセトアミンフェン(acetaminphen)のマイクロカプセルを、Glatt流動層コーターGlatt GPCG 5(9インチボトムスプレーワースターインサート、35mmカラム高さ、「D」空気分配プレート、及び200メッシュ生成物保持スクリーンを装備)において以下の条件下で薬物レイヤリング製剤により被覆した−入口空気温度:60±3℃;生成物温度:40±5℃;噴霧空気圧力2.0バール;ポート径:1.0mm;流量:8mL/分 段階的に26mL/分まで増加させる、空気量:50±5CFM。薬物をレイヤリングした後、ヒドロキシプロピルセルロース(10%固形分で50/50アセトン/水中210.5g、各1650g)のシールコーティング/味マスキング溶液を、薬物層をレイヤリングしたビーズ上に5%の重量増加となるよう噴霧した。乾燥させたIR薬物粒子を35メッシュ及び80メッシュスクリーンで篩別して過大なサイズの微粒子及び微粉を廃棄した。
【0095】
1.C 圧縮性コーティングで被覆されたヒドロコドン/アセトアミノフェンマイクロカプセル:上記ステップ1.Bのヒドロコドン/アセトアミノフェンマイクロカプセル(3400g)を、ボトムスプレーワースターインサートを装備したGlatt GPCG 5において、水(1014g)中に溶解したスクラロース(179g)を含有する圧縮性コーティング配合物で5%の重量増加となるように、以下の処理条件で被覆した:−8mL/分の噴霧速度、段階的に15mL/分まで増加させる;生成物温度32±2℃。被覆完了後、圧縮性コーティング被覆薬物粒子はユニットで約5分間乾燥させて残留水分を最小限に抑え、微粉及び二倍の大きさのもの(double)が形成された場合には篩別してそれらを廃棄する。
【0096】
1.D 速分散性顆粒:速分散性微顆粒は、マンニトールなどの糖アルコール及び/又はラクトースなどのサッカリドと、クロスポビドンなどの崩壊剤とを含む。糖アルコール及び/又はサッカリド及び崩壊剤は、典型的には速分散性微顆粒中に約99:1〜約90:10(糖アルコール及び/又はサッカリド対崩壊剤)の比で存在し得る。例えば、約95/5の比の、平均粒度が約15μmの糖アルコールであるD−マンニトールと、スーパーディスインテグラント(super disintegrant)であるクロスポビドンXL−10とを、高剪断造粒機において造粒液として精製水を使用して造粒し、湿式粉砕し、トレイ乾燥オーブンにおいて1重量%未満のLODとなるよう乾燥させ、乾式粉砕して平均粒度が約200〜400μmの速分散性顆粒を生成した。
【0097】
1.E ヒドロコドン/アセトアミノフェンODT:微結晶性セルロース(MCC)、スクラロース、崩壊剤、及び香味料(ODT製剤の組成については表1を参照のこと(例えば、配合A〜D)をVブレンダーでブレンドした。この予備ブレンド物と、上記ステップ1.C及び1.Aの味がマスキングされたヒドロコドン/アセトアミノフェンマイクロカプセル(10%EC−100コーティングのアセトアミノフェン)の必要量と、ステップ1.Dの速分散性微顆粒の必要量とを、Vブレンダーで30分間混合してブレンド物の均質化を達成し、重量約1400mgの500mgアセトアミノフェンOTDに圧縮した。各圧縮サイクル前に杵及び臼の表面を潤滑させるための外部潤滑装置であるMatsui Ex−Lub Systemを装備したHata錠剤成形機で配合A、B、及びDを圧縮した一方、圧縮混合物Cはステアリルフマル酸ナトリウムとブレンドしてからHata成形機で圧縮した。配合A〜Dは、それぞれ5mg、5mg、25mg及び34mgの酒石酸水素ヒドロコドンからなる。表1に示されるとおり、ポリマー圧縮性コーティング材料(例えば、ヒドロキシプロピルセルロース(Klucel LF))で被覆されたヒドロコドン/アセトアミノフェンマイクロカプセル及び/又は疎水性味マスキング層を覆って配置された圧縮性コーティング層を有しないアセトアミノフェンマイクロカプセルに代わり、圧縮性コーティングで被覆されたヒドロコドン/アセトアミノフェンマイクロカプセルの割合が増加すると、打錠特性が向上し、すなわち錠剤硬度が増加したとともに摩損度が低下し、予期されたとおり、より低い圧縮力であっても打錠性が向上した錠剤を圧縮することができた。

【0098】
実施例2
2.A 5ガロン溶媒システムにおけるマイクロカプセル化:塩酸ラニチジン(望ましい粒度/アスペクト比の規格を満たすShasun Drugs and ChemicalsのForm II)を、トップスプレーを装備したGlatt GPCG 1(VersaGlatt)において、4%固形分のOpadry Clear(ヒプロメロース)水溶液で2%w/wの重量増加となるよう流動層コーティング法により被覆した。噴霧条件−ポート径:0.8mm;噴霧空気圧力:1.5バール;ボトム空気分配プレート:造粒プレート;入口空気温度:60℃;生成物温度:28〜34℃;噴霧速度:5mL/分、出口フラップ:40%;及び振盪間隔/時間:30秒/3秒。流動層コーティング法で被覆したラニチジンについて、5ガロンシステムで溶媒コアセルベーション法により味をマスキングした。10,000gのシクロヘキサンを充填した5ガロンシステムに、エチルセルロース(Dow ChemicalsのEthocel Standard Premium 100;200g)、ポリエチレン(Epolene C−10;200g)、及び薬物(466.7g)を装入した。システムを制御された加熱サイクルに供して80℃の温度を達成し、300RPMの速度で内容物を撹拌しながらエチルセルロースを溶解した。その後、システムを45分間以上で<30℃まで冷却サイクルに供し、薬物結晶を滑らかなコーティングにより、30重量%で、且つ凝集塊が形成されないようにして包み込んだ。マイクロカプセルをデカンテーションにより分離し、新鮮なシクロヘキサンで洗浄し、フード内で乾燥させた。30メッシュ(<590μm)スクリーンで篩別したマイクロカプセルを収集した。流動層コーティング法で被覆されたラニチジンの一つのバッチもまた、8:3の比のEthocelと無機胃溶性細孔形成剤の微粉化炭酸カルシウムとで、冷却サイクル中に約58℃のタンク温度で微粉化細孔形成剤を含有するスラリーを均一に分散させることによりマイクロカプセル化した。
【0099】
2.B 圧縮性コーティングで被覆されたラニチジンマイクロカプセル:上記ステップ2.Aのラニチジンマイクロカプセル(EC−100被覆、3401g)をGlatt GPCG 5においてステップ1.Cに記載する手順に従い、水(1014g)中に溶解したスクラロース(179g)を含む圧縮性コーティング配合物で5%の重量増加となるよう被覆する。上記ステップ2.Aのラニチジンマイクロカプセル(EC−100/CaCO3被覆、3401g)もまた、Glatt GPCG 5において、水(1014g)中に溶解したスクラロース(179g)を含む圧縮性コーティング配合物で5%の重量増加となるよう被覆する。
【0100】
2.C 圧縮性コーティングで被覆したラニチジンマイクロカプセルを含むODT:上記ステップ2.Aからの味がマスキングされた被覆ラニチジン薬物粒子(24〜33%w/wのEC−100及びEC−100/CaCO3)と、速分散性顆粒(68〜55%w/w)と、崩壊剤(5%w/w)と、甘味料(0.1〜0.5%w/w)と、香味料の組み合わせ(0.5〜3.5%w/w)と、MCC(0〜10%w/w)と、着色料(0.1〜0.3%w/w)とを合わせてVブレンダーでブレンドし、150mg(ラニチジンを基準として)のODTに圧縮した。これらの錠剤は、許容可能な官能特性及び溶解プロファイルを有した。圧縮性コーティングで被覆したマイクロカプセル(EC−100又はEC−100/CaCO3被覆)もまたODTに圧縮する。

【0101】
実施例3
3.A ジフェンヒドラミンHCl IRビーズ:プロペラミキサーを装備した床置きステンレス鋼製タンクに300kgのアセトンNFを充填した。タンクを約850rpm±25rpmで撹拌しながらタンクに精製水USP(93.3kg)を徐々に添加した。タンクに塩酸ジフェンヒドラミン(76.5kg)を徐々に添加して溶解させ、続いて8.42kgのKlucel LFを同じタンクに添加して溶解させ、その間継続的に撹拌を続けた。86.4kgのアセトン及び9.6kgの水が入った別のステンレス鋼製タンクにヒドロキシプロピルセルロース(Klucel LF;6.12kg)を徐々に添加して溶解させた。60〜80メッシュ球状糖(215kg)を、32インチボトムスプレーワースターインサートを装備した予熱済みのGlatt流動層コーターGPCG 120に装入した(3 23.75インチ高さ;インナーボトム空気分配プレート:G1;外側プレート:C1;生成物保持プレート:100メッシュスクリーン;ノズル先端ポート径:50mm;処理空気温度:70℃;処理空気量:1500CFM;噴霧速度:1500(範囲:200〜2000)g/分;生成物温度:49〜51℃)。バッチレシピは300g/分での薬物レイヤリングステップで自動的に進み、それに合わせて流量及び入口温度が上昇し得る。処理パラメータは(最低)約30分毎に記録した。サンプルポートを介して生成物を定期的に検査し、噴霧中に凝集が起きていないことを確認した。薬物レイヤリング溶液の噴霧が終わると、300g/分の噴霧速度で2%重量増加となるようシールコーティングを施した。シールコーティングの完了後、ビーズをユニット内で乾燥させて余分な残留アセトンを除去した。このように生成したIRビーズを#32メッシュ及び#80メッシュスクリーンで篩別し、過大及び過小なサイズのビーズを廃棄した。
【0102】
3.B ジフェンヒドラミンHCl IRビーズの味マスキング:それぞれのタンクを備える二槽タンク500ガロンコアセルベーションシステムに、415ガロンのシクロヘキサン、61.5kgの塩酸ジフェンヒドラミンIRビーズ、20.5〜25.1kgのエチルセルロース及び10〜25kgのポリエチレンを75±5rpmで撹拌しながら装入した。このシステムをコンピュータ制御された「加熱及び保留」サイクルに供することにより、タンクの内容物を約80℃に加熱してエチルセルロースを完全に溶解させ、その後「フィルタ及び流動層乾燥」ルーチンに供することにより、タンクの内容物を約30℃に冷却した。温度が約65℃を下回るとエチルセルロースはそれ以上シクロヘキサンに溶けず、析出し始める。その間、相誘導剤(phase inducer)のポリエチレンで促進すると、エチルセルロースが個々の薬物粒子を被覆して味マスキングをもたらす。周囲温度に冷却した後、このように形成されたマイクロカプセルを真空ろ過し、新鮮なシクロヘキサンでリンスし、流動層機器において真空乾燥して所定の残留溶媒レベルを達成した。乾燥させたマイクロカプセルを、Kasonの篩装置を使用して40メッシュスクリーンで篩別し、ポリエチレン袋が二重に内張りされたファイバードラムに廃棄した。このようにして得られたマイクロカプセルは約18.4〜19.4%のアッセイを有し、10%以下が40メッシュ篩に残り、且つ10%以下が80メッシュ篩を通過する粒度を示し、及び75rpmで水中において溶解試験を行ったとき、5分で約11〜22%、45分で約62〜70%の平均溶解度を示した。
【0103】
3.C ジフェンヒドラミン微粒子のラクチトールコーティング:上記ステップ3.Bのジフェンヒドラミン微粒子を、上記ステップ1.Cに開示する手順に従いGlatt流動層コーターGlatt GPCG 3において、水中に溶解(%固形分)したヒドロキシプロピルセルロース(Klucel LF; g)とラクチトール( g)とを含む圧縮性コーティング配合物で5%の重量増加となるよう被覆する。乾燥させた圧縮性コーティング被覆ビーズを50メッシュ及び80メッシュスクリーンで篩別し、過大なサイズの微粒子及び微粉を廃棄する。
【0104】
3.D ジフェンヒドラミンマイクロカプセルを含むODT:上記ステップ3.Bのジフェンヒドラミン微粒子(34〜40%w/w)又は上記ステップ3.Cの圧縮性コーティング被覆ジフェンヒドラミン微粒子(32〜37%w/w)を、速分散性微顆粒(50〜56%w/w)と、クロスポビドン(5%w/w)、微結晶性セルロース(4〜10%w/w)、スクラロース(0.2〜0.5%)、バニラミント香味料(0.4〜1.0%)、及び着色料(0.1〜0.3%)を含む予備ブレンド混合物と共にVブレンダーで15分間ブレンドし、ステアリン酸マグネシウムを外部潤滑剤として使用してODTに圧縮する。これらの錠剤は、許容可能な官能特性、打錠性、及び薬物放出プロファイルを呈する。
【0105】
実施例4
4.A ジサイクロミンHCl IRビーズ:ポビドン(PVP K30;100.0g)を75/25の95%エタノール/水(2325.0gの95%エタノール及び775.0gの水)に、溶解するまで継続的に撹拌しながら10分間以上にわたり徐々に添加した。塩酸ジサイクロミン(800.0g)を、溶解するまで撹拌しながら徐々に添加した。7インチボトムスプレーワースター8インチ高さカラムを装備した、200メッシュ生成物保持スクリーンを被せた「B」ボトム空気分配プレートからの仕切りカラム間隙15mm(0.8mmポートノズル)のGlatt GPCG 3に2800gの60〜80メッシュ球状糖を装入し、ジサイクロミン溶液(20%固形分)を初期速度5g/分で15.5g/分まで段階的に増加させて、入口空気量90〜105m3/時間、空気噴霧圧力1.50バールで、生成物温度37±3℃を維持しながら噴霧した。スプレーシステムを50gのエタノールでリンスした後、薬物層をレイヤリングしたビーズをGlattユニット内で50分間乾燥させて残留溶媒(水分を含む)を除去した。得られたジサイクロミンIRビーズを35メッシュ及び120メッシュスクリーンで篩別して過大なサイズの粒子及び微粉を廃棄した。Cellets 100(球状微結晶性セルロース)の代わりにCellets 200を使用して、薬物負荷が30%w/wのジサイクロアミン(dicycloamine)IRビーズのバッチもまた調製する。
【0106】
4.B ジサイクロミンHCl SRビーズ:エチルセルロース(Dow ChemicalsのEC−10、Ethocel Premium 10;159.1g)を、95%エタノールに継続的に撹拌しながら徐々に添加して溶解させた。クエン酸トリエチル(TEC;15.9g)を徐々に添加して溶解させた。6インチボトムスプレーワースター6インチ高さカラム、200メッシュ生成物保持スクリーンを被せた「B」ボトム空気分配プレート、0.8mmポートノズルを装備したGlatt GPCG 1に、上記ステップ4.Aの700gのIRビーズを装入した。IRビーズに生成物温度33±3℃、噴霧空気圧力1.50バール、入口空気流量50〜75m3/時間で、及び初期流量1g/分として段階的に6g/分まで増加させて、20%のSRコーティング重量となるようにSR機能性ポリマーコーティング配合物(10%固形分)を噴霧した。噴霧後、被覆されたビーズをGlattユニット内で30分間乾燥させて残留溶媒(水分を含む)を除去した。得られたSRビーズを篩別して平均粒度が約500μm未満の粒子を得た。15%SR(EC−10/TEC)コーティングで被覆されたジサイクロアミン(dicycloamine)ビーズのバッチもまた、IRビーズ(Cellets 200上に30%薬物負荷)を使用して調製する。
【0107】
4.C ジサイクロミンHCl CRビーズ:エチルセルロース(EC−10;93.0g)を90/10のアセトン/水(1876.4gのアセトン及び208.5gの水)に激しく撹拌しながら徐々に添加して溶解させた。そのEC−10溶液にフタル酸ヒプロメロース(信越化学工業株式会社のHP−55;50.7g)を激しく撹拌しながら添加して溶解させた。その溶液にTEC(25.4g)を添加して溶解/均一に分散させ、それによりTPRコーティング配合物を形成した。実施例4.Bで調製した15%コーティング(395g)のSRビーズを、4インチワースターインサートを装備したGlatt 1において、生成物温度33±2℃、噴霧空気圧力1.50バール、入口空気量70〜90m3/時間、及び噴霧流量3〜6g/分で、TPRコーティング配合物(7.5%固形分)により30重量%のTPR被覆レベルとなるよう流動層コーティング法で被覆した。薬物放出試験用サンプルを、15重量%、20重量%及び25重量%の被覆レベルで抜き出した。平均粒度が約355gm未満の乾燥したビーズを篩別して回収した。15%SR(EC−10/TEC)コーティングで被覆されたジサイクロアミン(dicycloamine)ビーズ(Cellets 200)もまた、TPR(60/30/10のEC−10/HP−55/TEC)配合物で20%w/wの重量増加となるよう被覆し、CRビーズ(Cellts 200)を生成する。
【0108】
4.D ジサイクロミンCRビーズの圧縮性コーティング:上記ステップ4.Bの20%コーティングのジサイクロアミン(dicycloamine)SRビーズはまた、上記ステップ1.Cに開示される手順に従い、マルチトールを含有する圧縮性コーティング配合物で5%w/wの重量増加となるよう被覆される。同じ手順に従い、上記ステップ4.Cのジサイクロアミン(dicycloamine)CRビーズもまた、スクラロースを含有する圧縮性コーティング配合物で5%w/wの重量増加となるよう被覆する。
【0109】
4.E ジサイクロミンHCl ODT CR:薬学的に許容可能な成分(すなわち、チェリー香味料(0.5〜1.5%w/w)、スクラロース(0.1〜0.5%w/w)、クロスポビドン(クロスポビドンXL−10;3〜5%w/w)、及び微結晶性セルロース(Ceolus KG−802;3〜10%w/w)を、初めにVブレンダーでブレンドして均一に混合されたプレミックスを得る。速分散性微顆粒(上記実施例1.Dに記載されるとおり調製したもの;54〜65%w/w)を、上記ステップ4.Dの圧縮性コーティング被覆ジサイクロミンHCl CR又はSRビーズ(22〜33%w/w)と、先に調製したプレミックスと共にツインシェルVブレンダーでブレンドし、40mgジサイクロミンHCl ODT CR又はODT SRに圧縮した。
【0110】
従って、外部潤滑システム(Matsui Ex−Lub System)を装備した生産規模のHata錠剤成形機を使用して、最適化した打錠条件下で口腔内崩壊錠(例えば、ODT SR又はODT CR)が圧縮され、それらは、HDPEボトル、剥離台紙付きのAclar 200ブリスター、及び/又は「プッシュスルー」Aclarブリスターパックでの包装に好適な許容される打錠特性を呈する。例えば、圧縮性コーティング被覆SR又はCRビーズとして40mgジサイクロミンHClを含むODTは、以下の条件で圧縮される:−ツーリング:14mm円形、平坦な端面、アールの付いた縁部;圧縮力:12〜16kN;平均重量:800mg;平均硬度:約30〜60N;及び摩損度:0.2〜0.4%。このように生成されたジサイクロミンHCl ODT SR又はODT CR錠剤は口腔内で急速に崩壊して、被覆されたジサイクロミンHClビーズを含む滑らかな嚥下し易い懸濁液を生じ、1日1回又は2回の投与レジメンに好適な放出プロファイルを有し得る。
【0111】
実施例5
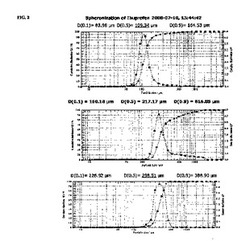
5.A 球形化の制御によるイブプロフェンペレット:ポビドン(PVP K−30;50g)を精製水(500g)に継続的に撹拌しながら徐々に添加し、10%w/w固形分でポリマー結合剤溶液を調製した。10gのコロイドシリカ(流動助剤、W.R.GraceのSyloid)をブレンドしたイブプロフェン(2000g)を、Vector Corporation(米国Iowa)のGranurex GX−40の生成物ボウルに装入した。10%PVP結合剤溶液を回転している材料層に制御された速度で噴霧し、同時に粉末を粉末レイヤー(powder layer)(K−Tron)により制御された速度でユニット内に添加した。最適化パラメータ−入口温度:50℃;ローラー速度:300RPM;スリット空気量:10CFM;処理時間:20分。完了後、ペレットをユニット内で乾燥させた。このように調製したペレット(バッチサイズ:2kg、有効収率約96%)は、109μmの平均粒度を有した(Sympatecレーザー粒度測定装置により決定される粒度分布プロファイルについては図2.Aを参照のこと。同様の手順に従い(ポビドン(50g)をイブプロフェン及びSyloidとブレンドし、及びより速い噴霧速度を用いた点は異なる)、平均粒度が217μm及び198μmのペレットの2つのバッチもまた調製した(粒度分布プロファイルについては図2.Bを参照のこと)。
【0112】
5.B 粉末レイヤリングによるイブプロフェンペレット:一組の試験は、Granurex GX−40における50〜70メッシュ球状ラクトース/デンプン上へのイブプロフェンの粉末レイヤリングを利用した。ポビドン溶液(10%固形分)を噴霧速度12〜16g/分及び粉末噴霧速度で噴霧した。このように調製したイブプロフェンペレットは、約34重量%の薬物負荷及び約300μmの平均粒度を有した(レーザー粒度データについては図2.Cを参照のこと)。
【0113】
5.C 球形化の制御によるナイアシンペレット:Malvern粒度測定装置により決定したとき平均粒度が約12μmのナイアシン(Lonzaからの2000gニコチン酸)を、コロイドシリカ(Cabbott Corporationからの10gのCab−O−Sil 10)とポビドン(50gのPVP K−30)と共にブレンドした。平均粒度が300μmのナイアシンペレットを、上記ステップ5.Aに開示されるとおりGranurex GX−35を使用して球形化の制御により調製する。
【0114】
5.D ナイアシンSRペレット:初めに上記ステップ5.Cのナイアシンペレット(1400g)に、7インチボトムスプレーワースターインサート、7 13/16インチ仕切りカラム、200メッシュ生成物保持スクリーンを被せた「C」空気分配プレート、及び16mmチューブ材を装備したGlatt GPCG 3において、約2重量%のOpadry Clearによるシールコートを提供する。上記ステップ4.Bに開示される手順に従い、シールコートで被覆されたペレットを、同じGlattユニットにおいて以下の処理パラメータで、アセトン(2180.3g)−水(384.7g)混合物(6%固形分)中に溶解したEC−10(Ethocel Standard Premium 10cps;230g)とクエン酸トリエチル(TEC)(25.6g)との溶液により20%の重量増加となるようSRコーティング被覆する−入口温度:45〜48℃;入口空気量:40〜45cfm;流量:8mL/分〜18mL/分(段階的に増加させる);噴霧空気圧力:1.25バール;ノズルポート径:1.0mm;生成物温度:35〜40℃。薬物放出試験用サンプルを、10%、15%、及び17.5%の被覆レベルで抜き出す。
【0115】
5.E ナイアシンSRペレットの圧縮性コーティング被覆:5%w/wコーティング(1000g)のナイアシンSRペレットを、上記ステップ1.0の手順に従い約20%w/wコーティングのスクラロースでさらに被覆する。
【0116】
5.F ナイアシンペレットを含む速分散錠:上記ステップ5.Eからの75〜85部の圧縮性コーティングで被覆されたナイアシンSRペレットと、10〜15部の微結晶性セルロースと、0〜10部の速分散性顆粒と、1.5〜2.5部のクロスポビドンとを、初めにVブレンダーで20分間ブレンドし、次に0.5部のステアリルフマル酸ナトリウムをブレンダーに添加し、約10分間ブレンドすることにより潤滑剤を均一に分布させる。このように生成された圧縮ブレンド物を、回転式錠剤成形機を使用して500mg又は1,000mgRDT(速分散錠)に圧縮する。
【0117】
6.A メルペロンHCl IRビーズ:メルペロンHCl(15.0kg)を50/50のアセトン/水(各3425g)に撹拌しながら徐々に添加して溶解させた。18インチボトムスプレーワースター23.75インチカラム、50mm仕切り間隙、16mmチューブ材、100メッシュ生成物保持スクリーンを被せた外側「G」及び内側「C」ボトム空気分配プレート、及び噴霧空気圧力2.5バールのHS Collarを備える3.0mmノズルを装備したGlatt GPCG 120に、目標流動化空気量500〜900CFM及び生成物温度32℃(範囲:29〜36℃を維持しながら43.8kgの45〜60メッシュ球状糖を100g/分で段階的に700g/分まで増加させて噴霧して装入した。アセトン/水中に溶解したKlucel LFのシールコートを2重量%で施し、IRビーズを乾燥させて水分及びアセトンを除去した。IRビーズを篩別して過大なサイズの(>500nm又は35メッシュ)ビーズ及び微粉(<80メッシュ)を廃棄した。
【0118】
6.B 無水リン酸水素ナトリウム(DPA)緩衝層レイヤリング:無水リン酸二ナトリウム(6.2kg)を撹拌下に溶解するまで精製水に添加する。この緩衝溶液をIRビーズ(52.6kg)に流動化空気量650(400〜800)CFMで噴霧した。任意選択により緩衝コーティングで被覆したビーズを溶媒でリンスした後、約2重量%増加とするKlucel LFのシールコートを施した。乾燥させたIRビーズを5分間乾燥させて残留溶媒を除去し、篩別して(例えば、35メッシュ及び80メッシュ篩を使用)過大なサイズのビーズ及び微粉を廃棄した。
【0119】
6.C メルペロンHCl SRビーズ:実施例6.B(34.0kg)の緩衝コーティング被覆ビーズを、流動層コーティング装置において、可塑化した(例えば、10%w/wエチルセルロースのクエン酸トリエチル)水不溶性ポリマー(例えば、13.9kgのエチルセルロース及び1.1kgのセバシン酸ジブチル)のSRコーティングで被覆した。溶媒中に溶解した圧縮性コーティング溶液(例えば、Klucel(登録商標)LFなどのヒドロキシプロピルセルロース)を緩衝コーティング被覆ビーズに約2重量%の重量増加となるよう噴霧する。得られたSRビーズをスクラロースの圧縮性コーティングで4%の重量増加となるようさらに被覆し、乾燥させて残留溶媒を除去する。
【0120】
6.D SRビーズを含む制御放出性ODT:速分散性微顆粒(4295g)を、圧縮性コーティング被覆SRビーズ(3720g)と、他の薬学的に許容可能な成分(例えば、ペパーミント香味料:100g、甘味料(スクラロース):35g、クロスポビドン:500g、二酸化ケイ素(Cab−O−Sil):25g、及び微結晶性セルロース(Avicel PH10):1350g)を含む予備ブレンド物と共に、均一に分布した圧縮用ブレンド物を得るのに十分な時間にわたりツインシェルVブレンダーでブレンドする。50mgメルペロンHClを圧縮性コーティング被覆SRビーズとして含むODTを、外部潤滑システムを装備した生産規模の錠剤成形機(Hata)を使用して以下の条件で圧縮する:−ツーリング:15mm円形、平坦な端面、アールの付いた縁部;圧縮力:16kN;平均重量:1000mg;平均硬度(目標):45N;及び摩損度:<0.5%。このように生成した得られたODT(50mg用量)は口腔内で急速に崩壊し、被覆ビーズを含む滑らかな嚥下し易い懸濁液を生じ、1日1回の投与レジメンに好適な期待される薬物放出プロファイルを提供する。
【0121】
本明細書に引用される全ての特許、公開特許出願、刊行物、及び他の文献は、あらゆる目的から全体として参照により本明細書に援用される。
【技術分野】
【0001】
関連出願の相互参照
本願は、2009年11月30日に出願された米国仮特許出願第61/265,213号明細書の利益を主張し、これはあらゆる目的から全体として参照により本明細書に援用される。
【背景技術】
【0002】
錠剤及びカプセルは最も広く用いられている剤形の2つであるが、かかる剤形にはいくつかの欠点がある。例えば、人口の推定50%が錠剤の嚥下に障害を有する(Seager in Journal of Pharmacol.and Pharm.50,pages 375−382,1998を参照のこと);特に、老年者が錠剤若しくはカプセルを嚥下すること、又は錠剤若しくはカプセルを嚥下できない、若しくは嚥下を嫌がる小児に投薬することは困難である。これにより治療に対するコンプライアンスが不十分となり、さらにはノンコンプライアンスとなることさえあるため、治療の効力に負の影響が及ぶ。多くの薬物は苦味を呈し、そのため、小児に対する薬剤投与方法として一般に用いられるように、薬剤を簡便にアップルソースなどの食品にまぶすことができない。従来のカプセル又は錠剤の剤形はまた、飲用の水又は液体を入手できないことの多い「あちこち動き回っている人」には不都合である。
【0003】
口腔内崩壊性の剤形は、従来の錠剤及びカプセルに代わるより簡便且つ潜在的により安全なものとして着実に人気が高まっている。こうした速崩壊性剤形は口腔内で崩壊又は溶解し、水なしに容易に嚥下される。この剤形は、従来の錠剤の嚥下に困難を伴う人(高齢患者及び小児患者によく見られる);水を容易に入手できない人(例えば、寝たきり患者若しくは動けない患者、又は外出の多い活動的な人);及び薬剤を服用したがらない患者を介護する者にとって重宝する。口腔内崩壊性剤形は投与が簡単で、どこでも人目を引かず服用するのに好都合で、及び一度投与すると吐き捨てることが困難であるため、経口投薬レジメンに対する患者コンプライアンスの向上を促進する。
【0004】
薬物粒子は、十分に小さいもので、有効に味をマスキングする1つ又は複数のポリマーで被覆されたもので、且つ口腔内崩壊錠(「ODT」)に製剤化された、それによりODTが患者の口腔内で急速に崩壊して、ざらついた舌触り及び後味のない、被覆された薬物粒子を含有する滑らかな嚥下し易い懸濁液を生じるものでなければならない。口腔内崩壊錠に組み込むのに好適な薬物含有粒子は、以下の特徴の1つ又は複数を呈する必要がある:
・望ましい官能特性を実現するのに適切な被覆レベルで1つ又は複数のポリマーによって被覆されていること(例えば、有効に味がマスキングされるよう口腔内での薬物放出が、及び後味が、全くない、又は僅かである)。
・ざらつきのない舌触りを実現する望ましい平均粒度(例えば、典型的には<500μm)
・望ましい薬物動態学的特性(すなわち、インビトロ薬物放出、血漿濃度−時間プロファイル、Cmax、Tmax、終末相消失半減期、及びAUC)。
【0005】
マイクロカプセルは、口腔内での薬物放出を妨げるのに十分な厚さの、1つ又は複数のポリマー又は脂肪酸及び/又はエステルを含むコーティング層で封入された小粒子(典型的には平均直径<400μm)であり、すなわち、実際にはコーティング層が下層にある薬物の味を有効にマスキングし、ODT製剤に特に好適である。その場合、被覆された薬物粒子がインビトロ及びインビボ条件下で望ましい薬物放出プロファイルを提供することを確実にする必要がある。即時放出性(IR)の剤形の場合、望ましいインビトロ薬物放出/薬物動態特性(すなわち、急速な薬物放出、Cmax、及びAUC)は、生物学的に同等であるべきRLD(収載基準薬物(reference listed drug))と同様のものでなければならない。対照的に、制御放出性の薬物粒子を含むODTは、1日1回又は2回の投与レジメンに好適とするのに望ましいインビトロ薬物放出/薬物動態特性[例えば、持続放出性(SR)、二峰性{IR+SR、IR+TPR(時限パルス放出)、又はIR+TSR(時限持続放出)}プロファイル、血漿濃度−時間プロファイル、Cmax、Tmax、血漿中消失半減期、及びAUC]を呈するものでなければならない。
【0006】
薬物含有小粒子の被覆を、IR剤形の場合において有効な味マスキングと生物学的に同等な急速薬物放出との均衡が得られるように行うこと、又はMicrocaps(登録商標)(マイクロカプセル化)若しくはDiffucaps(登録商標)(流動層コーティング法)の技術を用いたCR剤形の場合において長時間持続するインビトロ薬物放出プロファイルが得られるように行うことは、難題であり得る。これは特に、薬物が極めて強い苦味を呈したり、水又は胃腸液に溶け易かったり、及び/又はpH依存性の溶解度プロファイルを有したりする場合に当てはまる。米国特許第6,139,865号明細書又は同時係属中の2004年4月19日に出願された米国特許出願第10/827,106号明細書(米国特許出願公開第2005/0232988号明細書)、2005年8月26日に出願された米国特許出願第11/213,266号明細書(米国特許出願公開第2006/0105038号明細書);2005年10月21日に出願された米国特許出願第11/256,653号明細書(米国特許出願公開第2006/0105039号明細書);2005年10月12日に出願された米国特許出願第11/248,596号明細書(米国特許出願公開第2006/0078614号明細書)、及び2009年2月13日に出願された米国特許出願第12/370,852号明細書(米国特許出願公開第2009/0202630号明細書)(これらはあらゆる目的から全体として参照により援用される)の開示における一つの手法は、薬物含有粒子(薬物結晶、薬物顆粒、薬物ペレット、又は薬物層がレイヤリングされたビーズ)を、約10%〜65%w/wの水不溶性ポリマー(例えば、平均粘度が100cpsのエチルセルロース)を含む1つ又は複数の厚い層により、それ単独で、又は胃溶性有機、無機若しくはポリマー細孔形成剤と組み合わせて溶媒コアセルベーション法又は流動層コーティング法で被覆し、それにより口腔内にある間に苦いAPIが露出しないよう確実にすることであった。米国特許第6,627,223号明細書;米国特許第7,387,793号明細書、又は同時係属中の2007年1月29日に出願された米国特許出願第11/668,408号明細書(米国特許出願公開第2008/0196491号明細書)、2006年8月29日に出願された米国特許出願第11/847,219号明細書(米国特許出願公開第2007/0069878号明細書)、及び2009年4月15日に出願された米国特許出願第12/424,201号明細書(米国特許出願公開第2009/0258066号明細書)、並びに国際公開第2010/096820号パンフレット及び国際公開第2010/096814号パンフレット(これらはあらゆる目的から全体として参照により援用される)の開示に基づく別の手法は、持続放出性又は時限パルス放出性のプロファイルを呈するSRビーズ又はTPRビーズを生成することである。さらに、被覆された薬物含有粒子(例えば、味がマスキングされた微粒子、SRコーティングで被覆された微粒子又はTPRコーティングで被覆された微粒子)において、ODT中に組み込むため平均粒度が500μm以下で、前記ODTが口腔内で急速に崩壊して滑らかな嚥下し易い懸濁液となるものは、ざらついた舌触り及び後味を呈しないことが要件である。結果として、胃腸管内で急速に放出されることが求められる苦味を呈する薬物は、口腔内溶解剤形の製剤化において固有の難題を提示する。
【0007】
最後に、口腔内崩壊錠は口腔内で、又はUSP崩壊時間試験に従い試験するときに、急速な崩壊を達成するように、典型的には低い圧縮力で圧縮される。結果的にOTDは従来の錠剤より摩損度が高い。錠剤の硬度及び摩損度は、錠剤基質中に微結晶性セルロースなどの圧縮助剤を含めることにより向上し得る。しかしながら、それにより舌触りがチョーク質となる。さらに、許容される錠剤硬度及び摩損度を呈するロバストな錠剤製剤はまた、輸送、商品流通、及び最終使用に向けてバルク包装する、及び/又はHDPEボトル若しくはプッシュスルーブリスター(最も好ましい包装)に包装するためにも必要とされる。ODTは1980年代に市場に導入されたが、これらの課題はいまだ十分には対処されていない。
【0008】
製剤学的及び実際的な観点から、本発明の発明者らは、厚く被覆した薬物含有微粒子を含むOTDの打錠特性の改善(例えば、より高い硬度及びより低い摩損度)を、官能特性(例えば、有効な味マスキング、ざらつきのない舌触り及び後味がないこと)を犠牲にすることなく行う様々な方法を検討した。有効な味マスキング及び急速放出、持続放出、又は時限パルス放出特性のため、OTDへの組込み前にスクラロースなどの非ポリマー性水溶性圧縮性甘味料を含む圧縮性コーティング層を、ポリマーコーティングで被覆された薬物含有微粒子上に配置して施す方法が、意外にも、著しく低い圧縮力で圧縮しても打錠特性が著しく向上したOTDをもたらすことが分かった。
【発明の概要】
【0009】
一実施形態において、本発明は、1つ又は複数の薬物を含む被覆された微粒子を含む多粒子医薬組成物において、被覆された粒子が打錠特性を向上させる圧縮性コーティング剤でさらに被覆される多粒子医薬組成物、並びに圧縮性コーティングで被覆された微粒子を含む医薬組成物及び口腔内崩壊錠を調製する方法に関する。
【0010】
別の実施形態では、本発明は、薬物の味並びに後味を有効にマスキングし、且つ薬剤を必要とする患者に経口投与すると望ましい薬物動態プロファイルを提供する1つ又は複数の膜層を含む、治療有効量の薬物含有粒子を含む医薬組成物に関する。別の実施形態では、本発明は、味を有効にマスキングするとともに、胃に入ると収載基準即時放出(IR)薬物製品と生物学的に同等である急速な用量放出をもたらす1つ又は複数の膜層を含む、治療有効量の薬物含有粒子を含む医薬組成物に関する。特定の他の実施形態において、本発明は、薬物の味を有効にマスキングするとともに、1日1回又は2回の投与レジメンに好適であるように制御放出プロファイル(例えば、持続放出(SR)、時限パルス放出(TPR)、時限持続放出(TSR)又は修飾放出(IR+TPR、−IR+SR、SR+TPR又はIR+TSR))を提供する1つ又は複数の膜層を含む薬物を含む医薬組成物に関し、すなわち換言すれば本発明は、薬物の味を有効にマスキングするのみならず、制御放出(CR)プロファイルも提供し、それにより患者コンプライアンスを向上させる1つ又は複数の膜層を含む薬物を含む医薬組成物に関する。そのそれぞれの場合に、被覆された薬物含有微粒子はスクラロース、ラクチトール、ソルビトール、又はマルチトールなどの非ポリマー性圧縮性甘味料でさらに被覆され、それにより、味がマスキングされた及び/又は制御放出性コーティングで被覆された微粒子と、速分散性微顆粒と、1つ又は複数の香味料、甘味料等を含む他のODT賦形剤とを含む圧縮ブレンド物は打錠中における膜の破断が最小限に抑えられ、又は解消され、ここでこのように生成されたODT錠剤は口腔内で急速に崩壊し、ざらついた舌触り及び後味を呈しない滑らかな嚥下し易い懸濁液を形成する。
【0011】
特定の他の実施形態において、本発明は、コアセルベート化ポリマー材料を含む第1のコーティング層と、任意選択により、味がマスキングされた微粒子を生成する水不溶性ポリマーと水溶性又は胃溶性細孔形成ポリマーとの組み合わせを含む流動層コーティング法で被覆されたブレンドポリマー材料を含む第2のコーティング層とを含む、味がマスキングされた組成物に関する。味がマスキングされた及び/又は制御放出性の微粒子はラクチトールの圧縮性コーティング層でさらに被覆され、及び圧縮性コーティングで被覆された薬物粒子は他の薬学的に許容可能な賦形剤(例えば、希釈剤、圧縮助剤、潤滑剤等)とブレンドされ、速分散錠に圧縮される。速分散錠は水又は体液に接触すると、薬物放出及び薬物動態プロファイルを制御する被覆された微粒子を急速に分散させる。
【0012】
本発明のこれらの及び他の実施形態、利点及び特徴は、以降の節に提供される詳細な説明及び例から明らかとなる。
【図面の簡単な説明】
【0013】
【図1】図1は、VFC−Lab 3に装着されたGranurex GRX−35インサートを示す。
【図2】図2はヒストグラムを示す:実施例3のイブプロフェンペレットのQICPIC粒度解析。
【発明を実施するための形態】
【0014】
用語「薬物」、「有効分」、「治療剤」又は「医薬品有効成分」は、本明細書で使用されるとき、薬学的に許容可能且つ治療上有効な量のラニチジンなどの薬物、又はその(例えばラニチジンの)薬学的に許容可能な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形、及び/又はエステルを含む。本発明の様々な実施形態の記載においてラニチジンなどの薬物を参照するとき、その参照には前記薬物の薬学的に許容可能な塩、立体異性体及び立体異性体の混合物、溶媒和物(水和物を含む)、多形、及び/又はエステルもまた包含される。
【0015】
用語「口腔内崩壊錠」、「口腔内溶解錠」、「口腔内分散錠」又は「ODT」は、投与後に患者の口腔内で咀嚼なしに急速に崩壊する本発明の固形剤形を指す。崩壊速度は様々であり得るが、水で直ちに嚥下すること又は投与後咀嚼することを意図した従来の固形剤形又はチュアブルな固形剤形(例えば錠剤)の崩壊速度より速い。本発明の口腔内崩壊性組成物は、膨潤し、溶解し、又は他の形でODT組成物の崩壊又は溶解を促進する薬学的に許容可能な成分を含有し得る。かかる成分としては、クロスポビドンなどの医薬崩壊剤、マンニトールなどの水溶性糖アルコール、ラクトースなどのサッカリド、又はその混合物、ポビドンなどの水溶性結合剤、融解性固形物(例えばワックス)のポリエチレングリコールなど、胃に入ると薬物を放出することができるものを挙げることができる。本発明の口腔内崩壊性組成物は、錠剤又はミニ錠剤の形態であってもよい。
【0016】
用語「約」は、本明細書で使用されるとき数量を指し、「ちょうど」を含む。例えば、「約60秒」は、60秒ちょうど、並びに60秒に近い値(例えば、50秒、55秒、59秒、61秒、65秒、70秒等)を含む。
【0017】
用語「コア」には、限定はされないが、典型的には約100μm〜約800μm、約100μm〜約600μm、約100μm〜約500μm、約100μm〜約400μm、約200μm〜約600μm、約200μm〜約500μm、約200μm〜約400μm、約300μm〜約500μm、約300μm〜約600μmの範囲及びその部分的な範囲のサイズを有するビーズ、ペレット、微顆粒、粒状物、ミニ錠剤、薬物結晶等が含まれる。
【0018】
本明細書で使用されるとき、用語「修飾放出」コーティングは、かかるコーティングを含まず薬物を比較的速く放出する製剤(すなわち「即時放出」組成物)と比べて薬物の放出を遅延させ、放出を持続させ、放出を延長させ、放出を阻止し、及び/又は他の形で放出を長引かせる味マスキングを含むコーティングを包含する。用語「制御放出性」は、「持続放出」、「長期放出」、「遅延放出」及び「時限パルス放出」を包含する。用語「タイムラグ」コーティングは特別な種類の「制御放出」コーティングを指し、ここではタイムラグコーティングにより投与後の薬物放出が遅延する。用語「制御放出」はまた、「修飾放出」と同義的に使用される。用語「制御放出性粒子」は、本明細書に記載されるとおりの、1つ又は複数の制御放出特性を示す粒子を指す。用語「制御放出性粒子」はまた、本明細書に記載されるとおりの、1つ又は複数の制御放出性コーティングで被覆された薬物含有粒子も指す。
【0019】
用語「ラグタイム」は、薬物含有粒子の投与直後において、粒子から放出される薬物が約10%未満、例えば約9%未満、約8%未満、約7%未満、約6%未満、約5%未満、約4%未満、約3%未満、約2%未満、約1%未満、又はさらには実質的に約0%である期間を指す。インビトロ溶解試験との関連では、ラグタイムは溶解条件に曝露された直後において、薬物含有粒子から放出される薬物が約10%未満、例えば約9%未満、約8%未満、約7%未満、約6%未満、約5%未満、約4%未満、約3%未満、約2%未満、約1%未満、又はさらには実質的に約0%である期間を指す。
【0020】
本明細書で使用されるとき、用語「即時放出」(IR)は、剤形の投与後約2時間以内、又は他の実施形態では約1時間以内に薬物の約50%以上(特に口腔内崩壊錠に組み込むため味がマスキングされる場合)、いくつかの実施形態では約75%超、他の実施形態では約90%超、及びさらに他の実施形態では約95%超が放出されることを指す。
【0021】
本明細書で使用されるとき、用語「即時放出性コア」は、任意選択によりシーラント層がレイヤリングされた、薬物とアルカリ性剤とを含む本明細書に定義されるとおりのコアを指し、ここで任意選択のシーラント層は即時放出性コアを摩耗及び摩擦から保護する働きをするが、実質的な制御放出特性は全く提供しない。「即時放出性コア」には、薬物結晶(又は非晶質粒子);アルカリ性剤と薬物の顆粒又は粒状物とにおいて1つ又は複数の賦形剤を伴うもの、薬物(及び任意選択の結合剤)と任意選択の保護シーラントコーティングとアルカリ性緩衝層とがレイヤリングされた不活性コア(例えば、球状糖)、又は薬物(及び任意選択の結合剤)と任意選択の保護シーラントコーティングとがレイヤリングされたアルカリ性剤が含まれ得る。即時放出性コアは本明細書に記載されるとおりの即時放出特性を有する。即時放出性コアを1つ又は複数の制御放出性コーティングで被覆することにより、制御放出性粒子(例えば、長期放出性粒子;持続放出性粒子;遅延放出性粒子;時限パルス放出粒子等)を調製することができる。
【0022】
本明細書で使用されるとき、用語「持続放出性」(SR)は、感知され得るラグタイムなしに薬物含有コア粒子からの薬物放出が減速する特性を指す。用語「持続放出性コーティング」又は「SRコーティング」は、持続放出特性を示すコーティングを指す。用語「持続放出性粒子」は、持続放出特性を示す薬物含有粒子を指す。一実施形態において、持続放出性コーティングは水不溶性ポリマーと、任意選択により水溶性ポリマーとを含む。SRコーティングは、任意選択により可塑剤又はコーティングの「持続放出」特性を妨げない他の成分を含有してもよい。
【0023】
本明細書で使用されるとき、用語「時限パルス放出」(TPR)は、所定のラグタイム後の修飾された薬物放出の特性を指す。用語「時限パルス放出性コーティング」又は「TPRコーティング」は、時限パルス放出特性を示すコーティングを指す。用語「時限パルス放出性粒子」は、時限パルス放出特性を示す薬物含有粒子を指す。いくつかの実施形態では、例えば少なくとも1つの水不溶性ポリマーと少なくとも1つの腸溶性ポリマーとの組み合わせ(例えば、エチルセルロースとフタル酸ヒプロメロースとの組み合わせ)で粒子を被覆することにより、少なくとも約2〜約10時間のラグタイムが実現される。TPRコーティングは、任意選択により可塑剤又はコーティングの「時限パルス放出」特性を妨げない他の成分を含有してもよい。
【0024】
本明細書で使用されるとき、用語「遅延放出」(DR)は、所定のラグタイム後に薬物が即時放出される特性を指す。用語「遅延放出コーティング」又は「DRコーティング」は、遅延放出特性を示すコーティングを指す。用語「遅延放出性粒子」は、遅延放出特性を示す薬物含有粒子を指す。いくつかの実施形態では、アルカリ性pHに曝露されるまで実質的な薬物放出が起こらないような遅延放出特性を示す薬物含有粒子が、粒子を腸溶性ポリマー(例えばフタル酸ヒプロメロース)で被覆することにより実現される。遅延放出性コーティングは、任意選択により可塑剤又はコーティングの遅延放出特性を妨げない他の成分を含有してもよい。
【0025】
例えば基体上のコーティングに関連して用語「〜を覆って配置される」は、例えば基体に対するコーティングの相対的な位置を指し、しかしながらコーティングが基体と直接接触している必要はない。例えば、基体を「覆って配置される」第1のコーティングは、基体と直接接触していてもよく、又は1つ以上の介在する材料若しくはコーティングが第1のコーティングと基体との間に置かれてもよい。換言すれば、例えば、薬物含有コアを覆って配置されるSRコーティングは、薬物含有コア上に直接堆積したSRコーティングを指すこともあり、又は薬物含有コア上に堆積した保護シールコーティング上に堆積したSRコーティングを指すこともある。
【0026】
用語「シーラント層」又は「シールコーティング」は、薬物層がレイヤリングされたビーズなどの薬物含有コア粒子を覆って配置された保護膜を指す。
【0027】
用語「実質的に崩壊する」は、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%の崩壊、又は約100%崩壊に達する崩壊レベルを指す。用語「崩壊」が、錠剤を含む例えば構成粒子の構造的まとまりが壊れること、又はそれが失われることを指す一方、用語「溶解」が液体中における固体の可溶化(例えば、溶媒又は胃液中における薬物の可溶化)を指す点で、「崩壊」は「溶解」と区別される。
【0028】
剤形中のIR粒子の味マスキング層(存在する場合)に関連して用語「味を実質的にマスキングする」は、患者の口腔内で薬物が放出又は溶解することを実質的に阻止し、それにより患者が薬物の味を知覚することを阻止する味マスキング層の特性を指す。薬物の味を「実質的にマスキングする」味マスキング層は、典型的には患者の口腔内で薬物の約10%未満、他の実施形態では薬物の約5%未満、約1%未満、約0.5%未満、約0.1%未満、約0.05%未満、約0.03%未満、又は約0.01%未満を放出する。本発明の組成物の味マスキング層の味マスキング特性は、インビボで(例えば、当該技術分野において公知の従来の官能検査方法を用いて)、又はインビトロで(例えば、本明細書に記載されるとおりの溶解試験を用いて)計測することができる。当業者は、薬物の味を「実質的にマスキングする」味マスキング層に関連する薬物放出の量が本明細書に明示的に開示される範囲に限定されず、知覚される薬物の苦味、及び例えば組成物中における香味剤の存在などの他の要因に応じて様々であり得ることを認識するであろう。
【0029】
用語「実質的に不含」は、指示される成分が存在しないか、又はほんの僅かな量のみ存在することを意味する。一実施形態では、「実質的に不含」は約10%未満を意味する。他の実施形態では、「実質的に不含」は約5%未満、約2%未満、又は約1%未満、又は約0%を意味する。例えば、実質的に水不溶性ポリマー不含のコーティングは、いかなる水不溶性ポリマーも多量に含有することはない。用語「実質的に水不溶性ポリマー不含」は、水溶性であるポリマー又はポリマーでない水不溶性成分を除外するものではない。
【0030】
用語「水不溶性」は、水性媒体中でpHとは無関係に、又は生理学的に関連性のある広いpH範囲(例えば、pH1〜約pH8)に対して不溶性又は極めて難溶性であることを意味する。水性媒体中で膨潤はするが溶解しないポリマーは、本明細書で使用されるとき「水不溶性」であり得る。
【0031】
用語「水溶性」は、水性媒体中でpHとは無関係に可溶性である(すなわち相当量が溶解する)ことを意味する。限られたpH範囲に対して可溶性である成分は、本明細書で使用されるとき「水溶性」と見なすことが(必須ではないが)できる。「水溶性」(本明細書で使用されるとき)である成分は、イオン性官能基;すなわちpHの変化でイオン化する官能基を含有しない。例えば、ほぼ中性〜アルカリ性条件下で可溶性であり、すなわちpH5.5以上、pH6以上、又は約pH7.0で可溶性であり、及び低いpH条件下で不溶性であるポリマーは、本明細書で使用されるとき「水溶性」と見なすことが(必須ではないが)できる。
【0032】
用語「腸溶性」又は「腸可溶性」は、腸内条件下;すなわちアルカリ性条件下の水性媒体中で可溶性であり(すなわち相当量が溶解し)、及び酸性条件下(すなわち低pH)で不溶性であることを意味する。例えば、中性〜アルカリ性条件下で可溶性であり、及びより低いpH条件下で不溶性である腸溶性ポリマーは、本明細書で使用されるとき必ずしも「水溶性」ではない。ポリビニルアセテートフタレートはpH4.5以上で可溶性であり、腸溶性ポリマーの例である。
【0033】
用語「逆腸溶性」は、酸性条件下で可溶性であり、及び中性〜アルカリ性条件下で不溶性であることを意味する。逆腸溶性ポリマーは、本明細書で使用されるとき「水溶性」とは見なされない。
【0034】
用語「胃溶性細孔形成剤」は、中性〜アルカリ性pHで不溶性であるが、酸性条件下では易溶性である細孔形成剤を指す。本発明における胃溶性細孔形成剤としては、有機細孔形成剤(例えば、カルシウムサッカリド、コハク酸カルシウム)、無機細孔形成剤(例えば、炭酸カルシウム、酸化マグネシウム)、又はポリマー細孔形成剤(例えば、Eudragit EPO又はAEA(登録商標))を利用することができる。
【0035】
用語「速分散錠」は、水及び/又は体液に接触すると急速に分散する錠剤を指し、この錠剤においては、味がマスキングされた又は制御放出性の微粒子(例えば、少なくとも1つの味マスキングポリマー膜層又は少なくとも1つの水不溶性持続放出ポリマー層で被覆された、薬物結晶粒子、不活性コア上にレイヤリングされた薬物、及び球状化又は粉末レイヤリングによるペレットなどの薬物含有コア)が賦形剤基質に埋め込まれている。前記分散した微粒子上に配置される膜が薬物放出を制御する。このような錠剤は嚥下されるように意図されるが、薬剤を必要とする対象又は患者において錠剤又はカプセルの嚥下に困難を覚える者に対する経口投与方法が他に少なくとも2つある−速分散錠を2つに半割し、一方の半錠を摂取してから他方を摂取すること、及び約150mLの水中に錠剤を急速に分散させ、かき混ぜて、その薬物調製物を飲むこと。
【0036】
用語「血漿濃度対時間プロファイル」、「Cmax」、「AUC」、「Tmax」、及び「消失半減期」は、「FDA Guidance for Industry:Bioavailability and Bioequivalence Studies for Orally Administered Drug Products−General Considerations(2003年3月発行)」に定義されるとおりの、その一般に認められている意味を有する。
【0037】
一実施形態において、本発明の口腔内崩壊性組成物は治療有効量の高度に球形の薬物粒子、例えば塩酸ラニチジンを含み、それらの薬物粒子は少なくとも1つの味マスキング層で被覆され、且つ前記味がマスキングされた微粒子を覆って圧縮性コーティング層が配置され、及び崩壊剤と、糖アルコール、サッカリド又はその混合物とを含む速分散性微顆粒をさらに含む口腔内崩壊錠(ODT)の形態である。口腔内崩壊性組成物が本発明の経口剤形(例えばODT)で患者の口腔内に投与されると、経口剤形(例えば錠剤)は患者の口腔内で急速に崩壊する一方、速分散性微顆粒が溶解して、味がマスキングされた薬物粒子を含む滑らかな嚥下し易い懸濁液となる。
【0038】
患者の口腔内での口腔内崩壊性組成物の崩壊速度は、約60秒以下、約50秒以下、約40秒以下、約30秒以下、約20秒以下、又は約10秒以下程度であり得る。
【0039】
或いは、本発明の口腔内崩壊性組成物の崩壊速度は、様々なインビトロ試験方法、例えばUSP<701>崩壊試験法を用いて計測することができる。USP<701>崩壊試験法を用いる場合、口腔内崩壊性組成物の崩壊速度は従来の非口腔内崩壊性経口組成物の速度より速く、例えば約60秒以下、約30秒以下、約20秒以下、又は約10秒以下である。
【0040】
用語「薬物溶解プロファイル」は、薬物含有組成物の溶解プロファイルを指す。味がマスキングされたIR微粒子を含む本発明の口腔内崩壊性組成物の溶解速度は、米国薬局方装置2(パドル、50rpm又は75rpm、900mLの0.1N HCl中又はpH=4.5、5.8又は6.8の緩衝液中)を使用して評価することができる。米国薬局方装置2試験を用いる場合、薬物(例えばラニチジン)の溶解速度は従来の非口腔内崩壊性組成物(すなわち、収載基準薬物(RLD)の即時放出製剤(例えばZantac(登録商標)))の速度と同程度でなければならず、例えば薬物総量の約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%が45分間で放出される。
【0041】
用語「非口腔内崩壊性即時放出薬物組成物」は、当該技術分野において公知の、嚥下されて胃腸管内で吸収されることを意図した従来の錠剤又はカプセル、錠剤構造を崩すために咀嚼が必要なチュアブル錠などの、前記薬物を含有する非口腔内崩壊性組成物を指す。
【0042】
従って、本発明の即時放出性(IR)の又は味がマスキングされた薬物粒子を含む口腔内崩壊性組成物は、非口腔内崩壊性即時放出組成物と実質的に同様の血漿濃度−時間プロファイルを有し得るとともに、薬物動態(PK)パラメータ、AUC(0−24)及びCmaxが、市販品と生物学的に同等であるように、適切に行われたPK交差試験において同一の条件下で投与されたZantacなどのRLD製剤についてのそれぞれの値の80.0%〜125.0%の90%信頼区間(CI)の範囲内に含まれ得る。
【0043】
或いは、本発明の口腔内崩壊性組成物を構成する多重被覆された薬物含有粒子からの薬物放出速度は、米国薬局方装置2(パドル、50rpm、37℃及び二段階溶解媒体(例えば、最初の2時間について700mLの0.1N HCl緩衝液中、その後900mLのpH=6.8の緩衝液中で試験)を使用して評価することができる。
【0044】
微粒子は、本発明で使用されるとき、平均粒度が約500μm以下、より詳細には約400μm以下の粒子又は顆粒を指す。用語「粒子」、「微粒子」、「顆粒」及び/又は「微顆粒」は本明細書では同義的に使用され、粒子が薬物及び/又は糖アルコールを含むか否かとは無関係に、平均粒度が約500μm以下の粒子を意味する。用語「マイクロキャップス(microcaps)」は、平均粒度が約500μm以下の、特別に味がマスキングされた薬物含有粒子を指す。
【0045】
微粒子は、一次粒子又は二次粒子として記載することができる。一次粒子は凝集していない一方、二次粒子は一次粒子が凝集したものである。従って、糖アルコール、サッカリド、又はその混合物(例えば、平均粒度又は粒径が30μm以下のD−マンニトール)と崩壊剤(例えば、平均粒度又は粒径が30μm以下のクロスポビドンXL−10)とを含む微顆粒を急速に分散させる一次粒子は、概して二次粒子(例えば、平均粒度又は粒径が400μm以下の微顆粒を急速に分散させる)より小さい。
【0046】
特に指示がない限り、全ての百分率及び比は重量で計算される。特に指示がない限り、全ての百分率及び比は全組成物を基準として計算される。
【0047】
本発明の口腔内崩壊性組成物は、以下の利点の1つ又は複数を有し得る:良好な崩壊特性及び薬物動態を有する美味な薬物製剤;従来の錠剤の嚥下に困難を伴う患者についての患者コンプライアンスの向上;及び患者又は患者の介護者による容易及び/又は簡便な投与。
【0048】
理想的には、口腔内崩壊性組成物は美味でなければならず、例えば許容される味及び舌触りの特徴を有しなければならない。ラニチジンなどの苦味を呈する薬物には、口腔内崩壊性製剤に味マスキングポリマーを含めることで製剤の味覚的特性が改善され得るとともに、崩壊剤、糖アルコール、サッカリド、又はその混合物を含めることで口腔内での急速な崩壊並びに「クリーム様の」舌触りがもたらされ得る。加えて、口腔内崩壊性製剤はまた、許容される薬物動態及びバイオアベイラビリティを提供して望ましい治療効果を提供しなければならない。口腔内崩壊性製剤のこれらの望ましい特性は、製剤のうち許容可能な味マスキング特性を提供する構成成分が薬物放出を妨害し、又は遅延させることによって許容し難い薬物動態特性をもたらし得る点で、相容れないものであり得る。逆に、製剤のうち口腔内での薬物放出を促進する構成成分は、望ましくない味又は舌触り特性を生じる。従って、IR薬物製品と生物学的に同等であるように設計された許容可能な口腔内崩壊錠製剤は、許容される薬物動態(例えば、胃に入ったときの急速な薬物溶解)を有する美味な(例えば、味が十分にマスキングされた)速崩壊錠組成物を提供するため、これらの相反する特性の均衡をとらなければならない。さらに、こうした錠剤は、輸送、商品流通、及び最終使用のためバルク容器、HDPEボトル又はプッシュスルーブリスターに包装されたときの摩耗の厳しさに耐えるのに十分な硬度及び低い摩損度を備えることが求められる。しかしながら、有効な味マスキング及び/又は長時間持続する薬物放出のため1つ又は複数の水不溶性ポリマーで厚く被覆された薬物含有粒子は典型的には剛性で、結果的に、特に低い圧縮力でOTDに圧縮されたとき、高摩損度の錠剤となる。従って、ポリマーで被覆された薬物粒子が、構造的完全性、すなわち錠剤圧縮中のひび割れ又は膜の破断を回避することを含めた最も望ましい打錠特性を実現するには、薬物含有粒子を覆って配置される圧縮性コーティング材料(例えば、スクラロース)による圧縮性コーティングが必要となる。
【0049】
本発明の組成物は、治療有効量の1つ又は複数の薬物と、味マスキングポリマーと、本明細書に定義されるとおりの口腔内崩壊性組成物を提供する1つ又は複数の薬学的に許容可能な成分との任意の組み合わせを含むことができる。例えば、望ましい粒度範囲[例えば、5%以下が30メッシュ(600μm)スクリーン上に残り、及び10%以下が270メッシュスクリーン(53μm)を通過する]を有する塩酸ラニチジン原薬が、米国特許第6,139,863号明細書及び同時係属中の2004年4月19日に出願された米国特許出願第10/827,106号明細書(米国特許出願公開第2005/0232988号明細書)(これらの内容は本明細書によってあらゆる目的から全体として参照により援用される)の開示に従う溶媒コアセルベーション法により水不溶性ポリマーでマイクロカプセル化される。水溶性スクラロースでさらに被覆されるこの味がマスキングされた粒子は、高剪断造粒機において精製水で造粒し、トレイ乾燥式の従来のオーブンで、又は流動層乾燥機で乾燥させた、崩壊剤、糖アルコール及び/又はサッカリドを含む顆粒(この材料は、以下では速分散性微顆粒と称する)と組み合わされ、バルク容器又はHDPEボトルでの輸送の厳しさに耐える十分に強固な口腔内崩壊錠に圧縮され、従って患者の口腔の唾液中で崩壊剤、糖アルコール又はサッカリドが膨潤及び/又は溶解し、それにより味がマスキングされた又はCRコーティングで被覆された薬物粒子を含有する滑らかな嚥下し易い懸濁液を形成する。加えて他のODT賦形剤、例えば、チェリー又はミント香味料などの1つ又は複数の香味剤、スクラロースなどの甘味料、急速な崩壊を促進する追加的な崩壊剤(同じ又は異なる崩壊剤)、及び任意選択により1つ又は複数の着色料が含まれ、口腔内崩壊錠製剤の官能特性をさらに改善する。
【0050】
特定の実施形態において、本発明は、制御放出性微粒子の1つ又は複数の集合を含む医薬組成物に関し、ここで各微粒子は、少なくとも1つの薬物又はその薬学的に許容可能な塩、溶媒和物、及び/又はエステルを含むコアと、前記コアを覆って配置された、水不溶性皮膜形成材料(例えば、エチルセルロース又は脂肪酸エステル)を含む第1のコーティングと、前記コアを覆って配置された、圧縮性コーティング材料(例えば、水溶性スクラロース)を含む外側コーティングとを含み、ここで前記圧縮性コーティング材料は実質的にポリマー不含であり、それにより打錠特性の著しい向上を実現する。
【0051】
一実施形態において、本発明は、制御放出性粒子の第1又は第2の集合を含む医薬組成物に関し、ここで各制御放出性粒子は、少なくとも1つの薬物又はその薬学的に許容可能な塩、溶媒和物、及び/又はエステルを含むコアと;水不溶性ポリマー(例えば、エチルセルロース)と、第1のコーティングを覆って配置された、水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含む(例えば、約9:1〜約1:2の比のエチルセルロースとフタル酸ヒプロメロースとの)第2の任意選択のコーティングと、第2のコーティングを覆って配置された、実質的にポリマー不含の圧縮性コーティング材料(例えば、水溶性スクラロース)を含む第3のコーティングとを含む。
【0052】
2007年1月29日に出願された米国特許出願第11/668,408号明細書(米国特許出願公開第2008/0196491号明細書)、2007年8月29日に出願された米国特許出願第11/847,219号明細書(米国特許出願公開第2008/0069878号明細書)、及び2009年4月15日に出願された米国特許出願第12/424,201号明細書(米国特許出願公開第2009/0258066号明細書)、並びに国際公開第2010/096820号パンフレット及び国際公開第2010/096814号パンフレット(これらの内容は本明細書によってあらゆる目的から全体として参照により援用される)に開示されるとおりの特定の他の実施形態において、本発明は、制御放出性微粒子の1つ又は複数の集合を含む医薬組成物に関し、ここで各微粒子は、少なくとも1つの薬物又はその薬学的に許容可能な塩、溶媒和物、エステル、及び/又は混合物を含むコアと、前記コアを覆って配置された、水不溶性皮膜形成材料(例えば、エチルセルロース又は脂肪酸エステル)を含む第1のコーティング、及び/又は水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含む任意選択の第2のコーティングと、前記CRコーティング被覆コアを覆って配置された外側コーティング層とを含み、ここで前記圧縮性コーティング材料は、ヒドロキシプロピルセルロースなどの親水性ポリマーである。圧縮性ポリマーで被覆された薬物粒子を速分散性微顆粒との組み合わせで含む口腔内崩壊錠は、十分な硬さの摩損度が低い錠剤をもたらし、輸送、商品流通、及び最終使用に向けた高密度ポリエチレン(HDPE)ボトル及び/又はプッシュスルー又は剥離式背面台紙ブリスター包装での包装が利用可能となる。その場合、非ポリマー性圧縮性コーティング材料(例えば、スクラロース)によるさらなるコーティングは、打錠特性の著しい向上をもたらすことも、又はもたらさないこともある。
【0053】
別の実施形態において、本発明は速分散錠としての医薬剤形に関し、これは、(i)制御放出性粒子の第1又は第2の集合であって、各制御放出性粒子が、少なくとも1つの薬物又はその薬学的に許容可能な塩、溶媒和物、エステル、及び/又は混合物を含むコアを含み;コアを覆って、腸溶性ポリマーを含む遅延放出性コーティングを配置し;及びコアを覆って、腸溶性ポリマーを水不溶性ポリマーとの組み合わせで含む時限パルス放出性コーティングを配置し;及び時限パルス放出性コーティングを覆って配置された、実質的にポリマー不含の圧縮性コーティング材料(例えば、水溶性スクラロース)を含む外側コーティングを含む、第1又は第2の集合と、(ii)充填剤、希釈剤、圧縮助剤、及びサッカリド及び/又は糖アルコールを崩壊剤との組み合わせで含む速分散性顆粒を含めた、薬学的に許容可能な賦形剤とを含む。
【0054】
さらに別の実施形態において、本発明は口腔内崩壊錠の調製方法に関し、これは(i)本明細書に記載されるとおりの、制御放出性粒子の1つ又は複数の集合を、サッカリド及び/又は糖アルコールを崩壊剤との組み合わせで含む速分散性顆粒、及び他のODT賦形剤(例えば、香味料、甘味料、追加的な崩壊剤、圧縮助剤(微結晶性セルロース及び/又は噴霧乾燥マンニトールなどの充填剤)、着色料等)と混合するステップであって、それにより圧縮ブレンド物を形成するステップと;(ii)圧縮ブレンド物を口腔内崩壊錠に圧縮するステップとを含む。
【0055】
別の実施形態において、本発明の薬物粒子は、相分離によって水不溶性ポリマー(例えば、エチルセルロース)を含む第1のコーティングで被覆され、米国特許出願公開第2009/0202630号明細書に開示されるとおりの水不溶性ポリマーの胃溶性ポリマーとの約9:1〜約5:5の比の組み合わせにより流動層コーターにおいて第2のコーティングで被覆され、続いて圧縮性スクラロースで流動層コーティング法により被覆される。本発明のさらに別の実施形態において、薬物含有粒子は初めに、同時係属中の米国特許出願公開第2005/0232988号明細書(その全体があらゆる目的から参照により援用される)に従い全重量増加が約30%〜約60%w/wとなるよう相分離によって皮膜形成水不溶性ポリマー(例えば、エチルセルロース)で被覆される。第1のコーティングは、続いて圧縮性スクラロースで流動層コーティング法により被覆される。
【0056】
本発明の特定の他の実施形態において、薬物粒子は、米国特許出願公開第2006/0078614号明細書、米国特許出願公開第2006/0105038号明細書、及び米国特許出願公開第2006/0105039号明細書(これらの内容は本明細書によってあらゆる目的から参照により援用される)の開示に従い、水不溶性ポリマー(例えば、80%トルエン/20%アルコール中5%溶液として周囲温度で試験したときの平均粘度が10cpsのエチルセルロース)と、Eudragit EPO、カチオン性ポリマー、炭酸カルシウム又はコハク酸カルシウムなどの胃溶性細孔形成剤との組み合わせで流動層コーティング法により被覆することにより味がマスキングされる。これらの味がマスキングされた薬物粒子の各々は、さらに圧縮性スクラロースの膜で被覆される。
【0057】
本発明のさらに別の実施形態において、80%トルエン/20%アルコール中5%溶液として周囲温度で試験したとき平均粘度が100cpsのエチルセルロースを用いた温度誘起相分離法による約5%〜約20%w/wの重量増加となる水不溶性ポリマーのコーティングと、水不溶性ポリマー(例えば、平均粘度が10cps以上のエチルセルロース)を逆腸溶性ポリマーと組み合わせた外側コーティングとを有する高度に球形の薬物粒子に、米国特許出願公開第2009/0202630号明細書に従い前記第1のコーティングと第2のコーティングとの間に挟まれる香味料−甘味料の組み合わせの中間コーティングが提供され、それにより誤って被覆薬物粒子に歯が食い込んだ場合に薬物の味が知覚されることが回避される。この三重層は、さらに圧縮性スクラロースで被膜される。
【0058】
薬物粒子上に保護シールコーティング層として施される皮膜形成ポリマーは、任意の水溶性ポリマーを含み得る。好適な皮膜形成ポリマーの非限定的な例としては、水溶性、アルコール可溶性又はアセトン/水可溶性ヒドロキシプロピルメチルセルロース(HPMC;例えば、ColorconのOpadry(登録商標)Clear)、ヒドロキシプロピルセルロース(HPC;AqualonのKlucel(登録商標)LF)、及びポリビニルピロリドン(PVP)が挙げられる。薬物粒子上に適用される皮膜形成ポリマーの量は、約0.5%〜約5%、例えば約1%〜約3%の範囲、又は約2%w/wであり得る。
【0059】
本発明に従い薬物粒子の味をマスキングするのに有用な水不溶性ポリマーの代表的な例としては、エチルセルロース、ポリ酢酸ビニル(例えば、BASFのKollicoat SR#30D)、酢酸セルロース、酢酸酪酸セルロース、アクリル酸エチル及びメタクリル酸メチルをベースとする中性の共重合体、アクリル酸エステル及びメタクリル酸エステルとEudragit NE、RS及びRS30D、RL又はRL30Dなどの第四級アンモニウム基との共重合体が挙げられる。
【0060】
本発明に従い薬物粒子の味をマスキングするのに有用な胃溶性有機又は無機細孔形成剤の代表的な例としては、限定はされないが、炭酸カルシウム、リン酸カルシウム、カルシウムサッカリド、コハク酸カルシウム、酒石酸カルシウム、酢酸第二鉄、水酸化第二鉄、リン酸第二鉄、炭酸マグネシウム、クエン酸マグネシウム、水酸化マグネシウム、リン酸マグネシウムなど及びそれらの混合物が挙げられる。味がマスキングされた粒子を生成するための、水不溶性ポリマーの胃溶性有機又は無機細孔形成剤との比は、典型的には約95/5から約50/50まで、又はいくつかの実施形態では約85/15から65/35まで様々であってよく、厚さが被覆薬物粒子の約5重量%〜約50重量%、より詳細には約10重量%〜約60重量%である。
【0061】
別の実施形態では、細孔形成ポリマー材料は本質的に、アクリル酸又はメタクリル酸アミノアルキル、アクリル酸又はメタクリル酸ブチル、及びメタクリレートをベースとするターポリマーからなる。別の実施形態では細孔形成ポリマー材料は、メタクリル酸ジメチルアミノエチル、メタクリル酸ブチル、及びメタクリル酸メチルをベースとするターポリマーであってよく;及びさらに別の実施形態ではターポリマーは150,000の平均分子量を有し、単量体比がメタクリル酸メチルとN,N−メタクリル酸ジメチルアミノエチルとメタクリル酸ブチルとの1:2:1である。細孔形成ポリマー材料の例はEUDRAGITO(登録商標)Eシリーズのポリマー(例えば、EUDRAGITO(登録商標)E100又はEUDRAGITO(登録商標)EPO)である。このシリーズのポリマーはpKaが6.3であり、pHが5より低い胃液に対して可溶性である一方、pHが5.0より高い水及び緩衝溶液中では膨潤し、及び/又は透過性である。唾液は典型的には約6.7〜7.4のpH範囲である。胃溶性細孔形成ポリマーの別の例は、ポリ(ビニルアセタルジエチルアミノアセテート)、例えば三共株式会社、東京(日本)から入手可能なAEA(登録商標)である。一実施形態では、逆腸溶性ポリマーは、メタクリル酸ジメチルアミノエチル、メタクリル酸ブチル、及びメタクリル酸メチルをベースとするターポリマーである。別の実施形態ではターポリマーは150,000の平均分子量を有し、単量体比がメタクリル酸メチルとN,N−メタクリル酸ジメチルアミノエチルとメタクリル酸ブチルとの1:2:1である。味がマスキングされたラニチジンHCl薬物粒子を生成するための、水不溶性ポリマーの細孔形成ポリマー材料との比は、典型的には約95/5から約50/50まで様々であり得る。味マスキングコーティングの量は、味がマスキングされたラニチジン含有顆粒の重量で約5%〜約30%、又は約5%〜25%、約5%〜20%、約5%〜15%、約5%〜10%、約10%〜30%、約10%〜25%、約10%〜20%、約10%〜15%、約15%〜30%、約50%〜25%、約15%〜20%、約20%〜30%、約20%〜25%、又は約25%〜30%の範囲である。
【0062】
本明細書に記載される中間膜及び外側膜は1つ又は複数の可塑剤を含む。膜の可塑化に用いられ得る可塑剤の代表的な例としては、好ましくは以下のサブグループ:アセチル化モノグリセリド又はジグリセリド(例えば、Myvacet(登録商標)9−45)、モノステアリン酸グリセリン、トリステアリン酸グリセリン、三酪酸グリセリンからのグリセロール及びそのエステル、好ましくは以下のサブグループ:フタル酸ジブチル、フタル酸ジエチル、フタル酸ジメチル、フタル酸ジオクチルからのフタレート、好ましくは以下のサブグループ:アセチルクエン酸トリブチルエステル、アセチルクエン酸トリエチルエステル、クエン酸トリブチル、クエン酸アセチルトリブチル、クエン酸トリエチルからのシトレート、グリセロールトリブチレート;好ましくは以下のサブグループ:セバシン酸ジエチル、セバシン酸ジブチルからのセバケート、アジペート、アゼレート、ベンゾエート、クロロブタノール、ポリエチレングリコール、植物油、フマレート、好ましくはフマル酸ジエチル、マレート、好ましくはリンゴ酸ジエチル、オキサレート、好ましくはシュウ酸ジエチル、スクシネート、好ましくはコハク酸ジブチル、ブチレート、セチルアルコールエステル、マロネート、好ましくはマロン酸ジエチル、ヒマシ油(これは特に好ましい)、及び混合物が挙げられる。本発明の実施形態で使用されるとき、可塑剤は水不溶性ポリマーの約3重量%〜約30重量%を構成し得る。別の実施形態では、可塑剤は水不溶性ポリマーの10重量%〜約25重量%を構成する。さらに他の実施形態では、水不溶性ポリマーの重量に対する可塑剤の量は、約3%、約5%、約7%、約10%、約12%、約15%、約17%、約20%、約22%、約25%、約27%、及び約30%である(全ての範囲及びその間の部分的範囲を含む)。当業者であれば、その1つ又は複数のポリマー及びコーティング系の性質(例えば、水性又は溶媒ベース、溶液又は分散体ベース)及び全固形分に基づいて可塑剤の種類を選ぶことが分かるであろう。さらに、本発明の特定の実施形態において、逆腸溶性ポリマーを含有する外側膜は粘着防止剤をさらに含む。粘着防止剤の代表的な例としては、タルク、ステアリン酸マグネシウムなどが挙げられる。
【0063】
本発明の口腔内崩壊性組成物は、崩壊剤と糖アルコール及び/又はサッカリドとを含む速分散性顆粒を含む。崩壊剤含有顆粒に好適な崩壊剤の非限定的な例としては、崩壊剤又はいわゆるスーパーディスインテグラント(super−disintegrant)、例えばクロスポビドン(架橋PVP)、デンプングリコール酸ナトリウム、架橋カルボキシメチルセルロースナトリウム、低置換度ヒドロキシプロピルセルロース、及びそれらの混合物を挙げることができる。速分散性顆粒中の崩壊剤の量は、速分散性顆粒の全重量の約1%〜10%、又は約5%〜10%の範囲であり得る(全ての範囲及びその間の部分的範囲を含む)。
【0064】
糖アルコールは水素化された形態の炭水化物であり、ここではカルボニル基(すなわち、アルデヒド又はケトン)が第一級又は第二級ヒドロキシル基に還元されている。本発明の口腔内崩壊性組成物の速分散性顆粒に好適な糖アルコールの非限定的な例としては、例えば、アラビトール、イソマルト、エリスリトール、グリセロール、ラクチトール、マンニトール、ソルビトール、キシリトール、マルチトール、及びそれらの混合物が挙げられる。用語「サッカリド」は用語「糖類」と同義語であり、グルコース、フルクトース、ラクトース、マルトース、トレハロース、及びリボースなどの単糖類;及びスクロース、ラクトース、マルトース、及びセロビオースなどの二糖類を含む。一実施形態において、本発明の組成物での使用に好適なサッカリドの非限定的な例としては、例えばラクトース、スクロース、マルトース、及びそれらの混合物を挙げることができる。別の実施形態において、速分散性顆粒は少なくとも1つの崩壊剤を糖アルコールとの組み合わせで含む。別の実施形態において、速分散性顆粒は少なくとも1つの崩壊剤をサッカリドとの組み合わせで含む。さらに別の実施形態において、崩壊剤含有顆粒は少なくとも1つの崩壊剤を糖アルコール及びサッカリドとの組み合わせで含む。速分散性顆粒中の糖アルコール及び/又はサッカリドの量は崩壊剤含有顆粒の全重量の約99%〜90%、又は約95%〜90%の範囲である(全ての範囲及びその間の部分的範囲を含む)。一実施形態において、糖アルコール及び/又はサッカリドの平均粒度は30μm以下、例えば約1〜30μm、約5〜30μm、約5〜25μm、約5〜20μm、約5〜15μm、約5〜10μm、約10〜30μm、約10〜25μm、約10〜20μm、約10〜15μm、約15〜30μm、約15〜25μm、約15〜20μm、約20〜30μm、約20〜25μm、又は約25〜30μmである。
【0065】
本発明の速分散性顆粒は任意の好適な方法により調製することができる。例えば、速分散性顆粒は、1つ又は複数の崩壊剤と1つ又は複数の糖アルコール及び/又はサッカリドとを高剪断造粒機において造粒し、流動層機器において、又は従来のオーブンのトレイ上で乾燥させることで、例えば速分散性微顆粒の形態の速分散性顆粒を生成することにより調製することができる。速分散性微顆粒はまた、米国特許出願公開第2005/0232988 A1号明細書(これはあらゆる目的から全体として参照により本明細書に援用される)に記載される方法によっても調製することができる。
【0066】
本発明の組成物は、患者の口腔内で好適な崩壊速度を提供して滑らかで美味な嚥下し易い薬物粒子含有懸濁液を形成するのに十分な量の速分散性顆粒及び/又は崩壊剤と糖アルコール及び/又はサッカリドとの混合物を含む。速分散性顆粒中の崩壊剤の量及び/又は本発明の組成物中における薬物に対する崩壊剤−糖アルコール/サッカリドの組み合わせの量は、好適な崩壊速度を提供するように、並びに薬物粒子を含有する滑らかで美味な嚥下し易い懸濁液を形成するように調整することができる。例えば、本発明の組成物は、約≦30秒(USP<701>崩壊試験法)のインビトロ崩壊速度を提供するのに十分な対薬物量の崩壊剤−糖アルコール/サッカリドの組み合わせを含む。
【0067】
速分散性顆粒の量又は味がマスキングされた薬物粒子に対する速分散性顆粒(すなわち、崩壊剤−糖アルコール/サッカリドの組み合わせ)の量は、望ましい崩壊速度、並びに味マスキング、舌触り及び後味を含めた望ましい官能特性に応じて様々であり得る。本発明の組成物中の速分散性顆粒の量は、約30%〜約90%の範囲、例えば約40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、及び約85%であり得る(全ての値、範囲、及びその間の部分的範囲を含む)。一実施形態において、速分散性顆粒の量は組成物の全重量の約60〜70%である。別の実施形態において、速分散性顆粒の量は約65重量%である。
【0068】
本発明の口腔内崩壊性組成物中における薬物を含む多重被覆粒子の1つ又は複数の集合の総量は、約5%〜約50%の範囲、例えば約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、約45%、及び約50%であり得る(全ての値、範囲、及びその間の部分的範囲を含む)。一実施形態において、本発明の口腔内崩壊性組成物中における味がマスキングされた薬物粒子の量は、口腔内崩壊性組成物の約30重量%である。
【0069】
いくつかの実施形態において、本発明のODT組成物中における味がマスキングされた薬物粒子の集合の、CRコーティングで被覆された粒子の集合との比は、約1:4から約1:1まで様々であり得る。1つ又は複数の味マスキング層(本明細書に記載されるとおりの)は、味マスキング方法の任意の好適な組み合わせ、例えば(1)コアセルベーション法、続いて流動層コーティング法、(2)流動層コーティング法、続いてコアセルベーション法、(3)コアセルベーション法、続いて2回の連続する流動層コーティング法、及び(4)流動層コーティング法、続いてコアセルベーション法、続いて流動層コーティング法により薬物粒子上に施すことができる。
【0070】
本発明の組成物は、1つ又は複数の薬学的に許容可能な香味剤をさらに含み得る。かかる香味剤の非限定的な例としては、例えば、錠剤重量を基準として最大約5%までの、チェリー、スペアミント、オレンジ、若しくは他の許容可能な果実香味料、又はチェリー、スペアミント、オレンジ、及び他の許容可能な果実香味料の混合物が挙げられる。加えて、本発明の組成物はまた、アスパルテーム、スクラロース、又は他の薬学的に許容可能な甘味料などの1つ又は複数の甘味料、又はかかる甘味料の混合物も、錠剤重量を基準として最大約2重量%まで含むことができる。さらに本発明の組成物は、1つ又は複数のFD&C着色料を、錠剤重量を基準として最大約0.2重量%〜約2重量%まで含むことができる。
【0071】
本発明の組成物はまた、崩壊剤含有顆粒(例えば、ラニチジンを含有する顆粒及び/又は速分散性の顆粒)中の崩壊剤に加え、追加的な崩壊剤も含むことができる。追加的な崩壊剤は、崩壊剤含有顆粒中に使用されるものと同じ崩壊剤であっても、又は異なる崩壊剤であってもよい。追加的な崩壊剤は本発明の組成物中に、錠剤重量を基準として最大約10%まで存在してもよい。
【0072】
本発明の組成物はまた、微結晶性セルロースなどの薬学的に許容可能な充填剤、例えばAvicel PH101、Avicel PH102、Ceolus KG−802、Ceolus KG−1000、Ceolus UF 711、Prosolv SMCC 50又はSMCC 90又は他の薬学的に許容可能な等級の微結晶性セルロース、並びにそれらの混合物も含むことができる。
【0073】
一実施形態において、本発明の口腔内崩壊性組成物は、水不溶性ポリマー(例えば、エチルセルロース)を含む味マスキング層と、それに続いて非ポリマー性甘味料の圧縮性コーティング層とでコアセルベート化した約25〜35%の薬物粒子、約60〜70%の速分散性顆粒(例えば、クロスポビドン及びマンニトールを含む);約5%の追加的な崩壊剤(例えばクロスポビドン);約5重量%〜15重量%の微結晶性セルロース、約0.5〜2.0%の1つ又は複数の香味料、及び約0.5%〜1%の甘味料(例えばスクラロース)を含む。さらに、速分散性微顆粒は、噴霧乾燥マンニトール、又はMerck KGaAから「Parteck(登録商標)200又は300」として市販される特別に加工されたマンニトール顆粒、BASFからの「Ludiplus(登録商標)(特別に加工されたラクトース顆粒)」及び「Ludiflash(登録商標)(特別に加工されたマンニトール顆粒)」、GalenIQ(登録商標)凝集イソマルトに部分的に置き換えられてもよい。
【0074】
本発明の特定の実施形態において、本方法は以下のステップを含み得る:
i.薬物粒子(例えば、結晶、薬物層がレイヤリングされたビーズ、顆粒、又はVector Freund(Iowa)のGranurexを使用する球形化の制御又は粉末レイヤリングによるペレット、平均粒度約400μm以下)の味を以下によりマスキングするステップ、すなわち(a)水不溶性ポリマー(例えば、平均粘度が100cpsのエチルセルロース)による、及び任意選択により微粉化炭酸カルシウムなどの無機又は有機細孔形成剤との組み合わせでの、約10%w/w〜約40%w/wの重量増加とする溶媒コアセルベーション、又は(b)同時係属中の2005年8月26日に出願された米国特許出願第11/213,266号明細書(米国特許出願公開第2006/0105038号明細書)、2005年8月26日に出願された米国特許出願第11/256,653号明細書(米国特許出願公開第2006/0105039号明細書)、又は2005年10月12日に出願された米国特許出願第11/248,596号明細書(米国特許出願公開第20060078614号明細書)(これらの内容はあらゆる目的から参照により援用される)の開示に従う、水不溶性ポリマー(例えば、エチルセルロース)による約10%w/w〜約20%w/wの重量増加とする溶媒コアセルベーションと、それに続く水不溶性ポリマー(例えば、エチルセルロース)の胃溶性細孔形成剤(例えば、炭酸カルシウム)との組み合わせによる流動層コーティング、及び(c)非ポリマー性圧縮性甘味料(例えば、スクラロース)による圧縮性コーティングの適用、スクラロースなどの非ポリマー性圧縮性コーティング材料を含む圧縮性コーティングによる、味がマスキングされた薬物粒子のさらなる被覆;
ii.マンニトールなどの糖アルコール又はラクトースなどのサッカリドとクロスポビドンとの粉末混合物を、例えば欧州特許第0914818号明細書及び同時係属中の2004年4月19日に出願された米国特許出願第10/827,106号明細書(米国特許出願公開第2005/0232988号明細書)(これらの内容は本明細書によって参照により援用される)の開示を使用して造粒するステップであって、それにより速分散性微顆粒を生成するステップ;
iii.ステップ(i)の味がマスキングされた薬物粒子と、ステップ(ii)の速分散性微顆粒と、他の薬学的に許容可能な賦形剤との適量をブレンドするステップ;及び
iv.口腔内で唾液と接触すると急速に崩壊して滑らかな嚥下し易い懸濁液を形成し、且つ90%信頼区間80.0%〜125.0の範囲の薬物動態パラメータを呈し得る前記薬物の必要用量を含む口腔内崩壊錠となるように、米国特許第6,964,779号明細書及び米国特許第5,700,492号明細書(これらは各々、全体として参照により援用される)の開示に従いステップ(iii)のブレンド物を圧縮するステップ。
【0075】
本発明の、味がマスキングされた組成物の調製方法の一実施形態は、以下を含む:
a.第1のコーティングステップ、これは、流動層コーターで薬物粒子(例えば、結晶、薬物層がレイヤリングされたビーズ、顆粒、又はVector Freund(Iowa)のGranurexを使用する球形化の制御又は粉末レイヤリングによるペレット、平均粒度約400μ以下)を水不溶性ポリマー、腸溶性ポリマー、又は脂肪酸及び/又はエステルで2重量%〜50重量%の重量増加となるよう被覆するステップを含む;
b.第2の任意選択のコーティングステップ、これは、ステップ(a)の前記被覆薬物粒子を、水不溶性ポリマーと腸溶性ポリマーとを含む第2のポリマーコーティング材料で10重量%〜40重量%の重量増加となるよう被覆し、それにより制御放出性コーティングで被覆された薬物粒子を形成することを含む;及び
c.非ポリマー性甘味料(例えば、スクラロース、ラクチトール、又はマルチトール)による2重量%〜10重量%の重量増加とする外側圧縮性コーティング、これにより圧縮性コーティングで被覆された制御放出性(CR)薬物含有微粒子が形成される。
【0076】
ポリマー材料は、前記マイクロカプセルに対して約10重量%〜約30重量%の前記第1又は第2の膜を含み得る。
【0077】
本発明の特定の実施形態において、本方法は以下のステップを含み得る
i.水不溶性ポリマー(例えば、平均粘度が100cpsのエチルセルロース)による約4〜8%w/wの重量増加とするコアセルベーション法により、薬理活性薬物又はその薬学的に許容可能な塩、溶媒和物、エステル及び/又は混合物の薬物含有微粒子を調製するステップ;
ii.ステップ(i)の薬物粒子上にポリマー結合剤溶液から低用量成分(例えば、ヒドロコドンなどのオピオイド鎮痛薬)をレイヤリングするステップ;
iii.前記オピオイドコーティングで被覆された薬物粒子を覆って配置して、親水性ポリマーを単独で又は水不溶性ポリマーとの組み合わせで含む第2の味マスキング層を、2010年5月3日に出願された米国特許出願第12/772,770号明細書又は2010年5月3日に出願された米国特許出願第12/772,776号明細書(これらの内容は本明細書によってあらゆる目的から全体として参照により援用される)の開示に従い施すステップ;及び
iv.外側圧縮性コーティングを、非ポリマー性甘味料(例えば、スクラロース、ラクチトール、又はマルチトール)により2重量%〜10重量%の重量増加となるよう施すステップであって、それにより味がマスキングされた薬物粒子を打錠する間の膜の破断を最小限に抑えるステップ。
【0078】
本発明の特定の他の実施形態において、本方法は以下のステップを含み得る:
i.上記に記載したとおりの平均粒度が400μm以下の粒子を含有する圧縮性コーティング被覆CR薬物を調製するステップ;
ii.マンニトールなどの糖アルコール又はラクトースなどのサッカリドとクロスポビドンなどのスーパーディスインテグラント(super disintegrant)との粉末混合物を造粒するステップであって、それにより速分散性微顆粒を生成するステップ;
iii.ステップ(i)のCRコーティング被覆薬物粒子と、ステップ(ii)の速分散性微顆粒及び/又は他の薬学的に許容可能な賦形剤、例えば、1つ又は複数の香味剤、着色料、甘味料、希釈剤/充填剤/圧縮助剤、例えば微結晶性セルロースなど、噴霧乾燥ラクトース、及び追加的な崩壊剤などとの適量をブレンドするステップ;及び
iv.ステップ(iii)のブレンド物を、薬剤を必要とする患者又は対象への経口投与に必要な用量の薬物を含む口腔内崩壊錠又は速分散錠に圧縮するステップ。このように生成されたODT錠剤は、口腔内で唾液に接触すると急速に崩壊して滑らかな嚥下し易い懸濁液を形成し得る。速分散錠は水又は体液に接触すると急速に分散し、消化されると望ましい薬物動態パラメータを呈する。
【0079】
一実施形態において、第1のコーティングステップは、(i)水溶性ポリマーを極性及び/又は非極性有機溶媒混合物と混合して前記ポリマーを溶解させること、及び前記薬物粒子を望ましい流動化生成物層温度に維持しながら前記薬物粒子上にコーティングを施すことを含み、及び前記第2のコーティングステップは、(i)前記第1の被覆薬物粒子を第1の水不溶性ポリマー(エチルセルロース)及び非極性有機溶媒(シクロヘキサン)及び相誘導剤(phase inducer)(ポリエチレンワックス)と混合して前記薬物粒子−ポリマー混合物を形成すること;(ii)前記薬物粒子−ポリマー混合物を第1の温度で加熱し、それにより前記第1のポリマー材料を前記非極性有機溶媒中に溶解させること;(iii)前記薬物粒子−ポリマー混合物を撹拌しながら時間をかけて第2の温度に冷却し、被覆薬物粒子の分散体を形成すること;(iv)前記被覆薬物粒子を回収すること;及び(v)非ポリマー性圧縮性材料(例えば、スクラロース)の圧縮性コーティングを乾燥させた前記被覆薬物粒子上に施すことを含む。別の実施形態では、この製造工程に、圧縮性コーティングを施す前に流動層コーターで前記コアセルベート化した第1のポリマー被覆薬物粒子に香味料−甘味料コーティング組成物を施すさらなるステップが含まれてもよい。さらに別の実施形態では、この全製造工程に、圧縮性コーティングの前に流動層コーターで前記香味料被覆薬物粒子に第2のコーティング組成物を施すさらなるステップが含まれてもよい。
【0080】
一実施形態において、上記に記載したとおりの前記第1のコーティングを有する薬物粒子は第2のコーティングでさらに被覆され、これは(i)水不溶性ポリマー(エチルセルロース)、逆腸溶性ポリマー(Eudragit E100)、可塑剤(クエン酸トリエチル)を非極性溶媒と混合して溶解させるステップと、(ii)粘着防止剤(タルク又はステアリン酸マグネシウム)を均一に懸濁するステップと、(iii)一個ずつ被覆された薬物粒子上に、前記一個ずつ被覆された薬物粒子を望ましい生成物温度に維持しながら、且つ前記薬物粒子の凝塊形成を回避するよう適切に流動化された状態で噴霧するステップと、(iv)前記被覆薬物粒子上に圧縮性コーティングを施すステップと、により行われる。別の実施形態では、この全製造工程に、流動層コーターで前記第1のポリマー被覆薬物粒子上に香味料−甘味料コーティング組成物を施すさらなるステップが含まれてもよい。
【0081】
別の実施形態において、流動層コーターで施される第1及び第2の双方のコーティングステップには、約2%〜約20%w/wの増加量となるように施される水不溶性ポリマーと任意選択の水溶性又は逆腸溶性ポリマーとを含む第1の膜と、被覆薬物粒子の最大約40重量%の全重量増加となるように施される水不溶性ポリマーを腸溶性ポリマーと組み合わせて約9:1〜約1:4の比で含む第2の膜と、それに続く圧縮性コーティングとが含まれる。
【0082】
別の実施形態において、本発明の組成物の調製方法はまた、非ポリマー性圧縮性コーティング材料(例えば、スクラロース)で被覆される被覆薬物粒子、すなわち持続放出性(SR)、遅延放出性(DR)、時限パルス放出性(TPR)及び/又は制御放出性(SRコーティング又はDRコーティング上のTPRコーティング)ビーズを生成するための被覆ステップも含む。本発明の組成物の味がマスキングされた及び/又は制御放出性コーティングで被覆された薬物粒子は様々な方法により調製することができ、例えば、エチルセルロースなどの水不溶性ポリマーによる、若しくは水不溶性ポリマーの胃溶性細孔形成剤との組み合わせによる溶媒コアセルベーション法、又は水不溶性ポリマー、腸溶性ポリマー、逆腸溶性ポリマー、及びその混合物による流動層コーティング法が挙げられる。マイクロカプセル化された薬物粒子のコーティング重量は、約5%〜約50%の範囲、例えば、約10%、15%、20%、25%、30%、35%、40%、及び45%であり得る(全ての範囲及びその間の部分的範囲を含む)。
【0083】
或いは、薬物粒子は初めに、流動層コーターにおいて、水不溶性ポリマー(例えばエチルセルロース)又は腸溶性ポリマー(例えばフタル酸ヒプロメロース)と有機溶媒とを含む溶液、及び/又は水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含む溶液により約10%〜約50%w/wの重量増加となるよう被覆される。水不溶性ポリマーの腸溶性ポリマーとの比は、約50/50〜95/05の範囲、例えば、約55/45、約60/40、約65/35、約70/30、約75/25、約80/20、約85/15、及び約90/10であり得る(全ての範囲及びその間の部分的範囲を含む)。マイクロカプセル化された薬物粒子のコーティング重量は、約5%〜約30%の範囲、例えば、約10%、15%、20%、及び25%であり得る(全ての範囲及びその間の部分的範囲を含む)。かかる制御放出性コーティングの被覆プロセスの例は、米国特許第6,627,223号明細書;米国特許第6,500,454号明細書;米国特許第7,387,793号明細書及び同時係属出願の米国特許出願公開第2006/0246134号明細書;米国特許出願公開第2007/0190145号明細書;米国特許出願公開第2007/0196491号明細書;米国特許出願公開第2009/0232885号明細書;米国特許出願公開第2009/0258066号明細書;国際公開第2010/096820号パンフレット;国際公開第2010/096814号パンフレット)(これらの内容はあらゆる目的から全体として参照により本明細書に援用される)に開示されている。これらのCRコーティング被覆薬物粒子は、非ポリマー性圧縮性甘味料(例えばラクチトール)を含む最外層の圧縮性コーティングでさらに被覆される。
【0084】
球形化の制御又は粉末レイヤリングによるVector CorporationのGranurex(商標)又は同等の機器(例えば、回転式造粒機)を使用して生成された高薬物負荷ペレットを含む、本発明の快い味を呈する口腔内崩壊錠又は速分散錠(すなわち、ODT又はRDT)製剤を生成する方法の一実施形態は、(i)医薬品有効成分、任意選択の流動助剤(W.R.GraceのコロイドシリカSyloid)、及び任意選択の結合剤(例えば、PVP K−30)をGranurexボウルに装入するステップと、(ii)10%結合剤溶液を回転している材料層に制御された速度で噴霧すると同時に、粉末レイヤー(powder layer)(K−Tron)でユニット内に粉末を制御された速度で加え、ペレットの形態の混合粉体を結合させるステップと、(iii)このように生成したペレットを乾燥させるステップと、(iv)前記ペレット上に1つ又は複数の味マスキング膜又はCRコーティング膜を施し、続いて非ポリマー性圧縮性材料の圧縮性コーティングを施すステップと、(v)崩壊剤、糖アルコール及び/又はサッカリドを含む速分散性顆粒を調製するステップと、(vi)経口剤形を形成するステップとを含む。経口剤形をODT又はRDTとして形成するステップは、例えば、前記圧縮性コーティングで被覆された、味がマスキングされた微粒子又はCR薬物を含有する微粒子と、前記速分散性顆粒及び/又は充填剤とを含むブレンド物を、任意選択により薬学的に許容可能な1つ以上の矯味剤、1つ以上の甘味料、1つ以上の他の崩壊剤、1つ以上の着色料及び/又は微結晶性セルロースなどの圧縮助剤と共に十分な分量で、錠剤成形機、例えば圧縮前に杵及び臼を潤滑させる外部潤滑システムを備えた回転式錠剤成形機を使用して、口腔内崩壊錠又は速分散錠形態に圧縮するステップを含み得る。これらの口腔内崩壊錠は、口の中で唾液に曝露されると急速に崩壊し、ざらついた後味のない滑らかな嚥下し易い懸濁液になる。速分散錠は、薬剤を必要とする対象又は患者において疾患状態の治療のため、投与様式−(1)錠剤を丸ごと嚥下する、(2)錠剤を2つに半割して個別に嚥下する、及び(3)錠剤を約150mLの水に分散させ、かき混ぜて飲む−のうちの一つによって経口投与するのに好適である。
【0085】
別の実施形態において、本発明の方法は、圧縮性コーティングで被覆された、味がマスキングされた微粒子又はCRコーティングで被覆された微粒子と、1つ又は複数の香味剤と、甘味料と、速分散性微顆粒と、微結晶性セルロースと、追加的な崩壊剤と、ステアリン酸マグネシウムとを混合し、従来の回転式錠剤成形機を使用してその混合物を口腔内崩壊錠に圧縮することによる、口腔内崩壊錠の調製ステップを含む。これにより形成された口腔内崩壊錠は、以下を提供し得る:口腔内で唾液に接触したときの急速な崩壊、快い味(良質なクリーム様の口当たり)、及び胃内での急速で実質的に完全な用量放出又は患者体内での1つ又は複数の疾患状態の治療に望ましい目標放出又は血漿濃度−時間プロファイル。
【0086】
別の実施形態において、本発明の方法は、圧縮性コーティングで被覆された、圧縮性コーティングで被覆された、味がマスキングされた微粒子又はCRコーティングで被覆された微粒子と、1つ又は複数の充填剤/希釈剤(例えば、噴霧乾燥ラクトース(例えば、Fast Floラクトース)と、微結晶性セルロースと、噴霧乾燥マンニトールと、Ludiplus(登録商標)(顆粒化ラクトース)と、Ludiflash(登録商標)(顆粒化マンニトール)と、Parteck(登録商標)200/300(加工マンニトール)と、追加的な崩壊剤と、ステアリン酸マグネシウムとを混合し、従来の回転式錠剤成形機を使用してその混合物を速分散錠に圧縮することによる、速分散錠の調製ステップを含む。これにより形成された速分散錠は、以下を提供し得る:水又は体液に接触したときの急速な分散、及び胃内での急速で実質的に完全な用量放出又は望ましい目標放出プロファイル。
【0087】
理論及び/又は作用機序に拘束されるものではないが、前記被覆薬物粒子(すなわち、味がマスキングされた、又は制御放出性コーティングで被覆された苦味を呈する薬物コア)上に配置される圧縮性コーティングにより、以下を実現することが可能となる−(i)前記圧縮ブレンド物をODT又はRDTに打錠する間の膜の破断を最小限に抑え/解消する、(ii)口腔内で唾液に接触したときに薬物の苦味(biiter)が知覚されることを最小限に抑え/解消する、(iii)前記ODT又はRDT製剤の前記制御放出性コーティングで被覆された薬物粒子からの同様のインビトロ−インビボ放出プロファイル、及び(iv)場合によっては、前記圧縮性コーティングが存在しない場合に有効な味マスキングを達成するのに必要な被覆レベルを低下させる。
【0088】
インビトロ崩壊時間/溶解試験
崩壊時間はUSP<701>崩壊試験手順を用いて計測される。味がマスキングされた、及び/又はCRコーティングで被覆された微粒子及び口腔内崩壊錠の味マスキング特性は、必要であれば監督のもと、承認されたプロトコルにより健常ボランティアパネルを使用して評価されてもよい。例えば、pHが約6.8〜7.0の500mLの模擬唾液中においてUSP装置2(パドル、50rpm)を使用して溶解試験を行ったときの薬物放出率(約3分間で約10%以下の用量放出が許容範囲と見なされる)が決定される。加えて、薬物放出率を決定することにより、37.0±0.5℃で900mLの0.01N HCl中においてUSP装置2(パドル、50rpm)を使用して溶解試験を行ったときの、味がマスキングされた微粒子及び口腔内崩壊錠の胃内急速放出特性が評価され得る(塩酸ラニチジンの場合には、約30分間で約70%以上の用量放出が許容範囲と見なされる)。米国薬局方装置1(バスケット、100rpm)又は装置2(パドル、50rpm)、薬物毎に特別に開発されたHPLC法を使用して、錠剤の効力並びにCRコーティング被覆薬物粒子及びODT CR又はRDT CR製剤の薬物放出プロファイルが決定される。
【0089】
その様々な実施形態において、圧縮性コーティングで被覆された、味がマスキングされた微粒子及び/又はCR微粒子を含む本発明の口腔内崩壊錠組成物は、以下の特性の1つ又は複数を示す:
(1)ボトル及びプッシュスルー又は剥離式背面台紙ブリスターパッケージングへの包装、保管、輸送及び商品流通に好適な許容される硬度及び摩損度;
(2)口腔内で唾液に接触すると約60秒で崩壊し、快い味の(ざらつき又は後味のない)滑らかな嚥下し易い懸濁液を形成し、<USP 701>崩壊試験法で30秒以下の規格を満たす;
(3)味がマスキングされた及び/又はCRコーティングで被覆された薬物粒子が滑らかな舌触りを呈し(ざらつきがない)、且つ後味を呈しない;及び
(4)USP装置2(パドル、75rpm)を使用して溶解試験を行ったとき、900mLの0.01N HCl緩衝液中約45分間で用量の約85%の溶解規格を満たすことから明らかなとおり、胃に入ると、味がマスキングされた薬物粒子からの急速で実質的に完全な用量放出をもたらす、及び/又はUSP装置2(パドル、50rpm、最初の2時間について700mLの0.1N HCl中、続いて900mLの緩衝液中pH6.8でさらに試験)を使用して溶解試験を行ったとき薬物放出規格を満たすことから明らかなとおり、1つ以上の望ましい(目標)放出プロファイルを提供する。
【0090】
その様々な実施形態において、圧縮性コーティングで被覆された、味がマスキングされた微粒子及び/又はCR微粒子を含む本発明の速分散錠組成物は、以下の特性の1つ又は複数を示す:
(5)ボトル及びプッシュスルー又は剥離式背面台紙ブリスターパッケージングへの包装、保管、輸送、商品流通、及び最終使用に好適な許容される硬度及び摩損度;
(6)水又は体液に接触すると急速に分散し、それにより1つ又は複数の疾患状態を治療するため3つの投与様式のうちの1つにより患者又は対象に経口投与することが可能である;
(7)味がマスキングされた及び/又はCRコーティングで被覆された薬物粒子が、RDTに高速圧縮する間の膜の破断に抵抗性を示す;及び
(8)USP装置2(パドル、75rpm)を使用して溶解試験を行ったとき、900mLの0.01N HCl緩衝液中約45分間で用量の約85%の溶解規格を満たすことから明らかなとおり、胃に入ると、味がマスキングされた薬物粒子からの急速で実質的に完全な用量放出をもたらす、及び/又はUSP装置2(パドル、50rpm、最初の2時間について700mLの0.1N HCl中、続いて900mLの緩衝液中pH6.8でさらに試験)を使用して溶解試験を行ったとき薬物放出規格を満たすことから明らかなとおり、1つ以上の望ましい(目標)放出プロファイルを提供する。
【0091】
本発明の組成物は、胃腸障害、心血管疾患、中枢神経系疾患、糖尿病、アルツハイマー病又はパーキンソン病、統合失調症、精神病、癲癇、うつ病、双極性障害、感染症、肥満症、又は炎症性障害などの病態の治療又は予防に有用である。本発明の組成物は、必要量の1つ以上の薬物を、疾患状態の重症度及び、及び/又は患者の健康状態に応じた望ましい血漿濃度−時間プロファイルを提供する適切な比で含み得る。例えば、本発明の組成物は、例えば病態の重症度及び患者の健康状態に応じて、単一の1日量、又は複数の1日量で投与することができる。
【0092】
以下の非限定的な例は、圧縮性コーティングで被覆された、味がマスキングされた微粒子及び/又はCR薬物を含有する微粒子を含む本発明の組成物、又は口腔内崩壊錠若しくは速分散錠剤形を例示し、ここで組成物は、圧縮性コーティングで被覆された薬物、又はその薬学的に許容可能な塩、異性体、エステル、及び/又は混合物を含む。本発明の組成物は本明細書に記載されるとおり調製され、許容される官能又は容易な経口投与様式及び/又は打錠の特性並びに意図した投与レジメンに応じた摂取時の望ましい薬物動態プロファイルを示す。
【実施例】
【0093】
実施例1
1.A アセトアミノフェンを含むマイクロカプセル:工業規模の200ガロン、500ガロン又は1000ガロンシステムを使用する工業規模のアセトアミノフェンマイクロカプセルの生成は、プロセスにコンピュータ処理されたレシピ(例えば、6%コーティングでの200ガロンシステムに対する分量−アセトアミノフェン(APAP):94.1kg;Ethocel 100:10.5kg、Epolene:2.1kg及びシクロヘキサン:142ガロン)を使用する。タンクを約107±5rpmで撹拌しながら予め定義した加熱プロファイルにより約80℃に加熱し、続いて制御しながら周囲温度の35℃NMT(以下)に冷却する。マイクロカプセル層を真空ろ過に供し、シクロヘキサンでリンスして残留ポリエチレンを洗い流す。マイクロカプセルを流動層乾燥機に移し、段階的な乾燥レシピ(例えば、入口温度設定25℃、35℃及び最後に99℃)に供し、4〜6時間にわたり乾燥させてシクロヘキサンレベルを1000ppm以下に低下させる。乾燥したマイクロカプセルを16MGメッシュスクリーンで篩別して、形成された場合には大きい凝集体を廃棄する。同じ手順の後、10%EC−100コーティングのマイクロカプセルのバッチを500ガロンシステム(単一のタンク)において溶媒コアセルベーション法によって調製した。
【0094】
1.B 味がマスキングされた、ヒドロコドン層をレイヤリングしたアセトアミノフェンマイクロカプセル:酒石酸水素ヒドロコドン(HCB)(240g)をヒドロキシプロピルセルロースの水溶液(2400gの水中26.7gのヒドロキシプロピルセルロース(Klucel LF)に徐々に添加し、十分に混合して溶解させた。上記ステップ1.Aの6重量%(3733.3g)のアセトアミンフェン(acetaminphen)のマイクロカプセルを、Glatt流動層コーターGlatt GPCG 5(9インチボトムスプレーワースターインサート、35mmカラム高さ、「D」空気分配プレート、及び200メッシュ生成物保持スクリーンを装備)において以下の条件下で薬物レイヤリング製剤により被覆した−入口空気温度:60±3℃;生成物温度:40±5℃;噴霧空気圧力2.0バール;ポート径:1.0mm;流量:8mL/分 段階的に26mL/分まで増加させる、空気量:50±5CFM。薬物をレイヤリングした後、ヒドロキシプロピルセルロース(10%固形分で50/50アセトン/水中210.5g、各1650g)のシールコーティング/味マスキング溶液を、薬物層をレイヤリングしたビーズ上に5%の重量増加となるよう噴霧した。乾燥させたIR薬物粒子を35メッシュ及び80メッシュスクリーンで篩別して過大なサイズの微粒子及び微粉を廃棄した。
【0095】
1.C 圧縮性コーティングで被覆されたヒドロコドン/アセトアミノフェンマイクロカプセル:上記ステップ1.Bのヒドロコドン/アセトアミノフェンマイクロカプセル(3400g)を、ボトムスプレーワースターインサートを装備したGlatt GPCG 5において、水(1014g)中に溶解したスクラロース(179g)を含有する圧縮性コーティング配合物で5%の重量増加となるように、以下の処理条件で被覆した:−8mL/分の噴霧速度、段階的に15mL/分まで増加させる;生成物温度32±2℃。被覆完了後、圧縮性コーティング被覆薬物粒子はユニットで約5分間乾燥させて残留水分を最小限に抑え、微粉及び二倍の大きさのもの(double)が形成された場合には篩別してそれらを廃棄する。
【0096】
1.D 速分散性顆粒:速分散性微顆粒は、マンニトールなどの糖アルコール及び/又はラクトースなどのサッカリドと、クロスポビドンなどの崩壊剤とを含む。糖アルコール及び/又はサッカリド及び崩壊剤は、典型的には速分散性微顆粒中に約99:1〜約90:10(糖アルコール及び/又はサッカリド対崩壊剤)の比で存在し得る。例えば、約95/5の比の、平均粒度が約15μmの糖アルコールであるD−マンニトールと、スーパーディスインテグラント(super disintegrant)であるクロスポビドンXL−10とを、高剪断造粒機において造粒液として精製水を使用して造粒し、湿式粉砕し、トレイ乾燥オーブンにおいて1重量%未満のLODとなるよう乾燥させ、乾式粉砕して平均粒度が約200〜400μmの速分散性顆粒を生成した。
【0097】
1.E ヒドロコドン/アセトアミノフェンODT:微結晶性セルロース(MCC)、スクラロース、崩壊剤、及び香味料(ODT製剤の組成については表1を参照のこと(例えば、配合A〜D)をVブレンダーでブレンドした。この予備ブレンド物と、上記ステップ1.C及び1.Aの味がマスキングされたヒドロコドン/アセトアミノフェンマイクロカプセル(10%EC−100コーティングのアセトアミノフェン)の必要量と、ステップ1.Dの速分散性微顆粒の必要量とを、Vブレンダーで30分間混合してブレンド物の均質化を達成し、重量約1400mgの500mgアセトアミノフェンOTDに圧縮した。各圧縮サイクル前に杵及び臼の表面を潤滑させるための外部潤滑装置であるMatsui Ex−Lub Systemを装備したHata錠剤成形機で配合A、B、及びDを圧縮した一方、圧縮混合物Cはステアリルフマル酸ナトリウムとブレンドしてからHata成形機で圧縮した。配合A〜Dは、それぞれ5mg、5mg、25mg及び34mgの酒石酸水素ヒドロコドンからなる。表1に示されるとおり、ポリマー圧縮性コーティング材料(例えば、ヒドロキシプロピルセルロース(Klucel LF))で被覆されたヒドロコドン/アセトアミノフェンマイクロカプセル及び/又は疎水性味マスキング層を覆って配置された圧縮性コーティング層を有しないアセトアミノフェンマイクロカプセルに代わり、圧縮性コーティングで被覆されたヒドロコドン/アセトアミノフェンマイクロカプセルの割合が増加すると、打錠特性が向上し、すなわち錠剤硬度が増加したとともに摩損度が低下し、予期されたとおり、より低い圧縮力であっても打錠性が向上した錠剤を圧縮することができた。

【0098】
実施例2
2.A 5ガロン溶媒システムにおけるマイクロカプセル化:塩酸ラニチジン(望ましい粒度/アスペクト比の規格を満たすShasun Drugs and ChemicalsのForm II)を、トップスプレーを装備したGlatt GPCG 1(VersaGlatt)において、4%固形分のOpadry Clear(ヒプロメロース)水溶液で2%w/wの重量増加となるよう流動層コーティング法により被覆した。噴霧条件−ポート径:0.8mm;噴霧空気圧力:1.5バール;ボトム空気分配プレート:造粒プレート;入口空気温度:60℃;生成物温度:28〜34℃;噴霧速度:5mL/分、出口フラップ:40%;及び振盪間隔/時間:30秒/3秒。流動層コーティング法で被覆したラニチジンについて、5ガロンシステムで溶媒コアセルベーション法により味をマスキングした。10,000gのシクロヘキサンを充填した5ガロンシステムに、エチルセルロース(Dow ChemicalsのEthocel Standard Premium 100;200g)、ポリエチレン(Epolene C−10;200g)、及び薬物(466.7g)を装入した。システムを制御された加熱サイクルに供して80℃の温度を達成し、300RPMの速度で内容物を撹拌しながらエチルセルロースを溶解した。その後、システムを45分間以上で<30℃まで冷却サイクルに供し、薬物結晶を滑らかなコーティングにより、30重量%で、且つ凝集塊が形成されないようにして包み込んだ。マイクロカプセルをデカンテーションにより分離し、新鮮なシクロヘキサンで洗浄し、フード内で乾燥させた。30メッシュ(<590μm)スクリーンで篩別したマイクロカプセルを収集した。流動層コーティング法で被覆されたラニチジンの一つのバッチもまた、8:3の比のEthocelと無機胃溶性細孔形成剤の微粉化炭酸カルシウムとで、冷却サイクル中に約58℃のタンク温度で微粉化細孔形成剤を含有するスラリーを均一に分散させることによりマイクロカプセル化した。
【0099】
2.B 圧縮性コーティングで被覆されたラニチジンマイクロカプセル:上記ステップ2.Aのラニチジンマイクロカプセル(EC−100被覆、3401g)をGlatt GPCG 5においてステップ1.Cに記載する手順に従い、水(1014g)中に溶解したスクラロース(179g)を含む圧縮性コーティング配合物で5%の重量増加となるよう被覆する。上記ステップ2.Aのラニチジンマイクロカプセル(EC−100/CaCO3被覆、3401g)もまた、Glatt GPCG 5において、水(1014g)中に溶解したスクラロース(179g)を含む圧縮性コーティング配合物で5%の重量増加となるよう被覆する。
【0100】
2.C 圧縮性コーティングで被覆したラニチジンマイクロカプセルを含むODT:上記ステップ2.Aからの味がマスキングされた被覆ラニチジン薬物粒子(24〜33%w/wのEC−100及びEC−100/CaCO3)と、速分散性顆粒(68〜55%w/w)と、崩壊剤(5%w/w)と、甘味料(0.1〜0.5%w/w)と、香味料の組み合わせ(0.5〜3.5%w/w)と、MCC(0〜10%w/w)と、着色料(0.1〜0.3%w/w)とを合わせてVブレンダーでブレンドし、150mg(ラニチジンを基準として)のODTに圧縮した。これらの錠剤は、許容可能な官能特性及び溶解プロファイルを有した。圧縮性コーティングで被覆したマイクロカプセル(EC−100又はEC−100/CaCO3被覆)もまたODTに圧縮する。

【0101】
実施例3
3.A ジフェンヒドラミンHCl IRビーズ:プロペラミキサーを装備した床置きステンレス鋼製タンクに300kgのアセトンNFを充填した。タンクを約850rpm±25rpmで撹拌しながらタンクに精製水USP(93.3kg)を徐々に添加した。タンクに塩酸ジフェンヒドラミン(76.5kg)を徐々に添加して溶解させ、続いて8.42kgのKlucel LFを同じタンクに添加して溶解させ、その間継続的に撹拌を続けた。86.4kgのアセトン及び9.6kgの水が入った別のステンレス鋼製タンクにヒドロキシプロピルセルロース(Klucel LF;6.12kg)を徐々に添加して溶解させた。60〜80メッシュ球状糖(215kg)を、32インチボトムスプレーワースターインサートを装備した予熱済みのGlatt流動層コーターGPCG 120に装入した(3 23.75インチ高さ;インナーボトム空気分配プレート:G1;外側プレート:C1;生成物保持プレート:100メッシュスクリーン;ノズル先端ポート径:50mm;処理空気温度:70℃;処理空気量:1500CFM;噴霧速度:1500(範囲:200〜2000)g/分;生成物温度:49〜51℃)。バッチレシピは300g/分での薬物レイヤリングステップで自動的に進み、それに合わせて流量及び入口温度が上昇し得る。処理パラメータは(最低)約30分毎に記録した。サンプルポートを介して生成物を定期的に検査し、噴霧中に凝集が起きていないことを確認した。薬物レイヤリング溶液の噴霧が終わると、300g/分の噴霧速度で2%重量増加となるようシールコーティングを施した。シールコーティングの完了後、ビーズをユニット内で乾燥させて余分な残留アセトンを除去した。このように生成したIRビーズを#32メッシュ及び#80メッシュスクリーンで篩別し、過大及び過小なサイズのビーズを廃棄した。
【0102】
3.B ジフェンヒドラミンHCl IRビーズの味マスキング:それぞれのタンクを備える二槽タンク500ガロンコアセルベーションシステムに、415ガロンのシクロヘキサン、61.5kgの塩酸ジフェンヒドラミンIRビーズ、20.5〜25.1kgのエチルセルロース及び10〜25kgのポリエチレンを75±5rpmで撹拌しながら装入した。このシステムをコンピュータ制御された「加熱及び保留」サイクルに供することにより、タンクの内容物を約80℃に加熱してエチルセルロースを完全に溶解させ、その後「フィルタ及び流動層乾燥」ルーチンに供することにより、タンクの内容物を約30℃に冷却した。温度が約65℃を下回るとエチルセルロースはそれ以上シクロヘキサンに溶けず、析出し始める。その間、相誘導剤(phase inducer)のポリエチレンで促進すると、エチルセルロースが個々の薬物粒子を被覆して味マスキングをもたらす。周囲温度に冷却した後、このように形成されたマイクロカプセルを真空ろ過し、新鮮なシクロヘキサンでリンスし、流動層機器において真空乾燥して所定の残留溶媒レベルを達成した。乾燥させたマイクロカプセルを、Kasonの篩装置を使用して40メッシュスクリーンで篩別し、ポリエチレン袋が二重に内張りされたファイバードラムに廃棄した。このようにして得られたマイクロカプセルは約18.4〜19.4%のアッセイを有し、10%以下が40メッシュ篩に残り、且つ10%以下が80メッシュ篩を通過する粒度を示し、及び75rpmで水中において溶解試験を行ったとき、5分で約11〜22%、45分で約62〜70%の平均溶解度を示した。
【0103】
3.C ジフェンヒドラミン微粒子のラクチトールコーティング:上記ステップ3.Bのジフェンヒドラミン微粒子を、上記ステップ1.Cに開示する手順に従いGlatt流動層コーターGlatt GPCG 3において、水中に溶解(%固形分)したヒドロキシプロピルセルロース(Klucel LF; g)とラクチトール( g)とを含む圧縮性コーティング配合物で5%の重量増加となるよう被覆する。乾燥させた圧縮性コーティング被覆ビーズを50メッシュ及び80メッシュスクリーンで篩別し、過大なサイズの微粒子及び微粉を廃棄する。
【0104】
3.D ジフェンヒドラミンマイクロカプセルを含むODT:上記ステップ3.Bのジフェンヒドラミン微粒子(34〜40%w/w)又は上記ステップ3.Cの圧縮性コーティング被覆ジフェンヒドラミン微粒子(32〜37%w/w)を、速分散性微顆粒(50〜56%w/w)と、クロスポビドン(5%w/w)、微結晶性セルロース(4〜10%w/w)、スクラロース(0.2〜0.5%)、バニラミント香味料(0.4〜1.0%)、及び着色料(0.1〜0.3%)を含む予備ブレンド混合物と共にVブレンダーで15分間ブレンドし、ステアリン酸マグネシウムを外部潤滑剤として使用してODTに圧縮する。これらの錠剤は、許容可能な官能特性、打錠性、及び薬物放出プロファイルを呈する。
【0105】
実施例4
4.A ジサイクロミンHCl IRビーズ:ポビドン(PVP K30;100.0g)を75/25の95%エタノール/水(2325.0gの95%エタノール及び775.0gの水)に、溶解するまで継続的に撹拌しながら10分間以上にわたり徐々に添加した。塩酸ジサイクロミン(800.0g)を、溶解するまで撹拌しながら徐々に添加した。7インチボトムスプレーワースター8インチ高さカラムを装備した、200メッシュ生成物保持スクリーンを被せた「B」ボトム空気分配プレートからの仕切りカラム間隙15mm(0.8mmポートノズル)のGlatt GPCG 3に2800gの60〜80メッシュ球状糖を装入し、ジサイクロミン溶液(20%固形分)を初期速度5g/分で15.5g/分まで段階的に増加させて、入口空気量90〜105m3/時間、空気噴霧圧力1.50バールで、生成物温度37±3℃を維持しながら噴霧した。スプレーシステムを50gのエタノールでリンスした後、薬物層をレイヤリングしたビーズをGlattユニット内で50分間乾燥させて残留溶媒(水分を含む)を除去した。得られたジサイクロミンIRビーズを35メッシュ及び120メッシュスクリーンで篩別して過大なサイズの粒子及び微粉を廃棄した。Cellets 100(球状微結晶性セルロース)の代わりにCellets 200を使用して、薬物負荷が30%w/wのジサイクロアミン(dicycloamine)IRビーズのバッチもまた調製する。
【0106】
4.B ジサイクロミンHCl SRビーズ:エチルセルロース(Dow ChemicalsのEC−10、Ethocel Premium 10;159.1g)を、95%エタノールに継続的に撹拌しながら徐々に添加して溶解させた。クエン酸トリエチル(TEC;15.9g)を徐々に添加して溶解させた。6インチボトムスプレーワースター6インチ高さカラム、200メッシュ生成物保持スクリーンを被せた「B」ボトム空気分配プレート、0.8mmポートノズルを装備したGlatt GPCG 1に、上記ステップ4.Aの700gのIRビーズを装入した。IRビーズに生成物温度33±3℃、噴霧空気圧力1.50バール、入口空気流量50〜75m3/時間で、及び初期流量1g/分として段階的に6g/分まで増加させて、20%のSRコーティング重量となるようにSR機能性ポリマーコーティング配合物(10%固形分)を噴霧した。噴霧後、被覆されたビーズをGlattユニット内で30分間乾燥させて残留溶媒(水分を含む)を除去した。得られたSRビーズを篩別して平均粒度が約500μm未満の粒子を得た。15%SR(EC−10/TEC)コーティングで被覆されたジサイクロアミン(dicycloamine)ビーズのバッチもまた、IRビーズ(Cellets 200上に30%薬物負荷)を使用して調製する。
【0107】
4.C ジサイクロミンHCl CRビーズ:エチルセルロース(EC−10;93.0g)を90/10のアセトン/水(1876.4gのアセトン及び208.5gの水)に激しく撹拌しながら徐々に添加して溶解させた。そのEC−10溶液にフタル酸ヒプロメロース(信越化学工業株式会社のHP−55;50.7g)を激しく撹拌しながら添加して溶解させた。その溶液にTEC(25.4g)を添加して溶解/均一に分散させ、それによりTPRコーティング配合物を形成した。実施例4.Bで調製した15%コーティング(395g)のSRビーズを、4インチワースターインサートを装備したGlatt 1において、生成物温度33±2℃、噴霧空気圧力1.50バール、入口空気量70〜90m3/時間、及び噴霧流量3〜6g/分で、TPRコーティング配合物(7.5%固形分)により30重量%のTPR被覆レベルとなるよう流動層コーティング法で被覆した。薬物放出試験用サンプルを、15重量%、20重量%及び25重量%の被覆レベルで抜き出した。平均粒度が約355gm未満の乾燥したビーズを篩別して回収した。15%SR(EC−10/TEC)コーティングで被覆されたジサイクロアミン(dicycloamine)ビーズ(Cellets 200)もまた、TPR(60/30/10のEC−10/HP−55/TEC)配合物で20%w/wの重量増加となるよう被覆し、CRビーズ(Cellts 200)を生成する。
【0108】
4.D ジサイクロミンCRビーズの圧縮性コーティング:上記ステップ4.Bの20%コーティングのジサイクロアミン(dicycloamine)SRビーズはまた、上記ステップ1.Cに開示される手順に従い、マルチトールを含有する圧縮性コーティング配合物で5%w/wの重量増加となるよう被覆される。同じ手順に従い、上記ステップ4.Cのジサイクロアミン(dicycloamine)CRビーズもまた、スクラロースを含有する圧縮性コーティング配合物で5%w/wの重量増加となるよう被覆する。
【0109】
4.E ジサイクロミンHCl ODT CR:薬学的に許容可能な成分(すなわち、チェリー香味料(0.5〜1.5%w/w)、スクラロース(0.1〜0.5%w/w)、クロスポビドン(クロスポビドンXL−10;3〜5%w/w)、及び微結晶性セルロース(Ceolus KG−802;3〜10%w/w)を、初めにVブレンダーでブレンドして均一に混合されたプレミックスを得る。速分散性微顆粒(上記実施例1.Dに記載されるとおり調製したもの;54〜65%w/w)を、上記ステップ4.Dの圧縮性コーティング被覆ジサイクロミンHCl CR又はSRビーズ(22〜33%w/w)と、先に調製したプレミックスと共にツインシェルVブレンダーでブレンドし、40mgジサイクロミンHCl ODT CR又はODT SRに圧縮した。
【0110】
従って、外部潤滑システム(Matsui Ex−Lub System)を装備した生産規模のHata錠剤成形機を使用して、最適化した打錠条件下で口腔内崩壊錠(例えば、ODT SR又はODT CR)が圧縮され、それらは、HDPEボトル、剥離台紙付きのAclar 200ブリスター、及び/又は「プッシュスルー」Aclarブリスターパックでの包装に好適な許容される打錠特性を呈する。例えば、圧縮性コーティング被覆SR又はCRビーズとして40mgジサイクロミンHClを含むODTは、以下の条件で圧縮される:−ツーリング:14mm円形、平坦な端面、アールの付いた縁部;圧縮力:12〜16kN;平均重量:800mg;平均硬度:約30〜60N;及び摩損度:0.2〜0.4%。このように生成されたジサイクロミンHCl ODT SR又はODT CR錠剤は口腔内で急速に崩壊して、被覆されたジサイクロミンHClビーズを含む滑らかな嚥下し易い懸濁液を生じ、1日1回又は2回の投与レジメンに好適な放出プロファイルを有し得る。
【0111】
実施例5
5.A 球形化の制御によるイブプロフェンペレット:ポビドン(PVP K−30;50g)を精製水(500g)に継続的に撹拌しながら徐々に添加し、10%w/w固形分でポリマー結合剤溶液を調製した。10gのコロイドシリカ(流動助剤、W.R.GraceのSyloid)をブレンドしたイブプロフェン(2000g)を、Vector Corporation(米国Iowa)のGranurex GX−40の生成物ボウルに装入した。10%PVP結合剤溶液を回転している材料層に制御された速度で噴霧し、同時に粉末を粉末レイヤー(powder layer)(K−Tron)により制御された速度でユニット内に添加した。最適化パラメータ−入口温度:50℃;ローラー速度:300RPM;スリット空気量:10CFM;処理時間:20分。完了後、ペレットをユニット内で乾燥させた。このように調製したペレット(バッチサイズ:2kg、有効収率約96%)は、109μmの平均粒度を有した(Sympatecレーザー粒度測定装置により決定される粒度分布プロファイルについては図2.Aを参照のこと。同様の手順に従い(ポビドン(50g)をイブプロフェン及びSyloidとブレンドし、及びより速い噴霧速度を用いた点は異なる)、平均粒度が217μm及び198μmのペレットの2つのバッチもまた調製した(粒度分布プロファイルについては図2.Bを参照のこと)。
【0112】
5.B 粉末レイヤリングによるイブプロフェンペレット:一組の試験は、Granurex GX−40における50〜70メッシュ球状ラクトース/デンプン上へのイブプロフェンの粉末レイヤリングを利用した。ポビドン溶液(10%固形分)を噴霧速度12〜16g/分及び粉末噴霧速度で噴霧した。このように調製したイブプロフェンペレットは、約34重量%の薬物負荷及び約300μmの平均粒度を有した(レーザー粒度データについては図2.Cを参照のこと)。
【0113】
5.C 球形化の制御によるナイアシンペレット:Malvern粒度測定装置により決定したとき平均粒度が約12μmのナイアシン(Lonzaからの2000gニコチン酸)を、コロイドシリカ(Cabbott Corporationからの10gのCab−O−Sil 10)とポビドン(50gのPVP K−30)と共にブレンドした。平均粒度が300μmのナイアシンペレットを、上記ステップ5.Aに開示されるとおりGranurex GX−35を使用して球形化の制御により調製する。
【0114】
5.D ナイアシンSRペレット:初めに上記ステップ5.Cのナイアシンペレット(1400g)に、7インチボトムスプレーワースターインサート、7 13/16インチ仕切りカラム、200メッシュ生成物保持スクリーンを被せた「C」空気分配プレート、及び16mmチューブ材を装備したGlatt GPCG 3において、約2重量%のOpadry Clearによるシールコートを提供する。上記ステップ4.Bに開示される手順に従い、シールコートで被覆されたペレットを、同じGlattユニットにおいて以下の処理パラメータで、アセトン(2180.3g)−水(384.7g)混合物(6%固形分)中に溶解したEC−10(Ethocel Standard Premium 10cps;230g)とクエン酸トリエチル(TEC)(25.6g)との溶液により20%の重量増加となるようSRコーティング被覆する−入口温度:45〜48℃;入口空気量:40〜45cfm;流量:8mL/分〜18mL/分(段階的に増加させる);噴霧空気圧力:1.25バール;ノズルポート径:1.0mm;生成物温度:35〜40℃。薬物放出試験用サンプルを、10%、15%、及び17.5%の被覆レベルで抜き出す。
【0115】
5.E ナイアシンSRペレットの圧縮性コーティング被覆:5%w/wコーティング(1000g)のナイアシンSRペレットを、上記ステップ1.0の手順に従い約20%w/wコーティングのスクラロースでさらに被覆する。
【0116】
5.F ナイアシンペレットを含む速分散錠:上記ステップ5.Eからの75〜85部の圧縮性コーティングで被覆されたナイアシンSRペレットと、10〜15部の微結晶性セルロースと、0〜10部の速分散性顆粒と、1.5〜2.5部のクロスポビドンとを、初めにVブレンダーで20分間ブレンドし、次に0.5部のステアリルフマル酸ナトリウムをブレンダーに添加し、約10分間ブレンドすることにより潤滑剤を均一に分布させる。このように生成された圧縮ブレンド物を、回転式錠剤成形機を使用して500mg又は1,000mgRDT(速分散錠)に圧縮する。
【0117】
6.A メルペロンHCl IRビーズ:メルペロンHCl(15.0kg)を50/50のアセトン/水(各3425g)に撹拌しながら徐々に添加して溶解させた。18インチボトムスプレーワースター23.75インチカラム、50mm仕切り間隙、16mmチューブ材、100メッシュ生成物保持スクリーンを被せた外側「G」及び内側「C」ボトム空気分配プレート、及び噴霧空気圧力2.5バールのHS Collarを備える3.0mmノズルを装備したGlatt GPCG 120に、目標流動化空気量500〜900CFM及び生成物温度32℃(範囲:29〜36℃を維持しながら43.8kgの45〜60メッシュ球状糖を100g/分で段階的に700g/分まで増加させて噴霧して装入した。アセトン/水中に溶解したKlucel LFのシールコートを2重量%で施し、IRビーズを乾燥させて水分及びアセトンを除去した。IRビーズを篩別して過大なサイズの(>500nm又は35メッシュ)ビーズ及び微粉(<80メッシュ)を廃棄した。
【0118】
6.B 無水リン酸水素ナトリウム(DPA)緩衝層レイヤリング:無水リン酸二ナトリウム(6.2kg)を撹拌下に溶解するまで精製水に添加する。この緩衝溶液をIRビーズ(52.6kg)に流動化空気量650(400〜800)CFMで噴霧した。任意選択により緩衝コーティングで被覆したビーズを溶媒でリンスした後、約2重量%増加とするKlucel LFのシールコートを施した。乾燥させたIRビーズを5分間乾燥させて残留溶媒を除去し、篩別して(例えば、35メッシュ及び80メッシュ篩を使用)過大なサイズのビーズ及び微粉を廃棄した。
【0119】
6.C メルペロンHCl SRビーズ:実施例6.B(34.0kg)の緩衝コーティング被覆ビーズを、流動層コーティング装置において、可塑化した(例えば、10%w/wエチルセルロースのクエン酸トリエチル)水不溶性ポリマー(例えば、13.9kgのエチルセルロース及び1.1kgのセバシン酸ジブチル)のSRコーティングで被覆した。溶媒中に溶解した圧縮性コーティング溶液(例えば、Klucel(登録商標)LFなどのヒドロキシプロピルセルロース)を緩衝コーティング被覆ビーズに約2重量%の重量増加となるよう噴霧する。得られたSRビーズをスクラロースの圧縮性コーティングで4%の重量増加となるようさらに被覆し、乾燥させて残留溶媒を除去する。
【0120】
6.D SRビーズを含む制御放出性ODT:速分散性微顆粒(4295g)を、圧縮性コーティング被覆SRビーズ(3720g)と、他の薬学的に許容可能な成分(例えば、ペパーミント香味料:100g、甘味料(スクラロース):35g、クロスポビドン:500g、二酸化ケイ素(Cab−O−Sil):25g、及び微結晶性セルロース(Avicel PH10):1350g)を含む予備ブレンド物と共に、均一に分布した圧縮用ブレンド物を得るのに十分な時間にわたりツインシェルVブレンダーでブレンドする。50mgメルペロンHClを圧縮性コーティング被覆SRビーズとして含むODTを、外部潤滑システムを装備した生産規模の錠剤成形機(Hata)を使用して以下の条件で圧縮する:−ツーリング:15mm円形、平坦な端面、アールの付いた縁部;圧縮力:16kN;平均重量:1000mg;平均硬度(目標):45N;及び摩損度:<0.5%。このように生成した得られたODT(50mg用量)は口腔内で急速に崩壊し、被覆ビーズを含む滑らかな嚥下し易い懸濁液を生じ、1日1回の投与レジメンに好適な期待される薬物放出プロファイルを提供する。
【0121】
本明細書に引用される全ての特許、公開特許出願、刊行物、及び他の文献は、あらゆる目的から全体として参照により本明細書に援用される。
【特許請求の範囲】
【請求項1】
圧縮性コーティング被覆微粒子を含む医薬組成物において、
a.薬物及び/又はその薬学的に許容可能な塩、エステル、多形、若しくは溶媒和物を含む薬物粒子と、
b.前記薬物含有コアを覆って配置された、水不溶性ポリマー材料を含む少なくとも1つの修飾放出性膜層と、
c.非ポリマー性甘味料を含む圧縮性コーティング層と、
を含むことを特徴とする医薬組成物。
【請求項2】
請求項1に記載の医薬組成物において、前記修飾放出性膜層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約50重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項3】
請求項1に記載の医薬組成物において、前記修飾放出性膜が味マスキング層であり、前記味マスキング層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約50重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項4】
請求項3に記載の医薬組成物において、前記味マスキング層が胃溶性細孔形成剤をさらに含み、前記層における水不溶性ポリマー材料の胃溶性細孔形成剤との比が約95:5から50:50まで様々であり、前記層全体が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約50重量%の重量増加となるように施され、及び前記味マスキング層が前記薬物及び/又はその薬学的に許容可能な塩、エステル、若しくは溶媒和物の味を有効にマスキングし、且つ胃に入ると実質的に完全な用量放出をもたらすことを特徴とする医薬組成物。
【請求項5】
請求項3に記載の医薬組成物において、前記薬物含有コア粒子を覆って配置された、親水性ポリマーを含むシーラント層をさらに含み、前記シーラント層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約1重量%〜約10重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項6】
請求項3に記載の医薬組成物において、前記味マスキング層を覆って配置された、水不溶性ポリマーを胃溶性細孔形成ポリマーとの組み合わせで含む第2の膜層をさらに含み、前記第2の膜層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約50重量%の重量増加となるように施され、及び前記第1及び/又は第2のコーティングが、薬物含有コア粒子の味を実質的にマスキングすることを特徴とする医薬組成物。
【請求項7】
請求項3に記載の医薬組成物において、前記医薬組成物が、胃に入ると、又は米国薬局方装置2(パドル50rpm、900mLのpH1.2又はpH2.0緩衝液中)で模擬胃液又は0.01N HClにおける溶解試験を行ったとき30分以内に、前記薬物又はその薬学的に許容可能な塩、エステル、溶媒和物、若しくは組み合わせの少なくとも約70%を放出することを特徴とする医薬組成物。
【請求項8】
請求項1に記載の医薬組成物において、前記薬物含有コア粒子を覆って配置された、親水性ポリマーを含むシーラント層をさらに含むことを特徴とする医薬組成物。
【請求項9】
請求項1に記載の医薬組成物において、前記薬物含有コア粒子が、結晶性薬物物質、薬物顆粒、球形化の制御による薬物含有ペレット、又は薬物層がレイヤリングされたビーズを含むことを特徴とする医薬組成物。
【請求項10】
請求項1に記載の医薬組成物において、前記修飾放出性コーティング被覆膜層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約25重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項11】
請求項10に記載の医薬組成物において、前記医薬組成物が、胃腸管内に入ると、又は米国薬局方装置2で溶解試験(パドル50rpm、37℃、最初の2時間は700mLのpH1.2緩衝液中、続いて200mLのpH調整剤を添加することにより得られるpH6.8でさらに試験)を行ったとき、前記薬物又はその薬学的に許容可能な塩、エステル、溶媒和物、若しくは組み合わせの持続放出性プロファイルを提供することを特徴とする医薬組成物。
【請求項12】
請求項10に記載の医薬組成物において、前記膜層が腸溶性ポリマーをさらに含み、前記第1の膜における水不溶性ポリマー材料の腸溶性ポリマーとの比が約9:1から1:2まで様々であり、前記膜全体が、前記圧縮性コーティング被覆微粒子の全重量を基準として約10重量%〜約40重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項13】
請求項10に記載の医薬組成物において、第2の膜をさらに含み、前記第2の膜が水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含み、前記第2の膜における水不溶性ポリマーの腸溶性ポリマーとの比が約9:1から1:2まで様々であり、前記膜全体が、前記圧縮性コーティング被覆微粒子の全重量を基準として約10重量%〜約40重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項14】
請求項5に記載の味がマスキングされた組成物において、前記親水性ポリマー材料が、ヒプロメロース、ヒドロキシプロピルセルロース、ポリビニルピロリドン(ポビドン)、及びそれらの混合物からなる群から選択されることを特徴とする組成物。
【請求項15】
請求項1に記載の医薬組成物において、前記修飾放出性コーティングで被覆された薬物微粒子が、約500μm以下の平均粒度を有することを特徴とする医薬組成物。
【請求項16】
請求項3に記載の医薬組成物において、前記味マスキング層が、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、メタクリル酸−メタクリル酸メチルの中性の共重合体、アクリル酸エチル及びメタクリル酸メチルをベースとする中性の共重合体、及びそれらの混合物からなる群から選択される1つ又は複数のポリマーを含むことを特徴とする医薬組成物。
【請求項17】
請求項4に記載の医薬組成物において、前記胃溶性細孔形成剤が、マルトリン(maltrin)、Eudragite(登録商標)(タイプE100又はEPO)の商標で入手可能なメタクリル酸アミノアルキル共重合体、三共株式会社、東京(日本)からAEA(登録商標)の商標で入手可能なポリ(ビニルアセテート−ジエチルアミノアセテート)、及びそれらの組み合わせからなる群から選択されるポリマーであることを特徴とする医薬組成物。
【請求項18】
請求項3に記載の医薬組成物において、前記胃溶性細孔形成剤が、炭酸カルシウム、リン酸カルシウム、カルシウムサッカリド、コハク酸カルシウム、酒石酸カルシウム、酢酸第二鉄、水酸化第二鉄、リン酸第二鉄、炭酸マグネシウム、クエン酸マグネシウム、水酸化マグネシウム、リン酸マグネシウム、及びそれらの混合物からなる群から選択される有機又は無機細孔形成剤であることを特徴とする医薬組成物。
【請求項19】
請求項10に記載の医薬組成物において、前記修飾放出性膜材料が、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、メタクリル酸−メタクリル酸メチルの中性の共重合体、アクリル酸エチル及びメタクリル酸メチルベースの中性の共重合体、並びにそれらの混合物からなる群から選択される水不溶性ポリマーを含むことを特徴とする医薬組成物。
【請求項20】
請求項12に記載の医薬組成物において、前記腸溶性ポリマーが、フタル酸ヒプロメロース、酢酸フタル酸セルロース、ポリビニルアセテートフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ポリビニルアセテートフタレート、pH感受性メタクリル酸/メタクリル酸メチル共重合体(例えば、Eudragit(登録商標)L、S及びFSポリマー)、シェラック、及びそれらの混合物からなる群から選択されることを特徴とする医薬組成物。
【請求項21】
請求項1又は10に記載の味がマスキングされた及び/又は修飾放出性コーティングで被覆された薬物含有コアを含む口腔内崩壊錠(ODT)又は速分散錠(RDT)組成物において、
a.治療有効量の薬物及び/又はその薬学的に許容可能な塩、エステル、若しくは溶媒和物を含む薬物粒子と、
b.1つ又は複数のポリマー膜であって、各々が水不溶性ポリマー又は任意選択により水不溶性且つ胃溶性ポリマーブレンド材料を含む膜と、
c.ステップ(b.)の修飾放出性コーティングで被覆された薬物粒子を覆って配置された、スクラロース、ラクチトール、ソルビトール、マルチトール、又はその混合物からなる群から選択される非ポリマー性甘味料を含む圧縮性コーティングと、
d.(i)崩壊剤と(ii)糖アルコール、サッカリド、又はその混合物とを約90:10〜約99:1の比で含む速分散性顆粒と
を含むことを特徴とする組成物。
【請求項22】
1つ又は複数の味マスキング膜で被覆された、薬物の及び/又は薬学的に許容可能な塩、溶媒和物の微粒子を含む請求項21に記載の口腔内崩壊錠(ODT)組成物において、以下の特性、すなわち、
i.ボトル及びブリスターパッケージングでの包装、保管、輸送、商品流通、及び最終使用に好適な許容可能な硬度及び摩損度;
ii.口腔内で唾液に接触したとき約60秒で崩壊して、快い味の滑らかな嚥下し易い懸濁液(ざらつきも後味もない)を形成し、<USP 701>崩壊試験法で30秒以下の規格を満たすこと;
iii.味がマスキングされた薬物粒子が滑らかな舌触り(ざらつきのなさ)を呈し、且つ後味を呈しないこと;
iv.USP装置2(パドル、75rpm)を使用して溶解試験を行ったとき、900mLの0.01N HCl緩衝液中において約45分間で用量の約85%の溶解規格を満たすことにより明らかなとおり、胃に入ると、急速で実質的に完全な用量放出を提供すること;
v.収載基準薬物である同等の強度の非ODT生成物との生物学的同等性、患者の利便性及び投与レジメンに対するコンプライアンスが達成される可能性が高まること
の1つ又は複数を示すことを特徴とする組成物。
【請求項23】
必要がある患者に味がマスキングされた組成物を投与することを含む胃腸障害を治療又は予防する方法において、
a.薬物及び/又はその薬学的に許容可能な塩、溶媒和物、多形、若しくはエステルを含む望ましい粒度分布の薬物粒子上に1つ又は複数のポリマー膜を施すステップと、
b.ステップ(a)の修飾放出性コーティングで被覆された薬物粒子を覆って配置される非ポリマー材料で圧縮性コーティングを被覆するステップと、
c.糖アルコール、サッカリド、又はその混合物と、平均粒度が30μm以下のスーパーディスインテグラント(super disintegrant)とを含む、平均粒度が400μm以下の速分散性顆粒を、水を造粒液として使用して99/1〜90/10の比の前記混合物を造粒し、流動層乾燥機において又はトレイ乾燥で乾燥させることにより生成するステップと、
d.(b)の圧縮性コーティングで被覆された、味がマスキングされた薬物粒子と、(c)の速分散性微顆粒と、1つ又は複数の香味剤、1つ又は複数の着色料、甘味料、追加的な崩壊剤、及び微結晶性セルロースなどの希釈剤を含むさらなる賦形剤とをブレンドするステップと、
e.外部潤滑システムを装備した回転式錠剤成形機を使用して、(d)の前記ブレンド物を口腔内崩壊錠に圧縮するステップと、
を含み、
(1)1つ又は複数の前記味マスキング層が、前記薬物及び/又はその薬学的に許容可能な塩、エステル、若しくは溶媒和物の味を有効にマスキングし、
(2)前記口腔内崩壊錠が患者の口腔内で急速に崩壊し、それによりざらついた舌触り及び後味を呈しない、味がマスキングされた粒子を含む滑らかな嚥下し易い懸濁液となることを特徴とする方法。
【請求項24】
請求項1に従い、必要がある患者に修飾放出性組成物を投与することを含む疾患状態の治療方法において、修飾放出性コーティングで被覆された薬物粒子を製造することが、
a.薬物及び/又はその薬学的に許容可能な塩、溶媒和物、多形、若しくはエステルを含む望ましい粒度規格の微粒子上に、水不溶性ポリマー材料を含む第1のコーティング層を5%w/w〜約20%w/wの重量増加となるよう施すステップと、
b.水不溶性ポリマーの腸溶性ポリマーとの比が9:1〜1:2の水不溶性−腸溶性ポリマーブレンド材料を含む任意選択の第2のコーティング層を、10%w/w〜約40%w/wの重量増加となるよう薬物粒子上に施すステップと、
c.ステップ(b)の前記修飾放出性コーティングで被覆された薬物粒子を覆って配置された、非ポリマー材料による圧縮性コーティングを施すステップと、
d.糖アルコール、サッカリド、又はその混合物と、平均粒度が30μm以下のスーパーディスインテグラント(super disintegrant)とを含む、平均粒度が400μm以下の速分散性顆粒を、造粒液として水を使用して99/1〜90/10の比の前記混合物を造粒し、流動層乾燥機において又はトレイ乾燥で乾燥させることにより生成するステップと、
e.(c)の圧縮性コーティングで被覆された修飾放出性薬物粒子と、(d)の速分散性微顆粒と、1つ又は複数の香味剤、1つ又は複数の着色料、甘味料、追加的な崩壊剤、及び微結晶性セルロースなどの希釈剤を含むさらなる賦形剤とをブレンドするステップと、
f.外部潤滑システムを装備した回転式錠剤成形機を使用して、(e)の前記ブレンド物を口腔内崩壊錠に圧縮するステップと、
を含み、
(1)1つ又は複数の前記修飾放出性コーティング層が、前記薬物及び/又はその薬学的に許容可能な塩、エステル、若しくは溶媒和物の味を有効にマスキングし、
(2)前記口腔内崩壊錠が患者の口腔内で急速に崩壊し、それによりざらついた舌触り及び後味を呈しない、修飾放出性コーティングで被覆された薬物粒子を含む滑らかな嚥下し易い懸濁液となることを特徴とする方法。
【請求項25】
請求項1に従い、必要がある患者に修飾放出性組成物を投与することを含む疾患状態の治療方法において、前記組成物を製造することが、
a.薬物及び/又はその薬学的に許容可能な塩、溶媒和物、多形、若しくはエステルを含む微粒子上に、水不溶性ポリマーの逆腸溶性ポリマーとの比を9:1〜1:1として水不溶性ポリマーを逆腸溶性ポリマーとの組み合わせで含む味マスキング膜を10%w/w〜約40%w/wの重量増加となるように施すステップと、
b.薬物及び/又はその薬学的に許容可能な塩、溶媒和物、多形、若しくはエステルを含む望ましい粒度規格の微粒子上に、水不溶性ポリマーの腸溶性ポリマーとの比を9:1〜1:2として水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含む制御放出層を10%w/w〜約20%w/wの重量増加となるように施すステップと、
c.スクラロース、ラクチトール、ソルビトール、マルチトール、又はその混合物からなる群から選択される非ポリマー性甘味料を含む圧縮性コーティング層を、ステップ(a.)の味がマスキングされた薬物微粒子上又はステップ(b.)の制御放出性コーティングで被覆された薬物微粒子上に施すステップと、
d.1つ又は複数の香味剤、1つ又は複数の着色料、甘味料、滑剤のコロイド状二酸化ケイ素、崩壊剤、及び希釈剤の微結晶性セルロースを含む薬学的に許容可能な賦形剤を予備ブレンドし、さらに、(a.)の圧縮性コーティングで被覆された、味がマスキングされた薬物微粒子と、(b.)の圧縮性コーティングで被覆された、制御放出性コーティングで被覆された薬物微粒子と、速分散性微顆粒又は圧縮性希釈剤と共にブレンドするステップと、
e.回転式錠剤成形機を使用して、(d.)の前記ブレンド物を口腔内崩壊錠又は速分散錠に圧縮するステップと、
を含むことを特徴とする方法。
【請求項26】
請求項23又は24に従い、修飾放出性組成物を必要がある患者に投与することを含む疾患状態の治療又は予防方法において、薬物粒子を覆って配置された味マスキングコーティング又は修飾放出性コーティングを含む微粒子を製造することが、スクラロース、ラクチトール、ソルビトール、マルチトール、又はその混合物からなる群から選択される非ポリマー性甘味料を含む圧縮性コーティング層を、味がマスキングされた又は修飾放出性コーティングで被覆された薬物粒子上に施すステップをさらに含むことを特徴とする方法。
【請求項27】
修飾放出性組成物を必要がある患者に投与することを含む疾患状態の治療又は予防方法において、請求項25に従う修飾放出性コーティングで被覆された微粒子を含む前記口腔内崩壊錠が、以下の特性:
i.ボトル及びブリスターパッケージングでの包装、保管、輸送、商品流通、及び最終使用に好適な許容可能な硬度及び摩損度;
ii.口腔内で唾液に接触すると約60秒間で崩壊して快い味の滑らかな嚥下し易い懸濁液を形成し(ざらつき又は後味のない)、<USP 701>崩壊試験法において30秒以下の規格を満たすこと;
iii.修飾放出性コーティングで被覆された薬物粒子が滑らかな舌触り(ざらつきのなさ)を呈し、且つ後味を呈しないこと;
iv.USP装置2(パドル50rpm、37℃、最初の2時間は900mLの0.1N HCl中又は700mLの0.1N HCl中、続いて900mLのpH6.8緩衝液中でさらに試験)において溶解試験を行ったときに薬物放出規格を満たすことから明らかなとおり、胃に入ると、急速で実質的に完全な又は望ましい目標の薬物放出プロファイルを提供すること;及び
v.収載基準薬物である同等の強度の非ODT生成物との生物学的同等性、又は適切な薬物動態プロファイルを提供することによる投与頻度の低減、患者の利便性及び投与レジメンに対するコンプライアンスが達成される可能性が高まること
の1つ又は複数を示すことを特徴とする方法。
【請求項1】
圧縮性コーティング被覆微粒子を含む医薬組成物において、
a.薬物及び/又はその薬学的に許容可能な塩、エステル、多形、若しくは溶媒和物を含む薬物粒子と、
b.前記薬物含有コアを覆って配置された、水不溶性ポリマー材料を含む少なくとも1つの修飾放出性膜層と、
c.非ポリマー性甘味料を含む圧縮性コーティング層と、
を含むことを特徴とする医薬組成物。
【請求項2】
請求項1に記載の医薬組成物において、前記修飾放出性膜層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約50重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項3】
請求項1に記載の医薬組成物において、前記修飾放出性膜が味マスキング層であり、前記味マスキング層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約50重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項4】
請求項3に記載の医薬組成物において、前記味マスキング層が胃溶性細孔形成剤をさらに含み、前記層における水不溶性ポリマー材料の胃溶性細孔形成剤との比が約95:5から50:50まで様々であり、前記層全体が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約50重量%の重量増加となるように施され、及び前記味マスキング層が前記薬物及び/又はその薬学的に許容可能な塩、エステル、若しくは溶媒和物の味を有効にマスキングし、且つ胃に入ると実質的に完全な用量放出をもたらすことを特徴とする医薬組成物。
【請求項5】
請求項3に記載の医薬組成物において、前記薬物含有コア粒子を覆って配置された、親水性ポリマーを含むシーラント層をさらに含み、前記シーラント層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約1重量%〜約10重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項6】
請求項3に記載の医薬組成物において、前記味マスキング層を覆って配置された、水不溶性ポリマーを胃溶性細孔形成ポリマーとの組み合わせで含む第2の膜層をさらに含み、前記第2の膜層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約50重量%の重量増加となるように施され、及び前記第1及び/又は第2のコーティングが、薬物含有コア粒子の味を実質的にマスキングすることを特徴とする医薬組成物。
【請求項7】
請求項3に記載の医薬組成物において、前記医薬組成物が、胃に入ると、又は米国薬局方装置2(パドル50rpm、900mLのpH1.2又はpH2.0緩衝液中)で模擬胃液又は0.01N HClにおける溶解試験を行ったとき30分以内に、前記薬物又はその薬学的に許容可能な塩、エステル、溶媒和物、若しくは組み合わせの少なくとも約70%を放出することを特徴とする医薬組成物。
【請求項8】
請求項1に記載の医薬組成物において、前記薬物含有コア粒子を覆って配置された、親水性ポリマーを含むシーラント層をさらに含むことを特徴とする医薬組成物。
【請求項9】
請求項1に記載の医薬組成物において、前記薬物含有コア粒子が、結晶性薬物物質、薬物顆粒、球形化の制御による薬物含有ペレット、又は薬物層がレイヤリングされたビーズを含むことを特徴とする医薬組成物。
【請求項10】
請求項1に記載の医薬組成物において、前記修飾放出性コーティング被覆膜層が、前記圧縮性コーティング被覆微粒子の全重量を基準として約5重量%〜約25重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項11】
請求項10に記載の医薬組成物において、前記医薬組成物が、胃腸管内に入ると、又は米国薬局方装置2で溶解試験(パドル50rpm、37℃、最初の2時間は700mLのpH1.2緩衝液中、続いて200mLのpH調整剤を添加することにより得られるpH6.8でさらに試験)を行ったとき、前記薬物又はその薬学的に許容可能な塩、エステル、溶媒和物、若しくは組み合わせの持続放出性プロファイルを提供することを特徴とする医薬組成物。
【請求項12】
請求項10に記載の医薬組成物において、前記膜層が腸溶性ポリマーをさらに含み、前記第1の膜における水不溶性ポリマー材料の腸溶性ポリマーとの比が約9:1から1:2まで様々であり、前記膜全体が、前記圧縮性コーティング被覆微粒子の全重量を基準として約10重量%〜約40重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項13】
請求項10に記載の医薬組成物において、第2の膜をさらに含み、前記第2の膜が水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含み、前記第2の膜における水不溶性ポリマーの腸溶性ポリマーとの比が約9:1から1:2まで様々であり、前記膜全体が、前記圧縮性コーティング被覆微粒子の全重量を基準として約10重量%〜約40重量%の重量増加となるように施されることを特徴とする医薬組成物。
【請求項14】
請求項5に記載の味がマスキングされた組成物において、前記親水性ポリマー材料が、ヒプロメロース、ヒドロキシプロピルセルロース、ポリビニルピロリドン(ポビドン)、及びそれらの混合物からなる群から選択されることを特徴とする組成物。
【請求項15】
請求項1に記載の医薬組成物において、前記修飾放出性コーティングで被覆された薬物微粒子が、約500μm以下の平均粒度を有することを特徴とする医薬組成物。
【請求項16】
請求項3に記載の医薬組成物において、前記味マスキング層が、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、メタクリル酸−メタクリル酸メチルの中性の共重合体、アクリル酸エチル及びメタクリル酸メチルをベースとする中性の共重合体、及びそれらの混合物からなる群から選択される1つ又は複数のポリマーを含むことを特徴とする医薬組成物。
【請求項17】
請求項4に記載の医薬組成物において、前記胃溶性細孔形成剤が、マルトリン(maltrin)、Eudragite(登録商標)(タイプE100又はEPO)の商標で入手可能なメタクリル酸アミノアルキル共重合体、三共株式会社、東京(日本)からAEA(登録商標)の商標で入手可能なポリ(ビニルアセテート−ジエチルアミノアセテート)、及びそれらの組み合わせからなる群から選択されるポリマーであることを特徴とする医薬組成物。
【請求項18】
請求項3に記載の医薬組成物において、前記胃溶性細孔形成剤が、炭酸カルシウム、リン酸カルシウム、カルシウムサッカリド、コハク酸カルシウム、酒石酸カルシウム、酢酸第二鉄、水酸化第二鉄、リン酸第二鉄、炭酸マグネシウム、クエン酸マグネシウム、水酸化マグネシウム、リン酸マグネシウム、及びそれらの混合物からなる群から選択される有機又は無機細孔形成剤であることを特徴とする医薬組成物。
【請求項19】
請求項10に記載の医薬組成物において、前記修飾放出性膜材料が、エチルセルロース、酢酸セルロース、酢酸酪酸セルロース、ポリ酢酸ビニル、メタクリル酸−メタクリル酸メチルの中性の共重合体、アクリル酸エチル及びメタクリル酸メチルベースの中性の共重合体、並びにそれらの混合物からなる群から選択される水不溶性ポリマーを含むことを特徴とする医薬組成物。
【請求項20】
請求項12に記載の医薬組成物において、前記腸溶性ポリマーが、フタル酸ヒプロメロース、酢酸フタル酸セルロース、ポリビニルアセテートフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ポリビニルアセテートフタレート、pH感受性メタクリル酸/メタクリル酸メチル共重合体(例えば、Eudragit(登録商標)L、S及びFSポリマー)、シェラック、及びそれらの混合物からなる群から選択されることを特徴とする医薬組成物。
【請求項21】
請求項1又は10に記載の味がマスキングされた及び/又は修飾放出性コーティングで被覆された薬物含有コアを含む口腔内崩壊錠(ODT)又は速分散錠(RDT)組成物において、
a.治療有効量の薬物及び/又はその薬学的に許容可能な塩、エステル、若しくは溶媒和物を含む薬物粒子と、
b.1つ又は複数のポリマー膜であって、各々が水不溶性ポリマー又は任意選択により水不溶性且つ胃溶性ポリマーブレンド材料を含む膜と、
c.ステップ(b.)の修飾放出性コーティングで被覆された薬物粒子を覆って配置された、スクラロース、ラクチトール、ソルビトール、マルチトール、又はその混合物からなる群から選択される非ポリマー性甘味料を含む圧縮性コーティングと、
d.(i)崩壊剤と(ii)糖アルコール、サッカリド、又はその混合物とを約90:10〜約99:1の比で含む速分散性顆粒と
を含むことを特徴とする組成物。
【請求項22】
1つ又は複数の味マスキング膜で被覆された、薬物の及び/又は薬学的に許容可能な塩、溶媒和物の微粒子を含む請求項21に記載の口腔内崩壊錠(ODT)組成物において、以下の特性、すなわち、
i.ボトル及びブリスターパッケージングでの包装、保管、輸送、商品流通、及び最終使用に好適な許容可能な硬度及び摩損度;
ii.口腔内で唾液に接触したとき約60秒で崩壊して、快い味の滑らかな嚥下し易い懸濁液(ざらつきも後味もない)を形成し、<USP 701>崩壊試験法で30秒以下の規格を満たすこと;
iii.味がマスキングされた薬物粒子が滑らかな舌触り(ざらつきのなさ)を呈し、且つ後味を呈しないこと;
iv.USP装置2(パドル、75rpm)を使用して溶解試験を行ったとき、900mLの0.01N HCl緩衝液中において約45分間で用量の約85%の溶解規格を満たすことにより明らかなとおり、胃に入ると、急速で実質的に完全な用量放出を提供すること;
v.収載基準薬物である同等の強度の非ODT生成物との生物学的同等性、患者の利便性及び投与レジメンに対するコンプライアンスが達成される可能性が高まること
の1つ又は複数を示すことを特徴とする組成物。
【請求項23】
必要がある患者に味がマスキングされた組成物を投与することを含む胃腸障害を治療又は予防する方法において、
a.薬物及び/又はその薬学的に許容可能な塩、溶媒和物、多形、若しくはエステルを含む望ましい粒度分布の薬物粒子上に1つ又は複数のポリマー膜を施すステップと、
b.ステップ(a)の修飾放出性コーティングで被覆された薬物粒子を覆って配置される非ポリマー材料で圧縮性コーティングを被覆するステップと、
c.糖アルコール、サッカリド、又はその混合物と、平均粒度が30μm以下のスーパーディスインテグラント(super disintegrant)とを含む、平均粒度が400μm以下の速分散性顆粒を、水を造粒液として使用して99/1〜90/10の比の前記混合物を造粒し、流動層乾燥機において又はトレイ乾燥で乾燥させることにより生成するステップと、
d.(b)の圧縮性コーティングで被覆された、味がマスキングされた薬物粒子と、(c)の速分散性微顆粒と、1つ又は複数の香味剤、1つ又は複数の着色料、甘味料、追加的な崩壊剤、及び微結晶性セルロースなどの希釈剤を含むさらなる賦形剤とをブレンドするステップと、
e.外部潤滑システムを装備した回転式錠剤成形機を使用して、(d)の前記ブレンド物を口腔内崩壊錠に圧縮するステップと、
を含み、
(1)1つ又は複数の前記味マスキング層が、前記薬物及び/又はその薬学的に許容可能な塩、エステル、若しくは溶媒和物の味を有効にマスキングし、
(2)前記口腔内崩壊錠が患者の口腔内で急速に崩壊し、それによりざらついた舌触り及び後味を呈しない、味がマスキングされた粒子を含む滑らかな嚥下し易い懸濁液となることを特徴とする方法。
【請求項24】
請求項1に従い、必要がある患者に修飾放出性組成物を投与することを含む疾患状態の治療方法において、修飾放出性コーティングで被覆された薬物粒子を製造することが、
a.薬物及び/又はその薬学的に許容可能な塩、溶媒和物、多形、若しくはエステルを含む望ましい粒度規格の微粒子上に、水不溶性ポリマー材料を含む第1のコーティング層を5%w/w〜約20%w/wの重量増加となるよう施すステップと、
b.水不溶性ポリマーの腸溶性ポリマーとの比が9:1〜1:2の水不溶性−腸溶性ポリマーブレンド材料を含む任意選択の第2のコーティング層を、10%w/w〜約40%w/wの重量増加となるよう薬物粒子上に施すステップと、
c.ステップ(b)の前記修飾放出性コーティングで被覆された薬物粒子を覆って配置された、非ポリマー材料による圧縮性コーティングを施すステップと、
d.糖アルコール、サッカリド、又はその混合物と、平均粒度が30μm以下のスーパーディスインテグラント(super disintegrant)とを含む、平均粒度が400μm以下の速分散性顆粒を、造粒液として水を使用して99/1〜90/10の比の前記混合物を造粒し、流動層乾燥機において又はトレイ乾燥で乾燥させることにより生成するステップと、
e.(c)の圧縮性コーティングで被覆された修飾放出性薬物粒子と、(d)の速分散性微顆粒と、1つ又は複数の香味剤、1つ又は複数の着色料、甘味料、追加的な崩壊剤、及び微結晶性セルロースなどの希釈剤を含むさらなる賦形剤とをブレンドするステップと、
f.外部潤滑システムを装備した回転式錠剤成形機を使用して、(e)の前記ブレンド物を口腔内崩壊錠に圧縮するステップと、
を含み、
(1)1つ又は複数の前記修飾放出性コーティング層が、前記薬物及び/又はその薬学的に許容可能な塩、エステル、若しくは溶媒和物の味を有効にマスキングし、
(2)前記口腔内崩壊錠が患者の口腔内で急速に崩壊し、それによりざらついた舌触り及び後味を呈しない、修飾放出性コーティングで被覆された薬物粒子を含む滑らかな嚥下し易い懸濁液となることを特徴とする方法。
【請求項25】
請求項1に従い、必要がある患者に修飾放出性組成物を投与することを含む疾患状態の治療方法において、前記組成物を製造することが、
a.薬物及び/又はその薬学的に許容可能な塩、溶媒和物、多形、若しくはエステルを含む微粒子上に、水不溶性ポリマーの逆腸溶性ポリマーとの比を9:1〜1:1として水不溶性ポリマーを逆腸溶性ポリマーとの組み合わせで含む味マスキング膜を10%w/w〜約40%w/wの重量増加となるように施すステップと、
b.薬物及び/又はその薬学的に許容可能な塩、溶媒和物、多形、若しくはエステルを含む望ましい粒度規格の微粒子上に、水不溶性ポリマーの腸溶性ポリマーとの比を9:1〜1:2として水不溶性ポリマーを腸溶性ポリマーとの組み合わせで含む制御放出層を10%w/w〜約20%w/wの重量増加となるように施すステップと、
c.スクラロース、ラクチトール、ソルビトール、マルチトール、又はその混合物からなる群から選択される非ポリマー性甘味料を含む圧縮性コーティング層を、ステップ(a.)の味がマスキングされた薬物微粒子上又はステップ(b.)の制御放出性コーティングで被覆された薬物微粒子上に施すステップと、
d.1つ又は複数の香味剤、1つ又は複数の着色料、甘味料、滑剤のコロイド状二酸化ケイ素、崩壊剤、及び希釈剤の微結晶性セルロースを含む薬学的に許容可能な賦形剤を予備ブレンドし、さらに、(a.)の圧縮性コーティングで被覆された、味がマスキングされた薬物微粒子と、(b.)の圧縮性コーティングで被覆された、制御放出性コーティングで被覆された薬物微粒子と、速分散性微顆粒又は圧縮性希釈剤と共にブレンドするステップと、
e.回転式錠剤成形機を使用して、(d.)の前記ブレンド物を口腔内崩壊錠又は速分散錠に圧縮するステップと、
を含むことを特徴とする方法。
【請求項26】
請求項23又は24に従い、修飾放出性組成物を必要がある患者に投与することを含む疾患状態の治療又は予防方法において、薬物粒子を覆って配置された味マスキングコーティング又は修飾放出性コーティングを含む微粒子を製造することが、スクラロース、ラクチトール、ソルビトール、マルチトール、又はその混合物からなる群から選択される非ポリマー性甘味料を含む圧縮性コーティング層を、味がマスキングされた又は修飾放出性コーティングで被覆された薬物粒子上に施すステップをさらに含むことを特徴とする方法。
【請求項27】
修飾放出性組成物を必要がある患者に投与することを含む疾患状態の治療又は予防方法において、請求項25に従う修飾放出性コーティングで被覆された微粒子を含む前記口腔内崩壊錠が、以下の特性:
i.ボトル及びブリスターパッケージングでの包装、保管、輸送、商品流通、及び最終使用に好適な許容可能な硬度及び摩損度;
ii.口腔内で唾液に接触すると約60秒間で崩壊して快い味の滑らかな嚥下し易い懸濁液を形成し(ざらつき又は後味のない)、<USP 701>崩壊試験法において30秒以下の規格を満たすこと;
iii.修飾放出性コーティングで被覆された薬物粒子が滑らかな舌触り(ざらつきのなさ)を呈し、且つ後味を呈しないこと;
iv.USP装置2(パドル50rpm、37℃、最初の2時間は900mLの0.1N HCl中又は700mLの0.1N HCl中、続いて900mLのpH6.8緩衝液中でさらに試験)において溶解試験を行ったときに薬物放出規格を満たすことから明らかなとおり、胃に入ると、急速で実質的に完全な又は望ましい目標の薬物放出プロファイルを提供すること;及び
v.収載基準薬物である同等の強度の非ODT生成物との生物学的同等性、又は適切な薬物動態プロファイルを提供することによる投与頻度の低減、患者の利便性及び投与レジメンに対するコンプライアンスが達成される可能性が高まること
の1つ又は複数を示すことを特徴とする方法。
【図1】


【図2】




【図2】


【公表番号】特表2013−512250(P2013−512250A)
【公表日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願番号】特願2012−541164(P2012−541164)
【出願日】平成22年11月23日(2010.11.23)
【国際出願番号】PCT/US2010/057811
【国際公開番号】WO2011/066287
【国際公開日】平成23年6月3日(2011.6.3)
【出願人】(512000167)アプタリス ファーマテク,インコーポレイテッド (4)
【氏名又は名称原語表記】APTALIS PHARMATECH,INC.
【Fターム(参考)】
【公表日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願日】平成22年11月23日(2010.11.23)
【国際出願番号】PCT/US2010/057811
【国際公開番号】WO2011/066287
【国際公開日】平成23年6月3日(2011.6.3)
【出願人】(512000167)アプタリス ファーマテク,インコーポレイテッド (4)
【氏名又は名称原語表記】APTALIS PHARMATECH,INC.
【Fターム(参考)】
[ Back to top ]

