培養床及びその製造方法
【課題】 支持体との接着性が良好であり、細胞を容易に接着、増殖できる培養床、且つ生物由来の材料を全く使用しないか、その使用量を最小限に抑えた非生物由来材料を主成分とした培養床、及びその製造方法を提供する。
【解決手段】 水膨潤性粘土鉱物と溶媒とを含有し、前記溶媒と前記水膨潤性粘土鉱物の合計質量に対する水膨潤性粘土鉱物の質量比率が50%以上であり、全固形分中の前記水膨潤性粘土鉱物の質量比率が80%以上であることを特徴とする培養床。
【解決手段】 水膨潤性粘土鉱物と溶媒とを含有し、前記溶媒と前記水膨潤性粘土鉱物の合計質量に対する水膨潤性粘土鉱物の質量比率が50%以上であり、全固形分中の前記水膨潤性粘土鉱物の質量比率が80%以上であることを特徴とする培養床。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞培養の技術に関し、具体的には、細胞を容易に接着、増殖できる培養床、及びその製造方法に関する。
【背景技術】
【0002】
従来、動物組織等の培養床としては、主にプラスチック(例えばポリスチレン)製やガラス製容器が使用されてきた。これら容器は、細胞培養を有効に行わせるために、その表面にプラズマ処理や、細胞接着因子等のコーティングなどの表面処理が施されている。プラズマ処理は、ほとんどの不死化細胞株や正常細胞で細胞培養が行えるが、必ずしも有効ではなく、その表面にさらにフィブロネクチンやコラーゲンといった生体由来の細胞接着因子をコーティングすることで、細胞接着と増殖を有効に行わせていた。
【0003】
しかし、上述の細胞接着因子は生体由来であることから、ウイルスやその他伝染性物質の除去が必要であった。
【0004】
近年、培養した細胞を生体内に戻す再生医療が盛んにおこなわれ、生体由来物質を含まない細胞培養方法や細胞培養容器が求められており、細胞培養容器の表面に水に均一に分散した水膨潤性粘土鉱物(クレイ)の存在下で、水溶性有機モノマーを放射線の照射により重合させてなる三次元網目構造を有する高分子ヒドロゲルを形成させたり、水膨潤性粘土鉱物からなるクレイヒドロゲルを、その表面上で細胞を接着・伸展・増殖させたりする技術が報告されている。(例えば特許文献1および2参照)。
【0005】
しかしながら、特許文献1では、クレイは高分子ヒドロゲルを作製する架橋剤として用いられており、作製された高分子ヒドロゲルは温度によって細胞が接着・剥離する性質を持つため、温度管理や培養操作に熟練を要する問題点があった。さらに、非ゲル状での細胞培養性については開示されていない。また、特許文献2では、クレイ単独でヒドロゲルが作製され、細胞培養がなされているが、クレイの含有率が高い(含水率の低い)場合の細胞培養性や、支持体へ塗布した薄膜層による細胞培養有効性に関しては、これまでに開示されていなかった。
【0006】
細胞培養操作等の点においては、培養床がプラスチック製培養ディッシュのような容器と一体化するものが求められている。しかしながら、上記従来文献においては、このような一体化した細胞培養容器の具体的手段は開示されていない。
【0007】
また、細胞培養容器の表面にカーボンナノチューブ(CNT)層を形成することでその表面上で細胞を接着・伸展・増殖させる技術が報告されている。(特許文献3参照)。
【0008】
しかし、CNT層が効果的に細胞を接着・伸展・増殖させるには20回以上積層を繰り返す必要があり、大量生産性に欠ける問題点がある。
【0009】
一方、粘土鉱物ではないが、金属酸化物を含む細胞培養床として金属酸化物層を形成させる技術が報告されている。(特許文献4参照)。しかしながら、この培養床で培養される細胞は三次元的な集合体を構築させることを目的としており、広くおこなわれる二次元的な接着増殖ではない。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2005−110604(高分子ヒドロゲル)
【特許文献2】特開2006−325461(クレイヒドロゲル)
【特許文献3】特開2009−142218(カーボンナノチューブ)
【特許文献4】特開2004−275122(金属酸化物ゲル)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明が解決しようとする課題は、上記従来技術の問題点を解決し、高培養性を有する培養床を提供することにある。また、本発明が解決しようとする他の課題は、高培養性を有し、且つ生物由来の材料を全く使用しないか、その使用量を最小限に抑えた非生物由来材料を主成分とした培養床を提供することにある。
【課題を解決するための手段】
【0012】
本発明者等は、上記課題を解決すべく鋭意研究した結果、水膨潤性粘土鉱物(A)を含有する培養床が各種細胞に対する良好な培養性を示すことを見出し、本発明を完成するに至った。
即ち、本発明は、水膨潤性粘土鉱物と溶媒とを含有し、前記溶媒と前記水膨潤性粘土鉱物の合計質量に対する水膨潤性粘土鉱物の質量比率が24%以上であり、全固形分中の前記水膨潤性粘土鉱物の質量比率が80%以上であることを特徴とする培養床を提供する。
【0013】
また、本発明は、上記水膨潤性粘土鉱物(A)を含有する培養床の製造方法であって、
前記水膨潤性粘土鉱物(A)を水媒体に混合した後、分散液(L)を製造する第1工程、
前記分散液(L)を支持体に塗布し、その後乾燥することにより前記水膨潤性粘土鉱物(A)の薄層を形成する第2工程、を行なうことを特徴とする培養床の製造方法を提供する。
【0014】
本発明の培養床の最大の特徴は、上記水膨潤性粘土鉱物(A)がタンパク吸着とそれに伴う細胞の接着、増殖を担うことにある。
【0015】
本発明の培養床は、水膨潤性粘土鉱物(A)がほぼ均一な層状構造になっている薄層から構成されており、これを各種の支持体上に積層することにより細胞培養基材として使用することができる。
【発明の効果】
【0016】
本発明の培養床は、培養液中のタンパク質成分を表面に多く吸着でき、続いて細胞の良好な接着・伸展・増殖(高培養性)を可能にし、培養される細胞は従来通りの方法で剥離・回収できる特徴を有する。
【0017】
また、本発明の製造方法は、電子線照射のような方法を使用することなく、該培養床を(プラスチック製培養容器のような)支持体に容易に接着させることができ、装置と工程が簡便である特徴を有する。
【図面の簡単な説明】
【0018】
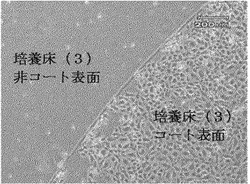
【図1】実施例4において、細胞が培養床(3)上にのみ接着増殖して、培養床(3)をコートしていない表面では細胞が接着しなかった様子を観察した光学顕微鏡写真である。
【発明を実施するための形態】
【0019】
本発明に用いる水膨潤性粘土鉱物(A)は、層状に剥離可能な水膨潤性粘土鉱物が挙げられ、好ましくは水または水と有機溶剤との混合溶液中で膨潤し均一に分散可能な粘土鉱物、特に好ましくは水中で分子状(単一層)またはそれに近いレベルで均一分散可能な無機粘土鉱物が用いられる。具体的にはナトリウムを層間イオンとして含む水膨潤性ヘクトライト、水膨潤性モンモリライト、水膨潤性サポナイト、水膨潤性合成雲母、等が挙げられる。これらの粘土鉱物を混合して用いても良い。
【0020】
本発明の培養床は、溶媒と水膨潤性粘土鉱物の合計質量に対する水膨潤性粘土鉱物の質量比率が50%以上、好ましくは70%以上、さらに好ましくは90%以上含有する層により形成される。
【0021】
本発明の培養床の厚みは50μm以下であることが好ましく、さらに好ましくは15μm以下、特に好ましくは50nm以下である。50μm以上であると乾燥工程で亀裂を生じ、支持体から培養床(水膨潤性粘土鉱物層)が脱落する可能性がある。前述の厚みであれば水膨潤性粘土鉱物が乾燥工程で亀裂や脱落することなく、かつ細胞接着と増殖に効果がある。
【0022】
本発明の培養床は水溶性有機化合物、例えば防腐剤や抗菌剤、着色料、香料、酵素、たんぱく質、コラーゲン、合成ペプチド類、糖類、アミノ酸類、ビタミン類、細胞、DNA類、塩類、水溶性有機溶剤類、界面活性剤、高分子化合物、レベリング剤などを含むことができる。
【0023】
水溶性有機化合物を含む全固形分と粘土鉱物の比率は、全固形分中の水膨潤性粘土鉱物の質量比率が80%以上であり、83%以上であることが好ましく、85%以上であることが特に好ましい。かかる質量比であれば培養床として特性が十分に発揮できる。
【0024】
本発明で使用する支持体とは例えば、糸状、フィルム状、板状、ディッシュ状、多孔体状などの人工物や骨、血管、脂肪、皮膚などの生体由来組織など、細胞を接着増殖させるための足場を言う。
【0025】
本発明にいう細胞培養用組成物とは水膨潤性粘土鉱物を必須として水媒体等の溶媒の分散液であれば特に限定されない。例えば水、または水と混和性を有する溶剤及び/またはその他の化合物を含む水溶液であってよく、その中には更に、防腐剤や抗菌剤、着色料、香料、酵素、たんぱく質、コラーゲン、合成ペプチド類、糖類、アミノ酸類、ビタミン類、細胞、DNA類、塩類、水溶性有機溶剤類、界面活性剤、高分子化合物、レベリング剤などを含むことができる。
【0026】
本発明にいう細胞培養用組成物は水膨潤性粘土鉱物を0.1〜3%、好ましくは0.1〜2%、さらに好ましくは0.1〜1%の濃度で含有する。かかる濃度であれば、容易に支持体を被覆することができる。
【0027】
本発明の培養床に用いられる培養床用組成物は、例えば、糸状、フィルム状、板状、ディッシュ状、多孔体状である金属、セラミック、プラスチック、ガラス、スポンジ等の平滑表面または凹凸表面を有する支持体に被覆して細胞培養基材として用いられる。
【0028】
本発明にいう細胞培養方法とは多細胞生物から細胞を分離し、体外で増殖、維持することである。本発明の培養床を用いる細胞培養方法であれば特に限定されない。例えば、生体から分離し、最初の植え替えを行う初代培養、既存の培養細胞(生体外で培養されている細胞のこと)を新たな培養容器へと移し替えて増殖、維持する継代培養、三次元構造物上に増殖される三次元培養などがあげられる。
【0029】
次いで、本発明の培養床の製造方法について説明する。
【0030】
本発明は、下記の方法で製造することができる。
【0031】
前記水膨潤性粘土鉱物(A)を水媒体等の溶媒に混合し、分散液(L)を製造する第1工程、前記分散液(L)を基材に塗布し、その後乾燥することにより前記水膨潤性粘土鉱物(A)の薄層を形成する第2工程を行なうことを特徴とする培養床の製造方法である。
【0032】
なお、本発明の培養床は非ゲル状の培養床である。
非ゲル状とは、水を大量に含まず、膨潤・収縮挙動を取らず、ゾル−ゲル転移を行わない状態を指す。
【0033】
この製造方法に用いられる水膨潤性粘土鉱物(A)は、前記の説明で述べたのと同じものを使用できるので、省略する。
【0034】
本発明の製造方法に用いる水媒体は、水膨潤性粘土鉱物(A)を含むことができ、分散液が得られれば良く、特に限定されない。例えば水、または水と混和性を有する溶剤及び/またはその他の化合物を含む水溶液であってよく、その中には更に、防腐剤や抗菌剤、着色料、香料、酵素、たんぱく質、コラーゲン、合成ペプチド類、糖類、アミノ酸類、ビタミン類、細胞、DNA類、塩類、水溶性有機溶剤類、界面活性剤、高分子化合物、レベリング剤などを含むことができる。
【0035】
水膨潤性粘土鉱物(A)の水媒体に対する濃度(質量%)は好ましくは2%以下、さらに好ましくは1%以下、より好ましくは0.8%以下である。水膨潤性粘土鉱物(A)の水媒体に対する濃度(質量%)が上記であると、非ゲル状の良好な分散液(L)が得られ、支持体への塗布が容易で、平滑で均一な薄い塗膜が得られ、好ましい。
【0036】
本発明の製造方法で製造される分散液(L)は、そのまま使用してもよいし、水洗や濾過などによる精製工程を経てから使用してもよい。また該分散液(L)に更にレベリング剤や界面活性剤、ペプチド、たんぱく質、コラーゲン、アミノ酸類、ビタミン類、高分子化合物などを添加して使用してもよい。
【0037】
本製造方法の第2工程における、前記分散液(L)の支持体への塗布方法は、公知慣用の方法でよい。例えば、分散液を支持体に流延させる方法や、バーコーターやスピンコーターによるコーター法、または噴霧などのスプレー法、模様のあるゴム版に分散液をつけてから支持体に転写する方法、また支持体に塗布しない部分を予め遮蔽して塗布後遮蔽部分を取り除くパターン状塗布や、インクジェットプリンター方式による分散液の塗布方法が挙げられる。
【0038】
細胞が接着や増殖しない支持体(例えばコロナ放電処理をしていないポリスチレン)表面に、分散液(L)を種々パターン状に塗布することにより、浮遊系細胞、例えばマクロファージやリンパ球、と接着細胞、例えば血管内皮細胞や間葉系幹細胞、などとの共培養、接着細胞同士の共培養、細胞をシート状で剥離させることも可能になる。
【0039】
乾燥方法も、分散液(L)中の揮発成分が揮発し、水膨潤性粘土鉱物(A)の薄層ができれば、任意の方法でよい。例えば、室温自然乾燥、室温の風や加熱または熱風による乾燥、遠赤外線乾燥などがあげられる。或いは分散液をスピンコーターで回転しながら熱風を当てたり加熱したりする方法も挙げられる。
【0040】
また、本発明の溶媒としては、水膨潤性粘土鉱物(A)を溶解でき、且つ一定以上の水溶性を有する溶剤を用いることができる。ここで言う水溶性を有する溶剤とは、水100gに対し50g以上溶解できる溶剤であることが好ましい。
【0041】
例えば、水溶性溶剤としては、ジメチルアセトアミド、ジメチルホルムアミドなどのアミド類、メタノール、エタノール、2−プロパノールなどのアルコール類、ジメチルスルホキシド、テトラヒドロフランなどが挙げられる。これらの溶剤を混合して用いても良い
上記の製造方法は、水膨潤性粘土鉱物(A)の比率を調整することにより、細胞の増殖速度を幅広く調整することができるという特徴を有する。
【実施例】
【0042】
以下、実施例により本発明を具体的に説明するが、本発明の範囲がこれらの実施例にのみ限定されるものではない。
【0043】
(実施例1)
この実施例は培養床を製造する例である。
[水膨潤性粘土鉱物(A)を含む分散液の調製]
水膨潤性粘土鉱物(A)としてLaponite XLG(Rockwood Additives Ltd.社製)0.08g、水20g、を均一に混合して分散液(L)を調製した。
[水膨潤性粘土鉱物(A)からなる培養床の作製(第2工程)]
直径35mmのポリスチレン製シャーレ(旭テクノグラス株式会社製、)に、上記水膨潤性粘土鉱物(A)の分散液(L1)を入れ、スピンコーターを用いて2000回転で該分散液をシャーレの表面に薄く塗布した後、80℃の熱風乾燥器中で10分間乾燥させ、50℃の精製水で2回、滅菌水で1回洗浄することで、水膨潤性粘土鉱物(A)の薄層からなる培養床(1)を作成した。培養床(1)の厚みを透過型電子顕微鏡(TEM)で計測すると、約20nmであった。また、含水率は6%、含クレイ率は94%であった。
【0044】
[培養試験]
このようにして得られた培養床(1)を5枚用いて、細胞の培養を行った。培養する細胞は、正常ヒト真皮線維芽細胞(DSファーマバイオメディカル株式会社製)を使用した。培養は、ウシ胎児血清(バイオウエスト社製)を10%含有するダルベッコ変法ミニマム・エッセンシャル・イーグル培地(和光純薬製)を使用して、5%二酸化炭素含有37℃恒温器内で行った。また、5枚のディッシュには全く同じ条件で細胞の播種を行った。播種細胞数は一枚のディッシュあたり10万個の細胞を播種した。細胞を含む培地の播種量は2mlとした。播種してから1日後、4日後、1週間後、これらの培養床(1)の表面を光学顕微鏡にて観察したところ、細胞が培養床(1)上に接着して、また十分に増殖していた様子が鮮明に確認することが出来た。一週間培養した細胞を0.05%トリプシン/0.53mM EDTA(ナカライテスク社製)を用いて回収し、再播種したところ、良好な接着と増殖が確認できた。
【0045】
(比較例1)
細胞培養用ディッシュ「ファルコン3003」(ベクトン・ディッキンソン社製)(以下,TCPSディッシュ)を何も表面処理を行わずに使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。
【0046】
(比較例2)
細胞培養用ディッシュ「ファルコンコラーゲンIコート354456」(ベクトン・ディッキンソン社製)(以下、コラーゲンコートディッシュ)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。この培養床は、I型コラーゲンをポリスチレンディッシュ表面に吸着させたものである。
【0047】
(比較例3)
細胞培養用ディッシュ「BDピュアコートアミン354721」(ベクトン・ディッキンソン社製)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。この培養床は、ポリスチレンディッシュ表面にアミド基を化学修飾したものである。
【0048】
(比較例4)
細胞培養用ディッシュ「BDピュアコートカルボキシル354773」(ベクトン・ディッキンソン社製)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。この培養床は、ポリスチレンディッシュ表面にカルボキシル基を化学修飾したものである。
【0049】
(比較例5)
細胞培養用ディッシュ「セルバインド3294」(コーニング・インターナショナル社製)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。この培養床は、ポリスチレンディッシュ表面をマイクロウェーブ処理したものである。
【0050】
実施例1、および比較例1〜5の培養1日後、4日後、1週間後のATP産生量を調べるために、リン酸緩衝生理食塩水(PBS,和光純薬製)2mLで培養表面を洗浄し、細胞のATP試薬(和光純薬製)0.5mLを添加し、10分後にマルチプレートリーダーMTP-810Lab(日立製作所製)の発光測定モードで検出した。
【0051】
培養試験の結果を表−1に示す。
【0052】
【表1】

【0053】
表1に示されるように、培養床(1)を用いた培養によると、TCPSディッシュ(比較例1)に勝り、コラーゲンコートディッシュに(比較例2)迫る細胞増殖が確認できた。また、市販の合成品コートディッシュ(比較例3〜5)のいずれよりも細胞増殖効果があることが実現できた。
【0054】
水膨潤性粘土鉱物を薄膜化させたものは、良好な細胞増殖を示す培養床となることが表−1で明らかとなった。
【0055】
(実施例2)
実施例1と同様に水膨潤性粘土鉱物(A)としてLaponite XLG0.16g、水媒体(W)として水10g、を均一に混合して分散液(L1)を調製した。この分散液0.3gを直径15mmのガラス(松波ガラス社製)にコートし、室温で18時間乾燥させ、培養床(2)が作製できた。培養床(2)の厚みをデジタルインジケーター(SONY U12B)で測定したところ、約13μmであった。また、含水率は11%、含クレイ率は89%であった。
【0056】
ベクトン・ディッキンソン社製24ウェルプレート353047に培養床(2)を入れ、細胞培養に使用した。播種細胞、培地、培養条件は実施例1と同様で、播種した細胞数は13万個である。播種してから1日後、4日後に培養床(2)の表面を光学顕微鏡にて観察したところ、細胞が培養床(2)上に接着して、また十分に増殖していた様子が鮮明に確認することが出来た。また、1日後と4日後のATP産生量を添加する細胞のATP試薬の量を0.2mLとするほかは実施例1と同様の手法で確認した結果を表―2に示す。
【0057】
(実施例3)
分散液(L1)にアスコルビ酸リン酸エステルマグネシウム塩n水和物(和光純薬社製)を最終濃度0.28mMで添加する以外は実施例2と同様に作製し、厚み約13μmの培養床(3)が作製できた。また、含水率は13%、含クレイ率は87%であった。アスコルビ酸リン酸エステルマグネシウム塩n水和物の含有量はクレイの0.005%であった。
【0058】
細胞及び培地、培養条件は実施例2と同様にして行った。播種してから1日後、4日後に培養床(3)の表面を光学顕微鏡にて観察したところ、細胞が培養床(3)上に接着して、また十分に増殖していた様子が鮮明に確認することが出来た。また、1日後と4日後のATP産生量を実施例2と同様の手法で確認した結果を表―2に示す。
【0059】
(比較例6)
細胞培養用24ウェルプレート353047(ベクトン・ディッキンソ社製)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例2と同様にして行った。播種してから1日後、4日後の表面を光学顕微鏡にて観察したところ、細胞が接着して、また十分に増殖していた様子が鮮明に確認することが出来た。また、1日後と4日後のATP産生量を実施例2と同様の手法で確認した結果を表―2に示す。
【0060】
【表2】

【0061】
以上の実施例2,3および比較例6の結果より、水膨潤性粘土鉱物にビタミンCの誘導体であるアスコルビ酸リン酸エステルマグネシウム塩n水和物を含有させることで、さらに良好な細胞増殖を示す培養床となることが表−2で明らかとなった。
【0062】
(比較例7)
20℃の恒温室において、内部を窒素置換した平底ガラス容器に、超純水57.06gとテフロン(登録商標)製攪拌子を入れ、攪拌しながら1.44gのラポナイトXLG を加え、無色透明の溶液を調製した。これにNIPA(N-イソプロピルアクリルアミド) 6.78gを加え、窒素雰囲気内で攪拌して無色透明溶液を得た。次に、KPS(ペルオキソ二硫酸カリウム(関東化学株式会社製))水溶液3gとTEMED(N,N,N’,N’-テトラメチルエチレンジアミン(和光純薬工業株式会社製))48μlを攪拌しながら無色透明溶液に加えた。この溶液をあらかじめ窒素雰囲気中に静置して容器内の酸素を除去しておいた蓋付きのポリスチレン製容器(9cm×15cm 3枚にそれぞれ酸素にふれないようにして移した後、密栓をし、20℃の恒温水槽中で20時間静置して重合を行った。なお、これらの溶液調製から重合までの操作は、全てクリーンベンチ内にて行い、さらに酸素を遮断した窒素雰囲気下で行った。重合開始から20時間後に、ポリスチレン製容器内に無色透明で均一なシート状のヒドロゲル(A)が得られた。
【0063】
次に、シート状のヒドロゲル(A)を、20℃で2Lの超純水に2日間浸漬して、ヒドロゲルを膨潤させてから取り出し、次いで50℃の超純水1Lに12時間浸漬して、ヒドロゲルを収縮させてから取り出した。該洗浄による精製操作を3 回繰り返した後、精製したシート状のヒドロゲル(A)を、直径8cmの大きさに切断し、ヒドロゲル(A)からなる細胞培養基材(A)とした。このヒドロゲルの含水率は84%、含クレイ率は2%、クレイ/樹脂比は0.2である。それを細胞培養用ディッシュ(ベクトン・ディッキンソン・ラブウェア社製「ファルコン3003」)の中に移し替えてから蓋をして3 7 ℃ で静置した。この時細胞培養基材(A)は、疎水化されたため、完全に白色化していた。なお、これらの精製から細胞培養ディッシュ内に細胞培養基材(A)を移し替えるまでの操作は、すべてクリーンベンチ内で行った。
【0064】
この細胞培養基材(A)を使用すると、確かに細胞培養基材(A)表面で細胞の接着増殖は確認できる。しかしながら、細胞培養基材(A)はゲル状であるために、(1)水を大量に含み、(2)膨潤・収縮挙動を取るため、細胞培養ディッシュ(支持体)との固着性が無く、支持体上に積層させることが出来ない。
【0065】
(比較例8)
直径35mmのポリスチレン製シャーレ(旭テクノグラス株式会社製、)に、上記水膨潤性粘土鉱物(A)の分散液(L1)を入れ、粘土鉱物の含有量が9%、含水率が91%となった培養床を作成した。
【0066】
この培養床を使用して(実施例1)と同様の培養試験を行ったところ、細胞は足場に接着伸展しなかった。このことから、粘土鉱物の含有量が9%、含水率が91%の足場は培養床として使用できないことが理解できる。
【0067】
(実施例3)
直径35mmの低接着細胞培養容器(EZ−BindShut、旭テクノグラス社製)の一部分に実施例2で作製した分散液(L1)を直径約15mmになるよう0.3gをコートし、室温で18時間乾燥させ、培養床(4)が作製できた。含水率は10%、含クレイ率は90%であった。
【0068】
培養する細胞は、正常ヒト静脈由来血管内皮細胞(倉敷紡績株式会社製)を使用した。培養は、HuMedia培地(倉敷紡績株式会社製)を使用して、5%二酸化炭素含有37℃恒温器内で行った。播種した細胞数は10万個である。播種してから1日後、4日後に培養床(2)の表面を光学顕微鏡にて観察したところ、細胞が培養床(3)上にのみ接着増殖して、培養床をコートしていない表面では細胞が接着しなかった様子が鮮明に確認することが出来た(図1)。
【0069】
(実施例4〜8、比較例9〜11)
実施例2と同様に水膨潤性粘土鉱物(A)としてLaponite XLG0.24g、水媒体(W)として水10g、を均一に混合して分散液(L1)を調製した。この分散液0.5gを直径22mmのガラス(松波ガラス社製)にコートした。乾燥時間を変えることで、含水率と含クレイ率が異なる培養床(実施例4〜8、比較例9〜11)を作製した。
【0070】
含水率及び含クレイ率の測定方法は、まず、ガラスを入れた培養皿(A)の重量を測定し、そこに分散液を加えた重量(B)を測定した。室温環境下で乾燥し、(B1)の重量を測定した。含クレイ率は下記の式で求めた。
【0071】
含クレイ率(%)=0.024×{(B)−(A)}/{(B1)−(A)}×100
各含クレイ率のコートクレイ上にCHO−K1細胞(JCRB9018,ヒューマンサイエンス研究資源バンク)を1×105細胞播種した。37℃、5%CO2雰囲気下で1日培養を行い、細胞の接着伸展を確認した。含クレイ率と細胞の接着伸展の関係は表−3の通りである。
【0072】
【表3】

【0073】
表−3での結果から、含クレイ率が50%以上で良好な培養性を発現することがわかる。
【0074】
(実施例9、10、比較例12〜15)
実施例2と同様に水膨潤性粘土鉱物(A)としてLaponite XLG0.16g、水媒体(W)として水10g、を均一に混合して分散液(L1)を調製した。また、寒天(和光純薬、010−15815)0.16g、水媒体(W)として水10g、を均一に混合して分散液(L2)を調製した。L1、L2を混合することで、全固形分中の含クレイ率の異なる分散液(L3)を調製し、この分散液0.3gを直径18mmのガラス(松波ガラス社製)にコートし、一晩室温で乾燥した。
各含クレイ率のコートクレイ上にCHO−K1細胞(JCRB9018,ヒューマンサイエンス研究資源バンク)を1×105細胞播種した。37℃、5%CO2雰囲気下で1日培養を行い、細胞の接着伸展を確認した。含クレイ率と細胞の接着伸展の関係は表−4の通りである。
【0075】
【表4】

【0076】
表−4の結果から、全固形分中の含クレイ率が80%以上で良好な培養性を発現することがわかる。
【0077】
(実施例11、比較例16〜18)
実施例2と同様に水膨潤性粘土鉱物(A)としてLaponite XLG0.16g、水媒体(W)として水10g、を均一に混合して分散液(L1)を調製した。また、メタノール9.8g、重合開始剤(D)として1−ヒドロキシシクロヘキシルフェニルケトン「イルガキュアー184」(チバガイギー社製)0.2gを、均一に混合した溶液250μlをポリジメチルアクリルアミド9.9g、水媒体(W)として水100gの混合液中に入れ、均一に分散させた後、365nmにおける紫外線強度が40mW/cm2の紫外線を180秒照射し分散液(L4)を作製した。L4を水媒体で希釈し、水膨潤性粘土鉱物と同質量%の分散液(L5)を調製した。L1、L5を混合することで、全固形分中の含クレイ率の異なる分散液(L6)を調製し、この分散液0.3gを直径18mmのガラス(松波ガラス社製)にコートし、一晩室温で乾燥した。
【0078】
実施例9,10と同様に細胞の接着伸展を確認した。含クレイ率と細胞の接着伸展の関係は表−5の通りである。
【0079】
【表5】

【0080】
表−5の結果から、全固形分中の含クレイ率が80%以上で良好な培養性を発現することがわかる。
【0081】
上記実施例及び比較例から、本発明の培養床は、他の材質の支持体との間、良好な接着性を有し、優れた細胞培養機能を有している。また、この培養床は、極短時間で、容易に製造できることが明らかであった。
【産業上の利用可能性】
【0082】
本発明による培養床をポリスチレン製培養皿や、生体埋め込み材であるセラミックス多孔体、コラーゲンスポンジ、酸化チタンなどの表面に形成させることで、細胞接着・伸展・増殖能を向上させることができ、再生医療分野での利用可能性がある。
【技術分野】
【0001】
本発明は、細胞培養の技術に関し、具体的には、細胞を容易に接着、増殖できる培養床、及びその製造方法に関する。
【背景技術】
【0002】
従来、動物組織等の培養床としては、主にプラスチック(例えばポリスチレン)製やガラス製容器が使用されてきた。これら容器は、細胞培養を有効に行わせるために、その表面にプラズマ処理や、細胞接着因子等のコーティングなどの表面処理が施されている。プラズマ処理は、ほとんどの不死化細胞株や正常細胞で細胞培養が行えるが、必ずしも有効ではなく、その表面にさらにフィブロネクチンやコラーゲンといった生体由来の細胞接着因子をコーティングすることで、細胞接着と増殖を有効に行わせていた。
【0003】
しかし、上述の細胞接着因子は生体由来であることから、ウイルスやその他伝染性物質の除去が必要であった。
【0004】
近年、培養した細胞を生体内に戻す再生医療が盛んにおこなわれ、生体由来物質を含まない細胞培養方法や細胞培養容器が求められており、細胞培養容器の表面に水に均一に分散した水膨潤性粘土鉱物(クレイ)の存在下で、水溶性有機モノマーを放射線の照射により重合させてなる三次元網目構造を有する高分子ヒドロゲルを形成させたり、水膨潤性粘土鉱物からなるクレイヒドロゲルを、その表面上で細胞を接着・伸展・増殖させたりする技術が報告されている。(例えば特許文献1および2参照)。
【0005】
しかしながら、特許文献1では、クレイは高分子ヒドロゲルを作製する架橋剤として用いられており、作製された高分子ヒドロゲルは温度によって細胞が接着・剥離する性質を持つため、温度管理や培養操作に熟練を要する問題点があった。さらに、非ゲル状での細胞培養性については開示されていない。また、特許文献2では、クレイ単独でヒドロゲルが作製され、細胞培養がなされているが、クレイの含有率が高い(含水率の低い)場合の細胞培養性や、支持体へ塗布した薄膜層による細胞培養有効性に関しては、これまでに開示されていなかった。
【0006】
細胞培養操作等の点においては、培養床がプラスチック製培養ディッシュのような容器と一体化するものが求められている。しかしながら、上記従来文献においては、このような一体化した細胞培養容器の具体的手段は開示されていない。
【0007】
また、細胞培養容器の表面にカーボンナノチューブ(CNT)層を形成することでその表面上で細胞を接着・伸展・増殖させる技術が報告されている。(特許文献3参照)。
【0008】
しかし、CNT層が効果的に細胞を接着・伸展・増殖させるには20回以上積層を繰り返す必要があり、大量生産性に欠ける問題点がある。
【0009】
一方、粘土鉱物ではないが、金属酸化物を含む細胞培養床として金属酸化物層を形成させる技術が報告されている。(特許文献4参照)。しかしながら、この培養床で培養される細胞は三次元的な集合体を構築させることを目的としており、広くおこなわれる二次元的な接着増殖ではない。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2005−110604(高分子ヒドロゲル)
【特許文献2】特開2006−325461(クレイヒドロゲル)
【特許文献3】特開2009−142218(カーボンナノチューブ)
【特許文献4】特開2004−275122(金属酸化物ゲル)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明が解決しようとする課題は、上記従来技術の問題点を解決し、高培養性を有する培養床を提供することにある。また、本発明が解決しようとする他の課題は、高培養性を有し、且つ生物由来の材料を全く使用しないか、その使用量を最小限に抑えた非生物由来材料を主成分とした培養床を提供することにある。
【課題を解決するための手段】
【0012】
本発明者等は、上記課題を解決すべく鋭意研究した結果、水膨潤性粘土鉱物(A)を含有する培養床が各種細胞に対する良好な培養性を示すことを見出し、本発明を完成するに至った。
即ち、本発明は、水膨潤性粘土鉱物と溶媒とを含有し、前記溶媒と前記水膨潤性粘土鉱物の合計質量に対する水膨潤性粘土鉱物の質量比率が24%以上であり、全固形分中の前記水膨潤性粘土鉱物の質量比率が80%以上であることを特徴とする培養床を提供する。
【0013】
また、本発明は、上記水膨潤性粘土鉱物(A)を含有する培養床の製造方法であって、
前記水膨潤性粘土鉱物(A)を水媒体に混合した後、分散液(L)を製造する第1工程、
前記分散液(L)を支持体に塗布し、その後乾燥することにより前記水膨潤性粘土鉱物(A)の薄層を形成する第2工程、を行なうことを特徴とする培養床の製造方法を提供する。
【0014】
本発明の培養床の最大の特徴は、上記水膨潤性粘土鉱物(A)がタンパク吸着とそれに伴う細胞の接着、増殖を担うことにある。
【0015】
本発明の培養床は、水膨潤性粘土鉱物(A)がほぼ均一な層状構造になっている薄層から構成されており、これを各種の支持体上に積層することにより細胞培養基材として使用することができる。
【発明の効果】
【0016】
本発明の培養床は、培養液中のタンパク質成分を表面に多く吸着でき、続いて細胞の良好な接着・伸展・増殖(高培養性)を可能にし、培養される細胞は従来通りの方法で剥離・回収できる特徴を有する。
【0017】
また、本発明の製造方法は、電子線照射のような方法を使用することなく、該培養床を(プラスチック製培養容器のような)支持体に容易に接着させることができ、装置と工程が簡便である特徴を有する。
【図面の簡単な説明】
【0018】
【図1】実施例4において、細胞が培養床(3)上にのみ接着増殖して、培養床(3)をコートしていない表面では細胞が接着しなかった様子を観察した光学顕微鏡写真である。
【発明を実施するための形態】
【0019】
本発明に用いる水膨潤性粘土鉱物(A)は、層状に剥離可能な水膨潤性粘土鉱物が挙げられ、好ましくは水または水と有機溶剤との混合溶液中で膨潤し均一に分散可能な粘土鉱物、特に好ましくは水中で分子状(単一層)またはそれに近いレベルで均一分散可能な無機粘土鉱物が用いられる。具体的にはナトリウムを層間イオンとして含む水膨潤性ヘクトライト、水膨潤性モンモリライト、水膨潤性サポナイト、水膨潤性合成雲母、等が挙げられる。これらの粘土鉱物を混合して用いても良い。
【0020】
本発明の培養床は、溶媒と水膨潤性粘土鉱物の合計質量に対する水膨潤性粘土鉱物の質量比率が50%以上、好ましくは70%以上、さらに好ましくは90%以上含有する層により形成される。
【0021】
本発明の培養床の厚みは50μm以下であることが好ましく、さらに好ましくは15μm以下、特に好ましくは50nm以下である。50μm以上であると乾燥工程で亀裂を生じ、支持体から培養床(水膨潤性粘土鉱物層)が脱落する可能性がある。前述の厚みであれば水膨潤性粘土鉱物が乾燥工程で亀裂や脱落することなく、かつ細胞接着と増殖に効果がある。
【0022】
本発明の培養床は水溶性有機化合物、例えば防腐剤や抗菌剤、着色料、香料、酵素、たんぱく質、コラーゲン、合成ペプチド類、糖類、アミノ酸類、ビタミン類、細胞、DNA類、塩類、水溶性有機溶剤類、界面活性剤、高分子化合物、レベリング剤などを含むことができる。
【0023】
水溶性有機化合物を含む全固形分と粘土鉱物の比率は、全固形分中の水膨潤性粘土鉱物の質量比率が80%以上であり、83%以上であることが好ましく、85%以上であることが特に好ましい。かかる質量比であれば培養床として特性が十分に発揮できる。
【0024】
本発明で使用する支持体とは例えば、糸状、フィルム状、板状、ディッシュ状、多孔体状などの人工物や骨、血管、脂肪、皮膚などの生体由来組織など、細胞を接着増殖させるための足場を言う。
【0025】
本発明にいう細胞培養用組成物とは水膨潤性粘土鉱物を必須として水媒体等の溶媒の分散液であれば特に限定されない。例えば水、または水と混和性を有する溶剤及び/またはその他の化合物を含む水溶液であってよく、その中には更に、防腐剤や抗菌剤、着色料、香料、酵素、たんぱく質、コラーゲン、合成ペプチド類、糖類、アミノ酸類、ビタミン類、細胞、DNA類、塩類、水溶性有機溶剤類、界面活性剤、高分子化合物、レベリング剤などを含むことができる。
【0026】
本発明にいう細胞培養用組成物は水膨潤性粘土鉱物を0.1〜3%、好ましくは0.1〜2%、さらに好ましくは0.1〜1%の濃度で含有する。かかる濃度であれば、容易に支持体を被覆することができる。
【0027】
本発明の培養床に用いられる培養床用組成物は、例えば、糸状、フィルム状、板状、ディッシュ状、多孔体状である金属、セラミック、プラスチック、ガラス、スポンジ等の平滑表面または凹凸表面を有する支持体に被覆して細胞培養基材として用いられる。
【0028】
本発明にいう細胞培養方法とは多細胞生物から細胞を分離し、体外で増殖、維持することである。本発明の培養床を用いる細胞培養方法であれば特に限定されない。例えば、生体から分離し、最初の植え替えを行う初代培養、既存の培養細胞(生体外で培養されている細胞のこと)を新たな培養容器へと移し替えて増殖、維持する継代培養、三次元構造物上に増殖される三次元培養などがあげられる。
【0029】
次いで、本発明の培養床の製造方法について説明する。
【0030】
本発明は、下記の方法で製造することができる。
【0031】
前記水膨潤性粘土鉱物(A)を水媒体等の溶媒に混合し、分散液(L)を製造する第1工程、前記分散液(L)を基材に塗布し、その後乾燥することにより前記水膨潤性粘土鉱物(A)の薄層を形成する第2工程を行なうことを特徴とする培養床の製造方法である。
【0032】
なお、本発明の培養床は非ゲル状の培養床である。
非ゲル状とは、水を大量に含まず、膨潤・収縮挙動を取らず、ゾル−ゲル転移を行わない状態を指す。
【0033】
この製造方法に用いられる水膨潤性粘土鉱物(A)は、前記の説明で述べたのと同じものを使用できるので、省略する。
【0034】
本発明の製造方法に用いる水媒体は、水膨潤性粘土鉱物(A)を含むことができ、分散液が得られれば良く、特に限定されない。例えば水、または水と混和性を有する溶剤及び/またはその他の化合物を含む水溶液であってよく、その中には更に、防腐剤や抗菌剤、着色料、香料、酵素、たんぱく質、コラーゲン、合成ペプチド類、糖類、アミノ酸類、ビタミン類、細胞、DNA類、塩類、水溶性有機溶剤類、界面活性剤、高分子化合物、レベリング剤などを含むことができる。
【0035】
水膨潤性粘土鉱物(A)の水媒体に対する濃度(質量%)は好ましくは2%以下、さらに好ましくは1%以下、より好ましくは0.8%以下である。水膨潤性粘土鉱物(A)の水媒体に対する濃度(質量%)が上記であると、非ゲル状の良好な分散液(L)が得られ、支持体への塗布が容易で、平滑で均一な薄い塗膜が得られ、好ましい。
【0036】
本発明の製造方法で製造される分散液(L)は、そのまま使用してもよいし、水洗や濾過などによる精製工程を経てから使用してもよい。また該分散液(L)に更にレベリング剤や界面活性剤、ペプチド、たんぱく質、コラーゲン、アミノ酸類、ビタミン類、高分子化合物などを添加して使用してもよい。
【0037】
本製造方法の第2工程における、前記分散液(L)の支持体への塗布方法は、公知慣用の方法でよい。例えば、分散液を支持体に流延させる方法や、バーコーターやスピンコーターによるコーター法、または噴霧などのスプレー法、模様のあるゴム版に分散液をつけてから支持体に転写する方法、また支持体に塗布しない部分を予め遮蔽して塗布後遮蔽部分を取り除くパターン状塗布や、インクジェットプリンター方式による分散液の塗布方法が挙げられる。
【0038】
細胞が接着や増殖しない支持体(例えばコロナ放電処理をしていないポリスチレン)表面に、分散液(L)を種々パターン状に塗布することにより、浮遊系細胞、例えばマクロファージやリンパ球、と接着細胞、例えば血管内皮細胞や間葉系幹細胞、などとの共培養、接着細胞同士の共培養、細胞をシート状で剥離させることも可能になる。
【0039】
乾燥方法も、分散液(L)中の揮発成分が揮発し、水膨潤性粘土鉱物(A)の薄層ができれば、任意の方法でよい。例えば、室温自然乾燥、室温の風や加熱または熱風による乾燥、遠赤外線乾燥などがあげられる。或いは分散液をスピンコーターで回転しながら熱風を当てたり加熱したりする方法も挙げられる。
【0040】
また、本発明の溶媒としては、水膨潤性粘土鉱物(A)を溶解でき、且つ一定以上の水溶性を有する溶剤を用いることができる。ここで言う水溶性を有する溶剤とは、水100gに対し50g以上溶解できる溶剤であることが好ましい。
【0041】
例えば、水溶性溶剤としては、ジメチルアセトアミド、ジメチルホルムアミドなどのアミド類、メタノール、エタノール、2−プロパノールなどのアルコール類、ジメチルスルホキシド、テトラヒドロフランなどが挙げられる。これらの溶剤を混合して用いても良い
上記の製造方法は、水膨潤性粘土鉱物(A)の比率を調整することにより、細胞の増殖速度を幅広く調整することができるという特徴を有する。
【実施例】
【0042】
以下、実施例により本発明を具体的に説明するが、本発明の範囲がこれらの実施例にのみ限定されるものではない。
【0043】
(実施例1)
この実施例は培養床を製造する例である。
[水膨潤性粘土鉱物(A)を含む分散液の調製]
水膨潤性粘土鉱物(A)としてLaponite XLG(Rockwood Additives Ltd.社製)0.08g、水20g、を均一に混合して分散液(L)を調製した。
[水膨潤性粘土鉱物(A)からなる培養床の作製(第2工程)]
直径35mmのポリスチレン製シャーレ(旭テクノグラス株式会社製、)に、上記水膨潤性粘土鉱物(A)の分散液(L1)を入れ、スピンコーターを用いて2000回転で該分散液をシャーレの表面に薄く塗布した後、80℃の熱風乾燥器中で10分間乾燥させ、50℃の精製水で2回、滅菌水で1回洗浄することで、水膨潤性粘土鉱物(A)の薄層からなる培養床(1)を作成した。培養床(1)の厚みを透過型電子顕微鏡(TEM)で計測すると、約20nmであった。また、含水率は6%、含クレイ率は94%であった。
【0044】
[培養試験]
このようにして得られた培養床(1)を5枚用いて、細胞の培養を行った。培養する細胞は、正常ヒト真皮線維芽細胞(DSファーマバイオメディカル株式会社製)を使用した。培養は、ウシ胎児血清(バイオウエスト社製)を10%含有するダルベッコ変法ミニマム・エッセンシャル・イーグル培地(和光純薬製)を使用して、5%二酸化炭素含有37℃恒温器内で行った。また、5枚のディッシュには全く同じ条件で細胞の播種を行った。播種細胞数は一枚のディッシュあたり10万個の細胞を播種した。細胞を含む培地の播種量は2mlとした。播種してから1日後、4日後、1週間後、これらの培養床(1)の表面を光学顕微鏡にて観察したところ、細胞が培養床(1)上に接着して、また十分に増殖していた様子が鮮明に確認することが出来た。一週間培養した細胞を0.05%トリプシン/0.53mM EDTA(ナカライテスク社製)を用いて回収し、再播種したところ、良好な接着と増殖が確認できた。
【0045】
(比較例1)
細胞培養用ディッシュ「ファルコン3003」(ベクトン・ディッキンソン社製)(以下,TCPSディッシュ)を何も表面処理を行わずに使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。
【0046】
(比較例2)
細胞培養用ディッシュ「ファルコンコラーゲンIコート354456」(ベクトン・ディッキンソン社製)(以下、コラーゲンコートディッシュ)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。この培養床は、I型コラーゲンをポリスチレンディッシュ表面に吸着させたものである。
【0047】
(比較例3)
細胞培養用ディッシュ「BDピュアコートアミン354721」(ベクトン・ディッキンソン社製)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。この培養床は、ポリスチレンディッシュ表面にアミド基を化学修飾したものである。
【0048】
(比較例4)
細胞培養用ディッシュ「BDピュアコートカルボキシル354773」(ベクトン・ディッキンソン社製)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。この培養床は、ポリスチレンディッシュ表面にカルボキシル基を化学修飾したものである。
【0049】
(比較例5)
細胞培養用ディッシュ「セルバインド3294」(コーニング・インターナショナル社製)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例1と同様にして行った。この培養床は、ポリスチレンディッシュ表面をマイクロウェーブ処理したものである。
【0050】
実施例1、および比較例1〜5の培養1日後、4日後、1週間後のATP産生量を調べるために、リン酸緩衝生理食塩水(PBS,和光純薬製)2mLで培養表面を洗浄し、細胞のATP試薬(和光純薬製)0.5mLを添加し、10分後にマルチプレートリーダーMTP-810Lab(日立製作所製)の発光測定モードで検出した。
【0051】
培養試験の結果を表−1に示す。
【0052】
【表1】

【0053】
表1に示されるように、培養床(1)を用いた培養によると、TCPSディッシュ(比較例1)に勝り、コラーゲンコートディッシュに(比較例2)迫る細胞増殖が確認できた。また、市販の合成品コートディッシュ(比較例3〜5)のいずれよりも細胞増殖効果があることが実現できた。
【0054】
水膨潤性粘土鉱物を薄膜化させたものは、良好な細胞増殖を示す培養床となることが表−1で明らかとなった。
【0055】
(実施例2)
実施例1と同様に水膨潤性粘土鉱物(A)としてLaponite XLG0.16g、水媒体(W)として水10g、を均一に混合して分散液(L1)を調製した。この分散液0.3gを直径15mmのガラス(松波ガラス社製)にコートし、室温で18時間乾燥させ、培養床(2)が作製できた。培養床(2)の厚みをデジタルインジケーター(SONY U12B)で測定したところ、約13μmであった。また、含水率は11%、含クレイ率は89%であった。
【0056】
ベクトン・ディッキンソン社製24ウェルプレート353047に培養床(2)を入れ、細胞培養に使用した。播種細胞、培地、培養条件は実施例1と同様で、播種した細胞数は13万個である。播種してから1日後、4日後に培養床(2)の表面を光学顕微鏡にて観察したところ、細胞が培養床(2)上に接着して、また十分に増殖していた様子が鮮明に確認することが出来た。また、1日後と4日後のATP産生量を添加する細胞のATP試薬の量を0.2mLとするほかは実施例1と同様の手法で確認した結果を表―2に示す。
【0057】
(実施例3)
分散液(L1)にアスコルビ酸リン酸エステルマグネシウム塩n水和物(和光純薬社製)を最終濃度0.28mMで添加する以外は実施例2と同様に作製し、厚み約13μmの培養床(3)が作製できた。また、含水率は13%、含クレイ率は87%であった。アスコルビ酸リン酸エステルマグネシウム塩n水和物の含有量はクレイの0.005%であった。
【0058】
細胞及び培地、培養条件は実施例2と同様にして行った。播種してから1日後、4日後に培養床(3)の表面を光学顕微鏡にて観察したところ、細胞が培養床(3)上に接着して、また十分に増殖していた様子が鮮明に確認することが出来た。また、1日後と4日後のATP産生量を実施例2と同様の手法で確認した結果を表―2に示す。
【0059】
(比較例6)
細胞培養用24ウェルプレート353047(ベクトン・ディッキンソ社製)を使用して、細胞培養を行った。細胞及び培地、培養条件は実施例2と同様にして行った。播種してから1日後、4日後の表面を光学顕微鏡にて観察したところ、細胞が接着して、また十分に増殖していた様子が鮮明に確認することが出来た。また、1日後と4日後のATP産生量を実施例2と同様の手法で確認した結果を表―2に示す。
【0060】
【表2】

【0061】
以上の実施例2,3および比較例6の結果より、水膨潤性粘土鉱物にビタミンCの誘導体であるアスコルビ酸リン酸エステルマグネシウム塩n水和物を含有させることで、さらに良好な細胞増殖を示す培養床となることが表−2で明らかとなった。
【0062】
(比較例7)
20℃の恒温室において、内部を窒素置換した平底ガラス容器に、超純水57.06gとテフロン(登録商標)製攪拌子を入れ、攪拌しながら1.44gのラポナイトXLG を加え、無色透明の溶液を調製した。これにNIPA(N-イソプロピルアクリルアミド) 6.78gを加え、窒素雰囲気内で攪拌して無色透明溶液を得た。次に、KPS(ペルオキソ二硫酸カリウム(関東化学株式会社製))水溶液3gとTEMED(N,N,N’,N’-テトラメチルエチレンジアミン(和光純薬工業株式会社製))48μlを攪拌しながら無色透明溶液に加えた。この溶液をあらかじめ窒素雰囲気中に静置して容器内の酸素を除去しておいた蓋付きのポリスチレン製容器(9cm×15cm 3枚にそれぞれ酸素にふれないようにして移した後、密栓をし、20℃の恒温水槽中で20時間静置して重合を行った。なお、これらの溶液調製から重合までの操作は、全てクリーンベンチ内にて行い、さらに酸素を遮断した窒素雰囲気下で行った。重合開始から20時間後に、ポリスチレン製容器内に無色透明で均一なシート状のヒドロゲル(A)が得られた。
【0063】
次に、シート状のヒドロゲル(A)を、20℃で2Lの超純水に2日間浸漬して、ヒドロゲルを膨潤させてから取り出し、次いで50℃の超純水1Lに12時間浸漬して、ヒドロゲルを収縮させてから取り出した。該洗浄による精製操作を3 回繰り返した後、精製したシート状のヒドロゲル(A)を、直径8cmの大きさに切断し、ヒドロゲル(A)からなる細胞培養基材(A)とした。このヒドロゲルの含水率は84%、含クレイ率は2%、クレイ/樹脂比は0.2である。それを細胞培養用ディッシュ(ベクトン・ディッキンソン・ラブウェア社製「ファルコン3003」)の中に移し替えてから蓋をして3 7 ℃ で静置した。この時細胞培養基材(A)は、疎水化されたため、完全に白色化していた。なお、これらの精製から細胞培養ディッシュ内に細胞培養基材(A)を移し替えるまでの操作は、すべてクリーンベンチ内で行った。
【0064】
この細胞培養基材(A)を使用すると、確かに細胞培養基材(A)表面で細胞の接着増殖は確認できる。しかしながら、細胞培養基材(A)はゲル状であるために、(1)水を大量に含み、(2)膨潤・収縮挙動を取るため、細胞培養ディッシュ(支持体)との固着性が無く、支持体上に積層させることが出来ない。
【0065】
(比較例8)
直径35mmのポリスチレン製シャーレ(旭テクノグラス株式会社製、)に、上記水膨潤性粘土鉱物(A)の分散液(L1)を入れ、粘土鉱物の含有量が9%、含水率が91%となった培養床を作成した。
【0066】
この培養床を使用して(実施例1)と同様の培養試験を行ったところ、細胞は足場に接着伸展しなかった。このことから、粘土鉱物の含有量が9%、含水率が91%の足場は培養床として使用できないことが理解できる。
【0067】
(実施例3)
直径35mmの低接着細胞培養容器(EZ−BindShut、旭テクノグラス社製)の一部分に実施例2で作製した分散液(L1)を直径約15mmになるよう0.3gをコートし、室温で18時間乾燥させ、培養床(4)が作製できた。含水率は10%、含クレイ率は90%であった。
【0068】
培養する細胞は、正常ヒト静脈由来血管内皮細胞(倉敷紡績株式会社製)を使用した。培養は、HuMedia培地(倉敷紡績株式会社製)を使用して、5%二酸化炭素含有37℃恒温器内で行った。播種した細胞数は10万個である。播種してから1日後、4日後に培養床(2)の表面を光学顕微鏡にて観察したところ、細胞が培養床(3)上にのみ接着増殖して、培養床をコートしていない表面では細胞が接着しなかった様子が鮮明に確認することが出来た(図1)。
【0069】
(実施例4〜8、比較例9〜11)
実施例2と同様に水膨潤性粘土鉱物(A)としてLaponite XLG0.24g、水媒体(W)として水10g、を均一に混合して分散液(L1)を調製した。この分散液0.5gを直径22mmのガラス(松波ガラス社製)にコートした。乾燥時間を変えることで、含水率と含クレイ率が異なる培養床(実施例4〜8、比較例9〜11)を作製した。
【0070】
含水率及び含クレイ率の測定方法は、まず、ガラスを入れた培養皿(A)の重量を測定し、そこに分散液を加えた重量(B)を測定した。室温環境下で乾燥し、(B1)の重量を測定した。含クレイ率は下記の式で求めた。
【0071】
含クレイ率(%)=0.024×{(B)−(A)}/{(B1)−(A)}×100
各含クレイ率のコートクレイ上にCHO−K1細胞(JCRB9018,ヒューマンサイエンス研究資源バンク)を1×105細胞播種した。37℃、5%CO2雰囲気下で1日培養を行い、細胞の接着伸展を確認した。含クレイ率と細胞の接着伸展の関係は表−3の通りである。
【0072】
【表3】

【0073】
表−3での結果から、含クレイ率が50%以上で良好な培養性を発現することがわかる。
【0074】
(実施例9、10、比較例12〜15)
実施例2と同様に水膨潤性粘土鉱物(A)としてLaponite XLG0.16g、水媒体(W)として水10g、を均一に混合して分散液(L1)を調製した。また、寒天(和光純薬、010−15815)0.16g、水媒体(W)として水10g、を均一に混合して分散液(L2)を調製した。L1、L2を混合することで、全固形分中の含クレイ率の異なる分散液(L3)を調製し、この分散液0.3gを直径18mmのガラス(松波ガラス社製)にコートし、一晩室温で乾燥した。
各含クレイ率のコートクレイ上にCHO−K1細胞(JCRB9018,ヒューマンサイエンス研究資源バンク)を1×105細胞播種した。37℃、5%CO2雰囲気下で1日培養を行い、細胞の接着伸展を確認した。含クレイ率と細胞の接着伸展の関係は表−4の通りである。
【0075】
【表4】

【0076】
表−4の結果から、全固形分中の含クレイ率が80%以上で良好な培養性を発現することがわかる。
【0077】
(実施例11、比較例16〜18)
実施例2と同様に水膨潤性粘土鉱物(A)としてLaponite XLG0.16g、水媒体(W)として水10g、を均一に混合して分散液(L1)を調製した。また、メタノール9.8g、重合開始剤(D)として1−ヒドロキシシクロヘキシルフェニルケトン「イルガキュアー184」(チバガイギー社製)0.2gを、均一に混合した溶液250μlをポリジメチルアクリルアミド9.9g、水媒体(W)として水100gの混合液中に入れ、均一に分散させた後、365nmにおける紫外線強度が40mW/cm2の紫外線を180秒照射し分散液(L4)を作製した。L4を水媒体で希釈し、水膨潤性粘土鉱物と同質量%の分散液(L5)を調製した。L1、L5を混合することで、全固形分中の含クレイ率の異なる分散液(L6)を調製し、この分散液0.3gを直径18mmのガラス(松波ガラス社製)にコートし、一晩室温で乾燥した。
【0078】
実施例9,10と同様に細胞の接着伸展を確認した。含クレイ率と細胞の接着伸展の関係は表−5の通りである。
【0079】
【表5】

【0080】
表−5の結果から、全固形分中の含クレイ率が80%以上で良好な培養性を発現することがわかる。
【0081】
上記実施例及び比較例から、本発明の培養床は、他の材質の支持体との間、良好な接着性を有し、優れた細胞培養機能を有している。また、この培養床は、極短時間で、容易に製造できることが明らかであった。
【産業上の利用可能性】
【0082】
本発明による培養床をポリスチレン製培養皿や、生体埋め込み材であるセラミックス多孔体、コラーゲンスポンジ、酸化チタンなどの表面に形成させることで、細胞接着・伸展・増殖能を向上させることができ、再生医療分野での利用可能性がある。
【特許請求の範囲】
【請求項1】
水膨潤性粘土鉱物と溶媒とを含有し、前記溶媒と前記水膨潤性粘土鉱物の合計質量に対する水膨潤性粘土鉱物の質量比率が50%以上であり、全固形分中の前記水膨潤性粘土鉱物の質量比率が80%以上であることを特徴とする培養床。
【請求項2】
前記層の厚みが1nm〜50μmである請求項1記載の培養床。
【請求項3】
水溶性有機化合物を含有する請求項1又は2記載の培養床。
【請求項4】
前記水溶性有機化合物がビタミン類から選ばれる少なくとも一種である請求項1〜3のいずれかに記載の培養床。
【請求項5】
請求項1〜4のいずれかに記載の培養床を支持体上に積層した培養基材。
【請求項6】
請求項1〜4のいずれかに記載の培養床を製造するための培養床用組成物であり、溶媒中に水膨潤性粘土鉱物を0.1〜3%分散させた培養床用組成物。
【請求項7】
請求項1〜4のいずれかに記載の培養床を用いた細胞培養方法。
【請求項8】
水膨潤性粘土鉱物を溶媒中に分散させて得られた分散液、もしくはさらに水溶性有機化合物を含む分散液を支持体に塗付し、その後溶媒を除去することにより前記水膨潤性粘土鉱物の薄層を形成する培養床の製造方法。
【請求項1】
水膨潤性粘土鉱物と溶媒とを含有し、前記溶媒と前記水膨潤性粘土鉱物の合計質量に対する水膨潤性粘土鉱物の質量比率が50%以上であり、全固形分中の前記水膨潤性粘土鉱物の質量比率が80%以上であることを特徴とする培養床。
【請求項2】
前記層の厚みが1nm〜50μmである請求項1記載の培養床。
【請求項3】
水溶性有機化合物を含有する請求項1又は2記載の培養床。
【請求項4】
前記水溶性有機化合物がビタミン類から選ばれる少なくとも一種である請求項1〜3のいずれかに記載の培養床。
【請求項5】
請求項1〜4のいずれかに記載の培養床を支持体上に積層した培養基材。
【請求項6】
請求項1〜4のいずれかに記載の培養床を製造するための培養床用組成物であり、溶媒中に水膨潤性粘土鉱物を0.1〜3%分散させた培養床用組成物。
【請求項7】
請求項1〜4のいずれかに記載の培養床を用いた細胞培養方法。
【請求項8】
水膨潤性粘土鉱物を溶媒中に分散させて得られた分散液、もしくはさらに水溶性有機化合物を含む分散液を支持体に塗付し、その後溶媒を除去することにより前記水膨潤性粘土鉱物の薄層を形成する培養床の製造方法。
【図1】




【公開番号】特開2013−55908(P2013−55908A)
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願番号】特願2011−196012(P2011−196012)
【出願日】平成23年9月8日(2011.9.8)
【出願人】(000173751)一般財団法人川村理化学研究所 (206)
【Fターム(参考)】
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願日】平成23年9月8日(2011.9.8)
【出願人】(000173751)一般財団法人川村理化学研究所 (206)
【Fターム(参考)】
[ Back to top ]

