培養重層上皮シートの改良作製方法
【課題】
特定の乾燥方法で製造される乾燥羊膜を用いる培養重層上皮シートの改良作製方法を提供する。
【解決手段】
処理槽内に載置したヒト生羊膜を、処理槽内に設けた遠赤外線ヒータによって連続して加温して、処理槽内を減圧状態とする減圧操作と、この生羊膜に処理槽外に設けたマイクロ波加熱装置からもマイクロ波を照射して羊膜を加温しつつ、減圧状態の処理槽内を復圧する復圧操作とを、複数回繰り返すことによって、生羊膜の細胞組織を保持しつつ乾燥させた羊膜は、それ自体が支持体(スキャフォールド)および支持細胞(フィーダー細胞)の機能を持ち、この乾燥羊膜を使用した上皮細胞の重層シートの作製は、培養液中に異種動物由来成分不在下行うことができる。
特定の乾燥方法で製造される乾燥羊膜を用いる培養重層上皮シートの改良作製方法を提供する。
【解決手段】
処理槽内に載置したヒト生羊膜を、処理槽内に設けた遠赤外線ヒータによって連続して加温して、処理槽内を減圧状態とする減圧操作と、この生羊膜に処理槽外に設けたマイクロ波加熱装置からもマイクロ波を照射して羊膜を加温しつつ、減圧状態の処理槽内を復圧する復圧操作とを、複数回繰り返すことによって、生羊膜の細胞組織を保持しつつ乾燥させた羊膜は、それ自体が支持体(スキャフォールド)および支持細胞(フィーダー細胞)の機能を持ち、この乾燥羊膜を使用した上皮細胞の重層シートの作製は、培養液中に異種動物由来成分不在下行うことができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、培養重層上皮シートの改良作製方法に関し、特に、特定の乾燥処理により製造されるヒト乾燥羊膜を用いた培養重層上皮シートの作製方法に関する。
【背景技術】
【0002】
上皮系細胞を培養により分化・増殖させる場合、対象とする細胞とは異なる種類の支持細胞(フィーダー細胞)を共培養することで、フィーダー細胞が産生する細胞成長因子や細胞外マトリックスを活用する技術が知られており、フィーダー細胞として、マウス由来の3T3線維芽細胞が汎用されている。
培養の対象とする上皮系細胞がヒト細胞である場合、3T3などヒト以外の細胞を対象ヒト細胞の培養液中に存在させない技術、例えば、上皮系細胞を重層化する際、上皮細胞を多孔膜上に置き、支持細胞(フィーダー細胞)を含む培養液を、多孔膜を通して供給し、上皮細胞にフィーダー細胞を接触させずに培養する方法(特許文献1)が提案されている。
一方、MCDB培地にウシ下垂体抽出を添加することで、フィーダー細胞なしに表皮細胞の培養できることが報告されている(非特許文献1)
他方、上皮系細胞をシート状に増殖させるためには、足場となる支持体(スキャホールド)が必要である。羊膜の上皮を脱細胞化したものを、スキャホールドとして利用する技術が知られている。例えば、羊膜上に口腔粘膜上皮細胞を播種し支持細胞の共存下で培養し、口腔粘膜上皮細胞が重層化した後、その最表層を空気に接触させ分化誘導する。次いで羊膜上に口腔粘膜上皮細胞層が形成された角膜上皮様のシートを得る(特許文献2)。(1)乾燥状態である(2)上皮層を有しない(3)使用時にその上で細胞の接着及び増殖が可能な構造を保持した基底膜を有する、角膜上皮様シートの作製方法であって、(a)角膜上皮細胞又は角膜上皮細胞様細胞への分化能を有する細胞を支持細胞の共存下で培養する、(b)前記細胞が増殖して重層化した後、最表層を空気に接触させる工程を含む方法(特許文献3)など。また、プロネクチンFなどの細胞接着シグナルを現す特定のポリペプチドを結合させた羊膜を使用し、無血清培地で培養すれば、角膜上皮細胞を重層化できることが知られている(特許文献4)。
【0003】
【非特許文献1】The Journal of Investigative Dermatology, 81, 33s-40s (1983)
【特許文献1】特開2005-130838
【特許文献2】WO2003/043542
【特許文献3】WO2004/078225
【特許文献4】特開2002-320666
【発明の開示】
【発明が解決しようとする課題】
【0004】
ヒト羊膜上皮を脱細胞した羊膜の基底膜をスキャホールドとして使用する技術においては、上皮系細胞の重層化培養の際に、フィーダー細胞として3T3など異種動物細胞の使用や基底膜中の羊膜由来因子の利用が行われている。
一方、ヒト羊膜自体をスキャホールドとして使用した場合、上記、特許文献4に記載されているように、羊膜自体を特殊加工する必要がある。
他方、FDA(アメリカ食品医薬品局)のガイドラインでは、上皮細胞の培養にマウスフィーダー細胞やウシ血清を用いる方法は、プリオンや未知のウイルスの混入の可能性があるため推奨されていない。
本発明は、異種動物の細胞並びに異種動物の血清および下垂体抽出物など異種動物由来の蛋白質混合物使用せず、さらには羊膜上皮の脱細胞処理あるいは羊膜自体の特殊加工を必要としない簡便な培養重層上皮シートの作製方法の開発を目的とする。
【課題を解決するための手段】
【0005】
特定の乾燥処理により製造されるヒト乾燥羊膜、すなわち、処理槽内に載置したヒト生羊膜を、処理槽内に設けた遠赤外線ヒータによって連続して加温して、処理槽内を減圧状態とする減圧操作と、この生羊膜に処理槽外に設けたマイクロ波加熱装置からもマイクロ波を照射して羊膜を加温しつつ、減圧状態の処理槽内を復圧する復圧操作とを、複数回繰り返すことによって、製造される乾燥羊膜は、羊膜細胞自体は不活化されるが、その細胞組織構造を保持できる。
本発明者らは、この特定の乾燥処理により製造される乾燥羊膜それ自体を口腔上皮細胞培養のスキャホールドとして使用することで、フィーダー細胞を使用せず、培養液にウシ血清、ウシ下垂体抽出物の添加を行うことなく、上皮細胞の重層化ができることを見出し、本発明を完成するに至った。
以下、本発明を詳細に説明する。
【0006】
本発明は、 培養重層上皮シートの作製において、(a)無菌状態の乾燥大気中で保存できるように脱水乾燥されており、かつ水または緩衝液に浸漬して再水和した羊膜には、生羊膜を構成する上皮細胞、基底膜および結合組織が保持されているヒト乾燥羊膜を支持体(スキャホールド)として使用し、(b)対象とするヒト上皮を支持細胞(フィーダー細胞)並びに異種動物由来の血清および抽出物の無い状態で培養し、次いで(c)異種動物由来の血清および抽出物の無い状態で重層化させることを特徴とする培養重層上皮シートの作製方法。
【0007】
本発明に使用される乾燥羊膜は、ヒトの胎児を包む生羊膜を乾燥処理して得た乾燥羊膜が、無菌状態の乾燥大気中で保存できるように脱水乾燥されていると共に、前記乾燥羊膜を水または緩衝液に浸漬して再水和した羊膜には、前記生羊膜を構成する上皮細胞、基底膜および結合組織が保持されていることを特徴としている。
【0008】
本発明に使用する乾燥羊膜は、以下の方法により製造される。
ヒトの胎児を包む生羊膜を乾燥処理する際に、該生羊膜を乾燥する乾燥装置として、羊膜を載置した処理槽内を減圧状態とする減圧手段と、減圧状態の前記処理槽内に載置した羊膜を加温する加温手段と、前記処理槽内の減圧状態を大気圧方向に復圧する復圧手段とを具備する乾燥装置を用い、前記減圧手段によって減圧状態の処理槽内に載置した羊膜を、前記加温手段によって加温しつつ、その構成する基底膜及び結合組織が破壊されることのない温度に保持すべく、前記減圧手段によって処理槽内を減圧状態とする減圧操作と、前記復圧手段によって減圧状態の処理槽内を大気圧方向に復圧する復圧操作とを、交互に複数回繰り返して、前記処理槽内に載置した生羊膜を脱水乾燥する。
【0009】
本発明に使用する乾燥羊膜の製造おいて、加温手段としては、遠赤外線ヒータおよびマイクロ波照射装置の少なくとも一方を好適に用いることができる。加温手段の設定温度を50℃以下とすることによって、羊膜を構成する細胞組織の破壊を可及的に少なくできる。さらに、生羊膜を処理槽内にシート状に広げて載置することによって、生羊膜の脱水を容易に行うことができる。かかる処理槽内を復圧操作によって復圧したとき、処理槽内の圧力を大気圧よりも低圧とすることによって、次の減圧操作によって処理槽内を早期に最高減圧到達圧力とすることができる。
【0010】
上記の方法で製造された乾燥羊膜は、乾燥剤が封入された滅菌パック中に滅菌・密閉することによって長期間の保存が可能である。また、該乾燥羊膜は、生羊膜の細胞組織が実質的に破壊されることなく保持できるため、水又は緩衝液に浸漬して再水和することによって、ほぼ生羊膜様の羊膜を得ることができる。
【0011】
上記の方法で製造された乾燥羊膜を上皮系細胞の培養において使用するには、適宜な大きさに切断し、使用する前に蒸留水、生理食塩液、人工房水、緩衝液などで水和させたものを用いればよい。
【0012】
本発明に使用される上皮系細胞として、例えば、ヒトの角膜上皮細胞、表皮角化細胞、口腔粘膜細胞、結膜上皮細胞、食道上皮細胞、気道上皮細胞などが挙げられ、好ましいものとして、ヒトの角膜上皮細胞、表皮角化細胞、口腔粘膜細胞および結膜上皮細胞が挙げられる。
【0013】
(b)のフィーダー細胞の無い状態での対象とする上皮の培養および(c)の重層化させる際の培養において使用される培養液は、当該細胞を増殖させ、重層化できるものであれば特に限定されない。例えば、上皮細胞の成長に通常用いられるDMEM(Dulbecco’s modified Eagle’s medium)とハムF12培地(Ham’s F12medium)とを所定割合で混ぜ、FBS、成長因子、抗生物質等を添加した培地を使用することができる。
フィーダー細胞の無い状態での対象とする上皮の培養に使用する培地としては、例えば、Boyce & Hamの方法に準じて調製された培地が挙げられる。具体的には、MCDB153基礎培地に上皮細胞増殖因子(EGF;Epidermal Growth Factor)、インシュリン、トランスフェリン、ヒドロコルチゾン、抗生物質を添加し、塩化カルシウムでカルシウム濃度を調整したMCDB153培地である。さらに、MCDB基礎培地のアミノ酸構成比率を改変した特開2005-269923のヒト上皮細胞培養用の培地を用いることができる。
重層化の際に用いる培養液として、例えば、ウシ血清やウシ脳下垂体抽出物などの異種動物由来成分を含まない上記したMCDB153基礎培地をベースにした培地が挙げられる。
【0014】
口腔などから単離された上皮細胞は、フィーダー細胞および異種動物由来成分不存在下に、乾燥羊膜上で培養される。例えば、上皮細胞浮遊液を調製し、これを乾燥羊膜の上皮細胞側(基底膜側)または結合組織側に播種し、適当な培養条件下で培養する。上皮細胞は、例えば、細胞密度が約1×103個/cm2以上、好ましくは約1×103個/cm2〜約1×107個/cm2、更に好ましくは約1×104個/cm2〜約1×106個/cm2となるように乾燥羊膜上に播種する。
上記した培養において乾燥羊膜は複数枚重ねて使用することが好ましく、二枚重ねがさらに好ましい。重ねる場合、乾燥羊膜の上皮側を上にして重ね合わせるか、または結合組織側を上にして重ね合わせるかのいずれでもよい。
【0015】
本発明において上皮細胞の重層化は、気相培養によって行われる。気相培養では、エアーリフティング(Air-lifting)と呼ばれる細胞層を形成する細胞の分化およびバリア機能の誘導のための処理を行う。具体的には、培養液の一部を一時的に除去することにより培養液表面を低下させ、これにより上皮細胞層の最表層を一時的に培養液外に露出させるか、または、上皮細胞層を乾燥羊膜ごと持ち上げて、最表層を培養液表面から一時的に露出させる。または、チューブなどを用いて空気を培養液中に送り込み、上皮細胞層の最上層に空気を接触させてもよい。好ましい方法は、培養液表面を低下させて上皮細胞の最表層を露出させる方法である。重層化した細胞層の最表層を空気に接触させる時間は、細胞の状態や培養条件などによって変動するが、3日〜3週間程度であり、好ましくは5日〜2週間、更に好ましくは約1週間である。
【0016】
以上、乾燥羊膜上において、上皮細胞が重層化した上皮シートが形成される。この培養重層上皮シートは、スキャホールドとした乾燥羊膜とともに、例えば、角膜、結膜、口腔粘膜、食道、気道などが損傷・欠損、あるいは創傷などした患者に対する移植材料として用いることができる。
【発明の効果】
【0017】
処理槽内に載置した生羊膜を、処理槽内に設けた遠赤外線ヒータによって連続して加温して、処理槽内を減圧状態とする減圧操作と、この生羊膜に処理槽外に設けたマイクロ波加熱装置からもマイクロ波を照射して羊膜を加温しつつ、減圧状態の処理槽内を復圧する復圧操作とを、複数回繰り返すことによって、生羊膜の細胞組織を保持しつつ乾燥させた羊膜は、それ自体がフィーダー細胞の機能を持ち、これを支持体として培養重層上皮シートを簡便に作製することできるとともに汚染のリスクを軽減させることができる。
【発明を実施するための最良の形態】
【0018】
以下、本発明を参考例、実施例で説明するが、本発明はそれらに限定されない。
参考例
(1)生羊膜の採取
予め同意を得た妊婦の帝王切開分娩で排出された胎盤を、直ちに無菌生理食塩水によって漿膜や血塊等を除去洗浄して生羊膜を採取した。採取した生羊膜は直ちに生理食塩水と共に滅菌試験管内に密閉して冷蔵保存した。
【0019】
(2)生羊膜の乾燥
図1に示す乾燥装置を用いて生羊膜の乾燥を行った。この乾燥装置では、マイクロ波照射装置30としては、出力1.5KWのマグネトロンを用いた。また、遠赤外線ヒータ14の温度設定を50℃とし、遠赤外線を羊膜に対して乾燥開始から終了まで連続照射した。更に、処理槽10内に羊膜を載置していないとき、真空ポンプ18による最高減圧到達圧力を0.4kPaとなるように設定した。図1に示す乾燥装置によって先に採取した羊膜を乾燥する際に、シワにならないように広げたシリコンコート紙上に、滅菌試験管から取り出した生羊膜(50g)をシワのないように広げ、これらをトレイ上に載置した。更に、このトレイを処理槽10内の回転テーブル12上に載置した後、回転テーブル12を回転した。この回転テーブル12は、乾燥開始から終了まで連続回転した。次いで、遠赤外線ヒータ14をONとして、真空ポンプ18を駆動すると共に電磁弁20を開けて処理槽10内を減圧する減圧操作を開始した。減圧開始から暫くすると減圧速度が低下してきたため、最高減圧到達圧力が0.90kPaに到達したとき、真空ポンプ18を停止すると共に電磁弁20を閉じ、電磁弁26を開いて、フィルター24によってゴミや細菌が濾過された空気を処理槽10内に導入する復圧操作を開始し、処理槽10内の圧力を4.53kPaに復圧した。復圧操作の開始と同時に、マイクロ波照射装置30としてのマグネトロンをONとしてマイクロ波を回転テーブル12上の羊膜に照射する加温操作を施した。
【0020】
かかる遠赤外線ヒータ14とマグネトロンとによる加温操作を3分間照射した後、マグネトロンをOFFにして、遠赤外線ヒータ14をONとしつつ減圧操作を再開した。再開した減圧操作によって処理槽10内を0.62kPaまで減圧状態とした後、処理槽10内を4.63kPaに復圧する復圧操作と、遠赤外線ヒータ14とマグネトロンとによる3分間の加温操作とを施した。減圧操作、加温操作及び復圧操作を合計で6回施して羊膜の乾燥を終了した。
この乾燥終了は、第5回目の減圧操作による処理槽10内の最高減圧到達圧力と、処理槽10内に羊膜を載置していないときの最高減圧到達圧力とによって判断した。すなわち、第6回目の減圧操作の最高減圧到達圧力が0.40kPaに到達し、処理槽10内に羊膜を載置していないときの最高減圧到達圧力と等しくなったため、乾燥終了と判断した。乾燥を終了した乾燥羊膜は、処理槽10に載置した生羊膜50gに対して1gに脱水乾燥されており、乾燥剤が封入された滅菌パック中に滅菌・密閉して保存した。
【0021】
(3)乾燥羊膜の状態
得られた乾燥羊膜の両面を走査電子顕微鏡によって観察したところ、図2(a)〜(c)に示す様に、平坦で起伏、断裂に乏しく一定の構造を保持していた。また、この乾燥羊膜をリン酸緩衝液(PBS)に浸漬して再水和した羊膜を、通常の光学顕微鏡標本作成方法に準拠して作成した標本を、光学顕微鏡を用いて観察したところ、図3に示す様に、生羊膜と略同様に、上皮細胞(En)、結合組織(Ct)及び間葉系の細胞(矢印M)が認められた。
【0022】
実施例
<口腔上皮細胞を培養する際の基礎培地>
・Serum Free Defined Keratinocyte-SFM medium (Invitrogen Corp., Carlsbad, CA, USA)
<添加物>
・Antibiotic-Antimycotic solution (Invitrogen Corp.,)
<乾燥羊膜/口腔上皮細胞複合体を気相下培養する際の基礎培地>
(1) Serum Free MCDB153 medium (Sigma-Aldrich Co.)
<添加物>
・Epidermal Growth Factor (Invitrogen Corp.,)
・Hydrocortisone (Wako Pure Chemical Industries, Ltd. )
・Insulin-Transferrin-Selenium-A supplement (Invitrogen Corp.,)
・Antibiotic-Antimycotic solution (Invitrogen Corp.,)
・1.8mM/l CaCl2 (Wako Pure Chemical Industries, Ltd. )
(2) Serum Free Defined Keratinocyte-SFM medium
<添加物>
・Antibiotic-Antimycotic solution(Invitrogen Corp.,)
・1.8mM/l CaCl2
※上記(1)(2)溶液を混和。
【0023】
< 口腔上皮細胞の培養 >
(1)抜歯時に付着している歯肉を採取し、単離した口腔上皮細胞浮遊液を遠心分離(1200rpm, 6分間)後、細胞生存率・細胞数を計測し、細胞密度が3×104に/cm2なるよう
Serum Free Defined Keratinocyte-SFM mediumを入れた100mm径Cell culture dish(Greiner Bio-One GmbH, Frickenhausen, Germany)に播種し、37℃、5%CO2インキュベータ中で培養した。培地は2日毎に交換した。
(2)口腔上皮細胞の密度が70〜80% confluentになった時点で継代培養した。
(3)気相化(Air-liqid interface)環境による培養が可能な容器(図4参照)に適合するようヒト乾燥羊膜をカットし、次いでヒト乾燥羊膜を2枚重ね(基底膜側を上に2枚、結合組織側を上に2枚)とし容器に固定した。
(4)容器に固定してあるヒト乾燥羊膜を、容器ごとリン酸緩衝液(PBS)に浸漬して再水和した。
(5)再水和した羊膜上に、2〜3継代した口腔上皮細胞を1×106/cm2の細胞密度にて播種した。
(6)カルシウム濃度を1.8mMに上昇させた培養液中で約4〜5日間液相化(liqid interface)環境で培養した。
(7)気相化環境に培養条件を変更し、さらに約3週間培養を継続した。
【産業上の利用可能性】
【0024】
特定の乾燥方法で製造された乾燥羊膜を利用する培養重層上皮シートの作製方法は、該乾燥羊膜自体がスキャホールドとフィーダー細胞の機能を合わせ持ち、かつ培養を異種動物由来成分不存在下に行うことができるため汚染などのリスクを軽減させることができる。そのため、再生医療用材料の製造方法として有用である。
【図面の簡単な説明】
【0025】
【図1】生羊膜の乾燥に用いる乾燥装置の一例の概略を示す概略図である。
【図2】得られた乾燥羊膜の表面の走査電子顕微鏡写真を示す。
【図3】乾燥羊膜をリン酸緩衝液に浸漬して再水和した羊膜及び生羊膜の光学顕微鏡写真を示す。
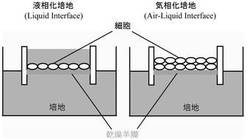
【図4】液相化培養と気相化培養の概念図である。
【図5】乾燥羊膜の結合組織側上で作製した口腔粘膜上皮重層シート断面の光学顕微鏡写真
【図6】乾燥羊膜の上皮側上で作製した口腔粘膜上皮重層シート断面の光学顕微鏡写真
【符号の説明】
【0026】
10 処理槽
12 回転テーブル
14 遠赤外線ヒータ
16 モータ
18 真空ポンプ
20 電磁弁
22 減圧配管
24 フィルター
28 復圧配管
30 マイクロ波照射装置
【技術分野】
【0001】
本発明は、培養重層上皮シートの改良作製方法に関し、特に、特定の乾燥処理により製造されるヒト乾燥羊膜を用いた培養重層上皮シートの作製方法に関する。
【背景技術】
【0002】
上皮系細胞を培養により分化・増殖させる場合、対象とする細胞とは異なる種類の支持細胞(フィーダー細胞)を共培養することで、フィーダー細胞が産生する細胞成長因子や細胞外マトリックスを活用する技術が知られており、フィーダー細胞として、マウス由来の3T3線維芽細胞が汎用されている。
培養の対象とする上皮系細胞がヒト細胞である場合、3T3などヒト以外の細胞を対象ヒト細胞の培養液中に存在させない技術、例えば、上皮系細胞を重層化する際、上皮細胞を多孔膜上に置き、支持細胞(フィーダー細胞)を含む培養液を、多孔膜を通して供給し、上皮細胞にフィーダー細胞を接触させずに培養する方法(特許文献1)が提案されている。
一方、MCDB培地にウシ下垂体抽出を添加することで、フィーダー細胞なしに表皮細胞の培養できることが報告されている(非特許文献1)
他方、上皮系細胞をシート状に増殖させるためには、足場となる支持体(スキャホールド)が必要である。羊膜の上皮を脱細胞化したものを、スキャホールドとして利用する技術が知られている。例えば、羊膜上に口腔粘膜上皮細胞を播種し支持細胞の共存下で培養し、口腔粘膜上皮細胞が重層化した後、その最表層を空気に接触させ分化誘導する。次いで羊膜上に口腔粘膜上皮細胞層が形成された角膜上皮様のシートを得る(特許文献2)。(1)乾燥状態である(2)上皮層を有しない(3)使用時にその上で細胞の接着及び増殖が可能な構造を保持した基底膜を有する、角膜上皮様シートの作製方法であって、(a)角膜上皮細胞又は角膜上皮細胞様細胞への分化能を有する細胞を支持細胞の共存下で培養する、(b)前記細胞が増殖して重層化した後、最表層を空気に接触させる工程を含む方法(特許文献3)など。また、プロネクチンFなどの細胞接着シグナルを現す特定のポリペプチドを結合させた羊膜を使用し、無血清培地で培養すれば、角膜上皮細胞を重層化できることが知られている(特許文献4)。
【0003】
【非特許文献1】The Journal of Investigative Dermatology, 81, 33s-40s (1983)
【特許文献1】特開2005-130838
【特許文献2】WO2003/043542
【特許文献3】WO2004/078225
【特許文献4】特開2002-320666
【発明の開示】
【発明が解決しようとする課題】
【0004】
ヒト羊膜上皮を脱細胞した羊膜の基底膜をスキャホールドとして使用する技術においては、上皮系細胞の重層化培養の際に、フィーダー細胞として3T3など異種動物細胞の使用や基底膜中の羊膜由来因子の利用が行われている。
一方、ヒト羊膜自体をスキャホールドとして使用した場合、上記、特許文献4に記載されているように、羊膜自体を特殊加工する必要がある。
他方、FDA(アメリカ食品医薬品局)のガイドラインでは、上皮細胞の培養にマウスフィーダー細胞やウシ血清を用いる方法は、プリオンや未知のウイルスの混入の可能性があるため推奨されていない。
本発明は、異種動物の細胞並びに異種動物の血清および下垂体抽出物など異種動物由来の蛋白質混合物使用せず、さらには羊膜上皮の脱細胞処理あるいは羊膜自体の特殊加工を必要としない簡便な培養重層上皮シートの作製方法の開発を目的とする。
【課題を解決するための手段】
【0005】
特定の乾燥処理により製造されるヒト乾燥羊膜、すなわち、処理槽内に載置したヒト生羊膜を、処理槽内に設けた遠赤外線ヒータによって連続して加温して、処理槽内を減圧状態とする減圧操作と、この生羊膜に処理槽外に設けたマイクロ波加熱装置からもマイクロ波を照射して羊膜を加温しつつ、減圧状態の処理槽内を復圧する復圧操作とを、複数回繰り返すことによって、製造される乾燥羊膜は、羊膜細胞自体は不活化されるが、その細胞組織構造を保持できる。
本発明者らは、この特定の乾燥処理により製造される乾燥羊膜それ自体を口腔上皮細胞培養のスキャホールドとして使用することで、フィーダー細胞を使用せず、培養液にウシ血清、ウシ下垂体抽出物の添加を行うことなく、上皮細胞の重層化ができることを見出し、本発明を完成するに至った。
以下、本発明を詳細に説明する。
【0006】
本発明は、 培養重層上皮シートの作製において、(a)無菌状態の乾燥大気中で保存できるように脱水乾燥されており、かつ水または緩衝液に浸漬して再水和した羊膜には、生羊膜を構成する上皮細胞、基底膜および結合組織が保持されているヒト乾燥羊膜を支持体(スキャホールド)として使用し、(b)対象とするヒト上皮を支持細胞(フィーダー細胞)並びに異種動物由来の血清および抽出物の無い状態で培養し、次いで(c)異種動物由来の血清および抽出物の無い状態で重層化させることを特徴とする培養重層上皮シートの作製方法。
【0007】
本発明に使用される乾燥羊膜は、ヒトの胎児を包む生羊膜を乾燥処理して得た乾燥羊膜が、無菌状態の乾燥大気中で保存できるように脱水乾燥されていると共に、前記乾燥羊膜を水または緩衝液に浸漬して再水和した羊膜には、前記生羊膜を構成する上皮細胞、基底膜および結合組織が保持されていることを特徴としている。
【0008】
本発明に使用する乾燥羊膜は、以下の方法により製造される。
ヒトの胎児を包む生羊膜を乾燥処理する際に、該生羊膜を乾燥する乾燥装置として、羊膜を載置した処理槽内を減圧状態とする減圧手段と、減圧状態の前記処理槽内に載置した羊膜を加温する加温手段と、前記処理槽内の減圧状態を大気圧方向に復圧する復圧手段とを具備する乾燥装置を用い、前記減圧手段によって減圧状態の処理槽内に載置した羊膜を、前記加温手段によって加温しつつ、その構成する基底膜及び結合組織が破壊されることのない温度に保持すべく、前記減圧手段によって処理槽内を減圧状態とする減圧操作と、前記復圧手段によって減圧状態の処理槽内を大気圧方向に復圧する復圧操作とを、交互に複数回繰り返して、前記処理槽内に載置した生羊膜を脱水乾燥する。
【0009】
本発明に使用する乾燥羊膜の製造おいて、加温手段としては、遠赤外線ヒータおよびマイクロ波照射装置の少なくとも一方を好適に用いることができる。加温手段の設定温度を50℃以下とすることによって、羊膜を構成する細胞組織の破壊を可及的に少なくできる。さらに、生羊膜を処理槽内にシート状に広げて載置することによって、生羊膜の脱水を容易に行うことができる。かかる処理槽内を復圧操作によって復圧したとき、処理槽内の圧力を大気圧よりも低圧とすることによって、次の減圧操作によって処理槽内を早期に最高減圧到達圧力とすることができる。
【0010】
上記の方法で製造された乾燥羊膜は、乾燥剤が封入された滅菌パック中に滅菌・密閉することによって長期間の保存が可能である。また、該乾燥羊膜は、生羊膜の細胞組織が実質的に破壊されることなく保持できるため、水又は緩衝液に浸漬して再水和することによって、ほぼ生羊膜様の羊膜を得ることができる。
【0011】
上記の方法で製造された乾燥羊膜を上皮系細胞の培養において使用するには、適宜な大きさに切断し、使用する前に蒸留水、生理食塩液、人工房水、緩衝液などで水和させたものを用いればよい。
【0012】
本発明に使用される上皮系細胞として、例えば、ヒトの角膜上皮細胞、表皮角化細胞、口腔粘膜細胞、結膜上皮細胞、食道上皮細胞、気道上皮細胞などが挙げられ、好ましいものとして、ヒトの角膜上皮細胞、表皮角化細胞、口腔粘膜細胞および結膜上皮細胞が挙げられる。
【0013】
(b)のフィーダー細胞の無い状態での対象とする上皮の培養および(c)の重層化させる際の培養において使用される培養液は、当該細胞を増殖させ、重層化できるものであれば特に限定されない。例えば、上皮細胞の成長に通常用いられるDMEM(Dulbecco’s modified Eagle’s medium)とハムF12培地(Ham’s F12medium)とを所定割合で混ぜ、FBS、成長因子、抗生物質等を添加した培地を使用することができる。
フィーダー細胞の無い状態での対象とする上皮の培養に使用する培地としては、例えば、Boyce & Hamの方法に準じて調製された培地が挙げられる。具体的には、MCDB153基礎培地に上皮細胞増殖因子(EGF;Epidermal Growth Factor)、インシュリン、トランスフェリン、ヒドロコルチゾン、抗生物質を添加し、塩化カルシウムでカルシウム濃度を調整したMCDB153培地である。さらに、MCDB基礎培地のアミノ酸構成比率を改変した特開2005-269923のヒト上皮細胞培養用の培地を用いることができる。
重層化の際に用いる培養液として、例えば、ウシ血清やウシ脳下垂体抽出物などの異種動物由来成分を含まない上記したMCDB153基礎培地をベースにした培地が挙げられる。
【0014】
口腔などから単離された上皮細胞は、フィーダー細胞および異種動物由来成分不存在下に、乾燥羊膜上で培養される。例えば、上皮細胞浮遊液を調製し、これを乾燥羊膜の上皮細胞側(基底膜側)または結合組織側に播種し、適当な培養条件下で培養する。上皮細胞は、例えば、細胞密度が約1×103個/cm2以上、好ましくは約1×103個/cm2〜約1×107個/cm2、更に好ましくは約1×104個/cm2〜約1×106個/cm2となるように乾燥羊膜上に播種する。
上記した培養において乾燥羊膜は複数枚重ねて使用することが好ましく、二枚重ねがさらに好ましい。重ねる場合、乾燥羊膜の上皮側を上にして重ね合わせるか、または結合組織側を上にして重ね合わせるかのいずれでもよい。
【0015】
本発明において上皮細胞の重層化は、気相培養によって行われる。気相培養では、エアーリフティング(Air-lifting)と呼ばれる細胞層を形成する細胞の分化およびバリア機能の誘導のための処理を行う。具体的には、培養液の一部を一時的に除去することにより培養液表面を低下させ、これにより上皮細胞層の最表層を一時的に培養液外に露出させるか、または、上皮細胞層を乾燥羊膜ごと持ち上げて、最表層を培養液表面から一時的に露出させる。または、チューブなどを用いて空気を培養液中に送り込み、上皮細胞層の最上層に空気を接触させてもよい。好ましい方法は、培養液表面を低下させて上皮細胞の最表層を露出させる方法である。重層化した細胞層の最表層を空気に接触させる時間は、細胞の状態や培養条件などによって変動するが、3日〜3週間程度であり、好ましくは5日〜2週間、更に好ましくは約1週間である。
【0016】
以上、乾燥羊膜上において、上皮細胞が重層化した上皮シートが形成される。この培養重層上皮シートは、スキャホールドとした乾燥羊膜とともに、例えば、角膜、結膜、口腔粘膜、食道、気道などが損傷・欠損、あるいは創傷などした患者に対する移植材料として用いることができる。
【発明の効果】
【0017】
処理槽内に載置した生羊膜を、処理槽内に設けた遠赤外線ヒータによって連続して加温して、処理槽内を減圧状態とする減圧操作と、この生羊膜に処理槽外に設けたマイクロ波加熱装置からもマイクロ波を照射して羊膜を加温しつつ、減圧状態の処理槽内を復圧する復圧操作とを、複数回繰り返すことによって、生羊膜の細胞組織を保持しつつ乾燥させた羊膜は、それ自体がフィーダー細胞の機能を持ち、これを支持体として培養重層上皮シートを簡便に作製することできるとともに汚染のリスクを軽減させることができる。
【発明を実施するための最良の形態】
【0018】
以下、本発明を参考例、実施例で説明するが、本発明はそれらに限定されない。
参考例
(1)生羊膜の採取
予め同意を得た妊婦の帝王切開分娩で排出された胎盤を、直ちに無菌生理食塩水によって漿膜や血塊等を除去洗浄して生羊膜を採取した。採取した生羊膜は直ちに生理食塩水と共に滅菌試験管内に密閉して冷蔵保存した。
【0019】
(2)生羊膜の乾燥
図1に示す乾燥装置を用いて生羊膜の乾燥を行った。この乾燥装置では、マイクロ波照射装置30としては、出力1.5KWのマグネトロンを用いた。また、遠赤外線ヒータ14の温度設定を50℃とし、遠赤外線を羊膜に対して乾燥開始から終了まで連続照射した。更に、処理槽10内に羊膜を載置していないとき、真空ポンプ18による最高減圧到達圧力を0.4kPaとなるように設定した。図1に示す乾燥装置によって先に採取した羊膜を乾燥する際に、シワにならないように広げたシリコンコート紙上に、滅菌試験管から取り出した生羊膜(50g)をシワのないように広げ、これらをトレイ上に載置した。更に、このトレイを処理槽10内の回転テーブル12上に載置した後、回転テーブル12を回転した。この回転テーブル12は、乾燥開始から終了まで連続回転した。次いで、遠赤外線ヒータ14をONとして、真空ポンプ18を駆動すると共に電磁弁20を開けて処理槽10内を減圧する減圧操作を開始した。減圧開始から暫くすると減圧速度が低下してきたため、最高減圧到達圧力が0.90kPaに到達したとき、真空ポンプ18を停止すると共に電磁弁20を閉じ、電磁弁26を開いて、フィルター24によってゴミや細菌が濾過された空気を処理槽10内に導入する復圧操作を開始し、処理槽10内の圧力を4.53kPaに復圧した。復圧操作の開始と同時に、マイクロ波照射装置30としてのマグネトロンをONとしてマイクロ波を回転テーブル12上の羊膜に照射する加温操作を施した。
【0020】
かかる遠赤外線ヒータ14とマグネトロンとによる加温操作を3分間照射した後、マグネトロンをOFFにして、遠赤外線ヒータ14をONとしつつ減圧操作を再開した。再開した減圧操作によって処理槽10内を0.62kPaまで減圧状態とした後、処理槽10内を4.63kPaに復圧する復圧操作と、遠赤外線ヒータ14とマグネトロンとによる3分間の加温操作とを施した。減圧操作、加温操作及び復圧操作を合計で6回施して羊膜の乾燥を終了した。
この乾燥終了は、第5回目の減圧操作による処理槽10内の最高減圧到達圧力と、処理槽10内に羊膜を載置していないときの最高減圧到達圧力とによって判断した。すなわち、第6回目の減圧操作の最高減圧到達圧力が0.40kPaに到達し、処理槽10内に羊膜を載置していないときの最高減圧到達圧力と等しくなったため、乾燥終了と判断した。乾燥を終了した乾燥羊膜は、処理槽10に載置した生羊膜50gに対して1gに脱水乾燥されており、乾燥剤が封入された滅菌パック中に滅菌・密閉して保存した。
【0021】
(3)乾燥羊膜の状態
得られた乾燥羊膜の両面を走査電子顕微鏡によって観察したところ、図2(a)〜(c)に示す様に、平坦で起伏、断裂に乏しく一定の構造を保持していた。また、この乾燥羊膜をリン酸緩衝液(PBS)に浸漬して再水和した羊膜を、通常の光学顕微鏡標本作成方法に準拠して作成した標本を、光学顕微鏡を用いて観察したところ、図3に示す様に、生羊膜と略同様に、上皮細胞(En)、結合組織(Ct)及び間葉系の細胞(矢印M)が認められた。
【0022】
実施例
<口腔上皮細胞を培養する際の基礎培地>
・Serum Free Defined Keratinocyte-SFM medium (Invitrogen Corp., Carlsbad, CA, USA)
<添加物>
・Antibiotic-Antimycotic solution (Invitrogen Corp.,)
<乾燥羊膜/口腔上皮細胞複合体を気相下培養する際の基礎培地>
(1) Serum Free MCDB153 medium (Sigma-Aldrich Co.)
<添加物>
・Epidermal Growth Factor (Invitrogen Corp.,)
・Hydrocortisone (Wako Pure Chemical Industries, Ltd. )
・Insulin-Transferrin-Selenium-A supplement (Invitrogen Corp.,)
・Antibiotic-Antimycotic solution (Invitrogen Corp.,)
・1.8mM/l CaCl2 (Wako Pure Chemical Industries, Ltd. )
(2) Serum Free Defined Keratinocyte-SFM medium
<添加物>
・Antibiotic-Antimycotic solution(Invitrogen Corp.,)
・1.8mM/l CaCl2
※上記(1)(2)溶液を混和。
【0023】
< 口腔上皮細胞の培養 >
(1)抜歯時に付着している歯肉を採取し、単離した口腔上皮細胞浮遊液を遠心分離(1200rpm, 6分間)後、細胞生存率・細胞数を計測し、細胞密度が3×104に/cm2なるよう
Serum Free Defined Keratinocyte-SFM mediumを入れた100mm径Cell culture dish(Greiner Bio-One GmbH, Frickenhausen, Germany)に播種し、37℃、5%CO2インキュベータ中で培養した。培地は2日毎に交換した。
(2)口腔上皮細胞の密度が70〜80% confluentになった時点で継代培養した。
(3)気相化(Air-liqid interface)環境による培養が可能な容器(図4参照)に適合するようヒト乾燥羊膜をカットし、次いでヒト乾燥羊膜を2枚重ね(基底膜側を上に2枚、結合組織側を上に2枚)とし容器に固定した。
(4)容器に固定してあるヒト乾燥羊膜を、容器ごとリン酸緩衝液(PBS)に浸漬して再水和した。
(5)再水和した羊膜上に、2〜3継代した口腔上皮細胞を1×106/cm2の細胞密度にて播種した。
(6)カルシウム濃度を1.8mMに上昇させた培養液中で約4〜5日間液相化(liqid interface)環境で培養した。
(7)気相化環境に培養条件を変更し、さらに約3週間培養を継続した。
【産業上の利用可能性】
【0024】
特定の乾燥方法で製造された乾燥羊膜を利用する培養重層上皮シートの作製方法は、該乾燥羊膜自体がスキャホールドとフィーダー細胞の機能を合わせ持ち、かつ培養を異種動物由来成分不存在下に行うことができるため汚染などのリスクを軽減させることができる。そのため、再生医療用材料の製造方法として有用である。
【図面の簡単な説明】
【0025】
【図1】生羊膜の乾燥に用いる乾燥装置の一例の概略を示す概略図である。
【図2】得られた乾燥羊膜の表面の走査電子顕微鏡写真を示す。
【図3】乾燥羊膜をリン酸緩衝液に浸漬して再水和した羊膜及び生羊膜の光学顕微鏡写真を示す。
【図4】液相化培養と気相化培養の概念図である。
【図5】乾燥羊膜の結合組織側上で作製した口腔粘膜上皮重層シート断面の光学顕微鏡写真
【図6】乾燥羊膜の上皮側上で作製した口腔粘膜上皮重層シート断面の光学顕微鏡写真
【符号の説明】
【0026】
10 処理槽
12 回転テーブル
14 遠赤外線ヒータ
16 モータ
18 真空ポンプ
20 電磁弁
22 減圧配管
24 フィルター
28 復圧配管
30 マイクロ波照射装置
【特許請求の範囲】
【請求項1】
培養重層上皮シートの作製において、(a)無菌状態の乾燥大気中で保存できるように脱水乾燥されており、かつ水または緩衝液に浸漬して再水和した羊膜には、生羊膜を構成する上皮細胞、基底膜および結合組織が保持されているヒト乾燥羊膜を支持体(スキャホールド)として使用し、(b)対象とするヒト上皮を支持細胞(フィーダー細胞)並びに異種動物由来の血清および抽出物の無い状態で培養し、次いで(c)異種動物由来の血清および抽出物の無い状態で重層化させることを特徴とする培養重層上皮シートの作製方法。
【請求項2】
ヒト乾燥羊膜が以下の乾燥処理方法によって製造されるものである請求項1記載の培養重層上皮シートの作製方法
乾燥処理方法:ヒトの胎児を包む生羊膜を乾燥処理する際に、該生羊膜を乾燥する乾燥装置として、羊膜を載置した処理槽内を減圧状態とする減圧手段と、減圧状態の前記処理槽内に載置した羊膜を加温する加温手段と、前記処理槽内の減圧状態を大気圧方向に復圧する復圧手段とを具備する乾燥装置を用い、前記減圧手段によって減圧状態の処理槽内に載置した羊膜を、前記加温手段によって加温しつつ、その構成する上皮細胞、基底膜および結合組織が破壊されることのない温度に保持すべく、前記減圧手段によって処理槽内を減圧状態とする減圧操作と、前記復圧手段によって減圧状態の処理槽内を大気圧方向に復圧する復圧操作とを、交互に複数回繰り返して、前記処理槽内に載置した生羊膜を脱水乾燥することを特徴とするヒト羊膜の乾燥処理方法。
【請求項3】
対象とする上皮が、角膜上皮細胞、表皮角化細胞、口腔粘膜細胞、結膜上皮細胞またはそれらの混合物から構成されるものである請求項1または2記載の培養重層上皮シートの作製方法。
【請求項4】
ヒト乾燥羊膜を重ね合わせて使用する請求項1〜3に記載の培養重層上皮シートの作製方法。
【請求項1】
培養重層上皮シートの作製において、(a)無菌状態の乾燥大気中で保存できるように脱水乾燥されており、かつ水または緩衝液に浸漬して再水和した羊膜には、生羊膜を構成する上皮細胞、基底膜および結合組織が保持されているヒト乾燥羊膜を支持体(スキャホールド)として使用し、(b)対象とするヒト上皮を支持細胞(フィーダー細胞)並びに異種動物由来の血清および抽出物の無い状態で培養し、次いで(c)異種動物由来の血清および抽出物の無い状態で重層化させることを特徴とする培養重層上皮シートの作製方法。
【請求項2】
ヒト乾燥羊膜が以下の乾燥処理方法によって製造されるものである請求項1記載の培養重層上皮シートの作製方法
乾燥処理方法:ヒトの胎児を包む生羊膜を乾燥処理する際に、該生羊膜を乾燥する乾燥装置として、羊膜を載置した処理槽内を減圧状態とする減圧手段と、減圧状態の前記処理槽内に載置した羊膜を加温する加温手段と、前記処理槽内の減圧状態を大気圧方向に復圧する復圧手段とを具備する乾燥装置を用い、前記減圧手段によって減圧状態の処理槽内に載置した羊膜を、前記加温手段によって加温しつつ、その構成する上皮細胞、基底膜および結合組織が破壊されることのない温度に保持すべく、前記減圧手段によって処理槽内を減圧状態とする減圧操作と、前記復圧手段によって減圧状態の処理槽内を大気圧方向に復圧する復圧操作とを、交互に複数回繰り返して、前記処理槽内に載置した生羊膜を脱水乾燥することを特徴とするヒト羊膜の乾燥処理方法。
【請求項3】
対象とする上皮が、角膜上皮細胞、表皮角化細胞、口腔粘膜細胞、結膜上皮細胞またはそれらの混合物から構成されるものである請求項1または2記載の培養重層上皮シートの作製方法。
【請求項4】
ヒト乾燥羊膜を重ね合わせて使用する請求項1〜3に記載の培養重層上皮シートの作製方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2009−254273(P2009−254273A)
【公開日】平成21年11月5日(2009.11.5)
【国際特許分類】
【出願番号】特願2008−106448(P2008−106448)
【出願日】平成20年4月16日(2008.4.16)
【出願人】(305060567)国立大学法人富山大学 (194)
【出願人】(504180239)国立大学法人信州大学 (759)
【Fターム(参考)】
【公開日】平成21年11月5日(2009.11.5)
【国際特許分類】
【出願日】平成20年4月16日(2008.4.16)
【出願人】(305060567)国立大学法人富山大学 (194)
【出願人】(504180239)国立大学法人信州大学 (759)
【Fターム(参考)】
[ Back to top ]

