塩素化アミノ酸を有するインスリン類似体
【解決手段】インスリン類似体は、塩化フェニルアラニンを導入するB鎖ポリペプチドを含む。該塩化フェニルアラニンは、B24位に位置し得る。該塩化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンであり得る。該類似体は、ヒトインスリンのような哺乳動物インスリン型であり得る。核酸は、係るインスリン類似体をコードする。該塩化インスリン類似体は、著しい活性を保持する。患者を治療する方法は、生理学的有効量の前記インスリン類似体或いはその生理学的に許容される塩を患者に投与することを含む。インスリンの塩素置換に基づく安定化は、細繊維形成を低下し得、それによって冷蔵を欠如する開発途上世界の地域における真性糖尿病の治療を向上し得る。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本出願は、2009年12月11日付で出願した係属中の米国仮出願第61/285、955号の利益を主張する。
【0002】
政府援助研究又は開発に関連する供述
本発明は、助成金番号DK40949およびDK074176下に国立衛生研究所により授与された協力協定の基に政府の支援でなされた。米国政府は、本発明に一定の権利を有し得る。
【0003】
本発明は、耐熱分解性ポリペプチドに関連する。特に、本発明は、熱的に安定したインスリン類似体に関連する。さらに特に、本発明は、前記インスリン類似体のアミノ酸中に塩素元素を導入することで化学的、熱的に安定化したインスリン類似体に関連する。塩素はハロゲンの一つに分類され、その原子半径、電気陰性度、部分電荷の立体電子分布、および分子中の隣接原子の立体電子特性に及ぼす伝達効果によって、タンパク質類の一般成分とは区別されるものである。
【背景技術】
【0004】
治療薬とワクチンを含む、超安定タンパク質の改変(engineering)は、電気や冷凍が安定して利用できない発展途上国世界の地域で広範な社会的利益をもたらし得る。熱劣化の影響を受けやすい治療用タンパク質の1例として、インスリンがあげられる。その化学的および物理的な劣化が投げ掛ける課題は、アフリカおよびアジアでさし迫った真性糖尿病の流行によって深刻になっている。インスリン類似体の化学的劣化速度は、その相対的安定性と逆相関しているので、超安定化製剤の設計は、係る課題地域でのインスリン補充療法の安全性と有効性を向上し得る。
【0005】
有機小分子においてハロゲン置換が有用なことがあるのは、薬化学で知られている。フッ素官能基は、コレステロール生合成の阻害剤である、アトルバスタチン(atorvastatin)(Lipitor(商標))、うつ病やその他の情動障害の治療に使用される、選択的セロトニン再導入阻害剤である、フルオキセチン塩酸塩(Fluoxetin(Prozac(商標))などのように広く処方されている小分子の有効性にとって重要である。フッ素の原子半径は、水素のと同様であるが、その大きな誘起効果は、これらの薬剤の立体電子的性質を変え、その結果生物学的活性を向上させるのである。類似した物理有機化学上の考慮は、塩素のような大きいハロゲン原子の導入に関連する。小分子モンテルカストナトリウム(montelukast sodium)(Singulair(商標))は、その医薬品の特性が塩素原子の共有結合の導入で強化されたロイコトリエン(leukotriene)阻害剤である。さらに、インスリン類似体でのフッ素置換アミノ酸の使用は、2009年7月31日出願の国際特許出願PCT/US第2009/52477号に提供されている。
【0006】
修飾アミノ酸中への塩素原子の部位特異的導入によるタンパク質の化学的、物理的、および生物学的特性の調節に就いては、フッ素原子の導入による上記効果に比して、あまりよく科学文献に特性が記述されていない。
【0007】
芳香族側鎖は、隣接する芳香環だけでなく、正或いは負の静電ポテンシャルの他の発生源を含む、様々の弱い極性相互作用に関係し得る。例としては、ペプチド結合中の主鎖カルボニル基とアミド基が含まれる。
【0008】
インスリンの投与は、永年真性糖尿病の治療として確立されている。インスリンは脊椎動物の代謝において中心的な役割を果たす小さな球状蛋白質である。インスリンは、21残基を含有するA鎖および30残基を含有するB鎖である、2つの鎖を含有する。当該ホルモンは、膵臓β細胞中にZn2+で安定化された6量体として貯蔵されるが、血液中ではZn2+不含単量体として機能する。インスリンは、接続領域(35残基)が、A鎖のN末端残基にB鎖のC末端残基(残基B30)を結びつける単鎖前駆体である、プロインスリンの産出物である(図1A)。プロインスリンの構造は、決定されていないが、様々な証拠は、それがインスリン様のコアと無秩序の連結ペプチド(図1B)から成ることを示している。3つの特定のジスルフィド結合(A6−A11、A7−B7、およびA20−B19、図1Aおよび1B)の形成は、粗面小胞体(ER)でのインスリンの酸化的フォールディングと連携していると考えられている。プロインスリンは、ERからゴルジ(Golgi)体へ排出後直ぐに会合して、水溶性のZn2+−配位6量体を形成する。内部タンパク質分解による消化およびインスリンへの変換は、未熟な分泌顆粒で起こり、次いで形態学的縮合が起こる。成熟した貯蔵顆粒内の亜鉛インスリン6量体の結晶配列は、電子顕微鏡(EM)により可視化されている。
【0009】
生理学的貯蔵形態である、Zn2+配位インスリン6量体については、広範囲なX線結晶学的研究が行われてきた。インビトロで複数の結晶形態が記載され、T6、T3Rf3及びR6と命名された、3個の構造系統が定義されている。これらの6量体では、2個のZnイオンが6量体中心軸に沿って位置すると考えられ、各3個のヒスチジン(HisB10)が配位し、更なる低親和性Zn結合部位が、いくつかの結晶形態で観察されている。T−状態プロトマーは、溶液中のインスリン単量体の構造に似ている。R−状態プロトマーは、B鎖の二次構造にある変化を示し、中央のα−ヘリックスは、B1(R状態)或いはB3(擦り切れたRf状態)にまで延長している。
【0010】
インスリンは、血流中単量体として機能するが、それにもかかわらず、この単量体こそが最も細繊維維形成しやすく、化学的分解の大抵の形態であると考えられている。NMRで溶液中の特徴を求めた、インスリン単量体の構造は、図1Dに示されている。A鎖は、N末端ヘリックス(残基A1〜A8)、非正規のターン(A9〜A12)、第2α−ヘリックス(A12〜A18)、およびC末端延長(A19〜A21)から成る。B鎖は、N末端アーム(B1〜B6)、β−ターン(B7〜B10)、中央α−ヘリックス(B9〜B19)、β−ターン(B20〜B23)、β−ストランド(B24〜B28)、および柔軟なC−末端残基B29〜B30を含む。この二つの鎖は、3個のジスルフィド架橋(システイン、A6〜A11、A7〜B7、およびA20〜B19)によって安定化した、緻密な球状ドメインを形成するように纏まる(pack)。
【0011】
通常のインスリンの吸収は、亜鉛―インスリン6量体の動力学的寿命で限定されていて、毛細血管の内皮細胞ライニングを介して通過できる為にはより小さな2量体および単量体に分解しなければならない。Humalog(登録商標)及びNovolog(登録商標)の設計の基にある本質的な考え方は、分解を加速することである。これは古典的な二量体形成面(C末端反平行β−シート)を不安定にすることで達成される。Humalog(登録商標)は、IGF−Iの配列を模倣する反転である、ProB28→LysおよびLysB29→Pro置換を含んでいる。Novolog(登録商標)はProB28→Asp置換を含んでいる。該置換は二量体化を阻害するが、前記類似体は、フェノール或いはメタ−クレゾール安定化亜鉛6量体の会合能力がある。この会合は、前記類似体がバイアル中で細繊維形成しないように保護するが、皮下注射後、前記フェノール(或いはm−クレゾール)と亜鉛イオンとが拡散除去されるにつれて、前記6量体は、急速に解離する。これらの類似体の不安定性は、患者或いは医療提供者による希釈後にその有効期限が短くなる原因となる。インスリン類似体がHumalog(登録商標)の変異形2量体−関連β−シートを保持しつつ、インスリン単量体の本質的な安定性を強化するのは有用であろう。
【0012】
貯蔵時に亜鉛インスリン6量体を使用することは、既知であり、バイアルやポンプの貯留タンク内での製剤の物理的劣化、化学的劣化を遅延させるための古典的な戦略を代表する。前記亜鉛インスリン6量体は毛細血管中に瞬時に通過するには大きすぎるため、皮下注射後のインスリンの吸収速度は、6量体がより小さい2量体および単量体単位に解離するのに必要な時間で限定される。したがって、インスリン類似体が(a)高いタンパク質濃度(バイル或いはポンプ内のように)で、6量体が十分会合出来、しかも(b)前記2量体界面では十分不安定化し、加速化した分解を示し、その為当該皮下デポー(depot)から超高速で吸収が予期されるという両方の能力があれば有利であろう。これらの構造上の目標は、安定性(貯蔵時)と不安定性(注入後)との間の紙一重の所を行くことである。
【0013】
インスリン中のアミノ酸置換が熱力学的安定性および生物学的活性に及ぼす影響について検討されてきた。安定性と活性の間には、一致した関係が見られていない。熱力学的安定性を向上させる置換のあるものは、インスリン受容体への結合も強化する一方、安定性を向上させる他の置換は、そのような結合を妨げるのである。ThrA8をいくつかの他のアミノ酸で置換する効果が、野生型ヒトインスリンで検討され、又、B鎖中の3個の無関係な置換(HisB10→Asp、ProB28→Lys、およびLysB29→Pro)を含む、改変インスリン単量体の場合について報告されている。置換の当該分野では、吸収の経時変化を加速或いは遅延させる例も知られている。係る置換(例えばNovalog(登録商標)におけるAspB28およびHumalog(登録商標)などにおける[LysB28、ProB29])は、より迅速な細繊維形成と、より低い物理的安定性とに関連し得るし、またしばしば関係がある。事実、ある研究に於いてAspB28インスリンとAspB10インスリンとを含む、ヒトインスリン類似体10種のシリーズで、細繊維形成のし易さが試験された。10種は全てが、pH7.4および37℃で、ヒトインスリンより細繊維形成しやすいことが判った。この10種の置換は、当インスリン分子の多様な部位にあって、古典的な熱力学的安定性の変化の幅広い違いと関連する可能性がある。一連の効果が観察されてきたが、活性と熱力学的安定性間には、相関関係が存在しない。
【0014】
インスリンは化学合成も半合成も極めてし易い、小さな球状タンパク質であり、それで非標準的な側鎖の導入が容易になる。インスリンは3個のフェニルアラニン残基(B1、B24、及びB25位)と、B26位に構造的に類似のチロシンとを含有する。PheB24の芳香環は、脊椎動物のインスリン及びインスリン様成長因子間に保存されていて、B鎖の超二次構造を安定させるよう、疎水性コア(ただし内部ではなく)に対して纏まって(pack)いる。PheB24は、古典的な受容体結合表面に位置し、受容体結合時の立体構造(コンフォメーション)の変化を誘導すると提案されている。PheB25は、インスリン単量体の表面から突出している一方、TyrB26は、前記コアの一端に於いて脂肪族側鎖(IleA2、ValA3およびValB12)付近に纏まって(pack)いる。B24に関連する立体構造の変化は、PheB25およびTyrB26がインスリン受容体の別個のドメインと接触出来るようにするものと提案する。
【0015】
蛋白質細繊維形成の現在の理論は、細繊維形成のメカニズムが部分的に折り畳まれた中間体状態を介して進行し、次いで凝集し、アミロイド形成的核を形成すると仮定する。この理論では、天然状態を安定させるアミノ酸置換は、部分的に折り畳まれた中間状態を安定させ得るか、或いはさせ得ず、亦、天然状態と中間状態間の自由エネルギー障壁を増加(或いは減少)させ得るか、或いはさせ得ないことが可能である。したがって、現在の理論は、当該インスリン分子内の特定のアミノ酸置換が細繊維形成のリスクを増加或いは減少させる傾向が極めて予測不能であることを示している。
【0016】
糖尿病治療用のインスリンおよびインスリン類似体の製造、貯蔵、及び使用における重大な問題である細繊維形成は、高温、低pH、攪拌、或いは尿素、グアニジン、エタノール共溶媒、或いは疎水性表面の存在下で促進される。現行の米国医薬品規制は、細繊維形成が1%或いはそれ以上のレベルで発生した場合、インスリンは破棄すべしと定めている。細繊維形成は、高温で促進されるので、糖尿病患者は、最適には、使用前には、インスリンを冷蔵しておかなければならない。インスリン或いはインスリン類似体は、インスリン又はインスリン類似体を少量定期的に患者の体内に注入する体外インスリン・ポンプを利用する糖尿病患者にとって特に問題となり得る。係る使用法では、前記インスリン又はインスリン類似体は、ポンプ装置内で冷蔵保存されていなく、インスリンの細繊維形成により、体内にインスリン或いはインスリン類似体注入用カテーテルの閉塞をもたらし得るので、予測不能な血糖値の変動を招き、危険な高血糖症さえ引き起こす可能性がある。少なくとも最近のある報告は、リスプロインスリン(野生型ヒトインスリンで残基B28とB29がこれらの位置を入れ替えた類似体、商品名Humalog(登録商標))が特に細繊維形成し易く、インスリンポンプ・カテーテルの閉塞を起こし得ることを示している。
【0017】
インスリン細繊維形成は、インスリンが1〜3箇月間高濃度で、しかも体外ポンプのような常温ではなく生理学的温度(すなわち37℃)でインプラント内に収納されている、植込み式(インプランタブル)インスリンポンプにおいては、さらにより大きな問題である。さらに、通常の運動によって引き起こされる攪拌も、またインスリンの細繊維形成を加速する傾向となるであろう。インスリン細繊維形成の可能性が増大するにもかかわらず、植込み型インスリンポンプは、係るシステムの可能性のある利点のために、まだ研究活動の題目となっている。これらの長所は、全身循環系を介して患者にインスリンを提供する皮下注射より密接に、インスリンの正常な生理学的送達を真似た門脈循環器系へのインスリンの腹腔内への送達を包含する。腹腔内送達は、注射部位が変われば吸収と分解が変わり得る皮下注射に比べて、より迅速で且つ着実にインスリンの吸収を提供する。植込み型ポンプを介するインスリンの投与は、また、患者にとってより便利になる可能性がある。例えば、貯留タンクへ界面活性剤を添加することなどで細繊維形成を防止するための努力は、いくらかの改善をもたらしたが、これまで、これらの改善は、厳密な監視下の臨床試験以外には、植え込みインスリンポンプを信頼して糖尿病患者に使用を認めるには不十分だと考えられている。
【0018】
上述したように、発展途上国世界は、医薬及びワクチンの安全な保管、輸送、及び使用に関連する課題に直面している。この課題は、電気と冷蔵に着実にアクセスできない、アフリカ及びアジア地域での、温度に敏感なインスリン製剤の使用を悪化させるが、さらに該発展途上国世界の糖尿病の目下の流行によって、課題が深刻化する可能性が高い。インスリンは、25℃を超える温度で、10℃上昇毎に分解速度が10倍増、或いはそれ以上を示すので、指針は、30℃未満の温度での貯蔵、好ましくは冷蔵保存するよう求めている。より高温でインスリンは、化学的劣化(例えば、イソ−アスパラギン酸の形成、ジスルフィド結合の再配列、及び共有結合ポリマーの形成などの共有結合構造の変化)と物理的劣化(非天然凝集及び細繊維形成)との両方を受ける。
【0019】
インスリンのアミノ酸置換は、蛋白質を安定化するが、インスリン受容体(IR)への結合及びインスリン様成長因子(IGFR)の相同受容体への交差(クロス)結合を増大するので、発癌リスクを付与すると記載されている。当分野で知られている例は、アスパラギン酸によるHisB10の置換が挙げられる。AspB10インスリンは、安定性と薬物動態とに関して有利な薬学的特性を示すが、その増大した受容体−結合特性は、Sprague−Dawleyラットの腫瘍形成と関連していた。IR及びIGFRへの結合をヒトインスリンのそれに似たレベルまでに減らすのに、AspB10−インスリン或いは関連類似体に導入し得る、A或いはB鎖に可能な置換が多くあるが、係る置換は、一般にインスリン(或いはインスリン類似体)の安定性を悪化し、その化学的および物理的劣化し易さを高める。受容体―結合親和性の"調整"を可能にし、同時に細繊維形成に対する安定性及び抵抗力を高める、インスリンおよびインスリン類似体の修飾方法を発見することは、望ましいであろう。係る応用法では、その受容体―結合特性において超活性な類似体の発癌可能性を相殺するように、IRおよびIGFRへの結合を種々の程度に減らす一組の安定化の修飾が必要となるであろう。
【0020】
したがって、貯蔵中安定であるが、同時に即効性のものを含めて、代替インスリン類似体の必要性がある。
【発明の概要】
【課題を解決するための手段】
【0021】
したがって、本発明の一態様は、アミノ酸の塩素置換によって改善された安定性のような特性変化をもたらし、さらに、対応する非塩素系インスリン或いは類似体の生物学的活性の少なくとも一部を保持するインスリン類似体を提供することである。
【0022】
さらに、或いは代替として、本発明の一態様は、速効性インスリンであるが従来の速効型インスリン類似体に勝る、改善した安定性を有するインスリン類似体を提供することである。
【0023】
一般に、本発明は、塩素化アミノ酸を導入するB−鎖のポリペプチドを含むインスリン類似体を提供する。一実施形態では、該塩素化アミノ酸は、B24位におけるフェニルアラニンである。特定の一実施態様において、前記塩素化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンである。さらに、或いは代替物では、前記インスリン類似体は、ヒトインスリン類似体のような、哺乳動物のインスリン類似体であり得る。特定の一組の実施形態では、前記B鎖ポリペプチドは、配列ID番号4〜8からなる群から選択されるアミノ酸配列と、その3個或いはそれ以下の更なるアミノ酸置換を有するポリペプチドとを、含む。
【0024】
また、B24位でパラ−モノクロロ−フェニルアラニンのような塩素化フェニルアラニンを導入するB鎖ポリペプチドを含むインスリン類似体をコードする核酸も提供される。一例において、前記塩素化フェニルアラニンは、核酸配列TAGのような終止コドンによりコードされる。発現ベクターが係る核酸を含み得、宿主細胞が係る発現ベクターを含み得る。
【0025】
本発明はまた、患者を治療する方法を提供する。該方法は、インスリン類似体或いはその生理学的に許容される塩の生理学的有効量を患者に投与することを含むが、該インスリン類似体或いはその生理学的に許容される塩は、塩素化アミノ酸を含む。一実施形態では、インスリンB鎖は、B24位に塩素化フェニルアラニンを導入する。特定の一態様では、前記塩素化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンである。さらに、或いは代替では、インスリン類似体は、例えば、ヒトインスリンの類似体のような哺乳動物のインスリン類似体を含み得る。さらに、前記B鎖ポリペプチドは、配列ID番号4〜8からなる群から選択されるアミノ酸配列と、その3個或いはそれ以下の更なるアミノ酸置換を有するポリペプチドとを、含み得る。
【図面の簡単な説明】
【0026】
【図1A】図1AはA−鎖及びB−鎖と、隣接する2塩基性切断部位(黒丸)で示される連結領域と、C−ペプチド(白丸)と、を含むヒトプロインスリン配列の概略図である。
【図1B】図1Bは、インスリン様部分と不規則連結ペプチド(破線)から成る、プロインスリンの構造モデルである。
【図1C】図1Cは、B鎖中の残基B24の位置を示すヒトインスリン配列の概略図である。
【図1D】図1Dは、3つのジスルフィド架橋との関聯でPheB24の芳香族残基を示すインスリン単量体のリボンモデルである。LeuB15(黒)及びPheB24(灰色)の隣接する側鎖が示されている。A鎖とB鎖の鎖が示され、ジスルフィド架橋は、球及び棒として示されている。
【図1E】図1Eは、疎水性コアの端にあるポケット内のPheB24側鎖を示すインスリンの空間充填モデルである。
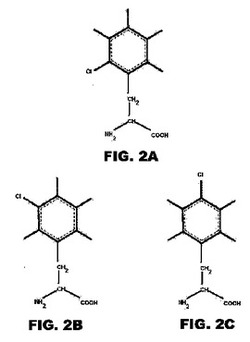
【図2A】図2Aは、オルト−モノクロロ−フェニルアラニン(2Cl−Phe)の図である。
【図2B】図2Bは、メタ−モノクロロ−フェニルアラニン(3Cl−Phe)の図である。
【図2C】図2Cは、パラ−モノクロロ−フェニルアラニン(4Cl−Phe)の図である。
【図3A】図3Aは、単離インスリン受容体(アイソフォーム B):ヒトインスリン(三角)、KP−インスリン(四角)、および4Cl−PheB24−KP−インスリン(逆三角)を用いたインビトロ受容体―結合アッセイの結果を示すグラフである。
【図3B】図3Bは、IGF−1R:ヒトインスリン(三角)、KP−インスリン(四角)、4Cl−PheB24−KP−インスリン(逆三角)、および天然IGF−I(円)を用いたインビトロ受容体―結合アッセイの結果を示すグラフである。
【図3C】図3Cは、単離インスリン受容体(アイソフォームB):ヒトインスリン(実線)、KP−インスリン(破線)、4Cl−PheB24−KP−インスリン(三角)、4F−PheB24−KP−インスリン(四角)を用いたインビトロ受容体−結合アッセイの結果を比較したグラフである。
【図3D】図3Dは、単離インスリン受容体(アイソフォームB):ヒトインスリン(実線)、KP−インスリン(破線)、4Cl−PheB24−KP−インスリン(三角)、4F−PheB24−KP−インスリン(四角)を用いたインビトロ受容体―結合アッセイの結果を比較したグラフである。
【図4】図4は、STZ誘発糖尿病Lewisラットでの4Cl−PheB24−KP−インスリン(逆三角)の皮下注射の経時血糖降下作用を、希釈液単独(丸)、ヒトインスリン(x)、及KP−インスリン(四角)に対して相対的に示すグラフである。
【図5】図5A〜Cは、インスリンコバルト溶液の平均トレース(記録図)を示すグラフであって、2mMEDTAの添加前と後の400〜750nmの特徴的なスペクトル・プロファイルを示す。試料は、50mMトリス(pH7.4)、50mMフェノール、および0.2mM塩化コバルト(CoCl2)に溶解した。次いで、NaSCNを最終濃度1mMになるまで添加した。実線は、EDTA抽出前データを示す。破線は、EDTA抽出後のデータを示す。図A:野生型インスリン;図B:KP−インスリン;図C;4Cl−PheB24−KP−インスリン。 図5Dは、2mMEDTA添加後、574nm(25℃およびpH7.4)で測定した、6量体解離の動態を示すグラフである。データは、各試料のタイム・ゼロに正規化した:野生型(実線)、KP−インスリン(破線)、および4Cl−PheB24−KP−インスリン(点線)。
【図6】図6は、平均濾過グルコース注入速度対体重kg当たり0.2単位用量でインスリンKP−インスリン(リスプロインスリン)及び4Cl−PheB24−KP−インスリン(4−Cl−リスプロインスリン)のインスリン投与後の時間とのプロットを示すグラフである。
【図7】図7は、豚の薬理試験20組をまとめた棒グラフであって、5つの異なる投与量レベルで、KP−インスリンに比し、4Cl−PheB24−KP−インスリンが後期最大半量到達時間(1/2T−max late)の有意な改善を実証している。
【図8】図8は、豚の薬理試験14組をまとめた棒グラフであって、3つの異なる投与量レベルで、KP−インスリンに比し、4Cl−PheB24−KP−インスリンが初期最大半量到達時間(1/2T−max early)の改善を示唆している。
【図9】図9は、曲線下面積(AUC)で測定した、4Cl−PheB24−KP−インスリンのKPインスリンに対する相対的効力を比較した10組の対応する薬物動態の研究要約であって、4−Cl−KPの平均効力のわずかな減少は、統計的に有意でないことが判明した(p=0.22)。
【発明を実施するための形態】
【0027】
本発明は、アミノ酸の塩素置換によってより高い安定性を提供するインスリン類似体であって、対応する非塩素系インスリン或いはインスリン類似体の生物学的活性の少なくとも一部を保持する、当該類似体に関聯する。特に、本発明は、アミノ酸における塩素置換で、より高い安定性を提供するインスリン類似体であって、同時に対応する非塩素系インスリン或いはインスリン類似体の生物学的活性の少なくとも一部を保持する当該類似体を提供する。ある特定の態様において、本発明は、野生型フェニルアラニンのB位における置換としてパラ−モノクロロ−フェニルアラニン(4−Cl−PheB24)残基を含むインスリン類似体を提供する。
【0028】
しかし、本発明はヒトインスリンおよびその類似体に限定されない。これらの置換は非限定的例により、ブタ、ウシ、ウマ、及びイヌインスリンのような動物インスリンでも実施し得ることも想定される。
【0029】
さらに、ヒトとインスリンと動物インスリン間の類似性と、過去において人間の糖尿病患者に使用した動物インスリンと、の観点から、インスリンの配列内に他の小規模な修飾、とくに"保存"とみなされる置換を導入し得ることも想定される。例えば、アミノ酸の更なる置換は、本発明から逸脱することなく、類似の側鎖を有するアミノ酸のグループ内で行い得る。これらは中性疎水性アミノ酸:アラニン(Ala或いはA)、バリン(Val或いはV)、ロイシン(Leu或いはL)、イソロイシン(IlE或いはI)、プロリン(Pro或いはP)、トリプトファン(Trp或いはW)、フェニルアラニン(Phe或いはF)及びメチオニン(Met或いはM)を含む。同様に、中性の極性アミノ酸は、グリシン(Gly或いはG)、セリン(Ser或いはS)、スレオニン(Thr或いはT)、チロシン(Tyr或いはY)、システイン(Cys或いはC)、グルタミン(Glu或いはQ)、およびアスパラギン(Asn或いはN)のグループ内で互いに置換し得る。塩基性アミノ酸は、リジン(Lys或いはK)、アルギニン(ArG或いはR)およびヒスチジン(His或いはH)を含むと考えられる。酸性アミノ酸は、アスパラギン酸(Asp或いはD)とグルタミン酸(Glu或いはE)とがある。別途に記載があるか、或いは前後関係から明らかな場合でない限り、本明細書に記載のアミノ酸は、L−アミノ酸であると考えるべきである。一例では、本発明のインスリン類似体は、本発明の前記4Cl−PheB24置換以外の3個或いはそれ以下の保存的置換を含む。別の例では、本発明のインスリン類似体は、本発明の前記4Cl−PheB24置換以外の1個或いはそれ以下の保存的置換を含む。
【0030】
本明細書および特許請求の範囲で使用されている場合、インスリンあるいはインスリン類似体中の様々なアミノ酸は、問題にしているアミノ酸残基を記載し、次いで当該アミノ酸の位置を、選択的には上付き文字で記載し得る。問題のアミノ酸の位置は、前記置換が位置するインスリンの前記A鎖或いはB鎖を含む。したがって、PheB24は、インスリンのB鎖の第24番目のアミノ酸にあるフェニルアラニンを表し、一方PheB25は、インスリンのB鎖の第25番目のアミノ酸にあるフェニルアラニンを表す。塩素化アミノ酸は接頭辞「Cl−」で表し得る。したがって、塩素化フェニルアラニンは、「Cl−Phe」と省略し得る。フェニルアラニンの場合には、塩素置換基或いはフェニル側鎖上の置換基の位置をさらに前記塩素が結合する炭素の番号で表してもよい。したがって、オルト−モノクロロ−フェニルアラニンは、(図2Bに示すように)「2Cl−Phe」と省略され、メタ−モノクロロ−フェニルアラニンは(図2Cに示すように)3Cl−Phe」と省略され、パラ−モノクロロ−フェニルアラニンは4Cl−Pheとl−Pheと、省略される。
【0031】
B24にあるフェニルアラニンは、機能性インスリンにおける不変アミノ酸であって、芳香族側鎖を包含する。インスリンにおけるPheB24の生物学的重要性は、臨床的変異(SerB24)がヒトの真性糖尿病を引き起こすことで示される。図1Dと図1Eに図示のように、亦、理論に束縛されることを望まないが、PheB24は、古典的な受容体結合表面で疎水性コアの端に纏まって(pack)いると考えられている。このモデルは、結晶学的プロトマー(2−Zn分子1;プロテインデータバンク識別名4INS)に基づいている。PheB24は、B鎖(残基B24〜B28)のC末端β−ストランド内に位置し、中央のα−ヘリックス(残基B9〜B19)に隣接している。芳香環の一面と一端は、LeuB15とCysB19により規定される浅いポケット内に位置する。他の面と他の端は溶剤に露出している(図1E)。このポケットは、部分的に主鎖カルボニル基とアミド基とで囲まれているので、複雑で且つ非対称的な静電気的環境を形成する。
【0032】
本発明の前記置換は、現行の多くのインスリン類似体のいずれにでも実施し得ることが想定される。例えば、本明細書で提供される塩素化PheB24置換は、ヒトインスリンの他にリスプロ(KP)インスリン、インスリンアスパルト(Aspart)、他の修飾インスリン或いはインスリン類似体、或いは、通常のインスリン、NPHインスリン、レンテインスリン或いはウルトラレンテインスリンのような様々な医薬製剤内で実施し得る。アスパルト(Aspart)インスリンは、AspB28置換を含み、Novalog(登録商標)として販売され、一方リスプロインスリンは、LysB28とProB29置換とを含み、名称Humalog(登録商標)として知られ、また、その名称で販売されている。これらの類似体は、米国特許第5,149,777号及び第5,474,978号に記載されている。これらの類似体は、共に速効性インスリンとして知られている。
【0033】
理論に束縛されることを望まないが、芳香環のパラ位にある前記塩素置換は二量体インターフェース(4Cl−PheB24)内に埋め込まれていると考えられ、また不利な塩素―芳香族静電双極子モーメントの配置を形成し、当該6量体内において、各二量体界面で対に並置することで、6量体の分解を促進するとも考えられている。これによって、Zn2+イオンの存在下に前記インスリン類似体を形成しても、尚且速効性(食事時)インスリン類似体である能力を保持出来ると考えられている。
【0034】
塩素化−Phe置換は、B24におけるものを含めて、従来臨床的に使用されていないが、なお実験的に有用である、以下にもっと詳しく記載のDKPインスリンのようなヒトインスリン類似体にも導入し得るし、或いはB鎖のC末端残基とA鎖のN末端残基との間の正常の35個のアミノ酸連結領域の代わりにインスリンの前記A鎖部分とB鎖部分の間に一つのジペプチドリンカー(Ala−Lys)を含む、プロインスリン類似体であるミニプロインスリンにも導入し得る(図1B参照)。DKP−インスリン(或いはAspB10を含む、或いはヒトインスリンのそれよりも高い受容体−結合親和性を示す他のインスリン類似体)においてB24位での塩素化―Pheの導入は、これらの受容体―結合親和性をヒトインスリンと同様或いはそれ以下までに低下できるので、潜在的に臨床的使用を可能にする。このようにして、インスリン類似体の、分裂促進的なIGFRへの交差結合も低下し得る。
【0035】
ヒトプロインスリンのアミノ酸配列を、比較の目的のために、配列ID番号1として提供する。
配列ID番号1(プロインスリン)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr-Arg-Arg-Glu-Ala-Glu-Asp-Leu-Gln-Val-Gly-Gln-Val-Glu-Leu-Gly-Gly-Gly-Pro-Gly-Ala-Gly-Ser-Leu-Gln-Pro-Leu-Ala-Leu-Glu-Gly-Ser-Leu-Gln-Lys-Arg-Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
【0036】
ヒトインスリンA鎖のアミノ酸配列を配列ID番号2として提供する。
配列ID番号2 (A鎖)
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
【0037】
ヒトインスリンBA鎖のアミノ酸配列を配列ID番号3として提供する。
配列ID番号3 (B鎖)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr
【0038】
他の置換のさらなる組合せも、本発明の範囲内である。本発明の置換を、従来既知のインスリン類似体の置換と組み合わせ得ることも想定される。例えば、塩素化Phe置換も導入し得るリスプロインスリン(Humalog(登録商標))のLysB28、ProB29置換を含むヒトインスリンのB鎖の類似体のアミノ酸配列を、配列ID番号4として提供する。同様に、塩素化Phe置換も導入し得る、アスパートインスリンのAspB28の置換を含むヒトインスリンのB鎖の類似体のアミノ酸配列を、配列ID番号5として提供する。
配列ID番号4
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Lys-Pro-Thr
配列ID番号5
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Asp-Lys-Thr
【0039】
塩素化−PheB24置換はまた、残基A4、A8および/或いはB1でのHis置換を含むヒトインスリンの類似体のような他のインスリン類似体置換との組み合わせにでも、導入し得るが、これは、もっと詳細に、同時係属中の国際特許出願第PCT/US07/00320号および米国特許出願第12/160,187号に記載されている通りであって、その参照により本明細書に組み込まれる。例えば、4Cl−PheB24置換は、[HisA4、HisA8]および/或いはHisB1置換と共に、配列ID番号6で表されるアミノ酸配列を有するインスリン類似体或いはプロインスリン類似体中に存在し得る。
配列ID番号6
R1-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-R2-Thr-R3-R4-Thr-Xaa0-35-Gly-Ile-Val-R5-Gln-Cys-Cys-R6-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn;
【0040】
ここで、R1はHis或いはPheであり;R2はTyr或いはPheであり、R3はPro、Lys或いはAspであり;R4はLys或いはProであり;R5はHis或いはGluであり;R6はHis或いはThrであり;Xaa0〜35は0〜35個の任意のアミノ酸或いは該アミノ酸鎖中の切れ目(break)であり;
さらに、以下のアミノ酸置換の群から選択される、少なくとも1つの置換が存在する:
R1はHisである;
R6はHisである;
R5とR6とは共にHisである。
【0041】
前記4Cl−PheB24置換は、同時係属中の米国特許出願番号第12/160,187に開示のような単一鎖インスリン類似体にも導入することが可能であり、その開示は、この参照により本明細書に組み込まれる。
【0042】
塩素化−PheB24置換は、インスリンA鎖中に置換を含むインスリン類似体にも導入し得ることが想定される。例えば、インスリン類似体は、さらに、A8位に野生型のスレオニン(配列ID番号2参照)の代わりに、配列ID番号7に示すように、A8位にリジン、ヒスチジン或いはアルギニン置換を含み得る。
配列ID番号7
Gly-Ile-Val-Glu-Gln-Cys-Cys-Xaa-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
[Xaa = His, Arg,或いはLys]
【0043】
上記したように、4Cl−PheB24置換は、AspB10(D)、LysB28(K)およびProB29(P)置換を含む、DKP−インスリンと呼ぶ高活性の改変インスリン単量体中に導入し得る。前記B鎖の表面上のこれら3個の置換は、2量体および6量体形成を妨害すると考えられる。改変単量体の使用で、安定性アッセイに及ぼす自己会合の混乱効果を回避する。DKP−インスリンの構造は、結晶学的プロトマーに密接に似ている。DKPインスリンのB鎖ポリペプチドの配列を、配列ID番号8として提供する。
配列ID番号8(DKP B鎖配列)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-Asp-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Lys-Pro-Thr
【0044】
KP−インスリン類似体は、トリプシン−触媒による半合成により調製し、高速液体クロマトグラフィーにより精製し得る。(Mirmira,R.G.およびTagerr,H.S.、1989、J.Biol.Chem.264:6349〜6354)。このプロトコルは、(i)残基(N)−GF*FYTKPTを表す合成オクタペプチド(修飾した残基(F*)と「KP」置換(下線)とを含む;配列ID番号9)と、(ii)切断型類似体デスオクタペプチド[B23〜B30]−インスリン(DOI:配列ID番号15)とを用いる。オクタペプチドは、ProB28およびLysB29(斜体)の相互交換により、野生型B23〜B30配列(GFFYTPKT;配列ID番号10)とは異なるので、トリプシン処理中、リジンε−アミノ基の保護は、必要ない。要するに、このプロトコルでは、デスオクタペプチド(150mg)およびオクタペプチド(150mg)を、10mM酢酸カルシウムおよび1mMエチレンジアミン4酢酸(EDTA)を含有するジメチルアセトアミド/1,4−ブタンジオール/0.2Mトリス酢酸(pH8)(35:35:30、v/v、4ml)の混合物中に溶解する。DOIに対して5倍モル過剰のオクタペプチドで、トリプシンの逆反応(タンパク質分解方向)の防止を基質飽和によって確実にするのである。最終pHを、0.1mlのN−メチルモルホリンを用いて7.0に調整する。該溶液を12℃まで冷却し、1.5mgのトリプシンを加え、12℃で2日間インキュベートする。追加の1.5mgのトリプシンを、24時間後に加える。反応物を、0.1%トリフルオロ酢酸を用いて酸性にし、分取逆相HPLC(C4)により精製する。生成物は、次いで、マトリクス支援レーザ脱着/イオン化飛行時間型(MALDI−TOF;Applied Biosystems、カリフォルニア州Foster City)を使用して確証し得る。固相合成の一般的なプロトコルは、記載されている通りである(Merrifieldら、1982.Biochemistry 21:5020〜5031)。9−フルオレン−9−イル−メトキシカルボニル(F−moc)保護フェニルアラニン類似体は、Chem−Impex International(イリノイ州 Wood Dale)から入手し得る。
【0045】
円二色性(CD)スペクトルは、Aviv分光旋光計を用いて4℃および25℃で取得し得る(Weissら、Biochemistry 39:15429〜15440)。試料は、約25μMのKP−インスリン或いは類似体を、50mMリン酸カリウム(pH7.4)中に含有し得る。試料は、25℃でのグアニジン−誘導による変性研究用に5μMに希釈される。アンフォールディングの自由エネルギーを導き出すために、変性遷移を、非線形最小2乗法により、Sosnickらの、Methods Enzymol.317:393〜409に記載されているように、2相モデルにフィットさせる。要するに、xは変性剤の濃度を示す、CDデータθ(x)を次式により、非線形最小2乗法プログラムによりフィットさせる。
【0046】
【数1】

【0047】
ここで、xはグアニジンの濃度であり、θAおよびθBは天然で、アンフォールドした状態におけるベースライン値である。ベースラインは、遷移前および遷移後の次の直線により近似する。
【0048】
【数2】

【0049】
相対活性は、特異的に結合した125I−ヒトインスリンの50%を置き換えるのに要する野生型ヒトインスリンに対する類似体の割合として定義する。インスリン受容体(IR)を含むヒト胎盤膜調製物を、当該技術分野で既知のように使用する。膜断片(0.025mgタンパク質/チューブ)を、125I標識インスリン(約30,000cpm)と共に、選択した濃度の未標識類似体の存在下で18時間、4℃で、最終容積0.25mlの0.05Mトリス−HClおよび0.25%(w/v)ウシ血清アルブミン中、pH8でインキュベートした。インキュベーション後、混合物を1mlの氷冷緩衝液で希釈し、4℃で5分間遠心分離する(10,000g)。次いで、上清を吸引により除去し、膜ペレットを放射能について計測する。データを、非特異的結合(1μMヒトインスリンの存在下で結合した膜に残存する放射能の量)に対して補正する。全てのアッセイにおいて、競合リガンド不在で結合したトレーサーのパーセンテージは、リガンド喪失による人為的結果(artifacts)を回避するため、15%未満であった。インスリン類似体の37℃でのインキュベーション間中の活性の変化を測定するための更なるインスリン受容体−結合アッセイは、マイクロタイター(microtiter)プレート抗体捕捉を用いて、当該技術分野で既知のように行い得る。マイクロタイターストリッププレート(Nunc Maxisorb)を、4℃で1晩、AU5 IgG(リン酸緩衝食塩水中40μg/mlを100μl/ウェル)と共にインキュベートする。結合データは、二サイト(two−site)逐次モデルで分析し得る。IGF I型受容体を用いた、対応するマイクロタイタープレート抗体アッセイを行い、この相同受容体への交差結合を評価し得る。
【0050】
修飾された残基は、KP−インスリンの範囲内に導入された。提示した活性値は、ヒトインスリンとの相対的なホルモン−受容体の解離定数の比率に基づくものであり、ヒトインスリンの活性は、このように定義によって、1.0である。活性値の標準誤差は一般に25%未満であった。25℃におけるアンフォールディングの自由エネルギー(ΔGu)は、2状態モデルに基づき、ゼロ変性剤濃度に外挿して見積もった。時間のずれは、亜鉛不含リン酸緩衝生理食塩水(pH7.4)中、37℃で穏やかに撹拌する際の蛋白質細繊維形成開始に必要な時間(日数)を示す。
【0051】
本明細書で提供される塩素化−PheB24置換は、インスリン類似体、例えば、リスプロインスリン(つまり、置換LysB28及び置換ProB29も含むインスリン類似体(名称Humalog(登録商標)として販売))で実施できる。係るインスリン類似体は、塩素化−PheB24−KP−インスリンと呼ぶ。比較目的のために、フッ素置換も、本質的には、上述のように導入されたが、但し、パラフッ化フェニルアラニン置換は、リスプロインスリンのB24位とB26位に導入された。B24位にパラフッ素フェニルアラニン置換を含む類似体は4F−PheB24−KP−インスリンと呼ぶ。B26位(チロシンを置換する)にパラフッ素化フェニルアラニン置換を含む類似体は4F−PheB26−KP−インスリンと呼ぶ。KP−インスリンおよびDKP−インスリンのそれぞれの類似体の名称を表や図で簡潔にする為、"インスリン"を除去してKP及びDKPと省略し得る。
【0052】
B24での塩素化フェニルアラニン置換には、残基(N)−GF*FYTKPTを表す合成オクタペプチド(塩素化フェニルアラニン残基を「F*」として、「KP」置換を(下線)で表わした:配列ID番号9)及び切断した類似体デスオクタペプチド[B23〜B30]−インスリン(B10位において野生型、配列ID番号15)を用いた。B26でのフッ素化フェニルアラニン置換には、残基(N)−GFFF*TKPTを表す合成オクタペプチド(再び、フッ素化フェニルアラニン残基を「F*」として、「KP」置換を(下線)で表わした:配列ID番号16)及び切断した類似体デスオクタペプチド[B23〜B30]−インスリン(配列ID番号15)を用いた。
【0053】
リスプロインスリン類似体のバックグラウンド中のB24位或いはB26位のハロゲン化フェニルアラニン置換で得られたデータを以下の表1に示す。
【0054】
【表1】

【0055】
細繊維形成アッセイ。4Cl−PheB24−KP−インスリンの物理的安定性は、ガラスバイアル中で穏やかに撹拌しながらpH7.4、37℃で亜鉛不含リン酸緩衝生理食塩水(PBS)中でインキュベーションの間に三重反復して評価した。該試料は、タンパク質濃度60μMで曇り度の外観を12日間観察し、毎日2回、チオフラビン−T(ThT)蛍光分析用に一定分量を採取した。ThT蛍光は、アミロイドが存在しない場合には僅少であるが、細繊維形成の発生時には著しく強まるので、このアッセイは、前記時間のずれを求める。ヒトインスリン、KP−インスリン、及び4Cl−PheB24−KP−インスリンの時間のずれは、それぞれ、5±1日、3±1日、および13日以上である。したがって、4Cl−PheB24−KP−インスリンは、これらの条件下で、KP−インスリンよりも4倍以上細繊維形成に対して耐性があり、少なくともヒトインスリンの2倍以上耐性がある。特許性を理論に条件付けるのは望まないが、4Cl−PheB24インスリン類似体の細繊維形成抵抗の向上で、個々の試料の使用開始前でも後でも、概インスリン類似体の貯蔵期間を余り短縮することなく、当該インスリン類似体の即効性を高めるよう、亜鉛不含製剤で調剤が可能になると想定される。
【0056】
熱力学的安定性。本発明者らは、4Cl−PheB24−KP−インスリンのアンフォールディングの自由エネルギーを、KP−インスリン及びLysA8−KP−インスリンに相対的に、亜鉛不含緩衝液中pH7.4および25℃(10 mMリン酸カリウムおよび50mMKCl)で測定した。このアッセイは、ヘリックスに敏感な波長222 nmでプローブし、グアニジン誘発性変性のCDによる検出を利用した。二状態モデルに基づく、アンフォールディングの自由エネルギーによる推定値を得るために、ΔGuの値を変性剤濃度ゼロに外挿した。置換ThrA8→Lysは、熱力学的安定性を0.6±0.2Kcal/モル増加した一方、該4Cl−PheB24修飾は、安定性を0.4±0.2Kcal/モル減少させた。
【0057】
4Cl−PheB24−KP−インスリン−A8Tと、界面活性剤−可溶化し、レクチン精製したインスリン受容体(アイソフォームB)との親和性は、ヒトインスリンのそれと類似している。単離インスリン受容体(アイソフォームB):ヒトインスリン(三角)、KP−インスリン(四角)、4Cl−PheB24−KP−インスリン(逆三角)を使用して、トレーサーとして125I標識ヒトインスリンを用いた競合置換アッセイを図3Aに示す。3つの曲線はすべて密接に整列しており、類似した受容体−結合親和性を示す。4Cl−PheB24−KP−インスリンのインスリン受容体に対する親和性は、KP−ヒトインスリンのそれと区別できなかったが、それぞれ野生型インスリンの親和性よりもわずかに低かった。
【0058】
図3Bは、インスリン様成長因子I受容体(IGF−1R)を使用し、トレーサーとして125Iで標識したIGF−Iを使用してプローブした競合置換によって調べた、対応するアッセイの結果を示す。天然IGF−I(円)が追加されているが、記号は同一である。4Cl−PheB24−KP−インスリン曲線の右側シフトは、IGF−1Rへの交差結合の減少を示す。IGF−1Rへの4Cl−PheB24−KP−インスリンの交差結合は、KP−インスリン或いは野生型インスリンのそれに対して約3倍相対的に減少している。
【0059】
単離インスリン受容体(アイソフォームB)を用いた、ヒトインスリン(黒実線)、KP−インスリン(破線)、4Cl−PheB24−KP−インスリン(三角)、4F−PheB24−KP−インスリン(四角)間の同様な比較は、図3Cに示す。4Cl−PheB24−KP−インスリン、野生型ヒトインスリン、及びインスリンリスプロと相対的に、4F−PheB24−KP−インスリン曲線の右側シフトは、フェニルアラニン環の同一位置での異なるハロゲンの使用で、B24位でのフェニルアラニンのパラ−クロロ置換に比較して減少した受容体−結合親和性を示している。対照的に、4Cl−PheB24−KP−インスリンのインスリン受容体結合親和性は、野生型ヒトインスリン及びリスプロ(KP)インスリンのそれと似ている。
【0060】
単離インスリン受容体(アイソフォームB)を使用した、ヒトインスリン(実線)、KP−インスリン(破線)、4Cl−PheB26−KP−インスリン(三角)、4F−PheB26−KP−インスリン(四角)間のさらなる比較は、図3Dに示す。4Cl−PheB26−KP−インスリン及び4F−PheB26−KP−インスリンは、両方とも野生型インスリンとリスプロインスリンとに比べて、インスリン受容体結合親和性が低下した。上記のように、4Cl−PheB24−KP−インスリンは、受容体−結合親和性で類似した減少を示さない。
【0061】
糖尿病ラットにおける4Cl−PheB24−KP−インスリンのインビボ効力は、KP−インスリンのそれと似ている。生物学的活性の特徴づけを行う為に、雄Lewisラット(体重約300g)をストレプトゾトシン(streptozotocin)で糖尿病状態にした。ヒトインスリン、KP−インスリン、4Cl−PheB24−KP−インスリンは、HPLCにより精製、乾燥して粉末にし、インスリン希釈液(Eli Lilly Corp)に溶解した。KP−インスリン或いは4Cl−PheB24−KP−インスリンを希釈液100μl中20μg或いは6.7μg、時間=0で、ラットに皮下注射した。多い方の用量は、野生型インスリンの用量−応答曲線の定常(プラトー)になるが、一方少ない方の用量は、グルコース処理最高初速度の50〜70%に相当する。希釈剤単独の注入は、負の対照として行った。各グループ8匹のラットについて研究した。血液は時間0および継続間隔で最大120分まで、切り取った尾の先端から得た。血糖は、Hypoguard Advance Micro−Drawメーターを用いて測定した。血糖濃度は、図4に示すように減少することが観察された。注入後最初の24分間の血中グルコース濃度降下の初速度を比較すると、4Cl−PheB24−KP−インスリン(−225±29 mg/dl/時)、KP−インスリン(−256±35 mg/dl/時)及びヒトインスリン(−255±35mg/dl/時)で似ている。初期速度の違いは、いずれも統計的に有意ではない。しかし、次の60分に亘る4Cl−PheB24−KP−インスリンの作用持続時間は、ヒトインスリン或いはKP−インスリンの持続時間よりも短いと思われる。
【0062】
4Cl−PheB24−KP−インスリンの天然受容体−結合親和性を考慮すれば、その効力がヒトインスリンのそれよりより低いことは異常なことであろう。確かに、野生型に比べた相対的な親和性が30〜100%台のインスリン類似体は、通常、インビボで天然物の効力を示す。しかし、形式的には、Cl−PheB24−KP−インスリンの生物学的効力が、ヒトインスリン或いはKP−インスリンの効力より(モル基準で)やや低いことはあり得る。もしそうであっても、我々は、如何なる係る降下も、臨床で使用の現行のインスリン製品のモル当たり活性閾値の範囲内になるであろうということに注目する(慣例により、国際単位(IU)は、それぞれ、糖降下程度を反映するように再定義され、その結果製品毎の単位当りミリグラム或いはナノモル数に違いが出ることになる)。留意すべきは、タンパク質不含希釈剤(図4の褐色破線)の対照注入での血糖濃度の緩やかな減少は、注入後の動物の昼間の空腹を示していることである。
【0063】
インスリン6量体分解の薬物動態(EDTA封鎖アッセイと呼ぶ)用代替えマーカーは、亜鉛イオン(Zn2+)ではなくコバルトイオン(Co2+)を使用して、6量体会合を仲介させるのである。Co2+6量体とZn2+6量体は、構造上似ているが、該コバルトイオンは、未充填d−電子殻に起因する好都合な分光プローブを提供する。
【0064】
アッセイの原理は次の通りである。R6のフェノール安定化Co2+インスリン6量体溶液は、四面体Co2+配位の為に青色であるが、分解後、該タンパク質溶液は、水或いはEDTA(エチレンジアミンテトラ酢酸:金属イオンの強力なキレート剤)による八面体Co2+の配位で、配位子場理論の結果として、可視波長での光学遷移が無くなるので、無色となる。該EDTA金属イオン封鎖アッセイは、次のように、これらの分光機能を利用する。時刻t=0に、モル過剰量のEDTAをR6インスリン6量体或いはインスリン類似体6量体溶液に添加する。EDTA自体は6量体に作用してそれから金属イオンを抜き取ることはないが、一時的な6量体分解の過程で解放されたCo2+はいずれもキレート剤によって補足され、再会合のために利用できなくなるのである。青色(R6固有のインスリン−結合Co2+の574nmにおける正四面体d−d光学遷移)消失速度は、このように、6量体分解動態の光学的証拠を提供する。
【0065】
400〜750nmの特徴的なスペクトルプロファイルを示す、インスリン・コバルト溶液の平均化トレースは、2mMEDTA(図5A−C)の添加前と添加後測定した。試料を、50mMトリス(pH7.4)、50mMフェノール、および0.2mMCoCl2に溶解した。その後、NaSCNを最終濃度1mMまで追加した。574nm(25℃およびpH7.4)で追跡した、2mMEDTA添加後の6量体解離の速度式も示す。EDTA抽出前の類似体のスペクトルは実線として表示する。EDTA抽出後、該スペクトルは破線として表示する。野生型は、パネルAに、KP−インスリンはパネルBに、4Cl−PheB24−KP−インスリンはパネルCに示す。データは各試料について時間ゼロに正規化した。
【0066】
一方、t=0で6量体コバルト錯体のベースライン光吸収スペクトルは、野生型インスリン6量体、KPインスリン6量体、及び4Cl−PheB24−KPインスリン6量体(図5A〜5C参照)間で類似している。これら各のd−d電子遷移の類似した形状と大きさは、前記金属イオンが、野生型と変異型6量体で、類似したR6−固有の四面体配位部位にあることを示唆している。それは、4Cl−PheB24−KP−インスリンが金属イオン媒介会合に適格であり、それゆえ、亜鉛ベースの製剤に有用なことを意味するので、この結果は重要である。
【0067】
2mMEDTA添加後、574nm(25℃およびpH7.4)で追跡した6量体解離の動力学は、野生型と変異型の6量体がEDTA介在Co2+封鎖速度に著しい違いを見せることを示す。予想通り、野生型6量体は、最高の動力学的安定性(図5Dの実線)を示し、次いでKP−インスリン(図5Dの一点鎖線)および4−Cl−PheB24−KP−インスリン(図5Dの点線)が続く。それぞれの半減期は481秒(野生型)、363秒(KP−インスリン)、66秒(4Cl−PheB24−KP−インスリン)である。パラ−クロロ芳香族置換によって誘導される加速の程度は、リスプロインスリン(Humalog(商標))の「KPスイッチ(切替)」関連の程度よりも大きい。皮下注射部位からの亜鉛イオンの拡散は、EDTA封鎖アッセイにおけるコバルトイオンのインビトロ封鎖に類似するので、これらの知見から、4Cl−PheB24−KP−インスリンが著しい吸収の加速を示すものと予測される。
【0068】
野生型インスリン(Humulin(商標);ELi Lilly and Co.)とKP−インスリン(Humalog(商標)と、に比して、4−Cl−PheB24−KP−インスリンの薬物動態(PK)、薬物動力学(PD)特性、及びその効力を青年期のヨークシャーファーム(Yorkshire farm)の豚(体重25〜45kg)で調べた。野生型とKP−インスリンは、製造元(Eli Lilly and Co.)から提供を受けたまま、U−100強度で使用した。前記4−Cl−PheB24−KP−インスリンは、野生型及びKP−インスリン製品のそれと同様なタンパク質対亜鉛イオンの比率でLilly希釈液に調剤した;その強度は、U−87であった。動物は、試験日にそれぞれTerazolで麻酔導入し、次いで、Isofluraneで全身麻酔した。各動物に気管挿管し、酸素飽和度と終末呼気CO2とを連続的にモニターした。内因性の膵臓α−およびβ−細胞分泌をブロックする為に、クランプ調査開始前約30分と、その後2時間毎に、酢酸オクトレオチド(octreotide)を豚に皮下注射(44μg/kg)により投与した。静脈カテーテルを設置し、10%ブドウ糖輸液でベースライン正常血糖値を確立してから、カテーテルを介してインスリンを静脈注射で投与した。末梢インスリン媒介による、グルコース取り込みを定量化する為に、可変流量でグルコース注入を行い、血中グルコース濃度を約85mg/dlに維持するようにした。グルコース注入速度がインスリン投与以前のベースラインに戻るまで、前記グルコース注入は、通常5〜8時間必要であった。グルコース濃度は10分毎、Hemocue201ポータブルグルコース分析器で測定した(機器の誤差:1.9%)。グルコース・クランプ法のコンピュータ化プロトコルは、Matthewsらの報告通りであった。インスリンアッセイのための血液試料2mlも次のスケジュールに従って取得した:インスリン送達後0〜40分:5分間隔;50〜140分:10分間隔;160分〜GIRがベースラインに戻るまで:20分間隔。PK/PDの分析のために、20分間の移動平均カーブフィットとフィルタが適用された。PDは、初期最大半量到達時間、後期最大半量到達時間、最大効果到達時間、およびベースライン上の曲線下のエリア(AUC)として測定された。これらの分析のそれぞれについては、生データではなくて近似曲線を使用した。3頭の豚では、それぞれ3組の試験を行った。これらの試験の結果を図6〜9に提供する.
4−Cl−PheB24−KP−インスリン(図6では、4−Cl−リスプロインスリンと短縮)は、KP−インスリン或いは野生型インスリンよりも大幅に低下した、延長後期の"尾部"を示すことが見出された。インスリンの作用遮断が改善した事は、遅発型食後低血糖症に関して潜在的な臨床的有益性を示唆する。
【0069】
図7は、豚での薬力学試験20組を要約し、後期最大半量到達時間に於いて、KP−インスリンより、4Cl−PheB24−KP−インスリンが、0.05U/kg、0.1U/kg、0.2U/kg、0.5U/kg、及び1U/kgの5つの異なる投与量レベルで有意な改善を実証する。
【0070】
図8は、豚での薬力学試験14組を要約し、初期最大半量到達時間に於いて、KP−インスリンより、4Cl−PheB24−KP−インスリンが、0.05U/kg、0.1U/kg、0.2U/kgの3つの異なる投与量レベルで、改善を示唆する。
【0071】
図9は、曲線下面積(AUC)で測定した、4Cl−PheB24−KP−インスリンの相対的な効力をKPインスリンのそれと比較した、対応10組の薬力学研究を要約し、その中で、4−Cl−KPの平均効力のわずかな減少は、統計的に有意でないことが見出された(p=0.22)。類似の製剤配合条件下(フェノール及びメタクレゾールで安定化した、亜鉛インスリン6量体或いは亜鉛インスリン類似体6量体)で、野生型インスリンとKP−インスリン(リスプロ−インスリン)との関連で、4−Cl−PheB24−KP−インスリンの薬物動態(PK)および薬力学(PD)の特性は、曲線下エリア(AUC)法で測定した、4−Cl−PheB24−KP−インスリンの効力が、野生型インスリン及びKP−インスリンのものと類似していたことを示す。
【0072】
患者を治療する方法は、当該患者に塩素化−PheB24置換インスリン類似体を投与することを含む。一例では、前記インスリン類似体は、4Cl−PheB24−KPインスリンである。前記インスリン類似体は、選択的にA8位にヒスチジン、リジン或いはアルギニン置換を含み得る。別の例では、前記塩素置換インスリン類似体は、さらに、インスリン分子内の他の位置に、人体での前記類似体の作用速度を変更するように設計された1つ或いはそれ以上の置換を含む。なお別の例では、前記インスリン類似体は、外付け或いは植込み型インスリンポンプで投与される。同時係属中の米国特許出願番号12/419169により完全に記載されている通り、本発明のインスリン類似体は、また、前記B鎖のC−末端およびA鎖のN末端のとの間のテザー(係留)のような、他の修飾を含み得る。
【0073】
医薬組成物は、係るインスリン類似体を含み得、選択的に亜鉛を含み得る。亜鉛イオンは、インスリン類似体の6量体につき2.2〜3.0モル比のレベルで、当該組成物中に含め得る。当該製剤において、インスリン類似体濃度は、通常、約0.1〜約3mMであって、インスリンポンプの貯槽では、3mM以下の濃度を使用し得る。食事時のインスリン類似体の修飾は、(a)Humulin(登録商標)(Eli Lilly and Co.)、Humalog(登録商標)(Eli Lilly and Co.)、Novalin(登録商標)(Novo−Nordisk)及びNovalog(登録商標)(Novo−Nordisk)及びヒトでの使用が現在承認されている他の速効インスリン製剤の「通常の」製剤、(b)上記および他のインスリン類似体の「NPH」製剤、並びに(c)係る製剤の混合物について記載のように調剤し得る。前述したように、その細繊維形成に対する抵抗の向上の為、4Cl−PheB24含有インスリン類似体は亜鉛の存在なしで調剤し、前記類似体の速効性を最大限にし得ると思われる。しかし、また、亜鉛の存在下でも、前記4Cl−PheB24含有インスリン類似体は、6量体から2量体および単量体に十分に速く解離するので、速効性インスリン類似体としても考慮されるべきと考えられる。
【0074】
賦形剤は、グリセロール、グリシン、他の緩衝剤、及び塩、並びにフェノールおよびメタ−クレゾールなどの抗菌保存剤を含み得、後者の保存剤は、インスリン6量体の安定性を強化することが既知である。係る医薬組成物は、生理学的有効量の前記組成物を患者に投与することにより、真性糖尿病或いは他の病状を有する患者を治療するのに使用し得る。
【0075】
少なくとも、B24位に塩素化フェニルアラニンを有するインスリンのB鎖をコードする配列を含むインスリン類似体をコードするポリペプチドをコードする配列を含む核酸も想定される。これは、終止コドン(アンバーコドンTAGのような)をB24位に導入することで達成できるのであって、抑制(サプレッサー)tRNA(アンバーコドンを用いる場合はアンバーサプレッサー)及び以前に記載されたような(Furter、1998、Protein Sci.7:419〜426;Xieら、2005、Methods.36:227〜238)、前記終止コドンに応答してポリペプチド中に非標準的なアミノ酸を導入する対応tRNA合成酵素を併用して行う。特定の配列は、核酸配列が導入される種の好ましいコドン使用に依存し得る。該核酸は、野生型インスリンの他の修飾体もコードし得る。前記核酸配列は、該ポリペプチド或いは修飾されたプロインスリン類似体の他の位置に無関係の置換或いは伸長を含む、修飾されたA鎖或いはB鎖配列をコードし得る。該核酸は、発現ベクターの一部分であり得るし、また、このベクターは、大腸菌細胞系のような原核宿主細胞、或いはS.セレビシエ(S.cereviciae)或いはピチア・パストリス(Pichia Pastoris)株、或いは細胞系のような真核細胞系などの宿主細胞に挿入し得る。
【0076】
例えば、酵母ピチア・パストリス(Pichia Pastoris)および他の微生物中のB鎖ポリペプチドの発現に向けるように、合成遺伝子を合成し得ることが想定される。B24位に終止コドンを用い、その位置に塩素化フェニルアラニンを導入する目的でのB鎖ポリペプチドのヌクレオチド配列は、次のいずれか或いはその変異型であり得る:
(a)ヒトコドン優先性を持つ:TTTGTGAACCAACACCTGTGCGGCTCACACCTGGTGGAAGCTCTCTACCTAGT
GTGCGGGGAACGAGGCTAGTTCTACACACCCAAGACC (配列ID番号11)
(b)ピチアコドン優先性を持つ
TTTGTTAACCAACATTTGTGTGGTTCTCATTTGGTTGAAGCTTTGTACTTGGTT
TGTGGTGAAAGAGGTTAGTTTTACACTCCAAAGACT (配列ID番号12)
【0077】
同様に、ヒトコドン優先性を有し、B24位に終止コドンを用いてその位置に塩素化化フェニルアラニンを導入する目的の、全長プロインスリンcDNAは、配列番号13の配列を有し得る。
TTTGTGAACC AACACCTGTG CGGCTCACAC CTGGTGGAAG CTCTCTACCT AGTGTGCGGG GAACGAGGCT AGTTCTACAC ACCCAAGACC CGCCGGGAGG CAGAGGACCT GCAGGTGGGG CAGGTGGAGC TGGGCGGCGG CCCTGGTGCA GGCAGCCTGC AGCCCTTGGC CCTGGAGGGG TCCCTGCAGA AGCGTGGCAT TGTGGAACAA TGCTGTACCA GCATCTGCTC CCTCTACCAG CTGGAGAACT ACTGCAACTA G (配列ID番号13)
【0078】
同様に、ヒトコドン優先性を有し、B24位に終止コドンを用いてその位置に塩素化フェニルアラニンを導入する目的であり、P.パストリスに好ましいコドンを有する、全長プロインスリンcDNAは、配列ID番号14の配列を有し得る。
TTTGTTAACC AACATTTGTG TGGTTCTCAT TTGGTTGAAG CTTTGTACTT GGTTTGTGGT GAAAGAGGTT AGTTTTACAC TCCAAAGACT AGAAGAGAAG CTGAAGATTT GCAAGTTGGT CAAGTTGAAT TGGGTGGTGG TCCAGGTGCT GGTTCTTTGC AACCATTGGC TTTGGAAGGT TCTTTGCAAA AGAGAGGTAT TGTTGAACAA TGTTGTACTT CTATTTGTTC TTTGTACCAA TTGGAAAACT ACTGTAACTA A (配列ID番号14)
【0079】
前述の開示に基づいて、塩素置換インスリン類似体が上述した目的を達成するのは、もう明らかのはずである。即ち、これらのインスリン類似体は、向上した熱力学的安定性、細繊維形成への耐性、および血糖値を低下させる効力を示す。塩素置換フェニルアラニンを含むインスリン類似体は、またインスリン様成長因子(IGFR)への交差反応性も低下させる。従って、如何なる明白な変形形態も特許請求に係わる発明の範囲内に含まれ、また、それ故に特定の構成要素の選択は、本明細書に開示、記載された本発明の精神から逸脱することなく決定できることを理解すべきである。
【0080】
以下の文献は、本明細書に記載の試験およびアッセイ方法が当業者に理解されることを実証するために引用する。
【0081】
Furter, R., 1998. Expansion of the genetic code: Site-directed p-fluoro-phenylalanine incorporation in Escherichia coli. Protein Sci. 7:419-426.
Matthews D.R., Hosker J.P. 1989. Unbiased and flexible iterative computer program to achieve glucose clamping. Diabetes Care. 12: 156-9.
Merrifield, R.B., Vizioli, L.D., and Boman, H.G. 1982. Synthesis of the antibacterial peptide cecropin A (1-33). Biochemistry 21: 5020-5031.
Mirmira, R.G., and Tager, H.S. 1989. Role of the phenylalanine B24 side chain in directing insulin interaction with its receptor: Importance of main chain conformation. J. Biol. Chem. 264: 6349-6354. Sosnick, T.R., Fang, X., and Shelton, V.M. 2000. Application of circular dichroism to study RNA folding transitions. Methods Enzymol. 317: 393-409.
Wang, Z.X. 1995. An exact mathematical expression for describing competitive biding of two different ligands to a protein molecule FEBS Lett. 360: 111-114.
Weiss, M.A., Hua, Q.X., Jia, W., Chu, Y.C., Wang, R.Y., and Katsoyannis, P.G. 2000.
Hierarchiacal protein "un-design": insulin's intrachain disulfide bridge tethers a recognition α-helix. Biochemistry 39: 15429-15440.
Whittaker, J., and Whittaker, L. 2005. Characterization of the functional insulin binding epitopes of the full length insulin receptor. J. Biol. Chem. 280: 20932-20936.
Xie, J. and Schultz, P.G. 2005. An expanding genetic code. Methods. 36: 227-238.
【技術分野】
【0001】
関連出願の相互参照
本出願は、2009年12月11日付で出願した係属中の米国仮出願第61/285、955号の利益を主張する。
【0002】
政府援助研究又は開発に関連する供述
本発明は、助成金番号DK40949およびDK074176下に国立衛生研究所により授与された協力協定の基に政府の支援でなされた。米国政府は、本発明に一定の権利を有し得る。
【0003】
本発明は、耐熱分解性ポリペプチドに関連する。特に、本発明は、熱的に安定したインスリン類似体に関連する。さらに特に、本発明は、前記インスリン類似体のアミノ酸中に塩素元素を導入することで化学的、熱的に安定化したインスリン類似体に関連する。塩素はハロゲンの一つに分類され、その原子半径、電気陰性度、部分電荷の立体電子分布、および分子中の隣接原子の立体電子特性に及ぼす伝達効果によって、タンパク質類の一般成分とは区別されるものである。
【背景技術】
【0004】
治療薬とワクチンを含む、超安定タンパク質の改変(engineering)は、電気や冷凍が安定して利用できない発展途上国世界の地域で広範な社会的利益をもたらし得る。熱劣化の影響を受けやすい治療用タンパク質の1例として、インスリンがあげられる。その化学的および物理的な劣化が投げ掛ける課題は、アフリカおよびアジアでさし迫った真性糖尿病の流行によって深刻になっている。インスリン類似体の化学的劣化速度は、その相対的安定性と逆相関しているので、超安定化製剤の設計は、係る課題地域でのインスリン補充療法の安全性と有効性を向上し得る。
【0005】
有機小分子においてハロゲン置換が有用なことがあるのは、薬化学で知られている。フッ素官能基は、コレステロール生合成の阻害剤である、アトルバスタチン(atorvastatin)(Lipitor(商標))、うつ病やその他の情動障害の治療に使用される、選択的セロトニン再導入阻害剤である、フルオキセチン塩酸塩(Fluoxetin(Prozac(商標))などのように広く処方されている小分子の有効性にとって重要である。フッ素の原子半径は、水素のと同様であるが、その大きな誘起効果は、これらの薬剤の立体電子的性質を変え、その結果生物学的活性を向上させるのである。類似した物理有機化学上の考慮は、塩素のような大きいハロゲン原子の導入に関連する。小分子モンテルカストナトリウム(montelukast sodium)(Singulair(商標))は、その医薬品の特性が塩素原子の共有結合の導入で強化されたロイコトリエン(leukotriene)阻害剤である。さらに、インスリン類似体でのフッ素置換アミノ酸の使用は、2009年7月31日出願の国際特許出願PCT/US第2009/52477号に提供されている。
【0006】
修飾アミノ酸中への塩素原子の部位特異的導入によるタンパク質の化学的、物理的、および生物学的特性の調節に就いては、フッ素原子の導入による上記効果に比して、あまりよく科学文献に特性が記述されていない。
【0007】
芳香族側鎖は、隣接する芳香環だけでなく、正或いは負の静電ポテンシャルの他の発生源を含む、様々の弱い極性相互作用に関係し得る。例としては、ペプチド結合中の主鎖カルボニル基とアミド基が含まれる。
【0008】
インスリンの投与は、永年真性糖尿病の治療として確立されている。インスリンは脊椎動物の代謝において中心的な役割を果たす小さな球状蛋白質である。インスリンは、21残基を含有するA鎖および30残基を含有するB鎖である、2つの鎖を含有する。当該ホルモンは、膵臓β細胞中にZn2+で安定化された6量体として貯蔵されるが、血液中ではZn2+不含単量体として機能する。インスリンは、接続領域(35残基)が、A鎖のN末端残基にB鎖のC末端残基(残基B30)を結びつける単鎖前駆体である、プロインスリンの産出物である(図1A)。プロインスリンの構造は、決定されていないが、様々な証拠は、それがインスリン様のコアと無秩序の連結ペプチド(図1B)から成ることを示している。3つの特定のジスルフィド結合(A6−A11、A7−B7、およびA20−B19、図1Aおよび1B)の形成は、粗面小胞体(ER)でのインスリンの酸化的フォールディングと連携していると考えられている。プロインスリンは、ERからゴルジ(Golgi)体へ排出後直ぐに会合して、水溶性のZn2+−配位6量体を形成する。内部タンパク質分解による消化およびインスリンへの変換は、未熟な分泌顆粒で起こり、次いで形態学的縮合が起こる。成熟した貯蔵顆粒内の亜鉛インスリン6量体の結晶配列は、電子顕微鏡(EM)により可視化されている。
【0009】
生理学的貯蔵形態である、Zn2+配位インスリン6量体については、広範囲なX線結晶学的研究が行われてきた。インビトロで複数の結晶形態が記載され、T6、T3Rf3及びR6と命名された、3個の構造系統が定義されている。これらの6量体では、2個のZnイオンが6量体中心軸に沿って位置すると考えられ、各3個のヒスチジン(HisB10)が配位し、更なる低親和性Zn結合部位が、いくつかの結晶形態で観察されている。T−状態プロトマーは、溶液中のインスリン単量体の構造に似ている。R−状態プロトマーは、B鎖の二次構造にある変化を示し、中央のα−ヘリックスは、B1(R状態)或いはB3(擦り切れたRf状態)にまで延長している。
【0010】
インスリンは、血流中単量体として機能するが、それにもかかわらず、この単量体こそが最も細繊維維形成しやすく、化学的分解の大抵の形態であると考えられている。NMRで溶液中の特徴を求めた、インスリン単量体の構造は、図1Dに示されている。A鎖は、N末端ヘリックス(残基A1〜A8)、非正規のターン(A9〜A12)、第2α−ヘリックス(A12〜A18)、およびC末端延長(A19〜A21)から成る。B鎖は、N末端アーム(B1〜B6)、β−ターン(B7〜B10)、中央α−ヘリックス(B9〜B19)、β−ターン(B20〜B23)、β−ストランド(B24〜B28)、および柔軟なC−末端残基B29〜B30を含む。この二つの鎖は、3個のジスルフィド架橋(システイン、A6〜A11、A7〜B7、およびA20〜B19)によって安定化した、緻密な球状ドメインを形成するように纏まる(pack)。
【0011】
通常のインスリンの吸収は、亜鉛―インスリン6量体の動力学的寿命で限定されていて、毛細血管の内皮細胞ライニングを介して通過できる為にはより小さな2量体および単量体に分解しなければならない。Humalog(登録商標)及びNovolog(登録商標)の設計の基にある本質的な考え方は、分解を加速することである。これは古典的な二量体形成面(C末端反平行β−シート)を不安定にすることで達成される。Humalog(登録商標)は、IGF−Iの配列を模倣する反転である、ProB28→LysおよびLysB29→Pro置換を含んでいる。Novolog(登録商標)はProB28→Asp置換を含んでいる。該置換は二量体化を阻害するが、前記類似体は、フェノール或いはメタ−クレゾール安定化亜鉛6量体の会合能力がある。この会合は、前記類似体がバイアル中で細繊維形成しないように保護するが、皮下注射後、前記フェノール(或いはm−クレゾール)と亜鉛イオンとが拡散除去されるにつれて、前記6量体は、急速に解離する。これらの類似体の不安定性は、患者或いは医療提供者による希釈後にその有効期限が短くなる原因となる。インスリン類似体がHumalog(登録商標)の変異形2量体−関連β−シートを保持しつつ、インスリン単量体の本質的な安定性を強化するのは有用であろう。
【0012】
貯蔵時に亜鉛インスリン6量体を使用することは、既知であり、バイアルやポンプの貯留タンク内での製剤の物理的劣化、化学的劣化を遅延させるための古典的な戦略を代表する。前記亜鉛インスリン6量体は毛細血管中に瞬時に通過するには大きすぎるため、皮下注射後のインスリンの吸収速度は、6量体がより小さい2量体および単量体単位に解離するのに必要な時間で限定される。したがって、インスリン類似体が(a)高いタンパク質濃度(バイル或いはポンプ内のように)で、6量体が十分会合出来、しかも(b)前記2量体界面では十分不安定化し、加速化した分解を示し、その為当該皮下デポー(depot)から超高速で吸収が予期されるという両方の能力があれば有利であろう。これらの構造上の目標は、安定性(貯蔵時)と不安定性(注入後)との間の紙一重の所を行くことである。
【0013】
インスリン中のアミノ酸置換が熱力学的安定性および生物学的活性に及ぼす影響について検討されてきた。安定性と活性の間には、一致した関係が見られていない。熱力学的安定性を向上させる置換のあるものは、インスリン受容体への結合も強化する一方、安定性を向上させる他の置換は、そのような結合を妨げるのである。ThrA8をいくつかの他のアミノ酸で置換する効果が、野生型ヒトインスリンで検討され、又、B鎖中の3個の無関係な置換(HisB10→Asp、ProB28→Lys、およびLysB29→Pro)を含む、改変インスリン単量体の場合について報告されている。置換の当該分野では、吸収の経時変化を加速或いは遅延させる例も知られている。係る置換(例えばNovalog(登録商標)におけるAspB28およびHumalog(登録商標)などにおける[LysB28、ProB29])は、より迅速な細繊維形成と、より低い物理的安定性とに関連し得るし、またしばしば関係がある。事実、ある研究に於いてAspB28インスリンとAspB10インスリンとを含む、ヒトインスリン類似体10種のシリーズで、細繊維形成のし易さが試験された。10種は全てが、pH7.4および37℃で、ヒトインスリンより細繊維形成しやすいことが判った。この10種の置換は、当インスリン分子の多様な部位にあって、古典的な熱力学的安定性の変化の幅広い違いと関連する可能性がある。一連の効果が観察されてきたが、活性と熱力学的安定性間には、相関関係が存在しない。
【0014】
インスリンは化学合成も半合成も極めてし易い、小さな球状タンパク質であり、それで非標準的な側鎖の導入が容易になる。インスリンは3個のフェニルアラニン残基(B1、B24、及びB25位)と、B26位に構造的に類似のチロシンとを含有する。PheB24の芳香環は、脊椎動物のインスリン及びインスリン様成長因子間に保存されていて、B鎖の超二次構造を安定させるよう、疎水性コア(ただし内部ではなく)に対して纏まって(pack)いる。PheB24は、古典的な受容体結合表面に位置し、受容体結合時の立体構造(コンフォメーション)の変化を誘導すると提案されている。PheB25は、インスリン単量体の表面から突出している一方、TyrB26は、前記コアの一端に於いて脂肪族側鎖(IleA2、ValA3およびValB12)付近に纏まって(pack)いる。B24に関連する立体構造の変化は、PheB25およびTyrB26がインスリン受容体の別個のドメインと接触出来るようにするものと提案する。
【0015】
蛋白質細繊維形成の現在の理論は、細繊維形成のメカニズムが部分的に折り畳まれた中間体状態を介して進行し、次いで凝集し、アミロイド形成的核を形成すると仮定する。この理論では、天然状態を安定させるアミノ酸置換は、部分的に折り畳まれた中間状態を安定させ得るか、或いはさせ得ず、亦、天然状態と中間状態間の自由エネルギー障壁を増加(或いは減少)させ得るか、或いはさせ得ないことが可能である。したがって、現在の理論は、当該インスリン分子内の特定のアミノ酸置換が細繊維形成のリスクを増加或いは減少させる傾向が極めて予測不能であることを示している。
【0016】
糖尿病治療用のインスリンおよびインスリン類似体の製造、貯蔵、及び使用における重大な問題である細繊維形成は、高温、低pH、攪拌、或いは尿素、グアニジン、エタノール共溶媒、或いは疎水性表面の存在下で促進される。現行の米国医薬品規制は、細繊維形成が1%或いはそれ以上のレベルで発生した場合、インスリンは破棄すべしと定めている。細繊維形成は、高温で促進されるので、糖尿病患者は、最適には、使用前には、インスリンを冷蔵しておかなければならない。インスリン或いはインスリン類似体は、インスリン又はインスリン類似体を少量定期的に患者の体内に注入する体外インスリン・ポンプを利用する糖尿病患者にとって特に問題となり得る。係る使用法では、前記インスリン又はインスリン類似体は、ポンプ装置内で冷蔵保存されていなく、インスリンの細繊維形成により、体内にインスリン或いはインスリン類似体注入用カテーテルの閉塞をもたらし得るので、予測不能な血糖値の変動を招き、危険な高血糖症さえ引き起こす可能性がある。少なくとも最近のある報告は、リスプロインスリン(野生型ヒトインスリンで残基B28とB29がこれらの位置を入れ替えた類似体、商品名Humalog(登録商標))が特に細繊維形成し易く、インスリンポンプ・カテーテルの閉塞を起こし得ることを示している。
【0017】
インスリン細繊維形成は、インスリンが1〜3箇月間高濃度で、しかも体外ポンプのような常温ではなく生理学的温度(すなわち37℃)でインプラント内に収納されている、植込み式(インプランタブル)インスリンポンプにおいては、さらにより大きな問題である。さらに、通常の運動によって引き起こされる攪拌も、またインスリンの細繊維形成を加速する傾向となるであろう。インスリン細繊維形成の可能性が増大するにもかかわらず、植込み型インスリンポンプは、係るシステムの可能性のある利点のために、まだ研究活動の題目となっている。これらの長所は、全身循環系を介して患者にインスリンを提供する皮下注射より密接に、インスリンの正常な生理学的送達を真似た門脈循環器系へのインスリンの腹腔内への送達を包含する。腹腔内送達は、注射部位が変われば吸収と分解が変わり得る皮下注射に比べて、より迅速で且つ着実にインスリンの吸収を提供する。植込み型ポンプを介するインスリンの投与は、また、患者にとってより便利になる可能性がある。例えば、貯留タンクへ界面活性剤を添加することなどで細繊維形成を防止するための努力は、いくらかの改善をもたらしたが、これまで、これらの改善は、厳密な監視下の臨床試験以外には、植え込みインスリンポンプを信頼して糖尿病患者に使用を認めるには不十分だと考えられている。
【0018】
上述したように、発展途上国世界は、医薬及びワクチンの安全な保管、輸送、及び使用に関連する課題に直面している。この課題は、電気と冷蔵に着実にアクセスできない、アフリカ及びアジア地域での、温度に敏感なインスリン製剤の使用を悪化させるが、さらに該発展途上国世界の糖尿病の目下の流行によって、課題が深刻化する可能性が高い。インスリンは、25℃を超える温度で、10℃上昇毎に分解速度が10倍増、或いはそれ以上を示すので、指針は、30℃未満の温度での貯蔵、好ましくは冷蔵保存するよう求めている。より高温でインスリンは、化学的劣化(例えば、イソ−アスパラギン酸の形成、ジスルフィド結合の再配列、及び共有結合ポリマーの形成などの共有結合構造の変化)と物理的劣化(非天然凝集及び細繊維形成)との両方を受ける。
【0019】
インスリンのアミノ酸置換は、蛋白質を安定化するが、インスリン受容体(IR)への結合及びインスリン様成長因子(IGFR)の相同受容体への交差(クロス)結合を増大するので、発癌リスクを付与すると記載されている。当分野で知られている例は、アスパラギン酸によるHisB10の置換が挙げられる。AspB10インスリンは、安定性と薬物動態とに関して有利な薬学的特性を示すが、その増大した受容体−結合特性は、Sprague−Dawleyラットの腫瘍形成と関連していた。IR及びIGFRへの結合をヒトインスリンのそれに似たレベルまでに減らすのに、AspB10−インスリン或いは関連類似体に導入し得る、A或いはB鎖に可能な置換が多くあるが、係る置換は、一般にインスリン(或いはインスリン類似体)の安定性を悪化し、その化学的および物理的劣化し易さを高める。受容体―結合親和性の"調整"を可能にし、同時に細繊維形成に対する安定性及び抵抗力を高める、インスリンおよびインスリン類似体の修飾方法を発見することは、望ましいであろう。係る応用法では、その受容体―結合特性において超活性な類似体の発癌可能性を相殺するように、IRおよびIGFRへの結合を種々の程度に減らす一組の安定化の修飾が必要となるであろう。
【0020】
したがって、貯蔵中安定であるが、同時に即効性のものを含めて、代替インスリン類似体の必要性がある。
【発明の概要】
【課題を解決するための手段】
【0021】
したがって、本発明の一態様は、アミノ酸の塩素置換によって改善された安定性のような特性変化をもたらし、さらに、対応する非塩素系インスリン或いは類似体の生物学的活性の少なくとも一部を保持するインスリン類似体を提供することである。
【0022】
さらに、或いは代替として、本発明の一態様は、速効性インスリンであるが従来の速効型インスリン類似体に勝る、改善した安定性を有するインスリン類似体を提供することである。
【0023】
一般に、本発明は、塩素化アミノ酸を導入するB−鎖のポリペプチドを含むインスリン類似体を提供する。一実施形態では、該塩素化アミノ酸は、B24位におけるフェニルアラニンである。特定の一実施態様において、前記塩素化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンである。さらに、或いは代替物では、前記インスリン類似体は、ヒトインスリン類似体のような、哺乳動物のインスリン類似体であり得る。特定の一組の実施形態では、前記B鎖ポリペプチドは、配列ID番号4〜8からなる群から選択されるアミノ酸配列と、その3個或いはそれ以下の更なるアミノ酸置換を有するポリペプチドとを、含む。
【0024】
また、B24位でパラ−モノクロロ−フェニルアラニンのような塩素化フェニルアラニンを導入するB鎖ポリペプチドを含むインスリン類似体をコードする核酸も提供される。一例において、前記塩素化フェニルアラニンは、核酸配列TAGのような終止コドンによりコードされる。発現ベクターが係る核酸を含み得、宿主細胞が係る発現ベクターを含み得る。
【0025】
本発明はまた、患者を治療する方法を提供する。該方法は、インスリン類似体或いはその生理学的に許容される塩の生理学的有効量を患者に投与することを含むが、該インスリン類似体或いはその生理学的に許容される塩は、塩素化アミノ酸を含む。一実施形態では、インスリンB鎖は、B24位に塩素化フェニルアラニンを導入する。特定の一態様では、前記塩素化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンである。さらに、或いは代替では、インスリン類似体は、例えば、ヒトインスリンの類似体のような哺乳動物のインスリン類似体を含み得る。さらに、前記B鎖ポリペプチドは、配列ID番号4〜8からなる群から選択されるアミノ酸配列と、その3個或いはそれ以下の更なるアミノ酸置換を有するポリペプチドとを、含み得る。
【図面の簡単な説明】
【0026】
【図1A】図1AはA−鎖及びB−鎖と、隣接する2塩基性切断部位(黒丸)で示される連結領域と、C−ペプチド(白丸)と、を含むヒトプロインスリン配列の概略図である。
【図1B】図1Bは、インスリン様部分と不規則連結ペプチド(破線)から成る、プロインスリンの構造モデルである。
【図1C】図1Cは、B鎖中の残基B24の位置を示すヒトインスリン配列の概略図である。
【図1D】図1Dは、3つのジスルフィド架橋との関聯でPheB24の芳香族残基を示すインスリン単量体のリボンモデルである。LeuB15(黒)及びPheB24(灰色)の隣接する側鎖が示されている。A鎖とB鎖の鎖が示され、ジスルフィド架橋は、球及び棒として示されている。
【図1E】図1Eは、疎水性コアの端にあるポケット内のPheB24側鎖を示すインスリンの空間充填モデルである。
【図2A】図2Aは、オルト−モノクロロ−フェニルアラニン(2Cl−Phe)の図である。
【図2B】図2Bは、メタ−モノクロロ−フェニルアラニン(3Cl−Phe)の図である。
【図2C】図2Cは、パラ−モノクロロ−フェニルアラニン(4Cl−Phe)の図である。
【図3A】図3Aは、単離インスリン受容体(アイソフォーム B):ヒトインスリン(三角)、KP−インスリン(四角)、および4Cl−PheB24−KP−インスリン(逆三角)を用いたインビトロ受容体―結合アッセイの結果を示すグラフである。
【図3B】図3Bは、IGF−1R:ヒトインスリン(三角)、KP−インスリン(四角)、4Cl−PheB24−KP−インスリン(逆三角)、および天然IGF−I(円)を用いたインビトロ受容体―結合アッセイの結果を示すグラフである。
【図3C】図3Cは、単離インスリン受容体(アイソフォームB):ヒトインスリン(実線)、KP−インスリン(破線)、4Cl−PheB24−KP−インスリン(三角)、4F−PheB24−KP−インスリン(四角)を用いたインビトロ受容体−結合アッセイの結果を比較したグラフである。
【図3D】図3Dは、単離インスリン受容体(アイソフォームB):ヒトインスリン(実線)、KP−インスリン(破線)、4Cl−PheB24−KP−インスリン(三角)、4F−PheB24−KP−インスリン(四角)を用いたインビトロ受容体―結合アッセイの結果を比較したグラフである。
【図4】図4は、STZ誘発糖尿病Lewisラットでの4Cl−PheB24−KP−インスリン(逆三角)の皮下注射の経時血糖降下作用を、希釈液単独(丸)、ヒトインスリン(x)、及KP−インスリン(四角)に対して相対的に示すグラフである。
【図5】図5A〜Cは、インスリンコバルト溶液の平均トレース(記録図)を示すグラフであって、2mMEDTAの添加前と後の400〜750nmの特徴的なスペクトル・プロファイルを示す。試料は、50mMトリス(pH7.4)、50mMフェノール、および0.2mM塩化コバルト(CoCl2)に溶解した。次いで、NaSCNを最終濃度1mMになるまで添加した。実線は、EDTA抽出前データを示す。破線は、EDTA抽出後のデータを示す。図A:野生型インスリン;図B:KP−インスリン;図C;4Cl−PheB24−KP−インスリン。 図5Dは、2mMEDTA添加後、574nm(25℃およびpH7.4)で測定した、6量体解離の動態を示すグラフである。データは、各試料のタイム・ゼロに正規化した:野生型(実線)、KP−インスリン(破線)、および4Cl−PheB24−KP−インスリン(点線)。
【図6】図6は、平均濾過グルコース注入速度対体重kg当たり0.2単位用量でインスリンKP−インスリン(リスプロインスリン)及び4Cl−PheB24−KP−インスリン(4−Cl−リスプロインスリン)のインスリン投与後の時間とのプロットを示すグラフである。
【図7】図7は、豚の薬理試験20組をまとめた棒グラフであって、5つの異なる投与量レベルで、KP−インスリンに比し、4Cl−PheB24−KP−インスリンが後期最大半量到達時間(1/2T−max late)の有意な改善を実証している。
【図8】図8は、豚の薬理試験14組をまとめた棒グラフであって、3つの異なる投与量レベルで、KP−インスリンに比し、4Cl−PheB24−KP−インスリンが初期最大半量到達時間(1/2T−max early)の改善を示唆している。
【図9】図9は、曲線下面積(AUC)で測定した、4Cl−PheB24−KP−インスリンのKPインスリンに対する相対的効力を比較した10組の対応する薬物動態の研究要約であって、4−Cl−KPの平均効力のわずかな減少は、統計的に有意でないことが判明した(p=0.22)。
【発明を実施するための形態】
【0027】
本発明は、アミノ酸の塩素置換によってより高い安定性を提供するインスリン類似体であって、対応する非塩素系インスリン或いはインスリン類似体の生物学的活性の少なくとも一部を保持する、当該類似体に関聯する。特に、本発明は、アミノ酸における塩素置換で、より高い安定性を提供するインスリン類似体であって、同時に対応する非塩素系インスリン或いはインスリン類似体の生物学的活性の少なくとも一部を保持する当該類似体を提供する。ある特定の態様において、本発明は、野生型フェニルアラニンのB位における置換としてパラ−モノクロロ−フェニルアラニン(4−Cl−PheB24)残基を含むインスリン類似体を提供する。
【0028】
しかし、本発明はヒトインスリンおよびその類似体に限定されない。これらの置換は非限定的例により、ブタ、ウシ、ウマ、及びイヌインスリンのような動物インスリンでも実施し得ることも想定される。
【0029】
さらに、ヒトとインスリンと動物インスリン間の類似性と、過去において人間の糖尿病患者に使用した動物インスリンと、の観点から、インスリンの配列内に他の小規模な修飾、とくに"保存"とみなされる置換を導入し得ることも想定される。例えば、アミノ酸の更なる置換は、本発明から逸脱することなく、類似の側鎖を有するアミノ酸のグループ内で行い得る。これらは中性疎水性アミノ酸:アラニン(Ala或いはA)、バリン(Val或いはV)、ロイシン(Leu或いはL)、イソロイシン(IlE或いはI)、プロリン(Pro或いはP)、トリプトファン(Trp或いはW)、フェニルアラニン(Phe或いはF)及びメチオニン(Met或いはM)を含む。同様に、中性の極性アミノ酸は、グリシン(Gly或いはG)、セリン(Ser或いはS)、スレオニン(Thr或いはT)、チロシン(Tyr或いはY)、システイン(Cys或いはC)、グルタミン(Glu或いはQ)、およびアスパラギン(Asn或いはN)のグループ内で互いに置換し得る。塩基性アミノ酸は、リジン(Lys或いはK)、アルギニン(ArG或いはR)およびヒスチジン(His或いはH)を含むと考えられる。酸性アミノ酸は、アスパラギン酸(Asp或いはD)とグルタミン酸(Glu或いはE)とがある。別途に記載があるか、或いは前後関係から明らかな場合でない限り、本明細書に記載のアミノ酸は、L−アミノ酸であると考えるべきである。一例では、本発明のインスリン類似体は、本発明の前記4Cl−PheB24置換以外の3個或いはそれ以下の保存的置換を含む。別の例では、本発明のインスリン類似体は、本発明の前記4Cl−PheB24置換以外の1個或いはそれ以下の保存的置換を含む。
【0030】
本明細書および特許請求の範囲で使用されている場合、インスリンあるいはインスリン類似体中の様々なアミノ酸は、問題にしているアミノ酸残基を記載し、次いで当該アミノ酸の位置を、選択的には上付き文字で記載し得る。問題のアミノ酸の位置は、前記置換が位置するインスリンの前記A鎖或いはB鎖を含む。したがって、PheB24は、インスリンのB鎖の第24番目のアミノ酸にあるフェニルアラニンを表し、一方PheB25は、インスリンのB鎖の第25番目のアミノ酸にあるフェニルアラニンを表す。塩素化アミノ酸は接頭辞「Cl−」で表し得る。したがって、塩素化フェニルアラニンは、「Cl−Phe」と省略し得る。フェニルアラニンの場合には、塩素置換基或いはフェニル側鎖上の置換基の位置をさらに前記塩素が結合する炭素の番号で表してもよい。したがって、オルト−モノクロロ−フェニルアラニンは、(図2Bに示すように)「2Cl−Phe」と省略され、メタ−モノクロロ−フェニルアラニンは(図2Cに示すように)3Cl−Phe」と省略され、パラ−モノクロロ−フェニルアラニンは4Cl−Pheとl−Pheと、省略される。
【0031】
B24にあるフェニルアラニンは、機能性インスリンにおける不変アミノ酸であって、芳香族側鎖を包含する。インスリンにおけるPheB24の生物学的重要性は、臨床的変異(SerB24)がヒトの真性糖尿病を引き起こすことで示される。図1Dと図1Eに図示のように、亦、理論に束縛されることを望まないが、PheB24は、古典的な受容体結合表面で疎水性コアの端に纏まって(pack)いると考えられている。このモデルは、結晶学的プロトマー(2−Zn分子1;プロテインデータバンク識別名4INS)に基づいている。PheB24は、B鎖(残基B24〜B28)のC末端β−ストランド内に位置し、中央のα−ヘリックス(残基B9〜B19)に隣接している。芳香環の一面と一端は、LeuB15とCysB19により規定される浅いポケット内に位置する。他の面と他の端は溶剤に露出している(図1E)。このポケットは、部分的に主鎖カルボニル基とアミド基とで囲まれているので、複雑で且つ非対称的な静電気的環境を形成する。
【0032】
本発明の前記置換は、現行の多くのインスリン類似体のいずれにでも実施し得ることが想定される。例えば、本明細書で提供される塩素化PheB24置換は、ヒトインスリンの他にリスプロ(KP)インスリン、インスリンアスパルト(Aspart)、他の修飾インスリン或いはインスリン類似体、或いは、通常のインスリン、NPHインスリン、レンテインスリン或いはウルトラレンテインスリンのような様々な医薬製剤内で実施し得る。アスパルト(Aspart)インスリンは、AspB28置換を含み、Novalog(登録商標)として販売され、一方リスプロインスリンは、LysB28とProB29置換とを含み、名称Humalog(登録商標)として知られ、また、その名称で販売されている。これらの類似体は、米国特許第5,149,777号及び第5,474,978号に記載されている。これらの類似体は、共に速効性インスリンとして知られている。
【0033】
理論に束縛されることを望まないが、芳香環のパラ位にある前記塩素置換は二量体インターフェース(4Cl−PheB24)内に埋め込まれていると考えられ、また不利な塩素―芳香族静電双極子モーメントの配置を形成し、当該6量体内において、各二量体界面で対に並置することで、6量体の分解を促進するとも考えられている。これによって、Zn2+イオンの存在下に前記インスリン類似体を形成しても、尚且速効性(食事時)インスリン類似体である能力を保持出来ると考えられている。
【0034】
塩素化−Phe置換は、B24におけるものを含めて、従来臨床的に使用されていないが、なお実験的に有用である、以下にもっと詳しく記載のDKPインスリンのようなヒトインスリン類似体にも導入し得るし、或いはB鎖のC末端残基とA鎖のN末端残基との間の正常の35個のアミノ酸連結領域の代わりにインスリンの前記A鎖部分とB鎖部分の間に一つのジペプチドリンカー(Ala−Lys)を含む、プロインスリン類似体であるミニプロインスリンにも導入し得る(図1B参照)。DKP−インスリン(或いはAspB10を含む、或いはヒトインスリンのそれよりも高い受容体−結合親和性を示す他のインスリン類似体)においてB24位での塩素化―Pheの導入は、これらの受容体―結合親和性をヒトインスリンと同様或いはそれ以下までに低下できるので、潜在的に臨床的使用を可能にする。このようにして、インスリン類似体の、分裂促進的なIGFRへの交差結合も低下し得る。
【0035】
ヒトプロインスリンのアミノ酸配列を、比較の目的のために、配列ID番号1として提供する。
配列ID番号1(プロインスリン)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr-Arg-Arg-Glu-Ala-Glu-Asp-Leu-Gln-Val-Gly-Gln-Val-Glu-Leu-Gly-Gly-Gly-Pro-Gly-Ala-Gly-Ser-Leu-Gln-Pro-Leu-Ala-Leu-Glu-Gly-Ser-Leu-Gln-Lys-Arg-Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
【0036】
ヒトインスリンA鎖のアミノ酸配列を配列ID番号2として提供する。
配列ID番号2 (A鎖)
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
【0037】
ヒトインスリンBA鎖のアミノ酸配列を配列ID番号3として提供する。
配列ID番号3 (B鎖)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr
【0038】
他の置換のさらなる組合せも、本発明の範囲内である。本発明の置換を、従来既知のインスリン類似体の置換と組み合わせ得ることも想定される。例えば、塩素化Phe置換も導入し得るリスプロインスリン(Humalog(登録商標))のLysB28、ProB29置換を含むヒトインスリンのB鎖の類似体のアミノ酸配列を、配列ID番号4として提供する。同様に、塩素化Phe置換も導入し得る、アスパートインスリンのAspB28の置換を含むヒトインスリンのB鎖の類似体のアミノ酸配列を、配列ID番号5として提供する。
配列ID番号4
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Lys-Pro-Thr
配列ID番号5
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Asp-Lys-Thr
【0039】
塩素化−PheB24置換はまた、残基A4、A8および/或いはB1でのHis置換を含むヒトインスリンの類似体のような他のインスリン類似体置換との組み合わせにでも、導入し得るが、これは、もっと詳細に、同時係属中の国際特許出願第PCT/US07/00320号および米国特許出願第12/160,187号に記載されている通りであって、その参照により本明細書に組み込まれる。例えば、4Cl−PheB24置換は、[HisA4、HisA8]および/或いはHisB1置換と共に、配列ID番号6で表されるアミノ酸配列を有するインスリン類似体或いはプロインスリン類似体中に存在し得る。
配列ID番号6
R1-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-R2-Thr-R3-R4-Thr-Xaa0-35-Gly-Ile-Val-R5-Gln-Cys-Cys-R6-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn;
【0040】
ここで、R1はHis或いはPheであり;R2はTyr或いはPheであり、R3はPro、Lys或いはAspであり;R4はLys或いはProであり;R5はHis或いはGluであり;R6はHis或いはThrであり;Xaa0〜35は0〜35個の任意のアミノ酸或いは該アミノ酸鎖中の切れ目(break)であり;
さらに、以下のアミノ酸置換の群から選択される、少なくとも1つの置換が存在する:
R1はHisである;
R6はHisである;
R5とR6とは共にHisである。
【0041】
前記4Cl−PheB24置換は、同時係属中の米国特許出願番号第12/160,187に開示のような単一鎖インスリン類似体にも導入することが可能であり、その開示は、この参照により本明細書に組み込まれる。
【0042】
塩素化−PheB24置換は、インスリンA鎖中に置換を含むインスリン類似体にも導入し得ることが想定される。例えば、インスリン類似体は、さらに、A8位に野生型のスレオニン(配列ID番号2参照)の代わりに、配列ID番号7に示すように、A8位にリジン、ヒスチジン或いはアルギニン置換を含み得る。
配列ID番号7
Gly-Ile-Val-Glu-Gln-Cys-Cys-Xaa-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
[Xaa = His, Arg,或いはLys]
【0043】
上記したように、4Cl−PheB24置換は、AspB10(D)、LysB28(K)およびProB29(P)置換を含む、DKP−インスリンと呼ぶ高活性の改変インスリン単量体中に導入し得る。前記B鎖の表面上のこれら3個の置換は、2量体および6量体形成を妨害すると考えられる。改変単量体の使用で、安定性アッセイに及ぼす自己会合の混乱効果を回避する。DKP−インスリンの構造は、結晶学的プロトマーに密接に似ている。DKPインスリンのB鎖ポリペプチドの配列を、配列ID番号8として提供する。
配列ID番号8(DKP B鎖配列)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-Asp-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Lys-Pro-Thr
【0044】
KP−インスリン類似体は、トリプシン−触媒による半合成により調製し、高速液体クロマトグラフィーにより精製し得る。(Mirmira,R.G.およびTagerr,H.S.、1989、J.Biol.Chem.264:6349〜6354)。このプロトコルは、(i)残基(N)−GF*FYTKPTを表す合成オクタペプチド(修飾した残基(F*)と「KP」置換(下線)とを含む;配列ID番号9)と、(ii)切断型類似体デスオクタペプチド[B23〜B30]−インスリン(DOI:配列ID番号15)とを用いる。オクタペプチドは、ProB28およびLysB29(斜体)の相互交換により、野生型B23〜B30配列(GFFYTPKT;配列ID番号10)とは異なるので、トリプシン処理中、リジンε−アミノ基の保護は、必要ない。要するに、このプロトコルでは、デスオクタペプチド(150mg)およびオクタペプチド(150mg)を、10mM酢酸カルシウムおよび1mMエチレンジアミン4酢酸(EDTA)を含有するジメチルアセトアミド/1,4−ブタンジオール/0.2Mトリス酢酸(pH8)(35:35:30、v/v、4ml)の混合物中に溶解する。DOIに対して5倍モル過剰のオクタペプチドで、トリプシンの逆反応(タンパク質分解方向)の防止を基質飽和によって確実にするのである。最終pHを、0.1mlのN−メチルモルホリンを用いて7.0に調整する。該溶液を12℃まで冷却し、1.5mgのトリプシンを加え、12℃で2日間インキュベートする。追加の1.5mgのトリプシンを、24時間後に加える。反応物を、0.1%トリフルオロ酢酸を用いて酸性にし、分取逆相HPLC(C4)により精製する。生成物は、次いで、マトリクス支援レーザ脱着/イオン化飛行時間型(MALDI−TOF;Applied Biosystems、カリフォルニア州Foster City)を使用して確証し得る。固相合成の一般的なプロトコルは、記載されている通りである(Merrifieldら、1982.Biochemistry 21:5020〜5031)。9−フルオレン−9−イル−メトキシカルボニル(F−moc)保護フェニルアラニン類似体は、Chem−Impex International(イリノイ州 Wood Dale)から入手し得る。
【0045】
円二色性(CD)スペクトルは、Aviv分光旋光計を用いて4℃および25℃で取得し得る(Weissら、Biochemistry 39:15429〜15440)。試料は、約25μMのKP−インスリン或いは類似体を、50mMリン酸カリウム(pH7.4)中に含有し得る。試料は、25℃でのグアニジン−誘導による変性研究用に5μMに希釈される。アンフォールディングの自由エネルギーを導き出すために、変性遷移を、非線形最小2乗法により、Sosnickらの、Methods Enzymol.317:393〜409に記載されているように、2相モデルにフィットさせる。要するに、xは変性剤の濃度を示す、CDデータθ(x)を次式により、非線形最小2乗法プログラムによりフィットさせる。
【0046】
【数1】

【0047】
ここで、xはグアニジンの濃度であり、θAおよびθBは天然で、アンフォールドした状態におけるベースライン値である。ベースラインは、遷移前および遷移後の次の直線により近似する。
【0048】
【数2】

【0049】
相対活性は、特異的に結合した125I−ヒトインスリンの50%を置き換えるのに要する野生型ヒトインスリンに対する類似体の割合として定義する。インスリン受容体(IR)を含むヒト胎盤膜調製物を、当該技術分野で既知のように使用する。膜断片(0.025mgタンパク質/チューブ)を、125I標識インスリン(約30,000cpm)と共に、選択した濃度の未標識類似体の存在下で18時間、4℃で、最終容積0.25mlの0.05Mトリス−HClおよび0.25%(w/v)ウシ血清アルブミン中、pH8でインキュベートした。インキュベーション後、混合物を1mlの氷冷緩衝液で希釈し、4℃で5分間遠心分離する(10,000g)。次いで、上清を吸引により除去し、膜ペレットを放射能について計測する。データを、非特異的結合(1μMヒトインスリンの存在下で結合した膜に残存する放射能の量)に対して補正する。全てのアッセイにおいて、競合リガンド不在で結合したトレーサーのパーセンテージは、リガンド喪失による人為的結果(artifacts)を回避するため、15%未満であった。インスリン類似体の37℃でのインキュベーション間中の活性の変化を測定するための更なるインスリン受容体−結合アッセイは、マイクロタイター(microtiter)プレート抗体捕捉を用いて、当該技術分野で既知のように行い得る。マイクロタイターストリッププレート(Nunc Maxisorb)を、4℃で1晩、AU5 IgG(リン酸緩衝食塩水中40μg/mlを100μl/ウェル)と共にインキュベートする。結合データは、二サイト(two−site)逐次モデルで分析し得る。IGF I型受容体を用いた、対応するマイクロタイタープレート抗体アッセイを行い、この相同受容体への交差結合を評価し得る。
【0050】
修飾された残基は、KP−インスリンの範囲内に導入された。提示した活性値は、ヒトインスリンとの相対的なホルモン−受容体の解離定数の比率に基づくものであり、ヒトインスリンの活性は、このように定義によって、1.0である。活性値の標準誤差は一般に25%未満であった。25℃におけるアンフォールディングの自由エネルギー(ΔGu)は、2状態モデルに基づき、ゼロ変性剤濃度に外挿して見積もった。時間のずれは、亜鉛不含リン酸緩衝生理食塩水(pH7.4)中、37℃で穏やかに撹拌する際の蛋白質細繊維形成開始に必要な時間(日数)を示す。
【0051】
本明細書で提供される塩素化−PheB24置換は、インスリン類似体、例えば、リスプロインスリン(つまり、置換LysB28及び置換ProB29も含むインスリン類似体(名称Humalog(登録商標)として販売))で実施できる。係るインスリン類似体は、塩素化−PheB24−KP−インスリンと呼ぶ。比較目的のために、フッ素置換も、本質的には、上述のように導入されたが、但し、パラフッ化フェニルアラニン置換は、リスプロインスリンのB24位とB26位に導入された。B24位にパラフッ素フェニルアラニン置換を含む類似体は4F−PheB24−KP−インスリンと呼ぶ。B26位(チロシンを置換する)にパラフッ素化フェニルアラニン置換を含む類似体は4F−PheB26−KP−インスリンと呼ぶ。KP−インスリンおよびDKP−インスリンのそれぞれの類似体の名称を表や図で簡潔にする為、"インスリン"を除去してKP及びDKPと省略し得る。
【0052】
B24での塩素化フェニルアラニン置換には、残基(N)−GF*FYTKPTを表す合成オクタペプチド(塩素化フェニルアラニン残基を「F*」として、「KP」置換を(下線)で表わした:配列ID番号9)及び切断した類似体デスオクタペプチド[B23〜B30]−インスリン(B10位において野生型、配列ID番号15)を用いた。B26でのフッ素化フェニルアラニン置換には、残基(N)−GFFF*TKPTを表す合成オクタペプチド(再び、フッ素化フェニルアラニン残基を「F*」として、「KP」置換を(下線)で表わした:配列ID番号16)及び切断した類似体デスオクタペプチド[B23〜B30]−インスリン(配列ID番号15)を用いた。
【0053】
リスプロインスリン類似体のバックグラウンド中のB24位或いはB26位のハロゲン化フェニルアラニン置換で得られたデータを以下の表1に示す。
【0054】
【表1】

【0055】
細繊維形成アッセイ。4Cl−PheB24−KP−インスリンの物理的安定性は、ガラスバイアル中で穏やかに撹拌しながらpH7.4、37℃で亜鉛不含リン酸緩衝生理食塩水(PBS)中でインキュベーションの間に三重反復して評価した。該試料は、タンパク質濃度60μMで曇り度の外観を12日間観察し、毎日2回、チオフラビン−T(ThT)蛍光分析用に一定分量を採取した。ThT蛍光は、アミロイドが存在しない場合には僅少であるが、細繊維形成の発生時には著しく強まるので、このアッセイは、前記時間のずれを求める。ヒトインスリン、KP−インスリン、及び4Cl−PheB24−KP−インスリンの時間のずれは、それぞれ、5±1日、3±1日、および13日以上である。したがって、4Cl−PheB24−KP−インスリンは、これらの条件下で、KP−インスリンよりも4倍以上細繊維形成に対して耐性があり、少なくともヒトインスリンの2倍以上耐性がある。特許性を理論に条件付けるのは望まないが、4Cl−PheB24インスリン類似体の細繊維形成抵抗の向上で、個々の試料の使用開始前でも後でも、概インスリン類似体の貯蔵期間を余り短縮することなく、当該インスリン類似体の即効性を高めるよう、亜鉛不含製剤で調剤が可能になると想定される。
【0056】
熱力学的安定性。本発明者らは、4Cl−PheB24−KP−インスリンのアンフォールディングの自由エネルギーを、KP−インスリン及びLysA8−KP−インスリンに相対的に、亜鉛不含緩衝液中pH7.4および25℃(10 mMリン酸カリウムおよび50mMKCl)で測定した。このアッセイは、ヘリックスに敏感な波長222 nmでプローブし、グアニジン誘発性変性のCDによる検出を利用した。二状態モデルに基づく、アンフォールディングの自由エネルギーによる推定値を得るために、ΔGuの値を変性剤濃度ゼロに外挿した。置換ThrA8→Lysは、熱力学的安定性を0.6±0.2Kcal/モル増加した一方、該4Cl−PheB24修飾は、安定性を0.4±0.2Kcal/モル減少させた。
【0057】
4Cl−PheB24−KP−インスリン−A8Tと、界面活性剤−可溶化し、レクチン精製したインスリン受容体(アイソフォームB)との親和性は、ヒトインスリンのそれと類似している。単離インスリン受容体(アイソフォームB):ヒトインスリン(三角)、KP−インスリン(四角)、4Cl−PheB24−KP−インスリン(逆三角)を使用して、トレーサーとして125I標識ヒトインスリンを用いた競合置換アッセイを図3Aに示す。3つの曲線はすべて密接に整列しており、類似した受容体−結合親和性を示す。4Cl−PheB24−KP−インスリンのインスリン受容体に対する親和性は、KP−ヒトインスリンのそれと区別できなかったが、それぞれ野生型インスリンの親和性よりもわずかに低かった。
【0058】
図3Bは、インスリン様成長因子I受容体(IGF−1R)を使用し、トレーサーとして125Iで標識したIGF−Iを使用してプローブした競合置換によって調べた、対応するアッセイの結果を示す。天然IGF−I(円)が追加されているが、記号は同一である。4Cl−PheB24−KP−インスリン曲線の右側シフトは、IGF−1Rへの交差結合の減少を示す。IGF−1Rへの4Cl−PheB24−KP−インスリンの交差結合は、KP−インスリン或いは野生型インスリンのそれに対して約3倍相対的に減少している。
【0059】
単離インスリン受容体(アイソフォームB)を用いた、ヒトインスリン(黒実線)、KP−インスリン(破線)、4Cl−PheB24−KP−インスリン(三角)、4F−PheB24−KP−インスリン(四角)間の同様な比較は、図3Cに示す。4Cl−PheB24−KP−インスリン、野生型ヒトインスリン、及びインスリンリスプロと相対的に、4F−PheB24−KP−インスリン曲線の右側シフトは、フェニルアラニン環の同一位置での異なるハロゲンの使用で、B24位でのフェニルアラニンのパラ−クロロ置換に比較して減少した受容体−結合親和性を示している。対照的に、4Cl−PheB24−KP−インスリンのインスリン受容体結合親和性は、野生型ヒトインスリン及びリスプロ(KP)インスリンのそれと似ている。
【0060】
単離インスリン受容体(アイソフォームB)を使用した、ヒトインスリン(実線)、KP−インスリン(破線)、4Cl−PheB26−KP−インスリン(三角)、4F−PheB26−KP−インスリン(四角)間のさらなる比較は、図3Dに示す。4Cl−PheB26−KP−インスリン及び4F−PheB26−KP−インスリンは、両方とも野生型インスリンとリスプロインスリンとに比べて、インスリン受容体結合親和性が低下した。上記のように、4Cl−PheB24−KP−インスリンは、受容体−結合親和性で類似した減少を示さない。
【0061】
糖尿病ラットにおける4Cl−PheB24−KP−インスリンのインビボ効力は、KP−インスリンのそれと似ている。生物学的活性の特徴づけを行う為に、雄Lewisラット(体重約300g)をストレプトゾトシン(streptozotocin)で糖尿病状態にした。ヒトインスリン、KP−インスリン、4Cl−PheB24−KP−インスリンは、HPLCにより精製、乾燥して粉末にし、インスリン希釈液(Eli Lilly Corp)に溶解した。KP−インスリン或いは4Cl−PheB24−KP−インスリンを希釈液100μl中20μg或いは6.7μg、時間=0で、ラットに皮下注射した。多い方の用量は、野生型インスリンの用量−応答曲線の定常(プラトー)になるが、一方少ない方の用量は、グルコース処理最高初速度の50〜70%に相当する。希釈剤単独の注入は、負の対照として行った。各グループ8匹のラットについて研究した。血液は時間0および継続間隔で最大120分まで、切り取った尾の先端から得た。血糖は、Hypoguard Advance Micro−Drawメーターを用いて測定した。血糖濃度は、図4に示すように減少することが観察された。注入後最初の24分間の血中グルコース濃度降下の初速度を比較すると、4Cl−PheB24−KP−インスリン(−225±29 mg/dl/時)、KP−インスリン(−256±35 mg/dl/時)及びヒトインスリン(−255±35mg/dl/時)で似ている。初期速度の違いは、いずれも統計的に有意ではない。しかし、次の60分に亘る4Cl−PheB24−KP−インスリンの作用持続時間は、ヒトインスリン或いはKP−インスリンの持続時間よりも短いと思われる。
【0062】
4Cl−PheB24−KP−インスリンの天然受容体−結合親和性を考慮すれば、その効力がヒトインスリンのそれよりより低いことは異常なことであろう。確かに、野生型に比べた相対的な親和性が30〜100%台のインスリン類似体は、通常、インビボで天然物の効力を示す。しかし、形式的には、Cl−PheB24−KP−インスリンの生物学的効力が、ヒトインスリン或いはKP−インスリンの効力より(モル基準で)やや低いことはあり得る。もしそうであっても、我々は、如何なる係る降下も、臨床で使用の現行のインスリン製品のモル当たり活性閾値の範囲内になるであろうということに注目する(慣例により、国際単位(IU)は、それぞれ、糖降下程度を反映するように再定義され、その結果製品毎の単位当りミリグラム或いはナノモル数に違いが出ることになる)。留意すべきは、タンパク質不含希釈剤(図4の褐色破線)の対照注入での血糖濃度の緩やかな減少は、注入後の動物の昼間の空腹を示していることである。
【0063】
インスリン6量体分解の薬物動態(EDTA封鎖アッセイと呼ぶ)用代替えマーカーは、亜鉛イオン(Zn2+)ではなくコバルトイオン(Co2+)を使用して、6量体会合を仲介させるのである。Co2+6量体とZn2+6量体は、構造上似ているが、該コバルトイオンは、未充填d−電子殻に起因する好都合な分光プローブを提供する。
【0064】
アッセイの原理は次の通りである。R6のフェノール安定化Co2+インスリン6量体溶液は、四面体Co2+配位の為に青色であるが、分解後、該タンパク質溶液は、水或いはEDTA(エチレンジアミンテトラ酢酸:金属イオンの強力なキレート剤)による八面体Co2+の配位で、配位子場理論の結果として、可視波長での光学遷移が無くなるので、無色となる。該EDTA金属イオン封鎖アッセイは、次のように、これらの分光機能を利用する。時刻t=0に、モル過剰量のEDTAをR6インスリン6量体或いはインスリン類似体6量体溶液に添加する。EDTA自体は6量体に作用してそれから金属イオンを抜き取ることはないが、一時的な6量体分解の過程で解放されたCo2+はいずれもキレート剤によって補足され、再会合のために利用できなくなるのである。青色(R6固有のインスリン−結合Co2+の574nmにおける正四面体d−d光学遷移)消失速度は、このように、6量体分解動態の光学的証拠を提供する。
【0065】
400〜750nmの特徴的なスペクトルプロファイルを示す、インスリン・コバルト溶液の平均化トレースは、2mMEDTA(図5A−C)の添加前と添加後測定した。試料を、50mMトリス(pH7.4)、50mMフェノール、および0.2mMCoCl2に溶解した。その後、NaSCNを最終濃度1mMまで追加した。574nm(25℃およびpH7.4)で追跡した、2mMEDTA添加後の6量体解離の速度式も示す。EDTA抽出前の類似体のスペクトルは実線として表示する。EDTA抽出後、該スペクトルは破線として表示する。野生型は、パネルAに、KP−インスリンはパネルBに、4Cl−PheB24−KP−インスリンはパネルCに示す。データは各試料について時間ゼロに正規化した。
【0066】
一方、t=0で6量体コバルト錯体のベースライン光吸収スペクトルは、野生型インスリン6量体、KPインスリン6量体、及び4Cl−PheB24−KPインスリン6量体(図5A〜5C参照)間で類似している。これら各のd−d電子遷移の類似した形状と大きさは、前記金属イオンが、野生型と変異型6量体で、類似したR6−固有の四面体配位部位にあることを示唆している。それは、4Cl−PheB24−KP−インスリンが金属イオン媒介会合に適格であり、それゆえ、亜鉛ベースの製剤に有用なことを意味するので、この結果は重要である。
【0067】
2mMEDTA添加後、574nm(25℃およびpH7.4)で追跡した6量体解離の動力学は、野生型と変異型の6量体がEDTA介在Co2+封鎖速度に著しい違いを見せることを示す。予想通り、野生型6量体は、最高の動力学的安定性(図5Dの実線)を示し、次いでKP−インスリン(図5Dの一点鎖線)および4−Cl−PheB24−KP−インスリン(図5Dの点線)が続く。それぞれの半減期は481秒(野生型)、363秒(KP−インスリン)、66秒(4Cl−PheB24−KP−インスリン)である。パラ−クロロ芳香族置換によって誘導される加速の程度は、リスプロインスリン(Humalog(商標))の「KPスイッチ(切替)」関連の程度よりも大きい。皮下注射部位からの亜鉛イオンの拡散は、EDTA封鎖アッセイにおけるコバルトイオンのインビトロ封鎖に類似するので、これらの知見から、4Cl−PheB24−KP−インスリンが著しい吸収の加速を示すものと予測される。
【0068】
野生型インスリン(Humulin(商標);ELi Lilly and Co.)とKP−インスリン(Humalog(商標)と、に比して、4−Cl−PheB24−KP−インスリンの薬物動態(PK)、薬物動力学(PD)特性、及びその効力を青年期のヨークシャーファーム(Yorkshire farm)の豚(体重25〜45kg)で調べた。野生型とKP−インスリンは、製造元(Eli Lilly and Co.)から提供を受けたまま、U−100強度で使用した。前記4−Cl−PheB24−KP−インスリンは、野生型及びKP−インスリン製品のそれと同様なタンパク質対亜鉛イオンの比率でLilly希釈液に調剤した;その強度は、U−87であった。動物は、試験日にそれぞれTerazolで麻酔導入し、次いで、Isofluraneで全身麻酔した。各動物に気管挿管し、酸素飽和度と終末呼気CO2とを連続的にモニターした。内因性の膵臓α−およびβ−細胞分泌をブロックする為に、クランプ調査開始前約30分と、その後2時間毎に、酢酸オクトレオチド(octreotide)を豚に皮下注射(44μg/kg)により投与した。静脈カテーテルを設置し、10%ブドウ糖輸液でベースライン正常血糖値を確立してから、カテーテルを介してインスリンを静脈注射で投与した。末梢インスリン媒介による、グルコース取り込みを定量化する為に、可変流量でグルコース注入を行い、血中グルコース濃度を約85mg/dlに維持するようにした。グルコース注入速度がインスリン投与以前のベースラインに戻るまで、前記グルコース注入は、通常5〜8時間必要であった。グルコース濃度は10分毎、Hemocue201ポータブルグルコース分析器で測定した(機器の誤差:1.9%)。グルコース・クランプ法のコンピュータ化プロトコルは、Matthewsらの報告通りであった。インスリンアッセイのための血液試料2mlも次のスケジュールに従って取得した:インスリン送達後0〜40分:5分間隔;50〜140分:10分間隔;160分〜GIRがベースラインに戻るまで:20分間隔。PK/PDの分析のために、20分間の移動平均カーブフィットとフィルタが適用された。PDは、初期最大半量到達時間、後期最大半量到達時間、最大効果到達時間、およびベースライン上の曲線下のエリア(AUC)として測定された。これらの分析のそれぞれについては、生データではなくて近似曲線を使用した。3頭の豚では、それぞれ3組の試験を行った。これらの試験の結果を図6〜9に提供する.
4−Cl−PheB24−KP−インスリン(図6では、4−Cl−リスプロインスリンと短縮)は、KP−インスリン或いは野生型インスリンよりも大幅に低下した、延長後期の"尾部"を示すことが見出された。インスリンの作用遮断が改善した事は、遅発型食後低血糖症に関して潜在的な臨床的有益性を示唆する。
【0069】
図7は、豚での薬力学試験20組を要約し、後期最大半量到達時間に於いて、KP−インスリンより、4Cl−PheB24−KP−インスリンが、0.05U/kg、0.1U/kg、0.2U/kg、0.5U/kg、及び1U/kgの5つの異なる投与量レベルで有意な改善を実証する。
【0070】
図8は、豚での薬力学試験14組を要約し、初期最大半量到達時間に於いて、KP−インスリンより、4Cl−PheB24−KP−インスリンが、0.05U/kg、0.1U/kg、0.2U/kgの3つの異なる投与量レベルで、改善を示唆する。
【0071】
図9は、曲線下面積(AUC)で測定した、4Cl−PheB24−KP−インスリンの相対的な効力をKPインスリンのそれと比較した、対応10組の薬力学研究を要約し、その中で、4−Cl−KPの平均効力のわずかな減少は、統計的に有意でないことが見出された(p=0.22)。類似の製剤配合条件下(フェノール及びメタクレゾールで安定化した、亜鉛インスリン6量体或いは亜鉛インスリン類似体6量体)で、野生型インスリンとKP−インスリン(リスプロ−インスリン)との関連で、4−Cl−PheB24−KP−インスリンの薬物動態(PK)および薬力学(PD)の特性は、曲線下エリア(AUC)法で測定した、4−Cl−PheB24−KP−インスリンの効力が、野生型インスリン及びKP−インスリンのものと類似していたことを示す。
【0072】
患者を治療する方法は、当該患者に塩素化−PheB24置換インスリン類似体を投与することを含む。一例では、前記インスリン類似体は、4Cl−PheB24−KPインスリンである。前記インスリン類似体は、選択的にA8位にヒスチジン、リジン或いはアルギニン置換を含み得る。別の例では、前記塩素置換インスリン類似体は、さらに、インスリン分子内の他の位置に、人体での前記類似体の作用速度を変更するように設計された1つ或いはそれ以上の置換を含む。なお別の例では、前記インスリン類似体は、外付け或いは植込み型インスリンポンプで投与される。同時係属中の米国特許出願番号12/419169により完全に記載されている通り、本発明のインスリン類似体は、また、前記B鎖のC−末端およびA鎖のN末端のとの間のテザー(係留)のような、他の修飾を含み得る。
【0073】
医薬組成物は、係るインスリン類似体を含み得、選択的に亜鉛を含み得る。亜鉛イオンは、インスリン類似体の6量体につき2.2〜3.0モル比のレベルで、当該組成物中に含め得る。当該製剤において、インスリン類似体濃度は、通常、約0.1〜約3mMであって、インスリンポンプの貯槽では、3mM以下の濃度を使用し得る。食事時のインスリン類似体の修飾は、(a)Humulin(登録商標)(Eli Lilly and Co.)、Humalog(登録商標)(Eli Lilly and Co.)、Novalin(登録商標)(Novo−Nordisk)及びNovalog(登録商標)(Novo−Nordisk)及びヒトでの使用が現在承認されている他の速効インスリン製剤の「通常の」製剤、(b)上記および他のインスリン類似体の「NPH」製剤、並びに(c)係る製剤の混合物について記載のように調剤し得る。前述したように、その細繊維形成に対する抵抗の向上の為、4Cl−PheB24含有インスリン類似体は亜鉛の存在なしで調剤し、前記類似体の速効性を最大限にし得ると思われる。しかし、また、亜鉛の存在下でも、前記4Cl−PheB24含有インスリン類似体は、6量体から2量体および単量体に十分に速く解離するので、速効性インスリン類似体としても考慮されるべきと考えられる。
【0074】
賦形剤は、グリセロール、グリシン、他の緩衝剤、及び塩、並びにフェノールおよびメタ−クレゾールなどの抗菌保存剤を含み得、後者の保存剤は、インスリン6量体の安定性を強化することが既知である。係る医薬組成物は、生理学的有効量の前記組成物を患者に投与することにより、真性糖尿病或いは他の病状を有する患者を治療するのに使用し得る。
【0075】
少なくとも、B24位に塩素化フェニルアラニンを有するインスリンのB鎖をコードする配列を含むインスリン類似体をコードするポリペプチドをコードする配列を含む核酸も想定される。これは、終止コドン(アンバーコドンTAGのような)をB24位に導入することで達成できるのであって、抑制(サプレッサー)tRNA(アンバーコドンを用いる場合はアンバーサプレッサー)及び以前に記載されたような(Furter、1998、Protein Sci.7:419〜426;Xieら、2005、Methods.36:227〜238)、前記終止コドンに応答してポリペプチド中に非標準的なアミノ酸を導入する対応tRNA合成酵素を併用して行う。特定の配列は、核酸配列が導入される種の好ましいコドン使用に依存し得る。該核酸は、野生型インスリンの他の修飾体もコードし得る。前記核酸配列は、該ポリペプチド或いは修飾されたプロインスリン類似体の他の位置に無関係の置換或いは伸長を含む、修飾されたA鎖或いはB鎖配列をコードし得る。該核酸は、発現ベクターの一部分であり得るし、また、このベクターは、大腸菌細胞系のような原核宿主細胞、或いはS.セレビシエ(S.cereviciae)或いはピチア・パストリス(Pichia Pastoris)株、或いは細胞系のような真核細胞系などの宿主細胞に挿入し得る。
【0076】
例えば、酵母ピチア・パストリス(Pichia Pastoris)および他の微生物中のB鎖ポリペプチドの発現に向けるように、合成遺伝子を合成し得ることが想定される。B24位に終止コドンを用い、その位置に塩素化フェニルアラニンを導入する目的でのB鎖ポリペプチドのヌクレオチド配列は、次のいずれか或いはその変異型であり得る:
(a)ヒトコドン優先性を持つ:TTTGTGAACCAACACCTGTGCGGCTCACACCTGGTGGAAGCTCTCTACCTAGT
GTGCGGGGAACGAGGCTAGTTCTACACACCCAAGACC (配列ID番号11)
(b)ピチアコドン優先性を持つ
TTTGTTAACCAACATTTGTGTGGTTCTCATTTGGTTGAAGCTTTGTACTTGGTT
TGTGGTGAAAGAGGTTAGTTTTACACTCCAAAGACT (配列ID番号12)
【0077】
同様に、ヒトコドン優先性を有し、B24位に終止コドンを用いてその位置に塩素化化フェニルアラニンを導入する目的の、全長プロインスリンcDNAは、配列番号13の配列を有し得る。
TTTGTGAACC AACACCTGTG CGGCTCACAC CTGGTGGAAG CTCTCTACCT AGTGTGCGGG GAACGAGGCT AGTTCTACAC ACCCAAGACC CGCCGGGAGG CAGAGGACCT GCAGGTGGGG CAGGTGGAGC TGGGCGGCGG CCCTGGTGCA GGCAGCCTGC AGCCCTTGGC CCTGGAGGGG TCCCTGCAGA AGCGTGGCAT TGTGGAACAA TGCTGTACCA GCATCTGCTC CCTCTACCAG CTGGAGAACT ACTGCAACTA G (配列ID番号13)
【0078】
同様に、ヒトコドン優先性を有し、B24位に終止コドンを用いてその位置に塩素化フェニルアラニンを導入する目的であり、P.パストリスに好ましいコドンを有する、全長プロインスリンcDNAは、配列ID番号14の配列を有し得る。
TTTGTTAACC AACATTTGTG TGGTTCTCAT TTGGTTGAAG CTTTGTACTT GGTTTGTGGT GAAAGAGGTT AGTTTTACAC TCCAAAGACT AGAAGAGAAG CTGAAGATTT GCAAGTTGGT CAAGTTGAAT TGGGTGGTGG TCCAGGTGCT GGTTCTTTGC AACCATTGGC TTTGGAAGGT TCTTTGCAAA AGAGAGGTAT TGTTGAACAA TGTTGTACTT CTATTTGTTC TTTGTACCAA TTGGAAAACT ACTGTAACTA A (配列ID番号14)
【0079】
前述の開示に基づいて、塩素置換インスリン類似体が上述した目的を達成するのは、もう明らかのはずである。即ち、これらのインスリン類似体は、向上した熱力学的安定性、細繊維形成への耐性、および血糖値を低下させる効力を示す。塩素置換フェニルアラニンを含むインスリン類似体は、またインスリン様成長因子(IGFR)への交差反応性も低下させる。従って、如何なる明白な変形形態も特許請求に係わる発明の範囲内に含まれ、また、それ故に特定の構成要素の選択は、本明細書に開示、記載された本発明の精神から逸脱することなく決定できることを理解すべきである。
【0080】
以下の文献は、本明細書に記載の試験およびアッセイ方法が当業者に理解されることを実証するために引用する。
【0081】
Furter, R., 1998. Expansion of the genetic code: Site-directed p-fluoro-phenylalanine incorporation in Escherichia coli. Protein Sci. 7:419-426.
Matthews D.R., Hosker J.P. 1989. Unbiased and flexible iterative computer program to achieve glucose clamping. Diabetes Care. 12: 156-9.
Merrifield, R.B., Vizioli, L.D., and Boman, H.G. 1982. Synthesis of the antibacterial peptide cecropin A (1-33). Biochemistry 21: 5020-5031.
Mirmira, R.G., and Tager, H.S. 1989. Role of the phenylalanine B24 side chain in directing insulin interaction with its receptor: Importance of main chain conformation. J. Biol. Chem. 264: 6349-6354. Sosnick, T.R., Fang, X., and Shelton, V.M. 2000. Application of circular dichroism to study RNA folding transitions. Methods Enzymol. 317: 393-409.
Wang, Z.X. 1995. An exact mathematical expression for describing competitive biding of two different ligands to a protein molecule FEBS Lett. 360: 111-114.
Weiss, M.A., Hua, Q.X., Jia, W., Chu, Y.C., Wang, R.Y., and Katsoyannis, P.G. 2000.
Hierarchiacal protein "un-design": insulin's intrachain disulfide bridge tethers a recognition α-helix. Biochemistry 39: 15429-15440.
Whittaker, J., and Whittaker, L. 2005. Characterization of the functional insulin binding epitopes of the full length insulin receptor. J. Biol. Chem. 280: 20932-20936.
Xie, J. and Schultz, P.G. 2005. An expanding genetic code. Methods. 36: 227-238.
【特許請求の範囲】
【請求項1】
塩素化フェニルアラニンを導入するB鎖ポリペプチドを有するインスリン類似体。
【請求項2】
請求項1に記載のインスリン類似体において、前記塩素化フェニルアラニンは、B24位に位置するものである、類似体。
【請求項3】
請求項2に記載のインスリン類似体において、前記塩素化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンである、類似体。
【請求項4】
請求項1〜3の何れかに記載のインスリン類似体において、前記類似体は、哺乳動物のインスリン類似体である、類似体。
【請求項5】
請求項4に記載のインスリン類似体において、前記類似体は、ヒトインスリンの類似体である、類似体。
【請求項6】
請求項4に記載のインスリン類似体において、前記B鎖ポリペプチドは、配列ID番号4〜8からなる群から選択されるアミノ酸配列と、3個或いはそれ以下の追加のアミノ酸置換を有するポリペプチドとを有するものである、類似体。
【請求項7】
請求項4に記載のインスリン類似体をコードする核酸。
【請求項8】
請求項6に記載の核酸において、前記塩化フェニルアラニンは、終止コドンによりコードされているものである、核酸。
【請求項9】
請求項7に記載の核酸において、前記終止コドンは、核酸配列TAGである、核酸。
【請求項10】
請求項7、8或いは9に記載の前記核酸配列を有する発現ベクター。
【請求項11】
請求項10記載の前記発現ベクターで形質転換された宿主細胞。
【請求項12】
患者を治療する方法であって、生理学的有効量のインスリン類似体或いはその生理学的に許容される塩を前記患者に投与する工程を有し、前記インスリン類似体或いはその生理学的に許容される塩は、塩化フェニルアラニンを導入するB鎖ポリペプチドを含有するものである、方法。
【請求項13】
請求項12に記載の方法において、前記塩化フェニルアラニンは、B24位に位置するものである、方法。
【請求項14】
請求項13に記載の方法において、前記塩化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンである、方法。
【請求項15】
請求項14に記載の方法において、前記B鎖ポリペプチドは、配列番号4〜8からなる群から選択されるアミノ酸配列と、その3個或いはそれ以下の追加のアミノ酸置換を有するポリペプチドとを有するものである、方法。
【請求項1】
塩素化フェニルアラニンを導入するB鎖ポリペプチドを有するインスリン類似体。
【請求項2】
請求項1に記載のインスリン類似体において、前記塩素化フェニルアラニンは、B24位に位置するものである、類似体。
【請求項3】
請求項2に記載のインスリン類似体において、前記塩素化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンである、類似体。
【請求項4】
請求項1〜3の何れかに記載のインスリン類似体において、前記類似体は、哺乳動物のインスリン類似体である、類似体。
【請求項5】
請求項4に記載のインスリン類似体において、前記類似体は、ヒトインスリンの類似体である、類似体。
【請求項6】
請求項4に記載のインスリン類似体において、前記B鎖ポリペプチドは、配列ID番号4〜8からなる群から選択されるアミノ酸配列と、3個或いはそれ以下の追加のアミノ酸置換を有するポリペプチドとを有するものである、類似体。
【請求項7】
請求項4に記載のインスリン類似体をコードする核酸。
【請求項8】
請求項6に記載の核酸において、前記塩化フェニルアラニンは、終止コドンによりコードされているものである、核酸。
【請求項9】
請求項7に記載の核酸において、前記終止コドンは、核酸配列TAGである、核酸。
【請求項10】
請求項7、8或いは9に記載の前記核酸配列を有する発現ベクター。
【請求項11】
請求項10記載の前記発現ベクターで形質転換された宿主細胞。
【請求項12】
患者を治療する方法であって、生理学的有効量のインスリン類似体或いはその生理学的に許容される塩を前記患者に投与する工程を有し、前記インスリン類似体或いはその生理学的に許容される塩は、塩化フェニルアラニンを導入するB鎖ポリペプチドを含有するものである、方法。
【請求項13】
請求項12に記載の方法において、前記塩化フェニルアラニンは、B24位に位置するものである、方法。
【請求項14】
請求項13に記載の方法において、前記塩化フェニルアラニンは、パラ−モノクロロ−フェニルアラニンである、方法。
【請求項15】
請求項14に記載の方法において、前記B鎖ポリペプチドは、配列番号4〜8からなる群から選択されるアミノ酸配列と、その3個或いはそれ以下の追加のアミノ酸置換を有するポリペプチドとを有するものである、方法。
【図1A】


【図1B】


【図1C】


【図1D】


【図1E】


【図2A】


【図2B】


【図2C】


【図3A】


【図3B】


【図3C】


【図3D】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図1B】


【図1C】


【図1D】


【図1E】


【図2A】


【図2B】


【図2C】


【図3A】


【図3B】


【図3C】


【図3D】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2013−513391(P2013−513391A)
【公表日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願番号】特願2012−543329(P2012−543329)
【出願日】平成22年12月13日(2010.12.13)
【国際出願番号】PCT/US2010/060085
【国際公開番号】WO2011/072288
【国際公開日】平成23年6月16日(2011.6.16)
【出願人】(500429332)ケース ウェスタン リザーブ ユニバーシティ (12)
【氏名又は名称原語表記】CASE WESTERN RESERVE UNIVERSITY
【Fターム(参考)】
【公表日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願日】平成22年12月13日(2010.12.13)
【国際出願番号】PCT/US2010/060085
【国際公開番号】WO2011/072288
【国際公開日】平成23年6月16日(2011.6.16)
【出願人】(500429332)ケース ウェスタン リザーブ ユニバーシティ (12)
【氏名又は名称原語表記】CASE WESTERN RESERVE UNIVERSITY
【Fターム(参考)】
[ Back to top ]

