増幅によるクラミジア・トラコマティスの分析およびクラミジア・トラコマティスの核酸の検出
【課題】 本発明は、患者においてクラミジア・トラコマティス(Chlamydia tra
chomatis)の存在の有無を決定する方法に関する。
【解決手段】 試験すべき試料中にChlamydia trachomatisが存在するかどうか
を特異的に決定するための増幅分析を実施するのに有用なC. trachomatisのltuB
遺伝子の1領域が同定されている。この遺伝子を用いて、好熱性鎖置換分析(t
SDA)反応を実施するのに有用なオリゴヌクレオチドを開示する。C. trachom
atisの全種に特異的であり、かつ他の微生物またはヒトDNAと交差反応性を示
さない分析に、開示されたオリゴヌクレオチドを使用することができる。
chomatis)の存在の有無を決定する方法に関する。
【解決手段】 試験すべき試料中にChlamydia trachomatisが存在するかどうか
を特異的に決定するための増幅分析を実施するのに有用なC. trachomatisのltuB
遺伝子の1領域が同定されている。この遺伝子を用いて、好熱性鎖置換分析(t
SDA)反応を実施するのに有用なオリゴヌクレオチドを開示する。C. trachom
atisの全種に特異的であり、かつ他の微生物またはヒトDNAと交差反応性を示
さない分析に、開示されたオリゴヌクレオチドを使用することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、患者においてクラミジア・トラコマティス(Chlamydia trachomatis
)の存在の有無を決定する方法に関する。本発明は、好ましくは鎖置換増幅(Stra
nd Displacement Amplification; SDA)、好熱性鎖置換増幅(thermophilic S
trand Displacement Amplification;tSDA)または蛍光リアルタイムtSD
Aの1つを使用して、特異的にChlamydia trachomatis ltuB核酸を増幅するため
の核酸プライマーを使用することを含む。
【背景技術】
【0002】
クラミジア・トラコマティス(Chlamydia trachomatis)は、トラコーマ(盲目
の最大の単一原因である)、封入体結膜炎、小児肺実質炎、尿道炎および性病性
リンパ肉芽腫の原因因子である。この微生物の診断および検出は、病理学的所見
または臨床所見に基づく場合が多く、単離技術および染色技術によって確認する
ことが可能である。
【0003】
C. trachomatisは、ltuBと呼ばれる遺伝子を含む。この遺伝子は、1995年
にHatchらによって発見された(Fahr et al., J. Bacteriol.177: 4252-4260 (1
995))。ltuB遺伝子は、2種の特異的なメッセンジャーRNA(T1およびT2
)の生成を行うことが判明した。この転写物は、網様体(reticulate body;RB
)から基本小体(elemental body; EB)にそれ自身を転換する細菌に関わる段
階特異的スイッチの間に、大量に合成されると決定された。網様体は、細菌の非
感染型であるのに対し、EBはその正反対(感染型)である。ltuB遺伝子は、両
mRNA転写物をコードし、T2はより大きいT1mRNAの転写後修飾物であ
ると考えられる。
【発明の概要】
【課題を解決するための手段】
【0004】
本発明は、クラミジア・トラコマティス(Chlamydia trachomatis)の特異的検
出および同定のための増幅プライマーおよびアッセイプローブとして有用なオリ
ゴヌクレオチドを提供する。特異的オリゴヌクレオチドは、ヒトDNAまたは他
の微生物のDNAについては、検出可能な増幅を殆どまたは全く伴わずに、C. t
rachomatisのltuB核酸を増幅するのに使用される。
【0005】
本発明のオリゴヌクレオチドは、生物を培養後、培養されたその生物の同定を
確認する手段として使用することが可能である。あるいは、このオリゴヌクレオ
チドは、既知の増幅方法を使用して、C. trachomatisを検出および同定するため
、培養前に、または培養の代わりに使用することが可能である。いずれの場合に
も、本発明のオリゴヌクレオチドおよび分析方法は、C.trachomatisと他の微生
物とを識別する手段を提供し、開業医は、慣例上頼みにする伝統的な手順を行使
しなくても、この微生物を迅速に同定することができる。感染に関与する特異的
病原体がこのように迅速に同定されると、適切な治療法の決定に使用することが
できる情報を短時間のうちに得ることができる。
【0006】
本願明細書では、下記の用語を次のように定義する。
増幅プライマーは、標的配列にハイブリッド形成後、プライマーの伸長によっ
て標的配列を増幅するためのプライマーである。一般に、増幅プライマーは長さ
約10〜75ヌクレオチドであり、好ましくは長さ約15〜50ヌクレオチドで
ある。SDA用の増幅プライマーの全長は、一般に約25〜50ヌクレオチドで
ある。SDA増幅プライマー(標的結合配列)の3'末端は、標的配列の5'末端
でハイブリッド形成する。標的結合配列は、長さ約10〜25ヌクレオチドであ
り、増幅プライマーにハイブリッド形成特異性を与える。SDA増幅プライマー
は、5'から標的結合配列に制限エンドヌクレアーゼ認識部位をさらに含む。G.
Walkerらが記載している通り(PNAS 89: 392-396 (1992)およびNucl. Acids Re
s. 20: 1691-1696 (1992))、認識部位が半修飾されているとき、認識部位はD
NA二重らせんの鎖1本にニックを入れる制限エンドヌクレアーゼ用である。S
DA中に増幅プライマーの残りにニックを入れて、置換するとき、5'から制限
エンドヌクレアーゼ認識部位のヌクレオチド(「尾部」)は、ポリメラーゼリプ
ライミング部位の役割をする。尾部ヌクレオチドのリプライミング機能によって
、SDA反応が維持され、1つの標的分子から複数アンプリコンを合成をするこ
とが可能になる。尾部は、一般に長さ約10〜25ヌクレオチドである。その長
さおよび配列は、一般に重要ではなく、ハイブリッド形成に望ましいTmを獲得
できるように、日常的に選択したり修飾したりすることができる。標的結合配列
は、その標的特異性を決定するプライマーの一部であるため、標的の末端に専用
の配列を必要としない増幅方法の場合、一般に、増幅プライマーは、本質的に標
的結合配列のみで構成される。ニック可能な制限エンドヌクレアーゼ認識部位お
よびSDAの尾部以外の標的に追加された専用の配列(たとえば、3SR、NA
SBAまたは転写に基づく増殖用のRNAポリメラーゼプロモーター)を必要と
する増幅方法では、ルーチンのオリゴヌクレオチド調製方法を使用して、プライ
マーのハイブリッド形成特異性を変えずに、必要とする専用の配列を標的結合配
列に連結させることが可能である。
【0007】
バンパープライマーまたは外部プライマーは、等温増幅反応においてプライマ
ー伸長生成物を置換するために使用される。このバンパープライマーは、バンパ
ープライマーの伸長が下流の増殖プライマーとその伸長生成物を置換するように
、増幅プライマーの上流の標的配列にアニールする。
【0008】
標的または標的配列という用語は、増幅すべき核酸配列を指す。これは、増幅
すべき最初の核酸配列、増幅すべき最初の核酸配列に相補的な第二の鎖および増
幅反応によって生成された最初の配列のコピーのいずれかの鎖を含む。これらの
コピーは、増幅プライマーがハイブリッド形成する対象である配列のコピーを含
むという理由で、増幅可能な標的の役割をする。
【0009】
増幅反応中に生じた標的配列のコピーは、増幅生成物、アンプリマー、または
アンプリコンと呼ばれる。
伸長生成物という用語は、プライマーのハイブリッド形成および標的配列を鋳
型として使用するポリメラーゼによるプライマーの伸長によって生じる標的配列
のコピーを指す。
【0010】
種特異的という用語は、同じ属の他種または異なる属の種では実質的に検出、
増幅またはオリゴヌクレオチドがハイブリッド形成されることのない、生物の種
または一群の関連種での検出、増幅またはオリゴヌクレオチドのハイブリッド形
成を指す。
アッセイプローブという用語は、核酸の検出または同定を容易にするために使
用されるオリゴヌクレオチドを指す。たとえば、本発明では、アッセイプローブ
は、C. trachomatisのltuB核酸の検出および同定に使用される。以下に記載の検
出用プローブ、検出用プライマー、捕捉プライマーおよびシグナルプライマーは
、アッセイプローブの例である。
【図面の簡単な説明】
【0011】
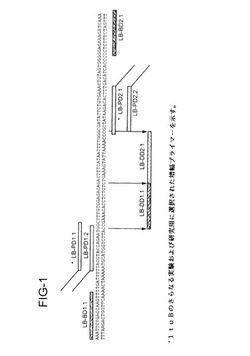
【図1】図1は、部分的ltuB配列を表し、かつtSDAに使用されたプライマー、バンパー、検出用配列の位置を示す。
【発明を実施するための形態】
【0012】
本発明は、核酸増幅反応においてクラミジア・トラコマティス(Chlamydia tra
chomatis)に特異性を示すオリゴヌクレオチド、増幅プライマーおよびアッセイ
プローブを提供する。本発明のオリゴヌクレオチドを使用して、C. trachomatis
のltuB核酸を検出および同定する方法も提供する。好ましい方法は、SDA、t
SDAまたは均一リアルタイム蛍光tSDA(homogeneous real time fluoresc
ent t SDA)を使用することである。以上の方法は、米国特許第5,547,86
1号、米国特許第5,648,211号、1997年5月30日に提出された米
国特許出願番号第08/865,675号、1997年5月13日に提出された
米国特許出願番号第08/855,085号により教示されており、この開示内
容は参照することにより本願明細書の一部とする。
【0013】
ライフサイクルの間のスイッチの間ににltuB遺伝子が果たす役割から、本発明
の発明者は、ltuB遺伝子は種特異的であるという仮説をたてた。データベース検
索を実施したが、ltuB遺伝子内の2つのオープンリーディングフレームによって
仮想上コードされているタンパク質については、陰性であった。ヒトDNAまた
は他の微生物DNAと交差反応性を示さない全てのChlamydia trachomatis抗原
型(serovars)において、この遺伝子を特異的に増幅する核酸プライマーを開発す
るために、この遺伝子を研究した。
【0014】
GenBankから入手可能なC. trachomatisのltuB遺伝子の配列に基づいて、プラ
イマーをデザインした。このプライマーを使用して、幾つかのC. trachomatis抗
原型のltuB遺伝子の配列を決定し、相同な遺伝子の同定を他種で試みた。tSD
A反応における特異性および感受性に関して、プライマーの様々な組み合わせを
試験した。
【0015】
核酸はハイブリッド形成に完全な相補性を必要としないため、本願明細書に開
示されているプローブ配列およびプライマー配列は、C. trachomatis特異的プロ
ーブおよびプライマーとしての有用性を喪失せずに、ある程度修飾できることが
理解されるであろう。当該技術で周知の通り、ハイブリッド形成条件(すなわち
、ハイブリッド形成温度または緩衝液の塩含有量)を調節してストリンジェンシ
ー(厳密性)を高めるかまたは低減させることにより、相補的な核酸配列および
部分的に相補的な核酸配列のハイブリッド形成を達成することが可能である。開
示された配列のこのような些細な修飾およびC. trachomatis特異性を維持するた
めに必要なハイブリッド形成条件の調節は、ルーチンの実験のみを必要とするも
のであり、かつ当該技術分野における通常の技術の範囲内である。
【0016】
本発明のプライマーを使用して製作した増幅生成物は、独特のサイズによって
たとえば、臭化エチジウムで染色したポリアクリルアミドゲルまたはアガロース
ゲル上で検出することが可能である。あるいは、検出可能な標識で標識したオリ
ゴヌクレオチドであるアッセイプローブを使用して、増幅されたC. trachomatis
のltuB遺伝子標的配列を検出することが可能である。1つの実施態様では、少な
くとも1つのアッセイプローブを、ハイブリッド形成(検出用プローブ)、Walk
er et al., Nucl. Acids Res.,前出に記載のハイブリッド形成および伸長(検出
用プライマー)、または欧州特許第0 678 582号に記載のハイブリッド形成、伸
長および二本鎖型への変換(シグナルプライマー)によって増幅された標的配列
の検出に使用することが可能である。好ましくは、アッセイプローブは、増幅プ
ライマーの間にある標的の配列にハイブリッド形成するように選択される、すな
わち、アッセイプローブは内部アッセイプローブでなければならない。あるいは
、増幅プライマーまたはその標的結合配列を、アッセイプローブとして使用する
ことが可能である。
【0017】
アッセイプローブの検出可能な標識は、標的核酸が存在する指標として、直接
または間接に検出することができる部分である。標識の直接検出の場合、アッセ
イプローブを放射性同位元素で標識してオートラジオグラフィーで検出するか、
または蛍光部分で標識して当該技術上周知の蛍光で検出することが可能である。
あるいは、アッセイプローブを検出可能にするために、別の試薬を必要とする標
識で標識することによって、アッセイプローブを間接的に検出することが可能で
ある。間接的に検出可能な標識としては、たとえば、化学発光剤、可視反応生成
物を生じる酵素および標識された特異的結合パートナー(たとえば、抗体または
抗原/ハプテン)に結合することによって、検出することが可能なリガンド(た
とえば、ハプテン、抗体または抗原)などがある。リガンドは、検出を容易にす
るために、リガンド−標識オリゴヌクレオチド(捕捉プローブ)を固相に固定す
るのにも有用である。特に有用な標識としては、ビオチン(標識されたアビジン
またはストレプトアビジンに結合することによって検出できる)および西洋ワサ
ビペルオキシダーゼやアルカリホスファターゼなどの酵素(酵素基質を加えて有
色反応生成物を生ずることによって検出できる)などがある。オリゴヌクレオチ
ドに、このような標識を加えたりこのような標識を含ませる方法は、当該技術上
公知であり、これらの方法のいずれも本発明で使用するのに適している。
【0018】
使用できる特異的検出方法の例としては、米国特許第5,470,723号に
記載されているビオチン化された捕捉プローブおよび酵素複合検出用プローブを
使用して、増幅生成物を検出する化学発光法がある。上記2つのアッセイプロー
ブを、標的配列のアッセイ領域の異なる部位(2つの増幅プライマーの結合部位
の間)にハイブリッド形成した後、捕捉プローブを使用して、この複合体をスト
レプトアビジンを被覆したマイクロタイタープレートに捕捉し、化学発光シグナ
ルを発生させて照度計で読む。増幅生成物を検出する他の方法として、欧州特許
第0 678 582号に記載のシグナルプライマーが、SDA反応に含まれていてもよ
い。この実施態様では、標識された二次増幅生成物がSDA中に標的増幅に依存
的に発生し、これを、関連標識を使用して標的増幅の目安として検出することが
できる。
【0019】
商業的に便利なため、C. trachomatisのltuB核酸の特異的検出および同定のた
めの増幅プライマーをキットの形で包装することが可能である。一般に、このよ
うなキットは、本発明による増幅プライマーを少なくとも1対含む。C. trachom
atisのltuB特異的増幅プライマーと共に、核酸増幅反応を実施するための試薬、
たとえば、緩衝液、別のプライマー、ヌクレオチド三リン酸、酵素なども含んで
もよい。キットの成分は、普通の容器内に一緒に包装されており、場合に応じて
、本発明の方法の個々の実施態様を実施するための説明書が入っている。他の任
意の成分、たとえば、アッセイプローブとして使用するのに適した標識で標識さ
れたオリゴヌクレオチド、および/または標識を検出するための試薬または手段
も、キットに含まれていてもよい。
【0020】
増幅プライマーおよび検出用配列の標的結合配列は、ハイブリッド形成の種特
異性をオリゴヌクレオチドに与えることができ、したがって、増幅反応に種特異
性を提供することができる。選択された増幅反応の実施に必要であれば、オリゴ
ヌクレオチドの種特異性を変えずに、他の配列を、本願明細書に開示されている
標的結合配列に任意に加えることが可能である。例として、本発明のC. trachom
atisのltuB特異的増幅プライマーは、SDA反応中にニックされる制限エンドヌ
クレアーゼBsoBIの認識部位を含んでもよい。欧州特許第0 684 315号に記載の認
識部位を含む他のニック可能な制限エンドヌクレアーゼ認識部位を、BsoBI認識
部位の代わりに用いてもよいことが当業者には明白であろうが、これに限定され
ない。好ましくは、認識部位は、好熱性SDA(tSDA)の条件下で増幅反応
を実施することができるように、好熱性制限エンドヌクレアーゼ用である。同様
に、増幅プライマーの尾部配列(5'から制限エンドヌクレアーゼ認識部位まで
)は、一般に重要ではないが、SDAに使用される制限部位および自身の標的結
合配列または他のプライマーのいずれかにハイブリッド形成する配列は、避けな
ければならない。したがって、SDAに有用な本発明の増幅プライマーは、3'
標的結合配列、ニック可能な制限エンドヌクレアーゼ認識部位5'から標的結合
配列まで、および長さ約10〜25ヌクレオチドの尾部配列から制限エンドヌク
レアーゼ認識部位までで構成される。ニック可能な制限エンドヌクレアーゼ認識
部位および尾部配列は、SDA反応に必要な配列である。他の増幅反応の場合、
本発明の増幅プライマーは、開示されている標的結合配列のみで構成されてもよ
く(たとえば、PCRの場合)、または標的結合配列と選択された増幅反応に必
要な別の配列(たとえば、上述のSDAに必要な配列または3SR用RNAポリ
メラーゼにより認識されるプロモーター)とで構成されてもよい。
【0021】
SDAでは、バンパープライマーは、下流の種特異的増殖プライマーを置換す
る機能を有するため、種特異性に不可欠ではない。バンパープライマーが伸長さ
れるとき、増幅プライマーとその伸長生成物を置換えるように、バンパープライ
マーが増幅プライマーから上流の標的にハイブリッド形成することのみが必要で
ある。したがって、バンパープライマーの個々の配列は、一般に重要ではなく、
バンパープライマーが伸長するとすぐに、増幅プライマー伸長生成物を置換でき
るほど、増幅プライマーの結合部位に十分に近い任意の上流標的配列から誘導す
ることが可能である。バンパープライマーが相変わらず特定の標的配列にハイブ
リッド形成できる限り、バンパープライマー配列における標的と時々ミスマッチ
であること、または非標的配列との若干の交差ハイブリッドを形成することは、
一般に、増幅効率に負の影響を及ぼさない。しかし、本願明細書に記載のバンパ
ープライマーはC. trachomatis特異的であり、したがって要望があれば、増幅プ
ライマーの標的結合配列としても使用される。
【0022】
本発明のプライマーを使用する増幅反応は、Walkerら、前出、による教示通り
、チミンを含んでもよく、あるいは、たとえば欧州特許第0 624 643号に教示さ
れている通りに、TTPの代わりに2'-デオキシウリジン5'-三リン酸を全体的に
または部分的に反応に用いて、次の増幅反応の交差汚染を減少させることが可能
である。dU(ウリジン)は増幅生成物中に組込まれるため、ウラシルDNAグ
ルコシラーゼ(UDG)処理によって切除できる。これらの非塩基性部位は、次
の増幅反応で増幅生成物を増幅可能でない状態にさせる。次の増幅を実施する前
に、ウラシルDNAグリコシラーゼインヒビター(Ugi)によってUDGを失活
させ、新たに形成された増幅生成物におけるdUの切除を防止することができる
。
【0023】
鎖置換増幅(Strand Displacement Amplification;SDA)は、プライマーの
伸長、半修飾制限エンドヌクレアーゼ認識/開裂部位のニッキング、1本鎖伸長
生成物の置換、プライマーの伸長生成物(または最初の標的配列)へのアニーリ
ング、および次のプライマーの伸長が反応混合物中で同時に起こる等温核酸増幅
法である。これは、反応の温度循環特性の結果として、反応の諸段階が不連続な
相または反応の温度サイクル的特徴の結果として周期サイクルで起こるPCRと
は異なる。SDAは、1)制限エンドヌクレアーゼが、ヘミホスホロチオエート
型の二本鎖認識/開裂部位の未修飾鎖をニックできること、2)あるポリメラー
ゼが、ニックで複製を開始し、下流の非鋳型鎖を置換できることに基づいている
。プライマーのアニーリングのために二本鎖標的配列を変性させるため、高温(
約95℃)で初回インキュベーション後、その後の重合および新たに合成された
鎖の置換は一定の温度で行われる。標的配列の各新しいコピーの生成は、5つの
段階で構成される。
【0024】
1)増幅プライマーを、最初の標的配列または予め重合させて置換した一本鎖
伸長生成物に結合させること、2)α−チオデオキシヌクレオシド三リン酸(α
−チオdNTP)を組み込む5'−3'エキソヌクレアーゼ欠損ポリメラーゼによ
るプライマーの伸長、3)半修飾二本鎖制限部位のニッキング、4)ニック部位
からの制限酵素の分離、および5)5'−3'エキソヌクレアーゼ欠損ポリメラー
ゼによる、ニックの3'末端からの伸長と、下流の新たに合成された鎖の置換。
ニックからの伸長によって別のニック可能な制限部位が発生するため、ニッキン
グ、重合および置換は一定の温度で同時にかつ連続的に起こる。一対の増幅プラ
イマーを使用し、その各々が二本鎖標的配列の2本の鎖のうちの1本にハイブリ
ッド形成するとき、増幅は指数関数的である。これは、センス鎖およびアンチセ
ンス鎖が、次の回の増幅で反対のプライマーの鋳型の役割を果たすためである。
増幅プライマーを1個使用するとき、鎖1本のみがプライマー伸長の鋳型の役割
をするため、増幅は直線的である。α−チオdNTPが組み込まれるとき、二本
鎖認識/開裂部位をニックする制限エンドヌクレアーゼの例は、HincII、HindII
、AvaI、NciIおよびFnu4HIである。以上の制限エンドヌクレアーゼ全てと、必要
なニッキング活性を示す他の制限エンドヌクレアーゼは、従来のSDAで使用す
るのに適している。しかし、これらは比較的熱に不安定であり、約40℃を超え
ると活性を失う傾向がある。
【0025】
標的配列を切断しないエンドヌクレアーゼで制限することによって、より大き
い核酸を断片化することにより、SDAによる増幅の標的を調製することが可能
である。しかし、Walkerら(Nuc. Acids Res. (1992)前出)および米国特許第5
,270,184号(参照することにより本願明細書の一部とする)に記載の通
りに、SDA反応におけるニッキング用に選択された制限エンドヌクレアーゼ認
識/開裂部位を有する標的核酸を調製することが、一般に好ましい。簡単に説明
すると、標的配列が二本鎖の場合、4種のプライマーが標的配列にハイブリッド
形成する。そのプライマーのうち2種(S1およびS2)はSDA増幅プライマー
であり、2種(B1およびB2)は外部プライマーまたはバンパープライマーであ
る。S1とS2は、標的配列に隣接する二本鎖核酸の反対の鎖に結合する。B1と
B2は、それぞれS1およびS2の標的配列5'(すなわち、上流)に結合する。3
種のデオキシヌクレオシド三リン酸および少なくとも1種の修飾されたデオキシ
ヌクレオシド三リン酸(たとえば、2'−デオキシアデノシン5'−O−(1−チオ
三リン酸)、「dATPαS」)が存在する条件下で、エキソヌクレアーゼ欠損
ポリメラーゼを使用して、4種のプライマー全てを同時に伸長させる。S1とS2
の伸長生成物は、それによりB1とB2の伸長により最初の標的配列鋳型から置換
される。置換された増幅プライマーの一本鎖伸長生成物は、反対の増幅プライマ
ーおよびバンパープライマーを結合する標的の役割をする(たとえば、S1の伸
長生成物はS2およびB2を結合する)。次の伸長および置換のサイクルで、各末
端に半修飾制限エンドヌクレアーゼ認識/開裂部位を有する2つの二本鎖核酸フ
ラグメントが生じる。これらは、SDAによる増幅に適した基質である。SDA
の場合と同様、標的生成反応の個々の段階は、同時に且つ連続的に起こり、SD
Aでの制限酵素によるニッキングに必要な末端に認識/開裂部位を有する標的配
列が生じる。SDA反応の成分の全てが既に標的生成反応に存在するため、自動
的且つ連続的に発生した標的配列は、SDAサイクルに入って増幅される。
【0026】
1つのSDA反応が別の増幅生成物によって交差汚染されるのを防止するため
に、増幅反応を阻害せずに、dTTPの代わりにdUTPをSDA増幅DNAに
組み込むことが可能である。UDGで処理することによって、ウラシル修飾核酸
を特異的に認識させ失活させることが可能である。したがって、先行反応でSD
A増幅DNAにdUTPが組み込まれる場合、二本鎖標的を増幅する前に、後続
のあらゆるSDA反応をUDGで処理し、以前の増幅反応由来のdU含有DNA
を増幅不可能にさせることができる。その後の反応で増幅すべき標的DNAは、
dUを含まず、UDG処理による影響を受けない。次に、標的を増幅する前にUg
iで処理することにより、UDGを阻害することが可能である。あるいは、UDGを
熱失活させてもよい。好熱性SDAでは、より高い反応温度そのもの(≧50℃
)を使用してUDG失活と標的の増幅を同時に行うことができる。
【0027】
SDAには、5'−3'エキソヌクレアーゼ活性がなく、二本鎖核酸の一本鎖ニ
ックにおいて重合を開始し、ニックの下流で鎖を置換すると同時に、非ニック鎖
を鋳型として使用して新しい相補鎖を生成するポリメラーゼが必要である。非結
合3'−OHにヌクレオチドを加えることによって、このポリメラーゼを伸長さ
せなければならい。SDA反応を最適化させるためには、ポリメラーゼが極めて
前進的であり、増幅することが可能な標的配列の長さを最大にすることが望まし
い。極めて前進的なポリメラーゼは、伸長生成物の分離および合成停止前に、か
なりの長さの新しい鎖を重合することができる。置換活性は、コピーのさらなる
合成に標的を利用できるようにし、指数関数的増幅反応で第二の増幅プライマー
をハイブリッド形成することが可能な対象である一本鎖伸長生成物を生成するた
め、増幅反応に置換活性は不可欠である。
【0028】
好熱性SDAは、望ましい熱安定なポリメラーゼおよび熱安定な制限エンドヌ
クレアーゼを置き換えて、Walkerら(PNASおよびNuc. Acids Res. (1992)前出)
に記載された従来のSDAと本質的に同様に実施される。もちろん、置換された
酵素に適したより高い温度に反応温度を調節し、HincII制限エンドヌクレアーゼ
認識/開裂部位を、選択された熱安定なエンドヌクレアーゼの適当な制限エンド
ヌクレアーゼ認識/開裂部位と置換する。また、Walkerらとは異なり、酵素が変
性温度で十分に安定であれば、初回変性段階の前に、開業医は反応混合物に酵素
を含めることが可能である。好熱性SDAで使用するのに好ましい制限エンドヌ
クレアーゼは、BsrI、BstNI、BsmAI、BslIおよびBsoBI (New England BioLabs
)、およびBstOI(Promega)である。好ましい好熱性ポリメラーゼは、Bca (Panv
era)およびBst (New England BioLabs)である。
【0029】
均一リアルタイム蛍光tSDA(homogeneous real time fluorescent tSDA)は
、tSDAの改良型である。この方法は検出用オリゴヌクレオチドを使用して、
蛍光消光を標的依存性様式で減少させる。検出用オリゴヌクレオチドは、標的の
非存在下で蛍光消光が起こるように結合されたドナー/アクセプター色素対を含
む。標的の存在下で検出用オリゴヌクレオチドの分子内塩基対二次構造が開いて
直線化すると、色素間の距離が増大し、蛍光消光が減少する。一般に、塩基対二
次構造を開くことは、二次構造が少なくとも部分的に崩壊されるような、二次構
造の配列と相補鎖との間の分子内塩基対形成を含む。塩基対二次構造は、十分な
長さの相補鎖の存在下で完全に直線化すると考えられる。好ましい実施態様で、
制限エンドヌクレアーゼ認識部位(restriction endonukulease recognition si
te;RERS)は2つの色素の間に存在し、二次構造と相補鎖との間の分子内塩
基対はRERSも二本鎖にして、制限エンドヌクレアーゼで開裂およびニック可
能にする。制限エンドヌクレアーゼによる開裂またはニッキングは、ドナー色素
とアクセプター色素を別個の核酸フラグメント上に分け、さらに消光を減少させ
る一因となる。いずれの実施態様でも、関連する蛍光パラメーターの変化(たと
えば、ドナー蛍光強度の増加、アクセプター蛍光強度の低減または展開前後の蛍
光の比率)を標的配列の存在の指標としてモニタリングする。一般にドナー蛍光
強度の変化は、アクセプター蛍光強度の変化よりも大きいため、ドナー蛍光強度
の変化をモニタリングすることが好ましい。蛍光寿命の変化など、他の蛍光パラ
メーターをモニタリングしてもよい。
【0030】
均一リアルタイム蛍光tSDA用の検出用オリゴヌクレオチドは、標的配列(
標的結合配列)にハイブリッド形成する一本鎖5'セクションまたは3'セクショ
ンを含むオリゴヌクレオチドであり、標的結合配列に隣接する分子内塩基対二次
構造である。本発明の検出用オリゴヌクレオチドは、二次構造が分子内塩基対形
成するとき蛍光が消え、二次構造が開いて直線化すると蛍光消光が減少するとい
う具合に、検出用オリゴヌクレオチドに結合したドナー/アクセプター色素対を
さらに含む。オリゴヌクレオチドの開裂は、DNA二重らせんの両鎖のホスホジ
エステル結合の破壊または一本鎖DNAのホスホジエステル結合の破壊を指す。
これは、DNA二重らせんの鎖2本のうちの1本のみのホスホジエステル結合の
破壊を指すニッキングとは違う。
【0031】
均一リアルタイム蛍光tSDA用の発明の検出用オリゴヌクレオチドは、プラ
イマー伸長またはハイブリッド形成のために選択された反応条件で分子内塩基対
二次構造を形成する配列を含む。この二次構造は、標的結合配列の少なくとも一
部が一本鎖3'尾部または5'尾部を形成するように、検出オリゴヌクレオチドの
標的結合配列に隣接して位置する。本願明細書で使用されるとき、「標的結合配
列に隣接した」という用語は、標的結合配列の全部または一部が、標的へのハイ
ブリッド形成に利用できる5'尾部または3'尾部中に一本鎖のまま残されること
を意味する。すなわち、二次構造は標的結合配列全体を含まない。標的結合配列
の一部が二次構造の分子内塩基対形成に含まれてもよく、二次構造の分子内塩基
対形成に含まれる第1の配列の全部または一部を含んでもよいが、その相補的配
列内に伸長しないことが好ましい。たとえば、二次構造がステム・ループ構造(
たとえば、「ヘアピン」)であり、検出用オリゴヌクレオチドの標的結合配列が
一本鎖3'尾部として存在する場合、標的結合配列もステムの第1アームの全部
または一部、および場合に応じて、ループの全部または一部に伸長してもよい。
しかし、標的結合配列は、ステム分子内塩基対形成に関与する配列の第2アーム
内に伸長しないことが好ましい。すなわち、標的にハイブリッド形成することが
できる二次構造の分子内塩基対形成に関与する両配列を具有しないことが望まし
い。検出用オリゴヌクレオチド二次構造の分子内塩基対部分のミスマッチは、標
的の存在下で蛍光の変化の大きさを低減させるが、分析の感度が問題でなければ
、容認できる。一本鎖尾部の標的結合配列のミスマッチも容認できるが、同様に
分析の感度および/または特異性が低減する可能性がある。しかし、二次構造と
標的結合配列の両者における完全な塩基対形成が反応を犠牲にしないことが本発
明の特徴である。ハイブリッド形成に関与する配列が完全にマッチすると、反応
速度論に負の影響を及ぼすことなく、分析の特異性が向上する。
【0032】
本発明の検出用オリゴヌクレオチドを増幅反応に加えると、増幅プライマーの
ハイブリッド形成および伸長によって二本鎖型に変換される。ポリメラーゼによ
る鎖置換も二次構造を開いたり直線化したりし、相補鎖の合成によってこれを二
本鎖型に変換する。RERSは、存在すれば、二本鎖となり、且つ制限エンドヌ
クレアーゼで開裂可能またはニック可能になる。ポリメラーゼの鎖置換活性によ
って二次構造が開かれたり、直線化されたりすると、ドナー色素とアクセプター
色素として、モニタリングしたり検出したりすることが可能である。一般に、R
ERSが開裂またはニックすると、二本鎖二次増幅生成物の別々のフラグメント
が2個生じ、各々に2種の色素のうちの1種が結合しているため、蛍光の変化の
大きさがさらに増大する。このフラグメントは反応溶液中で自由に拡散でき、ド
ナー/アクセプター対の色素間の距離がさらに増大する。ドナー蛍光強度の増大
またはアクセプター蛍光強度の低減は、標的増幅が起こっているまたは起こった
指標として、検出および/またはモニタリングすることができるが、ドナー/ア
クセプター色素対の近接によって影響を受ける他の蛍光パラメータもモニタリン
グすることが可能である。ドナーまたはアクセプターの蛍光強度の変化も、ドナ
ーおよび/またはアクセプター蛍光強度の比率の変化として検出することが可能
である。たとえば、a)二次構造を直線化または開いた後のドナー発蛍光団蛍光
と、直線化または開く前の検出用オリゴヌクレオチドにおけるドナー発蛍光団蛍
光との比率の増加、またはb)直線化または開く後のアクセプター色素蛍光と、
直線化または開く前の検出用オリゴヌクレオチドにおけるアクセプター色素蛍光
との比率の低減として、蛍光強度の変化を検出することが可能である。
【0033】
SDAのほかにも、本発明の検出用オリゴヌクレオチドは、他のプライマー伸
長増幅方法(たとえば、PCR、3SR、TMAまたはNASBA)におけるシ
グナルプライマー用に改変することが可能である。たとえば、PCR増幅プライ
マーおよび5'→3'エキソヌクレアーゼ活性のない鎖置換DNAポリメラーゼ(
たとえば、PrimegaのSequencing Grade TaqまたはNew England BioLabsのexo-Ve
ntまたはexo-Deep VentをPCRで使用することによって、この方法をPCR用
に改変することが可能である。検出用オリゴヌクレオチドシグナルプライマーは
、PCR増幅プライマーから下流の標的にハイブリッド形成し、置換されて、本
質的にSDAに関する記載と同様に二本鎖になる。一般に、RERSの開裂より
むしろニッキングを誘導すると考えられる修飾されたデオキシヌクレオシド三リ
ン酸が全く存在しないため、PCRでは、場合に応じて検出用オリゴヌクレオチ
ド用RERSを選択することが可能である。温度周期はPCRによる増幅の特徴
であるため、制限エンドヌクレアーゼは、最終周期のプライマーアニーリングお
よび増幅のエンドポイント検出のための伸長の後に低温で加えることが好ましい
。しかし、PCR反応の高温相を通して活性のままである好熱性制限エンドヌク
レアーゼは、増幅中ずっと存在することができ、リアルタイムアッセイを実施す
ることが可能である。SDAシステムの場合と同様、二次構造の直線化および色
素対の分離によって蛍光消光が低減し、強度などの蛍光パラメータの変化は標的
増幅の指標の役割をする。
【0034】
検出用オリゴヌクレオチドを開くことまたは検出用オリゴヌクレオチドの直線
化に起因する蛍光の変化は、選択された反応のエンドポイントで検出することが
可能である。しかし、直線化された二次構造はハイブリッド形成およびプライマ
ー伸長と同時に生じるため、反応が起こるにつれて、すなわち「リアルタイム」
に、蛍光の変化もモニタリングすることが可能である。この均一リアルタイムア
ッセイフォーマットを使用して、存在する標的の初期量に関する半定量的または
定量的情報を提供することができる。たとえば、(標的増幅の一部として、また
は非増幅検出方法で)塩基対を開く反応中または直線化する反応中に蛍光強度が
変化する速度は、初期標的レベルの指標である。結果として、存在する標的配列
の初期コピーが多いほど、ドナー蛍光は選択された閾値に速やかに(すなわち、
短時間で確実に)達する。同様に、アクセプター蛍光の減少は短時間で確実に達
し、選択された最小値に達するのに要する時間として検出される。さらに、反応
経過中の蛍光パラメータの変化の速度は、初期標的含有量が少ない試料よりも初
期標的含有量が多い試料で迅速である(すなわち、上昇勾配の蛍光曲線)。当該
技術上周知の通り、これらの測定または他の測定を、標的が存在する指標として
、あるいは標的増幅の指標として行うことができる。一般に、標的の初期量は、
実験結果と既知量の標的の結果とを比較することによって決定される。
【0035】
本発明の方法による選択された標的配列の存在の分析は、溶液または固相で実
施することができる。検出用オリゴヌクレオチドがプライマーの役割をするリア
ルタイムまたはエンドポイント均一アッセイは、一般に溶液で行われる。本発明
の検出用オリゴヌクレオチドを使用するハイブリッド形成アッセイは、溶液でも
実施することが可能である(たとえば、均一リアルタイムアッセイとして)が、
標的のリアルタイム検出またはエンドポイント検出のための固相分析に特に適し
ている。固相分析では、当該技術上周知の方法を使用した内部標識または末端標
識によって検出用オリゴヌクレオチドを固相(たとえば、ビーズ、膜または反応
容器)に固定することが可能である。たとえば、ビオチン標識検出用オリゴヌク
レオチドをアビジンで修飾した固相に固定することが可能であり、この場合、適
切なハイブリッド形成条件で標的に曝露したとき蛍光を変化させる。この様式で
標識を捕捉すると、試料から標的を分離することが容易になり、シグナルの検出
または分析の他の局面を妨害する可能性がある試料中の物質を除去することがで
きる。
【0036】
以下の実施例は、本願明細書に記載の本発明の詳細な実施例を示す。当業者に
は明白であろうが、様々な変化および修正が可能であり、様々な変化および修正
は記載されている本発明の範囲内であると考えられる。
【実施例】
【0037】
実施例1
ltuBを基礎とするプライマーの特異性および交差反応性の初期分析
GeneworksTMソフトウエアプログラムを使用してGenBank/EMBLデータベースで
最初のltuB配列を発見した。C. trachomatis LGV II抗原型から寄託された配列
(CHTLTUB)を得た。ltuB遺伝子をコードするゲノムのセクションに隣接
し、その内に位置する一連のプライマー(たとえば、ltuB-1およびltuB-2)をデ
ザインした。ltuB遺伝子のオープンリーディングフレーム内に位置する別のプラ
イマーを設計した。これらのプライマーを実験で使用して、様々なC. trachomat
is抗原型および交差反応物であるC. psittaciおよびC. pneumoniaeのゲノムに由
来するltuB領域を増幅した。使用したプライマーは次の通りであった。
【0038】
ltuB-1 5'-CCACTTCCAGAAATTGACA-3'(配列番号1)
ltuB-2 5'-GCAATATAGAGGGATAACG-3'(配列番号2)
ltuB-3 5'-CGTACCAGAATGGCTTTG-3'(配列番号3)
ltuB-4 5'-CAAAGCCATTCTGGTAG-3'(配列番号4)
ltuB-5 5'-AAGAAGCAGTCGCAAGCT-3'(配列番号5)
ltuB-6 5'-AAAGTGCATCTCTGTAGC-3'(配列番号6)
【0039】
部分的ltuB(CHTLTUB)配列およびプライマーの位置を図1に示す。上
記プライマーを使用した増幅を実施し、その結果を表1に示す。試験したC. tra
chomatisの株全てが陽性の結果を示したが、C. psittaciおよびC. pneumoniaeは
陰性の結果を示した。これらの最初の結果から、ltuB遺伝子はC. trachomatis特
異的種であり得ることがわかる。
【0040】
【表1】

【0041】
実施例2
数種のC. trachomatisの抗原型におけるltuBの配列決定およびltuB tSDAシステ
ムのデザイン
実施例1で得られた増幅生成物を精製し、さらに増幅してから配列を決定した
。フランキングプライマーと内部プライマー(図1に表示)の組み合わせを使用
して、C. trachomatis6種のltuB遺伝子の全配列を得た。この中には、抗原型A
、C、D、E、HおよびL3が含まれていた。
tSDAに有益と思われる潜在的領域についてこの配列のアラインメント配列
を試験し、tSDAプライマーセット用のセクションを選択した。特定のプライ
マーセットを使用すべきかどうかを決定する際に、OligoTMソフトウエアプログ
ラムを使用した。このソフトウエアプログラムを使用すると、特定のtSDAシ
ステムを構成するプライマー全部の間の相互作用を決定することが可能である。
試験用に選択されたtSDAプライマー全ての名称および配列は、以下の通りで
あった。
【0042】
上流プライマー
LB-PD1.1 5'-ACCGCATCGAATGCATGTCTCGGGTTACGTACCAGAATGG-3' (配列番号7)
LB-PD1.2 5'-ACCGCATCGAATGCATGTCTCGGGTTACGTACCAGAATG-3' (配列番号8)
下流プライマー
LB-PD2.1 5'-CGATTCCGCTCCAGACTTCTCGGGTTCACAGAATATCGCC-3' (配列番号9)
LB-PD2.2 5'-CGATTCCGCTCCAGACTTCTCGGGTTCACAGAATATCGC-3' (配列番号10)
バンパー
BD1.1 5'-AAATTCTGACCAAGTT-3' (配列番号11)
BD2.1 5'-TTTGATCTTTCTCCC-3' (配列番号12)
検出用配列1
DD1.1 5'-GGCTTTGTGGAGACA-3' (配列番号13)
検出用配列2
DD2.1 5'-GACTTTCATAATTTTGG-3' (配列番号14)
プライマー、バンパーおよび検出用配列のデザインおよび位置を図1に示す。
【0043】
実施例3
ltuBシステムを用いたtSDAの反応条件の最適化
典型的なtSDA反応で、以下の成分、すなわち、グリセロール、DMSO、
リン酸カリウムおよびヒトDNAと共に標的DNAを試験管に加えた。この混合
物を温浴中で2〜5分間沸騰させた。試料を45℃のサーモロックに移し、以下
のものを含む除染混合物を加えた。すなわち、リン酸カリウム、dGTP、dC
TP、dATP、プライマー、DTT、BSA、トレハロース、酢酸マグネシウ
ムおよびUDGを加えた。試料を30分間インキュベートし、52℃または54
℃のサーモロックブロックに移した。リン酸カリウム、dUTP、DTT、BS
A、トレハロース、酢酸マグネシウム、UDI、BsoBIおよびBstを含有する増幅
混合物を加えた。再び試料を30分間インキュベートした。反応は全て、5分間
煮沸することによって停止させた。プライマー伸長反応を使用し、末端標識32P
検出用プローブを用いて増幅反応の生成物を検出した。アクリルアミドシークエ
ンシングゲルを用いて、検出された生成物を分子量で分離し、X線フィルムを使
用してこれを感光させ、併せてMolecular Dynamics Phosphoimagerを使用して、
走査した。
増幅プライマーの異なる組み合わせが生成物に及ぼす影響を試験するためのス
クリーニング実験をデザインした。リン酸カリウム(25mMまたは35mM)、D
MSO(3%または8%)、グリセロール(3.5%または7%)、ヒトDNA
(650ngまたは1250ng)の濃度、および温度(52℃または54℃)の影
響を試験する多数のtSDAバッファー組み合わせを使用して、これを実施した
。tSDAシステムの他の成分は全て一定に保った。プライマー/プライマー組
み合わせに関連した上記パラメーターの全ての様々な組み合わせを試験するため
に、統計学的にデザインした実験を実施した。試験した条件の中で、最良の結果
が得られた一組の条件は表2の通りであった。
【0044】
【表2】

【0045】
実施例4
ltuBの感度検定
ltuBシステムの感度を試験するために、1×106ゲノム/5μLから下は1ゲ
ノム/5μLまで C. trachomatisのLGV IIの段階希釈液を調製した。検出限界実
験でこの標的DNAの滴定を使用した。650ng/反応と120 ng/反応の2種の
ヒトDNAレベルでltuBのtSDAシステムを用いて滴定パネルを試験した。こ
の実験に用いたtSDA条件は、実施例3に記載の最適条件と同じであった。1
×106ゲノム/反応、1×105ゲノム/反応および1×104ゲノム/反応の
量を単一試料で試験し、1×103ゲノム/反応を二重に試験し、100、10
および1ゲノム/反応を三重に試験した。ネガティブコントロールも含めた。1
つの試料における増幅の欠如がシステムの感度を示すと考えないことを確実にす
るために、コピー数が少ないC. trachomatisゲノムを複数の反応で試験する方法
を実施した。実験結果から、初期感度は下は1×102ゲノム/50uL反応に至
ることがわかる。
【0046】
実施例5
ltuBシステムの交差反応性および特異性の拡張分析
ltuBのtSDAシステム用の交差反応性/特異性実験をデザインした。実施例
3に記載の最適条件を使用して、標準tSDA反応を実施した。試験した微生物
のパネルは、C. trachomatis抗原型および多数の交差反応物で構成されていた。
C. trachomatisの各々を1×104ゲノムで試験した。交差反応物DNAを、1
×107ゲノムで各々試験した。C. trachomatis試料は個々に試験したが、交差
反応物は反応当たり3〜4種のプールで試験した。交差反応物プール内に増幅が
欠如しているのは、ltuBシステムの特異性に起因するものであって、tSDAの
インヒビターが原因ではないことを決定するために、各プールに1×104ゲノ
ムのC. trachomatis(株LGV II)をスパイクし、コントロールと同様に試験した
。結果を表3および表4に示す。LtuBのtSDAシステムで各C. trachomatis抗
原型は増幅について陽性であった。また、交差反応物細菌プールは、どれも検出
可能な増幅が起こらず、PGV IIをスパイクした各プールは、適当なサイズの増幅
生成物を産生した。
【0047】
【表3】

【0048】
【表4】

【0049】
本発明をかなり具体的に説明してきたが、当業者に明白な修正は、本発明の範
囲から逸脱せずに行うことが可能である。
添付の図面と一緒に読むと、以上の詳細な説明から本発明の様々な目的、長所
および斬新な特徴が容易に理解できるであろう。
【技術分野】
【0001】
本発明は、患者においてクラミジア・トラコマティス(Chlamydia trachomatis
)の存在の有無を決定する方法に関する。本発明は、好ましくは鎖置換増幅(Stra
nd Displacement Amplification; SDA)、好熱性鎖置換増幅(thermophilic S
trand Displacement Amplification;tSDA)または蛍光リアルタイムtSD
Aの1つを使用して、特異的にChlamydia trachomatis ltuB核酸を増幅するため
の核酸プライマーを使用することを含む。
【背景技術】
【0002】
クラミジア・トラコマティス(Chlamydia trachomatis)は、トラコーマ(盲目
の最大の単一原因である)、封入体結膜炎、小児肺実質炎、尿道炎および性病性
リンパ肉芽腫の原因因子である。この微生物の診断および検出は、病理学的所見
または臨床所見に基づく場合が多く、単離技術および染色技術によって確認する
ことが可能である。
【0003】
C. trachomatisは、ltuBと呼ばれる遺伝子を含む。この遺伝子は、1995年
にHatchらによって発見された(Fahr et al., J. Bacteriol.177: 4252-4260 (1
995))。ltuB遺伝子は、2種の特異的なメッセンジャーRNA(T1およびT2
)の生成を行うことが判明した。この転写物は、網様体(reticulate body;RB
)から基本小体(elemental body; EB)にそれ自身を転換する細菌に関わる段
階特異的スイッチの間に、大量に合成されると決定された。網様体は、細菌の非
感染型であるのに対し、EBはその正反対(感染型)である。ltuB遺伝子は、両
mRNA転写物をコードし、T2はより大きいT1mRNAの転写後修飾物であ
ると考えられる。
【発明の概要】
【課題を解決するための手段】
【0004】
本発明は、クラミジア・トラコマティス(Chlamydia trachomatis)の特異的検
出および同定のための増幅プライマーおよびアッセイプローブとして有用なオリ
ゴヌクレオチドを提供する。特異的オリゴヌクレオチドは、ヒトDNAまたは他
の微生物のDNAについては、検出可能な増幅を殆どまたは全く伴わずに、C. t
rachomatisのltuB核酸を増幅するのに使用される。
【0005】
本発明のオリゴヌクレオチドは、生物を培養後、培養されたその生物の同定を
確認する手段として使用することが可能である。あるいは、このオリゴヌクレオ
チドは、既知の増幅方法を使用して、C. trachomatisを検出および同定するため
、培養前に、または培養の代わりに使用することが可能である。いずれの場合に
も、本発明のオリゴヌクレオチドおよび分析方法は、C.trachomatisと他の微生
物とを識別する手段を提供し、開業医は、慣例上頼みにする伝統的な手順を行使
しなくても、この微生物を迅速に同定することができる。感染に関与する特異的
病原体がこのように迅速に同定されると、適切な治療法の決定に使用することが
できる情報を短時間のうちに得ることができる。
【0006】
本願明細書では、下記の用語を次のように定義する。
増幅プライマーは、標的配列にハイブリッド形成後、プライマーの伸長によっ
て標的配列を増幅するためのプライマーである。一般に、増幅プライマーは長さ
約10〜75ヌクレオチドであり、好ましくは長さ約15〜50ヌクレオチドで
ある。SDA用の増幅プライマーの全長は、一般に約25〜50ヌクレオチドで
ある。SDA増幅プライマー(標的結合配列)の3'末端は、標的配列の5'末端
でハイブリッド形成する。標的結合配列は、長さ約10〜25ヌクレオチドであ
り、増幅プライマーにハイブリッド形成特異性を与える。SDA増幅プライマー
は、5'から標的結合配列に制限エンドヌクレアーゼ認識部位をさらに含む。G.
Walkerらが記載している通り(PNAS 89: 392-396 (1992)およびNucl. Acids Re
s. 20: 1691-1696 (1992))、認識部位が半修飾されているとき、認識部位はD
NA二重らせんの鎖1本にニックを入れる制限エンドヌクレアーゼ用である。S
DA中に増幅プライマーの残りにニックを入れて、置換するとき、5'から制限
エンドヌクレアーゼ認識部位のヌクレオチド(「尾部」)は、ポリメラーゼリプ
ライミング部位の役割をする。尾部ヌクレオチドのリプライミング機能によって
、SDA反応が維持され、1つの標的分子から複数アンプリコンを合成をするこ
とが可能になる。尾部は、一般に長さ約10〜25ヌクレオチドである。その長
さおよび配列は、一般に重要ではなく、ハイブリッド形成に望ましいTmを獲得
できるように、日常的に選択したり修飾したりすることができる。標的結合配列
は、その標的特異性を決定するプライマーの一部であるため、標的の末端に専用
の配列を必要としない増幅方法の場合、一般に、増幅プライマーは、本質的に標
的結合配列のみで構成される。ニック可能な制限エンドヌクレアーゼ認識部位お
よびSDAの尾部以外の標的に追加された専用の配列(たとえば、3SR、NA
SBAまたは転写に基づく増殖用のRNAポリメラーゼプロモーター)を必要と
する増幅方法では、ルーチンのオリゴヌクレオチド調製方法を使用して、プライ
マーのハイブリッド形成特異性を変えずに、必要とする専用の配列を標的結合配
列に連結させることが可能である。
【0007】
バンパープライマーまたは外部プライマーは、等温増幅反応においてプライマ
ー伸長生成物を置換するために使用される。このバンパープライマーは、バンパ
ープライマーの伸長が下流の増殖プライマーとその伸長生成物を置換するように
、増幅プライマーの上流の標的配列にアニールする。
【0008】
標的または標的配列という用語は、増幅すべき核酸配列を指す。これは、増幅
すべき最初の核酸配列、増幅すべき最初の核酸配列に相補的な第二の鎖および増
幅反応によって生成された最初の配列のコピーのいずれかの鎖を含む。これらの
コピーは、増幅プライマーがハイブリッド形成する対象である配列のコピーを含
むという理由で、増幅可能な標的の役割をする。
【0009】
増幅反応中に生じた標的配列のコピーは、増幅生成物、アンプリマー、または
アンプリコンと呼ばれる。
伸長生成物という用語は、プライマーのハイブリッド形成および標的配列を鋳
型として使用するポリメラーゼによるプライマーの伸長によって生じる標的配列
のコピーを指す。
【0010】
種特異的という用語は、同じ属の他種または異なる属の種では実質的に検出、
増幅またはオリゴヌクレオチドがハイブリッド形成されることのない、生物の種
または一群の関連種での検出、増幅またはオリゴヌクレオチドのハイブリッド形
成を指す。
アッセイプローブという用語は、核酸の検出または同定を容易にするために使
用されるオリゴヌクレオチドを指す。たとえば、本発明では、アッセイプローブ
は、C. trachomatisのltuB核酸の検出および同定に使用される。以下に記載の検
出用プローブ、検出用プライマー、捕捉プライマーおよびシグナルプライマーは
、アッセイプローブの例である。
【図面の簡単な説明】
【0011】
【図1】図1は、部分的ltuB配列を表し、かつtSDAに使用されたプライマー、バンパー、検出用配列の位置を示す。
【発明を実施するための形態】
【0012】
本発明は、核酸増幅反応においてクラミジア・トラコマティス(Chlamydia tra
chomatis)に特異性を示すオリゴヌクレオチド、増幅プライマーおよびアッセイ
プローブを提供する。本発明のオリゴヌクレオチドを使用して、C. trachomatis
のltuB核酸を検出および同定する方法も提供する。好ましい方法は、SDA、t
SDAまたは均一リアルタイム蛍光tSDA(homogeneous real time fluoresc
ent t SDA)を使用することである。以上の方法は、米国特許第5,547,86
1号、米国特許第5,648,211号、1997年5月30日に提出された米
国特許出願番号第08/865,675号、1997年5月13日に提出された
米国特許出願番号第08/855,085号により教示されており、この開示内
容は参照することにより本願明細書の一部とする。
【0013】
ライフサイクルの間のスイッチの間ににltuB遺伝子が果たす役割から、本発明
の発明者は、ltuB遺伝子は種特異的であるという仮説をたてた。データベース検
索を実施したが、ltuB遺伝子内の2つのオープンリーディングフレームによって
仮想上コードされているタンパク質については、陰性であった。ヒトDNAまた
は他の微生物DNAと交差反応性を示さない全てのChlamydia trachomatis抗原
型(serovars)において、この遺伝子を特異的に増幅する核酸プライマーを開発す
るために、この遺伝子を研究した。
【0014】
GenBankから入手可能なC. trachomatisのltuB遺伝子の配列に基づいて、プラ
イマーをデザインした。このプライマーを使用して、幾つかのC. trachomatis抗
原型のltuB遺伝子の配列を決定し、相同な遺伝子の同定を他種で試みた。tSD
A反応における特異性および感受性に関して、プライマーの様々な組み合わせを
試験した。
【0015】
核酸はハイブリッド形成に完全な相補性を必要としないため、本願明細書に開
示されているプローブ配列およびプライマー配列は、C. trachomatis特異的プロ
ーブおよびプライマーとしての有用性を喪失せずに、ある程度修飾できることが
理解されるであろう。当該技術で周知の通り、ハイブリッド形成条件(すなわち
、ハイブリッド形成温度または緩衝液の塩含有量)を調節してストリンジェンシ
ー(厳密性)を高めるかまたは低減させることにより、相補的な核酸配列および
部分的に相補的な核酸配列のハイブリッド形成を達成することが可能である。開
示された配列のこのような些細な修飾およびC. trachomatis特異性を維持するた
めに必要なハイブリッド形成条件の調節は、ルーチンの実験のみを必要とするも
のであり、かつ当該技術分野における通常の技術の範囲内である。
【0016】
本発明のプライマーを使用して製作した増幅生成物は、独特のサイズによって
たとえば、臭化エチジウムで染色したポリアクリルアミドゲルまたはアガロース
ゲル上で検出することが可能である。あるいは、検出可能な標識で標識したオリ
ゴヌクレオチドであるアッセイプローブを使用して、増幅されたC. trachomatis
のltuB遺伝子標的配列を検出することが可能である。1つの実施態様では、少な
くとも1つのアッセイプローブを、ハイブリッド形成(検出用プローブ)、Walk
er et al., Nucl. Acids Res.,前出に記載のハイブリッド形成および伸長(検出
用プライマー)、または欧州特許第0 678 582号に記載のハイブリッド形成、伸
長および二本鎖型への変換(シグナルプライマー)によって増幅された標的配列
の検出に使用することが可能である。好ましくは、アッセイプローブは、増幅プ
ライマーの間にある標的の配列にハイブリッド形成するように選択される、すな
わち、アッセイプローブは内部アッセイプローブでなければならない。あるいは
、増幅プライマーまたはその標的結合配列を、アッセイプローブとして使用する
ことが可能である。
【0017】
アッセイプローブの検出可能な標識は、標的核酸が存在する指標として、直接
または間接に検出することができる部分である。標識の直接検出の場合、アッセ
イプローブを放射性同位元素で標識してオートラジオグラフィーで検出するか、
または蛍光部分で標識して当該技術上周知の蛍光で検出することが可能である。
あるいは、アッセイプローブを検出可能にするために、別の試薬を必要とする標
識で標識することによって、アッセイプローブを間接的に検出することが可能で
ある。間接的に検出可能な標識としては、たとえば、化学発光剤、可視反応生成
物を生じる酵素および標識された特異的結合パートナー(たとえば、抗体または
抗原/ハプテン)に結合することによって、検出することが可能なリガンド(た
とえば、ハプテン、抗体または抗原)などがある。リガンドは、検出を容易にす
るために、リガンド−標識オリゴヌクレオチド(捕捉プローブ)を固相に固定す
るのにも有用である。特に有用な標識としては、ビオチン(標識されたアビジン
またはストレプトアビジンに結合することによって検出できる)および西洋ワサ
ビペルオキシダーゼやアルカリホスファターゼなどの酵素(酵素基質を加えて有
色反応生成物を生ずることによって検出できる)などがある。オリゴヌクレオチ
ドに、このような標識を加えたりこのような標識を含ませる方法は、当該技術上
公知であり、これらの方法のいずれも本発明で使用するのに適している。
【0018】
使用できる特異的検出方法の例としては、米国特許第5,470,723号に
記載されているビオチン化された捕捉プローブおよび酵素複合検出用プローブを
使用して、増幅生成物を検出する化学発光法がある。上記2つのアッセイプロー
ブを、標的配列のアッセイ領域の異なる部位(2つの増幅プライマーの結合部位
の間)にハイブリッド形成した後、捕捉プローブを使用して、この複合体をスト
レプトアビジンを被覆したマイクロタイタープレートに捕捉し、化学発光シグナ
ルを発生させて照度計で読む。増幅生成物を検出する他の方法として、欧州特許
第0 678 582号に記載のシグナルプライマーが、SDA反応に含まれていてもよ
い。この実施態様では、標識された二次増幅生成物がSDA中に標的増幅に依存
的に発生し、これを、関連標識を使用して標的増幅の目安として検出することが
できる。
【0019】
商業的に便利なため、C. trachomatisのltuB核酸の特異的検出および同定のた
めの増幅プライマーをキットの形で包装することが可能である。一般に、このよ
うなキットは、本発明による増幅プライマーを少なくとも1対含む。C. trachom
atisのltuB特異的増幅プライマーと共に、核酸増幅反応を実施するための試薬、
たとえば、緩衝液、別のプライマー、ヌクレオチド三リン酸、酵素なども含んで
もよい。キットの成分は、普通の容器内に一緒に包装されており、場合に応じて
、本発明の方法の個々の実施態様を実施するための説明書が入っている。他の任
意の成分、たとえば、アッセイプローブとして使用するのに適した標識で標識さ
れたオリゴヌクレオチド、および/または標識を検出するための試薬または手段
も、キットに含まれていてもよい。
【0020】
増幅プライマーおよび検出用配列の標的結合配列は、ハイブリッド形成の種特
異性をオリゴヌクレオチドに与えることができ、したがって、増幅反応に種特異
性を提供することができる。選択された増幅反応の実施に必要であれば、オリゴ
ヌクレオチドの種特異性を変えずに、他の配列を、本願明細書に開示されている
標的結合配列に任意に加えることが可能である。例として、本発明のC. trachom
atisのltuB特異的増幅プライマーは、SDA反応中にニックされる制限エンドヌ
クレアーゼBsoBIの認識部位を含んでもよい。欧州特許第0 684 315号に記載の認
識部位を含む他のニック可能な制限エンドヌクレアーゼ認識部位を、BsoBI認識
部位の代わりに用いてもよいことが当業者には明白であろうが、これに限定され
ない。好ましくは、認識部位は、好熱性SDA(tSDA)の条件下で増幅反応
を実施することができるように、好熱性制限エンドヌクレアーゼ用である。同様
に、増幅プライマーの尾部配列(5'から制限エンドヌクレアーゼ認識部位まで
)は、一般に重要ではないが、SDAに使用される制限部位および自身の標的結
合配列または他のプライマーのいずれかにハイブリッド形成する配列は、避けな
ければならない。したがって、SDAに有用な本発明の増幅プライマーは、3'
標的結合配列、ニック可能な制限エンドヌクレアーゼ認識部位5'から標的結合
配列まで、および長さ約10〜25ヌクレオチドの尾部配列から制限エンドヌク
レアーゼ認識部位までで構成される。ニック可能な制限エンドヌクレアーゼ認識
部位および尾部配列は、SDA反応に必要な配列である。他の増幅反応の場合、
本発明の増幅プライマーは、開示されている標的結合配列のみで構成されてもよ
く(たとえば、PCRの場合)、または標的結合配列と選択された増幅反応に必
要な別の配列(たとえば、上述のSDAに必要な配列または3SR用RNAポリ
メラーゼにより認識されるプロモーター)とで構成されてもよい。
【0021】
SDAでは、バンパープライマーは、下流の種特異的増殖プライマーを置換す
る機能を有するため、種特異性に不可欠ではない。バンパープライマーが伸長さ
れるとき、増幅プライマーとその伸長生成物を置換えるように、バンパープライ
マーが増幅プライマーから上流の標的にハイブリッド形成することのみが必要で
ある。したがって、バンパープライマーの個々の配列は、一般に重要ではなく、
バンパープライマーが伸長するとすぐに、増幅プライマー伸長生成物を置換でき
るほど、増幅プライマーの結合部位に十分に近い任意の上流標的配列から誘導す
ることが可能である。バンパープライマーが相変わらず特定の標的配列にハイブ
リッド形成できる限り、バンパープライマー配列における標的と時々ミスマッチ
であること、または非標的配列との若干の交差ハイブリッドを形成することは、
一般に、増幅効率に負の影響を及ぼさない。しかし、本願明細書に記載のバンパ
ープライマーはC. trachomatis特異的であり、したがって要望があれば、増幅プ
ライマーの標的結合配列としても使用される。
【0022】
本発明のプライマーを使用する増幅反応は、Walkerら、前出、による教示通り
、チミンを含んでもよく、あるいは、たとえば欧州特許第0 624 643号に教示さ
れている通りに、TTPの代わりに2'-デオキシウリジン5'-三リン酸を全体的に
または部分的に反応に用いて、次の増幅反応の交差汚染を減少させることが可能
である。dU(ウリジン)は増幅生成物中に組込まれるため、ウラシルDNAグ
ルコシラーゼ(UDG)処理によって切除できる。これらの非塩基性部位は、次
の増幅反応で増幅生成物を増幅可能でない状態にさせる。次の増幅を実施する前
に、ウラシルDNAグリコシラーゼインヒビター(Ugi)によってUDGを失活
させ、新たに形成された増幅生成物におけるdUの切除を防止することができる
。
【0023】
鎖置換増幅(Strand Displacement Amplification;SDA)は、プライマーの
伸長、半修飾制限エンドヌクレアーゼ認識/開裂部位のニッキング、1本鎖伸長
生成物の置換、プライマーの伸長生成物(または最初の標的配列)へのアニーリ
ング、および次のプライマーの伸長が反応混合物中で同時に起こる等温核酸増幅
法である。これは、反応の温度循環特性の結果として、反応の諸段階が不連続な
相または反応の温度サイクル的特徴の結果として周期サイクルで起こるPCRと
は異なる。SDAは、1)制限エンドヌクレアーゼが、ヘミホスホロチオエート
型の二本鎖認識/開裂部位の未修飾鎖をニックできること、2)あるポリメラー
ゼが、ニックで複製を開始し、下流の非鋳型鎖を置換できることに基づいている
。プライマーのアニーリングのために二本鎖標的配列を変性させるため、高温(
約95℃)で初回インキュベーション後、その後の重合および新たに合成された
鎖の置換は一定の温度で行われる。標的配列の各新しいコピーの生成は、5つの
段階で構成される。
【0024】
1)増幅プライマーを、最初の標的配列または予め重合させて置換した一本鎖
伸長生成物に結合させること、2)α−チオデオキシヌクレオシド三リン酸(α
−チオdNTP)を組み込む5'−3'エキソヌクレアーゼ欠損ポリメラーゼによ
るプライマーの伸長、3)半修飾二本鎖制限部位のニッキング、4)ニック部位
からの制限酵素の分離、および5)5'−3'エキソヌクレアーゼ欠損ポリメラー
ゼによる、ニックの3'末端からの伸長と、下流の新たに合成された鎖の置換。
ニックからの伸長によって別のニック可能な制限部位が発生するため、ニッキン
グ、重合および置換は一定の温度で同時にかつ連続的に起こる。一対の増幅プラ
イマーを使用し、その各々が二本鎖標的配列の2本の鎖のうちの1本にハイブリ
ッド形成するとき、増幅は指数関数的である。これは、センス鎖およびアンチセ
ンス鎖が、次の回の増幅で反対のプライマーの鋳型の役割を果たすためである。
増幅プライマーを1個使用するとき、鎖1本のみがプライマー伸長の鋳型の役割
をするため、増幅は直線的である。α−チオdNTPが組み込まれるとき、二本
鎖認識/開裂部位をニックする制限エンドヌクレアーゼの例は、HincII、HindII
、AvaI、NciIおよびFnu4HIである。以上の制限エンドヌクレアーゼ全てと、必要
なニッキング活性を示す他の制限エンドヌクレアーゼは、従来のSDAで使用す
るのに適している。しかし、これらは比較的熱に不安定であり、約40℃を超え
ると活性を失う傾向がある。
【0025】
標的配列を切断しないエンドヌクレアーゼで制限することによって、より大き
い核酸を断片化することにより、SDAによる増幅の標的を調製することが可能
である。しかし、Walkerら(Nuc. Acids Res. (1992)前出)および米国特許第5
,270,184号(参照することにより本願明細書の一部とする)に記載の通
りに、SDA反応におけるニッキング用に選択された制限エンドヌクレアーゼ認
識/開裂部位を有する標的核酸を調製することが、一般に好ましい。簡単に説明
すると、標的配列が二本鎖の場合、4種のプライマーが標的配列にハイブリッド
形成する。そのプライマーのうち2種(S1およびS2)はSDA増幅プライマー
であり、2種(B1およびB2)は外部プライマーまたはバンパープライマーであ
る。S1とS2は、標的配列に隣接する二本鎖核酸の反対の鎖に結合する。B1と
B2は、それぞれS1およびS2の標的配列5'(すなわち、上流)に結合する。3
種のデオキシヌクレオシド三リン酸および少なくとも1種の修飾されたデオキシ
ヌクレオシド三リン酸(たとえば、2'−デオキシアデノシン5'−O−(1−チオ
三リン酸)、「dATPαS」)が存在する条件下で、エキソヌクレアーゼ欠損
ポリメラーゼを使用して、4種のプライマー全てを同時に伸長させる。S1とS2
の伸長生成物は、それによりB1とB2の伸長により最初の標的配列鋳型から置換
される。置換された増幅プライマーの一本鎖伸長生成物は、反対の増幅プライマ
ーおよびバンパープライマーを結合する標的の役割をする(たとえば、S1の伸
長生成物はS2およびB2を結合する)。次の伸長および置換のサイクルで、各末
端に半修飾制限エンドヌクレアーゼ認識/開裂部位を有する2つの二本鎖核酸フ
ラグメントが生じる。これらは、SDAによる増幅に適した基質である。SDA
の場合と同様、標的生成反応の個々の段階は、同時に且つ連続的に起こり、SD
Aでの制限酵素によるニッキングに必要な末端に認識/開裂部位を有する標的配
列が生じる。SDA反応の成分の全てが既に標的生成反応に存在するため、自動
的且つ連続的に発生した標的配列は、SDAサイクルに入って増幅される。
【0026】
1つのSDA反応が別の増幅生成物によって交差汚染されるのを防止するため
に、増幅反応を阻害せずに、dTTPの代わりにdUTPをSDA増幅DNAに
組み込むことが可能である。UDGで処理することによって、ウラシル修飾核酸
を特異的に認識させ失活させることが可能である。したがって、先行反応でSD
A増幅DNAにdUTPが組み込まれる場合、二本鎖標的を増幅する前に、後続
のあらゆるSDA反応をUDGで処理し、以前の増幅反応由来のdU含有DNA
を増幅不可能にさせることができる。その後の反応で増幅すべき標的DNAは、
dUを含まず、UDG処理による影響を受けない。次に、標的を増幅する前にUg
iで処理することにより、UDGを阻害することが可能である。あるいは、UDGを
熱失活させてもよい。好熱性SDAでは、より高い反応温度そのもの(≧50℃
)を使用してUDG失活と標的の増幅を同時に行うことができる。
【0027】
SDAには、5'−3'エキソヌクレアーゼ活性がなく、二本鎖核酸の一本鎖ニ
ックにおいて重合を開始し、ニックの下流で鎖を置換すると同時に、非ニック鎖
を鋳型として使用して新しい相補鎖を生成するポリメラーゼが必要である。非結
合3'−OHにヌクレオチドを加えることによって、このポリメラーゼを伸長さ
せなければならい。SDA反応を最適化させるためには、ポリメラーゼが極めて
前進的であり、増幅することが可能な標的配列の長さを最大にすることが望まし
い。極めて前進的なポリメラーゼは、伸長生成物の分離および合成停止前に、か
なりの長さの新しい鎖を重合することができる。置換活性は、コピーのさらなる
合成に標的を利用できるようにし、指数関数的増幅反応で第二の増幅プライマー
をハイブリッド形成することが可能な対象である一本鎖伸長生成物を生成するた
め、増幅反応に置換活性は不可欠である。
【0028】
好熱性SDAは、望ましい熱安定なポリメラーゼおよび熱安定な制限エンドヌ
クレアーゼを置き換えて、Walkerら(PNASおよびNuc. Acids Res. (1992)前出)
に記載された従来のSDAと本質的に同様に実施される。もちろん、置換された
酵素に適したより高い温度に反応温度を調節し、HincII制限エンドヌクレアーゼ
認識/開裂部位を、選択された熱安定なエンドヌクレアーゼの適当な制限エンド
ヌクレアーゼ認識/開裂部位と置換する。また、Walkerらとは異なり、酵素が変
性温度で十分に安定であれば、初回変性段階の前に、開業医は反応混合物に酵素
を含めることが可能である。好熱性SDAで使用するのに好ましい制限エンドヌ
クレアーゼは、BsrI、BstNI、BsmAI、BslIおよびBsoBI (New England BioLabs
)、およびBstOI(Promega)である。好ましい好熱性ポリメラーゼは、Bca (Panv
era)およびBst (New England BioLabs)である。
【0029】
均一リアルタイム蛍光tSDA(homogeneous real time fluorescent tSDA)は
、tSDAの改良型である。この方法は検出用オリゴヌクレオチドを使用して、
蛍光消光を標的依存性様式で減少させる。検出用オリゴヌクレオチドは、標的の
非存在下で蛍光消光が起こるように結合されたドナー/アクセプター色素対を含
む。標的の存在下で検出用オリゴヌクレオチドの分子内塩基対二次構造が開いて
直線化すると、色素間の距離が増大し、蛍光消光が減少する。一般に、塩基対二
次構造を開くことは、二次構造が少なくとも部分的に崩壊されるような、二次構
造の配列と相補鎖との間の分子内塩基対形成を含む。塩基対二次構造は、十分な
長さの相補鎖の存在下で完全に直線化すると考えられる。好ましい実施態様で、
制限エンドヌクレアーゼ認識部位(restriction endonukulease recognition si
te;RERS)は2つの色素の間に存在し、二次構造と相補鎖との間の分子内塩
基対はRERSも二本鎖にして、制限エンドヌクレアーゼで開裂およびニック可
能にする。制限エンドヌクレアーゼによる開裂またはニッキングは、ドナー色素
とアクセプター色素を別個の核酸フラグメント上に分け、さらに消光を減少させ
る一因となる。いずれの実施態様でも、関連する蛍光パラメーターの変化(たと
えば、ドナー蛍光強度の増加、アクセプター蛍光強度の低減または展開前後の蛍
光の比率)を標的配列の存在の指標としてモニタリングする。一般にドナー蛍光
強度の変化は、アクセプター蛍光強度の変化よりも大きいため、ドナー蛍光強度
の変化をモニタリングすることが好ましい。蛍光寿命の変化など、他の蛍光パラ
メーターをモニタリングしてもよい。
【0030】
均一リアルタイム蛍光tSDA用の検出用オリゴヌクレオチドは、標的配列(
標的結合配列)にハイブリッド形成する一本鎖5'セクションまたは3'セクショ
ンを含むオリゴヌクレオチドであり、標的結合配列に隣接する分子内塩基対二次
構造である。本発明の検出用オリゴヌクレオチドは、二次構造が分子内塩基対形
成するとき蛍光が消え、二次構造が開いて直線化すると蛍光消光が減少するとい
う具合に、検出用オリゴヌクレオチドに結合したドナー/アクセプター色素対を
さらに含む。オリゴヌクレオチドの開裂は、DNA二重らせんの両鎖のホスホジ
エステル結合の破壊または一本鎖DNAのホスホジエステル結合の破壊を指す。
これは、DNA二重らせんの鎖2本のうちの1本のみのホスホジエステル結合の
破壊を指すニッキングとは違う。
【0031】
均一リアルタイム蛍光tSDA用の発明の検出用オリゴヌクレオチドは、プラ
イマー伸長またはハイブリッド形成のために選択された反応条件で分子内塩基対
二次構造を形成する配列を含む。この二次構造は、標的結合配列の少なくとも一
部が一本鎖3'尾部または5'尾部を形成するように、検出オリゴヌクレオチドの
標的結合配列に隣接して位置する。本願明細書で使用されるとき、「標的結合配
列に隣接した」という用語は、標的結合配列の全部または一部が、標的へのハイ
ブリッド形成に利用できる5'尾部または3'尾部中に一本鎖のまま残されること
を意味する。すなわち、二次構造は標的結合配列全体を含まない。標的結合配列
の一部が二次構造の分子内塩基対形成に含まれてもよく、二次構造の分子内塩基
対形成に含まれる第1の配列の全部または一部を含んでもよいが、その相補的配
列内に伸長しないことが好ましい。たとえば、二次構造がステム・ループ構造(
たとえば、「ヘアピン」)であり、検出用オリゴヌクレオチドの標的結合配列が
一本鎖3'尾部として存在する場合、標的結合配列もステムの第1アームの全部
または一部、および場合に応じて、ループの全部または一部に伸長してもよい。
しかし、標的結合配列は、ステム分子内塩基対形成に関与する配列の第2アーム
内に伸長しないことが好ましい。すなわち、標的にハイブリッド形成することが
できる二次構造の分子内塩基対形成に関与する両配列を具有しないことが望まし
い。検出用オリゴヌクレオチド二次構造の分子内塩基対部分のミスマッチは、標
的の存在下で蛍光の変化の大きさを低減させるが、分析の感度が問題でなければ
、容認できる。一本鎖尾部の標的結合配列のミスマッチも容認できるが、同様に
分析の感度および/または特異性が低減する可能性がある。しかし、二次構造と
標的結合配列の両者における完全な塩基対形成が反応を犠牲にしないことが本発
明の特徴である。ハイブリッド形成に関与する配列が完全にマッチすると、反応
速度論に負の影響を及ぼすことなく、分析の特異性が向上する。
【0032】
本発明の検出用オリゴヌクレオチドを増幅反応に加えると、増幅プライマーの
ハイブリッド形成および伸長によって二本鎖型に変換される。ポリメラーゼによ
る鎖置換も二次構造を開いたり直線化したりし、相補鎖の合成によってこれを二
本鎖型に変換する。RERSは、存在すれば、二本鎖となり、且つ制限エンドヌ
クレアーゼで開裂可能またはニック可能になる。ポリメラーゼの鎖置換活性によ
って二次構造が開かれたり、直線化されたりすると、ドナー色素とアクセプター
色素として、モニタリングしたり検出したりすることが可能である。一般に、R
ERSが開裂またはニックすると、二本鎖二次増幅生成物の別々のフラグメント
が2個生じ、各々に2種の色素のうちの1種が結合しているため、蛍光の変化の
大きさがさらに増大する。このフラグメントは反応溶液中で自由に拡散でき、ド
ナー/アクセプター対の色素間の距離がさらに増大する。ドナー蛍光強度の増大
またはアクセプター蛍光強度の低減は、標的増幅が起こっているまたは起こった
指標として、検出および/またはモニタリングすることができるが、ドナー/ア
クセプター色素対の近接によって影響を受ける他の蛍光パラメータもモニタリン
グすることが可能である。ドナーまたはアクセプターの蛍光強度の変化も、ドナ
ーおよび/またはアクセプター蛍光強度の比率の変化として検出することが可能
である。たとえば、a)二次構造を直線化または開いた後のドナー発蛍光団蛍光
と、直線化または開く前の検出用オリゴヌクレオチドにおけるドナー発蛍光団蛍
光との比率の増加、またはb)直線化または開く後のアクセプター色素蛍光と、
直線化または開く前の検出用オリゴヌクレオチドにおけるアクセプター色素蛍光
との比率の低減として、蛍光強度の変化を検出することが可能である。
【0033】
SDAのほかにも、本発明の検出用オリゴヌクレオチドは、他のプライマー伸
長増幅方法(たとえば、PCR、3SR、TMAまたはNASBA)におけるシ
グナルプライマー用に改変することが可能である。たとえば、PCR増幅プライ
マーおよび5'→3'エキソヌクレアーゼ活性のない鎖置換DNAポリメラーゼ(
たとえば、PrimegaのSequencing Grade TaqまたはNew England BioLabsのexo-Ve
ntまたはexo-Deep VentをPCRで使用することによって、この方法をPCR用
に改変することが可能である。検出用オリゴヌクレオチドシグナルプライマーは
、PCR増幅プライマーから下流の標的にハイブリッド形成し、置換されて、本
質的にSDAに関する記載と同様に二本鎖になる。一般に、RERSの開裂より
むしろニッキングを誘導すると考えられる修飾されたデオキシヌクレオシド三リ
ン酸が全く存在しないため、PCRでは、場合に応じて検出用オリゴヌクレオチ
ド用RERSを選択することが可能である。温度周期はPCRによる増幅の特徴
であるため、制限エンドヌクレアーゼは、最終周期のプライマーアニーリングお
よび増幅のエンドポイント検出のための伸長の後に低温で加えることが好ましい
。しかし、PCR反応の高温相を通して活性のままである好熱性制限エンドヌク
レアーゼは、増幅中ずっと存在することができ、リアルタイムアッセイを実施す
ることが可能である。SDAシステムの場合と同様、二次構造の直線化および色
素対の分離によって蛍光消光が低減し、強度などの蛍光パラメータの変化は標的
増幅の指標の役割をする。
【0034】
検出用オリゴヌクレオチドを開くことまたは検出用オリゴヌクレオチドの直線
化に起因する蛍光の変化は、選択された反応のエンドポイントで検出することが
可能である。しかし、直線化された二次構造はハイブリッド形成およびプライマ
ー伸長と同時に生じるため、反応が起こるにつれて、すなわち「リアルタイム」
に、蛍光の変化もモニタリングすることが可能である。この均一リアルタイムア
ッセイフォーマットを使用して、存在する標的の初期量に関する半定量的または
定量的情報を提供することができる。たとえば、(標的増幅の一部として、また
は非増幅検出方法で)塩基対を開く反応中または直線化する反応中に蛍光強度が
変化する速度は、初期標的レベルの指標である。結果として、存在する標的配列
の初期コピーが多いほど、ドナー蛍光は選択された閾値に速やかに(すなわち、
短時間で確実に)達する。同様に、アクセプター蛍光の減少は短時間で確実に達
し、選択された最小値に達するのに要する時間として検出される。さらに、反応
経過中の蛍光パラメータの変化の速度は、初期標的含有量が少ない試料よりも初
期標的含有量が多い試料で迅速である(すなわち、上昇勾配の蛍光曲線)。当該
技術上周知の通り、これらの測定または他の測定を、標的が存在する指標として
、あるいは標的増幅の指標として行うことができる。一般に、標的の初期量は、
実験結果と既知量の標的の結果とを比較することによって決定される。
【0035】
本発明の方法による選択された標的配列の存在の分析は、溶液または固相で実
施することができる。検出用オリゴヌクレオチドがプライマーの役割をするリア
ルタイムまたはエンドポイント均一アッセイは、一般に溶液で行われる。本発明
の検出用オリゴヌクレオチドを使用するハイブリッド形成アッセイは、溶液でも
実施することが可能である(たとえば、均一リアルタイムアッセイとして)が、
標的のリアルタイム検出またはエンドポイント検出のための固相分析に特に適し
ている。固相分析では、当該技術上周知の方法を使用した内部標識または末端標
識によって検出用オリゴヌクレオチドを固相(たとえば、ビーズ、膜または反応
容器)に固定することが可能である。たとえば、ビオチン標識検出用オリゴヌク
レオチドをアビジンで修飾した固相に固定することが可能であり、この場合、適
切なハイブリッド形成条件で標的に曝露したとき蛍光を変化させる。この様式で
標識を捕捉すると、試料から標的を分離することが容易になり、シグナルの検出
または分析の他の局面を妨害する可能性がある試料中の物質を除去することがで
きる。
【0036】
以下の実施例は、本願明細書に記載の本発明の詳細な実施例を示す。当業者に
は明白であろうが、様々な変化および修正が可能であり、様々な変化および修正
は記載されている本発明の範囲内であると考えられる。
【実施例】
【0037】
実施例1
ltuBを基礎とするプライマーの特異性および交差反応性の初期分析
GeneworksTMソフトウエアプログラムを使用してGenBank/EMBLデータベースで
最初のltuB配列を発見した。C. trachomatis LGV II抗原型から寄託された配列
(CHTLTUB)を得た。ltuB遺伝子をコードするゲノムのセクションに隣接
し、その内に位置する一連のプライマー(たとえば、ltuB-1およびltuB-2)をデ
ザインした。ltuB遺伝子のオープンリーディングフレーム内に位置する別のプラ
イマーを設計した。これらのプライマーを実験で使用して、様々なC. trachomat
is抗原型および交差反応物であるC. psittaciおよびC. pneumoniaeのゲノムに由
来するltuB領域を増幅した。使用したプライマーは次の通りであった。
【0038】
ltuB-1 5'-CCACTTCCAGAAATTGACA-3'(配列番号1)
ltuB-2 5'-GCAATATAGAGGGATAACG-3'(配列番号2)
ltuB-3 5'-CGTACCAGAATGGCTTTG-3'(配列番号3)
ltuB-4 5'-CAAAGCCATTCTGGTAG-3'(配列番号4)
ltuB-5 5'-AAGAAGCAGTCGCAAGCT-3'(配列番号5)
ltuB-6 5'-AAAGTGCATCTCTGTAGC-3'(配列番号6)
【0039】
部分的ltuB(CHTLTUB)配列およびプライマーの位置を図1に示す。上
記プライマーを使用した増幅を実施し、その結果を表1に示す。試験したC. tra
chomatisの株全てが陽性の結果を示したが、C. psittaciおよびC. pneumoniaeは
陰性の結果を示した。これらの最初の結果から、ltuB遺伝子はC. trachomatis特
異的種であり得ることがわかる。
【0040】
【表1】

【0041】
実施例2
数種のC. trachomatisの抗原型におけるltuBの配列決定およびltuB tSDAシステ
ムのデザイン
実施例1で得られた増幅生成物を精製し、さらに増幅してから配列を決定した
。フランキングプライマーと内部プライマー(図1に表示)の組み合わせを使用
して、C. trachomatis6種のltuB遺伝子の全配列を得た。この中には、抗原型A
、C、D、E、HおよびL3が含まれていた。
tSDAに有益と思われる潜在的領域についてこの配列のアラインメント配列
を試験し、tSDAプライマーセット用のセクションを選択した。特定のプライ
マーセットを使用すべきかどうかを決定する際に、OligoTMソフトウエアプログ
ラムを使用した。このソフトウエアプログラムを使用すると、特定のtSDAシ
ステムを構成するプライマー全部の間の相互作用を決定することが可能である。
試験用に選択されたtSDAプライマー全ての名称および配列は、以下の通りで
あった。
【0042】
上流プライマー
LB-PD1.1 5'-ACCGCATCGAATGCATGTCTCGGGTTACGTACCAGAATGG-3' (配列番号7)
LB-PD1.2 5'-ACCGCATCGAATGCATGTCTCGGGTTACGTACCAGAATG-3' (配列番号8)
下流プライマー
LB-PD2.1 5'-CGATTCCGCTCCAGACTTCTCGGGTTCACAGAATATCGCC-3' (配列番号9)
LB-PD2.2 5'-CGATTCCGCTCCAGACTTCTCGGGTTCACAGAATATCGC-3' (配列番号10)
バンパー
BD1.1 5'-AAATTCTGACCAAGTT-3' (配列番号11)
BD2.1 5'-TTTGATCTTTCTCCC-3' (配列番号12)
検出用配列1
DD1.1 5'-GGCTTTGTGGAGACA-3' (配列番号13)
検出用配列2
DD2.1 5'-GACTTTCATAATTTTGG-3' (配列番号14)
プライマー、バンパーおよび検出用配列のデザインおよび位置を図1に示す。
【0043】
実施例3
ltuBシステムを用いたtSDAの反応条件の最適化
典型的なtSDA反応で、以下の成分、すなわち、グリセロール、DMSO、
リン酸カリウムおよびヒトDNAと共に標的DNAを試験管に加えた。この混合
物を温浴中で2〜5分間沸騰させた。試料を45℃のサーモロックに移し、以下
のものを含む除染混合物を加えた。すなわち、リン酸カリウム、dGTP、dC
TP、dATP、プライマー、DTT、BSA、トレハロース、酢酸マグネシウ
ムおよびUDGを加えた。試料を30分間インキュベートし、52℃または54
℃のサーモロックブロックに移した。リン酸カリウム、dUTP、DTT、BS
A、トレハロース、酢酸マグネシウム、UDI、BsoBIおよびBstを含有する増幅
混合物を加えた。再び試料を30分間インキュベートした。反応は全て、5分間
煮沸することによって停止させた。プライマー伸長反応を使用し、末端標識32P
検出用プローブを用いて増幅反応の生成物を検出した。アクリルアミドシークエ
ンシングゲルを用いて、検出された生成物を分子量で分離し、X線フィルムを使
用してこれを感光させ、併せてMolecular Dynamics Phosphoimagerを使用して、
走査した。
増幅プライマーの異なる組み合わせが生成物に及ぼす影響を試験するためのス
クリーニング実験をデザインした。リン酸カリウム(25mMまたは35mM)、D
MSO(3%または8%)、グリセロール(3.5%または7%)、ヒトDNA
(650ngまたは1250ng)の濃度、および温度(52℃または54℃)の影
響を試験する多数のtSDAバッファー組み合わせを使用して、これを実施した
。tSDAシステムの他の成分は全て一定に保った。プライマー/プライマー組
み合わせに関連した上記パラメーターの全ての様々な組み合わせを試験するため
に、統計学的にデザインした実験を実施した。試験した条件の中で、最良の結果
が得られた一組の条件は表2の通りであった。
【0044】
【表2】

【0045】
実施例4
ltuBの感度検定
ltuBシステムの感度を試験するために、1×106ゲノム/5μLから下は1ゲ
ノム/5μLまで C. trachomatisのLGV IIの段階希釈液を調製した。検出限界実
験でこの標的DNAの滴定を使用した。650ng/反応と120 ng/反応の2種の
ヒトDNAレベルでltuBのtSDAシステムを用いて滴定パネルを試験した。こ
の実験に用いたtSDA条件は、実施例3に記載の最適条件と同じであった。1
×106ゲノム/反応、1×105ゲノム/反応および1×104ゲノム/反応の
量を単一試料で試験し、1×103ゲノム/反応を二重に試験し、100、10
および1ゲノム/反応を三重に試験した。ネガティブコントロールも含めた。1
つの試料における増幅の欠如がシステムの感度を示すと考えないことを確実にす
るために、コピー数が少ないC. trachomatisゲノムを複数の反応で試験する方法
を実施した。実験結果から、初期感度は下は1×102ゲノム/50uL反応に至
ることがわかる。
【0046】
実施例5
ltuBシステムの交差反応性および特異性の拡張分析
ltuBのtSDAシステム用の交差反応性/特異性実験をデザインした。実施例
3に記載の最適条件を使用して、標準tSDA反応を実施した。試験した微生物
のパネルは、C. trachomatis抗原型および多数の交差反応物で構成されていた。
C. trachomatisの各々を1×104ゲノムで試験した。交差反応物DNAを、1
×107ゲノムで各々試験した。C. trachomatis試料は個々に試験したが、交差
反応物は反応当たり3〜4種のプールで試験した。交差反応物プール内に増幅が
欠如しているのは、ltuBシステムの特異性に起因するものであって、tSDAの
インヒビターが原因ではないことを決定するために、各プールに1×104ゲノ
ムのC. trachomatis(株LGV II)をスパイクし、コントロールと同様に試験した
。結果を表3および表4に示す。LtuBのtSDAシステムで各C. trachomatis抗
原型は増幅について陽性であった。また、交差反応物細菌プールは、どれも検出
可能な増幅が起こらず、PGV IIをスパイクした各プールは、適当なサイズの増幅
生成物を産生した。
【0047】
【表3】

【0048】
【表4】

【0049】
本発明をかなり具体的に説明してきたが、当業者に明白な修正は、本発明の範
囲から逸脱せずに行うことが可能である。
添付の図面と一緒に読むと、以上の詳細な説明から本発明の様々な目的、長所
および斬新な特徴が容易に理解できるであろう。
【特許請求の範囲】
【請求項1】
LB−PD1.1(配列番号7)と、LB−PD1.2(配
列番号8)とからなる群から選択された核酸。
【請求項2】
LB−PD2.1(配列番号9)と、LB−PD2.2(配
列番号10)とからなる群から選択された核酸。
【請求項3】
BD1.1(配列番号11)と、BD2.1(配列番号12
)とからなる群から選択された核酸。
【請求項4】
DD1.1(配列番号13)の核酸と、配列番号13に相補
的な核酸と、DD2.1(配列番号14)の核酸と、配列番号14に相補的な核
酸とからなる群から選択された核酸。
【請求項5】
前記核酸が検出可能なマーカーを含むことを特徴とする請求
項4に記載の核酸。
【請求項6】
前記検出可能なマーカーが放射性マーカーおよび蛍光マーカ
ーからなる群から選択されることを特徴とする請求項5に記載の核酸。
【請求項7】
ltuB−1(配列番号1)と、ltuB−2(配列番号2
)と、ltuB−3(配列番号3)と、ltuB−4(配列番号4)と、ltu
B−5(配列番号5)と、ltuB−6(配列番号6)とからなる群から選択さ
れた核酸。
【請求項8】
a)LB−PD1.1(配列番号7)およびLB−PD1.
2(配列番号8)から成る群から選択された1個以上のプライマーと、
b)LB−PD2.1(配列番号9)およびLB−PD2.2(配列番号1
0)から成る群から選択された1個以上のプライマーと、
c)バンパーであるBD1.1(配列番号11)およびBD2.1(配列番
号12)と、
d)DD1.1(配列番号13)の核酸と、配列番号13に相補的な核酸と
、DD2.1(配列番号14)の核酸と、配列番号14に相補的な核酸とからな
る群から選択された1種以上の検出用配列と
を含んでなるキット。
【請求項9】
試料中のクラミジア・トラコマティス(Chlamydia trachomat
is)の有無を検出する方法であって、
a)第1のプライマーはLB−PD1.1(配列番号7)およびLB−PD1.
2(配列番号8)から成る群から選択され、第2のプライマーはLB−PD2.
1(配列番号9)およびLB−PD2.2(配列番号10)から成る群から選択
されることを特徴とする一対の核酸プライマーを、核酸増幅反応に使用して、前
記試料を処理するステップと、
b)増幅生成物の検出がクラミジア・トラコマティスの存在を示すことを特徴と
する増幅された核酸生成物を検出するステップと
を含む方法。
【請求項10】
前記SDA反応がBD1.1(配列番号11)およびBD
2.1(配列番号12)をバンパーとして使用することを特徴とする請求項9に
記載の方法。
【請求項11】
前記増幅された核酸生成物が、DD1.1(配列番号13
)の核酸と、配列番号13に相補的な核酸と、DD2.1(配列番号14)の核
酸と、配列番号14に相補的な核酸とからなる群から選択される検出用配列と、
前記増幅された核酸生成物とのハイブリッド形成によって得られることを特徴と
する請求項10に記載の方法。
【請求項1】
LB−PD1.1(配列番号7)と、LB−PD1.2(配
列番号8)とからなる群から選択された核酸。
【請求項2】
LB−PD2.1(配列番号9)と、LB−PD2.2(配
列番号10)とからなる群から選択された核酸。
【請求項3】
BD1.1(配列番号11)と、BD2.1(配列番号12
)とからなる群から選択された核酸。
【請求項4】
DD1.1(配列番号13)の核酸と、配列番号13に相補
的な核酸と、DD2.1(配列番号14)の核酸と、配列番号14に相補的な核
酸とからなる群から選択された核酸。
【請求項5】
前記核酸が検出可能なマーカーを含むことを特徴とする請求
項4に記載の核酸。
【請求項6】
前記検出可能なマーカーが放射性マーカーおよび蛍光マーカ
ーからなる群から選択されることを特徴とする請求項5に記載の核酸。
【請求項7】
ltuB−1(配列番号1)と、ltuB−2(配列番号2
)と、ltuB−3(配列番号3)と、ltuB−4(配列番号4)と、ltu
B−5(配列番号5)と、ltuB−6(配列番号6)とからなる群から選択さ
れた核酸。
【請求項8】
a)LB−PD1.1(配列番号7)およびLB−PD1.
2(配列番号8)から成る群から選択された1個以上のプライマーと、
b)LB−PD2.1(配列番号9)およびLB−PD2.2(配列番号1
0)から成る群から選択された1個以上のプライマーと、
c)バンパーであるBD1.1(配列番号11)およびBD2.1(配列番
号12)と、
d)DD1.1(配列番号13)の核酸と、配列番号13に相補的な核酸と
、DD2.1(配列番号14)の核酸と、配列番号14に相補的な核酸とからな
る群から選択された1種以上の検出用配列と
を含んでなるキット。
【請求項9】
試料中のクラミジア・トラコマティス(Chlamydia trachomat
is)の有無を検出する方法であって、
a)第1のプライマーはLB−PD1.1(配列番号7)およびLB−PD1.
2(配列番号8)から成る群から選択され、第2のプライマーはLB−PD2.
1(配列番号9)およびLB−PD2.2(配列番号10)から成る群から選択
されることを特徴とする一対の核酸プライマーを、核酸増幅反応に使用して、前
記試料を処理するステップと、
b)増幅生成物の検出がクラミジア・トラコマティスの存在を示すことを特徴と
する増幅された核酸生成物を検出するステップと
を含む方法。
【請求項10】
前記SDA反応がBD1.1(配列番号11)およびBD
2.1(配列番号12)をバンパーとして使用することを特徴とする請求項9に
記載の方法。
【請求項11】
前記増幅された核酸生成物が、DD1.1(配列番号13
)の核酸と、配列番号13に相補的な核酸と、DD2.1(配列番号14)の核
酸と、配列番号14に相補的な核酸とからなる群から選択される検出用配列と、
前記増幅された核酸生成物とのハイブリッド形成によって得られることを特徴と
する請求項10に記載の方法。
【図1】




【公開番号】特開2010−227103(P2010−227103A)
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願番号】特願2010−105122(P2010−105122)
【出願日】平成22年4月30日(2010.4.30)
【分割の表示】特願平10−309592の分割
【原出願日】平成10年10月30日(1998.10.30)
【出願人】(595117091)ベクトン・ディキンソン・アンド・カンパニー (539)
【氏名又は名称原語表記】BECTON, DICKINSON AND COMPANY
【住所又は居所原語表記】1 BECTON DRIVE, FRANKLIN LAKES, NEW JERSEY 07417−1880, UNITED STATES OF AMERICA
【Fターム(参考)】
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願日】平成22年4月30日(2010.4.30)
【分割の表示】特願平10−309592の分割
【原出願日】平成10年10月30日(1998.10.30)
【出願人】(595117091)ベクトン・ディキンソン・アンド・カンパニー (539)
【氏名又は名称原語表記】BECTON, DICKINSON AND COMPANY
【住所又は居所原語表記】1 BECTON DRIVE, FRANKLIN LAKES, NEW JERSEY 07417−1880, UNITED STATES OF AMERICA
【Fターム(参考)】
[ Back to top ]

