増幅核酸の解析方法及び解析装置
【課題】単一細胞や微小な生体組織に由来する微量な核酸を増幅して高精度且つ簡便に解析できる増幅核酸の解析方法及び解析装置の提供。
【解決手段】表面に平面状の試料保持部である第一親水性領域とその周縁部を包囲する第一撥水性領域が設けられた基板2をステージ19上に設置し、生体試料30を試料スライド3に固定し、該試料30に光源6からレーザ7を照射して切片を切り出し、該切片を前記第一親水性領域上に保持し、核酸増幅を行うための液に浸漬させ、該切片を含有する前記液の総液量を0.2〜3μLとし、接眼レンズ12及び/又はカメラ17により前記切片の有無及び/又は形態を観察し、該観察結果から核酸増幅の進行可否を判断し、進行可と判断した場合にステージ19の温度を調節して、前記第一親水性領域上において前記切片に由来する核酸を増幅し、カメラ17で増幅された核酸のシグナルを検出する。
【解決手段】表面に平面状の試料保持部である第一親水性領域とその周縁部を包囲する第一撥水性領域が設けられた基板2をステージ19上に設置し、生体試料30を試料スライド3に固定し、該試料30に光源6からレーザ7を照射して切片を切り出し、該切片を前記第一親水性領域上に保持し、核酸増幅を行うための液に浸漬させ、該切片を含有する前記液の総液量を0.2〜3μLとし、接眼レンズ12及び/又はカメラ17により前記切片の有無及び/又は形態を観察し、該観察結果から核酸増幅の進行可否を判断し、進行可と判断した場合にステージ19の温度を調節して、前記第一親水性領域上において前記切片に由来する核酸を増幅し、カメラ17で増幅された核酸のシグナルを検出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、単一細胞や微小な生体組織に由来する微量な核酸を増幅して、高精度且つ簡便に解析できる増幅核酸の解析方法及び解析装置並びに該解析装置への使用に好適なスライドホルダに関する
【背景技術】
【0002】
単一又は少数の細胞、あるいは微小な生体組織を採取して、その中の遺伝子を解析する研究が近年盛んとなっている。例えば、癌組織中の細胞をマイクロダイセクション(顕微解剖または顕微切断)により採取し、癌細胞のみの遺伝子発現を解析したり、隣り合う神経細胞の個々における遺伝子発現レベルを解析する研究が為されている。具体例を挙げると、同一個体のカタツムリの神経細胞でCREBs遺伝子の発現量を比較することにより、細胞によって10倍程度の発現量の差があることが見出されている(非特許文献1参照)。このような研究から、細胞が一つずつ遺伝子レベルで別々に働いていることが判明し、特に、癌細胞、神経細胞、胚などにおいては、単一細胞レベルで解析を行うことが重要となってきており、様々な技術が検討されている。したがって、単一細胞や微小な生体組織等の生体試料を採取する技術は、解析の精度を左右する重要な技術である。
【0003】
生体試料を採取する方法としては、これまでにマイクロダイセクション、マイクロマニピュレーター、フローサイトメトリー(FACS)などが知られている。
マイクロダイセクションとは、例えば、細胞や組織薄片のプレパラートなど、通常は平坦な標本に、細いレーザ光線を照射し、解析対象の細胞又は組織の小切片を切り取る方法であり、生物学及び医学の分野において汎用されている。切り取られた切片は、通常サンプルチューブに捕獲されて核酸を抽出され、引き続きDNA解析や遺伝子発現解析が行われる。
マイクロマニピュレーターとは、解析対象である細胞の近傍に、細いガラス管の先端を配して陰圧をかけることによって、細胞や体液を吸引する方法である。捕獲対象が微小であるため、通常は顕微鏡下で、ガラス管の先端をマイクロメートル単位でXYZ軸方向にそれぞれ動かせるような構成の装置を使用する。
フローサイトメトリーとは、細胞浮遊液を高速で流しながら、レーザ光を照射して、細胞一つずつにつき、その大きさ、細胞内構造、蛍光強度などについて解析する手法であり、レーザ光のセルソート機能により、特定の特徴をもつ細胞だけを採取することが可能である。
そして、これらいずれの方法においても、採取した細胞や組織切片を捕獲する容器として、通常はチューブ型、コップ型又はキャップ型の容器が使用されている。
【0004】
採取した細胞や組織切片の捕獲方法として、具体的には、これまでに以下のような方法が知られている。
特許文献1には、ライカ社の落下型試料捕獲法を適用したマイクロダイセクションについて記載されている。この方法では、試料はガラススライド上に張り付けられた高分子支持フィルム上に配置され、試料の解析対象領域がレーザ光線によって切り取られて試料から切片が分離され、重力の作用によって容器中に落下及び捕獲される。容器はコップ型で、引き出し式に収納でき、かつガラスライド近傍に配置できるように移動可能となっている。この方法では、次いで増幅反応を行うための反応液などを容器に予め入れておき、落下させた試料切片を直接反応液中に捕獲できる。
特許文献2には、Arcturus社のフィルム接着型試料捕獲法を適用したマイクロダイセクションについて記載されている。この方法では、ガラススライド上の生体試料の上部に、熱可塑性フィルムが上部に配され、中央部に観察ポートが設けられたキャップ型の容器を配置し、顕微鏡視野のターゲット領域内に位置するようにガラススライドを移動させ、パルスをレーザから発振させる。レーザパルスは熱可塑性フィルムを通過する際にこれを局所的に加熱し、その結果当該箇所が粘着性を有するようになり、生体試料はこの局所的な粘着領域に付着することで捕獲される。
【特許文献1】特開2002−168740号公報
【特許文献2】特表2001−519898号公報
【非特許文献1】J.Exp.Biol.,2005 Jun;208(Pt12):2389−98.
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかし、特許文献1に記載の方法では、容器中の試料切片の有無や様子を顕微鏡で確認できない。そのため、試料切片が容器中に捕獲されなかったり、容器内壁に付着して溶液中に浸漬されていない状態のまま解析が行われることがある。また、試料切片の状態が悪いまま解析が行われることもある。したがって、正しく解析できず、しかもその原因が特定できないことがあるという問題点があった。
また、試料切片を捕獲して容器内の溶液に確実に浸漬させるためには、試料切片と溶液とが接触する可能性を高くする必要があり、試料切片が微小でも数十μl程度と多量の溶液が必要になる。このような低濃度の溶液を解析に供すると、解析時に核酸濃度が検出限界に到達しないことがあり、確実に解析データを取得するためには、溶液を数μl程度にまで濃縮してから解析に供する必要がある。そこで、例えば、溶液中で試料切片から核酸を抽出後、エタノール沈殿法やカラム精製法を利用して核酸を濃縮し、得られた核酸全量を増幅して電気泳動などの解析に供したり、核酸を抽出することなく試料切片中で直接増幅させ、次いで同様に濃縮して解析に供する。このように濃縮を伴う解析では、煩雑な作業と数時間にも及ぶ作業時間を要し、遠心分離機などの専用装置を必要とするため、解析が煩雑で自動化が困難であるという問題点があった。
【0006】
また、特許文献2に記載の方法では、容器の中央部に設けられた観察ポートを通じて、容器中の生体試料の有無や様子を確認できるので、正しく解析できる。しかし、容器がキャップ型であり、遠心分離用のチューブ型容器に接続して使用するため、捕獲した細胞を浸漬させるのに数十μl程度と多量の溶液が必要になる。したがって、特許文献1に記載の方法と同様に、溶液を濃縮する必要があるという問題点があった。
【0007】
そしてこれら特許文献に記載の方法は、マイクロダイセクションを利用するものであるが、マイクロマニピュレーターやフローサイトメトリーを利用する方法でも、チューブ型の容器を使用するため、容器中の細胞の有無や様子を確認できず、細胞を溶解させるために多量の溶液を必要とし、特許文献1及び2に記載の方法と同様の問題点があった。
【0008】
本発明は上記事情に鑑みてなされたものであり、単一細胞や微小な生体組織に由来する微量な核酸を増幅して、高精度且つ簡便に解析できる、増幅核酸の解析方法及び解析装置を提供すること課題とする。
【課題を解決するための手段】
【0009】
上記課題を解決するため、
請求項1に記載の発明は、生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する方法であって、生体試料を採取する工程と、表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられた基板を使用し、前記試料保持部において、採取した生体試料を、核酸増幅を行うための液に浸漬させ、該生体試料を含有する液の総液量を0.2〜3μLとして保持する工程と、保持された生体試料の有無及び/又は形態を観察する工程と、前記試料保持部において前記生体試料に由来する核酸を増幅する工程と、増幅された核酸のシグナルを検出する工程と、を有し、前記生体試料の観察結果が、あらかじめ定められた所定の条件を満たした場合にのみ、前記シグナルの検出結果を解析に使用することを特徴とする増幅核酸の解析方法である。
請求項2に記載の発明は、前記基板において、さらに前記第一撥水性領域の外側周縁部を包囲する第二親水性領域と、該第二親水性領域の外側周縁部を包囲する第二撥水性領域とが設けられていることを特徴とする請求項1に記載の増幅核酸の解析方法である。
請求項3に記載の発明は、前記試料保持部に保持した生体試料から核酸の抽出を行わずに核酸増幅を行うことを特徴とする請求項1又は2に記載の増幅核酸の解析方法である。
請求項4に記載の発明は、前記核酸増幅を行うための液に浸漬前に、保持した前記生体試料を乾燥させることを特徴とする請求項1〜3のいずれか一項に記載の増幅核酸の解析方法である。
請求項5に記載の発明は、前記生体試料を採取する工程において、マイクロダイセクション法、マイクロマニピュレーター法又はフローサイトメトリー法を利用することを特徴とする請求項1〜4のいずれか一項に記載の増幅核酸の解析方法である。
請求項6に記載の発明は、前記生体試料を採取する工程を顕微鏡観察下で行うことを特徴とする請求項1〜5のいずれか一項に記載の増幅核酸の解析方法である。
請求項7に記載の発明は、前記試料保持部上の生体試料を含有する液を、該液よりも比重が小さく且つ沸点が100℃以上である非水溶性の液体で被覆してから核酸を増幅することを特徴とする請求項1〜6のいずれか一項に記載の増幅核酸の解析方法である。
請求項8に記載の発明は、前記核酸増幅を行うための液のpHが8.5〜9.5であることを特徴とする請求項1〜7のいずれか一項に記載の増幅核酸の解析方法である。
請求項9に記載の発明は、前記核酸増幅を行うための液に界面活性剤又はプロテアーゼを含有させることを特徴とする請求項1〜8のいずれか一項に記載の増幅核酸の解析方法である。
請求項10に記載の発明は、前記核酸増幅を行うための液にジチオトレイトール及び/又は硫酸化多糖を含有させることを特徴とする請求項1〜9のいずれか一項に記載の増幅核酸の解析方法である。
請求項11に記載の発明は、前記核酸増幅を行うための液にウシ血清アルブミンを含有させることを特徴とする請求項1〜10のいずれか一項に記載の増幅核酸の解析方法である。
請求項12に記載の発明は、前記核酸増幅を行うための液に、増幅核酸を蛍光標識する蛍光物質を含有させ、増幅核酸の蛍光強度を定量し、増幅核酸を定量することを特徴とする請求項1〜11のいずれか一項に記載の増幅核酸の解析方法である。
【0010】
請求項13に記載の発明は、生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する装置であって、採取対象の生体試料を固定するプレートを具備した試料固定手段と、固定された前記生体試料にレーザを照射して生体試料を切り出す照射手段と、切り出された生体試料を保持すると共に該生体試料に由来する核酸を増幅するための試料保持部を有する基板と、前記基板を支持及び温度調節するステージと、増幅核酸のシグナルを検出するシグナル検出手段と、を備え、前記基板は、その表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられていることを特徴とする増幅核酸の解析装置である。
請求項14に記載の発明は、請求項13に記載の増幅核酸の解析装置に備えるスライドホルダであって、前記プレート及び基板を固定すると共に、該プレート及び基板の少なくとも一方を、その表面と略平行な面内において移動させる手段を備えることを特徴とするスライドホルダである。
【発明の効果】
【0011】
本発明によれば、単一細胞や微小な生体組織に由来する微量な核酸を増幅して、高精度且つ簡便に解析できる。
【発明を実施するための最良の形態】
【0012】
以下、図面を参照しながら、本発明について詳しく説明する。
本発明に係る増幅核酸の解析方法は、生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する方法であって、生体試料を採取する工程と、表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられた基板を使用し、前記試料保持部において、採取した生体試料を、核酸増幅を行うための液に浸漬させ、該生体試料を含有する液の総液量を0.2〜3μLとして保持する工程と、保持された生体試料の有無及び/又は形態を観察する工程と、前記観察結果から、核酸増幅の進行可否を判断する工程と、核酸増幅を進行可と判断した場合に、前記試料保持部において前記生体試料に由来する核酸を増幅する工程と、増幅された核酸のシグナルを検出する工程と、を有することを特徴とするものである。
ここで生体試料とは、生体に由来し解析対象の核酸を含有するものであればいずれでも良く、各種生体組織、細胞、体液等が例示できる。そして、生体試料に由来する核酸とは、前記生体試料中に元来含まれている核酸を指し、生体試料中に含まれたままの状態の核酸や、生体試料から抽出された核酸等を指す。
【0013】
生体試料を採取する工程においては、主に基板表面の所定箇所に配置できるように生体試料を取得する。例えば、生体組織の一部から所望の組織切片を切り出したり、生体組織や複数の細胞の中から所望の細胞を抽出又は選別する操作等を行う。
【0014】
採取した生体試料は、基板表面の試料保持部に保持する。
本工程において使用する基板は、その表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられたものである。このような基板の一例として、液体を保持した状態のものを図1に例示する。図1(a)は、基板2の斜視図、(b)は(a)のII−II線における基板2の断面図である。
【0015】
基板2は透光性の材質からなるものが好ましい。透光性の材質とは、光の透過率が高く且つ自家蛍光の少ない材質を指し、具体的にはガラス類や透明な樹脂類が例示できる。なかでも好ましいものとしては、水板ガラス、白板ガラス、ハーフホワイトガラス等のガラス類が例示できる。
基板2は、表面21及び裏面22が平滑なものが好ましい。ここで、基板の表面21とは、後記する試料保持部が設けられている側の基板2の面を指し、基板の裏面22とは、前記表面21とは反対側の基板2の面を指す。
基板2の大きさは特に限定されず、例えば表面21及び裏面22の大きさは、目的に応じて適宜選択し得る。ただし、基板2の厚みは、光の透過率が良好であるという観点からは薄いほど好ましく、基板2の強度も考慮して取り扱いのし易さという観点からは、0.9〜1.1mmであることが好ましい。
【0016】
図1(b)に示すように、基板の表面21には、試料保持部となる第一親水性領域211と、該第一親水性領域211の周縁部を包囲する第一撥水性領域212とが設けられている。第一親水性領域211は平面状であり、採取した生体試料を、核酸増幅を行うための液と共に保持する部位であり、検出対象の増幅核酸を得るために、核酸増幅を行う部位でもある。すなわち、液体20は、生体試料を含有する液であり、例えば、核酸増幅前の増幅反応に供する液や、核酸増幅中又は増幅後の反応液である。前記核酸増幅を行うための液とは、プライマーや酵素等、増幅反応に必要な成分を含有する液であり、増幅反応の種類により異なり、前記酵素としては、逆転写酵素やDNAポリメラーゼが例示できる。核酸増幅を行うための液としては、市販品を使用しても良い。増幅方法の特性から、液体20は、通常水溶液である。
【0017】
液体20は、第一親水性領域211上で安定して保持される。そして、第一撥水性領域212を設けることで、液体20の移動が抑制されるので、液体20がより安定して保持される。第一親水性領域211は、平面状であればその外形は特に限定されず、目的に応じて選択すれば良いが、図1に示すように略円形状が好ましい。第一撥水性領域212も平面状であることが好ましい。そしてその外形は特に限定されず、目的に応じて選択すれば良いが、リング状であることが好ましい。このようにすることで、液体20がより安定して保持される。
【0018】
基板の表面21においては、図1に示すように、第一撥水性領域212の外側周縁部を包囲する第二親水性領域213と、該第二親水性領域213の外側周縁部を包囲する第二撥水性領域214とが設けられていることが好ましい。このようにすることで、保持された液体20の蒸発を防ぐために、被覆液25で液体20を被覆した際に、被覆液25も安定して保持できる。第二親水性領域213及び第二撥水性領域214は平面状であることが好ましい。そして、第二親水性領域213の外形は特に限定されないが、リング状であることが好ましい。このようにすることで、被覆液25がより安定して保持される。また、第二撥水性領域214の外形はリング状でも良いし、その他の形状でも良く、特に限定されない。そして、第一親水性領域211、第一撥水性領域212及び第二親水性領域213は、同心状に設けられていることが好ましい。
【0019】
被覆液25としては、液体20の主溶媒である水の蒸発を抑制し、核酸増幅時における液体20の加温にも耐えるようにするという目的から、液体20よりも比重が小さく且つ沸点が100℃以上である非水溶性の液体を使用する。このような物性を有するものであれば如何なるものも使用し得るが、好ましい市販品として、各種ミネラルオイルが例示できる。液体20を直接被覆することで、マイクロタイタープレートやサンプルチューブを使用した場合のように、液体20近傍に多量の空気層が存在することがなく、例えば、ポリメラーゼ連鎖反応(以下、PCRと略記する)法の熱サイクル中に液体20が蒸発することがなく、液体20の濃度変化が抑制されるので、安定して核酸増幅を行うことができる。
そして、基板の表面21に、第二親水性領域213及び第二撥水性領域214を設けることで、上記のような物性を有する被覆液25の移動が、第一撥水性領域212及び第二撥水性領域214により抑制される。
【0020】
親水性領域及び撥水性領域の寸法は、目的に応じて適宜選択し得る。例えば、0.2〜3μL程度の極微量の液体20を保持する場合には、第一親水性領域211の直径D1は0.5mm〜6mmとすることが好ましく、第一撥水性領域212の幅L1及び第二親水性領域213の幅L2は0.2mm〜3mmとすることが好ましい。第二撥水性領域214の寸法は、基板2の大きさや試料保持部の数を考慮して、任意に選択し得る。例えば、図1に示すように、第二親水性領域213の外側全面を第二撥水性領域214としても良い。
【0021】
親水性領域及び撥水性領域を有する基板2は、公知の方法で作製できる。具体的には、基板表面に親水処理及び撥水処理を施す方法、親水性基板表面に撥水処理を施す方法が例示できる。
親水処理としては、水酸基、アミノ基又はカルボキシ基等の親水性の官能基を基板表面に導入するものが例示できる。撥水処理としては、アルキル基、アルケニル基、アルコキシ基又はアルケニルオキシ基等の低極性の官能基や、一つ以上の水素原子がフッ素原子で置換されたアルキル基又はアルコキシ基等の疎水性の官能基を基板表面に導入するものが例示できる。
このような、親水性領域及び撥水性領域を有する基板2としては市販品を使用しても良く、例えば、極微量の液体20を保持する目的においては、Advalytix社製のAmpliGrid(商標)が好適である。
【0022】
生体試料を採取する方法は特に限定されず、目的に応じて公知の方法から適宜選択できる。例えば、マイクロダイセクション、マイクロマニピュレーター又はフローサイトメトリーを利用する方法が例示できる。
【0023】
例えば、マイクロダイセクションは、落下型及びフィルム接着型のいずれも適用できる。
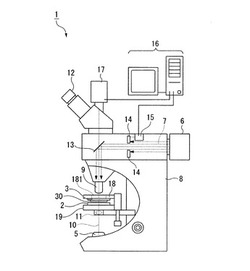
マイクロダイセクションを利用する方法で使用する解析装置としては、例えば、通常の顕微鏡に、レーザを照射して生体試料の切り出し等を行う照射手段と、レーザ照射に供する採取対象の生体試料を固定するプレートを具備した試料固定手段等を設けたものが使用できる。図2は、落下型のマイクロダイセクションを利用する方法で使用する解析装置を例示する概略構成図である。
【0024】
図2中、光源6から照射されたレーザ7は、絞り14を介してダイクロイックミラー13に到達し、ここで反射後、採取対象の生体試料に照射される。絞り14は、コンピュータ16に電気的に接続された絞りモータ15により制御される。このように、ここでは光源6、絞り14、絞りモータ15及びダイクロイックミラー13等が、照射手段を構成する。
【0025】
一方、基板2の所定箇所に採取された生体試料は、観察用光源5から照射され、集光レンズ11で集光された光により、その像が対物レンズ9及びダイクロイックミラー13を通じて接眼レンズ12において観察でき、さらにカメラ17によって撮像できるようになっている。ダイクロイックミラー13は、レーザ7を反射する一方、観察用光源5からの光を通過させる。図2中、符号10は光軸である。カメラ17としては、CCDカメラが好ましく、図2に示すように、コンピュータ16に電気的に接続されていることが好ましい。このようにすることで、撮像の回数、タイミング、露光時間等の条件の制御や、撮像データの記録及び処理を自動で行うことができる。また、後記するように、採取された生体試料が核酸増幅を正常に行える状態にあるかどうかも自動で判断できる。
【0026】
スタンド8には、略水平方向へ移動可能にステージ19が設けられており、該ステージ19上に基板2が設置できるようになっている。すなわち、ステージ19を移動させることで、基板2の略水平方向における配置位置を調整できるようになっている。
また、基板2の所定箇所に載置する生体試料を採取するために、採取に供する生体試料を保持する試料スライド3がスライドホルダ18に着脱可能に固定されており、さらにスライドホルダ18は、略水平方向へ移動可能にスタンド8に設置されている。すなわち、スライドホルダ18を移動させることで、試料スライド3の略水平方向における配置位置を調整できるようになっている。そして、スライドホルダ18には、レーザや観察用光源5からの光を通過させる通過孔181が穿設されている。
このように、ここでは試料スライド3及びスライドホルダ18等が試料固定手段を構成する。なお、基板2及び試料スライド3の少なくとも一方は、鉛直方向へも移動可能とされていることが好ましい。
【0027】
図3は、生体試料採取時における、解析装置1のステージ19近傍を拡大して示す図である。
ステージ19上には、裏面22を設置面として基板2が設置されている。そして、基板2の表面21には、試料保持部となる第一親水性領域211が設けられている。
試料スライド3の下面、すなわち前記基板2と略平行に対向する面の所定箇所には接着フィルム31が貼付され、該接着フィルム31上に、切片の採取に供する生体試料30が貼付されている。このように、試料スライド3表面に接着フィルム31を貼付するためには、接着フィルム31を試料スライド3表面に接触させ、後記する生体試料切片の接着部以外のいずれかの部位を加熱すれば良い。そして、接着フィルム31上に生体試料30を貼付するためには、例えば、生体試料30を接着フィルム31に接触させ、該接触箇所にレーザ等を照射して接着フィルム31を加熱すれば良い。
【0028】
ここで接着フィルムとは、レーザ照射等の加熱操作により接着性を発現するフィルムであり、熱可塑性フィルムが好ましく、その材質として具体的には、ポリエチレン(低密度ポリエチレン、中密度ポリエチレン、高密度ポリエチレン)、ポリプロピレン、ポリスチレン、ポリ塩化ビニル、ポリ酢酸ビニル、アクリル樹脂、ABS樹脂、AS樹脂、ポリイミド樹脂、ポリウレタン樹脂、エチルビニルアセテート(EVA)樹脂が例示でき、透明度の高いものが好ましい。接着フィルム31の厚さは特に限定されないが、5〜600μmであることが好ましい。
【0029】
落下型のマイクロダイセクションにおいては、所望の生体試料切片を採取するために、生体試料30の採取対象の領域が、略水平方向において基板2の第一親水性領域211に重なるように、生体試料30の配置位置を調整する必要がある。そのためには、スライドホルダ18及びステージ19の少なくとも一方を移動させることで、基板2及び試料スライド3の少なくとも一方の略水平方向の配置位置を調整すると良い。配置位置の調整は、例えば、以下の手順により一層精密に行うことができる。すなわち、まず、試料スライド3をスライドホルダ18に固定する。この時の固定方法は特に限定されず、図示するように、スライドホルダ18の保持枠180に試料スライド3を係合させる方法でも良いし、その他の方法でも良い。このように試料スライド3を固定した後、顕微鏡の接眼レンズ12の焦点を基板2に合わせて、ステージ19を略水平方向に移動させ、基板2の第一親水性領域211が視野に入るように調整する。次いで、生体試料30に焦点を合わせ、採取対象の領域が第一親水性領域211のほぼ真上に位置するように、顕微鏡で確認しながらスライドホルダ18を移動させて試料スライド3を略水平方向に移動させる。
【0030】
落下型のマイクロダイセクションにおいては、レーザのエネルギーにより、生体試料がその切断面以外は極力傷まないようにすることが好ましい。そのためには、前記接着フィルム31として、レーザのエネルギーを吸収し得る前記熱可塑性の接着フィルムや、前記試料スライド3として、エネルギートランスファーコーティングが施されたスライドを使用して、生体試料30をスライド上に配置すると良い。この場合、レーザのエネルギーを吸収し得る接着フィルム及びエネルギートランスファーコーティングスライドのいずれか一方を使用しても良いし、両方を使用すれば一層高い効果が得られる。ここで、レーザのエネルギーを吸収し得る熱可塑性の接着フィルムとしては、特に好ましいものとして、エチルビニルアセテート(EVA)フィルムが例示できる。また、エネルギートランスファーコーティングスライドとしては、例えば、AMR社製のDIRECTORTMが例示できる。
【0031】
配置位置の調整後は、レーザを照射して生体試料30及び接着フィルム31を切断する。この時、エネルギートランスファーコーティングスライドを使用した場合には、エネルギートランスファーコーティングも切断する。このようにすることで、生体試料30から切片を接着フィルム31と共に切り出す。この時のレーザの照射条件は、生体試料30、接着フィルム31及びエネルギートランスファーコーティングスライドの種類に応じて適宜設定すれば良いが、通常、接着フィルム31又はエネルギートランスファーコーティングに接着性を発現させる場合よりも、レーザの照射量が多くなるように設定する。
切り出された生体試料切片は、共に切り出された接着フィルム31又はエネルギートランスファーコーティングが試料スライド3に接着していないので、基板上の第一親水性領域211上に落下して捕獲される。基板2と試料スライド3との間の距離は、生体試料切片が第一親水性領域211上に確実に落下するように、適宜調整しても良い。そのためには、例えば、スライドホルダ18及びステージ19の少なくとも一方を略鉛直方向に移動させて、基板2及び試料スライド3の少なくとも一方の鉛直方向の配置位置を調整すれば良い。
前記操作を繰り返すことにより、複数の生体試料切片を切り出して、それぞれ異なる第一親水性領域211に捕獲できる。
【0032】
スライドホルダ18又はステージ19を略水平方向又は略鉛直方向に移動可能とする方法は、公知のものから適宜選択すれば良い。例えば、最も単純な構成として、スライドホルダ18又はステージ19を支持する部材に歯車を設け、スライドホルダ18又はステージ19に、該歯車に係合する突起部を列設して、該歯車と連動するようにしたものが挙げられる。
【0033】
図5は、本発明において使用するのに好適な、略水平方向に移動可能とされた二段式のスライドホルダ4を例示する概略構成図である。
スライドホルダ4において、第一のスライド40Aを固定する第一ホルダ41は、略水平方向のうちX軸方向に移動可能な第一可動部41Aと、略水平方向のうちX軸方向に直交するY軸方向に移動可能な第二可動部41Bとを有する。第一可動部41A及び第二可動部41Bには、レーザや観察用光源5からの光を通過させる第一通過孔411A及び第二通過孔411Bが穿設されている。そして、第一のスライド40Aは、図3に例示する固定方法と同様の方法で、第二可動部41Bの保持枠410に係合され、固定されている。また、前記第一可動部41A及び第二可動部41Bは、第一ホルダ41に設けられた第一のハンドル43を回転させることで作動するようになっている。
【0034】
スライドホルダ4において、第二のスライド40Bを固定する第二ホルダ42は、前記X軸方向に移動可能な第一可動部42Aと、前記Y軸方向に移動可能な第二可動部42Bとを有する。第一可動部42A及び第二可動部42Bには、レーザや観察用光源5からの光を通過させる第一通過孔421A及び第二通過孔421Bが穿設されている。そして、第二のスライド40Bは、第一のスライド40Aと同様に、第二可動部42Bの保持枠420に係合され、固定されている。また、前記第一可動部42A及び第二可動部42Bは、第二ホルダ42に設けられた第二のハンドル44を回転させることで作動するようになっており、その構成は前記第一可動部41A及び第二可動部41Bと同様である。
【0035】
そして、第一ホルダ41及び第二ホルダ42は、第一の支持部材401及び第二の支持部材402で支持されている。また、第一の支持部材401及び第二の支持部材402が立設されている底面403上には、図2及び3に例示したものと同様の観察用光源45が設けられている。ただし、スライドホルダ4において、観察用光源45は省略することも可能である。また、第一通過孔411A及び第二通過孔411B、並びに第一通過孔421A及び第二通過孔421Bは、いずれも、第一のスライド40A及び第二のスライド40Bの大きさを考慮して、適宜形状や大きさを設定すれば良い。
このように、スライドホルダ4において、第一ホルダ41及び第二ホルダ42は、それぞれX軸方向及びY軸方向に別々に作動する部位により、その略水平方向の位置が調整される。そして例えば、図2及び3において、スライドホルダ18、ステージ19及び観察用光源5を、ここに示すスライドホルダ4と置き換えることができる。
【0036】
一方、フィルム接着型のマイクロダイセクションを利用する方法で使用する解析装置としては、図3に示した基板2、試料スライド3及び接着フィルム31の配置形態を図4に示すように変更し、試料スライド3に代わり基板2をスライドホルダ18に固定するようにしたこと以外は、前記解析装置1と同様のものが例示できる。
フィルム接着型のマイクロダイセクションにおいては、図4に示すように、ステージ19上に、試料スライド3が設置され、該試料スライド3上には、生体試料30が載置される。そして基板2は、その表面のうち少なくとも第一親水性領域211上が接着フィルム31で被覆されるように、接着フィルム31が貼付され、該第一親水性領域211が試料スライド3と略平行に対向するように、表面21を下向きにしてスライドホルダ18に固定される。基板2表面に接着フィルム31を貼付する方法は、先に述べたような試料スライド3表面に接着フィルム31を貼付する方法と同様で良い。ただし、接着フィルム31は、第一親水性領域211に接着されていても良いし、されていなくても良い。
【0037】
そして、前記落下型の場合と同様に、生体試料30の略水平方向の配置位置を調整する。
次いで、基板2と生体試料30とが接触するように、スライドホルダ18及びステージ19の少なくとも一方を略鉛直方向に移動させて、基板2及び試料スライド3の少なくとも一方の鉛直方向の配置位置を調整する。
基板2の配置位置の調整後は、レーザを照射して生体試料30及び接着フィルム31を切断し、生体試料30から切片を切り出す。この時のレーザの照射条件は、前記落下型の場合と同様で良い。
次いで、切断された接着フィルム31のうち、生体試料切片と接触している部位にレーザを照射して加熱することで、生体試料切片を接着させ、基板2の第一親水性領域211上に生体試料切片を捕獲する。基板2への接着フィルム31貼付時に、接着フィルム31が基板2の第一親水性領域211へ接着されていなくても、この時のレーザ照射によって接着されることになる。
捕獲後は、例えば、基板2をステージ19上に設置するなど、反転させ、その表面21が上を向くようにすれば、生体試料切片が第一親水性領域211上に保持され、後記するように核酸増幅に供することが可能となる。
【0038】
上記落下型及びフィルム接着型のいずれの場合も、切断された接着フィルムは微小であり、マイクロダイセクション終了後に、これを基板から除去することが困難である場合が多い。このような場合には、続く生体試料を観察する工程、核酸を増幅する工程及び増幅核酸のシグナルを検出する工程はいずれも、切断された接着フィルムの存在下で行っても良い。ただし、このような場合には、接着フィルムとして、核酸増幅反応を阻害せず、かつシグナルの検出を阻害しないよう自家蛍光が弱い材質からなるものを使用することが好ましい。通常、先に例示した材質の接着フィルムであれば、いずれも好適に使用でき、なかでもEVAフィルムが特に好ましい。
【0039】
一方、マイクロマニピュレーター又はフローサイトメトリーを利用する場合には、公知の方法で生体試料を採取できる。例えば、マイクロマニピュレーターを利用する場合には、顕微鏡観察下にて細いガラス管等を使用して所望の生体試料を吸引して採取すれば良いし、フローサイトメトリーを利用する場合には、セルソーターにより所望の生体試料を選別して採取すれば良い。
採取した生体試料は、前記基板2の第一親水性領域211上に載置すれば良い。
【0040】
採取した生体試料が生体組織や細胞等である場合には、液体20に浸漬させる前に、乾燥させることが好ましく、試料保持部上において乾燥させることがより好ましい。ここで、生体試料を乾燥させるとは、生体試料の水分含有率を低減させることを指す。生体試料を乾燥させることで、細胞質や核質が生体試料外に排出され、核酸増幅を行うための液と直接接触し易くなり、核酸増幅を円滑に行うことができる。
乾燥方法は適宜選択でき、例えば、採取後に生体試料を常温で所定時間静置するだけでも良いし、常温で送風乾燥しても良く、生体試料が劣化しない範囲内で加熱しても良い。常温で静置する場合には、静置時間は特に限定されないが、10分以下で十分であり、4〜8分程度であることが好ましい。
【0041】
試料保持部上で、液体20に浸漬させた状態で生体試料を保持する場合には、例えば、試料保持部上に予め保持された液体20に生体試料を添加する方法(以下、方法(A)と略記する)、試料保持部上に予め載置された生体試料に液体20を添加する方法(以下、方法(B)と略記する)のいずれかを適用すれば良い。生体試料を乾燥させる場合や、液体20の飛散を抑制したい場合には、方法(B)が好ましい。
また、液体20を被覆液25で被覆する場合には、方法(A)においては、生体試料を添加後に被覆液25を液体20に添加すれば良く、方法(B)においては、液体20を添加後に被覆液25を液体20に添加すれば良い。
【0042】
生体試料を含有する液体20の総液量は0.2〜3μL、好ましくは0.5〜2μLとする。本発明においては、平面状の試料保持部で核酸増幅を行い、そのまま増幅核酸を解析できるので、生体試料を含有する液体20の液量が極微量でも、高精度に解析できる。
また被覆液25の量は、液体20を被覆できる範囲で選択すれば良いが、例えば、液体20の総液量が上記範囲である場合には、1〜10μLであることが好ましく、2〜8μLであることがより好ましく、4〜6μLであることが特に好ましい。
【0043】
保持された生体試料は、引き続き試料保持部に保持されているか、どのような形態か、少なくともいずれかについて観察する。すなわち、保持された生体試料の有無及び/又は形態を観察する。これは、核酸増幅を正確に行うことができるか確認したり、増幅核酸のシグナルの検出結果が解析に使用し得るような信頼性の高いものかどうかを判断するためである。
生体試料の観察は、例えば、以下のように行えば良い。生体試料の採取に、図2又は3に例示した解析装置を使用してマイクロダイセクションを利用した場合には、前記解析装置に備えられた対物レンズからの像や、カメラの撮像データを観察すれば良い。生体試料の採取に、マイクロマニピュレーター又はフローサイトメトリー等、マイクロダイセクション以外の方法を利用した場合には、生体試料を保持した基板を顕微鏡に設置して、対物レンズからの像を観察すれば良い。この時の顕微鏡としては、例えば図2に示すように、カメラ等の撮像手段を備えたものが好ましく、該撮像手段がコンピュータに電気的に接続されたものがより好ましい。このような顕微鏡を使用することで、自動で撮像データの記録やデータ処理を行うことができる。また、後記するように、保持された生体試料が核酸増幅を正常に行える状態にあるかどうかも自動で判断できる。
【0044】
生体試料の観察結果は、増幅核酸のシグナル検出結果を解析に使用するか否かを判断するため、あらかじめ定められた所定の条件と比較する。ここで所定の条件とは、核酸増幅が正常に行われるために必要な条件のことであり、具体的には、生体試料が試料保持部に保持されていること、試料保持部に保持された生体試料が核酸増幅対象の所望のものであること、生体試料が核酸増幅を行うための液体20に浸漬されていること、生体試料が著しく劣化していないこと等を指す。
【0045】
生体試料の観察結果と所定の条件との比較を行う時期は、生体試料の観察結果を得た後であれば、いずれでも良い。具体的には、
(A)生体試料に由来する核酸を増幅する工程の前
(B)生体試料に由来する核酸を増幅する工程の途中
(C)生体試料に由来する核酸を増幅する工程と、増幅された核酸のシグナルを検出する工程との間
(D)増幅された核酸のシグナルを検出する工程の途中
(E)増幅された核酸のシグナルを検出する工程の後
が例示できる。生体試料に由来する核酸を増幅する工程、増幅された核酸のシグナルを検出する工程については、後ほど詳細に説明する。
【0046】
前記比較を行う時期が(A)である場合には、(1)生体試料の観察結果が所定の条件を満たした場合には、次いで核酸の増幅を行い、満たさなかった場合には、核酸増幅を行わず、解析を中止するのが好ましい。
前記比較を行う時期が(B)である場合には、(2)生体試料の観察結果が所定の条件を満たした場合には、引き続き核酸増幅を行い、満たさなかった場合には、核酸増幅を中止して、解析を中止すると良い。
このようにすることで、生体試料が適した状態にある場合にのみ、核酸増幅を行うことで、解析を確実かつ高精度に行うことができる。
【0047】
前記比較を行う時期が(C)である場合には、(3)生体試料の観察結果が所定の条件を満たした場合には、次いでシグナルの検出を行い、満たさなかった場合には、シグナルの検出を行わず、解析を中止するのが好ましい。
前記比較を行う時期が(D)である場合には、(4)生体試料の観察結果が所定の条件を満たした場合には、引き続きシグナルの検出を行い、満たさなかった場合には、シグナルの検出を中止して、解析を中止するのが好ましい。
前記比較を行う時期が(E)である場合には、(5)生体試料の観察結果が所定の条件を満たした場合には、シグナルの検出結果を解析に使用し、満たさなかった場合には、シグナルの検出結果を解析に使用しなければ良い。
このようにすることで、核酸増幅が正常に行われた場合にのみ、シグナルの検出結果を解析に使用することで、解析を高精度に行うことができる。
ここで解析とは、例えば、シグナルの検出結果を生体試料のデータとして採用し、所定の生体試料間での比較検討に使用することを示す。
【0048】
本発明においては、上記に限定されず、例えば、前記比較を行う時期が(A)である場合には、(1)以外に(2)〜(5)のいずれかを適用しても良い。また、前記比較を行う時期が(B)である場合には、(2)以外に(3)〜(5)のいずれかを適用しても良い。また、前記比較を行う時期が(C)である場合には、(3)以外に(4)又は(5)を適用しても良い。また、前記比較を行う時期が(D)である場合には、(4)以外に(5)を適用しても良い。このように本発明においては、前記比較を行う時期によって、解析の継続又は中止の判断を様々な段階で行うことができる。
ただし、無駄な操作を省略して工程を簡略化するという観点からは、前記比較を行う時期を(A)として(1)を適用するのが好ましい。
また、工程を円滑に行うという観点からは、前記比較を行う時期を(E)として(5)を適用するのも好ましい。例えば、臨床検査などのルーチーンな大量アッセイにおいては、この方が規則的な作業ができ、作業効率を高めることができる。また、観察結果とシグナルの検出結果との関係を考察することで、解析を高精度に行うために使用できる生体試料の条件を絞り込むこともできる。
【0049】
核酸増幅は、第一親水性領域211において、核酸増幅を行うための液に生体試料を浸漬させて、これらを保持した状態で行う。
そして、増幅反応は、基板2を使用すること以外は、公知の方法で行えば良く、例えば、PCR法、LAMP法等の等温増幅法、whole−Genome−amplification法等が適用できる。
【0050】
増幅反応を行う際は、例えば、生体試料を保持した基板2を、増幅装置の所定箇所に設置して反応を行えば良い。
また、生体試料の採取に、マイクロダイセクションを利用する場合には、例えば、図2又は3に例示した解析装置1において、ステージ19をサーマルサイクラー等の温調手段と一体化させた装置を使用すると良い。そして、生体試料の採取に、マイクロマニピュレーター又はフローサイトメトリー等、マイクロダイセクション以外の方法を利用する場合には、生体試料観察時の前記顕微鏡において、同様にステージをサーマルサイクラー等の温調手段と一体化させた装置を使用すると良い。このように、ステージと温調手段を一体化した装置を使用すれば、生体試料の観察後に、基板2を移動させることなく、そのまま引き続き核酸増幅を行うことができ、解析操作を簡略化できる。
【0051】
温調手段は、加温及び冷却が可能な公知のものから適宜選択して使用できる。
【0052】
温調手段は、基板2の支持を妨げない配置でステージ19表面近傍において露出されていても良いし、ステージ19表面の熱伝導部位に接してステージ19に設けられていても良い。
温調手段及びステージの、熱伝導部位の材質は、耐熱性で且つ熱伝導性の高いものが好ましく、アルミニウム、鉄、銅などの金属、ステンレスなどの合金、熱伝導性の各種樹脂類が例示できる。なかでも安定性、熱伝導性に優れることから、金属又は合金が好ましく、アルミニウムが特に好ましい。
【0053】
温調手段は、例えば、図2に示すコンピュータ16に電気的に接続されていることが好ましい。このようにすることで、核酸増幅時における温度、時間、サイクル数などを自動で制御できる。これにより、膨大な数のサンプルも迅速に処理できる。
【0054】
核酸増幅においては、保持した生体試料から核酸を抽出して増幅反応を行っても良いし、核酸を抽出せずにそのまま増幅反応を行っても良い。抽出せずに増幅反応を行えば、簡便に増幅核酸を解析できる。
【0055】
核酸増幅を行うための液、好ましくは生体試料を含有する液体20のpHは、核酸増幅開始前において、8.5〜9.5とすることが好ましい。このような範囲とすることで、細胞から核酸を抽出することなく増幅反応を行う場合に、共存する夾雑物による増幅反応の阻害が抑制される。また同様の理由により、核酸増幅を行うための液、好ましくは生体試料を含有する液体20に、ジチオトレイトール(DTT)及び/又は硫酸化多糖を含有させて、増幅反応を行うのが好ましい。DTT及び硫酸化多糖の含有量は、適宜調整すれば良い。
また、核酸増幅を行うための液、好ましくは生体試料を含有する液体20に、界面活性剤又はプロテアーゼを含有させて、増幅反応を行うのが好ましい。このようにすることで、細胞膜を破壊しながら核酸増幅を行うことができ、細胞質や核質が生体試料外に排出され、核酸増幅を行うための液と直接し易くなり、核酸増幅を円滑に行うことができる。界面活性剤及びプロテアーゼは、公知のものから目的に応じて適宜任意に選択し得る。そして、これらの含有量も適宜調整すれば良い。
【0056】
また、基板2など、液体20が接触する部位がガラス製である場合には、液体20に含有される核酸やDNAポリメラーゼ等がガラス表面に吸着されることがあり、この場合、増幅反応が阻害されてしまう。これを抑制するために、増幅反応前において液体20にブロッキング剤を含有させておくことが好ましい。このようにすることで、ガラス表面をブロッキングでき、さらに液体20を基板2上で粒状に保持し易くなり、取り扱い性も向上する。
ブロッキング剤は公知のもので良く、好ましいものとして、ウシ血清アルブミン(BSA)が例示できる。
【0057】
増幅された核酸のシグナルを検出する方法は、公知の方法から目的に応じて適宜選択すれば良い。
例えば、ゲルやキャピラリーシケンサーを利用する電気泳動を行った後、常法により増幅核酸を染色してそのシグナルを検出しても良いし、増幅核酸を蛍光物質で標識し、蛍光シグナルを検出しても良い。なかでも蛍光シグナルを検出する方法は、増幅反応中の増幅核酸をリアルタイムで検出できるなど利便性や汎用性が高いので、特に好ましい。蛍光シグナルを検出する場合には、増幅反応前において液体20に蛍光物質を含有させておけば良い。
【0058】
蛍光物質としては、公知の如何なるものも使用でき特に限定されない。具体的には、フルオレセイン、ローダミン(ローダミングリーン、TAMRA等)、アクリフラビン、アレクサ(アレクサ647等)、サイバーグリーン(SYBR Green)等が例示できる。
例えば、サイバーグリーンI(SYBR GREEN I)は、二重らせん構造を形成している核酸と特異的にインターカレートし、その結果、青色光(波長488nm)を吸収し、緑色光(波長522nm)の蛍光を発することが知られている。したがって、サイバーグリーンIを含む反応液を増幅反応に供して核酸を増幅すると、増幅された核酸の二重らせんにサイバーグリーンIがインターカレートするので、励起光を照射すると蛍光を発し、この時の蛍光強度は、増幅された核酸の量に比例する。
蛍光物質は一種を単独で用いても良いし、二種以上を併用しても良い。二種以上を併用する場合には、その組み合わせ及び比率等は、目的に応じて適宜選択し得る。
また、増幅産物に導入する蛍光物質の量も、目的に応じて適宜選択し得る。
【0059】
増幅核酸のシグナルを検出する時は、シグナル強度を定量することが好ましい。該定量値より増幅核酸を定量できる。また、シグナルの検出時期は、検出方法や目的に応じて適宜選択すれば良い。例えば、蛍光シグナルを検出する場合のように、シグナル検出のために増幅反応を停止する必要がない場合であれば、増幅反応中のいずれの時期でも検出できる。またこの時、基板の温度調節を特定の温度サイクルで行う場合には、温度サイクルごとに、増幅核酸の定量を一回又は二回以上行うことが好ましい。このように増幅核酸をリアルタイムで定量することにより、鋳型として使用した核酸の増幅反応前の量を迅速且つ高精度に定量できる。増幅核酸の定量回数は、状況に応じて選択すれば良い。
【0060】
増幅核酸のシグナルは、公知のシグナル検出手段を使用して検出すれば良い。例えば、増幅核酸に励起光を照射して、励起された光シグナルを検出する場合には、励起光照射手段と光シグナル検出器を備えた装置を使用すれば良く、前記検出器としては、CCDカメラ等が例示できる。例えば、図2又は3で例示した解析装置1において、光源6として各種波長の励起光を照射できるものを備えたものであれば、生体試料の採取と光シグナルの検出を共に行うことができるし、上記説明のように、さらにステージ19が温調手段と一体化された装置であれば、生体試料の採取から光シグナルの検出まで、一貫して同じ装置で行うことができる。
また、生体試料観察時の顕微鏡に、前記と同様の励起光照射手段とCCDカメラ等を備えたものであれば、マイクロマニピュレーター又はフローサイトメトリー等、マイクロダイセクション以外の方法を利用した生体試料の採取と、光シグナルの検出を同じ装置で行うことができるし、さらにステージ19が温調手段と一体化された装置であれば、生体試料の採取から光シグナルの検出まで、一貫して同じ装置で行うことができる。
【0061】
励起光を照射するための前記光源6としては、ハロゲンランプやキセノンランプ等、目的に応じて適宜選択すれば良い。また、光源6からの励起光のうち、特定範囲の波長の光のみを透過させるために、励起フィルタを使用しても良い。励起フィルタは、励起対象、例えば標識物質の種類に応じて選択すれば良く、反射光や迷光から生じるゴースト像の発生を防止するために、励起に必要な波長範囲以外の光を精度良く減衰させる励起フィルタを使用するのが好ましい。例えば、蛍光物質としてサイバーグリーンを使用する場合には、488nm近傍を中心とする波長帯域の光を透過させるものが好ましい。
【0062】
光シグナルは、吸収フィルタを介して特定範囲の波長の光のみを透過させてから、光シグナル検出器で検出しても良い。吸収フィルタは、光シグナルに応じて選択すれば良く、反射光や迷光から生じるゴースト像の発生を防止するために、目的とする波長範囲以外の光を精度良く減衰させるものが好ましい。例えば、蛍光物質としてサイバーグリーンを使用する場合には、522nm近傍を中心とする波長帯域の光を透過させるものが好ましい。
【0063】
本発明の解析方法で使用する装置は、上記で説明した形態に限定されるものではなく、本発明の効果を損なわない範囲において、構成を一部削除又は変更しても良いことは、言うまでも無い。例えば、スライドホルダ18、ステージ19、光源6等、その他の構成をコンピュータ16で制御できるようにしても良い。
【0064】
本発明においては、平面状の試料保持部で生体試料を保持するので、試料保持部における生体試料の有無、核酸増幅を行うための液体に対する生体試料の浸漬状態、生体試料の劣化の有無等を確実に確認できる。そして、核酸増幅を行うのに適した生体試料を選別して核酸増幅を正確に行ったり、核酸増幅を行うのに適していない生体試料については解析を中止したりすることで、信頼性の高い増幅核酸の検出データのみを解析に使用するので、解析を高精度に行うことができる。また、平面状の試料保持部で核酸増幅を行い、そのまま増幅核酸を検出できるので、解析に供する反応液は微量で良い。そして、検出時に従来のテレセントリックな光学系が不要であるだけでなく、生体試料を含む液と基板との接触面で焦点調整でき、焦点位置を溶液量に影響されることなく一定にでき、前記液ごとに焦点調整を行う必要がない。さらに、検出時に反応液の濃縮等を行う必要がなく、特殊な装置も不要である。したがって、装置の小型化と安価な作製が可能であり、解析を簡便に行うことができる。以上のように、微量な核酸も高精度且つ簡便に解析できる。
【実施例】
【0065】
以下、具体的実施例により、本発明についてさらに詳しく説明する。ただし、本発明は、以下に示す実施例に何ら限定されるものではない。
【0066】
(実施例1)
癌の組織切片を使用して、レーザマイクロダイセクションにより癌細胞と非癌細胞を切り出し、遺伝子発現解析を行った。基板としては、図1に示す構成のAdvalytix社製のAmpliGrid(商標)を使用した。該基板の第一親水性領域の直径D1は1.6mmであり、第一撥水性領域の幅L1及び第二親水性領域の幅L2は0.8mmであった。そして、レーザマイクロダイセクションには、図3に示すホルダを備えた顕微鏡を使用した。
まず、前記基板を、前記第一親水性領域が上側となるように顕微鏡のステージ上に設置した。
一方、図3に示すように、試料スライド上面に接着された接着フィルム上に、癌の凍結組織切片を載置し、前記試料スライドを、その表面と平行な水平面内で移動可能なスライドホルダに前記凍結組織切片が下向きになるようにはめ込んで支持し、顕微鏡のステージ上方に設置した。なお、接着フィルムとしては、厚さ100μmのEVAフィルムを用いてた。
そして、顕微鏡の焦点を前記基板にあわせて、ステージを水平面内で移動させ、基板の第一親水性領域が視野に入るように調整した。さらに、接着フィルム上の癌組織に焦点を合わせ、前記スライドホルダをステージと平行に移動させ、切り出したい癌細胞に標的を定め、標的が基板の第一親水性領域の真上に位置するように顕微鏡で確認しながら、前記スライドホルダを移動させた。そして、レーザにて標的の癌細胞を切り出し、癌細胞を基板の第一親水性領域上に落下させ、捕獲した。
次に、前記癌細胞近傍の非癌細胞に焦点を合わせ、前記スライドホルダをステージと平行に移動させ、切り出したい非癌細胞に標的を定め、基板の前記癌細胞を捕獲したものとは異なる第一親水性領域の真上に標的が位置するように顕微鏡で確認しながら、前記スライドホルダを移動させた。そして、レーザにて標的の非癌細胞を切り出し、基板の第一親水性領域上に落下させ、捕獲した。
【0067】
次いで、前記試料スライドをはずし、基板に焦点を合わせて、基板の個々の第一親水性領域上に癌細胞及び非癌細胞がそれぞれ存在し、前記捕獲操作によって傷んでいないことなど、捕獲された細胞が核酸増幅を正常に行える状態にあることを確認した。そして、そのまま約5分間静置して捕獲した癌細胞及び非癌細胞を乾燥させた後、界面活性剤の入った1step−PCR試薬(QIAGEN社製)をそれぞれ1μl分注して癌細胞及び非癌細胞を浸漬させ、さらにその上にそれぞれミネラルオイルを5μl滴下した。そして、基板を移動させ、in situ PCR用のサーマルサイクラーに設置し、50℃/30分の条件で逆転写反応を行った後、95℃/15分の条件で逆転写酵素を失活させ、94℃/30秒、60℃/1分の条件を35回繰り返し、PCRを行った。なお、前記PCR試薬には、プライマーとしてMMP2の配列を添加し、TaqMan反応用の蛍光FRLET(5’FAM−3’TAMRA)プローブも同時に添加した。サーマルサイクラーの上方に蛍光顕微鏡を設置し、癌細胞及び非癌細胞を含有する液を保持した第一親水性領域に焦点を合わせ、60℃の反応時毎に波長490nmの光を照射してプローブを励起し、その結果生じた波長520nmの蛍光をCCDカメラで撮影して、FAMの蛍光強度を測定した。なお、内部標準遺伝子として(5’VIC−3’TAMRA)で標識したGAPDHも同時に増幅させてその蛍光強度も測定した。この時の測定結果を図6に示す。図6(a)はMMP2由来の蛍光強度の測定結果を示すグラフであり、図6(b)はGAPDH由来の蛍光強度の測定結果を示すグラフである。
【0068】
得られた結果から、蛍光強度の経時変化をプロットしたところ、癌細胞では非癌細胞と比較してMMP2の発現が亢進していることが確認された。
なお、マイクロダイセクション終了後からデータ取得までに要した時間は約2.5時間であり、簡便かつ迅速に解析できた。これは、核酸抽出及び濃縮という煩雑な工程が不要であり、遠心分離などの煩雑かつ特殊な装置を使用する操作も不要であるためであった。
【0069】
(比較例1)
ライカ社製の落下型レーザマイクロダイセクション装置を使用して、以下に示す手順で、癌細胞及び非癌細胞を切り出し、遺伝子発現解析を行った。
捕獲容器としては、1.5μlの遠心分離用チューブ状容器を使用し、あらかじめ50μlの細胞溶解液を添加しておいた。そして、前記チューブ状容器の上方に、標的領域が位置するように試料スライドを移動させ、レーザにて癌細胞及び非癌細胞をそれぞれ切り出した。その結果、細胞がどこに落下したのか不明であったため、チューブ状容器の蓋を閉めた後、前記溶解液で該容器の壁面全体を洗浄するように、何度も丁寧に上下に振とうさせる操作を行った。次いで、遠心分離した後、RNA抽出用カラム(QIAGEN社製)に溶液を分注し、再度遠心分離し、洗浄液を載せてさらに遠心分離し、溶出液を30μl注入して溶出を行った。次いで、得られた溶液にエタノールと酢酸ナトリウムを添加してエタノール沈殿させて濃縮し、これに10μlの水に溶解させた。そしてここに、1step−PCR試薬(QIAGEN社製)に実施例1と同様のMMP2のプライマーとTaqManのプローブを添加したものを加えて、総液量を20μlとし、96ウェルのPCR用プレートに分注した後、ABI PRISM 7900リアルタイムPCR装置(Applied Biosystems社製)を使用して、蛍光強度を測定し、遺伝子発現解析を行った。この時の測定結果を図8に示す。図8(a)はMMP2由来の蛍光強度の測定結果を示すグラフであり、図8(b)はGAPDH由来の蛍光強度の測定結果を示すグラフである。
その結果、MMP2は癌細胞で非癌細胞よりも発現量の亢進が見られた。
なお、マイクロダイセクション終了後からデータ取得までに要した時間は約6時間であり、実施例1の場合よりも手間と時間を要した。これは、核酸抽出及び濃縮という煩雑な工程が必要であり、遠心分離などの煩雑かつ特殊な装置を使用する操作が必要であるためであった。
【0070】
(実施例2)
前記顕微鏡に代わり、図2に示すような、顕微鏡のステージにPCR用のサーマルサイクラーが一体化され、さらに蛍光検出部を備えた構成の顕微鏡をマイクロダイセクションに使用した。そして、癌細胞及び非癌細胞を捕獲後に、これら細胞の観察画像を撮影するとともにコンピュータにより画像処理を行い、基板の所定の第一親水性領域上に癌細胞及び非癌細胞がそれぞれ存在し、これら細胞が核酸増幅を正常に行える状態にあることを自動的に確認した。さらに、基板を移動させることなく直ちにPCRを行うと共に、リアルタイムで増幅核酸の蛍光強度を測定した。これらの点以外は、実施例1と同様に蛍光強度を測定した。その結果、基板を移動させることなく、実施例1と同様の結果が得られた。基板の移動が不要で、かつ捕獲細胞の有無や捕獲位置をはじめとする捕獲細胞の状態を自動的に確認できたので、実施例1の場合よりもさらに簡便かつ迅速に解析できた。
【0071】
(実施例3)
癌培養細胞であるLc−1Sqは、17番染色体17p11.2−13の領域が増幅又は欠質していることが知られている。これら染色体部位の増幅又は欠失が株全体で均一か否かを確認するために、以下の操作で解析を行った。
スライドホルダを備えていないこと以外は実施例1で使用したものと同様の顕微鏡を使用し、マイクロマニピュレーターで培養皿からLc−1Sqを1細胞ずつ吸引し、顕微鏡で確認しながら、実施例1と同様の基板の第一親水性領域上に排出して載置し、合計8細胞をそれぞれ別々に第一親水性領域上に載置した。載置した細胞は、前記操作によって傷んでいないことなど、核酸増幅を正常に行える状態にあることを確認した。
次いで、載置した8細胞のうち、4細胞についてはLc−1Sqを載置直後に1μlのPCR試薬を分注し、残りの4細胞については載置後約5分間静置して乾燥させてから1μlのPCR試薬を分注して、それぞれ細胞を浸漬させた。なお、前記PCR試薬には、プライマーとして前記領域に存在するTP53遺伝子の配列を添加した。また、該PCR試薬はpH8.0のものを使用した。そして、さらにそれぞれにミネラルオイルを5μl滴下し、基板を移動させてin situ PCR用のサーマルサイクラーに設置し、実施例1と同様にPCRを行った。
【0072】
PCR終了後、反応溶液をアガロースゲルで電気泳動し、バンドの位置と濃さを検出した。この時の検出結果を図7に示す。図7(a)〜(d)は載置直後にPCR試薬を分注したものから得られた画像であり、図7(e)〜(h)は乾燥後にPCR試薬を分注したものから得られた画像である。
【0073】
図7に示すように、PCR産物のバンドは、Lc−1Sqを乾燥させた場合では、乾燥させなかった場合に対して10倍高濃度であった。すなわち、Lc−1Sqを乾燥させた場合では、PCR産物の量が約10倍多くなることが確認された。これは、乾燥工程においてLc−1Sqの細胞膜が破壊され、細胞質、核質が細胞外に排出され、効率良くPCRが進行したためと推測される。
また、すべてのLc−1Sqでバンドは得られたが、位置と濃さには差が認められた。このように単一細胞の解析により、Lc−1Sqでは、同一株でも細胞により前記領域の増幅の程度に差があることが判明した。
なお、細胞吸引後からデータ取得までに要した時間は3時間であり、簡便かつ迅速に解析できた。
【0074】
(実施例4)
PCR試薬のpHを8.0及び9.1の二通りに調整したこと以外は、実施例3と同様にして解析を行った。
その結果、pH9.1の場合の方が、pH8.0の場合よりもPCRの増幅効率が高いことが確認された。これは、細胞夾雑物によるPCR阻害の抑制がpH調整により可能であることを示すものであった。
このように、上記基板を使用する本発明の解析方法は、PCR阻害の抑制に好適であることが確認された。
なお、細胞吸引後からデータ取得までに要した時間は3時間であり、簡便かつ迅速に解析できた。
【0075】
(比較例2)
吸引したLc−1Sqを、上記基板に代わり市販のサンプルチューブに採取し、QIAeasy(商品名、QIAGEN社製)を使用してDNAを抽出し、該DNAを含むPCR試薬を10μLとして、上記サンプルチューブ内でPCRに供したこと以外は、実施例4と同様に解析を行った。
その結果、pH8.0及び9.1のいずれにおいても、PCRの増幅効率に違いは認められず、pH調整により、細胞夾雑物によるPCR阻害は抑制できないことが示唆された。
なお、細胞吸引後からデータ取得までに要した時間は5時間であり、実施例3の場合よりも手間と時間を要した。
【産業上の利用可能性】
【0076】
本発明は、細胞ごとの遺伝子発現解析に利用可能である。
【図面の簡単な説明】
【0077】
【図1】溶液を保持した状態の本発明における基板を例示する図であり、(a)は斜視図、(b)は(a)のII−II線における断面図である。
【図2】本発明において、落下型のマイクロダイセクションで使用する解析装置を例示する概略構成図である。
【図3】解析装置のステージ近傍を拡大して示す図である。
【図4】他の実施形態にかかる解析装置のステージ近傍を拡大して示す概略構成図である。
【図5】略水平方向に移動可能な二段式のスライドホルダを例示する概略構成図である。
【図6】実施例1における増幅核酸の蛍光強度の測定結果を示すグラフであり、(a)はMMP2由来、(b)はGAPDH由来の蛍光強度の測定結果である。
【図7】実施例3における電気泳動の結果を示す画像であり、(a)〜(d)は細胞を載置直後にPCR試薬を分注したものから得られた画像、(e)〜(h)は細胞を乾燥後にPCR試薬を分注したものから得られた画像である。
【図8】比較例1における増幅核酸の蛍光強度の測定結果を示すグラフであり、(a)はMMP2由来、(b)はGAPDH由来の蛍光強度の測定結果である。
【符号の説明】
【0078】
1・・・解析装置、12・・・接眼レンズ、13・・・ダイクロイックミラー、14・・・絞り、15・・・絞りモータ、17・・・カメラ、4,18・・・スライドホルダ、19・・・ステージ、2・・・基板、20・・・核酸増幅を行うための液、21・・・基板表面、22・・・基板裏面、211・・・第一親水性領域、212・・・第一撥水性領域、213・・・第二親水性領域、214・・・第二撥水性領域、25・・・被覆液、3・・・試料スライド、30・・・生体試料、6・・・光源、7・・・レーザ
【技術分野】
【0001】
本発明は、単一細胞や微小な生体組織に由来する微量な核酸を増幅して、高精度且つ簡便に解析できる増幅核酸の解析方法及び解析装置並びに該解析装置への使用に好適なスライドホルダに関する
【背景技術】
【0002】
単一又は少数の細胞、あるいは微小な生体組織を採取して、その中の遺伝子を解析する研究が近年盛んとなっている。例えば、癌組織中の細胞をマイクロダイセクション(顕微解剖または顕微切断)により採取し、癌細胞のみの遺伝子発現を解析したり、隣り合う神経細胞の個々における遺伝子発現レベルを解析する研究が為されている。具体例を挙げると、同一個体のカタツムリの神経細胞でCREBs遺伝子の発現量を比較することにより、細胞によって10倍程度の発現量の差があることが見出されている(非特許文献1参照)。このような研究から、細胞が一つずつ遺伝子レベルで別々に働いていることが判明し、特に、癌細胞、神経細胞、胚などにおいては、単一細胞レベルで解析を行うことが重要となってきており、様々な技術が検討されている。したがって、単一細胞や微小な生体組織等の生体試料を採取する技術は、解析の精度を左右する重要な技術である。
【0003】
生体試料を採取する方法としては、これまでにマイクロダイセクション、マイクロマニピュレーター、フローサイトメトリー(FACS)などが知られている。
マイクロダイセクションとは、例えば、細胞や組織薄片のプレパラートなど、通常は平坦な標本に、細いレーザ光線を照射し、解析対象の細胞又は組織の小切片を切り取る方法であり、生物学及び医学の分野において汎用されている。切り取られた切片は、通常サンプルチューブに捕獲されて核酸を抽出され、引き続きDNA解析や遺伝子発現解析が行われる。
マイクロマニピュレーターとは、解析対象である細胞の近傍に、細いガラス管の先端を配して陰圧をかけることによって、細胞や体液を吸引する方法である。捕獲対象が微小であるため、通常は顕微鏡下で、ガラス管の先端をマイクロメートル単位でXYZ軸方向にそれぞれ動かせるような構成の装置を使用する。
フローサイトメトリーとは、細胞浮遊液を高速で流しながら、レーザ光を照射して、細胞一つずつにつき、その大きさ、細胞内構造、蛍光強度などについて解析する手法であり、レーザ光のセルソート機能により、特定の特徴をもつ細胞だけを採取することが可能である。
そして、これらいずれの方法においても、採取した細胞や組織切片を捕獲する容器として、通常はチューブ型、コップ型又はキャップ型の容器が使用されている。
【0004】
採取した細胞や組織切片の捕獲方法として、具体的には、これまでに以下のような方法が知られている。
特許文献1には、ライカ社の落下型試料捕獲法を適用したマイクロダイセクションについて記載されている。この方法では、試料はガラススライド上に張り付けられた高分子支持フィルム上に配置され、試料の解析対象領域がレーザ光線によって切り取られて試料から切片が分離され、重力の作用によって容器中に落下及び捕獲される。容器はコップ型で、引き出し式に収納でき、かつガラスライド近傍に配置できるように移動可能となっている。この方法では、次いで増幅反応を行うための反応液などを容器に予め入れておき、落下させた試料切片を直接反応液中に捕獲できる。
特許文献2には、Arcturus社のフィルム接着型試料捕獲法を適用したマイクロダイセクションについて記載されている。この方法では、ガラススライド上の生体試料の上部に、熱可塑性フィルムが上部に配され、中央部に観察ポートが設けられたキャップ型の容器を配置し、顕微鏡視野のターゲット領域内に位置するようにガラススライドを移動させ、パルスをレーザから発振させる。レーザパルスは熱可塑性フィルムを通過する際にこれを局所的に加熱し、その結果当該箇所が粘着性を有するようになり、生体試料はこの局所的な粘着領域に付着することで捕獲される。
【特許文献1】特開2002−168740号公報
【特許文献2】特表2001−519898号公報
【非特許文献1】J.Exp.Biol.,2005 Jun;208(Pt12):2389−98.
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかし、特許文献1に記載の方法では、容器中の試料切片の有無や様子を顕微鏡で確認できない。そのため、試料切片が容器中に捕獲されなかったり、容器内壁に付着して溶液中に浸漬されていない状態のまま解析が行われることがある。また、試料切片の状態が悪いまま解析が行われることもある。したがって、正しく解析できず、しかもその原因が特定できないことがあるという問題点があった。
また、試料切片を捕獲して容器内の溶液に確実に浸漬させるためには、試料切片と溶液とが接触する可能性を高くする必要があり、試料切片が微小でも数十μl程度と多量の溶液が必要になる。このような低濃度の溶液を解析に供すると、解析時に核酸濃度が検出限界に到達しないことがあり、確実に解析データを取得するためには、溶液を数μl程度にまで濃縮してから解析に供する必要がある。そこで、例えば、溶液中で試料切片から核酸を抽出後、エタノール沈殿法やカラム精製法を利用して核酸を濃縮し、得られた核酸全量を増幅して電気泳動などの解析に供したり、核酸を抽出することなく試料切片中で直接増幅させ、次いで同様に濃縮して解析に供する。このように濃縮を伴う解析では、煩雑な作業と数時間にも及ぶ作業時間を要し、遠心分離機などの専用装置を必要とするため、解析が煩雑で自動化が困難であるという問題点があった。
【0006】
また、特許文献2に記載の方法では、容器の中央部に設けられた観察ポートを通じて、容器中の生体試料の有無や様子を確認できるので、正しく解析できる。しかし、容器がキャップ型であり、遠心分離用のチューブ型容器に接続して使用するため、捕獲した細胞を浸漬させるのに数十μl程度と多量の溶液が必要になる。したがって、特許文献1に記載の方法と同様に、溶液を濃縮する必要があるという問題点があった。
【0007】
そしてこれら特許文献に記載の方法は、マイクロダイセクションを利用するものであるが、マイクロマニピュレーターやフローサイトメトリーを利用する方法でも、チューブ型の容器を使用するため、容器中の細胞の有無や様子を確認できず、細胞を溶解させるために多量の溶液を必要とし、特許文献1及び2に記載の方法と同様の問題点があった。
【0008】
本発明は上記事情に鑑みてなされたものであり、単一細胞や微小な生体組織に由来する微量な核酸を増幅して、高精度且つ簡便に解析できる、増幅核酸の解析方法及び解析装置を提供すること課題とする。
【課題を解決するための手段】
【0009】
上記課題を解決するため、
請求項1に記載の発明は、生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する方法であって、生体試料を採取する工程と、表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられた基板を使用し、前記試料保持部において、採取した生体試料を、核酸増幅を行うための液に浸漬させ、該生体試料を含有する液の総液量を0.2〜3μLとして保持する工程と、保持された生体試料の有無及び/又は形態を観察する工程と、前記試料保持部において前記生体試料に由来する核酸を増幅する工程と、増幅された核酸のシグナルを検出する工程と、を有し、前記生体試料の観察結果が、あらかじめ定められた所定の条件を満たした場合にのみ、前記シグナルの検出結果を解析に使用することを特徴とする増幅核酸の解析方法である。
請求項2に記載の発明は、前記基板において、さらに前記第一撥水性領域の外側周縁部を包囲する第二親水性領域と、該第二親水性領域の外側周縁部を包囲する第二撥水性領域とが設けられていることを特徴とする請求項1に記載の増幅核酸の解析方法である。
請求項3に記載の発明は、前記試料保持部に保持した生体試料から核酸の抽出を行わずに核酸増幅を行うことを特徴とする請求項1又は2に記載の増幅核酸の解析方法である。
請求項4に記載の発明は、前記核酸増幅を行うための液に浸漬前に、保持した前記生体試料を乾燥させることを特徴とする請求項1〜3のいずれか一項に記載の増幅核酸の解析方法である。
請求項5に記載の発明は、前記生体試料を採取する工程において、マイクロダイセクション法、マイクロマニピュレーター法又はフローサイトメトリー法を利用することを特徴とする請求項1〜4のいずれか一項に記載の増幅核酸の解析方法である。
請求項6に記載の発明は、前記生体試料を採取する工程を顕微鏡観察下で行うことを特徴とする請求項1〜5のいずれか一項に記載の増幅核酸の解析方法である。
請求項7に記載の発明は、前記試料保持部上の生体試料を含有する液を、該液よりも比重が小さく且つ沸点が100℃以上である非水溶性の液体で被覆してから核酸を増幅することを特徴とする請求項1〜6のいずれか一項に記載の増幅核酸の解析方法である。
請求項8に記載の発明は、前記核酸増幅を行うための液のpHが8.5〜9.5であることを特徴とする請求項1〜7のいずれか一項に記載の増幅核酸の解析方法である。
請求項9に記載の発明は、前記核酸増幅を行うための液に界面活性剤又はプロテアーゼを含有させることを特徴とする請求項1〜8のいずれか一項に記載の増幅核酸の解析方法である。
請求項10に記載の発明は、前記核酸増幅を行うための液にジチオトレイトール及び/又は硫酸化多糖を含有させることを特徴とする請求項1〜9のいずれか一項に記載の増幅核酸の解析方法である。
請求項11に記載の発明は、前記核酸増幅を行うための液にウシ血清アルブミンを含有させることを特徴とする請求項1〜10のいずれか一項に記載の増幅核酸の解析方法である。
請求項12に記載の発明は、前記核酸増幅を行うための液に、増幅核酸を蛍光標識する蛍光物質を含有させ、増幅核酸の蛍光強度を定量し、増幅核酸を定量することを特徴とする請求項1〜11のいずれか一項に記載の増幅核酸の解析方法である。
【0010】
請求項13に記載の発明は、生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する装置であって、採取対象の生体試料を固定するプレートを具備した試料固定手段と、固定された前記生体試料にレーザを照射して生体試料を切り出す照射手段と、切り出された生体試料を保持すると共に該生体試料に由来する核酸を増幅するための試料保持部を有する基板と、前記基板を支持及び温度調節するステージと、増幅核酸のシグナルを検出するシグナル検出手段と、を備え、前記基板は、その表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられていることを特徴とする増幅核酸の解析装置である。
請求項14に記載の発明は、請求項13に記載の増幅核酸の解析装置に備えるスライドホルダであって、前記プレート及び基板を固定すると共に、該プレート及び基板の少なくとも一方を、その表面と略平行な面内において移動させる手段を備えることを特徴とするスライドホルダである。
【発明の効果】
【0011】
本発明によれば、単一細胞や微小な生体組織に由来する微量な核酸を増幅して、高精度且つ簡便に解析できる。
【発明を実施するための最良の形態】
【0012】
以下、図面を参照しながら、本発明について詳しく説明する。
本発明に係る増幅核酸の解析方法は、生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する方法であって、生体試料を採取する工程と、表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられた基板を使用し、前記試料保持部において、採取した生体試料を、核酸増幅を行うための液に浸漬させ、該生体試料を含有する液の総液量を0.2〜3μLとして保持する工程と、保持された生体試料の有無及び/又は形態を観察する工程と、前記観察結果から、核酸増幅の進行可否を判断する工程と、核酸増幅を進行可と判断した場合に、前記試料保持部において前記生体試料に由来する核酸を増幅する工程と、増幅された核酸のシグナルを検出する工程と、を有することを特徴とするものである。
ここで生体試料とは、生体に由来し解析対象の核酸を含有するものであればいずれでも良く、各種生体組織、細胞、体液等が例示できる。そして、生体試料に由来する核酸とは、前記生体試料中に元来含まれている核酸を指し、生体試料中に含まれたままの状態の核酸や、生体試料から抽出された核酸等を指す。
【0013】
生体試料を採取する工程においては、主に基板表面の所定箇所に配置できるように生体試料を取得する。例えば、生体組織の一部から所望の組織切片を切り出したり、生体組織や複数の細胞の中から所望の細胞を抽出又は選別する操作等を行う。
【0014】
採取した生体試料は、基板表面の試料保持部に保持する。
本工程において使用する基板は、その表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられたものである。このような基板の一例として、液体を保持した状態のものを図1に例示する。図1(a)は、基板2の斜視図、(b)は(a)のII−II線における基板2の断面図である。
【0015】
基板2は透光性の材質からなるものが好ましい。透光性の材質とは、光の透過率が高く且つ自家蛍光の少ない材質を指し、具体的にはガラス類や透明な樹脂類が例示できる。なかでも好ましいものとしては、水板ガラス、白板ガラス、ハーフホワイトガラス等のガラス類が例示できる。
基板2は、表面21及び裏面22が平滑なものが好ましい。ここで、基板の表面21とは、後記する試料保持部が設けられている側の基板2の面を指し、基板の裏面22とは、前記表面21とは反対側の基板2の面を指す。
基板2の大きさは特に限定されず、例えば表面21及び裏面22の大きさは、目的に応じて適宜選択し得る。ただし、基板2の厚みは、光の透過率が良好であるという観点からは薄いほど好ましく、基板2の強度も考慮して取り扱いのし易さという観点からは、0.9〜1.1mmであることが好ましい。
【0016】
図1(b)に示すように、基板の表面21には、試料保持部となる第一親水性領域211と、該第一親水性領域211の周縁部を包囲する第一撥水性領域212とが設けられている。第一親水性領域211は平面状であり、採取した生体試料を、核酸増幅を行うための液と共に保持する部位であり、検出対象の増幅核酸を得るために、核酸増幅を行う部位でもある。すなわち、液体20は、生体試料を含有する液であり、例えば、核酸増幅前の増幅反応に供する液や、核酸増幅中又は増幅後の反応液である。前記核酸増幅を行うための液とは、プライマーや酵素等、増幅反応に必要な成分を含有する液であり、増幅反応の種類により異なり、前記酵素としては、逆転写酵素やDNAポリメラーゼが例示できる。核酸増幅を行うための液としては、市販品を使用しても良い。増幅方法の特性から、液体20は、通常水溶液である。
【0017】
液体20は、第一親水性領域211上で安定して保持される。そして、第一撥水性領域212を設けることで、液体20の移動が抑制されるので、液体20がより安定して保持される。第一親水性領域211は、平面状であればその外形は特に限定されず、目的に応じて選択すれば良いが、図1に示すように略円形状が好ましい。第一撥水性領域212も平面状であることが好ましい。そしてその外形は特に限定されず、目的に応じて選択すれば良いが、リング状であることが好ましい。このようにすることで、液体20がより安定して保持される。
【0018】
基板の表面21においては、図1に示すように、第一撥水性領域212の外側周縁部を包囲する第二親水性領域213と、該第二親水性領域213の外側周縁部を包囲する第二撥水性領域214とが設けられていることが好ましい。このようにすることで、保持された液体20の蒸発を防ぐために、被覆液25で液体20を被覆した際に、被覆液25も安定して保持できる。第二親水性領域213及び第二撥水性領域214は平面状であることが好ましい。そして、第二親水性領域213の外形は特に限定されないが、リング状であることが好ましい。このようにすることで、被覆液25がより安定して保持される。また、第二撥水性領域214の外形はリング状でも良いし、その他の形状でも良く、特に限定されない。そして、第一親水性領域211、第一撥水性領域212及び第二親水性領域213は、同心状に設けられていることが好ましい。
【0019】
被覆液25としては、液体20の主溶媒である水の蒸発を抑制し、核酸増幅時における液体20の加温にも耐えるようにするという目的から、液体20よりも比重が小さく且つ沸点が100℃以上である非水溶性の液体を使用する。このような物性を有するものであれば如何なるものも使用し得るが、好ましい市販品として、各種ミネラルオイルが例示できる。液体20を直接被覆することで、マイクロタイタープレートやサンプルチューブを使用した場合のように、液体20近傍に多量の空気層が存在することがなく、例えば、ポリメラーゼ連鎖反応(以下、PCRと略記する)法の熱サイクル中に液体20が蒸発することがなく、液体20の濃度変化が抑制されるので、安定して核酸増幅を行うことができる。
そして、基板の表面21に、第二親水性領域213及び第二撥水性領域214を設けることで、上記のような物性を有する被覆液25の移動が、第一撥水性領域212及び第二撥水性領域214により抑制される。
【0020】
親水性領域及び撥水性領域の寸法は、目的に応じて適宜選択し得る。例えば、0.2〜3μL程度の極微量の液体20を保持する場合には、第一親水性領域211の直径D1は0.5mm〜6mmとすることが好ましく、第一撥水性領域212の幅L1及び第二親水性領域213の幅L2は0.2mm〜3mmとすることが好ましい。第二撥水性領域214の寸法は、基板2の大きさや試料保持部の数を考慮して、任意に選択し得る。例えば、図1に示すように、第二親水性領域213の外側全面を第二撥水性領域214としても良い。
【0021】
親水性領域及び撥水性領域を有する基板2は、公知の方法で作製できる。具体的には、基板表面に親水処理及び撥水処理を施す方法、親水性基板表面に撥水処理を施す方法が例示できる。
親水処理としては、水酸基、アミノ基又はカルボキシ基等の親水性の官能基を基板表面に導入するものが例示できる。撥水処理としては、アルキル基、アルケニル基、アルコキシ基又はアルケニルオキシ基等の低極性の官能基や、一つ以上の水素原子がフッ素原子で置換されたアルキル基又はアルコキシ基等の疎水性の官能基を基板表面に導入するものが例示できる。
このような、親水性領域及び撥水性領域を有する基板2としては市販品を使用しても良く、例えば、極微量の液体20を保持する目的においては、Advalytix社製のAmpliGrid(商標)が好適である。
【0022】
生体試料を採取する方法は特に限定されず、目的に応じて公知の方法から適宜選択できる。例えば、マイクロダイセクション、マイクロマニピュレーター又はフローサイトメトリーを利用する方法が例示できる。
【0023】
例えば、マイクロダイセクションは、落下型及びフィルム接着型のいずれも適用できる。
マイクロダイセクションを利用する方法で使用する解析装置としては、例えば、通常の顕微鏡に、レーザを照射して生体試料の切り出し等を行う照射手段と、レーザ照射に供する採取対象の生体試料を固定するプレートを具備した試料固定手段等を設けたものが使用できる。図2は、落下型のマイクロダイセクションを利用する方法で使用する解析装置を例示する概略構成図である。
【0024】
図2中、光源6から照射されたレーザ7は、絞り14を介してダイクロイックミラー13に到達し、ここで反射後、採取対象の生体試料に照射される。絞り14は、コンピュータ16に電気的に接続された絞りモータ15により制御される。このように、ここでは光源6、絞り14、絞りモータ15及びダイクロイックミラー13等が、照射手段を構成する。
【0025】
一方、基板2の所定箇所に採取された生体試料は、観察用光源5から照射され、集光レンズ11で集光された光により、その像が対物レンズ9及びダイクロイックミラー13を通じて接眼レンズ12において観察でき、さらにカメラ17によって撮像できるようになっている。ダイクロイックミラー13は、レーザ7を反射する一方、観察用光源5からの光を通過させる。図2中、符号10は光軸である。カメラ17としては、CCDカメラが好ましく、図2に示すように、コンピュータ16に電気的に接続されていることが好ましい。このようにすることで、撮像の回数、タイミング、露光時間等の条件の制御や、撮像データの記録及び処理を自動で行うことができる。また、後記するように、採取された生体試料が核酸増幅を正常に行える状態にあるかどうかも自動で判断できる。
【0026】
スタンド8には、略水平方向へ移動可能にステージ19が設けられており、該ステージ19上に基板2が設置できるようになっている。すなわち、ステージ19を移動させることで、基板2の略水平方向における配置位置を調整できるようになっている。
また、基板2の所定箇所に載置する生体試料を採取するために、採取に供する生体試料を保持する試料スライド3がスライドホルダ18に着脱可能に固定されており、さらにスライドホルダ18は、略水平方向へ移動可能にスタンド8に設置されている。すなわち、スライドホルダ18を移動させることで、試料スライド3の略水平方向における配置位置を調整できるようになっている。そして、スライドホルダ18には、レーザや観察用光源5からの光を通過させる通過孔181が穿設されている。
このように、ここでは試料スライド3及びスライドホルダ18等が試料固定手段を構成する。なお、基板2及び試料スライド3の少なくとも一方は、鉛直方向へも移動可能とされていることが好ましい。
【0027】
図3は、生体試料採取時における、解析装置1のステージ19近傍を拡大して示す図である。
ステージ19上には、裏面22を設置面として基板2が設置されている。そして、基板2の表面21には、試料保持部となる第一親水性領域211が設けられている。
試料スライド3の下面、すなわち前記基板2と略平行に対向する面の所定箇所には接着フィルム31が貼付され、該接着フィルム31上に、切片の採取に供する生体試料30が貼付されている。このように、試料スライド3表面に接着フィルム31を貼付するためには、接着フィルム31を試料スライド3表面に接触させ、後記する生体試料切片の接着部以外のいずれかの部位を加熱すれば良い。そして、接着フィルム31上に生体試料30を貼付するためには、例えば、生体試料30を接着フィルム31に接触させ、該接触箇所にレーザ等を照射して接着フィルム31を加熱すれば良い。
【0028】
ここで接着フィルムとは、レーザ照射等の加熱操作により接着性を発現するフィルムであり、熱可塑性フィルムが好ましく、その材質として具体的には、ポリエチレン(低密度ポリエチレン、中密度ポリエチレン、高密度ポリエチレン)、ポリプロピレン、ポリスチレン、ポリ塩化ビニル、ポリ酢酸ビニル、アクリル樹脂、ABS樹脂、AS樹脂、ポリイミド樹脂、ポリウレタン樹脂、エチルビニルアセテート(EVA)樹脂が例示でき、透明度の高いものが好ましい。接着フィルム31の厚さは特に限定されないが、5〜600μmであることが好ましい。
【0029】
落下型のマイクロダイセクションにおいては、所望の生体試料切片を採取するために、生体試料30の採取対象の領域が、略水平方向において基板2の第一親水性領域211に重なるように、生体試料30の配置位置を調整する必要がある。そのためには、スライドホルダ18及びステージ19の少なくとも一方を移動させることで、基板2及び試料スライド3の少なくとも一方の略水平方向の配置位置を調整すると良い。配置位置の調整は、例えば、以下の手順により一層精密に行うことができる。すなわち、まず、試料スライド3をスライドホルダ18に固定する。この時の固定方法は特に限定されず、図示するように、スライドホルダ18の保持枠180に試料スライド3を係合させる方法でも良いし、その他の方法でも良い。このように試料スライド3を固定した後、顕微鏡の接眼レンズ12の焦点を基板2に合わせて、ステージ19を略水平方向に移動させ、基板2の第一親水性領域211が視野に入るように調整する。次いで、生体試料30に焦点を合わせ、採取対象の領域が第一親水性領域211のほぼ真上に位置するように、顕微鏡で確認しながらスライドホルダ18を移動させて試料スライド3を略水平方向に移動させる。
【0030】
落下型のマイクロダイセクションにおいては、レーザのエネルギーにより、生体試料がその切断面以外は極力傷まないようにすることが好ましい。そのためには、前記接着フィルム31として、レーザのエネルギーを吸収し得る前記熱可塑性の接着フィルムや、前記試料スライド3として、エネルギートランスファーコーティングが施されたスライドを使用して、生体試料30をスライド上に配置すると良い。この場合、レーザのエネルギーを吸収し得る接着フィルム及びエネルギートランスファーコーティングスライドのいずれか一方を使用しても良いし、両方を使用すれば一層高い効果が得られる。ここで、レーザのエネルギーを吸収し得る熱可塑性の接着フィルムとしては、特に好ましいものとして、エチルビニルアセテート(EVA)フィルムが例示できる。また、エネルギートランスファーコーティングスライドとしては、例えば、AMR社製のDIRECTORTMが例示できる。
【0031】
配置位置の調整後は、レーザを照射して生体試料30及び接着フィルム31を切断する。この時、エネルギートランスファーコーティングスライドを使用した場合には、エネルギートランスファーコーティングも切断する。このようにすることで、生体試料30から切片を接着フィルム31と共に切り出す。この時のレーザの照射条件は、生体試料30、接着フィルム31及びエネルギートランスファーコーティングスライドの種類に応じて適宜設定すれば良いが、通常、接着フィルム31又はエネルギートランスファーコーティングに接着性を発現させる場合よりも、レーザの照射量が多くなるように設定する。
切り出された生体試料切片は、共に切り出された接着フィルム31又はエネルギートランスファーコーティングが試料スライド3に接着していないので、基板上の第一親水性領域211上に落下して捕獲される。基板2と試料スライド3との間の距離は、生体試料切片が第一親水性領域211上に確実に落下するように、適宜調整しても良い。そのためには、例えば、スライドホルダ18及びステージ19の少なくとも一方を略鉛直方向に移動させて、基板2及び試料スライド3の少なくとも一方の鉛直方向の配置位置を調整すれば良い。
前記操作を繰り返すことにより、複数の生体試料切片を切り出して、それぞれ異なる第一親水性領域211に捕獲できる。
【0032】
スライドホルダ18又はステージ19を略水平方向又は略鉛直方向に移動可能とする方法は、公知のものから適宜選択すれば良い。例えば、最も単純な構成として、スライドホルダ18又はステージ19を支持する部材に歯車を設け、スライドホルダ18又はステージ19に、該歯車に係合する突起部を列設して、該歯車と連動するようにしたものが挙げられる。
【0033】
図5は、本発明において使用するのに好適な、略水平方向に移動可能とされた二段式のスライドホルダ4を例示する概略構成図である。
スライドホルダ4において、第一のスライド40Aを固定する第一ホルダ41は、略水平方向のうちX軸方向に移動可能な第一可動部41Aと、略水平方向のうちX軸方向に直交するY軸方向に移動可能な第二可動部41Bとを有する。第一可動部41A及び第二可動部41Bには、レーザや観察用光源5からの光を通過させる第一通過孔411A及び第二通過孔411Bが穿設されている。そして、第一のスライド40Aは、図3に例示する固定方法と同様の方法で、第二可動部41Bの保持枠410に係合され、固定されている。また、前記第一可動部41A及び第二可動部41Bは、第一ホルダ41に設けられた第一のハンドル43を回転させることで作動するようになっている。
【0034】
スライドホルダ4において、第二のスライド40Bを固定する第二ホルダ42は、前記X軸方向に移動可能な第一可動部42Aと、前記Y軸方向に移動可能な第二可動部42Bとを有する。第一可動部42A及び第二可動部42Bには、レーザや観察用光源5からの光を通過させる第一通過孔421A及び第二通過孔421Bが穿設されている。そして、第二のスライド40Bは、第一のスライド40Aと同様に、第二可動部42Bの保持枠420に係合され、固定されている。また、前記第一可動部42A及び第二可動部42Bは、第二ホルダ42に設けられた第二のハンドル44を回転させることで作動するようになっており、その構成は前記第一可動部41A及び第二可動部41Bと同様である。
【0035】
そして、第一ホルダ41及び第二ホルダ42は、第一の支持部材401及び第二の支持部材402で支持されている。また、第一の支持部材401及び第二の支持部材402が立設されている底面403上には、図2及び3に例示したものと同様の観察用光源45が設けられている。ただし、スライドホルダ4において、観察用光源45は省略することも可能である。また、第一通過孔411A及び第二通過孔411B、並びに第一通過孔421A及び第二通過孔421Bは、いずれも、第一のスライド40A及び第二のスライド40Bの大きさを考慮して、適宜形状や大きさを設定すれば良い。
このように、スライドホルダ4において、第一ホルダ41及び第二ホルダ42は、それぞれX軸方向及びY軸方向に別々に作動する部位により、その略水平方向の位置が調整される。そして例えば、図2及び3において、スライドホルダ18、ステージ19及び観察用光源5を、ここに示すスライドホルダ4と置き換えることができる。
【0036】
一方、フィルム接着型のマイクロダイセクションを利用する方法で使用する解析装置としては、図3に示した基板2、試料スライド3及び接着フィルム31の配置形態を図4に示すように変更し、試料スライド3に代わり基板2をスライドホルダ18に固定するようにしたこと以外は、前記解析装置1と同様のものが例示できる。
フィルム接着型のマイクロダイセクションにおいては、図4に示すように、ステージ19上に、試料スライド3が設置され、該試料スライド3上には、生体試料30が載置される。そして基板2は、その表面のうち少なくとも第一親水性領域211上が接着フィルム31で被覆されるように、接着フィルム31が貼付され、該第一親水性領域211が試料スライド3と略平行に対向するように、表面21を下向きにしてスライドホルダ18に固定される。基板2表面に接着フィルム31を貼付する方法は、先に述べたような試料スライド3表面に接着フィルム31を貼付する方法と同様で良い。ただし、接着フィルム31は、第一親水性領域211に接着されていても良いし、されていなくても良い。
【0037】
そして、前記落下型の場合と同様に、生体試料30の略水平方向の配置位置を調整する。
次いで、基板2と生体試料30とが接触するように、スライドホルダ18及びステージ19の少なくとも一方を略鉛直方向に移動させて、基板2及び試料スライド3の少なくとも一方の鉛直方向の配置位置を調整する。
基板2の配置位置の調整後は、レーザを照射して生体試料30及び接着フィルム31を切断し、生体試料30から切片を切り出す。この時のレーザの照射条件は、前記落下型の場合と同様で良い。
次いで、切断された接着フィルム31のうち、生体試料切片と接触している部位にレーザを照射して加熱することで、生体試料切片を接着させ、基板2の第一親水性領域211上に生体試料切片を捕獲する。基板2への接着フィルム31貼付時に、接着フィルム31が基板2の第一親水性領域211へ接着されていなくても、この時のレーザ照射によって接着されることになる。
捕獲後は、例えば、基板2をステージ19上に設置するなど、反転させ、その表面21が上を向くようにすれば、生体試料切片が第一親水性領域211上に保持され、後記するように核酸増幅に供することが可能となる。
【0038】
上記落下型及びフィルム接着型のいずれの場合も、切断された接着フィルムは微小であり、マイクロダイセクション終了後に、これを基板から除去することが困難である場合が多い。このような場合には、続く生体試料を観察する工程、核酸を増幅する工程及び増幅核酸のシグナルを検出する工程はいずれも、切断された接着フィルムの存在下で行っても良い。ただし、このような場合には、接着フィルムとして、核酸増幅反応を阻害せず、かつシグナルの検出を阻害しないよう自家蛍光が弱い材質からなるものを使用することが好ましい。通常、先に例示した材質の接着フィルムであれば、いずれも好適に使用でき、なかでもEVAフィルムが特に好ましい。
【0039】
一方、マイクロマニピュレーター又はフローサイトメトリーを利用する場合には、公知の方法で生体試料を採取できる。例えば、マイクロマニピュレーターを利用する場合には、顕微鏡観察下にて細いガラス管等を使用して所望の生体試料を吸引して採取すれば良いし、フローサイトメトリーを利用する場合には、セルソーターにより所望の生体試料を選別して採取すれば良い。
採取した生体試料は、前記基板2の第一親水性領域211上に載置すれば良い。
【0040】
採取した生体試料が生体組織や細胞等である場合には、液体20に浸漬させる前に、乾燥させることが好ましく、試料保持部上において乾燥させることがより好ましい。ここで、生体試料を乾燥させるとは、生体試料の水分含有率を低減させることを指す。生体試料を乾燥させることで、細胞質や核質が生体試料外に排出され、核酸増幅を行うための液と直接接触し易くなり、核酸増幅を円滑に行うことができる。
乾燥方法は適宜選択でき、例えば、採取後に生体試料を常温で所定時間静置するだけでも良いし、常温で送風乾燥しても良く、生体試料が劣化しない範囲内で加熱しても良い。常温で静置する場合には、静置時間は特に限定されないが、10分以下で十分であり、4〜8分程度であることが好ましい。
【0041】
試料保持部上で、液体20に浸漬させた状態で生体試料を保持する場合には、例えば、試料保持部上に予め保持された液体20に生体試料を添加する方法(以下、方法(A)と略記する)、試料保持部上に予め載置された生体試料に液体20を添加する方法(以下、方法(B)と略記する)のいずれかを適用すれば良い。生体試料を乾燥させる場合や、液体20の飛散を抑制したい場合には、方法(B)が好ましい。
また、液体20を被覆液25で被覆する場合には、方法(A)においては、生体試料を添加後に被覆液25を液体20に添加すれば良く、方法(B)においては、液体20を添加後に被覆液25を液体20に添加すれば良い。
【0042】
生体試料を含有する液体20の総液量は0.2〜3μL、好ましくは0.5〜2μLとする。本発明においては、平面状の試料保持部で核酸増幅を行い、そのまま増幅核酸を解析できるので、生体試料を含有する液体20の液量が極微量でも、高精度に解析できる。
また被覆液25の量は、液体20を被覆できる範囲で選択すれば良いが、例えば、液体20の総液量が上記範囲である場合には、1〜10μLであることが好ましく、2〜8μLであることがより好ましく、4〜6μLであることが特に好ましい。
【0043】
保持された生体試料は、引き続き試料保持部に保持されているか、どのような形態か、少なくともいずれかについて観察する。すなわち、保持された生体試料の有無及び/又は形態を観察する。これは、核酸増幅を正確に行うことができるか確認したり、増幅核酸のシグナルの検出結果が解析に使用し得るような信頼性の高いものかどうかを判断するためである。
生体試料の観察は、例えば、以下のように行えば良い。生体試料の採取に、図2又は3に例示した解析装置を使用してマイクロダイセクションを利用した場合には、前記解析装置に備えられた対物レンズからの像や、カメラの撮像データを観察すれば良い。生体試料の採取に、マイクロマニピュレーター又はフローサイトメトリー等、マイクロダイセクション以外の方法を利用した場合には、生体試料を保持した基板を顕微鏡に設置して、対物レンズからの像を観察すれば良い。この時の顕微鏡としては、例えば図2に示すように、カメラ等の撮像手段を備えたものが好ましく、該撮像手段がコンピュータに電気的に接続されたものがより好ましい。このような顕微鏡を使用することで、自動で撮像データの記録やデータ処理を行うことができる。また、後記するように、保持された生体試料が核酸増幅を正常に行える状態にあるかどうかも自動で判断できる。
【0044】
生体試料の観察結果は、増幅核酸のシグナル検出結果を解析に使用するか否かを判断するため、あらかじめ定められた所定の条件と比較する。ここで所定の条件とは、核酸増幅が正常に行われるために必要な条件のことであり、具体的には、生体試料が試料保持部に保持されていること、試料保持部に保持された生体試料が核酸増幅対象の所望のものであること、生体試料が核酸増幅を行うための液体20に浸漬されていること、生体試料が著しく劣化していないこと等を指す。
【0045】
生体試料の観察結果と所定の条件との比較を行う時期は、生体試料の観察結果を得た後であれば、いずれでも良い。具体的には、
(A)生体試料に由来する核酸を増幅する工程の前
(B)生体試料に由来する核酸を増幅する工程の途中
(C)生体試料に由来する核酸を増幅する工程と、増幅された核酸のシグナルを検出する工程との間
(D)増幅された核酸のシグナルを検出する工程の途中
(E)増幅された核酸のシグナルを検出する工程の後
が例示できる。生体試料に由来する核酸を増幅する工程、増幅された核酸のシグナルを検出する工程については、後ほど詳細に説明する。
【0046】
前記比較を行う時期が(A)である場合には、(1)生体試料の観察結果が所定の条件を満たした場合には、次いで核酸の増幅を行い、満たさなかった場合には、核酸増幅を行わず、解析を中止するのが好ましい。
前記比較を行う時期が(B)である場合には、(2)生体試料の観察結果が所定の条件を満たした場合には、引き続き核酸増幅を行い、満たさなかった場合には、核酸増幅を中止して、解析を中止すると良い。
このようにすることで、生体試料が適した状態にある場合にのみ、核酸増幅を行うことで、解析を確実かつ高精度に行うことができる。
【0047】
前記比較を行う時期が(C)である場合には、(3)生体試料の観察結果が所定の条件を満たした場合には、次いでシグナルの検出を行い、満たさなかった場合には、シグナルの検出を行わず、解析を中止するのが好ましい。
前記比較を行う時期が(D)である場合には、(4)生体試料の観察結果が所定の条件を満たした場合には、引き続きシグナルの検出を行い、満たさなかった場合には、シグナルの検出を中止して、解析を中止するのが好ましい。
前記比較を行う時期が(E)である場合には、(5)生体試料の観察結果が所定の条件を満たした場合には、シグナルの検出結果を解析に使用し、満たさなかった場合には、シグナルの検出結果を解析に使用しなければ良い。
このようにすることで、核酸増幅が正常に行われた場合にのみ、シグナルの検出結果を解析に使用することで、解析を高精度に行うことができる。
ここで解析とは、例えば、シグナルの検出結果を生体試料のデータとして採用し、所定の生体試料間での比較検討に使用することを示す。
【0048】
本発明においては、上記に限定されず、例えば、前記比較を行う時期が(A)である場合には、(1)以外に(2)〜(5)のいずれかを適用しても良い。また、前記比較を行う時期が(B)である場合には、(2)以外に(3)〜(5)のいずれかを適用しても良い。また、前記比較を行う時期が(C)である場合には、(3)以外に(4)又は(5)を適用しても良い。また、前記比較を行う時期が(D)である場合には、(4)以外に(5)を適用しても良い。このように本発明においては、前記比較を行う時期によって、解析の継続又は中止の判断を様々な段階で行うことができる。
ただし、無駄な操作を省略して工程を簡略化するという観点からは、前記比較を行う時期を(A)として(1)を適用するのが好ましい。
また、工程を円滑に行うという観点からは、前記比較を行う時期を(E)として(5)を適用するのも好ましい。例えば、臨床検査などのルーチーンな大量アッセイにおいては、この方が規則的な作業ができ、作業効率を高めることができる。また、観察結果とシグナルの検出結果との関係を考察することで、解析を高精度に行うために使用できる生体試料の条件を絞り込むこともできる。
【0049】
核酸増幅は、第一親水性領域211において、核酸増幅を行うための液に生体試料を浸漬させて、これらを保持した状態で行う。
そして、増幅反応は、基板2を使用すること以外は、公知の方法で行えば良く、例えば、PCR法、LAMP法等の等温増幅法、whole−Genome−amplification法等が適用できる。
【0050】
増幅反応を行う際は、例えば、生体試料を保持した基板2を、増幅装置の所定箇所に設置して反応を行えば良い。
また、生体試料の採取に、マイクロダイセクションを利用する場合には、例えば、図2又は3に例示した解析装置1において、ステージ19をサーマルサイクラー等の温調手段と一体化させた装置を使用すると良い。そして、生体試料の採取に、マイクロマニピュレーター又はフローサイトメトリー等、マイクロダイセクション以外の方法を利用する場合には、生体試料観察時の前記顕微鏡において、同様にステージをサーマルサイクラー等の温調手段と一体化させた装置を使用すると良い。このように、ステージと温調手段を一体化した装置を使用すれば、生体試料の観察後に、基板2を移動させることなく、そのまま引き続き核酸増幅を行うことができ、解析操作を簡略化できる。
【0051】
温調手段は、加温及び冷却が可能な公知のものから適宜選択して使用できる。
【0052】
温調手段は、基板2の支持を妨げない配置でステージ19表面近傍において露出されていても良いし、ステージ19表面の熱伝導部位に接してステージ19に設けられていても良い。
温調手段及びステージの、熱伝導部位の材質は、耐熱性で且つ熱伝導性の高いものが好ましく、アルミニウム、鉄、銅などの金属、ステンレスなどの合金、熱伝導性の各種樹脂類が例示できる。なかでも安定性、熱伝導性に優れることから、金属又は合金が好ましく、アルミニウムが特に好ましい。
【0053】
温調手段は、例えば、図2に示すコンピュータ16に電気的に接続されていることが好ましい。このようにすることで、核酸増幅時における温度、時間、サイクル数などを自動で制御できる。これにより、膨大な数のサンプルも迅速に処理できる。
【0054】
核酸増幅においては、保持した生体試料から核酸を抽出して増幅反応を行っても良いし、核酸を抽出せずにそのまま増幅反応を行っても良い。抽出せずに増幅反応を行えば、簡便に増幅核酸を解析できる。
【0055】
核酸増幅を行うための液、好ましくは生体試料を含有する液体20のpHは、核酸増幅開始前において、8.5〜9.5とすることが好ましい。このような範囲とすることで、細胞から核酸を抽出することなく増幅反応を行う場合に、共存する夾雑物による増幅反応の阻害が抑制される。また同様の理由により、核酸増幅を行うための液、好ましくは生体試料を含有する液体20に、ジチオトレイトール(DTT)及び/又は硫酸化多糖を含有させて、増幅反応を行うのが好ましい。DTT及び硫酸化多糖の含有量は、適宜調整すれば良い。
また、核酸増幅を行うための液、好ましくは生体試料を含有する液体20に、界面活性剤又はプロテアーゼを含有させて、増幅反応を行うのが好ましい。このようにすることで、細胞膜を破壊しながら核酸増幅を行うことができ、細胞質や核質が生体試料外に排出され、核酸増幅を行うための液と直接し易くなり、核酸増幅を円滑に行うことができる。界面活性剤及びプロテアーゼは、公知のものから目的に応じて適宜任意に選択し得る。そして、これらの含有量も適宜調整すれば良い。
【0056】
また、基板2など、液体20が接触する部位がガラス製である場合には、液体20に含有される核酸やDNAポリメラーゼ等がガラス表面に吸着されることがあり、この場合、増幅反応が阻害されてしまう。これを抑制するために、増幅反応前において液体20にブロッキング剤を含有させておくことが好ましい。このようにすることで、ガラス表面をブロッキングでき、さらに液体20を基板2上で粒状に保持し易くなり、取り扱い性も向上する。
ブロッキング剤は公知のもので良く、好ましいものとして、ウシ血清アルブミン(BSA)が例示できる。
【0057】
増幅された核酸のシグナルを検出する方法は、公知の方法から目的に応じて適宜選択すれば良い。
例えば、ゲルやキャピラリーシケンサーを利用する電気泳動を行った後、常法により増幅核酸を染色してそのシグナルを検出しても良いし、増幅核酸を蛍光物質で標識し、蛍光シグナルを検出しても良い。なかでも蛍光シグナルを検出する方法は、増幅反応中の増幅核酸をリアルタイムで検出できるなど利便性や汎用性が高いので、特に好ましい。蛍光シグナルを検出する場合には、増幅反応前において液体20に蛍光物質を含有させておけば良い。
【0058】
蛍光物質としては、公知の如何なるものも使用でき特に限定されない。具体的には、フルオレセイン、ローダミン(ローダミングリーン、TAMRA等)、アクリフラビン、アレクサ(アレクサ647等)、サイバーグリーン(SYBR Green)等が例示できる。
例えば、サイバーグリーンI(SYBR GREEN I)は、二重らせん構造を形成している核酸と特異的にインターカレートし、その結果、青色光(波長488nm)を吸収し、緑色光(波長522nm)の蛍光を発することが知られている。したがって、サイバーグリーンIを含む反応液を増幅反応に供して核酸を増幅すると、増幅された核酸の二重らせんにサイバーグリーンIがインターカレートするので、励起光を照射すると蛍光を発し、この時の蛍光強度は、増幅された核酸の量に比例する。
蛍光物質は一種を単独で用いても良いし、二種以上を併用しても良い。二種以上を併用する場合には、その組み合わせ及び比率等は、目的に応じて適宜選択し得る。
また、増幅産物に導入する蛍光物質の量も、目的に応じて適宜選択し得る。
【0059】
増幅核酸のシグナルを検出する時は、シグナル強度を定量することが好ましい。該定量値より増幅核酸を定量できる。また、シグナルの検出時期は、検出方法や目的に応じて適宜選択すれば良い。例えば、蛍光シグナルを検出する場合のように、シグナル検出のために増幅反応を停止する必要がない場合であれば、増幅反応中のいずれの時期でも検出できる。またこの時、基板の温度調節を特定の温度サイクルで行う場合には、温度サイクルごとに、増幅核酸の定量を一回又は二回以上行うことが好ましい。このように増幅核酸をリアルタイムで定量することにより、鋳型として使用した核酸の増幅反応前の量を迅速且つ高精度に定量できる。増幅核酸の定量回数は、状況に応じて選択すれば良い。
【0060】
増幅核酸のシグナルは、公知のシグナル検出手段を使用して検出すれば良い。例えば、増幅核酸に励起光を照射して、励起された光シグナルを検出する場合には、励起光照射手段と光シグナル検出器を備えた装置を使用すれば良く、前記検出器としては、CCDカメラ等が例示できる。例えば、図2又は3で例示した解析装置1において、光源6として各種波長の励起光を照射できるものを備えたものであれば、生体試料の採取と光シグナルの検出を共に行うことができるし、上記説明のように、さらにステージ19が温調手段と一体化された装置であれば、生体試料の採取から光シグナルの検出まで、一貫して同じ装置で行うことができる。
また、生体試料観察時の顕微鏡に、前記と同様の励起光照射手段とCCDカメラ等を備えたものであれば、マイクロマニピュレーター又はフローサイトメトリー等、マイクロダイセクション以外の方法を利用した生体試料の採取と、光シグナルの検出を同じ装置で行うことができるし、さらにステージ19が温調手段と一体化された装置であれば、生体試料の採取から光シグナルの検出まで、一貫して同じ装置で行うことができる。
【0061】
励起光を照射するための前記光源6としては、ハロゲンランプやキセノンランプ等、目的に応じて適宜選択すれば良い。また、光源6からの励起光のうち、特定範囲の波長の光のみを透過させるために、励起フィルタを使用しても良い。励起フィルタは、励起対象、例えば標識物質の種類に応じて選択すれば良く、反射光や迷光から生じるゴースト像の発生を防止するために、励起に必要な波長範囲以外の光を精度良く減衰させる励起フィルタを使用するのが好ましい。例えば、蛍光物質としてサイバーグリーンを使用する場合には、488nm近傍を中心とする波長帯域の光を透過させるものが好ましい。
【0062】
光シグナルは、吸収フィルタを介して特定範囲の波長の光のみを透過させてから、光シグナル検出器で検出しても良い。吸収フィルタは、光シグナルに応じて選択すれば良く、反射光や迷光から生じるゴースト像の発生を防止するために、目的とする波長範囲以外の光を精度良く減衰させるものが好ましい。例えば、蛍光物質としてサイバーグリーンを使用する場合には、522nm近傍を中心とする波長帯域の光を透過させるものが好ましい。
【0063】
本発明の解析方法で使用する装置は、上記で説明した形態に限定されるものではなく、本発明の効果を損なわない範囲において、構成を一部削除又は変更しても良いことは、言うまでも無い。例えば、スライドホルダ18、ステージ19、光源6等、その他の構成をコンピュータ16で制御できるようにしても良い。
【0064】
本発明においては、平面状の試料保持部で生体試料を保持するので、試料保持部における生体試料の有無、核酸増幅を行うための液体に対する生体試料の浸漬状態、生体試料の劣化の有無等を確実に確認できる。そして、核酸増幅を行うのに適した生体試料を選別して核酸増幅を正確に行ったり、核酸増幅を行うのに適していない生体試料については解析を中止したりすることで、信頼性の高い増幅核酸の検出データのみを解析に使用するので、解析を高精度に行うことができる。また、平面状の試料保持部で核酸増幅を行い、そのまま増幅核酸を検出できるので、解析に供する反応液は微量で良い。そして、検出時に従来のテレセントリックな光学系が不要であるだけでなく、生体試料を含む液と基板との接触面で焦点調整でき、焦点位置を溶液量に影響されることなく一定にでき、前記液ごとに焦点調整を行う必要がない。さらに、検出時に反応液の濃縮等を行う必要がなく、特殊な装置も不要である。したがって、装置の小型化と安価な作製が可能であり、解析を簡便に行うことができる。以上のように、微量な核酸も高精度且つ簡便に解析できる。
【実施例】
【0065】
以下、具体的実施例により、本発明についてさらに詳しく説明する。ただし、本発明は、以下に示す実施例に何ら限定されるものではない。
【0066】
(実施例1)
癌の組織切片を使用して、レーザマイクロダイセクションにより癌細胞と非癌細胞を切り出し、遺伝子発現解析を行った。基板としては、図1に示す構成のAdvalytix社製のAmpliGrid(商標)を使用した。該基板の第一親水性領域の直径D1は1.6mmであり、第一撥水性領域の幅L1及び第二親水性領域の幅L2は0.8mmであった。そして、レーザマイクロダイセクションには、図3に示すホルダを備えた顕微鏡を使用した。
まず、前記基板を、前記第一親水性領域が上側となるように顕微鏡のステージ上に設置した。
一方、図3に示すように、試料スライド上面に接着された接着フィルム上に、癌の凍結組織切片を載置し、前記試料スライドを、その表面と平行な水平面内で移動可能なスライドホルダに前記凍結組織切片が下向きになるようにはめ込んで支持し、顕微鏡のステージ上方に設置した。なお、接着フィルムとしては、厚さ100μmのEVAフィルムを用いてた。
そして、顕微鏡の焦点を前記基板にあわせて、ステージを水平面内で移動させ、基板の第一親水性領域が視野に入るように調整した。さらに、接着フィルム上の癌組織に焦点を合わせ、前記スライドホルダをステージと平行に移動させ、切り出したい癌細胞に標的を定め、標的が基板の第一親水性領域の真上に位置するように顕微鏡で確認しながら、前記スライドホルダを移動させた。そして、レーザにて標的の癌細胞を切り出し、癌細胞を基板の第一親水性領域上に落下させ、捕獲した。
次に、前記癌細胞近傍の非癌細胞に焦点を合わせ、前記スライドホルダをステージと平行に移動させ、切り出したい非癌細胞に標的を定め、基板の前記癌細胞を捕獲したものとは異なる第一親水性領域の真上に標的が位置するように顕微鏡で確認しながら、前記スライドホルダを移動させた。そして、レーザにて標的の非癌細胞を切り出し、基板の第一親水性領域上に落下させ、捕獲した。
【0067】
次いで、前記試料スライドをはずし、基板に焦点を合わせて、基板の個々の第一親水性領域上に癌細胞及び非癌細胞がそれぞれ存在し、前記捕獲操作によって傷んでいないことなど、捕獲された細胞が核酸増幅を正常に行える状態にあることを確認した。そして、そのまま約5分間静置して捕獲した癌細胞及び非癌細胞を乾燥させた後、界面活性剤の入った1step−PCR試薬(QIAGEN社製)をそれぞれ1μl分注して癌細胞及び非癌細胞を浸漬させ、さらにその上にそれぞれミネラルオイルを5μl滴下した。そして、基板を移動させ、in situ PCR用のサーマルサイクラーに設置し、50℃/30分の条件で逆転写反応を行った後、95℃/15分の条件で逆転写酵素を失活させ、94℃/30秒、60℃/1分の条件を35回繰り返し、PCRを行った。なお、前記PCR試薬には、プライマーとしてMMP2の配列を添加し、TaqMan反応用の蛍光FRLET(5’FAM−3’TAMRA)プローブも同時に添加した。サーマルサイクラーの上方に蛍光顕微鏡を設置し、癌細胞及び非癌細胞を含有する液を保持した第一親水性領域に焦点を合わせ、60℃の反応時毎に波長490nmの光を照射してプローブを励起し、その結果生じた波長520nmの蛍光をCCDカメラで撮影して、FAMの蛍光強度を測定した。なお、内部標準遺伝子として(5’VIC−3’TAMRA)で標識したGAPDHも同時に増幅させてその蛍光強度も測定した。この時の測定結果を図6に示す。図6(a)はMMP2由来の蛍光強度の測定結果を示すグラフであり、図6(b)はGAPDH由来の蛍光強度の測定結果を示すグラフである。
【0068】
得られた結果から、蛍光強度の経時変化をプロットしたところ、癌細胞では非癌細胞と比較してMMP2の発現が亢進していることが確認された。
なお、マイクロダイセクション終了後からデータ取得までに要した時間は約2.5時間であり、簡便かつ迅速に解析できた。これは、核酸抽出及び濃縮という煩雑な工程が不要であり、遠心分離などの煩雑かつ特殊な装置を使用する操作も不要であるためであった。
【0069】
(比較例1)
ライカ社製の落下型レーザマイクロダイセクション装置を使用して、以下に示す手順で、癌細胞及び非癌細胞を切り出し、遺伝子発現解析を行った。
捕獲容器としては、1.5μlの遠心分離用チューブ状容器を使用し、あらかじめ50μlの細胞溶解液を添加しておいた。そして、前記チューブ状容器の上方に、標的領域が位置するように試料スライドを移動させ、レーザにて癌細胞及び非癌細胞をそれぞれ切り出した。その結果、細胞がどこに落下したのか不明であったため、チューブ状容器の蓋を閉めた後、前記溶解液で該容器の壁面全体を洗浄するように、何度も丁寧に上下に振とうさせる操作を行った。次いで、遠心分離した後、RNA抽出用カラム(QIAGEN社製)に溶液を分注し、再度遠心分離し、洗浄液を載せてさらに遠心分離し、溶出液を30μl注入して溶出を行った。次いで、得られた溶液にエタノールと酢酸ナトリウムを添加してエタノール沈殿させて濃縮し、これに10μlの水に溶解させた。そしてここに、1step−PCR試薬(QIAGEN社製)に実施例1と同様のMMP2のプライマーとTaqManのプローブを添加したものを加えて、総液量を20μlとし、96ウェルのPCR用プレートに分注した後、ABI PRISM 7900リアルタイムPCR装置(Applied Biosystems社製)を使用して、蛍光強度を測定し、遺伝子発現解析を行った。この時の測定結果を図8に示す。図8(a)はMMP2由来の蛍光強度の測定結果を示すグラフであり、図8(b)はGAPDH由来の蛍光強度の測定結果を示すグラフである。
その結果、MMP2は癌細胞で非癌細胞よりも発現量の亢進が見られた。
なお、マイクロダイセクション終了後からデータ取得までに要した時間は約6時間であり、実施例1の場合よりも手間と時間を要した。これは、核酸抽出及び濃縮という煩雑な工程が必要であり、遠心分離などの煩雑かつ特殊な装置を使用する操作が必要であるためであった。
【0070】
(実施例2)
前記顕微鏡に代わり、図2に示すような、顕微鏡のステージにPCR用のサーマルサイクラーが一体化され、さらに蛍光検出部を備えた構成の顕微鏡をマイクロダイセクションに使用した。そして、癌細胞及び非癌細胞を捕獲後に、これら細胞の観察画像を撮影するとともにコンピュータにより画像処理を行い、基板の所定の第一親水性領域上に癌細胞及び非癌細胞がそれぞれ存在し、これら細胞が核酸増幅を正常に行える状態にあることを自動的に確認した。さらに、基板を移動させることなく直ちにPCRを行うと共に、リアルタイムで増幅核酸の蛍光強度を測定した。これらの点以外は、実施例1と同様に蛍光強度を測定した。その結果、基板を移動させることなく、実施例1と同様の結果が得られた。基板の移動が不要で、かつ捕獲細胞の有無や捕獲位置をはじめとする捕獲細胞の状態を自動的に確認できたので、実施例1の場合よりもさらに簡便かつ迅速に解析できた。
【0071】
(実施例3)
癌培養細胞であるLc−1Sqは、17番染色体17p11.2−13の領域が増幅又は欠質していることが知られている。これら染色体部位の増幅又は欠失が株全体で均一か否かを確認するために、以下の操作で解析を行った。
スライドホルダを備えていないこと以外は実施例1で使用したものと同様の顕微鏡を使用し、マイクロマニピュレーターで培養皿からLc−1Sqを1細胞ずつ吸引し、顕微鏡で確認しながら、実施例1と同様の基板の第一親水性領域上に排出して載置し、合計8細胞をそれぞれ別々に第一親水性領域上に載置した。載置した細胞は、前記操作によって傷んでいないことなど、核酸増幅を正常に行える状態にあることを確認した。
次いで、載置した8細胞のうち、4細胞についてはLc−1Sqを載置直後に1μlのPCR試薬を分注し、残りの4細胞については載置後約5分間静置して乾燥させてから1μlのPCR試薬を分注して、それぞれ細胞を浸漬させた。なお、前記PCR試薬には、プライマーとして前記領域に存在するTP53遺伝子の配列を添加した。また、該PCR試薬はpH8.0のものを使用した。そして、さらにそれぞれにミネラルオイルを5μl滴下し、基板を移動させてin situ PCR用のサーマルサイクラーに設置し、実施例1と同様にPCRを行った。
【0072】
PCR終了後、反応溶液をアガロースゲルで電気泳動し、バンドの位置と濃さを検出した。この時の検出結果を図7に示す。図7(a)〜(d)は載置直後にPCR試薬を分注したものから得られた画像であり、図7(e)〜(h)は乾燥後にPCR試薬を分注したものから得られた画像である。
【0073】
図7に示すように、PCR産物のバンドは、Lc−1Sqを乾燥させた場合では、乾燥させなかった場合に対して10倍高濃度であった。すなわち、Lc−1Sqを乾燥させた場合では、PCR産物の量が約10倍多くなることが確認された。これは、乾燥工程においてLc−1Sqの細胞膜が破壊され、細胞質、核質が細胞外に排出され、効率良くPCRが進行したためと推測される。
また、すべてのLc−1Sqでバンドは得られたが、位置と濃さには差が認められた。このように単一細胞の解析により、Lc−1Sqでは、同一株でも細胞により前記領域の増幅の程度に差があることが判明した。
なお、細胞吸引後からデータ取得までに要した時間は3時間であり、簡便かつ迅速に解析できた。
【0074】
(実施例4)
PCR試薬のpHを8.0及び9.1の二通りに調整したこと以外は、実施例3と同様にして解析を行った。
その結果、pH9.1の場合の方が、pH8.0の場合よりもPCRの増幅効率が高いことが確認された。これは、細胞夾雑物によるPCR阻害の抑制がpH調整により可能であることを示すものであった。
このように、上記基板を使用する本発明の解析方法は、PCR阻害の抑制に好適であることが確認された。
なお、細胞吸引後からデータ取得までに要した時間は3時間であり、簡便かつ迅速に解析できた。
【0075】
(比較例2)
吸引したLc−1Sqを、上記基板に代わり市販のサンプルチューブに採取し、QIAeasy(商品名、QIAGEN社製)を使用してDNAを抽出し、該DNAを含むPCR試薬を10μLとして、上記サンプルチューブ内でPCRに供したこと以外は、実施例4と同様に解析を行った。
その結果、pH8.0及び9.1のいずれにおいても、PCRの増幅効率に違いは認められず、pH調整により、細胞夾雑物によるPCR阻害は抑制できないことが示唆された。
なお、細胞吸引後からデータ取得までに要した時間は5時間であり、実施例3の場合よりも手間と時間を要した。
【産業上の利用可能性】
【0076】
本発明は、細胞ごとの遺伝子発現解析に利用可能である。
【図面の簡単な説明】
【0077】
【図1】溶液を保持した状態の本発明における基板を例示する図であり、(a)は斜視図、(b)は(a)のII−II線における断面図である。
【図2】本発明において、落下型のマイクロダイセクションで使用する解析装置を例示する概略構成図である。
【図3】解析装置のステージ近傍を拡大して示す図である。
【図4】他の実施形態にかかる解析装置のステージ近傍を拡大して示す概略構成図である。
【図5】略水平方向に移動可能な二段式のスライドホルダを例示する概略構成図である。
【図6】実施例1における増幅核酸の蛍光強度の測定結果を示すグラフであり、(a)はMMP2由来、(b)はGAPDH由来の蛍光強度の測定結果である。
【図7】実施例3における電気泳動の結果を示す画像であり、(a)〜(d)は細胞を載置直後にPCR試薬を分注したものから得られた画像、(e)〜(h)は細胞を乾燥後にPCR試薬を分注したものから得られた画像である。
【図8】比較例1における増幅核酸の蛍光強度の測定結果を示すグラフであり、(a)はMMP2由来、(b)はGAPDH由来の蛍光強度の測定結果である。
【符号の説明】
【0078】
1・・・解析装置、12・・・接眼レンズ、13・・・ダイクロイックミラー、14・・・絞り、15・・・絞りモータ、17・・・カメラ、4,18・・・スライドホルダ、19・・・ステージ、2・・・基板、20・・・核酸増幅を行うための液、21・・・基板表面、22・・・基板裏面、211・・・第一親水性領域、212・・・第一撥水性領域、213・・・第二親水性領域、214・・・第二撥水性領域、25・・・被覆液、3・・・試料スライド、30・・・生体試料、6・・・光源、7・・・レーザ
【特許請求の範囲】
【請求項1】
生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する方法であって、
生体試料を採取する工程と、
表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられた基板を使用し、前記試料保持部において、採取した生体試料を、核酸増幅を行うための液に浸漬させ、該生体試料を含有する液の総液量を0.2〜3μLとして保持する工程と、
保持された生体試料の有無及び/又は形態を観察する工程と、
前記試料保持部において前記生体試料に由来する核酸を増幅する工程と、
増幅された核酸のシグナルを検出する工程と、
を有し、
前記生体試料の観察結果が、あらかじめ定められた所定の条件を満たした場合にのみ、前記シグナルの検出結果を解析に使用することを特徴とする増幅核酸の解析方法。
【請求項2】
前記基板において、さらに前記第一撥水性領域の外側周縁部を包囲する第二親水性領域と、該第二親水性領域の外側周縁部を包囲する第二撥水性領域とが設けられていることを特徴とする請求項1に記載の増幅核酸の解析方法。
【請求項3】
前記試料保持部に保持した生体試料から核酸の抽出を行わずに核酸増幅を行うことを特徴とする請求項1又は2に記載の増幅核酸の解析方法。
【請求項4】
前記核酸増幅を行うための液に浸漬前に、保持した前記生体試料を乾燥させることを特徴とする請求項1〜3のいずれか一項に記載の増幅核酸の解析方法。
【請求項5】
前記生体試料を採取する工程において、マイクロダイセクション法、マイクロマニピュレーター法又はフローサイトメトリー法を利用することを特徴とする請求項1〜4のいずれか一項に記載の増幅核酸の解析方法。
【請求項6】
前記生体試料を採取する工程を顕微鏡観察下で行うことを特徴とする請求項1〜5のいずれか一項に記載の増幅核酸の解析方法。
【請求項7】
前記試料保持部上の生体試料を含有する液を、該液よりも比重が小さく且つ沸点が100℃以上である非水溶性の液体で被覆してから核酸を増幅することを特徴とする請求項1〜6のいずれか一項に記載の増幅核酸の解析方法。
【請求項8】
前記核酸増幅を行うための液のpHが8.5〜9.5であることを特徴とする請求項1〜7のいずれか一項に記載の増幅核酸の解析方法。
【請求項9】
前記核酸増幅を行うための液に界面活性剤又はプロテアーゼを含有させることを特徴とする請求項1〜8のいずれか一項に記載の増幅核酸の解析方法。
【請求項10】
前記核酸増幅を行うための液にジチオトレイトール及び/又は硫酸化多糖を含有させることを特徴とする請求項1〜9のいずれか一項に記載の増幅核酸の解析方法。
【請求項11】
前記核酸増幅を行うための液にウシ血清アルブミンを含有させることを特徴とする請求項1〜10のいずれか一項に記載の増幅核酸の解析方法。
【請求項12】
前記核酸増幅を行うための液に、増幅核酸を蛍光標識する蛍光物質を含有させ、増幅核酸の蛍光強度を定量し、増幅核酸を定量することを特徴とする請求項1〜11のいずれか一項に記載の増幅核酸の解析方法。
【請求項13】
生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する装置であって、
採取対象の生体試料を固定するプレートを具備した試料固定手段と、
固定された前記生体試料にレーザを照射して生体試料を切り出す照射手段と、
切り出された生体試料を保持すると共に該生体試料に由来する核酸を増幅するための試料保持部を有する基板と、
前記基板を支持及び温度調節するステージと、
増幅核酸のシグナルを検出するシグナル検出手段と、
を備え、
前記基板は、その表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられていることを特徴とする増幅核酸の解析装置。
【請求項14】
請求項13に記載の増幅核酸の解析装置に備えるスライドホルダであって、
前記プレート及び基板を固定すると共に、該プレート及び基板の少なくとも一方を、その表面と略平行な面内において移動させる手段を備えることを特徴とするスライドホルダ。
【請求項1】
生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する方法であって、
生体試料を採取する工程と、
表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられた基板を使用し、前記試料保持部において、採取した生体試料を、核酸増幅を行うための液に浸漬させ、該生体試料を含有する液の総液量を0.2〜3μLとして保持する工程と、
保持された生体試料の有無及び/又は形態を観察する工程と、
前記試料保持部において前記生体試料に由来する核酸を増幅する工程と、
増幅された核酸のシグナルを検出する工程と、
を有し、
前記生体試料の観察結果が、あらかじめ定められた所定の条件を満たした場合にのみ、前記シグナルの検出結果を解析に使用することを特徴とする増幅核酸の解析方法。
【請求項2】
前記基板において、さらに前記第一撥水性領域の外側周縁部を包囲する第二親水性領域と、該第二親水性領域の外側周縁部を包囲する第二撥水性領域とが設けられていることを特徴とする請求項1に記載の増幅核酸の解析方法。
【請求項3】
前記試料保持部に保持した生体試料から核酸の抽出を行わずに核酸増幅を行うことを特徴とする請求項1又は2に記載の増幅核酸の解析方法。
【請求項4】
前記核酸増幅を行うための液に浸漬前に、保持した前記生体試料を乾燥させることを特徴とする請求項1〜3のいずれか一項に記載の増幅核酸の解析方法。
【請求項5】
前記生体試料を採取する工程において、マイクロダイセクション法、マイクロマニピュレーター法又はフローサイトメトリー法を利用することを特徴とする請求項1〜4のいずれか一項に記載の増幅核酸の解析方法。
【請求項6】
前記生体試料を採取する工程を顕微鏡観察下で行うことを特徴とする請求項1〜5のいずれか一項に記載の増幅核酸の解析方法。
【請求項7】
前記試料保持部上の生体試料を含有する液を、該液よりも比重が小さく且つ沸点が100℃以上である非水溶性の液体で被覆してから核酸を増幅することを特徴とする請求項1〜6のいずれか一項に記載の増幅核酸の解析方法。
【請求項8】
前記核酸増幅を行うための液のpHが8.5〜9.5であることを特徴とする請求項1〜7のいずれか一項に記載の増幅核酸の解析方法。
【請求項9】
前記核酸増幅を行うための液に界面活性剤又はプロテアーゼを含有させることを特徴とする請求項1〜8のいずれか一項に記載の増幅核酸の解析方法。
【請求項10】
前記核酸増幅を行うための液にジチオトレイトール及び/又は硫酸化多糖を含有させることを特徴とする請求項1〜9のいずれか一項に記載の増幅核酸の解析方法。
【請求項11】
前記核酸増幅を行うための液にウシ血清アルブミンを含有させることを特徴とする請求項1〜10のいずれか一項に記載の増幅核酸の解析方法。
【請求項12】
前記核酸増幅を行うための液に、増幅核酸を蛍光標識する蛍光物質を含有させ、増幅核酸の蛍光強度を定量し、増幅核酸を定量することを特徴とする請求項1〜11のいずれか一項に記載の増幅核酸の解析方法。
【請求項13】
生体試料を採取して基板平面上に保持し、該生体試料に由来する核酸を増幅させて解析する装置であって、
採取対象の生体試料を固定するプレートを具備した試料固定手段と、
固定された前記生体試料にレーザを照射して生体試料を切り出す照射手段と、
切り出された生体試料を保持すると共に該生体試料に由来する核酸を増幅するための試料保持部を有する基板と、
前記基板を支持及び温度調節するステージと、
増幅核酸のシグナルを検出するシグナル検出手段と、
を備え、
前記基板は、その表面に平面状の試料保持部である第一親水性領域と、該第一親水性領域周縁部を包囲する第一撥水性領域とが設けられていることを特徴とする増幅核酸の解析装置。
【請求項14】
請求項13に記載の増幅核酸の解析装置に備えるスライドホルダであって、
前記プレート及び基板を固定すると共に、該プレート及び基板の少なくとも一方を、その表面と略平行な面内において移動させる手段を備えることを特徴とするスライドホルダ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2009−207392(P2009−207392A)
【公開日】平成21年9月17日(2009.9.17)
【国際特許分類】
【出願番号】特願2008−52240(P2008−52240)
【出願日】平成20年3月3日(2008.3.3)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成21年9月17日(2009.9.17)
【国際特許分類】
【出願日】平成20年3月3日(2008.3.3)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

