壊死マーカー及びその用途
【課題】
各種の癌及び壊死巣に関連する様々な病変の検出・診断において、特異性が高く有効に使用できるようなバイオマーカーは提供すること。
【解決手段】
以下のアミノ酸配列:
(1)配列番号1〜35のいずれか一つで示されるアミノ酸配列、
(2)(1)の各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列、又は(1)の各アミノ酸配列と90%以上、好ましくは95%以上、更に好ましくは98%以上の相同性を有するアミノ酸配列であって、(1)の各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列、からなる壊死マーカー。
各種の癌及び壊死巣に関連する様々な病変の検出・診断において、特異性が高く有効に使用できるようなバイオマーカーは提供すること。
【解決手段】
以下のアミノ酸配列:
(1)配列番号1〜35のいずれか一つで示されるアミノ酸配列、
(2)(1)の各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列、又は(1)の各アミノ酸配列と90%以上、好ましくは95%以上、更に好ましくは98%以上の相同性を有するアミノ酸配列であって、(1)の各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列、からなる壊死マーカー。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規な壊死マーカー、該壊死マーカー量を使用する壊死巣を検出する方法、壊死マーカーと特異的に反応する化合物を含む壊死巣を検出するためのキット、該壊死マーカーと特異的に反応する化合物と標識化合物又は治療に有効な化合物から成る、画像診断用組成物又は治療用コンジュゲート、該コンジュゲートを含む、画像診断用キットもしくは医薬組成物、及び、疾患に関連する壊死を検出する壊死マーカーを同定する方法等に関する。
【背景技術】
【0002】
一般に壊死巣は、物理的損傷あるいは血液供給の障害、喪失、減少により各種組織の細胞に対する栄養並びに酸素供給が低下した状態で起こる細胞死により起因する。例えば固形癌の場合は、癌腫が大きくなって癌組織全体に栄養供給が行き渡らなくなった結果として壊死巣が生じる。また、心筋梗塞や脳梗塞についても必ず壊死が起こる。更に、血流の悪いことから貧栄養、低酸素となる壊死後性肝硬変 (postnecrotic cirrhosis)、壊死性膵炎 (necrotizing pancreatitis)、皮下組織から筋膜にかけて重症となる炎症である壊死性筋膜炎 (necrotizing fasciitis)なども壊死巣をもつ病態である。その他に、動脈硬化性壊疽、糖尿病性壊疽あるいは閉塞性壊疽についても、壊死巣に関連する病変である。
【0003】
壊死巣は周囲の組織、細胞に悪影響を与えることから、壊死部位の病勢、病巣などを検出・診断したり、その重症となっている病巣部位を見つけだしその部位をターゲットとして治療することができるようになれば、産業上有用である。
【0004】
しかし、壊死巣を検出するバイオマーカーに関する先行技術として、リンパ腫細胞系および肺癌細胞系由来の不溶性細胞内抗原として選択した3種の抗体(特許文献1)、可溶性核マトリックス蛋白に対する抗体(特許文献2)、あるいは腫瘍の壊死中心として同定された核抽出物およびヒストンH1に特異的結合する抗体あるいは低分子抗体(特許文献3)などに限られている。心臓血管関連の壊死も含む悪性度診断用マーカーとして炎症性マーカー(CRP,TNF,IL-1,-6 他)が知られている。心筋ストレスマーカーとしてBNPも使用されている。
【0005】
又、癌のバイオマーカーとしては、例えば、すい臓がん及び肺腺癌のバイオマーカーとしてPeroxiredoxin 4(非特許文献1及び2)、及び、大腸がんのバイオマーカーとしてAnnexin A2(特許文献4)が知られている。更に、壊死細胞の細胞核から放出されるHMGB1に対する特異的単クロー ン抗体の治療への開発も進行中である。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特許第2733658号明細書
【特許文献2】特許第3190042号明細書
【特許文献3】特表2002-519065号公報
【特許文献4】特開2008-14937号公報
【非特許文献】
【0007】
【非特許文献1】Lin JF, Xu J, Tian HY, Gao X, Chen QX, Gu Q, Xu GJ, Song JD, Zhao FK.,Int J Cancer. 2007 Dec 15;121(12):2596-605
【非特許文献2】Chen G, Gharib TG, Huang CC, Thomas DG, Shedden KA, Taylor JM, Kardia SL, Misek DE, Giordano TJ, Iannettoni MD, Orringer MB, Hanash SM, Beer DG.,Clin Cancer Res. 2002 Jul;8(7):2298-305
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、各種の癌及び壊死巣に関連する様々な病変の検出・診断において、特異性が高く有効に使用できるようなバイオマーカーは未だ得られていない。
【0009】
本発明者は壊死巣が栄養並びに酸素供給が低下した状態で起こることに着目し、壊死巣に特徴的なタンパク質あるいはその断片を、低栄養、低酸素、高密度および足場非依存的な条件下で培養したヒト細胞から、蛍光標識二次元ディファレンスゲル電気泳動(2D-DIGE)、質量分析計(MS)、N-末端アミノ酸分析法を用いた疾患プロテオミクス手法を用いて、上記のような汎用性を有する壊死マーカーとしての機能を有する、9種類の遺伝子の発現産物であるタンパク質又はその断片を同定することに成功し、本発明を完成した。
【0010】
更に、上記タンパク質に対する抗体が乳癌と肺癌の病巣標本の切片における壊死巣を特異的に認識し、染め分けることが出来ることが確認された。更に、アイソトープ標識した該抗体が癌細胞を移植したヌードマウスの担癌部分の壊死叢周囲を特異的に認識し、イメージング可能であることが今回初めて示された。
【課題を解決するための手段】
【0011】
即ち、本発明は以下の各態様に係るものである。
[態様1]以下の9つの群に含まれるいずれか一つのアミノ酸配列をコードする遺伝子の発現産物又は該発現産物に対する自己抗体から成る、壊死マーカー:
(1)配列番号1で示されるアミノ酸配列、又は、該アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは該アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、該アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(2)配列番号2〜4のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(3)配列番号5〜9のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(4)配列番号10〜15のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(5)配列番号16〜18のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(6)配列番号19〜22のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(7)配列番号23〜26のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(8)配列番号27〜29のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(9)配列番号30〜35のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列。
[態様2]遺伝子の発現産物が、該遺伝子のmRNA,cDNA,若しくは、それらの部分塩基配列を含む核酸分子、又は、該遺伝子がコードするタンパク質又はその部分ポリペプチドである、態様1記載の壊死マーカー。
[態様3]配列番号1、又は、配列番号2〜4のいずれか一つで示されるアミノ酸配列を有するタンパク質の部分ポリペプチドから成る、態様1又は2記載の壊死マーカー。
[態様4]態様1ないし3のいずれか一項に記載の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの量を測定することにより、壊死巣を検出する方法。
[態様5](1)試料中に含まれる態様1ないし3のいずれか一項に記載の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの濃度を測定し、その測定値が正常レベルよりも上昇していることを指標として壊死巣を検出する、態様4記載の方法。
[態様6]配列番号1〜35のいずれか一つで示されるアミノ酸配列を有するタンパク質又はその部分ポリペプチドに対する抗体を用いて、該タンパク質又はその部分ポリペプチドの量を測定することを特徴とする、態様4又は5記載の方法。
[態様7]各遺伝子の発現産物であるタンパク質又はその部分ポリペプチドを抗原として用いて、該発現産物に対する自己抗体から成る壊死マーカーの量を測定する、態様4又は5記載の方法。
[態様8]試料として全血又は血清を使用する、態様4ないし7のいずれか一項に記載の方法。
[態様9]壊死巣が、各種固形癌、心筋梗塞、脳梗塞、壊死後性肝硬変 (postnecrotic cirrhosis)、壊死性膵炎 (necrotizing pancreatitis)、壊死性筋膜炎 (necrotizing fasciitis)、動脈硬化性壊疽、糖尿病性壊疽、又は、閉塞性壊疽に関連することを特徴とする、態様4ないし8のいずれか一項に記載の方法。
[態様10]態様4ないし8のいずれか一項に記載の方法に用いる検出キットであって、態様1ないし3のいずれか一項に記載の壊死マーカーと特異的に反応する化合物を含む該キット。
[態様11]特異的に反応する化合物が抗体である、態様10記載のキット。
[態様12]態様1ないし4のいずれか一項に記載の壊死マーカーと特異的に反応する化合物と標識化合物又は治療に有効な化合物から成る、画像診断用又は治療用コンジュゲート。
[態様13]態様12に記載のコンジュゲートを活性成分として含む、画像診断用キット又は医薬組成物。
[態様14]
疾患に関連する壊死を検出する壊死マーカーを同定する方法であって、ヒト細胞を低栄養、低酸素、高密度および足場非依存的な条件下の培養で誘導して得られる壊死細胞が発現するタンパク質と、通常の培養条件で培養した同細胞が発現するタンパク質とを比較して、該壊死細胞においてより高濃度で存在するタンパク質あるいはその断片を該壊死マーカー選択することを特徴とした前記方法。
【発明の効果】
【0012】
試料において本発明の壊死マーカー量を測定することによって、各種固形癌、心筋梗塞又は脳梗塞の壊死巣(組織)のみならず、壊死後性肝硬変、壊死性膵炎、壊死性筋膜炎等の壊死巣、更に、動脈硬化性壊疽、糖尿病性壊疽あるいは閉塞性壊疽における壊死巣となる部位を検出することが可能となる。
【0013】
又、本発明の壊死マーカーであるタンパク質あるいはその断片に対する抗体は、乳癌と肺癌の病巣標本の切片における壊死巣を染め分けることが出来ることが確認され、これらはヒトの乳癌及び肺癌の壊死巣組織を陽性として検出可能な癌の壊死マーカーとして有用であることが具体的に示された。
【0014】
更に、アイソトープ標識した該抗体によって、癌細胞を移植したヌードマウスの担癌部分の壊死叢周囲を特異的に認識してイメージング可能であることが示された。
【図面の簡単な説明】
【0015】
【図1】図1は本発明の実施例において、ネクローシスを誘導したHeLa細胞と通常培養のHeLa細胞から調製した細胞抽出精製液を蛍光標識二次元ディファレンシャルゲル電気泳動(2D-DIGE)法を用いてプロテオミクス解析したゲルの写真である。図1Aはネクローシス誘導1日後、図1Bはネクローシス3日後、図1Cはネクローシス誘導6日後の2D-DIGE法で解析した結果をそれぞれ示す。図1C中の矢印で示したスポットは質量分析法およびN末端アミノ酸解析により同定したスポットを示し、各スポット番号は表1のスポット番号(群)に対応する。
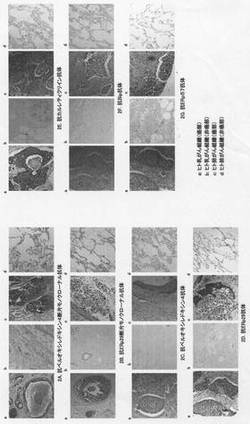
【図2】図2は本発明の実施例において、壊死巣特異的マーカーに対する各種の抗体を用いて、壊死巣を含むヒト乳がんおよびヒト肺がん組織を免疫染色した典型的な組織免疫染色像である。図中のaはヒト乳がん組織の壊死巣を含む癌部、bは非癌部の染色像を示す。図中のcはヒト肺がん組織の壊死巣を含む癌部、dは非癌部の染色像を示す。ヒト乳がんおよび肺がん組織の壊死巣を含む癌細胞は各抗体により強く染色され、ところどころにヘマトキシリン液で対比染色された核が認められた。
【図3】抗PRDX4抗体とビオチン化ペプチドとの相互作用を測定してカイネティック解析したBIACoreのセンサグラムを示す。
【図4】セルロースアセテート電気泳動により、精製前と精製後のDTPA-IgGの泳動後のオートラジオグラフィーの写真を示す。
【図5】各In-111標識モノクローナル抗体とHeLa生細胞との反応をガンマカウンターで測定した結果を示す。
【図6】In-111標識モノクローナル抗体を用いた担癌マウスに於けるイメージングの結果を示すレントゲン写真である。
【図7】In-111標識モノクローナル抗体投与4日目の撮像終了後に、腫瘍を摘出し、凍結標本を複数作製し、作製した複数の標本のうち隣接標本でオートラジオグラフィーとヘマトキシリン・エオシン染色(HE染色)を実施した結果を示す。
【図8】In-111標識モノクローナル抗体が集積する壊死巣周辺部の細胞の形態を示す。
【発明を実施するための形態】
【0016】
本発明の壊死マーカーは、本明細書の実施例に記載したように、適当なヒト細胞(例えば、子宮頸がん細胞株であるHeLa細胞株等の樹立培養細胞株)を低栄養、低酸素、高密度および足場非依存的な条件下の培養で誘導して得られるヒト壊死細胞が発現するタンパク質と通常の培養条件で培養した同細胞が発現するタンパク質を、当業者に公知の蛍光標識二次元ディファレンスゲル電気泳動(2D-DIGE)、質量分析計(MS)、N-末端アミノ酸分析法を用いた疾患プロテオミクス手法を用いて同定・比較することにより得ることができる。
【0017】
従って、本発明は、疾患に関連する壊死を検出する壊死マーカーを同定する方法も提供する。従って、この方法は、ヒト細胞を低栄養、低酸素、高密度および足場非依存的な条件下の培養で誘導して得られる壊死細胞が発現するタンパク質と、通常の培養条件で培養した同細胞が発現するタンパク質とを比較して、該壊死細胞においてより高濃度で存在する(高発現する)タンパク質あるいはその断片(限定分解物又は部分タンパク質)を該壊死マーカー選択することを特徴とする。
【0018】
本明細書において、「低栄養、低酸素、高密度および足場非依存的な条件」とは、例えば、1x107個/ml程度の細胞密度でチューブに蓋をした嫌気条件で培地交換せずに約1週間〜2週間培養チューブ中で浮遊させて培養するような条件を意味する。
一方、「通常の培養条件」とは、例えば、血清含有DMEM 培地(Dulbecco’s modified Eagle medium) 中で、2x104〜1x105個/mlの細胞密度で、37℃, 5% CO2存在下95%空気の気相、飽和湿度の条件で培養することを意味する。
更に、「より高濃度で存在する(高発現する)タンパク質」とは、例えば、通常の培養条件で培養した細胞と比較して、蛍光標識二次元ディファレンスゲル電気泳動において約2倍以上の蛍光強度があり、壊死が誘導された細胞内で経時的に増加するスポットに含まれるタンパク質を意味する。
【0019】
このような比較の結果、実施例に記載の表1に示すような、Peroxiredoxin 4, ERp29, VDAC-1, Annexin A2, Calreticulin, GRP78, PDIA6, HSP60及びERp57の9種類(群)の遺伝子産物であるタンパク質又はその部分ポリペプチドが、通常の培養条件で培養した正常なヒト細胞と比較して、ヒト壊死細胞において有意なレベルのより高濃度で存在することを初めて見出した。因みに、これらの遺伝子自体は公知であるが、それが、壊死組織に特異的に高発現することはこれまで知られていなかった。
【0020】
従って、上記の遺伝子の発現産物又は該発現産物に対する自己抗体は壊死マーカーとして有用である。
【0021】
このような壊死マーカーとして使用できる遺伝子の発現産物として、例えば、該遺伝子のmRNA,cDNA,若しくは、それらの部分塩基配列を含む核酸分子、又は、該遺伝子がコードするタンパク質又はその部分ポリペプチドを挙げることが出来る。例えば、上記遺伝子が発現するタンパク質は、壊死組織に特異的に高発現する「壊死巣特異的マーカータンパク質」として有用である。
【0022】
より具体的には、上記の各遺伝子がコードするタンパク質のアミノ酸配列として、夫々、以下のアミノ酸配列挙げることが出来る:
(1)配列番号1〜35のいずれか一つで示されるアミノ酸配列、
(2)(1)の各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列、又は(1)の各アミノ酸配列と90%以上、好ましくは95%以上、更に好ましくは98%以上の相同性を有するアミノ酸配列であって、(1)の各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列。
【0023】
更に、該遺伝子がコードするタンパク質の部分ポリペプチドの一例として、実施例2で同定されたような、Peroxiredoxin 4(配列番号1)及びERp29(配列番号2〜4)の部分ポリペプチドを挙げることができる。
【0024】
尚、2つのアミノ酸配列における配列の相同性(同一性)を決定するために、配列は比較に最適な状態に前処理される。例えば、一方の配列にギャップを入れることにより、他方の配列とのアラインメントの最適化を行う。その後、各部位におけるアミノ酸残基又は塩基が比較される。第一の配列における、ある部位に、第二の配列の相当する部位と同じアミノ酸残基又は塩基が存在する場合、それらの配列は、その部位において同一である。2つの配列における相同性は、配列間での同一である部位数の全部位(全アミノ酸又は全塩基)数に対する百分率で示される。
【0025】
上記の原理に従い、2つのアミノ酸配列における相同性は当業者に公知の任意の方法で決定することができる。例えば、Karlin及びAltshulのアルゴリズム(Proc.Natl.Acad.Sci.USA 87:2264−2268,1990及びProc.Natl.Acad.Sci.USA 90:5873−5877,1993)により決定することが出来る。このようなアルゴリズムを用いたBLASTプログラムがAltshulらによって開発された(J.Mol.Biol.215:403−410,1990)。さらに、Gapped BLASTはBLASTより感度良く相同性を決定するプログラムである(Nucleic Acids Res.25:3389−3402,1997)。上記のプログラムは、主に与えられた配列に対し、高い相同性を示す配列をデータベース中から検索するために用いられる。これらは、例えば米国National Center for Biotechnology Informationのインターネット上のウェブサイトにおいて利用可能である。
【0026】
或いは、配列間の相同性として、Tatiana A. Tatusovaらによって開発されたBLAST 2 Sequencesソフトウェア(FEMS Microbiol Lett.,174:247−250,1999)を用いて決定した値を用いることも可能である。このソフトウェアは米国National Center for Biotechnology Informationのインターネット上のウェブサイトにおいて利用可能であり、入手も可能である。用いるプログラム及びパラメーターは以下のとおりである。アミノ酸配列の場合、blastpプログラムを用いパラメーターとしては、Open gap:11 and extension gap:1 penalties,gap x_dropoff:50,expect:10,word size:3,Filter:ONを用いる。更に、高感度なFASTAソフトウェア(W.R.Pearson and D.J.Lipman,Proc.Natl.Acad.Sci.USA,85:2444−2448,1988)を用いて相同性を示す配列をデータベースから検索することもできる。いずれのパラメーターも、ウェブサイト上でデフォルト値として用いられているものである。
【0027】
本発明に係る壊死巣を検出する方法は、上記の本発明の壊死マーカー量を測定することを含むものである。より具体的には、例えば、(1)試料中に含まれる本発明の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの濃度を測定し、その測定値が正常レベルよりも上昇していることを指標として壊死巣を検出することから成る。
【0028】
本発明方法に使用する試料としては、壊死巣からの上記発現産物が含まれているような生体由来の試料である限り、その由来・形態等に特に制限は無いが、好適例として、全血又は血清を挙げることが出来る。
【0029】
本発明方法によって検出することができる壊死巣の種類・由来組織等に特に制限はなく、例えば、各種固形癌、心筋梗塞、脳梗塞、壊死後性肝硬変 (postnecrotic cirrhosis)、壊死性膵炎 (necrotizing pancreatitis)、壊死性筋膜炎 (necrotizing fasciitis)、動脈硬化性壊疽、糖尿病性壊疽、又は、閉塞性壊疽に関連すること壊死巣を挙げることが出来る。
【0030】
上記各遺伝子の発現産物の発現量の測定は、測定方法・原理に応じて、定量的、半定量的、又は定性的であり得る。指標となる上昇のレベルは、検出方法において用いた試料及び壊死マーカーの種類、測定手段・方法の原理及び条件等において有意な差を示すものである。例えば、定量的な測定においては、正常レベルに対して、1.5倍以上とすることができる。
【0031】
上記遺伝子がコードするタンパク質又はその部分ポリペプチドの量は、当業者に公知の任意の方法で測定することが可能である。例えば、該適当な抗体を用いたウェスタンブロット等の免疫染色及びEIA等の各種の免疫学的特異反応を利用する方法、エドマン法を用いた気相シークエンサー等ペプチドのアミノ酸配列分析法、更には、MALDI−TOF/MS及びESI Q−TOF/MS法等に代表される質量分析によって検出することが出来る。
【0032】
上記の方法の中でも、ウェスタンブロット法及びEIA等の酵素免疫測定法等の、該タンパク質又はその部分ポリペプチドに特異的な抗体との抗原抗体反応によって該白質の発現量又はその部分ポリペプチドを測定する検査方法が好適である。
【0033】
更には、上記の各遺伝子の発現産物であるタンパク質又はその部分ポリペプチドを抗原として用いて、該発現産物に対する自己抗体から成る壊死マーカーの量を抗原抗体反応によって測定する方法を挙げることができる。
【0034】
従って、上記抗体は、該タンパク質又はその適当な部分ポリペプチド(ペプチド断片)又はそれらの各種誘導体又は複合体等を抗原物質又は免疫原として用いて、当業者に公知の適当な方法で調製することが可能である。例えば、ポリクローナル抗体の場合には、マウス、ラット、ウサギ、ヤギ、ニワトリ等の適当な動物に投与し、その抗血清から調製することが可能である。或いは、モノクローナル抗体作成法(「単クローン抗体」、長宗香明、寺田弘共著、廣川書店、1990年; "Monoclonal Antibody" James W. Goding, third edition, Academic Press, 1996)等に記載の公知の細胞融合を用いる方法でモノクローナル抗体として調製することも可能である。
【0035】
更に、遺伝子工学的手法によって調製することができる、キメラ抗体、ヒト化抗体、並びに、一本鎖抗体、重鎖CDR1〜3を有する重鎖可変ドメインと、軽鎖CDR1〜3を有する軽鎖可変ドメインとをリンカーで結合した構造からなる単鎖可変領域抗体断片(scFv)、Fab断片抗体、及びFab’断片抗体等の低分子抗体等の当業者に公知の任意の形態を有する各種の人工抗体を挙げることが出来る。これらは当業者に公知の任意の方法によって容易に製造することができる。
【0036】
このような抗体には、酵素、放射性同位体、ナノ粒子、蛍光色素、及び金属原子等の当業者に公知の各種の標識物質で標識されているものも含まれる。
【0037】
又、上記遺伝子のmRNA(又は、cDNA)は、例えば、該遺伝子の塩基配列に基づき適宜設計したプライマー又はプローブを使用したRT−PCR法、リアルタイム逆転写PCR(リアルタイムRT−PCR)等の各種定量的PCR法、並びに各種のマイクロアレイ(DNAチップ)法等の当業者に公知の方法で増幅・検出することが出来る。PCR法で増幅された核酸分子の検出・同定は、その塩基配列を直接決定する方法(シークエンス法)、又は電気泳動との組み合わせ等、適当な方法で行うことが出来る。
【0038】
上記のプライマー又はプローブの塩基配列は、鋳型との特異的な結合が可能となるような塩基数、例えば、15−40塩基、より具体的には、15−25塩基程度を有することが好ましく、更には、プライマー内でヘアピン構造をとったり、センス鎖とアンチセンス鎖とが互いにアニーリングしないような塩基配列とすることも重要である。例えば、OligoTM(National Bioscience Inc.製)のような市販のプライマー設計用のソフトウェアを使用することも可能である。
【0039】
本発明検出の方法に用いる検出キットは、本発明の壊死マーカーと特異的に反応する化合物を含むことを特徴とする。このような化合物の好適例として、上記の各種抗体を挙げることが出来る。
【0040】
本発明の検出キットは、測定対象又は測定原理等に応じて、適当な構成をとることが出来る。該キットは、その構成要素として、例えば、上記発現産物、例えば、タンパク質又はその部分ポリペプチドに特異的な抗体、若しくは該発現産物に対する自己抗体に対する抗原である該発現産物であるタンパク質又はその部分ポリペプチド、各種の二次抗体(標識抗体)、上記のmRNA(cDNA)の増幅用プライマー及びDNAチップ等で使用するハイブリダイゼーション用のプローブ(例えば、10〜100個程度の連続した塩基配列から成る)のような、上記遺伝子の発現産物と特異的に反応する化合物を含むことができる。更に、上記キットには、その構成・使用目的などに応じて、当業者に公知の他の要素又は成分、例えば、各種試薬、酵素、緩衝液、反応プレート(容器)等が含まれる。尚、PCR反応後の検出を容易にするために、これらプライマーの少なくともいずれかの末端に、当業者に公知の任意の蛍光物質等の標識物質が結合していることが好ましい。例えば、適当な標識物質として32P等の放射線標識、Cy3及びCy5のようなシアニン類、6−カルボキシフルオレッセイン(FAM)、4,7,2’,4’,5’,7’−ヘキサクロロー6−カルボキシフルオレッセイン(HEX)及びNED(アプライドシステムズジャパン社)及び6−カルボキシ−X−ローダミン(Rox)等の蛍光物質、並びに、化学発光物質等を挙げることが出来る。
【0041】
以上の各測定に使用する材料及び器具・装置などは当業者に容易に入手可能であり、各測定操作の手順・条件等は、使用する器具・装置に添付のマニュアルに従うか、又は、使用する細胞の種類等のその他条件に応じて適宜設定することが出来る。
【0042】
更に、上記の壊死マーカーと特異的に反応する化合物、例えば、既に記載したような壊死マーカーに対する各種の抗体、と標識化合物又は治療に有効な化合物とから成る複合体は、例えば、PET又はSPECTのような画像診断用又は治療用医薬品(コンジュゲート:複合体)として有用である。核医学診断に有効な放射性核種としては、例えば、ポジトロン放出核種(Cu-64など)、ガンマ線放出核種(In-111など)を挙げることが出来る。更に、標識化合物としては、15O、13N,11C及び18Fのようなよう電子反β崩壊する核種を上げることが出来る。治療に有効な化合物としては、当業者に公知の任意の薬剤、例えば、抗腫瘍剤及び細胞傷害性のβ線(Y-90など)などを放出する放射性核種を挙げることが出来る。
【0043】
従って、このようなコンジュゲートは画像診断用キットもしくは医薬組成物の有効成分と成り得る。このような医薬組成物は公知の製剤学的方法により製剤化することが可能である。例えば、薬理学上許容される担体もしくは媒体、具体的には、滅菌水や生理食塩水、植物油、乳化剤、懸濁剤、界面活性剤、安定剤、徐放剤などと適宜組み合わせて製剤化して投与することが考えられる。本発明の医薬組成物は、水溶液、錠剤、カプセル、トローチ、バッカル錠、エリキシル、懸濁液、シロップ、点鼻液、または吸入液などの形態であり得る。本発明化合物の含有率は、治療目的、投与経路、治療対象等に応じて、当業者が適宜決定することが出来る。
【実施例】
【0044】
以下、実施例に基づき本発明を更に詳細に説明するが、これらの実施例は本発明の技術的範囲を何等限定するものではない。当業者であれば、本明細書の記載に基づき、本発明の技術的範囲を逸脱せずに、多くの変形及び修飾を実施することが可能である。
【0045】
致死表現型の単離:
致死表現系を持つ細胞を同定するための種々の方法が存在する。壊死(ネクローシス)細胞またはアポトーシス細胞において、細胞形態、または細胞透過性の変化、つまり細胞膜の「水泡化」が観察される。種々の色素、染色および抗体が、そのような方法で利用可能であり、限定はしないで、ヨウ化プロピジウム、抗体Apo2.7およびカスパーゼ色素等が含まれる。
【0046】
トリパンブルーによる染色:
トリパンブルーは青色の色素である。無傷の膜を持つ生細胞は、細胞間区画からトリパンブルーを排除するため、染色されない。死細胞および瀕死細胞の細胞膜は透過性があるため、細胞質が青色に染色される。
【0047】
ヨウ化プロピジウム染色:
ヨウ化プロピジウム(PI)は蛍光のDNA間在分子である。無傷の膜を持つ生細胞は、細胞間区画からPIを排除するため、非蛍光である。死細胞および瀕死細胞はPIに対して易感染性で、透過性あるため、蛍光である。PI染色技法は壊死およびアポトーシス細胞に等しく利用される。
【0048】
アネキシンV:
アネキシンVは、ホスファチジルセリンなどの陰イオン性リン脂質部位に結合する。生細胞の細胞膜は脂質二重層構造をとっており、細胞膜の内膜と外膜でリン脂質に偏りがあり、ホスファチジルセリンは通常内膜に局在している。多くの細胞がアポトーシスを起こしている時、この脂質は細胞外膜上に転位し、露出する。この転位により、外来より加えた蛍光共役アネキシンVが、脂質と相互作用することが可能となり、それによって、アポトーシスを起こしている細胞を標識することが可能である。そこで、蛍光共役アネキシンVに標識されない死細胞を分取することにより、壊死細胞を分離することが可能になる。
【0049】
実施例1:壊死巣細胞モデル系の作製
本発明の方法は、壊死巣を形成している細胞モデルとしてネクローシスを誘導した細胞を必要とする。そこで、子宮頚がん細胞株のHeLa細胞にネクローシスを誘導し、壊死巣を形成する細胞モデル系を作製した。一般的に、HeLa細胞は接着性細胞であり、2x105〜1x106個の細胞を10cm2シャーレ上で足場依存的に培養する。通常培養では血清含有DMEM 培地(Dulbecco’s modified Eagle medium) 10mlに、2x104〜1x105個/mlの密度で、37℃, 5% CO2存在下95%空気の気相、飽和湿度の条件で培養する。HeLa細胞は増殖能が高く、栄養豊富な血清含有DMEM培地中では、2〜3日で10cm2シャーレがコンフルエントになるまで増殖する。HeLa細胞は癌細胞株なのでシャーレがコンフルエント状態になっても接触阻害はかからず増殖可能であるが、過剰に増殖させるとすみやかに細胞死を起こす。今回、HeLa細胞を1x107個/mlという高密度、さらにチューブ中で浮遊させる足場なしの状態で、チューブに蓋をした嫌気条件で培地交換せずに1週間〜2週間培養することにより、壊死巣に特徴的な低栄養、低酸素、高密度および足場非依存的な細胞の環境を再現した。
【0050】
1.1 HeLa細胞へのネクローシス誘導
HeLa細胞を10 cm2シャーレで、100 units/ml ペニシリン・ストレプトマイシン(Gibco BRL)および10% FBS(JRH社)を添加したDMEM培地(Gibco BRL)中で通常培養した。増殖したHeLa細胞をトリプシン・EDTA(Gibco BRL)で10cm2 シャーレから剥がし、氷冷したPBS(-)で2回洗浄し、1 x 10 7 個の細胞を1.5 mlのチューブに移し、1mlの上記DMEM培地あるいは10% FBSを添加しないDMEM培地中で15日間培養した。培地にはpH指示薬を添加し、細胞呼吸による酸素消費により酸素濃度の低下を3日目以降確認したが、蓋をしたまま培養を継続した。
【0051】
1.2 致死表現型の単離
1.2.1 トリパンブルーによる染色
ネクローシスを誘導したHeLa細胞を遠心分離して回収し、氷冷したPBS(-)で2回洗浄した。回収したHeLa細胞を氷冷したPBS(-)で約1 x 106個/ mlになるように懸濁し、1/10容量の0.4% トリパンブルー/PBSバッファー溶液(Gibco BRL)を加えて混和し、室温で3〜5分間インキュベーションした後、顕微鏡下で観察した。無色の生細胞、青色に染色された死細胞および瀕死細胞数をそれぞれ計測した。
【0052】
上記の方法でネクローシスを誘導したHeLa細胞は、培養1日目後には、無血清DMEM培地で13.9%、血清添加DMEM培地で20.6%、培養2日目後には、無血清DMEM培地で79.5%、血清添加DMEM培地で68.5%、培養3日目後には、無血清DMEM培地で91.5%、血清添加DMEM培地で81.2%の細胞が青色に染色され死細胞であることが確認された。その後、15日間培養したが、約90%の細胞集団が死細胞であることが確認された。
【0053】
1.2.2 蛍光色素標識による死細胞の染色
致死表現型を有する細胞には大別してネクローシスとアポトーシス(プログラム細胞死)が考えられる。壊死巣ではネクローシス細胞がアポトーシス細胞よりも比重が大きいと考えられ、細胞死を区別するため、さらに細胞を蛍光色素で染色した。ネクローシスを誘導したHeLa細胞を遠心分離して回収し、氷冷したPBS(-)で2回洗浄した。回収した細胞にアネキシンV (Annexin-V-Fluos :終濃度20 μl/ml; Roche)およびヨウ化プロピジウム(PI):終濃度1μg/ml, 株式会社同仁化学研究所)を含む染色Hepesバッファー溶液(10 mM Hepes-NaOH (pH 7.4), 140 mM NaCl, 5mM CaCl2)100 μlを加えて室温で10〜15分間インキュベーションし、蛍光顕微鏡下(励起光;488 nm, 検出;515-565 nm)で観察した。一方、10 cm2シャーレに培養したHeLa細胞を、1mM 過酸化水素を含む10%FCS含有DMEM培地に代えて1時間培養し、氷冷したPBS(-)で2回洗浄し、通常の10% FCS含有DMEM培地に戻して5時間培養し、アポトーシスを誘導した。そのHeLa細胞を同様にAnnexin-V-Fluos およびPIで染色し、蛍光顕微鏡下で観察した。
【0054】
10% FCS添加DMEM培地で6日間培養してネクローシスを誘導したHeLa細胞は核がPIで染色された。一方、アポトーシスを誘導したHeLa細胞は、細胞膜付近がアネキシンVで強く染色され、一部の細胞は核もPIで染色された。通常培養から調製した生細胞はPIおよびアネキシンVのいずれにも染色されなかった。この結果から上記の方法で作製された死細胞は、ネクローシス細胞であることが確認された。
【0055】
実施例2:壊死巣特異的マーカー分子の同定
2.1 細胞抽出液の調製
実施例1において10% FCS添加DMEM培地でネクローシスを誘導して1日目〜6日目のHeLa細胞および通常培養したHeLa細胞を回収し、氷冷したPBS(-)で2回洗浄した。氷冷した500-1,000μlの可溶化バッファー(20 mM Tris-HCl (pH 7.5), 150 mM NaCl, 1 mM EDTA, 1% NP-40)を加えて細胞を懸濁し、1.5 mlチューブに移した。チューブを4 ℃で30分間回転させながら細胞の可溶性画分を抽出し、15,000rpmで15分間遠心分離し、その上清を細胞抽出液とした。回収した細胞抽出液を、2D-Clean up kit(80-6484-51, Amersham)を用い、そのプロトコールに従って精製し、適量のlysis buffer ( 30 mM Tris (pH 8.5), 7M Urea, 2M Thiourea, 4% CHAPS, 5mM 酢酸マグネシウム)に溶解し、遠心分離した後、その上清を細胞抽出精製液とした。
【0056】
2.2 タンパク質定量
細胞抽出精製液に含まれるタンパク質をProtein Assay試薬( 500-0006, Bio-Rad )を用い、そのプロトコールに従ってBradford法に基づき定量した。具体的には、細胞抽出精製液1μlに0.1 N HCl 1μlと精製水8μlを加えてサンプル溶液とした。タンパク質標準液としてBSA溶液(23209, Thermo)を0.25-1 mg/mlに希釈し、その1μlにlysis buffer 1μlと0.1 N HCl 1μlを加えて全量を10μlとした。同様に精製水8μlにlysis buffer 1μlと0.1 N HCl 1μlを加えてブランク溶液とした。それぞれのサンプル溶液、標準溶液およびブランク溶液に、5倍希釈したProtein Assay試薬を200μlずつ加えてよく混和し、室温で5分間放置した。Protein Assay試薬を混和してから1時間以内に測定波長595 nmで吸光度を測定し、BSA標準溶液の吸光度から検量線を求め、細胞抽出精製液に含まれるタンパク質量を算出した。
【0057】
2.3 蛍光標識二次元ディファレンシャルゲル電気泳動(2D-DIGE)法を用いたプロテオミクス解析
通常培養およびネクローシスを誘導して1〜6日目のHeLa細胞から調製した細胞抽出精製液25μgずつを、それぞれCy3(CyDye DIGE Fluor Cy3, GE Healthcare)およびCy5(CyDye DIGE Fluor Cy5, GE Heaithcare)で別々に標識し、10mM Lysine(SIGMA社)を加えて蛍光標識反応を停止した。Cy3およびCy5で標識したそれぞれのHeLa細胞抽出精製液を等量混合し、一次元電気泳動用サンプルバッファー (8M Urea, 2% CHAPS, 0.5% IPG Buffer(17-6004-40, GE), 0.002% ブロモチモールブルー溶液)を加えてよく混合し、15,000rpmで5分間遠心分離し、その上清をサンプル溶液とした。そのサンプル溶液中でpH3-11のイオン勾配を有する24cmの一次元目専用ゲル(Immobiline DryStrip pH 3-11NL, 17-6003-77, GE Healthcare)を12時間膨潤し、一次元目専用等電点電気泳動システム装置(Ettan IPGphor 3 IEF System, GE Healthcare)を用いて段階的に電圧をあげながら細胞抽出精製液に含まれるタンパク質を等電点電気泳動で分離した。次に10% ポリアクリルアミドゲル(Acrylamide:17-1310-01, GE Healthcare)を用いた二次元目の電気泳動により、細胞内可溶化タンパク質をさらに分子量で分離した。二次元電気泳動により分離した蛍光標識タンパク質はバリアブルイメージアナライザー(Typhoon TRIO+, GE Healthcare) で検出し、ゲルイメージは2D-DIGE専用解析ソフトDeCyder(GE Healthcare)を用いてスポットを解析し、それぞれの細胞内でのタンパク質発現を比較した。
【0058】
ネクローシスを誘導したHeLa細胞内で発現している約3,000個のタンパク質スポットを解析した結果、ネクローシス誘導1日後には、通常培養のものと比較して発現が増加したタンパク質が0.6%, 減少したものが0.4% (図1A)、3日後には増加したものが1.1%、減少したものが3.4%みられた(図1B)。さらに、ネクローシスを誘導して6日後の細胞内可溶性画分のタンパク質の発現は、通常培養のそれと比較して、5.1%のタンパク質が増加し、2.9%が減少した(図1C)。
【0059】
2.4 質量分析法によるタンパク質の同定
ネクローシスを誘導したHeLa細胞で発現量の増加したタンパク質をMALD-TOF/MSで同定した。具体的には、上記の二次元電気泳動後の10%ポリアクリルアミドゲルをトリス、6-アミノカプロン酸、メタノール系のバッファー溶液中で2mA/cm2ゲル面積の定電流で90分間通電し、ゲル中のタンパク質を電気的にPVDF膜(ProBlott(登録商標), ABI社)に転写した。PVDF膜上のタンパク質をクマシーブルー R-350(17-0518-01, GE Healthcare)で染色して可視化し、目的とするスポットを剃刀で切り出し、1fmolのリシリルエンドペプチダーゼ(125-05061, Wako)を加えて37℃で16時間消化し、その断片化ペプチドをNuTip (登録商標)ピペットチップ(Glygen Corp.)で精製し、MALD-TOF/MS(Voyager-DETMPRO, AB SCIEX社)で解析した。得られたフラグメントをタンパク質解析用データベースと比較して、該タンパクに関する情報を得た。
【0060】
2.5 N末端アミノ酸の解析
ネクローシスを誘導したHeLa細胞で発現量の増加したタンパク質のN末端アミノ酸を、エドマン分解により順次分解して一次構造決定した。具体的には、上記の2.4で得られたタンパク質が転写されたPVDF膜をクマシーブルー R-350(GE)で染色し、目的とするスポットを剃刀で切り出し1.5 mlチューブに移した。PVDF膜を少量のアセトニトリルで湿らせた後、1 ml のMilli-Q水を加えて激しく攪拌した後、Milli-Q水を除く洗浄操作を5回繰り返し、全自動タンパク質一次構造解析装置(PPSQ33A, 島津製作所)でアミノ酸配列を自動解析した。
【0061】
その結果、壊死巣特異的マーカーとして同定されたタンパク質のうち、ペルオキシレドキシン4断片またはERp29断片について、以下に通り、N末端アミノ酸(9個)の一次配列を同定した。
(1)ペルオキシレドキシン4:WETEERPRT
(2)Erp29:LHTKGALPL
【0062】
以上の結果に基づき、通常培養のHeLa細胞と比較して2倍以上の蛍光強度があり、ネクローシスを誘導したHeLa細胞内で経時的に増加してくるスポットの中から、本発明の壊死マーカーとして、以下の表1に示すように、9種類(群)の壊死巣特異的マーカータンパク質(限定分解および部分タンパク質を含む)を同定した。尚、表1及び表2に掲載した群の中にはタンパク質が複数のGI(GenBank Identifier)番号を有するものがある。これは該タンパク質およびそのプレカーサーや変異型が、マススペクトルにおいて同様な結果を示すからである。
【0063】
【表1】

【0064】
【表2】

【0065】
2.6 ウエスタンブロッティング法によるタンパク質の同定
質量分析法およびN末端アミノ酸分析により同定した表1に記載の壊死巣特異的マーカータンパク質のうち、市販抗体が入手可能な以下に示す5種類についてウエスタンブロッティング法で確認した。具体的には、上記の2.4で得られたタンパク質が転写されたPVDF膜の非特異吸着をブロックエース(UK-B80, DSファーマ)を用いてブロッキングした後、PBS(-)で至適濃度(100〜2,000倍)に希釈した一次抗体を加え、静かに振とうしながら室温で1時間反応させた。PBSTで3回洗浄後、ビオチン標識抗IgG抗体(BA-1400, VECTASTAINN社)を加え、静かに振とうしながら室温で30分間反応させた。PBSTで3回洗浄後、アビジンービオチン標識西洋ワサビペルオキシダーゼ複合体溶液(VEC社)を加えて静かに振とうしながら室温で30分間反応させ、PBSTで3回洗浄した後、ペルオキシダーゼの基質である3, 3’-Diaminobenzidine(DAB;SK-4105, VEC社)溶液を加え、発色シグナルが観察されたところでPVDF膜をMilli-Q水に移して発色を停止させた。ネガティブコントロールとして、抗Bip抗体についてはそのブロッキングペプチド(#1084, Cell Signaling)、抗ペルオキシレドキシン4、抗カルレティクリン及び抗ERp57各抗体に対しては抗マウスIgGコントロール抗体、抗Erp29抗体に対しては抗ウサギIgGコントロール抗体を用いて同様にウエスタンブロッティングを行った。
【0066】
使用した一次抗体:
(1)ペルオキシレドキシン4:Peroxiredoxin 4 antibody [7A1], ab 16943, Abcam (スポット番号1)
(2)ERp29:ERp29 antibody, ab40982, Abcam (スポット番号2)
(3)カルレティクリン:Calreticulin mouse mAb, ab54922, Abcam (スポット番号5)
(4)Bip:Bip(C50B12) Rabbit mAb, #3177, Cell Signaling (スポット番号6)
(5)ERp57:Monoclonal Anti-ERp57 (TO-2), E5031, SIGMA (スポット番号9)
【0067】
ウエスタンブロッティング法により、MSおよびN末端アミノ酸分析により同定された9つのスポットのうち5つのスポットは、それぞれペルオキシレドキシン4、ERp29、カルレティクリン、Bip、ERp57と確認された。
【0068】
実施例3:モノクローナル抗体の作製
3.1免疫動物の感作および細胞融合
壊死巣特異的マーカーとして同定されたタンパク質のうち、ペルオキシレドキシン4断片またはERp29断片については、実施例2で同定したN末端アミノ酸配列を基にして、各々の配列を認識するマウスモノクローナル抗体を作製した。
【0069】
ペルオキシレドキシン4断片またはERp29断片の上記N末端9アミノ酸残基と、そのC末端にキャリア高分子(KLH)との結合のためシステイン残基を加えた10残基のペプチドを常法に従って約10mgずつ化学合成し、HPLCを用いて精製し、それら精製ペプチドを抗原ペプチドとした。その抗原ペプチドを常法に従ってKLHに架橋し、フロイント完全アジュバント(RM606-1、株式会社三菱化学ヤトロン)と等量で混和してエマルジョン化したものを免疫原とし、メスのマウス一群2匹ずつにそれぞれ50μgずつ投与した。免疫感作はそれらの免疫原を2日おきに3回、マウスのフットパッド(foot pad)に皮下投与して10日間感作する短期免疫と、1週間おきに3回皮下投与して3週間感作する長期免疫を行った。短期免疫では、免疫開始から10日目にマウスの肥大したリンパ節をいくつか摘出し、その内部のリンパ球とミエローマ細胞P3U1との細胞融合を行なった。長期免疫では、免疫開始から21日目に短期免疫と同様にマウスリンパ節を摘出し、その内部のリンパ球とミエローマ細胞P3U1との細胞融合を行なった。
【0070】
その結果、ペルオキシレドキシン4断片あるいはERp29断片の抗原ペプチドにKLHを架橋したそれぞれの免疫原を、短期あるいは長期免疫したマウス2匹ずつから調製したリンパ球と、ミエローマ細胞株P3U1との細胞融合から、いずれも約800ウエルでコロニーが形成した。
【0071】
3.2 ELISA法によるハイブリドーマのスクリーニング
細胞融合後のハイブリドーマは96穴プレートで培養し、通常のHAT培地により選別した。コロニー形成がみられたウエルの培養上清について、免疫原の抗原ペプチドに結合する抗体を含むかどうか、ELISA法によってスクリーニングした。ペルオキシレドキシン4断片のN末端ペプチド+システイン(WETEERPRTC)またはERp29断片N末端ペプチド+システイン(LHTKGALPLC)、あるいは新たに化学合成してHPLCで精製したぺルオキシレドキシン4断片のN末端8残基ペプチド(WETEERPR)またはERp29断片N末端8残基ペプチド(LHTKGALP)を200 μg/mlの濃度になるようにPBS(-)で希釈し、その50 μlずつを96穴イムノプレート(Maxisorp, Nunc社)に分注した。4℃で一晩静置して合成ペプチドをプレートに固定し、PBS(-)で2回洗浄し、ブロックエース(DSファーム)を加えて室温で1時間ブロッキングした後、0.1% Triton-X 100含有PBS(-)(PBST)で2回洗浄した。コロニー形成ウエルの培養上清100 μlを加えて室温で1時間インキュベーションした後、PBSTで2回洗浄し、ビオチン標識抗マウスIgG抗体(BA-1400, VEC社)と室温で30分間反応させ、PBSTで3回洗浄した。さらに、アビジン-ビオチン標識ペルオキシダーゼ複合体溶液(Mouse IgG ABC kit, VECTASTAIN社)と室温で30分間反応させ、PBSTで3回洗浄した後、ペルオキシダーゼの基質である2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS; SK-4500, VEC社)溶液を加えて室温で発色するまでインキュベーションし、マイクロプレートリーダーを用いて、測定波長405 nmの吸光度を測定して各クローンにより生じる吸光度シグナルを評価した。タイターの高いウエルを選択して、限界希釈法によりモノクローナル抗体産生ハイブリドーマをクローニングした。
【0072】
ペルオキシレドキシン4断片を免疫したマウスから得たハイブリドーマ培養上清の一次スクリーニングの結果、ペルオキシレドキシン4断片のN末端ペプチド(9アミノ酸残基)にシステインを付加した抗原ペプチドを認識し、KLHを認識しない抗体産生ウエルは短期免疫で2個、長期免疫で33個得られた。同定したペルオキシレドキシン4断片のN末端は通常の限定分解で切断される部位とは異なっていたため、このN末端配列を認識する抗体は壊死巣特異的であり、さらに認識部位を限定するため、2種類のN末端をマスクしたネガティブスクリーニング用ペプチド((Ac)WETEERPRTC, GAVQGWETEERPRTC)を常法に従って化学合成してHPLCで精製し、KLHと架橋したものを96穴プレートに固定してELISA法により二次スクリーニングを行った。その結果、同定したN末端(WETEERPRTC)を認識し、2種類のKLHに架橋したネガティブスクリーニング用ペプチド((Ac)WETEERPRTC-KLH、 GAVQGWETEERPRTC-KLH)及びKLHを認識しない抗体産生ウエルが、一次スクリーニングで選択された中から、短期免疫で1個、長期免疫で31個得られた。その中で更に、N末端8アミノ酸残基を認識する抗体産生ウエルは長期免疫で3個得られたが、短期免疫では得られなかった。そこで長期免疫マウスのハイブリドーマから、N末端8アミノ酸残基を認識する抗体産生3ウエルを含め、タイターが高かったウエルを5個選択して限外希釈法によりクローニングし、抗ペルオキシレドキシン4特異的モノクローナル抗体産生ハイブリドーマを5クローンを取得した。
【0073】
又、ERp29断片を免疫したマウスのハイブリドーマ上清の一次スクリーニングの結果、ERp29断片のN末端ペプチド(9アミノ酸残基)にシステインを付加した抗原ペプチドを認識し、KLHを認識しない抗体産生ウエルは短期免疫で39個、長期免疫で21個得られた。その中で、N末端8アミノ酸残基を認識する抗体産生ウエルは短期免疫で7個、長期免疫で5個得られ、その中からタイターの高いウエルを、短期免疫から2個、長期免疫から3個選択して限外希釈法によりクローニングし、抗ERp29断片特異的モノクローナル抗体産生ハイブリドーマを5クローン取得した。
【0074】
上記のクローンの代表的なクローンとして、壊死マーカーであるヒトペルオキシレドキシン4(PRDX4)断片に対するマウスモノクローナル抗体を産生するハイブリドーマ(名称:YKP4 C8505 FCS(+))及び壊死マーカーであるヒトErp29断片に対するマウスモノクローナル抗体を産生するハイブリドーマ(名称:YKERp C6707 FCS(+))を千葉県木更津市かずさ鎌足2−5−8、独立行政法人製品評価機構特許微生物寄託センターに、特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約に基づき寄託した。同センターから、夫々、受領番号NITE ABP-1062及び受領番号NITE ABP-1063(受領日:2011年1月20日)として寄託されたことが確認された。
【0075】
実施例4:モノクローナル抗体および市販抗体による壊死巣およびその周辺組織の免疫染色
4.1 組織免疫染色法
ヒト乳がん組織の癌部と非癌部(N=5)およびヒト肺がん組織の癌部と非癌部(N=5)の組織切片を用いて、壊死巣特異的マーカータンパク質を認識する抗体を評価した。乳がん患者および肺がん患者由来組織サンプルのパラフィン包埋切片は(株)医学生物学研究所から入手した。各組織のパラフィン包埋切片は、キシレンおよびエタノールを用いて常法に従って脱パラフィンし、組織切片をPBS(-)で3回洗浄し、10mM クエン酸バッファー(pH 6.0)で抗原を賦活化し、0.3% H2O2中30分間静置して内在性のペルオキシダーゼを失活させた後、ウマ血清で非特異吸着をブロッキングした。壊死巣マーカーに対する抗体(ペルオキシレドキシン4断片のN末端ペプチドおよびERp29断片のN末端ペプチドを認識するモノクローナル抗体(実施例3で最終的に得られた、夫々、5クローンの中の一つ)、及び実施例2に記載の5種類の市販抗体)をそれぞれPBS(-)で至適濃度(250〜1,000倍)に希釈して、ブロッキング後の組織切片と室温でそれぞれ1時間反応させた後、PBS(-)で3回洗浄し、ビオチン標識抗IgG抗体(BA-1400, VEC社)と室温で30分反応させた。組織切片をPBS(-)で3回洗浄した後、アビジンービオチン標識西洋ワサビペルオキシダーゼ複合体(VEC社)と室温で30分間反応させ、PBS(-)で3回洗浄した後、ペルオキシダーゼの基質である3, 3’-Diaminobenzidine(DAB;SK-4105, VEC)溶液を加え、室温で約2分間インキュベーションして組織を免疫染色した。発色した組織切片を蒸留水につけて反応を停止させた後、ヘマトキシリン液で対比染色を行い、非水性封入剤(MGK-S、松浪硝子工)で封入した後、顕微鏡下で組織を観察した。
【0076】
組織免疫染色の結果を図2に示す。ペルオキシレドキシン4断片のN末端ペプチド、またはERp29断片のN末端ペプチドを認識するモノクローナル抗体を用いて、ヒト乳がん組織の癌部と非癌部(N=5)およびヒト肺がん組織の癌部と非癌部(N=5)をそれぞれ免疫染色した結果、ヒト乳がん組織およびヒト肺がん組織の壊死巣、あるいはその周辺部の組織に於いて強い染色が認められたが(図2A-a,c,および図2B-a,c)、ヒト乳がんおよび肺がんの非癌部組織は染色されないかまたは染色されても弱かった(図2A-b,d,及び図2B-b,d)。また、実施例2に記載の5種類の市販抗体(一次抗体)を用いて同様にヒト組織免疫染色した結果、それらの抗体はヒト乳がん組織およびヒト肺がん組織の壊死巣、あるいはその周辺部の組織に於いて強い染色が認められたが、ヒト非癌部では染色されないかまたは染色されても弱い同様の結果が得られた(図2C-図2G)。
【0077】
実施例5:モノクローナル抗体の精製
ハイブリドーマ(YKP4 C8505 FCS(+)及びYKERp C6707 FCS(+))の各培養上清から、夫々、抗ヒトPRDX4モノクローナル抗体及び抗ヒトErp29モノクローナル抗体をプロテインAカラムで精製した。即ち、PBS(-)で平衡化したHiTrapAカラム(GE Healthcare社)1mlに培養上清を50ml添加し、PBS(-) 5mlでカラムを洗浄した後、0.17 Mの(pH2.3)緩衝液でカラムから溶出した。溶出画分は280nmの吸光度でモニタリングしながら1mlずつ分取し、吸光度の高い画分をブラッドフォード法(Protein Assay, Bio-Rad社)で測定して夫々の精製モノクローナル抗体を得た。
【0078】
実施例6:モノクローナル抗体のアイソタイプの決定
実施例5で精製した2種類のモノクローナル抗体のアイソタイプをマウスモノクローナル抗体アイソタイピングキット(MMT1, Serotec社) で確認した。マニュアルに準じ、精製したモノクローナル抗体150μlを反応チューブに添加して室温で30秒反応させた。反応液をボルテックスミキサーでよく混和した後、アイソタイピングストリップを反応チューブに入れてアイソタイプを判定した。その結果、抗ヒトPRDX4モノクローナル抗体及び抗ヒトErp29モノクローナル抗体のアイソタイプは夫々、IgG1/κ及びIgG2a/κであった。
【0079】
実施例7:抗体の評価
実施例5で得られた精製モノクローナル抗体の親和定数及び解離定数をBIACore システム(Biacore AB Corporation:現在は GEヘルスケア・ジャパン株式会社が供給する)を用いて、表面プラズモン共鳴現象(SPR)を測定することにより得た。すなわち、抗原となるビオチン化ペプチドを合成して得て、それをHBバッファーで1mg/mlに希釈して作製したペプチド溶液100μlをセンサチップSAにBIACore システムの機器使用マニュアルに従って固定した。精製したモノクローナル抗体を0.25μg/ml 〜80 μg/mlの濃度範囲で2倍希釈系列を作製し、そのうち45μlをBIACoreシステム(流速30μl/min)に添加してBIACore システムの機器使用マニュアルに従って抗原となるペプチドに対する結合量を測定した。その結果、抗ヒトPRDX4モノクローナル抗体の親和定数及び解離定数として1.26 x 108及び7.9 x 10-9を得た(図3)。
【0080】
実施例8:放射線標識モノクローナル抗体を用いる担癌マウスの癌部の検出
1)抗ヒトPRDX4モノクローナル抗体及び抗ヒトErp29モノクローナル抗体のIn-111標識 0.05M borate buffer pH8.5に溶解した各IgG抗体と0.05M borate buffer pH8.5に溶解したN-[(R)-2-amino-3-p-isothiocyanato-phenyl]propyl]-trans -(S,S)-cyclohexane-1,2-diamine-pentaacetic acid(DTPA)を、分子量比で1対2.5の割合で混合し、37度で16時間反応させた。塩化インジウム([In-111]Cl3)を等量の1M acetate buffer pH6.0と混合し、室温で5分間静置した後、等量の上記DTPAとIgGの反応物を混合し、室温で30分静置した。セルロースアセテート電気泳動により、[In-111]DTPA-IgGと[In-111]DTPAに分離し、IgGに結合したDTPAの数を求めた。上記DTPAとIgGの反応物をSephadex G50担体にアプライし、未結合のDTPAを取り除き、DTPA-IgGを精製した。この精製DTPA-IgGを上述の方法により、In-111標識し、Sephadex G50担体により、未反応のIn-111を除去した[In-111]DTPA-IgGを使用し、以下の実験を実施した。図4は、セルロースアセテート電気泳動により精製前と精製後のDTPA-IgGの泳動後のオートラジオグラフィーの写真を示す。
【0081】
2)In-111標識モノクローナル抗体とHeLa生細胞との反応 5x105と5x106のHeLa細胞を1% BSA/PBAに懸濁し、[In-111]DTPA-IgGを加え、氷中で1時間インキュベートし、PBSで洗浄し、HeLa細胞に結合した放射活性をガンマカウンターで測定した。その結果、標識した抗ヒトPRDX4モノクローナル抗体及び抗ヒトErp29モノクローナル抗体は、生きたHeLa細胞には結合しないことが明らかとなった。図5には、左が5x105のHeLa細胞に、右が5x106のHeLa細胞に夫々のIn-111標識モノクローナル抗体(Pで示す)を接触させて結合させた特異的結合率を示す。IgG2a、E、IgG1はそれぞれ他の抗体を使用した陰性コントロールを示す。PRDX4及びErp29は細胞内蛋白質であることからHeLa細胞に結合しないことは合理的であり、次に示す担癌動物を用いた試験を進める上での一つの根拠となった。
【0082】
3)In-111標識モノクローナル抗体を用いた担癌マウスに於けるイメージング HeLa細胞をBALB/c-nu/nuマウスの皮下に移植し腫瘍を形成させた。50μCiの各[In-111]DTPA-IgG(未標識IgGによりタンパク量を12μgに調整)を尾静脈から投与し、投与後1、2、3、4日にレントゲンとガンマ線撮像を実施した。時間とともに腫瘍の一部に[In-111]DTPA-IgGが集積することが明らかとなった。図6は、吸入麻酔をしてテープで固定して撮影した、担癌マウスのレントゲン像(左)とガンマ線撮像(右)を示す。図6では、左から1日目、2日目、3日目、4日目の各々レントゲン像(左)とガンマ線撮像(右)が並んでいる。図6の1から4日目の担癌マウスのレントゲン写真(左)では、充分に大きくなったヒト癌が右側の臀部付近に瘤状に写っている。また、ガンマ線撮像(マウス像右)では、ヌードマウスの腫瘍に明瞭な、特に2目から4日目でより明瞭な標識抗ペルオキシレドキシン4(PRDX4)抗体の集積が認められた。
【0083】
4)In-111標識モノクローナル抗体の集積部位の確認
[In-111]DTPA-IgG投与4日目の撮像終了後に、腫瘍を摘出し、凍結標本を複数作製し、作製した複数の標本のうち隣接標本でオートラジオグラフィーとヘマトキシリン・エオシン染色(HE染色)を実施した。図7では、腫瘍の切片が、左からオートラジオグラフィー、HE染色、その2つの重ね合わせが並べてある。腫瘍切片のHE染色では、中央付近の壊死部は青色に乏しく弱いが赤色がかった色に、外側の正常な癌組織部位と中央を取り巻く壊死巣周辺部位は赤みがかった青色に染まっていた。図7に示される様に、摘出した腫瘍(大きさ:PRDX4で約13.6mm X 18.3mm、ERp29で約13.5mm X 16.5mm)の中央の壊死部を取り巻く壊死巣周辺部位に[In-111]DTPA-IgGが選択的に集積することが明らかとなった。すなわち、オートラジオグラフィーとHE染色の写真を重ね合わせると、中央付近の壊死巣を取り巻く壊死巣周辺部位にIn-111標識モノクローナル抗体の集積が認められると判断された。
【0084】
5)In-111標識モノクローナル抗体が集積する壊死巣周辺部の細胞の形態
摘出した腫瘍の病理より、核が残っている壊死細胞に[In-111]DTPA-IgGが集積し、核が脱落した壊死細胞には集積しないことが明らかとなった。このことは、壊死して時間があまり経過していない細胞及びその近傍に壊死マーカータンパク質が残存していることを示しているものと思われる。すなわち、図8では、中央付近の壊死部では細胞の形態がくずれて核が認められないこと、また壊死部周辺部では細胞の核が認められるが正常な癌細胞と形態が異なること、腫瘍の外側付近の周辺部は核と細胞質が明確であり正常な癌細胞の形態であることがわかる。図中の顕微鏡写真の中のバーは100ミクロンメーターを示す。
【産業上の利用可能性】
【0085】
本発明の壊死マーカー、例えば、タンパク質又はその断片に対応する抗体あるいは抗体を用いることによって、該抗体が認識する壊死巣又はその原因となる病態の進行状況を簡便、迅速に測定できる新規な測定キットを提供することが可能となる。このような壊死巣としては、各種固形癌、心筋梗塞又は脳梗塞の壊死巣(組織)のみならず、壊死後性肝硬変、壊死性膵炎、壊死性筋膜炎等の壊死巣、更に、動脈硬化性壊疽、糖尿病性壊疽あるいは閉塞性壊疽における壊死巣も対象となる。
【0086】
その結果、各種癌マーカーなどに比較して病巣の壊死という観点からより広範な疾病の分野で使用が出来る検出キットやそれら疾病の壊死部位をターゲットとする治療薬開発が可能となる。例えば、低分子抗体など人工抗体を作製して、従来の高分子である抗体を使用することによって、通常の抗体を使用した場合には高分子であるが故に細胞内に導入することが難しかったのに対して、低分子であるが故により導入し易くやすくなり、更に、このような各種低分子抗体は、組織移行性が高いと考えられ、画像診断用キットもしくは医薬組成物の有効成分として有用である。
【技術分野】
【0001】
本発明は、新規な壊死マーカー、該壊死マーカー量を使用する壊死巣を検出する方法、壊死マーカーと特異的に反応する化合物を含む壊死巣を検出するためのキット、該壊死マーカーと特異的に反応する化合物と標識化合物又は治療に有効な化合物から成る、画像診断用組成物又は治療用コンジュゲート、該コンジュゲートを含む、画像診断用キットもしくは医薬組成物、及び、疾患に関連する壊死を検出する壊死マーカーを同定する方法等に関する。
【背景技術】
【0002】
一般に壊死巣は、物理的損傷あるいは血液供給の障害、喪失、減少により各種組織の細胞に対する栄養並びに酸素供給が低下した状態で起こる細胞死により起因する。例えば固形癌の場合は、癌腫が大きくなって癌組織全体に栄養供給が行き渡らなくなった結果として壊死巣が生じる。また、心筋梗塞や脳梗塞についても必ず壊死が起こる。更に、血流の悪いことから貧栄養、低酸素となる壊死後性肝硬変 (postnecrotic cirrhosis)、壊死性膵炎 (necrotizing pancreatitis)、皮下組織から筋膜にかけて重症となる炎症である壊死性筋膜炎 (necrotizing fasciitis)なども壊死巣をもつ病態である。その他に、動脈硬化性壊疽、糖尿病性壊疽あるいは閉塞性壊疽についても、壊死巣に関連する病変である。
【0003】
壊死巣は周囲の組織、細胞に悪影響を与えることから、壊死部位の病勢、病巣などを検出・診断したり、その重症となっている病巣部位を見つけだしその部位をターゲットとして治療することができるようになれば、産業上有用である。
【0004】
しかし、壊死巣を検出するバイオマーカーに関する先行技術として、リンパ腫細胞系および肺癌細胞系由来の不溶性細胞内抗原として選択した3種の抗体(特許文献1)、可溶性核マトリックス蛋白に対する抗体(特許文献2)、あるいは腫瘍の壊死中心として同定された核抽出物およびヒストンH1に特異的結合する抗体あるいは低分子抗体(特許文献3)などに限られている。心臓血管関連の壊死も含む悪性度診断用マーカーとして炎症性マーカー(CRP,TNF,IL-1,-6 他)が知られている。心筋ストレスマーカーとしてBNPも使用されている。
【0005】
又、癌のバイオマーカーとしては、例えば、すい臓がん及び肺腺癌のバイオマーカーとしてPeroxiredoxin 4(非特許文献1及び2)、及び、大腸がんのバイオマーカーとしてAnnexin A2(特許文献4)が知られている。更に、壊死細胞の細胞核から放出されるHMGB1に対する特異的単クロー ン抗体の治療への開発も進行中である。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特許第2733658号明細書
【特許文献2】特許第3190042号明細書
【特許文献3】特表2002-519065号公報
【特許文献4】特開2008-14937号公報
【非特許文献】
【0007】
【非特許文献1】Lin JF, Xu J, Tian HY, Gao X, Chen QX, Gu Q, Xu GJ, Song JD, Zhao FK.,Int J Cancer. 2007 Dec 15;121(12):2596-605
【非特許文献2】Chen G, Gharib TG, Huang CC, Thomas DG, Shedden KA, Taylor JM, Kardia SL, Misek DE, Giordano TJ, Iannettoni MD, Orringer MB, Hanash SM, Beer DG.,Clin Cancer Res. 2002 Jul;8(7):2298-305
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、各種の癌及び壊死巣に関連する様々な病変の検出・診断において、特異性が高く有効に使用できるようなバイオマーカーは未だ得られていない。
【0009】
本発明者は壊死巣が栄養並びに酸素供給が低下した状態で起こることに着目し、壊死巣に特徴的なタンパク質あるいはその断片を、低栄養、低酸素、高密度および足場非依存的な条件下で培養したヒト細胞から、蛍光標識二次元ディファレンスゲル電気泳動(2D-DIGE)、質量分析計(MS)、N-末端アミノ酸分析法を用いた疾患プロテオミクス手法を用いて、上記のような汎用性を有する壊死マーカーとしての機能を有する、9種類の遺伝子の発現産物であるタンパク質又はその断片を同定することに成功し、本発明を完成した。
【0010】
更に、上記タンパク質に対する抗体が乳癌と肺癌の病巣標本の切片における壊死巣を特異的に認識し、染め分けることが出来ることが確認された。更に、アイソトープ標識した該抗体が癌細胞を移植したヌードマウスの担癌部分の壊死叢周囲を特異的に認識し、イメージング可能であることが今回初めて示された。
【課題を解決するための手段】
【0011】
即ち、本発明は以下の各態様に係るものである。
[態様1]以下の9つの群に含まれるいずれか一つのアミノ酸配列をコードする遺伝子の発現産物又は該発現産物に対する自己抗体から成る、壊死マーカー:
(1)配列番号1で示されるアミノ酸配列、又は、該アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは該アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、該アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(2)配列番号2〜4のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(3)配列番号5〜9のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(4)配列番号10〜15のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(5)配列番号16〜18のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(6)配列番号19〜22のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(7)配列番号23〜26のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(8)配列番号27〜29のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(9)配列番号30〜35のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列。
[態様2]遺伝子の発現産物が、該遺伝子のmRNA,cDNA,若しくは、それらの部分塩基配列を含む核酸分子、又は、該遺伝子がコードするタンパク質又はその部分ポリペプチドである、態様1記載の壊死マーカー。
[態様3]配列番号1、又は、配列番号2〜4のいずれか一つで示されるアミノ酸配列を有するタンパク質の部分ポリペプチドから成る、態様1又は2記載の壊死マーカー。
[態様4]態様1ないし3のいずれか一項に記載の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの量を測定することにより、壊死巣を検出する方法。
[態様5](1)試料中に含まれる態様1ないし3のいずれか一項に記載の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの濃度を測定し、その測定値が正常レベルよりも上昇していることを指標として壊死巣を検出する、態様4記載の方法。
[態様6]配列番号1〜35のいずれか一つで示されるアミノ酸配列を有するタンパク質又はその部分ポリペプチドに対する抗体を用いて、該タンパク質又はその部分ポリペプチドの量を測定することを特徴とする、態様4又は5記載の方法。
[態様7]各遺伝子の発現産物であるタンパク質又はその部分ポリペプチドを抗原として用いて、該発現産物に対する自己抗体から成る壊死マーカーの量を測定する、態様4又は5記載の方法。
[態様8]試料として全血又は血清を使用する、態様4ないし7のいずれか一項に記載の方法。
[態様9]壊死巣が、各種固形癌、心筋梗塞、脳梗塞、壊死後性肝硬変 (postnecrotic cirrhosis)、壊死性膵炎 (necrotizing pancreatitis)、壊死性筋膜炎 (necrotizing fasciitis)、動脈硬化性壊疽、糖尿病性壊疽、又は、閉塞性壊疽に関連することを特徴とする、態様4ないし8のいずれか一項に記載の方法。
[態様10]態様4ないし8のいずれか一項に記載の方法に用いる検出キットであって、態様1ないし3のいずれか一項に記載の壊死マーカーと特異的に反応する化合物を含む該キット。
[態様11]特異的に反応する化合物が抗体である、態様10記載のキット。
[態様12]態様1ないし4のいずれか一項に記載の壊死マーカーと特異的に反応する化合物と標識化合物又は治療に有効な化合物から成る、画像診断用又は治療用コンジュゲート。
[態様13]態様12に記載のコンジュゲートを活性成分として含む、画像診断用キット又は医薬組成物。
[態様14]
疾患に関連する壊死を検出する壊死マーカーを同定する方法であって、ヒト細胞を低栄養、低酸素、高密度および足場非依存的な条件下の培養で誘導して得られる壊死細胞が発現するタンパク質と、通常の培養条件で培養した同細胞が発現するタンパク質とを比較して、該壊死細胞においてより高濃度で存在するタンパク質あるいはその断片を該壊死マーカー選択することを特徴とした前記方法。
【発明の効果】
【0012】
試料において本発明の壊死マーカー量を測定することによって、各種固形癌、心筋梗塞又は脳梗塞の壊死巣(組織)のみならず、壊死後性肝硬変、壊死性膵炎、壊死性筋膜炎等の壊死巣、更に、動脈硬化性壊疽、糖尿病性壊疽あるいは閉塞性壊疽における壊死巣となる部位を検出することが可能となる。
【0013】
又、本発明の壊死マーカーであるタンパク質あるいはその断片に対する抗体は、乳癌と肺癌の病巣標本の切片における壊死巣を染め分けることが出来ることが確認され、これらはヒトの乳癌及び肺癌の壊死巣組織を陽性として検出可能な癌の壊死マーカーとして有用であることが具体的に示された。
【0014】
更に、アイソトープ標識した該抗体によって、癌細胞を移植したヌードマウスの担癌部分の壊死叢周囲を特異的に認識してイメージング可能であることが示された。
【図面の簡単な説明】
【0015】
【図1】図1は本発明の実施例において、ネクローシスを誘導したHeLa細胞と通常培養のHeLa細胞から調製した細胞抽出精製液を蛍光標識二次元ディファレンシャルゲル電気泳動(2D-DIGE)法を用いてプロテオミクス解析したゲルの写真である。図1Aはネクローシス誘導1日後、図1Bはネクローシス3日後、図1Cはネクローシス誘導6日後の2D-DIGE法で解析した結果をそれぞれ示す。図1C中の矢印で示したスポットは質量分析法およびN末端アミノ酸解析により同定したスポットを示し、各スポット番号は表1のスポット番号(群)に対応する。
【図2】図2は本発明の実施例において、壊死巣特異的マーカーに対する各種の抗体を用いて、壊死巣を含むヒト乳がんおよびヒト肺がん組織を免疫染色した典型的な組織免疫染色像である。図中のaはヒト乳がん組織の壊死巣を含む癌部、bは非癌部の染色像を示す。図中のcはヒト肺がん組織の壊死巣を含む癌部、dは非癌部の染色像を示す。ヒト乳がんおよび肺がん組織の壊死巣を含む癌細胞は各抗体により強く染色され、ところどころにヘマトキシリン液で対比染色された核が認められた。
【図3】抗PRDX4抗体とビオチン化ペプチドとの相互作用を測定してカイネティック解析したBIACoreのセンサグラムを示す。
【図4】セルロースアセテート電気泳動により、精製前と精製後のDTPA-IgGの泳動後のオートラジオグラフィーの写真を示す。
【図5】各In-111標識モノクローナル抗体とHeLa生細胞との反応をガンマカウンターで測定した結果を示す。
【図6】In-111標識モノクローナル抗体を用いた担癌マウスに於けるイメージングの結果を示すレントゲン写真である。
【図7】In-111標識モノクローナル抗体投与4日目の撮像終了後に、腫瘍を摘出し、凍結標本を複数作製し、作製した複数の標本のうち隣接標本でオートラジオグラフィーとヘマトキシリン・エオシン染色(HE染色)を実施した結果を示す。
【図8】In-111標識モノクローナル抗体が集積する壊死巣周辺部の細胞の形態を示す。
【発明を実施するための形態】
【0016】
本発明の壊死マーカーは、本明細書の実施例に記載したように、適当なヒト細胞(例えば、子宮頸がん細胞株であるHeLa細胞株等の樹立培養細胞株)を低栄養、低酸素、高密度および足場非依存的な条件下の培養で誘導して得られるヒト壊死細胞が発現するタンパク質と通常の培養条件で培養した同細胞が発現するタンパク質を、当業者に公知の蛍光標識二次元ディファレンスゲル電気泳動(2D-DIGE)、質量分析計(MS)、N-末端アミノ酸分析法を用いた疾患プロテオミクス手法を用いて同定・比較することにより得ることができる。
【0017】
従って、本発明は、疾患に関連する壊死を検出する壊死マーカーを同定する方法も提供する。従って、この方法は、ヒト細胞を低栄養、低酸素、高密度および足場非依存的な条件下の培養で誘導して得られる壊死細胞が発現するタンパク質と、通常の培養条件で培養した同細胞が発現するタンパク質とを比較して、該壊死細胞においてより高濃度で存在する(高発現する)タンパク質あるいはその断片(限定分解物又は部分タンパク質)を該壊死マーカー選択することを特徴とする。
【0018】
本明細書において、「低栄養、低酸素、高密度および足場非依存的な条件」とは、例えば、1x107個/ml程度の細胞密度でチューブに蓋をした嫌気条件で培地交換せずに約1週間〜2週間培養チューブ中で浮遊させて培養するような条件を意味する。
一方、「通常の培養条件」とは、例えば、血清含有DMEM 培地(Dulbecco’s modified Eagle medium) 中で、2x104〜1x105個/mlの細胞密度で、37℃, 5% CO2存在下95%空気の気相、飽和湿度の条件で培養することを意味する。
更に、「より高濃度で存在する(高発現する)タンパク質」とは、例えば、通常の培養条件で培養した細胞と比較して、蛍光標識二次元ディファレンスゲル電気泳動において約2倍以上の蛍光強度があり、壊死が誘導された細胞内で経時的に増加するスポットに含まれるタンパク質を意味する。
【0019】
このような比較の結果、実施例に記載の表1に示すような、Peroxiredoxin 4, ERp29, VDAC-1, Annexin A2, Calreticulin, GRP78, PDIA6, HSP60及びERp57の9種類(群)の遺伝子産物であるタンパク質又はその部分ポリペプチドが、通常の培養条件で培養した正常なヒト細胞と比較して、ヒト壊死細胞において有意なレベルのより高濃度で存在することを初めて見出した。因みに、これらの遺伝子自体は公知であるが、それが、壊死組織に特異的に高発現することはこれまで知られていなかった。
【0020】
従って、上記の遺伝子の発現産物又は該発現産物に対する自己抗体は壊死マーカーとして有用である。
【0021】
このような壊死マーカーとして使用できる遺伝子の発現産物として、例えば、該遺伝子のmRNA,cDNA,若しくは、それらの部分塩基配列を含む核酸分子、又は、該遺伝子がコードするタンパク質又はその部分ポリペプチドを挙げることが出来る。例えば、上記遺伝子が発現するタンパク質は、壊死組織に特異的に高発現する「壊死巣特異的マーカータンパク質」として有用である。
【0022】
より具体的には、上記の各遺伝子がコードするタンパク質のアミノ酸配列として、夫々、以下のアミノ酸配列挙げることが出来る:
(1)配列番号1〜35のいずれか一つで示されるアミノ酸配列、
(2)(1)の各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列、又は(1)の各アミノ酸配列と90%以上、好ましくは95%以上、更に好ましくは98%以上の相同性を有するアミノ酸配列であって、(1)の各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列。
【0023】
更に、該遺伝子がコードするタンパク質の部分ポリペプチドの一例として、実施例2で同定されたような、Peroxiredoxin 4(配列番号1)及びERp29(配列番号2〜4)の部分ポリペプチドを挙げることができる。
【0024】
尚、2つのアミノ酸配列における配列の相同性(同一性)を決定するために、配列は比較に最適な状態に前処理される。例えば、一方の配列にギャップを入れることにより、他方の配列とのアラインメントの最適化を行う。その後、各部位におけるアミノ酸残基又は塩基が比較される。第一の配列における、ある部位に、第二の配列の相当する部位と同じアミノ酸残基又は塩基が存在する場合、それらの配列は、その部位において同一である。2つの配列における相同性は、配列間での同一である部位数の全部位(全アミノ酸又は全塩基)数に対する百分率で示される。
【0025】
上記の原理に従い、2つのアミノ酸配列における相同性は当業者に公知の任意の方法で決定することができる。例えば、Karlin及びAltshulのアルゴリズム(Proc.Natl.Acad.Sci.USA 87:2264−2268,1990及びProc.Natl.Acad.Sci.USA 90:5873−5877,1993)により決定することが出来る。このようなアルゴリズムを用いたBLASTプログラムがAltshulらによって開発された(J.Mol.Biol.215:403−410,1990)。さらに、Gapped BLASTはBLASTより感度良く相同性を決定するプログラムである(Nucleic Acids Res.25:3389−3402,1997)。上記のプログラムは、主に与えられた配列に対し、高い相同性を示す配列をデータベース中から検索するために用いられる。これらは、例えば米国National Center for Biotechnology Informationのインターネット上のウェブサイトにおいて利用可能である。
【0026】
或いは、配列間の相同性として、Tatiana A. Tatusovaらによって開発されたBLAST 2 Sequencesソフトウェア(FEMS Microbiol Lett.,174:247−250,1999)を用いて決定した値を用いることも可能である。このソフトウェアは米国National Center for Biotechnology Informationのインターネット上のウェブサイトにおいて利用可能であり、入手も可能である。用いるプログラム及びパラメーターは以下のとおりである。アミノ酸配列の場合、blastpプログラムを用いパラメーターとしては、Open gap:11 and extension gap:1 penalties,gap x_dropoff:50,expect:10,word size:3,Filter:ONを用いる。更に、高感度なFASTAソフトウェア(W.R.Pearson and D.J.Lipman,Proc.Natl.Acad.Sci.USA,85:2444−2448,1988)を用いて相同性を示す配列をデータベースから検索することもできる。いずれのパラメーターも、ウェブサイト上でデフォルト値として用いられているものである。
【0027】
本発明に係る壊死巣を検出する方法は、上記の本発明の壊死マーカー量を測定することを含むものである。より具体的には、例えば、(1)試料中に含まれる本発明の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの濃度を測定し、その測定値が正常レベルよりも上昇していることを指標として壊死巣を検出することから成る。
【0028】
本発明方法に使用する試料としては、壊死巣からの上記発現産物が含まれているような生体由来の試料である限り、その由来・形態等に特に制限は無いが、好適例として、全血又は血清を挙げることが出来る。
【0029】
本発明方法によって検出することができる壊死巣の種類・由来組織等に特に制限はなく、例えば、各種固形癌、心筋梗塞、脳梗塞、壊死後性肝硬変 (postnecrotic cirrhosis)、壊死性膵炎 (necrotizing pancreatitis)、壊死性筋膜炎 (necrotizing fasciitis)、動脈硬化性壊疽、糖尿病性壊疽、又は、閉塞性壊疽に関連すること壊死巣を挙げることが出来る。
【0030】
上記各遺伝子の発現産物の発現量の測定は、測定方法・原理に応じて、定量的、半定量的、又は定性的であり得る。指標となる上昇のレベルは、検出方法において用いた試料及び壊死マーカーの種類、測定手段・方法の原理及び条件等において有意な差を示すものである。例えば、定量的な測定においては、正常レベルに対して、1.5倍以上とすることができる。
【0031】
上記遺伝子がコードするタンパク質又はその部分ポリペプチドの量は、当業者に公知の任意の方法で測定することが可能である。例えば、該適当な抗体を用いたウェスタンブロット等の免疫染色及びEIA等の各種の免疫学的特異反応を利用する方法、エドマン法を用いた気相シークエンサー等ペプチドのアミノ酸配列分析法、更には、MALDI−TOF/MS及びESI Q−TOF/MS法等に代表される質量分析によって検出することが出来る。
【0032】
上記の方法の中でも、ウェスタンブロット法及びEIA等の酵素免疫測定法等の、該タンパク質又はその部分ポリペプチドに特異的な抗体との抗原抗体反応によって該白質の発現量又はその部分ポリペプチドを測定する検査方法が好適である。
【0033】
更には、上記の各遺伝子の発現産物であるタンパク質又はその部分ポリペプチドを抗原として用いて、該発現産物に対する自己抗体から成る壊死マーカーの量を抗原抗体反応によって測定する方法を挙げることができる。
【0034】
従って、上記抗体は、該タンパク質又はその適当な部分ポリペプチド(ペプチド断片)又はそれらの各種誘導体又は複合体等を抗原物質又は免疫原として用いて、当業者に公知の適当な方法で調製することが可能である。例えば、ポリクローナル抗体の場合には、マウス、ラット、ウサギ、ヤギ、ニワトリ等の適当な動物に投与し、その抗血清から調製することが可能である。或いは、モノクローナル抗体作成法(「単クローン抗体」、長宗香明、寺田弘共著、廣川書店、1990年; "Monoclonal Antibody" James W. Goding, third edition, Academic Press, 1996)等に記載の公知の細胞融合を用いる方法でモノクローナル抗体として調製することも可能である。
【0035】
更に、遺伝子工学的手法によって調製することができる、キメラ抗体、ヒト化抗体、並びに、一本鎖抗体、重鎖CDR1〜3を有する重鎖可変ドメインと、軽鎖CDR1〜3を有する軽鎖可変ドメインとをリンカーで結合した構造からなる単鎖可変領域抗体断片(scFv)、Fab断片抗体、及びFab’断片抗体等の低分子抗体等の当業者に公知の任意の形態を有する各種の人工抗体を挙げることが出来る。これらは当業者に公知の任意の方法によって容易に製造することができる。
【0036】
このような抗体には、酵素、放射性同位体、ナノ粒子、蛍光色素、及び金属原子等の当業者に公知の各種の標識物質で標識されているものも含まれる。
【0037】
又、上記遺伝子のmRNA(又は、cDNA)は、例えば、該遺伝子の塩基配列に基づき適宜設計したプライマー又はプローブを使用したRT−PCR法、リアルタイム逆転写PCR(リアルタイムRT−PCR)等の各種定量的PCR法、並びに各種のマイクロアレイ(DNAチップ)法等の当業者に公知の方法で増幅・検出することが出来る。PCR法で増幅された核酸分子の検出・同定は、その塩基配列を直接決定する方法(シークエンス法)、又は電気泳動との組み合わせ等、適当な方法で行うことが出来る。
【0038】
上記のプライマー又はプローブの塩基配列は、鋳型との特異的な結合が可能となるような塩基数、例えば、15−40塩基、より具体的には、15−25塩基程度を有することが好ましく、更には、プライマー内でヘアピン構造をとったり、センス鎖とアンチセンス鎖とが互いにアニーリングしないような塩基配列とすることも重要である。例えば、OligoTM(National Bioscience Inc.製)のような市販のプライマー設計用のソフトウェアを使用することも可能である。
【0039】
本発明検出の方法に用いる検出キットは、本発明の壊死マーカーと特異的に反応する化合物を含むことを特徴とする。このような化合物の好適例として、上記の各種抗体を挙げることが出来る。
【0040】
本発明の検出キットは、測定対象又は測定原理等に応じて、適当な構成をとることが出来る。該キットは、その構成要素として、例えば、上記発現産物、例えば、タンパク質又はその部分ポリペプチドに特異的な抗体、若しくは該発現産物に対する自己抗体に対する抗原である該発現産物であるタンパク質又はその部分ポリペプチド、各種の二次抗体(標識抗体)、上記のmRNA(cDNA)の増幅用プライマー及びDNAチップ等で使用するハイブリダイゼーション用のプローブ(例えば、10〜100個程度の連続した塩基配列から成る)のような、上記遺伝子の発現産物と特異的に反応する化合物を含むことができる。更に、上記キットには、その構成・使用目的などに応じて、当業者に公知の他の要素又は成分、例えば、各種試薬、酵素、緩衝液、反応プレート(容器)等が含まれる。尚、PCR反応後の検出を容易にするために、これらプライマーの少なくともいずれかの末端に、当業者に公知の任意の蛍光物質等の標識物質が結合していることが好ましい。例えば、適当な標識物質として32P等の放射線標識、Cy3及びCy5のようなシアニン類、6−カルボキシフルオレッセイン(FAM)、4,7,2’,4’,5’,7’−ヘキサクロロー6−カルボキシフルオレッセイン(HEX)及びNED(アプライドシステムズジャパン社)及び6−カルボキシ−X−ローダミン(Rox)等の蛍光物質、並びに、化学発光物質等を挙げることが出来る。
【0041】
以上の各測定に使用する材料及び器具・装置などは当業者に容易に入手可能であり、各測定操作の手順・条件等は、使用する器具・装置に添付のマニュアルに従うか、又は、使用する細胞の種類等のその他条件に応じて適宜設定することが出来る。
【0042】
更に、上記の壊死マーカーと特異的に反応する化合物、例えば、既に記載したような壊死マーカーに対する各種の抗体、と標識化合物又は治療に有効な化合物とから成る複合体は、例えば、PET又はSPECTのような画像診断用又は治療用医薬品(コンジュゲート:複合体)として有用である。核医学診断に有効な放射性核種としては、例えば、ポジトロン放出核種(Cu-64など)、ガンマ線放出核種(In-111など)を挙げることが出来る。更に、標識化合物としては、15O、13N,11C及び18Fのようなよう電子反β崩壊する核種を上げることが出来る。治療に有効な化合物としては、当業者に公知の任意の薬剤、例えば、抗腫瘍剤及び細胞傷害性のβ線(Y-90など)などを放出する放射性核種を挙げることが出来る。
【0043】
従って、このようなコンジュゲートは画像診断用キットもしくは医薬組成物の有効成分と成り得る。このような医薬組成物は公知の製剤学的方法により製剤化することが可能である。例えば、薬理学上許容される担体もしくは媒体、具体的には、滅菌水や生理食塩水、植物油、乳化剤、懸濁剤、界面活性剤、安定剤、徐放剤などと適宜組み合わせて製剤化して投与することが考えられる。本発明の医薬組成物は、水溶液、錠剤、カプセル、トローチ、バッカル錠、エリキシル、懸濁液、シロップ、点鼻液、または吸入液などの形態であり得る。本発明化合物の含有率は、治療目的、投与経路、治療対象等に応じて、当業者が適宜決定することが出来る。
【実施例】
【0044】
以下、実施例に基づき本発明を更に詳細に説明するが、これらの実施例は本発明の技術的範囲を何等限定するものではない。当業者であれば、本明細書の記載に基づき、本発明の技術的範囲を逸脱せずに、多くの変形及び修飾を実施することが可能である。
【0045】
致死表現型の単離:
致死表現系を持つ細胞を同定するための種々の方法が存在する。壊死(ネクローシス)細胞またはアポトーシス細胞において、細胞形態、または細胞透過性の変化、つまり細胞膜の「水泡化」が観察される。種々の色素、染色および抗体が、そのような方法で利用可能であり、限定はしないで、ヨウ化プロピジウム、抗体Apo2.7およびカスパーゼ色素等が含まれる。
【0046】
トリパンブルーによる染色:
トリパンブルーは青色の色素である。無傷の膜を持つ生細胞は、細胞間区画からトリパンブルーを排除するため、染色されない。死細胞および瀕死細胞の細胞膜は透過性があるため、細胞質が青色に染色される。
【0047】
ヨウ化プロピジウム染色:
ヨウ化プロピジウム(PI)は蛍光のDNA間在分子である。無傷の膜を持つ生細胞は、細胞間区画からPIを排除するため、非蛍光である。死細胞および瀕死細胞はPIに対して易感染性で、透過性あるため、蛍光である。PI染色技法は壊死およびアポトーシス細胞に等しく利用される。
【0048】
アネキシンV:
アネキシンVは、ホスファチジルセリンなどの陰イオン性リン脂質部位に結合する。生細胞の細胞膜は脂質二重層構造をとっており、細胞膜の内膜と外膜でリン脂質に偏りがあり、ホスファチジルセリンは通常内膜に局在している。多くの細胞がアポトーシスを起こしている時、この脂質は細胞外膜上に転位し、露出する。この転位により、外来より加えた蛍光共役アネキシンVが、脂質と相互作用することが可能となり、それによって、アポトーシスを起こしている細胞を標識することが可能である。そこで、蛍光共役アネキシンVに標識されない死細胞を分取することにより、壊死細胞を分離することが可能になる。
【0049】
実施例1:壊死巣細胞モデル系の作製
本発明の方法は、壊死巣を形成している細胞モデルとしてネクローシスを誘導した細胞を必要とする。そこで、子宮頚がん細胞株のHeLa細胞にネクローシスを誘導し、壊死巣を形成する細胞モデル系を作製した。一般的に、HeLa細胞は接着性細胞であり、2x105〜1x106個の細胞を10cm2シャーレ上で足場依存的に培養する。通常培養では血清含有DMEM 培地(Dulbecco’s modified Eagle medium) 10mlに、2x104〜1x105個/mlの密度で、37℃, 5% CO2存在下95%空気の気相、飽和湿度の条件で培養する。HeLa細胞は増殖能が高く、栄養豊富な血清含有DMEM培地中では、2〜3日で10cm2シャーレがコンフルエントになるまで増殖する。HeLa細胞は癌細胞株なのでシャーレがコンフルエント状態になっても接触阻害はかからず増殖可能であるが、過剰に増殖させるとすみやかに細胞死を起こす。今回、HeLa細胞を1x107個/mlという高密度、さらにチューブ中で浮遊させる足場なしの状態で、チューブに蓋をした嫌気条件で培地交換せずに1週間〜2週間培養することにより、壊死巣に特徴的な低栄養、低酸素、高密度および足場非依存的な細胞の環境を再現した。
【0050】
1.1 HeLa細胞へのネクローシス誘導
HeLa細胞を10 cm2シャーレで、100 units/ml ペニシリン・ストレプトマイシン(Gibco BRL)および10% FBS(JRH社)を添加したDMEM培地(Gibco BRL)中で通常培養した。増殖したHeLa細胞をトリプシン・EDTA(Gibco BRL)で10cm2 シャーレから剥がし、氷冷したPBS(-)で2回洗浄し、1 x 10 7 個の細胞を1.5 mlのチューブに移し、1mlの上記DMEM培地あるいは10% FBSを添加しないDMEM培地中で15日間培養した。培地にはpH指示薬を添加し、細胞呼吸による酸素消費により酸素濃度の低下を3日目以降確認したが、蓋をしたまま培養を継続した。
【0051】
1.2 致死表現型の単離
1.2.1 トリパンブルーによる染色
ネクローシスを誘導したHeLa細胞を遠心分離して回収し、氷冷したPBS(-)で2回洗浄した。回収したHeLa細胞を氷冷したPBS(-)で約1 x 106個/ mlになるように懸濁し、1/10容量の0.4% トリパンブルー/PBSバッファー溶液(Gibco BRL)を加えて混和し、室温で3〜5分間インキュベーションした後、顕微鏡下で観察した。無色の生細胞、青色に染色された死細胞および瀕死細胞数をそれぞれ計測した。
【0052】
上記の方法でネクローシスを誘導したHeLa細胞は、培養1日目後には、無血清DMEM培地で13.9%、血清添加DMEM培地で20.6%、培養2日目後には、無血清DMEM培地で79.5%、血清添加DMEM培地で68.5%、培養3日目後には、無血清DMEM培地で91.5%、血清添加DMEM培地で81.2%の細胞が青色に染色され死細胞であることが確認された。その後、15日間培養したが、約90%の細胞集団が死細胞であることが確認された。
【0053】
1.2.2 蛍光色素標識による死細胞の染色
致死表現型を有する細胞には大別してネクローシスとアポトーシス(プログラム細胞死)が考えられる。壊死巣ではネクローシス細胞がアポトーシス細胞よりも比重が大きいと考えられ、細胞死を区別するため、さらに細胞を蛍光色素で染色した。ネクローシスを誘導したHeLa細胞を遠心分離して回収し、氷冷したPBS(-)で2回洗浄した。回収した細胞にアネキシンV (Annexin-V-Fluos :終濃度20 μl/ml; Roche)およびヨウ化プロピジウム(PI):終濃度1μg/ml, 株式会社同仁化学研究所)を含む染色Hepesバッファー溶液(10 mM Hepes-NaOH (pH 7.4), 140 mM NaCl, 5mM CaCl2)100 μlを加えて室温で10〜15分間インキュベーションし、蛍光顕微鏡下(励起光;488 nm, 検出;515-565 nm)で観察した。一方、10 cm2シャーレに培養したHeLa細胞を、1mM 過酸化水素を含む10%FCS含有DMEM培地に代えて1時間培養し、氷冷したPBS(-)で2回洗浄し、通常の10% FCS含有DMEM培地に戻して5時間培養し、アポトーシスを誘導した。そのHeLa細胞を同様にAnnexin-V-Fluos およびPIで染色し、蛍光顕微鏡下で観察した。
【0054】
10% FCS添加DMEM培地で6日間培養してネクローシスを誘導したHeLa細胞は核がPIで染色された。一方、アポトーシスを誘導したHeLa細胞は、細胞膜付近がアネキシンVで強く染色され、一部の細胞は核もPIで染色された。通常培養から調製した生細胞はPIおよびアネキシンVのいずれにも染色されなかった。この結果から上記の方法で作製された死細胞は、ネクローシス細胞であることが確認された。
【0055】
実施例2:壊死巣特異的マーカー分子の同定
2.1 細胞抽出液の調製
実施例1において10% FCS添加DMEM培地でネクローシスを誘導して1日目〜6日目のHeLa細胞および通常培養したHeLa細胞を回収し、氷冷したPBS(-)で2回洗浄した。氷冷した500-1,000μlの可溶化バッファー(20 mM Tris-HCl (pH 7.5), 150 mM NaCl, 1 mM EDTA, 1% NP-40)を加えて細胞を懸濁し、1.5 mlチューブに移した。チューブを4 ℃で30分間回転させながら細胞の可溶性画分を抽出し、15,000rpmで15分間遠心分離し、その上清を細胞抽出液とした。回収した細胞抽出液を、2D-Clean up kit(80-6484-51, Amersham)を用い、そのプロトコールに従って精製し、適量のlysis buffer ( 30 mM Tris (pH 8.5), 7M Urea, 2M Thiourea, 4% CHAPS, 5mM 酢酸マグネシウム)に溶解し、遠心分離した後、その上清を細胞抽出精製液とした。
【0056】
2.2 タンパク質定量
細胞抽出精製液に含まれるタンパク質をProtein Assay試薬( 500-0006, Bio-Rad )を用い、そのプロトコールに従ってBradford法に基づき定量した。具体的には、細胞抽出精製液1μlに0.1 N HCl 1μlと精製水8μlを加えてサンプル溶液とした。タンパク質標準液としてBSA溶液(23209, Thermo)を0.25-1 mg/mlに希釈し、その1μlにlysis buffer 1μlと0.1 N HCl 1μlを加えて全量を10μlとした。同様に精製水8μlにlysis buffer 1μlと0.1 N HCl 1μlを加えてブランク溶液とした。それぞれのサンプル溶液、標準溶液およびブランク溶液に、5倍希釈したProtein Assay試薬を200μlずつ加えてよく混和し、室温で5分間放置した。Protein Assay試薬を混和してから1時間以内に測定波長595 nmで吸光度を測定し、BSA標準溶液の吸光度から検量線を求め、細胞抽出精製液に含まれるタンパク質量を算出した。
【0057】
2.3 蛍光標識二次元ディファレンシャルゲル電気泳動(2D-DIGE)法を用いたプロテオミクス解析
通常培養およびネクローシスを誘導して1〜6日目のHeLa細胞から調製した細胞抽出精製液25μgずつを、それぞれCy3(CyDye DIGE Fluor Cy3, GE Healthcare)およびCy5(CyDye DIGE Fluor Cy5, GE Heaithcare)で別々に標識し、10mM Lysine(SIGMA社)を加えて蛍光標識反応を停止した。Cy3およびCy5で標識したそれぞれのHeLa細胞抽出精製液を等量混合し、一次元電気泳動用サンプルバッファー (8M Urea, 2% CHAPS, 0.5% IPG Buffer(17-6004-40, GE), 0.002% ブロモチモールブルー溶液)を加えてよく混合し、15,000rpmで5分間遠心分離し、その上清をサンプル溶液とした。そのサンプル溶液中でpH3-11のイオン勾配を有する24cmの一次元目専用ゲル(Immobiline DryStrip pH 3-11NL, 17-6003-77, GE Healthcare)を12時間膨潤し、一次元目専用等電点電気泳動システム装置(Ettan IPGphor 3 IEF System, GE Healthcare)を用いて段階的に電圧をあげながら細胞抽出精製液に含まれるタンパク質を等電点電気泳動で分離した。次に10% ポリアクリルアミドゲル(Acrylamide:17-1310-01, GE Healthcare)を用いた二次元目の電気泳動により、細胞内可溶化タンパク質をさらに分子量で分離した。二次元電気泳動により分離した蛍光標識タンパク質はバリアブルイメージアナライザー(Typhoon TRIO+, GE Healthcare) で検出し、ゲルイメージは2D-DIGE専用解析ソフトDeCyder(GE Healthcare)を用いてスポットを解析し、それぞれの細胞内でのタンパク質発現を比較した。
【0058】
ネクローシスを誘導したHeLa細胞内で発現している約3,000個のタンパク質スポットを解析した結果、ネクローシス誘導1日後には、通常培養のものと比較して発現が増加したタンパク質が0.6%, 減少したものが0.4% (図1A)、3日後には増加したものが1.1%、減少したものが3.4%みられた(図1B)。さらに、ネクローシスを誘導して6日後の細胞内可溶性画分のタンパク質の発現は、通常培養のそれと比較して、5.1%のタンパク質が増加し、2.9%が減少した(図1C)。
【0059】
2.4 質量分析法によるタンパク質の同定
ネクローシスを誘導したHeLa細胞で発現量の増加したタンパク質をMALD-TOF/MSで同定した。具体的には、上記の二次元電気泳動後の10%ポリアクリルアミドゲルをトリス、6-アミノカプロン酸、メタノール系のバッファー溶液中で2mA/cm2ゲル面積の定電流で90分間通電し、ゲル中のタンパク質を電気的にPVDF膜(ProBlott(登録商標), ABI社)に転写した。PVDF膜上のタンパク質をクマシーブルー R-350(17-0518-01, GE Healthcare)で染色して可視化し、目的とするスポットを剃刀で切り出し、1fmolのリシリルエンドペプチダーゼ(125-05061, Wako)を加えて37℃で16時間消化し、その断片化ペプチドをNuTip (登録商標)ピペットチップ(Glygen Corp.)で精製し、MALD-TOF/MS(Voyager-DETMPRO, AB SCIEX社)で解析した。得られたフラグメントをタンパク質解析用データベースと比較して、該タンパクに関する情報を得た。
【0060】
2.5 N末端アミノ酸の解析
ネクローシスを誘導したHeLa細胞で発現量の増加したタンパク質のN末端アミノ酸を、エドマン分解により順次分解して一次構造決定した。具体的には、上記の2.4で得られたタンパク質が転写されたPVDF膜をクマシーブルー R-350(GE)で染色し、目的とするスポットを剃刀で切り出し1.5 mlチューブに移した。PVDF膜を少量のアセトニトリルで湿らせた後、1 ml のMilli-Q水を加えて激しく攪拌した後、Milli-Q水を除く洗浄操作を5回繰り返し、全自動タンパク質一次構造解析装置(PPSQ33A, 島津製作所)でアミノ酸配列を自動解析した。
【0061】
その結果、壊死巣特異的マーカーとして同定されたタンパク質のうち、ペルオキシレドキシン4断片またはERp29断片について、以下に通り、N末端アミノ酸(9個)の一次配列を同定した。
(1)ペルオキシレドキシン4:WETEERPRT
(2)Erp29:LHTKGALPL
【0062】
以上の結果に基づき、通常培養のHeLa細胞と比較して2倍以上の蛍光強度があり、ネクローシスを誘導したHeLa細胞内で経時的に増加してくるスポットの中から、本発明の壊死マーカーとして、以下の表1に示すように、9種類(群)の壊死巣特異的マーカータンパク質(限定分解および部分タンパク質を含む)を同定した。尚、表1及び表2に掲載した群の中にはタンパク質が複数のGI(GenBank Identifier)番号を有するものがある。これは該タンパク質およびそのプレカーサーや変異型が、マススペクトルにおいて同様な結果を示すからである。
【0063】
【表1】

【0064】
【表2】

【0065】
2.6 ウエスタンブロッティング法によるタンパク質の同定
質量分析法およびN末端アミノ酸分析により同定した表1に記載の壊死巣特異的マーカータンパク質のうち、市販抗体が入手可能な以下に示す5種類についてウエスタンブロッティング法で確認した。具体的には、上記の2.4で得られたタンパク質が転写されたPVDF膜の非特異吸着をブロックエース(UK-B80, DSファーマ)を用いてブロッキングした後、PBS(-)で至適濃度(100〜2,000倍)に希釈した一次抗体を加え、静かに振とうしながら室温で1時間反応させた。PBSTで3回洗浄後、ビオチン標識抗IgG抗体(BA-1400, VECTASTAINN社)を加え、静かに振とうしながら室温で30分間反応させた。PBSTで3回洗浄後、アビジンービオチン標識西洋ワサビペルオキシダーゼ複合体溶液(VEC社)を加えて静かに振とうしながら室温で30分間反応させ、PBSTで3回洗浄した後、ペルオキシダーゼの基質である3, 3’-Diaminobenzidine(DAB;SK-4105, VEC社)溶液を加え、発色シグナルが観察されたところでPVDF膜をMilli-Q水に移して発色を停止させた。ネガティブコントロールとして、抗Bip抗体についてはそのブロッキングペプチド(#1084, Cell Signaling)、抗ペルオキシレドキシン4、抗カルレティクリン及び抗ERp57各抗体に対しては抗マウスIgGコントロール抗体、抗Erp29抗体に対しては抗ウサギIgGコントロール抗体を用いて同様にウエスタンブロッティングを行った。
【0066】
使用した一次抗体:
(1)ペルオキシレドキシン4:Peroxiredoxin 4 antibody [7A1], ab 16943, Abcam (スポット番号1)
(2)ERp29:ERp29 antibody, ab40982, Abcam (スポット番号2)
(3)カルレティクリン:Calreticulin mouse mAb, ab54922, Abcam (スポット番号5)
(4)Bip:Bip(C50B12) Rabbit mAb, #3177, Cell Signaling (スポット番号6)
(5)ERp57:Monoclonal Anti-ERp57 (TO-2), E5031, SIGMA (スポット番号9)
【0067】
ウエスタンブロッティング法により、MSおよびN末端アミノ酸分析により同定された9つのスポットのうち5つのスポットは、それぞれペルオキシレドキシン4、ERp29、カルレティクリン、Bip、ERp57と確認された。
【0068】
実施例3:モノクローナル抗体の作製
3.1免疫動物の感作および細胞融合
壊死巣特異的マーカーとして同定されたタンパク質のうち、ペルオキシレドキシン4断片またはERp29断片については、実施例2で同定したN末端アミノ酸配列を基にして、各々の配列を認識するマウスモノクローナル抗体を作製した。
【0069】
ペルオキシレドキシン4断片またはERp29断片の上記N末端9アミノ酸残基と、そのC末端にキャリア高分子(KLH)との結合のためシステイン残基を加えた10残基のペプチドを常法に従って約10mgずつ化学合成し、HPLCを用いて精製し、それら精製ペプチドを抗原ペプチドとした。その抗原ペプチドを常法に従ってKLHに架橋し、フロイント完全アジュバント(RM606-1、株式会社三菱化学ヤトロン)と等量で混和してエマルジョン化したものを免疫原とし、メスのマウス一群2匹ずつにそれぞれ50μgずつ投与した。免疫感作はそれらの免疫原を2日おきに3回、マウスのフットパッド(foot pad)に皮下投与して10日間感作する短期免疫と、1週間おきに3回皮下投与して3週間感作する長期免疫を行った。短期免疫では、免疫開始から10日目にマウスの肥大したリンパ節をいくつか摘出し、その内部のリンパ球とミエローマ細胞P3U1との細胞融合を行なった。長期免疫では、免疫開始から21日目に短期免疫と同様にマウスリンパ節を摘出し、その内部のリンパ球とミエローマ細胞P3U1との細胞融合を行なった。
【0070】
その結果、ペルオキシレドキシン4断片あるいはERp29断片の抗原ペプチドにKLHを架橋したそれぞれの免疫原を、短期あるいは長期免疫したマウス2匹ずつから調製したリンパ球と、ミエローマ細胞株P3U1との細胞融合から、いずれも約800ウエルでコロニーが形成した。
【0071】
3.2 ELISA法によるハイブリドーマのスクリーニング
細胞融合後のハイブリドーマは96穴プレートで培養し、通常のHAT培地により選別した。コロニー形成がみられたウエルの培養上清について、免疫原の抗原ペプチドに結合する抗体を含むかどうか、ELISA法によってスクリーニングした。ペルオキシレドキシン4断片のN末端ペプチド+システイン(WETEERPRTC)またはERp29断片N末端ペプチド+システイン(LHTKGALPLC)、あるいは新たに化学合成してHPLCで精製したぺルオキシレドキシン4断片のN末端8残基ペプチド(WETEERPR)またはERp29断片N末端8残基ペプチド(LHTKGALP)を200 μg/mlの濃度になるようにPBS(-)で希釈し、その50 μlずつを96穴イムノプレート(Maxisorp, Nunc社)に分注した。4℃で一晩静置して合成ペプチドをプレートに固定し、PBS(-)で2回洗浄し、ブロックエース(DSファーム)を加えて室温で1時間ブロッキングした後、0.1% Triton-X 100含有PBS(-)(PBST)で2回洗浄した。コロニー形成ウエルの培養上清100 μlを加えて室温で1時間インキュベーションした後、PBSTで2回洗浄し、ビオチン標識抗マウスIgG抗体(BA-1400, VEC社)と室温で30分間反応させ、PBSTで3回洗浄した。さらに、アビジン-ビオチン標識ペルオキシダーゼ複合体溶液(Mouse IgG ABC kit, VECTASTAIN社)と室温で30分間反応させ、PBSTで3回洗浄した後、ペルオキシダーゼの基質である2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS; SK-4500, VEC社)溶液を加えて室温で発色するまでインキュベーションし、マイクロプレートリーダーを用いて、測定波長405 nmの吸光度を測定して各クローンにより生じる吸光度シグナルを評価した。タイターの高いウエルを選択して、限界希釈法によりモノクローナル抗体産生ハイブリドーマをクローニングした。
【0072】
ペルオキシレドキシン4断片を免疫したマウスから得たハイブリドーマ培養上清の一次スクリーニングの結果、ペルオキシレドキシン4断片のN末端ペプチド(9アミノ酸残基)にシステインを付加した抗原ペプチドを認識し、KLHを認識しない抗体産生ウエルは短期免疫で2個、長期免疫で33個得られた。同定したペルオキシレドキシン4断片のN末端は通常の限定分解で切断される部位とは異なっていたため、このN末端配列を認識する抗体は壊死巣特異的であり、さらに認識部位を限定するため、2種類のN末端をマスクしたネガティブスクリーニング用ペプチド((Ac)WETEERPRTC, GAVQGWETEERPRTC)を常法に従って化学合成してHPLCで精製し、KLHと架橋したものを96穴プレートに固定してELISA法により二次スクリーニングを行った。その結果、同定したN末端(WETEERPRTC)を認識し、2種類のKLHに架橋したネガティブスクリーニング用ペプチド((Ac)WETEERPRTC-KLH、 GAVQGWETEERPRTC-KLH)及びKLHを認識しない抗体産生ウエルが、一次スクリーニングで選択された中から、短期免疫で1個、長期免疫で31個得られた。その中で更に、N末端8アミノ酸残基を認識する抗体産生ウエルは長期免疫で3個得られたが、短期免疫では得られなかった。そこで長期免疫マウスのハイブリドーマから、N末端8アミノ酸残基を認識する抗体産生3ウエルを含め、タイターが高かったウエルを5個選択して限外希釈法によりクローニングし、抗ペルオキシレドキシン4特異的モノクローナル抗体産生ハイブリドーマを5クローンを取得した。
【0073】
又、ERp29断片を免疫したマウスのハイブリドーマ上清の一次スクリーニングの結果、ERp29断片のN末端ペプチド(9アミノ酸残基)にシステインを付加した抗原ペプチドを認識し、KLHを認識しない抗体産生ウエルは短期免疫で39個、長期免疫で21個得られた。その中で、N末端8アミノ酸残基を認識する抗体産生ウエルは短期免疫で7個、長期免疫で5個得られ、その中からタイターの高いウエルを、短期免疫から2個、長期免疫から3個選択して限外希釈法によりクローニングし、抗ERp29断片特異的モノクローナル抗体産生ハイブリドーマを5クローン取得した。
【0074】
上記のクローンの代表的なクローンとして、壊死マーカーであるヒトペルオキシレドキシン4(PRDX4)断片に対するマウスモノクローナル抗体を産生するハイブリドーマ(名称:YKP4 C8505 FCS(+))及び壊死マーカーであるヒトErp29断片に対するマウスモノクローナル抗体を産生するハイブリドーマ(名称:YKERp C6707 FCS(+))を千葉県木更津市かずさ鎌足2−5−8、独立行政法人製品評価機構特許微生物寄託センターに、特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約に基づき寄託した。同センターから、夫々、受領番号NITE ABP-1062及び受領番号NITE ABP-1063(受領日:2011年1月20日)として寄託されたことが確認された。
【0075】
実施例4:モノクローナル抗体および市販抗体による壊死巣およびその周辺組織の免疫染色
4.1 組織免疫染色法
ヒト乳がん組織の癌部と非癌部(N=5)およびヒト肺がん組織の癌部と非癌部(N=5)の組織切片を用いて、壊死巣特異的マーカータンパク質を認識する抗体を評価した。乳がん患者および肺がん患者由来組織サンプルのパラフィン包埋切片は(株)医学生物学研究所から入手した。各組織のパラフィン包埋切片は、キシレンおよびエタノールを用いて常法に従って脱パラフィンし、組織切片をPBS(-)で3回洗浄し、10mM クエン酸バッファー(pH 6.0)で抗原を賦活化し、0.3% H2O2中30分間静置して内在性のペルオキシダーゼを失活させた後、ウマ血清で非特異吸着をブロッキングした。壊死巣マーカーに対する抗体(ペルオキシレドキシン4断片のN末端ペプチドおよびERp29断片のN末端ペプチドを認識するモノクローナル抗体(実施例3で最終的に得られた、夫々、5クローンの中の一つ)、及び実施例2に記載の5種類の市販抗体)をそれぞれPBS(-)で至適濃度(250〜1,000倍)に希釈して、ブロッキング後の組織切片と室温でそれぞれ1時間反応させた後、PBS(-)で3回洗浄し、ビオチン標識抗IgG抗体(BA-1400, VEC社)と室温で30分反応させた。組織切片をPBS(-)で3回洗浄した後、アビジンービオチン標識西洋ワサビペルオキシダーゼ複合体(VEC社)と室温で30分間反応させ、PBS(-)で3回洗浄した後、ペルオキシダーゼの基質である3, 3’-Diaminobenzidine(DAB;SK-4105, VEC)溶液を加え、室温で約2分間インキュベーションして組織を免疫染色した。発色した組織切片を蒸留水につけて反応を停止させた後、ヘマトキシリン液で対比染色を行い、非水性封入剤(MGK-S、松浪硝子工)で封入した後、顕微鏡下で組織を観察した。
【0076】
組織免疫染色の結果を図2に示す。ペルオキシレドキシン4断片のN末端ペプチド、またはERp29断片のN末端ペプチドを認識するモノクローナル抗体を用いて、ヒト乳がん組織の癌部と非癌部(N=5)およびヒト肺がん組織の癌部と非癌部(N=5)をそれぞれ免疫染色した結果、ヒト乳がん組織およびヒト肺がん組織の壊死巣、あるいはその周辺部の組織に於いて強い染色が認められたが(図2A-a,c,および図2B-a,c)、ヒト乳がんおよび肺がんの非癌部組織は染色されないかまたは染色されても弱かった(図2A-b,d,及び図2B-b,d)。また、実施例2に記載の5種類の市販抗体(一次抗体)を用いて同様にヒト組織免疫染色した結果、それらの抗体はヒト乳がん組織およびヒト肺がん組織の壊死巣、あるいはその周辺部の組織に於いて強い染色が認められたが、ヒト非癌部では染色されないかまたは染色されても弱い同様の結果が得られた(図2C-図2G)。
【0077】
実施例5:モノクローナル抗体の精製
ハイブリドーマ(YKP4 C8505 FCS(+)及びYKERp C6707 FCS(+))の各培養上清から、夫々、抗ヒトPRDX4モノクローナル抗体及び抗ヒトErp29モノクローナル抗体をプロテインAカラムで精製した。即ち、PBS(-)で平衡化したHiTrapAカラム(GE Healthcare社)1mlに培養上清を50ml添加し、PBS(-) 5mlでカラムを洗浄した後、0.17 Mの(pH2.3)緩衝液でカラムから溶出した。溶出画分は280nmの吸光度でモニタリングしながら1mlずつ分取し、吸光度の高い画分をブラッドフォード法(Protein Assay, Bio-Rad社)で測定して夫々の精製モノクローナル抗体を得た。
【0078】
実施例6:モノクローナル抗体のアイソタイプの決定
実施例5で精製した2種類のモノクローナル抗体のアイソタイプをマウスモノクローナル抗体アイソタイピングキット(MMT1, Serotec社) で確認した。マニュアルに準じ、精製したモノクローナル抗体150μlを反応チューブに添加して室温で30秒反応させた。反応液をボルテックスミキサーでよく混和した後、アイソタイピングストリップを反応チューブに入れてアイソタイプを判定した。その結果、抗ヒトPRDX4モノクローナル抗体及び抗ヒトErp29モノクローナル抗体のアイソタイプは夫々、IgG1/κ及びIgG2a/κであった。
【0079】
実施例7:抗体の評価
実施例5で得られた精製モノクローナル抗体の親和定数及び解離定数をBIACore システム(Biacore AB Corporation:現在は GEヘルスケア・ジャパン株式会社が供給する)を用いて、表面プラズモン共鳴現象(SPR)を測定することにより得た。すなわち、抗原となるビオチン化ペプチドを合成して得て、それをHBバッファーで1mg/mlに希釈して作製したペプチド溶液100μlをセンサチップSAにBIACore システムの機器使用マニュアルに従って固定した。精製したモノクローナル抗体を0.25μg/ml 〜80 μg/mlの濃度範囲で2倍希釈系列を作製し、そのうち45μlをBIACoreシステム(流速30μl/min)に添加してBIACore システムの機器使用マニュアルに従って抗原となるペプチドに対する結合量を測定した。その結果、抗ヒトPRDX4モノクローナル抗体の親和定数及び解離定数として1.26 x 108及び7.9 x 10-9を得た(図3)。
【0080】
実施例8:放射線標識モノクローナル抗体を用いる担癌マウスの癌部の検出
1)抗ヒトPRDX4モノクローナル抗体及び抗ヒトErp29モノクローナル抗体のIn-111標識 0.05M borate buffer pH8.5に溶解した各IgG抗体と0.05M borate buffer pH8.5に溶解したN-[(R)-2-amino-3-p-isothiocyanato-phenyl]propyl]-trans -(S,S)-cyclohexane-1,2-diamine-pentaacetic acid(DTPA)を、分子量比で1対2.5の割合で混合し、37度で16時間反応させた。塩化インジウム([In-111]Cl3)を等量の1M acetate buffer pH6.0と混合し、室温で5分間静置した後、等量の上記DTPAとIgGの反応物を混合し、室温で30分静置した。セルロースアセテート電気泳動により、[In-111]DTPA-IgGと[In-111]DTPAに分離し、IgGに結合したDTPAの数を求めた。上記DTPAとIgGの反応物をSephadex G50担体にアプライし、未結合のDTPAを取り除き、DTPA-IgGを精製した。この精製DTPA-IgGを上述の方法により、In-111標識し、Sephadex G50担体により、未反応のIn-111を除去した[In-111]DTPA-IgGを使用し、以下の実験を実施した。図4は、セルロースアセテート電気泳動により精製前と精製後のDTPA-IgGの泳動後のオートラジオグラフィーの写真を示す。
【0081】
2)In-111標識モノクローナル抗体とHeLa生細胞との反応 5x105と5x106のHeLa細胞を1% BSA/PBAに懸濁し、[In-111]DTPA-IgGを加え、氷中で1時間インキュベートし、PBSで洗浄し、HeLa細胞に結合した放射活性をガンマカウンターで測定した。その結果、標識した抗ヒトPRDX4モノクローナル抗体及び抗ヒトErp29モノクローナル抗体は、生きたHeLa細胞には結合しないことが明らかとなった。図5には、左が5x105のHeLa細胞に、右が5x106のHeLa細胞に夫々のIn-111標識モノクローナル抗体(Pで示す)を接触させて結合させた特異的結合率を示す。IgG2a、E、IgG1はそれぞれ他の抗体を使用した陰性コントロールを示す。PRDX4及びErp29は細胞内蛋白質であることからHeLa細胞に結合しないことは合理的であり、次に示す担癌動物を用いた試験を進める上での一つの根拠となった。
【0082】
3)In-111標識モノクローナル抗体を用いた担癌マウスに於けるイメージング HeLa細胞をBALB/c-nu/nuマウスの皮下に移植し腫瘍を形成させた。50μCiの各[In-111]DTPA-IgG(未標識IgGによりタンパク量を12μgに調整)を尾静脈から投与し、投与後1、2、3、4日にレントゲンとガンマ線撮像を実施した。時間とともに腫瘍の一部に[In-111]DTPA-IgGが集積することが明らかとなった。図6は、吸入麻酔をしてテープで固定して撮影した、担癌マウスのレントゲン像(左)とガンマ線撮像(右)を示す。図6では、左から1日目、2日目、3日目、4日目の各々レントゲン像(左)とガンマ線撮像(右)が並んでいる。図6の1から4日目の担癌マウスのレントゲン写真(左)では、充分に大きくなったヒト癌が右側の臀部付近に瘤状に写っている。また、ガンマ線撮像(マウス像右)では、ヌードマウスの腫瘍に明瞭な、特に2目から4日目でより明瞭な標識抗ペルオキシレドキシン4(PRDX4)抗体の集積が認められた。
【0083】
4)In-111標識モノクローナル抗体の集積部位の確認
[In-111]DTPA-IgG投与4日目の撮像終了後に、腫瘍を摘出し、凍結標本を複数作製し、作製した複数の標本のうち隣接標本でオートラジオグラフィーとヘマトキシリン・エオシン染色(HE染色)を実施した。図7では、腫瘍の切片が、左からオートラジオグラフィー、HE染色、その2つの重ね合わせが並べてある。腫瘍切片のHE染色では、中央付近の壊死部は青色に乏しく弱いが赤色がかった色に、外側の正常な癌組織部位と中央を取り巻く壊死巣周辺部位は赤みがかった青色に染まっていた。図7に示される様に、摘出した腫瘍(大きさ:PRDX4で約13.6mm X 18.3mm、ERp29で約13.5mm X 16.5mm)の中央の壊死部を取り巻く壊死巣周辺部位に[In-111]DTPA-IgGが選択的に集積することが明らかとなった。すなわち、オートラジオグラフィーとHE染色の写真を重ね合わせると、中央付近の壊死巣を取り巻く壊死巣周辺部位にIn-111標識モノクローナル抗体の集積が認められると判断された。
【0084】
5)In-111標識モノクローナル抗体が集積する壊死巣周辺部の細胞の形態
摘出した腫瘍の病理より、核が残っている壊死細胞に[In-111]DTPA-IgGが集積し、核が脱落した壊死細胞には集積しないことが明らかとなった。このことは、壊死して時間があまり経過していない細胞及びその近傍に壊死マーカータンパク質が残存していることを示しているものと思われる。すなわち、図8では、中央付近の壊死部では細胞の形態がくずれて核が認められないこと、また壊死部周辺部では細胞の核が認められるが正常な癌細胞と形態が異なること、腫瘍の外側付近の周辺部は核と細胞質が明確であり正常な癌細胞の形態であることがわかる。図中の顕微鏡写真の中のバーは100ミクロンメーターを示す。
【産業上の利用可能性】
【0085】
本発明の壊死マーカー、例えば、タンパク質又はその断片に対応する抗体あるいは抗体を用いることによって、該抗体が認識する壊死巣又はその原因となる病態の進行状況を簡便、迅速に測定できる新規な測定キットを提供することが可能となる。このような壊死巣としては、各種固形癌、心筋梗塞又は脳梗塞の壊死巣(組織)のみならず、壊死後性肝硬変、壊死性膵炎、壊死性筋膜炎等の壊死巣、更に、動脈硬化性壊疽、糖尿病性壊疽あるいは閉塞性壊疽における壊死巣も対象となる。
【0086】
その結果、各種癌マーカーなどに比較して病巣の壊死という観点からより広範な疾病の分野で使用が出来る検出キットやそれら疾病の壊死部位をターゲットとする治療薬開発が可能となる。例えば、低分子抗体など人工抗体を作製して、従来の高分子である抗体を使用することによって、通常の抗体を使用した場合には高分子であるが故に細胞内に導入することが難しかったのに対して、低分子であるが故により導入し易くやすくなり、更に、このような各種低分子抗体は、組織移行性が高いと考えられ、画像診断用キットもしくは医薬組成物の有効成分として有用である。
【特許請求の範囲】
【請求項1】
以下の9つの群に含まれるいずれか一つのアミノ酸配列をコードする遺伝子の発現産物又は該発現産物に対する自己抗体から成る、壊死マーカー:
(1)配列番号1で示されるアミノ酸配列、又は、該アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは該アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、該アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(2)配列番号2〜4のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(3)配列番号5〜9のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(4)配列番号10〜15のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(5)配列番号16〜18のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(6)配列番号19〜22のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(7)配列番号23〜26のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(8)配列番号27〜29のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(9)配列番号30〜35のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列。
【請求項2】
遺伝子の発現産物が、該遺伝子のmRNA,cDNA,若しくは、それらの部分塩基配列を含む核酸分子、又は、該遺伝子がコードするタンパク質又はその部分ポリペプチドである、請求項1記載の壊死マーカー。
【請求項3】
配列番号1、又は、配列番号2〜4のいずれか一つで示されるアミノ酸配列を有するタンパク質の部分ポリペプチドから成る、請求項1又は2記載の壊死マーカー。
【請求項4】
請求項1ないし3のいずれか一項に記載の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの量を測定することにより、壊死巣を検出する方法。
【請求項5】
(1)試料中に含まれる請求項1ないし3のいずれか一項に記載の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの濃度を測定し、その測定値が正常レベルよりも上昇していることを指標として壊死巣を検出する、請求項4記載の方法。
【請求項6】
配列番号1〜35のいずれか一つで示されるアミノ酸配列を有するタンパク質又はその部分ポリペプチドに対する抗体を用いて、該タンパク質又はその部分ポリペプチドの量を測定することを特徴とする、請求項4又は5記載の方法。
【請求項7】
各遺伝子の発現産物であるタンパク質又はその部分ポリペプチドを抗原として用いて、該発現産物に対する自己抗体から成る壊死マーカーの量を測定する、請求項4又は5記載の方法。
【請求項8】
試料として全血又は血清を使用する、請求項4ないし7のいずれか一項に記載の方法。
【請求項9】
壊死巣が、各種固形癌、心筋梗塞、脳梗塞、壊死後性肝硬変 (postnecrotic cirrhosis)、壊死性膵炎 (necrotizing pancreatitis)、壊死性筋膜炎 (necrotizing fasciitis)、動脈硬化性壊疽、糖尿病性壊疽、又は、閉塞性壊疽に関連することを特徴とする、請求項4ないし8のいずれか一項に記載の方法。
【請求項10】
請求項4ないし8のいずれか一項に記載の方法に用いる検出キットであって、請求項1ないし3のいずれか一項に記載の壊死マーカーと特異的に反応する化合物を含む該キット。
【請求項11】
特異的に反応する化合物が抗体である、請求項10記載のキット。
【請求項12】
請求項1ないし4のいずれか一項に記載の壊死マーカーと特異的に反応する化合物と標識化合物又は治療に有効な化合物から成る、画像診断用又は治療用コンジュゲート。
【請求項13】
請求項12に記載のコンジュゲートを活性成分として含む、画像診断用キット又は医薬組成物。
【請求項14】
疾患に関連する壊死を検出する壊死マーカーを同定する方法であって、ヒト細胞を低栄養、低酸素、高密度および足場非依存的な条件下の培養で誘導して得られる壊死細胞が発現するタンパク質と、通常の培養条件で培養した同細胞が発現するタンパク質とを比較して、該壊死細胞においてより高濃度で存在するタンパク質あるいはその断片を該壊死マーカー選択することを特徴とした前記方法。
【請求項1】
以下の9つの群に含まれるいずれか一つのアミノ酸配列をコードする遺伝子の発現産物又は該発現産物に対する自己抗体から成る、壊死マーカー:
(1)配列番号1で示されるアミノ酸配列、又は、該アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは該アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、該アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(2)配列番号2〜4のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(3)配列番号5〜9のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(4)配列番号10〜15のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(5)配列番号16〜18のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(6)配列番号19〜22のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(7)配列番号23〜26のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(8)配列番号27〜29のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列;
(9)配列番号30〜35のいずれかで示されるアミノ酸配列、又は、各アミノ酸配列において一個又は数個のアミノ酸が置換、欠失及び/又は挿入されたアミノ酸配列若しくは各アミノ酸配列と90%以上の相同性を有するアミノ酸配列であって、各アミノ酸配列とタンパク質としての同一の機能、活性、又は性質を示すアミノ酸配列。
【請求項2】
遺伝子の発現産物が、該遺伝子のmRNA,cDNA,若しくは、それらの部分塩基配列を含む核酸分子、又は、該遺伝子がコードするタンパク質又はその部分ポリペプチドである、請求項1記載の壊死マーカー。
【請求項3】
配列番号1、又は、配列番号2〜4のいずれか一つで示されるアミノ酸配列を有するタンパク質の部分ポリペプチドから成る、請求項1又は2記載の壊死マーカー。
【請求項4】
請求項1ないし3のいずれか一項に記載の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの量を測定することにより、壊死巣を検出する方法。
【請求項5】
(1)試料中に含まれる請求項1ないし3のいずれか一項に記載の壊死マーカーから選択された一つ又はそれらの任意の組み合わせから成る壊死マーカーの濃度を測定し、その測定値が正常レベルよりも上昇していることを指標として壊死巣を検出する、請求項4記載の方法。
【請求項6】
配列番号1〜35のいずれか一つで示されるアミノ酸配列を有するタンパク質又はその部分ポリペプチドに対する抗体を用いて、該タンパク質又はその部分ポリペプチドの量を測定することを特徴とする、請求項4又は5記載の方法。
【請求項7】
各遺伝子の発現産物であるタンパク質又はその部分ポリペプチドを抗原として用いて、該発現産物に対する自己抗体から成る壊死マーカーの量を測定する、請求項4又は5記載の方法。
【請求項8】
試料として全血又は血清を使用する、請求項4ないし7のいずれか一項に記載の方法。
【請求項9】
壊死巣が、各種固形癌、心筋梗塞、脳梗塞、壊死後性肝硬変 (postnecrotic cirrhosis)、壊死性膵炎 (necrotizing pancreatitis)、壊死性筋膜炎 (necrotizing fasciitis)、動脈硬化性壊疽、糖尿病性壊疽、又は、閉塞性壊疽に関連することを特徴とする、請求項4ないし8のいずれか一項に記載の方法。
【請求項10】
請求項4ないし8のいずれか一項に記載の方法に用いる検出キットであって、請求項1ないし3のいずれか一項に記載の壊死マーカーと特異的に反応する化合物を含む該キット。
【請求項11】
特異的に反応する化合物が抗体である、請求項10記載のキット。
【請求項12】
請求項1ないし4のいずれか一項に記載の壊死マーカーと特異的に反応する化合物と標識化合物又は治療に有効な化合物から成る、画像診断用又は治療用コンジュゲート。
【請求項13】
請求項12に記載のコンジュゲートを活性成分として含む、画像診断用キット又は医薬組成物。
【請求項14】
疾患に関連する壊死を検出する壊死マーカーを同定する方法であって、ヒト細胞を低栄養、低酸素、高密度および足場非依存的な条件下の培養で誘導して得られる壊死細胞が発現するタンパク質と、通常の培養条件で培養した同細胞が発現するタンパク質とを比較して、該壊死細胞においてより高濃度で存在するタンパク質あるいはその断片を該壊死マーカー選択することを特徴とした前記方法。
【図3】


【図5】


【図1】


【図2】


【図4】


【図6】


【図7】


【図8】




【図5】


【図1】


【図2】


【図4】


【図6】


【図7】


【図8】


【公開番号】特開2011−206049(P2011−206049A)
【公開日】平成23年10月20日(2011.10.20)
【国際特許分類】
【出願番号】特願2011−49029(P2011−49029)
【出願日】平成23年3月7日(2011.3.7)
【出願人】(510063535)
【Fターム(参考)】
【公開日】平成23年10月20日(2011.10.20)
【国際特許分類】
【出願日】平成23年3月7日(2011.3.7)
【出願人】(510063535)

【Fターム(参考)】
[ Back to top ]

