変形性関節症の治療のための方法及び手段
本発明は、軟骨組織の変性を包含する医学的研究、軟骨生理学、及び疾患の分野に関する。より具体的には、本発明は、軟骨細胞における異化過程を阻害し、かつ軟骨及び/又はECMの変性を低下させる化合物を同定する方法及び手段に関する。また、本発明は、変形性関節症の治療において有用な化合物にも関する。また、本発明は、その修飾が、ECM及び/又は軟骨の変性の低下を結果的に生じ、かつ炎症を低下させる標的にも関する。加えて、本発明は、ECM及び/又は軟骨の変性並びに炎症を特徴とする容態を治療する上での組成物及びその使用方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、炎症並びに/又は軟骨組織及び/若しくは細胞外マトリックス(ECM)の変性を包含する医学的研究、炎症、軟骨生理学、及び疾患の分野に関する。より具体的には、本発明は、薬剤及び化合物が軟骨細胞における異化過程を阻害し、かつ軟骨及び/又は細胞外マトリックスの変性を低下させるであろう前記薬剤、及び前記化合物を同定するための方法に関する。また、本発明は、その修飾がECM及び/又は軟骨の変性の低下を結果的に生じ、かつ炎症を低下させる標的にも関する。加えて、本発明は、ECM及び/又は軟骨の変性並びに炎症を特徴とする容態を治療する上での組成物及びその使用方法に関する。また、本発明は、変形性関節症の治療において有用な化合物にも関する。
【背景技術】
【0002】
軟骨は、その軟骨細胞が主要な細胞構成要素である無血管性組織である。正常な関節の軟骨における軟骨細胞は、組織体積のおよそ5%を占めるのに対し、細胞外マトリックスは、組織の残部の95%を構成する。軟骨細胞は、マトリックスの構成要素、主としてプロテオグリカン及びコラーゲンを分泌し、該構成要素が順に、軟骨細胞に、機械的ストレスの下での生存に好適な環境を供給する。軟骨において、II型コラーゲンは、タンパク質IX型コラーゲンとともに、優れた機械的強度を軟骨に提供する固形原線維様構造で配置される。プロテオグリカンは、水を吸収することができ、軟骨の弾性特性及び衝撃吸収特性の原因となる。
【0003】
関節における軟骨の機能的役割の1つは、骨が互いに関して潤滑に関節でつながることができることである。関節の軟骨の損失はそれゆえ、骨を互いに対して擦れさせ、疼痛及び可動性の損失をもたらす。軟骨の変性は、種々の要因を有することができる。関節リウマチのような炎症性関節炎において、例えば、軟骨の変性は、炎症を受けた組織(例えば、炎症を受けた滑膜)によるプロテアーゼ(例えば、コラゲナーゼ)の分泌によって生じる。また、軟骨の変性は、事故若しくは手術、又は過度の負荷若しくは「摩滅」による、軟骨の損傷の結果でもあり得る。また、軟骨の変性は、軟骨合成(同化)過程及び軟骨変性(異化)過程における不均衡の結果でもあるかもしれない。このような傷害後に軟骨組織が再生する能力は限られている。損傷を受けた軟骨における軟骨細胞はしばしば、低い同化活性及び/又は高い異化活性を示す。損傷、疾患、又は手術後に軟骨が自己修復する限られた能力は、変性している関節表面及び半月状軟骨に対する損傷のリハビリテーションにおける主要な制限因子である。
【0004】
軟骨の変性は、種々の疾患の顕著な特徴であり、該疾患のうち、関節リウマチ及び変形性関節症が最も顕著である。
【0005】
変形性関節症(OA又は摩滅関節炎ともいう。)は、関節炎の最も普遍的な形態であり、骨の肥大及び疼痛としばしば関連した関節軟骨の損失を特徴とする。該疾患は主として、手、並びに膝、股、及び脊椎など、重量支持関節に影響を及ぼす。この過程は、軟骨を薄くさせる。表面積が、菲薄化により消失すると、グレードI変形性関節症に到達し;接線方向の表面積が消失すると、グレードIIの変形性関節症に到達する。変性及び破壊のさらなるレベルがあり、該レベルは、肋軟骨下骨と境界を接する深部にある石灰化した軟骨層に影響を及ぼす。変形性関節症に関する広範な総説について、本発明者らは、Wielandらの文献(2005)を引用する。
【0006】
関節リウマチ(RA)は、慢性関節変性疾患であり、関節構造の炎症及び破壊を特徴とする。該疾患がチェックされていないと、関節の機能性の損失による実質的な能力障害及び疼痛、並びに早期の死亡さえもたらす。RA治療法の目的はそれゆえ、該疾患を衰えさせることではなく、関節の破壊を停止させるために寛解を果たすことである。該疾患の結果の重症度のほかに、RAの高い有病率(成人の〜0.8%が世界規模で影響を受けている。)は、高い社会‐経済的衝撃を意味する(RAに関する総説について、本発明者らは、Smolen及びSteinerの文献(2003);Lee及びWeinblattの文献(2001);Choy及びPanayiの文献(2001);O'Dellの文献(2004)並びにFiresteinの文献(2003)を引用する。)。
【0007】
変形性関節症の容態の発達に関する臨床的徴候は、大きな関節体積、疼痛をもたらす捻髪音及び機能的能力障害、並びに低い関節可動性である。疾患がさらに発達すると、安静時における疼痛が現れる。容態が、矯正及び/又は治療法なしで持続すれば、関節は、破壊され、能力障害をもたらす。そこで、全体的な人工関節との交換手術が必要となる。
【0008】
成熟関節軟骨において、軟骨細胞は、軟骨特異的マトリックス表現型を維持する。OAの初期の徴候には、II型コラーゲンに対する損傷によるプロテオグリカンアグリカンの関節軟骨からの漸増的損失を含む。このタンパク質は、健常個体における関節軟骨において認められる主要な構造コラーゲンを表す。関節の正常なリモデリングの間の触媒酵素によるII型コラーゲンの産生とこのタンパク質の変性との間には通常、厳密な均衡がある。OAなどの病理学的容態は、高いタンパク質変性によるこの均衡の損失を特徴とする。
【0009】
一般的に、MMPの高い発現は、軟骨及び/又は細胞外マトリックスの変性と関連しているが、すべてのプロテアーゼが必ずしも、未変性コラーゲンを変性できるわけではない。マトリックスメタロプロテアーゼのうち、MMP1、MMP8、MMP13、およびMMP14は、II型コラーゲンを変性する最高能力を示す。MMP‐1(コラゲナーゼ‐1)及びMMP‐13の発現及び含有量(Mitchelらの文献(1996);Shlopovらの文献(1997))。MMP‐8の発現(コラゲナーゼ‐2)、並びにコラゲナーゼ活性(Billinghurstらの文献(1997)、Dahlbergらの文献(2000))は、ヒトOA軟骨において上方制御されている。特に、コラゲナーゼ‐3としても公知もMMP‐13は、種々の観察によって示されるように、関節軟骨において、及び特にOAにおいてII型コラーゲン変性における重要な役割を担っていると考えられる(Billinghurstらの文献(1997)、Mitchellらの文献(1996)、Dahlbergらの文献(2000)、Billinghurstらの文献(2000))。1)MMP13の発現は、半月板切除術のような関節炎に起因する手術に供されたOA患者の及び動物の軟骨において高い(Appletonらの文献(2007))。2)関節軟骨におけるMMP1及びMMP13の局在は、軟骨切断によって誘発される新生エピトープを明らかにする抗体によって明らかにされるように、軟骨の破壊の一と一致するように見える(Wuらの文献(2002))。3)トランスジェニックマウスの軟骨におけるMMP13の過剰発現は、OA様軟骨破壊表現型をもたらした(Neuholdらの文献(2001))。4)II型コラーゲンは、MMP‐13について好ましい基質である(Billinghurstらの文献(1997);Mitchellらの文献(1996))。ひとまとめに考えると、MMP13は、OA誘発性の軟骨及びECMの変性における鍵となる担い手として十分認められる。
【0010】
変形性関節症疾患の間に現れる関節軟骨病変の矯正のための治療方法は開発されてきたが、これまで、該方法のいずれも、関節軟骨の再生をインサイツ(in situ)及びインビボで仲介することはできなかった。
【0011】
変形性関節炎は、治療するのが困難である。目下、治癒は得られず、治療は、疼痛を緩和すること、及び影響を受けた関節が変形するのを防止することに焦点を当てている。普遍的な治療には、非ステロイド性抗炎症薬(NSAID)の使用を含む。コンドロイチン及び硫酸グルコサミンなどの栄養補助食品が、変形性関節炎の治療及び寛解のための安全かつ有効な選択肢として唱道されてきたが、近年の臨床治験は、両治療が、変形性関節炎と関連した疼痛を低減しないことを明らかにした(Cleggらの文献(2006))。ひとまとめに考えると、疾患を改変する変形性関節炎薬は入手可能ではない。
【0012】
重症の場合、関節交換は必要かもしれない。このことは特に、股及び膝に対して真である。関節が極度に有痛であり、交換できない場合、関節は融着し得る。この手順は疼痛を停止させるが、関節機能の永続的な損失を結果として生じ、歩行及び屈曲が困難となる。
【0013】
別の可能な治療は、培養された自己軟骨細胞の移植である。ここで、軟骨細胞材料は、患者から採取され、実験室に送られ、そこで増殖される。次に、材料が損傷を受けた組織に移植され、組織の欠陥を保護する。
【0014】
別の治療には、滑液のレオロジーを一時的に改良する物質であるHylan G‐F 20(例えば、Synvisc(登録商標)、Hyalgan(登録商標)、Artz(登録商標))の関節内滴下注入を含み、自由な動作のほぼ即時的な感覚及び疼痛の顕著な低下を生じる。
【0015】
他の報告された方法には、腱、骨膜、筋膜、筋肉、又は軟骨膜の移植片の適用;フィブリン又は培養軟骨細胞の移植;コラーゲン、カーボンファイバーなどの合成マトリックスの移植;電磁場の投与を含む。これらのすべては、最小かつ不完全な効果を報告しており、重量のかけられた負荷を支持することもできず、正常な動作による関節の機能の修復もできない質の乏しい組織を結果として生じる。
【0016】
同化過程の刺激、異化過程の遮断、又はこれら2つの組み合わせは、軟骨の安定化、及びおそらくは損傷の復帰さえを結果として生じ得、それゆえ、前記疾患のさらなる進行を防止する。
【0017】
本発明は、本発明者らによって同定された選択されたタンパク質(以後、「TARGETS」と呼ぶ。)の機能と、軟骨及び/又は細胞外マトリックス(ECM)の変性の阻害並びに炎症の阻害との間の関連性に関する。
【発明の概要】
【0018】
本発明は、細胞外マトリックス(ECM)及び/又は軟骨変性過程を低下させる化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチド(以後「TARGETS」)又はその機能的断片と、該ポリペプチドが化合物に結合できる条件下で接触させることと、ECM及び/又は軟骨の変性の阻害と関連した化合物‐ポリペプチド特性を測定することとを含む、該化合物を同定する方法に関する。特定の実施態様において、化合物‐ポリペプチド特性は、炎症性サイトカイン、例えば、IL‐1b、IL‐6、IL‐8、IL‐11、TNFα、及び/又はLIFのレベルである。具体的な実施態様において、測定される化合物‐ポリペプチド特性は、軟骨変性タンパク質又はコラゲナーゼなどのプロテアーゼの発現レベルである。特定の実施態様において、測定される化合物‐ポリペプチド特性は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現レベルである。具体的な実施態様において、測定される化合物‐ポリペプチド特性は、MMP13発現レベルである。
【0019】
本方法の態様には、TARGETに相応するポリペプチド又はその断片(このような断片は、配列番号22〜42の配列によって説明されるアミノ酸配列の断片である。)を用いる化合物のインビトロアッセイ、及びTARGET阻害が、例えばTARGET発現レベル、TARGET酵素活性、及び/又はMMP13レベルを含む有効性の指標を観察することによって追随される細胞アッセイを含む。
【0020】
また、本発明は、
(1)アンチセンスポリヌクレオチド、リボザイム、及び低分子干渉RNA(siRNA)の群から選択されるポリヌクレオチドを含む発現阻害薬(この中で、該ポリヌクレオチドは、TARGETポリペプチドをコードする天然のポリヌクレオチド配列と相補的なまたは前記ポリヌクレオチド配列から操作された核酸を含み、該ポリヌクレオチド配列は、配列番号22〜42からなる群から選択される配列を含む。)並びに
(2)ECM変性及び/又は変形性関節炎などの軟骨変性を特徴とする疾患の治療又は予防において有用な、該薬剤を含む医薬組成物にも関する。
【0021】
本発明の別の態様は、有効なTARGET発現阻害量の発現阻害薬又は有効なTARGET活性阻害量の活性阻害薬を含む医薬組成物を投与することによる、軟骨及び/又はECMの変性、骨及び/又は関節の変性と関連した容態に罹患している又は罹患しやすい対象における前記容態の治療又は予防の方法である。特定の実施態様において、容態は変形性関節炎である。
【0022】
本発明の別の態様は、有効なTARGET発現阻害量の発現阻害薬又は有効なTARGET活性阻害量の活性阻害薬を含む医薬組成物を投与することによる、炎症と関連した容態に罹患している又は罹患しやすい対象における炎症と関連した容態の治療又は予防の方法である。
【0023】
本発明のさらなる態様は、対象におけるTARGET発現及び/又は活性のレベルの指標の測定を含む、軟骨及び/又はECM変性と関連した容態の診断のための方法である。
【0024】
本発明のさらなる態様は、対象におけるTARGET発現及び/又は活性のレベルの指標の測定を含む、炎症と関連した容態の診断のための方法である。
【0025】
本発明の別の態様は、軟骨及び/又はECM変性を包含する疾患の治療に有用な、治療方法、医薬組成物、及びこのような組成物の製造における、本明細書に開示されたTARGETを阻害する薬剤の使用に関する。特に、本方法は、関節の変性を特徴とする疾患、特に異常なMMP13発現を特徴とする疾患の治療におけるTARGETを阻害する薬剤の使用に関する。薬剤は、変形性関節症、関節リウマチ、乾癬性関節炎、若年性関節リウマチ、痛風性関節炎、化膿性又は感染性関節炎、反応性関節炎、反射性交感神経性ジストロフィー、有痛性骨萎縮症、ティーツェ症候群又は肋軟骨炎(costal chondritis)、線維筋痛症、骨軟骨炎、神経原性又は神経障害性関節炎, 関節症、地方性変形性骨軟骨関節症のような風土性形態の関節炎、 ムセルニ病(Mseleni disease)、及びハンディゴデュ病(Handigodu disease);線維筋痛症、全身性エリテマトーデス、強皮症、強直性脊椎炎、遺伝性軟骨溶解、軟骨異形成症、及び偽軟骨異形成(pseudoachondrodysplasias)を含む先天性軟骨形成異常、並びに先天性軟骨形成異常、例えば小耳症、無耳症、及び骨幹端軟骨異形成症から結果として生じる変性を含むがこれらに限定されない軟骨変性を包含する疾患の寛解又は治療に有用である。特定の実施態様において、疾患は、変形性関節炎、関節リウマチ、及び炎症性関節炎から選択される。特定の実施態様において、疾患は変形性関節炎である。
【0026】
本発明の別の態様は、アレルギー性気道疾患(例えば、喘息、鼻炎)、自己免疫疾患、移植片拒絶、クローン病、関節リウマチ、乾癬、若年性特発性関節炎、大腸炎、及び炎症性腸疾患を含むがこれらに限定されない炎症を包含する疾患の治療に有用な治療方法、医薬組成物、及びこのような組成物の製造における、本明細書に開示されたTARGETを阻害する薬剤の使用に関する。
【0027】
また、さらなる態様において、本発明は、軟骨組織のインビトロでの製造のための方法にも関する。
【0028】
本発明の別のさらなる態様は、治療的に有効な軟骨及び/又はECM変性阻害量のTARGET阻害薬又はその医薬として許容し得る塩、水和物、溶媒和物、若しくはプロドラッグを、医薬として許容し得る担体と混合して含む医薬組成物である。また、本ポリヌクレオチド及びTARGET阻害薬化合物は、ECM変性、軟骨変性、及び/又は炎症を包含する容態の治療のための医薬の製造にも有用である。
【0029】
さらに、また、本発明は、診断方法にも関する。
【0030】
他の目的および利点は、以下の実例となる図とともに採用される以下の説明に関する考慮から明らかとなるであろう。
【図面の簡単な説明】
【0031】
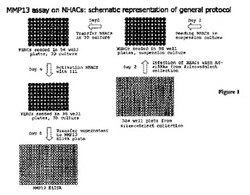
【図1】図1は、正常ヒト関節軟骨細胞(NHAC)におけるMMP13アッセイについての一般的なスクリーニングプロトコールの原理を示す。
【0032】
【図2】正常ヒト関節軟骨細胞におけるMMP13アッセイの模式図。
【0033】
【図3】正常ヒト関節軟骨細胞におけるMMP13アッセイについて説明されるスクリーニングプロトコールを用いて試験した対照プレートの能力に関する代表的な例。
【0034】
【図4】SilenceSelect(登録商標)回収物のスクリーニングバッチのうちの1つの間に得られたデータの例。
【0035】
【図5A】3MOI再スクリーン試行についての典型的なレイアウト。
【0036】
【図5B】3MOIの再スクリーンにおいて得られた結果の例。
【0037】
【図6】スクリーニングの間に得られた摩滅及びより詳細に分析された的中物の選択を示すスキーム。
【0038】
【図7】表4は、SYBR(登録商標)Green定量的リアルタイムPCRに用いられるオリゴヌクレオチドプライマーを列挙する。
【発明を実施するための形態】
【0039】
(詳細な説明)
以下の用語は、下記に表された意味を有するよう意図され、本発明の明細書及び意図された範囲を理解する上で有用である。
【0040】
用語「薬剤」は、ポリペプチド、抗体、ポリヌクレオチド、化学物質の化合物、及び低分子を含む任意の分子を意味する。特に、用語薬剤には、試験化合物又は薬剤候補化合物などの化合物を含む。
【0041】
用語「アゴニスト」は、最も広範な意味でリガンドが結合する受容体を刺激するリガンドを指す。
【0042】
本明細書で使用する場合、用語「アンタゴニスト」は、受容体への結合の際に生物学的応答自体を惹起しないが、アゴニスト仲介性応答を遮断若しくは減弱させ、又はアゴニストの結合を防止若しくは低下させ、それによりアゴニスト仲介性応答を予防若しくは低下させる化合物を示すために用いられる。
【0043】
用語「アッセイ」は、薬剤の具体的な特性を測定するために用いられる任意のプロセスを意味する。「スクリーニングアッセイ」は、薬剤の集まりからその活性に基づいて薬剤を特徴付けまたは選択するために用いられるプロセスを意味する。
【0044】
用語「結合親和性」は、2つ以上の化合物が、非共有結合関係において互いにどのように強く会合しているかを示す特性である。結合親和性は、定性的に(「強い」、「弱い」、「高い」、又は「低い」)又は定量的に(KDを測定することなど)特徴づけることができる。
【0045】
用語「担体」は、医薬組成物に媒介物、容積、及び/又は使用可能な形態を提供するために医薬組成物の製剤において用いられる非毒性材料を意味する。担体は、賦形剤、安定化剤、又は水性pH緩衝溶液など、このような材料の1つ以上を含み得る。生理学的に許容し得る担体の例には、リン酸、クエン酸、及び他の有機酸を含めた水性の又は固体の緩衝成分;アスコルビン酸を含めた抗酸化剤;低分子量(約10残基未満)ポリペプチド;血清アルブミン、ゼラチン、又は免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、アルギニン、又はリシンなどのアミノ酸;グルコース、マンノース、又はデキストリンを含む単糖、二糖、及び他の炭水化物;EDTAなどのキレート剤;マンニトール又はソルビトールなどの糖アルコール;ナトリウムなどの塩形成対イオン;並びに/あるいはTWEEN(登録商標)、ポリエチレングリコール(PEG)、及びPLURONICS(登録商標)などの非イオン性界面活性剤が挙げられる。
【0046】
用語「複合体」は、2つ以上の化合物が互いに結合し、接触し、又は会合する場合に作られる実体を意味する。
【0047】
用語「化合物」は、本発明のアッセイと関連して説明される「試験化合物」又は「薬剤候補化合物」の文脈で本明細書で用いられる。このように、これらの化合物は、合成的に、組換えで、又は天然源に由来する、有機化合物または無機化合物を含む。
【0048】
化合物には、ポリヌクレオチド、脂質、又はホルモン類似体などの無機化合物又は有機化合物を含む。他の生体ポリマー有機試験化合物には、約2〜約40のアミノ酸を含むペプチド、及び約40〜約500のアミノ酸を含むより大きなポリペプチドを含み、これには、ポリペプチドリガンド、酵素、受容体、チャネル、抗体、又は抗体抱合体を含む。
【0049】
用語「容態」又は「疾患」は、症状(すなわち、病気)の明白な提示又は異常な臨床的指標(例えば、生化学的指標又は診断指標)の顕在化を意味する。あるいは、用語「疾患」は、遺伝的リスク若しくは環境的リスク又はこのような症状若しくは異常な臨床指標を発達させる傾向を指す。
【0050】
用語「接触する」又は「接触すること」は、インビトロの系であろうとインビボの系であろうと、少なくとも2つの部分を互いにまとめることを意味する。
【0051】
用語「ポリペプチドの誘導体」は、ポリペプチドの連続したアミノ酸残基のひと続きを含み、かつタンパク質、例えば、ポリペプチドの天然の形態のアミノ酸配列と比較してアミノ酸突然変異を有するポリペプチドの生物活性を保有する該ペプチド、オリゴペプチド、ポリペプチド、タンパク質、及び酵素に関する。誘導体はさらに、ポリペプチドの天然の形態のアミノ酸配列と比較して、追加的な天然の、変化した、グリコシル化した、アシル化した、又は非天然のアミノ酸残基を含み得る。また、誘導体は、ポリペプチドの天然の形態のアミノ酸配列と比較して、1つ以上の非アミノ酸置換基又は異種性のアミノ酸置換基、例えば、アミノ酸配列に共有結合した又は非共有結合したリポーター分子又は他のリガンドを含み得る。
【0052】
用語「ポリヌクレオチドの誘導体」は、ポリヌクレオチドの核酸残基のひと続きを含むDNA分子、RNA分子、及びオリゴヌクレオチド、例えば、ポリヌクレオチドの天然の形態の核酸配列と比較して核酸の突然変異を有し得るポリヌクレオチドに関する。誘導体はさらに、PNA、ポリシロキサン、及び2'-O-(2-メトキシ) エチル-ホスホロチオアート、非天然核酸残基、又はメチル-、チオ-、スルファート、ベンゾイル-、フェニル-、アミノ-、プロピル-、クロロ-、及びメタノカルバヌクレオシドなどの1つ以上の核酸置換基、あるいはその検出を容易にするためのリポーター分子など、修飾された骨格を有する核酸を含み得る。
【0053】
用語「内在性」は、哺乳類が天然に産生する材料を意味するものとする。用語「プロテアーゼ」、「キナーゼ」、「因子」、又は「受容体」に対する言及における内在性は、哺乳類(例えば、ヒトであって、これに限定されない。)によって天然に産生されるものを意味するものとする。対照的に、この文脈における用語非内在性は、哺乳類(例えば、ヒトであって、これに限定されない。)によって天然には産生されないものを意味するものとする。両用語は、インビボの系及びインビトロの系の両方を説明するために利用することができる。例えば、制限することなく、スクリーニングアプローチにおいて、内在性又は非内在性のTARGETは、インビトロスクリーニングの系に対する言及であり得る。さらなる例としてかつ制限することなく、哺乳類のゲノムが非内在性TARGETを含むよう操作された場合、インビトロの系による候補化合物のスクリーニングは実現性がある。
【0054】
用語「発現可能な核酸」は、タンパク質性分子、RNA分子、又はDNA分子をコードする核酸を意味する。
【0055】
用語「発現」は、内在性発現及び形質導入による過剰発現の両方を含む。
【0056】
用語「発現阻害薬」は、細胞内で通常発現される具体的なポリペプチド又はタンパク質の転写、翻訳及び/又は発現を選択的に干渉するよう設計されたポリヌクレオチドを意味する。より具体的には、「発現阻害薬」は、具体的なポリペプチド又はタンパク質をコードするポリリボヌクレオチド配列内の少なくとも約15〜30の、特に少なくとも17の連続したヌクレオチドと同一の又は相補的なヌクレオチド配列を含むDNA分子又はRNA分子を含む。典型的な発現阻害分子には、リボザイム、二本鎖siRNA分子、自己相補性一本鎖siRNA分子(shRNA)、遺伝的アンチセンスコンストラクト、及び修飾され安定化した骨格を有する合成RNAアンチセンス分子を含む。
【0057】
用語「ポリヌクレオチドの断片」は、完全な配列と実質的に類似しているが同一である必要のない活性を呈する連続した核酸残基のひと続きを含むオリゴヌクレオチドに関する。特定の態様において、「断片」は、該完全な配列の核酸配列の少なくとも5核酸残基(好ましくは、少なくとも10核酸残基、少なくとも15核酸残基、少なくとも20核酸残基、少なくとも25核酸残基、少なくとも40核酸残基、少なくとも50核酸残基、少なくとも60核酸残基、少なくとも70核酸残基、少なくとも80核酸残基、少なくとも90核酸残基、少なくとも100核酸残基、少なくとも125核酸残基、少なくとも150核酸残基、少なくとも175核酸残基、少なくとも200核酸残基、又は少なくとも250核酸残基)の核酸配列を含むオリゴヌクレオチドを指し得る。
【0058】
用語「ポリペプチドの断片」は、連続したアミノ酸残基のひと続きを含み、かつ完全な配列と実質的に類似だが同一である必要のない、機能的な、又は発現活性を呈するペプチド、オリゴペプチド、ポリペプチド、タンパク質、モノマー、サブユニット、及び酵素に関する。特定の態様において、「断片」は、該完全な配列のアミノ酸配列の少なくとも5アミノ酸残基(好ましくは、少なくとも10アミノ酸残基、少なくとも15アミノ酸残基、少なくとも20アミノ酸残基、少なくとも25アミノ酸残基、少なくとも40アミノ酸残基、少なくとも50アミノ酸残基、少なくとも60アミノ酸残基、少なくとも70アミノ酸残基、少なくとも80アミノ酸残基、少なくとも90アミノ酸残基、少なくとも100アミノ酸残基、少なくとも125アミノ酸残基、少なくとも150アミノ酸残基、少なくとも175アミノ酸残基、少なくとも200アミノ酸残基、又は少なくとも250アミノ酸残基)のアミノ酸配列を含むペプチド又はポリペプチドを指し得る。
【0059】
用語「ハイブリダイゼーション」は、一本鎖の核酸が、塩基対形成を通じて相補鎖と結合する任意のプロセスを意味する。用語「ハイブリダイゼーション複合体」は、相補性塩基間の水素結合の形成によって2つの核酸配列間に形成された複合体を指す。ハイブリダイゼーション複合体は、溶液中で形成され得(例えば、C0t又はR0t)、又は溶液中に存在する1つの核酸配列と固相支持体(例えば、紙、メンブレン、フィルター、チップ、ピン、若しくははガラススライド、又は細胞若しくは当該核酸が固定された任意の他の適切な基体)上に固定化された別の核酸配列の間に形成され得る。用語「ストリンジェントな条件」は、ポリヌクレオチドと要求されたポリヌクレオチドの間でハイブリダイゼーションを可能にする条件を指す。ストリンジェントな条件は、塩濃度、有機溶媒、例えばホルムアミドの濃度、温度、及び当技術分野で周知の他の条件によって規定することができる。特に、遠濃度を低下させること、ホルムアミドの濃度を増大させること、又はハイブリダイゼーション温度を上昇させることは、ストリンジェンシーを増すことができる。用語「標準的なハイブリダイゼーション条件」は、ハイブリダイゼーション及び洗浄の両方について5×SSC及び65℃と実質的に等価の塩条件及び温度条件を指す。しかしながら、当業者は、このような「標準的なハイブリダイゼーション条件」が、緩衝液中のナトリウム及びマグネシウムの濃度、核酸配列の長さ及び濃度、パーセントミスマッチ、パーセントホルムアミド、及びこれらの類するものによることを認識するであろう。また、ハイブリダイズする2つの配列が、RNA‐RNA、DNA‐DNA、又はRNA‐DNAであるかどうかも、「標準的なハイブリダイゼーション条件」の決定において重要である。このような標準的なハイブリダイゼーション条件は、周知の定則に従って当業者によって容易に決定され、この中で、ハイブリダイゼーションは、予測又は決定されたTm未満で典型的には10〜20℃であり、所望の場合、より高いストリンジェンシーの洗浄をともなう。
【0060】
用語「阻害する」又は「阻害すること」は、用語「応答」との関連性において、応答が、化合物の不在下とは対照的に、化合物の存在下で低下又は予防されることを意味する。用語阻害又は阻害することは、より一般的には、特に化合物の存在下対化合物の不在下で、活性又は測定可能な現象の相対的な低下、減少又は防止を指す。
【0061】
用語「阻害」は、タンパク質又はポリペプチドの発現又は活性の不在又は最小化を結果的に生じるプロセスの低下、下方制御、又はプロセスに対する刺激の除去を指す。
【0062】
用語「誘導」は、タンパク質又はポリペプチドの発現又は活性を結果的に生じるプロセスの誘導、上方制御、又は刺激を指す。
【0063】
用語「リガンド」は、内在性の天然の受容体に特異的な内在性の、天然の、又は合成の、非天然の分子を含む分子を意味する。
【0064】
用語「医薬として許容し得る塩」は、本明細書に開示されたTARGETSの発現または活性を阻害する化合物の非毒性の、無機の、及び有機の酸付加塩及び塩基付加塩を指す。これらの塩は、本発明において有用な化合物の最終的な単離及び精製の間にインサイツで調製することができる。
【0065】
用語「ポリペプチド」は、タンパク質(TARGETSなど)、タンパク質性分子、タンパク質の断片、モノマー、ポリマータンパク質のサブユニット又は部分、ペプチド、オリゴペプチド、及び酵素(キナーゼ、プロテアーゼ、GPCRなど)に関する。
【0066】
用語「ポリヌクレオチド」は、一本鎖又は二本鎖の形態における、及びセンス又はアンチセンスの向きにおけるポリ核酸、ストリンジェントな条件下で特定のポリ核酸とハイブリダイズする相補的なポリ核酸、その塩基対の少なくとも約60%で、より具体的には、その塩基対の70%が共通である、最も具体的には90%、及び特定の実施態様においてはその塩基対の100%で相同であるポリヌクレオチドを意味する。ポリヌクレオチドには、ポリリボ核酸、ポリデオキシリボ核酸、及びそれらの合成類似体を含む。また、ポリヌクレオチドには、ペプチド核酸(PNA)、ポリシロキサン、及び2'-O-(2-メトキシ)エチルホスホロチオアートなどの修飾された骨格を有する核酸も含む。ポリヌクレオチドは、長さが変動し、約10〜約5000塩基、特に約100〜約4000塩基、より具体的には約250〜約2500塩基に及ぶ配列によって説明される。1つのポリヌクレオチド実施態様は、長さ約10〜約30塩基を含む。ポリヌクレオチドの特定の実施態様は、約17〜約22ヌクレオチドのポリヌクレオチドであり、低分子干渉RNA(siRNA‐二本鎖siRNA分子又は自己相補的な一本鎖siRNA分子(shRNA))としてより普遍的に説明される。別の特定の実施態様は、ペプチド核酸(PNA)、ポリシロキサン、及び2'-O-(2-メトキシ)エチルホスホロチオアートなどの修飾された骨格を有する核酸、又は非天然の核酸残基、若しくはメチル-カルバヌクレオシド、チオ-カルバヌクレオシド、スルファートカルバヌクレオシド、ベンゾイル-カルバヌクレオシド、フェニル-カルバヌクレオシド、アミノ-カルバヌクレオシド、プロピル-カルバヌクレオシド、クロロ-カルバヌクレオシド、及びメタノカルバヌクレオシドなどの1つ以上の核酸置換基、若しくはその検出を容易にするリポーター分子を含む核酸である。本明細書のポリヌクレオチドは、特定の標的DNA配列の異なる鎖と「実質的に」相補的であるよう選択される。このことは、ポリヌクレオチドが、その個々の鎖とハイブリダイズするよう十分相補的でなければならないことを意味する。それゆえ、ポリヌクレオチド配列は、標的配列の実際の配列を反映する必要はない。例えば、非相補的なヌクレオチド断片は、ポリヌクレオチドの5'末端に結合し得、ポリヌクレオチドの配列の残りは前記鎖と相補的である。あるいは、非相補的な塩基又はより長い配列は、ポリヌクレオチドに散在することができ、但し、ポリヌクレオチド配列が、ストリンジェントな条件下でハイブリダイズするのに、又は伸長産物の合成のためのテンプレートを形成するのに十分な相補性を有することを条件とする。
【0067】
用語「予防すること(preventing)」又は「予防(prevention)」は、疾患を生じる薬剤に曝露され得る、又は疾患の発症の前に疾患に罹患しやすくし得る対象において、疾患又は障害を獲得又は発達させる危険の低下を指す。
【0068】
用語「予防(prophylaxis)」は、用語「予防(prevention)」と関連し、該用語に包含され、その目的が疾患を治療又は治癒させるよりもむしろ予防する(prevent)測定又は手順を指す。予防的(prophylactic)測定に関する制限のない例には、ワクチンの投与;例えば運動抑制による血栓症についての危険にある入院患者に対する低分子量ヘパリンの投与;及びマラリアが風土性である又はマラリアにかかる危険性が高い地理的領域への訪問の前のクロロキンなどの抗マラリア薬の投与を含み得る。
【0069】
用語「溶媒和物」は、本発明において有用な化合物と1つ以上の溶媒分子との物理的会合を意味する。この物理的会合には水素結合を含む。ある場合において、溶媒和物は、例えば、1つ以上の溶媒分子が結晶性固体の結晶格子に組み込まれる場合、単離することができるであろう。「溶媒和物」は、液相の溶媒和物及び単離可能な溶媒和物の両方を包含する。代表的な溶媒和物には、水和物、エタノラート(ethanolate)、及びメタノラート(methanolate)を含む。
【0070】
用語「対象」には、ヒト及び他の哺乳類を含む。
【0071】
「治療有効量」は、医師または他の臨床家によって探究されている対象の生物学的応答又は医学的応答を誘発するであろう薬剤、化合物、発現阻害薬、又は医薬剤の量を意味する。
【0072】
任意の疾患又は障害の用語「治療すること」又は「治療」は、一実施態様において、疾患又は障害を寛解させること(すなわち、疾患を抑止すること、又はその臨床的症状の少なくとも1つの徴候、程度、若しくは重症度を低下させること)を指す。別の実施態様において、「治療すること」又は「治療」は、対象によって認識不可能かもしれない少なくとも1つの身体的パラメータを寛解させることを指す。さらに別の実施態様において、「治療すること」又は「治療」は、疾患又は障害を身体的に(例えば、認識可能な症状の安定化)、生理学的に(例えば、身体的パラメータの安定化)、又はその両方のいずれかで調節することを指す。さらなる実施態様において、「治療すること」又は「治療」は、疾患の進行を遅延させることに関する。
【0073】
また、用語「べクター」は、プラスミドに、及び組換えウイルスなどのウイルスベクター、又は組換えウイルスをコードする核酸に関する。
【0074】
用語「脊椎動物細胞」は、魚、鳥類、爬虫類、両生類、有袋類、及び哺乳類の種を含む、脊椎構造を有する動物由来の細胞を意味する。好ましい細胞は、哺乳類種由来であり、最も好ましい細胞はヒト細胞である。哺乳類細胞には、ネコ、イヌ、ウシ、ウマ、ヤギ、ヒツジ、マウス及びラットなどのブタネズミ、並びにウサギを含む。
【0075】
用語「TARGET」又は「TARGETS」は、本明細書に説明されたアッセイに従って同定されかつECM及び/又は軟骨の変性を包含されると決定されたタンパク質を意味する。用語TARGET又はTARGETSは、スプライスバリアント、対立遺伝子バリアント、フレームエクソンにおける代替物、及び代替的な又は成熟前の終止部位又は開始部位などのバリアントを含み及び予期し、これらには、表1に示されるようなそれらの公知の又は認識されたアイソフォーム又はバリアントを含む。
【0076】
用語「ECM及び/又は軟骨の変性を特徴とする疾患」は、細胞外マトリックスの分解又は軟骨における分解を包含する、該分野を少なくとも一部結果として生じる、又は該分野を含む疾患又は容態を指し、又はこの中で、軟骨及び/又はECMの分解、変性、又は損失は、軟骨及び/又はECMの生成又は再生を超過する。前記用語には、変形性関節症、関節リウマチ、乾癬性関節炎、若年性関節リウマチ、痛風性関節炎、化膿性又は感染性関節炎、反応性関節炎、反射性交感神経性ジストロフィー、有痛性骨萎縮症、ティーツェ症候群又は肋軟骨炎、線維筋痛症、骨軟骨炎、神経原性又は神経障害性関節炎, 関節症、地方性変形性骨軟骨関節症のような風土性形態の関節炎、 ムセルニ病、及びハンディゴデュ病;線維筋痛症、全身性エリテマトーデス、強皮症、強直性脊椎炎、遺伝性軟骨溶解、軟骨異形成症、及び偽軟骨異形成(pseudoachondrodysplasias)を含む先天性軟骨形成異常、並びに先天性軟骨形成異常と関連した疾患、例えば小耳症、無耳症、及び骨幹端軟骨異形成症から結果として生じる変性から選択される典型的な疾患を含むが、これらに限定されない。
【0077】
用語「炎症を特徴とする疾患」は、炎症を包含する、炎症から少なくとも一部結果として生じる、又は炎症を含む疾患を指す。前記用語には、アレルギー性気道疾患(例えば、喘息、鼻炎)、自己免疫疾患、移植片拒絶反応、クローン病、関節リウマチ、乾癬、若年性特発性関節炎、大腸炎、及び炎症性腸疾患から選択される典型的な疾患を含むが、これらに限定されない。
【0078】
(TARGETS)
本発明は、TARGETSが、軟骨細胞の異化過程の制御における因子、特に阻害が軟骨及び/又はECMの異化作用の低下をもたらす因子であるという本発明者らの発見に基づいている。このような疾患は、軟骨及び/又はECMの分解と関連したタンパク質、例えば限定するわけではないが、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4、特にMMP13の発現を追うことによってモニターされ得る。用語「TARGET」又は「TARGETS」は、ECM及び/又は軟骨の分解の阻害に関与することが下記に説明されているアッセイに従って同定されたタンパク質を意味する。
【0079】
下記の表1に列挙されたTARGETSは、本明細書において、軟骨の異化作用を制御又は調節する経路に関与するものとして、特に軟骨の異化作用を阻害することに関与するものとして同定され、それゆえ、これらのTARGETSの阻害薬は、軟骨細胞の分解を阻害することができ、軟骨の分解を特徴とする疾患の予防及び/又は治療において使用される。
【0080】
また、TARGETSは、炎症過程における因子であり、特にTARGETSは、炎症誘発性刺激に対する応答、特にIL1刺激に対する応答の低下に関与するものとして同定され、それゆえ、これらのTARGETSの阻害薬は、炎症過程を阻害することができ、炎症を特徴とする疾患の予防及び/又は治療において使用される。
【0081】
それゆえ、一態様において、本発明は、化合物を配列番号22〜42の配列のポリペプチド(TARGETS)又はその断片のアミノ酸配列を含むポリペプチドと、該ポリペプチドが化合物に結合できる条件下で接触させること、及びポリペプチドと化合物の間の複合体形成を検出することを含む、ECM及び/又は軟骨の分解を低下させあるいは炎症を阻害する化合物をアッセイする方法に関する。特に、該方法は、軟骨の分解を阻害する薬剤を同定するために用いられる。特に該方法は、軟骨細胞を介した軟骨の分解を阻害する薬剤候補化合物を同定するために用いられ得る。代替的な実施態様において、方法は、炎症を阻害する薬剤を同定するために用いられる。代替的な実施態様において、方法は、ECM分解を阻害する薬剤を同定するために用いられる。複合体形成を測定する1つの好ましい手段は、該化合物の該ポリペプチドに対する結合親和性を決定することである。
【0082】
より具体的には、本発明は、軟骨細胞によるECM及び/又は軟骨の分解を低下させる薬剤を同定する方法に関し、該方法は下記を含む:
(a)軟骨細胞の集団を、TARGETポリペプチド又はその断片に対する結合親和性を呈する1つ以上の化合物と接触させること、並びに
(b)ECM及び/または軟骨の分解の阻害と関連した化合物‐ポリペプチド特性を測定すること。
【0083】
本発明のさらなる態様において、該方法は、例えば、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4を含む1つ以上の軟骨分解酵素の発現又は活性を調節する化合物を同定するために用いられる。特に、MMP13発現の阻害が測定され得る。
【0084】
本発明のさらなる態様において、該方法は、例えばIL‐1b、IL‐6、IL‐8、IL‐11、TNFα、及び/又はLIFを含む1つ以上の炎症性サイトカインの発現又は活性を調節する化合物を同定するために用いられる。
【0085】
さらなる態様において、本発明は、化合物を配列番号22〜42からなる群から選択されるアミノ酸配列又はその断片を含むポリペプチドと、該化合物が、ポリペプチドの活性又は発現を調節することのできる条件下で接触させること、及びポリペプチドの活性又は発現を決定することを含む、軟骨及び/又はECMの分解を阻害する薬剤候補化合物をアッセイする方法に関する。特に、該方法は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現を抑制すること、特にMMP13の発現を抑制することができる薬剤候補化合物を同定するために用いられ得る。特に、該方法は、正常ヒト関節軟骨細胞(NHAC)におけるMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4、特にMMP13の発現を抑制することができる薬剤候補化合物を同定することであり得る。ポリペプチドの活性又は発現を測定する1つの特定の手段は、抗体などのポリペプチド結合剤を用いて該ポリペプチドの量を決定すること、又は生物学的測定若しくは生化学的測定において該ポリペプチドの活性を、例えば、キナーゼポリペプチドの標的のリン酸化の量、若しくは、酵素による又は酵素の基質ポリペプチドに関する分解の量を決定することである。
【0086】
先に言及された化合物‐ポリペプチド特性は、ECM及び/又は軟骨の分解の阻害に関し、当業者によって選択された測定可能な現象である。測定可能な特性は例えば、ポリペプチドTARGETのペプチドドメインに対する結合親和性、又は軟骨細胞による低い異化作用のいくつかの生化学的マーカーレベルのうちの任意の1つのレベルであり得る。軟骨細胞の異化作用の阻害は例えば、分解経路の一部として誘導されるタンパク質及び他の分子のレベルを測定することによって測定することができる。特に、MMP13のレベルが測定され得る。
【0087】
加えて、ECM及び/又は軟骨分解の阻害と関連した化合物‐ポリペプチド特性は、正常ヒト関節軟骨細胞(NHAC)、SW1353(軟骨肉腫細胞)、線維芽細胞(例えば、滑膜線維芽細胞)、又は分化した間葉系幹細胞培養物において測定され得る。ある程度まで、このようなタンパク質は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4発現を含む軟骨分解酵素の発現を呈する細胞において測定され得る。しかしながらまた、このようなタンパク質は、代替的な細胞系においても測定される。例えば、化合物が本発明のポリペプチドに結合する親和性を決定するインサイツ結合アッセイは、ポリペプチドを発現する任意の細胞種類を用いて実施される。ポリペプチドの発現は外来性又は内在性である。さらに、化合物‐ポリペプチド特性が生物学的経路の活性化である場合、経路の細胞構成要素を含む任意の細胞を用いて、化合物‐ポリペプチド特性を測定する。細胞は、これらの構成要素を本質的に含み得、あるいは1つ以上の構成要素を発現するよう、又は標識され若しくは測定可能な構成要素のバリアントを発現するよう操作され得る。例えば、NHACのIL‐1刺激に応じたMMP13の誘導は、軟骨及び/又はECM分解を示す。具体的に、細胞は、MMP13プロモーターによって活性化されたリポーター分子を含むよう操作することができる。この方法で、代替的な細胞を用いて、軟骨及び/又はECM分解の阻害を示す特性を測定することができる。
【0088】
追加的な態様において、本発明は、化合物を、配列番号1〜21からなる群から選択される核酸配列又はその断片を含む、TARGETポリペプチドをコードする核酸と、該核酸が化合物に結合できる又はそうでなければ会合できる条件下で接触させること、及び核酸と化合物の間における複合体の形成を検出することを含む、軟骨及び/又はECMの分解を阻害する薬剤候補化合物をアッセイする方法に関する。特に、該方法は、分解経路の一部として誘導されるタンパク質及び他の分子のレベルを低下させることのできる薬剤候補化合物を同定するために用いられ得る。特に、該方法は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4のレベルを低下させることのできる薬剤候補化合物を同定するために用いられ得る。特に、該方法は、MMP13のレベルを低下させることのできる薬剤候補化合物を同定するために用いられ得る。複合体形成を測定する1つの特定の手段は、該化合物の該核酸に対する結合親和性、又は複合体の存在を、ヌクレアーゼに対する耐性によって又はゲル移動度アッセイによって決定することである。あるいは、複合体形成は、核酸の転写又は翻訳の阻害によって決定され得る。
【0089】
本発明は、軟骨及び/又はECMの分解を低下させる化合物を同定する方法に関し、該方法は下記の工程を含む:表1に列挙されたもののうちの任意の1つのポリペプチド又はその機能的断片若しくは誘導体を発現する細胞の集団を培養する工程;該細胞の集団におけるIL‐1刺激に応じて第一のレベルのMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4発現を決定する工程;該細胞の集団を化合物又は化合物の混合物に曝露する工程;該細胞の集団の化合物又は化合物の混合物への曝露の間又は後に該細胞の集団におけるIL‐1刺激に応じてMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4発現のレベルを決定する工程;並びに軟骨及び/又はECMの分解の低下を予測するMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現を低下させる化合物を同定する工程。具体的な実施態様において、先の方法において測定された軟骨分解酵素はMMP13である。
【0090】
より特定には、本発明は、炎症を低下させる薬剤を同定する方法に関し、該方法は下記を含む:
(a)細胞の集団を、TARGETポリペプチド又はその断片に対する結合親和性を呈する1つ以上の化合物と接触させること、及び
(b)炎症の阻害と関連した化合物‐ポリペプチド特性を測定すること。
【0091】
一実施態様において、炎症の阻害と関連した化合物‐ポリペプチド特性は、IL1刺激に対する細胞の応答である。さらなる実施態様において、薬剤は、IL1刺激に対する細胞の応答を低下させることができる。
【0092】
また、本発明は、表1に列挙されたポリペプチドの任意の1つの発現及び/又は活性を低下させる化合物を同定する方法にも関し、該方法は、以下の工程を含む:該ポリペプチド、又はその断片、若しくはその誘導体を発現する細胞の集団を培養する工程;該ポリペプチドの第一レベルの発現及び/又は活性を決定する工程;該細胞の集団を化合物又は化合物の混合物に曝露する工程;該細胞の集団の化合物又は化合物の混合物への曝露の間又は後に該ポリペプチドの発現及び/又は活性のレベルを決定する工程;並びに該ポリペプチドの発現及び/又は活性を低下させる化合物を同定する工程。ポリペプチド活性が容易に測定可能でない場合、化合物の同定は、該細胞の集団を該ポリペプチドのアゴニストに曝露することを含む余分な工程から利益を得ることができる。さらに、本発明の方法は、該細胞の集団において、表1に列挙されたポリペプチドの任意の1つをコードする遺伝子を導入する工程を含み得る。高処理目的のために、遺伝子を該細胞のゲノムに安定して組み込ませることは有益であり得る。
【0093】
好ましい実施態様において、軟骨及び/又はECMの分解の阻害のレベルは、マーカー遺伝子の発現レベルを測定することによって決定され、この中で、特定のマーカー遺伝子は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4をコードする。具体的な実施態様において、MMP13の発現及び/又は活性が測定される。具体的な実施態様において、MMP13の発現及び/又は活性は低い。
【0094】
本発明の特定の実施態様において、TARGETポリペプチドは、表1に列挙された配列22〜42からなる群から選択されるアミノ酸配列を含む。本発明の実施態様において、TARGETポリペプチドをコードすることのできる核酸は、表1に列挙された配列番号1〜21からなる群から選択される核酸配列を含む。表1は、2つ以上の受入番号及び配列番号が示されている認識されたバリアント又はアイソフォームを含むTARGETの典型的なヒト核酸及びタンパク質配列を提供する。TARGET(S)のアイソフォーム又はバリアントには、フレームエクソンにおける代替物、選択的スプライシング又はスプライスバリアント、及び選択的又は成熟前終止バリアント(termination variant)を有する又は利用する核酸又はタンパク質を含む。
【表1】


【0095】
本発明は、特定の一実施態様において、ポリペプチドがGPCRである新規の化合物を同定する方法を提供する。もしそうである場合、該GPCRの発現及び/又は活性は好ましくは、セカンドメッセンジャーのレベルを測定することによって決定される。好ましいセカンドメッセンジャーは、サイクリックAMP、Ca2+、又はその両方である。典型的には、セカンドメッセンジャーのレベルは、セカンドメッセンジャーに応答するプロモーターの制御下でリポーター遺伝子を用いて決定され、この中で、プロモーターが、サイクリックAMP応答性プロモーター、NF‐KB応答性プロモーター、又はNF‐AT応答性プロモーターであることが好ましく、かつこの中で、リポーター遺伝子は、アルカリホスファターゼ、GFP、eGFP、dGFP、ルシフェラーゼ、及びβ‐ガラクトシダーゼからなる群から選択される。GPCRである典型的なTARGETは、表1に列挙され、GPR34、GPR43、MC3R、及びEDG4を含む。
【0096】
別の特定の実施態様において、本発明は、ポリペプチドがキナーゼ又はホスファターゼである新規の化合物を同定する方法を提供する。好ましくは、該キナーゼ又はホスファターゼの活性は、該キナーゼ又はホスファターゼの基質のリン酸化のレベルを測定することによって決定される。キナーゼである典型的なTARGETSは、表1に列挙されており、MET、STK32B、MAP2K2、MAP4K1、EPHA5、及びCSNK1G2を含み、キナーゼである好ましいTARGETSは、STK32B、EPHA5、及びCSNK1G2からなる群から選択される。キナーゼである特定の好ましいTARGETSは、EPHA5及びCSNK1G2である。
【0097】
さらに別の特定の実施態様において、本発明は、ポリペプチドがプロテアーゼである新規の化合物を同定する方法を提供する。好ましくは、該プロテアーゼの活性は、該プロテアーゼの基質の切断のレベルを決定することによって測定される。プロテアーゼである典型的なTARGETSは、表1に列挙されており、ADAMTS6及びADAM15を含む。
【0098】
さらに別の特定の実施態様において、本発明は、ポリペプチドがイオンチャネルである新規の化合物を同定する方法を提供する。イオンチャネルである典型的なTARGETは、表1に列挙されており、KCNN4である。
【0099】
セカンドメッセンジャーレベルを決定する方法、リポーター遺伝子及びセカンドメッセンジャー応答性プロモーターの使用、並びにホスファターゼアッセイ及びプロテアーゼアッセイは、当技術分野で周知であり、本明細書でさらに詳しく述べることはない。
【0100】
好ましい実施態様において、ポリペプチドを阻害する化合物は、最高10マイクロモル濃度のポリペプチドに対する結合親和性を呈する。
【0101】
本発明の好ましい実施態様において、ポリペプチドTARGETは、配列番号22〜42からなる群から選択されるアミノ酸配列を含む(表1)。
【0102】
当業者の選択に応じて、本アッセイ方法は、一連の測定として機能するよう設計でき、その各々は、薬剤候補化合物が、実際にポリペプチドに作用していて、それにより軟骨及び/又はECMの分解を阻害するかどうか、あるいは炎症を阻害するかどうかを決定するよう設計される。例えば、ポリペプチド又はその断片に対する化合物の結合親和性を決定するよう設計されたアッセイは、対象に投与される場合、試験化合物が、ECM及び/又は軟骨の分解を低下させるのに有用であろうかどうかを確かめるために、あるいは試験化合物が炎症を低下させるのに有用であろうかどうかを確かめるために必要かもしれないが十分ではないかもしれない。それにもかかわらず、このような結合情報は、生化学的経路へとさらに上る異なる特性を測定するであろうアッセイ、例えば、下記に説明されるMMP13アッセイ又は軟骨外植片を用いたアッセイにおける使用のための1セットの試験化合物を同定する上で有用であろう。このような第二のアッセイは、ポリペプチドに対する結合親和性を有する試験化合物がインビトロ又はインビボで、軟骨及び/又はECMの分解を実際に低下させること、又は炎症を低下させることを確認するために設計され得る。
【0103】
好適な対照は常に、偽陽性の読み取りに対してしかるべき所で保証すべきである。本発明の特定の実施態様において、スクリーニング方法は、化合物を好適な対照と比較する追加的な工程を含む。一実施態様において、対照は、試験化合物と接触しなかった細胞又は試料であり得る。代替的な実施態様において、対照は、TARGETを発現しない細胞であり得;例えば、このような実施態様の一態様において、試験細胞は、TARGETを天然に発現でき、対照細胞は、TARGETの発現を阻害又は予防する薬剤、例えばsiRNAと接触し得る。あるいは、このような実施態様の別の態様において、その未変性状態における細胞は、TARGETを発現せず、試験細胞は、TARGETを発現するよう操作されており、それにより本実施態様において、対照は、形質転換されていない未変性細胞であり得る。また又はそうでなければ、対照は、サイトカイン、例えばIL1、TNFα、OSM、又は他の炎症性メディエーター(例えば、LPA又は活性酸素種)を用いて処理された細胞など、炎症あるいはECM及び/又は軟骨の分解の公知のメディエーターを利用し得る。典型的な対照が本明細書で説明されているが、このことは制限として取られるべきではなく;使用されている実験条件について適切な対照を選択することは当業者の範囲内である。
【0104】
これらの測定をする順番は、任意の順番で実施され得る本発明の実施にとって必須であると考えられていない。例えば、ポリペプチドに対する化合物の結合親和性に関して何ら情報が知られていない1セットの化合物のスクリーニングアッセイが最初に実施され得る。あるいは、ポリペプチドドメインに対する結合親和性を有するものとして同定された1セットの化合物、又はポリペプチドの阻害薬であると同定された1クラスの化合物がスクリーニングされ得る。しかしながら、薬剤候補化合物の究極的な使用にとって本アッセイが意味のあるものとなるために、炎症、ECM分解、及び/又は軟骨分解に関する直接的な測定が貴重である。それにもかかわらず、対照を含めた確認試験、及び本発明のポリペプチドに対する結合親和性の測定は、任意の治療的又は診断的応用において有用な化合物を同定する上で有用である。
【0105】
当技術分野で認識された方法及びアッセイに基づいた類似のアプローチは、軟骨及び/又はECMの分解を特徴とする任意の種々の疾患におけるTARGETS及び化合物に関して適用可能であり得る。1つのアッセイ又はアッセイ類は、TARGETに対する結合親和性を有する試験化合物が、軟骨及び/又はECMの分解を阻害することを確認するよう設計され得る。1つのこのような方法において、コラゲナーゼなどの軟骨分解酵素の発現及び/活性が測定される。1つの特定のこのような方法において、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性が測定される。1つの特定のこのような方法において、MMP13の発現及び/又は活性が測定される。
【0106】
当技術分野で認識された方法及びアッセイに基づいた類似のアプローチは、炎症を特徴とする任意の種々の疾患におけるTARGETS及び化合物に関して適用可能であり得る。1つのアッセイ又はアッセイ類は、TARGETに対する結合親和性を有する試験化合物が、炎症を阻害することを確認するよう設計され得る。1つのこのような方法において、コラゲナーゼなどの軟骨分解酵素の発現及び/又は活性が測定される。1つの特定のこのような方法において、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性が測定される。1つの特定のこのような方法において、MMP13の発現及び/又は活性が測定される。代替的な方法において、IL‐1b、IL‐6、IL‐8、IL‐11、TNFα、及び/又はLIFから選択される1つ以上の炎症性サイトカインのレベルが測定される。
【0107】
本アッセイ方法は、モノマー、ポリマータンパク質の部分又はサブユニット、ペプチド、オリゴペプチド、及びそれらの酵素活性のある部分を含む、TARGETタンパク質又はその断片の1つ以上を用いて、インビトロで実施され得る。
【0108】
化合物とポリペプチドTARGETとの結合親和性は、表面プラズモン共鳴バイオセンサー(Biacore)を用いて、標識した化合物を用いた飽和結合分析によって(例えば、Scatchard及びLindmo分析)、差次的紫外線分光光度計、蛍光偏光アッセイ、蛍光画像化プレートリーダー(FLIPR(登録商標))システム、蛍光共鳴エネルギー転移、及び生物発光共鳴エネルギー移動によってなど、当技術分野で公知の方法によって測定することができる。また、化合物の結合親和性は、解離定数(Kd)又はIC50又はEC50において表すことができる。IC50は、ポリペプチドに対する別のリガンドの結合の50%阻害に必要な化合物の濃度を表す。EC50は、TARGET機能を測定する任意のアッセイにおける最大効果の50%を得るのに必要な濃度を表す。解離定数Kdは、リガンドがポリペプチドにどれほど十分に結合しているかの測定結果であり、ポリペプチドにおける結合部位の実際に半分を飽和させるのに必要なリガンド濃度と等価である。高い親和性の結合を有する化合物は、低いKd、IC50、及びEC50を有し、すなわち、100nM〜1pMの範囲にあり;中程度〜低い親和性の結合は高いKd、IC50、及びEC50に関し、すなわちマイクルモル濃度の範囲にある。
【0109】
また、本アッセイ方法は、細胞アッセイにおいても実施できる。TARGETを発現する宿主細胞は、内在性発現を有する細胞、又は例えば形質導入によってTARGETを過剰発現している細胞であることができる。ポリペプチドの内在性発現が、容易に測定することのできるベースラインを決定するのに十分ではない場合、TARGETを過剰発現する宿主細胞を用いて使用され得る。過剰発現は、TARGET基質末端産物のレベルが、内在性発現による活性レベルよりも高いという利点を有する。従って、現に利用可能な技術を用いてこのようなレベルを測定することはより容易である。1つのこのような細胞アッセイにおいて、TARGETの生物学的活性は、軟骨構成要素合成の産生を追随することによって測定され得る。
【0110】
炎症、ECM及び/又は軟骨の分解を阻害する化合物を同定する本方法の1つの実施態様は、TARGETポリペプチド又はその断片若しくは誘導体を発現する細胞の集団を培養すること;細胞の集団の活性化に関して該細胞の集団における第一のレベルのMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4を決定すること(例えば、IL1を用いた刺激による。);該細胞の集団を化合物又は化合物の混合物に曝露すること;該化合物又は該化合物の混合物への該細胞の集団の曝露と同じ活性化の後、前記曝露の間、又は前記曝露の後、該細胞の集団における第二のレベルのMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現又は活性を決定すること;並びにMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4、特にMMP13の発現及び/又は活性を抑制する化合物を同定することを含む。具体的な実施態様において、細胞は軟骨細胞である。具体的な実施態様において、細胞は哺乳類細胞である。具体的な実施態様において、細胞はヒト細胞である。
【0111】
MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性は、本明細書に説明された方法など、当技術分野で公知の方法によって決定することができる。
【0112】
本発明者らは、「ノックダウン」ライブラリーを用いることによって、炎症、軟骨及び/ECMの分解の阻害に関与するTARGET遺伝子を同定した。この種類のライブラリーは、siRNA分子が組換えアデノウイルスによって細胞へと形質導入されたスクリーンであり、前記siRNA分子は、細胞における具体的な遺伝子の発現並びに相応の遺伝子産物の発現及び活性を阻害又は抑制する。ウイルスベクターにおける各siRNAは、具体的な天然遺伝子に対応する。MMP13の発現の抑制によって測定されるように、軟骨の分解を阻害するsiRNAを同定することによって、具体的な遺伝子発現と炎症、軟骨及び/又はECMの分解を阻害するための経路の間に直接的な相関を引くことができる。次に、ノックダウンライブラリー(本明細書で「TARGET」ポリペプチドと呼ばれるそのタンパク質発現産物)を用いて同定されるTARGET遺伝子は、ECM及び/又は軟骨の分解と関連する疾患の治療に用いることのできる化合物を同定する本発明の方法において用いられる。実際、表2に列挙された配列(配列番号43〜57)を含むshRNA化合物は、これらのTARGET遺伝子の発現及び/活性を阻害し、MMP13の発現を低下させ、軟骨及び/又はECMの分解あるいは炎症をもたらす経路におけるTARGETSの役割を確認する。
【表2】

【0113】
本発明はさらに、炎症並びに/あるいは軟骨及び/又はECMの分解を低下させる化合物を同定する方法に関し、下記を含む:
(a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドと接触させること;
(b)該化合物の該ポリペプチドに対する結合親和性を決定すること;
(c)該ポリペプチドを発現する哺乳類細胞の集団を、少なくとも10マイクロモル濃度の結合親和性を呈する化合物と接触させること;及び
(d)IL‐1に対する応答を低下させる、あるいはECM及び/若しくは軟骨を分解するよう作用する酵素の合成並びに/又は該酵素の存在を示す関連マーカーを低下させる化合物を同定すること。
【0114】
一態様において、アッセイ方法には、該ポリペプチドを発現する細胞を、マイクロモル濃度の範囲における結合親和性を呈する化合物と接触させることを含む。一態様において、呈される結合親和性は、少なくとも10マイクロモル濃度である。一態様において、結合親和性は、少なくとも1マイクロモル濃度である。一態様において、結合親和性は、少なくとも500ナノモル濃度である。
【0115】
アッセイ方法は、酵素活性を含むがこれに限定されないTARGETポリペプチドの特定の発現又は活性に基づき得る。プロテアーゼTARGET ADAMTS6(配列番号29)、又はADAM15(配列番号31、32、33、34、35、又は36)についてのアッセイは、プロテアーゼの活性又は発現に基づき得る。キナーゼTARGETについてのアッセイは、MET(配列番号22)、STK32B(配列番号23)、MAP2K2(配列番号28)、MAP4K1(配列番号37)、EPHA5(配列番号39又は40)、及びCSNK1G2(配列番号41)として同定され、標的タンパク質のリン酸化または脱リン酸化を含むがこれらに限定されないキナーゼ又はホスファターゼの活性又は発現に基づき得る。GPR34(配列番号24、25、又は26)、GPR43(配列番号27)、MC3R(配列番号39)、及びEDG4(配列番号42)として同定されるGPCR TARGETについてのアッセイは、下流のメディエーター又は活性化因子を含む、GPCRの活性又は発現に基づき得る。KCNN4(配列番号30)として同定されるイオンチャネルTARGETについてのアッセイは、イオンチャネルを開閉し、それにより膜を通じて又は細胞内で蛍光色素又はトレーサーの濃度を変化させる化合物の能力を測定する古典的なパッチクランプ、高処理量蛍光ベースの、又はトレーサーベースのアッセイを含む、当業者に周知の技術を用い得る。測定可能な現象、活性、又は特性は、当業者によって選択(selected)又は選択され(chosen)得る。当業者は、当技術分野における当業者の知識及び専門的意見を用いて、多くのアッセイフォーマット、システム、又は設計のうちの任意から選択し得る。
【0116】
表1は、同定されたポリペプチドのクラスを含む、下記に説明されたMMP13アッセイにおける出願人のノックダウンライブラリーを用いて同定されたTARGETSを列挙する。TARGETSは、例えば、キナーゼ、ホスファターゼ、プロテアーゼ、GPCR、及びイオンチャネルを含むポリペプチドクラスにおいて同定されている。化合物の存在下又は不在下で測定が実施されるキナーゼによる基質のリン酸化を測定することによって、キナーゼの活性を決定する具体的な方法は、当技術分野で周知である。
【0117】
プロテアーゼであるポリペプチドによる基質の切断を測定することによって化合物による阻害を決定する具体的な方法は、当技術分野で周知である。古典的には、蛍光基がペプチド配列を通じて消光剤に連結された基質が用いられ、前記ペプチド配列は、標的プロテアーゼによって切断することのできる基質である。リンカーの切断は、蛍光基及び消光剤を分離し、蛍光の増大を生じる。
【0118】
イオンチャネルは、膜タンパク質複合体であり、その機能は、生体膜を通過するイオンの拡散を容易にすることである。膜又は脂質二重層は、親水性のかつ帯電した分子に対して疎水性の低い誘電性遮蔽を構築する。イオンチャネルは、膜の疎水性の内部を通過する高い伝導性の親水性経路を提供する。イオンチャネルの活性は、古典的なパッチクランプを用いて測定することができる。また、高処理量蛍光ベースの又はトレーサーベースのアッセイも、イオンチャネルの活性を測定するために広範に利用可能である。これらの蛍光ベースのアッセイは、イオンチャネルを開閉のいずれかをし、それにより膜を通じての具体的な蛍光色素の濃度を変化させる能力に基づいて化合物をスクリーニングする。トレーサーベースのアッセイの場合、細胞内及び細胞外のトレーサーの濃度の変化は、放射能測定又は気相吸光分析(gas absorption spectrometry)によって測定される。
【0119】
Gタンパク質共役受容体(GPCR)は、エフェクタータンパク質を活性化することができ、それにより細胞におけるセカンドメッセンジャーレベルにおける変化を結果的に生じる。GPCRの活性は、このようなセカンドメッセンジャーの活性レベルを測定することによって決定することができる。細胞における2つの典型的な重要かつ有用なセカンドメッセンジャーは、サイクリックAMP(cAMP)及びCa2+である。セカンドメッセンジャーの活性レベルは、当業者に公知の方法によって、ELISA若しくは放射能技術のいずれかによって、又はCa2+と接触した場合に蛍光シグナル若しくは発光シグナルを生じる基質を用いることによって直接的に、あるいは、リポーター遺伝子分析によって間接的に測定することができる。1つ以上の二次メッセンジャーの活性レベルは、プロモーターによって制御されたリポーター遺伝子を用いて典型的に決定され得、この中で、プロモーターは、セカンドメッセンジャーに対して応答する。このような目的のための当技術分野で公知の及び用いられるプロモーターは、細胞におけるサイクリックAMPレベルに応答するサイクリックAMP応答プロモーター、及び細胞における細胞質Ca2+レベルに対して感受性のあるNF‐AT応答プロモーターである。リポーター遺伝子は典型的に、容易に検出可能な遺伝子産物を有する。リポーター遺伝子は、宿主細胞において安定して感染させることができるか、又は一過性にトランスフェクトされることができるかのいずれかである。有用なリポーター遺伝子は、アルカリホスファターゼ、増強した緑色蛍光タンパク質、脱安定化した緑色蛍光タンパク質、ルシフェラーゼ、及びβ-ガラクトシダーゼである。
【0120】
ポリペプチドを発現する細胞は、ポリペプチドを天然に発現する細胞であり得、又は細胞は、先に説明したとおり、ポリペプチドを発現するようトランスフェクトされ得る。また、細胞は、ポリペプチドを過剰発現するよう形質導入され得、又はポリペプチドの非内在性形態を発現するようトランスフェクトされ得、これらは示差的にアッセイ又は評価することができる。
【0121】
1つの特定の実施態様において、本発明の方法はさらに、細胞の集団をポリペプチドのアゴニストと接触させる工程を含む。これは、細胞のある選択された集団におけるポリペプチドの発現が、その活性の適切な検出にとってあまりにも低い方法において有用である。アゴニストを用いることによって、ポリペプチドが誘発され、化合物がポリペプチドを阻害する場合、適切な読み出しを可能にし得る。類似の考え方は、炎症性メディエーターの放出の測定に適用する。特定の実施態様において、本方法において用いられる細胞は、哺乳類NHACである。NHACは、予期されるアッセイにおいて活性化され得る(例えば、IL1による刺激による。)。
【0122】
炎症又は軟骨及び/若しくはECM分解を阻害する化合物を同定する方法は、下記を含む:
(a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチド及びその断片と接触させること;並びに
(b)軟骨分解と関連した化合物‐ポリペプチド特性を測定すること。
【0123】
本発明の一実施態様において、方法は、軟骨細胞の異化過程を阻害する化合物を同定することに関する。
【0124】
本発明の一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、結合親和性である。
【0125】
一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性の阻害である。
【0126】
一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、MMP13の発現及び/又は活性の阻害である。
【0127】
一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、IL‐1b、IL‐6、IL‐8、IL‐11、TNFα、及び/又はLIFなどの炎症性サイトカインの発現である。
【0128】
本発明の一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、該ポリペプチドの活性である。特に、一実施態様において、化合物は、該ポリペプチドの活性を阻害する。
【0129】
本発明の一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチドの特性は、該ポリペプチドの活性である。特に、一実施態様において、化合物は、該ポリペプチドの発現を阻害する。
【0130】
本発明はさらに、炎症又は軟骨及び/若しくはECMの分解と関連した化合物を同定する方法に関し、この中で、該化合物は、配列番号22〜42からなる群から選択されるアミノ酸と少なくとも中程度の結合親和性を呈し、該方法は下記を含む:
a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドを発現する哺乳類細胞の集団と接触させ、この中で、該細胞は活性化されていること;
b)該細胞からのMMP13の発現を決定すること;及び
c)炎症又は軟骨及び/若しくはECMの分解を阻害する化合物を、該細胞からのMMP13の放出を抑制する化合物として同定すること。
【0131】
1つのこのような方法において、細胞は、炎症誘発性因子と接触していることによって活性化される。本方法の具体的な実施態様において、炎症誘発性因子は、TNF‐アルファ、IL‐1、OSM(オンコスタチンM)、IL6、エンドセリン、ブラジキニン、LPA、ロイコトリエン、プロスタグランジン、LPS(リポ多糖類)、又は他のTLRリガンド、あるいはそれらの組み合わせから選択される。
【0132】
1つのこのような方法において、化合物は、少なくとも10マイクロモル濃度の配列番号22〜42からなる群から選択されるアミノ酸に対する結合親和性を呈する。
【0133】
本発明はさらに、炎症又は軟骨及び/若しくはECM分解を阻害する化合物を同定する方法に関し、該方法は下記を含む:
a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドと接触させること;
b)該化合物の該ポリペプチドに対する結合親和性を決定すること;
c)該ポリペプチドを発現する哺乳類細胞の集団を、少なくとも10マイクロモル濃度の結合親和性を呈する化合物と接触させること;及び
d)炎症又は軟骨及び/若しくはECMの分解を阻害する化合物を同定すること。
【0134】
本発明はさらに、炎症又は軟骨及び/若しくはECMの分解を阻害する化合物を同定する方法に関し、該方法は下記を含む:
a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドと接触させること;
b)該ポリペプチドの発現又は活性を阻害する化合物の能力を決定すること;
c)該ポリペプチドを発現する哺乳類細胞の集団を、ポリペプチドの発現又は活性を有意に阻害する化合物と接触させること;及び
d)炎症又は軟骨及び/若しくはECMの分解を阻害する化合物を同定すること。
【0135】
本発明の特定の態様において、先に説明した方法には、試験されるべき化合物を対照と比較する追加的な工程を含み、ここで、対照は、試験化合物と接触しなかった細胞の集団である。
【0136】
本発明の特定の態様において、先に説明した方法には、試験されるべき化合物を対照と比較する追加的な工程を含み、ここで、対照は、該ポリペプチドを発現しない細胞の集団である。
【0137】
ハスループッット目的のために、抗体断片ライブラリー、ペプチドファージディプレイライブラリー、ペプチドライブラリー(例えば、LOPAP(商標)、Sigma Aldrich)、脂質ライブラリー(BioMol)、合成化合物ライブラリー(例えば、LOPAC(商標)、Sigma Aldrich、BioFocus DPI)、又は天然化合物ライブラリー(Specs、TimTec、BioFocus DPI)などの化合物のライブラリーが用いられ得る。
【0138】
好ましい薬剤候補化合物は、低分子量化合物である。すなわち、500ダルトン以下の分子量を有する低分子量化合物は、生物システムにおいて良好な吸収及び透過を有するようであり、結果的に、500ダルトンを上回る分子量を有する化合物よりも成功する薬剤候補である可能性が高い(Lipinskiらの文献(2001))。ペプチドは、薬剤候補化合物の別の好ましいクラスを含む。ペプチドは、妊孕性ホルモン及び血小板凝集阻害薬など、商業的に価値のあるペプチドの複数の例がある。天然産物は、薬剤候補化合物の別の好ましいクラスである。このような化合物は、天然源に認められており、天然源から抽出され、その後合成され得る。脂質は、薬剤候補化合物の別の好ましいクラスである。
【0139】
薬剤候補化合物の別の好ましいクラスは、抗体である。また、本発明は、TARGETSに対して指向する抗体を提供する。これらの抗体は、細胞内のTARGETSに結合するよう内在的に産生され得、組織に付加して、細胞の外側に存在するTARGETポリペプチドに結合し得る。これらの抗体は、モノクローナル抗体またはポリクローナル抗体であり得る。本発明には、キメラ抗体、一本鎖抗体、ドメイン抗体、ラクダ抗体、及びヒト化抗体、並びにFAb断片及びFAb発現ライブラリーの産物、並びにFv断片及びFv発現ライブラリーの産物を含む。抗体は、中和抗体あるいは、TARGETの活性を阻害する、又はTARGETに対するリガンドの若しくは別のタンパク質に対するTARGETの結合を遮断若しくは阻害する抗体であり得る。
【0140】
ある実施態様において、ポリクローナル抗体は、本発明の実施において使用され得る。当業者は、ポリクローナル抗体を調製する方法を知っている。ポリクローナル抗体は、例えば免疫化剤及び所望の場合アジュバントの1回以上の注射によって、哺乳類において上昇することができる。典型的には、免疫化剤及び/又はアジュバントは、複数回の皮下注射又は腹腔内注射によって哺乳類において注射されるであろう。また、抗体は、未処置のTARGETタンパク質若しくはポリペプチドに対して、又は断片、抱合体を含む誘導体、若しくは細胞膜に移入されたTARGETなど、TARGETタンパク質若しくはポリペプチドの他のエピトープ、又はファージディスプレイライブラリーなどの抗体可変領域のライブラリーに対して生じ得る。
【0141】
免疫化されている哺乳類において免疫原性であることが公知のタンパク質に免疫化剤を抱合することは有用であり得る。このような免疫原性のタンパク質の例には、キーホールリンペットヘモシアニン、血清アルブミン、ウシチログロブリン、及びダイズトリプシン阻害剤を含むが、これらに限定されない。採用され得るアジュバントの例には、フロイント完全アジュバント及びMPL‐TDMアジュバント(モノホスホリルリピドA、合成トレハロースジコリノミコラート)を含む。過度の実験なしに、当業者は、免疫化プロトコールを選択し得る。
【0142】
いくつかの実施態様において、抗体は、モノクローナル抗体であり得る。モノクローナル抗体は、当技術分野で公知の方法を用いて調製され得る。本発明のモノクローナル抗体は、ヒト化されて、宿主が抗体に対する免疫応答を展開するのを防止し得る。「ヒト化抗体」は、相補性決定領域(CDR)並びに/又は軽鎖及び/若しくは重鎖可変ドメインフレームワークの他の部分が、非ヒト免疫グロブリンに由来するが、分子の残りの部分が、1つ以上のヒト免疫グロブリンに由来するものである。また、ヒト化抗体には、ドナー若しくはアクセプターの修飾されていない軽鎖若しくはキメラ軽鎖と会合したヒト化重鎖を特徴とする抗体、又はその逆も含む。抗体のヒト化は、当技術分野で公知の方法によって達成され得る(例えば、Mark及びPadlanの文献(1994)参照)。トランスジェニック動物を用いて、ヒト化抗体を発現し得る。
【0143】
また、ヒト化抗体は、ファージディスプレイライブラリーを含む、当技術分野で公知の種々の技術を用いて作製することができる(Hoogenboom及びWinterの文献(1991);Marksらの文献(1991))。また、Coleら及びBoernerらの技術も、ヒトモノクローナル抗体の調製に利用可能である(Coleらの文献(1985);Boernerらの文献(1991))。一本鎖抗体の作製のための当技術分野で公知の技術は、TARGETSに対する一本鎖抗体を作製するのに適用させることができる。抗体は、一価の抗体であり得る。一価の抗体を調製する方法は当技術分野で周知である。例えば、1つの方法は、免疫グロブリン軽鎖及び修飾された重鎖の組換え発現を包含する。重鎖は、重鎖架橋を防止するよう、Fc領域における任意の地点で一般的に切断されている。あるいは;関連性のあるシステイン残基は、別のアミノ酸残基と置換され、又は欠失され、それにより架橋を防止する。
【0144】
二重特異性抗体は、少なくとも2つの異なる抗原に対する、及び好ましくは細胞表面のタンパク質又は受容体又は受容体サブユニットに対する結合特異性を有するモノクローナル抗体、好ましくはヒト抗体又はヒト化抗体である。この場合において、結合特異性のうちの1つは、TARGETの1つのドメインに対するものであり;もう1つは、同じか又は異なるTARGETの別のドメインに対するものである。
【0145】
二重特異性抗体を作製する方法は、当技術分野で公知である。伝統的に、二重特異性抗体の組換え作製は、2つの免疫グロブリン重鎖/軽鎖対の同時発現に基づいており、ここで、2つの重鎖は異なる特異性を有する(Milstein及びCuelloの文献(1983))。免疫グロブリン重鎖及び軽鎖が無作為に分類されるので、これらのハイブリドーマ(クアドローマ)は、10の異なる抗体分子の可能性のある混合物を生じ、そのうちたった1つが正確な二重特異性構造を有する。アフィニティクロマトグラフィー工程は通常、正確な分子の精製を達成する。類似の手順は、Trauneekerらの文献(1991)に開示されている。
【0146】
別の好ましい実施態様によると、アッセイ方法は、TARGETに対する結合親和性を有するものとして同定された薬剤候補化合物を用い、及び/又は相対して1つ以上のTARGETに対するアンタゴニスト活性などの下方制御活性を有するものとして既に同定されている。
【0147】
関節炎若しくは変形性関節症の又は炎症若しくは炎症性疾患のインビボ動物モデルは、インビボでのTARGET調節をさらに評価することを含む、本発明において同定された薬剤又は化合物をさらに又は追加的にスクリーニング、評価、及び/又は検証するために、当業者によって利用され得る。このような動物モデルには、潰瘍性大腸炎モデル、多発性硬化症モデル(EAE、リゾレシチン誘発性を含む。)、関節炎モデル、アレルギー性喘息モデル、気道炎症モデル、及び急性炎症モデルを含むが、これらに限定されない。変形性関節症モデルには、例えば、膝前十字靱帯の切断後のウサギにおいて、及び内側側副靱帯の断裂後のラットにおいて誘発された実験的変形性関節症を含む。
【0148】
本発明はさらに、軟骨細胞を、配列番号1〜21からなる群から選択されるヌクレオチド配列を含む、ポリリボヌクレオチドの少なくとも約17のヌクレオチドを補完するポリヌクレオチド配列を含む発現阻害薬と接触させることを含む、該細胞の同化刺激を誘導し、又は該細胞の分解を低下させる方法に関する。
【0149】
本発明の別の態様は、該細胞を、TARGETポリペプチドをコードするポリリボヌクレオチドの細胞における翻訳を阻害する発現阻害薬と接触させることを含む、炎症又は軟骨及び/若しくはECMの分解を阻害する方法に関する。特定の実施態様は、薬剤をTARGET mRNAと対形成するよう機能する少なくとも1つのアンチセンス鎖を含むポリヌクレオチドを含み、それによりTARGETポリペプチドの発現を下方制御又は遮断する組成物に関する。阻害薬は好ましくは、アンチセンスポリヌクレオチド、リボザイム、及び低分子干渉RNA(siRNA)を含み、この中で、該薬剤は、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドの一部をコードする天然のポリヌクレオチド配列と相補的な、又は前記ポリヌクレオチド配列から操作された核酸配列を含む。好ましい実施態様において、発現阻害薬は、配列番号1〜21からなる群から選択されるポリヌクレオチド配列と相補的である。特に好ましい実施態様において、発現阻害薬は、配列番号43〜57からなる群から選択されるポリヌクレオチド配列と相補的である。
【0150】
本発明の実施態様は、発現阻害薬が、アンチセンスRNA、アンチセンスオリゴデオキシヌクレオチド(ODN)、配列番号22〜42の配列をコードするポリリボヌクレオチドを切断するリボザイム、siRNA、好ましくはshRNAが、TARGETポリリボヌクレオチドのTARGETポリペプチドへの翻訳に干渉するよう配列番号22〜42の配列をコードするポリリボヌクレオチドの一部と十分に相補的な低分子干渉RNA(siRNA、好ましくはshRNA)からなる群から選択される方法に関する。好ましくは、発現阻害薬は、アンチセンスRNA、リボザイム、アンチセンスオリゴデオキシヌクレオチド、又は配列番号1〜21からなる群から選択されるヌクレオチド配列と相補的なsiRNA、好ましくはshRNAである。特に好ましい実施態様において、発現阻害薬は、配列番号43〜57からなる群から選択されるポリヌクレオチドと相補的である。
【0151】
本発明の特別な実施態様は、発現阻害薬が、アンチセンスRNA、アンチセンスオリゴデオキシヌクレオチド(ODN)、配列番号22〜42の配列をコードするポリリボヌクレオチドを切断するリボザイム、siRNA、好ましくはshRNAが、TARGETポリリボヌクレオチドのTARGETポリペプチドへの翻訳に干渉するよう配列番号22〜42の配列をコードするポリリボヌクレオチドの一部と十分に相補的な低分子干渉RNA(siRNA、好ましくはshRNA)を発現する核酸である。好ましくは、ヌクレオチド配列は、配列番号1〜21からなる群から選択されるポリヌクレオチドと相補的である。特に好ましい実施態様において、ヌクレオチド配列は、配列番号43〜57からなる群から選択されるポリヌクレオチドと相補的である。
【0152】
アンチセンス核酸を用いた遺伝子発現の下方制御は、翻訳レベル又は転写レベルで達成することができる。本発明のアンチセンス核酸は、好ましくは、TARGETポリペプチド又は相応するメッセンジャーRNAをコードする核酸のすべて又は部分と特異的にハイブリダイズすることのできる核酸断片である。加えて、主要転写産物のスプライシングを阻害することによってTARGETポリペプチドをコードすることのできる核酸配列の発現を減少させるアンチセンス核酸が設計され得る。アンチセンス配列の任意の長さは、TARGETSをコードする核酸の発現を下方制御又は遮断することができる限り、本発明の実施に好適である。好ましくは、アンチセンス配列は、長さ少なくとも約17ヌクレオチドである。アンチセンス核酸の調製及び使用、アンチセンスRNAをコードするDNA、並びにオリゴ及び遺伝的アンチセンスの使用は、当技術分野で公知である。
【0153】
発現阻害薬の一実施態様は、配列番号1〜21の配列を含む核酸に対するアンチセンスである核酸である。例えば、アンチセンス核酸(例えば、DNA)は、配列番号1〜21の配列を含む核酸の細胞での発現を阻害する遺伝子治療法として、インビトロで細胞に導入され得、又はインビボで対象に投与され得る。アンチセンスオリゴヌクレオチドは好ましくは、約17〜約100のヌクレオチドを含む配列を含み、より好ましくは、アンチセンスオリゴヌクレオチドは、約18〜約30を含む。アンチセンス核酸は、配列番号1〜21からなる群から選択される核酸配列と相補的な約10〜約30の連続したヌクレオチドから調製され得る。
【0154】
アンチセンス核酸は好ましくは、オリゴヌクレオチドであり、デオキシリボヌクレオチド、修飾されたデオキシリボヌクレオチド、又はその両方の何らかの組み合わせから完全になり得る。アンチセンス核酸は、合成オリゴヌクレオチドであることができる。オリゴヌクレオチドは、化学的に修飾され、所望の場合、安定性及び/又は選択性を改良し得る。オリゴヌクレオチドは、細胞内ヌクレアーゼによる分解を受けやすいので、修飾には、例えば、ホスホジエステル結合の遊離酸素を置き換えるための硫黄基の使用を含むことができる。この修飾は、ホスホロチオアート結合と呼ばれる。ホスホロチオアートアンチセンスオリゴヌクレオチドは、水溶性であり、多価陰イオン性であり、内在性ヌクレアーゼに対して耐性である。加えて、ホスホロチオアートアンチセンスオリゴヌクレオチドがそのTARGET部位とハイブリダイズする場合、RN202‐315NA二本鎖は、内在性酵素リボヌクレアーゼ(RNase)Hを活性化し、これがハイブリッド分子のmRNA構成要素を切断する。
【0155】
加えて、ホスホラミダイト及びポリアミド(ペプチド)結合を有するアンチセンスオリゴヌクレオチドが合成できる。これらの分子は、ヌクレアーゼ分解に対して非常に耐性があるべきである。さらに、化学基は、糖部分の2'炭素及びピリミジンの5炭素(C‐5)に付加され、安定性を増強し、アンチセンスオリゴヌクレオチドのそのTARGET部位への結合を容易にすることができる。修飾には、2'-デオキシ、O-ペントキシ、O-プロポキシ、O-メトキシ、フルオロ、メトキシエトキシホスホロチオアート、修飾された塩基、及び当業者に公知の他の修飾を含み得る。
【0156】
TARGETSのレベルを低下させることのできる別の種類の発現阻害薬は、リボザイムである。リボザイムは、個別の触媒ドメイン及び基質結合ドメインを有する触媒性RNA分子(RNA酵素)である。基質結合配列は、ヌクレオチド相補性及びおそらくは、そのTARGET配列との非水素結合相互作用によって組み合わせる。触媒部分は、特異的部位でTARGET RNAを切断する。リボザイムの基質ドメインは、指定されたmRNA配列に配向するよう操作することができる。リボザイムは相補性塩基対形成を通じてTARGET mRNAを認識した後、前記標的mRNAを結合する。一旦、正確なTARGET部位に結合すると、リボザイムは、酵素的に作用して、TARGET mRNAを切る。リボザイムによるmRNAの切断は、相応のポリペプチドの合成を扱う前記mRNAの能力を破壊する。一旦、リボザイムがそのTARGET配列を切断すると、前記標的配列が放出され、他のmRNAにおいて反復して結合及び切断することができる。
【0157】
リボザイムの形態には、ハンマーヘッドモチーフ、ヘアピンモチーフ、デルタ型肝炎ウイルス、グループIイントロンモチーフ若しくは(RNA誘導配列と会合した)RNaseP RNAモチーフ又はパンカビVS RNAモチーフを含む。これらの触媒RNA分子が、真核生物プロモーターから細胞内で発現することができるので、ハンマーヘッド又はヘアピン構造を有するリボザイムは容易に調製される(Chenらの文献(1992))。本発明のリボザイムは、適切なDNAベクターから真核細胞において発現することができる。所望の場合、リボザイムの活性は、第二のリボザイムによる主要転写産物からの放出によって増大し得る(Venturaらの文献(1993))。
【0158】
リボザイムは、オリゴデオキシリボヌクレオチドを、転写後にTARGET mRNAとハイブリダイズする配列によって隣接されたリボザイム触媒ドメイン(20ヌクレオチド)と組み合わせることによって化学的に合成され得る。オリゴデオキシリボヌクレオチドは、基質結合配列をプライマーとして用いることによって増幅される。増幅産物は、真核生物発現ベクターへとクローニングされる。
【0159】
リボザイムは、DNA、RNA、又はウイルスベクターへと挿入された転写単位から発現する。リボザイム配列の転写は、真核生物RNAポリメラーゼI(pol(I)、RNAポリメラーゼII(pol II)、又はRNAポリメラーゼIII(pol III))についてのプロモーターから駆動される。pol IIプロモーター又はpol IIIプロモーターからの転写産物は、すべての細胞において高レベルで発現するであろうし;所与の細胞種類における所与のpol IIプロモーターのレベルは、近くの遺伝子調節配列によるであろう。また、原核生物RNAポリメラーゼプロモーターも使用され、但し、原核生物RNAポリメラーゼ酵素が、適切な細胞において発現するという条件付きである(Gao及びHuangの文献(1993))。これらのプロモーターから発現したリボザイムが哺乳類細胞において機能することができることは示されている(Kashani-Sabetらの文献(1992))。
【0160】
特に好ましい阻害薬は、低分子干渉RNA(siRNA、好ましくはshRNA)である。siRNA、好ましくはshRNAは、発現停止したRNAと配列において類似している二本鎖RNA(dsRNA)による遺伝子サイレンシングの転写後プロセスを仲介する。本発明に従ったsiRNAは、配列番号1〜21の配列において説明された配列の群から、好ましくは配列番号43〜57の配列において説明された配列の群から選択された連続した17〜25のヌクレオチド配列と相補的な又は前記ヌクレオチド配列と類似した17〜25のヌクレオチドのセンス鎖と、センス鎖に相補的な17〜23のヌクレオチドのアンチセンス鎖とを含む。典型的な配列は、配列番号43〜57と相補的な配列として説明されている。最も好ましいsiRNAは、互いに及びTARGETポリヌクレオチド配列と100パーセント相補的なセンス鎖及びアンチセンス鎖を含む。好ましくは、siRNAはさらに、センス鎖及びアンチセンス鎖を連結するループ領域を含む。
【0161】
本発明に従った自己相補性一本鎖siRNA分子ポリヌクレオチドは、ループ領域リンカーによって接続されたセンス部分とアンチセンス部分とを含む。好ましくは、ループ領域配列は、4〜30ヌクレオチド長、より好ましくは5〜15ヌクレオチド長、最も好ましくは8又は12ヌクレオチド長である。具体的な実施態様において、リンカー配列は、UUGCUAUAである。代替的な具体的実施態様において、リンカー配列は、GUUUGCUAUAAC(配列番号58)である。自己相補性一本鎖siRNAは、ヘアピンループを形成し、通常のdsRNAよりも安定である。加えて、自己相補性一本鎖siRNAは、ベクターからより簡単に作製される。
【0162】
アンチセンスRNAに類似して、siRNAは、核酸分解に対する耐性を確実にし、又は活性を亢進し、又は細胞分布を亢進し、又は細胞の取り込みを亢進するよう修飾することができ、このような修飾は、修飾されたヌクレオシド間連結、修飾された核酸塩基、修飾された糖及び/又はsiRNAの1つ以上の部分若しくは抱合体への化学的連結からなり得る。ヌクレオチド配列は、これらのsiRNA設計則に従わないヌクレオチド配列と比較して、TARGET配列の改良された縮小(reduction)を与えるsiRNA設計則に従って選択される(これらの法則及び、siRNAの調製の例に関する論議については、WO2004/094636、及びUS2003/0198627が引用により本明細書により組み込まれている。)。
【0163】
また、本発明は、軟骨の分解を阻害することのできるポリヌクレオチドを発現することのできるDNA発現ベクターを含み、発現阻害薬として先に説明された組成物、及び該組成物を用いる方法にも関する。
【0164】
これらの組成物及び方法の特別な態様は、TARGETポリペプチドと選択的に相互作用することのできる細胞内結合タンパク質をコードするポリヌクレオチドの誘導された発現による、TARGETポリペプチドの発現の下方制御又は遮断に関する。細胞内結合タンパク質には、発現する細胞においてポリペプチドと選択的に相互作用することのできる又は結合することのできる、及びポリペプチドの機能を中和することのできる任意のタンパク質を含む。好ましくは、細胞内結合タンパク質は、配列番号22〜42の配列のTARGETポリペプチドのエピトープに対する結合親和性を有する中和抗体又は中和抗体の断片である。
【0165】
この組成物の特別な実施態様は、アンチセンスRNA、アンチセンスオリゴデオキシヌクレオチド(ODN)、配列番号22〜42の配列をコードするポリヌクレオチドを切断するリボザイム、及び配列番号22〜42の配列をコードするポリリボヌクレオチドの一部と十分に類似しており、それによりsiRNAが、TARGETポリリボヌクレオチドのTARGETポリペプチドへの翻訳に干渉する低分子干渉RNA(siRNA)からなる群から選択される発現阻害薬を含む。
【0166】
発現阻害薬を発現するポリヌクレオチドは、ベクター内に特に含まれる。ポリ核酸は、核酸配列の発現を可能にするシグナルに作用可能に連結され、好ましくは、一旦ベクターが細胞に導入されるとアンチセンス核酸を発現するであろう組換えベクターコンストラクトを利用する細胞へと導入される。アデノウイルスベクターシステム、レトロウイルスベクターシステム、アデノ随伴ウイルスベクターシステム、レンチウイルスベクターシステム、単純ヘルペスウイルスベクターシステム、又はセンダウイルス(sendaviral)ベクターシステムを含む種々のウイルスベースの系が利用可能であり、すべて、TARGET細胞における発現阻害薬についてのポリヌクレオチド配列を導入及び発現するために用いられ得る。
【0167】
好ましくは、本発明の方法において用いられるウイルスベクターは、複製欠損である。このような複製欠損ベクターは通常、感染した細胞におけるウイルスの複製に必要な少なくとも1つの領域を欠失するであろう。これらの領域は、当業者に公知の任意の技術によって、(全体において又は部分において)除去されるか又は非機能的にされるかのいずれかであることができる。これらの技術には、(複製に)必須の領域に対する1つ以上の完全な除去、置換、部分的な欠失又は塩基の付加を含む。このような技術は、遺伝子操作の技術を用いて又は突然変異原性剤を用いた処理によって、インビトロで(単離されたDNAに関して)又はインサイツで実施され得る。好ましくは、複製欠損ウイルスは、ウイルス粒子をカプシド形成するのに必要な前記複製欠損ウイルスのゲノムの配列を保有する。
【0168】
好ましい実施態様において、ウイルスエレメントは、アデノウイルス由来である。好ましくはビヒクルには、アデノウイルスカプシドにパッケージされたアデノウイルスベクター、又はその機能的部分、誘導体、及び/若しくは類似体を含む。また、アデノウイルス生物学は、分子レベルで比較的周知である。アデノウイルスベクターについての多くのツールは、開発されており及び開発され続けており、従って、アデノウイルスカプシドを、本発明のライブラリーにおいて組み込むのに好ましいビヒクルにする。アデノウイルスは、広範な種々の細胞を感染させることができる。しかしながら、異なるアデノウイルス血清型は、細胞に対する異なる優先性を有する。好ましい実施態様において、本発明のアデノウイルスカプシドが入ることのできるTARGET細胞集団を組み合わせかつ広げるために、ビヒクルには、少なくとも2つのアデノウイルスに由来するアデノウイルス線維タンパク質を含む。好ましいアデノウイルス線維タンパク質配列は、血清型5、17、45、及び51である。これらのキメラベクターの技術又は構築及び発現は、US 2003/0180258及びUS 2004/0071660に開示されており、引用により本明細書により組み込まれている。
【0169】
好ましい実施態様において、アデノウイルス由来の核酸には、アデノウイルス後期タンパク質又はその機能的部分、誘導体、及び/若しくは類似体をコードする核酸を含む。アデノウイルス後期タンパク質、例えば、アデノウイルス線維タンパク質は、ビヒクルをある細胞に標的化する(TARGET)ために、又は細胞へのビヒクルの高い送達を誘導するために好ましく用いられ得る。好ましくは、アデノウイルスに由来する核酸は、本質的にすべてのアデノウイルス後期タンパク質をコードし、アデノウイルスカプシド全体又はその機能的部分、類似体、及び/若しくは誘導体の形成を可能にする。好ましくは、アデノウイルスに由来する核酸には、アデノウイルスE2A又はその機能的部分、誘導体、及び/若しくは類似体をコードする核酸を含む。好ましくは、アデノウイルスに由来する核酸には、細胞におけるアデノウイルス由来核酸の複製を少なくとも一部容易にする、少なくとも1つのE4領域タンパク質又はその機能的部分、誘導体、及び/若しくは類似体をコードする核酸を含む。本用途の例において用いられるアデノウイルスベクターは、本治療方法発明において有用なベクターの典型である。
【0170】
本発明のある実施態様は、レトロウイルスベクターの系を用いる。レトロウイルスは、分裂中の細胞に感染する組み込みウイルスであり、前記ウイルスの構築は、当技術分野で公知である。レトロウイルスベクターは、MoMuLV(「モロニーマウス白血病ウイルス」)MSV(「モロニーマウス肉腫ウイルス」)、HaSV(「ハーベイ肉腫ウイルス」);SNV(「脾壊死ウイルス」);RSV(「ラウス肉腫ウイルス」)、及びフレンドウイルスなど、異なる種類のレトロウイルスから構築することができる。また、レンチウイルスベクターの系も、本発明の実施において使用され得る。
【0171】
本発明の他の実施態様において、アデノ随伴ウイルス(「AAV」)が利用される。AAVウイルスは、安定したかつ部位特異的な様式で、感染した細胞のゲノムへと組み込む比較的小さなサイズのDNAウイルスである。AAVウイルスは、細胞の増殖、形態、又は分化に何ら影響を誘導することなく、広範な細胞に感染することができ、かつヒトの病態に関与するようには見えない。
【0172】
ベクター構築において、本発明のポリヌクレオチド剤は、1つ以上の調節領域に連結され得る。適切な調節領域又は領域類の選択は、当業者のレベル内で慣例のことである。調節領域にはプロモーターを含み、エンハンサー、サプレッサーなどを含み得る。
【0173】
本発明の発現ベクターにおいて用いられ得るプロモーターには、構成的プロモーター及び制御的(誘導性)プロモーターの両方を含む。プロモーターは、宿主に応じて原核生物性又は真核生物性であってよい。本発明の実施の有用な原核生物性(バクテリオファージを含む。)プロモーターには、lacプロモーター、lacZプロモーター、T3プロモーター、T7プロモーター、ラムダPrプロモーター、P1プロモーター、及びtrpプロモーターがある。本発明の実施に有用な真核生物性(ウイルス性を含む。)プロモーターには、遍在性プロモーター(例えば、HPRT、ビメンチン、アクチン、チューブリン)、中間径フィラメントプロモーター(例えば、デスミン、ニューロフィラメント、ケラチン、GFAP)、治療遺伝子プロモーター(例えば、MDR型、CFTR、第VIII因子)、組織特異的プロモーター(例えば、平滑筋細胞におけるアクチンプロモーター、内皮細胞において活性のあるFlt及びFlkプロモーター)であり、これらには、組織特異性を呈し、かつトランスジェニック動物において利用されている動物転写調節領域:膵腺房細胞において活性のあるエラスターゼI遺伝子調節領域(Swiftらの文献((1984) Cell 38:639-46);Ornitzらの文献((1986) Cold Spring Harbor Symp. Quant. Biol. 50:399-409);MacDonald, (1987) Hepatology 7:425-515);膵ベータ細胞において活性のあるインスリン遺伝子調節領域(Hanahanの文献((1985) Nature 315:115-22))、リンパ球系細胞において活性のある免疫グロブリン遺伝子調節領域(Grosschedlらの文献((1984) Cell 38:647-58);Adamesらの文献((1985) Nature 318:533-8);Alexanderらの文献((1987) Mol. Cell. Biol. 7:1436-44))、精巣細胞、乳房細胞、リンパ球系細胞、及びマスト細胞において活性のあるマウス乳房腫瘍ウイルス調節領域(Lederらの文献((1986) Cell 45:485-95))、肝臓において活性のあるアルブミン遺伝子調節領域(Pinkertらの文献((1987) Genes and Devel. 1:268-76))、肝臓において活性のあるアルファ‐フェトプロテイン遺伝子調節領域(Krumlaufらの文献((1985) Mol. Cell. Biol., 5:1639-48);Hammerらの文献((1987) Science 235:53-8))、肝臓において活性のあるアルファ1‐抗トリプシン遺伝子調節領域(Kelseyの文献((1987) Genes and Devel., 1: 161-71))、骨髄系細胞において活性のあるベータ‐グロブリン遺伝子調節領域(Mogramらの文献((1985) Nature 315:338-40);Kolliasらの文献((1986) Cell 46:89-94))、脳におけるオリゴデンドロサイトにおいて活性のあるミエリン塩基性タンパク質遺伝子調節領域(Readheadらの文献((1987) Cell 48:703-12))、骨格筋において活性のあるミオシン軽鎖‐2遺伝子調節領域(Saniの文献((1985) Nature 314.283-6))、並びに視床下部において活性のある性腺刺激ホルモン(gonadotropic)放出ホルモン遺伝子調節領域(Masonらの文献( (1986) Science 234:1372-8))を含む。
【0174】
本発明の実施において用いられ得る他のプロモーターには、分裂中の細胞において優先的に活性化されるプロモーター、刺激に応答するプロモーター(例えば、ステロイドホルモン受容体、レチノイン酸受容体)、テトラサイクリン調節性転写修飾因子、サイトメガロウイルス最初期、レトロウイルス末端反復配列、メタロチオネイン、SV-40、E1a、及びMLPプロモーターを含む。
【0175】
追加的なベクター系には、患者へのポリヌクレオチド座位の導入を容易にする非ウイルス性システムを含む。例えば、所望の配列をコードするDNAベクターは、リポフェクションによってインビボで導入することができる。リポソーム仲介性トランスフェクションで遭遇する困難を制限するよう設計された合成陽イオン性脂質は、マーカーをコードする遺伝子のインビボトランスフェクション用のリポソームを調製するために使用することができる(Felgnerらの文献((1987) Proc. Natl. Acad Sci. USA 84:7413-7);Mackeyらの文献((1988) Proc. Natl. Acad. Sci. USA 85:8027-31);Ulmerらの文献((1993) Science 259:1745-8参照))。陽イオン性脂質の使用は、負に帯電した核酸の封入を促進し得、また、負に帯電した細胞膜との融合も促進し得る(Felgner及びRingoldの文献((1989) Nature 337:387-8))。核酸の転移に特に有用な脂質化合物及び組成物は、WO 95/18863及びWO 96/17823において、並びに米国特許第5,459,127号において説明されている。インビボでの特異的臓器へ外来性遺伝子を導入するためのリポフェクションの使用は、ある実際上の利点を有し、特定の細胞種類に対して配向するトランスフェクションは、細胞の異種性を有する組織、例えば、膵臓、肝臓、腎臓、及び脳において特に有利であろう。脂質は、ターゲティングの目的のために、他の分子に化学的と共役し得る。標的にされたペプチド、例えば、ホルモン若しくは神経伝達物質、及びタンパク質、例えば、抗体、又は非ペプチド分子は、リポソームと化学的に共役し得る。また、他の分子は、インビボでの核酸のトランスフェクションを容易にするのに有用であり、例えば、陽イオン性オリゴペプチド(例えば、WO95/21931)、DNA結合タンパク質に由来するペプチド(例えば、WO96/25508)、又は陽イオン性ポリマー(例えば、WO95/21931)である。
【0176】
また、むき出しのDNAプラスミドとしてインビボでDNAベクターを導入することも可能である(米国特許第5,693,622号、第5,589,466号、及び第5,580,859号参照)。治療目的のためのむき出しのDNAベクターは、所望の宿主細胞へと、当技術分野で公知の方法、例えば、トランスフェクション、電気穿孔法、マイクロインジェクション、形質導入、細胞融合、DEAEデキストラン、リン酸カルシウム沈殿、遺伝子銃の使用、又はDNAベクター輸送体の使用によって導入することができる(例えば、Wilsonらの文献((1992) J. Biol. Chem. 267:963-7);Wu及びWuの文献((1988) J. Biol. Chem. 263:14621-4);Hartmutらの文献(1990年3月15日に出願されたカナダ国特許出願第2,012,311号;Williamsらの文献((1991). Proc. Natl. Acad. Sci. USA 88:2726-30)参照)。リポーター仲介性DNA送達アプローチも使用することができる(Curielらの文献((1992) Hum. Gene Ther. 3:147-54);Wu及びWuの文献((1987) J. Biol. Chem. 262:4429-32))。
【0177】
また、本発明は、TARGET阻害薬として同定された1つ以上の有効量の化合物、及び/又は先に説明された発現阻害薬を含む、生物学的に適合性のある軟骨分解阻害組成物も提供する。
【0178】
生物学的に適合性のある組成物は、本発明の化合物、ポリヌクレオチド、ベクター、及び抗体が、活性形態で、例えば、生物活性を有効にできる形態で維持される、固体、液体、ゲル、又は他の形態であり得る組成物である。例えば、本発明の化合物は、TARGETに及ぼす逆性のアゴニスト活性又はアンタゴニスト活性を有するであろうし;核酸は、メッセージを複製、翻訳でき、又はTARGETの相補的mRNAとハイブリダイズすることができるであろうし;ベクターは、TARGET細胞をトランスフェクトして、先に説明したアンチセンス、抗体、リボザイム、又はsiRNAを発現することができるであろうし;抗体は、TARGETポリペプチドドメインを結合するであろう。
【0179】
好ましい生物学的に適合性のある組成物は、例えば、塩イオンを含む、トリス緩衝液、リン酸緩衝液、又はHEPES緩衝液を用いて緩衝する水溶液である。通常、塩イオン濃度は、生理学的レベルに類似しているであろう。生物学的に適合性のある溶液には、安定化剤及び保存料を含み得る。より好ましい実施態様において、生物適合性のある組成物は、医薬として許容し得る組成物である。このような組成物は、局所的、経口、非経口、鼻内、皮下、及び眼内の経路による投与のために製剤することができる。非経口投与は、静脈内注射、筋肉内注射、動脈内注射又は注入の技術を含む。組成物は、標準的な周知の非毒性の生理学的に許容し得る担体、アジュバント、及びビヒクルを所望の通り含む薬用量単位製剤において非経口的に投与され得る。
【0180】
本組成物発明の特に好ましい実施態様は、先に説明した治療有効量の発現阻害薬を、医薬として許容し得る担体との混合物で含む軟骨形成増強医薬組成物である。別の好ましい実施態様は、炎症又は軟骨及び/若しくはECM分解を包含する容態、あるいは容態に対する易罹患性の治療又は予防のための医薬組成物であって、軟骨形成増強に有効な量のTARGETアンタゴニスト若しくは逆性アゴニスト、その医薬として許容し得る塩、水和物、溶媒和物、又はプロドラッグを、医薬として許容し得る担体との混合物で含む前記医薬組成物である。一態様において、容態は、平均軟骨厚の全身性の又は局所的な減少を包含する。
【0181】
経口投与のための医薬組成物は、経口投与に好適な薬用量で、当技術分野で周知の医薬として許容し得る担体を用いて製剤することができる。このような担体によって医薬組成物を錠剤、丸剤、糖衣錠、カプセル剤、液剤、ゲル、シロップ剤、スラリー、懸濁剤、及びこれらの類するものとして、患者による消化のために製剤することができる。経口使用のための医薬組成物は、活性化合物を固体賦形剤と組み合わせること、結果として生じる混合物を任意に粉砕すること、及び所望の場合好適な助剤を添加した後、顆粒混合物を加工して、錠剤又は糖衣錠中心を得ることによって調製することができる。好適な賦形剤は、ラクトース、スクロース、マンニトール、又はソルビトールを含めた糖類などの炭水化物又はタンパク質充填剤;トウモロコシ、コムギ、コメ、ジャガイモ、又は他の植物に由来するデンプン;メチルセルロース、ヒドロキシプロピルメチルセルロース、又はカルボキシメチルセルロースナトリウムなどのセルロース;アラビアゴム及びトラガカントゴムを含めたゴム;並びに、ゼラチン及びコラーゲンなどのタンパク質である。所望の場合、架橋したポリビニルピロリドン、アガー、アルギン酸、又はアルギン酸ナトリウムなどのその塩などの崩壊剤又は可溶化剤を添加し得る。糖衣錠中心は、濃縮糖溶液など、好適なコーティングとともに用いてよく、前記コーティングはまた、アラビアゴム、滑石、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール及び/又は二酸化チタン、ラッカー溶液、及び好適な有機溶媒又は溶媒混合物も含み得る。製品の同定のために、又は活性化合物の量、すなわち薬用量を特徴付けるために、染料又は色素を錠剤又は糖衣錠コーティングに添加し得る。
【0182】
経口で使用することのできる医薬調製物には、ゼラチンでできた押し込み型(push-fit)カプセル、並びにゼラチン及びグリセロール又はソルビトールなどのコーティングでできた軟質密封カプセルを含む。押し込み型カプセルは、ラクトース又はデンプンなどの充填剤又は結合剤、滑石又はステアリン酸マグネシウムなどの潤滑剤、及び任意に安定化剤と混合した活性成分を含むことができる。軟質カプセルにおいて、活性化合物は、脂肪油、液体、又は安定化剤を有する若しくは有さない液体ポリエチレングリコールなどの好適な液体において溶解又は懸濁され得る。
【0183】
好ましい滅菌済みの注射可能な調製物は、非毒性の非経口的に許容し得る溶媒又は希釈剤における溶液又は懸濁液であることができる。医薬として許容し得る担体の例は、塩類溶液、緩衝塩類溶液、等張性塩類溶液(例えば、リン酸一ナトリウム若しくはリン酸二ナトリウム、ナトリウム、カリウム;塩化カルシウム若しくは塩化マグネシウム、又はこのような塩の混合物)、リンゲル溶液、デキストロース、水、滅菌水、グリセロール、エタノール、及びそれらの組み合わせであり、1,3-ブタンジオール及び滅菌済み固定油が、溶媒又は懸濁媒体として簡便に採用される。合成モノグリセリド又は合成ジグリセリドを含む刺激の強くない任意の固定油を採用することができる。また、オレイン酸などの脂肪酸も、注射可能物の調製における使用を提供する。
【0184】
本発明の化合物又は組成物は、ポリマー担体、生分解性マトリックス若しくは生物模倣型マトリックスを用いた投与のために組み合され得、あるいは前記ポリマー、生分解性マトリックス若しくは生物模倣型マトリックスにおいて、又は足場において移入され得る。担体、マトリックス、又は足場は、組成物が組み込まれることができるであろう、かつ発現することができるであろう任意の材料であり得、細胞の添加と又は細胞の存在下で適合性であろう。好ましくは、担体マトリックス又は足場は、主に非免疫原性であり、かつ生分解性である。生分解性材料の例には、ポリグリコール酸(PGA)、ポリ乳酸(PLA)、ヒアルロン酸、腸線縫合材料、ゼラチン、セルロース、ニトロセルロース、コラーゲン、アルブミン、フィブリン、アルギン酸塩、綿、又は他の天然の生分解性材料を含むが、これらに限定されない。投与又は移入の前に、例えば、酸化エチレンによる処理によって又はガンマ照射若しくは電子線を用いた照射によって、マトリックス又は足場材料を滅菌することが好ましくあり得る。加えて、多くの他の材料が、下記を含むがこれらに限定されない足場又はフレームワーク構造を形成するのに用いられ得る:ナイロン(ポリアミド)、ダクロン(ポリエステル)、ポリスチレン、ポリプロピレン、ポリアクリラート、ポリビニル化合物(例えば、ポリビニルクロリド)、ポリカーボネート(PVC)、ポリテトラフルオロエチレン(polytetrafluorethylene)(PTFE、テフロン)、サーマノックス(thermanox)(TPX)、ポリ乳酸(PLA)、ポリグリコール酸(PGA)、及びポリ乳酸‐グリコール酸(PLGA)などのヒドロキシ酸のポリマー、ポリオルトエステル類、ポリ無水物類、ポリホスファゼン類、及び種々のポリヒドロキシアルカノアート類、並びにこれらの組み合わせ。好適なマトリックスには、ポリマーメッシュ若しくはポリマースポンジ、及びポリマーヒドロゲルを含む。好ましい実施態様において、マトリックスは、経時的に、1年未満の期間、より好ましくは6ヶ月未満、最も好ましくは、2〜10週間にわたって生分解性である。ポリマー組成物及び製造方法は、分解速度を特定するために用いることができる。例えば、増大する量のポリ乳酸をポリグリコール酸と混合すると、分解時間が減縮する。使用することのできるポリグリコール酸のメッシュは、例えば、外科的供給企業(例えば、Ethicon, N.J.)から商業的に得ることができる。ヒドロゲルは、有機ポリマー(天然又は合成)が共有結合、イオン結合、又は水素結合を介して架橋されて3次元の開いた格子の構造を作る場合に形成される物質として規定され、該構造は水分子を捕捉してゲルを形成する。一般に、これらのポリマーは、水、緩衝塩溶液、又は水性アルコール溶液などの、帯電した側鎖基又はその一価のイオン塩を有する水溶液において少なくとも部分的に可溶性である。組成物媒体は、ヒドロゲルであり得、これは、薬剤吸収スポンジとして作用することのできる親水性ポリアクリル酸ポリマーなど、任意の生体適合性、又は非細胞毒性のホモポリマー若しくはヘテロポリマーから調製される。これらのうちの1つもの、特にエチレン及び/又は酸化プロピレンから得られるものは、市販されている。ヒドロゲルは、例えば外科的介入の間に治療されるべき組織の表面に直接配置することができる。
【0185】
本発明の医薬組成物の実施態様は、本発明のポリヌクレオチド阻害剤をコードする複製欠損組換えウイルスベクターと、ポロキサマーなどのトランスフェクションエンハンサーとを含む。ポロキサマーの例は、ポロキサマー407であり、市販されており(BASF, Parsippany, N.J.)、非毒性の生体適合性ポリオールである。組換えウイルスを含浸したポロキサマーは、例えば外科的介入の間に治療されるべき組織の表面に直接配置してよい。ポロキサマーは、より低い粘度を有しながらも、ヒドロゲルと本質的に同じ利点を有する。
【0186】
また、活性のある発現阻害薬は、例えば、界面重合化によって調製されたマイクロカプセル、例えば、ヒドロキシメチルセルロース若しくはゼラチンマイクロカプセル及びポリ-(メチルメタクリラート)マイクロカプセルにおいてそれぞれ、コロイド状薬剤送達システム(例えば、リポソーム、アルブミンミクロスフェア、ミクロエマルション、ナノ粒子、及びナノカプセル)において、又はマクロエマルションにおいて封入され得る。このような技術は、Remingtonの文献「医薬科学(Pharmaceutical Sciences)」((1980) 第16版, Osol, A.編)に開示されている。
【0187】
徐放性調製物が調製され得る。徐放性調製物の好適な例には、マトリックスが、成形された物品の形態にある、抗体を含む固体疎水性ポリマーの半透性マトリックス、例えば、フィルム又はマイクロカプセルを含む。徐放性マトリックスの例には、ポリエステル、ヒドロゲル(例えば、ポリ(2-ヒドロキシエチル-メタクリラート)、又はポリ(ビニルアルコール))、ポリラクチド(米国特許第3,773,919号)、L-グルタミン酸とガンマ-エチル-L-グルタマートとのコポリマー、非分解性エチレン-ビニルアセタート、LUPRON DEPOT(商標)などの分解性乳酸-グリコール酸コポリマー(乳酸-グリコール酸コポリマー及び酢酸ロイプロリドから構成される注射可能なミクロスフェア)、及びポリ-D-(-)-3-ヒドロキシ酪酸を含む。エチレン-ビニルアセタート及び乳酸-グリコール酸などのポリマーによって100日間超にわたる分子の放出が可能となる一方で、アルヒドロゲルは、より短い期間タンパク質を放出する。封入された抗体が、長時間にわたって身体にとどまる場合、前記抗体は、37℃での湿気に対する曝露の結果として変性又は凝集し得、結果的に、生物学的活性の損失及び免疫原性の起こり得る変化を生じる。包含される機序に応じて安定化のために合理的な戦略を考案することができる。例えば、凝集機序が、チオ‐ジスルフィド交換を通じた分子間S-S結合形成であると発見される場合、安定化は、スルフヒドリル残基を修飾し、酸性溶液から凍結乾燥し、水分含有量を制御し、適切な添加剤を用い、及び具体的なポリマーマトリックス組成物を展開することによって達成され得る。
【0188】
先に規定したように、治療効果のある用量は、症状または容態を寛解するタンパク質、ポリヌクレオチド、ペプチド、又はその抗体、アゴニスト、若しくはアンタゴニストの量を意味する。このような化合物の治療有効性及び毒性は、細胞培養又は実験動物における標準的な医薬手順、例えば、ED50(集団の50%において治療有効である用量)及びLD50(集団の50%に対する致死的用量)によって決定することができる。治療効果に対して毒性である用量比は、治療指数であり、比LD50/ED50として表すことができる。細胞培養アッセイ及び動物研究から得られたデータは、ヒトの使用のための薬用量範囲を処方する上で用いられる。このような化合物の薬用量は好ましくは、毒性をほとんど又は全く有さないED50を含む循環濃度の範囲内に収まる。薬用量は、採用される剤形、患者の感受性、及び投与の経路に応じて、この範囲内で変動する。
【0189】
任意の化合物について、治療有効用量は、細胞培養アッセイにおいて又は動物モデル、通常、マウス、ウサギ、イヌ、又はブタにおいてのいずれかで初期的に概算することができる。また、動物モデルは、所望の濃度範囲及び投与経路を達成するために用いられる。次に、このような情報は、ヒトにおける投与に有用な用量及び経路を決定するために用いることができる。実際の薬用量は、治療されるべき患者を考慮して個々の医師によって選択される。薬用量及び投与は、十分なレベルの活性部分を提供するために、又は所望の効果を維持するために調整される。考慮され得る追加的な因子には、患者の疾患状態の重症度、齢、体重、及び性別;食事、治療の所望の期間、投与方法、投与の回数及び頻度、薬剤の組み合わせ、反応の感受性、及び治療法に対する耐性/応答を含む。長時間作用性医薬組成物は、特定の製剤の半減期及びクリアランス速度に応じて、3〜4日ごとに、毎週、又は2週間に1回投与され得る。
【0190】
本発明に従った医薬組成物は、種々の方法によって対象に投与され得る。前記医薬組成物は、TARGET組織に直接添加でき、陽イオン性脂質と複合体形成でき、リポソーム内に封入でき、又は当技術分野で公知の他の方法によってTARGET細胞に送達できる。所望の組織への局在性投与は、直接注射、経皮的吸収、カテーテル、注入ポンプ、又はステントによって実施され得る。DNA、DNA/ビヒクル複合体、又は組換えウイルス粒子は、治療部位に局所投与される。送達の代替的な経路には、静脈内注射、筋肉内注射、皮下注射、エアロゾル吸入、経口送達(錠剤又は丸剤の形態)、局所送達、全身送達、眼内送達、腹腔内送達、及び/又はくも膜下腔内送達を含むが、これらに限定されない。リボザイムへの送達及び投与の例は、SullivanらのWO94/02595において提供される。
【0191】
本発明に従った抗体は、急速投与として1回送達され得、経時的に注入され得、又は急速投与として投与され得かつ経時的に注入され得る。当業者は、タンパク質に対するよりもむしろポリヌクレオチドに対する異なる製剤を採用し得る。同様に、ポリヌクレオチド又はポリペプチドの送達は、特定の細胞、容態、位置などに特異的であろう。
【0192】
先に論議されるように、組換えウイルスは、本発明において有用なポリヌクレオチド剤をコードするDNAを導入するために用いられ得る。本発明に従った組換えウイルスは一般的に、約104〜約1014pfuの用量の形態で製剤及び投与される。AAV及びアデノウイルスの場合、約106〜約1011pfuの用量が好ましくは用いられる。用語pfu(「プラーク形成単位」)は、ウイルス粒子の懸濁液の感染力に相応しており、適切な細胞培養物を感染させて、形成されるプラーク数を測定することによって決定される。ウイルス溶液のpfu力価を決定するための技術は、従来技術において十分に実証されている。
【0193】
また、本発明は、軟骨形成を増強する方法も提供し、該方法は、該対象への治療有効量の本明細書の発現阻害薬の投与を含む。本発明のさらなる態様は、該対象に、本明細書に説明された軟骨形成増強医薬組成物を投与することを含む、軟骨細胞の同化刺激を包含する疾患を治療又は予防する方法に関する。
【0194】
本発明の手段及び方法を用いて治療できるECMの分解を包含する疾患の例には、乾癬性関節炎、若年性関節炎、初期関節炎、反応性関節炎、変形性関節症、強直性脊椎炎、骨粗鬆症、腱炎及び歯周病などの筋骨格疾患、癌転移、気道疾患(慢性閉塞性肺疾患、喘息)、腎線維症及び肝線維症、粥状硬化及び心不全などの心臓脈管系疾患、並びに神経炎症及び多発性硬化症などの神経学的疾患が挙げられるが、これらに限定されない。
【0195】
本発明の手段及び方法を用いて治療可能な軟骨の分解を包含する疾患の例には、変形性関節症、関節リウマチ、乾癬性関節炎、若年性関節リウマチ、痛風性関節炎、化膿性又は感染性関節炎、反応性関節炎、反射性交感神経性ジストロフィー、有痛性骨萎縮症、ティーツェ症候群又は肋軟骨炎、線維筋痛症、骨軟骨炎、神経原性又は神経障害性関節炎, 関節症、地方性変形性骨軟骨関節症のような風土性形態の関節炎、 ムセルニ病、及びハンディゴデュ病;線維筋痛症、全身性エリテマトーデス、強皮症、及び強直性脊椎炎から結果として生じる変性が挙げられるが、これらに限定されない。さらに、遺伝性軟骨溶解、軟骨異形成症、及び偽軟骨異形成を含む先天性軟骨形成異常を罹患している人々は、軟骨細胞の同化刺激を結果として生じるプログラムから利益を得る可能性があり、またこれらの疾患はそれゆえ、本発明の方法及び手段を用いることによって治療され得る。先天性軟骨形成異常関連疾患の制限のない例は、小耳症、無耳症、及び骨幹端軟骨異形成症である。
【0196】
加えて、また同定された標的はIL‐1シグナル伝達も阻害するので、これらの標的の阻害薬は、炎症性疾患の治療において使用され得る。本発明の手段及び方法を用いて治療できる炎症を包含する疾患の例には、アレルギー性気道疾患(例えば、喘息、鼻炎)、自己免疫疾患、移植片拒絶、クローン病、関節リウマチ、乾癬、若年性特発性関節炎、大腸炎、及び炎症性腸疾患が挙げられるが、これらに限定されない。
【0197】
一態様において、本発明は、炎症、ECM分解、及び/又は軟骨分解を包含する障害を予防及び/又は治療する方法を提供し、該方法は、対象に、本明細書に開示された治療有効量の薬剤を投与することを含む。特定の実施態様において、薬剤は、発現阻害薬及び抗体から選択される。特定の実施態様において、障害は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0198】
また、本発明は、炎症、ECM分解、及び/又は軟骨分解を包含する疾患を治療又は予防するための医薬の製造のための先に説明された薬剤の使用にも関する。特定の実施態様において、薬剤は、発現阻害薬及び抗体から選択される。本発明の特定の実施態様において、疾患は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0199】
また、本発明は、炎症、ECM分解、及び/又は軟骨分解を包含する疾患を治療及び/又は予防する方法も提供し、該方法は、軟骨の分解を包含する疾患を罹患している又は易罹患性の対象に、本明細書に記載された医薬組成物又は化合物、特に本明細書に同定されたTARGETの発現又は活性を阻害する治療有効量の薬剤を投与することを含む。特定の実施態様において、障害は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0200】
また、本発明は、炎症、ECM分解、及び/又は軟骨分解を包含する疾患の治療及び/又は要望における使用のための先に説明された薬剤又は医薬組成物にも関する。特定の実施態様において、障害は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0201】
本発明の薬剤又は医薬組成物の対象患者への投与には、自己投与及び別の人間による投与の両方を含む。患者は、既存の疾患若しくは医学的容態のための治療の必要にあり得、又は軟骨分解を特徴とする疾患及び医学的容態についてのリスクを予防又は低下させるために予防的処置を望み得る。本発明の薬剤は、対象患者へ経口的に、経皮的に、吸入、注射を介して、鼻内に、直腸内に、又は徐放性製剤を介して送達され得る。
【0202】
本発明のなおも別の態様は、炎症、ECM分解、及び/又は軟骨分解を包含する病理学的容態を診断する方法であって、生物学的試料における配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドの量を決定すること、及び前記量を健常対象のポリペプチドの量と比較することを含む前記方法に関し、この中で、健常対象と比較したポリペプチドの量の増大は、病理学的容態の存在を示す。特定の実施態様において、障害は、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0203】
本発明のさらに別の態様は、炎症、ECM分解、及び/又は軟骨分解を包含する病理学的容態を診断する方法であって、生物学的試料における配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドの活性を決定すること、及び前記活性を健常対象におけるポリペプチドの活性と比較することを含む前記方法に関し、この中で、健常対象と比較したポリペプチドの活性の増大は、病理学的容態の存在を示す。明確に、本明細書に開示された標的遺伝子の活性及び/又は発現レベルは、軟骨細胞の同化刺激に及ぼす効果を有し得る。疾患について診断するために、活性がどのレベルまで上昇すべきであるかはまだ決定されていないままである。しかしながら、患者、症状を有さない個体、及び明確に健常な個体において認められたレベルを比較することによって、当業者は、これらの関連するレベルを容易に決定し得る。当業者はいまや、どのポリペプチドがモニターされるべきであるかに気付いているので、本発明は、このような診断についての試験アッセイのための新規のツールを提供する。本発明によって提供される知識を用いることによって制御、チェック、及び診断され得る顕著な疾患は、変形性関節症である。特定の実施態様において、障害は、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0204】
本発明のなおも別の態様は、炎症、ECM分解、及び/又は軟骨分解を包含する病理学的容態を診断する方法であって、対象のゲノムDNA内に配列番号1〜21の配列の遺伝子の少なくとも1つの核酸配列を決定すること;前記配列を、データベース及び/又は健常対象から得られた核酸配列と比較すること;並びに本明細書に開示された病理学的容態の発症又は蔓延と関連した任意の差を同定することを含む前記方法に関する。このような差は、本明細書に開示された類似のマーカー遺伝子を適用するインビトロアッセイにおいてさらにチェックされ得る。このようなアッセイは、軟骨細胞の同化刺激過程における遺伝子又は該遺伝子のコードしたポリペプチドの役割を明らかにするであろう。このような突然変異が同定される場合、この知識はさらに、類似の疾患の診断のための試験キットにおいて活用することができる。特定の実施態様において、障害は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0205】
本明細書の方法において採用されるポリペプチド又はポリヌクレオチドは、溶液中で遊離し得、固相支持体に固定され得、細胞表面に支持され得、又は細胞内に配置され得る。前記方法を実施するために、本発明のポリペプチド又は化合物のいずれかを固定化して、ポリペプチドの複合体形成していない形態から複合体の分離を容易にすること、及びアッセイの自動化を収容することが可能である。本発明のポリペプチドと化合物との相互作用(例えば、結合)は、反応体を含むのに適した任意の容器において達成することができる。このような容器の例には、マイクロタイタープレート、試験管、及び微量遠心管を含む。一実施態様において、ポリペプチドがマトリックスに結合できるドメインを付加する融合タンパク質を提供することができる。例えば、本発明のポリペプチドは、「His」タグ付きであることができ、その後、Ni‐NTAマイクロタイタープレートに吸着させることができ、又は本発明のポリペプチドとのProtA融合体がIgGに吸着させることができ、これが次に細胞溶解物(例えば、(35)S標識済み)及び候補化合物と組み合わさり、混合物を複合体形成に好ましい条件下で(例えば、塩及びpHについての生理学的条件で)インキュベートされる。インキュベーション後、プレートを洗浄して、任意の結合していない標識を除去し、マトリックスを固定化する。放射能の量は、直接的に、又は複合体の解離後に上清中で、決定することができる。あるいは、複合体は、マトリックスから解離され、SDS‐PAGEによって分離されることができ、本発明のタンパク質に対して結合しているタンパク質のレベルを、標準的な電気泳動技術を用いてゲルから定量する。
【0206】
また、マトリックス上にタンパク質を固定化する他の技術は、化合物を同定する方法において用いることができる。例えば、本発明のポリペプチド又は化合物は、ビオチン及びストレプトアビジンの抱合を利用して固定化することができる。本発明のビオチン化タンパク質分子は、当技術分野で周知の技術を用いてビオチン‐NHS(N-ヒドロキシ-スクシンイミド)から調製することができ、ストレプトアビジンでコーティングした96ウェルプレート(Pierce Chemical)のウェルにおいて固定化することができる。あるいは、本発明のポリペプチドと反応するが、化合物に対するポリペプチドの結合に干渉しない抗体は、プレートのウェルへと誘導体化することができ、本発明のポリペプチドは、抗体抱合によってウェルに捕捉することができる。先に説明したように、標識済みの候補化合物の調製物は、本発明のポリペプチドの存在するプレートのウェルにおいてインキュベートされ、ウェルに捕捉された複合体の量は定量化することができる。
【0207】
本発明の別の実施態様は、エクスビボ培養の間又は移入後のいずれかで細胞又は軟骨の自家移植のために用いられる軟骨細胞、軟骨細胞前駆細胞、又は間葉系幹細胞の特性を回復又は安定化することができる化合物の使用のための方法に関する。この回復は、移植片の中または周りの低レベルのECM及び/又は軟骨分解プロテアーゼの結果となり得る。例えば、候補化合物は、所望の分子が吸収又は封入されたメンブレン、スポンジ、又は他の適切な材料の移入を介して局所的に投与され得る。移入デバイスが用いられる場合、デバイスは、任意の好適な組織又は臓器へと移入され得、所望の分子の送達は、拡散、時限放出(timed-release)急速投与、又は持続性投与を介し得る。
【0208】
ECM及び/又は軟骨分解の速度は典型的には、培地において軟骨細胞によって産生される軟骨、又は軟骨構成要素、又は軟骨含有細胞外マトリックスの沈着を決定することによって測定することができる。Walsh G.の文献「タンパク質:バイオテクノロジー及び生化学(Proteins: Biotechnology and Biochemistry)」(John Wiley and Sons, 2001)において説明されるもののような、細胞べースのELISA、酵素アッセイ、又は当技術分野で公知の他の一般的な技術を用いて、軟骨構成要素を測定することができる。
【0209】
本発明は、以下の図及び実施例においてさらに説明される。
【実施例】
【0210】
(実施例1:NHACを用いたMMP13アッセイ)
導入において説明したように、MMP13は、変形性関節症患者の影響を受けた関節における軟骨の分解に至る異化事象に関与する鍵となる担い手のうちの1つとして、変形性関節症の文献において同定されている。それゆえ、疾患関連誘発因子を用いて活性化された初代ヒト軟骨細胞におけるMMP13の発現を調節する因子を同定するために、機能的ゲノミクスの尽力を開始するよう決定した。本アッセイはさらに、「MMP13アッセイ」として本明細書で言及される。本アッセイにおいて同定された因子は、変形性関節症のための新規の治療法の開発のための基礎として用いることができる。
【0211】
SilenceSelect回収物のスクリーニングのために開発されたMMP13アッセイは、以下の特有の特色を有する:
・本アッセイは、初代ヒト関節軟骨細胞を用いて実施するが、最小の適用を用いて、初代軟骨細胞、軟骨細胞前駆細胞、又は軟骨細胞細胞株の任意の他の源について用いられ得る。
・本アッセイは、用いられる初代ヒト軟骨細胞が、可能な限り多くの正常環境(軟骨マトリックス)に類似した環境にあるよう実施される。細胞は、三次元培養において増殖し、培養容器への細胞接着を回避する。
・本アッセイは、機能的ゲノミクス目的のために整列したアデノウイルス回収物を用いた使用のために最適化されている。
・最小の適用を用いて、本アッセイはまた、化合物又は化合物回収物をスクリーニングすることができる。
・本アッセイは、高処理モードで実施することができる。
【0212】
正常ヒト関節軟骨細胞(NHAC)を用いたMMP13アッセイは、下記により詳細に説明されている。まず、開発されたMMP13 ELISAのプロトコールは、第1節に説明されている。次に、初代軟骨細胞の培養及び維持は、第2節に説明されている。NHACを用いたMMP13アッセイのスクリーニングプロトコールは、第3節に説明されている。対照プレートの組成及び性能は、第4節に示されている。SilenceSelect回収物のスクリーニングの性能に関する例は、第5節に示されている。
【0213】
NHACにおけるMMP13アッセイは、NHACにおけるshRNAの発現を仲介する10946の異なる組換えアデノウイルスの整列した回収物に対してスクリーニングされている。これらのshRNAは、RNA干渉(RNAi)として公知の機序によって、相同的配列を含む遺伝子の発現レベルの低下を生じる。整列した回収物において含まれる10946のAd-siRNAは、6308の異なる転写産物を標的とする。平均して、いずれの転写産物も、2〜3の独立したAd-siRNAによって標的とされる。スクリーニングの原理を図1に説明し、下記のより詳細に説明する。
【0214】
(1.1 MMP13 ELISAプロトコール)
培養されたNHACによって産生されるMMP13量を検出するのに十分な感度でELISAを展開するために、種々の抗体及び基質を試験した。MMP13の測定についての384ウェルフォーマットELISAを展開した。種々の一次抗体を試験し、及び種々のELISAプロトコールは、384ウェルプレートにおけるMMP13レベルの測定について以下の検証されたプロトコールをもたらした。黒色マキシソルブ384ウェルプレート(Nunc 460518)を5μg/mL抗MMP13抗体MAB511(R&D System)で被覆する。抗体を炭酸‐重炭酸被覆緩衝液(1.59g Na2CO3(Sigma S‐7795)及び2.93g NaHCO3(Sigma S‐5761))含有1LミリQ、pH9.6に調整)で希釈する。4℃で一晩インキュベーション後、プレートを100μL PBST(80g NaCl、2g KCl(Sigma)、11.5g Na2HPO4・7H2O、及び2g KH2PO4含有10LミリQ;pH7.4+0.05%Tween‐20(Sigma))で3回洗浄し、100μL/ウェルのブロッキング緩衝液(5%無脂肪ドライミルク含有PBS)でブロッキングする。室温で2時間のインキュベーションの後、プレートを100μLのPBSTで3回洗浄する。次に、PBSTを除去し、35μLの試料をELISAプレートに移す。4℃で一晩インキュべ−ションの後、プレートをPBSTで3回洗浄し、35μL/ウェルの1.5mM APMAとともに37℃で1時間インキュベートする。10mM APMAストック溶液(前日に調製)を4℃で保存する(35.18mg APMA(Sigma A‐9563)含有10mL 0.1M NaOH(Merck 1.06469.1000))。10mM APMAストック溶液をAPMA緩衝液(10×APMA緩衝液:500mMトリス(Roche 708976)、50mM CaCl2(Sigma C‐5080)、500μM ZnCl2(Sigma Z‐0173)、1.5M NaCl(Calbiochem 567441)、0.5%Brij35(Sigma 430 AG‐6)、及びpH7.0に調整)において1.5mMに希釈する。APMAによるMMP13の活性化後、プレートを100μL PBST/ウェルで再度3回洗浄する。OmniMMP Fluorescent基質(Biomol P‐126)をOmniMMP緩衝液(10×OmniMMP緩衝液:500mM Hepes(Sigma H4034)、100mM CaCl2(Sigma C5080)、0.5%Brij35(Sigma 430 AG‐6;pH7.0に調整))に溶解し、0.01mMの終濃度にする。この基質35μLを各ウェルに添加する。37℃での一晩のインキュベーション後、試料中の活性のあるMMP13は基質を切断し、蛍光を放出する。読み出しを、320nm励起/405nm発光フィルターを用いるEnVision(Perkin Elmer)において実施する。
【0215】
(1.2 初代軟骨細胞の維持)
正常ヒト関節軟骨細胞(NHAC)継代1を商業源から獲得した(カタログ番号CC‐2250、Cambrex Verviers, BE)。実験ごとについて、ウイルス含有初代NHACを製造元のプロトコールに従って解凍し、細胞を標準的な条件(37℃、5%CO2)下で軟骨細胞増殖培地(CGM、カタログ番号CC3216、Cambrex、Verviers)においてT80細胞培養容器において単層で培養する。この培養がコンフルエンスに到達すると、細胞を製造元のプロトコールに従ってトリプシン処理し(試薬パックカタログ番号CC‐3233、Cambrex、Verviers、BEを使用)、新たなT175培養容器(1×10E+05個の細胞/T175フラスコ)に転移させた。これらの培養物がコンフルエンスに到達すると、細胞をトリプシン処理し、MMP13アッセイに供した。それゆえ、MMP13アッセイに用いた細胞は、解凍後2回の継代について継代したのみであった。
【0216】
(1.3.スクリーニング手順)
最適なスクリーニングプロトコールは、以下のとおりである:96ウェル組織培養プレートを、5%FBS並びに100単位/mLペニシリン(Invitrogen)及び100μg/mLストレプトマイシン(Invitrogen)の混合物を補充したDMEM‐F12培地(この培地はさらに、「アッセイ培地」と呼ばれる。)において調製された50μLの1.5%低融点アガロースで被覆する。NHACをトリプシン処理し、5%FBS並びにペニシリン及びストレプトマイシンの混合物を含むDMEM‐F12において7500個の細胞/20μL/ウェルの密度でポリプロピレン96ウェルプレートに蒔種する(細胞接着を回避するため)。次に、細胞をヒトコクサッキー/アデノウイルス受容体(hCAR)の発現を仲介するアデノウイルスに(およそ250のMOI(感染多重度、アッセイにおける細胞あたりに用いられるウイルス粒子の量を指す。)で)感染させて、SilenceSelect回収物に含まれるAd‐SiRNAウイルスによるその後の感染を容易にする。ヒトコクサッキー/アデノウイルス受容体は、ヒト細胞膜へのアデノウイルスの付着に関与する共受容体である。細胞におけるこの受容体の発現は、例えばT細胞におけるアデノウイルスによるその後の感染を容易にするために説明されている(Schmidtらの文献(2000))。翌日、384ウェルプレート(1mLあたり1×109のウイルス粒子の概算力価)に保存されたSilenceSelect(登録商標)回収物(WO03/020931)の各ウェルからの12μLのAd‐SiRNAウイルスを96/384チャネルディスペンサーの助力で、NHACを含む96ウェルプレートの個々のウェルに転移させた。アデノウイルスライブラリーの平均力価が1×109のウイルス粒子/mLであるので、このことは、約1600の平均MOIを表す。Ad‐siRNAのウェルへの添加後、37℃で1時間のインキュベーション工程を実施する。感染を、各ウェルがSilenceSelect(登録商標)回収物由来のAd‐siRNAの1つの個々の種類で感染すると、整列した様式で実施する。次に、8%FBS並びにペニシリン及びストレプトマイシンの混合物を補充したDMEMF12培地において調製した40μLの0.8%低融点アガロースをウェルに添加する。ウェルの内容物を多重チャネルロボットを用いたピペッティングによって上下にすることによって混合し、50μLの混合物をアガロースで被覆した96ウェルプレートに転移させる。アガロースの凝固の速度を上げるために、プレートを4℃でおよそ15分間保存する。150μLのアッセイ培地をウェルに添加する。次に、感染したNHACを4日間インキュベートし、細胞におけるshRNA発現を十分なレベルに到達させておき、細胞における遺伝子サイレンシングの機構を完全に刺激しかつ有効にしておく。感染4日後、細胞における培地をアッセイ培地で改める。翌日、細胞を、10ng/mL組換えヒトIL1bを含むアッセイ培地の添加によって刺激する。誘発因子の添加2日後、上清を回収し、MMP13 ELISAに供するまで−80℃で保存する。35μLの上清をMMP13 ELISAに供し、MMP13 ELISAを384ウェルプレートフォーマットにおいて実施する。高処理量適合性ELISAに適用されるプロトコールは実施例1.1に説明されている。感染、培地交換、及び培地回収の工程をTECAN Freedomピペッター(TeMO96、TeMO384、及びRoMaを装備したTecan Freedom 200、Tecan AG、Switzerland)を用いて実施した。
【0217】
(1.4.対照プレートの性能)
96ウェル対照プレートを、本アッセイの質を評価するために作製する。対照プレートは、SilenceSelect(登録商標)回収物と同じ方法で作製する。この対照プレートの複数の一定分量を生じ、−80℃で保存する。スクリーニングの施行ごとについて、スクリーニングプレートの新たな一定分量を解凍し、スクリーニング試行すべての性能を比較させる。このプレートの組成は以下のとおりである。ウェルを、SilenceSelect(登録商標)アデノウイルス回収物(WO03/020931)と同じ条件下で産生された対照ウイルスで満たす。この対照プレートは、4セットの陽性対照ウイルス(陽性対照ウイルスあたり8ウェル;P1(Ad5‐R1T1_v5_KD)、P2(Ad5‐SLC26A8_v2_KD)、P3(Ad5‐TRAF6_v4_KD)、P4(Ad5‐NFKBIA_KI)、列に配置、3セットの陰性対照ウイルス(陰性対照ウイルスにつき16ウェル;N1(Ad5‐空_KD)、N2(Ad5‐M6PR_v1_KD)、N3(Ad5‐LacZ_KI))で間を配置)を含む。陰性対照ウイルスをIL1の存在下(8ウェル)又はIL1の不在下(8ウェル)のいずれかで試験する。陽性対照試料を、文献情報(P3(Ad5‐TRAF6_v4_KD)、P4(Ad5‐NFKBIA_KI))に基づいて、又は限定されたAd‐siRNAウイルスの予備スクリーニング(P1(Ad5‐RIT1_v5_KD)、P2(Ad5‐SLC26A8_v2_KD))に基づいてのいずれかで選択する。TRAF6は、IL1βの下流のシグナル伝達に必要であることが公知であり(Caoらの文献(1996))、NFKBIAの過剰発現は、MMP13の発現に必要であることが公知の転写因子であるNFカッパBを阻害することが公知である(Karinの文献(1999))。
【0218】
対照プレートを、異なるスクリーニング実施の間のSilenceSelect(登録商標)回収物からの一定分量プレートと同じ条件下で並行して実施する。先に説明したスクリーニングプロトコールを用いて試験した対照プレートの性能に関する代表的な例を図3に示す。示されるデータは、対照プレートに含まれるウイルスに感染したNHACによって産生されるMMP13のレベルを表す。2つの対照プレートの試験から得られたデータの平均を示す。データは、細胞のIL1処理によるMMP13発現の明確な上方制御を示す。細胞のIL1処理の際に得られる最大MMP13レベルは、3つのネガティブコントロールに匹敵する。4つのポジティブコントロールはすべて、NHACのIL1応答を低下させ、最大の効果は、P3(Ad5‐TRAF6_v4_KD)及びP4(Ad5‐NFKBIA_KI)ポジティブコントロールについて観察された。これらのデータは、スクリーニングの良好な質を確認する。
【0219】
(実施例2:SilenceSelect回収物のスクリーニング)
合計10946のウイルスのSilenceSelect回収物を、実施例1.3において説明されたプロトコールに従って3次元フォーマットにおけるアガロースにおいて培養した初代NHACに関して実施したMMP13アッセイにおいてスクリーニングする。これらの10946ウイルスは、6308の転写産物を網羅し、SilenceSelect(登録商標)回収物において構築される重複性を反映する。これらの重複性は、SilenceSelect(登録商標)回収物内に含まれる複数の独立したAd‐siRNAによって標的とされるほとんどの転写産物を結果として生じる。スクリーニングバッチの1つの間に得られるデータを図4に示す。スクリーニングバッチの間、SilenceSelect(登録商標)回収物の4384ウェルプレートにおいて含まれる1536のAd‐siRNAを、MMP13アッセイにおける二つ組においてスクリーニングする。実施例1において与えられるNHACに関するMMP13アッセイの説明において記述されているように、NHAC細胞培養、Ad5‐siRNAによる感染、及びIL1による活性化を96ウェルフォーマットにおいて実施する。このように、SilenceSelect(登録商標)回収物に含まれる384ウェルプレートのあらゆる四半分を用いて、NHACを含む2つの96ウェルプレートを並行して感染させる。次に、得られた上清を384ウェルプレートに転移させて、実施例1.1に説明されたMMP13 ELISAにおけるMMP13レベルを決定する。転移は、二つ組試料が、同じMMP13 ELISAプレートに関して測定されるよう計画される。データ分析を以下の通り実施する:
【0220】
まず、あらゆる384ウェルプレートについて個々に、すべての試料についてのデータを標準化し、「標準化された値」へと以下の通り変換する。384のデータポイントすべてを列挙し、5%の最高の及び5%の最低のMMP13シグナルをリストから除去する。次に、平均及び標準偏差を個の削減したリストのすべての試料にわたって算出し、これらの平均及び標準偏差に基づいて、標準化されたデータを式:標準化された値の試料A=[(生のMMP13シグナルの試料A−平均)/(標準偏差)]を適用することによって算出する。384ウェルプレートについてのこのデータの変換によって、異なるスクリーニングバッチの試料の比較が可能となる。
【0221】
次に、閾値を以下の通り的中物喚起(hit calling)させるよう決定する。スクリーニングバッチごとについて、2つの96ウェル対照プレートをSilenceSelect(登録商標)回収物からの試料と並行して試験し、あらゆる対照プレートは、3つのネガティブコントロールウイルスを含む(ネガティブオントロールウイルスあたり8ウェル)。対照プレートに含まれる3つのネガティブコントロール(3×16ウェル=合計48ウェル)についてのMMP13シグナルの平均及び標準偏差を算出する。このデータに基づいて、種々の閾値を以下の式を適用することによって標準偏差と関連して表す:閾値=[(ネガティブコントロールにわたる平均)−(「カットオフ」回数×ネガティブコントロールにわたる標準偏差)]。次に、種々の閾値を48のネガティブコントロールに対して試験する。カットオフは、ネガティブコントロールの19%未満がこの閾値よりも低い閾値を規定するよう選択される。Ad‐siRNAウイルスは、これらのAd‐siRNAについての両方のデータポイント(標準化された値として表される。)が、最初のスクリーンにおける選択されたカットオフ値を下回ってスコア化した場合、初回的中物として任命した。
【0222】
図4において、NHACに関するMMP!3アッセイに対するSilenceSelect(登録商標)回収物のスクリーニングの間にスクリーニングバッチのうちの1つにおいて得られるデータを示す。このスクリーニングバッチにおいて、1536のAd‐siRNAを二つ組で試験した。グラフにおいて、Ad‐siRNAについて得られた2つのデータポイント(標準化されたMMP13レベルの点で表される。)を互いに対してプロットする。このスクリーニングバッチについて決定されたカットオフ(−1.8)を点線で示す。カットオフを下回る2つのデータポイントを生じ、かつ最初の的中物(36Ad‐siRNA)として任命したAd‐siRNAについてのデータを黒点として示し、選択されたカットオフを下回る唯一のデータポイントを生じたAd‐siRNAについてデータを灰色の点として示し、非的中物Ad‐siRNAについてのデータを白色の点として示す。二つ組のデータポイント(データポイントは、直線の周りに集中している。)間で観察される対称性は、スクリーニングの良好な質及び再現性を示す。
【0223】
図6に示されるスキームは、より詳細に分析された的中物のスクリーニング及び選択の間に得られる摩擦を示す。スクリーニングされた10946のAd‐siRNAのうち、263を二つ組でのスコア化として同定された。加えて、最初のスクリーンうちの最大値を抽出するために、2つのデータポイントのうちの1つにおいてのみのウイルスのスコア化のリストをさらに分析して、同一の転写産物を標的とする独立したウイルスを同定した。異なる標的配列を通じて同じ遺伝子を標的にする2つの独立したAd‐siRNAが、たとえより弱くてもMMP13アッセイにおいて活性があるという事実は、価値のある情報と考えられる。本分析は、106の的中物を最初の的中物リストに付加し、最初の的中物の最終数を369とした。これらの369の最初の的中物を実施例3において説明される再スクリーン手順においてさらに分析した。
【0224】
(実施例3:3MOI再スクリーン)
(3.1 再スクリーニングプロトコール)
最初の的中物を確認した的中物にするために、元の的中物Ad‐siRNAを独立して2倍に再増殖させて、独立したAd‐siRNA材料を生じる。次に、これらの再増殖したウイルスを3MOIでNHACに関するMMP13 ELISAにおいて試験する。再増殖材料が、SilenceSelect(登録商標)回収物に含まれる元の最初の的中物と比較して異なる力価を有するウイルス材料を生じ得るので、元の最初の新たなウイルス材料を3MOIでスクリーニングする。2つの再増殖物を3MOIで試験すると、6つのデータポイントを、「3MOI再スクリーン」に供したあらゆるAd‐siRNAについて生じる。両再増殖材料について少なくとも1MOIをスコア化する的中物のみが、確認された的中物と考えられる。
【0225】
再増殖工程について、最初の的中物をSilenceSelect回収物から拾い、ポジティブコントロール及びネガティブコントロールとともに96ウェルプレートにおいて再増殖させる。3MOI再スクリーンの実施についての考えられるレイアウトを図5Aに示す。各再増殖プレートは、20の対照ウェルによって取り囲まれる的中物ウイルスを含む40ウェルを有する。これらの対照ウェルは、ネガティブコントロール(N1(Ad5‐空_KD);N2(Ad5‐LacZ_KI);N3(Ad5‐M6PR_v1_KD);N4(Ad5‐空_KD))又はポジティブコントロール(P1(Ad5‐TRAF6_v4_KD);P2(Ad5‐RIT1_v5_KD);P6(Ad5‐空_KD);P7(Ad5‐空_KD))のいずれかを含む。増殖のために、SilenceSelect(登録商標)回収物からの的中物Ad‐siRNA試料の粗可溶化液を拾い、96ウェルプレートにおいて対照とともに配置する。粗可溶化液の容器は、バーコード(Screenmates(商標)、Matrix technologies)で標識されているので、品質チェックをプレートについて実施する。ウイルスを増殖させるために、2.25×104PER.C6/E2A細胞を、96ウェルプレートの各ウェルにおいて10%の非熱失活FCSを含む200μLのDMEMに蒔種し、10%CO2で加湿されたインキュベーターにおいて39℃で一晩インキュベートする。次に、先に示した96ウェルプレートに配置された各的中物Ad‐siRNA由来の1μLの粗可溶化液を添加して、96ウェルディスペンサーを用いてPER.C6/E2A細胞のウェルを分離する。10%CO2で加湿されたインキュベーターにおけるインキュベーションの7〜10日後、再増殖プレートを−20℃で凍結し、但し、完全なCPE(ウイルス産生が完全であることを示す細胞変性効果)が観察され得ることを条件とする。
【0226】
次の工程において、再増殖プレートに含まれるAd‐siRNAを、NHACに関するMMP13アッセイにおいて試験する。本試験のために、最初のスクリーニングについて実施例2に説明されたものと同じプロトコールを用い、増殖したウイルスの3容積:すなわち8μL、12μL、及び16μLを用いて、MMP13アッセイに供した軟骨細胞を感染させることが唯一の違いであった。次に、2つの感染していないものを除くすべての対照ウェルをIL1で活性化させる。加えて、P6及びP7対照をスタウロスポリン(5μM終濃度)及びブレフェルジンA(0.5μL/mL終濃度)で処理する。これらの化合物をIL1誘発因子の添加の前日に、及びIL1誘発因子の添加とともに翌日に添加する。P6及びP7対照ウェルへのスタウロスポリン及びブレフェルジンAの添加の目的は、NHACによる分泌が完全に遮断される場合(ブレフェルジンA)又は細胞が細胞毒性化合物で処理される場合(スタウロスポリン)、背景MMP13発現レベルを規定することである。3MOI再スクリーンのデータを以下の通り分析する。
【0227】
まず、あらゆるプレートについて、試料データを以下の式を用いて標準化する:
標準化されたMMP13値の試料A=[((生のMMP13シグナルの試料A)−(ネガティブコントロールにわたるMMP13シグナルの中央値))/(ネガティブコントロールのMMP13シグナルにわたる標準偏差)]。
【0228】
同じ基礎を適用して、ポジティブコントロールについての標準化された値を生じる:
標準化されたMMP13値のポジティブコントロール=[((ポジティブコントロールにわたるMMP13シグナル中央値))−(ネガティブコントロールにわたるMMP13シグナル中央値)/(ネガティブコントロールのMMP13シグナルにわたる標準偏差)]。
【0229】
「3MOI再スクリーン」について、ポジティブコントロールは、IL1により誘導されるMMP13発現レベルの最大阻害を反映することが期待されるスタウロスポリン及びブレフェルジンA(P6及びP7)で処理したウェルである。試料及びポジティブコントロールについて標準化されたMMP13値に基づいて、パーセンテージ阻害を、以下の式を適用することによってあらゆる資料について算出する:パーセント阻害試料A=[(標準化されたMMP13値の試料A)/(標準化されたMMP13値のポジティブコントロール)×100]。
【0230】
3MOI再スクリーンの結果の例を図5Bに示す。示される実験は、二つ組で8μLのNHAC MMP13アッセイにおける1つの96ウェル再増殖プレート(40の最初の的中物AdsiRNA及び適切な対照を含む。)のスクリーニングの間に得られるデータを表す。データは、IL1により誘導されるMMP13の発現のパーセント阻害として表される。的中物喚起について選択されるカットオフは、40パーセントである(点線として表される。)。P6及びP7ポジティブコントロールについての平均パーセント阻害(100%)は、黒色三角形として表され、P1及びP2ポジティブコントロールについての平均パーセント阻害(48%)は、十字として表され、N1、N2、N3、及びN4ネガティブコントロールについての平均パーセント阻害(−8.6%%)は、灰色三角形として表される。的中物喚起基準を厳守するAd‐siRNAについてのデータ(2つのデータポイントは、40%カットオフを上回る。)は、白色又は灰色の円として示され、的中物喚起基準を厳守していないAd‐siRNAについてのデータは、四角形として示される。この再増殖プレートについて及びこのMOIにおいて、40の最初の的中物Ad‐siRNAのうちの11を確認した。
【0231】
13の好ましい標的すべてについて得られた3MOI再スクリーンデータを表3に示す。この表は、「3MOI再スクリーン」において活性があるものとして同定されたTARGETを示す。
【表3】

【0232】
再スクリーン実験の結果に関する典型的な例を図6に示す。本再スクリーン手順において、試験した369のノックダウンウイルス的中物のうちの225を確認した。これらのうち、13を、薬剤能(drugability)、小分子回収物に対する標的のスクリーニングを可能にする消耗品の有効性、ヒトオルソログ及び齧歯類オルソログ間の標的配列の保存のレベルとして、候補標的の種々の特性が分析される「インシリコ(in silico)」分析に基づいたさらなる検証のために選択した。
【0233】
(3.2 標的Ad‐siRNAの品質管理)
的中物Ad‐siRNAの品質及び同一性をPCRによってチェックし、さらに説明されるとおり配列決定する。標的Ad‐siRNAを96ウェルプレートにおいてPER.C6(登録商標)細胞の誘導体(Crucell, ライデン、オランダ)を用いて増殖させた後、標的Ad‐siRNAウイルスによってコードされるsiRNAを配列決定する。PER.C6/E2A細胞を180μLのPER.C6/E2A培地において40,000個の細胞/ウェルの密度で96ウェルプレートに蒔種する。次に、細胞を10%CO2加湿インキュベーターにおいて39℃で一晩インキュベートする。翌日、細胞に、標的Ad‐siRNAを含むSilenceSelect(登録商標)ストック由来の1μLの粗細胞可溶化液を感染させる。(典型的には感染7日後、細胞の膨潤及び丸みを帯びることによって明らかとなる)細胞病理効果の出現まで、細胞を34℃、10%CO2でさらにインキュベートする。上清を回収し、1mg/mLのプロテイナーゼK(Roche Molecular Biochemicals、カタログ番号745 723)及び0.45%Tween‐20(Roche Molecular Biochemicals、カタログ番号1335465)を補充したMgCl2を有する4μLの溶解緩衝液(1×Expand High Fidelity緩衝液)を滅菌済みPCRチューブに12μLの粗可溶化液に添加することによって、ウイルス粗可溶化液をプロテイナーゼKで処理する。これらのチューブを55℃で2時間インキュベートした後、95℃での15分間の失活工程に続く。PCR反応のために、1μLの溶解物を、MgCl2を有する5μLの10×Expand High Fidelity緩衝液、0.5μLのdNTP混合物(各dNTPにつき10mM)、1μLの「順方向プライマー」(10mMストック、
【化1】

、1μLの「逆方向プライマー」(10mMストック、
【化2】

、0.2μLのExpand High Fidelity DNAポリメラーゼ(3.5U/μL、Roche Molecular Biochemicals)、及び41.3μLのH2Oから構成されるPCRマスター混合物に添加する。
【0234】
PCRをPE Biosystems GeneAmp PCRシステム9700において以下の通り実施する:PCR混合物(合計50μL)を95℃で5分間インキュベートし;各周期を95℃で15秒間、55℃で30秒間、68℃で4分間実施し、35周期反復する。68℃における最終インキュベーションを7分間実施する。5μLのPCR混合物を2μLの6×ゲル負荷緩衝液と混合し、0.5μg/μLの臭化エチジウムを含む0.8%のアガロースゲルに負荷して、増幅産物を分離する。増幅した断片の大きさは、同じゲルに負荷された標準的なDNAラダーから概算される。期待される大きさはおよそ500bpである。配列決定分析のために、標的アデノウイルスによって発現したsiRNAコンストラクトを、pIPspAdapt6-U6プラスミドのSapI部位を隣接するベクター配列と相補的なプライマーを用いるPCRによって増幅する。PCR断片の配列を決定し、期待された配列と比較する。すべての配列は、期待された配列と同一であることが認められる。
【0235】
(実施例4:オンターゲット(On target)検証)
siRNA技術の強み及び利点は、本技術が科学界を通じて広がった速度によって十分に認識され及び立証される。なおも、本技術の使用は、1)siRNAが、部分的な配列のみの相補性と関連していない遺伝子を非特異的に標的にし得(オフターゲット効果)、かつ2)siRNAの有効性が予測困難である(Peiらの文献(2006))ので、必要とされる技術及び知識を要する。このように、独立した設定においてノックダウンウイルススクリーンにおいて同定された最初の的中物の活性を確認することが重要なままである。この目的のために2つのアプローチが取られた。第一に、異なる標的配列を通じてある遺伝子の発現を低下させるよう設計された1セットの追加的なノックダウンウイルスを作製した。第二に、合成siRNAを購入し(Dharmacon)、軟骨細胞株SW1353における標的検証について用いた。
【0236】
(4.1.追加的なノックダウンウイルスを用いるオンターゲット分析)
異なる標的配列を通じて選択された好ましい的中物の発現を低下させるよう設計された1セットのノックダウンウイルスを作製した。これらのノックダウンウイルスをその後、ポジティブコントロールウイルス及びネガティブコントロールウイルスとともに、96ウェルプレートに整列させた。3MOI再スクリーン(実施例3)について説明した再増殖プレートについて説明したのと同じ対照を用いた。特定の的中物を標的にするすべての追加的な異なるノックダウンウイルスを、最初のスクリーンの間にこの標的について同定された元の的中物ノックダウンウイルスとともにプレートにおいて再グループ化した。これらのプレートを2回再増殖させた。次に、あらゆる再増殖したプレートの2つのコピーを二つ組で2回の独立した試行において、最初のスクリーンについて先に説明したNHAC MMP13アッセイにおいて、12μLのMOIを用いて試験した。このように、8個のデータポイントをあらゆるノックダウンウイルスについて生じた。データを3MOI再スクリーン(実施例3)について先に説明したとおり分析し、データを%阻害に変換した。生じた8個のデータポイントのうちの4つについて35%のMMP13レベルの低下を生じているノックダウンウイルスを、本アッセイにおいて検証されたと考えた。このように、NHACにおけるIL1により誘導されるMMP13発現レベルを低下させる能力を有する1つの追加的なノックダウンウイルスを、以下の標的について同定し:ADAM15、GRP34、EPHA5、MAP2K2、MET、GPR43、2つの追加的なノックダウンウイルスをADAMTS6について、3つをSTK32Bについて、4つをMC3Rについて同定した。
【0237】
(4.2.合成siRNAを用いたオンターゲット分析)
本実験の目的は、合成siRNA二本鎖を用いてIL1により刺激されたMMP13放出に及ぼすアデノウイルスshRNA仲介性ノックダウン効果をさらに検証することであった。検証は、IL1刺激に対する応答におけるMMP13発現を上方制御することがすでに示されている軟骨肉腫SW1353細胞株において実施した。
【0238】
(4.2.1 材料)
ヒト軟骨肉腫SW1353細胞(カタログ番号HTB‐94、ATCC)を37℃の加湿した5%CO2インキュベーターにおいて、10%熱失活FBS(Hyclone)及び1×ペニシリン/ストレプトマイシンDMEM(カタログ番号15140‐122、Gibco)を補充したDMEM(カタログ番号41966‐029、Gibco)において増殖させ、トリプシン処理の1週間後に2回経代する(1:5の分岐比)。
【0239】
関心対象の遺伝子についての既製の遺伝子サイレンシングsiRNA二本鎖はDharmaconから得られ得る。siGENOME SMARTプール(または4のON‐TARGETプラスセット)の凍結乾燥したストック試薬を1×siRNA緩衝液(カタログ番号B‐002000‐UB‐015、Dharmacon)で再構成して、20μM濃度を達成し、一定分量を−20℃で保存する。
【0240】
(4.2.2 手順)
最適化された条件下で、siRNA二本鎖をSW1353細胞に送達する。SW1353細胞を、96ウェルプレート(Nunc)において、10000個の細胞/100μLの細胞培地でトランスフェクションの24時間前に蒔種する。細胞に、本質的に製造元の説明書に従って、1μL/ウェルの終濃度でINTERFERin(商標)(カタログ番号409‐10、Polyplus‐トランスフェクション)を用いてsiRNA試薬(30nM又は10nM終濃度)を形質移入する。簡潔には、siRNAストック試薬を50μLの無血清OptiMEM(カタログ番号51985‐026、Gibco)に希釈し、1μLのINTERFERin(商標)試薬を添加した後、10秒間即時均質化し、室温で10〜45分間インキュベーションして、INTERFERin(商標)/siRNA複合体を形成しておいた。複合体形成の間、SW1353細胞の上部の培地を、抗生物質を含まない100μLのあらかじめ加温しておいた細胞培地と交換する。次に、50μLの形成されたINTERFERin(商標)/siRNA混合物を細胞に添加し、プレートを37℃及び5%CO2のインキュベーターに戻す。
【0241】
72時間後、細胞の上部の培地を除去し、10ng/mL組換えヒトIL1β(カタログ番号200‐01B、PeproTech)及び25ng/mL組換えヒトOSM(カタログ番号295‐0M、R&D Systems)を含む100μLのあらかじめ加温しておいた培地と交換する。培地は、5%熱失活FBS及び1×ペニシリン/ストレプトマイシンを含むDMEM/F12(カタログ番号11320‐074、Gibco)である。
【0242】
サイトカインの添加24時間後、上清を回収し、MMP13 ELISA(実施例1参照)、MMP1 ELISA(WO2006/040357において説明されるとおり)、及びTIMP2 ELISA(WO2006/040357において説明されるとおり)における適切な希釈物に関するその後の分析のために−80℃で保存する。TIMP2レベルは、誘発因子の添加によって影響されないので、上清に分泌されるTIMP2の量の変化を用いて、細胞生存率/分泌に及ぼすsiRNA遺伝子特異的二本鎖トランスフェクションの効果を評価する。
【0243】
MMP13及びMMP1のIL1/OSM仲介性上方制御に及ぼす関心対象の遺伝子についてのsiRNA二本鎖送達の効果を2つの独立した実験において評価し得る。各実験において、siRNA二本鎖のトランスフェクションを2つのsiRNA濃度(10nM及び30nM)において二つ組で実施する。ヒトMMP1を標的とするSMARTpool試薬(siGENOME SMARTpool siRNA MMP1)、並びにヒトTRAF6遺伝子(4のうちのsiGENOME SMARTpool siRNAセット)及びMMP13遺伝子(4のうちのsiGENOME SMARTpoolセット)を標的とする4つの選択された個々のsiRNA二本鎖のうちの1つをポジティブコントロールとして用いる。siCONTROL非標的化siRNAプール又は30nM及び/若しくは10nMのGL2.2二本鎖標的ルシフェラーゼを形質移入した細胞をネガティブコントロールとして用いる。MMP1分析について、ネガティブコントロールには2つの濃度の両siRNA試薬を含む。MMP13分析について、ネガティブコントロールには30nM及び10nMの非標的化siRNA試薬、並びに10nMのGL2.2二本鎖を含む。刺激されていないままのGL2.2対照を形質移入した追加的なウェルを、刺激されていない対照として含む。ポジティブコントロール、ネガティブコントロール、及び刺激されていない対照は、各96ウェルプレートに含まれる。4つの異なる96ウェルプレートの回収された上清を、1つの384ウェルELISAにおいて分析し、結果を以下のとおり分析し得る:
【0244】
第一に、各ウェルについてのMMP13及びMMP1数値データを、以下のとおりシグナルのパーセント阻害(%PIN)として再算出する:
%PIN=100−((シグナル試料−Avシグナル刺激されていない対照)/(Avシグナルネガティブコントロール−Avシグナル刺激されていない対照)×100)
式中、
Avシグナル刺激されていない対照は、同じ384ELISAに関して分析された4つの96ウェルプレートすべての刺激されていない対照の平均である。
Avシグナルネガティブコントロールは、同じ384ELISAに関して分析された4つの96ウェルプレートすべての説明されたネガティブコントロールの平均である。
【0245】
TIMP2の結果は、以下の式に従ってシグナルのパーセント阻害(%PIN)として表される:
%PIN=100−((シグナル試料−Avシグナル背景)/(Avシグナルネガティブコントロール−Avシグナル背景)×100)
式中、
Avシグナル背景は、TIMP2 ELISAの背景シグナル、すなわちTIMP2の不在下で得られたシグナルである。
Avシグナルネガティブコントロールは、同じ384ELISAに関して分析された4つの96ウェルプレートのすべてのネガティブコントロールの平均である。
【0246】
次に、個々のウェルは、%PINが35%よりも(MMP1の場合)又は50%よりも(MMP1の場合)高い場合、正のスコアを有すると言われ得る。これらのカットオフ設定において、ネガティブコントロールは、正のスコアを有するとは認められない。10nM又は30nMでのトランスフェクションについての結果は、両方の複製物があらかじめ設定されたカットオフを上回ってスコア化している場合にのみ、1のスコア化値を与えられる。MMP1又はMMP13の発現の低下が、細胞生存率の損失に起因していないことを確認するために、TIMP2の結果を考慮に入れる。TIMP2シグナルが両方の複製物について35%超低下すると認められる場合、MMP1又はMMP13の結果は考慮に入れない。各スクリーンについて、最終的な値は、TIMP2分析を考慮に入れた後のsiRNA二本鎖の両試験濃度におけるスコア化値の合計であった標的に割り当てられる。次に、与えられた遺伝子についてのsiRNA二本鎖の効果は、両スクリーンの最終的な値の合計が2以上である場合、「真の」効果であると考えられる。標的は、MMP1又はMMP13のいずれかにおいて真の的中物としてスコア化した場合、合成siRNAと検証されると考えられる。このように、以下の標的を、合成siRNA技術を用いて検証したと考えられた:ADAMTS6、MC3R、MET、CSNK1G2、EDG4、MAP4K1、KCNN4。
【0247】
ひとまとめに考えると、オンターゲット分析を通じて選択された13の的中物についてのオンターゲット検証運動の結果を表3に示す。最初のスクリーンにおいて同定された元のノックダウンウイルス的中物の効果を反復できる追加的なノックダウンウイルスの同定を通じて9の標的が検証され、合成siRNA技術を用いて7(そのうち3は追加的なノックダウンウイルスを用いて検証された。)が検証された。初代ヒト軟骨細胞におけるこれらの検証された標的の発現をさらに評価した(実施例5)。
【0248】
(実施例5:好ましい標的のヒト軟骨細胞における発現分析)
好ましい標的として検証されるために、遺伝子は、軟骨細胞において発現すべきである。このことは、定量的リアルタイムPCRを用いて評価され得る。関節軟骨(NHAC)(Cambrex、Verviers、Belgium)由来の正常ヒト軟骨細胞を、5%ウシ胎仔血清(HighClone、Perbio、Erembodegem、Belgium)を補充したDMEM/F12培地において3百個の細胞/皿で9cm培養皿へと蒔種する。2日後、培地を、10ng/mLのIL‐1βを有する若しくは有さない5%ウシ胎仔血清を補充したDMEM/F12培地によって、又は10ng/mLのIL‐1βを有するか若しくは有さない軟骨細胞分化培地(CDM、Cell Applications、San Diego、CA)と交換する。各条件を二つ組で実施する。48時間のインキュベーション後、培地を除去し、細胞を、製造元の説明書に従ってRNeasy midiキット(Qiagen、Venlo Netherlands)を用いたRNA単離のために加工し、精製されたRNAを一定分量で−20℃で保存する。
【0249】
RNAを製造元の説明書に従ってTaqMan(登録商標)Gold RTキット(Applied Biosystems、Lennik、Belgium)を用いてcDNAへと逆転写する(1×TaqMan(登録商標)RT緩衝液、5mM MgCl2、0.5mM dNTP、2.5μMランダムヘキサマー、10U RNase阻害薬、及び25U マルチスクライブ(multiscribe)逆転写酵素)。
【0250】
cDNAを6倍希釈し、5μLを、SYBR(登録商標)Green Universal Mastermix又はTaqMan(登録商標)Universal Mastermix(両方ともApplied Biosystems製)のいずれかを用いて、ABI7000機器におけるリアルタイムQPCRのためにPCR反応につき25μLの反応物において用いる。
【0251】
SYBR(登録商標)Green QPCR分析におけるプライマーの開発のために、DNA配列をRefSeq配列保管所から抽出し、又は利用可能ではない場合、GenBank回収物から抽出する。これらの配列から、SYBR(登録商標)Green QPCRに好適なプライマー対を、PrimerExpressソフトウェア(Applied Biosystems)を用いて設計する。これらのプライマー対を、Blastソフトウェア(NCBI、Entrez)を用いて該プライマー対の標的遺伝子に対する該プライマー対の特異性についてチェックする。好適なプライマー対を発注し(Invitrogen)、0.3μM濃度で用いる。本プライマー対を表4に示す。
【0252】
プライマー対の質を、融点分析によってモニターし、それにより2つ以上の融点を生じる対を廃棄し、参照cDNA(Clontech Laboratories、Mountain View、CA)との比較によってモニターし、それにより融点における差は1℃を超えて異なるべきではない。
【0253】
SYBR(登録商標)Greenプライマー対が必要条件を満たさない遺伝子については、TaqMan(登録商標)アッセイを用いる(注文対応のアッセイ、Applied Biosystems)。
【0254】
遺伝子は、全条件にわたる平均Ct値が37以下であった場合に発現するものとして考えられる。
【0255】
定量的リアルタイムPCRによって得られたようなヒト関節軟骨細胞における好ましい標的の発現。各Ct値は、実施例5において概略されるように、4つの異なる条件において増殖した細胞の8の独立したRNA調製物の平均である。結果を表5に示す。
【表4】

【0256】
25を下回るCt値は高い発現と考えられ、25〜30は良好な発現と考えられ、30〜35は中程度の発現と考えられ、35超は低い発現と考えられる。それゆえ、初代軟骨細胞における良好な発現レベルを、ほとんどの標的について示すことができたが、例外は、低い発現レベルを示したGPR34(Ct=36)であった。しかしながら、低い発現レベルは、GPCRについて観察でき、この低い発現は、必ずしも常に低い受容体活性を予測するわけではない。
【0257】
(実施例6 EPHA5に関するさらなる検証)
典型的な先のTARGET EPHA5を、EPHA5を阻害し、かつNHACにおけるMMP13活性も阻害する、EPHA5に対して配向する化合物によって検証及び確認した。EPHA5に対する活性は、下記の実施例6.1及び6.2において説明されるアッセイを用いて試験され得、NHACにおけるMMP13活性を阻害する能力は、実施例7において説明されるとおり試験され得る。
【0258】
(6.1 EPHA5阻害‐生化学的アッセイ)
組換えEpha5(Milliporeカタログ番号14‐639)を、0.1mg/mLのポリ(Glu, Tyr)ナトリウム塩(4:1)、分子量20000〜50000(Sigmaカタログ番号P0275)含有キナーゼ反応緩衝液(10mM MOPS pH7.0 、1mM DTT、0.01%Triton‐X100、2.5mM MnCl2、0.5mM Na3VO4、5mMβ‐グリセロールホスファート、0.5μM非放射性ATP、0.25μCi 33P‐ガンマ‐ATP)(Perkin Elmer, カタログ番号NEG602K)とともに、5μLの試験化合物又はビヒクル(DMSO、1%終濃度)を含むか又は含まない終濃度で、総容積25μLで、ポリプロピレン96ウェルプレート(Greiner、V底)においてインキュベートする。30℃で45分後、反応を、25μL/ウェルの150mMリン酸を添加することによって停止する。終止したキナーゼ反応物をすべて、あらかじめ洗浄しておいた(75mMリン酸)96ウェルフィルタープレート(Perkin Elmerカタログ番号6005177)へと細胞回収機(Perkin Elmer)を用いて転移させる。プレートをウェルあたり300μLの75mMリン酸溶液で6回洗浄し、プレートの底部を密封する。40μL/ウェルのMicroscint‐20を添加し、プレートの上部を密封し、読み出しを、Topcount(Perkin Elmer)を用いて実施する。キナーゼ活性は、ポジティブコントロール阻害薬(10μMスタウロスポリン)の存在下で得られた1分間あたりの計数(cpm)を、ビヒクルの存在下で得られたcpmから減算することによって算出する。この活性を阻害する試験化合物の能力を以下のとおり決定する:
【0259】
パーセント阻害=((試験化合物の存在した試料について決定したcpm−ポジティブコントロール阻害薬の存在した試料について決定したcpm)/(ビヒクルの存在下で決定したcpm−ポジティブコントロール阻害薬の存在した試料について決定したcpm))×100%。
【0260】
用量希釈系列を、EPHA5アッセイにおける用量‐応答効果の試験及び各化合物についてのIC50の算出を可能にする化合物について調製する。各化合物を、30μMの濃度で定型的に試験した後、1%DMSOの終濃度で1/3の連続希釈を8地点(30μM‐6.67μM‐2.22μM‐740nM‐247nM‐82nM‐27nM‐9nM)実施する。化合物シリーズの効力が高い場合、より多くの希釈を調製し及び/又は最大濃度を下げてよい(例えば、5μM、1μM)。
【0261】
(6.2 EPHA5阻害‐細胞アッセイ)
本アッセイの原理は、STAT3及びEPHA5で一過性に形質移入したHEK293細胞におけるSTAT3(Tyr705)リン酸化レベルに関する阻害活性を決定することである。
【0262】
HEK293細胞を、10%熱失活ウシ胎仔血清、100U/mLペニシリン、及び100μg/mLストレプトマイシンを含むダルベッコ変法イーグル培地(DMEM)において維持する。
【0263】
70%培養密度のHEK293を標準的なトリプシン処理によって回収する。15,000,000個に6,250ngのpIPspAdapt6‐STAT3、3,750ngのpIPspAdapt6‐EPHA5、4,000ngのpIPspAdapt6‐eGFP、及び11,000ngのpBSKを、T175cm2細胞培養フラスコあたり50μLのJet‐PEI(Polyplus)をトランスフェクション試薬として用いて一過性に形質移入する。形質移入した細胞をT175cm2細胞培養フラスコにおいて蒔種する。37℃、10%CO2で一晩インキュベーション後、トランスフェクション培地を除去し、細胞の脱離を回避するよう新鮮な細胞培地を注意深く添加する。
【0264】
トランスフェクションの48時間後、培地を除去する。細胞を、あらかじめ加温しておいた細胞解離溶液(Sigmaカタログ番号C5914)で脱離させる。ウェルあたり60,000個の細胞/40μLのDMEMを384ウェルプレートにおいて蒔種する。次に、10μLの化合物希釈液(5×)含有DMEMを添加する。
【0265】
すべての化合物を二つ組で試験し、20μMから出発した後、1/3の連続希釈を8地点(20μM‐6.6μM‐2.2μM‐740nM‐250nM‐82nM‐27nM‐9nM)で0.2%DMSOの終濃度で実施する。
【0266】
37℃で5時間インキュベーション後、リン光体‐Stat3(Tyr705)レベルを、AlphaScreen(登録商標)SureFire(登録商標)Phospho‐STAT3(Tyr705)Assay Kit(Perkin Elmer製)を用いて決定する。細胞を、15μLの1×溶解緩衝液の添加によって溶解する。プレートを室温で20分間穏やかに振蘯する。4μLの可溶化液をプロキシプレートに転移させた後、アルファ‐ビーズを含む7μL反応緩衝液/活性化緩衝液混合物を添加し、プレートをアルミニウムシールで密封し、5分間振蘯し、室温で暗所で16時間インキュベートする。
【0267】
プレートを標準的なAlphaScreen設定を用いてEnvisionで読み取る。0.2%DMSOをネガティブコントロールとして用いる(0%阻害)。ポジティブコントロール及びネガティブコントロールを用いて、z'値及びPIN値を算出する。
【0268】
パーセント阻害=(1−((試験化合物が存在する試料について決定した値−ポジティブコントロール阻害薬を有する試料について決定した値)/(ビヒクルの存在下で決定した値−ポジティブコントロール阻害薬を有する試料について決定した値)))×100%。
【0269】
(実施例7 MMP13阻害アッセイ)
本明細書で同定されたTARGETのうちの1つに対して活性があるものとして同定された化合物を、MMP13阻害アッセイにおいて直接試験し得る。
【0270】
正常ヒト関節軟骨細胞(NHAC、Lonzaカタログ番号CC‐2550)を、5%FBS及び1%ペニシリン/ストレプトマイシンを含む培地(Gibco、DMEM:F12)において1mLあたり1600000個の濃度で懸濁する。次に、25μLの細胞懸濁液を、5%血清及び1%ペニシリン/ストレプトマイシンを有する培地中の0.8%アガロース25μLとともにプールし、5%血清及び1%ペニシリン/ストレプトマイシンを有する培地における1.5%アガロースの50μLであらかじめ被覆した96ウェル培養皿のウェルに添加する。アガロースが設定された後、127.5μLの培地を各ウェルに添加する。次に、細胞を、種々の濃度の7.5μL化合物で1時間処理した後、15μLの10ng/mL IL‐1bで刺激する(終濃度:1ng/mL)。刺激48時間後、上清を回収し、MMP13分泌を測定する。各化合物を30μMの濃度で定型的に試験した後、0.3%DMSOの終濃度で1/3連続希釈を8地点(30μM‐10μM‐3.33μM‐1.11μM‐370nM‐123nM‐41nM‐14nM)実施する。
【0271】
MMP13活性を、抗体捕捉活性アッセイにおいて測定する。この目的のために、384ウェルプレート(NUNC、P6491、MaxiSorp黒色)を35μLの1.5μg/mL抗ヒトMMP13抗体(R&D Systems、MAB511)溶液で4℃で24時間被覆する。ウェルをPBS+0.05%Tweenで2回洗浄した後、残りの結合部位を100μLの5%無脂肪乾燥乳(Santa Cruz、sc‐2325、Blotto)含有PBSで4℃で24時間ブロッキングする。次に、ウェルをPBS+0.05%Tweenで2回洗浄し、MMP13を含む35μLの培養上清を添加し、室温で4時間インキュベートする。この後、ウェルをPBS+0.05%Tweenで2回洗浄した後、MMP13タンパク質を、35μLの1.5mM 4-アミノフェニル水銀アセタート(APMA)(Sigma、A9563)溶液の添加及び37℃で1時間のインキュベーションによって完全に活性化する。次に、ウェルをPBS+0.05%Tweenで再度洗浄し、35μLのMMP13基質(Biomol、P‐126、OmniMMP蛍光発生基質)を添加する。37℃で1時間インキュベーション後、変換した基質の蛍光を、Perkin Elmer Wallac EnVision 2102 Multilabel Reader(励起波長:320nm、発光波長:405nm)において測定する。
【0272】
パーセント阻害=((ビヒクルの存在下で決定された蛍光−試験化合物が存在しながら試料について決定された蛍光)/(ビヒクルの存在下で決定された蛍光−誘発因子なしで試料について決定された蛍光))×100%。
【0273】
GPR43に対する化合物の活性は、下記の説明される実施例8又は9のようなアッセイを用いて試験され得る。
【0274】
(実施例8:GPR43表現型アッセイ‐好中球遊走アッセイ)
8.1 バフィーコートからの好中球の単離
ヒトバフィーコートを等容積の氷冷DPBS(Invitrogenカタログ番号14190169)で希釈する。20mLの希釈したバフィーコートダウンを50mLコニカルチューブにおいて、140mMクエン酸、200mMクエン酸ナトリウム、及び220mMデキストロース4mLと穏やかに混合する。12mLの6%デキストラン/0.9%NaCl溶液(w/v)含有水を穏やかに添加し、チューブを最高20回転倒混和する。次に、総容積を新鮮チューブに転移させ、2相の完全な分離のために、室温で1時間インキュベートする。次に、黄色の上清を新たなチューブに転移させ、1300rpmで12分間、標準的な卓上遠心分離機において4℃でブレーキなしで遠心分離する。上清を廃棄し、残りの細胞ペレットを12mLの氷冷水において上下にピペッティングすることによって迅速に再懸濁する。20秒後、4mLの氷冷0.6M KClを添加し、注意深く混合し、1300rpmで12分間、標準的な卓上遠心分離機において、4℃でブレーキなしで遠心分離する。この手順を赤血球が残らなくなるまで反復する。最終的に、ペレットを15mLのチューブにおいて4mLのDPBSに再懸濁し、5mLのLymphoprep(商標)(Nycomed Pharma、カタログ番号1114545)上で層状にする。標準的な卓上遠心分離機において、4℃で低ブレーキで1300rpmで12分間の遠心分離後、上清を除去し、細胞ペレットを10mMのHEPES(Invitrogen、カタログ番号15630)を補充した25mLの走化性緩衝液(RPMI1640(Invitrogen、カタログ番号21875))において再懸濁する。
【0275】
8.2 遊走アッセイ
遊走アッセイを、5.0μMの孔サイズのポリカーボネートメンブレン(Corningカタログ番号3387)を有するCorning HTSトランスウェル96透過性支持システムにおいて実施する。180μLの8.9×106個の細胞/mLの細胞懸濁液を、ポリプロピレン96ウェルV底プレートにおいて、20μLの化合物溶液含有走化性緩衝液に添加する。細胞を30分間インキュベートした15分後に中間的な再懸濁をして、細胞がプレートの底部に定着するのを防止する。この後、70μLの細胞懸濁液をトランスウェルシステムの上部区画に転移させる。受容ウェルを、化合物及び走化剤を含有する200μLの走化性緩衝液で満たす。37℃で5%CO2において1時間のインキュベーション後、受容プレートに遊走する細胞の量を溶解と、ルミノメーターにおいてATP‐lite(Promega、カタログ番号6016739)を用いて可溶化液のATP含有量を測定することとによって測定する。
【0276】
8.3 データ分析
化合物の効果を、下記式を用いたパーセント阻害として表す:
[(ビヒクル及び走化剤の存在下でのRLU−化合物及び走化剤の存在下でのRLU)/(ビヒクル及び走化剤の存在下でのRLU−走化剤の不在下でのRLU)]×100
RLU=相対的発光単位。
【0277】
(実施例9:GPR43‐カルシウムフラックスアッセイ)
GPR43に対する活性を、下記に説明されるアッセイを用いて試験し得る。
【0278】
透明な底部の384ウェルプレート(Corning、参照番号3712)を0.05mg/mLの終濃度でPBSに希釈した25μLのポリ‐D‐リジン(Sigma、参照番号P‐6407)でコーティングし、37℃で30分間インキュベートする。ポリリシンをPBSによる2回の洗浄によって除去する。6千個のHEK293細胞を、10%FBS、10μg/mLピューロマイシン、及び1%ペニシリン/ストレプトマイシンで補完した25μLのDMEMにおいて蒔種する。次に、プレートを37℃/5%CO2で24時間インキュベートする。25μLのカルシウム4色素(Molecular devices、参照番号R8141)を製造元の説明書に従ってプレートに添加し、プレートを37℃/5%CO2で2時間15分インキュベートする。次に、10μLの化合物溶液含有HBSS、20mM hepesを添加し、プレートを37℃/5%CO2で15分間インキュベートする。アンタゴニスト活性を、10μLの酢酸ナトリウム(Sigma、参照番号S2889)含有HBSS、20mM hepesをEC80濃度で添加することによって測定する。
【0279】
カルシウムシグナル伝達を、Flexステーション3(Molecular Devices)を用いて、蛍光(励起485nm、発光525nm)を60秒間記録することによって測定する。活性を、酢酸ナトリウムによって生じたカルシウム曲線の最大蛍光と、酢酸ナトリウム添加前に測定された基線蛍光の間の比として決定する。阻害のパーセンテージを、各プレートに関するネガティブコントロール(ビヒクル添加)及びポジティブコントロール(EC100における酢酸ナトリウム)を用いて算出する。
【0280】
(実施例10:EDG4カルシウムフラックスアッセイ)
EDG4に対する化合物の活性を、下記に説明されるアッセイを用いて試験し得る。
【0281】
ウェルあたり1万個のCHO‐EDG4細胞を10%FBS及び10μg/mLピューロマイシンを補完した50μLのDMEM/F12に再懸濁した後、透明な底部の384ウェルプレート(Corning、参照番号3712)において蒔種する。37℃/5%CO2で24時間インキュベーション後、プレートを、0.1%無脂肪酸BSAを補完した25μLのDMEM/F12で2回洗浄した後、プレートを37℃/5%CO2で1時間インキュベートする。20mM HEPES(製造元の説明書と比較してさらに1/2希釈)を補完したカルシウム及びマグネシウムを含むHBSS(Gibco、参照番号14025)に希釈したFluo4 Direct Ca色素(Invitrogen、参照番号F10473)25μLをプレートに添加する。次に、プレートを37℃/5%CO2で1時間インキュベートする。次に、HBSS、20mM hepes、0.1%無脂肪酸BSA、0.6%DMSOにおける化合物溶液10μLを添加し、プレートを37℃/5%CO2で15分間インキュベートする。アンタゴニスト活性を、10μLのオレオイル‐L‐リソホスファチジン酸ナトリウム塩(LPA、Sigma、参照番号L7260)含有HBSS、20mM hepes、0.1%無脂肪酸BSA10をEC80濃度で添加することによって測定する。
【0282】
カルシウムシグナル伝達を、Flexステーション3(Molecular Devices)を用いて、蛍光(励起485nm、発光525nm)を60秒間記録することによって測定する。活性を、LPAによって生じたカルシウム曲線の最大蛍光と、LPA添加前に測定された基線蛍光の間の比として決定する。阻害のパーセンテージを、各プレートに関するネガティブコントロール(ビヒクル添加)及びポジティブコントロール(EC100におけるLPA)を用いて算出する。
【0283】
CSNK1G2に対する化合物の活性を、下記の実施例11又は12において説明されるアッセイを用いて試験し得る。
【0284】
(実施例11:CSNK1G2生化学的アッセイ)
0.75mUの組換えCSNK1G2(Milliporeカタログ番号14‐712)を0.1mg/mLカゼイン(Sigmaカタログ番号C4765)含有キナーゼ反応緩衝液(10mM MOPS pH7.0、0.01% Triton‐X‐100、0.5mM EDTA、1mM DTT、0.5mM Na3VO4、5mMベータ‐グリセロホスファート、10mM MgCl2、0.5μM非放射性ATP、0.25μCi 33P‐ガンマ−ATP(Perkin Elmer, カタログ番号NEG602K)終濃度で、試験化合物又はビヒクル(DMSO、1%終濃度)を5μL含有する又は含有しない。)とともに、総容積25μLでポリプロピレン96ウェルプレート(Greiner, V底)においてインキュベートする。30℃で45分後、25μL/ウェルの150mMリン酸を添加することによって、反応を停止させる。終止したキナーゼ反応物をすべて、あらかじめ洗浄しておいた(75mMリン酸)96ウェルフィルタープレート(Perkin Elmerカタログ番号6005177)へと、細胞回収機(Perkin Elmer)を用いて転移させる。プレートを、ウェルあたり300μの75mMリン酸溶液で6回洗浄し、プレートの底部を密封する。40μL/ウェルのMicroscint‐20を添加し、プレートの上部を密封し、Topcount(Perkin Elmer)を用いて読み出しを実施する。
【0285】
キナーゼ活性を、ビヒクル存在下で得られた1分間あたりの計数(cpm)から、ポジティブコントロール阻害薬(20μMスタウロスポリン)の存在下で得られたcpmを減算することによって算出する。この活性を阻害する試験化合物の能力を以下のとおり決定する:
【0286】
パーセント阻害=((試験化合物の存在下で使用について決定されたcpm−ポジティブコントロール阻害薬を用いて試料について決定されたcpm)/(ビヒクルの存在下で決定されたcpm−ポジティブコントロール阻害薬を用いて試料について決定されたcpm))×100%。
【0287】
用量希釈系列を、CSNK1G2アッセイにおける用量‐応答効果の試験及び各化合物についてのIC50の算出を可能にする化合物について調製する。各化合物を、30μMの濃度で定型的に試験した後、1%DMSOの終濃度で1/3の連続希釈を8地点(30μM‐6.67μM‐2.22μM‐740nM‐247nM‐82nM‐27nM‐9nM)実施する。化合物シリーズの効力が高い場合、より多くの希釈を調製し及び/又は最大濃度を下げてよい(例えば、5μM、1μM)。
【0288】
(実施例12:CSNK1G2細胞アッセイ)
Wntシグナル伝達アッセイにおいて、Wntルシフェラーゼリポーターコンストラクトを、LRP6及びCSNK1G2についての発現べクターとともにSW1353細胞へと、JetPEIトランスフェクション剤(Polyplus Transfection, カタログ番号101‐40)を用いて形質移入する。CSNK1G2過剰発現は、LRP6により誘導されるWnt‐リポーター活性を増強する。ルシフェラーゼリポーター遺伝子のCSNK1G2仲介性及びLRP6仲介性発現を、ルシフェラーゼ基質を用いて測定する。CSNK1G2活性を阻害する化合物は、リポーター活性を低下させるであろう。
【0289】
1日後:SW1353細胞の懸濁液を調製する(密度:30000個の細胞/ウェル/80μL(375000個の細胞/mL))。並行して、DNA/トランスフェクション剤混合物を以下の通り調製する。
【0290】
ウェルあたり添加されるべきDNAの全量をNaClの150mM溶液において10μLに希釈する。典型的には、以下の量のDNAをウェルあたり形質移入するであろう:Wnt‐lucリポーター(20ng)、A010800‐CSNK1G2‐WT(20ng)、pCS‐myc‐hLRP(10ng)。ウェルあたりに必要とされるJetPEIトランスフェクション剤の全量(0.32μL)をNaClの150mM溶液において10μLに希釈する。次に、JetPEI溶液及びDNA溶液を混合して、ウェルに添加されるべき20μL DNA/トランスフェクション剤混合物を生じる。この溶液を即時混合し、遠心分離し、室温で30分間インキュベートする。細胞懸濁液をDNA/トランスフェクション剤混合物に滴下して添加し、37℃で2時間インキュベートする。次に、試験されるべき化合物を11μLに希釈して、形質移入された細胞を含むウェルに、自動ディスペンサー(Tecan aquarius)を用いて添加し、混合物を16〜24時間インキュベートする。
【0291】
2日後:細胞の上部における培地を除去した後、ルシフェラーゼ基質SteadyLite HTS(Perkin Elmer, カタログ番号550‐070303)を白色96ウェルプレートに添加する(50μL/ウェル)。暗所で連続的な振蘯をしながら30分間のインキュベーション後、ルミノメーター(Envision, Perkin Elmer)を用いて読み出される読み出しを実施する。
(参考文献)
Appleton CT, Pitelka V, Henry J, Beier Fの文献「初期実験的変形性関節症における遺伝子発現の包括的分析(Global analyses of gene expression in early experimental osteoarthritis)」(Arthritis Rheum. 2007; 56(6):1854-68)
Billinghurst, RCらの文献「インターロイキン‐1によって誘導される鼻及び関節の軟骨におけるII型コラーゲンおよびプロテオグリカンの分解の比較並びにコラゲナーゼによるII型コラーゲン切断の選択的阻害(Comparison of the degradation of type II collagen and proteoglycan in nasal and articular cartilages induced by interleukin-1 and the selective inhibition of type II collagen cleavage by collagenase)」(Arthritis Rheum. 2000; 43:664672)
Billinghurst, RCらの文献「変形性関節症関節軟骨におけるコラゲナーゼによるII型コラーゲンの高い切断(Enhanced cleavage of type II collagen by collagenases in osteoarthritic articular cartilage)」(J Clin Invest. 1997; 99:15341545)
Boerner. P, Lafond, R, Lu, WZ, Brams, P, 及びRoyston, Iの文献「インビトロで刺激されるヒト脾細胞由来の抗原特異的ヒトモノクローナル抗体の産生(Production of antigen-specific human monoclonal antibodies from in vitro-primed human splenocytes)」(J. Immunol., 1991, 147(1):86-95)
Cao, Z; Xiong, J; Takeuchi, M; Kurama, T; Goeddel, DVの文献「TRAF6は、インターロイキン‐1のためのシグナル伝達因子である(TRAF6 is a signal transducer for interleukin-1)」(Nature 383: 443-446, 1996)
Chen, CJ, Banerjea, AC, Harmison, GG, Haglund, K, Schubert, Mの文献「最大9つの高度に保存されたHIV‐1env RNA領域において切断するよう配向された多重標的リボザイムは、HIV‐1複製を阻害する―最もすぐに配列決定されたHIV‐1単離物に対する潜在的な有効性(Multitarget-ribozyme directed to cleave at up to nine highly conserved HIV-1 env RNA regions inhibits HIV-1 replicationpotential effectiveness against most presently sequenced HIV-1 isolates)」(Nucl. Acids Res. 1992 20: 4581-4589);
Choy EH, Panayi GSの文献「関節リウマチにおけるサイトカイン経路及び関節炎症(Cytokine pathways and joint inflammation in rheumatoid arthritis)」(N Engl J Med. 2001; 344(12):907-16)
Clegg DO, Reda DJ, Harris CL, Klein MA, O'Dell JR, Hooper MM, Bradley JD, Bingham CO 3rd, Weisman MH, Jackson CG, Lane NE, Cush JJ, Moreland LW, Schumacher HR Jr, Oddis CV, Wolfe F, Molitor JA, Yocum DE, Schnitzer TJ, Furst DE, Sawitzke AD, Shi H, Brandt KD, Moskowitz RW, Williams HJの文献「有痛の膝変形性関節症のためのグルコサミン、硫酸コンドロイチン、及び組み合わせにおけるこれら2つ(Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis)」(N Engl J Med. 2006; 354(8):795-808)
Coleらの文献「モノクローナル抗体及び癌治療法(Monoclonal Antibodies and Cancer Therapy)」((1985) Alan R. Liss, p. 77);
Dahlberg, Lらの文献「II型コラーゲンのコラゲナーゼ仲介性切断は、変形性関節症軟骨において選択的に高く、コラゲナーゼ‐1(MMP‐1)を残す合成阻害薬を用いて捕捉することができる(Collagenase-mediated cleavage of type II collagen is selectively enhanced in osteoarthritis cartilage and can be arrested with a synthetic inhibitor which spares collagenase-1 (MMP-1))」(Arthritis Rheum. 2000;43:673682)
Firestein GSの文献「関節リウマチの進化する概念(Evolving concepts of rheumatoid arthritis)」(Nature. 2003; 423(6937):356-61)
Gao, X及びHuang, Lの文献「T7 RNAポリメラーゼ及びT7プロモーター配列の陽イオン性リポソームとの共送達によるリポーター遺伝子の細胞質発現(Cytoplasmic expression of a reporter gene by co-delivery of T7 RNA polymerase and T7 promoter sequence with cationic liposomes)」(Nucl. Acids Res. 1993 21: 2867-2872)
Hoogenboom及びWinterの文献「免疫化のバイパス形成:インビトロで再配置された生殖系列VH遺伝子セグメントの合成レパートリー由来のヒト抗体(By-passing immunisation : Human antibodies from synthetic repertoires of germline VH gene segments rearranged in vitro)」(J. Mol. Biol. 1992, 227:381-8);
Karin Mの文献「終わりの始まり:IカッパBキナーゼ(IKK)及びNFカッパBの活性化(The beginning of the end: IkappaB kinase (IKK) and NF-kappaB activation)」(J Biol Chem. 1999 Sep 24;274(39):27339-42. 総説)
Kashani-Sabetらの文献「抗rasリボザイムによる悪性表現型の逆転(Reversal of the malignant phenotype by an anti-ras ribozyme)」(Antisense Res Dev, 1992 2:3-15)
Lee DM, Weinblatt MEの文献「関節リウマチ(Rheumatoid arthritis)」(Lancet. 2001; 358(9285):903-11)
Lipinski CA, Lombardo F, Dominy BW及びFeeney PJ.の文献「薬剤発見及び開発設定における溶解度及び透過性を概算するための実験的及び計算的アプローチ(Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings)」(Adv Drug Deliv Rev, 2001; 46: 3-26)
Mark及びPadlan「第4章モノクローナル抗体のヒト化(Chapter 4. Humanization of Monoclonal Antibodies)」((1994) The Handbook of Experimental Pharmacology Vol. 113, Springer-Verlag, New York)
Marks JD, Hoogenboom HR, Bonnert TP, McCafferty J, Griffiths AD, Winter Gの文献「免疫化のバイパス形成。ファージに示されるV遺伝子ライブラリー由来のヒト抗体(By-passing immunization. Human antibodies from V-gene libraries displayed on phage)」(J Mol Biol. 1991 Dec 5;222(3):581-97. リンク)
Milstein及びCuelloの文献「免疫組織化学におけるハイブリッドハイブリドーマ及びその使用(Hybrid hybridomas and their use in immunohistochemistry)」(Nature 1983, 305:537-9)
Mitchell, PGらの文献「ヒト変形性骨関節症軟骨由来のマトリックスメタロプロテイナーゼ‐13のクローニング、発現、及びII型コラーゲン分解活性(Cloning, expression, and type II collagenolytic activity of matrix metalloproteinase-13 from human osteoarthritic cartilage)」(J Clin Invest. 1996;97:761768)
Neuhold LA, Killar L, Zhao W, Sung ML, Warner L, Kulik J, Turner J, Wu W, Billinghurst C, Meijers T, Poole AR, Babij P, DeGennaro LJ Jの文献「構成的に活性のあるヒトコラゲナーゼ‐3(MMP‐13)の硝子軟骨における生後発現は、マウスにおける変形性関節症を誘導する(Postnatal expression in hyaline cartilage of constitutively active human collagenase-3 (MMP-13) induces osteoarthritis in mice)」(Clin Invest. 2001 Jan;107(1):35-44)
O'Dell JRの文献「関節リウマチについての治療的戦略(Therapeutic strategies for rheumatoid arthritis)」(N Engl J Med. 2004; 350(25):2591-602)
Pei Y, Tuschl Tの文献「有効かつ特異的なsiRNAを同定する技術分野について(On the art of identifying effective and specific siRNAs)」(Nat Methods. 2006; 3(9):670-6)
Schmidt MR, Piekos B, Cabatingan MS, Woodland RTの文献「ヒトコクサッキー/アデノウイルス受容体導入遺伝子の発現は、初代リンパ球のアデノウイルス感染を可能にする(Expression of a human coxsackie/adenovirus receptor transgene permits adenovirus infection of primary lymphocytes)」(J Immunol. 2000 165:4112-9)
Shlopov, BVらの文献「変形性関節症障害.3つの異なるコラゲナーゼの関与(Osteoarthritic lesions. Involvement of three different collagenases)」(Arthritis Rheum. 1997;40:20652074)
Smolen JS, Steiner G.の文献「関節リウマチについてに治療的戦略(Therapeutic strategies for rheumatoid arthritis)」)(Nat Rev Drug Discov. 2003; 2(6):473-88)
Traunecker A, Lanzavecchia A, Karjalainen Kの文献「HIV感染細胞における二重特異性一本鎖分子(ヤヌシンズ(Janusins))標的細胞毒性リンパ球(Bispecific single chain molecules (Janusins) target cytotoxic lymphocytes on HIV infected cells)」(EMBO J. 1991;10(12):3655-9)
Ventura M, Wang P, Ragot T, Perricaudet M, Saragosti S.の文献「自己切断によるHIV特異的リボザイム活性の活性化(Activation of HIV-specific ribozyme activity by self-cleavage)」(Nucleic Acids Res. 1993; 21(14):3249-55)
Wieland HA, Michaelis M, Kirschbaum BJ, Rudolphi KA.の文献「変形性関節症―治療不可能な疾患か?(Osteoarthritis - an untreatable disease?)」(Nat Rev Drug Discov. 2005;4(4):331-44)
Wu W, Billinghurst RC, Pidoux I, Antoniou J, Zukor D, Tanzer M, Poole ARの文献「加齢におけるII型コラーゲンのコラゲナーゼ切断及び変性の部位並びに変形性関節症軟骨及びそのマトリックスメタロプロテイナーゼ1及びマトリックスメタロプロテイナーゼ13の分布との関連性(Sites of collagenase cleavage and denaturation of type II collagen in aging and osteoarthritic articular cartilage and their relationship to the distribution of matrix metalloproteinase 1 and matrix metalloproteinase 13)」(Arthritis Rheum. 2002 Aug;46(8):2087-94)
【技術分野】
【0001】
本発明は、炎症並びに/又は軟骨組織及び/若しくは細胞外マトリックス(ECM)の変性を包含する医学的研究、炎症、軟骨生理学、及び疾患の分野に関する。より具体的には、本発明は、薬剤及び化合物が軟骨細胞における異化過程を阻害し、かつ軟骨及び/又は細胞外マトリックスの変性を低下させるであろう前記薬剤、及び前記化合物を同定するための方法に関する。また、本発明は、その修飾がECM及び/又は軟骨の変性の低下を結果的に生じ、かつ炎症を低下させる標的にも関する。加えて、本発明は、ECM及び/又は軟骨の変性並びに炎症を特徴とする容態を治療する上での組成物及びその使用方法に関する。また、本発明は、変形性関節症の治療において有用な化合物にも関する。
【背景技術】
【0002】
軟骨は、その軟骨細胞が主要な細胞構成要素である無血管性組織である。正常な関節の軟骨における軟骨細胞は、組織体積のおよそ5%を占めるのに対し、細胞外マトリックスは、組織の残部の95%を構成する。軟骨細胞は、マトリックスの構成要素、主としてプロテオグリカン及びコラーゲンを分泌し、該構成要素が順に、軟骨細胞に、機械的ストレスの下での生存に好適な環境を供給する。軟骨において、II型コラーゲンは、タンパク質IX型コラーゲンとともに、優れた機械的強度を軟骨に提供する固形原線維様構造で配置される。プロテオグリカンは、水を吸収することができ、軟骨の弾性特性及び衝撃吸収特性の原因となる。
【0003】
関節における軟骨の機能的役割の1つは、骨が互いに関して潤滑に関節でつながることができることである。関節の軟骨の損失はそれゆえ、骨を互いに対して擦れさせ、疼痛及び可動性の損失をもたらす。軟骨の変性は、種々の要因を有することができる。関節リウマチのような炎症性関節炎において、例えば、軟骨の変性は、炎症を受けた組織(例えば、炎症を受けた滑膜)によるプロテアーゼ(例えば、コラゲナーゼ)の分泌によって生じる。また、軟骨の変性は、事故若しくは手術、又は過度の負荷若しくは「摩滅」による、軟骨の損傷の結果でもあり得る。また、軟骨の変性は、軟骨合成(同化)過程及び軟骨変性(異化)過程における不均衡の結果でもあるかもしれない。このような傷害後に軟骨組織が再生する能力は限られている。損傷を受けた軟骨における軟骨細胞はしばしば、低い同化活性及び/又は高い異化活性を示す。損傷、疾患、又は手術後に軟骨が自己修復する限られた能力は、変性している関節表面及び半月状軟骨に対する損傷のリハビリテーションにおける主要な制限因子である。
【0004】
軟骨の変性は、種々の疾患の顕著な特徴であり、該疾患のうち、関節リウマチ及び変形性関節症が最も顕著である。
【0005】
変形性関節症(OA又は摩滅関節炎ともいう。)は、関節炎の最も普遍的な形態であり、骨の肥大及び疼痛としばしば関連した関節軟骨の損失を特徴とする。該疾患は主として、手、並びに膝、股、及び脊椎など、重量支持関節に影響を及ぼす。この過程は、軟骨を薄くさせる。表面積が、菲薄化により消失すると、グレードI変形性関節症に到達し;接線方向の表面積が消失すると、グレードIIの変形性関節症に到達する。変性及び破壊のさらなるレベルがあり、該レベルは、肋軟骨下骨と境界を接する深部にある石灰化した軟骨層に影響を及ぼす。変形性関節症に関する広範な総説について、本発明者らは、Wielandらの文献(2005)を引用する。
【0006】
関節リウマチ(RA)は、慢性関節変性疾患であり、関節構造の炎症及び破壊を特徴とする。該疾患がチェックされていないと、関節の機能性の損失による実質的な能力障害及び疼痛、並びに早期の死亡さえもたらす。RA治療法の目的はそれゆえ、該疾患を衰えさせることではなく、関節の破壊を停止させるために寛解を果たすことである。該疾患の結果の重症度のほかに、RAの高い有病率(成人の〜0.8%が世界規模で影響を受けている。)は、高い社会‐経済的衝撃を意味する(RAに関する総説について、本発明者らは、Smolen及びSteinerの文献(2003);Lee及びWeinblattの文献(2001);Choy及びPanayiの文献(2001);O'Dellの文献(2004)並びにFiresteinの文献(2003)を引用する。)。
【0007】
変形性関節症の容態の発達に関する臨床的徴候は、大きな関節体積、疼痛をもたらす捻髪音及び機能的能力障害、並びに低い関節可動性である。疾患がさらに発達すると、安静時における疼痛が現れる。容態が、矯正及び/又は治療法なしで持続すれば、関節は、破壊され、能力障害をもたらす。そこで、全体的な人工関節との交換手術が必要となる。
【0008】
成熟関節軟骨において、軟骨細胞は、軟骨特異的マトリックス表現型を維持する。OAの初期の徴候には、II型コラーゲンに対する損傷によるプロテオグリカンアグリカンの関節軟骨からの漸増的損失を含む。このタンパク質は、健常個体における関節軟骨において認められる主要な構造コラーゲンを表す。関節の正常なリモデリングの間の触媒酵素によるII型コラーゲンの産生とこのタンパク質の変性との間には通常、厳密な均衡がある。OAなどの病理学的容態は、高いタンパク質変性によるこの均衡の損失を特徴とする。
【0009】
一般的に、MMPの高い発現は、軟骨及び/又は細胞外マトリックスの変性と関連しているが、すべてのプロテアーゼが必ずしも、未変性コラーゲンを変性できるわけではない。マトリックスメタロプロテアーゼのうち、MMP1、MMP8、MMP13、およびMMP14は、II型コラーゲンを変性する最高能力を示す。MMP‐1(コラゲナーゼ‐1)及びMMP‐13の発現及び含有量(Mitchelらの文献(1996);Shlopovらの文献(1997))。MMP‐8の発現(コラゲナーゼ‐2)、並びにコラゲナーゼ活性(Billinghurstらの文献(1997)、Dahlbergらの文献(2000))は、ヒトOA軟骨において上方制御されている。特に、コラゲナーゼ‐3としても公知もMMP‐13は、種々の観察によって示されるように、関節軟骨において、及び特にOAにおいてII型コラーゲン変性における重要な役割を担っていると考えられる(Billinghurstらの文献(1997)、Mitchellらの文献(1996)、Dahlbergらの文献(2000)、Billinghurstらの文献(2000))。1)MMP13の発現は、半月板切除術のような関節炎に起因する手術に供されたOA患者の及び動物の軟骨において高い(Appletonらの文献(2007))。2)関節軟骨におけるMMP1及びMMP13の局在は、軟骨切断によって誘発される新生エピトープを明らかにする抗体によって明らかにされるように、軟骨の破壊の一と一致するように見える(Wuらの文献(2002))。3)トランスジェニックマウスの軟骨におけるMMP13の過剰発現は、OA様軟骨破壊表現型をもたらした(Neuholdらの文献(2001))。4)II型コラーゲンは、MMP‐13について好ましい基質である(Billinghurstらの文献(1997);Mitchellらの文献(1996))。ひとまとめに考えると、MMP13は、OA誘発性の軟骨及びECMの変性における鍵となる担い手として十分認められる。
【0010】
変形性関節症疾患の間に現れる関節軟骨病変の矯正のための治療方法は開発されてきたが、これまで、該方法のいずれも、関節軟骨の再生をインサイツ(in situ)及びインビボで仲介することはできなかった。
【0011】
変形性関節炎は、治療するのが困難である。目下、治癒は得られず、治療は、疼痛を緩和すること、及び影響を受けた関節が変形するのを防止することに焦点を当てている。普遍的な治療には、非ステロイド性抗炎症薬(NSAID)の使用を含む。コンドロイチン及び硫酸グルコサミンなどの栄養補助食品が、変形性関節炎の治療及び寛解のための安全かつ有効な選択肢として唱道されてきたが、近年の臨床治験は、両治療が、変形性関節炎と関連した疼痛を低減しないことを明らかにした(Cleggらの文献(2006))。ひとまとめに考えると、疾患を改変する変形性関節炎薬は入手可能ではない。
【0012】
重症の場合、関節交換は必要かもしれない。このことは特に、股及び膝に対して真である。関節が極度に有痛であり、交換できない場合、関節は融着し得る。この手順は疼痛を停止させるが、関節機能の永続的な損失を結果として生じ、歩行及び屈曲が困難となる。
【0013】
別の可能な治療は、培養された自己軟骨細胞の移植である。ここで、軟骨細胞材料は、患者から採取され、実験室に送られ、そこで増殖される。次に、材料が損傷を受けた組織に移植され、組織の欠陥を保護する。
【0014】
別の治療には、滑液のレオロジーを一時的に改良する物質であるHylan G‐F 20(例えば、Synvisc(登録商標)、Hyalgan(登録商標)、Artz(登録商標))の関節内滴下注入を含み、自由な動作のほぼ即時的な感覚及び疼痛の顕著な低下を生じる。
【0015】
他の報告された方法には、腱、骨膜、筋膜、筋肉、又は軟骨膜の移植片の適用;フィブリン又は培養軟骨細胞の移植;コラーゲン、カーボンファイバーなどの合成マトリックスの移植;電磁場の投与を含む。これらのすべては、最小かつ不完全な効果を報告しており、重量のかけられた負荷を支持することもできず、正常な動作による関節の機能の修復もできない質の乏しい組織を結果として生じる。
【0016】
同化過程の刺激、異化過程の遮断、又はこれら2つの組み合わせは、軟骨の安定化、及びおそらくは損傷の復帰さえを結果として生じ得、それゆえ、前記疾患のさらなる進行を防止する。
【0017】
本発明は、本発明者らによって同定された選択されたタンパク質(以後、「TARGETS」と呼ぶ。)の機能と、軟骨及び/又は細胞外マトリックス(ECM)の変性の阻害並びに炎症の阻害との間の関連性に関する。
【発明の概要】
【0018】
本発明は、細胞外マトリックス(ECM)及び/又は軟骨変性過程を低下させる化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチド(以後「TARGETS」)又はその機能的断片と、該ポリペプチドが化合物に結合できる条件下で接触させることと、ECM及び/又は軟骨の変性の阻害と関連した化合物‐ポリペプチド特性を測定することとを含む、該化合物を同定する方法に関する。特定の実施態様において、化合物‐ポリペプチド特性は、炎症性サイトカイン、例えば、IL‐1b、IL‐6、IL‐8、IL‐11、TNFα、及び/又はLIFのレベルである。具体的な実施態様において、測定される化合物‐ポリペプチド特性は、軟骨変性タンパク質又はコラゲナーゼなどのプロテアーゼの発現レベルである。特定の実施態様において、測定される化合物‐ポリペプチド特性は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現レベルである。具体的な実施態様において、測定される化合物‐ポリペプチド特性は、MMP13発現レベルである。
【0019】
本方法の態様には、TARGETに相応するポリペプチド又はその断片(このような断片は、配列番号22〜42の配列によって説明されるアミノ酸配列の断片である。)を用いる化合物のインビトロアッセイ、及びTARGET阻害が、例えばTARGET発現レベル、TARGET酵素活性、及び/又はMMP13レベルを含む有効性の指標を観察することによって追随される細胞アッセイを含む。
【0020】
また、本発明は、
(1)アンチセンスポリヌクレオチド、リボザイム、及び低分子干渉RNA(siRNA)の群から選択されるポリヌクレオチドを含む発現阻害薬(この中で、該ポリヌクレオチドは、TARGETポリペプチドをコードする天然のポリヌクレオチド配列と相補的なまたは前記ポリヌクレオチド配列から操作された核酸を含み、該ポリヌクレオチド配列は、配列番号22〜42からなる群から選択される配列を含む。)並びに
(2)ECM変性及び/又は変形性関節炎などの軟骨変性を特徴とする疾患の治療又は予防において有用な、該薬剤を含む医薬組成物にも関する。
【0021】
本発明の別の態様は、有効なTARGET発現阻害量の発現阻害薬又は有効なTARGET活性阻害量の活性阻害薬を含む医薬組成物を投与することによる、軟骨及び/又はECMの変性、骨及び/又は関節の変性と関連した容態に罹患している又は罹患しやすい対象における前記容態の治療又は予防の方法である。特定の実施態様において、容態は変形性関節炎である。
【0022】
本発明の別の態様は、有効なTARGET発現阻害量の発現阻害薬又は有効なTARGET活性阻害量の活性阻害薬を含む医薬組成物を投与することによる、炎症と関連した容態に罹患している又は罹患しやすい対象における炎症と関連した容態の治療又は予防の方法である。
【0023】
本発明のさらなる態様は、対象におけるTARGET発現及び/又は活性のレベルの指標の測定を含む、軟骨及び/又はECM変性と関連した容態の診断のための方法である。
【0024】
本発明のさらなる態様は、対象におけるTARGET発現及び/又は活性のレベルの指標の測定を含む、炎症と関連した容態の診断のための方法である。
【0025】
本発明の別の態様は、軟骨及び/又はECM変性を包含する疾患の治療に有用な、治療方法、医薬組成物、及びこのような組成物の製造における、本明細書に開示されたTARGETを阻害する薬剤の使用に関する。特に、本方法は、関節の変性を特徴とする疾患、特に異常なMMP13発現を特徴とする疾患の治療におけるTARGETを阻害する薬剤の使用に関する。薬剤は、変形性関節症、関節リウマチ、乾癬性関節炎、若年性関節リウマチ、痛風性関節炎、化膿性又は感染性関節炎、反応性関節炎、反射性交感神経性ジストロフィー、有痛性骨萎縮症、ティーツェ症候群又は肋軟骨炎(costal chondritis)、線維筋痛症、骨軟骨炎、神経原性又は神経障害性関節炎, 関節症、地方性変形性骨軟骨関節症のような風土性形態の関節炎、 ムセルニ病(Mseleni disease)、及びハンディゴデュ病(Handigodu disease);線維筋痛症、全身性エリテマトーデス、強皮症、強直性脊椎炎、遺伝性軟骨溶解、軟骨異形成症、及び偽軟骨異形成(pseudoachondrodysplasias)を含む先天性軟骨形成異常、並びに先天性軟骨形成異常、例えば小耳症、無耳症、及び骨幹端軟骨異形成症から結果として生じる変性を含むがこれらに限定されない軟骨変性を包含する疾患の寛解又は治療に有用である。特定の実施態様において、疾患は、変形性関節炎、関節リウマチ、及び炎症性関節炎から選択される。特定の実施態様において、疾患は変形性関節炎である。
【0026】
本発明の別の態様は、アレルギー性気道疾患(例えば、喘息、鼻炎)、自己免疫疾患、移植片拒絶、クローン病、関節リウマチ、乾癬、若年性特発性関節炎、大腸炎、及び炎症性腸疾患を含むがこれらに限定されない炎症を包含する疾患の治療に有用な治療方法、医薬組成物、及びこのような組成物の製造における、本明細書に開示されたTARGETを阻害する薬剤の使用に関する。
【0027】
また、さらなる態様において、本発明は、軟骨組織のインビトロでの製造のための方法にも関する。
【0028】
本発明の別のさらなる態様は、治療的に有効な軟骨及び/又はECM変性阻害量のTARGET阻害薬又はその医薬として許容し得る塩、水和物、溶媒和物、若しくはプロドラッグを、医薬として許容し得る担体と混合して含む医薬組成物である。また、本ポリヌクレオチド及びTARGET阻害薬化合物は、ECM変性、軟骨変性、及び/又は炎症を包含する容態の治療のための医薬の製造にも有用である。
【0029】
さらに、また、本発明は、診断方法にも関する。
【0030】
他の目的および利点は、以下の実例となる図とともに採用される以下の説明に関する考慮から明らかとなるであろう。
【図面の簡単な説明】
【0031】
【図1】図1は、正常ヒト関節軟骨細胞(NHAC)におけるMMP13アッセイについての一般的なスクリーニングプロトコールの原理を示す。
【0032】
【図2】正常ヒト関節軟骨細胞におけるMMP13アッセイの模式図。
【0033】
【図3】正常ヒト関節軟骨細胞におけるMMP13アッセイについて説明されるスクリーニングプロトコールを用いて試験した対照プレートの能力に関する代表的な例。
【0034】
【図4】SilenceSelect(登録商標)回収物のスクリーニングバッチのうちの1つの間に得られたデータの例。
【0035】
【図5A】3MOI再スクリーン試行についての典型的なレイアウト。
【0036】
【図5B】3MOIの再スクリーンにおいて得られた結果の例。
【0037】
【図6】スクリーニングの間に得られた摩滅及びより詳細に分析された的中物の選択を示すスキーム。
【0038】
【図7】表4は、SYBR(登録商標)Green定量的リアルタイムPCRに用いられるオリゴヌクレオチドプライマーを列挙する。
【発明を実施するための形態】
【0039】
(詳細な説明)
以下の用語は、下記に表された意味を有するよう意図され、本発明の明細書及び意図された範囲を理解する上で有用である。
【0040】
用語「薬剤」は、ポリペプチド、抗体、ポリヌクレオチド、化学物質の化合物、及び低分子を含む任意の分子を意味する。特に、用語薬剤には、試験化合物又は薬剤候補化合物などの化合物を含む。
【0041】
用語「アゴニスト」は、最も広範な意味でリガンドが結合する受容体を刺激するリガンドを指す。
【0042】
本明細書で使用する場合、用語「アンタゴニスト」は、受容体への結合の際に生物学的応答自体を惹起しないが、アゴニスト仲介性応答を遮断若しくは減弱させ、又はアゴニストの結合を防止若しくは低下させ、それによりアゴニスト仲介性応答を予防若しくは低下させる化合物を示すために用いられる。
【0043】
用語「アッセイ」は、薬剤の具体的な特性を測定するために用いられる任意のプロセスを意味する。「スクリーニングアッセイ」は、薬剤の集まりからその活性に基づいて薬剤を特徴付けまたは選択するために用いられるプロセスを意味する。
【0044】
用語「結合親和性」は、2つ以上の化合物が、非共有結合関係において互いにどのように強く会合しているかを示す特性である。結合親和性は、定性的に(「強い」、「弱い」、「高い」、又は「低い」)又は定量的に(KDを測定することなど)特徴づけることができる。
【0045】
用語「担体」は、医薬組成物に媒介物、容積、及び/又は使用可能な形態を提供するために医薬組成物の製剤において用いられる非毒性材料を意味する。担体は、賦形剤、安定化剤、又は水性pH緩衝溶液など、このような材料の1つ以上を含み得る。生理学的に許容し得る担体の例には、リン酸、クエン酸、及び他の有機酸を含めた水性の又は固体の緩衝成分;アスコルビン酸を含めた抗酸化剤;低分子量(約10残基未満)ポリペプチド;血清アルブミン、ゼラチン、又は免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、アルギニン、又はリシンなどのアミノ酸;グルコース、マンノース、又はデキストリンを含む単糖、二糖、及び他の炭水化物;EDTAなどのキレート剤;マンニトール又はソルビトールなどの糖アルコール;ナトリウムなどの塩形成対イオン;並びに/あるいはTWEEN(登録商標)、ポリエチレングリコール(PEG)、及びPLURONICS(登録商標)などの非イオン性界面活性剤が挙げられる。
【0046】
用語「複合体」は、2つ以上の化合物が互いに結合し、接触し、又は会合する場合に作られる実体を意味する。
【0047】
用語「化合物」は、本発明のアッセイと関連して説明される「試験化合物」又は「薬剤候補化合物」の文脈で本明細書で用いられる。このように、これらの化合物は、合成的に、組換えで、又は天然源に由来する、有機化合物または無機化合物を含む。
【0048】
化合物には、ポリヌクレオチド、脂質、又はホルモン類似体などの無機化合物又は有機化合物を含む。他の生体ポリマー有機試験化合物には、約2〜約40のアミノ酸を含むペプチド、及び約40〜約500のアミノ酸を含むより大きなポリペプチドを含み、これには、ポリペプチドリガンド、酵素、受容体、チャネル、抗体、又は抗体抱合体を含む。
【0049】
用語「容態」又は「疾患」は、症状(すなわち、病気)の明白な提示又は異常な臨床的指標(例えば、生化学的指標又は診断指標)の顕在化を意味する。あるいは、用語「疾患」は、遺伝的リスク若しくは環境的リスク又はこのような症状若しくは異常な臨床指標を発達させる傾向を指す。
【0050】
用語「接触する」又は「接触すること」は、インビトロの系であろうとインビボの系であろうと、少なくとも2つの部分を互いにまとめることを意味する。
【0051】
用語「ポリペプチドの誘導体」は、ポリペプチドの連続したアミノ酸残基のひと続きを含み、かつタンパク質、例えば、ポリペプチドの天然の形態のアミノ酸配列と比較してアミノ酸突然変異を有するポリペプチドの生物活性を保有する該ペプチド、オリゴペプチド、ポリペプチド、タンパク質、及び酵素に関する。誘導体はさらに、ポリペプチドの天然の形態のアミノ酸配列と比較して、追加的な天然の、変化した、グリコシル化した、アシル化した、又は非天然のアミノ酸残基を含み得る。また、誘導体は、ポリペプチドの天然の形態のアミノ酸配列と比較して、1つ以上の非アミノ酸置換基又は異種性のアミノ酸置換基、例えば、アミノ酸配列に共有結合した又は非共有結合したリポーター分子又は他のリガンドを含み得る。
【0052】
用語「ポリヌクレオチドの誘導体」は、ポリヌクレオチドの核酸残基のひと続きを含むDNA分子、RNA分子、及びオリゴヌクレオチド、例えば、ポリヌクレオチドの天然の形態の核酸配列と比較して核酸の突然変異を有し得るポリヌクレオチドに関する。誘導体はさらに、PNA、ポリシロキサン、及び2'-O-(2-メトキシ) エチル-ホスホロチオアート、非天然核酸残基、又はメチル-、チオ-、スルファート、ベンゾイル-、フェニル-、アミノ-、プロピル-、クロロ-、及びメタノカルバヌクレオシドなどの1つ以上の核酸置換基、あるいはその検出を容易にするためのリポーター分子など、修飾された骨格を有する核酸を含み得る。
【0053】
用語「内在性」は、哺乳類が天然に産生する材料を意味するものとする。用語「プロテアーゼ」、「キナーゼ」、「因子」、又は「受容体」に対する言及における内在性は、哺乳類(例えば、ヒトであって、これに限定されない。)によって天然に産生されるものを意味するものとする。対照的に、この文脈における用語非内在性は、哺乳類(例えば、ヒトであって、これに限定されない。)によって天然には産生されないものを意味するものとする。両用語は、インビボの系及びインビトロの系の両方を説明するために利用することができる。例えば、制限することなく、スクリーニングアプローチにおいて、内在性又は非内在性のTARGETは、インビトロスクリーニングの系に対する言及であり得る。さらなる例としてかつ制限することなく、哺乳類のゲノムが非内在性TARGETを含むよう操作された場合、インビトロの系による候補化合物のスクリーニングは実現性がある。
【0054】
用語「発現可能な核酸」は、タンパク質性分子、RNA分子、又はDNA分子をコードする核酸を意味する。
【0055】
用語「発現」は、内在性発現及び形質導入による過剰発現の両方を含む。
【0056】
用語「発現阻害薬」は、細胞内で通常発現される具体的なポリペプチド又はタンパク質の転写、翻訳及び/又は発現を選択的に干渉するよう設計されたポリヌクレオチドを意味する。より具体的には、「発現阻害薬」は、具体的なポリペプチド又はタンパク質をコードするポリリボヌクレオチド配列内の少なくとも約15〜30の、特に少なくとも17の連続したヌクレオチドと同一の又は相補的なヌクレオチド配列を含むDNA分子又はRNA分子を含む。典型的な発現阻害分子には、リボザイム、二本鎖siRNA分子、自己相補性一本鎖siRNA分子(shRNA)、遺伝的アンチセンスコンストラクト、及び修飾され安定化した骨格を有する合成RNAアンチセンス分子を含む。
【0057】
用語「ポリヌクレオチドの断片」は、完全な配列と実質的に類似しているが同一である必要のない活性を呈する連続した核酸残基のひと続きを含むオリゴヌクレオチドに関する。特定の態様において、「断片」は、該完全な配列の核酸配列の少なくとも5核酸残基(好ましくは、少なくとも10核酸残基、少なくとも15核酸残基、少なくとも20核酸残基、少なくとも25核酸残基、少なくとも40核酸残基、少なくとも50核酸残基、少なくとも60核酸残基、少なくとも70核酸残基、少なくとも80核酸残基、少なくとも90核酸残基、少なくとも100核酸残基、少なくとも125核酸残基、少なくとも150核酸残基、少なくとも175核酸残基、少なくとも200核酸残基、又は少なくとも250核酸残基)の核酸配列を含むオリゴヌクレオチドを指し得る。
【0058】
用語「ポリペプチドの断片」は、連続したアミノ酸残基のひと続きを含み、かつ完全な配列と実質的に類似だが同一である必要のない、機能的な、又は発現活性を呈するペプチド、オリゴペプチド、ポリペプチド、タンパク質、モノマー、サブユニット、及び酵素に関する。特定の態様において、「断片」は、該完全な配列のアミノ酸配列の少なくとも5アミノ酸残基(好ましくは、少なくとも10アミノ酸残基、少なくとも15アミノ酸残基、少なくとも20アミノ酸残基、少なくとも25アミノ酸残基、少なくとも40アミノ酸残基、少なくとも50アミノ酸残基、少なくとも60アミノ酸残基、少なくとも70アミノ酸残基、少なくとも80アミノ酸残基、少なくとも90アミノ酸残基、少なくとも100アミノ酸残基、少なくとも125アミノ酸残基、少なくとも150アミノ酸残基、少なくとも175アミノ酸残基、少なくとも200アミノ酸残基、又は少なくとも250アミノ酸残基)のアミノ酸配列を含むペプチド又はポリペプチドを指し得る。
【0059】
用語「ハイブリダイゼーション」は、一本鎖の核酸が、塩基対形成を通じて相補鎖と結合する任意のプロセスを意味する。用語「ハイブリダイゼーション複合体」は、相補性塩基間の水素結合の形成によって2つの核酸配列間に形成された複合体を指す。ハイブリダイゼーション複合体は、溶液中で形成され得(例えば、C0t又はR0t)、又は溶液中に存在する1つの核酸配列と固相支持体(例えば、紙、メンブレン、フィルター、チップ、ピン、若しくははガラススライド、又は細胞若しくは当該核酸が固定された任意の他の適切な基体)上に固定化された別の核酸配列の間に形成され得る。用語「ストリンジェントな条件」は、ポリヌクレオチドと要求されたポリヌクレオチドの間でハイブリダイゼーションを可能にする条件を指す。ストリンジェントな条件は、塩濃度、有機溶媒、例えばホルムアミドの濃度、温度、及び当技術分野で周知の他の条件によって規定することができる。特に、遠濃度を低下させること、ホルムアミドの濃度を増大させること、又はハイブリダイゼーション温度を上昇させることは、ストリンジェンシーを増すことができる。用語「標準的なハイブリダイゼーション条件」は、ハイブリダイゼーション及び洗浄の両方について5×SSC及び65℃と実質的に等価の塩条件及び温度条件を指す。しかしながら、当業者は、このような「標準的なハイブリダイゼーション条件」が、緩衝液中のナトリウム及びマグネシウムの濃度、核酸配列の長さ及び濃度、パーセントミスマッチ、パーセントホルムアミド、及びこれらの類するものによることを認識するであろう。また、ハイブリダイズする2つの配列が、RNA‐RNA、DNA‐DNA、又はRNA‐DNAであるかどうかも、「標準的なハイブリダイゼーション条件」の決定において重要である。このような標準的なハイブリダイゼーション条件は、周知の定則に従って当業者によって容易に決定され、この中で、ハイブリダイゼーションは、予測又は決定されたTm未満で典型的には10〜20℃であり、所望の場合、より高いストリンジェンシーの洗浄をともなう。
【0060】
用語「阻害する」又は「阻害すること」は、用語「応答」との関連性において、応答が、化合物の不在下とは対照的に、化合物の存在下で低下又は予防されることを意味する。用語阻害又は阻害することは、より一般的には、特に化合物の存在下対化合物の不在下で、活性又は測定可能な現象の相対的な低下、減少又は防止を指す。
【0061】
用語「阻害」は、タンパク質又はポリペプチドの発現又は活性の不在又は最小化を結果的に生じるプロセスの低下、下方制御、又はプロセスに対する刺激の除去を指す。
【0062】
用語「誘導」は、タンパク質又はポリペプチドの発現又は活性を結果的に生じるプロセスの誘導、上方制御、又は刺激を指す。
【0063】
用語「リガンド」は、内在性の天然の受容体に特異的な内在性の、天然の、又は合成の、非天然の分子を含む分子を意味する。
【0064】
用語「医薬として許容し得る塩」は、本明細書に開示されたTARGETSの発現または活性を阻害する化合物の非毒性の、無機の、及び有機の酸付加塩及び塩基付加塩を指す。これらの塩は、本発明において有用な化合物の最終的な単離及び精製の間にインサイツで調製することができる。
【0065】
用語「ポリペプチド」は、タンパク質(TARGETSなど)、タンパク質性分子、タンパク質の断片、モノマー、ポリマータンパク質のサブユニット又は部分、ペプチド、オリゴペプチド、及び酵素(キナーゼ、プロテアーゼ、GPCRなど)に関する。
【0066】
用語「ポリヌクレオチド」は、一本鎖又は二本鎖の形態における、及びセンス又はアンチセンスの向きにおけるポリ核酸、ストリンジェントな条件下で特定のポリ核酸とハイブリダイズする相補的なポリ核酸、その塩基対の少なくとも約60%で、より具体的には、その塩基対の70%が共通である、最も具体的には90%、及び特定の実施態様においてはその塩基対の100%で相同であるポリヌクレオチドを意味する。ポリヌクレオチドには、ポリリボ核酸、ポリデオキシリボ核酸、及びそれらの合成類似体を含む。また、ポリヌクレオチドには、ペプチド核酸(PNA)、ポリシロキサン、及び2'-O-(2-メトキシ)エチルホスホロチオアートなどの修飾された骨格を有する核酸も含む。ポリヌクレオチドは、長さが変動し、約10〜約5000塩基、特に約100〜約4000塩基、より具体的には約250〜約2500塩基に及ぶ配列によって説明される。1つのポリヌクレオチド実施態様は、長さ約10〜約30塩基を含む。ポリヌクレオチドの特定の実施態様は、約17〜約22ヌクレオチドのポリヌクレオチドであり、低分子干渉RNA(siRNA‐二本鎖siRNA分子又は自己相補的な一本鎖siRNA分子(shRNA))としてより普遍的に説明される。別の特定の実施態様は、ペプチド核酸(PNA)、ポリシロキサン、及び2'-O-(2-メトキシ)エチルホスホロチオアートなどの修飾された骨格を有する核酸、又は非天然の核酸残基、若しくはメチル-カルバヌクレオシド、チオ-カルバヌクレオシド、スルファートカルバヌクレオシド、ベンゾイル-カルバヌクレオシド、フェニル-カルバヌクレオシド、アミノ-カルバヌクレオシド、プロピル-カルバヌクレオシド、クロロ-カルバヌクレオシド、及びメタノカルバヌクレオシドなどの1つ以上の核酸置換基、若しくはその検出を容易にするリポーター分子を含む核酸である。本明細書のポリヌクレオチドは、特定の標的DNA配列の異なる鎖と「実質的に」相補的であるよう選択される。このことは、ポリヌクレオチドが、その個々の鎖とハイブリダイズするよう十分相補的でなければならないことを意味する。それゆえ、ポリヌクレオチド配列は、標的配列の実際の配列を反映する必要はない。例えば、非相補的なヌクレオチド断片は、ポリヌクレオチドの5'末端に結合し得、ポリヌクレオチドの配列の残りは前記鎖と相補的である。あるいは、非相補的な塩基又はより長い配列は、ポリヌクレオチドに散在することができ、但し、ポリヌクレオチド配列が、ストリンジェントな条件下でハイブリダイズするのに、又は伸長産物の合成のためのテンプレートを形成するのに十分な相補性を有することを条件とする。
【0067】
用語「予防すること(preventing)」又は「予防(prevention)」は、疾患を生じる薬剤に曝露され得る、又は疾患の発症の前に疾患に罹患しやすくし得る対象において、疾患又は障害を獲得又は発達させる危険の低下を指す。
【0068】
用語「予防(prophylaxis)」は、用語「予防(prevention)」と関連し、該用語に包含され、その目的が疾患を治療又は治癒させるよりもむしろ予防する(prevent)測定又は手順を指す。予防的(prophylactic)測定に関する制限のない例には、ワクチンの投与;例えば運動抑制による血栓症についての危険にある入院患者に対する低分子量ヘパリンの投与;及びマラリアが風土性である又はマラリアにかかる危険性が高い地理的領域への訪問の前のクロロキンなどの抗マラリア薬の投与を含み得る。
【0069】
用語「溶媒和物」は、本発明において有用な化合物と1つ以上の溶媒分子との物理的会合を意味する。この物理的会合には水素結合を含む。ある場合において、溶媒和物は、例えば、1つ以上の溶媒分子が結晶性固体の結晶格子に組み込まれる場合、単離することができるであろう。「溶媒和物」は、液相の溶媒和物及び単離可能な溶媒和物の両方を包含する。代表的な溶媒和物には、水和物、エタノラート(ethanolate)、及びメタノラート(methanolate)を含む。
【0070】
用語「対象」には、ヒト及び他の哺乳類を含む。
【0071】
「治療有効量」は、医師または他の臨床家によって探究されている対象の生物学的応答又は医学的応答を誘発するであろう薬剤、化合物、発現阻害薬、又は医薬剤の量を意味する。
【0072】
任意の疾患又は障害の用語「治療すること」又は「治療」は、一実施態様において、疾患又は障害を寛解させること(すなわち、疾患を抑止すること、又はその臨床的症状の少なくとも1つの徴候、程度、若しくは重症度を低下させること)を指す。別の実施態様において、「治療すること」又は「治療」は、対象によって認識不可能かもしれない少なくとも1つの身体的パラメータを寛解させることを指す。さらに別の実施態様において、「治療すること」又は「治療」は、疾患又は障害を身体的に(例えば、認識可能な症状の安定化)、生理学的に(例えば、身体的パラメータの安定化)、又はその両方のいずれかで調節することを指す。さらなる実施態様において、「治療すること」又は「治療」は、疾患の進行を遅延させることに関する。
【0073】
また、用語「べクター」は、プラスミドに、及び組換えウイルスなどのウイルスベクター、又は組換えウイルスをコードする核酸に関する。
【0074】
用語「脊椎動物細胞」は、魚、鳥類、爬虫類、両生類、有袋類、及び哺乳類の種を含む、脊椎構造を有する動物由来の細胞を意味する。好ましい細胞は、哺乳類種由来であり、最も好ましい細胞はヒト細胞である。哺乳類細胞には、ネコ、イヌ、ウシ、ウマ、ヤギ、ヒツジ、マウス及びラットなどのブタネズミ、並びにウサギを含む。
【0075】
用語「TARGET」又は「TARGETS」は、本明細書に説明されたアッセイに従って同定されかつECM及び/又は軟骨の変性を包含されると決定されたタンパク質を意味する。用語TARGET又はTARGETSは、スプライスバリアント、対立遺伝子バリアント、フレームエクソンにおける代替物、及び代替的な又は成熟前の終止部位又は開始部位などのバリアントを含み及び予期し、これらには、表1に示されるようなそれらの公知の又は認識されたアイソフォーム又はバリアントを含む。
【0076】
用語「ECM及び/又は軟骨の変性を特徴とする疾患」は、細胞外マトリックスの分解又は軟骨における分解を包含する、該分野を少なくとも一部結果として生じる、又は該分野を含む疾患又は容態を指し、又はこの中で、軟骨及び/又はECMの分解、変性、又は損失は、軟骨及び/又はECMの生成又は再生を超過する。前記用語には、変形性関節症、関節リウマチ、乾癬性関節炎、若年性関節リウマチ、痛風性関節炎、化膿性又は感染性関節炎、反応性関節炎、反射性交感神経性ジストロフィー、有痛性骨萎縮症、ティーツェ症候群又は肋軟骨炎、線維筋痛症、骨軟骨炎、神経原性又は神経障害性関節炎, 関節症、地方性変形性骨軟骨関節症のような風土性形態の関節炎、 ムセルニ病、及びハンディゴデュ病;線維筋痛症、全身性エリテマトーデス、強皮症、強直性脊椎炎、遺伝性軟骨溶解、軟骨異形成症、及び偽軟骨異形成(pseudoachondrodysplasias)を含む先天性軟骨形成異常、並びに先天性軟骨形成異常と関連した疾患、例えば小耳症、無耳症、及び骨幹端軟骨異形成症から結果として生じる変性から選択される典型的な疾患を含むが、これらに限定されない。
【0077】
用語「炎症を特徴とする疾患」は、炎症を包含する、炎症から少なくとも一部結果として生じる、又は炎症を含む疾患を指す。前記用語には、アレルギー性気道疾患(例えば、喘息、鼻炎)、自己免疫疾患、移植片拒絶反応、クローン病、関節リウマチ、乾癬、若年性特発性関節炎、大腸炎、及び炎症性腸疾患から選択される典型的な疾患を含むが、これらに限定されない。
【0078】
(TARGETS)
本発明は、TARGETSが、軟骨細胞の異化過程の制御における因子、特に阻害が軟骨及び/又はECMの異化作用の低下をもたらす因子であるという本発明者らの発見に基づいている。このような疾患は、軟骨及び/又はECMの分解と関連したタンパク質、例えば限定するわけではないが、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4、特にMMP13の発現を追うことによってモニターされ得る。用語「TARGET」又は「TARGETS」は、ECM及び/又は軟骨の分解の阻害に関与することが下記に説明されているアッセイに従って同定されたタンパク質を意味する。
【0079】
下記の表1に列挙されたTARGETSは、本明細書において、軟骨の異化作用を制御又は調節する経路に関与するものとして、特に軟骨の異化作用を阻害することに関与するものとして同定され、それゆえ、これらのTARGETSの阻害薬は、軟骨細胞の分解を阻害することができ、軟骨の分解を特徴とする疾患の予防及び/又は治療において使用される。
【0080】
また、TARGETSは、炎症過程における因子であり、特にTARGETSは、炎症誘発性刺激に対する応答、特にIL1刺激に対する応答の低下に関与するものとして同定され、それゆえ、これらのTARGETSの阻害薬は、炎症過程を阻害することができ、炎症を特徴とする疾患の予防及び/又は治療において使用される。
【0081】
それゆえ、一態様において、本発明は、化合物を配列番号22〜42の配列のポリペプチド(TARGETS)又はその断片のアミノ酸配列を含むポリペプチドと、該ポリペプチドが化合物に結合できる条件下で接触させること、及びポリペプチドと化合物の間の複合体形成を検出することを含む、ECM及び/又は軟骨の分解を低下させあるいは炎症を阻害する化合物をアッセイする方法に関する。特に、該方法は、軟骨の分解を阻害する薬剤を同定するために用いられる。特に該方法は、軟骨細胞を介した軟骨の分解を阻害する薬剤候補化合物を同定するために用いられ得る。代替的な実施態様において、方法は、炎症を阻害する薬剤を同定するために用いられる。代替的な実施態様において、方法は、ECM分解を阻害する薬剤を同定するために用いられる。複合体形成を測定する1つの好ましい手段は、該化合物の該ポリペプチドに対する結合親和性を決定することである。
【0082】
より具体的には、本発明は、軟骨細胞によるECM及び/又は軟骨の分解を低下させる薬剤を同定する方法に関し、該方法は下記を含む:
(a)軟骨細胞の集団を、TARGETポリペプチド又はその断片に対する結合親和性を呈する1つ以上の化合物と接触させること、並びに
(b)ECM及び/または軟骨の分解の阻害と関連した化合物‐ポリペプチド特性を測定すること。
【0083】
本発明のさらなる態様において、該方法は、例えば、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4を含む1つ以上の軟骨分解酵素の発現又は活性を調節する化合物を同定するために用いられる。特に、MMP13発現の阻害が測定され得る。
【0084】
本発明のさらなる態様において、該方法は、例えばIL‐1b、IL‐6、IL‐8、IL‐11、TNFα、及び/又はLIFを含む1つ以上の炎症性サイトカインの発現又は活性を調節する化合物を同定するために用いられる。
【0085】
さらなる態様において、本発明は、化合物を配列番号22〜42からなる群から選択されるアミノ酸配列又はその断片を含むポリペプチドと、該化合物が、ポリペプチドの活性又は発現を調節することのできる条件下で接触させること、及びポリペプチドの活性又は発現を決定することを含む、軟骨及び/又はECMの分解を阻害する薬剤候補化合物をアッセイする方法に関する。特に、該方法は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現を抑制すること、特にMMP13の発現を抑制することができる薬剤候補化合物を同定するために用いられ得る。特に、該方法は、正常ヒト関節軟骨細胞(NHAC)におけるMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4、特にMMP13の発現を抑制することができる薬剤候補化合物を同定することであり得る。ポリペプチドの活性又は発現を測定する1つの特定の手段は、抗体などのポリペプチド結合剤を用いて該ポリペプチドの量を決定すること、又は生物学的測定若しくは生化学的測定において該ポリペプチドの活性を、例えば、キナーゼポリペプチドの標的のリン酸化の量、若しくは、酵素による又は酵素の基質ポリペプチドに関する分解の量を決定することである。
【0086】
先に言及された化合物‐ポリペプチド特性は、ECM及び/又は軟骨の分解の阻害に関し、当業者によって選択された測定可能な現象である。測定可能な特性は例えば、ポリペプチドTARGETのペプチドドメインに対する結合親和性、又は軟骨細胞による低い異化作用のいくつかの生化学的マーカーレベルのうちの任意の1つのレベルであり得る。軟骨細胞の異化作用の阻害は例えば、分解経路の一部として誘導されるタンパク質及び他の分子のレベルを測定することによって測定することができる。特に、MMP13のレベルが測定され得る。
【0087】
加えて、ECM及び/又は軟骨分解の阻害と関連した化合物‐ポリペプチド特性は、正常ヒト関節軟骨細胞(NHAC)、SW1353(軟骨肉腫細胞)、線維芽細胞(例えば、滑膜線維芽細胞)、又は分化した間葉系幹細胞培養物において測定され得る。ある程度まで、このようなタンパク質は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4発現を含む軟骨分解酵素の発現を呈する細胞において測定され得る。しかしながらまた、このようなタンパク質は、代替的な細胞系においても測定される。例えば、化合物が本発明のポリペプチドに結合する親和性を決定するインサイツ結合アッセイは、ポリペプチドを発現する任意の細胞種類を用いて実施される。ポリペプチドの発現は外来性又は内在性である。さらに、化合物‐ポリペプチド特性が生物学的経路の活性化である場合、経路の細胞構成要素を含む任意の細胞を用いて、化合物‐ポリペプチド特性を測定する。細胞は、これらの構成要素を本質的に含み得、あるいは1つ以上の構成要素を発現するよう、又は標識され若しくは測定可能な構成要素のバリアントを発現するよう操作され得る。例えば、NHACのIL‐1刺激に応じたMMP13の誘導は、軟骨及び/又はECM分解を示す。具体的に、細胞は、MMP13プロモーターによって活性化されたリポーター分子を含むよう操作することができる。この方法で、代替的な細胞を用いて、軟骨及び/又はECM分解の阻害を示す特性を測定することができる。
【0088】
追加的な態様において、本発明は、化合物を、配列番号1〜21からなる群から選択される核酸配列又はその断片を含む、TARGETポリペプチドをコードする核酸と、該核酸が化合物に結合できる又はそうでなければ会合できる条件下で接触させること、及び核酸と化合物の間における複合体の形成を検出することを含む、軟骨及び/又はECMの分解を阻害する薬剤候補化合物をアッセイする方法に関する。特に、該方法は、分解経路の一部として誘導されるタンパク質及び他の分子のレベルを低下させることのできる薬剤候補化合物を同定するために用いられ得る。特に、該方法は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4のレベルを低下させることのできる薬剤候補化合物を同定するために用いられ得る。特に、該方法は、MMP13のレベルを低下させることのできる薬剤候補化合物を同定するために用いられ得る。複合体形成を測定する1つの特定の手段は、該化合物の該核酸に対する結合親和性、又は複合体の存在を、ヌクレアーゼに対する耐性によって又はゲル移動度アッセイによって決定することである。あるいは、複合体形成は、核酸の転写又は翻訳の阻害によって決定され得る。
【0089】
本発明は、軟骨及び/又はECMの分解を低下させる化合物を同定する方法に関し、該方法は下記の工程を含む:表1に列挙されたもののうちの任意の1つのポリペプチド又はその機能的断片若しくは誘導体を発現する細胞の集団を培養する工程;該細胞の集団におけるIL‐1刺激に応じて第一のレベルのMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4発現を決定する工程;該細胞の集団を化合物又は化合物の混合物に曝露する工程;該細胞の集団の化合物又は化合物の混合物への曝露の間又は後に該細胞の集団におけるIL‐1刺激に応じてMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4発現のレベルを決定する工程;並びに軟骨及び/又はECMの分解の低下を予測するMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現を低下させる化合物を同定する工程。具体的な実施態様において、先の方法において測定された軟骨分解酵素はMMP13である。
【0090】
より特定には、本発明は、炎症を低下させる薬剤を同定する方法に関し、該方法は下記を含む:
(a)細胞の集団を、TARGETポリペプチド又はその断片に対する結合親和性を呈する1つ以上の化合物と接触させること、及び
(b)炎症の阻害と関連した化合物‐ポリペプチド特性を測定すること。
【0091】
一実施態様において、炎症の阻害と関連した化合物‐ポリペプチド特性は、IL1刺激に対する細胞の応答である。さらなる実施態様において、薬剤は、IL1刺激に対する細胞の応答を低下させることができる。
【0092】
また、本発明は、表1に列挙されたポリペプチドの任意の1つの発現及び/又は活性を低下させる化合物を同定する方法にも関し、該方法は、以下の工程を含む:該ポリペプチド、又はその断片、若しくはその誘導体を発現する細胞の集団を培養する工程;該ポリペプチドの第一レベルの発現及び/又は活性を決定する工程;該細胞の集団を化合物又は化合物の混合物に曝露する工程;該細胞の集団の化合物又は化合物の混合物への曝露の間又は後に該ポリペプチドの発現及び/又は活性のレベルを決定する工程;並びに該ポリペプチドの発現及び/又は活性を低下させる化合物を同定する工程。ポリペプチド活性が容易に測定可能でない場合、化合物の同定は、該細胞の集団を該ポリペプチドのアゴニストに曝露することを含む余分な工程から利益を得ることができる。さらに、本発明の方法は、該細胞の集団において、表1に列挙されたポリペプチドの任意の1つをコードする遺伝子を導入する工程を含み得る。高処理目的のために、遺伝子を該細胞のゲノムに安定して組み込ませることは有益であり得る。
【0093】
好ましい実施態様において、軟骨及び/又はECMの分解の阻害のレベルは、マーカー遺伝子の発現レベルを測定することによって決定され、この中で、特定のマーカー遺伝子は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4をコードする。具体的な実施態様において、MMP13の発現及び/又は活性が測定される。具体的な実施態様において、MMP13の発現及び/又は活性は低い。
【0094】
本発明の特定の実施態様において、TARGETポリペプチドは、表1に列挙された配列22〜42からなる群から選択されるアミノ酸配列を含む。本発明の実施態様において、TARGETポリペプチドをコードすることのできる核酸は、表1に列挙された配列番号1〜21からなる群から選択される核酸配列を含む。表1は、2つ以上の受入番号及び配列番号が示されている認識されたバリアント又はアイソフォームを含むTARGETの典型的なヒト核酸及びタンパク質配列を提供する。TARGET(S)のアイソフォーム又はバリアントには、フレームエクソンにおける代替物、選択的スプライシング又はスプライスバリアント、及び選択的又は成熟前終止バリアント(termination variant)を有する又は利用する核酸又はタンパク質を含む。
【表1】


【0095】
本発明は、特定の一実施態様において、ポリペプチドがGPCRである新規の化合物を同定する方法を提供する。もしそうである場合、該GPCRの発現及び/又は活性は好ましくは、セカンドメッセンジャーのレベルを測定することによって決定される。好ましいセカンドメッセンジャーは、サイクリックAMP、Ca2+、又はその両方である。典型的には、セカンドメッセンジャーのレベルは、セカンドメッセンジャーに応答するプロモーターの制御下でリポーター遺伝子を用いて決定され、この中で、プロモーターが、サイクリックAMP応答性プロモーター、NF‐KB応答性プロモーター、又はNF‐AT応答性プロモーターであることが好ましく、かつこの中で、リポーター遺伝子は、アルカリホスファターゼ、GFP、eGFP、dGFP、ルシフェラーゼ、及びβ‐ガラクトシダーゼからなる群から選択される。GPCRである典型的なTARGETは、表1に列挙され、GPR34、GPR43、MC3R、及びEDG4を含む。
【0096】
別の特定の実施態様において、本発明は、ポリペプチドがキナーゼ又はホスファターゼである新規の化合物を同定する方法を提供する。好ましくは、該キナーゼ又はホスファターゼの活性は、該キナーゼ又はホスファターゼの基質のリン酸化のレベルを測定することによって決定される。キナーゼである典型的なTARGETSは、表1に列挙されており、MET、STK32B、MAP2K2、MAP4K1、EPHA5、及びCSNK1G2を含み、キナーゼである好ましいTARGETSは、STK32B、EPHA5、及びCSNK1G2からなる群から選択される。キナーゼである特定の好ましいTARGETSは、EPHA5及びCSNK1G2である。
【0097】
さらに別の特定の実施態様において、本発明は、ポリペプチドがプロテアーゼである新規の化合物を同定する方法を提供する。好ましくは、該プロテアーゼの活性は、該プロテアーゼの基質の切断のレベルを決定することによって測定される。プロテアーゼである典型的なTARGETSは、表1に列挙されており、ADAMTS6及びADAM15を含む。
【0098】
さらに別の特定の実施態様において、本発明は、ポリペプチドがイオンチャネルである新規の化合物を同定する方法を提供する。イオンチャネルである典型的なTARGETは、表1に列挙されており、KCNN4である。
【0099】
セカンドメッセンジャーレベルを決定する方法、リポーター遺伝子及びセカンドメッセンジャー応答性プロモーターの使用、並びにホスファターゼアッセイ及びプロテアーゼアッセイは、当技術分野で周知であり、本明細書でさらに詳しく述べることはない。
【0100】
好ましい実施態様において、ポリペプチドを阻害する化合物は、最高10マイクロモル濃度のポリペプチドに対する結合親和性を呈する。
【0101】
本発明の好ましい実施態様において、ポリペプチドTARGETは、配列番号22〜42からなる群から選択されるアミノ酸配列を含む(表1)。
【0102】
当業者の選択に応じて、本アッセイ方法は、一連の測定として機能するよう設計でき、その各々は、薬剤候補化合物が、実際にポリペプチドに作用していて、それにより軟骨及び/又はECMの分解を阻害するかどうか、あるいは炎症を阻害するかどうかを決定するよう設計される。例えば、ポリペプチド又はその断片に対する化合物の結合親和性を決定するよう設計されたアッセイは、対象に投与される場合、試験化合物が、ECM及び/又は軟骨の分解を低下させるのに有用であろうかどうかを確かめるために、あるいは試験化合物が炎症を低下させるのに有用であろうかどうかを確かめるために必要かもしれないが十分ではないかもしれない。それにもかかわらず、このような結合情報は、生化学的経路へとさらに上る異なる特性を測定するであろうアッセイ、例えば、下記に説明されるMMP13アッセイ又は軟骨外植片を用いたアッセイにおける使用のための1セットの試験化合物を同定する上で有用であろう。このような第二のアッセイは、ポリペプチドに対する結合親和性を有する試験化合物がインビトロ又はインビボで、軟骨及び/又はECMの分解を実際に低下させること、又は炎症を低下させることを確認するために設計され得る。
【0103】
好適な対照は常に、偽陽性の読み取りに対してしかるべき所で保証すべきである。本発明の特定の実施態様において、スクリーニング方法は、化合物を好適な対照と比較する追加的な工程を含む。一実施態様において、対照は、試験化合物と接触しなかった細胞又は試料であり得る。代替的な実施態様において、対照は、TARGETを発現しない細胞であり得;例えば、このような実施態様の一態様において、試験細胞は、TARGETを天然に発現でき、対照細胞は、TARGETの発現を阻害又は予防する薬剤、例えばsiRNAと接触し得る。あるいは、このような実施態様の別の態様において、その未変性状態における細胞は、TARGETを発現せず、試験細胞は、TARGETを発現するよう操作されており、それにより本実施態様において、対照は、形質転換されていない未変性細胞であり得る。また又はそうでなければ、対照は、サイトカイン、例えばIL1、TNFα、OSM、又は他の炎症性メディエーター(例えば、LPA又は活性酸素種)を用いて処理された細胞など、炎症あるいはECM及び/又は軟骨の分解の公知のメディエーターを利用し得る。典型的な対照が本明細書で説明されているが、このことは制限として取られるべきではなく;使用されている実験条件について適切な対照を選択することは当業者の範囲内である。
【0104】
これらの測定をする順番は、任意の順番で実施され得る本発明の実施にとって必須であると考えられていない。例えば、ポリペプチドに対する化合物の結合親和性に関して何ら情報が知られていない1セットの化合物のスクリーニングアッセイが最初に実施され得る。あるいは、ポリペプチドドメインに対する結合親和性を有するものとして同定された1セットの化合物、又はポリペプチドの阻害薬であると同定された1クラスの化合物がスクリーニングされ得る。しかしながら、薬剤候補化合物の究極的な使用にとって本アッセイが意味のあるものとなるために、炎症、ECM分解、及び/又は軟骨分解に関する直接的な測定が貴重である。それにもかかわらず、対照を含めた確認試験、及び本発明のポリペプチドに対する結合親和性の測定は、任意の治療的又は診断的応用において有用な化合物を同定する上で有用である。
【0105】
当技術分野で認識された方法及びアッセイに基づいた類似のアプローチは、軟骨及び/又はECMの分解を特徴とする任意の種々の疾患におけるTARGETS及び化合物に関して適用可能であり得る。1つのアッセイ又はアッセイ類は、TARGETに対する結合親和性を有する試験化合物が、軟骨及び/又はECMの分解を阻害することを確認するよう設計され得る。1つのこのような方法において、コラゲナーゼなどの軟骨分解酵素の発現及び/活性が測定される。1つの特定のこのような方法において、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性が測定される。1つの特定のこのような方法において、MMP13の発現及び/又は活性が測定される。
【0106】
当技術分野で認識された方法及びアッセイに基づいた類似のアプローチは、炎症を特徴とする任意の種々の疾患におけるTARGETS及び化合物に関して適用可能であり得る。1つのアッセイ又はアッセイ類は、TARGETに対する結合親和性を有する試験化合物が、炎症を阻害することを確認するよう設計され得る。1つのこのような方法において、コラゲナーゼなどの軟骨分解酵素の発現及び/又は活性が測定される。1つの特定のこのような方法において、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性が測定される。1つの特定のこのような方法において、MMP13の発現及び/又は活性が測定される。代替的な方法において、IL‐1b、IL‐6、IL‐8、IL‐11、TNFα、及び/又はLIFから選択される1つ以上の炎症性サイトカインのレベルが測定される。
【0107】
本アッセイ方法は、モノマー、ポリマータンパク質の部分又はサブユニット、ペプチド、オリゴペプチド、及びそれらの酵素活性のある部分を含む、TARGETタンパク質又はその断片の1つ以上を用いて、インビトロで実施され得る。
【0108】
化合物とポリペプチドTARGETとの結合親和性は、表面プラズモン共鳴バイオセンサー(Biacore)を用いて、標識した化合物を用いた飽和結合分析によって(例えば、Scatchard及びLindmo分析)、差次的紫外線分光光度計、蛍光偏光アッセイ、蛍光画像化プレートリーダー(FLIPR(登録商標))システム、蛍光共鳴エネルギー転移、及び生物発光共鳴エネルギー移動によってなど、当技術分野で公知の方法によって測定することができる。また、化合物の結合親和性は、解離定数(Kd)又はIC50又はEC50において表すことができる。IC50は、ポリペプチドに対する別のリガンドの結合の50%阻害に必要な化合物の濃度を表す。EC50は、TARGET機能を測定する任意のアッセイにおける最大効果の50%を得るのに必要な濃度を表す。解離定数Kdは、リガンドがポリペプチドにどれほど十分に結合しているかの測定結果であり、ポリペプチドにおける結合部位の実際に半分を飽和させるのに必要なリガンド濃度と等価である。高い親和性の結合を有する化合物は、低いKd、IC50、及びEC50を有し、すなわち、100nM〜1pMの範囲にあり;中程度〜低い親和性の結合は高いKd、IC50、及びEC50に関し、すなわちマイクルモル濃度の範囲にある。
【0109】
また、本アッセイ方法は、細胞アッセイにおいても実施できる。TARGETを発現する宿主細胞は、内在性発現を有する細胞、又は例えば形質導入によってTARGETを過剰発現している細胞であることができる。ポリペプチドの内在性発現が、容易に測定することのできるベースラインを決定するのに十分ではない場合、TARGETを過剰発現する宿主細胞を用いて使用され得る。過剰発現は、TARGET基質末端産物のレベルが、内在性発現による活性レベルよりも高いという利点を有する。従って、現に利用可能な技術を用いてこのようなレベルを測定することはより容易である。1つのこのような細胞アッセイにおいて、TARGETの生物学的活性は、軟骨構成要素合成の産生を追随することによって測定され得る。
【0110】
炎症、ECM及び/又は軟骨の分解を阻害する化合物を同定する本方法の1つの実施態様は、TARGETポリペプチド又はその断片若しくは誘導体を発現する細胞の集団を培養すること;細胞の集団の活性化に関して該細胞の集団における第一のレベルのMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4を決定すること(例えば、IL1を用いた刺激による。);該細胞の集団を化合物又は化合物の混合物に曝露すること;該化合物又は該化合物の混合物への該細胞の集団の曝露と同じ活性化の後、前記曝露の間、又は前記曝露の後、該細胞の集団における第二のレベルのMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現又は活性を決定すること;並びにMMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4、特にMMP13の発現及び/又は活性を抑制する化合物を同定することを含む。具体的な実施態様において、細胞は軟骨細胞である。具体的な実施態様において、細胞は哺乳類細胞である。具体的な実施態様において、細胞はヒト細胞である。
【0111】
MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性は、本明細書に説明された方法など、当技術分野で公知の方法によって決定することができる。
【0112】
本発明者らは、「ノックダウン」ライブラリーを用いることによって、炎症、軟骨及び/ECMの分解の阻害に関与するTARGET遺伝子を同定した。この種類のライブラリーは、siRNA分子が組換えアデノウイルスによって細胞へと形質導入されたスクリーンであり、前記siRNA分子は、細胞における具体的な遺伝子の発現並びに相応の遺伝子産物の発現及び活性を阻害又は抑制する。ウイルスベクターにおける各siRNAは、具体的な天然遺伝子に対応する。MMP13の発現の抑制によって測定されるように、軟骨の分解を阻害するsiRNAを同定することによって、具体的な遺伝子発現と炎症、軟骨及び/又はECMの分解を阻害するための経路の間に直接的な相関を引くことができる。次に、ノックダウンライブラリー(本明細書で「TARGET」ポリペプチドと呼ばれるそのタンパク質発現産物)を用いて同定されるTARGET遺伝子は、ECM及び/又は軟骨の分解と関連する疾患の治療に用いることのできる化合物を同定する本発明の方法において用いられる。実際、表2に列挙された配列(配列番号43〜57)を含むshRNA化合物は、これらのTARGET遺伝子の発現及び/活性を阻害し、MMP13の発現を低下させ、軟骨及び/又はECMの分解あるいは炎症をもたらす経路におけるTARGETSの役割を確認する。
【表2】

【0113】
本発明はさらに、炎症並びに/あるいは軟骨及び/又はECMの分解を低下させる化合物を同定する方法に関し、下記を含む:
(a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドと接触させること;
(b)該化合物の該ポリペプチドに対する結合親和性を決定すること;
(c)該ポリペプチドを発現する哺乳類細胞の集団を、少なくとも10マイクロモル濃度の結合親和性を呈する化合物と接触させること;及び
(d)IL‐1に対する応答を低下させる、あるいはECM及び/若しくは軟骨を分解するよう作用する酵素の合成並びに/又は該酵素の存在を示す関連マーカーを低下させる化合物を同定すること。
【0114】
一態様において、アッセイ方法には、該ポリペプチドを発現する細胞を、マイクロモル濃度の範囲における結合親和性を呈する化合物と接触させることを含む。一態様において、呈される結合親和性は、少なくとも10マイクロモル濃度である。一態様において、結合親和性は、少なくとも1マイクロモル濃度である。一態様において、結合親和性は、少なくとも500ナノモル濃度である。
【0115】
アッセイ方法は、酵素活性を含むがこれに限定されないTARGETポリペプチドの特定の発現又は活性に基づき得る。プロテアーゼTARGET ADAMTS6(配列番号29)、又はADAM15(配列番号31、32、33、34、35、又は36)についてのアッセイは、プロテアーゼの活性又は発現に基づき得る。キナーゼTARGETについてのアッセイは、MET(配列番号22)、STK32B(配列番号23)、MAP2K2(配列番号28)、MAP4K1(配列番号37)、EPHA5(配列番号39又は40)、及びCSNK1G2(配列番号41)として同定され、標的タンパク質のリン酸化または脱リン酸化を含むがこれらに限定されないキナーゼ又はホスファターゼの活性又は発現に基づき得る。GPR34(配列番号24、25、又は26)、GPR43(配列番号27)、MC3R(配列番号39)、及びEDG4(配列番号42)として同定されるGPCR TARGETについてのアッセイは、下流のメディエーター又は活性化因子を含む、GPCRの活性又は発現に基づき得る。KCNN4(配列番号30)として同定されるイオンチャネルTARGETについてのアッセイは、イオンチャネルを開閉し、それにより膜を通じて又は細胞内で蛍光色素又はトレーサーの濃度を変化させる化合物の能力を測定する古典的なパッチクランプ、高処理量蛍光ベースの、又はトレーサーベースのアッセイを含む、当業者に周知の技術を用い得る。測定可能な現象、活性、又は特性は、当業者によって選択(selected)又は選択され(chosen)得る。当業者は、当技術分野における当業者の知識及び専門的意見を用いて、多くのアッセイフォーマット、システム、又は設計のうちの任意から選択し得る。
【0116】
表1は、同定されたポリペプチドのクラスを含む、下記に説明されたMMP13アッセイにおける出願人のノックダウンライブラリーを用いて同定されたTARGETSを列挙する。TARGETSは、例えば、キナーゼ、ホスファターゼ、プロテアーゼ、GPCR、及びイオンチャネルを含むポリペプチドクラスにおいて同定されている。化合物の存在下又は不在下で測定が実施されるキナーゼによる基質のリン酸化を測定することによって、キナーゼの活性を決定する具体的な方法は、当技術分野で周知である。
【0117】
プロテアーゼであるポリペプチドによる基質の切断を測定することによって化合物による阻害を決定する具体的な方法は、当技術分野で周知である。古典的には、蛍光基がペプチド配列を通じて消光剤に連結された基質が用いられ、前記ペプチド配列は、標的プロテアーゼによって切断することのできる基質である。リンカーの切断は、蛍光基及び消光剤を分離し、蛍光の増大を生じる。
【0118】
イオンチャネルは、膜タンパク質複合体であり、その機能は、生体膜を通過するイオンの拡散を容易にすることである。膜又は脂質二重層は、親水性のかつ帯電した分子に対して疎水性の低い誘電性遮蔽を構築する。イオンチャネルは、膜の疎水性の内部を通過する高い伝導性の親水性経路を提供する。イオンチャネルの活性は、古典的なパッチクランプを用いて測定することができる。また、高処理量蛍光ベースの又はトレーサーベースのアッセイも、イオンチャネルの活性を測定するために広範に利用可能である。これらの蛍光ベースのアッセイは、イオンチャネルを開閉のいずれかをし、それにより膜を通じての具体的な蛍光色素の濃度を変化させる能力に基づいて化合物をスクリーニングする。トレーサーベースのアッセイの場合、細胞内及び細胞外のトレーサーの濃度の変化は、放射能測定又は気相吸光分析(gas absorption spectrometry)によって測定される。
【0119】
Gタンパク質共役受容体(GPCR)は、エフェクタータンパク質を活性化することができ、それにより細胞におけるセカンドメッセンジャーレベルにおける変化を結果的に生じる。GPCRの活性は、このようなセカンドメッセンジャーの活性レベルを測定することによって決定することができる。細胞における2つの典型的な重要かつ有用なセカンドメッセンジャーは、サイクリックAMP(cAMP)及びCa2+である。セカンドメッセンジャーの活性レベルは、当業者に公知の方法によって、ELISA若しくは放射能技術のいずれかによって、又はCa2+と接触した場合に蛍光シグナル若しくは発光シグナルを生じる基質を用いることによって直接的に、あるいは、リポーター遺伝子分析によって間接的に測定することができる。1つ以上の二次メッセンジャーの活性レベルは、プロモーターによって制御されたリポーター遺伝子を用いて典型的に決定され得、この中で、プロモーターは、セカンドメッセンジャーに対して応答する。このような目的のための当技術分野で公知の及び用いられるプロモーターは、細胞におけるサイクリックAMPレベルに応答するサイクリックAMP応答プロモーター、及び細胞における細胞質Ca2+レベルに対して感受性のあるNF‐AT応答プロモーターである。リポーター遺伝子は典型的に、容易に検出可能な遺伝子産物を有する。リポーター遺伝子は、宿主細胞において安定して感染させることができるか、又は一過性にトランスフェクトされることができるかのいずれかである。有用なリポーター遺伝子は、アルカリホスファターゼ、増強した緑色蛍光タンパク質、脱安定化した緑色蛍光タンパク質、ルシフェラーゼ、及びβ-ガラクトシダーゼである。
【0120】
ポリペプチドを発現する細胞は、ポリペプチドを天然に発現する細胞であり得、又は細胞は、先に説明したとおり、ポリペプチドを発現するようトランスフェクトされ得る。また、細胞は、ポリペプチドを過剰発現するよう形質導入され得、又はポリペプチドの非内在性形態を発現するようトランスフェクトされ得、これらは示差的にアッセイ又は評価することができる。
【0121】
1つの特定の実施態様において、本発明の方法はさらに、細胞の集団をポリペプチドのアゴニストと接触させる工程を含む。これは、細胞のある選択された集団におけるポリペプチドの発現が、その活性の適切な検出にとってあまりにも低い方法において有用である。アゴニストを用いることによって、ポリペプチドが誘発され、化合物がポリペプチドを阻害する場合、適切な読み出しを可能にし得る。類似の考え方は、炎症性メディエーターの放出の測定に適用する。特定の実施態様において、本方法において用いられる細胞は、哺乳類NHACである。NHACは、予期されるアッセイにおいて活性化され得る(例えば、IL1による刺激による。)。
【0122】
炎症又は軟骨及び/若しくはECM分解を阻害する化合物を同定する方法は、下記を含む:
(a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチド及びその断片と接触させること;並びに
(b)軟骨分解と関連した化合物‐ポリペプチド特性を測定すること。
【0123】
本発明の一実施態様において、方法は、軟骨細胞の異化過程を阻害する化合物を同定することに関する。
【0124】
本発明の一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、結合親和性である。
【0125】
一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性の阻害である。
【0126】
一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、MMP13の発現及び/又は活性の阻害である。
【0127】
一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、IL‐1b、IL‐6、IL‐8、IL‐11、TNFα、及び/又はLIFなどの炎症性サイトカインの発現である。
【0128】
本発明の一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチド特性は、該ポリペプチドの活性である。特に、一実施態様において、化合物は、該ポリペプチドの活性を阻害する。
【0129】
本発明の一実施態様において、炎症又は軟骨及び/若しくはECMの分解と関連した化合物‐ポリペプチドの特性は、該ポリペプチドの活性である。特に、一実施態様において、化合物は、該ポリペプチドの発現を阻害する。
【0130】
本発明はさらに、炎症又は軟骨及び/若しくはECMの分解と関連した化合物を同定する方法に関し、この中で、該化合物は、配列番号22〜42からなる群から選択されるアミノ酸と少なくとも中程度の結合親和性を呈し、該方法は下記を含む:
a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドを発現する哺乳類細胞の集団と接触させ、この中で、該細胞は活性化されていること;
b)該細胞からのMMP13の発現を決定すること;及び
c)炎症又は軟骨及び/若しくはECMの分解を阻害する化合物を、該細胞からのMMP13の放出を抑制する化合物として同定すること。
【0131】
1つのこのような方法において、細胞は、炎症誘発性因子と接触していることによって活性化される。本方法の具体的な実施態様において、炎症誘発性因子は、TNF‐アルファ、IL‐1、OSM(オンコスタチンM)、IL6、エンドセリン、ブラジキニン、LPA、ロイコトリエン、プロスタグランジン、LPS(リポ多糖類)、又は他のTLRリガンド、あるいはそれらの組み合わせから選択される。
【0132】
1つのこのような方法において、化合物は、少なくとも10マイクロモル濃度の配列番号22〜42からなる群から選択されるアミノ酸に対する結合親和性を呈する。
【0133】
本発明はさらに、炎症又は軟骨及び/若しくはECM分解を阻害する化合物を同定する方法に関し、該方法は下記を含む:
a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドと接触させること;
b)該化合物の該ポリペプチドに対する結合親和性を決定すること;
c)該ポリペプチドを発現する哺乳類細胞の集団を、少なくとも10マイクロモル濃度の結合親和性を呈する化合物と接触させること;及び
d)炎症又は軟骨及び/若しくはECMの分解を阻害する化合物を同定すること。
【0134】
本発明はさらに、炎症又は軟骨及び/若しくはECMの分解を阻害する化合物を同定する方法に関し、該方法は下記を含む:
a)化合物を、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドと接触させること;
b)該ポリペプチドの発現又は活性を阻害する化合物の能力を決定すること;
c)該ポリペプチドを発現する哺乳類細胞の集団を、ポリペプチドの発現又は活性を有意に阻害する化合物と接触させること;及び
d)炎症又は軟骨及び/若しくはECMの分解を阻害する化合物を同定すること。
【0135】
本発明の特定の態様において、先に説明した方法には、試験されるべき化合物を対照と比較する追加的な工程を含み、ここで、対照は、試験化合物と接触しなかった細胞の集団である。
【0136】
本発明の特定の態様において、先に説明した方法には、試験されるべき化合物を対照と比較する追加的な工程を含み、ここで、対照は、該ポリペプチドを発現しない細胞の集団である。
【0137】
ハスループッット目的のために、抗体断片ライブラリー、ペプチドファージディプレイライブラリー、ペプチドライブラリー(例えば、LOPAP(商標)、Sigma Aldrich)、脂質ライブラリー(BioMol)、合成化合物ライブラリー(例えば、LOPAC(商標)、Sigma Aldrich、BioFocus DPI)、又は天然化合物ライブラリー(Specs、TimTec、BioFocus DPI)などの化合物のライブラリーが用いられ得る。
【0138】
好ましい薬剤候補化合物は、低分子量化合物である。すなわち、500ダルトン以下の分子量を有する低分子量化合物は、生物システムにおいて良好な吸収及び透過を有するようであり、結果的に、500ダルトンを上回る分子量を有する化合物よりも成功する薬剤候補である可能性が高い(Lipinskiらの文献(2001))。ペプチドは、薬剤候補化合物の別の好ましいクラスを含む。ペプチドは、妊孕性ホルモン及び血小板凝集阻害薬など、商業的に価値のあるペプチドの複数の例がある。天然産物は、薬剤候補化合物の別の好ましいクラスである。このような化合物は、天然源に認められており、天然源から抽出され、その後合成され得る。脂質は、薬剤候補化合物の別の好ましいクラスである。
【0139】
薬剤候補化合物の別の好ましいクラスは、抗体である。また、本発明は、TARGETSに対して指向する抗体を提供する。これらの抗体は、細胞内のTARGETSに結合するよう内在的に産生され得、組織に付加して、細胞の外側に存在するTARGETポリペプチドに結合し得る。これらの抗体は、モノクローナル抗体またはポリクローナル抗体であり得る。本発明には、キメラ抗体、一本鎖抗体、ドメイン抗体、ラクダ抗体、及びヒト化抗体、並びにFAb断片及びFAb発現ライブラリーの産物、並びにFv断片及びFv発現ライブラリーの産物を含む。抗体は、中和抗体あるいは、TARGETの活性を阻害する、又はTARGETに対するリガンドの若しくは別のタンパク質に対するTARGETの結合を遮断若しくは阻害する抗体であり得る。
【0140】
ある実施態様において、ポリクローナル抗体は、本発明の実施において使用され得る。当業者は、ポリクローナル抗体を調製する方法を知っている。ポリクローナル抗体は、例えば免疫化剤及び所望の場合アジュバントの1回以上の注射によって、哺乳類において上昇することができる。典型的には、免疫化剤及び/又はアジュバントは、複数回の皮下注射又は腹腔内注射によって哺乳類において注射されるであろう。また、抗体は、未処置のTARGETタンパク質若しくはポリペプチドに対して、又は断片、抱合体を含む誘導体、若しくは細胞膜に移入されたTARGETなど、TARGETタンパク質若しくはポリペプチドの他のエピトープ、又はファージディスプレイライブラリーなどの抗体可変領域のライブラリーに対して生じ得る。
【0141】
免疫化されている哺乳類において免疫原性であることが公知のタンパク質に免疫化剤を抱合することは有用であり得る。このような免疫原性のタンパク質の例には、キーホールリンペットヘモシアニン、血清アルブミン、ウシチログロブリン、及びダイズトリプシン阻害剤を含むが、これらに限定されない。採用され得るアジュバントの例には、フロイント完全アジュバント及びMPL‐TDMアジュバント(モノホスホリルリピドA、合成トレハロースジコリノミコラート)を含む。過度の実験なしに、当業者は、免疫化プロトコールを選択し得る。
【0142】
いくつかの実施態様において、抗体は、モノクローナル抗体であり得る。モノクローナル抗体は、当技術分野で公知の方法を用いて調製され得る。本発明のモノクローナル抗体は、ヒト化されて、宿主が抗体に対する免疫応答を展開するのを防止し得る。「ヒト化抗体」は、相補性決定領域(CDR)並びに/又は軽鎖及び/若しくは重鎖可変ドメインフレームワークの他の部分が、非ヒト免疫グロブリンに由来するが、分子の残りの部分が、1つ以上のヒト免疫グロブリンに由来するものである。また、ヒト化抗体には、ドナー若しくはアクセプターの修飾されていない軽鎖若しくはキメラ軽鎖と会合したヒト化重鎖を特徴とする抗体、又はその逆も含む。抗体のヒト化は、当技術分野で公知の方法によって達成され得る(例えば、Mark及びPadlanの文献(1994)参照)。トランスジェニック動物を用いて、ヒト化抗体を発現し得る。
【0143】
また、ヒト化抗体は、ファージディスプレイライブラリーを含む、当技術分野で公知の種々の技術を用いて作製することができる(Hoogenboom及びWinterの文献(1991);Marksらの文献(1991))。また、Coleら及びBoernerらの技術も、ヒトモノクローナル抗体の調製に利用可能である(Coleらの文献(1985);Boernerらの文献(1991))。一本鎖抗体の作製のための当技術分野で公知の技術は、TARGETSに対する一本鎖抗体を作製するのに適用させることができる。抗体は、一価の抗体であり得る。一価の抗体を調製する方法は当技術分野で周知である。例えば、1つの方法は、免疫グロブリン軽鎖及び修飾された重鎖の組換え発現を包含する。重鎖は、重鎖架橋を防止するよう、Fc領域における任意の地点で一般的に切断されている。あるいは;関連性のあるシステイン残基は、別のアミノ酸残基と置換され、又は欠失され、それにより架橋を防止する。
【0144】
二重特異性抗体は、少なくとも2つの異なる抗原に対する、及び好ましくは細胞表面のタンパク質又は受容体又は受容体サブユニットに対する結合特異性を有するモノクローナル抗体、好ましくはヒト抗体又はヒト化抗体である。この場合において、結合特異性のうちの1つは、TARGETの1つのドメインに対するものであり;もう1つは、同じか又は異なるTARGETの別のドメインに対するものである。
【0145】
二重特異性抗体を作製する方法は、当技術分野で公知である。伝統的に、二重特異性抗体の組換え作製は、2つの免疫グロブリン重鎖/軽鎖対の同時発現に基づいており、ここで、2つの重鎖は異なる特異性を有する(Milstein及びCuelloの文献(1983))。免疫グロブリン重鎖及び軽鎖が無作為に分類されるので、これらのハイブリドーマ(クアドローマ)は、10の異なる抗体分子の可能性のある混合物を生じ、そのうちたった1つが正確な二重特異性構造を有する。アフィニティクロマトグラフィー工程は通常、正確な分子の精製を達成する。類似の手順は、Trauneekerらの文献(1991)に開示されている。
【0146】
別の好ましい実施態様によると、アッセイ方法は、TARGETに対する結合親和性を有するものとして同定された薬剤候補化合物を用い、及び/又は相対して1つ以上のTARGETに対するアンタゴニスト活性などの下方制御活性を有するものとして既に同定されている。
【0147】
関節炎若しくは変形性関節症の又は炎症若しくは炎症性疾患のインビボ動物モデルは、インビボでのTARGET調節をさらに評価することを含む、本発明において同定された薬剤又は化合物をさらに又は追加的にスクリーニング、評価、及び/又は検証するために、当業者によって利用され得る。このような動物モデルには、潰瘍性大腸炎モデル、多発性硬化症モデル(EAE、リゾレシチン誘発性を含む。)、関節炎モデル、アレルギー性喘息モデル、気道炎症モデル、及び急性炎症モデルを含むが、これらに限定されない。変形性関節症モデルには、例えば、膝前十字靱帯の切断後のウサギにおいて、及び内側側副靱帯の断裂後のラットにおいて誘発された実験的変形性関節症を含む。
【0148】
本発明はさらに、軟骨細胞を、配列番号1〜21からなる群から選択されるヌクレオチド配列を含む、ポリリボヌクレオチドの少なくとも約17のヌクレオチドを補完するポリヌクレオチド配列を含む発現阻害薬と接触させることを含む、該細胞の同化刺激を誘導し、又は該細胞の分解を低下させる方法に関する。
【0149】
本発明の別の態様は、該細胞を、TARGETポリペプチドをコードするポリリボヌクレオチドの細胞における翻訳を阻害する発現阻害薬と接触させることを含む、炎症又は軟骨及び/若しくはECMの分解を阻害する方法に関する。特定の実施態様は、薬剤をTARGET mRNAと対形成するよう機能する少なくとも1つのアンチセンス鎖を含むポリヌクレオチドを含み、それによりTARGETポリペプチドの発現を下方制御又は遮断する組成物に関する。阻害薬は好ましくは、アンチセンスポリヌクレオチド、リボザイム、及び低分子干渉RNA(siRNA)を含み、この中で、該薬剤は、配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドの一部をコードする天然のポリヌクレオチド配列と相補的な、又は前記ポリヌクレオチド配列から操作された核酸配列を含む。好ましい実施態様において、発現阻害薬は、配列番号1〜21からなる群から選択されるポリヌクレオチド配列と相補的である。特に好ましい実施態様において、発現阻害薬は、配列番号43〜57からなる群から選択されるポリヌクレオチド配列と相補的である。
【0150】
本発明の実施態様は、発現阻害薬が、アンチセンスRNA、アンチセンスオリゴデオキシヌクレオチド(ODN)、配列番号22〜42の配列をコードするポリリボヌクレオチドを切断するリボザイム、siRNA、好ましくはshRNAが、TARGETポリリボヌクレオチドのTARGETポリペプチドへの翻訳に干渉するよう配列番号22〜42の配列をコードするポリリボヌクレオチドの一部と十分に相補的な低分子干渉RNA(siRNA、好ましくはshRNA)からなる群から選択される方法に関する。好ましくは、発現阻害薬は、アンチセンスRNA、リボザイム、アンチセンスオリゴデオキシヌクレオチド、又は配列番号1〜21からなる群から選択されるヌクレオチド配列と相補的なsiRNA、好ましくはshRNAである。特に好ましい実施態様において、発現阻害薬は、配列番号43〜57からなる群から選択されるポリヌクレオチドと相補的である。
【0151】
本発明の特別な実施態様は、発現阻害薬が、アンチセンスRNA、アンチセンスオリゴデオキシヌクレオチド(ODN)、配列番号22〜42の配列をコードするポリリボヌクレオチドを切断するリボザイム、siRNA、好ましくはshRNAが、TARGETポリリボヌクレオチドのTARGETポリペプチドへの翻訳に干渉するよう配列番号22〜42の配列をコードするポリリボヌクレオチドの一部と十分に相補的な低分子干渉RNA(siRNA、好ましくはshRNA)を発現する核酸である。好ましくは、ヌクレオチド配列は、配列番号1〜21からなる群から選択されるポリヌクレオチドと相補的である。特に好ましい実施態様において、ヌクレオチド配列は、配列番号43〜57からなる群から選択されるポリヌクレオチドと相補的である。
【0152】
アンチセンス核酸を用いた遺伝子発現の下方制御は、翻訳レベル又は転写レベルで達成することができる。本発明のアンチセンス核酸は、好ましくは、TARGETポリペプチド又は相応するメッセンジャーRNAをコードする核酸のすべて又は部分と特異的にハイブリダイズすることのできる核酸断片である。加えて、主要転写産物のスプライシングを阻害することによってTARGETポリペプチドをコードすることのできる核酸配列の発現を減少させるアンチセンス核酸が設計され得る。アンチセンス配列の任意の長さは、TARGETSをコードする核酸の発現を下方制御又は遮断することができる限り、本発明の実施に好適である。好ましくは、アンチセンス配列は、長さ少なくとも約17ヌクレオチドである。アンチセンス核酸の調製及び使用、アンチセンスRNAをコードするDNA、並びにオリゴ及び遺伝的アンチセンスの使用は、当技術分野で公知である。
【0153】
発現阻害薬の一実施態様は、配列番号1〜21の配列を含む核酸に対するアンチセンスである核酸である。例えば、アンチセンス核酸(例えば、DNA)は、配列番号1〜21の配列を含む核酸の細胞での発現を阻害する遺伝子治療法として、インビトロで細胞に導入され得、又はインビボで対象に投与され得る。アンチセンスオリゴヌクレオチドは好ましくは、約17〜約100のヌクレオチドを含む配列を含み、より好ましくは、アンチセンスオリゴヌクレオチドは、約18〜約30を含む。アンチセンス核酸は、配列番号1〜21からなる群から選択される核酸配列と相補的な約10〜約30の連続したヌクレオチドから調製され得る。
【0154】
アンチセンス核酸は好ましくは、オリゴヌクレオチドであり、デオキシリボヌクレオチド、修飾されたデオキシリボヌクレオチド、又はその両方の何らかの組み合わせから完全になり得る。アンチセンス核酸は、合成オリゴヌクレオチドであることができる。オリゴヌクレオチドは、化学的に修飾され、所望の場合、安定性及び/又は選択性を改良し得る。オリゴヌクレオチドは、細胞内ヌクレアーゼによる分解を受けやすいので、修飾には、例えば、ホスホジエステル結合の遊離酸素を置き換えるための硫黄基の使用を含むことができる。この修飾は、ホスホロチオアート結合と呼ばれる。ホスホロチオアートアンチセンスオリゴヌクレオチドは、水溶性であり、多価陰イオン性であり、内在性ヌクレアーゼに対して耐性である。加えて、ホスホロチオアートアンチセンスオリゴヌクレオチドがそのTARGET部位とハイブリダイズする場合、RN202‐315NA二本鎖は、内在性酵素リボヌクレアーゼ(RNase)Hを活性化し、これがハイブリッド分子のmRNA構成要素を切断する。
【0155】
加えて、ホスホラミダイト及びポリアミド(ペプチド)結合を有するアンチセンスオリゴヌクレオチドが合成できる。これらの分子は、ヌクレアーゼ分解に対して非常に耐性があるべきである。さらに、化学基は、糖部分の2'炭素及びピリミジンの5炭素(C‐5)に付加され、安定性を増強し、アンチセンスオリゴヌクレオチドのそのTARGET部位への結合を容易にすることができる。修飾には、2'-デオキシ、O-ペントキシ、O-プロポキシ、O-メトキシ、フルオロ、メトキシエトキシホスホロチオアート、修飾された塩基、及び当業者に公知の他の修飾を含み得る。
【0156】
TARGETSのレベルを低下させることのできる別の種類の発現阻害薬は、リボザイムである。リボザイムは、個別の触媒ドメイン及び基質結合ドメインを有する触媒性RNA分子(RNA酵素)である。基質結合配列は、ヌクレオチド相補性及びおそらくは、そのTARGET配列との非水素結合相互作用によって組み合わせる。触媒部分は、特異的部位でTARGET RNAを切断する。リボザイムの基質ドメインは、指定されたmRNA配列に配向するよう操作することができる。リボザイムは相補性塩基対形成を通じてTARGET mRNAを認識した後、前記標的mRNAを結合する。一旦、正確なTARGET部位に結合すると、リボザイムは、酵素的に作用して、TARGET mRNAを切る。リボザイムによるmRNAの切断は、相応のポリペプチドの合成を扱う前記mRNAの能力を破壊する。一旦、リボザイムがそのTARGET配列を切断すると、前記標的配列が放出され、他のmRNAにおいて反復して結合及び切断することができる。
【0157】
リボザイムの形態には、ハンマーヘッドモチーフ、ヘアピンモチーフ、デルタ型肝炎ウイルス、グループIイントロンモチーフ若しくは(RNA誘導配列と会合した)RNaseP RNAモチーフ又はパンカビVS RNAモチーフを含む。これらの触媒RNA分子が、真核生物プロモーターから細胞内で発現することができるので、ハンマーヘッド又はヘアピン構造を有するリボザイムは容易に調製される(Chenらの文献(1992))。本発明のリボザイムは、適切なDNAベクターから真核細胞において発現することができる。所望の場合、リボザイムの活性は、第二のリボザイムによる主要転写産物からの放出によって増大し得る(Venturaらの文献(1993))。
【0158】
リボザイムは、オリゴデオキシリボヌクレオチドを、転写後にTARGET mRNAとハイブリダイズする配列によって隣接されたリボザイム触媒ドメイン(20ヌクレオチド)と組み合わせることによって化学的に合成され得る。オリゴデオキシリボヌクレオチドは、基質結合配列をプライマーとして用いることによって増幅される。増幅産物は、真核生物発現ベクターへとクローニングされる。
【0159】
リボザイムは、DNA、RNA、又はウイルスベクターへと挿入された転写単位から発現する。リボザイム配列の転写は、真核生物RNAポリメラーゼI(pol(I)、RNAポリメラーゼII(pol II)、又はRNAポリメラーゼIII(pol III))についてのプロモーターから駆動される。pol IIプロモーター又はpol IIIプロモーターからの転写産物は、すべての細胞において高レベルで発現するであろうし;所与の細胞種類における所与のpol IIプロモーターのレベルは、近くの遺伝子調節配列によるであろう。また、原核生物RNAポリメラーゼプロモーターも使用され、但し、原核生物RNAポリメラーゼ酵素が、適切な細胞において発現するという条件付きである(Gao及びHuangの文献(1993))。これらのプロモーターから発現したリボザイムが哺乳類細胞において機能することができることは示されている(Kashani-Sabetらの文献(1992))。
【0160】
特に好ましい阻害薬は、低分子干渉RNA(siRNA、好ましくはshRNA)である。siRNA、好ましくはshRNAは、発現停止したRNAと配列において類似している二本鎖RNA(dsRNA)による遺伝子サイレンシングの転写後プロセスを仲介する。本発明に従ったsiRNAは、配列番号1〜21の配列において説明された配列の群から、好ましくは配列番号43〜57の配列において説明された配列の群から選択された連続した17〜25のヌクレオチド配列と相補的な又は前記ヌクレオチド配列と類似した17〜25のヌクレオチドのセンス鎖と、センス鎖に相補的な17〜23のヌクレオチドのアンチセンス鎖とを含む。典型的な配列は、配列番号43〜57と相補的な配列として説明されている。最も好ましいsiRNAは、互いに及びTARGETポリヌクレオチド配列と100パーセント相補的なセンス鎖及びアンチセンス鎖を含む。好ましくは、siRNAはさらに、センス鎖及びアンチセンス鎖を連結するループ領域を含む。
【0161】
本発明に従った自己相補性一本鎖siRNA分子ポリヌクレオチドは、ループ領域リンカーによって接続されたセンス部分とアンチセンス部分とを含む。好ましくは、ループ領域配列は、4〜30ヌクレオチド長、より好ましくは5〜15ヌクレオチド長、最も好ましくは8又は12ヌクレオチド長である。具体的な実施態様において、リンカー配列は、UUGCUAUAである。代替的な具体的実施態様において、リンカー配列は、GUUUGCUAUAAC(配列番号58)である。自己相補性一本鎖siRNAは、ヘアピンループを形成し、通常のdsRNAよりも安定である。加えて、自己相補性一本鎖siRNAは、ベクターからより簡単に作製される。
【0162】
アンチセンスRNAに類似して、siRNAは、核酸分解に対する耐性を確実にし、又は活性を亢進し、又は細胞分布を亢進し、又は細胞の取り込みを亢進するよう修飾することができ、このような修飾は、修飾されたヌクレオシド間連結、修飾された核酸塩基、修飾された糖及び/又はsiRNAの1つ以上の部分若しくは抱合体への化学的連結からなり得る。ヌクレオチド配列は、これらのsiRNA設計則に従わないヌクレオチド配列と比較して、TARGET配列の改良された縮小(reduction)を与えるsiRNA設計則に従って選択される(これらの法則及び、siRNAの調製の例に関する論議については、WO2004/094636、及びUS2003/0198627が引用により本明細書により組み込まれている。)。
【0163】
また、本発明は、軟骨の分解を阻害することのできるポリヌクレオチドを発現することのできるDNA発現ベクターを含み、発現阻害薬として先に説明された組成物、及び該組成物を用いる方法にも関する。
【0164】
これらの組成物及び方法の特別な態様は、TARGETポリペプチドと選択的に相互作用することのできる細胞内結合タンパク質をコードするポリヌクレオチドの誘導された発現による、TARGETポリペプチドの発現の下方制御又は遮断に関する。細胞内結合タンパク質には、発現する細胞においてポリペプチドと選択的に相互作用することのできる又は結合することのできる、及びポリペプチドの機能を中和することのできる任意のタンパク質を含む。好ましくは、細胞内結合タンパク質は、配列番号22〜42の配列のTARGETポリペプチドのエピトープに対する結合親和性を有する中和抗体又は中和抗体の断片である。
【0165】
この組成物の特別な実施態様は、アンチセンスRNA、アンチセンスオリゴデオキシヌクレオチド(ODN)、配列番号22〜42の配列をコードするポリヌクレオチドを切断するリボザイム、及び配列番号22〜42の配列をコードするポリリボヌクレオチドの一部と十分に類似しており、それによりsiRNAが、TARGETポリリボヌクレオチドのTARGETポリペプチドへの翻訳に干渉する低分子干渉RNA(siRNA)からなる群から選択される発現阻害薬を含む。
【0166】
発現阻害薬を発現するポリヌクレオチドは、ベクター内に特に含まれる。ポリ核酸は、核酸配列の発現を可能にするシグナルに作用可能に連結され、好ましくは、一旦ベクターが細胞に導入されるとアンチセンス核酸を発現するであろう組換えベクターコンストラクトを利用する細胞へと導入される。アデノウイルスベクターシステム、レトロウイルスベクターシステム、アデノ随伴ウイルスベクターシステム、レンチウイルスベクターシステム、単純ヘルペスウイルスベクターシステム、又はセンダウイルス(sendaviral)ベクターシステムを含む種々のウイルスベースの系が利用可能であり、すべて、TARGET細胞における発現阻害薬についてのポリヌクレオチド配列を導入及び発現するために用いられ得る。
【0167】
好ましくは、本発明の方法において用いられるウイルスベクターは、複製欠損である。このような複製欠損ベクターは通常、感染した細胞におけるウイルスの複製に必要な少なくとも1つの領域を欠失するであろう。これらの領域は、当業者に公知の任意の技術によって、(全体において又は部分において)除去されるか又は非機能的にされるかのいずれかであることができる。これらの技術には、(複製に)必須の領域に対する1つ以上の完全な除去、置換、部分的な欠失又は塩基の付加を含む。このような技術は、遺伝子操作の技術を用いて又は突然変異原性剤を用いた処理によって、インビトロで(単離されたDNAに関して)又はインサイツで実施され得る。好ましくは、複製欠損ウイルスは、ウイルス粒子をカプシド形成するのに必要な前記複製欠損ウイルスのゲノムの配列を保有する。
【0168】
好ましい実施態様において、ウイルスエレメントは、アデノウイルス由来である。好ましくはビヒクルには、アデノウイルスカプシドにパッケージされたアデノウイルスベクター、又はその機能的部分、誘導体、及び/若しくは類似体を含む。また、アデノウイルス生物学は、分子レベルで比較的周知である。アデノウイルスベクターについての多くのツールは、開発されており及び開発され続けており、従って、アデノウイルスカプシドを、本発明のライブラリーにおいて組み込むのに好ましいビヒクルにする。アデノウイルスは、広範な種々の細胞を感染させることができる。しかしながら、異なるアデノウイルス血清型は、細胞に対する異なる優先性を有する。好ましい実施態様において、本発明のアデノウイルスカプシドが入ることのできるTARGET細胞集団を組み合わせかつ広げるために、ビヒクルには、少なくとも2つのアデノウイルスに由来するアデノウイルス線維タンパク質を含む。好ましいアデノウイルス線維タンパク質配列は、血清型5、17、45、及び51である。これらのキメラベクターの技術又は構築及び発現は、US 2003/0180258及びUS 2004/0071660に開示されており、引用により本明細書により組み込まれている。
【0169】
好ましい実施態様において、アデノウイルス由来の核酸には、アデノウイルス後期タンパク質又はその機能的部分、誘導体、及び/若しくは類似体をコードする核酸を含む。アデノウイルス後期タンパク質、例えば、アデノウイルス線維タンパク質は、ビヒクルをある細胞に標的化する(TARGET)ために、又は細胞へのビヒクルの高い送達を誘導するために好ましく用いられ得る。好ましくは、アデノウイルスに由来する核酸は、本質的にすべてのアデノウイルス後期タンパク質をコードし、アデノウイルスカプシド全体又はその機能的部分、類似体、及び/若しくは誘導体の形成を可能にする。好ましくは、アデノウイルスに由来する核酸には、アデノウイルスE2A又はその機能的部分、誘導体、及び/若しくは類似体をコードする核酸を含む。好ましくは、アデノウイルスに由来する核酸には、細胞におけるアデノウイルス由来核酸の複製を少なくとも一部容易にする、少なくとも1つのE4領域タンパク質又はその機能的部分、誘導体、及び/若しくは類似体をコードする核酸を含む。本用途の例において用いられるアデノウイルスベクターは、本治療方法発明において有用なベクターの典型である。
【0170】
本発明のある実施態様は、レトロウイルスベクターの系を用いる。レトロウイルスは、分裂中の細胞に感染する組み込みウイルスであり、前記ウイルスの構築は、当技術分野で公知である。レトロウイルスベクターは、MoMuLV(「モロニーマウス白血病ウイルス」)MSV(「モロニーマウス肉腫ウイルス」)、HaSV(「ハーベイ肉腫ウイルス」);SNV(「脾壊死ウイルス」);RSV(「ラウス肉腫ウイルス」)、及びフレンドウイルスなど、異なる種類のレトロウイルスから構築することができる。また、レンチウイルスベクターの系も、本発明の実施において使用され得る。
【0171】
本発明の他の実施態様において、アデノ随伴ウイルス(「AAV」)が利用される。AAVウイルスは、安定したかつ部位特異的な様式で、感染した細胞のゲノムへと組み込む比較的小さなサイズのDNAウイルスである。AAVウイルスは、細胞の増殖、形態、又は分化に何ら影響を誘導することなく、広範な細胞に感染することができ、かつヒトの病態に関与するようには見えない。
【0172】
ベクター構築において、本発明のポリヌクレオチド剤は、1つ以上の調節領域に連結され得る。適切な調節領域又は領域類の選択は、当業者のレベル内で慣例のことである。調節領域にはプロモーターを含み、エンハンサー、サプレッサーなどを含み得る。
【0173】
本発明の発現ベクターにおいて用いられ得るプロモーターには、構成的プロモーター及び制御的(誘導性)プロモーターの両方を含む。プロモーターは、宿主に応じて原核生物性又は真核生物性であってよい。本発明の実施の有用な原核生物性(バクテリオファージを含む。)プロモーターには、lacプロモーター、lacZプロモーター、T3プロモーター、T7プロモーター、ラムダPrプロモーター、P1プロモーター、及びtrpプロモーターがある。本発明の実施に有用な真核生物性(ウイルス性を含む。)プロモーターには、遍在性プロモーター(例えば、HPRT、ビメンチン、アクチン、チューブリン)、中間径フィラメントプロモーター(例えば、デスミン、ニューロフィラメント、ケラチン、GFAP)、治療遺伝子プロモーター(例えば、MDR型、CFTR、第VIII因子)、組織特異的プロモーター(例えば、平滑筋細胞におけるアクチンプロモーター、内皮細胞において活性のあるFlt及びFlkプロモーター)であり、これらには、組織特異性を呈し、かつトランスジェニック動物において利用されている動物転写調節領域:膵腺房細胞において活性のあるエラスターゼI遺伝子調節領域(Swiftらの文献((1984) Cell 38:639-46);Ornitzらの文献((1986) Cold Spring Harbor Symp. Quant. Biol. 50:399-409);MacDonald, (1987) Hepatology 7:425-515);膵ベータ細胞において活性のあるインスリン遺伝子調節領域(Hanahanの文献((1985) Nature 315:115-22))、リンパ球系細胞において活性のある免疫グロブリン遺伝子調節領域(Grosschedlらの文献((1984) Cell 38:647-58);Adamesらの文献((1985) Nature 318:533-8);Alexanderらの文献((1987) Mol. Cell. Biol. 7:1436-44))、精巣細胞、乳房細胞、リンパ球系細胞、及びマスト細胞において活性のあるマウス乳房腫瘍ウイルス調節領域(Lederらの文献((1986) Cell 45:485-95))、肝臓において活性のあるアルブミン遺伝子調節領域(Pinkertらの文献((1987) Genes and Devel. 1:268-76))、肝臓において活性のあるアルファ‐フェトプロテイン遺伝子調節領域(Krumlaufらの文献((1985) Mol. Cell. Biol., 5:1639-48);Hammerらの文献((1987) Science 235:53-8))、肝臓において活性のあるアルファ1‐抗トリプシン遺伝子調節領域(Kelseyの文献((1987) Genes and Devel., 1: 161-71))、骨髄系細胞において活性のあるベータ‐グロブリン遺伝子調節領域(Mogramらの文献((1985) Nature 315:338-40);Kolliasらの文献((1986) Cell 46:89-94))、脳におけるオリゴデンドロサイトにおいて活性のあるミエリン塩基性タンパク質遺伝子調節領域(Readheadらの文献((1987) Cell 48:703-12))、骨格筋において活性のあるミオシン軽鎖‐2遺伝子調節領域(Saniの文献((1985) Nature 314.283-6))、並びに視床下部において活性のある性腺刺激ホルモン(gonadotropic)放出ホルモン遺伝子調節領域(Masonらの文献( (1986) Science 234:1372-8))を含む。
【0174】
本発明の実施において用いられ得る他のプロモーターには、分裂中の細胞において優先的に活性化されるプロモーター、刺激に応答するプロモーター(例えば、ステロイドホルモン受容体、レチノイン酸受容体)、テトラサイクリン調節性転写修飾因子、サイトメガロウイルス最初期、レトロウイルス末端反復配列、メタロチオネイン、SV-40、E1a、及びMLPプロモーターを含む。
【0175】
追加的なベクター系には、患者へのポリヌクレオチド座位の導入を容易にする非ウイルス性システムを含む。例えば、所望の配列をコードするDNAベクターは、リポフェクションによってインビボで導入することができる。リポソーム仲介性トランスフェクションで遭遇する困難を制限するよう設計された合成陽イオン性脂質は、マーカーをコードする遺伝子のインビボトランスフェクション用のリポソームを調製するために使用することができる(Felgnerらの文献((1987) Proc. Natl. Acad Sci. USA 84:7413-7);Mackeyらの文献((1988) Proc. Natl. Acad. Sci. USA 85:8027-31);Ulmerらの文献((1993) Science 259:1745-8参照))。陽イオン性脂質の使用は、負に帯電した核酸の封入を促進し得、また、負に帯電した細胞膜との融合も促進し得る(Felgner及びRingoldの文献((1989) Nature 337:387-8))。核酸の転移に特に有用な脂質化合物及び組成物は、WO 95/18863及びWO 96/17823において、並びに米国特許第5,459,127号において説明されている。インビボでの特異的臓器へ外来性遺伝子を導入するためのリポフェクションの使用は、ある実際上の利点を有し、特定の細胞種類に対して配向するトランスフェクションは、細胞の異種性を有する組織、例えば、膵臓、肝臓、腎臓、及び脳において特に有利であろう。脂質は、ターゲティングの目的のために、他の分子に化学的と共役し得る。標的にされたペプチド、例えば、ホルモン若しくは神経伝達物質、及びタンパク質、例えば、抗体、又は非ペプチド分子は、リポソームと化学的に共役し得る。また、他の分子は、インビボでの核酸のトランスフェクションを容易にするのに有用であり、例えば、陽イオン性オリゴペプチド(例えば、WO95/21931)、DNA結合タンパク質に由来するペプチド(例えば、WO96/25508)、又は陽イオン性ポリマー(例えば、WO95/21931)である。
【0176】
また、むき出しのDNAプラスミドとしてインビボでDNAベクターを導入することも可能である(米国特許第5,693,622号、第5,589,466号、及び第5,580,859号参照)。治療目的のためのむき出しのDNAベクターは、所望の宿主細胞へと、当技術分野で公知の方法、例えば、トランスフェクション、電気穿孔法、マイクロインジェクション、形質導入、細胞融合、DEAEデキストラン、リン酸カルシウム沈殿、遺伝子銃の使用、又はDNAベクター輸送体の使用によって導入することができる(例えば、Wilsonらの文献((1992) J. Biol. Chem. 267:963-7);Wu及びWuの文献((1988) J. Biol. Chem. 263:14621-4);Hartmutらの文献(1990年3月15日に出願されたカナダ国特許出願第2,012,311号;Williamsらの文献((1991). Proc. Natl. Acad. Sci. USA 88:2726-30)参照)。リポーター仲介性DNA送達アプローチも使用することができる(Curielらの文献((1992) Hum. Gene Ther. 3:147-54);Wu及びWuの文献((1987) J. Biol. Chem. 262:4429-32))。
【0177】
また、本発明は、TARGET阻害薬として同定された1つ以上の有効量の化合物、及び/又は先に説明された発現阻害薬を含む、生物学的に適合性のある軟骨分解阻害組成物も提供する。
【0178】
生物学的に適合性のある組成物は、本発明の化合物、ポリヌクレオチド、ベクター、及び抗体が、活性形態で、例えば、生物活性を有効にできる形態で維持される、固体、液体、ゲル、又は他の形態であり得る組成物である。例えば、本発明の化合物は、TARGETに及ぼす逆性のアゴニスト活性又はアンタゴニスト活性を有するであろうし;核酸は、メッセージを複製、翻訳でき、又はTARGETの相補的mRNAとハイブリダイズすることができるであろうし;ベクターは、TARGET細胞をトランスフェクトして、先に説明したアンチセンス、抗体、リボザイム、又はsiRNAを発現することができるであろうし;抗体は、TARGETポリペプチドドメインを結合するであろう。
【0179】
好ましい生物学的に適合性のある組成物は、例えば、塩イオンを含む、トリス緩衝液、リン酸緩衝液、又はHEPES緩衝液を用いて緩衝する水溶液である。通常、塩イオン濃度は、生理学的レベルに類似しているであろう。生物学的に適合性のある溶液には、安定化剤及び保存料を含み得る。より好ましい実施態様において、生物適合性のある組成物は、医薬として許容し得る組成物である。このような組成物は、局所的、経口、非経口、鼻内、皮下、及び眼内の経路による投与のために製剤することができる。非経口投与は、静脈内注射、筋肉内注射、動脈内注射又は注入の技術を含む。組成物は、標準的な周知の非毒性の生理学的に許容し得る担体、アジュバント、及びビヒクルを所望の通り含む薬用量単位製剤において非経口的に投与され得る。
【0180】
本組成物発明の特に好ましい実施態様は、先に説明した治療有効量の発現阻害薬を、医薬として許容し得る担体との混合物で含む軟骨形成増強医薬組成物である。別の好ましい実施態様は、炎症又は軟骨及び/若しくはECM分解を包含する容態、あるいは容態に対する易罹患性の治療又は予防のための医薬組成物であって、軟骨形成増強に有効な量のTARGETアンタゴニスト若しくは逆性アゴニスト、その医薬として許容し得る塩、水和物、溶媒和物、又はプロドラッグを、医薬として許容し得る担体との混合物で含む前記医薬組成物である。一態様において、容態は、平均軟骨厚の全身性の又は局所的な減少を包含する。
【0181】
経口投与のための医薬組成物は、経口投与に好適な薬用量で、当技術分野で周知の医薬として許容し得る担体を用いて製剤することができる。このような担体によって医薬組成物を錠剤、丸剤、糖衣錠、カプセル剤、液剤、ゲル、シロップ剤、スラリー、懸濁剤、及びこれらの類するものとして、患者による消化のために製剤することができる。経口使用のための医薬組成物は、活性化合物を固体賦形剤と組み合わせること、結果として生じる混合物を任意に粉砕すること、及び所望の場合好適な助剤を添加した後、顆粒混合物を加工して、錠剤又は糖衣錠中心を得ることによって調製することができる。好適な賦形剤は、ラクトース、スクロース、マンニトール、又はソルビトールを含めた糖類などの炭水化物又はタンパク質充填剤;トウモロコシ、コムギ、コメ、ジャガイモ、又は他の植物に由来するデンプン;メチルセルロース、ヒドロキシプロピルメチルセルロース、又はカルボキシメチルセルロースナトリウムなどのセルロース;アラビアゴム及びトラガカントゴムを含めたゴム;並びに、ゼラチン及びコラーゲンなどのタンパク質である。所望の場合、架橋したポリビニルピロリドン、アガー、アルギン酸、又はアルギン酸ナトリウムなどのその塩などの崩壊剤又は可溶化剤を添加し得る。糖衣錠中心は、濃縮糖溶液など、好適なコーティングとともに用いてよく、前記コーティングはまた、アラビアゴム、滑石、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール及び/又は二酸化チタン、ラッカー溶液、及び好適な有機溶媒又は溶媒混合物も含み得る。製品の同定のために、又は活性化合物の量、すなわち薬用量を特徴付けるために、染料又は色素を錠剤又は糖衣錠コーティングに添加し得る。
【0182】
経口で使用することのできる医薬調製物には、ゼラチンでできた押し込み型(push-fit)カプセル、並びにゼラチン及びグリセロール又はソルビトールなどのコーティングでできた軟質密封カプセルを含む。押し込み型カプセルは、ラクトース又はデンプンなどの充填剤又は結合剤、滑石又はステアリン酸マグネシウムなどの潤滑剤、及び任意に安定化剤と混合した活性成分を含むことができる。軟質カプセルにおいて、活性化合物は、脂肪油、液体、又は安定化剤を有する若しくは有さない液体ポリエチレングリコールなどの好適な液体において溶解又は懸濁され得る。
【0183】
好ましい滅菌済みの注射可能な調製物は、非毒性の非経口的に許容し得る溶媒又は希釈剤における溶液又は懸濁液であることができる。医薬として許容し得る担体の例は、塩類溶液、緩衝塩類溶液、等張性塩類溶液(例えば、リン酸一ナトリウム若しくはリン酸二ナトリウム、ナトリウム、カリウム;塩化カルシウム若しくは塩化マグネシウム、又はこのような塩の混合物)、リンゲル溶液、デキストロース、水、滅菌水、グリセロール、エタノール、及びそれらの組み合わせであり、1,3-ブタンジオール及び滅菌済み固定油が、溶媒又は懸濁媒体として簡便に採用される。合成モノグリセリド又は合成ジグリセリドを含む刺激の強くない任意の固定油を採用することができる。また、オレイン酸などの脂肪酸も、注射可能物の調製における使用を提供する。
【0184】
本発明の化合物又は組成物は、ポリマー担体、生分解性マトリックス若しくは生物模倣型マトリックスを用いた投与のために組み合され得、あるいは前記ポリマー、生分解性マトリックス若しくは生物模倣型マトリックスにおいて、又は足場において移入され得る。担体、マトリックス、又は足場は、組成物が組み込まれることができるであろう、かつ発現することができるであろう任意の材料であり得、細胞の添加と又は細胞の存在下で適合性であろう。好ましくは、担体マトリックス又は足場は、主に非免疫原性であり、かつ生分解性である。生分解性材料の例には、ポリグリコール酸(PGA)、ポリ乳酸(PLA)、ヒアルロン酸、腸線縫合材料、ゼラチン、セルロース、ニトロセルロース、コラーゲン、アルブミン、フィブリン、アルギン酸塩、綿、又は他の天然の生分解性材料を含むが、これらに限定されない。投与又は移入の前に、例えば、酸化エチレンによる処理によって又はガンマ照射若しくは電子線を用いた照射によって、マトリックス又は足場材料を滅菌することが好ましくあり得る。加えて、多くの他の材料が、下記を含むがこれらに限定されない足場又はフレームワーク構造を形成するのに用いられ得る:ナイロン(ポリアミド)、ダクロン(ポリエステル)、ポリスチレン、ポリプロピレン、ポリアクリラート、ポリビニル化合物(例えば、ポリビニルクロリド)、ポリカーボネート(PVC)、ポリテトラフルオロエチレン(polytetrafluorethylene)(PTFE、テフロン)、サーマノックス(thermanox)(TPX)、ポリ乳酸(PLA)、ポリグリコール酸(PGA)、及びポリ乳酸‐グリコール酸(PLGA)などのヒドロキシ酸のポリマー、ポリオルトエステル類、ポリ無水物類、ポリホスファゼン類、及び種々のポリヒドロキシアルカノアート類、並びにこれらの組み合わせ。好適なマトリックスには、ポリマーメッシュ若しくはポリマースポンジ、及びポリマーヒドロゲルを含む。好ましい実施態様において、マトリックスは、経時的に、1年未満の期間、より好ましくは6ヶ月未満、最も好ましくは、2〜10週間にわたって生分解性である。ポリマー組成物及び製造方法は、分解速度を特定するために用いることができる。例えば、増大する量のポリ乳酸をポリグリコール酸と混合すると、分解時間が減縮する。使用することのできるポリグリコール酸のメッシュは、例えば、外科的供給企業(例えば、Ethicon, N.J.)から商業的に得ることができる。ヒドロゲルは、有機ポリマー(天然又は合成)が共有結合、イオン結合、又は水素結合を介して架橋されて3次元の開いた格子の構造を作る場合に形成される物質として規定され、該構造は水分子を捕捉してゲルを形成する。一般に、これらのポリマーは、水、緩衝塩溶液、又は水性アルコール溶液などの、帯電した側鎖基又はその一価のイオン塩を有する水溶液において少なくとも部分的に可溶性である。組成物媒体は、ヒドロゲルであり得、これは、薬剤吸収スポンジとして作用することのできる親水性ポリアクリル酸ポリマーなど、任意の生体適合性、又は非細胞毒性のホモポリマー若しくはヘテロポリマーから調製される。これらのうちの1つもの、特にエチレン及び/又は酸化プロピレンから得られるものは、市販されている。ヒドロゲルは、例えば外科的介入の間に治療されるべき組織の表面に直接配置することができる。
【0185】
本発明の医薬組成物の実施態様は、本発明のポリヌクレオチド阻害剤をコードする複製欠損組換えウイルスベクターと、ポロキサマーなどのトランスフェクションエンハンサーとを含む。ポロキサマーの例は、ポロキサマー407であり、市販されており(BASF, Parsippany, N.J.)、非毒性の生体適合性ポリオールである。組換えウイルスを含浸したポロキサマーは、例えば外科的介入の間に治療されるべき組織の表面に直接配置してよい。ポロキサマーは、より低い粘度を有しながらも、ヒドロゲルと本質的に同じ利点を有する。
【0186】
また、活性のある発現阻害薬は、例えば、界面重合化によって調製されたマイクロカプセル、例えば、ヒドロキシメチルセルロース若しくはゼラチンマイクロカプセル及びポリ-(メチルメタクリラート)マイクロカプセルにおいてそれぞれ、コロイド状薬剤送達システム(例えば、リポソーム、アルブミンミクロスフェア、ミクロエマルション、ナノ粒子、及びナノカプセル)において、又はマクロエマルションにおいて封入され得る。このような技術は、Remingtonの文献「医薬科学(Pharmaceutical Sciences)」((1980) 第16版, Osol, A.編)に開示されている。
【0187】
徐放性調製物が調製され得る。徐放性調製物の好適な例には、マトリックスが、成形された物品の形態にある、抗体を含む固体疎水性ポリマーの半透性マトリックス、例えば、フィルム又はマイクロカプセルを含む。徐放性マトリックスの例には、ポリエステル、ヒドロゲル(例えば、ポリ(2-ヒドロキシエチル-メタクリラート)、又はポリ(ビニルアルコール))、ポリラクチド(米国特許第3,773,919号)、L-グルタミン酸とガンマ-エチル-L-グルタマートとのコポリマー、非分解性エチレン-ビニルアセタート、LUPRON DEPOT(商標)などの分解性乳酸-グリコール酸コポリマー(乳酸-グリコール酸コポリマー及び酢酸ロイプロリドから構成される注射可能なミクロスフェア)、及びポリ-D-(-)-3-ヒドロキシ酪酸を含む。エチレン-ビニルアセタート及び乳酸-グリコール酸などのポリマーによって100日間超にわたる分子の放出が可能となる一方で、アルヒドロゲルは、より短い期間タンパク質を放出する。封入された抗体が、長時間にわたって身体にとどまる場合、前記抗体は、37℃での湿気に対する曝露の結果として変性又は凝集し得、結果的に、生物学的活性の損失及び免疫原性の起こり得る変化を生じる。包含される機序に応じて安定化のために合理的な戦略を考案することができる。例えば、凝集機序が、チオ‐ジスルフィド交換を通じた分子間S-S結合形成であると発見される場合、安定化は、スルフヒドリル残基を修飾し、酸性溶液から凍結乾燥し、水分含有量を制御し、適切な添加剤を用い、及び具体的なポリマーマトリックス組成物を展開することによって達成され得る。
【0188】
先に規定したように、治療効果のある用量は、症状または容態を寛解するタンパク質、ポリヌクレオチド、ペプチド、又はその抗体、アゴニスト、若しくはアンタゴニストの量を意味する。このような化合物の治療有効性及び毒性は、細胞培養又は実験動物における標準的な医薬手順、例えば、ED50(集団の50%において治療有効である用量)及びLD50(集団の50%に対する致死的用量)によって決定することができる。治療効果に対して毒性である用量比は、治療指数であり、比LD50/ED50として表すことができる。細胞培養アッセイ及び動物研究から得られたデータは、ヒトの使用のための薬用量範囲を処方する上で用いられる。このような化合物の薬用量は好ましくは、毒性をほとんど又は全く有さないED50を含む循環濃度の範囲内に収まる。薬用量は、採用される剤形、患者の感受性、及び投与の経路に応じて、この範囲内で変動する。
【0189】
任意の化合物について、治療有効用量は、細胞培養アッセイにおいて又は動物モデル、通常、マウス、ウサギ、イヌ、又はブタにおいてのいずれかで初期的に概算することができる。また、動物モデルは、所望の濃度範囲及び投与経路を達成するために用いられる。次に、このような情報は、ヒトにおける投与に有用な用量及び経路を決定するために用いることができる。実際の薬用量は、治療されるべき患者を考慮して個々の医師によって選択される。薬用量及び投与は、十分なレベルの活性部分を提供するために、又は所望の効果を維持するために調整される。考慮され得る追加的な因子には、患者の疾患状態の重症度、齢、体重、及び性別;食事、治療の所望の期間、投与方法、投与の回数及び頻度、薬剤の組み合わせ、反応の感受性、及び治療法に対する耐性/応答を含む。長時間作用性医薬組成物は、特定の製剤の半減期及びクリアランス速度に応じて、3〜4日ごとに、毎週、又は2週間に1回投与され得る。
【0190】
本発明に従った医薬組成物は、種々の方法によって対象に投与され得る。前記医薬組成物は、TARGET組織に直接添加でき、陽イオン性脂質と複合体形成でき、リポソーム内に封入でき、又は当技術分野で公知の他の方法によってTARGET細胞に送達できる。所望の組織への局在性投与は、直接注射、経皮的吸収、カテーテル、注入ポンプ、又はステントによって実施され得る。DNA、DNA/ビヒクル複合体、又は組換えウイルス粒子は、治療部位に局所投与される。送達の代替的な経路には、静脈内注射、筋肉内注射、皮下注射、エアロゾル吸入、経口送達(錠剤又は丸剤の形態)、局所送達、全身送達、眼内送達、腹腔内送達、及び/又はくも膜下腔内送達を含むが、これらに限定されない。リボザイムへの送達及び投与の例は、SullivanらのWO94/02595において提供される。
【0191】
本発明に従った抗体は、急速投与として1回送達され得、経時的に注入され得、又は急速投与として投与され得かつ経時的に注入され得る。当業者は、タンパク質に対するよりもむしろポリヌクレオチドに対する異なる製剤を採用し得る。同様に、ポリヌクレオチド又はポリペプチドの送達は、特定の細胞、容態、位置などに特異的であろう。
【0192】
先に論議されるように、組換えウイルスは、本発明において有用なポリヌクレオチド剤をコードするDNAを導入するために用いられ得る。本発明に従った組換えウイルスは一般的に、約104〜約1014pfuの用量の形態で製剤及び投与される。AAV及びアデノウイルスの場合、約106〜約1011pfuの用量が好ましくは用いられる。用語pfu(「プラーク形成単位」)は、ウイルス粒子の懸濁液の感染力に相応しており、適切な細胞培養物を感染させて、形成されるプラーク数を測定することによって決定される。ウイルス溶液のpfu力価を決定するための技術は、従来技術において十分に実証されている。
【0193】
また、本発明は、軟骨形成を増強する方法も提供し、該方法は、該対象への治療有効量の本明細書の発現阻害薬の投与を含む。本発明のさらなる態様は、該対象に、本明細書に説明された軟骨形成増強医薬組成物を投与することを含む、軟骨細胞の同化刺激を包含する疾患を治療又は予防する方法に関する。
【0194】
本発明の手段及び方法を用いて治療できるECMの分解を包含する疾患の例には、乾癬性関節炎、若年性関節炎、初期関節炎、反応性関節炎、変形性関節症、強直性脊椎炎、骨粗鬆症、腱炎及び歯周病などの筋骨格疾患、癌転移、気道疾患(慢性閉塞性肺疾患、喘息)、腎線維症及び肝線維症、粥状硬化及び心不全などの心臓脈管系疾患、並びに神経炎症及び多発性硬化症などの神経学的疾患が挙げられるが、これらに限定されない。
【0195】
本発明の手段及び方法を用いて治療可能な軟骨の分解を包含する疾患の例には、変形性関節症、関節リウマチ、乾癬性関節炎、若年性関節リウマチ、痛風性関節炎、化膿性又は感染性関節炎、反応性関節炎、反射性交感神経性ジストロフィー、有痛性骨萎縮症、ティーツェ症候群又は肋軟骨炎、線維筋痛症、骨軟骨炎、神経原性又は神経障害性関節炎, 関節症、地方性変形性骨軟骨関節症のような風土性形態の関節炎、 ムセルニ病、及びハンディゴデュ病;線維筋痛症、全身性エリテマトーデス、強皮症、及び強直性脊椎炎から結果として生じる変性が挙げられるが、これらに限定されない。さらに、遺伝性軟骨溶解、軟骨異形成症、及び偽軟骨異形成を含む先天性軟骨形成異常を罹患している人々は、軟骨細胞の同化刺激を結果として生じるプログラムから利益を得る可能性があり、またこれらの疾患はそれゆえ、本発明の方法及び手段を用いることによって治療され得る。先天性軟骨形成異常関連疾患の制限のない例は、小耳症、無耳症、及び骨幹端軟骨異形成症である。
【0196】
加えて、また同定された標的はIL‐1シグナル伝達も阻害するので、これらの標的の阻害薬は、炎症性疾患の治療において使用され得る。本発明の手段及び方法を用いて治療できる炎症を包含する疾患の例には、アレルギー性気道疾患(例えば、喘息、鼻炎)、自己免疫疾患、移植片拒絶、クローン病、関節リウマチ、乾癬、若年性特発性関節炎、大腸炎、及び炎症性腸疾患が挙げられるが、これらに限定されない。
【0197】
一態様において、本発明は、炎症、ECM分解、及び/又は軟骨分解を包含する障害を予防及び/又は治療する方法を提供し、該方法は、対象に、本明細書に開示された治療有効量の薬剤を投与することを含む。特定の実施態様において、薬剤は、発現阻害薬及び抗体から選択される。特定の実施態様において、障害は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0198】
また、本発明は、炎症、ECM分解、及び/又は軟骨分解を包含する疾患を治療又は予防するための医薬の製造のための先に説明された薬剤の使用にも関する。特定の実施態様において、薬剤は、発現阻害薬及び抗体から選択される。本発明の特定の実施態様において、疾患は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0199】
また、本発明は、炎症、ECM分解、及び/又は軟骨分解を包含する疾患を治療及び/又は予防する方法も提供し、該方法は、軟骨の分解を包含する疾患を罹患している又は易罹患性の対象に、本明細書に記載された医薬組成物又は化合物、特に本明細書に同定されたTARGETの発現又は活性を阻害する治療有効量の薬剤を投与することを含む。特定の実施態様において、障害は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0200】
また、本発明は、炎症、ECM分解、及び/又は軟骨分解を包含する疾患の治療及び/又は要望における使用のための先に説明された薬剤又は医薬組成物にも関する。特定の実施態様において、障害は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0201】
本発明の薬剤又は医薬組成物の対象患者への投与には、自己投与及び別の人間による投与の両方を含む。患者は、既存の疾患若しくは医学的容態のための治療の必要にあり得、又は軟骨分解を特徴とする疾患及び医学的容態についてのリスクを予防又は低下させるために予防的処置を望み得る。本発明の薬剤は、対象患者へ経口的に、経皮的に、吸入、注射を介して、鼻内に、直腸内に、又は徐放性製剤を介して送達され得る。
【0202】
本発明のなおも別の態様は、炎症、ECM分解、及び/又は軟骨分解を包含する病理学的容態を診断する方法であって、生物学的試料における配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドの量を決定すること、及び前記量を健常対象のポリペプチドの量と比較することを含む前記方法に関し、この中で、健常対象と比較したポリペプチドの量の増大は、病理学的容態の存在を示す。特定の実施態様において、障害は、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0203】
本発明のさらに別の態様は、炎症、ECM分解、及び/又は軟骨分解を包含する病理学的容態を診断する方法であって、生物学的試料における配列番号22〜42からなる群から選択されるアミノ酸配列を含むポリペプチドの活性を決定すること、及び前記活性を健常対象におけるポリペプチドの活性と比較することを含む前記方法に関し、この中で、健常対象と比較したポリペプチドの活性の増大は、病理学的容態の存在を示す。明確に、本明細書に開示された標的遺伝子の活性及び/又は発現レベルは、軟骨細胞の同化刺激に及ぼす効果を有し得る。疾患について診断するために、活性がどのレベルまで上昇すべきであるかはまだ決定されていないままである。しかしながら、患者、症状を有さない個体、及び明確に健常な個体において認められたレベルを比較することによって、当業者は、これらの関連するレベルを容易に決定し得る。当業者はいまや、どのポリペプチドがモニターされるべきであるかに気付いているので、本発明は、このような診断についての試験アッセイのための新規のツールを提供する。本発明によって提供される知識を用いることによって制御、チェック、及び診断され得る顕著な疾患は、変形性関節症である。特定の実施態様において、障害は、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0204】
本発明のなおも別の態様は、炎症、ECM分解、及び/又は軟骨分解を包含する病理学的容態を診断する方法であって、対象のゲノムDNA内に配列番号1〜21の配列の遺伝子の少なくとも1つの核酸配列を決定すること;前記配列を、データベース及び/又は健常対象から得られた核酸配列と比較すること;並びに本明細書に開示された病理学的容態の発症又は蔓延と関連した任意の差を同定することを含む前記方法に関する。このような差は、本明細書に開示された類似のマーカー遺伝子を適用するインビトロアッセイにおいてさらにチェックされ得る。このようなアッセイは、軟骨細胞の同化刺激過程における遺伝子又は該遺伝子のコードしたポリペプチドの役割を明らかにするであろう。このような突然変異が同定される場合、この知識はさらに、類似の疾患の診断のための試験キットにおいて活用することができる。特定の実施態様において、障害は、変形性関節症、関節リウマチ、アレルギー性気道疾患(例えば、喘息、鼻炎)、及び自己免疫疾患から選択される。特定の実施態様において、障害は変形性関節症である。
【0205】
本明細書の方法において採用されるポリペプチド又はポリヌクレオチドは、溶液中で遊離し得、固相支持体に固定され得、細胞表面に支持され得、又は細胞内に配置され得る。前記方法を実施するために、本発明のポリペプチド又は化合物のいずれかを固定化して、ポリペプチドの複合体形成していない形態から複合体の分離を容易にすること、及びアッセイの自動化を収容することが可能である。本発明のポリペプチドと化合物との相互作用(例えば、結合)は、反応体を含むのに適した任意の容器において達成することができる。このような容器の例には、マイクロタイタープレート、試験管、及び微量遠心管を含む。一実施態様において、ポリペプチドがマトリックスに結合できるドメインを付加する融合タンパク質を提供することができる。例えば、本発明のポリペプチドは、「His」タグ付きであることができ、その後、Ni‐NTAマイクロタイタープレートに吸着させることができ、又は本発明のポリペプチドとのProtA融合体がIgGに吸着させることができ、これが次に細胞溶解物(例えば、(35)S標識済み)及び候補化合物と組み合わさり、混合物を複合体形成に好ましい条件下で(例えば、塩及びpHについての生理学的条件で)インキュベートされる。インキュベーション後、プレートを洗浄して、任意の結合していない標識を除去し、マトリックスを固定化する。放射能の量は、直接的に、又は複合体の解離後に上清中で、決定することができる。あるいは、複合体は、マトリックスから解離され、SDS‐PAGEによって分離されることができ、本発明のタンパク質に対して結合しているタンパク質のレベルを、標準的な電気泳動技術を用いてゲルから定量する。
【0206】
また、マトリックス上にタンパク質を固定化する他の技術は、化合物を同定する方法において用いることができる。例えば、本発明のポリペプチド又は化合物は、ビオチン及びストレプトアビジンの抱合を利用して固定化することができる。本発明のビオチン化タンパク質分子は、当技術分野で周知の技術を用いてビオチン‐NHS(N-ヒドロキシ-スクシンイミド)から調製することができ、ストレプトアビジンでコーティングした96ウェルプレート(Pierce Chemical)のウェルにおいて固定化することができる。あるいは、本発明のポリペプチドと反応するが、化合物に対するポリペプチドの結合に干渉しない抗体は、プレートのウェルへと誘導体化することができ、本発明のポリペプチドは、抗体抱合によってウェルに捕捉することができる。先に説明したように、標識済みの候補化合物の調製物は、本発明のポリペプチドの存在するプレートのウェルにおいてインキュベートされ、ウェルに捕捉された複合体の量は定量化することができる。
【0207】
本発明の別の実施態様は、エクスビボ培養の間又は移入後のいずれかで細胞又は軟骨の自家移植のために用いられる軟骨細胞、軟骨細胞前駆細胞、又は間葉系幹細胞の特性を回復又は安定化することができる化合物の使用のための方法に関する。この回復は、移植片の中または周りの低レベルのECM及び/又は軟骨分解プロテアーゼの結果となり得る。例えば、候補化合物は、所望の分子が吸収又は封入されたメンブレン、スポンジ、又は他の適切な材料の移入を介して局所的に投与され得る。移入デバイスが用いられる場合、デバイスは、任意の好適な組織又は臓器へと移入され得、所望の分子の送達は、拡散、時限放出(timed-release)急速投与、又は持続性投与を介し得る。
【0208】
ECM及び/又は軟骨分解の速度は典型的には、培地において軟骨細胞によって産生される軟骨、又は軟骨構成要素、又は軟骨含有細胞外マトリックスの沈着を決定することによって測定することができる。Walsh G.の文献「タンパク質:バイオテクノロジー及び生化学(Proteins: Biotechnology and Biochemistry)」(John Wiley and Sons, 2001)において説明されるもののような、細胞べースのELISA、酵素アッセイ、又は当技術分野で公知の他の一般的な技術を用いて、軟骨構成要素を測定することができる。
【0209】
本発明は、以下の図及び実施例においてさらに説明される。
【実施例】
【0210】
(実施例1:NHACを用いたMMP13アッセイ)
導入において説明したように、MMP13は、変形性関節症患者の影響を受けた関節における軟骨の分解に至る異化事象に関与する鍵となる担い手のうちの1つとして、変形性関節症の文献において同定されている。それゆえ、疾患関連誘発因子を用いて活性化された初代ヒト軟骨細胞におけるMMP13の発現を調節する因子を同定するために、機能的ゲノミクスの尽力を開始するよう決定した。本アッセイはさらに、「MMP13アッセイ」として本明細書で言及される。本アッセイにおいて同定された因子は、変形性関節症のための新規の治療法の開発のための基礎として用いることができる。
【0211】
SilenceSelect回収物のスクリーニングのために開発されたMMP13アッセイは、以下の特有の特色を有する:
・本アッセイは、初代ヒト関節軟骨細胞を用いて実施するが、最小の適用を用いて、初代軟骨細胞、軟骨細胞前駆細胞、又は軟骨細胞細胞株の任意の他の源について用いられ得る。
・本アッセイは、用いられる初代ヒト軟骨細胞が、可能な限り多くの正常環境(軟骨マトリックス)に類似した環境にあるよう実施される。細胞は、三次元培養において増殖し、培養容器への細胞接着を回避する。
・本アッセイは、機能的ゲノミクス目的のために整列したアデノウイルス回収物を用いた使用のために最適化されている。
・最小の適用を用いて、本アッセイはまた、化合物又は化合物回収物をスクリーニングすることができる。
・本アッセイは、高処理モードで実施することができる。
【0212】
正常ヒト関節軟骨細胞(NHAC)を用いたMMP13アッセイは、下記により詳細に説明されている。まず、開発されたMMP13 ELISAのプロトコールは、第1節に説明されている。次に、初代軟骨細胞の培養及び維持は、第2節に説明されている。NHACを用いたMMP13アッセイのスクリーニングプロトコールは、第3節に説明されている。対照プレートの組成及び性能は、第4節に示されている。SilenceSelect回収物のスクリーニングの性能に関する例は、第5節に示されている。
【0213】
NHACにおけるMMP13アッセイは、NHACにおけるshRNAの発現を仲介する10946の異なる組換えアデノウイルスの整列した回収物に対してスクリーニングされている。これらのshRNAは、RNA干渉(RNAi)として公知の機序によって、相同的配列を含む遺伝子の発現レベルの低下を生じる。整列した回収物において含まれる10946のAd-siRNAは、6308の異なる転写産物を標的とする。平均して、いずれの転写産物も、2〜3の独立したAd-siRNAによって標的とされる。スクリーニングの原理を図1に説明し、下記のより詳細に説明する。
【0214】
(1.1 MMP13 ELISAプロトコール)
培養されたNHACによって産生されるMMP13量を検出するのに十分な感度でELISAを展開するために、種々の抗体及び基質を試験した。MMP13の測定についての384ウェルフォーマットELISAを展開した。種々の一次抗体を試験し、及び種々のELISAプロトコールは、384ウェルプレートにおけるMMP13レベルの測定について以下の検証されたプロトコールをもたらした。黒色マキシソルブ384ウェルプレート(Nunc 460518)を5μg/mL抗MMP13抗体MAB511(R&D System)で被覆する。抗体を炭酸‐重炭酸被覆緩衝液(1.59g Na2CO3(Sigma S‐7795)及び2.93g NaHCO3(Sigma S‐5761))含有1LミリQ、pH9.6に調整)で希釈する。4℃で一晩インキュベーション後、プレートを100μL PBST(80g NaCl、2g KCl(Sigma)、11.5g Na2HPO4・7H2O、及び2g KH2PO4含有10LミリQ;pH7.4+0.05%Tween‐20(Sigma))で3回洗浄し、100μL/ウェルのブロッキング緩衝液(5%無脂肪ドライミルク含有PBS)でブロッキングする。室温で2時間のインキュベーションの後、プレートを100μLのPBSTで3回洗浄する。次に、PBSTを除去し、35μLの試料をELISAプレートに移す。4℃で一晩インキュべ−ションの後、プレートをPBSTで3回洗浄し、35μL/ウェルの1.5mM APMAとともに37℃で1時間インキュベートする。10mM APMAストック溶液(前日に調製)を4℃で保存する(35.18mg APMA(Sigma A‐9563)含有10mL 0.1M NaOH(Merck 1.06469.1000))。10mM APMAストック溶液をAPMA緩衝液(10×APMA緩衝液:500mMトリス(Roche 708976)、50mM CaCl2(Sigma C‐5080)、500μM ZnCl2(Sigma Z‐0173)、1.5M NaCl(Calbiochem 567441)、0.5%Brij35(Sigma 430 AG‐6)、及びpH7.0に調整)において1.5mMに希釈する。APMAによるMMP13の活性化後、プレートを100μL PBST/ウェルで再度3回洗浄する。OmniMMP Fluorescent基質(Biomol P‐126)をOmniMMP緩衝液(10×OmniMMP緩衝液:500mM Hepes(Sigma H4034)、100mM CaCl2(Sigma C5080)、0.5%Brij35(Sigma 430 AG‐6;pH7.0に調整))に溶解し、0.01mMの終濃度にする。この基質35μLを各ウェルに添加する。37℃での一晩のインキュベーション後、試料中の活性のあるMMP13は基質を切断し、蛍光を放出する。読み出しを、320nm励起/405nm発光フィルターを用いるEnVision(Perkin Elmer)において実施する。
【0215】
(1.2 初代軟骨細胞の維持)
正常ヒト関節軟骨細胞(NHAC)継代1を商業源から獲得した(カタログ番号CC‐2250、Cambrex Verviers, BE)。実験ごとについて、ウイルス含有初代NHACを製造元のプロトコールに従って解凍し、細胞を標準的な条件(37℃、5%CO2)下で軟骨細胞増殖培地(CGM、カタログ番号CC3216、Cambrex、Verviers)においてT80細胞培養容器において単層で培養する。この培養がコンフルエンスに到達すると、細胞を製造元のプロトコールに従ってトリプシン処理し(試薬パックカタログ番号CC‐3233、Cambrex、Verviers、BEを使用)、新たなT175培養容器(1×10E+05個の細胞/T175フラスコ)に転移させた。これらの培養物がコンフルエンスに到達すると、細胞をトリプシン処理し、MMP13アッセイに供した。それゆえ、MMP13アッセイに用いた細胞は、解凍後2回の継代について継代したのみであった。
【0216】
(1.3.スクリーニング手順)
最適なスクリーニングプロトコールは、以下のとおりである:96ウェル組織培養プレートを、5%FBS並びに100単位/mLペニシリン(Invitrogen)及び100μg/mLストレプトマイシン(Invitrogen)の混合物を補充したDMEM‐F12培地(この培地はさらに、「アッセイ培地」と呼ばれる。)において調製された50μLの1.5%低融点アガロースで被覆する。NHACをトリプシン処理し、5%FBS並びにペニシリン及びストレプトマイシンの混合物を含むDMEM‐F12において7500個の細胞/20μL/ウェルの密度でポリプロピレン96ウェルプレートに蒔種する(細胞接着を回避するため)。次に、細胞をヒトコクサッキー/アデノウイルス受容体(hCAR)の発現を仲介するアデノウイルスに(およそ250のMOI(感染多重度、アッセイにおける細胞あたりに用いられるウイルス粒子の量を指す。)で)感染させて、SilenceSelect回収物に含まれるAd‐SiRNAウイルスによるその後の感染を容易にする。ヒトコクサッキー/アデノウイルス受容体は、ヒト細胞膜へのアデノウイルスの付着に関与する共受容体である。細胞におけるこの受容体の発現は、例えばT細胞におけるアデノウイルスによるその後の感染を容易にするために説明されている(Schmidtらの文献(2000))。翌日、384ウェルプレート(1mLあたり1×109のウイルス粒子の概算力価)に保存されたSilenceSelect(登録商標)回収物(WO03/020931)の各ウェルからの12μLのAd‐SiRNAウイルスを96/384チャネルディスペンサーの助力で、NHACを含む96ウェルプレートの個々のウェルに転移させた。アデノウイルスライブラリーの平均力価が1×109のウイルス粒子/mLであるので、このことは、約1600の平均MOIを表す。Ad‐siRNAのウェルへの添加後、37℃で1時間のインキュベーション工程を実施する。感染を、各ウェルがSilenceSelect(登録商標)回収物由来のAd‐siRNAの1つの個々の種類で感染すると、整列した様式で実施する。次に、8%FBS並びにペニシリン及びストレプトマイシンの混合物を補充したDMEMF12培地において調製した40μLの0.8%低融点アガロースをウェルに添加する。ウェルの内容物を多重チャネルロボットを用いたピペッティングによって上下にすることによって混合し、50μLの混合物をアガロースで被覆した96ウェルプレートに転移させる。アガロースの凝固の速度を上げるために、プレートを4℃でおよそ15分間保存する。150μLのアッセイ培地をウェルに添加する。次に、感染したNHACを4日間インキュベートし、細胞におけるshRNA発現を十分なレベルに到達させておき、細胞における遺伝子サイレンシングの機構を完全に刺激しかつ有効にしておく。感染4日後、細胞における培地をアッセイ培地で改める。翌日、細胞を、10ng/mL組換えヒトIL1bを含むアッセイ培地の添加によって刺激する。誘発因子の添加2日後、上清を回収し、MMP13 ELISAに供するまで−80℃で保存する。35μLの上清をMMP13 ELISAに供し、MMP13 ELISAを384ウェルプレートフォーマットにおいて実施する。高処理量適合性ELISAに適用されるプロトコールは実施例1.1に説明されている。感染、培地交換、及び培地回収の工程をTECAN Freedomピペッター(TeMO96、TeMO384、及びRoMaを装備したTecan Freedom 200、Tecan AG、Switzerland)を用いて実施した。
【0217】
(1.4.対照プレートの性能)
96ウェル対照プレートを、本アッセイの質を評価するために作製する。対照プレートは、SilenceSelect(登録商標)回収物と同じ方法で作製する。この対照プレートの複数の一定分量を生じ、−80℃で保存する。スクリーニングの施行ごとについて、スクリーニングプレートの新たな一定分量を解凍し、スクリーニング試行すべての性能を比較させる。このプレートの組成は以下のとおりである。ウェルを、SilenceSelect(登録商標)アデノウイルス回収物(WO03/020931)と同じ条件下で産生された対照ウイルスで満たす。この対照プレートは、4セットの陽性対照ウイルス(陽性対照ウイルスあたり8ウェル;P1(Ad5‐R1T1_v5_KD)、P2(Ad5‐SLC26A8_v2_KD)、P3(Ad5‐TRAF6_v4_KD)、P4(Ad5‐NFKBIA_KI)、列に配置、3セットの陰性対照ウイルス(陰性対照ウイルスにつき16ウェル;N1(Ad5‐空_KD)、N2(Ad5‐M6PR_v1_KD)、N3(Ad5‐LacZ_KI))で間を配置)を含む。陰性対照ウイルスをIL1の存在下(8ウェル)又はIL1の不在下(8ウェル)のいずれかで試験する。陽性対照試料を、文献情報(P3(Ad5‐TRAF6_v4_KD)、P4(Ad5‐NFKBIA_KI))に基づいて、又は限定されたAd‐siRNAウイルスの予備スクリーニング(P1(Ad5‐RIT1_v5_KD)、P2(Ad5‐SLC26A8_v2_KD))に基づいてのいずれかで選択する。TRAF6は、IL1βの下流のシグナル伝達に必要であることが公知であり(Caoらの文献(1996))、NFKBIAの過剰発現は、MMP13の発現に必要であることが公知の転写因子であるNFカッパBを阻害することが公知である(Karinの文献(1999))。
【0218】
対照プレートを、異なるスクリーニング実施の間のSilenceSelect(登録商標)回収物からの一定分量プレートと同じ条件下で並行して実施する。先に説明したスクリーニングプロトコールを用いて試験した対照プレートの性能に関する代表的な例を図3に示す。示されるデータは、対照プレートに含まれるウイルスに感染したNHACによって産生されるMMP13のレベルを表す。2つの対照プレートの試験から得られたデータの平均を示す。データは、細胞のIL1処理によるMMP13発現の明確な上方制御を示す。細胞のIL1処理の際に得られる最大MMP13レベルは、3つのネガティブコントロールに匹敵する。4つのポジティブコントロールはすべて、NHACのIL1応答を低下させ、最大の効果は、P3(Ad5‐TRAF6_v4_KD)及びP4(Ad5‐NFKBIA_KI)ポジティブコントロールについて観察された。これらのデータは、スクリーニングの良好な質を確認する。
【0219】
(実施例2:SilenceSelect回収物のスクリーニング)
合計10946のウイルスのSilenceSelect回収物を、実施例1.3において説明されたプロトコールに従って3次元フォーマットにおけるアガロースにおいて培養した初代NHACに関して実施したMMP13アッセイにおいてスクリーニングする。これらの10946ウイルスは、6308の転写産物を網羅し、SilenceSelect(登録商標)回収物において構築される重複性を反映する。これらの重複性は、SilenceSelect(登録商標)回収物内に含まれる複数の独立したAd‐siRNAによって標的とされるほとんどの転写産物を結果として生じる。スクリーニングバッチの1つの間に得られるデータを図4に示す。スクリーニングバッチの間、SilenceSelect(登録商標)回収物の4384ウェルプレートにおいて含まれる1536のAd‐siRNAを、MMP13アッセイにおける二つ組においてスクリーニングする。実施例1において与えられるNHACに関するMMP13アッセイの説明において記述されているように、NHAC細胞培養、Ad5‐siRNAによる感染、及びIL1による活性化を96ウェルフォーマットにおいて実施する。このように、SilenceSelect(登録商標)回収物に含まれる384ウェルプレートのあらゆる四半分を用いて、NHACを含む2つの96ウェルプレートを並行して感染させる。次に、得られた上清を384ウェルプレートに転移させて、実施例1.1に説明されたMMP13 ELISAにおけるMMP13レベルを決定する。転移は、二つ組試料が、同じMMP13 ELISAプレートに関して測定されるよう計画される。データ分析を以下の通り実施する:
【0220】
まず、あらゆる384ウェルプレートについて個々に、すべての試料についてのデータを標準化し、「標準化された値」へと以下の通り変換する。384のデータポイントすべてを列挙し、5%の最高の及び5%の最低のMMP13シグナルをリストから除去する。次に、平均及び標準偏差を個の削減したリストのすべての試料にわたって算出し、これらの平均及び標準偏差に基づいて、標準化されたデータを式:標準化された値の試料A=[(生のMMP13シグナルの試料A−平均)/(標準偏差)]を適用することによって算出する。384ウェルプレートについてのこのデータの変換によって、異なるスクリーニングバッチの試料の比較が可能となる。
【0221】
次に、閾値を以下の通り的中物喚起(hit calling)させるよう決定する。スクリーニングバッチごとについて、2つの96ウェル対照プレートをSilenceSelect(登録商標)回収物からの試料と並行して試験し、あらゆる対照プレートは、3つのネガティブコントロールウイルスを含む(ネガティブオントロールウイルスあたり8ウェル)。対照プレートに含まれる3つのネガティブコントロール(3×16ウェル=合計48ウェル)についてのMMP13シグナルの平均及び標準偏差を算出する。このデータに基づいて、種々の閾値を以下の式を適用することによって標準偏差と関連して表す:閾値=[(ネガティブコントロールにわたる平均)−(「カットオフ」回数×ネガティブコントロールにわたる標準偏差)]。次に、種々の閾値を48のネガティブコントロールに対して試験する。カットオフは、ネガティブコントロールの19%未満がこの閾値よりも低い閾値を規定するよう選択される。Ad‐siRNAウイルスは、これらのAd‐siRNAについての両方のデータポイント(標準化された値として表される。)が、最初のスクリーンにおける選択されたカットオフ値を下回ってスコア化した場合、初回的中物として任命した。
【0222】
図4において、NHACに関するMMP!3アッセイに対するSilenceSelect(登録商標)回収物のスクリーニングの間にスクリーニングバッチのうちの1つにおいて得られるデータを示す。このスクリーニングバッチにおいて、1536のAd‐siRNAを二つ組で試験した。グラフにおいて、Ad‐siRNAについて得られた2つのデータポイント(標準化されたMMP13レベルの点で表される。)を互いに対してプロットする。このスクリーニングバッチについて決定されたカットオフ(−1.8)を点線で示す。カットオフを下回る2つのデータポイントを生じ、かつ最初の的中物(36Ad‐siRNA)として任命したAd‐siRNAについてのデータを黒点として示し、選択されたカットオフを下回る唯一のデータポイントを生じたAd‐siRNAについてデータを灰色の点として示し、非的中物Ad‐siRNAについてのデータを白色の点として示す。二つ組のデータポイント(データポイントは、直線の周りに集中している。)間で観察される対称性は、スクリーニングの良好な質及び再現性を示す。
【0223】
図6に示されるスキームは、より詳細に分析された的中物のスクリーニング及び選択の間に得られる摩擦を示す。スクリーニングされた10946のAd‐siRNAのうち、263を二つ組でのスコア化として同定された。加えて、最初のスクリーンうちの最大値を抽出するために、2つのデータポイントのうちの1つにおいてのみのウイルスのスコア化のリストをさらに分析して、同一の転写産物を標的とする独立したウイルスを同定した。異なる標的配列を通じて同じ遺伝子を標的にする2つの独立したAd‐siRNAが、たとえより弱くてもMMP13アッセイにおいて活性があるという事実は、価値のある情報と考えられる。本分析は、106の的中物を最初の的中物リストに付加し、最初の的中物の最終数を369とした。これらの369の最初の的中物を実施例3において説明される再スクリーン手順においてさらに分析した。
【0224】
(実施例3:3MOI再スクリーン)
(3.1 再スクリーニングプロトコール)
最初の的中物を確認した的中物にするために、元の的中物Ad‐siRNAを独立して2倍に再増殖させて、独立したAd‐siRNA材料を生じる。次に、これらの再増殖したウイルスを3MOIでNHACに関するMMP13 ELISAにおいて試験する。再増殖材料が、SilenceSelect(登録商標)回収物に含まれる元の最初の的中物と比較して異なる力価を有するウイルス材料を生じ得るので、元の最初の新たなウイルス材料を3MOIでスクリーニングする。2つの再増殖物を3MOIで試験すると、6つのデータポイントを、「3MOI再スクリーン」に供したあらゆるAd‐siRNAについて生じる。両再増殖材料について少なくとも1MOIをスコア化する的中物のみが、確認された的中物と考えられる。
【0225】
再増殖工程について、最初の的中物をSilenceSelect回収物から拾い、ポジティブコントロール及びネガティブコントロールとともに96ウェルプレートにおいて再増殖させる。3MOI再スクリーンの実施についての考えられるレイアウトを図5Aに示す。各再増殖プレートは、20の対照ウェルによって取り囲まれる的中物ウイルスを含む40ウェルを有する。これらの対照ウェルは、ネガティブコントロール(N1(Ad5‐空_KD);N2(Ad5‐LacZ_KI);N3(Ad5‐M6PR_v1_KD);N4(Ad5‐空_KD))又はポジティブコントロール(P1(Ad5‐TRAF6_v4_KD);P2(Ad5‐RIT1_v5_KD);P6(Ad5‐空_KD);P7(Ad5‐空_KD))のいずれかを含む。増殖のために、SilenceSelect(登録商標)回収物からの的中物Ad‐siRNA試料の粗可溶化液を拾い、96ウェルプレートにおいて対照とともに配置する。粗可溶化液の容器は、バーコード(Screenmates(商標)、Matrix technologies)で標識されているので、品質チェックをプレートについて実施する。ウイルスを増殖させるために、2.25×104PER.C6/E2A細胞を、96ウェルプレートの各ウェルにおいて10%の非熱失活FCSを含む200μLのDMEMに蒔種し、10%CO2で加湿されたインキュベーターにおいて39℃で一晩インキュベートする。次に、先に示した96ウェルプレートに配置された各的中物Ad‐siRNA由来の1μLの粗可溶化液を添加して、96ウェルディスペンサーを用いてPER.C6/E2A細胞のウェルを分離する。10%CO2で加湿されたインキュベーターにおけるインキュベーションの7〜10日後、再増殖プレートを−20℃で凍結し、但し、完全なCPE(ウイルス産生が完全であることを示す細胞変性効果)が観察され得ることを条件とする。
【0226】
次の工程において、再増殖プレートに含まれるAd‐siRNAを、NHACに関するMMP13アッセイにおいて試験する。本試験のために、最初のスクリーニングについて実施例2に説明されたものと同じプロトコールを用い、増殖したウイルスの3容積:すなわち8μL、12μL、及び16μLを用いて、MMP13アッセイに供した軟骨細胞を感染させることが唯一の違いであった。次に、2つの感染していないものを除くすべての対照ウェルをIL1で活性化させる。加えて、P6及びP7対照をスタウロスポリン(5μM終濃度)及びブレフェルジンA(0.5μL/mL終濃度)で処理する。これらの化合物をIL1誘発因子の添加の前日に、及びIL1誘発因子の添加とともに翌日に添加する。P6及びP7対照ウェルへのスタウロスポリン及びブレフェルジンAの添加の目的は、NHACによる分泌が完全に遮断される場合(ブレフェルジンA)又は細胞が細胞毒性化合物で処理される場合(スタウロスポリン)、背景MMP13発現レベルを規定することである。3MOI再スクリーンのデータを以下の通り分析する。
【0227】
まず、あらゆるプレートについて、試料データを以下の式を用いて標準化する:
標準化されたMMP13値の試料A=[((生のMMP13シグナルの試料A)−(ネガティブコントロールにわたるMMP13シグナルの中央値))/(ネガティブコントロールのMMP13シグナルにわたる標準偏差)]。
【0228】
同じ基礎を適用して、ポジティブコントロールについての標準化された値を生じる:
標準化されたMMP13値のポジティブコントロール=[((ポジティブコントロールにわたるMMP13シグナル中央値))−(ネガティブコントロールにわたるMMP13シグナル中央値)/(ネガティブコントロールのMMP13シグナルにわたる標準偏差)]。
【0229】
「3MOI再スクリーン」について、ポジティブコントロールは、IL1により誘導されるMMP13発現レベルの最大阻害を反映することが期待されるスタウロスポリン及びブレフェルジンA(P6及びP7)で処理したウェルである。試料及びポジティブコントロールについて標準化されたMMP13値に基づいて、パーセンテージ阻害を、以下の式を適用することによってあらゆる資料について算出する:パーセント阻害試料A=[(標準化されたMMP13値の試料A)/(標準化されたMMP13値のポジティブコントロール)×100]。
【0230】
3MOI再スクリーンの結果の例を図5Bに示す。示される実験は、二つ組で8μLのNHAC MMP13アッセイにおける1つの96ウェル再増殖プレート(40の最初の的中物AdsiRNA及び適切な対照を含む。)のスクリーニングの間に得られるデータを表す。データは、IL1により誘導されるMMP13の発現のパーセント阻害として表される。的中物喚起について選択されるカットオフは、40パーセントである(点線として表される。)。P6及びP7ポジティブコントロールについての平均パーセント阻害(100%)は、黒色三角形として表され、P1及びP2ポジティブコントロールについての平均パーセント阻害(48%)は、十字として表され、N1、N2、N3、及びN4ネガティブコントロールについての平均パーセント阻害(−8.6%%)は、灰色三角形として表される。的中物喚起基準を厳守するAd‐siRNAについてのデータ(2つのデータポイントは、40%カットオフを上回る。)は、白色又は灰色の円として示され、的中物喚起基準を厳守していないAd‐siRNAについてのデータは、四角形として示される。この再増殖プレートについて及びこのMOIにおいて、40の最初の的中物Ad‐siRNAのうちの11を確認した。
【0231】
13の好ましい標的すべてについて得られた3MOI再スクリーンデータを表3に示す。この表は、「3MOI再スクリーン」において活性があるものとして同定されたTARGETを示す。
【表3】

【0232】
再スクリーン実験の結果に関する典型的な例を図6に示す。本再スクリーン手順において、試験した369のノックダウンウイルス的中物のうちの225を確認した。これらのうち、13を、薬剤能(drugability)、小分子回収物に対する標的のスクリーニングを可能にする消耗品の有効性、ヒトオルソログ及び齧歯類オルソログ間の標的配列の保存のレベルとして、候補標的の種々の特性が分析される「インシリコ(in silico)」分析に基づいたさらなる検証のために選択した。
【0233】
(3.2 標的Ad‐siRNAの品質管理)
的中物Ad‐siRNAの品質及び同一性をPCRによってチェックし、さらに説明されるとおり配列決定する。標的Ad‐siRNAを96ウェルプレートにおいてPER.C6(登録商標)細胞の誘導体(Crucell, ライデン、オランダ)を用いて増殖させた後、標的Ad‐siRNAウイルスによってコードされるsiRNAを配列決定する。PER.C6/E2A細胞を180μLのPER.C6/E2A培地において40,000個の細胞/ウェルの密度で96ウェルプレートに蒔種する。次に、細胞を10%CO2加湿インキュベーターにおいて39℃で一晩インキュベートする。翌日、細胞に、標的Ad‐siRNAを含むSilenceSelect(登録商標)ストック由来の1μLの粗細胞可溶化液を感染させる。(典型的には感染7日後、細胞の膨潤及び丸みを帯びることによって明らかとなる)細胞病理効果の出現まで、細胞を34℃、10%CO2でさらにインキュベートする。上清を回収し、1mg/mLのプロテイナーゼK(Roche Molecular Biochemicals、カタログ番号745 723)及び0.45%Tween‐20(Roche Molecular Biochemicals、カタログ番号1335465)を補充したMgCl2を有する4μLの溶解緩衝液(1×Expand High Fidelity緩衝液)を滅菌済みPCRチューブに12μLの粗可溶化液に添加することによって、ウイルス粗可溶化液をプロテイナーゼKで処理する。これらのチューブを55℃で2時間インキュベートした後、95℃での15分間の失活工程に続く。PCR反応のために、1μLの溶解物を、MgCl2を有する5μLの10×Expand High Fidelity緩衝液、0.5μLのdNTP混合物(各dNTPにつき10mM)、1μLの「順方向プライマー」(10mMストック、
【化1】

、1μLの「逆方向プライマー」(10mMストック、
【化2】

、0.2μLのExpand High Fidelity DNAポリメラーゼ(3.5U/μL、Roche Molecular Biochemicals)、及び41.3μLのH2Oから構成されるPCRマスター混合物に添加する。
【0234】
PCRをPE Biosystems GeneAmp PCRシステム9700において以下の通り実施する:PCR混合物(合計50μL)を95℃で5分間インキュベートし;各周期を95℃で15秒間、55℃で30秒間、68℃で4分間実施し、35周期反復する。68℃における最終インキュベーションを7分間実施する。5μLのPCR混合物を2μLの6×ゲル負荷緩衝液と混合し、0.5μg/μLの臭化エチジウムを含む0.8%のアガロースゲルに負荷して、増幅産物を分離する。増幅した断片の大きさは、同じゲルに負荷された標準的なDNAラダーから概算される。期待される大きさはおよそ500bpである。配列決定分析のために、標的アデノウイルスによって発現したsiRNAコンストラクトを、pIPspAdapt6-U6プラスミドのSapI部位を隣接するベクター配列と相補的なプライマーを用いるPCRによって増幅する。PCR断片の配列を決定し、期待された配列と比較する。すべての配列は、期待された配列と同一であることが認められる。
【0235】
(実施例4:オンターゲット(On target)検証)
siRNA技術の強み及び利点は、本技術が科学界を通じて広がった速度によって十分に認識され及び立証される。なおも、本技術の使用は、1)siRNAが、部分的な配列のみの相補性と関連していない遺伝子を非特異的に標的にし得(オフターゲット効果)、かつ2)siRNAの有効性が予測困難である(Peiらの文献(2006))ので、必要とされる技術及び知識を要する。このように、独立した設定においてノックダウンウイルススクリーンにおいて同定された最初の的中物の活性を確認することが重要なままである。この目的のために2つのアプローチが取られた。第一に、異なる標的配列を通じてある遺伝子の発現を低下させるよう設計された1セットの追加的なノックダウンウイルスを作製した。第二に、合成siRNAを購入し(Dharmacon)、軟骨細胞株SW1353における標的検証について用いた。
【0236】
(4.1.追加的なノックダウンウイルスを用いるオンターゲット分析)
異なる標的配列を通じて選択された好ましい的中物の発現を低下させるよう設計された1セットのノックダウンウイルスを作製した。これらのノックダウンウイルスをその後、ポジティブコントロールウイルス及びネガティブコントロールウイルスとともに、96ウェルプレートに整列させた。3MOI再スクリーン(実施例3)について説明した再増殖プレートについて説明したのと同じ対照を用いた。特定の的中物を標的にするすべての追加的な異なるノックダウンウイルスを、最初のスクリーンの間にこの標的について同定された元の的中物ノックダウンウイルスとともにプレートにおいて再グループ化した。これらのプレートを2回再増殖させた。次に、あらゆる再増殖したプレートの2つのコピーを二つ組で2回の独立した試行において、最初のスクリーンについて先に説明したNHAC MMP13アッセイにおいて、12μLのMOIを用いて試験した。このように、8個のデータポイントをあらゆるノックダウンウイルスについて生じた。データを3MOI再スクリーン(実施例3)について先に説明したとおり分析し、データを%阻害に変換した。生じた8個のデータポイントのうちの4つについて35%のMMP13レベルの低下を生じているノックダウンウイルスを、本アッセイにおいて検証されたと考えた。このように、NHACにおけるIL1により誘導されるMMP13発現レベルを低下させる能力を有する1つの追加的なノックダウンウイルスを、以下の標的について同定し:ADAM15、GRP34、EPHA5、MAP2K2、MET、GPR43、2つの追加的なノックダウンウイルスをADAMTS6について、3つをSTK32Bについて、4つをMC3Rについて同定した。
【0237】
(4.2.合成siRNAを用いたオンターゲット分析)
本実験の目的は、合成siRNA二本鎖を用いてIL1により刺激されたMMP13放出に及ぼすアデノウイルスshRNA仲介性ノックダウン効果をさらに検証することであった。検証は、IL1刺激に対する応答におけるMMP13発現を上方制御することがすでに示されている軟骨肉腫SW1353細胞株において実施した。
【0238】
(4.2.1 材料)
ヒト軟骨肉腫SW1353細胞(カタログ番号HTB‐94、ATCC)を37℃の加湿した5%CO2インキュベーターにおいて、10%熱失活FBS(Hyclone)及び1×ペニシリン/ストレプトマイシンDMEM(カタログ番号15140‐122、Gibco)を補充したDMEM(カタログ番号41966‐029、Gibco)において増殖させ、トリプシン処理の1週間後に2回経代する(1:5の分岐比)。
【0239】
関心対象の遺伝子についての既製の遺伝子サイレンシングsiRNA二本鎖はDharmaconから得られ得る。siGENOME SMARTプール(または4のON‐TARGETプラスセット)の凍結乾燥したストック試薬を1×siRNA緩衝液(カタログ番号B‐002000‐UB‐015、Dharmacon)で再構成して、20μM濃度を達成し、一定分量を−20℃で保存する。
【0240】
(4.2.2 手順)
最適化された条件下で、siRNA二本鎖をSW1353細胞に送達する。SW1353細胞を、96ウェルプレート(Nunc)において、10000個の細胞/100μLの細胞培地でトランスフェクションの24時間前に蒔種する。細胞に、本質的に製造元の説明書に従って、1μL/ウェルの終濃度でINTERFERin(商標)(カタログ番号409‐10、Polyplus‐トランスフェクション)を用いてsiRNA試薬(30nM又は10nM終濃度)を形質移入する。簡潔には、siRNAストック試薬を50μLの無血清OptiMEM(カタログ番号51985‐026、Gibco)に希釈し、1μLのINTERFERin(商標)試薬を添加した後、10秒間即時均質化し、室温で10〜45分間インキュベーションして、INTERFERin(商標)/siRNA複合体を形成しておいた。複合体形成の間、SW1353細胞の上部の培地を、抗生物質を含まない100μLのあらかじめ加温しておいた細胞培地と交換する。次に、50μLの形成されたINTERFERin(商標)/siRNA混合物を細胞に添加し、プレートを37℃及び5%CO2のインキュベーターに戻す。
【0241】
72時間後、細胞の上部の培地を除去し、10ng/mL組換えヒトIL1β(カタログ番号200‐01B、PeproTech)及び25ng/mL組換えヒトOSM(カタログ番号295‐0M、R&D Systems)を含む100μLのあらかじめ加温しておいた培地と交換する。培地は、5%熱失活FBS及び1×ペニシリン/ストレプトマイシンを含むDMEM/F12(カタログ番号11320‐074、Gibco)である。
【0242】
サイトカインの添加24時間後、上清を回収し、MMP13 ELISA(実施例1参照)、MMP1 ELISA(WO2006/040357において説明されるとおり)、及びTIMP2 ELISA(WO2006/040357において説明されるとおり)における適切な希釈物に関するその後の分析のために−80℃で保存する。TIMP2レベルは、誘発因子の添加によって影響されないので、上清に分泌されるTIMP2の量の変化を用いて、細胞生存率/分泌に及ぼすsiRNA遺伝子特異的二本鎖トランスフェクションの効果を評価する。
【0243】
MMP13及びMMP1のIL1/OSM仲介性上方制御に及ぼす関心対象の遺伝子についてのsiRNA二本鎖送達の効果を2つの独立した実験において評価し得る。各実験において、siRNA二本鎖のトランスフェクションを2つのsiRNA濃度(10nM及び30nM)において二つ組で実施する。ヒトMMP1を標的とするSMARTpool試薬(siGENOME SMARTpool siRNA MMP1)、並びにヒトTRAF6遺伝子(4のうちのsiGENOME SMARTpool siRNAセット)及びMMP13遺伝子(4のうちのsiGENOME SMARTpoolセット)を標的とする4つの選択された個々のsiRNA二本鎖のうちの1つをポジティブコントロールとして用いる。siCONTROL非標的化siRNAプール又は30nM及び/若しくは10nMのGL2.2二本鎖標的ルシフェラーゼを形質移入した細胞をネガティブコントロールとして用いる。MMP1分析について、ネガティブコントロールには2つの濃度の両siRNA試薬を含む。MMP13分析について、ネガティブコントロールには30nM及び10nMの非標的化siRNA試薬、並びに10nMのGL2.2二本鎖を含む。刺激されていないままのGL2.2対照を形質移入した追加的なウェルを、刺激されていない対照として含む。ポジティブコントロール、ネガティブコントロール、及び刺激されていない対照は、各96ウェルプレートに含まれる。4つの異なる96ウェルプレートの回収された上清を、1つの384ウェルELISAにおいて分析し、結果を以下のとおり分析し得る:
【0244】
第一に、各ウェルについてのMMP13及びMMP1数値データを、以下のとおりシグナルのパーセント阻害(%PIN)として再算出する:
%PIN=100−((シグナル試料−Avシグナル刺激されていない対照)/(Avシグナルネガティブコントロール−Avシグナル刺激されていない対照)×100)
式中、
Avシグナル刺激されていない対照は、同じ384ELISAに関して分析された4つの96ウェルプレートすべての刺激されていない対照の平均である。
Avシグナルネガティブコントロールは、同じ384ELISAに関して分析された4つの96ウェルプレートすべての説明されたネガティブコントロールの平均である。
【0245】
TIMP2の結果は、以下の式に従ってシグナルのパーセント阻害(%PIN)として表される:
%PIN=100−((シグナル試料−Avシグナル背景)/(Avシグナルネガティブコントロール−Avシグナル背景)×100)
式中、
Avシグナル背景は、TIMP2 ELISAの背景シグナル、すなわちTIMP2の不在下で得られたシグナルである。
Avシグナルネガティブコントロールは、同じ384ELISAに関して分析された4つの96ウェルプレートのすべてのネガティブコントロールの平均である。
【0246】
次に、個々のウェルは、%PINが35%よりも(MMP1の場合)又は50%よりも(MMP1の場合)高い場合、正のスコアを有すると言われ得る。これらのカットオフ設定において、ネガティブコントロールは、正のスコアを有するとは認められない。10nM又は30nMでのトランスフェクションについての結果は、両方の複製物があらかじめ設定されたカットオフを上回ってスコア化している場合にのみ、1のスコア化値を与えられる。MMP1又はMMP13の発現の低下が、細胞生存率の損失に起因していないことを確認するために、TIMP2の結果を考慮に入れる。TIMP2シグナルが両方の複製物について35%超低下すると認められる場合、MMP1又はMMP13の結果は考慮に入れない。各スクリーンについて、最終的な値は、TIMP2分析を考慮に入れた後のsiRNA二本鎖の両試験濃度におけるスコア化値の合計であった標的に割り当てられる。次に、与えられた遺伝子についてのsiRNA二本鎖の効果は、両スクリーンの最終的な値の合計が2以上である場合、「真の」効果であると考えられる。標的は、MMP1又はMMP13のいずれかにおいて真の的中物としてスコア化した場合、合成siRNAと検証されると考えられる。このように、以下の標的を、合成siRNA技術を用いて検証したと考えられた:ADAMTS6、MC3R、MET、CSNK1G2、EDG4、MAP4K1、KCNN4。
【0247】
ひとまとめに考えると、オンターゲット分析を通じて選択された13の的中物についてのオンターゲット検証運動の結果を表3に示す。最初のスクリーンにおいて同定された元のノックダウンウイルス的中物の効果を反復できる追加的なノックダウンウイルスの同定を通じて9の標的が検証され、合成siRNA技術を用いて7(そのうち3は追加的なノックダウンウイルスを用いて検証された。)が検証された。初代ヒト軟骨細胞におけるこれらの検証された標的の発現をさらに評価した(実施例5)。
【0248】
(実施例5:好ましい標的のヒト軟骨細胞における発現分析)
好ましい標的として検証されるために、遺伝子は、軟骨細胞において発現すべきである。このことは、定量的リアルタイムPCRを用いて評価され得る。関節軟骨(NHAC)(Cambrex、Verviers、Belgium)由来の正常ヒト軟骨細胞を、5%ウシ胎仔血清(HighClone、Perbio、Erembodegem、Belgium)を補充したDMEM/F12培地において3百個の細胞/皿で9cm培養皿へと蒔種する。2日後、培地を、10ng/mLのIL‐1βを有する若しくは有さない5%ウシ胎仔血清を補充したDMEM/F12培地によって、又は10ng/mLのIL‐1βを有するか若しくは有さない軟骨細胞分化培地(CDM、Cell Applications、San Diego、CA)と交換する。各条件を二つ組で実施する。48時間のインキュベーション後、培地を除去し、細胞を、製造元の説明書に従ってRNeasy midiキット(Qiagen、Venlo Netherlands)を用いたRNA単離のために加工し、精製されたRNAを一定分量で−20℃で保存する。
【0249】
RNAを製造元の説明書に従ってTaqMan(登録商標)Gold RTキット(Applied Biosystems、Lennik、Belgium)を用いてcDNAへと逆転写する(1×TaqMan(登録商標)RT緩衝液、5mM MgCl2、0.5mM dNTP、2.5μMランダムヘキサマー、10U RNase阻害薬、及び25U マルチスクライブ(multiscribe)逆転写酵素)。
【0250】
cDNAを6倍希釈し、5μLを、SYBR(登録商標)Green Universal Mastermix又はTaqMan(登録商標)Universal Mastermix(両方ともApplied Biosystems製)のいずれかを用いて、ABI7000機器におけるリアルタイムQPCRのためにPCR反応につき25μLの反応物において用いる。
【0251】
SYBR(登録商標)Green QPCR分析におけるプライマーの開発のために、DNA配列をRefSeq配列保管所から抽出し、又は利用可能ではない場合、GenBank回収物から抽出する。これらの配列から、SYBR(登録商標)Green QPCRに好適なプライマー対を、PrimerExpressソフトウェア(Applied Biosystems)を用いて設計する。これらのプライマー対を、Blastソフトウェア(NCBI、Entrez)を用いて該プライマー対の標的遺伝子に対する該プライマー対の特異性についてチェックする。好適なプライマー対を発注し(Invitrogen)、0.3μM濃度で用いる。本プライマー対を表4に示す。
【0252】
プライマー対の質を、融点分析によってモニターし、それにより2つ以上の融点を生じる対を廃棄し、参照cDNA(Clontech Laboratories、Mountain View、CA)との比較によってモニターし、それにより融点における差は1℃を超えて異なるべきではない。
【0253】
SYBR(登録商標)Greenプライマー対が必要条件を満たさない遺伝子については、TaqMan(登録商標)アッセイを用いる(注文対応のアッセイ、Applied Biosystems)。
【0254】
遺伝子は、全条件にわたる平均Ct値が37以下であった場合に発現するものとして考えられる。
【0255】
定量的リアルタイムPCRによって得られたようなヒト関節軟骨細胞における好ましい標的の発現。各Ct値は、実施例5において概略されるように、4つの異なる条件において増殖した細胞の8の独立したRNA調製物の平均である。結果を表5に示す。
【表4】

【0256】
25を下回るCt値は高い発現と考えられ、25〜30は良好な発現と考えられ、30〜35は中程度の発現と考えられ、35超は低い発現と考えられる。それゆえ、初代軟骨細胞における良好な発現レベルを、ほとんどの標的について示すことができたが、例外は、低い発現レベルを示したGPR34(Ct=36)であった。しかしながら、低い発現レベルは、GPCRについて観察でき、この低い発現は、必ずしも常に低い受容体活性を予測するわけではない。
【0257】
(実施例6 EPHA5に関するさらなる検証)
典型的な先のTARGET EPHA5を、EPHA5を阻害し、かつNHACにおけるMMP13活性も阻害する、EPHA5に対して配向する化合物によって検証及び確認した。EPHA5に対する活性は、下記の実施例6.1及び6.2において説明されるアッセイを用いて試験され得、NHACにおけるMMP13活性を阻害する能力は、実施例7において説明されるとおり試験され得る。
【0258】
(6.1 EPHA5阻害‐生化学的アッセイ)
組換えEpha5(Milliporeカタログ番号14‐639)を、0.1mg/mLのポリ(Glu, Tyr)ナトリウム塩(4:1)、分子量20000〜50000(Sigmaカタログ番号P0275)含有キナーゼ反応緩衝液(10mM MOPS pH7.0 、1mM DTT、0.01%Triton‐X100、2.5mM MnCl2、0.5mM Na3VO4、5mMβ‐グリセロールホスファート、0.5μM非放射性ATP、0.25μCi 33P‐ガンマ‐ATP)(Perkin Elmer, カタログ番号NEG602K)とともに、5μLの試験化合物又はビヒクル(DMSO、1%終濃度)を含むか又は含まない終濃度で、総容積25μLで、ポリプロピレン96ウェルプレート(Greiner、V底)においてインキュベートする。30℃で45分後、反応を、25μL/ウェルの150mMリン酸を添加することによって停止する。終止したキナーゼ反応物をすべて、あらかじめ洗浄しておいた(75mMリン酸)96ウェルフィルタープレート(Perkin Elmerカタログ番号6005177)へと細胞回収機(Perkin Elmer)を用いて転移させる。プレートをウェルあたり300μLの75mMリン酸溶液で6回洗浄し、プレートの底部を密封する。40μL/ウェルのMicroscint‐20を添加し、プレートの上部を密封し、読み出しを、Topcount(Perkin Elmer)を用いて実施する。キナーゼ活性は、ポジティブコントロール阻害薬(10μMスタウロスポリン)の存在下で得られた1分間あたりの計数(cpm)を、ビヒクルの存在下で得られたcpmから減算することによって算出する。この活性を阻害する試験化合物の能力を以下のとおり決定する:
【0259】
パーセント阻害=((試験化合物の存在した試料について決定したcpm−ポジティブコントロール阻害薬の存在した試料について決定したcpm)/(ビヒクルの存在下で決定したcpm−ポジティブコントロール阻害薬の存在した試料について決定したcpm))×100%。
【0260】
用量希釈系列を、EPHA5アッセイにおける用量‐応答効果の試験及び各化合物についてのIC50の算出を可能にする化合物について調製する。各化合物を、30μMの濃度で定型的に試験した後、1%DMSOの終濃度で1/3の連続希釈を8地点(30μM‐6.67μM‐2.22μM‐740nM‐247nM‐82nM‐27nM‐9nM)実施する。化合物シリーズの効力が高い場合、より多くの希釈を調製し及び/又は最大濃度を下げてよい(例えば、5μM、1μM)。
【0261】
(6.2 EPHA5阻害‐細胞アッセイ)
本アッセイの原理は、STAT3及びEPHA5で一過性に形質移入したHEK293細胞におけるSTAT3(Tyr705)リン酸化レベルに関する阻害活性を決定することである。
【0262】
HEK293細胞を、10%熱失活ウシ胎仔血清、100U/mLペニシリン、及び100μg/mLストレプトマイシンを含むダルベッコ変法イーグル培地(DMEM)において維持する。
【0263】
70%培養密度のHEK293を標準的なトリプシン処理によって回収する。15,000,000個に6,250ngのpIPspAdapt6‐STAT3、3,750ngのpIPspAdapt6‐EPHA5、4,000ngのpIPspAdapt6‐eGFP、及び11,000ngのpBSKを、T175cm2細胞培養フラスコあたり50μLのJet‐PEI(Polyplus)をトランスフェクション試薬として用いて一過性に形質移入する。形質移入した細胞をT175cm2細胞培養フラスコにおいて蒔種する。37℃、10%CO2で一晩インキュベーション後、トランスフェクション培地を除去し、細胞の脱離を回避するよう新鮮な細胞培地を注意深く添加する。
【0264】
トランスフェクションの48時間後、培地を除去する。細胞を、あらかじめ加温しておいた細胞解離溶液(Sigmaカタログ番号C5914)で脱離させる。ウェルあたり60,000個の細胞/40μLのDMEMを384ウェルプレートにおいて蒔種する。次に、10μLの化合物希釈液(5×)含有DMEMを添加する。
【0265】
すべての化合物を二つ組で試験し、20μMから出発した後、1/3の連続希釈を8地点(20μM‐6.6μM‐2.2μM‐740nM‐250nM‐82nM‐27nM‐9nM)で0.2%DMSOの終濃度で実施する。
【0266】
37℃で5時間インキュベーション後、リン光体‐Stat3(Tyr705)レベルを、AlphaScreen(登録商標)SureFire(登録商標)Phospho‐STAT3(Tyr705)Assay Kit(Perkin Elmer製)を用いて決定する。細胞を、15μLの1×溶解緩衝液の添加によって溶解する。プレートを室温で20分間穏やかに振蘯する。4μLの可溶化液をプロキシプレートに転移させた後、アルファ‐ビーズを含む7μL反応緩衝液/活性化緩衝液混合物を添加し、プレートをアルミニウムシールで密封し、5分間振蘯し、室温で暗所で16時間インキュベートする。
【0267】
プレートを標準的なAlphaScreen設定を用いてEnvisionで読み取る。0.2%DMSOをネガティブコントロールとして用いる(0%阻害)。ポジティブコントロール及びネガティブコントロールを用いて、z'値及びPIN値を算出する。
【0268】
パーセント阻害=(1−((試験化合物が存在する試料について決定した値−ポジティブコントロール阻害薬を有する試料について決定した値)/(ビヒクルの存在下で決定した値−ポジティブコントロール阻害薬を有する試料について決定した値)))×100%。
【0269】
(実施例7 MMP13阻害アッセイ)
本明細書で同定されたTARGETのうちの1つに対して活性があるものとして同定された化合物を、MMP13阻害アッセイにおいて直接試験し得る。
【0270】
正常ヒト関節軟骨細胞(NHAC、Lonzaカタログ番号CC‐2550)を、5%FBS及び1%ペニシリン/ストレプトマイシンを含む培地(Gibco、DMEM:F12)において1mLあたり1600000個の濃度で懸濁する。次に、25μLの細胞懸濁液を、5%血清及び1%ペニシリン/ストレプトマイシンを有する培地中の0.8%アガロース25μLとともにプールし、5%血清及び1%ペニシリン/ストレプトマイシンを有する培地における1.5%アガロースの50μLであらかじめ被覆した96ウェル培養皿のウェルに添加する。アガロースが設定された後、127.5μLの培地を各ウェルに添加する。次に、細胞を、種々の濃度の7.5μL化合物で1時間処理した後、15μLの10ng/mL IL‐1bで刺激する(終濃度:1ng/mL)。刺激48時間後、上清を回収し、MMP13分泌を測定する。各化合物を30μMの濃度で定型的に試験した後、0.3%DMSOの終濃度で1/3連続希釈を8地点(30μM‐10μM‐3.33μM‐1.11μM‐370nM‐123nM‐41nM‐14nM)実施する。
【0271】
MMP13活性を、抗体捕捉活性アッセイにおいて測定する。この目的のために、384ウェルプレート(NUNC、P6491、MaxiSorp黒色)を35μLの1.5μg/mL抗ヒトMMP13抗体(R&D Systems、MAB511)溶液で4℃で24時間被覆する。ウェルをPBS+0.05%Tweenで2回洗浄した後、残りの結合部位を100μLの5%無脂肪乾燥乳(Santa Cruz、sc‐2325、Blotto)含有PBSで4℃で24時間ブロッキングする。次に、ウェルをPBS+0.05%Tweenで2回洗浄し、MMP13を含む35μLの培養上清を添加し、室温で4時間インキュベートする。この後、ウェルをPBS+0.05%Tweenで2回洗浄した後、MMP13タンパク質を、35μLの1.5mM 4-アミノフェニル水銀アセタート(APMA)(Sigma、A9563)溶液の添加及び37℃で1時間のインキュベーションによって完全に活性化する。次に、ウェルをPBS+0.05%Tweenで再度洗浄し、35μLのMMP13基質(Biomol、P‐126、OmniMMP蛍光発生基質)を添加する。37℃で1時間インキュベーション後、変換した基質の蛍光を、Perkin Elmer Wallac EnVision 2102 Multilabel Reader(励起波長:320nm、発光波長:405nm)において測定する。
【0272】
パーセント阻害=((ビヒクルの存在下で決定された蛍光−試験化合物が存在しながら試料について決定された蛍光)/(ビヒクルの存在下で決定された蛍光−誘発因子なしで試料について決定された蛍光))×100%。
【0273】
GPR43に対する化合物の活性は、下記の説明される実施例8又は9のようなアッセイを用いて試験され得る。
【0274】
(実施例8:GPR43表現型アッセイ‐好中球遊走アッセイ)
8.1 バフィーコートからの好中球の単離
ヒトバフィーコートを等容積の氷冷DPBS(Invitrogenカタログ番号14190169)で希釈する。20mLの希釈したバフィーコートダウンを50mLコニカルチューブにおいて、140mMクエン酸、200mMクエン酸ナトリウム、及び220mMデキストロース4mLと穏やかに混合する。12mLの6%デキストラン/0.9%NaCl溶液(w/v)含有水を穏やかに添加し、チューブを最高20回転倒混和する。次に、総容積を新鮮チューブに転移させ、2相の完全な分離のために、室温で1時間インキュベートする。次に、黄色の上清を新たなチューブに転移させ、1300rpmで12分間、標準的な卓上遠心分離機において4℃でブレーキなしで遠心分離する。上清を廃棄し、残りの細胞ペレットを12mLの氷冷水において上下にピペッティングすることによって迅速に再懸濁する。20秒後、4mLの氷冷0.6M KClを添加し、注意深く混合し、1300rpmで12分間、標準的な卓上遠心分離機において、4℃でブレーキなしで遠心分離する。この手順を赤血球が残らなくなるまで反復する。最終的に、ペレットを15mLのチューブにおいて4mLのDPBSに再懸濁し、5mLのLymphoprep(商標)(Nycomed Pharma、カタログ番号1114545)上で層状にする。標準的な卓上遠心分離機において、4℃で低ブレーキで1300rpmで12分間の遠心分離後、上清を除去し、細胞ペレットを10mMのHEPES(Invitrogen、カタログ番号15630)を補充した25mLの走化性緩衝液(RPMI1640(Invitrogen、カタログ番号21875))において再懸濁する。
【0275】
8.2 遊走アッセイ
遊走アッセイを、5.0μMの孔サイズのポリカーボネートメンブレン(Corningカタログ番号3387)を有するCorning HTSトランスウェル96透過性支持システムにおいて実施する。180μLの8.9×106個の細胞/mLの細胞懸濁液を、ポリプロピレン96ウェルV底プレートにおいて、20μLの化合物溶液含有走化性緩衝液に添加する。細胞を30分間インキュベートした15分後に中間的な再懸濁をして、細胞がプレートの底部に定着するのを防止する。この後、70μLの細胞懸濁液をトランスウェルシステムの上部区画に転移させる。受容ウェルを、化合物及び走化剤を含有する200μLの走化性緩衝液で満たす。37℃で5%CO2において1時間のインキュベーション後、受容プレートに遊走する細胞の量を溶解と、ルミノメーターにおいてATP‐lite(Promega、カタログ番号6016739)を用いて可溶化液のATP含有量を測定することとによって測定する。
【0276】
8.3 データ分析
化合物の効果を、下記式を用いたパーセント阻害として表す:
[(ビヒクル及び走化剤の存在下でのRLU−化合物及び走化剤の存在下でのRLU)/(ビヒクル及び走化剤の存在下でのRLU−走化剤の不在下でのRLU)]×100
RLU=相対的発光単位。
【0277】
(実施例9:GPR43‐カルシウムフラックスアッセイ)
GPR43に対する活性を、下記に説明されるアッセイを用いて試験し得る。
【0278】
透明な底部の384ウェルプレート(Corning、参照番号3712)を0.05mg/mLの終濃度でPBSに希釈した25μLのポリ‐D‐リジン(Sigma、参照番号P‐6407)でコーティングし、37℃で30分間インキュベートする。ポリリシンをPBSによる2回の洗浄によって除去する。6千個のHEK293細胞を、10%FBS、10μg/mLピューロマイシン、及び1%ペニシリン/ストレプトマイシンで補完した25μLのDMEMにおいて蒔種する。次に、プレートを37℃/5%CO2で24時間インキュベートする。25μLのカルシウム4色素(Molecular devices、参照番号R8141)を製造元の説明書に従ってプレートに添加し、プレートを37℃/5%CO2で2時間15分インキュベートする。次に、10μLの化合物溶液含有HBSS、20mM hepesを添加し、プレートを37℃/5%CO2で15分間インキュベートする。アンタゴニスト活性を、10μLの酢酸ナトリウム(Sigma、参照番号S2889)含有HBSS、20mM hepesをEC80濃度で添加することによって測定する。
【0279】
カルシウムシグナル伝達を、Flexステーション3(Molecular Devices)を用いて、蛍光(励起485nm、発光525nm)を60秒間記録することによって測定する。活性を、酢酸ナトリウムによって生じたカルシウム曲線の最大蛍光と、酢酸ナトリウム添加前に測定された基線蛍光の間の比として決定する。阻害のパーセンテージを、各プレートに関するネガティブコントロール(ビヒクル添加)及びポジティブコントロール(EC100における酢酸ナトリウム)を用いて算出する。
【0280】
(実施例10:EDG4カルシウムフラックスアッセイ)
EDG4に対する化合物の活性を、下記に説明されるアッセイを用いて試験し得る。
【0281】
ウェルあたり1万個のCHO‐EDG4細胞を10%FBS及び10μg/mLピューロマイシンを補完した50μLのDMEM/F12に再懸濁した後、透明な底部の384ウェルプレート(Corning、参照番号3712)において蒔種する。37℃/5%CO2で24時間インキュベーション後、プレートを、0.1%無脂肪酸BSAを補完した25μLのDMEM/F12で2回洗浄した後、プレートを37℃/5%CO2で1時間インキュベートする。20mM HEPES(製造元の説明書と比較してさらに1/2希釈)を補完したカルシウム及びマグネシウムを含むHBSS(Gibco、参照番号14025)に希釈したFluo4 Direct Ca色素(Invitrogen、参照番号F10473)25μLをプレートに添加する。次に、プレートを37℃/5%CO2で1時間インキュベートする。次に、HBSS、20mM hepes、0.1%無脂肪酸BSA、0.6%DMSOにおける化合物溶液10μLを添加し、プレートを37℃/5%CO2で15分間インキュベートする。アンタゴニスト活性を、10μLのオレオイル‐L‐リソホスファチジン酸ナトリウム塩(LPA、Sigma、参照番号L7260)含有HBSS、20mM hepes、0.1%無脂肪酸BSA10をEC80濃度で添加することによって測定する。
【0282】
カルシウムシグナル伝達を、Flexステーション3(Molecular Devices)を用いて、蛍光(励起485nm、発光525nm)を60秒間記録することによって測定する。活性を、LPAによって生じたカルシウム曲線の最大蛍光と、LPA添加前に測定された基線蛍光の間の比として決定する。阻害のパーセンテージを、各プレートに関するネガティブコントロール(ビヒクル添加)及びポジティブコントロール(EC100におけるLPA)を用いて算出する。
【0283】
CSNK1G2に対する化合物の活性を、下記の実施例11又は12において説明されるアッセイを用いて試験し得る。
【0284】
(実施例11:CSNK1G2生化学的アッセイ)
0.75mUの組換えCSNK1G2(Milliporeカタログ番号14‐712)を0.1mg/mLカゼイン(Sigmaカタログ番号C4765)含有キナーゼ反応緩衝液(10mM MOPS pH7.0、0.01% Triton‐X‐100、0.5mM EDTA、1mM DTT、0.5mM Na3VO4、5mMベータ‐グリセロホスファート、10mM MgCl2、0.5μM非放射性ATP、0.25μCi 33P‐ガンマ−ATP(Perkin Elmer, カタログ番号NEG602K)終濃度で、試験化合物又はビヒクル(DMSO、1%終濃度)を5μL含有する又は含有しない。)とともに、総容積25μLでポリプロピレン96ウェルプレート(Greiner, V底)においてインキュベートする。30℃で45分後、25μL/ウェルの150mMリン酸を添加することによって、反応を停止させる。終止したキナーゼ反応物をすべて、あらかじめ洗浄しておいた(75mMリン酸)96ウェルフィルタープレート(Perkin Elmerカタログ番号6005177)へと、細胞回収機(Perkin Elmer)を用いて転移させる。プレートを、ウェルあたり300μの75mMリン酸溶液で6回洗浄し、プレートの底部を密封する。40μL/ウェルのMicroscint‐20を添加し、プレートの上部を密封し、Topcount(Perkin Elmer)を用いて読み出しを実施する。
【0285】
キナーゼ活性を、ビヒクル存在下で得られた1分間あたりの計数(cpm)から、ポジティブコントロール阻害薬(20μMスタウロスポリン)の存在下で得られたcpmを減算することによって算出する。この活性を阻害する試験化合物の能力を以下のとおり決定する:
【0286】
パーセント阻害=((試験化合物の存在下で使用について決定されたcpm−ポジティブコントロール阻害薬を用いて試料について決定されたcpm)/(ビヒクルの存在下で決定されたcpm−ポジティブコントロール阻害薬を用いて試料について決定されたcpm))×100%。
【0287】
用量希釈系列を、CSNK1G2アッセイにおける用量‐応答効果の試験及び各化合物についてのIC50の算出を可能にする化合物について調製する。各化合物を、30μMの濃度で定型的に試験した後、1%DMSOの終濃度で1/3の連続希釈を8地点(30μM‐6.67μM‐2.22μM‐740nM‐247nM‐82nM‐27nM‐9nM)実施する。化合物シリーズの効力が高い場合、より多くの希釈を調製し及び/又は最大濃度を下げてよい(例えば、5μM、1μM)。
【0288】
(実施例12:CSNK1G2細胞アッセイ)
Wntシグナル伝達アッセイにおいて、Wntルシフェラーゼリポーターコンストラクトを、LRP6及びCSNK1G2についての発現べクターとともにSW1353細胞へと、JetPEIトランスフェクション剤(Polyplus Transfection, カタログ番号101‐40)を用いて形質移入する。CSNK1G2過剰発現は、LRP6により誘導されるWnt‐リポーター活性を増強する。ルシフェラーゼリポーター遺伝子のCSNK1G2仲介性及びLRP6仲介性発現を、ルシフェラーゼ基質を用いて測定する。CSNK1G2活性を阻害する化合物は、リポーター活性を低下させるであろう。
【0289】
1日後:SW1353細胞の懸濁液を調製する(密度:30000個の細胞/ウェル/80μL(375000個の細胞/mL))。並行して、DNA/トランスフェクション剤混合物を以下の通り調製する。
【0290】
ウェルあたり添加されるべきDNAの全量をNaClの150mM溶液において10μLに希釈する。典型的には、以下の量のDNAをウェルあたり形質移入するであろう:Wnt‐lucリポーター(20ng)、A010800‐CSNK1G2‐WT(20ng)、pCS‐myc‐hLRP(10ng)。ウェルあたりに必要とされるJetPEIトランスフェクション剤の全量(0.32μL)をNaClの150mM溶液において10μLに希釈する。次に、JetPEI溶液及びDNA溶液を混合して、ウェルに添加されるべき20μL DNA/トランスフェクション剤混合物を生じる。この溶液を即時混合し、遠心分離し、室温で30分間インキュベートする。細胞懸濁液をDNA/トランスフェクション剤混合物に滴下して添加し、37℃で2時間インキュベートする。次に、試験されるべき化合物を11μLに希釈して、形質移入された細胞を含むウェルに、自動ディスペンサー(Tecan aquarius)を用いて添加し、混合物を16〜24時間インキュベートする。
【0291】
2日後:細胞の上部における培地を除去した後、ルシフェラーゼ基質SteadyLite HTS(Perkin Elmer, カタログ番号550‐070303)を白色96ウェルプレートに添加する(50μL/ウェル)。暗所で連続的な振蘯をしながら30分間のインキュベーション後、ルミノメーター(Envision, Perkin Elmer)を用いて読み出される読み出しを実施する。
(参考文献)
Appleton CT, Pitelka V, Henry J, Beier Fの文献「初期実験的変形性関節症における遺伝子発現の包括的分析(Global analyses of gene expression in early experimental osteoarthritis)」(Arthritis Rheum. 2007; 56(6):1854-68)
Billinghurst, RCらの文献「インターロイキン‐1によって誘導される鼻及び関節の軟骨におけるII型コラーゲンおよびプロテオグリカンの分解の比較並びにコラゲナーゼによるII型コラーゲン切断の選択的阻害(Comparison of the degradation of type II collagen and proteoglycan in nasal and articular cartilages induced by interleukin-1 and the selective inhibition of type II collagen cleavage by collagenase)」(Arthritis Rheum. 2000; 43:664672)
Billinghurst, RCらの文献「変形性関節症関節軟骨におけるコラゲナーゼによるII型コラーゲンの高い切断(Enhanced cleavage of type II collagen by collagenases in osteoarthritic articular cartilage)」(J Clin Invest. 1997; 99:15341545)
Boerner. P, Lafond, R, Lu, WZ, Brams, P, 及びRoyston, Iの文献「インビトロで刺激されるヒト脾細胞由来の抗原特異的ヒトモノクローナル抗体の産生(Production of antigen-specific human monoclonal antibodies from in vitro-primed human splenocytes)」(J. Immunol., 1991, 147(1):86-95)
Cao, Z; Xiong, J; Takeuchi, M; Kurama, T; Goeddel, DVの文献「TRAF6は、インターロイキン‐1のためのシグナル伝達因子である(TRAF6 is a signal transducer for interleukin-1)」(Nature 383: 443-446, 1996)
Chen, CJ, Banerjea, AC, Harmison, GG, Haglund, K, Schubert, Mの文献「最大9つの高度に保存されたHIV‐1env RNA領域において切断するよう配向された多重標的リボザイムは、HIV‐1複製を阻害する―最もすぐに配列決定されたHIV‐1単離物に対する潜在的な有効性(Multitarget-ribozyme directed to cleave at up to nine highly conserved HIV-1 env RNA regions inhibits HIV-1 replicationpotential effectiveness against most presently sequenced HIV-1 isolates)」(Nucl. Acids Res. 1992 20: 4581-4589);
Choy EH, Panayi GSの文献「関節リウマチにおけるサイトカイン経路及び関節炎症(Cytokine pathways and joint inflammation in rheumatoid arthritis)」(N Engl J Med. 2001; 344(12):907-16)
Clegg DO, Reda DJ, Harris CL, Klein MA, O'Dell JR, Hooper MM, Bradley JD, Bingham CO 3rd, Weisman MH, Jackson CG, Lane NE, Cush JJ, Moreland LW, Schumacher HR Jr, Oddis CV, Wolfe F, Molitor JA, Yocum DE, Schnitzer TJ, Furst DE, Sawitzke AD, Shi H, Brandt KD, Moskowitz RW, Williams HJの文献「有痛の膝変形性関節症のためのグルコサミン、硫酸コンドロイチン、及び組み合わせにおけるこれら2つ(Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis)」(N Engl J Med. 2006; 354(8):795-808)
Coleらの文献「モノクローナル抗体及び癌治療法(Monoclonal Antibodies and Cancer Therapy)」((1985) Alan R. Liss, p. 77);
Dahlberg, Lらの文献「II型コラーゲンのコラゲナーゼ仲介性切断は、変形性関節症軟骨において選択的に高く、コラゲナーゼ‐1(MMP‐1)を残す合成阻害薬を用いて捕捉することができる(Collagenase-mediated cleavage of type II collagen is selectively enhanced in osteoarthritis cartilage and can be arrested with a synthetic inhibitor which spares collagenase-1 (MMP-1))」(Arthritis Rheum. 2000;43:673682)
Firestein GSの文献「関節リウマチの進化する概念(Evolving concepts of rheumatoid arthritis)」(Nature. 2003; 423(6937):356-61)
Gao, X及びHuang, Lの文献「T7 RNAポリメラーゼ及びT7プロモーター配列の陽イオン性リポソームとの共送達によるリポーター遺伝子の細胞質発現(Cytoplasmic expression of a reporter gene by co-delivery of T7 RNA polymerase and T7 promoter sequence with cationic liposomes)」(Nucl. Acids Res. 1993 21: 2867-2872)
Hoogenboom及びWinterの文献「免疫化のバイパス形成:インビトロで再配置された生殖系列VH遺伝子セグメントの合成レパートリー由来のヒト抗体(By-passing immunisation : Human antibodies from synthetic repertoires of germline VH gene segments rearranged in vitro)」(J. Mol. Biol. 1992, 227:381-8);
Karin Mの文献「終わりの始まり:IカッパBキナーゼ(IKK)及びNFカッパBの活性化(The beginning of the end: IkappaB kinase (IKK) and NF-kappaB activation)」(J Biol Chem. 1999 Sep 24;274(39):27339-42. 総説)
Kashani-Sabetらの文献「抗rasリボザイムによる悪性表現型の逆転(Reversal of the malignant phenotype by an anti-ras ribozyme)」(Antisense Res Dev, 1992 2:3-15)
Lee DM, Weinblatt MEの文献「関節リウマチ(Rheumatoid arthritis)」(Lancet. 2001; 358(9285):903-11)
Lipinski CA, Lombardo F, Dominy BW及びFeeney PJ.の文献「薬剤発見及び開発設定における溶解度及び透過性を概算するための実験的及び計算的アプローチ(Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings)」(Adv Drug Deliv Rev, 2001; 46: 3-26)
Mark及びPadlan「第4章モノクローナル抗体のヒト化(Chapter 4. Humanization of Monoclonal Antibodies)」((1994) The Handbook of Experimental Pharmacology Vol. 113, Springer-Verlag, New York)
Marks JD, Hoogenboom HR, Bonnert TP, McCafferty J, Griffiths AD, Winter Gの文献「免疫化のバイパス形成。ファージに示されるV遺伝子ライブラリー由来のヒト抗体(By-passing immunization. Human antibodies from V-gene libraries displayed on phage)」(J Mol Biol. 1991 Dec 5;222(3):581-97. リンク)
Milstein及びCuelloの文献「免疫組織化学におけるハイブリッドハイブリドーマ及びその使用(Hybrid hybridomas and their use in immunohistochemistry)」(Nature 1983, 305:537-9)
Mitchell, PGらの文献「ヒト変形性骨関節症軟骨由来のマトリックスメタロプロテイナーゼ‐13のクローニング、発現、及びII型コラーゲン分解活性(Cloning, expression, and type II collagenolytic activity of matrix metalloproteinase-13 from human osteoarthritic cartilage)」(J Clin Invest. 1996;97:761768)
Neuhold LA, Killar L, Zhao W, Sung ML, Warner L, Kulik J, Turner J, Wu W, Billinghurst C, Meijers T, Poole AR, Babij P, DeGennaro LJ Jの文献「構成的に活性のあるヒトコラゲナーゼ‐3(MMP‐13)の硝子軟骨における生後発現は、マウスにおける変形性関節症を誘導する(Postnatal expression in hyaline cartilage of constitutively active human collagenase-3 (MMP-13) induces osteoarthritis in mice)」(Clin Invest. 2001 Jan;107(1):35-44)
O'Dell JRの文献「関節リウマチについての治療的戦略(Therapeutic strategies for rheumatoid arthritis)」(N Engl J Med. 2004; 350(25):2591-602)
Pei Y, Tuschl Tの文献「有効かつ特異的なsiRNAを同定する技術分野について(On the art of identifying effective and specific siRNAs)」(Nat Methods. 2006; 3(9):670-6)
Schmidt MR, Piekos B, Cabatingan MS, Woodland RTの文献「ヒトコクサッキー/アデノウイルス受容体導入遺伝子の発現は、初代リンパ球のアデノウイルス感染を可能にする(Expression of a human coxsackie/adenovirus receptor transgene permits adenovirus infection of primary lymphocytes)」(J Immunol. 2000 165:4112-9)
Shlopov, BVらの文献「変形性関節症障害.3つの異なるコラゲナーゼの関与(Osteoarthritic lesions. Involvement of three different collagenases)」(Arthritis Rheum. 1997;40:20652074)
Smolen JS, Steiner G.の文献「関節リウマチについてに治療的戦略(Therapeutic strategies for rheumatoid arthritis)」)(Nat Rev Drug Discov. 2003; 2(6):473-88)
Traunecker A, Lanzavecchia A, Karjalainen Kの文献「HIV感染細胞における二重特異性一本鎖分子(ヤヌシンズ(Janusins))標的細胞毒性リンパ球(Bispecific single chain molecules (Janusins) target cytotoxic lymphocytes on HIV infected cells)」(EMBO J. 1991;10(12):3655-9)
Ventura M, Wang P, Ragot T, Perricaudet M, Saragosti S.の文献「自己切断によるHIV特異的リボザイム活性の活性化(Activation of HIV-specific ribozyme activity by self-cleavage)」(Nucleic Acids Res. 1993; 21(14):3249-55)
Wieland HA, Michaelis M, Kirschbaum BJ, Rudolphi KA.の文献「変形性関節症―治療不可能な疾患か?(Osteoarthritis - an untreatable disease?)」(Nat Rev Drug Discov. 2005;4(4):331-44)
Wu W, Billinghurst RC, Pidoux I, Antoniou J, Zukor D, Tanzer M, Poole ARの文献「加齢におけるII型コラーゲンのコラゲナーゼ切断及び変性の部位並びに変形性関節症軟骨及びそのマトリックスメタロプロテイナーゼ1及びマトリックスメタロプロテイナーゼ13の分布との関連性(Sites of collagenase cleavage and denaturation of type II collagen in aging and osteoarthritic articular cartilage and their relationship to the distribution of matrix metalloproteinase 1 and matrix metalloproteinase 13)」(Arthritis Rheum. 2002 Aug;46(8):2087-94)
【特許請求の範囲】
【請求項1】
ECM及び/又は軟骨変性を阻害する化合物を同定する方法であって:
(a)化合物を、配列番号39、40、27、42、22〜26、28〜38及び41並びにその断片からなる群から選択されるアミノ酸配列を含むポリペプチドと接触させること;及び
(b)ECM及び/又は軟骨変性と関連した化合物‐ポリペプチド特性を測定すること
を含む、前記方法。
【請求項2】
前記ポリペプチドが、インビトロでの無細胞調製物中にある、請求項1記載の方法。
【請求項3】
前記ポリペプチドが、哺乳類細胞に存在する、請求項1記載の方法。
【請求項4】
前記特性が、前記化合物の前記ポリペプチドに対する結合親和性である、請求項2記載の方法。
【請求項5】
前記方法が、軟骨細胞の異化過程を阻害する化合物を同定するために用いられる、請求項1〜4のいずれか一項記載の方法。
【請求項6】
下記の工程を追加的に含む、請求項4記載の方法:
c)前記ポリペプチドを発現する哺乳類細胞の集団を、少なくとも10マイクロモル濃度の結合親和性を呈する化合物と接触させる工程;及び
d)ECM及び/又は軟骨変性を阻害する化合物を同定する工程。
【請求項7】
前記特性が、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性である、請求項1又は3記載の方法。
【請求項8】
前記特性が、MMP13の発現及び/又は活性である、請求項7記載の方法。
【請求項9】
前記特性が、前記ポリペプチドの活性である、請求項1〜3のいずれか一項記載の方法。
【請求項10】
前記特性が、前記ポリペプチドの発現である、請求項1又は3記載の方法。
【請求項11】
下記の工程を追加的に含む、請求項9又は10記載の方法:
c)前記ポリペプチドを発現する哺乳類細胞の集団を、該ポリペプチドの発現又は活性を有意に阻害する化合物と接触させる工程;及び
d)ECM及び/又は軟骨変性を阻害する化合物を同定する工程。
【請求項12】
試験されるべき化合物を対照と比較する工程を追加的に含む、請求項1〜11のいずれか一項記載の方法。
【請求項13】
前記対照が、前記ポリペプチドが前記化合物と接触しなかった場合のものである、請求項12記載の方法。
【請求項14】
前記化合物を対照と比較する工程を追加的に含み、この中で、該対照が、前記ポリペプチドを発現しない哺乳類細胞の集団である、請求項6又は11記載の方法。
【請求項15】
前記化合物が、市販のスクリーニングライブラリーの化合物、及び配列番号39、40、27、42、22〜26、28〜38、及び41からなる群から選択されるアミノ酸配列を含むポリペプチドに対する結合親和性を有する化合物からなる群から選択される、請求項1〜14のいずれか一項記載の方法。
【請求項16】
前記化合物が、ファージディスプレイライブラリー又は抗体断片ライブラリーにおけるペプチドである、請求項1記載の方法。
【請求項17】
アンチセンスポリヌクレオチド、リボザイム、および低分子干渉RNA(siRNA)からなる群から選択される、ECM及び/又は軟骨変性を阻害する上で有効な薬剤であって、配列番号18、19、6、21、1〜5、7〜17、及び20からなる群から選択される核酸配列の約17〜約30の連続したヌクレオチドの天然ポリヌクレオチド配列と相補的なまたは前記天然ポリヌクレオチド配列から操作された核酸配列を含む、前記薬剤。
【請求項18】
哺乳類細胞におけるベクターが前記薬剤を発現する、請求項17記載の薬剤。
【請求項19】
ECM及び/又は軟骨変性を阻害する、請求項17記載の薬剤。
【請求項20】
前記ベクターが、アデノウイルスベクター、レトロウイルスベクター、アデノ随伴ウイルスベクター、レンチウイルスベクター、単純ヘルペスウイルスベクター、又はセンダイウイルスベクターである、請求項18記載の薬剤。
【請求項21】
前記アンチセンスポリヌクレオチド及び前記siRNAが、センス鎖と相補的な17〜25のヌクレオチドのアンチセンス鎖を含み、この中で、該センス鎖が、配列番号18、19、6、21、1〜5、7〜17、及び20からなる群から選択される核酸配列の17〜25の連続したヌクレオチドから選択される、請求項17記載の薬剤。
【請求項22】
前記siRNAがさらに前記センス鎖を含む、請求項21記載の薬剤。
【請求項23】
前記センス鎖が、配列番号55、46、47、57、43〜45、48〜54、及び56からなる群から選択される、請求項22記載の薬剤。
【請求項24】
前記siRNAが、前記センス及び前記アンチセンス鎖を接続するループ領域をさらに含む、請求項21記載の薬剤。
【請求項25】
前記ループ領域が、
【化1】

からなる群から選択される核酸配列を含む、請求項24記載の薬剤。
【請求項26】
前記薬剤が、配列番号39、40、27、42、22〜26、28〜38、及び41からなる群から選択される核酸配列と相補的な核酸配列を含むアンチセンスポリヌクレオチド、リボザイム、又はsiRNAである、請求項17〜25のいずれか一項記載の薬剤。
【請求項27】
請求項17〜26のいずれか一項記載の治療有効量の薬剤を、医薬として許容し得る担体との混合物において含む医薬組成物。
【請求項28】
ECM及び/又は軟骨変性を包含する疾患の治療及び/又は予防における使用のための、請求項17〜26のいずれか一項記載の薬剤。
【請求項29】
前記疾患が、変形性関節症である、請求項28記載の薬剤。
【請求項30】
ECM及び/又は軟骨変性を特徴とする容態の治療又は予防における使用のための、請求項17〜26のいずれか一項記載の薬剤。
【請求項31】
対象におけるECM及び/又は軟骨変性を包含する病理学的容態の治療及び/又は予防のための方法であって、該対象に、配列番号39、40、27、42、22〜26、28〜38、及び41からなる群から選択されるアミノ酸配列を含むポリペプチド及びその断片、並びに配列番号18、19、6、21、1〜5、7〜17、及び20からなる群から選択される核酸配列の約17〜約30の連続したヌクレオチドの天然ポリヌクレオチド配列と相補的な核酸配列または該天然ポリヌクレオチド配列から操作された核酸配列を含むアンチセンスポリヌクレオチド、リボザイム、及び低分子干渉RNA(siRNA)と結合親和性を有する薬剤からなる群から選択される治療有効量の薬剤を投与することを含む前記方法。
【請求項32】
ECM及び/又は軟骨変性を包含する病理学的容態を診断する方法であって、前記対象から得られた生物学的試料中に存在する配列番号39、40、27、42、22〜26、28〜38、及び41からなる群から選択されるアミノ酸配列を含むポリペプチドの第一の量又は活性を決定することと、該第一の量又は活性を、健常対象の集団において決定されたポリペプチドの量又は活性の範囲と比較することとを含み、この中で、健常対象について決定された量又は活性の範囲と比較した該生物学的試料中のポリペプチドの量又は活性の増大が、前記病理学的容態の存在を示す、前記方法。
【請求項33】
病理学的容態が変形性関節症である、請求項31又は32記載の方法。
【請求項1】
ECM及び/又は軟骨変性を阻害する化合物を同定する方法であって:
(a)化合物を、配列番号39、40、27、42、22〜26、28〜38及び41並びにその断片からなる群から選択されるアミノ酸配列を含むポリペプチドと接触させること;及び
(b)ECM及び/又は軟骨変性と関連した化合物‐ポリペプチド特性を測定すること
を含む、前記方法。
【請求項2】
前記ポリペプチドが、インビトロでの無細胞調製物中にある、請求項1記載の方法。
【請求項3】
前記ポリペプチドが、哺乳類細胞に存在する、請求項1記載の方法。
【請求項4】
前記特性が、前記化合物の前記ポリペプチドに対する結合親和性である、請求項2記載の方法。
【請求項5】
前記方法が、軟骨細胞の異化過程を阻害する化合物を同定するために用いられる、請求項1〜4のいずれか一項記載の方法。
【請求項6】
下記の工程を追加的に含む、請求項4記載の方法:
c)前記ポリペプチドを発現する哺乳類細胞の集団を、少なくとも10マイクロモル濃度の結合親和性を呈する化合物と接触させる工程;及び
d)ECM及び/又は軟骨変性を阻害する化合物を同定する工程。
【請求項7】
前記特性が、MMP1、MMP3、MMP8、MMP13、MMP14、及び/又はADAMTS4の発現及び/又は活性である、請求項1又は3記載の方法。
【請求項8】
前記特性が、MMP13の発現及び/又は活性である、請求項7記載の方法。
【請求項9】
前記特性が、前記ポリペプチドの活性である、請求項1〜3のいずれか一項記載の方法。
【請求項10】
前記特性が、前記ポリペプチドの発現である、請求項1又は3記載の方法。
【請求項11】
下記の工程を追加的に含む、請求項9又は10記載の方法:
c)前記ポリペプチドを発現する哺乳類細胞の集団を、該ポリペプチドの発現又は活性を有意に阻害する化合物と接触させる工程;及び
d)ECM及び/又は軟骨変性を阻害する化合物を同定する工程。
【請求項12】
試験されるべき化合物を対照と比較する工程を追加的に含む、請求項1〜11のいずれか一項記載の方法。
【請求項13】
前記対照が、前記ポリペプチドが前記化合物と接触しなかった場合のものである、請求項12記載の方法。
【請求項14】
前記化合物を対照と比較する工程を追加的に含み、この中で、該対照が、前記ポリペプチドを発現しない哺乳類細胞の集団である、請求項6又は11記載の方法。
【請求項15】
前記化合物が、市販のスクリーニングライブラリーの化合物、及び配列番号39、40、27、42、22〜26、28〜38、及び41からなる群から選択されるアミノ酸配列を含むポリペプチドに対する結合親和性を有する化合物からなる群から選択される、請求項1〜14のいずれか一項記載の方法。
【請求項16】
前記化合物が、ファージディスプレイライブラリー又は抗体断片ライブラリーにおけるペプチドである、請求項1記載の方法。
【請求項17】
アンチセンスポリヌクレオチド、リボザイム、および低分子干渉RNA(siRNA)からなる群から選択される、ECM及び/又は軟骨変性を阻害する上で有効な薬剤であって、配列番号18、19、6、21、1〜5、7〜17、及び20からなる群から選択される核酸配列の約17〜約30の連続したヌクレオチドの天然ポリヌクレオチド配列と相補的なまたは前記天然ポリヌクレオチド配列から操作された核酸配列を含む、前記薬剤。
【請求項18】
哺乳類細胞におけるベクターが前記薬剤を発現する、請求項17記載の薬剤。
【請求項19】
ECM及び/又は軟骨変性を阻害する、請求項17記載の薬剤。
【請求項20】
前記ベクターが、アデノウイルスベクター、レトロウイルスベクター、アデノ随伴ウイルスベクター、レンチウイルスベクター、単純ヘルペスウイルスベクター、又はセンダイウイルスベクターである、請求項18記載の薬剤。
【請求項21】
前記アンチセンスポリヌクレオチド及び前記siRNAが、センス鎖と相補的な17〜25のヌクレオチドのアンチセンス鎖を含み、この中で、該センス鎖が、配列番号18、19、6、21、1〜5、7〜17、及び20からなる群から選択される核酸配列の17〜25の連続したヌクレオチドから選択される、請求項17記載の薬剤。
【請求項22】
前記siRNAがさらに前記センス鎖を含む、請求項21記載の薬剤。
【請求項23】
前記センス鎖が、配列番号55、46、47、57、43〜45、48〜54、及び56からなる群から選択される、請求項22記載の薬剤。
【請求項24】
前記siRNAが、前記センス及び前記アンチセンス鎖を接続するループ領域をさらに含む、請求項21記載の薬剤。
【請求項25】
前記ループ領域が、
【化1】

からなる群から選択される核酸配列を含む、請求項24記載の薬剤。
【請求項26】
前記薬剤が、配列番号39、40、27、42、22〜26、28〜38、及び41からなる群から選択される核酸配列と相補的な核酸配列を含むアンチセンスポリヌクレオチド、リボザイム、又はsiRNAである、請求項17〜25のいずれか一項記載の薬剤。
【請求項27】
請求項17〜26のいずれか一項記載の治療有効量の薬剤を、医薬として許容し得る担体との混合物において含む医薬組成物。
【請求項28】
ECM及び/又は軟骨変性を包含する疾患の治療及び/又は予防における使用のための、請求項17〜26のいずれか一項記載の薬剤。
【請求項29】
前記疾患が、変形性関節症である、請求項28記載の薬剤。
【請求項30】
ECM及び/又は軟骨変性を特徴とする容態の治療又は予防における使用のための、請求項17〜26のいずれか一項記載の薬剤。
【請求項31】
対象におけるECM及び/又は軟骨変性を包含する病理学的容態の治療及び/又は予防のための方法であって、該対象に、配列番号39、40、27、42、22〜26、28〜38、及び41からなる群から選択されるアミノ酸配列を含むポリペプチド及びその断片、並びに配列番号18、19、6、21、1〜5、7〜17、及び20からなる群から選択される核酸配列の約17〜約30の連続したヌクレオチドの天然ポリヌクレオチド配列と相補的な核酸配列または該天然ポリヌクレオチド配列から操作された核酸配列を含むアンチセンスポリヌクレオチド、リボザイム、及び低分子干渉RNA(siRNA)と結合親和性を有する薬剤からなる群から選択される治療有効量の薬剤を投与することを含む前記方法。
【請求項32】
ECM及び/又は軟骨変性を包含する病理学的容態を診断する方法であって、前記対象から得られた生物学的試料中に存在する配列番号39、40、27、42、22〜26、28〜38、及び41からなる群から選択されるアミノ酸配列を含むポリペプチドの第一の量又は活性を決定することと、該第一の量又は活性を、健常対象の集団において決定されたポリペプチドの量又は活性の範囲と比較することとを含み、この中で、健常対象について決定された量又は活性の範囲と比較した該生物学的試料中のポリペプチドの量又は活性の増大が、前記病理学的容態の存在を示す、前記方法。
【請求項33】
病理学的容態が変形性関節症である、請求項31又は32記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【公表番号】特表2012−522977(P2012−522977A)
【公表日】平成24年9月27日(2012.9.27)
【国際特許分類】
【出願番号】特願2012−502692(P2012−502692)
【出願日】平成22年4月1日(2010.4.1)
【国際出願番号】PCT/EP2010/054412
【国際公開番号】WO2010/115841
【国際公開日】平成22年10月14日(2010.10.14)
【出願人】(504064364)ガラパゴス・ナムローゼ・フェンノートシャップ (27)
【氏名又は名称原語表記】Galapagos N.V.
【Fターム(参考)】
【公表日】平成24年9月27日(2012.9.27)
【国際特許分類】
【出願日】平成22年4月1日(2010.4.1)
【国際出願番号】PCT/EP2010/054412
【国際公開番号】WO2010/115841
【国際公開日】平成22年10月14日(2010.10.14)
【出願人】(504064364)ガラパゴス・ナムローゼ・フェンノートシャップ (27)
【氏名又は名称原語表記】Galapagos N.V.
【Fターム(参考)】
[ Back to top ]

