変異型マルチ銅オキシダーゼ、これをコードする遺伝子及びこれを用いたバイオ燃料電池
【課題】イミダゾール系化合物への耐性向上した変異型マルチ銅オキシダーゼ、これをコードする遺伝子及びこれを用いたバイオ燃料電池を提供する。
【解決手段】特定のアミノ酸配列における、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基のいずれか一方又は両方が他のアミノ酸に置換したアミノ酸配列を有し、ABTS(2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を基質とし、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性を有する。
【解決手段】特定のアミノ酸配列における、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基のいずれか一方又は両方が他のアミノ酸に置換したアミノ酸配列を有し、ABTS(2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を基質とし、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、マルチ銅オキシダーゼにおける特定の部位に置換型変異を有する変異型マルチ銅オキシダーゼ、当該変異型マルチ銅オキシダーゼをコードする遺伝子及び当該マルチ銅オキシダーゼを用いたバイオ燃料電池に関する。
【背景技術】
【0002】
マルチ銅オキシダーゼ(bilirubin oxidase)は、分子内に酵素活性に必要な4原子の銅を含むタンパク質で、種々の基質から取り出した電子を用いて、酸素分子を4電子還元し、水分子を生成する反応を触媒する酸化還元酵素である。マルチ銅オキシダーゼは、特許文献1乃至4に記載されるように、バイオ燃料電池におけるカソード電極や、各種バイオセンサーの電極材料として使用されている。また、特許文献1乃至3に示すように、マルチ銅オキシダーゼに対して1以上のアミノ酸置換変異を導入することで、固定化の際の活性低下を防止したり、熱安定性を向上させたり、反応過電圧が小さくするといった機能を改変する試みが提案されている。
【0003】
一方、バイオ燃料電池とは、酵素燃料電池とも呼称され、酵素や微生物による化学反応により発生した電気エネルギーを利用するものである。バイオ燃料電池は、一般の電池と同様にカソード電極及びアノード電極が電解質を介して対向した構造を有し、燃料としてメタノールやエタノールのようなアルコール類又はグルコースのような糖類を用いる。また、特許文献5に記載されるように、電解質としてイミダゾール系化合物を利用することが知られている。
【0004】
しかしながら、イミダゾール系化合物を電解質として利用する場合、バイオ燃料電池に使用される酵素、例えば上述したマルチ銅オキシダーゼに対する変性作用が働き、酵素の活性低下を招くこととになってしまう。例えば、特許文献5に示すように、酵素を固定化することでイミダゾール系化合物による活性低下を抑制することもできるが、その抑制効果は十分とは言えなかった。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2009-158480号公報
【特許文献2】特開2008-161178号公報
【特許文献3】特開2010-183857号公報
【特許文献4】特開2009-044997号公報
【特許文献5】特開2009-158458号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
上述した実情に鑑み、イミダゾール系化合物の存在下においても酵素活性の低下が抑制された変異型マルチ銅オキシダーゼ、すなわち、イミダゾール系化合物への耐性向上した変異型マルチ銅オキシダーゼ、これをコードする遺伝子及びこれを用いたバイオ燃料電池を提供することを目的とする。
【課題を解決するための手段】
【0007】
上述した目的を達成するため本発明者らが鋭意検討した結果、マルチ銅オキシダーゼの特定の部位におけるアミノ酸置換変異が、イミダゾール系化合物によるマルチ銅オキシダーゼ活性の低下を防止でき、マルチ銅オキシダーゼのイダゾール系化合物に対する耐性を大幅に向上させることを見いだし本発明を完成するに至った。
【0008】
すなわち、本発明に係る変異型マルチ銅オキシダーゼは、配列番号2に示すアミノ酸配列における、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基の一方又は両方が他のアミノ酸に置換したアミノ酸配列を有し、ABTS(2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を基質とし、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性を有する。
【0009】
また、本発明に係る変異型マルチ銅オキシダーゼにおいて、上記157番目のメチオニンに相当するアミノ酸残基はロイシンに置換されることが好ましく、上記414番目のプロリンに相当するアミノ酸残基はロイシン又はトレオニンに置換されることが好ましい。
【0010】
さらに、本発明に係る変異型マルチ銅オキシダーゼは、上記157番目のメチオニンに相当するアミノ酸残基が他のアミノ酸に置換したアミン酸配列に対して、更に90番目のヒスチジンに相当するアミノ酸残基が他のアミノ酸に置換されていることがより好ましい。特に、この場合、90番目のヒスチジンに相当するアミノ酸残基はアルギニンに置換されていることが好ましい。
【0011】
さらにまた、本発明に係る変異型マルチ銅オキシダーゼは、上記157番目のメチオニンに相当するアミノ酸残基が他のアミノ酸に置換し、上記414番目のプロリンに相当するアミノ酸残基が他のアミノ酸に置換し、上記90番目のヒスチジンに相当するアミノ酸残基が他のアミノ酸に置換されていることが最も好ましい。特に、この場合、157番目のメチオニンに相当するアミノ酸残基はロイシンに置換され、414番目のプロリンに相当するアミノ酸残基はロイシンに置換され、90番目のヒスチジンに相当するアミノ酸残基はアルギニンに置換されていることが好ましい。
【0012】
一方、本発明に係る変異型マルチ銅オキシダーゼ遺伝子は、上述した変異型マルチ銅オキシダーゼをコードするポリヌクレオチドを含むものである。すなわち、本発明に係る変異型マルチ銅オキシダーゼ遺伝子は、配列番号2に示すアミノ酸配列における、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基が他のアミノ酸に置換したアミノ酸配列を有し、ABTS(2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を基質とし、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性を有するタンパク質をコードするものである。
【0013】
さらに、本発明に係るバイオ燃料電池は、上述した変異型マルチ銅オキシダーゼをカソード側電極に使用したものである。すなわち、本発明に係るバイオ燃料電池は、正極と負極とが電解質を介して対向した構造を有し、上記正極に触媒として本発明に係る変異型マルチ銅オキシダーゼを備えるものである。ここで、変異型マルチ銅オキシダーゼは、公知の手法により電極状に固定化することができる。また、電解質には、イミダゾール系化合物を含有することが好ましい。
【発明の効果】
【0014】
本発明に係る変異型マルチ銅オキシダーゼは、新規な置換型変異を有するため、変異前と比較してイミダゾール系化合物に対する耐性が大幅に向上するといった特徴を有している。本発明に係る変異型マルチ銅オキシダーゼを用いたバイオ燃料電池は、イミダゾール系化合物の存在下においてもマルチ銅オキシダーゼの酵素活性の低下を防止できるため、長期に亘って優れた電池特性を維持することができる。
【図面の簡単な説明】
【0015】
【図1】本発明が適用できる従来公知のマルチ銅オキシダーゼについてアミノ酸配列を比較した結果を示す特性図である。
【図2】変異型マルチ銅オキシダーゼをイミダゾール系化合物で処理した後の残存活性を示す特性図である。
【図3】変異型マルチ銅オキシダーゼの比活性を示す特性図である。
【発明を実施するための最良の形態】
【0016】
以下、本発明を図面を参照して詳細に説明する。
<マルチ銅オキシダーゼ>
本発明に係る変異型マルチ銅オキシダーゼは、マルチ銅オキシダーゼにおける特定のアミノ酸残基を置換したアミノ酸配列を有する。ここで、マルチ銅オキシダーゼとは、分子内に酵素活性に必要な4原子の銅を含むタンパク質で、種々の基質から取り出した電子を用いて、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性(以下、マルチ銅オキシダーゼ活性と称する)を有するものであれば特に限定されない。なお、マルチ銅オキシダーゼは、種々の物質を基質として上記マルチ銅オキシダーゼ活性を示す。基質としては、一例としてABTS(2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を挙げることができる。すなわち、マルチ銅オキシダーゼ活性とは、ABTSから電子を取り出し、酸素分子から4電子還元し、水分子を生成する反応を触媒する活性と言い換えることもできる。また、基質としては、ビリルビンを挙げることもできる。なお、マルチ銅オキシダーゼのなかでも、ビリルビンを基質とし、ビリルビンと酸素分子から、二分子のビリベルジンと水分子を生成する反応を触媒する活性を有するものをビリルビンオキシダーゼと称する。
【0017】
その他、基質としては、フェロセン、フェリシアン化アルカリ金属(フェリシアン化カリウム、フェリシアン化リチウム、フェリシアン化ナトリウム等)又はこれらのアルキル置換体(メチル置換体、エチル置換体、プロピル置換体等)、フェナジンメトサルフェート、p−ベンゾキノン、2,6−ジクロロフェノールインドフェノール、メチレンブルー、β−ナフトキノン−4−スルホン酸カリウム、フェナジンエトサルフェート、ビタミンK、ビオローゲン、Os錯体(例えば、特表2003−514823号公報、特表2003−514924号公報に記載のもの等)等の酸化還元性の有機又は無機化合物等を用いることができる。また、基質としては、例えば、Os、Fe、Ru、Co、Cu、Ni、V、Mo、Cr、Mn、Pt、W等の金属元素又はこれら金属のイオンを中心金属とする金属錯体や;キノン、ベンゾキノン、アントラキノン、ナフトキノン等のキノン類;ビオローゲン、メチルビオローゲン、ベンジルビオローゲン等の複素環式化合物等が挙げられる。さらに、基質としては、特開2011-124090号公報及び特開2009-245930号公報においてカソード(正極)に固定される電子伝達メディエーターとして記載される各種化合物を使用することができる。
【0018】
マルチ銅オキシダーゼとしては、植物由来の酵素であっても良いし、動物由来の酵素であっても良いし、微生物由来の酵素であっても良い。微生物由来のマルチ銅オキシダーゼとしては、例えば、枯草菌(Bacillus subtilis)由来のマルチ銅オキシダーゼ、Myrothecium verrucaria由来のマルチ銅オキシダーゼを挙げることができる。
【0019】
枯草菌由来のマルチ銅オキシダーゼ遺伝子塩基配列及び当該遺伝子によりコードされるマルチ銅オキシダーゼのアミノ酸配列をそれぞれ配列番号1及び2に示す。また、Myrothecium verrucaria由来のマルチ銅オキシダーゼ遺伝子によりコードされるマルチ銅オキシダーゼのアミノ酸配列を配列番号3に示す。なお、このMyrothecium verrucaria由来のマルチ銅オキシダーゼについては、そのN末端側が欠損したタイプのものが配列データベースにAccession番号「3ABC_B」として開示されている。このAccession番号「3ABC_B」として開示されたタイプのMyrothecium verrucaria由来のマルチ銅オキシダーゼのアミノ酸配列を配列番号4に示す。
【0020】
本発明において使用可能なマルチ銅オキシダーゼは、配列番号2、3及び4に示したアミノ酸配列からなるものに限定されず、例えば、配列番号2、3及び4に示すアミノ酸配列において詳細を後述する置換対象アミノ酸残基を除く、1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、マルチ銅オキシダーゼ活性を示すものであってもよい。ここで、複数個のアミノ酸としては、例えば、1から30個、好ましくは1から20個、より好ましくは1から10個、さらに好ましくは1個から5個、特に好ましくは1個から3個を意味する。なお、アミノ酸の欠失、置換若しくは付加は、上記マルチ銅オキシダーゼをコードする遺伝子を、当該技術分野で公知の手法によって改変することによって行うことができる。遺伝子に変異を導入するには、Kunkel法またはGapped duplex法等の公知手法又はこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-KやMutant-G(何れも商品名、TAKARA社製))等を用いて、あるいはLA PCR in vitro Mutagenesisシリーズキット(商品名、TAKARA社製)を用いて変異が導入される。
【0021】
また、本発明においては、配列番号2、3及び4に示すアミノ酸配列に対して、例えば85%以上、好ましくは90%以上、より好ましくは95%以上、最も好ましくは98%以上の配列類似性を有するアミノ酸配列を含み、マルチ銅オキシダーゼ活性を有するタンパク質もギマルチ銅オキシダーゼとして使用することもできる。ここで、配列類似性の値は、blastアルゴリズムを実装したコンピュータプログラムを用いてデフォルトの設定で求められる値を意味する。
【0022】
さらに、本発明においては、配列番号1に示す塩基配列の一部又は全部に対して相補的なポリヌクレオチドに対してストリンジェントな条件下でハイブリダイズするポリヌクレオチドにコードされたタンパク質であって、マルチ銅オキシダーゼ活性を有するタンパク質をマルチ銅オキシダーゼとして使用することができる。ここで、ストリンジェントな条件下でハイブリダイズするとは、60℃で2×SSC洗浄条件下で結合を維持することを意味する。ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual,2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。
【0023】
また、マルチ銅オキシダーゼとしては、上述した枯草菌由来のもの及びMyrothecium verrucaria由来のものに限定されず、いかなる生物種由来のものであっても本発明を適用することができる。例えば、遺伝子情報が格納されたデータベースを検索することで、種々の生物種由来のマルチ銅オキシダーゼについて、そのアミノ酸配列等を特定することができる。
【0024】
なお、本発明においてマルチ銅オキシダーゼとしては、上述した活性を有する限り、如何なる名称で呼称されたものであってもよい。例えば、ラッカーゼ、ビリルビンオキシダーゼ、マルチカッパーオキシダーゼ、及びブルーカッパーオキシダーゼ等の呼称が知られている。
【0025】
<置換変異>
本発明に係る変異型マルチ銅オキシダーゼは、上述した各種生物由来のマルチ銅オキシダーゼにおける所定のアミノ酸残基を置換し、アミノ酸置換前と比較してイミダゾール系化合物への耐性が有意に向上したものである。ここで、置換対象のアミノ酸残基は、配列番号2に示すアミノ酸配列からなる枯草菌由来のマルチ銅オキシダーゼを基準として、N末端から数えた数値として特定することができる。しかしながら、配列番号2に示すアミノ酸配列を基準として具体的数値で特定された置換対象のアミノ酸残基は、マルチ銅オキシダーゼの種類によっては異なる数値で表されることとなる。したがって、『配列番号2に示すアミノ酸配列におけるX番目のアミノ酸残基』と表記した場合、配列番号2に示すアミノ酸配列とは異なるアミノ酸配列を有するマルチ銅オキシダーゼについてはX番目とはならず、異なる数値として表現されることとなる。
【0026】
配列番号2に示すアミノ酸配列と異なるアミノ酸配列において、配列番号2に示すアミノ酸配列における所定のアミノ酸残基に相当するアミノ酸残基は、配列番号2に示すアミノ酸配列を含む複数のアミノ酸配列についてマルチプルアラインメント解析を行うことで特定することができる。マルチプルアラインメント解析は、特に限定されないがCLUSTAL W (1.83) multiple sequence alignmentプログラム(国立遺伝学研究所のDDBJで使用できる(http://clustalw.ddbj.nig.ac.jp/top-j.html))を用いて当業者が容易に実施することができる。なお、ペアワイズアライメント解析法を用いて、配列番号2に示すアミノ酸配列に対して他の異なるアミノ酸配列をアラインメントし、配列番号2に示すアミノ酸配列における所定のアミノ酸残基に相当するアミノ酸残基を当該他の異なるアミノ酸配列において特定することもできる。
【0027】
枯草菌由来のマルチ銅オキシダーゼ(配列番号2)及びMyrothecium verrucaria由来のマルチ銅オキシダーゼ(配列番号3及び4)についてマルチプルアラインメント解析した結果を図1に示す。図1に示すマルチプルアライメントにおいて、1行目及び2行目がMyrothecium verrucaria由来のマルチ銅オキシダーゼであり、3行目が枯草菌由来のマルチ銅オキシダーゼである。なお、これら具体的なマルチ銅オキシダーゼ以外の他のマルチ銅オキシダーゼについても、同様にマルチプルアラインメント解析に供することができ、枯草菌由来のマルチ銅オキシダーゼ(配列番号2)を基準として特定のアミノ酸残基の位置を特定することができる。
【0028】
以下の説明において、置換対象アミノ酸は、配列番号2に示すアミノ酸配列、すなわち枯草菌由来のマルチ銅オキシダーゼを基準として表記する。しかし、上述したように、アミノ酸の位置を表す数値は、マルチ銅オキシダーゼの種類に応じて異なる数値となる点に留意する。本発明に係る変異型マルチ銅オキシダーゼは、以下に説明するアミノ酸残基に置換変異を有する変異型マルチ銅オキシダーゼ、及び当該変異型マルチ銅オキシダーゼに対して更に異なる置換変異を有する変異型マルチ銅オキシダーゼが含まれる。
【0029】
<変異型マルチ銅オキシダーゼ>
本発明に係る変異型マルチ銅オキシダーゼは、配列番号2に示すアミノ酸配列における、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基のいずれか一方又は両方が他のアミノ酸に置換したアミノ酸配列を有している。図1には、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基を枠で囲っている。図1に示すように、配列番号2に示すアミノ酸配列における157番目のメチオニンはMyrothecium verrucaria由来のマルチ銅オキシダーゼにおいても保存されている。
【0030】
ここで、他のアミノ酸としては、変異後のマルチ銅オキシダーゼのイミダゾール系化合物に対する耐性が変異前のマルチ銅オキシダーゼにおける耐性と比較して有意に向上するものである限り、特に限定されず、如何なるアミノ酸であっても良い。イミダゾール系化合物に対する耐性は、イミダゾール系化合物を含む溶液にて所定時間処理(例えば、90℃で30分間)し、当該処理後の残存活性として評価することができる。また、イミダゾール系化合物に対する耐性が向上するとは、変異導入前の野生型マルチ銅オキシダーゼの残存活性と比較して変異導入後のマルチ銅オキシダーゼの残存活性が統計的に有意に高いことを意味する。ここで、変異型マルチ銅オキシダーゼ及び置換変異前のマルチ銅オキシダーゼの酵素活性は、従来公知の手法を適宜使用することができる。例えば、基質として2,2’-アジノビス(3-エチルベンゾチアゾリン-6-スルホン酸)アンモニウム塩(ABTS)を含む所定のpHの緩衝液中で測定対象のマルチ銅オキシダーゼを作用させ、ABTSの反応物による吸光度変化を測定する。これにより、上述した残存活性を測定することができ、所定のアミノ酸置換変異がイミダゾール系化合物に対する耐性を向上させる効果を有するかいなか判断することができる。
【0031】
特に、上述した置換変異については、より具体的に157番目のメチオニンに相当するアミノ酸残基はロイシンに置換されることが好ましく、上記414番目のプロリンに相当するアミノ酸残基はロイシン又はトレオニンに置換されることが好ましい。なお、変異型マルチ銅オキシダーゼは、これら157番目のメチオニンの置換変異と、上記414番目のプロリンの置換変異とを両方有していても良いし、片方のみを有していても良い。いずれの場合でも、変異型マルチ銅オキシダーゼは、変異導入前のマルチ銅オキシダーゼと比較してイミダゾール系化合物に対する優れた耐性を有することとなる。
【0032】
さらに、変異型マルチ銅オキシダーゼは、上記157番目のメチオニンに相当するアミノ酸残基が他のアミノ酸に置換したアミン酸配列に対して、更に90番目のヒスチジンに相当するアミノ酸残基が他のアミノ酸に置換されていることがより好ましい。特に、この場合、90番目のヒスチジンに相当するアミノ酸残基はアルギニンに置換されていることがより好ましい。なお、この90番目のヒスチジンの置換変異を単独で有する変異型マルチ銅オキシダーゼは、イミダゾール系化合物に対する耐性は野生型と同等である。しかし、この90番目のヒスチジンの置換変異は、上述した157番目のメチオニンの置換変異によるイミダゾール系化合物への耐性向上効果を増強する作用を示す。すなわち、157番目のメチオニンの置換変異と90番目のヒスチジンの置換変異を有する二重変異型マルチ銅オキシダーゼは、157番目のメチオニンの置換変異を単独で有する変異型マルチ銅オキシダーゼと比較して、イミダゾール系化合物への耐性が大幅に向上している。
【0033】
なお、上述したように、置換後のアミノ酸として具体的に好ましいアミノ酸を例示したが、置換後のアミノ酸は上記例示に限定されるものではない。参考文献(1)(「マッキー生化学」第3版 5章アミノ酸・ペプチド・タンパク質 5.1アミノ酸、監修:市川厚、監訳:福岡伸一、発行者:曽根良介、発行所:(株)化学同人、ISBN4-7598-0944 -9)でも記載されているように、アミノ酸は同様の性質(化学的性質や物理的大きさ)を持つ側鎖に従って分類される事がよく知られる。また、タンパク質の活性を保持したまま、所定のグループに分類されるアミノ酸残基間における分子進化上の置換が頻度高く起こることがよく知られる。この考えを基に、参考文献(2): Henikoff S., Henikoff J.G., Amino-acid substitution matrices from protein blocks, Proc. Natl. Acad. Sci. USA, 89, 10915-10919 (1992)中の、Fig.2でアミノ酸残基の置換変異のスコアマトリックス(BLOSUM)が提唱され、広く使用されている。参考文献(2)では、側鎖の化学的性質が似たもの同士のアミノ酸置換は、タンパク質全体に与える構造や機能変化が少なくなると言う知見に基づくものである。上記参考文献(1)及び(2)によれば、マルチプルアラインメントで考慮するアミノ酸の側鎖のグループは、化学的性質や物理的大きさなどの指標を基にして考えることができる。これは、参考文献(2)に開示されたスコアマトリックス(BLOSUM)において、スコアの0以上の値を持つアミノ酸、好ましくは1以上の値を持つアミノ酸のグループとして示される。
【0034】
以上のような知見に基づいて、性質の類似したアミノ酸を下記の8つのグループに分類することができる。したがって、置換後のアミノ酸としては、上記例示したアミノ酸が含まれるグループに分類されるアミノ酸とすることが好ましい。例えば、枯草菌由来のマルチ銅オキシダーゼにおける157番目のメチオニンはロイシンに置換することが好ましいとしたが、当該メチオニン残基は、ロイシンが分類されている後記1)脂肪族疎水性アミノ酸グループに分類されるイソロイシン、メチオニン又はバリンに置換されても良い。同様に、枯草菌由来のマルチ銅オキシダーゼにおける414番目のプロリンはロイシン又はトレオニンに置換することが好ましいとしたが、当該プロリン残基は、ロイシンが分類されている後記1)脂肪族疎水性アミノ酸グループに分類されるイソロイシン、メチオニン又はバリンに置換されても良いし、トレオニンが分類されている後記2)ヒドロキシメチレン基をもつグループに分類されるセリンに置換されても良い。さらに、枯草菌由来のマルチ銅オキシダーゼにおける90番目のヒスチジンはアルギニンに置換することが好ましいとしたが、当該ヒスチジン残基は、アルギニンが分類されている後記4)塩基性アミノ酸に分類されるリジンに置換されても良い。
【0035】
1)脂肪族疎水性アミノ酸グループ(ILMVグループ)
このグループは、上記参考文献(1)で示された中性非極性アミノ酸のうち、脂肪属性の疎水性側鎖をもつアミノ酸のグループであり、V(Val、バリン)、L(Leu、ロイシン)、I(Ile、イソロイシン)及びM(Met、メチオニン)から構成される。参考文献(1)による中性非極性アミノ酸と分類されるもののうちFGACWPは以下理由で、この「脂肪族疎水性アミノ酸グループ」には含めない。G(Gly、グリシン)やA(Ala、アラニン)はメチル基以下の大きさで非極性の効果が弱いからである。C(Cys、システイン)はS-S結合に重要な役目を担う場合があり、また、酸素原子や窒素原子と水素結合を形成する特性があるからである。F(Phe、フェニルアラニン)やW(Trp、トリプトファン)は側鎖がとりわけ大きな分子量をもち、かつ、芳香族の効果が強いからである。P(Pro、プロリン)はイミノ酸効果が強く、ポリペプチドの主鎖の角度を固定してしまうからである。
【0036】
2)ヒドロキシメチレン基をもつグループ(STグループ)
このグループは、中性極性アミノ酸のうちヒドロキシメチレン基を側鎖に持つアミノ酸のグループであり、S(Ser、セリン)とT(Thr、スレオニン)から構成される。SとTの側鎖に存在する水酸基は、糖の結合部位であるため、あるポリペプチド(タンパク質)が特定の活性を持つために重要な部位である場合が多い。
【0037】
3)酸性アミノ酸(DEグループ)
このグループは、酸性であるカルボキシル基を側鎖に持つアミノ酸のグループであり、D(Asp、アスパラギン酸)とE(Glu、グルタミン酸)から構成される。
【0038】
4)塩基性アミノ酸(KRグループ)
このグループは、塩基性アミノ酸のグループであり、K(Lys、リジン)とR(Arg、アルギニン)から構成される。これらKとRは、pHの広い範囲で正に帯電し塩基性の性質をもつ。一方、塩基性アミノ酸に分類されるH(His、ヒスチジン)はpH7においてほとんどイオン化されないので、このグループには分類されない。
【0039】
5)メチレン基=極性基(DHNグループ)
このグループは、全てα位の炭素元素に側鎖としてメチレン基が結合しその先に極性基を有すると言う特徴を持つ。非極性基であるメチレン基の物理的大きさが酷似している特徴を持ち、N(Asn、アスパラギン、極性基はアミド基)、D(Asp、アスパラギン酸、極性基はカルボキシル基)とH(His、ヒスチジン、極性基はイミダゾール基)から成る。
【0040】
6)ジメチレン基=極性基(EKQRグループ)
このグループは、全てα位の炭素元素に側鎖としてジメチレン基以上の直鎖炭化水素が結合しその先に極性基を有すると言う特徴を持つ。非極性基であるジメチレン基の物理的大きさが酷似している特徴を持つ。E(Glu、グルタミン酸、極性基はカルボキシル基)、K(Lys、リジン、極性基はアミノ基)、Q(Gln、グルタミン、極性基はアミド基)、R(Arg、アルギニン、極性基はイミノ基とアミノ基)から成る。
【0041】
7)芳香族(FYWグループ)
このグループには、側鎖にベンゼン核を持つ芳香族アミノ酸であり、芳香族特有の化学的性質を特徴とする。F(Phe、フェニルアラニン)、Y(Tyr、チロシン)、W(Trp、トリプトファン)から成る。
【0042】
8)環状&極性(HYグループ)
このグループには、側鎖に環状構造を持つと同時に極性も持つアミノ酸で、H(H、ヒスチジン、環状構造と極性基は共にイミダゾール基)、Y(Tyr、チロシン、環状構造はベンゼン核で極性基は水酸基)から成る。
【0043】
<変異型マルチ銅オキシダーゼの製造>
上述した本発明に係る変異型マルチ銅オキシダーゼは、従来公知のタンパク質の製造方法を利用することによって取得することができる。変異型マルチ銅オキシダーゼが真核生物由来である場合には、例えば酵母を宿主としたタンパク質製造システムを利用して変異型マルチ銅オキシダーゼを取得することができる。また、変異型マルチ銅オキシダーゼが原核生物由来の場合、例えば、大腸菌を宿主としたタンパク質製造システムや、無細胞タンパク質製造システムを利用して変異型マルチ銅オキシダーゼを取得することができる。
【0044】
より具体的には、上述した変異型マルチ銅オキシダーゼをコードする遺伝子を準備する。例えば、T. クンケル(Kunkel)の部位特異的変異導入法(Kunkel, T. A. Proc. Nati. Acad. Sci. U. S. A. 82, 488-492 (1985))、Gapped duplex法等を適用して、野生型のマルチ銅オキシダーゼ遺伝子に対して所定の位置に突然変異を導入し、変異型マルチ銅オキシダーゼをコードする遺伝子を準備することができる。また、部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutan-K(宝酒造社製)やMutan-G(宝酒造社製))などを用いて、あるいは、宝酒造社製のLA PCR in vitro Mutagenesis シリーズキットを用いて、例えば野生型のマルチ銅オキシダーゼ遺伝子に対して変異を導入することで、上述した変異型マルチ銅オキシダーゼをコードする遺伝子を準備することもできる。
【0045】
特に、本発明において変異型マルチ銅オキシダーゼとしては、枯草菌由来のマルチ銅オキシダーゼに対して変異を導入したものを製造することが好ましい。枯草菌由来のマルチ銅オキシダーゼは他のマルチ銅オキシダーゼと比較して非常に高い耐熱性を示すためである。また、原核生物である枯草菌由来のマルチ銅オキシダーゼは、真核生物由来のマルチ銅オキシダーゼと異なり糖鎖修飾などが不要であり、大腸菌を利用したタンパク質生産システムや無細胞タンパク質製造システムを利用して簡易に製造することができるため好ましい。
【0046】
酵母を宿主としたタンパク質製造システムを利用する場合、変異型マルチ銅オキシダーゼ遺伝子は、一般的に利用されている発現ベクターの形で酵母に導入することができる。ベクターは典型的には、選択マーカー遺伝子、クローニング部位及び制御領域(プロモーター及びターミネーター)を有している。このベクターは、本技術分野においてよく知られており商業的に入手可能である。ベクターに含まれるプロモーターは、酵母において機能しうるならば、構成的発現プロモーター及び誘導型プロモーターのいずれでも良い。プロモーターが機能しうるとは、宿主酵母内において変異型マルチ銅オキシダーゼ遺伝子の転写が可能であることを意味する。プロモーターとしては、特に限定されないが、例えばグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子(TDH3)のプロモーター、3-ホスホグリセレートキナーゼ遺伝子(PGK1)のプロモーター、高浸透圧応答7遺伝子(HOR7)のプロモーターなどが利用可能である。なかでもピルビン酸脱炭酸酵素遺伝子(PDC1)のプロモーターが下流の変異型マルチ銅オキシダーゼ遺伝子を高発現させる能力が高いために好ましい。
【0047】
本発明では、上述した変異型マルチ銅オキシダーゼ遺伝子を発現可能に組み込んだ発現ベクターを定法に従って導入し、当該変異型マルチ銅オキシダーゼを生産する。発現ベクターを導入する方法としては、従来公知の各種方法、例えば、エレクトロポレーション法“Meth. Enzym., 194, p182 (1990)”、スフェロプラスト法“Proc. Natl. Acad. Sci. USA, 75 p1929(1978)”、酢酸リチウム法“J.Bacteriology, 153, p163(1983)”、Proc. Natl. Acad. Sci. USA, 75 p1929 (1978)、Methods in yeast genetics, 2000 Edition : A Cold Spring Harbor Laboratory Course Manualなどに記載の方法で実施可能であるが、これに限定されない。
【0048】
また、大腸菌を宿主としたタンパク質製造システムを利用する場合、変異型マルチ銅オキシダーゼ遺伝子は、一般的に利用されている発現ベクターの形で大腸菌に導入することができる。ベクターは典型的には、選択マーカー遺伝子、クローニング部位及び制御領域(プロモーター及びターミネーター)を有している。このベクターは、本技術分野においてよく知られており商業的に入手可能である。例えば、大腸菌由来のプラスミド(pBR322、pBR325、pUC18、pUC19、pUC119、pTV118N、pTV119N、pBluescript、pHSG298、pHSG396又はpTrc99AなどのColE系プラスミド、pACYC177又はpACYC184などのp1A系プラスミド、pMW118、pMW119、pMW218又はpMW219などのpSC101系プラスミド等)、枯草菌由来のプラスミド(例えば、pUB110、pTP5等)などを使用することができる。さらに、ファージDNAとしては、λファージ(Charon4A、Charon21A、EMBL3、EMBL4、λgt100、gt11、zap)、φX174、M13mp18又はM13mp19などを使用することができる。なお、宿主としては、大腸菌のみならず枯草菌を使用することもできる。
【0049】
さらにまた、無細胞タンパク質製造システムを利用する場合、変異型マルチ銅オキシダーゼ遺伝子は、当該システムに適した発現ベクターの形で使用する。無細胞タンパク質製造システムとしては、例えば、大腸菌、小麦胚芽ウサギ網状赤血球などを破砕し、膜成分を遠心分離で除いた細胞抽出液を使用することができる。また、いわゆるPUREシステムと呼称される無細胞タンパク質製造システムを利用することもできる。
【0050】
酵母を使用する場合、大腸菌等を使用する場合及び/又は無細胞タンパク質製造システムを使用する場合のいずれにおいても、定法に従って変異型マルチ銅オキシダーゼを精製することができる。変異型マルチ銅オキシダーゼの精製には、例えば、アフィニティークロマトグラフィー、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、エタノール沈殿、逆相HPLC、シリカ上またはDEAEなどの陽イオン交換樹脂によるクロマトグラフィー、クロマトフォーカシング、 SDS-PAGE、硫酸アンモニュウム沈殿法、ゲルろ過等の手法を単独で又は組み合わせて使用できる。
【0051】
<変異型マルチ銅オキシダーゼの利用形態>
以上で説明した変異型マルチ銅オキシダーゼは、従来、マルチ銅オキシダーゼが使用されている反応系のいずれにも優れた代替物として利用することができる。特に、上述した変異型マルチ銅オキシダーゼは、変異導入前のマルチ銅オキシダーゼと比較すると、イミダゾール系化合物に対する耐性が非常に優れている。したがって、上述した変異型マルチ銅オキシダーゼは、従来、マルチ銅オキシダーゼをイミダゾール系化合物とともに使用した反応系に使用することがより好ましい。
【0052】
上述した変異型マルチ銅オキシダーゼは、例えば、燃料電池のカソード電極に使用することができる。このとき、燃料電池は、イミダゾール系化合物を電解質として使用したものであることが好ましい。変異型マルチ銅オキシダーゼをカソード電極に使用する場合、通常、電極として使用される材料(例えば、多孔質カーボン材料など)に変異型マルチ銅オキシダーゼを固定化しても良い。
【0053】
なお、上述した変異型マルチ銅オキシダーゼ、如何なる構成、構造の燃料電池に適用することができる。燃料電池としては、例えば、正極と負極とが電解質を介して対向した構造を有するものを挙げることができる。電解質としては、特に限定されないが、イミダゾール系化合物を含有するものが好ましい。イミダゾール系化合物を電解質に含有する場合、電池特性に優れるためである。ここで、イミダゾール系化合物としては、イミダゾール、トリアゾール、ピリジン誘導体、ビピリジン誘導体、イミダゾール誘導体(ヒスチジン、1−メチルイミダゾール、2−メチルイミダゾール、4−メチルイミダゾール、2−エチルイミダゾール、イミダゾール−2−カルボン酸エチル、イミダゾール−2−カルボキシアルデヒド、イミダゾール−4−カルボン酸、イミダゾール−4,5−ジカルボン酸、イミダゾール−1−イル−酢酸、2−アセチルベンズイミダゾール、1−アセチルイミダゾール、N−アセチルイミダゾール、2−アミノベンズイミダゾール、N−(3−アミノプロピル) イミダゾール、5−アミノ−2−(トリフルオロメチル) ベンズイミダゾール、4−アザベンズイミダゾール、4−アザ−2−メルカプトベンズイミダゾール、ベンズイミダゾール、1−ベンジルイミダゾール、1−ブチルイミダゾール)等を挙げることができる。
【0054】
なお、燃料電池における燃料としては、多糖類(二糖、三糖、四糖などのオリゴ糖を含む)や単糖類を使用することができる。多糖類を使用する場合には、多糖類の加水分解などの分解を促進し、グルコースなどの単糖類を生成する分解酵素を併用することが好ましい。多糖類としては、具体的には、例えば、デンプン、アミロース、アミロペクチン、グリコーゲン、セルロース、マルトース、スクロース、ラクトースなどが挙げられる。これらは単糖類が二つ以上結合したものであり、いずれの多糖類においても結合単位の単糖類としてグルコースが含まれている。
【実施例】
【0055】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の技術的範囲は以下の実施例に限定されるものではない。
【0056】
〔実施例1〕
(1)スクリーニング用ライブラリーの作製
下記1stPCRにより3つのフラグメントを作製したのち、2nd PCRで連結したものをライブラリーとした。
【0057】
1-1. 1st PCR
1-1-1.エラープローンPCR
Diversify PCR Random Mutagenesis Kit(Clontech社製)を用いて以下の条件でPCRを実施し、B. subtilis由来のマルチ銅オキシダーゼ遺伝子(BOD遺伝子)に変異をランダムに導入した。使用したprimerの配列は表2に示した。また使用した鋳型DNAはpET23b(+)ベクターへ、B. subtilis由来のBOD遺伝子をクローニング(NdeI/XhoIサイト))したものを使用した。B. subtilis由来のBOD遺伝子の塩基配列を配列番号1に示した。また、当該BOD遺伝子がコードするマルチ銅オキシダーゼのアミノ酸配列を配列番号2に示した。
【0058】
【表1】

【0059】
【表2】

【0060】
なお、本PCRの反応サイクルは、94℃で30秒間の後、94℃で30秒間→55℃で30秒間→68℃で1.5分間を1サイクルとして25サイクル行い、その後、68℃で1分間、その後4℃とした。PCR産物はアガロース電気泳動の後、定法に従い、バンドを切り出し、精製した。
【0061】
1-1-2.ベクターを含むPCR断片の作製
表3及び4に示す反応液組成でPCRを行い、断片1及び断片2を作製した。酵素はKOD-Plus-DNA Polymeraseを使用した。使用したprimerの配列は表5に示した。
【0062】
【表3】

【0063】
【表4】

【0064】
【表5】

【0065】
なお、本PCRの反応サイクルは、94℃で2分間の後、94℃で15秒間→55℃で30秒間→68℃で1分間を1サイクルとして30サイクル行い、その後、68℃で5分間、その後4℃とした。PCR産物はアガロース電気泳動の後、定法に従い、バンドを切り出し、精製した。
【0066】
1-2.2nd PCR
表6に示す反応液組成でPCRを実施し、1-1.で作製した3つの断片を連結した。
【表6】

【0067】
本PCRのプライマーとしては、bsLinkerFR :5'-TACAATACTAATCTACGAGAGCCTACGGTTTACCACTC-3'を使用した。なお、本PCRの反応サイクルは、94℃で2分間の後、94℃で15秒間→53℃で30秒間→68℃で2分間を1サイクルとして30サイクル行い、その後、68℃で5分間、その後4℃とした。PCR産物は、アガロース電気泳動により増幅バンドが1本であることを確認した後、定法に従い、バンドを切り出し、精製した。この溶出液をライブラリーとした。
【0068】
(2)組換え体BODのスクリーニング
2-1. PCR
ライブラリー溶液を希釈し、表7に示す反応液組成でPCRを実施した。
【0069】
【表7】

【0070】
本PCRのプライマーとしては、 bsHomo:5'-CTACGAGAGCCTACGGTTTACCACTC-3'を使用した。なお、本PCRの反応サイクルは、94℃で2分間の後、94℃で20秒間→68℃で2分間を1サイクルとして40サイクル行い、その後、4℃とした。
【0071】
2-2.無細胞翻訳系による組換え体BODの合成
大腸菌B株由来のS30画分を用いて、以下の条件で翻訳を実施した。反応液組成を表8に示す。
【0072】
【表8】

【0073】
なお、表8に示したアミノ酸ミックスの組成を表9に示した。
【表9】

【0074】
翻訳反応は、サーマルサイクラーを使用して25℃で1.5時間反応させた。続いて、翻訳産物に11.12μl 2mM Cu/50mM HEPES-KOH(pH 7.5)溶液を添加して4℃で一晩置き、銅を吸着させた。
【0075】
2-3.活性測定
2-3-1.初活性
反応液に含まれるBOD活性を以下の条件で測定した。反応液組成を表10に示す。
【0076】
【表10】

【0077】
また、反応条件は、予め37℃に保温した水槽において37℃ 40分保温する条件とし、発色の有無を確認した。
【0078】
2-3-2.イミダゾール耐久性の確認
2-3-1.で発色を確認が確認されたサンプルについて、以下の手順によりイミダゾール耐久性が向上しているかどうか調べた。反応液組成を表11に示す。
【0079】
【表11】

【0080】
上記組成の反応液をサーマルサイクラーを使用して90℃で30分加熱した。その後、活性測定反応液143μl添加した。活性測定反応液の組成を表12に示す。
【0081】
【表12】

【0082】
上記活性測定反応液を添加した溶液をサーマルサイクラーを用いて37℃で20分加熱した。加熱終了後、目視で発色を確認した。
【0083】
(3)スクリーニングにより抽出された変異体の評価
3-1.有望変異体のクローニング
2-3-2.で抽出された変異体をpET23b(+)ベクターへクローニングした。
【0084】
3-2.評価
3-2-1. 鋳型DNAの調製
以下の条件でPCRを実施した。反応液組成を表13に示す。使用したprimerの配列は表14に示した。
【0085】
【表13】

【0086】
【表14】

【0087】
なお、本PCRの反応サイクルは、94℃で2分間の後、94℃で15秒間→53℃で30秒間→68℃で2分間を1サイクルとして25サイクル行い、その後、68℃で2分間、その後4℃とした。PCR反応液をMinElute PCR Purification Kit(QIAGEN社製) を用いて精製し、これを鋳型DNAとした。
【0088】
3-2-2. 無細胞翻訳系による組換え体BODの合成
2-2.と同様に実施した。
【0089】
3-2-3.活性測定
3-2-3-1.初期活性
反応液に含まれるBOD活性を以下の条件で測定した。反応液組成を表15に示す。
【表15】

【0090】
また、反応液をサーマルサイクラーで37℃で20分間反応した後、infinite M200(TECAN社製)を用いてA420を測定した。
【0091】
3-2-3-2.イミダゾール耐久性の確認
以下の手順によりイミダゾール耐久性が向上しているかどうか調べた。反応液組成を表16に示す。
【0092】
【表16】

【0093】
上記組成の反応液をサーマルサイクラーを使用して90℃で30分加熱した。その後、活性測定反応液143μl添加した。活性測定反応液の組成を表17に示す。
【0094】
【表17】

【0095】
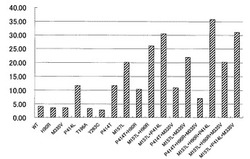
反応液をサーマルサイクラーで37℃で20分間反応した後、infinite M200(TECAN社製)を用いてA420を測定した。結果を図2に示した。また定法に従ってシークエンサーにより各変異体の塩基配列を確認した。図2に示すように、B. subtilis由来のBOD遺伝子がコードするマルチ銅オキシダーゼのアミノ酸配列における157番目のメチオニンがロイシンに置換された変異型マルチ銅オキシダーゼ(M157L)は、イミダゾール系化合物に対する優れた耐性を有することが示された。また、同アミノ酸配列における414番目のプロリンがロイシン又はトレオニンに置換された変異型マルチ銅オキシダーゼ(P414L、P414T)も、同様にイミダゾール系化合物に対する優れた耐性を有することが示された。また、M157LとP414Lの両方の置換変異を有する変異型マルチ銅オキシダーゼは、イミダゾール系化合物に対する更に優れた耐性を示すことが判った。
【0096】
また興味深いことに、マルチ銅オキシダーゼのアミノ酸配列における90番目のヒスチジンがアルギニンに置換した変異型マルチ銅オキシダーゼ(H90R)はイミダゾール系化合物に対する耐性が野生型と同等であったにも拘わらず、このH90R変異はM157L変異による耐性向上効果を増強できることが判った。すなわち、H90R及びM157Lを共に有する変異型マルチ銅オキシダーゼは、M157Lを単独で有する変異型マルチ銅オキシダーゼと比較して、イミダゾール系化合物への耐性が大幅に向上していることが判った。
【0097】
なお、図2に示すように、マルチ銅オキシダーゼのアミノ酸配列における335番目のメチオニンがバリンに置換した変異型マルチ銅オキシダーゼ(M335V)など各種の単独置換変異が同定されたが、イミダゾール系化合物に対する耐性を向上させる効果は見られなかった。さらに、H90R変異のように、他の置換変異によるイミダゾール系化合物への耐性向上効果を増強するような変異も見いだされなかった。
【0098】
また、図2に示した各種変異型マルチ銅オキシダーゼについて、BOD活性を比活性として比較した結果を図3に示した。図3に示すように、P414L又はP414Tを有する変異型マルチ銅オキシダーゼは、非常に高い比活性を示すことが判った。これらP414L又はP414Tを有する変異型マルチ銅オキシダーゼのように、本実施例により、イミダゾール系化合物への耐性向上効果のみならず酵素活性を向上させる置換変異が明らかになった。
【技術分野】
【0001】
本発明は、マルチ銅オキシダーゼにおける特定の部位に置換型変異を有する変異型マルチ銅オキシダーゼ、当該変異型マルチ銅オキシダーゼをコードする遺伝子及び当該マルチ銅オキシダーゼを用いたバイオ燃料電池に関する。
【背景技術】
【0002】
マルチ銅オキシダーゼ(bilirubin oxidase)は、分子内に酵素活性に必要な4原子の銅を含むタンパク質で、種々の基質から取り出した電子を用いて、酸素分子を4電子還元し、水分子を生成する反応を触媒する酸化還元酵素である。マルチ銅オキシダーゼは、特許文献1乃至4に記載されるように、バイオ燃料電池におけるカソード電極や、各種バイオセンサーの電極材料として使用されている。また、特許文献1乃至3に示すように、マルチ銅オキシダーゼに対して1以上のアミノ酸置換変異を導入することで、固定化の際の活性低下を防止したり、熱安定性を向上させたり、反応過電圧が小さくするといった機能を改変する試みが提案されている。
【0003】
一方、バイオ燃料電池とは、酵素燃料電池とも呼称され、酵素や微生物による化学反応により発生した電気エネルギーを利用するものである。バイオ燃料電池は、一般の電池と同様にカソード電極及びアノード電極が電解質を介して対向した構造を有し、燃料としてメタノールやエタノールのようなアルコール類又はグルコースのような糖類を用いる。また、特許文献5に記載されるように、電解質としてイミダゾール系化合物を利用することが知られている。
【0004】
しかしながら、イミダゾール系化合物を電解質として利用する場合、バイオ燃料電池に使用される酵素、例えば上述したマルチ銅オキシダーゼに対する変性作用が働き、酵素の活性低下を招くこととになってしまう。例えば、特許文献5に示すように、酵素を固定化することでイミダゾール系化合物による活性低下を抑制することもできるが、その抑制効果は十分とは言えなかった。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2009-158480号公報
【特許文献2】特開2008-161178号公報
【特許文献3】特開2010-183857号公報
【特許文献4】特開2009-044997号公報
【特許文献5】特開2009-158458号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
上述した実情に鑑み、イミダゾール系化合物の存在下においても酵素活性の低下が抑制された変異型マルチ銅オキシダーゼ、すなわち、イミダゾール系化合物への耐性向上した変異型マルチ銅オキシダーゼ、これをコードする遺伝子及びこれを用いたバイオ燃料電池を提供することを目的とする。
【課題を解決するための手段】
【0007】
上述した目的を達成するため本発明者らが鋭意検討した結果、マルチ銅オキシダーゼの特定の部位におけるアミノ酸置換変異が、イミダゾール系化合物によるマルチ銅オキシダーゼ活性の低下を防止でき、マルチ銅オキシダーゼのイダゾール系化合物に対する耐性を大幅に向上させることを見いだし本発明を完成するに至った。
【0008】
すなわち、本発明に係る変異型マルチ銅オキシダーゼは、配列番号2に示すアミノ酸配列における、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基の一方又は両方が他のアミノ酸に置換したアミノ酸配列を有し、ABTS(2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を基質とし、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性を有する。
【0009】
また、本発明に係る変異型マルチ銅オキシダーゼにおいて、上記157番目のメチオニンに相当するアミノ酸残基はロイシンに置換されることが好ましく、上記414番目のプロリンに相当するアミノ酸残基はロイシン又はトレオニンに置換されることが好ましい。
【0010】
さらに、本発明に係る変異型マルチ銅オキシダーゼは、上記157番目のメチオニンに相当するアミノ酸残基が他のアミノ酸に置換したアミン酸配列に対して、更に90番目のヒスチジンに相当するアミノ酸残基が他のアミノ酸に置換されていることがより好ましい。特に、この場合、90番目のヒスチジンに相当するアミノ酸残基はアルギニンに置換されていることが好ましい。
【0011】
さらにまた、本発明に係る変異型マルチ銅オキシダーゼは、上記157番目のメチオニンに相当するアミノ酸残基が他のアミノ酸に置換し、上記414番目のプロリンに相当するアミノ酸残基が他のアミノ酸に置換し、上記90番目のヒスチジンに相当するアミノ酸残基が他のアミノ酸に置換されていることが最も好ましい。特に、この場合、157番目のメチオニンに相当するアミノ酸残基はロイシンに置換され、414番目のプロリンに相当するアミノ酸残基はロイシンに置換され、90番目のヒスチジンに相当するアミノ酸残基はアルギニンに置換されていることが好ましい。
【0012】
一方、本発明に係る変異型マルチ銅オキシダーゼ遺伝子は、上述した変異型マルチ銅オキシダーゼをコードするポリヌクレオチドを含むものである。すなわち、本発明に係る変異型マルチ銅オキシダーゼ遺伝子は、配列番号2に示すアミノ酸配列における、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基が他のアミノ酸に置換したアミノ酸配列を有し、ABTS(2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を基質とし、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性を有するタンパク質をコードするものである。
【0013】
さらに、本発明に係るバイオ燃料電池は、上述した変異型マルチ銅オキシダーゼをカソード側電極に使用したものである。すなわち、本発明に係るバイオ燃料電池は、正極と負極とが電解質を介して対向した構造を有し、上記正極に触媒として本発明に係る変異型マルチ銅オキシダーゼを備えるものである。ここで、変異型マルチ銅オキシダーゼは、公知の手法により電極状に固定化することができる。また、電解質には、イミダゾール系化合物を含有することが好ましい。
【発明の効果】
【0014】
本発明に係る変異型マルチ銅オキシダーゼは、新規な置換型変異を有するため、変異前と比較してイミダゾール系化合物に対する耐性が大幅に向上するといった特徴を有している。本発明に係る変異型マルチ銅オキシダーゼを用いたバイオ燃料電池は、イミダゾール系化合物の存在下においてもマルチ銅オキシダーゼの酵素活性の低下を防止できるため、長期に亘って優れた電池特性を維持することができる。
【図面の簡単な説明】
【0015】
【図1】本発明が適用できる従来公知のマルチ銅オキシダーゼについてアミノ酸配列を比較した結果を示す特性図である。
【図2】変異型マルチ銅オキシダーゼをイミダゾール系化合物で処理した後の残存活性を示す特性図である。
【図3】変異型マルチ銅オキシダーゼの比活性を示す特性図である。
【発明を実施するための最良の形態】
【0016】
以下、本発明を図面を参照して詳細に説明する。
<マルチ銅オキシダーゼ>
本発明に係る変異型マルチ銅オキシダーゼは、マルチ銅オキシダーゼにおける特定のアミノ酸残基を置換したアミノ酸配列を有する。ここで、マルチ銅オキシダーゼとは、分子内に酵素活性に必要な4原子の銅を含むタンパク質で、種々の基質から取り出した電子を用いて、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性(以下、マルチ銅オキシダーゼ活性と称する)を有するものであれば特に限定されない。なお、マルチ銅オキシダーゼは、種々の物質を基質として上記マルチ銅オキシダーゼ活性を示す。基質としては、一例としてABTS(2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を挙げることができる。すなわち、マルチ銅オキシダーゼ活性とは、ABTSから電子を取り出し、酸素分子から4電子還元し、水分子を生成する反応を触媒する活性と言い換えることもできる。また、基質としては、ビリルビンを挙げることもできる。なお、マルチ銅オキシダーゼのなかでも、ビリルビンを基質とし、ビリルビンと酸素分子から、二分子のビリベルジンと水分子を生成する反応を触媒する活性を有するものをビリルビンオキシダーゼと称する。
【0017】
その他、基質としては、フェロセン、フェリシアン化アルカリ金属(フェリシアン化カリウム、フェリシアン化リチウム、フェリシアン化ナトリウム等)又はこれらのアルキル置換体(メチル置換体、エチル置換体、プロピル置換体等)、フェナジンメトサルフェート、p−ベンゾキノン、2,6−ジクロロフェノールインドフェノール、メチレンブルー、β−ナフトキノン−4−スルホン酸カリウム、フェナジンエトサルフェート、ビタミンK、ビオローゲン、Os錯体(例えば、特表2003−514823号公報、特表2003−514924号公報に記載のもの等)等の酸化還元性の有機又は無機化合物等を用いることができる。また、基質としては、例えば、Os、Fe、Ru、Co、Cu、Ni、V、Mo、Cr、Mn、Pt、W等の金属元素又はこれら金属のイオンを中心金属とする金属錯体や;キノン、ベンゾキノン、アントラキノン、ナフトキノン等のキノン類;ビオローゲン、メチルビオローゲン、ベンジルビオローゲン等の複素環式化合物等が挙げられる。さらに、基質としては、特開2011-124090号公報及び特開2009-245930号公報においてカソード(正極)に固定される電子伝達メディエーターとして記載される各種化合物を使用することができる。
【0018】
マルチ銅オキシダーゼとしては、植物由来の酵素であっても良いし、動物由来の酵素であっても良いし、微生物由来の酵素であっても良い。微生物由来のマルチ銅オキシダーゼとしては、例えば、枯草菌(Bacillus subtilis)由来のマルチ銅オキシダーゼ、Myrothecium verrucaria由来のマルチ銅オキシダーゼを挙げることができる。
【0019】
枯草菌由来のマルチ銅オキシダーゼ遺伝子塩基配列及び当該遺伝子によりコードされるマルチ銅オキシダーゼのアミノ酸配列をそれぞれ配列番号1及び2に示す。また、Myrothecium verrucaria由来のマルチ銅オキシダーゼ遺伝子によりコードされるマルチ銅オキシダーゼのアミノ酸配列を配列番号3に示す。なお、このMyrothecium verrucaria由来のマルチ銅オキシダーゼについては、そのN末端側が欠損したタイプのものが配列データベースにAccession番号「3ABC_B」として開示されている。このAccession番号「3ABC_B」として開示されたタイプのMyrothecium verrucaria由来のマルチ銅オキシダーゼのアミノ酸配列を配列番号4に示す。
【0020】
本発明において使用可能なマルチ銅オキシダーゼは、配列番号2、3及び4に示したアミノ酸配列からなるものに限定されず、例えば、配列番号2、3及び4に示すアミノ酸配列において詳細を後述する置換対象アミノ酸残基を除く、1又は複数個のアミノ酸が欠失、置換、付加又は挿入されたアミノ酸配列を含み、マルチ銅オキシダーゼ活性を示すものであってもよい。ここで、複数個のアミノ酸としては、例えば、1から30個、好ましくは1から20個、より好ましくは1から10個、さらに好ましくは1個から5個、特に好ましくは1個から3個を意味する。なお、アミノ酸の欠失、置換若しくは付加は、上記マルチ銅オキシダーゼをコードする遺伝子を、当該技術分野で公知の手法によって改変することによって行うことができる。遺伝子に変異を導入するには、Kunkel法またはGapped duplex法等の公知手法又はこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-KやMutant-G(何れも商品名、TAKARA社製))等を用いて、あるいはLA PCR in vitro Mutagenesisシリーズキット(商品名、TAKARA社製)を用いて変異が導入される。
【0021】
また、本発明においては、配列番号2、3及び4に示すアミノ酸配列に対して、例えば85%以上、好ましくは90%以上、より好ましくは95%以上、最も好ましくは98%以上の配列類似性を有するアミノ酸配列を含み、マルチ銅オキシダーゼ活性を有するタンパク質もギマルチ銅オキシダーゼとして使用することもできる。ここで、配列類似性の値は、blastアルゴリズムを実装したコンピュータプログラムを用いてデフォルトの設定で求められる値を意味する。
【0022】
さらに、本発明においては、配列番号1に示す塩基配列の一部又は全部に対して相補的なポリヌクレオチドに対してストリンジェントな条件下でハイブリダイズするポリヌクレオチドにコードされたタンパク質であって、マルチ銅オキシダーゼ活性を有するタンパク質をマルチ銅オキシダーゼとして使用することができる。ここで、ストリンジェントな条件下でハイブリダイズするとは、60℃で2×SSC洗浄条件下で結合を維持することを意味する。ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual,2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。
【0023】
また、マルチ銅オキシダーゼとしては、上述した枯草菌由来のもの及びMyrothecium verrucaria由来のものに限定されず、いかなる生物種由来のものであっても本発明を適用することができる。例えば、遺伝子情報が格納されたデータベースを検索することで、種々の生物種由来のマルチ銅オキシダーゼについて、そのアミノ酸配列等を特定することができる。
【0024】
なお、本発明においてマルチ銅オキシダーゼとしては、上述した活性を有する限り、如何なる名称で呼称されたものであってもよい。例えば、ラッカーゼ、ビリルビンオキシダーゼ、マルチカッパーオキシダーゼ、及びブルーカッパーオキシダーゼ等の呼称が知られている。
【0025】
<置換変異>
本発明に係る変異型マルチ銅オキシダーゼは、上述した各種生物由来のマルチ銅オキシダーゼにおける所定のアミノ酸残基を置換し、アミノ酸置換前と比較してイミダゾール系化合物への耐性が有意に向上したものである。ここで、置換対象のアミノ酸残基は、配列番号2に示すアミノ酸配列からなる枯草菌由来のマルチ銅オキシダーゼを基準として、N末端から数えた数値として特定することができる。しかしながら、配列番号2に示すアミノ酸配列を基準として具体的数値で特定された置換対象のアミノ酸残基は、マルチ銅オキシダーゼの種類によっては異なる数値で表されることとなる。したがって、『配列番号2に示すアミノ酸配列におけるX番目のアミノ酸残基』と表記した場合、配列番号2に示すアミノ酸配列とは異なるアミノ酸配列を有するマルチ銅オキシダーゼについてはX番目とはならず、異なる数値として表現されることとなる。
【0026】
配列番号2に示すアミノ酸配列と異なるアミノ酸配列において、配列番号2に示すアミノ酸配列における所定のアミノ酸残基に相当するアミノ酸残基は、配列番号2に示すアミノ酸配列を含む複数のアミノ酸配列についてマルチプルアラインメント解析を行うことで特定することができる。マルチプルアラインメント解析は、特に限定されないがCLUSTAL W (1.83) multiple sequence alignmentプログラム(国立遺伝学研究所のDDBJで使用できる(http://clustalw.ddbj.nig.ac.jp/top-j.html))を用いて当業者が容易に実施することができる。なお、ペアワイズアライメント解析法を用いて、配列番号2に示すアミノ酸配列に対して他の異なるアミノ酸配列をアラインメントし、配列番号2に示すアミノ酸配列における所定のアミノ酸残基に相当するアミノ酸残基を当該他の異なるアミノ酸配列において特定することもできる。
【0027】
枯草菌由来のマルチ銅オキシダーゼ(配列番号2)及びMyrothecium verrucaria由来のマルチ銅オキシダーゼ(配列番号3及び4)についてマルチプルアラインメント解析した結果を図1に示す。図1に示すマルチプルアライメントにおいて、1行目及び2行目がMyrothecium verrucaria由来のマルチ銅オキシダーゼであり、3行目が枯草菌由来のマルチ銅オキシダーゼである。なお、これら具体的なマルチ銅オキシダーゼ以外の他のマルチ銅オキシダーゼについても、同様にマルチプルアラインメント解析に供することができ、枯草菌由来のマルチ銅オキシダーゼ(配列番号2)を基準として特定のアミノ酸残基の位置を特定することができる。
【0028】
以下の説明において、置換対象アミノ酸は、配列番号2に示すアミノ酸配列、すなわち枯草菌由来のマルチ銅オキシダーゼを基準として表記する。しかし、上述したように、アミノ酸の位置を表す数値は、マルチ銅オキシダーゼの種類に応じて異なる数値となる点に留意する。本発明に係る変異型マルチ銅オキシダーゼは、以下に説明するアミノ酸残基に置換変異を有する変異型マルチ銅オキシダーゼ、及び当該変異型マルチ銅オキシダーゼに対して更に異なる置換変異を有する変異型マルチ銅オキシダーゼが含まれる。
【0029】
<変異型マルチ銅オキシダーゼ>
本発明に係る変異型マルチ銅オキシダーゼは、配列番号2に示すアミノ酸配列における、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基のいずれか一方又は両方が他のアミノ酸に置換したアミノ酸配列を有している。図1には、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基を枠で囲っている。図1に示すように、配列番号2に示すアミノ酸配列における157番目のメチオニンはMyrothecium verrucaria由来のマルチ銅オキシダーゼにおいても保存されている。
【0030】
ここで、他のアミノ酸としては、変異後のマルチ銅オキシダーゼのイミダゾール系化合物に対する耐性が変異前のマルチ銅オキシダーゼにおける耐性と比較して有意に向上するものである限り、特に限定されず、如何なるアミノ酸であっても良い。イミダゾール系化合物に対する耐性は、イミダゾール系化合物を含む溶液にて所定時間処理(例えば、90℃で30分間)し、当該処理後の残存活性として評価することができる。また、イミダゾール系化合物に対する耐性が向上するとは、変異導入前の野生型マルチ銅オキシダーゼの残存活性と比較して変異導入後のマルチ銅オキシダーゼの残存活性が統計的に有意に高いことを意味する。ここで、変異型マルチ銅オキシダーゼ及び置換変異前のマルチ銅オキシダーゼの酵素活性は、従来公知の手法を適宜使用することができる。例えば、基質として2,2’-アジノビス(3-エチルベンゾチアゾリン-6-スルホン酸)アンモニウム塩(ABTS)を含む所定のpHの緩衝液中で測定対象のマルチ銅オキシダーゼを作用させ、ABTSの反応物による吸光度変化を測定する。これにより、上述した残存活性を測定することができ、所定のアミノ酸置換変異がイミダゾール系化合物に対する耐性を向上させる効果を有するかいなか判断することができる。
【0031】
特に、上述した置換変異については、より具体的に157番目のメチオニンに相当するアミノ酸残基はロイシンに置換されることが好ましく、上記414番目のプロリンに相当するアミノ酸残基はロイシン又はトレオニンに置換されることが好ましい。なお、変異型マルチ銅オキシダーゼは、これら157番目のメチオニンの置換変異と、上記414番目のプロリンの置換変異とを両方有していても良いし、片方のみを有していても良い。いずれの場合でも、変異型マルチ銅オキシダーゼは、変異導入前のマルチ銅オキシダーゼと比較してイミダゾール系化合物に対する優れた耐性を有することとなる。
【0032】
さらに、変異型マルチ銅オキシダーゼは、上記157番目のメチオニンに相当するアミノ酸残基が他のアミノ酸に置換したアミン酸配列に対して、更に90番目のヒスチジンに相当するアミノ酸残基が他のアミノ酸に置換されていることがより好ましい。特に、この場合、90番目のヒスチジンに相当するアミノ酸残基はアルギニンに置換されていることがより好ましい。なお、この90番目のヒスチジンの置換変異を単独で有する変異型マルチ銅オキシダーゼは、イミダゾール系化合物に対する耐性は野生型と同等である。しかし、この90番目のヒスチジンの置換変異は、上述した157番目のメチオニンの置換変異によるイミダゾール系化合物への耐性向上効果を増強する作用を示す。すなわち、157番目のメチオニンの置換変異と90番目のヒスチジンの置換変異を有する二重変異型マルチ銅オキシダーゼは、157番目のメチオニンの置換変異を単独で有する変異型マルチ銅オキシダーゼと比較して、イミダゾール系化合物への耐性が大幅に向上している。
【0033】
なお、上述したように、置換後のアミノ酸として具体的に好ましいアミノ酸を例示したが、置換後のアミノ酸は上記例示に限定されるものではない。参考文献(1)(「マッキー生化学」第3版 5章アミノ酸・ペプチド・タンパク質 5.1アミノ酸、監修:市川厚、監訳:福岡伸一、発行者:曽根良介、発行所:(株)化学同人、ISBN4-7598-0944 -9)でも記載されているように、アミノ酸は同様の性質(化学的性質や物理的大きさ)を持つ側鎖に従って分類される事がよく知られる。また、タンパク質の活性を保持したまま、所定のグループに分類されるアミノ酸残基間における分子進化上の置換が頻度高く起こることがよく知られる。この考えを基に、参考文献(2): Henikoff S., Henikoff J.G., Amino-acid substitution matrices from protein blocks, Proc. Natl. Acad. Sci. USA, 89, 10915-10919 (1992)中の、Fig.2でアミノ酸残基の置換変異のスコアマトリックス(BLOSUM)が提唱され、広く使用されている。参考文献(2)では、側鎖の化学的性質が似たもの同士のアミノ酸置換は、タンパク質全体に与える構造や機能変化が少なくなると言う知見に基づくものである。上記参考文献(1)及び(2)によれば、マルチプルアラインメントで考慮するアミノ酸の側鎖のグループは、化学的性質や物理的大きさなどの指標を基にして考えることができる。これは、参考文献(2)に開示されたスコアマトリックス(BLOSUM)において、スコアの0以上の値を持つアミノ酸、好ましくは1以上の値を持つアミノ酸のグループとして示される。
【0034】
以上のような知見に基づいて、性質の類似したアミノ酸を下記の8つのグループに分類することができる。したがって、置換後のアミノ酸としては、上記例示したアミノ酸が含まれるグループに分類されるアミノ酸とすることが好ましい。例えば、枯草菌由来のマルチ銅オキシダーゼにおける157番目のメチオニンはロイシンに置換することが好ましいとしたが、当該メチオニン残基は、ロイシンが分類されている後記1)脂肪族疎水性アミノ酸グループに分類されるイソロイシン、メチオニン又はバリンに置換されても良い。同様に、枯草菌由来のマルチ銅オキシダーゼにおける414番目のプロリンはロイシン又はトレオニンに置換することが好ましいとしたが、当該プロリン残基は、ロイシンが分類されている後記1)脂肪族疎水性アミノ酸グループに分類されるイソロイシン、メチオニン又はバリンに置換されても良いし、トレオニンが分類されている後記2)ヒドロキシメチレン基をもつグループに分類されるセリンに置換されても良い。さらに、枯草菌由来のマルチ銅オキシダーゼにおける90番目のヒスチジンはアルギニンに置換することが好ましいとしたが、当該ヒスチジン残基は、アルギニンが分類されている後記4)塩基性アミノ酸に分類されるリジンに置換されても良い。
【0035】
1)脂肪族疎水性アミノ酸グループ(ILMVグループ)
このグループは、上記参考文献(1)で示された中性非極性アミノ酸のうち、脂肪属性の疎水性側鎖をもつアミノ酸のグループであり、V(Val、バリン)、L(Leu、ロイシン)、I(Ile、イソロイシン)及びM(Met、メチオニン)から構成される。参考文献(1)による中性非極性アミノ酸と分類されるもののうちFGACWPは以下理由で、この「脂肪族疎水性アミノ酸グループ」には含めない。G(Gly、グリシン)やA(Ala、アラニン)はメチル基以下の大きさで非極性の効果が弱いからである。C(Cys、システイン)はS-S結合に重要な役目を担う場合があり、また、酸素原子や窒素原子と水素結合を形成する特性があるからである。F(Phe、フェニルアラニン)やW(Trp、トリプトファン)は側鎖がとりわけ大きな分子量をもち、かつ、芳香族の効果が強いからである。P(Pro、プロリン)はイミノ酸効果が強く、ポリペプチドの主鎖の角度を固定してしまうからである。
【0036】
2)ヒドロキシメチレン基をもつグループ(STグループ)
このグループは、中性極性アミノ酸のうちヒドロキシメチレン基を側鎖に持つアミノ酸のグループであり、S(Ser、セリン)とT(Thr、スレオニン)から構成される。SとTの側鎖に存在する水酸基は、糖の結合部位であるため、あるポリペプチド(タンパク質)が特定の活性を持つために重要な部位である場合が多い。
【0037】
3)酸性アミノ酸(DEグループ)
このグループは、酸性であるカルボキシル基を側鎖に持つアミノ酸のグループであり、D(Asp、アスパラギン酸)とE(Glu、グルタミン酸)から構成される。
【0038】
4)塩基性アミノ酸(KRグループ)
このグループは、塩基性アミノ酸のグループであり、K(Lys、リジン)とR(Arg、アルギニン)から構成される。これらKとRは、pHの広い範囲で正に帯電し塩基性の性質をもつ。一方、塩基性アミノ酸に分類されるH(His、ヒスチジン)はpH7においてほとんどイオン化されないので、このグループには分類されない。
【0039】
5)メチレン基=極性基(DHNグループ)
このグループは、全てα位の炭素元素に側鎖としてメチレン基が結合しその先に極性基を有すると言う特徴を持つ。非極性基であるメチレン基の物理的大きさが酷似している特徴を持ち、N(Asn、アスパラギン、極性基はアミド基)、D(Asp、アスパラギン酸、極性基はカルボキシル基)とH(His、ヒスチジン、極性基はイミダゾール基)から成る。
【0040】
6)ジメチレン基=極性基(EKQRグループ)
このグループは、全てα位の炭素元素に側鎖としてジメチレン基以上の直鎖炭化水素が結合しその先に極性基を有すると言う特徴を持つ。非極性基であるジメチレン基の物理的大きさが酷似している特徴を持つ。E(Glu、グルタミン酸、極性基はカルボキシル基)、K(Lys、リジン、極性基はアミノ基)、Q(Gln、グルタミン、極性基はアミド基)、R(Arg、アルギニン、極性基はイミノ基とアミノ基)から成る。
【0041】
7)芳香族(FYWグループ)
このグループには、側鎖にベンゼン核を持つ芳香族アミノ酸であり、芳香族特有の化学的性質を特徴とする。F(Phe、フェニルアラニン)、Y(Tyr、チロシン)、W(Trp、トリプトファン)から成る。
【0042】
8)環状&極性(HYグループ)
このグループには、側鎖に環状構造を持つと同時に極性も持つアミノ酸で、H(H、ヒスチジン、環状構造と極性基は共にイミダゾール基)、Y(Tyr、チロシン、環状構造はベンゼン核で極性基は水酸基)から成る。
【0043】
<変異型マルチ銅オキシダーゼの製造>
上述した本発明に係る変異型マルチ銅オキシダーゼは、従来公知のタンパク質の製造方法を利用することによって取得することができる。変異型マルチ銅オキシダーゼが真核生物由来である場合には、例えば酵母を宿主としたタンパク質製造システムを利用して変異型マルチ銅オキシダーゼを取得することができる。また、変異型マルチ銅オキシダーゼが原核生物由来の場合、例えば、大腸菌を宿主としたタンパク質製造システムや、無細胞タンパク質製造システムを利用して変異型マルチ銅オキシダーゼを取得することができる。
【0044】
より具体的には、上述した変異型マルチ銅オキシダーゼをコードする遺伝子を準備する。例えば、T. クンケル(Kunkel)の部位特異的変異導入法(Kunkel, T. A. Proc. Nati. Acad. Sci. U. S. A. 82, 488-492 (1985))、Gapped duplex法等を適用して、野生型のマルチ銅オキシダーゼ遺伝子に対して所定の位置に突然変異を導入し、変異型マルチ銅オキシダーゼをコードする遺伝子を準備することができる。また、部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutan-K(宝酒造社製)やMutan-G(宝酒造社製))などを用いて、あるいは、宝酒造社製のLA PCR in vitro Mutagenesis シリーズキットを用いて、例えば野生型のマルチ銅オキシダーゼ遺伝子に対して変異を導入することで、上述した変異型マルチ銅オキシダーゼをコードする遺伝子を準備することもできる。
【0045】
特に、本発明において変異型マルチ銅オキシダーゼとしては、枯草菌由来のマルチ銅オキシダーゼに対して変異を導入したものを製造することが好ましい。枯草菌由来のマルチ銅オキシダーゼは他のマルチ銅オキシダーゼと比較して非常に高い耐熱性を示すためである。また、原核生物である枯草菌由来のマルチ銅オキシダーゼは、真核生物由来のマルチ銅オキシダーゼと異なり糖鎖修飾などが不要であり、大腸菌を利用したタンパク質生産システムや無細胞タンパク質製造システムを利用して簡易に製造することができるため好ましい。
【0046】
酵母を宿主としたタンパク質製造システムを利用する場合、変異型マルチ銅オキシダーゼ遺伝子は、一般的に利用されている発現ベクターの形で酵母に導入することができる。ベクターは典型的には、選択マーカー遺伝子、クローニング部位及び制御領域(プロモーター及びターミネーター)を有している。このベクターは、本技術分野においてよく知られており商業的に入手可能である。ベクターに含まれるプロモーターは、酵母において機能しうるならば、構成的発現プロモーター及び誘導型プロモーターのいずれでも良い。プロモーターが機能しうるとは、宿主酵母内において変異型マルチ銅オキシダーゼ遺伝子の転写が可能であることを意味する。プロモーターとしては、特に限定されないが、例えばグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子(TDH3)のプロモーター、3-ホスホグリセレートキナーゼ遺伝子(PGK1)のプロモーター、高浸透圧応答7遺伝子(HOR7)のプロモーターなどが利用可能である。なかでもピルビン酸脱炭酸酵素遺伝子(PDC1)のプロモーターが下流の変異型マルチ銅オキシダーゼ遺伝子を高発現させる能力が高いために好ましい。
【0047】
本発明では、上述した変異型マルチ銅オキシダーゼ遺伝子を発現可能に組み込んだ発現ベクターを定法に従って導入し、当該変異型マルチ銅オキシダーゼを生産する。発現ベクターを導入する方法としては、従来公知の各種方法、例えば、エレクトロポレーション法“Meth. Enzym., 194, p182 (1990)”、スフェロプラスト法“Proc. Natl. Acad. Sci. USA, 75 p1929(1978)”、酢酸リチウム法“J.Bacteriology, 153, p163(1983)”、Proc. Natl. Acad. Sci. USA, 75 p1929 (1978)、Methods in yeast genetics, 2000 Edition : A Cold Spring Harbor Laboratory Course Manualなどに記載の方法で実施可能であるが、これに限定されない。
【0048】
また、大腸菌を宿主としたタンパク質製造システムを利用する場合、変異型マルチ銅オキシダーゼ遺伝子は、一般的に利用されている発現ベクターの形で大腸菌に導入することができる。ベクターは典型的には、選択マーカー遺伝子、クローニング部位及び制御領域(プロモーター及びターミネーター)を有している。このベクターは、本技術分野においてよく知られており商業的に入手可能である。例えば、大腸菌由来のプラスミド(pBR322、pBR325、pUC18、pUC19、pUC119、pTV118N、pTV119N、pBluescript、pHSG298、pHSG396又はpTrc99AなどのColE系プラスミド、pACYC177又はpACYC184などのp1A系プラスミド、pMW118、pMW119、pMW218又はpMW219などのpSC101系プラスミド等)、枯草菌由来のプラスミド(例えば、pUB110、pTP5等)などを使用することができる。さらに、ファージDNAとしては、λファージ(Charon4A、Charon21A、EMBL3、EMBL4、λgt100、gt11、zap)、φX174、M13mp18又はM13mp19などを使用することができる。なお、宿主としては、大腸菌のみならず枯草菌を使用することもできる。
【0049】
さらにまた、無細胞タンパク質製造システムを利用する場合、変異型マルチ銅オキシダーゼ遺伝子は、当該システムに適した発現ベクターの形で使用する。無細胞タンパク質製造システムとしては、例えば、大腸菌、小麦胚芽ウサギ網状赤血球などを破砕し、膜成分を遠心分離で除いた細胞抽出液を使用することができる。また、いわゆるPUREシステムと呼称される無細胞タンパク質製造システムを利用することもできる。
【0050】
酵母を使用する場合、大腸菌等を使用する場合及び/又は無細胞タンパク質製造システムを使用する場合のいずれにおいても、定法に従って変異型マルチ銅オキシダーゼを精製することができる。変異型マルチ銅オキシダーゼの精製には、例えば、アフィニティークロマトグラフィー、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、エタノール沈殿、逆相HPLC、シリカ上またはDEAEなどの陽イオン交換樹脂によるクロマトグラフィー、クロマトフォーカシング、 SDS-PAGE、硫酸アンモニュウム沈殿法、ゲルろ過等の手法を単独で又は組み合わせて使用できる。
【0051】
<変異型マルチ銅オキシダーゼの利用形態>
以上で説明した変異型マルチ銅オキシダーゼは、従来、マルチ銅オキシダーゼが使用されている反応系のいずれにも優れた代替物として利用することができる。特に、上述した変異型マルチ銅オキシダーゼは、変異導入前のマルチ銅オキシダーゼと比較すると、イミダゾール系化合物に対する耐性が非常に優れている。したがって、上述した変異型マルチ銅オキシダーゼは、従来、マルチ銅オキシダーゼをイミダゾール系化合物とともに使用した反応系に使用することがより好ましい。
【0052】
上述した変異型マルチ銅オキシダーゼは、例えば、燃料電池のカソード電極に使用することができる。このとき、燃料電池は、イミダゾール系化合物を電解質として使用したものであることが好ましい。変異型マルチ銅オキシダーゼをカソード電極に使用する場合、通常、電極として使用される材料(例えば、多孔質カーボン材料など)に変異型マルチ銅オキシダーゼを固定化しても良い。
【0053】
なお、上述した変異型マルチ銅オキシダーゼ、如何なる構成、構造の燃料電池に適用することができる。燃料電池としては、例えば、正極と負極とが電解質を介して対向した構造を有するものを挙げることができる。電解質としては、特に限定されないが、イミダゾール系化合物を含有するものが好ましい。イミダゾール系化合物を電解質に含有する場合、電池特性に優れるためである。ここで、イミダゾール系化合物としては、イミダゾール、トリアゾール、ピリジン誘導体、ビピリジン誘導体、イミダゾール誘導体(ヒスチジン、1−メチルイミダゾール、2−メチルイミダゾール、4−メチルイミダゾール、2−エチルイミダゾール、イミダゾール−2−カルボン酸エチル、イミダゾール−2−カルボキシアルデヒド、イミダゾール−4−カルボン酸、イミダゾール−4,5−ジカルボン酸、イミダゾール−1−イル−酢酸、2−アセチルベンズイミダゾール、1−アセチルイミダゾール、N−アセチルイミダゾール、2−アミノベンズイミダゾール、N−(3−アミノプロピル) イミダゾール、5−アミノ−2−(トリフルオロメチル) ベンズイミダゾール、4−アザベンズイミダゾール、4−アザ−2−メルカプトベンズイミダゾール、ベンズイミダゾール、1−ベンジルイミダゾール、1−ブチルイミダゾール)等を挙げることができる。
【0054】
なお、燃料電池における燃料としては、多糖類(二糖、三糖、四糖などのオリゴ糖を含む)や単糖類を使用することができる。多糖類を使用する場合には、多糖類の加水分解などの分解を促進し、グルコースなどの単糖類を生成する分解酵素を併用することが好ましい。多糖類としては、具体的には、例えば、デンプン、アミロース、アミロペクチン、グリコーゲン、セルロース、マルトース、スクロース、ラクトースなどが挙げられる。これらは単糖類が二つ以上結合したものであり、いずれの多糖類においても結合単位の単糖類としてグルコースが含まれている。
【実施例】
【0055】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の技術的範囲は以下の実施例に限定されるものではない。
【0056】
〔実施例1〕
(1)スクリーニング用ライブラリーの作製
下記1stPCRにより3つのフラグメントを作製したのち、2nd PCRで連結したものをライブラリーとした。
【0057】
1-1. 1st PCR
1-1-1.エラープローンPCR
Diversify PCR Random Mutagenesis Kit(Clontech社製)を用いて以下の条件でPCRを実施し、B. subtilis由来のマルチ銅オキシダーゼ遺伝子(BOD遺伝子)に変異をランダムに導入した。使用したprimerの配列は表2に示した。また使用した鋳型DNAはpET23b(+)ベクターへ、B. subtilis由来のBOD遺伝子をクローニング(NdeI/XhoIサイト))したものを使用した。B. subtilis由来のBOD遺伝子の塩基配列を配列番号1に示した。また、当該BOD遺伝子がコードするマルチ銅オキシダーゼのアミノ酸配列を配列番号2に示した。
【0058】
【表1】

【0059】
【表2】

【0060】
なお、本PCRの反応サイクルは、94℃で30秒間の後、94℃で30秒間→55℃で30秒間→68℃で1.5分間を1サイクルとして25サイクル行い、その後、68℃で1分間、その後4℃とした。PCR産物はアガロース電気泳動の後、定法に従い、バンドを切り出し、精製した。
【0061】
1-1-2.ベクターを含むPCR断片の作製
表3及び4に示す反応液組成でPCRを行い、断片1及び断片2を作製した。酵素はKOD-Plus-DNA Polymeraseを使用した。使用したprimerの配列は表5に示した。
【0062】
【表3】

【0063】
【表4】

【0064】
【表5】

【0065】
なお、本PCRの反応サイクルは、94℃で2分間の後、94℃で15秒間→55℃で30秒間→68℃で1分間を1サイクルとして30サイクル行い、その後、68℃で5分間、その後4℃とした。PCR産物はアガロース電気泳動の後、定法に従い、バンドを切り出し、精製した。
【0066】
1-2.2nd PCR
表6に示す反応液組成でPCRを実施し、1-1.で作製した3つの断片を連結した。
【表6】

【0067】
本PCRのプライマーとしては、bsLinkerFR :5'-TACAATACTAATCTACGAGAGCCTACGGTTTACCACTC-3'を使用した。なお、本PCRの反応サイクルは、94℃で2分間の後、94℃で15秒間→53℃で30秒間→68℃で2分間を1サイクルとして30サイクル行い、その後、68℃で5分間、その後4℃とした。PCR産物は、アガロース電気泳動により増幅バンドが1本であることを確認した後、定法に従い、バンドを切り出し、精製した。この溶出液をライブラリーとした。
【0068】
(2)組換え体BODのスクリーニング
2-1. PCR
ライブラリー溶液を希釈し、表7に示す反応液組成でPCRを実施した。
【0069】
【表7】

【0070】
本PCRのプライマーとしては、 bsHomo:5'-CTACGAGAGCCTACGGTTTACCACTC-3'を使用した。なお、本PCRの反応サイクルは、94℃で2分間の後、94℃で20秒間→68℃で2分間を1サイクルとして40サイクル行い、その後、4℃とした。
【0071】
2-2.無細胞翻訳系による組換え体BODの合成
大腸菌B株由来のS30画分を用いて、以下の条件で翻訳を実施した。反応液組成を表8に示す。
【0072】
【表8】

【0073】
なお、表8に示したアミノ酸ミックスの組成を表9に示した。
【表9】

【0074】
翻訳反応は、サーマルサイクラーを使用して25℃で1.5時間反応させた。続いて、翻訳産物に11.12μl 2mM Cu/50mM HEPES-KOH(pH 7.5)溶液を添加して4℃で一晩置き、銅を吸着させた。
【0075】
2-3.活性測定
2-3-1.初活性
反応液に含まれるBOD活性を以下の条件で測定した。反応液組成を表10に示す。
【0076】
【表10】

【0077】
また、反応条件は、予め37℃に保温した水槽において37℃ 40分保温する条件とし、発色の有無を確認した。
【0078】
2-3-2.イミダゾール耐久性の確認
2-3-1.で発色を確認が確認されたサンプルについて、以下の手順によりイミダゾール耐久性が向上しているかどうか調べた。反応液組成を表11に示す。
【0079】
【表11】

【0080】
上記組成の反応液をサーマルサイクラーを使用して90℃で30分加熱した。その後、活性測定反応液143μl添加した。活性測定反応液の組成を表12に示す。
【0081】
【表12】

【0082】
上記活性測定反応液を添加した溶液をサーマルサイクラーを用いて37℃で20分加熱した。加熱終了後、目視で発色を確認した。
【0083】
(3)スクリーニングにより抽出された変異体の評価
3-1.有望変異体のクローニング
2-3-2.で抽出された変異体をpET23b(+)ベクターへクローニングした。
【0084】
3-2.評価
3-2-1. 鋳型DNAの調製
以下の条件でPCRを実施した。反応液組成を表13に示す。使用したprimerの配列は表14に示した。
【0085】
【表13】

【0086】
【表14】

【0087】
なお、本PCRの反応サイクルは、94℃で2分間の後、94℃で15秒間→53℃で30秒間→68℃で2分間を1サイクルとして25サイクル行い、その後、68℃で2分間、その後4℃とした。PCR反応液をMinElute PCR Purification Kit(QIAGEN社製) を用いて精製し、これを鋳型DNAとした。
【0088】
3-2-2. 無細胞翻訳系による組換え体BODの合成
2-2.と同様に実施した。
【0089】
3-2-3.活性測定
3-2-3-1.初期活性
反応液に含まれるBOD活性を以下の条件で測定した。反応液組成を表15に示す。
【表15】

【0090】
また、反応液をサーマルサイクラーで37℃で20分間反応した後、infinite M200(TECAN社製)を用いてA420を測定した。
【0091】
3-2-3-2.イミダゾール耐久性の確認
以下の手順によりイミダゾール耐久性が向上しているかどうか調べた。反応液組成を表16に示す。
【0092】
【表16】

【0093】
上記組成の反応液をサーマルサイクラーを使用して90℃で30分加熱した。その後、活性測定反応液143μl添加した。活性測定反応液の組成を表17に示す。
【0094】
【表17】

【0095】
反応液をサーマルサイクラーで37℃で20分間反応した後、infinite M200(TECAN社製)を用いてA420を測定した。結果を図2に示した。また定法に従ってシークエンサーにより各変異体の塩基配列を確認した。図2に示すように、B. subtilis由来のBOD遺伝子がコードするマルチ銅オキシダーゼのアミノ酸配列における157番目のメチオニンがロイシンに置換された変異型マルチ銅オキシダーゼ(M157L)は、イミダゾール系化合物に対する優れた耐性を有することが示された。また、同アミノ酸配列における414番目のプロリンがロイシン又はトレオニンに置換された変異型マルチ銅オキシダーゼ(P414L、P414T)も、同様にイミダゾール系化合物に対する優れた耐性を有することが示された。また、M157LとP414Lの両方の置換変異を有する変異型マルチ銅オキシダーゼは、イミダゾール系化合物に対する更に優れた耐性を示すことが判った。
【0096】
また興味深いことに、マルチ銅オキシダーゼのアミノ酸配列における90番目のヒスチジンがアルギニンに置換した変異型マルチ銅オキシダーゼ(H90R)はイミダゾール系化合物に対する耐性が野生型と同等であったにも拘わらず、このH90R変異はM157L変異による耐性向上効果を増強できることが判った。すなわち、H90R及びM157Lを共に有する変異型マルチ銅オキシダーゼは、M157Lを単独で有する変異型マルチ銅オキシダーゼと比較して、イミダゾール系化合物への耐性が大幅に向上していることが判った。
【0097】
なお、図2に示すように、マルチ銅オキシダーゼのアミノ酸配列における335番目のメチオニンがバリンに置換した変異型マルチ銅オキシダーゼ(M335V)など各種の単独置換変異が同定されたが、イミダゾール系化合物に対する耐性を向上させる効果は見られなかった。さらに、H90R変異のように、他の置換変異によるイミダゾール系化合物への耐性向上効果を増強するような変異も見いだされなかった。
【0098】
また、図2に示した各種変異型マルチ銅オキシダーゼについて、BOD活性を比活性として比較した結果を図3に示した。図3に示すように、P414L又はP414Tを有する変異型マルチ銅オキシダーゼは、非常に高い比活性を示すことが判った。これらP414L又はP414Tを有する変異型マルチ銅オキシダーゼのように、本実施例により、イミダゾール系化合物への耐性向上効果のみならず酵素活性を向上させる置換変異が明らかになった。
【特許請求の範囲】
【請求項1】
配列番号2に示すアミノ酸配列からなるマルチ銅オキシダーゼにおける、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基の一方又は両方が他のアミノ酸に置換したアミノ酸配列を有し、ABTS (2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を基質とし、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性を有する、変異型マルチ銅オキシダーゼ。
【請求項2】
上記157番目のメチオニンに相当するアミノ酸残基がロイシンに変異したことを特徴とする請求項1記載の変異型マルチ銅オキシダーゼ。
【請求項3】
上記414番目のプロリンに相当するアミノ酸残基がロイシン又はトレオニンに変異したことを特徴とする請求項1記載の変異型マルチ銅オキシダーゼ。
【請求項4】
枯草菌由来のマルチ銅オキシダーゼに対して変異を導入したものであることを特徴とする請求項1記載の変異型マルチ銅オキシダーゼ。
【請求項5】
配列番号2に示すアミノ酸配列からなるマルチ銅オキシダーゼにおける90番目のヒスチジンに相当するアミノ酸残基が他のアミノ酸に置換したことを特徴とする請求項2記載の変異型マルチ銅オキシダーゼ。
【請求項6】
請求項1乃至5いずれか一項記載の変異型マルチ銅オキシダーゼをコードする遺伝子。
【請求項7】
請求項1乃至5いずれか一項記載の変異型マルチ銅オキシダーゼをカソード電極に使用したバイオ燃料電池。
【請求項8】
カソード電極とアノード電極とが電解質を介して対向した構造を有することを特徴とする請求項7記載のバイオ燃料電池。
【請求項9】
上記電解質はイミダゾール系化合物を含有することを特徴とする請求項8記載のバイオ燃料電池。
【請求項1】
配列番号2に示すアミノ酸配列からなるマルチ銅オキシダーゼにおける、157番目のメチオニンに相当するアミノ酸残基及び414番目のプロリンに相当するアミノ酸残基の一方又は両方が他のアミノ酸に置換したアミノ酸配列を有し、ABTS (2,2'-azinobis(3-ethylbenzoline-6-sulfonate))を基質とし、酸素分子を4電子還元し、水分子を生成する反応を触媒する活性を有する、変異型マルチ銅オキシダーゼ。
【請求項2】
上記157番目のメチオニンに相当するアミノ酸残基がロイシンに変異したことを特徴とする請求項1記載の変異型マルチ銅オキシダーゼ。
【請求項3】
上記414番目のプロリンに相当するアミノ酸残基がロイシン又はトレオニンに変異したことを特徴とする請求項1記載の変異型マルチ銅オキシダーゼ。
【請求項4】
枯草菌由来のマルチ銅オキシダーゼに対して変異を導入したものであることを特徴とする請求項1記載の変異型マルチ銅オキシダーゼ。
【請求項5】
配列番号2に示すアミノ酸配列からなるマルチ銅オキシダーゼにおける90番目のヒスチジンに相当するアミノ酸残基が他のアミノ酸に置換したことを特徴とする請求項2記載の変異型マルチ銅オキシダーゼ。
【請求項6】
請求項1乃至5いずれか一項記載の変異型マルチ銅オキシダーゼをコードする遺伝子。
【請求項7】
請求項1乃至5いずれか一項記載の変異型マルチ銅オキシダーゼをカソード電極に使用したバイオ燃料電池。
【請求項8】
カソード電極とアノード電極とが電解質を介して対向した構造を有することを特徴とする請求項7記載のバイオ燃料電池。
【請求項9】
上記電解質はイミダゾール系化合物を含有することを特徴とする請求項8記載のバイオ燃料電池。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−81410(P2013−81410A)
【公開日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願番号】特願2011−222756(P2011−222756)
【出願日】平成23年10月7日(2011.10.7)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【Fターム(参考)】
【公開日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願日】平成23年10月7日(2011.10.7)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【Fターム(参考)】
[ Back to top ]

