多ヒドロキシル化脂肪族炭化水素又はそのエステルのクロロヒドリンへの転化
【課題】多ヒドロキシル化脂肪族炭化水素及び/又はそれらのエステルからエポキシド又はエピクロロヒドリンを製造する方法の提供。
【解決手段】超大気圧、大気圧及び大気圧よりも低い圧力条件で、改良された結果を伴って使用することができる触媒を用いて、多ヒドロキシル化脂肪族炭化水素及び/又はそれらのエステルを、超大気圧分圧の塩化水素源と、十分な時間、十分な温度で、水を実質的に除去することなく、接触させてクロロヒドリンを製造し、次にクロロヒドリンを塩基と接触させてエポキシドを高収率で製造することができる方法の提供。
【解決手段】超大気圧、大気圧及び大気圧よりも低い圧力条件で、改良された結果を伴って使用することができる触媒を用いて、多ヒドロキシル化脂肪族炭化水素及び/又はそれらのエステルを、超大気圧分圧の塩化水素源と、十分な時間、十分な温度で、水を実質的に除去することなく、接触させてクロロヒドリンを製造し、次にクロロヒドリンを塩基と接触させてエポキシドを高収率で製造することができる方法の提供。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は多ヒドロキシル化脂肪族炭化水素又はそのエステルのクロロヒドリンへの転化方法に関する。クロロヒドリンは、次いで、エピクロロヒドリンのようなエポキシドを製造するのに有用である。
【背景技術】
【0002】
エピクロロヒドリンはエポキシ樹脂への広く使用されている前駆体である。エピクロロヒドリンは、P−ビスフェノールAのアルキル化のために一般的に使用されているモノマーである。遊離モノマー又はオリゴマー性ジエポキシドとして得られるジエポキシドは、例えば電気用積層板、缶被覆、自動車用トップコート及びクリアコート中に使用される高分子量樹脂にまで進めることができる。
【0003】
エピクロロヒドリンの公知の製造方法には、ジクロロヒドリンを生成するための塩化アリルの次亜塩素化(hypochlorination)が含まれる。苛性によるジクロロヒドリン混合物の閉環によって、エピクロロヒドリンが得られ、これは高純度(>99.6%)にまで蒸留される。このクロロヒドリン方法は、エピクロロヒドリンの1モル当たり、2当量の塩素及び1当量の苛性を必要とする。
【0004】
エピクロロヒドリンを製造するための別の公知の方法に於いて、第一工程には、酢酸中の分子状酸素のパラジウム触媒作用反応により、プロピレンのアリル位に酸素を導入することが含まれる。次いで、得られる酢酸アリルを加水分解し、塩素化し、そして最初のジクロロヒドリンを苛性によって閉環して、エピクロロヒドリンにする。この方法は、塩化アリルの製造を回避し、従って、より少ない塩素(僅か1当量)を使用する。
【0005】
上記のエピクロロヒドリンの公知の製造方法の両方は、塩素の犠牲的使用及び工業的使用に付随する複雑さを必要とし、そして次亜塩素酸(HOCl)の発生は、工業的規模で拡大され、そしてこれらの方法は、かなりの量の塩素化副生物を製造することが知られている。特に、塩化アリルの次亜塩素化によって、1,2,3−トリクロロプロパン並びにその他の望ましくない塩素化されたエーテル及びオリゴマー(RCl)が製造されることが、よく知られている。RCl問題は、増加した製造コストとして管理される。より大きい世界的製造に対応するために新たな資本が追加されるとき、これらの望ましくない副生物に対応し、これを改善するために、下流の処理に於いて実質的な投資を加えなくてはならない。これらの同じ問題は、プロピレン及びエチレンクロルヒドリンへのHOCl経路に於いて同様であり、従ってこれらの経路はあまり実施されない。
【0006】
例えば、特許文献1及び特許文献2に記載されているような、HOClの発生を回避する代替方法には、チタンシリカライト(titanium silicalite)触媒を過酸化水素と共に使用する、塩化アリルの直接エポキシ化が含まれる。HOClの発生を減少させるという利点にもかかわらず、塩化アリルが依然として中間体である。塩化アリルを使用することの欠点は2倍である。(1)プロピレンの塩化アリルへの遊離基塩素化は非常に選択的ではなく、そしてかなりの大きさの画分(>15モル%)の1,2−ジクロロプロパンが製造される。(2)プロピレンは炭化水素原料であり、プロピレン価格の長期間の世界的予想は、上昇し続けている。制御された塩素系酸化化学の複雑さ及びRCl発生を回避する、エピクロロヒドリンの製造のための新規な経済的に価値のある方法が望ましい。非炭化水素再生可能原料を含む、エピクロロヒドリンの製造方法についての工業界に於ける要求が存在する。
【0007】
グリセリンは、燃料添加剤を製造するためのバイオディーゼル方法の副産物である、低コストの再生可能な原料であると考えられている。他の再生可能な原料、例えばフルクトース、グルコース及びソルビトールを水素化分解して、ビシナルジオール及びトリオール、例えば、グリセリン、エチレングリコール、1,2−プロピレングリコール、1,3−プロピレングリコール等の混合物を製造できることが知られている。
【0008】
豊富で低コストのグリセリン又は混合グリコールで、グリセリン又は混合グリコール塩化水素化のための経済的に魅力的な方法が望ましい。このような方法が、RClの生成無しに、ビシナルクロロヒドリンの生成に向けて非常に化学選択的であったならば、有利であろう。
【0009】
下記の反応式1に示されるような、グリセロール(本明細書に於いて、「グリセリン」とも呼ぶ)のジクロロプロパノール(本明細書に於いて、「ジクロロヒドリン」とも呼ぶ)、即ち、化合物I及びIIの混合物への転化のための方法が公知である。この反応は、無水HCl及び酢酸(HOAc)触媒の存在下で、水を除去しながら実施する。次いで、化合物I及び化合物IIの両方は、苛性で処理することによって、エピクロロヒドリンに転化させることができる。
【0010】
【化1】

【0011】
図式1に於ける上記の化学反応を使用する種々の方法は、先行技術に於いて報告されている。例えばエピクロロヒドリンはジクロロプロパノール、例えば2,3−ジクロロプロパン−1−オール又は1,3−ジクロロプロパン−2−オールを塩基と反応させることによって製造することができる。ジクロロプロパノールは、大気圧で、グリセロール、無水塩酸及び酸触媒から製造することができる。この反応の過程の間に形成される水の共沸的除去を促進するために、大過剰の塩化水素(HCl)ガスが推奨されている。
【0012】
例えば、非特許文献1、非特許文献2及び非特許文献3には、グリセロール及び有機酸触媒の攪拌した溶液を通して、大過剰の無水HCl(7当量以下)をパージすることによって、ジクロロヒドリン、即ち上記の反応式1に於ける化合物I及びIIについて、70%を超えるジクロロヒドリンの蒸留収率が報告されている。上記の文献中に記載された方法では、蓄積された水を除去するための共沸剤として使用される、大気圧のHClの使用が必要とされる。他の共沸混合物が知られている。例えば、特許文献3には、水の反応的蒸留及び除去を促進するために、過剰の塩化水素(HCl)ガスと一緒にn−ブチルエーテルを使用することが記載されている。
【0013】
確かに、全ての先行技術は、高い転化率を得るための水との共沸混合物の蒸発及び水除去を達成するための大気圧よりも低い又は大気圧条件についてのプロセス必要条件を教示している。特許文献3では、再び大気圧条件で過剰のHClを使用して、水の反応的共沸蒸留及び除去を促進するための、添加した共沸剤(例えばn−ブチルエーテル)の有利な使用が主張されている。水の真空除去を使用する同様のアプローチは、特許文献4に教示されている。
【0014】
特許文献5には、無水塩化水素の手段による、グリセリンの接触塩化水素化によるクロロヒドリンの製造方法が教示されている。この文献では、大気圧条件で水の分離による回分式方法が教示されている。特許文献5には、上昇した圧力で塩化水素化反応方法を実施することは教示されていない。
【0015】
クロロヒドリンの製造のための全ての公知の先行技術では、水を、プロセスから共生成物として除去する、塩化水素化プロセスが報告されている。特に、特許文献6では、反応の水は、大気圧又は大気圧よりも低い方法で反応的蒸留によって除去する、一連の塩化水素化反応が教示されている。同様の技術は、特許文献7に於いて、より高い全圧力(HCl分圧は特定されていない)下で実施される反応によって、反応速度を改良することができるという追加の教示と共に教示されている。しかしながら、特許文献7に於いては、HCl分圧の使用及びその方法に於けるその影響は全く開示されていない。特許文献7には、また、大気圧又は大気圧よりも低い圧力下で、高い転化率及び選択率をもたらすために、水の除去が必要であることを例示している。特許文献6又は特許文献7の何れにも、それらの方法に於いて水を残すことの如何なる利点も又は水を除去することが、望ましくないクロロエタン及びRClの生成をもたらすことは教示されていない。
【0016】
極めて大過剰量の塩化水素(HCl)ガスの使用は経済的に問題であり、そして未反応の塩化水素の水との固有の混合は、容易に再循環できない水性塩化水素流になる。更に、決して完全ではないグリセリンの転化を達成するために、24〜48時間の反応時間が必要であるが、生成物には、しばしば、顕著な量の望ましくない過塩素化されたトリクロロプロパン及び塩素化されたエーテルが含有されている。アルコールを塩化物に転化するが、インシトゥで水を捕捉する試薬を使用する他の方法も公知である。例えば、非特許文献4に記載されているように、塩化チオニルは、グリセリンをクロロヒドリンに転化させるために使用でき、そして選択的であるが、化学量論的量のSO2を製造する。この試薬のコスト及び費用は、エピクロロヒドリン又は多ヒドロキシル化脂肪族炭化水素から誘導される任意の他のクロロヒドリンの工業的製造のために受け入れることができない。同様に、非特許文献5に記載されているように、穏和であり、そして有効である他の塩化水素化試薬は、この転換のために高価であり、そして普通ではないと考えられる。他の低温度方法は、非特許文献6に記載されているように、アルコールを、より良い離脱基(例えばメシレート)に転化し、そしてモル過剰で使用されるイオン性液体により塩化物の可溶性形を与える。再び、無水条件、化学量論的試薬及び塩化物の高価な形を必要とすることは、上記の方法の工業的考慮を阻止する。更に、非特許文献7に教示されているように、これらの試薬は、多ヒドロキシル化脂肪族炭化水素の消尽的塩素化を起こし、再び望ましくないRCl副生物に至り得る。
【0017】
要約すると、グリセリン又は任意の他のビシナル−ジオール、トリオール又は多ヒドロキシル化脂肪族炭化水素からクロロヒドリンを製造するための、上記の公知のアプローチの全てには、少なくとも5個の主な欠点が存在する。(1)グリセリン又は任意のジオールの塩化水素化のための大気圧方法では、大過剰の、しばしば7〜10倍モル過剰のHClが必要である。大気圧方法に於いて、過剰の無水HClは、次いで水で汚染される。(2)上記の公知の方法の変形は、非常に遅い回分式反応であり、これは、しばしば、100℃を超える温度で24〜48時間を要し、そして所望のクロロヒドリン生成物(類)への80〜90%転化率を超えない。(3)普通ではない塩化水素化試薬は、水を捕捉することによって反応を駆動するが、しばしば、商品の経済的製造と一致しない副生物を製造する。(4)上記のアプローチの全ては、グリセリン塩化水素化について前に定義したような、より高いレベルの望ましくないRClを製造する。(5)反応器内容物の蒸発を制御するために、反応を上昇した圧力で運転するとき、HClの低い分圧は、低い転化率又は遅延した反応速度になる。
【0018】
先行技術は、グリセリンのジクロロヒドリンへの完全な転化を促進するために、水除去が必要であると結論づけている。この水除去必要条件に適合するために、先行技術反応は、共溶媒又はチェイサー(chaser)及びプロセスのためのかなりの資本追加を必要とする、共沸的若しくは反応的蒸留又は抽出条件下で実施される。全ての先行技術は、反応混合物中の水の存在のために、この転化への平衡制限が存在すると結論づけた。
【0019】
産業に於いて、先行技術の欠点の全てを克服する、多ヒドロキシル化脂肪族炭化水素からの高純度のクロロヒドリンの製造のための塩化水素化方法を提供することが望まれている。従って、ジオール及びトリオールをクロロヒドリンに転化させる、単純で、費用効果的な方法を見出すことが、クロロヒドリン化学の技術分野に於ける進歩であろう。
【先行技術文献】
【特許文献】
【0020】
【特許文献1】国際特許出願公開第WO2002092586号明細書
【特許文献2】米国特許第6,288,248号明細書
【特許文献3】米国特許第2,144,612号明細書
【特許文献4】独国特許第1075103号明細書
【特許文献5】独国特許第197308号明細書
【特許文献6】国際特許出願公開第WO2005/021476号明細書
【特許文献7】国際特許出願公開第WO2005/054167号明細書
【非特許文献】
【0021】
【非特許文献1】Gibson,G.P.、Chemistry and Industry、1931年、第20巻、第949〜975頁
【非特許文献2】Conant等、Organic Synthesis CV 1、292〜294頁
【非特許文献3】Conant等、Organic Synthesis CV 1、295〜297頁
【非特許文献4】Carre,Mauclere C.R.Hebd.Seances Acad.Sci.、1930年、第192頁
【非特許文献5】Gomez等、Tetrahedron Letters、2000年、第41巻、第6049〜6052頁
【非特許文献6】Leadbeater等、Tetrahedron、2003年、第59巻、第2253〜58頁
【非特許文献7】Viswanathan等、Current Science、1978年、第21巻、第802〜803頁
【発明の概要】
【発明が解決しようとする課題】
【0022】
本発明の目的は、本発明の方法を使用して、望ましくないRCl又は塩素化されたグリセロールオリゴマーの生成を最小にすることである。
【課題を解決するための手段】
【0023】
本発明の一つの面は、クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物の製造方法であって、多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はこれらの混合物を、超大気圧の分圧の塩化水素の源泉と接触させて、水を実質的に除去することなく、クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物を製造する工程を含む方法に指向している。本明細書に於いて、「超大気圧(superatmospheric pressure)」は、塩化水素(HCl)分圧が、大気圧よりも高い、即ち、15psia又はそれ以上であることを意味する。
【0024】
本発明の一つの態様は、クロロヒドリンを製造するための塩化水素源として塩化水素ガスを使用する。
【0025】
第二の面に於いて、本発明は、クロロヒドリンの製造方法であって、例えば約20psia〜約1000psiaの範囲内の、HClの超大気圧の分圧で、例えば約25℃〜約300℃の範囲内の十分な温度で、(a)多ヒドロキシル化脂肪族炭化水素、例えば1,2−ジオール又は1,2,3−トリオール、(b)多ヒドロキシル化脂肪族炭化水素のクロロヒドリンへの転化を容易にする触媒、例えばカルボン酸、エステル、ラクトン、アミド又はラクタム及びそれらの混合物並びに(c)塩化水素源、例えば塩化水素ガスを一緒に、水を実質的に除去することなく、接触させる工程を含んでなる方法に関する。
【0026】
第三の面に於いて、本発明は、例えば約20psia〜約1000psiaの範囲内の、HClの超大気圧の分圧で、例えば約25℃〜約300℃の範囲内の十分な温度で、(a)多ヒドロキシル化脂肪族炭化水素のエステル、例えばグリセリンモノアセテート並びに(b)塩化水素源、例えば塩化水素を一緒に、水を実質的に除去することなく、接触させる工程を含んでなるクロロヒドリンの製造方法に関する。
【0027】
本発明の第四の面に於いては、新規な組成物を上記の方法によって製造することができる。
【0028】
先行技術の大気圧方法を超えた、本発明の超大気圧方法の利点には、例えば下記のものが含まれる。(1)本発明の方法は、水の除去が必要でなく、そして共溶媒/チェイサーが必要でない点で単純化される。本明細書に於いて、「超大気圧方法(superatmospheric pressure process)」は、塩化水素(HCl)分圧が、大気圧よりも上で、即ち、15psia又はそれ以上である条件下で、反応が起こる方法を意味する。本発明の方法は、追加の添加剤、例えば共沸剤無しに運転することができる。(2)水を除去することのない本発明の方法に於いて使用される触媒/HCl分圧/温度範囲は、多ヒドロキシル化脂肪族炭化水素のクロロヒドリンへの転化速度を、ほぼ20倍ほど加速する。先行技術は、先行技術方法が水除去を必要とするので、超大気圧HCl分圧を使用することが不利であった。(3)意外にも、高圧反応混合物中に蓄積された水は、先行技術よりもより高い選択率方法で、より速い転化速度を可能にする。即ち、先行技術の大気圧HCl方法よりも少ない塩素化されたエーテル、少ないRClが、本発明の方法に於いて生成される。(4)本発明の方法に於いて使用する触媒は、先行技術に於いて使用される他の触媒、例えば酢酸を超えた改良を示し、それによって選択率をより高くし、そしてプロセスの速度を増大させる。(5)本発明の超大気圧方法は、先行技術の大気圧方法よりも遙かに少ないHClを使用して、一層高い転化率を達成する(例えば、本発明では1〜25%HCl過剰であるのに対し、先行技術では700〜1400%過剰)。
【0029】
超大気圧方法によって、多ヒドロキシル化脂肪族炭化水素出発材料として粗製の湿潤グリセロールの使用が可能になり、なお更に、追加の水除去を必要とすることなく、先行技術よりも高い選択率及びより速い転化を達成する。
【0030】
本発明の触媒を使用することの別の利点は、低揮発性で再循環可能な触媒の使用から得られる単純化された方法及びその結果として改良されたプロセスの経済性である。
【0031】
本発明の超大気圧方法は、多ヒドロキシル化脂肪族炭化水素又はそのエステルをクロロヒドリンに、高い通過当たり収率(per-pass yield)(例えば90モル%よりも大きい)及び高い選択率(例えば90モル%よりも大きい)で、迅速に(例えば約12時間よりも短い)転化させるための手段を提供することによって、当該技術分野に於ける要求に取り組む。驚くべきことに、本発明の方法は、水の共沸的又はインシトゥ(in situ)除去無しに実施できる。
【0032】
本発明の上記の面は、超大気圧方法に向けられているが、超大気圧方法に於いて機能するある種の触媒は、水除去有り又は無しで、大気圧及び大気圧よりも低い条件でも、驚くほどよく機能することを見出した。従って、本発明の第五の面は、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物の製造方法であって、多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、触媒の存在下で、大気圧の又は大気圧よりも低い分圧の塩化水素源と接触させて、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物を製造する工程を含み、この触媒が、(i)2〜約20個の炭素原子を有し、そしてアミン、アルコール、ハロゲン、スルフヒドリル、エーテル、エステル若しくはこれらの組合せからなる群から選択された、少なくとも1個の官能基を含有するカルボキシレート誘導体(但し、この官能基は、α炭素よりも近くなく酸官能基に結合している)又はそれらへの前駆体であり、(ii)クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物よりも低い揮発性であり、そして(iii)ヘテロ原子置換基を含有する方法に指向している。
【0033】
本発明の第五の面内において、本発明の触媒構造の一つの態様は、一般的に、下記に示す式(a)によって表され、式中、官能基「R’」には、アミン、アルコール、ハロゲン、スルフヒドリル(sulfhydryl)、エーテルからなる官能基又はそれらの官能基を含有する炭素数1〜約20のアルキル、アリール若しくはアラルキル基又はこれらの組合せが含まれ、そして官能基「R」には、水素、アルカリ金属、アルカリ土類金属若しくは遷移金属又は炭化水素官能基が含まれてよい。
【0034】
【化2】

【図面の簡単な説明】
【0035】
【図1】1回通過、再循環無しのプロセスとして本明細書中で参照する本発明の方法の一態様を示すプロセスフローチャート。
【図2】触媒及び中間体再循環方法として本明細書中で参照する、本発明の方法の他の態様を示すプロセスフローチャート。
【図3】エステル交換反応を伴う触媒及び中間体再循環方法として本明細書中で参照する本発明の方法の他の態様を示すプロセスフローチャート。
【図4】本発明の一部ではない実施例を使用して実施された、時間の関数としての、グリセロールの、モノクロロヒドリン及びジクロロヒドリンへの転化の、モル%での量の結果を示すグラフ表示。
【発明を実施するための形態】
【0036】
本発明の一つの広い面に於いて、本発明は、多ヒドロキシル化脂肪族炭化水素又はそれらのエステルを、クロロヒドリン又はそれらのエステルに転化する方法であって、多ヒドロキシル化脂肪族炭化水素又はこれらのエステルを、塩化水素源と、超大気圧の分圧で、そして水除去の実質的不存在下で、クロロヒドリン又はそれらのエステルを製造するための反応条件下で接触させる工程を含む方法である。本明細書に於いて、「水除去の実質的不存在」は、反応方法工程又は工程群の間に、塩化水素化工程の間にプロセス中に存在する水(例えば、反応の水又は供給成分(類)と共に導入される水)を除去する方法を使用しないことを意味する。これらの方法には、任意の反応的、凝固点降下的、抽出的、共沸的、吸収的若しくは蒸発的なインシトゥ又はエクスシトゥ(ex-situ)技術又は水除去のための任意の公知の技術が含まれてよい。
【0037】
本明細書で使用する用語「多ヒドロキシル化脂肪族炭化水素」は、別個の飽和炭素原子に結合された少なくとも2個のヒドロキシル基を含有する炭化水素を指す。多ヒドロキシル化脂肪族炭化水素は、これらに限定するものではないが、2〜約60個の炭素原子が含有されていてよい。
【0038】
ヒドロキシル(OH)官能基を有する、多ヒドロキシル化脂肪族炭化水素の任意の単一の炭素も、1個より多いOH基を有していてはならず、そしてsp3混成されていなくてはならない。OH基を有する炭素原子は、第一級、第二級又は第三級であってよい。本発明に於いて使用する多ヒドロキシル化脂肪族炭化水素は、それぞれOH基を有する少なくとも2個のsp3混成炭素を含有していなくてはならない。多ヒドロキシル化脂肪族炭化水素には、より高次の近接又はビシナル繰り返し単位を含む、任意のビシナル−ジオール(1,2−ジオール)又はトリオール(1,2,3−トリオール)が含まれる。多ヒドロキシル化脂肪族炭化水素の定義には、また、例えば、1種又はそれ以上の、1,3−、1,4−、1,5−及び1,6−ジオール官能基が同様に含まれる。多ヒドロキシル化脂肪族炭化水素は、また、ポリビニルアルコールのようなポリマーであってもよい。例えば、ジェミナル−ジオールは、多ヒドロキシル化脂肪族炭化水素化合物のこの種類から除外される。
【0039】
多ヒドロキシル化脂肪族炭化水素には、芳香族単位又は、例えばハライド、硫黄、リン、窒素、酸素、ケイ素及びホウ素ヘテロ原子を含むヘテロ原子及びこれらの混合物が含有されていてよいことが、理解されるべきである。
【0040】
「クロロヒドリン」は、本明細書に於いて、別個の飽和炭素原子に結合された少なくとも1個のヒドロキシル基及び少なくとも1個のの塩素原子を含有する化合物を記載するために使用する。少なくとも2個のヒドロキシル基を含有するクロロヒドリンは、また、多ヒドロキシル化脂肪族炭化水素である。従って、本発明の出発材料及び生成物は、それぞれ、クロロヒドリンであってよく、この場合、生成物クロロヒドリンは、出発クロロヒドリンよりも一層高度に塩素化されており、即ち、出発クロロヒドリンよりも、多くの塩素原子及び僅かなヒドロキシル基を有する。好ましいクロロヒドリンは、例えば出発材料として使用されるクロロヒドリンである。ジクロロヒドリンのような一層好ましい高度に塩素化されたクロロヒドリンは、例えば本発明の方法の生成物であってよい。
【0041】
本発明に於いて有用である多ヒドロキシル化脂肪族炭化水素には、例えば1,2−エタンジオール、1,2−プロパンジオール、1,3−プロパンジオール、1−クロロ−2,3−プロパンジオール、2−クロロ−1,3−プロパンジオール、1,4−ブタンジオール、1,5−ペンタンジオール、シクロヘキサンジオール、1,2−ブタンジオール、1,2−シクロヘキサンジメタノール、1,2,3−プロパントリオール(また、「グリセリン」又は「グリセロール」として知られ、そして本明細書に於いて互換的に使用される)及びこれらの混合物が含まれる。好ましくは、本発明に於いて使用される多ヒドロキシル化脂肪族炭化水素には、例えば1,2−エタンジオール、1,2−プロパンジオール、1,3−プロパンジオール及び1,2,3−プロパントリオールが含まれ、1,2,3−プロパントリオールが最も好ましい。
【0042】
本発明に於いて有用である多ヒドロキシル化脂肪族炭化水素のエステルの例には、例えばエチレングリコールモノアセテート、プロパンジオールモノアセテート、グリセリンモノアセテート、グリセリンモノステアレート、グリセリンジアセテート及びこれらの混合物が含まれる。一つの態様に於いて、このようなエステルは、多ヒドロキシル化脂肪族炭化水素と完全にエステル化された多ヒドロキシル化脂肪族炭化水素との混合物、例えばグリセロールトリアセテートとグリセロールとの混合物から製造することができる。
【0043】
本発明の多ヒドロキシル化脂肪族炭化水素は、任意の望ましい限定されない濃度で使用することができる。一般的に、経済的理由のために、より高い濃度が好ましい。本発明のための有用な濃度には、例えば約0.01モル%〜約99.99モル%、好ましくは約1モル%〜約99.5モル%、更に好ましくは約5モル%〜約99モル%、最も好ましくは約10モル%〜約95モル%が含まれてよい。
【0044】
本発明に於いて使用する塩化水素源は、好ましくは、気体として、液体として又は溶液若しくは混合物中で又はこれらの混合物、例えば本発明の方法のために必要な塩化水素の分圧が与えられる限り、塩化水素と窒素ガスとの混合物で導入される。
【0045】
最も好ましい塩化水素源は塩化水素ガスである。塩化水素の必要な分圧が発生する限り、塩化物の他の形を本発明に於いて使用することができる。特に、塩化物は、相間移動剤、例えば第四級アンモニウム塩及びホスホニウム塩(例えばテトラブチルホスホニウムクロリド)に付随するものを含む多数のカチオンと共に導入することができる。その代わりに、イオン性液体、例えばn−ブチル−2−メチルイミダゾリウムクロリドを、多ヒドロキシル化脂肪族炭化水素からのOHの酸触媒作用置換を促進するための相乗剤として使用することができる。
【0046】
これらの他のハロゲン化物源が、アルコールの塩化水素化のための共触媒として作用し得ることも公知である。この点に関して、触媒量のヨウ化物又は臭化物を、これらの反応を加速するために、使用することができる。これらの試薬は、相間移動又はイオン性液体フォーマットを使用して、気体、液体又は対イオン塩として導入することができる。試薬は、また、金属塩(ここで、アルカリ又は遷移金属対イオンは、多ヒドロキシル化脂肪族炭化水素の酸化を促進しない)として導入することもできる。RCl生成の可能性が増加し得るので、制御された塩化水素化方法に於いてこれらの共触媒を使用する際に注意を払わなくてはならない。ハライドの異なった源泉の混合物、例えば塩化水素ガスと、イオン性塩化物、例えばテトラアルキルアンモニウムクロリド又は金属ハライドとを使用することができる。例えば、金属ハライドは、塩化ナトリウム、ヨウ化カリウム、臭化カリウム等であってよい。
【0047】
出発材料としての多ヒドロキシル化脂肪族炭化水素のエステルとは対称的に、多ヒドロキシル化脂肪族炭化水素が出発材料である本発明の態様に於いて、クロロヒドリンの生成を、触媒の存在によって促進させることが好ましい。多ヒドロキシル化脂肪族炭化水素のエステル、好ましくは部分エステルが出発材料として使用される、本発明の別の態様に於いて、触媒は固有的にそのエステル中に存在し、従って、別の触媒成分の使用は任意である。しかしながら、所望の生成物への転化を更に促進するために、追加の触媒が、本発明の方法の中になお含有されていてよい。追加の触媒は、また、出発材料に、エステル化された多ヒドロキシル化脂肪族炭化水素とエステル化されていない多ヒドロキシル化脂肪族炭化水素との組合せが含まれている場合に使用することができる。
【0048】
本発明の超大気圧方法に於いて触媒を使用するとき、この触媒は、例えばカルボン酸、無水物、酸クロリド、エステル、ラクトン、ラクタム、アミド、金属有機化合物、例えば酢酸ナトリウム又はこれらの混合物であってよい。本発明の反応条件下で、カルボン酸又は官能化されたカルボン酸に転化できる如何なる化合物も使用することができる。
【0049】
超大気圧方法のための好ましいカルボン酸は、ハロゲン、アミン、アルコール、アルキル化アミン、スルフヒドリル、アリール基若しくはアルキル基又はこれらの組合せからなる官能基(但し、この部分(moiety)は、カルボン酸基を立体的に妨害しない)を有する酸である。本発明の方法のための好ましい酸は酢酸である。
【0050】
本発明に於いて触媒として有用であるカルボン酸の例には、酢酸、プロピオン酸、4−メチル吉草酸、アジピン酸、4−ヒドロキシフェニル酢酸、6−クロロヘキサン酸、4−アミノ酪酸、ヘキサン酸、ヘプタン酸、4−ジメチルアミノ酪酸、6−アミノヘキサン酸、6−ヒドロキシヘキサン酸、4−アミノフェニル酢酸、4−トリメチルアンモニウム酪酸クロリド、ポリアクリル酸、アクリル酸でグラフト化されたポリエチレン、ジビニルベンゼン/メタクリル酸コポリマー及びそれらの混合物が含まれる。無水物の例には、無水酢酸、無水マレイン酸及びこれらの混合物が含まれる。酸クロリドの例には、アセチルクロリド、6−クロロヘキサノイルクロリド、6−ヒドロキシヘキサノイルクロリド及びこれらの混合物が含まれる。エステルの例には、酢酸メチル、プロピオン酸メチル、ピバル酸メチル、酪酸メチル、エチレングリコールモノアセテート、エチレングリコールジアセテート、プロパンジオールモノアセテート、プロパンジオールジアセテート、グリセリンモノアセテート、グリセリンジアセテート、グリセリントリアセテート、カルボン酸のグリセリンエステル(グリセリンモノ−、ジ−及びトリエステルを含む)及びこれらの組合せが含まれる。最も好ましいラクトンの例には、ε−カプロラクトン、γ−ブチロラクトン、δ−バレロラクトン及びそれらの混合物が含まれる。ラクタムの例はε−カプロラクタムである。酢酸亜鉛が金属有機化合物の例である。
【0051】
本発明に於いて使用する好ましい触媒は、カルボン酸、カルボン酸のエステル又はこれらの組合せ、特に、触媒を除去することなく、クロロヒドリンを除去できるように、反応混合物中で生成される所望の最高沸点のクロロヒドリンのものよりも高い沸点を有するエステル又は酸である。この定義に適合し、そして本発明に於いて有用である触媒には、例えばポリアクリル酸、カルボン酸のグリセリンエステル(グリセリンモノ−、ジ−及びトリエステルを含む)、アクリル酸でグラフト化されたポリエチレン、6−クロロヘキサン酸、4−クロロブタン酸、カプロラクトン、ヘプタン酸、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、6−ヒドロキシヘキサン酸、4−アミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、ステアリン酸、5−クロロ吉草酸、6−ヒドロキシヘキサン酸、4−アミノフェニル酢酸及びそれらの混合物が含まれる。
【0052】
カルボン酸、RCOOHは、多ヒドロキシル化脂肪族炭化水素のクロロヒドリンへの塩化水素化に触媒作用する。本発明の方法のために選択された特定のカルボン酸触媒は、例えば触媒としてのその効能、そのコスト、反応条件に対するその安定性及びその物理的特性を含む多数の要因に基づいてよい。触媒が使用されるべき特定の方法及び方法図式も、本発明の方法のための特別の触媒を選択する際の要因であり得る。カルボン酸の「R」基は、水素又はアルキル、アリール、アラルキル及びアルカリールを含むヒドロカルビル基から選択することができる。このヒドロカルビル基は、直鎖、分枝鎖又は環式であってよく、そして置換されていてよく又は非置換でもよい。許容される置換基には、触媒の性能に有害に干渉せず、そしてヘテロ原子を含有していてよい任意の官能基が含まれる。許容される官能基の限定しない例には、塩化物、臭化物、ヨウ化物、ヒドロキシル、フェノール、エーテル、アミド、第一級アミン、第二級アミン、第三級アミン、第四級アンモニウム、スルホネート、スルホン酸、ホスホネート及びホスホン酸が含まれる。
【0053】
本発明に於いて有用であるカルボン酸は、酢酸、ギ酸、プロピオン酸、イソ酪酸、ヘキサン酸、ヘプタン酸、オレイン酸若しくはステアリン酸のような一塩基性又はコハク酸、アジピン酸若しくはテレフタル酸のような多塩基性であってよい。アラルキルカルボン酸の例には、フェニル酢酸及び4−アミノフェニル酢酸が含まれる。置換されたカルボン酸の例には、4−アミノ酪酸、4−ジメチルアミノ酪酸、6−アミノカプロン酸、4−アミノフェニル酢酸、4−ヒドロキシフェニル酢酸、乳酸、グリコール酸、4−ジメチルアミノ酪酸及び4−トリメチルアンモニウム酪酸が含まれる。更に、例えば、カルボン酸ハライド、例えばアセチルクロリド、カルボン酸無水物、例えば無水酢酸、カルボン酸エステル、例えば酢酸メチル、多ヒドロキシル化脂肪族炭化水素アセテート、例えばグリセロール1,2−ジアセテート、カルボン酸アミド、例えばε−カプロラクタム及びγ−ブチロラクタム並びにカルボン酸ラクトン、例えばγ−ブチロラクトン、δ−バレロラクトン及びε−カプロラクトンを含む、反応条件下でカルボン酸に転化させることができる物質も、本発明に於いて使用することができる。カルボン酸の混合物も、本発明に於いて使用することができる。
【0054】
本発明に於いて使用することができる幾つかのカルボン酸触媒、例えばカルボン酸基に近い立体的に要求する置換基を有するもの、例えば2,2−ジメチル酪酸、立体的に妨害された2−置換された安息香酸、例えば2−アミノ安息香酸及び2−メチルアミノ安息香酸は、本発明の塩化水素化方法に於いて他のものよりも効率が低い。この理由のために、カルボン酸基の周りに立体的に邪魔物がないカルボン酸が一層好ましい。
【0055】
超大気圧分圧のHCl条件を使用する本発明の方法に於いて、本発明に於いて使用される好ましい酸触媒には、例えば酢酸、プロピオン酸、酪酸、イソ酪酸、ヘキサン酸、ヘプタン酸、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、コハク酸、6−クロロヘキサン酸、6−ヒドロキシヘキサン酸及びこれらの混合物が含まれる。
【0056】
本発明の別の面に於いて、前記の超大気圧方法に於いて機能する本発明の触媒の幾つかは、また、水除去有り又は無しで、大気圧及び大気圧よりも低い条件でも、驚くほどよく機能することができる。従って、本発明の第五の面は、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物の製造方法であって、多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、触媒の存在下で、超大気圧の、大気圧の又は大気圧よりも低い分圧の塩化水素源と接触させて、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物を製造する工程を含み、この触媒が、(i)2〜約20個の炭素原子を有し、そしてアミン、アルコール、ハロゲン、スルフヒドリル、エーテル、エステル若しくはこれらの組合せからなる群から選択された、少なくとも1個の官能基を含有するカルボキシレート誘導体(但し、この官能基は、α炭素よりも近くなく酸官能基に結合している)又はそれらへの前駆体であり、(ii)クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物よりも低い揮発性であり、そして(iii)ヘテロ原子置換基を含有する方法に指向している。
【0057】
本発明の第五の面内で、本発明の触媒構造の一つの態様は、一般的に、下記に示す式(a)によって表され、式中、官能基「R’」には、アミン、アルコール、ハロゲン、スルフヒドリル、エーテルからなる官能基又は前記官能基を含有する炭素数1〜約20のアルキル、アリール若しくはアラルキル基又はこれらの組合せが含まれ、そして官能基「R」には、水素、アルカリ金属、アルカリ土類金属若しくは遷移金属又は炭化水素官能基が含まれてよい。
【0058】
【化3】

【0059】
本発明の第五の面に従って、ある種の触媒は、また、超大気圧、大気圧又は大気圧よりも低い圧力で、特に、水が、反応混合物から連続的に又は周期的に除去されて、転化を望ましく高いレベルにまで駆動する状況に於いて、有利に使用することができる。例えば、グリセロールの塩化水素化反応は、多ヒドロキシル化脂肪族炭化水素及び触媒の混合物を通して、塩化水素ガスを散布することによって実施することができる。このような方法に於いて、揮発性触媒、例えば酢酸は、溶液を通って散布されている塩化水素ガスによって、反応溶液から少なくとも部分的に除去され、そして反応媒体から失われる。触媒濃度が減少するために、多ヒドロキシル化脂肪族炭化水素の所望のクロロヒドリンへの転化は、その結果として遅くなる。このような方法に於いて、蒸発し難い触媒、例えば6−ヒドロキシヘキサン酸、4−アミノ酪酸、ジメチル4−アミノ酪酸、6−クロロヘキサン酸、カプロラクトン、カルボン酸アミド、例えばε−カプロラクタム及びγ−ブチロラクタム、カルボン酸ラクトン、例えばγ−ブチロラクトン、δ−バレロラクトン及びε−カプロラクトン、カプロラクタム、4−ヒドロキシフェニル酢酸、6−アミノカプロン酸、4−アミノフェニル酢酸、乳酸、グリコール酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸並びにそれらの混合物等の使用が好ましい。これらの大気圧又は大気圧よりも低い条件下で、製造される所望のクロロヒドリンよりも揮発性でない触媒を使用することが最も望ましい。更に、この触媒が、使用される多ヒドロキシル化脂肪族炭化水素と完全に混和性であることが望ましい。触媒が完全に混和性でない場合、これは第二相を形成し、そして完全な触媒効果が実現されない。この理由のために、触媒が、触媒を多ヒドロキシル化脂肪族炭化水素、例えばグリセロールと混和性にする極性ヘテロ原子置換基、例えばヒドロキシル、アミノ若しくは置換されたアミノ又はハライド基を含有することが望ましい。
【0060】
本発明の方法で使用するための触媒、例えばカルボン酸触媒の選択は、また、多ヒドロキシル化脂肪族炭化水素塩化水素化のために使用される特定のプロセス図式によって支配される。例えば、多ヒドロキシル化脂肪族炭化水素が、できるだけ高い転化率で所望のクロロヒドリンに反応され、次いで触媒からの分離無しに、他の生成物に更に転化される1回通過プロセスに於いて、カルボン酸触媒は、続いて更に利用されない。このようなプロセススキームに於いて、カルボン酸は、有効であることに加えて、安価であることが望ましい。このような状況に於いて、好ましいカルボン酸触媒は、例えば酢酸である。
【0061】
例えば、製造されたクロロヒドリンをカルボン酸触媒から分離し、その後、更に処理又は使用する、再循環方法に於いて、カルボン酸触媒は、追加的に、所望のクロロヒドリン生成物からの、触媒及びその反応生成物とのエステルの分離の容易性に基づいて選択される。このような場合に、それを、更なる反応のために未反応のグリセロール又は中間体モノクロロヒドリンと共に反応器に容易に再循環できるような、重い(即ち、より低い揮発性の)酸を使用することが好ましい。本発明に於いて有用である適当な重い酸には、例えば4−ヒドロキシフェニル酢酸、ヘプタン酸、4−アミノ酪酸、カプロラクトン、6−ヒドロキシヘキサン酸、6−クロロヘキサン酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド及びこれらの混合物が含まれる。
【0062】
また、酸又はその塩化水素化される多ヒドロキシル化脂肪族炭化水素とのエステル又はその反応中間体若しくは反応生成物とのエステルが、反応溶液中で混和性であることが好ましい。この理由のために、これらの溶解度制約を考慮に入れてカルボン酸触媒を選択することが望ましい。従って、例えば塩化水素化される多ヒドロキシル化脂肪族炭化水素が、グリセロールのように非常に極性である場合、幾つかのカルボン酸触媒は、完全よりも低い溶解度を示し、混合した際に二相を形成する。このような場合に、一層混和性である酸触媒、例えば酢酸又は4−アミノ酪酸が望ましい。
【0063】
本発明に於いて有用である触媒は、広範囲の濃度に亘って、例えば多ヒドロキシル化脂肪族炭化水素の1モル基準で、約0.01モル%から約99.9モル%まで、好ましくは約0.1モル%から約67モル%まで、更に好ましくは約0.5モル%から約50モル%まで、最も好ましくは約1モル%から約40モル%まで有効である。本発明に於いて使用する触媒の特定の濃度は、本発明に於いて使用する特定の触媒及びそのような触媒が使用されるプロセス図式に依存するであろう。
【0064】
例えば、触媒を1回だけ使用し、次いで廃棄する1回通過プロセスに於いては、低濃度の高度に活性の触媒を使用することが好ましい。更に、安価な触媒を使用することが望ましい。このような方法に於いて、例えば多ヒドロキシル化脂肪族炭化水素基準で、約0.01モル%から約10モル%まで、好ましくは約0.1モル%から約6モル%まで、更に好ましくは約1モル%から約5モル%までの濃度を使用できる。
【0065】
例えば、触媒を再循環し、そして繰り返して使用するプロセス図式に於いては、廃棄する触媒のときよりも高い濃度を使用することが望ましい。このような再循環する触媒は、多ヒドロキシル化脂肪族炭化水素基準で、約1モル%から約99.9モル%まで、好ましくは約5モル%から約70モル%まで、更に好ましくは約5モル%から約50モル%まで使用することができるが、これらの濃度は限定ではないと考えるべきである。反応時間を短縮し、プロセス装置のサイズを最小にし、そして望ましくない触媒作用されない副生物の生成を減少するために、より高い触媒濃度を望ましく使用することができる。
【0066】
一般的に、本発明の方法は、超大気圧条件下で実施することが好ましい。本明細書に於いて、「超大気圧」は、塩化水素(HCl)分圧が、大気圧よりも上、即ち、15psia又はそれ以上であることを意味する。一般的に、本発明の方法に於いて使用する塩化水素分圧は、少なくとも約15psia HCl又はそれ以上である。好ましくは、本発明の方法の圧力は、約25psia又はそれ以上、更に好ましくは約35psia HCl又はそれ以上、最も好ましくは約55psia又はそれ以上で、好ましくは約1000psia HCl又はそれ以下、更に好ましくは約600psia又はそれ以下、最も好ましくは約150psia又はそれ以下である。
【0067】
本発明に於いて使用するHClは、最も好ましくは無水である。HCl組成は、100体積%の塩化水素から約50体積%の塩化水素までの範囲であってよい。好ましくは、HCl供給物組成は、約50体積%HClよりも大きく、更に好ましくは約90体積%HClよりも大きく、最も好ましくは約99体積%HClよりも大きい。
【0068】
本発明プロセスの実施に於いて有用である温度は、経済的な反応速度を与えるために十分であるが、出発材料、生成物又は触媒安定性が危うくなるほど高くはない。更に、高い温度は、望ましくない触媒作用しない反応、例えば非選択的過塩素化の速度を増加させ、そして装置腐食の増加した速度になり得る。本発明に於いて有用な温度は、一般的に約25℃〜約300℃、好ましくは約25℃〜約200℃、更に好ましくは約30℃〜約160℃、なお更に好ましくは約40℃〜約150℃、最も好ましくは約50℃〜約140℃であってよい。
【0069】
本発明の超大気圧方法の反応は、有利に速く、そして約12時間より短く、好ましくは約5時間より短く、更に好ましくは約3時間より短く、最も好ましくは約2時間より短い時間で実施することができる。約12時間よりも長いような、より長い反応時間で、この方法は、RCl及びその他の過塩素化副生物を生成し始める。
【0070】
驚くべきことに、本発明の超大気圧方法を使用して、高い通過当たり収率及び高い選択率を達成できることが見出された。例えば、約80%よりも高い、好ましくは約85%よりも高い、更に好ましくは約90%よりも高い、最も好ましくは約93%よりも高い、多ヒドロキシル化脂肪族炭化水素基準のクロロヒドリンについての通過当たり収率を、本発明によって達成できる。例えば約80%よりも高い、好ましくは約85%よりも高い、更に好ましくは約90%よりも高い、最も好ましくは約93%よりも高い、クロロヒドリンの高い選択率を、本発明の方法によって達成できる。勿論、収率は、反応中間体を再循環することによって増加させることができる。
【0071】
例えば、本発明に於いて使用する多ヒドロキシル化脂肪族炭化水素がグリセロールであるとき、中間体モノクロロヒドリンを再循環することによって、達成されるジクロロヒドリンの最終収率を増加させることができる。更に、先行技術の方法の多くとは違って、クロロヒドリンを生成する反応を実施する際に、水除去は、本発明の方法の本質的な特徴ではない。実際に、本発明の反応は、水の共沸的除去のような水除去の不存在下で優先的に実施される。
【0072】
本発明の超大気圧方法に於いて、また、水、塩又は多ヒドロキシル化脂肪族炭化水素以外の有機不純物のような汚染物質を含有していない出発材料を使用することは必須ではない。従って、出発材料に、一般的に約50重量%以下のこのような汚染物質が含有されていてよい。例えば、水(約5〜約25重量%)、アルカリ(例えばナトリウム又はカリウム)若しくはアルカリ土類(例えばカルシウム又はマグネシウム)金属塩(約1〜約20重量%)及び/又はカルボン酸アルカリ塩(約1〜約5重量%)を含有し得る粗製1,2,3−プロパントリオール(粗製グリセロール)も、本発明に於いて使用して、所望の生成物を有効に製造することができる。従って、本発明の方法は特に経済的なアプローチである。
【0073】
本発明の方法の一つの態様に於いて、1,2,3−プロパントリオール(グリセロール)を、密閉した容器内に入れ、そして前記の触媒量のカルボン酸又はそのエステルの存在下で、HClガスの雰囲気下で、加熱し、加圧する。プロセスの好ましい条件下で、主生成物は、少量(例えば、<10%合計収率)の下記の生成物、即ち1−クロロ−2,3−プロパンジオール、2−クロロ−1,3−プロパンジオール及び2,3−ジクロロプロパン−1−オール並びに検出できない量(200ppm未満)の1,2,3−トリクロロプロパンを含有する、1,3−ジクロロプロパン−2−オール(例えば、>90%収率)である。有利なことに、主及び副二塩素化生成物(1,3−ジクロロプロパン−2−オール及び2,3−ジクロロプロパン−1−オール)は、エピクロロヒドリンへの前駆体である。この二塩素化生成物は、当該技術分野で公知であるような、塩基との反応によってエピクロロヒドリンに、容易に転化させることができる。
【0074】
本発明には、例えば、回分式、半回分式又は連続式を含む、種々のプロセス図式が含まれてよい。一つの態様に於いて、例えば、本発明には、塩化水素との反応による多ヒドロキシル化脂肪族炭化水素の塩化水素化が含まれる。多ヒドロキシル化脂肪族炭化水素は、生で使用することができ又は適当な溶媒中に希釈させることができる。このような溶媒には、例えば、水及びアルコールが含まれてよい。使用の前に、水、有機物質又は無機物質を含む汚染物質を除去することによって、それを塩化水素化反応に使用する前に、多ヒドロキシル化脂肪族炭化水素を精製することが好ましい。この精製には、公知の精製技術、例えば蒸留、抽出、吸収、遠心分離又は他の適切な方法が含まれてよい。多ヒドロキシル化脂肪族炭化水素は、一般的に、液体として方法に供給されるが、これは絶対的に必須ではない。
【0075】
本発明方法で使用される塩化水素は、好ましくはガス状である。しかしながら、塩化水素を、所望により、溶媒、例えばアルコール(例えばメタノール)中に又は担体ガス、例えば窒素中に希釈することができる。任意的に、塩化水素を、使用の前に精製して、任意の望ましくない汚染物質を除去することができる。塩化水素は実質的に無水であることが好ましいが、塩化水素中に存在する幾らかの量(例えば約50モル%未満、好ましくは約20モル%未満、更に好ましくは約10モル%未満、なお更に好ましくは約5モル%未満、最も好ましくは約3モル%未満)の水は、過度に有害ではない。塩化水素は、任意の適当な方法でプロセス装置に供給される。プロセス装置は、本発明の方法に於いて使用される塩化水素化反応器全体への塩化水素の良好な分散を確実にするように設計される。従って、1個又は多数個のスパージャー、バッフル及び効率的な攪拌機構が望ましい。
【0076】
使用される触媒は、プロセス装置に、独立で又は多ヒドロキシル化脂肪族炭化水素若しくは塩化水素供給物との混合物として若しくはこれらの成分として供給することができる。
【0077】
本発明の塩化水素化反応のために有用な装置は、当該技術分野で公知の任意の装置であってもよく、そして塩化水素化の条件で反応混合物を含有できなくてはならない。適切な装置は、プロセス成分による腐食に対して耐性であり、そして例えばタンタルのような金属、ハスタロイ(Hastalloy)C(登録商標)のような適切な合金又はガラスライニングされた装置を含む材料から製作することができる。適切な装置には、例えば1個又は複数個の、攪拌槽、チューブ若しくはパイプ又はこれらの組合せが含まれてよい。
【0078】
代表的回分式方法に於いて、多ヒドロキシル化脂肪族炭化水素及び塩化水素化触媒を反応器に装入する。次いで、塩化水素を所望の圧力まで添加し、そして反応器内容物を、所望の温度に、所望の長さの時間加熱する。次いで、反応器内容物を反応器から排出し、そして精製するか又は次の処理のために他の装置に送るか若しくは貯蔵に送る。
【0079】
代表的半回分式方法に於いて、他の試薬を反応の開始時にのみ供給し、1種又はそれ以上の試薬を、反応の全期間に亘って反応器に供給する。このような方法に於いて、例えば、多ヒドロキシル化脂肪族炭化水素及び触媒を、単一回分で塩化水素化反応器に供給し、次いでこれを適当な時間、反応条件で維持し、その間に、塩化水素を、所望の速度(これは、一定流量又は一定圧力であってよい)で、反応の全期間に亘って連続的に供給することができる。反応後、塩化水素供給を終結させ、そして反応器内容物を、貯蔵、精製又は更なる処理のために排出することができる。
【0080】
化学品の大規模製造に於いて、連続式方法を使用することが、そのようにすることの経済的利点が、通常、回分式処理よりも大きいので、しばしば望ましい。連続式方法は、例えば、1回通過又は再循環プロセスであってよい。1回通過プロセスに於いて、1種又はそれ以上の試薬を、プロセス装置に1回通過させ、次いで反応器からの得られる排出物を、精製又は更なる処理のために送る。このような図式に於いて、多ヒドロキシル化脂肪族炭化水素及び触媒を装置に供給し、そして塩化水素を、プロセス装置(これには、連続攪拌型槽反応器、チューブ、パイプ又はこれらの組合せが含まれてよい)全体の1点又は複数点で、所望のときに添加することができる。
【0081】
その代わりに、使用する触媒は、フィルター又は等価の装置の手段によって、プロセス装置内に留まっている固体であってよい。試薬及び触媒を、プロセス装置内の滞留時間が、多ヒドロキシル化脂肪族炭化水素の生成物への所望の転化率を達成するために適切であるような速度で供給する。プロセス装置から出る材料を、所望により、貯蔵、精製又は更なる処理のために送る。このようなプロセスに於いて、できるだけ多くの多ヒドロキシル化脂肪族炭化水素を所望の生成物に転化させることが、一般的に望ましい。
【0082】
連続式再循環プロセスに於いて、プロセス装置から出る、未反応の多ヒドロキシル化脂肪族炭化水素、反応中間体、塩化水素又は触媒の1種又はそれ以上を、プロセスのより前の点に戻し再循環する。このプロセスに於いて、原材料効率が最大化されるか又は触媒が再使用される。このようなプロセス図式に於いて、触媒は再使用されるので、触媒が、1回通過プロセス(この場合、触媒はしばしば廃棄される)に於いて使用されるよりも高い濃度で、触媒を使用することが望ましい。これは、より速い反応又はより小さいプロセス装置になり得、これは使用する装置のための、より低い資本コストになる。
【0083】
触媒又は他のプロセス成分からの所望の生成物の除去は、種々の方法によって達成することができる。例えば、連続方式での蒸発により、塩化水素化反応器から直接的に又は蒸発器若しくは蒸留塔のような装置の別の部分から、分離を達成することが可能であろう。このような場合に、所望の生成物よりも低い揮発性である触媒を使用し、そうして触媒はプロセス装置内に残留するようになる。その代わりに、固体触媒を使用することができ、そして分離は、例えば濾過、遠心分離又は蒸発によって達成できる。幾つかの場合に、触媒又は反応中間体を再循環するために、液体抽出、吸収又は化学反応を使用することもできる。
【0084】
本発明の一つの態様に於いて、多ヒドロキシル化脂肪族炭化水素は、所望の塩化水素化生成物よりも低い揮発性であるように選択された塩化水素化触媒を使用して、塩化水素化される。塩化水素化反応の後、追加の多ヒドロキシル化脂肪族炭化水素を、反応生成物、過剰の出発材料、反応中間体及び触媒に添加する。これは、触媒のエステルとして存在したであろう所望の塩化水素化生成物の幾らかを遊離し、そうして所望の生成物を、蒸発によって反応溶液から一層完全に回収することができると考えられる。所望の塩化水素化生成物を回収した後、プロセス流の残りを、塩化水素化流に再循環することができる。このプロセス図式は、また、多ヒドロキシル化脂肪族炭化水素の添加後にプロセス流中に残留している塩化水素の多くが、新たに添加された多ヒドロキシル化脂肪族炭化水素との反応によって消費されるので、塩化水素損失の量を最小にするという利点を有する。
【0085】
使用される特別のプロセス図式は、例えば、塩化水素化される多ヒドロキシル化脂肪族炭化水素の素性、コスト及び純度、使用する特定のプロセス条件、生成物を精製するために必要な分離並びにその他の要因を含む多数の要因に依存するであろう。本明細書に記載したプロセスの例は、本発明を限定するとして考えるべきではない。
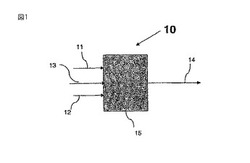
【0086】
図1、2及び3は、本発明の塩化水素化プロセスの3種の限定しない態様を示す。図1、2及び3に示した本発明のプロセスを例示する実施例は、本発明の好ましい態様に過ぎない。
【0087】
例えば、図1は、数字10によって全体的に示される、本発明のプロセスを示し、ここで、多ヒドロキシル化脂肪族炭化水素、例えばグリセロール供給物流11は、反応容器15の中に導入される。反応容器15は、例えば、1個又はそれ以上の、連続攪拌型槽反応器(CSTR)若しくは管型反応器又はこれらの組合せを含む、任意の公知の適当な型のものであってもよい。
【0088】
容器15には、塩化水素供給物流12及びカルボン酸又はカルボン酸前駆体触媒供給物流13も導入される。流れ12及び流れ13は、容器15の中に、別々に又は一緒に導入させることができる。更に、任意的に、流れ11、流れ12及び流れ13の全てを、1個の供給物流の中に一緒に組み合わせることができる。任意の流れ11、流れ12又は流れ13を、容器15の1個の点で又は複数個の点で導入することができる。容器15に於いて、グリセロールは、カルボン酸触媒とのそのエステル、モノクロロヒドリン及びジクロロヒドリン並びにそれらのエステルに、部分的に又は完全に転化される。例えばジクロロヒドリン、モノクロロヒドリン、未反応グリセロール及びそれらのエステル、水、未反応の塩化水素並びに触媒を含有する流れ14が、容器15から出て、貯蔵に、精製のような更なる処理に又は更なる反応のための他の装置に送られる。
【0089】
例えば、一つの態様に於いて、流れ14を塩基と反応させて、エピクロロヒドリンを生成させることができる。このようなプロセスに於けるカルボン酸触媒は、低濃度でのその効能及びその低コストに基づいて選択することができる。例えば、カルボン酸は、酢酸又はプロピオン酸であってよい。
【0090】
図2は、数字20によって全体的に示される、本発明の方法の他の態様を示し、ここで、多ヒドロキシル化脂肪族炭化水素、例えばグリセロールを含有する供給物流21は、容器26に供給され、容器26は、1個又はそれ以上の、CSTR若しくは管型反応器又はこれらの組合せであってよい。また、容器26には、塩化水素を含有する供給物流22が供給される。また、容器26には、例えば未反応のグリセロール、モノクロロヒドリン及び触媒とのそのエステルを含有する、容器27から再循環された再循環流25が供給され、触媒もまた、この流25内で再循環する。
【0091】
容器26内で、グリセロールは、モノクロロヒドリン及びそれらのエステルに転化され、そしてモノクロロヒドリンは、ジクロロヒドリン及びこれらのエステルに転化される。例えばジクロロヒドリン、モノクロロヒドリン、未反応グリセロール及びカルボン酸触媒とのこれらのエステル、水、未反応の塩化水素並びに触媒を含有する流れ23が、容器26から出て、容器27に供給される。容器27内で、流れ24としての、所望のジクロロヒドリン、水及び未反応の塩化水素の少なくとも幾らかは、容器26に再循環される再循環流25としての、モノクロロヒドリン及びこれらのエステル、未反応のグリセロール及びこれらのエステル並びに触媒から分離される。流れ25には、また、任意的に、幾らかのジクロロヒドリン及びこれらのエステルが含有されていてよい。
【0092】
容器27は、1個又はそれ以上の、蒸留塔、フラッシュ容器、抽出若しくは吸収塔又は当該技術分野で公知である任意の適当な公知の分離装置を含む、任意の公知の適当な分離容器からなっていてもよい。生成物流24は、貯蔵に、更なる処理、例えば精製に又は更なる反応、例えばエピクロロヒドリンへの転化に送られる。このプロセス図式の一つの実施例に於いて、触媒は、その化学的又は物理的特性が、所望のジクロロヒドリンからの触媒又はそのエステルの容易な分離になるように選択することができる。例えば、このプロセス図式のために選択される触媒は、6−クロロヘキサン酸、カプロラクトン、4−クロロ酪酸、ステアリン酸又は4−ヒドロキシフェニル酢酸であってよい。
【0093】
図3は、数字30によって全体的に示される、本発明プロセスの他の態様を示し、ここで、容器36には、塩化水素を含有する供給物流31並びに流れ35により、グリセロール、グリセロールエステル、モノクロロヒドリン及びそれらのエステル並びに触媒を含有する再循環流が供給される。1個若しくはそれ以上のCSTR、1個若しくはそれ以上の管型反応器又はこれらの組合せからなっていてよい容器36内に於いて、グリセロール及びモノクロロヒドリンは、ジクロロヒドリンに転化される。例えばジクロロヒドリン、モノクロロヒドリン、グリセロール及びこれらのエステル、触媒、未反応塩化水素並びに水を含有する流れ32は、容器36から出て、容器37に供給される。また、容器37には、グリセロールを含有する供給物流33が供給される。
【0094】
容器37内に於いて、グリセロールは、モノクロロヒドリン及びジクロロヒドリンのエステルと反応して、遊離のモノクロロヒドリン及びジクロロヒドリンを単離し、グリセロールエステルを生成する。更に、流れ32により容器37に入る未反応の塩化水素の少なくとも幾らかは、また、主としてモノクロロヒドリンを生成するために消費される。容器37は、また、所望のジクロロヒドリンを、未反応のモノクロロヒドリン及びグリセロール並びにそれらのエステルから分離するための手段として機能することができる。容器37には、例えば、1個若しくはそれ以上の、蒸留塔、フラッシュ容器、抽出器若しくは任意の他の分離装置が含まれていてよく又は容器37は、例えば攪拌槽、管型反応器若しくは前記の分離装置を有する同様の容器の組合せであってよい。容器37から出る、そしてジクロロヒドリン、水及び残留塩化水素を含有する生成物流34は、貯蔵に、更なる処理、例えば精製に又は更なる反応、例えばエピクロロヒドリンを製造するための反応プロセスに送られる。グリセロール及びモノクロロヒドリン並びにこれらのエステル並びに触媒を含有する流れ35は、容器37から出て、流れ35として、容器36に再循環される。
【0095】
図3のプロセス配置に於いて、比較的多量、例えばグリセロール基準で約10モル%〜約70モル%の触媒を使用して、容器36内の塩化水素化反応の速度が非常に速く、そしてその結果として装置が小さくなるようにすることが望ましい。また、図3のプロセス配置に於いて、触媒が、容器37内の分離が容易に実施されるような化学的又は物理的特性を有することが好ましく、例えば、分離方法が蒸留であるとき、最低沸点のジクロロヒドリンが沸騰する温度よりも実質的に低い温度で沸騰する触媒の使用が好ましい。このような触媒の例には、6−クロロヘキサン酸、ヘプタン酸及び4−ヒドロキシフェニル酢酸が含まれる。
【0096】
本発明には、また、本発明の方法によって製造された新規な組成物が含まれる。本発明の方法によって製造された本発明の組成物には、例えばグリセロールから製造されたジクロロヒドリンが含まれる。本発明の方法によって製造されたこのようなジクロロヒドリンは、それらが、ジクロロヒドリン(即ち、1,3−ジクロロプロパン−2−オール及び2,3−ジクロロプロパン−1−オール)の高い濃度、ジクロロヒドリン及びこれらのエステルの2種の異性体の高い比、即ち1,3−ジクロロプロパン−2−オール及びエステルの、2,3−ジクロロプロパン−1−オール及びエステルに対する高い比、グリセロール及びそのエステル並びにモノクロロヒドリン、即ち2−クロロ−1,3−プロパンジオール及び1−クロロ−2,3−プロパンジオール並びにこれらのエステルの低い濃度並びに非所望の副生物、即ち1,2,3−トリクロロプロパン並びに塩素化されたグリセロールオリゴマー、例えばビス(3−クロロ−2−ヒドロキシプロピル)エーテル及びこれらのエステルの低い濃度を含む点で有用である。
【0097】
本発明の組成物は、エピクロロヒドリンの製造に於いて有用であり、廃棄することが困難であるか又は高価である塩素化された副生物の低いレベルで、短い反応時間内に高純度のエピクロロヒドリンの高い収率を与える。
【0098】
本発明の一つの態様及び例示として、それらによって結び付けられるべきではないが、本発明に従って製造することができる有用な組成物(水及び無機不純物を除く)は、例えばグリセロールの塩化水素化から製造することができる。下記の略語を、以下の表中に使用する。「1,3−ジクロロヒドリン」は、1,3−ジクロロプロパン−2−オールである。「2,3−ジクロロヒドリン」は、2,3−ジクロロプロパン−1−オールである。「モノクロロヒドリン」には、1−クロロ−2,3−プロパンジオール及び2−クロロ−1,3−プロパンジオール並びにこれらの混合物が含まれる。一般的に、このような組成物には、例えば脂肪酸メチルエステル等を除く下記の成分が含まれる。
【0099】
【表1】

【0100】
上記の組成物中の1,3−ジクロロヒドリン対2,3−ジクロロヒドリン比は、一般的に約8:1〜約100:1である。
【0101】
好ましくは、本発明の組成物は下記の通りとすることができる。
【0102】
【表2】

【0103】
更に好ましくは、本発明の組成物は下記の通りであろう。
【0104】
【表3】

【0105】
最も好ましくは、本発明の組成物は下記の通りであろう。
【0106】
【表4】

【0107】
本発明の上記の組成物は、エピクロロヒドリンの製造に於いて有用である。2,3−ジクロロヒドリン及びそのエステルへの選択率に対する、1,3−ジクロロヒドリン及びそのエステルへの高い選択率は、苛性との反応の際のエピクロロヒドリンの一層効率よく、そして速い生成になる。更に、本発明の組成物中のトリクロロプロパン(TCP)の低いレベルは、それによって、TCPの取扱い及び廃棄のコストが最小になるので望まれる。グリセロール及びモノクロロヒドリンの低いレベルも、所望のジクロロヒドリンへの高い転化率を通してグリセロール原材料効率を最大にするために、本発明の組成物に於いて望まれる。
【0108】
下記の実施例は、例示目的のみのためであり、そして本発明の範囲を限定することを意図していない。
【0109】
実施例1:グリセロールからのクロロヒドリンの製造
磁気駆動攪拌機、内部冷却コイル及びサーモカップルを取り付けた100mLのハステロイC(登録商標)パル(Parr)反応器に、グリセロール(30.0g、シグマ−アルドリッチ・ケミカル社(Sigma-Aldrich Chemical Corporation)から得た)及び氷酢酸(4.5g、ジェイティー・ベイカー社(JT Baker Corporation)から得た)を添加した。反応器を密閉し、無水塩化水素ガス(エアーガス社(Airgas Corporation))で90psigまで加圧し、そして93℃に90分間加熱し、そして無水塩化水素ガスで90psigに維持し、その後、反応器を冷却し、そして室温(約25℃)で排気した。反応器内容物(65.9g)を集め、ガスクロマトグラフィー(GC)によって分析し、そして下記の生成物、1,3−ジクロロプロパン−2−オール及びその酢酸エステル(合計92.6モル%)並びに2,3−ジクロロプロパン−1−オール及びその酢酸エステル(合計1.7モル%)を含有することが見出された。更に、多数のモノ塩素化化合物(合計4.4モル%)並びに未反応のグリセロール及びそのエステル(合計1.0モル%)が検出された。トリクロロプロパンは検出されなかった(200ppmの検出限界で)。
【0110】
実施例2:グリセロール/グリセロールエステル混合物からのクロロヒドリンの製造
200mLのハステロイC(登録商標)高圧反応器に、乾燥グリセロール(アルドリッチ社、モレキュラーシーブスで予備乾燥した、91mg、0.99ミリモル)及びトリアセチン(アルドリッチ社、グリセロールのトリ酢酸エステル、457mg、2.10ミリモル)を含有する、10mLのガラスメスフラスコを添加した。反応器を密閉し、そして窒素で40psigまで加圧し(3回加圧サイクル)、窒素排気後に攪拌しながら110℃にした。無水HClを76psigの一定圧力で導入し、そして反応を3時間進行させた。反応器を排気して生成物を得た。この生成物は、GCフレームイオン化検出分析によって決定したとき、25.90面積%の1,3−ジクロロプロパン−2−オール、68.34面積%の1,3−ジクロロ−2−アセトキシプロパン、1.57面積%の1,2−ジクロロ−3−アセトキシプロパン、2.86面積%の2−クロロプロパン−1,3−ジアセトキシプロパン及び検出できないグリセロール、トリアセチン又は1,2,3−トリクロロプロパンを含有することが見出された。
【0111】
実施例3:粗製グリセロールからのクロロヒドリンの製造
磁気駆動攪拌機、内部冷却コイル及びサーモカップルを取り付けた100mLのハステロイC(登録商標)パル反応器に、粗製グリセロール(30.0g、インターウエスト社(Interwest Corporation)から得た)及び氷酢酸(0.6g、ジェイティー・ベイカー社から得た)を添加した。反応器を密閉し、無水塩化水素ガス(エアーガス社)で120psigまで加圧し、そして圧力を無水塩化水素ガスで120psigで維持しながら、120℃に90分間加熱した。この時間の後、反応器を冷却し、そして室温で排気した。反応器内容物(57.2g)を、懸濁した白色固体を含有する流動性液体として集めた。
【0112】
上記のような手順を繰り返して、58.0gの反応器内容物を第二反応から集めた。次いで、この2個の反応生成物(57.2g及び58.0g)を一緒にした。
【0113】
濾過によって、粗製グリセロールと共に導入された白色固体、ナトリウム塩及びカリウム塩を除去した後、濾液をガスクロマトグラフィーによって分析し、そして、1,3−ジクロロプロパン−2−オール(95.3重量%)、2,3−ジクロロプロパン−1−オール(2.6重量%)、2−アセトキシ−1,3−ジクロロプロパン(0.7重量%)及び1−アセトキシ−2,3−ジクロロプロパン(0.1重量%)を含有することが見出された。更に、多数のアセトキシクロロプロパノール類(0.87重量%)が検出された。未反応のグリセロール若しくはそのエステル又はトリクロロプロパノールは、何れも検出されなかった。
【0114】
実施例4〜41:
下記の実施例を、磁気駆動攪拌機、サーモカップル及び内部冷却コイルを取り付けた100mLのハステロイC(登録商標)パルオートクレーブ内で実施した。グリセロール(30g、326ミリモル、アルドリッチ99%)を、下記の表Iに記載したような触媒(10ミリモル)又は他の添加物及び水(3.0g、167ミリモル)と共に反応器に添加し、次いで反応器を密閉した。反応器及び内容物の質量を記録した。反応器を攪拌し、そして氷冷した水を、冷却コイルに通して循環させた。110psigの所望の圧力で塩化水素ガス(エアーガス社)を反応器に入れ、典型的に15〜25℃の発熱になった。反応器を、110℃の所望の温度に加熱し、そして、塩化水素ガスが反応によって消費されたとき、塩化水素ガスを設定圧力で連続的に供給しながら、反応を4時間進行させた。反応器に供給した塩化水素の質量を、反応を通してシリンダーの質量を記録することによって測定した。
【0115】
4時間の所望の反応時間が経過した後、塩化水素供給を停止し、そして反応器及び内容物を室温にまで冷却した。次いで、反応器を排気し、反応器及び内容物の質量を記録した。反応生成物をガスクロマトグラフィーによって分析した。ジクロロヒドリンへの選択率を、100%×ジクロロヒドリンのモル数/装入したグリセロールのモル数として報告する。
【0116】
ここで、下記の略語を使用する。「1,3−DCH」は1,3−ジクロロプロパン−2−オールであり、「2,3−DCH」は2,3−ジクロロプロパン−1−オールであり、「1−MCH」は1−クロロ−2,3−プロパンジオールであり、「2−MCH」は2−クロロ−1,3−プロパンジオールであり、「BZIM Br」はn−ブチルメチルイミダゾリウムブロミドであり、「BZIM Cl」はn−ブチルメチルイミダゾリウムクロリドであり、「Bu4NCl・H2O」はテトラ−n−ブチルアンモニウムクロリドヒドレートであり、そして「C16Me3NCl」はn−ヘキサデシルトリメチルアンモニウムクロリドである。
【0117】
【表5】

【0118】
比較例A:大気圧よりも低い圧力で、HCl、酢酸及び共沸剤としてのトルエンでの、ジクロロヒドリンへのグリセロール反応
オーバーヘッド空気攪拌機、HCl入口フリット、凝縮器付きディーン・シュタルク(Dean Stark)トラップを取り付けた、500mLワルトン(Wharton)バッフル付き三つ口フラスコに、グリセロール(92.0g、1.00モル)、5mLの酢酸(HOAc)及び200mLのトルエンを添加した。正の窒素流下で反応物を、無水HClをゆっくりパージしながら(決定した速度又は流量調節無し)、還流まで加熱した。5時間還流させた後、23mLの6N HCl水溶液が集められ、NMR分析によって、得られた底相は>85%のモノクロロヒドリンであることが示された。3時間後に、他の5mLのHOAcを添加し、そして再び6時間で、それぞれのとき水発生は、添加後に非常に速かった(トラップ内に1〜2mL/15分)。相は6時間後に熱混和性であり、次いで冷却すると2個の相に分離した。得られた生成物は、標準物質に対してNMRにより同定され、そして大部分のトルエンが分離された残留物を使用して、122gの材料のサンプルを得た。このサンプルを、ガスクロマトグラフィー/質量分析法(GC/MS)分析を使用して分析した。
【0119】
分析の結果及び化学図式を、下記の図式2に示す。
【0120】
【化4】

【0121】
比較例B:共沸的水除去無し及び大気圧で、過剰のHClパージ、酢酸での、ジクロロヒドリンへのグリセロール反応
この比較例に於いて、水を厳しく除去するための試みは行わなかった。オーバーヘッド空気攪拌機、HCl入口フリット及びスクラバーへの出口を取り付けた、500mLワルトン三つ口フラスコに、4Aシーブ乾燥したグリセロール(138.0g、1.50モル)、3.8gのHOAc(グリセリン基準で2.75%)を添加した。この出口チューブは、こぶ付き(burled)セラミックサドルが充填された3フート水スクラビング塔にフランジで取り付けられた、1/16インチのポリエチレン出口チューブ(約7フィート)に連結された、冷却しない16インチ直管凝縮器(ガラス)からなっていた。正の窒素流下で反応物を、100℃に加熱し、次いで無水HClによる遅いパージ(約200mg/分)を開始した。添加したHClの速度及び全量を、秤量セルによってモニターした。サンプルの小量のアリコート(例えば300mg)を、適当な間隔でサイドアームから取って、それから半減期を得ることができる粗動力学的転化プロフィールを完結した。反応物内部反応温度を、温度調節器によって等温(100℃±2℃)に維持した。24時間かけて、700gの無水HClの全量を、溶液に通過させた。サンプルを、重量%GCアッセイを使用して分析し、そして最終サンプルもまた、水及びHCl含有量について電位差測定により分析して、全質量バランスを得た。23.75時間のパージの後に得られた暗褐色反応生成物(200mgの残留物を引く)は、218.5gであった。
【0122】
分析の結果及び化学図式を、下記の図式3に示す。グリセロールの、モノクロロヒドリン及びジクロロヒドリンへの転化を、図4にグラフで示す。図4に於いて、「MCH」は、モノクロロヒドリン、即ち、3−クロロ−2,3−プロパンジオール及び2−クロロ−1,3−プロパンジオールの合計モル%であり、「MCH−OAc」は、MCHの酢酸エステルの合計モル%であり、そして「DCH」は、ジクロロヒドリン、即ち、1,3−ジクロロプロパン−2−オール及び2,3−ジクロロプロパン−1−オールの合計モル%である。
【0123】
【化5】

【0124】
実施例42:加圧HCl、酢酸で、共沸水的除去無しでの、ジクロロヒドリンへのグリセロール反応
窒素パージ(2回の40psig加圧/排気サイクル)後に、触媒として4重量%の酢酸(1.2g、アルドリッチ社)を含有する乾燥グリセリン(30.0g、0.320モル)を、磁気駆動した100mLハステロイ−Cパル反応器内で、攪拌及び加熱しながら、無水HClの静圧90〜96psigに付した。この反応器に、内部溶液温度を測定する内部サーモカップルを取り付けた。温度調節器によって制御された浸漬浴によって、反応器に外部加熱を与えた。90℃の初期内部温度で、殆ど即時の発熱が確保され、そして10分間以内に、内部反応温度は120〜123℃であった。この発熱は、HClの迅速な吸収によって同時に起こった。浸漬浴をこの温度まで1.5〜2時間上昇させ、そしてHClを、秤量セル(シリンダー)及びコンピュータ制御システムを介してモニターした。この期間の後、より以上のHCl吸収は殆ど見られなかった(ほぼ、32.1g吸収)。反応器を室温にまで冷却し、注意深くHClパージカラムに排気し、開き、そして内容物(68.0g)を、ポリエチレンねじ蓋を有するガラス瓶に移した。正確なH2O、HCl及び重量%有機バランスを、このサンプル及び他のサンプルで得た。
【0125】
分析の結果及び化学図式を、下記の図式4に示す。
【0126】
【化6】

【0127】
実施例42の結果と比較例Bの結果との比較を、下記の表IIに示す。
【0128】
【表6】

【0129】
比較例Bは、超大気圧方法に対して、大気圧比較例に於いて、延長された反応時間及び触媒の損失があることを示している。また、予想外に、超大気圧ケースに於いて、モノクロロヒドリンのジクロロヒドリンへの、より大きい転化率が起こり、より少ないクロロエーテル(RCl)が製造される。HClの大きい損失が、比較例Bで起こる。
【0130】
実施例43
エチレングリコール(501mg、8.07ミリモル)、1,2−プロピレングリコール(519mg、6.82ミリモル)及び氷酢酸(102mg、1.715ミリモル)を、磁気攪拌棒と一緒にガラスバイアルに入れた。このバイアルを200mLハステロイC(登録商標)圧力容器に入れた。次いで、この圧力容器を、40psigの無水HClガスで加圧した。バイアルの底を72〜74℃の水浴中に浸漬させ、そして攪拌及び圧力を45分間維持した。反応の終わりに、バイアル中の溶液は、透明で色は澄んでいた。この反応によって、1.893gの水を含有する粗製生成物が得られ、これをフレームイオン化検出ガスクロマトグラフィーによって分析した。既知の商業的標準物質の保持時間を基準にして、下記の生成物が分析された。クロロエタノール(35.62面積%)、1−クロロプロパン−2−オール(40.47面積%)、2−クロロプロパン−1−オール(6.47面積%)、非転化プロパンジオール(3.00面積%)、2−クロロ−1−アセトキシエタン(5.09面積%)、1−クロロ−2−アセトキシプロパン(4.45面積%)及び2−クロロ−1−アセトキシプロパン(0.75面積%)。
【0131】
実施例44〜51
グリセロール塩化水素化への塩化水素圧力の影響を試験するための下記の実験を、30gのグリセロール、3gの水、12.6モル%の酢酸を使用して実施した。反応温度は90℃であり、そして反応時間は120分間であった。塩化水素圧力は表IIIに示した通りであり、そしてジクロロヒドリン及びこれらの酢酸エステルへの選択率は示した通りであった。
【0132】
【表7】

【0133】
実施例52
下記の実施例は本発明の新規な組成物の生成を示す。
【0134】
グリセロール(30g、326ミリモル)、水(3.0g、167ミリモル)及びε−カプロラクトン(1.14g、10.0ミリモル)を、100mLパル反応器に装入し、110℃に加熱し、そして無水塩化水素で110psigまで加圧した。この条件で4時間後に、反応混合物は34.0グラムの塩化水素を吸収した。反応器内容物を取り出し、分析し、そして下記の組成(水及び残留塩化水素を除く)を有することが見出された。
【0135】
【表8】

【0136】
実施例53:エピクロロヒドリンを製造するためのクロロヒドリンの使用
前記実施例3から製造したジクロロヒドリン(DCH)生成物を、この実施例で使用した。この実験では、頂部に、30トレイオールダーショウ(Oldershaw)セクション、10%苛性/DCH供給物用の供給点、6トレイオールダーショウセクション、水性戻し供給点及び相分離器に連結した凝縮器を取り付けた、底出口を有する1リットルのジャケット付きケトルからなる反応性蒸留装置を使用した。DCH及び10%苛性を予熱し、そして上記システム30トレイオールダーショウセクションに導入する直前に混合した。運転条件は、250mmHgの圧力、75〜77℃のケトル温度、65〜67℃のオーバーヘッド温度及び68〜76℃の供給物温度であった。DCH供給速度及び苛性供給速度を、DCHに対して10%モル過剰の苛性を達成するように調節した。この反応/蒸留装置内で製造された粗製エピクロロヒドリンのサンプルは、フレームイオン化検出器を有するガスクロマトグラフィーによって分析したとき、下記の組成(面積%)を有していた。
【0137】
【表9】

【0138】
実施例54及び55並びに比較例C及びD
塩化水素を、グリセロール(30g)、水(3.0g)及び10ミリモルの触媒の混合物を通して、大気圧で、110℃で、4時間バブリングさせた。塩化水素流速を、4時間の反応時間に亘って、20〜25g/時で調節した。この時間の後、反応混合物を冷却し、ガスクロマトグラフィーによって分析して、ジクロロヒドリン、モノクロロヒドリン及び未反応グリセロールの濃度を決定した。表Vに、触媒として、酢酸、6−ヒドロキシヘキサン酸、フェニル酢酸及び4−ヒドロキシフェニル酢酸を使用して得られた結果を示す。
【0139】
【表10】

【技術分野】
【0001】
本発明は多ヒドロキシル化脂肪族炭化水素又はそのエステルのクロロヒドリンへの転化方法に関する。クロロヒドリンは、次いで、エピクロロヒドリンのようなエポキシドを製造するのに有用である。
【背景技術】
【0002】
エピクロロヒドリンはエポキシ樹脂への広く使用されている前駆体である。エピクロロヒドリンは、P−ビスフェノールAのアルキル化のために一般的に使用されているモノマーである。遊離モノマー又はオリゴマー性ジエポキシドとして得られるジエポキシドは、例えば電気用積層板、缶被覆、自動車用トップコート及びクリアコート中に使用される高分子量樹脂にまで進めることができる。
【0003】
エピクロロヒドリンの公知の製造方法には、ジクロロヒドリンを生成するための塩化アリルの次亜塩素化(hypochlorination)が含まれる。苛性によるジクロロヒドリン混合物の閉環によって、エピクロロヒドリンが得られ、これは高純度(>99.6%)にまで蒸留される。このクロロヒドリン方法は、エピクロロヒドリンの1モル当たり、2当量の塩素及び1当量の苛性を必要とする。
【0004】
エピクロロヒドリンを製造するための別の公知の方法に於いて、第一工程には、酢酸中の分子状酸素のパラジウム触媒作用反応により、プロピレンのアリル位に酸素を導入することが含まれる。次いで、得られる酢酸アリルを加水分解し、塩素化し、そして最初のジクロロヒドリンを苛性によって閉環して、エピクロロヒドリンにする。この方法は、塩化アリルの製造を回避し、従って、より少ない塩素(僅か1当量)を使用する。
【0005】
上記のエピクロロヒドリンの公知の製造方法の両方は、塩素の犠牲的使用及び工業的使用に付随する複雑さを必要とし、そして次亜塩素酸(HOCl)の発生は、工業的規模で拡大され、そしてこれらの方法は、かなりの量の塩素化副生物を製造することが知られている。特に、塩化アリルの次亜塩素化によって、1,2,3−トリクロロプロパン並びにその他の望ましくない塩素化されたエーテル及びオリゴマー(RCl)が製造されることが、よく知られている。RCl問題は、増加した製造コストとして管理される。より大きい世界的製造に対応するために新たな資本が追加されるとき、これらの望ましくない副生物に対応し、これを改善するために、下流の処理に於いて実質的な投資を加えなくてはならない。これらの同じ問題は、プロピレン及びエチレンクロルヒドリンへのHOCl経路に於いて同様であり、従ってこれらの経路はあまり実施されない。
【0006】
例えば、特許文献1及び特許文献2に記載されているような、HOClの発生を回避する代替方法には、チタンシリカライト(titanium silicalite)触媒を過酸化水素と共に使用する、塩化アリルの直接エポキシ化が含まれる。HOClの発生を減少させるという利点にもかかわらず、塩化アリルが依然として中間体である。塩化アリルを使用することの欠点は2倍である。(1)プロピレンの塩化アリルへの遊離基塩素化は非常に選択的ではなく、そしてかなりの大きさの画分(>15モル%)の1,2−ジクロロプロパンが製造される。(2)プロピレンは炭化水素原料であり、プロピレン価格の長期間の世界的予想は、上昇し続けている。制御された塩素系酸化化学の複雑さ及びRCl発生を回避する、エピクロロヒドリンの製造のための新規な経済的に価値のある方法が望ましい。非炭化水素再生可能原料を含む、エピクロロヒドリンの製造方法についての工業界に於ける要求が存在する。
【0007】
グリセリンは、燃料添加剤を製造するためのバイオディーゼル方法の副産物である、低コストの再生可能な原料であると考えられている。他の再生可能な原料、例えばフルクトース、グルコース及びソルビトールを水素化分解して、ビシナルジオール及びトリオール、例えば、グリセリン、エチレングリコール、1,2−プロピレングリコール、1,3−プロピレングリコール等の混合物を製造できることが知られている。
【0008】
豊富で低コストのグリセリン又は混合グリコールで、グリセリン又は混合グリコール塩化水素化のための経済的に魅力的な方法が望ましい。このような方法が、RClの生成無しに、ビシナルクロロヒドリンの生成に向けて非常に化学選択的であったならば、有利であろう。
【0009】
下記の反応式1に示されるような、グリセロール(本明細書に於いて、「グリセリン」とも呼ぶ)のジクロロプロパノール(本明細書に於いて、「ジクロロヒドリン」とも呼ぶ)、即ち、化合物I及びIIの混合物への転化のための方法が公知である。この反応は、無水HCl及び酢酸(HOAc)触媒の存在下で、水を除去しながら実施する。次いで、化合物I及び化合物IIの両方は、苛性で処理することによって、エピクロロヒドリンに転化させることができる。
【0010】
【化1】

【0011】
図式1に於ける上記の化学反応を使用する種々の方法は、先行技術に於いて報告されている。例えばエピクロロヒドリンはジクロロプロパノール、例えば2,3−ジクロロプロパン−1−オール又は1,3−ジクロロプロパン−2−オールを塩基と反応させることによって製造することができる。ジクロロプロパノールは、大気圧で、グリセロール、無水塩酸及び酸触媒から製造することができる。この反応の過程の間に形成される水の共沸的除去を促進するために、大過剰の塩化水素(HCl)ガスが推奨されている。
【0012】
例えば、非特許文献1、非特許文献2及び非特許文献3には、グリセロール及び有機酸触媒の攪拌した溶液を通して、大過剰の無水HCl(7当量以下)をパージすることによって、ジクロロヒドリン、即ち上記の反応式1に於ける化合物I及びIIについて、70%を超えるジクロロヒドリンの蒸留収率が報告されている。上記の文献中に記載された方法では、蓄積された水を除去するための共沸剤として使用される、大気圧のHClの使用が必要とされる。他の共沸混合物が知られている。例えば、特許文献3には、水の反応的蒸留及び除去を促進するために、過剰の塩化水素(HCl)ガスと一緒にn−ブチルエーテルを使用することが記載されている。
【0013】
確かに、全ての先行技術は、高い転化率を得るための水との共沸混合物の蒸発及び水除去を達成するための大気圧よりも低い又は大気圧条件についてのプロセス必要条件を教示している。特許文献3では、再び大気圧条件で過剰のHClを使用して、水の反応的共沸蒸留及び除去を促進するための、添加した共沸剤(例えばn−ブチルエーテル)の有利な使用が主張されている。水の真空除去を使用する同様のアプローチは、特許文献4に教示されている。
【0014】
特許文献5には、無水塩化水素の手段による、グリセリンの接触塩化水素化によるクロロヒドリンの製造方法が教示されている。この文献では、大気圧条件で水の分離による回分式方法が教示されている。特許文献5には、上昇した圧力で塩化水素化反応方法を実施することは教示されていない。
【0015】
クロロヒドリンの製造のための全ての公知の先行技術では、水を、プロセスから共生成物として除去する、塩化水素化プロセスが報告されている。特に、特許文献6では、反応の水は、大気圧又は大気圧よりも低い方法で反応的蒸留によって除去する、一連の塩化水素化反応が教示されている。同様の技術は、特許文献7に於いて、より高い全圧力(HCl分圧は特定されていない)下で実施される反応によって、反応速度を改良することができるという追加の教示と共に教示されている。しかしながら、特許文献7に於いては、HCl分圧の使用及びその方法に於けるその影響は全く開示されていない。特許文献7には、また、大気圧又は大気圧よりも低い圧力下で、高い転化率及び選択率をもたらすために、水の除去が必要であることを例示している。特許文献6又は特許文献7の何れにも、それらの方法に於いて水を残すことの如何なる利点も又は水を除去することが、望ましくないクロロエタン及びRClの生成をもたらすことは教示されていない。
【0016】
極めて大過剰量の塩化水素(HCl)ガスの使用は経済的に問題であり、そして未反応の塩化水素の水との固有の混合は、容易に再循環できない水性塩化水素流になる。更に、決して完全ではないグリセリンの転化を達成するために、24〜48時間の反応時間が必要であるが、生成物には、しばしば、顕著な量の望ましくない過塩素化されたトリクロロプロパン及び塩素化されたエーテルが含有されている。アルコールを塩化物に転化するが、インシトゥで水を捕捉する試薬を使用する他の方法も公知である。例えば、非特許文献4に記載されているように、塩化チオニルは、グリセリンをクロロヒドリンに転化させるために使用でき、そして選択的であるが、化学量論的量のSO2を製造する。この試薬のコスト及び費用は、エピクロロヒドリン又は多ヒドロキシル化脂肪族炭化水素から誘導される任意の他のクロロヒドリンの工業的製造のために受け入れることができない。同様に、非特許文献5に記載されているように、穏和であり、そして有効である他の塩化水素化試薬は、この転換のために高価であり、そして普通ではないと考えられる。他の低温度方法は、非特許文献6に記載されているように、アルコールを、より良い離脱基(例えばメシレート)に転化し、そしてモル過剰で使用されるイオン性液体により塩化物の可溶性形を与える。再び、無水条件、化学量論的試薬及び塩化物の高価な形を必要とすることは、上記の方法の工業的考慮を阻止する。更に、非特許文献7に教示されているように、これらの試薬は、多ヒドロキシル化脂肪族炭化水素の消尽的塩素化を起こし、再び望ましくないRCl副生物に至り得る。
【0017】
要約すると、グリセリン又は任意の他のビシナル−ジオール、トリオール又は多ヒドロキシル化脂肪族炭化水素からクロロヒドリンを製造するための、上記の公知のアプローチの全てには、少なくとも5個の主な欠点が存在する。(1)グリセリン又は任意のジオールの塩化水素化のための大気圧方法では、大過剰の、しばしば7〜10倍モル過剰のHClが必要である。大気圧方法に於いて、過剰の無水HClは、次いで水で汚染される。(2)上記の公知の方法の変形は、非常に遅い回分式反応であり、これは、しばしば、100℃を超える温度で24〜48時間を要し、そして所望のクロロヒドリン生成物(類)への80〜90%転化率を超えない。(3)普通ではない塩化水素化試薬は、水を捕捉することによって反応を駆動するが、しばしば、商品の経済的製造と一致しない副生物を製造する。(4)上記のアプローチの全ては、グリセリン塩化水素化について前に定義したような、より高いレベルの望ましくないRClを製造する。(5)反応器内容物の蒸発を制御するために、反応を上昇した圧力で運転するとき、HClの低い分圧は、低い転化率又は遅延した反応速度になる。
【0018】
先行技術は、グリセリンのジクロロヒドリンへの完全な転化を促進するために、水除去が必要であると結論づけている。この水除去必要条件に適合するために、先行技術反応は、共溶媒又はチェイサー(chaser)及びプロセスのためのかなりの資本追加を必要とする、共沸的若しくは反応的蒸留又は抽出条件下で実施される。全ての先行技術は、反応混合物中の水の存在のために、この転化への平衡制限が存在すると結論づけた。
【0019】
産業に於いて、先行技術の欠点の全てを克服する、多ヒドロキシル化脂肪族炭化水素からの高純度のクロロヒドリンの製造のための塩化水素化方法を提供することが望まれている。従って、ジオール及びトリオールをクロロヒドリンに転化させる、単純で、費用効果的な方法を見出すことが、クロロヒドリン化学の技術分野に於ける進歩であろう。
【先行技術文献】
【特許文献】
【0020】
【特許文献1】国際特許出願公開第WO2002092586号明細書
【特許文献2】米国特許第6,288,248号明細書
【特許文献3】米国特許第2,144,612号明細書
【特許文献4】独国特許第1075103号明細書
【特許文献5】独国特許第197308号明細書
【特許文献6】国際特許出願公開第WO2005/021476号明細書
【特許文献7】国際特許出願公開第WO2005/054167号明細書
【非特許文献】
【0021】
【非特許文献1】Gibson,G.P.、Chemistry and Industry、1931年、第20巻、第949〜975頁
【非特許文献2】Conant等、Organic Synthesis CV 1、292〜294頁
【非特許文献3】Conant等、Organic Synthesis CV 1、295〜297頁
【非特許文献4】Carre,Mauclere C.R.Hebd.Seances Acad.Sci.、1930年、第192頁
【非特許文献5】Gomez等、Tetrahedron Letters、2000年、第41巻、第6049〜6052頁
【非特許文献6】Leadbeater等、Tetrahedron、2003年、第59巻、第2253〜58頁
【非特許文献7】Viswanathan等、Current Science、1978年、第21巻、第802〜803頁
【発明の概要】
【発明が解決しようとする課題】
【0022】
本発明の目的は、本発明の方法を使用して、望ましくないRCl又は塩素化されたグリセロールオリゴマーの生成を最小にすることである。
【課題を解決するための手段】
【0023】
本発明の一つの面は、クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物の製造方法であって、多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はこれらの混合物を、超大気圧の分圧の塩化水素の源泉と接触させて、水を実質的に除去することなく、クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物を製造する工程を含む方法に指向している。本明細書に於いて、「超大気圧(superatmospheric pressure)」は、塩化水素(HCl)分圧が、大気圧よりも高い、即ち、15psia又はそれ以上であることを意味する。
【0024】
本発明の一つの態様は、クロロヒドリンを製造するための塩化水素源として塩化水素ガスを使用する。
【0025】
第二の面に於いて、本発明は、クロロヒドリンの製造方法であって、例えば約20psia〜約1000psiaの範囲内の、HClの超大気圧の分圧で、例えば約25℃〜約300℃の範囲内の十分な温度で、(a)多ヒドロキシル化脂肪族炭化水素、例えば1,2−ジオール又は1,2,3−トリオール、(b)多ヒドロキシル化脂肪族炭化水素のクロロヒドリンへの転化を容易にする触媒、例えばカルボン酸、エステル、ラクトン、アミド又はラクタム及びそれらの混合物並びに(c)塩化水素源、例えば塩化水素ガスを一緒に、水を実質的に除去することなく、接触させる工程を含んでなる方法に関する。
【0026】
第三の面に於いて、本発明は、例えば約20psia〜約1000psiaの範囲内の、HClの超大気圧の分圧で、例えば約25℃〜約300℃の範囲内の十分な温度で、(a)多ヒドロキシル化脂肪族炭化水素のエステル、例えばグリセリンモノアセテート並びに(b)塩化水素源、例えば塩化水素を一緒に、水を実質的に除去することなく、接触させる工程を含んでなるクロロヒドリンの製造方法に関する。
【0027】
本発明の第四の面に於いては、新規な組成物を上記の方法によって製造することができる。
【0028】
先行技術の大気圧方法を超えた、本発明の超大気圧方法の利点には、例えば下記のものが含まれる。(1)本発明の方法は、水の除去が必要でなく、そして共溶媒/チェイサーが必要でない点で単純化される。本明細書に於いて、「超大気圧方法(superatmospheric pressure process)」は、塩化水素(HCl)分圧が、大気圧よりも上で、即ち、15psia又はそれ以上である条件下で、反応が起こる方法を意味する。本発明の方法は、追加の添加剤、例えば共沸剤無しに運転することができる。(2)水を除去することのない本発明の方法に於いて使用される触媒/HCl分圧/温度範囲は、多ヒドロキシル化脂肪族炭化水素のクロロヒドリンへの転化速度を、ほぼ20倍ほど加速する。先行技術は、先行技術方法が水除去を必要とするので、超大気圧HCl分圧を使用することが不利であった。(3)意外にも、高圧反応混合物中に蓄積された水は、先行技術よりもより高い選択率方法で、より速い転化速度を可能にする。即ち、先行技術の大気圧HCl方法よりも少ない塩素化されたエーテル、少ないRClが、本発明の方法に於いて生成される。(4)本発明の方法に於いて使用する触媒は、先行技術に於いて使用される他の触媒、例えば酢酸を超えた改良を示し、それによって選択率をより高くし、そしてプロセスの速度を増大させる。(5)本発明の超大気圧方法は、先行技術の大気圧方法よりも遙かに少ないHClを使用して、一層高い転化率を達成する(例えば、本発明では1〜25%HCl過剰であるのに対し、先行技術では700〜1400%過剰)。
【0029】
超大気圧方法によって、多ヒドロキシル化脂肪族炭化水素出発材料として粗製の湿潤グリセロールの使用が可能になり、なお更に、追加の水除去を必要とすることなく、先行技術よりも高い選択率及びより速い転化を達成する。
【0030】
本発明の触媒を使用することの別の利点は、低揮発性で再循環可能な触媒の使用から得られる単純化された方法及びその結果として改良されたプロセスの経済性である。
【0031】
本発明の超大気圧方法は、多ヒドロキシル化脂肪族炭化水素又はそのエステルをクロロヒドリンに、高い通過当たり収率(per-pass yield)(例えば90モル%よりも大きい)及び高い選択率(例えば90モル%よりも大きい)で、迅速に(例えば約12時間よりも短い)転化させるための手段を提供することによって、当該技術分野に於ける要求に取り組む。驚くべきことに、本発明の方法は、水の共沸的又はインシトゥ(in situ)除去無しに実施できる。
【0032】
本発明の上記の面は、超大気圧方法に向けられているが、超大気圧方法に於いて機能するある種の触媒は、水除去有り又は無しで、大気圧及び大気圧よりも低い条件でも、驚くほどよく機能することを見出した。従って、本発明の第五の面は、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物の製造方法であって、多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、触媒の存在下で、大気圧の又は大気圧よりも低い分圧の塩化水素源と接触させて、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物を製造する工程を含み、この触媒が、(i)2〜約20個の炭素原子を有し、そしてアミン、アルコール、ハロゲン、スルフヒドリル、エーテル、エステル若しくはこれらの組合せからなる群から選択された、少なくとも1個の官能基を含有するカルボキシレート誘導体(但し、この官能基は、α炭素よりも近くなく酸官能基に結合している)又はそれらへの前駆体であり、(ii)クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物よりも低い揮発性であり、そして(iii)ヘテロ原子置換基を含有する方法に指向している。
【0033】
本発明の第五の面内において、本発明の触媒構造の一つの態様は、一般的に、下記に示す式(a)によって表され、式中、官能基「R’」には、アミン、アルコール、ハロゲン、スルフヒドリル(sulfhydryl)、エーテルからなる官能基又はそれらの官能基を含有する炭素数1〜約20のアルキル、アリール若しくはアラルキル基又はこれらの組合せが含まれ、そして官能基「R」には、水素、アルカリ金属、アルカリ土類金属若しくは遷移金属又は炭化水素官能基が含まれてよい。
【0034】
【化2】

【図面の簡単な説明】
【0035】
【図1】1回通過、再循環無しのプロセスとして本明細書中で参照する本発明の方法の一態様を示すプロセスフローチャート。
【図2】触媒及び中間体再循環方法として本明細書中で参照する、本発明の方法の他の態様を示すプロセスフローチャート。
【図3】エステル交換反応を伴う触媒及び中間体再循環方法として本明細書中で参照する本発明の方法の他の態様を示すプロセスフローチャート。
【図4】本発明の一部ではない実施例を使用して実施された、時間の関数としての、グリセロールの、モノクロロヒドリン及びジクロロヒドリンへの転化の、モル%での量の結果を示すグラフ表示。
【発明を実施するための形態】
【0036】
本発明の一つの広い面に於いて、本発明は、多ヒドロキシル化脂肪族炭化水素又はそれらのエステルを、クロロヒドリン又はそれらのエステルに転化する方法であって、多ヒドロキシル化脂肪族炭化水素又はこれらのエステルを、塩化水素源と、超大気圧の分圧で、そして水除去の実質的不存在下で、クロロヒドリン又はそれらのエステルを製造するための反応条件下で接触させる工程を含む方法である。本明細書に於いて、「水除去の実質的不存在」は、反応方法工程又は工程群の間に、塩化水素化工程の間にプロセス中に存在する水(例えば、反応の水又は供給成分(類)と共に導入される水)を除去する方法を使用しないことを意味する。これらの方法には、任意の反応的、凝固点降下的、抽出的、共沸的、吸収的若しくは蒸発的なインシトゥ又はエクスシトゥ(ex-situ)技術又は水除去のための任意の公知の技術が含まれてよい。
【0037】
本明細書で使用する用語「多ヒドロキシル化脂肪族炭化水素」は、別個の飽和炭素原子に結合された少なくとも2個のヒドロキシル基を含有する炭化水素を指す。多ヒドロキシル化脂肪族炭化水素は、これらに限定するものではないが、2〜約60個の炭素原子が含有されていてよい。
【0038】
ヒドロキシル(OH)官能基を有する、多ヒドロキシル化脂肪族炭化水素の任意の単一の炭素も、1個より多いOH基を有していてはならず、そしてsp3混成されていなくてはならない。OH基を有する炭素原子は、第一級、第二級又は第三級であってよい。本発明に於いて使用する多ヒドロキシル化脂肪族炭化水素は、それぞれOH基を有する少なくとも2個のsp3混成炭素を含有していなくてはならない。多ヒドロキシル化脂肪族炭化水素には、より高次の近接又はビシナル繰り返し単位を含む、任意のビシナル−ジオール(1,2−ジオール)又はトリオール(1,2,3−トリオール)が含まれる。多ヒドロキシル化脂肪族炭化水素の定義には、また、例えば、1種又はそれ以上の、1,3−、1,4−、1,5−及び1,6−ジオール官能基が同様に含まれる。多ヒドロキシル化脂肪族炭化水素は、また、ポリビニルアルコールのようなポリマーであってもよい。例えば、ジェミナル−ジオールは、多ヒドロキシル化脂肪族炭化水素化合物のこの種類から除外される。
【0039】
多ヒドロキシル化脂肪族炭化水素には、芳香族単位又は、例えばハライド、硫黄、リン、窒素、酸素、ケイ素及びホウ素ヘテロ原子を含むヘテロ原子及びこれらの混合物が含有されていてよいことが、理解されるべきである。
【0040】
「クロロヒドリン」は、本明細書に於いて、別個の飽和炭素原子に結合された少なくとも1個のヒドロキシル基及び少なくとも1個のの塩素原子を含有する化合物を記載するために使用する。少なくとも2個のヒドロキシル基を含有するクロロヒドリンは、また、多ヒドロキシル化脂肪族炭化水素である。従って、本発明の出発材料及び生成物は、それぞれ、クロロヒドリンであってよく、この場合、生成物クロロヒドリンは、出発クロロヒドリンよりも一層高度に塩素化されており、即ち、出発クロロヒドリンよりも、多くの塩素原子及び僅かなヒドロキシル基を有する。好ましいクロロヒドリンは、例えば出発材料として使用されるクロロヒドリンである。ジクロロヒドリンのような一層好ましい高度に塩素化されたクロロヒドリンは、例えば本発明の方法の生成物であってよい。
【0041】
本発明に於いて有用である多ヒドロキシル化脂肪族炭化水素には、例えば1,2−エタンジオール、1,2−プロパンジオール、1,3−プロパンジオール、1−クロロ−2,3−プロパンジオール、2−クロロ−1,3−プロパンジオール、1,4−ブタンジオール、1,5−ペンタンジオール、シクロヘキサンジオール、1,2−ブタンジオール、1,2−シクロヘキサンジメタノール、1,2,3−プロパントリオール(また、「グリセリン」又は「グリセロール」として知られ、そして本明細書に於いて互換的に使用される)及びこれらの混合物が含まれる。好ましくは、本発明に於いて使用される多ヒドロキシル化脂肪族炭化水素には、例えば1,2−エタンジオール、1,2−プロパンジオール、1,3−プロパンジオール及び1,2,3−プロパントリオールが含まれ、1,2,3−プロパントリオールが最も好ましい。
【0042】
本発明に於いて有用である多ヒドロキシル化脂肪族炭化水素のエステルの例には、例えばエチレングリコールモノアセテート、プロパンジオールモノアセテート、グリセリンモノアセテート、グリセリンモノステアレート、グリセリンジアセテート及びこれらの混合物が含まれる。一つの態様に於いて、このようなエステルは、多ヒドロキシル化脂肪族炭化水素と完全にエステル化された多ヒドロキシル化脂肪族炭化水素との混合物、例えばグリセロールトリアセテートとグリセロールとの混合物から製造することができる。
【0043】
本発明の多ヒドロキシル化脂肪族炭化水素は、任意の望ましい限定されない濃度で使用することができる。一般的に、経済的理由のために、より高い濃度が好ましい。本発明のための有用な濃度には、例えば約0.01モル%〜約99.99モル%、好ましくは約1モル%〜約99.5モル%、更に好ましくは約5モル%〜約99モル%、最も好ましくは約10モル%〜約95モル%が含まれてよい。
【0044】
本発明に於いて使用する塩化水素源は、好ましくは、気体として、液体として又は溶液若しくは混合物中で又はこれらの混合物、例えば本発明の方法のために必要な塩化水素の分圧が与えられる限り、塩化水素と窒素ガスとの混合物で導入される。
【0045】
最も好ましい塩化水素源は塩化水素ガスである。塩化水素の必要な分圧が発生する限り、塩化物の他の形を本発明に於いて使用することができる。特に、塩化物は、相間移動剤、例えば第四級アンモニウム塩及びホスホニウム塩(例えばテトラブチルホスホニウムクロリド)に付随するものを含む多数のカチオンと共に導入することができる。その代わりに、イオン性液体、例えばn−ブチル−2−メチルイミダゾリウムクロリドを、多ヒドロキシル化脂肪族炭化水素からのOHの酸触媒作用置換を促進するための相乗剤として使用することができる。
【0046】
これらの他のハロゲン化物源が、アルコールの塩化水素化のための共触媒として作用し得ることも公知である。この点に関して、触媒量のヨウ化物又は臭化物を、これらの反応を加速するために、使用することができる。これらの試薬は、相間移動又はイオン性液体フォーマットを使用して、気体、液体又は対イオン塩として導入することができる。試薬は、また、金属塩(ここで、アルカリ又は遷移金属対イオンは、多ヒドロキシル化脂肪族炭化水素の酸化を促進しない)として導入することもできる。RCl生成の可能性が増加し得るので、制御された塩化水素化方法に於いてこれらの共触媒を使用する際に注意を払わなくてはならない。ハライドの異なった源泉の混合物、例えば塩化水素ガスと、イオン性塩化物、例えばテトラアルキルアンモニウムクロリド又は金属ハライドとを使用することができる。例えば、金属ハライドは、塩化ナトリウム、ヨウ化カリウム、臭化カリウム等であってよい。
【0047】
出発材料としての多ヒドロキシル化脂肪族炭化水素のエステルとは対称的に、多ヒドロキシル化脂肪族炭化水素が出発材料である本発明の態様に於いて、クロロヒドリンの生成を、触媒の存在によって促進させることが好ましい。多ヒドロキシル化脂肪族炭化水素のエステル、好ましくは部分エステルが出発材料として使用される、本発明の別の態様に於いて、触媒は固有的にそのエステル中に存在し、従って、別の触媒成分の使用は任意である。しかしながら、所望の生成物への転化を更に促進するために、追加の触媒が、本発明の方法の中になお含有されていてよい。追加の触媒は、また、出発材料に、エステル化された多ヒドロキシル化脂肪族炭化水素とエステル化されていない多ヒドロキシル化脂肪族炭化水素との組合せが含まれている場合に使用することができる。
【0048】
本発明の超大気圧方法に於いて触媒を使用するとき、この触媒は、例えばカルボン酸、無水物、酸クロリド、エステル、ラクトン、ラクタム、アミド、金属有機化合物、例えば酢酸ナトリウム又はこれらの混合物であってよい。本発明の反応条件下で、カルボン酸又は官能化されたカルボン酸に転化できる如何なる化合物も使用することができる。
【0049】
超大気圧方法のための好ましいカルボン酸は、ハロゲン、アミン、アルコール、アルキル化アミン、スルフヒドリル、アリール基若しくはアルキル基又はこれらの組合せからなる官能基(但し、この部分(moiety)は、カルボン酸基を立体的に妨害しない)を有する酸である。本発明の方法のための好ましい酸は酢酸である。
【0050】
本発明に於いて触媒として有用であるカルボン酸の例には、酢酸、プロピオン酸、4−メチル吉草酸、アジピン酸、4−ヒドロキシフェニル酢酸、6−クロロヘキサン酸、4−アミノ酪酸、ヘキサン酸、ヘプタン酸、4−ジメチルアミノ酪酸、6−アミノヘキサン酸、6−ヒドロキシヘキサン酸、4−アミノフェニル酢酸、4−トリメチルアンモニウム酪酸クロリド、ポリアクリル酸、アクリル酸でグラフト化されたポリエチレン、ジビニルベンゼン/メタクリル酸コポリマー及びそれらの混合物が含まれる。無水物の例には、無水酢酸、無水マレイン酸及びこれらの混合物が含まれる。酸クロリドの例には、アセチルクロリド、6−クロロヘキサノイルクロリド、6−ヒドロキシヘキサノイルクロリド及びこれらの混合物が含まれる。エステルの例には、酢酸メチル、プロピオン酸メチル、ピバル酸メチル、酪酸メチル、エチレングリコールモノアセテート、エチレングリコールジアセテート、プロパンジオールモノアセテート、プロパンジオールジアセテート、グリセリンモノアセテート、グリセリンジアセテート、グリセリントリアセテート、カルボン酸のグリセリンエステル(グリセリンモノ−、ジ−及びトリエステルを含む)及びこれらの組合せが含まれる。最も好ましいラクトンの例には、ε−カプロラクトン、γ−ブチロラクトン、δ−バレロラクトン及びそれらの混合物が含まれる。ラクタムの例はε−カプロラクタムである。酢酸亜鉛が金属有機化合物の例である。
【0051】
本発明に於いて使用する好ましい触媒は、カルボン酸、カルボン酸のエステル又はこれらの組合せ、特に、触媒を除去することなく、クロロヒドリンを除去できるように、反応混合物中で生成される所望の最高沸点のクロロヒドリンのものよりも高い沸点を有するエステル又は酸である。この定義に適合し、そして本発明に於いて有用である触媒には、例えばポリアクリル酸、カルボン酸のグリセリンエステル(グリセリンモノ−、ジ−及びトリエステルを含む)、アクリル酸でグラフト化されたポリエチレン、6−クロロヘキサン酸、4−クロロブタン酸、カプロラクトン、ヘプタン酸、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、6−ヒドロキシヘキサン酸、4−アミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、ステアリン酸、5−クロロ吉草酸、6−ヒドロキシヘキサン酸、4−アミノフェニル酢酸及びそれらの混合物が含まれる。
【0052】
カルボン酸、RCOOHは、多ヒドロキシル化脂肪族炭化水素のクロロヒドリンへの塩化水素化に触媒作用する。本発明の方法のために選択された特定のカルボン酸触媒は、例えば触媒としてのその効能、そのコスト、反応条件に対するその安定性及びその物理的特性を含む多数の要因に基づいてよい。触媒が使用されるべき特定の方法及び方法図式も、本発明の方法のための特別の触媒を選択する際の要因であり得る。カルボン酸の「R」基は、水素又はアルキル、アリール、アラルキル及びアルカリールを含むヒドロカルビル基から選択することができる。このヒドロカルビル基は、直鎖、分枝鎖又は環式であってよく、そして置換されていてよく又は非置換でもよい。許容される置換基には、触媒の性能に有害に干渉せず、そしてヘテロ原子を含有していてよい任意の官能基が含まれる。許容される官能基の限定しない例には、塩化物、臭化物、ヨウ化物、ヒドロキシル、フェノール、エーテル、アミド、第一級アミン、第二級アミン、第三級アミン、第四級アンモニウム、スルホネート、スルホン酸、ホスホネート及びホスホン酸が含まれる。
【0053】
本発明に於いて有用であるカルボン酸は、酢酸、ギ酸、プロピオン酸、イソ酪酸、ヘキサン酸、ヘプタン酸、オレイン酸若しくはステアリン酸のような一塩基性又はコハク酸、アジピン酸若しくはテレフタル酸のような多塩基性であってよい。アラルキルカルボン酸の例には、フェニル酢酸及び4−アミノフェニル酢酸が含まれる。置換されたカルボン酸の例には、4−アミノ酪酸、4−ジメチルアミノ酪酸、6−アミノカプロン酸、4−アミノフェニル酢酸、4−ヒドロキシフェニル酢酸、乳酸、グリコール酸、4−ジメチルアミノ酪酸及び4−トリメチルアンモニウム酪酸が含まれる。更に、例えば、カルボン酸ハライド、例えばアセチルクロリド、カルボン酸無水物、例えば無水酢酸、カルボン酸エステル、例えば酢酸メチル、多ヒドロキシル化脂肪族炭化水素アセテート、例えばグリセロール1,2−ジアセテート、カルボン酸アミド、例えばε−カプロラクタム及びγ−ブチロラクタム並びにカルボン酸ラクトン、例えばγ−ブチロラクトン、δ−バレロラクトン及びε−カプロラクトンを含む、反応条件下でカルボン酸に転化させることができる物質も、本発明に於いて使用することができる。カルボン酸の混合物も、本発明に於いて使用することができる。
【0054】
本発明に於いて使用することができる幾つかのカルボン酸触媒、例えばカルボン酸基に近い立体的に要求する置換基を有するもの、例えば2,2−ジメチル酪酸、立体的に妨害された2−置換された安息香酸、例えば2−アミノ安息香酸及び2−メチルアミノ安息香酸は、本発明の塩化水素化方法に於いて他のものよりも効率が低い。この理由のために、カルボン酸基の周りに立体的に邪魔物がないカルボン酸が一層好ましい。
【0055】
超大気圧分圧のHCl条件を使用する本発明の方法に於いて、本発明に於いて使用される好ましい酸触媒には、例えば酢酸、プロピオン酸、酪酸、イソ酪酸、ヘキサン酸、ヘプタン酸、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、コハク酸、6−クロロヘキサン酸、6−ヒドロキシヘキサン酸及びこれらの混合物が含まれる。
【0056】
本発明の別の面に於いて、前記の超大気圧方法に於いて機能する本発明の触媒の幾つかは、また、水除去有り又は無しで、大気圧及び大気圧よりも低い条件でも、驚くほどよく機能することができる。従って、本発明の第五の面は、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物の製造方法であって、多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、触媒の存在下で、超大気圧の、大気圧の又は大気圧よりも低い分圧の塩化水素源と接触させて、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物を製造する工程を含み、この触媒が、(i)2〜約20個の炭素原子を有し、そしてアミン、アルコール、ハロゲン、スルフヒドリル、エーテル、エステル若しくはこれらの組合せからなる群から選択された、少なくとも1個の官能基を含有するカルボキシレート誘導体(但し、この官能基は、α炭素よりも近くなく酸官能基に結合している)又はそれらへの前駆体であり、(ii)クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物よりも低い揮発性であり、そして(iii)ヘテロ原子置換基を含有する方法に指向している。
【0057】
本発明の第五の面内で、本発明の触媒構造の一つの態様は、一般的に、下記に示す式(a)によって表され、式中、官能基「R’」には、アミン、アルコール、ハロゲン、スルフヒドリル、エーテルからなる官能基又は前記官能基を含有する炭素数1〜約20のアルキル、アリール若しくはアラルキル基又はこれらの組合せが含まれ、そして官能基「R」には、水素、アルカリ金属、アルカリ土類金属若しくは遷移金属又は炭化水素官能基が含まれてよい。
【0058】
【化3】

【0059】
本発明の第五の面に従って、ある種の触媒は、また、超大気圧、大気圧又は大気圧よりも低い圧力で、特に、水が、反応混合物から連続的に又は周期的に除去されて、転化を望ましく高いレベルにまで駆動する状況に於いて、有利に使用することができる。例えば、グリセロールの塩化水素化反応は、多ヒドロキシル化脂肪族炭化水素及び触媒の混合物を通して、塩化水素ガスを散布することによって実施することができる。このような方法に於いて、揮発性触媒、例えば酢酸は、溶液を通って散布されている塩化水素ガスによって、反応溶液から少なくとも部分的に除去され、そして反応媒体から失われる。触媒濃度が減少するために、多ヒドロキシル化脂肪族炭化水素の所望のクロロヒドリンへの転化は、その結果として遅くなる。このような方法に於いて、蒸発し難い触媒、例えば6−ヒドロキシヘキサン酸、4−アミノ酪酸、ジメチル4−アミノ酪酸、6−クロロヘキサン酸、カプロラクトン、カルボン酸アミド、例えばε−カプロラクタム及びγ−ブチロラクタム、カルボン酸ラクトン、例えばγ−ブチロラクトン、δ−バレロラクトン及びε−カプロラクトン、カプロラクタム、4−ヒドロキシフェニル酢酸、6−アミノカプロン酸、4−アミノフェニル酢酸、乳酸、グリコール酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸並びにそれらの混合物等の使用が好ましい。これらの大気圧又は大気圧よりも低い条件下で、製造される所望のクロロヒドリンよりも揮発性でない触媒を使用することが最も望ましい。更に、この触媒が、使用される多ヒドロキシル化脂肪族炭化水素と完全に混和性であることが望ましい。触媒が完全に混和性でない場合、これは第二相を形成し、そして完全な触媒効果が実現されない。この理由のために、触媒が、触媒を多ヒドロキシル化脂肪族炭化水素、例えばグリセロールと混和性にする極性ヘテロ原子置換基、例えばヒドロキシル、アミノ若しくは置換されたアミノ又はハライド基を含有することが望ましい。
【0060】
本発明の方法で使用するための触媒、例えばカルボン酸触媒の選択は、また、多ヒドロキシル化脂肪族炭化水素塩化水素化のために使用される特定のプロセス図式によって支配される。例えば、多ヒドロキシル化脂肪族炭化水素が、できるだけ高い転化率で所望のクロロヒドリンに反応され、次いで触媒からの分離無しに、他の生成物に更に転化される1回通過プロセスに於いて、カルボン酸触媒は、続いて更に利用されない。このようなプロセススキームに於いて、カルボン酸は、有効であることに加えて、安価であることが望ましい。このような状況に於いて、好ましいカルボン酸触媒は、例えば酢酸である。
【0061】
例えば、製造されたクロロヒドリンをカルボン酸触媒から分離し、その後、更に処理又は使用する、再循環方法に於いて、カルボン酸触媒は、追加的に、所望のクロロヒドリン生成物からの、触媒及びその反応生成物とのエステルの分離の容易性に基づいて選択される。このような場合に、それを、更なる反応のために未反応のグリセロール又は中間体モノクロロヒドリンと共に反応器に容易に再循環できるような、重い(即ち、より低い揮発性の)酸を使用することが好ましい。本発明に於いて有用である適当な重い酸には、例えば4−ヒドロキシフェニル酢酸、ヘプタン酸、4−アミノ酪酸、カプロラクトン、6−ヒドロキシヘキサン酸、6−クロロヘキサン酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド及びこれらの混合物が含まれる。
【0062】
また、酸又はその塩化水素化される多ヒドロキシル化脂肪族炭化水素とのエステル又はその反応中間体若しくは反応生成物とのエステルが、反応溶液中で混和性であることが好ましい。この理由のために、これらの溶解度制約を考慮に入れてカルボン酸触媒を選択することが望ましい。従って、例えば塩化水素化される多ヒドロキシル化脂肪族炭化水素が、グリセロールのように非常に極性である場合、幾つかのカルボン酸触媒は、完全よりも低い溶解度を示し、混合した際に二相を形成する。このような場合に、一層混和性である酸触媒、例えば酢酸又は4−アミノ酪酸が望ましい。
【0063】
本発明に於いて有用である触媒は、広範囲の濃度に亘って、例えば多ヒドロキシル化脂肪族炭化水素の1モル基準で、約0.01モル%から約99.9モル%まで、好ましくは約0.1モル%から約67モル%まで、更に好ましくは約0.5モル%から約50モル%まで、最も好ましくは約1モル%から約40モル%まで有効である。本発明に於いて使用する触媒の特定の濃度は、本発明に於いて使用する特定の触媒及びそのような触媒が使用されるプロセス図式に依存するであろう。
【0064】
例えば、触媒を1回だけ使用し、次いで廃棄する1回通過プロセスに於いては、低濃度の高度に活性の触媒を使用することが好ましい。更に、安価な触媒を使用することが望ましい。このような方法に於いて、例えば多ヒドロキシル化脂肪族炭化水素基準で、約0.01モル%から約10モル%まで、好ましくは約0.1モル%から約6モル%まで、更に好ましくは約1モル%から約5モル%までの濃度を使用できる。
【0065】
例えば、触媒を再循環し、そして繰り返して使用するプロセス図式に於いては、廃棄する触媒のときよりも高い濃度を使用することが望ましい。このような再循環する触媒は、多ヒドロキシル化脂肪族炭化水素基準で、約1モル%から約99.9モル%まで、好ましくは約5モル%から約70モル%まで、更に好ましくは約5モル%から約50モル%まで使用することができるが、これらの濃度は限定ではないと考えるべきである。反応時間を短縮し、プロセス装置のサイズを最小にし、そして望ましくない触媒作用されない副生物の生成を減少するために、より高い触媒濃度を望ましく使用することができる。
【0066】
一般的に、本発明の方法は、超大気圧条件下で実施することが好ましい。本明細書に於いて、「超大気圧」は、塩化水素(HCl)分圧が、大気圧よりも上、即ち、15psia又はそれ以上であることを意味する。一般的に、本発明の方法に於いて使用する塩化水素分圧は、少なくとも約15psia HCl又はそれ以上である。好ましくは、本発明の方法の圧力は、約25psia又はそれ以上、更に好ましくは約35psia HCl又はそれ以上、最も好ましくは約55psia又はそれ以上で、好ましくは約1000psia HCl又はそれ以下、更に好ましくは約600psia又はそれ以下、最も好ましくは約150psia又はそれ以下である。
【0067】
本発明に於いて使用するHClは、最も好ましくは無水である。HCl組成は、100体積%の塩化水素から約50体積%の塩化水素までの範囲であってよい。好ましくは、HCl供給物組成は、約50体積%HClよりも大きく、更に好ましくは約90体積%HClよりも大きく、最も好ましくは約99体積%HClよりも大きい。
【0068】
本発明プロセスの実施に於いて有用である温度は、経済的な反応速度を与えるために十分であるが、出発材料、生成物又は触媒安定性が危うくなるほど高くはない。更に、高い温度は、望ましくない触媒作用しない反応、例えば非選択的過塩素化の速度を増加させ、そして装置腐食の増加した速度になり得る。本発明に於いて有用な温度は、一般的に約25℃〜約300℃、好ましくは約25℃〜約200℃、更に好ましくは約30℃〜約160℃、なお更に好ましくは約40℃〜約150℃、最も好ましくは約50℃〜約140℃であってよい。
【0069】
本発明の超大気圧方法の反応は、有利に速く、そして約12時間より短く、好ましくは約5時間より短く、更に好ましくは約3時間より短く、最も好ましくは約2時間より短い時間で実施することができる。約12時間よりも長いような、より長い反応時間で、この方法は、RCl及びその他の過塩素化副生物を生成し始める。
【0070】
驚くべきことに、本発明の超大気圧方法を使用して、高い通過当たり収率及び高い選択率を達成できることが見出された。例えば、約80%よりも高い、好ましくは約85%よりも高い、更に好ましくは約90%よりも高い、最も好ましくは約93%よりも高い、多ヒドロキシル化脂肪族炭化水素基準のクロロヒドリンについての通過当たり収率を、本発明によって達成できる。例えば約80%よりも高い、好ましくは約85%よりも高い、更に好ましくは約90%よりも高い、最も好ましくは約93%よりも高い、クロロヒドリンの高い選択率を、本発明の方法によって達成できる。勿論、収率は、反応中間体を再循環することによって増加させることができる。
【0071】
例えば、本発明に於いて使用する多ヒドロキシル化脂肪族炭化水素がグリセロールであるとき、中間体モノクロロヒドリンを再循環することによって、達成されるジクロロヒドリンの最終収率を増加させることができる。更に、先行技術の方法の多くとは違って、クロロヒドリンを生成する反応を実施する際に、水除去は、本発明の方法の本質的な特徴ではない。実際に、本発明の反応は、水の共沸的除去のような水除去の不存在下で優先的に実施される。
【0072】
本発明の超大気圧方法に於いて、また、水、塩又は多ヒドロキシル化脂肪族炭化水素以外の有機不純物のような汚染物質を含有していない出発材料を使用することは必須ではない。従って、出発材料に、一般的に約50重量%以下のこのような汚染物質が含有されていてよい。例えば、水(約5〜約25重量%)、アルカリ(例えばナトリウム又はカリウム)若しくはアルカリ土類(例えばカルシウム又はマグネシウム)金属塩(約1〜約20重量%)及び/又はカルボン酸アルカリ塩(約1〜約5重量%)を含有し得る粗製1,2,3−プロパントリオール(粗製グリセロール)も、本発明に於いて使用して、所望の生成物を有効に製造することができる。従って、本発明の方法は特に経済的なアプローチである。
【0073】
本発明の方法の一つの態様に於いて、1,2,3−プロパントリオール(グリセロール)を、密閉した容器内に入れ、そして前記の触媒量のカルボン酸又はそのエステルの存在下で、HClガスの雰囲気下で、加熱し、加圧する。プロセスの好ましい条件下で、主生成物は、少量(例えば、<10%合計収率)の下記の生成物、即ち1−クロロ−2,3−プロパンジオール、2−クロロ−1,3−プロパンジオール及び2,3−ジクロロプロパン−1−オール並びに検出できない量(200ppm未満)の1,2,3−トリクロロプロパンを含有する、1,3−ジクロロプロパン−2−オール(例えば、>90%収率)である。有利なことに、主及び副二塩素化生成物(1,3−ジクロロプロパン−2−オール及び2,3−ジクロロプロパン−1−オール)は、エピクロロヒドリンへの前駆体である。この二塩素化生成物は、当該技術分野で公知であるような、塩基との反応によってエピクロロヒドリンに、容易に転化させることができる。
【0074】
本発明には、例えば、回分式、半回分式又は連続式を含む、種々のプロセス図式が含まれてよい。一つの態様に於いて、例えば、本発明には、塩化水素との反応による多ヒドロキシル化脂肪族炭化水素の塩化水素化が含まれる。多ヒドロキシル化脂肪族炭化水素は、生で使用することができ又は適当な溶媒中に希釈させることができる。このような溶媒には、例えば、水及びアルコールが含まれてよい。使用の前に、水、有機物質又は無機物質を含む汚染物質を除去することによって、それを塩化水素化反応に使用する前に、多ヒドロキシル化脂肪族炭化水素を精製することが好ましい。この精製には、公知の精製技術、例えば蒸留、抽出、吸収、遠心分離又は他の適切な方法が含まれてよい。多ヒドロキシル化脂肪族炭化水素は、一般的に、液体として方法に供給されるが、これは絶対的に必須ではない。
【0075】
本発明方法で使用される塩化水素は、好ましくはガス状である。しかしながら、塩化水素を、所望により、溶媒、例えばアルコール(例えばメタノール)中に又は担体ガス、例えば窒素中に希釈することができる。任意的に、塩化水素を、使用の前に精製して、任意の望ましくない汚染物質を除去することができる。塩化水素は実質的に無水であることが好ましいが、塩化水素中に存在する幾らかの量(例えば約50モル%未満、好ましくは約20モル%未満、更に好ましくは約10モル%未満、なお更に好ましくは約5モル%未満、最も好ましくは約3モル%未満)の水は、過度に有害ではない。塩化水素は、任意の適当な方法でプロセス装置に供給される。プロセス装置は、本発明の方法に於いて使用される塩化水素化反応器全体への塩化水素の良好な分散を確実にするように設計される。従って、1個又は多数個のスパージャー、バッフル及び効率的な攪拌機構が望ましい。
【0076】
使用される触媒は、プロセス装置に、独立で又は多ヒドロキシル化脂肪族炭化水素若しくは塩化水素供給物との混合物として若しくはこれらの成分として供給することができる。
【0077】
本発明の塩化水素化反応のために有用な装置は、当該技術分野で公知の任意の装置であってもよく、そして塩化水素化の条件で反応混合物を含有できなくてはならない。適切な装置は、プロセス成分による腐食に対して耐性であり、そして例えばタンタルのような金属、ハスタロイ(Hastalloy)C(登録商標)のような適切な合金又はガラスライニングされた装置を含む材料から製作することができる。適切な装置には、例えば1個又は複数個の、攪拌槽、チューブ若しくはパイプ又はこれらの組合せが含まれてよい。
【0078】
代表的回分式方法に於いて、多ヒドロキシル化脂肪族炭化水素及び塩化水素化触媒を反応器に装入する。次いで、塩化水素を所望の圧力まで添加し、そして反応器内容物を、所望の温度に、所望の長さの時間加熱する。次いで、反応器内容物を反応器から排出し、そして精製するか又は次の処理のために他の装置に送るか若しくは貯蔵に送る。
【0079】
代表的半回分式方法に於いて、他の試薬を反応の開始時にのみ供給し、1種又はそれ以上の試薬を、反応の全期間に亘って反応器に供給する。このような方法に於いて、例えば、多ヒドロキシル化脂肪族炭化水素及び触媒を、単一回分で塩化水素化反応器に供給し、次いでこれを適当な時間、反応条件で維持し、その間に、塩化水素を、所望の速度(これは、一定流量又は一定圧力であってよい)で、反応の全期間に亘って連続的に供給することができる。反応後、塩化水素供給を終結させ、そして反応器内容物を、貯蔵、精製又は更なる処理のために排出することができる。
【0080】
化学品の大規模製造に於いて、連続式方法を使用することが、そのようにすることの経済的利点が、通常、回分式処理よりも大きいので、しばしば望ましい。連続式方法は、例えば、1回通過又は再循環プロセスであってよい。1回通過プロセスに於いて、1種又はそれ以上の試薬を、プロセス装置に1回通過させ、次いで反応器からの得られる排出物を、精製又は更なる処理のために送る。このような図式に於いて、多ヒドロキシル化脂肪族炭化水素及び触媒を装置に供給し、そして塩化水素を、プロセス装置(これには、連続攪拌型槽反応器、チューブ、パイプ又はこれらの組合せが含まれてよい)全体の1点又は複数点で、所望のときに添加することができる。
【0081】
その代わりに、使用する触媒は、フィルター又は等価の装置の手段によって、プロセス装置内に留まっている固体であってよい。試薬及び触媒を、プロセス装置内の滞留時間が、多ヒドロキシル化脂肪族炭化水素の生成物への所望の転化率を達成するために適切であるような速度で供給する。プロセス装置から出る材料を、所望により、貯蔵、精製又は更なる処理のために送る。このようなプロセスに於いて、できるだけ多くの多ヒドロキシル化脂肪族炭化水素を所望の生成物に転化させることが、一般的に望ましい。
【0082】
連続式再循環プロセスに於いて、プロセス装置から出る、未反応の多ヒドロキシル化脂肪族炭化水素、反応中間体、塩化水素又は触媒の1種又はそれ以上を、プロセスのより前の点に戻し再循環する。このプロセスに於いて、原材料効率が最大化されるか又は触媒が再使用される。このようなプロセス図式に於いて、触媒は再使用されるので、触媒が、1回通過プロセス(この場合、触媒はしばしば廃棄される)に於いて使用されるよりも高い濃度で、触媒を使用することが望ましい。これは、より速い反応又はより小さいプロセス装置になり得、これは使用する装置のための、より低い資本コストになる。
【0083】
触媒又は他のプロセス成分からの所望の生成物の除去は、種々の方法によって達成することができる。例えば、連続方式での蒸発により、塩化水素化反応器から直接的に又は蒸発器若しくは蒸留塔のような装置の別の部分から、分離を達成することが可能であろう。このような場合に、所望の生成物よりも低い揮発性である触媒を使用し、そうして触媒はプロセス装置内に残留するようになる。その代わりに、固体触媒を使用することができ、そして分離は、例えば濾過、遠心分離又は蒸発によって達成できる。幾つかの場合に、触媒又は反応中間体を再循環するために、液体抽出、吸収又は化学反応を使用することもできる。
【0084】
本発明の一つの態様に於いて、多ヒドロキシル化脂肪族炭化水素は、所望の塩化水素化生成物よりも低い揮発性であるように選択された塩化水素化触媒を使用して、塩化水素化される。塩化水素化反応の後、追加の多ヒドロキシル化脂肪族炭化水素を、反応生成物、過剰の出発材料、反応中間体及び触媒に添加する。これは、触媒のエステルとして存在したであろう所望の塩化水素化生成物の幾らかを遊離し、そうして所望の生成物を、蒸発によって反応溶液から一層完全に回収することができると考えられる。所望の塩化水素化生成物を回収した後、プロセス流の残りを、塩化水素化流に再循環することができる。このプロセス図式は、また、多ヒドロキシル化脂肪族炭化水素の添加後にプロセス流中に残留している塩化水素の多くが、新たに添加された多ヒドロキシル化脂肪族炭化水素との反応によって消費されるので、塩化水素損失の量を最小にするという利点を有する。
【0085】
使用される特別のプロセス図式は、例えば、塩化水素化される多ヒドロキシル化脂肪族炭化水素の素性、コスト及び純度、使用する特定のプロセス条件、生成物を精製するために必要な分離並びにその他の要因を含む多数の要因に依存するであろう。本明細書に記載したプロセスの例は、本発明を限定するとして考えるべきではない。
【0086】
図1、2及び3は、本発明の塩化水素化プロセスの3種の限定しない態様を示す。図1、2及び3に示した本発明のプロセスを例示する実施例は、本発明の好ましい態様に過ぎない。
【0087】
例えば、図1は、数字10によって全体的に示される、本発明のプロセスを示し、ここで、多ヒドロキシル化脂肪族炭化水素、例えばグリセロール供給物流11は、反応容器15の中に導入される。反応容器15は、例えば、1個又はそれ以上の、連続攪拌型槽反応器(CSTR)若しくは管型反応器又はこれらの組合せを含む、任意の公知の適当な型のものであってもよい。
【0088】
容器15には、塩化水素供給物流12及びカルボン酸又はカルボン酸前駆体触媒供給物流13も導入される。流れ12及び流れ13は、容器15の中に、別々に又は一緒に導入させることができる。更に、任意的に、流れ11、流れ12及び流れ13の全てを、1個の供給物流の中に一緒に組み合わせることができる。任意の流れ11、流れ12又は流れ13を、容器15の1個の点で又は複数個の点で導入することができる。容器15に於いて、グリセロールは、カルボン酸触媒とのそのエステル、モノクロロヒドリン及びジクロロヒドリン並びにそれらのエステルに、部分的に又は完全に転化される。例えばジクロロヒドリン、モノクロロヒドリン、未反応グリセロール及びそれらのエステル、水、未反応の塩化水素並びに触媒を含有する流れ14が、容器15から出て、貯蔵に、精製のような更なる処理に又は更なる反応のための他の装置に送られる。
【0089】
例えば、一つの態様に於いて、流れ14を塩基と反応させて、エピクロロヒドリンを生成させることができる。このようなプロセスに於けるカルボン酸触媒は、低濃度でのその効能及びその低コストに基づいて選択することができる。例えば、カルボン酸は、酢酸又はプロピオン酸であってよい。
【0090】
図2は、数字20によって全体的に示される、本発明の方法の他の態様を示し、ここで、多ヒドロキシル化脂肪族炭化水素、例えばグリセロールを含有する供給物流21は、容器26に供給され、容器26は、1個又はそれ以上の、CSTR若しくは管型反応器又はこれらの組合せであってよい。また、容器26には、塩化水素を含有する供給物流22が供給される。また、容器26には、例えば未反応のグリセロール、モノクロロヒドリン及び触媒とのそのエステルを含有する、容器27から再循環された再循環流25が供給され、触媒もまた、この流25内で再循環する。
【0091】
容器26内で、グリセロールは、モノクロロヒドリン及びそれらのエステルに転化され、そしてモノクロロヒドリンは、ジクロロヒドリン及びこれらのエステルに転化される。例えばジクロロヒドリン、モノクロロヒドリン、未反応グリセロール及びカルボン酸触媒とのこれらのエステル、水、未反応の塩化水素並びに触媒を含有する流れ23が、容器26から出て、容器27に供給される。容器27内で、流れ24としての、所望のジクロロヒドリン、水及び未反応の塩化水素の少なくとも幾らかは、容器26に再循環される再循環流25としての、モノクロロヒドリン及びこれらのエステル、未反応のグリセロール及びこれらのエステル並びに触媒から分離される。流れ25には、また、任意的に、幾らかのジクロロヒドリン及びこれらのエステルが含有されていてよい。
【0092】
容器27は、1個又はそれ以上の、蒸留塔、フラッシュ容器、抽出若しくは吸収塔又は当該技術分野で公知である任意の適当な公知の分離装置を含む、任意の公知の適当な分離容器からなっていてもよい。生成物流24は、貯蔵に、更なる処理、例えば精製に又は更なる反応、例えばエピクロロヒドリンへの転化に送られる。このプロセス図式の一つの実施例に於いて、触媒は、その化学的又は物理的特性が、所望のジクロロヒドリンからの触媒又はそのエステルの容易な分離になるように選択することができる。例えば、このプロセス図式のために選択される触媒は、6−クロロヘキサン酸、カプロラクトン、4−クロロ酪酸、ステアリン酸又は4−ヒドロキシフェニル酢酸であってよい。
【0093】
図3は、数字30によって全体的に示される、本発明プロセスの他の態様を示し、ここで、容器36には、塩化水素を含有する供給物流31並びに流れ35により、グリセロール、グリセロールエステル、モノクロロヒドリン及びそれらのエステル並びに触媒を含有する再循環流が供給される。1個若しくはそれ以上のCSTR、1個若しくはそれ以上の管型反応器又はこれらの組合せからなっていてよい容器36内に於いて、グリセロール及びモノクロロヒドリンは、ジクロロヒドリンに転化される。例えばジクロロヒドリン、モノクロロヒドリン、グリセロール及びこれらのエステル、触媒、未反応塩化水素並びに水を含有する流れ32は、容器36から出て、容器37に供給される。また、容器37には、グリセロールを含有する供給物流33が供給される。
【0094】
容器37内に於いて、グリセロールは、モノクロロヒドリン及びジクロロヒドリンのエステルと反応して、遊離のモノクロロヒドリン及びジクロロヒドリンを単離し、グリセロールエステルを生成する。更に、流れ32により容器37に入る未反応の塩化水素の少なくとも幾らかは、また、主としてモノクロロヒドリンを生成するために消費される。容器37は、また、所望のジクロロヒドリンを、未反応のモノクロロヒドリン及びグリセロール並びにそれらのエステルから分離するための手段として機能することができる。容器37には、例えば、1個若しくはそれ以上の、蒸留塔、フラッシュ容器、抽出器若しくは任意の他の分離装置が含まれていてよく又は容器37は、例えば攪拌槽、管型反応器若しくは前記の分離装置を有する同様の容器の組合せであってよい。容器37から出る、そしてジクロロヒドリン、水及び残留塩化水素を含有する生成物流34は、貯蔵に、更なる処理、例えば精製に又は更なる反応、例えばエピクロロヒドリンを製造するための反応プロセスに送られる。グリセロール及びモノクロロヒドリン並びにこれらのエステル並びに触媒を含有する流れ35は、容器37から出て、流れ35として、容器36に再循環される。
【0095】
図3のプロセス配置に於いて、比較的多量、例えばグリセロール基準で約10モル%〜約70モル%の触媒を使用して、容器36内の塩化水素化反応の速度が非常に速く、そしてその結果として装置が小さくなるようにすることが望ましい。また、図3のプロセス配置に於いて、触媒が、容器37内の分離が容易に実施されるような化学的又は物理的特性を有することが好ましく、例えば、分離方法が蒸留であるとき、最低沸点のジクロロヒドリンが沸騰する温度よりも実質的に低い温度で沸騰する触媒の使用が好ましい。このような触媒の例には、6−クロロヘキサン酸、ヘプタン酸及び4−ヒドロキシフェニル酢酸が含まれる。
【0096】
本発明には、また、本発明の方法によって製造された新規な組成物が含まれる。本発明の方法によって製造された本発明の組成物には、例えばグリセロールから製造されたジクロロヒドリンが含まれる。本発明の方法によって製造されたこのようなジクロロヒドリンは、それらが、ジクロロヒドリン(即ち、1,3−ジクロロプロパン−2−オール及び2,3−ジクロロプロパン−1−オール)の高い濃度、ジクロロヒドリン及びこれらのエステルの2種の異性体の高い比、即ち1,3−ジクロロプロパン−2−オール及びエステルの、2,3−ジクロロプロパン−1−オール及びエステルに対する高い比、グリセロール及びそのエステル並びにモノクロロヒドリン、即ち2−クロロ−1,3−プロパンジオール及び1−クロロ−2,3−プロパンジオール並びにこれらのエステルの低い濃度並びに非所望の副生物、即ち1,2,3−トリクロロプロパン並びに塩素化されたグリセロールオリゴマー、例えばビス(3−クロロ−2−ヒドロキシプロピル)エーテル及びこれらのエステルの低い濃度を含む点で有用である。
【0097】
本発明の組成物は、エピクロロヒドリンの製造に於いて有用であり、廃棄することが困難であるか又は高価である塩素化された副生物の低いレベルで、短い反応時間内に高純度のエピクロロヒドリンの高い収率を与える。
【0098】
本発明の一つの態様及び例示として、それらによって結び付けられるべきではないが、本発明に従って製造することができる有用な組成物(水及び無機不純物を除く)は、例えばグリセロールの塩化水素化から製造することができる。下記の略語を、以下の表中に使用する。「1,3−ジクロロヒドリン」は、1,3−ジクロロプロパン−2−オールである。「2,3−ジクロロヒドリン」は、2,3−ジクロロプロパン−1−オールである。「モノクロロヒドリン」には、1−クロロ−2,3−プロパンジオール及び2−クロロ−1,3−プロパンジオール並びにこれらの混合物が含まれる。一般的に、このような組成物には、例えば脂肪酸メチルエステル等を除く下記の成分が含まれる。
【0099】
【表1】

【0100】
上記の組成物中の1,3−ジクロロヒドリン対2,3−ジクロロヒドリン比は、一般的に約8:1〜約100:1である。
【0101】
好ましくは、本発明の組成物は下記の通りとすることができる。
【0102】
【表2】

【0103】
更に好ましくは、本発明の組成物は下記の通りであろう。
【0104】
【表3】

【0105】
最も好ましくは、本発明の組成物は下記の通りであろう。
【0106】
【表4】

【0107】
本発明の上記の組成物は、エピクロロヒドリンの製造に於いて有用である。2,3−ジクロロヒドリン及びそのエステルへの選択率に対する、1,3−ジクロロヒドリン及びそのエステルへの高い選択率は、苛性との反応の際のエピクロロヒドリンの一層効率よく、そして速い生成になる。更に、本発明の組成物中のトリクロロプロパン(TCP)の低いレベルは、それによって、TCPの取扱い及び廃棄のコストが最小になるので望まれる。グリセロール及びモノクロロヒドリンの低いレベルも、所望のジクロロヒドリンへの高い転化率を通してグリセロール原材料効率を最大にするために、本発明の組成物に於いて望まれる。
【0108】
下記の実施例は、例示目的のみのためであり、そして本発明の範囲を限定することを意図していない。
【0109】
実施例1:グリセロールからのクロロヒドリンの製造
磁気駆動攪拌機、内部冷却コイル及びサーモカップルを取り付けた100mLのハステロイC(登録商標)パル(Parr)反応器に、グリセロール(30.0g、シグマ−アルドリッチ・ケミカル社(Sigma-Aldrich Chemical Corporation)から得た)及び氷酢酸(4.5g、ジェイティー・ベイカー社(JT Baker Corporation)から得た)を添加した。反応器を密閉し、無水塩化水素ガス(エアーガス社(Airgas Corporation))で90psigまで加圧し、そして93℃に90分間加熱し、そして無水塩化水素ガスで90psigに維持し、その後、反応器を冷却し、そして室温(約25℃)で排気した。反応器内容物(65.9g)を集め、ガスクロマトグラフィー(GC)によって分析し、そして下記の生成物、1,3−ジクロロプロパン−2−オール及びその酢酸エステル(合計92.6モル%)並びに2,3−ジクロロプロパン−1−オール及びその酢酸エステル(合計1.7モル%)を含有することが見出された。更に、多数のモノ塩素化化合物(合計4.4モル%)並びに未反応のグリセロール及びそのエステル(合計1.0モル%)が検出された。トリクロロプロパンは検出されなかった(200ppmの検出限界で)。
【0110】
実施例2:グリセロール/グリセロールエステル混合物からのクロロヒドリンの製造
200mLのハステロイC(登録商標)高圧反応器に、乾燥グリセロール(アルドリッチ社、モレキュラーシーブスで予備乾燥した、91mg、0.99ミリモル)及びトリアセチン(アルドリッチ社、グリセロールのトリ酢酸エステル、457mg、2.10ミリモル)を含有する、10mLのガラスメスフラスコを添加した。反応器を密閉し、そして窒素で40psigまで加圧し(3回加圧サイクル)、窒素排気後に攪拌しながら110℃にした。無水HClを76psigの一定圧力で導入し、そして反応を3時間進行させた。反応器を排気して生成物を得た。この生成物は、GCフレームイオン化検出分析によって決定したとき、25.90面積%の1,3−ジクロロプロパン−2−オール、68.34面積%の1,3−ジクロロ−2−アセトキシプロパン、1.57面積%の1,2−ジクロロ−3−アセトキシプロパン、2.86面積%の2−クロロプロパン−1,3−ジアセトキシプロパン及び検出できないグリセロール、トリアセチン又は1,2,3−トリクロロプロパンを含有することが見出された。
【0111】
実施例3:粗製グリセロールからのクロロヒドリンの製造
磁気駆動攪拌機、内部冷却コイル及びサーモカップルを取り付けた100mLのハステロイC(登録商標)パル反応器に、粗製グリセロール(30.0g、インターウエスト社(Interwest Corporation)から得た)及び氷酢酸(0.6g、ジェイティー・ベイカー社から得た)を添加した。反応器を密閉し、無水塩化水素ガス(エアーガス社)で120psigまで加圧し、そして圧力を無水塩化水素ガスで120psigで維持しながら、120℃に90分間加熱した。この時間の後、反応器を冷却し、そして室温で排気した。反応器内容物(57.2g)を、懸濁した白色固体を含有する流動性液体として集めた。
【0112】
上記のような手順を繰り返して、58.0gの反応器内容物を第二反応から集めた。次いで、この2個の反応生成物(57.2g及び58.0g)を一緒にした。
【0113】
濾過によって、粗製グリセロールと共に導入された白色固体、ナトリウム塩及びカリウム塩を除去した後、濾液をガスクロマトグラフィーによって分析し、そして、1,3−ジクロロプロパン−2−オール(95.3重量%)、2,3−ジクロロプロパン−1−オール(2.6重量%)、2−アセトキシ−1,3−ジクロロプロパン(0.7重量%)及び1−アセトキシ−2,3−ジクロロプロパン(0.1重量%)を含有することが見出された。更に、多数のアセトキシクロロプロパノール類(0.87重量%)が検出された。未反応のグリセロール若しくはそのエステル又はトリクロロプロパノールは、何れも検出されなかった。
【0114】
実施例4〜41:
下記の実施例を、磁気駆動攪拌機、サーモカップル及び内部冷却コイルを取り付けた100mLのハステロイC(登録商標)パルオートクレーブ内で実施した。グリセロール(30g、326ミリモル、アルドリッチ99%)を、下記の表Iに記載したような触媒(10ミリモル)又は他の添加物及び水(3.0g、167ミリモル)と共に反応器に添加し、次いで反応器を密閉した。反応器及び内容物の質量を記録した。反応器を攪拌し、そして氷冷した水を、冷却コイルに通して循環させた。110psigの所望の圧力で塩化水素ガス(エアーガス社)を反応器に入れ、典型的に15〜25℃の発熱になった。反応器を、110℃の所望の温度に加熱し、そして、塩化水素ガスが反応によって消費されたとき、塩化水素ガスを設定圧力で連続的に供給しながら、反応を4時間進行させた。反応器に供給した塩化水素の質量を、反応を通してシリンダーの質量を記録することによって測定した。
【0115】
4時間の所望の反応時間が経過した後、塩化水素供給を停止し、そして反応器及び内容物を室温にまで冷却した。次いで、反応器を排気し、反応器及び内容物の質量を記録した。反応生成物をガスクロマトグラフィーによって分析した。ジクロロヒドリンへの選択率を、100%×ジクロロヒドリンのモル数/装入したグリセロールのモル数として報告する。
【0116】
ここで、下記の略語を使用する。「1,3−DCH」は1,3−ジクロロプロパン−2−オールであり、「2,3−DCH」は2,3−ジクロロプロパン−1−オールであり、「1−MCH」は1−クロロ−2,3−プロパンジオールであり、「2−MCH」は2−クロロ−1,3−プロパンジオールであり、「BZIM Br」はn−ブチルメチルイミダゾリウムブロミドであり、「BZIM Cl」はn−ブチルメチルイミダゾリウムクロリドであり、「Bu4NCl・H2O」はテトラ−n−ブチルアンモニウムクロリドヒドレートであり、そして「C16Me3NCl」はn−ヘキサデシルトリメチルアンモニウムクロリドである。
【0117】
【表5】

【0118】
比較例A:大気圧よりも低い圧力で、HCl、酢酸及び共沸剤としてのトルエンでの、ジクロロヒドリンへのグリセロール反応
オーバーヘッド空気攪拌機、HCl入口フリット、凝縮器付きディーン・シュタルク(Dean Stark)トラップを取り付けた、500mLワルトン(Wharton)バッフル付き三つ口フラスコに、グリセロール(92.0g、1.00モル)、5mLの酢酸(HOAc)及び200mLのトルエンを添加した。正の窒素流下で反応物を、無水HClをゆっくりパージしながら(決定した速度又は流量調節無し)、還流まで加熱した。5時間還流させた後、23mLの6N HCl水溶液が集められ、NMR分析によって、得られた底相は>85%のモノクロロヒドリンであることが示された。3時間後に、他の5mLのHOAcを添加し、そして再び6時間で、それぞれのとき水発生は、添加後に非常に速かった(トラップ内に1〜2mL/15分)。相は6時間後に熱混和性であり、次いで冷却すると2個の相に分離した。得られた生成物は、標準物質に対してNMRにより同定され、そして大部分のトルエンが分離された残留物を使用して、122gの材料のサンプルを得た。このサンプルを、ガスクロマトグラフィー/質量分析法(GC/MS)分析を使用して分析した。
【0119】
分析の結果及び化学図式を、下記の図式2に示す。
【0120】
【化4】

【0121】
比較例B:共沸的水除去無し及び大気圧で、過剰のHClパージ、酢酸での、ジクロロヒドリンへのグリセロール反応
この比較例に於いて、水を厳しく除去するための試みは行わなかった。オーバーヘッド空気攪拌機、HCl入口フリット及びスクラバーへの出口を取り付けた、500mLワルトン三つ口フラスコに、4Aシーブ乾燥したグリセロール(138.0g、1.50モル)、3.8gのHOAc(グリセリン基準で2.75%)を添加した。この出口チューブは、こぶ付き(burled)セラミックサドルが充填された3フート水スクラビング塔にフランジで取り付けられた、1/16インチのポリエチレン出口チューブ(約7フィート)に連結された、冷却しない16インチ直管凝縮器(ガラス)からなっていた。正の窒素流下で反応物を、100℃に加熱し、次いで無水HClによる遅いパージ(約200mg/分)を開始した。添加したHClの速度及び全量を、秤量セルによってモニターした。サンプルの小量のアリコート(例えば300mg)を、適当な間隔でサイドアームから取って、それから半減期を得ることができる粗動力学的転化プロフィールを完結した。反応物内部反応温度を、温度調節器によって等温(100℃±2℃)に維持した。24時間かけて、700gの無水HClの全量を、溶液に通過させた。サンプルを、重量%GCアッセイを使用して分析し、そして最終サンプルもまた、水及びHCl含有量について電位差測定により分析して、全質量バランスを得た。23.75時間のパージの後に得られた暗褐色反応生成物(200mgの残留物を引く)は、218.5gであった。
【0122】
分析の結果及び化学図式を、下記の図式3に示す。グリセロールの、モノクロロヒドリン及びジクロロヒドリンへの転化を、図4にグラフで示す。図4に於いて、「MCH」は、モノクロロヒドリン、即ち、3−クロロ−2,3−プロパンジオール及び2−クロロ−1,3−プロパンジオールの合計モル%であり、「MCH−OAc」は、MCHの酢酸エステルの合計モル%であり、そして「DCH」は、ジクロロヒドリン、即ち、1,3−ジクロロプロパン−2−オール及び2,3−ジクロロプロパン−1−オールの合計モル%である。
【0123】
【化5】

【0124】
実施例42:加圧HCl、酢酸で、共沸水的除去無しでの、ジクロロヒドリンへのグリセロール反応
窒素パージ(2回の40psig加圧/排気サイクル)後に、触媒として4重量%の酢酸(1.2g、アルドリッチ社)を含有する乾燥グリセリン(30.0g、0.320モル)を、磁気駆動した100mLハステロイ−Cパル反応器内で、攪拌及び加熱しながら、無水HClの静圧90〜96psigに付した。この反応器に、内部溶液温度を測定する内部サーモカップルを取り付けた。温度調節器によって制御された浸漬浴によって、反応器に外部加熱を与えた。90℃の初期内部温度で、殆ど即時の発熱が確保され、そして10分間以内に、内部反応温度は120〜123℃であった。この発熱は、HClの迅速な吸収によって同時に起こった。浸漬浴をこの温度まで1.5〜2時間上昇させ、そしてHClを、秤量セル(シリンダー)及びコンピュータ制御システムを介してモニターした。この期間の後、より以上のHCl吸収は殆ど見られなかった(ほぼ、32.1g吸収)。反応器を室温にまで冷却し、注意深くHClパージカラムに排気し、開き、そして内容物(68.0g)を、ポリエチレンねじ蓋を有するガラス瓶に移した。正確なH2O、HCl及び重量%有機バランスを、このサンプル及び他のサンプルで得た。
【0125】
分析の結果及び化学図式を、下記の図式4に示す。
【0126】
【化6】

【0127】
実施例42の結果と比較例Bの結果との比較を、下記の表IIに示す。
【0128】
【表6】

【0129】
比較例Bは、超大気圧方法に対して、大気圧比較例に於いて、延長された反応時間及び触媒の損失があることを示している。また、予想外に、超大気圧ケースに於いて、モノクロロヒドリンのジクロロヒドリンへの、より大きい転化率が起こり、より少ないクロロエーテル(RCl)が製造される。HClの大きい損失が、比較例Bで起こる。
【0130】
実施例43
エチレングリコール(501mg、8.07ミリモル)、1,2−プロピレングリコール(519mg、6.82ミリモル)及び氷酢酸(102mg、1.715ミリモル)を、磁気攪拌棒と一緒にガラスバイアルに入れた。このバイアルを200mLハステロイC(登録商標)圧力容器に入れた。次いで、この圧力容器を、40psigの無水HClガスで加圧した。バイアルの底を72〜74℃の水浴中に浸漬させ、そして攪拌及び圧力を45分間維持した。反応の終わりに、バイアル中の溶液は、透明で色は澄んでいた。この反応によって、1.893gの水を含有する粗製生成物が得られ、これをフレームイオン化検出ガスクロマトグラフィーによって分析した。既知の商業的標準物質の保持時間を基準にして、下記の生成物が分析された。クロロエタノール(35.62面積%)、1−クロロプロパン−2−オール(40.47面積%)、2−クロロプロパン−1−オール(6.47面積%)、非転化プロパンジオール(3.00面積%)、2−クロロ−1−アセトキシエタン(5.09面積%)、1−クロロ−2−アセトキシプロパン(4.45面積%)及び2−クロロ−1−アセトキシプロパン(0.75面積%)。
【0131】
実施例44〜51
グリセロール塩化水素化への塩化水素圧力の影響を試験するための下記の実験を、30gのグリセロール、3gの水、12.6モル%の酢酸を使用して実施した。反応温度は90℃であり、そして反応時間は120分間であった。塩化水素圧力は表IIIに示した通りであり、そしてジクロロヒドリン及びこれらの酢酸エステルへの選択率は示した通りであった。
【0132】
【表7】

【0133】
実施例52
下記の実施例は本発明の新規な組成物の生成を示す。
【0134】
グリセロール(30g、326ミリモル)、水(3.0g、167ミリモル)及びε−カプロラクトン(1.14g、10.0ミリモル)を、100mLパル反応器に装入し、110℃に加熱し、そして無水塩化水素で110psigまで加圧した。この条件で4時間後に、反応混合物は34.0グラムの塩化水素を吸収した。反応器内容物を取り出し、分析し、そして下記の組成(水及び残留塩化水素を除く)を有することが見出された。
【0135】
【表8】

【0136】
実施例53:エピクロロヒドリンを製造するためのクロロヒドリンの使用
前記実施例3から製造したジクロロヒドリン(DCH)生成物を、この実施例で使用した。この実験では、頂部に、30トレイオールダーショウ(Oldershaw)セクション、10%苛性/DCH供給物用の供給点、6トレイオールダーショウセクション、水性戻し供給点及び相分離器に連結した凝縮器を取り付けた、底出口を有する1リットルのジャケット付きケトルからなる反応性蒸留装置を使用した。DCH及び10%苛性を予熱し、そして上記システム30トレイオールダーショウセクションに導入する直前に混合した。運転条件は、250mmHgの圧力、75〜77℃のケトル温度、65〜67℃のオーバーヘッド温度及び68〜76℃の供給物温度であった。DCH供給速度及び苛性供給速度を、DCHに対して10%モル過剰の苛性を達成するように調節した。この反応/蒸留装置内で製造された粗製エピクロロヒドリンのサンプルは、フレームイオン化検出器を有するガスクロマトグラフィーによって分析したとき、下記の組成(面積%)を有していた。
【0137】
【表9】

【0138】
実施例54及び55並びに比較例C及びD
塩化水素を、グリセロール(30g)、水(3.0g)及び10ミリモルの触媒の混合物を通して、大気圧で、110℃で、4時間バブリングさせた。塩化水素流速を、4時間の反応時間に亘って、20〜25g/時で調節した。この時間の後、反応混合物を冷却し、ガスクロマトグラフィーによって分析して、ジクロロヒドリン、モノクロロヒドリン及び未反応グリセロールの濃度を決定した。表Vに、触媒として、酢酸、6−ヒドロキシヘキサン酸、フェニル酢酸及び4−ヒドロキシフェニル酢酸を使用して得られた結果を示す。
【0139】
【表10】

【特許請求の範囲】
【請求項1】
多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、超大気圧の分圧の塩化水素源と、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物を製造する触媒の存在下に、接触させる工程を含んでなり、前記接触工程を、水を実質的に除去することなく実施するクロロヒドリン、クロロヒドリンのエステル又はそれらの混合物の製造方法。
【請求項2】
触媒及び共触媒の存在下で実施する請求項1に記載の方法。
【請求項3】
共触媒が塩化物、臭化物又はヨウ化物源である請求項2に記載の方法。
【請求項4】
塩化水素源が少なくとも50モル%の塩化水素である請求項1に記載の方法。
【請求項5】
塩化水素源が塩化水素ガスである請求項1に記載の方法。
【請求項6】
クロロヒドリンがジクロロヒドリン、ジクロロヒドリンのエステル又はそれらの混合物である請求項1に記載の方法。
【請求項7】
ジクロロヒドリンが1,3−ジクロロプロパン−2−オール若しくは2,3−ジクロロプロパン−1−オール又はそれらの混合物である請求項6に記載の方法。
【請求項8】
多ヒドロキシル化脂肪族炭化水素が粗製グリセロールである請求項1に記載の方法。
【請求項9】
粗製グリセロールが、25重量%未満の水及び25重量%未満のアルカリ又はアルカリ土類金属塩を含む請求項8に記載の方法。
【請求項10】
多ヒドロキシル化脂肪族炭化水素が1,2,3−プロパントリオールである請求項1に記載の方法。
【請求項11】
多ヒドロキシル化脂肪族炭化水素が1,2−エタンジオール、1,2−プロパンジオール、1,3−プロパンジオール、1−クロロ−2,3−プロパンジオール、2−クロロ−1,3−プロパンジオール及び1,2,3−プロパントリオール並びにそれらの混合物からなる群から選択される請求項1に記載の方法。
【請求項12】
触媒がカルボン酸、無水物、酸クロリド、エステル、ラクトン、ラクタム、アミド、金属有機化合物、金属塩、この方法の反応条件下で、カルボン酸に転化できる任意の化合物又はそれらの組合せからなる群から選択される請求項1に記載の方法。
【請求項13】
触媒が炭素数1〜60のカルボン酸又はそれらの前駆体である請求項1に記載の方法。
【請求項14】
触媒が2〜20個の炭素原子を有し、そしてアミン、アルコール、ハロゲン、スルフヒドリル、エーテル、エステル又はそれらの組合せを含む、少なくとも1個の官能基を含有するカルボキシレート誘導体(但し、この官能基はα炭素よりも近くなく、酸官能基に結合している)又はそれらへの前駆体である請求項1に記載の方法。
【請求項15】
触媒が酢酸、プロピオン酸、ヘキサン酸、ヘプタン酸、ステアリン酸、酪酸、吉草酸、4−メチル吉草酸、フェニル酢酸、ケイ皮酸、コハク酸、ポリアクリル酸、アクリル酸でグラフト化されたポリエチレン、ε−カプロラクトン、δ−バレロラクトン、γ−ブチロラクトン、ε−カプロラクタム、6−クロロヘキサン酸、4−ヒドロキシフェニル酢酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、5−クロロ吉草酸、5−ヒドロキシ吉草酸、4−ヒドロキシ酪酸、4−クロロ酪酸、5−クロロペンタン酸及びそれらの混合物からなる群から選択される請求項1に記載の方法。
【請求項16】
触媒が酢酸、プロピオン酸、酪酸、4−メチル吉草酸、ヘキサン酸、ヘプタン酸、ステアリン酸、ε−カプロラクトン、γ−ブチロラクトン、6−クロロヘキサン酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸及びそれらの混合物からなる群から選択される請求項1に記載の方法。
【請求項17】
触媒が酢酸、ε−カプロラクトン、6−クロロヘキサン酸、δ−バレロラクトン、5−クロロペンタン酸、4−クロロ酪酸、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、4−アミノ酪酸及びそれらの混合物からなる群から選択される請求項1に記載の方法。
【請求項18】
触媒が酢酸又は酢酸の誘導体である請求項1に記載の方法。
【請求項19】
触媒がカプロラクトン又はカプロラクトンの誘導体である請求項1に記載の方法。
【請求項20】
触媒が酢酸、プロピオン酸、ヘキサン酸、ヘプタン酸、ステアリン酸、酪酸、吉草酸、4−メチル吉草酸、フェニル酢酸、ケイ皮酸、コハク酸、安息香酸、ポリアクリル酸、アクリル酸でグラフト化されたポリエチレン、ε−カプロラクトン、δ−バレロラクトン、γ−ブチロラクトン、ε−カプロラクタム、6−クロロヘキサン酸、4−ヒドロキシフェニル酢酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、5−クロロ吉草酸、5−ヒドロキシ吉草酸、4−ヒドロキシ酪酸、4−クロロ酪酸、5−クロロペンタン酸及びそれらの混合物からなる群から選択される化合物から誘導された、グリセリンのエステル、エチレングリコールのエステル又はプロピレングリコールのエステルである請求項1に記載の方法。
【請求項21】
触媒がグリセリンモノアセテート、グリセリンジアセテート、グリセリンジステアレート、1−クロロ−2,3−プロパンジオールモノアセテート、ポリカルボン酸のグリセリンエステル及びそれらの混合物からなる群から選択されるエステルである請求項1に記載の方法。
【請求項22】
触媒がカルボン酸部分を含有する不溶性ポリマー又はそれらのエステルである請求項1に記載の方法。
【請求項23】
不溶性ポリマー又はコポリマーがポリエステル、ポリアクリル酸、ポリアミド、ポリアクリレート及びこれらのコポリマー並びにそれらの混合物である請求項22に記載の方法。
【請求項24】
触媒がクロロヒドリン又はその水との共沸混合物よりも低い蒸気圧を有する請求項1に記載の方法。
【請求項25】
15〜1000psiaの塩化水素分圧で実施する請求項1に記載の方法。
【請求項26】
35〜600psiaの塩化水素分圧で実施する請求項1に記載の方法。
【請求項27】
55〜150psiaの塩化水素分圧で実施する請求項1に記載の方法。
【請求項28】
20〜120psiaの塩化水素分圧で実施する請求項1に記載の方法。
【請求項29】
25〜300℃の温度で実施する請求項1に記載の方法。
【請求項30】
25〜200℃の温度で実施する請求項1に記載の方法。
【請求項31】
30〜160℃の温度で実施する請求項1に記載の方法。
【請求項32】
40〜150℃の温度で実施する請求項1に記載の方法。
【請求項33】
50〜140℃の温度で実施する請求項1に記載の方法。
【請求項34】
15〜1000psiaの塩化水素分圧で、そして25〜300℃の範囲内の温度で、(a)多ヒドロキシル化脂肪族炭化水素、(b)多ヒドロキシル化脂肪族炭化水素のクロロヒドリンへの転化を容易に実施する触媒及び(c)塩化水素ガスを一緒に接触させる工程を含んでなり、前記接触工程を、水を実質的に除去することなく実施するクロロヒドリンの製造方法。
【請求項35】
15〜1000psiaの塩化水素分圧で、そして25〜300℃の範囲内の温度で、(a)多ヒドロキシル化脂肪族炭化水素のエステル及び(b)塩化水素を一緒に接触させる工程を含んでなり、前記接触工程を、水を実質的に除去することなく、実施するクロロヒドリンの製造方法。
【請求項36】
(a)多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、塩化水素源と、超大気圧で、水を実質的に除去することなく、接触させて、クロロヒドリンを製造する工程、及び
(b)上記工程(a)に於いて生成したクロロヒドリンを塩基と接触させて、エポキシドを生成させる工程を含んでなるエポキシドの製造方法。
【請求項37】
(a)グリセリン、グリセリンのエステル又はそれらの混合物を、塩化水素源と、超大気圧で、水を実質的に除去することなく、接触させて、ジクロロヒドリンを製造する工程、及び
(b)上記工程(a)に於いて生成したジクロロヒドリンを塩基と接触させて、エピクロロヒドリンを生成させる工程を含んでなるエピクロロヒドリンの製造方法。
【請求項38】
(a)多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、塩化水素源と、超大気圧で、水を実質的に除去することなく、接触させて、所望のクロロヒドリンを製造する工程、
(b)所望のクロロヒドリンを、未反応の多ヒドロキシル化脂肪族炭化水素、非所望のクロロヒドリン及びそれらのエステル並びに触媒から分離する工程並びに
(c)上記工程(b)に於いて分離された所望のクロロヒドリンを塩基と接触させて、エポキシドを生成させる工程を含んでなるエポキシドの製造方法。
【請求項39】
分離された未反応の多ヒドロキシル化脂肪族炭化水素、モノクロロヒドリン及びそれらのエステル並びに触媒を、工程(a)に再循環する工程を含む請求項38に記載の方法。
【請求項40】
(a)グリセリン、グリセリンのエステル又はそれらの混合物を、塩化水素源と、超大気圧で、水を実質的に除去することなく、接触させて、ジクロロヒドリンを製造する工程、
(b)ジクロロヒドリンを、未反応のグリセリン、モノクロロヒドリン及びそれらのエステル並びに触媒から分離する工程並びに
(c)上記工程(b)に於いて分離されたジクロロヒドリンを塩基と接触させて、エピクロロヒドリンを生成させる工程を含んでなるエピクロロヒドリンの製造方法。
【請求項41】
(a)多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、塩化物イオン源と、超大気圧で、水を実質的に除去することなく、接触させて、所望のクロロヒドリン及びそのエステルを製造する工程、
(b)工程(a)の生成物を多ヒドロキシル化脂肪族炭化水素と反応させて、所望のクロロヒドリンエステルを所望のクロロヒドリンに転化させる工程、
(c)所望のクロロヒドリンを、未反応の多ヒドロキシル化脂肪族炭化水素、非所望のクロロヒドリン及びこれらのエステル並びに触媒から分離する工程並びに
(d)上記工程(c)に於いて分離された所望のクロロヒドリンを塩基と接触させてエポキシドを生成させる工程を含んでなるエポキシドの製造方法。
【請求項42】
(a)グリセリン、グリセリンのエステル又はそれらの混合物を、塩化物イオン源と、超大気圧で、水を実質的に除去することなく、接触させて、ジクロロヒドリン及びそのエステルを製造する工程、
(b)工程(a)の生成物をグリセリンと反応させて、ジクロロヒドリンエステルをジクロロヒドリンに転化させる工程、
(c)ジクロロヒドリンを、未反応のグリセリン、モノクロロヒドリン及びそれらのエステル並びに触媒から分離する工程並びに
(d)上記工程(c)に於いて分離されたジクロロヒドリンを塩基と接触させて、エピクロロヒドリンを生成させる工程を含んでなるエピクロロヒドリンの製造方法。
【請求項43】
塩基がナトリウム、カリウム、カルシウム、マグネシウム又はそれらの混合物の、炭酸塩、重炭酸塩又は水酸化物である請求項40に記載の方法。
【請求項44】
多ヒドロキシル化脂肪族炭化水素が粗製グリセロールである請求項34〜43のいずれか1項に記載の方法。
【請求項45】
多ヒドロキシル化脂肪族炭化水素が1,2,3−プロパントリオールである請求項34〜43のいずれか1項に記載の方法。
【請求項46】
多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、超大気圧の分圧の塩化水素源と、クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物を製造する触媒の存在下に、水を実質的に除去することなく、接触させる工程を含んでなる高収率のクロロヒドリン、クロロヒドリンのエステル又はそれらの混合物を製造する方法。
【請求項47】
多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、超大気圧圧力で塩化水素ガスと、水を実質的に除去することなく、接触させて、クロロヒドリンを製造する工程を含んでなる方法。
【請求項48】
0.1〜1モル%のグリセロール及びそのエステル、4〜10モル%のモノクロロヒドリン及びそれらのエステル、80モル%よりも多い1,3−ジクロロヒドリン及びそのエステル、1〜4モル%の2,3−ジクロロヒドリン及びそのエステル、1モル%よりも少ない1,2,3−トリクロロプロパン並びに0.3モル%よりも少ない塩素化されたグリセロールエーテル及びそれらのエステルを含有し、組成物中の1,3−ジクロロヒドリン対2,3−ジクロロヒドリンの比が8:1よりも大きいジクロロヒドリンを含む組成物。
【請求項49】
塩素化されたグリセロールエーテル及びそれらのエステルが0.2モル%よりも少ない請求項48に記載の組成物。
【請求項50】
塩素化されたグリセロールエーテル及びそれらのエステルが0.15モル%よりも少ない請求項48に記載の組成物。
【請求項51】
塩素化されたグリセロールエーテル及びそれらのエステルが0.1モル%よりも少ない請求項48に記載の組成物。
【請求項52】
1,2,3−トリクロロプロパンが0.1モル%よりも少ない請求項48に記載の組成物。
【請求項53】
1,2,3−トリクロロプロパンが0.05モル%よりも少ない請求項48に記載の組成物。
【請求項54】
1,2,3−トリクロロプロパンが0.02モル%よりも少ない請求項48に記載の組成物。
【請求項55】
多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、触媒の存在下で、超大気圧の、大気圧の又は大気圧よりも低い分圧の塩化水素源と接触させて、クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物を製造する工程を含んでなり、前記触媒が(i)2〜20個の炭素原子を有し、そしてアミン、アルコール、ハロゲン、スルフヒドリル、エーテル、エステル若しくはそれらの組合せからなる群から選択される、少なくとも1個の官能基を含有するカルボキシレート誘導体(但し、この官能基はα炭素より酸官能基に結合している)又はそれらへの前駆体である、(ii)所望のクロロヒドリン、クロロヒドリンのエステル又はこれらの混合物よりも低い揮発性であり、そして(iii)ヘテロ原子置換基を含有する、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物の製造方法。
【請求項56】
カルボキシレート誘導体触媒が下記の一般式(a):
【化1】

(式中、「R’」はアミン、アルコール、ハロゲン、スルフヒドリル、エーテルからなる官能基又は前記官能基を含有する炭素数1〜20のアルキル、アリール若しくはアラルキル基又はそれらの組合せを含む、そして「R」は、水素、アルカリ金属、アルカリ土類金属若しくは遷移金属又は炭化水素官能基を含む)
を有する請求項55に記載の方法。
【請求項57】
カルボキシレート誘導体触媒がラクトン、エステル、ラクタム、アミド及び官能化されたカルボン酸からなる群から選択される請求項55に記載の方法。
【請求項58】
カルボキシレート誘導体触媒がカプロラクトン、カルボン酸アミド、カルボン酸ラクトン、カプロラクタム及びそれらの組合せからなる群から選択される請求項55に記載の方法。
【請求項59】
カルボキシレート誘導体触媒が6−ヒドロキシヘキサン酸、6−クロロヘキサン酸、カプロラクトン、ε−カプロラクタム及びγ−ブチロラクタム、γ−ブチロラクトン、δ−バレロラクトン及びε−カプロラクトン、6−アミノカプロン酸、4−アミノフェニル酢酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−ヒドロキシフェニル酢酸、4−ジメチルアミノフェニル酢酸、アミノフェニル酢酸、乳酸、グリコール酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸並びにそれらの組合せからなる群から選択される請求項55に記載の方法。
【請求項60】
多ヒドロキシル化脂肪族炭化水素がグリセロール又は粗製グリセロールである請求項55に記載の方法。
【請求項1】
多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、超大気圧の分圧の塩化水素源と、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物を製造する触媒の存在下に、接触させる工程を含んでなり、前記接触工程を、水を実質的に除去することなく実施するクロロヒドリン、クロロヒドリンのエステル又はそれらの混合物の製造方法。
【請求項2】
触媒及び共触媒の存在下で実施する請求項1に記載の方法。
【請求項3】
共触媒が塩化物、臭化物又はヨウ化物源である請求項2に記載の方法。
【請求項4】
塩化水素源が少なくとも50モル%の塩化水素である請求項1に記載の方法。
【請求項5】
塩化水素源が塩化水素ガスである請求項1に記載の方法。
【請求項6】
クロロヒドリンがジクロロヒドリン、ジクロロヒドリンのエステル又はそれらの混合物である請求項1に記載の方法。
【請求項7】
ジクロロヒドリンが1,3−ジクロロプロパン−2−オール若しくは2,3−ジクロロプロパン−1−オール又はそれらの混合物である請求項6に記載の方法。
【請求項8】
多ヒドロキシル化脂肪族炭化水素が粗製グリセロールである請求項1に記載の方法。
【請求項9】
粗製グリセロールが、25重量%未満の水及び25重量%未満のアルカリ又はアルカリ土類金属塩を含む請求項8に記載の方法。
【請求項10】
多ヒドロキシル化脂肪族炭化水素が1,2,3−プロパントリオールである請求項1に記載の方法。
【請求項11】
多ヒドロキシル化脂肪族炭化水素が1,2−エタンジオール、1,2−プロパンジオール、1,3−プロパンジオール、1−クロロ−2,3−プロパンジオール、2−クロロ−1,3−プロパンジオール及び1,2,3−プロパントリオール並びにそれらの混合物からなる群から選択される請求項1に記載の方法。
【請求項12】
触媒がカルボン酸、無水物、酸クロリド、エステル、ラクトン、ラクタム、アミド、金属有機化合物、金属塩、この方法の反応条件下で、カルボン酸に転化できる任意の化合物又はそれらの組合せからなる群から選択される請求項1に記載の方法。
【請求項13】
触媒が炭素数1〜60のカルボン酸又はそれらの前駆体である請求項1に記載の方法。
【請求項14】
触媒が2〜20個の炭素原子を有し、そしてアミン、アルコール、ハロゲン、スルフヒドリル、エーテル、エステル又はそれらの組合せを含む、少なくとも1個の官能基を含有するカルボキシレート誘導体(但し、この官能基はα炭素よりも近くなく、酸官能基に結合している)又はそれらへの前駆体である請求項1に記載の方法。
【請求項15】
触媒が酢酸、プロピオン酸、ヘキサン酸、ヘプタン酸、ステアリン酸、酪酸、吉草酸、4−メチル吉草酸、フェニル酢酸、ケイ皮酸、コハク酸、ポリアクリル酸、アクリル酸でグラフト化されたポリエチレン、ε−カプロラクトン、δ−バレロラクトン、γ−ブチロラクトン、ε−カプロラクタム、6−クロロヘキサン酸、4−ヒドロキシフェニル酢酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、5−クロロ吉草酸、5−ヒドロキシ吉草酸、4−ヒドロキシ酪酸、4−クロロ酪酸、5−クロロペンタン酸及びそれらの混合物からなる群から選択される請求項1に記載の方法。
【請求項16】
触媒が酢酸、プロピオン酸、酪酸、4−メチル吉草酸、ヘキサン酸、ヘプタン酸、ステアリン酸、ε−カプロラクトン、γ−ブチロラクトン、6−クロロヘキサン酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸及びそれらの混合物からなる群から選択される請求項1に記載の方法。
【請求項17】
触媒が酢酸、ε−カプロラクトン、6−クロロヘキサン酸、δ−バレロラクトン、5−クロロペンタン酸、4−クロロ酪酸、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、4−アミノ酪酸及びそれらの混合物からなる群から選択される請求項1に記載の方法。
【請求項18】
触媒が酢酸又は酢酸の誘導体である請求項1に記載の方法。
【請求項19】
触媒がカプロラクトン又はカプロラクトンの誘導体である請求項1に記載の方法。
【請求項20】
触媒が酢酸、プロピオン酸、ヘキサン酸、ヘプタン酸、ステアリン酸、酪酸、吉草酸、4−メチル吉草酸、フェニル酢酸、ケイ皮酸、コハク酸、安息香酸、ポリアクリル酸、アクリル酸でグラフト化されたポリエチレン、ε−カプロラクトン、δ−バレロラクトン、γ−ブチロラクトン、ε−カプロラクタム、6−クロロヘキサン酸、4−ヒドロキシフェニル酢酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸クロリド、4−ヒドロキシフェニル酢酸、4−アミノフェニル酢酸、5−クロロ吉草酸、5−ヒドロキシ吉草酸、4−ヒドロキシ酪酸、4−クロロ酪酸、5−クロロペンタン酸及びそれらの混合物からなる群から選択される化合物から誘導された、グリセリンのエステル、エチレングリコールのエステル又はプロピレングリコールのエステルである請求項1に記載の方法。
【請求項21】
触媒がグリセリンモノアセテート、グリセリンジアセテート、グリセリンジステアレート、1−クロロ−2,3−プロパンジオールモノアセテート、ポリカルボン酸のグリセリンエステル及びそれらの混合物からなる群から選択されるエステルである請求項1に記載の方法。
【請求項22】
触媒がカルボン酸部分を含有する不溶性ポリマー又はそれらのエステルである請求項1に記載の方法。
【請求項23】
不溶性ポリマー又はコポリマーがポリエステル、ポリアクリル酸、ポリアミド、ポリアクリレート及びこれらのコポリマー並びにそれらの混合物である請求項22に記載の方法。
【請求項24】
触媒がクロロヒドリン又はその水との共沸混合物よりも低い蒸気圧を有する請求項1に記載の方法。
【請求項25】
15〜1000psiaの塩化水素分圧で実施する請求項1に記載の方法。
【請求項26】
35〜600psiaの塩化水素分圧で実施する請求項1に記載の方法。
【請求項27】
55〜150psiaの塩化水素分圧で実施する請求項1に記載の方法。
【請求項28】
20〜120psiaの塩化水素分圧で実施する請求項1に記載の方法。
【請求項29】
25〜300℃の温度で実施する請求項1に記載の方法。
【請求項30】
25〜200℃の温度で実施する請求項1に記載の方法。
【請求項31】
30〜160℃の温度で実施する請求項1に記載の方法。
【請求項32】
40〜150℃の温度で実施する請求項1に記載の方法。
【請求項33】
50〜140℃の温度で実施する請求項1に記載の方法。
【請求項34】
15〜1000psiaの塩化水素分圧で、そして25〜300℃の範囲内の温度で、(a)多ヒドロキシル化脂肪族炭化水素、(b)多ヒドロキシル化脂肪族炭化水素のクロロヒドリンへの転化を容易に実施する触媒及び(c)塩化水素ガスを一緒に接触させる工程を含んでなり、前記接触工程を、水を実質的に除去することなく実施するクロロヒドリンの製造方法。
【請求項35】
15〜1000psiaの塩化水素分圧で、そして25〜300℃の範囲内の温度で、(a)多ヒドロキシル化脂肪族炭化水素のエステル及び(b)塩化水素を一緒に接触させる工程を含んでなり、前記接触工程を、水を実質的に除去することなく、実施するクロロヒドリンの製造方法。
【請求項36】
(a)多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、塩化水素源と、超大気圧で、水を実質的に除去することなく、接触させて、クロロヒドリンを製造する工程、及び
(b)上記工程(a)に於いて生成したクロロヒドリンを塩基と接触させて、エポキシドを生成させる工程を含んでなるエポキシドの製造方法。
【請求項37】
(a)グリセリン、グリセリンのエステル又はそれらの混合物を、塩化水素源と、超大気圧で、水を実質的に除去することなく、接触させて、ジクロロヒドリンを製造する工程、及び
(b)上記工程(a)に於いて生成したジクロロヒドリンを塩基と接触させて、エピクロロヒドリンを生成させる工程を含んでなるエピクロロヒドリンの製造方法。
【請求項38】
(a)多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、塩化水素源と、超大気圧で、水を実質的に除去することなく、接触させて、所望のクロロヒドリンを製造する工程、
(b)所望のクロロヒドリンを、未反応の多ヒドロキシル化脂肪族炭化水素、非所望のクロロヒドリン及びそれらのエステル並びに触媒から分離する工程並びに
(c)上記工程(b)に於いて分離された所望のクロロヒドリンを塩基と接触させて、エポキシドを生成させる工程を含んでなるエポキシドの製造方法。
【請求項39】
分離された未反応の多ヒドロキシル化脂肪族炭化水素、モノクロロヒドリン及びそれらのエステル並びに触媒を、工程(a)に再循環する工程を含む請求項38に記載の方法。
【請求項40】
(a)グリセリン、グリセリンのエステル又はそれらの混合物を、塩化水素源と、超大気圧で、水を実質的に除去することなく、接触させて、ジクロロヒドリンを製造する工程、
(b)ジクロロヒドリンを、未反応のグリセリン、モノクロロヒドリン及びそれらのエステル並びに触媒から分離する工程並びに
(c)上記工程(b)に於いて分離されたジクロロヒドリンを塩基と接触させて、エピクロロヒドリンを生成させる工程を含んでなるエピクロロヒドリンの製造方法。
【請求項41】
(a)多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、塩化物イオン源と、超大気圧で、水を実質的に除去することなく、接触させて、所望のクロロヒドリン及びそのエステルを製造する工程、
(b)工程(a)の生成物を多ヒドロキシル化脂肪族炭化水素と反応させて、所望のクロロヒドリンエステルを所望のクロロヒドリンに転化させる工程、
(c)所望のクロロヒドリンを、未反応の多ヒドロキシル化脂肪族炭化水素、非所望のクロロヒドリン及びこれらのエステル並びに触媒から分離する工程並びに
(d)上記工程(c)に於いて分離された所望のクロロヒドリンを塩基と接触させてエポキシドを生成させる工程を含んでなるエポキシドの製造方法。
【請求項42】
(a)グリセリン、グリセリンのエステル又はそれらの混合物を、塩化物イオン源と、超大気圧で、水を実質的に除去することなく、接触させて、ジクロロヒドリン及びそのエステルを製造する工程、
(b)工程(a)の生成物をグリセリンと反応させて、ジクロロヒドリンエステルをジクロロヒドリンに転化させる工程、
(c)ジクロロヒドリンを、未反応のグリセリン、モノクロロヒドリン及びそれらのエステル並びに触媒から分離する工程並びに
(d)上記工程(c)に於いて分離されたジクロロヒドリンを塩基と接触させて、エピクロロヒドリンを生成させる工程を含んでなるエピクロロヒドリンの製造方法。
【請求項43】
塩基がナトリウム、カリウム、カルシウム、マグネシウム又はそれらの混合物の、炭酸塩、重炭酸塩又は水酸化物である請求項40に記載の方法。
【請求項44】
多ヒドロキシル化脂肪族炭化水素が粗製グリセロールである請求項34〜43のいずれか1項に記載の方法。
【請求項45】
多ヒドロキシル化脂肪族炭化水素が1,2,3−プロパントリオールである請求項34〜43のいずれか1項に記載の方法。
【請求項46】
多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、超大気圧の分圧の塩化水素源と、クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物を製造する触媒の存在下に、水を実質的に除去することなく、接触させる工程を含んでなる高収率のクロロヒドリン、クロロヒドリンのエステル又はそれらの混合物を製造する方法。
【請求項47】
多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、超大気圧圧力で塩化水素ガスと、水を実質的に除去することなく、接触させて、クロロヒドリンを製造する工程を含んでなる方法。
【請求項48】
0.1〜1モル%のグリセロール及びそのエステル、4〜10モル%のモノクロロヒドリン及びそれらのエステル、80モル%よりも多い1,3−ジクロロヒドリン及びそのエステル、1〜4モル%の2,3−ジクロロヒドリン及びそのエステル、1モル%よりも少ない1,2,3−トリクロロプロパン並びに0.3モル%よりも少ない塩素化されたグリセロールエーテル及びそれらのエステルを含有し、組成物中の1,3−ジクロロヒドリン対2,3−ジクロロヒドリンの比が8:1よりも大きいジクロロヒドリンを含む組成物。
【請求項49】
塩素化されたグリセロールエーテル及びそれらのエステルが0.2モル%よりも少ない請求項48に記載の組成物。
【請求項50】
塩素化されたグリセロールエーテル及びそれらのエステルが0.15モル%よりも少ない請求項48に記載の組成物。
【請求項51】
塩素化されたグリセロールエーテル及びそれらのエステルが0.1モル%よりも少ない請求項48に記載の組成物。
【請求項52】
1,2,3−トリクロロプロパンが0.1モル%よりも少ない請求項48に記載の組成物。
【請求項53】
1,2,3−トリクロロプロパンが0.05モル%よりも少ない請求項48に記載の組成物。
【請求項54】
1,2,3−トリクロロプロパンが0.02モル%よりも少ない請求項48に記載の組成物。
【請求項55】
多ヒドロキシル化脂肪族炭化水素、多ヒドロキシル化脂肪族炭化水素のエステル又はそれらの混合物を、触媒の存在下で、超大気圧の、大気圧の又は大気圧よりも低い分圧の塩化水素源と接触させて、クロロヒドリン、クロロヒドリンのエステル又はこれらの混合物を製造する工程を含んでなり、前記触媒が(i)2〜20個の炭素原子を有し、そしてアミン、アルコール、ハロゲン、スルフヒドリル、エーテル、エステル若しくはそれらの組合せからなる群から選択される、少なくとも1個の官能基を含有するカルボキシレート誘導体(但し、この官能基はα炭素より酸官能基に結合している)又はそれらへの前駆体である、(ii)所望のクロロヒドリン、クロロヒドリンのエステル又はこれらの混合物よりも低い揮発性であり、そして(iii)ヘテロ原子置換基を含有する、クロロヒドリン、クロロヒドリンのエステル又はそれらの混合物の製造方法。
【請求項56】
カルボキシレート誘導体触媒が下記の一般式(a):
【化1】

(式中、「R’」はアミン、アルコール、ハロゲン、スルフヒドリル、エーテルからなる官能基又は前記官能基を含有する炭素数1〜20のアルキル、アリール若しくはアラルキル基又はそれらの組合せを含む、そして「R」は、水素、アルカリ金属、アルカリ土類金属若しくは遷移金属又は炭化水素官能基を含む)
を有する請求項55に記載の方法。
【請求項57】
カルボキシレート誘導体触媒がラクトン、エステル、ラクタム、アミド及び官能化されたカルボン酸からなる群から選択される請求項55に記載の方法。
【請求項58】
カルボキシレート誘導体触媒がカプロラクトン、カルボン酸アミド、カルボン酸ラクトン、カプロラクタム及びそれらの組合せからなる群から選択される請求項55に記載の方法。
【請求項59】
カルボキシレート誘導体触媒が6−ヒドロキシヘキサン酸、6−クロロヘキサン酸、カプロラクトン、ε−カプロラクタム及びγ−ブチロラクタム、γ−ブチロラクトン、δ−バレロラクトン及びε−カプロラクトン、6−アミノカプロン酸、4−アミノフェニル酢酸、4−アミノ酪酸、4−ジメチルアミノ酪酸、4−ヒドロキシフェニル酢酸、4−ジメチルアミノフェニル酢酸、アミノフェニル酢酸、乳酸、グリコール酸、4−ジメチルアミノ酪酸、4−トリメチルアンモニウム酪酸並びにそれらの組合せからなる群から選択される請求項55に記載の方法。
【請求項60】
多ヒドロキシル化脂肪族炭化水素がグリセロール又は粗製グリセロールである請求項55に記載の方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−158594(P2012−158594A)
【公開日】平成24年8月23日(2012.8.23)
【国際特許分類】
【出願番号】特願2012−63819(P2012−63819)
【出願日】平成24年3月21日(2012.3.21)
【分割の表示】特願2007−522625(P2007−522625)の分割
【原出願日】平成17年7月18日(2005.7.18)
【出願人】(502141050)ダウ グローバル テクノロジーズ エルエルシー (1,383)
【Fターム(参考)】
【公開日】平成24年8月23日(2012.8.23)
【国際特許分類】
【出願日】平成24年3月21日(2012.3.21)
【分割の表示】特願2007−522625(P2007−522625)の分割
【原出願日】平成17年7月18日(2005.7.18)
【出願人】(502141050)ダウ グローバル テクノロジーズ エルエルシー (1,383)
【Fターム(参考)】
[ Back to top ]

