多価分子の作製方法
【課題】scFv分子とのミスフォールディングを防ぎ、多価結合分子を構築することができる。
【解決手段】第一のscFv(1)にコリシンE9(2)を連結させ、また第二のscFv(3)にIm9(4)を連結させ、それぞれの融合タンパク質を作製する。次にコリシンE9(2)とIm9(4)を結合させることで多価結合分子を構築する。コリシンE9(2)及びIm9(4)はシステイン残基を持たないため、融合タンパク質作製時にシステイン残基によるミスフォールディングを防ぐことができる。
【解決手段】第一のscFv(1)にコリシンE9(2)を連結させ、また第二のscFv(3)にIm9(4)を連結させ、それぞれの融合タンパク質を作製する。次にコリシンE9(2)とIm9(4)を結合させることで多価結合分子を構築する。コリシンE9(2)及びIm9(4)はシステイン残基を持たないため、融合タンパク質作製時にシステイン残基によるミスフォールディングを防ぐことができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は多価分子の作製方法に関する。より詳細には、本発明は、コリシンDNA分解酵素及びコリシン特異的免疫タンパク質を用いた多価分子の作成方法に関する。
【背景技術】
【0002】
それぞれの抗原結合部位が異なる抗原に結合する抗体を2重特異性抗体という.例えば,癌細胞抗原とエフェクター細胞抗原を認識する2重特異性抗体は,これら細胞を効果的に接触させることで抗腫瘍作用の増強が期待され現在臨床評価が行われている。近年、抗体分子を結合部位に持つ2重特異性抗体に関する研究が活発化され、その簡易的な作製方法が次々と開発されている。その一例として、特許文献1に記載の作製方法は、バーナーゼ及びバースターそれぞれにscFv(一本鎖抗体)を連結させた融合タンパク質を発現させ、バーナーゼ、バースターの高い親和性(Kd=10^―14)を利用することで、多価抗体及び2重特異性抗体を作製することを特徴としている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】米国特許出願公開第2006/0120960号明細書
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、野生型のバースターは分子内においてジスルフィド結合を形成していなりシステイン残基を2箇所有する。そのため、scFvとの融合タンパク質を発現させる際、scFvの持つシステイン残基とバースターの持つシステイン残基がジスルフィド結合を形成してしまい、その結果として融合タンパク質はミスフォールディングを生じるという課題があった。
【課題を解決するための手段】
【0005】
上記従来の課題を解決するために、本発明の多価結合分子の作製方法は、
アルブミンに対し特異的に結合する少なくとも一つの結合部とコリシンDNA分解酵素E9の変異体を連結させた第一の分子を作製する工程と、
上記第一の分子とは異なるアルブミン分子表面に対し特異的に結合する少なくとも一つの結合部とコリシン特異的免疫タンパク質Im9を連結させた第二の分子を作製する工程と、
上記コリシンDNA分解酵素E9の変異体とコリシン特異的免疫タンパク質Im9を介し、第一の分子と第二の分子を連結させる工程からなることを特徴とする。
【0006】
本発明の多価結合分子の作製方法は、コリシンDNA分解酵素E9の変異体がDNA分解酵素活性を持たないことを特徴とする。
【0007】
本発明の多価結合分子の作製方法は、コリシンDNA分解酵素E9の変異体がコリシン特異的免疫タンパク質Im9と結合する領域のみから構成されることを特徴とする。
【発明の効果】
【0008】
本発明によれば、アルブミンに対し特異的に結合する結合部の持つシステイン残基と、コリシンDNA分解酵素及びコリシン特異的免疫タンパク質がジスルフィド結合を形成することがないため、分子内でのミスフォールディングの影響を低減することができる。
【図面の簡単な説明】
【0009】
【図1】コリシンE9と第一の抗アルブミンscFv抗体融合タンパク質発現の遺伝子構成を示す図
【図2】Im9と第二の抗アルブミンscFv抗体融合タンパク質発現の遺伝子構成を示す図
【図3】コリシンE9と第一の抗アルブミンscFv抗体融合タンパク質の構成を示す図
【図4】Im9と第二の抗アルブミンscFv抗体融合タンパク質の構成を示す図
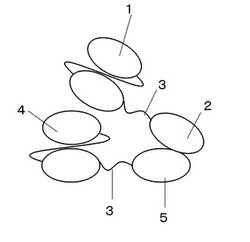
【図5】多価結合分子の構成を示す図
【発明を実施するための形態】
【0010】
(実施の形態1)
以下に本発明の実施の形態について、図面を参照しながら説明する。ここで示す実施の形態はあくまでも一例であって、必ずしもこの実施の形態に限定されない。
【0011】
以下に、アルブミン抗原に対し、異なるエピトープに結合し得る多価結合分子を作製する例を示す。抗原結合部位の分子形態には、scFvを選択する例を示す。コリシンE9でありDNA分解酵素活性を失うようにアミノ酸変異を加えたものを用いる例を示す。
【0012】
<抗アルブミン抗体の遺伝子単離とscFv遺伝子の作製>
抗アルブミン抗体の取得には、例えばHSAをBALB/ Cマウスなどに免疫し、脾臓細胞とミエローマとをポリエチレングリコールを用いる通常の方法で細胞融合させ、抗原への反応性を確認した後に、限界希釈法によりクローニングを行い、抗モノクローナル抗体を作製することができる。また、ファージディスプレイ法やイーストディスプレイ法など、DNAライブラリーを用いたスクリーニング法により、アルブミンに特異的に結合し得る抗体遺伝子を取得する方法もある。異なるエピトープに対するクローンの選択には、例えば、得られた複数の抗体をサンドイッチELISA法や、SPRを用いることにより、複数の抗体が同時に一つの抗原に結合し得るか否かを実験的に評価することで選別することができる。
【0013】
上記のようにして、得られるモノクローナル抗体より抗体可変領域をコードする遺伝子を抽出し、scFv(一本鎖抗体)の遺伝子配列の作製方法を以下に示す。まず、モノクローナル抗体を、RPMI1640などの培地中で1×10^6個程度まで培養する。次に、TRIZOL(インビトロジェン製)により全RNAを抽出し、市販のmRNA抽出キット(タカラバイオ製)により、mRNAを抽出し、常法に従ってcDNAを調製することできる。得られたcDNAを鋳型とし、例えば、Mouse ScFv Module/Recombinant Phage Antibody System(アマシャム)のオリゴヌクレオチオドプライマーや、既存のサブクラスの抗体可変領域を増幅するためのプライマーを用い、PCR反応を行うことによって、抗体のH鎖及びL鎖のV領域をコードするDNA断片を増幅することができる。得られたH鎖及びL鎖のV領域をコードするDNA断片を市販のクローニング用ベクターに、制限酵素処理にて結合させ、L鎖V領域をコードする遺伝子と、H鎖V領域をコードする遺伝子配列の間に、配列番号1などのリンカー配列を持たせることで、scFvの遺伝子配列を構築することができる。
このようにして、2種のアルブミン上の異なるエピトープに同時に結合し得る第一のscFv遺伝子及び第二のscFv遺伝子を得ることができる。
【0014】
<コリシンE9と抗アルブミンscFv抗体融合タンパク質発現プラスミドの構築>
コリシンE9発現のための遺伝子は、既存の人工遺伝子合成技術を用い作製・取得することができる。上記のようにして得られた第1のscFv遺伝子と、コリシンE9遺伝子配列の間に、例えば、配列番号1や抗体ヒンジ領域のアミノ酸配列など適当なアミノ酸をリンカーとして選択し、発現に用いるベクター上にて、常法を用いて連結させる。また、融合タンパク質発現後の精製のため、バーナーゼ遺伝子配列の3‘側にヒスチジンタグなどの遺伝子配列を挿入しても良い。また、必要に応じてscFv遺伝子の5’側に、pelBなどのシグナル配列を挿入しておくと、目的のタンパク質がペリプラズムへ運ばれるため好ましい。scFv特性によっては、シグナル配列を含まなくても良い。発現ベクターに用いるプロモーターとしては、T7、tac、lac、trcプロモーターなどが挙げられるが、発現させるscFvの特性によって、適宜・適切に選択することが好ましい。また、ベクターにはアンピシリン、カナマイシン、テトラサイクリン、クロラムフェニコールなどに対する耐性遺伝子を有することが好ましい。以下では、発現ベクターがアンピシリン耐性遺伝子を有している場合の例について示す。
【0015】
<Im9と抗アルブミンscFv抗体融合タンパク質発現プラスミドの構築>
Im9発現のための遺伝子は、既存の人工遺伝子合成技術を用い作製・取得することができる。上記のようにして得られた第1のscFvとは異なるエピトープを認識する第二のscFv遺伝子と、Im9遺伝子配列の間に、例えば、配列番号1や抗体ヒンジ領域のアミノ酸配列など適当なアミノ酸をリンカーとして選択し、発現に用いるベクター上にて、常法を用いて連結させる。また、融合タンパク質発現後の精製のため、バーナーゼ遺伝子配列の3‘側にヒスチジンタグなどの遺伝子配列を挿入しても良い。また、必要に応じてscFv遺伝子の5’側に、pelBなどのシグナル配列を挿入しておくと、目的のタンパク質がペリプラズムへ運ばれるため好ましい。scFv特性によっては、シグナル配列を含まなくても良い。発現ベクターに用いるプロモーターとしては、T7、tac、lac、trcプロモーターなどが挙げられるが、発現させるscFvの特性によって、適宜・適切に選択することが好ましい。また、ベクターにはアンピシリン、カナマイシン、テトラサイクリン、クロラムフェニコールなどに対する耐性遺伝子を有することが好ましい。以下では、発現ベクターがアンピシリン耐性遺伝子を有している場合の例について示す。
【0016】
また、コリシンE9と第一のscFvを連結させるリンカーやIm9と第二のscFvを結合させるリンカーのアミノ酸の種類や数は、第一のscFv及び第二のscFvのエピトープの位置に応じて適宜選択すれば良い。
【0017】
<コリシンE9と抗アルブミンscFv抗体融合タンパク質の発現>
上記のようにして得られたコリシンE9と抗アルブミンscFv抗体融合タンパク質発現のためのプラスミドをタンパク質大腸菌発現用の宿主に形質転換する。形質転換を行う宿主としては、BL21由来のものが好ましいが、その他発現可能な宿主があれば、適宜・適切に選択することができる。形質転換後の溶液を、50μg/mlのアンピシリンを含むLBプレート培地にまき、37℃にて16時間培養する。次に形成されたシングルコロニーをピックアップし、50μg/mlのアンピシリンを含む5mLの2YT培地を用い、37℃、250rpmにて5時間培養する。次に、培養後の大腸菌を含む培地5mLを1Lの50μg/mlのアンピシリンを含むLB培地に添加し、37℃、250rpmにて培地の中心波長600nmのO.Dが0.4〜0.9になるまで培養する。次に、培養液中の0.1mM〜1mM程度のIPTGを加え、さらに37℃、250rpmにて約4〜20時間培養する。また、融合タンパク質の特性によっては、IPTG添加後の培養温度を16〜30℃に設定するのが好ましい。培養後の溶液を、5000rpm、4℃にて10分間遠心する。発現ベクターにpelBなどのペリプラズムへのシグナル配列を組み込んだ場合には、遠心後の上澄みを除去し、30mLの30mM Tris-HCl pH8.0、20%スクロース及び60μlの0.5M EDTApH8.0を加え、スタラーなどを用い室温にてゆっくりと10分間攪拌する。次に、溶液を4℃、10000gにて10分間遠心し、上澄みを除去する。次に、30mLの氷上にて冷却しておいた5mMの硫酸マグネシウムを加え再懸濁し、氷上にて10分間、ゆっくりと攪拌する。攪拌後の溶液を4℃、10000gにて10分間遠心する。得られた上澄みをゲルろ過クロマトグラフィ、イオン交換クロマトグラフィ、予めアルブミンを固定化したアフィニティカラムなどを通し、常法に従って、目的の融合タンパク質を精製することができる。得られるタンパク質の構成を図3に示す。また、ペリプラズムでの発現が低い、あるいは発現していない場合には、遠心後の沈殿物を30mM Tris-HClpH8.0、0.1M NaClなどに再懸濁し、大腸菌を超音波にて破砕することで細胞質内の可溶性タンパク質を得ても良い。また、不溶性のタンパク質を既存の希釈法・透析法などを用い、巻き戻しを行っても良い。また、大腸菌を育成した培養液中から、精製が必要になる場合もある。精製方法や手順・試薬の組成などは、タンパク質の特性によって、適宜・適切に選択されることが好ましい。
【0018】
<Im9と抗アルブミンscFv抗体融合タンパク質の発現>
上記のようにして得られたIm9と抗アルブミンscFv抗体融合タンパク質発現のためのプラスミドをタンパク質大腸菌発現用の宿主に形質転換する。形質転換を行う宿主としては、BL21由来のものが好ましいが、その他発現可能な宿主があれば、適宜・適切に選択することができる。形質転換後の溶液を、50μg/mlのアンピシリンを含むLBプレート培地にまき、37℃にて16時間培養する。次に形成されたシングルコロニーをピックアップし、50μg/mlのアンピシリンを含む5mLの2YT培地を用い、37℃、250rpmにて5時間培養する。次に、培養後の大腸菌を含む培地5mLを1Lの50μg/mlのアンピシリンを含むLB培地に添加し、37℃、250rpmにて培地の中心波長600nmのO.Dが0.4〜0.9になるまで培養する。次に、培養液中の0.1mM〜1mM程度のIPTGを加え、さらに37℃、250rpmにて約4〜20時間培養する。また、融合タンパク質の特性によっては、IPTG添加後の培養温度を16〜30℃に設定するのが好ましい。培養後の溶液を、5000rpm、4℃にて10分間遠心する。発現ベクターにpelBなどのペリプラズムへのシグナル配列を組み込んだ場合には、遠心後の上澄みを除去し、30mLの30mM Tris-HCl pH8.0、20%スクロース及び60μlの0.5M EDTApH8.0を加え、スタラーなどを用い室温にてゆっくりと10分間攪拌する。次に、溶液を4℃、10000gにて10分間遠心し、上澄みを除去する。次に、30mLの氷上にて冷却しておいた5mMの硫酸マグネシウムを加え再懸濁し、氷上にて10分間、ゆっくりと攪拌する。攪拌後の溶液を4℃、10000gにて10分間遠心する。得られた上澄みをゲルろ過クロマトグラフィ、イオン交換クロマトグラフィ、予めアルブミンを固定化したアフィニティカラムなどを通し、常法に従って、目的の融合タンパク質を精製することができる。得られるタンパク質の構成を図4に示す。また、ペリプラズムでの発現が低い、あるいは発現していない場合には、遠心後の沈殿物を30mM Tris-HClpH8.0、0.1M NaClなどに再懸濁し、大腸菌を超音波にて破砕することで細胞質内の可溶性タンパク質を得ても良い。また、不溶性のタンパク質を既存の希釈法・透析法などを用い、巻き戻しを行っても良い。また、大腸菌を育成した培養液中から、精製が必要になる場合もある。精製方法や手順・試薬の組成などは、タンパク質の特性によって、適宜・適切に選択されることが好ましい。
【0019】
<多価結合分子の作製と精製>
上記のようにして、得られたコリシンE9と第一の抗アルブミンscFv抗体融合タンパク質とIm9と第二の抗アルブミンsvFv抗体融合タンパク質を例えば、モル比1:1で混合させ、ゲル濾過クロマトグラフィなど所望の精製法にて分離・精製することで、図5に示すような多価結合分子を取得することができる。
【産業上の利用可能性】
【0020】
本発明に係るコリシンDNA分解酵素及びコリシン特異的免疫タンパク質を用いた多価分子は、生体内に含まれる対象生体分子に特異的に結合し得る多価結合分子として有用である。
【符号の説明】
【0021】
1 第一の抗アルブミンscFv抗体
2 コリシンE9
3 リンカー
4 第2の抗アルブミンscFv抗体
5 Im9
【技術分野】
【0001】
本発明は多価分子の作製方法に関する。より詳細には、本発明は、コリシンDNA分解酵素及びコリシン特異的免疫タンパク質を用いた多価分子の作成方法に関する。
【背景技術】
【0002】
それぞれの抗原結合部位が異なる抗原に結合する抗体を2重特異性抗体という.例えば,癌細胞抗原とエフェクター細胞抗原を認識する2重特異性抗体は,これら細胞を効果的に接触させることで抗腫瘍作用の増強が期待され現在臨床評価が行われている。近年、抗体分子を結合部位に持つ2重特異性抗体に関する研究が活発化され、その簡易的な作製方法が次々と開発されている。その一例として、特許文献1に記載の作製方法は、バーナーゼ及びバースターそれぞれにscFv(一本鎖抗体)を連結させた融合タンパク質を発現させ、バーナーゼ、バースターの高い親和性(Kd=10^―14)を利用することで、多価抗体及び2重特異性抗体を作製することを特徴としている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】米国特許出願公開第2006/0120960号明細書
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、野生型のバースターは分子内においてジスルフィド結合を形成していなりシステイン残基を2箇所有する。そのため、scFvとの融合タンパク質を発現させる際、scFvの持つシステイン残基とバースターの持つシステイン残基がジスルフィド結合を形成してしまい、その結果として融合タンパク質はミスフォールディングを生じるという課題があった。
【課題を解決するための手段】
【0005】
上記従来の課題を解決するために、本発明の多価結合分子の作製方法は、
アルブミンに対し特異的に結合する少なくとも一つの結合部とコリシンDNA分解酵素E9の変異体を連結させた第一の分子を作製する工程と、
上記第一の分子とは異なるアルブミン分子表面に対し特異的に結合する少なくとも一つの結合部とコリシン特異的免疫タンパク質Im9を連結させた第二の分子を作製する工程と、
上記コリシンDNA分解酵素E9の変異体とコリシン特異的免疫タンパク質Im9を介し、第一の分子と第二の分子を連結させる工程からなることを特徴とする。
【0006】
本発明の多価結合分子の作製方法は、コリシンDNA分解酵素E9の変異体がDNA分解酵素活性を持たないことを特徴とする。
【0007】
本発明の多価結合分子の作製方法は、コリシンDNA分解酵素E9の変異体がコリシン特異的免疫タンパク質Im9と結合する領域のみから構成されることを特徴とする。
【発明の効果】
【0008】
本発明によれば、アルブミンに対し特異的に結合する結合部の持つシステイン残基と、コリシンDNA分解酵素及びコリシン特異的免疫タンパク質がジスルフィド結合を形成することがないため、分子内でのミスフォールディングの影響を低減することができる。
【図面の簡単な説明】
【0009】
【図1】コリシンE9と第一の抗アルブミンscFv抗体融合タンパク質発現の遺伝子構成を示す図
【図2】Im9と第二の抗アルブミンscFv抗体融合タンパク質発現の遺伝子構成を示す図
【図3】コリシンE9と第一の抗アルブミンscFv抗体融合タンパク質の構成を示す図
【図4】Im9と第二の抗アルブミンscFv抗体融合タンパク質の構成を示す図
【図5】多価結合分子の構成を示す図
【発明を実施するための形態】
【0010】
(実施の形態1)
以下に本発明の実施の形態について、図面を参照しながら説明する。ここで示す実施の形態はあくまでも一例であって、必ずしもこの実施の形態に限定されない。
【0011】
以下に、アルブミン抗原に対し、異なるエピトープに結合し得る多価結合分子を作製する例を示す。抗原結合部位の分子形態には、scFvを選択する例を示す。コリシンE9でありDNA分解酵素活性を失うようにアミノ酸変異を加えたものを用いる例を示す。
【0012】
<抗アルブミン抗体の遺伝子単離とscFv遺伝子の作製>
抗アルブミン抗体の取得には、例えばHSAをBALB/ Cマウスなどに免疫し、脾臓細胞とミエローマとをポリエチレングリコールを用いる通常の方法で細胞融合させ、抗原への反応性を確認した後に、限界希釈法によりクローニングを行い、抗モノクローナル抗体を作製することができる。また、ファージディスプレイ法やイーストディスプレイ法など、DNAライブラリーを用いたスクリーニング法により、アルブミンに特異的に結合し得る抗体遺伝子を取得する方法もある。異なるエピトープに対するクローンの選択には、例えば、得られた複数の抗体をサンドイッチELISA法や、SPRを用いることにより、複数の抗体が同時に一つの抗原に結合し得るか否かを実験的に評価することで選別することができる。
【0013】
上記のようにして、得られるモノクローナル抗体より抗体可変領域をコードする遺伝子を抽出し、scFv(一本鎖抗体)の遺伝子配列の作製方法を以下に示す。まず、モノクローナル抗体を、RPMI1640などの培地中で1×10^6個程度まで培養する。次に、TRIZOL(インビトロジェン製)により全RNAを抽出し、市販のmRNA抽出キット(タカラバイオ製)により、mRNAを抽出し、常法に従ってcDNAを調製することできる。得られたcDNAを鋳型とし、例えば、Mouse ScFv Module/Recombinant Phage Antibody System(アマシャム)のオリゴヌクレオチオドプライマーや、既存のサブクラスの抗体可変領域を増幅するためのプライマーを用い、PCR反応を行うことによって、抗体のH鎖及びL鎖のV領域をコードするDNA断片を増幅することができる。得られたH鎖及びL鎖のV領域をコードするDNA断片を市販のクローニング用ベクターに、制限酵素処理にて結合させ、L鎖V領域をコードする遺伝子と、H鎖V領域をコードする遺伝子配列の間に、配列番号1などのリンカー配列を持たせることで、scFvの遺伝子配列を構築することができる。
このようにして、2種のアルブミン上の異なるエピトープに同時に結合し得る第一のscFv遺伝子及び第二のscFv遺伝子を得ることができる。
【0014】
<コリシンE9と抗アルブミンscFv抗体融合タンパク質発現プラスミドの構築>
コリシンE9発現のための遺伝子は、既存の人工遺伝子合成技術を用い作製・取得することができる。上記のようにして得られた第1のscFv遺伝子と、コリシンE9遺伝子配列の間に、例えば、配列番号1や抗体ヒンジ領域のアミノ酸配列など適当なアミノ酸をリンカーとして選択し、発現に用いるベクター上にて、常法を用いて連結させる。また、融合タンパク質発現後の精製のため、バーナーゼ遺伝子配列の3‘側にヒスチジンタグなどの遺伝子配列を挿入しても良い。また、必要に応じてscFv遺伝子の5’側に、pelBなどのシグナル配列を挿入しておくと、目的のタンパク質がペリプラズムへ運ばれるため好ましい。scFv特性によっては、シグナル配列を含まなくても良い。発現ベクターに用いるプロモーターとしては、T7、tac、lac、trcプロモーターなどが挙げられるが、発現させるscFvの特性によって、適宜・適切に選択することが好ましい。また、ベクターにはアンピシリン、カナマイシン、テトラサイクリン、クロラムフェニコールなどに対する耐性遺伝子を有することが好ましい。以下では、発現ベクターがアンピシリン耐性遺伝子を有している場合の例について示す。
【0015】
<Im9と抗アルブミンscFv抗体融合タンパク質発現プラスミドの構築>
Im9発現のための遺伝子は、既存の人工遺伝子合成技術を用い作製・取得することができる。上記のようにして得られた第1のscFvとは異なるエピトープを認識する第二のscFv遺伝子と、Im9遺伝子配列の間に、例えば、配列番号1や抗体ヒンジ領域のアミノ酸配列など適当なアミノ酸をリンカーとして選択し、発現に用いるベクター上にて、常法を用いて連結させる。また、融合タンパク質発現後の精製のため、バーナーゼ遺伝子配列の3‘側にヒスチジンタグなどの遺伝子配列を挿入しても良い。また、必要に応じてscFv遺伝子の5’側に、pelBなどのシグナル配列を挿入しておくと、目的のタンパク質がペリプラズムへ運ばれるため好ましい。scFv特性によっては、シグナル配列を含まなくても良い。発現ベクターに用いるプロモーターとしては、T7、tac、lac、trcプロモーターなどが挙げられるが、発現させるscFvの特性によって、適宜・適切に選択することが好ましい。また、ベクターにはアンピシリン、カナマイシン、テトラサイクリン、クロラムフェニコールなどに対する耐性遺伝子を有することが好ましい。以下では、発現ベクターがアンピシリン耐性遺伝子を有している場合の例について示す。
【0016】
また、コリシンE9と第一のscFvを連結させるリンカーやIm9と第二のscFvを結合させるリンカーのアミノ酸の種類や数は、第一のscFv及び第二のscFvのエピトープの位置に応じて適宜選択すれば良い。
【0017】
<コリシンE9と抗アルブミンscFv抗体融合タンパク質の発現>
上記のようにして得られたコリシンE9と抗アルブミンscFv抗体融合タンパク質発現のためのプラスミドをタンパク質大腸菌発現用の宿主に形質転換する。形質転換を行う宿主としては、BL21由来のものが好ましいが、その他発現可能な宿主があれば、適宜・適切に選択することができる。形質転換後の溶液を、50μg/mlのアンピシリンを含むLBプレート培地にまき、37℃にて16時間培養する。次に形成されたシングルコロニーをピックアップし、50μg/mlのアンピシリンを含む5mLの2YT培地を用い、37℃、250rpmにて5時間培養する。次に、培養後の大腸菌を含む培地5mLを1Lの50μg/mlのアンピシリンを含むLB培地に添加し、37℃、250rpmにて培地の中心波長600nmのO.Dが0.4〜0.9になるまで培養する。次に、培養液中の0.1mM〜1mM程度のIPTGを加え、さらに37℃、250rpmにて約4〜20時間培養する。また、融合タンパク質の特性によっては、IPTG添加後の培養温度を16〜30℃に設定するのが好ましい。培養後の溶液を、5000rpm、4℃にて10分間遠心する。発現ベクターにpelBなどのペリプラズムへのシグナル配列を組み込んだ場合には、遠心後の上澄みを除去し、30mLの30mM Tris-HCl pH8.0、20%スクロース及び60μlの0.5M EDTApH8.0を加え、スタラーなどを用い室温にてゆっくりと10分間攪拌する。次に、溶液を4℃、10000gにて10分間遠心し、上澄みを除去する。次に、30mLの氷上にて冷却しておいた5mMの硫酸マグネシウムを加え再懸濁し、氷上にて10分間、ゆっくりと攪拌する。攪拌後の溶液を4℃、10000gにて10分間遠心する。得られた上澄みをゲルろ過クロマトグラフィ、イオン交換クロマトグラフィ、予めアルブミンを固定化したアフィニティカラムなどを通し、常法に従って、目的の融合タンパク質を精製することができる。得られるタンパク質の構成を図3に示す。また、ペリプラズムでの発現が低い、あるいは発現していない場合には、遠心後の沈殿物を30mM Tris-HClpH8.0、0.1M NaClなどに再懸濁し、大腸菌を超音波にて破砕することで細胞質内の可溶性タンパク質を得ても良い。また、不溶性のタンパク質を既存の希釈法・透析法などを用い、巻き戻しを行っても良い。また、大腸菌を育成した培養液中から、精製が必要になる場合もある。精製方法や手順・試薬の組成などは、タンパク質の特性によって、適宜・適切に選択されることが好ましい。
【0018】
<Im9と抗アルブミンscFv抗体融合タンパク質の発現>
上記のようにして得られたIm9と抗アルブミンscFv抗体融合タンパク質発現のためのプラスミドをタンパク質大腸菌発現用の宿主に形質転換する。形質転換を行う宿主としては、BL21由来のものが好ましいが、その他発現可能な宿主があれば、適宜・適切に選択することができる。形質転換後の溶液を、50μg/mlのアンピシリンを含むLBプレート培地にまき、37℃にて16時間培養する。次に形成されたシングルコロニーをピックアップし、50μg/mlのアンピシリンを含む5mLの2YT培地を用い、37℃、250rpmにて5時間培養する。次に、培養後の大腸菌を含む培地5mLを1Lの50μg/mlのアンピシリンを含むLB培地に添加し、37℃、250rpmにて培地の中心波長600nmのO.Dが0.4〜0.9になるまで培養する。次に、培養液中の0.1mM〜1mM程度のIPTGを加え、さらに37℃、250rpmにて約4〜20時間培養する。また、融合タンパク質の特性によっては、IPTG添加後の培養温度を16〜30℃に設定するのが好ましい。培養後の溶液を、5000rpm、4℃にて10分間遠心する。発現ベクターにpelBなどのペリプラズムへのシグナル配列を組み込んだ場合には、遠心後の上澄みを除去し、30mLの30mM Tris-HCl pH8.0、20%スクロース及び60μlの0.5M EDTApH8.0を加え、スタラーなどを用い室温にてゆっくりと10分間攪拌する。次に、溶液を4℃、10000gにて10分間遠心し、上澄みを除去する。次に、30mLの氷上にて冷却しておいた5mMの硫酸マグネシウムを加え再懸濁し、氷上にて10分間、ゆっくりと攪拌する。攪拌後の溶液を4℃、10000gにて10分間遠心する。得られた上澄みをゲルろ過クロマトグラフィ、イオン交換クロマトグラフィ、予めアルブミンを固定化したアフィニティカラムなどを通し、常法に従って、目的の融合タンパク質を精製することができる。得られるタンパク質の構成を図4に示す。また、ペリプラズムでの発現が低い、あるいは発現していない場合には、遠心後の沈殿物を30mM Tris-HClpH8.0、0.1M NaClなどに再懸濁し、大腸菌を超音波にて破砕することで細胞質内の可溶性タンパク質を得ても良い。また、不溶性のタンパク質を既存の希釈法・透析法などを用い、巻き戻しを行っても良い。また、大腸菌を育成した培養液中から、精製が必要になる場合もある。精製方法や手順・試薬の組成などは、タンパク質の特性によって、適宜・適切に選択されることが好ましい。
【0019】
<多価結合分子の作製と精製>
上記のようにして、得られたコリシンE9と第一の抗アルブミンscFv抗体融合タンパク質とIm9と第二の抗アルブミンsvFv抗体融合タンパク質を例えば、モル比1:1で混合させ、ゲル濾過クロマトグラフィなど所望の精製法にて分離・精製することで、図5に示すような多価結合分子を取得することができる。
【産業上の利用可能性】
【0020】
本発明に係るコリシンDNA分解酵素及びコリシン特異的免疫タンパク質を用いた多価分子は、生体内に含まれる対象生体分子に特異的に結合し得る多価結合分子として有用である。
【符号の説明】
【0021】
1 第一の抗アルブミンscFv抗体
2 コリシンE9
3 リンカー
4 第2の抗アルブミンscFv抗体
5 Im9
【特許請求の範囲】
【請求項1】
アルブミンに対し特異的に結合する少なくとも一つの結合部とコリシンDNA分解酵素E9の変異体を連結させた第一の分子を作製する工程と、
上記第一の分子とは異なるアルブミン分子表面に対し特異的に結合する少なくとも一つの結合部とコリシン特異的免疫タンパク質Im9を連結させた第二の分子を作製する工程と、
上記コリシンDNA分解酵素E9の変異体とコリシン特異的免疫タンパク質Im9を介し、第一の分子と第二の分子を連結させる工程からなることを特徴とする多価結合分子の作製方法。
【請求項2】
上記コリシンDNA分解酵素E9の変異体がDNA分解酵素活性を持たないことを特徴とする請求項1に記載の多価結合分子の作製方法。
【請求項3】
上記コリシンDNA分解酵素E9の変異体がコリシン特異的免疫タンパク質Im9と結合する領域のみから構成されることを特徴とする請求項1〜2に記載の多価結合分子の作製方法。
【請求項1】
アルブミンに対し特異的に結合する少なくとも一つの結合部とコリシンDNA分解酵素E9の変異体を連結させた第一の分子を作製する工程と、
上記第一の分子とは異なるアルブミン分子表面に対し特異的に結合する少なくとも一つの結合部とコリシン特異的免疫タンパク質Im9を連結させた第二の分子を作製する工程と、
上記コリシンDNA分解酵素E9の変異体とコリシン特異的免疫タンパク質Im9を介し、第一の分子と第二の分子を連結させる工程からなることを特徴とする多価結合分子の作製方法。
【請求項2】
上記コリシンDNA分解酵素E9の変異体がDNA分解酵素活性を持たないことを特徴とする請求項1に記載の多価結合分子の作製方法。
【請求項3】
上記コリシンDNA分解酵素E9の変異体がコリシン特異的免疫タンパク質Im9と結合する領域のみから構成されることを特徴とする請求項1〜2に記載の多価結合分子の作製方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−147385(P2011−147385A)
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願番号】特願2010−10784(P2010−10784)
【出願日】平成22年1月21日(2010.1.21)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願日】平成22年1月21日(2010.1.21)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

