多剤リガンド結合体
本明細書では患者において病原性細胞集団を治療するための化合物、医薬組成物、および方法が記載される。本明細書に記載する化合物は、複数の細胞毒性薬物およびビタミン受容体結合リガンドの結合体を含む。複数の薬物は同じまたは異なりうる。同様に、ビタミン受容体結合リガンドは同じまたは異なりうる。該結合体は、1個以上のスペーサーリンカー、ヘテロ原子リンカー、および放出型リンカーから形成されるリンカーも含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、標的薬物送達で使用するための組成物および方法に関するものである。特に本発明は、2つ以上の薬物、ならびにその類似体および誘導体を含むリガンド結合体、例えばビタミン受容体結合化合物および2つ以上の薬物の結合体に関するものである。
【背景技術】
【0002】
哺乳類免疫系は、腫瘍細胞、他の病原性細胞、および侵入する外来病原体の認識および排除のための手段を提供する。免疫系は通常、強力な防御線を提供するが、癌細胞、他の病原性細胞、または感染性因子が宿主免疫反応を逃れて、共存する宿主病原性と共に増殖または持続する多くの例がある。化学療法剤および放射線療法は、例えば分裂を繰り返す新生物を排除するために開発されてきた。しかしながら現在入手可能な化学療法剤および放射線療法投与計画の多くは、それらが病原性細胞を破壊するだけでなく、それらが正常な宿主細胞、例えば造血系の細胞にも影響を及ぼすために有害な副作用を有する。これらの抗癌剤の有害な副作用は、病原性細胞集団に対して選択的であり、かつ宿主毒性の低い新たな治療法の開発の必要性を際立たせている。
【0003】
研究者らは、病原性細胞を、このような細胞へ細胞毒性化合物を標的指向化することによって破壊する治療プロトコルを開発してきた。これらのプロトコルの多くは、毒素の正常細胞への送達を最小限に抑えることを試みて、病原性細胞に特有の抗原、または病原性細胞によって過剰に発現された抗原に結合する抗体に結合された毒素を利用する。この手法を使用して、病原性細胞上の特異性抗原に対する抗体より成る、ある免疫毒素が開発され、該抗体はリシン、緑膿菌外毒素、ジフテリア毒素、および腫瘍壊死因子などの毒素に結合されている。これらの免疫毒素は、抗体によって認識される特異性抗原を持つ病原性細胞、例えば腫瘍細胞を標的とする(非特許文献1及び2、特許文献1参照)。
【0004】
宿主内の病原性細胞、例えば癌細胞または外来病原体の集団を標的とする別の手法は、独立した宿主毒性をも示しうる化合物投与の必要性を回避するために、病原性細胞に対する宿主免疫応答を向上させることである。免疫療法について報告された1つの方法は、抗体、例えば遺伝子組換え多重結合抗体を腫瘍細胞の表面に結合させて、細胞表面で抗体の定常領域を提示して、それにより各種の免疫系媒介プロセスによって腫瘍細胞の死滅を誘発させることである(非特許文献3、特許文献2参照)。しかしながらこれらの手法は、腫瘍特異性抗原を定義することの困難さによって複雑にされている。
【特許文献1】国際公開WO91/07418号
【特許文献2】米国特許第5,672,486号
【非特許文献1】Olsnes, S., Immunol. Today, 10, pp.291-295, 1989
【非特許文献2】Melby, E.L., Cancer Res., 53(8), pp.1755-1760, 1993
【非特許文献3】De Vita, V. T., Biologic Therapy of Cancer, 2d ed. Philadelphia, Lippincott, 1995
【発明の開示】
【課題を解決するための手段】
【0005】
薬物、ならびにその類似体および誘導体のリガンド結合体を本明細書で説明する。結合体は、細胞へ標的指向化されうる2つ以上の薬物に共有結合された、細胞受容体結合リガンドを含む。本明細書に記載する結合体は、リガンドを薬物に結合するための多価リンカーも含みうる。
【0006】
一実施形態において、受容体結合薬物送達結合体が記載される。薬物送達結合体は、細胞表面受容体のリガンド、2つ以上の薬物、あるいはその類似体または誘導体、および場合により多価リンカーを含み、一般に式
(B)−(L)−(D)n
によって表され、式中、(B)は、受容体結合部分を表し;(D)は、受容体結合部分によって細胞へ標的指向化される薬物、あるいはその類似体または誘導体を表し;(L)は、多価リンカーを表し、nは、1を超える整数である。多価リンカー(L)は、相互に共有結合された複数のリンカーを含みうる。例えば多価リンカー(L)は、それぞれ相互に、そしてリガンドおよび薬物に1個以上のヘテロ原子リンカー(lH)によって結合されている、1個以上のスペーサーリンカー(ls)、および/または放出型リンカー(lr)を含むことができる。これらの各種リンカーは、多価リンカー(L)を構築するために選択され、いずれかの順序でも配置されてもよい。例証的には、多価リンカー(L)は、次の2価リンカーの1つ以上から構築されてもよい:

式中、a、b、c、d、およびeは整数、例えば0〜約4の範囲の整数であり、(ls)、(lH)、および(lr)はそれぞれ、スペーサーリンカー、放出型リンカー、ヘテロ原子リンカーである。本明細書に記載する多価リンカーを構築するために使用されうる2価リンカーのさらなる例証的な例は、米国特許出願第10/765,336号(米国特許出願公開第2005/0002942A1号としても見出される)および国際公開WO2006/012527号に記載されており、その開示の全体は参照により本明細書に組み入れられている。
【0007】
多価リンカーが、受容体結合部分を、これに限定されるわけではないが次の例証的な一般式:

を含めた、各種の構造形態の2つ以上の薬物に対して結合させてもよいことが理解されるであろう。式中、Bは、受容体結合リガンドであり、(L1)、(L2)、および(L3)はそれぞれ、1個以上のスペーサーリンカー、放出型リンカー、および/またはヘテロ原子リンカーから構築された多価リンカーであり、(D1)、D2、およびD3はそれぞれ、薬物、あるいはその類似体または誘導体である。追加の薬物、あるいはその類似体または誘導体、追加のリンカー、(B)、(L)、および(D)のそれぞれの配列の追加の形態を含む、他の変更形態も本明細書で企図される。
【0008】
一変更形態において、1個を超える受容体結合リガンドが、本明細書に記載する薬物送達結合体に含まれ、これには、限定されるわけではないが、次の例証的な一般式:

が含まれる。式中、各Bは、受容体結合リガンドであり、(L1)、(L2)、および(L3)のそれぞれは、1個以上のスペーサーリンカー、放出型リンカー、および/またはヘテロ原子リンカーから構築された多価リンカーであり、(D1)、D2、およびD3はそれぞれ、薬物、あるいはその類似体または誘導体である。追加の薬物、あるいはその類似体または誘導体、追加のリンカー、(B)、(L)、および(D)それぞれの配列の追加の形態を含む、他の変更形態も本明細書で企図される。一変更形態において、複数の受容体結合リガンドは同じ受容体に対するリガンドであり、別の変更形態において、複数の受容体結合リガンドは異なる受容体に対するリガンドである。
【0009】
本明細書に記載する薬物送達結合体の例証的な一実施形態において、多価リンカーは、少なくとも1個の放出型のリンカー(lr)を含む。本明細書に記載する薬物送達結合体の別の例証的な実施形態において、多価リンカーは、少なくとも2個の放出型リンカー(lr)2を含む。別の例証的な態様において、多価リンカー(L)は、ジスルフィド放出型リンカーでない、少なくとも1個の放出型リンカー(lr)を含む。別の例証的な態様において、多価リンカー(L)は、1個の放出型リンカーがジスルフィド放出型リンカーでない、少なくとも2個の放出型リンカー(lr)2を含む。1個を超える放出型リンカーが多価リンカーに含まれるとき、これらの放出型リンカーは隣接してもよいことが認識される。2個の放出型リンカーが多価リンカーにおいて隣接しているとき、2個の放出型リンカーは連携して薬物の放出を引き起こしてもよいことがさらに認識される。
【0010】
別の実施形態において、多価リンカーは、アミノ酸から形成されたペプチドである少なくとも1個のスペーサーリンカーを含む。一態様において、ペプチドは天然型アミノ酸、およびその立体異性体を含む。別の態様において、ペプチドは天然型アミノ酸、およびその立体異性体のみから形成される。
【0011】
本明細書に記載するリガンドは一般に、細胞表面受容体のリガンドを含む。本明細書に記載する結合体において有用な例証的なリガンドとしては、これに限定されるわけではないが、ビタミン、およびビタミン受容体に結合する他の部分、トランスポータ、もしくはビタミンあるいはその類似体または誘導体に特異的に結合する他の表面提示タンパク質、ライブラリースクリーニングから同定されたペプチドリガンド、腫瘍細胞特異性ペプチド、腫瘍細胞特異性アプタマー、腫瘍細胞特異性炭水化物、腫瘍細胞特異性モノクローナルまたはポリクローナル抗体、抗体のFabまたはscFv(すなわち単鎖可変領域)断片(例えばEphA2に対する、または転移性癌細胞で特異的に発現または独自に接近可能な他のタンパク質に対する抗体のFab断片)、コンビナトリアルライブラリーに由来する小型有機分子、成長因子(例えばEGF、FGF、インスリン、およびインスリン様成長因子)、ならびに相同ポリペプチド、ソマトスタチンおよびその類似体、トランスフェリン、リポタンパク質複合体、胆汁塩、セレクチン、ステロイドホルモン、Arg−Gly−Asp含有ペプチド、レチノイド、各種のガラクチン、δ−オピオイド受容体リガンド、コレシストキニンA受容体リガンド、アンギオテンシンAT1またはAT2受容体に特異的なリガンド、ペルオキシソーム増殖因子活性化受容体λリガンド、β−ラクタム抗生物質(例えばペニシリン、抗菌薬を含む小型有機分子、ならびに腫瘍細胞の表面でまたは感染性生物で優先的に発現される受容体に特異的に結合する他の分子)、受容体または他の細胞表面タンパク質の結晶構造に基づき特定の受容体の結合ポケット内に適合するように設計された抗菌薬および他の薬物、腫瘍抗原または腫瘍細胞の表面で優先的に発現される他の分子のリガンド、あるいはこれらの分子のいずれかの断片、などが挙げられる。リガンド−薬物結合体の結合部位として機能しうる腫瘍特異性抗原は、タンパク質のエフリンファミリーのメンバーの細胞外エピトープ、例えばEphA2を含む。EphA2発現は、正常細胞の細胞−細胞接合部に限定されるが、転移性腫瘍細胞ではEphA2は細胞表面全体に分布している。それゆえ転移性細胞上のEphA2は、例えば薬物あるいはその類似体または誘導体に結合した抗体のFab断片への結合のために接近可能であるが、これに対して該タンパク質は正常細胞のFab断片への結合のためには接近できないので、結果として、転移性癌細胞に対して特異的なリガンド−薬物結合体を生じる。
【0012】
本明細書に記載する薬物、およびその各種の類似体および誘導体は一般に、感染性因子、癌、腫瘍などを含む病原性細胞の集合を排除、死滅、妨害、および/またはその成長を低下させるための薬物である。さらに、本明細書に記載する結合体において有用な薬物、およびその各種の類似体および誘導体は、これに限定されるわけではないが、アルキル化剤、微小管形成を安定化および/または不安定化するもの(例えばベータチューブリン剤)を含む、微小管阻害薬、CDKN1a、CDKN1bなどのサイクリン依存性キナーゼ(CDK)阻害薬、トポイソメラーゼ阻害薬、タンパク質合成阻害薬、Ras、Raf、PKC、PI3K、および同様の阻害薬を含むタンパク質キナーゼ阻害薬、転写阻害薬、葉酸拮抗薬、熱ショックタンパク質遮断薬などを含む、多種多様の作用機構を有しうる。
【0013】
別の実施形態において、医薬組成物が記載されている。本医薬組成物は、本明細書に記載した薬物送達結合体を、製薬的に許容される担体、賦形剤および/または希釈剤と組合せて含む。
【0014】
別の実施形態において、病原性細胞の集団を内部に持つ宿主動物において、病原性細胞の集団を排除する方法が記載される。例証的な一態様において、病原性細胞集団のメンバーは、受容体結合部分、あるいはその類似体または誘導体に対する接近可能な結合部位を有し、その結合部位は病原性細胞によって独自に発現、過剰に発現、または優先的に発現される。該方法は、本明細書で記載するように、宿主に本明細書に記載する薬物送達結合体、あるいはその医薬組成物を投与する工程を含む。
【0015】
==関連出願==
本出願は、米国特許法119条(e)に基づいて、その開示全体が参照により本明細書に組み入れられている、2005年8月19日に出願された米国特許仮出願第60/709,950号、および2006年3月30日に出願された米国特許仮出願第60/787,558号の利益を主張する。
【発明を実施するための最良の形態】
【0016】
薬物、ならびにその類似体および誘導体のリガンド結合体が本明細書に記載される。本結合体は、病原性細胞を含む細胞へ標的指向化されうる2つ以上の薬物に共有結合された、細胞表面受容体のリガンドを含めた、細胞受容体結合リガンドを含む。本明細書に記載する結合体は、リガンドを薬物に結合するための多価リンカーも含んでもよい。
【0017】
受容体結合部分(B)、多価リンカー(L)、および2つ以上の薬物、あるいは薬物類似体または薬物誘導体(D)nを含む、受容体結合薬物送達結合体が記載され、ここでnは2またはそれ以上である。本明細書に記載する送達結合体において、受容体結合部分(B)および2つ以上の薬物(D)nは、それぞれ、独立して選択されたヘテロ原子リンカー(lH)を介して多価リンカー(L)に結合される。多価リンカー(L)は、1個以上のスペーサーリンカー、ヘテロ原子リンカー、および放出型リンカー、ならびにその組合せをいずれかの順序で含む。
【0018】
一実施形態において、受容体結合薬物送達結合体が記載される。薬物送達結合体は、リガンド、例えば細胞表面受容体のリガンド、2つ以上の薬物、あるいはその類似体または誘導体、および場合により多価リンカーを含み、一般に式
(B)−(L)−(D)n
によって表される。式中、(B)は、受容体結合部分を表し;(D)は、受容体結合部分によって細胞へ標的指向化される薬物、あるいはその類似体または誘導体を表し;(L)は、多価リンカーを表し、nは、1を超える整数である。多価リンカー(L)は、相互に共有結合された複数のリンカーを含みうる。例えば多価リンカー(L)は、それぞれ相互に、そしてリガンドおよび薬物に1個以上のヘテロ原子リンカー(lH)によって結合されている、1個以上のスペーサーリンカー(ls)、および/または放出型リンカー(lr)を含みうる。これらの各種リンカーは、多価リンカー(L)を構築するために選択され、いずれかの順序で配置されてもよい。
【0019】
例証的には、多価リンカー(L)は、次の2価リンカーの1つ以上から構築されうる:

式中、a、b、c、d、およびeは整数、例えば0〜約4の範囲の整数であり、(ls)、(lH)、および(lr)はそれぞれ、スペーサーリンカー、放出型リンカー、ヘテロ原子リンカーである。本明細書に記載する多価リンカーを構築するために使用されうる2価リンカーのさらなる例証的な例は、米国特許出願第10/765,336号(米国特許出願公開第2005/0002942A1号としても見出される)および国際公開WO2006/012527号に記載されており、その開示の全体は参照により本明細書に組み入れられている。
【0020】
多価リンカーが、受容体結合部分を、これに限定されるわけではないが次の例証的な一般式:

を含む、各種の構造形態の2つ以上の薬物に対して結合させてもよいことが理解されるであろう。式中、Bは、受容体結合リガンドであり、(L1)、(L2)、および(L3)は、1個以上のスペーサーリンカー、放出型リンカー、および/またはヘテロ原子リンカーから構築された多価リンカーであり、(D1)、D2、およびD3はそれぞれ、薬物、あるいはその類似体または誘導体である。追加の薬物、あるいはその類似体または誘導体、追加のリンカー、ならびに(B)、(L)、および(D)それぞれの配列の追加の形態を含む、他の変更形態も本明細書で企図される。
【0021】
一変更形態において、1個を超える受容体結合リガンドが、本明細書に記載する薬物送達結合体に含まれ、これには、限定されるわけではないが、次の例証的な一般式:

が含まれる。式中、各Bは、受容体結合リガンドであり、(L1)、(L2)、および(L3)はそれぞれ、1個以上のスペーサーリンカー、放出型リンカー、および/またはヘテロ原子リンカーから構築された多価リンカーであり、(D1)、D2、およびD3はそれぞれ、薬物、あるいはその類似体または誘導体である。追加の薬物、あるいはその類似体または誘導体、追加のリンカー、ならびに(B)、(L)、および(D)それぞれの配列の追加の形態を含む、他の変更形態も本明細書で企図される。一変更形態において、受容体結合リガンドは同じ受容体に対してであり、別の変更形態において、受容体結合リガンドは異なる受容体に対してである。上の式に示すように、1個を超える多価リンカーが、本明細書に記載する薬物送達結合体に含まれうることが認識される。一態様において、リンカーの数は、受容体結合リガンド、および薬物の形態に応じて選択されることが理解される。
【0022】
例えば多価リンカー、または多価リンカーの一部を形成するためにリンカーが共有結合的に組み立てられる方法の例証的な一実施形態において、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーが結合されて式:

の多価基を形成し、この式は

としても表される。式中、(ls)1は、トリペプチドAsp−Asp−Aspであり、(ls)2は、Cysであり、(lr)1は、S−Sであり、(ls)3は、CH2CH2であり、(lH)1は、Oであり、(lr)2は、C(O)NHNHであり、(ls)4は、ω−Lysであり、(ls)5は、C(O)CH2CH2であり、(lr)3は、S−Sであり、(lH)6は、CH2CH2である。
【0023】
本明細書に記載する結合体において有用な細胞表面受容体のリガンドとしては、これに限定されるわけではないが、ビタミン、およびビタミン受容体に結合する他の部分、トランスポータ、もしくはビタミンあるいはその類似体または誘導体に特異的に結合する他の表面提示タンパク質、ライブラリースクリーニングから同定されたペプチドリガンド、腫瘍細胞特異性ペプチド、腫瘍細胞特異性アプタマー、腫瘍細胞特異性炭水化物、腫瘍細胞特異性モノクローナルまたはポリクローナル抗体、抗体のFabまたはscFv(すなわち単鎖可変領域)断片(例えばEphA2に対する、または転移性癌細胞で特異的に発現または独自に接近可能な他のタンパク質に対する抗体のFab断片)、コンビナトリアルライブラリーに由来する小型有機分子、成長因子(例えばEGF、FGF、インスリン、およびインスリン様成長因子)、ならびに相同ポリペプチド、ソマトスタチンおよびその類似体、トランスフェリン、リポタンパク質複合体、胆汁塩、セレクチン、ステロイドホルモン、Arg−Gly−Asp含有ペプチド、レチノイド、各種のガラクチン、δ−オピオイド受容体リガンド、コレシストキニンA受容体リガンド、アンギオテンシンAT1またはAT2受容体に特異的なリガンド、ペルオキシソーム増殖因子活性化受容体λリガンド、β−ラクタム抗生物質(例えばペニシリン、抗菌薬を含む小型有機分子、ならびに腫瘍細胞の表面でまたは感染性生物で優先的に発現される受容体に特異的に結合する他の分子)、受容体または他の細胞表面タンパク質の結晶構造に基づき特定の受容体の結合ポケット内に適合するように設計された抗菌薬および他の薬物、腫瘍抗原または腫瘍細胞の表面で優先的に発現される他の分子のリガンド、あるいはこれらの分子のいずれかの断片、などが挙げられる。リガンド−薬物、あるいはその類似体または誘導体の結合体の結合部位として機能しうる腫瘍特異性抗原の例は、タンパク質のエフリンファミリーのメンバーの細胞外エピトープ、例えばEphA2を含む。EphA2発現は、正常細胞の細胞−細胞接合部に限定されるが、転移性腫瘍細胞ではEphA2は細胞表面全体に分布している。それゆえ転移性細胞のEphA2は、例えば薬物あるいはその類似体または誘導体に結合した抗体のFab断片への結合のために接近可能であるが、これに対して該タンパク質は正常細胞のFab断片への結合のためには接近できないので、結果として、転移性癌細胞に対して特異的なリガンド−薬物結合体を生じる。
【0024】
一実施形態において、受容体結合部分はビタミン、あるいはそのビタミン受容体結合類似体または誘導体、例えばビタミン受容体を結合することができるビタミンならびにその類似体および誘導体である。
【0025】
本明細書に記載する方法および化合物に従って使用されうるビタミンとしては、カルニチン、イノシトール、リポ酸、ピリドキサール、アスコルビン酸、ナイアシン、パントテン酸、葉酸、リボフラビン、チアミン、ビオチン、ビタミンB12、ビタミンA、D、EおよびK,他の関連ビタミン分子、その類似体および誘導体、ならびにその組合せ、などが挙げられる。これらのビタミン、ならびにその受容体結合類似体および誘導体は、薬物送達結合体を作製するために、本明細書に記載する多価リンカー(L)によって薬物化合物、あるいはその類似体または誘導体に結合されうる例証的な標的実体を構成する。
【0026】
例証的な一態様において、ビタミンは、葉酸、葉酸類似体、または別の葉酸塩受容体結合分子であってもよい。使用されうる葉酸塩の類似体の例としては、フォリン酸、プテロイルポリグルタミン酸、プテロイン酸およびその他のアミノ酸誘導体、ならびに葉酸塩受容体結合プテリジン(例えばテトラヒドロプテリン)、ジヒドロ葉酸塩、テトラヒドロ葉酸塩、ならびにそのデアザおよびジデアザ類似体、などが挙げられる。「デアザ」および「ジデアザ」類似体という用語は、天然型葉酸構造において1または2個の窒素原子に代わって置換された炭素原子を有する当分野で認識された類似体を指す。例えばデアザ類似体としては、1−デアザ、3−デアザ、5−デアザ、8−デアザ、および10−デアザ類似体、などが挙げられる。ジデアザ類似体としては例えば、1,5−ジデアザ、5,10−ジデアザ、8,10−ジデアザ、および5,8−ジデアザ類似体、などが挙げられる。上記の葉酸類似体は、葉酸塩受容体に結合するその能力を反映して、慣例的に「葉酸塩」と呼ばれる。他の葉酸塩受容体結合類似体としては、アミノプテリン、アメトプテリン(メトトレキセート)、N10−メチル葉酸、2−デアミノ−ヒドロキシ葉酸、デアザ類似体、例えば1−デアザメトプテリンまたは3−デアザメトプテリン、および3’,5’−ジクロロ−4−アミノ−4−デオキシ−N10−メチルプテロイルグルタミン酸(ジクロロメトトレキセート)などが挙げられる。薬物送達結合体の受容体媒介エンドサイトーシス輸送を開始するために葉酸塩受容体に結合可能である他の適切なリガンドとしては、葉酸受容体への抗体が挙げられる。したがって例証的な一態様において、葉酸塩受容体への抗体と複合化したビンカ化合物は、複合体の膜透過輸送を引き起こすために使用されうる。
【0027】
ビタミン類似体および/または誘導体の例証的な実施形態は、ビオチンの類似体および誘導体、例えばビオシチン、ビオチンスルホキシド、オキシビオチンおよび他のビオチン受容体結合化合物なども含む。本明細書に記載する他のビタミンの類似体および誘導体も本明細書で企図されることが認識される。
【0028】
記載した結合体のいずれの形状も本明細書で企図され、薬物、受容体結合部分、および各種の多価リンカーが結合される方法によって決定される。一態様において、本明細書に記載する結合体の三次元形状全体が線形である。別の態様において、本明細書に記載する結合体の三次元形状全体が「Y」または「T」字形状である。別の態様において、本明細書に記載する結合体の三次元形状全体が「X」字形状または十字架形状である。別の
【0029】
本明細書に記載する薬物送達結合体の例証的な一実施形態において、多価リンカーは、少なくとも1個の放出型リンカー(lr)を含む。本明細書に記載する薬物送達結合体の別の例証的な実施形態において、多価リンカーは、少なくとも2個の放出型リンカー(lr)2を含む。別の例証的な態様において、多価リンカー(L)は、ジスルフィド放出型リンカーでない、少なくとも1個の放出型リンカー(lr)を含む。別の例証的な態様において、多価リンカー(L)は、1個の放出型リンカーがジスルフィド放出型リンカーでない、少なくとも2個の放出型リンカー(lr)2を有する。1個を超える放出型リンカーが多価リンカーに含まれるとき、これらの放出型リンカーは隣接してもよいことが認識される。2個の放出型リンカーが多価リンカーにおいて隣接しているとき、2個の放出型リンカーは連携して薬物の放出を引き起こしてもよいことがさらに認識される。
【0030】
本明細書で使用され、また開裂性リンカーとしても知られている「放出型リンカー」という用語は、生理学的条件下で切断されうる少なくとも1個の結合(例えばpH不安定性、酸不安定性、酸化不安定性、または酵素不安定性の結合)を含むリンカーを指す。結合切断を生じるこのような生理学的条件としては、例えば生理学的pHにて生じる、またはサイトゾルpHよりも低いpHを有するエンドソームなどの細胞器官への細分化の結果として生じる、標準的な化学加水分解反応が挙げられることが認識されるべきである。
【0031】
開裂性結合が、放出型リンカーのどちらかまたは両方の端にて、本明細書に記載するように、放出型リンカー内の2個の隣接する原子を結合しうる、ならびに/あるいは、他のリンカーまたは(B)および/または(D)を結合しうることが理解されるはずである。開裂性結合が放出型リンカー内の2個の隣接する原子を結合する場合、結合の切断後に、放出型リンカーは2個以上の断片に切断される。あるいは開裂性結合が放出型リンカーと別の部分、例えばヘテロ原子リンカー、スペーサーリンカー、別の放出型リンカー、薬物、あるいはその類似体または誘導体、あるいはビタミン、あるいはその類似体または誘導体との間にある場合、結合の切断後に、放出型リンカーは他の部分から分離される。
【0032】
開裂性結合の不安定性は例えば、開裂性結合におけるまたはその付近の置換的な変更、例えば開裂性ジスルフィド結合に隣接したアルファ分岐を含むこと、加水分解されうるケイ素−酸素結合を有する部分におけるケイ素上の置換基の疎水性の上昇、加水分解されうるケタールまたはアセタールの部分を形成するアルコキシ基のホモログ化、などによって調整されうる。
【0033】
本明細書に記載する2価リンカーの開裂の例示的な機構は、次の1,4および1,6断片化機構:

を含み、式中、Xは、外来性または内在性求核試薬、グルタチオン、または生物還元剤などであり、ZまたはZ’のどちらかは、ビタミン、あるいはその類似体または誘導体、もしくは薬物、あるいはその類似体または誘導体、あるいは多価リンカーの他の部分と併せたビタミンまたは薬物部分である。上の断片化機構は、協奏機構として示されているが、多数の別個の工程が起こることによって、最終的に、多価リンカーからの示された最終生成物への断片化が生じてもよいことが理解されるものとする。例えば、結合開裂は酸触媒によるカルバメート部分の脱離反応によっても起こりうることが認識され、この脱離反応は、上の例に示されたベータ硫黄のアリール基またはジスルフィドのどちらかによってもたらされる安定化により、隣接基によって(anchimerically)補助されうる。本実施形態のこれらの変更態様において、放出型リンカーはカルバメート部分である。あるいは断片化は、ジスルフィド基に対する求核攻撃によって開始されて、開裂が引き起こされ、チオラートが形成される。チオラートはカルボン酸またはカルバミン酸部分を分子間で置換して、対応するチアシクロプロパンを形成しうる。ベンジル含有多価リンカーの場合、例示のジスルフィド結合の切断の後、得られたフェニルチオラートはさらに断片化して、共鳴安定化中間体を形成することによってカルボン酸またはカルバミン酸を放出しうる。これらの場合にいずれにおいても、本明細書に記載する例証的な多価リンカーの放出性質は、存在する化学的、代謝的、生理学的、または生物学的条件に関連しうるどんな機構によっても実現されうる。
【0034】
放出型リンカーの結合開裂のための他の例証的な機構は、次のようなオキソニウム補助開裂:

を含み、式中、Zは、ビタミン、あるいはその類似体または誘導体、あるいは薬物、あるいはその類似体または誘導体であり、あるいはそれぞれが、多価リンカーの他の部分と併せたビタミンまたは薬物部分、例えば1個以上のスペーサーリンカー、ヘテロ原子リンカー、および/または他の放出型リンカーを含む薬物またはビタミン部分である。この実施形態において、カルバメートの酸触媒による脱離は、CO2の放出およびZに結合した窒素含有部分の放出と、水、または他の任意のルイス塩基によって捕捉されうるベンジルカチオンの形成につながる。
【0035】
別の例証的な機構は、多価リンカーにおける結合の開裂に続いて、放出された官能基が、隣接基補助(anchimeric assisted)開裂または切断とも呼ばれる、さらなる結合の切断または開裂を化学的に補助するような方法で、放出型リンカー、スペーサーリンカー、およびヘテロ原子リンカーの配置をともなう。このような多価リンカーまたはその部分の例証的な実施形態は、式:

を有する化合物を含み、式中、Xは、ヘテロ原子、例えば窒素、酸素、または硫黄であり、nは、0、1、2、および3から選択される整数であり、Rは、水素または置換基、例えばアリール環に正電荷を誘導的にまたは共鳴によって安定化できる置換基(例えばアルコキシなど)であり、ZまたはZ’のどちらかは、ビタミン、あるいはその類似体または誘導体、あるいは薬物、あるいはその類似体または誘導体、あるいは多価リンカーの他の部分と併せたビタミンまたは薬物部分である。これに限定されるわけではないが、ヒドロキシ、アルキル、アルコキシ、アルキルチオ、ハロなどを含む他の置換基が、アリール環、ベンジル炭素、カルバメート窒素、アルカン酸、またはメチレン架橋に存在しうることが認識される。補助開裂には、ベンジリウム中間体、ベンジン中間体、ラクトン環化、オキソニウム中間体、ベータ脱離などをともなう機構が含まれうる。放出型リンカーの開裂に続く断片化に加えて、放出型リンカーの初期開裂が隣接基補助機構によって促進されうることがさらに認識される。
【0036】
この実施形態において、環化しうるヒドロキシアルカン酸は、例えばオキソニウムイオンによってメチレン架橋の開裂を促進し、結合開裂または放出型リンカーの結合開裂後の続いての断片化を促進する。あるいは、メチレン架橋の酸触媒によるオキソニウムイオン補助開裂は、この例証的な多価リンカー、またはその断片の断片化のカスケードを開始しうる。あるいはカルバメートの酸触媒による加水分解は、環化しうるヒドロキシアルカン酸のベータ脱離を促進し、例えばオキソニウムイオンによってメチレン架橋の開裂を促進しうる。本明細書に記載する代謝的、生理学的、または細胞的条件下での結合切断または開裂の他の化学的機構がこのような断片化のカスケードを開始しうることが認識される。本明細書に記載する代謝的、生理学的、または細胞的条件下での結合切断または開裂の他の化学的機構がこのような断片化のカスケードを開始しうることが認識される。
【0037】
一実施形態において、本明細書に記載する多価リンカーは、次の式

の化合物であり、式中、nは、1〜約4より選択される整数であり;RaおよびRbは、水素および場合により分岐しているC1〜C4アルキルなどの低級アルキルを含むアルキルから成る群よりそれぞれ独立して選択され;あるいはRaおよびRbは、結合した炭素原子とひとまとめにされて、炭素環を形成し;Rは、場合により置換されたアルキル基、場合により置換されたアシル基、または適切に選択された窒素保護基であり;そして(*)は、薬物、ビタミン、造影剤、診断剤、他の多価リンカー、または結合体の他の部分への結合点を示す。
【0038】
別の実施形態において、本明細書に記載する多価リンカーは、次の式

の化合物を含み、式中、mは、1〜約4より選択される整数であり;Rは、場合により置換されたアルキル基、場合により置換されたアシル基、または適切に選択された窒素保護基であり;そして(*)は、薬物、ビタミン、造影剤、診断剤、他の多価リンカー、または結合体の他の部分への結合点を示す。
【0039】
別の実施形態において、本明細書に記載する多価リンカーは、次の式

の化合物を含み、式中、mは、1〜約4より選択される整数であり;Rは、場合により置換されたアルキル基、場合により置換されたアシル基、または適切に選択された窒素保護基であり;そして(*)は、薬物、ビタミン、造影剤、診断剤、他の多価リンカー、または結合体の他の部分への結合点を示す。
【0040】
別の実施形態において、多価リンカーにおける結合の開裂に続いて、放出された官能基が、隣接基補助(anchimeric assisted)開裂または切断とも呼ばれる、さらなる結合の切断または開裂を化学的に補助するような方法で、放出型リンカー、スペーサーリンカー、およびヘテロ原子リンカーが配置されてもよい。このような多価リンカーまたはその部分の例証的な実施形態は、式:

を有する化合物を含み、式中、Xは、ヘテロ原子、例えば窒素、酸素、または硫黄であり、nは、0、1、2、および3から選択される整数であり、Rは、水素、またはアリール環に正電荷を誘導的にまたは共鳴によって安定化できる置換基(例えばアルコキシなど)を含めた置換基であり、記号(*)は、多価リンカーを形成する追加のスペーサーリンカー、ヘテロ原子リンカー、または放出型リンカーへの結合点、あるいは薬物、あるいはその類似体または誘導体、あるいはビタミン、あるいはその類似体または誘導体への結合点を示す。これに限定されるわけではないが、ヒドロキシ、アルキル、アルコキシ、アルキルチオ、ハロなどを含む他の置換基が、アリール環、ベンジル炭素、アルカン酸、またはメチレン架橋に存在してもよいことが認識される。補助開裂は、ベンジリウム中間体、ベンジン中間体、ラクトン環化、オキソニウム中間体、ベータ脱離をともなう機構が含まれてもよい。放出型リンカーの開裂に続く断片化に加えて、放出型リンカーの初期開裂が隣接基補助機構(anchimerically assisted mechanism)によって促進されてもよいことがさらに認識される。
【0041】
別の実施形態において、多価リンカーは、多価3−チオスクシンイミド−1−イルアルキルオキシメチルオキシ基を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、次の式

によって表される。式中、nは、1〜6の整数であり、アルキル基は場合により置換され、メチルは、追加のアルキルまたは場合により置換されたアリール基によって場合により置換され、そのそれぞれが独立して選択された基Rによって表される。記号(*)は、多価リンカー断片の、本明細書に記載する結合体の他の部分への結合点を示す。
【0042】
別の実施形態において、多価リンカーは、多価3−チオスクシンイミド−1−イルアルキルカルボニル基を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、次の式

によって表される。式中、nは、1〜6の整数であり、アルキル基は場合により置換される。記号(*)は、多価リンカー断片の、本明細書に記載する結合体の他の部分への結合点を示す。別の実施形態において、多価リンカーは、多価3−チオアルキルスルホニルアルキル(2置換シリル)オキシ基を形成するために結合されたヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、2置換シリルは、アルキルおよび/または場合により置換されたアリール基によって置換される。
【0043】
別の実施形態において、多価リンカーは、多価ジチオアルキルカルボニルヒドラジド基、または多価3−チオスクシンイミド−1−イルアルキルカルボニルヒドラジドを形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、次の式

によって表される。式中、nは、1〜6の整数であり、アルキル基は場合により置換され、ヒドラジドは、(B)、(D)、または多価リンカー(L)の他の部分と共にヒドラゾンを形成する。記号(*)は、多価リンカー断片の、本明細書に記載する結合体の他の部分への結合点を示す。
【0044】
別の実施形態において、多価リンカーは、多価3−チオスクシンイミド−1−イルアルキルオキシアルキルオキシアルキリデン基を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、次の式

によって表される。式中、各nは、1〜6より独立して選択された整数であり、各アルキル基は、独立して選択され、例えばアルキルまたは場合により置換されたアリールによって場合により置換され、ここでアルキリデンは、(B)、(D)、または多価リンカー(L)の他の部分と共にヒドラゾンを形成する。記号(*)は、多価リンカー断片の、本明細書に記載する結合体の他の部分への結合点を示す。
【0045】
別の実施形態において、多価リンカーは、多価3−チオまたは3−ジチオアリールアルキルオキシカルボニル基、3−チオまたは3−ジチオアリールアルキルアミノカルボニル基、多価3−チオまたは3−ジチオアルキルオキシカルボニル、あるいは多価3−チオまたは3−ジチオアルキルアミノカルボニルを形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、ここでアルキルカルボニルは、(B)、(D)、または多価リンカー(L)の他の部分と共にカーボネート、カルバメート、または尿素を形成する。例証的には、アルキル基はエチルである。
【0046】
別の実施形態において、多価リンカーは、多価3−ジチオアルキルアミノ基を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、ここでアミノは、(B)、(D)、または多価リンカー(L)の他の部分と共にビニル性アミドを形成する。例証的には、アルキル基はエチルである。
【0047】
別の実施形態において、多価リンカーは、多価1−アルコキシシクロアルキレンオキシ基、多価アルキレンアミノカルボニル(ジカルボキシルアリーレン)カルボキシラート基、多価3−ジチオアルキルオキシカルボニル基、多価3−ジチオアルキルオキシカルボニルヒドラジン基、多価を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含む。
【0048】
別の実施形態において、多価リンカーは、アミノ酸から形成されたペプチドである少なくとも1個のスペーサーリンカーを含む。一態様において、ペプチドは天然型アミノ酸、およびその立体異性体を含む。別の態様において、ペプチドは天然型アミノ酸、およびその立体異性体のみから形成される。
【0049】
スペーサーおよび放出型リンカーのさらなる例証的な例を表1および2に示し、ここで(*)は、別のリンカーへの、ビンカアルカロイド、あるいはその類似体または誘導体への、あるいは受容体結合部分への結合点を示す。
【0050】
〔表1 企図されるスペーサーおよびヘテロ原子リンカー、ならびにその組合せ〕


【0051】
〔表2 企図される放出型およびヘテロ原子リンカー、ならびにその組合せ〕

【0052】
いずれの各種薬物も本明細書に記載する薬物送達結合体に含まれてもよい。例証的な一実施形態において、薬物は病原性細胞の1つ以上の集団に対する活性に基づいて選択される。一態様において、これらの病原性細胞は、固形腫瘍を含む癌細胞である。
【0053】
別の例証的な一実施形態において、薬物は特定の作用機構を持つ病原性細胞の1つ以上の集団に対する活性に基づいて選択される。例証的な作用機構としては、アルキル化剤、微小管形成を安定化および/または不安定化するもの(例えばベータチューブリン剤)を含む、微小管阻害薬、サイクリン依存性キナーゼ(CDK)阻害薬、トポイソメラーゼ阻害薬、タンパク質合成阻害薬、Ras、Raf、PKC、PI3および同様の阻害薬を含むタンパク質キナーゼ阻害薬、転写阻害薬、葉酸拮抗薬、熱ショックタンパク質遮断薬、などが挙げられる。
【0054】
例証的なアルキル化剤としては、これに限定されるわけではないが、マイトマイシンCBIなどを含む。例証的なサイクリン依存性キナーゼ(CDK)阻害薬としては、これに限定されるわけではないが、CYC202、セリシクリブ、R−ロスコビチン、AGM−1470などが挙げられる。例証的なトポイソメラーゼ阻害薬としては、これに限定されるわけではないが、ドキソルビシン、他のアントラサイクリンなどが挙げられる。例証的なタンパク質合成阻害薬としては、これに限定されるわけではないが、ブルセアンチンなどが挙げられる。Ras、Raf、PKC、PI3Kなどの阻害薬を含む例証的なタンパク質キナーゼ阻害薬としては、これに限定されるわけではないが、L−779,450、R115777などが挙げられる。例証的な転写阻害薬としては、これに限定されるわけではないが、α−アマンチン、アクチノマイシンなどが挙げられる。例証的な葉酸拮抗薬としては、これに限定されるわけではないが、メトトレキセートなどが挙げられる。例証的な熱ショックタンパク質遮断薬としては、これに限定されるわけではないが、ゲルダナマイシンなどが挙げられる。
【0055】
微小管形成を安定化および/または不安定化するものを含む、例証的な微小管阻害薬としては、ベータチューブリン剤、微小管毒などが挙げられる。選択した受容体に結合する例証的な微小管毒としては、これに限定されるわけではないが、ビンカ結合部位に結合する阻害薬、例えばアレナスタチン、ドラスタチン、ハリコンドリンB、メイタンシン、ホモプシンA、リゾキシン、ウスチロキシン、ビンブラスチン、ビンクリスチンなど、タキソール結合部位に結合する安定剤、例えばディスコデルマリド(discodermalide)、エポチロン、タキソール、パクリタキセルなど、コルヒチン結合部位に結合する阻害薬、例えばコルヒチン、コンブレタスタチン、クラシンA、ポドフィロトキシン、ステガナシンなど、および未定義部位に結合するその他、例えばクリプトフィシン、チューブリシン(tubulysins)、などが挙げられる。
【0056】
本明細書に記載する薬物送達結合体の一実施形態において、薬物の少なくとも1つは、微小管阻害薬、あるいはその類似体または誘導体である。別の実施形態において、薬物の少なくとも1つは、DNAアルキル化剤である。別の実施形態において、薬物の少なくとも1つは、DNAアルキル化剤であり、薬物の少なくとも他の1つは、微小管阻害薬である。本明細書に記載するアルカロイドとしては、アルカロイドのビンカインドール−ジヒドロインドールファミリーのすべてのメンバー、例えば、これに限定されるわけではないが、ビンデシン、ビンブラスチン、ビンクリスチン、カタランチン、ビンドリン、ロイロシン、ビノレルビン、イミドカルブ、シブトラミン、トルトラズリル、ビンブラスチン酸など、ならびにその類似体および誘導体、などが挙げられる。
【0057】
本明細書に記載する薬物送達結合体の別の実施形態において、薬物の少なくとも1つは、P−糖タンパク質(PGP)阻害薬である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つはPGP阻害薬であり、薬物送達結合体に含まれる薬物の少なくとも他の1つはPGP基質である。例証的には、この後者の実施形態において、PGP基質はDNAアルキル化剤である。この実施形態を参照すると、PGP阻害薬を、PGP基質、例えばこれに限定されるわけではないが、マイトマイシンC、マイトマイシンAなどのマイトマイシンのいずれかを含むDNAアルキル化剤と組合せることは、そうでなければPGP基質である薬物の性能全体を改善しうることが認識される。本明細書に記載する放出型結合体において、PGP阻害薬およびPGP基質薬はどちらもエンドサイトーシスの後に細胞中で放出される。その方法では、PGP阻害薬は、PGP基質薬の全体の有効性および/または効力を改善してもよい。加えてPGP阻害薬はPGP発現を低下させ、それは次に本明細書に記載する多剤結合体に含まれる1つ以上の薬物の病原性細胞からの放出放出を低下させる。マイトマイシン、あるいはその類似体または誘導体、例えばマイトマイシンCは、PGP阻害剤、またはPGPのダウンレギュレータとして作用してもよいことが認識される。ビンカアルカロイド、あるいはその類似体または誘導体、例えばビンブラスチン類似体および誘導体が、病原性細胞からの放出をPGP阻害薬またはダウンレギュレータによって防止されるPGP基質であってもよいことがさらに認識される。
【0058】
本明細書に記載する薬物送達結合体の別の実施形態において、薬物の少なくとも1つは、ビンカアルカロイド、あるいはその類似体または誘導体である。本明細書に記載するビンカアルカロイドとしては、アルカロイドのビンカインドール−ジヒドロインドールファミリーのすべてのメンバー、例えばこれに限定されるわけではないが、ビンデシン、ビンブラスチン、ビンクリスチン、カタランチン、ビンドリン、ロイロシン、ビノレルビン、イミドカルブ、シブトラミン、トルトラズリル、ビンブラスチン酸など、ならびにその類似体および誘導体、などが挙げられる。
【0059】
本明細書で言及するように、本明細書に記載する結合体で有用なビンカ薬物としては、アルカロイドのビンカインドール−ジヒドロインドールファミリーのすべてのメンバー、例えばビンデシン、ビンブラスチン、ビンクリスチン、カタランチン、ビンドリン、ロイロシン、ビノレルビン、イミドカルブ、シブトラミン、トルトラズリル、ビンブラスチン酸など、ならびにその類似体および誘導体、などが挙げられる。例証的には、そのような類似体および誘導体としては、米国特許第4,203,898号に記載されている3−カルボキスアジド;米国特許第4,166,810号に記載されている4−デスアセチルビンブラスチン−3−カルボキスヒドラジドのN2−アルキルおよび他の誘導体;Neuss et al. Tetrahedron Lett.783 (1968)に記載されているロイロシンヒドラジド;Barnett et al. J. Med. Chem. 21:88 (1978)に記載されているヒドラジド誘導体;米国特許第3,392,173号および同第3,387,001号に記載されているC−4エステル誘導体;Langone et al. Anal. Biochem. 95:214 (1979)に記載されている酸化から生じるジカルボン酸誘導体;およびEP 0247792A2号に記載されているビンカヒドラジド、などが挙げられる。上記の特許および刊行物のそれぞれは、それが合成経路、およびビンカ化合物を調製するための反応条件に関して開示しているすべてについて、参照により本明細書に組み入れられている。
【0060】
例証的な一実施形態において、ビンカ薬物は、式

の化合物であり、式中:
R1およびR2の一方はHであり、他方はエチルであり、かつR3はHであり、あるいはR1はエチルであり、R2、およびR3はひとまとめにされて、−O−を形成し;
R4、R7、およびR8は、H、アルキル、およびアシルからそれぞれ独立して選択され、
R5およびR6は、それぞれ独立して選択されたアルキルであり;
R9は、基−NHNHRであり、式中、Rは、H、アルキル、またはアシルであり;
R10は、Hまたはアシルであり;かつ
R11は、エチルである。
【0061】
一態様において、ビンカ薬物は、上の式の化合物であり、式中、R4およびR8はそれぞれHであり;かつR5、R6、R9、およびR10はそれぞれメチルである。
【0062】
別の実施形態において、受容体結合部分、多価リンカー(L)、ビンカアルカロイド薬物、あるいはその類似体または誘導体、および別の薬物、あるいはその類似体または誘導体を含む受容体結合薬物送達結合体が記載され、該受容体結合部分、ビンカアルカロイド、および他の薬物はそれぞれ、ヘテロ原子リンカー(lH)を介して多価リンカー(L)に結合される。多価リンカー(L)は、1個以上のスペーサーリンカー、ヘテロ原子リンカー、および放出型リンカー、ならびにその組合せをいずれかの順序で含む。
【0063】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、アクラマイシン、あるいはその類似体または誘導体である。アクラマイシンおよびその類似体および誘導体がPGP放出ポンプ基質であることもありうる。一態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つはDNAアルキル化剤、例えばマイトマイシンあるいはその類似体または誘導体である。
【0064】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、DNA合成阻害薬、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、紡錘糸形成阻害薬、あるいはその類似体または誘導体である。一態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、DNA合成阻害薬、あるいはその類似体または誘導体であり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、紡錘糸形成阻害薬、あるいはその類似体または誘導体である。
【0065】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、微小管安定化剤、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、微小管合成阻害薬、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、微小管不安定化剤、あるいはその類似体または誘導体である。
【0066】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、アポトーシス誘発剤、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、タキソール、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、葉酸拮抗薬、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、メトトレキセート、あるいはその類似体または誘導体である。一態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、葉酸拮抗薬、あるいはその類似体または誘導体、例えばメトトレキセートであり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、タキソール、あるいはその類似体または誘導体である。
【0067】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、葉酸塩、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、ヒト上皮成長因子受容体−2(HER−2)阻害薬、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、放射性標識化学療法剤、例えばシスプラチンなどである。一態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、葉酸拮抗薬、あるいはその類似体または誘導体、例えばメトトレキセートであり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、葉酸塩、あるいはその類似体または誘導体である。別の態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、タキソール、あるいはその類似体または誘導体であり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、HER−2阻害薬、あるいはその類似体または誘導体である。別の態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、タキソール、あるいはその類似体または誘導体であり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、放射性標識化学療法剤、例えばシスプラチンであり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、HER−2阻害薬、あるいはその類似体または誘導体である。
【0068】
本明細書に記載する薬物送達結合体は、在来の合成方法によって調製されうる。合成方法は、ヘテロ原子リンカーの選択、ならびにスペーサーリンカーおよび放出型リンカーに存在する官能基に応じて選択されうる。一般に、関連する結合形成反応は、Richard C.Larock, “Comprehensive Organic Transformations, a guide to functional group preparations”, VCH Publishers, Inc. New York (1989)、およびTheodora E. Greene & Peter G. M. Wuts, “Protective Groups ion Organic Synthesis,” 2d edition, John Wiley & Sons, Inc. New York (1991)に記載されており、その開示は全体が参照により本明細書に組み入れられている。さらなる合成経路および反応条件は、米国特許出願公開第2005/0002942A1号に記載されている。
【0069】
例証的に、本明細書に記載する薬物送達結合体は、線形および収束合成経路の両方を使用して調製されうる。このような経路で使用できる例証的な中間体としては、受容体結合部分、あるいはその類似体および誘導体、ならびにビンカアルカロイド、あるいは類似体または誘導体への共有結合のために適切なカップリング基をそれぞれの端に含む多価リンカーを含む中間体、などが挙げられる。このような経路で使用できる他の例証的な中間体としては、カップリング基を含み、多価リンカーに結合された受容体結合部分あるいはその類似体または誘導体を含む中間体が挙げられる。このような経路で使用できる他の例証的な中間体としては、カップリング基を含む、多価リンカーに結合された、ビンカアルカロイド、あるいはその類似体または誘導体を含む中間体が挙げられる。どちらの場合でも、カップリング基は求核試薬、求電子試薬、またはその前駆体でありうる。
【0070】
合成中間体の例証的な一実施形態において、カップリング基はMichael受容体であり、多価リンカーには、式−C(O)NHN=、−NHC(O)NHN=、または−CH2C(O)NHN=を有する放出型リンカーが含まれる。例証的な一態様において、カップリング基および多価リンカーはひとまとめにされて、式

を有する化合物またはその保護誘導体を形成し、式中、(D)は、本明細書で例証するようなヒドラゾンを形成できるビンカアルカロイド、あるいはその類似体または誘導体であり;かつnは、1、2、3、または4などの整数である。本明細書に記載する受容体結合薬物送達結合体中間体の別の例証的な態様において、第2のリンカーが、第2のリンカーに含まれるアルキルチオール求核試薬を通じて上の式に共有結合される。別の例証的な態様において、受容体結合部分、あるいはその類似体または誘導体は、その部分に含まれるアルキルチオール求核試薬を通じて上の式に共有結合される。
【0071】
別の例証的な実施形態において、カップリング基はヘテロ原子、例えば窒素、酸素、または硫黄であり、多価リンカーは、受容体結合部分をカップリング基に共有結合する1個以上のヘテロ原子リンカーおよび1個以上のスペーサーリンカーを含む。例証的な一態様において、本明細書に記載する中間体は、式

を有する化合物またはその保護誘導体を含み、式中、Xは、酸素、窒素、または硫黄であり、mは、整数、例えば1、2、または3であり、ここで(B)、ls、およびlHは、本明細書で定義する通りである。例証的な一態様において、lHは−NH−であり、mは1である。別の例証的な態様において、lHは−NH−であり、mは1であり、Xは−S−である。
【0072】
別の例証的な態様において、本明細書に記載する中間体は、式

を有する化合物またはその保護誘導体を含み、式中、Yは、Hまたは置換基、例証的には、これに限定されるわけではないが、ニトロ、シアノ、ハロ、アルキルスルホニル、カルボン酸誘導体などを含む電子吸引置換基であり、ここで(B)およびlsは本明細書で定義する通りである。
【0073】
本明細書に記載する中間体の例証的な実施形態において、カップリング基はMichael受容体であり、多価リンカーは、受容体結合部分をカップリング基に共有結合する1個以上のヘテロ原子リンカーおよび1個以上のスペーサーリンカーを含む。例証的な一態様において、カップリング基および多価リンカーはひとまとめにされて、式

を有する化合物またはその保護誘導体を形成し、式中、Xは、酸素、窒素、または硫黄であり、mおよびnは、独立して選択された整数、例えば1、2、または3であり、ここで(B)、lsおよび1Hは、本明細書で定義する通りである。別の例証的な態様において、ビンカアルカロイド、あるいはその類似体または誘導体は、ビンカアルカロイドに含まれるアルキルチオール求核試薬を通じて上の式に共有結合される。
【0074】
別の例証的な態様において、中間体は、式

を有する化合物またはその保護誘導体を含み、式中、AAは、1個以上のアミノ酸であって、例証的には天然型アミノ酸またはその立体異性体から選択され、Xは、窒素、酸素、または硫黄であり、Yは、水素または置換基であって、例証的には、これに限定されるわけではないが、ニトロ、シアノ、ハロ、アルキルスルホニル、カルボン酸誘導体などを含む電子吸引置換基であり、nおよびmは、独立して選択される整数、例えば1、2、または3であり、pは、1、2、3、4、または5などの整数である。
【0075】
AAは、任意の他のアミノ酸、例えば一般式:
−N(R)−(CR’R”)t−C(O)−
を有する任意のアミノ酸であってもよく、式中、Rは、水素、アルキル、アシル、または適切な窒素保護基であり、R’およびR”は、水素または置換基であり、そのそれぞれが各存在ごとに独立して選択され、tは、1、2、3、4、または5などの整数である。例証的には、R’および/またはR”は、これに限定されるわけではないが、天然型アミノ酸に存在する水素または側鎖、例えばメチル、ベンジル、ヒドロキシメチル、チオメチル、カルボキシ、カルボキシメチル、グアニジノプロピルなど、ならびにその誘導体および保護誘導体に、それぞれ独立して相当する。上記の式は、すべての立体異性変形を含む。例えばアミノ酸は、アスパラギン、アスパラギン酸、システイン、グルタミン酸、リジン、グルタミン、アルギニン、セリン、オルニチン、トレオニンなどから選択されうる。本明細書に記載するビタミン受容体結合薬物送達結合体中間体の別の例証的な態様において、薬物、あるいはその類似体または中間体は、アルキルチオール求核試薬を含む。
【0076】
上の中間体のそれぞれは、在来の合成経路を使用して調製されうる。さらなる合成経路および反応条件は、米国特許出願公開第2005/0002942A1号および国際公開WO2006/012527号に記載されている。
【0077】
上の例証的な実施形態は、本明細書に記載する本発明の例証として意図され、本明細書に記載する本発明を制限するものとして、決して説明または解釈されるべきではない。例えば、次の例証的なビタミン−薬物結合体中間体によって一般に表される化合物は、本明細書によって記載されるように、本発明に含まれるものである:

式中、R1およびR2はそれぞれ独立して、水素またはアルキル、例えばメチルであり;かつlHは、ヘテロ原子、例えば酸素、硫黄、場合により置換された窒素、または場合により保護された窒素などである。2つ以上の薬物、および場合により追加の受容体結合リガンド、例えば葉酸塩ならびにその類似体および誘導体は、(lH)にて、または存在する他の官能基、例えばアミド窒素またはカルボニル、酸カルボキシラート、またはグアニジンアミノ基にて、この例証的な中間体に共有結合しうる。
【0078】
別の実施形態において、次の式

を有する葉酸塩リガンド中間体が記載され、式中、m、n、およびqは、0〜約8の範囲から独立して選択される整数であり;AAは、アミノ酸であり、R1は、水素、アルキル、または窒素保護基であり、薬物は、場合により(*)原子にて結合される。一態様において、AAは、天然または非天然形態のいずれかの天然型アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、親水性アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、Aspおよび/またはArgである。別の態様において、整数oは、1以上である。別の態様において、整数mは、2以上である。薬物、あるいはその類似体または誘導体、ならびに場合により追加のリンカーおよび追加の受容体結合リガンドは上の式に対し、該式中の自由原子価によって示される、2,ω−ジアミノアルカン酸断片の自由NH側鎖にて、または末端カルボキシラートにて結合されうる。
【0079】
別の実施形態において、次の式

を有する葉酸塩リガンド中間体が記載され、式中、m、n、qおよびpは、0〜約8の範囲から独立して選択される整数であり;AAは、アミノ酸であり、R1は、水素、アルキル、または窒素保護基であり、薬物は、場合により(*)原子にて結合される。一態様において、AAは、天然または非天然形態のいずれかの天然型アミノ酸としてである。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、親水性アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、Aspおよび/またはArgである。別の態様において、整数oおよびpは、1以上である。別の態様において、整数mは、2以上である。薬物、あるいはその類似体または誘導体、ならびに、場合により追加のリンカーおよび追加の受容体結合リガンドは、上の式に対して、該式中の自由原子価によって示される、2,ω−ジアミノアルカン酸断片の自由NH側鎖にて、システイニルチオール基にて、または末端カルボキシラートにて結合してもよい。
【0080】
別の実施形態において、次の式

を有する葉酸塩リガンド中間体が記載される。式中、m、n、q、p、およびrは、0〜約8の範囲から独立して選択される整数であり;AAは、アミノ酸であり、R1は、水素、アルキル、または窒素保護基であり、薬物は、場合により(*)原子にて結合される。一態様において、AAは、天然または非天然形態のいずれかの天然型アミノ酸としてである。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、親水性アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、Aspおよび/またはArgである。別の態様において、整数o、p、およびrは、1以上である。別の態様において、整数mは、2以上である。薬物、あるいはその類似体または誘導体、ならびに場合により追加のリンカーおよび追加の受容体結合リガンドは、上の式に対して、該式中の自由原子価によって示される、2,ω−ジアミノアルカン酸断片の自由NH側鎖にて、システイニルチオール基にて、セリニルヒドロキシ基にて、または末端カルボキシラートにて結合してもよい。
【0081】
別の実施形態において、薬物の1つとしてマイトマイシンを含む葉酸塩リガンド中間体が記載され、次の式

を有し、式中、m、n、およびqは、0〜約8の範囲から独立して選択される整数であり;AAは、アミノ酸である。一態様において、AAは、天然または非天然形態のいずれかの天然型アミノ酸としてである。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、親水性アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、Aspおよび/またはArgである。別の態様において、整数oは、1以上である。別の態様において、整数mは、2以上である。薬物、あるいはその類似体または誘導体、ならびに場合により追加のリンカーおよび追加の受容体結合リガンドは上の式に対して、該式中の自由原子価によって示される、2,ω−ジアミノアルカン酸断片の追加の自由NH側鎖にて、または末端カルボキシラートにて結合してもよい。
【0082】
別の実施形態において、下記の式を有する、マイトマイシン、およびビンカアルカロイドを含む、葉酸塩リガンド多剤結合体が記載される。

【0083】
別の実施形態において、下記の式を有し、マイトマイシン、アクラマイシン、およびビンカアルカロイドを含む、葉酸塩リガンド多剤結合体が記載される。

【0084】
別の実施形態において、医薬組成物が記載されている。本医薬組成物は、本明細書に記載した薬物送達結合体を、製薬的に許容される担体、賦形剤および/または希釈剤と組合せて含む。
【0085】
別の実施形態において、病原性細胞の集団を内部に持つ宿主動物において病原性細胞の集団を排除する方法が記載される。例証的な一態様において、病原性細胞集団のメンバーは、受容体結合部分、あるいはその類似体または誘導体に対する接近可能な結合部位を有し、その結合部位は病原性細胞によって独自に発現、過剰に発現、または優先的に発現される。該方法は、本明細書で記載するように、宿主に本明細書に記載する薬物送達結合体、あるいはその医薬組成物を投与する工程を含む。
【0086】
本明細書に記載する方法を使用して治療されうる病原性細胞の集団としては、これに限定されるわけではないが、癌、例えば卵巣、乳腺、結腸、肺、鼻、咽喉、脳の上皮癌、そして他の腫瘍細胞種、感染性因子、活性化マクロファージ、活性化単球、などが挙げられる。
【0087】
本明細書に記載する薬物送達結合体は、ヒト臨床医学および動物用途の両方に使用されうる。それゆえ病原性細胞の集団を持ち、薬物送達結合体によって治療される宿主動物はヒトであってもよく、あるいは動物用途の場合には、実験用動物、農業用動物、家畜、または野生動物であってもよい。本明細書に記載する薬物送達結合体は、これに限定されるわけではないが、ヒト、実験用動物、例えばげっ歯類(例えばマウス、ラット、ハムスターなど)、ウサギ、サル、チンパンジー、家畜、例えばイヌ、ネコ、およびウサギ、農業用動物、例えばウシ、ウマ、ブタ、ヒツジ、ヤギ、および飼育されている野生動物、例えばクマ、パンダ、ライオン、トラ、ヒョウ、ゾウ、シマウマ、キリン、ゴリラ、イルカ、およびクジラを含む宿主動物、などに投与されてもよい。
【0088】
本明細書に記載する薬物送達結合体は、宿主動物における各種の病状および病原性細胞を治療するために使用されてもよい。本明細書で使用するように「病原性細胞」は、癌細胞、感染性因子(例えば細菌およびウィルス)、細菌またはウィルス感染細胞、疾患状態を引き起こすことができる活性化マクロファージ、リガンド受容体(例えばビタミン受容体あるいはビタミンの類似体または誘導体を結合する受容体)を独自に発現する、優先的に発現する、または過剰に発現する他の任意の種類の病原性細胞を意味する。病原性細胞は、薬物送達結合体による治療が疾患症状の低減をもたらす疾患状態を引き起こすいかなる細胞も含みうる。病原性細胞は、移植片対宿主病の原因である免疫系の細胞などの、ある状況の下で病原性であるが、他の状況では病原性でない宿主細胞でもありうる。
【0089】
それゆえ病原性細胞の集団は、良性腫瘍および悪性腫瘍を含めて腫瘍原性でありうる癌細胞集団でありうるか、またはそれは非腫瘍原性でありうる。癌細胞集団は、自然発症的に、または宿主動物の生殖細胞系に存在する変異または体細胞変異などのプロセスによって発生しうるか、あるいはそれは化学的に、ウィルスによって、または放射線によって誘発されうる。本発明は、癌腫、肉腫、リンパ腫、ホジキン病、黒色腫、中皮腫、バーキットリンパ腫、上咽頭癌、白血病、および骨髄腫などの癌を治療するために利用されうる。癌細胞集団としては、これに限定されるわけではないが、口腔癌、甲状腺癌、内分泌癌、皮膚癌、胃癌、食道癌、喉頭癌、膵臓癌、結腸癌、膀胱癌、骨癌、卵巣癌、子宮頸癌、子宮癌、乳癌、精巣癌、前立腺癌、直腸癌、腎臓癌、肝臓癌、および肺癌、などが挙げられる。
【0090】
病原性細胞集団が癌細胞集団である実施形態において、薬物送達結合体投与の効果は、腫瘤の縮小または排除あるいは腫瘍細胞増殖の阻害によって測定された治療応答である。腫瘍の場合、排除は、原発性腫瘍の細胞の、あるいは転移した細胞の、または原発性腫瘍から解離するプロセスにある細胞の排除でありうる。腫瘍の外科的除去、放射線療法、化学療法、または生物療法を含むいずれかの治療手法による腫瘍の除去後に腫瘍の再発を防止するための、薬物送達結合体による予防的治療も企図される。予防的治療は、薬物送達結合体を用いた初期治療、例えば連日多回用量処方での治療であってもよく、および/または初期治療後に数日または数ヶ月の間隔を置いた追加治療または一連の治療であってもよい。したがって上記の任意の病原性細胞集団の排除は、病原性細胞の数の減少、病原性細胞の増殖の阻害、病原性細胞の再発を防止する予防的治療、または疾患の症状の低減を引き起こす病原性細胞の治療を含む。
【0091】
癌細胞が排除される場合、本明細書に記載する方法は、腫瘍の外科的除去、放射線療法、化学療法、または生物療法、例えば、これに限定されるわけではないが、モノクローナル抗体療法、免疫調節薬による治療、免疫エフェクタ細胞の養子移入、造血成長因子、サイトカインおよびワクチン接種による治療を含む他の免疫療法、などと組合せて使用されうる。
【0092】
本明細書に記載する方法は、各種の感染性疾患を引き起こす病原性細胞の集団にも利用できる。例えば本発明は、細菌、酵母を含む真菌、ウィルス、ウィルス感染細胞、マイコプラズマ、および寄生生物などの病原性細胞の集団に利用できる。本明細書に記載する薬物送達結合体によって治療されうる感染性生物は、グラム陰性またはグラム陽性球菌または桿菌である細菌などの生物を含む、動物において病原を引き起こす当分野で認識された任意の感染性生物である。例えば、プロテウス種、クレブシエラ種、プロビデンシア種、エルシニア種、エルウィニア種、エンテロバクター種、サルモネラ種、セラチア種、アエロバクター種、エシェリキア種、シュードモナス種、赤痢菌種、ビブリオ種、アエロモナス種、カンピロバクター種、ストレプトコッカス種、スタフィロコッカス種、ラクトバシラス種、ミクロコッカス種、モラクセラ種、バシラス種、クロストリジウム種、コリネバクテリウム種、エベルセラ(Eberthella)種、ミクロコッカス種、マイコバクテリウム種、ナイセリア種、ヘモフィルス種、バクテロイデス種、リステリア種、エリジペロスリックス種、アシネトバクター種、ブルセラ種、パスツレラ種、ビブリオ種、フラボバクテリウム種、フゾバクテリウム種、ストレプトバシラス種、カリマトバクテリウム種、レジオネラ種、トレポネーマ種、ボレリア種、レプトスピラ種、アクチノミセス種、ノカルジア種、リケッチア種、および、宿主動物において疾患を引き起こす他の任意の細菌種は、本明細書に記載する薬物送達結合体によって治療されうる。
【0093】
特に興味深いのは、抗生物質耐性ストレプトコッカス種およびスタフィロコッカス種などの、抗生物質に対して耐性である細菌、または抗生物質に対して感受性であるが、抗生物質によって治療される反復性感染を引き起こすので、耐性生物が最終的に発生する細菌である。抗生物質に対して感受性であるが、抗生物質によって治療される反復性感染を引き起こすので、耐性生物が最終的に発生する細菌は、これらの抗生物質耐性細菌株の発生を回避するために、抗生物質の非存在下で、または宿主動物に通常投与されるよりも低い用量の抗生物質と組合されて、本明細書に記載する薬物送達結合体によって治療されうる。
【0094】
ウィルス、例えばDNAおよびRNAウィルスによって引き起こされた疾患もまた、本明細書に記載する薬物送達結合体によって治療されうる。このようなウィルスとしては、これに限定されるわけではないが、DNAウィルス、例えばパピローマウィルス、パルボウィルス、アデノウィルス、ヘルペスウィルスおよびワクシニアウィルス、ならびにRNAウィルス、例えばアレナウィルス、コロナウィルス、リノウィルス、呼吸器合胞体ウィルス、インフルエンザウィルス、ピコルナウィルス、パラミキソウィルス、レオウィルス、レトロウィルス、レンチウィルス、およびラブドウィルス、などが挙げられる。
【0095】
本明細書に記載する薬物送達結合体は、酵母を含む任意の真菌、マイコプラズマ種、寄生生物、または動物で疾患を引き起こす他の感染性生物によって引き起こされた疾患を治療するためにも使用されうる。本明細書に記載する方法および薬物送達結合体によって治療されうる真菌の例としては、例えば白癬、ヒストプラスマ症、ブラストミセス症、アスペルギルス症、クリプトコッカス症、スポロトリクム症、コクシジオイデス症、パラコクシジオイデス症、ムコール症、色素酵母菌症、皮膚糸状菌症、プロトテカ症、フザリウム症、粃糠疹、菌腫、パラコクシジオイデス症、フェオフィホ真菌症、シュードアレシェリア症、スポロトリクム症、砂毛症、ニューモシスチス感染症、およびカンジダ症を引き起こす真菌を含めた、カビとして成長する、または酵母様である真菌、などが挙げられる。
【0096】
本明細書に記載する薬物送達結合体は、これに限定されるわけではないが、サナダムシ(例えば条虫、矮小条虫、裂頭条虫属、およびエキノコッカス種)、吸虫(例えば肥大吸虫、異形吸虫、メタゴニムス、肝吸虫、肝蛭、肺吸虫、および住血吸虫種)、回虫(例えば蟯虫、鞭虫、回虫、鉤虫、アメリカ鉤虫、ストロンギロイデス、旋毛虫、ブケレリア、ブルギア、ロアオンコセルカ、およびドラクンクルス種)、アメーバ(例えばネグレリアおよびアカントアメーバ種)、ならびに原虫(例えばプラスモディウム、トリパノソーマ、リーシュマニア、トキソプラズマ、エントアメーバ、ジアルジア、イソスポラ、クリプトスポリジウム、およびエンテロシトゾーン種)によって引き起こされる感染を含めた、寄生生物感染を治療するためにも使用されうる。
【0097】
薬物送達結合体が向けられる病原性細胞は、これらの細胞がリガンド受容体、例えばビタミンあるいはその類似体または誘導体の受容体を優先的に発現する場合、内在性病原体を持つ細胞、例えば、ウィルス、マイコプラズマ、寄生生物、または細菌に感染した細胞でもありうる。
【0098】
一実施形態において、薬物送達結合体は、リガンドが、受容体、輸送体、またはリガンドを特異的に結合して、病原性細胞で優先的に発現される他の表面提示タンパク質へ結合する時に、標的病原性細胞内へ内部移行されうる。そのような内部移行は例えば、受容体媒介エンドサイトーシスを通じて発生しうる。薬物送達結合体が放出型リンカーを含有する場合、リガンドおよびビンカ化合物は細胞内で解離して、ビンカはその細胞内標的に作用しうる。
【0099】
別の例証的な実施形態において、薬物送達結合体のリガンドは、ビンカ化合物を病原性細胞の表面に密接に関連付けて配置する病原性細胞に結合しうる。ビンカ化合物は次に、放出型リンカーの開裂によって放出されうる。例えばビンカ化合物は、放出型リンカーがジスルフィド基である場合、タンパク質ジスルフィドイソメラーゼによって放出されうる。ビンカ化合物は次に、受容体結合薬物送達結合体が結合されている病原性細胞によって取り込まれてもよいし、またはビンカ化合物はそれに近接した別の病原性細胞によって取り込まれてもよい。あるいはビンカ化合物は、放出型リンカーがジスルフィド基である場合、細胞内のタンパク質ジスルフィドイソメラーゼによって放出されうる。ビンカ化合物は、あるベータ離脱機構について上述したような加水分解機構、例えば酸触媒による加水分解によって、あるいはオキソニウムイオンまたはラクトニウムイオン産生機構を通じた隣接基補助開裂(anchimerically assisted cleavage)によっても放出されうる。放出型リンカーの選択は、ビンカ化合物が結合体から放出される機構を決定するであろう。このような選択は、薬物送達結合体が使用される条件によって事前に定義されうることが認識される。
【0100】
リンカーが放出型リンカーを含まない別の例証的な実施形態において、薬物送達結合体のリガンド部分は、ビンカ化合物に結合できる他の分子による攻撃で病原性細胞を標的とするために、病原性細胞の表面にビンカ化合物を配置する病原性細胞に結合しうる。あるいはこの実施形態において、薬物送達結合体は結合時に標的とした細胞内へ内部移行可能であり、リガンド部分およびビンカ化合物は細胞内で結合を維持することができ、ビンカ化合物はリガンド部分から解離せずにその効果を示す。
【0101】
さらに別の実施形態において、または上記の実施形態と組合せて、薬物送達結合体がビタミン受容体または別のリガンド受容体を結合する場合、結合体は、血清中に存在する溶解性ビタミン受容体または血清タンパク質、例えばアルブミンに結合可能であり、そのため未結合ビンカ化合物と比較して結合体の長期循環と、未結合ビンカ化合物と比較して病原性細胞集団に対して結合体の活性上昇を引き起こす。
【0102】
リガンド、例えばビタミンへの結合部位は、リガンドに特異的に結合できるリガンドの受容体を含んでいてもよく、この場合、受容体または他のタンパク質は病原性細胞の集団によって独自に発現、過剰に発現、または優先的に発現される。病原性細胞によって独自に発現、過剰に発現、または優先的に発現された表面提示タンパク質は通例、非病原性細胞には存在しないか、または低濃度でしか存在せず、病原性細胞の選択的排除の手段を与える受容体である。薬物送達結合体は、癌細胞または他の種類の病原性細胞の受容体への高親和性結合が可能でありうる。高親和性結合はリガンドに固有であってもよいし、は結合親和性は化学修飾リガンドの使用によって向上されてもよい。
【0103】
本明細書に記載する薬物送達結合体は、他の任意の既知の薬物と共に、追加の薬物が標的指向化されるかどうかにかかわらず、併用療法によって投与されてもよい。例証的な追加の薬剤としては、これに限定されるわけではないが、ペプチド、オリゴペプチド、レトロ−インベルソオリゴペプチド、タンパク質、少なくとも1個の非ペプチド結合がペプチド結合を置換するタンパク質類似体、アポタンパク、糖タンパク質、酵素、補酵素、酵素阻害薬、アミノ酸およびその誘導体、受容体および他の膜タンパク質、抗原およびそれに対する抗体、ハプテンおよびそれに対する抗体、ホルモン、脂質、リン脂質、リポソーム、毒素、抗生物質、鎮痛剤、気管支拡張薬、ベータ遮断薬、抗菌剤、降圧剤、(抗不整脈薬、強心配糖体、抗狭心症薬、血管拡張薬を含む)心血管作動薬、(刺激薬、向精神薬、抗躁薬、および抑制薬を含む)中枢神経系剤、抗ウィルス剤、抗ヒスタミン薬、化学治療剤を含む制癌剤、精神安定剤、抗うつ薬、H−2アンタゴニスト、抗痙攣薬、制嘔吐剤、プロスタグランジンおよびプロスタグランジン類似体、筋弛緩剤、抗炎症性物質、刺激薬、うっ血除去薬、鎮吐薬、利尿剤、鎮痙薬、抗喘息薬、抗パーキンソン病薬、去痰薬、鎮咳剤、粘液溶解薬、ならびにミネラルおよび栄養添加物、などが挙げられる。
【0104】
別の例証的な態様において、追加の薬物は、内在性免疫応答を刺激できる化合物より選択されうる。適切な化合物としては、これに限定されるわけではないが、サイトカインまたは免疫細胞成長因子、例えばインターロイキン1〜18、幹細胞因子、塩基性FGF、EGF、G−CSF、GM−CSF、FLK−2リガンド、HILDA、MIP−1α、TGF−α、TGF−β、M−CSF、IFN−α、IFN−β、IFN−γ、溶解性CD23、LIF、およびその組合せ、などが挙げられる。
【0105】
これらの免疫活性化因子の治療的に有効な組合せが使用されてもよい。一実施形態において、例えば連日多回用量処方における約0.1MIU/m2/用量/日〜約15MIU/m2/用量/日の範囲の量のIL−2の治療的有効量、および、例えば連日多回用量処方における約0.1MIU/m2/用量/日〜約7.5MIU/m2/用量/日の範囲の量のIFN−αの治療的有効量は、病原性細胞を持つ宿主動物において病原性細胞を排除、削減または中和するために、薬物送達結合体と共に使用されうる(MIU=100万国際単位;m2=平均的なヒトのおおよその体表面積)。別の実施形態において、IL−12およびIFN−αは、インターロイキンおよびインターフェロンについての上記の治療的有効量で使用することができ、さらに別の実施形態において、IL−15およびIFN−αは、インターロイキンおよびインターフェロンについての上記の治療的有効量で使用されうる。代わりの実施形態において、IL−2、IFN−αまたはIFN−γ、ならびにGM−CSFは組合せて、上記の治療的有効量で使用されうる。他のインターロイキンおよびインターフェロンならびにコロニー刺激因子の組み合わせを含む他の任意の有効な組合せも使用されうる。
【0106】
さらに、追加の薬物は、細胞毒性または細胞増殖抑制性であるか、腫瘍浸透性を向上させるか、腫瘍細胞増殖を阻害するか、アポトーシスを促進するか、標的細胞の抗アポトーシス活性を低下させるか、感染性因子によって引き起こされた疾患を治療するために使用されるか、病原性細胞に対する内在性免疫応答を向上させるか、または、任意の種類の病原性細胞によって引き起こされた疾患状態を治療するために有用であるような、当分野で既知の任意の薬物であってもよい。例示的で適切な追加の薬物としては、アデノコルチコイドおよびコルチコステロイド、アルキル化剤、抗アンドロゲン、抗エストロゲン、アンドロゲン、アクラマイシンおよびアクラマイシン誘導体、エストロゲン、抗代謝産物(例えばシトシンアラビノシド、プリン類似体、ピリミジン類似体、およびメトトレキセート)、ブスルファン、カルボプラチン、クロランブシル、シスプラチンおよび他のプラチナ化合物、タモキシフェン、タキソール、パクリタキセル、パクリタキセル誘導体、タキソテール(登録商標)、シクロホスファミド、ダウノマイシン、リゾキシン、T2毒素、植物アルカロイド、プレドニゾン、ヒドロキシ尿素、テニポシド、マイトマイシン、ディスコデルモライド、非ビンカ微小管阻害薬、エポチロン、チューブリシン(tubulysin)、シクロプロピルベンズ[e]インドロン、seco−シクロプロピルベンズ[e]インドロン、O−Ac−seco−シクロプロピルベンズ[e]インドロン、ブレオマイシンおよび他のいずれかの抗生物質、窒素マスタード、ニトロソ尿素、コルヒチン、コルヒチン誘導体、アロコルヒチン、チオコルヒチン、トリチルシステイン、ハリコンドリンB、ドラスタチン(例えばドラスタチン10)、アマニチン(例えばα−アマニチン)、カンプトセシン、イリノテカン、および他のそのカンプトセシン誘導体、ゲルダナマイシンおよびゲルダナマイシン誘導体、エストラムスチン、ノコダゾール、MAP4、コルセミド、ビンデシン、ビンブラスチン、ビンクリスチン、カタランチン、ビンドリン、ロイロシン、ビノレルビン、イミドカルブ、シブトラミン、トルトラズリル、ビンブラスチン酸、メイタンシンならびにその類似体および誘導体、ゲムシタビン、炎症性物質および炎症誘発物質、ペプチドおよびペプチドミメティックシグナル伝達阻害薬、および他の任意の当分野で認識される薬物または毒素、などが挙げられる。併用療法で使用されうる他の薬物としては、ペニシリン、セファロスポリン、バンコマイシン、エリスロマイシン、クリンダマイシン、リファンピン、クロラムフェニコール、アミノグリコシド、抗生物質、ゲンタマイシン、アンホテリシンB、アシクロビル、トリフルリジン、ガンシクロビル、ジドブジン、アマンタジン、リバビリン、および他の任意の当分野で認識される抗菌化合物、などが挙げられる。上記の追加の薬物の任意の類似体または誘導体も併用療法で使用されうる。
【0107】
別の例証的な実施形態において、医薬組成物が提供される。本医薬組成物は、1回以上の用量で投与されるときに宿主動物において病原性細胞の集団を排除するのに有効な薬物送達結合体の量を含む。薬物送達結合体は好ましくは、宿主動物に非経口的に、例えば皮内に、皮下に、筋肉内に、腹腔内に、静脈内に、または髄腔内に投与される。あるいは薬物送達結合体は、宿主動物に他の医療的に有用なプロセスによって、例えば経口で投与することができ、そして任意の有効な用量および適切な治療剤形、例えば持続放出剤形が使用されうる。経口剤形に有用な例示的な賦形剤としては、これに限定されるわけではないが、コーンスターチ、ゼラチン、ラクトース、ステアリル酸マグネシウム、重炭酸ナトリウム、セルロース誘導体、およびナトリウムデンプングリコラート、などが挙げられる。
【0108】
非経口剤形の例としては、等張性生理的食塩水、5%グルコース、または他の周知の製薬的に許容される液体、例えば液体アルコール、グリコール、エステル、およびアミド中の活性剤の水性溶液、などが挙げられる。本発明による非経口剤形は、薬物送達結合体の用量を含む還元可能な凍結乾燥物の形でありうる。この実施形態の一態様において、例えばその開示が参照により本明細書に組み入れられている、米国特許第4,713,249号;同第5,266,333号;および同第5,417,982号に記載されている生分解性炭水化物マトリクスなどの、当分野で既知の多数の持続放出剤形のいずれも投与可能であり、あるいは低速ポンプ(例えば浸透圧ポンプ)が使用されうる。
【0109】
併用療法における追加の薬物は、薬物送達結合体の投与の前に、後に、または同時に宿主動物に投与可能であり、追加の薬物は、薬物送達結合体を含有する同じ組成物の一部として、または薬物送達結合体とは異なる組成物の一部として投与されうる。追加の薬物の有効な用量でのこのような任意の併用療法が使用されうる。
【0110】
別の例証的な態様において、1つを超える種類の薬物送達結合体が使用されうる。例えば、宿主動物は、異なるリガンドを持つ結合体、例えば組合された葉酸塩−ビンカおよびビタミンB12−ビンカ結合体などを用いた同時投薬プロトコルで治療されうる。別の例証的な実施形態において、宿主動物は、1個を超えるリガンド、例えば複数の葉酸塩または複数のビタミンB12分子を1つの結合体中に含む結合体を用いて、または葉酸塩およびビタミンB12リガンドの両方に結合されたビンカ化合物などの、同じ結合体中のリガンドの組合せを用いて治療されうる。さらに別の薬物送達結合体中に異なる種類のビンカ化合物を含む薬物送達結合体が使用されうる。
【0111】
薬物送達結合体の単位連日処方量は、宿主の状態、治療される疾患状態、結合体の分子量、その投与経路および組織分布、ならびに放射線療法または併用療法の追加の薬物などの他の治療処置の同時使用の可能性に応じて著しく変化しうる。宿主動物へ投与される有効量は、体表面積、体重、および患者の状態の医師による評価に基づく。有効用量は、例えば約1ng/kg〜約1mg/kg、約1μg/kg〜約500μg/kg、および約1μg/kg〜約100μg/kgの範囲で変化しうる。
【0112】
薬物送達結合体を投与するための任意の有効な投薬計画が使用されうる。例えば、薬物送達結合体は、1回用量として投与されうるか、または分割されて、連日多回用量処方として投与されうる。さらに時差投薬計画、例えば週に1〜3日を連日治療の代用として使用することができ、本発明を定義する目的で、このような間欠的または時差連日処方は、毎日の治療と同等と見なされ、企図される。例証的な一実施形態において、宿主動物は、病原性細胞の集団を排除するために薬物送達結合体の複数回注射によって治療される。一実施形態において、宿主は、薬物送達結合体を複数回(好ましくは約2〜約50回まで)、例えば12〜72時間の間隔で、または48〜72時間の間隔で注射される。薬物送達結合体の追加の注射は宿主動物に、初回注射後の数日または数ヶ月の間隔で投与でき、追加の注射は病原性細胞によって引き起こされた疾患状態の再発を防止しうる。
【0113】
例証的な一態様において、薬物送達結合体で使用されうるビタミン、あるいはその類似体または誘導体は、活性化マクロファージ上で特異的に発現される受容体、例えば葉酸塩あるいはその類似体または誘導体を結合する葉酸塩受容体に結合するものを含む。葉酸塩結合体は例えば、宿主の疾患状態を引き起こす活性化マクロファージの活性を死滅または抑制するために使用されうる。そのようなマクロファージを標的とする結合体は、活性化マクロファージ媒介疾患状態に罹患している宿主動物に投与されるときに、活性化マクロファージを死滅させる、またはマクロファージ機能を抑制するために、結合されたビンカ化合物を活性化マクロファージの集団に集中させ結合させるように作用する。活性化マクロファージ集団の排除、低減、または非活性化は、治療される疾患状態の活性化マクロファージ媒介病原特徴を停止または低減するように作用する。活性化マクロファージによって媒介されることが既知の疾患の例としては、関節リウマチ、潰瘍性大腸炎、クローン病、乾癬、骨髄炎、多発性硬化症、アテローム硬化症、肺線維症、サルコイドージス、全身性硬化症、移植臓器拒絶(GVHD)、および慢性炎症、などが挙げられる。薬物送達結合体の投与は通例、疾患状態の症状が低減または排除されるまで継続される。
【0114】
活性化マクロファージを死滅させる、または活性化マクロファージの機能を抑制するために投与される薬物送達結合体は、宿主動物に非経口的に、例えば皮内に、皮下に、筋肉内に、腹腔内に、または静脈内に、製薬的に許容される担体と共に投与されうる。あるいは薬物送達結合体は、宿主動物に他の医療的に有用な手順で投与でき、有効用量は標準剤形または持続放出剤形で投与されうる。治療方法は単独で、または活性化マクロファージによって媒介される疾患状態の治療のために認められた他の治療方法と組合せて使用されうる。
【0115】
次の例証的な例示された実施形態は、限定的なものとして意図されず、また解釈されるべきではない。例えば本明細書に示す各化合物において、リンカーを形成するのに使用されるアミノ酸の立体化学は、場合により、天然L配置または非天然D配置から選択されうる。各実施例は、示されたようにNMR、MS、および/またはUV分光法、および/またはHPLCによって特徴付けられており、特徴的なシグナルは必要に応じて記載される。
【実施例】
【0116】
===方法実施例===
〔方法実施例1 マウスにおける腫瘍成長の阻害〕
本明細書に記載した化合物の抗腫瘍活性は、腫瘍担持動物へ静脈内(i.v.)投与したときに、皮下M109腫瘍を担持するBalb/cマウスにおいて評価した。右腋窩の皮下組織への1x106個のM109細胞の腫瘍接種(t0の時点で平均腫瘍体積=60mm3)の約11日後に、マウス(5/グループ)に、週3回(TIW)、3週間にわたって、1500nmol/kgの薬物送達結合体、または等用量体積のPBS(対照)をi.v.注射した。腫瘍成長は、各処置グループで2日または3日間隔でカリパスを使用して測定した。腫瘍体積は、式V=axb2/2を使用して計算し、式中、「a」は腫瘍の長さであり、「b」は幅である(ミリメートルで表す)。
【0117】
〔方法実施例2 マウスにおける腫瘍成長の阻害〕
本明細書に記載した化合物の抗腫瘍活性は、腫瘍担持動物へ静脈内(i.v.)投与したときに、皮下KB腫瘍を担持するnu/nuマウスにおいて評価した。右腋窩の皮下組織への1x106個のKB細胞の腫瘍接種(t0における平均腫瘍体積=50〜100mm3)の約8日後に、マウス(5/グループ)に、週3回(TIW)、3週間にわたって、5μmol/kgの薬物送達結合体、または等投薬体積のPBS(対照)をi.v.注射した。腫瘍成長は、各処置グループで2日または3日間隔でカリパスを使用して測定した。腫瘍体積は、式V=axb2/2を使用して計算し、式中、「a」は腫瘍の長さであり、「b」は幅である(ミリメートルで表す)。
【0118】
〔方法実施例3 細胞DNA合成の阻害〕
本明細書に記載する化合物は、薬物が葉酸塩受容体陽性KB細胞の成長を阻害する能力を予測するin vitro細胞毒性アッセイを使用して評価した。化合物は、本明細書に記載するプロトコルに従って調製したような、各化学療法薬に結合された葉酸塩を含んでいた。KB細胞を7時間まで37℃にて、少なくとも100倍過剰の葉酸の非存在下または存在下で、指示された濃度の葉酸−薬物結合体に暴露した。細胞を次に新しい培地で1回すすぎ、新しい培地で72時間にわたって37℃でインキュベートした。細胞生存能力は、3H−チミジン取り込みアッセイを使用して評価した。
【0119】
本明細書の図に示すように、用量依存性細胞毒性は測定可能であり、大半の場合でIC50値(新たに合成されたDNAへの3H−チミジン取り込みを50%低下させるのに必要な薬物結合体の濃度)は低いナノモル範囲であった。さらにこれらの結合体の細胞毒性は、過剰な遊離葉酸の存在下で低減され、観察された細胞死滅は葉酸塩受容体への結合によって媒介されたことを示す。
【0120】
〔方法実施例4 相対親和性アッセイ〕
葉酸塩に対する葉酸塩受容体(FR)の親和性は、先に記載された方法(Westerhof, G.R., J.H. Schornagel, et al. (1995) Mol. Pharm. 48:459-471)にわずかな変更を加えたものに従って決定した。簡潔には、FR陽性KB細胞を24ウェル細胞培養プレートに密集して播種して、18時間にわたってプラスチックに付着させた。使用済みインキュベーション培地は指定されたウェルにて、試験品または葉酸の上昇する濃度の非存在下または存在下で、100nM 3H−葉酸を添加した、葉酸塩を含まないRPMI培地(FFRPMI)と交換した。細胞は37℃にて60分間インキュベートして、次にPBS、pH7.4で3回すすいだ。PBS、pH7.4中の1% SDS 500マイクロリットルをウェルごとに添加した。次に細胞溶解物を収集して、シンチレーションカクテル5mLを含有する各バイアルに添加し、次に放射能をカウントした。負の対照管は、FFRPMI中に3H−葉酸のみを含有していた(競合者なし)。正の対照管は最終濃度1mMの葉酸を含有し、これらのサンプルで測定されたCMP(標識の非特異性結合を示す)はすべてのサンプルから引き算された。特に相対親和性は、KB細胞のFRに結合する3H−葉酸の50%を置換するのに必要な化合物のモル比の逆数として定義され、FRに対する葉酸の相対親和性は1に設定された。
【0121】
〔方法実施例5 4T−1腫瘍体積アッセイ〕
6〜7週齢マウス(メスBalb/c株)をインディアナ州インディアナポリスのHarlan, Inc.より入手した。マウスをHarlanの葉酸を含まない固形飼料で、本実験の開始前および本実験中の合計3週間にわたって維持した。葉酸塩受容体−陰性4T−1腫瘍細胞(動物あたり1x106細胞)を右腋窩の皮下組織に接種した。4T−1腫瘍平均容積が〜100mm3である、腫瘍接種の約5日後に、マウス(5/グループ)に、週3回(TIW)、3週間にわたって、3μmol/kgの薬物送達結合体、または等用量体積のPBS(対照)をi.v.注射した。腫瘍成長は、各処置グループで2日または3日間隔でカリパスを使用して測定した。腫瘍体積は、式V=axb2/2を使用して計算し、式中、「a」は腫瘍の長さであり、「b」は幅である(ミリメートルで表す)。
【0122】
〔方法実施例6 体重測定〕
マウスの体重変化パーセントは、関連する腫瘍体積アッセイに記載したサンプルのグラフに示すように、腫瘍接種後(PTI)の指示された日にマウス(5マウス/グループ)において測定した。
【0123】
〔方法実施例7 葉酸塩−ペプチドの一般的な調製〕
ペプチドを含む本明細書に記載するリンカーは、酸感受性Fmoc−AA−Wang樹脂におけるFmoc方法などの標準方法を使用したポリマー支持連続手法によって調製した。例証的には、葉酸塩含有ペプチジル断片Pte−Glu−(AA)n−NH(CHR2)CO2H(3)は、Wang樹脂支持アミノ酸およびFmoc保護アミノ酸合成からスキーム1に示す方法によって調製する。
<スキーム1>

(a)20%ピペリジン/DMF;(b)Fmoc−AA−OH、PyBop、DIPEA、DMF;(c)Fmoc−Glu−O−t−BuまたはFmoc−Glu(γ−O−t−Bu)−OH、PyBop、、DIPEA、DMF;(d)N10(TFA)−Pte−OH;PyBop、DIPEA、DMSO;(e)TFAA、(CH2SH)2、i−Pr3SiH;(f)NH4OH、pH9〜10。
【0124】
本明細書に記載するプロセスのこの例示的な実施形態において、R1は、Fmocであり、R2は、所望の適切に保護されたアミノ酸側鎖であり、Wangは、2−クロロトリチル樹脂であり、DIPEAは、ジイソプロピルエチルアミンである。標準カップリング手順、例えばPyBop、および本明細書に記載するまたは当分野で既知である他の手順が使用され、そこではカップリング剤が例証的に、効率的なカップリングを確実にするための活性化剤として利用される。Fmoc保護基は、標準条件下での各カップリング工程の後に、例えばピペリジン、テトラブチルアンモニウムフルオリド(TBAF)などによる処置時に除去される。適切に保護されたアミノ酸構築ブロック、例えばFmoc−Glu−OtBu、N10−TFA−Pte−OHなどが、スキーム1に記載され、Fmoc−AA−OHによる工程(b)で表されるように使用される。したがってAAは、適切に保護される任意のアミノ酸出発物質を指す。本明細書で使用するようにアミノ酸という用語は、1個以上の炭素によって隔離されたアミンおよびカルボン酸官能基の両方を有するいずれの試薬も指すことが意図され、天然型アルファおよびベータアミノ酸はもちろんのこと、これらのアミノ酸のアミノ酸誘導体および類似体を含むことが理解されるであろう。特に保護される側鎖を有するアミノ酸、例えば保護セリン、トレオニン、システイン、アスパルテートなども、本明細書に記載する葉酸塩−ペプチド合成で使用されうる。さらなるガンマ、デルタ、またはより長い相同性アミノ酸も、本明細書に記載の葉酸塩−ペプチド合成で出発物質として含まれうる。さらに相同性側鎖、または交互の分岐構造を有するアミノ酸類似体、例えばノルロイシン、イソバリン、β−メチルトレオニン、β−メチルシステイン、β,β−ジメチルシステインなども、本明細書に記載する葉酸塩−ペプチド合成で出発物質として含まれうる。
【0125】
式Fmoc−AA−OHのFmoc−保護アミノ酸(AA)を含むカップリングシーケンス(工程(a)および(b))は、固体支持ペプチド(2)を調製するために「n」回実施され、ここでnは整数であり、0〜約100に等しくてもよい。最後のカップリング工程の後の、残存するFmoc基が除去され(工程(a))、ペプチドが逐次的にグルタメート誘導体にカップリングされ(工程(c))、脱保護されて、TFA−保護プテロイン酸にカップリングされる(工程(d))。次にペプチドは、トリフルオロ酢酸、エタンジチオール、およびトリイソプロピルシランによる処理時にポリマー支持体から開裂される(工程(e))。これらの反応条件は、適切に保護されたアミノ酸側鎖の一部を形成しうるt−Bu、t−Boc、およびTrt保護基の同時除去を引き起こす。TFA保護基は、塩基による処理(工程(f))時に除去されて、葉酸塩含有ペプチジル断片(3)を与える。
【0126】
===化合物実施例===
〔実施例1〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合4−メトキシトリチル(MTT)保護Cys−NH2を次のシーケンスに従って反応させた。1)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;3)a.Fmoc−Arg(Pbf)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−Glu−OtBu、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびPbf保護基はTFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去され、TFA保護基はpH=9.3のNH4OH水溶液によって除去した。選択された1H NMR(D2O)δ(ppm)8.68(s,1H,FA H−7),7.57(d,2H,J=8.4Hz,FA H−12&16),6.67(d,2H,J=9Hz,FA H−13&15),4.40−4.75(m,5H),4.35(m,2H),4.16(m,1H),3.02(m,2H),2.55−2.95(m,8H),2.42(m,2H),2.00−2.30(m,2H),1.55−1.90(m,2H),1.48(m,2H);MS(ESI,m+H+)1046。
【0127】
〔実施例2〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合4−メトキシトリチル(MTT)保護Cys−NH2を次のシーケンスに従って反応させた。1)a.Fmoc−β−アミノアラニン(NH−MTT)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20% ピペリジン/DMF;3)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−Glu−OtBu、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびTFA保護基は、a.2%ヒドラジン/DMF;b.TFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去した。次の表に示す試薬を調製で使用した:
〔表3〕

【0128】
カップリング工程は次のように実施した:ペプチド合成容器に樹脂を添加し、アミノ酸溶液、DIPEA、およびPyBOPを添加する。アルゴンを1時間通気して、DMFおよびIPAで3回洗浄する。各アミノ酸カップリング前に、Fmoc脱保護のためにDMF中の20%ピペリジンを3回(10分間)使用する。継続して6回のカップリング工程をすべて完了させる。最後に樹脂をDMF中の2%ヒドラジンによって3回(5分間)洗浄して、プテロイン酸のTFA保護基を開裂させる。
【0129】
次の試薬、92.5%(50ml)TFA、2.5%(1.34ml)H2O、2.5%(1.34ml)トリイソプロピルシラン、2.5%(1.34ml)エタンジチオール を使用して樹脂からペプチド類似体を開裂させ、開裂工程を次のように実施した:開裂試薬25mlを添加して、1.5時間通気し、排出させて、残りの試薬で3回洗浄した。約5mLまで蒸発させて、エチルエーテル中に沈殿させる。遠心分離にかけて、乾燥させる。精製は次のように実施した:カラム−Waters NovaPak C18 300xl9mm;緩衝液A=10mM酢酸アンモニウム、pH5;B=CAN;1%B〜20%B、15 ml/分にて40分間、350mg(64%)まで;HPLC−RT 10.307分、100%純度、1H HMRスペクトルは割り当てられた構造と一致した、そしてMS(ES−)は:1624.8、1463.2、1462.3、977.1、976.2、975.1、974.1、486.8、477.8。
【0130】
〔実施例3〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合4−メトキシトリチル(MTT)保護Cys−NH2を次のシーケンスに従って反応させた:1)a.Fmoc−β−アミノアラニン(NH−IvDde)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20% ピペリジン/DMF;3)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−Glu−OtBu、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびTFA保護基は、a.2%ヒドラジン/DMF;b.TFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去した。
次の表に示す試薬を調製で使用した:
〔表4〕

【0131】
カップリング工程は次のように実施した:ペプチド合成容器に樹脂を添加し、DMFによるアミノ酸溶液、DIPEA、およびPyBOPを添加する。アルゴンを1時間通気して、DMFおよびIPA 10mLで3回洗浄する。各アミノ酸カップリング前に、Fmoc脱保護のためにDMF中の20%ピペリジンを3回x10mL(10分間)使用する。継続して6回のカップリング工程を完了させる。終わりに樹脂をDMF中の2%ヒドラジンによって3回x10mL(5分間)洗浄して、プテロイン酸のTFA保護基およびβ−アミノアラニンのIvDde保護基を開裂させる。最後に、β−アミノアラニンの遊離アミンをFmoc−チオプロピオン酸とDMF中で、DIPEAおよびPyBopを使用してカップリングさせる。アルゴンを1時間通気して、DMFおよびIPA3回x10mLで洗浄する。樹脂をアルゴン下で30分間乾燥させる。
【0132】
次の試薬、92.5%(50ml)TFA、2.5%(1.34ml)H2O、2.5%(1.34ml)トリイソプロピルシラン、2.5%(1.34ml)エタンジチオールを使用して樹脂からペプチド類似体を開裂させ、開裂工程を次のように実施した:開裂試薬25mlを添加して、1.5時間通気し、排出させて、残りの試薬で3回洗浄した。約5mLまで蒸発させて、エチルエーテル中に沈殿させる。遠心分離にかけて、乾燥させる。精製は次のように実施した:カラム−Waters NovaPak C18 300xl9mm;緩衝液A=10mM酢酸アンモニウム、pH5;B=CAN;1%B〜20%B、15ml/分にて40分間、450mg(65%)まで;1H HMRスペクトルは割り当てられた構造と一致。
【0133】
〔実施例4〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合MTT保護Cys−NH2を次のシーケンスに従って反応させた:1)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;3)a.Fmoc−Arg(Pbf)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−Glu(γ−OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびPbf保護基はTFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去され、TFA保護基はpH=9.3のNH4OH水溶液によって除去した。1H NMRスペクトルは、割り当てられた構造と一致していた。
【0134】
〔実施例5〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合MTT保護D−Cys−NH2を次のシーケンスに従って反応させた:1)a.Fmoc−D−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−D−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;3)a.Fmoc−D−Arg(Pbf)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−D−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−D−Glu−OtBu、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびPbf保護基はTFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去され、TFA保護基はpH=9.3のNH4OH水溶液によって除去した。1H NMRスペクトルは、割り当てられた構造と一致していた。
【0135】
〔実施例6〕

2−[(ベンゾトリアゾール−1−イル−(オキシカルボニルオキシ)−エチルジスルファニル]−ピリジンHCl(601mg)およびDIPEA 378μLを、0℃の、デスアセチルビンブラスチンヒドラジド(668mg)の5mlDCM中溶液に逐次的に添加した。反応物を室温まで加温して、3時間撹拌した。TLC(DCM中15% MeOH)は、完全な変換を示した。混合物をシリカゲルクロマトグラフィー(1:9 MeOH/DCM)によって精製した。合せた画分を蒸発させ、DCMに再溶解させて、10% Na2CO3、塩水、乾燥(MgSO4)によって洗浄して、550mg(80%)まで蒸発させた;HPLC−RT 12.651分、91%純度、1H NMRスペクトルは割り当てられた構造と一致した。MS(ESI+):984.3,983.3,982.4,492.4,491.9,141.8。この手順のさらなる詳細は、参照によりその全体が本明細書に組み入れられている、米国特許出願公開第2005/0002942A1号に記載されている。
【0136】
〔実施例7〕
マイトマイシンC−エチルジスルフィドプロピオン酸を次のスキームに従って調製した。

(a)ジイソプロピルエチルアミン(DIPEA)、MeOH。
アミノエチルジスルフィドプロピオン酸(81mg、0.372mmol)の2mLメタノール(MeOH)中溶液に、DIPEA(0.13mL、0.746mmol)を添加した。この溶液にMeOH(3.0mL)中のマイトマイシン−A(100mg、0.286mmol)をゆっくり添加した。得られた溶液を3時間撹拌した。TLC分析(CHCl3中20% MeOH)は、反応が完了したことを示した。溶媒を減圧下で除去して、シリカカラムを使用して残渣を精製した。勾配溶離(CHC13/0.5% TEA中の10%〜20% MeOHは、生成物の純粋な画分(110mg、77%)を与えた。選択された1H NMRシグナル(CDCl3)δ(ppm)3.50(d,1H),3.56(dd,1H),3.90(t,2H),4.15(d,1H),4.25(t,1H),4.68(dd,1H)。
【0137】
〔実施例8〕

実施例7のプロセスに従って調製。
【0138】
〔実施例9〕

ポリプロピレン遠心分離ボトル内で、実施例2(82mg、0.084mmol)を水5mLに溶解させて、アルゴンを10分間通気した。別のフラスコで0.1N NaHCO3溶液にアルゴンを10分間通気した。リンカー溶液のpHは、0.1N NaHCO3溶液を使用して約6.9に調整した。テトラヒドロフラン(THF)5mL中のビンブラスチンヒドラジド誘導体(実施例6、91mg、0.092mM)を上の溶液にゆっくり添加した。得られた透明溶液をアルゴン下で15分間〜1時間撹拌した。反応の進行は、分析HPLC(10mM酢酸アンモニウム、pH=7.0およびアセトニトリル)によって監視した。THFを蒸発させて、水溶液を濾過して、分取HPLCカラム(XTerra Column,19x300mM)に注入した。1mMリン酸ナトリウムpH=7.0およびアセトニトリルによる溶出は、生成物を含有する純粋な画分を生じ、生成物は48時間の凍結乾燥後に単離した(78mg、50%);C83H103N19O26S2;正確な質量;1845.68;MW:1846.95;HPLC−RT 15.113分、100%純度、1H HMRスペクトルは割り当てられた構造と一致、そしてMS(ES−);1846.6,1845.5,933.3,924.2,923.3,922.5,615.6,614.7,525.0。
【0139】
図21Aおよび図21Bは、葉酸塩対実施例9の相対結合親和性、および3H−チミジン取り込みに対する実施例9の効果、結合体のIC50(58nM)と、葉酸塩が葉酸塩受容体への結合で結合体と競合することを示し、結合体の結合の特異性を証明している。アッセイは方法実施例4および3にそれぞれ従って実施した。
【0140】
図1Bは、過剰な葉酸を含む(〇)および含まない(●)場合の、KB細胞への3H−チミジン取り込みに対する実施例9の活性を示す;実施例9のIC50は約58nMである。
【0141】
〔実施例10〕

ポリプロピレン遠心分離ボトル内で、実施例3(56mg)を水7.5mLに溶解させて、アルゴンを10分間通気した。別のフラスコで0.1N NaHCO3溶液にアルゴンを10分間通気した。実施例3溶液のpHは、0.1N NaHCO3溶液を使用して6.9に調整した。テトラヒドロフラン(THF)7.5mL中の実施例6(44mg)を実施例3溶液にゆっくり添加した。得られた透明溶液をアルゴン下で15分間〜1時間撹拌した。反応の進行は、分析HPLC(10mM酢酸アンモニウム、pH=7.0およびアセトニトリル)によって監視した。THFを蒸発させて、水溶液を濾過して、分取HPLCによって精製した。pH=7.0の1mMリン酸ナトリウムおよびアセトニトリルによる溶離は純粋な画分を生じ、画分をプールして、周囲温度にて蒸発させて、得られた水溶液は0.1N HClを使用してpH4.0に調整した。実施例10は、48時間の凍結乾燥後に単離した(61mg、64%)。1H HMRスペクトルおよびLCMSデータは、割り当てられた構造と一致した。
【0142】
〔実施例11〕

方法A.実施例11は次のプロセスに従って調製した:

(a)は、DCC、DIPEA、THFである;そして(b)は、pH8.5の水/THFである。
マイトマイシンC−エチルジスルフィドプロピオン酸(34.4mg,0.069mmol)をアルゴン下で乾燥THF(1mL)に溶解した。N−ヒドロキシスクシンアミド(7.9mg、0.069mmol)、続けてジシクロヘキシルカルボジイミド(14.2mg、0.069mmol)を添加した。ジイソプロピルエチルアミン(0.024mL、0.138mmol)を添加して、得られた混合物を3時間撹拌した。ポリプロピレン遠心分離管内で、葉酸ビンブラスチン(実施例9、26mg、0.014mmol)を水3mLに溶解させた。0.1N NaHCO3を使用して、溶液のpHを8.5にゆっくりと調整した。本明細書に記載したように調製した活性化マイトマイシンC誘導体を3mL THF溶液として葉酸塩溶液に添加した。得られた溶液をアルゴン下で15分間〜1時間撹拌して、そこで反応の進行を分析HPLC(10mM酢酸アンモニウムおよびアセトニトリル、pH=7.0)によって監視した。THFを減圧下で除去して、水溶液を濾過して、分取HPLCカラム(X−terra Column,19x300mm)へ注入した。1mMリン酸ナトリウム(pH=7.0)およびアセトニトリルによる溶離は純粋な画分を生じ、これを蒸発させて、48時間にわたって12mg(50%、回収した出発物質に基づいて)まで凍結乾燥させた。1H NMRおよび、マススペクトルデータは、図9および10にそれぞれ示したように割り当てられた構造を裏付けた。C103H127N23O32S4;正確な質量2325.79;MW 2327.51。HPLC−RT 20.054分、99%純度、1H HMRスペクトルは割り当てられた構造と一致、そしてMS(ES+);1552.5,116.0,1165.3,1164.3,1148.4,744.9,746.4,745.6.
【0143】
方法B.:無水DMF(4.5mL)を、アルゴン下、室温で実施例10(103mg、48.7μmol)および実施例8(NO2−PySSCH2CH2−MMC、33.4mg、1.25当量)の混合物に注入した。得られた溶液にDIPEA(84.9μL、10当量)およびDBU(72.9μL、10当量)を同時に注入した。反応混合物を室温にてアルゴン下で20分間撹拌して、次に撹拌中のジエチルエーテル(50mL)中に移した。得られた懸濁物を遠心分離にかけ、沈殿をジエチルエーテル(15mLx2)で洗浄し、次にリン酸緩衝液(9mL、1.25mM、pH6.8)に溶解させて、分取HPLCにかけた(カラム:Waters XTerra RP18、7μm、19x300mm;移動層:A=1.25mMリン酸緩衝液、pH6.8、B=アセトニトリル;方法:25分間にわたって25mL/分で10%B〜40%B)。11.72〜13.88分の画分を収集して凍結乾燥させて、リン酸塩99.2mgおよび6.6mgを含有する物質105.8mgを得た。
【0144】
方法C.実施例11を次のプロセスに従って、収率34%で調製した:

(a)NHS、DCC−樹脂、DIPEA、THF;(b)実施例7、DIPEA、DMSO。
【0145】
図2は、葉酸(●、1.0)対実施例11(■、0.21)の相対結合親和性を示す。図2のデータは、結合体が葉酸塩受容体に対して高い相対結合を有することを示す。アッセイは方法実施例4に従って実施した。
【0146】
図1Bおよび3はそれぞれ、実施例9(単一の薬物を有する)および11(1対の薬物のを有する)の、3H−チミジン取り込みに対する効果、実施例9(58nM)および実施例11(5nM)の結合体のIC50を示す。図1Bおよび3のデータも、葉酸が葉酸塩受容体への結合で結合体と競合することを示し、結合体の結合特異性を証明している。アッセイは方法実施例3に従って実施した。加えて、2つの薬物を有する実施例11は、単一の薬物のみ有する実施例9よりも、葉酸塩受容体にて10倍の効力を示した。
【0147】
図4は、3つの異なる腫瘍細胞株(KB、4T−1cl2、およびID8−cl15)に対する実施例11(a)のin vitro細胞毒性活性を示す。加えて、図4は、実施例11の細胞毒性活性が過剰の葉酸の存在下で低下することを示し(b)、実施例11が葉酸塩受容体にて作用することを示している。
【0148】
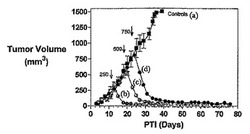
図5Aおよび5Bは、Balb/cマウスにおけるM109肺癌腫瘍に対して、そしてBalb/cマウスの体重(Balb/cマウスはM109腫瘍体積アッセイに使用した)に対する、2つの異なる用量(1μmol/kgおよび2μmol/kg)での実施例11の活性を示す。アッセイは方法実施例1および6にそれぞれ従って実施した。実施例11は両方の用量にて、固形腫瘍の成長を阻害するが、マウスの体重にほとんど効果を持たなかった。加えて、より高い用量(2μmol/kg)は、投薬を第20日に終了した後にすら、腫瘍成長の強力な阻害を示した。垂直線は、最終投薬日(第20日)に相当する。5匹の動物に試験を行い、2μmol/kgの高い用量において、5匹の動物すべてが完全寛解を示した。
【0149】
図6は、対照(a)と対比した、40μmol/kg EC20(レニウム錯体)を含む(b)および(c)含まない場合の、FR陽性KB腫瘍に対する2週間にわたる1μmol/kg TIWでの実施例11の活性を示す。垂直点線は最終投薬日を示す。図は、実施例11が固形腫瘍の成長を阻害することと、その阻害効果はEC20レニウム錯体によって防止(競合)されることとを示す。加えて数値は、実施例11を用いた処置が、試験動物の体重に対照から著しく異なって影響を及ぼさないことを示ず。EC20(レニウム錯体)は、レニウムにキレート化された次の式の化合物であり:

レニウムにキレート化される。EC20の調製は、米国特許出願公開第2004/0033195A1号に記載されており、その合成手順の説明は参照により本明細書に組み入れられている。アッセイは方法実施例2に従って実施した。EC20は、葉酸塩受容体において実施例11の競合相手として作用し、結果は、実施例11の効果の特異性を示している。
【0150】
図8は、ヌードマウスにおける40μmol/kg EC20(レニウム錯体)を添加した(b)および(c)添加しない場合の、葉酸受容体陽性s.c.植え込みヒト異種移植KB腫瘍に対する1μmol/kg TIWでの実施例11の活性を示す。図8のデータはは、実施例11が固形腫瘍の成長を阻害することと、その阻害効果はEC20レニウム錯体(b)対(c)によって防止(競合)されることとを示す。加えて図8のデータは、実施例11による処置が対照(a)と比較して、試験されたヌードマウス動物モデルの体重に著しく影響しないことを示す。
【0151】
図10は、0.5μmol/kg TIW(b)、1μmol/kg TIW(c)、および2μmol/kg TIW(d)における非結合体ベース薬物、マイトマイシンCおよびデスアセチルビンブラスチンモノヒドラジドの混合物と対比した、未処置対照(a)と対比した、ヌードマウスにおける葉酸受容体陽性ヒト腫瘍に対する2μmol/kg TIW(e)における実施例11の活性を示す。図10のデータは、実施例11が固形腫瘍の成長を阻害し、5匹の試験動物中5匹において完全寛解を与えることを示す。対照的に、0.5μmol/kg TIW(b)における、または1μmol/kg TIW(c)におけるベース薬物の混合物による処置は、5匹の試験動物のいずれにおいても完全寛解を示さなかった。2μmol/kg TIW(d)におけるベース薬物の混合物の高い用量は、試験動物体重に対するベース薬物および実施例11の効果を示す図11に示すように、観察された毒性のために第20日以前に中止された。
【0152】
図11は、対照(a)と比べて、実施例11(e)が処置中に試験動物の体重に著しく影響を及ぼさなかったことを示す。実施例11と対照的に、図11のデータは、(0.5μmol/kg TIW(b)および1μmol/kg TIW(c))における非結合体ベース薬物、マイトマイシンC、およびデスアセチルビンブラスチンモノヒドラジドの混合物のより低い用量を用いた長期処置が、対照(a)と比較して著しい試験動物の体重減少を引き起こしたことを示す。加えて、非結合体ベース薬物の混合物の高用量(2μmol/kg TIW(d))が最大の体重減少を引き起こし、その試験の中止をもたらした。
【0153】
本明細書に記載する化合物は、大型または確立された腫瘍の治療に有用でありうる。例証的には実施例11は、大型腫瘍に有効である。図12は、大型(250mm3、500mm3、および750mm3)s.c.KB腫瘍に対する、2μmol/kg TIW、2週間での実施例11の活性を示す。実施例11による処置は、腫瘍体積に相当する垂直矢印によって示されるように、腫瘍が3つの標的体積の1つに達したときに開始した。図12のデータは、実施例11が大型腫瘍の成長を阻害し、試験動物に完全寛解を与えることを示す。
【0154】
図13は、対照(a);それぞれ単一薬物のみの結合体、マイトマイシンC結合体(b)およびデスアセチルビンブラスチンモノヒドラジド結合体(c)、またはこれらの単一薬物結合体の混合物(d)と対比した、確立されたs.c.KB腫瘍に対する2週間の処置での1μmol/kg TIWにおける実施例11(e)の活性を示す。各薬物結合体は、2週間の処置にわたって1μmol/kg TIWの同じレベルで投薬された。図は、実施例11がどちらかの単一薬物結合体または両方の単一薬物結合体の混合物よりも良好に作用することを示す。驚くべきことに、単一薬物結合体の混合物は、個別に投薬された単一薬物結合体よりも著しく良好に作用せず、単一薬物結合体投薬計画のいずれも対照からの統計的有意差がない。実施例11の化合物のみが対照より優れていた。加えてこれらのデータは、単一結合体にビンカ薬物およびマイトマイシン薬物の両方を含めることの相乗効果を示唆している。
【0155】
〔実施例12〜14〕
実施例11について本明細書で上述したプロセスを含めて、本明細書に記載するプロセスおよび条件に従って調製。要求されたチオスルホナートまたはピリジルジチオ活性化ビンブラスチン、およびマレイミド活性化ビンブラスチン誘導体の調製についてのさらなる詳細は、米国特許出願公開第2005/0002942A1号に記載されている。要求されたマイトマイシン誘導体の調製についてのさらなる詳細は、米国特許出願公開第2005/0165227A1号に記載されており、その開示は参照により本明細書に組み入れられている。
【0156】
〔実施例12〕

図15は、FR陽性KB細胞への3H−チミジン取り込み対パルス時間における、100nMでの実施例12の活性を示す。アッセイは方法実施例3に従って実施した。
【0157】
〔実施例13〕

【0158】
〔実施例14〕

【図面の簡単な説明】
【0159】
【図1A】葉酸受容体における、実施例9(■、0.24)対葉酸(●、1.0)の相対結合親和性を示す。
【図1B】過剰な葉酸を含む場合(〇)および含まない場合(●)の、KB細胞への3H−チミジン取り込みに対する実施例9の活性を示す;実施例9のIC50は約58nMである。
【図2】葉酸受容体における、実施例11(■、0.21)対葉酸(●、1.0)の相対結合親和性を示す。
【図3】過剰な葉酸を含む場合(〇)および含まない場合(●)の、3H−チミジン取り込みに対する実施例11(多剤結合体)の活性を示す;実施例11のIC50=5nM。
【図4】実施例11+過剰な葉酸(b)と比較した、3つの異なる腫瘍細胞株(KB、4T−1cl2、およびID8−cl15)に対する実施例11(a)のin vitro細胞毒性活性を示す。
【図5A】未処置対照群(■)と対比し、Balb/cマウスにおけるFR陽性M109腫瘍に対する1μmol/kg TIW(6回用量)(●)、および2μmol/kg TIW(6回用量)(▼)での実施例11の活性を示す。
【図5B】未処置対照群(■)と対比した、Balb/cマウスの体重に対する1μmol/kg TIW(6回用量)(●)、および2μmol/kg TIW(6回用量)(▼)での実施例11による効果がないことを示す。
【図6】未処置対照群(●)と対比し、40μmol/kg EC20(レニウム錯体)を含む場合(□)および含まない場合(■)の、FR陽性KB腫瘍に対する2週間にわたる1μmol/kg TIW(6回用量)での実施例11の活性を示す;単独の実施例11が5/5の完全寛解を示した;実施例11+EC20は0/5の完全寛解を示した。
【図7】未処置対照群(●)と対比し、40μmol/kg EC20(レニウム錯体)を含む場合(□)および含まない場合(■)の、nu/nuマウスの体重に対する2週間にわたる1μmol/kg TIW(6回用量)(●)での実施例11による効果がないことを示す。
【図8】未処置対照群(a)と対比し、40μmol/kg EC20(レニウム錯体)を含む場合(b)および含まない場合(c)の、ヌードマウスに植え込まれたs.c.ヒト異種移植KB腫瘍に対する2週間にわたる1μmol/kg TIW(6回用量)での実施例11の活性を示す;単独の実施例11が5/5の完全寛解を示した;実施例11+EC20は0/5の完全寛解を示した。
【図9】未処置対照群(a)と対比し、40μmol/kg EC20(レニウム錯体)を含む場合(b)および含まない場合(c)の、ヌードマウスの体重に対する2週間にわたる1μmol/kg TIW(6回用量)での実施例11による効果がないことを示す。
【図10】0.5μmol/kg TIW(b)、1μmol/kg TIW(c)、および2μmol/kg TIW(d)における、非結合体ベース薬物、マイトマイシンC、およびデスアセチルビンブラスチンモノヒドラジドの混合物と対比した、そして未処置対照群(a)と対比した、ヌードマウスにおける葉酸塩受容体陽性ヒト腫瘍に対する2μmol/kg TIW(e)での実施例11の活性を示す。
【図11】未処置対照群(a)と対比し、ヌードマウスの体重に対する2週間にわたる2μmol/kg TIWでの実施例11(e)による効果がないことを示す。体重減少は、非結合体ベース薬物、マイトマイシンC、およびデスアセチルビンブラスチンモノヒドラジドの混合物の3つの用量すべて(0.5μmol/kg TIW(b)、1μmol/kg TIW(c)、2μmol/kg TIW(d))で発生した。高用量(d)は第20日以前に中止した。
【図12】対照群(a)と対比した、2週間にわたる2μmol/kg TIWでの、nu/nuマウスにおける3つのサイズの大型KB腫瘍、250mm3(b)、500mm3(c)、および750mm3(d)に対する実施例11の活性を示す。
【図13】マイトマイシンC(b)またはデスアセチルビンブラスチンモノヒドラジド(c)の単一薬物のみの結合体、またはこれらの2つの単一薬物結合体の混合物(d)と対比した、そして対照群(a)と対比した、実施例11(e)の活性を示す。
【図14】対照群(a)と対比し、Balb/cマウスにおける葉酸塩受容体陰性4T1腫瘍に対する治療の2週間にわたる2μmol/kg TIWでの実施例11の活性がないこと(b)を示す。図14のデータは、実施例11(b)が、これらの腫瘍に葉酸塩受容体が存在しないために、対照群(a)と対比して腫瘍に対して一切効果を持たないことを示す。
【図15】FR陽性KB細胞への3H−チミジン取り込みに対する実施例12の活性を示す。
【技術分野】
【0001】
本発明は、標的薬物送達で使用するための組成物および方法に関するものである。特に本発明は、2つ以上の薬物、ならびにその類似体および誘導体を含むリガンド結合体、例えばビタミン受容体結合化合物および2つ以上の薬物の結合体に関するものである。
【背景技術】
【0002】
哺乳類免疫系は、腫瘍細胞、他の病原性細胞、および侵入する外来病原体の認識および排除のための手段を提供する。免疫系は通常、強力な防御線を提供するが、癌細胞、他の病原性細胞、または感染性因子が宿主免疫反応を逃れて、共存する宿主病原性と共に増殖または持続する多くの例がある。化学療法剤および放射線療法は、例えば分裂を繰り返す新生物を排除するために開発されてきた。しかしながら現在入手可能な化学療法剤および放射線療法投与計画の多くは、それらが病原性細胞を破壊するだけでなく、それらが正常な宿主細胞、例えば造血系の細胞にも影響を及ぼすために有害な副作用を有する。これらの抗癌剤の有害な副作用は、病原性細胞集団に対して選択的であり、かつ宿主毒性の低い新たな治療法の開発の必要性を際立たせている。
【0003】
研究者らは、病原性細胞を、このような細胞へ細胞毒性化合物を標的指向化することによって破壊する治療プロトコルを開発してきた。これらのプロトコルの多くは、毒素の正常細胞への送達を最小限に抑えることを試みて、病原性細胞に特有の抗原、または病原性細胞によって過剰に発現された抗原に結合する抗体に結合された毒素を利用する。この手法を使用して、病原性細胞上の特異性抗原に対する抗体より成る、ある免疫毒素が開発され、該抗体はリシン、緑膿菌外毒素、ジフテリア毒素、および腫瘍壊死因子などの毒素に結合されている。これらの免疫毒素は、抗体によって認識される特異性抗原を持つ病原性細胞、例えば腫瘍細胞を標的とする(非特許文献1及び2、特許文献1参照)。
【0004】
宿主内の病原性細胞、例えば癌細胞または外来病原体の集団を標的とする別の手法は、独立した宿主毒性をも示しうる化合物投与の必要性を回避するために、病原性細胞に対する宿主免疫応答を向上させることである。免疫療法について報告された1つの方法は、抗体、例えば遺伝子組換え多重結合抗体を腫瘍細胞の表面に結合させて、細胞表面で抗体の定常領域を提示して、それにより各種の免疫系媒介プロセスによって腫瘍細胞の死滅を誘発させることである(非特許文献3、特許文献2参照)。しかしながらこれらの手法は、腫瘍特異性抗原を定義することの困難さによって複雑にされている。
【特許文献1】国際公開WO91/07418号
【特許文献2】米国特許第5,672,486号
【非特許文献1】Olsnes, S., Immunol. Today, 10, pp.291-295, 1989
【非特許文献2】Melby, E.L., Cancer Res., 53(8), pp.1755-1760, 1993
【非特許文献3】De Vita, V. T., Biologic Therapy of Cancer, 2d ed. Philadelphia, Lippincott, 1995
【発明の開示】
【課題を解決するための手段】
【0005】
薬物、ならびにその類似体および誘導体のリガンド結合体を本明細書で説明する。結合体は、細胞へ標的指向化されうる2つ以上の薬物に共有結合された、細胞受容体結合リガンドを含む。本明細書に記載する結合体は、リガンドを薬物に結合するための多価リンカーも含みうる。
【0006】
一実施形態において、受容体結合薬物送達結合体が記載される。薬物送達結合体は、細胞表面受容体のリガンド、2つ以上の薬物、あるいはその類似体または誘導体、および場合により多価リンカーを含み、一般に式
(B)−(L)−(D)n
によって表され、式中、(B)は、受容体結合部分を表し;(D)は、受容体結合部分によって細胞へ標的指向化される薬物、あるいはその類似体または誘導体を表し;(L)は、多価リンカーを表し、nは、1を超える整数である。多価リンカー(L)は、相互に共有結合された複数のリンカーを含みうる。例えば多価リンカー(L)は、それぞれ相互に、そしてリガンドおよび薬物に1個以上のヘテロ原子リンカー(lH)によって結合されている、1個以上のスペーサーリンカー(ls)、および/または放出型リンカー(lr)を含むことができる。これらの各種リンカーは、多価リンカー(L)を構築するために選択され、いずれかの順序でも配置されてもよい。例証的には、多価リンカー(L)は、次の2価リンカーの1つ以上から構築されてもよい:

式中、a、b、c、d、およびeは整数、例えば0〜約4の範囲の整数であり、(ls)、(lH)、および(lr)はそれぞれ、スペーサーリンカー、放出型リンカー、ヘテロ原子リンカーである。本明細書に記載する多価リンカーを構築するために使用されうる2価リンカーのさらなる例証的な例は、米国特許出願第10/765,336号(米国特許出願公開第2005/0002942A1号としても見出される)および国際公開WO2006/012527号に記載されており、その開示の全体は参照により本明細書に組み入れられている。
【0007】
多価リンカーが、受容体結合部分を、これに限定されるわけではないが次の例証的な一般式:

を含めた、各種の構造形態の2つ以上の薬物に対して結合させてもよいことが理解されるであろう。式中、Bは、受容体結合リガンドであり、(L1)、(L2)、および(L3)はそれぞれ、1個以上のスペーサーリンカー、放出型リンカー、および/またはヘテロ原子リンカーから構築された多価リンカーであり、(D1)、D2、およびD3はそれぞれ、薬物、あるいはその類似体または誘導体である。追加の薬物、あるいはその類似体または誘導体、追加のリンカー、(B)、(L)、および(D)のそれぞれの配列の追加の形態を含む、他の変更形態も本明細書で企図される。
【0008】
一変更形態において、1個を超える受容体結合リガンドが、本明細書に記載する薬物送達結合体に含まれ、これには、限定されるわけではないが、次の例証的な一般式:

が含まれる。式中、各Bは、受容体結合リガンドであり、(L1)、(L2)、および(L3)のそれぞれは、1個以上のスペーサーリンカー、放出型リンカー、および/またはヘテロ原子リンカーから構築された多価リンカーであり、(D1)、D2、およびD3はそれぞれ、薬物、あるいはその類似体または誘導体である。追加の薬物、あるいはその類似体または誘導体、追加のリンカー、(B)、(L)、および(D)それぞれの配列の追加の形態を含む、他の変更形態も本明細書で企図される。一変更形態において、複数の受容体結合リガンドは同じ受容体に対するリガンドであり、別の変更形態において、複数の受容体結合リガンドは異なる受容体に対するリガンドである。
【0009】
本明細書に記載する薬物送達結合体の例証的な一実施形態において、多価リンカーは、少なくとも1個の放出型のリンカー(lr)を含む。本明細書に記載する薬物送達結合体の別の例証的な実施形態において、多価リンカーは、少なくとも2個の放出型リンカー(lr)2を含む。別の例証的な態様において、多価リンカー(L)は、ジスルフィド放出型リンカーでない、少なくとも1個の放出型リンカー(lr)を含む。別の例証的な態様において、多価リンカー(L)は、1個の放出型リンカーがジスルフィド放出型リンカーでない、少なくとも2個の放出型リンカー(lr)2を含む。1個を超える放出型リンカーが多価リンカーに含まれるとき、これらの放出型リンカーは隣接してもよいことが認識される。2個の放出型リンカーが多価リンカーにおいて隣接しているとき、2個の放出型リンカーは連携して薬物の放出を引き起こしてもよいことがさらに認識される。
【0010】
別の実施形態において、多価リンカーは、アミノ酸から形成されたペプチドである少なくとも1個のスペーサーリンカーを含む。一態様において、ペプチドは天然型アミノ酸、およびその立体異性体を含む。別の態様において、ペプチドは天然型アミノ酸、およびその立体異性体のみから形成される。
【0011】
本明細書に記載するリガンドは一般に、細胞表面受容体のリガンドを含む。本明細書に記載する結合体において有用な例証的なリガンドとしては、これに限定されるわけではないが、ビタミン、およびビタミン受容体に結合する他の部分、トランスポータ、もしくはビタミンあるいはその類似体または誘導体に特異的に結合する他の表面提示タンパク質、ライブラリースクリーニングから同定されたペプチドリガンド、腫瘍細胞特異性ペプチド、腫瘍細胞特異性アプタマー、腫瘍細胞特異性炭水化物、腫瘍細胞特異性モノクローナルまたはポリクローナル抗体、抗体のFabまたはscFv(すなわち単鎖可変領域)断片(例えばEphA2に対する、または転移性癌細胞で特異的に発現または独自に接近可能な他のタンパク質に対する抗体のFab断片)、コンビナトリアルライブラリーに由来する小型有機分子、成長因子(例えばEGF、FGF、インスリン、およびインスリン様成長因子)、ならびに相同ポリペプチド、ソマトスタチンおよびその類似体、トランスフェリン、リポタンパク質複合体、胆汁塩、セレクチン、ステロイドホルモン、Arg−Gly−Asp含有ペプチド、レチノイド、各種のガラクチン、δ−オピオイド受容体リガンド、コレシストキニンA受容体リガンド、アンギオテンシンAT1またはAT2受容体に特異的なリガンド、ペルオキシソーム増殖因子活性化受容体λリガンド、β−ラクタム抗生物質(例えばペニシリン、抗菌薬を含む小型有機分子、ならびに腫瘍細胞の表面でまたは感染性生物で優先的に発現される受容体に特異的に結合する他の分子)、受容体または他の細胞表面タンパク質の結晶構造に基づき特定の受容体の結合ポケット内に適合するように設計された抗菌薬および他の薬物、腫瘍抗原または腫瘍細胞の表面で優先的に発現される他の分子のリガンド、あるいはこれらの分子のいずれかの断片、などが挙げられる。リガンド−薬物結合体の結合部位として機能しうる腫瘍特異性抗原は、タンパク質のエフリンファミリーのメンバーの細胞外エピトープ、例えばEphA2を含む。EphA2発現は、正常細胞の細胞−細胞接合部に限定されるが、転移性腫瘍細胞ではEphA2は細胞表面全体に分布している。それゆえ転移性細胞上のEphA2は、例えば薬物あるいはその類似体または誘導体に結合した抗体のFab断片への結合のために接近可能であるが、これに対して該タンパク質は正常細胞のFab断片への結合のためには接近できないので、結果として、転移性癌細胞に対して特異的なリガンド−薬物結合体を生じる。
【0012】
本明細書に記載する薬物、およびその各種の類似体および誘導体は一般に、感染性因子、癌、腫瘍などを含む病原性細胞の集合を排除、死滅、妨害、および/またはその成長を低下させるための薬物である。さらに、本明細書に記載する結合体において有用な薬物、およびその各種の類似体および誘導体は、これに限定されるわけではないが、アルキル化剤、微小管形成を安定化および/または不安定化するもの(例えばベータチューブリン剤)を含む、微小管阻害薬、CDKN1a、CDKN1bなどのサイクリン依存性キナーゼ(CDK)阻害薬、トポイソメラーゼ阻害薬、タンパク質合成阻害薬、Ras、Raf、PKC、PI3K、および同様の阻害薬を含むタンパク質キナーゼ阻害薬、転写阻害薬、葉酸拮抗薬、熱ショックタンパク質遮断薬などを含む、多種多様の作用機構を有しうる。
【0013】
別の実施形態において、医薬組成物が記載されている。本医薬組成物は、本明細書に記載した薬物送達結合体を、製薬的に許容される担体、賦形剤および/または希釈剤と組合せて含む。
【0014】
別の実施形態において、病原性細胞の集団を内部に持つ宿主動物において、病原性細胞の集団を排除する方法が記載される。例証的な一態様において、病原性細胞集団のメンバーは、受容体結合部分、あるいはその類似体または誘導体に対する接近可能な結合部位を有し、その結合部位は病原性細胞によって独自に発現、過剰に発現、または優先的に発現される。該方法は、本明細書で記載するように、宿主に本明細書に記載する薬物送達結合体、あるいはその医薬組成物を投与する工程を含む。
【0015】
==関連出願==
本出願は、米国特許法119条(e)に基づいて、その開示全体が参照により本明細書に組み入れられている、2005年8月19日に出願された米国特許仮出願第60/709,950号、および2006年3月30日に出願された米国特許仮出願第60/787,558号の利益を主張する。
【発明を実施するための最良の形態】
【0016】
薬物、ならびにその類似体および誘導体のリガンド結合体が本明細書に記載される。本結合体は、病原性細胞を含む細胞へ標的指向化されうる2つ以上の薬物に共有結合された、細胞表面受容体のリガンドを含めた、細胞受容体結合リガンドを含む。本明細書に記載する結合体は、リガンドを薬物に結合するための多価リンカーも含んでもよい。
【0017】
受容体結合部分(B)、多価リンカー(L)、および2つ以上の薬物、あるいは薬物類似体または薬物誘導体(D)nを含む、受容体結合薬物送達結合体が記載され、ここでnは2またはそれ以上である。本明細書に記載する送達結合体において、受容体結合部分(B)および2つ以上の薬物(D)nは、それぞれ、独立して選択されたヘテロ原子リンカー(lH)を介して多価リンカー(L)に結合される。多価リンカー(L)は、1個以上のスペーサーリンカー、ヘテロ原子リンカー、および放出型リンカー、ならびにその組合せをいずれかの順序で含む。
【0018】
一実施形態において、受容体結合薬物送達結合体が記載される。薬物送達結合体は、リガンド、例えば細胞表面受容体のリガンド、2つ以上の薬物、あるいはその類似体または誘導体、および場合により多価リンカーを含み、一般に式
(B)−(L)−(D)n
によって表される。式中、(B)は、受容体結合部分を表し;(D)は、受容体結合部分によって細胞へ標的指向化される薬物、あるいはその類似体または誘導体を表し;(L)は、多価リンカーを表し、nは、1を超える整数である。多価リンカー(L)は、相互に共有結合された複数のリンカーを含みうる。例えば多価リンカー(L)は、それぞれ相互に、そしてリガンドおよび薬物に1個以上のヘテロ原子リンカー(lH)によって結合されている、1個以上のスペーサーリンカー(ls)、および/または放出型リンカー(lr)を含みうる。これらの各種リンカーは、多価リンカー(L)を構築するために選択され、いずれかの順序で配置されてもよい。
【0019】
例証的には、多価リンカー(L)は、次の2価リンカーの1つ以上から構築されうる:

式中、a、b、c、d、およびeは整数、例えば0〜約4の範囲の整数であり、(ls)、(lH)、および(lr)はそれぞれ、スペーサーリンカー、放出型リンカー、ヘテロ原子リンカーである。本明細書に記載する多価リンカーを構築するために使用されうる2価リンカーのさらなる例証的な例は、米国特許出願第10/765,336号(米国特許出願公開第2005/0002942A1号としても見出される)および国際公開WO2006/012527号に記載されており、その開示の全体は参照により本明細書に組み入れられている。
【0020】
多価リンカーが、受容体結合部分を、これに限定されるわけではないが次の例証的な一般式:

を含む、各種の構造形態の2つ以上の薬物に対して結合させてもよいことが理解されるであろう。式中、Bは、受容体結合リガンドであり、(L1)、(L2)、および(L3)は、1個以上のスペーサーリンカー、放出型リンカー、および/またはヘテロ原子リンカーから構築された多価リンカーであり、(D1)、D2、およびD3はそれぞれ、薬物、あるいはその類似体または誘導体である。追加の薬物、あるいはその類似体または誘導体、追加のリンカー、ならびに(B)、(L)、および(D)それぞれの配列の追加の形態を含む、他の変更形態も本明細書で企図される。
【0021】
一変更形態において、1個を超える受容体結合リガンドが、本明細書に記載する薬物送達結合体に含まれ、これには、限定されるわけではないが、次の例証的な一般式:

が含まれる。式中、各Bは、受容体結合リガンドであり、(L1)、(L2)、および(L3)はそれぞれ、1個以上のスペーサーリンカー、放出型リンカー、および/またはヘテロ原子リンカーから構築された多価リンカーであり、(D1)、D2、およびD3はそれぞれ、薬物、あるいはその類似体または誘導体である。追加の薬物、あるいはその類似体または誘導体、追加のリンカー、ならびに(B)、(L)、および(D)それぞれの配列の追加の形態を含む、他の変更形態も本明細書で企図される。一変更形態において、受容体結合リガンドは同じ受容体に対してであり、別の変更形態において、受容体結合リガンドは異なる受容体に対してである。上の式に示すように、1個を超える多価リンカーが、本明細書に記載する薬物送達結合体に含まれうることが認識される。一態様において、リンカーの数は、受容体結合リガンド、および薬物の形態に応じて選択されることが理解される。
【0022】
例えば多価リンカー、または多価リンカーの一部を形成するためにリンカーが共有結合的に組み立てられる方法の例証的な一実施形態において、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーが結合されて式:

の多価基を形成し、この式は

としても表される。式中、(ls)1は、トリペプチドAsp−Asp−Aspであり、(ls)2は、Cysであり、(lr)1は、S−Sであり、(ls)3は、CH2CH2であり、(lH)1は、Oであり、(lr)2は、C(O)NHNHであり、(ls)4は、ω−Lysであり、(ls)5は、C(O)CH2CH2であり、(lr)3は、S−Sであり、(lH)6は、CH2CH2である。
【0023】
本明細書に記載する結合体において有用な細胞表面受容体のリガンドとしては、これに限定されるわけではないが、ビタミン、およびビタミン受容体に結合する他の部分、トランスポータ、もしくはビタミンあるいはその類似体または誘導体に特異的に結合する他の表面提示タンパク質、ライブラリースクリーニングから同定されたペプチドリガンド、腫瘍細胞特異性ペプチド、腫瘍細胞特異性アプタマー、腫瘍細胞特異性炭水化物、腫瘍細胞特異性モノクローナルまたはポリクローナル抗体、抗体のFabまたはscFv(すなわち単鎖可変領域)断片(例えばEphA2に対する、または転移性癌細胞で特異的に発現または独自に接近可能な他のタンパク質に対する抗体のFab断片)、コンビナトリアルライブラリーに由来する小型有機分子、成長因子(例えばEGF、FGF、インスリン、およびインスリン様成長因子)、ならびに相同ポリペプチド、ソマトスタチンおよびその類似体、トランスフェリン、リポタンパク質複合体、胆汁塩、セレクチン、ステロイドホルモン、Arg−Gly−Asp含有ペプチド、レチノイド、各種のガラクチン、δ−オピオイド受容体リガンド、コレシストキニンA受容体リガンド、アンギオテンシンAT1またはAT2受容体に特異的なリガンド、ペルオキシソーム増殖因子活性化受容体λリガンド、β−ラクタム抗生物質(例えばペニシリン、抗菌薬を含む小型有機分子、ならびに腫瘍細胞の表面でまたは感染性生物で優先的に発現される受容体に特異的に結合する他の分子)、受容体または他の細胞表面タンパク質の結晶構造に基づき特定の受容体の結合ポケット内に適合するように設計された抗菌薬および他の薬物、腫瘍抗原または腫瘍細胞の表面で優先的に発現される他の分子のリガンド、あるいはこれらの分子のいずれかの断片、などが挙げられる。リガンド−薬物、あるいはその類似体または誘導体の結合体の結合部位として機能しうる腫瘍特異性抗原の例は、タンパク質のエフリンファミリーのメンバーの細胞外エピトープ、例えばEphA2を含む。EphA2発現は、正常細胞の細胞−細胞接合部に限定されるが、転移性腫瘍細胞ではEphA2は細胞表面全体に分布している。それゆえ転移性細胞のEphA2は、例えば薬物あるいはその類似体または誘導体に結合した抗体のFab断片への結合のために接近可能であるが、これに対して該タンパク質は正常細胞のFab断片への結合のためには接近できないので、結果として、転移性癌細胞に対して特異的なリガンド−薬物結合体を生じる。
【0024】
一実施形態において、受容体結合部分はビタミン、あるいはそのビタミン受容体結合類似体または誘導体、例えばビタミン受容体を結合することができるビタミンならびにその類似体および誘導体である。
【0025】
本明細書に記載する方法および化合物に従って使用されうるビタミンとしては、カルニチン、イノシトール、リポ酸、ピリドキサール、アスコルビン酸、ナイアシン、パントテン酸、葉酸、リボフラビン、チアミン、ビオチン、ビタミンB12、ビタミンA、D、EおよびK,他の関連ビタミン分子、その類似体および誘導体、ならびにその組合せ、などが挙げられる。これらのビタミン、ならびにその受容体結合類似体および誘導体は、薬物送達結合体を作製するために、本明細書に記載する多価リンカー(L)によって薬物化合物、あるいはその類似体または誘導体に結合されうる例証的な標的実体を構成する。
【0026】
例証的な一態様において、ビタミンは、葉酸、葉酸類似体、または別の葉酸塩受容体結合分子であってもよい。使用されうる葉酸塩の類似体の例としては、フォリン酸、プテロイルポリグルタミン酸、プテロイン酸およびその他のアミノ酸誘導体、ならびに葉酸塩受容体結合プテリジン(例えばテトラヒドロプテリン)、ジヒドロ葉酸塩、テトラヒドロ葉酸塩、ならびにそのデアザおよびジデアザ類似体、などが挙げられる。「デアザ」および「ジデアザ」類似体という用語は、天然型葉酸構造において1または2個の窒素原子に代わって置換された炭素原子を有する当分野で認識された類似体を指す。例えばデアザ類似体としては、1−デアザ、3−デアザ、5−デアザ、8−デアザ、および10−デアザ類似体、などが挙げられる。ジデアザ類似体としては例えば、1,5−ジデアザ、5,10−ジデアザ、8,10−ジデアザ、および5,8−ジデアザ類似体、などが挙げられる。上記の葉酸類似体は、葉酸塩受容体に結合するその能力を反映して、慣例的に「葉酸塩」と呼ばれる。他の葉酸塩受容体結合類似体としては、アミノプテリン、アメトプテリン(メトトレキセート)、N10−メチル葉酸、2−デアミノ−ヒドロキシ葉酸、デアザ類似体、例えば1−デアザメトプテリンまたは3−デアザメトプテリン、および3’,5’−ジクロロ−4−アミノ−4−デオキシ−N10−メチルプテロイルグルタミン酸(ジクロロメトトレキセート)などが挙げられる。薬物送達結合体の受容体媒介エンドサイトーシス輸送を開始するために葉酸塩受容体に結合可能である他の適切なリガンドとしては、葉酸受容体への抗体が挙げられる。したがって例証的な一態様において、葉酸塩受容体への抗体と複合化したビンカ化合物は、複合体の膜透過輸送を引き起こすために使用されうる。
【0027】
ビタミン類似体および/または誘導体の例証的な実施形態は、ビオチンの類似体および誘導体、例えばビオシチン、ビオチンスルホキシド、オキシビオチンおよび他のビオチン受容体結合化合物なども含む。本明細書に記載する他のビタミンの類似体および誘導体も本明細書で企図されることが認識される。
【0028】
記載した結合体のいずれの形状も本明細書で企図され、薬物、受容体結合部分、および各種の多価リンカーが結合される方法によって決定される。一態様において、本明細書に記載する結合体の三次元形状全体が線形である。別の態様において、本明細書に記載する結合体の三次元形状全体が「Y」または「T」字形状である。別の態様において、本明細書に記載する結合体の三次元形状全体が「X」字形状または十字架形状である。別の
【0029】
本明細書に記載する薬物送達結合体の例証的な一実施形態において、多価リンカーは、少なくとも1個の放出型リンカー(lr)を含む。本明細書に記載する薬物送達結合体の別の例証的な実施形態において、多価リンカーは、少なくとも2個の放出型リンカー(lr)2を含む。別の例証的な態様において、多価リンカー(L)は、ジスルフィド放出型リンカーでない、少なくとも1個の放出型リンカー(lr)を含む。別の例証的な態様において、多価リンカー(L)は、1個の放出型リンカーがジスルフィド放出型リンカーでない、少なくとも2個の放出型リンカー(lr)2を有する。1個を超える放出型リンカーが多価リンカーに含まれるとき、これらの放出型リンカーは隣接してもよいことが認識される。2個の放出型リンカーが多価リンカーにおいて隣接しているとき、2個の放出型リンカーは連携して薬物の放出を引き起こしてもよいことがさらに認識される。
【0030】
本明細書で使用され、また開裂性リンカーとしても知られている「放出型リンカー」という用語は、生理学的条件下で切断されうる少なくとも1個の結合(例えばpH不安定性、酸不安定性、酸化不安定性、または酵素不安定性の結合)を含むリンカーを指す。結合切断を生じるこのような生理学的条件としては、例えば生理学的pHにて生じる、またはサイトゾルpHよりも低いpHを有するエンドソームなどの細胞器官への細分化の結果として生じる、標準的な化学加水分解反応が挙げられることが認識されるべきである。
【0031】
開裂性結合が、放出型リンカーのどちらかまたは両方の端にて、本明細書に記載するように、放出型リンカー内の2個の隣接する原子を結合しうる、ならびに/あるいは、他のリンカーまたは(B)および/または(D)を結合しうることが理解されるはずである。開裂性結合が放出型リンカー内の2個の隣接する原子を結合する場合、結合の切断後に、放出型リンカーは2個以上の断片に切断される。あるいは開裂性結合が放出型リンカーと別の部分、例えばヘテロ原子リンカー、スペーサーリンカー、別の放出型リンカー、薬物、あるいはその類似体または誘導体、あるいはビタミン、あるいはその類似体または誘導体との間にある場合、結合の切断後に、放出型リンカーは他の部分から分離される。
【0032】
開裂性結合の不安定性は例えば、開裂性結合におけるまたはその付近の置換的な変更、例えば開裂性ジスルフィド結合に隣接したアルファ分岐を含むこと、加水分解されうるケイ素−酸素結合を有する部分におけるケイ素上の置換基の疎水性の上昇、加水分解されうるケタールまたはアセタールの部分を形成するアルコキシ基のホモログ化、などによって調整されうる。
【0033】
本明細書に記載する2価リンカーの開裂の例示的な機構は、次の1,4および1,6断片化機構:

を含み、式中、Xは、外来性または内在性求核試薬、グルタチオン、または生物還元剤などであり、ZまたはZ’のどちらかは、ビタミン、あるいはその類似体または誘導体、もしくは薬物、あるいはその類似体または誘導体、あるいは多価リンカーの他の部分と併せたビタミンまたは薬物部分である。上の断片化機構は、協奏機構として示されているが、多数の別個の工程が起こることによって、最終的に、多価リンカーからの示された最終生成物への断片化が生じてもよいことが理解されるものとする。例えば、結合開裂は酸触媒によるカルバメート部分の脱離反応によっても起こりうることが認識され、この脱離反応は、上の例に示されたベータ硫黄のアリール基またはジスルフィドのどちらかによってもたらされる安定化により、隣接基によって(anchimerically)補助されうる。本実施形態のこれらの変更態様において、放出型リンカーはカルバメート部分である。あるいは断片化は、ジスルフィド基に対する求核攻撃によって開始されて、開裂が引き起こされ、チオラートが形成される。チオラートはカルボン酸またはカルバミン酸部分を分子間で置換して、対応するチアシクロプロパンを形成しうる。ベンジル含有多価リンカーの場合、例示のジスルフィド結合の切断の後、得られたフェニルチオラートはさらに断片化して、共鳴安定化中間体を形成することによってカルボン酸またはカルバミン酸を放出しうる。これらの場合にいずれにおいても、本明細書に記載する例証的な多価リンカーの放出性質は、存在する化学的、代謝的、生理学的、または生物学的条件に関連しうるどんな機構によっても実現されうる。
【0034】
放出型リンカーの結合開裂のための他の例証的な機構は、次のようなオキソニウム補助開裂:

を含み、式中、Zは、ビタミン、あるいはその類似体または誘導体、あるいは薬物、あるいはその類似体または誘導体であり、あるいはそれぞれが、多価リンカーの他の部分と併せたビタミンまたは薬物部分、例えば1個以上のスペーサーリンカー、ヘテロ原子リンカー、および/または他の放出型リンカーを含む薬物またはビタミン部分である。この実施形態において、カルバメートの酸触媒による脱離は、CO2の放出およびZに結合した窒素含有部分の放出と、水、または他の任意のルイス塩基によって捕捉されうるベンジルカチオンの形成につながる。
【0035】
別の例証的な機構は、多価リンカーにおける結合の開裂に続いて、放出された官能基が、隣接基補助(anchimeric assisted)開裂または切断とも呼ばれる、さらなる結合の切断または開裂を化学的に補助するような方法で、放出型リンカー、スペーサーリンカー、およびヘテロ原子リンカーの配置をともなう。このような多価リンカーまたはその部分の例証的な実施形態は、式:

を有する化合物を含み、式中、Xは、ヘテロ原子、例えば窒素、酸素、または硫黄であり、nは、0、1、2、および3から選択される整数であり、Rは、水素または置換基、例えばアリール環に正電荷を誘導的にまたは共鳴によって安定化できる置換基(例えばアルコキシなど)であり、ZまたはZ’のどちらかは、ビタミン、あるいはその類似体または誘導体、あるいは薬物、あるいはその類似体または誘導体、あるいは多価リンカーの他の部分と併せたビタミンまたは薬物部分である。これに限定されるわけではないが、ヒドロキシ、アルキル、アルコキシ、アルキルチオ、ハロなどを含む他の置換基が、アリール環、ベンジル炭素、カルバメート窒素、アルカン酸、またはメチレン架橋に存在しうることが認識される。補助開裂には、ベンジリウム中間体、ベンジン中間体、ラクトン環化、オキソニウム中間体、ベータ脱離などをともなう機構が含まれうる。放出型リンカーの開裂に続く断片化に加えて、放出型リンカーの初期開裂が隣接基補助機構によって促進されうることがさらに認識される。
【0036】
この実施形態において、環化しうるヒドロキシアルカン酸は、例えばオキソニウムイオンによってメチレン架橋の開裂を促進し、結合開裂または放出型リンカーの結合開裂後の続いての断片化を促進する。あるいは、メチレン架橋の酸触媒によるオキソニウムイオン補助開裂は、この例証的な多価リンカー、またはその断片の断片化のカスケードを開始しうる。あるいはカルバメートの酸触媒による加水分解は、環化しうるヒドロキシアルカン酸のベータ脱離を促進し、例えばオキソニウムイオンによってメチレン架橋の開裂を促進しうる。本明細書に記載する代謝的、生理学的、または細胞的条件下での結合切断または開裂の他の化学的機構がこのような断片化のカスケードを開始しうることが認識される。本明細書に記載する代謝的、生理学的、または細胞的条件下での結合切断または開裂の他の化学的機構がこのような断片化のカスケードを開始しうることが認識される。
【0037】
一実施形態において、本明細書に記載する多価リンカーは、次の式

の化合物であり、式中、nは、1〜約4より選択される整数であり;RaおよびRbは、水素および場合により分岐しているC1〜C4アルキルなどの低級アルキルを含むアルキルから成る群よりそれぞれ独立して選択され;あるいはRaおよびRbは、結合した炭素原子とひとまとめにされて、炭素環を形成し;Rは、場合により置換されたアルキル基、場合により置換されたアシル基、または適切に選択された窒素保護基であり;そして(*)は、薬物、ビタミン、造影剤、診断剤、他の多価リンカー、または結合体の他の部分への結合点を示す。
【0038】
別の実施形態において、本明細書に記載する多価リンカーは、次の式

の化合物を含み、式中、mは、1〜約4より選択される整数であり;Rは、場合により置換されたアルキル基、場合により置換されたアシル基、または適切に選択された窒素保護基であり;そして(*)は、薬物、ビタミン、造影剤、診断剤、他の多価リンカー、または結合体の他の部分への結合点を示す。
【0039】
別の実施形態において、本明細書に記載する多価リンカーは、次の式

の化合物を含み、式中、mは、1〜約4より選択される整数であり;Rは、場合により置換されたアルキル基、場合により置換されたアシル基、または適切に選択された窒素保護基であり;そして(*)は、薬物、ビタミン、造影剤、診断剤、他の多価リンカー、または結合体の他の部分への結合点を示す。
【0040】
別の実施形態において、多価リンカーにおける結合の開裂に続いて、放出された官能基が、隣接基補助(anchimeric assisted)開裂または切断とも呼ばれる、さらなる結合の切断または開裂を化学的に補助するような方法で、放出型リンカー、スペーサーリンカー、およびヘテロ原子リンカーが配置されてもよい。このような多価リンカーまたはその部分の例証的な実施形態は、式:

を有する化合物を含み、式中、Xは、ヘテロ原子、例えば窒素、酸素、または硫黄であり、nは、0、1、2、および3から選択される整数であり、Rは、水素、またはアリール環に正電荷を誘導的にまたは共鳴によって安定化できる置換基(例えばアルコキシなど)を含めた置換基であり、記号(*)は、多価リンカーを形成する追加のスペーサーリンカー、ヘテロ原子リンカー、または放出型リンカーへの結合点、あるいは薬物、あるいはその類似体または誘導体、あるいはビタミン、あるいはその類似体または誘導体への結合点を示す。これに限定されるわけではないが、ヒドロキシ、アルキル、アルコキシ、アルキルチオ、ハロなどを含む他の置換基が、アリール環、ベンジル炭素、アルカン酸、またはメチレン架橋に存在してもよいことが認識される。補助開裂は、ベンジリウム中間体、ベンジン中間体、ラクトン環化、オキソニウム中間体、ベータ脱離をともなう機構が含まれてもよい。放出型リンカーの開裂に続く断片化に加えて、放出型リンカーの初期開裂が隣接基補助機構(anchimerically assisted mechanism)によって促進されてもよいことがさらに認識される。
【0041】
別の実施形態において、多価リンカーは、多価3−チオスクシンイミド−1−イルアルキルオキシメチルオキシ基を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、次の式

によって表される。式中、nは、1〜6の整数であり、アルキル基は場合により置換され、メチルは、追加のアルキルまたは場合により置換されたアリール基によって場合により置換され、そのそれぞれが独立して選択された基Rによって表される。記号(*)は、多価リンカー断片の、本明細書に記載する結合体の他の部分への結合点を示す。
【0042】
別の実施形態において、多価リンカーは、多価3−チオスクシンイミド−1−イルアルキルカルボニル基を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、次の式

によって表される。式中、nは、1〜6の整数であり、アルキル基は場合により置換される。記号(*)は、多価リンカー断片の、本明細書に記載する結合体の他の部分への結合点を示す。別の実施形態において、多価リンカーは、多価3−チオアルキルスルホニルアルキル(2置換シリル)オキシ基を形成するために結合されたヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、2置換シリルは、アルキルおよび/または場合により置換されたアリール基によって置換される。
【0043】
別の実施形態において、多価リンカーは、多価ジチオアルキルカルボニルヒドラジド基、または多価3−チオスクシンイミド−1−イルアルキルカルボニルヒドラジドを形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、次の式

によって表される。式中、nは、1〜6の整数であり、アルキル基は場合により置換され、ヒドラジドは、(B)、(D)、または多価リンカー(L)の他の部分と共にヒドラゾンを形成する。記号(*)は、多価リンカー断片の、本明細書に記載する結合体の他の部分への結合点を示す。
【0044】
別の実施形態において、多価リンカーは、多価3−チオスクシンイミド−1−イルアルキルオキシアルキルオキシアルキリデン基を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、次の式

によって表される。式中、各nは、1〜6より独立して選択された整数であり、各アルキル基は、独立して選択され、例えばアルキルまたは場合により置換されたアリールによって場合により置換され、ここでアルキリデンは、(B)、(D)、または多価リンカー(L)の他の部分と共にヒドラゾンを形成する。記号(*)は、多価リンカー断片の、本明細書に記載する結合体の他の部分への結合点を示す。
【0045】
別の実施形態において、多価リンカーは、多価3−チオまたは3−ジチオアリールアルキルオキシカルボニル基、3−チオまたは3−ジチオアリールアルキルアミノカルボニル基、多価3−チオまたは3−ジチオアルキルオキシカルボニル、あるいは多価3−チオまたは3−ジチオアルキルアミノカルボニルを形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、ここでアルキルカルボニルは、(B)、(D)、または多価リンカー(L)の他の部分と共にカーボネート、カルバメート、または尿素を形成する。例証的には、アルキル基はエチルである。
【0046】
別の実施形態において、多価リンカーは、多価3−ジチオアルキルアミノ基を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、ここでアミノは、(B)、(D)、または多価リンカー(L)の他の部分と共にビニル性アミドを形成する。例証的には、アルキル基はエチルである。
【0047】
別の実施形態において、多価リンカーは、多価1−アルコキシシクロアルキレンオキシ基、多価アルキレンアミノカルボニル(ジカルボキシルアリーレン)カルボキシラート基、多価3−ジチオアルキルオキシカルボニル基、多価3−ジチオアルキルオキシカルボニルヒドラジン基、多価を形成するように結合された、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含む。
【0048】
別の実施形態において、多価リンカーは、アミノ酸から形成されたペプチドである少なくとも1個のスペーサーリンカーを含む。一態様において、ペプチドは天然型アミノ酸、およびその立体異性体を含む。別の態様において、ペプチドは天然型アミノ酸、およびその立体異性体のみから形成される。
【0049】
スペーサーおよび放出型リンカーのさらなる例証的な例を表1および2に示し、ここで(*)は、別のリンカーへの、ビンカアルカロイド、あるいはその類似体または誘導体への、あるいは受容体結合部分への結合点を示す。
【0050】
〔表1 企図されるスペーサーおよびヘテロ原子リンカー、ならびにその組合せ〕


【0051】
〔表2 企図される放出型およびヘテロ原子リンカー、ならびにその組合せ〕

【0052】
いずれの各種薬物も本明細書に記載する薬物送達結合体に含まれてもよい。例証的な一実施形態において、薬物は病原性細胞の1つ以上の集団に対する活性に基づいて選択される。一態様において、これらの病原性細胞は、固形腫瘍を含む癌細胞である。
【0053】
別の例証的な一実施形態において、薬物は特定の作用機構を持つ病原性細胞の1つ以上の集団に対する活性に基づいて選択される。例証的な作用機構としては、アルキル化剤、微小管形成を安定化および/または不安定化するもの(例えばベータチューブリン剤)を含む、微小管阻害薬、サイクリン依存性キナーゼ(CDK)阻害薬、トポイソメラーゼ阻害薬、タンパク質合成阻害薬、Ras、Raf、PKC、PI3および同様の阻害薬を含むタンパク質キナーゼ阻害薬、転写阻害薬、葉酸拮抗薬、熱ショックタンパク質遮断薬、などが挙げられる。
【0054】
例証的なアルキル化剤としては、これに限定されるわけではないが、マイトマイシンCBIなどを含む。例証的なサイクリン依存性キナーゼ(CDK)阻害薬としては、これに限定されるわけではないが、CYC202、セリシクリブ、R−ロスコビチン、AGM−1470などが挙げられる。例証的なトポイソメラーゼ阻害薬としては、これに限定されるわけではないが、ドキソルビシン、他のアントラサイクリンなどが挙げられる。例証的なタンパク質合成阻害薬としては、これに限定されるわけではないが、ブルセアンチンなどが挙げられる。Ras、Raf、PKC、PI3Kなどの阻害薬を含む例証的なタンパク質キナーゼ阻害薬としては、これに限定されるわけではないが、L−779,450、R115777などが挙げられる。例証的な転写阻害薬としては、これに限定されるわけではないが、α−アマンチン、アクチノマイシンなどが挙げられる。例証的な葉酸拮抗薬としては、これに限定されるわけではないが、メトトレキセートなどが挙げられる。例証的な熱ショックタンパク質遮断薬としては、これに限定されるわけではないが、ゲルダナマイシンなどが挙げられる。
【0055】
微小管形成を安定化および/または不安定化するものを含む、例証的な微小管阻害薬としては、ベータチューブリン剤、微小管毒などが挙げられる。選択した受容体に結合する例証的な微小管毒としては、これに限定されるわけではないが、ビンカ結合部位に結合する阻害薬、例えばアレナスタチン、ドラスタチン、ハリコンドリンB、メイタンシン、ホモプシンA、リゾキシン、ウスチロキシン、ビンブラスチン、ビンクリスチンなど、タキソール結合部位に結合する安定剤、例えばディスコデルマリド(discodermalide)、エポチロン、タキソール、パクリタキセルなど、コルヒチン結合部位に結合する阻害薬、例えばコルヒチン、コンブレタスタチン、クラシンA、ポドフィロトキシン、ステガナシンなど、および未定義部位に結合するその他、例えばクリプトフィシン、チューブリシン(tubulysins)、などが挙げられる。
【0056】
本明細書に記載する薬物送達結合体の一実施形態において、薬物の少なくとも1つは、微小管阻害薬、あるいはその類似体または誘導体である。別の実施形態において、薬物の少なくとも1つは、DNAアルキル化剤である。別の実施形態において、薬物の少なくとも1つは、DNAアルキル化剤であり、薬物の少なくとも他の1つは、微小管阻害薬である。本明細書に記載するアルカロイドとしては、アルカロイドのビンカインドール−ジヒドロインドールファミリーのすべてのメンバー、例えば、これに限定されるわけではないが、ビンデシン、ビンブラスチン、ビンクリスチン、カタランチン、ビンドリン、ロイロシン、ビノレルビン、イミドカルブ、シブトラミン、トルトラズリル、ビンブラスチン酸など、ならびにその類似体および誘導体、などが挙げられる。
【0057】
本明細書に記載する薬物送達結合体の別の実施形態において、薬物の少なくとも1つは、P−糖タンパク質(PGP)阻害薬である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つはPGP阻害薬であり、薬物送達結合体に含まれる薬物の少なくとも他の1つはPGP基質である。例証的には、この後者の実施形態において、PGP基質はDNAアルキル化剤である。この実施形態を参照すると、PGP阻害薬を、PGP基質、例えばこれに限定されるわけではないが、マイトマイシンC、マイトマイシンAなどのマイトマイシンのいずれかを含むDNAアルキル化剤と組合せることは、そうでなければPGP基質である薬物の性能全体を改善しうることが認識される。本明細書に記載する放出型結合体において、PGP阻害薬およびPGP基質薬はどちらもエンドサイトーシスの後に細胞中で放出される。その方法では、PGP阻害薬は、PGP基質薬の全体の有効性および/または効力を改善してもよい。加えてPGP阻害薬はPGP発現を低下させ、それは次に本明細書に記載する多剤結合体に含まれる1つ以上の薬物の病原性細胞からの放出放出を低下させる。マイトマイシン、あるいはその類似体または誘導体、例えばマイトマイシンCは、PGP阻害剤、またはPGPのダウンレギュレータとして作用してもよいことが認識される。ビンカアルカロイド、あるいはその類似体または誘導体、例えばビンブラスチン類似体および誘導体が、病原性細胞からの放出をPGP阻害薬またはダウンレギュレータによって防止されるPGP基質であってもよいことがさらに認識される。
【0058】
本明細書に記載する薬物送達結合体の別の実施形態において、薬物の少なくとも1つは、ビンカアルカロイド、あるいはその類似体または誘導体である。本明細書に記載するビンカアルカロイドとしては、アルカロイドのビンカインドール−ジヒドロインドールファミリーのすべてのメンバー、例えばこれに限定されるわけではないが、ビンデシン、ビンブラスチン、ビンクリスチン、カタランチン、ビンドリン、ロイロシン、ビノレルビン、イミドカルブ、シブトラミン、トルトラズリル、ビンブラスチン酸など、ならびにその類似体および誘導体、などが挙げられる。
【0059】
本明細書で言及するように、本明細書に記載する結合体で有用なビンカ薬物としては、アルカロイドのビンカインドール−ジヒドロインドールファミリーのすべてのメンバー、例えばビンデシン、ビンブラスチン、ビンクリスチン、カタランチン、ビンドリン、ロイロシン、ビノレルビン、イミドカルブ、シブトラミン、トルトラズリル、ビンブラスチン酸など、ならびにその類似体および誘導体、などが挙げられる。例証的には、そのような類似体および誘導体としては、米国特許第4,203,898号に記載されている3−カルボキスアジド;米国特許第4,166,810号に記載されている4−デスアセチルビンブラスチン−3−カルボキスヒドラジドのN2−アルキルおよび他の誘導体;Neuss et al. Tetrahedron Lett.783 (1968)に記載されているロイロシンヒドラジド;Barnett et al. J. Med. Chem. 21:88 (1978)に記載されているヒドラジド誘導体;米国特許第3,392,173号および同第3,387,001号に記載されているC−4エステル誘導体;Langone et al. Anal. Biochem. 95:214 (1979)に記載されている酸化から生じるジカルボン酸誘導体;およびEP 0247792A2号に記載されているビンカヒドラジド、などが挙げられる。上記の特許および刊行物のそれぞれは、それが合成経路、およびビンカ化合物を調製するための反応条件に関して開示しているすべてについて、参照により本明細書に組み入れられている。
【0060】
例証的な一実施形態において、ビンカ薬物は、式

の化合物であり、式中:
R1およびR2の一方はHであり、他方はエチルであり、かつR3はHであり、あるいはR1はエチルであり、R2、およびR3はひとまとめにされて、−O−を形成し;
R4、R7、およびR8は、H、アルキル、およびアシルからそれぞれ独立して選択され、
R5およびR6は、それぞれ独立して選択されたアルキルであり;
R9は、基−NHNHRであり、式中、Rは、H、アルキル、またはアシルであり;
R10は、Hまたはアシルであり;かつ
R11は、エチルである。
【0061】
一態様において、ビンカ薬物は、上の式の化合物であり、式中、R4およびR8はそれぞれHであり;かつR5、R6、R9、およびR10はそれぞれメチルである。
【0062】
別の実施形態において、受容体結合部分、多価リンカー(L)、ビンカアルカロイド薬物、あるいはその類似体または誘導体、および別の薬物、あるいはその類似体または誘導体を含む受容体結合薬物送達結合体が記載され、該受容体結合部分、ビンカアルカロイド、および他の薬物はそれぞれ、ヘテロ原子リンカー(lH)を介して多価リンカー(L)に結合される。多価リンカー(L)は、1個以上のスペーサーリンカー、ヘテロ原子リンカー、および放出型リンカー、ならびにその組合せをいずれかの順序で含む。
【0063】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、アクラマイシン、あるいはその類似体または誘導体である。アクラマイシンおよびその類似体および誘導体がPGP放出ポンプ基質であることもありうる。一態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つはDNAアルキル化剤、例えばマイトマイシンあるいはその類似体または誘導体である。
【0064】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、DNA合成阻害薬、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、紡錘糸形成阻害薬、あるいはその類似体または誘導体である。一態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、DNA合成阻害薬、あるいはその類似体または誘導体であり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、紡錘糸形成阻害薬、あるいはその類似体または誘導体である。
【0065】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、微小管安定化剤、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、微小管合成阻害薬、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、微小管不安定化剤、あるいはその類似体または誘導体である。
【0066】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、アポトーシス誘発剤、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、タキソール、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、葉酸拮抗薬、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、メトトレキセート、あるいはその類似体または誘導体である。一態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、葉酸拮抗薬、あるいはその類似体または誘導体、例えばメトトレキセートであり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、タキソール、あるいはその類似体または誘導体である。
【0067】
別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、葉酸塩、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、ヒト上皮成長因子受容体−2(HER−2)阻害薬、あるいはその類似体または誘導体である。別の実施形態において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、放射性標識化学療法剤、例えばシスプラチンなどである。一態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、葉酸拮抗薬、あるいはその類似体または誘導体、例えばメトトレキセートであり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、葉酸塩、あるいはその類似体または誘導体である。別の態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、タキソール、あるいはその類似体または誘導体であり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、HER−2阻害薬、あるいはその類似体または誘導体である。別の態様において、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも1つは、タキソール、あるいはその類似体または誘導体であり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、放射性標識化学療法剤、例えばシスプラチンであり、本明細書に記載する薬物送達結合体に含まれる薬物の少なくとも他の1つは、HER−2阻害薬、あるいはその類似体または誘導体である。
【0068】
本明細書に記載する薬物送達結合体は、在来の合成方法によって調製されうる。合成方法は、ヘテロ原子リンカーの選択、ならびにスペーサーリンカーおよび放出型リンカーに存在する官能基に応じて選択されうる。一般に、関連する結合形成反応は、Richard C.Larock, “Comprehensive Organic Transformations, a guide to functional group preparations”, VCH Publishers, Inc. New York (1989)、およびTheodora E. Greene & Peter G. M. Wuts, “Protective Groups ion Organic Synthesis,” 2d edition, John Wiley & Sons, Inc. New York (1991)に記載されており、その開示は全体が参照により本明細書に組み入れられている。さらなる合成経路および反応条件は、米国特許出願公開第2005/0002942A1号に記載されている。
【0069】
例証的に、本明細書に記載する薬物送達結合体は、線形および収束合成経路の両方を使用して調製されうる。このような経路で使用できる例証的な中間体としては、受容体結合部分、あるいはその類似体および誘導体、ならびにビンカアルカロイド、あるいは類似体または誘導体への共有結合のために適切なカップリング基をそれぞれの端に含む多価リンカーを含む中間体、などが挙げられる。このような経路で使用できる他の例証的な中間体としては、カップリング基を含み、多価リンカーに結合された受容体結合部分あるいはその類似体または誘導体を含む中間体が挙げられる。このような経路で使用できる他の例証的な中間体としては、カップリング基を含む、多価リンカーに結合された、ビンカアルカロイド、あるいはその類似体または誘導体を含む中間体が挙げられる。どちらの場合でも、カップリング基は求核試薬、求電子試薬、またはその前駆体でありうる。
【0070】
合成中間体の例証的な一実施形態において、カップリング基はMichael受容体であり、多価リンカーには、式−C(O)NHN=、−NHC(O)NHN=、または−CH2C(O)NHN=を有する放出型リンカーが含まれる。例証的な一態様において、カップリング基および多価リンカーはひとまとめにされて、式

を有する化合物またはその保護誘導体を形成し、式中、(D)は、本明細書で例証するようなヒドラゾンを形成できるビンカアルカロイド、あるいはその類似体または誘導体であり;かつnは、1、2、3、または4などの整数である。本明細書に記載する受容体結合薬物送達結合体中間体の別の例証的な態様において、第2のリンカーが、第2のリンカーに含まれるアルキルチオール求核試薬を通じて上の式に共有結合される。別の例証的な態様において、受容体結合部分、あるいはその類似体または誘導体は、その部分に含まれるアルキルチオール求核試薬を通じて上の式に共有結合される。
【0071】
別の例証的な実施形態において、カップリング基はヘテロ原子、例えば窒素、酸素、または硫黄であり、多価リンカーは、受容体結合部分をカップリング基に共有結合する1個以上のヘテロ原子リンカーおよび1個以上のスペーサーリンカーを含む。例証的な一態様において、本明細書に記載する中間体は、式

を有する化合物またはその保護誘導体を含み、式中、Xは、酸素、窒素、または硫黄であり、mは、整数、例えば1、2、または3であり、ここで(B)、ls、およびlHは、本明細書で定義する通りである。例証的な一態様において、lHは−NH−であり、mは1である。別の例証的な態様において、lHは−NH−であり、mは1であり、Xは−S−である。
【0072】
別の例証的な態様において、本明細書に記載する中間体は、式

を有する化合物またはその保護誘導体を含み、式中、Yは、Hまたは置換基、例証的には、これに限定されるわけではないが、ニトロ、シアノ、ハロ、アルキルスルホニル、カルボン酸誘導体などを含む電子吸引置換基であり、ここで(B)およびlsは本明細書で定義する通りである。
【0073】
本明細書に記載する中間体の例証的な実施形態において、カップリング基はMichael受容体であり、多価リンカーは、受容体結合部分をカップリング基に共有結合する1個以上のヘテロ原子リンカーおよび1個以上のスペーサーリンカーを含む。例証的な一態様において、カップリング基および多価リンカーはひとまとめにされて、式

を有する化合物またはその保護誘導体を形成し、式中、Xは、酸素、窒素、または硫黄であり、mおよびnは、独立して選択された整数、例えば1、2、または3であり、ここで(B)、lsおよび1Hは、本明細書で定義する通りである。別の例証的な態様において、ビンカアルカロイド、あるいはその類似体または誘導体は、ビンカアルカロイドに含まれるアルキルチオール求核試薬を通じて上の式に共有結合される。
【0074】
別の例証的な態様において、中間体は、式

を有する化合物またはその保護誘導体を含み、式中、AAは、1個以上のアミノ酸であって、例証的には天然型アミノ酸またはその立体異性体から選択され、Xは、窒素、酸素、または硫黄であり、Yは、水素または置換基であって、例証的には、これに限定されるわけではないが、ニトロ、シアノ、ハロ、アルキルスルホニル、カルボン酸誘導体などを含む電子吸引置換基であり、nおよびmは、独立して選択される整数、例えば1、2、または3であり、pは、1、2、3、4、または5などの整数である。
【0075】
AAは、任意の他のアミノ酸、例えば一般式:
−N(R)−(CR’R”)t−C(O)−
を有する任意のアミノ酸であってもよく、式中、Rは、水素、アルキル、アシル、または適切な窒素保護基であり、R’およびR”は、水素または置換基であり、そのそれぞれが各存在ごとに独立して選択され、tは、1、2、3、4、または5などの整数である。例証的には、R’および/またはR”は、これに限定されるわけではないが、天然型アミノ酸に存在する水素または側鎖、例えばメチル、ベンジル、ヒドロキシメチル、チオメチル、カルボキシ、カルボキシメチル、グアニジノプロピルなど、ならびにその誘導体および保護誘導体に、それぞれ独立して相当する。上記の式は、すべての立体異性変形を含む。例えばアミノ酸は、アスパラギン、アスパラギン酸、システイン、グルタミン酸、リジン、グルタミン、アルギニン、セリン、オルニチン、トレオニンなどから選択されうる。本明細書に記載するビタミン受容体結合薬物送達結合体中間体の別の例証的な態様において、薬物、あるいはその類似体または中間体は、アルキルチオール求核試薬を含む。
【0076】
上の中間体のそれぞれは、在来の合成経路を使用して調製されうる。さらなる合成経路および反応条件は、米国特許出願公開第2005/0002942A1号および国際公開WO2006/012527号に記載されている。
【0077】
上の例証的な実施形態は、本明細書に記載する本発明の例証として意図され、本明細書に記載する本発明を制限するものとして、決して説明または解釈されるべきではない。例えば、次の例証的なビタミン−薬物結合体中間体によって一般に表される化合物は、本明細書によって記載されるように、本発明に含まれるものである:

式中、R1およびR2はそれぞれ独立して、水素またはアルキル、例えばメチルであり;かつlHは、ヘテロ原子、例えば酸素、硫黄、場合により置換された窒素、または場合により保護された窒素などである。2つ以上の薬物、および場合により追加の受容体結合リガンド、例えば葉酸塩ならびにその類似体および誘導体は、(lH)にて、または存在する他の官能基、例えばアミド窒素またはカルボニル、酸カルボキシラート、またはグアニジンアミノ基にて、この例証的な中間体に共有結合しうる。
【0078】
別の実施形態において、次の式

を有する葉酸塩リガンド中間体が記載され、式中、m、n、およびqは、0〜約8の範囲から独立して選択される整数であり;AAは、アミノ酸であり、R1は、水素、アルキル、または窒素保護基であり、薬物は、場合により(*)原子にて結合される。一態様において、AAは、天然または非天然形態のいずれかの天然型アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、親水性アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、Aspおよび/またはArgである。別の態様において、整数oは、1以上である。別の態様において、整数mは、2以上である。薬物、あるいはその類似体または誘導体、ならびに場合により追加のリンカーおよび追加の受容体結合リガンドは上の式に対し、該式中の自由原子価によって示される、2,ω−ジアミノアルカン酸断片の自由NH側鎖にて、または末端カルボキシラートにて結合されうる。
【0079】
別の実施形態において、次の式

を有する葉酸塩リガンド中間体が記載され、式中、m、n、qおよびpは、0〜約8の範囲から独立して選択される整数であり;AAは、アミノ酸であり、R1は、水素、アルキル、または窒素保護基であり、薬物は、場合により(*)原子にて結合される。一態様において、AAは、天然または非天然形態のいずれかの天然型アミノ酸としてである。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、親水性アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、Aspおよび/またはArgである。別の態様において、整数oおよびpは、1以上である。別の態様において、整数mは、2以上である。薬物、あるいはその類似体または誘導体、ならびに、場合により追加のリンカーおよび追加の受容体結合リガンドは、上の式に対して、該式中の自由原子価によって示される、2,ω−ジアミノアルカン酸断片の自由NH側鎖にて、システイニルチオール基にて、または末端カルボキシラートにて結合してもよい。
【0080】
別の実施形態において、次の式

を有する葉酸塩リガンド中間体が記載される。式中、m、n、q、p、およびrは、0〜約8の範囲から独立して選択される整数であり;AAは、アミノ酸であり、R1は、水素、アルキル、または窒素保護基であり、薬物は、場合により(*)原子にて結合される。一態様において、AAは、天然または非天然形態のいずれかの天然型アミノ酸としてである。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、親水性アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、Aspおよび/またはArgである。別の態様において、整数o、p、およびrは、1以上である。別の態様において、整数mは、2以上である。薬物、あるいはその類似体または誘導体、ならびに場合により追加のリンカーおよび追加の受容体結合リガンドは、上の式に対して、該式中の自由原子価によって示される、2,ω−ジアミノアルカン酸断片の自由NH側鎖にて、システイニルチオール基にて、セリニルヒドロキシ基にて、または末端カルボキシラートにて結合してもよい。
【0081】
別の実施形態において、薬物の1つとしてマイトマイシンを含む葉酸塩リガンド中間体が記載され、次の式

を有し、式中、m、n、およびqは、0〜約8の範囲から独立して選択される整数であり;AAは、アミノ酸である。一態様において、AAは、天然または非天然形態のいずれかの天然型アミノ酸としてである。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、親水性アミノ酸である。別の態様において、断片(−NH−AA−C(O)−)n中の1つ以上のAAは、Aspおよび/またはArgである。別の態様において、整数oは、1以上である。別の態様において、整数mは、2以上である。薬物、あるいはその類似体または誘導体、ならびに場合により追加のリンカーおよび追加の受容体結合リガンドは上の式に対して、該式中の自由原子価によって示される、2,ω−ジアミノアルカン酸断片の追加の自由NH側鎖にて、または末端カルボキシラートにて結合してもよい。
【0082】
別の実施形態において、下記の式を有する、マイトマイシン、およびビンカアルカロイドを含む、葉酸塩リガンド多剤結合体が記載される。

【0083】
別の実施形態において、下記の式を有し、マイトマイシン、アクラマイシン、およびビンカアルカロイドを含む、葉酸塩リガンド多剤結合体が記載される。

【0084】
別の実施形態において、医薬組成物が記載されている。本医薬組成物は、本明細書に記載した薬物送達結合体を、製薬的に許容される担体、賦形剤および/または希釈剤と組合せて含む。
【0085】
別の実施形態において、病原性細胞の集団を内部に持つ宿主動物において病原性細胞の集団を排除する方法が記載される。例証的な一態様において、病原性細胞集団のメンバーは、受容体結合部分、あるいはその類似体または誘導体に対する接近可能な結合部位を有し、その結合部位は病原性細胞によって独自に発現、過剰に発現、または優先的に発現される。該方法は、本明細書で記載するように、宿主に本明細書に記載する薬物送達結合体、あるいはその医薬組成物を投与する工程を含む。
【0086】
本明細書に記載する方法を使用して治療されうる病原性細胞の集団としては、これに限定されるわけではないが、癌、例えば卵巣、乳腺、結腸、肺、鼻、咽喉、脳の上皮癌、そして他の腫瘍細胞種、感染性因子、活性化マクロファージ、活性化単球、などが挙げられる。
【0087】
本明細書に記載する薬物送達結合体は、ヒト臨床医学および動物用途の両方に使用されうる。それゆえ病原性細胞の集団を持ち、薬物送達結合体によって治療される宿主動物はヒトであってもよく、あるいは動物用途の場合には、実験用動物、農業用動物、家畜、または野生動物であってもよい。本明細書に記載する薬物送達結合体は、これに限定されるわけではないが、ヒト、実験用動物、例えばげっ歯類(例えばマウス、ラット、ハムスターなど)、ウサギ、サル、チンパンジー、家畜、例えばイヌ、ネコ、およびウサギ、農業用動物、例えばウシ、ウマ、ブタ、ヒツジ、ヤギ、および飼育されている野生動物、例えばクマ、パンダ、ライオン、トラ、ヒョウ、ゾウ、シマウマ、キリン、ゴリラ、イルカ、およびクジラを含む宿主動物、などに投与されてもよい。
【0088】
本明細書に記載する薬物送達結合体は、宿主動物における各種の病状および病原性細胞を治療するために使用されてもよい。本明細書で使用するように「病原性細胞」は、癌細胞、感染性因子(例えば細菌およびウィルス)、細菌またはウィルス感染細胞、疾患状態を引き起こすことができる活性化マクロファージ、リガンド受容体(例えばビタミン受容体あるいはビタミンの類似体または誘導体を結合する受容体)を独自に発現する、優先的に発現する、または過剰に発現する他の任意の種類の病原性細胞を意味する。病原性細胞は、薬物送達結合体による治療が疾患症状の低減をもたらす疾患状態を引き起こすいかなる細胞も含みうる。病原性細胞は、移植片対宿主病の原因である免疫系の細胞などの、ある状況の下で病原性であるが、他の状況では病原性でない宿主細胞でもありうる。
【0089】
それゆえ病原性細胞の集団は、良性腫瘍および悪性腫瘍を含めて腫瘍原性でありうる癌細胞集団でありうるか、またはそれは非腫瘍原性でありうる。癌細胞集団は、自然発症的に、または宿主動物の生殖細胞系に存在する変異または体細胞変異などのプロセスによって発生しうるか、あるいはそれは化学的に、ウィルスによって、または放射線によって誘発されうる。本発明は、癌腫、肉腫、リンパ腫、ホジキン病、黒色腫、中皮腫、バーキットリンパ腫、上咽頭癌、白血病、および骨髄腫などの癌を治療するために利用されうる。癌細胞集団としては、これに限定されるわけではないが、口腔癌、甲状腺癌、内分泌癌、皮膚癌、胃癌、食道癌、喉頭癌、膵臓癌、結腸癌、膀胱癌、骨癌、卵巣癌、子宮頸癌、子宮癌、乳癌、精巣癌、前立腺癌、直腸癌、腎臓癌、肝臓癌、および肺癌、などが挙げられる。
【0090】
病原性細胞集団が癌細胞集団である実施形態において、薬物送達結合体投与の効果は、腫瘤の縮小または排除あるいは腫瘍細胞増殖の阻害によって測定された治療応答である。腫瘍の場合、排除は、原発性腫瘍の細胞の、あるいは転移した細胞の、または原発性腫瘍から解離するプロセスにある細胞の排除でありうる。腫瘍の外科的除去、放射線療法、化学療法、または生物療法を含むいずれかの治療手法による腫瘍の除去後に腫瘍の再発を防止するための、薬物送達結合体による予防的治療も企図される。予防的治療は、薬物送達結合体を用いた初期治療、例えば連日多回用量処方での治療であってもよく、および/または初期治療後に数日または数ヶ月の間隔を置いた追加治療または一連の治療であってもよい。したがって上記の任意の病原性細胞集団の排除は、病原性細胞の数の減少、病原性細胞の増殖の阻害、病原性細胞の再発を防止する予防的治療、または疾患の症状の低減を引き起こす病原性細胞の治療を含む。
【0091】
癌細胞が排除される場合、本明細書に記載する方法は、腫瘍の外科的除去、放射線療法、化学療法、または生物療法、例えば、これに限定されるわけではないが、モノクローナル抗体療法、免疫調節薬による治療、免疫エフェクタ細胞の養子移入、造血成長因子、サイトカインおよびワクチン接種による治療を含む他の免疫療法、などと組合せて使用されうる。
【0092】
本明細書に記載する方法は、各種の感染性疾患を引き起こす病原性細胞の集団にも利用できる。例えば本発明は、細菌、酵母を含む真菌、ウィルス、ウィルス感染細胞、マイコプラズマ、および寄生生物などの病原性細胞の集団に利用できる。本明細書に記載する薬物送達結合体によって治療されうる感染性生物は、グラム陰性またはグラム陽性球菌または桿菌である細菌などの生物を含む、動物において病原を引き起こす当分野で認識された任意の感染性生物である。例えば、プロテウス種、クレブシエラ種、プロビデンシア種、エルシニア種、エルウィニア種、エンテロバクター種、サルモネラ種、セラチア種、アエロバクター種、エシェリキア種、シュードモナス種、赤痢菌種、ビブリオ種、アエロモナス種、カンピロバクター種、ストレプトコッカス種、スタフィロコッカス種、ラクトバシラス種、ミクロコッカス種、モラクセラ種、バシラス種、クロストリジウム種、コリネバクテリウム種、エベルセラ(Eberthella)種、ミクロコッカス種、マイコバクテリウム種、ナイセリア種、ヘモフィルス種、バクテロイデス種、リステリア種、エリジペロスリックス種、アシネトバクター種、ブルセラ種、パスツレラ種、ビブリオ種、フラボバクテリウム種、フゾバクテリウム種、ストレプトバシラス種、カリマトバクテリウム種、レジオネラ種、トレポネーマ種、ボレリア種、レプトスピラ種、アクチノミセス種、ノカルジア種、リケッチア種、および、宿主動物において疾患を引き起こす他の任意の細菌種は、本明細書に記載する薬物送達結合体によって治療されうる。
【0093】
特に興味深いのは、抗生物質耐性ストレプトコッカス種およびスタフィロコッカス種などの、抗生物質に対して耐性である細菌、または抗生物質に対して感受性であるが、抗生物質によって治療される反復性感染を引き起こすので、耐性生物が最終的に発生する細菌である。抗生物質に対して感受性であるが、抗生物質によって治療される反復性感染を引き起こすので、耐性生物が最終的に発生する細菌は、これらの抗生物質耐性細菌株の発生を回避するために、抗生物質の非存在下で、または宿主動物に通常投与されるよりも低い用量の抗生物質と組合されて、本明細書に記載する薬物送達結合体によって治療されうる。
【0094】
ウィルス、例えばDNAおよびRNAウィルスによって引き起こされた疾患もまた、本明細書に記載する薬物送達結合体によって治療されうる。このようなウィルスとしては、これに限定されるわけではないが、DNAウィルス、例えばパピローマウィルス、パルボウィルス、アデノウィルス、ヘルペスウィルスおよびワクシニアウィルス、ならびにRNAウィルス、例えばアレナウィルス、コロナウィルス、リノウィルス、呼吸器合胞体ウィルス、インフルエンザウィルス、ピコルナウィルス、パラミキソウィルス、レオウィルス、レトロウィルス、レンチウィルス、およびラブドウィルス、などが挙げられる。
【0095】
本明細書に記載する薬物送達結合体は、酵母を含む任意の真菌、マイコプラズマ種、寄生生物、または動物で疾患を引き起こす他の感染性生物によって引き起こされた疾患を治療するためにも使用されうる。本明細書に記載する方法および薬物送達結合体によって治療されうる真菌の例としては、例えば白癬、ヒストプラスマ症、ブラストミセス症、アスペルギルス症、クリプトコッカス症、スポロトリクム症、コクシジオイデス症、パラコクシジオイデス症、ムコール症、色素酵母菌症、皮膚糸状菌症、プロトテカ症、フザリウム症、粃糠疹、菌腫、パラコクシジオイデス症、フェオフィホ真菌症、シュードアレシェリア症、スポロトリクム症、砂毛症、ニューモシスチス感染症、およびカンジダ症を引き起こす真菌を含めた、カビとして成長する、または酵母様である真菌、などが挙げられる。
【0096】
本明細書に記載する薬物送達結合体は、これに限定されるわけではないが、サナダムシ(例えば条虫、矮小条虫、裂頭条虫属、およびエキノコッカス種)、吸虫(例えば肥大吸虫、異形吸虫、メタゴニムス、肝吸虫、肝蛭、肺吸虫、および住血吸虫種)、回虫(例えば蟯虫、鞭虫、回虫、鉤虫、アメリカ鉤虫、ストロンギロイデス、旋毛虫、ブケレリア、ブルギア、ロアオンコセルカ、およびドラクンクルス種)、アメーバ(例えばネグレリアおよびアカントアメーバ種)、ならびに原虫(例えばプラスモディウム、トリパノソーマ、リーシュマニア、トキソプラズマ、エントアメーバ、ジアルジア、イソスポラ、クリプトスポリジウム、およびエンテロシトゾーン種)によって引き起こされる感染を含めた、寄生生物感染を治療するためにも使用されうる。
【0097】
薬物送達結合体が向けられる病原性細胞は、これらの細胞がリガンド受容体、例えばビタミンあるいはその類似体または誘導体の受容体を優先的に発現する場合、内在性病原体を持つ細胞、例えば、ウィルス、マイコプラズマ、寄生生物、または細菌に感染した細胞でもありうる。
【0098】
一実施形態において、薬物送達結合体は、リガンドが、受容体、輸送体、またはリガンドを特異的に結合して、病原性細胞で優先的に発現される他の表面提示タンパク質へ結合する時に、標的病原性細胞内へ内部移行されうる。そのような内部移行は例えば、受容体媒介エンドサイトーシスを通じて発生しうる。薬物送達結合体が放出型リンカーを含有する場合、リガンドおよびビンカ化合物は細胞内で解離して、ビンカはその細胞内標的に作用しうる。
【0099】
別の例証的な実施形態において、薬物送達結合体のリガンドは、ビンカ化合物を病原性細胞の表面に密接に関連付けて配置する病原性細胞に結合しうる。ビンカ化合物は次に、放出型リンカーの開裂によって放出されうる。例えばビンカ化合物は、放出型リンカーがジスルフィド基である場合、タンパク質ジスルフィドイソメラーゼによって放出されうる。ビンカ化合物は次に、受容体結合薬物送達結合体が結合されている病原性細胞によって取り込まれてもよいし、またはビンカ化合物はそれに近接した別の病原性細胞によって取り込まれてもよい。あるいはビンカ化合物は、放出型リンカーがジスルフィド基である場合、細胞内のタンパク質ジスルフィドイソメラーゼによって放出されうる。ビンカ化合物は、あるベータ離脱機構について上述したような加水分解機構、例えば酸触媒による加水分解によって、あるいはオキソニウムイオンまたはラクトニウムイオン産生機構を通じた隣接基補助開裂(anchimerically assisted cleavage)によっても放出されうる。放出型リンカーの選択は、ビンカ化合物が結合体から放出される機構を決定するであろう。このような選択は、薬物送達結合体が使用される条件によって事前に定義されうることが認識される。
【0100】
リンカーが放出型リンカーを含まない別の例証的な実施形態において、薬物送達結合体のリガンド部分は、ビンカ化合物に結合できる他の分子による攻撃で病原性細胞を標的とするために、病原性細胞の表面にビンカ化合物を配置する病原性細胞に結合しうる。あるいはこの実施形態において、薬物送達結合体は結合時に標的とした細胞内へ内部移行可能であり、リガンド部分およびビンカ化合物は細胞内で結合を維持することができ、ビンカ化合物はリガンド部分から解離せずにその効果を示す。
【0101】
さらに別の実施形態において、または上記の実施形態と組合せて、薬物送達結合体がビタミン受容体または別のリガンド受容体を結合する場合、結合体は、血清中に存在する溶解性ビタミン受容体または血清タンパク質、例えばアルブミンに結合可能であり、そのため未結合ビンカ化合物と比較して結合体の長期循環と、未結合ビンカ化合物と比較して病原性細胞集団に対して結合体の活性上昇を引き起こす。
【0102】
リガンド、例えばビタミンへの結合部位は、リガンドに特異的に結合できるリガンドの受容体を含んでいてもよく、この場合、受容体または他のタンパク質は病原性細胞の集団によって独自に発現、過剰に発現、または優先的に発現される。病原性細胞によって独自に発現、過剰に発現、または優先的に発現された表面提示タンパク質は通例、非病原性細胞には存在しないか、または低濃度でしか存在せず、病原性細胞の選択的排除の手段を与える受容体である。薬物送達結合体は、癌細胞または他の種類の病原性細胞の受容体への高親和性結合が可能でありうる。高親和性結合はリガンドに固有であってもよいし、は結合親和性は化学修飾リガンドの使用によって向上されてもよい。
【0103】
本明細書に記載する薬物送達結合体は、他の任意の既知の薬物と共に、追加の薬物が標的指向化されるかどうかにかかわらず、併用療法によって投与されてもよい。例証的な追加の薬剤としては、これに限定されるわけではないが、ペプチド、オリゴペプチド、レトロ−インベルソオリゴペプチド、タンパク質、少なくとも1個の非ペプチド結合がペプチド結合を置換するタンパク質類似体、アポタンパク、糖タンパク質、酵素、補酵素、酵素阻害薬、アミノ酸およびその誘導体、受容体および他の膜タンパク質、抗原およびそれに対する抗体、ハプテンおよびそれに対する抗体、ホルモン、脂質、リン脂質、リポソーム、毒素、抗生物質、鎮痛剤、気管支拡張薬、ベータ遮断薬、抗菌剤、降圧剤、(抗不整脈薬、強心配糖体、抗狭心症薬、血管拡張薬を含む)心血管作動薬、(刺激薬、向精神薬、抗躁薬、および抑制薬を含む)中枢神経系剤、抗ウィルス剤、抗ヒスタミン薬、化学治療剤を含む制癌剤、精神安定剤、抗うつ薬、H−2アンタゴニスト、抗痙攣薬、制嘔吐剤、プロスタグランジンおよびプロスタグランジン類似体、筋弛緩剤、抗炎症性物質、刺激薬、うっ血除去薬、鎮吐薬、利尿剤、鎮痙薬、抗喘息薬、抗パーキンソン病薬、去痰薬、鎮咳剤、粘液溶解薬、ならびにミネラルおよび栄養添加物、などが挙げられる。
【0104】
別の例証的な態様において、追加の薬物は、内在性免疫応答を刺激できる化合物より選択されうる。適切な化合物としては、これに限定されるわけではないが、サイトカインまたは免疫細胞成長因子、例えばインターロイキン1〜18、幹細胞因子、塩基性FGF、EGF、G−CSF、GM−CSF、FLK−2リガンド、HILDA、MIP−1α、TGF−α、TGF−β、M−CSF、IFN−α、IFN−β、IFN−γ、溶解性CD23、LIF、およびその組合せ、などが挙げられる。
【0105】
これらの免疫活性化因子の治療的に有効な組合せが使用されてもよい。一実施形態において、例えば連日多回用量処方における約0.1MIU/m2/用量/日〜約15MIU/m2/用量/日の範囲の量のIL−2の治療的有効量、および、例えば連日多回用量処方における約0.1MIU/m2/用量/日〜約7.5MIU/m2/用量/日の範囲の量のIFN−αの治療的有効量は、病原性細胞を持つ宿主動物において病原性細胞を排除、削減または中和するために、薬物送達結合体と共に使用されうる(MIU=100万国際単位;m2=平均的なヒトのおおよその体表面積)。別の実施形態において、IL−12およびIFN−αは、インターロイキンおよびインターフェロンについての上記の治療的有効量で使用することができ、さらに別の実施形態において、IL−15およびIFN−αは、インターロイキンおよびインターフェロンについての上記の治療的有効量で使用されうる。代わりの実施形態において、IL−2、IFN−αまたはIFN−γ、ならびにGM−CSFは組合せて、上記の治療的有効量で使用されうる。他のインターロイキンおよびインターフェロンならびにコロニー刺激因子の組み合わせを含む他の任意の有効な組合せも使用されうる。
【0106】
さらに、追加の薬物は、細胞毒性または細胞増殖抑制性であるか、腫瘍浸透性を向上させるか、腫瘍細胞増殖を阻害するか、アポトーシスを促進するか、標的細胞の抗アポトーシス活性を低下させるか、感染性因子によって引き起こされた疾患を治療するために使用されるか、病原性細胞に対する内在性免疫応答を向上させるか、または、任意の種類の病原性細胞によって引き起こされた疾患状態を治療するために有用であるような、当分野で既知の任意の薬物であってもよい。例示的で適切な追加の薬物としては、アデノコルチコイドおよびコルチコステロイド、アルキル化剤、抗アンドロゲン、抗エストロゲン、アンドロゲン、アクラマイシンおよびアクラマイシン誘導体、エストロゲン、抗代謝産物(例えばシトシンアラビノシド、プリン類似体、ピリミジン類似体、およびメトトレキセート)、ブスルファン、カルボプラチン、クロランブシル、シスプラチンおよび他のプラチナ化合物、タモキシフェン、タキソール、パクリタキセル、パクリタキセル誘導体、タキソテール(登録商標)、シクロホスファミド、ダウノマイシン、リゾキシン、T2毒素、植物アルカロイド、プレドニゾン、ヒドロキシ尿素、テニポシド、マイトマイシン、ディスコデルモライド、非ビンカ微小管阻害薬、エポチロン、チューブリシン(tubulysin)、シクロプロピルベンズ[e]インドロン、seco−シクロプロピルベンズ[e]インドロン、O−Ac−seco−シクロプロピルベンズ[e]インドロン、ブレオマイシンおよび他のいずれかの抗生物質、窒素マスタード、ニトロソ尿素、コルヒチン、コルヒチン誘導体、アロコルヒチン、チオコルヒチン、トリチルシステイン、ハリコンドリンB、ドラスタチン(例えばドラスタチン10)、アマニチン(例えばα−アマニチン)、カンプトセシン、イリノテカン、および他のそのカンプトセシン誘導体、ゲルダナマイシンおよびゲルダナマイシン誘導体、エストラムスチン、ノコダゾール、MAP4、コルセミド、ビンデシン、ビンブラスチン、ビンクリスチン、カタランチン、ビンドリン、ロイロシン、ビノレルビン、イミドカルブ、シブトラミン、トルトラズリル、ビンブラスチン酸、メイタンシンならびにその類似体および誘導体、ゲムシタビン、炎症性物質および炎症誘発物質、ペプチドおよびペプチドミメティックシグナル伝達阻害薬、および他の任意の当分野で認識される薬物または毒素、などが挙げられる。併用療法で使用されうる他の薬物としては、ペニシリン、セファロスポリン、バンコマイシン、エリスロマイシン、クリンダマイシン、リファンピン、クロラムフェニコール、アミノグリコシド、抗生物質、ゲンタマイシン、アンホテリシンB、アシクロビル、トリフルリジン、ガンシクロビル、ジドブジン、アマンタジン、リバビリン、および他の任意の当分野で認識される抗菌化合物、などが挙げられる。上記の追加の薬物の任意の類似体または誘導体も併用療法で使用されうる。
【0107】
別の例証的な実施形態において、医薬組成物が提供される。本医薬組成物は、1回以上の用量で投与されるときに宿主動物において病原性細胞の集団を排除するのに有効な薬物送達結合体の量を含む。薬物送達結合体は好ましくは、宿主動物に非経口的に、例えば皮内に、皮下に、筋肉内に、腹腔内に、静脈内に、または髄腔内に投与される。あるいは薬物送達結合体は、宿主動物に他の医療的に有用なプロセスによって、例えば経口で投与することができ、そして任意の有効な用量および適切な治療剤形、例えば持続放出剤形が使用されうる。経口剤形に有用な例示的な賦形剤としては、これに限定されるわけではないが、コーンスターチ、ゼラチン、ラクトース、ステアリル酸マグネシウム、重炭酸ナトリウム、セルロース誘導体、およびナトリウムデンプングリコラート、などが挙げられる。
【0108】
非経口剤形の例としては、等張性生理的食塩水、5%グルコース、または他の周知の製薬的に許容される液体、例えば液体アルコール、グリコール、エステル、およびアミド中の活性剤の水性溶液、などが挙げられる。本発明による非経口剤形は、薬物送達結合体の用量を含む還元可能な凍結乾燥物の形でありうる。この実施形態の一態様において、例えばその開示が参照により本明細書に組み入れられている、米国特許第4,713,249号;同第5,266,333号;および同第5,417,982号に記載されている生分解性炭水化物マトリクスなどの、当分野で既知の多数の持続放出剤形のいずれも投与可能であり、あるいは低速ポンプ(例えば浸透圧ポンプ)が使用されうる。
【0109】
併用療法における追加の薬物は、薬物送達結合体の投与の前に、後に、または同時に宿主動物に投与可能であり、追加の薬物は、薬物送達結合体を含有する同じ組成物の一部として、または薬物送達結合体とは異なる組成物の一部として投与されうる。追加の薬物の有効な用量でのこのような任意の併用療法が使用されうる。
【0110】
別の例証的な態様において、1つを超える種類の薬物送達結合体が使用されうる。例えば、宿主動物は、異なるリガンドを持つ結合体、例えば組合された葉酸塩−ビンカおよびビタミンB12−ビンカ結合体などを用いた同時投薬プロトコルで治療されうる。別の例証的な実施形態において、宿主動物は、1個を超えるリガンド、例えば複数の葉酸塩または複数のビタミンB12分子を1つの結合体中に含む結合体を用いて、または葉酸塩およびビタミンB12リガンドの両方に結合されたビンカ化合物などの、同じ結合体中のリガンドの組合せを用いて治療されうる。さらに別の薬物送達結合体中に異なる種類のビンカ化合物を含む薬物送達結合体が使用されうる。
【0111】
薬物送達結合体の単位連日処方量は、宿主の状態、治療される疾患状態、結合体の分子量、その投与経路および組織分布、ならびに放射線療法または併用療法の追加の薬物などの他の治療処置の同時使用の可能性に応じて著しく変化しうる。宿主動物へ投与される有効量は、体表面積、体重、および患者の状態の医師による評価に基づく。有効用量は、例えば約1ng/kg〜約1mg/kg、約1μg/kg〜約500μg/kg、および約1μg/kg〜約100μg/kgの範囲で変化しうる。
【0112】
薬物送達結合体を投与するための任意の有効な投薬計画が使用されうる。例えば、薬物送達結合体は、1回用量として投与されうるか、または分割されて、連日多回用量処方として投与されうる。さらに時差投薬計画、例えば週に1〜3日を連日治療の代用として使用することができ、本発明を定義する目的で、このような間欠的または時差連日処方は、毎日の治療と同等と見なされ、企図される。例証的な一実施形態において、宿主動物は、病原性細胞の集団を排除するために薬物送達結合体の複数回注射によって治療される。一実施形態において、宿主は、薬物送達結合体を複数回(好ましくは約2〜約50回まで)、例えば12〜72時間の間隔で、または48〜72時間の間隔で注射される。薬物送達結合体の追加の注射は宿主動物に、初回注射後の数日または数ヶ月の間隔で投与でき、追加の注射は病原性細胞によって引き起こされた疾患状態の再発を防止しうる。
【0113】
例証的な一態様において、薬物送達結合体で使用されうるビタミン、あるいはその類似体または誘導体は、活性化マクロファージ上で特異的に発現される受容体、例えば葉酸塩あるいはその類似体または誘導体を結合する葉酸塩受容体に結合するものを含む。葉酸塩結合体は例えば、宿主の疾患状態を引き起こす活性化マクロファージの活性を死滅または抑制するために使用されうる。そのようなマクロファージを標的とする結合体は、活性化マクロファージ媒介疾患状態に罹患している宿主動物に投与されるときに、活性化マクロファージを死滅させる、またはマクロファージ機能を抑制するために、結合されたビンカ化合物を活性化マクロファージの集団に集中させ結合させるように作用する。活性化マクロファージ集団の排除、低減、または非活性化は、治療される疾患状態の活性化マクロファージ媒介病原特徴を停止または低減するように作用する。活性化マクロファージによって媒介されることが既知の疾患の例としては、関節リウマチ、潰瘍性大腸炎、クローン病、乾癬、骨髄炎、多発性硬化症、アテローム硬化症、肺線維症、サルコイドージス、全身性硬化症、移植臓器拒絶(GVHD)、および慢性炎症、などが挙げられる。薬物送達結合体の投与は通例、疾患状態の症状が低減または排除されるまで継続される。
【0114】
活性化マクロファージを死滅させる、または活性化マクロファージの機能を抑制するために投与される薬物送達結合体は、宿主動物に非経口的に、例えば皮内に、皮下に、筋肉内に、腹腔内に、または静脈内に、製薬的に許容される担体と共に投与されうる。あるいは薬物送達結合体は、宿主動物に他の医療的に有用な手順で投与でき、有効用量は標準剤形または持続放出剤形で投与されうる。治療方法は単独で、または活性化マクロファージによって媒介される疾患状態の治療のために認められた他の治療方法と組合せて使用されうる。
【0115】
次の例証的な例示された実施形態は、限定的なものとして意図されず、また解釈されるべきではない。例えば本明細書に示す各化合物において、リンカーを形成するのに使用されるアミノ酸の立体化学は、場合により、天然L配置または非天然D配置から選択されうる。各実施例は、示されたようにNMR、MS、および/またはUV分光法、および/またはHPLCによって特徴付けられており、特徴的なシグナルは必要に応じて記載される。
【実施例】
【0116】
===方法実施例===
〔方法実施例1 マウスにおける腫瘍成長の阻害〕
本明細書に記載した化合物の抗腫瘍活性は、腫瘍担持動物へ静脈内(i.v.)投与したときに、皮下M109腫瘍を担持するBalb/cマウスにおいて評価した。右腋窩の皮下組織への1x106個のM109細胞の腫瘍接種(t0の時点で平均腫瘍体積=60mm3)の約11日後に、マウス(5/グループ)に、週3回(TIW)、3週間にわたって、1500nmol/kgの薬物送達結合体、または等用量体積のPBS(対照)をi.v.注射した。腫瘍成長は、各処置グループで2日または3日間隔でカリパスを使用して測定した。腫瘍体積は、式V=axb2/2を使用して計算し、式中、「a」は腫瘍の長さであり、「b」は幅である(ミリメートルで表す)。
【0117】
〔方法実施例2 マウスにおける腫瘍成長の阻害〕
本明細書に記載した化合物の抗腫瘍活性は、腫瘍担持動物へ静脈内(i.v.)投与したときに、皮下KB腫瘍を担持するnu/nuマウスにおいて評価した。右腋窩の皮下組織への1x106個のKB細胞の腫瘍接種(t0における平均腫瘍体積=50〜100mm3)の約8日後に、マウス(5/グループ)に、週3回(TIW)、3週間にわたって、5μmol/kgの薬物送達結合体、または等投薬体積のPBS(対照)をi.v.注射した。腫瘍成長は、各処置グループで2日または3日間隔でカリパスを使用して測定した。腫瘍体積は、式V=axb2/2を使用して計算し、式中、「a」は腫瘍の長さであり、「b」は幅である(ミリメートルで表す)。
【0118】
〔方法実施例3 細胞DNA合成の阻害〕
本明細書に記載する化合物は、薬物が葉酸塩受容体陽性KB細胞の成長を阻害する能力を予測するin vitro細胞毒性アッセイを使用して評価した。化合物は、本明細書に記載するプロトコルに従って調製したような、各化学療法薬に結合された葉酸塩を含んでいた。KB細胞を7時間まで37℃にて、少なくとも100倍過剰の葉酸の非存在下または存在下で、指示された濃度の葉酸−薬物結合体に暴露した。細胞を次に新しい培地で1回すすぎ、新しい培地で72時間にわたって37℃でインキュベートした。細胞生存能力は、3H−チミジン取り込みアッセイを使用して評価した。
【0119】
本明細書の図に示すように、用量依存性細胞毒性は測定可能であり、大半の場合でIC50値(新たに合成されたDNAへの3H−チミジン取り込みを50%低下させるのに必要な薬物結合体の濃度)は低いナノモル範囲であった。さらにこれらの結合体の細胞毒性は、過剰な遊離葉酸の存在下で低減され、観察された細胞死滅は葉酸塩受容体への結合によって媒介されたことを示す。
【0120】
〔方法実施例4 相対親和性アッセイ〕
葉酸塩に対する葉酸塩受容体(FR)の親和性は、先に記載された方法(Westerhof, G.R., J.H. Schornagel, et al. (1995) Mol. Pharm. 48:459-471)にわずかな変更を加えたものに従って決定した。簡潔には、FR陽性KB細胞を24ウェル細胞培養プレートに密集して播種して、18時間にわたってプラスチックに付着させた。使用済みインキュベーション培地は指定されたウェルにて、試験品または葉酸の上昇する濃度の非存在下または存在下で、100nM 3H−葉酸を添加した、葉酸塩を含まないRPMI培地(FFRPMI)と交換した。細胞は37℃にて60分間インキュベートして、次にPBS、pH7.4で3回すすいだ。PBS、pH7.4中の1% SDS 500マイクロリットルをウェルごとに添加した。次に細胞溶解物を収集して、シンチレーションカクテル5mLを含有する各バイアルに添加し、次に放射能をカウントした。負の対照管は、FFRPMI中に3H−葉酸のみを含有していた(競合者なし)。正の対照管は最終濃度1mMの葉酸を含有し、これらのサンプルで測定されたCMP(標識の非特異性結合を示す)はすべてのサンプルから引き算された。特に相対親和性は、KB細胞のFRに結合する3H−葉酸の50%を置換するのに必要な化合物のモル比の逆数として定義され、FRに対する葉酸の相対親和性は1に設定された。
【0121】
〔方法実施例5 4T−1腫瘍体積アッセイ〕
6〜7週齢マウス(メスBalb/c株)をインディアナ州インディアナポリスのHarlan, Inc.より入手した。マウスをHarlanの葉酸を含まない固形飼料で、本実験の開始前および本実験中の合計3週間にわたって維持した。葉酸塩受容体−陰性4T−1腫瘍細胞(動物あたり1x106細胞)を右腋窩の皮下組織に接種した。4T−1腫瘍平均容積が〜100mm3である、腫瘍接種の約5日後に、マウス(5/グループ)に、週3回(TIW)、3週間にわたって、3μmol/kgの薬物送達結合体、または等用量体積のPBS(対照)をi.v.注射した。腫瘍成長は、各処置グループで2日または3日間隔でカリパスを使用して測定した。腫瘍体積は、式V=axb2/2を使用して計算し、式中、「a」は腫瘍の長さであり、「b」は幅である(ミリメートルで表す)。
【0122】
〔方法実施例6 体重測定〕
マウスの体重変化パーセントは、関連する腫瘍体積アッセイに記載したサンプルのグラフに示すように、腫瘍接種後(PTI)の指示された日にマウス(5マウス/グループ)において測定した。
【0123】
〔方法実施例7 葉酸塩−ペプチドの一般的な調製〕
ペプチドを含む本明細書に記載するリンカーは、酸感受性Fmoc−AA−Wang樹脂におけるFmoc方法などの標準方法を使用したポリマー支持連続手法によって調製した。例証的には、葉酸塩含有ペプチジル断片Pte−Glu−(AA)n−NH(CHR2)CO2H(3)は、Wang樹脂支持アミノ酸およびFmoc保護アミノ酸合成からスキーム1に示す方法によって調製する。
<スキーム1>

(a)20%ピペリジン/DMF;(b)Fmoc−AA−OH、PyBop、DIPEA、DMF;(c)Fmoc−Glu−O−t−BuまたはFmoc−Glu(γ−O−t−Bu)−OH、PyBop、、DIPEA、DMF;(d)N10(TFA)−Pte−OH;PyBop、DIPEA、DMSO;(e)TFAA、(CH2SH)2、i−Pr3SiH;(f)NH4OH、pH9〜10。
【0124】
本明細書に記載するプロセスのこの例示的な実施形態において、R1は、Fmocであり、R2は、所望の適切に保護されたアミノ酸側鎖であり、Wangは、2−クロロトリチル樹脂であり、DIPEAは、ジイソプロピルエチルアミンである。標準カップリング手順、例えばPyBop、および本明細書に記載するまたは当分野で既知である他の手順が使用され、そこではカップリング剤が例証的に、効率的なカップリングを確実にするための活性化剤として利用される。Fmoc保護基は、標準条件下での各カップリング工程の後に、例えばピペリジン、テトラブチルアンモニウムフルオリド(TBAF)などによる処置時に除去される。適切に保護されたアミノ酸構築ブロック、例えばFmoc−Glu−OtBu、N10−TFA−Pte−OHなどが、スキーム1に記載され、Fmoc−AA−OHによる工程(b)で表されるように使用される。したがってAAは、適切に保護される任意のアミノ酸出発物質を指す。本明細書で使用するようにアミノ酸という用語は、1個以上の炭素によって隔離されたアミンおよびカルボン酸官能基の両方を有するいずれの試薬も指すことが意図され、天然型アルファおよびベータアミノ酸はもちろんのこと、これらのアミノ酸のアミノ酸誘導体および類似体を含むことが理解されるであろう。特に保護される側鎖を有するアミノ酸、例えば保護セリン、トレオニン、システイン、アスパルテートなども、本明細書に記載する葉酸塩−ペプチド合成で使用されうる。さらなるガンマ、デルタ、またはより長い相同性アミノ酸も、本明細書に記載の葉酸塩−ペプチド合成で出発物質として含まれうる。さらに相同性側鎖、または交互の分岐構造を有するアミノ酸類似体、例えばノルロイシン、イソバリン、β−メチルトレオニン、β−メチルシステイン、β,β−ジメチルシステインなども、本明細書に記載する葉酸塩−ペプチド合成で出発物質として含まれうる。
【0125】
式Fmoc−AA−OHのFmoc−保護アミノ酸(AA)を含むカップリングシーケンス(工程(a)および(b))は、固体支持ペプチド(2)を調製するために「n」回実施され、ここでnは整数であり、0〜約100に等しくてもよい。最後のカップリング工程の後の、残存するFmoc基が除去され(工程(a))、ペプチドが逐次的にグルタメート誘導体にカップリングされ(工程(c))、脱保護されて、TFA−保護プテロイン酸にカップリングされる(工程(d))。次にペプチドは、トリフルオロ酢酸、エタンジチオール、およびトリイソプロピルシランによる処理時にポリマー支持体から開裂される(工程(e))。これらの反応条件は、適切に保護されたアミノ酸側鎖の一部を形成しうるt−Bu、t−Boc、およびTrt保護基の同時除去を引き起こす。TFA保護基は、塩基による処理(工程(f))時に除去されて、葉酸塩含有ペプチジル断片(3)を与える。
【0126】
===化合物実施例===
〔実施例1〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合4−メトキシトリチル(MTT)保護Cys−NH2を次のシーケンスに従って反応させた。1)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;3)a.Fmoc−Arg(Pbf)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−Glu−OtBu、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびPbf保護基はTFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去され、TFA保護基はpH=9.3のNH4OH水溶液によって除去した。選択された1H NMR(D2O)δ(ppm)8.68(s,1H,FA H−7),7.57(d,2H,J=8.4Hz,FA H−12&16),6.67(d,2H,J=9Hz,FA H−13&15),4.40−4.75(m,5H),4.35(m,2H),4.16(m,1H),3.02(m,2H),2.55−2.95(m,8H),2.42(m,2H),2.00−2.30(m,2H),1.55−1.90(m,2H),1.48(m,2H);MS(ESI,m+H+)1046。
【0127】
〔実施例2〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合4−メトキシトリチル(MTT)保護Cys−NH2を次のシーケンスに従って反応させた。1)a.Fmoc−β−アミノアラニン(NH−MTT)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20% ピペリジン/DMF;3)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−Glu−OtBu、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびTFA保護基は、a.2%ヒドラジン/DMF;b.TFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去した。次の表に示す試薬を調製で使用した:
〔表3〕

【0128】
カップリング工程は次のように実施した:ペプチド合成容器に樹脂を添加し、アミノ酸溶液、DIPEA、およびPyBOPを添加する。アルゴンを1時間通気して、DMFおよびIPAで3回洗浄する。各アミノ酸カップリング前に、Fmoc脱保護のためにDMF中の20%ピペリジンを3回(10分間)使用する。継続して6回のカップリング工程をすべて完了させる。最後に樹脂をDMF中の2%ヒドラジンによって3回(5分間)洗浄して、プテロイン酸のTFA保護基を開裂させる。
【0129】
次の試薬、92.5%(50ml)TFA、2.5%(1.34ml)H2O、2.5%(1.34ml)トリイソプロピルシラン、2.5%(1.34ml)エタンジチオール を使用して樹脂からペプチド類似体を開裂させ、開裂工程を次のように実施した:開裂試薬25mlを添加して、1.5時間通気し、排出させて、残りの試薬で3回洗浄した。約5mLまで蒸発させて、エチルエーテル中に沈殿させる。遠心分離にかけて、乾燥させる。精製は次のように実施した:カラム−Waters NovaPak C18 300xl9mm;緩衝液A=10mM酢酸アンモニウム、pH5;B=CAN;1%B〜20%B、15 ml/分にて40分間、350mg(64%)まで;HPLC−RT 10.307分、100%純度、1H HMRスペクトルは割り当てられた構造と一致した、そしてMS(ES−)は:1624.8、1463.2、1462.3、977.1、976.2、975.1、974.1、486.8、477.8。
【0130】
〔実施例3〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合4−メトキシトリチル(MTT)保護Cys−NH2を次のシーケンスに従って反応させた:1)a.Fmoc−β−アミノアラニン(NH−IvDde)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20% ピペリジン/DMF;3)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−Glu−OtBu、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびTFA保護基は、a.2%ヒドラジン/DMF;b.TFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去した。
次の表に示す試薬を調製で使用した:
〔表4〕

【0131】
カップリング工程は次のように実施した:ペプチド合成容器に樹脂を添加し、DMFによるアミノ酸溶液、DIPEA、およびPyBOPを添加する。アルゴンを1時間通気して、DMFおよびIPA 10mLで3回洗浄する。各アミノ酸カップリング前に、Fmoc脱保護のためにDMF中の20%ピペリジンを3回x10mL(10分間)使用する。継続して6回のカップリング工程を完了させる。終わりに樹脂をDMF中の2%ヒドラジンによって3回x10mL(5分間)洗浄して、プテロイン酸のTFA保護基およびβ−アミノアラニンのIvDde保護基を開裂させる。最後に、β−アミノアラニンの遊離アミンをFmoc−チオプロピオン酸とDMF中で、DIPEAおよびPyBopを使用してカップリングさせる。アルゴンを1時間通気して、DMFおよびIPA3回x10mLで洗浄する。樹脂をアルゴン下で30分間乾燥させる。
【0132】
次の試薬、92.5%(50ml)TFA、2.5%(1.34ml)H2O、2.5%(1.34ml)トリイソプロピルシラン、2.5%(1.34ml)エタンジチオールを使用して樹脂からペプチド類似体を開裂させ、開裂工程を次のように実施した:開裂試薬25mlを添加して、1.5時間通気し、排出させて、残りの試薬で3回洗浄した。約5mLまで蒸発させて、エチルエーテル中に沈殿させる。遠心分離にかけて、乾燥させる。精製は次のように実施した:カラム−Waters NovaPak C18 300xl9mm;緩衝液A=10mM酢酸アンモニウム、pH5;B=CAN;1%B〜20%B、15ml/分にて40分間、450mg(65%)まで;1H HMRスペクトルは割り当てられた構造と一致。
【0133】
〔実施例4〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合MTT保護Cys−NH2を次のシーケンスに従って反応させた:1)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;3)a.Fmoc−Arg(Pbf)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−Glu(γ−OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびPbf保護基はTFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去され、TFA保護基はpH=9.3のNH4OH水溶液によって除去した。1H NMRスペクトルは、割り当てられた構造と一致していた。
【0134】
〔実施例5〕

方法実施例7の一般手順(スキーム1)により、Wang樹脂結合MTT保護D−Cys−NH2を次のシーケンスに従って反応させた:1)a.Fmoc−D−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;2)a.Fmoc−D−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;3)a.Fmoc−D−Arg(Pbf)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;4)a.Fmoc−D−Asp(OtBu)−OH、PyBOP、DIPEA;b.20%ピペリジン/DMF;5)a.Fmoc−D−Glu−OtBu、PyBOP、DIPEA;b.20%ピペリジン/DMF;6)N10−TFA−プテロイン酸、PyBOP、DIPEA。MTT、tBu、およびPbf保護基はTFA/H2O/TIPS/EDT(92.5:2.5:2.5:2.5)によって除去され、TFA保護基はpH=9.3のNH4OH水溶液によって除去した。1H NMRスペクトルは、割り当てられた構造と一致していた。
【0135】
〔実施例6〕

2−[(ベンゾトリアゾール−1−イル−(オキシカルボニルオキシ)−エチルジスルファニル]−ピリジンHCl(601mg)およびDIPEA 378μLを、0℃の、デスアセチルビンブラスチンヒドラジド(668mg)の5mlDCM中溶液に逐次的に添加した。反応物を室温まで加温して、3時間撹拌した。TLC(DCM中15% MeOH)は、完全な変換を示した。混合物をシリカゲルクロマトグラフィー(1:9 MeOH/DCM)によって精製した。合せた画分を蒸発させ、DCMに再溶解させて、10% Na2CO3、塩水、乾燥(MgSO4)によって洗浄して、550mg(80%)まで蒸発させた;HPLC−RT 12.651分、91%純度、1H NMRスペクトルは割り当てられた構造と一致した。MS(ESI+):984.3,983.3,982.4,492.4,491.9,141.8。この手順のさらなる詳細は、参照によりその全体が本明細書に組み入れられている、米国特許出願公開第2005/0002942A1号に記載されている。
【0136】
〔実施例7〕
マイトマイシンC−エチルジスルフィドプロピオン酸を次のスキームに従って調製した。

(a)ジイソプロピルエチルアミン(DIPEA)、MeOH。
アミノエチルジスルフィドプロピオン酸(81mg、0.372mmol)の2mLメタノール(MeOH)中溶液に、DIPEA(0.13mL、0.746mmol)を添加した。この溶液にMeOH(3.0mL)中のマイトマイシン−A(100mg、0.286mmol)をゆっくり添加した。得られた溶液を3時間撹拌した。TLC分析(CHCl3中20% MeOH)は、反応が完了したことを示した。溶媒を減圧下で除去して、シリカカラムを使用して残渣を精製した。勾配溶離(CHC13/0.5% TEA中の10%〜20% MeOHは、生成物の純粋な画分(110mg、77%)を与えた。選択された1H NMRシグナル(CDCl3)δ(ppm)3.50(d,1H),3.56(dd,1H),3.90(t,2H),4.15(d,1H),4.25(t,1H),4.68(dd,1H)。
【0137】
〔実施例8〕

実施例7のプロセスに従って調製。
【0138】
〔実施例9〕

ポリプロピレン遠心分離ボトル内で、実施例2(82mg、0.084mmol)を水5mLに溶解させて、アルゴンを10分間通気した。別のフラスコで0.1N NaHCO3溶液にアルゴンを10分間通気した。リンカー溶液のpHは、0.1N NaHCO3溶液を使用して約6.9に調整した。テトラヒドロフラン(THF)5mL中のビンブラスチンヒドラジド誘導体(実施例6、91mg、0.092mM)を上の溶液にゆっくり添加した。得られた透明溶液をアルゴン下で15分間〜1時間撹拌した。反応の進行は、分析HPLC(10mM酢酸アンモニウム、pH=7.0およびアセトニトリル)によって監視した。THFを蒸発させて、水溶液を濾過して、分取HPLCカラム(XTerra Column,19x300mM)に注入した。1mMリン酸ナトリウムpH=7.0およびアセトニトリルによる溶出は、生成物を含有する純粋な画分を生じ、生成物は48時間の凍結乾燥後に単離した(78mg、50%);C83H103N19O26S2;正確な質量;1845.68;MW:1846.95;HPLC−RT 15.113分、100%純度、1H HMRスペクトルは割り当てられた構造と一致、そしてMS(ES−);1846.6,1845.5,933.3,924.2,923.3,922.5,615.6,614.7,525.0。
【0139】
図21Aおよび図21Bは、葉酸塩対実施例9の相対結合親和性、および3H−チミジン取り込みに対する実施例9の効果、結合体のIC50(58nM)と、葉酸塩が葉酸塩受容体への結合で結合体と競合することを示し、結合体の結合の特異性を証明している。アッセイは方法実施例4および3にそれぞれ従って実施した。
【0140】
図1Bは、過剰な葉酸を含む(〇)および含まない(●)場合の、KB細胞への3H−チミジン取り込みに対する実施例9の活性を示す;実施例9のIC50は約58nMである。
【0141】
〔実施例10〕

ポリプロピレン遠心分離ボトル内で、実施例3(56mg)を水7.5mLに溶解させて、アルゴンを10分間通気した。別のフラスコで0.1N NaHCO3溶液にアルゴンを10分間通気した。実施例3溶液のpHは、0.1N NaHCO3溶液を使用して6.9に調整した。テトラヒドロフラン(THF)7.5mL中の実施例6(44mg)を実施例3溶液にゆっくり添加した。得られた透明溶液をアルゴン下で15分間〜1時間撹拌した。反応の進行は、分析HPLC(10mM酢酸アンモニウム、pH=7.0およびアセトニトリル)によって監視した。THFを蒸発させて、水溶液を濾過して、分取HPLCによって精製した。pH=7.0の1mMリン酸ナトリウムおよびアセトニトリルによる溶離は純粋な画分を生じ、画分をプールして、周囲温度にて蒸発させて、得られた水溶液は0.1N HClを使用してpH4.0に調整した。実施例10は、48時間の凍結乾燥後に単離した(61mg、64%)。1H HMRスペクトルおよびLCMSデータは、割り当てられた構造と一致した。
【0142】
〔実施例11〕

方法A.実施例11は次のプロセスに従って調製した:

(a)は、DCC、DIPEA、THFである;そして(b)は、pH8.5の水/THFである。
マイトマイシンC−エチルジスルフィドプロピオン酸(34.4mg,0.069mmol)をアルゴン下で乾燥THF(1mL)に溶解した。N−ヒドロキシスクシンアミド(7.9mg、0.069mmol)、続けてジシクロヘキシルカルボジイミド(14.2mg、0.069mmol)を添加した。ジイソプロピルエチルアミン(0.024mL、0.138mmol)を添加して、得られた混合物を3時間撹拌した。ポリプロピレン遠心分離管内で、葉酸ビンブラスチン(実施例9、26mg、0.014mmol)を水3mLに溶解させた。0.1N NaHCO3を使用して、溶液のpHを8.5にゆっくりと調整した。本明細書に記載したように調製した活性化マイトマイシンC誘導体を3mL THF溶液として葉酸塩溶液に添加した。得られた溶液をアルゴン下で15分間〜1時間撹拌して、そこで反応の進行を分析HPLC(10mM酢酸アンモニウムおよびアセトニトリル、pH=7.0)によって監視した。THFを減圧下で除去して、水溶液を濾過して、分取HPLCカラム(X−terra Column,19x300mm)へ注入した。1mMリン酸ナトリウム(pH=7.0)およびアセトニトリルによる溶離は純粋な画分を生じ、これを蒸発させて、48時間にわたって12mg(50%、回収した出発物質に基づいて)まで凍結乾燥させた。1H NMRおよび、マススペクトルデータは、図9および10にそれぞれ示したように割り当てられた構造を裏付けた。C103H127N23O32S4;正確な質量2325.79;MW 2327.51。HPLC−RT 20.054分、99%純度、1H HMRスペクトルは割り当てられた構造と一致、そしてMS(ES+);1552.5,116.0,1165.3,1164.3,1148.4,744.9,746.4,745.6.
【0143】
方法B.:無水DMF(4.5mL)を、アルゴン下、室温で実施例10(103mg、48.7μmol)および実施例8(NO2−PySSCH2CH2−MMC、33.4mg、1.25当量)の混合物に注入した。得られた溶液にDIPEA(84.9μL、10当量)およびDBU(72.9μL、10当量)を同時に注入した。反応混合物を室温にてアルゴン下で20分間撹拌して、次に撹拌中のジエチルエーテル(50mL)中に移した。得られた懸濁物を遠心分離にかけ、沈殿をジエチルエーテル(15mLx2)で洗浄し、次にリン酸緩衝液(9mL、1.25mM、pH6.8)に溶解させて、分取HPLCにかけた(カラム:Waters XTerra RP18、7μm、19x300mm;移動層:A=1.25mMリン酸緩衝液、pH6.8、B=アセトニトリル;方法:25分間にわたって25mL/分で10%B〜40%B)。11.72〜13.88分の画分を収集して凍結乾燥させて、リン酸塩99.2mgおよび6.6mgを含有する物質105.8mgを得た。
【0144】
方法C.実施例11を次のプロセスに従って、収率34%で調製した:

(a)NHS、DCC−樹脂、DIPEA、THF;(b)実施例7、DIPEA、DMSO。
【0145】
図2は、葉酸(●、1.0)対実施例11(■、0.21)の相対結合親和性を示す。図2のデータは、結合体が葉酸塩受容体に対して高い相対結合を有することを示す。アッセイは方法実施例4に従って実施した。
【0146】
図1Bおよび3はそれぞれ、実施例9(単一の薬物を有する)および11(1対の薬物のを有する)の、3H−チミジン取り込みに対する効果、実施例9(58nM)および実施例11(5nM)の結合体のIC50を示す。図1Bおよび3のデータも、葉酸が葉酸塩受容体への結合で結合体と競合することを示し、結合体の結合特異性を証明している。アッセイは方法実施例3に従って実施した。加えて、2つの薬物を有する実施例11は、単一の薬物のみ有する実施例9よりも、葉酸塩受容体にて10倍の効力を示した。
【0147】
図4は、3つの異なる腫瘍細胞株(KB、4T−1cl2、およびID8−cl15)に対する実施例11(a)のin vitro細胞毒性活性を示す。加えて、図4は、実施例11の細胞毒性活性が過剰の葉酸の存在下で低下することを示し(b)、実施例11が葉酸塩受容体にて作用することを示している。
【0148】
図5Aおよび5Bは、Balb/cマウスにおけるM109肺癌腫瘍に対して、そしてBalb/cマウスの体重(Balb/cマウスはM109腫瘍体積アッセイに使用した)に対する、2つの異なる用量(1μmol/kgおよび2μmol/kg)での実施例11の活性を示す。アッセイは方法実施例1および6にそれぞれ従って実施した。実施例11は両方の用量にて、固形腫瘍の成長を阻害するが、マウスの体重にほとんど効果を持たなかった。加えて、より高い用量(2μmol/kg)は、投薬を第20日に終了した後にすら、腫瘍成長の強力な阻害を示した。垂直線は、最終投薬日(第20日)に相当する。5匹の動物に試験を行い、2μmol/kgの高い用量において、5匹の動物すべてが完全寛解を示した。
【0149】
図6は、対照(a)と対比した、40μmol/kg EC20(レニウム錯体)を含む(b)および(c)含まない場合の、FR陽性KB腫瘍に対する2週間にわたる1μmol/kg TIWでの実施例11の活性を示す。垂直点線は最終投薬日を示す。図は、実施例11が固形腫瘍の成長を阻害することと、その阻害効果はEC20レニウム錯体によって防止(競合)されることとを示す。加えて数値は、実施例11を用いた処置が、試験動物の体重に対照から著しく異なって影響を及ぼさないことを示ず。EC20(レニウム錯体)は、レニウムにキレート化された次の式の化合物であり:

レニウムにキレート化される。EC20の調製は、米国特許出願公開第2004/0033195A1号に記載されており、その合成手順の説明は参照により本明細書に組み入れられている。アッセイは方法実施例2に従って実施した。EC20は、葉酸塩受容体において実施例11の競合相手として作用し、結果は、実施例11の効果の特異性を示している。
【0150】
図8は、ヌードマウスにおける40μmol/kg EC20(レニウム錯体)を添加した(b)および(c)添加しない場合の、葉酸受容体陽性s.c.植え込みヒト異種移植KB腫瘍に対する1μmol/kg TIWでの実施例11の活性を示す。図8のデータはは、実施例11が固形腫瘍の成長を阻害することと、その阻害効果はEC20レニウム錯体(b)対(c)によって防止(競合)されることとを示す。加えて図8のデータは、実施例11による処置が対照(a)と比較して、試験されたヌードマウス動物モデルの体重に著しく影響しないことを示す。
【0151】
図10は、0.5μmol/kg TIW(b)、1μmol/kg TIW(c)、および2μmol/kg TIW(d)における非結合体ベース薬物、マイトマイシンCおよびデスアセチルビンブラスチンモノヒドラジドの混合物と対比した、未処置対照(a)と対比した、ヌードマウスにおける葉酸受容体陽性ヒト腫瘍に対する2μmol/kg TIW(e)における実施例11の活性を示す。図10のデータは、実施例11が固形腫瘍の成長を阻害し、5匹の試験動物中5匹において完全寛解を与えることを示す。対照的に、0.5μmol/kg TIW(b)における、または1μmol/kg TIW(c)におけるベース薬物の混合物による処置は、5匹の試験動物のいずれにおいても完全寛解を示さなかった。2μmol/kg TIW(d)におけるベース薬物の混合物の高い用量は、試験動物体重に対するベース薬物および実施例11の効果を示す図11に示すように、観察された毒性のために第20日以前に中止された。
【0152】
図11は、対照(a)と比べて、実施例11(e)が処置中に試験動物の体重に著しく影響を及ぼさなかったことを示す。実施例11と対照的に、図11のデータは、(0.5μmol/kg TIW(b)および1μmol/kg TIW(c))における非結合体ベース薬物、マイトマイシンC、およびデスアセチルビンブラスチンモノヒドラジドの混合物のより低い用量を用いた長期処置が、対照(a)と比較して著しい試験動物の体重減少を引き起こしたことを示す。加えて、非結合体ベース薬物の混合物の高用量(2μmol/kg TIW(d))が最大の体重減少を引き起こし、その試験の中止をもたらした。
【0153】
本明細書に記載する化合物は、大型または確立された腫瘍の治療に有用でありうる。例証的には実施例11は、大型腫瘍に有効である。図12は、大型(250mm3、500mm3、および750mm3)s.c.KB腫瘍に対する、2μmol/kg TIW、2週間での実施例11の活性を示す。実施例11による処置は、腫瘍体積に相当する垂直矢印によって示されるように、腫瘍が3つの標的体積の1つに達したときに開始した。図12のデータは、実施例11が大型腫瘍の成長を阻害し、試験動物に完全寛解を与えることを示す。
【0154】
図13は、対照(a);それぞれ単一薬物のみの結合体、マイトマイシンC結合体(b)およびデスアセチルビンブラスチンモノヒドラジド結合体(c)、またはこれらの単一薬物結合体の混合物(d)と対比した、確立されたs.c.KB腫瘍に対する2週間の処置での1μmol/kg TIWにおける実施例11(e)の活性を示す。各薬物結合体は、2週間の処置にわたって1μmol/kg TIWの同じレベルで投薬された。図は、実施例11がどちらかの単一薬物結合体または両方の単一薬物結合体の混合物よりも良好に作用することを示す。驚くべきことに、単一薬物結合体の混合物は、個別に投薬された単一薬物結合体よりも著しく良好に作用せず、単一薬物結合体投薬計画のいずれも対照からの統計的有意差がない。実施例11の化合物のみが対照より優れていた。加えてこれらのデータは、単一結合体にビンカ薬物およびマイトマイシン薬物の両方を含めることの相乗効果を示唆している。
【0155】
〔実施例12〜14〕
実施例11について本明細書で上述したプロセスを含めて、本明細書に記載するプロセスおよび条件に従って調製。要求されたチオスルホナートまたはピリジルジチオ活性化ビンブラスチン、およびマレイミド活性化ビンブラスチン誘導体の調製についてのさらなる詳細は、米国特許出願公開第2005/0002942A1号に記載されている。要求されたマイトマイシン誘導体の調製についてのさらなる詳細は、米国特許出願公開第2005/0165227A1号に記載されており、その開示は参照により本明細書に組み入れられている。
【0156】
〔実施例12〕

図15は、FR陽性KB細胞への3H−チミジン取り込み対パルス時間における、100nMでの実施例12の活性を示す。アッセイは方法実施例3に従って実施した。
【0157】
〔実施例13〕

【0158】
〔実施例14〕

【図面の簡単な説明】
【0159】
【図1A】葉酸受容体における、実施例9(■、0.24)対葉酸(●、1.0)の相対結合親和性を示す。
【図1B】過剰な葉酸を含む場合(〇)および含まない場合(●)の、KB細胞への3H−チミジン取り込みに対する実施例9の活性を示す;実施例9のIC50は約58nMである。
【図2】葉酸受容体における、実施例11(■、0.21)対葉酸(●、1.0)の相対結合親和性を示す。
【図3】過剰な葉酸を含む場合(〇)および含まない場合(●)の、3H−チミジン取り込みに対する実施例11(多剤結合体)の活性を示す;実施例11のIC50=5nM。
【図4】実施例11+過剰な葉酸(b)と比較した、3つの異なる腫瘍細胞株(KB、4T−1cl2、およびID8−cl15)に対する実施例11(a)のin vitro細胞毒性活性を示す。
【図5A】未処置対照群(■)と対比し、Balb/cマウスにおけるFR陽性M109腫瘍に対する1μmol/kg TIW(6回用量)(●)、および2μmol/kg TIW(6回用量)(▼)での実施例11の活性を示す。
【図5B】未処置対照群(■)と対比した、Balb/cマウスの体重に対する1μmol/kg TIW(6回用量)(●)、および2μmol/kg TIW(6回用量)(▼)での実施例11による効果がないことを示す。
【図6】未処置対照群(●)と対比し、40μmol/kg EC20(レニウム錯体)を含む場合(□)および含まない場合(■)の、FR陽性KB腫瘍に対する2週間にわたる1μmol/kg TIW(6回用量)での実施例11の活性を示す;単独の実施例11が5/5の完全寛解を示した;実施例11+EC20は0/5の完全寛解を示した。
【図7】未処置対照群(●)と対比し、40μmol/kg EC20(レニウム錯体)を含む場合(□)および含まない場合(■)の、nu/nuマウスの体重に対する2週間にわたる1μmol/kg TIW(6回用量)(●)での実施例11による効果がないことを示す。
【図8】未処置対照群(a)と対比し、40μmol/kg EC20(レニウム錯体)を含む場合(b)および含まない場合(c)の、ヌードマウスに植え込まれたs.c.ヒト異種移植KB腫瘍に対する2週間にわたる1μmol/kg TIW(6回用量)での実施例11の活性を示す;単独の実施例11が5/5の完全寛解を示した;実施例11+EC20は0/5の完全寛解を示した。
【図9】未処置対照群(a)と対比し、40μmol/kg EC20(レニウム錯体)を含む場合(b)および含まない場合(c)の、ヌードマウスの体重に対する2週間にわたる1μmol/kg TIW(6回用量)での実施例11による効果がないことを示す。
【図10】0.5μmol/kg TIW(b)、1μmol/kg TIW(c)、および2μmol/kg TIW(d)における、非結合体ベース薬物、マイトマイシンC、およびデスアセチルビンブラスチンモノヒドラジドの混合物と対比した、そして未処置対照群(a)と対比した、ヌードマウスにおける葉酸塩受容体陽性ヒト腫瘍に対する2μmol/kg TIW(e)での実施例11の活性を示す。
【図11】未処置対照群(a)と対比し、ヌードマウスの体重に対する2週間にわたる2μmol/kg TIWでの実施例11(e)による効果がないことを示す。体重減少は、非結合体ベース薬物、マイトマイシンC、およびデスアセチルビンブラスチンモノヒドラジドの混合物の3つの用量すべて(0.5μmol/kg TIW(b)、1μmol/kg TIW(c)、2μmol/kg TIW(d))で発生した。高用量(d)は第20日以前に中止した。
【図12】対照群(a)と対比した、2週間にわたる2μmol/kg TIWでの、nu/nuマウスにおける3つのサイズの大型KB腫瘍、250mm3(b)、500mm3(c)、および750mm3(d)に対する実施例11の活性を示す。
【図13】マイトマイシンC(b)またはデスアセチルビンブラスチンモノヒドラジド(c)の単一薬物のみの結合体、またはこれらの2つの単一薬物結合体の混合物(d)と対比した、そして対照群(a)と対比した、実施例11(e)の活性を示す。
【図14】対照群(a)と対比し、Balb/cマウスにおける葉酸塩受容体陰性4T1腫瘍に対する治療の2週間にわたる2μmol/kg TIWでの実施例11の活性がないこと(b)を示す。図14のデータは、実施例11(b)が、これらの腫瘍に葉酸塩受容体が存在しないために、対照群(a)と対比して腫瘍に対して一切効果を持たないことを示す。
【図15】FR陽性KB細胞への3H−チミジン取り込みに対する実施例12の活性を示す。
【特許請求の範囲】
【請求項1】
受容体結合薬物送達結合体であって、
(a)受容体結合部分と、
(b)多価リンカーと、
(c)2つ以上の薬物、あるいはその類似体または誘導体と、を含み、
受容体結合部分は多価リンカーに共有結合され、
2つ以上の薬物、あるいはその類似体または誘導体が、多価リンカーに共有結合され、
多価リンカーが、スペーサーリンカー、放出型リンカー、およびヘテロ原子リンカー、ならびにその組合せから成る群より選択される1つ以上の構成要素を含む、
結合体。
【請求項2】
式(B)−(L)−(D)nを有するビタミン受容体結合薬物送達結合体であって、
式中、(L)は、(ls)a、(lH)b、および(lr)c、ならびにその組合せから成る群より選択され、(lr)は放出型リンカーであり、(ls)はスペーサーリンカーであり、(lH)はヘテロ原子リンカーであり、
(B)はビタミン受容体結合部分であり、nは1より大きい整数であり、かつ(D)は各存在ごとに独立して選択される薬物、あるいはその類似体または誘導体であり、かつ
a、b、およびcはそれぞれ独立して、0、1、2、3、または4である、
結合体。
【請求項3】
式(B)−(L)−(D)nを有するビタミン受容体結合薬物送達結合体であって、
式中、(L)は、(ls)aおよび(lH)b、ならびにその組合せから成る群より選択され、(ls)はスペーサーリンカーであり、(lH)はヘテロ原子リンカーであり、
aおよびbはそれぞれ独立して、0、1、2、3、または4であり、かつ
(B)はビタミン受容体結合部分であり、nは1より大きい整数であり、(D)は各存在ごとに独立して選択される薬物である、
結合体。
【請求項4】
多価リンカーが、ジスルフィドでない少なくとも1個の放出型リンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項5】
ヘテロ原子リンカーが窒素、酸素、または硫黄原子であるか、あるいは−NHR1NHR2−、−SO−、−S(O)2−、および−NR3O−から成る式の群より選択され、R1、R2、およびR3が水素、アルキル、アリール、アリールアルキル、置換アリール、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、およびアルコキシアルキルから成る群よりそれぞれ独立して選択される、請求項1、2、または3に記載の薬物送達結合体。
【請求項6】
スペーサーリンカーが、カルボニル、チオノカルボニル、アルキレン、シクロアルキレン、アルキレンシクロアルキル、アルキレンカルボニル、シクロアルキレンカルボニル、カルボニルアルキルカルボニル、1−アルキレンスクシンイミド−3−イル、1−(カルボニルアルキル)スクシンイミド−3−イル、アルキレンスルホキシル、スルホニルアルキル、アルキレンスルホキシルアルキル、アルキレンスルホニルアルキル、カルボニルテトラヒドロ−2H−ピラニル、カルボニルテトラヒドロフラニル、1−(カルボニルテトラヒドロ−2H−ピラニル)スクシンイミド−3−イル、および1−(カルボニルテトラヒドロフラニル)スクシンイミド−3−イルから成る群より選択され、ここで前記スペーサーリンカーのそれぞれが1個以上の置換基X1によって場合により置換され、
各置換基X1は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択される、
請求項1、2、または3に記載の薬物送達結合体。
【請求項7】
ヘテロ原子リンカーが窒素であり、かつ置換基X1およびヘテロ原子リンカーが、それらが結合するスペーサーリンカーとひとまとめにされて複素環を形成する、請求項6に記載の薬物送達結合体。
【請求項8】
複素環がピロリジン、ピペリジン、オキサゾリジン、イソオキサゾリジン、チアゾリジン、イソチアゾリジン、ピロリジノン、ピペリジノン、オキサゾリジノン、イソオキサゾリジノン、チアゾリジノン、イソチアゾリジノン、およびスクシンイミドから成る群より選択される、請求項7に記載の薬物送達結合体。
【請求項9】
放出型リンカーが、メチレン、1−アルコキシアルキレン、1−アルコキシシクロアルキレン、1−アルコキシアルキレンカルボニル、1−アルコキシシクロアルキレンカルボニル、カルボニルアリールカルボニル、カルボニル(カルボキシアリール)カルボニル、カルボニル(ビスカルボキシアリール)カルボニル、ハロアルキレンカルボニル、アルキレン(ジアルキルシリル)、アルキレン(アルキルアリールシリル)、アルキレン(ジアリールシリル)、(ジアルキルシリル)アリール、(アルキルアリールシリル)アリール、(ジアリールシリル)アリール、オキシカルボニルオキシ、オキシカルボニルオキシアルキル、スルホニルアルキル、イミノアルキリデニル、カルボニルアルキリデンイミニル、イミノシクロアルキリデニル、カルボニルシクロアルキリデンイミニル、アルキレンスルホニル、アルキレンチオ、アルキレンアリールチオ、およびカルボニルアルキルチオから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択される、
請求項1、2、または3に記載の薬物送達結合体。
【請求項10】
ヘテロ原子リンカーが窒素であり、かつ置換基X2およびヘテロ原子リンカーが、それらが結合する放出型リンカーとひとまとめにされて複素環を形成する、請求項9に記載の薬物送達結合体。
【請求項11】
複素環がピロリジン、ピペリジン、オキサゾリジン、イソオキサゾリジン、チアゾリジン、イソチアゾリジン、ピロリジノン、ピペリジノン、オキサゾリジノン、イソオキサゾリジノン、チアゾリジノン、イソチアゾリジノン、およびスクシンイミドから成る群より選択される、請求項10に記載の薬物送達結合体。
【請求項12】
ヘテロ原子リンカーが窒素であり、放出型リンカーおよびヘテロ原子リンカーがひとまとめにされて、アルキレンアジリジン−1−イル、アルキレンカルボニルアジリジン−1−イル、カルボニルアルキルアジリジン−1−イル、アルキレンスルホキシルアジリジン−1−イル、スルホキシルアルキルアジリジン−1−イル、スルホニルアルキルアジリジン−1−イル、またはアルキレンスルホニルアジリジン−1−イルを含む2価ラジカルを形成し、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択される、
請求項1、2、または3に記載の薬物送達結合体。
【請求項13】
ヘテロ原子リンカーが窒素であり、かつ、放出型リンカーおよびヘテロ原子リンカーがひとまとめにされて、アルキレンアジリジン−1−イル、カルボニルアルキルアジリジン−1−イル、スルホキシルアルキルアジリジン−1−イル、またはスルホニルアルキルアジリジン−1−イルを含む2価ラジカルを形成する、請求項12に記載の薬物送達結合体。
【請求項14】
スペーサーリンカーがカルボニル、チオノカルボニル、アルキレンカルボニル、シクロアルキレンカルボニル、カルボニルアルキルカルボニル、および1−(カルボニルアルキル)スクシンイミド−3−イルから成る群より選択され、前記スペーサーリンカーそれぞれが1個以上の置換基X1によって場合により置換され、
各置換基X1は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、
かつスペーサーリンカーが放出型リンカーに結合されて、アジリジンアミドを形成する、
請求項13に記載の薬物送達結合体。
【請求項15】
少なくとも1つの薬物、あるいはその類似体または誘導体が、ビンブラスチン、デスアセチルビンブラスチン、ビンデシン、チオビンデシン、ならびにその類似体および誘導体から成る群より選択されるビンカアルカロイドである、請求項1、2、または3に記載の薬物送達結合体。
【請求項16】
薬物が、二重結合窒素原子を含む薬物またはその薬物誘導体であり、放出型リンカーがアルキレンカルボニルアミノおよび1−(アルキレンカルボニルアミノ)スクシンイミド−3−イルから成る群より選択され、かつ放出型リンカーが薬物窒素に結合されてヒドラゾンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項17】
薬物が硫黄原子を含む薬物またはその薬物誘導体であり、放出型リンカーがアルキレンチオおよびカルボニルアルキルチオから成る群より選択され、かつ放出型リンカーが薬物硫黄に結合されてジスルフィドを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項18】
受容体結合部分が窒素を含む葉酸塩であり、スペーサーリンカーがアルキレンカルボニル、シクロアルキレンカルボニル、カルボニルアルキルカルボニル、および1−(カルボニルアルキル)スクシンイミド−3−イルから成る群より選択され、スペーサーリンカーが葉酸塩窒素と結合されてイミドまたはアルキルアミドを形成する、請求項6に記載の薬物送達結合体。
【請求項19】
各置換基X1がアルキル、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、カルボキシ、カルボキシアルキル、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5が、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7が、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択される、請求項18に記載の薬物送達結合体。
【請求項20】
ヘテロ原子リンカーが窒素であり、かつスペーサーリンカーがアルキレンカルボニル、シクロアルキレンカルボニル、カルボニルアルキルカルボニル、および1−(カルボニルアルキル)スクシンイミド−3−イルから成る群より選択され、前記スペーサーリンカーのそれぞれが1個以上の置換基X1によって場合により置換され、かつスペーサーリンカーが窒素と結合されてアミドを形成する、請求項6に記載の薬物送達結合体。
【請求項21】
ヘテロ原子リンカーが硫黄であり、かつスペーサーリンカーがアルキレンおよびシクロアルキレンから成る群より選択され、前記スペーサーリンカーのそれぞれがカルボキシによって場合により置換され、かつスペーサーリンカーが硫黄に結合されてチオールを形成する、請求項6に記載の薬物送達結合体。
【請求項22】
ヘテロ原子リンカーが硫黄であり、かつスペーサーリンカーが1−アルキレンスクシンイミド−3−イルおよび1−(カルボニルアルキル)スクシンイミド−3−イルから成る群より選択され、スペーサーリンカーが硫黄に結合されてスクシンイミド−3−イルチオールを形成する、請求項6に記載の薬物送達結合体。
【請求項23】
ヘテロ原子リンカーが酸素であり、かつ放出型リンカーがメチレン、1−アルコキシアルキレン、1−アルコキシシクロアルキレン、1−アルコキシアルキレンカルボニル、および1−アルコキシシクロアルキレンカルボニルから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、かつ放出型リンカーが酸素と結合されてアセタールまたはケタールを形成する、請求項9に記載の薬物送達結合体。
【請求項24】
ヘテロ原子リンカーが酸素であり、かつ放出型リンカーがメチレンであり、前記メチレンが場合により置換されたアリールによって置換され、かつ放出型リンカーが酸素と結合されてアセタールまたはケタールを形成する、請求項9に記載の薬物送達結合体。
【請求項25】
薬物が窒素原子を含む薬物またはその薬物誘導体であり、ヘテロ原子リンカーが窒素であり、かつ放出型リンカーがカルボニルアリールカルボニル、カルボニル(カルボキシアリール)カルボニル、カルボニル(ビスカルボキシアリール)カルボニルから成る群より選択され、かつ放出型リンカーがヘテロ原子リンカー窒素に結合されてアミドを形成し、かつ薬物窒素にも結合されてアミドを形成する、請求項9に記載の薬物送達結合体。
【請求項26】
薬物が酸素原子を含む薬物またはその薬物誘導体であり、ヘテロ原子リンカーが窒素であり、かつ放出型リンカーがカルボニルアリールカルボニル、カルボニル(カルボキシアリール)カルボニル、カルボニル(ビスカルボキシアリール)カルボニルから成る群より選択され、かつ放出型リンカーがヘテロ原子リンカー窒素に結合されてアミドを形成し、かつ薬物酸素にも結合されてエステルを形成する、請求項9に記載の薬物送達結合体。
【請求項27】
ヘテロ原子リンカーが窒素であり、かつ放出型リンカーがイミノアルキリデニル、カルボニルアルキリデンイミニル、イミノシクロアルキリデニル、およびカルボニルシクロアルキリデンイミニルから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、かつ放出型リンカーが窒素と結合されてヒドラゾンを形成する、請求項9に記載の薬物送達結合体。
【請求項28】
ヘテロ原子リンカーが酸素であり、かつ放出型リンカーがアルキレン(ジアルキルシリル)、アルキレン(アルキルアリールシリル)、アルキレン(ジアリールシリル)、(ジアルキルシリル)アリール、(アルキルアリールシリル)アリールおよび(ジアリールシリル)アリールから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、かつ放出型リンカーが酸素に結合されて、シラノールを形成する、請求項9に記載の薬物送達結合体。
【請求項29】
薬物が窒素原子を含む薬物またはその薬物誘導体であり、かつ放出型リンカーが1個以上の置換基X2によって場合により置換されたハロアルキレンカルボニルであり、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、
かつ放出型リンカーが薬物窒素または薬物誘導体窒素に結合されてアミドを形成する、
請求項1、2、または3に記載の薬物送達結合体。
【請求項30】
薬物が酸素原子を含む薬物またはその薬物誘導体であり、かつ放出型リンカーが1個以上の置換基X2によって場合により置換されたアルキレンオキシカルボニルまたはハロアルキレンカルボニルであり、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、
かつ放出型リンカーが薬物酸素または薬物誘導体酸素に結合されてカーボネートまたはエステルを形成する、
請求項1、2、または3に記載の薬物送達結合体。
【請求項31】
ヘテロ原子リンカーが酸素であり、スペーサーリンカーが1個以上の置換基X1によって場合により置換された1−アルキレンスクシンイミド−3−イルであり、かつ放出型リンカーがメチレン、1−アルコキシアルキレン、1−アルコキシシクロアルキレン、1−アルコキシアルキレンカルボニル、1−アルコキシシクロアルキレンカルボニルから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、
かつスペースリンカーおよび放出型リンカーがそれぞれヘテロ原子リンカーに結合されてスクシンイミド−1−イルアルキルアセタールまたはケタールを形成する、
請求項1、2、または3に記載の薬物送達結合体。
【請求項32】
多価リンカーが、ひとまとめにされて3−チオスクシンイミド−1−イルアルキルオキシメチルオキシを形成する、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、メチルがアルキルまたは置換アリールによって場合により置換される、請求項1、2、または3に記載の薬物送達結合体。
【請求項33】
多価リンカーが、ひとまとめにされて3−チオスクシンイミド−1−イルアルキルカルボニルを形成する、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが薬物、あるいはその類似体または誘導体と共にアシルアジリジンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項34】
多価リンカーが、ひとまとめにされて1−アルコキシシクロアルキルレンオキシを形成する、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項35】
多価リンカーが、ひとまとめにされてアルキレンアミノカルボニル(ジカルボキシルアリーレン)カルボキシラートを形成する、スペーサーリンカー、ヘテロ原子リンカー、および放出型リンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項36】
多価リンカーが、ひとまとめにされてジチオアルキルカルボニルヒドラジドを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、ヒドラジドが、薬物、あるいはその類似体または誘導体と共にヒドラゾンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項37】
多価リンカーが、ひとまとめにされて3−チオスクシンイミド−1−イルアルキルカルボニルヒドラジドを形成する、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、ヒドラジドが、薬物、あるいはその類似体または誘導体と共にヒドラゾンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項38】
多価リンカーが、ひとまとめにされて3−チオアルキルスルホニルアルキル(2置換シリル)オキシを形成する、ヘテロ原子リンカー、スペーサーリンカー、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、2置換シリルが、アルキルまたは場合により置換されたアリールによって置換される、請求項1、2、または3に記載の薬物送達結合体。
【請求項39】
多価リンカーが、天然型アミノ酸およびその立体異性体から成る群より選択される複数のスペーサーリンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項40】
多価リンカーが、ひとまとめにされて3−ジチオアルキルオキシカルボニルを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが、薬物、あるいはその類似体または誘導体と共にカーボネートを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項41】
多価リンカーが、ひとまとめにされて3−ジチオアリールアルキルオキシカルボニルを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが、薬物、あるいはその類似体または誘導体と共にカーボネートを形成し、かつアリールが場合により置換される、請求項1、2、または3に記載の薬物送達結合体。
【請求項42】
多価リンカーが、ひとまとめにされて3−チオスクシンイミド−1−イルアルキルオキシアルキルオキシアルキリデンを形成する、ヘテロ原子リンカー、スペーサーリンカー、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、アルキリデンが、薬物、あるいはその類似体または誘導体と共にヒドラゾンを形成し、各アルキルが独立して選択され、かつオキシアルキルオキシがアルキルまたは場合により置換されたアリールによって場合により置換される、1、2、または3に記載の薬物送達結合体。
【請求項43】
多価リンカーが、ひとまとめにされて3−ジチオアルキルオキシカルボニルヒドラジドを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項44】
多価リンカーが、ひとまとめにされて3−ジチオアルキルアミノを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、アミノが薬物、薬物類似体、または薬物誘導体と共にビニル性アミドを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項45】
アルキルがエチルである、請求項44に記載の薬物送達結合体。
【請求項46】
多価リンカーが、ひとまとめにされて3−ジチオアルキルアミノカルボニルを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが、薬物、薬物類似体、または薬物誘導体と共にカルバメートを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項47】
アルキルがエチルである、請求項46に記載の薬物送達結合体。
【請求項48】
多価リンカーが、ひとまとめにされて3−ジチオアリールアルキルオキシカルボニルを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが、薬物、薬物類似体、または薬物誘導体と共にカルバメートまたはカルバモイルアジリジンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項49】
少なくとも1つの薬物がハプテンである、請求項3に記載の薬物送達結合体。
【請求項50】
ハプテンがフルオレセインおよびジニトロフェニルから成る群より選択される、請求項53に記載の薬物送達結合体。
【請求項51】
請求項1、2、または3に記載の薬物送達結合体および製薬的に許容される担体、希釈剤、または賦形剤を含む医薬組成物。
【請求項52】
病原性細胞の集団を内部に持つ宿主動物において病原性細胞の集団を排除する方法であって、病原性細胞集団のメンバーが、ビタミン、あるいはその類似体または誘導体に対して接近可能な結合部位を有し、かつ結合部位が病原性細胞によって独自に発現、過剰に発現、または優先的に発現され、前記宿主に対して、請求項1、2、または3に記載の薬物送達結合体、あるいはその医薬組成物を投与する工程を含む、方法。
【請求項1】
受容体結合薬物送達結合体であって、
(a)受容体結合部分と、
(b)多価リンカーと、
(c)2つ以上の薬物、あるいはその類似体または誘導体と、を含み、
受容体結合部分は多価リンカーに共有結合され、
2つ以上の薬物、あるいはその類似体または誘導体が、多価リンカーに共有結合され、
多価リンカーが、スペーサーリンカー、放出型リンカー、およびヘテロ原子リンカー、ならびにその組合せから成る群より選択される1つ以上の構成要素を含む、
結合体。
【請求項2】
式(B)−(L)−(D)nを有するビタミン受容体結合薬物送達結合体であって、
式中、(L)は、(ls)a、(lH)b、および(lr)c、ならびにその組合せから成る群より選択され、(lr)は放出型リンカーであり、(ls)はスペーサーリンカーであり、(lH)はヘテロ原子リンカーであり、
(B)はビタミン受容体結合部分であり、nは1より大きい整数であり、かつ(D)は各存在ごとに独立して選択される薬物、あるいはその類似体または誘導体であり、かつ
a、b、およびcはそれぞれ独立して、0、1、2、3、または4である、
結合体。
【請求項3】
式(B)−(L)−(D)nを有するビタミン受容体結合薬物送達結合体であって、
式中、(L)は、(ls)aおよび(lH)b、ならびにその組合せから成る群より選択され、(ls)はスペーサーリンカーであり、(lH)はヘテロ原子リンカーであり、
aおよびbはそれぞれ独立して、0、1、2、3、または4であり、かつ
(B)はビタミン受容体結合部分であり、nは1より大きい整数であり、(D)は各存在ごとに独立して選択される薬物である、
結合体。
【請求項4】
多価リンカーが、ジスルフィドでない少なくとも1個の放出型リンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項5】
ヘテロ原子リンカーが窒素、酸素、または硫黄原子であるか、あるいは−NHR1NHR2−、−SO−、−S(O)2−、および−NR3O−から成る式の群より選択され、R1、R2、およびR3が水素、アルキル、アリール、アリールアルキル、置換アリール、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、およびアルコキシアルキルから成る群よりそれぞれ独立して選択される、請求項1、2、または3に記載の薬物送達結合体。
【請求項6】
スペーサーリンカーが、カルボニル、チオノカルボニル、アルキレン、シクロアルキレン、アルキレンシクロアルキル、アルキレンカルボニル、シクロアルキレンカルボニル、カルボニルアルキルカルボニル、1−アルキレンスクシンイミド−3−イル、1−(カルボニルアルキル)スクシンイミド−3−イル、アルキレンスルホキシル、スルホニルアルキル、アルキレンスルホキシルアルキル、アルキレンスルホニルアルキル、カルボニルテトラヒドロ−2H−ピラニル、カルボニルテトラヒドロフラニル、1−(カルボニルテトラヒドロ−2H−ピラニル)スクシンイミド−3−イル、および1−(カルボニルテトラヒドロフラニル)スクシンイミド−3−イルから成る群より選択され、ここで前記スペーサーリンカーのそれぞれが1個以上の置換基X1によって場合により置換され、
各置換基X1は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択される、
請求項1、2、または3に記載の薬物送達結合体。
【請求項7】
ヘテロ原子リンカーが窒素であり、かつ置換基X1およびヘテロ原子リンカーが、それらが結合するスペーサーリンカーとひとまとめにされて複素環を形成する、請求項6に記載の薬物送達結合体。
【請求項8】
複素環がピロリジン、ピペリジン、オキサゾリジン、イソオキサゾリジン、チアゾリジン、イソチアゾリジン、ピロリジノン、ピペリジノン、オキサゾリジノン、イソオキサゾリジノン、チアゾリジノン、イソチアゾリジノン、およびスクシンイミドから成る群より選択される、請求項7に記載の薬物送達結合体。
【請求項9】
放出型リンカーが、メチレン、1−アルコキシアルキレン、1−アルコキシシクロアルキレン、1−アルコキシアルキレンカルボニル、1−アルコキシシクロアルキレンカルボニル、カルボニルアリールカルボニル、カルボニル(カルボキシアリール)カルボニル、カルボニル(ビスカルボキシアリール)カルボニル、ハロアルキレンカルボニル、アルキレン(ジアルキルシリル)、アルキレン(アルキルアリールシリル)、アルキレン(ジアリールシリル)、(ジアルキルシリル)アリール、(アルキルアリールシリル)アリール、(ジアリールシリル)アリール、オキシカルボニルオキシ、オキシカルボニルオキシアルキル、スルホニルアルキル、イミノアルキリデニル、カルボニルアルキリデンイミニル、イミノシクロアルキリデニル、カルボニルシクロアルキリデンイミニル、アルキレンスルホニル、アルキレンチオ、アルキレンアリールチオ、およびカルボニルアルキルチオから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択される、
請求項1、2、または3に記載の薬物送達結合体。
【請求項10】
ヘテロ原子リンカーが窒素であり、かつ置換基X2およびヘテロ原子リンカーが、それらが結合する放出型リンカーとひとまとめにされて複素環を形成する、請求項9に記載の薬物送達結合体。
【請求項11】
複素環がピロリジン、ピペリジン、オキサゾリジン、イソオキサゾリジン、チアゾリジン、イソチアゾリジン、ピロリジノン、ピペリジノン、オキサゾリジノン、イソオキサゾリジノン、チアゾリジノン、イソチアゾリジノン、およびスクシンイミドから成る群より選択される、請求項10に記載の薬物送達結合体。
【請求項12】
ヘテロ原子リンカーが窒素であり、放出型リンカーおよびヘテロ原子リンカーがひとまとめにされて、アルキレンアジリジン−1−イル、アルキレンカルボニルアジリジン−1−イル、カルボニルアルキルアジリジン−1−イル、アルキレンスルホキシルアジリジン−1−イル、スルホキシルアルキルアジリジン−1−イル、スルホニルアルキルアジリジン−1−イル、またはアルキレンスルホニルアジリジン−1−イルを含む2価ラジカルを形成し、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択される、
請求項1、2、または3に記載の薬物送達結合体。
【請求項13】
ヘテロ原子リンカーが窒素であり、かつ、放出型リンカーおよびヘテロ原子リンカーがひとまとめにされて、アルキレンアジリジン−1−イル、カルボニルアルキルアジリジン−1−イル、スルホキシルアルキルアジリジン−1−イル、またはスルホニルアルキルアジリジン−1−イルを含む2価ラジカルを形成する、請求項12に記載の薬物送達結合体。
【請求項14】
スペーサーリンカーがカルボニル、チオノカルボニル、アルキレンカルボニル、シクロアルキレンカルボニル、カルボニルアルキルカルボニル、および1−(カルボニルアルキル)スクシンイミド−3−イルから成る群より選択され、前記スペーサーリンカーそれぞれが1個以上の置換基X1によって場合により置換され、
各置換基X1は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、
かつスペーサーリンカーが放出型リンカーに結合されて、アジリジンアミドを形成する、
請求項13に記載の薬物送達結合体。
【請求項15】
少なくとも1つの薬物、あるいはその類似体または誘導体が、ビンブラスチン、デスアセチルビンブラスチン、ビンデシン、チオビンデシン、ならびにその類似体および誘導体から成る群より選択されるビンカアルカロイドである、請求項1、2、または3に記載の薬物送達結合体。
【請求項16】
薬物が、二重結合窒素原子を含む薬物またはその薬物誘導体であり、放出型リンカーがアルキレンカルボニルアミノおよび1−(アルキレンカルボニルアミノ)スクシンイミド−3−イルから成る群より選択され、かつ放出型リンカーが薬物窒素に結合されてヒドラゾンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項17】
薬物が硫黄原子を含む薬物またはその薬物誘導体であり、放出型リンカーがアルキレンチオおよびカルボニルアルキルチオから成る群より選択され、かつ放出型リンカーが薬物硫黄に結合されてジスルフィドを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項18】
受容体結合部分が窒素を含む葉酸塩であり、スペーサーリンカーがアルキレンカルボニル、シクロアルキレンカルボニル、カルボニルアルキルカルボニル、および1−(カルボニルアルキル)スクシンイミド−3−イルから成る群より選択され、スペーサーリンカーが葉酸塩窒素と結合されてイミドまたはアルキルアミドを形成する、請求項6に記載の薬物送達結合体。
【請求項19】
各置換基X1がアルキル、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、カルボキシ、カルボキシアルキル、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5が、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7が、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択される、請求項18に記載の薬物送達結合体。
【請求項20】
ヘテロ原子リンカーが窒素であり、かつスペーサーリンカーがアルキレンカルボニル、シクロアルキレンカルボニル、カルボニルアルキルカルボニル、および1−(カルボニルアルキル)スクシンイミド−3−イルから成る群より選択され、前記スペーサーリンカーのそれぞれが1個以上の置換基X1によって場合により置換され、かつスペーサーリンカーが窒素と結合されてアミドを形成する、請求項6に記載の薬物送達結合体。
【請求項21】
ヘテロ原子リンカーが硫黄であり、かつスペーサーリンカーがアルキレンおよびシクロアルキレンから成る群より選択され、前記スペーサーリンカーのそれぞれがカルボキシによって場合により置換され、かつスペーサーリンカーが硫黄に結合されてチオールを形成する、請求項6に記載の薬物送達結合体。
【請求項22】
ヘテロ原子リンカーが硫黄であり、かつスペーサーリンカーが1−アルキレンスクシンイミド−3−イルおよび1−(カルボニルアルキル)スクシンイミド−3−イルから成る群より選択され、スペーサーリンカーが硫黄に結合されてスクシンイミド−3−イルチオールを形成する、請求項6に記載の薬物送達結合体。
【請求項23】
ヘテロ原子リンカーが酸素であり、かつ放出型リンカーがメチレン、1−アルコキシアルキレン、1−アルコキシシクロアルキレン、1−アルコキシアルキレンカルボニル、および1−アルコキシシクロアルキレンカルボニルから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、かつ放出型リンカーが酸素と結合されてアセタールまたはケタールを形成する、請求項9に記載の薬物送達結合体。
【請求項24】
ヘテロ原子リンカーが酸素であり、かつ放出型リンカーがメチレンであり、前記メチレンが場合により置換されたアリールによって置換され、かつ放出型リンカーが酸素と結合されてアセタールまたはケタールを形成する、請求項9に記載の薬物送達結合体。
【請求項25】
薬物が窒素原子を含む薬物またはその薬物誘導体であり、ヘテロ原子リンカーが窒素であり、かつ放出型リンカーがカルボニルアリールカルボニル、カルボニル(カルボキシアリール)カルボニル、カルボニル(ビスカルボキシアリール)カルボニルから成る群より選択され、かつ放出型リンカーがヘテロ原子リンカー窒素に結合されてアミドを形成し、かつ薬物窒素にも結合されてアミドを形成する、請求項9に記載の薬物送達結合体。
【請求項26】
薬物が酸素原子を含む薬物またはその薬物誘導体であり、ヘテロ原子リンカーが窒素であり、かつ放出型リンカーがカルボニルアリールカルボニル、カルボニル(カルボキシアリール)カルボニル、カルボニル(ビスカルボキシアリール)カルボニルから成る群より選択され、かつ放出型リンカーがヘテロ原子リンカー窒素に結合されてアミドを形成し、かつ薬物酸素にも結合されてエステルを形成する、請求項9に記載の薬物送達結合体。
【請求項27】
ヘテロ原子リンカーが窒素であり、かつ放出型リンカーがイミノアルキリデニル、カルボニルアルキリデンイミニル、イミノシクロアルキリデニル、およびカルボニルシクロアルキリデンイミニルから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、かつ放出型リンカーが窒素と結合されてヒドラゾンを形成する、請求項9に記載の薬物送達結合体。
【請求項28】
ヘテロ原子リンカーが酸素であり、かつ放出型リンカーがアルキレン(ジアルキルシリル)、アルキレン(アルキルアリールシリル)、アルキレン(ジアリールシリル)、(ジアルキルシリル)アリール、(アルキルアリールシリル)アリールおよび(ジアリールシリル)アリールから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、かつ放出型リンカーが酸素に結合されて、シラノールを形成する、請求項9に記載の薬物送達結合体。
【請求項29】
薬物が窒素原子を含む薬物またはその薬物誘導体であり、かつ放出型リンカーが1個以上の置換基X2によって場合により置換されたハロアルキレンカルボニルであり、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、
かつ放出型リンカーが薬物窒素または薬物誘導体窒素に結合されてアミドを形成する、
請求項1、2、または3に記載の薬物送達結合体。
【請求項30】
薬物が酸素原子を含む薬物またはその薬物誘導体であり、かつ放出型リンカーが1個以上の置換基X2によって場合により置換されたアルキレンオキシカルボニルまたはハロアルキレンカルボニルであり、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、
かつ放出型リンカーが薬物酸素または薬物誘導体酸素に結合されてカーボネートまたはエステルを形成する、
請求項1、2、または3に記載の薬物送達結合体。
【請求項31】
ヘテロ原子リンカーが酸素であり、スペーサーリンカーが1個以上の置換基X1によって場合により置換された1−アルキレンスクシンイミド−3−イルであり、かつ放出型リンカーがメチレン、1−アルコキシアルキレン、1−アルコキシシクロアルキレン、1−アルコキシアルキレンカルボニル、1−アルコキシシクロアルキレンカルボニルから成る群より選択され、前記放出型リンカーのそれぞれが1個以上の置換基X2によって場合により置換され、
各置換基X2は、アルキル、アルコキシ、アルコキシアルキル、ヒドロキシ、ヒドロキシアルキル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、ハロ、ハロアルキル、スルフヒドリルアルキル、アルキルチオアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリール、置換ヘテロアリール、カルボキシ、カルボキシアルキル、アルキルカルボキシラート、アルキルアルカノアート、グアニジノアルキル、R4−カルボニル、R5−カルボニルアルキル、R6−アシルアミノ、およびR7−アシルアミノアルキルから成る群より独立して選択され、R4およびR5は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、かつR6およびR7は、アミノ酸、アミノ酸誘導体、およびペプチドから成る群よりそれぞれ独立して選択され、
かつスペースリンカーおよび放出型リンカーがそれぞれヘテロ原子リンカーに結合されてスクシンイミド−1−イルアルキルアセタールまたはケタールを形成する、
請求項1、2、または3に記載の薬物送達結合体。
【請求項32】
多価リンカーが、ひとまとめにされて3−チオスクシンイミド−1−イルアルキルオキシメチルオキシを形成する、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、メチルがアルキルまたは置換アリールによって場合により置換される、請求項1、2、または3に記載の薬物送達結合体。
【請求項33】
多価リンカーが、ひとまとめにされて3−チオスクシンイミド−1−イルアルキルカルボニルを形成する、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが薬物、あるいはその類似体または誘導体と共にアシルアジリジンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項34】
多価リンカーが、ひとまとめにされて1−アルコキシシクロアルキルレンオキシを形成する、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項35】
多価リンカーが、ひとまとめにされてアルキレンアミノカルボニル(ジカルボキシルアリーレン)カルボキシラートを形成する、スペーサーリンカー、ヘテロ原子リンカー、および放出型リンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項36】
多価リンカーが、ひとまとめにされてジチオアルキルカルボニルヒドラジドを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、ヒドラジドが、薬物、あるいはその類似体または誘導体と共にヒドラゾンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項37】
多価リンカーが、ひとまとめにされて3−チオスクシンイミド−1−イルアルキルカルボニルヒドラジドを形成する、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、ヒドラジドが、薬物、あるいはその類似体または誘導体と共にヒドラゾンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項38】
多価リンカーが、ひとまとめにされて3−チオアルキルスルホニルアルキル(2置換シリル)オキシを形成する、ヘテロ原子リンカー、スペーサーリンカー、ヘテロ原子リンカー、スペーサーリンカー、および放出型リンカーを含み、2置換シリルが、アルキルまたは場合により置換されたアリールによって置換される、請求項1、2、または3に記載の薬物送達結合体。
【請求項39】
多価リンカーが、天然型アミノ酸およびその立体異性体から成る群より選択される複数のスペーサーリンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項40】
多価リンカーが、ひとまとめにされて3−ジチオアルキルオキシカルボニルを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが、薬物、あるいはその類似体または誘導体と共にカーボネートを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項41】
多価リンカーが、ひとまとめにされて3−ジチオアリールアルキルオキシカルボニルを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが、薬物、あるいはその類似体または誘導体と共にカーボネートを形成し、かつアリールが場合により置換される、請求項1、2、または3に記載の薬物送達結合体。
【請求項42】
多価リンカーが、ひとまとめにされて3−チオスクシンイミド−1−イルアルキルオキシアルキルオキシアルキリデンを形成する、ヘテロ原子リンカー、スペーサーリンカー、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、アルキリデンが、薬物、あるいはその類似体または誘導体と共にヒドラゾンを形成し、各アルキルが独立して選択され、かつオキシアルキルオキシがアルキルまたは場合により置換されたアリールによって場合により置換される、1、2、または3に記載の薬物送達結合体。
【請求項43】
多価リンカーが、ひとまとめにされて3−ジチオアルキルオキシカルボニルヒドラジドを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含む、請求項1、2、または3に記載の薬物送達結合体。
【請求項44】
多価リンカーが、ひとまとめにされて3−ジチオアルキルアミノを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、アミノが薬物、薬物類似体、または薬物誘導体と共にビニル性アミドを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項45】
アルキルがエチルである、請求項44に記載の薬物送達結合体。
【請求項46】
多価リンカーが、ひとまとめにされて3−ジチオアルキルアミノカルボニルを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが、薬物、薬物類似体、または薬物誘導体と共にカルバメートを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項47】
アルキルがエチルである、請求項46に記載の薬物送達結合体。
【請求項48】
多価リンカーが、ひとまとめにされて3−ジチオアリールアルキルオキシカルボニルを形成する、放出型リンカー、スペーサーリンカー、および放出型リンカーを含み、カルボニルが、薬物、薬物類似体、または薬物誘導体と共にカルバメートまたはカルバモイルアジリジンを形成する、請求項1、2、または3に記載の薬物送達結合体。
【請求項49】
少なくとも1つの薬物がハプテンである、請求項3に記載の薬物送達結合体。
【請求項50】
ハプテンがフルオレセインおよびジニトロフェニルから成る群より選択される、請求項53に記載の薬物送達結合体。
【請求項51】
請求項1、2、または3に記載の薬物送達結合体および製薬的に許容される担体、希釈剤、または賦形剤を含む医薬組成物。
【請求項52】
病原性細胞の集団を内部に持つ宿主動物において病原性細胞の集団を排除する方法であって、病原性細胞集団のメンバーが、ビタミン、あるいはその類似体または誘導体に対して接近可能な結合部位を有し、かつ結合部位が病原性細胞によって独自に発現、過剰に発現、または優先的に発現され、前記宿主に対して、請求項1、2、または3に記載の薬物送達結合体、あるいはその医薬組成物を投与する工程を含む、方法。
【図1A】


【図1B】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図1B】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公表番号】特表2009−504784(P2009−504784A)
【公表日】平成21年2月5日(2009.2.5)
【国際特許分類】
【出願番号】特願2008−527205(P2008−527205)
【出願日】平成18年8月18日(2006.8.18)
【国際出願番号】PCT/US2006/032561
【国際公開番号】WO2007/022494
【国際公開日】平成19年2月22日(2007.2.22)
【出願人】(504389588)エンドサイト,インコーポレイテッド (16)
【Fターム(参考)】
【公表日】平成21年2月5日(2009.2.5)
【国際特許分類】
【出願日】平成18年8月18日(2006.8.18)
【国際出願番号】PCT/US2006/032561
【国際公開番号】WO2007/022494
【国際公開日】平成19年2月22日(2007.2.22)
【出願人】(504389588)エンドサイト,インコーポレイテッド (16)
【Fターム(参考)】
[ Back to top ]

