多孔性バクテリアセルロースファイバー及びその製造方法
【課題】本発明は、その表面で細胞が増殖し、例えば血管のような管状の細胞培養体を作るためのスキャフォールドになり得るファイバー状のバクテリアセルロースを提供することを課題とする。
【解決手段】本発明は、チューブ状のハイドロゲル内でセルロース産生菌を培養する工程と、前記ハイドロゲルを除去する工程と、を含む多孔性バクテリアセルロースファイバーの製造方法とを提供する。
【解決手段】本発明は、チューブ状のハイドロゲル内でセルロース産生菌を培養する工程と、前記ハイドロゲルを除去する工程と、を含む多孔性バクテリアセルロースファイバーの製造方法とを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、セルロース産生菌を利用する多孔性バクテリアセルロースファイバーの製造方法等に関する。
【背景技術】
【0002】
ある種の細菌は、セルロースを分泌する。このような細菌として、例えば、酢酸菌の一種、アセトバクター・キシリナム(Acetobacter xylinum)が挙げられる。アセトバクター・キシリナムは、増殖に伴ってバクテリアセルロースを合成し、複雑なセルロースネットワークを形成する。このバクテリアセルロースは、生体適合性及び水分保持能が高く、機械強度に優れ、またセルラーゼで特異的に分解することができるという特徴を有することが知られている(非特許文献1、2)。これらの特性から、バクテリアセルロースは既に食品、オーディオスピーカー、創傷被覆材、高強度紙の製造などに広く用いられている。例えば、切断された神経をつなぐように菌が産生したセルロースのシートで包むと、周囲に炎症を生じさせることなく、内部で血管等が再生することが報告されている(非特許文献3)。
また、細胞の三次元培養のためのスキャフォールドとして、バクテリアセルロースを使用する試みもなされている。例えば、パラフィンビーズを充填した容器の中でセルロース産生菌を培養してセルロースを形成させ、パラフィンビーズを除くことによって得られた表面の粗いセルロースをスキャフォールドとして細胞を培養したことが報告されている(Zaborowska, M. et al. 2010, Anderssen et al. 2011)。しかしながら、この方法では細胞がコンフルエントな状態まで増殖せず、血管等の組織を形成するのは困難であった。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】Miyamoto T. et al. J Biomed Mater Res, Vol 23, pp.125-133, 1989.
【非特許文献2】Helenius G. et al. J Biomed Mater Res A, Vol 76, pp.431-438, 2006.
【非特許文献3】Klemm D. et al. J Prog. Polym. Sci. Vol 26, pp.1561-1603, 2001.
【非特許文献4】Zaborowska M. et al. Acta Biomater. Vol 6, pp. 2540-2547,2010.
【非特許文献5】Anderssen J et al. J Biomed Mater Res, Vol 94A, pp.1124-1132, 2011.
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、その表面で細胞が増殖し、例えば血管のような管状の細胞培養体を作るためのスキャフォールドになり得るファイバー状のバクテリアセルロースを提供することを課題とする。
【課題を解決するための手段】
【0005】
本発明者らは、上記課題を解決するために研究を重ねた結果、チューブ状のハイドロゲル内でセルロース産生菌を培養すると多孔性のバクテリアセルロースファイバーを短時間で効率よく作製できること、また、このバクテリアセルロースファイバー表面では細胞が好適に増殖することができ、バクテリアセルロースファイバーを覆って管状構造を形成できることを確認し、本発明を完成するに至った。
即ち、本発明は
〔1〕チューブ状のハイドロゲル内でセルロース産生菌を培養する工程と、
前記ハイドロゲルを除去する工程と、を含む多孔性バクテリアセルロースファイバーの製造方法;
〔2〕前記セルロース産生菌が、酢酸菌である、上記〔1〕に記載の方法;
〔3〕前記ハイドロゲルが、アルギン酸ゲルである、上記〔1〕又は〔2〕に記載の方法;
〔4〕前記培養工程は、12時間から48時間行う、上記〔1〕から〔3〕のいずれか1項に記載の方法;
〔5〕多孔性バクテリアセルロースファイバーの直径が50μmから300μmである、上記〔1〕から〔4〕のいずれか1項に記載の方法;
〔6〕前記バクテリアセルロースファイバーの平均孔径が5μmから15μmである、上記〔1〕から〔5〕のいずれか1項に記載の方法;
〔7〕直径が50μmから300μmであり、平均孔径が5μmから15μmである、多孔性バクテリアセルロースファイバー;
〔8〕上記〔1〕から〔6〕のいずれか1項に記載の方法で製造される、上記〔7〕に記載の多孔性バクテリアセルロースファイバー;
〔9〕管状の細胞培養体を形成する方法であって、
上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーに細胞を播種する工程と、
前記細胞が前記多孔性バクテリアセルロースファイバーを覆うまで培養する工程と、を含む方法;
〔10〕さらに、多孔性バクテリアセルロースファイバーをセルラーゼで分解する工程を含む、上記〔9〕に記載の方法;
〔11〕細胞又は組織の灌流培養方法であって、
前記細胞又は組織中に上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーを配置して培養する工程と、
前記多孔性バクテリアセルロースファイバーを介して細胞培養体又は組織中に培養液を灌流させる工程と、を含む方法;
〔12〕上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーを内包したハイドロゲルチューブ;
〔13〕上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーを内包した細胞培養体;及び
〔14〕上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーを内包した培養組織、
に関する。
【発明の効果】
【0006】
本発明に係る多孔性バクテリアセルロースファイバーの製造方法によれば、生分解性及び機会強度に優れた多孔性のバクテリアセルロースファイバーを簡便かつ迅速に得ることができる。このセルロースファイバーは、その表面で細胞を培養するのに適しており、その表面に細胞を播種すると、ファイバー表面を覆いつくすまで効率よく細胞が増殖する。また、バクテリアセルロースはセルラーゼで分解することができるので、細胞培養後に細胞培養体からバクテリアセルロースファイバーを除去し、管状構造を形成することが可能である。
さらに、本発明の多孔性バクテリアセルロースファイバーを細胞培養体や組織内に配置し、該ファイバーを介して培養液を組織内部にまで送ることにより、厚みのある細胞培養体や組織も長時間灌流培養することができる。
また、本発明のバクテリアセルロースファイバーを利用して、紐状、布状、網状構造等を形成することもでき、各種の製品に利用可能である。
【図面の簡単な説明】
【0007】
【図1A】図1Aは、セルロース産生菌を内包するハイドロゲルチューブを製造する装置の概要を示す。
【図1B】図1Bは、図1Aの装置によって得られたハイドロゲルチューブの位相差画像である。
【図1C】図1Cは、図1Aの装置によって得られたハイドロゲルチューブの写真である。
【図2】図2(A)は、ハイドロゲルチューブ内でセルロース産生菌が自由に動いて増殖し、セルロースネットワークを形成する様子を示す概念図である。(B)及び(C)は、ハイドロゲルチューブ形成直後、(D)及び(E)は24時間後の位相差画像である。
【図3】図3(A)及び(B)は、ハイドロゲルを除去した後のバクテリアセルロースファイバーの位相差画像である。(C)及び(D)は、バクテリアセルロースファイバーをアルカリ性溶液中で加熱して精製した後の位相差画像である。
【図4】図4は、バクテリアセルロースファイバーのX線回折の結果を示す。
【図5】図5(A)及び(B)は、バクテリアセルロースファイバー、(C)及び(D)は、バクテリアセルロースのバルクサンプルの走査型顕微鏡像である。
【図6】図6(A)は、バクテリアセルロースファイバー表面に3T3細胞を播種してから24時間経過後の位相差画像を示す。(B)は、最初の播種から24時間に再度3T3細胞を播種し、24時間経過した後の位相差画像を示す。(C)及び(D)は、2回目の播種から24時間後に細胞を蛍光染色して観察した像を示す。
【図7】図7は、バクテリアセルロースファイバー表面に血管内皮細胞を播種してから72時間経過後の位相差画像を示す。
【図8】図8は、3T3細胞のスフェロイド組織にバクテリアセルロースファイバーを埋め込み、1週間培養した後の写真である。
【発明を実施するための形態】
【0008】
(多孔性バクテリアセルロースファイバーの製造方法)
本発明に係る多孔性バクテリアセルロースファイバーの製造方法は、チューブ状のハイドロゲル内でセルロース産生菌を培養する工程と、ハイドロゲルを除去する工程とを含む。
【0009】
本明細書において、バクテリアセルロースとは、セルロース産生菌が産生したセルロースをいう。セルロース産生菌の種類は特に限定されず、例えば、酢酸菌属(Acetobacter xylinum、Acetobacter pasteurianus、Acetobacter aceti、Acetobacter rancens等)、サルシナ属(Sarcina ventriculi等)、バクテリウム・キシロイデス(Bacterium xyloides)、シュードモナス属細菌、リゾビウム属菌(アグロバクテリウム等)、Gluconacetobacter hansei、enterobacter sakazaki、Gluconacetobacter kakiaceti、Dickeya dadantii、Asaia bogorensis、及びこれらの変異体等が挙げられる。
なお、セルロース産生菌は、セルロースを産生する限り特に限定されず、天然の菌であっても遺伝子組換え菌であってもよい。遺伝子組換え菌としては、例えば、所望の機能性タンパク質(例えば蛍光タンパク質)を発現するように改変した菌が挙げられる。このような遺伝子組換え菌を用いれば、機能性タンパク質で修飾されたバクテリアセルロースファイバーを得ることができる。
【0010】
本明細書において、多孔性バクテリアセルロースファイバーとは、セルロース産生菌が産生したセルロースが複雑に絡み合ってできるファイバー状の構造物のうち、細胞がその表面に接着して十分に増殖できるような多孔性のものをいう。細胞がその表面に接着して十分に増殖できるほど多孔性か否かは、得られたバクテリアセルロースファイバーに細胞を播種して24時間程度培養することで簡単に確認できるが、ここでいう多孔性は、例えば、平均孔径が5μm以上20μm以下のスポンジ状の構造をいう。平均孔径は、8μm以上15μm以下、約10μm等であってもよい。バクテリアセルロースファイバーの平均孔径は、走査型電子顕微鏡(SEM)で表面を観察することによって調べることができる。
【0011】
本明細書において、ファイバー状とは、その最も広い意味で用いられ、直径に比較して長さが十分に長い構造をいう。本発明に係る多孔性バクテリアセルロースファイバーは、その直径を、例えば50μmから300μmとすることができる。直径は80μmから250μm、100μmから200μm等としてもよい。一方、多孔性BCファイバーの長さは特に限定されず、例えば数ミリメートルからメートル単位まで、あらゆる長さとすることができる。
【0012】
本明細書においてチューブ状のハイドロゲルとは、その芯部においてセルロース産生菌が増殖できるように、外側はある程度の機械強度を有し、内側は流動性があってセルロース産生菌が自由に動くことのできる構造になっているハイドロゲルをいう。
ハイドロゲルとしては、親水性高分子鎖間が架橋されて多量の水を保持し、吸収性に優れる材料であればよく、例えばアルギン酸ナトリウム、ポリビニルアルコール、ポリエチレンオキサイド、ポリビニルピロリドンを材料とするポリマーが挙げられる。また、ゼラチン、コラーゲン、ジェランガム、カラギーナン、キトサン、ヒアルロン酸、プロテオグリカン、アグリカン等を用いてもよい。
チューブ状のハイドロゲルの外径、内径及び長さは、製造しようとするBCファイバーの直径及び長さに応じて適宜決定することができるが、例えば、200−500μmとすることができる。
【0013】
チューブ状のハイドロゲルはどのような方法によって製造してもよく、その内部にセルロース産生菌を配置する方法も特に限定されないが、例えば、Onoeらの装置(Onoe H. et al. Proceedings of MEMS 2010, pp.248-251, 2010.)を使用すれば、セルロース産生菌を内包した所望の直径を有するハイドロゲルチューブをメートル単位で作製することができる。
当該装置は、3層のガラスチューブを有し、内側から、コアフロー、シェルフロー、及びシース(sheath)フローを供給する。例えば、コアフロー用チューブからセルロース産生菌懸濁液を、シェルフロー用チューブからアルギン酸ナトリウムを、シースフロー用チューブから塩化カルシウムを流出させると、アルギン酸ナトリウムの外面が塩化カルシウムと接触してゲル化し、ハイドロゲルチューブが形成される。ハイドロゲルチューブの内部では流動性が維持され、セルロース産生菌が自由に動いて増殖し、バクテリアセルロースが複雑に絡んだ構造(セルロースネットワーク)を形成する。この装置を用いれば、各フローの流速を調節することにより、ハイドロゲルチューブの外径及び内径を調節することができる。
ハイドロゲルはセルロース産生菌のための培養液を浸透させることができるので、ハイドロゲルチューブ内の菌は、ハイドロゲルチューブごと培養液に浸漬させることにより培養することができる。
培養液は、セルロース産生菌の種類に応じて、選択すればよい。
培養工程においては、セルロース産生菌が流出しないよう、ハイドロゲルチューブの両端は閉じておいてもよい。
また、培養工程においては、セルロース産生菌を他の物質を産生する菌と共培養してもよい。この方法によって当該他の物質が混入したバクテリアセルロースファイバーを得ることができる。
【0014】
また、ハイドロゲルチューブを分岐させ、分岐したバクテリアセルロースファイバーを作製してもよい。ハイドロゲルチューブの径は一定でなくてもよく、途中で径を変更してもよい。かかるハイドロゲルチューブを用いれば、途中で径が変化するバクテリアセルロースファイバーを作製することができる。
【0015】
ハイドロゲルチューブ内でのセルロース産生菌の培養時間は、製造しようとする多孔性バクテリアセルロースファイバーの直径や長さ等によって適宜変更することができるが、直系が50μm〜300μmの場合、例えば12時間から48時間とすることができる。18時間から36時間、約24時間等としてもよい。
培養時間が長すぎると、BCセルロースの孔径が小さくなって細胞培養に適さなくなり、培養時間が短すぎると、十分にセルロースネットワークが形成されず、機械強度が不足する傾向がある。
【0016】
ハイドロゲルを除去する工程は、ハイドロゲルの種類に応じて適宜方法を選択することができる。例えば、アルギン酸ゲルの場合はクエン酸、アスコルビン酸、乳酸などの有機酸で溶解させて除去することができる。
【0017】
ハイドロゲルを除去した多孔性バクテリアセルロースは、その後細胞培養のスキャフォールドや組織の灌流培養に用いる場合、残存するタンパク質や菌を除くために精製してもよい。精製は公知の方法又はそれに準ずる方法で行うことができるが、例えば、水酸化ナトリウムなどのアルカリ性溶液中で加熱することによって精製してもよい。
【0018】
(バクテリアセルロースファイバー)
本発明に係る多孔性バクテリアセルロースファイバーの一態様は、バクテリアが産生するセルロースネットワークによって形成された繊維状の多孔性バクテリアセルロースであり、その直径は50μmから300μmであって、平均孔径は5μmから15μmである。
直径は、直径は80μmから250μm、100μmから200μm等であってもよい。また、平均孔径は、8μm以上12μm以下、約10μm等であってもよい。長さは特に限定されず、ミリメートル単位からメートル単位まで、当業者が適宜決定選択することができる。
このように径が細く、多孔質で細胞をその表面で培養するのに適したバクテリアセルロースファイバーはこれまでになく、上述したハイドロゲルチューブを用いる方法によって、初めて作製できたものである。
多孔性バクテリアセルロースファイバーは、分岐していてもよく、また途中で径が変化してもよい。また、多孔性バクテリアセルロースファイバーを、紐状、ネット状、シート状等に編むこともでき、かかる構造も本発明に包含される。シート状に編んだものは、例えばろ紙として用いることが可能である。
【0019】
(多孔性バクテリアセルロースファイバー)
本発明は、多孔性バクテリアセルロースファイバーを内包したハイドロゲルチューブも包含する。かかる構成は、本発明に係る多孔性バクテリアセルロースファイバーの製造方法の工程の途中で得られるものである。多孔性バクテリアセルロースファイバーは、ハイドロゲルチューブを除いた後も形状を維持し、十分な機械強度を有するが、ハイドロゲルチューブをつけたまま流通させ、使用者においてハイドロゲルチューブを除去してもよい。
【0020】
(管状の細胞培養体)
本発明に係る多孔性バクテリアセルロースファイバーは、後述する実施例にも示されるとおり、細胞を播種すると、その表面に細胞がよく接着して増殖し、短時間でファイバー表面を覆って管状の細胞培養体を得ることができる。その後、多孔性バクテリアセルロースファイバーをセルラーゼで分解することにより、管状の細胞培養体のみとすることができ、例えば血管として移植したり、血管モデルとして実験に用いたりすることが可能である。
播種する細胞の種類は特に限定されず、得られた管状の細胞培養体の用途により、当業者が適宜選択することができる。例えば、血管として用いる場合には、血管内皮細胞(例えば、HUVEC、HUAEC、HAoEC、HPAEC、HCAEC、HMVEC、HLEC、HMEC-1、bEND.3、HUV-EC-C、MS1、EOMA、CPAE)を用いることができる。その他、平滑筋細胞を用いてもよい。また、胚性幹細胞や、本人に由来する多能性幹細胞等の幹細胞を適宜分化させた細胞を用いてもよい。
【0021】
多孔性バクテリアセルロースファイバーに細胞を播種する工程は、細胞に適した培養液の中に多孔性バクテリアセルロースファイバーを浸し、そこに細胞を添加すればよい。
【0022】
細胞が多孔性バクテリアセルロースファイバーを覆うまで培養する工程は、例えば、細胞添加後、12時間から60時間インキュベートすることにより行うことができる。インキュベートの時間、温度等の条件は、培養する細胞の性質によって適宜変更することができる。
管状の細胞培養体を形成するためには、例えば、適当な長さの多孔性バクテリアセルロースファイバーの両端を固相に固定して、セルロースファイバーが直線形状を維持するようにしてもよい。
【0023】
多孔性バクテリアセルロースファイバーをセルラーゼで分解する工程は、例えば、培地にセルラーゼを添加することによって行うことができる。
【0024】
(灌流培養)
三次元細胞培養体や組織の灌流培養においては、培養液が到達しない内部から細胞が死滅していくことが問題となるが、本発明に係る多孔性バクテリアセルロースファイバーは、厚みのある三次元細胞培養体や組織の灌流培養において、その内部まで培養液を到達させるための流路として用いることもできる。
例えば、細胞を培養する場合に培養容器に予め多孔性バクテリアセルロースファイバーを配置し、これに細胞を加えて培養する。これにより、中に多孔性バクテリアセルロースファイバーが包埋された細胞培養体を得ることができる。多孔性バクテリアセルロースファイバーはスポンジ状で液体を良く通す構造であるから、全体を培養液に浸すことにより、細胞培養体の内部までこれを通じて培養液を送ることができる。また、ポンプ等を用いて、ファイバーで積極的に送液してもよい。
なお、細胞又は組織中に多孔性バクテリアセルロースファイバーを配置して培養する工程と、多孔性バクテリアセルロースファイバーを介して細胞培養体又は組織中に培養液を灌流させる工程は同時に行ってもよい。
細胞の種類は特に限定されず、ヒト肝臓がん細胞、肝芽腫細胞、肝細胞癌細胞、ラットへパトーマ細胞、ヒト腎臓由来細胞、ラット腎臓由来細胞、マウス足細胞、ヒト腎細胞癌細胞、表皮由来細胞、メラノーマ由来細胞、その他各種肝細胞を適宜分化させた細胞等を用いることができる。
また、生体から摘出した組織の内部に多孔性バクテリアセルロースを配置し、同様に灌流培養を行うことも可能である。
【0025】
こうして培養した細胞培養体や組織は、各種の実験や試験に用いることもできるし、また、生体適合性の高いバクテリアセルロースごと移植に用いることもできる。バクテリアセルロースをセルラーゼで分解してから使用してもよい。
【0026】
また、本発明は、チューブ状のハイドロゲル内でセルロース産生細胞を培養する工程と、
前記ハイドロゲルを除去する工程と、を含むセルロースファイバーの製造方法も包含する。
セルロース産生細胞は、特に限定されないが、例えば、各種の植物細胞が挙げられる。ハイドロゲルチューブごと植物細胞を培養することにより、セルロースファイバーを得ることができる。
【0027】
また、本発明は、チューブ状のハイドロゲル内で繊維状高分子を産生する細胞を培養する工程と、
前記ハイドロゲルを除去する工程と、を含むマイクロファイバーの製造方法も包含する。
繊維状高分子を産生する菌は、特に限定されないが、例えば、ポリグルタミン酸を産生する納豆菌が挙げられる。
【0028】
これらの方法で得られるセルロースファイバー及びマイクロファイバーは、本発明に係る多孔性バクテリアセルロースファイバーと同様に、細胞培養のスキャフォールドや灌流培養に用いることができる。また、ファイバーを編んで紐状、布状、網状構造を形成し、各種製品に用いることもできる。
【0029】
本明細書において引用されるすべての特許文献及び非特許文献の開示は、全体として本明細書に参照により組み込まれる。
【実施例】
【0030】
以下、本発明を実施例に基づいて具体的に説明するが、本発明は何らこれに限定されるものではない。当業者は、本発明の意義を逸脱することなく様々な態様に本発明を変更することができ、かかる変更も本発明の範囲に含まれる。
【0031】
セルロース産生菌を封じ込めたハイドロゲルチューブを、Onoeらの装置を用いて調製した。この方法の概要を図1Aに示す。
コアフローとしてA. xylinumの懸濁液、シェルフローとして1.5wt%アルギン酸ナトリウム、シースフローとして100mM塩化カルシウムを装置から流出させた。なお、菌の懸濁液は、既存のセルロースを除去するために、液体培養の培養物を激しく撹拌して菌体をバクテリアセルロースの外に出し、40μmのフィルターでセルロースを除去し、遠心処理によって菌体を沈殿させた後、再度懸濁して5μmのフィルターでろ過したものを用いた。
アルギン酸ナトリウムと塩化カルシウムが接触することによってアルギン酸がゲル化して、ハイドロゲルチューブが形成された。
また、最初と最後にアルギン酸ナトリウムと塩化カルシウムのみ流すことにより、チューブの両端を閉じて、菌が流出しないようにした。
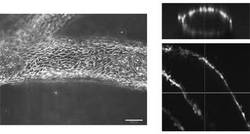
この状態の位相差画像を図1Bに示す。外側にアルギン酸ゲルが形成されている。中心の白い点はA. xylinumである(スケールバーは200μm)。この状態の写真を図1Cに示す(スケールバーは3.5mm)。
【0032】
これを培養液に浸すと、ハイドロゲルチューブ内に培養液が浸透し、チューブ内部は流動性が維持されて菌が自由に動いて増殖し、セルロースネットワークを形成した。この概念図を図2Aに示す。
ハイドロゲルチューブ形成直後の位相差画像を図2B及びCに、24時間後の画像を図2D及びEに示す。24時間後、ハイドロゲルチューブ内にはセルロースが絡み合ったセルロースネットワークが形成され、菌がセルロースとタンパク質の中に埋まったような構造が得られた。
【0033】
24時間後、アルギン酸ゲルを除去するために、全体を100mMクエン酸溶液に1分以内浸した。アルギン酸ゲルが除去された後も、バクテリアセルロースファイバーはその構造を維持した(図3A、B)。
アルギン酸ゲル除去後、Anandaらの方法(Ananda P. et al. Polymer Journal, Vol. 40, pp. 137-142, 2008.)に従って、バクテリアセルロースファイバーは1M NaOH中で加熱し、残存するタンパク質と菌を除去した。加熱処理後、顕微鏡により、メッシュ様構造が観察された(図3C、D)。
X線回折により、得られたファイバーがバクテリアセルロースに特徴的な3つのピーク(2θ=14.5、16.6、及び22.5)を示すことを確認し、バクテリアセルロースであることを確認した(図4)。
【0034】
精製したバクテリアセルロースファイバーとバクテリアセルロースのバルクサンプルを走査型電子顕微鏡(SEM)で表面を観察して比較した(図5A−D)。バルクサンプルは、Backdahlらの方法(Backdahl et al. Biomaterials, Vol 27, pp.2141-2179, 2006.)に従い、A. xylinumのシングルコロニーを10mLの培地に接種し、バクテリアセルロースが肉眼で見えるようになるまで5日間培養して作製した。SEM像に示されるとおり、ハイドロゲルチューブ内で作製したバクテリアセルロースファイバーの表面は、バルクサンプルの表面より孔が多く、孔径もバクテリアセルロースファイバーは10μm前後であったが、バルクサンプルは1μmよりかなり小さかった。
【0035】
得られた多孔性バクテリアセルロースファイバーに3T3細胞(約1.0×106個/mlを2ml)を播種して培養した。24時間後までに細胞はよく接着した(図6A、B)。バクテリアセルロースファイバーを完全に覆うよう、24時間後に再度細胞を播種したところ、その24時間後にはバクテリアセルロースファイバーを覆うチューブ様構造が観察された(図6C、D)。
【0036】
次に、多孔性バクテリアセルロースファイバーに血管内皮細胞を播種して培養した。細胞はよく接着し、72時間後にはバクテリアセルロースファイバーを覆うチューブ様構造が観察された(図7)。このチューブ様構造は、血管として各種の実験や再生医療に用いられうる。
【0037】
また、多孔性バクテリアセルロースファイバー表面でMS-1細胞を培養し、ファイバー表面を被覆して、3T3細胞のスフェロイドの組織に埋め込み、全体を培養液に浸して培養した。1週間後の状態を図8に示す。1週間後もセルロースファイバーは安定に存在し、細胞内部への侵入も見られず、また組織も安定に培養された。このときの組織の厚さは1.5mmであった。培養が安定に維持されたのは、培養液が、ファイバーを通じてスフェロイド組織の内部にまで到達しているからであると考えられる。
【技術分野】
【0001】
本発明は、セルロース産生菌を利用する多孔性バクテリアセルロースファイバーの製造方法等に関する。
【背景技術】
【0002】
ある種の細菌は、セルロースを分泌する。このような細菌として、例えば、酢酸菌の一種、アセトバクター・キシリナム(Acetobacter xylinum)が挙げられる。アセトバクター・キシリナムは、増殖に伴ってバクテリアセルロースを合成し、複雑なセルロースネットワークを形成する。このバクテリアセルロースは、生体適合性及び水分保持能が高く、機械強度に優れ、またセルラーゼで特異的に分解することができるという特徴を有することが知られている(非特許文献1、2)。これらの特性から、バクテリアセルロースは既に食品、オーディオスピーカー、創傷被覆材、高強度紙の製造などに広く用いられている。例えば、切断された神経をつなぐように菌が産生したセルロースのシートで包むと、周囲に炎症を生じさせることなく、内部で血管等が再生することが報告されている(非特許文献3)。
また、細胞の三次元培養のためのスキャフォールドとして、バクテリアセルロースを使用する試みもなされている。例えば、パラフィンビーズを充填した容器の中でセルロース産生菌を培養してセルロースを形成させ、パラフィンビーズを除くことによって得られた表面の粗いセルロースをスキャフォールドとして細胞を培養したことが報告されている(Zaborowska, M. et al. 2010, Anderssen et al. 2011)。しかしながら、この方法では細胞がコンフルエントな状態まで増殖せず、血管等の組織を形成するのは困難であった。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】Miyamoto T. et al. J Biomed Mater Res, Vol 23, pp.125-133, 1989.
【非特許文献2】Helenius G. et al. J Biomed Mater Res A, Vol 76, pp.431-438, 2006.
【非特許文献3】Klemm D. et al. J Prog. Polym. Sci. Vol 26, pp.1561-1603, 2001.
【非特許文献4】Zaborowska M. et al. Acta Biomater. Vol 6, pp. 2540-2547,2010.
【非特許文献5】Anderssen J et al. J Biomed Mater Res, Vol 94A, pp.1124-1132, 2011.
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、その表面で細胞が増殖し、例えば血管のような管状の細胞培養体を作るためのスキャフォールドになり得るファイバー状のバクテリアセルロースを提供することを課題とする。
【課題を解決するための手段】
【0005】
本発明者らは、上記課題を解決するために研究を重ねた結果、チューブ状のハイドロゲル内でセルロース産生菌を培養すると多孔性のバクテリアセルロースファイバーを短時間で効率よく作製できること、また、このバクテリアセルロースファイバー表面では細胞が好適に増殖することができ、バクテリアセルロースファイバーを覆って管状構造を形成できることを確認し、本発明を完成するに至った。
即ち、本発明は
〔1〕チューブ状のハイドロゲル内でセルロース産生菌を培養する工程と、
前記ハイドロゲルを除去する工程と、を含む多孔性バクテリアセルロースファイバーの製造方法;
〔2〕前記セルロース産生菌が、酢酸菌である、上記〔1〕に記載の方法;
〔3〕前記ハイドロゲルが、アルギン酸ゲルである、上記〔1〕又は〔2〕に記載の方法;
〔4〕前記培養工程は、12時間から48時間行う、上記〔1〕から〔3〕のいずれか1項に記載の方法;
〔5〕多孔性バクテリアセルロースファイバーの直径が50μmから300μmである、上記〔1〕から〔4〕のいずれか1項に記載の方法;
〔6〕前記バクテリアセルロースファイバーの平均孔径が5μmから15μmである、上記〔1〕から〔5〕のいずれか1項に記載の方法;
〔7〕直径が50μmから300μmであり、平均孔径が5μmから15μmである、多孔性バクテリアセルロースファイバー;
〔8〕上記〔1〕から〔6〕のいずれか1項に記載の方法で製造される、上記〔7〕に記載の多孔性バクテリアセルロースファイバー;
〔9〕管状の細胞培養体を形成する方法であって、
上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーに細胞を播種する工程と、
前記細胞が前記多孔性バクテリアセルロースファイバーを覆うまで培養する工程と、を含む方法;
〔10〕さらに、多孔性バクテリアセルロースファイバーをセルラーゼで分解する工程を含む、上記〔9〕に記載の方法;
〔11〕細胞又は組織の灌流培養方法であって、
前記細胞又は組織中に上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーを配置して培養する工程と、
前記多孔性バクテリアセルロースファイバーを介して細胞培養体又は組織中に培養液を灌流させる工程と、を含む方法;
〔12〕上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーを内包したハイドロゲルチューブ;
〔13〕上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーを内包した細胞培養体;及び
〔14〕上記〔7〕又は〔8〕に記載の多孔性バクテリアセルロースファイバーを内包した培養組織、
に関する。
【発明の効果】
【0006】
本発明に係る多孔性バクテリアセルロースファイバーの製造方法によれば、生分解性及び機会強度に優れた多孔性のバクテリアセルロースファイバーを簡便かつ迅速に得ることができる。このセルロースファイバーは、その表面で細胞を培養するのに適しており、その表面に細胞を播種すると、ファイバー表面を覆いつくすまで効率よく細胞が増殖する。また、バクテリアセルロースはセルラーゼで分解することができるので、細胞培養後に細胞培養体からバクテリアセルロースファイバーを除去し、管状構造を形成することが可能である。
さらに、本発明の多孔性バクテリアセルロースファイバーを細胞培養体や組織内に配置し、該ファイバーを介して培養液を組織内部にまで送ることにより、厚みのある細胞培養体や組織も長時間灌流培養することができる。
また、本発明のバクテリアセルロースファイバーを利用して、紐状、布状、網状構造等を形成することもでき、各種の製品に利用可能である。
【図面の簡単な説明】
【0007】
【図1A】図1Aは、セルロース産生菌を内包するハイドロゲルチューブを製造する装置の概要を示す。
【図1B】図1Bは、図1Aの装置によって得られたハイドロゲルチューブの位相差画像である。
【図1C】図1Cは、図1Aの装置によって得られたハイドロゲルチューブの写真である。
【図2】図2(A)は、ハイドロゲルチューブ内でセルロース産生菌が自由に動いて増殖し、セルロースネットワークを形成する様子を示す概念図である。(B)及び(C)は、ハイドロゲルチューブ形成直後、(D)及び(E)は24時間後の位相差画像である。
【図3】図3(A)及び(B)は、ハイドロゲルを除去した後のバクテリアセルロースファイバーの位相差画像である。(C)及び(D)は、バクテリアセルロースファイバーをアルカリ性溶液中で加熱して精製した後の位相差画像である。
【図4】図4は、バクテリアセルロースファイバーのX線回折の結果を示す。
【図5】図5(A)及び(B)は、バクテリアセルロースファイバー、(C)及び(D)は、バクテリアセルロースのバルクサンプルの走査型顕微鏡像である。
【図6】図6(A)は、バクテリアセルロースファイバー表面に3T3細胞を播種してから24時間経過後の位相差画像を示す。(B)は、最初の播種から24時間に再度3T3細胞を播種し、24時間経過した後の位相差画像を示す。(C)及び(D)は、2回目の播種から24時間後に細胞を蛍光染色して観察した像を示す。
【図7】図7は、バクテリアセルロースファイバー表面に血管内皮細胞を播種してから72時間経過後の位相差画像を示す。
【図8】図8は、3T3細胞のスフェロイド組織にバクテリアセルロースファイバーを埋め込み、1週間培養した後の写真である。
【発明を実施するための形態】
【0008】
(多孔性バクテリアセルロースファイバーの製造方法)
本発明に係る多孔性バクテリアセルロースファイバーの製造方法は、チューブ状のハイドロゲル内でセルロース産生菌を培養する工程と、ハイドロゲルを除去する工程とを含む。
【0009】
本明細書において、バクテリアセルロースとは、セルロース産生菌が産生したセルロースをいう。セルロース産生菌の種類は特に限定されず、例えば、酢酸菌属(Acetobacter xylinum、Acetobacter pasteurianus、Acetobacter aceti、Acetobacter rancens等)、サルシナ属(Sarcina ventriculi等)、バクテリウム・キシロイデス(Bacterium xyloides)、シュードモナス属細菌、リゾビウム属菌(アグロバクテリウム等)、Gluconacetobacter hansei、enterobacter sakazaki、Gluconacetobacter kakiaceti、Dickeya dadantii、Asaia bogorensis、及びこれらの変異体等が挙げられる。
なお、セルロース産生菌は、セルロースを産生する限り特に限定されず、天然の菌であっても遺伝子組換え菌であってもよい。遺伝子組換え菌としては、例えば、所望の機能性タンパク質(例えば蛍光タンパク質)を発現するように改変した菌が挙げられる。このような遺伝子組換え菌を用いれば、機能性タンパク質で修飾されたバクテリアセルロースファイバーを得ることができる。
【0010】
本明細書において、多孔性バクテリアセルロースファイバーとは、セルロース産生菌が産生したセルロースが複雑に絡み合ってできるファイバー状の構造物のうち、細胞がその表面に接着して十分に増殖できるような多孔性のものをいう。細胞がその表面に接着して十分に増殖できるほど多孔性か否かは、得られたバクテリアセルロースファイバーに細胞を播種して24時間程度培養することで簡単に確認できるが、ここでいう多孔性は、例えば、平均孔径が5μm以上20μm以下のスポンジ状の構造をいう。平均孔径は、8μm以上15μm以下、約10μm等であってもよい。バクテリアセルロースファイバーの平均孔径は、走査型電子顕微鏡(SEM)で表面を観察することによって調べることができる。
【0011】
本明細書において、ファイバー状とは、その最も広い意味で用いられ、直径に比較して長さが十分に長い構造をいう。本発明に係る多孔性バクテリアセルロースファイバーは、その直径を、例えば50μmから300μmとすることができる。直径は80μmから250μm、100μmから200μm等としてもよい。一方、多孔性BCファイバーの長さは特に限定されず、例えば数ミリメートルからメートル単位まで、あらゆる長さとすることができる。
【0012】
本明細書においてチューブ状のハイドロゲルとは、その芯部においてセルロース産生菌が増殖できるように、外側はある程度の機械強度を有し、内側は流動性があってセルロース産生菌が自由に動くことのできる構造になっているハイドロゲルをいう。
ハイドロゲルとしては、親水性高分子鎖間が架橋されて多量の水を保持し、吸収性に優れる材料であればよく、例えばアルギン酸ナトリウム、ポリビニルアルコール、ポリエチレンオキサイド、ポリビニルピロリドンを材料とするポリマーが挙げられる。また、ゼラチン、コラーゲン、ジェランガム、カラギーナン、キトサン、ヒアルロン酸、プロテオグリカン、アグリカン等を用いてもよい。
チューブ状のハイドロゲルの外径、内径及び長さは、製造しようとするBCファイバーの直径及び長さに応じて適宜決定することができるが、例えば、200−500μmとすることができる。
【0013】
チューブ状のハイドロゲルはどのような方法によって製造してもよく、その内部にセルロース産生菌を配置する方法も特に限定されないが、例えば、Onoeらの装置(Onoe H. et al. Proceedings of MEMS 2010, pp.248-251, 2010.)を使用すれば、セルロース産生菌を内包した所望の直径を有するハイドロゲルチューブをメートル単位で作製することができる。
当該装置は、3層のガラスチューブを有し、内側から、コアフロー、シェルフロー、及びシース(sheath)フローを供給する。例えば、コアフロー用チューブからセルロース産生菌懸濁液を、シェルフロー用チューブからアルギン酸ナトリウムを、シースフロー用チューブから塩化カルシウムを流出させると、アルギン酸ナトリウムの外面が塩化カルシウムと接触してゲル化し、ハイドロゲルチューブが形成される。ハイドロゲルチューブの内部では流動性が維持され、セルロース産生菌が自由に動いて増殖し、バクテリアセルロースが複雑に絡んだ構造(セルロースネットワーク)を形成する。この装置を用いれば、各フローの流速を調節することにより、ハイドロゲルチューブの外径及び内径を調節することができる。
ハイドロゲルはセルロース産生菌のための培養液を浸透させることができるので、ハイドロゲルチューブ内の菌は、ハイドロゲルチューブごと培養液に浸漬させることにより培養することができる。
培養液は、セルロース産生菌の種類に応じて、選択すればよい。
培養工程においては、セルロース産生菌が流出しないよう、ハイドロゲルチューブの両端は閉じておいてもよい。
また、培養工程においては、セルロース産生菌を他の物質を産生する菌と共培養してもよい。この方法によって当該他の物質が混入したバクテリアセルロースファイバーを得ることができる。
【0014】
また、ハイドロゲルチューブを分岐させ、分岐したバクテリアセルロースファイバーを作製してもよい。ハイドロゲルチューブの径は一定でなくてもよく、途中で径を変更してもよい。かかるハイドロゲルチューブを用いれば、途中で径が変化するバクテリアセルロースファイバーを作製することができる。
【0015】
ハイドロゲルチューブ内でのセルロース産生菌の培養時間は、製造しようとする多孔性バクテリアセルロースファイバーの直径や長さ等によって適宜変更することができるが、直系が50μm〜300μmの場合、例えば12時間から48時間とすることができる。18時間から36時間、約24時間等としてもよい。
培養時間が長すぎると、BCセルロースの孔径が小さくなって細胞培養に適さなくなり、培養時間が短すぎると、十分にセルロースネットワークが形成されず、機械強度が不足する傾向がある。
【0016】
ハイドロゲルを除去する工程は、ハイドロゲルの種類に応じて適宜方法を選択することができる。例えば、アルギン酸ゲルの場合はクエン酸、アスコルビン酸、乳酸などの有機酸で溶解させて除去することができる。
【0017】
ハイドロゲルを除去した多孔性バクテリアセルロースは、その後細胞培養のスキャフォールドや組織の灌流培養に用いる場合、残存するタンパク質や菌を除くために精製してもよい。精製は公知の方法又はそれに準ずる方法で行うことができるが、例えば、水酸化ナトリウムなどのアルカリ性溶液中で加熱することによって精製してもよい。
【0018】
(バクテリアセルロースファイバー)
本発明に係る多孔性バクテリアセルロースファイバーの一態様は、バクテリアが産生するセルロースネットワークによって形成された繊維状の多孔性バクテリアセルロースであり、その直径は50μmから300μmであって、平均孔径は5μmから15μmである。
直径は、直径は80μmから250μm、100μmから200μm等であってもよい。また、平均孔径は、8μm以上12μm以下、約10μm等であってもよい。長さは特に限定されず、ミリメートル単位からメートル単位まで、当業者が適宜決定選択することができる。
このように径が細く、多孔質で細胞をその表面で培養するのに適したバクテリアセルロースファイバーはこれまでになく、上述したハイドロゲルチューブを用いる方法によって、初めて作製できたものである。
多孔性バクテリアセルロースファイバーは、分岐していてもよく、また途中で径が変化してもよい。また、多孔性バクテリアセルロースファイバーを、紐状、ネット状、シート状等に編むこともでき、かかる構造も本発明に包含される。シート状に編んだものは、例えばろ紙として用いることが可能である。
【0019】
(多孔性バクテリアセルロースファイバー)
本発明は、多孔性バクテリアセルロースファイバーを内包したハイドロゲルチューブも包含する。かかる構成は、本発明に係る多孔性バクテリアセルロースファイバーの製造方法の工程の途中で得られるものである。多孔性バクテリアセルロースファイバーは、ハイドロゲルチューブを除いた後も形状を維持し、十分な機械強度を有するが、ハイドロゲルチューブをつけたまま流通させ、使用者においてハイドロゲルチューブを除去してもよい。
【0020】
(管状の細胞培養体)
本発明に係る多孔性バクテリアセルロースファイバーは、後述する実施例にも示されるとおり、細胞を播種すると、その表面に細胞がよく接着して増殖し、短時間でファイバー表面を覆って管状の細胞培養体を得ることができる。その後、多孔性バクテリアセルロースファイバーをセルラーゼで分解することにより、管状の細胞培養体のみとすることができ、例えば血管として移植したり、血管モデルとして実験に用いたりすることが可能である。
播種する細胞の種類は特に限定されず、得られた管状の細胞培養体の用途により、当業者が適宜選択することができる。例えば、血管として用いる場合には、血管内皮細胞(例えば、HUVEC、HUAEC、HAoEC、HPAEC、HCAEC、HMVEC、HLEC、HMEC-1、bEND.3、HUV-EC-C、MS1、EOMA、CPAE)を用いることができる。その他、平滑筋細胞を用いてもよい。また、胚性幹細胞や、本人に由来する多能性幹細胞等の幹細胞を適宜分化させた細胞を用いてもよい。
【0021】
多孔性バクテリアセルロースファイバーに細胞を播種する工程は、細胞に適した培養液の中に多孔性バクテリアセルロースファイバーを浸し、そこに細胞を添加すればよい。
【0022】
細胞が多孔性バクテリアセルロースファイバーを覆うまで培養する工程は、例えば、細胞添加後、12時間から60時間インキュベートすることにより行うことができる。インキュベートの時間、温度等の条件は、培養する細胞の性質によって適宜変更することができる。
管状の細胞培養体を形成するためには、例えば、適当な長さの多孔性バクテリアセルロースファイバーの両端を固相に固定して、セルロースファイバーが直線形状を維持するようにしてもよい。
【0023】
多孔性バクテリアセルロースファイバーをセルラーゼで分解する工程は、例えば、培地にセルラーゼを添加することによって行うことができる。
【0024】
(灌流培養)
三次元細胞培養体や組織の灌流培養においては、培養液が到達しない内部から細胞が死滅していくことが問題となるが、本発明に係る多孔性バクテリアセルロースファイバーは、厚みのある三次元細胞培養体や組織の灌流培養において、その内部まで培養液を到達させるための流路として用いることもできる。
例えば、細胞を培養する場合に培養容器に予め多孔性バクテリアセルロースファイバーを配置し、これに細胞を加えて培養する。これにより、中に多孔性バクテリアセルロースファイバーが包埋された細胞培養体を得ることができる。多孔性バクテリアセルロースファイバーはスポンジ状で液体を良く通す構造であるから、全体を培養液に浸すことにより、細胞培養体の内部までこれを通じて培養液を送ることができる。また、ポンプ等を用いて、ファイバーで積極的に送液してもよい。
なお、細胞又は組織中に多孔性バクテリアセルロースファイバーを配置して培養する工程と、多孔性バクテリアセルロースファイバーを介して細胞培養体又は組織中に培養液を灌流させる工程は同時に行ってもよい。
細胞の種類は特に限定されず、ヒト肝臓がん細胞、肝芽腫細胞、肝細胞癌細胞、ラットへパトーマ細胞、ヒト腎臓由来細胞、ラット腎臓由来細胞、マウス足細胞、ヒト腎細胞癌細胞、表皮由来細胞、メラノーマ由来細胞、その他各種肝細胞を適宜分化させた細胞等を用いることができる。
また、生体から摘出した組織の内部に多孔性バクテリアセルロースを配置し、同様に灌流培養を行うことも可能である。
【0025】
こうして培養した細胞培養体や組織は、各種の実験や試験に用いることもできるし、また、生体適合性の高いバクテリアセルロースごと移植に用いることもできる。バクテリアセルロースをセルラーゼで分解してから使用してもよい。
【0026】
また、本発明は、チューブ状のハイドロゲル内でセルロース産生細胞を培養する工程と、
前記ハイドロゲルを除去する工程と、を含むセルロースファイバーの製造方法も包含する。
セルロース産生細胞は、特に限定されないが、例えば、各種の植物細胞が挙げられる。ハイドロゲルチューブごと植物細胞を培養することにより、セルロースファイバーを得ることができる。
【0027】
また、本発明は、チューブ状のハイドロゲル内で繊維状高分子を産生する細胞を培養する工程と、
前記ハイドロゲルを除去する工程と、を含むマイクロファイバーの製造方法も包含する。
繊維状高分子を産生する菌は、特に限定されないが、例えば、ポリグルタミン酸を産生する納豆菌が挙げられる。
【0028】
これらの方法で得られるセルロースファイバー及びマイクロファイバーは、本発明に係る多孔性バクテリアセルロースファイバーと同様に、細胞培養のスキャフォールドや灌流培養に用いることができる。また、ファイバーを編んで紐状、布状、網状構造を形成し、各種製品に用いることもできる。
【0029】
本明細書において引用されるすべての特許文献及び非特許文献の開示は、全体として本明細書に参照により組み込まれる。
【実施例】
【0030】
以下、本発明を実施例に基づいて具体的に説明するが、本発明は何らこれに限定されるものではない。当業者は、本発明の意義を逸脱することなく様々な態様に本発明を変更することができ、かかる変更も本発明の範囲に含まれる。
【0031】
セルロース産生菌を封じ込めたハイドロゲルチューブを、Onoeらの装置を用いて調製した。この方法の概要を図1Aに示す。
コアフローとしてA. xylinumの懸濁液、シェルフローとして1.5wt%アルギン酸ナトリウム、シースフローとして100mM塩化カルシウムを装置から流出させた。なお、菌の懸濁液は、既存のセルロースを除去するために、液体培養の培養物を激しく撹拌して菌体をバクテリアセルロースの外に出し、40μmのフィルターでセルロースを除去し、遠心処理によって菌体を沈殿させた後、再度懸濁して5μmのフィルターでろ過したものを用いた。
アルギン酸ナトリウムと塩化カルシウムが接触することによってアルギン酸がゲル化して、ハイドロゲルチューブが形成された。
また、最初と最後にアルギン酸ナトリウムと塩化カルシウムのみ流すことにより、チューブの両端を閉じて、菌が流出しないようにした。
この状態の位相差画像を図1Bに示す。外側にアルギン酸ゲルが形成されている。中心の白い点はA. xylinumである(スケールバーは200μm)。この状態の写真を図1Cに示す(スケールバーは3.5mm)。
【0032】
これを培養液に浸すと、ハイドロゲルチューブ内に培養液が浸透し、チューブ内部は流動性が維持されて菌が自由に動いて増殖し、セルロースネットワークを形成した。この概念図を図2Aに示す。
ハイドロゲルチューブ形成直後の位相差画像を図2B及びCに、24時間後の画像を図2D及びEに示す。24時間後、ハイドロゲルチューブ内にはセルロースが絡み合ったセルロースネットワークが形成され、菌がセルロースとタンパク質の中に埋まったような構造が得られた。
【0033】
24時間後、アルギン酸ゲルを除去するために、全体を100mMクエン酸溶液に1分以内浸した。アルギン酸ゲルが除去された後も、バクテリアセルロースファイバーはその構造を維持した(図3A、B)。
アルギン酸ゲル除去後、Anandaらの方法(Ananda P. et al. Polymer Journal, Vol. 40, pp. 137-142, 2008.)に従って、バクテリアセルロースファイバーは1M NaOH中で加熱し、残存するタンパク質と菌を除去した。加熱処理後、顕微鏡により、メッシュ様構造が観察された(図3C、D)。
X線回折により、得られたファイバーがバクテリアセルロースに特徴的な3つのピーク(2θ=14.5、16.6、及び22.5)を示すことを確認し、バクテリアセルロースであることを確認した(図4)。
【0034】
精製したバクテリアセルロースファイバーとバクテリアセルロースのバルクサンプルを走査型電子顕微鏡(SEM)で表面を観察して比較した(図5A−D)。バルクサンプルは、Backdahlらの方法(Backdahl et al. Biomaterials, Vol 27, pp.2141-2179, 2006.)に従い、A. xylinumのシングルコロニーを10mLの培地に接種し、バクテリアセルロースが肉眼で見えるようになるまで5日間培養して作製した。SEM像に示されるとおり、ハイドロゲルチューブ内で作製したバクテリアセルロースファイバーの表面は、バルクサンプルの表面より孔が多く、孔径もバクテリアセルロースファイバーは10μm前後であったが、バルクサンプルは1μmよりかなり小さかった。
【0035】
得られた多孔性バクテリアセルロースファイバーに3T3細胞(約1.0×106個/mlを2ml)を播種して培養した。24時間後までに細胞はよく接着した(図6A、B)。バクテリアセルロースファイバーを完全に覆うよう、24時間後に再度細胞を播種したところ、その24時間後にはバクテリアセルロースファイバーを覆うチューブ様構造が観察された(図6C、D)。
【0036】
次に、多孔性バクテリアセルロースファイバーに血管内皮細胞を播種して培養した。細胞はよく接着し、72時間後にはバクテリアセルロースファイバーを覆うチューブ様構造が観察された(図7)。このチューブ様構造は、血管として各種の実験や再生医療に用いられうる。
【0037】
また、多孔性バクテリアセルロースファイバー表面でMS-1細胞を培養し、ファイバー表面を被覆して、3T3細胞のスフェロイドの組織に埋め込み、全体を培養液に浸して培養した。1週間後の状態を図8に示す。1週間後もセルロースファイバーは安定に存在し、細胞内部への侵入も見られず、また組織も安定に培養された。このときの組織の厚さは1.5mmであった。培養が安定に維持されたのは、培養液が、ファイバーを通じてスフェロイド組織の内部にまで到達しているからであると考えられる。
【特許請求の範囲】
【請求項1】
チューブ状のハイドロゲル内でセルロース産生菌を培養する工程と、
前記ハイドロゲルを除去する工程と、を含む多孔性バクテリアセルロースファイバーの製造方法。
【請求項2】
前記セルロース産生菌が、酢酸菌である、請求項1に記載の方法。
【請求項3】
前記ハイドロゲルが、アルギン酸ゲルである、請求項1又は2に記載の方法。
【請求項4】
前記培養工程は、12時間から48時間行う、請求項1から3のいずれか1項に記載の方法。
【請求項5】
多孔性バクテリアセルロースファイバーの直径が50μmから300μmである、請求項1から4のいずれか1項に記載の方法。
【請求項6】
前記バクテリアセルロースファイバーの平均孔径が5μmから15μmである、請求項1から5のいずれか1項に記載の方法。
【請求項7】
直径が50μmから300μmであり、平均孔径が5μmから15μmである、多孔性バクテリアセルロースファイバー。
【請求項8】
請求項1から6のいずれか1項に記載の方法で製造される、請求項7に記載の多孔性バクテリアセルロースファイバー。
【請求項9】
管状の細胞培養体を形成する方法であって、
請求項7又は8に記載の多孔性バクテリアセルロースファイバーに細胞を播種する工程と、
前記細胞が前記多孔性バクテリアセルロースファイバーを覆うまで培養する工程と、を含む方法。
【請求項10】
さらに、多孔性バクテリアセルロースファイバーをセルラーゼで分解する工程を含む、請求項9に記載の方法。
【請求項11】
細胞又は組織の灌流培養方法であって、
前記細胞又は組織中に請求項7又は8に記載の多孔性バクテリアセルロースファイバーを配置して培養する工程と、
前記多孔性バクテリアセルロースファイバーを介して細胞培養体又は組織中に培養液を灌流させる工程と、を含む方法。
【請求項12】
請求項7又は8に記載の多孔性バクテリアセルロースファイバーを内包したハイドロゲルチューブ。
【請求項13】
請求項7又は8に記載の多孔性バクテリアセルロースファイバーを内包した細胞培養体。
【請求項14】
請求項7又は8に記載の多孔性バクテリアセルロースファイバーを内包した培養組織。
【請求項1】
チューブ状のハイドロゲル内でセルロース産生菌を培養する工程と、
前記ハイドロゲルを除去する工程と、を含む多孔性バクテリアセルロースファイバーの製造方法。
【請求項2】
前記セルロース産生菌が、酢酸菌である、請求項1に記載の方法。
【請求項3】
前記ハイドロゲルが、アルギン酸ゲルである、請求項1又は2に記載の方法。
【請求項4】
前記培養工程は、12時間から48時間行う、請求項1から3のいずれか1項に記載の方法。
【請求項5】
多孔性バクテリアセルロースファイバーの直径が50μmから300μmである、請求項1から4のいずれか1項に記載の方法。
【請求項6】
前記バクテリアセルロースファイバーの平均孔径が5μmから15μmである、請求項1から5のいずれか1項に記載の方法。
【請求項7】
直径が50μmから300μmであり、平均孔径が5μmから15μmである、多孔性バクテリアセルロースファイバー。
【請求項8】
請求項1から6のいずれか1項に記載の方法で製造される、請求項7に記載の多孔性バクテリアセルロースファイバー。
【請求項9】
管状の細胞培養体を形成する方法であって、
請求項7又は8に記載の多孔性バクテリアセルロースファイバーに細胞を播種する工程と、
前記細胞が前記多孔性バクテリアセルロースファイバーを覆うまで培養する工程と、を含む方法。
【請求項10】
さらに、多孔性バクテリアセルロースファイバーをセルラーゼで分解する工程を含む、請求項9に記載の方法。
【請求項11】
細胞又は組織の灌流培養方法であって、
前記細胞又は組織中に請求項7又は8に記載の多孔性バクテリアセルロースファイバーを配置して培養する工程と、
前記多孔性バクテリアセルロースファイバーを介して細胞培養体又は組織中に培養液を灌流させる工程と、を含む方法。
【請求項12】
請求項7又は8に記載の多孔性バクテリアセルロースファイバーを内包したハイドロゲルチューブ。
【請求項13】
請求項7又は8に記載の多孔性バクテリアセルロースファイバーを内包した細胞培養体。
【請求項14】
請求項7又は8に記載の多孔性バクテリアセルロースファイバーを内包した培養組織。
【図1A】


【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−74863(P2013−74863A)
【公開日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願番号】特願2011−218184(P2011−218184)
【出願日】平成23年9月30日(2011.9.30)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願日】平成23年9月30日(2011.9.30)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

