多数の水酸基を含むマイケル受容体、およびこれから誘導されたマイケル付加生成物
【課題】アクリル官能基を導入することが可能な多数の水酸基を含む多官能性アクリルモノマーをマイケル受容体とし、これをマイケル供与体に導入したマイケル付加生成物を提供する。
【解決手段】エポキシ樹脂にカルボキシル基含有アクリレートを反応させ、マイケル受容体を形成させ、これにβージカルボニルマイケル供与体を反応させる。生成物にジイソシアネートを反応させる。得られた反応物はコーティング材料として有用である。
【解決手段】エポキシ樹脂にカルボキシル基含有アクリレートを反応させ、マイケル受容体を形成させ、これにβージカルボニルマイケル供与体を反応させる。生成物にジイソシアネートを反応させる。得られた反応物はコーティング材料として有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、多数の水酸基を含むマイケル受容体、およびこれから誘導されたマイケル付加生成物に係り、より詳しくは、官能基を導入することが可能な水酸基を多数保有し、必要に応じて膨張性や摩擦性などの強度と自己接着(self-adhesion)に必要な反応性や親水性などの多様な性能を発現させることが可能なマイケル受容体、およびこれから誘導されたマイケル付加生成物に関する。このようなマイケル受容体およびその付加生成物は、紫外線および電子ビーム硬化型自己光開始剤でありながらオリゴマーとしても使用可能であって、情報通信、半導体、電気電子分野およびマイクロパターン印刷、木材印などの多様な分野で利用できる。
【背景技術】
【0002】
紫外線硬化型樹脂は、紫外線反応基を有するオリゴマーとモノマーが紫外線照射によって高密度網状組織の重合体を形成することにより、耐熱性と化学的安定性を有すると共に優れた光学的、機械的特性を示す不溶解性物質であって、いろいろの分野で広範囲に応用されている。このように活用性が広い理由は、紫外線による硬化反応が短時間で行われてそれによるエネルギー節約と生産性が増加し、無溶剤により環境にやさしく、製造工程が小さい空間内で行われるうえ、便利性も増進するなどの多くの利点を持っているためである。
【0003】
紫外線反応基は、一般に、(メタ)アクリレートのモノマーおよびオリゴマーであって、光開始剤によってフリーラジカル連鎖メカニズムによって架橋できるが、これは、紫外線(UV)または電子ビーム(EB)放射線を用いて光開始剤によってより低い活性化エネルギーでフリーラジカルを作るのである。
光開始剤の欠点は、作業者及び作業環境に安定性の問題を引き起こすことである。なぜなら、製造過程中または製造後に、揮発する低分子量の分解産物を生成するためである。例えば、このような低分子量分解産物は、呼吸器および皮膚を通じて容易に吸収される傾向があって、健康に有害な影響を引き起こすおそれがある。
このような限界を克服するために幾つかの主要方法が紹介された。例えば、製造中または製造後に分解産物を発生する添加型光開始剤を、オリゴマーとして光開始剤の機能を果たす新規化合物、すなわち自己光開始能を有する(メタ)アクリレート樹脂、その他に必要な不飽和樹脂に適用することにより、解決しようとした。
【0004】
本発明に先立ち、1994年に特許文献1(Nippon Paint)に開示されたマイケル付加生成物は、アクリル共重合体の側鎖基としてのβ−ジカルボニルマイケル供与体および多官能性アクリレートとしてのマイケル受容体を用いて製造された、4つのアクリル官能基を有するUV−硬化性樹脂である。これらは触媒としてのエポキシド残基と4級塩の存在下でマイケル付加反応によって製造され、光開始剤なしで架橋することができることを特徴とするが、反応基が側鎖であって立体障害とアクリルの架橋密度により表面特性が低下するという欠点がある。
また、2005年にAshland社によって開示された特許文献2では、多官能性アクリレートであるマイケル受容体と、光活性能を有するマイケル付加生成物を提示している。すなわち光開始剤が置換されたβ−ジカルボニルマイケル供与体を用いて一つの分子内に製造された、4つのアクリル官能基を有する液体非架橋UV−硬化性マイケル付加生成物である。生成されたオリゴマーは、紫外線に晒されるとき、自己光開始反応以外にも、導入された光開始剤による光活性を向上させてアクリル基の付加重合を促進する。これらは粘度が低く硬化反応性に優れるにも拘らず、アクリルの架橋密度により表面特性が大きくは向上しない。
【0005】
このような方法から製造される自己光開始(メタ)アクリレートオリゴマーは、マイケル付加反応により追加的な製造過程とそれによるコストがかかるが、用途による性能は期待ほどには高くない。これはマイケル付加反応においてマイケル受容体のアクリル官能性が低いためである。その結果、これらを含んでなる組成物の架橋性を高めるために、反応性および最終性質に不利でありうる揮発性の高い低分子量多官能モノマーの添加だけでなく、光開始剤などを依然として必要とすることもある。
したがって、別途の光開始剤を使用することなくより環境にやさしく、安全に硬化型(メタ)アクリレート樹脂を主鎖とする技術の開発が多様に行われており、特に、内蔵型光開始剤を有する(メタ)アクリレートオリゴマーを形成する際に、光開始剤として機能するものと知られている化合物を全く使用しない技術の開発が提供されている。
【0006】
1997年に、Ashland社では、多官能性アクリレートとしてのマイケル受容体と1つの分子内に2つのβ−ジカルボニルからなるジアセトアセテートマイケル供与体から8つのアクリル官能基を有する自己光開始樹脂を開発し、米国で特許(特許文献3および特許文献4)を獲得した。また、2009年に、CHOKWANGペイントでは、特許文献5に開示されているように、β−ジカルボニル供与体にヒドロキシアクリレートマイケル受容体を付加し、ウレタン結合を用いて4つのアクリル官能基を有する内蔵光硬化型(メタ)アクリレート樹脂を製造し、光開始剤の不在下でも適切な光硬化反応を引き起こす樹脂を開発した。
2007年にAshland社によって開示された特許文献6では、アミン系の相乗効果剤を用いて光硬化反応性を向上させるに際し、β−ジカルボニルマイケル供与体とのマイケル付加反応を介して4つのアクリル官能基を有する自己−光開始多官能性ウレタンアクリレートを用いている。
ところが、有効性能を向上させるためには、既存のマイケル付加生成物よりさらに多数のアクリル官能基を導入することが可能なマイケル付加生成物が要求される。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第5,565,525号明細書
【特許文献2】米国公開特許第2005−0261388号明細書
【特許文献3】米国特許第5,845,489号明細書
【特許文献4】米国特許第6,025,410号明細書
【特許文献5】韓国特許第10−0903209号明細書
【特許文献6】米国公開特許0004815Al明細書
【発明の概要】
【発明が解決しようとする課題】
【0008】
そこで、本発明者は、既存のマイケル付加生成物より多数のアクリル官能基を導入することが可能なマイケル付加生成物を開発しようと努力した結果、本発明を完成するに至った。
本発明の目的は、多数の水酸基を含むマイケル受容体およびその製造方法を提供することである。
本発明の他の目的は、前記マイケル受容体から誘導されるマイケル付加生成物およびその製造方法を提供することである。
本発明の別の目的は、前記マイケル付加生成物の硬化架橋残留物を含むコーティング膜を提供することである。
【課題を解決するための手段】
【0009】
本発明は、多数の水酸基を含む、下記化学式1で表示されるマイケル受容体を提供する。
[化学式1]

前記化学式1において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、
R1およびR2は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、
nは0または1〜10の整数である。
また、本発明は、前記マイケル受容体から誘導される、下記化学式2または化学式3で表されるマイケル付加生成物を提供する。
[化学式2]

[化学式3]

前記化学式2および化学式3において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、
R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、
nは0または1〜10の整数であり、
R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基であり、
R4はそれぞれ独立に水素または多官能性イソシアネートである。
最後に、本発明は、前記マイケル付加生成物の硬化架橋残留物を含むコーティング膜を提供する。
【発明の効果】
【0010】
本発明のマイケル受容体は、官能基を導入することが可能な水酸基を多数保有し、ここに適切な結合剤を導入することにより、3次元以上の架橋結合を形成することができるとともに、膨張性や摩擦性などの強度と自己接着に必要な反応性や親水性などの多様な性能を発現させることができる。また、本発明のマイケル受容体は、既存のマイケル受容体とは異なり、分子内に含まれたエポキシアクリレート構造の他にも、イソシアネート基との結合によってウレタンアクリレートの構造が同一に共存するようにすることにより、混合比率による分子設計が可能であって硬化物の特性を容易に変化させることができる。
前記マイケル受容体から誘導されたマイケル付加生成物は、アクリル基の含量が高く、硬化性と硬化被膜の硬度に優れるうえ、光開始基を含んでいるため、別途の光開始剤または増感剤を使用することなく標準紫外線硬化条件で粘着性なしに硬化できる。また、光開始剤の均一分散に必要なエネルギーを減らすことができ、硬化後に分解産物がないため、大気環境汚染または人体の有害性なしに優れた性能を発現することができるという利点がある。
【図面の簡単な説明】
【0011】
【図1】本発明の実施例1によって合成されたマイケル受容体のFT−IRスペクトルを示す図である。
【図2】本発明の実施例2によって合成されたマイケル受容体の1H−NMRスペクトルを示す図である。
【図3】本発明の実施例1によって合成されたマイケル受容体の13C−NMRスペクトルを示す図である。
【図4】本発明の実施例1によって合成されたマイケル受容体のprep−LC結果を示す図である。
【図5】本発明の実施例2によって合成されたマイケル受容体のFT−IRスペクトルを示す図である。
【図6】本発明の実施例2によって合成されたマイケル受容体の1H−NMRスペクトルを示す図である。
【図7】本発明の実施例2によって合成されたマイケル受容体の13C−NMRスペクトルを示す図である。
【図8】本発明の実施例2によって合成されたマイケル受容体のprep−LC結果を示す図である。
【発明を実施するための形態】
【0012】
以下、本発明をさらに詳細に説明する。
本発明は、多数の水酸基を含むマイケル受容体に関するもので、マイケル受容体は前記化学式1で表示される。
また、前記化学式1で表示されるマイケル受容体は、下記化学式8または化学式9で表示されるマイケル受容体でありうる。
[化学式8]

[化学式9]

【0013】
本発明のマイケル受容体は、既存のマイケル受容体とは異なり、多数の水酸基を含んでいるため、適切な特性発現の設計が可能であることが特徴である。そして、前記マイケル受容体の添加法によるマイケル付加生成物は、光反応を起こしうる開始基を含んでいるため、既存の添加型光開始剤を全く使用しないことにより、開始反応において、熱または光による分解が、製造過程中または製造後に皮膚に容易に吸収される揮発性低分子量物質がないから、人体に有害な副作用または環境汚染の誘発を最小化することができる。
前記化学式1のマイケル受容体は、下記化学式4および化学式5で表示される、カルボン酸基を含むアクリレートと、下記化学式6で表示されるエポキシ樹脂とを反応器内で加熱反応させて合成することが好ましい。
[化学式4]

[化学式5]

【0014】
前記化学式4および化学式5において、Xはアルキレン基であり、
Yはシクロアルキレン基、フェニル基、エチレン基またはカプロラクトン基であり、
R1は水素または炭素数1〜6のアルキル基であり、
nは2〜3の整数である。
【0015】
[化学式6]

【0016】
前記化学式6において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、
nは0または1〜10の整数である。
特に、前記化学式4または化学式5で表示される、カルボン酸基を含むアクリレートとしては、2−カルボキシエチルアクリレート、2−カルボキシプロピルアクリレート、2−アクリロイルオキシエチルフタレート、2−アクリロイルオキシエチルヘキサヒドロフタレート、2−アクリロイルオキシプロピルフタレート、エチレンオキシド(EO)付加コハク酸アクリレート、ω−カルボキシポリカプロラクトン酸アクリレート、またはこれらのメタクリレートになれる。
【0017】
また、前記化学式6で表示されるエポキシ樹脂は、1,4−ブタンジオールジグリシジルエーテル、1,4−シクロヘキサンジメタノールジグリシジルエーテル、ジグリシジル1,2−シクロヘキサンジカルボキシレート、グリセロールジグリシジルエーテル、ネオペンチルグリコールジグリシジルエーテル、ペンタエリトリトールジグリシジルエーテル、エチレングリコールジグリシジルエーテル、プロピレングリコールジグリシジルエーテル、1,6−ヘキサンジオールジグリシジルエーテル、トリメチロールプロパンジグリシジルエーテル、およびジエチレングリコールジグリシジルエーテルよりなる群から選ばれた1種以上であることが好ましい。
【0018】
また、前記反応はオニウム塩または3級アミンなどの塩基触媒によって促進できる。そのような触媒の例としてはトリエチルアミン、ベンジルジメチルアミン、メチルトリエチルアンモニウムクロライド、ベンジルトリメチルアンモニウムブロマイド、ベンジルトリメチルアンモニウムヨウ化物、トリフェニルホスフィン、トリフェニルスチビン、オクタン酸クロム、およびオクタン酸ジルコニウムなどがあり、触媒の使用量は反応原料としてのグリシジル系化合物の量を基準にして1〜5質量%であることが好ましい。
前記化学式1、化学式8または化学式9で表示されるマイケル受容体は、既存のマイケル受容体より顕著に多数の水酸基を含んでいるため、適切な特性発現の設計が可能であることが特徴である。
また、本発明は、前記化学式1のマイケル受容体から誘導されるマイケル付加生成物に関する。
前記マイケル付加生成物は前記化学式2または化学式3の構造で表示できる。
【0019】
[化学式2]

[化学式3]

【0020】
前記化学式2および化学式3において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、
R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、
nは0または1〜10の整数であり、
R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基であり、
R4はそれぞれ独立に水素または多官能性イソシアネート基である。
【0021】
前記化学式3における多官能性イソシアネート基は、脂肪族ジイソシアネート、芳香族ジイソシアネート、またはこれらの混合物に由来した構造または作用基である。
脂肪族ジイソシアネートは、ヘキサメチレンジイソシアネート、4,4−ジシクロヘキシルメタンジイソシアネート、1,4−テトラメチレンジイソシアネート、1,10−デカメチレンジイソシアネート、イソホロンジイソシアネート、および1,4−シクロヘキサンジイソシアネートよりなる群から選ばれた1種以上であり、芳香族ジイソシアネートは、トルエン−2,4−ジイソシアネート、トルエン−2,6−ジイソシアネート、1,5−ナフタレンジイソシアネート、4−メトキシ−1,3−フェニレンジイソシアネート、4−クロロ−1,3−フェニレンジイソシアネート、2,4−ジメチル−1,3−フェニレンジイソシアネート、4,4−ジイソシアネートジフェニルエーテル、ベンジジンジイソシアネート、4,4’−ジイソシアネートジベンジル、メチレン−ビス(4−フェニルイソシアネート)−1,3−フェニレンジイソシアネートよりなる群から選ばれた1種以上である。
【0022】
また、前記多官能性イソシアネート基の一部または全部は、多価アクリル基を含むイソシアネート基でありうる。これは前記イソシアネート基を含むマイケル付加生成物をヒドロキシルアクリレートと50〜80℃で1〜5時間反応させて製造することができる。このようなマイケル付加生成物は、既存のマイケル付加生成物とは異なり、分子内に含まれたエポキシアクリレート構造以外にも、イソシアネート基との結合による多価アクリレートの構造が共存して適切な特性発現の設計が可能である。
特に、前記多官能性イソシアネートは下記化学式7で表示される。
【0023】
[化学式7]

【0024】
前記化学式2のマイケル付加生成物は、水酸基、UV−硬化性を有する二官能性アクリレートマイケル付加生成物であって、これらの水酸基は3次元架橋結合、膨張性や摩擦性などの性能、および自己接着のための親水性や反応性などの分子設計および組成物設計が可能な側鎖構造が多数存在する。よって、水酸基を用いて別の官能基との反応によって改質が可能である。
前記化学式2および化学式3のマイケル付加生成物は、光反応を引き起こしうる開始基を含んでいるため、既存の添加型光開始剤を全く使用しなくてもよいという利点がある。よって、皮膚に吸収され易い揮発性低分子量物質を光開始に使用する必要がないため、人体に有害な副作用または環境汚染の誘発を最小化することができる。
前記化学式2のマイケル付加生成物は、マイケル受容体とマイケル供与体とを合成して製造することができる。
【0025】
本発明において、マイケル供与体とは、α、β不飽和カルボニル化合物およびα、β不飽和ニトリルに、活性メチレンを有する化合物が添加されるマイケル付加反応において、電子供与体に該当する化合物を意味する。
具体的には、マイケル付加生成物を合成する方法は、前記化学式1のマイケル受容体とマイケル供与体とを反応器によって60〜100℃で3〜5時間加熱して反応させる。前記マイケル供与体はβ−ジカルボニルマイケル供与体であることが好ましい。
前記β−ジカルボニルマイケル供与体は、β−ケトエステル、β−ジケトン、β−ケトアミドおよびβ−ケトアニリドよりなる群から選ばれた1種以上を含んでもよい。
あるいは、前記β−ジカルボニルマイケル供与体は、アセトアセテート、2,4−ペンタンジオン、アセト酢酸アニリド、およびアセト酢酸アミドよりなる群から選ばれた1種以上を含んでもよい。
【0026】
あるいは、前記β−ジカルボニルマイケル供与体は、分子当り2つの作用基を有する、メチルアセトアセテート、エチルアセトアセテート、t−ブチルアセトセテート、アリルアセトアセテート、2−エチルヘキシルアセトアセテート、ラウリルアセトアセテート、および2−アセトアセトキシエチルメタクリレート(AAEM)よりなる群から選ばれた1種以上を含んでもよい。
あるいは、前記β−ジカルボニルマイケル供与体は、分子当り4つの作用基を有する、1,4−ブタンジオールジアセトアセテート、1,6−ヘキサンジオールジアセトアセテート、ネオペンチルグリコールジアセトアセテート、シクロヘキサンジメタノールジアセトアセテート、およびエトキシ化ビスフェノールAジアセトアセテートよりなる群から選ばれた1種以上を含んでもよい。
【0027】
あるいは、前記β−ジカルボニルマイケル供与体は、分子当り6つの作用基を有する、トリメチロールプロパントリアセトアセテート、グリセロールトリアセトアセテート、ポリカプロラクトントリアセトアセテート、エトキシ化またはプロポキシ化トリメチロールプロパントリアセトアセテート、およびエトキシ化またはプロポキシ化グリセロールトリアセトアセテートよりなる群から選ばれた1種以上を含んでもよい。
あるいは、前記β−ジカルボニルマイケル供与体は、分子当り8つの作用基を有する、ペンタエリトリトールテトラアセトアセテート、およびエトキシ化またはプロポキシ化ペンタエリトリトールテトラアセトアセテートよりなる群から選ばれた1種以上を含んでもよい。
あるいは、前記β−ジカルボニルマイケル供与体は、マロン酸エステル、o−アセト酢酸アニシジド、o−アセト酢酸トルイジド、N,N−ジメチルアセト酢酸アミド、メチルシアノアセテート、エチルシアノアセテート、およびブチルシアノアセテートよりなる群から選ばれた1種以上を含んでもよい。
すなわち、このように所望の物性または反応性に応じて、多様なマイケル供与体を選択して反応させることができる。
【0028】
前記マイケル受容体とマイケル供与体のマイケル付加反応は強塩基によって促進できる。そのような塩基の一例は、十分強く、モノマー混合物内で容易に可溶化できるジアザビシクロウンデセン(DBU)である。その他環状アミジン、例えばジアザビシクロ−ノネン(DBN)およびグアニジンも、この反応を触媒するのに適する。反応媒質内で十分な溶解度を有するカリウムtert−ブトキシドなどのI群アルコキシド塩基も典型的に所望の反応を促進するのに適する。4級ヒドロキシドおよびアルコキシド、例えばテトラブチルアンモニウムヒドロキシドまたはベンジルトリメチルアンモニウムメトキシドは、マイケル付加反応を促進する他の部類の塩基触媒を構成することができる。最終的に、親有機性のアルコキシド強塩基がハライド陰イオン(例えば、4級ハライド)とエポキシド部分間の反応からインサイチュ(in-situ)にて発生できる。
【0029】
前記化学式3のマイケル付加生成物は、前記化学式2のマイケル付加生成物の水酸基の水素を多官能性イソシアネート基で置換して製造することができる。置換する方法は、化学式2のマイケル付加生成物と前記多官能性イソシアネートと多官能性アクリルモノマーを反応器に投与した後、30〜60℃の温度で2〜4時間反応させることにより行われ得る。
また、本発明の前記マイケル付加生成物は、アミン系の相乗効果剤を添加することにより、1級または2級アミンで改質されて空気中の酸素を遮断することができ、これにより光反応性が増進できる。そのような改質の例には、非硬化マイケル付加生成物に1級または2級アミンを混入することが含まれうる。具体的な改質方法としては、化学式2または化学式3のマイケル付加生成物に一定量のジエタノールアミンを添加し、常温で攪拌させた反応生成物を紫外線(UV)に晒す方法を挙げることができる。典型的な1級アミンの例には、エタノールアミン、メチル−1,6−ヘキサンジアミン、3−アミノプロピルトリメトキシシラン、ジアミノプロパン、ベンジルアミン、トリエチレンテトラアミン、イソホロンジアミン、およびこれらの混合物が含まれる。典型的な2級アミンの例には、ジメチルアミン、ジブチルアミン、ジエタノールアミン、ピペリジン、モルホリン、およびこれらの混合物が含まれる。液体マイケル付加生成物が1級または2級アミンで改質される場合、改質アミンは液体非硬化マイケル付加生成物と単純に反応する可能性もある。
【0030】
最後に、本発明は、前記マイケル付加生成物の硬化架橋残留物を含むコーティング膜に関する。本発明のマイケル付加生成物の特徴である内蔵光硬化性により、別途の光開始剤または増感剤を使用することなく一般紫外線に晒して硬化させる方法によってコーティング膜を製造することができる。
【実施例】
【0031】
以下、実施例によって本発明をより詳細に説明する。ところが、下記実施例は説明の目的で本発明を例示するものに過ぎず、本発明の範囲を限定するものではない。
本発明のマイケル付加生成物の一部分を表面に塗布することにより、紫外線光重合を証明した。組成物を10μm以下の厚さで表面に塗布した。樹脂をドローダウン(draw down)技法でガラス基板に塗布した。硬化反応は照射量500mJ/cm2の紫外線を照射して「無粘着」硬化させた。
【0032】
実施例1:水酸基を含むマイケル受容体の合成

【0033】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に2−カルボキシエチルアクリレート(28.826g、0.2 mol)、グリセロールジグリシジルエーテル(20.433g、0.1 mol)、トリエチルアミン(グリセロールジグリシジルエーテルの2wt%)を順次仕込み、60℃に昇温して維持しながら4時間重合禁止剤なしで反応させた。
反応の後、室温に冷却して分液漏斗に移し、残っている触媒を中性化させるために5%HCl水溶液を添加して除去した後、さらに蒸留水で2〜3回水洗を繰り返し行い、50℃で減圧して透明な液体状の水酸基を含むマイケル受容体を得た。マイケル受容体の生成物を分離・分取して副反応物を除去した主生成物を得た。
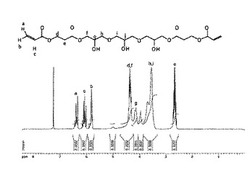
実施例1で得たマイケル受容体の生成物のFT−IRモニタリング結果を図1に示し、1H−NMRスペクトルを図2に示し、13C−NMRスペクトルを図3に示し、prep−LC結果を図4に示した。
【0034】
prep-LC(収率): 83%
IR (KBr, cm-1) : 3421 (-OH), 2919 (脂肪族 C-H), 1727 (C=O), 1635 & 1618 (C=C), 1186 & 1122 (C-O-C), 984 (=CH2(ねじれ振動))
1H-NMR (CDCl3, 300 MHz), δ (ppm) : 5.80〜6.33 (m, 3H, -CH=CH2), 4.13 & 4.31〜4.41 (m, 5H, -CH2CHOHCH2OOCCH2CH2-), 3.98 (m, 1H, -CH2CHOHCH2-), 3.55 & 3.70 (m, 4H, -CH2OCH2-), 2.61〜2.72 (m, 2H, -CH2COO-)
13C-NMR (CDCl3, 75 MHz), δ (ppm) : 173.63 (-CH2COO-), 165.99 (CH2=CHCOO-), 131.20 (CH2=CH-), 127.97 (CH2=CH-), 65.14〜73.05 (-COOCH2CHOHCH2OCH2CHOH-), 59.83 (CH2=CHCOOCH2-), 33.18 (CH2=CHCOOCH2CH2-)
【0035】
実施例2:水酸基を含むマイケル受容体の合成

【0036】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に2−カルボキシエチルアクリレート(28.826g、0.2 mol)、1,4−シクロヘキサンジメタノールジグリシジルエーテル(25.634g、0.1 mol)、トリエチルアミン(グリセロールジグリシジルエーテルの2wt%)を順次仕込み、60℃に昇温して維持しながら4時間重合禁止剤なしで反応させた。
反応の後、室温に冷却して分液漏斗に移し、残っている触媒を中性化させるために5%HCl水溶液を添加して除去した後、さらに蒸留水で2〜3回水洗を繰り返し行い、50℃で減圧して透明な液体状の水酸基を含むマイケル受容体を得た。マイケル受容体の生成物を分離・分取して副反応物を除去した主生成物を得た。
実施例2で得たマイケル受容体の生成物のFT−IRモニタリング結果を図5に示し、1H−NMRスペクトルを図6に示し、13C−NMRスペクトルを図7に示し、prep−LC結果を図8に示した。
【0037】
prep-LC(収率): 73%
IR (KBr, cm-1) : 3421 (-OH), 2919 (脂肪族 C-H), 1727 (C=O), 1635 & 1618 (C=C), 1186 & 1122 (C-O-C), 984 (=CH2(ねじれ振動))
1H-NMR (CDCl3, 300 MHz), δ (ppm) : 5.80〜6.33 (m, 3H, -CH=CH2), 4.32〜4.40 (m, 2H, -COOCH2CH2COO-), 3.91〜4.17 (m, 3H, -COOCH2CHOHCH2-), 3.22〜3.57 (m, 4H, -CHOHCH2OCH2-), 2.60〜2.68 (m, 2H, -CH2COO-), 0.85〜2.60 (m, 5H, -CHCH2CH2CH-(cyclohexane))
13C-NMR (CDCl3, 75 MHz), δ (ppm) : 173.54 (-CH2COO-), 165.54 (CH2=CHCOO-), 130.93 (CH2=CH-), 127.54 (CH2=CH-), 68.13〜74.42 (-COOCH2CHOHCH2OCH2CH-), 59.41 (CH2=CHCOOCH2-), 37.53 (cyclohexane, -CHCH2-), 33.00 (-CH2COO-), 28.72 (cyclohexane, -CHCH2CH2CH-)
【0038】
実施例3:内蔵光硬化型マイケル付加生成物の合成

【0039】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に、実施例1の水酸基を含むマイケル受容体(20.19g、0.04 mol)、エチルアセトアセテート(2.64g、0.02 mol)、グリシジルメタクリレート(0.46g、2wt%)およびテトラブチルアンモニウムブロマイド(0.12g、0.5wt%)を置いた。反応器内で機械的攪拌器を用いて適切に攪拌させながら配合した。反応器内の反応物を1℃/分の速度で80℃まで加熱し、3時間維持した。3時間後、樹脂を反応器から排出し、冷却させて内蔵光硬化型マイケル付加生成物を得た。
マイケル付加生成物を10μmの厚さでガラス基板に塗布し、照射量500mJ/cm2で露出させて「無粘着」硬化させた。硬化した被覆層は、柔らかく、艶が出るうえ、軟質であった。
【0040】
IR (KBr, cm-1) : 3421 (-OH), 2919 (脂肪族 C-H), 1727 (C=O), 1635 & 1618 (C=C), 1186 & 1122 (C-O-C), 984 (=CH2(ねじれ振動))
13C-NMR (CDCl3, 75 MHz), δ (ppm) : 208.7 (CH3C=OC-), 173.63 (-CH2COO-), 172.7 (-CCOOCH2CH3), 165.99 (CH2=CHCOO-), 131.20 (CH2=CH-), 127.97 (CH2=CH-), 65.14〜73.05 (-COOCH2CHOHCH2OCH2CHOH-), 61.6 (-COOCH2CH3), 59.83 (-COOCH2CH2COO-), 33.18 (-COOCH2CH2COO-), 26.9〜28.4 (-OOCCH2CH2CCH2CH2COO-), 25.9 (CH3C=OC-), 14.1 (-COOCH2CH3)
【0041】
実施例4:内蔵光硬化型付加生成物の合成

【0042】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に、実施例2の水酸基を含むマイケル受容体(21.78g、0.04 mol)、エチルアセトアセテート(2.64g、0.02 mol)、グリシジルメタクリレート(0.50g、2wt%)およびテトラブチルアンモニウムブロマイド(0.12g、0.5wt%)を置いた。反応器内で機械的攪拌器を用いて適切に攪拌させながら配合した。反応器内の反応物を1℃/分の速度で80℃まで加熱し、3時間維持した。3時間の後、樹脂を反応器から排出し、冷却させて内蔵光硬化型マイケル付加生成物を得た。
マイケル付加生成物を10μmの厚さでガラス基板に塗布し、照射量500mJ/cm2で露出させて「無粘着」硬化させた。硬化した被覆層は、柔らかく、艶が出るうえ、軟質であった。
【0043】
IR (KBr, cm-1) : 3421 (-OH), 2919 (脂肪族 C-H), 1727 (C=O), 1635 & 1618 (C=C), 1186 & 1122 (C-O-C), 984 (=CH2(ねじれ振動))
13C-NMR (CDCl3, 75 MHz), δ (ppm) : 208.7 (CH3C=OC-), 173.54 (-CH2COO-), 172.7 (-CCOOCH2CH3), 165.54 (CH2=CHCOO-), 130.93 (CH2=CH-), 127.54 (CH2=CH-), 68.13〜74.42 (-COOCH2CHOHCH2OCH2CH-), 61.6 (-COOCH2CH3), 59.41 (-COOCH2CH2COO-), 37.53 (cyclohexane, -CHCH2-), 33.00 (-CH2COO-), 28.72 (cyclohexane, -CHCH2CH2CH-), 25.9 (CH3C=OC-), 14.1 (-COOCH2CH3)
【0044】
実施例5:内蔵光硬化型マイケル付加生成物の合成

【0045】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に、実施例3のマイケル付加生成物(30g、0.027 mol)、アセトン50gおよびジブチル錫ジラウレート0.1gを置いた。反応器内で機械的攪拌器を用いて適切に攪拌させ、20分にわたって加熱させて温度を45℃に昇温させた。温度を45℃に維持させながらイソホロンジイソシアネート(35.88g、0.161 mol)を1時間にわたって滴下した。イソホロンジイソシアネートの添加後、温度を3時間にわたって60℃に昇温した。
前記反応はFT−IRでモニタリングした。3400cm-1(−OHバンド)における強度が一定の最小値となったときまで反応混合物を45〜50℃に降温させた。その後、ペンタエリトリトールトリアクリレート(48.02g、0.161 mol)を添加し、反応混合物をさらに攪拌し加熱した。ゲル化を防止するためにフェノチアジン0.01gを本段階の間添加した。
前記反応はFT−IRでモニタリングした。2300cm-1(−NCOバンド)における強度が一定の最小値となったとき、アセトンを60℃、圧力100mmHgの真空蒸留で除去してウレタンアクリレートタイプのマイケル付加生成物を得た。
マイケル付加生成物を10μmの厚さでガラス基板に塗布し、照射量500mJ/cm2で露出させて「無粘着」硬化させた。硬化した被覆層は、柔らかく、艶が出るうえ、硬質であった。
【0046】
実施例6:内蔵光硬化型マイケル付加生成物の合成

【0047】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に、実施例3のマイケル付加生成物(30g、0.025 mol)、アセトン50gおよびジブチル錫ジラウレート0.1gを置いた。反応器内で機械的攪拌器を用いて適切に攪拌させ、20分にわたって加熱させて温度を45℃に昇温させた。温度を45℃に維持させながらイソホロンジイソシアネート(32.81g、0.148 mol)を1時間にわたって滴下した。イソホロンジイソシアネートの添加後、温度を3時間にわたって60℃に昇温した。
前記反応はFT−IRでモニタリングした。3400cm-1(−OHバンド)における強度が一定の最小値となったときまで反応混合物を45〜50℃に降温させた。その後、ペンタエリトリトールトリアクリレート(48.02g、0.148 mol)を添加し、反応混合物をさらに攪拌し加熱した。ゲル化を防止するためにフェノチアジン0.01gを本段階の間添加した。
前記反応はFT−IRでモニタリングした。2300cm-1(−NCOバンド)における強度が一定の最小値となったとき、アセトンを60℃、圧力100mmHgの真空蒸留によって除去してウレタンアクリレートタイプのマイケル付加生成物を得た。
マイケル付加生成物を10μmの厚さでガラス基板に塗布し、照射量500mJ/cm2で露出させて「無粘着」硬化させた。硬化した被覆層は、柔らかく、艶が出るうえ、硬質であった。
【技術分野】
【0001】
本発明は、多数の水酸基を含むマイケル受容体、およびこれから誘導されたマイケル付加生成物に係り、より詳しくは、官能基を導入することが可能な水酸基を多数保有し、必要に応じて膨張性や摩擦性などの強度と自己接着(self-adhesion)に必要な反応性や親水性などの多様な性能を発現させることが可能なマイケル受容体、およびこれから誘導されたマイケル付加生成物に関する。このようなマイケル受容体およびその付加生成物は、紫外線および電子ビーム硬化型自己光開始剤でありながらオリゴマーとしても使用可能であって、情報通信、半導体、電気電子分野およびマイクロパターン印刷、木材印などの多様な分野で利用できる。
【背景技術】
【0002】
紫外線硬化型樹脂は、紫外線反応基を有するオリゴマーとモノマーが紫外線照射によって高密度網状組織の重合体を形成することにより、耐熱性と化学的安定性を有すると共に優れた光学的、機械的特性を示す不溶解性物質であって、いろいろの分野で広範囲に応用されている。このように活用性が広い理由は、紫外線による硬化反応が短時間で行われてそれによるエネルギー節約と生産性が増加し、無溶剤により環境にやさしく、製造工程が小さい空間内で行われるうえ、便利性も増進するなどの多くの利点を持っているためである。
【0003】
紫外線反応基は、一般に、(メタ)アクリレートのモノマーおよびオリゴマーであって、光開始剤によってフリーラジカル連鎖メカニズムによって架橋できるが、これは、紫外線(UV)または電子ビーム(EB)放射線を用いて光開始剤によってより低い活性化エネルギーでフリーラジカルを作るのである。
光開始剤の欠点は、作業者及び作業環境に安定性の問題を引き起こすことである。なぜなら、製造過程中または製造後に、揮発する低分子量の分解産物を生成するためである。例えば、このような低分子量分解産物は、呼吸器および皮膚を通じて容易に吸収される傾向があって、健康に有害な影響を引き起こすおそれがある。
このような限界を克服するために幾つかの主要方法が紹介された。例えば、製造中または製造後に分解産物を発生する添加型光開始剤を、オリゴマーとして光開始剤の機能を果たす新規化合物、すなわち自己光開始能を有する(メタ)アクリレート樹脂、その他に必要な不飽和樹脂に適用することにより、解決しようとした。
【0004】
本発明に先立ち、1994年に特許文献1(Nippon Paint)に開示されたマイケル付加生成物は、アクリル共重合体の側鎖基としてのβ−ジカルボニルマイケル供与体および多官能性アクリレートとしてのマイケル受容体を用いて製造された、4つのアクリル官能基を有するUV−硬化性樹脂である。これらは触媒としてのエポキシド残基と4級塩の存在下でマイケル付加反応によって製造され、光開始剤なしで架橋することができることを特徴とするが、反応基が側鎖であって立体障害とアクリルの架橋密度により表面特性が低下するという欠点がある。
また、2005年にAshland社によって開示された特許文献2では、多官能性アクリレートであるマイケル受容体と、光活性能を有するマイケル付加生成物を提示している。すなわち光開始剤が置換されたβ−ジカルボニルマイケル供与体を用いて一つの分子内に製造された、4つのアクリル官能基を有する液体非架橋UV−硬化性マイケル付加生成物である。生成されたオリゴマーは、紫外線に晒されるとき、自己光開始反応以外にも、導入された光開始剤による光活性を向上させてアクリル基の付加重合を促進する。これらは粘度が低く硬化反応性に優れるにも拘らず、アクリルの架橋密度により表面特性が大きくは向上しない。
【0005】
このような方法から製造される自己光開始(メタ)アクリレートオリゴマーは、マイケル付加反応により追加的な製造過程とそれによるコストがかかるが、用途による性能は期待ほどには高くない。これはマイケル付加反応においてマイケル受容体のアクリル官能性が低いためである。その結果、これらを含んでなる組成物の架橋性を高めるために、反応性および最終性質に不利でありうる揮発性の高い低分子量多官能モノマーの添加だけでなく、光開始剤などを依然として必要とすることもある。
したがって、別途の光開始剤を使用することなくより環境にやさしく、安全に硬化型(メタ)アクリレート樹脂を主鎖とする技術の開発が多様に行われており、特に、内蔵型光開始剤を有する(メタ)アクリレートオリゴマーを形成する際に、光開始剤として機能するものと知られている化合物を全く使用しない技術の開発が提供されている。
【0006】
1997年に、Ashland社では、多官能性アクリレートとしてのマイケル受容体と1つの分子内に2つのβ−ジカルボニルからなるジアセトアセテートマイケル供与体から8つのアクリル官能基を有する自己光開始樹脂を開発し、米国で特許(特許文献3および特許文献4)を獲得した。また、2009年に、CHOKWANGペイントでは、特許文献5に開示されているように、β−ジカルボニル供与体にヒドロキシアクリレートマイケル受容体を付加し、ウレタン結合を用いて4つのアクリル官能基を有する内蔵光硬化型(メタ)アクリレート樹脂を製造し、光開始剤の不在下でも適切な光硬化反応を引き起こす樹脂を開発した。
2007年にAshland社によって開示された特許文献6では、アミン系の相乗効果剤を用いて光硬化反応性を向上させるに際し、β−ジカルボニルマイケル供与体とのマイケル付加反応を介して4つのアクリル官能基を有する自己−光開始多官能性ウレタンアクリレートを用いている。
ところが、有効性能を向上させるためには、既存のマイケル付加生成物よりさらに多数のアクリル官能基を導入することが可能なマイケル付加生成物が要求される。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第5,565,525号明細書
【特許文献2】米国公開特許第2005−0261388号明細書
【特許文献3】米国特許第5,845,489号明細書
【特許文献4】米国特許第6,025,410号明細書
【特許文献5】韓国特許第10−0903209号明細書
【特許文献6】米国公開特許0004815Al明細書
【発明の概要】
【発明が解決しようとする課題】
【0008】
そこで、本発明者は、既存のマイケル付加生成物より多数のアクリル官能基を導入することが可能なマイケル付加生成物を開発しようと努力した結果、本発明を完成するに至った。
本発明の目的は、多数の水酸基を含むマイケル受容体およびその製造方法を提供することである。
本発明の他の目的は、前記マイケル受容体から誘導されるマイケル付加生成物およびその製造方法を提供することである。
本発明の別の目的は、前記マイケル付加生成物の硬化架橋残留物を含むコーティング膜を提供することである。
【課題を解決するための手段】
【0009】
本発明は、多数の水酸基を含む、下記化学式1で表示されるマイケル受容体を提供する。
[化学式1]

前記化学式1において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、
R1およびR2は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、
nは0または1〜10の整数である。
また、本発明は、前記マイケル受容体から誘導される、下記化学式2または化学式3で表されるマイケル付加生成物を提供する。
[化学式2]

[化学式3]

前記化学式2および化学式3において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、
R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、
nは0または1〜10の整数であり、
R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基であり、
R4はそれぞれ独立に水素または多官能性イソシアネートである。
最後に、本発明は、前記マイケル付加生成物の硬化架橋残留物を含むコーティング膜を提供する。
【発明の効果】
【0010】
本発明のマイケル受容体は、官能基を導入することが可能な水酸基を多数保有し、ここに適切な結合剤を導入することにより、3次元以上の架橋結合を形成することができるとともに、膨張性や摩擦性などの強度と自己接着に必要な反応性や親水性などの多様な性能を発現させることができる。また、本発明のマイケル受容体は、既存のマイケル受容体とは異なり、分子内に含まれたエポキシアクリレート構造の他にも、イソシアネート基との結合によってウレタンアクリレートの構造が同一に共存するようにすることにより、混合比率による分子設計が可能であって硬化物の特性を容易に変化させることができる。
前記マイケル受容体から誘導されたマイケル付加生成物は、アクリル基の含量が高く、硬化性と硬化被膜の硬度に優れるうえ、光開始基を含んでいるため、別途の光開始剤または増感剤を使用することなく標準紫外線硬化条件で粘着性なしに硬化できる。また、光開始剤の均一分散に必要なエネルギーを減らすことができ、硬化後に分解産物がないため、大気環境汚染または人体の有害性なしに優れた性能を発現することができるという利点がある。
【図面の簡単な説明】
【0011】
【図1】本発明の実施例1によって合成されたマイケル受容体のFT−IRスペクトルを示す図である。
【図2】本発明の実施例2によって合成されたマイケル受容体の1H−NMRスペクトルを示す図である。
【図3】本発明の実施例1によって合成されたマイケル受容体の13C−NMRスペクトルを示す図である。
【図4】本発明の実施例1によって合成されたマイケル受容体のprep−LC結果を示す図である。
【図5】本発明の実施例2によって合成されたマイケル受容体のFT−IRスペクトルを示す図である。
【図6】本発明の実施例2によって合成されたマイケル受容体の1H−NMRスペクトルを示す図である。
【図7】本発明の実施例2によって合成されたマイケル受容体の13C−NMRスペクトルを示す図である。
【図8】本発明の実施例2によって合成されたマイケル受容体のprep−LC結果を示す図である。
【発明を実施するための形態】
【0012】
以下、本発明をさらに詳細に説明する。
本発明は、多数の水酸基を含むマイケル受容体に関するもので、マイケル受容体は前記化学式1で表示される。
また、前記化学式1で表示されるマイケル受容体は、下記化学式8または化学式9で表示されるマイケル受容体でありうる。
[化学式8]

[化学式9]

【0013】
本発明のマイケル受容体は、既存のマイケル受容体とは異なり、多数の水酸基を含んでいるため、適切な特性発現の設計が可能であることが特徴である。そして、前記マイケル受容体の添加法によるマイケル付加生成物は、光反応を起こしうる開始基を含んでいるため、既存の添加型光開始剤を全く使用しないことにより、開始反応において、熱または光による分解が、製造過程中または製造後に皮膚に容易に吸収される揮発性低分子量物質がないから、人体に有害な副作用または環境汚染の誘発を最小化することができる。
前記化学式1のマイケル受容体は、下記化学式4および化学式5で表示される、カルボン酸基を含むアクリレートと、下記化学式6で表示されるエポキシ樹脂とを反応器内で加熱反応させて合成することが好ましい。
[化学式4]

[化学式5]

【0014】
前記化学式4および化学式5において、Xはアルキレン基であり、
Yはシクロアルキレン基、フェニル基、エチレン基またはカプロラクトン基であり、
R1は水素または炭素数1〜6のアルキル基であり、
nは2〜3の整数である。
【0015】
[化学式6]

【0016】
前記化学式6において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、
nは0または1〜10の整数である。
特に、前記化学式4または化学式5で表示される、カルボン酸基を含むアクリレートとしては、2−カルボキシエチルアクリレート、2−カルボキシプロピルアクリレート、2−アクリロイルオキシエチルフタレート、2−アクリロイルオキシエチルヘキサヒドロフタレート、2−アクリロイルオキシプロピルフタレート、エチレンオキシド(EO)付加コハク酸アクリレート、ω−カルボキシポリカプロラクトン酸アクリレート、またはこれらのメタクリレートになれる。
【0017】
また、前記化学式6で表示されるエポキシ樹脂は、1,4−ブタンジオールジグリシジルエーテル、1,4−シクロヘキサンジメタノールジグリシジルエーテル、ジグリシジル1,2−シクロヘキサンジカルボキシレート、グリセロールジグリシジルエーテル、ネオペンチルグリコールジグリシジルエーテル、ペンタエリトリトールジグリシジルエーテル、エチレングリコールジグリシジルエーテル、プロピレングリコールジグリシジルエーテル、1,6−ヘキサンジオールジグリシジルエーテル、トリメチロールプロパンジグリシジルエーテル、およびジエチレングリコールジグリシジルエーテルよりなる群から選ばれた1種以上であることが好ましい。
【0018】
また、前記反応はオニウム塩または3級アミンなどの塩基触媒によって促進できる。そのような触媒の例としてはトリエチルアミン、ベンジルジメチルアミン、メチルトリエチルアンモニウムクロライド、ベンジルトリメチルアンモニウムブロマイド、ベンジルトリメチルアンモニウムヨウ化物、トリフェニルホスフィン、トリフェニルスチビン、オクタン酸クロム、およびオクタン酸ジルコニウムなどがあり、触媒の使用量は反応原料としてのグリシジル系化合物の量を基準にして1〜5質量%であることが好ましい。
前記化学式1、化学式8または化学式9で表示されるマイケル受容体は、既存のマイケル受容体より顕著に多数の水酸基を含んでいるため、適切な特性発現の設計が可能であることが特徴である。
また、本発明は、前記化学式1のマイケル受容体から誘導されるマイケル付加生成物に関する。
前記マイケル付加生成物は前記化学式2または化学式3の構造で表示できる。
【0019】
[化学式2]

[化学式3]

【0020】
前記化学式2および化学式3において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、
R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、
nは0または1〜10の整数であり、
R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基であり、
R4はそれぞれ独立に水素または多官能性イソシアネート基である。
【0021】
前記化学式3における多官能性イソシアネート基は、脂肪族ジイソシアネート、芳香族ジイソシアネート、またはこれらの混合物に由来した構造または作用基である。
脂肪族ジイソシアネートは、ヘキサメチレンジイソシアネート、4,4−ジシクロヘキシルメタンジイソシアネート、1,4−テトラメチレンジイソシアネート、1,10−デカメチレンジイソシアネート、イソホロンジイソシアネート、および1,4−シクロヘキサンジイソシアネートよりなる群から選ばれた1種以上であり、芳香族ジイソシアネートは、トルエン−2,4−ジイソシアネート、トルエン−2,6−ジイソシアネート、1,5−ナフタレンジイソシアネート、4−メトキシ−1,3−フェニレンジイソシアネート、4−クロロ−1,3−フェニレンジイソシアネート、2,4−ジメチル−1,3−フェニレンジイソシアネート、4,4−ジイソシアネートジフェニルエーテル、ベンジジンジイソシアネート、4,4’−ジイソシアネートジベンジル、メチレン−ビス(4−フェニルイソシアネート)−1,3−フェニレンジイソシアネートよりなる群から選ばれた1種以上である。
【0022】
また、前記多官能性イソシアネート基の一部または全部は、多価アクリル基を含むイソシアネート基でありうる。これは前記イソシアネート基を含むマイケル付加生成物をヒドロキシルアクリレートと50〜80℃で1〜5時間反応させて製造することができる。このようなマイケル付加生成物は、既存のマイケル付加生成物とは異なり、分子内に含まれたエポキシアクリレート構造以外にも、イソシアネート基との結合による多価アクリレートの構造が共存して適切な特性発現の設計が可能である。
特に、前記多官能性イソシアネートは下記化学式7で表示される。
【0023】
[化学式7]

【0024】
前記化学式2のマイケル付加生成物は、水酸基、UV−硬化性を有する二官能性アクリレートマイケル付加生成物であって、これらの水酸基は3次元架橋結合、膨張性や摩擦性などの性能、および自己接着のための親水性や反応性などの分子設計および組成物設計が可能な側鎖構造が多数存在する。よって、水酸基を用いて別の官能基との反応によって改質が可能である。
前記化学式2および化学式3のマイケル付加生成物は、光反応を引き起こしうる開始基を含んでいるため、既存の添加型光開始剤を全く使用しなくてもよいという利点がある。よって、皮膚に吸収され易い揮発性低分子量物質を光開始に使用する必要がないため、人体に有害な副作用または環境汚染の誘発を最小化することができる。
前記化学式2のマイケル付加生成物は、マイケル受容体とマイケル供与体とを合成して製造することができる。
【0025】
本発明において、マイケル供与体とは、α、β不飽和カルボニル化合物およびα、β不飽和ニトリルに、活性メチレンを有する化合物が添加されるマイケル付加反応において、電子供与体に該当する化合物を意味する。
具体的には、マイケル付加生成物を合成する方法は、前記化学式1のマイケル受容体とマイケル供与体とを反応器によって60〜100℃で3〜5時間加熱して反応させる。前記マイケル供与体はβ−ジカルボニルマイケル供与体であることが好ましい。
前記β−ジカルボニルマイケル供与体は、β−ケトエステル、β−ジケトン、β−ケトアミドおよびβ−ケトアニリドよりなる群から選ばれた1種以上を含んでもよい。
あるいは、前記β−ジカルボニルマイケル供与体は、アセトアセテート、2,4−ペンタンジオン、アセト酢酸アニリド、およびアセト酢酸アミドよりなる群から選ばれた1種以上を含んでもよい。
【0026】
あるいは、前記β−ジカルボニルマイケル供与体は、分子当り2つの作用基を有する、メチルアセトアセテート、エチルアセトアセテート、t−ブチルアセトセテート、アリルアセトアセテート、2−エチルヘキシルアセトアセテート、ラウリルアセトアセテート、および2−アセトアセトキシエチルメタクリレート(AAEM)よりなる群から選ばれた1種以上を含んでもよい。
あるいは、前記β−ジカルボニルマイケル供与体は、分子当り4つの作用基を有する、1,4−ブタンジオールジアセトアセテート、1,6−ヘキサンジオールジアセトアセテート、ネオペンチルグリコールジアセトアセテート、シクロヘキサンジメタノールジアセトアセテート、およびエトキシ化ビスフェノールAジアセトアセテートよりなる群から選ばれた1種以上を含んでもよい。
【0027】
あるいは、前記β−ジカルボニルマイケル供与体は、分子当り6つの作用基を有する、トリメチロールプロパントリアセトアセテート、グリセロールトリアセトアセテート、ポリカプロラクトントリアセトアセテート、エトキシ化またはプロポキシ化トリメチロールプロパントリアセトアセテート、およびエトキシ化またはプロポキシ化グリセロールトリアセトアセテートよりなる群から選ばれた1種以上を含んでもよい。
あるいは、前記β−ジカルボニルマイケル供与体は、分子当り8つの作用基を有する、ペンタエリトリトールテトラアセトアセテート、およびエトキシ化またはプロポキシ化ペンタエリトリトールテトラアセトアセテートよりなる群から選ばれた1種以上を含んでもよい。
あるいは、前記β−ジカルボニルマイケル供与体は、マロン酸エステル、o−アセト酢酸アニシジド、o−アセト酢酸トルイジド、N,N−ジメチルアセト酢酸アミド、メチルシアノアセテート、エチルシアノアセテート、およびブチルシアノアセテートよりなる群から選ばれた1種以上を含んでもよい。
すなわち、このように所望の物性または反応性に応じて、多様なマイケル供与体を選択して反応させることができる。
【0028】
前記マイケル受容体とマイケル供与体のマイケル付加反応は強塩基によって促進できる。そのような塩基の一例は、十分強く、モノマー混合物内で容易に可溶化できるジアザビシクロウンデセン(DBU)である。その他環状アミジン、例えばジアザビシクロ−ノネン(DBN)およびグアニジンも、この反応を触媒するのに適する。反応媒質内で十分な溶解度を有するカリウムtert−ブトキシドなどのI群アルコキシド塩基も典型的に所望の反応を促進するのに適する。4級ヒドロキシドおよびアルコキシド、例えばテトラブチルアンモニウムヒドロキシドまたはベンジルトリメチルアンモニウムメトキシドは、マイケル付加反応を促進する他の部類の塩基触媒を構成することができる。最終的に、親有機性のアルコキシド強塩基がハライド陰イオン(例えば、4級ハライド)とエポキシド部分間の反応からインサイチュ(in-situ)にて発生できる。
【0029】
前記化学式3のマイケル付加生成物は、前記化学式2のマイケル付加生成物の水酸基の水素を多官能性イソシアネート基で置換して製造することができる。置換する方法は、化学式2のマイケル付加生成物と前記多官能性イソシアネートと多官能性アクリルモノマーを反応器に投与した後、30〜60℃の温度で2〜4時間反応させることにより行われ得る。
また、本発明の前記マイケル付加生成物は、アミン系の相乗効果剤を添加することにより、1級または2級アミンで改質されて空気中の酸素を遮断することができ、これにより光反応性が増進できる。そのような改質の例には、非硬化マイケル付加生成物に1級または2級アミンを混入することが含まれうる。具体的な改質方法としては、化学式2または化学式3のマイケル付加生成物に一定量のジエタノールアミンを添加し、常温で攪拌させた反応生成物を紫外線(UV)に晒す方法を挙げることができる。典型的な1級アミンの例には、エタノールアミン、メチル−1,6−ヘキサンジアミン、3−アミノプロピルトリメトキシシラン、ジアミノプロパン、ベンジルアミン、トリエチレンテトラアミン、イソホロンジアミン、およびこれらの混合物が含まれる。典型的な2級アミンの例には、ジメチルアミン、ジブチルアミン、ジエタノールアミン、ピペリジン、モルホリン、およびこれらの混合物が含まれる。液体マイケル付加生成物が1級または2級アミンで改質される場合、改質アミンは液体非硬化マイケル付加生成物と単純に反応する可能性もある。
【0030】
最後に、本発明は、前記マイケル付加生成物の硬化架橋残留物を含むコーティング膜に関する。本発明のマイケル付加生成物の特徴である内蔵光硬化性により、別途の光開始剤または増感剤を使用することなく一般紫外線に晒して硬化させる方法によってコーティング膜を製造することができる。
【実施例】
【0031】
以下、実施例によって本発明をより詳細に説明する。ところが、下記実施例は説明の目的で本発明を例示するものに過ぎず、本発明の範囲を限定するものではない。
本発明のマイケル付加生成物の一部分を表面に塗布することにより、紫外線光重合を証明した。組成物を10μm以下の厚さで表面に塗布した。樹脂をドローダウン(draw down)技法でガラス基板に塗布した。硬化反応は照射量500mJ/cm2の紫外線を照射して「無粘着」硬化させた。
【0032】
実施例1:水酸基を含むマイケル受容体の合成

【0033】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に2−カルボキシエチルアクリレート(28.826g、0.2 mol)、グリセロールジグリシジルエーテル(20.433g、0.1 mol)、トリエチルアミン(グリセロールジグリシジルエーテルの2wt%)を順次仕込み、60℃に昇温して維持しながら4時間重合禁止剤なしで反応させた。
反応の後、室温に冷却して分液漏斗に移し、残っている触媒を中性化させるために5%HCl水溶液を添加して除去した後、さらに蒸留水で2〜3回水洗を繰り返し行い、50℃で減圧して透明な液体状の水酸基を含むマイケル受容体を得た。マイケル受容体の生成物を分離・分取して副反応物を除去した主生成物を得た。
実施例1で得たマイケル受容体の生成物のFT−IRモニタリング結果を図1に示し、1H−NMRスペクトルを図2に示し、13C−NMRスペクトルを図3に示し、prep−LC結果を図4に示した。
【0034】
prep-LC(収率): 83%
IR (KBr, cm-1) : 3421 (-OH), 2919 (脂肪族 C-H), 1727 (C=O), 1635 & 1618 (C=C), 1186 & 1122 (C-O-C), 984 (=CH2(ねじれ振動))
1H-NMR (CDCl3, 300 MHz), δ (ppm) : 5.80〜6.33 (m, 3H, -CH=CH2), 4.13 & 4.31〜4.41 (m, 5H, -CH2CHOHCH2OOCCH2CH2-), 3.98 (m, 1H, -CH2CHOHCH2-), 3.55 & 3.70 (m, 4H, -CH2OCH2-), 2.61〜2.72 (m, 2H, -CH2COO-)
13C-NMR (CDCl3, 75 MHz), δ (ppm) : 173.63 (-CH2COO-), 165.99 (CH2=CHCOO-), 131.20 (CH2=CH-), 127.97 (CH2=CH-), 65.14〜73.05 (-COOCH2CHOHCH2OCH2CHOH-), 59.83 (CH2=CHCOOCH2-), 33.18 (CH2=CHCOOCH2CH2-)
【0035】
実施例2:水酸基を含むマイケル受容体の合成

【0036】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に2−カルボキシエチルアクリレート(28.826g、0.2 mol)、1,4−シクロヘキサンジメタノールジグリシジルエーテル(25.634g、0.1 mol)、トリエチルアミン(グリセロールジグリシジルエーテルの2wt%)を順次仕込み、60℃に昇温して維持しながら4時間重合禁止剤なしで反応させた。
反応の後、室温に冷却して分液漏斗に移し、残っている触媒を中性化させるために5%HCl水溶液を添加して除去した後、さらに蒸留水で2〜3回水洗を繰り返し行い、50℃で減圧して透明な液体状の水酸基を含むマイケル受容体を得た。マイケル受容体の生成物を分離・分取して副反応物を除去した主生成物を得た。
実施例2で得たマイケル受容体の生成物のFT−IRモニタリング結果を図5に示し、1H−NMRスペクトルを図6に示し、13C−NMRスペクトルを図7に示し、prep−LC結果を図8に示した。
【0037】
prep-LC(収率): 73%
IR (KBr, cm-1) : 3421 (-OH), 2919 (脂肪族 C-H), 1727 (C=O), 1635 & 1618 (C=C), 1186 & 1122 (C-O-C), 984 (=CH2(ねじれ振動))
1H-NMR (CDCl3, 300 MHz), δ (ppm) : 5.80〜6.33 (m, 3H, -CH=CH2), 4.32〜4.40 (m, 2H, -COOCH2CH2COO-), 3.91〜4.17 (m, 3H, -COOCH2CHOHCH2-), 3.22〜3.57 (m, 4H, -CHOHCH2OCH2-), 2.60〜2.68 (m, 2H, -CH2COO-), 0.85〜2.60 (m, 5H, -CHCH2CH2CH-(cyclohexane))
13C-NMR (CDCl3, 75 MHz), δ (ppm) : 173.54 (-CH2COO-), 165.54 (CH2=CHCOO-), 130.93 (CH2=CH-), 127.54 (CH2=CH-), 68.13〜74.42 (-COOCH2CHOHCH2OCH2CH-), 59.41 (CH2=CHCOOCH2-), 37.53 (cyclohexane, -CHCH2-), 33.00 (-CH2COO-), 28.72 (cyclohexane, -CHCH2CH2CH-)
【0038】
実施例3:内蔵光硬化型マイケル付加生成物の合成

【0039】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に、実施例1の水酸基を含むマイケル受容体(20.19g、0.04 mol)、エチルアセトアセテート(2.64g、0.02 mol)、グリシジルメタクリレート(0.46g、2wt%)およびテトラブチルアンモニウムブロマイド(0.12g、0.5wt%)を置いた。反応器内で機械的攪拌器を用いて適切に攪拌させながら配合した。反応器内の反応物を1℃/分の速度で80℃まで加熱し、3時間維持した。3時間後、樹脂を反応器から排出し、冷却させて内蔵光硬化型マイケル付加生成物を得た。
マイケル付加生成物を10μmの厚さでガラス基板に塗布し、照射量500mJ/cm2で露出させて「無粘着」硬化させた。硬化した被覆層は、柔らかく、艶が出るうえ、軟質であった。
【0040】
IR (KBr, cm-1) : 3421 (-OH), 2919 (脂肪族 C-H), 1727 (C=O), 1635 & 1618 (C=C), 1186 & 1122 (C-O-C), 984 (=CH2(ねじれ振動))
13C-NMR (CDCl3, 75 MHz), δ (ppm) : 208.7 (CH3C=OC-), 173.63 (-CH2COO-), 172.7 (-CCOOCH2CH3), 165.99 (CH2=CHCOO-), 131.20 (CH2=CH-), 127.97 (CH2=CH-), 65.14〜73.05 (-COOCH2CHOHCH2OCH2CHOH-), 61.6 (-COOCH2CH3), 59.83 (-COOCH2CH2COO-), 33.18 (-COOCH2CH2COO-), 26.9〜28.4 (-OOCCH2CH2CCH2CH2COO-), 25.9 (CH3C=OC-), 14.1 (-COOCH2CH3)
【0041】
実施例4:内蔵光硬化型付加生成物の合成

【0042】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に、実施例2の水酸基を含むマイケル受容体(21.78g、0.04 mol)、エチルアセトアセテート(2.64g、0.02 mol)、グリシジルメタクリレート(0.50g、2wt%)およびテトラブチルアンモニウムブロマイド(0.12g、0.5wt%)を置いた。反応器内で機械的攪拌器を用いて適切に攪拌させながら配合した。反応器内の反応物を1℃/分の速度で80℃まで加熱し、3時間維持した。3時間の後、樹脂を反応器から排出し、冷却させて内蔵光硬化型マイケル付加生成物を得た。
マイケル付加生成物を10μmの厚さでガラス基板に塗布し、照射量500mJ/cm2で露出させて「無粘着」硬化させた。硬化した被覆層は、柔らかく、艶が出るうえ、軟質であった。
【0043】
IR (KBr, cm-1) : 3421 (-OH), 2919 (脂肪族 C-H), 1727 (C=O), 1635 & 1618 (C=C), 1186 & 1122 (C-O-C), 984 (=CH2(ねじれ振動))
13C-NMR (CDCl3, 75 MHz), δ (ppm) : 208.7 (CH3C=OC-), 173.54 (-CH2COO-), 172.7 (-CCOOCH2CH3), 165.54 (CH2=CHCOO-), 130.93 (CH2=CH-), 127.54 (CH2=CH-), 68.13〜74.42 (-COOCH2CHOHCH2OCH2CH-), 61.6 (-COOCH2CH3), 59.41 (-COOCH2CH2COO-), 37.53 (cyclohexane, -CHCH2-), 33.00 (-CH2COO-), 28.72 (cyclohexane, -CHCH2CH2CH-), 25.9 (CH3C=OC-), 14.1 (-COOCH2CH3)
【0044】
実施例5:内蔵光硬化型マイケル付加生成物の合成

【0045】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に、実施例3のマイケル付加生成物(30g、0.027 mol)、アセトン50gおよびジブチル錫ジラウレート0.1gを置いた。反応器内で機械的攪拌器を用いて適切に攪拌させ、20分にわたって加熱させて温度を45℃に昇温させた。温度を45℃に維持させながらイソホロンジイソシアネート(35.88g、0.161 mol)を1時間にわたって滴下した。イソホロンジイソシアネートの添加後、温度を3時間にわたって60℃に昇温した。
前記反応はFT−IRでモニタリングした。3400cm-1(−OHバンド)における強度が一定の最小値となったときまで反応混合物を45〜50℃に降温させた。その後、ペンタエリトリトールトリアクリレート(48.02g、0.161 mol)を添加し、反応混合物をさらに攪拌し加熱した。ゲル化を防止するためにフェノチアジン0.01gを本段階の間添加した。
前記反応はFT−IRでモニタリングした。2300cm-1(−NCOバンド)における強度が一定の最小値となったとき、アセトンを60℃、圧力100mmHgの真空蒸留で除去してウレタンアクリレートタイプのマイケル付加生成物を得た。
マイケル付加生成物を10μmの厚さでガラス基板に塗布し、照射量500mJ/cm2で露出させて「無粘着」硬化させた。硬化した被覆層は、柔らかく、艶が出るうえ、硬質であった。
【0046】
実施例6:内蔵光硬化型マイケル付加生成物の合成

【0047】
還流冷却器、窒素流入器、攪拌器および加熱装置付きの4口ガラスフラスコ反応器内に、実施例3のマイケル付加生成物(30g、0.025 mol)、アセトン50gおよびジブチル錫ジラウレート0.1gを置いた。反応器内で機械的攪拌器を用いて適切に攪拌させ、20分にわたって加熱させて温度を45℃に昇温させた。温度を45℃に維持させながらイソホロンジイソシアネート(32.81g、0.148 mol)を1時間にわたって滴下した。イソホロンジイソシアネートの添加後、温度を3時間にわたって60℃に昇温した。
前記反応はFT−IRでモニタリングした。3400cm-1(−OHバンド)における強度が一定の最小値となったときまで反応混合物を45〜50℃に降温させた。その後、ペンタエリトリトールトリアクリレート(48.02g、0.148 mol)を添加し、反応混合物をさらに攪拌し加熱した。ゲル化を防止するためにフェノチアジン0.01gを本段階の間添加した。
前記反応はFT−IRでモニタリングした。2300cm-1(−NCOバンド)における強度が一定の最小値となったとき、アセトンを60℃、圧力100mmHgの真空蒸留によって除去してウレタンアクリレートタイプのマイケル付加生成物を得た。
マイケル付加生成物を10μmの厚さでガラス基板に塗布し、照射量500mJ/cm2で露出させて「無粘着」硬化させた。硬化した被覆層は、柔らかく、艶が出るうえ、硬質であった。
【特許請求の範囲】
【請求項1】
下記化学式1で表示されるマイケル受容体。
[化学式1]

(前記化学式1において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1およびR2は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数である。)
【請求項2】
前記マイケル受容体は下記化学式8で表示されることを特徴とする、請求項1に記載のマイケル受容体。
[化学式8]

【請求項3】
前記マイケル受容体は下記化学式9で表示されることを特徴とする、請求項1に記載のマイケル受容体。
[化学式9]

【請求項4】
下記化学式4または化学式5で表示される、カルボン酸基を含むアクリレートと、下記化学式6で表示されるエポキシ樹脂とを反応させ、下記化学式1で表示されるマイケル受容体を製造する方法。
[化学式1]

(前記化学式1において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1およびR2は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数である。)
[化学式4]

[化学式5]

(前記化学式4および化学式5において、Xはアルキレン基であり、R1は水素または炭素数1〜6のアルキル基であり、 Yはシクロアルキレン基、フェニル基、エチレン基またはカプロラクトン基であり、nは2〜3の整数である。)
[化学式6]

(前記化学式6において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、nは0または1〜10の整数である。)
【請求項5】
前記化学式4または化学式5で表示される、カルボン酸基を含むアクリレートとしては、2−カルボキシエチルアクリレート、2−カルボキシプロピルアクリレート、2−アクリロイルオキシエチルフタレート、2−アクリロイルオキシエチルヘキサヒドロフタレート、2−アクリロイルオキシプロピルフタレート、エチレンオキシド(EO)付加コハク酸アクリレート、ω−カルボキシポリカプロラクトン酸アクリレート、またはこれらのメタアクリレートであることを特徴とする、請求項4に記載のマイケル受容体の製造方法。
【請求項6】
前記化学式6で表示されるエポキシ樹脂は、1,4−ブタンジオールジグリシジルエーテル、1,4−シクロヘキサンジメタノールジグリシジルエーテル、ジグリシジル1,2−シクロヘキサンジカルボキシレート、グリセロールジグリシジルエーテル、ネオペンチルグリコールジグリシジルエーテル、ペンタエリトリトールジグリシジルエーテル、エチレングリコールジグリシジルエーテル、プロピレングリコールジグリシジルエーテル、1,6−ヘキサンジオールジグリシジルエーテル、トリメチロールプロパンジグリシジルエーテル、およびジエチレングリコールジグリシジルエーテルよりなる群から選ばれた1種以上を含むことを特徴とする、請求項4に記載のマイケル受容体の製造方法。
【請求項7】
前記反応はオニウム塩または3級アミンによって促進されることを特徴とする、請求項4に記載のマイケル受容体の製造方法。
【請求項8】
下記化学式2の構造で表示されるマイケル付加生成物。
[化学式2]

(前記化学式2において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数であり、R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基である。)
【請求項9】
下記化学式3の構造で表示されるマイケル付加生成物。
[化学式3]

(前記化学式3において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数であり、R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基であり、R4はそれぞれ独立に水素または多官能性イソシアネート基である。)
【請求項10】
前記多官能性イソシアネート基は脂肪族ジイソシアネート、芳香族ジイソシアネート、またはこれらの混合物に由来した構造または作用基であることを特徴とする、請求項9に記載のマイケル付加生成物。
【請求項11】
前記脂肪族ジイソシアネートは、ヘキサメチレンジイソシアネート、4,4−ジシクロヘキシルメタンジイソシアネート、1,4−テトラメチレンジイソシアネート、1,10−デカメチレンジイソシアネート、イソホロンジイソシアネート、および1,4−シクロヘキサンジイソシアネートよりなる群から選ばれた1種以上を含むことを特徴とする、請求項10に記載のマイケル付加生成物。
【請求項12】
前記芳香族ジイソシアネートは、トルエン−2,4−ジイソシアネート、トルエン−2,6−ジイソシアネート、1,5−ナフタレンジイソシアネート、4−メトキシ−1,3−フェニレンジイソシアネート、4−クロロ−1,3−フェニレンジイソシアネート、2,4−ジメチル−1,3−フェニレンジイソシアネート、4,4−ジイソシアネートジフェニルエーテル、ベンジジンジイソシアネート、4,4’−ジイソシアネートジベンジル、およびメチレン−ビス(4−フェニルイソシアネート)−1,3−フェニレンジイソシアネートよりなる群から選ばれた1種以上を含むことを特徴とする、請求項10に記載のマイケル付加生成物。
【請求項13】
前記多官能性イソシアネート基の一部または全部は多価アクリル基を含むことを特徴とする、請求項9に記載のマイケル付加生成物。
【請求項14】
前記多官能性イソシアネート基の一部または全部は下記化学式7で表示されることを特徴とする、請求項9に記載のマイケル付加生成物。
[化学式7]

【請求項15】
β−ジカルボニルマイケル供与体と請求項1のマイケル受容体とを反応させ、下記化学式2で表示されるマイケル付加生成物を製造する、マイケル付加生成物の製造方法。
[化学式2]

(前記化学式2において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数であり、R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基である。)
【請求項16】
前記β−ジカルボニルマイケル供与体は、β−ケトエステル、β−ジケトン、β−ケトアミド、およびβ−ケトアニリドよりなる群から選ばれた1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項17】
前記β−ジカルボニルマイケル供与体は、アセトアセテート、2,4−ペンタンジオン、アセト酢酸アニリド、およびアセト酢酸アミドよりなる群から選択された1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項18】
前記β−ジカルボニルマイケル供与体は、分子当り2つの作用基を有する、メチルアセトアセテート、エチルアセトアセテート、t−ブチルアセトアセテート、アリルアセトアセテート、2−エチルヘキシルアセトアセテート、ラウリルアセトアセテート、および2−アセトアセトキシエチルメタクリレート(AAEM)よりなる群から選ばれた1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項19】
前記β−ジカルボニルマイケル供与体は、分子当り4つの作用基を有する、1,4−ブタンジオールジアセトアセテート、1,6−ヘキサンジオールジアセトアセテート、ネオペンチルグリコールジアセトアセテート、シクロヘキサンジメタノールジアセトアセテート、およびエトキシ化ビスフェノールAジアセトアセテートよりなる群から選ばれた1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項20】
前記β−ジカルボニルマイケル供与体は、分子当り6つの作用基を有する、トリメチロールプロパントリアセトアセテート、グリセロールトリアセトアセテート、ポリカプロラクトントリアセトアセテート、エトキシ化またはプロポキシ化トリメチロールプロパントリアセトアセテート、およびエトキシ化またはプロポキシ化グリセロールトリアセトアセテートよりなる群から選ばれた1種以上を含むことを特徴とする、 請求項15に記載のマイケル付加生成物の製造方法。
【請求項21】
前記β−ジカルボニルマイケル供与体は、分子当り8つの作用基を有する、ペンタエリトリトールテトラアセトアセテート、およびエトキシ化またはプロポキシ化ペンタエリトリトールテトラアセトアセテートよりなる群から選ばれた1種以上を含むことを特徴とする、 請求項15に記載のマイケル付加生成物の製造方法。
【請求項22】
前記β−ジカルボニルマイケル供与体は、マロン酸エステル、o−アセト酢酸アニシジド、o−アセト酢酸トルイジド、N,N−ジメチルアセト酢酸アミド、メチルシアノアセテート、エチルシアノアセテート、およびブチルシアノアセテートよりなる群から選ばれた1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項23】
前記マイケル受容体と前記β−ジカルボニルマイケル供与体のマイケル付加反応がジアザビシクロウンデセン(DBU)、ジアザビシクロ−ノネン(DBN)、グアニジン、またはカリウムtert−ブトキシドによって促進されることを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項24】
請求項9のマイケル付加生成物に1級または2級アミンを混入して改質することを特徴とする、マイケル付加生成物の改質方法。
【請求項25】
請求項9〜14のいずれか1項に記載のマイケル付加生成物の硬化架橋残留物を含むコーティング膜。
【請求項26】
前記マイケル付加生成物が紫外線に晒されることにより硬化することを特徴とする、請求項25に記載のコーティング膜。
【請求項1】
下記化学式1で表示されるマイケル受容体。
[化学式1]

(前記化学式1において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1およびR2は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数である。)
【請求項2】
前記マイケル受容体は下記化学式8で表示されることを特徴とする、請求項1に記載のマイケル受容体。
[化学式8]

【請求項3】
前記マイケル受容体は下記化学式9で表示されることを特徴とする、請求項1に記載のマイケル受容体。
[化学式9]

【請求項4】
下記化学式4または化学式5で表示される、カルボン酸基を含むアクリレートと、下記化学式6で表示されるエポキシ樹脂とを反応させ、下記化学式1で表示されるマイケル受容体を製造する方法。
[化学式1]

(前記化学式1において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1およびR2は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数である。)
[化学式4]

[化学式5]

(前記化学式4および化学式5において、Xはアルキレン基であり、R1は水素または炭素数1〜6のアルキル基であり、 Yはシクロアルキレン基、フェニル基、エチレン基またはカプロラクトン基であり、nは2〜3の整数である。)
[化学式6]

(前記化学式6において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、nは0または1〜10の整数である。)
【請求項5】
前記化学式4または化学式5で表示される、カルボン酸基を含むアクリレートとしては、2−カルボキシエチルアクリレート、2−カルボキシプロピルアクリレート、2−アクリロイルオキシエチルフタレート、2−アクリロイルオキシエチルヘキサヒドロフタレート、2−アクリロイルオキシプロピルフタレート、エチレンオキシド(EO)付加コハク酸アクリレート、ω−カルボキシポリカプロラクトン酸アクリレート、またはこれらのメタアクリレートであることを特徴とする、請求項4に記載のマイケル受容体の製造方法。
【請求項6】
前記化学式6で表示されるエポキシ樹脂は、1,4−ブタンジオールジグリシジルエーテル、1,4−シクロヘキサンジメタノールジグリシジルエーテル、ジグリシジル1,2−シクロヘキサンジカルボキシレート、グリセロールジグリシジルエーテル、ネオペンチルグリコールジグリシジルエーテル、ペンタエリトリトールジグリシジルエーテル、エチレングリコールジグリシジルエーテル、プロピレングリコールジグリシジルエーテル、1,6−ヘキサンジオールジグリシジルエーテル、トリメチロールプロパンジグリシジルエーテル、およびジエチレングリコールジグリシジルエーテルよりなる群から選ばれた1種以上を含むことを特徴とする、請求項4に記載のマイケル受容体の製造方法。
【請求項7】
前記反応はオニウム塩または3級アミンによって促進されることを特徴とする、請求項4に記載のマイケル受容体の製造方法。
【請求項8】
下記化学式2の構造で表示されるマイケル付加生成物。
[化学式2]

(前記化学式2において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数であり、R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基である。)
【請求項9】
下記化学式3の構造で表示されるマイケル付加生成物。
[化学式3]

(前記化学式3において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数であり、R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基であり、R4はそれぞれ独立に水素または多官能性イソシアネート基である。)
【請求項10】
前記多官能性イソシアネート基は脂肪族ジイソシアネート、芳香族ジイソシアネート、またはこれらの混合物に由来した構造または作用基であることを特徴とする、請求項9に記載のマイケル付加生成物。
【請求項11】
前記脂肪族ジイソシアネートは、ヘキサメチレンジイソシアネート、4,4−ジシクロヘキシルメタンジイソシアネート、1,4−テトラメチレンジイソシアネート、1,10−デカメチレンジイソシアネート、イソホロンジイソシアネート、および1,4−シクロヘキサンジイソシアネートよりなる群から選ばれた1種以上を含むことを特徴とする、請求項10に記載のマイケル付加生成物。
【請求項12】
前記芳香族ジイソシアネートは、トルエン−2,4−ジイソシアネート、トルエン−2,6−ジイソシアネート、1,5−ナフタレンジイソシアネート、4−メトキシ−1,3−フェニレンジイソシアネート、4−クロロ−1,3−フェニレンジイソシアネート、2,4−ジメチル−1,3−フェニレンジイソシアネート、4,4−ジイソシアネートジフェニルエーテル、ベンジジンジイソシアネート、4,4’−ジイソシアネートジベンジル、およびメチレン−ビス(4−フェニルイソシアネート)−1,3−フェニレンジイソシアネートよりなる群から選ばれた1種以上を含むことを特徴とする、請求項10に記載のマイケル付加生成物。
【請求項13】
前記多官能性イソシアネート基の一部または全部は多価アクリル基を含むことを特徴とする、請求項9に記載のマイケル付加生成物。
【請求項14】
前記多官能性イソシアネート基の一部または全部は下記化学式7で表示されることを特徴とする、請求項9に記載のマイケル付加生成物。
[化学式7]

【請求項15】
β−ジカルボニルマイケル供与体と請求項1のマイケル受容体とを反応させ、下記化学式2で表示されるマイケル付加生成物を製造する、マイケル付加生成物の製造方法。
[化学式2]

(前記化学式2において、Xは炭素数1〜6のアルキレン基または炭素数3〜10のシクロアルキレン基であり、R1、R1’、R2およびR2’は同一であっても相違してもよく、水素または炭素数1〜6のアルキル基であり、nは0または1〜10の整数であり、R3は炭素数1〜12のアルキル基、ベンジル基、ベンゾイル基、アクリル基またはアミド基である。)
【請求項16】
前記β−ジカルボニルマイケル供与体は、β−ケトエステル、β−ジケトン、β−ケトアミド、およびβ−ケトアニリドよりなる群から選ばれた1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項17】
前記β−ジカルボニルマイケル供与体は、アセトアセテート、2,4−ペンタンジオン、アセト酢酸アニリド、およびアセト酢酸アミドよりなる群から選択された1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項18】
前記β−ジカルボニルマイケル供与体は、分子当り2つの作用基を有する、メチルアセトアセテート、エチルアセトアセテート、t−ブチルアセトアセテート、アリルアセトアセテート、2−エチルヘキシルアセトアセテート、ラウリルアセトアセテート、および2−アセトアセトキシエチルメタクリレート(AAEM)よりなる群から選ばれた1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項19】
前記β−ジカルボニルマイケル供与体は、分子当り4つの作用基を有する、1,4−ブタンジオールジアセトアセテート、1,6−ヘキサンジオールジアセトアセテート、ネオペンチルグリコールジアセトアセテート、シクロヘキサンジメタノールジアセトアセテート、およびエトキシ化ビスフェノールAジアセトアセテートよりなる群から選ばれた1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項20】
前記β−ジカルボニルマイケル供与体は、分子当り6つの作用基を有する、トリメチロールプロパントリアセトアセテート、グリセロールトリアセトアセテート、ポリカプロラクトントリアセトアセテート、エトキシ化またはプロポキシ化トリメチロールプロパントリアセトアセテート、およびエトキシ化またはプロポキシ化グリセロールトリアセトアセテートよりなる群から選ばれた1種以上を含むことを特徴とする、 請求項15に記載のマイケル付加生成物の製造方法。
【請求項21】
前記β−ジカルボニルマイケル供与体は、分子当り8つの作用基を有する、ペンタエリトリトールテトラアセトアセテート、およびエトキシ化またはプロポキシ化ペンタエリトリトールテトラアセトアセテートよりなる群から選ばれた1種以上を含むことを特徴とする、 請求項15に記載のマイケル付加生成物の製造方法。
【請求項22】
前記β−ジカルボニルマイケル供与体は、マロン酸エステル、o−アセト酢酸アニシジド、o−アセト酢酸トルイジド、N,N−ジメチルアセト酢酸アミド、メチルシアノアセテート、エチルシアノアセテート、およびブチルシアノアセテートよりなる群から選ばれた1種以上を含むことを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項23】
前記マイケル受容体と前記β−ジカルボニルマイケル供与体のマイケル付加反応がジアザビシクロウンデセン(DBU)、ジアザビシクロ−ノネン(DBN)、グアニジン、またはカリウムtert−ブトキシドによって促進されることを特徴とする、請求項15に記載のマイケル付加生成物の製造方法。
【請求項24】
請求項9のマイケル付加生成物に1級または2級アミンを混入して改質することを特徴とする、マイケル付加生成物の改質方法。
【請求項25】
請求項9〜14のいずれか1項に記載のマイケル付加生成物の硬化架橋残留物を含むコーティング膜。
【請求項26】
前記マイケル付加生成物が紫外線に晒されることにより硬化することを特徴とする、請求項25に記載のコーティング膜。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2011−219713(P2011−219713A)
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2010−149353(P2010−149353)
【出願日】平成22年6月30日(2010.6.30)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2009年12月30日 「The Society of Adhesion and Interface,Korea」(ザ ソサイエティ オブ アドヒージョン アンド インターフェイス(大韓民国))発行の刊行物 「Journal of Adhesion and Interface」第10巻第4号第191頁〜第198頁
【出願人】(398043850)コリア リサーチ インスティテュート オブ ケミカル テクノロジー (21)
【Fターム(参考)】
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成22年6月30日(2010.6.30)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2009年12月30日 「The Society of Adhesion and Interface,Korea」(ザ ソサイエティ オブ アドヒージョン アンド インターフェイス(大韓民国))発行の刊行物 「Journal of Adhesion and Interface」第10巻第4号第191頁〜第198頁
【出願人】(398043850)コリア リサーチ インスティテュート オブ ケミカル テクノロジー (21)
【Fターム(参考)】
[ Back to top ]

