多機能の自己集合性高分子ナノシステム
治療薬および/または造影剤を含むナノ粒子のライブラリーのほか、前記ナノ粒子のライブラリーの作成方法、カスタム化方法および使用方法が開示されている。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
この出願は、2008年10月9日出願の米国仮出願番号61/104,056、および2009年9月28日出願の米国仮出願番号61/246,355の利益を主張し、その内容全体が参照によって本明細書に組み込まれる。
【0002】
発明の分野
本発明は、医療用の治療的ナノ粒子の分野に属する。
【背景技術】
【0003】
体内の特定の病変組織および細胞への核酸治療薬の送達は、分子量が大きいこと、負電荷、および特に分解酵素(DNA分解酵素およびRNA分解酵素など)の多い体液中での安定性が比較的低いために、困難である。核酸送達の多くの技術は、静電複合体(リポプレックスおよびポリプレックスなど)を形成する陽イオン性脂質およびポリマーを、負電荷の核酸構成物と共に利用する。これらの陽イオンシステムは、細胞内放出および安定性の欠如のために、(プラスミドDNAでの)遺伝子治療または(低分子干渉RNAでの)RNA干渉療法に対しては効果がない可能性がある。さらに、陽イオン性脂質およびポリマーは、細胞および組織に対して有毒な可能性がある。
【0004】
薬剤耐性は、骨肉腫に対する化学療法の効率における主な障害である。1980年代初めのネオアジュバント療法の導入後、化学療法は骨肉腫患者の予後を改善したが、転帰は5年生存率が約70%で頭打ちとなっている。残り30%の患者は、最終的には、複数タイプの化学療法に対する耐性を生じる。このため、従来の化学療法剤の用量を制限する副作用および多剤耐性(MDR)腫瘍細胞によって生じる治療の失敗の両方を克服するためのニーズがいまだにある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
【課題を解決するための手段】
【0006】
本発明は、治療薬および/または造影剤を含むナノ粒子形成物のカスタム化されたライブラリーを作るための機能成分のモジュラープラットフォームの発見に、少なくとも一部基づいている。従って、1つの態様では、本発明は、カスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a) 治療薬の分配計数を決定すること、b) 治療薬を水溶液に可溶化すること、c) PEGおよび脂肪酸を含む第一の水溶性誘導体化ポリマーを提供すること、d) 可溶化された治療薬と第一の水溶性誘導体化ポリマーを混合し、可溶化された治療薬と第一の水溶性誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、e) PEGおよび第一の水溶性誘導体化ポリマーの脂肪酸とは異なる脂肪酸を含む第二の水溶性誘導体化ポリマーを提供すること、およびf) ステップd) を繰り返して第二のナノ粒子を形成し、それによってカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0007】
一部の実施態様では、治療薬は、約100よりも大きい、約200よりも大きい、約300よりも大きい、約400よりも大きい、約500よりも大きい、約600よりも大きい、約700よりも大きい、約800よりも大きい、約900よりも大きい、または約1000よりも大きい分配計数を持つ。特定の実施態様では、脂肪酸は C14脂肪酸、C15脂肪酸、 C16脂肪酸、 C17脂肪酸、 C18脂肪酸、 C19脂肪酸、 C20脂肪酸、 C21脂肪酸、C22脂肪酸、 C23脂肪酸、 C24脂肪酸、 C25脂肪酸、 C26脂肪酸、 C27脂肪酸、またはC28脂肪酸である。
【0008】
他の実施態様では、治療薬は、約100未満、約90未満、約80未満、約70未満、約60未満、約50未満、約40未満、約30未満、約20未満、約10未満、約5未満、または約1未満の分配計数を持つ。特定の実施態様では、脂肪酸は C2脂肪酸、C3脂肪酸、 C4脂肪酸、 C5脂肪酸、 C6脂肪酸、 C7脂肪酸、 C8脂肪酸、 C9脂肪酸、C10脂肪酸、 C11脂肪酸、 C12脂肪酸、 C13脂肪酸、 C14脂肪酸である。
【0009】
一部の実施態様では、第一および第二の水溶性誘導体化ポリマーは、可溶化された治療薬を取り囲むヒドロゲルの殻を形成する。
【0010】
他の実施態様では、第一および第二の水溶性誘導体化ポリマーは 中性電荷を持つ。特定の実施態様では、第一および第二の水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。
【0011】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーは負電荷を持つ。ある実施態様では、第一および第二の水溶性誘導体化ポリマーは、アルギン酸塩、ヒアルロン酸、ペクチン、またはセルロース誘導体である。
【0012】
一部の実施態様では、方法はさらに、第一および第二の水溶性誘導体化ポリマーに架橋剤を添加して、それによりナノ粒子の安定性を強化することを含む。ある実施態様では、架橋剤はジスルフィド結合形成架橋剤である。特定の実施態様では、ジスルフィド結合形成架橋剤は、シスタミン、2-イミノチオラン、アミノチオラン、グルタチオン、リポ酸、グリオキサル、またはエピクロロヒドリンである。
【0013】
他の実施態様では、架橋剤は二価陽イオンである。ある実施態様では、二価陽イオンは、Ca2+、Mg2+、Ba2+、またはFe2+である。また他の実施態様では、架橋剤は三価陽イオンである。特定の実施態様では、三価陽イオンはAl3+またはFe3+である。
【0014】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーはチオール基で修飾される。他の実施態様では、PEGはチオール基で修飾される。
【0015】
ある実施態様では、PEGは、約1,000ダルトン、約1,500ダルトン、約2,000ダルトン、約2,500ダルトン、約3,000ダルトン、約3,500ダルトン、約4,000ダルトン、約4,500ダルトン、約5,000ダルトン、約6,000ダルトン、約7,000ダルトン、約8,000ダルトン、約9,000ダルトン、または約10,000ダルトンの分子量を持つ。
【0016】
他の実施態様では、PEGは一つの末端に反応性基を含む。ある実施態様では、反応基は、酸、アミン、マレイミド、アクリレート、またはスクシンイミジルカルボキシメチルエステルである。
【0017】
また他の実施態様では、方法は、標的薬剤をPEG上の反応基に結合することをさらに含む。特定の実施態様では、標的薬剤は、核酸、ポリペプチド、多糖、または小分子である。特定の実施態様では、標的薬剤は、葉酸、EGF、FGF、または腫瘍関連抗原MUC1の抗体、cMet受容体、またはCD56 (NCAM)である。
【0018】
一部の実施例では、治療薬は化学療法剤である。特定の実施態様では、化学療法剤は、ドキソルビシン、パクリタキセル、またはタモキシフェンである。
【0019】
また他の実施態様では、方法は、第一および第二の水溶性ポリマーとジエチレントリアミン5酢酸(DTPA)を共役させることをさらに含む。特定の実施態様では、方法は、造影剤をDTPAに結合することをさらに含む。ある実施態様では、造影剤は、64Gd、111In、または125Iである。
【0020】
一部の実施態様では、ライブラリーは、約2、約10、約25、約50、約100、約150、約200、約250、約300、約350、約400、約450、約500、約600、約700、約800、約900、約1,000、約2,000、約3,000、約4,000、約5,000、約6,000、約7,000、約8,000、約9,000、約10,000、の異なるタイプのナノ粒子またはそれ以上を含む。
【0021】
別の態様では、本発明は、カスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a) 疎水性の治療薬を水溶液に可溶化すること、b) ポリエチレングリコール(PEG)およびC14-C28脂肪酸を含む第一の水溶性誘導体化ポリマーを提供すること、c) 可溶化された治療薬と第一の水溶性誘導体化ポリマーを混合し、可溶化された治療薬と第一の水溶性誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、d) PEGおよび第一の水溶性誘導体化ポリマーの脂肪酸とは異なるC14-C28脂肪酸を含む第二の水溶性誘導体化ポリマーを提供すること、およびe) ステップc) を繰り返して第二のナノ粒子を形成し、それによってカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0022】
一部の実施態様では、治療薬は、約100よりも大きい、約200よりも大きい、約300よりも大きい、約400よりも大きい、約500よりも大きい、約600よりも大きい、約700よりも大きい、約800よりも大きい、約900よりも大きい、または約1000よりも大きい分配計数を持つ。
【0023】
特定の実施態様では、脂肪酸はC14脂肪酸、C15脂肪酸、 C16脂肪酸、 C17脂肪酸、 C18脂肪酸、 C19脂肪酸、 C20脂肪酸、 C21脂肪酸、C22脂肪酸、 C23脂肪酸、 C24脂肪酸、 C25脂肪酸、 C26脂肪酸、 C27またはC28脂肪酸である。
【0024】
一部の実施態様では、第一および第二の水溶性誘導体化ポリマーは、可溶化された治療薬を取り囲むヒドロゲルの殻を形成する。
【0025】
他の実施態様では、第一および第二の水溶性誘導体化ポリマーは中性電荷を持つ。特定の実施態様では、第一および第二の水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。
【0026】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーは負電荷を持つ。ある実施態様では、第一および第二の水溶性誘導体化ポリマーは、アルギン酸塩、ヒアルロン酸、ペクチン、またはセルロース誘導体である。
【0027】
一部の実施態様では、本方法はさらに、第一および第二の水溶性誘導体化ポリマーに架橋剤を添加して、それによりナノ粒子の安定性を強化することを含む。ある実施態様では、架橋剤はジスルフィド結合形成架橋剤である。特定の実施態様では、ジスルフィド結合形成架橋剤は、シスタミン、2-イミノチオラン、アミノチオラン、グルタチオン、リポ酸、グリオキサル、またはエピクロロヒドリンである。
【0028】
他の実施態様では、架橋剤は二価陽イオンである。ある実施態様では、二価陽イオンは、Ca2+、Mg2+、Ba2+、またはFe2+である。また他の実施態様では、架橋剤は三価陽イオンである。特定の実施態様では、三価陽イオンはAl3+またはFe3+である。
【0029】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーはチオール基で修飾される。他の実施態様では、PEGはチオール基で修飾される。
【0030】
ある実施態様では、PEGは、約1,000ダルトン、約1,500ダルトン、約2,000ダルトン、約2,500ダルトン、約3,000ダルトン、約3,500ダルトン、約4,000ダルトン、約4,500ダルトン、約5,000ダルトン、約6,000ダルトン、約7,000ダルトン、約8,000ダルトン、約9,000ダルトン、または約10,000ダルトンの分子量を持つ。
【0031】
他の実施態様では、PEGは一つの末端に反応性基を含む。ある実施態様では、反応基は、酸、アミン、マレイミド、アクリレート、またはスクシンイミジルカルボキシメチルエステルである。
【0032】
また他の実施態様では、方法は、標的薬剤をPEG上の反応基に結合することをさらに含む。特定の実施態様では、標的薬剤は、核酸、ポリペプチド、多糖、または小分子である。特定の実施態様では、標的薬剤は、葉酸、EGF、FGF、または腫瘍関連抗原MUC1の抗体、cMet受容体、またはCD56 (NCAM)である。
【0033】
一部の実施例では、治療薬は化学療法剤である。特定の実施態様では、化学療法剤は、ドキソルビシン、パクリタキセル、またはタモキシフェンである。
【0034】
また他の実施態様では、方法は、第一および第二の水溶性ポリマーとジエチレントリアミン5酢酸(DTPA)を共役させることをさらに含む。特定の実施態様では、方法は、造影剤をDTPAに結合することをさらに含む。ある実施態様では、造影剤は、64Gd、111In、または125Iである。
【0035】
一部の実施態様では、ライブラリーは、約2、約10、約25、約50、約100、約150、約200、約250、約300、約350、約400、約450、約500、約600、約700、約800、約900、約1,000、約2,000、約3,000、約4,000、約5,000、約6,000、約7,000、約8,000、約9,000、約10,000、の異なるタイプのナノ粒子またはそれ以上を含む。
【0036】
別の態様では、本発明は、カスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a) 親水性の治療薬を水溶液に可溶化すること、b) ポリエチレングリコール(PEG)およびC2-C14脂肪酸を含む第一の水溶性誘導体化ポリマーを提供すること、c) 可溶化された治療薬と第一の水溶性誘導体化ポリマーを混合し、可溶化された治療薬と第一の水溶性誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、d) PEGおよび第一の水溶性誘導体化ポリマーの脂肪酸とは異なるC2-C14脂肪酸を含む第二の水溶性誘導体化ポリマーを提供すること、およびe) ステップc) を繰り返して第二のナノ粒子を形成し、それによってカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0037】
他の実施態様では、治療薬は、約100未満、約90未満、約80未満、約70未満、約60未満、約50未満、約40未満、約30未満、約20未満、約10未満、約5未満、または約1未満の分配計数を持つ。
【0038】
特定の実施態様では、脂肪酸は C2脂肪酸、C3脂肪酸、 C4脂肪酸、 C5脂肪酸、 C6脂肪酸、 C7脂肪酸、 C8脂肪酸、 C9脂肪酸、C10脂肪酸、 C11脂肪酸、C12脂肪酸、C13脂肪酸、 C14脂肪酸である。
【0039】
一部の実施態様では、第一および第二の水溶性誘導体化ポリマーは、可溶化された治療薬を取り囲むヒドロゲルの殻を形成する。
【0040】
他の実施態様では、第一および第二の水溶性誘導体化ポリマーは中性電荷を持つ。特定の実施態様では、第一および第二の水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。
【0041】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーは負電荷を持つ。ある実施態様では、第一および第二の水溶性誘導体化ポリマーは、アルギン酸塩、ヒアルロン酸、ペクチン、またはセルロース誘導体である。
【0042】
一部の実施態様では、本方法はさらに、第一および第二の水溶性誘導体化ポリマーに架橋剤を添加して、それによりナノ粒子の安定性を強化することを含む。ある実施態様では、架橋剤はジスルフィド結合形成架橋剤である。特定の実施態様では、ジスルフィド結合形成架橋剤は、シスタミン、2-イムノチオラン、アミノチオラン、グルタチオン、リポ酸、グリオキサル、またはエピクロロヒドリンである。
【0043】
他の実施態様では、架橋剤は二価陽イオンである。ある実施態様では、二価陽イオンは、Ca2+、Mg2+、Ba2+、またはFe2+である。また他の実施態様では、架橋剤は三価陽イオンである。特定の実施態様では、三価陽イオンはAl3+またはFe3+である。
【0044】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーはチオール基で修飾される。他の実施態様では、PEGはチオール基で修飾される。
【0045】
ある実施態様では、PEGは、約1,000ダルトン、約1,500ダルトン、約2,000ダルトン、約2,500ダルトン、約3,000ダルトン、約3,500ダルトン、約4,000ダルトン、約4,500ダルトン、約5,000ダルトン、約6,000ダルトン、約7,000ダルトン、約8,000ダルトン、約9,000ダルトン、または約10,000ダルトンの分子量を持つ。
【0046】
他の実施態様では、PEGは一つの末端に反応性基を含む。ある実施態様では、反応基は、酸、アミン、マレイミド、アクリレート、またはスクシンイミジルカルボキシメチルエステルである。
【0047】
また他の実施態様では、方法は、標的薬剤をPEG上の反応基に結合することをさらに含む。特定の実施態様では、標的薬剤は、核酸、ポリペプチド、多糖、または小分子である。特定の実施態様では、標的薬剤は、葉酸、EGF、FGF、または腫瘍関連抗原MUC1の抗体、cMet受容体、またはCD56 (NCAM)である。
【0048】
一部の実施態様では、治療薬は核酸である。特定の実施態様では、核酸は低分子干渉RNA分子、アプタマー、またはリボザイムである。
【0049】
また他の実施態様では、方法は、第一および第二の水溶性ポリマーとジエチレントリアミン5酢酸(DTPA)を共役させることをさらに含む。特定の実施態様では、方法は、造影剤をDTPAに結合することをさらに含む。ある実施態様では、造影剤は、64Gd、111In、または125Iである。
【0050】
一部の実施態様では、ライブラリーは、約2、約10、約25、約50、約100、約150、約200、約250、約300、約350、約400、約450、約500、約600、約700、約800、約900、約1,000、約2,000、約3,000、約4,000、約5,000、約6,000、約7,000、約8,000、約9,000、約10,000、の異なるタイプのナノ粒子またはそれ以上を含む。
【0051】
別の態様では、本発明はカスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a)(i) PEG、(ii) DTPA、および(iii) C14-C28脂肪酸を含む第一の水溶性誘導体化ポリマーを提供し、b) 造影剤と第一の誘導体化ポリマーを混合し、造影剤と第一の誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、c) (i) PEG、 (ii) DTPA、および第一の誘導体化ポリマーの脂肪酸とは異なる(iii) C14-C28脂肪酸を含む第二の水溶性誘導体化ポリマーを提供し、d) ステップb)を繰り返して第二のナノ粒子を形成し、それによりカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0052】
一部の実施態様では、造影剤は、64Gd、111In、または125Iである。他の実施態様では、第一および第二の水溶性誘導体化ポリマー、PEGおよび C14-C28脂肪酸は本明細書に記述された任意のものである。
【0053】
別の態様では、本発明はカスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a)(i) PEG、(ii) DTPA、および(iii) C2-C14脂肪酸を含む第一の誘導体化ポリマーを提供し、b) 造影剤と第一の誘導体化ポリマーを混合し、造影剤と第一の誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、[c)] (i) PEG、 (ii) DTPA、および第一の誘導体化ポリマーの脂肪酸とは異なる(iii) C2-C14脂肪酸を含む第二の誘導体化ポリマーを提供し、[d)] ステップc)を繰り返して第二のナノ粒子を形成し、それによりカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0054】
一部の実施態様では、造影剤は酸化鉄または量子ドットである。他の実施態様では、第一および第二の水溶性誘導体化ポリマー、PEGおよび C2-C14脂肪酸は本明細書に記述された任意のものである。
【0055】
別の態様では、本発明は腫瘍を持つ被験者の治療方法を取り上げており、その方法は、腫瘍サイズまたは腫瘍内の腫瘍細胞数を低減するのに十分な量のナノ粒子を被験者に投与することを含み、ここでナノ粒子は、a) 治療薬、b) 治療薬を取り囲むヒドロゲルの殻(ここでヒドロゲルの殻は(i) C14-C28脂肪酸、(ii)、PEG、および(iii) 架橋剤を含む水溶性誘導体化ポリマーを含む)、およびc) PEGに結合している標的薬剤を含み、その結果、被験者を治療する。
【0056】
一部の実施態様では、水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。特定の実施態様では、水溶性誘導体化ポリマーはデキストランである。ある実施態様では、水溶性誘導体化ポリマーはチオール化デキストランを含む。
【0057】
他の実施態様では、脂肪酸はC16、C18、または C20脂肪酸である。
【0058】
一部の実施例では、被験者は脊椎動物である。ある実施態様では、被験者は哺乳類である。特定の実施態様では、被験者はヒトである。
【0059】
また別の態様では、本発明は被験者の標的ポリペプチドの発現を阻害する方法を取り上げており、その方法は、標的ポリペプチドの発現を阻害するのに十分な量のナノ粒子を被験者に投与することを含み、ここでナノ粒子は、a) 低分子干渉RNA分子、b) 低分子干渉RNA分子を取り囲むヒドロゲルの殻(ヒドロゲルの殻は、(i) C2-C14脂肪酸、(ii)PEG、および(iii)架橋剤を含む水溶性誘導体化ポリマーを含む)、およびc) PEGに結合した標的薬剤を含み、その結果、標的ポリペプチドの発現を阻害する。
【0060】
一部の実施態様では、水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。特定の実施態様では、水溶性誘導体化ポリマーはデキストランである。ある実施態様では、水溶性誘導体化ポリマーはチオール化デキストランを含む。
【0061】
一部の実施例では、被験者は脊椎動物である。ある実施態様では、被験者は哺乳類である。特定の実施態様では、被験者はヒトである。
【0062】
また別の態様では、本発明は、本明細書に記述された任意の方法で作成されるナノ粒子ライブラリーを取り上げている。一部の実施態様では、ライブラリーは、約2、約10、約25、約50、約100、約150、約200、約250、約300、約350、約400、約450、約500、約600、約700、約800、約900、約1,000、約2,000、約3,000、約4,000、約5,000、約6,000、約7,000、約8,000、約9,000、約10,000、の異なるタイプのナノ粒子またはそれ以上を含む。
【0063】
別の態様では、本発明は、本明細書に記述された疾患を治療するための薬剤の製造における、本明細書に記述されたナノ粒子の使用を取り上げている。一部の実施態様では、薬剤は、疾患の治療のための追加的治療薬を含む。
【0064】
定義
本明細書で使用される場合、「約」とは、引用値の前後に± 10%の範囲を持つ数値を意味する。
【0065】
本明細書で使用される場合、「被験者」は、哺乳類、例えば、ヒト、マウス、ラット、モルモット、犬、猫、馬、牛、豚、または猿、チンパンジー、マントヒヒまたは赤毛猿などの人間以外の霊長類である。
【0066】
本明細書で使用される場合、「生分解性」という用語は、自然の生物学的過程(例えば、ヒトなどの脊椎動物)によって成分分子に(例えば、化学的または酵素的に)分解または破壊される物質を指す。
【0067】
本明細書で使用される場合、「生体適合性」という用語は、標的生物の生物学的機能に意図せぬ有毒または有害な影響を持たない物質を指す。
【0068】
本明細書で使用される場合、「ナノ粒子」という用語は、約50 nm〜約1000 nmの範囲の直径を持つ粒子を指す。ナノ粒子には、被験者内に放出され得る治療薬または造影剤を含むことができる粒子を含む。
【0069】
本明細書で使用される場合、「共役した」、「誘導体化」、および「結合した」という用語は互換的に使用され、2つの成分が、例えば化学的共有結合、またはファン・デル・ワールスや疎水的相互作用などの物理的力によって物理的に結合されていることを意味する。2つの成分はまた、例えば、共有結合した原子の鎖などのリンカーを通して、間接的に共役され得る。
【0070】
本明細書で使用される場合、「治療する」「治療すること」または「治療」とは、疾患(例えば、本明細書に記述されている疾患)またはその症状を改善するため、または疾患(例えば、本明細書に記述されている疾患)またはその症状の進行を防止または遅くするために効果的な量、様式(例えば、投与計画)、および/またはモード(例えば、投与経路)の治療薬を投与することを指す。これは、例えば、疾患またはその症状に関連するパラメーターの例えば統計的に有意な程度または当業者が検出できる程度の改善で明らかとなり得る。効果的な量、様式、またはモードは、被験者によって異なることがあり、被験者に合わせることができる。疾患またはその症状の進行を防止または遅くすることにより、罹患したまたは診断された被験者の疾患またはその症状から生じる悪化を、治療によって防止または遅くすることができる。
【0071】
本明細書で記述された組成物と関連して使用される場合、「効果的な量」とは、疾患またはその症状を治療するのに効果的な量である。
【0072】
本明細書で使用される場合、「ポリマー」とは反復するサブユニットで構成される分子を指す。このような分子には、ポリペプチド、ポリヌクレオチド、多糖またはポリアルキレングリコールを含むが、これに限定されない。ポリマーはまた、生分解性および/または生体適合性であり得る。
【0073】
「ポリペプチド」、「ペプチド」、および「タンパク質」という用語は本明細書では互換的に使用され、アミノ酸残基のポリマーを指す。これらの用語は天然アミノ酸ポリマー、および1つ以上のアミノ酸残基が非天然アミノ酸であるアミノ酸ポリマーに適用される。さらに、このようなポリペプチド、ペプチド、およびタンパク質は、アミノ酸残基がペプチド共有結合で結合されている全長タンパク質を含む任意の長さのアミノ酸鎖を含む。
【0074】
「薬剤」または「治療薬」という用語は本明細書で使用される場合、病気または疾患の予防、診断、緩和、治療または治癒に使用される任意の物質を指す。
【0075】
「標的薬剤」という用語は、特異的または選択的に(例えば、非無作為的に)目的標的分子に結合または混成、または相互作用することができるリガンドまたは分子を指す。標的薬剤の例には、核酸分子(例えば、アプタマー、アンチセンス、またはリボザイムなどのリガンド結合RNA分子を含むRNAおよびDNA)、ポリペプチド(例えば、抗原結合タンパク質、受容体リガンド、シグナル・ペプチド、および疎水性膜貫通ドメイン)、抗体(およびその部分)、有機分子(例えば、ビオチン、炭水化物、および糖タンパク質)、および無機分子(例えば、ビタミン)を含むが、これに限定されない。本明細書に記述されたナノ粒子は、このようなさまざまな標的薬剤の1つ以上がそれに付着していることがある。
【0076】
本明細書で使用される場合、「自己集合」、「自己集合した」、または「自己集合性」とは、超音波処理、高圧、膜貫入、または遠心分離などの物理的力を適用することなく、成分が集合してナノ粒子になることを意味する。
【0077】
別段の定義がない限り、本明細書で使用されるすべての技術的および科学的用語は、この発明が属する当業者によって一般的に理解されているものと同じ意味を持つ。本発明の実施または試験において、本明細書に記述されたものと同様または同等の方法および材料を使用できるが、適切な方法および材料を以下に記述する。本明細書で言及したすべての出版物、特許出願、特許、および他の参考文献は、参照によりその全体を本明細書に組み込む。不一致が生じた場合、定義を含めて、本明細書が支配するものとする。さらに、材料、方法、および例は例示目的のみであり制限を意図するものではない。
【発明の効果】
【0078】
本発明の他の特徴および利点は、以下の詳細な説明および請求項で明らかとなる。
【図面の簡単な説明】
【0079】
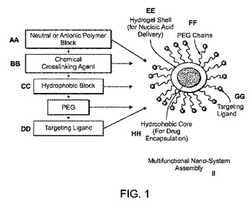
【図1】図 1は多機能ポリマーライブラリーの略図である。
【図2】図 2は、組み合わせデザインのナノプラットフォーム・システムの略図である。
【図3】図 3は、組み合わせ低分子干渉RNAおよび薬物送達のための自己集合ナノプラットフォームの開発に対する組み合わせ方法の略図である。
【図4】図 4は、デキストランのチオレーションの程度を図解したものである。
【図5A】図 5Aは、デキストランの500 MHz 1H NMRスペクトルを図解したものである。
【図5B】図 5Bは、精製後のデキストラン共役ステアリルアミンの500 MHz 1H NMRスペクトルを図解したものである。
【図6】図 6は、MDR1低分子干渉RNA負荷ステアリルアミン・デキストラン修飾ナノ粒子の略図である。
【図7】図 7は、SKOV3細胞内のチオール化デキストランの細胞毒性を図解したものである。
【図8】図 8は、チオール化ポリマーの細胞毒性を図解したものである。細胞毒性は、SKOV3卵巣がん細胞においてさまざまな濃度の高分子誘導体を培養して測定した。相対的細胞生存(%)は、ホルマザン(MTT)分析によって決定した。
【図9】図 9は、チオール化デキストラン誘導体のGFP・低分子干渉RNAサイレンシングの略図である。
【図10A】図 10Aは、MDR1低分子干渉RNA負荷ナノ粒子で処理した後のKHOSR2細胞におけるP-gp発現のウェスタンブロット分析を図解したものである。
【図10B】図 10Bは、MDR1低分子干渉RNA負荷ナノ粒子で処理した後のU-2OSR2細胞におけるP-gp発現のウェスタンブロット分析を図解したものである。
【図11A】図 11Aは、裸MDR1低分子干渉RNAで処理した後のKHOSR2細胞におけるP-gp発現のウェスタンブロット分析を図解したものである。
【図11B】図 11Bは、MDR1低分子干渉RNA負荷ナノ粒子で処理した後のKHOSR2細胞におけるP-gp発現のウェスタンブロット分析を図解したものである。
【図12】図 12は、MDR1低分子干渉負荷ナノ粒子で処理した後のP-gp媒介性取り込みおよび流出の図解である。
【図13A】図 13Aは、ドキソルビシン単独、またはMDR1低分子干渉RNAでナノ粒子負荷したものの、KHOSR2細胞に対する影響の図解である。
【図13B】図 13Bは、ドキソルビシン単独、またはMDR1低分子干渉RNAでナノ粒子負荷したものの、KHOSR2細胞に対する影響の図解である。
【図14】図 14は、ドキソルビシン負荷ステアリルアミン・デキストラン修飾ナノ粒子の略図である。
【図15A】図 15Aは、ドキソルビシン処理単独またはドキソルビシンでナノ粒子負荷した後の、フローサイトメトリー分析によるKHOSおよびKHOSR2の蛍光を図解したものである。
【図15B】図 15Bは、ドキソルビシン処理単独またはドキソルビシンでナノ粒子負荷した後の、フローサイトメトリー分析によるU-2OSおよびU-2OSR2細胞の蛍光を図解したものである。
【図16】図 16は、KHOS およびKHOSR2細胞に対するデキストラン・ナノ粒子の細胞毒性の図解である。
【図17A】図 17Aは、KHOS細胞に対する、ドキソルビシン単独、またはドキソルビシンを負荷したナノ粒子の増殖抑制作用を図解したものである。
【図17B】図 17Bは、KHOSR2細胞に対する、ドキソルビシン単独、またはドキソルビシンを負荷したナノ粒子の増殖抑制作用を図解したものである。
【図17C】図 17Cは、U-2OS細胞に対する、ドキソルビシン単独、またはドキソルビシンを負荷したナノ粒子の増殖抑制作用を図解したものである。
【図17D】図 17Dは、U-2OSR2細胞に対する、ドキソルビシン単独、またはドキソルビシンを負荷したナノ粒子の増殖抑制作用を図解したものである。
【図18A】図 18Aは、薬剤感受性KHOS細胞をドキソルビシン負荷ナノ粒子で処理した時の、PARPの切断のウェスタンブロット分析を図解したものである。
【図18B】図 18Bは、多剤耐性KHOSR2骨肉腫細胞をドキソルビシン負荷ナノ粒子で処理した時の、PARPの切断のウェスタンブロット分析を図解したものである。
【図19A】図 19Aは、ドキソルビシン負荷ナノ粒子で処理したKHOS細胞のカスパーゼ-3/7活性を図解したものである。
【図19B】図 19Bは、ドキソルビシン負荷ナノ粒子で処理したKHOSR2細胞のカスパーゼ-3/7活性を図解したものである。
【発明を実施するための形態】
【0080】
GenBankを含む、本明細書で言及したすべての出版物、特許出願、特許、および他の参考文献は、参照によりその全体を本明細書に組み込む。別段の定義がない限り、本明細書で使用されるすべての技術的および科学的用語は、この発明が属する当業者によって一般的に理解されているものと同じ意味を持つ。不一致が生じた場合、定義を含めて、本明細書が支配するものとする。さらに、材料、方法、および例は例示目的のみであり制限を意図するものではない。本発明の実施または試験において、本明細書に記述されたものと同様または同等の方法および材料を使用できるが、適切な方法および材料を以下に記述する。
【0081】
本発明の他の特徴および利点は、以下の詳細な説明および請求項で明らかとなる。
【0082】
本開示は、病変組織および細胞などの組織および細胞への、治療薬および/または造影剤の送達を促進するのに役立つ多機能、高分子ナノシステムの作成およびカスタム化に関連する。1つの模範的な高分子ナノシステムが図1に概略的に示されている。図1に示されるように、ナノ粒子ライブラリーは、以下の機能成分のうち少なくとも3つに基づいた組み合わせ化学的アプローチを使って作成できる:ポリマー、疎水性または親水性薬剤(脂質)、ポリエチレングリコール(PEG)、架橋剤、および標的薬剤。一部の例では、これらの成分の少なくとも3つが、ナノ粒子を作成するために使用される:ポリマー、疎水性または親水性薬剤、およびPEG。他の例では、5つの成分すべてが使用される。本明細書に記述されるように、特定の成分とその配置は、送達されるべき治療薬および/または造影剤の物理化学的特性に基づいて選択される。
【0083】
ポリマー
本明細書に記述されるナノ粒子には、中性またはアニオン性の水溶性ポリマーなどの水溶性ポリマーを含む。このようなポリマーには、ポリ(スチレンスルホン酸)、ポリグルタミン酸またはアルギニン酸、ポリ(アクリル酸)、ポリ(アスパラギン酸)、ポリ(グルタル酸)、および硫酸デキストラン、カルボキシルメチルセルロース、ヒアルロン酸、アルギン酸ナトリウム、ゼラチンB、硫酸コンドロイチン、および/またはヘパリンなど、同様のイオン化基を持つ天然高分子電解質を含むがこれに限定されない。これらのポリマーは合成、単離、または商業的に入手できる。一部の例では、ポリマーはホモポリマーまたは共重合体である。
【0084】
ある例では、中性または負電荷の水溶性の生分解性および/または生体適合性ポリマーが使用される。これらには、かなり純粋な炭素格子(例えば、グラファイト)、デキストラン、多糖、ポリペプチド、ポリヌクレオチド、アクリレートゲル、ポリ酸無水物、ポリ(ラクタイドcoグリコライド)、ポリテトラフルオロエチレン、ポリヒドロキシアルコネート、 架橋アルギン酸、ゼラチン、コラーゲン、架橋コラーゲン、コラーゲン誘導体(コハク酸化コラーゲンまたはメチル化コラーゲンなど)、架橋ヒアルロン酸、チトサン、チトサン誘導体(メチルピロリドン・チトサンなど)、セルロースおよびセルロース誘導体(酢酸セルロースまたはカルボキシメチルセルロースなど)、デキストラン誘導体(カルボキシメチルデキストランなど)、デンプンおよびデンプンの誘導体(ヒドロキシエチルデンプンなど)、他のグリコサミノグリカンおよびその誘導体、他のポリアニオン性多糖またはその誘導体、ポリ乳酸(PLA)、ポリグリコール酸(PGA)、 ポリ乳酸とポリグリコール酸の共重合体(PLGA)、ラクチド、グリコライド、および他のポリエステル、ポリグリコライド・ホモポリマー、ポリオキサノンおよびポリシュウ酸、ポリ(ビス(p-カルボキシフェノキシ)プロパン)無水物(PCPP)とセバシン酸の共重合体、ポリ(1-グルタミン酸)、ポリ(d-グルタミン酸)ポリアクリル酸、ポリ(dl-グルタミン酸))、ポリ(1-アスパラギン酸)、ポリ(d-アスパラギン酸)、ポリ(dl-アスパラギン酸)、ポリエチレングリコール、上記にポリアミノ酸とポリエチレングリコールの共重合体、コラーゲン様、シルク様、およびシルク・エラスチン様タンパク質などのポリペプチド、ポリカプロラクトン、ポリ(アルキレンコハク酸)、ポリ(ヒドロキシ酪酸)(PHB)、ポリ(ブチレンジグリコール酸)、ナイロン-2/ナイロン-6共重合ポリアミド、ポリジヒドロピラン、ポリホスファゼン、ポリ(オルソエステル)、ポリ(シアノアクリレート)、ポリビニルピロリドン、ポリビニルアルコール、ポリカゼイン、ケラチン、ミオシン、およびフィブリン、シリコンゴム、またはポリウレタンおよび同類のものを含むが、これに限定されない。使用され得る他の中性または負電荷水溶性ポリマーには、アカシア、ゼラチン、デキストラン、アルブミン、アルギン酸/デンプンおよび同類のものなどの天然由来ポリマー、または親水性または疎水性の合成ポリマーを含む。材料は合成、単離することができ、市販されている。
【0085】
本明細書に記述された方法と組成物で使用され得るポリマーの特定の限定されない例には、デキストラン、イヌリン、水溶性デンプン、アルギン酸、セルロース誘導体、ポリ(ビニルアルコール)、単糖と二糖および誘導体、アクリレート誘導体、およびエチレングリコールを含む。
【0086】
疎水性および親水性薬剤
図1に示されるように、本明細書に記述されたナノ粒子は、疎水性治療薬または親水性造影剤を含むことができる。このような例では、ナノ粒子は、C14〜C28脂肪酸などの脂肪酸または脂肪酸誘導体を含み得る。疎水性薬剤の限定されない例には、ステアリン酸、ステアリルアミン、オレイン酸、パルミチン酸、ラウリルアミン、ドデシルアミン、ポリ(プロピレングリコール-メチルエーテルアクリレート、ネオペンチルグリコールメチルエーテルポロポキシレート、ポリカプロラクトン-ジオール(PCL)、およびポリ乳酸グリコール酸-ジオール(PLGA)を含む。
【0087】
送達されるべき治療薬または造影剤が親水性である場合などの他の例では、ナノ粒子はC2〜C14脂肪酸などの脂肪酸または脂肪酸誘導体を含み得る。親水性薬剤の限定されない例には、酢酸、プロピオン酸、酪酸、吉草酸、ヘキサン酸、およびオクタン酸を含む。
【0088】
本明細書に記述された水溶性ポリマーは、疎水性薬剤(例えば、C2〜C28脂肪酸)で誘導体化または共役され得る。ポリマーは、既知の方法を使って脂肪酸に共役することができ、その例は以下に記述されている:Zalipsky et al., Bioconjug. Chem. 8:111 (1997)、Zalipsky et al., Meth. Enzymol. 387:50 (2004)、米国特許 5,631,018、米国特許 5,395,619、米国特許 6,586,001、および米国特許 5,013,556。
【0089】
特定の例では、本明細書に記述されているナノ粒子ライブラリーには、さまざまな程度の脂肪酸飽和度を持つポリマーを含む。例えば、ポリマーの約10%を脂肪酸に共役することができ、ポリマーの約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、または約100%が脂肪酸と共役され得る。
【0090】
架橋剤
図1に示されているように、本明細書に記述されたナノ粒子に含まれ得る別の機能成分には、架橋剤を含む。架橋剤は水溶性ポリマーと反応して、架橋ヒドロゲルおよび相互貫通ネットワーク(IPN)を形成する。本明細書に記述の任意のポリマーを架橋することが知られている任意の架橋剤を使用することができる。
【0091】
架橋剤の限定されない例には、ジスルフィド結合(例えば、アミノチオラン、シスタミン、グルタチオン、2-イムノチオラン、およびリポ酸)およびグリオキサル、エピクロロヒドリンなどの他の共有架橋剤を含む。いかなる理論にも拘束されることを望むものではないが、チオール修飾ポリマーの分子間ジスルフィド架橋は、循環系内などで安定性の強化されたナノ粒子を生成することができるが、腫瘍細胞環境などの高度に還元的な環境では解離する可能性があると考えられている。一部の状況では、共有ジスルフィド架橋は、エンドソーム/リソソームコンパートメント内などで、治療薬の早期放出を防止することによって、細胞内送達を促進し治療薬の流出を克服することができる。
【0092】
架橋剤の他の限定されない例には陽イオンを含む。一部の例では、Ca2+、Mg2+、Ba2+、またはFe2+などの二価陽イオンが使用される。他の状況では、Al3+またはFe3+などの三価陽イオンが使用される。
【0093】
本書に記述の方法および組成物で使用され得る他の架橋剤には、例えば、ゲニピン(Biomaterials 20:1759-72, 1999)、エポキシ化合物、ジアルデヒドデンプン、グルタルアルデヒド、ホルムアルデヒド、ジメチルスベリミデート、カルボジイミド、スクシンイミジル、ジイソシナネート、アクリルアジド、ロイテリン、紫外線照射、脱水熱処理、トリス(ヒドロキシメチル)ホスフィン、アスコルビン酸銅、グルコース・リシンおよび光酸化剤を含む。
【0094】
ポリエチレングリコール
図1に示されるように、本明細書に記述されたナノ粒子はポリエチレングリコール(PEG)を含み得る。本明細書に記述された方法および組成物に使用できるPEGの限定されない例には、約1,000〜約10,000ダルトンの分子量を持つPEGを含む。
【0095】
一部の例では、PEGは本明細書に記述された標的薬剤に結合される。PEGを標的薬剤に結合するには、1つの末端に反応基を持つPEGの誘導体を作成することによってPEGを活性化し得る。多くの活性PEG誘導体が、当技術分野で知られている。活性PEG誘導体の限定されない一例は、PEGのスクシンイミジルコハク酸である(例えば、米国4,179,337を参照)。本明細書に記述された方法に使用され得る活性PEG分子の他の限定されない例には、反応性塩化シアヌル部分、PEGの炭酸スクシンイミジル、PEGのフェニル炭酸塩、PEGのギ酸イミダゾリル誘導体、PEG・カルボキシメチルアジド、PEG・イミドエステル、PEG・ビニルスルホン、PEGの活性エチルスルホン誘導体、PEGのトレシレート、PEG・フェニルグリオキサル、アルデヒド基で活性化されたPEG、PEG・マレイミド、および末端アミノ部分を持つPEGを含む。これらのPEG誘導体およびこのような誘導体の薬剤との共役方法は、当技術分野で知られている(例えば、Zalipsky et al., “Use of Functionalized Poly(Ethylene Glycol)s for Modification of Polypeptides”(Use of Polyethylene Glycol Chemistry. Biotechnical and Biomedical Applications, J. M. Harris, Ed., Plenum Press, New York (1992))を参照、またZalipsky, Adv. Drug Rev. 16:157-182 (1995)も参照)。
【0096】
標的薬剤
図1に示される最終成分は標的薬剤から成り、これは本明細書に記述のようにPEGに結合されている。ある状況では、標的薬剤は特定の生物学的標的に特異的に結合する。生物学的標的の限定されない例には、腫瘍細胞、バクテリア、ウイルス、細胞表面タンパク質、細胞表面受容体、細胞表面多糖、細胞外基質タンパク質、細胞内タンパク質および細胞内核酸を含む。標的薬剤は、例えば、抗体、モノクローナル抗体およびその断片などのさまざまな特異的リガンド、葉酸、マンノース、ガラクトースおよび他の単糖、二糖およびオリゴ糖、およびRGDペプチドであり得る。
【0097】
本明細書に記述されたナノ粒子および方法は、いかなる特定の標的薬剤にも限定されるものではなく、さまざまな標的薬剤を使用し得る。このような標的薬剤の例には、核酸(例えば、RNAおよびDNA)、ポリペプチド(例えば、受容体リガンド、シグナルペプチド、アビジン、タンパク質A、および抗原結合タンパク質)、多糖、ビオチン、疎水性基、親水性基、薬剤および受容体に結合する任意の有機分子を含むがこれに限定されない。一部の例では、本明細書に記述されたナノ粒子は、1つ、2つ、またはそれ以上のさまざまな標的薬剤に共役され得る。例えば、2つ以上の標的薬剤を使用する場合、標的薬剤は類似しても類似していなくてもよい。特定のナノ粒子で2つ以上の標的薬剤を使用することにより、複数の生物学的標的を狙うことができ、または特定の標的に対する親和性を増加させることができる。
【0098】
標的薬剤は、ナノ粒子と多くの方法で結合され得る。例えば、標的薬剤は、ナノ粒子の他の副成分/要素に、短い(例えば、直接カップリング)、中くらい(例えば、SPDP(Pierce Biotechnology, Inc.、イリノイ州ロックフォード)などの小分子二官能性リンカーを使用する)、または長い(例えば、PEG二官能性リンカー(Nektar Therapeutics, Inc.、カリフォルニア州サンカルロス))リンケージで結合(例えば、共有または非共有結合)し得る。また、このような薬剤は、最も外側の高分子層に直接共役され得る。
【0099】
さらに、本明細書に記述されたナノ粒子を生成するために使用されるポリマーは、反応基(例えば、ポリリシン、デキストラミン、硫酸プロファミン、および/またはチトサンなどのアミン基)を取り入れることもできる。反応基は、さまざまな特異的リガンドまたは受容体基(例えば、125I、131I、 I、Br、DTPAなどのさまざまなキレート基で、これは111In、99m-Tc、GD、Mnなどのレポーター重金属、FITCなどの蛍光基、ローダミン、アレクサ、および量子ドットを負荷し得る)および/または他の部分(例えば、リガンド、抗体および/またはその部分)をさらに付着させることを可能にし得る。これらの部分はまた、本明細書に記述のナノ粒子の形成中に、高分子殻に取り込むこともできる。
【0100】
標的薬剤としての抗体
一部の例では、標的薬剤は、抗原結合タンパク質または抗体またはその抗原特異的結合タンパク質部分である。抗体は、さまざまな生物学的標的(例えば、病原体、腫瘍細胞、正常組織)上の抗原または免疫原(例えば、腫瘍、組織、または病原体特異的抗原)を特異的に狙うことを可能にするために生成され得る。このような抗体には、ポリクローナル抗体、モノクローナル抗体またはその抗原結合断片、キメラ抗体、再構築抗体、ヒト化抗体、またはその断片(例えば、Fv、Fab'、Fab、F(ab')2)、または生合成抗体(例えば、単鎖抗体、単一ドメイン抗体(DAB)、Fvs、または単鎖Fvs (scFv)を含むがこれに限定されない。
【0101】
ポリクローナルおよびモノクローナル抗体の製造および使用の方法は、当技術分野ではよく知られており、例としてはHarlow et al., Using Antibodies: A Laboratory Manual: Portable Protocol I. Cold Spring Harbor Laboratory (1998年12月1日)がある。修飾抗体および抗体断片(例えば、キメラ抗体、再構築抗体、ヒト化抗体、またはその断片(例えば、Fab', Fab, F(ab')2断片))、または、生合成抗体(例えば、単鎖抗体、単一ドメイン抗体(DAB)、Fv、単鎖Fv (scFv)、および同類のもの)の製造方法は、当技術分野では知られており、例えば、Zola, Monoclonal Antibodies: Preparation and Use of Monoclonal Antibodies and Engineered Antibody Derivatives, Springer Verlag(2000年12月15日、第一版)に記述されている。
【0102】
一部の例では、抗体は、腫瘍特異的エピトープ(例えば、TAG-72 (Kjeldsen et al., Cancer Res., 48:2214-2220 (1988)、米国5,892,020、5,892,019および5,512,443)、ヒト癌抗原(米国5,693,763、5,545,530、および5,808,005)、骨肉腫細胞からのTP1およびTP3抗原(米国5,855,866)、腺癌細胞からのThomsen-Friedenreich(TF)抗原(米国5,110,911)、ヒト前立腺癌からの「KC-4抗原」(米国4,708,930および4,743,543)、ヒト結腸直腸癌抗原(米国4,921,789)、嚢胞腺癌からのCA125抗原(米国4,921,790)、ヒト乳癌からのDF3抗原(米国4,963,484および5,053,489)、ヒト乳房腫瘍抗原(米国4,939,240)、ヒト黒色腫からのp97 抗原(米国4,918,164)、癌またはオロソムコイド関連抗原(CORA)(米国4,914,021)、ヒト扁平上皮細胞肺癌とは反応するがヒト小細胞肺癌とは反応しないヒト肺癌抗原(米国4,892,935)、ヒト乳癌の糖タンパク質中のT およびTnハプテン(Springer et al., Carbohydr. Res., 178:271-292 (1988))、MSA乳癌糖タンパク質(Tjandra et al., Br. J. Surg., 75:811-817 (1988))、MFGM 乳癌抗原(Ishida et al., Tumor Biol., 10: 12-22 (1989))、DU-PAN-2 膵臓癌抗原(Lan et al., Cancer Res., 45:305-310 (1985))、CA125卵巣癌抗原(Hanisch et al., Carbohydr. Res., 178:29-47 (1988))、およびYH206肺癌抗原(Hinoda et al., Cancer J., 42:653-658 (1988))を認識する。
【0103】
例えば、乳癌細胞を標的とするには、ナノ粒子は、腫瘍関連抗原MUC1、cMet受容体およびCD56 (NCAM)に対する標的薬剤として、葉酸、EGF、FGF、および抗体(または抗体断片)を含み得る。
【0104】
使用され得る他の抗体は、特異的病原体(例えば、レジオネラニューモフィラ 、結核菌、破傷風菌、インフルエンザ菌、淋菌、梅毒トレポネーマ 、炭疽菌、コレラ菌、ライム病ボレリア、ジフテリア菌、黄色ブドウ球菌、ヒトパピローマウィルス、ヒト免疫不全ウイルス、風疹ウイルス、ポリオウィルス) を認識する。
【0105】
本明細書に記述されたナノ粒子に付着可能な抗体またはリガンドには、IL2受容体aに対する抗体、補体系タンパク質C5、CD11a、CD20、TNF-α、T細胞CD3受容体、T細胞VLA4受容体、RSVのFタンパク質、表皮成長因子受容体、血管内皮成長因子、糖タンパク質IIb/IIIa、CD52、および表皮成長因子受容体を含むがこれに限定されない。
【0106】
ナノ粒子への抗体の付着は、本明細書に記述のポリマーの最も外側の層の遊離アミン基への標準共有結合を通して行うことができる(例えば、Torchilin et al. (1987) Hybridoma, 6:229-240; Torchilin, et al., (2001) Biochim. Biophys. Acta,1511:397-411; Masuko, et al., (2005), Biomacromol., 6:800-884参照)。アミン基を通しての共有結合などの、タンパク質共有結合の標準方法が知られている。この方法論は、例えば、Protein Architecture: Interfacing Molecular Assemblies and Immobilization、編集者: Lvov et al. (2000) Chapter 2, pp. 25-54に記述されている。
【0107】
粒子のポリマーコートを活性化するために、遊離アミノ基、カルボキシ基、SH-基、エポキシ基、および/またはリガンド分子と直接ま反応できるか、または例えば、カルボジイミド、SPDP、SMCCおよび/または他の単一および二官能性試薬で事前に活性化した後に反応できる他の基を持つポリマーを使用し得る。または、ポリマーは、当技術分野で周知の方法によって、これらの基の1つを含むように官能化され得る。
【0108】
標的薬剤としてのシグナルペプチド
一部の例では、標的薬剤はシグナルペプチドを含む。これらのペプチドは、周知の技術を使用して、化学的に合成またはクローニング、発現および精製され得る。シグナルペプチドは、本明細書に記述されているナノ粒子を標的とするために、細胞内の慎重に選ばれた領域に使用され得る。一部の状況では、細胞器官およびコンパートメント内のナノ粒子を標的とすることには、特定のアミノ酸配列が関与している。例えば、シグナルペプチドは、本明細書に記述のナノ粒子をミトコンドリア内に移動させ得る。他の例では、核局在化シグナルが使用される。
【0109】
標的薬剤としての核酸
他の例では、標的薬剤は核酸(例えば、RNAまたはDNA)である。一部の例では、核酸標的薬剤は、塩基対合によって特定の核酸(例えば、染色体DNA、mRNA、またはリボソームRNA)とハイブリッド形成するよう設計されている。他の状況では、核酸はリガンドまたは生物学的標的に結合する。例えば、核酸は、逆転写酵素、HIVのRevまたはTatタンパク質(Tuerk et al., Gene, 137(1):33-9 (1993))、ヒト成長因子(Binkley et al., Nuc. Acids Res., 23(16):3198-205 (1995))、または、血管内皮成長因子(Jellinek et al., Biochem., 83(34): 10450-6 (1994))を結合できる。リガンドに結合する核酸は、SELEX手法(例えば、米国5,475,096、5,270,163、および5,475,096、およびWO 97/38134、WO 98/33941、および WO 99/07724を参照)などの既知の方法で特定できる。標的薬剤はまた、特定の配列に結合するアプタマーでもあり得る。
【0110】
アンチセンスおよびリボザイム
本明細書に記述された方法に有用な他の薬剤は核酸であり、アンチセンス分子、または標的ポリペプチドをコードしているmRNAを特異的にハイブリッド形成する触媒的核酸分子(例えば、リボザイム)を含む。アンチセンス構成物には、標的ポリペプチドのcDNAコード配列またはmRNAの少なくとも一部の逆補体、標的ポリペプチドcDNA、または遺伝子配列またはその隣接領域を含み、従ってmRNAとハイブリッド形成し得る。
【0111】
導入される配列は全長cDNAまたは遺伝子またはその補体である必要はなく、転換される細胞タイプで見られる相当配列と完全に相同である必要はない。アンチセンス分子は、当技術分野で周知の技術を使って作ることができる(例えば、Agrawal, Methods in Molecular Biology, Humana Press Inc., 1993, Vol. 20 (“Protocols for Oligonucleotides and Analogs”)を参照)。
【0112】
アンチセンス分子は別の分子(例えば、ペプチド、ハイブリッド形成誘発架橋剤、輸送剤、アプタマー、またはハイブリッド形成誘発切断剤)と共役されることがある。細胞による分子の取り込みを促進する標的部分もまた含まれ得る。標的部分は、細胞表面上に存在する分子を認識する抗体またはその断片などの、特異的結合分子であり得る。
【0113】
または、薬剤は、リボザイム(高度に特異的なエンドリボヌクレアーゼ活性を持つ合成RNA分子)などの触媒核酸である。リボザイムの製造および使用は、例えば、米国4,987,071および米国5,543,508に公開されている。リボザイムは合成して、細胞または被験者に投与するか、または発現ベクター上にコード化することができ、このベクターからリボザイムが標的細胞内で合成される(例えば、WO 9523225、およびBeigelman et al., Nucl. Acids Res. 23:4434-42, 1995を参照)。触媒活性を持つオリゴヌクレオチドの例は、例えば、WO 9506764 および WO 9011364、およびSarver et al., Science 247:1222-1225, 1990に記述されている。アンチセンスRNA内へのリボザイム配列の封入は、アンチセンスRNAに結合する内因性mRNA分子が切断され、次に内因性遺伝子発現のアンチセンス阻害が促進されるように、アンチセンスRNAにRNA切断活性を与えるために使用し得る。
【0114】
RNA干渉
標的ポリペプチドをコードしている遺伝子の発現を停止させることのできる二本鎖核酸分子も、本明細書に記述された方法の薬剤として使用され得る。RNA干渉(RNAi)は転写後遺伝子サイレンシングの機序であり、これにおいて対象遺伝子(またはコード領域)に対応する二本鎖RNA(dsRNA)が細胞または生物に導入され、対応するmRNAの分解が生じる。RNAi効果は、遺伝子発現が回復するまでに、複数の細胞分割の間持続する。従ってRNAi は、RNAレベルで標的ノックアウトまたは「ノックダウン」を作るために効果的な方法である。RNAiは、ヒト胚腎臓およびヒーラ細胞を含むヒト細胞で成功を収めている(例えば、Elbashir et al., Nature 411:494-498, 2001を参照)。例えば、遺伝子サイレンシングは、RNAヘアピンの内因性発現によって哺乳類細胞に導入され得る(Paddison et al., PNAS (USA) 99:1443-1448, 2002を参照)。別の例では、小さな(21-23 nt)dsRNAのトランスフェクションは、遺伝子発現を特異的に阻害する( Caplen, Trends Biotechnol. 20:49-51, 2002で再考察された)。
【0115】
簡潔には、RNAiは以下のように働くと考えられている。発現を停止すべき遺伝子の一部に対応するmiRNA、pre-miRNA、pri-miRNA、またはdsRNAが細胞に導入される。dsRNAが、21-23ヌクレオチドsiRNA、または短い干渉RNAに消化される。siRNA二本鎖がヌクレアーゼ複合体に結合して、RNA誘導型サイレンシング複合体(RISC)として知られているものを形成する。RISCは、siRNA鎖の1つと内因性mRNAの間の塩基対合相互作用により、相同転写産物を標的とする。次に、siRNAの3'末端から約12ヌクレオチドでmRNAを切断する(Sharp et al., Genes Dev. 15: 485-490, 2001; およびHammond et al., Nature Rev. Gen. 2: 110-119, 2001で再考察された)。
【0116】
遺伝子サイレンシングにおけるRNAi技術は、標準的分子生物学的方法を使用する。不活性化されるべき標的遺伝子からの配列に対応するdsRNAは、例えば、T7 RNAポリメラーゼによるテンプレートDNA(標的配列に対応している)の両鎖の同時転写などの標準的方法で生成できる。RNAiで使用するdsRNAの生成用キットは、例えば、New England Biolabs, Inc.から市販されている。dsRNAを作るために操作されたdsRNAまたはプラスミドのトランスフェクションの方法は、当技術分野では日常的である。
【0117】
RNAiに類似の遺伝子サイレンシング効果が、哺乳類細胞のmRNA-cDNAハイブリッド構成物のフトランスフェクションで報告されており(Lin et al., Biochem. Biophys. Res. Commun. 281:639-644, 2001)、遺伝子サイレンシングの別の方法として使用され得る。RNAi の治療用途が、例えば、Shuey, Drug Discov. Today 7:1040-1046, 2002に記述されている。
【0118】
アプタマー
一部の例では、薬剤は、特定のポリペプチドを標的とするアプタマーである。アプタマーは、タンパク質リガンドに特異的に結合することを可能にする三次構造を持つ核酸分子である(例えば、 Osborne et al., Curr. Opin. Chem. Biol. 1:5-9, 1997; およびPatel, Curr. Opin. Chem. Biol. 1:32-46, 1997を参照)。アプタマーはまた、siRNAまたはmiRNAにも共役され得る(WO 2007/143086参照)。
【0119】
アプタマーは、選択された標的に結合する無作為に生成された核酸配列に対するインビトロ自然選択の一種を使用して生成できる。この方法は、「SELEX」(Systematic Evolution of Ligands by Exponential Enrichment(試験管内進化法))と呼ばれている。SELEX法(以下SELEXと称する)および関連適用は、例えば米国5,475,096、米国6,083,696、米国6,441,158および米国6,458,559に記述されている。SELEXプロセスは、核酸リガンドと呼ばれるクラスの生成物を提供し、このようなリガンドは固有配列を持ち、目的標的化合物または分子への特異的結合特性を持つ。各SELEX認識核酸リガンドは、任意の標的化合物または分子の特異的リガンドである。SELEXは、核酸が、さまざまな二次元または三次元構造を形成するのに十分な能力および十分な化学的多様性をモノマー内に持ち、単量体であっても高分子であっても、実質的に任意の化学的化合物に対してリガンドとして働く(特異的結合対を形成する)という見識に基づいている。
【0120】
簡潔には、SELEX法は、同じ一般的選択テーマを使用した、候補混合物からの選択および結合の段階的反復、分割、および増幅から成り、結合親和性および選択性の実質的に任意の目的基準を達成する。好ましくは無作為化配列のセグメントを含む核酸の混合物から開始して、本方法は、結合に適した条件下で混合物を標的と接触させること、標的分子に結合した核酸から未結合の核酸を分割すること、核酸・標的対を解離させること、核酸・標的対から解離された核酸を増幅して核酸のリガンド濃縮混合物を生成すること、そして結合、分割、解離および増幅のステップを望ましいだけ反復することを含む。核酸のプール中、混合物の核酸の大半よりも標的に対する親和性が高い核酸を分割するには、さまざまな技術が使用され得る。
【0121】
いかなる理論にも拘束されるものではないが、SELEXは、多数の可能性のある配列および構造を含む核酸混合物中には、任意の標的に対する幅広い結合親和性があるという観察に基づいている。例えば、20-ヌクレオチド無作為化セグメントを含む核酸混合物は、420の候補を持つ可能性があり得る。標的に対してより高い親和定数を持つものは、その標的に結合する可能性が最も高い。分割、解離および増幅ステップの後、第二の核酸混合物が生成され、より高い結合親和性候補が濃縮される。結果生じる核酸混合物が主に1つまたは2,3の配列のみで構成されるまで、選択ラウンドの追加によって次第に最適リガンドを優先する。次にこれらをクローン化、配列化し、純粋リガンドとして結合親和性を個別に試験する。
【0122】
所定のゴールを達成するまで、選択、分割および増幅のサイクルを繰り返す。最も一般的な例では、選択、分割および増幅は、サイクルの反復において結合強度の著しい向上が見られなくなるまで継続される。約1018もの数の異なる核酸種をサンプルするために、本方法を使用し得る。試験混合物の核酸は、好ましくは、無作為化配列に加えて効率的な増幅のために必要な保存配列も含む。無作為化核酸配列の合成および無作為に切断された細胞核酸からのサイズ選択を含む多くの方法で、核酸配列の変異型を生成することができる。可変配列部分は、完全にまたは部分的に無作為な配列を含むことがあり、また無作為化配列と組み合わされた保存配列のサブ部分も含むことがある。試験核酸の配列変異は、選択、分割および増幅の反復前または反復中の突然変異誘発によって導入または増加され得る。
【0123】
特定の目的を達成するために、基本的SELEX法を変更することができる。例えば、米国5,707,796では、湾曲DNAなどの特異的構造特性を持つ核酸分子を選択するために、ゲル電気泳動法と併せたSELEXの使用を記述している。米国5,763,177では、標的分子に結合および/または光架橋できる、および/または標的分子を光不活性化できる光反応基を含む核酸リガンドを選択するための、SELEXに基づく方法を記述している。米国5,580,737では、「カウンターSELEX」と呼ばれる、近似する分子を区別できる高度に特異的な核酸リガンドを識別するための方法を記述している。米国5,567,588では、標的分子に対して高い親和性を持つオリゴ糖と低い親和性を持つオリゴ糖を非常に効率的に分割できる、SELEXに基づいた方法を記述している。
【0124】
SELEX法は、改善されたインビボ安定性または送達など、改善された特性をリガンドにもたらす修飾ヌクレオチドを含む高親和性核酸リガンドの識別を包含する。このような修飾の例には、リボースおよび/またはリン酸塩および/または塩基位置の化学的置換を含む。修飾ヌクレオチドを含む特異的SELEX識別核酸リガンドは、例えば、米国5,660,985に記述されており、これは、ピリミジンの5- および 2'-位置で化学的に修飾されたヌクレオチド誘導体を含むオリゴ糖に加えて、2'-アミノ修飾を含むトロンビンへの特異的RNAリガンドを記述している。また、2'-アミノ(2'-NH2)、2'-フルオロ(2'-F)、および/または 2'-O-メチル(2'-OMe)で修飾された1つ以上のヌクレオチドを含む高度に特異的な核酸リガンドも含まれている。
【0125】
他の標的薬剤
標的薬剤は、予め選択された生物学的標的(例:病原体、腫瘍細胞、または正常細胞)上のさまざまなエピトープを認識してもよい。例えば、一部の場合において、標的薬剤は、HIV (Wies et al., Nature, 333:426 (1988))、インフルエンザ (White et al., Cell, 56:725 (1989))、クラミジア (Infect. Immunol, 57:2378 (1989))、髄膜炎菌、豚連鎖球菌、サルモネラ菌、おたふく風邪、ニューカッスル病、レオウィルス、センダイウィルスおよびミクソウィルスを標的とするシアル酸、コロナウィルス、脳脊髄炎ウィルス、およびロタウィルスに対する9-OACシアル酸、サイトメガロウィルスを標的とする非シアル酸糖タンパク質 (Virology, 176:337 (1990)) および麻疹ウィルス (Virology, 172:386 (1989))、HIVを標的とするCD4 (Khatzman et al., Nature, 312:763 (1985))、血管活性腸管ペプチド (Sacerdote et al., J. Neurosci. Res. 18:102 (1987))、およびペプチドT (Ruff et al., FEBS Letters, 211:17 (1987))、ワクチンを標的とする表皮成長因子 (Epstein et al., Nature, 318: 663 (1985))、狂犬病を標的とするアセチルコリン受容体 (Lentz et al., Science215: 182 (1982))、エプスタイン・バー・ウィルスを標的とするCd3補体受容体 (Carel et al., J. Biol. Chem., 265:12293 (1990))、レオウィルスを標的とするベータアドレナリン作動性受容体 (Co et al., Proc. Natl. Acad. Sci. USA, 82:1494 (1985))、ライノウィルスを標的とするICAM-1 (Marlin et al., Nature, 344:70 (1990)), N-CAM、およびミエリン関連糖タンパク質MAb (Shephey et al., Proc. Natl. Acad. Sci. USA, 85:7743 (1988))、ポリオウィルスを標的とするポリオウィルス受容体 (Mendelsohn et al., Cell, 56:855 (1989))、ヘルペスウィルスを標的とする線維芽細胞成長因子受容体 (Kaner et al., Science, 248:1410 (1990))、大腸菌を標的とするオリゴマンノース、および髄膜炎菌を標的とするガングリオシドGM1であってもよい。
【0126】
他の場合において、標的薬剤は癌遺伝子によって発現された因子に対するナノ粒子を標的にする。これらには、Srcファミリーのメンバーなどのチロシンキナーゼ(膜結合および細胞質型)、Mosなどのセリン/トレオニンキナーゼ、血小板由来成長因子(PDDG)などの成長因子および受容体、rasファミリーを含むSMALL GTPase(Gタンパク質)、サイクリン依存性タンパク質キナーゼ(cdk)、c-myc、N-myc、およびL-myc、およびbcl-2ファミリーメンバーを含むmycファミリーメンバーのメンバーを含むがこれらに限定されない。
【0127】
加えて、ビタミンに対する受容体を備えるか別の方法でビタミンを摂取する生物学的標的(例:細胞)を標的とする標的薬剤として、ビタミン(脂溶性と非脂溶性ビタミンの両方)を使用してもよい。例えば、脂溶性ビタミン(ビタミンDおよびその類似体、ビタミンE、ビタミンAなど)、および水溶性ビタミン(ビタミンCおよびビタミンB9(葉酸)など)を標的薬剤として使用してもよい。
【0128】
治療薬
一部の場合において、本明細書に記載するナノ粒子は治療薬である化合物を含んでもよい。有益な治療薬は、選択的障害を治療することが知られている。これらには、ステロイド、鎮痛薬、局所麻酔薬、抗生物質製剤、化学療法剤、免疫抑制薬剤、抗炎症薬剤、抗増殖剤、抗有糸分裂薬剤、血管形成剤、抗精神病薬、中枢神経系(CNS)薬剤、抗凝固剤、線維素溶解剤、成長因子、抗体、眼薬、および代謝産物、類似体、誘導体、断片、およびこれらの種、およびその組み合わせの精製、孤立、組換えおよび化学合成されたバージョンがあるがこれらに限定されない。
【0129】
代表的な有益な治療薬には、タモキシフェン、パクリタキセル、ドキソルビシン、低溶解性抗癌剤、カンプトテシンおよびその誘導体(例:トポテカンおよびイリノテカン)、KRN 5500(KRN)、メソ-テトラフェニルポルフィリン、デキサメタゾン、ベンゾジアゼピン、アロプリノール、アセトヘキサミド、ベンズチアジド、クロルプロマジン、クロルジアゼポキシド、ハロペリドール、インドメタシン、ロラゼパム、メトキサレン、メチルプレドニゾン、ニフェジピン、オキサゼパム、オキシフェンブタゾン、プレドニゾン、プレドニゾロン、ピリメタミン、フェニンジオン、スルフィソキサゾール、スルファジアジン、テマゼパム、スルファメラジン、エリプチシン、光動力学的治療に対するポルフィン誘導体、および/またはトリオキサレンのほか、ペニシリン群、フルオロキノロン、および第一、第二、第三、および第四世代セファロスポリンを含むすべての主流の抗生物質を含むがこれらに限定されない。これらの薬剤は、とりわけ、例えばMerck & Co.、Barr Laboratories、Avalon Pharma、およびSun Pharmaから市販されている。
【0130】
他の治療薬は、本明細書に記載するように、アンチセンス薬剤、リボゾーム、siRNAなどのRNAi薬剤、およびアプタマーを含む。
【0131】
造影剤
一部の場合において、本明細書に記載するナノ粒子は造影剤を含む。本明細書で使用する場合、「造影剤」という用語は検出可能な化合物を意味する。造影剤の例には、磁気共鳴映像法、コンピュータ断層撮影法(CTスキャン)造影剤、光学造影剤および放射性同位元素を含む。特定の場合において、造影剤は治療薬とともに本明細書に記載するナノ粒子中に存在する。他の場合において、造影剤は治療薬が存在しない中でナノ粒子に含まれる。
【0132】
造影剤は、本明細書に記載するポリマーに結合される。例えば、本明細書に記載するポリマーは、当技術分野で知られている方法を用いてジエチレントリアミン五酢酸(DTPA)に共有結合されてもよく、または造影剤はDTPAに結合されてもよい。
【0133】
特定の場合において、本明細書に記載するナノ粒子ライブラリーは、DTPA飽和度がさまざまなポリマーを含む。例えば、ポリマーの約10%はDTPAと共有結合されてもよく、ポリマーの約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、または約100%がDTPAと共有結合されてもよい。
【0134】
本明細書に記載する方法および組成物で使用できる造影剤の限定されない例は、放射性核種(例:64Gd、111In、99mTc、90Y、125I、および166Ho)、酸化鉄および量子ドットを含む。他の造影剤には、フルオレセインまたはダンシルなどの蛍光色素分子が含まれる。
【0135】
ナノ粒子ライブラリーの作成方法
それぞれが異なる物理化学的特性を持つ潜在的な治療薬が多様なことから、特定の治療薬の特性および特定の生物学的標的にカスタム化された適切なナノ粒子送達システムの合成および特定にはモジュール式プラットフォームが使用される。機能要素の組み合わせ製剤ライブラリーによって、従来型のライブラリーに比べて比較的少数の潜在的なナノ粒子を含むライブラリーの開発が可能となり、これをその後、例えば高スループットシステムを使用してスクリーニングしてもよい。
【0136】
本明細書に記載する機能要素の少なくとも三つを、ナノ製剤の作成に使用してもよい。ライブラリーは、各自の最終的なナノ集合における適切な成分と重量比の選択に基づいて設計される。治療薬の物理化学的特性が適切な成分の選択に使用される。例えば、疎水性中核(例:本明細書に記載する疎水性薬剤を含む)を疎水性治療薬のカプセル化に使用してもよく、その一方で親和性中核(例:本明細書に記載する親和性薬剤を含む)を親和性治療薬のカプセル化のために使用してもよい。
【0137】
特定の場合において、水溶性ポリマーは適した脂肪酸によって誘導体化される。治療薬が親和性の場合にポリマーを誘導体化するようC2-C14脂肪酸を選択してもよく、治療薬が疎水性の場合にポリマーを誘導体化するようC14-C28脂肪酸を選択してもよい。治療薬の疎水性または親和性を判断する方法は、当技術分野で知られている。治療薬の疎水性または親和性を判断する一つの限定されない例は、治療薬の分配係数を測定することである。本明細書で使用する場合、「分配係数」とは、ある物質が脂質(油)と水の間でどの程度分配されるかを測定するものである。分配係数は、水およびn-オクタノールなどの多分に非混和性の溶媒から構成される二相系中で溶解された物質の平衡濃度の比率を決定することで測定されうる(例えば、Sangster, Octanol-Water Partition Coefficients: Fundamentals and Physical Chemistry, John Wiley & Sons(1997)を参照)。本明細書に記載する方法において、分配係数が約100未満であれば治療薬は親和性、分配係数が約100を上回る場合は治療薬は疎水性である。
【0138】
一般に、カスタム化されたナノ粒子ライブラリーは、まず水溶液中に治療薬を可溶化することで作成されてもよい。適切な水溶液の選択は当業者の技術範囲内であり、治療薬を可溶化する任意の水溶液を使用してもよい。
【0139】
次に、ポリマーを適切な脂肪酸によって誘導体化する。一部の場合において、治療薬が親和性の場合にはポリマーを誘導体化するようC2-C14脂肪酸を選択してもよく、治療薬が疎水性の場合にはポリマーを誘導体化するようC14-C28脂肪酸を選択してもよい。特定の状況において、ポリマーはまた、本明細書に記載するPEGと共有結合される。
【0140】
可溶化された治療薬と誘導体化ポリマーを次に組み合わせるとナノ粒子の自己集合が生まれ、ここでポリマーは治療薬を取り囲むヒドロゲルの殻を形成する。ポリマー、脂肪酸、および/またはPEGの濃度またはタイプをさまざまに変えることで、異なるナノ粒子が形成され、異なるタイプのナノ粒子のカスタム化されたライブラリーが得られる。
【0141】
ナノ粒子が生体内への送達用に製剤されるある状況において、ポリマーは本明細書に記載する架橋剤を用いて架橋結合されてもよい。一部の状況において、架橋ポリマーの第一の集団と脂肪酸から誘導体化されたポリマーの第二の集団というポリマーの二つの集団を組み合わせてもよい。これらのポリマーを次に本明細書に記載するように可溶化された治療薬とPEGと組み合わせると、自己集合されたナノ粒子が生まれる。
【0142】
標的薬剤がナノ粒子に含まれる場合、PEGは、本明細書に記載するように適切な標的薬剤によって活性化し誘導体化されてもよい。脂肪酸により誘導体化されたポリマー、標的薬剤によって共有結合されたPEG、および可溶化された治療薬を組み合わせることで、中核(治療薬を含む)を取り囲むポリマーで作られたヒドロゲルの殻を持ち、PEGの一端はヒドロゲルの殻に結合しもう一方の一端は標的薬剤に結合された、これらの成分のナノ粒子への自己集合が生まれる。
【0143】
一つの模範的な方法において、分子間のジスルフィド架橋を促進するために、また全身投与に伴い血漿中の形成されたナノ構造を安定させうるチオール修飾デキストランが合成される。細胞内グルタチオンレベルがより高いため、ナノ粒子から細胞の細胞質中への治療薬の放出を促進するために、ジスルフィド架橋は細胞中で破壊されてもよい。別の模範的な方法において、浸透性および保持効果の強化による長時間の循環と腫瘤への受動的な標的送達を可能にするために、PEG修飾デキストランを使用してもよい。
【0144】
図2に図示する別の模範的な方法において、異なるタイプのポリマーに基づくナノ粒子が合成され、ライブラリーに含まれる。機能ブロック各自は、自己集合されたナノ構造の作製のために水媒体に混合してもよい。各自の機能ブロックのタイプ、ポリマーの誘導体化の程度、各誘導体の濃度、および重量比は、組み合わせライブラリーを開発するように多様化させてもよい(例:最高5,000〜約7,000の異なるナノ粒子を持つ)。ナノ粒子の大きさ、表面電荷、および安定性に基づいて、治療薬のカプセル化のために製剤を選択してもよい。機能マクロ構造の物理化学的特性は、特定の治療薬にとって最適な製剤を特定するために、カプセル化された治療薬の物理化学的特性と一致させてもよい。
【0145】
ナノ粒子ライブラリーのスクリーニング方法
本明細書に記載するナノ粒子ライブラリーは、特定の治療薬および/または特定の送達のためにカスタム化されたナノ粒子候補を特定するためにスクリーニングされうる。一つの模範的なスクリーニング方法を図3に図示する。
【0146】
最初に、当技術分野で知られている方法を用いてナノ粒子の安定性を評価してもよい。例えば、ナノ粒子のカプセル化や安定性の初期スクリーニングについて、蛍光標識された治療薬、親和性蛍光色素分子、または疎水性蛍光色素分子を使用してもよい。この初期スクリーニングに基づいて、PEGおよび/または標的薬剤によって適切なカプセル化を実証するナノ粒子をさらに修飾してもよく、また細胞株の使用など知られている生体外検定においてナノ粒子をスクリーニングしてもよい。生体外研究に基づいてさらなるポリマー誘導体を設計・合成してもよく、また、 生体内試験での一定の「ヒット」製剤を特定するために、組み合わせ製剤の開発と予備評価のサイクルを実施してもよい。
【0147】
生体外のナノ粒子の最適化の後、生体内研究を実施してもよい。一つの模範的な方法において、ナノ粒子について、動物モデルにおける腫瘍標的効率、滞留時間、および生体内での生体内分布プロファイルが評価される。さらに、腫瘍蓄積の増強を示すものとして特定された製剤を、ナノ粒子の単独投与または全身投与される治療薬との組み合わせでの投与を用いて、有効性スクリーニングで試験してもよい。生体内の急性安全性プロファイルは、例えば体重の変化、血液細胞数、肝酵素値、および肝組織病理の測定によって考察することができる。
【0148】
模範的な1000個のポリマーライブラリーが、適切なヒットのスクリーニングと選択のために生成された。表1は、かかるライブラリーの合成に対するポリマーおよび標的薬剤の限定されない例を示す。
【表1】

【0149】
疾患および障害
本明細書に記載するナノ粒子は、罹患した細胞および組織の治療(例:前記細胞や組織への薬物の移動を媒介)に使用されうる。この点に関して、さまざまな疾患は本明細書に記載するナノ粒子および方法を用いた治療に適している。主題のナノ粒子によって治療されうる疾患の模範的な限定されないリストは、乳癌、前立腺癌、肺癌、リンパ腫、皮膚癌、膵臓癌、結腸癌、黒色腫、卵巣癌、脳癌、頭部および頸部癌、肝臓癌、膀胱癌、非小細胞肺癌、子宮頸癌、白血病、非ホジキンリンパ腫、多発性硬化症、神経芽細胞腫および膠芽細胞腫、T細胞およびB細胞媒介性自己免疫疾患、炎症疾患、感染症、感染疾患、過剰増殖性疾患、AIDS、変性状態、心臓血管疾患(冠動脈再狭窄を含む)、糖尿病、移植拒絶反応、および同類のものを含む。一部の場合において、治療される癌細胞は転移性である。
【0150】
特定の場合において、本明細書に記載するナノ粒子は多剤耐性(MDR)の逆転に使用してもよい。例えば、MDR輸送体の下方制御およびsiRNA含有ナノ粒子Bcl-2、スルビビン、mdr-1、またはmrp-1などの抗アポトーシス遺伝子を使用してもよい。
【0151】
治療のための投与
本明細書に記載するナノ粒子 の投与経路および/または投与方法は、所望の結果によってさまざまである。投薬計画は、所望の反応(例:治療反応)を提供するために調整されてもよい。
【0152】
投与方法には、皮内、筋肉内、腹腔内、静脈内、皮下、鼻腔内、硬膜外、経口、舌下、脳内、膣内、経皮、直腸、吸入、または局所的(特に耳、鼻、目または皮膚)を含むがこれらに限定されない。投与方法は医療関係者の裁量に任される。
【0153】
一部の場合において、本明細書に記載するナノ粒子は局所投与される。これは、例えば、手術中の局所点滴、局所的塗布(例:クリームまたはローション)、注射、カテーテル、坐薬または浣腸、または移植によって達成され、前記移植は膜を含めてシラスティック膜や繊維などの多孔、非多孔、またはゼラチン物質からできたものである。一部の状況において、本明細書に記載するナノ粒子は、脳室内、髄腔内注射、傍脊柱筋注射、硬膜外注射、浣腸、および末梢神経近くへの注射を含む適した経路を通して中枢神経系、循環系または消化管に導入される。脳室内注射は、例えば、オンマヤ槽などの槽に取り付けられた脳室内カテーテルによって促進されてもよい。
【0154】
本開示はまた、本明細書に記載するナノ粒子を投与するための装置について説明する。装置は、例えば医薬組成物を保管するための一つ以上の筐体(housings)を含んでもよく、また本明細書に記載するナノ粒子の単位用量を送達するよう構成されてもよい。
【0155】
また、例えば吸入器またはネブライザー、噴霧薬剤を含む製剤の使用によって、またはフッ化炭素または合成肺表面活性剤のかん流による肺内投与を使用してもよい。
【0156】
一部の場合において、本明細書に記載するナノ粒子は、特にリポソーム(Langer, Science249:1527-1533 (1990) およびTreat et al.、Liposomes in the Therapy of Infectious Disease and Cancer,pp. 317-327およびpp. 353-365 (1989) を参照)で小嚢に送達されてもよい。
【0157】
また他の状況において、本明細書に記載するナノ粒子は、制御放出システムまたは徐放性システム(例:Goodson、Medical Applications of Controlled Release、2:115-138 (1984) を参照)で送達されてもよい。Langer、Science 249:1527-1533 (1990) で考察された他の制御放出または徐放性システムを使用してもよい。一つのケースにおいて、ポンプを使用してもよい(Langer、Science249:1527-1533 (1990); Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980)、およびSaudek et al., N. Engl. J. Med. 321:574 (1989))。
【0158】
また他の状況において、制御放出または徐放性システムは本明細書に記載するナノ粒子の標的の近くに配置され、投与量をわずかな全身投与量へと低下してもよい。
【0159】
本明細書に記載するナノ粒子は、適した量の生理的に許容できる賦形剤を含む医薬組成物として製剤されてもよい(例:Remington’s Pharmaceutical Sciences pp. 1447-1676 (Alfonso R. Gennaro, ed., 19th ed. 1995) を参照)。前記の生理的に許容できる賦形剤は、例えば、原油、動物、植物のものを含む水や油などの液体、またはピーナッツ油、大豆油、ミネラル油、ゴマ油および同類のものなどの合成起源であってもよい。生理的に許容できる賦形剤は、生理食塩水、アカシア・ゴム、ゼラチン、でんぷんペースト、タルク、ケラチン、コロイドシリカ、尿素および同類のものであってもよい。加えて、補助剤、安定剤、増粘剤、潤滑剤、および着色剤を用いてもよい。一つの状況において、生理的に許容できる賦形剤は動物に投与されるときに滅菌性である。生理的に許容できる賦形剤は製造・保管条件下で安定しており、微生物による汚染行為に対して保護されるべきである。本明細書に記載するナノ粒子が静脈内投与される場合は、水が特に有益な賦形剤である。また、特に注射可能な溶液の場合は、液体賦形剤として食塩水および水溶ブドウ糖およびグリコール溶液を使用してもよい。適した生理的に許容できる賦形剤はまた、でんぷん、グルコース、ラクトース、蔗糖、ゼラチン、モルト、米、小麦粉、チョーク、シリカゲル、ステアリン酸ナトリウム、ステアリン酸グリコールモノ、タルク、塩化ナトリウム、乾燥スキムミルク、グリコール、プロピレン、グリコール、水、エタノールおよび同類のものを含む。適した生理的に許容できる賦形剤の他の例は、Remington’s Pharmaceutical Sciences pp. 1447-1676 (Alfonso R. Gennaro, ed., 19th ed. 1995) に記載されている。希望する場合、医薬組成物はまた、少量の湿潤剤または乳化剤、またはpH緩衝剤を含んでもよい。
【0160】
液体担体を溶液、懸濁液、乳剤、シロップ、およびエリキシル剤の調製に使用してもよい。本明細書に記載するナノ粒子は、水、有機溶媒、その混合物などの薬学上許容できる液体担体、または薬学上許容できる油または脂肪などで懸濁してもよい。液体担体は、可溶化剤、乳化剤、緩衝剤、保存剤、甘味剤、香味剤、懸濁化剤、増粘剤、色、粘性調整剤、安定剤または浸透圧調節剤を含むその他の適した薬剤上の添加剤を含んでもよい。経口用および非経口投与用の液体担体の適した例には、水(例えば、特にカルボキシメチルセルロースナトリウム溶液を含むセルロース誘導体など本明細書に記載する添加剤を含むもの)、アルコール(例えば、グリコールなどの単価アルコールおよび多価アルコールなどを含む)およびその誘導体、および油(例:ヤシ油およびラッカセイ油)を含む。非経口投与では、担体はまたオレイン酸エチルおよびミリスチン酸イソプロピルなどの油性エステルでもよい。液体担体は、投与のための滅菌された液体形態であってもよい。加圧組成物のための液体担体は、ハロゲン化炭化水素または他の薬学上許容できる噴射剤であってもよい。
【0161】
他の場合において、本明細書に記載するナノ粒子は静脈内投与のために製剤される。静脈内投与のための組成物は、滅菌された等張水溶緩衝液を含んでもよい。組成物はまた可溶化剤を含んでもよい。静脈内投与のための組成物は、注射部位の痛みを緩和するためにリグノカインなどの局所麻酔薬を随意で含んでもよい。成分は、活性剤の量を示したアンプルまたは小袋などの密閉容器において、例えば凍結乾燥粉末または水なし濃縮物として、個別または混合して単位用量の形態で供給してもよい。本明細書に記載するナノ粒子が点滴投与される場合は、例えば、医薬品グレードの滅菌水または生理食塩水を含む点滴ボトルで供給してもよい。本明細書に記載するナノ粒子が注射投与される場合は、投与前に成分を混合できるように、注射用の滅菌水または生理食塩水のアンプルを提供してもよい。
【0162】
他の状況において、本明細書に記載するナノ粒子は、身体表面全体にわたって投与されても、上皮組織および粘膜組織を含む身体経路の内層に投与してもよい。ローション、クリーム、フォーム、パッチ、懸濁液、溶液、および坐薬(例:直腸または膣)への本明細書に記載するナノ粒子を用いて、前記投与を実行してもよい。一部の場合において、明細書に記載するナノ粒子と、本明細書に記載するナノ粒子に対して不活性で、皮膚への毒性がなく、皮膚から血流への全身吸収のための薬剤の送達を可能にする担体を含む経皮パッチを使用してもよい。担体は、クリームまたは軟膏、ペースト、ジェル、または閉塞的な装置といった多数の形態を取ることができる。クリームまたは軟膏は、水中油型または油中水型のどちらかでの粘性のある液体または半固体乳剤であってもよい。本明細書に記載するナノ粒子を含む原油または親和性原油中に拡散される吸収粉末のペーストを使用してもよい。担体の有無を問わず本明細書に記載するナノ粒子を含む槽を覆う半透性の膜、または本明細書に記載するナノ粒子を含む基質といった、本明細書に記載するナノ粒子を血流に放出するためのさまざまな閉塞的な装置を使用してもよい。
【0163】
本明細書に記載するナノ粒子は、従来型の坐薬という形態で直腸または膣から投与してもよい。坐薬剤は、ココアバターを含む従来型の物質から、坐薬の融点を変えるためのワックスやグリセリンの添加の有無を問わず、当技術分野で知られている方法を用いて作製してもよい。さまざまな分子量のポリエチレングリコールなど、水溶性坐薬の基剤を使用してもよい。
【0164】
障害または疾患の治療に効果的な本明細書に記載するナノ粒子の量は、当業者に知られている標準の臨床技術を用いて決定される。加えて、生体外または生体内検定は、最適な用量域の特定のために随意で使用してもよい。使用するべき正確な投与量はまた、投与経路、病状、治療対象の病状の重篤度のほか、治療対象の個人に関するさまざまな物理的要因に依存しており、医療関係者の判断に従って決定できる。例えば、本明細書に記載するナノ粒子の投与量は各自、一日当たり体重の約0.001mg/kg〜約250mg/kg、一日当たり体重の約1mg/kg〜約250mg/kg、一日当たり体重の約1mg/kg〜約50mg/kg、または一日当たり体重の約1mg/kg〜約20mg/kgであってもよい。等価用量は、2時間ごと、約6時間ごと、約8時間ごと、約12時間ごと、約24時間ごと、約36時間ごと、約48時間ごと、約72時間ごと、約1週間ごと、約2週間ごと、約3間ごと週、約1ヵ月ごと、および約2ヵ月ごとを含むがこれらに限定されないさまざまな期間で投与してもよい。完了した治療過程に呼応する用量の数と頻度は、医療関係者の判断に従って決定してもよい。
【0165】
一部の場合において、本明細書に記載する医薬組成物は、例えば錠剤、カプセル、粉末、溶液、懸濁液、乳剤、顆粒、または坐薬などの単位剤形である。前記形態において、医薬組成物は、本明細書に記載するナノ粒子の適切な数量を含む単位用量に分割されてもよい。単位剤形は、例えば、液体を含むパケット粉末、バイアル、アンプル、予め充填されたシリンジまたは小袋などの包装された医薬組成物であってもよい。単位剤形は、例えばカプセルまたは錠剤自体でも、または適切な数でのパッケージ形態での前記組成物でもよい。前記単位剤形は約1mg/kg〜約250mg/kgを含んでもよく、一回の投与量または二回以上に分けた投与量で提供してもよい。
【0166】
併用療法
一部の場合において、本明細書に記載するナノ粒子は、本明細書に記載する障害または病状の治療に有益な治療薬などの一つ以上の治療薬と併用して投与される。例えば、化学療法剤を含むナノ粒子は、裸の化学療法剤(つまり、ナノ粒子中でカプセル化されていない)と組み合わせて投与してもよい。
【0167】
キット
本明細書に記載するナノ粒子は、キットで提供してもよい。一部の場合において、キットには(a)ナノ粒子を含む容器と、随意に(b)情報資料を含む。情報資料は、本明細書に記載する方法および/またはナノ粒子の使用(例:治療的有用性)に関連した、説明、指示、マーケティングまたは他の資料であってもよい。
【0168】
キットの情報資料はその形態に限定されない。一部の場合において、情報資料は、ナノ粒子の製造に関する情報、ナノ粒子の分子量、濃度、有効期限、バッチまたは製造場所の情報などを含んでもよい。他の状況において、情報資料は、例えば適した量、方法、または投与方法(例:本明細書に記載する投与量、剤形、または投与方法)でのナノ粒子の投与方法に関連する。方法は、障害を持つ被験者を治療する方法であってもよい。
【0169】
一部の場合において、情報資料(例:指示)は印刷物(例:印刷された文、図および/または写真(例:ラベル)または印刷されたシートで提供される。情報資料はまた、点字、コンピュータ可読資料、ビデオ録画、または音声録音などの他の形式で提供してもよい。他の場合において、キットの情報資料は、連絡先情報(例:キットの使用者がその中のナノ粒子および/または本明細書に記載する方法の使用について実質的な情報を得ることのできる物理的な住所、電子メールアドレス、ウェブサイト、または電話番号)である。当然ながら、情報資料はまた形式を組み合わせて提供してもよい。
【0170】
ナノ粒子に加えて、キットは溶媒または緩衝液、安定剤、または保存剤などの他の成分を含んでもよい。キットはまた、例えば他の治療薬などの第二または第三の薬剤など、例えば他の薬剤を含んでもよい。成分は、例えば液体、乾燥または凍結乾燥された形態などの任意の形態で提供してもよい。成分は、実質的に純粋(一緒に組み合わされても別々に送達されてもよい)および/または滅菌されてもよい。成分が液体溶液で提供される場合、液体溶液は滅菌水溶液などの水溶液であってもよい。成分が乾燥形態で提供される場合、再溶解は一般に適した溶媒の添加によって行われる。溶媒、例えば滅菌水または緩衝液は、随意でキットで提供してもよい。
【0171】
キットはナノ粒子または他の薬剤に対する一つ以上の容器を含んでもよい。一部の場合において、キットは、ナノ粒子および情報資料のための別々の容器、分割器または区分を含む。例えば、ナノ粒子はボトル、バイアル、またはシリンジ中に含み、情報資料はプラスチック製スリーブまたはパケットに含んでもよい。他の状況において、キットの別々の要素は一つの分割されない容器内に含まれる。例えば、ナノ粒子はラベルという形態で情報資料に添付されるボトル、バイアルまたはシリンジに含まれてもよい。一部の場合において、キットは、複数(例:パック)の個別の容器を含み、それぞれがナノ粒子の一つ以上の単位剤形(例:本明細書に記載する剤形)を含んでもよい。容器は、単位用量(例:ナノ粒子を含む単位)を含んでもよい。例えば、キットは複数のシリンジ、アンプル、フォイルパケット、ブリスターパック、または医学装置(例:各自が単位用量を含む)を含んでもよい。キットの容器は密閉式、防水性(例:湿度や蒸発の変化に対して不浸透性) 、および/または遮光されていてもよい。
【0172】
キットは、ナノ粒子の投与に適した装置(例:シリンジ)または他の適した送達装置を随意で含んでもよい。装置は、ナノ粒子(例:単位用量)で予め充填して提供しても、または中身はないが充填に適した状態で提供してもよい。
【0173】
本発明についてさらに下記の実施例で説明するが、これは請求項に記載する本発明の範囲を制限するものではない。
【実施例】
【0174】
【実施例1】
【0175】
siRNAナノ粒子による(MDR1)発現の阻害
骨肉腫における薬物耐性を克服するための送達システム
新しい薬物送達システムを作製し、MDR1 siRNA送達について評価した。生体適合性のある脂質修飾デキストランに基づく新しいポリマーナノ粒子をMDR1 siRNA送達のプラットフォームとして使用し、このシステムとの併用療法の有効性が評価された。
【0176】
A. 物質および方法
化学物質
デキストラン(Mwは約40 kDa)、ステアリルアミン(99%純度)、シスタミン、ピリジン、過ヨウ素酸ナトリウム(NaIO4)、シアノ水素化ホウ素ナトリウム(NaCNBH3)、硫酸カリウム(K2SO4)およびアゾビスイソブチロニトリル(AIBN)は、Sigma-Aldrich Chemical Co(ミズーリ州セントルイス)から入手した。ジチオール修飾ポリ(エチレングリコール)(PEG-(SH)2、M.W. 2,000)は、SunBio, Inc.(韓国、ソウル)から入手した。無水リチウム塩素(LiCl)はFisher Scientific(ペンシルベニア州フィラデルフィア)から入手した。分子篩付き脱水ジメチルホルムアミド(DMF)およびジメチルスルホキシド(DMSO)は、Acros Organics(ニュージャージ州パーシッパニー)から入手した。アクリロイル塩素、ピリジンおよび他の試薬および溶媒はSigma-Aldrichから入手し、さらなる精製なく受け取ったものとして使用された。
【0177】
ABCB1 siRNAの合成
ABCB1遺伝子(Genbank登録番号NM_000927)を標的とするsiRNA配列は、この遺伝子のコード領域に呼応するものであった。四つの標的配列がABCB1遺伝子について選択された。各siRNAのセンス配列は5' GAG CUUAACA CC CGA CUUAUU 3'、5' GAAAGUAUACCUCCAGUUUUU 3'、5' GAC CAUAAAU GUAAGGUUUUU 3'、および5' CCAGGUAUGCCUAUUAUUAUU 3'。
【0178】
合成siRNA二本鎖は、Dharmacon Inc.(コロラド州ラフィーエット)から入手した。siRNAは、1mLの緩衝液(100 mmol/L酢酸カリウム、30 mmol/L HEPES-KOH、および2 mmol/L酢酸マグネシウム(pH 7.4))を各試験管に添加して溶解し、下記のトランスフェクション方法まで-20°Cで保管した。
【0179】
アクリル酸デキストランの合成
アクリル酸デキストランの合成は、Zang et al., J. Polym. Sci. Part A: Polym. Chem. 41:386-394 (2003) の手順に基づいて行った。手短に、丸底フラスコ(200mL)中で一定量のデキストラン(M.W. 約40 kDa、2g)をLiCl/DMF(4% w/v、50mL)溶媒混合物に添加した。油槽の温度は2時間にわたり室温(RT)から120°Cに上昇させた。結果的に得られる混合物は均質な黄金色の溶液になった。溶液を室温にまで冷却し、ピリジン(500μL)を添加して攪拌した。反応混合物は氷槽を用いて0°Cにまで冷却し、添加漏斗を用いてさまざまな量のアクリロイル塩素(1-1.5モル過剰)を液滴で添加した。反応は、アクリロイル塩素の完全な添加が1〜2時間にわたって行われるまで0°Cで維持した。反応は一晩継続させた。得られたアクリル酸デキストランは過剰な低温エタノール中で沈殿させ、無水エタノールで3回洗浄した。アクリル酸デキストランの形成を確認するために、アクリレート単量体の小さな一部をDMSO中で60°Cで24時間、0.001% AIBN阻害剤を用いて重合した。結果的にアクリレート重合体の形成が生じ、反応が確認された。別の方法として、脂質修飾について、ワンポット合成において直接、次の手順の単量体としてアクリル酸デキストランを使用した。
【0180】
アクリル酸デキストランの脂質修飾
前述の手順から得られた200mgのアクリル酸デキストランを乾燥DMFに溶解し、さまざまな量の(5-10モル%)ステアリルアミンおよび触媒(0.01モル% AlCl3)で20mLガラス製バイアル中で攪拌した。反応混合物を油槽で24時間、40-50°Cで加熱した。得られた生成物(ステアリルアミン修飾デキストラン)を低温エタノールで数回沈殿・洗浄して、生成物を精製した。次に、脂質修飾デキストラン誘導体を少量の脱イオン水中に溶解・凍結乾燥させ、淡黄色の最終生成物を生み出した。デキストランの脂肪族アミン修飾は1H NMR分光法(Varian 500MHz NMR分光計、Varian Inc.、カリフォルニア州)によって確認され、脂質修飾の割合は7モル%と推定された。図5は、長鎖脂肪族アミンの追加ピークが約1 ppmの結果的に得られたスペクトル(D2Oを溶媒として使用した場合)を示し、デキストランの脂質修飾が成功したことを示している。脂肪修飾の割合は、デキストランの7モル%と推定された。
【0181】
異なるブロックの他の誘導体および合成されたその組み合わせを表2に示す。
【表2】

【0182】
デキストランの酸化
デキストランは、側鎖1-3がデキストラン生体高分子のバックボーンユニットに結合された、α-D-1、6-グルコース結合グルカンである。デキストランは、血漿増量剤および薬物送達プラットフォームとして長い間使用されてきたことから、マクロ構造の開発のために選択された。デキストランのバックボーンは、Surangkhana et al.、Langmuir 22:8192-8196 (2006) の手順に基づき酸化した。手短に、所望する量のNaIO4を60mLの脱イオン水中に溶解した。前記溶液を4gのデキストランと30mLの脱イオン水を含む他の溶液に添加した。反応物を室温で2時間、暗所で攪拌した。反応の終わりに、数回水を交換しつつ、Spectrapor(R)透析膜(M.W. カットオフ12-14 kDa、Spectrum Labs、Rancho Dominguez、CA)を用いて、脱イオン水(2 L)に対して溶液を4日間透析した。冷凍乾燥後、粉末状のフリーフロー・サンプルが得られ、3.7g(92.5%)が生み出された。
【0183】
デキストランのチオール修飾
酸化デキストランの500mg部分を、K2SO4およびNaCNBH3を含む50mLのpH 5.2緩衝液中に溶解した。50mgのシスタミンを添加し、40°Cで4日間攪拌した。生成物を集中的な透析にかけてから凍結乾燥させて、チオール化デキストランを生み出した。チオール化の割合は、Ellmanの試薬(Ellman、Arch. Biochem. Biophys. 82:70-77 (1959))によって定量化した。精製されたチオール化デキストラン誘導体中のスルフヒドリルの濃度は、約14.2μM/mgと推定された。
【0184】
MDR1 siRNAを含むデキストランナノ粒子の調製
5mg/mLのPEG-(SH)2、ステアリルアミン修飾デキストラン、およびチオール化デキストラン(前述の通り合成)の原液を脱イオン水中で調製した。MDR1 siRNAの溶液に40μLのデキストラン-チオールをまず添加し、渦巻き振とう器を用いて混合した。次に、前記を5分間培養した。次に、この混合物に40μLデキストラン-ステアリルアミン誘導体を添加して、さらに5分間培養した。最後に、40μLのPEG-(SH)2を添加してさらに15分間培養し、ナノ粒子の親和性のある殻を形成した。siRNA、チオール、および脂質修飾デキストラン誘導体の間でより優れた相互作用を生むために、逐次追加のこの方法を使用し、ナノ粒子に隠れた特性を与えるためにPEG-チオールの殻を追加した。
【0185】
粒子サイズとゼータ電位測定
MDR1 siRNA担持ナノ粒子の粒子サイズとゼータ電位は、Brookhaven Zeta PALS計器(ニューヨーク州ホルツビル)を用いて実施した。光散乱の実験のため、サンプルは90°の固定角度で25°Cで測定した。散乱強度はサンプルを脱イオン水で希釈して50-500 kcpsの範囲に調整した。ゼータ電位については、ナノ粒子の電気泳動移動度に基づき、誘電率、屈折率、および水の粘度のデフォルトパラメータを使用した。
【0186】
細胞培養および試薬
細胞株KHOSR2とU-2OSR2を発現するヒト骨肉腫細胞株KHOSおよび多剤耐性MDR1(P-gp)は、National Hellenic Research Foundation(ギリシャ、アテネ)から入手した。すべての細胞株は、10%の幼牛血清、100 U/mLペニシリン、および100μg/mLストレプトマイシンで補足されたRPMI 1640で培養した(すべてはInvitrogen、カリフォルニア州カールズバッドより入手)。細胞は37°Cの5% CO2-95%空気中で培養し、トリプシンEDTA溶液を用いてほぼ融合性単層を達成したときに通過した。耐性細胞株は、引き続きドキソルビシン中で培養した。ドキソルビシンはSigma-Aldrich(ミズーリ州セントルイス)から入手した。P-gp1モノクローナル抗体C219はSignet(マサチューセッツ州デダム)から入手した。ヒトβ-アクチンモノクローナル抗体およびMTT試薬はSigma-Aldrich(ミズーリ州セントルイス)から入手した。
【0187】
EGFP siRNA担持ナノ粒子EGFPを発現する細胞およびトランスフェクションの生成
Stat3および高感度緑色蛍光タンパク質(EGFP)の融合タンパク質発現ベクターpCORON1000 EGFP-Stat3(pEGFP-Stat3)は、Amersham Biosciences(英国、バッキンガムシャー)から入手した。このpEGFP-Stat3ベクターは、Stat3をEGFPのCOOH末端に融合して生成した。ハムスター腎臓細胞株(BHK-21)は、G418(Invitrogen、カリフォルニア州カールズバッド)の選択を通してpEGFP-Stat3に安定に導入された。EGFP発現細胞は、96ウェルプレート上でウェル当たり約4000個の細胞の密度で播種し、濃度が増したEGFP siRNAを添加した後、48時間培養した。EGFP siRNAはAmbion(テキサス州オースティン)から入手した。siPORTTM NeoFXTM トランスフェクション薬剤は陽性対照として使用した(Ambion)。画像は、SPOT RTデジタルカメラ(Diagnostic Instruments, Inc.、ミシガン州スターリングハイツ)搭載のNikon Eclipse Ti-U蛍光顕微鏡(Nikon Corp.)によって得た。
【0188】
ウエスタンブロット法分析
P-gp1は総細胞溶解物中で分析した。細胞からのタンパク質の溶解物は、1倍のRIPA Lysis Buffer(Upstate Biotechnology、ヴァージニア州シャーロッツビル)による溶解を通して生成した。タンパク質の濃度は、タンパク質検定試薬(Bio-Rad、カリフォルニア州ハーキュリーズ)および分光光度計(Beckman DU-640、Beckman Instruments, Inc.、メリーランド州コロンビア)によって決定した。25μgの総タンパク質はNu-Page 4-12% Bis-Tris Gel(Invitrogen)上で処理して、純ニトロセルロース膜(Bio-Rad Laboratories、カリフォルニア州ハーキュリーズ)に転移させた。一次抗体は、pH 7.4のトリス緩衝液の生理食塩水中で、0.1% Tween 20とともに4°Cで一晩培養した。信号は、pH 7.4のトリス緩衝液の生理食塩水中で、5%無脂肪ミルクと0.1% Tween 20とともに、1:2000の希釈率で室温で1時間培養した西洋ワサビペルオキシダーゼで共有結合された二次抗体(Bio-Rad、カリフォルニア州ハーキュリーズ)による培養を通して生成した。陽性免疫反応は、Super Signal(R)West Pico Chemiluminescent Substrate(Pierce、ロックフォードイリノイ州)を用いて検出した。バンドは、 PhotoShop 7.0(Adobe、カリフォルニア州サンノゼ)による反転画像スキャン濃度測定によって半定量化した。信号のないゲル画像の領域は、背景値として指定された。次に、さまざまな濃度のMDR1 siRNAナノ粒子で処理したKHOSR2またはU2OSR2からのP-gpを示すタンパク質の各バンドについては、背景レベルを超える密度を分析した。タンパク質の担持が同等であり、検体ごとにタンパク質の量が違うという理由で違いが観察されないように、各タンパク質についてβ-アクチンに呼応するバンドを決定した。タンパク質バンドの密度はタンパク質のβ-アクチンバンドに標準化し、P-gpの比率は各P-gpに呼応するβ-アクチンの比率で割ることで標準化した。
【0189】
MDR1反転の期間
MDR1 siRNA単独またはMDR1 siRNA担持ナノ粒子のいずれかによるMDR1阻害の期間を比較するために、1 x 105 KHOSR2セル/ウェルをMDR1 siRNA単独およびナノ粒子中で5日間培養した。P-gpの発現は前述のウエスタンブロット法分析によって決定した。
【0190】
薬物流出検定
抵抗を示す細胞株の薬物流出特性を測定するために、VybrantTM 多剤耐性検定 キット(Invitrogen/Molecular Probes)を使用した。この検定は、蛍光染料カルセインアセトキシメチルエステル(カルセインAM)をP-gpまたは他の膜ポンプABCタンパク質の流出活性のための基質として使用する。カルセインAMは細胞によって吸収され、細胞質エステラーゼによって蛍光カルセインへと加水分解される。カルセインAMのサイトゾル中での保持性は良好である。但し、高レベルのP-gpを発現する多剤耐性の細胞は、非蛍光カルセインAMを血漿膜から急速に排出してサイトゾル中の蛍光カルセインの蓄積を低下させる。薬物耐性細胞(1 x 105)は、濃度が増したMDR1 siRNA担持ナノ粒子とともに、または培地のみで、96 ウェルプレート上で培養した。48時間後、細胞を150μL全容積において0.25μM カルセインAMで培養した。10μMのベラパミルを陽性対照として、PBSを陰性対照として使用した。30分後、細胞を洗浄して200μLの冷却RPMI1640培養培地で2回遠心分離し、細胞蛍光をSPECTRAmax(R)Microplate Spectrofluorometer(Molecular Devices)上で波長490nm(A490)で測定した。カルセインAMの細胞内保持性を可視化するために、SPOT RTデジタルカメラ(Diagnostic Instruments, Inc.、ミシガン州スターリングハイツ)搭載のNikon Eclipse Ti-U蛍光顕微鏡(Nikon Corp.)によって画像を得た。
【0191】
ドキソルビシンの細胞取り込みの蛍光顕微鏡検査
細胞取り込み研究のために、KHOS および KHOSR2細胞を6ウェルプレート上で5 x 105細胞/ウェルの密度で播種した。MDR1 siRNAはKHOSR2のウェルに適用して48時間培養した。培養後、ドキソルビシンを各ウェルに添加してさらに3時間培養した。培養後、細胞を洗浄し、新鮮なRPMI 1640で懸濁した後、SPOT RT デジタルカメラ(Diagnostic Instruments, Inc.、ミシガン州スターリングハイツ)搭載のNikon Eclipse Ti-U蛍光顕微鏡で可視化した。蛍光強度および細胞局在を波長488nmで三通り、ランダムに異なるフィールドで分析した。
【0192】
生体外細胞毒性検定
生体外細胞毒性検定は、前述のようにMTT検定によって実施した。手短に、この過程においてウェル当たり3 x 103細胞を96ウェルプレートに乗せた。MDR1 siRNA担持ナノ担体とまたは培地のみと48時間培養させた後、濃度の増したドキソルビシンを適用した。5日間培養した後、10μLのMTT(5mg/mL、PBS中)を各ウェルに添加して3時間培養した。結果得られたホルマザン生成物をイソプロパノル酸で溶解した後、SPECTRA max Microplate Spectrophotometer(Molecular Devices)上で波長490nmで吸収度(A490)を読み取った。各実験は三通りで実施した。
【0193】
統計分析
群間の違いを比較するためスチューデントt-検定を使用した(GraphPad PRISM(R) 4 ソフトウェア、GraphPad Software、カリフォルニア州サンディエゴ)。平均±SDとして結果を算出し、p<0.05の結果を統計上有意と見なした。
【0194】
B. 結果
細胞内MDR1 siRNA送達のための脂質修飾デキストランナノ粒子
MDR1 siRNA担持ナノ粒子の調製のために、MDR1 siRNAを脱イオン水中で室温でチオール修飾デキストラン誘導体とともに培養して、チオール化したデキストラン誘導体とsiRNA上の遊離アミン間のチオール-アミン会合によってナノ粒子を形成した(Sainsbury et al., J. Phys. Chem. 111:12992-12999 (2007))。さらに、siRNA含有チオール-デキストラン誘導体によってステアリルアミン修飾デキストラン誘導体とPEG化チオール誘導体を連続して混合して、PEG鎖の三元網への結合効率と安定性を強化するためのヒドロゲル網を形成した。この方法は、siRNA担持およびPEG鎖の結合が良好な安定したナノ粒子の形成をもたらした(図6)。動的光散乱(DLS)測定によって決定されたMDR1 siRNA担持ナノ粒子の粒子サイズの平均は104.4+3.7nm、ゼータ電位はほぼ中性(-0.19+1.13 mV)であった。表3および4は他のポリマーの粒子サイズとゼータ電位を示している。
【表3】

【表4】

【0195】
粒子は室温で安定しており、保管(少なくとも4 oCで1週間)段階での粒子サイズの変化は最小限であった。
【0196】
精製チオール化デキストラン(40 kDaおよび80 kDa)中のスルフヒドリル基の濃度はそれぞれ14.2 μM/mg および11.2 μM/mgであった。結果を図4に示す。
【0197】
BHK-21-EGFP細胞上でのEGFP siRNA担持ナノ粒子の効果
細胞株上でのsiRNA担持ナノ粒子のトランスフェクション有効性を評価するために、我々はまず、BHK-21細胞を発現するEGFPを使用して効果を試験した。EGFP siRNA担持ナノ粒子は、図7および8に示すようにこの研究で使用される濃度では毒性がなかった。EGFP siRNAは効率良く細胞に導入され、EGFPの発現を効果的に阻害した(図9)。阻害は投与量には依存していなかったが、およそ100nmで停滞期に達した。
【0198】
他のナノ粒子の阻害を評価するために、10 μgの前溶解したポリマー(Dex-チオ+Dex脂質)を150nmのGFP-SiRNAとともに30分間培養した。96ウェルプレートでBHKpEGFP細胞と24時間培養させた後で、サイレンシング効果を研究した。結果を図9に示す。
【0199】
これらの誘導体の細胞毒性は、PEI陽性対照と比較してSKOV3卵巣癌細胞で試験した。結果を図7および8に示す。デキストラン誘導体(チオール+脂質)の混合物は、PEIと比較して、試験した濃度では比較的毒性がないことが判明した。
【0200】
MDR1siRNA担持ナノ粒子を用いたP-gpの安定した抑制
P-gp発現でのMDR1 siRNA担持ナノ粒子の効果を推定するために、ウエスタンブロット法を実施した。P-gp発現は、薬物耐性のある二種の細胞株KHOSR2およびU-2OSR2で確認された。MDR1 siRNA担持ナノ粒子は、30nMほどの濃度でもP-gpの発現を阻害した。同じ効果は、二種の異なる薬物耐性のある骨肉腫細胞株でも観察された(図10Aおよび10B)。裸のsiRNAはP-gp発現を48時間抑制することができた。siRNA担持ナノ粒子は、Pgpの抑制を達成するまでの時間はより遅かったが抑制を96時間持続することができた(図11Aおよび11B)。
【0201】
MDR1 siRNA担持ナノ粒子によるカルセインAMのP-gp-媒介性流出の阻害
MDRの反転は通常、化学療法薬の細胞内蓄積の増加の現われであり、これはP-gp-媒介性薬物取り込みと流出を妨害することで達成されうる。そのため、MDR1 siRNA担持ナノ粒子の効果について、P-gp基質であるカルセインAMのKHOSR2中での取り込みと流出を考察した。画像分析によって決定されマイクロプレート蛍光分光分析で確認された、用量依存性のある形での、カルセインAMの流出を低下させるためにMDR1 siRNAで処理された細胞を示す(図12)。
【0202】
MDR1 siRNA担持ナノ粒子送達による細胞内ドキソルビシン蓄積の増強
蛍光顕微鏡を用いて、KHOSおよびKHOSR2におけるドキソルビシンの細胞内分布を分析した。薬物耐性のある骨肉腫細胞内での遊離ドキソルビシンとの3時間の培養期間後、薬物は主に細胞質に集中し、非常に低レベルの蛍光が核で観察された。薬物耐性のある細胞株に対するMDR1 siRNA担持ナノ粒子の処理後にドキソルビシンが投与された場合、蛍光の増加が核と細胞質で観察された。この細胞内分布は、 ドキソルビシンで処理した際の薬物感受性のある変種の細胞内分布を模倣するものだった。
【0203】
薬物耐性のある骨肉腫細胞における生体外細胞毒性研究
デキストランナノ粒子自体は、使用された投与量では細胞毒性がなかった。MDR1 siRNA担持ナノ粒子による治療後、ドキソルビシンは用量依存性のある形で、薬物耐性のある骨肉腫細胞株において増殖抑制作用量の増加を示した(図13Aおよび13B)。100nMのMDR1 siRNA担持ナノ粒子の送達により、100倍も高い量の遊離薬物を投与した場合よりも、ドキソルビシンによる成長の阻害は大幅に顕著となった。例えば、KHOSR2細胞株において、ドキソルビシンのIC50のみでは10μMだったが、MDR1 siRNA担持ナノ粒子と共同処理した場合は0.1μMに低下した。同様に、薬物耐性のある細胞株U-2OSR2は同じような傾向を示し、ドキソルビシンのIC50のみでは6μMだったが、MDR1 siRNA担持ナノ粒子と共同処理した場合は0.06μMに低下した。
【0204】
この実施例では、多剤耐性のある骨肉腫細胞株(KHOSR2およびU-2OSR2)をMDR1 siRNAナノ担体で処理し、MDR1タンパク質(P-gp)の発現、薬物滞留性および免疫蛍光を分析した。ドキソルビシンの濃度を増したMDR1 siRNA担持ナノ担体の併用療法についてもまた分析を行った。MDR1 siRNA担持デキストランナノ粒子は、薬物耐性のある骨肉腫細胞株におけるP-gp発現を効率的に抑制した。また結果によって、このアプローチはMDR細胞株における薬物蓄積量を増加させることで薬物耐性を逆転できることが実証された。そのため、脂質修飾デキストランに基づくポリマーナノ粒子は、siRNA送達のプラットフォームとして使用してもよい。さらに、MDR1 siRNA担持のナノ担体は、骨肉種におけるMDRの逆転のための治療戦略としても使用してもよい。
【実施例2】
【0205】
骨肉腫における薬物耐性を克服するための
ドキソルビシン担持ポリマーナノ粒子送達システム
A. 物質および方法
デキストラン(Mwは約40 kDa)、ステアリルアミン(99%純度)、シスタミン、ピリジン、過ヨウ素酸ナトリウム(NaIO4)、シアノ水素化ホウ素ナトリウム(NaCNBH3)、硫酸カリウム(K2SO4)およびアゾビスイソブチロニトリル(AIBN)は、Sigma-Aldrich Chemical Co(ミズーリ州セントルイス)から入手した。ジチオール修飾ポリ(エチレングリコール)(PEG-(SH)2、M.W. 2,000)は、SunBio, Inc.(韓国、ソウル)から得 た。無水リチウム塩素(LiCl)はFisher Scientific(ペンシルベニア州フィラデルフィア)から入手した。分子篩付き脱水ジメチルホルムアミド(DMF)およびジメチルスルホキシド(DMSO)は、Acros Organics(ニュージャージ州パーシッパニー)から入手した。アクリロイル塩素、ピリジンおよび他の試薬および溶媒はSigma-Aldrichから入手し、さらなる精製なく受け取ったものとして使用された。
【0206】
脂質修飾デキストラン誘導体およびチオール化したデキストランは実施例1に記載する通り調製した。
【0207】
ドキソルビシン含有デキストランナノ粒子の調製
5mg/mLのPEG-(SH)2、ステアリルアミン修飾デキストラン、および前述の通り合成したチオール化デキストランの原液を脱イオン水中で調製した。ドキソルビシンの10mM(1mL)原液をドキソルビシン担持ナノ粒子の調製に使用した。混合物を調製するために、40 μLのデキストラン-ステアリルアミンをまず35μL(0.35mM)のドキソルビシン溶液に添加し、渦巻き振とう器を用いてよく混合した。次に、前記を5分間培養した。この混合物に40μLデキストラン-チオール誘導体を添加して、さらに5分間培養した。最後に、40μLのPEG-(SH)2を添加してさらに15分間培養し、ナノ粒子の親和性のある殻を形成した。逐次追加のこの方法を使用して、ドキソルビシン中の疎水性基と脂質修飾デキストラン誘導体の間のより優れた相互作用を実現した。サンプルの容積は小さいため、やさしく渦巻きにかけ攪拌は使用しなかった。ナノ粒子におけるドキソルビシンの効率と担持は、ドキソルビシンのlmaxに呼応するサンプルの既知量のA485吸収度を測定し、その数値をドキソルビシンの原液を用いた場合に得られる標準曲線と比較して決定した。粒子サイズとゼータ電位測定は、実施例1に記載する通り実施した。
【0208】
細胞培養研究
ヒト骨肉腫細胞株U-2OSは、American Type Tissue Collection(メリーランド州ロックビル)から入手した。National Hellenic Research Foundation(ギリシャ、アテネ)は、ヒト骨肉腫細胞株KHOS、U-2OSおよび多剤耐性のある細胞株KHOSR2、U-2OSR2を快く提供してくれた。すべての細胞株は、実施例1に記載する通り維持した。
【0209】
細胞毒性検定
生体外細胞毒性検定は、実施例1に記載する通りMTT検定によって実施した。
【0210】
細胞におけるドキソルビシン取り込みの定量評価と定性評価
フローサイトメトリーのために、ナノ粒子を伴うまたは伴わないドキソルビシンで1時間、37°Cで培養されたKHOS、KHOSR2、U-2OS、およびU-2OSR2の細胞懸濁液について、FACS Caliburフロー血球計算器(BD Biosciences、カリフォルニア州サンノゼ)で細胞蛍光を分析し、データ取得はCellQuestを用いて行った。ドキソルビシンは本質的に蛍光性があり、488-nmアルゴンレーザー光で励起されうる(Krishan et al., Cancer Res. 45:1046-1051 (1985))。細胞を洗浄しPBSと蛍光発光(530 nmより上)で再懸濁してから、前角光錯乱を収集、増幅して、ヒストグラムを生成するためにスケーリングを行った。生成されたヒストグラム各自について、最小で500,000個の細胞を分析した。使用した最終ドキソルビシン濃度は10μMであった。
【0211】
細胞取り込み研究は、Venne et al.(Cancer Res. 56:3626-3629 (1996))の蛍光顕微鏡による手順に基づいて行った。KHOS細胞とKHOSR2細胞を6ウェルプレート上で5 x 105細胞/ウェルの密度で播種し、24時間培養させて細胞接着を行わせた。培養後、ドキソルビシンのみ、またはドキソルビシン担持ナノ粒子を各ウェルに添加して、さらに3時間培養した。培養後、細胞を洗浄し、PBSで懸濁した後、SPOT RTデジタルカメラ(Diagnostic Instruments, Inc.、ミシガン州スターリングハイツ)搭載のNikon Eclipse Ti-U蛍光顕微鏡(Nikon Corp.)で可視化した。蛍光強度および細胞局在を波長488nmで三通り、異なるフィールドでランダムに分析した。
【0212】
細胞アポトーシス検定
全細胞溶解物は、PARP(Cell Signaling Technology)への特異抗体とその分解産物で免疫ブロットした。陽性免疫反応は、Super Signal(R) West Pico Chemiluminescent Substrateを用いて検出した。バンドは、PhotoShop 7.0(Adobe、カリフォルニア州サンノゼ)による反転画像スキャン濃度測定によって半定量化した。信号のないゲル画像の領域は、背景値として指定された。さまざまな濃度でドキソルビシンのみ、またはドキソルビシン担持ナノ粒子で治療したKHOSまたはKHOSR2からの切断されたPARPを示すタンパク質の各バンドについて、背景レベルを超えた密度を分析した。タンパク質の担持が同等であり、検体ごとにタンパク質の量が違うという理由で違いが観察されないように、各タンパク質についてβ-アクチンに呼応するバンドを決定した。タンパク質バンドの密度はタンパク質のβ-アクチンバンドに標準化し、切断されたPARPの比率は切断されたPARP各自に呼応するβ-アクチンの比率で割ることで標準化した。アポトーシス細胞死の第二のパラメータとして、Apo-ONE Homogenous カスパーゼ-3/7 システムを用いて、メーカー(Promega、Madison、WI)の指示に従い、ドキソルビシンのみ、またはドキソルビシン担持ナノ粒子で処理した後にKHOSおよびKHOSR2におけるカスパーゼ-3/7活性を測定した。発光した蛍光の強度は、SPECTRAmax(R) Microplate Spectrofluorometer(Molecular Devices)を使用して波長521nmで決定した。
【0213】
B. 結果
細胞内ドキソルビシン送達のための脂質修飾デキストランナノ粒子
ドキソルビシンを、室温にて脱イオン水中で脂質修飾デキストラン誘導体で培養して、自己集合された疎水性相互作用によってナノ粒子を形成した。さらに、チオール化デキストラン誘導体およびPEG化チオール誘導体を、PEG鎖のデキストランヒドロゲルへの結合効率を強化するために誘導体化されたドキソルビシン含有脂質修飾デキストランと逐次的に混合した。この方法によって、ドキソルビシン担持が良好な安定したナノ粒子の形成が得られた(図14で図示)。動的光散乱(DLS)測定によって決定されたドキソルビシン担持ナノ粒子の粒子サイズの平均は112.4+4.2 nm、ゼータ電位はほぼ中性(+1.19+0.82 mV)であった。粒子は室温で安定しており、保管(4oCで1週間)段階での粒子サイズの変化はあまりなかった。
【0214】
担持ナノ粒子送達による細胞内ドキソルビシン蓄積の増強
脂質修飾デキストランナノ粒子は、フローサイトメトリーによって考察した場合、KHOSR2(図15A)およびU-2OSR2(図15B)の両方におけるドキソルビシンの滞留の大幅な増加を引き起こした。ドキソルビシン担持ナノ粒子で処理した薬物耐性のある細胞の蛍光は、ドキソルビシンのみで処理した薬物感受性のある細胞の蛍光に匹敵するものであった。
【0215】
蛍光顕微鏡を用いて、KHOSおよびKHOSR2におけるドキソルビシンの細胞内分布を分析した。薬物耐性のある骨肉腫細胞内での遊離ドキソルビシンとの3時間の培養期間後、薬物は主に細胞質に集中し、非常に低レベルの蛍光が核で観察された。ドキソルビシンがナノ粒子とともに薬物耐性の細胞株に投与される場合、核において蛍光の顕著な増加が観察され、その一方で細胞質の蛍光は実質的に影響を受けないままであった。この細胞内分布は、 ドキソルビシンで治療した際に薬物感受性のある変種の細胞内分布を模倣するものだった。
【0216】
野生型細胞および耐性細胞における増殖抑制効果の評価
デキストランナノ粒子自体は、この研究で使用した投与量では細胞毒性はなかった(図16)。但し、ドキソルビシン担持ナノ粒子は、用量依存性のある形で、薬物感受性と薬物耐性両方のある骨肉腫細胞株における増殖抑制作用量の増加を示した(図20A-D)。ドキソルビシン担持ナノ粒子は、ドキソルビシンのみの場合と比べてU-2OSよりも10倍も高い活性 (IC50 0.03 μM〜0.3 μM、図17C)、KHOSR2よりも5倍も高い活性(IC500.6μM〜IC50 3μM、図17B)、およびU-2OSR2よりも20倍も高い活性(IC50 0.3μM〜6μM、図17D)を示した。
【0217】
Pgp発現に対するナノ粒子の効果は、ウエスタンブロット法検定を用いて評価した。Pgpは、薬物感受性のあるKHOSおよびU-2OSでは発現しなかったが、Pgpは二種の薬物耐性細胞株KHOSR2およびU-2OSR2では過剰発現した。ナノ粒子はPgpの発現を抑制しなかったが、Pgpの発現はドキソルビシンの濃度の増加に伴い次第に増加した。
【0218】
ドキソルビシンナノ粒子による細胞アポトーシスの誘導
KHOSおよびKHOSR2にアポトーシスを誘導する際のドキソルビシン担時ナノ粒子の有効性を評価するために、ウエスタンブロット法検定を用いてPARPの切断を検出した。デキストランナノ粒子自体は、この研究で使用する投与量ではPARPの切断の原因とはならなかった。より高いドキソルビシンの濃度のみでアポトーシスが誘導されたものの、ドキソルビシン担持ナノ粒子は薬物感受性(図18A)および抵抗耐性の細胞株(図18B)の両方よりもはるかに高いアポ トーシス誘導率を示した。さらに、KHOSおよびKHOSR2をドキソルビシン担持ナノ粒子で治療したとき、カスパーゼ-3/7活性は顕著に増加した(図19Aおよび19B)。
【0219】
均等物
本発明はその詳細な説明と併せて記載されているものの、前文の説明は図示目的であって本発明の範囲を制限する意図はなく、当該範囲は添付の請求項の範囲によって定義されることを理解されたい。他の態様、利点および修正も、下記の請求項の範囲内である。
【技術分野】
【0001】
関連出願の相互参照
この出願は、2008年10月9日出願の米国仮出願番号61/104,056、および2009年9月28日出願の米国仮出願番号61/246,355の利益を主張し、その内容全体が参照によって本明細書に組み込まれる。
【0002】
発明の分野
本発明は、医療用の治療的ナノ粒子の分野に属する。
【背景技術】
【0003】
体内の特定の病変組織および細胞への核酸治療薬の送達は、分子量が大きいこと、負電荷、および特に分解酵素(DNA分解酵素およびRNA分解酵素など)の多い体液中での安定性が比較的低いために、困難である。核酸送達の多くの技術は、静電複合体(リポプレックスおよびポリプレックスなど)を形成する陽イオン性脂質およびポリマーを、負電荷の核酸構成物と共に利用する。これらの陽イオンシステムは、細胞内放出および安定性の欠如のために、(プラスミドDNAでの)遺伝子治療または(低分子干渉RNAでの)RNA干渉療法に対しては効果がない可能性がある。さらに、陽イオン性脂質およびポリマーは、細胞および組織に対して有毒な可能性がある。
【0004】
薬剤耐性は、骨肉腫に対する化学療法の効率における主な障害である。1980年代初めのネオアジュバント療法の導入後、化学療法は骨肉腫患者の予後を改善したが、転帰は5年生存率が約70%で頭打ちとなっている。残り30%の患者は、最終的には、複数タイプの化学療法に対する耐性を生じる。このため、従来の化学療法剤の用量を制限する副作用および多剤耐性(MDR)腫瘍細胞によって生じる治療の失敗の両方を克服するためのニーズがいまだにある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
【課題を解決するための手段】
【0006】
本発明は、治療薬および/または造影剤を含むナノ粒子形成物のカスタム化されたライブラリーを作るための機能成分のモジュラープラットフォームの発見に、少なくとも一部基づいている。従って、1つの態様では、本発明は、カスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a) 治療薬の分配計数を決定すること、b) 治療薬を水溶液に可溶化すること、c) PEGおよび脂肪酸を含む第一の水溶性誘導体化ポリマーを提供すること、d) 可溶化された治療薬と第一の水溶性誘導体化ポリマーを混合し、可溶化された治療薬と第一の水溶性誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、e) PEGおよび第一の水溶性誘導体化ポリマーの脂肪酸とは異なる脂肪酸を含む第二の水溶性誘導体化ポリマーを提供すること、およびf) ステップd) を繰り返して第二のナノ粒子を形成し、それによってカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0007】
一部の実施態様では、治療薬は、約100よりも大きい、約200よりも大きい、約300よりも大きい、約400よりも大きい、約500よりも大きい、約600よりも大きい、約700よりも大きい、約800よりも大きい、約900よりも大きい、または約1000よりも大きい分配計数を持つ。特定の実施態様では、脂肪酸は C14脂肪酸、C15脂肪酸、 C16脂肪酸、 C17脂肪酸、 C18脂肪酸、 C19脂肪酸、 C20脂肪酸、 C21脂肪酸、C22脂肪酸、 C23脂肪酸、 C24脂肪酸、 C25脂肪酸、 C26脂肪酸、 C27脂肪酸、またはC28脂肪酸である。
【0008】
他の実施態様では、治療薬は、約100未満、約90未満、約80未満、約70未満、約60未満、約50未満、約40未満、約30未満、約20未満、約10未満、約5未満、または約1未満の分配計数を持つ。特定の実施態様では、脂肪酸は C2脂肪酸、C3脂肪酸、 C4脂肪酸、 C5脂肪酸、 C6脂肪酸、 C7脂肪酸、 C8脂肪酸、 C9脂肪酸、C10脂肪酸、 C11脂肪酸、 C12脂肪酸、 C13脂肪酸、 C14脂肪酸である。
【0009】
一部の実施態様では、第一および第二の水溶性誘導体化ポリマーは、可溶化された治療薬を取り囲むヒドロゲルの殻を形成する。
【0010】
他の実施態様では、第一および第二の水溶性誘導体化ポリマーは 中性電荷を持つ。特定の実施態様では、第一および第二の水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。
【0011】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーは負電荷を持つ。ある実施態様では、第一および第二の水溶性誘導体化ポリマーは、アルギン酸塩、ヒアルロン酸、ペクチン、またはセルロース誘導体である。
【0012】
一部の実施態様では、方法はさらに、第一および第二の水溶性誘導体化ポリマーに架橋剤を添加して、それによりナノ粒子の安定性を強化することを含む。ある実施態様では、架橋剤はジスルフィド結合形成架橋剤である。特定の実施態様では、ジスルフィド結合形成架橋剤は、シスタミン、2-イミノチオラン、アミノチオラン、グルタチオン、リポ酸、グリオキサル、またはエピクロロヒドリンである。
【0013】
他の実施態様では、架橋剤は二価陽イオンである。ある実施態様では、二価陽イオンは、Ca2+、Mg2+、Ba2+、またはFe2+である。また他の実施態様では、架橋剤は三価陽イオンである。特定の実施態様では、三価陽イオンはAl3+またはFe3+である。
【0014】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーはチオール基で修飾される。他の実施態様では、PEGはチオール基で修飾される。
【0015】
ある実施態様では、PEGは、約1,000ダルトン、約1,500ダルトン、約2,000ダルトン、約2,500ダルトン、約3,000ダルトン、約3,500ダルトン、約4,000ダルトン、約4,500ダルトン、約5,000ダルトン、約6,000ダルトン、約7,000ダルトン、約8,000ダルトン、約9,000ダルトン、または約10,000ダルトンの分子量を持つ。
【0016】
他の実施態様では、PEGは一つの末端に反応性基を含む。ある実施態様では、反応基は、酸、アミン、マレイミド、アクリレート、またはスクシンイミジルカルボキシメチルエステルである。
【0017】
また他の実施態様では、方法は、標的薬剤をPEG上の反応基に結合することをさらに含む。特定の実施態様では、標的薬剤は、核酸、ポリペプチド、多糖、または小分子である。特定の実施態様では、標的薬剤は、葉酸、EGF、FGF、または腫瘍関連抗原MUC1の抗体、cMet受容体、またはCD56 (NCAM)である。
【0018】
一部の実施例では、治療薬は化学療法剤である。特定の実施態様では、化学療法剤は、ドキソルビシン、パクリタキセル、またはタモキシフェンである。
【0019】
また他の実施態様では、方法は、第一および第二の水溶性ポリマーとジエチレントリアミン5酢酸(DTPA)を共役させることをさらに含む。特定の実施態様では、方法は、造影剤をDTPAに結合することをさらに含む。ある実施態様では、造影剤は、64Gd、111In、または125Iである。
【0020】
一部の実施態様では、ライブラリーは、約2、約10、約25、約50、約100、約150、約200、約250、約300、約350、約400、約450、約500、約600、約700、約800、約900、約1,000、約2,000、約3,000、約4,000、約5,000、約6,000、約7,000、約8,000、約9,000、約10,000、の異なるタイプのナノ粒子またはそれ以上を含む。
【0021】
別の態様では、本発明は、カスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a) 疎水性の治療薬を水溶液に可溶化すること、b) ポリエチレングリコール(PEG)およびC14-C28脂肪酸を含む第一の水溶性誘導体化ポリマーを提供すること、c) 可溶化された治療薬と第一の水溶性誘導体化ポリマーを混合し、可溶化された治療薬と第一の水溶性誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、d) PEGおよび第一の水溶性誘導体化ポリマーの脂肪酸とは異なるC14-C28脂肪酸を含む第二の水溶性誘導体化ポリマーを提供すること、およびe) ステップc) を繰り返して第二のナノ粒子を形成し、それによってカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0022】
一部の実施態様では、治療薬は、約100よりも大きい、約200よりも大きい、約300よりも大きい、約400よりも大きい、約500よりも大きい、約600よりも大きい、約700よりも大きい、約800よりも大きい、約900よりも大きい、または約1000よりも大きい分配計数を持つ。
【0023】
特定の実施態様では、脂肪酸はC14脂肪酸、C15脂肪酸、 C16脂肪酸、 C17脂肪酸、 C18脂肪酸、 C19脂肪酸、 C20脂肪酸、 C21脂肪酸、C22脂肪酸、 C23脂肪酸、 C24脂肪酸、 C25脂肪酸、 C26脂肪酸、 C27またはC28脂肪酸である。
【0024】
一部の実施態様では、第一および第二の水溶性誘導体化ポリマーは、可溶化された治療薬を取り囲むヒドロゲルの殻を形成する。
【0025】
他の実施態様では、第一および第二の水溶性誘導体化ポリマーは中性電荷を持つ。特定の実施態様では、第一および第二の水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。
【0026】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーは負電荷を持つ。ある実施態様では、第一および第二の水溶性誘導体化ポリマーは、アルギン酸塩、ヒアルロン酸、ペクチン、またはセルロース誘導体である。
【0027】
一部の実施態様では、本方法はさらに、第一および第二の水溶性誘導体化ポリマーに架橋剤を添加して、それによりナノ粒子の安定性を強化することを含む。ある実施態様では、架橋剤はジスルフィド結合形成架橋剤である。特定の実施態様では、ジスルフィド結合形成架橋剤は、シスタミン、2-イミノチオラン、アミノチオラン、グルタチオン、リポ酸、グリオキサル、またはエピクロロヒドリンである。
【0028】
他の実施態様では、架橋剤は二価陽イオンである。ある実施態様では、二価陽イオンは、Ca2+、Mg2+、Ba2+、またはFe2+である。また他の実施態様では、架橋剤は三価陽イオンである。特定の実施態様では、三価陽イオンはAl3+またはFe3+である。
【0029】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーはチオール基で修飾される。他の実施態様では、PEGはチオール基で修飾される。
【0030】
ある実施態様では、PEGは、約1,000ダルトン、約1,500ダルトン、約2,000ダルトン、約2,500ダルトン、約3,000ダルトン、約3,500ダルトン、約4,000ダルトン、約4,500ダルトン、約5,000ダルトン、約6,000ダルトン、約7,000ダルトン、約8,000ダルトン、約9,000ダルトン、または約10,000ダルトンの分子量を持つ。
【0031】
他の実施態様では、PEGは一つの末端に反応性基を含む。ある実施態様では、反応基は、酸、アミン、マレイミド、アクリレート、またはスクシンイミジルカルボキシメチルエステルである。
【0032】
また他の実施態様では、方法は、標的薬剤をPEG上の反応基に結合することをさらに含む。特定の実施態様では、標的薬剤は、核酸、ポリペプチド、多糖、または小分子である。特定の実施態様では、標的薬剤は、葉酸、EGF、FGF、または腫瘍関連抗原MUC1の抗体、cMet受容体、またはCD56 (NCAM)である。
【0033】
一部の実施例では、治療薬は化学療法剤である。特定の実施態様では、化学療法剤は、ドキソルビシン、パクリタキセル、またはタモキシフェンである。
【0034】
また他の実施態様では、方法は、第一および第二の水溶性ポリマーとジエチレントリアミン5酢酸(DTPA)を共役させることをさらに含む。特定の実施態様では、方法は、造影剤をDTPAに結合することをさらに含む。ある実施態様では、造影剤は、64Gd、111In、または125Iである。
【0035】
一部の実施態様では、ライブラリーは、約2、約10、約25、約50、約100、約150、約200、約250、約300、約350、約400、約450、約500、約600、約700、約800、約900、約1,000、約2,000、約3,000、約4,000、約5,000、約6,000、約7,000、約8,000、約9,000、約10,000、の異なるタイプのナノ粒子またはそれ以上を含む。
【0036】
別の態様では、本発明は、カスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a) 親水性の治療薬を水溶液に可溶化すること、b) ポリエチレングリコール(PEG)およびC2-C14脂肪酸を含む第一の水溶性誘導体化ポリマーを提供すること、c) 可溶化された治療薬と第一の水溶性誘導体化ポリマーを混合し、可溶化された治療薬と第一の水溶性誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、d) PEGおよび第一の水溶性誘導体化ポリマーの脂肪酸とは異なるC2-C14脂肪酸を含む第二の水溶性誘導体化ポリマーを提供すること、およびe) ステップc) を繰り返して第二のナノ粒子を形成し、それによってカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0037】
他の実施態様では、治療薬は、約100未満、約90未満、約80未満、約70未満、約60未満、約50未満、約40未満、約30未満、約20未満、約10未満、約5未満、または約1未満の分配計数を持つ。
【0038】
特定の実施態様では、脂肪酸は C2脂肪酸、C3脂肪酸、 C4脂肪酸、 C5脂肪酸、 C6脂肪酸、 C7脂肪酸、 C8脂肪酸、 C9脂肪酸、C10脂肪酸、 C11脂肪酸、C12脂肪酸、C13脂肪酸、 C14脂肪酸である。
【0039】
一部の実施態様では、第一および第二の水溶性誘導体化ポリマーは、可溶化された治療薬を取り囲むヒドロゲルの殻を形成する。
【0040】
他の実施態様では、第一および第二の水溶性誘導体化ポリマーは中性電荷を持つ。特定の実施態様では、第一および第二の水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。
【0041】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーは負電荷を持つ。ある実施態様では、第一および第二の水溶性誘導体化ポリマーは、アルギン酸塩、ヒアルロン酸、ペクチン、またはセルロース誘導体である。
【0042】
一部の実施態様では、本方法はさらに、第一および第二の水溶性誘導体化ポリマーに架橋剤を添加して、それによりナノ粒子の安定性を強化することを含む。ある実施態様では、架橋剤はジスルフィド結合形成架橋剤である。特定の実施態様では、ジスルフィド結合形成架橋剤は、シスタミン、2-イムノチオラン、アミノチオラン、グルタチオン、リポ酸、グリオキサル、またはエピクロロヒドリンである。
【0043】
他の実施態様では、架橋剤は二価陽イオンである。ある実施態様では、二価陽イオンは、Ca2+、Mg2+、Ba2+、またはFe2+である。また他の実施態様では、架橋剤は三価陽イオンである。特定の実施態様では、三価陽イオンはAl3+またはFe3+である。
【0044】
また他の実施態様では、第一および第二の水溶性誘導体化ポリマーはチオール基で修飾される。他の実施態様では、PEGはチオール基で修飾される。
【0045】
ある実施態様では、PEGは、約1,000ダルトン、約1,500ダルトン、約2,000ダルトン、約2,500ダルトン、約3,000ダルトン、約3,500ダルトン、約4,000ダルトン、約4,500ダルトン、約5,000ダルトン、約6,000ダルトン、約7,000ダルトン、約8,000ダルトン、約9,000ダルトン、または約10,000ダルトンの分子量を持つ。
【0046】
他の実施態様では、PEGは一つの末端に反応性基を含む。ある実施態様では、反応基は、酸、アミン、マレイミド、アクリレート、またはスクシンイミジルカルボキシメチルエステルである。
【0047】
また他の実施態様では、方法は、標的薬剤をPEG上の反応基に結合することをさらに含む。特定の実施態様では、標的薬剤は、核酸、ポリペプチド、多糖、または小分子である。特定の実施態様では、標的薬剤は、葉酸、EGF、FGF、または腫瘍関連抗原MUC1の抗体、cMet受容体、またはCD56 (NCAM)である。
【0048】
一部の実施態様では、治療薬は核酸である。特定の実施態様では、核酸は低分子干渉RNA分子、アプタマー、またはリボザイムである。
【0049】
また他の実施態様では、方法は、第一および第二の水溶性ポリマーとジエチレントリアミン5酢酸(DTPA)を共役させることをさらに含む。特定の実施態様では、方法は、造影剤をDTPAに結合することをさらに含む。ある実施態様では、造影剤は、64Gd、111In、または125Iである。
【0050】
一部の実施態様では、ライブラリーは、約2、約10、約25、約50、約100、約150、約200、約250、約300、約350、約400、約450、約500、約600、約700、約800、約900、約1,000、約2,000、約3,000、約4,000、約5,000、約6,000、約7,000、約8,000、約9,000、約10,000、の異なるタイプのナノ粒子またはそれ以上を含む。
【0051】
別の態様では、本発明はカスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a)(i) PEG、(ii) DTPA、および(iii) C14-C28脂肪酸を含む第一の水溶性誘導体化ポリマーを提供し、b) 造影剤と第一の誘導体化ポリマーを混合し、造影剤と第一の誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、c) (i) PEG、 (ii) DTPA、および第一の誘導体化ポリマーの脂肪酸とは異なる(iii) C14-C28脂肪酸を含む第二の水溶性誘導体化ポリマーを提供し、d) ステップb)を繰り返して第二のナノ粒子を形成し、それによりカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0052】
一部の実施態様では、造影剤は、64Gd、111In、または125Iである。他の実施態様では、第一および第二の水溶性誘導体化ポリマー、PEGおよび C14-C28脂肪酸は本明細書に記述された任意のものである。
【0053】
別の態様では、本発明はカスタム化されたナノ粒子ライブラリーの作成方法を取り上げており、その方法は、a)(i) PEG、(ii) DTPA、および(iii) C2-C14脂肪酸を含む第一の誘導体化ポリマーを提供し、b) 造影剤と第一の誘導体化ポリマーを混合し、造影剤と第一の誘導体化ポリマーを自己集合させて第一のナノ粒子を形成すること、[c)] (i) PEG、 (ii) DTPA、および第一の誘導体化ポリマーの脂肪酸とは異なる(iii) C2-C14脂肪酸を含む第二の誘導体化ポリマーを提供し、[d)] ステップc)を繰り返して第二のナノ粒子を形成し、それによりカスタム化されたナノ粒子ライブラリーを作成することを含む。
【0054】
一部の実施態様では、造影剤は酸化鉄または量子ドットである。他の実施態様では、第一および第二の水溶性誘導体化ポリマー、PEGおよび C2-C14脂肪酸は本明細書に記述された任意のものである。
【0055】
別の態様では、本発明は腫瘍を持つ被験者の治療方法を取り上げており、その方法は、腫瘍サイズまたは腫瘍内の腫瘍細胞数を低減するのに十分な量のナノ粒子を被験者に投与することを含み、ここでナノ粒子は、a) 治療薬、b) 治療薬を取り囲むヒドロゲルの殻(ここでヒドロゲルの殻は(i) C14-C28脂肪酸、(ii)、PEG、および(iii) 架橋剤を含む水溶性誘導体化ポリマーを含む)、およびc) PEGに結合している標的薬剤を含み、その結果、被験者を治療する。
【0056】
一部の実施態様では、水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。特定の実施態様では、水溶性誘導体化ポリマーはデキストランである。ある実施態様では、水溶性誘導体化ポリマーはチオール化デキストランを含む。
【0057】
他の実施態様では、脂肪酸はC16、C18、または C20脂肪酸である。
【0058】
一部の実施例では、被験者は脊椎動物である。ある実施態様では、被験者は哺乳類である。特定の実施態様では、被験者はヒトである。
【0059】
また別の態様では、本発明は被験者の標的ポリペプチドの発現を阻害する方法を取り上げており、その方法は、標的ポリペプチドの発現を阻害するのに十分な量のナノ粒子を被験者に投与することを含み、ここでナノ粒子は、a) 低分子干渉RNA分子、b) 低分子干渉RNA分子を取り囲むヒドロゲルの殻(ヒドロゲルの殻は、(i) C2-C14脂肪酸、(ii)PEG、および(iii)架橋剤を含む水溶性誘導体化ポリマーを含む)、およびc) PEGに結合した標的薬剤を含み、その結果、標的ポリペプチドの発現を阻害する。
【0060】
一部の実施態様では、水溶性誘導体化ポリマーは、デキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である。特定の実施態様では、水溶性誘導体化ポリマーはデキストランである。ある実施態様では、水溶性誘導体化ポリマーはチオール化デキストランを含む。
【0061】
一部の実施例では、被験者は脊椎動物である。ある実施態様では、被験者は哺乳類である。特定の実施態様では、被験者はヒトである。
【0062】
また別の態様では、本発明は、本明細書に記述された任意の方法で作成されるナノ粒子ライブラリーを取り上げている。一部の実施態様では、ライブラリーは、約2、約10、約25、約50、約100、約150、約200、約250、約300、約350、約400、約450、約500、約600、約700、約800、約900、約1,000、約2,000、約3,000、約4,000、約5,000、約6,000、約7,000、約8,000、約9,000、約10,000、の異なるタイプのナノ粒子またはそれ以上を含む。
【0063】
別の態様では、本発明は、本明細書に記述された疾患を治療するための薬剤の製造における、本明細書に記述されたナノ粒子の使用を取り上げている。一部の実施態様では、薬剤は、疾患の治療のための追加的治療薬を含む。
【0064】
定義
本明細書で使用される場合、「約」とは、引用値の前後に± 10%の範囲を持つ数値を意味する。
【0065】
本明細書で使用される場合、「被験者」は、哺乳類、例えば、ヒト、マウス、ラット、モルモット、犬、猫、馬、牛、豚、または猿、チンパンジー、マントヒヒまたは赤毛猿などの人間以外の霊長類である。
【0066】
本明細書で使用される場合、「生分解性」という用語は、自然の生物学的過程(例えば、ヒトなどの脊椎動物)によって成分分子に(例えば、化学的または酵素的に)分解または破壊される物質を指す。
【0067】
本明細書で使用される場合、「生体適合性」という用語は、標的生物の生物学的機能に意図せぬ有毒または有害な影響を持たない物質を指す。
【0068】
本明細書で使用される場合、「ナノ粒子」という用語は、約50 nm〜約1000 nmの範囲の直径を持つ粒子を指す。ナノ粒子には、被験者内に放出され得る治療薬または造影剤を含むことができる粒子を含む。
【0069】
本明細書で使用される場合、「共役した」、「誘導体化」、および「結合した」という用語は互換的に使用され、2つの成分が、例えば化学的共有結合、またはファン・デル・ワールスや疎水的相互作用などの物理的力によって物理的に結合されていることを意味する。2つの成分はまた、例えば、共有結合した原子の鎖などのリンカーを通して、間接的に共役され得る。
【0070】
本明細書で使用される場合、「治療する」「治療すること」または「治療」とは、疾患(例えば、本明細書に記述されている疾患)またはその症状を改善するため、または疾患(例えば、本明細書に記述されている疾患)またはその症状の進行を防止または遅くするために効果的な量、様式(例えば、投与計画)、および/またはモード(例えば、投与経路)の治療薬を投与することを指す。これは、例えば、疾患またはその症状に関連するパラメーターの例えば統計的に有意な程度または当業者が検出できる程度の改善で明らかとなり得る。効果的な量、様式、またはモードは、被験者によって異なることがあり、被験者に合わせることができる。疾患またはその症状の進行を防止または遅くすることにより、罹患したまたは診断された被験者の疾患またはその症状から生じる悪化を、治療によって防止または遅くすることができる。
【0071】
本明細書で記述された組成物と関連して使用される場合、「効果的な量」とは、疾患またはその症状を治療するのに効果的な量である。
【0072】
本明細書で使用される場合、「ポリマー」とは反復するサブユニットで構成される分子を指す。このような分子には、ポリペプチド、ポリヌクレオチド、多糖またはポリアルキレングリコールを含むが、これに限定されない。ポリマーはまた、生分解性および/または生体適合性であり得る。
【0073】
「ポリペプチド」、「ペプチド」、および「タンパク質」という用語は本明細書では互換的に使用され、アミノ酸残基のポリマーを指す。これらの用語は天然アミノ酸ポリマー、および1つ以上のアミノ酸残基が非天然アミノ酸であるアミノ酸ポリマーに適用される。さらに、このようなポリペプチド、ペプチド、およびタンパク質は、アミノ酸残基がペプチド共有結合で結合されている全長タンパク質を含む任意の長さのアミノ酸鎖を含む。
【0074】
「薬剤」または「治療薬」という用語は本明細書で使用される場合、病気または疾患の予防、診断、緩和、治療または治癒に使用される任意の物質を指す。
【0075】
「標的薬剤」という用語は、特異的または選択的に(例えば、非無作為的に)目的標的分子に結合または混成、または相互作用することができるリガンドまたは分子を指す。標的薬剤の例には、核酸分子(例えば、アプタマー、アンチセンス、またはリボザイムなどのリガンド結合RNA分子を含むRNAおよびDNA)、ポリペプチド(例えば、抗原結合タンパク質、受容体リガンド、シグナル・ペプチド、および疎水性膜貫通ドメイン)、抗体(およびその部分)、有機分子(例えば、ビオチン、炭水化物、および糖タンパク質)、および無機分子(例えば、ビタミン)を含むが、これに限定されない。本明細書に記述されたナノ粒子は、このようなさまざまな標的薬剤の1つ以上がそれに付着していることがある。
【0076】
本明細書で使用される場合、「自己集合」、「自己集合した」、または「自己集合性」とは、超音波処理、高圧、膜貫入、または遠心分離などの物理的力を適用することなく、成分が集合してナノ粒子になることを意味する。
【0077】
別段の定義がない限り、本明細書で使用されるすべての技術的および科学的用語は、この発明が属する当業者によって一般的に理解されているものと同じ意味を持つ。本発明の実施または試験において、本明細書に記述されたものと同様または同等の方法および材料を使用できるが、適切な方法および材料を以下に記述する。本明細書で言及したすべての出版物、特許出願、特許、および他の参考文献は、参照によりその全体を本明細書に組み込む。不一致が生じた場合、定義を含めて、本明細書が支配するものとする。さらに、材料、方法、および例は例示目的のみであり制限を意図するものではない。
【発明の効果】
【0078】
本発明の他の特徴および利点は、以下の詳細な説明および請求項で明らかとなる。
【図面の簡単な説明】
【0079】
【図1】図 1は多機能ポリマーライブラリーの略図である。
【図2】図 2は、組み合わせデザインのナノプラットフォーム・システムの略図である。
【図3】図 3は、組み合わせ低分子干渉RNAおよび薬物送達のための自己集合ナノプラットフォームの開発に対する組み合わせ方法の略図である。
【図4】図 4は、デキストランのチオレーションの程度を図解したものである。
【図5A】図 5Aは、デキストランの500 MHz 1H NMRスペクトルを図解したものである。
【図5B】図 5Bは、精製後のデキストラン共役ステアリルアミンの500 MHz 1H NMRスペクトルを図解したものである。
【図6】図 6は、MDR1低分子干渉RNA負荷ステアリルアミン・デキストラン修飾ナノ粒子の略図である。
【図7】図 7は、SKOV3細胞内のチオール化デキストランの細胞毒性を図解したものである。
【図8】図 8は、チオール化ポリマーの細胞毒性を図解したものである。細胞毒性は、SKOV3卵巣がん細胞においてさまざまな濃度の高分子誘導体を培養して測定した。相対的細胞生存(%)は、ホルマザン(MTT)分析によって決定した。
【図9】図 9は、チオール化デキストラン誘導体のGFP・低分子干渉RNAサイレンシングの略図である。
【図10A】図 10Aは、MDR1低分子干渉RNA負荷ナノ粒子で処理した後のKHOSR2細胞におけるP-gp発現のウェスタンブロット分析を図解したものである。
【図10B】図 10Bは、MDR1低分子干渉RNA負荷ナノ粒子で処理した後のU-2OSR2細胞におけるP-gp発現のウェスタンブロット分析を図解したものである。
【図11A】図 11Aは、裸MDR1低分子干渉RNAで処理した後のKHOSR2細胞におけるP-gp発現のウェスタンブロット分析を図解したものである。
【図11B】図 11Bは、MDR1低分子干渉RNA負荷ナノ粒子で処理した後のKHOSR2細胞におけるP-gp発現のウェスタンブロット分析を図解したものである。
【図12】図 12は、MDR1低分子干渉負荷ナノ粒子で処理した後のP-gp媒介性取り込みおよび流出の図解である。
【図13A】図 13Aは、ドキソルビシン単独、またはMDR1低分子干渉RNAでナノ粒子負荷したものの、KHOSR2細胞に対する影響の図解である。
【図13B】図 13Bは、ドキソルビシン単独、またはMDR1低分子干渉RNAでナノ粒子負荷したものの、KHOSR2細胞に対する影響の図解である。
【図14】図 14は、ドキソルビシン負荷ステアリルアミン・デキストラン修飾ナノ粒子の略図である。
【図15A】図 15Aは、ドキソルビシン処理単独またはドキソルビシンでナノ粒子負荷した後の、フローサイトメトリー分析によるKHOSおよびKHOSR2の蛍光を図解したものである。
【図15B】図 15Bは、ドキソルビシン処理単独またはドキソルビシンでナノ粒子負荷した後の、フローサイトメトリー分析によるU-2OSおよびU-2OSR2細胞の蛍光を図解したものである。
【図16】図 16は、KHOS およびKHOSR2細胞に対するデキストラン・ナノ粒子の細胞毒性の図解である。
【図17A】図 17Aは、KHOS細胞に対する、ドキソルビシン単独、またはドキソルビシンを負荷したナノ粒子の増殖抑制作用を図解したものである。
【図17B】図 17Bは、KHOSR2細胞に対する、ドキソルビシン単独、またはドキソルビシンを負荷したナノ粒子の増殖抑制作用を図解したものである。
【図17C】図 17Cは、U-2OS細胞に対する、ドキソルビシン単独、またはドキソルビシンを負荷したナノ粒子の増殖抑制作用を図解したものである。
【図17D】図 17Dは、U-2OSR2細胞に対する、ドキソルビシン単独、またはドキソルビシンを負荷したナノ粒子の増殖抑制作用を図解したものである。
【図18A】図 18Aは、薬剤感受性KHOS細胞をドキソルビシン負荷ナノ粒子で処理した時の、PARPの切断のウェスタンブロット分析を図解したものである。
【図18B】図 18Bは、多剤耐性KHOSR2骨肉腫細胞をドキソルビシン負荷ナノ粒子で処理した時の、PARPの切断のウェスタンブロット分析を図解したものである。
【図19A】図 19Aは、ドキソルビシン負荷ナノ粒子で処理したKHOS細胞のカスパーゼ-3/7活性を図解したものである。
【図19B】図 19Bは、ドキソルビシン負荷ナノ粒子で処理したKHOSR2細胞のカスパーゼ-3/7活性を図解したものである。
【発明を実施するための形態】
【0080】
GenBankを含む、本明細書で言及したすべての出版物、特許出願、特許、および他の参考文献は、参照によりその全体を本明細書に組み込む。別段の定義がない限り、本明細書で使用されるすべての技術的および科学的用語は、この発明が属する当業者によって一般的に理解されているものと同じ意味を持つ。不一致が生じた場合、定義を含めて、本明細書が支配するものとする。さらに、材料、方法、および例は例示目的のみであり制限を意図するものではない。本発明の実施または試験において、本明細書に記述されたものと同様または同等の方法および材料を使用できるが、適切な方法および材料を以下に記述する。
【0081】
本発明の他の特徴および利点は、以下の詳細な説明および請求項で明らかとなる。
【0082】
本開示は、病変組織および細胞などの組織および細胞への、治療薬および/または造影剤の送達を促進するのに役立つ多機能、高分子ナノシステムの作成およびカスタム化に関連する。1つの模範的な高分子ナノシステムが図1に概略的に示されている。図1に示されるように、ナノ粒子ライブラリーは、以下の機能成分のうち少なくとも3つに基づいた組み合わせ化学的アプローチを使って作成できる:ポリマー、疎水性または親水性薬剤(脂質)、ポリエチレングリコール(PEG)、架橋剤、および標的薬剤。一部の例では、これらの成分の少なくとも3つが、ナノ粒子を作成するために使用される:ポリマー、疎水性または親水性薬剤、およびPEG。他の例では、5つの成分すべてが使用される。本明細書に記述されるように、特定の成分とその配置は、送達されるべき治療薬および/または造影剤の物理化学的特性に基づいて選択される。
【0083】
ポリマー
本明細書に記述されるナノ粒子には、中性またはアニオン性の水溶性ポリマーなどの水溶性ポリマーを含む。このようなポリマーには、ポリ(スチレンスルホン酸)、ポリグルタミン酸またはアルギニン酸、ポリ(アクリル酸)、ポリ(アスパラギン酸)、ポリ(グルタル酸)、および硫酸デキストラン、カルボキシルメチルセルロース、ヒアルロン酸、アルギン酸ナトリウム、ゼラチンB、硫酸コンドロイチン、および/またはヘパリンなど、同様のイオン化基を持つ天然高分子電解質を含むがこれに限定されない。これらのポリマーは合成、単離、または商業的に入手できる。一部の例では、ポリマーはホモポリマーまたは共重合体である。
【0084】
ある例では、中性または負電荷の水溶性の生分解性および/または生体適合性ポリマーが使用される。これらには、かなり純粋な炭素格子(例えば、グラファイト)、デキストラン、多糖、ポリペプチド、ポリヌクレオチド、アクリレートゲル、ポリ酸無水物、ポリ(ラクタイドcoグリコライド)、ポリテトラフルオロエチレン、ポリヒドロキシアルコネート、 架橋アルギン酸、ゼラチン、コラーゲン、架橋コラーゲン、コラーゲン誘導体(コハク酸化コラーゲンまたはメチル化コラーゲンなど)、架橋ヒアルロン酸、チトサン、チトサン誘導体(メチルピロリドン・チトサンなど)、セルロースおよびセルロース誘導体(酢酸セルロースまたはカルボキシメチルセルロースなど)、デキストラン誘導体(カルボキシメチルデキストランなど)、デンプンおよびデンプンの誘導体(ヒドロキシエチルデンプンなど)、他のグリコサミノグリカンおよびその誘導体、他のポリアニオン性多糖またはその誘導体、ポリ乳酸(PLA)、ポリグリコール酸(PGA)、 ポリ乳酸とポリグリコール酸の共重合体(PLGA)、ラクチド、グリコライド、および他のポリエステル、ポリグリコライド・ホモポリマー、ポリオキサノンおよびポリシュウ酸、ポリ(ビス(p-カルボキシフェノキシ)プロパン)無水物(PCPP)とセバシン酸の共重合体、ポリ(1-グルタミン酸)、ポリ(d-グルタミン酸)ポリアクリル酸、ポリ(dl-グルタミン酸))、ポリ(1-アスパラギン酸)、ポリ(d-アスパラギン酸)、ポリ(dl-アスパラギン酸)、ポリエチレングリコール、上記にポリアミノ酸とポリエチレングリコールの共重合体、コラーゲン様、シルク様、およびシルク・エラスチン様タンパク質などのポリペプチド、ポリカプロラクトン、ポリ(アルキレンコハク酸)、ポリ(ヒドロキシ酪酸)(PHB)、ポリ(ブチレンジグリコール酸)、ナイロン-2/ナイロン-6共重合ポリアミド、ポリジヒドロピラン、ポリホスファゼン、ポリ(オルソエステル)、ポリ(シアノアクリレート)、ポリビニルピロリドン、ポリビニルアルコール、ポリカゼイン、ケラチン、ミオシン、およびフィブリン、シリコンゴム、またはポリウレタンおよび同類のものを含むが、これに限定されない。使用され得る他の中性または負電荷水溶性ポリマーには、アカシア、ゼラチン、デキストラン、アルブミン、アルギン酸/デンプンおよび同類のものなどの天然由来ポリマー、または親水性または疎水性の合成ポリマーを含む。材料は合成、単離することができ、市販されている。
【0085】
本明細書に記述された方法と組成物で使用され得るポリマーの特定の限定されない例には、デキストラン、イヌリン、水溶性デンプン、アルギン酸、セルロース誘導体、ポリ(ビニルアルコール)、単糖と二糖および誘導体、アクリレート誘導体、およびエチレングリコールを含む。
【0086】
疎水性および親水性薬剤
図1に示されるように、本明細書に記述されたナノ粒子は、疎水性治療薬または親水性造影剤を含むことができる。このような例では、ナノ粒子は、C14〜C28脂肪酸などの脂肪酸または脂肪酸誘導体を含み得る。疎水性薬剤の限定されない例には、ステアリン酸、ステアリルアミン、オレイン酸、パルミチン酸、ラウリルアミン、ドデシルアミン、ポリ(プロピレングリコール-メチルエーテルアクリレート、ネオペンチルグリコールメチルエーテルポロポキシレート、ポリカプロラクトン-ジオール(PCL)、およびポリ乳酸グリコール酸-ジオール(PLGA)を含む。
【0087】
送達されるべき治療薬または造影剤が親水性である場合などの他の例では、ナノ粒子はC2〜C14脂肪酸などの脂肪酸または脂肪酸誘導体を含み得る。親水性薬剤の限定されない例には、酢酸、プロピオン酸、酪酸、吉草酸、ヘキサン酸、およびオクタン酸を含む。
【0088】
本明細書に記述された水溶性ポリマーは、疎水性薬剤(例えば、C2〜C28脂肪酸)で誘導体化または共役され得る。ポリマーは、既知の方法を使って脂肪酸に共役することができ、その例は以下に記述されている:Zalipsky et al., Bioconjug. Chem. 8:111 (1997)、Zalipsky et al., Meth. Enzymol. 387:50 (2004)、米国特許 5,631,018、米国特許 5,395,619、米国特許 6,586,001、および米国特許 5,013,556。
【0089】
特定の例では、本明細書に記述されているナノ粒子ライブラリーには、さまざまな程度の脂肪酸飽和度を持つポリマーを含む。例えば、ポリマーの約10%を脂肪酸に共役することができ、ポリマーの約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、または約100%が脂肪酸と共役され得る。
【0090】
架橋剤
図1に示されているように、本明細書に記述されたナノ粒子に含まれ得る別の機能成分には、架橋剤を含む。架橋剤は水溶性ポリマーと反応して、架橋ヒドロゲルおよび相互貫通ネットワーク(IPN)を形成する。本明細書に記述の任意のポリマーを架橋することが知られている任意の架橋剤を使用することができる。
【0091】
架橋剤の限定されない例には、ジスルフィド結合(例えば、アミノチオラン、シスタミン、グルタチオン、2-イムノチオラン、およびリポ酸)およびグリオキサル、エピクロロヒドリンなどの他の共有架橋剤を含む。いかなる理論にも拘束されることを望むものではないが、チオール修飾ポリマーの分子間ジスルフィド架橋は、循環系内などで安定性の強化されたナノ粒子を生成することができるが、腫瘍細胞環境などの高度に還元的な環境では解離する可能性があると考えられている。一部の状況では、共有ジスルフィド架橋は、エンドソーム/リソソームコンパートメント内などで、治療薬の早期放出を防止することによって、細胞内送達を促進し治療薬の流出を克服することができる。
【0092】
架橋剤の他の限定されない例には陽イオンを含む。一部の例では、Ca2+、Mg2+、Ba2+、またはFe2+などの二価陽イオンが使用される。他の状況では、Al3+またはFe3+などの三価陽イオンが使用される。
【0093】
本書に記述の方法および組成物で使用され得る他の架橋剤には、例えば、ゲニピン(Biomaterials 20:1759-72, 1999)、エポキシ化合物、ジアルデヒドデンプン、グルタルアルデヒド、ホルムアルデヒド、ジメチルスベリミデート、カルボジイミド、スクシンイミジル、ジイソシナネート、アクリルアジド、ロイテリン、紫外線照射、脱水熱処理、トリス(ヒドロキシメチル)ホスフィン、アスコルビン酸銅、グルコース・リシンおよび光酸化剤を含む。
【0094】
ポリエチレングリコール
図1に示されるように、本明細書に記述されたナノ粒子はポリエチレングリコール(PEG)を含み得る。本明細書に記述された方法および組成物に使用できるPEGの限定されない例には、約1,000〜約10,000ダルトンの分子量を持つPEGを含む。
【0095】
一部の例では、PEGは本明細書に記述された標的薬剤に結合される。PEGを標的薬剤に結合するには、1つの末端に反応基を持つPEGの誘導体を作成することによってPEGを活性化し得る。多くの活性PEG誘導体が、当技術分野で知られている。活性PEG誘導体の限定されない一例は、PEGのスクシンイミジルコハク酸である(例えば、米国4,179,337を参照)。本明細書に記述された方法に使用され得る活性PEG分子の他の限定されない例には、反応性塩化シアヌル部分、PEGの炭酸スクシンイミジル、PEGのフェニル炭酸塩、PEGのギ酸イミダゾリル誘導体、PEG・カルボキシメチルアジド、PEG・イミドエステル、PEG・ビニルスルホン、PEGの活性エチルスルホン誘導体、PEGのトレシレート、PEG・フェニルグリオキサル、アルデヒド基で活性化されたPEG、PEG・マレイミド、および末端アミノ部分を持つPEGを含む。これらのPEG誘導体およびこのような誘導体の薬剤との共役方法は、当技術分野で知られている(例えば、Zalipsky et al., “Use of Functionalized Poly(Ethylene Glycol)s for Modification of Polypeptides”(Use of Polyethylene Glycol Chemistry. Biotechnical and Biomedical Applications, J. M. Harris, Ed., Plenum Press, New York (1992))を参照、またZalipsky, Adv. Drug Rev. 16:157-182 (1995)も参照)。
【0096】
標的薬剤
図1に示される最終成分は標的薬剤から成り、これは本明細書に記述のようにPEGに結合されている。ある状況では、標的薬剤は特定の生物学的標的に特異的に結合する。生物学的標的の限定されない例には、腫瘍細胞、バクテリア、ウイルス、細胞表面タンパク質、細胞表面受容体、細胞表面多糖、細胞外基質タンパク質、細胞内タンパク質および細胞内核酸を含む。標的薬剤は、例えば、抗体、モノクローナル抗体およびその断片などのさまざまな特異的リガンド、葉酸、マンノース、ガラクトースおよび他の単糖、二糖およびオリゴ糖、およびRGDペプチドであり得る。
【0097】
本明細書に記述されたナノ粒子および方法は、いかなる特定の標的薬剤にも限定されるものではなく、さまざまな標的薬剤を使用し得る。このような標的薬剤の例には、核酸(例えば、RNAおよびDNA)、ポリペプチド(例えば、受容体リガンド、シグナルペプチド、アビジン、タンパク質A、および抗原結合タンパク質)、多糖、ビオチン、疎水性基、親水性基、薬剤および受容体に結合する任意の有機分子を含むがこれに限定されない。一部の例では、本明細書に記述されたナノ粒子は、1つ、2つ、またはそれ以上のさまざまな標的薬剤に共役され得る。例えば、2つ以上の標的薬剤を使用する場合、標的薬剤は類似しても類似していなくてもよい。特定のナノ粒子で2つ以上の標的薬剤を使用することにより、複数の生物学的標的を狙うことができ、または特定の標的に対する親和性を増加させることができる。
【0098】
標的薬剤は、ナノ粒子と多くの方法で結合され得る。例えば、標的薬剤は、ナノ粒子の他の副成分/要素に、短い(例えば、直接カップリング)、中くらい(例えば、SPDP(Pierce Biotechnology, Inc.、イリノイ州ロックフォード)などの小分子二官能性リンカーを使用する)、または長い(例えば、PEG二官能性リンカー(Nektar Therapeutics, Inc.、カリフォルニア州サンカルロス))リンケージで結合(例えば、共有または非共有結合)し得る。また、このような薬剤は、最も外側の高分子層に直接共役され得る。
【0099】
さらに、本明細書に記述されたナノ粒子を生成するために使用されるポリマーは、反応基(例えば、ポリリシン、デキストラミン、硫酸プロファミン、および/またはチトサンなどのアミン基)を取り入れることもできる。反応基は、さまざまな特異的リガンドまたは受容体基(例えば、125I、131I、 I、Br、DTPAなどのさまざまなキレート基で、これは111In、99m-Tc、GD、Mnなどのレポーター重金属、FITCなどの蛍光基、ローダミン、アレクサ、および量子ドットを負荷し得る)および/または他の部分(例えば、リガンド、抗体および/またはその部分)をさらに付着させることを可能にし得る。これらの部分はまた、本明細書に記述のナノ粒子の形成中に、高分子殻に取り込むこともできる。
【0100】
標的薬剤としての抗体
一部の例では、標的薬剤は、抗原結合タンパク質または抗体またはその抗原特異的結合タンパク質部分である。抗体は、さまざまな生物学的標的(例えば、病原体、腫瘍細胞、正常組織)上の抗原または免疫原(例えば、腫瘍、組織、または病原体特異的抗原)を特異的に狙うことを可能にするために生成され得る。このような抗体には、ポリクローナル抗体、モノクローナル抗体またはその抗原結合断片、キメラ抗体、再構築抗体、ヒト化抗体、またはその断片(例えば、Fv、Fab'、Fab、F(ab')2)、または生合成抗体(例えば、単鎖抗体、単一ドメイン抗体(DAB)、Fvs、または単鎖Fvs (scFv)を含むがこれに限定されない。
【0101】
ポリクローナルおよびモノクローナル抗体の製造および使用の方法は、当技術分野ではよく知られており、例としてはHarlow et al., Using Antibodies: A Laboratory Manual: Portable Protocol I. Cold Spring Harbor Laboratory (1998年12月1日)がある。修飾抗体および抗体断片(例えば、キメラ抗体、再構築抗体、ヒト化抗体、またはその断片(例えば、Fab', Fab, F(ab')2断片))、または、生合成抗体(例えば、単鎖抗体、単一ドメイン抗体(DAB)、Fv、単鎖Fv (scFv)、および同類のもの)の製造方法は、当技術分野では知られており、例えば、Zola, Monoclonal Antibodies: Preparation and Use of Monoclonal Antibodies and Engineered Antibody Derivatives, Springer Verlag(2000年12月15日、第一版)に記述されている。
【0102】
一部の例では、抗体は、腫瘍特異的エピトープ(例えば、TAG-72 (Kjeldsen et al., Cancer Res., 48:2214-2220 (1988)、米国5,892,020、5,892,019および5,512,443)、ヒト癌抗原(米国5,693,763、5,545,530、および5,808,005)、骨肉腫細胞からのTP1およびTP3抗原(米国5,855,866)、腺癌細胞からのThomsen-Friedenreich(TF)抗原(米国5,110,911)、ヒト前立腺癌からの「KC-4抗原」(米国4,708,930および4,743,543)、ヒト結腸直腸癌抗原(米国4,921,789)、嚢胞腺癌からのCA125抗原(米国4,921,790)、ヒト乳癌からのDF3抗原(米国4,963,484および5,053,489)、ヒト乳房腫瘍抗原(米国4,939,240)、ヒト黒色腫からのp97 抗原(米国4,918,164)、癌またはオロソムコイド関連抗原(CORA)(米国4,914,021)、ヒト扁平上皮細胞肺癌とは反応するがヒト小細胞肺癌とは反応しないヒト肺癌抗原(米国4,892,935)、ヒト乳癌の糖タンパク質中のT およびTnハプテン(Springer et al., Carbohydr. Res., 178:271-292 (1988))、MSA乳癌糖タンパク質(Tjandra et al., Br. J. Surg., 75:811-817 (1988))、MFGM 乳癌抗原(Ishida et al., Tumor Biol., 10: 12-22 (1989))、DU-PAN-2 膵臓癌抗原(Lan et al., Cancer Res., 45:305-310 (1985))、CA125卵巣癌抗原(Hanisch et al., Carbohydr. Res., 178:29-47 (1988))、およびYH206肺癌抗原(Hinoda et al., Cancer J., 42:653-658 (1988))を認識する。
【0103】
例えば、乳癌細胞を標的とするには、ナノ粒子は、腫瘍関連抗原MUC1、cMet受容体およびCD56 (NCAM)に対する標的薬剤として、葉酸、EGF、FGF、および抗体(または抗体断片)を含み得る。
【0104】
使用され得る他の抗体は、特異的病原体(例えば、レジオネラニューモフィラ 、結核菌、破傷風菌、インフルエンザ菌、淋菌、梅毒トレポネーマ 、炭疽菌、コレラ菌、ライム病ボレリア、ジフテリア菌、黄色ブドウ球菌、ヒトパピローマウィルス、ヒト免疫不全ウイルス、風疹ウイルス、ポリオウィルス) を認識する。
【0105】
本明細書に記述されたナノ粒子に付着可能な抗体またはリガンドには、IL2受容体aに対する抗体、補体系タンパク質C5、CD11a、CD20、TNF-α、T細胞CD3受容体、T細胞VLA4受容体、RSVのFタンパク質、表皮成長因子受容体、血管内皮成長因子、糖タンパク質IIb/IIIa、CD52、および表皮成長因子受容体を含むがこれに限定されない。
【0106】
ナノ粒子への抗体の付着は、本明細書に記述のポリマーの最も外側の層の遊離アミン基への標準共有結合を通して行うことができる(例えば、Torchilin et al. (1987) Hybridoma, 6:229-240; Torchilin, et al., (2001) Biochim. Biophys. Acta,1511:397-411; Masuko, et al., (2005), Biomacromol., 6:800-884参照)。アミン基を通しての共有結合などの、タンパク質共有結合の標準方法が知られている。この方法論は、例えば、Protein Architecture: Interfacing Molecular Assemblies and Immobilization、編集者: Lvov et al. (2000) Chapter 2, pp. 25-54に記述されている。
【0107】
粒子のポリマーコートを活性化するために、遊離アミノ基、カルボキシ基、SH-基、エポキシ基、および/またはリガンド分子と直接ま反応できるか、または例えば、カルボジイミド、SPDP、SMCCおよび/または他の単一および二官能性試薬で事前に活性化した後に反応できる他の基を持つポリマーを使用し得る。または、ポリマーは、当技術分野で周知の方法によって、これらの基の1つを含むように官能化され得る。
【0108】
標的薬剤としてのシグナルペプチド
一部の例では、標的薬剤はシグナルペプチドを含む。これらのペプチドは、周知の技術を使用して、化学的に合成またはクローニング、発現および精製され得る。シグナルペプチドは、本明細書に記述されているナノ粒子を標的とするために、細胞内の慎重に選ばれた領域に使用され得る。一部の状況では、細胞器官およびコンパートメント内のナノ粒子を標的とすることには、特定のアミノ酸配列が関与している。例えば、シグナルペプチドは、本明細書に記述のナノ粒子をミトコンドリア内に移動させ得る。他の例では、核局在化シグナルが使用される。
【0109】
標的薬剤としての核酸
他の例では、標的薬剤は核酸(例えば、RNAまたはDNA)である。一部の例では、核酸標的薬剤は、塩基対合によって特定の核酸(例えば、染色体DNA、mRNA、またはリボソームRNA)とハイブリッド形成するよう設計されている。他の状況では、核酸はリガンドまたは生物学的標的に結合する。例えば、核酸は、逆転写酵素、HIVのRevまたはTatタンパク質(Tuerk et al., Gene, 137(1):33-9 (1993))、ヒト成長因子(Binkley et al., Nuc. Acids Res., 23(16):3198-205 (1995))、または、血管内皮成長因子(Jellinek et al., Biochem., 83(34): 10450-6 (1994))を結合できる。リガンドに結合する核酸は、SELEX手法(例えば、米国5,475,096、5,270,163、および5,475,096、およびWO 97/38134、WO 98/33941、および WO 99/07724を参照)などの既知の方法で特定できる。標的薬剤はまた、特定の配列に結合するアプタマーでもあり得る。
【0110】
アンチセンスおよびリボザイム
本明細書に記述された方法に有用な他の薬剤は核酸であり、アンチセンス分子、または標的ポリペプチドをコードしているmRNAを特異的にハイブリッド形成する触媒的核酸分子(例えば、リボザイム)を含む。アンチセンス構成物には、標的ポリペプチドのcDNAコード配列またはmRNAの少なくとも一部の逆補体、標的ポリペプチドcDNA、または遺伝子配列またはその隣接領域を含み、従ってmRNAとハイブリッド形成し得る。
【0111】
導入される配列は全長cDNAまたは遺伝子またはその補体である必要はなく、転換される細胞タイプで見られる相当配列と完全に相同である必要はない。アンチセンス分子は、当技術分野で周知の技術を使って作ることができる(例えば、Agrawal, Methods in Molecular Biology, Humana Press Inc., 1993, Vol. 20 (“Protocols for Oligonucleotides and Analogs”)を参照)。
【0112】
アンチセンス分子は別の分子(例えば、ペプチド、ハイブリッド形成誘発架橋剤、輸送剤、アプタマー、またはハイブリッド形成誘発切断剤)と共役されることがある。細胞による分子の取り込みを促進する標的部分もまた含まれ得る。標的部分は、細胞表面上に存在する分子を認識する抗体またはその断片などの、特異的結合分子であり得る。
【0113】
または、薬剤は、リボザイム(高度に特異的なエンドリボヌクレアーゼ活性を持つ合成RNA分子)などの触媒核酸である。リボザイムの製造および使用は、例えば、米国4,987,071および米国5,543,508に公開されている。リボザイムは合成して、細胞または被験者に投与するか、または発現ベクター上にコード化することができ、このベクターからリボザイムが標的細胞内で合成される(例えば、WO 9523225、およびBeigelman et al., Nucl. Acids Res. 23:4434-42, 1995を参照)。触媒活性を持つオリゴヌクレオチドの例は、例えば、WO 9506764 および WO 9011364、およびSarver et al., Science 247:1222-1225, 1990に記述されている。アンチセンスRNA内へのリボザイム配列の封入は、アンチセンスRNAに結合する内因性mRNA分子が切断され、次に内因性遺伝子発現のアンチセンス阻害が促進されるように、アンチセンスRNAにRNA切断活性を与えるために使用し得る。
【0114】
RNA干渉
標的ポリペプチドをコードしている遺伝子の発現を停止させることのできる二本鎖核酸分子も、本明細書に記述された方法の薬剤として使用され得る。RNA干渉(RNAi)は転写後遺伝子サイレンシングの機序であり、これにおいて対象遺伝子(またはコード領域)に対応する二本鎖RNA(dsRNA)が細胞または生物に導入され、対応するmRNAの分解が生じる。RNAi効果は、遺伝子発現が回復するまでに、複数の細胞分割の間持続する。従ってRNAi は、RNAレベルで標的ノックアウトまたは「ノックダウン」を作るために効果的な方法である。RNAiは、ヒト胚腎臓およびヒーラ細胞を含むヒト細胞で成功を収めている(例えば、Elbashir et al., Nature 411:494-498, 2001を参照)。例えば、遺伝子サイレンシングは、RNAヘアピンの内因性発現によって哺乳類細胞に導入され得る(Paddison et al., PNAS (USA) 99:1443-1448, 2002を参照)。別の例では、小さな(21-23 nt)dsRNAのトランスフェクションは、遺伝子発現を特異的に阻害する( Caplen, Trends Biotechnol. 20:49-51, 2002で再考察された)。
【0115】
簡潔には、RNAiは以下のように働くと考えられている。発現を停止すべき遺伝子の一部に対応するmiRNA、pre-miRNA、pri-miRNA、またはdsRNAが細胞に導入される。dsRNAが、21-23ヌクレオチドsiRNA、または短い干渉RNAに消化される。siRNA二本鎖がヌクレアーゼ複合体に結合して、RNA誘導型サイレンシング複合体(RISC)として知られているものを形成する。RISCは、siRNA鎖の1つと内因性mRNAの間の塩基対合相互作用により、相同転写産物を標的とする。次に、siRNAの3'末端から約12ヌクレオチドでmRNAを切断する(Sharp et al., Genes Dev. 15: 485-490, 2001; およびHammond et al., Nature Rev. Gen. 2: 110-119, 2001で再考察された)。
【0116】
遺伝子サイレンシングにおけるRNAi技術は、標準的分子生物学的方法を使用する。不活性化されるべき標的遺伝子からの配列に対応するdsRNAは、例えば、T7 RNAポリメラーゼによるテンプレートDNA(標的配列に対応している)の両鎖の同時転写などの標準的方法で生成できる。RNAiで使用するdsRNAの生成用キットは、例えば、New England Biolabs, Inc.から市販されている。dsRNAを作るために操作されたdsRNAまたはプラスミドのトランスフェクションの方法は、当技術分野では日常的である。
【0117】
RNAiに類似の遺伝子サイレンシング効果が、哺乳類細胞のmRNA-cDNAハイブリッド構成物のフトランスフェクションで報告されており(Lin et al., Biochem. Biophys. Res. Commun. 281:639-644, 2001)、遺伝子サイレンシングの別の方法として使用され得る。RNAi の治療用途が、例えば、Shuey, Drug Discov. Today 7:1040-1046, 2002に記述されている。
【0118】
アプタマー
一部の例では、薬剤は、特定のポリペプチドを標的とするアプタマーである。アプタマーは、タンパク質リガンドに特異的に結合することを可能にする三次構造を持つ核酸分子である(例えば、 Osborne et al., Curr. Opin. Chem. Biol. 1:5-9, 1997; およびPatel, Curr. Opin. Chem. Biol. 1:32-46, 1997を参照)。アプタマーはまた、siRNAまたはmiRNAにも共役され得る(WO 2007/143086参照)。
【0119】
アプタマーは、選択された標的に結合する無作為に生成された核酸配列に対するインビトロ自然選択の一種を使用して生成できる。この方法は、「SELEX」(Systematic Evolution of Ligands by Exponential Enrichment(試験管内進化法))と呼ばれている。SELEX法(以下SELEXと称する)および関連適用は、例えば米国5,475,096、米国6,083,696、米国6,441,158および米国6,458,559に記述されている。SELEXプロセスは、核酸リガンドと呼ばれるクラスの生成物を提供し、このようなリガンドは固有配列を持ち、目的標的化合物または分子への特異的結合特性を持つ。各SELEX認識核酸リガンドは、任意の標的化合物または分子の特異的リガンドである。SELEXは、核酸が、さまざまな二次元または三次元構造を形成するのに十分な能力および十分な化学的多様性をモノマー内に持ち、単量体であっても高分子であっても、実質的に任意の化学的化合物に対してリガンドとして働く(特異的結合対を形成する)という見識に基づいている。
【0120】
簡潔には、SELEX法は、同じ一般的選択テーマを使用した、候補混合物からの選択および結合の段階的反復、分割、および増幅から成り、結合親和性および選択性の実質的に任意の目的基準を達成する。好ましくは無作為化配列のセグメントを含む核酸の混合物から開始して、本方法は、結合に適した条件下で混合物を標的と接触させること、標的分子に結合した核酸から未結合の核酸を分割すること、核酸・標的対を解離させること、核酸・標的対から解離された核酸を増幅して核酸のリガンド濃縮混合物を生成すること、そして結合、分割、解離および増幅のステップを望ましいだけ反復することを含む。核酸のプール中、混合物の核酸の大半よりも標的に対する親和性が高い核酸を分割するには、さまざまな技術が使用され得る。
【0121】
いかなる理論にも拘束されるものではないが、SELEXは、多数の可能性のある配列および構造を含む核酸混合物中には、任意の標的に対する幅広い結合親和性があるという観察に基づいている。例えば、20-ヌクレオチド無作為化セグメントを含む核酸混合物は、420の候補を持つ可能性があり得る。標的に対してより高い親和定数を持つものは、その標的に結合する可能性が最も高い。分割、解離および増幅ステップの後、第二の核酸混合物が生成され、より高い結合親和性候補が濃縮される。結果生じる核酸混合物が主に1つまたは2,3の配列のみで構成されるまで、選択ラウンドの追加によって次第に最適リガンドを優先する。次にこれらをクローン化、配列化し、純粋リガンドとして結合親和性を個別に試験する。
【0122】
所定のゴールを達成するまで、選択、分割および増幅のサイクルを繰り返す。最も一般的な例では、選択、分割および増幅は、サイクルの反復において結合強度の著しい向上が見られなくなるまで継続される。約1018もの数の異なる核酸種をサンプルするために、本方法を使用し得る。試験混合物の核酸は、好ましくは、無作為化配列に加えて効率的な増幅のために必要な保存配列も含む。無作為化核酸配列の合成および無作為に切断された細胞核酸からのサイズ選択を含む多くの方法で、核酸配列の変異型を生成することができる。可変配列部分は、完全にまたは部分的に無作為な配列を含むことがあり、また無作為化配列と組み合わされた保存配列のサブ部分も含むことがある。試験核酸の配列変異は、選択、分割および増幅の反復前または反復中の突然変異誘発によって導入または増加され得る。
【0123】
特定の目的を達成するために、基本的SELEX法を変更することができる。例えば、米国5,707,796では、湾曲DNAなどの特異的構造特性を持つ核酸分子を選択するために、ゲル電気泳動法と併せたSELEXの使用を記述している。米国5,763,177では、標的分子に結合および/または光架橋できる、および/または標的分子を光不活性化できる光反応基を含む核酸リガンドを選択するための、SELEXに基づく方法を記述している。米国5,580,737では、「カウンターSELEX」と呼ばれる、近似する分子を区別できる高度に特異的な核酸リガンドを識別するための方法を記述している。米国5,567,588では、標的分子に対して高い親和性を持つオリゴ糖と低い親和性を持つオリゴ糖を非常に効率的に分割できる、SELEXに基づいた方法を記述している。
【0124】
SELEX法は、改善されたインビボ安定性または送達など、改善された特性をリガンドにもたらす修飾ヌクレオチドを含む高親和性核酸リガンドの識別を包含する。このような修飾の例には、リボースおよび/またはリン酸塩および/または塩基位置の化学的置換を含む。修飾ヌクレオチドを含む特異的SELEX識別核酸リガンドは、例えば、米国5,660,985に記述されており、これは、ピリミジンの5- および 2'-位置で化学的に修飾されたヌクレオチド誘導体を含むオリゴ糖に加えて、2'-アミノ修飾を含むトロンビンへの特異的RNAリガンドを記述している。また、2'-アミノ(2'-NH2)、2'-フルオロ(2'-F)、および/または 2'-O-メチル(2'-OMe)で修飾された1つ以上のヌクレオチドを含む高度に特異的な核酸リガンドも含まれている。
【0125】
他の標的薬剤
標的薬剤は、予め選択された生物学的標的(例:病原体、腫瘍細胞、または正常細胞)上のさまざまなエピトープを認識してもよい。例えば、一部の場合において、標的薬剤は、HIV (Wies et al., Nature, 333:426 (1988))、インフルエンザ (White et al., Cell, 56:725 (1989))、クラミジア (Infect. Immunol, 57:2378 (1989))、髄膜炎菌、豚連鎖球菌、サルモネラ菌、おたふく風邪、ニューカッスル病、レオウィルス、センダイウィルスおよびミクソウィルスを標的とするシアル酸、コロナウィルス、脳脊髄炎ウィルス、およびロタウィルスに対する9-OACシアル酸、サイトメガロウィルスを標的とする非シアル酸糖タンパク質 (Virology, 176:337 (1990)) および麻疹ウィルス (Virology, 172:386 (1989))、HIVを標的とするCD4 (Khatzman et al., Nature, 312:763 (1985))、血管活性腸管ペプチド (Sacerdote et al., J. Neurosci. Res. 18:102 (1987))、およびペプチドT (Ruff et al., FEBS Letters, 211:17 (1987))、ワクチンを標的とする表皮成長因子 (Epstein et al., Nature, 318: 663 (1985))、狂犬病を標的とするアセチルコリン受容体 (Lentz et al., Science215: 182 (1982))、エプスタイン・バー・ウィルスを標的とするCd3補体受容体 (Carel et al., J. Biol. Chem., 265:12293 (1990))、レオウィルスを標的とするベータアドレナリン作動性受容体 (Co et al., Proc. Natl. Acad. Sci. USA, 82:1494 (1985))、ライノウィルスを標的とするICAM-1 (Marlin et al., Nature, 344:70 (1990)), N-CAM、およびミエリン関連糖タンパク質MAb (Shephey et al., Proc. Natl. Acad. Sci. USA, 85:7743 (1988))、ポリオウィルスを標的とするポリオウィルス受容体 (Mendelsohn et al., Cell, 56:855 (1989))、ヘルペスウィルスを標的とする線維芽細胞成長因子受容体 (Kaner et al., Science, 248:1410 (1990))、大腸菌を標的とするオリゴマンノース、および髄膜炎菌を標的とするガングリオシドGM1であってもよい。
【0126】
他の場合において、標的薬剤は癌遺伝子によって発現された因子に対するナノ粒子を標的にする。これらには、Srcファミリーのメンバーなどのチロシンキナーゼ(膜結合および細胞質型)、Mosなどのセリン/トレオニンキナーゼ、血小板由来成長因子(PDDG)などの成長因子および受容体、rasファミリーを含むSMALL GTPase(Gタンパク質)、サイクリン依存性タンパク質キナーゼ(cdk)、c-myc、N-myc、およびL-myc、およびbcl-2ファミリーメンバーを含むmycファミリーメンバーのメンバーを含むがこれらに限定されない。
【0127】
加えて、ビタミンに対する受容体を備えるか別の方法でビタミンを摂取する生物学的標的(例:細胞)を標的とする標的薬剤として、ビタミン(脂溶性と非脂溶性ビタミンの両方)を使用してもよい。例えば、脂溶性ビタミン(ビタミンDおよびその類似体、ビタミンE、ビタミンAなど)、および水溶性ビタミン(ビタミンCおよびビタミンB9(葉酸)など)を標的薬剤として使用してもよい。
【0128】
治療薬
一部の場合において、本明細書に記載するナノ粒子は治療薬である化合物を含んでもよい。有益な治療薬は、選択的障害を治療することが知られている。これらには、ステロイド、鎮痛薬、局所麻酔薬、抗生物質製剤、化学療法剤、免疫抑制薬剤、抗炎症薬剤、抗増殖剤、抗有糸分裂薬剤、血管形成剤、抗精神病薬、中枢神経系(CNS)薬剤、抗凝固剤、線維素溶解剤、成長因子、抗体、眼薬、および代謝産物、類似体、誘導体、断片、およびこれらの種、およびその組み合わせの精製、孤立、組換えおよび化学合成されたバージョンがあるがこれらに限定されない。
【0129】
代表的な有益な治療薬には、タモキシフェン、パクリタキセル、ドキソルビシン、低溶解性抗癌剤、カンプトテシンおよびその誘導体(例:トポテカンおよびイリノテカン)、KRN 5500(KRN)、メソ-テトラフェニルポルフィリン、デキサメタゾン、ベンゾジアゼピン、アロプリノール、アセトヘキサミド、ベンズチアジド、クロルプロマジン、クロルジアゼポキシド、ハロペリドール、インドメタシン、ロラゼパム、メトキサレン、メチルプレドニゾン、ニフェジピン、オキサゼパム、オキシフェンブタゾン、プレドニゾン、プレドニゾロン、ピリメタミン、フェニンジオン、スルフィソキサゾール、スルファジアジン、テマゼパム、スルファメラジン、エリプチシン、光動力学的治療に対するポルフィン誘導体、および/またはトリオキサレンのほか、ペニシリン群、フルオロキノロン、および第一、第二、第三、および第四世代セファロスポリンを含むすべての主流の抗生物質を含むがこれらに限定されない。これらの薬剤は、とりわけ、例えばMerck & Co.、Barr Laboratories、Avalon Pharma、およびSun Pharmaから市販されている。
【0130】
他の治療薬は、本明細書に記載するように、アンチセンス薬剤、リボゾーム、siRNAなどのRNAi薬剤、およびアプタマーを含む。
【0131】
造影剤
一部の場合において、本明細書に記載するナノ粒子は造影剤を含む。本明細書で使用する場合、「造影剤」という用語は検出可能な化合物を意味する。造影剤の例には、磁気共鳴映像法、コンピュータ断層撮影法(CTスキャン)造影剤、光学造影剤および放射性同位元素を含む。特定の場合において、造影剤は治療薬とともに本明細書に記載するナノ粒子中に存在する。他の場合において、造影剤は治療薬が存在しない中でナノ粒子に含まれる。
【0132】
造影剤は、本明細書に記載するポリマーに結合される。例えば、本明細書に記載するポリマーは、当技術分野で知られている方法を用いてジエチレントリアミン五酢酸(DTPA)に共有結合されてもよく、または造影剤はDTPAに結合されてもよい。
【0133】
特定の場合において、本明細書に記載するナノ粒子ライブラリーは、DTPA飽和度がさまざまなポリマーを含む。例えば、ポリマーの約10%はDTPAと共有結合されてもよく、ポリマーの約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、または約100%がDTPAと共有結合されてもよい。
【0134】
本明細書に記載する方法および組成物で使用できる造影剤の限定されない例は、放射性核種(例:64Gd、111In、99mTc、90Y、125I、および166Ho)、酸化鉄および量子ドットを含む。他の造影剤には、フルオレセインまたはダンシルなどの蛍光色素分子が含まれる。
【0135】
ナノ粒子ライブラリーの作成方法
それぞれが異なる物理化学的特性を持つ潜在的な治療薬が多様なことから、特定の治療薬の特性および特定の生物学的標的にカスタム化された適切なナノ粒子送達システムの合成および特定にはモジュール式プラットフォームが使用される。機能要素の組み合わせ製剤ライブラリーによって、従来型のライブラリーに比べて比較的少数の潜在的なナノ粒子を含むライブラリーの開発が可能となり、これをその後、例えば高スループットシステムを使用してスクリーニングしてもよい。
【0136】
本明細書に記載する機能要素の少なくとも三つを、ナノ製剤の作成に使用してもよい。ライブラリーは、各自の最終的なナノ集合における適切な成分と重量比の選択に基づいて設計される。治療薬の物理化学的特性が適切な成分の選択に使用される。例えば、疎水性中核(例:本明細書に記載する疎水性薬剤を含む)を疎水性治療薬のカプセル化に使用してもよく、その一方で親和性中核(例:本明細書に記載する親和性薬剤を含む)を親和性治療薬のカプセル化のために使用してもよい。
【0137】
特定の場合において、水溶性ポリマーは適した脂肪酸によって誘導体化される。治療薬が親和性の場合にポリマーを誘導体化するようC2-C14脂肪酸を選択してもよく、治療薬が疎水性の場合にポリマーを誘導体化するようC14-C28脂肪酸を選択してもよい。治療薬の疎水性または親和性を判断する方法は、当技術分野で知られている。治療薬の疎水性または親和性を判断する一つの限定されない例は、治療薬の分配係数を測定することである。本明細書で使用する場合、「分配係数」とは、ある物質が脂質(油)と水の間でどの程度分配されるかを測定するものである。分配係数は、水およびn-オクタノールなどの多分に非混和性の溶媒から構成される二相系中で溶解された物質の平衡濃度の比率を決定することで測定されうる(例えば、Sangster, Octanol-Water Partition Coefficients: Fundamentals and Physical Chemistry, John Wiley & Sons(1997)を参照)。本明細書に記載する方法において、分配係数が約100未満であれば治療薬は親和性、分配係数が約100を上回る場合は治療薬は疎水性である。
【0138】
一般に、カスタム化されたナノ粒子ライブラリーは、まず水溶液中に治療薬を可溶化することで作成されてもよい。適切な水溶液の選択は当業者の技術範囲内であり、治療薬を可溶化する任意の水溶液を使用してもよい。
【0139】
次に、ポリマーを適切な脂肪酸によって誘導体化する。一部の場合において、治療薬が親和性の場合にはポリマーを誘導体化するようC2-C14脂肪酸を選択してもよく、治療薬が疎水性の場合にはポリマーを誘導体化するようC14-C28脂肪酸を選択してもよい。特定の状況において、ポリマーはまた、本明細書に記載するPEGと共有結合される。
【0140】
可溶化された治療薬と誘導体化ポリマーを次に組み合わせるとナノ粒子の自己集合が生まれ、ここでポリマーは治療薬を取り囲むヒドロゲルの殻を形成する。ポリマー、脂肪酸、および/またはPEGの濃度またはタイプをさまざまに変えることで、異なるナノ粒子が形成され、異なるタイプのナノ粒子のカスタム化されたライブラリーが得られる。
【0141】
ナノ粒子が生体内への送達用に製剤されるある状況において、ポリマーは本明細書に記載する架橋剤を用いて架橋結合されてもよい。一部の状況において、架橋ポリマーの第一の集団と脂肪酸から誘導体化されたポリマーの第二の集団というポリマーの二つの集団を組み合わせてもよい。これらのポリマーを次に本明細書に記載するように可溶化された治療薬とPEGと組み合わせると、自己集合されたナノ粒子が生まれる。
【0142】
標的薬剤がナノ粒子に含まれる場合、PEGは、本明細書に記載するように適切な標的薬剤によって活性化し誘導体化されてもよい。脂肪酸により誘導体化されたポリマー、標的薬剤によって共有結合されたPEG、および可溶化された治療薬を組み合わせることで、中核(治療薬を含む)を取り囲むポリマーで作られたヒドロゲルの殻を持ち、PEGの一端はヒドロゲルの殻に結合しもう一方の一端は標的薬剤に結合された、これらの成分のナノ粒子への自己集合が生まれる。
【0143】
一つの模範的な方法において、分子間のジスルフィド架橋を促進するために、また全身投与に伴い血漿中の形成されたナノ構造を安定させうるチオール修飾デキストランが合成される。細胞内グルタチオンレベルがより高いため、ナノ粒子から細胞の細胞質中への治療薬の放出を促進するために、ジスルフィド架橋は細胞中で破壊されてもよい。別の模範的な方法において、浸透性および保持効果の強化による長時間の循環と腫瘤への受動的な標的送達を可能にするために、PEG修飾デキストランを使用してもよい。
【0144】
図2に図示する別の模範的な方法において、異なるタイプのポリマーに基づくナノ粒子が合成され、ライブラリーに含まれる。機能ブロック各自は、自己集合されたナノ構造の作製のために水媒体に混合してもよい。各自の機能ブロックのタイプ、ポリマーの誘導体化の程度、各誘導体の濃度、および重量比は、組み合わせライブラリーを開発するように多様化させてもよい(例:最高5,000〜約7,000の異なるナノ粒子を持つ)。ナノ粒子の大きさ、表面電荷、および安定性に基づいて、治療薬のカプセル化のために製剤を選択してもよい。機能マクロ構造の物理化学的特性は、特定の治療薬にとって最適な製剤を特定するために、カプセル化された治療薬の物理化学的特性と一致させてもよい。
【0145】
ナノ粒子ライブラリーのスクリーニング方法
本明細書に記載するナノ粒子ライブラリーは、特定の治療薬および/または特定の送達のためにカスタム化されたナノ粒子候補を特定するためにスクリーニングされうる。一つの模範的なスクリーニング方法を図3に図示する。
【0146】
最初に、当技術分野で知られている方法を用いてナノ粒子の安定性を評価してもよい。例えば、ナノ粒子のカプセル化や安定性の初期スクリーニングについて、蛍光標識された治療薬、親和性蛍光色素分子、または疎水性蛍光色素分子を使用してもよい。この初期スクリーニングに基づいて、PEGおよび/または標的薬剤によって適切なカプセル化を実証するナノ粒子をさらに修飾してもよく、また細胞株の使用など知られている生体外検定においてナノ粒子をスクリーニングしてもよい。生体外研究に基づいてさらなるポリマー誘導体を設計・合成してもよく、また、 生体内試験での一定の「ヒット」製剤を特定するために、組み合わせ製剤の開発と予備評価のサイクルを実施してもよい。
【0147】
生体外のナノ粒子の最適化の後、生体内研究を実施してもよい。一つの模範的な方法において、ナノ粒子について、動物モデルにおける腫瘍標的効率、滞留時間、および生体内での生体内分布プロファイルが評価される。さらに、腫瘍蓄積の増強を示すものとして特定された製剤を、ナノ粒子の単独投与または全身投与される治療薬との組み合わせでの投与を用いて、有効性スクリーニングで試験してもよい。生体内の急性安全性プロファイルは、例えば体重の変化、血液細胞数、肝酵素値、および肝組織病理の測定によって考察することができる。
【0148】
模範的な1000個のポリマーライブラリーが、適切なヒットのスクリーニングと選択のために生成された。表1は、かかるライブラリーの合成に対するポリマーおよび標的薬剤の限定されない例を示す。
【表1】

【0149】
疾患および障害
本明細書に記載するナノ粒子は、罹患した細胞および組織の治療(例:前記細胞や組織への薬物の移動を媒介)に使用されうる。この点に関して、さまざまな疾患は本明細書に記載するナノ粒子および方法を用いた治療に適している。主題のナノ粒子によって治療されうる疾患の模範的な限定されないリストは、乳癌、前立腺癌、肺癌、リンパ腫、皮膚癌、膵臓癌、結腸癌、黒色腫、卵巣癌、脳癌、頭部および頸部癌、肝臓癌、膀胱癌、非小細胞肺癌、子宮頸癌、白血病、非ホジキンリンパ腫、多発性硬化症、神経芽細胞腫および膠芽細胞腫、T細胞およびB細胞媒介性自己免疫疾患、炎症疾患、感染症、感染疾患、過剰増殖性疾患、AIDS、変性状態、心臓血管疾患(冠動脈再狭窄を含む)、糖尿病、移植拒絶反応、および同類のものを含む。一部の場合において、治療される癌細胞は転移性である。
【0150】
特定の場合において、本明細書に記載するナノ粒子は多剤耐性(MDR)の逆転に使用してもよい。例えば、MDR輸送体の下方制御およびsiRNA含有ナノ粒子Bcl-2、スルビビン、mdr-1、またはmrp-1などの抗アポトーシス遺伝子を使用してもよい。
【0151】
治療のための投与
本明細書に記載するナノ粒子 の投与経路および/または投与方法は、所望の結果によってさまざまである。投薬計画は、所望の反応(例:治療反応)を提供するために調整されてもよい。
【0152】
投与方法には、皮内、筋肉内、腹腔内、静脈内、皮下、鼻腔内、硬膜外、経口、舌下、脳内、膣内、経皮、直腸、吸入、または局所的(特に耳、鼻、目または皮膚)を含むがこれらに限定されない。投与方法は医療関係者の裁量に任される。
【0153】
一部の場合において、本明細書に記載するナノ粒子は局所投与される。これは、例えば、手術中の局所点滴、局所的塗布(例:クリームまたはローション)、注射、カテーテル、坐薬または浣腸、または移植によって達成され、前記移植は膜を含めてシラスティック膜や繊維などの多孔、非多孔、またはゼラチン物質からできたものである。一部の状況において、本明細書に記載するナノ粒子は、脳室内、髄腔内注射、傍脊柱筋注射、硬膜外注射、浣腸、および末梢神経近くへの注射を含む適した経路を通して中枢神経系、循環系または消化管に導入される。脳室内注射は、例えば、オンマヤ槽などの槽に取り付けられた脳室内カテーテルによって促進されてもよい。
【0154】
本開示はまた、本明細書に記載するナノ粒子を投与するための装置について説明する。装置は、例えば医薬組成物を保管するための一つ以上の筐体(housings)を含んでもよく、また本明細書に記載するナノ粒子の単位用量を送達するよう構成されてもよい。
【0155】
また、例えば吸入器またはネブライザー、噴霧薬剤を含む製剤の使用によって、またはフッ化炭素または合成肺表面活性剤のかん流による肺内投与を使用してもよい。
【0156】
一部の場合において、本明細書に記載するナノ粒子は、特にリポソーム(Langer, Science249:1527-1533 (1990) およびTreat et al.、Liposomes in the Therapy of Infectious Disease and Cancer,pp. 317-327およびpp. 353-365 (1989) を参照)で小嚢に送達されてもよい。
【0157】
また他の状況において、本明細書に記載するナノ粒子は、制御放出システムまたは徐放性システム(例:Goodson、Medical Applications of Controlled Release、2:115-138 (1984) を参照)で送達されてもよい。Langer、Science 249:1527-1533 (1990) で考察された他の制御放出または徐放性システムを使用してもよい。一つのケースにおいて、ポンプを使用してもよい(Langer、Science249:1527-1533 (1990); Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980)、およびSaudek et al., N. Engl. J. Med. 321:574 (1989))。
【0158】
また他の状況において、制御放出または徐放性システムは本明細書に記載するナノ粒子の標的の近くに配置され、投与量をわずかな全身投与量へと低下してもよい。
【0159】
本明細書に記載するナノ粒子は、適した量の生理的に許容できる賦形剤を含む医薬組成物として製剤されてもよい(例:Remington’s Pharmaceutical Sciences pp. 1447-1676 (Alfonso R. Gennaro, ed., 19th ed. 1995) を参照)。前記の生理的に許容できる賦形剤は、例えば、原油、動物、植物のものを含む水や油などの液体、またはピーナッツ油、大豆油、ミネラル油、ゴマ油および同類のものなどの合成起源であってもよい。生理的に許容できる賦形剤は、生理食塩水、アカシア・ゴム、ゼラチン、でんぷんペースト、タルク、ケラチン、コロイドシリカ、尿素および同類のものであってもよい。加えて、補助剤、安定剤、増粘剤、潤滑剤、および着色剤を用いてもよい。一つの状況において、生理的に許容できる賦形剤は動物に投与されるときに滅菌性である。生理的に許容できる賦形剤は製造・保管条件下で安定しており、微生物による汚染行為に対して保護されるべきである。本明細書に記載するナノ粒子が静脈内投与される場合は、水が特に有益な賦形剤である。また、特に注射可能な溶液の場合は、液体賦形剤として食塩水および水溶ブドウ糖およびグリコール溶液を使用してもよい。適した生理的に許容できる賦形剤はまた、でんぷん、グルコース、ラクトース、蔗糖、ゼラチン、モルト、米、小麦粉、チョーク、シリカゲル、ステアリン酸ナトリウム、ステアリン酸グリコールモノ、タルク、塩化ナトリウム、乾燥スキムミルク、グリコール、プロピレン、グリコール、水、エタノールおよび同類のものを含む。適した生理的に許容できる賦形剤の他の例は、Remington’s Pharmaceutical Sciences pp. 1447-1676 (Alfonso R. Gennaro, ed., 19th ed. 1995) に記載されている。希望する場合、医薬組成物はまた、少量の湿潤剤または乳化剤、またはpH緩衝剤を含んでもよい。
【0160】
液体担体を溶液、懸濁液、乳剤、シロップ、およびエリキシル剤の調製に使用してもよい。本明細書に記載するナノ粒子は、水、有機溶媒、その混合物などの薬学上許容できる液体担体、または薬学上許容できる油または脂肪などで懸濁してもよい。液体担体は、可溶化剤、乳化剤、緩衝剤、保存剤、甘味剤、香味剤、懸濁化剤、増粘剤、色、粘性調整剤、安定剤または浸透圧調節剤を含むその他の適した薬剤上の添加剤を含んでもよい。経口用および非経口投与用の液体担体の適した例には、水(例えば、特にカルボキシメチルセルロースナトリウム溶液を含むセルロース誘導体など本明細書に記載する添加剤を含むもの)、アルコール(例えば、グリコールなどの単価アルコールおよび多価アルコールなどを含む)およびその誘導体、および油(例:ヤシ油およびラッカセイ油)を含む。非経口投与では、担体はまたオレイン酸エチルおよびミリスチン酸イソプロピルなどの油性エステルでもよい。液体担体は、投与のための滅菌された液体形態であってもよい。加圧組成物のための液体担体は、ハロゲン化炭化水素または他の薬学上許容できる噴射剤であってもよい。
【0161】
他の場合において、本明細書に記載するナノ粒子は静脈内投与のために製剤される。静脈内投与のための組成物は、滅菌された等張水溶緩衝液を含んでもよい。組成物はまた可溶化剤を含んでもよい。静脈内投与のための組成物は、注射部位の痛みを緩和するためにリグノカインなどの局所麻酔薬を随意で含んでもよい。成分は、活性剤の量を示したアンプルまたは小袋などの密閉容器において、例えば凍結乾燥粉末または水なし濃縮物として、個別または混合して単位用量の形態で供給してもよい。本明細書に記載するナノ粒子が点滴投与される場合は、例えば、医薬品グレードの滅菌水または生理食塩水を含む点滴ボトルで供給してもよい。本明細書に記載するナノ粒子が注射投与される場合は、投与前に成分を混合できるように、注射用の滅菌水または生理食塩水のアンプルを提供してもよい。
【0162】
他の状況において、本明細書に記載するナノ粒子は、身体表面全体にわたって投与されても、上皮組織および粘膜組織を含む身体経路の内層に投与してもよい。ローション、クリーム、フォーム、パッチ、懸濁液、溶液、および坐薬(例:直腸または膣)への本明細書に記載するナノ粒子を用いて、前記投与を実行してもよい。一部の場合において、明細書に記載するナノ粒子と、本明細書に記載するナノ粒子に対して不活性で、皮膚への毒性がなく、皮膚から血流への全身吸収のための薬剤の送達を可能にする担体を含む経皮パッチを使用してもよい。担体は、クリームまたは軟膏、ペースト、ジェル、または閉塞的な装置といった多数の形態を取ることができる。クリームまたは軟膏は、水中油型または油中水型のどちらかでの粘性のある液体または半固体乳剤であってもよい。本明細書に記載するナノ粒子を含む原油または親和性原油中に拡散される吸収粉末のペーストを使用してもよい。担体の有無を問わず本明細書に記載するナノ粒子を含む槽を覆う半透性の膜、または本明細書に記載するナノ粒子を含む基質といった、本明細書に記載するナノ粒子を血流に放出するためのさまざまな閉塞的な装置を使用してもよい。
【0163】
本明細書に記載するナノ粒子は、従来型の坐薬という形態で直腸または膣から投与してもよい。坐薬剤は、ココアバターを含む従来型の物質から、坐薬の融点を変えるためのワックスやグリセリンの添加の有無を問わず、当技術分野で知られている方法を用いて作製してもよい。さまざまな分子量のポリエチレングリコールなど、水溶性坐薬の基剤を使用してもよい。
【0164】
障害または疾患の治療に効果的な本明細書に記載するナノ粒子の量は、当業者に知られている標準の臨床技術を用いて決定される。加えて、生体外または生体内検定は、最適な用量域の特定のために随意で使用してもよい。使用するべき正確な投与量はまた、投与経路、病状、治療対象の病状の重篤度のほか、治療対象の個人に関するさまざまな物理的要因に依存しており、医療関係者の判断に従って決定できる。例えば、本明細書に記載するナノ粒子の投与量は各自、一日当たり体重の約0.001mg/kg〜約250mg/kg、一日当たり体重の約1mg/kg〜約250mg/kg、一日当たり体重の約1mg/kg〜約50mg/kg、または一日当たり体重の約1mg/kg〜約20mg/kgであってもよい。等価用量は、2時間ごと、約6時間ごと、約8時間ごと、約12時間ごと、約24時間ごと、約36時間ごと、約48時間ごと、約72時間ごと、約1週間ごと、約2週間ごと、約3間ごと週、約1ヵ月ごと、および約2ヵ月ごとを含むがこれらに限定されないさまざまな期間で投与してもよい。完了した治療過程に呼応する用量の数と頻度は、医療関係者の判断に従って決定してもよい。
【0165】
一部の場合において、本明細書に記載する医薬組成物は、例えば錠剤、カプセル、粉末、溶液、懸濁液、乳剤、顆粒、または坐薬などの単位剤形である。前記形態において、医薬組成物は、本明細書に記載するナノ粒子の適切な数量を含む単位用量に分割されてもよい。単位剤形は、例えば、液体を含むパケット粉末、バイアル、アンプル、予め充填されたシリンジまたは小袋などの包装された医薬組成物であってもよい。単位剤形は、例えばカプセルまたは錠剤自体でも、または適切な数でのパッケージ形態での前記組成物でもよい。前記単位剤形は約1mg/kg〜約250mg/kgを含んでもよく、一回の投与量または二回以上に分けた投与量で提供してもよい。
【0166】
併用療法
一部の場合において、本明細書に記載するナノ粒子は、本明細書に記載する障害または病状の治療に有益な治療薬などの一つ以上の治療薬と併用して投与される。例えば、化学療法剤を含むナノ粒子は、裸の化学療法剤(つまり、ナノ粒子中でカプセル化されていない)と組み合わせて投与してもよい。
【0167】
キット
本明細書に記載するナノ粒子は、キットで提供してもよい。一部の場合において、キットには(a)ナノ粒子を含む容器と、随意に(b)情報資料を含む。情報資料は、本明細書に記載する方法および/またはナノ粒子の使用(例:治療的有用性)に関連した、説明、指示、マーケティングまたは他の資料であってもよい。
【0168】
キットの情報資料はその形態に限定されない。一部の場合において、情報資料は、ナノ粒子の製造に関する情報、ナノ粒子の分子量、濃度、有効期限、バッチまたは製造場所の情報などを含んでもよい。他の状況において、情報資料は、例えば適した量、方法、または投与方法(例:本明細書に記載する投与量、剤形、または投与方法)でのナノ粒子の投与方法に関連する。方法は、障害を持つ被験者を治療する方法であってもよい。
【0169】
一部の場合において、情報資料(例:指示)は印刷物(例:印刷された文、図および/または写真(例:ラベル)または印刷されたシートで提供される。情報資料はまた、点字、コンピュータ可読資料、ビデオ録画、または音声録音などの他の形式で提供してもよい。他の場合において、キットの情報資料は、連絡先情報(例:キットの使用者がその中のナノ粒子および/または本明細書に記載する方法の使用について実質的な情報を得ることのできる物理的な住所、電子メールアドレス、ウェブサイト、または電話番号)である。当然ながら、情報資料はまた形式を組み合わせて提供してもよい。
【0170】
ナノ粒子に加えて、キットは溶媒または緩衝液、安定剤、または保存剤などの他の成分を含んでもよい。キットはまた、例えば他の治療薬などの第二または第三の薬剤など、例えば他の薬剤を含んでもよい。成分は、例えば液体、乾燥または凍結乾燥された形態などの任意の形態で提供してもよい。成分は、実質的に純粋(一緒に組み合わされても別々に送達されてもよい)および/または滅菌されてもよい。成分が液体溶液で提供される場合、液体溶液は滅菌水溶液などの水溶液であってもよい。成分が乾燥形態で提供される場合、再溶解は一般に適した溶媒の添加によって行われる。溶媒、例えば滅菌水または緩衝液は、随意でキットで提供してもよい。
【0171】
キットはナノ粒子または他の薬剤に対する一つ以上の容器を含んでもよい。一部の場合において、キットは、ナノ粒子および情報資料のための別々の容器、分割器または区分を含む。例えば、ナノ粒子はボトル、バイアル、またはシリンジ中に含み、情報資料はプラスチック製スリーブまたはパケットに含んでもよい。他の状況において、キットの別々の要素は一つの分割されない容器内に含まれる。例えば、ナノ粒子はラベルという形態で情報資料に添付されるボトル、バイアルまたはシリンジに含まれてもよい。一部の場合において、キットは、複数(例:パック)の個別の容器を含み、それぞれがナノ粒子の一つ以上の単位剤形(例:本明細書に記載する剤形)を含んでもよい。容器は、単位用量(例:ナノ粒子を含む単位)を含んでもよい。例えば、キットは複数のシリンジ、アンプル、フォイルパケット、ブリスターパック、または医学装置(例:各自が単位用量を含む)を含んでもよい。キットの容器は密閉式、防水性(例:湿度や蒸発の変化に対して不浸透性) 、および/または遮光されていてもよい。
【0172】
キットは、ナノ粒子の投与に適した装置(例:シリンジ)または他の適した送達装置を随意で含んでもよい。装置は、ナノ粒子(例:単位用量)で予め充填して提供しても、または中身はないが充填に適した状態で提供してもよい。
【0173】
本発明についてさらに下記の実施例で説明するが、これは請求項に記載する本発明の範囲を制限するものではない。
【実施例】
【0174】
【実施例1】
【0175】
siRNAナノ粒子による(MDR1)発現の阻害
骨肉腫における薬物耐性を克服するための送達システム
新しい薬物送達システムを作製し、MDR1 siRNA送達について評価した。生体適合性のある脂質修飾デキストランに基づく新しいポリマーナノ粒子をMDR1 siRNA送達のプラットフォームとして使用し、このシステムとの併用療法の有効性が評価された。
【0176】
A. 物質および方法
化学物質
デキストラン(Mwは約40 kDa)、ステアリルアミン(99%純度)、シスタミン、ピリジン、過ヨウ素酸ナトリウム(NaIO4)、シアノ水素化ホウ素ナトリウム(NaCNBH3)、硫酸カリウム(K2SO4)およびアゾビスイソブチロニトリル(AIBN)は、Sigma-Aldrich Chemical Co(ミズーリ州セントルイス)から入手した。ジチオール修飾ポリ(エチレングリコール)(PEG-(SH)2、M.W. 2,000)は、SunBio, Inc.(韓国、ソウル)から入手した。無水リチウム塩素(LiCl)はFisher Scientific(ペンシルベニア州フィラデルフィア)から入手した。分子篩付き脱水ジメチルホルムアミド(DMF)およびジメチルスルホキシド(DMSO)は、Acros Organics(ニュージャージ州パーシッパニー)から入手した。アクリロイル塩素、ピリジンおよび他の試薬および溶媒はSigma-Aldrichから入手し、さらなる精製なく受け取ったものとして使用された。
【0177】
ABCB1 siRNAの合成
ABCB1遺伝子(Genbank登録番号NM_000927)を標的とするsiRNA配列は、この遺伝子のコード領域に呼応するものであった。四つの標的配列がABCB1遺伝子について選択された。各siRNAのセンス配列は5' GAG CUUAACA CC CGA CUUAUU 3'、5' GAAAGUAUACCUCCAGUUUUU 3'、5' GAC CAUAAAU GUAAGGUUUUU 3'、および5' CCAGGUAUGCCUAUUAUUAUU 3'。
【0178】
合成siRNA二本鎖は、Dharmacon Inc.(コロラド州ラフィーエット)から入手した。siRNAは、1mLの緩衝液(100 mmol/L酢酸カリウム、30 mmol/L HEPES-KOH、および2 mmol/L酢酸マグネシウム(pH 7.4))を各試験管に添加して溶解し、下記のトランスフェクション方法まで-20°Cで保管した。
【0179】
アクリル酸デキストランの合成
アクリル酸デキストランの合成は、Zang et al., J. Polym. Sci. Part A: Polym. Chem. 41:386-394 (2003) の手順に基づいて行った。手短に、丸底フラスコ(200mL)中で一定量のデキストラン(M.W. 約40 kDa、2g)をLiCl/DMF(4% w/v、50mL)溶媒混合物に添加した。油槽の温度は2時間にわたり室温(RT)から120°Cに上昇させた。結果的に得られる混合物は均質な黄金色の溶液になった。溶液を室温にまで冷却し、ピリジン(500μL)を添加して攪拌した。反応混合物は氷槽を用いて0°Cにまで冷却し、添加漏斗を用いてさまざまな量のアクリロイル塩素(1-1.5モル過剰)を液滴で添加した。反応は、アクリロイル塩素の完全な添加が1〜2時間にわたって行われるまで0°Cで維持した。反応は一晩継続させた。得られたアクリル酸デキストランは過剰な低温エタノール中で沈殿させ、無水エタノールで3回洗浄した。アクリル酸デキストランの形成を確認するために、アクリレート単量体の小さな一部をDMSO中で60°Cで24時間、0.001% AIBN阻害剤を用いて重合した。結果的にアクリレート重合体の形成が生じ、反応が確認された。別の方法として、脂質修飾について、ワンポット合成において直接、次の手順の単量体としてアクリル酸デキストランを使用した。
【0180】
アクリル酸デキストランの脂質修飾
前述の手順から得られた200mgのアクリル酸デキストランを乾燥DMFに溶解し、さまざまな量の(5-10モル%)ステアリルアミンおよび触媒(0.01モル% AlCl3)で20mLガラス製バイアル中で攪拌した。反応混合物を油槽で24時間、40-50°Cで加熱した。得られた生成物(ステアリルアミン修飾デキストラン)を低温エタノールで数回沈殿・洗浄して、生成物を精製した。次に、脂質修飾デキストラン誘導体を少量の脱イオン水中に溶解・凍結乾燥させ、淡黄色の最終生成物を生み出した。デキストランの脂肪族アミン修飾は1H NMR分光法(Varian 500MHz NMR分光計、Varian Inc.、カリフォルニア州)によって確認され、脂質修飾の割合は7モル%と推定された。図5は、長鎖脂肪族アミンの追加ピークが約1 ppmの結果的に得られたスペクトル(D2Oを溶媒として使用した場合)を示し、デキストランの脂質修飾が成功したことを示している。脂肪修飾の割合は、デキストランの7モル%と推定された。
【0181】
異なるブロックの他の誘導体および合成されたその組み合わせを表2に示す。
【表2】

【0182】
デキストランの酸化
デキストランは、側鎖1-3がデキストラン生体高分子のバックボーンユニットに結合された、α-D-1、6-グルコース結合グルカンである。デキストランは、血漿増量剤および薬物送達プラットフォームとして長い間使用されてきたことから、マクロ構造の開発のために選択された。デキストランのバックボーンは、Surangkhana et al.、Langmuir 22:8192-8196 (2006) の手順に基づき酸化した。手短に、所望する量のNaIO4を60mLの脱イオン水中に溶解した。前記溶液を4gのデキストランと30mLの脱イオン水を含む他の溶液に添加した。反応物を室温で2時間、暗所で攪拌した。反応の終わりに、数回水を交換しつつ、Spectrapor(R)透析膜(M.W. カットオフ12-14 kDa、Spectrum Labs、Rancho Dominguez、CA)を用いて、脱イオン水(2 L)に対して溶液を4日間透析した。冷凍乾燥後、粉末状のフリーフロー・サンプルが得られ、3.7g(92.5%)が生み出された。
【0183】
デキストランのチオール修飾
酸化デキストランの500mg部分を、K2SO4およびNaCNBH3を含む50mLのpH 5.2緩衝液中に溶解した。50mgのシスタミンを添加し、40°Cで4日間攪拌した。生成物を集中的な透析にかけてから凍結乾燥させて、チオール化デキストランを生み出した。チオール化の割合は、Ellmanの試薬(Ellman、Arch. Biochem. Biophys. 82:70-77 (1959))によって定量化した。精製されたチオール化デキストラン誘導体中のスルフヒドリルの濃度は、約14.2μM/mgと推定された。
【0184】
MDR1 siRNAを含むデキストランナノ粒子の調製
5mg/mLのPEG-(SH)2、ステアリルアミン修飾デキストラン、およびチオール化デキストラン(前述の通り合成)の原液を脱イオン水中で調製した。MDR1 siRNAの溶液に40μLのデキストラン-チオールをまず添加し、渦巻き振とう器を用いて混合した。次に、前記を5分間培養した。次に、この混合物に40μLデキストラン-ステアリルアミン誘導体を添加して、さらに5分間培養した。最後に、40μLのPEG-(SH)2を添加してさらに15分間培養し、ナノ粒子の親和性のある殻を形成した。siRNA、チオール、および脂質修飾デキストラン誘導体の間でより優れた相互作用を生むために、逐次追加のこの方法を使用し、ナノ粒子に隠れた特性を与えるためにPEG-チオールの殻を追加した。
【0185】
粒子サイズとゼータ電位測定
MDR1 siRNA担持ナノ粒子の粒子サイズとゼータ電位は、Brookhaven Zeta PALS計器(ニューヨーク州ホルツビル)を用いて実施した。光散乱の実験のため、サンプルは90°の固定角度で25°Cで測定した。散乱強度はサンプルを脱イオン水で希釈して50-500 kcpsの範囲に調整した。ゼータ電位については、ナノ粒子の電気泳動移動度に基づき、誘電率、屈折率、および水の粘度のデフォルトパラメータを使用した。
【0186】
細胞培養および試薬
細胞株KHOSR2とU-2OSR2を発現するヒト骨肉腫細胞株KHOSおよび多剤耐性MDR1(P-gp)は、National Hellenic Research Foundation(ギリシャ、アテネ)から入手した。すべての細胞株は、10%の幼牛血清、100 U/mLペニシリン、および100μg/mLストレプトマイシンで補足されたRPMI 1640で培養した(すべてはInvitrogen、カリフォルニア州カールズバッドより入手)。細胞は37°Cの5% CO2-95%空気中で培養し、トリプシンEDTA溶液を用いてほぼ融合性単層を達成したときに通過した。耐性細胞株は、引き続きドキソルビシン中で培養した。ドキソルビシンはSigma-Aldrich(ミズーリ州セントルイス)から入手した。P-gp1モノクローナル抗体C219はSignet(マサチューセッツ州デダム)から入手した。ヒトβ-アクチンモノクローナル抗体およびMTT試薬はSigma-Aldrich(ミズーリ州セントルイス)から入手した。
【0187】
EGFP siRNA担持ナノ粒子EGFPを発現する細胞およびトランスフェクションの生成
Stat3および高感度緑色蛍光タンパク質(EGFP)の融合タンパク質発現ベクターpCORON1000 EGFP-Stat3(pEGFP-Stat3)は、Amersham Biosciences(英国、バッキンガムシャー)から入手した。このpEGFP-Stat3ベクターは、Stat3をEGFPのCOOH末端に融合して生成した。ハムスター腎臓細胞株(BHK-21)は、G418(Invitrogen、カリフォルニア州カールズバッド)の選択を通してpEGFP-Stat3に安定に導入された。EGFP発現細胞は、96ウェルプレート上でウェル当たり約4000個の細胞の密度で播種し、濃度が増したEGFP siRNAを添加した後、48時間培養した。EGFP siRNAはAmbion(テキサス州オースティン)から入手した。siPORTTM NeoFXTM トランスフェクション薬剤は陽性対照として使用した(Ambion)。画像は、SPOT RTデジタルカメラ(Diagnostic Instruments, Inc.、ミシガン州スターリングハイツ)搭載のNikon Eclipse Ti-U蛍光顕微鏡(Nikon Corp.)によって得た。
【0188】
ウエスタンブロット法分析
P-gp1は総細胞溶解物中で分析した。細胞からのタンパク質の溶解物は、1倍のRIPA Lysis Buffer(Upstate Biotechnology、ヴァージニア州シャーロッツビル)による溶解を通して生成した。タンパク質の濃度は、タンパク質検定試薬(Bio-Rad、カリフォルニア州ハーキュリーズ)および分光光度計(Beckman DU-640、Beckman Instruments, Inc.、メリーランド州コロンビア)によって決定した。25μgの総タンパク質はNu-Page 4-12% Bis-Tris Gel(Invitrogen)上で処理して、純ニトロセルロース膜(Bio-Rad Laboratories、カリフォルニア州ハーキュリーズ)に転移させた。一次抗体は、pH 7.4のトリス緩衝液の生理食塩水中で、0.1% Tween 20とともに4°Cで一晩培養した。信号は、pH 7.4のトリス緩衝液の生理食塩水中で、5%無脂肪ミルクと0.1% Tween 20とともに、1:2000の希釈率で室温で1時間培養した西洋ワサビペルオキシダーゼで共有結合された二次抗体(Bio-Rad、カリフォルニア州ハーキュリーズ)による培養を通して生成した。陽性免疫反応は、Super Signal(R)West Pico Chemiluminescent Substrate(Pierce、ロックフォードイリノイ州)を用いて検出した。バンドは、 PhotoShop 7.0(Adobe、カリフォルニア州サンノゼ)による反転画像スキャン濃度測定によって半定量化した。信号のないゲル画像の領域は、背景値として指定された。次に、さまざまな濃度のMDR1 siRNAナノ粒子で処理したKHOSR2またはU2OSR2からのP-gpを示すタンパク質の各バンドについては、背景レベルを超える密度を分析した。タンパク質の担持が同等であり、検体ごとにタンパク質の量が違うという理由で違いが観察されないように、各タンパク質についてβ-アクチンに呼応するバンドを決定した。タンパク質バンドの密度はタンパク質のβ-アクチンバンドに標準化し、P-gpの比率は各P-gpに呼応するβ-アクチンの比率で割ることで標準化した。
【0189】
MDR1反転の期間
MDR1 siRNA単独またはMDR1 siRNA担持ナノ粒子のいずれかによるMDR1阻害の期間を比較するために、1 x 105 KHOSR2セル/ウェルをMDR1 siRNA単独およびナノ粒子中で5日間培養した。P-gpの発現は前述のウエスタンブロット法分析によって決定した。
【0190】
薬物流出検定
抵抗を示す細胞株の薬物流出特性を測定するために、VybrantTM 多剤耐性検定 キット(Invitrogen/Molecular Probes)を使用した。この検定は、蛍光染料カルセインアセトキシメチルエステル(カルセインAM)をP-gpまたは他の膜ポンプABCタンパク質の流出活性のための基質として使用する。カルセインAMは細胞によって吸収され、細胞質エステラーゼによって蛍光カルセインへと加水分解される。カルセインAMのサイトゾル中での保持性は良好である。但し、高レベルのP-gpを発現する多剤耐性の細胞は、非蛍光カルセインAMを血漿膜から急速に排出してサイトゾル中の蛍光カルセインの蓄積を低下させる。薬物耐性細胞(1 x 105)は、濃度が増したMDR1 siRNA担持ナノ粒子とともに、または培地のみで、96 ウェルプレート上で培養した。48時間後、細胞を150μL全容積において0.25μM カルセインAMで培養した。10μMのベラパミルを陽性対照として、PBSを陰性対照として使用した。30分後、細胞を洗浄して200μLの冷却RPMI1640培養培地で2回遠心分離し、細胞蛍光をSPECTRAmax(R)Microplate Spectrofluorometer(Molecular Devices)上で波長490nm(A490)で測定した。カルセインAMの細胞内保持性を可視化するために、SPOT RTデジタルカメラ(Diagnostic Instruments, Inc.、ミシガン州スターリングハイツ)搭載のNikon Eclipse Ti-U蛍光顕微鏡(Nikon Corp.)によって画像を得た。
【0191】
ドキソルビシンの細胞取り込みの蛍光顕微鏡検査
細胞取り込み研究のために、KHOS および KHOSR2細胞を6ウェルプレート上で5 x 105細胞/ウェルの密度で播種した。MDR1 siRNAはKHOSR2のウェルに適用して48時間培養した。培養後、ドキソルビシンを各ウェルに添加してさらに3時間培養した。培養後、細胞を洗浄し、新鮮なRPMI 1640で懸濁した後、SPOT RT デジタルカメラ(Diagnostic Instruments, Inc.、ミシガン州スターリングハイツ)搭載のNikon Eclipse Ti-U蛍光顕微鏡で可視化した。蛍光強度および細胞局在を波長488nmで三通り、ランダムに異なるフィールドで分析した。
【0192】
生体外細胞毒性検定
生体外細胞毒性検定は、前述のようにMTT検定によって実施した。手短に、この過程においてウェル当たり3 x 103細胞を96ウェルプレートに乗せた。MDR1 siRNA担持ナノ担体とまたは培地のみと48時間培養させた後、濃度の増したドキソルビシンを適用した。5日間培養した後、10μLのMTT(5mg/mL、PBS中)を各ウェルに添加して3時間培養した。結果得られたホルマザン生成物をイソプロパノル酸で溶解した後、SPECTRA max Microplate Spectrophotometer(Molecular Devices)上で波長490nmで吸収度(A490)を読み取った。各実験は三通りで実施した。
【0193】
統計分析
群間の違いを比較するためスチューデントt-検定を使用した(GraphPad PRISM(R) 4 ソフトウェア、GraphPad Software、カリフォルニア州サンディエゴ)。平均±SDとして結果を算出し、p<0.05の結果を統計上有意と見なした。
【0194】
B. 結果
細胞内MDR1 siRNA送達のための脂質修飾デキストランナノ粒子
MDR1 siRNA担持ナノ粒子の調製のために、MDR1 siRNAを脱イオン水中で室温でチオール修飾デキストラン誘導体とともに培養して、チオール化したデキストラン誘導体とsiRNA上の遊離アミン間のチオール-アミン会合によってナノ粒子を形成した(Sainsbury et al., J. Phys. Chem. 111:12992-12999 (2007))。さらに、siRNA含有チオール-デキストラン誘導体によってステアリルアミン修飾デキストラン誘導体とPEG化チオール誘導体を連続して混合して、PEG鎖の三元網への結合効率と安定性を強化するためのヒドロゲル網を形成した。この方法は、siRNA担持およびPEG鎖の結合が良好な安定したナノ粒子の形成をもたらした(図6)。動的光散乱(DLS)測定によって決定されたMDR1 siRNA担持ナノ粒子の粒子サイズの平均は104.4+3.7nm、ゼータ電位はほぼ中性(-0.19+1.13 mV)であった。表3および4は他のポリマーの粒子サイズとゼータ電位を示している。
【表3】

【表4】

【0195】
粒子は室温で安定しており、保管(少なくとも4 oCで1週間)段階での粒子サイズの変化は最小限であった。
【0196】
精製チオール化デキストラン(40 kDaおよび80 kDa)中のスルフヒドリル基の濃度はそれぞれ14.2 μM/mg および11.2 μM/mgであった。結果を図4に示す。
【0197】
BHK-21-EGFP細胞上でのEGFP siRNA担持ナノ粒子の効果
細胞株上でのsiRNA担持ナノ粒子のトランスフェクション有効性を評価するために、我々はまず、BHK-21細胞を発現するEGFPを使用して効果を試験した。EGFP siRNA担持ナノ粒子は、図7および8に示すようにこの研究で使用される濃度では毒性がなかった。EGFP siRNAは効率良く細胞に導入され、EGFPの発現を効果的に阻害した(図9)。阻害は投与量には依存していなかったが、およそ100nmで停滞期に達した。
【0198】
他のナノ粒子の阻害を評価するために、10 μgの前溶解したポリマー(Dex-チオ+Dex脂質)を150nmのGFP-SiRNAとともに30分間培養した。96ウェルプレートでBHKpEGFP細胞と24時間培養させた後で、サイレンシング効果を研究した。結果を図9に示す。
【0199】
これらの誘導体の細胞毒性は、PEI陽性対照と比較してSKOV3卵巣癌細胞で試験した。結果を図7および8に示す。デキストラン誘導体(チオール+脂質)の混合物は、PEIと比較して、試験した濃度では比較的毒性がないことが判明した。
【0200】
MDR1siRNA担持ナノ粒子を用いたP-gpの安定した抑制
P-gp発現でのMDR1 siRNA担持ナノ粒子の効果を推定するために、ウエスタンブロット法を実施した。P-gp発現は、薬物耐性のある二種の細胞株KHOSR2およびU-2OSR2で確認された。MDR1 siRNA担持ナノ粒子は、30nMほどの濃度でもP-gpの発現を阻害した。同じ効果は、二種の異なる薬物耐性のある骨肉腫細胞株でも観察された(図10Aおよび10B)。裸のsiRNAはP-gp発現を48時間抑制することができた。siRNA担持ナノ粒子は、Pgpの抑制を達成するまでの時間はより遅かったが抑制を96時間持続することができた(図11Aおよび11B)。
【0201】
MDR1 siRNA担持ナノ粒子によるカルセインAMのP-gp-媒介性流出の阻害
MDRの反転は通常、化学療法薬の細胞内蓄積の増加の現われであり、これはP-gp-媒介性薬物取り込みと流出を妨害することで達成されうる。そのため、MDR1 siRNA担持ナノ粒子の効果について、P-gp基質であるカルセインAMのKHOSR2中での取り込みと流出を考察した。画像分析によって決定されマイクロプレート蛍光分光分析で確認された、用量依存性のある形での、カルセインAMの流出を低下させるためにMDR1 siRNAで処理された細胞を示す(図12)。
【0202】
MDR1 siRNA担持ナノ粒子送達による細胞内ドキソルビシン蓄積の増強
蛍光顕微鏡を用いて、KHOSおよびKHOSR2におけるドキソルビシンの細胞内分布を分析した。薬物耐性のある骨肉腫細胞内での遊離ドキソルビシンとの3時間の培養期間後、薬物は主に細胞質に集中し、非常に低レベルの蛍光が核で観察された。薬物耐性のある細胞株に対するMDR1 siRNA担持ナノ粒子の処理後にドキソルビシンが投与された場合、蛍光の増加が核と細胞質で観察された。この細胞内分布は、 ドキソルビシンで処理した際の薬物感受性のある変種の細胞内分布を模倣するものだった。
【0203】
薬物耐性のある骨肉腫細胞における生体外細胞毒性研究
デキストランナノ粒子自体は、使用された投与量では細胞毒性がなかった。MDR1 siRNA担持ナノ粒子による治療後、ドキソルビシンは用量依存性のある形で、薬物耐性のある骨肉腫細胞株において増殖抑制作用量の増加を示した(図13Aおよび13B)。100nMのMDR1 siRNA担持ナノ粒子の送達により、100倍も高い量の遊離薬物を投与した場合よりも、ドキソルビシンによる成長の阻害は大幅に顕著となった。例えば、KHOSR2細胞株において、ドキソルビシンのIC50のみでは10μMだったが、MDR1 siRNA担持ナノ粒子と共同処理した場合は0.1μMに低下した。同様に、薬物耐性のある細胞株U-2OSR2は同じような傾向を示し、ドキソルビシンのIC50のみでは6μMだったが、MDR1 siRNA担持ナノ粒子と共同処理した場合は0.06μMに低下した。
【0204】
この実施例では、多剤耐性のある骨肉腫細胞株(KHOSR2およびU-2OSR2)をMDR1 siRNAナノ担体で処理し、MDR1タンパク質(P-gp)の発現、薬物滞留性および免疫蛍光を分析した。ドキソルビシンの濃度を増したMDR1 siRNA担持ナノ担体の併用療法についてもまた分析を行った。MDR1 siRNA担持デキストランナノ粒子は、薬物耐性のある骨肉腫細胞株におけるP-gp発現を効率的に抑制した。また結果によって、このアプローチはMDR細胞株における薬物蓄積量を増加させることで薬物耐性を逆転できることが実証された。そのため、脂質修飾デキストランに基づくポリマーナノ粒子は、siRNA送達のプラットフォームとして使用してもよい。さらに、MDR1 siRNA担持のナノ担体は、骨肉種におけるMDRの逆転のための治療戦略としても使用してもよい。
【実施例2】
【0205】
骨肉腫における薬物耐性を克服するための
ドキソルビシン担持ポリマーナノ粒子送達システム
A. 物質および方法
デキストラン(Mwは約40 kDa)、ステアリルアミン(99%純度)、シスタミン、ピリジン、過ヨウ素酸ナトリウム(NaIO4)、シアノ水素化ホウ素ナトリウム(NaCNBH3)、硫酸カリウム(K2SO4)およびアゾビスイソブチロニトリル(AIBN)は、Sigma-Aldrich Chemical Co(ミズーリ州セントルイス)から入手した。ジチオール修飾ポリ(エチレングリコール)(PEG-(SH)2、M.W. 2,000)は、SunBio, Inc.(韓国、ソウル)から得 た。無水リチウム塩素(LiCl)はFisher Scientific(ペンシルベニア州フィラデルフィア)から入手した。分子篩付き脱水ジメチルホルムアミド(DMF)およびジメチルスルホキシド(DMSO)は、Acros Organics(ニュージャージ州パーシッパニー)から入手した。アクリロイル塩素、ピリジンおよび他の試薬および溶媒はSigma-Aldrichから入手し、さらなる精製なく受け取ったものとして使用された。
【0206】
脂質修飾デキストラン誘導体およびチオール化したデキストランは実施例1に記載する通り調製した。
【0207】
ドキソルビシン含有デキストランナノ粒子の調製
5mg/mLのPEG-(SH)2、ステアリルアミン修飾デキストラン、および前述の通り合成したチオール化デキストランの原液を脱イオン水中で調製した。ドキソルビシンの10mM(1mL)原液をドキソルビシン担持ナノ粒子の調製に使用した。混合物を調製するために、40 μLのデキストラン-ステアリルアミンをまず35μL(0.35mM)のドキソルビシン溶液に添加し、渦巻き振とう器を用いてよく混合した。次に、前記を5分間培養した。この混合物に40μLデキストラン-チオール誘導体を添加して、さらに5分間培養した。最後に、40μLのPEG-(SH)2を添加してさらに15分間培養し、ナノ粒子の親和性のある殻を形成した。逐次追加のこの方法を使用して、ドキソルビシン中の疎水性基と脂質修飾デキストラン誘導体の間のより優れた相互作用を実現した。サンプルの容積は小さいため、やさしく渦巻きにかけ攪拌は使用しなかった。ナノ粒子におけるドキソルビシンの効率と担持は、ドキソルビシンのlmaxに呼応するサンプルの既知量のA485吸収度を測定し、その数値をドキソルビシンの原液を用いた場合に得られる標準曲線と比較して決定した。粒子サイズとゼータ電位測定は、実施例1に記載する通り実施した。
【0208】
細胞培養研究
ヒト骨肉腫細胞株U-2OSは、American Type Tissue Collection(メリーランド州ロックビル)から入手した。National Hellenic Research Foundation(ギリシャ、アテネ)は、ヒト骨肉腫細胞株KHOS、U-2OSおよび多剤耐性のある細胞株KHOSR2、U-2OSR2を快く提供してくれた。すべての細胞株は、実施例1に記載する通り維持した。
【0209】
細胞毒性検定
生体外細胞毒性検定は、実施例1に記載する通りMTT検定によって実施した。
【0210】
細胞におけるドキソルビシン取り込みの定量評価と定性評価
フローサイトメトリーのために、ナノ粒子を伴うまたは伴わないドキソルビシンで1時間、37°Cで培養されたKHOS、KHOSR2、U-2OS、およびU-2OSR2の細胞懸濁液について、FACS Caliburフロー血球計算器(BD Biosciences、カリフォルニア州サンノゼ)で細胞蛍光を分析し、データ取得はCellQuestを用いて行った。ドキソルビシンは本質的に蛍光性があり、488-nmアルゴンレーザー光で励起されうる(Krishan et al., Cancer Res. 45:1046-1051 (1985))。細胞を洗浄しPBSと蛍光発光(530 nmより上)で再懸濁してから、前角光錯乱を収集、増幅して、ヒストグラムを生成するためにスケーリングを行った。生成されたヒストグラム各自について、最小で500,000個の細胞を分析した。使用した最終ドキソルビシン濃度は10μMであった。
【0211】
細胞取り込み研究は、Venne et al.(Cancer Res. 56:3626-3629 (1996))の蛍光顕微鏡による手順に基づいて行った。KHOS細胞とKHOSR2細胞を6ウェルプレート上で5 x 105細胞/ウェルの密度で播種し、24時間培養させて細胞接着を行わせた。培養後、ドキソルビシンのみ、またはドキソルビシン担持ナノ粒子を各ウェルに添加して、さらに3時間培養した。培養後、細胞を洗浄し、PBSで懸濁した後、SPOT RTデジタルカメラ(Diagnostic Instruments, Inc.、ミシガン州スターリングハイツ)搭載のNikon Eclipse Ti-U蛍光顕微鏡(Nikon Corp.)で可視化した。蛍光強度および細胞局在を波長488nmで三通り、異なるフィールドでランダムに分析した。
【0212】
細胞アポトーシス検定
全細胞溶解物は、PARP(Cell Signaling Technology)への特異抗体とその分解産物で免疫ブロットした。陽性免疫反応は、Super Signal(R) West Pico Chemiluminescent Substrateを用いて検出した。バンドは、PhotoShop 7.0(Adobe、カリフォルニア州サンノゼ)による反転画像スキャン濃度測定によって半定量化した。信号のないゲル画像の領域は、背景値として指定された。さまざまな濃度でドキソルビシンのみ、またはドキソルビシン担持ナノ粒子で治療したKHOSまたはKHOSR2からの切断されたPARPを示すタンパク質の各バンドについて、背景レベルを超えた密度を分析した。タンパク質の担持が同等であり、検体ごとにタンパク質の量が違うという理由で違いが観察されないように、各タンパク質についてβ-アクチンに呼応するバンドを決定した。タンパク質バンドの密度はタンパク質のβ-アクチンバンドに標準化し、切断されたPARPの比率は切断されたPARP各自に呼応するβ-アクチンの比率で割ることで標準化した。アポトーシス細胞死の第二のパラメータとして、Apo-ONE Homogenous カスパーゼ-3/7 システムを用いて、メーカー(Promega、Madison、WI)の指示に従い、ドキソルビシンのみ、またはドキソルビシン担持ナノ粒子で処理した後にKHOSおよびKHOSR2におけるカスパーゼ-3/7活性を測定した。発光した蛍光の強度は、SPECTRAmax(R) Microplate Spectrofluorometer(Molecular Devices)を使用して波長521nmで決定した。
【0213】
B. 結果
細胞内ドキソルビシン送達のための脂質修飾デキストランナノ粒子
ドキソルビシンを、室温にて脱イオン水中で脂質修飾デキストラン誘導体で培養して、自己集合された疎水性相互作用によってナノ粒子を形成した。さらに、チオール化デキストラン誘導体およびPEG化チオール誘導体を、PEG鎖のデキストランヒドロゲルへの結合効率を強化するために誘導体化されたドキソルビシン含有脂質修飾デキストランと逐次的に混合した。この方法によって、ドキソルビシン担持が良好な安定したナノ粒子の形成が得られた(図14で図示)。動的光散乱(DLS)測定によって決定されたドキソルビシン担持ナノ粒子の粒子サイズの平均は112.4+4.2 nm、ゼータ電位はほぼ中性(+1.19+0.82 mV)であった。粒子は室温で安定しており、保管(4oCで1週間)段階での粒子サイズの変化はあまりなかった。
【0214】
担持ナノ粒子送達による細胞内ドキソルビシン蓄積の増強
脂質修飾デキストランナノ粒子は、フローサイトメトリーによって考察した場合、KHOSR2(図15A)およびU-2OSR2(図15B)の両方におけるドキソルビシンの滞留の大幅な増加を引き起こした。ドキソルビシン担持ナノ粒子で処理した薬物耐性のある細胞の蛍光は、ドキソルビシンのみで処理した薬物感受性のある細胞の蛍光に匹敵するものであった。
【0215】
蛍光顕微鏡を用いて、KHOSおよびKHOSR2におけるドキソルビシンの細胞内分布を分析した。薬物耐性のある骨肉腫細胞内での遊離ドキソルビシンとの3時間の培養期間後、薬物は主に細胞質に集中し、非常に低レベルの蛍光が核で観察された。ドキソルビシンがナノ粒子とともに薬物耐性の細胞株に投与される場合、核において蛍光の顕著な増加が観察され、その一方で細胞質の蛍光は実質的に影響を受けないままであった。この細胞内分布は、 ドキソルビシンで治療した際に薬物感受性のある変種の細胞内分布を模倣するものだった。
【0216】
野生型細胞および耐性細胞における増殖抑制効果の評価
デキストランナノ粒子自体は、この研究で使用した投与量では細胞毒性はなかった(図16)。但し、ドキソルビシン担持ナノ粒子は、用量依存性のある形で、薬物感受性と薬物耐性両方のある骨肉腫細胞株における増殖抑制作用量の増加を示した(図20A-D)。ドキソルビシン担持ナノ粒子は、ドキソルビシンのみの場合と比べてU-2OSよりも10倍も高い活性 (IC50 0.03 μM〜0.3 μM、図17C)、KHOSR2よりも5倍も高い活性(IC500.6μM〜IC50 3μM、図17B)、およびU-2OSR2よりも20倍も高い活性(IC50 0.3μM〜6μM、図17D)を示した。
【0217】
Pgp発現に対するナノ粒子の効果は、ウエスタンブロット法検定を用いて評価した。Pgpは、薬物感受性のあるKHOSおよびU-2OSでは発現しなかったが、Pgpは二種の薬物耐性細胞株KHOSR2およびU-2OSR2では過剰発現した。ナノ粒子はPgpの発現を抑制しなかったが、Pgpの発現はドキソルビシンの濃度の増加に伴い次第に増加した。
【0218】
ドキソルビシンナノ粒子による細胞アポトーシスの誘導
KHOSおよびKHOSR2にアポトーシスを誘導する際のドキソルビシン担時ナノ粒子の有効性を評価するために、ウエスタンブロット法検定を用いてPARPの切断を検出した。デキストランナノ粒子自体は、この研究で使用する投与量ではPARPの切断の原因とはならなかった。より高いドキソルビシンの濃度のみでアポトーシスが誘導されたものの、ドキソルビシン担持ナノ粒子は薬物感受性(図18A)および抵抗耐性の細胞株(図18B)の両方よりもはるかに高いアポ トーシス誘導率を示した。さらに、KHOSおよびKHOSR2をドキソルビシン担持ナノ粒子で治療したとき、カスパーゼ-3/7活性は顕著に増加した(図19Aおよび19B)。
【0219】
均等物
本発明はその詳細な説明と併せて記載されているものの、前文の説明は図示目的であって本発明の範囲を制限する意図はなく、当該範囲は添付の請求項の範囲によって定義されることを理解されたい。他の態様、利点および修正も、下記の請求項の範囲内である。
【特許請求の範囲】
【請求項1】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) 水溶液中での疎水性治療薬の可溶化と、
b) ポリエチレングリコール(PEG)およびC14-C22脂肪酸を含む第一の水溶性誘導体化ポリマーの提供と、
c) 可溶化された治療薬と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、可溶化された治療薬と第一の誘導体化ポリマーの混合と、
d) PEGおよび第一の誘導体化ポリマーの脂肪酸とは異なるC14-C22脂肪酸を含む第二の水溶性誘導体化ポリマーの提供と、
e) 第二のナノ粒子を形成するための手順 c) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項2】
疎水性治療薬の分配係数が約1,000よりも大きい、請求項1に記載の方法。
【請求項3】
PEGが一つの末端で反応基を含む、請求項1に記載の方法。
【請求項4】
反応基が酸、アミン、マレイミド、アクリレート、またはスクシンイミジルカルボキシメチルエステルである、請求項3に記載の方法。
【請求項5】
標的薬剤の反応基への結合をさらに含む、請求項3に記載の方法。
【請求項6】
第一および第二の水溶性誘導体化ポリマーが可溶化された治療薬を取り囲むヒドロゲルの殻を形成する、請求項1に記載の方法。
【請求項7】
第一および第二の水溶性誘導体化ポリマーが中性電荷を持つ、請求項1に記載の方法。
【請求項8】
第一および第二の水溶性誘導体化ポリマーがデキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である、請求項7に記載の方法。
【請求項9】
第一および第二の水溶性誘導体化ポリマーが負電荷を持つ、請求項1に記載の方法。
【請求項10】
第一および第二の水溶性誘導体化ポリマーがアルギン酸塩、ヒアルロン酸、ペクチン、またはセルロース誘導体である、請求項9に記載の方法。
【請求項11】
第一および第二の水溶性誘導体化ポリマーに架橋剤を添加して、それによりナノ粒子の安定性を強化することをさらに含む、請求項1に記載の方法。
【請求項12】
架橋剤がジスルフィド結合形成架橋剤である、請求項11に記載の方法。
【請求項13】
ジスルフィド結合形成架橋剤がシスタミン、2-イミノチオラン、アミノチオラン、グルタチオン、リポ酸、グリオキサル、またはエピクロロヒドリンである、請求項12に記載の方法。
【請求項14】
架橋剤が二価陽イオンである、請求項11に記載の方法。
【請求項15】
二価陽イオンがCa2+、Mg2+、Ba2+、またはFe2+である、請求項12に記載の方法。
【請求項16】
架橋剤が三価陽イオンである、請求項11に記載の方法。
【請求項17】
三価陽イオンがAl3+またはFe3+である、請求項16に記載の方法。
【請求項18】
第一および第二の水溶性誘導体化ポリマーがチオール基で修飾される、請求項1に記載の方法。
【請求項19】
PEGがチオール基で修飾される、請求項1に記載の方法。
【請求項20】
治療薬が化学療法剤である、請求項1に記載の方法。
【請求項21】
化学療法剤がドキソルビシンである、請求項20に記載の方法。
【請求項22】
ライブラリーが約2〜約5,000もの異なるタイプのナノ粒子を有する、請求項1に記載の方法。
【請求項23】
第一および第二の水溶性ポリマーとジエチレントリアミン5酢酸(DTPA)を共役させることをさらに含む、請求項1に記載の方法。
【請求項24】
造影剤をDTPAに結合することをさらに含む、請求項23に記載の方法。
【請求項25】
造影剤が64Gd、111In、または125Iである、請求項24に記載の方法。
【請求項26】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) 水溶液中での親水性治療薬の可溶化と、
b) PEGおよびC2-C14脂肪酸を含む第一の誘導体化ポリマーの提供と、
c) 可溶化された治療薬と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、可溶化された治療薬と第一の誘導体化ポリマーの混合と、
d) PEGおよび第一の誘導体化ポリマーの脂肪酸とは異なるC2-C14脂肪酸を含む第二の誘導体化ポリマーの提供と、
e) 第二のナノ粒子を形成するための手順 c) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項27】
治療薬の分配係数が約1,000よりも大きい、請求項26に記載の方法。
【請求項28】
治療薬がsiRNAである、請求項26に記載の方法。
【請求項29】
第一および第二の水溶性ポリマーとDTPAを共役させることをさらに含む、請求項26に記載の方法。
【請求項30】
造影剤をDTPAに結合することをさらに含む、請求項29に記載の方法。
【請求項31】
造影剤が酸化鉄または量子ドットである、請求項30に記載の方法。
【請求項32】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) 治療薬の分配係数の決定と、
b) 水溶液中での治療薬の可溶化と、
c) PEGおよび脂肪酸を含む第一の誘導体化ポリマーの提供と、
d) 可溶化された治療薬と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、可溶化された治療薬と第一の誘導体化ポリマーの混合と、
e) PEGおよび第一の誘導体化ポリマーの脂肪酸とは異なる脂肪酸を含む第二の誘導体化ポリマーの提供と、
f) 第二のナノ粒子を形成するための手順 d) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項33】
治療薬の分配係数が約1,000よりも大きい、請求項32に記載の方法。
【請求項34】
脂肪酸がC14-C22脂肪酸である、請求項33に記載の方法。
【請求項35】
治療薬の分配係数が約100よりも小さい、請求項32に記載の方法。
【請求項36】
脂肪酸がC2-C14脂肪酸である、請求項35に記載の方法。
【請求項37】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) (i) PEG、(ii) DTPA、および (iii) C14-C22脂肪酸を含む第一の水溶性誘導体化ポリマーの提供と、
b) 造影剤と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、造影剤と第一の誘導体化ポリマーの混合と、
c) (i) PEG、(ii) DTPA、および(iii) 第一の誘導体化ポリマーの脂肪酸とは異なるC14-C22脂肪酸を含む第二の水溶性誘導体化ポリマーの提供と、
d) 第二のナノ粒子を形成するための手順 b) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項38】
造影剤が64Gd、111In、または125Iである、請求項37に記載の方法。
【請求項39】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) (i) PEG、(ii) DTPA、および (iii) C2-C14脂肪酸を含む第一の誘導体化ポリマーの提供と、
b) 造影剤と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、造影剤と第一の誘導体化ポリマーの混合と、
d) (i) PEG、(ii) DTPA、および (iii) 第一の誘導体化ポリマーの脂肪酸とは異なるC2-C14脂肪酸を含む第二の誘導体化ポリマーの提供と、
e) 第二のナノ粒子を形成するための手順 c) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項40】
造影剤が酸化鉄または量子ドットである、請求項39に記載の方法。
【請求項41】
腫瘍を抱える被験者を治療する方法であって、腫瘍の大きさまたは腫瘍内の腫瘍細胞の数を低下させるのに十分な量のナノ粒子の被験者への投与を含み、前記ナノ粒子が
a) 治療薬と、
b) (i) C14-C22脂肪酸、(ii) PEG、および (iii) 架橋剤を含む水溶性誘導体化ポリマーを含むヒドロゲルの殻である、治療薬を取り囲むヒドロゲルの殻と、
c) PEGに結合される標的薬剤を含み、
その結果、被験者を治療するナノ粒子。
【請求項42】
誘導体化ポリマーがチオール化デキストランを含む、請求項41に記載の方法。
【請求項43】
被験者において標的ポリペプチドの発現を阻害する方法であって、前記方法が標的ポリペプチドの発現を阻害するのに十分な量のナノ粒子の被験者への投与を含み、前記ナノ粒子が
a) siRNA分子と、
b) (i) C2-C14脂肪酸、(ii) PEG、および (iii) 架橋剤を含む水溶性誘導体化ポリマーを含むヒドロゲルの殻である、siRNA分子を取り囲むヒドロゲルの殻と、
c) PEGに結合される標的薬剤を含み、
その結果、標的ポリペプチドの発現を阻害する方法。
【請求項1】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) 水溶液中での疎水性治療薬の可溶化と、
b) ポリエチレングリコール(PEG)およびC14-C22脂肪酸を含む第一の水溶性誘導体化ポリマーの提供と、
c) 可溶化された治療薬と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、可溶化された治療薬と第一の誘導体化ポリマーの混合と、
d) PEGおよび第一の誘導体化ポリマーの脂肪酸とは異なるC14-C22脂肪酸を含む第二の水溶性誘導体化ポリマーの提供と、
e) 第二のナノ粒子を形成するための手順 c) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項2】
疎水性治療薬の分配係数が約1,000よりも大きい、請求項1に記載の方法。
【請求項3】
PEGが一つの末端で反応基を含む、請求項1に記載の方法。
【請求項4】
反応基が酸、アミン、マレイミド、アクリレート、またはスクシンイミジルカルボキシメチルエステルである、請求項3に記載の方法。
【請求項5】
標的薬剤の反応基への結合をさらに含む、請求項3に記載の方法。
【請求項6】
第一および第二の水溶性誘導体化ポリマーが可溶化された治療薬を取り囲むヒドロゲルの殻を形成する、請求項1に記載の方法。
【請求項7】
第一および第二の水溶性誘導体化ポリマーが中性電荷を持つ、請求項1に記載の方法。
【請求項8】
第一および第二の水溶性誘導体化ポリマーがデキストラン、イヌリン、フィコール、デンプン、PEG、またはポリ(ビニルアルコール)である、請求項7に記載の方法。
【請求項9】
第一および第二の水溶性誘導体化ポリマーが負電荷を持つ、請求項1に記載の方法。
【請求項10】
第一および第二の水溶性誘導体化ポリマーがアルギン酸塩、ヒアルロン酸、ペクチン、またはセルロース誘導体である、請求項9に記載の方法。
【請求項11】
第一および第二の水溶性誘導体化ポリマーに架橋剤を添加して、それによりナノ粒子の安定性を強化することをさらに含む、請求項1に記載の方法。
【請求項12】
架橋剤がジスルフィド結合形成架橋剤である、請求項11に記載の方法。
【請求項13】
ジスルフィド結合形成架橋剤がシスタミン、2-イミノチオラン、アミノチオラン、グルタチオン、リポ酸、グリオキサル、またはエピクロロヒドリンである、請求項12に記載の方法。
【請求項14】
架橋剤が二価陽イオンである、請求項11に記載の方法。
【請求項15】
二価陽イオンがCa2+、Mg2+、Ba2+、またはFe2+である、請求項12に記載の方法。
【請求項16】
架橋剤が三価陽イオンである、請求項11に記載の方法。
【請求項17】
三価陽イオンがAl3+またはFe3+である、請求項16に記載の方法。
【請求項18】
第一および第二の水溶性誘導体化ポリマーがチオール基で修飾される、請求項1に記載の方法。
【請求項19】
PEGがチオール基で修飾される、請求項1に記載の方法。
【請求項20】
治療薬が化学療法剤である、請求項1に記載の方法。
【請求項21】
化学療法剤がドキソルビシンである、請求項20に記載の方法。
【請求項22】
ライブラリーが約2〜約5,000もの異なるタイプのナノ粒子を有する、請求項1に記載の方法。
【請求項23】
第一および第二の水溶性ポリマーとジエチレントリアミン5酢酸(DTPA)を共役させることをさらに含む、請求項1に記載の方法。
【請求項24】
造影剤をDTPAに結合することをさらに含む、請求項23に記載の方法。
【請求項25】
造影剤が64Gd、111In、または125Iである、請求項24に記載の方法。
【請求項26】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) 水溶液中での親水性治療薬の可溶化と、
b) PEGおよびC2-C14脂肪酸を含む第一の誘導体化ポリマーの提供と、
c) 可溶化された治療薬と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、可溶化された治療薬と第一の誘導体化ポリマーの混合と、
d) PEGおよび第一の誘導体化ポリマーの脂肪酸とは異なるC2-C14脂肪酸を含む第二の誘導体化ポリマーの提供と、
e) 第二のナノ粒子を形成するための手順 c) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項27】
治療薬の分配係数が約1,000よりも大きい、請求項26に記載の方法。
【請求項28】
治療薬がsiRNAである、請求項26に記載の方法。
【請求項29】
第一および第二の水溶性ポリマーとDTPAを共役させることをさらに含む、請求項26に記載の方法。
【請求項30】
造影剤をDTPAに結合することをさらに含む、請求項29に記載の方法。
【請求項31】
造影剤が酸化鉄または量子ドットである、請求項30に記載の方法。
【請求項32】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) 治療薬の分配係数の決定と、
b) 水溶液中での治療薬の可溶化と、
c) PEGおよび脂肪酸を含む第一の誘導体化ポリマーの提供と、
d) 可溶化された治療薬と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、可溶化された治療薬と第一の誘導体化ポリマーの混合と、
e) PEGおよび第一の誘導体化ポリマーの脂肪酸とは異なる脂肪酸を含む第二の誘導体化ポリマーの提供と、
f) 第二のナノ粒子を形成するための手順 d) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項33】
治療薬の分配係数が約1,000よりも大きい、請求項32に記載の方法。
【請求項34】
脂肪酸がC14-C22脂肪酸である、請求項33に記載の方法。
【請求項35】
治療薬の分配係数が約100よりも小さい、請求項32に記載の方法。
【請求項36】
脂肪酸がC2-C14脂肪酸である、請求項35に記載の方法。
【請求項37】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) (i) PEG、(ii) DTPA、および (iii) C14-C22脂肪酸を含む第一の水溶性誘導体化ポリマーの提供と、
b) 造影剤と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、造影剤と第一の誘導体化ポリマーの混合と、
c) (i) PEG、(ii) DTPA、および(iii) 第一の誘導体化ポリマーの脂肪酸とは異なるC14-C22脂肪酸を含む第二の水溶性誘導体化ポリマーの提供と、
d) 第二のナノ粒子を形成するための手順 b) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項38】
造影剤が64Gd、111In、または125Iである、請求項37に記載の方法。
【請求項39】
カスタム化されたナノ粒子ライブラリーの作成方法であって、前記方法が
a) (i) PEG、(ii) DTPA、および (iii) C2-C14脂肪酸を含む第一の誘導体化ポリマーの提供と、
b) 造影剤と第一の誘導体化ポリマーが自己集合して第一のナノ粒子を形成する、造影剤と第一の誘導体化ポリマーの混合と、
d) (i) PEG、(ii) DTPA、および (iii) 第一の誘導体化ポリマーの脂肪酸とは異なるC2-C14脂肪酸を含む第二の誘導体化ポリマーの提供と、
e) 第二のナノ粒子を形成するための手順 c) の繰り返しを含み、
その結果、カスタム化されたナノ粒子ライブラリーを作成する方法。
【請求項40】
造影剤が酸化鉄または量子ドットである、請求項39に記載の方法。
【請求項41】
腫瘍を抱える被験者を治療する方法であって、腫瘍の大きさまたは腫瘍内の腫瘍細胞の数を低下させるのに十分な量のナノ粒子の被験者への投与を含み、前記ナノ粒子が
a) 治療薬と、
b) (i) C14-C22脂肪酸、(ii) PEG、および (iii) 架橋剤を含む水溶性誘導体化ポリマーを含むヒドロゲルの殻である、治療薬を取り囲むヒドロゲルの殻と、
c) PEGに結合される標的薬剤を含み、
その結果、被験者を治療するナノ粒子。
【請求項42】
誘導体化ポリマーがチオール化デキストランを含む、請求項41に記載の方法。
【請求項43】
被験者において標的ポリペプチドの発現を阻害する方法であって、前記方法が標的ポリペプチドの発現を阻害するのに十分な量のナノ粒子の被験者への投与を含み、前記ナノ粒子が
a) siRNA分子と、
b) (i) C2-C14脂肪酸、(ii) PEG、および (iii) 架橋剤を含む水溶性誘導体化ポリマーを含むヒドロゲルの殻である、siRNA分子を取り囲むヒドロゲルの殻と、
c) PEGに結合される標的薬剤を含み、
その結果、標的ポリペプチドの発現を阻害する方法。
【図1】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図11A】


【図11B】


【図12】


【図13A】


【図13B】


【図14】


【図15A】


【図15B】


【図16】


【図17A】


【図17B】


【図17C】


【図17D】


【図18A】


【図18B】


【図19A】


【図19B】




【図2】


【図3】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図11A】


【図11B】


【図12】


【図13A】


【図13B】


【図14】


【図15A】


【図15B】


【図16】


【図17A】


【図17B】


【図17C】


【図17D】


【図18A】


【図18B】


【図19A】


【図19B】


【公表番号】特表2012−505243(P2012−505243A)
【公表日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願番号】特願2011−531209(P2011−531209)
【出願日】平成21年10月9日(2009.10.9)
【国際出願番号】PCT/US2009/060175
【国際公開番号】WO2010/042823
【国際公開日】平成22年4月15日(2010.4.15)
【出願人】(510280464)ノースイースタン・ユニバーシティ (2)
【Fターム(参考)】
【公表日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願日】平成21年10月9日(2009.10.9)
【国際出願番号】PCT/US2009/060175
【国際公開番号】WO2010/042823
【国際公開日】平成22年4月15日(2010.4.15)
【出願人】(510280464)ノースイースタン・ユニバーシティ (2)
【Fターム(参考)】
[ Back to top ]

